Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ СУЛЬФОБЕТАИНОВ НА ОСНОВЕ БЕТУЛИНОВОЙ КИСЛОТЫ
Вид РИД
Изобретение
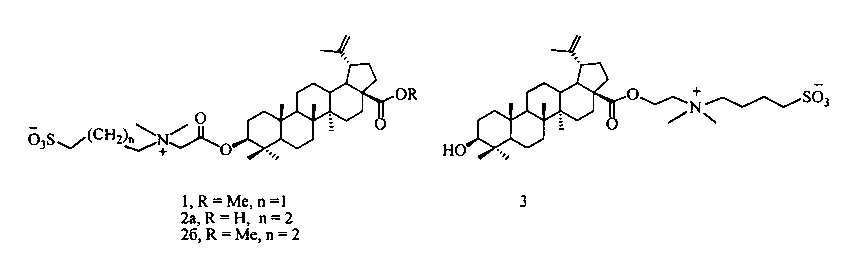
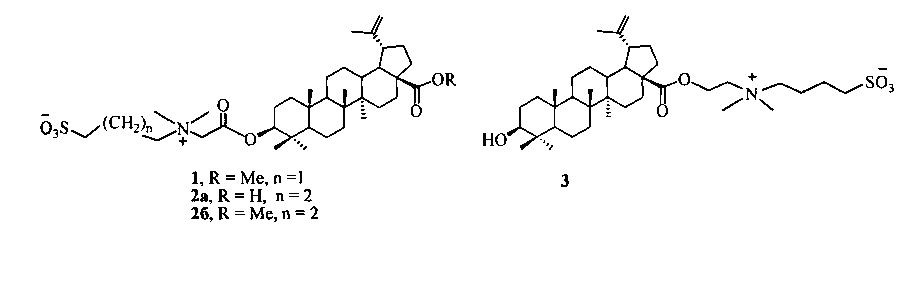
Изобретение относится к области органической и медицинской химии, в частности к способу получения новых потенциально биологически активных производных бетулиновой кислоты - сульфобетаинов с фрагментом 3-(диметиламмоний)пропан-1-сульфоната в положении C-3 и с фрагментом 4-(диметиламмоний)бутан-1-сульфоната в положениях C-3 или C-28 общей формулы (1, 2а, б, 3).
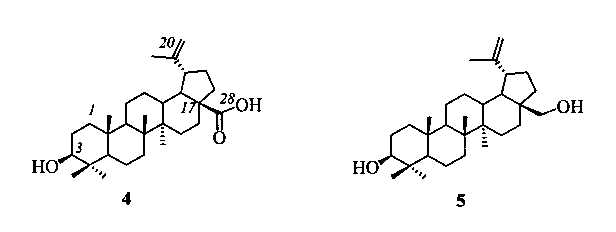
Бетулиновая (4) кислота, окисленное производное бетулина (5) - основного компонента коры березы, обладает широким спектром стартовой биологической активности, в том числе противоопухолевой, противовирусной, антимикробной и низкой токсичностью, что создает предпосылки для создания лекарственных препаратов на платформе пентациклических тритерпеноидов лупанового ряда.
В последние годы ассортимент модифицированных пентациклических тритерпеноидов лупанового ряда расширен за счет их ионных производных. На основе бетулиновой кислоты синтезированы аммонийные, трифенилфосфониевые соли, ионные производные с катионами бензалкония или холиния, проявившие значительно более высокую, по сравнению с природными соединениями, противоопухолевую и противомикробную активность.
Сведения о сульфобетаиновых (цвиттер-ионных) производных бетулиновой кислоты в литературе отсутствуют. Биомиметическая сульфобетаиновая группировка часто используется в дизайне биологически активных соединений с противовирусной, антибактериальной, противовоспалительной, антиаллергической активностью, апоптотическими свойствами, для улучшения растворимости биологически активных соединений, в создании био- и гемосовместимых материалов медицинского назначения, а также в дизайне наноносителей для адресной доставки лекарственных средств [WO 2012160187 A1, 2012; US 6136857, 2000; US 4183952, 1980; М. Krishnamoorthy, Sh. Hakobyan, M. Ramstedt, J.E. Gautrot, Chem. Rev. 2014. V. 114. №21. P. 10976-11026; J. Zhaoa, X. Zhaoa, Z. Jianga, Z. Lia, X. Fana, J. Zhua, H. Wua, Y. Sua, D. Yanga, F. Pana, J. Shib // Progress Polymer Science. 2014. V. 39. P. 1668-1720; Q. Jin, Y. Chen, Y. Wang, J. Ji. // Coll. Surfaces B: Biointerfaces. 2014. 124. P. 80-86; J. Cao, X. Xie, A. Lu, B. He, Y. Chen, Zh. Gu, X. Luo // Biomaterials. 2014. 35. P. 4517-4524].
Задача, на решение которой направлено заявляемое изобретение, заключается в разработке способа получения новых потенциально биологически активных производных бетулиновой кислоты - сульфобетаинов с фрагментами 3-(диметиламмоний)пропан- или 4-(диметиламмоний)бутан-1-сульфоната.
Техническим результатом изобретения является ранее не описанный тип производных бетулиновой кислоты и ее метилового эфира - сульфобетаинов, содержащих в положении С-3 фрагмент 3-(диметиламмоний)пропан-1-сульфоната (1) или 4-(диметиламмоний)бутан-1-сульфоната (2а), (2б) и производного бетулиновой кислоты с фрагментом 4-(диметиламмоний)бутан-1-сульфоната в положении С-28 (3).
Известен способ получения алкил-, алкиларил-, алкенил-, амидоалкилсульфобетаинов и амидоалкилсульфобетаинов стероидов кватернизацией соответствующих третичных алкил-, алкиларил-, алкенил-, амидоалкиламинов 1,3-пропан- или 1,4-бутансультоном. В зависимости от структуры субстрата реакцию проводят в растворе ацетона, ацетонитрила, 1,2-дихлорэтана (ДХЭ), тетрагидрофурана (ТГФ) или диметилформамида (ДМФА) при комнатной температуре, нагревании или при кипении растворителя при соотношении амин:сультон ~1÷1.1, 1÷2. [L. Sonnenschein, A. Seubert // Tetrahedron Letters. 2011. V. 52. №10. P. 1101-1104; R.S. Ward, J. Davies, G. Hodges, D.W. Roberts. // Synthesis. 2002. №16. P. 2431-2439; G. Qu, J. Cheng, J. Wei, T. Yu, W. Ding, H. Luan. // J. Surfact Deterg. 2011. 14. P. 31-35; WO 2012160187 A1, 2012, Z. Chua, Y. Fenga. // Synlett. 2009. №16. P. 2655-2658; RU 2079490, 1997; L.M. Hjelmeland // Prod. Nat. Acad. Sci. USA. 1980. V. 77. №11. P. 6368-6370; L.M. Hjelmeland, D.W. Nebert, J.C. Osborne Jr. // Anal. Biochem. 1983. 130. P. 72-82; US 2011/0071100 A1, 2011].
В качестве прототипа выбран способ получения алкил-, алкенил-арилсульфобетаинов [Т.A. Spenser, Т.J. Onofrey, R.O. Cann, J.S. Russel, L.E. Lee, D.E. Blanchard, A. Castro, P. Gu, G. Jiang, I. Shechter. // J. Org. Chem. 1999. V. 64. P. 807-818], заключающийся в том, что раствор соответствующего третичного N,N-диметил-R-амина (R = Alk, Ar, алкенил) в ДХЭ перемешивают при комнатной температуре с 1,3-пропан- или 1,4-бутансультоном (мольное соотношение амин : сультон ~1:1) в течение 24-43 ч, растворитель упаривают, полученный сырой продукт перекристаллизовывают из органического растворителя (EtOH, MeOH или их смеси с диэтиловым или изопропиловым эфиром).
Предлагаемый способ получения сульфобетаиновых (цвиттер-ионных) производных на основе бетулиновой (4) кислоты относится к получению нового типа производных в ряду пентациклических тритерпеноидов лупанового ряда.
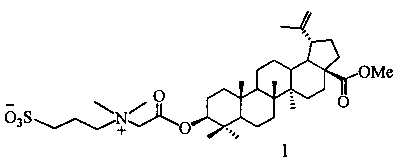
По предлагаемому способу получение сульфобетаина с фрагментом 3-(диметиламмоний)пропан-1-сульфоната (1) осуществляют взаимодействием третичного тритерпенового пентациклического амина лупанового ряда - метилового эфира 3β-(2-(диметиламино)ацетокси)бетулиновой кислоты (7) с 1,3-пропансультоном при мольном соотношении амин:сультон, равном 1:2, в среде безводного ДХЭ при кипячении в атмосфере аргона в течение 30 ч. Выпавший в ходе реакции осадок образующегося сульфобетаина отфильтровывают, промывают ДХЭ, высушивают в вакууме. Выход целевого соединения (1) составляет 79%.
Получение сульфобетаинов с фрагментом 4-(диметиламмоний)бутан-1-сульфоната (2а), (2б) или (3) осуществляют взаимодействием третичного тритерпенового пентациклического амина лупанового ряда - 3β-(2-(диметиламино)ацетокси)бетулиновой кислоты (6) или метилового эфира 3β-(2-(диметиламино)ацетокси)бетулиновой кислоты (7) или 2-(диметиламино)этилового эфира бетулиновой кислоты (8) с 1,4-бутансультоном при мольном соотношении амин:сультон равном 1:9÷10 в среде безводного ацетонитрила при кипячении в атмосфере аргона в течение 30 ч. Выпавший в ходе реакции осадок образующегося сульфобетаина отфильтровывают, промывают ацетонитрилом и высушивают в вакууме. Выход целевых сульфобетаинов (2а), (2б) и (3) составляет 48, 39 и 27% соответственно.
3β-(2-(Диметиламино)ацетокси)бетулиновую кислоту (6) синтезировали в четыре стадии из бетулина (5), который выделяли из коры березы по методу [RU 2270201, 2006]. На первой стадии, по разработанному нами ранее способу, проводили селективную защиту первичного гидроксила бетулина винильной группой методом прямого винилирования бетулина (5) ацетиленом в суперосновной среде КОН-ДМСО [А.В. Орлов, Н.Г. Комиссарова, О.В. Шитикова // Химия в интересах устойчивого развития. 2011. Т 19. С. 223-226]. В результате последующего ацилирования 3β-OH-группы в образующемся 28-O-виниловом эфире бетулина (9) 2-хлоруксусной кислотой в присутствии N,N-дициклогексилкарбодиимида (DCC) и диметиламинопиридина (DMAP), обработки реакционной массы 10% HCl и очистки продукта флэш-хроматографией на SiO2 получали 3β-(2-хлорацетокси)бетулин (10) с выходом 65%. Окисление 3β-(2-хлорацетокси)бетулина (10) вначале пиридинийхлорхроматом (PCC) с образованием соответствующего альдегида, очистка его методом флэш-хроматографии на SiO2 и окисление действием NaClO2 приводили к 3β-(2-хлорацетокси)бетулиновой кислоте (11). Аминирование последней
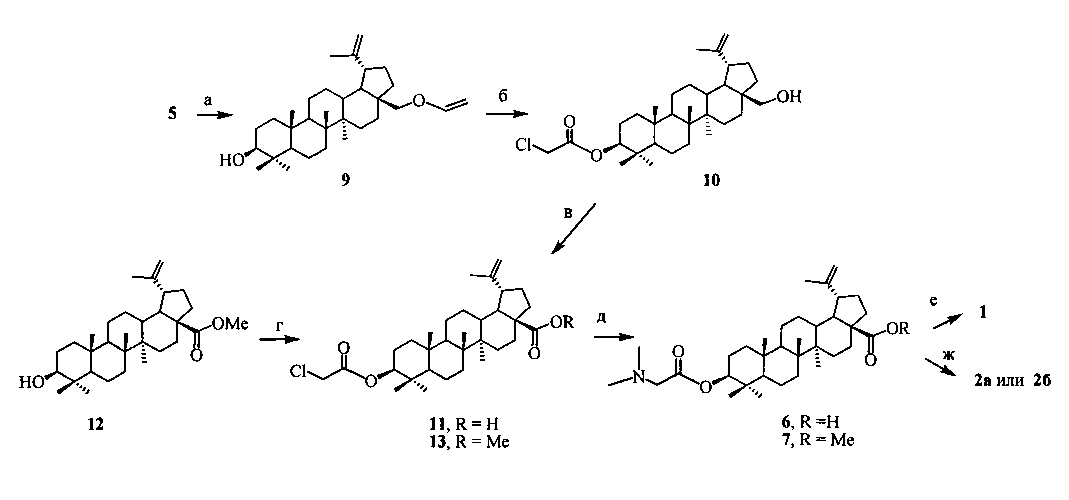
a. [лит.]; б. 1. ClCH2CO2H, DCC, DMAP, CH2Cl2; 2. 10% HCl, ч; в. 1. PCC, CH2Cl2, 2. NaClO2/NaH2PO4/2-метил-2-бутен, t-BuOH; г. ClCH2CO2H, DCC, DMAP, CH2Cl2; д. Me2NH (40% водн.), EtOH; е. 1,3-пропансультон, ДХЭ, кип. 30 ч; ж. 1,4-бутансультон, MeCN, кип. 30 ч.
N,N-диметиламином (40% водн.) при кипячении в спирте в течение 4 ч давало целевую 3β-(2-(диметиламино)ацетокси)бетулиновую кислоту (6), выход которой после очистки методом колоночной хроматографии (КХ) на SiO2 составил 93%. Метиловый эфир 3β-(2-(диметиламино)ацетокси)-бетулиновой кислоты (7) (выход 96%) синтезировали 3β-O-ацилированием 2-хлоруксусной кислотой метилового эфира бетулиновой кислоты (12), последующим аминированием образующегося метилового эфира 3β-(2-хлорацетокси)бетулиновой кислоты (13) N,N-диметиламином (40% водн.) в спирте при комнатной температуре в течение 1 ч и очистки сырого продукта методом КХ на SiO2. Выход соединения (7) составил 60%.
2-(Диметиламино)этиловый эфир бетулиновой кислоты (8), содержащий в положении С-28 третичный атом азота, синтезировали из 2-бромэтилового эфира бетулиновой кислоты (14) с выходом 98% аналогично аминам (6) и (7) при кипячении с избытком N,N-диметиламина (40% водн.) в спирте в течение 1 ч. 2-Бромэтиловый эфир бетулиновой кислоты (14) [D. Biedermann, В. Eignerova, М. Hajduch, J. Sarek // Synthesis. 2010. 22. P. 3839-3848], получали взаимодействием кислоты (4) с 1,2-дибромэтаном в ДМФА в присутствии K2CO3 с выходом 50%.
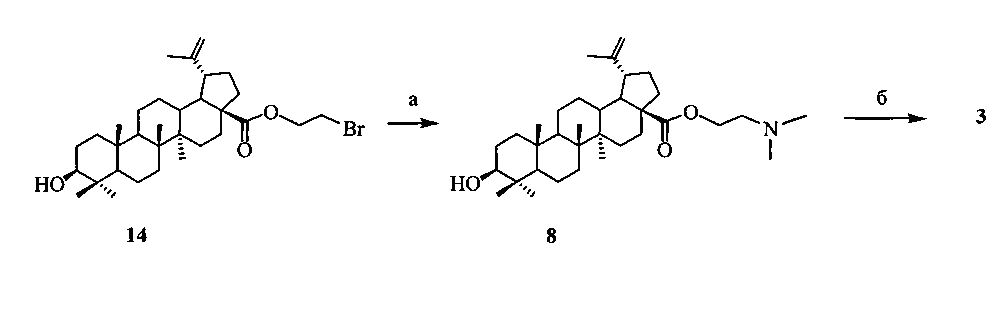
a: Me2NH (40% водн.), EtOH; б: 1,4-бутансультон, CH3CN, кипячение, 30 ч.
Таким образом, в заявленном изобретении разработан способ получения новых производных бетулиновой кислоты - сульфобетаинов с фрагментом 3-(диметиламмоний)пропан-1-сульфобетаина в положении C-3 и с фрагментом 4-(диметиламмоний)бутан-1-сульфобетаина в положениях C-3/C-28 тритерпенового остова, представляющих интерес в качестве потенциально биологически активных соединений для целей медицины.
Изобретение иллюстрируется следующими примерами.
Пример 1
3β-(2-Хлорацетокси)бетулин (10). Раствор 0.78 г (1.667 ммоль) винилового эфира (9), 0.32 г (3.333 ммоль), 2-хлоруксусной кислоты и 0.41 г (3.333 ммоль) DMAP в 30 мл безводн. CH2Cl2 перемешивали 5 мин, добавляли одной порцией 0.69 г (3.333 ммоль) DCC. Перемешивали в атмосфере Ar 30 мин, осадок отфильтровывали, фильтрат промывали 10 мл 10% HCl, водой, высушивали Na2SO4, растворитель упаривали, остаток очищали методом флэш-хроматографии на SiO2 (бензол:МТБЭ, 4:1). Получили 0.56 г (65%) 3β-(2-хлорацетокси)бетулина (10). Аморф. 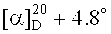 (с 0.37, CHCl3). ИК-спектр (ν, см-1): 1645, 1758, 3400. Спектр ЯМР 1H (300.13 МГц, CDCl3, δ, м.д., J/Гц): 0.79 (1H, д, J=9.4, H-5), 0.84 (6Н, с, CH3-24, CH3-25), 0.86 (3H, с, Н-23), 0.96 (3H, с, CH3-26), 1.01 (3H, с, CH3-27), 1.67 (3H, с, CH3-30), 1.80-2.00 (3H, м, Hb-16, Hb-21, Hb-22), 2.37 (1Н, дт, J=5.7, 11.0, Н-19), 3.30 (1Н, д, J=10.8, Ha-28), 3.79 (1Н, д, J=10.8, Hb-28), 4.04 (2Н, с, ОС(O)CH
2Cl), 4.55 (1H, м, Н-3), 4.57 (1H, с, Ha-29), 4.67 (1Н, с, Hb-29). Спектр ЯМР 13C (75.47 МГц, CDCl3, δ, м.д., J/Гц): 14.68 (C-27), 15.94 (C-24), 16.08 (C-25), 16.35 (C-26), 18.09 (C-6), 19.02 (C-30), 20.83 (C-11), 23.49 (C-2), 25.10 (C-12), 27.00 (C-15), 29.12 (C-21), 29.71 (C-16), 27.86 (C-23), 33.91 (C-22), 34.09 (C-7), 37.01 (C-10), 37.24 (C-13), 37.95 (C-4), 38.26 (C-1), 40.89 (C-8), 41.16 (ОС(O)CH2Cl), 42.68 (C-14), 47.70 (C-17), 47.74 (C-19), 48.71 (C-18), 50.24 (C-9), 55.30 (C-5), 60.45 (C-28), 83.30 (C-3), 109.67 (C-29), 150.38 (C-20), 167.01 (ОС(O)CH2). Масс-спектр (ИЭР), m/z: 442 [M-ClCH2CO2]+ (вычислено 519 для C32H51ClO3).
(с 0.37, CHCl3). ИК-спектр (ν, см-1): 1645, 1758, 3400. Спектр ЯМР 1H (300.13 МГц, CDCl3, δ, м.д., J/Гц): 0.79 (1H, д, J=9.4, H-5), 0.84 (6Н, с, CH3-24, CH3-25), 0.86 (3H, с, Н-23), 0.96 (3H, с, CH3-26), 1.01 (3H, с, CH3-27), 1.67 (3H, с, CH3-30), 1.80-2.00 (3H, м, Hb-16, Hb-21, Hb-22), 2.37 (1Н, дт, J=5.7, 11.0, Н-19), 3.30 (1Н, д, J=10.8, Ha-28), 3.79 (1Н, д, J=10.8, Hb-28), 4.04 (2Н, с, ОС(O)CH
2Cl), 4.55 (1H, м, Н-3), 4.57 (1H, с, Ha-29), 4.67 (1Н, с, Hb-29). Спектр ЯМР 13C (75.47 МГц, CDCl3, δ, м.д., J/Гц): 14.68 (C-27), 15.94 (C-24), 16.08 (C-25), 16.35 (C-26), 18.09 (C-6), 19.02 (C-30), 20.83 (C-11), 23.49 (C-2), 25.10 (C-12), 27.00 (C-15), 29.12 (C-21), 29.71 (C-16), 27.86 (C-23), 33.91 (C-22), 34.09 (C-7), 37.01 (C-10), 37.24 (C-13), 37.95 (C-4), 38.26 (C-1), 40.89 (C-8), 41.16 (ОС(O)CH2Cl), 42.68 (C-14), 47.70 (C-17), 47.74 (C-19), 48.71 (C-18), 50.24 (C-9), 55.30 (C-5), 60.45 (C-28), 83.30 (C-3), 109.67 (C-29), 150.38 (C-20), 167.01 (ОС(O)CH2). Масс-спектр (ИЭР), m/z: 442 [M-ClCH2CO2]+ (вычислено 519 для C32H51ClO3).
Пример 2
3β-(2-Хлорацетокси)бетулиновая кислота (11). К раствору 0.56 г (1.088 ммоль) соединения (10) в 30 мл безводн. CH2Cl2 при перемешивании в атмосфере Ar добавили одной порцией 0.70 г (3.263 ммоль) PCC, перемешивали 1 ч, разбавляли 30 мл метил-трет-бутилового эфира (МТБЭ), перемешивали 15 мин, реакционную массу фильтровали через слой Al2O3, растворитель упаривали, остаток очищали флэш-хроматографией на SiO2 (бензол:МТБЭ, 4:1), получили 0.56 г (98%) альдегида, который растворяли в 33 мл трет-бутанола, приливали 0.5 мл 2-метилбутена-2, прибавляли одновременно по каплям раствор 0.74 г (6.505 ммоль) NaClO2 в 5 мл воды и 0.78 г (6.505 ммоль) NaH2PO4 в 3 мл воды, перемешивали 40 мин, разбавляли водой (100 мл), экстрагировали CHCl3 (5×30 мл), органический слой высушивали Na2SO4, растворитель упаривали, остаток хроматографировали на SiO2 (бензол, бензол:МТБЭ, 4:1). Получили 0.40 г (70%) соединения (11) [Н. Kommera, G.N. Kaluderovic′, J. Kalbitz, R. Paschke. Arch. Pharm. Chem. Life Sci. 2010. 8. P. 449-457]. Аморф. 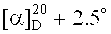 (c 0.6, CHCl3). ИК-спектр (ν, см-1): 1638, 1693, 1728. Спектр ЯМР 1H (300.13 МГц, CDCl3, δ, м.д., J/Гц): 0.79 (1Н, д, J=9.4, Н-5), 0.85 (6Н, с, CH3-24, CH3-25), 0.86 (3H, с, Н-23), 0.92 (3H, с, CH3-27), 0.96 (3H, с, CH3-26), 1.68 (3H, с, CH3-30), 1.96 (2Н, м, Hb-21, Hb-22), 2.17 (1H, т, J=10.0, Н-13), 2.27 (1H, д, J=12.0, Hb-16), 3.02 (1H, дт, J=5.5, 10.5, Н-19), 4.05 (2Н, с, ОС(O)CH2Cl), 4.54 (1H, дд, J=6.4, 10.0, Н-3), 4.61 (1H, с, Ha-29), 4.74 (1H, с, Hb-29). Спектр ЯМР 13C (75.47 МГц, CDCl3, δ, м.д., J/Гц): 14.66 (C-27), 16.04 (C-24), 16.16 (C-25), 16.40 (C-26), 18.10 (C-6), 19.36 (C-30), 20.84 (C-11), 23.55 (C-2), 25.41 (C-12), 27.93 (C-23), 29.67 (C-15), 30.55 (C-21), 32.14 (C-16), 34.19 (C-7), 37.10 (C-22), 37.10 (C-10), 38.01 (C-4), 38.29 (C-1), 38.41 (C-13), 40.69 (C-8), 41.26 (ОС(O)СН2С1), 42.43 (C-14), 46.95 (C-19), 49.24 (C-18), 50.37 (C-9), 55.35 (C-5), 56.41 (C-17), 83.36 (C-3), 109.78 (C-29), 150.36 (C-20), 167.19 (ОС(O)CH2Cl), 182.38 (C-28). Масс-спектр (ИЭР), m/z: 531 [M-H]- (вычислено 532 для C32H49ClO4).
(c 0.6, CHCl3). ИК-спектр (ν, см-1): 1638, 1693, 1728. Спектр ЯМР 1H (300.13 МГц, CDCl3, δ, м.д., J/Гц): 0.79 (1Н, д, J=9.4, Н-5), 0.85 (6Н, с, CH3-24, CH3-25), 0.86 (3H, с, Н-23), 0.92 (3H, с, CH3-27), 0.96 (3H, с, CH3-26), 1.68 (3H, с, CH3-30), 1.96 (2Н, м, Hb-21, Hb-22), 2.17 (1H, т, J=10.0, Н-13), 2.27 (1H, д, J=12.0, Hb-16), 3.02 (1H, дт, J=5.5, 10.5, Н-19), 4.05 (2Н, с, ОС(O)CH2Cl), 4.54 (1H, дд, J=6.4, 10.0, Н-3), 4.61 (1H, с, Ha-29), 4.74 (1H, с, Hb-29). Спектр ЯМР 13C (75.47 МГц, CDCl3, δ, м.д., J/Гц): 14.66 (C-27), 16.04 (C-24), 16.16 (C-25), 16.40 (C-26), 18.10 (C-6), 19.36 (C-30), 20.84 (C-11), 23.55 (C-2), 25.41 (C-12), 27.93 (C-23), 29.67 (C-15), 30.55 (C-21), 32.14 (C-16), 34.19 (C-7), 37.10 (C-22), 37.10 (C-10), 38.01 (C-4), 38.29 (C-1), 38.41 (C-13), 40.69 (C-8), 41.26 (ОС(O)СН2С1), 42.43 (C-14), 46.95 (C-19), 49.24 (C-18), 50.37 (C-9), 55.35 (C-5), 56.41 (C-17), 83.36 (C-3), 109.78 (C-29), 150.36 (C-20), 167.19 (ОС(O)CH2Cl), 182.38 (C-28). Масс-спектр (ИЭР), m/z: 531 [M-H]- (вычислено 532 для C32H49ClO4).
Пример 3
Метиловый эфир бетулиновой кислоты (12). К раствору 1.12 г (2.452 ммоль) бетулиновой кислоты (4) в 50 мл ТГФ добавили 35 мл раствора диазометана в диэтиловом эфире, перемешивали 10 мин, растворитель упаривали, остаток очищали методом флэш-хроматографии на SiO2 (бензол:МТБЭ, 4:1). Получили 1.1 г (96%) соединения (12). Т.пл. 222-224°C (лит.: Т.пл. 224-225°C). Спектры ЯМР 1H и 13C соответствуют литературным данным [H. Kojima, Н. Tominaga, S. Sato, Н. Ogura // Phytochemystry. 1987. V. 26, N. 4. P. 1107-1111].
Пример 4
Метиловый эфир 3β-(2-хлорацетокси)бетулиновой кислоты (13). К раствору 0.50 г (1.064 ммоль) метилового эфира бетулиновой кислоты (12) в 60 мл безводн. CH2Cl2 в атмосфере Ar добавили 0.20 г (2.128 ммоль) 2-хлоруксусной кислоты и 0.26 г (2.128 ммоль) DMAP. Перемешивали 5 мин, затем добавили 0.44 г (2.128 ммоль) DCC, перемешивали 20 мин, осадок N,N-дициклогексилмочевины отфильтровывали, органический слой промывали 20 мл 10% HCl, водой, высушивали Na2SO4, растворитель упаривали, остаток очищали флэш-хроматографией на SiO2 (бензол:МТБЭ, 4:1). Получили 0.55 г (94%) соединения (13). Аморф. 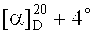 (с 0.15, CHCl3). ИК-спектр (ν, см-1): 1650, 1734. Спектр ЯМР 1H (300.13 МГц, CDCl3, δ, м.д., J/Гц): 0.68 (1H, д, J=10.0, Н-5), 0.84 (3H, с, CH3-24), 0.85 (3H, с, CH3-25), 0.86 (3H, с, Н-23), 0.91 (3H, с, CH3-27), 0.95 (3H, с, CH3-26), 1.68 (3H, с, CH3-30), 1.87 (2Н, м, Hb-21, Hb-22), 2.19 (1Н, м, Н-13), 2.22 (1H, м, Hb-16), 3.00 (1H, дт, J=4.5, 11.0, Н-19), 3.66 (3H, с, COOCH3), 4.05 (2Н, с, CH2Cl), 4.56 (1H, дд, J=6.0, 10.0, Н-3), 4.60 (1H, с, Ha-29), 4.73 (1Н, с, Hb-29). Спектр ЯМР 13C (75.47 МГц, CDCl3, δ, м.д., J/Гц): 14.64 (C-27), 15.92 (C-24), 16.13 (C-25), 16.40 (C-26), 18.10 (C-6), 19.31 (C-30), 20.86 (C-11), 23.52 (C-2), 25.41 (C-12), 27.88 (C-23), 29.63 (C-15), 30.55 (C-21), 32.12 (C-16), 34.17 (C-7), 36.92 (C-22), 37.06 (C-10), 37.97 (C-4), 38.18 (C-13), 38.28 (C-1), 40.65 (C-8), 41.23 (ОС(O)CH2Cl), 42.37 (C-14), 46.95 (С(O)OCH3), 49.41 (C-19), 50.40 (C-9), 51.26 (C-18), 55.35 (C-5), 56.51 (C-17), 83.35 (C-3), 109.62 (C-29), 150.52 (C-20), 167.14 (ОС(O)CH2Cl), 176.64 (C-28). Масс-спектр (ИЭР), m/z: 453 [M-ClCH2CO2]+ (вычислено 546.5 для C33H51ClO4).
(с 0.15, CHCl3). ИК-спектр (ν, см-1): 1650, 1734. Спектр ЯМР 1H (300.13 МГц, CDCl3, δ, м.д., J/Гц): 0.68 (1H, д, J=10.0, Н-5), 0.84 (3H, с, CH3-24), 0.85 (3H, с, CH3-25), 0.86 (3H, с, Н-23), 0.91 (3H, с, CH3-27), 0.95 (3H, с, CH3-26), 1.68 (3H, с, CH3-30), 1.87 (2Н, м, Hb-21, Hb-22), 2.19 (1Н, м, Н-13), 2.22 (1H, м, Hb-16), 3.00 (1H, дт, J=4.5, 11.0, Н-19), 3.66 (3H, с, COOCH3), 4.05 (2Н, с, CH2Cl), 4.56 (1H, дд, J=6.0, 10.0, Н-3), 4.60 (1H, с, Ha-29), 4.73 (1Н, с, Hb-29). Спектр ЯМР 13C (75.47 МГц, CDCl3, δ, м.д., J/Гц): 14.64 (C-27), 15.92 (C-24), 16.13 (C-25), 16.40 (C-26), 18.10 (C-6), 19.31 (C-30), 20.86 (C-11), 23.52 (C-2), 25.41 (C-12), 27.88 (C-23), 29.63 (C-15), 30.55 (C-21), 32.12 (C-16), 34.17 (C-7), 36.92 (C-22), 37.06 (C-10), 37.97 (C-4), 38.18 (C-13), 38.28 (C-1), 40.65 (C-8), 41.23 (ОС(O)CH2Cl), 42.37 (C-14), 46.95 (С(O)OCH3), 49.41 (C-19), 50.40 (C-9), 51.26 (C-18), 55.35 (C-5), 56.51 (C-17), 83.35 (C-3), 109.62 (C-29), 150.52 (C-20), 167.14 (ОС(O)CH2Cl), 176.64 (C-28). Масс-спектр (ИЭР), m/z: 453 [M-ClCH2CO2]+ (вычислено 546.5 для C33H51ClO4).
Пример 5
3β-(2-(Диметиламино)ацетокси)бетулиновая кислота (6). К суспензии 0.30 г (0.498 ммоль) хлорацетата бетулиновой кислоты (11) в 15 мл EtOH мл добавили 0.6 мл (4.975 ммоль) 1 N,N-диметиламина (40% водн.), кипятили 4 ч, растворитель упаривали, остаток очищали флэш-хроматографией на SiO2 (CHCl3:МеОН 10:1). Получили 0.25 г (93%) соединения (6). Аморф. 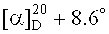 (c 0.33, CHCl3). ИК-спектр (ν, см-1): 1641, 1707, 1734, 3389. Спектр ЯМР 1H (300.13 МГц, CDCl3, δ, м.д., J/Гц): 0.80 (1H, м, Н-5), 0.82 (3H, с, CH3-24), 0.83 (3H, с, CH3-23), 0.85 (3H, с, Н-25), 0.92 (3H, с, CH3-27), 0.97 (3H, с, CH3-26), 1.68 (3H, с, CH3-30), 1.90 (2Н, м, Hb-21, Hb-22), 2.21 (2Н, м, J=10.0, Н-13, Hb-16), 2.38 (6Н, с, (N(CH3)2), 2.98 (1H, дт, J=5.6, 11.0, Н-19), 3.21 (2Н, с, ОС(O)CH2), 4.56 (1H, дд, J=5.3, 11.0, Н-3), 4.58 (1Н, с, Ha-29), 4.71 (1Н, с, Hb-29). Спектр ЯМР 13C (75.47 МГц, CDCl3, δ, м.д., J/Гц): 14.56 (C-27), 15.98 (C-24), 16.10 (C-25), 16.48 (C-26), 18.06 (C-6), 19.26 (C-30), 20.85 (C-11), 23.69 (C-2), 25.39 (C-12), 27.91 (C-23), 29.68 (C-15), 30.67 (C-21), 32.43 (C-16), 34.71 (C-7), 36.81 (C-22), 37.00 (C-10), 37.72 (C-4), 37.90 (C-1), 38.21 (C-13), 40.62 (C-8), 42.37 (C-14), 44.46 (N(CH3)2)), 47.00 (C-19), 49.16 (C-18), 50.33 (C-9), 55.32 (C-5), 56.46 (C-17), 59.66 (ОС(O)CH2), 81.35 (C-3), 109.38 (C-29), 150.80 (C-20), 169.90 (ОС(O)CH2), 181.21 (C-28). Масс-спектр (ИЭР), m/z: 542 [M+H]+ (вычислено 541 для C34H55NO4).
(c 0.33, CHCl3). ИК-спектр (ν, см-1): 1641, 1707, 1734, 3389. Спектр ЯМР 1H (300.13 МГц, CDCl3, δ, м.д., J/Гц): 0.80 (1H, м, Н-5), 0.82 (3H, с, CH3-24), 0.83 (3H, с, CH3-23), 0.85 (3H, с, Н-25), 0.92 (3H, с, CH3-27), 0.97 (3H, с, CH3-26), 1.68 (3H, с, CH3-30), 1.90 (2Н, м, Hb-21, Hb-22), 2.21 (2Н, м, J=10.0, Н-13, Hb-16), 2.38 (6Н, с, (N(CH3)2), 2.98 (1H, дт, J=5.6, 11.0, Н-19), 3.21 (2Н, с, ОС(O)CH2), 4.56 (1H, дд, J=5.3, 11.0, Н-3), 4.58 (1Н, с, Ha-29), 4.71 (1Н, с, Hb-29). Спектр ЯМР 13C (75.47 МГц, CDCl3, δ, м.д., J/Гц): 14.56 (C-27), 15.98 (C-24), 16.10 (C-25), 16.48 (C-26), 18.06 (C-6), 19.26 (C-30), 20.85 (C-11), 23.69 (C-2), 25.39 (C-12), 27.91 (C-23), 29.68 (C-15), 30.67 (C-21), 32.43 (C-16), 34.71 (C-7), 36.81 (C-22), 37.00 (C-10), 37.72 (C-4), 37.90 (C-1), 38.21 (C-13), 40.62 (C-8), 42.37 (C-14), 44.46 (N(CH3)2)), 47.00 (C-19), 49.16 (C-18), 50.33 (C-9), 55.32 (C-5), 56.46 (C-17), 59.66 (ОС(O)CH2), 81.35 (C-3), 109.38 (C-29), 150.80 (C-20), 169.90 (ОС(O)CH2), 181.21 (C-28). Масс-спектр (ИЭР), m/z: 542 [M+H]+ (вычислено 541 для C34H55NO4).
Пример 6
Метиловый эфир 3β-(2-(диметиламино)ацетокси)бетулиновой кислоты (7). К раствору 0.20 г (0.338 ммоль) соединения (13) в 10 мл EtOH мл добавили 1.0 мл (3.384 ммоль) N,N-диметиламина (40% водн.). Перемешивали 1 ч при комнатной температуре, растворитель упаривали, остаток очищали флэш-хроматографией на SiO2 (бензол:МТБЭ 4:1). Получили 0.11 г (60%) соединения (7). Т.пл. 147-148°C. 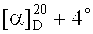 (с 0.39, CHCl3). ИК-спектр (ν, см-1): 1641, 1708, 1732. Спектр ЯМР 1H (300.13 МГц, CDCl3, δ, м.д., J/Гц): 0.83 (10H, с, Н-5, CH3-23, CH3-24, Н-25), 0.91 (3H, с, CH3-27), 0.95 (3H, с, CH3-26), 1.68 (3H, с, CH3-30), 1.88 (2Н, м, Hb-21, Hb-22), 2.22 (2Н, м, Н-13, Hb-16), 2.36 (6Н, с, (N(CH3)2), 2.97 (1Н, дт, J=5.3, 11.0, Н-19), 3.16 (2Н, с, ОС(O)CH2), 3.66 (3H, с, С(O)OCH3), 4.57 (1H, дд, J=5.3, 10.5, Н-3), 4.59 (1H, с, Ha-29), 4.73 (1Н, с, Hb-29). Спектр ЯМР 13C (75.47 МГц, CDCl3, δ, м.д., J/Гц): 14.65 (C-27), 15.92 (C-24), 16.16 (C-25), 16.59 (C-26), 18.16 (C-6), 19.33 (C-30), 20.88 (C-11), 23.81 (C-2), 25.44 (C-12), 27.99 (C-23), 29.65 (C-15), 30.57 (C-21), 32.16 (C-16), 34.22 (C-7), 36.95 (C-22), 37.07 (C-10), 37.83 (C-4), 38.21 (C-13), 38.36 (C-1), 40.67 (C-8), 42.37 (C-14), 45.17 (N(CH3)2), 49.44 (C-19), 46.98 (C(O)OCH3), 50.43 (C-9), 51.25 (C-18), 55.38 (C-5), 56.54 (C-17), 60.43 (ОС(O)CH2), 81.28 (C-3), 109.63 (C-29), 150.55 (C-20), 170.46 (ОС(O)CH2), 176.67 (C-28). Масс-спектр (ИЭР), m/z: 556 [М+Н]+ (вычислено 555 для C35H57NO4).
(с 0.39, CHCl3). ИК-спектр (ν, см-1): 1641, 1708, 1732. Спектр ЯМР 1H (300.13 МГц, CDCl3, δ, м.д., J/Гц): 0.83 (10H, с, Н-5, CH3-23, CH3-24, Н-25), 0.91 (3H, с, CH3-27), 0.95 (3H, с, CH3-26), 1.68 (3H, с, CH3-30), 1.88 (2Н, м, Hb-21, Hb-22), 2.22 (2Н, м, Н-13, Hb-16), 2.36 (6Н, с, (N(CH3)2), 2.97 (1Н, дт, J=5.3, 11.0, Н-19), 3.16 (2Н, с, ОС(O)CH2), 3.66 (3H, с, С(O)OCH3), 4.57 (1H, дд, J=5.3, 10.5, Н-3), 4.59 (1H, с, Ha-29), 4.73 (1Н, с, Hb-29). Спектр ЯМР 13C (75.47 МГц, CDCl3, δ, м.д., J/Гц): 14.65 (C-27), 15.92 (C-24), 16.16 (C-25), 16.59 (C-26), 18.16 (C-6), 19.33 (C-30), 20.88 (C-11), 23.81 (C-2), 25.44 (C-12), 27.99 (C-23), 29.65 (C-15), 30.57 (C-21), 32.16 (C-16), 34.22 (C-7), 36.95 (C-22), 37.07 (C-10), 37.83 (C-4), 38.21 (C-13), 38.36 (C-1), 40.67 (C-8), 42.37 (C-14), 45.17 (N(CH3)2), 49.44 (C-19), 46.98 (C(O)OCH3), 50.43 (C-9), 51.25 (C-18), 55.38 (C-5), 56.54 (C-17), 60.43 (ОС(O)CH2), 81.28 (C-3), 109.63 (C-29), 150.55 (C-20), 170.46 (ОС(O)CH2), 176.67 (C-28). Масс-спектр (ИЭР), m/z: 556 [М+Н]+ (вычислено 555 для C35H57NO4).
Пример 7
2-Бромэтиловый эфир бетулиновой кислоты (14). К суспензии 1.0 г (2.193 ммоль) бетулиновой кислоты (4) в 24 мл безводн. ДМФА в атмосфере Ar, добавили 0.30 г и (2.13 ммоль) прокаленного K2CO3. Перемешивали 20 мин, добавили по каплям 0.2 мл (2.193 ммоль) 1,2-дибромэтана в 1 мл ДМФА. Перемешивали при комнатной температуре 5 ч, отфильтровали K2CO3, фильтрат упарили, остаток хроматографировали на SiO2 (бензол, бензол:МТБЭ, 16:1). Получили 0.57 г (50%) соединения (14). Т.пл. 182-183°C (лит. 185°C (MeOH) [D. Biedermann, В. Eignerova, М. Hajduch, J. Sarek. // Synthesis. 2010. №22. P. 3839-3948]. ЯМР 1H (300.13 МГц, CDCl3, δ, м.д., J/Гц): 0.68 (1Н, д, J=8.0, Н-5), 0.75 (3H, с, CH3-24), 0.81 (3H, с, CH3-25), 0.91 (3H, с, CH3-26), 0.95 (6Н, с, CH3-23, CH3-27), 1.68 (3H, с, CH3-30), 1.92 (2Н, м, Hb-21, Hb-22), 2.17 (1H, дт, J=5.5, 11.0, Н-13), 2.29 (1H, дд, J=8.8, 1.8, Hb-6), 3.01 (1Н, дт, J=5.5, 10.5, Hb-19), 3. 18 (1H, дд, J=5.2, 11.0, Н-3), 3.53 (2Н, т, J=6.0, CH2Br), 4.39 (1Н, дт, J=15.0, 6.0, С(O)OCH2: Ha), 4.41 (1Н, дт, J=15.0, 6.0, C(O)OCH2:Hb), 4.60 (1Н, с, Ha-29), 4.73 (1Н, с, Hb-29). ЯМР 13C (75.47 МГц, CDCl3, δ, м.д., J/Гц): 14.72 (C-27), 15.37 (C-24), 16.01 (C-25), 16.13 (C-26), 18.29 (C-6), 19.37 (C-30), 20.88 (C-11), 25.53 (C-12), 27.40 (C-2), 27.99 (C-23), 29.17 (С(O)OCH2 CH2), 29.68 (C-15), 30.59 (C-21), 32.06 (C-16), 34.31 (C-7), 37.00 (C-22), 37.19 (C-10), 38.33 (C-13), 38.72 (C-1), 38.86 (C-4), 40.73 (C-8), 42.40 (C-14), 46.95 (C-19), 49.41 (C-18), 50.55 (C-9), 55.34 (C-5), 56.69 (C-17), 63.34 (С(O)OCH2CH2), 78.97 (C-3), 109.68 (C-29), 150.44 (C-20), 175.72 (C-28).
Пример 8
2-(Диметиламино)этиловый эфир бетулиновой кислоты (8). К раствору 0.26 г (0.443 ммоль) соединения (14) в 15 мл EtOH мл добавили 0.2 мл (4.434 ммоль) N,N-диметиламина (40% водн.). Перемешивали 1 ч при 20°C, растворитель упаривали, остаток очищали флэш-хроматографией SiO2 (бензол:МТБЭ 4:1). Получили 0.24 г (98%) соединения (8). Т.пл. 181-182°C. 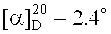 (с 0.3, CHCl3). ИК-Спектр (ν, см-1): 1650, 1726, 3440. Спектр ЯМР 1H (300.13 МГц, CDCl3, δ, м.д., J/Гц): 0.69 (1Н, м, Н-5), 0.75 (3H, с, CH3-24), 0.81 (3H, с, CH3-25), 0.91 (3H, с, CH3-26), 0.95 (6Н, с, CH3-23, CH3-27), 1.67 (3H, с, CH3-30), 1.91 (2Н, м, Hb-21, Hb-22), 2.23 (1Н, м, Hb-6), 2.28 (7H, с, Н-13, (N(CH3)2), 2.56 (2Н, т, J=6, C(O)OCH2N), 3.01 (1H, м, Н-19), 3.17 (1H, дд, J=5.2, 10.5, Н-3), 4.20 (2Н, м, С(O)OCH2), 4.59 (1H, с, Ha-29), 4.72 (1H, с, Hb-29). ЯМР 13C (75.47 МГц, CDCl3, TMC, δ, м.д., J/Гц): 14.67 (C-27), 15.33 (C-24), 15.97 (C-25), 16.11 (C-26), 18.27 (C-6), 19.35 (C-30), 20.87 (C-11), 25.52 (C-12), 27.40 (C-2), 27.97 (C-23), 29.59 (C-15), 30.57 (C-21), 32.09 (C-16), 34.32 (C-7), 36.96 (C-22), 37.17 (C-10), 38.18 (C-13), 38.70 (C-4), 38.84 (C-1), 40.70 (C-8), 42.38 (C-14), 45.72 (N(CH3)2), 46.90 (C-19), 49.40 (C-18), 50.56 (C-9), 55.35 (C-5), 56.47 (C-17), 57.85 (С(O)OCH2
CH2), 61.77 (С(O)OCH2CH2), 78.93 (C-3), 109.52 (C-29), 150.62 (C-20), 175.95 (C-28). Масс-спектр (ИЭР), m/z: 529 [М+Н]+ (вычислено 528 для C34H57NO3).
(с 0.3, CHCl3). ИК-Спектр (ν, см-1): 1650, 1726, 3440. Спектр ЯМР 1H (300.13 МГц, CDCl3, δ, м.д., J/Гц): 0.69 (1Н, м, Н-5), 0.75 (3H, с, CH3-24), 0.81 (3H, с, CH3-25), 0.91 (3H, с, CH3-26), 0.95 (6Н, с, CH3-23, CH3-27), 1.67 (3H, с, CH3-30), 1.91 (2Н, м, Hb-21, Hb-22), 2.23 (1Н, м, Hb-6), 2.28 (7H, с, Н-13, (N(CH3)2), 2.56 (2Н, т, J=6, C(O)OCH2N), 3.01 (1H, м, Н-19), 3.17 (1H, дд, J=5.2, 10.5, Н-3), 4.20 (2Н, м, С(O)OCH2), 4.59 (1H, с, Ha-29), 4.72 (1H, с, Hb-29). ЯМР 13C (75.47 МГц, CDCl3, TMC, δ, м.д., J/Гц): 14.67 (C-27), 15.33 (C-24), 15.97 (C-25), 16.11 (C-26), 18.27 (C-6), 19.35 (C-30), 20.87 (C-11), 25.52 (C-12), 27.40 (C-2), 27.97 (C-23), 29.59 (C-15), 30.57 (C-21), 32.09 (C-16), 34.32 (C-7), 36.96 (C-22), 37.17 (C-10), 38.18 (C-13), 38.70 (C-4), 38.84 (C-1), 40.70 (C-8), 42.38 (C-14), 45.72 (N(CH3)2), 46.90 (C-19), 49.40 (C-18), 50.56 (C-9), 55.35 (C-5), 56.47 (C-17), 57.85 (С(O)OCH2
CH2), 61.77 (С(O)OCH2CH2), 78.93 (C-3), 109.52 (C-29), 150.62 (C-20), 175.95 (C-28). Масс-спектр (ИЭР), m/z: 529 [М+Н]+ (вычислено 528 для C34H57NO3).
Пример 9
3-((2-(17β-метоксикарбониллуп-20(29)-ен-3β-илокси)-2-оксоэтил)диметиламмоний)пропан-1-сульфонат (1). К раствору 0.20 г (0.36 ммоль) третичного амина (7) в 3 мл безводн. ДХЭ в атмосфере Ar добавляли одной порцией 0.088 г (0.720 ммоль) 1,3-пропансультона, кипятили при перемешивании 30 ч. Выпавший осадок соединения (1) отфильтровывали, промывали ДХЭ (5 мл × 3), высушивали в вакууме (2 мм рт.ст., 80°C, 6 ч). Получили 0.19 г (79%) соединения (1). Т.пл. 285-287°C. 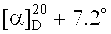 (с 0.41, HCOOH). ИК-спектр (ν, см-1): 712, 1036, 1182, 1207, 1222, 1377, 1645, 1719, 1734. Спектр ЯМР 1H (500.13 МГц, CD3CO2D, δ, м.д., J/Гц): 0.87 (1H, д, J=10.5, Н-5), 0.90 (3H, с, CH3-24), 0.91 (6Н, с, CH3-23, CH3-25), 0.96 (3H, с, CH3-26), 1.03 (3H, с, CH3-27), 1.04 (1H, м, Ha-1), 1.10 (1Н, кд, J=13.0, 4.0, Ha-12), 1.19 (1H, м, Ha-15), 1.31 (1Н, кд, J=13.0, 4.0, Ha-11), 1.39 (2Н, м, Н-9, Ha-21), 1.46 (7Н, м, Ha-6, Hb-11, 2Н-7, Ha-16, Hb-15, Ha-22), 1.55 (1H, м, Hb-6), 1.66 (1H, т, J=11.0, Н-18), 1.71 (3H, с, CH3-30), 1.72 (4Н, м, Hb-1, Hb-12, 2H-2), 1.90 (2Н, м, Hb-21, Hb-22), 2.26 (1Н, м, Hb-16), 2.28 (1Н, тд, J=13.0, 4.0, Н-13), 2.38 (2Н, м, NCH2CH
2CH2SO3), 3.04 (3H, тд, J=11.0, 5.0, Н-19), 3.09 (2Н, т, J=6.5, NCH2CH2CH
2SO3), 3.38 (6Н, с, (N(CH3)2), 3.69 (3H, с, C(О)OCH
3), 3.84 (2Н, м, NCH
2CH2CH2SO3), 4.38 (1Н, д, J=16.8, ОС(O)CH2: Ha), 4.42 (1Н, д, J=16.8, OC(O)CH2: Hb), 4.63 (1H, с, Ha-29), 4.67 (1H, дд, J=5.3, 10.5, Н-3), 4.76 (1Н, с, Hb-29). Спектр ЯМР 13C (125.47 МГц, CD3CO2D, δ, м.д., J/Гц): 14.01 (C-27), 15.32 (C-25), 15.55 (C-26), 15.80 (C-24), 17.95 (C-6), 18.45 (NCH2
CH2CH2SO3), 20.74 (C-11), 23.26 (C-2), 25.45 (C-12), 27.30 (C-23), 29.48 (C-15), 30.32 (C-21), 31.83 (C-16), 33.99 (C-7), 36.58 (C-22), 36.89 (C-10), 37.66 (C-4), 38.04 (C-1), 38.18 (C-13), 40.54 (C-8), 42.21 (C-14), 46.97 (C-19), 47.34 (NCH2CH2
CH2SO3), 49.29 (C-18), 50.34(C-9), 50.91 (C(О)OCH3), 51.01, 51.05 (N(CH3)2)), 55.30 (C-5), 56.47 (C-17), 61.30 (ОС(O)CH2), 65.09 (NCH2CH2CH2SO3), 84.07 (C-3), 109.21 (C-29), 150.37 (C-20), 164.50 (ОС(O)CH2), 176.83 (C-28). Масс-спектр (ИЭР), m/z: 676 [M-H+]- (вычислено 677 для C38H63NO7S).
(с 0.41, HCOOH). ИК-спектр (ν, см-1): 712, 1036, 1182, 1207, 1222, 1377, 1645, 1719, 1734. Спектр ЯМР 1H (500.13 МГц, CD3CO2D, δ, м.д., J/Гц): 0.87 (1H, д, J=10.5, Н-5), 0.90 (3H, с, CH3-24), 0.91 (6Н, с, CH3-23, CH3-25), 0.96 (3H, с, CH3-26), 1.03 (3H, с, CH3-27), 1.04 (1H, м, Ha-1), 1.10 (1Н, кд, J=13.0, 4.0, Ha-12), 1.19 (1H, м, Ha-15), 1.31 (1Н, кд, J=13.0, 4.0, Ha-11), 1.39 (2Н, м, Н-9, Ha-21), 1.46 (7Н, м, Ha-6, Hb-11, 2Н-7, Ha-16, Hb-15, Ha-22), 1.55 (1H, м, Hb-6), 1.66 (1H, т, J=11.0, Н-18), 1.71 (3H, с, CH3-30), 1.72 (4Н, м, Hb-1, Hb-12, 2H-2), 1.90 (2Н, м, Hb-21, Hb-22), 2.26 (1Н, м, Hb-16), 2.28 (1Н, тд, J=13.0, 4.0, Н-13), 2.38 (2Н, м, NCH2CH
2CH2SO3), 3.04 (3H, тд, J=11.0, 5.0, Н-19), 3.09 (2Н, т, J=6.5, NCH2CH2CH
2SO3), 3.38 (6Н, с, (N(CH3)2), 3.69 (3H, с, C(О)OCH
3), 3.84 (2Н, м, NCH
2CH2CH2SO3), 4.38 (1Н, д, J=16.8, ОС(O)CH2: Ha), 4.42 (1Н, д, J=16.8, OC(O)CH2: Hb), 4.63 (1H, с, Ha-29), 4.67 (1H, дд, J=5.3, 10.5, Н-3), 4.76 (1Н, с, Hb-29). Спектр ЯМР 13C (125.47 МГц, CD3CO2D, δ, м.д., J/Гц): 14.01 (C-27), 15.32 (C-25), 15.55 (C-26), 15.80 (C-24), 17.95 (C-6), 18.45 (NCH2
CH2CH2SO3), 20.74 (C-11), 23.26 (C-2), 25.45 (C-12), 27.30 (C-23), 29.48 (C-15), 30.32 (C-21), 31.83 (C-16), 33.99 (C-7), 36.58 (C-22), 36.89 (C-10), 37.66 (C-4), 38.04 (C-1), 38.18 (C-13), 40.54 (C-8), 42.21 (C-14), 46.97 (C-19), 47.34 (NCH2CH2
CH2SO3), 49.29 (C-18), 50.34(C-9), 50.91 (C(О)OCH3), 51.01, 51.05 (N(CH3)2)), 55.30 (C-5), 56.47 (C-17), 61.30 (ОС(O)CH2), 65.09 (NCH2CH2CH2SO3), 84.07 (C-3), 109.21 (C-29), 150.37 (C-20), 164.50 (ОС(O)CH2), 176.83 (C-28). Масс-спектр (ИЭР), m/z: 676 [M-H+]- (вычислено 677 для C38H63NO7S).
Пример 10
4-((2-(17β-карбоксилуп-20(29)-ен-3β-илокси)-2-оксоэтил)диметиламмоний)бутан-1-сульфонат (2а). К суспензии 0.10 г (0.185 ммоль) амина (6) в 3 мл безводн. CH3CN в атмосфере Ar добавляли по каплям раствор 0.17 мл (1.661 ммоль) 1,4-бутансультона в 1.0 мл безводн. CH3CN, кипятили 30 ч. Выпавший осадок сульфобетаина (2а) отфильтровывали, промывали CH3CN (5 мл × 5), высушивали в вакууме (2 мм рт.ст., 80°C, 6 ч). Получили 0.06 г (48%) соединения (2а). Т.пл. 288-290°C. 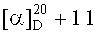 (0.31, HCOOH). ИК-спектр (ν, см-1): 794, 1307, 1151, 1193, 1204, 1640, 1725, 1743, 3440. Спектр ЯМР 1H (500.13 МГц, CD3CO2D, δ, м.д., ТМС, J/Гц): 0.86 (1H, м, Н-5), 0.89 (3H, с, CH3-24), 0.91 (6Н, с, CH3-23, CH3-25), 0.99 (3H, с, CH3-26), 1.04 (3H, с, CH3-27), 1.06 (1Н, м, Ha-1), 1.10 (1Н, м, Ha-12), 1.20 (1H, д, J=12.0, Ha-15), 1.31 (1Н, м, Ha-11), 1.40 (1H, м, Н-9), 1.42 (1Н, м, Ha-21), 1.45 (2Н, м, 2Н-7), 1.48 (3H, м, Ha-6, Hb-11, Ha-16), 1.51 (1Н, м, Ha-22), 1.56 (2Н, м, Hb-6, Hb-15), 1.65 (1Н, м, Н-18), 1.72 (5Н, с, 2Н-2, CH3-30), 1.75 (2Н, м, Hb-1, Hb-12), 1.90 (2Н, м, NCH2CH2CH
2CH2SO3), 2.00 (2Н, м, Hb-21, Hb-22), 2.07 (2Н, м, NCH2CH
2CH2CH2SO3), 2.30 (2Н, м, Н-13, Hb-16), 3.06 (3H, м, Н-19, NCH2CH2CH2CH
2SO3), 3.37 (6Н, с, (N(CH3)2), 3.65 (2Н, м, NCH
2CH2CH2CH2SO3), 4.36 (1H, д, J=17.0, ОС(O)CH2:Ha), 4.42 (1Н, д, J=17.0, OC(O)CH2:Nb), 4.63 (1H, с, Ha-29), 4.68 (1Н, дд, J=5.3, 10.5, Н-3), 4.77 (1Н, с, Hb-29). Спектр ЯМР 13C (125.47 МГц, CD3CO2D, δ, м.д., ТМС, J/Гц): 13.97 (C-27), 15.35 (C-25), 15.55 (C-26), 15.80 (C-24), 17.94 (C-6), 18.43 (C-30), 20.72 (C-11), 20.82 (NCH2
CH2CH2CH2SO3), 21.04 (NCH2CH2
CH2CH2SO3), 23.28 (C-2), 25.40 (C-12), 27.30 (C-23), 29.46 (C-15), 30.27 (C-21), 31.78 (C-16), 33.99 (C-7), 36.73 (C-22), 36.88 (C-10), 37.66 (C-4), 38.04 (C-1), 38.28 (C-13), 40.56 (C-8), 42.26 (C-14), 46.95 (C-19), 49.02 (C-18), 49.78 (NCH2CH2CH2
CH2SO3), 50.33 (C-9), 51.19, 51.29 (N(CH3)2)), 55.30 (C-5), 56.24 (C-17), 61.24 (ОС(О)CH2), 65.77 (NCH2CH2CH2CH2SO3), 84.06 (C-3), 109.36 (C-29), 150.25 (C-20), 164.58 (ОС(O)CH2), 182.04 (C-28). Масс-спектр (ИЭР), m/z: 678 [М+Н]+ (вычислено 677 для C38H63NO7S).
(0.31, HCOOH). ИК-спектр (ν, см-1): 794, 1307, 1151, 1193, 1204, 1640, 1725, 1743, 3440. Спектр ЯМР 1H (500.13 МГц, CD3CO2D, δ, м.д., ТМС, J/Гц): 0.86 (1H, м, Н-5), 0.89 (3H, с, CH3-24), 0.91 (6Н, с, CH3-23, CH3-25), 0.99 (3H, с, CH3-26), 1.04 (3H, с, CH3-27), 1.06 (1Н, м, Ha-1), 1.10 (1Н, м, Ha-12), 1.20 (1H, д, J=12.0, Ha-15), 1.31 (1Н, м, Ha-11), 1.40 (1H, м, Н-9), 1.42 (1Н, м, Ha-21), 1.45 (2Н, м, 2Н-7), 1.48 (3H, м, Ha-6, Hb-11, Ha-16), 1.51 (1Н, м, Ha-22), 1.56 (2Н, м, Hb-6, Hb-15), 1.65 (1Н, м, Н-18), 1.72 (5Н, с, 2Н-2, CH3-30), 1.75 (2Н, м, Hb-1, Hb-12), 1.90 (2Н, м, NCH2CH2CH
2CH2SO3), 2.00 (2Н, м, Hb-21, Hb-22), 2.07 (2Н, м, NCH2CH
2CH2CH2SO3), 2.30 (2Н, м, Н-13, Hb-16), 3.06 (3H, м, Н-19, NCH2CH2CH2CH
2SO3), 3.37 (6Н, с, (N(CH3)2), 3.65 (2Н, м, NCH
2CH2CH2CH2SO3), 4.36 (1H, д, J=17.0, ОС(O)CH2:Ha), 4.42 (1Н, д, J=17.0, OC(O)CH2:Nb), 4.63 (1H, с, Ha-29), 4.68 (1Н, дд, J=5.3, 10.5, Н-3), 4.77 (1Н, с, Hb-29). Спектр ЯМР 13C (125.47 МГц, CD3CO2D, δ, м.д., ТМС, J/Гц): 13.97 (C-27), 15.35 (C-25), 15.55 (C-26), 15.80 (C-24), 17.94 (C-6), 18.43 (C-30), 20.72 (C-11), 20.82 (NCH2
CH2CH2CH2SO3), 21.04 (NCH2CH2
CH2CH2SO3), 23.28 (C-2), 25.40 (C-12), 27.30 (C-23), 29.46 (C-15), 30.27 (C-21), 31.78 (C-16), 33.99 (C-7), 36.73 (C-22), 36.88 (C-10), 37.66 (C-4), 38.04 (C-1), 38.28 (C-13), 40.56 (C-8), 42.26 (C-14), 46.95 (C-19), 49.02 (C-18), 49.78 (NCH2CH2CH2
CH2SO3), 50.33 (C-9), 51.19, 51.29 (N(CH3)2)), 55.30 (C-5), 56.24 (C-17), 61.24 (ОС(О)CH2), 65.77 (NCH2CH2CH2CH2SO3), 84.06 (C-3), 109.36 (C-29), 150.25 (C-20), 164.58 (ОС(O)CH2), 182.04 (C-28). Масс-спектр (ИЭР), m/z: 678 [М+Н]+ (вычислено 677 для C38H63NO7S).
Пример 11
4-((2-(17β-метоксикарбониллуп-20(29)-ен-3β-илокси)-2-оксоэтил)диметиламмоний)бутан-1-сульфонат (2б). Получен аналогично соединению (2а) из 0.11 г (0.202 ммоль) соединения (7) и 0.20 мл (2.02 ммоль) 1,4-бутансультона. Выход 0.054 г (39%) соединения (2б). Т.пл. 283-286°C. 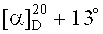 (с 0.28, HCOOH). ИК-спектр (ν, см-1): 1040, 1136, 1166, 1203, 1650, 1729. Спектр ЯМР 1H (500.13 МГц, CD3CO2D, δ, м.д., ТМС, J/Гц): 0.86 (1Н, д, J=10, Н-5), 0.88 (3H, с, CH3-24), 0.90 (6Н, с, CH3-23, CH3-25), 0.95 (3H, с, CH3-26), 1.02 (3H, с, CH3-27), 1.05 (1H, м, Ha-1), 1.10 (1H, м, Ha-12), 1.20 (1H, м, Ha-15), 1.30 (1Н, м, Ha-11), 1.39 (2Н, м, Н-9, Ha-21), 1.45 (7Н, м, Ha-6, 2Н-7, Hb-11, Hb-15, Ha-16, Ha-22), 1.52 (1Н, м, Hb-6), 1.65 (1Н, м, Н-18), 1.71 (3H, с, CH3-30), 1.73 (4Н, м, Hb-1, 2Н-2, Hb-12), 1.90 (4Н, м, NCH2CH
2CH2CH2SO3, Hb-21,Hb-22), 2.06 (2Н, м, NCH2CH
2CH2CH2SO3), 2.24 (2Н, м, Н-13, Hb-16), 3.03 (3H, м, Н-19, NCH2CH2CH2CH
2SO3), 3.34 (6Н, с, (N(CH3)2), 3.64 (2Н, м, NCH
2CH2CH2CH2SO3), 3.68 (3H, с, С(O)OCH3), 4.36 (1Н, д, J=17.0, ОС(O)CH2:Ha), 4.39 (1H, д, J=17.0, ОС(O)CH2:Nb), 4.61 (1Н, с, Ha-29), 4.66 (1Н, дд, J=5.3, 10.5, Н-3,), 4.73 (1Н, с, Hb-29). Спектр ЯМР 13C (125.47 МГц, CD3COOD, δ, м.д., ТМС, J/Гц): 14.06 (C-27), 15.36 (C-25), 15.61 (C-26), 15.86 (C-24), 17.99 (C-6), 18.51 (C-30), 20.77 (C-11), 20.92 (NCH2
CH2CH2CH2SO3), 21.14 (NCH2CH2
CH2CH2SO3), 23.30 (C-2), 25.45 (C-12), 27.35 (C-23), 29.52 (C-15), 30.35 (C-21), 31.86 (C-16), 34.02 (C-7), 36.62 (C-22), 36.93 (C-10), 37.70 (C-4), 38.08 (C-1), 38.22 (C-13), 40.58 (C-8), 42.25 (C-14), 47.01 (C-19), 49.31 (C-18), 49.93 (NCH2CH2CH2
CH2SO3), 50.38 (C-9), 50.97 (CO2
CH3), 51.22, 51.31 (N(CH3)2)), 55.35 (C-5), 56.50 (C-17), 61.29 (ОС(O)CH
2), 65.79 (NCH2CH2CH2CH2SO3), 84.06 (C-3), 109.33 (C-29), 150.41 (C-20), 164.62 (ОС(O)CH2), 176.89 (C-28). Масс-спектр (ИЭР), m/z: 714 [M+Na]+ (вычислено 691 для C39H65NO7S).
(с 0.28, HCOOH). ИК-спектр (ν, см-1): 1040, 1136, 1166, 1203, 1650, 1729. Спектр ЯМР 1H (500.13 МГц, CD3CO2D, δ, м.д., ТМС, J/Гц): 0.86 (1Н, д, J=10, Н-5), 0.88 (3H, с, CH3-24), 0.90 (6Н, с, CH3-23, CH3-25), 0.95 (3H, с, CH3-26), 1.02 (3H, с, CH3-27), 1.05 (1H, м, Ha-1), 1.10 (1H, м, Ha-12), 1.20 (1H, м, Ha-15), 1.30 (1Н, м, Ha-11), 1.39 (2Н, м, Н-9, Ha-21), 1.45 (7Н, м, Ha-6, 2Н-7, Hb-11, Hb-15, Ha-16, Ha-22), 1.52 (1Н, м, Hb-6), 1.65 (1Н, м, Н-18), 1.71 (3H, с, CH3-30), 1.73 (4Н, м, Hb-1, 2Н-2, Hb-12), 1.90 (4Н, м, NCH2CH
2CH2CH2SO3, Hb-21,Hb-22), 2.06 (2Н, м, NCH2CH
2CH2CH2SO3), 2.24 (2Н, м, Н-13, Hb-16), 3.03 (3H, м, Н-19, NCH2CH2CH2CH
2SO3), 3.34 (6Н, с, (N(CH3)2), 3.64 (2Н, м, NCH
2CH2CH2CH2SO3), 3.68 (3H, с, С(O)OCH3), 4.36 (1Н, д, J=17.0, ОС(O)CH2:Ha), 4.39 (1H, д, J=17.0, ОС(O)CH2:Nb), 4.61 (1Н, с, Ha-29), 4.66 (1Н, дд, J=5.3, 10.5, Н-3,), 4.73 (1Н, с, Hb-29). Спектр ЯМР 13C (125.47 МГц, CD3COOD, δ, м.д., ТМС, J/Гц): 14.06 (C-27), 15.36 (C-25), 15.61 (C-26), 15.86 (C-24), 17.99 (C-6), 18.51 (C-30), 20.77 (C-11), 20.92 (NCH2
CH2CH2CH2SO3), 21.14 (NCH2CH2
CH2CH2SO3), 23.30 (C-2), 25.45 (C-12), 27.35 (C-23), 29.52 (C-15), 30.35 (C-21), 31.86 (C-16), 34.02 (C-7), 36.62 (C-22), 36.93 (C-10), 37.70 (C-4), 38.08 (C-1), 38.22 (C-13), 40.58 (C-8), 42.25 (C-14), 47.01 (C-19), 49.31 (C-18), 49.93 (NCH2CH2CH2
CH2SO3), 50.38 (C-9), 50.97 (CO2
CH3), 51.22, 51.31 (N(CH3)2)), 55.35 (C-5), 56.50 (C-17), 61.29 (ОС(O)CH
2), 65.79 (NCH2CH2CH2CH2SO3), 84.06 (C-3), 109.33 (C-29), 150.41 (C-20), 164.62 (ОС(O)CH2), 176.89 (C-28). Масс-спектр (ИЭР), m/z: 714 [M+Na]+ (вычислено 691 для C39H65NO7S).
Пример 12
4-((2-(3β-Гидроксилуп-20(29)-ен-17β-карбонилокси)этил)диметиламмоний)бутан-1-сульфонат (3). Получен аналогично сульфобетаину (2а) из 0.12 г (0.224 ммоль) соединения (8) и 0.20 мл (2.02 ммоль) 1,4-бутансультона. Выход 0.04 г (27%) соединения (3). Т.пл. 265-267°C. 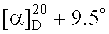 (с 0.4, HCOOH). ИК-спектр (ν, см-1): 1036, 1037, 1166, 1212, 1650, 1726, 3414. Спектр ЯМР 1H (500.13 МГц, CD3CO2D, δ, м.д., J/Гц): 0.68 (1Н, д, J=10.0, Н-5), 0.78 (3H, с, CH3-24), 0.86 (3H, с, CH3-25), 0.95 (4Н, с, CH3-26, Ha-1), 0.96 (6Н, с, CH3-23), 1.02 (3H, с, CH3-27), 1.08 (1H, м, Ha-12), 1.25 (2Н, м, Ha-15, Ha-11), 1.40 (1Н, м, Н-9), 1.43 (6Н, м, Ha-6, 2Н-7, Hb-15, Hb-11, Ha-21), 1.54 (3H, м, Hb-6, Ha-16, Ha-22), 1.65 (1Н, м, Н-18), 1.68 (2Н, м, Н-2), 1.70 (4Н, с, Hb-1, CH3-30), 1.74 (1Н, м, Hb-12), 1.92 (4Н, м, Hb-21, Hb-22, NCH2CH
2CH2CH2SO3), 2.05 (2Н, м, NCH2CH2CH
2CH2SO3), 2.23 (1Н, д, J=13.7, Hb-16), 2.28 (1H, дт, J=3.5, 12.5, Н-13), 3.02 (1Н, дт, J=5.5, 11.5, Н-19), 3.07 (2Н, т, J=7.5, NCH2CH2CH2CH
2SO3), 3.23 (6Н, с, (N(CH3)2), 3.26 (1Н, дд, J=5.5, 10.5, Н-3), 3.54 (2Н, м, NCH
2CH2CH2CH2SO3), 3.78 (2Н, уш.с, С(O)OCH2
CH2), 4.59 (1H, д, J=14.0, С(O)OCH2
CH2:Ha), 4.63 (1Н, с, Ha-29), 4.65 (1Н, д, J=14.0, C(O)OCH2
CH2:Hb), 4.76 (1Н, с, Hb-29). Спектр ЯМР 13С (125.47 МГц, CD3CO2D, δ, м.д., J/Гц): 15.09 (C-27), 16.09 (C-24), 16.62 (C-25), 16.70 (C-26), 19.23 (C-6), 19.41 (C-30), 21.86 (C-11), 21.95 (NCH2
CH2CH2CH2SO3), 22.28 (NCH2CH2
CH2CH2SO3), 26.56 (C-12), 27.42 (C-2), 28.45 (C-23), 30.70 (C-15), 31.28 (C-21), 32.71 (C-16), 35.31 (C-7), 37.46 (C-22), 38.06 (C-10), 39.21 (C-13), 39.62 (C-1), 39.62 (C-4), 41.71 (C-8), 43.46 (C-14), 48.01 (C-19), 50.40 (C-18), 51.01 (NCH2CH2CH2
CH2SO3), 51.62 (C-9), 52.22 (N(CH3)2)), 56.49 (C-5), 57.57 (C-17), 58.53 (С(O)OCH2
CH2), 64.00 (С(O)OCH2
CH2), 66.24 (NCH2CH2CH2CH2SO3), 80.18 (C-3), 110.67 (C-29), 151.23 (C-20), 176.34 (C-28). Масс-спектр (ИЭР), m/z: 664 [М+Н]+ (вычислено 663 для C38H65NO6S).
(с 0.4, HCOOH). ИК-спектр (ν, см-1): 1036, 1037, 1166, 1212, 1650, 1726, 3414. Спектр ЯМР 1H (500.13 МГц, CD3CO2D, δ, м.д., J/Гц): 0.68 (1Н, д, J=10.0, Н-5), 0.78 (3H, с, CH3-24), 0.86 (3H, с, CH3-25), 0.95 (4Н, с, CH3-26, Ha-1), 0.96 (6Н, с, CH3-23), 1.02 (3H, с, CH3-27), 1.08 (1H, м, Ha-12), 1.25 (2Н, м, Ha-15, Ha-11), 1.40 (1Н, м, Н-9), 1.43 (6Н, м, Ha-6, 2Н-7, Hb-15, Hb-11, Ha-21), 1.54 (3H, м, Hb-6, Ha-16, Ha-22), 1.65 (1Н, м, Н-18), 1.68 (2Н, м, Н-2), 1.70 (4Н, с, Hb-1, CH3-30), 1.74 (1Н, м, Hb-12), 1.92 (4Н, м, Hb-21, Hb-22, NCH2CH
2CH2CH2SO3), 2.05 (2Н, м, NCH2CH2CH
2CH2SO3), 2.23 (1Н, д, J=13.7, Hb-16), 2.28 (1H, дт, J=3.5, 12.5, Н-13), 3.02 (1Н, дт, J=5.5, 11.5, Н-19), 3.07 (2Н, т, J=7.5, NCH2CH2CH2CH
2SO3), 3.23 (6Н, с, (N(CH3)2), 3.26 (1Н, дд, J=5.5, 10.5, Н-3), 3.54 (2Н, м, NCH
2CH2CH2CH2SO3), 3.78 (2Н, уш.с, С(O)OCH2
CH2), 4.59 (1H, д, J=14.0, С(O)OCH2
CH2:Ha), 4.63 (1Н, с, Ha-29), 4.65 (1Н, д, J=14.0, C(O)OCH2
CH2:Hb), 4.76 (1Н, с, Hb-29). Спектр ЯМР 13С (125.47 МГц, CD3CO2D, δ, м.д., J/Гц): 15.09 (C-27), 16.09 (C-24), 16.62 (C-25), 16.70 (C-26), 19.23 (C-6), 19.41 (C-30), 21.86 (C-11), 21.95 (NCH2
CH2CH2CH2SO3), 22.28 (NCH2CH2
CH2CH2SO3), 26.56 (C-12), 27.42 (C-2), 28.45 (C-23), 30.70 (C-15), 31.28 (C-21), 32.71 (C-16), 35.31 (C-7), 37.46 (C-22), 38.06 (C-10), 39.21 (C-13), 39.62 (C-1), 39.62 (C-4), 41.71 (C-8), 43.46 (C-14), 48.01 (C-19), 50.40 (C-18), 51.01 (NCH2CH2CH2
CH2SO3), 51.62 (C-9), 52.22 (N(CH3)2)), 56.49 (C-5), 57.57 (C-17), 58.53 (С(O)OCH2
CH2), 64.00 (С(O)OCH2
CH2), 66.24 (NCH2CH2CH2CH2SO3), 80.18 (C-3), 110.67 (C-29), 151.23 (C-20), 176.34 (C-28). Масс-спектр (ИЭР), m/z: 664 [М+Н]+ (вычислено 663 для C38H65NO6S).
Структура соединений (1), (2а, б), (3) установлена методами ИК-, ЯМР-спектроскопии и масс-спектрометрии. Полное отнесение сигналов в спектрах ЯМР 1H и 13C проведено с использованием стандартного пакета 1D и 2D программ спектрометра "Bruker" Avance III (500.13 МГц (1H) и 125.47 МГц (13C)). В эксперименте использовали коммерческие 1,3-пропансультон (99%, «abcr GmbH & Co. KG»), 1,4-бутансультон (>99%, «Aldrich»), N,N-диметиламин (40% водн. «Fluka») и 2-хлоруксусную кислоту (99%, «Acros organics»).