Результат интеллектуальной деятельности: 2-МЕТОКСИ-ПИРИДИН-4-ИЛЬНЫЕ ПРОИЗВОДНЫЕ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
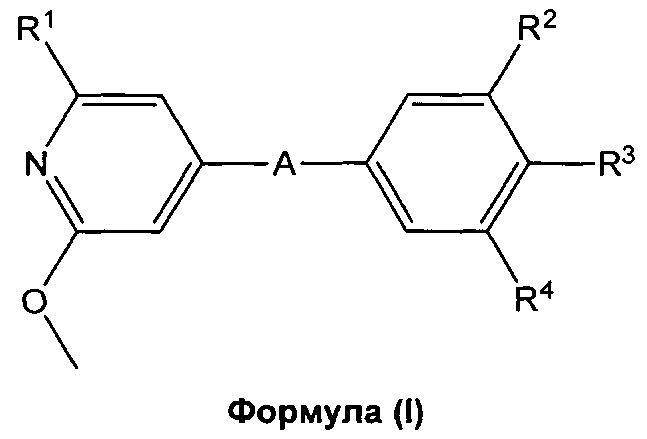
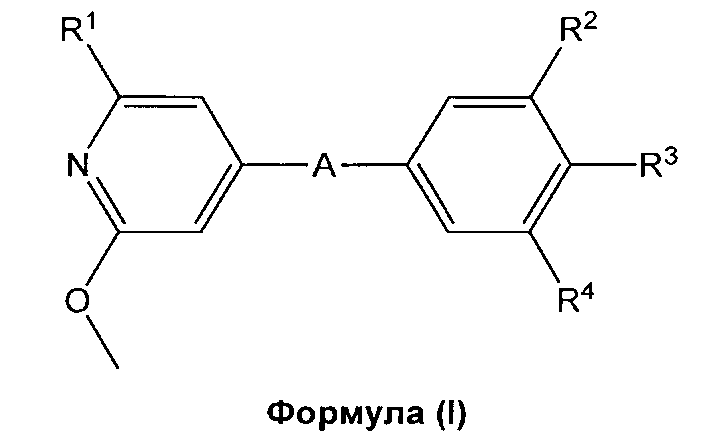
Настоящее изобретение относится к агонистам рецептора S1P1/EDG1 формулы (I), и к их применению в качестве активных компонентов при получении фармацевтических композиций. Изобретение также касается связанных аспектов, в том числе способов получения соединений, фармацевтических композиций, содержащих соединение формулы (I), и их применения в качестве соединений, улучшающих сосудистую функцию и в качестве иммуномодулирующих агентов, отдельно или в комбинации с другими активными соединениями или типами терапии.
Предпосылки к созданию изобретения
Иммунная система человека предназначена для защиты организма от инородных микроорганизмов и веществ, которые являются причиной инфекции и заболевания. Сложные регуляторные механизмы обеспечивают то, чтобы иммунный ответ направлялся на вторгшееся вещество или организм, а не на хозяина. В некоторых случаях, указанные контрольные механизмы становятся разрегулированными и могут развиваться аутоиммунные реакции. Результатом неконтролируемого воспалительного ответа является тяжелое повреждение органа, клеток, ткани или сустава. В процессе лечения, обычно происходит подавление всей иммунной системы и способность организма реагировать на инфекции также существенно снижается. Типичные лекарственные средства указанного класса включают азатиоприн, хлорамбуцил, циклофосфамид, циклоспорин, или метотрексат. Кортикостероиды, которые ослабляют воспаление и подавляют иммунный ответ, могут вызывать побочные явления при применении для лечения в течении длительного времени. Нестероидные противовоспалительные лекарственные средства (NSAID) могут снижать боль и воспаление, однако, они демонстрируют значительные побочные явления. Альтернативные способы лечения включают агенты, которые активируют или блокируют сигнальный путь цитокинов.
Пероральные активные соединения, обладающие иммуномодулирующими свойствами, не подавляющие ответные иммунные реакции и имеющие ослабленные побочные явления, позволят существенно улучшить текущие способы лечения разрегулированных воспалительных заболеваний.
В области трансплантации органов, для того, чтобы предотвратить отторжение органа, иммунный ответ хозяина должен быть подавлен. У реципиентов органа-трансплантата может наблюдаться определенное отторжение даже в том случае, если ни получают иммунодепрессантные лекарственные средства. Наиболее часто отторжение происходит в течение первых нескольких недель после трансплантации, но случаи отторжения могут также наблюдаться в течение месяцев или даже лет после трансплантации. Для обеспечения максимальной защиты против отторжения при сведении к минимуму побочных явлений обычно используют комбинации, включающие до трех или четырех лекарственных средств. Стандартные лекарственные средства, которые используются в настоящее время для лечения отторжения трансплантированных органов, оказывают воздействие на отдельные внутриклеточные пути активации лейкоцитов типа Т или типа В. Примерами таких лекарственных средств являются циклоспорин, даклизумаб, базиликсимаб, эверолимус или FK506, которые препятствуют высвобождению цитокина или подавляют соответствующий сигнальный путь; азатиоприн или лефлуномид, которые ингибируют синтез нуклеотидов; или 15-дезоксиспергуалин, ингибитор дифференциации лейкоцитов.
Благоприятное действие неспецифичных иммунодепрессантных типов терапии связано с их действиями; однако, общее подавление иммунитета, которое осуществляют указанные лекарственные средства, снижает защитную реакцию иммунной системы на инфекцию или злокачественные новообразования. Кроме того, стандартные иммунодепрессантные лекарственные средства часто применяются в высоких дозах и могут вызывать или ускорять повреждение органа.
Описание изобретения
Настоящее изобретение обеспечивает новые соединения формулы (I), которые являются агонистами сопряженного с G-белком рецептора S1P1/EDG1 и обладают сильным и продолжительным иммуномодулирующим действием, которое достигается за счет снижения числа циркулирующих и инфильтрующихся Т- и В-лимфоцитов, без влияния на процессы созревания, памяти или роста лимфоцитов. Снижение циркулирующих Т-/В-лимфоцитов в результате S1P1/EDG1 агонизма, возможно в комбинации с наблюдаемым улучшением функционирования слоя эндотелиальных клеток, связанным с активацией S1P1/EDG1, делает такие соединения пригодными лечения неконтролируемых воспалительных заболеваний и для улучшения сосудистой функции. Документ известного уровня техники WO 2008/029371 (документ D1) раскрывает соединения, которые действуют в качестве агонистов рецептора S1P1/EDG1 и демонстрируют иммуномодулирующее действие, как описано выше. Неожиданно было обнаружено, что соединения настоящего изобретения обладают пониженным потенциалом сжимать ткани дыхательных путей/сосудов по сравнению с соответствующими аналогами, в общем заявленными в документе известного уровня техники D1. Следовательно, соединения настоящего изобретения демонстрируют превосходство относительно их профиля безопасности, например, более низкий риск бронхоконстрикции.
Соединения в общем заявленные в D1 (соединения 1-4, 7 и 10) и соединения 5, 6, 8, 9 и 11, которые могут рассматриваться в качестве близких аналогов примеров 1-4, 7, 45, 5, 6, 35, 41 и 50, соответственно, показаны на Фигуре 1.
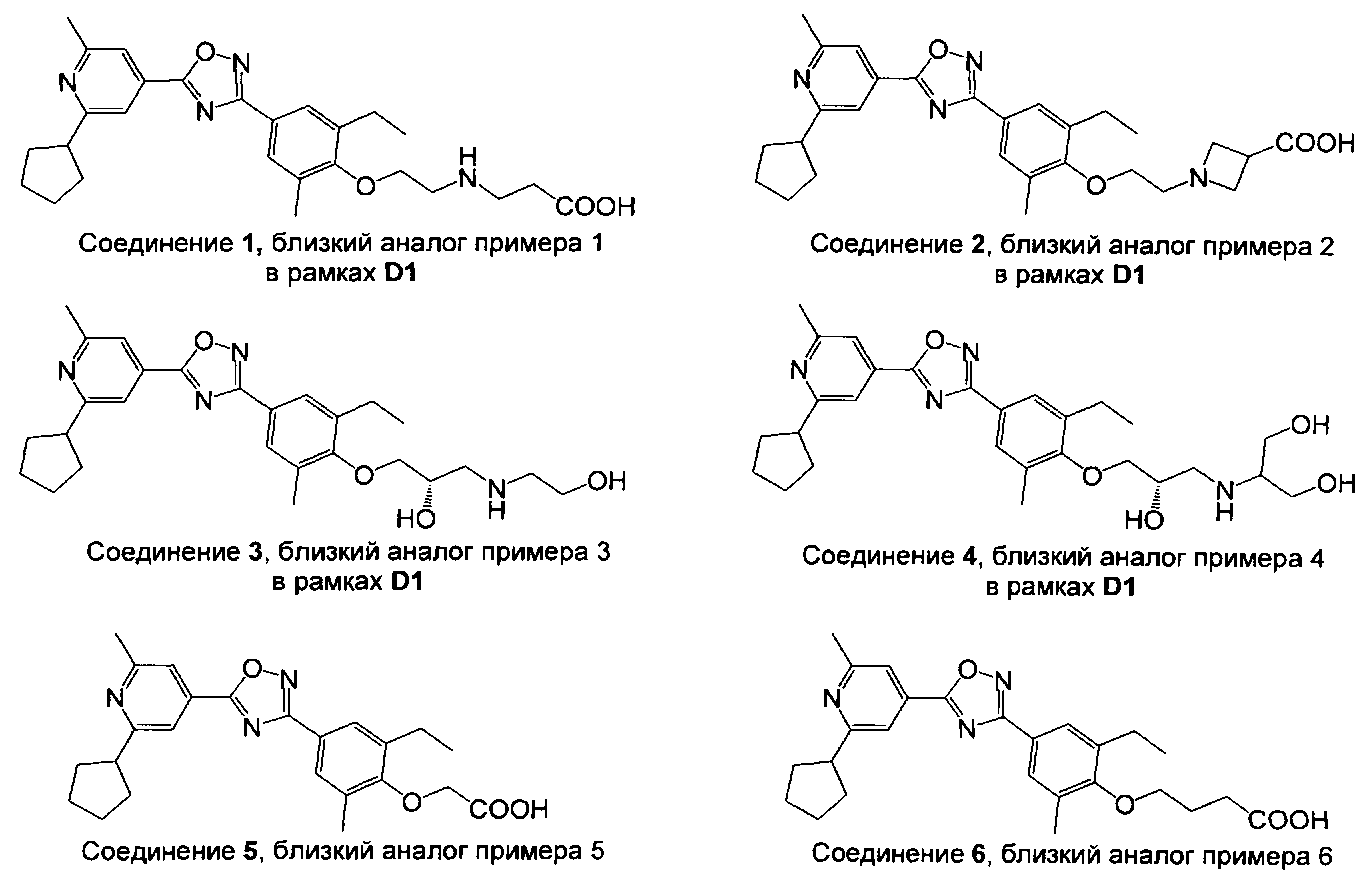
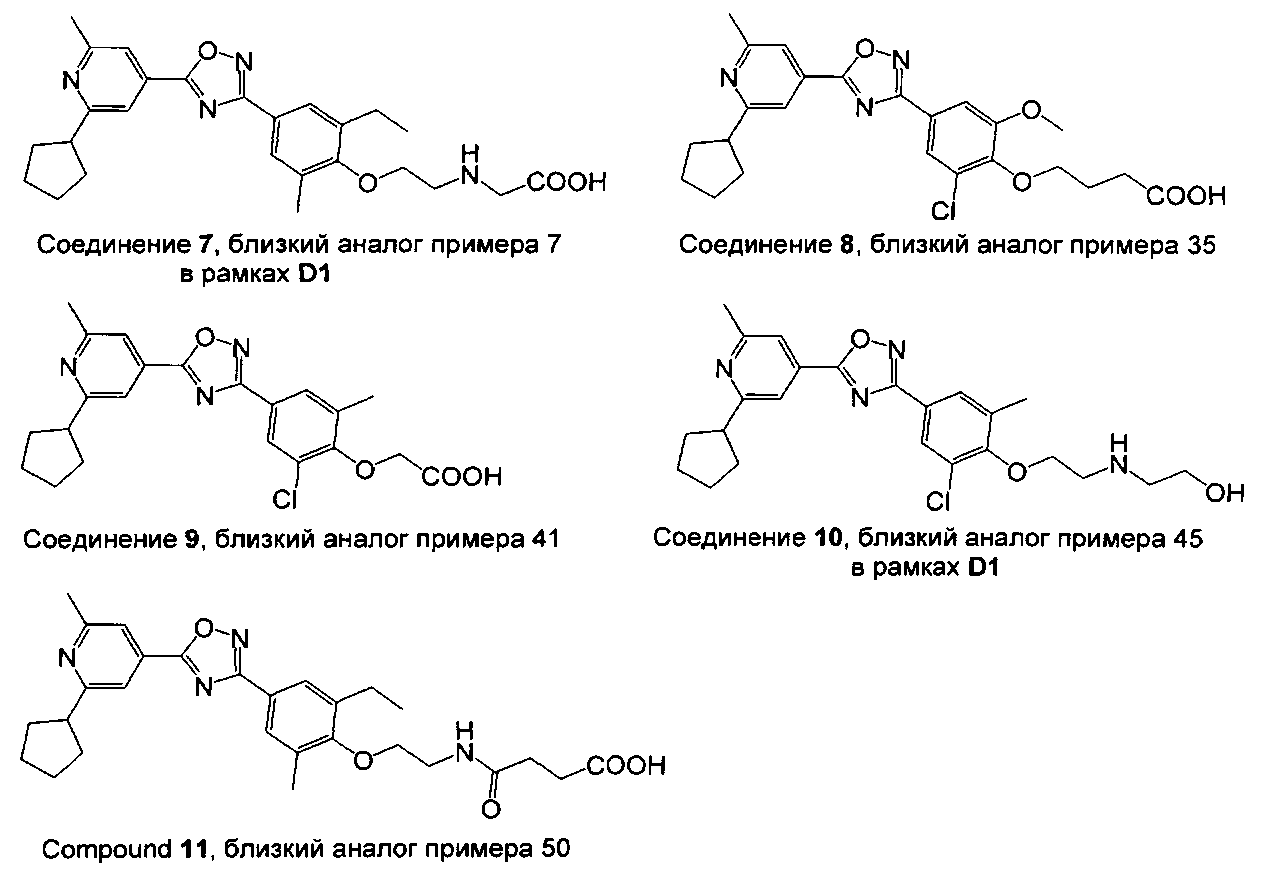
Фигура 1: Структуры соединений, которые являются близким аналогами соединений настоящего изобретения.
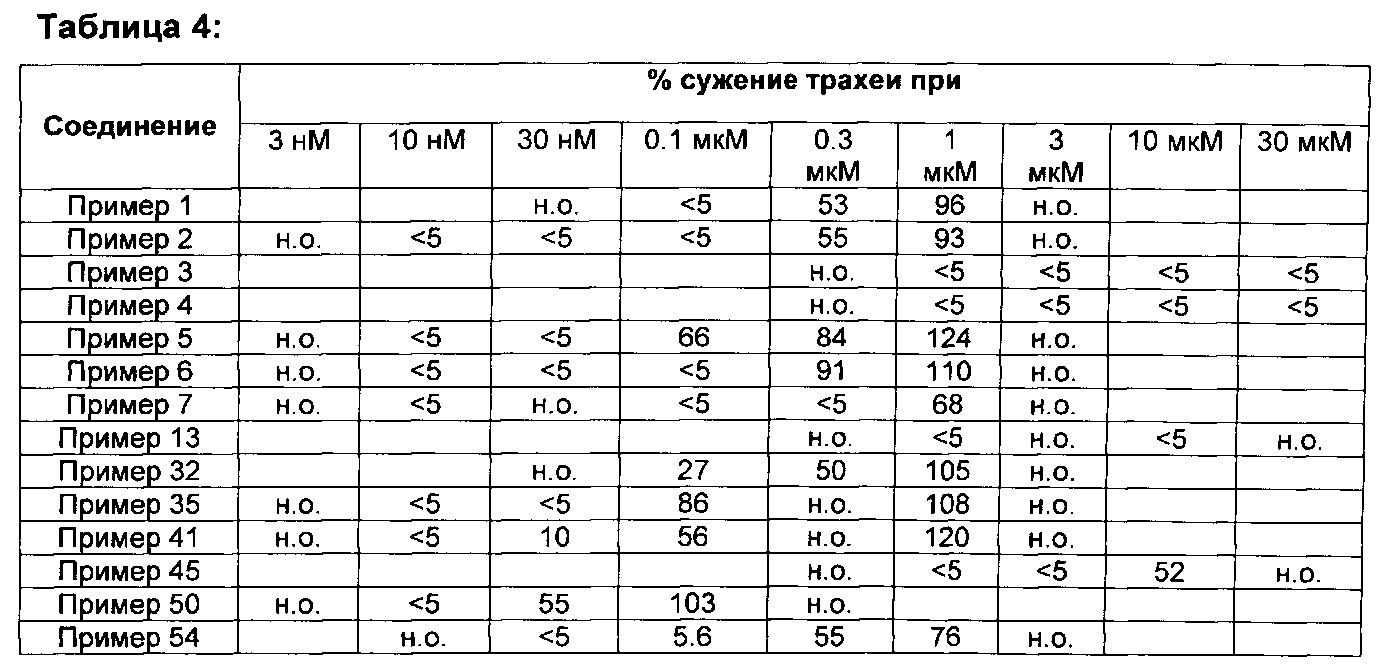
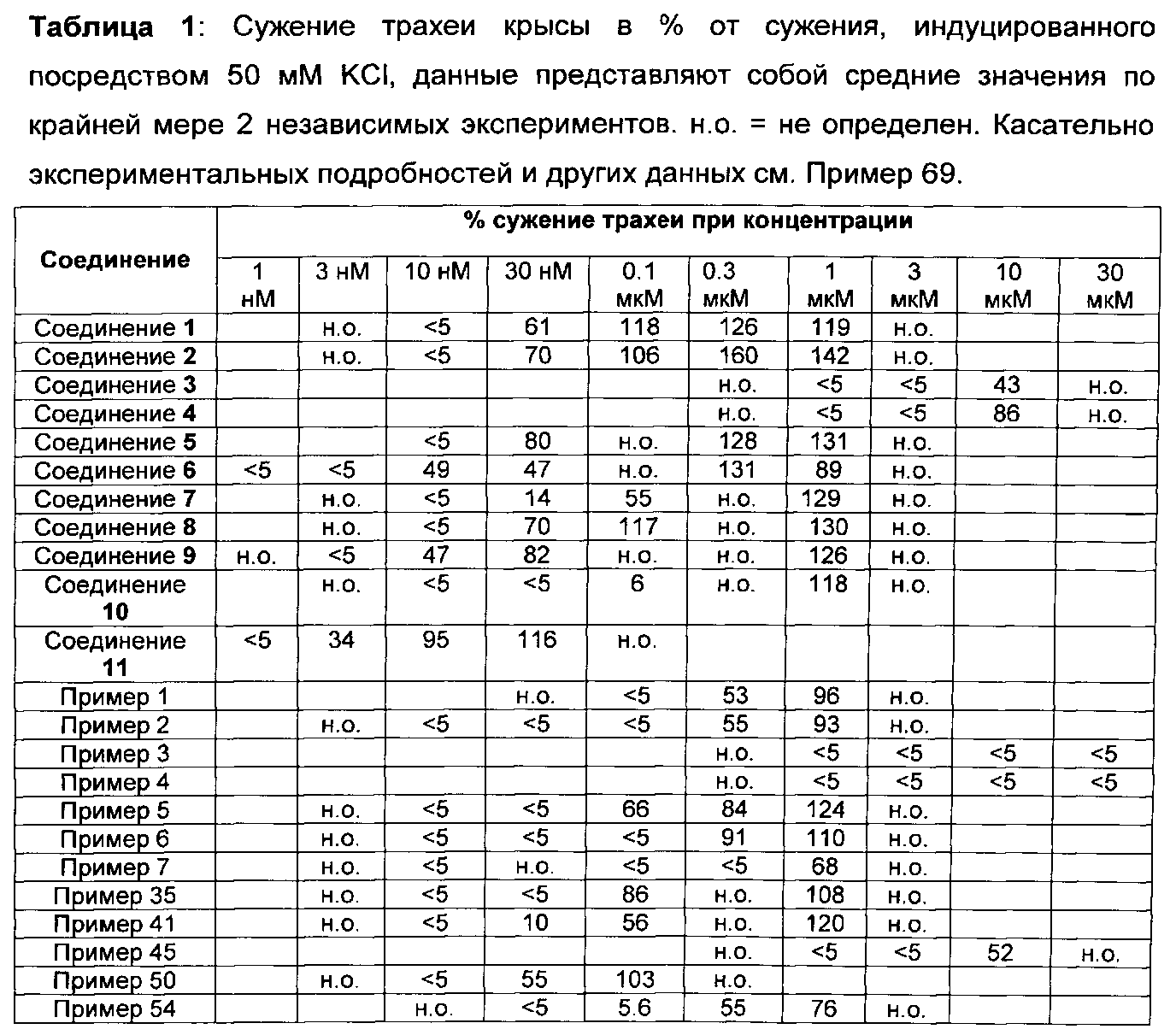
Данные относительно сужения кольца трахеи крысы, сведенные в таблицу 1, иллюстрируют превосходство соединений настоящего изобретения по сравнению с соединениями, подпадающих под объем документа известного уровня техники D1.
Например, соединения примеров 1 и 2 настоящего изобретения показывают значительно сниженный потенциал сужения кольца трахеи крысы по сравнению с их близкими аналогами, соединением 1 и соединением 2, соответственно, вышеуказанные аналоги подпадают под объем документа D1. В то время как соединение 1 и соединение 2 оба показывают значительное сужение трахеи крысы при концентрации 30 нМ, соединения примеров 1 и 2 показывают схожее действие только при концентрации, в 10 раз более высокой. Подобным образом, соединения примеров 3 и 4 настоящего изобретения показывают значительно сниженный потенциал сужения кольца трахеи крысы по сравнению с их близкими аналогами соединением 3 и соединением 4, соответственно, вышеуказанные аналоги подпадают под объем документа D1. В то время как соединение 3 и соединение 4, оба показывают значительное сужение трахеи крысы при концентрации 10 мкМ, соединения примеров 3 и 4 не инициируют какого-либо сужения до концентрации 30 мкМ. Концепция настоящего изобретения дополнительно подтверждается соединениями примеров 5 и 6. Соединения примеров 5 и 6 четко показывают сниженный потенциал сужать кольца трахеи крысы по сравнению с их соответствующими аналогами, соединением 5 и соединением 6, соответственно. Соединение 6, например, сужает кольца трахеи крысы уже при концентрации 10 нМ, в то время как соединение примера 6 показывает сопоставимое действие только при 300 нМ. Соединение примера 7 показывает значительное сужение при концентрация только 1 мкМ, в то время как его близкий аналог, в общем заявленный в D1, соединение 7, значительно сужает кольца трахеи при 100 нМ. При концентрации 100 нМ соединение примера 50 приводит к сужению трахеи, сопоставимому с таковым, индуцированным посредством 50 мМ KCl. Сопоставимое сужение наблюдается с соединением 11 уже при 10 нМ. Примеры, рассмотренные до сих пор, все имеют метил-этильную схему замещения на фенильном кольце. Следующие примеры демонстрируют, что концепция сниженного потенциала сужать кольца трахеи крысы распространяется на соединения с другими схемами замещения на фенильном кольце. Например, соединение 9, включающее хлор-метильную схему замещения на фенильном кольце, показывает значительное сужение трахеи при концентрациях 10 и 30 нМ, в то время как соединение примера 41 настоящего изобретения, не показывает вовсе или показывает только незначительное сужение при этих концентрациях. Подобным образом, полное сужение трахеи по сравнению с 50 мМ KCl, наблюдается при концентрации 1 мкМ соединения 10, в то время как соединение примера 45 показывает значительное сужение трахеи только при 10 мкМ. Примеры включения хлор-метокси схемы замещения на фенильном кольце показывают такое же поведение. Как указано ранее, метокси-пиридиновые соединения настоящего изобретения (например, соединение примера 35) показывают сниженный потенциал сужать кольца трахеи крысы по сравнению с их ближайшими метил-пиридиновыми аналогами (например, соединением 8). Соединение примера 54 означает оксадиазольный изомер примера 6. Как показано в таблице 1, эти два соединения имеют почти одинаковый потенциал сужать трахею красы, демонстрируя что природа оксадиазола не влияет на это свойство конкретного соединения.
Взятые вместе, данные, представленные в таблице 1 ясно демонстрируют, что 2-метокси-пиридиновые производные настоящего изобретения превосходят соответствующие 2-метил-пиридиновые аналоги, независимо от природы А и заместителей R2, R3 и R4 в формуле (I) (см. ниже).
Соединения настоящего изобретения можно использовать отдельно или в комбинации со стандартными лекарственными средствами, ингибирующими активацию Т-клеток, с обеспечением новой иммуномодулирующей терапии с пониженной предрасположенностью к инфекциям по сравнению со стандартной иммунодепрессантной терапией. Кроме того, соединения настоящего изобретения можно использовать в комбинации с пониженными дозами традиционных иммунодепрессантных средств, с обеспечением с одной стороны эффективного иммуномодулирующего действия, и, с другой стороны, уменьшения повреждения рецептора, связанного с высокими дозами стандартных иммунодепрессантных лекарственных средств. Наблюдаемое улучшение функционирования слоя эндотелиальных клеток, связанное с активацией S1P1/EDG1, обеспечивает дополнительные преимущества соединений для улучшения сосудистой функции.
Нуклеотидная последовательность и аминокислотная последовательность рецептора S1P1/EDG1 человека известны в данной области техники и опубликованы, например, в: Hla Т., и Maciag Т., J. Biol Chem. 265 (1990), 9308-9313; WO 91/15583, опуб. 17 октября 1991; WO 99/46277, опубл. 16 сентября 1999. Действенность и эффективность соединений формулы (I) оценивают с использованием анализа GTPYS для определения ЕС50 значений и путем измерения числа циркулирующих лимфоцитов у крыс после перорального введения, соответственно (см. в экспериментальной части).
i) В первом варианте осуществления, изобретение относится к пиридиновым соединеням формулы (I),
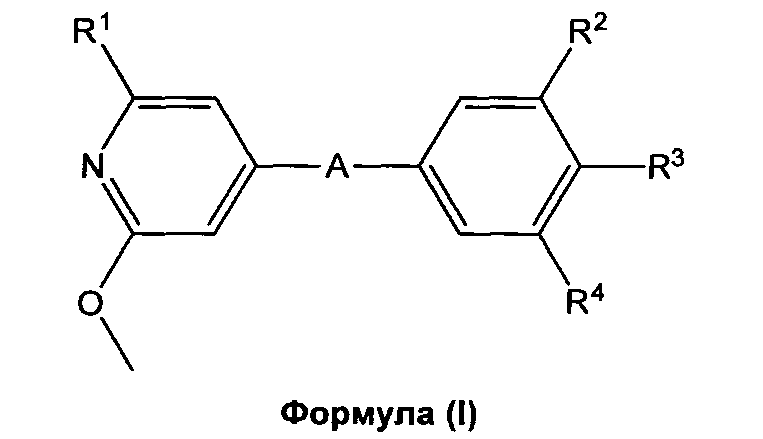
в которой
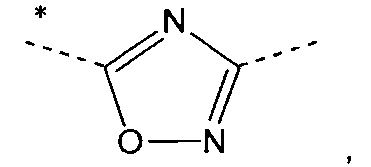
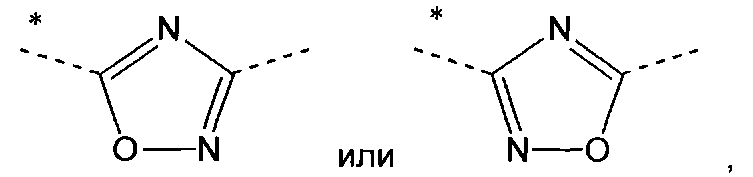
А означает
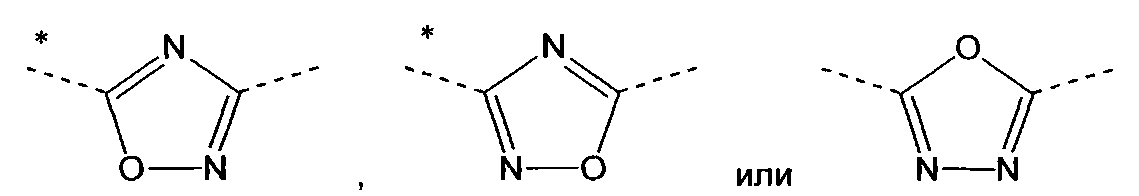
в которых звездочки указывают связь, которая присоединена к пиридиновой группе формулы (I);
R1 означает циклопентил;
R2 означает метил, и R4 означает этил или хлор; или
R2 означает метокси, и R4 означает хлор;
R3 означает -ОСН2СООН, -ОСН2СН2СН2СООН, -OCH2CONHCH2CH2OH, -OCH2CH2CH2CONHCH2CH2OH, -OCH2-(CH2)n-NH-(CH2)m-COOH, -OCH2-(CH2)n-N(CH3)-(CH2)m-COOH, 2-[(азетидин-3-карбоновая кислота)-1-ил]-этокси, 2-[(пирролидин-3-карбоновая кислота)-1-ил]-этокси, 3-[(азетидин-3-карбоновая кислота)-1-ил]-пропокси, 3-[(пирролидин-3-карбоновая кислота)-1-ил]-пропокси, -OCH2CH(OH)-CH2NH-CH2COOH, -OCH2CH(OH)-CH2NH-CH2CH2COOH, OCH2CH(OH)-CH2N(CH3)-CH2COOH, -OCH2CH(OH)-CH2N(CH3)-CH2CH2COOH, 3-[(азетидин-3-карбоновая кислота)-1-ил]-2-гидрокси-пропокси, 2-гидрокси-3-[(пирролидин-3-карбоновая кислота)-1-ил]-пропокси, -OCH2-(CH2)n-NH-СН2СН2ОН, -OCH2-(CH2)n-NH-CH(CH2OH)2, -OCH2-(CH2)n-NH-CH2CH(OH)-СН2ОН, -OCH2CH(OH)-CH2NH-CH2CH2OH, -OCH2CH(OH)-CH2NH-CH(CH2OH)2, -OCH2-(CH2)k-NH-CO-CH2OH, -OCH2-(CH2)n-NH-CO-CH2COOH, -OCH2-(CH2)n-NH-CO-CH2CH2COOH, -OCH2CH(OH)-CH2NH-CO-(CH2)nCOOH, -OCH2-(CH2)n-N(CH3)-CO-CH2OH, -OCH2-(CH2)n-N(CH3)-CO-CH2COOH, или -OCH2-(CH2)n-N(CH3)-CO-CH2CH2COOH;
n независимо означает 1 или 2;
m независимо означает 1, 2 или 3; и
k означает 1 или 2, как, например, особенно 2.
ii) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с вариантом осуществления i), где стереоцентр R3 группы 2-[(пирролидин-3-карбоновая кислота)- 1-ил]-этокси, 3-[(пирролидин-3-карбоновая кислота)-1-ил]-пропокси, -O-CH2CH(OH)-CH2NH-CH2COOH, OCH2CH(OH)-CH2NH-CH2CH2COOH, -OCH2CH(OH)-CH2N(CH3)-CH2COOH, -OCH2CH(OH)-CH2N(CH3)-CH2CH2COOH, 3-[(азетидин-3-карбоновая кислота)-1-ил]-2-гидрокси-пропокси, -OCH2-(CH2)n-NH-CH2CH(OH)-CH2OH, -ОСН2СН(ОН)-CH2NH-CH2CH2OH, -OCH2CH(OH)-CH2NH-CH(CH2OH)2, и -OCH2CH(OH)-CH2NH-СО-(СН2)nCOOH находится в S-конфигурации.
iii) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с вариантом осуществления i), где стереоцентр R3 группы 2-[(пирролидин-3-карбоновая кислота)-1-ил]-этокси, 3-[(пирролидин-3-карбоновая кислота)-1-ил]-пропокси, -O-CH2CH(OH)-CH2NH-CH2COOH, ОСН2СНСОН2СН2МН-СН2СН2СООН, -OCH2CH(OH)-CH2N(CH3)-CH2COOH, -OCH2CH(OH)-CH2N(CH3)-CH2CH2COOH, 3-[(азетидин-3-карбоновая кислота)-1-ил]-2-гидрокси-пропокси, -OCH2-(CH2)n-NH-CH2CH(OH)-CH2OH, -ОСН2СН(ОН)-CH2NH-CH2CH2OH, -OCH2CH(OH)-CH2NH-CH(CH2OH)2, и -OCH2CH(OH)-CH2NH-СО-(СН2)2СООН находится в R-конфигурации.
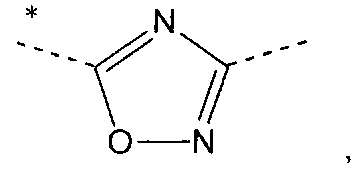
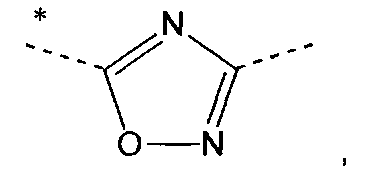
iv) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с любым одним из вариантов i) - iii), где А означает
в которых звездочки указывают связь, которая присоединена к пиридиновой группе формулы (I).
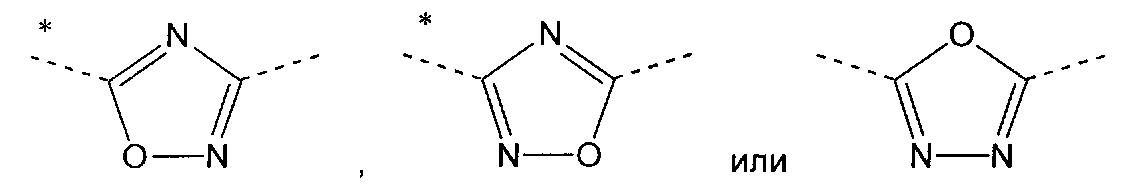
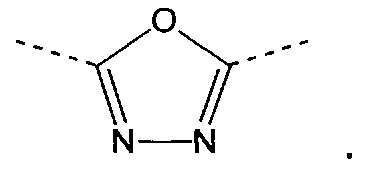
v) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с любым одним из вариантов i)-iii), где А означает
где звездочка указывает связь, которая присоединена к пиридиновой группе формулы (I).
vi) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с любым одним из вариантов i) - iii), где А означает
vii) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с любым одним из вариантов i) - vi), где R2 означает метил, и R4 означает этил или хлор.
viii) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с любым одним из вариантов i) - vi), где R2 означает метил, и R4 означает этил.
ix) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с любым одним из вариантов i) - vi), где R2 означает метокси, и R4 означает хлор.
x) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с любым одним из вариантов i) - ix), где R3 означает - ОСН2СООН, -ОСН2СН2СН2СООН, -OCH2CONHCH2CH2OH, -OCH2CH2CH2CONHCH2CH2OH, -OCH2-(CH2)n-NH-(CH2)m-COOH, -ОСН2-(СН2)n-N(CH3)-(CH2)m-COOH, 2-[(азетидин-3-карбоновая кислота)-1-ил]-этокси, 2-[(пирролидин-3-карбоновая кислота)-1-ил]-этокси, 3-[(азетидин-3-карбоновая кислота)-1-ил]-пропокси, -OCH2CH(OH)-CH2NH-CH2COOH, -ОСН2СН(ОН)-CH2NH-CH2CH2COOH, -OCH2CH(OH)-CH2N(CH3)-CH2COOH, 3-[(азетидин-3-карбоновая кислота)-1-ил]-2-гидрокси-пропокси, -OCH2-(CH2)n-NH-CH2CH2OH, -OCH2-(CH2)n-NH-CH(CH2OH)2, -OCH2-(CH2)n-NH-CH2CH(OH)-CH2OH, -OCH2CH(OH)-CH2NH-CH2CH2OH, -OCH2CH(OH)-CH2NH-CH(CH2OH)2, -OCH2-(CH2)k-NH-CO-CH2OH, -OCH2-(CH2)n-NH-CO-CH2COOH, -OCH2-(CH2)n-NH-CO-CH2CH2COOH, -OCH2CH(OH)-CH2NH-CO-(CH2)nCOOH, -OCH2-(CH2)n-N(CH3)-CO-CH2OH, -OCH2-(CH2)n-N(CH3)-CO-CH2COOH, или -OCH2-(CH2)n-N(CH3)-CO-CH2CH2COOH.
xi) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с любым одним из вариантов i) - ix), где R3 означает -ОСН2СООН, -ОСН2СН2СН2СООН, -OCH2CONHCH2CH2OH, -OCH2CH2CH2CONHCH2CH2OH, -OCH2-(CH2)n-NH-(CH2)m-COOH, -ОСН2-(СН2)n-N(CH3)-(CH2)m-COOH, 2-[(азетидин-3-карбоновая кислота)-1-ил]-этокси, 2-[(пиррол идин-3-карбоновая кислота)-1-ил]-этокси, 3-[(азетидин-3-карбоновая кислота)-1-ил]-пропокси, 3-[(пирролидин-3-карбоновая кислота)-1-ил]-пропокси, -O-CH2CH(OH)-CH2NH-CH2COOH, -OCH2CH(OH)-CH2NH-CH2CH2COOH, -OCH2CH(OH)-CH2N(CH3)-CH2COOH, -OCH2CH(OH)-CH2N(CH3)-CH2CH2COOH, 3-[(азетидин-3-карбоновая кислота)-1-ил]-2-гидрокси-пропокси, 2-гидрокси-3-[(пирролидин-3-карбоновая кислота)-1-ил]-пропокси, -OCH2-(CH2)n-NH-СН2СН2ОН, -OCH2-(CH2)n-NH-CH(CH2OH)2, -OCH2-(CH2)n-NH-CH2CH(OH)-СН2ОН, -OCH2CH(OH)-CH2NH-CH2CH2OH, -O-CH2CH(OH)-CH2NH-CH(CH2OH)2, -OCH2-(CH2)k-NH-CO-CH2OH, или -ОСН2-(СН2)n-N(СН3)-СО-СН2ОН.
xii) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с любым одним из вариантов i) - ix), где R3 означает -ОСН2СООН, -ОСН2СН2СН2СООН, -OCH2CONHCH2CH2OH, -OCH2CH2CH2CONHCH2CH2OH, -OCH2-(CH2)n-NH-(CH2)m-COOH, -OCH2-(CH2)n-N(CH3)-(CH2)m-COOH, 2-[(азетидин-3-карбоновая кислота)-1-ил]-этокси, 2-[(пирролидин-3-карбоновая кислота)-1-ил]-этокси, 3-[(азетидин-3-карбоновая кислота)-1-ил]-пропокси, 3-[(пирролидин-3-карбоновая кислота)-1-ил]-пропокси, -OCH2CH(OH)-CH2N(CH3)-CH2COOH, -OCH2CH(OH)-CH2N(CH3)-CH2CH2COOH, 3-[(азетидин-3-карбоновая кислота)-1-ил]-2-гидрокси-пропокси, 2-гидрокси-3-[(пирролидин-3-карбоновая кислота)-1-ил]-пропокси, -OCH2-(CH2)n-NH-CH2CH2OH, -OCH2-(CH2)n-NH-CH(CH2OH)2, -OCH2CH(OH)-CH2NH-CH2CH2OH, -O-CH2CH(OH)-CH2NH-CH(CH2OH)2, -OCH2-(CH2)n-NH-CO-CH2COOH, -OCH2-(CH2)n-NH-CO-CH2CH2COOH, -O-CH2CH(OH)-CH2NH-CO-(CH2)nCOOH, -OCH2-(CH2)n-N(CH3)-CO-CH2COOH, или -OCH2-(CH2)n-N(CH3)-CO-CH2CH2COOH.
xiii) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с любым одним из вариантов i) - ix), где R3 означает -ОСН2СООН, -ОСН2СН2СН2СООН, -OCH2CONHCH2CH2OH, OCH2CH2CH2CONHCH2CH2OH, -OCH2-(CH2)n-NH-(CH2)m-COOH, -OCH2-(CH2)n-N(CH3)-(CH2)m-COOH, 2-[(азетидин-3-карбоновая кислота)-1-ил]-этокси, 3-[(азетидин-3-карбоновая кислота)-1-ил]-пропокси, -OCH2CH(OH)-CH2N(CH3)-СН2СООН, -OCH2CH(OH)-CH2N(CH3)-CH2CH2COOH, 3-[(азетидин-3-карбоновая кислота)-1-ил]-2-гидрокси-пропокси, -OCH2-(CH2)n-NH-CH2CH2OH, -ОСН2-(СН2)n-NH-CH(CH2OH)2, -CH2CH(OH)-CH2NH-CH2CH2OH, -OCH2CH(OH)-CH2NH-CH(CH2OH)2, -OCH2-(CH2)k-NH-CO-CH2OH, -OCH2-(CH2)n-NH-CO-CH2COOH, -OCH2-(CH2)n-NH-CO-CH2CH2COOH, -OCH2CH(OH)-CH2NH-CO-(CH2)nCOOH, -OCH2-(CH2)n-N(CH3)-CO-CH2COOH, или -OCH2-(CH2)n-N(CH3)-CO-CH2CH2COOH.
xiv) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с любым одним из вариантов i) - ix), где R3 означает -ОСН2СООН, -ОСН2СН2СН2СООН, -OCH2-(CH2)n-NH-(CH2)m-COOH, -ОСН2-(CH2)n-N(CH3)-(CH2)m-COOH, 2-[(азетидин-3-карбоновая кислота)-1-ил]-этокси, 3-[(азетидин-3-карбоновая кислота)-1-ил]-пропокси, или 3-[(азетидин-3-карбоновая кислота)-1-ил]-2-гидрокси-пропокси.
xv) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с любым одним из вариантов i) - ix), где R3 означает -OCH2CONHCH2CH2OH, -OCH2CH2CH2CONHCH2CH2OH, -ОСН2СН(ОН)-CH2N(CH3)-CH2COOH, -OCH2CH(OH)-CH2N(CH3)-CH2CH2COOH, 3-[(азетидин-3- карбоновая кислота)-1-ил]-2-гидрокси-пропокси, -OCH2-(CH2)n-NH-CH2CH2OH, -OCH2-(CH2)n-NH-CH(CH2OH)2, -O-CH2CH(OH)-CH2NH-CH2CH2OH, или -О-CH2CH(OH)-CH2NH-CH(CH2OH)2.
xvi) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с любым одним из вариантов i) - xiv), где m означает 1 или 2.
xvii) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с любым одним из вариантов i) - xvi), где n означает 1.
xviii) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с вариантом осуществления i), где
А означает
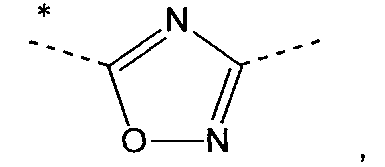
где звездочка указывает связь, которая присоединена к пиридиновой группе формулы (I);
R1 означает циклопентил;
R2 означает метил, и R4 означает этил или хлор; или
R2 означает метокси, и R4 означает хлор; и
R3 означает -ОСН2СООН, -ОСН2СН2СН2СООН, -OCH2CONHCH2CH2OH, -OCH2CH2CH2CONHCH2CH2OH, -OCH2-(CH2)1-2-NH-(CH2)1-2-COOH, -ОСН2-СН2-NH-(CH2)3-COOH, -OCH2-(CH2)1-2-N(CH3)-(CH2)1-2-COOH, 2-[(азетидин-3-карбоновая кислота)-1-ил]-этокси, 2-[(пирролидин-3-карбоновая кислота)-1-ил]-этокси, 3-[(азетидин-3-карбоновая кислота)-1-ил]-пропокси, -ОСН2СН(ОН)-CH2NH-CH2COOH, -OCH2CH(OH)-CH2NH-CH2CH2COOH, -ОСН2СН(ОН)-CH2N(CH3)-CH2COOH, 3-[(азетидин-3-карбоновая кислота)-1-ил]-2-гидрокси-пропокси, -OCH2-(CH2)1-2-NH-CH2CH2OH, -OCH2-(CH2)1-2-NH-CH(CH2OH)2, -ОСН2-(СН2)1-2-NH-СН2СН(ОН)-СН2ОН, -OCH2CH(OH)-CH2NH-CH2CH2OH, OCH2CH(OH)-CH2NH-CH(CH2OH)2, -OCH2-(CH2)2-NH-CO-CH2OH, -ОСН2-(СН2)2-NH-CO-CH2COOH, -OCH2-(CH2)2-NH-CO-CH2CH2COOH, -OCH2CH(OH)-CH2NH-CO-(CH2)1-2COOH, -OCH2-(CH2)2-N(CH3)-CO-CH2OH, -OCH2-(CH2)2-N(CH3)-CO-CH2COOH, или -OCH2-(CH2)2-N(CH3)-CO-CH2CH2COOH.
xix) Другой вариант осуществления изобретения относится к производным пиридина в соответствии с вариантом осуществления i), где
R3 означает -ОСН2СООН, -ОСН2СН2СН2СООН, -OCH2CONHCH2CH2OH, -OCH2CH2CH2CONHCH2CH2OH, -OCH2-(CH2)1-2-NH-(CH2)1-2-COOH, -ОСН2-СН2-NH-(CH2)3-COOH, -OCH2-(CH2)1-2-N(CH3)-(CH2)1-2-COOH, 2-[(азетидин-3-карбоновая кислота)-1-ил]-этокси, 2-[(пирролидин-3-карбоновая кислота)-1-ил]-этокси, 3-[(азетидин-3-карбоновая кислота)-1-ил]-пропокси, -ОСН2СН(ОН)-CH2NH-CH2COOH, -OCH2CH(OH)-CH2NH-CH2CH2COOH, -ОСН2СН(ОН)-CH2N(CH3)-CH2COOH, -OCH2CH(OH)-CH2N(CH3)-CH2CH2COOH, 3-[(азетидин-3-карбоновая кислота)-1-ил]-2-гидрокси-пропокси, -OCH2-(CH2)1-2-NH-CH2CH2OH, -OCH2-(CH2)1-2-NH-CH(CH2OH)2, -OCH2-(CH2)1-2-NH-CH2CH(OH)-CH2OH, -ОСН2СНСОН2СН2МН-СН2СН2ОН, -OCH2CH(OH)-CH2NH-CH(CH2OH)2, -ОСН2-(CH2)2-NH-CO-CH2OH, -OCH2-(CH2)1-2-NH-CO-CH2COOH, -OCH2-(CH2)1-2-NH-CO-CH2CH2COOH, -OCH2CH(OH)-CH2NH-CO-(CH2)1-2COOH, -OCH2-(CH2)2-N(CH3)-CO-CH2OH, -OCH2-(CH2)2-N(CH3)-CO-CH2COOH, или -OCH2-(CH2)2-N(CH3)-CO-CH2CH2COOH.
Соединения формулы (I) могут содержать один или несколько стереогенных центров или центров асимметрии, таких как один или несколько асимметричных атомов углерода. Соединения формулы (I) могут, таким образом, присутствовать в виде смеси стереоизомеров или, предпочтительно, в виде чистых стереоизомеров. Смеси стереоизомеров могут быть разделены способом, известным специалисту в данной области техники.
Подразумевается, что форма множественного числа, используемая в отношении соединений, солей, фармацевтических композиций, заболеваний и т.п., означает также одно единственное соединение, соль или т.п.
Любую ссылку выше или ниже на соединение формулы (I) следует понимать как относящуюся также к солям, особенно фармацевтически приемлемым солям соединения формулы (I), по мере необходимости и целесообразности.
Термин "фармацевтически приемлемые соли" относится к нетоксичным солям присоединения неорганических или органических кислот и/или оснований. Ссылка может быть сделана на "Salt selection for basic drugs", Int. J. Pharm. (1986), 33, 201-217.
Настоящее изобретение также включает соединения формулы (I), меченные изотопами, особенно меченные 2Н (дейтерием), где указанные соединения являются идентичными соединениям формулы (I), за исключением того, что один или каждый из нескольких атомов, заменен на атом, который имеет тот же атомный номер, но атомная масса которого отличается от атомной массы обычно встречающейся в природе. Меченные изотопами, особенно меченные 2Н (дейтерием) соединения формулы (I) и их соли находятся в рамках настоящего изобретения. Замещение водорода тяжелым изотопом 2Н (дейтерием) может привести к большей метаболической стабильности, приводящей, например, к увеличению in vivo периода полувыведения или снижению требуемой дозировки, или может привести к снижению ингибирования фермента цитохрома Р450, приводящему, например, к улучшенному профилю безопасности. В одном варианте осуществления изобретения, соединения формулы (I) не являются меченными изотопами, или они являются меченными только одним или несколькими атомами дейтерия. В подварианте осуществления, соединения формулы (I) не являются меченными изотопами полностью. Меченные изотопами соединения формулы (I) могут быть получены по аналогии с методами, описанными ниже, но с использованием подходящего изотопного варианта пригодных реагентов или исходных веществ.
Примеры пиридиновых соединений в соответствии с формулой (I) выбирают из:
3-(2-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-этиламино)-пропионовой кислоты,
1-(2-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-этил)-азетидин-3-карбоновой кислоты,
(S)-1-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-3-(2-гидрокси-этиламино)-пропан-2-ола,
2-((S)-3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-2-гидрокси-пропиламино)-пропан-1,3-диола,
{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-уксусной кислоты,
4-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-масляная кислота,
(2-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-этиламино)-уксусной кислоты,
1-(2-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-этил)-пирролидин-3-карбоновой кислоты,
((S)-3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-2-гидрокси-пропиламино)-уксусной кислоты,
3-((S)-3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-2-гидрокси-пропиламино)-пропионовой кислоты,
[((S)-3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-2-гидрокси-пропил)-метил-амино]-уксусной кислоты,
1-((S)-3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-2-гидрокси-пропил)-азетидин-3-карбоновой кислоты,
2-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-N-(2-гидрокси-этил)-ацетамида,
полуамида N-((S)-3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-2-гидрокси-пропил)-малоновой кислоты,
полуамида N-((S)-3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-2-гидрокси-пропил)-янтарной кислоты,
[(2-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-этил)-метил-амино]-уксусной кислоты,
3-[(2-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-этил)-метил-амино]-пропионовой кислоты,
(3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-пропиламино)-уксусной кислоты,
3-(3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-пропиламино)-пропионовой кислоты,
[(3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-пропил)-метил-амино]-уксусной кислоты,
3-[(3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-пропил)-метил-амино]-пропионовой кислоты,
1-(3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-пропил)-азетидин-3-карбоновой кислоты,
2-(2-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-этиламино)-этанола,
2-(3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-пропиламино)-этанола,
2-(2-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-этиламино)-пропан-1,3-диола,
2-(3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-пропиламино)-пропан-1,3-диола,
3-(2-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-этиламино)-пропан-1,2-диола,
3-(3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-пропиламино)-пропан-1,2-диола,
N-(3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-пропил)-2-гидрокси-ацетамида,
N-(3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-пропил)-2-гидрокси-N-метил-ацетамида,
полуамида N-(3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-пропил)-малоновой кислоты,
полуамида N-(3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-пропил)-янтарной кислоты,
полуамида N-(3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-пропил)-N-метил-малоновой кислоты,
полуамида N-(3-{4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенокси}-пропил)-N-метил-янтарной кислоты,
4-{2-хлор-4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-6-метокси-фенокси}-масляной кислоты,
4-{2-хлор-4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-6-метокси-фенокси}-N-(2-гидрокси-этил)-бутирамида,
3-(2-{2-хлор-4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-6-метокси-фенокси}-этиламино)-пропионовой кислоты,
N-(3-{2-хлор-4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-6-метокси-фенокси}-пропил)-2-гидрокси-ацетамида,
4-((2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)амино)бутановой кислоты, и
4-(2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метилфенокси)бутановой кислоты.
Дополнительные примеры пиридиновых соединений в соответствии с формулой (I) выбирают из:
2-(2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метилфенокси)уксусной кислоты,
2-(2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метил-фенокси)-М-(2-гидроксиэтил)ацетамида,
3-((2-(2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метилфенокси)этил)амино)пропановой кислоты,
1-(2-(2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метилфенокси)этил)азетидин-3-карбоновой кислоты,
2-((2-(2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метилфенокси)этил)амино)этанола,
4-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-N-(2-гидроксиэтил)бутанамида,
(S)-3-((3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)(метил)амино)пропановой кислоты,
(R)-3-((3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)(метил)амино)пропановой кислоты,
3-((2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)амино)-3-оксопропановой кислоты,
4-((2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)амино)-4-оксобутановой кислоты,
2-((2-(2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метоксифенокси)этил)амино)уксусной кислоты,
1-(2-(2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метоксифенокси)этил)азетидин-3-карбоновой кислоты,
2-(4-(3-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-5-ил)-2-этил-6-метилфенокси)уксусной кислоты,
4-(4-(3-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-5-ил)-2-этил-6-метилфенокси)бутановой кислоты,
2-((2-(4-(3-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-5-ил)-2-этил-6-метилфенокси)этил)амино)уксусной кислоты,
2-((2-(4-(3-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-5-ил)-2-этил-6-метилфенокси)этил)(метил)амино)уксусной кислоты,
3-((2-(4-(3-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-5-ил)-2-этил-6-метилфенокси)этил)амино)пропановой кислоты,
1-(2-(4-(3-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-5-ил)-2-этил-6-метилфенокси)этил)азетидин-3-карбоновой кислоты,
2-((3-(4-(3-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-5-ил)-2-этил-6-метилфенокси)пропил)амино)уксусной кислоты,
2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,3,4-оксадиазол-2-ил)-2-этил-6-метилфенокси)уксусной кислоты,
4-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,3,4-оксадиазол-2-ил)-2-этил-6-метилфенокси)бутановой кислоты,
3-((2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,3,4-оксадиазол-2-ил)-2-этил-6-метилфенокси)этил)амино)пропановой кислоты,
1-(2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,3,4-оксадиазол-2-ил)-2-этил-6-метилфенокси)этил)азетидин-3-карбоновой кислоты,
(S)-1-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,3,4-оксадиазол-2-ил)-2-этил-6-метилфенокси)-3-((2-гидроксиэтил)амино)пропан-2-ола,
(S)-2-((3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,3,4-оксадиазол-2-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)амино)пропан-1,3-диола, и
(S)-4-((3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,3,4-оксадиазол-2-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)амино)-4-оксобутановой кислоты.
Соединения формулы (I) и их фармацевтически приемлемые соли можно применять в качестве лекарственных средств, например, находящихся в форме фармацевтических композиций для энтерального (как, например, особенно пероральное) или парентерального (включая местное применение или ингаляцию) введения, причем они пригодны для уменьшения числа циркулирующих лимфоцитов и для предотвращения и/или лечения заболеваний или нарушений, связанных с активированной иммунной системой.
Получение фармацевтических композиций можно осуществить способом, который знаком любому специалисту в данной области техники (см., например, Remington, The Science and Practice of Pharmacy, 21-е издание (2005), часть 5, "Pharmaceutical Manufacturing" [опубликован Lippincott Williams & Wilkins]) путем введения описанных соединений формулы (I) или их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически ценными веществами, в галеновую лекарственную форму вместе с пригодными, нетоксичными, инертными, фармацевтически приемлемыми твердыми или жидкими веществами - носителями и, при необходимости, обычными фармацевтическими вспомогательными веществами.
Фармацевтические композиции, содержащие соединение формулы (I), являются полезными для предотвращения и/или лечения заболеваний или нарушений, связанных с активированной иммунной системой.
Такие заболевания или нарушения, связанные с активированной иммунной системой и подлежащие предотвращению/лечению соединениями формулы (I), например, выбирают из группы, состоящей из отторжения трансплантированных органов, ткани или клеток; реакции «трансплантат против хозяина», вызванной трансплантацией; аутоиммунных синдромов, включая ревматоидный артрит; системной красной волчанки; антифосфолипидного синдрома; тиреоидита Хашимото; лимфоцитарного тироидита; рассеянного склероза; тяжелой миастении; диабета I типа; увеита; эписклерита; склерита; болезни Кавасаки, увеоретинита; заднего (поясничного) увеита; увеита, связанного с болезнью Бехчета; увеоменингиального синдрома; аллергического энцефаломиелита; хронической васкулопатии аллотрансплантата; постинфекционных аутоиммунных заболеваний, включая ревматическую атаку и постинфекционный гломерулонефрит; воспалений и гиперпролиферативных кожных заболеваний; псориаза; псориатического артрита; атопического дерматита; миопатии; миозита; остеомиелита; контактного дерматита; экзематозного дерматита; себорейного дерматита; красного плоского лишая; пузырчатки; буллезного пемфигоида; врожденного буллезного эпидермолиза; уртикария; ангионевротического отека; васкулита; эритемы; кожной эозинофилии; угревой болезни; склеродермии; гнездной алопеции; кератоконъюнктивита; весеннего конъюнктивита; кератита; герпетического кератита; эпителиальной дистрофии роговой оболочки глаз; лейкомы роговой оболочки глаз; глазной пузырчатки; язвы Морена; язвенного кератита; склерита; офтальмопатии Грейвса; синдрома Фогта-Коянаги-Харады; саркоидоза; сенной лихорадки; обратимого обструктивного заболевания дыхательных путей; бронхиальной астмы; аллергической астмы; наследственной бронхиальной астмы; приобретенной бронхиальной астмы; астмы, вызванной пылью; хронической или запущенной астмы; поздней астмы и гиперчувствительности дыхательных путей; бронхиолита; бронхита; эндометриоза; орхита; язвы желудка; ишемических заболеваний кишечника; воспалительных заболеваний кишечника; некротизирующего энтероколита; патологических изменений кишечника, связанных с термическими ожогами; целиакии; проктита; эозинофильного гастроэнтерита; мастоцитоза; болезни Крона; неспецифического язвенного колита; повреждения сосудов, вызванного ишемическими заболеваниями и тромбозом; атеросклероза; ожирения сердца; миокардита; инфаркта миокарда; аортита; кахексии вследствие вирусного заболевания; тромбоза сосудов; мигрени; ринита; экземы; интерстициального нефрита; lgA-индуцированной нефропатии; синдрома Гудпасчера; гемолитического-уремического синдрома; диабетической нефропатии; гломерулосклероза; гломерулонефрита; тубулоинтерстициального нефрита; интерстициального цистита; дерматомиозита; синдрома Гийена-Барре; болезни Меньера; полиневрита; множественного полиневрита; миелита; мононеврита; радикулопатии; гипертиреоидизма; базедовой болезни; тиреотоксикоза; истинной эритроцитарной аплазии; апластической анемии; гипопластической анемии; идиопатической тромбоцитопенической пурпуры; аутоиммунной гемолитической анемии; аутоиммунной тромбоцитопении; агранулоцитоза; пернициозной анемии; мегалобластной анемии; анэритроплазии; остеопороза; фибромы легких; идиопатической интерстициальной пневмонии; дерматомиозита; обыкновенной лейкодермы; обыкновенного ихтиоза; фотоаллергической чувствительности; кожной Т-клеточной лимфомы; нодозного полиартериита; хореи Гентингтона; хореи Сиденгама; миокардоза; миокардита; склеродермии; гранулемы Вегенера; синдрома Шегрена; адипоза; эозинофильного фасцита; повреждений десен, периодонта, альвеолярной кости, зубного цемента; алопеции (мужского типа) или старческой; мышечной дистрофии; пиодермии; синдрома Сезари; гипофизита; хронической надпочечниковой недостаточности; болезни Аддисона; повреждения органов при ишемии/вторичной перфузии после сохранения; эндотоксинового шока; псевдомембранозного колита; колита, вызванного лекарственным средством или облучением; ишемической острой почечной недостаточности; хронической почечной недостаточности; рака легких; злокачественного новообразования лимфоидного происхождения; острого или хронического лимфоцитарного лейкоза; лимфомы; легочной эмфиземы; катаракты; сидероза; пигментного ретинита; старческой дегенерации желтого пятна; рубцевания стекловидного тела; щелочного ожога роговой оболочки глаз; дерматитной эритемы; пузырчатого дерматита; цементного дерматита; гингивита; периодонтита; сепсиса; панкреатита; заболевания периферических артерий; карциногенеза; солидных опухолей; метастазов карциномы; гипобаропатии; аутоиммунного гепатита; первичного билиарного цирроза; склерозирующего холангита; частичной резекции печени; острого некроза печени; цирроза; алкогольного цирроза; печеночной недостаточности; молниеносной печеночной недостаточности; поздней печеночной недостаточности; и острой на фоне хронической печеночной недостаточности.
Предпочтительные заболевания или нарушения, подлежащие лечению и/или профилактике соединениями формулы (I), выбирают из группы, состоящей из отторжения трансплантированных органов, таких как почка, печень, сердце, легкое, поджелудочная железа, роговая оболочка глаза, и кожа; реакций «трансплантат против хозяина», вызванных трансплантацией стволовых клеток; аутоиммунных синдромов, включая ревматоидный артрит, рассеянный склероз, воспалительные заболевания кишечника, такие как болезнь Крона и неспецифический язвенный колит, псориаз, псориатический артрит, тиреоидит, такой как тиреоидит Хашимото, увеоретинит; атопических заболеваний, таких как ринит, конъюнктивит, дерматит; астмы; диабета I типа; постинфекционных аутоиммунных заболеваний, включая ревматическую атаку и постинфекционный гломерулонефрит; солидного рака и опухолевых метастазов.
Более предпочтительные заболевания или нарушения, подлежащие лечению и/или профилактике соединениями формулы (I) выбирают из группы, состоящей из отторжения трансплантированных органов, выбранных из почки, печени, сердца и легкого; реакции «трансплантат против хозяина» вызванной трансплантацией стволовых клеток; аутоиммунных синдромов, выбранных из ревматоидного артрита, рассеянного склероза, псориаза, псориатического артрита, болезни Крона, и тиреоидита Хашимото; и атопического дерматита. Особенно предпочтительные заболевания или нарушения, подлежащие лечению и/или профилактике соединениями формулы (I), выбирают из рассеянного склероза и псориаза.
Настоящее изобретение также относится к способу предотвращения или лечения заболевания или нарушения, упомянутого в данной заявке, включающему введение субъекту фармацевтически активного количества соединения формулы (I).
Кроме того, соединения формулы (I) также полезны, в комбинации с одним или несколькими иммуномодулирующими агентами, для предотвращения и/или лечения заболеваний и нарушений, упомянутых в данной заявке. В соответствии с предпочтительным вариантом осуществления изобретения, вышеуказанные агенты выбирают из группы, состоящей из иммунодепрессантов, кортикостероидов, НПВС (нестероидных противовоспалительных средств), цитотоксических лекарственных средств, ингибиторов молекул адгезии, цитокинов, ингибиторов цитокинов, антагонистов рецепторов к цитокинам и рецепторов к рекомбинантному цитокину.
Настоящее изобретение также относится к применению соединения формулы (I) для получения фармацевтической композиции, необязательно для применения в комбинации с одним или несколькими иммуномодулирующими агентами, для предотвращения или лечения заболеваний и нарушений, упомянутых в данной заявке.
Соединения формулы (I) можно получить способами, приведенными ниже, способами, приведенными в примерах или аналогичными способами. Оптимальные условия проведения реакций могут изменяться в зависимости от конкретных используемых реагентов или растворителей, однако такие условия могут быть определены специалистом в данной области техники с помощью обычных методик оптимизации.
Соединения формулы (I) настоящего изобретения могут быть получены в соответствии с общей последовательностью реакций, очерченной ниже. Описываются только несколько синтетических возможностей, ведущих к соединениям формулы (I).
Соединения формулы (I), которые представляют собой производное 5-пиридин-4-ил-[1, 2, 4]оксадиазола, получают по реакции соединения структуры 1 в растворителе, таком как толуол, пиридин, ДМФА, ТГФ, диоксан, DME и т.д. при к.т. или повышенных температурах, в присутствии или отсутствии вспомогательных веществ, таких как кислоты (например, ТФУ, уксусная кислота, HCl и т.д.), основания (например, NaH, NaOAc, Na2CO3, K2CO3, NEt3 и т.д.), соли тетраалкиламмония, или водоотнимающие средства (например, оксалилхлорид, ангидрид карбоновой кислоты, POCl3, PCl5, Р4О10, молекулярные сита, реагент Бургесса и т.д.) (лит.: например, A.R. Gangloff, J. Litvak, Е.J. Shelton, D. Sperandio, V.R. Wang, K.D. Rice, Tetrahedron Lett. 42 (2001), 1441-1443; T. Suzuki, K. Iwaoka, N. Imanishi, Y. Nagakura, K. Miyta, H. Nakahara, M. Ohta, T. Mase, Chem. Pharm. Bull. 47 (1999), 120-122; R.F. Poulain, A.L. Tartar, B.P. Deprez, Tetrahedron Lett. 42 (2001), 1495-1498; R.M. Srivastava, F.J.S. Oliveira, D.S. Machado, R.M. Souto-Maior, Synthetic Commun. 29 (1999), 1437-1450; E.O. John, J.M. Shreeve, Inorganic Chemistry 27 (1988), 3100-3104; B. Kaboudin, K. Navaee, Heterocycles 60 (2003), 2287-2292).
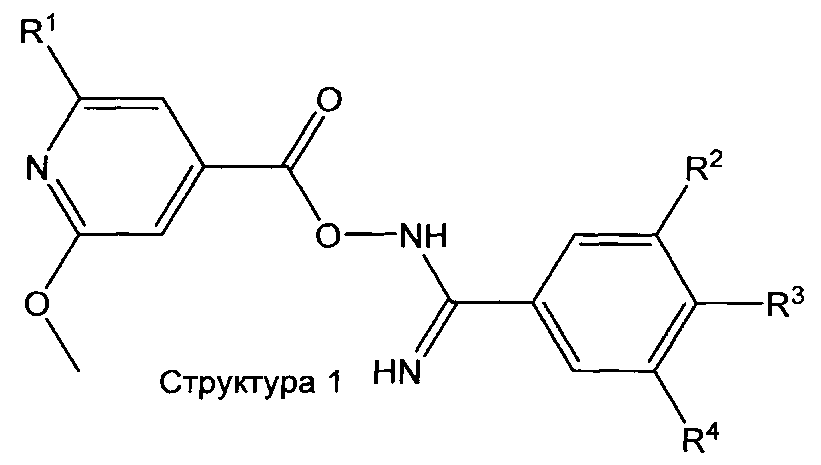
Соединения структуры 1 могут быть получены по реакции соединения структуры 2 с соединением структуры 3 в растворителе, таком как ДМФА, ТГФ, ДХМ и т.д. в присутствии одного или нескольких агентов сочетания, таких как TBTU, DCC, EDC, HBTU, CDI, и т.д. и в присутствии или отсутствии основания, такого как NEt3, DIPEA, NaH, K2CO3 и т.д. (лит.: например, A. Hamze, J.-F. Hernandez, P. Fulcrand, J. Martinez, J. Org. Chem. 68 (2003), 7316-7321; и литература, приведенная выше).
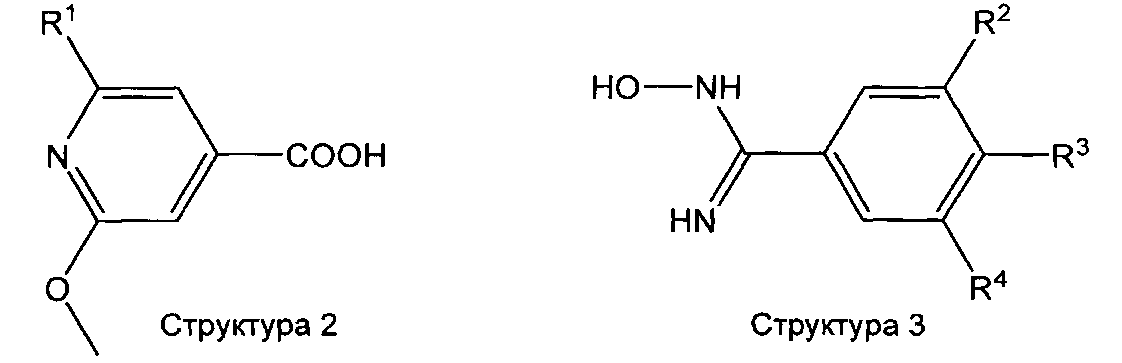
Соединения формулы (I), которые представляют собой производное 3-пиридин-4-ил-[1, 2, 4]оксадиазола, получают аналогичным образом (лит.: например, С.Т. Brain, J.М. Paul, Y. Loong, P.J. Oakley, Tetrahedron Lett. 40 (1999), 3275-3278) путем реакции соединения структуры 4 с соединением структуры 5 и последующей циклизации соответствующего промежуточного соединения - сложного эфира гидроксиамидина.
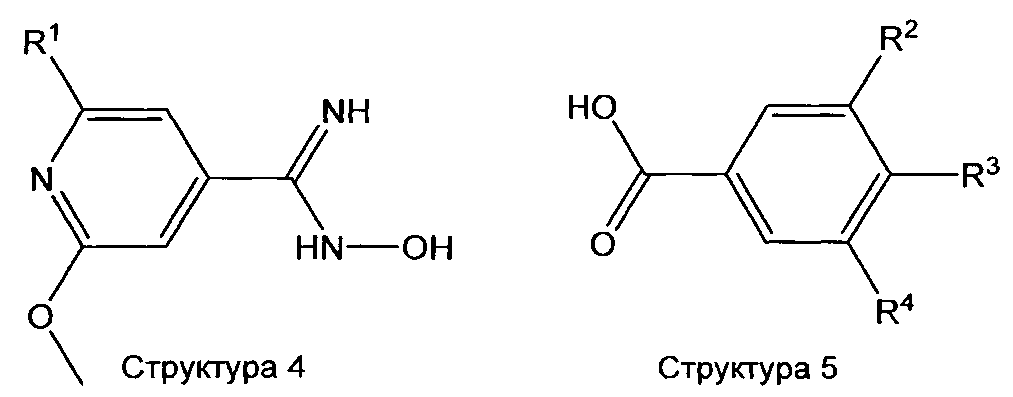
Соединения структуры 3 и 4 могут быть получены по реакции соединения структуры 6 и 7, соответственно, с гидроксиламином или одной из его солей в растворителе, таком как МеОН, EtOH, пиридин, и т.д. в присутствии или отсутствии основания, такого как Na2CO3, К2СО3, трет-бутилат калия, NEt3 и т.д. (лит.: например, Е. Meyer, А. С.Joussef, Н. Gallardo, Synthesis 2003, 899-905, WO 2004/035538 (Merck & Co., Inc., США)).
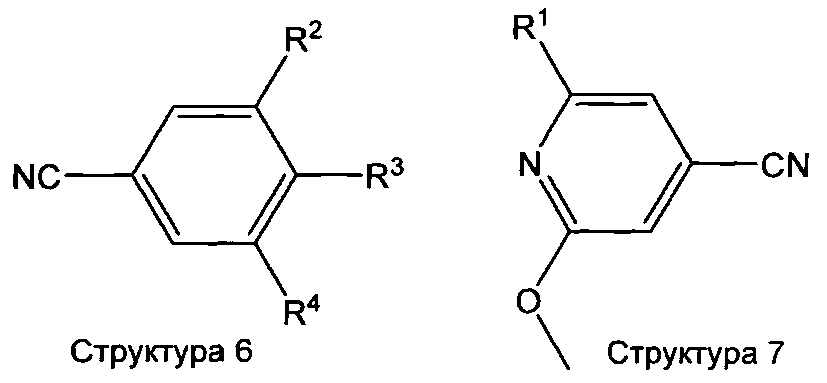
В зависимости от природы функциональностей, присутствующих в остатке R3 в структурах 3, 5 и 6, эти функциональности могут требовать временной защиты. Подходящие защитные группы известны специалисту в данной области техники и включают, например, бензильную или триалкилсилильную группу для защиты спирта, кеталь для защиты диола и т.д. Эти защитные группы могут быть использованы в соответствии со стандартными методиками (см., например, Т.W. Greene, P.G.М. Wuts, Protective Groups in Organic Synthesis, 3-е издание, Wiley New York, 1991; P.J. Kocienski, Protecting Groups, Thieme Stuttgart, 1994). Альтернативно, требуемые остатки R3 и R4, в частности R3, также могут быть введены на более поздних стадиях, которые следуют за сочетанием пиридинового соединения структуры 2 или 4 с фенильными производными структуры 3 или 5 путем использования пригодного предшественника соединения структуры 3 и 5. Требуемые остатки R3 могут быть введены серией из одной или нескольких реакций алкилирования, ацилирования и/или реакций замещения, известных специалисту в данной области техники. Фенильные соединения структуры 3, 5 и 6 или их предшественники являются либо доступными для приобретения, либо их получают в соответствии с методиками, известными специалисту в данной области техники.
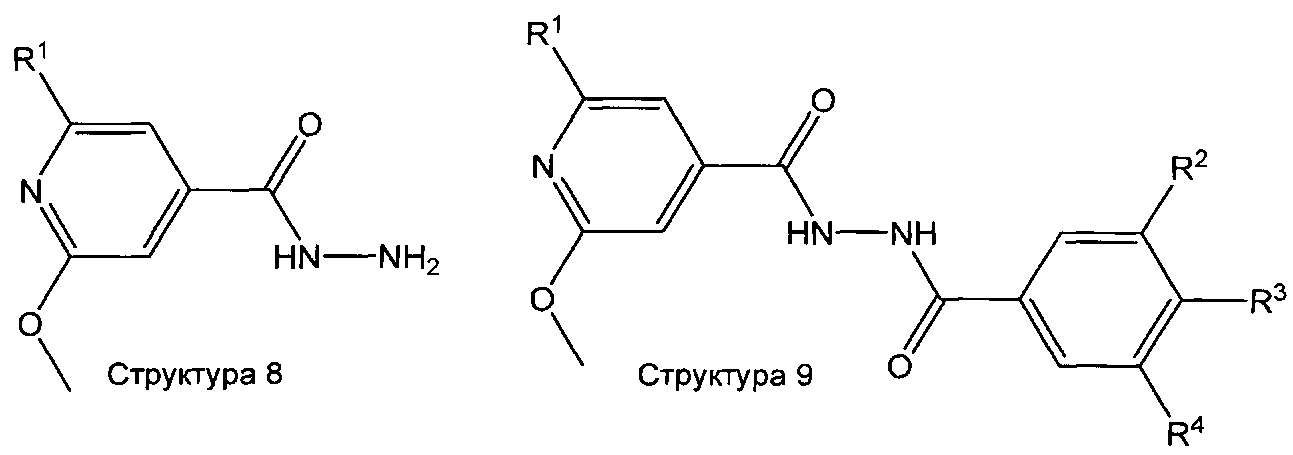
Соединения формулы (I), которые представляют собой 2-пиридин-4-ил-[1,3,4]оксадиазол, получают подобным образом по реакции соединения структуры 2 с гидразином (при использовании реагента сочетания, такого как TBTU, DCC, EDC, HBTU, РуВОР, CDI и т.д.), с образованием соединения структуры 8, которое затем сочетают с соединением структуры 5 с получением соединения структуры 9. Соединение структуры 9 также может быть получено при осуществлении реакций в обратном порядке, то есть прежде всего путем сочетания соединения структуры 5 с гидразином с последующей реакцией соответствующего промежуточного соединения - гидразида с соединением структуры 2. Дегидратацию соединения структуры 9 с образованием целевого 2-пиридин-4-ил-[1, 3, 4]оксадиазольного производного выполняют путем обработки соединения структуры 9 реагентом, таким как POCl3, CCl4 или CBr4 в комбинации с PPh3, Р2О5, реагент Бургесса и т.д. в растворителе, таком как толуол, MeCN, диоксан, ТГФ, CHCl3, и т.д. при температурах между 20 и 120°C в присутствии или отсутствии микроволнового облучения, (лит.: например, М.А. Garcia, S. Martin-Santamaria, М. Cacho, F. Moreno de la Llave, M. Julian, A. Martinez, B. De Pascual-Teresa, A. Ramos, J. Med. Chem. 48 (2005), 4068-4075; C.T. Brain, J.M. Paul, Y. Loong, P.J. Oakley, Tetrahedron Lett. 40 (1999), 3275-3278).
Методы, которые обеспечивают превращение соединения структуры 2 или 5 в соединение структуры 7 или 6, соответственно, или наоборот, известны специалисту в данной области техники.
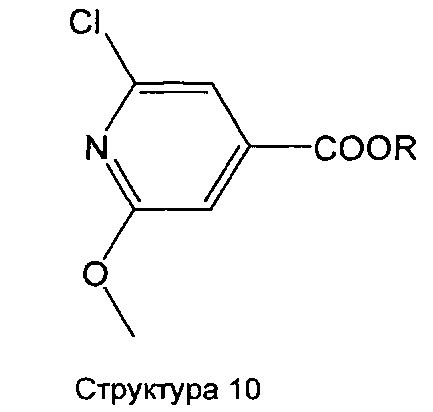
Соединения структуры 2 могут быть получены по реакции 2,6-дихлор-изоникотиновой кислоты или ее пригодного сложноэфирного производного с метанолом в присутствии или отсутствии основания, такого как NaOH, NaOMe, трет-бутилат калия, и т.д. в растворителе, таком как метанол, ТГФ, диоксан, и т.д. с получением соединения структуры 10 (R=Н или, предпочтительно, Me, Et, трет-бутил и т.д.) (лит.: например, N. Wild, U. Groth, Eur. J. Org. Chem. 2003, 4445-4449). Соединение структуры 10 затем может быть введено в реакцию с реагентом циклопентил-Zn в условиях Негиши (лит.: например, Н. Matsushita, Е. Negishi, J. Org. Chem. 47 (1982), 4161-4165), с подходящим циклопентильным реактивом Гриньяра, например, в присутствии Fe(acac)3, в растворителе, таком как ТГФ, диоксан, ДМФА, NMP и т.д., или их комбинации, при температуре в пределах от -78 до 25°C в условиях Фюрстнера (лит.: например, A. Furstner, А. Leitner, М. Mendez, Н. Krause, J. Am. Chem. Soc. 124 (2002), 13856-13863; A. Fürstner, A. Leitner, Angew. Chem. 114 (2002), 632-635) или с циклопентильным производным или производным 1-циклопентенилбора (лит.: например, F. Kerins, D.F. O′Shea, J. Org. Chem. 67 (2002), 4968-4971) в условиях сочетания Сузуки (лит.: например, Н. Doucet, Eur. J. Org. Chem. 2008, 2013-2030). В случае, если для введения углеродного скелета R1 применяют производные 1-циклопентенилбора, для образования целевой циклопентильной группы требуется последующая стадия гидрирования. В заключение, в случае использования на стадиях, описанных выше, сложного эфира пиридин-4-карбоновой кислоты, гидролиз сложного эфира в основных или кислотных реакционных условиях обеспечивает целевое соединение структуры 2.
Всякий раз, когда соединения формулы (I) получают в форме смесей энантиомеров, энантиомеры могут быть разделены с использованием способов, известных специалистам в данной области техники: например, путем образования и разделения диастереомерных солей или с помощью ВЭЖХ на хиральной неподвижной фазе, такой как колонка Regis Whelk-O1 (R,R) (10 мкм), колонка Daicel ChiralCel OD-H (5-10 мкм), или колонка Daicel ChiralPak IA (10 мкм) или AD-H (5 мкм). Типичные условия хиральной ВЭЖХ представляют изократическую смесь элюента А (ЕЮН, в присутствии или отсутствии амина, такого как NEt3, диэтиламин) и элюента В (гексан), при скорости потока от 0.8 до 150 мл/мин.
Экспериментальная часть
Следующие примеры иллюстрируют изобретение, но нисколько не ограничивают его объем.
Все температуры приведены в °C. Соединения характеризовали данными 1Н-ЯМР (300 МГц) или 13С-ЯМР (75 МГц) (Varian Oxford; химические сдвиги приводятся в м.д. относительно сигналов используемого растворителя; мультиплетности: s=синглет, d=дублет, t=триплет, р=пентуплет, hex=гексет, hept=гептет, m=мультиплет, br=широкий, константы взаимодействия приведены в Гц); ЖХ-МС (Finnigan Navigator с бинартным насосом HP 1100 и DAD, колонка: 4.6×50 мм, Zorbax SB-AQ, 5 мкм, 120 Å, градиент: 5-95% MeCN в воде, 1 мин, с 0.04% ТФУ, поток: 4.5 мл/мин, tR приведено в мин; значения времени удержания или ЖХ-МС, отмеченные ∗ относятся к ЖХ анализу в следующих условиях: Waters Xbridge С18, 2.5 мкм, 4.6×30 мм, градиент: 5-95% MeCN в воде, 1 мин, с 0.04% ТФУ, поток: 4.5 мл/мин; значения времени удержания или ЖХ-МС отмеченные ∗∗ относятся к ЖХ анализу в следующих условиях: колонка: Zorbax Extended С18, 1.8 мкм, 4.6×20 мм, градиент: 5-95% MeCN в воде, 1 мин, с 0.04% ТФУ, поток: 4.5 мл/мин); ТСХ (ТСХ-пластинки от Merck, Силикагель 60 F254); или температурой плавления. Соединения очищают с помощью преп. ВЭЖХ (колонка: X-terra RP18, 50×19 мм, 5 мкм, градиент: 10-95% MeCN в воде, содержащей 0.5% муравьиной кислоты) или с помощью ЖХСД (насос Labomatic MD-80-100, линейный детектор UVIS-201, колонка: 350×18 мм, Labogel-RP-18-5s-100, градиент: 10% МеОН в воде - 100% МеОН).
Сокращения (используемые здесь):
|
Получение промежуточных соединений
2-Циклопентил-6-метокси-изоникотиновая кислота
a) К раствору 2,6-дихлоризоникотиновой кислоты (200 г, 1.04 моль) в метаноле (3 л), добавляют 32% водн. NaOH (770 мл). Перемешиваемая смесь становится теплой (34°C) и затем, перед тем, как ее охлаждают до к.т., ее нагревают до 70°C в течение 4 ч. Смесь нейтрализуют путем добавления 32% водн. HCl (100 мл) и 25% водн. HCl (700 мл). Смесь перемешивают при к.т. в течение ночи. Белый осадок, который образуется, собирают, промывают метанолом и сушат. Фильтрат упаривают и остаток суспендируют в воде (200 мл). Полученную смесь нагревают до температуры 60°C. Твердое вещество собирают, промывают водой и сушат. Объединенные партии дают 2-хлор-6-метокси-изоникотиновую кислоту (183 г) в виде белого твердого вещества; ЖХ-МС: tR=0.80 мин, [М+1]+=187.93.
b) К суспензии 2-хлор-6-метокси-изоникотиновой кислоты (244 г, 1.30 моль) в метаноле (2.5 л) добавляют H2SO4 (20 мл). Смесь, перед тем, как ее охлаждают до 0°C, перемешивают при нагревании с обратным холодильником в течение 24 ч. Твердое вещество собирают, промывают метанолом (200 мл) и водой (500 мл) и сушат в ВВ с получением метилового сложного эфира 2-хлор-6-метокси-изоникотиновой кислоты (165 г) в виде белого твердого вещества; ЖХ-МС: tR=0.94 мин, [М+1]+=201.89.
c) Под аргоном, Pd(dppf) (2.00 г, 2.4 ммоль) добавляют к раствору метилового сложного эфира 2-хлор-6-метокси-изоникотиновой кислоты (32.0 г, 0.159 моль) в ТГФ (100 мл). Через капельную воронку добавляют 0.5 М раствор циклопентилцинкбромида в ТГФ (330 мл). После завершения добавления, смесь, перед тем, как ее охлаждают до к.т., нагревают до температуры 85°C в течение 3 ч. Реакционную смесь концентрируют, разбавляют 1 н. водн. HCl (275 мл) и экстрагируют с помощью ТВМЕ (275 мл). Орг.экстракт промывают 1 н. водн. HCl (275 мл), фильтруют через целит и промывают водой (275 мл). Орг. экстракт концентрируют и сушат с получением сырого метилового сложного эфира 2-циклопентил-6-метокси-изоникотиновой кислоты (34.8 г) в качестве коричневого масла. Это вещество растворяют в этаноле (180 мл), воде (45 мл) и 32% водн. растворе NaOH (45 мл). Смесь, перед тем, как ее охлаждают до к.т., перемешивают при 90°C в течение 30 мин. Этанол упаривают и остающийся раствор разбавляют водой (150 мл) и экстрагируют с помощью ДХМ (200 мл). Водн. фазу подкисляют путем добавления 32% водн. HCl (45 мл), и затем два раза экстрагируют с помощью ДХМ (2×100 мл). Орг. экстракты объединяют и концентрируют. Сырой продукт очищают с помощью кристаллизации из горячего ацетонитрила (174 мл). Кристаллическое вещество собирают и сушат при 50°C в ВВ. Из маточной жидкости может быть получена вторая партия кристаллического вещества. Две партии объединяют с получением 2-циклопентил-6-метокси-изоникотиновой кислоты (24.1 г) в виде бледно-серого кристаллического порошка; ЖХ-МС: tR=0.93 мин, [М+1]+=222.02; 1Н ЯМР (CDCl3): δ 1.68-1.77 (m, 2 Н), 1.81-1.90 (m, 4 Н), 2.03-2.12 (m, 2 Н), 3.15-3.25 (m, 1 Н), 3.99 (s, 3 Н), 7.18 (d, J=1.0 Гц, 1 Н), 7.35 (d, J=0.8 Гц, 1 Н).
2-Циклопентил-Ы-гидрокси-6-метокси-изоникотинамидин
a) Раствор метилового сложного эфира 2-циклопентил-6-метокси-изоникотиновой кислоты (3.19 г, 13.6 ммоль) в 7 н. NH3 в метаноле (50 мл) перемешивают при 60°C течение 18 ч. Растворитель удаляют в вакууме и остаток сушат в ВВ с получением сырого 2-циклопентил-6-метокси-изоникотинамида (3.35 г) в виде бледно-желтого твердого вещества; ЖХ-МС∗∗: tR=0.57 мин, [М+1]+=221.38.
b) Пиридин (8.86 г, 91.3 ммоль) добавляют к раствору 2-циклопентил-6-метокси- изоникотинамида (3.35 г, 15.2 ммоль) в ДХМ (100 мл). Смесь, перед тем, как порциями добавляют ангидрид трифторуксусной кислоты (9.58 г, 45.6 ммоль), охлаждают до 0°C. Смесь перемешивают при 0°C в течение 1 ч и затем разбавляют ДХМ (100 мл) и промывают насыщ. водн. раствором NaHCO3 (100 мл) и соляным раствором (100 мл). Отделенную орг. фазу сушат над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью КХ на силикагеле, элюируя смесью гептан:ЭА 9:1 с получением 2-циклопентил-6-метокси-изоникотинонитрила (2.09 г) в виде бледно-желтого масла; ЖХ-МС∗∗: tR=0.80 мин, [М+1]+=не обнаруживается; 1Н ЯМР (D6-ДМСО): δ 1.61-1.82 (m, 6 Н), 1.94-2.03 (m, 2 Н), 3.16 (квинт. J=7.8 Гц, 1 Н), 3.89 (s, 3 Н), 7.15 (s, 1 Н), 7.28 (s, 1 Н).
с) К раствору 2-циклопентил-6-метокси-изоникотинонитрила (2.09 г, 10.3 ммоль) в метаноле (100 мл) добавляют гидрохлорид гидроксиламина (2.15 г, 31.0 ммоль) и NaHCO3 (3.04 г, 36.2 ммоль). Смесь, перед тем, как ее фильтруют и фильтрат концентрируют, перемешивают при 60°C в течение 18 ч. Остаток растворяют в ЭА (300 мл) и промывают водой (30 мл). Промывные жидкости обратно экстрагируют с помощью ЭА (4×100 мл) и ДХМ (4×100 мл). Объединенные орг.экстракты сушат над MgSo4, фильтруют, концентрируют и сушат в ВВ с получением указанного в заголовке соединения (2.74 г) в виде белого твердого вещества; ЖХ-МС∗∗: tR=0.47 мин, [М+1]+=236.24; 1Н ЯМР (D6-ДМСО): δ 1.61-1.82 (m, 6 Н), 1.92-2.01 (m, 2 Н), 3.04-3.13 (m, 1 Н), 3.84 (s, 3 Н), 5.90 (s, 2 Н), 6.86 (s, 1 Н), 7.13 (s, 1 Н), 9.91 (s, 1 Н).
Гидразид 2-циклопентил-6-метокси-изоникотиновой кислоты
a) К раствору 2-циклопентил-6-метокси-изоникотиновой кислоты (2.00 г, 9.04 ммоль), сложного бензилового эфира гидразинкарбоновой кислоты (1.50 г, 9.04 ммоль) и DIPEA (2.34 г, 18.1 ммоль) в ДХМ (40 мл), добавляют TBTU (3.19 г, 9.94 ммоль). Смесь, перед тем, как ее разбавляют ЭА (250 мл), дважды промывают насыщ. водн. раствором МаНСО3 (150 мл) и, далее, соляным раствором (100 мл), сушат над MgSO4, фильтруют и концентрируют, перемешивают при к.т. в течение 2 ч. Сырой продукт очищают с помощью КХ на силикагеле, элюируя смесью гептан:ЭА 4:1 с получением сложного бензилового эфира N′-(2-циклопентил-6-метокси-пиридин-4-карбонил)-гидразинкарбоновой кислоты (2.74 г) в виде бледно-желтого масла; ЖХ-МС∗∗: tR=0.74 мин, [М+1]+=369.69; 1Н ЯМР (D6-ДМСО): δ 1.62-1.83 (m, 6 Н), 1.95-2.05 (m, 2 Н), 3.10-3.21 (m, 1 Н), 3.88 (s, 3 Н), 5.13 (s, 2 Н), 6.97 (s, 1 Н), 7.23 (s, 1 Н), 7.28-7.40 (m, 5 Н), 9.45 (s, 1 Н), 10.52 (s, 1 Н).
b) Pd/C (500 мг, 10% Pd) добавляют к раствору сложного бензилового эфира N′-(2-циклопентил-6-метокси-пиридин-4-карбонил)-гидразинкарбоновой кислоты (2.74 г, 7.42 ммоль) в ТГФ (50 мл) и метаноле (50 мл). Смесь перемешивают при к.т. под давлением 1 бар Н2 в течение 25 ч. Катализатор удаляют путем фильтрования и фильтрат концентрируют и сушат в ВВ с получением указанного в заголовке соединения (1.58 г) в виде не совсем белого твердого вещества; ЖХ-МС∗∗: tR=0.51 мин, [М+1]+=236.20; 1Н ЯМР (D6-ДМСО): δ 1.60-1.82 (m, 6 Н), 1.94-2.03 (m, 2 Н), 3.08-3.19 (m, 1 Н), 3.86 (s, 3 Н), 4.56 (s br, 2 Н), 6.93 (d, J=1.0 Гц, 1 Н), 7.20 (d, J=1.0 Гц, 1 Н), 9.94 (s, 1 Н).
3-Этил-4-гидрокси-5-метил-бензонитрил
Указанное в заголовке соединение получают из 3-этил-4-гидрокси-5-метил-бензальдегида, следуя методикам, описанным в литературе (А. К. Chakraborti, G. Kaur, Tetrahedron 55 (1999) 13265-13268); ЖХ-МС: tR=0.90 мин; 1Н ЯМР (CDCl3): δ 1.24 (t, J=7.6 Гц, 3 Н), 2.26 (s, 3 Н), 2.63 (q, J=7.6 Гц, 2 Н), 5.19 (s, 1 Н), 7.30 (s, 2 Н).
3-Хлор-4-гидрокси-5-метил-бензонитрил
Указанное в заголовке соединение получают из доступного для приобретения 2-хлор-6-метил-фенола по аналогии с методиками, описанными в литературе (см. 3-этил-4-гидрокси-5-метил-бензонитрил); ЖХ-МС: tR=0.85 мин. 1Н ЯМР (CDCl3): 6 2.33 (s, 3 Н), 6.10 (s, 1 Н), 7.38 (s, 1 Н), 7.53 (d, J=1.8 Гц, 1 Н).
3-Этил-4,N-дигидрокси-5-метил-бензамидин
Указанное в заголовке соединение получают из 3-этил-4-гидрокси-5-метил-бензонитрила или из доступного для приобретения 2-этил-6-метил-фенола, следуя методикам, описанным в литературе (G. Trapani, A. Latrofa, М. Franco, С.Altomare, Е. Sanna, М. Usala, G. Biggio, G. Liso, J. Med. Chem. 41 (1998) 1846-1854; A.K. Chakraborti, G. Kaur, Tetrahedron 55 (1999) 13265-13268; E. Meyer, A.C. Joussef, H. Gallardo, Synthesis 2003, 899-905); ЖХ-МС: tR=0.55 мин; 1H ЯМР (D6-ДМСО): 6 9.25 (s br, 1H), 7.21 (s, 2H), 5.56 (s, 2H), 2.55 (q, J=7.6 Гц, 2H), 2.15 (s, 3H), 1.10 (t, J=7.6 Гц, 3H).
3-Хлор-4,N-дигидрокси-5-метил-бензамидин
Указанное в заголовке соединение получают из доступного для приобретения 2-хлор-6-метил-фенола по аналогии с методиками, описанными в литературе (например, В. Roth и др. J. Med. Chem. 31 (1988) 122-129; и литературе, приведенной для 3-этил-4,N-дигидрокси-5-метил-бензамидина); 3-хлор-4-гидрокси-5-метил-бензальдегид: ЖХ-МС: tR=0.49 мин, [M+1]+=201.00; 1Н ЯМР δ 2.24 (s, 2 Н), 2.35 (s, 4 Н), 5.98 (s br, 1 Н), 7.59 (d, J=1.8 Гц, 1 Н), 7.73 (d, J=1.8 Гц, 1 Н), 9.80 (s, 1 Н); 3-хлор-4,N-дигидрокси-5-метил-бензамидин: 1Н ЯМР (D6-ДМСО): δ 2.21 (s, 3 Н), 5.72 (s br, 2 Н), 7.40 (s, 1 Н), 7.48 (s, 1 Н), 9.29 (s br, 1 Н), 9.48 (s br, 1 H).
3-Хлор-4,N-дигидрокси-5-метокси-бензамидин
Указанное в заголовке соединение получают из доступного для приобретения 3-хлор-4-гидрокси-5-метокси-бензальдегида по аналогии с литературой, приведенной для 3-этил-4,N-дигидрокси-5-метил-бензамидина; ЖХ-МС: tR=0.49 мин, [М+1]+=216.96; 1Н ЯМР (D6-ДМСО): δ 3.84 (s, 3 Н), 5.79 (s, 2 Н), 7.22 (d, J=1.5 Гц, 1 Н), 7.27 (d, J=1.8 Гц, 1 Н), 9.52 (s, 1 Н), 9.58 (s br, 1 Н).
3-Хлор-4-(2,2-диэтоксиэтокси)-N-гидрокси-5-метилбензимидамид
a) К смеси 3-хлор-4-гидрокси-5-метил-бензонитрила (4.16 г, 24.8 ммоль) и Cs2SO3 (16.2 г, 49.6 ммоль) в ДМФА (60 мл) добавляют диэтилацеталь бромацетальдегида (5.90 г, 29.9 ммоль). Смесь перемешивают при 80°C течение 18 ч. Коричневую суспензию растворяют в воде (200 мл) и экстрагируют четыре раза с помощью ЭА (4×100 мл). Объединенные орг. экстракты сушат над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью ЖХСД на силикагеле, элюируя градиентом ЭА в гептане с получением 3-хлор-4-(2,2-диэтоксиэтокси)-5-метилбензонитрила (3.60 г) в виде белого твердого вещества; ЖХ-МС: tR=0.92 мин, [М+1]+=не обнаруживается; 1Н ЯМР (CDCl3): 6 7.54 (d, J=1.6 Гц, 1 Н), 7.41 (d, J=0.8 Гц, 1 Н), 4.88 (t, J=5.2 Гц, 1 Н), 4.06 (d, J=5.2 Гц, 2 Н), 3.72-3.83 (m, 2 Н), 3.58-3.71 (m, 2 Н), 2.38 (s, 3 Н), 1.26 (t, J=7.1 Гц, 6 Н).
b) К раствору 3-хлор-4-(2,2-диэтоксиэтокси)-5-метилбензонитрила (4.54 г, 16.0 ммоль) в метаноле (50 мл), добавляют гидрохлорид гидроксиламина (3.34 г, 48.0 ммоль) и NaHCO3 (2.69 г, 32.0 ммоль). Смесь, перед тем, как ее разбавляют ЭА (120 мл) и промывают водой (100 мл), перемешивают при 75°C в течение 2 ч. Промывную жидкость два раза экстрагируют с помощью ЭА (2×75 мл). Объединенные орг. экстракты сушат над MgSO4, фильтруют и концентрируют с получением указанного в заголовке соединения (4.43 г) в виде бежевого воска, который медленно затвердевает при стоянии; ЖХ-МС: tR=0.55 мин, [М+1]+=317.28.
3-Хлор-4-(2,2-диметоксиэтокси)-N-гидрокси-5-метоксибензимидамид
Указанное в заголовке соединение получают по аналогии с 3-хлор-4-(2,2-диэтоксиэтокси)-N-гидрокси-5-метилбензимидамидом; ЖХ-МС: tR=0.53 мин, [М+1]+=305.18.
4-Бензилокси-3-этил-5-метил-бензойная кислота
a) К раствору 3-этил-4-гидрокси-5-метил-бензальдегида (34.9 г, 0.213 моль, получен из 2-этил-6-метил-фенола в соответствии с литературой, приведенной для 3-этил-4, N-дигидрокси-5-метил-бензамидина) в MeCN (350 мл), добавляют K2CO3 (58.7 г, 0.425 моль) и бензилбромид (36.4 г, 0.213 моль). Смесь, перед тем, как ее охлаждают до к.т., разбавляют водой и два раза экстрагируют с помощью ЭА, перемешивают при 60°C в течение 2 ч. Орг. экстракты промывают водой и концентрируют с получением сырого 4-бензилокси-3-этил-5-метил-бензальдегида (45 г) в виде оранжевого масла. 1Н ЯМР (CDCl3): δ 1.29 (t, J=7.5 Гц, 3 Н), 2.40 (s, 3 Н), 2.77 (q, J=7.8 Гц, 2 Н), 4.90 (s, 2 Н), 7.31-7.52 (m, 5 Н), 7.62 (d, J=1.5 Гц, 1 Н), 7.66 (d, J=1.8 Гц, 1 Н), 9.94 (s, 1 Н).
b) К смеси 4-бензилокси-3-этил-5-метил-бензальдегида (132 г, 0.519 моль) и 2-метил-2-бутена (364 г, 5.19 моль) в трет-бутаноле (1500 мл), добавляют раствор дигидрата NaH2PO4 (249 г, 2.08 моль) в воде (1500 мл). К этой смеси порциями добавляют NaClO2 (187.8 г, 2.08 моль). Температуру реакционной смеси поддерживают ниже 30°C, и наблюдают выделение газа. После завершения добавления, перед тем, как ее разбавляют ТВМЕ (1500 мл), оранжевую двухфазную смесь хорошо перемешивают в течение 3 ч. Орг. слой отделяют и промывают 20% водн. раствором NaHS (1500 мл) и водой (500 мл). Орг. фазу затем экстрагируют три раза 0.5 н. водн. NaOH (1000 мл), водн. фазу подкисляют 25% водн. HCl (500 мл) и два раза экстрагируют с помощью ТВМЕ (1000 мл). Эти орг. экстракты объединяют и упаривают досуха с получением указанного в заголовке соединения; 1Н ЯМР (D6-ДМСО): δ 1.17 (t, J=7.5 Гц, 3 Н), 2.31 (s, 3 Н), 2.67 (q, J=7.5 Гц, 2 Н), 4.86 (s, 2 Н), 7.34-7.53 (m, 5 Н), 7.68 (s, 2 Н), 12.70 (s, 1 Н).
Пример 1
3-((2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)амино)пропановая кислота
a) Раствор 2-циклопентил-6-метокси-изоникотиновой кислоты (21.0 г, 102 ммоль), 3-этил-4,N-дигидрокси-5-метил-бензамидина (20.0 г, 103 ммоль) и HOBt (1.24 г, 9 ммоль) в ТГФ (200 мл), перед тем, как по каплям добавляют раствор DCC (20.0 г, 97 ммоль) в ТГФ (100 мл), охлаждают до 5°C. После завершения добавления, смесь перемешивают при к.т. в течение 18 ч, затем при 75°C в течение 48 ч. Растворитель упаривают и остающийся остаток растворяют в ТВМЕ (200 мл). Осадок, который образовался, удаляют, отфильтровывают и промывают дополнительным ТВМЕ (200 мл). Фильтрат промывают приблизительно 4% водн. раствором NaHCO3 (100 мл) и водой (100 мл), и концентрируют. Сырой продукт перекристаллизовывают из горячего ацетонитрила (200 мл) с получением 4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенола (28.6 г) в виде белого твердого вещества; 1Н ЯМР (CDCl3): δ 1.33 (t, J=7.5 Гц, 3 Н), 1.70-1.80 (m, 2 Н), 1.84-1.96 (m, 4 Н), 2.05-2.16 (m, 2 Н), 2.36 (s, 3 Н), 2.74 (q, J=7.3 Гц, 2 Н), 3.25 (квинт., J=7.5 Гц, 1 Н), 4.02 (s, 3 Н), 5.01 (s), 7.31 (s, 1 Н), 7.51 (s, 1 Н), 7.85 (s, 2 Н).
b) К раствору 4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенола (1.26 г, 3.32 ммоль) в ДМФА (20 мл) добавляют СэгСОз (6.49 г, 19.9 ммоль). Смесь, перед тем, как добавляют 2-бромэтанол (2.07 г, 16.6 ммоль), перемешивают при к.т. в течение 10 мин. Смесь перемешивают при 60°C течение 5 дней. Смесь охлаждают до к.т., разбавляют насыщ. водн. раствором NaHCO3 (50 мл) и два раза экстрагируют с помощью ЭА (2×200 мл). Орг. экстракты объединяют и концентрируют.Сырой продукт очищают с помощью КХ на силикагеле, элюируя смесью гептан:ЭА 4:1 с получением 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этанола (639 мг) в виде бледно-желтого масла; 1Н ЯМР (CDCl3): 5: 7.90 (s, 1 Н), 7.88 (s, 1 Н), 7.51 (s, 1 Н), 7.31 (s, 1 Н), 4.02 (s, 3 Н), 3.97-4.01 (m, 4 Н), 3.21-3.29 (m, 1 Н), 2.79 (q, J=7.6 Гц, 2 Н), 2.42 (s, 3 Н), 2.15 (t, J=5.5 Гц, 1 H), 2.06-2.14 (m, 2 Н), 1.83-1.95 (m, 4 Н), 1.68-1.80 (m, 2 Н), 1.33 (t, J=7.6 Гц, 3 H).
c) К раствору 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этанола (638 мг, 1.51 ммоль) в ТГФ добавляют DIPEA (389 мг, 3.01 ммоль). Смесь, перед тем, как добавляют метансульфонилхлорид (207 мг, 1.81 ммоль), охлаждают до 0°C. Смесь, перед тем, как ее разбавляют ЭА (100 мл) и промывают насыщ. водн. МаНСО3 раствором (50 мл) и соляным раствором (50 мл), перемешивают при к.т. в течение 30 мин. Орг. экстракт сушат над MgSO4, фильтруют и концентрируют с получением 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил метансульфоната (733 мг) в виде желтого масла; ЖХ-МС: tR=1.19 мин, [М+Н]+=502.05.
d) Раствор 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил метансульфоната (245 мг, 0.488 ммоль), этил 3-аминопропаноата (286 мг, 2.44 ммоль, получен из соответствующей HCl соли путем замещения HCl, используя ионообмен на карбонат) и Et3N (247 мг, 2.44 ммоль) в этаноле (6 мл) перемешивают при 60°C течение 72 часов. Смесь разбавляют насыщ. водн. раствором NaHCO3 и два раза экстрагируют с помощью ДХМ. Объединенные орг. экстракты сушат над Na2SO4, фильтруют и концентрируют. Сырой продукт очищают на пластинах для преп. ТСХ, используя ДХМ:МеОН 9:1 с получением этил 3-((2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метил-фенокси)этил) амино)пропаноата (88 мг) в виде бледно-желтого масла; ЖХ-МС: tR=0.99 мин, [М+Н]+=523.13.
e) Раствор этил 3-((2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метил-фенокси)этил) амино)пропаноата (88 мг, 0.168 ммоль) в МеОН (0.5 мл), ТГФ (0.5 мл) и 2 н. водн. LiOH (0.2 мл) перемешивают при к.т. в течение 2 ч. Смесь концентрируют, разбавляют 2 н. водн. HCl (10 мл) и экстрагируют четыре раза ДХМ (4×20 мл). Объединенные орг. экстракты сушат над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью преп. ВЭЖХ с получением указанного в заголовке соединения (63 мг) в виде не совсем белого твердого вещества; ЖХ-МС: tR=0.93 мин, [М+Н]+=495.12; 1Н ЯМР (CDCl3): δ 8.37 (s br, 2 Н), 7.78 (s, 1 Н), 7.72 (s, 1 Н), 7.43 (s, 1 Н), 7.20 (s, 1 Н), 4.07-4.18 (m, 2 Н), 3.99 (s, 3 Н), 3.34-3.42 (m, 2 Н), 3.16-3.34 (m, 3 Н), 2.62-2.76 (m, 4 Н), 2.33 (s, 3 Н), 2.09 (m, 2 Н), 1.81-1.94 (m, 4 Н), 1.68-1.79 (m, 2 Н), 1.27 (t, J=7.5 Гц, 3 Н).
Пример 2
1-(2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (123 мг) получают в виде не совсем белой пены по аналогии с примером 1 исходя из 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил метансульфоната (500 мг, 0.997 ммоль) и метилового сложного эфира азетидин-3-карбоновой кислоты (302 мг, 1.99 ммоль); ЖХ-МС: tR=0.88 мин, [М+Н]+=507.23; 1Н ЯМР (CDCl3): δ 8.20 (s, 1 Н), 7.92 (d, J=1.8 Гц, 1 Н), 7.89 (d, J=1.6 Гц, 1 Н), 7.55 (s, 1 Н), 4.37-4.48 (m, 4 Н), 4.08-4.13 (m, 2 Н), 4.01 (s, 3 Н), 3.69-3.74 (m, 2 Н), 3.49-3.59 (m, 1 Н), 3.26-3.31 (m, 1 Н), 2.79 (q, J=7.7 Гц, 2 Н), 2.42 (s, 3 Н), 2.08-2.17 (m, 2 Н), 1.86-1.98 (m, 4 Н), 1.74-1.82 (m, 2 Н), 1.34 (t, J=7.5 Гц, 3 Н).
Пример 3
(S)-1-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-3-((2-гидроксиэтил)амино)пропан-2-ол
а) К раствору 4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенола (2.32 г, 4.91 ммоль) в 2-пропаноле (60 мл) и 3 н. водн. NaOH (6 мл) добавляют (R)-эпихлоргидрин (4.55 г, 49.1 ммоль). Смесь, перед тем, как ее разбавляют ЭА (100 мл) и дважды промывают 1 н. водн. NaOH (2×15 мл) и, далее, соляным раствором (25 мл), перемешивают при 45°C в течение 6 часов. Орг. экстракт сушат над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью ЖХСД на силикагеле, элюируя смесью гептан:ЭА 1:1 с получением (S)-5-(2-циклопентил-6-метоксипиридин-4-ил)-3-(3-этил-5-метил-4-(оксиран-2-илметокси)фенил)-1,2,4-оксадиазола (2.04 г) в виде бесцветного воска; ЖХ-МС: tR=1.52 мин, [М+Н]+=436.11; 1Н ЯМР (CDCl3): 6 7.88-7.90 (m, 1 Н), 7.85-7.88 (m, 1 Н), 7.51 (d, J=1.1 Гц, 1 Н), 7.31 (d, J=1.2 Гц, 1 Н), 4.14 (dd, J1=11.1 Гц, J2=3.1 Гц, 1 Н), 4.02 (s, 3 Н), 3.83 (dd, J1=11.1 Гц, J2=6.0 Гц, 1 Н), 3.40-3.44 (m, 1 Н), 3.19-3.29 (m, 1 Н), 2.94 (dd, J1=4.9 Гц, J2=4.3 Гц, 1 Н), 2.75-2.83 (m, 3 Н), 2.41 (s, 3 Н), 2.06-2.16 (m, 2 Н), 1.84-1.94 (m, 4 Н), 1.70-1.79 (m, 2 Н), 1.33 (t, J=7.5 Гц, 3 Н).
b) Раствор (S)-5-(2-циклопентил-6-метоксипиридин-4-ил)-3-(3-этил-5-метил-4-(оксиран-2-илметокси)фенил)-1,2,4-оксадиазола (245 мг, 0.563 ммоль) и этаноламина (4.46 г, 4.39 ммоль) в этаноле (8 мл) перемешивают при 60°C течение 18 ч. Растворитель упаривают и сырой продукт очищают с помощью преп. ВЭЖХ с получением указанного в заголовке соединения (154 мг) в виде белого твердого вещества; ЖХ-МС: tR=0.73 мин, [М+Н]+=497.25; 1Н ЯМР (CD3OD): δ 7.85 (s, 1 Н), 7.83 (s, 1 Н), 7.51 (s, 1 Н), 7.26 (s, 1 Н), 4.13-4.20 (m, 1 Н), 4.00 (s, 3 Н), 3.84-3.90 (m, 2 Н), 3.67-3.78 (m, 2 Н), 3.23-3.30 (m, 1 Н), 2.96 (dd, J1=12.2 Гц, J2=3.7 Гц, 1 Н), 2.76-2.89 (m, 5 Н), 2.41 (s, 3 Н), 2.05-2.17 (m, 2 Н), 1.85-1.98 (m, 4 Н), 1.71-1.83 (m, 2 Н), 1.31 (t, J=7.6 Гц, 3 Н).
Пример 4
(S)-2-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)амино)пропан-1,3-диол
Указанное в заголовке соединение (93 мг) получают в виде бледно-желтого твердого вещества в соответствии с методикой, описанной для Примера 3 и исходя из (8)-5-(2-циклопентил-6-метоксипиридин-4-ил)-3-(3-этил-5-метил-4-(оксиран-2-илметокси)фенил)-1,2,4-оксадиазола (100 мг, 0.230 ммоль) и серинола (42 мг, 0.459 ммоль); ЖХ-МС∗: tR=0.92 мин, [М+Н]+=527.27; 1Н ЯМР (CDCl3): δ 8.51 (s, 1 Н), 7.82 (s, 1 Н), 7.80 (s, 1 Н), 7.46 (s, 1 Н), 7.25 (s, 1 Н), 4.44-4.52 (m, 1 Н), 3.69-4.07 (m, 13 Н), 4.00 (s, 3 Н), 3.48-3.55 (m, 1 Н), 3.28-3.37 (m, 2 Н), 3.18-3.27 (m, 1 Н), 2.71 (q, J=7.5 Гц, 2 Н), 2.35 (s, 3 Н), 2.05-2.14 (m, 2 Н), 1.82-1.94 (m, 4 Н), 1.68-1.80 (m, 2 Н), 1.29 (t, J=7.5 Гц, 3 Н) (соль муравьиной кислоты); 1Н ЯМР (CD3OD): 5 8.51 (s, 1 Н), 7.89 (s, 1 Н), 7.87 (s, 1 Н), 7.55 (s, 1 Н), 7.30 (s, 1 Н), 4.29-4.37 (m, 1 Н), 4.01 (s, 3 Н), 3.83-4.00 (m, 4 Н), 3.72-3.83 (m, 2 Н), 3.47-3.55 (m, 1 Н), 3.22-3.30 (m, 3 Н), 2.82 (q, J=7.3 Гц, 2 Н), 2.43 (s, 3 Н), 2.06-2.17 (m, 2 Н), 1.85-1.98 (m, 4 Н), 1.70-1.84 (m, 2 Н), 1.33 (t, J=7.6 Гц, 3 Н) (соль муравьиной кислоты).
Пример 5
2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)уксусная кислота
К раствору 4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенола (203 мг, 0.535 ммоль) в ДМФА (5 мл) при 0°C добавляют NaH (43 мг, 1.07 ммоль, 60% в минеральном масле). Смесь перемешивают при 0°C и добавляют этилбромацетат (98 мг, 0.588 ммоль). Перемешивание продолжают при 0°C в течение 30 мин, затем при к.т. течение 72 часов. Реакцию гасят путем добавления воды (2 мл) и смесь концентрируют. Остаток растворяют в ТГФ (10 мл), метаноле (10 мл) и 2 н. водн. LiOH (10 мл). Смесь, перед тем, как ее охлаждают до к.т., подкисляют путем добавления 2 н. водн. HCl и экстрагируют три раза с помощью ЭА (3×20 мл), перемешивают при 60°C в течение 2 ч. Объединенные орг. экстракты концентрируют и сырой продукт очищают с помощью преп. ВЭЖХ с получением указанного в заголовке соединения (146 мг) в виде белого твердого вещества; ЖХ-МС: tR=1.14 мин, [М+Н]+=438.07; 1Н ЯМР (CDCl3): δ 7.90 (s, 1 Н), 7.88 (s, 1 Н), 7.79 (s br, 1 Н), 7.50 (s, 1 Н), 7.29 (s, 1 Н), 4.57 (s, 2 Н), 4.01 (s, 3 Н), 3.20-3.29 (m, 1 Н), 2.79 (q, J=7.5 Гц, 2 Н), 2.42 (s, 3 Н), 2.04-2.16 (m, 2 Н), 1.82-1.95 (m, 4 Н), 1.68-1.80 (m, 2 Н), 1.34 (t, J=7.5 Гц, 3 Н).
Пример 6
4-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)бутановая кислота
Указанное в заголовке соединение (146 мг) получают в виде белого твердого вещества, следуя методике, приведенной в примере 5 и исходя из 4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метил-фенола (200 мг, 0.528 ммоль) и этил 4-йодбутирата (256 мг, 1.06 ммоль); ЖХ-МС: tR=1.19 мин, [М+Н]+=465.82; 1Н ЯМР (CDCl3): δ 7.87 (s, 1 Н), 7.86 (s, 1 Н), 7.51 (s, 1 Н), 7.30 (s, 1 Н), 4.02 (s, 3 Н), 3.90 (t, J=6.1 Гц, 2 Н), 3.19-3.30 (m, 1 Н), 2.70-2.78 (m, 4 Н), 2.38 (s, 3 Н), 2.21 (квинт., J=6.5 Гц, 2 Н), 2.06-2.15 (m, 2 Н), 1.84-1.95 (m, 4 Н), 1.68-1.79 (m, 2 Н), 1.32 (t, J=7.5 Гц, 3 Н).
Пример 7
2-((2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)амино)уксусная кислота
Указанное в заголовке соединение (40 мг) получают в виде не совсем белого твердого вещества, следуя методикам, приведенным в примере 1, исходя из 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил метансульфоната (200 мг, 0.399 ммоль) и гидрохлорида сложного этилового эфира глицина (167 мг, 1.20 ммоль); ЖХ-МС: tR=0.94 мин, [М+Н]+=481.03; 1Н ЯМР (CD3OD): δ 7.92 (s, 1 Н), 7.90 (s, 1 Н), 7.55 (s, 1 Н), 7.31 (s, 1 Н), 4.13-4.18 (m, 2 Н), 4.02 (s, 3 Н), 3.66 (s, 2 Н), 3.49-3.55 (m, 3 Н), 2.82 (q, J=7.3 Гц, 2 Н), 2.45 (s, 3 Н), 2.08-2.17 (m, 2 Н), 1.86-1.98 (m, 4 Н), 1.73-1.82 (m, 2 Н), 1.35 (t, J=7.5 Гц, 3 Н).
Пример 8
рац-1-(2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)пирролидин-3-карбоновая кислота
Указанное в заголовке соединение получают (68 мг) в виде бледно-оранжевого твердого вещества, следуя методикам, приведенным в примере 1, исходя из 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил метансульфоната (250 мг, 0.498 ммоль) и гидрохлорида рац-метил 3-пирролидинкарбоксилата (322 мг, 2.49 ммоль); ЖХ-МС: tR=0.94 мин, [М+Н]+=521.05; 1Н ЯМР (CD3OD): 5 8.25 (s, 1 Н), 7.92 (s, 1 Н), 7.90 (s, 1 Н), 7.54 (s, 1 Н), 4.20 (t, J=5.1 Гц, 2 Н), 4.01 (s, 3 Н), 3.79-3.85 (m, 1 Н), 3.50-3.77 (m, 5 Н), 3.21-3.31 (m, 2 Н), 2.82 (q, J=7.6 Гц, 2 Н), 2.45 (s, 3 Н), 2.30-2.44 (m, 2 Н), 2.07-2.16 (m, 2 Н), 1.87-1.97 (m, 4 Н), 1.73-1.82 (m, 2 Н), 1.35 (t, J=7.5 Гц, 3 Н).
Пример 9
(S)-2-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)амино)уксусная кислота
а) Раствор (S)-5-(2-циклопентил-6-метоксипиридин-4-ил)-3-(3-этил-5-метил-4-(оксиран-2-илметокси)фенил)-1,2,4-оксадиазола (500 мг, 1.15 ммоль), гидрохлорида сложного этилового эфира глицина (320 мг, 2.30 ммоль), из которого гидрохлорид удаляли путем фильтрования через загруженную карбонатом силикагелевую смолу перед применением, и DIPEA (0.2 мл) в метаноле (3 мл) перемешивают при 60°C в течение 3 дней. Смесь разбавляют ДХМ и промывают насыщ. водн. раствором NaHCO3. Водн. фазу экстрагируют один раз с помощью ДХМ. Объединенные орг. экстракты сушат над Na2SO4, фильтруют и концентрируют. Сырой продукт очищают с помощью преп.ТСХ, используя ДХМ:метанол 9:1 с получением сложного этилового эфира (S)-2-((3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)амино)уксусной кислоты (60 мг) в виде белого твердого вещества; ЖХ-МС: tR=1.03 мин, [М+Н]+=537.29.
b) Раствор сложного этилового эфира (S)-2-((3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)амино)уксусной кислоты (60 мг, 0.114 ммоль) в ТГФ (3 мл), метаноле (3 мл) и 2 н. водн. LiOH (1 мл) перемешивают при к.т. в течение 2 ч. Растворитель упаривают и остаток растворяют в 2 н. водн. HCl (10 мл) и экстрагируют четыре раза с помощью ДХМ (4×20 мл). Орг. экстракты объединяют, сушат над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью преп. ВЭЖХ с получением указанного в заголовке соединения (31 мг) в виде белого твердого вещества; ЖХ-МС∗: tR=0.86 мин, [М+Н]+=511.19; 1Н ЯМР (CD3OD): δ 7.88 (s, 1 Н), 7.86 (s, 1 Н), 7.54 (s, 1 Н), 7.30 (s, 1 Н), 4.30-4.36 (m, 1 Н), 4.01 (s, 3 Н), 3.87-3.98 (m, 2 Н), 3.63 (s, 2 Н), 3.46 (dd, J1=12.5 Гц, J2=2.9 Гц, 1 Н), 3.24-3.32 (m, 2 Н), 2.81 (q, J=7.6 Гц, 2 Н), 2.42 (s, 3 Н), 2.07-2.17 (m, 2 Н), 1.86-1.98 (m, 4 Н), 1.74-1.82 (m, 2 Н), 1.32 (t, J=7.6 Гц, 3 Н).
Пример 10
(S)-3-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)амино)пропановая кислота
Указанное в заголовке соединение получают (114 мг) в виде белого твердого вещества, следуя методикам, приведенным в примере 9, исходя из (S)-5-(2-циклопентил-6-метоксипиридин-4-ил)-3-(3-этил-5-метил-4-(оксиран-2-илметокси)фенил)-1,2,4-оксадиазола (1090 мг, 2.50 ммоль) и сложного трет-бутилового эфира β-аланина (682 мг, 3.75 ммоль); ЖХ-МС: tR=0.95 мин, [М+Н]+=525.15; 1Н ЯМР (CDCl3): δ 7.91 (s br, 3 Н), 7.75 (s, 1 Н), 7.71 (s, 1 Н), 7.40 (s, 1 Н), 7.17 (s, 1 Н), 4.46-4.59 (m, 1 Н), 3.97 (s, 3 Н), 3.77-3.92 (m, 2 Н), 3.13-3.47 (m, 5 Н), 2.74-2.88 (m, 2 Н), 2.66 (q, J=7.3 Гц, 2 H), 2.29 (s, 3 Н), 2.01-2.15 (m, 2 Н), 1.80-1.93 (m, 4 Н), 1.66-1.79 (m, 2 Н), 1.25 (t, J=7.5 Гц, 3 H).
Пример 11
(S)-2-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)(метил)амино)уксусная кислота
Указанное в заголовке соединение получают (61 мг) в виде бледно-коричневатого масла, следуя методикам, приведенным в примере 9, исходя из (S)-5-(2-циклопентил-6-метоксипиридин-4-ил)-3-(3-этил-5-метил-4-(оксиран-2-илметокси)фенил)-1,2,4-оксадиазола (300 мг, 0.689 ммоль) и сложного метилового эфира саркозина (184 мг, 2.07 ммоль); ЖХ-МС: tR=0.95 мин, [М+Н]+=525.04; 1Н ЯМР (CDCl3): δ 8.07 (s, 2 Н), 7.85 (s, 1 Н), 7.83 (s, 1 Н), 7.49 (s, 1 Н), 4.57-4.65 (m, 1 Н), 4.01 (s, 3 Н), 3.76-3.97 (m, 4 Н), 3.49-3.58 (m, 1 Н), 3.41-3.47 (m, 1 Н), 3.19-3.29 (m, 1 Н), 3.10 (s, 3 Н), 2.72 (q, J=7.8 Гц, 2 Н), 2.40 (s br, 2 Н), 2.37 (s, 3 Н), 2.05-2.16 (m, 2 Н), 1.83-1.94 (m, 4 Н), 1.69-1.79 (m, 2 Н), 1.31 (t, J=7.5 Гц, 3 Н) (соль муравьиной кислоты).
Пример 12
(S)-1-(3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение получают (73 мг) в виде бледно-коричневатого масла, следуя методикам, приведенным в примере 9, исходя из (S)-5-(2-циклопентил-6-метоксипиридин-4-ил)-3-(3-этил-5-метил-4-(оксиран-2-илметокси)фенил)-1,2,4-оксадиазола (200 мг, 0.459 ммоль) и сложного метилового эфира азетидин-3-карбоновой кислоты (139 мг, 0.918 ммоль); ЖХ-МС: tR=0.87 мин, [М+Н]+=537.26; 1Н ЯМР (CD3OD): δ 8.18 (s, 2 Н), 7.89 (s, 1 Н), 7.87 (s, 1 Н), 7.55 (s, 1 Н), 7.31 (s, 1 Н), 4.32-4.43 (m, 4 Н), 4.21-4.28 (m, 1 Н), 4.02 (s, 3 Н), 3.88 (d, J=5.0 Гц, 2 Н), 3.42-3.64 (m, 4 Н), 2.81 (q, J=7.6 Гц, 2 Н), 2.42 (s, 3 Н), 2.07-2.17 (m, 2 Н), 1.87-1.97 (m, 4 Н), 1.73-1.83 (m, 2 Н), 1.33 (t, J=7.4 Гц, 3 Н) (соль муравьиной кислоты).
Пример 13
2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-N-(2-гидроксиэтил)ацетамид
К раствору 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)уксусной кислоты (780 мг, 1.65 ммоль) в ТГФ (30 мл) добавляют HOBt (267 мг, 1.98 ммоль) и, далее, EDC HCl (379 мг, 1.98 ммоль). Смесь, перед тем, как добавляют этаноламин (121 мг, 1.98 ммоль), перемешивают при к.т. в течение 5 мин. Перемешивание продолжают в течение 3 ч. Смесь разбавляют водой и насыщ. водн. раствором NaHCO3 и два раза экстрагируют с помощью ЭА. Объединенные орг. экстракты сушат над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью преп. ВЭЖХ с получением указанного в заголовке соединения (202 мг) в виде бесцветного масла; ЖХ-МС: tR=1.07 мин, [М+Н]+=481.01; 1Н ЯМР (CDCl3): 5 7.90 (s, 1 Н), 7.89 (s, 1 Н), 7.50 (d, J=0.5 Гц, 1 Н), 7.35 (t br, J=5.3 Гц, 1 Н), 7.30 (d, J=0.8 Гц, 1 Н), 4.39 (s, 2 Н), 4.02 (s, 3 Н), 3.87 (t, J=4.9 Гц, 2 Н), 3.63 (m, 2 Н), 3.51 (s, 2 Н), 3.20-3.29 (m, 1 Н), 2.73 (q, J=7.6 Гц, 2 Н), 2.38 (s, 3 Н), 2.06-2.15 (m, 2 Н), 1.84-1.95 (m, 4 Н), 1.70-1.80 (m, 2 Н), 1.33 (t, J=7.6 Гц, 3 Н).
Пример 14
(S)-3-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)амино)-3-оксопропановая кислота
a) Раствор (S)-5-(2-циклопентил-6-метоксипиридин-4-ил)-3-(3-этил-5-метил-4-(оксиран-2-илметокси)фенил)-1,2,4-оксадиазола (350 мг, 0.804 ммоль) в 7 н. NH3 в метаноле (15 мл) перемешивают при 45°C течение 18 ч. Растворитель упаривают и сырой продукт очищают с помощью КХ на силикагеле, элюируя ДХМ:7 н. NH3 в метаноле 94:6 с получением (S)-1-амино-3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропан-2-ола (256 мг) в виде бледно-желтого твердого вещества; ЖХ-МС: tR=0.83 мин, [М+Н]+=453.22.
b) К раствору моно-этил малоната (13 мг, 0.097 ммоль) в ДМФА (1 мл) добавляют DIPEA (38 мг, 0.291 ммоль) и TBTU (33 мг, 0.102 ммоль). Смесь, перед тем, как добавляют (S)-1-амино-3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропан-2-ол (44 мг, 0.097 ммоль), перемешивают при к.т. в течение 5 мин. Перемешивание продолжают при к.т. в течение 2 ч перед тем, как смесь разбавляют водой и насыщ. водн. NaHCO3 и два раза экстрагируют с помощью ЭА. Объединенные орг. экстракты сушат над MgSO4, фильтруют и концентрируют с получением сырого (S)-этил 3-((3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)амино)-3-оксопропаноата (39 мг) в виде желтого масла; ЖХ-МС: tR=1.03 мин, [М+Н]+=567.11. Это вещество растворяют в метаноле (5 мл) и 2 н. водн. LiOH (5 мл) и смесь перемешивают при к.т. в течение 15 ч. Реакционную смесь подкисляют путем добавления 2 н. водн. HCl и затем два раза экстрагируют с помощью ЭА. Объединенные орг. экстракты сушат над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью преп. ВЭЖХ с получением указанного в заголовке соединения (23 мг) в виде белого твердого вещества; ЖХ-МС: tR=1.00 мин, [М+Н]+=538.98; 1Н ЯМР (CD3OD): δ 7.86 (s, 1 Н), 7.84 (s, 1 Н), 7.53 (s, 1 Н), 7.29 (s, 1 Н), 4.10-4.19 (m, 1 Н), 4.01 (s, 3 Н), 3.83-3.93 (m, 2 Н), 3.62 (dd, J1=13.7 Гц, J2=4.8 Гц, 1 Н), 3.43 (dd, J1=13.8 Гц, J2=6.9 Гц, 1 Н), 3.24-3.32 (m, 2 Н), 2.80 (q, J=7.5 Гц, 2 Н), 2.41 (s, 3 Н), 2.06-2.18 (m, 2 Н), 1.85-1.97 (m, 4 Н), 1.73-1.82 (m, 2 Н), 1.31 (t, J=7.5 Гц, 3 Н).
Пример 15
(S)-4-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)амино)-4-оксобутановая кислота
Указанное в заголовке соединение получают (162 мг) в виде бледно-коричневатого масла, следуя методикам, приведенным в примере 14, исходя из (S)-1-амино-3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропан-2-ола (348 мг, 0.614 ммоль) и моно-метилсукцината (128 мг, 0.921 ммоль); ЖХ-МС: tR=1.05 мин, [М+Н]+=553.20; 1Н ЯМР (CD3OD): δ 7.85 (s, 1 Н), 7.83 (s, 1 Н), 7.53 (s, 1 Н), 7.28 (s, 1 Н), 4.07-4.15 (m, 1 Н), 4.00 (s, 3 Н), 3.81-3.92 (m, 2 Н), 3.57 (dd,=13.7 Гц, J2=4.8 Гц, 1 Н), 3.34-3.42 (m, 1 Н), 3.23-3.31 (m, 1 Н), 2.80 (q, J=7.6 Гц, 2 Н), 2.64 (m, 2 Н), 2.51-2.58 (m, 2 Н), 2.41 (s, 3 Н), 2.07-2.17 (m, 2 Н), 1.85-1.98 (m, 4 Н), 1.72-1.82 (m, 2 Н), 1.31 (t, J=7.5 Гц, 3 Н).
Пример 16
2-((2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)(метил)амино)уксусная кислота
Указанное в заголовке соединение получают (24 мг) в виде бежевого твердого вещества, следуя методикам, приведенным в примере 1, исходя из 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил метансульфоната (263 мг, 0.525 ммоль) и гидрохлорида сложного метилового эфира саркозина (878 мг, 6.29 ммоль); ЖХ-МС: tR=0.95 мин, [М+Н]+=495.25; 1Н ЯМР (CDCl3): δ 7.77 (s, 1 Н), 7.73 (s, 1 Н), 7.41 (s, 1 Н), 7.18 (s, 1 Н), 3.95 (s, 3 Н), 3.88-3.95 (m, 2 Н), 3.47 (s br, 3 Н), 3.14-3.24 (m, 3 Н), 2.98 (s br, 2 Н), 2.68 (q, J=7.0 Гц, 2 Н), 2.47 (s, 3 Н), 2.31 (s, 3 Н), 2.02-2.11 (m, 2 Н), 1.79-1.93 (m, 4 Н), 1.67-1.77 (m, 2 Н), 1.26 (t, J=7.3 Гц, 3 Н).
Пример 17
3-((2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)(метил)амино)пропановая кислота
Указанное в заголовке соединение получают (7 мг) в виде бесцветного стекла, следуя методикам, приведенным в примере 1, исходя из 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил метансульфоната (280 мг, 0.558 ммоль) и этил 3-(метиламино)-пропионата (148 мг, 1.13 ммоль); ЖХ-МС: tR=0.94 мин, [М+Н]+=509.26; 1Н ЯМР (CD3OD): δ 7.88 (s, 1 Н), 7.86 (s, 1 Н), 7.52 (s, 1 Н), 7.27 (s, 1 Н), 4.21 (t, J=5.0 Гц, 2 Н), 4.00 (s, 3 Н), 3.56 (t, J=5.0 Гц, 2 Н), 3.42 (t, J=6.5 Гц, 2 Н), 3.23-3.30 (m, 1 Н), 2.98 (s, 3 Н), 2.80 (q, J=7.5 Гц, 2 Н), 2.65 (t, J=6.5 Гц, 2 Н), 2.43 (s, 3 Н), 2.06-2.16 (m, 2 Н), 1.85-1.97 (m, 4 Н), 1.72-1.83 (m, 2 Н), 1.33 (t, J=7.5 Гц, 3 Н).
Пример 18
2-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил)амино)уксусная кислота
Указанное в заголовке соединение (59 мг) получают в виде бледно-желтого твердого вещества по аналогии с методиками, приведенными в примере 1, исходя из 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил метансульфоната (150 мг, 0.291 ммоль) и гидрохлорида сложного этилового эфира глицина (203 мг, 1.46 ммоль); ЖХ-МС: tR=0.96 мин, [М+Н]+=495.25; 1Н ЯМР (CD3OD): δ 7.88 (s, 1 Н), 7.86 (s, 1 Н), 7.53 (s, 1 Н), 7.28 (s, 1 Н), 3.98-4.03 (m, 2 Н), 4.00 (s, 3 Н), 3.84 (s, 2 Н), 3.38-3.44 (m, 2 Н), 3.24-3.31 (m, 1 Н), 2.78 (q, J=7.6 Гц, 2 Н), 2.41 (s, 3 Н), 2.23-2.32 (m, 2 Н), 2.06-2.17 (m, 2 Н), 1.85-1.97 (m, 4 Н), 1.72-1.82 (m, 2 Н), 1.32 (t, J=7.5 Гц, 3 Н).
Пример 19
3-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил)амино)пропановая кислота
Указанное в заголовке соединение (6 мг) получают в виде бледно-коричневатого твердого вещества по аналогии с методиками, приведенными в примере 1, исходя из 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил метансульфоната (100 мг, 0.194 ммоль) и гидрохлорида сложного этилового эфира В-аланина (149 мг, 0.970 ммоль); ЖХ-МС: tR=0.96 мин, [М+Н]+=509.28; 1Н ЯМР (CD3OD): δ 7.88 (s, 1 Н), 7.87 (s, 1 Н), 7.57 (s, 1 Н), 7.35 (s, 1 Н), 4.04 (s, 3 Н), 4.01 (t, J=6.0 Гц, 2 Н), 3.36-3.46 (m, 4 Н), 3.23-3.32 (m, 1 Н), 2.84 (t, J=6.4 Гц, 2 Н), 2.79 (q, J=7.6 Гц, 2 Н), 2.42 (s, 3 Н), 2.25-2.34 (m, 2 Н), 2.07-2.19 (m, 2 Н), 1.85-1.97 (m, 4 Н), 1.73-1.83 (m, 2 Н), 1.33 (t, J=7.5 Гц, 3 Н).
Пример 20
2-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил)(метил)амино)уксусная кислота
Указанное в заголовке соединение (102 мг) получают в виде бледно-желтого масла по аналогии с методиками, приведенными в примере 1, исходя из 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил метансульфоната (150 мг, 0.291 ммоль) и гидрохлорида метилового сложного эфира саркозина (203 мг, 1.46 ммоль); ЖХ-МС: tR=0.97 мин, [М+Н]+=509.26; 1Н ЯМР (CD3OD): δ 7.85 (s, 1 Н), 7.83 (s, 1 Н), 7.51 (s, 1 Н), 7.25 (s, 1 Н), 3.99 (s, 3 Н), 3.98 (t, J=5.9 Гц, 2 Н), 3.79 (s, 2 Н), 3.50-3.58 (m, 2 Н), 3.22-3.30 (m, 1 Н), 3.02 (s, 3 Н), 2.76 (q, J=7.5 Гц, 2 Н), 2.39 (s, 3 Н), 2.28-2.37 (m, 2 Н), 2.04-2.16 (m, 2 Н), 1.84-1.97 (m, 4 Н), 1.71-1.82 (m, 2 Н), 1.31 (t, J=7.5 Гц, 3 Н).
Пример 21
3-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил)(метил)амино)пропановая кислота
Указанное в заголовке соединение (46 мг) получают в виде бледно-желтого масла по аналогии с методиками, приведенными в примере 1, исходя из 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил метансульфоната (150 мг, 0.291 ммоль) и этил 3-(метиламино)пропаноата (244 мг, 1.46 ммоль); ЖХ-МС: tR=0.97 мин, [М+Н]+=523.26; 1Н ЯМР (CD3OD): δ 7.87 (s, 1 Н), 7.85 (s, 1 Н), 7.54 (s, 1 Н), 7.31 (s, 1 Н), 4.02 (s, 3 Н), 3.96-4.01 (m, 2 Н), 3.57-3.73 (m, 2 Н), 3.48-3.56 (m, 1 Н), 3.39-3.48 (m, 1 Н), 3.23-3.31 (m, 1 Н), 3.01 (s, 3 Н), 2.94 (t, J=6.7 Гц, 2 Н), 2.78 (q, J=7.5 Гц, 2 Н), 2.41 (s, 3 Н), 2.30-2.39 (m, 2 Н), 2.07-2.19 (m, 2 Н), 1.84-1.96 (m, 4 Н), 1.72-1.83 (m, 2 Н), 1.32 (t, J=7.5 Гц, 3 Н).
Пример 22
1-(3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (29 мг) получают в виде белого твердого вещества по аналогии с методиками, приведенными в примере 1, исходя из 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил метансульфоната (150 мг, 0.291 ммоль) и гидрохлорида сложного метилового эфира азетидин-3-карбоновой кислоты (220 мг, 1.46 ммоль); ЖХ-МС: tR=0.96 мин, [М+Н]+=521.39; 1Н ЯМР (CD3OD): δ 7.89 (d, J=1.4 Гц, 1 Н), 7.87 (d, J=1.4 Гц, 1 Н), 7.55 (d, J=1.0 Гц, 1 Н), 7.31 (d, J=1.1 Гц, 1 Н), 4.24-4.40 (m, 4 Н), 4.01 (s, 3 Н), 3.97 (t, J=5.8 Гц, 2 Н), 3.53-3.60 (m, 2 Н), 3.43-3.48 (m, 1 Н), 3.26-3.31 (m, 1 Н), 2.78 (q, J=7.5 Гц, 2 Н), 2.41 (s, 3 Н), 2.06-2.19 (m, 4 Н), 1.86-1.97 (m, 4 Н), 1.72-1.83 (m, 2 Н), 1.33 (t, J=7.5 Гц, 3 Н).
Пример 23
2-((2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)амино)этанол
Смесь 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил метансульфоната (184 мг, 0.367 ммоль) и этаноламина (112 мг, 1.83 ммоль) в ацетонитриле (6 мл), перед тем, как ее разделяют с помощью преп. ВЭЖХ с получением указанного в заголовке соединения (77 мг) в виде белого твердого вещества, перемешивают при 65°C в течение 18 ч; ЖХ-МС: tR=0.92 мин, [М+Н]+=467.25; 1Н ЯМР (CD3OD): δ 7.91 (s, 1 Н), 7.88 (s, 1 Н), 7.62 (s, 1 Н), 7.41 (s, 1 Н), 4.20 (t, J=5.0 Гц, 2 Н), 4.07 (s, 3 Н), 3.93 (t, J=5.1 Гц, 2 Н), 3.60 (t, J=4.9 Гц, 2 Н), 3.34-3.38 (m, 2 Н), 3.24-3.31 (m, 1 Н), 2.82 (q, J=7.5 Гц, 2 Н), 2.45 (s, 3 Н), 2.10-2.19 (m, 2 Н), 1.85-1.97 (m, 4 Н), 1.72-1.84 (m, 2 Н), 1.35 (t, J=7.5 Гц, 3 Н).
Пример 24
2-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил)амино)этанол
Указанное в заголовке соединение (54 мг) получают в виде бледно-желтого твердого вещества по аналогии с примером 23 исходя из 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил метансульфоната (200 мг, 0.388 ммоль) и этаноламина (72 мг, 1.16 ммоль); ЖХ-МС: tR=0.95 мин, [М+Н]+=481.10; 1Н ЯМР (CD3OD): 7.92 (s, 1 Н), 7.91 (s, 1 Н), 7.89 (s, 1 Н), 7.81 (s, 1 Н), 4.27 (s, 3 Н), 4.02 (t, J=5.9 Гц, 2 Н), 3.87 (m, 2 Н), 3.38-3.46 (m, 2 Н), 3.34-3.38 (m, 1 Н), 3.23-3.28 (m, 2 Н), 2.79 (q, J=7.5 Гц, 2 Н), 2.42 (s, 3 Н), 2.19-2.34 (m, 4 Н), 1.80-2.02 (m, 6 Н), 1.33 (t, J=7.5 Гц, 3 Н).
Пример 25
2-((2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)амино)пропан-1,3-диол
Указанное в заголовке соединение (66 мг) получают в виде белого твердого вещества по аналогии с примером 23 исходя из 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил метансульфоната (227 мг, 0.453 ммоль) и серинола (165 мг, 1.81 ммоль); ЖХ-МС: tR=0.91 мин, [М+Н]+=497.11; 1Н ЯМР (CD3OD): δ 7.80 (s, 1 Н), 7.78 (s, 1 Н), 7.46 (s, 1 Н), 7.20 (s, 1 Н), 4.00 (t, J=5.2 Гц, 2 Н), 3.97 (s, 3 Н), 3.71 (dd, J1=11.1 Гц, J2=5.3 Гц, 2 Н), 3.62 (dd, J1=11.0 Гц, J2=6.0 Гц, 2 Н), 3.19-3.29 (m, 1 Н), 3.14 (t, J=5.2 Гц, 2 Н), 2.85 (квинт., J=5.6 Гц, 1 Н), 2.77 (q, J=7.5 Гц, 2 Н), 2.38 (s, 3 Н), 2.04-2.16 (m, 2 Н), 1.83-1.95 (m, 4 Н), 1.70-1.81 (m, 2 Н), 1.30 (t, J=7.5 Гц, 3 Н).
Пример 26
2-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил)амино)пропан-1,3-диол
Указанное в заголовке соединение (54 мг) получают в виде бледно-коричневатого масла по аналогии с примером 23 исходя из 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил метансульфоната (200 мг, 0.388 ммоль) и серинола (106 мг, 1.16 ммоль); ЖХ-МС: tR=0.93 мин, [М+Н]+=511.28; 1Н ЯМР (D6-ДМСО): δ 7.79 (s, 2 Н), 7.54 (s, 1 Н), 7.27 (s, 1 Н), 4.38-4.45 (m, 2 Н), 3.94 (s, 3 Н), 3.88 (t, J=6.1 Гц, 2 Н), 3.36-3.45 (m, 2 Н), 3.23-3.33 (m, 1 Н), 2.81 (t, J=6.7 Гц, 2 Н), 2.71 (q, J=7.5 Гц, 2 Н), 2.52-2.58 (m, 1 Н), 2.34 (s, 3 Н), 1.98-2.10 (m, 2 Н), 1.86-1.94 (m, 2 Н), 1.76-1.85 (m, 4 Н), 1.63-1.73 (m, 2 Н), 1.23 (t, J=7.5 Гц, 3 Н).
Пример 27
рац-3-((2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)амино)пропан-1,2-диол
Смесь 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил метансульфоната (195 мг, 0.389 ммоль) и рац-2,2-диметил-1,3-диоксолан-4-метанамина (51 мг, 0.389 ммоль) в ацетонитриле (6 мл) перемешивают при 65°C течение 16 ч. Смесь разделяют с помощью преп. ВЭЖХ с получением рац-2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-N-((2,2-диметил-1,3-диоксолан-4-ил)метил)этанамина (180 мг) в виде белого твердого вещества. Это вещество растворяют в 2 н. водн. HCl (1 мл) и диоксане (5 мл) и перемешивают при 60°C течение 1 ч. Растворитель упаривают и сырой продукт очищают с помощью преп. ТСХ, элюируя ДХМ, содержащим 15% метанола, и, далее, с помощью преп. ВЭЖХ с получением указанного в заголовке соединения (16 мг) в виде белого твердого вещества; ЖХ-МС: tR=0.91 мин, [М+Н]+=497.11; 1Н ЯМР (CD3OD): δ 7.82 (s, 1 Н), 7.80 (s, 1 Н), 7.48 (s, 1 Н), 7.22 (s, 1 Н), 4.00 (t, J=5.0 Гц, 2 Н), 3.98 (s, 3 Н), 3.82-3.89 (m, 1 Н), 3.53-3.63 (m, 2 Н), 3.20-3.30 (m, 1 Н), 3.08 (t, J=5.0 Гц, 2 Н), 2.88 (dd, J1=12.1 Гц, J2=3.7 Гц, 1 Н), 2.70-2.81 (m, 3 Н), 2.38 (s, Н), 2.05-2.15 (m, 2 Н), 1.84-1.95 (m, 4 Н), 1.69-1.81 (m, 2 Н), 1.30 (t, J=7.5 Гц, 3 Н).
Пример 28
рац-3-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил)амино)пропан-1,2-диол
Указанное в заголовке соединение (94 мг) получают в виде бледно-коричневатого масла по аналогии с примером 27 исходя из 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил метансульфоната (200 мг, 0.388 ммоль) и рац-2,2-диметил-1,3-диоксолан-4-метанамина (153 мг, 1.16 ммоль); ЖХ-МС: tR=0.93 мин, [М+Н]+=511.28; 1Н ЯМР (D6-ДМСО): δ 7.80 (s, 2 Н), 7.55 (s, 1 Н), 7.28 (s, 1 Н), 4.55 (d br, J=4.0 Гц, 1 H), 3.95 (s, 3 Н), 3.88 (t, J=6.1 Гц, 2 H), 3.50-3.58 (m, 1 Н), 3.24-3.32 (m, 2 Н), 2.67-2.79 (m, 4 Н), 2.63 (dd, J1=11.7 Гц, J2=4.5 Гц, 1 Н), 2.47 (dd, J1=11.8 Гц, J2=7.0 Гц, 1 Н), 2.34 (s, 3 Н), 1.99-2.08 (m, 2 Н), 1.87-1.95 (m, 2 Н), 1.76-1.87 (m, 4 Н), 1.64-1.73 (m, 2 Н), 1.23 (t, J=7.5 Гц, 3 Н).
Пример 29
N-(3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил)-2-гидроксиацетамид
a) Раствор 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил метансульфоната (1.30 г, 2.52 ммоль) в 7 н. NH3 в метаноле (30 мл) перемешивают при 55°C в течение 24 ч. Смесь концентрируют и сушат с получением сырого 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропан-1-амина (1.24 г) в виде бледно-желтой пены; ЖХ-МС: tR=0.95 мин, [М+Н]+=437.33.
b) К раствору 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропан-1-амина (200 мг, 0.458 ммоль), гликолевой кислоты (52 мг, 0.687 ммоль) и DIPEA (178 мг, 1.37 ммоль) в ДМФА (5 мл) добавляют TBTU (191 мг, 0.596 ммоль). Смесь, перед тем, как ее разбавляют с помощью ЭА (50 мл) и дважды промывают насыщ. водн. раствором NaHCO3 (50 мл) и, далее, соляным раствором (50 мл), перемешивают при к.т. в течение 18 ч. Орг. экстракт сушат над Na2SO4, фильтруют, и концентрируют.Сырой продукт очищают с помощью преп. ВЭЖХ с получением указанного в заголовке соединения (116 мг) в виде бледно-желтого масла; ЖХ-МС: tR=1.14 мин, [М+Н]+=495.25; 1Н ЯМР (CD3OD): δ 7.85 (s, 1 Н), 7.83 (s, 1 Н), 7.53 (s, 1 Н), 7.28 (s, 1 Н), 4.01 (s, 2 Н), 4.00 (s, 3 Н), 3.94 (t, J=6.1 Гц, 2 Н), 3.57 (t, J=6.9 Гц, 2 Н), 3.24-3.31 (m, 1 Н), 2.77 (q, J=7.6 Гц, 2 Н), 2.38 (s, 3 Н), 2.05-2.16 (m, 4 Н), 1.86-1.96 (m, 4 Н), 1.72-1.82 (m, 2 Н), 1.31 (t, J=7.5 Гц, 3 Н).
Пример 30
N-(3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил)-2-гидрокси-N-метилацетамид
a) 3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2- этил-6-метилфенокси)-N-метилпропан-1-амин (941 мг) получают по аналогии с примером 29 исходя из 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил метансульфоната (700 мг, 1.36 ммоль) и 2 М раствора метиламина в ТГФ (20 мл); ЖХ-МС: tR=0.96 мин, [М+Н]+=451.29.
b) Указанное в заголовке соединение (155 мг) получают в виде бледно-желтого масла по аналогии с примером 29 исходя из 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-N-метилпропан-1-амина (206 мг, 0.458 ммоль) и гликолевой кислоты (52 мг, 0.687 ммоль); ЖХ-МС: tR=1.19 мин, [М+Н]+=509.40; 1Н ЯМР (CD3OD): δ 7.84-7.86 (m, 1 Н), 7.81-7.84 (m, 1 Н), 7.51-7.53 (m, 1 Н), 7.26-7.28 (m, 1 Н), 4.35 (s, 0.7 Н), 4.25 (s, 1.3 Н), 4.00 (s, 3 Н), 3.91 (q, J=5.8 Гц, 2 Н), 3.69 (m, 1.3 Н), 3.55-3.61 (m, 0.7 Н), 3.24-3.31 (m, 1 Н), 3.06 (s, 1.05 Н), 3.04 (s, 1.95 Н), 2.72-2.79 (m, 2 Н), 2.38 (s, 3 Н), 2.07-2.19 (m, 4 Н), 1.85-1.96 (m, 4 Н), 1.71-1.83 (m, 2 Н), 1.28-1.35 (m, 3 Н) (1:2 смесь атропоизомеров).
Пример 31
3-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил)амино)-3-оксопропановая кислота
К раствору 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропан-1-амина (200 мг, 0.458 ммоль), моноэтилмалоната (91 мг, 0.687 ммоль) и DIPEA (178 мг, 1.37 ммоль) в ДМФА (5 мл) добавляют TBTU (191 мг, 0.596 ммоль). Смесь перемешивают при к.т. течение 18 ч. Раствор разбавляют с помощью ЭА (50 мл) и дважды промывают насыщ. водн. раствором NaHCO3 (50 мл) и, далее, соляным раствором (50 мл). Орг. экстракт сушат над Na2SO4, фильтруют и концентрируют с получением сырого этил 3-((3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси) пропил)амино)-3-оксопропаноата (298 мг) в виде желтого масла; ЖХ-МС: tR=1.19 мин, [М+Н]+=551.38. Это вещество растворяют в метаноле (2 мл), ТГФ (2 мл) и 2 н. водн. LiOH (1 мл). Раствор перемешивают при к.т. в течение 2 ч, перед тем, как его концентрируют, разбавляют с помощью ДХМ (20 мл), и промывают 2 н. водн. HCl (10 мл). Водн. фазу экстрагируют три раза с помощью ДХМ (3×20 мл). Объединенные орг.экстракты сушат над mgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью преп. ВЭЖХ с получением указанного в заголовке соединения (105 мг) в виде белого твердого вещества; ЖХ-МС: tR=1.14 мин, [М+Н]+=523.21; 1Н ЯМР (CD3OD): δ 7.82 (s, 1 Н), 7.79 (s, 1 Н), 7.49 (s, 1 Н), 7.23 (s, 1 Н), 3.99 (s, 3 Н), 3.92 (t, J=6.2 Гц, 2 Н), 3.52 (t, J=6.9 Гц, 2 Н), 3.31 (s, 2 Н), 3.22-3.31 (m, 1 Н), 2.75 (q, J=7.5 Гц, 2 Н), 2.36 (s, 3 Н), 2.04-2.15 (m, 4 Н), 1.85-1.95 (m, 4 Н), 1.73-1.82 (m, 2 Н), 1.29 (t, J=7.5 Гц, 3 Н).
Пример 32
4-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил)амино)-4-оксобутановая кислота
Указанное в заголовке соединение (106 мг) получают в виде белого твердого вещества по аналогии с примером 31 исходя из 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропан-1-амина (200 мг, 0.458 ммоль) и монометилсукцината (96 мг, 0.687 ммоль); ЖХ-МС: tR=1.13 мин, [М+Н]+=537.22; 1Н ЯМР (CD3OD): δ 7.81 (s, 1 Н), 7.79 (s, 1 Н), 7.48 (s, 1 Н), 7.22 (s, 1 Н), 3.98 (s, 3 Н), 3.90 (t, J=6.2 Гц, 2 Н), 3.47 (t, J=7.0 Гц, 2 Н), 3.21-3.30 (m, 1 Н), 2.74 (q, J=7.5 Гц, 2 Н), 2.63 (t, J=7.0 Гц, 2 Н), 2.51 (t, J=6.7 Гц, 2 Н), 2.36 (s, 3 Н), 2.02-2.14 (m, 4 Н), 1.83-1.95 (m, 4 Н), 1.71-1.80 (m, 2 Н), 1.29 (t, J=7.5 Гц, 3 Н).
Пример 33
3-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил)(метил)амино)-3-оксопропановая кислота
Указанное в заголовке соединение (103 мг) получают в виде бледно-желтого масла по аналогии с примером 31 исходя из 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-N-метилпропан-1-амина (206 мг, 0.458 ммоль) и моноэтилмалоната (91 мг, 0.687 ммоль); ЖХ-МС: tR=1.16 мин, [М+Н]+=537.37; 1Н ЯМР (CD3OD): δ 7.81-7.84 (m, 1 Н), 7.78-7.81 (m, 1 Н), 7.49-7.50 (m, 1 Н), 7.23-7.24 (m, 1 Н), 3.99 (s, 3 Н), 3.88-3.95 (m, 2 Н), 3.66-3.74 (m, 2 Н), 3.59-3.62 (m, 0.3 Н), 3.52-3.54 (m, 0.7 Н), 3.23-3.30 (M, 1 Н), 3.16 (s, 2.1 Н), 3.05 (s, 0.9 Н), 2.75 (q, J=7.5 Гц, 2 Н), 2.37 (s, 0.9 Н), 2.36 (s, 2.1 Н), 2.06-2.22 (m, 4 Н), 1.84-1.95 (m, 4 Н), 1.73-1.81 (m, 2 Н), 1.26-1.33 (m, 3 Н) (смесь атропоизомеров).
Пример 34
4-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)пропил)(метил)амино)-4-оксобутановая кислота
Указанное в заголовке соединение (168 мг) получают в виде бледно-желтого масла по аналогии с примером 31 исходя из 3-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-N-метилпропан-1-амина (206 мг, 0.458 ммоль) и монометилсукцината (96 мг, 0.687 ммоль); ЖХ-МС: tR=1.16 мин, [М+Н]+=551.37; 1Н ЯМР (CD3OD): δ 7.80-7.83 (m, 1 Н), 7.77-7.80 (m, 1 Н), 7.47-7.49 (m, 1 Н), 7.22-7.24 (m, 1 Н), 3.98 (s, 3 Н), 3.94 (t, J=5.9 Гц, 0.8 Н), 3.87 (t, J=6.4 Гц, 1.2 Н), 3.70-3.75 (m, 0.8 Н), 3.63-3.68 (m, 1.2 Н), 3.21-3.30 (m, 1 Н), 3.16 (s, 2 Н), 3.01 (s, 1 Н), 2.60-2.80 (m, 6 Н), 2.37 (s, 1.2 Н), 2.35 (s, 1.8 Н), 2.06-2.23 (m, 4 Н), 1.84-1.96 (m, 4 Н), 1.71-1.82 (m, 2 Н), 1.26-1.33 (m, 3 Н).
Пример 35
4-(2-Хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метоксифенокси)бутановая кислота
а) 2-Хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метоксифенол (900 мг) получают в виде белого твердого вещества по аналогии с примером 1, стадия а), исходя из 2-циклопентил-6-метокси-изоникотиновой кислоты (3.00 г, 13.6 ммоль) и 3-хлор-4,N-дигидрокси-5-метокси-бензамидина (3.08 г, 14.24 ммоль); ЖХ-МС: tR=1.18 мин, [М+Н]+=401.98.
b) Указанное в заголовке соединение (182 мг) получают в виде бесцветного масла по аналогии с примером 6 исходя из 2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метоксифенола (225 мг, 0.56 ммоль) и этил-4-бромбутирата (169 мг, 0.84 ммоль); ЖХ-МС: tR=1.12 мин, [М+Н]+=488.17; 1Н ЯМР (CDCl3): 6 7.86 (d, J=1.9 Гц, 1 Н), 7.62 (d, J=1.8 Гц, 1 Н), 7.50 (d, J=0.8 Гц, 1 Н), 7.30 (d, J=0.9 Гц, 1 Н), 4.17 (t, J=5.9 Гц, 2 Н), 4.02 (s, 3 Н), 3.99 (s, 3 Н), 3.20-3.29 (m, 1 Н), 2.78 (t, J=7.3 Гц, 2 Н), 2.06-2.21 (m, 4 Н), 1.84-1.95 (m, 4 Н), 1.69-1.79 (m, 2 Н).
Пример 36
4-(2-Хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метоксифенокси)-N-(2-гидроксиэтил)бутанамид
Указанное в заголовке соединение (51 мг) получают в виде бесцветного масла по аналогии с примером 13 исходя из 4-(2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метоксифенокси)бутановой кислоты (75 мг, 0.154 ммоль) и этаноламина (11 мг, 0.184 ммоль); ЖХ-МС: tR=1.06 мин, [М+Н]+=531.15; 1Н ЯМР (CDCl3): δ 7.86 (d, J=1.8 Гц, 1 Н), 7.62 (d, J=1.8 Гц, 1 Н), 7.49 (s, 1 Н), 7.30 (s, 1 Н), 6.23 (s br, 1 Н), 4.17 (t, J=5.7 Гц, 2 Н), 4.02 (s, 3 Н), 3.99 (s, 3 Н), 3.76 (t, J=4.8 Гц, 2 Н), 3.48 (q, J=5.4 Гц, 2 Н), 3.19-3.29 (m, 1 Н), 2.60 (t, J=7.2 Гц, 2 Н), 2.14-2.22 (m, 2 Н), 2.06-2.15 (m, 2 Н), 1.84-1.95 (m, 4 Н), 1.69-1.80 (m, 2 Н).
Пример 37
3-((2-(2-Хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метоксифенокси)этил)амино)пропановая кислота
Указанное в заголовке соединение получают по аналогии с примером 1 исходя из 2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метоксифенола; ЖХ-МС: tR=0.86 мин, [М+Н]+=517.17.
Пример 38
N-(3-(2-Хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метоксифенокси)пропил)-2-гидроксиацетамид
Указанное в заголовке соединение получают по аналогии с примером 29 исходя из 2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метоксифенола; ЖХ-МС: tR=1.08 мин, [М+Н]+=517.19; 1Н ЯМР (CDCl3): 5 7.88 (d, J=1.7 Гц, 1 Н), 7.64 (d, J=1.7 Гц, 1 Н), 7.50 (s, 1 Н), 7.31 (s, 1 Н), 7.02 (s br, 1 Н), 4.19 (t, J=5.6 Гц, 2 Н), 4.16 (s, 2 Н), 4.02 (s, 3 Н), 4.01 (s, 3 Н), 3.70 (q, J=6.1 Гц, 2 Н), 3.20-3.29 (m, 1 Н), 2.03-2.16 (m, 4 Н), 1.84-1.95 (m, 4 Н), 1.70-1.80 (m, 2 Н).
Пример 39
4-((2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)амино)бутановая кислота
Указанное в заголовке соединение (88 мг) получают в виде бежевого твердого вещества по аналогии с примером 1 исходя из 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метил-фенокси)этил метансульфоната (292 мг, 0.582 ммоль) и гидрохлорида трет-бутил γ-амино бутирата (263 мг, 1.34 ммоль); ЖХ-МС: tR=0.93 мин, [М+Н]+=509.27; 1Н ЯМР (D6-ДМСО): δ 7.79 (s, 2 Н), 7.53 (s, 1 Н), 7.26 (s, 1 Н), 4.04 (s br, 2 Н), 3.94 (s, 3 Н), 3.90 (t, J=5.4 Гц, 2 Н), 3.23-3.33 (m, 1 Н), 2.99 (t, J=5.4 Гц, 2 Н), 2.66-2.77 (m, 4 Н), 2.35 (s, 3 Н), 2.30 (t, J=7.0 Гц, 2 Н), 1.99-2.09 (m, 2 Н), 1.75-1.88 (m, 4 Н), 1.62-1.73 (m, 4 Н), 1.23 (t, J=7.5 Гц, 3 Н).
Пример 40
4-(2-Хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метилфенокси)бутановая кислота
а) Смесь 3-хлор-4-гидрокси-5-метил-бензонитрила (1.15 г, 6.87 ммоль) и Cs2CO3 (13.43 г, 41.2 ммоль) в ДМФА (45 мл) перемешивают при к.т. в течение 30 мин перед тем, как добавляют трет-бутил 4-бромбутаноат (1.55 г, 6.95 ммоль). Оранжевую суспензию перемешивают при 65°C течение 72 часов. Добавляют другую порцию трет-бутил 4-бромбутаноата (1.55 г, 6.95 ммоль), и перемешивание продолжают при 65°C в течение 24 ч. Смесь разбавляют водой (150 мл) и экстрагируют три раза с помощью ДХМ (3×50 мл) и ЭА (3×50 мл). Орг. экстракты объединяют, сушат над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью ЖХСД на силикагеле, элюируя смесью гептан:ЭА:метанол с получением трет-бутил 4-(2-хлор-4-циано-6-метилфенокси)бутаноата (645 мг) в виде бесцветного масла; ЖХ-МС: tR=1.01 мин, [М+Н]+=масса не может быть обнаружена; 1Н ЯМР (D6-ДМСО): δ 7.94 (d, J=1.7 Гц, 1 Н), 7.75 (d, J=1.3 Гц, 1 Н), 3.95 (t, J=6.3 Гц, 2 Н), 2.46 (t, J=7.2 Гц, 2 Н), 2.30 (s, 3 Н), 1.98 (квинт., J=6.6 Гц, 2 Н), 1.41 (s, 9 Н).
b) Раствор трет-бутил 4-(2-хлор-4-циано-6-метилфенокси)бутаноата (640 мг, 2.07 ммоль), триэтиламина (418 мг, 4.13 ммоль) и гидрохлорида гидроксиламина (215 мг, 3.10 ммоль) в этаноле (5 мл) перемешивают при 65°C течение 72 часов. Смесь концентрируют и сырой продукт очищают с помощью преп. ВЭЖХ с получением трет-бутил 4-(2-хлор-4-(N-гидроксикарбамимидоил)-6-метилфенокси)бутаноата (145 мг) в виде бледно-серого твердого вещества; ЖХ-МС: tR=0.65 мин, [М+Н]+=343.20.
c) Смесь 2-циклопентил-6-метокси-изоникотиновой кислоты (33 мг, 0.149 ммоль), TBTU (50 мг, 0.156 ммоль) и DIPEA (62 мг, 0.479 ммоль) в ДМФА (2 мл), перед тем, как добавляют трет-бутил 4-(2-хпор-4-(N-гидроксикарбамимидоил)-6-метилфенокси)бутаноат (51 мг, 0.149 ммоль), перемешивают при к.т. в течение 15 мин. Смесь перемешивают при к.т. в течение 1 ч, перед тем, как добавляют другую порцию TBTU (50 мг, 0.156 ммоль). Перемешивание продолжают при к.т. в течение 2 ч. Смесь нагревают до температуры 110°C и перемешивание продолжают течение еще одного часа. Смесь концентрируют и сырой продукт очищают с помощью преп. ВЭЖХ с получением трет-бутил 4-(2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метилфенокси)бутаноата (33 мг) в виде бесцветного стекла; ЖХ-МС: tR=1.28 мин, [М+Н]+=528.37.
d) Раствор трет-бутил 4-(2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метилфенокси)бутаноата (90 мг, 170 мкмоль) в ДХМ (5 мл), перед тем, как добавляют ТФУ (1 мл), охлаждают до 0°C. Смесь перемешивают при 0°C в течение 10 мин, затем при к.т. в течение 30 мин. Смесь, перед тем, как добавляют другую порцию ТФУ (1 мл), снова охлаждают до 0°C. Перемешивание продолжают при к.т. в течение 2 ч. Смесь концентрируют и сырой продукт очищают с помощью преп. ВЭЖХ с получением указанного в заголовке соединения (59 мг) в виде белого твердого вещества; ЖХ-МС: tR=1.14 мин, [М+Н]+=472.29; 1Н ЯМР (CDCl3): δ 8.13 (s br, 1 Н), 8.02 (d, J=1.4 Гц, 1 H), 7.88 (d, J=0.7 Гц, 1 H), 7.47 (s, 1 Н), 7.25 (s, 1 Н), 4.05 (t, J=5.9 Гц, 2 H), 4.00 (s, 3 Н), 3.17-3.28 (m, 1 Н), 2.74 (t, J=7.3 Гц, 2 H), 2.39 (s, 3 Н), 2.21 (квинт., J=6.5 Гц, 2 Н), 2.05-2.15 (m, 2 Н), 1.81-1.95 (m, 4 Н), 1.68-1.80 (m, 2 Н).
Пример 41
2-(2-Хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метилфенокси)уксусная кислота
a) трет-Бутил 2-(2-хлор-4-(N-гидроксикарбамимидоил)-6-метилфенокси)ацетат получают по аналогии с трет-бутил 4-(2-хлор-4-(N-гидроксикарбамимидоил)-6-метилфенокси)бутаноатом (пример 40); ЖХ-МС: tR=0.57 мин, [М+Н]+=315.2.
b) Указанное в заголовке соединение получают в виде белого твердого вещества исходя из вышеупомянутого трет-бутил 2-(2-хлор-4-(N-гидроксикарбамимидоил)-6-метилфенокси)ацетата и 2-циклопентил-6-метокси-изоникотиновой кислоты по аналогии с примером 40; ЖХ-МС: tR=1.16 мин, [М+Н]+=444.24; 1Н ЯМР (CDCl3): δ 8.99 (s br, 1 Н), 8.07 (d, J=1.8 Гц, 1 Н), 7.94 (d, J=1.2 Гц, 1 Н), 7.48 (s, 1 Н), 7.27 (s, 1 Н), 4.75 (s, 2 Н), 4.01 (s, 3 Н), 3.18-3.30 (m, 1 Н), 2.47 (s, 3 Н), 2.05-2.17 (m, 2 Н), 1.82-1.95 (m, 4 Н), 1.69-1.81 (m, 2 Н).
Пример 42
2-(2-Хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метил-фенокси)-N-(2-гидроксиэтил)ацетамид
Указанное в заголовке соединение получают в виде бежевого воска исходя из соединения примера 41 по аналогии с примером 13; ЖХ-МС: tR=1.09 мин, [М+Н]+=487.24; 1Н ЯМР (CDCl3): δ 8.01 (s, 1 Н), 7.89 (s, 1 Н), 7.47 (t br, J=5.3 Гц, 1 Н), 7.44 (s, 1 Н), 7.22 (s, 1 Н), 4.48 (s, 2 Н), 3.99 (s, 3 Н), 3.84 (t, J=4.9 Гц, 2 Н), 3.61 (q, J=5.4 Гц, 2 Н), 3.16-3.27 (m, 1 Н), 3.05 (s br, 1 Н), 2.39 (s, 3 Н), 2.04-2.15 (m, 2 Н), 1.81-1.93 (m, 4 Н), 1.68-1.78 (m, 2 Н).
Пример 43
3-((2-(2-Хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метилфенокси)этил)амино)пропановая кислота
a) К раствору 2-циклопентил-6-метокси-изоникотиновой кислоты (704 мг, 3.18 ммоль) в ДМФА (5 мл) добавляют TBTU (1.43 г, 4.45 ммоль) и основание Хюнинга. Смесь, перед тем, как добавляют 3-хлор-4-(2,2-диэтоксиэтокси)-N-гидрокси-5-метилбензимидамид (907 мг, 2.86 ммоль), перемешивают при к.т. в течение 15 мин. Перемешивание, перед тем, как добавляют другую порцию 3-хлор-4-(2,2-диэтоксиэтокси)-N-гидрокси-5-метилбензимидамида (503 мг, 1.59 ммоль) и TBTU (510 мг, 1.59 ммоль), продолжают в течение 18 ч. Перемешивание продолжают в течение 4 ч. Смесь разбавляют с помощью ЭА (100 мл) и промывают водой (50 мл). Промывную жидкость экстрагируют три раза с помощью ЭА (3×50 мл). Объединенные орг.экстракты сушат над MgSO4, фильтруют и концентрируют. Остаток растворяют в диоксане (35 мл), и получающийся раствор перемешивают при 110°C течение 18 ч. Растворитель упаривают и сырой продукт очищают с помощью ЖХСД на силикагеле, элюируя смесью гептан:ЭА 7:3 с получением 3-(3-хлор-4-(2,2-диэтоксиэтокси)-5-метилфенил)-5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазола (1.01 г) в виде желтого масла; ЖХ-МС: tR=1.43 мин, [М+Н]+=502.29; 1Н ЯМР (CDCl3): δ 8.06 (d, J=1.9 Гц, 1 Н), 7.92 (d, J=1.4 Гц, 1 Н), 7.50 (d, J=0.9 Гц, 1 Н), 7.29 (d, J=1.1 Гц, 1 Н), 4.94 (t, J=5.3 Гц, 1 Н), 4.08 (d, J=5.3 Гц, 2 Н), 4.02 (s, 3 Н), 3.77-3.86 (m, 2 Н), 3.64-3.73 (m, 2 Н), 3.19-3.29 (m, 1 Н), 2.44 (s, 3 Н), 2.08-2.14 (m, 2 Н), 1.83-1.94 (m, 4Н), 1.71-1.77 (m, 2 Н), 1.28 (t, J=7.1 Гц, 6 Н).
b) Раствор 3-(3-хлор-4-(2,2-диэтоксиэтокси)-5-метилфенил)-5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазола (1.01 г, 2.01 ммоль) в диоксане (15 мл) и 2 М водн. H2SO4 (5 мл) перемешивают при 80°C в течение 3 ч. Смесь экстрагируют с помощью ЭА (100 мл) и орг. экстракт дважды промывают соляным раствором (2×35 мл), сушат над MgSO4, фильтруют и концентрируют с получением сырого 2-(2-хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метилфенокси)ацетальдегида (1.02 г) в виде желтого масла; ЖХ-МС: tR=1.11 мин, [М+Н]+=428.19. Часть этого вещества (345 мг, 0.806 ммоль), перед тем, как добавляют β-аланин (72 мг, 0.806 ммоль), растворяют в ДХМ (10 мл), метаноле (10 мл) и уксусной кислоте (0.7 мл). Смесь, перед тем, как добавляют Na(BH3CN) (23 мг, 0.364 ммоль), дегазируют и помещают под аргон. Прозрачный раствор, перед тем, как реакцию гасят путем добавления воды (2 мл), перемешивают при к.т. в течение 2 ч. Смесь концентрируют и сырой продукт очищают с помощью преп. ВЭЖХ с получением указанного в заголовке соединения (77 мг) виде коричневатого твердого вещества; ЖХ-МС: tR=0.95 мин, [М+Н]+=501.23; 1Н ЯМР (CDCl3): δ 8.53 (s br, 2 Н), 7.83 (s, 1 Н), 7.67 (s, 1 Н), 7.33 (s, 1 Н), 7.07 (s, 1 Н), 4.20-4.30 (m, 2 Н), 3.95 (s, 3 Н), 3.39-3.49 (m, 2 Н), 3.25-3.36 (m, 2 Н), 3.12-3.22 (m, 1 Н), 2.64-2.75 (m, 2 Н), 2.32 (s, 3 Н), 2.02-2.12 (m, 2 Н), 1.78-1.91 (m, 4 Н), 1.68-1.78 (m, 2 Н).
Пример 44
1-(2-(2-Хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метилфенокси)этил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение получают в виде бежевого твердого вещества с применением азетидин-3-карбоновой кислоты по аналогии с примером 43; ЖХ-МС: tR=0.95 мин, [М+Н]+=514.06.
Пример 45
2-((2-(2-Хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метилфенокси)этил)амино)этанол
Указанное в заголовке соединение получают в виде бежевого воска с применением этаноламина по аналогии с примером 43; ЖХ-МС: tR=0.93 мин, [М+Н]+=473.23; 1Н ЯМР (CDCl3): δ 8.03 (d, J=1.8 Гц, 1 Н), 7.89 (d, J=1.3 Гц, 1 Н), 7.46 (s, 1 Н), 7.25 (s, 1 Н), 4.12 (t, J=5.0 Гц, 2 Н), 4.00 (s, 3 Н), 3.74 (t, J=5.0 Гц, 2 Н), 3.18-3.27 (m, 1 Н), 3.10 (t, J=5.0 Гц, 2 Н), 2.93 (t, J=5.2 Гц, 2 Н), 2.54 (s br, 2 Н), 2.41 (s, 3 Н), 2.04-2.14 (m, 2 Н), 1.81-1.93 (m, 4 Н), 1.67-1.79 (m, 2 Н).
Пример 46
4-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-N-(2-гидроксиэтил)бутанамид
Указанное в заголовке соединение получают исходя из примера 6 по аналогии с примером 13; ЖХ-МС: tR=1.10 мин, [М+Н]+=509.49; 1Н ЯМР (CDCl3): δ 7.85 (s, 1 Н), 7.83 (s, 1 Н), 7.49 (s, 1 Н), 7.28 (s, 1 Н), 6.29 (t, J=5.0 Гц, 1 Н), 4.00 (s, 3 Н), 3.87 (t, J=5.9 Гц, 2 Н), 3.73-3.79 (m, 2 Н), 3.45-3.52 (m, 2 Н), 3.18-3.27 (m, 1 Н), 3.03 (s br, 1 H), 2.72 (q, J=7.5 Гц, 2 H), 2.54 (t, J=7.3 Гц, 2 H), 2.35 (s, 3 H), 2.15-2.24 (m, 2 H), 2.04-2.14 (m, 2 H), 1.82-1.96 (m, 4 H), 1.66-1.78 (m, 2 H), 1.30 (t, J=7.5 Гц, 3 H).
Пример 47
(S)-3-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)(метил)амино)пропановая кислота
Указанное в заголовке соединение получают исходя из (S)-5-(2-циклопентил-6-метоксипиридин-4-ил)-3-(3-этил-5-метил-4-(оксиран-2-илметокси)фенил)-1,2,4-оксадиазола и этил-3-(метиламино)-пропаноата по аналогии с примером 9; ЖХ-МС: tR=0.95 мин, [М+Н]+=539.53; 1Н ЯМР (CDCl3): δ 7.84 (s, 1 Н), 7.82 (s, 1 Н), 7.48 (s, 1 Н), 7.27 (s, 1 Н), 6.49 (s br, 2 Н), 4.52-4.60 (m, 1 Н), 4.00 (s, 3 Н), 3.90-3.96 (m, 1 Н), 3.84-3.90 (m, 1 Н), 3.41-3.51 (m, 2 Н), 3.18-3.39 (m, 3 Н), 2.97 (s, 3 Н), 2.68-2.80 (m, 4 Н), 2.36 (s, 3 Н), 2.04-2.14 (m, 2 Н), 1.82-1.94 (m, 4 Н), 1.68-1.78 (m, 2 Н), 1.30 (t, J=7.5 Гц, 3 H).
Пример 48
(R)-3-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)(метил)амино)пропановая кислота
Указанное в заголовке соединение получают по аналогии с примером 47; ЖХ-МС: tR=0.94 мин, [М+Н]+=539.35.
Пример 49
3-((2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)амино)-3-оксопропановая кислота
а) 2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этанамин (2.10 г) получают исходя из 2-(4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил метансульфоната (2.14 г, 4.27 ммоль) и 7 н. аммиака в метаноле по аналогии с примером 29; ЖХ-МС: tR=0.91 мин, [М+Н]+=464.29.
b) Указанное в заголовке соединение получают из указанного выше амина и моно-трет-бутил малоната по аналогии с примером 31; ЖХ-МС: tR=1.11 мин, [М+Н]+=509.21; 1Н ЯМР (CDCl3): δ 7.54 (s, 1 Н), 7.47 (s, 1 Н), 7.21 (s, 1 Н), 6.95 (s, 1 Н), 4.99 (s br, 2 Н), 3.85 (s, 3 Н), 3.68-3.77 (m, 2 Н), 3.57-3.65 (m, 2 Н), 3.41 (s, 2 Н), 3.02-3.12 (m, 1 Н), 2.50 (q, J=7.0 Гц, 2 Н), 2.12 (s, 3 Н), 1.93-2.03 (m, 2 Н), 1.70-1.85 (m, 4 Н), 1.61-1.70 (m, 2 Н), 1.12 (t, J=7.4 Гц, 3 Н).
Пример 50
4-((2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-2-этил-6-метилфенокси)этил)амино)-4-оксобутановая кислота
Указанное в заголовке соединение получают по аналогии с примером 49 с применением монометилсукцината; ЖХ-МС: tR=1.17 мин, [М+Н]+=537.25.
Пример 51
2-((2-(2-Хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метоксифенокси)этил)амино)уксусная кислота
Указанное в заголовке соединение получают исходя из 2-циклопентил-6-метокси-изоникотиновой кислоты, 3-хлор-4-(2,2-диметоксиэтокси)-N-гидрокси-5-метоксибензимидамида и этил глицината по аналогии с примером 43 и 1 (омыление); ЖХ-МС: tR=0.88 мин, [М+Н]+=503.11.
Пример 52
1-(2-(2-Хлор-4-(5-(2-циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-3-ил)-6-метоксифенокси)этил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение получают исходя из 2-циклопентил-6-метокси-изоникотиновой кислоты, 3-хлор-4-(2,2-диметоксиэтокси)-N-гидрокси-5-метоксибензимидамида и этил азетидин-3-карбоксилата по аналогии с примером 43 и 1 (омыление); ЖХ-МС: tR=0.88 мин, [М+Н]+=528.92; 1Н ЯМР (CDCl3): δ 7.79 (d, J=1.5 Гц, 1 Н), 7.57 (d, J=1.4 Гц, 1 Н), 7.45 (s, 1 Н), 7.24 (s, 1 Н), 5.96 (s br, 1 Н), 4.55-4.64 (m, 2 Н), 4.44-4.54 (m, 2 Н), 4.32-4.38 (m, 2 Н), 4.00 (s, 6 Н), 3.65-3.74 (m, 1 Н), 3.58-3.65 (m, 2 Н), 3.18-3.27 (m, 1 Н), 2.05-2.14 (m, 2 Н), 1.82-1.94 (m, 4 Н), 1.75 (m, 2 Н).
Пример 53
2-(4-(3-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-5-ил)-2-этил-6-метилфенокси)уксусная кислота
a) К раствору 2-циклопентил-N-гидрокси-6-метокси-изоникотинамидина (870 мг, 3.70 ммоль), 4-бензилокси-3-этил-5-метил-бензойной кислоты (1.00 г, 3.70 ммоль) и DIPEA (1.44 г, 11.1 ммоль) в ДХМ (30 мл) добавляют TBTU (1.43 г, 4.44 ммоль). Смесь, перед ее разбавлением ЭА (150 мл) и водой (50 мл), перемешивают при к.т. в течение 1 ч. Орг. фазу отделяют, промывают насыщ. водн. раствором NaHCO3 (50 мл) и, далее, соляным раствором (50 мл), сушат над MgSO4, фильтруют и концентрируют.Остающийся бледно-коричневое масло растворяют в диоксане (40 мл) и затем перемешивают при 115°C в течение 48 ч. Растворитель упаривают и сырой продукт очищают с помощью КХ на силикагеле, элюируя смесью гептан:ЭА 1:9 с получением 4-[5-(4-бензилокси-3-этил-5-метил-фенил)-[1,2,4]оксадиазол-3-ил]-2-циклопентил-6-метокси-пиридина (1040 мг) в виде бледно-желтого масла; ЖХ-МС∗∗: tR=1.11 мин, [М+Н]+=470.26.
b) Pd/C (150 мг, 10% Pd) добавляют к раствору 4-[5-(4-бензилокси-3-этил-5-метил-фенил)-[1,2,4]оксадиазол-3-ил]-2-циклопентил-6-метокси-пиридина (1040 мг, 2.22 ммоль) в ТГФ (20 мл) и метаноле (20 мл). Смесь перемешивают под давлением 1 бар Н2 при к.т. в течение 24 ч. Катализатор удаляют путем фильтрования и фильтрат концентрируют и сушат с получением 4-[3-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-5-ил]-2-этил-6-метил-фенола (672 мг) в виде не совсем белого твердого вещества; ЖХ-МС∗∗: tR=0.97 мин, [М+Н]+=380.27.
c) Указанное в заголовке соединение получают из вышеупомянутого фенола, используя этил бромацетат по аналогии с примером 5; ЖХ-МС: tR=1.15 мин, [М+Н]+=438.21; 1Н ЯМР (CDCl3): δ 7.87 (s, 1 Н), 7.83 (s, 1 Н), 7.42 (s, 1 Н), 7.22 (s, 1 Н), 6.85 (s br, 1 Н), 4.41 (s, 2 Н), 3.97 (s, 3 Н), 3.13-3.25 (m, 1 Н), 2.73 (q, J=7.5 Гц, 2 Н), 2.36 (s, 3 Н), 2.01-2.13 (m, 2 Н), 1.81-1.93 (m, 4 Н), 1.66-1.76 (m, 2 Н), 1.29 (t, J=7.5 Гц, ЗН).
Пример 54
4-(4-(3-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-5-ил)-2-этил-6-метилфенокси)бутановая кислота
Указанное в заголовке соединение получают по аналогии с примером 53, используя этил 4-йодбутират на стадии с); ЖХ-МС: tR=1.21 мин, [М+Н]+=465.99; 1Н ЯМР (CDCl3): δ 8.53 (s br, 1 Н), 7.92 (s, 1 Н), 7.91 (s, 1 Н), 7.48 (s, 1 Н), 7.29 (s, 1 Н), 4.00 (s, 3 Н), 3.91 (t, J=6.1 Гц, 2 Н), 3.16-3.27 (m, 1 Н), 2.69-2.79 (m, 4 Н), 2.39 (s, 3 Н), 2.17-2.26 (m, 2 Н), 2.04-2.14 (m, 2 Н), 1.82-1.95 (m, 4 Н), 1.67-1.79 (m, 2 Н), 1.32 (t, J=7.5 Гц, 3 Н).
Пример 55
2-((2-(4-(3-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-5-ил)-2-этил-6-метилфенокси)этил)амино)уксусная кислота
Указанное в заголовке соединение получают исходя из 4-[3-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-5-ил]-2-этил-6-метил-фенола (пример 53, стадия b) по аналогии с примером 1, используя трет-бутил глицинат; ЖХ-МС: tR=0.93 мин, [М+Н]+=481.12.
Пример 56
2-((2-(4-(3-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-5-ил)-2-этил-6-метилфенокси)этил)(метил)амино)уксусная кислота
Указанное в заголовке соединение получают исходя из 4-[3-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-5-ил]-2-этил-6-метил-фенола (пример 53, стадия b) по аналогии с примером 1, используя метиловый сложный эфир саркозина; ЖХ-МС: tR=0.95 мин, [М+Н]+=495.23; 1Н ЯМР (CDCl3): δ 7.84 (s, 1 Н), 7.81 (d, J=1.6 Гц, 1 Н), 7.40 (s, 1 Н), 7.20 (d, J=0.7 Гц, 1 Н), 6.42 (s br, 1 Н), 4.18-4.24 (m, 2 Н), 3.96 (s, 3 Н), 3.88 (s, 2 Н), 3.66-3.73 (m, 2 Н), 3.11-3.21 (m, 1 Н), 3.10 (s, 3 Н), 2.70 (q, J=7.5 Гц, 2 Н), 2.36 (s, 3 Н), 2.00-2.11 (m, 2 Н), 1.79-1.92 (m, 4 Н), 1.65-1.77 (m, 2 Н), 1.28 (t, J=7.5 Гц, 3 Н).
Пример 57
3-((2-(4-(3-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-5-ил)-2-этил-6-метилфенокси)этил)амино)пропановая кислота
Указанное в заголовке соединение получают исходя из 4-[3-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-5-ил]-2-этил-6-метил-фенола (пример 53, стадия b) по аналогии с примером 1, используя сложный этиловый эфир β-аланина; ЖХ-МС: tR=0.94 мин, [М+Н]+=495.20.
Пример 58
1-(2-(4-(3-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-5-ил)-2-этил-6-метилфенокси)этил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение получают исходя из 4-[3-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-5-ил]-2-этил-6-метил-фенола (пример 53, стадия b) по аналогии с примером 1, используя сложный метиловый эфир азетидин-3-карбоновой кислоты; ЖХ-МС: tR=0.95 мин, [М+Н]+=507.21.
Пример 59
2-((3-(4-(3-(2-Циклопентил-6-метоксипиридин-4-ил)-1,2,4-оксадиазол-5-ил)-2-этил-6-метилфенокси)пропил)амино)уксусная кислота
Указанное в заголовке соединение получают исходя из 4-[3-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,2,4]оксадиазол-5-ил]-2-этил-6-метил-фенола (пример 53, стадия b) по аналогии с примером 1, используя 3-бром-пропанол и сложный трет-бутиловый эфир глицина; ЖХ-МС: tR=0.97 мин, [М+Н]+=495.24; 1Н ЯМР (CDCl3): δ 7.84 (s, 1 Н), 7.80 (s, 1 Н), 7.41 (s, 1 Н), 7.22 (s, 1 Н), 3.97 (s, 3 Н), 3.91 (t, J=5.3 Гц, 2 Н), 3.66 (s, 2 Н), 3.34-3.41 (m, 2 Н), 3.13-3.23 (m, 1 Н), 2.68 (q, J=7.4 Гц, 2 Н), 2.35-2.43 (m, 2 Н), 2.33 (s, 3 Н), 2.02-2.11 (m, 2 Н), 1.81-1.93 (m, 4 Н), 1.67-1.76 (m, 2 Н), 1.29 (t, J=7.5 Гц, 3 Н); 13С ЯМР (CDCl3): δ 175.7, 170.8, 167.7, 165.0, 164.2, 158.8, 137.9, 136.7, 131.9, 129.0, 127.3, 120.0, 111.9, 105.5, 70.0, 53.5, 50.0, 47.5, 45.4, 33.3, 27.2, 25.9, 22.8, 16.5, 14.7.
Пример 60
2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,3,4-оксадиазол-2-ил)-2-этил-6-метилфенокси)уксусная кислота
a) К раствору гидразида 2-циклопентил-6-метокси-изоникотиновой кислоты (870 мг, 3.70 ммоль), 4-бензилокси-3-этил-5-метил-бензойной кислоты (1.00 г, 3.70 ммоль) и DIPEA (1.44 г, 11.1 ммоль) в ДХМ (30 мл) добавляют TBTU (1.43 г, 4.44 ммоль). Смесь, перед тем, как ее разбавляют ЭА (150 мл) и водой (50 мл), перемешивают при к.т. в течение 1 ч. Орг. фазу отделяют, промывают насыщ. водн. раствором МаНСО3 (50 мл) и, далее, соляным раствором (50 мл), сушат над MgSO4, фильтруют и концентрируют. Остающийся бледно-желтое масло растворяют в ТГФ (50 мл) и добавляют реагент Берджеса (1.23 г, 5.18 ммоль). Смесь, перед тем, как ее разбавляют ЭА (200 мл) и дважды промывают водой (50 мл), перемешивают при 110°C в течение 15 мин при микроволновом излучении. Орг. экстракт сушат над MgSO4, фильтруют и концентрируют и сырой продукт очищают с помощью КХ на силикагеле, элюируя смесью гептан:ЭА 1:9 с получением 4-[5-(4-бензилокси-3-этил-5-метил-фенил)-[1,3,4]оксадиазол-2-ил]-2-циклопентил-6-метокси-пиридина (750 мг) в виде бледно-желтого масла; ЖХ-МС∗∗: tR=1.06 мин, [М+Н]+=470.21.
b) Pd/C (150 мг, 10% Pd) добавляют к раствору 4-[5-(4-бензилокси-3-этил-5-метил-фенил)-[1,3,4]оксадиазол-2-ил]-2-циклопентил-6-метокси-пиридина (750 мг, 1.60 ммоль) в ТГФ (20 мл) и метаноле (20 мл). Смесь перемешивают под давлением 1 бар Н2 при к.т. в течение 24 ч. Катализатор удаляют путем фильтрования и фильтрат концентрируют и сушат с получением 4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,3,4]оксадиазол-2-ил]-2-этил-6-метил-фенола (495 мг) в виде белого твердого вещества; ЖХ-МС∗∗: tR=0.91 мин, [М+Н]+=380.25; 1Н ЯМР (D6-ДМСО): δ 1.20 (t, J=7.5 Гц, 3 Н), 1.65-1.74 (m, 2 Н), 1.76-1.88 (m, 4 Н), 1.99-2.09 (m, 2 Н), 2.29 (s, 3 Н), 2.69 (q, J=7.5 Гц, 2 Н), 3.94 (s, 3 Н), 7.26 (d, J=1.0 Гц, 1 Н), 7.50 (d, J=0.8 Гц, 1 Н), 7.76 (d, J=2.0 Гц, 1 Н), 7.78 (d, J=2.0 Гц, 1 Н).
c) Указанное в заголовке соединение получают из вышеупомянутого фенола, используя этил бромацетат по аналогии с примером 5; ЖХ-МС: tR=1.03 мин, [М+Н]+=438.33.
Пример 61
4-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,3,4-оксадиазол-2-ил)-2-этил-6-метилфенокси)бутановая кислота
Указанное в заголовке соединение получают по аналогии с примером 60, используя этил 4-йодбутират на стадии с); ЖХ-МС: tR=1.09 мин, [М+Н]+=466.38; 1Н ЯМР (D6-ДМСО): δ 7.88 (s, 1 Н), 7.87 (s, 1 Н), 7.52 (s, 1 Н), 7.29 (s, 1 Н), 3.94 (s, 3 Н), 3.84 (t, J=6.3 Гц, 2 Н), 3.21-3.31 (m, 1 Н), 2.70 (q, J=7.5 Гц, 2 Н), 2.43 (t, J=7.3 Гц, 2 Н), 2.34 (s, 3 Н), 1.96-2.09 (m, 4 Н), 1.76-1.88 (m, 4 Н), 1.63-1.74 (m, 2 Н), 1.23 (t, J=7.5 Гц, 3 Н).
Пример 62
3-((2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,3,4-оксадиазол-2-ил)-2-этил-6-метилфенокси)этил)амино)пропановая кислота
Указанное в заголовке соединение получают, исходя из 4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,3,4]оксадиазол-2-ил]-2-этил-6-метил-фенола (пример 60, стадия b) по аналогии с примером 1, используя сложный этиловый эфир β-аланина; ЖХ-МС: tR=0.85 мин, [М+Н]+=495.37; 1Н ЯМР (CDCl3): δ 7.73 (s, 1 Н), 7.67 (s, 1 Н), 7.38 (s, 1 Н), 7.12 (s, 1 Н), 4.13-4.18 (m, 2 Н), 3.98 (s, 3 Н), 3.37-3.42 (m, 2 Н), 3.23-3.29 (m, 2 Н), 3.15-3.23 (m, 1 Н), 2.64-2.74 (m, 4 Н), 2.35 (s, 3 Н), 2.02-2.13 (m, 2 Н), 1.81-1.93 (m, 4 Н), 1.67-1.78 (m, 2 Н), 1.27 (t, J=7.5 Гц, 3 Н).
Пример 63
1-(2-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,3,4-оксадиазол-2-ил)-2-этил-6-метилфенокси)этил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение получают исходя из 4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,3,4]оксадиазол-2-ил]-2-этил-6-метил-фенола (пример 60, стадия b) по аналогии с примером 1, используя сложный метиловый эфир азетидин-3-карбоновой кислоты; ЖХ-МС: tR=0.84 мин, [М+Н]+=507.37.
Пример 64
(S)-1-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,3,4-оксадиазол-2-ил)-2-этил-6-метилфенокси)-3-((2-гидроксиэтил)амино)пропан-2-ол
Указанное в заголовке соединение получают исходя из 4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,3,4]оксадиазол-2-ил]-2-этил-6-метил-фенола (пример 60, стадия b) по аналогии с примером 3; ЖХ-МС: tR=0.82 мин, [М+Н]+=498.24; 1Н ЯМР (CDCl3): δ 7.81 (s, 1 Н), 7.79 (s, 1 Н), 7.44 (s, 1 Н), 7.18 (s, 1 Н), 4.15-4.23 (m, 1 Н), 3.99 (s, 3 Н), 3.86 (d, J=5.0 Гц, 2 Н), 3.76 (t, J=4.7 Гц, 2 Н), 3.15-3.34 (m, 4 Н), 2.84-2.98 (m, 4 Н), 2.74 (q, J=7.5 Гц, 2 Н), 2.38 (s, 3 Н), 2.02-2.12 (m, 2 Н), 1.80-1.93 (m, 4 Н), 1.65-1.77 (m, 2 Н), 1.29 (t, J=7.5 Гц, 3 Н).
Пример 65
(S)-2-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,3,4-оксадиазол-2-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)амино)пропан-1,3-диол
Указанное в заголовке соединение получают исходя из 4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,3,4]оксадиазол-2-ил]-2-этил-6-метил-фенола (пример 60, стадия b) по аналогии с примером 4; ЖХ-МС: tR=0.82 мин, [М+Н]+=527.37.
Пример 66
(S)-4-((3-(4-(5-(2-Циклопентил-6-метоксипиридин-4-ил)-1,3,4-оксадиазол-2-ил)-2-этил-6-метилфенокси)-2-гидроксипропил)амино)-4-оксобутановая кислота
Указанное в заголовке соединение получают исходя из (S)-2-(2-циклопентил-6-метоксипиридин-4-ил)-5-(3-этил-5-метил-4-(оксиран-2-илметокси)фенил)-1,3,4-оксадиазола (получен из 4-[5-(2-циклопентил-6-метокси-пиридин-4-ил)-[1,3,4]оксадиазол-2-ил]-2-этил-6-метил-фенола (пример 60, стадия b) аналогично примеру 3, стадии а) по аналогии с примером 14, используя моно-трет-бутил сукцинат; ЖХ-МС: tR=0.94 мин, [М+Н]+=553.19; 1Н ЯМР (CD3OD): δ 7.83 (d, J=1.8 Гц, 1 Н), 7.79 (d, J=1.6 Гц, 1 Н), 7.43 (d, J=0.7 Гц, 1 Н), 7.16 (d, J=0.9 Гц, 1 Н), 4.08-4.15 (m, 1 Н), 3.97 (s, 3 Н), 3.81-3.91 (m, 2 Н), 3.57 (dd, J1=13.7 Гц, J2=4.7 Гц, 1 Н), 3.33-3.39 (m, 1 Н), 3.19-3.28 (m, 1 Н), 2.80 (q, J=7.5 Гц, 2 Н), 2.52 (s, 4 Н), 2.40 (s, 3 Н), 2.04-2.14 (m, 2 Н), 1.84-1.96 (m, 4 Н), 1.71-1.80 (m, 2 H), 1.31 (t, J=7.5 Гц, 3 Н).
Пример 67
Анализ S1P1 рекруитмента β-аррестина (Tango) для определения значений ЕС50
Принцип анализа:
После активации лигандом, сопряженные с G-белком рецепторы (GPCR) запускают два пути, которые независимо осуществляют трансдукцию сигналов в клетку: один через гетеротримерные GTP-связывающие белки (G белки), и один через β-аррестины. Индуцированные агонистом GPCR осуществляют рекруитмент β-аррестиновых белков, которые затем связываются с карбокси-терминальным доменом активированных лигандом GPCR. Количественный показатель рекруитмента β-аррестина можно использовать для оценки действенности и эффективности GPCR активирующих лигандов.
Для измерения действенности и эффективности соединений в качестве агонистов S1P1 (EDG1) рецептора, используют клетки Tango™-EDG1 bla U2OS (Invitrogen, США, каталожный № K1520). Технология Tango™ GPCR основана на анализах GeneBLAzer β-лактамазы репортерных клеток, которые используют оптимизированный для млекопитающих β-лактамазный репортерный ген (bla), в сочетании с FRET (резонансный перенос энергии флуоресценции) - задействованным субстратом. Клетки-хозяины, U2OS, стабильно экспрессируют человеческий рецептор S1P1 (EDG1) / транскрипционный фактор (TF) слитый белок. Клетки также экспрессируют рекомбинантный, нацеленный на протеазу β-аррестиновый белок, который рекруитируется к S1P1 рецептору после стимуляции лигандом и специфически расщепляет S1P1-TF слитый белок. Высвобожденный TF активирует β-лактамазный репортерный ген (bla). Для измерения активности репортерного гена, клетки нагружают флуоресцентным субстратом, содержащим два химически связанных флуорофора, кумарин и флуоресцеин. В отсутствии bla экспрессии, молекула субстрата остается неизменной, и возбуждение на длине 410 нм приводит к испусканию зеленого флуоресцентного излучения (520 нМ) вследствие внутреннего FRET. В присутствии bla, химическая связь расщепляется и FRET ингибируется. В этом случае, возбуждение на длине 410 нМ приводит к сигналу в виде испускания синего флуоресцентного излучения (450 нм). Количество рекруитмента β-аррестина пропорционально увеличению синей флуоресценции.
Культура клеток:
Клетки Tango™-EDG1 bla U2OS культивируют в McCoy′s 5А, содержащей 10% диализованной FBS, 0.1 мМ NEAA, 25 мМ HEPES, 1 мМ пирувата натрия, 1% пенициллина/стрептомицина, 200 мкг/мл зеоцина, 50 мкг/мл гигромицина и 100 мкг/мл генетицина (Invitrogen, США). Клетки отделяют трипсином, ресуспендируют в среде и затем подсчитывают.Клетки центрифугируют, затем промывают средой для анализа (Freestyle™ среда для экспрессии НЕК-293 (Invitrogen, США)) и высевают при плотности 5000 клеток/лунку в 384-луночные черные планшеты с прозрачным дном (Greiner, Германия) в 30 мкл/лунку среды для анализа.
Анализ агонистов:
Соединения (10 мМ основной раствор в ДМСО) разбавляют сначала в ДМСО. Предварительно разбавленные растворы соединений затем переносят в среду для анализа / 0.1% свободный от жирных кислот BSA, чтобы достичь четырехкратно концентрированного основного раствора соединений, который наносится на клетки для достижения конечных концентраций соединений, которые варьируются от 10 мкМ до 0.0005 нМ (0.5% конечный ДМСО). Затем клетки инкубируют в течение 16 ч при 37°C и 5% CO2.
Обнаружение:
Субстрат (1 мкМ субстрат LiveBLAzer™ FRET - B/G (с CCF4-AM), 1 мг/мл Pluronic® F-127 поверхностно-активного вещества, 0.001% уксусной кислоты, 4% мас./мас. ПЭГ 400, 3% TR-40 по объему в воде (Invitrogen, США)) добавляют к каждой лунке и клетки инкубируют в течение 2 ч при к.т. в темноте. Планшеты считывают с помощью Synergy4™ (Biotek, США), используя возбуждение на длине волны 410 нМ и испускание на длинах волн 450 нм и 520 нм.
Анализ данных:
ЕС50 тестируемого соединения означает концентрацию соединения, индуцирующую 50% его максимальной активности. Для расчетов ЕС50, рассчитывают отношения 450 нМ / 520 нМ после вычитания фона (то есть, полос без клеток), а максимальное действие соединения используется в качестве 100% и в качестве верхней асимптоты.
Агонистические активности (значения Tango ЕС50) были измерены для всех иллюстративных соединений, и они находятся в диапазоне от 0.02 до 69 нМ со средним значением 3.3 нМ. ЕС50 значения этих соединений отображены в Таблице 2.
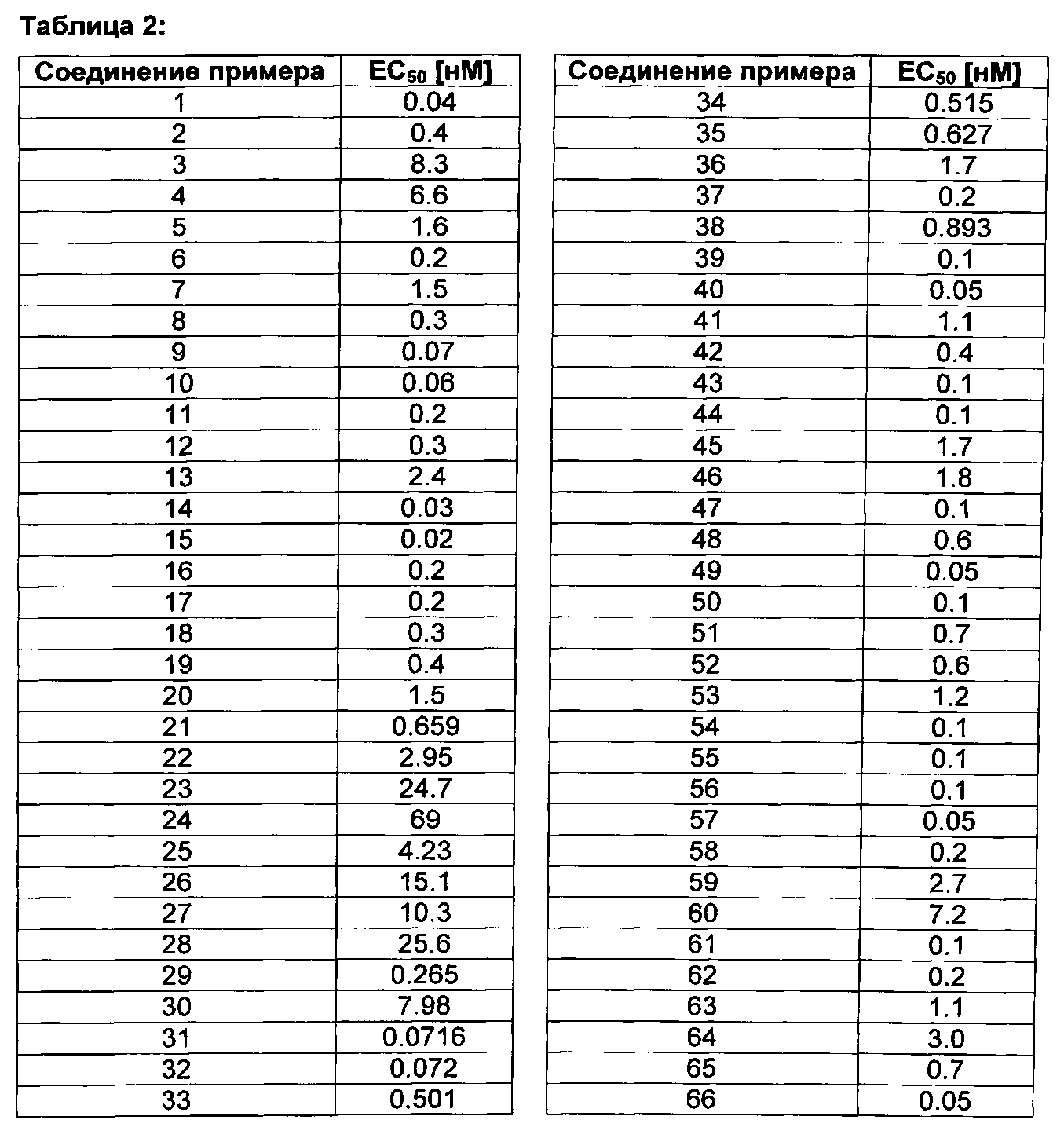
Пример 68
Оценка эффективности In vivo
Эффективность соединений формулы (I) оценивают путем измерения числа циркулирующих лимфоцитов после перорального введения от 3 до 30 мг/кг соединения формулы (I) самцам крысы Уистара с нормальным кровяным давлением. Животных содержат в контролируемых климатических условиях с 12 ч циклом чередования света и темноты, и обеспечивают свободным доступом к обыкновенному корму для крыс и питьевой воде. Кровь отбирают перед введением, как и через 3, 6 и 24 ч после введения лекарственного средств. Цельную кровь подвергают гематологии, используя систему Advia Hematology system (Bayer Diagnostics, Цюрих, Швейцария).
Все данные представлены как среднее ± SEM. Статистический анализ выполняют с помощью дисперсионного анализа (ANOVA), используя Statistica (StatSoft) и методику Стьюдента-Ньюмана-Кейлса для множественных сравнений. Нулевая гипотеза отвергается, когда р<0.05.
В качестве примера, таблица 3 показывает влияние соединения настоящего изобретения на число лимфоцитов через 6 ч после перорального введения в дозе 10 мг/кг самцам крыс Уистара с нормальным кровяным давлением, по сравнению группой животных, обработанных только носителем. Число лимфоцитов через 6 ч после перорального введения измеряли для 49 из 66 примерных соединений, и оно находится в диапазоне -24% -82% со средним - 63% (исключая соединения примеров 49 и 51, которые вводили в дозировке 3 мг/кг).
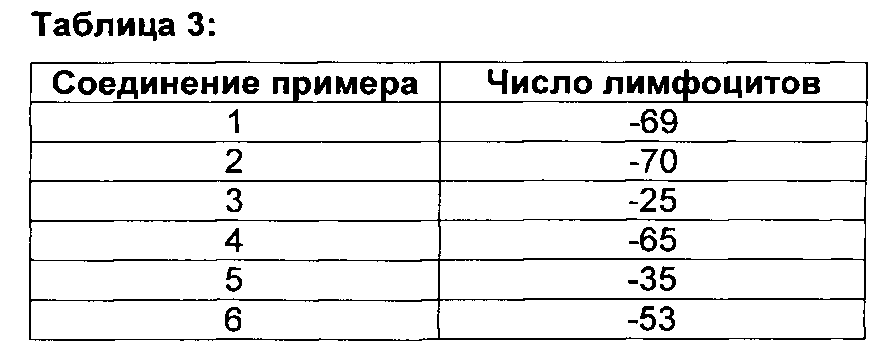
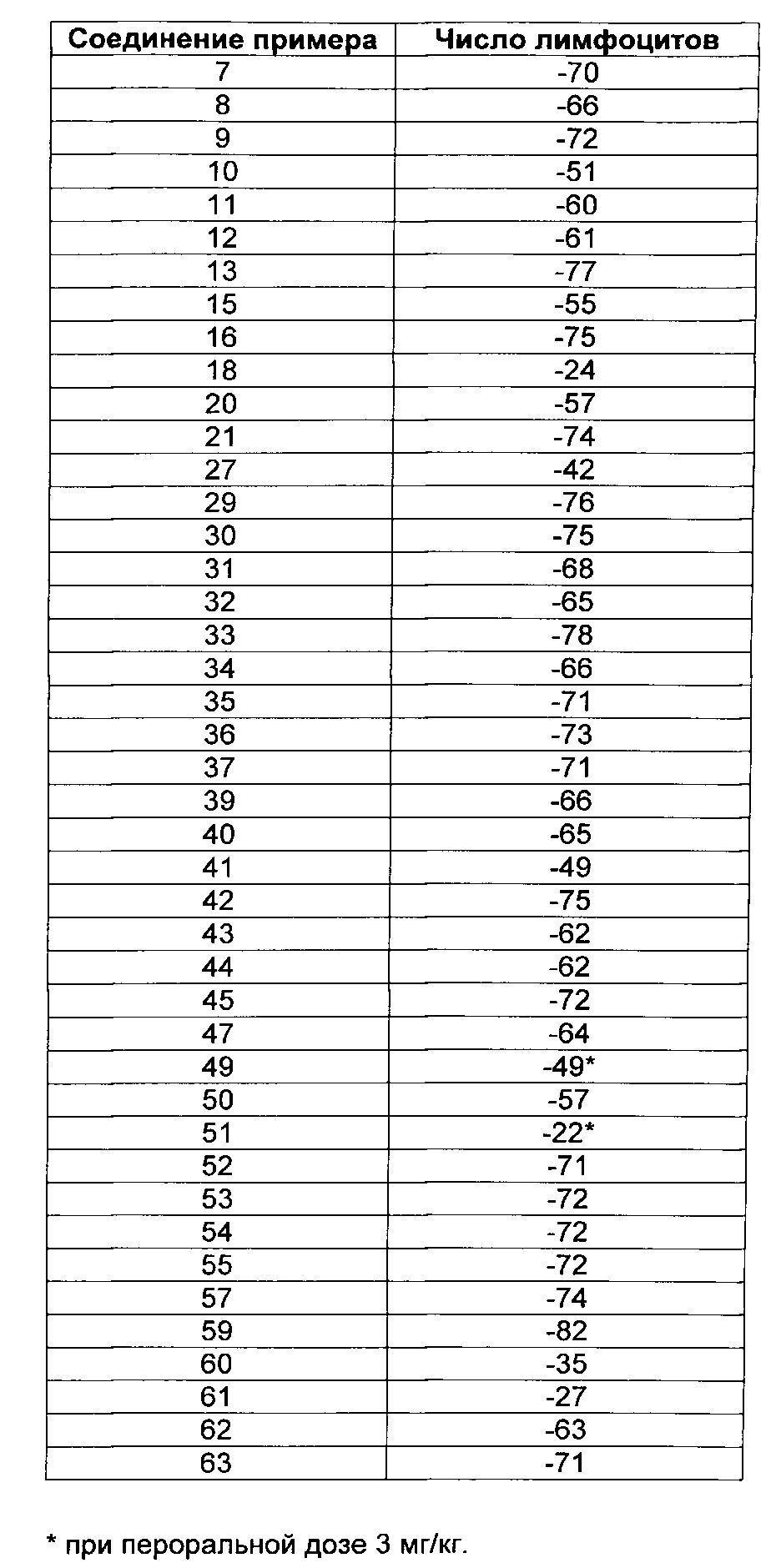
Пример 69
Измерение развитие изометрической силы
Животных получают от RCC Ltd (Фюллинсдорф, Швейцария). Самок крыс Уистара подвергают эвтаназии путем воздействия СО2. Трахеи вырезают и получают кольца из нижнего сегмента. Кольца трахеи суспендируют в инкубаторах тканевых культур (10 мл), содержащих буфер Кребса-Хенселейта следующего состава (мМ): NaCl 115; KCl 4.7; MgSO4 1.2; KH2PO4 1.5; CaCl2 2.5; NaHCO3 25; глюкоза 10. Температуру раствора в бане поддерживают на уровне 37°C и его аэрируют 95% О2/ 5%CO2 (рН 7.4). К препарату кольца прилагают силу покоя 2 г (20 мН), и генерированные изменения в силе измеряют, используя регистратор изометрической силы (ЕМКА Technologies Inc., Париж, Франция). Жизнеспособность колец оценивают путем воздействия деполяризующей концентрации KCl (50 мкМ). Сужение трахеи выражают в виде процентного отношения от ответа к KCl.
Соединения получают в виде основного раствора концентрацией 0.3 мМ в чистом ДМСО. Соединения добавляют в инкубатор (10 мл) в объеме 33 мкл с получением конечной концентрации ДМСО в инкубаторе 0.33%.
Сужение трахеи самки крысы измеряли для 14 из 66 иллюстративных соединений. Результаты сведены в таблицу 4.