КОМПОЗИЦИЯ ДЛЯ ДЕТОКСИКАЦИИ ОРГАНИЗМА
Вид РИД
Изобретение
Изобретение относится к биотехнологии, пищевой и фармацевтической промышленности, а именно к производству продуктов функционального питания для нормализации состояния организма и биологически активных добавок (БАД) к пище и лекарственных препаратов, предназначенных для нормализации состояния желудочно-кишечного тракта (удаления из организма токсичных веществ).
Интоксикация организма человека и животных является синдромом, сопровождающим самые разные патологические процессы и состояния, такие, как отравления экзогенными ядами или инфекционные заболевания, или поражения внутренних органов и систем, сопровождающиеся либо повышенным образованием, либо снижением эффективности выведения и нейтрализации эндогенных (метаболических) ядов, которые часто упрощенно обозначают как «шлаки» (Учайкин В.Ф. Энтеросорбция - эффективный метод этиопатогенетической терапии острых кишечных инфекций / В.Ф. Учайкин, А.А. Новокшонов, Н.В. Соколова // Дет.инфекции. -2005. - №3. - С. 39-43).
Острые кишечные инфекции (ОКИ) в структуре инфекционной заболеваемости населения занимают второе место после острых респираторно-вирусных инфекций, характеризуются отсутствием сезонности и возрастной избирательности заболеваемости, развитием нестойкого, кратковременного видоспецифического иммунитета, что предполагает повторное развитие инфекционного процесса, вызванного другим возбудителем, в течение ограниченного времени (Покровский В.И., Поздеев О. (ред.). Медицинская микробиология. - М.: ГОЭТАР «МЕДИЦИНА», 1998. - 1155 с.). Создание новых и совершенствование существующих методов лечения ОКИ формируется параллельно с новыми сведениями, полученными в ходе выполнения научных исследований в области патогенеза инфекционных заболеваний, создающих предпосылки для разработки новых лекарственных форм препаратов и их клинической апробации. Настоящая заявка направлена на создание средства, позволяющего отказаться в ряде случаев от традиционно применяемых в лечении инфекционных больных антибактериальных средств за счет усиления патогенетической терапии исходя из принципа минимального неблагоприятного воздействия на организм больного.
Вопросы этиопатогенетической терапии ОКИ сохраняют актуальность в связи с их повсеместным распространением, утяжелением клинического течения отдельных нозологических форм, развитием резистентности возбудителей к традиционно применяемым этиотропным препаратам. Широкое и нередко бесконтрольное применение антибактериальных средств часто оказывается не только малоэффективным, но и сопровождается нежелательными побочными эффектами и неблагоприятными последствиями для организма больного (Костюченко А.Л. Активная детоксикация // Мир медицины. СПб., 2000. - №9-10).
Среди острых кишечных инфекций в последние годы уделяется большое внимание диарее. Диарея - полиэтиологический клинический синдром, характеризующийся послаблением стула (более трех раз в сутки). Подавляющее число случаев острой диареи ассоциируется с острыми кишечными инфекциями, однако причинами ее могут быть и неинфекционные факторы: погрешности в питании, диетические перегрузки, несовместимость пищевых продуктов, избыток в пище грубоволокнистой клетчатки, аллергические реакции на определенные продукты (грибы, ракообразные, земляника), побочные эффекты медикаментов (Щербаков П.Л., Петухов В.А. Сравнительная эффективность энтеросорбентов при диарее у детей // Вопросы современной педиатрии. - 2005. - №4. - С. 85-89).
Частота возникновения диареи, как и других болезней, зависит от региона пребывания, длительности нахождения, условий обитания (качества воды и характера питания), а также вида деятельности. В развивающихся странах диарея явно доминирует, заболевают 60% и более приехавших лиц. Наиболее часто она возникает в странах Азии, Африки, Латинской Америки, Среднего Востока, реже в странах Южной Европы и Карибского бассейна (до 20%), наиболее редко - в США, Канаде, странах Северной Европы, Австралии (менее 8%). Есть сведения, что заболевание обнаруживается достаточно часто и у жителей развивающихся стран с низким уровнем санитарной культуры при въезде их в развитые страны.
Возбудителями диареи являются различные микроорганизмы: бактерии, вирусы, простейшие. Причинами дисфункции кишечника при въезде в другие страны или иную климатогеографическую зону также могут быть изменения диеты, режима питания и быта, солевого состава воды, злоупотребление алкоголем, непривычная пища, изменение на этом фоне бактериальной флоры кишечника.
Во всех этих случаях при выраженных (острых) интоксикациях предусмотрен дифференцированный подход, при выборе средств для детоксикации организма, которые различаются, в зависимости от природы токсичных веществ, вызвавших отравление. В частности, применяются известные энтеросорбенты на основе лигнина гидролизного или активированный уголь.
Известны различные формы энтеросорбентов на основе лигнина для перорального применения. Энтеросорбенты на основе лигнина в форме гранулята, порошков и таблеток применяют для профилактики и лечения острых и хронических заболеваний желудочно-кишечного тракта, печени и почек, для лечения таких инфекционных заболеваний, как дизентерия, вирусный гепатит и т.д., для лечения отравления, лекарственных и пищевых аллергий, бронхиальной астмы, диабета, нарушения жирового обмена. Энтеросорбенты на основе лигнина - это энтеросорбенты из гидролизного лигнина, подвергнутого технологической обработке до определенных качественных показателей с получением продукта, используемого в медицинских целях, и медицинского или лечебного лигнина (полифепана), полученного путем специальной технологической обработки гидролизного лигнина (RU 2084236, опубл. 20.07.1997 А61K 35/78, RU 2125463, опубл. 27.01.1999 А61K 35/78, RU 2061488, опубл. 10.06.1996 А61K 35/78, RU 2116080, опубл. 27.07.1998 А61K 35/78, RU 2166953, опубл. 20.02.2001 А61K 35/78, RU 2167669, опубл. 20.02.2001 А61K 35/78, RU 2131260, опубл. 10.06.1999 A61K 35/78, RU 2279278, опубл. 01.01.2000 А61K 31/70).
Недостатками твердых таблетированных форм энтеросорбентов являются низкое сродство к поверхности слизистой в просвете кишки, резко снижающая контакт энтеросорбента с токсинами, раздражающее действие на слизистую оболочку кишки и низкая способность связывания и выведения уремических токсинов. Недостатками ионных гипертонических растворов являются их неспособность связывать уремические токсины, способность вызывать диарею и гиперсекрецию токсинов в просвет кишки, создавая ионный дисбаланс в организме
Известны композиции для детоксикации в виде гелей гидрогели метилкремниевой кислоты и способ их получения по патенту (RU 2111979, опубл. 27.05.1998 C08G 77/02, GB1079265, опубл. 16.08.1967 А61K 31/42, UA 78922, опубл. 25.04.2007 С01В 33/158).
Известна также композиция для очищения организма от токсинов и нормализации состава микрофлоры пищеварительного тракта, нарушенного вследствие различных заболеваний, бактериальной или химической интоксикации, в том числе, в процессе антибиотикотерапии. В качестве одного из основных компонентов содержится масло какао (RU 2433751, опубл. 10.11.2010 A23L 1/30).
Указанная композиция обладает также следующими недостатками. Поскольку в данной композиции присутствует липидосодержащий агент, то сорбция данной композиции будет связана преимущественно с веществами имеющими также липидную природу. Поскольку основная масса пищи поступает в организм с водой, существенная часть токсинов, которые будут присутствовать в пищеварительном тракте также содержатся преимущественно водноорганической фазе. Таким образом, сорбция значительной части токсинов будет затруднена содержащейся вокруг энтеросорбента жировой фазой, что существенно снижает его сорбционный эффект. С другой стороны при профилактике и лечении расстройств желудочно-кишечного тракта зачастую необходимо уделять внимание профилактике и лечению печени, как основного детоксикационного органа. При профилактике и лечении печени часто необходимо принимать препараты эссенциальной либо липидной природы, например такие как эссенциальные фосфолипиды и жирорастворимые витамины группы А и Д. В виду своей липофильности при комлексной терапии с энтеросорбентом липидной природы их прием не будет эффективным ввиду их связывания и транзитной эвакуации из просвета кишечника вместе с основной массой энтеросорбента.
Наиболее близкой к заявляемому техническому решению является фармацевтическая композиция, в виде водной суспензии тонко измельченного лигнина гидролизного, используемая в качестве средства лечения острых и хронических кишечных инфекций, включая экзогенные и эндогенные интоксикации, нарушений жирового и других видов обмена (RU 2026078, опубл. 09.01.1995, А61K 35/78).
Однако, данная композиция обладает существенными недостатками. Поскольку в данной композиции отсутствует матрицеобразующий агент, то после поступления композиции в отделы пищеварительного тракта, вода быстро сорбируется и частицы нерастворимого сорбента концентрируются на поверхности слизистой в виде плотного слоя, существенно снижая тем самым свой сорбционный потенциал. Кроме того, нерастворимые частицы сорбента, ввиду своих небольших размеров имеют тенденцию к проникновению в более глубокие слои эпителия, оказывая тем самым раздражающий эффект.
Наконец, все описанные композиции на основе нерастворимых пищевых волокон либо кремнийорганических соединений обладают неудовлетворительными вкусовыми свойствами, задерживаются на слизистой оболочке ротовой полости, вызывая длительное неприятное послевкусие, требуют запивания большим количеством воды. Все это делает такие композиции неудобными и, часто, неприемлемыми, для их применения у детей младшего возраста.
Технической задачей заявленного изобретения является создание эффективной композиции, обеспечивающей полноценное оздоровление организма за счет оперативного выведения токсинов из всех отделов пищеварительного тракта, снижение нежелательных побочных эффектов, связанных с употреблением определенных категорий детоксикационных средств, а также расширение арсенала композиций, пригодных для очищения организма от токсинов за счет применения в более удобной форме, в том числе для детей.
Технический результат заявленного решения заключается в эффективном связывании и удержании в составе матрицы связанных токсинов. Оказывает эффективный детоксикационный эффект, при использовании заметно меньшего количества продукта, снижая нежелательные побочные эффекты, связанные с употреблением детоксикационных средств.
В композиции, включающей матрицеобразующую основу, максимально нивелирует раздражающий эффект за счет протекторных свойств матрицы.
Технический результат заявленного изобретения достигается тем, что композиция для очищения организма от токсинов в виде геля, содержит, в качестве активного компонента нерастворимый энтеросорбент и второй активный компонент в виде растворимого энтеросорбента. При этом растворимый энтеросорбент формирует матрицеобразующую основу для нерастворимого сорбента, нерастворимый сорбент и растворимый сорбент имеют размер частиц не более 150 мкм, при следующем содержании компонентов, в мас.%:
|
Композиция может содержать нерастворимые энтеросорбенты из группы: растительная клетчатка, лигнин гидролизный, отруби, целлюлоза и ее эфиры, микрокристаллическая целлюлоза, высокоэтерифицированный нерастворимый пектин, или минеральное вещество из группы: цеолит, смектит, кремнезем (кремния диоксид), активированный уголь.
Композиция может содержать растворимый энтеросорбент из группы пищевых волоки: камеди, пектины, гемицеллюлозы, растворимые эфиры целлюлозы, крахмал и его производные, поливидоны, полиэтиленгликоли, полидекстрозы, декстрины, циклодекстрины, агары, каррагинаны,
Композиция может содержать растворимый энтеросорбент из группы пищевых волоки: альгинаты и их производные, камеди, пектины, гемицеллюлозы, растворимые эфиры целлюлозы, крахмал и его производные, поливидоны, полиэтиленгликоли, полидекстрозы, декстрины, циклодекстрины, агары, каррагинаны.
Композиция дополнительно может содержать, по меньшей мере, одну вкусовую добавку, преимущественно натуральный пищевой ароматизатор в количестве не более 3 мас.%.
Композиция дополнительно содержит, по меньшей мере, одну вкусовую добавку, подсластитель в количестве не более 20 мас.%.
Композиция может содержать консервант в количестве не более 1 мас.%.
Композиция может быть изготовлена в виде гранул для приготовления водной суспензии.
Композиция может быть выполнена гомогенной консистенции в пастообразном виде.
Композиция может в вариантах исполнения содержать в качестве повышающего эффективность сорбции токсических веществ дополнительный сорбент до 49 мас.%.
Синергическое действие нерастворимого энтеросорбента и растворимого энтеросорбента обусловлено тем, что нерастворимый энтеросорбент взаимодействует с веществом главным образом за счет дисперсионных сил, обуславливающих сорбиционый эффект «твердого» носителя с одной стороны, а растворимый энтеросорбент взаимодействует с веществом главным образом за счет сил распределения между двумя жидкими фазами, а также обуславливающий пространственную конфигурацию с равномерно распределенными в ней частицами нерастворимого энтеросорбента, что дополнительно усиливает эффект сорбции частиц нерастворимого сорбента за счет формирования максимально возможных и оптимально распределенных «мест связывания». Частицы нерастворимого энтеросорбента в свою очередь формируют каркас, усиливающий сорбционный потенциал матрицеобразующих элементов растворимого энтеросорбента, а также существенно расширяющий диапазон по размеру и механизму сорбции для эффективного связывания и выведения токсинов из организма. Матрицеобразующая основа может состоять из двух и более растворимых энтеросорбентов. При этом, например, при использовании комбинации растворимых энтеросорбентов, таких как альгинат и пектин происходит дополнительная усиление сорбционной активности, за счет уникальной комбинации имеющихся наборов функциональных групп, существенно дополняющих механизмы сорбции каждого из компонентов. Альгинат в заявленной композиции выполняет одновременно функцию гелеобразующего вещества, а также функцию сорбента водорастворимых веществ при поступлении в желудочно-кишечный тракт. Таким образом, происходит удаление патогенных микробов и продуктов их метаболизма, снижается эффект раздражения слизистой верхних отделов пищеварительного тракта (ротовой полости, пищевода, желудка) частицами сорбента и уменьшается выраженность воспалительных процессов в слизистых оболочках желудочно кишечного тракта за счет улучшенных свойств продукта, выведения из организма широкого спектра токсинов различного происхождения, и за счет этого - для более быстрого оздоровления организма.
С учетом вышеизложенного активные компоненты в представленной фармацевтической композиции оказывают суммирующий эффект взаимодействия по действию существенно превосходящий лечебные свойства каждого отдельного компонента композиции.
Положительное влияние используемая гелевая форма композиции оказывает на органолептические свойства изделия, она позволяет исключить, или существенно уменьшить неприятные вкусовые ощущения от воздействия многих сорбентов (вкус древесных опилок лигнина гидролизного, неприятный кислый привкус активированного угля, некоторых минеральных сорбентов на основе глиноземов и др.) а также значительно снизить раздражающее воздействие частиц сорбентов на механические (осязательные) рецепторы языка и слизистой оболочки ротовой полости, придающие суспензиям и распадающимся во рту таблеткам неприятные ощущения грубой «зернистости». Значительно уменьшается адгезия (прилипание) частиц сорбента к поверхности слизистой, в связи с чем принятие препарата не требует запивания его большим количеством воды. Последнее особенно важно в случае необходимости приема препарата вне помещений.
Технологические преимущества предлагаемых вариантов композиций состоят в том, что предложенный подход позволяет существенно расширить возможности изготовления доступных и удобных форм продукта для массового употребления, как его лекарственных вариантов, так и нелекарственных потребительских форм (биологически активных добавок, функциональных пищевых продуктов и т.п.). Тем самым достигается существенное расширение области технологической реализации состава.
Композиция может изготавливаться на основе известного сорбента - например, минерального энтеросорбента, такого как смектит, цеолит, глинозем, силикагель, гидролизный лигнин, микрокристаллическая целлюлоза. Композиция на основе перечисленных ингредиентов изготавливается в виде суспензии, геля, пасты и шарообразных гранул сплошного студня. В изделие может вводиться дополнительный солюбилизатор (например, пропиленгликоль в количестве не более 5% по массе), а также корректоры вкуса (ароматизатор, подсластитель и т.п.) в необходимых для придания надлежащего вкусового ощущения количествах.
Кроме того, для получения продукта необходимой консистенции в состав композиции могут включаться разрешенные для использования в пищевых продуктах и (или) фармацевтические приемлемые вспомогательные вещества (производные целлюлозы, антиоксиданты, консерванты.
Важным свойством и особенностью предложенной композиции является использование в ее составе порошков сорбента, имеющего размеры частиц не более 150 мкм. Размер частиц влияет на основные свойства композиции прямым путем. Во- первых, широко известно, что сорбционная способность сорбентов сильно зависит от размера частиц: чем больше суммарная площадь поверхности - тем выше общая сорбционная способность сорбента. Суммарная же площадь поверхности частиц тем выше, чем меньше их среднегеометрический диаметр. В то же время излишнее измельчение сорбента приводит к проявлению отрицательных моментов: 1) резко возрастают потери продукта, поскольку эффективность получения очень мелких (менее 10 мкм) частиц известными методами и устройствами быстро падает; 2) при слишком мелких размерах частиц происходит разрушение внутренней пористой структуры многих сорбентов, что приводит не к дальнейшему ожидавшемуся росту их сорбционной емкости, а, наоборот - к быстрому ее падению; 3) снижается технологичность продукта, которой приобретает способность быстро переходить во взвешенное состояние («летучесть» порошков) с ростом технологических потерь на стадиях производства; 4) одновременно ухудшаются санитарно-гигиенические условия производства (растет запыленность помещений):
В совокупности все вышеперечисленные эффекты обеспечивают заявляемой композиции повышенную способность к профилактике последствий хронических отравлений вредными веществами, ядами, поступающими в организм извне, либо накапливающихся в организме при различных заболеваниях; дополняется и усиливается оздоравливающее влияние каждого из отдельно взятых компонентов:
а) сорбционные свойства нерастворимого энтеросорбента в отношении различных токсических молекул значительно усиливаются за счет синергетического эффекта взамодействия с матрицеоразуюшей водноорганической системой;
б) матричный агент образует комплексную полимерную систему, которая позволяет поддерживать эффективный сорбционный потенциал нерастворимого энтеросорбента длительное время после попадания продукта в организм за счет сильных влагоудерживающих свойств матрицеобразующего агента из ряда растворимых пищевых волоки;
в) благодаря включению нерастворимого энтеросорбента в состав композиции существенно снижаются нежелательные побочные эффекты, связанные с применением сорбентов в твердом виде, таких как раздражающий эффект на слизистую ЖКТ и запоры;
г) альгинат, как и многие другие растворимые пищевые волокна, имеет самостоятельное цитопротекторное действие, защищая слизистые оболочки различных отделов желудочно кишечного тракта от травмирующих химических и механических воздействий;
д) действующий совместно с нерастворимым энтеросорбентом, связывающим токсичные вещества, матрицеобразующий агент в составе композиции существенно расширяет сорбционный диапазон сорбируемых веществ за счет образования дополнительных механизмов связывания, в том числе за счет экструзионных стерически обусловленных эффектов;
е) благодаря включению нерастворимого энтеросорбента в композицию появилась возможность существенно изменить органолептические свойства фармацевтической композиции, так как благодаря включению нерастворимого сорбента в состав матрицы удалось значительно замаскировать неприятные ощущения, возникающие при приеме от его использования в составе композиции;
ж) благодаря включению нерастворимого энтеросорбента в композицию удалось создать платформу для создания удобной для применения у детской и возрастной категории пациентов, испытавающих затруднения при глотании.
Оценка сорбционной активности заявляемой композиции.
Основные целевые группы сорбатов представлены низкомолекулярными и высокомолекурярными соединениями. Были выбраны маркеры, которые характеризуются соответственно низкомолекулярной и высокомолекулярной структурой, отражающие сорбцию соответствующей группы веществ в организме (маркеры сорбции).
Сорбцию образцов препарата на этапе скрининговых исследований оценивали на примере трех маркеров - метиленового синего, метилового оранжевого и конго красного. Метиленовый синий - низкомолекулярный положительно заряженный маркер. Он является общепринятым маркером для оценки сорбционных свойств широкого спектра сорбентов. Конго красный имеет большие размеры молекулы и суммарно заряжен отрицательно. В качестве аналитической методики определения были выбраны методики на основе спектрофотометрии. Дополнительно первоначально сорбционный потенциал оценивался при помощи метилового оранжевого, однако практика его применения показало его неинформативность по отношению к выбранному массиву веществ.
Для оценки сорбционной активности заявляемого продукта оценивали эффективность сорбции in vitro. Для этого точную навеску препарата помещали в коническую колбу вместимостью 100 мл с притертой пробкой, прибавляли 20,0 мл раствора А метиленового синего, закрывали пробкой и перемешивали в течение 1 ч на магнитной мешалке или встряхивали на лабораторном аппарате для встряхивания при числе колебаний не менее 120 мин - 1. Суспензию центрифугировали в течение 15 мин при 6000 об/мин. 1,0 мл надосадочной жидкости помещали в мерную колбу вместимостью 100 мл, доводили объем раствора водой до метки и перемешивали (испытуемый раствор). Измеряли оптическую плотность раствора Б метиленового синего и испытуемого раствора на спектрофотометре в максимуме поглощения при длине волны 665 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения использовали воду. Далее делали расчет по соответствующей формуле. Практически аналогично проводили оценку сорбиции с конго красным.
Массив первичных данных был сформирован с использованием различных компонентов, в первую очередь с использованием различных гелеобразующих основ.
В качестве сравнения были выбраны, в том числе, сами основы, без добавления лигнина гидролизного, водная суспензия лигнина гидролизного и кремний-органический сорбент в виде геля. Дальнейшие исследования проводились на примере высокомолекулярных соединений, таких как белки. Результаты эксперимента приведены в таблице 1.
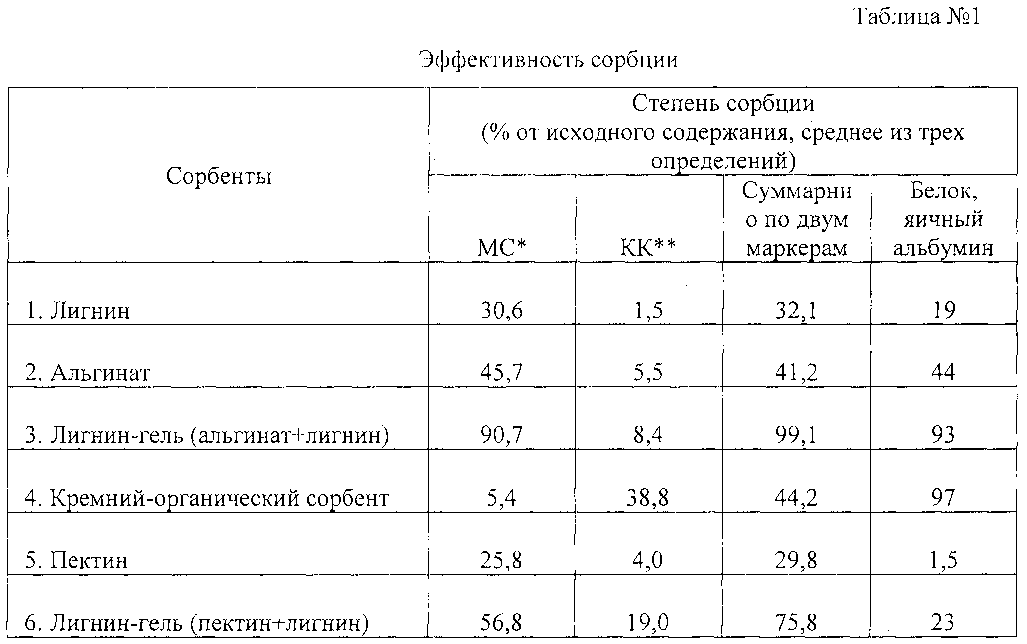
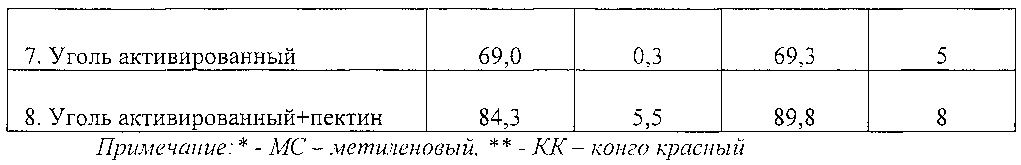
Из результатов эксперимента следует, что комбинированный препарат на основе сорбента лигнина и альгината способен эффективно связывать как низкомолекурные и среднемолекулярные молекулы, так и высокомолекулярные вещества, тогда как отдельно взятые компоненты показали более низкие результаты сорбции.
Причем в случае комбинации нерастворимого энтеросорбента с растворимым происходит не просто арифметическое увеличение за счет суммарного эффекта входящих в композицию компонентов, а синергетический рост сорбционного потенциала.
Помимо изучения сорбционных свойств были исследованы приемлемые органолептические свойства используемых полимеров и их комбинаций.
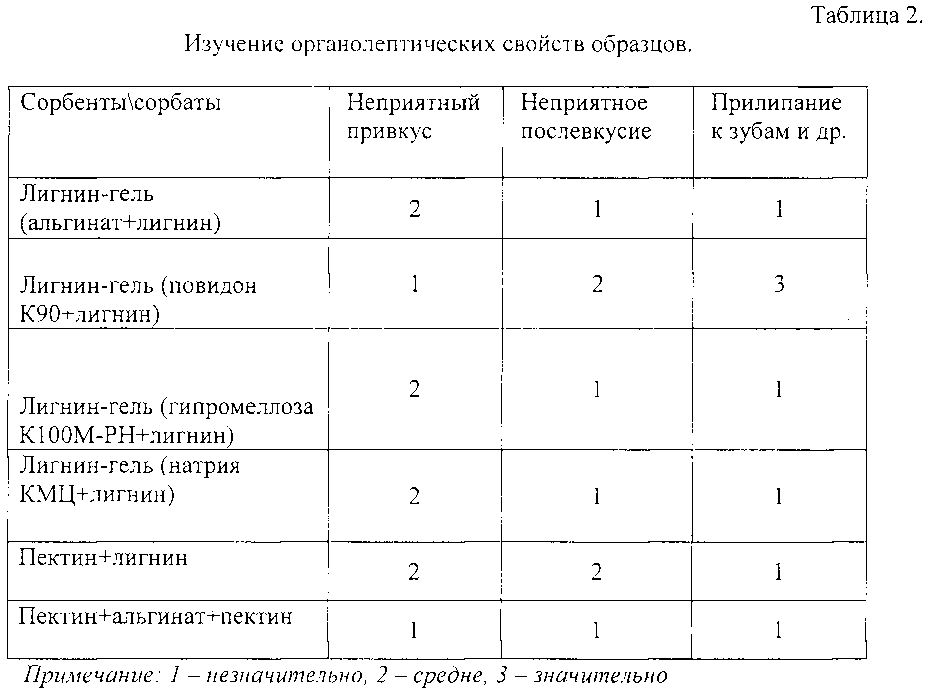
По органолептическим показателям - худшие показатели по органолептике имеют комбинации лигнина гидролизного с повидоном К90 и пектином. Однако комбинация пектина с другими гелеобразователями значительно повышают качество вкусовых показателей препарата.
Изучение эффективности комбинации было проведено на экспериментальной модели острой кишечной инфекции крыс.
Моделирование острой кишечной инфекции (ОКИ) состояло из двух этапов: моделирование дисбиоза и инфицирование введением условно-патогенными бактериями (УПМ). В качестве тест-систем использовали крыс-самцов линии Вистар, массой тела 200 г.
Дисбактериоз у крыс вызывали путем перорального введения антибиотика доксициклина. Введение животным доксициклина осуществлялось ежедневно в дозе 0,2 мг. Длительность курса введения составила 3-е суток. После чего ОКИ вызывали у крыс путем перорального введения 1,0 мл смеси культур УПМ каждые 4 часа на протяжении 5 дней (Е. coli гемолизирующая 1010 КОЕ/мл, К. pneumoniae 1010 КОЕ/мл, St. aureus (гиалуронидазная, лецитиназная, коагулазная, гемагглютинирующая активность) 1010 КОЕ/мл, Ps. aeruginosae 1010 КОЕ/мл, Enterobacter cloacae 1010 КОЕ/мл, Str. faecalis 1010 КОЕ/мл).
Экспериментальные животные были подразделены на шесть групп по 10 особей в каждой группе.
Для определения терапевтической эффективности вещества и комбинации вводили после инфицирования per os в дозах, рекомендованных для терапии ОКИ согласно инструкции по медицинскому применению препаратов-аналогов. Срок введения препаратов составлял 7 суток. Группы исследования приведены в таблице 3.

Эффективность оценивалась на основании процентного соотношения выживших/павших животных после введения культур, клинического состояния животных, гистологической картины тонкого, толстого отделов кишечника.
После выведения животных из эксперимента путем декапитации в условиях эфирного наркоза, осуществлялось взятие фрагментов толстой и тонкой кишок. Гистологические срезы окрашивались гематоксилин-эозином по стандартной методике. В тонкой кишке измеряли толщину стенки, глубину крипт, длину и диаметр ворсинок; в толстой - толщину стенки, глубину крипт, длину и диаметр полулунных складок. Изучали макроскопическую картину слизистой оболочки, на наличие видимых повреждений - отек, гиперемию, кровоизлияния.
Результаты
На первом этапе длительность курса введения доксициклина составляла 3-е суток. У большинства животных в опытной группе, получавших доксициклин в дозе 0,4 мг, отмечалась диарея, крысы набирали вес медленнее, чем животные контрольных групп. У 20% животных опытной группы, по прошествии курса введения доксициклина, отмечалось снижение массы тела в среднем на 7% по сравнению с исходной средней массой. У животных групп контроля увеличение массы составляло 3%.
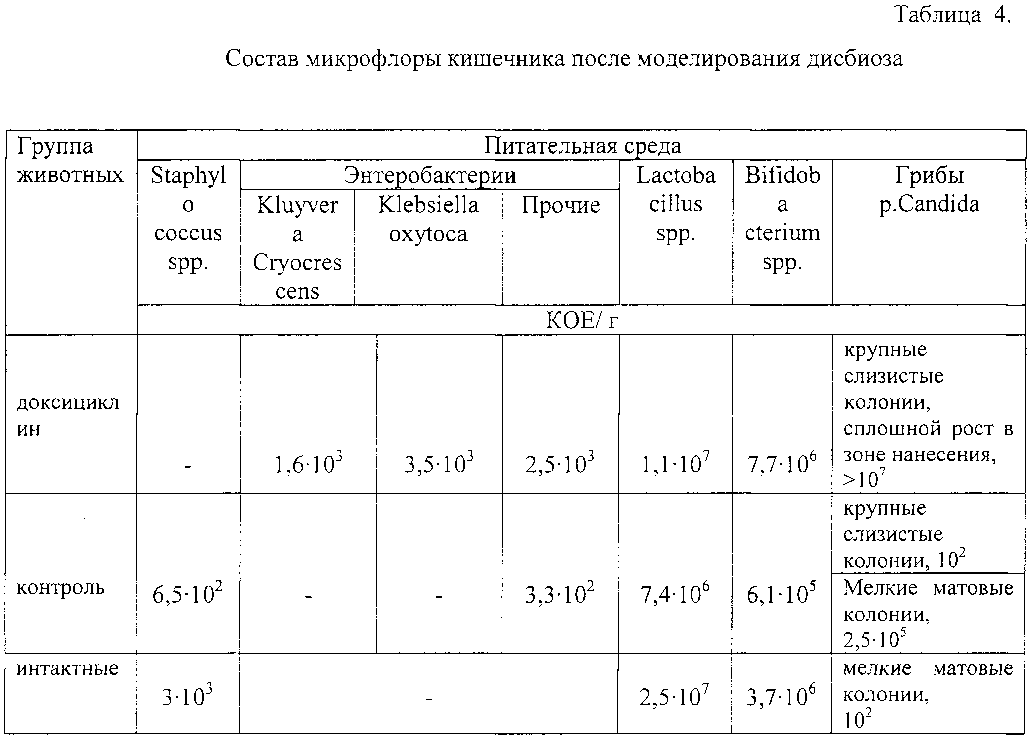
После моделирования дисбиоза было проведено исследование качественной и количественной характеристик фекальной микрофлоры лабораторных животных (таблица 4).
На втором этапе проводили пероральное введение 1,0 мл смеси культур УПМ каждые 4 часа на протяжении 5 дней.
В контрольной группе на 2,38±0,18 день введения смеси культур УПМ у экспериментальных животных всех групп происходило угнетение познавательной и двигательной активности, снижение аппетита. К 4,63±0,13 дню присоединились жажда, жидкий стул зелено-коричневого цвета без примесей слизи, крови, а масса тела уменьшилась в среднем на (9,81±0,3). Пик смертности (до 80%) приходился на 4-е сутки после инфицирования.
По данным эксперимента, в результате терапевтического введения защитных препаратов удалось снизить смертность животных с моделированной ОКИ (таблица 5).
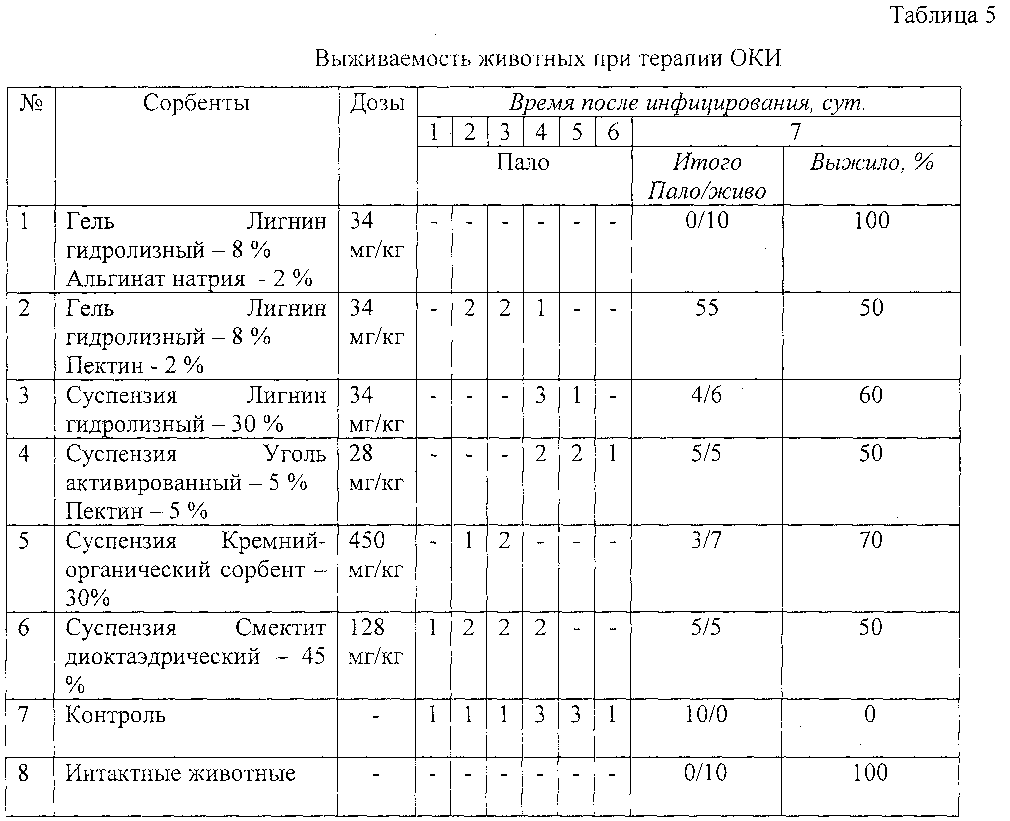
За весь период наблюдения гибели животных в группе исследования №1 не отмечалось. В группе №№2, 4, 6 выявлен наименьший показатель выживаемости (около 50%), что свидетельствовало о относительно низком вкладе компонентов от токсического действия патогенных штаммов. Более высоким являлся показатель выживаемости в группах животных №3, 5-60% и 70% соответственно.
У крыс 1 группы на 2,23±0,53 день от начала терапии наблюдалось восстановление аппетита, поведенческих и двигательных реакций, уменьшение диарейного синдрома. Наблюдалось более быстрое, в сравнении с другими группами, нормализация испражнений на (4,38±0,18) сутки от начала лечения соответственно, р<0,001.
Гистологическое исследование образцов тонкого кишечника крыс контрольной группы отклонений от нормы не выявило, а у животных с моделированной ОКИ наблюдались явления энтерита, более выраженные у групп 2, 4. Значительный объем занимали разрушенные ворсинки, наблюдалась воспалительная инфильтрация всех слове кишечника с формированием крипт-абсцесссов.
В условиях введения фармацевтической композиции гель Лигнин гидролизный - 8%+Альгинат натрия - 2% в группе №1 была выявлена оптимизация гистологической структуры тонкого кишечника. Деструкция ворсинок, отек тканей были менее выражены, а лимфогистиоцитарная инфильтрация локализовалась преимущественно в подслизистом слое.
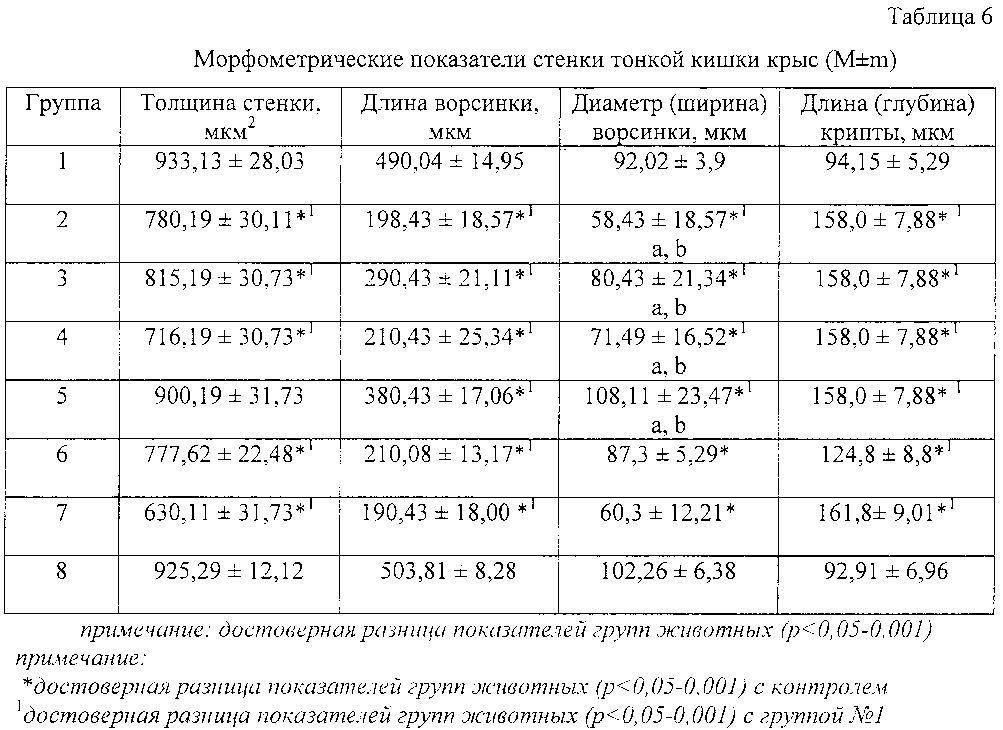
Происходило уменьшение толщины стенки сравнительно с контролем на 18,99% (р<0,001) у крыс 1 группы, а у животных 2-6 групп - в среднем на 25,99% (р<0,001). Данные изменения обусловлены дистрофическими и деструктивными изменениями слизистой оболочки тонкого кишечника вследствие активной десквамации эпителия ворсинок, разрушения их верхушек и воспалительной инфильтрации. Так, по сравнению с крысами 1 группы, у подопытных животных, получавших терапию другими компонентами, длина ворсинок уменьшалась в среднем на 60,60% (р<0,001), а в условиях введения тестируемой композиции гель Лигнин гидролизный - 8%+Альгинат натрия - 2% уменьшение составило всего 6,70% (р<0,05) (таблица 6).
Имело место также углубление кишечных крипт у крыс 2,4 группы на 70,06% от значений интактной группы (р<0,001), а по сравнению с 1 группой -на 21,01% (р<0,05).
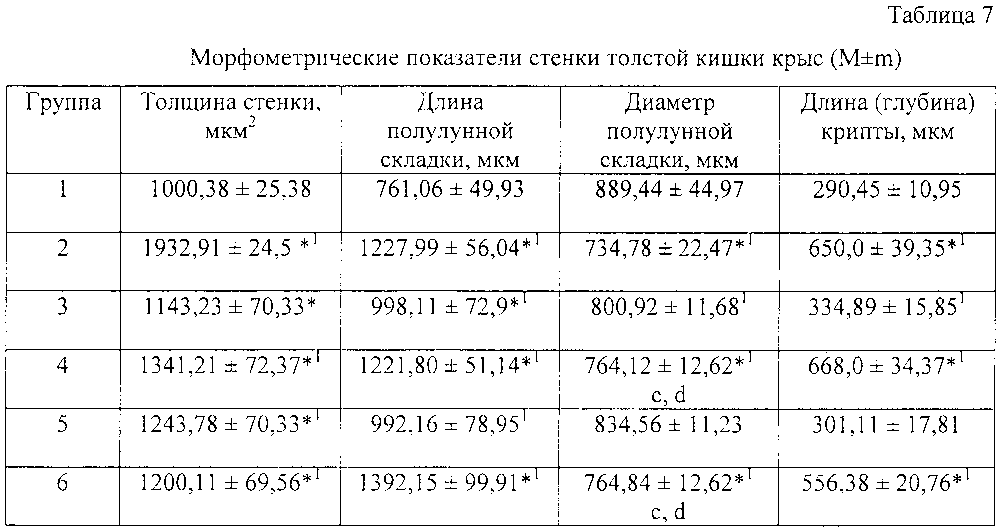
Данные микроскопии толстого кишечника характеризовались однонаправленными гистологическими изменениями, свидетельствующими о проявлениях колита у крыс с ОКИ, вызванной УПМ, что более выражено было у животных 3, 4, 6 групп. Вследствие эндотоксикоза происходила десквамация эпителия кишечника, отек тканей с полнокровием и деструкцией сосудов подслизистого слоя, а лимфатические узелки содержали в себе светлые центры пролиферации, что свидетельствует о выраженной активности воспалительного ответа на патоген.
В группе №1 ОКИ явления колита имели минимальную степень выраженности, на что указывала частичная деструкция полулунных складок, менее выраженные явления дисциркуляторных изменений и отека.
При морфометрии стенки толстого кишечника выявились увеличение его толщины, наиболее выраженные в группе 4, на 195,62%, наименее выраженные в условиях терапии гель Лигнин гидролизный - 8%+Альгинат натрия - 2% в группе №1 на 125,87%) соответственно (р<0,05).
В 6 и 4 группах подопытных животных отмечалось увеличение длины полулунных складок при уменьшении их диаметра и углублении крипт. Так, длина полулунных складок была больше на 23,77% (р<0,01), а глубина крипты - на 99,47% о (р<0,001) (таблица 7). Подобные изменения структуры толстой кишки можно объяснить большей интенсивностью воспалительной инфильтрации стенки, гиперплазии лимфоидных элементов и тканевого отека. Различие морфометрических показателей в сравниваемых группах показывает эффективность применения композиции Лигнин гидролизный - 8%+Альгинат натрия - 2% в лечении ОКИ по сравнению с другими сорбенатами.
Показано, что при моделировании ОКИ у крыс в периоде ранней реконвалесценции в тонкой и толстой кишке наблюдаются как деструктивные, так и компенсаторно-приспособительные процессы в виде десквамации кишечного эпителия, деструкции ворсинок, воспалительной клеточной инфильтрации и выраженного тканевого отека. Наименее выраженные деструктивные явления наблюдались в группе №1.
Композиция гель Лигнин гидролизный - 8% Альгинат натрия - 2% обеспечивала наиболее высокую защиту животных от токсинов УПМ - в 100% наблюдали защиту при «лечебном» введении такой композиции.

Полученные результаты исследований объективно демонстрируют эффективность заявленной композиции путем перорального введения фармацевтической композиции в гелевой форме, включающей в качестве активных компонентов нерастворимый и растворимый энтеросорбенты. Высокая эффективность и безопасность композиции, достигается за счет эффективного связывания и удержания токсинов.
Заявленная композиция может быть изготовлена на фармацевтическом производстве с применением стандартного оборудования.

