Результат интеллектуальной деятельности: МОЛЕКУЛЯРНЫЙ МАРКЕР FR_ER1 И ЕГО ИСПОЛЬЗОВАНИЕ ДЛЯ СЕЛЕКЦИИ НОВЫХ СОРТОВ ГОРОХА, УСТОЙЧИВЫХ К МУЧНИСТОЙ РОСЕ
Вид РИД
Изобретение
Предпосылки создания изобретения
Горох (Pisum sativum L.) подвергается нападению многих вредителей и патогенных микроорганизмов, включая насекомых, нематоды, бактерии, грибы и вирусы. Наиболее распространенными, а также наиболее вредными по степени воздействия, являются болезни, вызываемые грибами (более чем 28 видов грибов патогенны для гороха посевного). Мучнистая роса переносится воздушным путем и поражает листья, стебли, а также бобы. Возбудитель мучнистой росы Erysiphe communis f. pisi (H.A. Dietr.) Jacz. является узкоспециализированным облигатным паразитом, распространенным во всех районах выращивания гороха.
Мучнистая роса негативно влияет на качество зернобобовой продукции, используемой в пищевой и кормовой промышленности. В течение вегетации гриб Е. communis f. pisi распространяется конидиями с помощью ветра, капель дождя и насекомых. Болезнь проявляется на листьях и бобах как белый паутинистый налет, приобретающий позже серый цвет. В северо-западных, западных и центральных районах Нечерноземной полосы России заболевание обычно проявляется в конце лета, когда наступает влажная прохладная погода. В южных районах и странах заболевание проявляется значительно раньше, наиболее сильно распространяясь в условиях низкой влажности и высокой температуры. При сильном (до 90-100%) поражении растений гороха мучнистой росой происходит снижение урожая зерна в 5 раз, также снижается содержание белка (Mahmood et al., 1983).
Защитные меры против мучнистой росы гороха включают в себя ранние посадки культуры, мелкодисперсный полив, использование фунгицидов и растительных экстрактов. Одним из наиболее известных способов является применение коллоидной серы или серосодержащих соединений.
Альтернативой данным способам является использование сортов, устойчивых к мучнистой росе, или введение генов устойчивости в уже существующие сорта, что должно приводить к снижению затрат на химическую обработку посевов и негативного эффекта от обработок.
Уровень техники
У гороха (Pisum sativum L.) известны три гена, определяющих устойчивость гороха к мучнистой росе: er1, er2, Er3. Данные гены были выявлены на основе анализа устойчивости растений гороха из природных популяций к заболеванию мучнистой росой. Большинство выявленных случаев имеют в основе рецессивную аллель единственного локуса er1 (Tiwari et al., 1997).
У различных видов растений, таких как арабидопсис (Arabidopsis thaliana (L.) Heynh.), ячмень (Hordeum vulgare L.), томат (Solarium lycopersicum L.) и других, известны линии, обладающие устойчивостью к мучнистой росе, которая определяется мутацией с потерей функциональности в гене семейства MLO. Данное семейство кодирует белки, содержащие трансмембранные домены, которые сходны с рецепторами, сопряженные с G-белками (англ. G-protein-coupled receptors, GPCR) (Devoto et al., 2003).
Недавно была выявлена последовательность гена гороха PsMLOl (Humphry et al., 2011). Тест на аллелизм между линией гороха с мутацией в гене PsMLO1 и сортом Franklin, несущим аллель er1, определяющую устойчивость к заболеванию мучнистой росой, показал соответствие генов PsMLO1 и er1 (Pavan et al., 2011). Также соответствие PsMLO1 и er1 было подтверждено с помощью транзиентной экспрессии PsMLO1 в листьях устойчивых к мучнистой росе линий гороха (Humphry et al., 2011).
В практику мирового сельского хозяйства в последнее десятилетие активно внедряются сорта гороха, устойчивые к мучнистой росе. Линии и сорта, несущие подобные мутации в гене PsMLO1, являются перспективными донорами признака устойчивости к мучнистой росе. Для эффективного проведения селекции требуется разработка генетических маркеров, которые бы позволяли на самых ранних этапах проводить отбор гибридов. В работе (Pavan et al., 2013) провели разработку 5 молекулярных маркеров, пригодных для идентификации 5 мутантных аллелей гена PsMLO1. Данные маркеры строго специфичны и позволяют идентифицировать ДНК-полиморфизмы, непосредственно приводящие к нарушению функции PsMLO1. Разработанные маркеры относятся к типам CAPS (cleaved amplified polymorphic sequence), dCAPS (derived cleaved amplified polymorphic sequence), STS (sequence tagged site), HRM (high-resolution melting).
Описание изобретения
В работе (Pavan et al., 2011) было показано, что устойчивость к заражению мучнистой росой сорта гороха Franklin опосредована вставкой транспозона размером более 20000 п.о. в кодирующий регион гена PsMLO1. В работе (Pavan et al., 2013) был предложен молекулярный маркер типа STS (sequence tagged site), обозначенный er1-2/MGB, для идентификации данной аллели гена PsMLO1. В статье приведены ДНК-праймеры, которые позволяют амплифицировать фрагмент геномной ДНК, относящейся к сорту Franklin. Однако маркер erl-2/MGB является доминантным и не позволяет отличать гомозиготные растения по гену PsMLO1 (устойчивые к мучнистой росе) от гетерозиготных (восприимчивых). Кроме того, поскольку «внутренний контроль» в реакции ПЦР с праймерами er1-2/MGB не предусматривается, отсутствие продукта амплификации может быть вызвано ошибкой исследователя, например, неуспешной реакцией ПЦР.
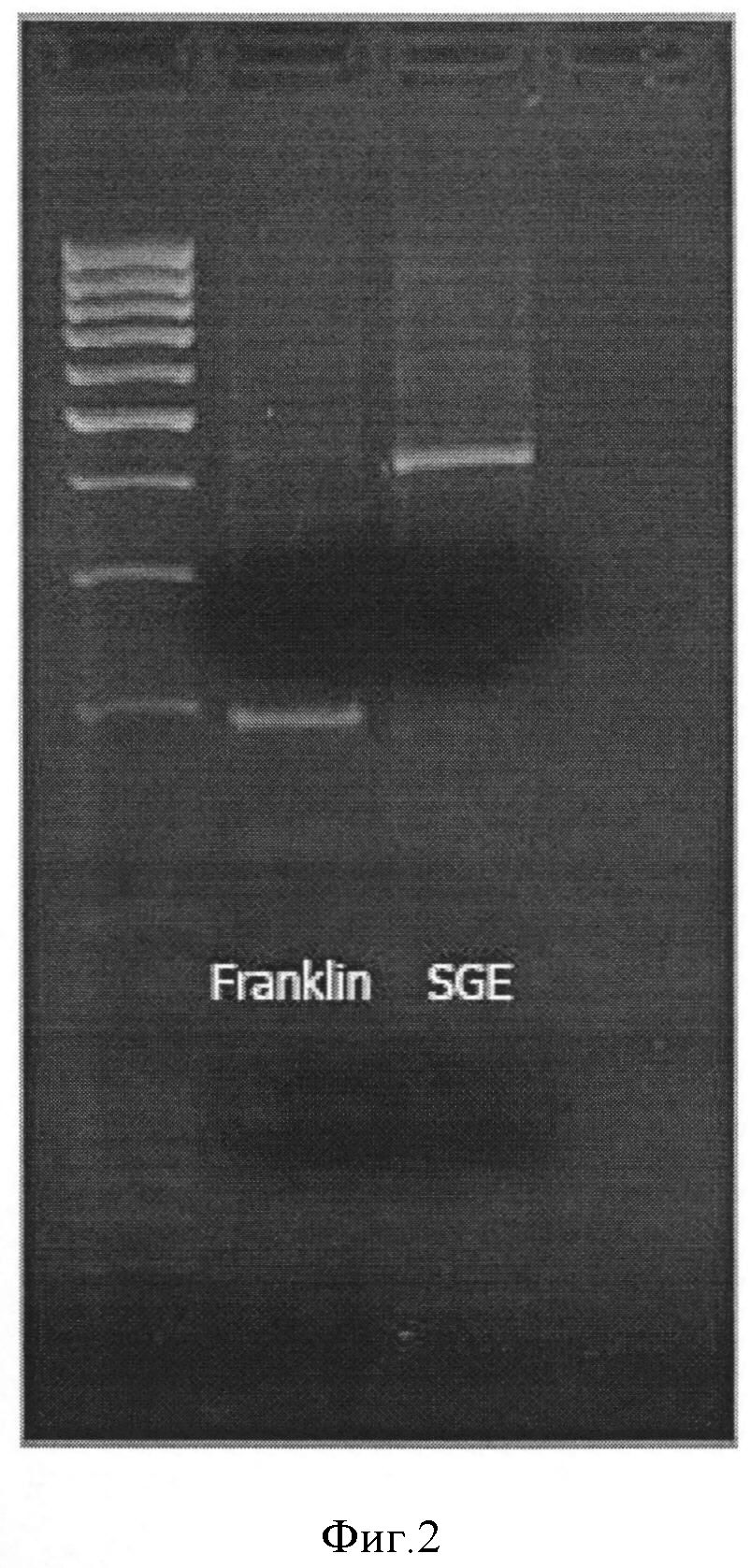
Авторы настоящего изобретения предлагают при проведении селекционных работ с использованием сорта Franklin (либо другого сорта или линии, имеющей аналогичную вставку транспозона) в качестве донора признака устойчивости к заражению мучнистой росой использовать молекулярный маркер типа RBIP (Retrotransposon-Based Insertion Polymorphisms), обозначаемый Fr_Er1, включающий систему из 3 праймеров, которая позволяет однозначно идентифицировать аллельное состояние гена PsMLO1 у анализируемого растения.
Данная система состоит из:
- праймер (А) - последовательность ДНК, комплементарная кодирующему участку гена PsMLO1;
- праймер (В) - последовательность ДНК, комплементарная кодирующему участку гена PsMLO1, которая вместе с праймером А позволяет амплифицировать фрагмент АВ на матрице ДНК природной аллели гена PsMLO1 (соответствующей восприимчивости к мучнистой росе);
- праймер (С) - последовательность ДНК, комплементарная вставке транспозона в гене PsMLO1, присутствующей у растений сорта Franklin, которая вместе с праймером А позволяет амплифицировать фрагмент АС на матрице ДНК аллели гена PsMLO1 со вставкой транспозона;
При этом размер фрагмента АС отличается от размера фрагмента АВ. При этом каждый из фрагментов можно отличить стандартными лабораторными методами, например, определив размер продукта амплификации после электрофореза в 2% агарозном геле.
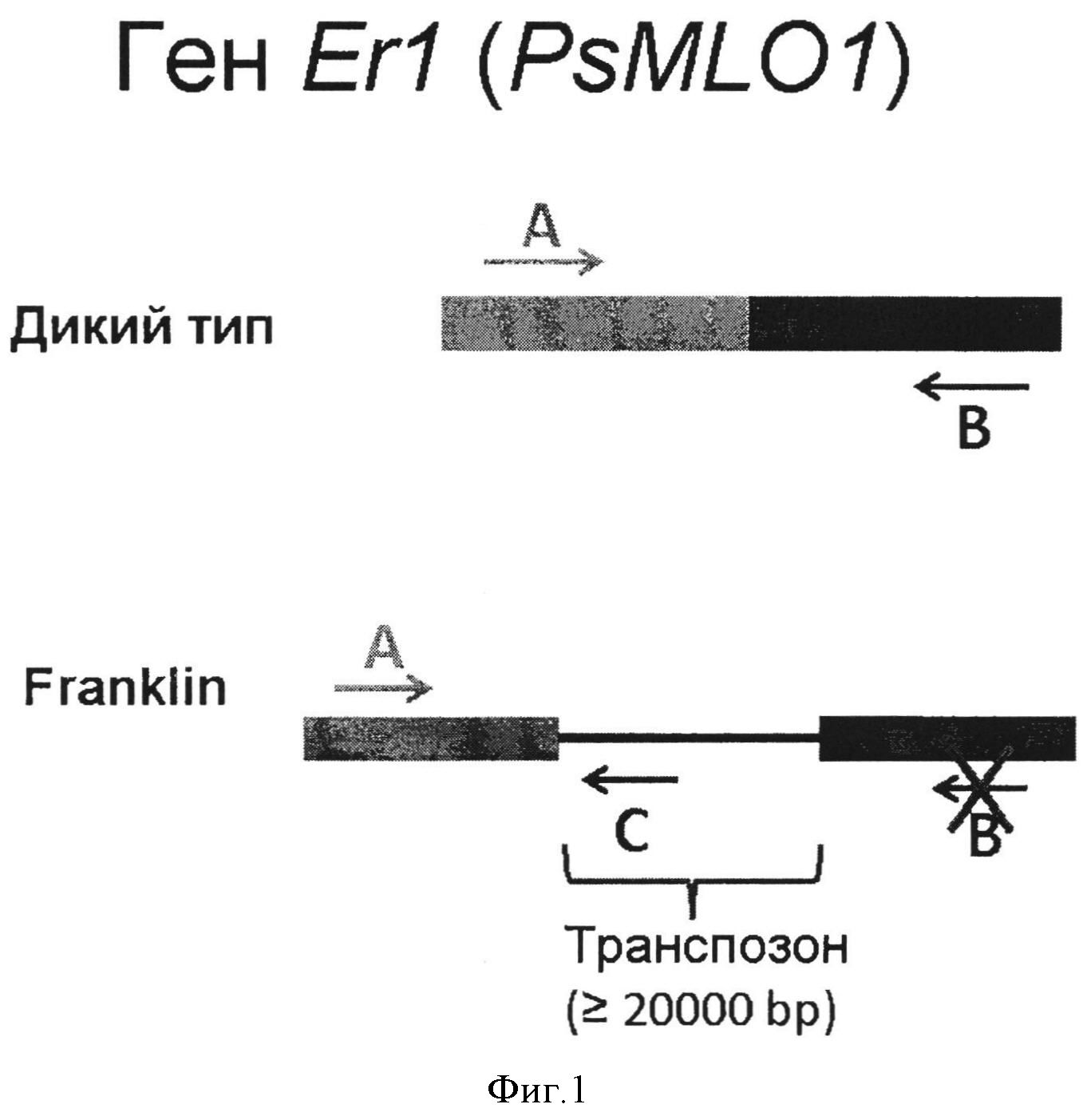
Таким образом, аллельное состояние гена PsMLO1 у анализируемого растения (например, перспективного образца для создания селекционной линии) можно определить по результату одной реакции ПЦР с последующей детекцией размера продуктов (Фигура 1).
Способ реализации изобретения
Для реализации изобретения на основании результатов секвенирования фрагментов гена PsMLO1 у линии SGE, восприимчивой к заболеванию мучнистой росой, и сорта Franklin, устойчивого к заболеванию мучнистой росой, создали варианты праймеров А, В и С. Последовательности данных праймеров приведены в Таблице 1.

Для нахождения подходящих и оптимальных комбинаций праймеров провели ПЦР со всеми возможными комбинациями праймеров А, В и С на геномной ДНК, выделенной из листьев растений линии SGE и сорта Franklin. Общее число комбинаций составило 2×5×5=50.
Использовали следующий состав компонентов ПЦР:
MgCl2 - 0,1 мМ
Нуклеотиды (каждый) - 0,2 мМ
Праймер (каждый) - 0,1 мкМ
Буфер для Taq-полимеразы - 1х
Taq-полимераза - 0,05 ед./мкл
ДНК-матрица - ~5-10 нг/реакция.
Реакцию проводили в объеме 10 мкл. Количество циклов реакции - 35. Температура отжига праймеров составляла 60°C, время отжига 30 секунд, время элонгации 30 секунд. После окончания реакции реакционную смесь разделяли методом электрофоретического разделения в 2% агарозном геле.
При использовании праймера PsMLO1_А1 (праймер А) на матрице ДНК обеих линий образовывалось большое количество неспецифичных продуктов реакции разного размера. Аналогичная картина наблюдалась при использовании праймеров PsMLO1_B2, (праймер В) и PsMLO1_C1, PsMLO1_C3 (праймер С). Неэффективная амплификация наблюдалась при использовании праймеров PsMLO1_B4, PsMLO1_B5 (праймер В) на матрице ДНК линии SGE и использовании праймера PsMLO1_С2 (праймер С) на матрице ДНК сорта Franklin.
Приемлемую картину, позволяющую установить аллельное состояние исследуемого растения, удалось получить при использовании следующих комбинаций праймеров:
Комбинация 1 (Фигура 2):
Праймер А - PsMLO1_A2-GACAATTTTAATTTGCAGGGTTG
Праймер В - PsMLO1_B1-CCAAGCACCTGACTCATCAA
Праймер С - PsMLO1_C4-TGCGAGACCTTGTCTTTTCC
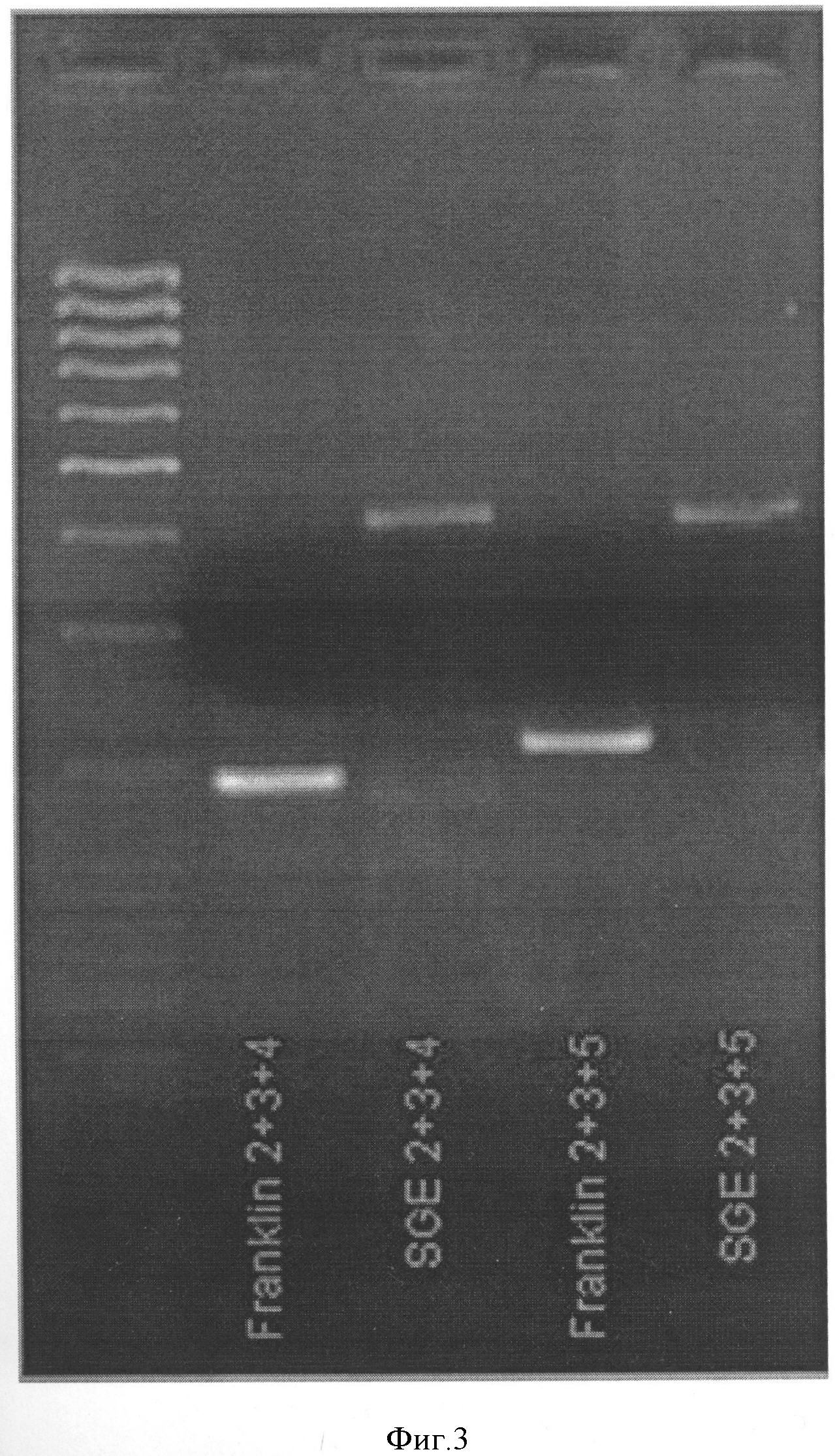
Комбинация 2 (Фигура 3):
Праймер А - PsMLO1_A2-GACAATTTTAATTTGCAGGGTTG
Праймер В - PsMLO1_B3-GCAGACCAAGCACCTGACTC
Праймер С - PsMLO1_C4-TGCGAGACCTTGTCTTTTCC
Комбинация 3 (Фигура 3):
Праймер А - PsMLO1_A2-GACAATTTTAATTTGCAGGGTTG
Праймер В - PsMLO1_B3-GCAGACCAAGCACCTGACTC
Праймер С - PsMLO1_C5-GACTCCCGAACCCAAGATTT
При использовании данных комбинаций размер продукта АВ составляет приблизительно 200 нуклеотидов, продукта АС - приблизительно 400 нуклеотидов.
Специфичность найденных комбинаций праймеров и разница в размерах получаемых продуктов на ДНК-матрицах устойчивых и неусточивых сортов и линий гороха позволяет использовать данный маркер для проведения селекционных работ.
Пример
Получили потомство F2 от гибридов сорта гороха Franklin (устойчивый к мучнистой росе) и линии SGE (восприимчивой к мучнистой росе). Гибриды получены в результате скрещивания ♀ SGE × ♂ Franklin. В летне-осенний период 2013 г. провели фенотипический анализ потомства (94 растения) на устойчивость к мучнистой росе (в F1 все растения поражались мучнистой росой). Фенотипический анализ показал, что соотношение восприимчивых и устойчивых растений соответствует расщеплению 3:1. Далее провели генетический анализ выборки для подтверждения наличия гомозиготной аллели PsMLO1 Franklin у устойчивых растений.
У растений индивидуально собрали биологический материал (зеленые листья), стандартными лабораторными методами выделили из них геномную ДНК, выделенную ДНК использовали для амплификации ДНК-продуктов с использованием следующей комбинации праймеров:
PsMLO1_A2 GACAATTTTAATTTGCAGGGTTG,
PsMLO1_B3 GCAGACCAAGCACCTGACTC,
PsMLO1_C5 GACTCCCGAACCCAAGATTT.
Данные о количестве растений, сильно пораженных, слабо пораженных и непораженных мучнистой росой, и их аллельном состоянии приведены в Таблице 2

1. Devoto A., Hartmann Н.А., Piffanelli P., Elliott С., Simmons С., Taramino G., Goh C.-S., Cohen F.E., Emerson B.C. and Schulze-Lefert P. Molecular phylogeny and evolution of the plant-specific seven-transmembrane MLO family. Journal of molecular evolution. 2003. Vol. 56. №1. P. 77-88.
2. Humphry M., Reinstädler A., Ivanov S., Bisseling T.O.N, and Panstruga R. Durable broad-spectrum powdery mildew resistance in pea erl plants is conferred by natural loss-of-function mutations in PsMLOl. Molecular Plant Pathology. 2011. Vol. 12. №9. P. 866-878.
3. Mahmood Т., Ahmad I., Qureshi S. and Aslam M. Estimation of yield losses due to powdery mildew in peas. Pak. J. Bot. 1983. №15. P. 113-115.
4. Pavan S., Schiavulli A., Appiano M., Marcotrigiano A.R., Cillo F., Visser R.G., Bai Y., Lotti C. and Ricciardi L. Pea powdery mildew er1 resistance is associated to loss-of-function mutations at a MLO homologous locus. TAG Theoretical and Applied Genetics. 2011. Vol. 123. №8. P. 1425-1431.
5. Pavan S., Schiavulli A., Appiano M., Miacola C., Visser R.F., Bai Y., Lotti C. and Ricciardi L. Identification of a complete set of functional markers for the selection of er1 powdery mildew resistance in Pisum sativum L. Molecular Breeding. 2013. Vol. 31. №1. P. 247-253.
6. Tiwari K., Penner G. and Warkentin T. Inheritance of powdery mildew resistance in pea. Canadian journal of plant science. 1997. Vol. 77. №3. P. 307-310.