Результат интеллектуальной деятельности: ВАКЦИНА ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ ПРОТИВ ЯЩУРА ТИПОВ А, О, АЗИЯ-1
Вид РИД
Изобретение
Изобретение относится к области ветеринарной вирусологии и биотехнологии, касается вакцины инактивированной эмульсионной с биштаммовым антигеном, которая может быть использована для специфической профилактики парнокопытных животных против вируса ящура типов А, О, Азия-1.
Проблема профилактики ящура у животных и снижения экономического ущерба от его возникновения и распространения, способных вызывать чрезвычайные ситуации в животноводстве с тяжелыми социально-экономическими последствиями, актуальна для многих стран мира, в том числе и для Российской Федерации.
Ящур представляет собой мировую проблему, так как является высоко контагиозным и быстро распространяющимся заболеванием, к которому восприимчивы основные сельскохозяйственные животные: крупный рогатый скот(КРС), свиньи, мелкий рогатый скот(МРС), и многие дикие животные, всего более 100 видов. Имеются 7 разных типов вируса, вакцинация против одного типа не защищает от ящура другого типа [1].
Для профилактической вакцинации нашли практическое применение традиционные моно- и поливалентные сорбированные и эмульсионные вакцины, изготовленные из культурального вируса, выращенного в суспензии ВНК-21, инактивированного аминоэтилэтиленимином [2].
Несмотря на принимаемые меры, эпизоотическая ситуация по ящуру в мире, том числе и в странах Азии, в 2013 г. не улучшилась. С начала 2013 года и в последующее время в Китае в ряде провинций были отмечены вспышки ящура среди КРС и свиней, вызванные вирусом типов О и А. В 2013 году в 4 пограничных с Китаем районах Забайкальского края отмечены 9 вспышек ящура. По данным Всемирной референтной лаборатории МЭБ по ящуру, выделенные на территории Забайкальского края и Амурской области Российской Федерации, Казахстана и Монголии, изоляты на 99% идентичны изолятам A/QHXN-CHA-2013-B и A/GDMM-CHA-2013S. В 2013 г. заболевание ящуром среди КРС отмечено на Северном Кавказе и в Краснодарском крае. Выделенные изоляты относились к генетической линии А/Иран/2005. Изоляты данной генетической линии в 2013 г. вызывали вспышки ящура на территории стран Ближнего Востока [3].
Следует отметить, что все выделенные изоляты отличаются в антигеном отношении от штаммов вируса ящура типа А, используемых до последнего времени для изготовления противоящурных вакцин [3].
Благодаря систематической вакцинации животных и контролю иммунного фона поголовья, подавляющее большинство субъектов РФ, в том числе Северного Кавказа, длительное время являются благополучными по ящуру. Однако неблагоприятная эпизоотическая обстановка по ящуру в мире и реальная возможность заноса возбудителя на территорию России диктует необходимость усиления противоящурных мероприятий, среди которых основным является осуществление профилактической поголовной вакцинации животных в зонах высокого риска возникновения и распространения ящура [4].
Опубликованные результаты исследований свидетельствуют о преимуществах эмульсионных препаратов, которые готовят с использованием масляных адъювантов [5, 6].
Эмульсионные препараты получают в результате смешивания двух взаимно нерастворимых фаз: масляной (масляного адъюванта) и водной, содержащей антиген (антигены) в поддерживающей среде, - путем их энергичного перемешивания (эмульгирования).
При этом в зависимости от состава масляного адъюванта получают эмульсии различных типов: «вода в масле» (обратная), «масло в воде» (прямая) или «вода-масло-вода» (множественная). Для иммунизации сельскохозяйственных животных наиболее широко используют эмульсии обратного типа.
Технология изготовления противоящурной вакцины из инактивированного вируса начинается с подбора производственных штаммов на основе эпизоотологического анализа динамики ящура в стране и сопредельных государствах. При создании препаратов для специфической профилактики используют соответствующие типы вируса ящура и подбирают штаммы с широким антигенным спектром внутри типа с выраженной перекрестной иммуногенностью. Штамм с широким спектром иммуногенности и удовлетворяющий требованиям региона выбирают с помощью его испытания в реакции перекрестной защиты или чаще в реакции перекрестной нейтрализации. Как правило, в качестве производственного штамма используется популяция вируса, которая в совокупности с системой и условиями промышленного культивирования обеспечивает гарантированное и высокое накопление 146S и 75S компонентов вируса и получение иммуногенной вакцины.
Кроме того, производственному штамму предъявляются требования стабильности вируса в процессе очистки от тканевых компонентов и концентрирования, а также сохранения вируса при инактивации и длительном его хранении [7].
Возбудитель ящура обладает значительной антигенной вариабельностью штаммов в пределах одного серотипа, которая выявляется в различные временные промежутки и на разных территориях и зависит от видового состава восприимчивого поголовья, его иммунного статуса и множества других различных факторов.
Антигенная изменчивость вируса ящура обусловлена заменами аминокислот в полипептидных фрагментах (антигенных эпитопах), экспонированных на поверхности капсидных белков. Сдвиги антигенного спектра, соответствующие обновлению структуры нового полевого штамма, могут варьировать от незначительных, улавливаемых моноклональными антителами, до существенных, регистрируемых с помощью традиционных поликлональных иммуноглобулинов. Существенные изменения антигенных характеристик природного штамма приводят к тому, что вакцинация животных производственным вакцинным штаммом не гарантирует защиту поголовья от антигенно отличающихся эпизоотических штаммов вируса ящура [7, 8].
Зарубежные ученые показали, что смесь из двух вакцин, обусловила защиту у морских свинок против гетерологичного штамма, в то время как каждая из них в отдельности не обеспечивала иммунного ответа против гетерологичного штамма вируса ящура [9].
Отечественные ученые провели исследования по сравнению иммуногенной активности моно- и полиштаммовых вакцин. Из полученных результатов следует, что введение в состав вакцины других, антигенно отличающихся штаммов вируса данного типа приводит к расширению антигенного спектра действия, за счет чего повышается иммуногенная активность полиштаммовой вакцины в отношении гомо- и гетерологичных штаммов вируса данного типа и не снижается активность против производственного [10].
Разработка новых средств диагностики и специфической иммунопрофилактики ящура является актуальной задачей.
Известна трехвалентная инактивированная эмульсионная вакцина против вируса ящура типов А, О и Азия-1 RAKSHA OVAC TRIVALENT производства INDIAN IMMUNOLOGICALS LIMITED RAKSHAPURAM, GACHIBOWLI HYDEREBAD, Индия [11].
Известна инактивированная вакцина «Decivac FMD DOE» (Децивак) против ящура крупного рогатого скота, буйволов, свиней, овец и коз «MSD Animal Health (Intervet International GmbH», Германия [12].
Известна вакцина инактивированная очищенная против ящура жвачных животных и свиней «Aftopor» (Автопор) трехвалентная (тип А, О, Азия-1) Компания «Merial Animal Health Ltd », Франция [13].
Известна вакцина FUTVAC (Foot and Mouth Disease Vaccine, Inactivated, types O,A, Asia-1) Brilliant Bio Pharma Limited, Hyderabad)), India [14].
Известна вакцина против ящура культуральная инактивированная эмульсионная «АРРИАХ-ВАК» трехвалентная [15].
Основным недостатком известных вакцин является невысокая эффективность из-за существующих антигенных различий между штаммами одного типа вируса ящура, а также недостаточной очищенности антигенных материалов.
Задачей изобретения является получение вакцины инактивированной эмульсионной типов А, О, Азия-1, обладающей высокой иммуногенной активностью с широким спектром антигенности при вакцинации от различающихся эпизоотических штаммов вируса ящура.
Поставленная задача достигается тем, что для профилактики и борьбы с заболеванием получена вакцина инактивированная эмульсионная против ящура типов А, О, Азия-1 с биштаммовым антигеном вируса ящура типа А, создающая эффективную защиту восприимчивых животных от заражения вирусом ящура типов А, О, Азия-1 и имеющая расширенное антигенное действие к вирусу ящура типа А.
Технический результат от использования предлагаемого изобретения заключается в повышении иммуногенной активности вакцины инактивированной эмульсионной против ящура типов А, О, Азия-1, за счет расширения антигенного спектра действия по валентности А.
Указанный технический результат достигнут созданием вакцины инактивированной эмульсионной против ящура типов А, О и Азия-1 с биштаммовым антигеном типа А, охарактеризованной следующей совокупностью признаков.
Предлагаемая вакцина в 1 см3 препарата в качестве активного вещества содержит смесь авирулентных и очищенных материалов из штаммов вируса ящура: биштаммовый антиген вируса ящура типа А в виде авирулентных и очищенных материалов из штаммов вируса ящура А № 2187/Кути/2013 и А №2171/Кабардино-Балкарский/2013, авирулентного и очищенного материала из штамма вируса ящура О №2123/Южная Осетия/2011 и авирулентного и очищенного материала из штамма вируса ящура Азия-1 №1946/Шамир 3/89 - полученных предпочтительно в перевиваемой культуре клеток ВНК-21, в количествах не менее 3 мкг, обеспечивающих антигенную активность в организме животного при введении ему целевого препарата и целевые добавки: поддерживающую среду и масляный адъювант - в количестве, обеспечивающем толерантную презентацию антигена в организме иммунизированного животного. Содержание целевых добавок в готовом препарате рассчитывают с учетом объема прививной дозы вакцины для каждого вида животных.
Исходный вирус для получения штамма вируса ящура А №2187/Кути/2013 выделен в 2013 году в России. Штамм получен путем многократных последовательных пассажей на чувствительных гетеро- и гомологичных культурах клеток. Штамм адаптирован к первичнотрипсинизированным клеткам свиной почки и перевиваемым клеточным культурам ВНК-21, IBRS-2 и ПСГК-30.
Исходный вирус для получения штамма
А №2171/Кабардино-Балкарский/2013 выделен в июле 2013 году в селе Нижний Куркужин Баксанского района Кабардино-Балкарской Республики. Штамм получен путем многократных последовательных пассажей на чувствительных гетеро- и гомологичных культурах клеток. Штамм адаптирован к первичнотрипсинизированным клеткам свиной почки и перевиваемым клеточным культурам ВНК-21, IBRS-2 и ПСГК-30.
Штамм вируса ящура Азия-1 №1946/Шамир 3/89 получен из Всемирной справочной лаборатории Pirbright.
Исходный вирус для получения штамма вируса ящура О №2123/Южная Осетия/2011 выделен от свиней в 2011 году в селе Стырфас Дзауского района Республики Южная Осетия. Штамм получен путем многократных последовательных пассажей на чувствительных гетеро- и гомологичных культурах клеток. Штамм адаптирован к первичнотрипсинизированным клеткам свиной почки и перевиваемым клеточным культурам ВНК-21, IBRS-2 и ПСГК-30.
Для изготовления вакцины в качестве чувствительной биологической системы используют предпочтительно суспензионную культуру клеток ВНК-21, а в качестве поддерживающей среды раствор Эрла без сыворотки с добавлением ферментативных гидролизатов мышц сухого (ФГМС), гидролизатов белков крови сухого (ГБКС) и антибиотиков при рН 7,4-7,6.
Для инактивации вируса используют АЭЭИ, который добавляют в вируссодержащую суспензию до концентрации 0,025-0,05%. По окончании инактивации АЭЭИ нейтрализуют внесением в суспензию тиосульфата натрия [16].
Полученный антиген очищают от балластных примесей с помощью полигексаметиленгуанидина гидрохлорида (ПГМГ), который вносят в суспензию до концентрации 0,005-0,007% [17].
Авирулентный и очищенный антигенный материал из штаммов: А №2187/Кути/2013, А №2171/Кабардино-Балкарский/2013,
Азия-1 №1946/Шамир 3/89 и О №2123/Южная Осетия/2011, представляет собой суспензию, содержащую преимущественно 146S и 75S иммуногенные компоненты вируса ящура.
Количественное и качественное содержание вирусного сырья определяют методом турбидиметрии [18].
Для приготовления вакцины используют вирусный материал, содержащий в 1 см3 не менее 0,5 мкг 146S и 75S иммуногенных компонентов вируса ящура.
Необходимую концентрацию 146S и 75S иммуногенных компонентов вируса ящура в вакцинном препарате обеспечивают путем концентрирования антигена проточной ультрафильтрацией.
Эмульсионную вакцину получают путем диспергирования на коллоидных мельницах концентрата ящурного антигена и масляного адъюванта в соотношении 3:7 и 1:1 по массе соответственно. Для усиления иммунного ответа преимущественно используют масляный адъювант производства фирмы «Seppic» марок Montanide ISA-70 или Montanide ISA-206.
Содержание антигена и поддерживающей среды с масляным адъювантом в прививной дозе вакцины для каждого вида животных в соотношении 3:7 и 1:1 является оптимальным, так как обеспечивает толерантную презентацию антигена в организме иммунизированного животного.
Полученная вакцина представляет собой молокоподобную жидкость, не растворимую в воде.
Предлагаемое изобретение включает следующую совокупность существенных признаков, обеспечивающих получение технического результата во всех случаях, на которые испрашивается правовая охрана:
1. Вакцина инактивированная эмульсионная против ящура типов А, О и Азия-1 с биштаммовым антигеном вируса ящура типа А.
2. Активное вещество в виде смеси авирулентных очищенных антигенных материалов из иммуногенных 146S и 75S компонентов вируса ящура штаммов А №2187/Кути/2013, А №2171/Кабардино-Балкарский/2013, Азия-1 №1946/Шамир 3/89 и О №2123/Южная Осетия/2011, полученных предпочтительно в перевиваемой культуре клеток ВНК-21 в эффективном количестве.
3. Целевые добавки.
Существенные отличительные признаки предлагаемой вакцины заключаются в том, что в качестве активного вещества она содержит смесь авирулентных очищенных антигенных материалов из штаммов А №2187/Кути/2013, А №2171/Кабардино-Балкарский/2013, Азия-1 №1946/Шамир 3/89 и О №2123/Южная Осетия/2011 вируса ящура, в эффективном количестве.
Предлагаемое изобретение характеризуется также другими отличительными признаками, выражающими конкретные формы выполнения или особые условия его использования:
1. Авирулентный и очищенный антигенный материал из штамма А №2187/Кути/2013 вируса ящура типа А, полученный предпочтительно в перевиваемой культуре клеток ВНК-21 и представляющий собой суспензию, содержащую преимущественно 146S и 75S иммуногенные компоненты вируса ящура, в эффективном количестве.
2. Авирулентный и очищенный антигенный материал из штамма А №2187/Кути/2013 вируса ящура типа А, полученный предпочтительно в перевиваемой культуре клеток ВНК-21 и представляющий собой суспензию, содержащую преимущественно 146S и 75S иммуногенные компоненты вируса ящура в количестве не менее 3,0 мкг в 1 см3 готового препарата.
3. Авирулентный и очищенный антигенный материал из штамма А №2171/Кабардино-Балкарский/2013 типа А, полученный предпочтительно в перевиваемой культуре клеток ВНК-21 и представляющий собой суспензию, содержащую преимущественно 146S и 75S иммуногенные компоненты вируса ящура, в эффективном количестве.
4. Авирулентный и очищенный антигенный материал из штамма А №2171/Кабардино-Балкарский/2013 типа А, полученный предпочтительно в перевиваемой культуре клеток ВНК-21 и представляющий собой суспензию, содержащую преимущественно 146S и 75S иммуногенные компоненты вируса ящура, в количестве не менее 3,0 мкг в 1 см3 готового препарата.
5. Авирулентный и очищенный антигенный материал из штамма О №2123/Южная Осетия/2011 типа О, полученный предпочтительно в перевиваемой культуре клеток ВНК-21 и представляющий собой суспензию, содержащую преимущественно 146S и 75S иммуногенные компоненты вируса ящура, в эффективном количестве.
6. Авирулентный и очищенный антигенный материал из штамма О №2123/Южная Осетия/2011 типа О, полученный предпочтительно в перевиваемой культуре клеток ВНК-21 и представляющий собой суспензию, содержащую преимущественно 146S и 75S иммуногенные компоненты вируса ящура, в количестве не менее 3,0 мкг в 1 см3 готового препарата.
7. Авирулентный и очищенный антигенный материал из штамма Азия-1 №1946/Шамир 3/89 типа Азия-1, полученный предпочтительно в перевиваемой культуре клеток ВНК-21 и представляющий собой суспензию, содержащую преимущественно 146S и 75S иммуногенные компоненты вируса ящура, в эффективном количестве.
8. Авирулентный и очищенный антигенный материал из штамма Азия-1 №1946/Шамир 3/89 типа Азия-1, полученный предпочтительно в перевиваемой культуре клеток ВНК-21 и представляющий собой суспензию, содержащую преимущественно 146S и 75S иммуногенные компоненты вируса ящура, в количестве не менее 3,0 мкг в 1 см3 готового препарата.
9. Из целевых добавок вакцина содержит поддерживающую среду.
10. Вакцина содержит поддерживающую среду в количестве 299996,0÷899988,0 мкг в 1 см3 готового препарата.
11. Из целевых добавок вакцина содержит масляный адъювант.
12. Из целевых добавок вакцина содержит масляный адъювант ISA-70.
13. Вакцина содержит масляный адъювант ISA-70 в количестве 500000,0÷700000,0 мкг в 1 см3 готового препарата.
14. Из целевых добавок вакцина содержит масляный адъювант ISA-206.
15. Вакцина содержит масляный адъювант ISA-206 в количестве 1000000,0÷1575000,0 мкг в 1 см3 готового препарата.
16. Авирулентный и очищенный антигенный материал из штаммов: А №2187/Кути/2013, А №2171/Кабардино-Балкарский/2013, Азия-1 №1946/Шамир 3/89 и О №2123/Южная Осетия/2011 вируса ящура, полученных предпочтительно в перевиваемой культуре клеток ВНК-21 и целевые добавки: поддерживающую среду и масляный адъювант в количестве, мкг/см3 препарата для свиней и МРС:
17. Авирулентный и очищенный антигенный материал из штаммов: А №2187/Кути/2013, А №2171/Кабардино-Балкарский/2013, Азия-1 №1946/Шамир 3/89 и О №2123/Южная Осетия/2011 вируса ящура, полученных предпочтительно в перевиваемой культуре клеток ВНК-21 и целевые добавки: поддерживающую среду и масляный адъювант в количестве, мкг/см3 препарата для КРС:

Предлагаемая вакцина обладает высокой иммуногенной активностью и обеспечивает надежную защиту против вируса ящура серотипов А, О и Азия-1, циркулирующих в странах Закавказья, Центральной Азии, Ближнего и Дальнего Востока.
Достижение технического результата от использования изобретения достигается тем, что в состав предлагаемой вакцины введен в качестве активного вещества антигенный материал из штамма А №2187/Кути/2013, А №2171/Кабардино-Балкарский/2013, Азия-1 №1946/Шамир 3/89 и О №2123/Южная Осетия/2011, обладающий высокой иммуногенной активностью, создающий эффективную защиту восприимчивых животных против вируса ящура серотипов А, О и Азия-1, вызывающих вспышки заболевания в последние годы в странах Закавказья, Центральной Азии, Ближнего и Дальнего Востока.
Вирусный изолят, послуживший источником для получения штамма А №2187/Кути/2013, был выделен в сентябре 2013 года от больных свиней в селе Кути Приаргунского района Забайкальского края (экспертиза №2187). Производственный штамм получен из данного изолята путем последовательных пассажей на чувствительных гетеро- и гомологичных культурах клеток.
Штамм А №2187/Кути/2013 вируса ящура типа А депонирован 22 января 2014 года в Коллекцию штаммов микроорганизмов Федерального государственного бюджетного учреждения «Федеральный центр охраны здоровья животных» (ФГБУ «ВНИИЗЖ»), под регистрационным номером (ссылкой): штамм вируса ящура А №2187/Кути/2013 (производственный).
Дендрограмма отражает филогенетическое взаимоотношения штаммов вируса ящура А №2187/Кути/2013 с эпизоотическими и вакцинными штаммами вируса ящура серологического типа А. Дендрограмма основана на сравнении полных нуклеотидных последовательностей гена VP1 (Фиг. 1).
Сущность изобретения пояснена в перечне последовательностей, в котором:
SEQ ID NO: 1 представляет последовательность нуклеотидов гена белка VP1 штамма А №2187/Кути/2013 вируса ящура типа А;
SEQ ID NO: 2 представляет последовательность аминокислот гена белка VP1 штамма А №2187/Кути/2013 вируса ящура типа А.
Штамм вируса ящура А №2187/Кути/2013 вируса ящура типа А характеризуется следующими признаками и свойствами.
Морфологические признаки
Штамм вируса ящура А №2187/Кути/2013 типа А относится к семейству Picornaviridae, роду Aphtovirus, серотипу А и обладает морфологическими признаками, характерными для возбудителя ящура: форма вириона икосаэдрическая, размер 23-25 нм. Вирион состоит из молекулы РНК, заключенной в белковую оболочку. Белковая оболочка состоит из 32 капсомеров, расположенных в кубической симметрии.
Антигенные свойства
По своим антигенным свойствам штамм А №2187/Кути/2013 вируса ящура относится к серотипу А. Вирус стабильно нейтрализуется гомологичной антисывороткой. Вирус не проявляет гемагглютинирующей активности (ГА-активности). У переболевших животных в сыворотке крови образуются антитела, выявляемые в иммуноферментном анализе (ИФА) и реакции микронейтрализации (РМН). При иммунизации КРС вакциной из инактивированного вируса индуцирует образование специфических антител, выявляемых в ИФА и РМН.
При гипериммунизации морских свинок концентрированный антиген из инактивированного вируса ящура типа А №2187/Кути/2013 индуцирует образование вирусспецифических антител, выявляемых в РСК в разведении 1:40.
Методом нуклеотидного секвенирования была определена первичная структура гена VP1 вируса ящура типа А №2187/Кути/2013 и выведена первичная структура белка VP1. Сравнительный анализ нуклеотидных последовательностей показал, что штамм вируса ящура типа А №2187/Кути/2013 значительно отличается от производственных штаммов типа А. Степень нуклеотидных различий последовательностей штамма А №2187/Кути/2013 со штаммами вируса ящура серологического типа А составило: А22№550 - 21,49%, А22/Ирак/64 - 21,73%, А/Иран/96 - 22,03%, А/Армения/98 - 22,39%, А/Турция/06 - 22,11%, А/Иран/05 - 22,32%.
Таким образом, филогенетический анализ показал, что штамм А №2187/Кути/2013 принадлежит к генетической линии Юго-Восточная Азия 97 (Sea-97) топотипа Азия.
Антигенное родство штамма ВЯ А №2187/Кути/2013 с имеющимися производственными штаммами ВЯ типа А исследовано серологическим методом в перекрестной реакции микронейтрализации (РМН). Штамм А №2187/Кути/2013 антигенно отличается от производственных штаммов А22 №550, А №2179/Щелковский биокомбинат, А/Иран/97, А/Киргизия/07 (А/Иран/05). Штамм ВЯ А №2187/Кути/2013 имеется слабо выраженное антигенное родство со штаммом А/Турция/06 (А/Иран/05).
Результаты исследований в РМН представлены в таблице 1. Антигенное соответствие (r1) составило для А22 №550 -0,13, А №2179/Щелковский биокомбинат -0,11, А/Иран/97 - 0,004, А/Турция/06-0,37, А №2045/Киргизия/07 - 0,13. При значении r1≥0,3 полевой изолят и производственный штамм являются близкородственными, и вакцина из производственного штамма будет защищать от эпизоотического вируса, при значении r1<0,3 полевой изолят отличается от производственного штамма, и вакцина из данного штамма не защищает от эпизоотического вируса [19, 20].
Биотехнологические характеристики
Штамм А №2187/Кути/2013 репродуцируется в первично-трипсинизированной монослойной культуре клеток почки свиньи (СП), перевиваемых культурах клеток почки сибирского горного козерога (ПСГК-30), ВНК-21 и IB-RS-2, и в течение 18+24 часов инкубирования вируса в указанных культурах клеток накапливается от 6,0 до 7,0 lg ТЦД50/см3. При высокой множественности заражения (1-10 ТЦД/клетка) вызывает ЦПД через 5 часов. Сохраняет исходные характеристики при пассировании в клеточных культурах на протяжении 5 пассажей (срок наблюдения).
Гено- и хемотаксономическая характеристика
Штамм А №2187/Кути/2013 вируса ящура типа А является РНК-содержащим вирусом с молекулярной массой 7×106 Д.
Нуклеиновая кислота представлена одноцепочной линейной молекулой молекулярной массой 2,8×106 Д. Вирион имеет белковую оболочку, состоящую из четырех основных белков VP1, VP2, VP3 и VP4. Липопротеиновая оболочка отсутствует.
Основным антигенным белком является VP1. В вирионе содержится приблизительно 31,5% РНК и 68,5% белка. Вирионная РНК является инфекционной и участвует в образовании белков-предшественников в инфицированных клетках. Предшественники, в свою очередь, расщепляются с образованием более стабильных структурных и неструктурных полипептидов вируса. Из 8 неструктурных полипептидов, накапливающихся в инфицированных клетках, один (VP66a) является РНК-зависимой РНК-полимеразой, участвующей в репликации РНК новых вирионов.
Физические свойства
Масса вириона составляет 8,4×10-18 г. Коэффициент седиментации 146S в градиенте сахарозы. Плавучая плотность 1,45 г/см3.
Устойчивость к внешним факторам
Штамм А №2187/Кути/2013 устойчив к эфиру, хлороформу, фреону, ацетону и другим органическим растворителям и детергентам. Наиболее стабилен при рН 7,2÷7,6. Сдвиги рН как в кислую, так и в щелочную сторону ведут к инактивации вируса. Чувствителен к формальдегиду, УФ-облучению, γ-облучению, высоким температурам.
Дополнительные признаки и свойства
Иммуногенная активность - иммуногенен в составе инактивированной вакцины.
Антигенная активность - введение инактивированного антигена морским свинкам индуцирует образование вирусоспецифических антител.
Реактогенность - реактогенными свойствами не обладает.
Патогенность - патогенен для парнокопытных животных, новорожденных мышат, морских свинок.
Вирулентность - вирулентен для естественно-восприимчивых животных при контактном, аэрозольном и парентеральном заражении.
Стабильность - сохраняет исходные биологические свойства при пассировании в чувствительных биологических системах в течение 5 пассажей (срок наблюдения).
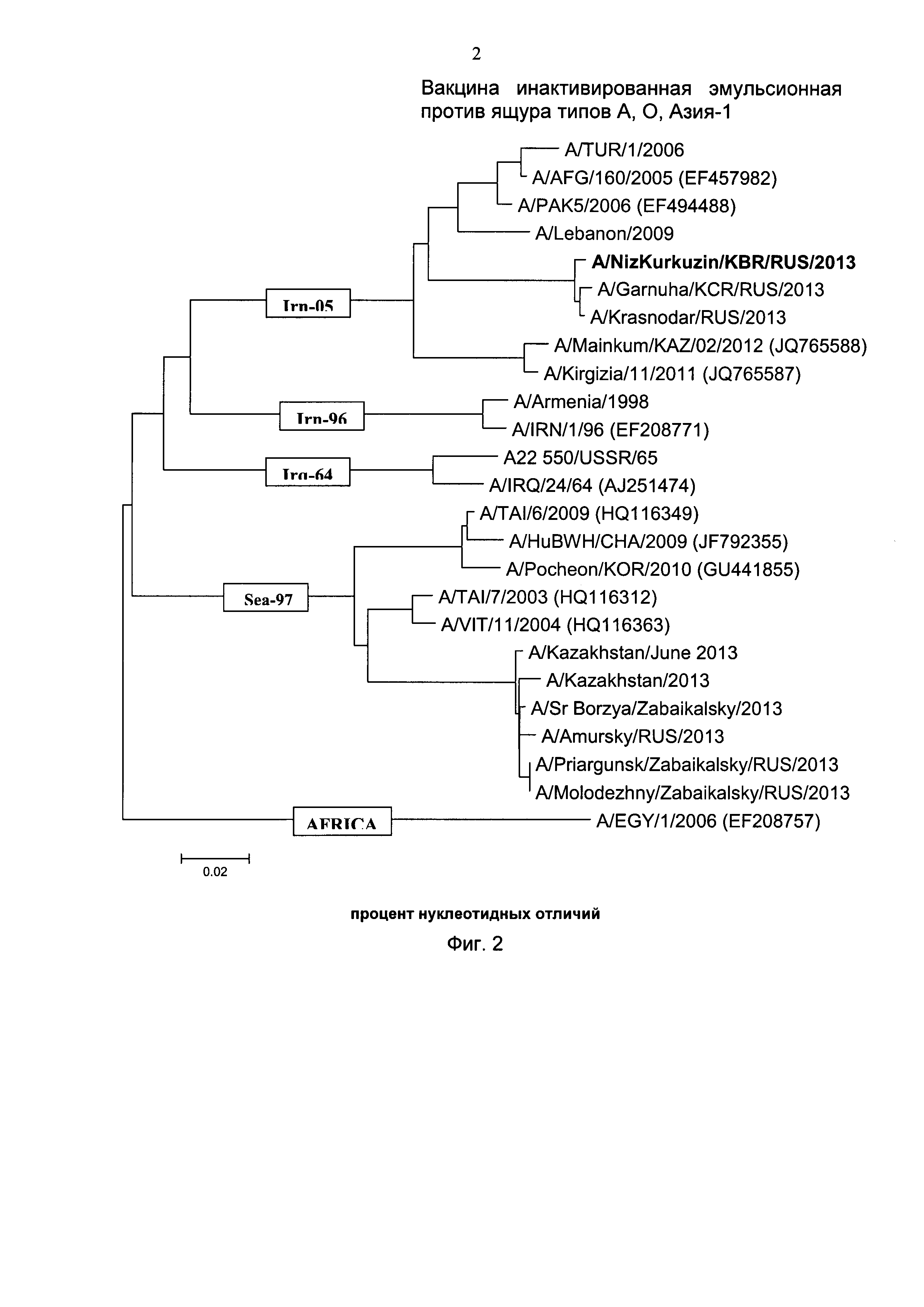
Штамм А №2171/Кабардино-Балкарский/2013 вируса ящура типа А депонирован 28 января 2014 года в Коллекцию штаммов микроорганизмов Федерального государственного бюджетного учреждения «Федеральный центр охраны здоровья животных» (ФГБУ «ВНИИЗЖ»), под регистрационным номером (ссылкой): штамм вируса ящура А №2171/Кабардино-Балкарский/2013 (производственный).
Дендрограмма отражает филогенетические взаимоотношения штамма вируса ящура А №2171/Кабардино-Балкарский/2013 с эпизоотическими и вакцинными штаммами вируса ящура серологического типа А. Дендрограмма основана на сравнении полных нуклеотидных последовательностей гена VP1 (Фиг. 2).
Сущность изобретения пояснена в перечне последовательностей, в котором:
SEQ ID NO: 3 представляет последовательность нуклеотидов гена белка VP1 штамма А №2171/Кабардино-Балкарский/2013 вируса ящура типа А;
SEQ ID NO: 4 представляет последовательность аминокислот гена белка VP1 штамма А №2171/Кабардино-Балкарский/2013 вируса ящура типа А.
Штамм А №2171/Кабардино-Балкарский/2013 вируса ящура типа А характеризуется следующими признаками и свойствами.
Морфологические признаки:
Штамм А №2171/Кабардино-Балкарский/2013 вируса ящура типа А относится к семейству Picornaviridae, роду Aphtovirus, серотипу А и обладает морфологическими признаками, характерными для возбудителя ящура: форма вириона икосаэдрическая, размер 23-25 нм. Вирион состоит из молекулы РНК, заключенной в белковую оболочку. Белковая оболочка состоит из 32 капсомеров, расположенных в кубической симметрии.
Антигенные свойства
По своим антигенным свойствам штамм А №2171/Кабардино-Балкарский/2013 вируса ящура относится к типу А. Вирус стабильно нейтрализуется гомологичной антисывороткой. Вирус не проявляет гемагглютинирующей активности (ГА-активности). У переболевших животных в сыворотке крови образуются антитела, выявляемые в иммуноферментном анализе (ИФА) и реакции микронейтрализации (РМН). При иммунизации КРС вакциной из инактивированного вируса индуцирует образование специфических антител, выявляемых в ИФА и РМН.
При гипериммунизации морских свинок концентрированный антиген из инактивированного вируса ящура типа А №2171/Кабардино-Балкарский/2013 индуцирует образование вирусспецифических антител, выявляемых в РСК в разведении 1:30.
Методом нуклеотидного секвенирования была определена первичная структура гена VP1 вируса ящура типа А №2171/Кабардино-Балкарский/2013 и выведена первичная структура белка VP1. Сравнительный анализ нуклеотидных последовательностей показал, что штамм вируса ящура типа А №2171/Кабардино-Балкарский/2013 значительно отличается от производственных штаммов типа А. Степень нуклеотидных различий последовательностей штамма А №2171/Кабардино-Балкарский/2013 со штаммами вируса ящура серологического типа А составила: А22№550 - 22,65%, А22/Ирак/64 - 21,66%, А/Иран/96 - 21,43%, А/Армения/98 - 21,98%, А/Турция/06 - 8,23%, А/Иран/05 - 8,75%.
Таким образом, филогенетический анализ показал, что штамм А №2171/Кабардино-Балкарский/2013 принадлежит к генетической линии «Иран-2005» топотипа «Азия» вируса ящура серологического типа А и антигенно отличается от имеющихся производственных штаммов ВЯ типа А.
Антигенное родство штамма ВЯ А №2171/Кабардино-Балкарский/2013 с имеющимися производственными штаммами ВЯ типа А исследовано серологическим методом в перекрестной реакции микронейтрализации (РМН). Штамм А №2171/Кабардино-Балкарский/2013 антигенно отличается от производственных штаммов А22 №550, А22 Ирак/64, А/Иран/97, А/Турция/06 (А/Иран/05), А/Киргизия/07 (А/Иран/05).
Результаты исследований в РМН представлены в таблице 2. Антигенное соответствие (r1) составило для А22 №550 -0,013, А22 Ирак/64 - 0,02, А/Иран/97 - 0,03, А/Турция/06 - 0,19 и А/Киргизия/2007 -0,03. При значении r1≥0,3 полевой изолят и производственный штамм являются близкородственными, и вакцина из производственного штамма будет защищать от эпизоотического вируса, при значении r1<0,3 полевой изолят отличается от производственного штамма, и вакцина из данного штамма не защищает от эпизоотического вируса [19, 20].
Биотехнологические характеристики
Штамм А №2171/Кабардино-Балкарский/2013 репродуцируется в монослойных культурах клеток: первично трипсинизированной культуре клеток почки свиньи (СП), перевиваемых культурах клеток почки сибирского горного козерога (ПСГК-30), ВНК-21 и IB-RS-2. В течение 18-24 часов инкубирования урожай вируса в указанных культурах достигает значений от 6,00 до 7,50 lg ТЦД50/см3. При высокой множественности заражения (1-10 ТЦД/клетка) вирус вызывает ЦПД через 5 часов. Вирус сохраняет исходные характеристики при пассировании в клеточных культурах на протяжении 5 пассажей (срок наблюдения).
Гено- и хемотаксономическая характеристика
Штамм А №2171/Кабардино-Балкарский/2013 вируса ящура типа А является РНК-содержащим вирусом с молекулярной массой 7×106 Д.
Нуклеиновая кислота представлена одноцепочной линейной молекулой молекулярной массой 2,8×106 Д. Вирион имеет белковую оболочку, состоящую из четырех основных белков VP1, VP2, VP3 и VP4. Липопротеидная оболочка отсутствует.
Основным антигенным белком является VP1. В вирионе содержится приблизительно 31,5% РНК и 68,5% белка. Вирионная РНК является инфекционной и участвует в образовании белков-предшественников в инфицированных клетках. Предшественники, в свою очередь, расщепляются с образованием более стабильных структурных и неструктурных полипептидов вируса. Из 8 неструктурных полипептидов, накапливающихся в инфицированных клетках, один (VP66a) является РНК-зависимой РНК-полимеразой, участвующей в репликации РНК новых вирионов.
Физические свойства
Масса вириона составляет 8,4×10-18 г. Коэффициент седиментации 146S в градиенте сахарозы. Плавучая плотность 1,45 г/см3.
Устойчивость к внешним факторам
Штамм А №2171/Кабардино-Балкарский/2013 устойчив к эфиру, хлороформу, фреону, ацетону и другим органическим растворителям и детергентам. Наиболее стабилен при рН 7,2-7,6. Сдвиги рН как в кислую, так и в щелочную сторону ведут к инактивации вируса. Чувствителен к формальдегиду, УФ-облучению, γ-облучению, высоким температурам.
Дополнительные признаки и свойства
Иммуногенная активность - иммуногенен в составе инактивированной вакцины.
Реактогенность - реактогенными свойствами не обладает.
Патогенность - патогенен для парнокопытных животных, новорожденных мышат, морских свинок.
Вирулентность - вирулентен для естественно-восприимчивых животных при контактном, аэрозольном и парентеральном заражении.
Стабильность - сохраняет исходные биологические свойства при пассировании в чувствительных биологических системах в течение 10 пассажей (срок наблюдения).
Штамм О №2123/Южная Осетия/2011 вируса ящура типа О депонирован 25 апреля 2013 года в Коллекцию штаммов микроорганизмов Федерального государственного бюджетного учреждения «Федеральный центр охраны здоровья животных» (ФГБУ «ВНИИЗЖ»), под регистрационным номером (ссылкой): штамм вируса ящура О №2123/Южная Осетия/2011 (производственный).
Дендрограмма отражает филогенетические взаимоотношения штамма вируса ящура О №2123/Южная Осетия/2011 с эпизоотическими и вакцинными штаммами вируса ящура серологического типа О. Дендрограмма основана на сравнении полных нуклеотидных последовательностей гена VP1 (Фиг. 3).
Сущность изобретения пояснена в перечне последовательностей, в котором:
SEQ ID NO: 5 представляет последовательность нуклеотидов гена белка VP1 штамма О №2123/Южная Осетия/2011 вируса ящура типа О;
SEQ ID NO: 6 представляет последовательность аминокислот гена белка VP1 штамма О №2123/Южная Осетия/2011 вируса ящура типа О.
Штамм вируса ящура О №2123/Южная Осетия/2011 вируса ящура типа О характеризуется следующими признаками и свойствами.
Морфологические признаки
Штамм вируса ящура О №2123/Южная Осетия/2011 типа О относится к семейству Picornaviridae, роду Aphtovirus, серотипу О и обладает морфологическими признаками, характерными для возбудителя ящура: форма вириона икосаэдрическая, размер 23-25 нм. Вирион состоит из молекулы РНК, заключенной в белковую оболочку. Белковая оболочка состоит из 32 капсомеров, расположенных в кубической симметрии.
Антигенные свойства
По своим антигенным свойствам штамм О №2123/Южная Осетия/2011 вируса ящура относится к серотипу О. Вирус стабильно нейтрализуется гомологичной антисывороткой. Вирус не проявляет гемагглютинирующей активности (ГА-активности). У переболевших животных в сыворотке крови образуются антитела, выявляемые в иммуноферментном анализе (ИФА) и реакции микронейтрализации (РМН). При иммунизации КРС вакциной из инактивированного вируса индуцирует образование специфических антител, выявляемых в ИФА и РМН.
При гипериммунизации морских свинок концентрированный антиген из инактивированного вируса ящура типа О №2123/Южная Осетия/2011 индуцирует образование вирусспецифических антител, выявляемых в РСК в разведении 1:30.
Филогенетический анализ показал, что штамм О №2123/Южная Осетия/2011 принадлежит к генетической линии О PanAsia 2 топотипа Средний Восток - Южная Азия.
Антигенное родство штамма ВЯ О №2123/Южная Осетия/2011 с имеющимися производственными штаммами ВЯ типа О исследовано серологическим методом в перекрестной реакции микронейтрализации (РМН). Штамм О №2123/Южная Осетия/2011 антигенно родственен к производственным штаммам Маниса, О №1734/Приморский/2000 (ПанАзия), О ПанАзия-2.
Результаты исследований в РМН представлены в таблице 3. Антигенное соответствие (r1) составило для О1 Маниса - 0,74, О №1734/Приморский/2000 (ПанАзия) - 1,0, О ПанАзия-2 - 1,0. При значении r1≥0,3 полевой изолят и производственный штамм являются близкородственными, и вакцина из производственного штамма будет защищать от эпизоотического вируса, при значении r1<0,3 полевой изолят отличается от производственного штамма, и вакцина из данного штамма не защищает от эпизоотического вируса [19, 20].
Биотехнологические характеристики
Штамм О №2123/Южная Осетия/2011 репродуцируется в первично-трипсинизированной монослойной культуре клеток почки свиньи (СП), перевиваемых культурах клеток почки сибирского горного козерога (ПСГК-30), ВНК-21 и IB-RS-2, и в течение 18-24 часов инкубирования вируса в указанных культурах клеток накапливается от 6,0 до 7,0 lg ТЦД50/см3. При высокой множественности заражения (1-10 ТЦД/клетка) вызывает ЦПД через 5 часов. Сохраняет исходные характеристики при пассировании в клеточных культурах на протяжении 10 пассажей (срок наблюдения).
Гено- и хемотаксономическая характеристика
Штамм О №2123/Южная Осетия/2011 вируса ящура типа О является РНК-содержащим вирусом с молекулярной массой 7×106 Д.
Нуклеиновая кислота представлена одноцепочной линейной молекулой молекулярной массой 2,8×106 Д. Вирион имеет белковую оболочку, состоящую из четырех основных белков VP1, VP2, VP3 и VP4. Липопротеиновая оболочка отсутствует.
Основным антигенным белком является VP1. В вирионе содержится приблизительно 31,5% РНК и 68,5% белка. Вирионная РНК является инфекционной и участвует в образовании белков-предшественников в инфицированных клетках. Предшественники, в свою очередь, расщепляются с образованием более стабильных структурных и неструктурных полипептидов вируса. Из 8 неструктурных полипептидов, накапливающихся в инфицированных клетках, один (VP66a) является РНК-зависимой РНК-полимеразой, участвующей в репликации РНК новых вирионов.
Физические свойства
Масса вириона составляет 8,4×10-18 г. Коэффициент седиментации 146S в градиенте сахарозы. Плавучая плотность 1,45 г/см3.
Устойчивость к внешним факторам
Штамм О №2123/Южная Осетия/2011 устойчив к эфиру, хлороформу, фреону, ацетону и другим органическим растворителям и детергентам. Наиболее стабилен при рН 7,2÷7,6. Сдвиги рН как в кислую, так и в щелочную сторону ведут к инактивации вируса. Чувствителен к формальдегиду, УФ-облучению, γ-облучению, высоким температурам.
Дополнительные признаки и свойства
Иммуногенная активность - иммуногенен в составе инактивированной вакцины.
Антигенная активность - введение инактивированного антигена морским свинкам индуцирует образование вирусоспецифических антител.
Реактогенность - реактогенными свойствами не обладает.
Патогенность - патогенен для парнокопытных животных, новорожденных мышат, морских свинок.
Вирулентность - вирулентен для естественно-восприимчивых животных при контактном, аэрозольном и парентеральном заражении.
Стабильность - сохраняет исходные биологические свойства при пассировании в чувствительных биологических системах в течение 10 пассажей (срок наблюдения).
Штамм Азия-1 №1946/Шамир 3/89 вируса ящура типа Азия-1 депонирован 24 ноября 2014 года в Коллекцию штаммов микроорганизмов Федерального государственного бюджетного учреждения «Федеральный центр охраны здоровья животных» (ФГБУ «ВНИИЗЖ»), под регистрационным номером (ссылкой): штамм вируса ящура Азия-1 №1946/Шамир 3/89 (производственный).
Дендрограмма отражает филогенетические взаимоотношения штамма вируса ящура Азия-1 №1946/Шамир 3/89 с эпизоотическими и вакцинными штаммами вируса ящура серологического типа Азия-1. Дендрограмма основана на сравнении полных нуклеотидных последовательностей гена VP1 (Фиг. 4).
Сущность изобретения пояснена в перечне последовательностей, в котором:
SEQ ID NO: 7 представляет последовательность нуклеотидов гена белка VP1 штамма Азия-1 №1946/Шамир 3/89 вируса ящура типа Азия-1;
SEQ ID NO: 8 представляет последовательность аминокислот гена белка VP1 штамма Азия-1 №1946/Шамир 3/89 вируса ящура типа Азия-1.
Штамм вируса ящура Азия-1 №1946/Шамир 3/89 вируса ящура типа Азия-1 характеризуется следующими признаками и свойствами.
Морфологические признаки
Штамм вируса ящура Азия-1 №1946/Шамир 3/89 типа Азия-1 относится к семейству Picornaviridae, роду Aphtovirus, серотипу Азия-1 и обладает морфологическими признаками, характерными для возбудителя ящура: форма вириона икосаэдрическая, размер 23-25 нм. Вирион состоит из молекулы РНК, заключенной в белковую оболочку. Белковая оболочка состоит из 32 капсомеров, расположенных в кубической симметрии.
Антигенные свойства
По своим антигенным свойствам штамм Азия-1 №1946/Шамир 3/89 вируса ящура относится к серотипу Азия-1. Вирус стабильно нейтрализуется гомологичной антисывороткой. Вирус не проявляет гемагглютинирующей активности (ГА-активности). У переболевших животных в сыворотке крови образуются антитела, выявляемые в иммуноферментном анализе (ИФА) и реакции микронейтрализации (РМН). При иммунизации КРС вакциной из инактивированного вируса индуцирует образование специфических антител, выявляемых в ИФА и РМН.
При гипериммунизации морских свинок концентрированный антиген из инактивированного вируса ящура типа Азия-1 №1946/Шамир 3/89 индуцирует образование вирусспецифических антител, выявляемых в РСК в разведении 1:120.
Методом нуклеотидного секвенирования была определена первичная структура гена VP1 вируса ящура типа Азия-1 №1946/Шамир 3/89 и выведена первичная структура белка VP1. Сравнительный анализ нуклеотидных последовательностей показал, что штамм вируса ящура типа Азия-1 №1946/Шамир 3/89 значительно отличается от производственных штаммов типа Азия-1. Степень нуклеотидных различий последовательностей штамма Азия-1 №1946/Шамир 3/89 со штаммами вируса ящура серологического типа Азия-1 составило: Азия-1 №1987/Амурский/2005 - 26%, Азия-1/Таджикистан/2011 - 21,73%, Азия-1/Пакистан 29/09 - 22,03%.
Таким образом, филогенетический анализ показал, что штамм Азия-1 №1946/Шамир 3/89 принадлежит к топотипу Азия-1.
Антигенное родство штамма ВЯ Азия-1 №1946/Шамир 3/89 с имеющимися производственными штаммами ВЯ типа Азия-1 исследовано серологическим методом в перекрестной реакции микронейтрализации (РМН). Штамм Азия-1 №1946/Шамир 3/89 антигенно отличается от производственных штаммов Азия-1 №1987/Амурский/2005, Азия-1/Таджикистан/2011, Азия-1/Пакистан 29/09, Азия-1/Иран 58/99.
Результаты исследований в РМН представлены в таблице 4. Антигенное соответствие (r1) составило для Азия-1 №1987/Амурский/2005 - 0,20, Азия-1 /Таджикистан/2011 - 0,21, Азия-1/Пакистан 29/09 - 0,14.
При значении r1≥0,3 полевой изолят и производственный штамм являются близкородственными, и вакцина из производственного штамма будет защищать от эпизоотического вируса, при значении r1<0,3 полевой изолят отличается от производственного штамма, и вакцина из данного штамма не защищает от эпизоотического вируса [19, 20].
Биотехнологические характеристики
Штамм Азия-1 №1946/Шамир 3/89 репродуцируется в первично-трипсинизированной монослойной культуре клеток почки свиньи (СП), перевиваемых культурах клеток почки сибирского горного козерога (ПСГК-30), ВНК-21 и IB-RS-2, и в течение 18÷24 часов инкубирования вируса в указанных культурах клеток накапливается от 6,0 до 7,0 lg ТЦД50/см3. При высокой множественности заражения (1-10 ТЦД/клетка) вызывает ЦПД через 5 часов. Сохраняет исходные характеристики при пассировании в клеточных культурах на протяжении 10 пассажей (срок наблюдения).
Гено- и хемотаксономическая характеристика
Штамм Азия-1 №1946/Шамир 3/89 вируса ящура типа Азия-1 является РНК-содержащим вирусом с молекулярной массой 7×106 Д.
Нуклеиновая кислота представлена одноцепочной линейной молекулой молекулярной массой 2,8×106 Д. Вирион имеет белковую оболочку, состоящую из четырех основных белков VP1, VP2, VP3 и VP4. Липопротеиновая оболочка отсутствует.
Основным антигенным белком является VP1. В вирионе содержится приблизительно 31,5% РНК и 68,5% белка. Вирионная РНК является инфекционной и участвует в образовании белков-предшественников в инфицированных клетках. Предшественники, в свою очередь, расщепляются с образованием более стабильных структурных и неструктурных полипептидов вируса. Из 8 неструктурных полипептидов, накапливающихся в инфицированных клетках, один (VP66a) является РНК-зависимой РНК-полимеразой, участвующей в репликации РНК новых вирионов.
Физические свойства
Масса вириона составляет 8,4×10-18 г. Коэффициент седиментации 146S в градиенте сахарозы. Плавучая плотность 1,45 г/см3.
Устойчивость к внешним факторам
Штамм Азия-1 №1946/Шамир 3/89 устойчив к эфиру, хлороформу, фреону, ацетону и другим органическим растворителям и детергентам. Наиболее стабилен при рН 7,2÷7,6. Сдвиги рН как в кислую, так и в щелочную сторону ведут к инактивации вируса. Чувствителен к формальдегиду, УФ-облучению, γ-облучению, высоким температурам.
Дополнительные признаки и свойства
Иммуногенная активность - иммуногенен в составе инактивированной вакцины.
Антигенная активность - введение инактивированного антигена морским свинкам индуцирует образование вирусоспецифических антител.
Реактогенность - реактогенными свойствами не обладает.
Патогенность - патогенен для парнокопытных животных, новорожденных мышат, морских свинок.
Вирулентность - вирулентен для естественно-восприимчивых животных при контактном, аэрозольном и парентеральном заражении.
Стабильность - сохраняет исходные биологические свойства при пассировании в чувствительных биологических системах в течение 10 пассажей (срок наблюдения).
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Пример 1.
Инактивированную эмульсионную вакцину против ящура типов А, О, Азия-1 с биштаммовым антигеном по типу А готовят из штаммов вируса ящура А №2187/Кути/2013, А №2171 /Кабардино-Балкарский/2013, 0№2123/Южная Осетия/2011 и Азия-1 №1946/Шамир 3/89.
Штаммы вируса ящура культивируют в отдельных биореакторах.
Культивирование вируса ящура ведут при температуре 36-37°С. Через 6-7 часов инкубирования проводят подсчет живых и мертвых клеток при окраске трипановым синим. Если количество живых клеток составляет 15-20%, то инкубирование продолжают еще 2-3 часа. При достижении количества мертвых клеток 90-95% культивирование прекращают и вируссодержащую суспензию контролируют на стерильность и содержание 146S и 75S компонентов. Количество 146S+75S компонентов в суспензии должно составлять не менее 0,5 мкг/см3. Сразу по окончании цикла репродукции вируса, не прекращая термостатирования, в вируссодержащую суспензию добавляют 15-20% раствор АЭЭИ, подкисленный ледяной уксусной кислотой до рН 8,0-8,5. Конечная концентрация АЭЭИ в вируссодержащей суспензии должна быть равной 0,025-0,05%. Инактивацию инфекционности вируса проводят в течение 12-24 часов при 36-37°С и рН 7,2-7,6 с перемешиванием через 5-6 часов в течение 3-5 минут. Остаток АЭЭИ нейтрализуют добавлением тиосульфата натрия.
В теплую суспензию добавляют 10% раствор ПГМГ до концентрации 0,005-0,007% для флокуляции балластных примесей и инактивации возможных контаминантов. Флокулированные балластные примеси подвергают седиментации с последующей декантацией.
Пример 2.
Полученный антиген контролируют на авирулентность в культуре клеток свиной почки, содержание вирусспецифического белка, 146S и 75S компонентов вируса и стерильность.
Полученный антиген четырех штаммов, как описано в примере 1, объединяют в зависимости от содержания 146S и 75S компонентов вируса.
Необходимую концентрацию 146S и 75S компонентов в 1 см3 достигают с помощью проточной ультрафильтрации.
Фильтрование ведут под давлением 1,5 атм.
Адъювант Montanide ISA-70 стерилизуют в биореакторе при температуре 120°С при давлении 1,1 атмосферы 40-60 минут.
Адъювант Montanide ISA-206 стерилизуют через фильтр с порами 0,20 µm.
Пример 3.
Эмульсионную вакцину получают путем диспергирования на коллоидных мельницах концентрата антигена и масляного адъюванта в соотношении 3:7 и 1:1 соответственно. Из масляных адъювантов, в частности, использовали масляный адъювант марок Montanide ISA-70 или Montanide ISA-206 производства фирмы «Seppic» (Франция).
При изготовлении эмульсионной вакцины на основе Montanide ISA-206 адъювант и антиген подогревают до 25-30°С. После этого проводят диспергирование на коллоидных мельницах в соотношении 1 доля антигена и 1 доля адъюванта.
Эмульсионную вакцину на основе Montanide ISA-70 изготавливают при температуре адъюванта и антигена от 18 до 25°С. После этого проводят диспергирование на коллоидных мельницах в соотношении 3 доли антигена и 7 долей адъюванта.
В результате получают вакцину инактивированную эмульсионную против ящура с биштаммовым антигеном по типу А из штаммов вируса ящура А №2187/Кути/2013, А №2171/Кабардино-Балкарский/2013, О №2123/Южная Осетия/2011 и Азия-1 №1946/Шамир 3/89.
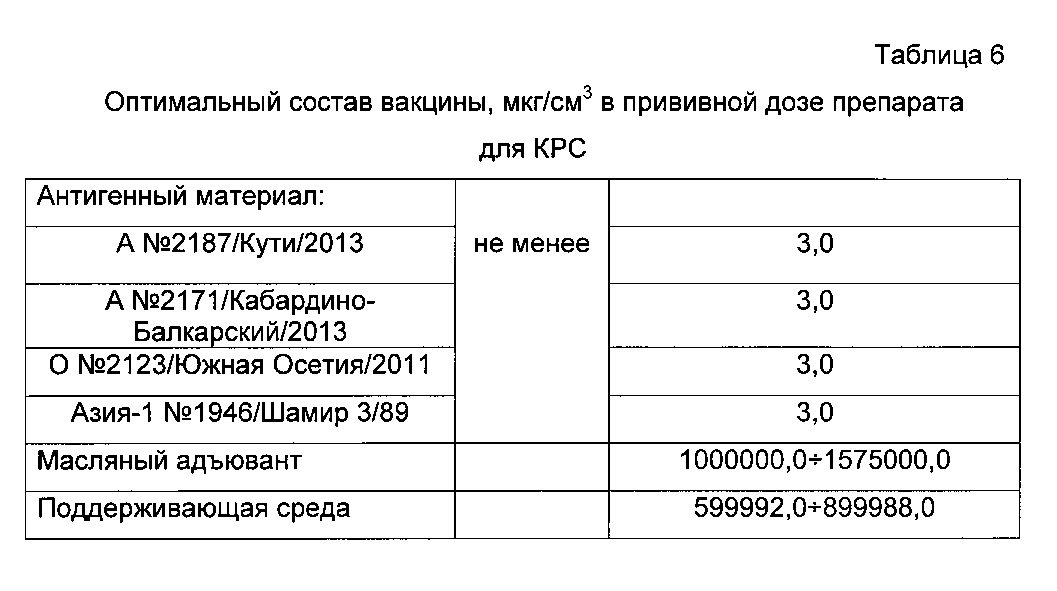
Оптимальный компонентный состав полученной вакцины представлен в таблицах 5, 6.
Вакцина легко рассасывается в месте введения, не вызывает абсцессов, общей реакции в виде подъема температуры и обладает выраженной иммуногенной активностью для свиней и КРС в прививной дозе 2÷3 см3, для MPC в прививной дозе 1÷2 см3 через 21 день после введения. Вакцину вводят свиньям, КРС и MPC внутримышечно. В прививном объеме должно содержаться не менее 3 мкг 146S и 75S компонентов вируса ящура.
Пример 4.
Биологический контроль на стерильность готовой вакцины осуществляли в соответствии с ГОСТ 280085-89 «Препараты биологические. Методы бактериологического контроля стерильности».
Приготовленная вакцина стерильна.
Пример 5.
Контроль авирулентности полученной вакцины осуществляли на КРС интрадермолингвальным методом введения по 0,1 мл в 20 точек. Наблюдение за клиническим состоянием животных вели в течение 10 дней.
Контроль безвредности на КРС проводили путем внутримышечного введения вакцины в дозе 6-10 см3.
Наблюдение за клиническим состоянием животных вели 5 суток. Вакцина была безвредной, все животные в течение указанного времени остались клинически здоровыми, и на месте введения вакцины не было чрезмерной воспалительной реакции.
Пример 6.
Для определения авирулентности вакцины на свиньях, отобранную пробу вакцины вводили внутрикожно по 0,1 см3 в две точки венчика на каждой конечности. Вакцина была авирулентной, свиньи в течение 10 суток наблюдения остались клинически здоровыми и при патологоанатомическом исследовании не обнаружено изменений характерных для ящура.
Контроль безвредности вакцины на свиньях проводили путем внутримышечного введения вакцины в область верхней трети шеи в дозе 6 см3. Срок наблюдения 10 суток. Температура тела животного может повышаться до 41°С и удерживаться на протяжении 1-3 суток.
Вакцина была безвредной, все животные в период наблюдения остались клинически здоровыми и при патологоанатомическом исследовании некроза тканей на месте введения вакцины не обнаружено.
Пример 7.
Качество вакцины проверяли исследованием сывороток крови от вакцинированных животных на наличие антител к неструктурным белкам при помощи наборов PrioCHECK FMDV NS методом ELISA.
На 14 день после начала испытаний на авирулентность и безвредность животным вводили вакцину в количестве одной прививной дозы внутримышечно. Через 14 суток после последней вакцинации от животных производили отбор крови для получения сывороток.
Результат был отрицательным, процент позитивности сывороток от вакцинированных животных менее 50%.
Пример 8.
Проведены испытания иммуногенной активности вакцины инактивированной эмульсионной против ящура типов А, О, Азия-1, изготовленной так, как описано в примерах 1-3, и содержащей, мкг:
Авирулентный и очищенный
антигенный материал в виде
иммуногенных 146S и 75S
компонентов вируса ящура
штаммов:
|
Иммуногенная активность данной вакцины проверена на 4 головах КРС массой 250÷300 кг. Вакцину вводили внутримышечно в область крупа в дозе 2 см3.
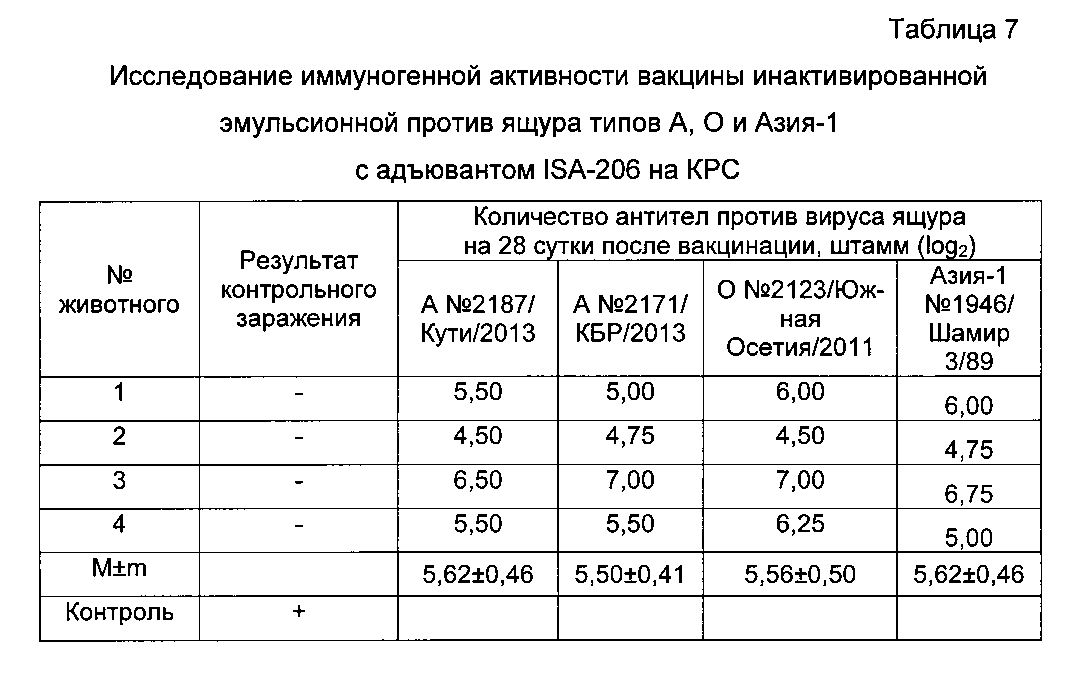
Контрольное заражение проводили гомологичными штаммами вируса ящура на 70 сутки после вакцинации. Результаты исследований представлены в таблице 7.
Исследования показали, что вакцинированные животные выдержали контрольное заражение, а невакцинированные заболели с генерализацией процесса, все 4 головы КРС были защищены от генерализации процесса на 70 сутки после вакцинации. Уровень гуморального иммунитета у привитых животных на момент заражения составил против вируса ящура штамм А №2187/Кути/2013 - 5,62±0,46 log2, А №2171/Кабардино-Балкарский/2013 - 5,50±0,41 log2, О №2123/Южная Осетия/2011 - 5,56±0,50 log2, Азия-1 №1946/Шамир 3/89 - 5,94±0,52 log2, что свидетельствует о высокой эффективности испытанной вакцины.
Пример 9.
Проведены испытания иммуногенной активности вакцины инактивированной эмульсионной против ящура типов А, О, Азия-1, изготовленной так, как описано в примерах 1-3, и содержащей, мкг:
Авирулентный и очищенный
антигенный материал в виде
иммуногенных 146S и 75S
компонентов вируса ящура
штаммов:
|
Иммуногенная активность данной вакцины проверена на 4 головах КРС массой 250÷300 кг. Вакцину вводили внутримышечно в область крупа в дозе 2 см3.
Контрольное заражение проводили гомологичными штаммами вируса ящура на 70 сутки после вакцинации. Результаты исследований представлены в таблице 8.
Исследования подтверждают высокую эффективность вакцины, все вакцинированные животные выдержали контрольное заражение на 70 сутки после вакцинации. Контрольные животные заболели с генерализацией процесса. Уровень гуморального иммунитета у привитых животных на момент заражения составил против вируса ящура А №2187/Кути/2013 - 6,75±1,10 log2, А №2171/Кабардино-Балкарский/2013 - 7,12±0,94 log2, О №2123/Южная Осетия/2011 - 6,31±0,81 log2, Азия-1 №1946/Шамир 3/89 - 6,21±0,65 log2.
Таким образом, приведенная информация свидетельствует о выполнении при использовании предлагаемой вакцины следующей совокупности условий:
- вакцина инактивированная эмульсионная против ящура типов А, О, Азия-1, воплощающая предлагаемое изобретение, предназначена для использования в сельском хозяйстве, а именно в ветеринарной вирусологии и биотехнологии;
- для предлагаемого изобретения в том виде, как оно охарактеризовано в независимом пункте формулы изобретения, подтверждена возможность его осуществления с помощью приведенных в заявке или известных до даты приоритета средств и методов;
- вакцина инактивированная эмульсионная против ящура типов А, О, Азия-1, изготовленная из штаммов А №2187/Кути/2013, А №2171/Кабардино-Балкарский/2013, О №2123/Южная Осетия/2011 и Азия-1 №1946/Шамир 3/89 в соответствии с предлагаемым изобретением, обладает высокой иммуногенной активностью и способна обеспечить эффективную защиту восприимчивых животных против вируса ящура, циркулирующего в странах Закавказья, Центральной Азии, Ближнего и Дальнего Востока.
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Вакцина инактивированная эмульсионная против ящура типов А, О и Азия-1».
1. Гуленкин В.М. Экономическая эффективность проведения профилактической вакцинации животных против ящура на территории Российской Федерации / Тр. Федерального центра охраны здоровья животных. - Владимир. 2012. - Т. 10. - С. 31-41.
2. Дудников А.И. Стратегия вакцинации при ликвидации ящура / Тр. Федерального центра охраны здоровья животных. - Владимир. 2006. - T. 4. - С.81-90.
3. Мищенко А.В., Кременчугская СР., Рахманов A.M. Обострение эпизоотической ситуации по ящуру животных в Азии и России // Инновационные процессы в АПК: сб. статей 6-й Междунар. научно-практ. конф. преподавателей, молодых ученых, аспирантов и студентов. - М., 2014. - С. 168-171.
4. Рахманов A.M., Мищенко А.В., Фомина C.H. Эпизоотическая ситуация по ящуру животных на Северном Кавказе // Вестник ветеринарии. - 2014. - Т. 69, №2. - С. 11-14.
5. De Mello Р.А. The use of oil adjuvanted foot-and-mouth disease vaccine in endemic areas. - Bol. CPFA, 1982, 45-46, 33-42.
6. Bahnemann H.G. Large scale application of oil adjuvanted foot-and-mouth disease vaccine. In.: Europ. Comm. Control FMD. Rio de Janeiro, Brasil, 5-10 Oct. 1985, Rome, 1986, 132-135.
7. Ререр X. Ящур /Перевод с нем. Г.А. Сурковой. Под ред. и с предисл. канд. вет. наук П.В. Малярца. - М.: Колос, 1971. - 432 с.
8. Бурдов А.Н., Дудников А.И., Малярец П.В. и др. Ящур / Под ред. А.Н. Бурдова. - М.: Агропромиздат, 1990. - С. 231-250.
9. Etudi immulogique comporative sur bovis de deuxsouches de virus aphteux de type О. О Flanders et O Espangne 64 / J. Fontaine [et al.] // Bull. Off. Intern. Epiz. - 1966. - Vol. 65, №11-12. - P. 2051-2062.
10. Сравнительное изучение иммуногенной активности моно- и полиштаммных вакцин из вируса ящура типа Азия-1 / Т.Ю. Черняева, А.Ф. Бондаренко, Е.В. Белик, Л.А. Дудников // Актуальные вопр. вет. вирусологии - Владимир, 1990. - С. 83-84.
11. Raksha (FOOT AND MOUTH DISEASE VACCINE BP (Vet)) - URL: https.//www.indimmune.com/livestock-vaccines.pdf (дата обращения 13.01.2015).
12. Официальный сайт MSD Animal Health - URL: http://www.thecattlesite.com/focus/msd-animal-health/1954/msd-anlmal-health-decivac-fmd-doe-from-msd-animal-health (дата обращения 13.01.2015).
13. Официальный сайт Merial - URL: http://www.merial.ph/Swine/Products/biologicals-products/Pages/aftopor.aspx (дата обращения 13.01.2015).
14. Официальный сайт BRILLIANT BIO PHARMA LIMITED - URL: http://shuka.fm.alibaba.com/product/127729792-103481258/FMD_Vaccine.html (дата обращения 13.01.2015).
15. Официальный сайт ФГБУ «ВНИИЗЖ» - URL: http://www.arriah.ru/main/production/price-vaccines/117 (дата обращения 13.01.2015).
16. Пат. РФ 594771, МПК А61K 39/12, Средство для инактивации вирусов при изготовлении противовирусных препаратов/ Н.А. Улупов, А.И. Дудников, П.А. Гембицкий, Д.С. Жук; ВНИЯИ - Заявл. 07.05.1973; опубл. 07.07.93 г.
17. Пат. РФ 2054039, МПК А61K 39/135, Способ очистки и стерилизации культурального вируса ящура/ Т.Н. Лезова, Н.А. Улупов, В.В. Борисов, В.В. Михалишин, А.И. Дудников, П.А. Гембицкий; ВНИЯИ - Заявл. 07.02.1992; опубл. 10.02.1996 г.
18. Авт. свид. СССР 784335, C12Q 1/02, Способ определения качества вирусного сырья / А.Ф. Бондаренко; ВНИЯИ - Заявл. 04.07.1979; опубл. 20.03.2000 г.
19. OIE. Manual of diagnostic tests and vaccines for terrestrial animals - 7th Ed. -, Paris, 2012 - Vol. 1, Chapter 2.1.5. - P. 166-169.
20. Selection of foot-and-mouth disease vaccine strains a review / D.J. Paton, J.F. Valacher, J. Bergman [et al.] // Rev. Sci. Tech. OIE. - 2005. - Vol. 24(3). - P. 981-983.