СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ПРЕДОТВРАЩЕНИЯ ПЕРЕДАЧИ ВИЧ-ИНФЕКЦИИ
Вид РИД
Изобретение
Настоящее изобретение предусматривает создание способов и композиции, приемлемых для использования в медицинской области и, в частности, при лечении вирусных инфекций. В частности, настоящее изобретение относится к использованию способов и композиций для предотвращения передачи инфекционного заболевания, вызываемого вирусом иммунодефицита человека (ВИЧ-инфекции).
Предпосылки к созданию изобретения
Ретровирус, называемый вирусом иммунодефицита человека (ВИЧ), является этиологическим фактором заболевания сложного характера, вызывающим прогрессирующее разрушение иммунной системы (синдром приобретенного иммунодефицита - СПИД) и дегенерацию центральной и периферической нервной системы. С момента появления в начале 80-х годов данного заболевания, представлявшего угрозу для здоровья людей, меры по борьбе с заболеванием или его искоренению в основном были сосредоточены на поиске вариантов лечения заболевания уже после свершившегося факта инфицирования человека.
Использование презервативов обеспечивает существенную степень защиты от заражения ВИЧ-инфекцией при совершении полового акта. Тем не менее, применение презервативов не обеспечивает 100% эффективную защиту против заражения ВИЧ-инфекцией. Более того, пары нередко не используют презервативы. Топическая композиция, которая могла бы быть введена во влагалище или прямую кишку с помощью пены, геля, губки или в иной форме, либо которая могла бы быть топически нанесена на мужские половые органы, во многих случаях была бы предпочтительней по сравнению с презервативами. Более того, профилактическая эффективность презервативов могла бы быть повышена путем включения приемлемого микробицида в смазку, нанесенную па внешнюю поверхность презерватива. Тем не менее, до настоящего времени был достигнут незначительный прогресс в разработке эффективной топической композиции против передачи ВИЧ-инфекции.
При проведении большинства исследований по разработке топических профилактических композиций против ВИЧ-инфекции основное внимание было сосредоточено на использовании поверхностно-активных веществ и буферов, таких как патентованный препарат ноноксинол-9. Поверхностно-активные вещества и детергенты разрушают мембраны микробов и мужских половых клеток путем лизиса и эмульсифицирования. Кремы и гели, содержащие поверхностно-активные вещества, имеют преимущество, заключающееся в их исключительно широких возможностях поражения, в результате чего они способны поразить вирус ВИЧ и вирусы, связанные с другими заболеваниями, передающимися половым путем. Тем не менее, применение поверхностно-активных веществ и буферов в существенной степени ограничено тем что, они могут вызвать повреждение клеточных мембран. Как было продемонстрировано, во влагалище ноноксинол-9 может вызвать утонение вагинальных стенок. В прямой кишке ноноксинол-9 может вызвать шелушение стенок прямой кишки.
Другие исследуемые вирулицидные композиции для их применения в качестве вирулицидов ВИЧ включают каррагинан и другие крупные сульфатные полисахариды, которые приклеиваются к вирусным оболочкам и, возможно, создают защиту клеточных мембран. Было продемонстрировано, что ненуклеозидные ингибиторы обратной транскриптазы вируса иммунодефицита человека также оказывают определенное антивирусное воздействие.
В последнее время появилась информация о том, что учеными был сделан ряд открытий в области биологии, углубляющих наше понимание того, каким образом ВИЧ проникает в организм после полового контакта, которые могли бы привести к созданию профилактических веществ, препятствующих взаимодействию ВИЧ с его целевыми клетками. Указанные открытия, главным образом, относятся к Т-лимфоцитам, моноцитам/макрофагам и дендритным клеткам и указывают на то, что CD4 клеточные рецепторы участвуют в процессе трансмиссии вируса. Например, предполагается, что ВИЧ прочно связывает поверхность дендритных клеток, и когда дендритные клетки представляют микробные антигены CD4+Т-хелперам для стимулирования иммунного ответа, дендритные клетки самопроизвольно передают ВИЧ CD4+Т-клеткам, тем самым способствуя прогрессированию инфекции.
Ряд ученых теоретически допускает на основе указанных открытий, что могут быть разработаны профилактические средства, блокирующие взаимодействие между вирусом и организмом-хозяином человека. Тем не менее, способы, основывающиеся на специфическом взаимодействии ВИЧ и клеток человека, ограничены ввиду того, что пути проникновения инфекции не были полностью определены, и инфекция может проникать в организм различными путями. (Miller, С.J. et al., "Genital Mucosal Transmission of Simian Immunodeficiency Virus: Animal Model for Heterosexual Transmission of Human Immunodeficiency Virus", J. Virol., 63, 4277-4284 (1989); Phillips, D. M. и Bourinbaiar, A. S., "Mechanism of ВИЧ Spread from Lymphocytes to Epithelia", Virology, 186, 261-273 (1992); Phillips, D. M, Tan, X., Pearce-Pratt, R. and Zacharopoulos, V. R., "An Assay for HIV Infection of Cultured Human Cervix-derived Cells", J. Virol. Methods, 52, 1-13 (1995); Ho, J. L. et al., "Neutrophils from Human Immunodeficiency Virus (HlV)-SeronegatiVe Donors Induce HIV Replication from ВИЧ-infected Patients Mononuclear Cells and Cell Lines": An In Vitro Model of HIV Transmission Facilitated by Chlamydia Trachomatis., "J. Exp.Med., 181, 1493-1505 (1995); и Braathen, L.R. & Mork, С.в "HIV infection of Skin Langerhans Cells", в: Skin Langerhans (dendritic) cells in virus infections and AIDS (ed. Becker, Y.) 131-139 (Kluwer Academic Publishers, Boston (1991).)
Работа исследователей по разработке вакцины против ВИЧ также до сих пор не была успешной. Например, вакцинация с использованием инактивированного ВИО (вирус иммунодефицита обезьян) не защищает африканских зеленых мартышек против инфицирования гомологичным вирусом несмотря на сильный иммунный ответ на ВИО.
Как очевидно из вышеуказанного обзора известного уровня техники, до сих пор остаются серьезные нерешенные проблемы в области профилактики и лечения ВИЧ и ВИЧ-инфицирования. Аспект настоящего изобретения состоит в устранении или частичном решении проблемы предшествующего уровня техники путем создания композиций и способов для предотвращения передачи ВИЧ-инфекции.
Обсуждение документов, законодательных документов, материалов, устройств, статей и т.д. включено в настоящее описание изобретения исключительно в целях обеспечения контекста для настоящего изобретения. Не допускается, что любой или все из указанных материалов образуют часть основы известного уровня техники или представляют собой общедоступные сведения в области, относящейся к настоящему изобретению, так как оно существовало до даты приоритета каждого пункта формулы настоящей заявки.
Краткое изложение существа изобретения
В первом аспекте настоящего изобретения предлагается композиция для предотвращения передачи ВИЧ, включающая поликлональные антитела или их фрагменты, способные связываться с белком вирусной оболочки (Env) вируса иммунодефицита человека (ВИЧ) или с его фрагментом. Белок Env или его фрагмент может быть любым белком Env ВИЧ, тем не менее, предпочтительно, чтобы белок Env являлся gpl40. Не ограничивая себя теорией, предполагается, что действие поликлональных антител обеспечивает связывание вирионов ВИЧ, тем самым ингибируя перемещение ВИЧ через клетки, которые образуют барьерный слой на поверхностях слизистой оболочки. В одном примере осуществления настоящего изобретения композиция способна предотвратить инфицирование клетки вирусом иммунодефицита человека.
В одном примере осуществления настоящего изобретения белок Env или его фрагмент является олигомером gp140. Олигомер может содержать тримеры gpl40, димеры и мономеры. Олигомеры могут быть очищены от супернатанта трансфицированных клеток HeLa и 293, например, методом аффинной хроматографии с использованием лектина чечевицы или методом гель-фильтрации. Белок Env или его фрагмент может являться белком (Env) вирусной оболочки штамма клады А, клады В или клады С ВИЧ или его фрагментом.
В одном примере осуществления настоящего изобретения поликлональные антитела или их фрагменты способны связываться с белком Env из гетерологичной клады ВИЧ или гетерологичного штамма ВИЧ.
В одном примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, индуцированные против gpl40 клады В, которые способны связываться с гетерологичной кладой А, кладой В или кладой С gpl40.
В одном примере осуществления настоящего изобретения поликлональные антитела или их фрагменты конкурируют с моноклональным антителом Ab b12, связывающимся с gpl40.
В одном примере осуществления настоящего изобретения поликлональные антитела или их фрагменты конкурируют с нейтрализующими антителами.
Антитело или его фрагмент или его функциональный эквивалент может быть выработано путем иммунизации животного с использованием белка (Env) вирусной оболочки ВИЧ или его фрагмента. Животное может быть иммунизировано gpl40, рекомбинантным gpl40 или олигомерным gpl40. Рекомбинантный gpl40 не может быть получен из культуры вириона. Животное может быть иммунизировано с использованием белка (Env) вирусной оболочки ВИЧ или его фрагмента и адъювантом. В одном примере осуществления настоящего изобретения адъювантом является вода в масляной эмульсии.
Животное может быть иммунизировано gpl40 клады В, и выработанные антитела способны связываться с gpl40 гетерологичной клады А, клады В или клады С.
Животное может быть иммунизировано gpl40 клады В, и выработанные антитела конкурируют с моноклональным антителом Ab b12, связывающимся с gpl40.
Животное может быть иммунизировано gpl40 клады В, и выработанные антитела способны связываться с gpl40 гетерологичной клады А, клады В или клады С, при этом выработанные антитела конкурируют с моноклональным антителом Ab b12, связывающимся с gp140.
Антитело или его фрагмент или его функциональный эквивалент может присутствовать в птичьем яйце или может быть получен из птичьего яйца либо может присутствовать в гипериммунном молозиве или гипериммунном молоке животного или получено из них. Животным может являться корова.
Композиция может быть составлена для местного применения, и в некоторых примерах осуществления настоящего изобретения композиция составлена для вагинального или ректального введения. Композиция может быть выполнена в виде геля или в виде крема, мази, лосьона или пены для топического применения.
В некоторых примерах осуществления настоящего изобретения композиция может дополнительно включать фармацевтически приемлемое вспомогательное вещество, лубрикант или антивирусное средство.
Настоящее изобретение также предусматривает использование композиции настоящего изобретения для изготовления лекарственного препарата, предназначенного для лечения и (или) профилактики передачи ВИЧ.
Настоящее изобретение также предусматривает создание способа изготовления композиции для предотвращения передачи ВИЧ, включающий иммунизацию животного белком (Env) вирусной оболочки ВИЧ или его фрагментом и получение гипериммунного молозива от иммунизированного животного.
Настоящее изобретение также предусматривает создание композиции для предотвращения передачи ВИЧ, изготовленной с помощью способа, включающего иммунизацию животного белком (Env) вирусной оболочки ВИЧ или его фрагментом и получение гипериммунного молока от иммунизированного животного.
Настоящее изобретение также предусматривает создание способа для предотвращения инфицирования ВИЧ, включающего:
формирование гипериммунного молозива или гипериммунного молока путем иммунизации коров; и
введение гипериммунного молозива или гипериммунного молока субъекту, при котором этап иммунизации коров для выработки гипериммунного молозива или гипериммунного молока включает вакцинацию белком вирусной оболочки (Env) вируса иммунодефицита человека (ВИЧ) или его фрагментом. Белок Env или его фрагмент может быть любым белком Env ВИЧ, тем не менее, предпочтительным белком Env является gp140.
Также предусматривается создание способа для предотвращения передачи ВИЧ-инфекции, включающего введение субъекту поликлональных антител или их фрагментов, способных связываться с белком вирусной оболочки (Env) вируса иммунодефицита человека (ВИЧ) или его фрагментом. Белок Env или его фрагмент может быть любым белком Env ВИЧ, тем не менее, предпочтительным белком Env является gpl40.
В одном примере осуществления настоящего изобретения белок Env или его фрагмент является олигомером gpl40. Олигомер может включать тримеры, димеры и мономеры gpl40. Олигомеры могут быть очищены от супернатанта трансфицированных клеток HeLa и 293, например, методом аффинной хроматографии с использованием лектина чечевицы и методом гель-фильтрации. Белок Env или его фрагмент может являться белком (Env) вирусной оболочки штамма клады Л, клады В или клады С ВИЧ или его фрагментом.
В одном примере осуществления настоящего изобретения поликлональные антитела или их фрагменты способны связываться с белком Env из гетерологичной клады ВИЧ или гетерологичного штамма ВИЧ.
Антитело или его фрагмент или его функциональный эквивалент может быть выработано путем иммунизации животного с использованием белка (Env) вирусной оболочки ВИЧ или его фрагмента. Животное может быть иммунизировано gpl40, рекомбинантным gpl40 или олигомерным gpl40. Рекомбинантный gpl40 не может быть получен из культуры вириона. Животное может быть иммунизировано с использованием белка (Env) вирусной оболочки ВИЧ или его фрагмента и адъювантом. В одном примере осуществления настоящего изобретения адъювантом является вода в масляной эмульсии.
Антитело или его фрагмент или его функциональный эквивалент может присутствовать в птичьем яйце или может быть получен из птичьего яйца либо может присутствовать в гипериммунном молозиве или гипериммунном молоке животного или получено из них. Животным может являться корова.
Композиция может быть составлена для местного применения, и в некоторых примерах осуществления настоящего изобретения композиция составлена для вагинального или ректального введения. Композиция может быть выполнена в виде геля или в виде крема, мази, лосьона или пены для топического применения.
Краткое описание чертежей
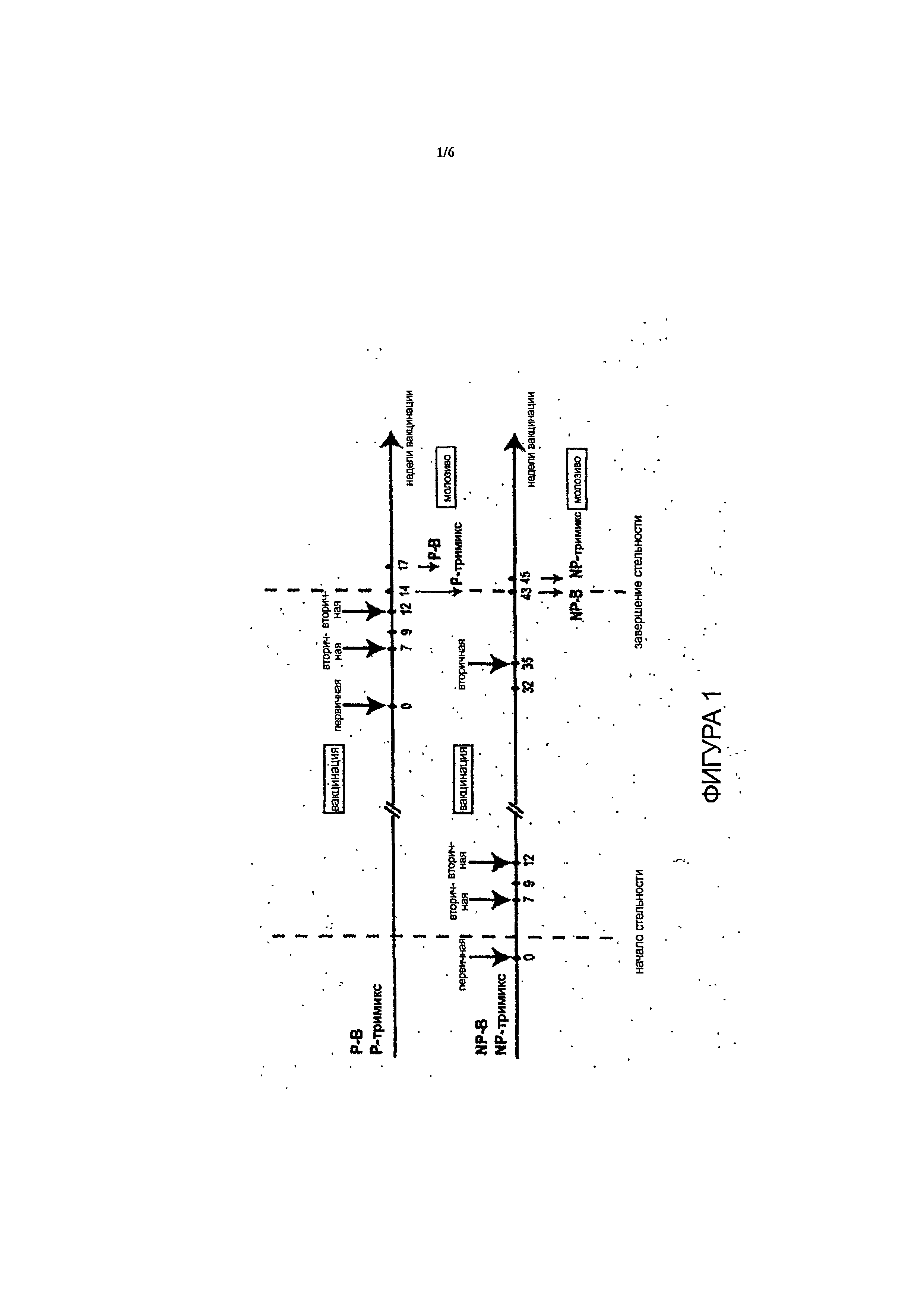
Фиг.1 - схема вакцинации gpl40.
Фиг.2 - схема вакцинации gpl40.
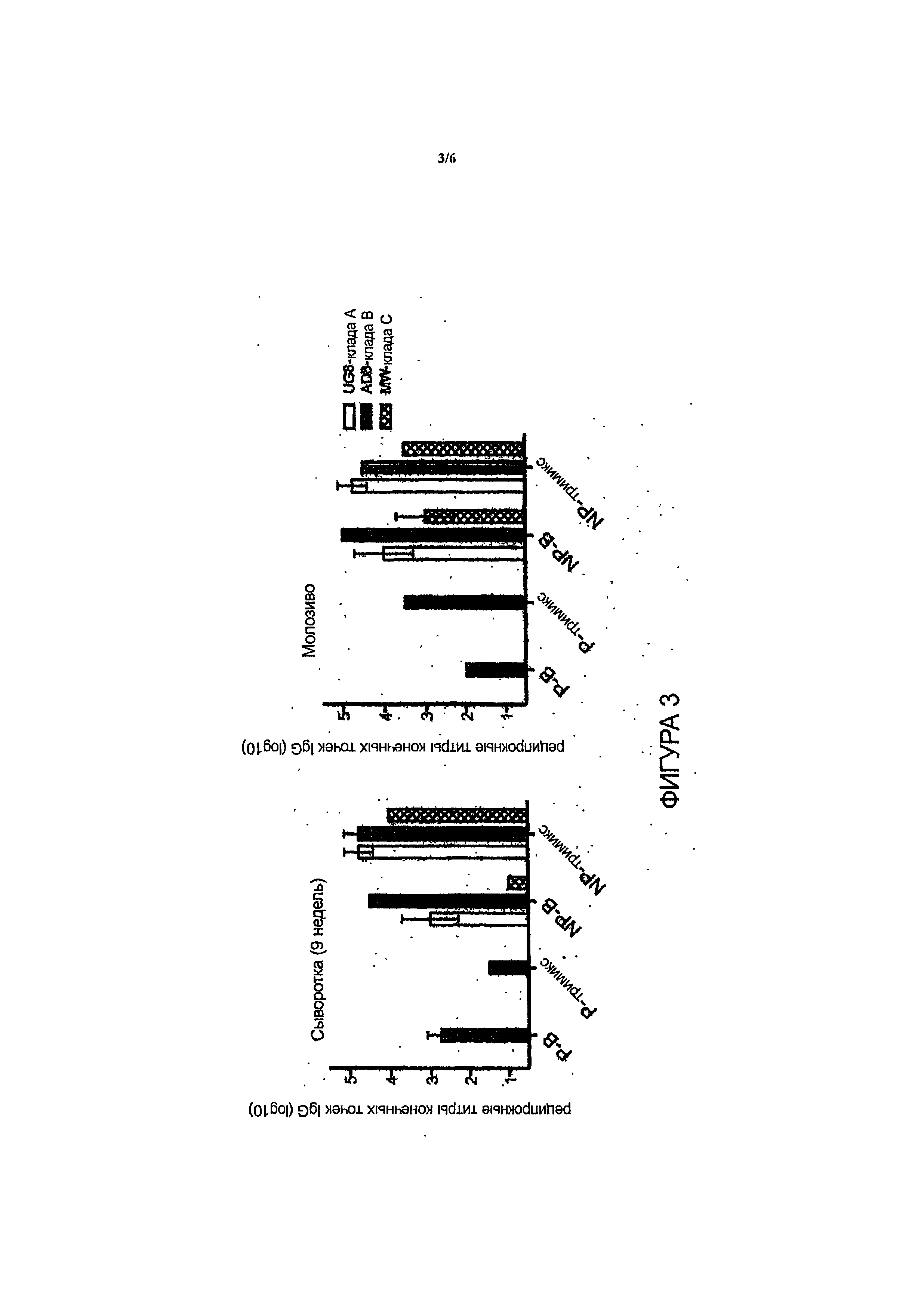
Фиг.3 - IgG из сыворотки или молозива связывается с gpl40 Env клады А, В и С.
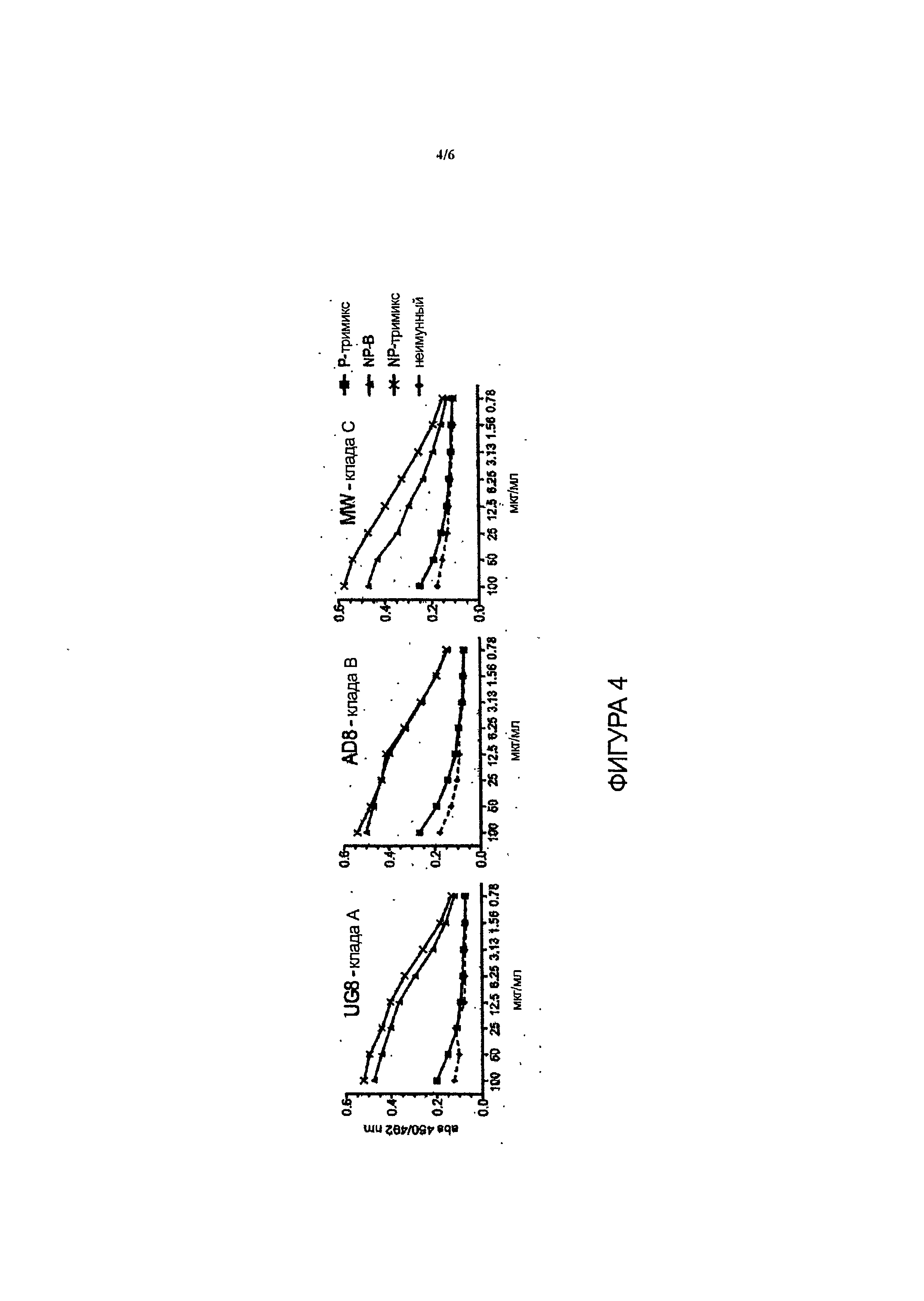
Фиг.4 - очищенный IgG молозива от нестельных коров задерживает связывание с gp140 Env и демонстрирует активность гетерологического связывания.
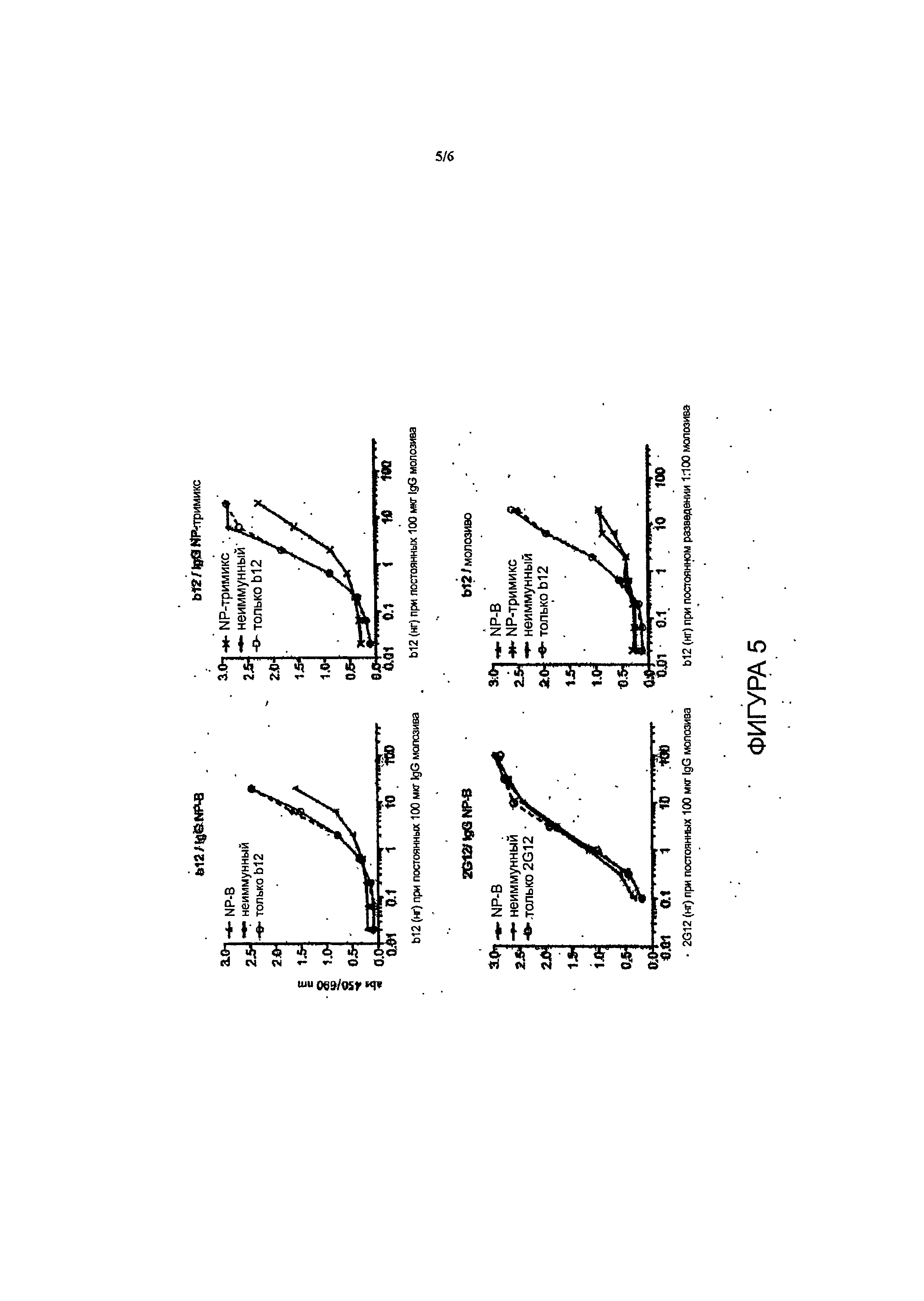
Фиг.5 - бычий IgG блокирует связывание моноклонального Ab b12 с сайтом связывания CD4 gp140.
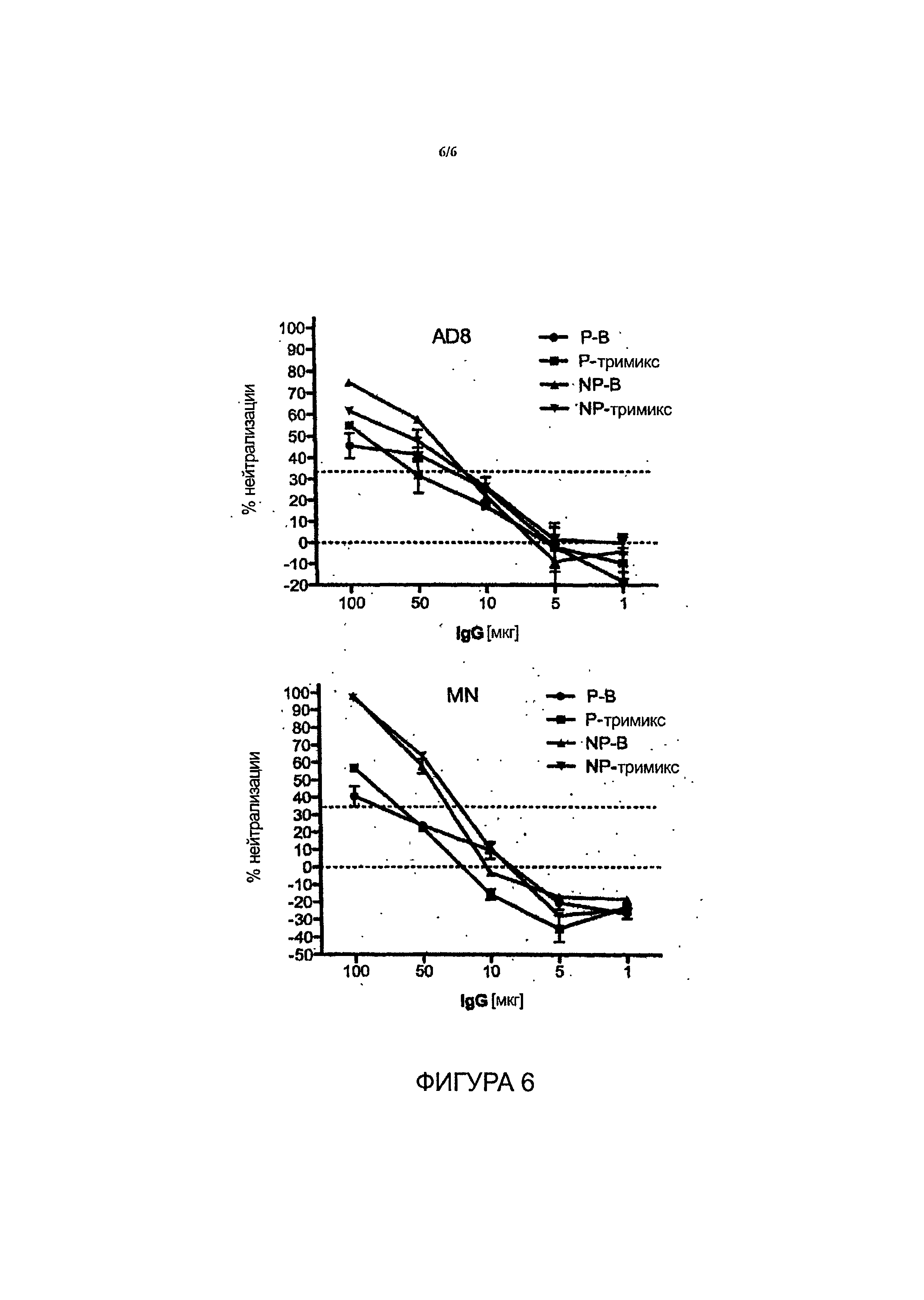
Фиг.6 - молозиво от стельных коров, вакцинированных gpl40 клад А/В/С и от нестельных коров, вакцинированных gpl40 клады В, проявляет широкую активность гетерологической нейтрализации.
Подробное описание изобретения
Настоящее изобретение основывается частично на открытии, заключающимся в том, что высокоспецифичные антитела молозива, связывающиеся с белком Env ВИЧ, могут быть выработаны путем вакцинации стельных животных. Таким образом, в первом аспекте настоящего изобретения предусматривается создание композиции для предотвращения передачи ВИЧ-инфекции, включающей поликлональные антитела или их фрагменты, способные связываться с белком (Env) вирусной оболочки вируса иммунодефицита человека или его фрагментом. Белок Env или его фрагмент может быть любым белком Env ВИЧ, тем не менее, предпочтительно, чтобы белок Env являлся gpl40. Не ограничивая себя теорией, предполагается, что действие поликлональных антител обеспечивает связывание вирионов ВИЧ, тем самым ингибируя перемещение ВИЧ через клетки, которые образуют барьерный слой на поверхностях слизистой оболочки. В одном примере осуществления настоящего изобретения композиция способна предотвратить инфицирование клетки вирусом иммунодефицита человека. В другом примере осуществления настоящего изобретения композиция способна ингибировать или предотвратить перемещение ВИЧ через эпителиальные клетки, именно такие клетки, которые образуют барьерный слой на поверхностях слизистой оболочки. Указанный подход к составлению композиций и способ для предотвращения передачи ВИЧ отличаются от подходов известного уровня техники и, безусловно, противоречат общей идеи известного уровня техники, существовавшего до настоящего изобретения.
Термин "предотвращение передачи" в соответствии со значением, используемым в настоящем контексте, в целом относится к полному предотвращению, а также частичному предотвращению передачи ВИЧ. Полное предотвращение указывает па то, что вирус полностью не в состоянии успешно инфицировать и (или) реплицироваться и (или) далее инфицировать другие клетки. Полное предотвращение может быть определено с помощью ряда методов на клеточном уровне и (или) на уровне всего организма квалифицированным практикующим врачом. Один из методов определения полного предотвращения заключается в том, что из клетки-хозяина невозможно получить инфекционный ВИЧ. Другой такой метод заключается в определении непроникновения ВИЧ в клетку-хозяина. На уровне всего организма могут быть использованы стандартные методы для проведения анализа на инфицирование ВИЧ (например, проведение анализа на наличие антител к ВИЧ в организме человека). Частичное предотвращение относится к поддающемуся измерению, статистически значимому снижению способности ВИЧ инфицировать и (или) реплицироваться и (или) далее инфицировать другие клетки по сравнению с соответствующей контрольной группой, которая не была подвергнута лечению, описание которого приведено в настоящем патенте. Одним из примеров является требование в отношении более высоких уровней воздействия или более длительных сроков воздействия ВИЧ для успешного инфицирования.
Термин "способный связываться" в соответствии со значением, используемым в настоящем контексте, обычно относится к антителу, которое связывается с gpl40 клады ВИЧ, например, к антителу, описание которого приведено в настоящем патенте. Связывание с gpl40 клады ВИЧ может быть продемонстрировано в соответствии с описанием в приведенных ниже примерах. В приведенных примерах осуществления настоящего изобретения антитела или их фрагменты связываются с gpl40 штамма или клады ВИЧ, против которого продуцированы нейтрализующие ВИЧ антитела, а также связываются с gpl40 штамма или клады ВИЧ, против которого не продуцированы нейтрализующие ВИЧ антитела. В других примерах осуществления настоящего изобретения антитела или их фрагменты связываются с gpl40 клады ВИЧ, против которого продуцированы нейтрализующие ВИЧ антитела, и также связываются с gpl40 гетерелогичной клады ВИЧ.
Термин "клада (-ы)" в соответствии со значением, используемым в настоящем контексте, обычно охватывает подтипы или рекомбинантные формы ВИЧ.
В предыдущей работе было указано о необходимости создания усовершенствованных композиций, обеспечивающих защиту от ВИЧ и (или) предотвращение передачи ВИЧ. В частности, существует необходимость в создании композиций, защищающих от ВИЧ, не нарушая целостность внутреннего защитного поверхностного слоя влагалища или прямой кишки. Работы в этом направлении были сосредоточены на прививочном иммунитете (например, вакцины), тем не менее, при использовании антител против ВИЧ в композициях против ВИЧ указанные антитела продуцируют с использованием антигена ВИЧ, в результате чего возникли бы сложности с получением разрешения регуляторного органа на их использование ввиду риска инфицирования и технологических проблем при их получении в большом количестве. В противоположность идеям известного уровня техники настоящее изобретение основывается на формировании пассивного гетероиммунитета, при котором антитела, продуцированные в конкретном организме, используют для защиты другого организма, обычно другого вида.
Внеклеточная часть вируса Env известна как gpl40, который содержит как gpl20, так и усеченный gp41 (отсутствие трансмембранных доменов и цитоплазмических хвостов). В одном примере осуществления настоящего изобретения белок Env или его фрагмент является олигомером gpl40. Олигомер может включать тримеры, димеры и мономеры gpl40. Олигомеры могут быть очищены от супернатанта трансфицированных клеток (например, HeLa и 293), например, методом аффинной хроматографии с использованием лектина чечевицы и методом гель фильтрации. Белок Env или его фрагмент может являться белком вирусной оболочки (Env) штамма клады А, клады В или клады С ВИЧ или его фрагментом.
В родственной заявке (PCT/AU2009/001218, инкорпорированной в настоящее описание путем отсылки), заявители продемонстрировали, что существуют различия Envs у штаммов ВИЧ-1.
В одном примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, способные связываться с gpl40 клады А, клады В или клады С.
В другом примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, способные связываться с gpl40 клады А и клады В.
В другом примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, способные связываться с gpl40 клады В и клады С.
В другом примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, способные связываться с gpl40 клады А и клады С.
В другом примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, способные связываться с gpl40 клады А, клады В и клады С.
В одном примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, продуцированные против gpl40 клады В, способные связываться с гетерологичным gp140 клады А, клады В или клады С.
В одном примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, которые конкурируют с моноклональным антителом Ab b12, связывающимся с gpl40.
В другом примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, продуцированные против gpl40 клады В, которые способны связываться с гетерологичным gpl40 клады А, клады В или клады С, в которой антитела или их фрагменты конкурируют с моноклональным антителом Ab b12, связывающимся с gpl40.
Заявители продемонстрировали молозиво, и IgG, очищенный от молозива, полученного от коров, вакцинированных олигомерами gpl40 Env ВИЧ одной клады, может связываться с gpl40 Env ВИЧ другой клады, несмотря на разнообразие в последовательности Env и гликозилирование штаммов ВИЧ. Кроме того, заявители продемонстрировали молозиво, и IgG, очищенный от молозива, полученного от коров, вакцинированных олигомерами gpl40 Env ВИЧ одной клады, может связываться с gpl 40 и нейтрализовать ВИЧ другой клады, несмотря на разнообразие в последовательности Env и гликозилирование штаммов ВИЧ.
Молочные коровы были вакцинированы во втором триместре стельности высококачественным растворимым олигомерным ВИЧ-1 Env (gpl40) для продуцирования молозива, содержащего высокие уровни ВИЧ-1 Env-специфических поликлональных нейтрализующих антител для использования в качестве композиции, ингибирующей трансмиссию ВИЧ. Изобретатели продемонстрировали, что анти-ВИЧ Env IgG синергизируется с врожденными антивирусными компонентами в бычьем молозиве для агрессивной нейтрализации ВИЧ-1.
Таким образом, настоящее изобретение предусматривает преимущество, заключающееся в получении килограммовых количеств бычьего IgG. Не ограничиваясь теорией, предполагается, что композиции настоящего изобретения обладают высокой способностью нейтрализовать ВИЧ и тем самым обеззараживать вирус для восприимчивых клеток in vitro.
В одном примере осуществления настоящего изобретения поликлональные антитела или их фрагменты являются нейтрализующими антителами.
Термин "нейтрализация" в соответствии со значением, используемым в настоящем контексте, обычно относится к антителам или их фрагментам, способным связываться с молекулой настоящего изобретения и препятствовать ее биологической активности. Термин включает антитела или их фрагменты, блокирующие вирус, например ВИЧ, и препятствующие инфицированию клетки, например, путем блокирования gpl40, связывающегося с CD4 на клетке.
Антитело или его фрагмент или его функциональный эквивалент может быть продуцировано путем иммунизации животного белком вирусной оболочки (Env) ВИЧ или его фрагментом.
Животное может быть иммунизировано gpl40, рекомбинантным gpl40 или олигомерным gpl40.
Животное может быть иммунизировано gpl40 клады В и продуцированными антителами, способными связываться с гетерологичным gpl40 клады А, клады В или клады С.
Животное может быть иммунизировано gpl40 клады В и продуцированными антителами, способными связываться с гетерологичным gpl40 клады А, клады В или клады С.
Животное может быть иммунизировано gpl40 клады В, и продуцированные антитела конкурируют с моноклональным антителом Ab b12, связывающимся с gpl40.
Животное может быть иммунизировано gpl40 клады В и продуцированными антителами, способными связываться с гетерологичным gpl40 клады А, клады В или клады С, при этом продуцированные антитела конкурируют с моноклональным антителом Ab b12, связывающимся с gpl40.
В одном примере осуществления настоящего изобретения продуцированные поликлональные антитела или их фрагменты являются нейтрализующими антителами.
В одном примере осуществления настоящего изобретения продуцированные поликлональные антитела или их фрагменты блокируют связывание gpl40 с CD4 на клетке.
В одном примере осуществления настоящего изобретения рекомбинантный gpl40 не может быть получен из культуры вириона.
Env полипептид, приемлемый для генерирования иммунного ответа, является Env полипептидом, обладающим, по меньшей мере, 90%, 95%, 96%, 97%, 98%, 99% или 100% аминокислотной идентичностью с gpl40. gpl40 содержит фрагмент gpl20 из данного штамма ВИЧ и фрагмент gp41 из того же штамма ВИЧ, при этом растворимый фрагмент gp41 не имеет трансмембранного домена. Полипептиды gp140, способные формировать олигомерные структуры, могут быть экспрессированы из конструкции. Таким образом, образуется нуклеотидная последовательность, кодирующая полипептид gpl40, и экспрессионная конструкция, включающая нуклеотидную последовательность, кодирующую полипептид gpl40. Экспрессионная конструкция может являться конструкцией для транзиторного использования или может быть в большей степени приемлема для стабильной трансфекции и сохранения внутри клетки-мишени либо в виде эписомально реплицирующей конструкции либо в интегрированной форме.
В одном примере осуществления настоящего изобретения предусматривается создание полипептида gpl40 и экспрессионной конструкции, экспрессирующей полипептид gpl40. В другом примере осуществления настоящего изобретения предусматривается создание гликозилированного полипептида gpl40, который был изготовлен или экспрессирован в экспрессионной системе, дополняющей нативную клеточную гликозиляцию.
Рекомбинантный gp140 может быть продуцирован с использованием псевдовирусов, несущих Env из различных клад/штаммов, использующих векторы экспрессии, приведенные в таблице 1.
gpl40 может быть очищен с использованием ряда различных методов. Например, содержащие gpl40 супернатанты тканевой культуры могут быть пропущены через аффинные колонки с лектином чечевицы, благодаря чему опосредуется захват гликопротеинов, в том числе gpl 40, за счет сродства лектина чечевицы к углеводу. После промывки проводится конкурентное элюирование gpl40 из колонки путем добавления 0,5М метил-Э-маннопиранозида (Sigma). Выход продукта, полученный с помощью указанной системы, в отношении других штаммов gpl40 находился в пределах от 0,4 до 1,0 миллиграмма на 100 миллилитров супернатанта тканевой культуры. Далее элюат может подвергнуться концентрированию и дополнительной очистке методом гель фильтрации, путем пропускания через колонку Superdex 200. gpl40 очищают от супернатантов тканевой культуры в олигомерной форме.
Растворимые Env gpl40 олигомеры были получены из штаммов ВИЧ-1 клад А, В и С из клеток HeLa и (или) 293Т и очищены методом аффинной хроматографии с использованием лектина чечевицы или методом гель-фильтрационной хроматографии.
Четыре коровы (две стельные во втором семестре и две первоначально нестельные) были вакцинированы 100 мкг очищенного олигомера ВИЧ-1 Env gpl40, составленного с адъювантом Montanide. Две группы из двух коров (одна стельная и одна нестельная) были вакцинированы Env gpl40 (UG8, AD8 и MW) (называемые «тримиксами»), либо только клады В (AD8), либо равными количествами (33,33 мкг) клад А, В и С. Всем четырем коровам были сделаны, по меньшей мере, три прививки, в то время как последнюю прививку сделали за четыре недели до отела. Все четыре коровы были сероконвертированы в течение девяти недель. Реципрокные титры конечных точек сыворотки IgG составляли приблизительно 1×102,5 для стельных коров и приблизительно lxlO5 для нестельных коров и были определены с помощью вновь разработанного специфического иммуносорбентного ферментного анализа Env gpl40 ВИЧ-1 анти-IgG. Нагнетание антител IgG сыворотки в молозиво приблизительно за четыре недели до отела позволило найти объяснение ожидаемого низкого титра сыворотки IgG у стельных коров.
У всех стельных коров, которым была сделана прививка, было собрано и пастеризовано ВИЧ-иммунное бычье молозиво после отела, в результате чего были обнаружены относительно низкие ответы с реципрокными титрами IgG<102 (вакцинирование кладой В) и 1×104,5 (вакцинирование тримиксом). Реципрокный титр IgG молозива коров, вакцинированных до стельности, составил 105 (вакцинирование кладой В) и 104'5 (вакцинирование тримиксом). Результаты вестерн-блоттинг анализа подтвердили, что IgG молозива всех четырех коров оказалось специфичным против gpl40 Env ВИЧ-1. Был проведен тест нефракционировапного молозива на нейтрализующую активность при проведении анализа Env-псевдотипированного вируса-репортера ВИЧ-1.
Короче говоря, анализ Env-псевдотипированного вируса-репортера позволяет обнаружить наличие вирус-нейтрализующих антител к белку оболочки ВИЧ-1. Частицы псевдовируса репортера усиленного зеленого флуоресцентного белка (EGFP), экспрессирующие ВИЧ-1 Env, полученный предпочтительно из штаммов/клад, используют для инфицирования клеток-мишеней Env-зависимым образом. При проведении одного анализа частицы псевдовируса репортера инкубировали в течение 1 часа до добавления клеток-мишеней (Cf2th-CD4/CCR5/CXCR4; CF2 клетки) при 2×104/лунку в 96-луночной плашке. После 2-часовой спинокуляции при 1200-х г при комнатной температуре остаточный псевдовирус и антитело были удалены, и к клеткам добавили свежую среду. Спустя два дня, был проведен анализ клеток-мишеней на экспрессию усиленного зеленого флуоресцентного белка путем флуоресцентно-активированного клеточного сортинга (FACS). При наличии молозива или IgG молозива, продуцированного против растворимых олигомеров ВИЧ-1 Env gpl40, степени снижения уровня инфекции был определен путем измерения процентного сокращения положительных клеток усиленного зеленого флуоресцентного белка (EGFP). Процент нейтрализации представляет собой соотношение между уровнями инфекции, наблюдаемыми в сыворотке мышей до вакцинации (сыворотка крови, полученная до иммунизации) и в сыворотке мышей 2 недели спустя после буст-вакцинации белком.
Было проведено тестирование вирусов псевдотипа клады А/Е, клады В и клады С, включающих стандартизованную панель Национального института здравоохранения в отношении вирусов клад В и С (всего n=27) и их сравнение с неиммунным бычьим молозивом, которое уже обладало естественной блокирующей инфекцию активностью ввиду наличия лактоферрина и иных биоактивных пептидов. Нефракционированное молозиво от коров, вакцинированных тримиксом в период стельности, проявило высокую степень нейтрализации до 50% в отношении всех псевдовирусов клады В (n=15), а также в отношении большинства псевдовирусов клады С (n=l1) и клады А/Е (n=1) при разведении в отношении 1:16. Первая вакцинированная кладой В корова оказалась низкоотвечающей особью, однако недавно от обеих коров, вакцинированных до периода стельности и имеющих телят, был получен высокий ответ. Вплоть до указанного момента наблюдалась широкая нейтрализация в отношении коровы, вакцинированной кладой В, у которой проявилась 50-80% нейтрализация в отношении псевдовирусов (n=9) (разведение в отношении 1:16) для клады В (n=12) и клады С (таблица 1). IgG Abs от первой пары коров подвергся очистке от молозива, и нейтрализующая активность сохранялась для очищенного IgG приблизительно до 50% нейтрализации в отношении тримикс-IgG по сравнению с неиммунным IgG при 500 мкг/мл. Результаты профиля нейтрализации двух образцов гипериммунного бычьего молозива gpl40 Env ВИЧ в отношении псевдовирусов различных клад приведены в таблице 1 (см. Пример 2). Указанный результат явился неожиданным, так как не ожидалось, что антитела, продуцированные против gpl40, будут прочно связываться с вирусами различных клад и в значительной степени нейтрализовать их, так как существуют значительные эпитопные различия между gpl40 различных клад.
Вышеизложенные результаты являются убедительным доводом в пользу указанного способа продуцирования высоких уровней нейтрализующих антител и нейтрализующих антител, способных связываться с гетерологичным и штаммами ВИЧ. Таким образом, в одном примере осуществления настоящего изобретения поликлональные антитела или их фрагменты способны связываться с белком Env из гетерологичной клады ВИЧ или гетерологичного штамма ВИЧ.
В одном примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, способные связываться с gpl40 клады А, клады В или клады С.
В другом примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, способные связываться с gpl40 клады А и клады В.
В другом примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, способные связываться с gpl40 клады В и клады С.
В другом примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, способные связываться с gpl40 клады А и клады С.
В другом примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, способные связываться с gpl40 клады А, клады В и клады С.
В другом примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, продуцированные против gpl4 клады В, способные связываться с гетерологичным gpl40 клады А, клады В или клады С.
В другом примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, конкурирующие с моноклональным антителом Ab b12, связывающимся с to gpl40.
В другом примере осуществления настоящего изобретения поликлональные антитела или их фрагменты являются нейтрализующими антителами.
В другом примере осуществления настоящего изобретения композиция включает поликлональные антитела или их фрагменты, продуцированные против gpl40 клады В, способные связываться с гетерологичным gpl40 клады А, клады В или клады С, в котором поликлональные антитела или их фрагменты конкурируют с моноклональным антителом Ab b12, связывающимся с gpl40.
Антитело или его фрагмент или его функциональный эквивалент может присутствовать в птичьем яйце или может быть получен из птичьего яйца либо может присутствовать в гипериммунном молозиве или гипериммунном молоке животного или получено из них. Животным может являться корова.
Способы получения гипериммунной сыворотки, молока, молозива и т.д. известны в данной области техники.
Способ получения гипериммунного материала может включать этап очистки белка Env от других потенциально иммуногенных молекул. Например, белки Env могут быть отделены с использованием таких способов как высокоскоростное и низкоскоростное центрифугирование, как вариант с использованием градиентов, образованных за счет использования сахарозы, перколла, цезия и т.д. Также могут быть применимы такие хроматографические методы, как эксклюзионная хроматография размеров, аффинная хроматография, высокоэффективная жидкостная хроматография, обращенно-фазная хроматография и т.д. Электрофоретические методы (например, капиллярный электрофорез), методы фильтрации (например, фильтрование тангенциальным потоком), методы разделения (например, осаждение белка) являются дополнительными примерами эффективных методов. Хронически инфицированные клеточные линии могут быть созданы путем инфицирования клеток, например, 6D5 клеток (субклон клеточной линии HUT78) вирусом иммунодефицита человека. Радиоиммунопреципитационный анализ используют для изучения того факта, что клеточная линия секретирует Env в среду. Далее белок Env может быть очищен от бессывороточной кондиционированной среды методом аффинной хроматографии с использованием мышиных MAbs к белку Env.
Для продуцирования гипериммунного материала белок Env (либо очищенный, либо нет) вводят животному обычно инъекционно (например, внутримышечно, подкожно, интраперитонеально или внутривенно). Белок Env может быть скомбинирован с адъювантом для повышения иммунного ответа, генерируемого животным.
Таким образом, животное может быть иммунизировано белком вирусной оболочки (Env) ВИЧ или его фрагментом и адъювантом. В одном примере осуществления настоящего изобретения адъювантом является вода в масляной эмульсии.
Специалистам в данной области техники известны многие потенциально используемые адъюванты, такие как полный адъювант Фрейнда, квасцы и сквален. Адъюванты, которые могут быть использованы в композициях настоящего изобретения, включают без ограничения масляные эмульсии, композиции, приемлемые для использования в качестве адъювантов в настоящем изобретении включают эмульсии масло в воде и эмульсии вода в масле, кроме того, могут быть использованы полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA). Предпочтительно могут быть использованы адъюванты марок Montanide (например, MONTANIDE ISA 50V, MONTANIDE ISA 206 и MONTANIDE IMS 1312). Указанные адъюванты являются композициями масляных адъювантов маннид олеата и минерального масла или наночастиц на водной основе в сочетании с растворимыми иммуностимулирующим средством.
Адъюванты, приемлемые для использования в настоящем изобретении включают бактериальные и микробные производные, такие как производные энтеробактериального липополисахарида, производные липида А, иммуностимулирующие олигонулкеотиды, АДФ - рибозилированные токсины и их детоксифицированные производные.
Животному может быть введена доза Env с интервалами в течение периода, составляющего несколько дней недель или месяцев. По завершению режима иммунизации собирают гипериммунный материал (такой как кровь, молоко или молозиво). Антитела в гипериммунном материале могут быть собраны с использованием любого приемлемого способа, в том числе выше приведенного способа.
В одном примере осуществления настоящего изобретения композиция включает антитела из молозива или экстракта молозива, дополнительно отличающегося тем, что молозиво обогащено анти-Env антителами по сравнению с молозивом, полученным без вакцинации.
В одном примере осуществления способа настоящего изобретения поликлональные антитела получают из гипериммунного материала. Гипериммунный материал обогащен по сравнению с соответствующим материалом, который был получен без введения антигена, о котором идет речь, в организм животного.
Животное, используемое для продуцирования гипериммунного материала, может быть любым приемлемым животным, в том числе человеком. Тем не менее, ввиду того, что человеческое молоко может содержать потенциально трансмиссивные патогены человека, одна форма способа предусматривает, что антитело не является антителом человеческого происхождения. В любом случае животные, вырабатывающие большое количество молока, являются предпочтительными. В этом отношении жвачные (и, в частности, коровы) являются животными, приемлемыми для генерирования гипериммунного материала.
В одном примере осуществления способа "гипериммунный материал" является получаемым из организма молочных животных гипериммунным материалом, например, молоком, в частности молозивным молоком (молозивом) и т.д., который насыщен антителами или их фрагментами и который имеет животное происхождение. Гипериммунный молочный предпочтительно является гипериммунным молозивом.
В другом примере осуществления настоящего изобретения гипериммунный материал получают из птичьих яиц. Подтип иммуноглобулина, известный как IgY, может быть легко экстрагирован из желтка. Обычно желток сначала обезжиривают и IgY выделяют с использованием способов, идентичных или аналогичных способам, используемым для обезжиривания молока.
Термин "молозиво" в соответствии со значением, используемым в настоящем контексте, включает молозивное молоко; переработанное молозивное молоко, такое как молозивное молоко, переработанное для частичного или полного удаления одного или нескольких жиров, продуктов распада клеток, лактозы и казеина; и молозивное молоко или переработанное молозивное молоко, высушенное, например, методом сублимационной сушки, распылительной сушки иными методами сушки, известными в данной области техники. Молозивное молоко обычно получают от млекопитающего, такого как корова, в течение пяти дней после отела. Молозиво млекопитающего предпочтительно является бычьим молозивом, сохранившимся с 4-го дня после отела, более предпочтительно бычьим молозивом, сохранившимся со 2-го дня после отела, еще более предпочтительно бычьим молозивом, сохранившимся с первого дня после отела, и наиболее предпочтительно бычье молозиво, сохранившееся с первой дойки после отела.
Молозиво, полученное от коровы, предпочтительно содержит, по меньшей мере, 4% общего белка (весовой %), более предпочтительно 5%, более предпочтительно, по меньшей мере, 8%, более предпочтительно, по меньшей мере, 10%.
Отношение IgG к общему белку молозива, полученного от коровы, составляет, по меньшей мере, 10%, более предпочтительно 20%.
Гипериммунный молочный материал предпочтительно содержит, по меньшей мере, 3 г на килограмм продукта, который является IgG, направленным против Env, или эквивалентную молярную концентрацию анти-Env антитела. Например, гипериммунный материал может содержать, по меньшей мере, 5 г, по меньшей мере, 10 г или, по меньшей мере, 15 г анти-Env антитела на кг гипериммунного материала на основе сухого веса компонентов. Верхний предел диапазона концентрации антител зависит от таких факторов, как доза, состояние заболевания и состояние здоровья пациента. Гипериммунный материал может, например, содержать не более 80 г, не более 60 г, не более 50 г или не более 40 г анти-Env антитела на 1 кг гипериммунного материала на основе сухого веса компонентов.
В одном примере осуществления способа поликлональные антитела вводят субъекту в виде композиции. В одном примере осуществления настоящего изобретения композиция может включать носитель, смешанный с лигандом до введения, например, путем перемешивания композиции гипериммунного молозива от иммунизированных коров, или одного или нескольких его переработанных компонентов с известными пищевыми продуктами и (или) фармацевтически приемлемыми вспомогательными веществами. Отношение обогащенного продукта к известному молочному материалу от невакцинированных животных может, например, составлять, по меньшей мере, 4, по меньшей мере, 10 при проведении сравнительного анализа ELISA.
В другом примере осуществления настоящего изобретения часть или все из антител, специфических для Env, экстрагируют из молозива и используют при приготовлении композиции для введения.
В одном примере осуществления настоящего изобретения гипериммунный материал связывает Env, полученный из штамма ВИЧ-1 клады А, клады В или клады С. Гипериммунный материал предпочтительно связывает, по меньшей мере, две из вышеуказанных, более предпочтительно, по меньшей мере, 3 из клад. Степень обогащения в материале, выбранным из антител, способных связываться с Env, может быть, по меньшей мере, в 4 раза, например, по меньшей мере, в 10 раз больше уровня, обнаруженного в соответствующих невакцинированных животных, по отношению к каждой из молекул Env в соответствии с результатами, полученными путем проведения стандартного анализа ELISA.
В одном примере осуществления настоящего изобретения части с низким молекулярным весом были в основном удалены из молозива или экстракта молозива. Под выражением «в основном удалены» понимается, что было удалено, по меньшей мере, 75% и предпочтительно 90% частей с низким молекулярным весом.
В указанном предпочтительном примере осуществления настоящего изобретения, по меньшей мере, 75% (по меньшей мере, 90% или удаление в полном объеме) частей с молекулярным весом менее 30 kDa было удалено из молозива или экстракта молозива. Предпочтительно, чтобы части с молекулярным весом менее 60 kDa были в основном удалены из молозива или экстракта молозива.
В одном примере осуществления настоящего изобретения гипериммунный материал содержит иммуногенетический материал, выбранный из антитела и фрагментов антитела, связывающих Env. Предпочтительно, чтобы антитело или фрагмент антитела являлись поликлональным антителом или фрагментом поликлонального антитела бычьего происхождения.
Композиция может дополнительно содержать молекулы фактора роста, которые обычно находятся в молоке или молозиве. Указанные факторы могут создавать синергетический эффект с анти-Env антителами, содержащимися в композиции. Иллюстративные факторы роста включают TGF-beta-1, TGF-beta-2, IGF-1, IGF-2, EGF, FGF и PDGF.
Композиция может быть составлена для местного применения, и в некоторых примерах осуществления настоящего изобретения композиция составлена для вагинального или ректального введения. Композиция может быть составлена в виде геля или в виде крема, мази, лосьона или пены для топического применения.
Лекарственные формы для топического применения в соответствии с настоящим изобретением могут быть использованы для предотвращения инфицирования человека ВИЧ или для ингибирования трансмиссии вируса ВИЧ от инфицированного человека другому человеку. Лекарственные формы для топического применения в соответствии с настоящим изобретением могут ингибировать рост или репликацию вируса, такого как ретровирус, в частности, вирус иммунодефицита человека, в частности, ВИЧ-1 и ВИЧ-2. Лекарственные формы для топического применения являются приемлемыми при профилактическом лечении людей, подверженных риску вирусной инфекции.
Лекарственные формы для топического применения также могут быть использованы для обработки объектов или материалов, таких как механические противозачаточные средства (например, презервативы или внутриматочные противозачаточные средства), медицинского оборудования, материалов или жидкостей, в том числе биологических жидкостей, таких как кровь, продукты крови и ткани, для предотвращения или ингибирования вирусной инфекции у человека. Такие лекарственные формы для топического применения также используются для предотвращения передачи, такой как передача половым путем вирусных инфекций, например, ВИЧ, что является основным путем передачи ВИЧ в глобальном масштабе. Способы предотвращения или ингибирования или замедления передачи вирусной инфекции, например, ВИЧ инфекции в соответствии с настоящим изобретением включают вагинальное, ректальное, пенильное или топическое лечение антивирусным эффективным количеством топического препарата в соответствии с настоящим изобретением, либо в отдельности, либо в сочетании с другим приведенным в настоящем описании антивирусным соединением.
Предпочтительные композиции могут быть выполнены в нескольких формах. Таким образом, в одном примере осуществления настоящего изобретения композиция выполнена в форме крема, лосьона, геля или пены, которые наносятся на поврежденную кожу или эпителиальную полость, и предпочтительно распределяются по всей поверхности кожи или эпителиальной поверхности, подверженной риску контакта с жидкостями организма. Такие лекарственные формы, являющиеся приемлемыми для вагинального или ректального введения, могут представлять собой водные или масляные суспензии, растворы или эмульсии (жидкие лекарственные формы), содержащие кроме активного компонента такие носители, известные в данной области техники, которые являются приемлемыми. Отдельно продаваемые лубриканты (т.е. лубриканты, не упакованных вместе с презервативами), гели и аналогичные лекарственные формы на водной основе обычно являются предпочтительными ввиду различных причин (как научных, так и экономических), известных специалистам в данной области техники. Указанные лекарственные формы являются полезными для защиты не только против передачи ВИЧ, но и для защиты ребенка во время его прохождения через родовой канал. Таким образом, вагинальное введение препарата может быть осуществлено до полового акта, во время полового акта и непосредственно до рождения ребенка.
Один из способов нанесения антивирусного лубриканта на половые органы в целях, раскрываемых в настоящем описании, заключается во взятии небольшого количества (например, чайную ложку или несколько миллиметров) геля, крема, мази или аналогичной лекарственной формы из пластикового или металлического тюбика, баночки или аналогичной емкости, либо из герметизированного пластикового, металлического или иного пакета, содержащего единичную дозу такой композиции, и распределение композиции по поверхности пениса непосредственно перед половым актом. Альтернативные способы нанесения включают: (1) распределение композиции по доступной поверхности внутри влагалища или прямой кишки непосредственно перед половым актом; и (2) надевание презерватива на пенис, или размещение диафрагмы или аналогичного устройства внутри влагалища, на которые уже был нанесен антивирусный лубрикант. В предпочтительном примере осуществления настоящего изобретения любой из указанных способов распределения антивирусного лубриканта по поверхности половых органов обеспечивает нанесение на них слоя лубриканта, который остается на половых органах или эпителиальных поверхностях в течение всего полового акта.
В другом примере осуществления настоящего изобретения предусматривается нанесение топической лекарственной формы на анус. Приемлемая композиция, вводимая в анус, представляет собой пену, гель и т.д. и аналогична описанным выше композициям, предназначенным для вагинального применения. Для анального применения предпочтительно использовать аппликатор, который в основном равномерно распределяет композицию по анусу. Например, приемлемым аппликатором является трубка длиной 2,5-25 см, предпочтительно 5-10 см, в которой выполнены отверстия, расположенные на равном расстоянии друг от друга по длине трубки.
В том случае, когда композиция представляет собой водорастворимый вагинальный крем или гель, наносят предпочтительно 0,1-4 грамма, предпочтительно приблизительно 0,5-2 грамма. В том случае, когда композиция представляет собой вагинальную распыляемую пену, наносят предпочтительно 0,1-2 грамма, предпочтительно приблизительно 0,5-1 грам. В том случае, когда композиция представляет собой анальный крем или гель, наносят предпочтительно 0,1-4 грамма, предпочтительно приблизительно 0,5-2 грамма или геля. В том случае, когда композиция представляет собой анальную распыляемую пену, наносят предпочтительно 0,1-2 грамма, предпочтительно приблизительно 0,5-1 грамм распыляемой пены.
В лекарственной форме для вагинального применения активный компонент может быть использован в сочетании со спермицидом и может быть применен с презервативом, диафрагмой, губкой или иным противозачаточным средством. Примеры приемлемых спермицидов включают нонилфеноксиполиоксиэтилен гликоль (ноноксинол 9), бензетоний хлорид и хлоринданол. Предпочтительно, чтобы значение рН композиции составляло от 4,5 до 8,5. Предпочтительно, чтобы вагинальные композиции имели значение рН от 4,5 до 6, наиболее предпочтительно приблизительно 5.
Вагинальные лекарственные формы также включают суппозитории (например, крем-гели), таблетки и пленки. Суппозитории могут быть введены во влагалище с помощью аппликатора, используя хорошо известные в данной области техники способы.
Стандартные буккальные лекарственные формы представляют собой кремы, мази, гели, таблетки или пленки, содержащие компоненты, являющиеся безвредными при введении через ротовую полость. Буккальные лекарственные формы также могут содержать компоненты, маскирующие вкус, или ароматизирующие вещества.
Композиции в соответствии с настоящим изобретением также могут быть в форме композиции с модифицированным высвобождением. В данном примере осуществления настоящего изобретения композиция включена в композицию, высвобождающую активное соединение со скоростью, которая приведет к вышеуказанной концентрации в вагинальной или анальной зонах. Композиции с модифицированным высвобождением раскрыты в Controlled Release of Pesticides and Pharmaceuticals, D. H. Lew, Ed., Plenum Press, New York, 1981; и U.S. Pat. Nos. 5,185,155; 5,248,700; 4,01 1,312; 3,887,699; 5,143,731; 3,640,741; 4,895,724; 4,795,642; Bodmeier et al, Journal of Pharmaceutical Sciences, vol. 78 (1989); Amies, Journal of Pathology and Bacteriology, vol. 77 (1959); и Pfister et al, Journal of Controlled Release, vol. 3, pp.229-233 (1986), все из которых инкорпорированы в настоящее описание путем отсылки.
Композиции в соответствии с настоящим изобретением также могут быть в форме, высвобождающей композицию, в ответ на определенное событие, такое как вагинальный или анальный половой акт. Например, композиция может содержать анти-Env антитела в везикулах или липосомах, которые разрушаются за счет механического действия полового акта. Композиции, включающие липосомы, раскрыты в U.S. Pat. No. 5,231,112 and Deamer and Uster, "Liposome Preparation: Methods and Mechanisms", in Liposomes, pp.27-51 (1983); Sessa et al, J. Biol. Chem., vol. 245, pp.3295-3300 (1970); Journal of Pharmaceutics and Pharmacology, vol. 34, pp.473-474 (1982); и Topics in Pharmaceutical Sciences, D. D. Breimer and P.Speiser, Eds., Elsevier, New York, pp.345-358 (1985), которые инкорпорированы в данное описание путем отсылки.
Следует отметить, что композиции в соответствии с настоящим изобретением могут сочетаться с противозачаточными средствами или изделиями, такими как вагинальное кольцо, внутриматочное противозачаточное средство, вагинальная диафрагма, вагинальная губка, пессарий, презерватив и т.д. В случае использования внутриматочного противозачаточного средства или диафрагмы предпочтительными могут явиться композиции с модифицированным и (или) механическим высвобождением, в то время как в случае использования презервативов предпочтительными являются композиции с механическим высвобождением.
Приемлемая система доставки лекарственного средства с помощью вагинального кольца для медленного высвобождения анти-Env антител раскрыта в US Patent 5,989,581, инкорпорированном в настоящее описание путем отсылки. В соответствии с описанием в U.S. Pat. No. 5,989,581 вагинальное кольцо обеспечивает доставку двух активных веществ для контрацепции. Раскрытая система доставки лекарственного средства включает, по меньшей мере, одно отделение, заполненное лекарственным средством, растворенным в ядре из термопластичного полимера и в термопластичной оболочке, покрывающей ядро. Предпочтительными термопластичными полимерами как для ядра, так и для оболочки, являются сополимеры этиленвинилацетата. Специалистам в данной области техники должно быть очевидно, что в соответствии с настоящим изобретением раскрытая система доставки лекарственного средства содержит анти-Env антитела, являющиеся эффективными для предотвращения, ингибирования или медленного инфицирования или передачи ВИЧ. В некоторых примерах осуществления настоящего изобретения вагинальное кольцо также может содержать одно или несколько дополнительных лекарственных средств, например, противозачаточное вещество, такое как стероидное прогестогенное соединение и (или) стероидное эстрогенное соединение. Еще в одном примере осуществления настоящего изобретения вагинальное кольцо, содержащее анти-Env антитела, также может содержать топический эстриол, такой как Ovestin™, или может быть использовано в сочетании с ним в целях усиления профилактики инфицирования или передачи ВИЧ через вагинальный эпителий.
В другом примере осуществления настоящего изобретения предусматривается создание новых изделий, являющихся эффективными для предотвращения или замедления развития ВИЧ инфекции. В частности, указанные изделия являются изделиями, высвобождающими анти-Env антитела при их размещении на соответствующих участках тела или в соответствующих полостях тела. Таким образом, указанным изделием может являться вагинальное кольцо, описание которого приведено выше, или ILID. Приемлемые ILIDs раскрыты в U.S. Pat. Nos. 3,888,975 и 4,283,325, инкорпорированные в настоящее описание путем отсылки.
Указанным изделием может являться внутривагинальная губка, содержащая и высвобождающая анти-Env антитела с регулированием по времени. Внутривагинальные губки раскрыты в U.S. Pat. Nos. 3,916,898 и 4,360,013, инкорпорированных в настоящее описание путем отсылки. Указанное изделие также может представлять собой вагинальное дозирующее устройство, высвобождающее анти-Env антитела. Вагинальные дозирующие устройства раскрыты в U.S. Pat. No. 4,961,931, инкорпорированном в настоящее описание путем отсылки.
В одном примере осуществления настоящего изобретения композиции используют в сочетании с презервативами для повышения их эффективности снижения риска и обеспечения максимальной защиты пользователей. Композиция может быть либо нанесена на поверхность презерватива в процессе изготовления, и изделие помещают в известные водонепроницаемые пластиковые или оклеенные фольгой упаковки, при этом в упаковке находится один презерватив, или композиция может быть нанесена вручную пользователем либо на внутреннюю, либо на внешнюю поверхность презерватива непосредственно перед его применением.
В соответствии со значением, используемым в настоящем контексте, термин "презерватив" относится к барьерному средству, используемому для создания водонепроницаемого физического барьера между мужскими и женскими половыми органами во время полового акта и удаляемому после завершения полового акта. Указанный термин включает известные презервативы, закрывающие пенис; указанный термин также включает так называемые «женские презервативы», которые вводят в вагинальную полость до полового акта. Термин «презерватив» не включает диафрагмы, шеечные колпачки или иные барьерные средства, закрывающие только часть эпителиальных мембран внутри вагинальной полости. Презервативы предпочтительно должны быть выполнены из латекса или синтетического пластического материала, такого как полиуретан, так как указанные материалы обеспечивают высокую степень защиты против вирусов.
В другом примере осуществления настоящего изобретения композиции используют для нанесения на другие изделия, поверхность которых может создавать риск передачи инфекции, например, перчатки, с целью обеспечения максимальной защиты для пользователя. Композицию можно либо нанести на перчатки в процессе изготовления и поместить их в известную водонепроницаемую пластиковую или оклеенную фольгой упаковку, в которой упакована одна пара перчаток, или композиция может быть нанесена вручную пользователем либо на внутреннюю, либо на внешнюю поверхность перчатки непосредственно перед применением.
В другом примере осуществления настоящего изобретения композиция изготовлена в форме внутривагинальной таблетки, внутриректальной таблетки или суппозитория. Суппозиторий или таблетку необходимо вводить в вагинальную или ректальную полость таким образом, чтобы обеспечить в процессе растворения или рассасывания суппозитория или таблетки образование на вагинальных или ректальных стенках профилактического слоя покрытия анти-ВИЧ вещества.
Еще в одном примере осуществления настоящего изобретения композиция топикально наносится путем подачи из внутривагинального средства. Такие средства, как вагинальные кольца, вагинальные губки, диафрагмы, шеечные колпачки, женские презервативы и т.д., могут быть легко приспособлены для высвобождения композиции в вагинальную полость после их установки.
В ряде примеров осуществления настоящего изобретения композиция может дополнительно содержать фармацевтически приемлемое вспомогательное вещество, лубрикант или противовирусный агент.
Композиции, используемые в способах настоящего изобретения, также могут содержать другие активные вещества, например, другие вещества для предотвращения ВИЧ-инфицирования, и вещества, препятствующие зачатию и защищающие от болезней, передаваемых половым путем. Таким образом, в другом примере осуществления композиции, используемые в настоящем изобретении, дополнительно содержат второе анти-ВИЧ вещество, вируцид, являющейся эффективным против вирусных инфекций помимо ВИЧ, и (или) спермицид.
В одном конкретном примере осуществления настоящего изобретения композиция содержит ноноксинол - широко используемое поверхностно-активное вещество, обладающее спермицидным действием. Полученная композиция могла бы рассматриваться как «бифункциональная» композиция, так как она содержала бы два активных вещества, обеспечивающих две различные требуемые функции, в относительно инертной жидкости-носителе; нонксинол обеспечивал бы спермицидные контрацептивные свойства, в то время как поликлональные антитела или их фрагменты обеспечивали бы противовирусные свойства. Нонокиснол, по всей вероятности, вызывает определенное раздражение, по меньшей мере, у части пользователей; это является нежелательным, однако хорошо известным побочным эффектом поверхностно-активных веществ со спермицидным действием, таких как ноноксинол и октоксинол, которые атакуют и разрушают липидные двухслойные мембраны, окружающие спермин и иные клетки млекопитающих.
Композиции, используемые в настоящем изобретении, также могут содержать лубрикант, упрощающий нанесение композиции на требуемые участки кожи и эпителиальной ткани и снижать трение во время полового акта. В случае применения таблетки или суппозитория лубрикант может быть нанесен на внешнюю поверхность лекарственной формы для упрощения введения в организм.
В дополнительном примере осуществления настоящее изобретение предусматривает средство для предотвращения передачи ВИЧ половым путем, включающее (а) барьерную структуру, предназначенную для введения и установки внутри вагинальной полости, и (b) композицию, содержащую поликлональное антитело в соответствии с настоящим изобретением. Как указывалось выше, предпочтительные средства, которые выступают в качестве барьерных структур и которые могут быть предназначены для нанесения анти-ВИЧ агента, включают вагинальную губку, диафрагму, шеечный колпачок ил презерватив (мужской или женский).
В примерах осуществления настоящего изобретения с кремом или мазью топическая формула содержит один или несколько лубрикантов. Гели и пены в соответствии с настоящим изобретением выборочно могут включать один или несколько лубрикантов.
Неограничивающие примеры эффективных лубрикантов включают воск цетиловых эфиров, гидрогенизированное растительное масло, стеарат магния, метилстеарат, минеральное масло, сополимер полиоксиэтилен-полиоксипропилен, полиэтиленгликоль, поливиниловый спирт, лаурилсульфат натрия, белый воск или смеси двух или более вышеуказанных веществ.
Количество лубриканта в топической формуле может находиться в пределах от приблизительно 0 до приблизительно 95 весовых процентов. Стандартные формы крема и мази включают 0,1-95 весовых процентов лубриканта.
Формулы для топического применения могут включать один или несколько адъювантов, при этом адъювантом является антимикробный агент, антиоксидант, смачивающее средство или эмульгатор либо смесь двух или более указанных веществ. Гели и пены в соответствии с настоящим изобретением могут включать один или несколько антимикробных агентов и выборочно могут включать один или несколько антиоксидантов, смачивающих средств и эмульгаторов.
Неограничивающие примерами эффективных антимикробных агентов являются бензиловый спирт, пропиленгликоль, пропилпарабен, метилпарабен или смеси двух или более вышеуказанных соединений.
Количество антимикробных агентов в топической формуле может находиться в пределах от приблизительно 0,01 до приблизительно 10 весовых процентов, и в ряде примеров осуществления от приблизительно 0,2 до приблизительно 10 весовых процентов с учетом общего веса топической формулы.
Неограничивающие примеры полезных антиоксидантов включают бутилированный гидроксианизол, бутилированный гидрокситолуол, эдетат динатрия или смеси двух или более вышеуказанных соединений.
Количество антиоксидантов в топической формуле может находиться в пределах от приблизительно 0,01 до приблизительно 1 весового процента, и в ряде примеров осуществления от приблизительно 0,01 до приблизительно 0,1 весового процента с учетом общего веса топической формулы.
Неограничивающие примеры эффективных смачивающих средств включают этиленгликоль, глицерин, сорбитол или смеси двух или более указанных веществ.
Количество смачивающего средства в топической формуле может находиться в пределах от приблизительно 1 до приблизительно 30 весовых процентов, и в ряде примеров осуществления от приблизительно 2 до приблизительно 20 весовых процентов с учетом общего веса топической формулы.
Неограничивающие примеры эффективных эмульгаторов включают полимеры акриловой кислоты (такие как загустители марки Карбомер, например Carbomer 934Р, производимые компанией «Voveon, Inc.»), простой эфир полиоксиэтилен-10-стеарила, простой эфир полиоксиэтилен-20-стеарила, цетостеариловый спирт, цетиловый спирт, холестерин, дигликольстеарат, глицерил моностеарат, глицерил стеарат, полиглицерил-3-олеат, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, ланолин, простой эфир полиоксиэтилен лаурила, метилцеллюлозу, полиоксиэтилен стеарат, полисорбат, пропиленгликоль моностеарат, сложные эфиры сорбитана, стеариновую кислоту или смеси двух или более указанных выше соединений.
Количество эмульгатора в топической формуле может находиться в пределах от приблизительно 1 до приблизительно 40 весовых процентов, и в ряде примеров осуществления от приблизительно 5 до приблизительно 30 весовых процентов с учетом общего веса топической формулы.
Гелевые формулы в соответствии с настоящим изобретением содержат один или несколько желирующих агентов. Неограничивающие примеры эффективных желирующих агентов включают полимеры карбоновой кислоты, включающие полимеры акриловой кислоты, сшитые поперечными сшивками, такими как аллиловые эфиры сахарозы (например, загустители марки Карбомер), цетостеариловый спирт, гидроксиметилцеллюлозу, сополимер полиоксиэтилен-полиоксипропилен, карбоксиметилцеллюлозу натрия, поливинилпирролидон или смеси двух или более вышеуказанных соединений.
Количество желирующего агента в топической формуле может находиться в пределах от приблизительно 0,1 до приблизительно 10 весовых процентов, и в ряде примеров осуществления от приблизительно 0,1 до приблизительно 1 весового процента с учетом общего веса топической формулы.
Гелевые формулы в соответствии с настоящим изобретением могут дополнительно содержать один или несколько подщелачивателей, например гидроксид натрия в количестве менее приблизительно 2 весовых процентов в качестве активаторов желирования.
Формулы могут содержать один или несколько дополнительных вспомогательных веществ, хорошо известных в данной области техники, например воду и загуститель, такой как коллоидный диоксид кремния.
Формулы в соответствии с настоящим изобретением могут быть введены в сочетании с одним или несколькими другими антивирусными и иными агентами, являющимися эффективными при лечении или профилактике ВИЧ-инфекции или при предотвращении передачи ВИЧ-инфекции, в сочетании с фармацевтически приемлемым носителем. В одной форме способа субъект проходит лечение с использованием антиретровирусного агента.
В ряде примеров осуществления настоящего изобретения способ включает совместное введение антиретровирусного агента и, в частности агента, используемого для лечения ВИЧ-инфекции, такого как Zidovudine (AZT), Abacavir, Emtricitabine (FTC), Lanrivudine (3TC), Didanosine (ddl), Stavudine (d4T), Zalcitabine (ddC), Nevirapine, Efavirenz, Delavirdine, Tenofovir, Enfuvirtide (T20), Maraviroc (CCR5), Lopinavir, Atazanavir, Fosamprenvir, Amprenavir, Saquinavir, Indinavir, Nelfinavir, Raltegravir и Elvitegravir.
Один или несколько, предпочтительно один-четыре противовирусных агентов, являющихся эффективными при анти-ВИЧ-1 терапии, могут быть использованы в сочетании, по меньшей мере, с одним (т.е. 1-4, предпочтительно 1) анти-Env антителом в формуле настоящего изобретения. Противовирусный агент или агенты могут сочетаться с анти-Env антителом в единичной лекарственной форме, либо анти-Env антитело и противовирусный агент или агенты могут быть введены одновременно или последовательно в виде отдельных лекарственных форм. Например, формула анти-Env антитела может быть использована в вагинальном кольце или для нанесения на внешнюю поверхность презерватива с целью предотвращения передачи ВИЧ-инфекции унифицированному сексуальному партнеру, в то время ВИЧ-инфицированный сексуальный партнер проходит лечение с применением системной противовирусной терапии. Противовирусные агенты, предназначенные для использования в сочетании с формулами анти-Env антитело в соответствии с настоящим изобретением включают нуклеотидные и нуклеозидные ингибиторы обратной траискриптазы, пенуклеозидные ингибиторы обратной траискриптазы, ингибиторы протеазы и иные перечисленные ниже противовирусные лекарственные средства, не подпадающие под указанные классификации. В частности, сочетания, известные как высокоактивная антиретровирусная терапия (HAART) предназначены для использования в сочетании с формулами анти-Env антитело в соответствии с настоящим изобретением.
Термин "нуклеотидные и нуклеозидные ингибиторы обратной траискриптазы" ("NRTI") в соответствии со значением, используемым в настоящем контексте, означает нуклеозиды и нуклеотиды или их аналоги, ингибирующие активность обратной траискриптазы ВИЧ-1, фермент которой катализирует преобразование вирусной геномной РНК ВИЧ-1 в провирусную ДНК ВИЧ-1.
Стандартные приемлемые нуклеотидные и нуклеозидные ингибиторы обратной траискриптазы включают зидовудин (AZT), имеющийся на рынке под торговым названием RETROVIR, выпускаемый компанией «Glaxo-Wellcome Inc., Research Triangle», NC 27709; диданозин (ddl), имеющийся на рынке под торговым названием VIDEX, выпускаемый компанией «Bristol-Myers Squibb Co., Princeton», NJ 08543; зальцитабин (ddC) имеющийся на рынке под торговым названием HMD, выпускаемый компанией «Roche Pharmaceuticals», Nutley, NJ 071 10; ставудин (d4T), имеющийся на рынке под торговым названием ZERIT, выпускаемый компанией «Bristol-Myers Squibb Со.», Princeton, NJ 08543; ламивудин (ЗТС), имеющийся на рынке под торговым названием EPIVIR, выпускаемый компанией «Glaxo-Smith Kline Triangle», NC 27709; абакавир (1592U89), раскрытый в патенте WO96/30025 и имеющийся на рынке под торговым названием ZIAGEN, выпускаемый компанией «Glaxo-Wellcome Research Triangle», NC 27709; адефовир дипивоксил [bis(POM)-PMEA], имеющийся на рынке под торговым названием PREVON, выпускаемый компанией «Gilead Sciences», Foster City, CA 94404; лобукавир (BMS-180194), ингибитор нуклеозидной обратной траискриптазы, раскрытый в патентах ЕР-0358154 и ЕР-0736533 и разрабатываемый компанией «Bristol-Myers Squibb», Princeton, NJ 08543; BCH-10652, ингибитор обратной траискриптазы (в форме рацемической смеси ВСН-10618 и ВСН-10619), разрабатываемый компанией «Biochem Pharma», Laval, Quebec H7V, 4A7, Canada; эмитрицитабин [(-)-FTC], лицензированный у Emory University в соответствии с Emory Univ. U.S. Patent No. 5,814,639 и выпускаемый компанией «Gilead» под торговым названием Emtrivia™; beta-L-FD4 (также называемый beta-L-D4C и называемый beta-L-2', 3'-диклеокси-5-фтор-цитидин), лицензируемый Yale University для Vion Pharmaceuticals, New Haven CT 0651 1; DAPD, пуриновый нуклеозид, (-)-beta-D-2,6,-flnaMiiHO-nypira диоксолан, раскрытый в ЕР 0656778 и лицензируемый Emory University и University of Georgia для Triangle Pharmaceuticals, Durham, NC 27707; и лоденозин (FddA), 9-(2,3-дидеокси-2-фтор-b-D-трео-пентофуранозил)аденин, кислотостойкий ингибитор обратной транскриптазы на основе пурина, открытый Национальным институтом здравоохранения и разрабатываемый компанией «U.S. Bioscience Inc.» West Conshohoken, PA 19428.
Термин "ненуклеозидные ингибиторы обратной транскриптазы" ("NNRTI1 IS) в соответствии со значением, используемым в настоящем контексте, означает ненуклеозиды, ингибирующие активность обратной транскриптазы ВИЧ-1.
Стандартные приемлемые ненуклеозидные ингибиторы обратной транскриптазы включают невирапин (BI-RG-587), имеющийся на рынке под торговым названием VIRAMUNE, выпускаемый компанией «Boehringer Ingelheim», производитель для Roxane Laboratories, Columbus, ОН 43216; делавирадин (ВНАР, U-90152), имеющийся на рынке под торговым названием RESCRIPTOR, выпускаемый компанией «Pharmacia & Upjohn Со.», Bridgewater NJ 08807; эфавиренц (DMP-266), бензоаксазин-2-она, раскрытый в WO94/03440 и имеющийся на рынке под торговым названием SUSTIVA, выпускаемый компаниями «Bristol Myers Squibb» в США и «Merck» в Европе; PNU-142721, фуропиридин-тио-пиримид, разрабатываемый « Pharmacia and Upjohn», Bridgewater NJ 08807; AG-1549 (прежде Shionogi # S-l 153); 5-(3,5-дихлорфенил)-тио-4-изопропил-1-(4-пиридил)метил-1Н-имидазол-2-илметил карбонат, раскрытый в WO 96/10019 и проходящий клинические испытания development в компании «Agouron Pharmaceuticals, Inc.», LaJolla CA 92037-1020; MKC-442 (1-(этокси-метил)-5-(1-метилэтил)-6-(фенилметил)-(2,4(1Н, 3Н)-пиримидиндион), открытый «Mitsubishi Chemical Со.» и разрабатываемый «Triangle Pharmaceuticals», Durham, NC 27707; (+)-каланолид A (NSC-675451) и В, производные кумарина, раскрытые NIH U.S. Patent No. 5,489,697, лицензированный для «Med Chem Research», которая совместно разрабатывает (+) каланолид А с «Vita-Invest» в качестве перорально вводимого препарата; и этравирип (ТМС-125, Intelence), продаваемый на рынке компанией «Tibotec».
Термин "ингибитор протеазы" ("PI") в соответствии со значением, используемым в настоящем контексте, означает ингибиторы протеазы ВИЧ-1, фермента, необходимого для протеолитического расщепления полипротеиновых прекурсов вируса (например, полипротеины GAG и GAG Pol вируса) на отдельные функциональные протеины, обнаруженные в инфекционном ВИЧ-1. Ингибиторы протеазы ВИЧ включают соединения, имеющие пептидомиметическую структуру, высокий молекулярный вес (7600 лаптопов) и существенные свойства пептидов, например, CRIXIVAN (выпускаемый «Merck»), а также непептидные ингибиторы протеазы например, VIRACEPT (выпускаемый «Agouron»).
Стандартные приемлемые пептидные ингибиторы включают саквинавир (Ro 31-8959), имеющийся на рынке в виде капсул с твердой желатиновой оболочкой под торговым названием 1NVIRASE и капсул с мягкой желатиновой оболочкой под торговым названием FORTOVASE, выпускаемых компанией «Roche Pharmaceuticals», Nutley, NJ 071 10-1 199; ритонавир (ABT-538), имеющийся на рынке под торговым названием NORVIR выпускаемый компанией «Abbott Laboratories», Abbott Park, IL 60064; индинавир (MK-639), имеющийся на рынке под торговым названием CRIXIVAN, выпускаемый компанией Merck & Co., Inc., West Point, PA 19486-0004; нелфнавир (AG-1343), имеющийся на рынке под торговым названием VIRACEPT, выпускаемый компанией «Agouron Pharmaceuticals, Inc.», LaJolla CA 92037-1020; ампренавир (141 W94), торговое название AGENERASE, пепептидпый ингибитор протеазы, разрабатываемый «Vertex Pharmaceuticals, Inc.», Cambridge, MA 02139-421 1 и выпускаемый «Glaxo-Wellcome, Research Triangle», NC в рамках программы расширенного доступа; лазинавир (BMS-234475), выпускаемый компанией «Bristol-Myers Squibb», Princeton, NJ 08543 (первоначально открытый «Novartis», Basel, Швейцария (CGP-61755); DMP-450, цикломочевина, открытая «Dupont» и разрабатываемая «TriangIe Pharmaceuticals)); BMS-2322623, азапептид, разрабатываемый «Bristol-Myers Squibb», Princeton, NJ 08543, в качестве пептидных ингибиторов ВИЧ-1 второго поколения; АВТ-378, разрабатываемый компанией «Abbott», Abbott Park, IL 60064; AG-1549, пероралыю активный имидазол карбамат, открытый Shionogi (Shionogi #S-1 153) и разрабатываемый «Agouron Pharmaceuticals, Inc.», LaJolla CA 92037-1020; атазанавир; типранавир; и дарунавир.
Другие противовирусные агенты включают антагонисты CXCR4, энфувиртид, гидроксимочевину, рибавирин, IL-2, IL-12, пентафузид и Yissum Project No. 1 1607. Гидроксимочевина (Droxia), ингибитор рибонуклеозид-трифосфат-редуктазы, фермент, участвующий в активации Т-клеток, была открыта в Национальном институте онкологии (NCI) и разрабатывается «Bristol-Myers Squibb»; при проведении доклинических исследований было продемонстрировано, что соединение оказывает синергетический эффект на активность диданозина, и ее изучение проводилось совместно со ставудином. IL-2 раскрыт в Ajinomoto ЕР-0142268, Takeda ЕР-0176299 и Chiron U.S. Patent Nos. RE 33653, 4530787, 4569790, 4604377, 4748234, 4752585 и 4949314, имеется на рынке под торговым названием PROLEUKIN (алдеслейкин), выпускается компанией «Chiron Corp.», Emeryville, CA 94608-2997 в виде лиофилизированного порошка для внутривенного капельного введения или для подкожного введения после растворения и разведения водой; доза составляет от приблизительно 1 до приблизительно 20 миллионов 1U/день, подкожное введение является предпочтительным; доза составляет приблизительно 15 миллионов lU/день, подкожное введение является более предпочтительным. 1L-12 раскрыт в W096/25171 и выпускается «Roche Pharmaceuticals», Nutley, NJ 071 10-1 199, и «American Home Products», Madison, NJ 07940; доза составляет приблизительно от 0,5 микрограмм/кг/день до приблизительно 10 микрограмм/кг/день, подкожное введение является предпочтительным. Энфувиртид (DP-178, Т-20), синтетический пептид 36-аминокислоты, раскрыт в U.S. Patent No. 5,464, 933, лицензия на который получена у Duke University для «Trimeris», которая разработала энфувиртид в сотрудничестве с Duke University и «Roche»; энфувиртид действует путем ингибирования слияния ВИЧ-1 с мембранами-мишенями. Энфувиртид (3-100 мг/день) вводится в виде непрерывной подкожной капельной инфузии или в виде инъекции в сочетании с эфавиренцем и 2 ингибиторами протеазы ВИЧ-1 положительным пациентам, трудно поддающимся лечению с применением тройной комбинированной терапии; введение 100 мг/день является предпочтительным. Yissum Project No. 1 1607, синтетический белок, основанный на VIF белке ВИЧ-1, находится на стадии доклинических испытаний, проводимых «Yissum Research Development Со.», Jerusalem 91042, Israel. Рибавирин, I-P-D-рибофуранозил-1 Н-1,2,4-триазол-3-карбоксамид, выпускается компанией «ICN Pharmaceuticals, Inc.», Costa Mesa, CA; процесс его изготовления и формула описаны в U.S. Patent No. 4,211,771; ралтеграфир, ингибитор интегразы, выпускается компанией «Merck» под торговым названием Isentress™; элвитегравир, ингибитор интегразы, разрабатываемый «Gilead Sciences»; беривимат, ингибитор созревания Gag ВИЧ-1, разрабатываемый (Phase lib) «Panacos Pharmaceuticals».
Термин "анти-ВИЧ-1 терапия" в соответствии со значением, используемым в настоящем контексте, означает любое анти-ВИЧ-1 лекарственное средство, оказавшееся эффективным для лечения инфекций ВИЧ-1 в организме человека, либо отдельно, либо как часть множественной лекарственной комбинированной терапии, в частности, HAART тройной и квадро-комбинированной терапии. Стандартные приемлемые известные анти-ВИЧ-1 терапии включают без ограничения множественные лекарственные комбинированные терапии, такие как (i), по меньшей мере, три анти-ВИЧ-1 лекарственных средства, выбранные из двух нуклеозидных ингибиторов обратной транскриптазы, одного пептидного ингибитора, второго пептидного ингибитора и одного ненуклеозидного ингибитора обратной транскриптазы; и (и), по меньшей мере, два анти-ВИЧ-1 лекарственных средства, выбранных из ненуклеозидных ингибиторов обратной транскриптазы и пептидных ингибиторов. Стандартная приемлемая HAART - множественные лекарственные комбинированные терапии включают:
(а) тройную комбинированную терапию, такую как два нуклеозидных ингибитора обратной траискриптазы и один пептидный ингибитор; или (b) два нуклеозидных ингибитора обратной траискриптазы и один пенуклеозидный ингибитор обратной траискриптазы; и (с) квадро-комбинированные терапии, такие как два нуклеозидных ингибитора обратной траискриптазы, один пептидный ингибитор и второй пептидный ингибитор или один пенуклеозидный ингибитор обратной траискриптазы. При лечении пациентов, ранее не получавших препарат, предпочтительно приступить к анти-ВИЧ-1 лечению с тройной комбинированной терапией; использование двух нуклеозидных ингибитора обратной траискриптазы и одного ненуклеозидного ингибитора обратной траискриптазы или двух нуклеозидных ингибиторов обратной траискриптазы и одного пептидного ингибитора является предпочтительным, если имеется непереносимость к ненуклеозидному ингибитору обратной траискриптазы. Схема приема лекарственного средства является важным фактором. Необходимо проводить контроль один раз в 3-6 месяцев за уровнями CD4+ и ВИЧ-1-РНК в плазме крови. В случае выравнивания вирусной нагрузки могло бы быть добавлено четвертое лекарственное средство, например, один пептидный ингибитор, один ненуклеозидный ингибитор обратной траискриптазы или ингибитор интегразы.
Настоящее изобретение также предусматривает использование композиции настоящего изобретения для изготовления лекарственного препарата, предназначенного для лечения и (или) профилактики передачи ВИЧ.
Настоящее изобретение также предусматривает создание способа изготовления композиции для предотвращения передачи ВИЧ, включающего иммунизацию животного белком (Env) вирусной оболочки ВИЧ или его фрагментом и получение гипериммунного молозива от иммунизированного животного.
Настоящее изобретение также предусматривает создание композиции для предотвращения передачи ВИЧ, изготовленной с помощью способа, включающего иммунизацию животного белком (Env) вирусной оболочки ВИЧ или его фрагментом и получение гипериммунного молока от иммунизированного животного.
Настоящее изобретение также предусматривает создание способа для предотвращения инфицирования ВИЧ, включающего:
формирование гипериммунного молозива пли гипериммунного молока путем иммунизации коров; и
введение гипериммунного молозива или гипериммунного молока субъекту, при котором этап иммунизации коров для выработки гипериммунного молозива или гипериммунного молока включает вакцинацию белком вирусной оболочки (Env) вируса иммунодефицита человека (ВИЧ) или его фрагментом. Белок Env или его фрагмент может быть любым белком Env ВИЧ, тем не менее, предпочтительным белком Env является gpl 40.
Также предусматривается создание способа для предотвращения передачи ВИЧ-инфекции, включающего введение субъекту поликлональных антител или их фрагментов, способных связываться с белком вирусной оболочки (Env) вируса иммунодефицита человека (ВИЧ) или его фрагментом. Белок Env или его фрагмент может быть любым белком Env ВИЧ, тем не менее, предпочтительным белком Env является gpl40.
В одном примере осуществления настоящего изобретения белок Env или его фрагмент является олигомером gpl40. Олигомер может включать тримеры, димеры и мономеры gpl40. Олигомеры могут быть очищены от супернатанта трансфицированных клеток HeLa и 293, например, методом аффинной хроматографии с использованием лектина чечевицы и методом гель-фильтрации. Белок Env или его фрагмент может являться белком (Env) вирусной оболочки штамма клады А, клады В или клады С ВИЧ или его фрагментом.
В одном примере осуществления настоящего изобретения поликлональные антитела или их фрагменты способны связываться с белком Env из гетерологичной клады ВИЧ или гетерологичного штамма ВИЧ.
Антитело или его фрагмент или его функциональный эквивалент может быть выработано путем иммунизации животного с использованием белка (Env) вирусной оболочки ВИЧ или его фрагмента. Животное может быть иммунизировано gpl40, рекомбинантным gpl40 или олигомерным gpl40. Рекомбинантный gpl40 не может быть получен из культуры вириона. Животное может быть иммунизировано с использованием белка (Env) вирусной оболочки ВИЧ или его фрагмента и адъювантом. В одном примере осуществления настоящего изобретения адъювантом является вода в масляной эмульсии.
Антитело или его фрагмент или его функциональный эквивалент может присутствовать в птичьем яйце или может быть получено из птичьего яйца либо может присутствовать в гипериммунном молозиве или гипериммунном молоке животного или получено из них. Животным может являться корова.
Композиция может быть составлена для местного применения, и в некоторых примерах осуществления настоящего изобретения композиция составлена для вагинального или ректального введения. Композиция может быть выполнена в виде геля или в виде крема, мази, лосьона или пены для топического применения.
В одном примере осуществления способа лиганд является антителом, либо его фрагментом, либо производным. Антитела или их фрагмент или производное могут являться поликлональными иммуноглобулинами или химерными антителами или дендримером, представленными иммуноактивными фрагментами или такими иммуноактивными фрагментами, как фрагменты F(ab) и F(ab)2 или рекомбинантные иммуноактивные фрагменты или аффинно очищенные иммуноглобулины или их иммуноактивные фрагменты.
В одной форме композиции антитело или его фрагмент или его производное продуцируют путем иммунизации животного микробом или микробным продуктом. Поликлональные антитела, способные связываться с микробом или микробным продуктом, могут быть получены путем иммунизации животного, при этом антитела получают их жидкостей организма, таких как кровь, секреты из желез или клеток, яиц, молока или молозива.
Способы, композиции и устройства настоящего изобретения могут быть в целом предназначены для высвобождения активного агента времязависимым образом, максимально согласующимся по времени с сексуальной активностью. При топическом использовании композиций в виде лосьона или геля, их предпочтительно применяют непосредственно до сексуальной активности. Другие формы применения, такие как средства и суппозитории, могут быть предназначены для высвобождения активного агента в течение длительного периода времени с заданной скоростью в зависимости от нужд потребителя.
В конкретных примерах осуществления настоящего изобретения цель применения композиций настоящего изобретения заключается в снижении вирусной нагрузки ВИЧ-1-РНК ниже предела обнаружаемости таким образом, чтобы обеспечивалось замедление, предотвращение или ингибирование инфекции или передачи инфекции. Термин "предел обнаружаемости ВИЧ-1-РНК" в контексте настоящего изобретения означает, что имеется менее приблизительно от 200 до менее приблизительно 50 копий ВИЧ-1-РНК на мл плазмы крови пациента по результатам измерений с использованием метода количественной многоциклической полимеразной цепной реакции (ПЦР) с обратной транскриптазой. В настоящем изобретении измерение ВИЧ-1-РНК предпочтительно проводят методом Amplicor-1 Monitor 1.5 (Roche Diagnostics) или методом Nuclisens ВИЧ-1 QT-1.
В конкретных примерах осуществления композиции в соответствии с настоящим изобретением являются эффективными для защиты не только против передачи ВИЧ половым путем, но также для предотвращения инфицирования ребенка во время его прохождения через родовой канал. Таким образом, вагинальное введение композиции можно осуществить до полового акта, во время полового акта, непосредственно до рождения ребенка или во время рождения ребенка. Такие топические лекарственные формы могут быть исключительно эффективными при их использовании для защиты новорожденного ВИЧ-инфицированной матери.
Ниже приведено подробное описание настоящего изобретения со ссылкой на следующие неограничивающие примеры.
ПРИМЕРЫ
ПРИМЕР 1: Получение гипериммунного молозива, содержащего поликлональные анти-Env антитела
Этап 1 - Получение вакцины для молочного скота
Были использованы процедуры для продуцирования антигена, информация о которых приведена в публикации №WO/2004/078209 международной заявки №PCT/AU2004/000277 (содержание которой включено в настоящий документ путем отсылки).
Этап 2 - Были использованы процедуры для продуцирования антител из организма вакцинированных животных, информация о которых приведена в публикации №WO/2004/078209 международной заявки №PCT/AU2004/000277 (содержание которой включено в настоящий документ путем отсылки).
ПРИМЕР 2: Продуцирование поликлональных антител, связывающихся с Env ВИЧ, и демонстрация нейтрализации
Растворимые Env gpl40 олигомеры были получены из штаммов ВИЧ-1 клад А, В и С из клеток HeLa и (или) 293Т и очищены методом аффинной хроматографии с использованием лектина чечевицы или методом гель-фильтрационной хроматографии.
Четыре коровы (две стельные во втором семестре и две первоначально нестельные) были вакцинированы 100 мкг очищенного олигомера ВИЧ-1 Env gpl40, составленного с адыовантом Montanide. Две группы из двух коров (одна стельная и одна нестельная) были вакцинированы Env gpl 40 (UG8, AD8 и MW) (называемые «тримиксами») либо только клады В (AD8) либо равными количествами (33,33 мкг) клад А, В и С. Всем четырем коровам были сделаны, по меньшей мере, три прививки, в то время как последнюю прививку сделали за четыре недели до отела. Все четыре коровы были сероконвертированы в течение девяти недель. Реципрокные титры конечных точек сыворотки IgG составляли приблизительно 1×102,5 для стельных коров и приблизительно 1×105 для нестельных коров и были определены с помощью вновь разработанного специфического иммуносорбентного ферментного анализа Env gpl40 ВИЧ-1 анти-IgG. Нагнетание антител IgG сыворотки в молозиво приблизительно за четыре недели до отела позволило найти объяснение ожидаемого низкого титра сыворотки IgG у стельных коров.
У всех стельных коров, которым была сделана прививка, было собрано и пастеризовано ВИЧ-иммунное бычье молозиво после отела, в результате чего были обнаружены относительно низкие ответы с реципрокными титрами IgG<102 (вакцинирование кладой В) и 1×103,5 (вакцинирование тримиксом). Реципрокный титр IgG молозива коров, вакцинированных до стельности, составил 105 (вакцинирование кладой В) и 104,5 (вакцинирование тримиксом). Результаты вестерн-блоттинг анализа подтвердили, что IgG молозива всех четырех коров оказалось специфичным против gpl40 Env ВИЧ-1. Был проведен тест нефракционированного молозива на нейтрализующую активность при проведении анализа Env-псевдотипированного вируса-репортера ВИЧ-1. Было проведено тестирование вирусов псевдотипа клады А/Е, клады В и клады С, включающих стандартизованную панель Национального института здравоохранения в отношении вирусов клад В и С (всего n=27) и их сравнение с неиммунным бычьим молозивом, которое уже обладало естественной блокирующей инфекцию активностью ввиду наличия лактоферрина и иных биоактивных пептидов. Нефракционированное молозиво от коров, вакцинированных тримиксом в период стельности проявило высокую степень нейтрализации до 50% в отношении всех псевдовирусов клады В (n=15), а также в отношении большинства псевдовирусов клады С (n=l 1) и клады А/Е (n=1) при разведении в отношении 1:16. Первая вакцинированная кладой В корова оказалась низкоотвечающей особью, однако недавно от обеих коров, вакцинированных до периода стельности и имеющих телят, был получен высокий ответ. Вплоть до указанного момента наблюдалась широкая нейтрализация в отношении коровы, вакцинированной кладой В, у которой проявилась 50-80% нейтрализация в отношении псевдовирусов (n=9) (разведение в отношении 1:16) для клады В (n=12) и клады С (таблица 1). IgG Abs от первой пары коров подвергся очистке от молозива, и нейтрализующая активность сохранялась для очищенного IgG приблизительно до 50% нейтрализации в отношении тримикс-IgG по сравнению с неиммунным IgG при 500 мкг/мл.
Результаты профиля нейтрализации двух образцов гипериммунного бычьего молозива gpl40 Env ВИЧ в отношении псевдовирусов различных клад приведены в таблице 1.
Вышеизложенные результаты являются убедительным доводом в пользу указанного способа продуцирования высоких уровней нейтрализующих антител.
|
Профиль нейтрализации: зеленый 0%-25%, желтый 25%-50%; оранжевый 50%-75%; красный75%-100%;
* в процессе разработки
ПРИМЕР 3: Поликлональные нейтрализующие антитела к Env ВИЧ-1 из бычьего молозива.
Двенадцать стельных коров, не болеющих губчатой энцефалопатией крупного рогатого скота, размещенных в одобренной карантинной ферме, штат Виктория, были вакцинированы 100 мкг эквимолярной смеси четырех олигомеров gpl40 Env ВИЧ-1:
1) gpl40 Env штамма предсероконверсии клады В SC35; указанный олигомер принимает открытую конфигурацию и явно проявляет важные эпитопы нейтрализации;
2) gpl40 Env первичная Я5-тропная клада В ADA;
3) gpl40 Env 966 клады A/E; и
4) gpl40 Env клады С MW.
Смеси указанных Env были составлены с адъювантом (Montanide) и введены дипломированным ветеринаром дважды до стельности и, по меньшей мере, дважды с трехнедельным интервалом в течение второго триместра стельности.
Иммуносорбентный ферментный анализ Env ELISA и Вестерн-блоттинг были использованы для контроля уровней Env-специфического IgG в пробах крови, которые брались регулярно во время вакцинирования и стельности, и вакцинирование продолжалось до момента обнаружения высоких титров IgG. Непосредственно после отела дипломированный ветеринар собирал первое молозиво, и телятам давали необходимое им молозиво, при этом оставляли приблизительно один литр молозива на корову.
После накопления 200 мл цельного молозива оставшуюся часть фракционировали и очищали, используя способы для получения 1 кг чистых лиофилизированных антител. Была проведена оценка цельного молозива и очищенных антител в отношении широты спектра действия и титра нейтрализующей активности антитела с использованием Env-псевдотипированного вирусологического теста по гену-репортеру. При проведении данных исследований было проведено тестирование типовых клеток-мишеней в указанных пробах, а также первичной культуры клеток. Нейтрализация ВИЧ также подтверждена в системе, в которой происходит распространение инфекции при инфицировании вирусом мононуклеарных клеток периферической крови.
Также были изучены пробы на нейтрализацию вируса иммунодефицита обезьян (SIV) для оценки возможности использования указанной надежной модель контрольного заражения для исследования приматов. Важно отметить тот факт, что антитела титровали в смешанную семенную плазму, являющуюся побочным продуктом при проведении клинических процедур экстракорпорального оплодотворения, и в вагинальную промывную жидкость, собранную на различных этапах менструального цикла и протестированную на нейтрализующую активность. Обычно значение рН во влагалище является кислотным (рН 4-5), но в присутствии семени значение рН повышается до нейтрального (рН 7) уровня. Активность антител бычьего молозива тестировали в пределах указанного диапазона рН.
ПРИМЕР 4: Механизмы ингибирования ВИЧ с помощью IgG бычьего молозива в вирусном трансцитозе и в пробах нейтрализации in vitro и в модели цервикалыюй инфекции экенланта.
Одним из основных путей, по которому ВИЧ преодолевает механизмы защиты организма-хозяина, является перемещение вируса внутри защитной везикулы по внутреннему пространству эпителиальных клеток, обращенных вовнутрь влагалища (известного как трансцитоз), при этом не происходит инфицирование указанных клеток. Оценку антитрансцитозной активности бычьих поликлональных антител проводили в Нес 1-В клетках с использованием вольтметра эпителиальной ткани EVOM2 при проведении анализа трансцитоза. Кроме очищенных IgA и IgG изучали антитрансцитозную активность цельного молозива. Получали цервикальную ткань и изучали проникновение флуоресцентно-меченого бычьего IgG в эпителиальные слои эктоцервикса, эндоцервикса и столбчатый эпителий влагалища. Добавляли вирион ВИЧ, меченый флуоресцентным Vpr, для отслеживания перемещения ВИЧ на указанных тканях и через них в модели эксплантатной культуры в целях наблюдения за виролизом или инкапсулированием.
ПРИМЕР 5: Включение нейтрализующих антител молозива в микробицидный гель и тестирование геля на безопасность и эффективность на кроликах.
Были протестированы, собраны и включены в формулу водных буферирующих гелей наиболее активные поликлональные бычьи анти-Env антитела ВИЧ-1. Было приготовлено несколько формул анти-Env Ab, в том числе формулы, в которых присоединен лактоферин в виде белкового вспомогательного вещества, так как он тоже обладает высокой нейтрализующей активностью, а также формула с казеином и карбонатом кальция для тестирования возможности сохранения связывающей активности IgG после прохождения через желудок и пищеварительную систему в отношении перорально доставляемого ректального микробицида.
Сохраняется активность антител при включении их в рецепт различных существующих гелей, таких как K-Y лубрикантный гель на основе гликоля, или микробицидный дендримерный гель, Vivagel, разработанный Starpharma. Композиции, сохраняющие или повышающие степень и эффективность нейтрализации ВИЧ, были протестированы на проявление активности как при нейтральных, так и кислотных значениях рН in vitro, а также была проверена их стабильность. Были протестированы стабильность, биораспределение и реактогенность/воспаление, вызываемое бычьими антителами, при проведении токсикологических исследований на кроликах. Биораспределение бычьего IgG изучали с использованием методов гистопатологии, иммуногистохимии, дермального наблюдения за местными воспалительными ответами, иммуногенностью антитела и клеточными ответами на бычий IgG, а также метода by Bioplex bead arrays (матрица микросфер) или цитокинного анализа ELISA и EliSpot. Был проведен анализ веса тела, зрения, ЭКГ, клинической химии, крови, мочи, веса внутренних органов, костного мозга и мазков крови на наличие каких-либо отклонений. В контрольной группе животных использовали гель плацебо. После проведения исследований на клеточную токсичность молозиво и очищенные антитела совместно культивировали с бактериями, распространенными во влагалище, например, Lactobacillus acidophilus, для оценки эффекта воздействия антител молозива на благоприятную нормальную флору. До проведения провокационных исследований на приматах было проведено тестирование стабильности и активности формулы в среде влагалища в различные моменты времени после ее применения к кроликам путем выделения антител промывкой физиологическим раствором.
ПРИМЕР 6: Формулы
Ниже представлены формулы, составленные с использованием стандартных способов путем включения в формулу ингредиентов, указанных в нижеприведенных списках. «Гипериммунное молозиво» является гипериммунным молозивом, содержащим антитела к Env.
Формула 1
Формула вагинального крема составлена путем перемешивания компонентов, перечисленных в таблице 2 ниже. При каждом применении 1-4 грамма крема вводят вагинально с помощью приемлемого аппликатора, например шприца.
|
Формула 2
Формула вагинального крема составлена путем перемешивания компонентов, перечисленных в таблице 3 ниже. При каждом применении 1-4 грамма крема вводят вагинально с помощью приемлемого аппликатора, например, шприца.
|
Формула 3
Формула вагинального геля составлена путем перемешивания компонентов, перечисленных в таблице 4 ниже. При каждом применении 4 грамма геля вводят вагинально с помощью приемлемого аппликатора, например шприца.
|
Формула 4
Формула пены для ректального применения составлена путем перемешивания компонентов, перечисленных в таблице 5 ниже, и инертных газов-вытеснителей изобутена и пропана. Пена поставляется в аэрозольной упаковке с ректальным аппликатором. При каждом применении с помощью аппликатора ректально вводят 900 миллиграмм пены.
|
ПРИМЕР 7: Продуцирование, очистка антигена и вакцинация коров
Растворимый тримерный gpl40 Env ВИЧ-1 клады A (92UG8037.8; UG8), клады В (AD8) и клады С (93MW965.26; MW) очищали методом аффинной хроматографии с использованием лектина чечевицы и методом гель фильтрации, и 100 мкг gpl40 в фирменном адъюванте использовали для трех внутримышечных вакцинаций 4-х коров; 2 коровы после оплодотворения (р) и две коровы до оплодотворения (NP) в соответствии с графиком вакцинации, приведенном на Фиг.1 и 2.
ПРИМЕР 8: IgG из сыворотки и молозива связывается с gpl40 Env клад А, В и С
На Фиг.3 показаны Env gpl40-специфические IgG титры в сыворотке 9 недель спустя после первичной вакцинации и в молозиве, определенные методом прямого анализа ELISA по отношению к gpl40 Env клады A (UG8), клады В (AD8) и клады С (MW). Реципрокные титры конечных точек определяли с использованием а 2-кратного превышения порогового значения оптической плотности на основе образцов сыворотки крови, полученных до иммунизации, или неиммунного молозива, соответственно. Данные результаты указывают на то, что IgG из сыворотки и молозива связывается с Env gpl40 клад А, В и С.Результаты также показывают, что IgG от нестельных коров обладают широкой активностью связывания с gpl40 клад А, В и С.
ПРИМЕР 9: Очищенное IgG молозива от нестельных коров сохраняет способность связывания с Env gpl40
На Фиг.4 приведены специфическая активность связывания очищенного IgG молозива, определенная методом прямого ИФА (ELISA) по кладе A (UG8), кладе В (AD8) и кладе С (MW), и результаты измерения поглощения (abs) при 450 нм. Данные результаты указывают на то, что очищенный IgG от нестельных коров сохраняет способность связывания с gpl40. Результаты также указывают на то, что очищенный IgG от нестельных коров сохраняет широкую активность связывания с gpl40 клад А, В и С.Результаты также демонстрируют кросс-кладовое (гетерологичное) связывание с молозивом от нестельных коров, вакцинированных растворимыми олигомерами gpl40 Env клады В, связывающими gpl40 клад А, В и С.
ПРИМЕР 10: Бычий IgG блокирует связывание моноклонального Ab b12 с CD4 сайтом связывания gpl40
От инфицированных больных было получено несколько нейтрализующих моноклональных антител человека (MAbs) с широким спектром действия, в том числе иммуноглобулин Gl (lgGl) b12 и 2G12. Среди наиболее активных хорошо известное моноклональное антитело b2 (Ab b12) блокирует сайт связывания CD4 на gpl20 (который образует часть gpl40), предотвращает присоединение вируса к CD4 на клетках-мишенях и обеспечивает нейтрализацию первичных изолятов ВИЧ-1. 2G12 распознает кластер высокоманнозных гликанов на гликопротеине gpl20 оболочки вируса. Понимание специфичности связывания, нейтрализации и защиты b12 позволит разработать иммуногены, индуцирующие нейтрализующие антитела аналогичной специфичности.
На Фиг.5 показано, как IgG бычьего молозива конкурирует с нейтрализующим mAb b12 человека для связывания на CD4 сайте связывания gpl40. Были проведены конкурентные ИФА путем титрования b12 и 2G12 при постоянном фоне 100 микрограмм IgG или при отношении разведения цельного молозива 1:100. Способность b12 и 2G12 связываться с AD8 (gpl40 клады В) в присутствии или отсутствии IgG молозива была обнаружена с помощью конъюгированного с пероксидазой хрена антитела античеловеческого IgG. Результаты указывают на то, что бычий IgG блокирует связывание активного b12 антитела с CD4 сайтом связывания Env gpl40. Результаты также указывают на то, что бычий IgG от нестельных коров блокирует связывание активного b12 антитела с CD4 сайтом связывания Env gpl40.
ПРИМЕР 11: Молозиво от стельных коров, вакцинированных gpl40 клад А/В/С и от нестельных коров, вакцинированных gpl40 клады В, обладает нейтрализующей активностью широкого спектра действия.
В таблице 6 приведен профиль нейтрализации цельного молозива. Значения представляют собой процентную нейтрализацию при разведении 1:16 против Env-псевдотипированных вирусов усиленного зеленого флуоресцентного белка, включающих обычные лабораторные штаммы и стандартизованную панель Национального института здравоохранения в отношении вирусов клад В и С (ARRP #1 1227, #1 1326) в клетках CF2. Приведенные данные являются репрезентативными данными по результатам двух независимых экспериментов. Результаты указывают на то, что молозиво от стельных коров, вакцинированных gpl40 клад А/В/С, и от нестельных коров, вакцинированных gpl40 клады В обладают нейтрализующей активностью с широким спектром действия. В частности, указанная нейтрализация является кросс-кладовой (гетерологичной) нейтрализацией, при этом молозиво от нестельных коров, вакцинированных растворимыми олигомерами gpl40 Env клады В, нейтрализует ВИЧ клад А, В и С. Более того, молозиво от стельных коров, вакцинированные растворимыми олигомерами gpl40 Env тримикса, нейтрализует ВИЧ клад А, В и С. Результаты также показывают, что неиммунное молозиво обладает нейтрализующей активностью.
|
Профиль нейтрализации: зеленый 0%-25%, желтый 25%-50%; оранжевый 50%-75%; красный 75%-100%.
ПРИМЕР 12: Очищенный IgG молозива обладает нейтрализующей активностью.
Показана нейтрализующая активность очищенного IgG от всех 4-х вакцинированных коров в отношении 2 EGFP Env-псевдотипированных вирусов-репортеров (клада В). Характеристики нейтрализации Env-псевдотипированных вирусов: AD*; резистентные, MN, чувствительные.
Наконец, очевидно, что в изобретение могут быть внесены различные изменения и (или) дополнения, которые не выходят за пределы существа настоящего изобретения.
Будущие заявки на патент могут быть поданы на основе притязания на приоритет из настоящей заявки. Понятно, что нижеприведенная предварительная формула изобретения представлена исключительно в иллюстративных целях и не ограничивает объем того, что может быть заявлено в любой такой будущей заявке. В предварительную формулу могут быть добавлены признаки или удалены из нее в более поздние сроки с целью дополнительного определения или переопределения изобретения или изобретений.