Результат интеллектуальной деятельности: СПОСОБ АВТОМАТИЗИРОВАННОГО ВЫДЕЛЕНИЯ С ОДНОВРЕМЕННОЙ ОЧИСТКОЙ НУКЛЕИНОВЫХ КИСЛОТ ИЗ НЕСКОЛЬКИХ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к биотехнологии, молекулярной биологии, микробиологии и медицине и касается способа автоматизированного выделения с одновременной очисткой нуклеиновых кислот из нескольких биологических образцов. Все стадии разрушения клеток, микроорганизмов и вирусных частиц, очистки и элюции нуклеиновых кислот производятся в автоматическом режиме внутри одноразовых модулей, изолированных от внешней среды и расположенных на вращающейся платформе. Полученные препараты ДНК можно непосредственно использовать для проведения ПЦР и молекулярно-генетических исследований.
Уровень техники
Методы современной молекулярной медицинской диагностики, основанные на анализе нуклеиновых кислот (НК), получают все более широкое распространение в России и во всем мире. Необходимой первой стадией при проведении исследований, является выделение и очистка нуклеиновых кислот (ДНК и РНК) из биологических образцов (физиологические жидкости, образцы тканей, животные и растительные клетки др.), представляющих собой сложные составные системы: смеси НК, белков, липидов, клеточных метаболитов, неорганических ионов и др. Возрастают требования к чистоте полученных препаратов НК, в частности, для того, чтобы ДНК можно было использовать для амплификации, препарат не должен содержать ингибиторы полимеразной цепной реакции (ПЦР).
Выделение НК в большинстве научно-исследовательских и клинических лабораторий мира производится вручную, и этот процесс остается наиболее трудоемкой, а главное, потенциально опасной для персонала стадией анализа при работе с инфекционным материалом. Кроме того, некоторые методы выделения НК требуют применения токсичных органических растворителей (фенол, хлороформ и др.).
Способы автоматического выделения НК из клинических образцов в первую очередь должны применяться при диагностике инфекционных заболеваний человека, таких как туберкулез, СПИД, гепатиты, инфекций, передаваемых половым путем, при диагностике возбудителей неонатальных и внутриутробных инфекций, для идентификации гемотрансмиссивных патогенов. Возрастает число анализов ДНК-идентификации личности и тестов на наличие мутаций и полиморфизмов генома человека для определения индивидуальных предрасположенностей к ряду заболеваний и переносимости некоторых лекарств.
Таким образом, существует острая потребность в создании способов, позволяющих автоматизировать процедуру выделения и очистки НК, соответствующих современным требованиям, таким как быстрота и эффективность проведения всех этапов выделения, безопасность выполнения процедуры для персонала, возможность использовать полученные препараты для проведения ПЦР и последующего молекулярно-генетического анализа. Неуклонный рост числа анализов на основе НК, в частности, анализов, проводимых в медицинских учреждениях, требует также способов одновременного выделения НК из нескольких биологических образцов, которые позволяют значительно упростить процедуру выделения НК для медицинского персонала, во много раз увеличить количество проводимых лабораторией анализов, сократить трудозатраты и уменьшить стоимость проведения анализа.
Классические, получившие широкое распространение лабораторные методы выделения НК описаны, например в J. Sambrook, D.W. Russel, Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press, 2001, NY, v. 1; Short protocols in molecular biology, Wiley, 1995. Этапу очистки НК, как правило, предшествует процедура концентрирования образца, далее происходит лизис клеток (разрушение клеточных стенок или вирусного капсида) и отделение белков, других примесных соединений и нерастворимых частиц.
К способам, позволяющим осуществлять полную или частичную автоматизацию процесса выделения и очистки НК, относятся способы с использованием твердофазных носителей (силикагели, кварцевые волокна, цеолиты и др.), магнитных микрочастиц, фильтрующих элементов.
Методы твердофазной очистки реализуются в микрофлюидных устройствах различного типа или на микрочипах. Например, описан метод очистки НК, включающий сорбцию НК на частицах стекла или кварца или в системе золь-гель в присутствии хаотропных солей, удаление примесей при промывкой водно-спиртовой смесью, элюирование ДНК буферным раствором, в котором можно проводить ПЦР (Н. Tian, A.F. Huhmer, J.P. Landers. Evaluation of silica resins for direct and efficient extraction of DNA from complex biological matrices in a miniaturized format. Anal. Biochem., 2000, v. 283, p. 175-191; K.A. Wolfe, M.C. Breadmore, J.P. Ferrance, M.E. Power, J.F. Conroy, P.M. Norris, J.P. Landers. Toward a microchip-based solid-phase extraction method for isolation of nucleic acids. Electrophoresis, 2002, v. 23, p 727-733).
Для увеличения количества связанной ДНК предложены пористые монолитные матрицы на основе кремния и различных полимеров с большой площадью поверхности и контролируемым размером пор (Q. Wu, J.B. Bienvenue, B.C. Giordano, B.J. Hassan, Y.C. Kwok, P.M. Norris, J.P. Landers, J.P. Ferrance. Microchip-Based macroporous silica sol-sel monolith for efficient isolation of DNA from clinical samples. Anal. Chem., 2006, v. 78, p. 5704-5710; M. Bencina, A. Podgornik, A. Strancar. Characterization of methacrylate monoliths for purification of DNA molecules. J. Sep. Sci., 2004, v. 27, p. 801-810).
Наиболее популярным методом выделения и очистки НК из биологических образов в последние годы является способ с использованием магнитных частиц, например, частиц железа, в виде микросфер контролируемого размера, на поверхности которых иммобилизованы различные лиганды для связывания биологических молекул. Магнитные частицы с адсорбированной НК осаждаются под действием магнитного поля. Увеличение сорбционной емкости частиц достигается путем модификации их поверхности (Magnetic particles for purifying nucleic acids, патент США 6,919,444; Particles having a magnetic core and outer glass layer for separating biological material, патент США 6,255,477). Широко используются частицы Dynabeads®, выпускаемые фирмой Invitrogen Dynal AS. (A. Deggerdal, F. Larsen. Rapid isolation of PCR-ready DNA from blood, bone marrow and cultured cells, based on paramagnetic beads. BioTechniques, 1997, v. 22, p. 554-557; I. Banzola, I. Kaufmann, O. Lapaire, S. Hahn, W. Holzgreve, C. Rusterholz. Isolation of serum nucleic acids for fetal DNA analysis: comparison of manual and automated extraction methods. Prenat. Diagn., 2008, v. 28, p. 1227-1231).
На способе с использованием фильтрующих элементов основано относительно простое устройство для выделения. НК из клеток вирусных частиц и микоплазмы фирмы Millipore Corporation (Filter device for the isolation of a nucleic acid, патент ЕР 183242), в котором очистка НК происходит при последовательном прохождении образца через систему фильтрующих элементов (пористых мембран). Фильтрующие мембраны соединены системой каналов и клапанов. Для одновременной обработки нескольких образцов несколько фильтрующих устройств могут быть собраны в кассету. К недостатками данного способа относится наличие сложной системы из большого числа клапанов, что неизбежно приводит к потерям НК в процессе выделения.
В последние годы получили распространение устройства, в которых реализуются способы автоматизированного выделения и очистки НК, в формате кассет, микрочипов, а также на основе микрофлюидных систем, содержащих сеть микроканалов, через которые пропускаются биологические образцы и растворы реагентов, а также резервуары, в которых проводится разделение компонентов, очистка, концентрирование и другие процедуры.
Патент США 7,491,495 фирмы Roche Diagnostics (США) (Adsorption of nucleic acids to a solid phase) предусматривает метод очистки НК путем адсорбции НК на твердую фазу после проведения лизиса. В качестве твердой фазы используются силикагель, кварцевые волокна, цеолиты и магнитные частицы. Буфер для лизиса содержит фермент, обладающий протеолитической активностью (каспаза, протеиназа К, субтилизин и др.) и детергент.
В патенте США 7,569,346 фирмы Cepheid (США) (Method for separating analyte from a sample) описано выделение и очистка НК из клеток, спор и микроорганизмов в картридже, содержащем совокупность камер и резервуаров с реагентами. Лизис клеток происходит на твердом носителе, например, мембране или бумаге, пропитанной химическими реагентами;одновременно производится высушивание образца при нагревании. НК элюируются при пропускании через мембрану специального раствора. Осуществляется обработка только одного биологического образца.
Патентная заявка WO/2008/002725 фирмы Bio-Rad (США) (Purification and amplification of nucleic acids in a microfluidic device) описывает очистку ДНК и РНК в микрофлюидном устройстве при взаимодействии образца с диатомитом. Следующей стадией является проведение ПЦР в этом же устройстве (для РНК - после обработки обратной транскриптазой). Выход и чистота получаемого продукта в значительной степени зависят от состава используемого образца, выход очищенной НК недостаточно высок. Не описана возможность одновременного выделения НК из нескольких биологических образцов.
В патентной заявке WO/2008/058204 (США) (DNA purification in a multi-stage, multiphase microchip) описана очистка ДНК путем последовательного прохождения через серию хроматографических микроколонок, сформированных на микрочипе. Недостатком устройства является неуниверсальность: необходимость подбирать состав сорбентов для каждого конкретного образца, а также ручное введение реагентов на разных стадиях выделения и очистки. Не описана возможность одновременного выделения НК из нескольких образцов.
Патентные заявки WO/2005/068627 фирмы 3М Innovative Properties (США) (Methods for nucleic acid isolation and kits using a microfluidic device and concentration step) и WO/2005/066343, Сингапур (Nucleic acid purification chip) касаются метода концентрирования и очистки НК для последующего проведения ПЦР в микрофлюидных устройствах и предусматривают прохождение образца через серию резервуаров, в которых осуществляется лизис, сорбция НК, несколько стадий концентрирования и разбавления. Способы осуществляют лишь частичную очистку НК, в основном, от ингибиторов ПЦР. Не описана возможность одновременного выделения НК из нескольких образцов.
Несколько патентов на способ автоматизированного выделения НК в микрофлюидных устройствах принадлежат фирме Samsung Electronics (Корея). В патенте США 7,429,470 (Method for purification of nucleic acids by phase separation using laser and beads) описана очистка НК из клеток и вирусных частиц в капиллярном устройстве с использованием магнитных микрочастиц различного типа: частиц на основе кварца, полимеров, металлов и др., покрытых ферромагнетиком; разрушение клеток и вирусов достигается при облучении лазером. К недостаткам устройства следует отнести также недостаточную очистку НК: в основном, очистку от ингибиторов ПЦР.
Объектом заявки WO/2008/030631, Microchip Biotechnologies, США (Microfluidic devices) является способ очистки НК в микрофлюидной системе, состоящей из совокупности модулей. В одном из модулей лизис клеток производится при обработке ультразвуком в проточном режиме. Очистка ДНК осуществляется путем взаимодействия с магнитными частицами, содержащими аффинный носитель. Система позволяет проводить выделение НК в автоматическом режиме, а также одновременно из нескольких биологических образцов. Недостатком данной системы является ее сложность и необходимость использования дорогостоящего оборудования.
Институтом молекулярной биологии РАН (ИМБ РАН) получен патент на способ автоматизированного выделения и очистки НК из биологических образцов с использованием сменного микрофлюидного модуля (патент РФ №2380418 «Сменный микрофлюидный модуль для автоматизированного выделения и очистки нуклеиновых кислот из биологических образцов и способ выделения и очистки нуклеиновых кислот с его использованием»). Способ предусматривает фильтрацию биологического образца через мембрану, задерживающую микроорганизмы и/или вирусы, лизис клеток на мембране, очистку НК на колонке с твердофазным сорбентом, причем все манипуляции выполняются внутри сменного микрофлюидного модуля, изолирующего образец от внешней среды. Сменный микрофлюидный модуль содержит резервуары для реагентов и реакционные объемы, микроканалы и клапаны. Недостатком данного способа является то, что перемещение газожидкостных потоков внутри модуля осуществляется через систему пневматических клапанов, что приводит к неизбежным потерям НК при проведении процедуры выделения. Кроме того, способ с применением данного микрофлюидного модуля предназначен для выделения НК только из одного образца.
ИМБ РАН запатентовано также устройство для автоматизированного выделения НК (патент РФ на полезную модель №84381 «Устройство для автоматизированного выделения нуклеиновых кислот»). Устройство состоит из картриджа, содержащего резервуары с реагентами для лизиса клеток, микроорганизмов и вирусных частиц, очистки и элюции нуклеиновых кислот, каналы, микроколонки и клапаны, и управляющей установки-контроллера, осуществляющей подачу давления, нагрев, перемешивание реагентов в индивидуальных резервуарах картриджа, а также перемещение реакционных смесей и растворов. Устройство предназначено для выделения НК только из одного биологического образца.
Существует ряд микрофлюидных устройств, в которых одновременно производится выделение ДНК, ее амплификация и последующая детекция:
- одноразовая микрофлюидная карта для выделения и амплификации ДНК из биологических жидкостей фирмы Micronics (США) (Method and system for microfluidic manipulation, amplification and analysis of fluids, for example, bacteria assays and antiglobulin testing, патентная заявка WO/2004/065010, патент США 7,416,892). Очистка НК осуществляется при пропускании образца через встроенную фильтрующую мембрану, на которой задерживаются клетки. Через мембрану последовательно пропускают серию растворов: растворы для лизиса, отмывки, растворы для амплификации и детекции. На этой карте проводится ПЦР-амплификация полученной ДНК, и ПЦР-продукт передается на детектирующий элемент;
- микрофлюидная система («лаборатория-на-чипе») для детекции некоторых возбудителей инфекционных заболеваний (Университет Пенсильвании, США, (Z. Chen, M.G. Mauk, J. Wang, W.R. Abrams, P.L. Corstjens, R.S. Niedbala, D. Malamud, H.H. Bau. A microfluidic system for saliva-based detection of infectious diseases. Ann. NY Acad. Sci., 2007, v. 1098, p. 429-436). В состав системы входит коллектор образца (слюны), одноразовая пластиковая кассета (микрофлюидный чип) для обработки образца, включающей систему для проведения лизиса, экстракции НК, ПЦР, мечения ПЦР-продукта, управляющая платформа-контроллер, а также лазерный сканер для считывания результатов.
- устройство для анализа геномной ДНК фирмы Canon U.S. Life Sciences, США (Method and molecular diagnostic device for detection, analysis and identification of genomic DNA, патентная заявка WO/2007/028084). Выделение ДНК происходит в реакционной камере с использованием магнитных частиц или материалов, меняющих свойства под действием электрического заряда. Устройство состоит из картриджа, в котором проводится выделение ДНК, инжектора, с помощью которого ДНК передается на микрофлюидный чип, включающий зону для ПЦР-амплификации, зону для детекции и зону для анализа ДНК. Возможен одновременный анализ нескольких биологических образцов;
- полностью автоматизированный портативный микрофлюидный чип для обнаружения патогенных микроорганизмов методом ПЦР с детекцией в реальном времени фирмы Cornell Research Foundation, США (Real-time PCR detection of microorganisms using an integrated microfluidic platform, патентная заявка WO/2006/085948). Лизис клеток проводится в растворе, содержащем хаотропные соли; далее проводится отмывка водно-спиртовым раствором для удаления белков и липидов. Микрочип включает модуль для очистки ДНК, который с помощью микроканалов соединен с модулем для ПЦР-детекции.
Микрофлюидные устройства, проводящие выделение ДНК с последующей ПЦР-детекцией, как правило, не являются универсальными, т.е. позволяют выделять ДНК только из образцов определенного типа, либо детектировать заболевания (патогенные микроорганизмы) одного определенного типа.
Описано также несколько устройств, в которых способ выделения и очистки ДНК осуществляется при перемещении жидкостей под действием центрифужных сил. Движение жидкостей определяется частотой и направлением вращения, геометрией каналов и расположением емкостей и резервуаров на вращающемся диске. Перемещение растворов при центрифугировании оказалось удобным использовать в конструкциях микрофлюидиков и «лабораториях-на-чипе» (S. Haeberle, R. Zengerle. Microfluidic platforms for lab-on-a-chip applications. Lab Chip, 2007, v. 7, p. 1094-1110; M. Madou, J. Zoval, G. Jia, H. Kido, J. Kim, N. Kim. Lab on a CD. Annu. Rev. Biomed. Eng., 2006, v. 8, p. 601-628). Разработкой таких систем занимается ряд компаний в Европе, США и Корее (Samsung Electronics).
Способ выделения НК из клеток, вирусных частиц и микоплазмы в устройстве фирмы Millipore Corporation (США) (Filter device for the isolation of a nucleic acid, патент ЕР 1873242) заключается в последовательном пропускании образца через систему фильтрующих элементов (пористых мембран). Движение образца осуществляется с помощью системы насосов, либо картридж с фильтрующими элементами помещается в центрифугу. Несколько картриджей можно объединить в единую систему, которая позволяет одновременную обработку нескольких образцов. К недостаткам данного устройства относится наличие ручных стадий при осуществлении процедуры очистки.
Фирмой Samsung Electronics (Корея) запатентована микрофлюидная платформа в форме CD-диска для выделения и детекции НК, а также для проведения иммуноанализа (Magnetic bead-packing unit using centrifugal force, microfluidic device including the same, and immunoassay method using the microfluidic device, патент ЕР 1900432; Centrifugal force-based microfluidic device for nucleic acid detection and microfluidic system including the same, заявка на патент США 20090035847). Способ выделения НК с использованием этой платформы включает лизис клеток при облучении лазером и сорбцию НК на магнитных частицах. Устройство показало хорошие результаты при выделении НК из цельной крови, содержащей вирус гепатита С (Y.K. Cho, J.G. Lee, J.M. Park, B.S. Lee, Y. Lee, С. Ко. One-step pathogen specific DNA extraction from whole blood on a centrifugal microfluidic device. Lab Chip, 2007, v. 7, p. 565-573). Недостатком этого устройства является неуниверсальность, а также сложная конструкция аппарата, включающего магнитные частицы, блок лазеров, термоконтроллер, систему для регистрации результатов ПЦР.
Фирмой Gyros (Швеция) запатентован метод и устройство в форме CD-диска, содержащего микроканалы, при движении внутри которых происходит отделение НК от примесей (DNA isolation method, патент США 6,992,181; Integrated microfluidic disc, патент США 7,332,126, заявка на патент WO/2001/047638). Устройство позволяет обрабатывать несколько клеточных лизатов одновременно, однако степень очистки полученных препаратов НК недостаточно высока.
В настоящее на рынке приборов существуют дорогостоящие роботизированные системы, обеспечивающие автоматизацию всех стадий обработки биологических образцов. В большинстве из них способ выделения НК основан на принципе их сорбции на магнитных микрочастицах. Среди устройств для автоматизированного выделения и очистки НК одновременно из нескольких образцов, следует отметить устройства следующих фирм:
- Thermo Electron (США): KingFisher, KingFisher mL, KingFisher Flex. Устройства предназначены для выделения НК из физиологических жидкостей; возможна обработка 15-96 образцов. Очистка ДНК, РНК и белков основана на перемещении магнитных частиц;
- Promega (США): Maxwell 16 System. Устройство состоит из системы картриджей, через которые пропускается образец; предназначено только для образцов крови. Картриджи содержат реагенты для обработки образца, включая картридж с магнитными частицами.
- Roche Diagnostics (Германия): приборы MagNA Pure LC, Cobas TaqMan 96/48, Cobas С series. Системы автоматической очистки НК на основе магнитных частиц в формате капилляров или 96-луночных планшетов.
- Qiagen (Германия): BioRobot EZ1, BioRobot MDx, QIAsymphony SP. Роботизированные системы, основанные на применении колонок с магнитными частицами, а также систем картриджей, через которые пропускается биологический образец. Позволяют одновременную обработку до 96 образцов.
- Corbett Technologies, (Австралия): рабочая станция X-tractor GeneTM System. Сложная роботизированная система автоматической экстракции НК, полностью воспроизводящая ручной способ выделения.
Компанией Bioneer Corp.запатентовано устройство для автоматической очистки ДНК (Automatic DNA purification apparatus, заявка на патент WO/2001/025482), состоящее из многочисленных контейнеров для растворов, каналов для прохождения жидкостей, регулируемых клапанами, вакуумного блока, штативов, шприцов для точного количественного введения и отсасывания жидкостей.
Все существующие в настоящее время полностью автоматизированные устройства по выделению НК представляют собой сложные громоздкие конструкции, основанные на применении робототехники. Это определяет высокую стоимость аппаратов (свыше 70 тыс. долл. США), их эксплуатации и высокую стоимость анализов. Устройства, в основном, воспроизводят ручные способы выделения НК, но с использованием роботов: перемещение пробирок, многоканальное дозирование реактивов. Эксплуатация этих систем должна производиться высококвалифицированным персоналом. Кроме того, необходимы постоянные закупки реагентов данной фирмы, которые предназначены для данного конкретного прибора.
Несмотря на высокую стоимость, роботизированные системы не являются универсальными: они позволяют обрабатывать только образцы определенного типа. Кроме того, в большинстве случаев требуется предварительная обработка клинического материала, например, подготовка образцов крови, лизис клеток, которая проводится в ручном режиме.
Из анализа научной и патентной литературы можно сделать вывод, что в настоящее время известны способы выделения и очистки НК из биологических образцов, которые позволяют осуществить автоматизацию процедуры. Наиболее популярным методом является применение магнитных микрочастиц для сорбции НК. На основе разработанных способов сконструированы различные устройства для автоматизированного выделения НК, в частности, относительно простые устройства в формате кассет, микрочипов и на основе микрофлюидных систем, а также сложные роботизированные аппараты, воспроизводящие ручное выделение НК. Для большинства способов, реализуемых в этих устройствах характерны следующие недостатки:
- способы предназначены для выделения НК из биологических образцов определенного типа: только из крови, мочи и др. или для анализа одного типа заболевания;
- способы позволяют осуществлять лишь неполную очистку НК и/или выход НК недостаточен;
- способы, реализуемые в устройствах более простой конструкции, как правило, не позволяют проводить одновременное автоматизированное выделение НК из нескольких биологических образцов, а сложные роботизированные системы для одновременной обработки нескольких образцов слишком дороги и сложны в эксплуатации и при этом не обеспечивают полную безопасность для персонала.
Следует отметить, что проведенный патентный поиск по патентам РФ, кроме патента РФ №2380418 ИМБ РАН и патента на полезную модель №84381 ИМБ РАН, не выявил патентов или заявок, касающихся способов автоматизированного выделения и очистки НК, а также устройств для выделения НК. Имеется лишь несколько патентов РФ, касающихся способов ручного выделения НК, или усовершенствования известных способов выделения и очистки НК, или способа выделения НК из одного определенного источника (клеток микроорганизмов, гистологического материала и т.п.) например, патент РФ №2232768 (способ выделения ДНК методом адсорбции на силикатном сорбенте в присутствии хаотропного агента), патент РФ №2351652 (выделение ДНК из парафинового блока среза гистологического материала), патент РФ №2272027 (способ экстракции НК с использованием стекловолокнистого сорбента, предварительно обработанного раствором плавиковой кислоты), заявка на патент РФ №2006 102723 (обработка клеток растворами, содержащими хаотропные агенты, соли гуанидиния и протеиназу К), заявка на патент РФ №2008109573 (выделение НК путем адсорбции НК на силикатном сорбенте, в качестве которого используются монодисперсные сферические частицы диоксида кремния размерами 100-500 нм).
Предлагаемый способ выделения с одновременной очисткой НК позволяет быстро и с высоким выходом (более 90%) осуществлять процедуру одновременной очистки НК из нескольких биологических образцов в автоматическом режиме. Способ полностью исключает контакт персонала с инфекционным образцом в процессе выделения НК. Полученную ДНК можно использовать для проведения ПЦР.
Раскрытие изобретения
Изобретение относится к способу автоматизированного выделения с одновременной очисткой НК из нескольких (двух и более) биологических образцов. Способ характеризуется тем, что выделение и очистка НК осуществляется в одноразовых модулях, изолированных от внешней среды и содержащих резервуары со всеми реагентами, необходимыми для разрушения клеток, микроорганизмов и вирусных частиц, очистки и элюции НК. Модули располагаются на вращающейся платформе. Перемещение жидкостей внутри модулей может осуществляться либо под действием сил, возникающих при вращении платформы, либо при создании разницы давлений в соответствующих резервуарах модулей. Выделение и очистка НК внутри модулей включает следующие стадии:
а) первая стадия лизиса клеток, микроорганизмов и вирусных частиц с использованием сухой реакционной смеси первого лизирующего буфера, содержащего лизоцим;
б) вторая стадия лизиса клеток, микроорганизмов и вирусных частиц с использованием сухой реакционной смеси второго лизирующего буфера, содержащего хаотропный агент, представляющий собой гуанидинтиоцианат или гуанидингидрохлорид в концентрации 3-6 моль/л, протеолитический фермент, представляющий собой протеиназу К или субтилизин, и детергент, представляющий собой Тритон Х-100 или N-лаурилсаркозил;
в) добавление спирта, представляющего собой этанол или изопропанол, к полученному лизату биологического образца;
г) связывание нуклеиновых кислот на твердофазном сорбенте, выбираемом из группы сорбентов, включающей силикагели, стекловолоконные фильтры, химически модифицированное стекло;
д) растворение сухой реакционной смеси промывочного буфера, содержащего хаотропный агент, представляющий собой гуанидинтиоцианат или гуанидингидрохлорид в концентрации 3-6 моль/л, смесью «этанол-вода»;
е) отмывка НК, связанных с твердофазным сорбентом, от примесей последовательным пропусканием раствора промывочного буфера и смеси «этанол-вода»;
ж) элюция НК с твердофазного сорбента пропусканием элюирующего раствора.
Вращающаяся платформа содержит несколько (два и более) модулей, каждый из которых включает резервуары с сухими реакционными смесями (резервуар с сухой смесью первого лизирующего буфера, резервуар с сухой смесью второго лизирующего буфера, резервуар с сухой смесью промывочного буфера), резервуары, содержащие жидкости-растворители (воду, спирт и смеси «этанол-вода»), резервуар, содержащий твердофазный сорбент, резервуар для сбора отходов, резервуар для сбора очищенных НК, каналы и полости-разделители жидкостных потоков. Растворителем сухой реакционной смеси первого лизирующего буфера, содержащего лизоцим, служит сам жидкий биологический образец. Растворителем сухой реакционной смеси второго лизирующего буфера, является жидкий биологический образец после первой стадии лизиса. Растворителем сухой смеси промывочного буфера является смесь «этанол-вода».
В качестве биологических образцов могут быть использованы цельная кровь, сыворотка крови, плазма крови, слюна или культуральные жидкости, содержащие клетки, микроорганизмы и/или вирусные частицы.
Одноразовые модули представляют собой отдельные элементы, закрепленные на вращающейся платформе, либо модули скомпонованы в виде сплошного блока, вращающегося вокруг центральной оси. Модули в виде отдельных элементов могут быть исполнены в виде сегментов кругового цилиндра, диска или любых других геометрических форм. Выделение и очистка нуклеиновых кислот из каждого биологического образца происходит в отдельном модуле после введения образца в приемную камеру модуля.
На стадиях выделения и очистки НК, где используется спирт или смеси «этанол-вода», в качестве спирта выбирают этанол или изопропанол.
На стадии (а) биологический образец вводится в резервуар с сухой реакционной смесью первого лизирующего буфера, где одновременно происходит растворение сухой реакционной смеси буфера и первая стадия лизиса: разрушение клеточной стенки микроорганизмов. Стадия (а) проводится при перемешивании и нагревании раствора в соответствующем резервуаре.
Образец после 1-ой стадии лизиса поступает в емкость с сухой реакционной смесью второго лизирующего буфера. Перемещение образца осуществляется либо под действием центробежной силы при вращении платформы, либо при создании разницы давлений в соответствующих резервуарах модуля, например, при подаче давления в резервуар с реакционной смесью 1-ой стадии лизиса.
На стадии (б) одновременно происходит растворение сухой реакционной смеси второго лизирующего буфера и окончательное разрушение клеток, микроорганизмов и вирусов с высвобождением НК. Стадия (б) проводится при перемешивании и нагревании раствора в соответствующем резервуаре.
Лизис на стадиях (а) и (б) осуществляется путем обработки реагентами, разрушающими клеточные стенки бактерий и/или оболочки вирусных частиц. На первой стадии лизиса используют лизоцим, на второй стадии лизиса буфер содержит хаотропный агент, представляющий собой гуанидинтиоцианат или гуанидингидрохлорид в концентрации 3-6 моль/л, протеолитический фермент, представляющий собой протеиназу К или субтилизин, и детергент, представляющий собой Тритон Х-100 или N-лаурилсаркозил.
Далее на стадии (в) к полученному лизату биологического образца добавляется спирт (этанол или изопропанол). Подача спирта осуществляется либо под действием центробежной силы при вращении платформы, либо при создании разницы давлений в соответствующих резервуарах модуля.
На стадии (г) происходит связывание НК на твердофазном сорбенте. Твердофазный сорбент выбирают из группы сорбентов, включающей силикагели, стекловолоконные фильтры, химически модифицированное стекло. Перемещение реакционной смеси в резервуар с твердофазным сорбентом осуществляется либо под действием центробежной силы при вращении платформы, либо при создании разницы давлений в соответствующих резервуарах модуля.
Растворение сухой реакционной смеси промывочного буфера, содержащего хаотропный агент, представляющий собой гуанидинтиоцианат или гуанидингидрохлорид в концентрации 3-6 моль/л, происходит на стадии (д) при поступлении в соответствующий резервуар смеси «этанол-вода». Подача смеси осуществляется либо под действием центробежной силы при вращении платформы, либо при создании разницы давлений в соответствующих резервуарах модуля, например, при подаче давления в резервуар с водно-спиртовой смесью. Растворение сухой реакционной смеси промывочного буфера проводится при перемешивании.
На стадии (е) проводится отмывка НК, связанных с твердофазным сорбентом, от примесей последовательным пропусканием раствора промывочного буфера и смеси «этанол-вода», а на стадии (ж) - смыв НК с сорбента элюирующим раствором и поступление очищенных НК в резервуар для сбора продуктов.
Поступление промывочного буфера и смеси «этанол-вода» на стадии (е) и элюирующего раствора на стадии (ж) осуществляется под действием центробежной силы при вращении платформы либо при создании разницы давлений в соответствующих резервуарах модуля.
На стадиях (е) и (ж) растворы после прохождения через твердофазный сорбент попадают в полость-разделитель жидкостных потоков, из которого растворы после промывки твердофазного сорбента (стадия (е)) направляются в резервуар для сбора отходов, а очищенный препарат нуклеиновых кислот после элюции с твердофазного сорбента (стадия (ж)) - в резервуар для сбора очищенных продуктов.
Разделение потоков в полости-разделителе может осуществляться разными способами, например, при использовании системы клапанов, регулируемых давлением, а также при вращении платформы с одноразовыми модулями. Разделение потоков при вращении осуществляется под действием центробежной силы и силы Кориолиса при вращении платформы в разных направлениях, при этом направление перемещения жидкости зависит от направления вращения. В последнем случае на стадии (ж) направление вращения платформы меняется на противоположное по сравнению со стадией (е). Это обеспечивает разделение потоков, при котором растворы после промывки твердофазного сорбента поступают в резервуар для сбора отходов, а очищенный препарат нуклеиновых кислот после элюции с твердофазного сорбента поступает в резервуар для сбора очищенных продуктов.
Перемешивание растворов в резервуарах модуля может осуществляться с использованием электромагнитных мешалок, с помощью перемешивающего устройства типа шейкера или любыми другими способами. Нагревание может осуществляться элементами Пельтье, лампами накаливания, потоками горячего воздуха или любыми другими способами.
Все стадии выделения и очистки НК проводятся в автоматическом режиме. Управление процессом может быть организовано с помощью управляющего контроллера с соответствующей программой. Контроллер осуществляет управление вращением платформы с одноразовыми модулями, созданием разницы давлений в соответствующих резервуарах модулей, управление режимами нагрева и перемешивания реакционных смесей в отдельных резервуарах модуля.
Другие аспекты настоящего изобретения будут ясны из прилагаемых фигур, подробного описания и формулы изобретения.
Предлагаемое изобретение иллюстрируется следующими чертежами:
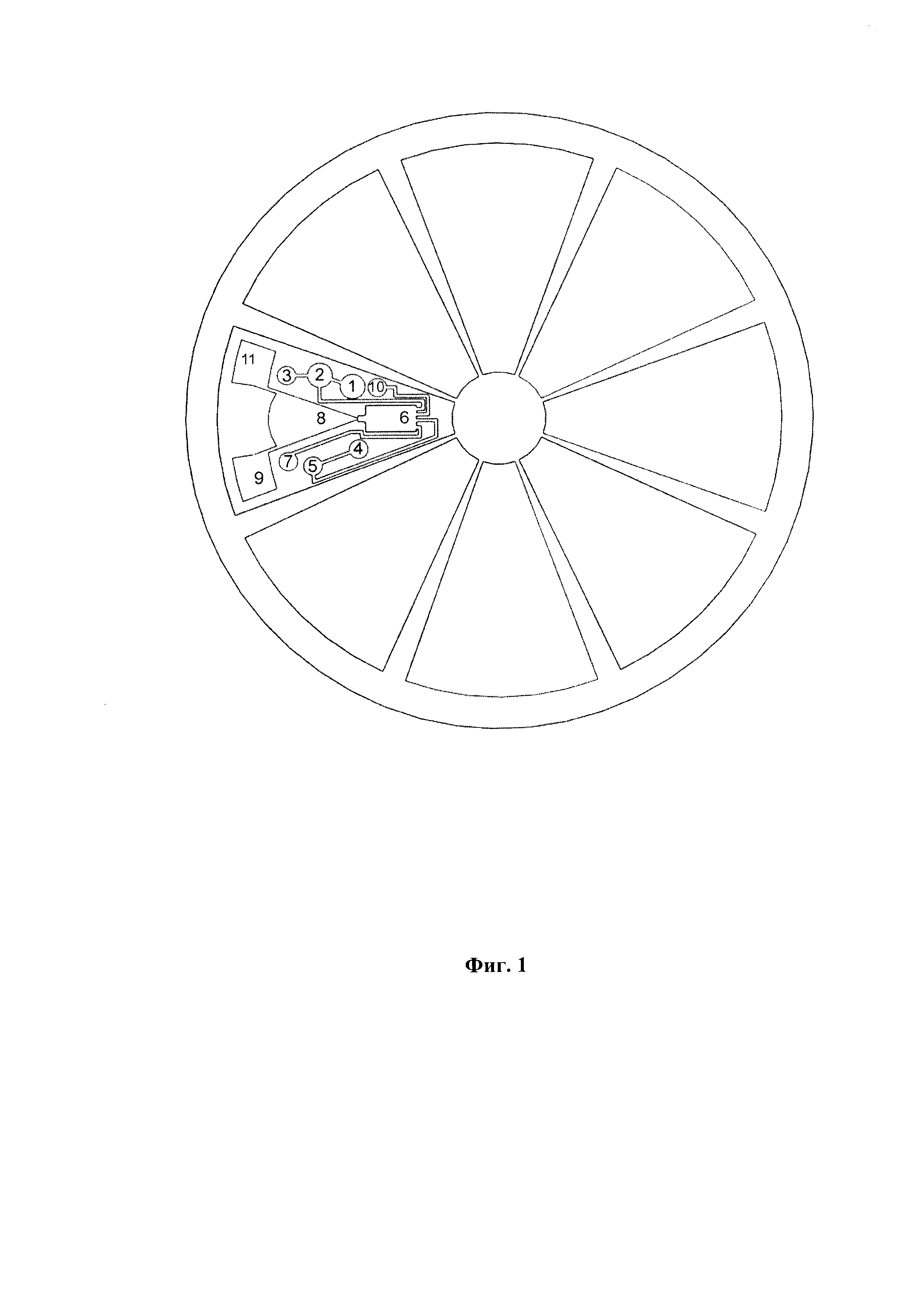
Фиг. 1 представляет схему вращающейся платформы с одноразовыми модулями для осуществления автоматизированного одновременного выделения и очистки НК из нескольких биологических образцов. Каждый модуль содержит резервуары с реагентами, необходимыми для обработки биологического образца. Обозначения:
1 - резервуар с сухой реакционной смесью первого лизирующего буфера (приемная камера);
2 - резервуар с сухой реакционной смесью второго лизирующего буфера;
3 - резервуар, содержащий спирт;
4 - резервуар, содержащий смесь «этанол-вода» (растворитель для сухой реакционной смеси промывочного буфера);
5 - резервуар с сухой реакционной смесью промывочного буфера;
6 - резервуар, содержащий твердофазный сорбент;
7 - резервуар, содержащий смесь «этанол-вода» для промывки твердофазного сорбента;
8 - полость-разделитель жидкостных потоков;
9 - резервуар для сбора отходов;
10 - резервуар, содержащий буфер для элюции;
11 - выходной порт, совместимый со стандартной микропробиркой.
Фиг. 2 представляет фотографию одноразовых модулей, исполненных в виде сегментов кругового цилиндра. (А) Одноразовый модуль для автоматизированного выделения и очистки НК: 12 - верхняя панель (крышка); 13 - прокладка из эластичного материала; 14 - основная рабочая платформа модуля, содержащего резервуары, каналы и др. элементы. (Б) Совокупность восьми модулей, расположенных на вращающейся платформе, для одновременного автоматизированного выделения и очистки НК из восьми биологических образцов.
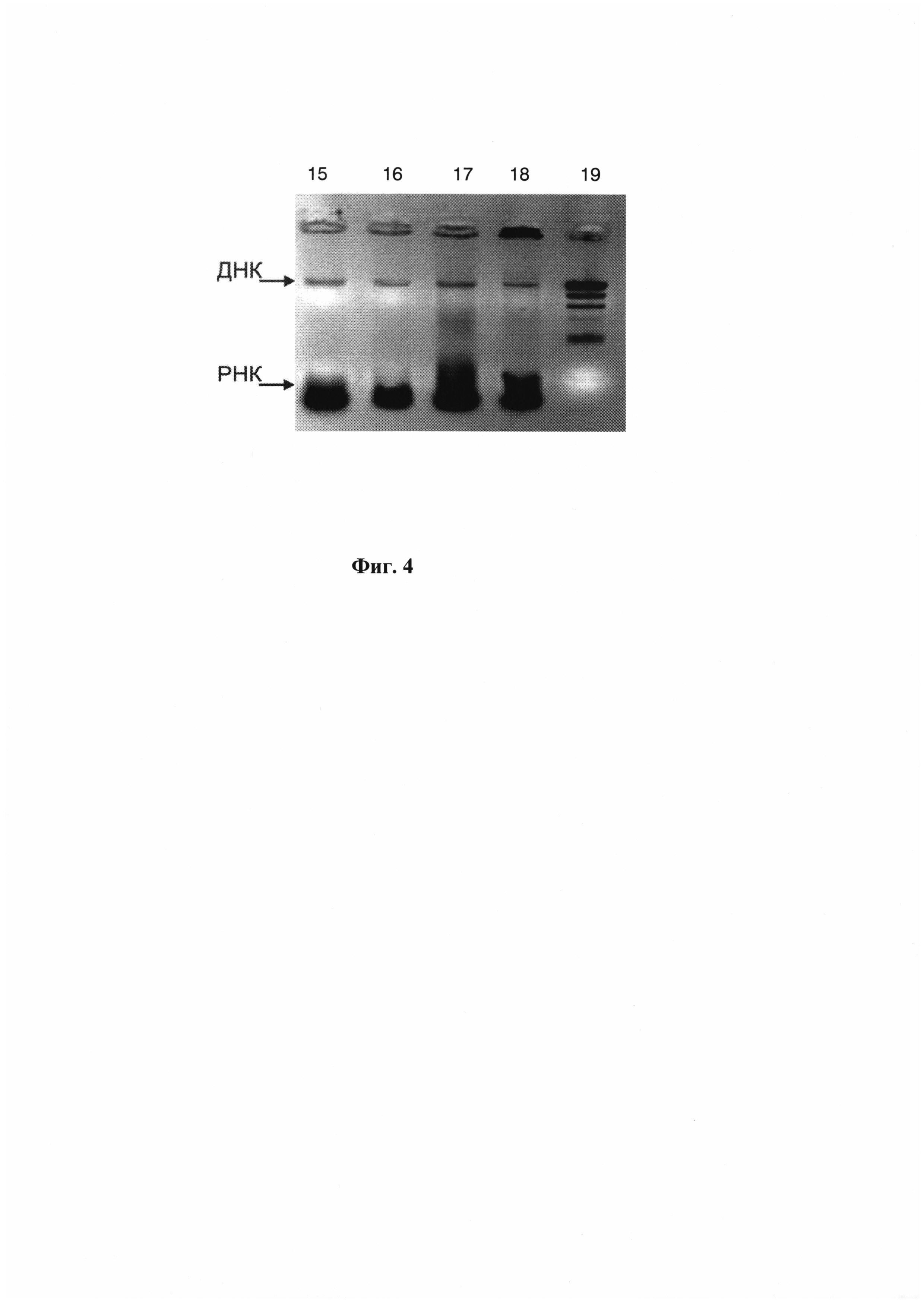
Фиг. 3 демонстрирует схему перемещения жидкости в полости-разделителе модуля при вращении платформы. Жидкость после прохождения через резервуар с твердофазным сорбентом (резервуар 6 на Фиг. 1) попадает в полость-разделитель жидкостных потоков (8 на Фиг. 1), где направление перемещения жидкости зависит от направления вращения. При вращении платформы с модулями вокруг центральной оси по часовой стрелке (А) поток жидкости направляется в одну сторону, а при вращении против часовой стрелки (Б) - в другую под действием центробежной силы (Fцб) и силы Кориолиса (Fк).
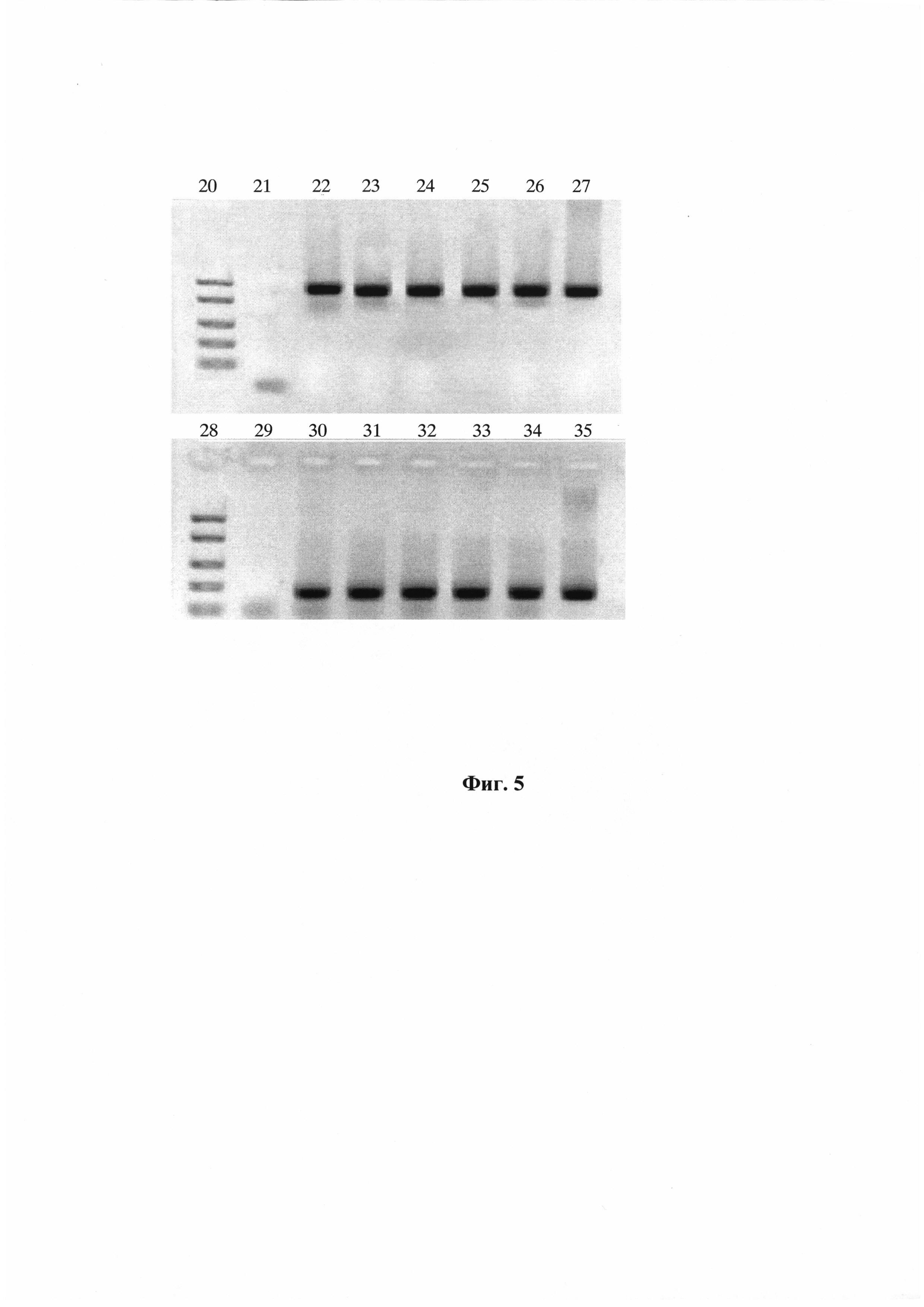
На Фиг. 4 показаны результаты выделения НК из грам-отрицательных (E. coli, 108 КОЕ/мл) и грам-положительных (B. thuringiensis, 1010 КОЕ/мл) бактериальных клеток при использовании способа автоматизированного выделения с одновременной очисткой НК из нескольких образцов внутри одноразовых модулей. Электрофорез в 1% агарозном геле. Дорожки:
1 - препарат НК, выделенный из культуры E. coli стандартным методом;
2 - препарат НК, выделенный из культуры E. coli методом автоматизированного выделения и очистки НК внутри одноразового модуля;
3 - препарат НК, выделенный из культуры B. thuringiensis стандартным методом;
4 - препарат НК, выделенный из культуры B. thuringiensis методом автоматизированного выделения и очистки НК внутри одноразового модуля;
5 - ДНК маркер FastRuler™ DNA Ladder, Middle Range (Ферментас, Литва).
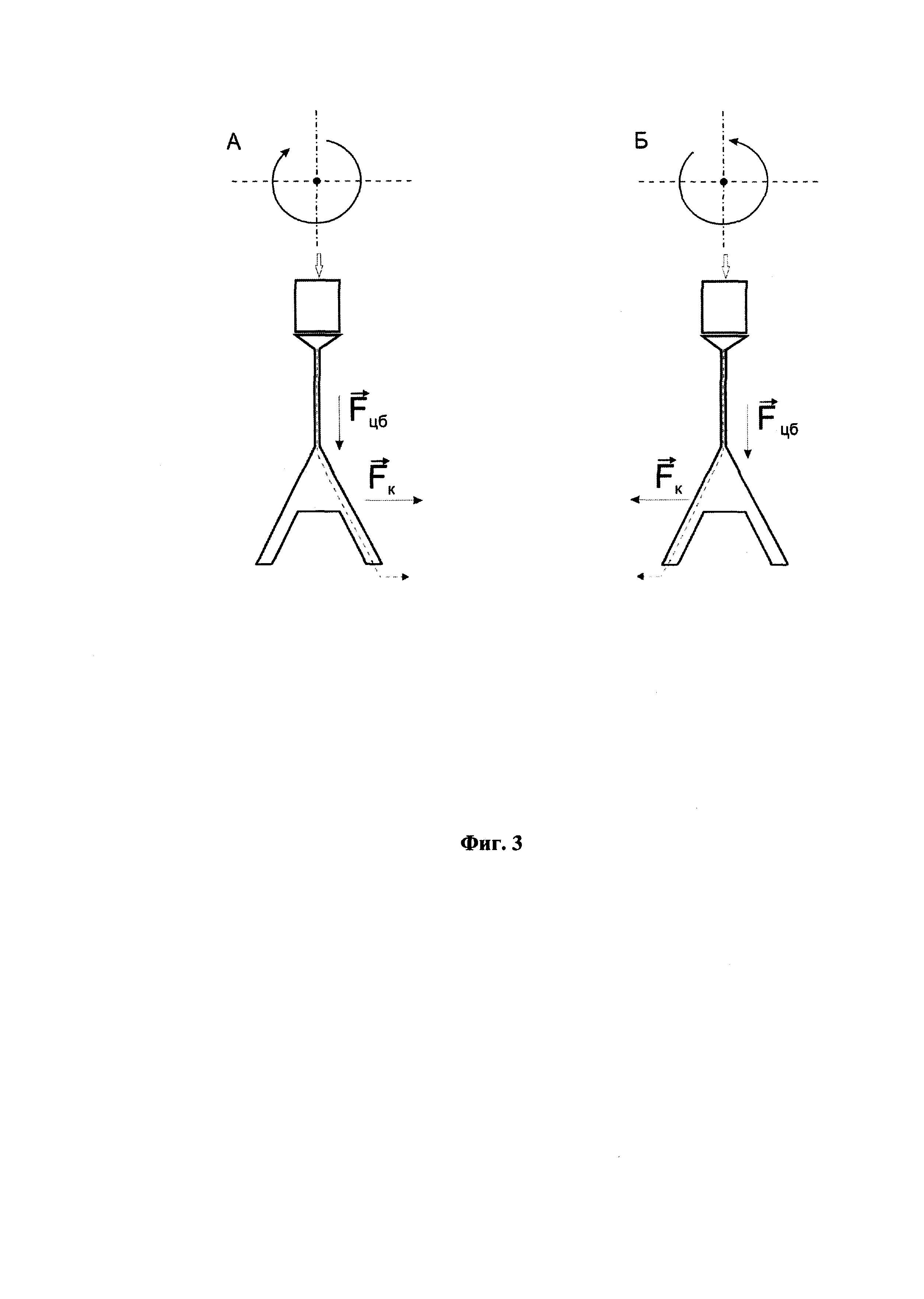
На Фиг. 5 показаны результаты амплификации препаратов РНК, выделенных из образцов, содержащих клетки E. coli К12 (108 КОЕ/мл), инфицированные бактериофагом MS2. РНК выделяли стандартным методом и с использованием способа автоматизированного одновременного выделения и очистки НК из нескольких образцов внутри одноразовых модулей. Электрофорез в 2% агарозном геле. Дорожки:
1, 9 - молекулярный маркер FastRuler Low Range (Fermentas, Литва);
2, 10 - отрицательный контроль;
3-8 - фрагмент рРНК E. coli длиной 800 п.н. после амплификации. Образцы:
3 - клетки E. coli в трис-ЭДТА буфере, РНК выделяли стандартным методом;
4 - клетки E. coli в трис-ЭДТА буфере, автоматизированное выделение РНК;
5 - клетки E. coli в цельной крови, автоматизированное выделение РНК;
6 - клетки E. coli в плазме крови, автоматизированное выделение РНК;
7 - клетки E. coli в моче, автоматизированное выделение РНК;
8 - клетки E. coli в слюне, автоматизированное выделение РНК;
11-16 - фрагмент РНК фага MS2 длиной 220 п. н. после амплификации. Образцы:
11 - клетки E. coli в трис-ЭДТА буфере, РНК выделяли стандартным методом;
12 - клетки E. coli в трис-ЭДТА буфере, автоматизированное выделение РНК;
13 - клетки E. coli в цельной крови, автоматизированное выделение РНК;
14 - клетки E. coli в плазме крови, автоматизированное выделение РНК;
15 - клетки E. coli в моче, автоматизированное выделение РНК;
16 - клетки E. coli в слюне, автоматизированное выделение РНК.
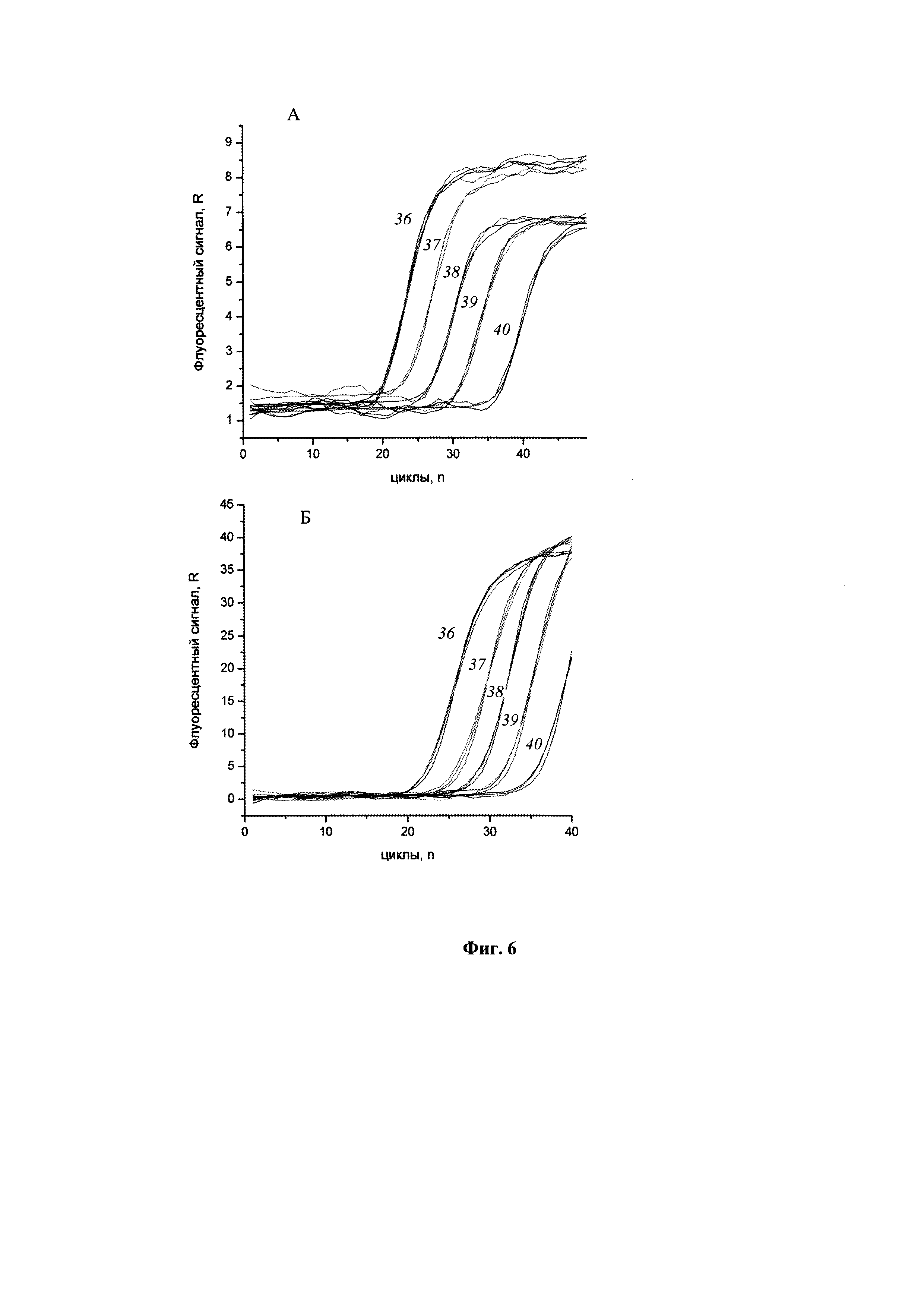
Фиг. 6 представляет результаты проведения ПЦР с детекцией в режиме реального времени с ДНК, полученной из образцов, содержащих E. coli и E. coli, инфицированные фагом λ, методом одновременного автоматизированного выделения и очистки НК в одноразовых модулях. (А) Матрица для ПЦР - ДНК клеток E. coli, выделенная из образцов, содержащих E. coli 108 (1), 107 (2), 106 (3), 105 (4) и 104 (5) клеток/мл. (Б) Матрица для ПЦР - ДНК фага λ, выделенная из образцов, содержащих клетки E. coli, инфицированные фагом λ 108 (1), 107 (2), 106 (3), 105 (4) и 104 (5) клеток/мл.
Осуществление изобретения
Целью настоящего изобретения является разработка способа выделения с одновременной очисткой НК из нескольких (двух и более) биологических образцов, при котором все стадии обработки образцов производятся изолированно от внешней среды в автоматическом режиме. Способ должен обеспечивать выделение и очистку НК с высоким выходом, и полученные НК должны быть очищены от ингибиторов ПЦР.
Способ характеризуется тем, что выделение и очистка НК осуществляется в одноразовых модулях, содержащих резервуары со всеми реагентами, необходимыми для разрушения клеток, микроорганизмов и вирусных частиц, очистки и элюции НК. Модули расположены на вращающейся платформе. Вращающаяся платформа содержит несколько (два и более) модулей со всеми реагентами, необходимыми для обработки биологических образцов. Биологические образцы помещают в приемные камеры модулей, и выделение и очистка нуклеиновых кислот производятся одновременно из нескольких (двух и более) биологических образцов. Перемещение жидкостей внутри модулей осуществляется под действием сил, возникающих при вращении платформы вокруг центральной оси, в частности, центробежной силы и силы Кориолиса, либо при подаче давления в соответствующие резервуары модулей. После внесения биологического образца в одноразовый модуль все стадии его обработки осуществляются внутри модуля изолированно от внешней среды. Выделение и очистка НК из каждого образца происходит в отдельном модуле. При использовании данного способа полностью исключается контакт оператора с потенциально инфицированным образцом и контакт образца с окружающей средой.
Все стадии выделения и очистки НК проводятся в автоматическом режиме. Управление процессом может быть организовано с помощью управляющего контроллера, оснащенного специальной программой. Контроллер осуществляет управление вращением платформы с одноразовыми модулями, созданием разницы давлений в соответствующих резервуарах модулей, управление режимами нагрева и перемешивания реакционных смесей в отдельных резервуарах модуля. Перемешивание растворов в резервуарах модулей может осуществляться с использованием электромагнитных мешалок, с помощью перемешивающего устройства типа шейкера или любыми другими способами. Нагревание может осуществляться элементами Пельтье, лампами накаливания, потоками горячего воздуха или любыми другими способами.
Способ выделения и очистки НК внутри модулей включает последовательное прохождение следующих стадий:
а) первая стадия лизиса клеток, микроорганизмов и вирусных частиц с использованием первого лизирующего буфера, содержащего лизоцим;
б) вторая стадия лизиса клеток, микроорганизмов и вирусных частиц с использованием второго лизирующего буфера, содержащего хаотропный агент, представляющий собой гуанидинтиоцианат или гуанидингидрохлорид в концентрации 3-6 моль/л, протеолитический фермент, представляющий собой протеиназу К или субтилизин, и детергент, представляющий собой Тритон Х-100 или N-лаурилсаркозил;
в) добавление спирта (этанола или изопропанола) к полученным лизатам биологических образцов;
г) связывание НК на твердофазном сорбенте, выбираемом из группы сорбентов, включающей силикагели, стекловолоконные фильтры, химически модифицированное стекло;
д) растворение сухой реакционной смеси промывочного буфера, содержащего хаотропный агент, представляющий собой гуанидинтиоцианат или гуанидингидрохлорид в концентрации 3-6 моль/л, смесью «этанол-вода».
е) отмывка НК, связанных с твердофазным сорбентом, от примесей последовательным пропусканием раствора промывочного буфера и смесью «этанол-вода»;
ж) элюция НК с твердофазного сорбента пропусканием элюирующего раствора.
Предлагаемый способ характеризуется тем, что он использует перемещение жидкостей по каналам и между резервуарами модулей под действием сил, вызванных вращением платформы, на которой расположены модули; перемещение жидкостей может также осуществляться при создании разницы давлений в соответствующих резервуарах модуля.
При использовании вращающейся платформы для перемещения жидкостей достигается высокая скорость перетекания растворов от 1 нл/сек до 1 мл/сек, причем перетекание практически не зависит от рН, ионной силы, химического состава жидкости, значительно уменьшаются потери за счет неполного перетекания растворов и образования пузырей и, соответственно, увеличивается выход продукта (очищенной НК). Кроме того, достигается более эффективное удаление примесей при промывке твердофазного сорбента после сорбции НК и, соответственно, более полная очистка НК. Конструкция устройства для осуществления способа значительно упрощается, достигается возможность миниатюризации и параллельного размещения большого числа модулей на одной вращающейся платформе, что открывает возможность одновременной обработки большого числа биологических образцов.
Схема платформы с одноразовыми модулями для осуществления автоматизированного выделения и очистки НК из биологических образцов представлена на Фиг. 1. Каждый модуль содержит резервуары с сухими реакционными смесями (резервуары 1, 2 и 5), резервуары с растворителями (спирт, вода и смеси «этанол-вода») (резервуары 3, 4, 7 и 10), резервуар с твердофазным сорбентом (6), полость-разделитель жидкостных потоков (8), резервуар для сбора отходов (9), выходной порт для сбора очищенных НК, совместимый со стандартной микропробиркой (11).
Одноразовые модули могут представлять собой отдельные элементы, закрепленные на вращающейся платформе, либо модули могут быть скомпонованы в виде сплошного блока, вращающегося вокруг центральной оси. Модули в виде отдельных элементов могут быть исполнены в виде сегментов кругового цилиндра, диска или любых других геометрических форм. На Фиг. 2 представлена фотография одноразового модуля в виде сегмента кругового цилиндра, а также фотография совокупности восьми модулей, расположенных на вращающейся платформе, для одновременного автоматизированного выделения и очистки НК из восьми биологических образцов.
В предлагаемом способе выделения и очистки НК резервуары модулей содержат жидкости: воду, спирт, смеси «этанол-вода», и сухие смеси для приготовления лизирующих буферов и промывочного буфера. Это значительно увеличивает стабильность реагентов, особенно смесей, содержащих ферменты, при хранении модулей. В качестве спирта используют этанол или изопропанол.
Растворителем сухой реакционной смеси первого лизирующего буфера является сам жидкий биологический образец. Растворителем сухой реакционной смеси второго лизирующего буфера является жидкий биологический образец после первой стадии лизиса. Растворителем сухой смеси промывочного буфера является смесь «этанол-вода».
Процедура автоматизированного выделения с одновременной очисткой НК из нескольких биологических образцов с использованием одноразовых модулей, расположенных на вращающейся платформе, приведена в Примере 1. В качестве биологических образцов для выделения НК используется цельная кровь, сыворотка и плазма крови, слюна или культуральные жидкости, содержащие клетки, микроорганизмы и/или вирусные частицы. Полученные НК можно использовать для проведения ПЦР, включая ПЦР в реальном времени. Результаты выделения НК из различных биологических образцов приведены в Примерах 2-4.
Процедура автоматизированного выделения с одновременной очисткой НК из нескольких биологических образцов осуществляется следующим образом.
Стадия (а). Биологические образцы вводятся в одноразовые модули, которые установлены на вращающейся платформе. Образцы попадают в резервуар с сухой реакционной смесью первого лизирующего буфера, где одновременно происходит растворение сухой смеси буфера и осуществляется первая стадия лизиса. На этой стадии происходит обработка клеток, микроорганизмов и/или вирусов раствором фермента для разрушения клеточных стенок (лизоцим). Стадия (а) проводится при перемешивании и нагревании реакционной смеси.
Перемещение жидкостей. Реакционная смесь после 1-ой стадии лизиса перемещается в резервуар, содержащий сухую смесь второго лизирующего буфера. Водно-спиртовая смесь перемещается в резервуар, содержащий сухую реакционную смесь промывочного буфера. Эти перемещения осуществляются под действием либо центробежной силы при вращении платформы, либо при создании разницы давлений в соответствующих резервуарах. Растворение сухой смеси промывочного буфера проводится при перемешивании.
Стадия (б). Происходит одновременное растворение сухой реакционной смеси второго лизирующего буфера и вторая стадия лизиса с окончательным разрушением клеток, микроорганизмов и вирусов и высвобождением НК. Лизирующий буфер содержит хаотропный агент, представляющий собой гуанидинтиоцианат или гуанидингидрохлорид в высокой (3-6 моль/л) концентрации, протеолитический фермент, представляющий собой протеиназу К или субтилизин, и детергент, представляющий собой Тритон Х-100 или N-лаурилсаркозил. Хаотропный агент используется с целью солюбилизации клеточных компонентов. Кроме того, в присутствии хаотропного агента НК легко сорбируются на силикатных поверхностях (твердофазные сорбенты). Стадия (б) проводится при перемешивании и нагревании раствора.
Перемещение жидкостей. После завершения второй стадии лизиса к реакционной смеси из соответствующего резервуара подается спирт (этанол или изопропанол) для создания оптимальных условий связывания НК с твердофазным сорбентом (стадия в). Далее реакционная смесь поступает в резервуар с твердофазным сорбентом. Подача спирта и перемещение реакционной смеси осуществляются либо под действием центробежной силы при вращении платформы, либо при создании разницы давлений в соответствующих резервуарах.
Стадия (г). Благодаря специфическому составу лизирующего/сорбционного буфера, содержащего хаотропный агент и спирт, НК связываются с твердофазным сорбентом, в то время как другие компоненты (белки, углеводы, полисахариды, липиды и др.) сорбции не подвергаются. Твердофазный сорбент выбирают из группы сорбентов, включающей силикагели, стекловолоконные фильтры, химически модифицированное стекло. Использование твердофазного сорбента позволяет избежать экстракции НК смесью фенол-хлороформ и дает возможность автоматизировать процесс очистки.
Стадия (д). Происходит растворение сухой реакционной смеси промывочного буфера, содержащего хаотропный агент, представляющий собой гуанидинтиоцианат или гуанидингидрохлорид в высокой (3-6 моль/л) концентрации, смесью «этанол-вода». Для этого смесь «этанол-вода» поступает из своего резервуара в резервуар с сухой смесью промывочного буфера. Перемещение смеси «этанол-вода» осуществляется либо под действием центробежной силы при вращении платформы, либо при создании разницы давлений в соответствующих резервуарах. Стадия (д) проводится при перемешивании раствора промывочного буфера в соответствующем резервуаре.
Стадии (е) и (ж). Перемещение жидкостей. Производится промывка твердофазного сорбента раствором промывочного буфера и смесью «этанол-вода» для отмывки сорбента от соединений, неспецифически связавшихся с сорбентом. Поскольку НК нерастворимы в спирте, они остаются связанными с сорбентом. После отмывки НК элюируется с твердофазного сорбента с помощью элюирующего раствора (вода или низкосолевой ТЕ буфер).
Поступление промывочного буфера и смеси «этанол-вода» на стадии (е) и элюирующего раствора на стадии (ж) осуществляется под действием центробежной силы при вращении платформы либо при создании разницы давлений в соответствующих резервуарах модуля.
На стадиях (е) и (ж) растворы после прохождения через твердофазный сорбент попадают в полость-разделитель жидкостных потоков, из которого растворы после промывки твердофазного сорбента (стадия (е)) направляются в резервуар для сбора отходов, а очищенный препарат нуклеиновых кислот после элюции с твердофазного сорбента (стадия (ж)) - в резервуар для сбора очищенных продуктов.
Разделение потоков в полости-разделителе может осуществляться разными способами, например, при использовании системы клапанов, регулируемых давлением, или при вращении платформы с одноразовыми модулями. Разделение потоков при вращении осуществляется под действием центробежной силы и силы Кориолиса при вращении платформы в разных направлениях, при этом направление перемещения жидкости зависит от направления вращения. В последнем случае, на стадии (ж) направление вращения платформы меняется на противоположное по сравнению со стадией (е). Это обеспечивает разделение потоков, при котором растворы после промывки твердофазного сорбента поступают в резервуар для сбора отходов, а очищенный препарат нуклеиновых кислот после элюции с твердофазного сорбента поступает в резервуар для сбора очищенных продуктов.
При перемещении жидкостей под действием сил, возникающих при вращении платформы, достигается более эффективное удаление промывочных растворов при промывке, а также более полная элюция раствора с очищенными НК по сравнению с другими способами, например, с перемещением под действием давления. Результатом этого является получение НК высокой степени очистки с высоким выходом.
Схема перемещения жидкости в полости-разделителе под действием центробежной силы (Fцб) и силы Кориолиса (Fк) приведена на Фиг. 3. При малой частоте вращения, когда сила Кориолиса незначительна, жидкость будет поступать одновременно в оба канала полости-разделителя. При достаточно большой частоте вращения вся жидкость целиком будет перетекать в одно из ответвлений полости-разделителя в зависимости от направления вращения. Растворы попадают в полость-разделитель после прохождения через твердофазный сорбент. На стадии (ж) направление вращения платформы меняется на противоположное по сравнению со стадией (е), и растворы после промывки твердофазного сорбента на стадии (е) направляются в резервуар для сбора отходов, а очищенный препарат нуклеиновых кислот на стадии элюции нуклеиновых кислот с сорбента на стадии (ж) поступает в резервуар для сбора очищенных продуктов (Фиг. 3).
Далее изобретение проиллюстрировано примерами, которые предназначены для обеспечения лучшего понимания сущности заявленного изобретения, но не должны рассматриваться как ограничивающие данное изобретение.
Примеры
Пример 1. Реализация способа автоматизированного выделения с одновременной очисткой НК из нескольких биологических образцов с использованием одноразовых модулей, расположенных на вращающейся платформе
Способ одновременного автоматизированного выделения и очистки НК из нескольких биологических образцов осуществляли в одноразовых модулях, схема расположения резервуаров в которых приведена на Фиг. 1. Модули представляли собой сегменты кругового цилиндра высотой 370 мм и длиной 800 мм. Восемь модулей устанавливали на вращающуюся платформу радиусом 900 мм (Фиг. 2).
Резервуары (1) заполняли сухой реакционной смесью для приготовления первого лизирующего буфера (10 мМ трис-HCl буфер, содержащий 1 мМ этилендиаминтетрауксусной кислоты и 50 мг/мл лизоцима, рН 8,0), резервуары (2) - сухой реакционной смесью для приготовления второго лизирующего буфера (10 мМ трис-HCl буфер, содержащий 1 мМ этилендиаминтетрауксусной кислоты, 4,5 М гуанидингидрохлорида, 1 мг/мл протеиназы К, 0,5% N-лаурилсаркозила, рН 8,0), резервуары (3) - 96%-ным этанолом, резервуары (4) - смесью «этанол-вода» 40:60, резервуары (5) - сухой реакционной смесью для приготовления промывочного буфера (0,15 М трис-HCl буфер, содержащий, 0,05 М этилендиаминтетрауксусной кислоты, 5 М гуанидинтиоцианата, рН 8,0), резервуары (6) - 5 мкл водной суспензии силикагеля G60 фирмы Merck, Германия, резервуары (7) - смесью «этанол-вода» 70: 30, резервуары (10) - буфером для элюции НК: 0,15 М Трис, рН 7,0, содержащий 0,05 М этилендиаминтетрауксусной кислоты, рН 7,0 или деионизованная вода.
Биологические образцы (100-500 мкл) с помощью пипетки или любого дозирующего устройства помещали в приемные камеры модулей. Далее все операции производились одновременно для 8 образцов, причем выделение и очистка НК из каждого биологического образца происходила в отдельном модуле.
Все стадии выделения с одновременной очисткой НК проводили в автоматическом режиме. Управление процессом проводилось с помощью управляющего контроллера, который осуществлял управление вращением платформы с одноразовыми модулями, подачей давления в соответствующие резервуары модулей при перемещении жидкостей, управление режимами нагрева и перемешивания реакционных смесей в отдельных резервуарах модуля. Подача давления осуществлялась с помощью компрессора. Перемешивание растворов в резервуарах модуля проводилось с использованием встроенного шейкера, нагревание -потоками горячего воздуха.
Процедура выделения с одновременной очисткой НК в одноразовых модулях
(1) Каждый образец поступал в резервуар модуля с сухой реакционной смесью первого лизирующего буфера (резервуары 1 на Фиг. 1). Производили нагревание растворов в резервуарах (1) до 37°С и перемешивание раствора в течение 5 мин. Происходило одновременное растворение сухой реакционной смеси буфера и первая стадия лизиса.
(2) Вращение платформы с частотой 1000 об/мин, 1 мин. При вращении образцы после 1-ой стадии лизиса из резервуаров (1) перемещались в резервуары (2) с сухой реакционной смесью второго лизирующего буфера. После остановки центрифуги производили нагревание растворов в резервуарах (2) до 60°С и перемешивание в течение 15 мин. Происходило одновременное растворение сухой реакционной смеси буфера и вторая стадия лизиса.
(3) Подача давления в резервуары (3), содержащие 96% этанол. Этанол из резервуаров (3) поступал в резервуары (2), содержащие лизат, для создания оптимальных условий связывания НК с твердофазным сорбентом.
(4) Вращение платформы с частотой 5000 об/мин, 1 мин. При вращении происходила подача смеси этанол-вода из резервуаров (4) в резервуары (5) с сухой смесью промывочного буфера. После остановки центрифуги производили нагревание растворов в резервуарах (5) до 60°С и перемешивание растворов в резервуарах (2) и (5).
(5) Подача давления в резервуары (2), содержащие смесь лизатов с этанолом. Реакционные смеси из резервуаров (2) перекачивались в резервуары (6), содержащие силикагель G60. На этой стадии происходило связывание НК с твердофазным сорбентом.
(6) Вращение платформы с частотой 7000 об/мин, 1 мин. Происходило удаление веществ, не связавшихся с твердофазным сорбентом, в емкость для отходов. После резервуаров (6) растворы при вращении попадали в полости-разделители жидкостных потоков и далее перемещались в резервуары (9) для сбора отходов.
(7) После остановки центрифуги производили подачу давления в резервуары (5) с промывочным буфером, и буфер далее поступал в резервуары (6), содержащие силикагель.
(8) Вращение платформы с частотой 7000 об/мин, 1 мин. Промывка твердофазного сорбента (силикагеля). Вещества, не связавшиеся с силикагелем, удалялись в емкость для отходов. После резервуаров (6) растворы при вращении попадали в полости-разделители жидкостных потоков и далее перемещались в резервуары (9) для сбора отходов.
(9) После остановки центрифуги производили подачу давления в резервуары (7), содержащие 80%-ный этанол, и этанол из резервуаров (7) поступал резервуары (6) для промывки твердофазного сорбента. Этанол (80%) использовали в качестве второго промывочного буфера.
(10) Вращение платформы с частотой 7000 об/мин, 3 мин. Удаление веществ, не связавшихся с силикагелем в емкость для отходов. После резервуаров (6) этанол при вращении попадал в полость-разделитель жидкостных потоков Y-образной формы и далее перемещался в резервуары (9) для сбора отходов.
(11) После остановки центрифуги производили подачу давления в резервуары (10), содержащие буфер для элюции, и буфер далее поступал в резервуары (6) с силикагелем.
(12) Вращение платформы с частотой 7000 об/мин в сторону, противоположную вращению на этапах (6), (8) и (10), 1 мин. На этом этапе происходила элюция НК с твердофазного сорбента. После резервуаров (6) раствор очищенных НК при вращении попадал в полость-разделитель жидкостных потоков и далее перемещался в приемные камеры для образцов (11), совместимые со стандартными пробирками для проведения ПЦР.
Общее время проведения выделения и очистки НК составляло 30 мин. Результаты выделения НК из различных биологических образцов и результаты проведения ПЦР с полученными препаратами НК приведены в Примерах 2-4.
Пример 2. Одновременное выделение НК из грам-отрицательных (Escherichia colt) и грам-положительных (Bacillus thuringiensis) бактерий с использованием способа автоматизированного выделения с одновременной очисткой НК внутри одноразовых модулей, расположенных на вращающейся платформе
Культуры грам-отрицательных клеток E. coli, 108 КОЕ/мл, и грам-положительных клеток B.thuringiensis, 1010 КОЕ/мл помещали по 0,1 мл в приемные камеры модулей, расположенных на вращающейся платформе, и проводили одновременное выделение и очистку НК из 8 образцов согласно процедуре, описанной в Примере 1.
В качестве метода сравнения использовали стандартную процедуру выделения НК, включающую лизис клеток, последующую экстракцию НК смесью фенол-хлороформ, переосаждение НК этанолом.
Результаты выделения НК представлены на Фиг. 4. Как видно из фигуры, на электрофорезной картине в 1% агарозном геле во всех препаратах наблюдается наличие специфичных полос, соответствующих геномной ДНК и двойной (или размытой) полосы на уровне 1500-2200 п. н. (относительно ДНК FastRuler™ DNA Ladder, Middle Range (Ферментас, Литва), соответствующих рибосомной РНК (рРНК).
Концентрации полученных НК были измерены спектрофотометрическим методом (Таблица 1).
Во всех экспериментах концентрации ДНК, выделенных автоматизированным методом, отличались от концентрации НК, выделенных стандартным методом, не более чем на 20%. Таким образом, способ автоматизированного выделения с одновременной очисткой НК внутри одноразовых модулей обеспечивает выделение НК из грам-положительных и грам-отрицательных клеток с эффективностью, не уступающей стандартной методике выделения.

Пример 3. Одновременное выделение РНК из нескольких биологических образцов, содержащих клетки E. coli, инфицированные бактериофагом MS2, с использованием способа автоматизированного выделения с одновременной очисткой НК внутри одноразовых модулей, расположенных на вращающейся платформе. Проведение ПЦР с полученными НК
Для проверки эффективности выделения НК из различных биологических образцов, содержащих вирусные частицы, проводили выделение НК из клеток E. coli, инфицированных бактериофагом MS2. Клетки E. coli, штамм К12, 108 КОЕ/мл, инфицированные бактериофагом MS2, суспендировали в 300 мкл трис-ЭДТА буфера, цельной крови, плазмы крови, мочи, слюны и проводили одновременное выделение и очистку НК из 8 образцов согласно процедуре, описанной в Примере 1. Для экспериментов использовали по 0,3 мл образцов.
Эффективность выделения вирусных и бактериальных нуклеиновых кислот проверяли амплификацией РНК бактериофага MS2 и рРНК E. coli с помощью метода ОТ-ПЦР со специфичными праймерами. В качестве сравнения использовали НК, выделенные из клеток E. coli, суспендированных в буфере ТЕ, стандартным методом с использованием набора «RNeasy Mini» фирм Qiagen, Германия.
Результаты представлены на Фиг. 5. Как видно из фигуры, на электрофорезной картине в 2% агарозном геле при амплификации фрагмента рРНК E. coli во всех препаратах наблюдается наличие специфичных полос ПЦР-продукта длиной 800 п.н. (дорожки 3-8), а при амплификации фрагмента РНК фага MS2 - специфичных полос ПЦР-продукта длиной 220 п.н. (дорожки 11-16).
Таким образом, способ автоматизированного выделения с одновременной очисткой НК внутри одноразовых модулей позволяет выделять вирусные и бактериальные НК из различных клинических образцов (цельная кровь, плазма крови, слюна, моча), и полученные НК можно использовать для проведения ПЦР.
Пример 4. Одновременное выделение РНК из образцов, содержащих клетки E. coli, и клетки E. coli, инфицированные фагом λ, с использованием способа автоматизированного выделения и очистки НК внутри одноразовых модулей, расположенных на вращающейся платформе. Проведение ПЦР в режиме реального времени
Проведено выделение НК из клеток E. coli и клеток E. coli, инфицированных фагом λ, в различных разведениях с использованием способа автоматизированного выделения и очистки НК внутри одноразовых модулей, расположенных на вращающейся платформе. Проводили одновременное выделение и очистку НК из 8 образцов согласно процедуре, описанной в Примере 1. Для экспериментов использовали по 0,5 мл образцов. Количество клеток составляло 104-108 в 1 мл образца.
После выделения бактериальной и фаговой ДНК из разведений бактериальных клеток E. coli проводили ПЦР с детекцией в режиме реального времени с праймерами, специфичными к геному E. coli и фага λ. Результаты ПЦР представлены на Фиг. 6.
Как показывают результаты, предложенный способ одновременного автоматизированного выделения и очистки НК внутри одноразовых модулей позволяет эффективно выделять бактериальную и вирусную НК из образцов, содержащих до 104 частиц в исследуемом образце, и полученные препараты могут быть использованы непосредственно для проведения ПЦР, в том числе ПЦР с детекцией в режиме реального времени.
Таким образом, представленный способ позволяет проводить выделение с одновременной очисткой НК бактерий и/или вирусных частиц из нескольких (двух и более) биологических образцов, таких как цельная кровь, сыворотка крови, плазма крови, слюна или культуральные жидкости. Все стадии обработки образцов производятся изолированно от внешней среды в автоматическом режиме. Способ позволяет проводить выделение и очистку НК с высоким выходом, низкими потерями и малым временем (30 мин). Полученный препарат НК может быть использован без дополнительной очистки непосредственно для проведения ПЦР, в том числе ПЦР с детекцией в режиме реального времени, или для гибридизации НК при проведении молекулярно-генетического анализа и для идентификации инфекционных агентов.