Результат интеллектуальной деятельности: КОМПОЗИЦИИ, СПОСОБЫ И СИСТЕМЫ ДЛЯ РЕСПИРАТОРНОЙ ДОСТАВКИ ДВУХ ИЛИ БОЛЕЕ АКТИВНЫХ АГЕНТОВ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее описание относится, в целом, к композициям, способам и системам для респираторной доставки двух или более активных агентов. В определенных вариантах осуществления, настоящее раскрытие относится к композициям, способам и системам для респираторной доставки двух или более активных агентов, где, по меньшей мере, один из активных агентов выбран из мускаринового антагониста длительного действия ("LAMA") или β2 адренергическего агониста длительного действия ("LABA") и кортикостероидных активных агентов.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Часто возникает необходимость в способах направленной доставки лекарственных средств, с помощью которых активные агенты доставляются к месту действия. Например, направленная доставка активных агентов может уменьшить нежелательные, побочные эффекты, снизить требуемую дозировку и уменьшить стоимость лечения. В контексте респираторной доставки, ингаляторы представляют собой хорошо известные устройства для введения активных агентов в дыхательные пути субъекта, и в настоящее время существует несколько коммерчески доступных различных ингаляционных систем. Три обычных системы ингаляторов включают порошковые ингаляторы, небулайзеры и дозирующие ингаляторы (MDI).
Дозирующие ингаляторы могут использоваться для доставки лекарственных средств, в солюбилизированной форме или виде суспензии. Обычно в таких ингаляторах применяется пропеллент с относительно высоким давлением пара для распыления аэрозолизированных тонкодисперсных капель, содержащих активный агент, в дыхательные пути при активации дозирующего ингалятора. Порошковые ингаляторы обычно основаны на усилиях пациента при вдохе, для введения медикамента в форме сухого порошка в дыхательные пути. С другой стороны, небулайзеры образуют аэрозоль из лекарственного средства, вдыхаемый посредством придания энергии жидкому раствору или суспензии.
MDI представляют собой активные устройства для доставки, которые используют давление, создаваемое пропеллентом. Традиционно в качестве пропеллента в дозированных ингаляторах использовали хлорфторуглероды (CFC) вследствие их низкой токсичности, желательного давления паров и пригодности к образованию стабильной суспензии. Однако следует понимать, что традиционные CFC пропелленты отрицательно влияют на окружающую среду, что привело к разработке альтернативных пропеллентов, которые, как полагают, являются более благоприятными для окружающей среды, таких как перфторированные соединения (PFC) и гидрофторалканы (HFA).
Активный агент, доставляемый посредством суспензионного MDI, обычно предоставляется в форме тонкодисперсных частиц, диспергированных в пропелленте или комбинации из двух или более пропеллентов (т.н. пропеллентной “системе”). С целью получения тонкодисперсных частиц активный агент обычно микронизируют. Тонкодисперсные частицы активного вещества, суспендированные в пропелленте или пропеллентной системе, склонны к быстрой агрегации или флоккуляции. Это особенно характерно для активных агентов, представленных в микронизированной форме. В свою очередь, агрегация или флоккуляция этих тонкодисперсных частиц может затруднить доставку активного агента. Например, агрегация или флоккуляция могут привести к механическим неполадкам, таким как те, которые могут быть вызваны возможной закупоркой отверстия клапана аэрозольного контейнера. Нежелательные агрегация или флоккуляция частиц лекарственного средства могут также привести к быстрому осаждению или вспениванию частиц лекарственного средства, и такое поведение может приводить к доставке несоответствующей дозы, что может создать особенную сложность при использовании сильнодействующих медикаментов с низкой дозировкой. Еще одна проблема, связанная с такими суспензионными готовыми лекарственными формами для MDI, относится к росту кристаллов лекарственного средства во время хранения, что со временем ведет к снижению свойств аэрозоля и однородности доставляемой дозы таких дозирующих ингаляторов. В последнее время были предложены новые подходы для готовых лекарственных форм для дозирующих ингаляторов, содержащих антихолинергические средства, такие как те, что описаны в патенте США № 6964759.
Одним из подходов для улучшения характеристик аэрозоля в порошковых ингаляторах было включение тонкодисперсных частиц носителя, такого, как лактоза. Применение таких тонкодисперсных эксципиентов для дозирующих ингаляторов в достаточной мере не исследовано. Недавнее сообщение Young et al., "The influence of micronized particulates on the aerosolization properties of pressurized metered dose inhalers"; Aerosol Science 40, стр. 324-337 (2009), предполагает, что применение тонкодисперсных частиц такого носителя в дозирующих ингаляторах на самом деле ведет к снижению эксплуатационных качеств аэрозоля.
В традиционных системах на основе CFC, когда активный агент, представленный в композиции для дозирующего ингалятора, суспендирован в пропелленте или системе пропеллентов, для покрытия поверхностей активного агента часто применяются поверхностно-активные вещества, для минимизации или предотвращения проблемы агрегации и поддержания по существу однородной дисперсии. Применение поверхностно-активных веществ, таким образом, иногда называют “стабилизацией” суспензии. Однако многие поверхностно-активные вещества, которые являются растворимыми и, таким образом, эффективными в системах с CFC, неэффективны в системах пропеллентов с HFA и PFC, поскольку такие поверхностно-активные вещества проявляют иные характеристики растворимости в пропеллентах без CFC.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
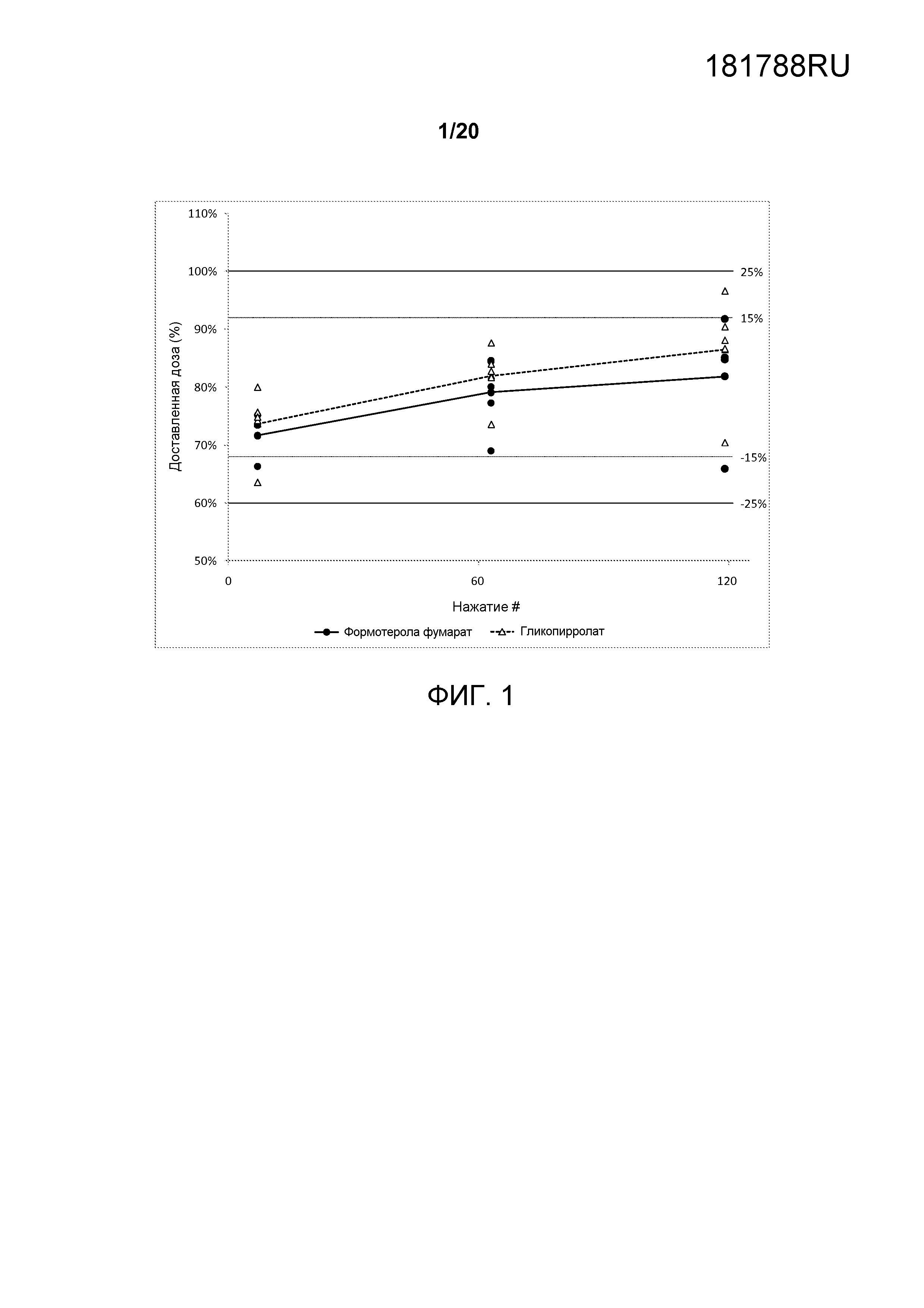
На ФИГ. 1 представлен график, который изображает однородность доставляемой дозы со-суспензионной готовой лекарственной формы, содержащей гликопирролат и формотерола фумарат, полученной в соответствии с настоящим описанием.
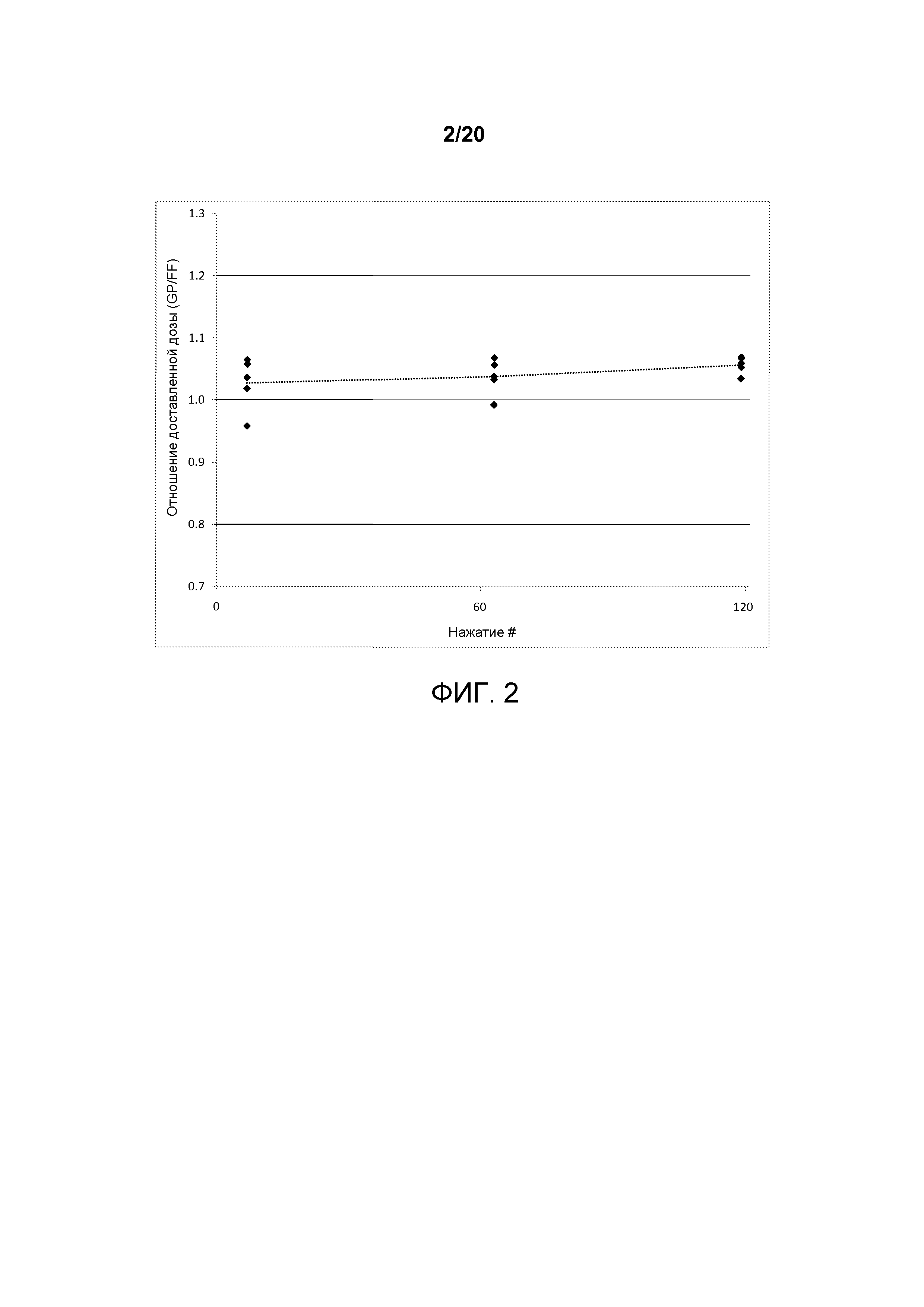
На ФИГ. 2 представлен график, который изображает соотношение доставляемой дозы для со-суспензионной готовой лекарственной формы ФИГ.1.
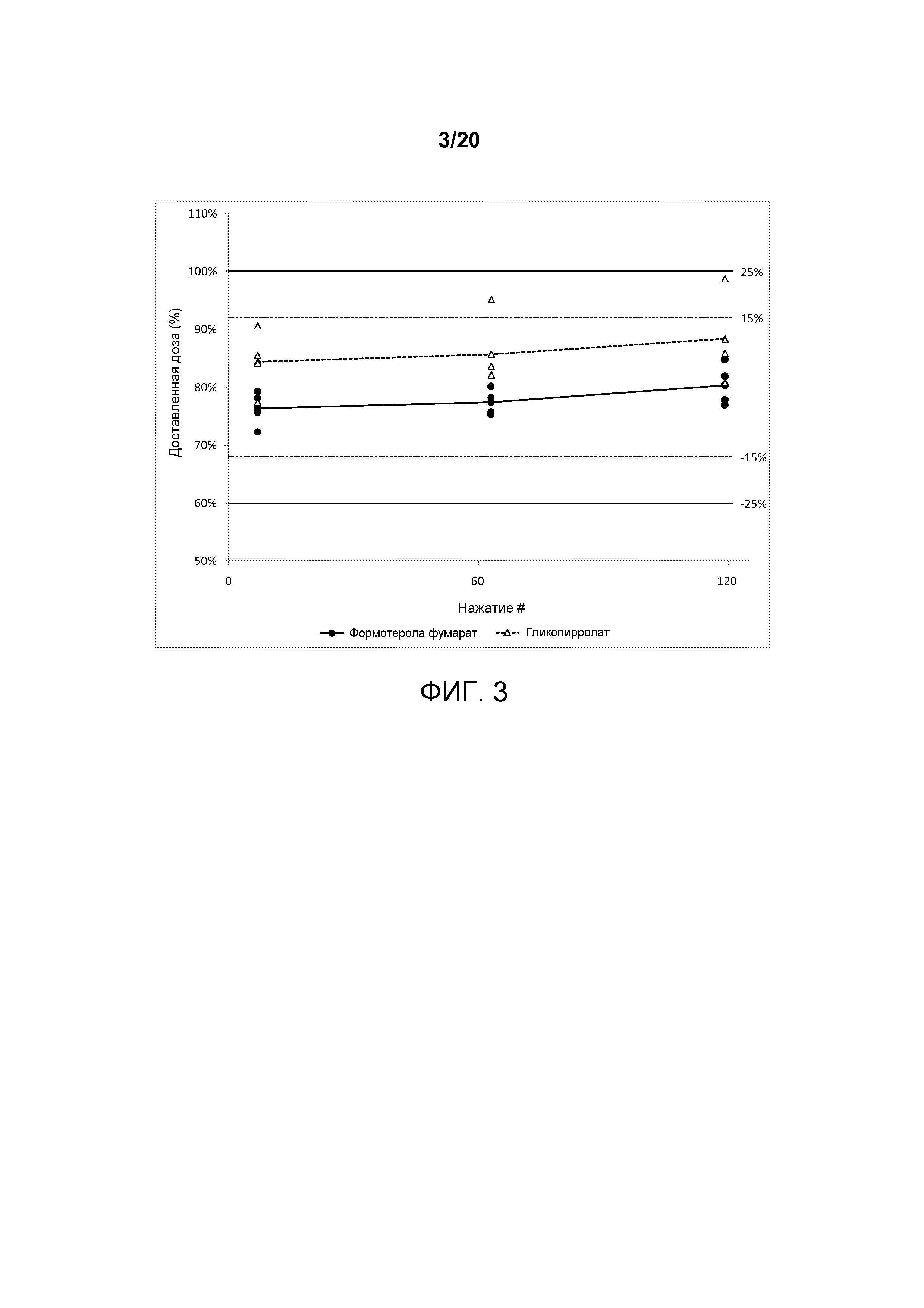
На ФИГ. 3 представлен график, который изображает однородность доставляемой дозы второй со-суспензионной готовой лекарственной формы, полученной в соответствии с настоящим описанием.
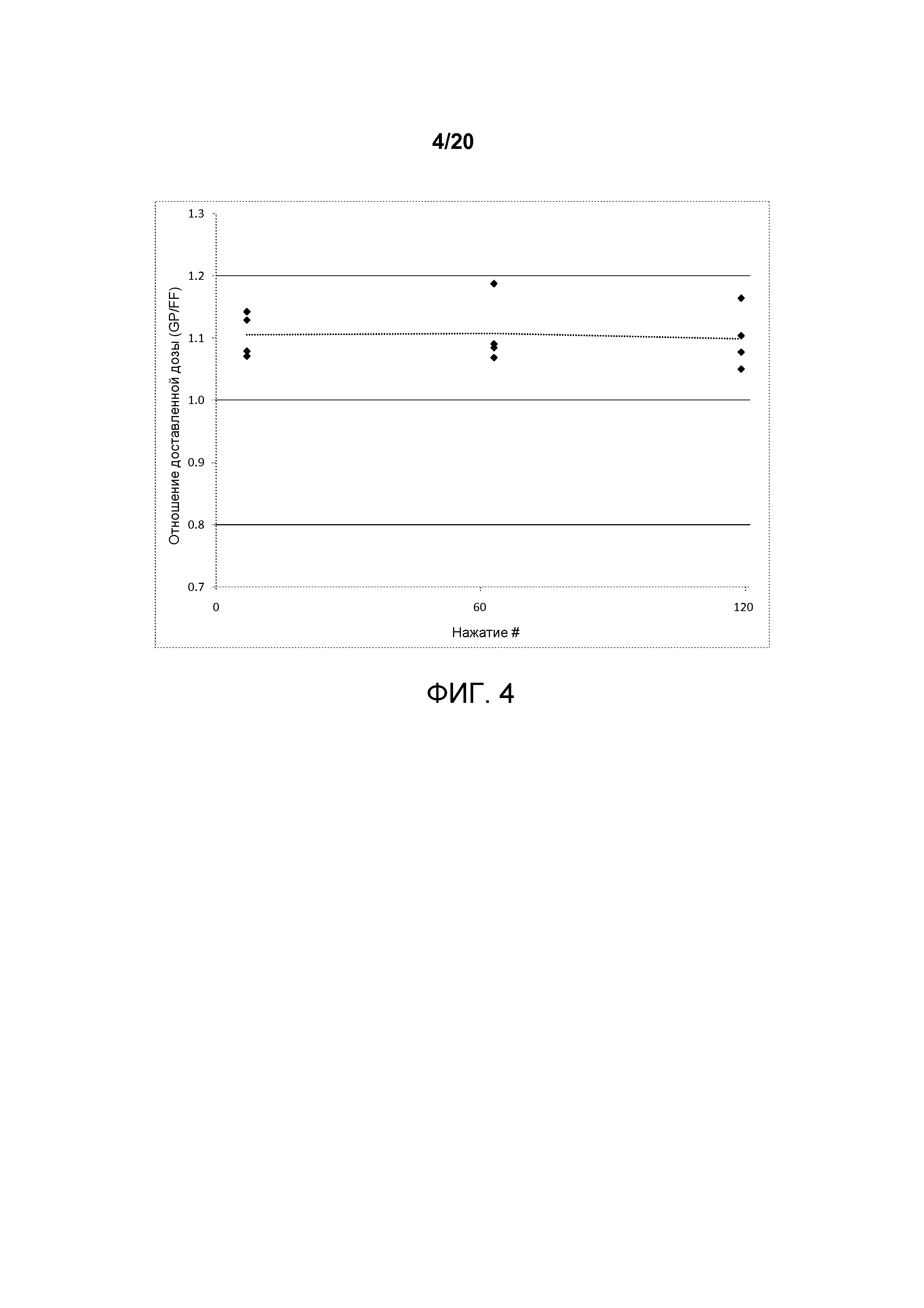
На ФИГ. 4 представлен график, который изображает соотношение доставляемой дозы второй со-суспензионной готовой лекарственной формы ФИГ. 3.
На ФИГ. 5 представлен график, который изображает однородность доставляемой дозы гликопирролата и формотерола фумарата в со-суспензионной готовой лекарственной форме, полученной в соответствии с настоящим описанием, при хранении в различных указанных условиях.
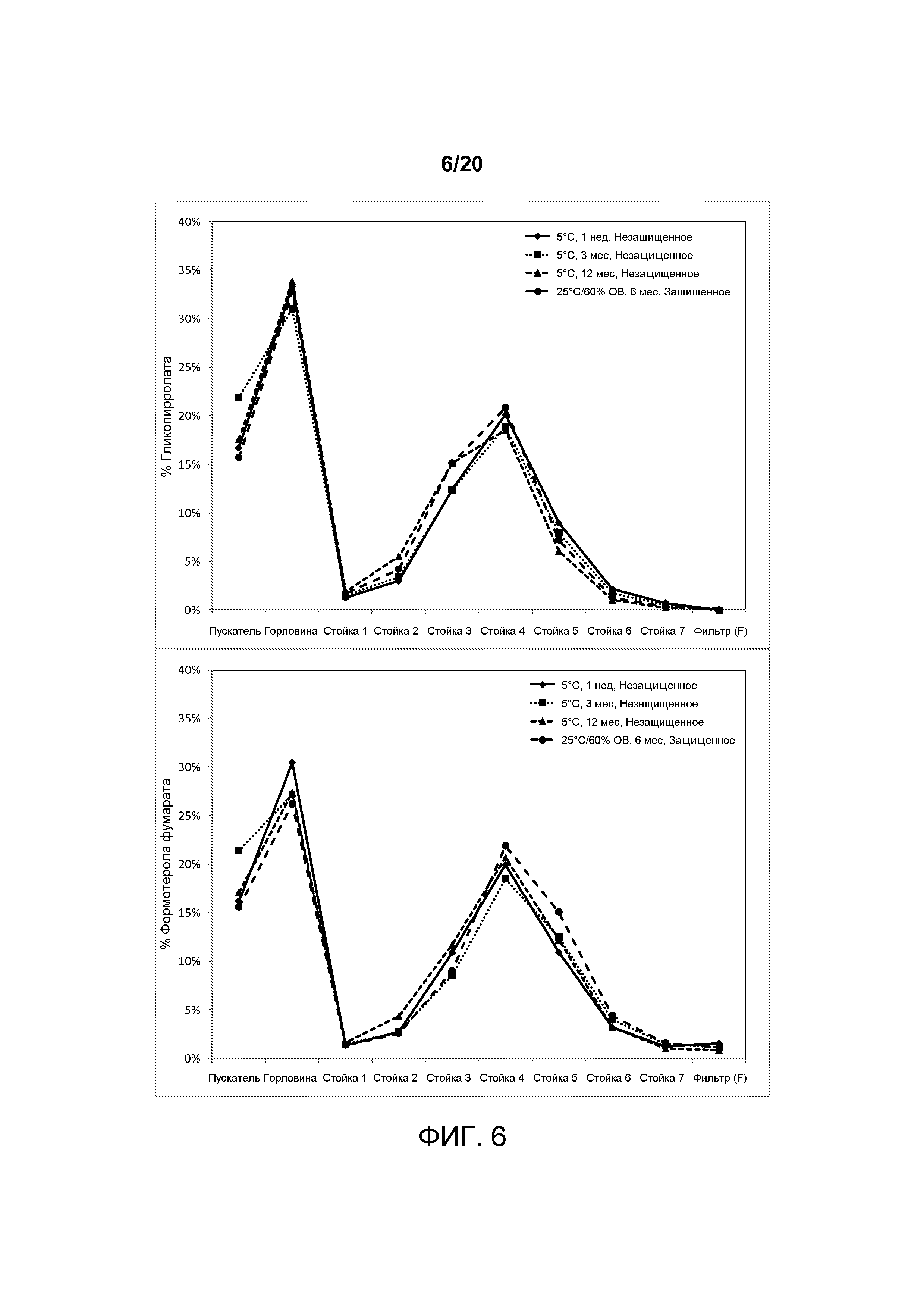
На ФИГ. 6 представлен график, который изображает распределения частиц по размерам примерных со-суспензионных готовых лекарственных форм, полученных в соответствии с настоящим описанием, при хранении в различных указанных условиях.
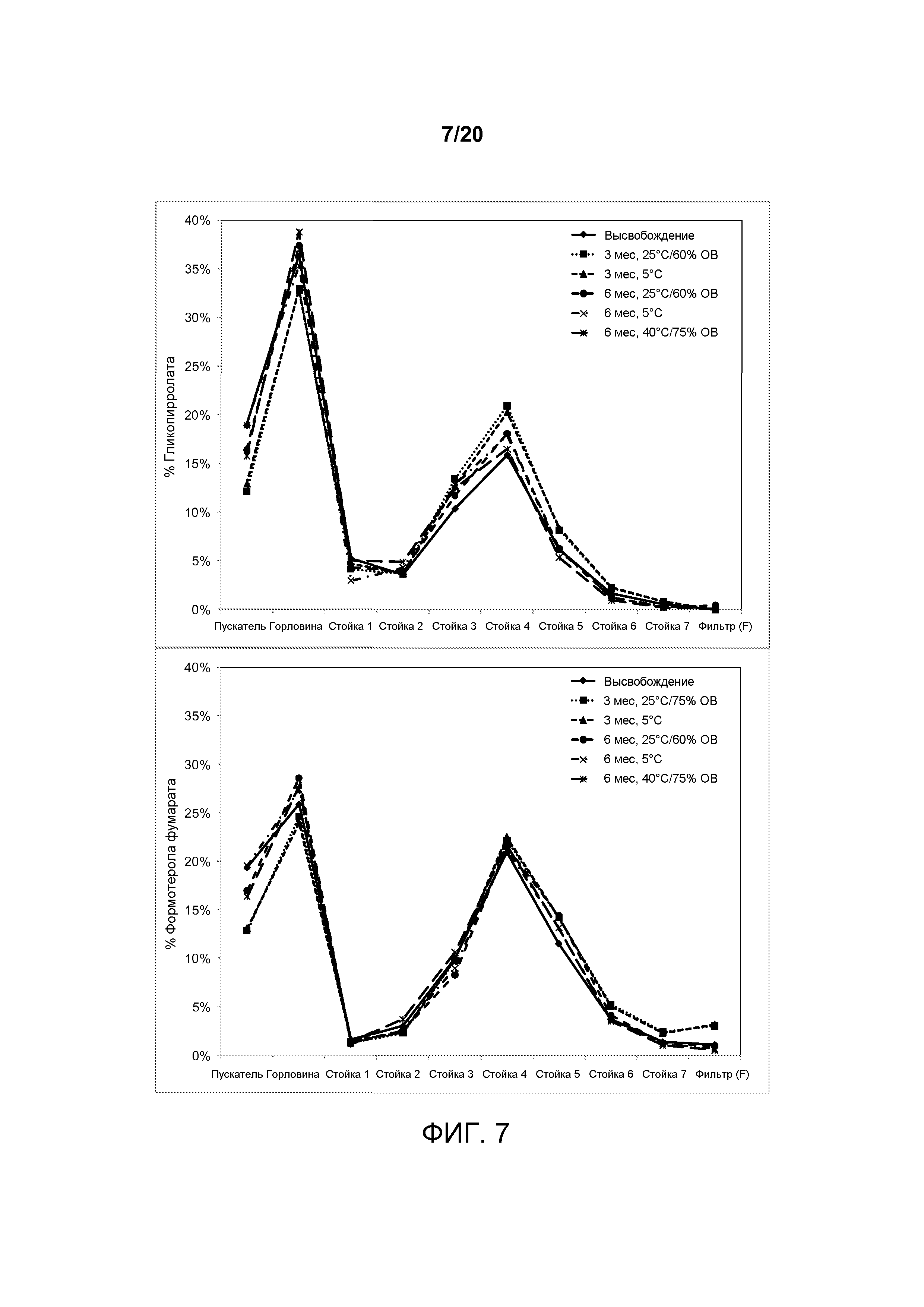
На ФИГ. 7 представлен график, который изображает распределения частиц по размерам, достигаемые примерной со-суспензией, включающей комбинацию гликопирролата и формотерола фумарата, при хранении в различных указанных условиях.
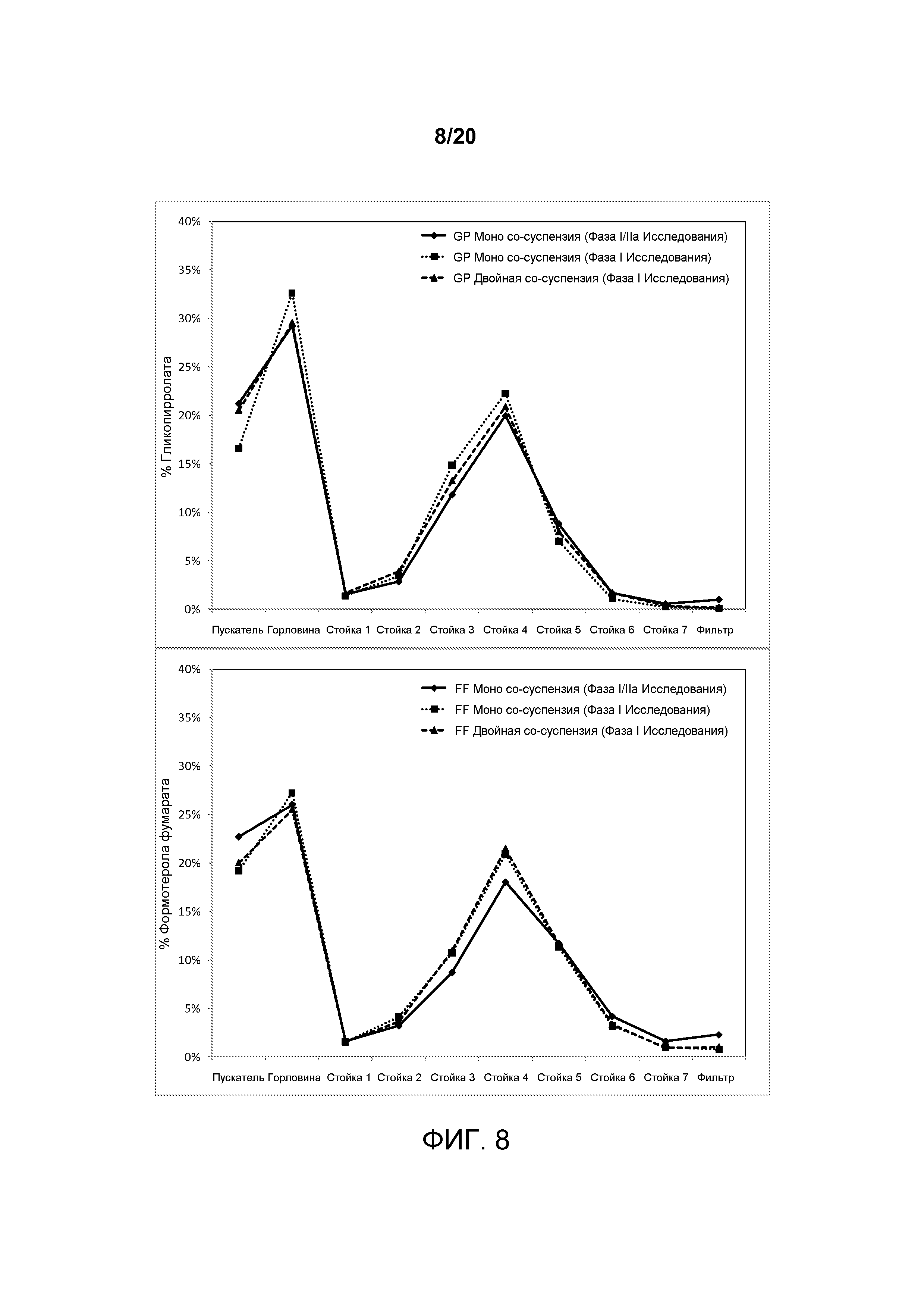
На ФИГ. 8 представлен график, который изображает распределения частиц по размерам, достигаемые примерной со-суспензией, включающей комбинацию гликопирролата и формотерола фумарата, в сравнении с распределениями частиц по размерам, достигаемыми готовыми лекарственными формами, включающими либо гликопирролат или формотерола фумарат по отдельности.
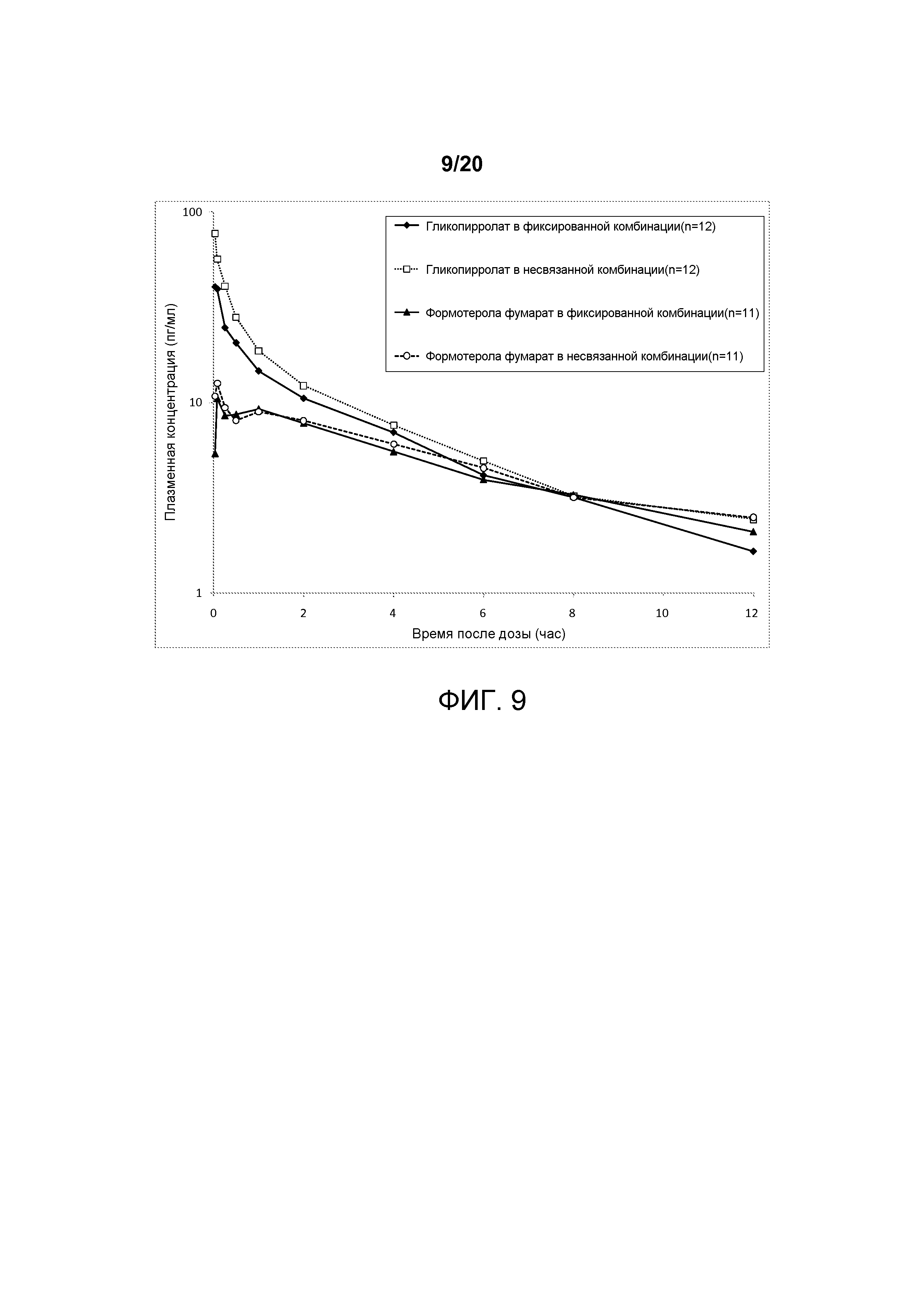
На ФИГ. 9 представлен график, который изображает сывороточные уровни концентрации гликопирролата и формотерола с течением времени, достигаемые после доставки примерной со-суспензии, включающей гликопирролат и формотерола фумарат, полученные в соответствии с настоящим описанием. Временной профиль сывороточной концентрации гликопирролата и формотерола фумарата, доставляемой из примерной комбинированной готовой лекарственной формы, сравнивают с профилем, достигаемым посредством композиции, содержащей и доставляющей гликопирролат или формотерола фумарат по отдельности.
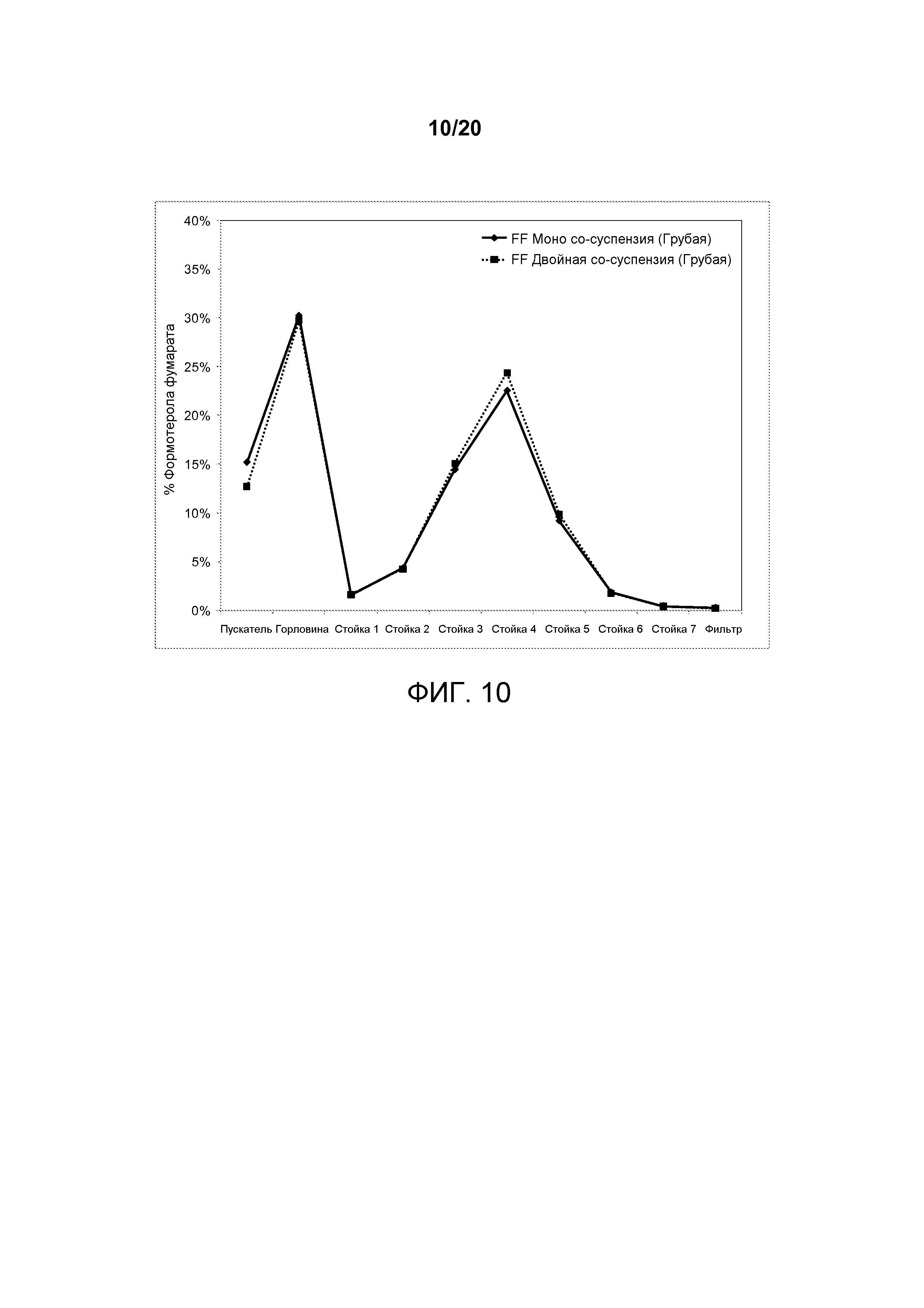
На ФИГ. 10 представлен график, который изображает распределение частиц формотерола по размерам, достигаемое посредством двойной со-суспензии, полученной в соответствии с настоящим описанием, которая включала микрокристаллические частицы активного агента формотерола фумарата и гликопирролата, в сравнении с со-суспензией, содержащей только кристаллический формотерола фумарат.
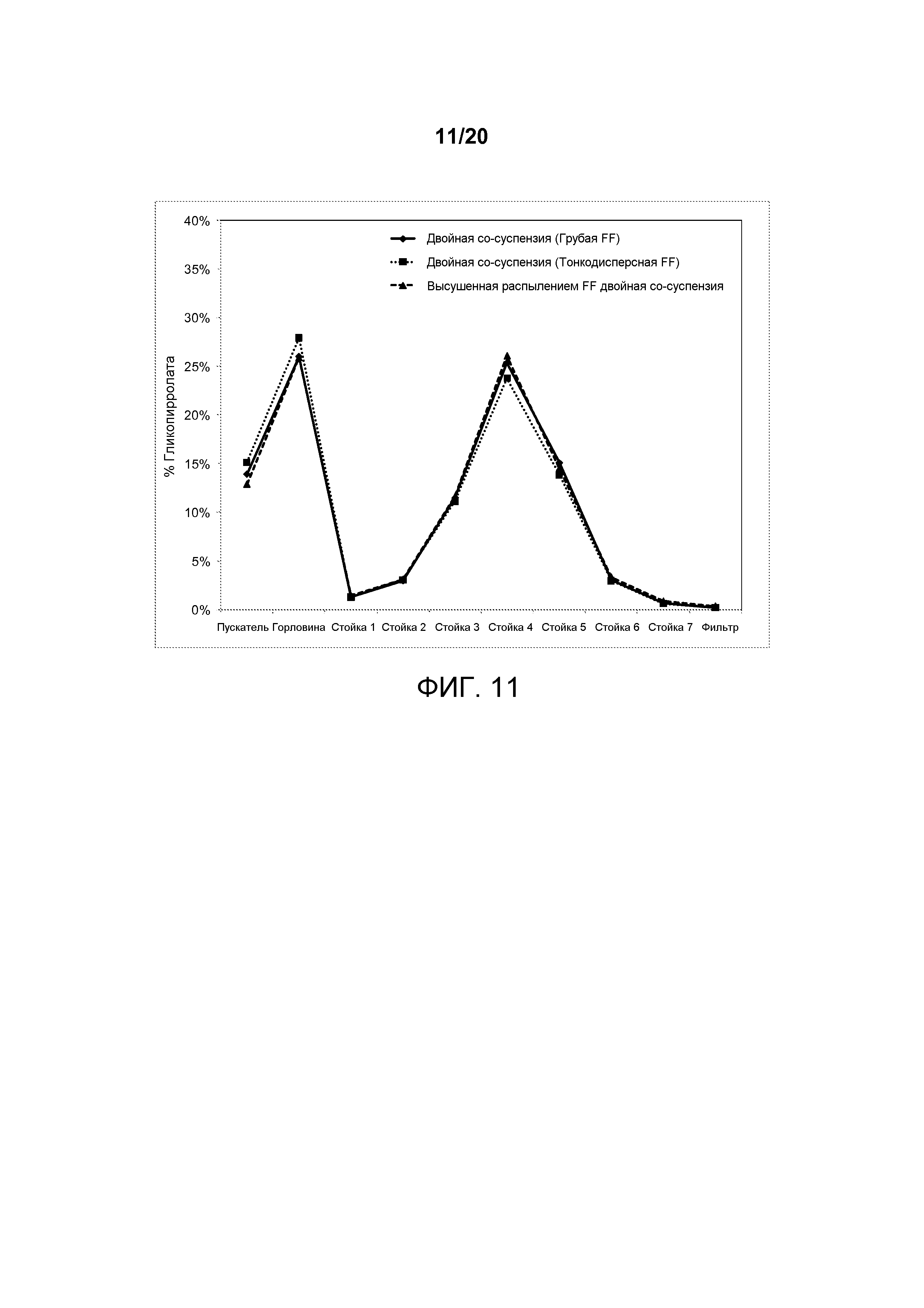
На ФИГ. 11 представлен график, который изображает распределение частиц гликопирролата по размерам, достигаемое посредством двойной со-суспензии, полученной в соответствии с настоящим описанием, которая включала микрокристаллические частицы активного агента гликопирролата и микрокристаллические частицы активного агента формотерола фумарата с двумя различными распределениями частиц по размерам (обозначенных "тонкодисперсное" и "грубое") или высушенный распылением формотерола фумарат.
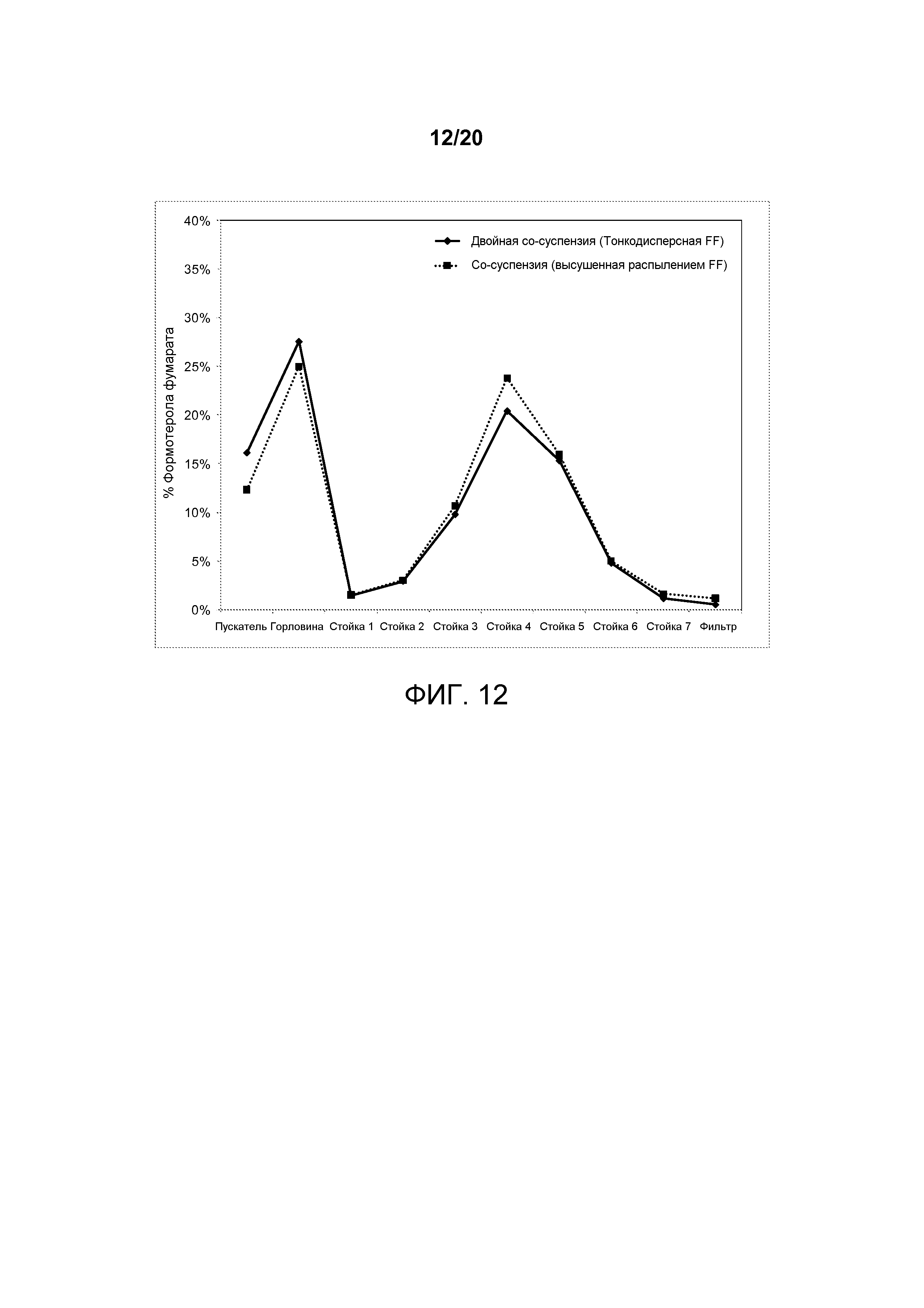
На ФИГ. 12 представлен график, который изображает распределение частиц формотерола фумарата по размерам, достигаемое посредством второй двойной со-суспензии, полученной в соответствии с настоящим описанием, которая включала микрокристаллический формотерола фумарат и микрокристаллические частицы активного агента гликопирролата в сравнении с со-суспензией, которая содержала микрокристаллические частицы активного агента гликопирролата и высушенные распылением частицы формотерола фумарата.
На ФИГ. 13 представлен график, который изображает однородность доставляемой дозы гликопирролата и формотерола фумарата в примерной двойной со-суспензионной готовой лекарственной форме, полученной в соответствии с настоящим описанием.
На ФИГ. 14 показана однородность доставляемой дозы для каждого активного агента, включенного в примерную тройную со-суспензионную композицю, которая включала микрокристаллические частицы активного агента гликопирролата, формотерола фумарата и мометазона фуроата.
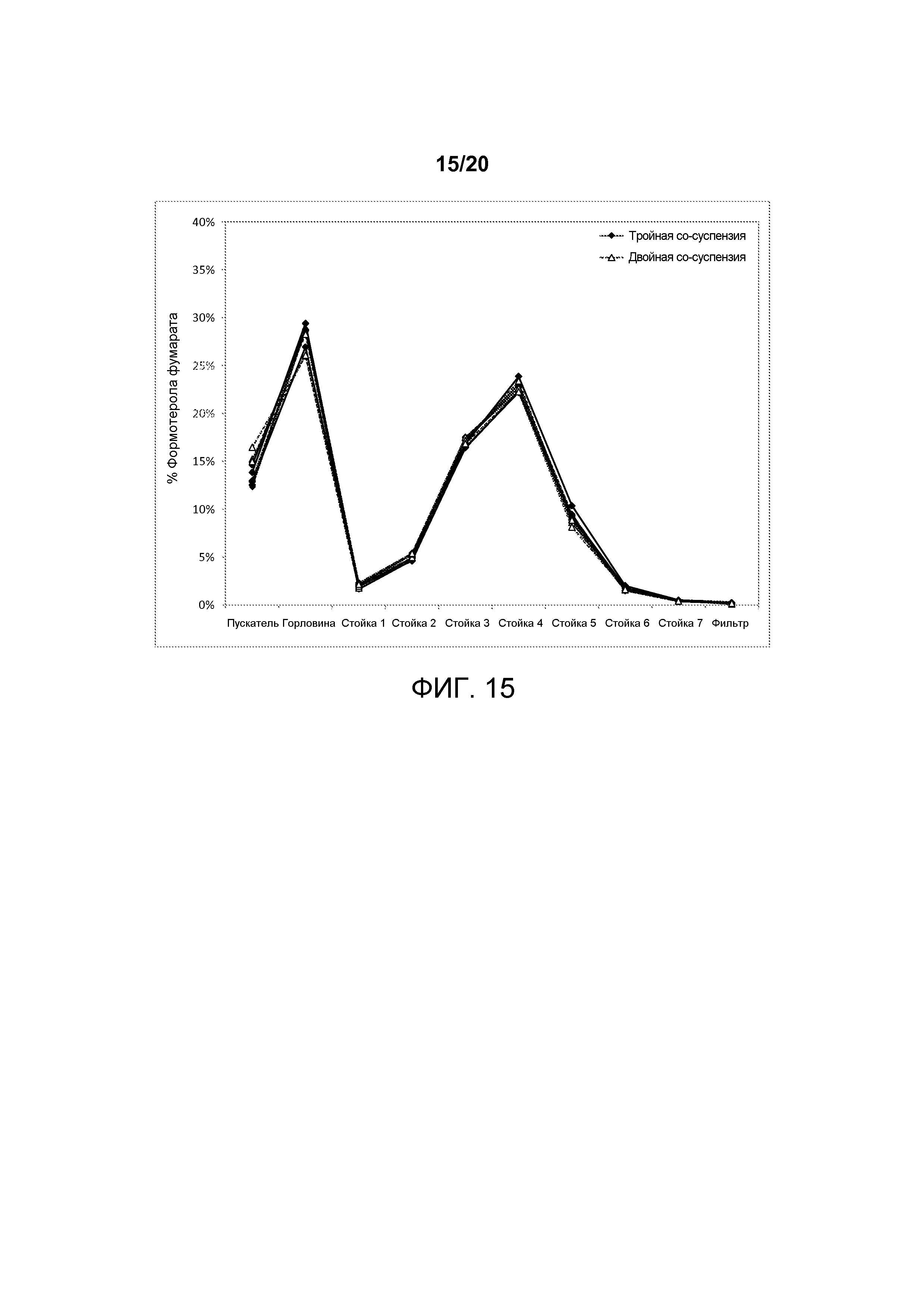
На ФИГ. 15 представлен график, изображающий аэродинамические распределения частиц формотерола фумарата по размерам, достигаемые в тройной со-суспензии, полученной в соответствии с настоящим описанием, которая включала микрокристаллические частицы активного агента гликопирролата, формотерола фумарата и мометазона фуроата, в сравнении с распределением, достигаемым в двойной со-суспензии, которая включала гликопирролат и формотерола фумарат.
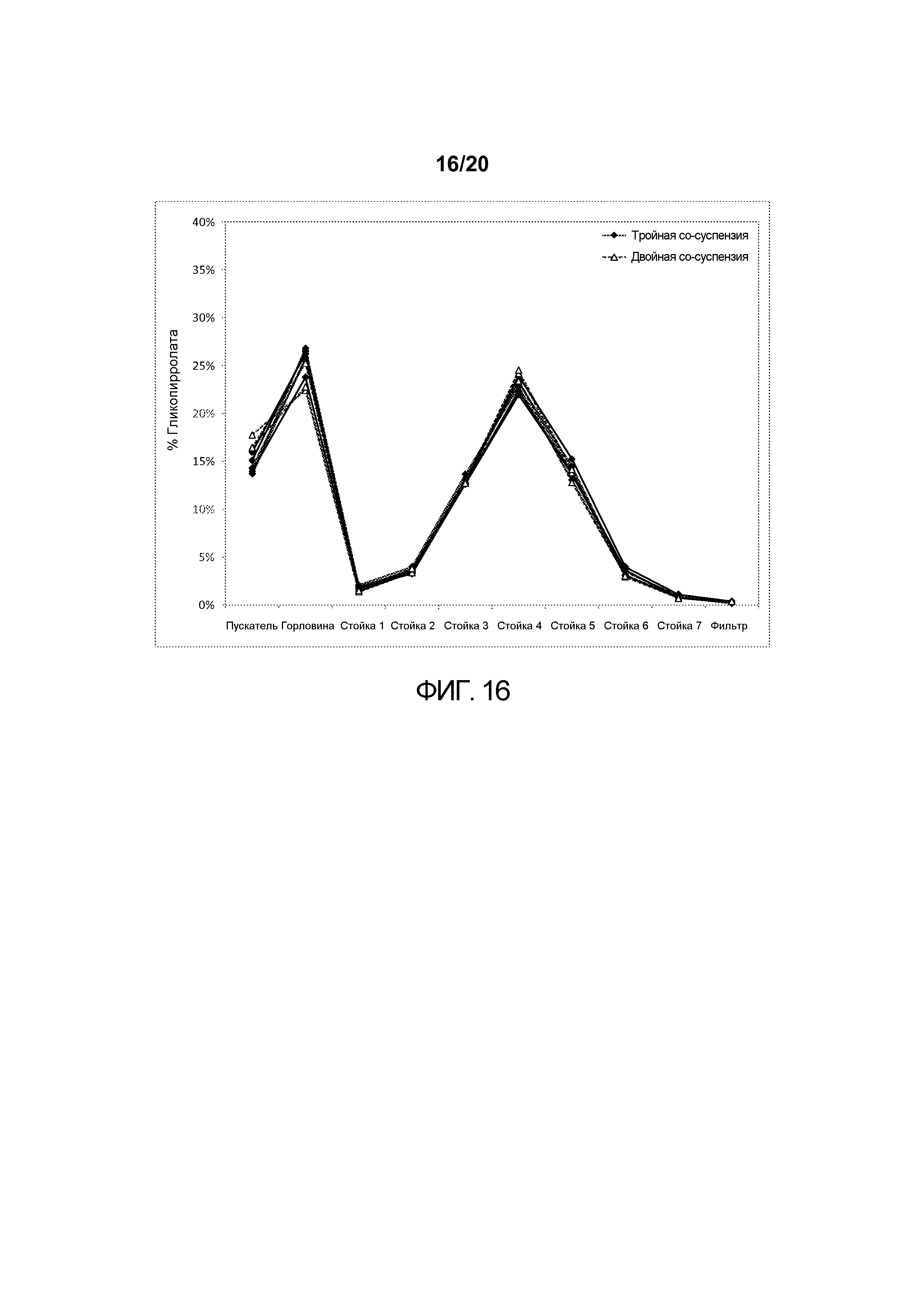
На ФИГ. 16 представлен график, изображающий аэродинамические распределения частиц гликопирролата по размерам, достигаемые в тройной со-суспензии, полученной в соответствии с настоящим описанием, которая включала микрокристаллические частицы активного агента гликопирролата, формотерола фумарата и мометазона фуроата, в сравнении с распределением, достигаемым в двойной со-суспензии, которая включала гликопирролат и формотерола фумарат.
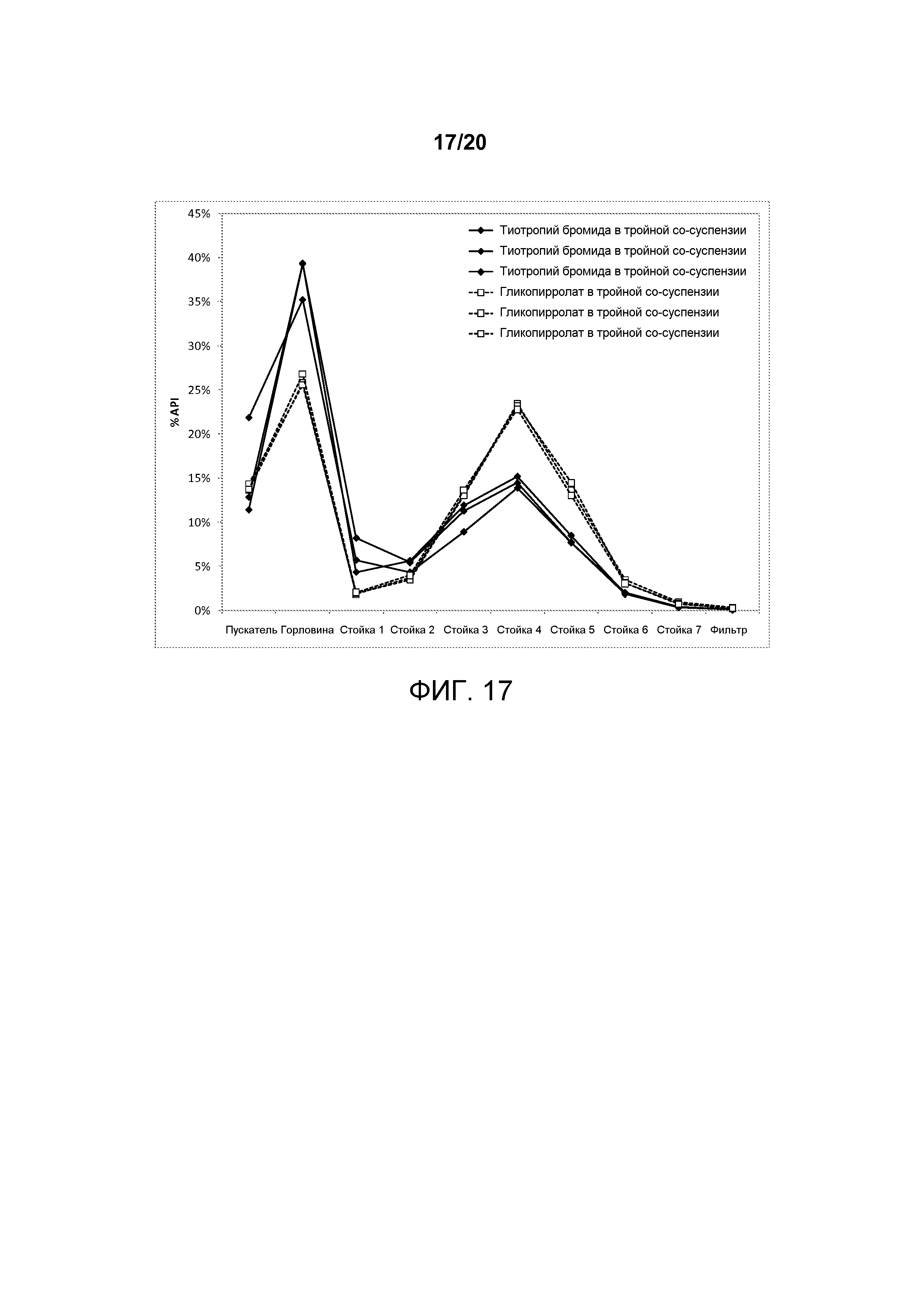
На ФИГ. 17 представлен график, изображающий аэродинамические распределения частиц гликопирролата и тиотропия бромида по размерам, достигаемые посредством тройной со-суспензии, полученной в соответствии с настоящим описанием, которая, в дополнение к частицам активного агента либо гликопирролата или тиотропия бромида, включала микрокристаллические частицы активного агента формотерола фумарата и мометазона фуроата.
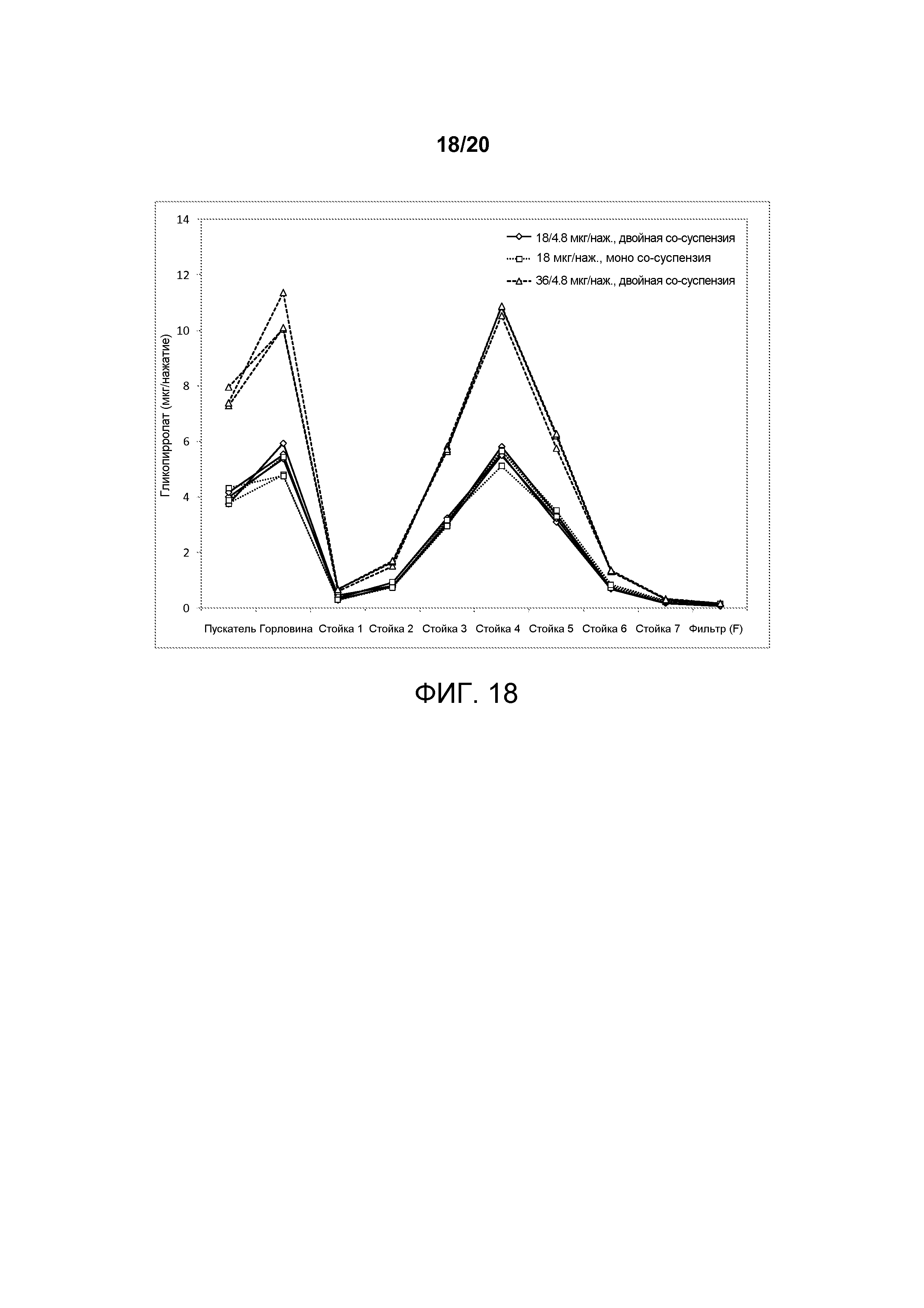
На ФИГ. 18 представлен график, изображающий аэродинамическое распределение по размерам гликопирролата, достигаемое посредством двух двойных и одной однокомпонентной со-суспензии, полученных в соответствии с настоящим описанием. Отображена пропорциональность дозы между двумя двойными со-суспензиями, а также эквивалентность между двойной и однокомпонентной со-суспензией.
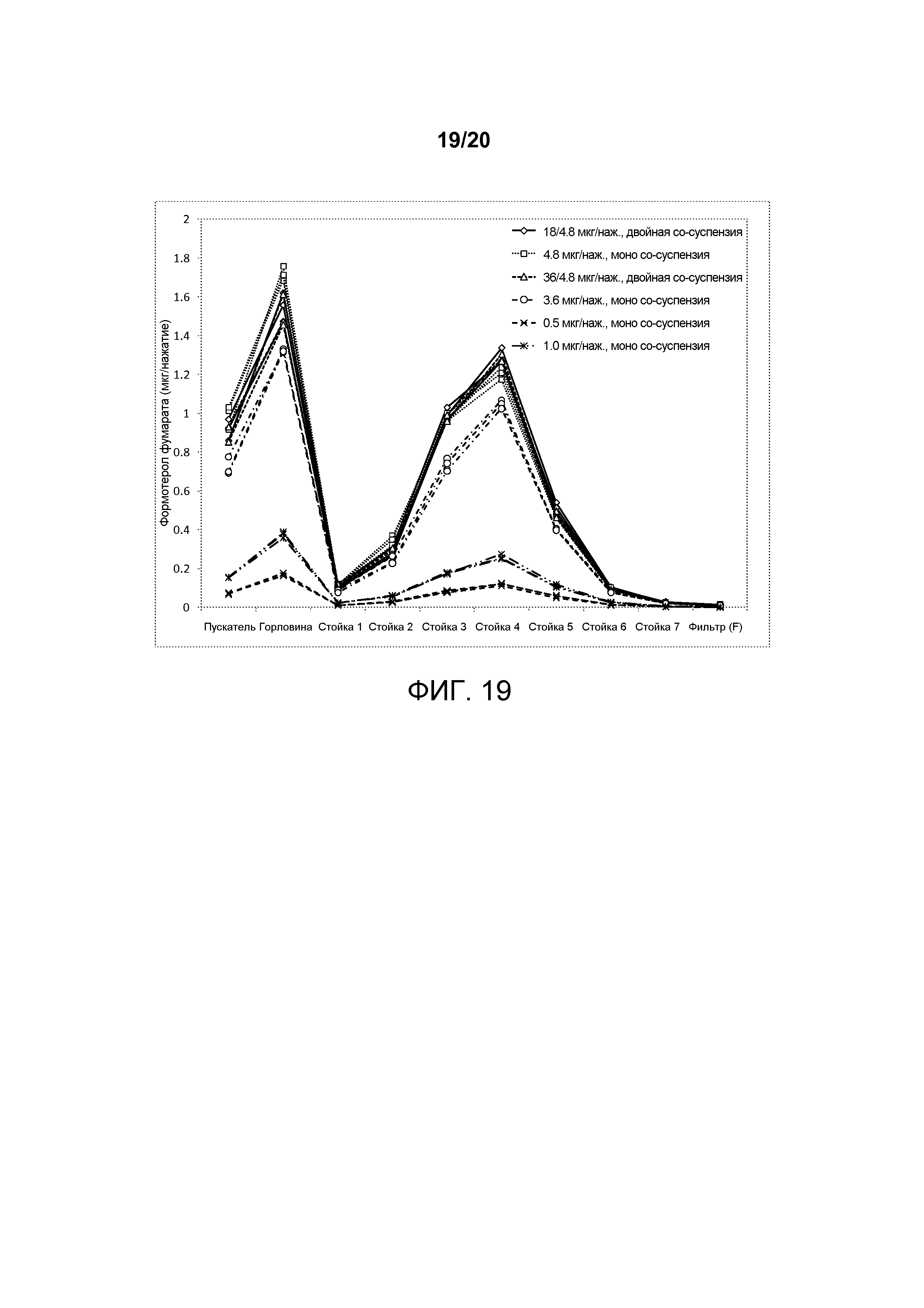
На ФИГ. 19 представлен график, изображающий аэродинамическое распределение по размерам формотерола фумарата, достигаемое посредством двух двойных и двух однокомпонентных со-суспензий, полученных в соответствии с настоящим описанием. Отображена пропорциональность дозы между двумя двойными и двумя однокомпонентными со-суспензииями, а также эквивалентность между двойной и однокомпонентной со-суспензией.
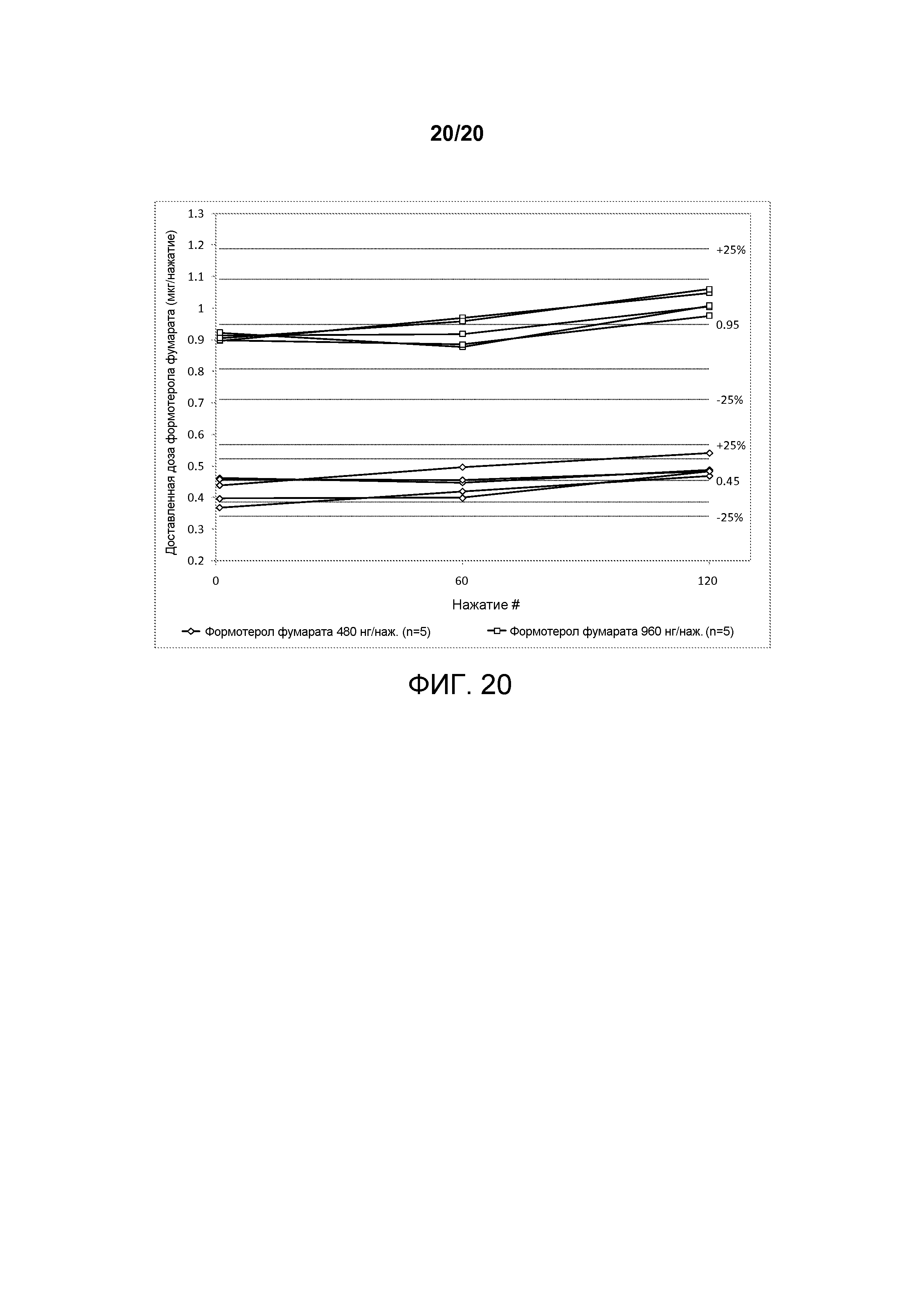
На ФИГ. 20 представлен график, изображающий однородность доставляемой дозы ультра-низких однокомпонентных со-суспензий формотерола фумарата, полученных в соответствии с настоящим описанием.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее раскрытие предоставляет композиции, способы, и системы для респираторной доставки двух или более активных агентов. Конкретно, в некоторых вариантах осуществления, настоящее раскрытие включает фармацевтические композиции, системы, и способы для респираторной доставки двух или более активных агентов через MDI, и в конкретных вариантах осуществления, по меньшей мере, один из активных агентов выбирают из мускаринового антагониста пролонгированного действия ("LAMA"), β2 адренергического агониста пролонгированного действия ("LABA"), и кортикостероидных активных агентов. Композиции, описанные здесь, могут быть составлены для легочной или назальной доставки через MDI. Способы, описанные здесь, включают способы стабилизации готовых лекарственных форм, включающих два или более активных агентов для респираторной доставки, а также способы для легочной доставки двух или более активных агентов для лечения легочного заболевания или нарушения через MDI. Также здесь описаны системы MDI для доставки двух или более активных агентов, а также способы получения таких систем.
Составление фармацевтических композиций, включающих два или более активных агентов, часто является проблематичным вследствие непредсказуемых или неожиданных взаимодействий между активными агентами или изменений в составах, полученных в результате от введения множества активных агентов. Такие взаимодействия, в общем случае, известны, как "комбинационный эффект", и в контексте суспензионных готовых лекарственных форм, доставляемых из MDI, комбинационный эффект может проявляться, например, отклонением от подобия между готовой лекарственной формой, включающей единственный активный агент, и готовой лекарственной формой, включающей комбинацию двух или более активных агентов, в одной или более из следующих областей: характеристики аэрозоля и распределения частиц по размерам, предоставленные готовой лекарственной формой; однородность доставляемой дозы для одного или более активных агентов; способность к доставке или поглощению одного или более активных агентов; или дозовой пропорциональности, наблюдаемой для одного или более активных агентов.
В конкретных вариантах осуществления, co-суспензионные композиции, описанные здесь, лишены комбинационных эффектов, ассоциированных с комбинированными готовыми лекарственными формами. Для целей представленного описания, композиция лишена комбинационных эффектов, где, для выбранного активного агента, свойства аэрозоля, характеристики распределения частиц по размерам, и однородность доставляемой дозы, достигаемые посредством комбинированной готовой лекарственной формы, не отклоняются от характеристик, достигаемых посредством сравниваемой готовой формы, где только один активный агент является выбранным активным агентом. В некоторых вариантах осуществления, об отсутствии комбинационного эффекта для выбранного активного агента свидетельствует, то, что концентрация в плазме с течением времени для намеченной дозы выбранного активного агента, доставляемого из комбинированной готовой лекарственной формы, не отклоняется от концентрации в плазме с течением времени, достигаемой, когда выбранный активный агент доставляют при такой же дозе из сравниваемой готовой формы, где единственный активный агент является выбранным активным агентом.
Как использовано здесь, фразы "не отклоняются" или "не отклоняется" означают, что, для данного параметра, эффективность действия, достигаемая посредством комбинированной готовой лекарственной формы, составляет ±20% от значения, достигаемого посредством сравниваемой готовой формы, включающей только один из активных агентов, включенных в комбинированную готовую лекарственную форму. В некоторых вариантах осуществления, эффективность действия, достигаемая посредством комбинированной готовой лекарственной формы, не отличается от той, что достигается посредством сравниваемой готовой формы, включающей только один из активных агентов, включенных в комбинацию. Например, со-суспензия, как описано здесь, включающая два или более активных агентов, считается не проявляющей комбинационного эффекта, когда, по отношению к каждому из таких активных агентов при данной дозе, одно или более из свойств аэрозоля, характеристики распределения частиц по размерам, однородность доставляемой дозы, и концентрация в плазме с течением времени, достигаемые посредством комбинированной со-суспензии, находятся в пределах ±20% от характеристик, достигаемых посредством сравниваемой готовой формы, включающей только единственный активный агент. В некоторых вариантах осуществления, для каждого активного агента при данной дозе, одно или более свойств аэрозоля, характеристики распределения частиц по размерам, однородность доставляемой дозы, и концентрация в плазме с течением времени, достигаемые посредством комбинированных со-суспензионных композиций, описанных здесь, находятся в пределах ±15% от характеристик, достигаемых посредством сравниваемой готовой формы, включающей только единственный активный агент. В еще других вариантах осуществления, для каждого активного агента при данной дозе, одно или более свойств аэрозоля, характеристики распределения частиц по размерам, однородность доставляемой дозы, и концентрация в плазме с течением времени, достигаемые посредством комбинированных со-суспензионных композиций, описанных здесь, находятся в пределах ±10% от характеристик, достигаемых посредством сравниваемой готовой формы, включающей только единственный активный агент. В некоторых вариантах осуществления, по отношению к каждому активному агенту при данной дозе, комбинированные со-суспензионные композиции, как описано здесь, не проявляют отличия от сравниваемых готовых лекарственных форм, включающих только один из активных агентов, включенных в комбинацию в одной или более из следующих областей: свойства аэрозоля для готовой лекарственной формы; характеристики распределения частиц по размерам; однородность доставляемой дозы; и концентрация в плазме с течением времени.
Комбинация из двух или более активных агентов, включенных в композиции, предоставленные здесь, могут, в некоторых вариантах осуществления, предоставлять преимущества над фармацевтическими готовыми лекарственными формами, включающими только единственный активный агент. Например, когда комбинацию двух или более активных агентов доставляют одновременно, терапевтически эффективная доза обоих активных агентов может быть относительно меньше, чем, когда любой из комбинируемых активных агентов доставляют по отдельности, посредством чего позволяя избежать или снизить возможные побочные эффекты. Кроме того, комбинации из двух или более активных агентов могут достигать более быстрого наступления или более длительной продолжительности терапевтического благоприятного эффекта, чем можно достичь посредством доставки одного из комбинируемых активных агентов по отдельности.
В конкретных вариантах осуществления, способы, описанные здесь, включают способы для лечения легочного заболевания или нарушения, поддающегося лечению посредством респираторной доставки со-суспензионной композиции, как описано здесь. Например, композиции, способы и системы, описанные здесь, могут применяться для лечения воспалительных или обструктивных легочных заболеваний или состояний. В некоторых вариантах осуществления, композиции, способы и системы, описанные здесь, могут применяться для лечения пациентов, страдающих от заболевания или нарушения, выбранного из астмы, хронической обструктивной болезни легких (ХОБЛ), обострения гиперреактивности дыхательных путей, следующего за терапией другим лекарственным средством, аллергического ринита, синусита, легочной вазоконстрикции, воспаления, аллергий, затрудненного дыхания, респираторного дистресс-синдрома, легочной гипертензии, легочной вазоконстрикции и любого другого респираторного заболевания, состояния, признака, генотипа или фенотипа, которые могут реагировать на введение, например, LAMA, LABA, кортикостероида, или другого активного агента, как описано здесь, либо по отдельности или в комбинации с другими терапиями. В некоторых вариантах осуществления, композиции, системы и способы, описанные здесь, могут применяться для лечения воспаления легких и обструкции, ассоциированной с кистозным фиброзом. Как использованы здесь, термины "ХОБЛ" и "хроническая обструктивная болезнь легких" охватывают хроническое обструктивное заболевание легких (COLD), хроническое обструктивное заболевание дыхательных путей (COAD), хроническое ограничение воздушного потока (CAL) и хроническое обструктивное респираторное заболевание (CORD), и включают хронический бронхит, бронхоэктазию и эмфизему. Как использован здесь термин "астма" относится к астме любого типа или генеза, включающей эндогенную (не-аллергическую) астму и экзогенную (аллергическую) астму, мягкую астму, умеренную астму, тяжелую астму, бронхитную астму, бронхиальную астму физического напряжения, профессиональную бронхиальную астму и астму, индуцированную после бактериальной инфекции. Следует понимать, что астма также охватывает синдром бронхита новорожденных.
Будет совершенно понятно, что варианты осуществления, как, в целом, описаны здесь, являются примерными. Следующее более детальное описание разнообразных вариантов осуществления не предназначено для ограничения объема представленного раскрытия, но просто представляет разнообразные варианты осуществления. Как таковые, конкретные особенности, приведенные здесь, могут включать независимо патентуемый объект изобретения. Кроме того, порядок стадий или действий способов, описанных в связи с вариантами осуществления, раскрытыми здесь, может быть изменен квалифицированными специалистами в области без отступления от объема настоящего раскрытия. Другими словами, если для необходимого варианта осуществления требуются конкретные порядок стадий или действий, порядок или применение конкретных стадий или действий может быть модифицирован.
I. Определения
Если конкретно не определено иным образом, технические термины, как используются здесь, имеют их обычное значение, как понимают в данной области. Следующее термины конкретно определены с целью ясности понимания.
Термин "активный агент" применяется здесь для включения любого агента, лекарственного средства, соединения, композиции или другого вещества, которые могут применяться или вводиться человеку или животному для любой цели, включая терапевтические, фармацевтические, фармакологические, диагностические, косметические и профилактические агенты и иммуномодуляторы. Термин "активный агент" может применяться взаимозаменяемо с терминами "лекарственное средство", "фармацевтический препарат", "лекарственное средство", "лекарственное вещество" или "терапевтическое средство". Как использовано здесь, "активный агент" может также охватывать природные или гомеопатические продукты, которые, как правило, не считаются терапевтическими.
Термины "ассоциируют", "ассоциируют с" или "ассоциация" относятся к взаимодействию или взаимосвязи между химической частицей, композицией, или структурой в состоянии близости к поверхности, такой как поверхность еще одной другой химической частицы, композиции или структуры. Ассоциация включает, например, адсорбцию, адгезию, ковалентное связывание, водородное связывание, ионное связывание и электростатическое притяжение, взаимодействия Лифшица-ван-дер-Ваальса и полярные взаимодействия. Термин "прилипать" или "адгезия" представляет форму ассоциации, и применяется как общий термин для всех сил, имеющих тенденцию вызывать привлечение частицы или массы к поверхности. "Прилипать" также относится к приведению и удержанию частиц в контакте друг с другом, таким образом, что по существу отсутствует видимое разделение между частицами, вследствие их различных сил выталкивания в пропелленте при нормальных условиях. В одном варианте осуществления, частица, которая присоединяется к поверхности или связывается с поверхностью, охватыватся термином "прилипать". Нормальные условия могут включать хранение при комнатной температуре или при ускоряющем усилии вследствие тяготения. Как описано здесь, частицы активного агента могут ассоциировать с суспендирующими частицами с образованием со-суспензии, где по существу отсутствует видимое разделение между суспендирующими частицами и частицами активного агента или их флоккулятами вследствие различий в выталкивании в пропелленте.
"Суспендирующие частицы" относятся к веществу или комбинации веществ, которые являются приемлемыми для респираторной доставки, и действуют в качестве среды для частиц активного агента. Суспендирующие частицы взаимодействуют с частицами активного агента для облегчения повторного дозирования, доставки или транспорта активного агента к целевому участку доставки, т.е. дыхательному пути. Суспендирующие частицы, описанные здесь, диспергированы в суспензионной среде, включающей пропеллент или систему пропеллента, и могут быть сконфигурированы в соответствии с любой характеристикой формы, размера или поверхности, пригодной для достижения желательной стабильности суспензии или эффективности доставки активного агента. Примерные суспендирующие частицы включают частицы, которые проявляют размер частиц, который облегчает респираторную доставку активного агента, и имеют физические конфигурации, пригодные для составления и доставки стабилизированной суспензии, как описано здесь.
Термин "со-суспензия" относится к суспензии двух или более типов частиц, имеющих различный состав в суспензионной среде, где один тип частиц ассоциирует, по меньшей мере, частично с одним или более другими типами частиц. Ассоциация приводит к наблюдаемому изменению одной или более характеристик, по меньшей мере, одного из индивидуальных типов частиц, суспендированных в суспензионной среде. Характеристики, модифицированные посредством ассоциации, могут включать, например, одну или более характеристик из скорости агрегации или флоккуляции, скорости и природы разделения, т.е. осаждения или пенообразования, плотности слоя пены или осадка, адгезии к стенкам контейнера, адгезии к компонентам клапана и скорости и уровня дисперсии при встряхивании.
Примерные способы для оценки того, присутствует ли со-суспензия, могут включать следующее: если один тип частиц имеет пикнометрическую плотность большую, чем у пропеллента, а еще один другой тип частиц имеет пикнометрическую плотность, более низкую, чем у пропеллента, может осуществляться визуальное наблюдение поведения пенообразования или осаждения, чтобы определить присутствие со-суспензии. Термин "пикнометрическая плотность" относится к плотности вещества, которое составляет частицу, исключая пустоты в частицах. В одном варианте осуществления, вещества могут быть составлены или переноситься в прозрачный пузырек, обычно стеклянный пузырек, для визуального наблюдения. После первоначального взбалтывания пузырек оставляют без воздействия на достаточное время для образования слоя осадка или пены, обычно 24 часа. Если наблюдают, что слой осадка или пены является полностью или большей частью однородным единственным слоем, со-суспензия присутствует. Термин "со-суспензия" включает частичные со-суспензии, где большая часть, по меньшей мере, двух типов частиц ассоциирует друг с другом, однако может наблюдаться некоторое разделение (т.е. меньше чем большей части), по меньшей мере, двух типов частиц.
Примерный тест на со-суспензию может осуществляться при различных температурах пропеллента для усиления проведения осаждения или пенообразования типов частиц с плотностью, близкой к плотности пропеллента при комнатной температуре. Если различные типы частиц имеют одну и ту же природу разделения, т.е. все осаждаются или все образуют пену, наличие со-суспензии может быть определено посредством измерения других характеристик суспензии, таких как скорость агрегации или флоккуляции, скорость разделения, плотность слоя пены или осадка, адгезия к стенкам контейнера, адгезия к компонентам клапана, и скорость и уровень дисперсии при встряхивании, и сравнения их с соответствующими характеристиками аналогично суспендированных индивидуальных типов частиц. Разнообразные аналитические способы, общеизвестные специалистам в данной области, могут использоваться для измерения этих характеристик.
В контексте композиции, содержащей или предоставляющей вдыхаемые агрегаты, частицы, капли и т.д., такой как композиции, описанные здесь, термин "доза тонкодисперсных частиц" или "FPD" относится к дозе, либо в общей массе или фракции номинальной дозы или отмеренной дозы, что находится в пределах вдыхаемого интервала. Дозу, которая находится в пределах вдыхаемого интервала, измеряют in vitro как дозу, которая осаждается за пределами горловой ступени каскадного импактора, т.е. суммарная доза, доставляемая на стадиях 3 через фильтр в импакторе Next Generation, работающем при скорости потока, равной 30 л/мин.
В контексте композиции, содержащей или предоставляющей вдыхаемые агрегаты, частицы, капли, и т.д., такой как композиции, описанные здесь, термин "фракция тонкодисперсных частиц" или "FPF" относится к части доставляемого вещества относительно доставляемой дозы (т.е. количество, которое выходит из пускового механизма устройства доставки, такого как MDI), которое находится в пределах вдыхаемого интервала. Количество доставляемого вещества в пределах вдыхаемого интервала измеряют in vitro как количество вещества, которое осаждается за пределами горловой ступени каскадного импактора, т.е. суммарное кличество, доставляемое на стадиях 3 через фильтр в импакторе Next Generation, работающем при скорости потока, равной 30 л/мин.
Как использован здесь, термин "ингибирует" относится к измеряемому снижению тенденции имеющего место явления, симптома или состояния или степени при которой такое явление, симптом или состояние происходит. Термин "ингибирует" или любая его форма, применяется в самом широком смысле и включает минимизацию, предотвращение, снижение, подавление, супрессию, сдерживание, стеснение, ограничение, медленное развитие и т.п.
"Масс-медианный аэродинамический диаметр" или "MMAD", как использован здесь, относится к аэродинамическому диаметру аэрозоля, ниже которого 50% массы аэрозоля состоит из частиц с аэродинамическим диаметром меньше, чем MMAD, причем MMAD рассчитывают в соответствии с монографией 601 Фармакопеи Соединенных Штатов ("USP").
Когда здесь приводится ссылка, термин "оптический диаметр" указывает размер частиц, как измерено посредством дифракции по Фраунгоферу с использованием лазерного дифракционного анализатора размера частиц, оборудованного распределителем сухого порошка (например, Sympatec GmbH, Clausthal-Zellerfeld, Germany).
Термин опосредованное раствором превращение относится к явлению, при котором более растворимая форма твердого вещества (т.е. частицы с небольшим радиусом кривизны (движущая сила для Оствальдовского созревания) или аморфного вещества) растворяется и перекристаллизовывается в более устойчивой кристаллической форме, которая может сосуществовать в равновесии с его насыщенным раствором в пропелленте.
"Пациент" относится к животному, у которого комбинация активных агентов, как описана здесь, будет иметь терапевтический эффект. В одном варианте осуществления, пациент является человеком.
"Перфорированные микроструктуры" относятся к суспендирующим частицам, которые включают структурный матрикс, который проявляет, определяет или содержит пустоты, поры, дефекты, полости, объемы, промежуточные объемы, апертуры, перфорации или отверстия, которые позволяют окружающей суспензионной среде проникать, заполнять или наполнять собой микроструктуры, такие как вещества и препараты, описанные в Патенте США № 6309623 на имя Weers, et al. Первичная форма перфорированных микроструктур, как правило, не является существенной, и любая общая конфигурация, которая предоставляет желательные характеристики готовой лекарственной формы, рассматривается здесь. Соответственно, в одном варианте осуществления, перфорированные микроструктуры могут содержать приблизительно сферические формы, такие как полые, суспендирующие, высушенные распылением микросферы. Однако разрушенные, гофрированные, деформированные или имеющие трещины макрочастицы любой первичной формы или аспектного отношения могут также быть совместимыми.
Что характерно для суспендирующих частиц, описанных здесь, перфорированные микроструктуры могут быть образованы из любого биосовместимого вещества, которое по существу не разрушается или растворяется в выбранной суспензионной среде. В то время как, для образования частиц может применяться большое разнообразие веществ, в некоторых вариантах осуществления, структурный матрикс ассоциирован с, или включает, поверхностно-активное вещество, такое как фосфолипид или фторированное поверхностно-активное вещество. Хотя это не требуется, введение совместимого поверхностно-активного вещества в перфорированную микроструктуру или, более широко, суспендирующие частицы, может улучшить стабильность респираторных дисперсий, увеличить осаждение в легких и облегчить получение суспензии.
Термин "суспензионная среда", как использован здесь, относится к веществу, предоставляющему непрерывную фазу, в пределах которой частицы активного агента и суспендирующие частицы могут быть диспергированы для предоставления со-суспензионной готовой лекарственной формы. Применяемая суспензионная среда в со-суспензионных готовых лекарственных формах, описанных здесь, включает пропеллент. Как использован здесь, термин "пропеллент" относится к одному или более фармакологически инертных веществ, которые проявляют достаточно высокое давление паров при нормальной комнатной температуре, чтобы выдавить лекарственное средство из емкости MDI пациенту при приведении в действие дозирующего клапана MDI. Следовательно, термин "пропеллент" относится как к единственному пропелленту, так и к комбинации двух или более различных пропеллентов, образующих "пропеллентную систему".
Термин "вдыхаемые" обычно относится к частицам, агрегатам, каплям, и т.д., разделенных по размеру таким образом, что их можно вдохнуть, и они достигают дыхательных путей легкого.
При использовании для отнесения к со-суспензионным композициям, описанным здесь, термины "физическая стабильность" и "физически стабильная" относятся к композиции, которая является устойчивой к одному или более из агрегации, флоккуляции и изменений размера частиц вследствие опосредовнных раствором превращений и является способной к поддержанию по существу дозы MMAD суспендирующих частиц и тонкодисперсных частиц. В одном варианте осуществления, физическую стабильность можно оценить посредством подвергания композиции условиям ускоренной деградации, таким как под действием циклического изменения температуры, как описано здесь.
При ссылке на активные агенты, термин "сильнодействующие" указывает на активные агенты, которые являются терапевтически эффективными при дозах, находящихся в интервале от приблизительно 0,01 мг/кг до приблизительно 1 мг/кг или ниже. Типовые дозы сильнодействующих активных агентов обычно находятся в интервале от приблизительно 100 мкг до приблизительно 100 мг.
При ссылке на активные агенты, термин "высоко сильнодействующие" указывает на активные агенты, которые являются терапевтически эффективными при дозах, равных приблизительно 10 мкг/кг или ниже. Типовые дозы высоко сильнодействующих активных агентов обычно находятся в интервале до приблизительно 100 мкг.
Термины "стабильность суспензии" и "устойчивая суспензия" относятся к суспензионным готовым лекарственным формам, способным к поддержанию свойств со-суспензии частиц активного агента и суспендирующих частиц в течение периода времени. В одном варианте осуществления, стабильность суспензии может быть измерена посредством однородности доставляемой дозы, достигаемой посредством со-суспензионных композиций, описанных здесь.
Термин "нерастворимая по существу" означает, что композиция является либо полностью нерастворимой в конкретном растворителе или она является плохо растворимой в таком конкретном растворителе. Термин "нерастворимая по существу" означает, что конкретное растворяемое вещество имеет растворимость меньше, чем одна часть на 100 частей растворителя. Термин "нерастворимая по существу" включает определения "слабо растворимая" (от 100 до 1000 частей растворителя на 1 часть растворяемого вещества), "очень слабо растворимая" (от 1000 до 10000 частей растворителя на 1 часть растворяемого вещества) "практически нерастворимая" (более, чем 10000 частей растворителя на 1 часть растворяемого вещества) как приведено в Таблице 16-1 Remington: The Science and Practice of Pharmacy, 21st ed. Lippincott, Williams & Wilkins, 2006, p. 212.
Термин "поверхностно-активное вещество", как использован здесь, относится к любому агенту, который предпочтительно адсорбируется на границе раздела фаз между двумя несмешивающимися фазами, такой как граница раздела фаз между водой и раствором органического полимера, граница раздела фаз вода/воздух или граница раздела фаз органический растворитель/воздух. Поверхностно-активные вещества, как правило, обладают гидрофильным фрагментом и липофильным фрагментом, таким образом, что, при адсорбции к микрочастице, они стремятся представить фрагменты в непрерывную фазу, что не привлекает аналогично-покрытые частицы, таким образом, уменьшая агломерацию частиц. В некоторых вариантах осуществления, поверхностно-активные вещества могут также инициировать адсорбцию лекарственного средства и увеличить биодоступность лекарственного средства.
"Терапевтически эффективное количество" представляет собой количество соединения, которое достигает терапевтического эффекта посредством ингибирования заболевания или нарушения у пациента или посредством профилактического ингибирования или предотвращения наступления заболевания или нарушения. Терапевтически эффективное количество может представлять собой количество, которое смягчает до некоторой степени один или более симптомов заболевания или нарушения у пациента; возвращает к нормальным значениям либо частично или полностью один или более физиологических или биохимических параметров, ассоциированных с или вызывающих заболевание или нарушение; и/или снижает вероятность наступления заболевания или нарушения.
Термины "химически стабильная" и "химическая стабильность" относятся к со-суспензионным готовым лекарственным формам, где индивидуальные продукты разложения активного агента остаются ниже пределов, установленных нормативными требованиями, во время хранения продукта для применения человеком (например, 1% общей площади хроматографического пика на ICH руководство Q3B(R2)) и, где существует приемлемый массовый баланс (например, как определено в ICH руководстве Q1E) между анализом активного агента и продуктов полного разложения.
II. Композиции
Композиции, описанные здесь, представляют собой со-суспензии, которые включают два или более активных агентов и включают суспензионную среду, один или более видов частиц активного агента, и один или более видов суспендирующих частиц. Конечно, если желательно, композиции, описанные здесь, могут включать один или более дополнительных компонентов. Кроме того, могут применяться вариации и комбинации компонентов композиций, описанных здесь.
Со-суспензионные композиции в соответствии с настоящим описанием могут осуществляться посредством разнообразных различных готовых лекарственных форм. В некоторых вариантах осуществления, композиции, описанные здесь, включают первый активный агент, предоставленный в частицах активного агента, которые со-суспендированы с, по меньшей мере, одним видом суспендирующих частиц, которые включают второй активный агент. В других вариантах осуществления, композиции, описанные здесь, включают два или более активных агентов, предоставленных в двух или более различных видах частиц активного агента, co-суспендированных с, по меньшей мере, одним видом суспендирующих частиц, которые включают активный агент, отличный от того, который содержится в любых частицах активного агента. В еще дополнительных вариантах осуществления композиции, описанные здесь, включают два или более активных агентов, предоставленных в двух или более различных видах частиц активного агента, co-суспендированных с, по меньшей мере, одним видом суспендирующих частиц, которые включают активный агент, который может быть таким же или отличным от того, который содержится в любых частицах активного агента. В еще дополнительных вариантах осуществления, композиции, описанные здесь, включают два или более активных агентов, предоставленных в двух или более различных видах частиц активного агента, co-суспендированных с одним или более видами суспендирующих частиц, которые не содержат активный агент. Где композиции, описанные здесь, включают два или более видов частиц активного агента, такие композиции могут именоваться как "мульти" со-суспензии. Например, композиция, включающая два вида частиц активного агента, co-суспендированных с одним или более видами суспендирующих частиц, может именоваться как двойная со-суспензия, композиция, включающая три вида частиц активного агента, co-суспендированных с одним или более видами суспендирующих частиц может именоваться как тройная со-суспензия и т.д.
В композициях в соответствии с настоящим описанием, даже когда множественные различные виды частиц активного агента представлены в композиции, частицы активного агента проявляют ассоциацию с суспендирующими частицами таким образом, что частицы активного агента и суспендирующие частицы совместно располагаются в суспензионной среде. Обычно, вследствие различий в плотности между индивидуальными видами частиц и средой, в которой они суспендированы (например, пропеллентом или пропеллентной системой), силы выталкивания вызывают всплывание частиц с более низкой плотностью, чем у пропеллента и осаждение частиц с более высокой плотностью, чем у пропеллента. Следовательно, в суспензиях, которые состоят из смеси различных типов частиц с различной плотностью или различными тенденциями к флоккуляции, осаждению или всплыванию, ожидается конкретное поведение для каждого из различных типов частиц, и ожидают, что это будет приводить к разделению различных типов частиц в суспензионной среде.
Однако комбинации пропеллента, частиц активного агента и суспендирующих частиц, описанные здесь, предоставляют со-суспензии, включающие комбинации двух или более активных агентов, где частицы активного агента и суспендирующие частицы совместно располагаются в пропелленте (т.е. частицы активного агента ассоциируют с суспендирующими частицами таким образом, что суспендирующие частицы и частицы активного агента не проявляют существенного разделения относительно друг друга, такого как посредством дифференциального осаждения или всплывания, даже после времени, достаточного для образования слоя пены или осадка). В конкретных вариантах осуществления, например, композиции, описанные здесь, образуют со-суспензии, где суспендирующие частицы остаются ассоциированными с частицами активного агента, когда их подвергают воздействию выталкивающих усилий, усиленных посредством температурных флуктуаций и/или центрифугированием при ускорениях до и свыше, например, 1 g, 10 g, 35 g, 50 g, и 100 g. Однако со-суспензии, описанные здесь, нет необходимости определять конкретным пороговым значением усилия ассоциации. Например, со-суспензия, как предусмотрена здесь, может успешно достигаться там, где частицы активного агента ассоциируют с суспендирующими частицами таким образом, что не существует существенного разделения частиц активного агента и суспендирующих частиц в непрерывной фазе, образованной суспензионной средой при типовых условиях применения пациентом.
Со-суспензии частиц активного агента и суспендирующие частицы в соответствии с настоящим описанием предоставляют желательную химическую стабильность, стабильность суспензии и характеристик доставки активного агента. Например, в некоторых вариантах осуществления, когда присутствует в емкости MDI, со-суспензии, как описаны здесь, могут ингибировать одно или более из следующих: флоккуляция вещества активного агента; дифференциальное осаждение или всплывание частиц активного агента и суспендирующих частиц; опосредованное раствором превращение вещества активного агента; химическое разложение компонента готовой лекарственной формы, включая вещество активного агента или поверхностно-активное вещество; и потеря активного агента на поверхностях системы укупорки контейнера, конкретно, компонентах дозирующего клапана. Такие качества работают для достижения и сохранения эффективности действия аэрозоля, поскольку со-суспензия готовой лекарственной формы доставляемая из MDI таким образом, что желательная фракция тонкодисперсных частиц, доза тонкодисперсных частиц и характеристики однородности доставляемой дозы достигаются и, по существу, поддерживаются на всем протяжении опорожнения емкости MDI, в которой содержится со-суспензионная готовая лекарственная форма. Дополнительно, со-суспензии в соответствии с настоящим описанием могут предоставлять физически и химически устойчивую готовую лекарственную форму, которая предоставляет соответствующие характеристики дозирования для двух или более активных агентов, даже там, где такие активные агенты доставляют при значительно различных дозах, при использовании относительно простой HFA суспензионной среды, которая не требует модификации посредством добавления, например, сорастворителей, антирастворителей, солюбилизирующих агентов или адъювантов. Даже дополнительно, композиции, полученные, как описано здесь, когда доставляются из MDI, устраняют, или по существу позволяют избежать фармацевтических эффектов, часто наблюдаемых с готовыми лекарственными формами, включающими множественные активные агенты. Например, как демонстрируется конкретными вариантами осуществления, детализированными здесь, комбинационные готовые лекарственные формы, описанные здесь, предоставляют характеристики доставки для каждого из активных агентов, содержащихся в них, сравнимые с характеристиками доставки тех же активных агентов, когда их составляют и доставляют раздельно.
Предоставление со-суспензии в соответствии с настоящим описанием может также упрощать составление готовой лекарственной формы, доставку и дозирование желательных активных агентов. Не будучи связанными конкретной теорией, полагают, что посредством достижения со-суспензии частиц активного агента и суспендирующих частиц, доставка, физическая стабильность и дозирование активного агента, содержащегося в такой дисперсии могут по существу контролироваться через контроль размера, композиции, морфологии и относительного количества суспендирующих частиц, и являются менее зависимыми от размера и морфологии частиц активного агента. Кроме того, в конкретных вариантах осуществления, фармацевтические композиции, описанные здесь, могут быть составлены с пропеллентом без CFC или пропеллентной системой, не содержащими по существу антирастворителей, солюбилизирующих агентов, сорастворителей, или адъювантов.
Со-суспензионные композиции, составленные в соответствии с настоящими рекомендациями, могут ингибировать физическое и химическое разложение активных агентов, включенных в них. Например, в конкретных вариантах осуществления, композиции, описанные здесь, могут ингибировать одно или более из химического разложения, флоккуляции, агрегации и опосредованного раствором превращения активных агентов, включенных в композиции. Химическая и суспензионная стабильность, предоставленные посредством со-суспензионных композиций, описанных здесь, обеспечивают распределение композиций таким образом, который позволяет достичь желательной однородности доставляемой дозы на всем протяжении опорожнения емкости MDI ("DDU") для множества активных агентов, даже там, где, по меньшей мере, один из активных агентов, подлежащий доставке, может быть высоко сильнодействующим, а доставляемые дозы каждого из активных агентов значительно изменяются.
Со-суспензионные композиции, как описаны здесь, которые включают два или более активных агентов, могут достигать DDU ±30%, или лучше, для каждого из активных агентов, включенных в них. В одном таком варианте осуществления, композиции, описанные здесь, достигают DDU ±25%, или лучше, для каждого из активных агентов, включенных в них. В еще одном другом таком варианте осуществления, композиции, описанные здесь, достигают DDU ±20%, или лучше, для каждого из активных агентов, включенных в них. Кроме того, со-суспензионные композиции в соответствии с настоящим описанием, служат для сохранения по существу эффективности действия FPF и FPD на всем протяжении опорожнения емкости MDI, даже после подвергания условиям ускоренного разложения. Например, композиции в соответствии с настоящим описанием поддерживают 80%, 90%, 95% или более, исходной эффективности действия FPF или FPD, даже после подвергания условиям ускоренного разложения.
Со-суспензионные композиции, описанные здесь, предоставляют добавленный благоприятный эффект достижения такой эффективности действия при составлении с использованием пропеллентов без CFC. В конкретных вариантах осуществления, композиции, описанные здесь, позволяют достичь одного или более из намеченных DDU, FPF или FPD, при составлении с суспензионной средой, включающей только один или более пропеллентов без CFC и без необходимости модифицировать характеристики пропеллента без CFC, таким образом, как посредством добавления, например, одного или более из сорастворителя, антирастворителя, солюбилизирующего агента, адъюванта или другого вещества, модифицирующего пропеллент.
(i) Суспензионная среда
Суспензионная среда, включенная в композицию, описанную здесь, включает один или более пропеллентов. В целом, подходящие пропелленты для применения в качестве суспензионных сред представляют собой такие пропеллентные газы, которые могут быть ожижены под давлением при комнатной температуре, и при ингаляции или местном применении, являются безопасными и токсикологически безвредными. Дополнительно, является желательным, чтобы выбранный пропеллент был относительно нереакционноспособным с суспендирующими частицами и частицами активного агента. Примерные совместимые пропелленты включают гидрофторалканы (HFA), перфторированные соединения (PFC), и хлорфторуглероды (CFC).
Конкретные примеры пропеллентов, которые могут применяться для образования суспензионной среды со-суспензий, раскрытых здесь, включают 1,1,1,2-тетрафторэтан (CF3CH2F) (HFA-134a), 1,1,1,2,3,3,3-гептафтор-н-пропан (CF3CHFCF3) (HFA-227), перфторэтан, монохлор-фторметан, 1,1-дифторэтан и их комбинации. Даже дополнительно, подходящие пропелленты включают, например: углеводороды с короткой цепью; C1-4 водород-содержащие хлорфторуглероды, такие как CH2ClF, CCl2FCHClF, CF3CHClF, CHF2CClF2, CHClFCHF2, CF3CH2Cl, и CClF2CH3; Cl-4 водород-содержащие фторуглероды (например, HFAs), такие как CHF2CHF2, CF3CH2F, CHF2CH3, и CF3CHFCF3; и перфторуглероды, такие как CF3CF3 и CF3CF2CF3.
Конкретные фторуглероды, или классы фторированных соединений, которые могут применяться в качестве суспензионных сред, включают, но не ограничены лишь ими, фторгептан, фторциклогептан, фторметилциклогептан, фторгексан, фторциклогексан, фторпентан, фторциклопентан, фторметилциклопентан, фтордиметилциклопентаны, фторметилциклобутан, фтордиметилциклобутан, фтортриметил-циклобутан, фторбутан, фторциклобутан, фторпропан, простые фторэфиры, простые фторполиэфиры и фтортриэтиламины. Эти соединения могут применяться по отдельности или в комбинации с более летучими пропеллентами.
В дополнение к вышеупомянутым фторуглеродам и гидрофторалканам, разнообразные примерные хлорфторуглероды и замещенные фторированные соединения могут также применяться в качестве суспензионных сред. В этом отношении, могут также применяться FC-11 (CCl3F), FC-11B1 (CBrCl2F), FC-11B2 (CBr2ClF), FC12B2 (CF2Br2), FC21 (CHCl2F), FC21B1 (CHBrClF), FC-21B2 (CHBr2F), FC-31B1 (CH2BrF), FC113A (CCl3CF3), FC-122 (CClF2CHCl2), FC-123 (CF3CHCl2), FC-132 (CHClFCHClF), FC-133 (CHClFCHF2), FC-141 (CH2ClCHClF), FC-141B (CCl2FCH3), FC-142 (CHF2CH2Cl), FC-151 (CH2FCH2Cl), FC-152 (CH2FCH2F), FC-1112 (CClF=CClF), FC-1121 (CHCl=CFCl) и FC-1131 (CHCl=CHF), в то же время, учитывая возможные сопутствующие аспекты охраны окружающей среды. Как таковое, каждое из этих соединений может применяться, по отдельности или в комбинации с другими соединениями (т.е. менее летучими фторуглеродами) с образованием стабилизированных суспензий, раскрытых здесь.
В некоторых вариантах осуществления, суспензионная среда может быть образована из единственного пропеллента. В других вариантах осуществления, может применяться комбинация пропеллентов с образованием суспензионной среды. В некоторых вариантах осуществления, относительно летучие соединения могут смешиваться с компонентами с более низким давлением паров для предоставления суспензионнных сред, имеющих определенные физические характеристики, выбранные для улучшения стабильности или усиления биодоступности диспергированных активных агентов. В некоторых вариантах осуществления, соединения с более низким давлением паров будут содержать фторированные соединения (например, фторуглероды), имеющие температуру кипения выше, чем приблизительно 25°C. В некоторых вариантах осуществления, фторированные соединения с более низким давлением паров для применения в суспензионной среде могут включать перфтороктилбромид C8F17Br (PFOB или перфлуброн), дихлорфтороктан C8F16Cl2, перфтороктилэтан C8F17C2H5 (PFOE), перфтордецилбромид C10F21Br (PFDB) или перфторбутилэтан C4F9C2H5. В некоторых вариантах осуществления, соединения с более низким давлением паров присутствуют при относительно низком уровне. Такие соединения могут добавляться непосредственно в суспензионную среду или могут быть ассоциированы с суспендирующими частицами.
Суспензионная среда, включенная в композиции, как описаны здесь, может быть образована из пропеллента или пропеллентной системы, которые по существу не содержат дополнительных материалов, включающих, например, антирастворители, солюбилизирующие агенты, сорастворители или адъюванты. Например, в некоторых вариантах осуществления, суспензионная среда может быть образована пропеллентом без CFC или пропеллентной системой, такими как HFA пропеллент или пропеллентная система, которая по существу, не содержит дополнительных веществ. Такие варианты осуществления упрощают составление и производство фармацевтических композиций, пригодных для респираторной доставки активных агентов, включенных в со-суспензионные композиции.
Однако в других вариантах осуществления, в зависимости от выбора пропеллента, свойств суспендирующих частиц или природы активных агентов, подлежащих доставке, использованные суспензионные среды могут включать вещества в дополнение к пропелленту или пропеллентной системе. Такие дополнительные вещества могут включать, например, один или более из соответствующих антирастворителя, солюбилизирующего агента, сорастворителя или адъюванта для регуляции, например, давления паров готовой лекарственной формы или стабильности или растворимости суспендированных частиц. Например, пропан, этанол, изопропиловый спирт, бутан, изобутан, пентан, изопентан или диалкиловый эфир, такой как диметиловый эфир, могут быть включены с пропеллентом в суспензионную среду. Аналогично, суспензионная среда может содержать летучий фторуглерод. В других вариантах осуществления, один или оба из поливинилпирролидона ("PVP") или полиэтиленгликоля ("PEG") могут добавляться к суспензионной среде. Добавление PVP или PEG к суспензионной среде может способствовать достижению одной или более желательных функциональных характеристик, и в одном примере, PVP или PEG могут добавляться к суспензионной среде в качестве ингибитора кристаллического роста. В целом, там, где применяется летучий сорастворитель или адъювант, такой адъювант или сорастворитель может быть выбран из известных углеводородных или фторуглеродных веществ и может составлять до приблизительно 1% масс./масс. суспензионной среды. Например, там, где сорастворитель или адъювант включен в суспензионную среду, сорастворитель или адъювант могут содержать меньше, чем приблизительно 0,01%, 0,1%, или 0,5% масс./масс. от суспензионной среды. Там, где PVP или PEG включены в суспензионную среду, такие компоненты могут быть включены при, до приблизительно 1% масс./масс., или они могут содержать меньше, чем приблизительно 0,01%, 0,1%, или 0,5% масс./масс. от суспензионной среды.
(ii) Частицы активного агента
Частицы активного агента, включенные в со-суспензии, описанные здесь, образованы из вещества, способного к диспергированию и суспендированию в суспензионной среде и распределены по размерам для облегчения доставки вдыхаемых частиц из со-суспензии. В одном варианте осуществления, следовательно, частицы активного агента предоставлены в виде микронизированного вещества, где, по меньшей мере, 90% частиц активного агента по объему проявляют оптический диаметр, равный приблизительно 7 мкм или менее. В других вариантах осуществления, частицы активного агента предоставлены в виде микронизированного вещества, где, по меньшей мере, 90% частиц активного агента по объему проявляют оптический диаметр, выбранный из интервала от приблизительно 7 мкм до приблизительно 1 мкм, от приблизительно 5 мкм до приблизительно 2 мкм, и от приблизительно 3 мкм до приблизительно 2 мкм. В других вариантах осуществления, частицы активного агента предоставлены в виде микронизированного вещества, где, по меньшей мере, 90% частиц активного агента по объему проявляют оптический диаметр, выбранный из 6 мкм или менее, 5 мкм или менее, 4 мкм или менее или 3 мкм или менее. В еще одном другом варианте осуществления, частицы активного агента предоставлены в виде микронизированного вещества, где, по меньшей мере, 50% вещества частиц активного агента по объему проявляют оптический диаметр, равный приблизительно 4 мкм или менее. В дополнительных вариантах осуществления, частицы активного агента предоставлены в виде микронизированного вещества, где, по меньшей мере, 50% вещества частиц активного агента по объему проявляют оптический диаметр, выбранный из приблизительно 3 мкм или менее, приблизительно 2 мкм или менее, приблизительно 1,5 мкм или менее и приблизительно 1 мкм или менее. В еще дополнительных вариантах осуществления, частицы активного агента предоставлены в виде микронизированного вещества, где, по меньшей мере, 50% частиц активного агента по объему проявляют оптический диаметр, выбранный из интервала от приблизительно 4 мкм до приблизительно 1 мкм, от приблизительно 3 мкм до приблизительно 1 мкм, от приблизительно 2 мкм до приблизительно 1 мкм, приблизительно 1,3 мкм и приблизительно 1,9 мкм.
Частицы активного агента могут быть образованы полностью из активного агента или они могут быть составлены, чтобы включать один или более активных агентов в комбинации с одним или более эксципиентами или адъювантами. В конкретных вариантах осуществления, активный агент, присутствующий в частицах активного агента, может быть полностью или по существу кристаллическим, т.е. большинство молекул активного агента расположены в регулярно повторяющейся решетке, над протяженными внешними торцами. В еще одном другом варианте осуществления, частицы активного агента могут включать активный агент, присутствующий как в кристаллическом, так и аморфном состояниях. В еще одном другом варианте осуществления, частицы активного агента могут включать активный агент, присутствующий в по существу аморфном состоянии, т.е. молекулы активного агента являются в целом некристаллическими по природе и не имеют регулярно повторяющегося расположения, поддерживаемого на протяжении длительного интервала. В еще дополнительном варианте осуществления, где два или более активных агентов присутствуют как частицы активного агента, все такие активные агенты могут присутствовать в кристаллической или по существу кристаллической форме. В альтернативных вариантах осуществления с присутствующими двумя или более активными агентами, по меньшей мере, один такой активный агент может присутствовать в кристаллической или по существу кристаллической форме, и, по меньшей мере, еще один другой активный агент может присутствовать в аморфном состоянии.
Там, где частицы активного агента, описанные здесь, включают два или более активных агента в комбинации с одним или более эксципиентов или адъювантов, эксципиенты и адъюванты могут быть выбраны на основании химических и физических свойств используемых активных агентов. Кроме того, подходящие эксципиенты для составления частиц активного агента включают те, что описаны здесь в ассоциации с суспендирующими частицами. В конкретных вариантах осуществления, например, частицы активного агента могут быть составлены с одним или более из липида, фосфолипида, углевода, аминокислоты, органической соли, пептида, белка, альдитолов, синтетического или природного полимера, или поверхностно-активных веществ как описано, например, в ассоциации с суспендирующими частицами.
В других вариантах осуществления, например, активный агент может добавляться к раствору одного или более из липида, фосфолипида, углевода, аминокислоты, соли металла, органической соли, пептида, белка, альдитолов, синтетического или природного полимера, или поверхностно-активных веществ вещества и подвергнут сушке распылением в суспендирующую частицу, которая содержит активный агент в веществе, образующем суспендирующую частицу.
Любой подходящий способ может использоваться для достижения микронизированного вещества активного агента для применения в качестве частиц активного агента или включения в частицы активного агента или суспендирующие частицы, как описано здесь. Такие способы включают, но не ограничены лишь ими, микронизацию посредством способов размола или измельчения, способов кристаллизации или перекристаллизации, и способов с использованием осаждения из сверхкритических или почти сверхкритических растворителей, сушки распылением, сушки замораживанием-распылением или лиофилизации. Патентные ссылки, с рекомендациями подходящих способов для получения микронизированных частиц активного агента описаны, например, в Патенте США № 6063138, Патенте США № 5858410, Патенте США № 5851453, Патенте США № 5833891, Патенте США № 5707634, и Публикации международной патентной заявки № WO 2007/009164. Там, где частицы активного агента включают вещество активного агента, составленное с одним или более эксципиентами или адъювантами, микронизированные частицы активного агента могут быть образованы с использованием одного или более предшествующих способов, и такие способы могут использоваться для достижения частиц активного агента, имеющих желательное распределение по размерам и конфигурации частиц.
Частицы активного агента могут быть предоставлены при любой подходящей концентрации в суспензионной среде. Например, в некоторых вариантах осуществления, частицы активного агента могут присутствовать при концентрациях между приблизительно 0,01 мг/мл и приблизительно 20 мг/мл. В некоторых таких вариантах осуществления, частицы активного агента могут присутствовать при концентрации, выбранной из приблизительно от 0,05 мг/мл до приблизительно 20 мг/мл, приблизительно от 0,05 мг/мл до приблизительно 10 мг/мл, и от приблизительно 0,05 мг/мл до приблизительно 5 мг/мл.
Разнообразные терапевтические или профилактические агенты могут использоваться в качестве активных компонентов в со-суспензионных композициях, раскрытых здесь. Примерные активные агенты включают агенты, которые могут вводиться в форме аэрозольных лекарственных средств, и активные агенты пригодные для применения в композициях, описанных здесь, включают агенты, которые могут быть представлены в форме или составлены таким способом, который обеспечивает их диспергируемость в выбранной суспензионной среде (например, является по существу нерастворимым или проявляет растворимость в суспензионной среде, которая по существу поддерживает состав со-суспензии), способен к образованию со-суспензии с суспендирующими частицами, и подвержен захвату в процессе дыхания в физиологически эффективных количествах. Активные агенты, которые могут использоваться при образовании частиц активного агента, описанных здесь, могут иметь разнообразные биологические активности.
Примеры конкретных активных агентов, которые могут быть включены в композиции в соответствии с настоящим описанием могут представлять собой, например, бета-агонисты быстрого действия, например, битолтерол, карбутерол, фенотерол, гексопреналин, изопреналин (изопротеренол), левосалбутамол, орципреналин (метапротеренол), пирбутерол, прокатерол, римитерол, салбутамол (албутерол), тербуталин, тулобутерол, репротерол, ипратропий и эпинефрин; агонист β2-адренергического рецептора пролонгированного действия ("LABA"), например, бамбутерол, кленбутерол, формотерол, салметерол; агонист β2- адренергического рецептора ультра пролонгированного действия, например, кармотерол, милветерол, индакатерол и салигенин- или индол-содержащие и адамантил-производные β2 агонистов; кортикостероиды, например, беклометазон, будесонид, циклесонид, флунизолид, флутиказон, метил-преднизолон, мометазон, преднизон и тримацинолон; противовоспалительные средства, например флутиказона пропионат, беклометазона дипропионат, флунизолид, будесонид, трипедан, кортизон, преднизон, преднизолон, дексаметазон, бетаметазон или триамцинолона ацетонид; противокашлевые препараты, например, носкапин; бронхолитические средства, например, эфедрин, адреналин, фенотерол, формотерол, изопреналин, метапротеренол, салбутамол, албутерол, салметерол, тербуталин; и мускариновые антагонисты, включающие мускариновые антагонисты пролонгированного действия ("LAMA"), например, гликопирролат, дексипирроний, скополамин, тропикамид, пирензепин, дименгидринат, тиотропий, даротропий, аклидиний, троспий, ипатропий, атропин, бензатропин или окситропий.
При необходимости, активные агенты, предоставленные в композиции, включающие, но неограниченные лишь ими, агенты, конкретно описанные здесь, могут применяться в виде солей (например, щелочного металла или солей аминов или как кислотно-аддитивные соли) или в виде сложных эфиров, сольватов (гидратов), производных, или свободного основания. Дополнительно, активные агенты могут находиться в любой кристаллической форме или изомерной форме или смеси изомерных форм, например, в виде чистых энантиомеров, смеси энантиомеров, как рацематы или в виде их смесей. В этом отношении, форма активных агентов может быть выбрана для оптимизации активности и/или стабильности активного агента и/или для минимизации растворимости активного агента в суспензионной среде.
Поскольку раскрытые композиции предоставляют воспроизводимую доставку очень низких доз активных агентов, в некоторых вариантах осуществления, активные агенты, включенные в композиции, описанные здесь, могут быть выбраны из одного или более сильнодействующих или высоко сильнодействующих активных агентов. Например, в некоторых вариантах осуществления, где могут включаться один или более сильнодействующих активных агентов, которые подлежат доставке при дозе, выбранной из, между приблизительно 100 мкг и приблизительно 100 мг на дозу, приблизительно 100 мкг и приблизительно 10 мг на дозу, и приблизительно 100 мкг и 1 мг на дозу. В других вариантах осуществления, композиции, описанные здесь, могут включать комбинацию из двух или более сильнодействующих или высоко сильнодействующих активных агентов, которые подлежат доставке при дозе, выбранной из до приблизительно 80 мкг на дозу, до приблизительно 40 мкг на дозу, до приблизительно 20 мкг на дозу, до приблизительно 10 мкг на дозу или между приблизительно 10 мкг и приблизительно 100 мкг на дозу. Дополнительно, в некоторых вариантах осуществления, композиции, описанные здесь, могут включать комбинацию из двух или более высоко сильнодействующих активных агентов, которые подлежат доставке при дозе, выбранной из между приблизительно 0,1 и приблизительно 2 мкг на дозу, приблизительно 0,1 и приблизительно 1 мкг на дозу, и приблизительно 0,1 и приблизительно 0,5 мкг на дозу.
В некоторых вариантах осуществления, композиции включают LABA активный агент. В одном таком варианте осуществления, композиция включает LABA активный агент в комбинации с LAMA активным агентом или кортикостероидным активным агентом. В еще одном другом таком варианте осуществления, композиция включает LAMA активный агент в комбинации с LABA активным агентом и кортикостероидом. В таких вариантах осуществления, LABA активный агент может быть выбран из, например, бамбутерола, кленбутерола, формотерола, салметерола, кармотерола, милветерола, индакатерола, и салигенин- или индол-содержащих и адамантил-производных β2 агонистов, и любых фармацевтически приемлемых их солей, сложных эфиров, изомеров или сольватов. В некоторых таких вариантах осуществления, активный агент выбирают из формотерола и его фармацевтически приемлемых солей, сложных эфиров, изомеров или сольватов.
Формотерол может применяться для лечения воспалительных или обструктивных легочных заболеваний и нарушений таких как, например, те, что описаны здесь. Формотерол имеет химическое наименование (±)-2-гидрокси-5-[(1 RS)-1-гидрокси-2-[[(1 RS )-2-(4-метоксифенил)-1-метилэтил]-амино]этил] форманилид, и обычно применяется в фармацевтических композициях в виде рацемической соли фумарата дигидрата. Где необходимо, формотерол может применяться в виде солей (например, щелочных металлов или солей аминов или как кислотно-аддитивные соли) или как сложный эфир или как сольваты (гидраты). Дополнительно, формотерол может находиться в любой кристаллической форме или изомерной форме или смеси изомерных форм, например чистого энантиомера, смеси энантиомеров, рацемата или их смесей. В этой связи, форма формотерола может быть выбрана для оптимизации активности и/или стабильности формотерола и/или для минимизации растворимости формотерола в суспензионной среде. Фармацевтически приемлемые соли формотерола включают, например, соли неорганических кислот, таких как хлористоводородная, бромистоводородная, серная и фосфорная кислоты, и органические кислоты, такие как фумаровая, малеиновая, уксусная, молочная, лимонная, винная, аскорбиновая, янтарная, глутаровая, глюконовая, трикарбаллиловая, олеиновая, бензойная, п-метоксибензойная, салициловая, o- и п-гидроксибензойная, п-хлорбензойная, метансульфоновая, п-толуолсульфоновая и 3-гидрокси-2-нафталинкарбоновая кислоты. Гидраты формотерола описаны, например, в патенте США № 3994974 и Патенте США № 5684199. Конкретные кристаллические формы описаны, например, в WO95/05805, и конкретные изомеры формотерола описаны в патенте США № 6040344.
В конкретных вариантах осуществления, вещество формотерол, используемое для образования частиц формотерола, представляет собой формотерола фумарат, и в одном таком варианте осуществления, формотерола фумарат присутствует в дигидратной форме. Когда композиции, описанные здесь, включают формотерол, в некоторых вариантах осуществления, композиции, описанные здесь, могут включать формотерол при концентрации, которая достигает доставляемой дозы, выбранной из между приблизительно 0,5 мкг и приблизительно 30 мкг, 0,5 мкг и приблизительно 1 мкг, приблизительно 1 мкг и приблизительно 10 мкг, приблизительно 2 мкг и 5 мкг, приблизительно 2 мкг и приблизительно 10 мкг, приблизительно 5 мкг и приблизительно 10 мкг, и 3 мкг и приблизительно 30 мкг на приведение в действие MDI. В других вариантах осуществления, композиции, описанные здесь, могут включать формотерол в количестве, достаточном для предоставления доставляемой дозы, выбранной из до приблизительно 30 мкг, до приблизительно 10 мкг, до приблизительно 5 мкг, до приблизительно 2,5 мкг, до приблизительно 2 мкг, или до приблизительно 1,5 мкг на приведение в действие (нажатие) MDI. Чтобы достичь доставляемых доз, как описано здесь, когда композиции, описанные здесь, включают формотерол в качестве активного агента, в конкретных вариантах осуществления, количество формотерола, включенное в композиции, может быть выбрано из, например, между приблизительно 0,01 мг/мл и приблизительно 1 мг/мл, между приблизительно 0,01 мг/мл и приблизительно 0,5 мг/мл, и между приблизительно 0,03 мг/мл и приблизительно 0,4 мг/мл.
Когда фармацевтические со-суспензионные композиции, описанные здесь, включают LABA активный агент, в некоторых вариантах осуществления, активный агент выбирают из салметерола, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты. Салметерол может применяться для лечения воспалительных или обструктивных легочных заболеваний и нарушений, таких как, например, заболевания и нарушения, описанные здесь. Повторно, где салметерол включен в качестве LABA активного агента, в некоторых таких вариантах осуществления, композиции могут также включать LAMA или кортикостероидный активный агент. В других таких вариантах осуществления, композиции включают салметерол в комбинации с LAMA активным агентом и кортикостероидом. Салметерол, фармацевтически приемлемые соли салметерола, и способы их получения описаны, например, в Патенте США № 4992474, Патенте США № 5126375 и Патенте США 5225445.
Когда салметерол включен в качестве LABA активного агента, в некоторых вариантах осуществления, композиции, описанные здесь, могут включать салметерол при концентрации, котрая достигает доставляемой дозы, выбранной из между приблизительно 2 мкг и приблизительно 120 мкг, приблизительно 4 мкг и приблизительно 40 мкг, приблизительно 8 мкг и 20 мкг, приблизительно 8 мкг и приблизительно 40 мкг, приблизительно 20 мкг и приблизительно 40 мкг, и приблизительно 12 мкг и приблизительно 120 мкг на нажатие MDI. В других вариантах осуществления, композиции, описанные здесь, могут включать салметерол в количестве, достаточном для предоставления доставляемой дозы, выбранной из до приблизительно 120 мкг, до приблизительно 40 мкг, до приблизительно 20 мкг, до приблизительно 10 мкг, до приблизительно 8 мкг, или до приблизительно 6 мкг на нажатие MDI. Чтобы достичь намеченной доставляемой дозы, как описано здесь, где композиции, описанные здесь, включают салметерол в качестве активного агента, в конкретных вариантах осуществления, количество салметерола, включенное в композиции, может быть выбрано из, например, между приблизительно 0,04 мг/мл и приблизительно 4 мг/мл, между приблизительно 0,04 мг/мл и приблизительно 2,0 мг/мл, и между приблизительно 0,12 мг/мл и приблизительно 0,8 мг/мл. Например, композиции, описанные здесь, могут включать достаточно салметерола для предоставления целевой доставляемой дозы, выбранной из, между приблизительно 4 мкг и приблизительно 120 мкг, приблизительно 20 мкг и приблизительно 100 мкг, и между приблизительно 40 мкг и приблизительно 120 мкг на нажатие MDI. В еще других вариантах осуществления, композиции, описанные здесь, могут включать достаточно салметерола для предоставления намеченной доставляемой дозы, выбранной из до приблизительно 100 мкг, до приблизительно 40 мкг, или до приблизительно 15 мкг на нажатие MDI.
В некоторых вариантах осуществления, композиции, описанные здесь, включают активный агент пролонгированного действия из мускаринового антагониста (LAMA). Примеры LAMA активных агентов, которые могут применяться в композициях, описанных здесь, включают, гликопирролат, дексипирроний, тиотропий, троспий, аклидиний и даротропий, включая любые фармацевтически приемлемые их соли, сложные эфиры, изомеры или сольваты. В некоторых вариантах осуществления, композиции, описанные здесь, включают LAMA активный агент в комбинации с LABA активным агентом или кортикостероидом. В других таких вариантах осуществления, композиции, описанные здесь, включают LAMA активный агент в комбинации с как LABA, так и кортикостероидными активными агентами. Когда композиции включают LAMA активный агент, в конкретных вариантах осуществления, может быть выбран гликопирролат, включая любые фармацевтически приемлемые его соли, сложные эфиры, изомеры или сольваты.
Гликопирролат может применяться для лечения воспалительных или обструктивных легочных заболеваний и нарушений таких как, например, те, что описаны здесь. В качестве антихолинергического средства, гликопирролат предоставляет антисекреторный эффект, который является благоприятным для применения в терапии легочных заболеваний и нарушений, характеризуемых повышенными секрециями слизи. Гликопирролат представляет собой четвертичную аммониевую соль. Где необходимо, гликопирролат может применяться в виде солей (например, щелочного металла, или солей аминов, или как кислотно-аддитивные соли), сложных эфиров, сольватов (гидратов), или выбранных изомеров. Дополнительно, гликопирролат может находиться в любой кристаллической форме или изомерной форме или смеси изомерных форм, например чистого энантиомера, смеси энантиомеров, рацемата или их смеси. В этой связи, форма гликопирролата может быть выбрана для оптимизации активности и/или стабильности гликопирролата и/или для минимизации растворимости гликопирролата в суспензионной среде. Подходящие противоионы представляют собой фармацевтически приемлемые противоионы, включающие, например, фторид, хлорид, бромид, йодид, нитрат, сульфат, фосфат, формиат, ацетат, трифторацетат, пропионат, бутират, лактат, цитрат, тартрат, малат, малеат, сукцинат, бензоат, п-хлорбензоат, дифенил-ацетат или трифенилацетат, o-гидроксибензоат, п-гидроксибензоат, 1-гидроксинафталин-2-карбоксилат, 3-гидроксинафталин-2-карбоксилат, метансульфонат и бензолсульфонат. В конкретных вариантах осуществления композиций, описанных здесь, применяется бромидная соль гликопирролата, а именно, 3-[(циклопентил-гидроксифенилацетил)окси]-1,1-диметилпирролидиния бромид, и может быть получена в соответствии с методиками, приведенными в патенте США № 2956062.
Когда композиции, описанные здесь, включают гликопирролат, в некоторых вариантах осуществления, композиции могут включать достаточно гликопирролата для предоставления доставляемой дозы, выбранной из между приблизительно 10 мкг и приблизительно 100 мкг, приблизительно 15 мкг и приблизительно 100 мкг, приблизительно 15 мкг и приблизительно 80 мкг, и приблизительно 10 мкг и приблизительно 80 мкг на нажатие MDI. В других таких вариантах осуществления, готовые лекарственные формы включают достаточно гликопирролата для предоставления доставляемой дозы, выбранной из до приблизительно 100 мкг, до приблизительно 80 мкг, до приблизительно 40 мкг, до приблизительно 20 мкг, или до приблизительно 10 мкг на нажатие MDI. В еще дополнительных вариантах осуществления, готовые лекарственные формы включают достаточно гликопирролата для предоставления доставляемой дозы, выбранной из приблизительно 9 мкг, 18 мкг, 36 мкг и 72 мкг на нажатие MDI. Чтобы достичь доставляемой дозы, как описано здесь, где композиции, описанные здесь, включают гликопирролат в качестве активного агента, в конкретных вариантах осуществления, количество гликопирролата, включенное в композиции может быть выбрано из, например, между приблизительно 0,04 мг/мл и приблизительно 2,25 мг/мл.
В других вариантах осуществления, тиотропий, включая любые егофармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, может быть выбран в качестве LAMA активного агента для включения в композицию, как описано здесь. Тиотропий является известным антихолинергическим лекарственным средством пролонгированного действия, подходящим для применения при лечении заболеваний или нарушений, ассоциированных с воспалением легких или обструкцией, таких как те, что описаны здесь. Тиотропий, включая кристаллические и фармацевтически приемлемые солевые формы тиотропия, описаны, например, в Патенте США № 5610163, Патенте США № RE39820, Патенте США № 6777423, и Патенте США № 6908928. Когда композиции, описанные здесь, включают тиотропий, в некоторых вариантах осуществления, композиции могут включать достаточно тиотропия для предоставления доставляемой дозы, выбранной из между приблизительно 2,5 мкг и приблизительно 25 мкг, приблизительно 4 мкг и приблизительно 25 мкг, приблизительно 2,5 мкг и приблизительно 20 мкг, и приблизительно 10 мкг и приблизительно 20 мкг на нажатие MDI. В других таких вариантах осуществления, готовые лекарственные формы включают достаточно тиотропия для предоставления доставляемой дозы, выбранной из до приблизительно 25 мкг, до приблизительно 20 мкг, до приблизительно 10 мкг, до приблизительно 5 мкг, или до приблизительно 2,5 мкг на нажатие MDI. В еще дополнительных вариантах осуществления, готовые лекарственные формы включают достаточно тиотропия для предоставления доставляемой дозы, выбранной из приблизительно 3 мкг, 6 мкг, 9 мкг, и 18 мкг на нажатие MDI. Чтобы достичь доставляемых доз, как описано здесь, где композиции, описанные здесь, включают тиотропий в качестве активного агента, в конкретных вариантах осуществления, количество тиотропия включенное в композиции, может быть выбрано из, например, между приблизительно 0,01 мг/мл и приблизительно 0,5 мг/мл.
В еще других вариантах осуществления, композиции, описанные здесь, включают кортикостероид. Такие активные агенты могут быть выбраны из, например, беклометазона, будесонида, циклесонида, флунизолида, флутиказона, метил-преднизолона, мометазона, преднизона и тримацинолона, включая любые фармацевтически приемлемые их соли, сложные эфиры, изомеры или сольваты. В некоторых вариантах осуществления, такие композиции включают кортикостероидный активный агент в комбинации с LAMA или LABA активным агентом. В других таких вариантах осуществления, композиции включают кортикостероидный активный агент в комбинации с LAMA и LABA активным агентом. Когда композиции включают кортикостероидный активный агент, в конкретных вариантах осуществления, может быть выбран мометазон.
Мометазон, фармацевтически приемлемые соли мометазона, такие как мометазона фуроат, и получение таких веществ известны, и описаны, например, в патенте США № 4472393, Патенте США № 5886200, и Патенте США № 6177560. Мометазон является подходящим для применения при лечении заболеваний или нарушений, ассоциированных с воспалением легких или обструкцией, таких как те, что описаны здесь (см., например, Патент США № 5889015, Патент США № 6057307, Патент США № 6057581, Патент США № 6677322, Патент США № 6677323 и Патент США № 6365581).
Когда композиции, описанные здесь, включают мометазон, в конкретных вариантах осуществления, композиции включают мометазон, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, в количестве, достаточном для предоставления целевой доставляемой дозы, выбранной из между приблизительно 20 мкг и приблизительно 400 мкг, приблизительно 20 мкг и приблизительно 200 мкг, приблизительно 50 мкг и приблизительно 200 мкг, приблизительно 100 мкг и приблизительно 200 мкг, приблизительно 20 мкг и приблизительно 100 мкг, и приблизительно 50 мкг и приблизительно 100 мкг, на нажатие MDI. В еще других вариантах осуществления, композиции, описанные здесь, могут включать мометазон, включя любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, в количестве, достаточном для предоставления намеченной доставляемой дозы, выбранной из до приблизительно 400 мкг, до приблизительно 200 мкг, или до приблизительно 100 мкг на нажатие MDI.
В других вариантах осуществления, композиции, описанные здесь, включают кортикостероид, выбранный из флутиказона и будесонида. Как флутиказон, так и будесонид являются подходящими для применения в лечении состояний, ассоциированных с воспалением легких или обструкцией, таких как те, что описаны здесь. Флутиказон, фармацевтически приемлемые соли флутиказона, такие как флутиказона пропионат, и получение таких веществ известны, и описаны, например, в патенте США № 4335121, Патенте США № 4187301, и обубликованной патентной заявке США № US2008125407. Будесонид также является хорошо известным и описан, например, в патенте США № 3929768. В некоторых вариантах осуществления, композиции, описанные здесь, могут включать флутиказон, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, в количестве, достаточном для предоставления целевой доставляемой дозы, выбранной из между приблизительно 20 мкг и приблизительно 200 мкг, приблизительно 50 мкг и приблизительно 175 мкг, и между приблизительно 80 мкг и приблизительно 160 мкг на нажатие MDI. В других вариантах осуществления, композиции, описанные здесь, могут включать флутиказон, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, в количестве, достаточном для предоставления намеченной доставляемой дозы, выбранной из до приблизительно 175 мкг, до приблизительно 160 мкг, до приблизительно 100 мкг, или до приблизительно 80 мкг на нажатие MDI. в конкретных вариантах осуществления, композиции, описанные здесь, могут включать будесонид, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, в количестве, достаточном для предоставления целевой доставляемой дозы, выбранной из между приблизительно 30 мкг и приблизительно 240 мкг, приблизительно 30 мкг и приблизительно 120 мкг, и между приблизительно 30 мкг и приблизительно 50 мкг нажатие MDI. В еще других вариантах осуществления, композиции, описанные здесь, могут включать будесонид, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, в количестве, достаточном для предоставления намеченной доставляемой дозы, выбранной из до приблизительно 240 мкг, до приблизительно 120 мкг, или до приблизительно 50 мкг на нажатие MDI.
В каждом варианте осуществления, композиция, как описано здесь, включает два или более активных агента. В некоторых вариантах осуществления, композиции включают комбинацию из двух или более видов частиц активного агента, которые могут быть co-суспендированы с единственным видом суспендирующих частиц. Альтернативно, композиция может включать два или более вида частиц активного агента, co-суспендированных с двумя или более различными видами суспендирующих частиц. В качестве еще одной альтернативы, композиции, как описано здесь, могут включать единственный вид частиц активного агента, суспендированных с единственным видом суспендирующих частиц, где единственный вид частиц активного агента включает один или более активных агентов и единственный вид суспендирующих частиц включает один или более активных агентов. Даже дополнительно, композиции как описано здесь, могут включать два или более активных агента, объединенных внутри единственным видом частиц активного агента. Например, где частицы активного агента составляют с использованием одного или более эксципиентов или адъювантов в дополнение к веществу активного агента, такие частицы активного агента могут включать индивидуальные частицы, которые включают два или более различных активных агентов.
(iii) Суспендирующие частицы
Суспендирующие частицы, включенные в со-суспензионные композиции, описанные здесь, работают для облегчения стабилизации и доставки активного агента, включенного в композиции. Хотя могут применяться разнообразные формы суспендирующих частиц, суспендирующие частицы обычно образованы из фармакологически инертного вещества, которое является приемлемым для ингаляции и является по существу нерастворимым в выбранном пропелленте. В целом, большинство суспендирующих частиц распределены по размерам в пределах вдыхаемого интервала. В конкретных вариантах осуществления, следовательно, MMAD суспендирующих частиц не будут превышать приблизительно 10 мкм, но не составляют ниже, чем приблизительно 500 нм. В альтернативном варианте осуществления, MMAD суспендирующих частиц находятся между приблизительно 5 мкм и приблизительно 750 нм. В еще одном другом варианте осуществления, MMAD суспендирующих частиц находятся между приблизительно 1 мкм и приблизительно 3 мкм. Когда используются в варианте осуществления для назальной доставки от MDI, MMAD суспендирующих частиц находятся между 10 мкм и 50 мкм.
Чтобы достичь вдыхаемых суспендирующих частиц в пределах описанных интервалов MMAD, суспендирующие частицы будут обычно проявлять объемный медианный оптический диаметр между приблизительно 0,2 мкм и приблизительно 50 мкм. В одном варианте осуществления, суспендирующие частицы проявляют объемный медианный оптический диаметр, который не превышает приблизительно 25 мкм. В еще одном другом варианте осуществления, суспендирующие частицы проявляют объемный медианный оптический диаметр, выбранный из, между приблизительно 0,5 мкм и приблизительно 15 мкм, между приблизительно 1,5 мкм и приблизительно 10 мкм, и между приблизительно 2 мкм и приблизительно 5 мкм.
Концентрация суспендирующих частиц, включенных в композицию в соответствии с настоящим описанием, может регулироваться, в зависимости от, например, количества частиц активного агента и применяемой суспензионной среды. В одном варианте осуществления, суспендирующие частицы включены в суспензионную среду при концентрации, выбранной из приблизительно от 1 мг/мл до приблизительно 15 мг/мл, приблизительно от 3 мг/мл до приблизительно 10 мг/мл, от 5 мг/мл до приблизительно 8 мг/мл и приблизительно 6 мг/мл. В еще одном другом варианте осуществления, суспендирующие частицы включены в суспензионную среду при концентрации до приблизительно 30 мг/мл. В еще одном другом варианте осуществления, суспендирующие частицы включены в суспензионную среду при концентрации до приблизительно 25 мг/мл.
Относительное количество суспендирующих частиц по отношению к частицам активного агента выбирают, чтобы достичь со-суспензии, как предусмотрено здесь. Со-суспензионная композиция может достигаться там, где количество суспендирующих частиц, при измерениях по массе, превышает количество частиц активного агента. Например, в конкретных вариантах осуществления, отношение общей массы суспендирующих частиц к общей массе частиц активного агента может находиться между, приблизительно 3:1 и приблизительно 15:1 или альтернативно от приблизительно 2:1 и 8:1. Альтернативно, отношение общей массы суспендирующих частиц к общей массе частиц активного агента может находиться свыше приблизительно 1, также до приблизительно 1,5, до приблизительно 5, до приблизительно 10, до приблизительно 15, до приблизительно 17, до приблизительно 20, до приблизительно 30, до приблизительно 40, до приблизительно 50, до приблизительно 60, до приблизительно 75, до приблизительно 100, до приблизительно 150 и до приблизительно 200, в зависимости от природы применяемых суспендирующих частиц и частиц активного агента. В дополнительных вариантах осуществления, отношение общей массы суспендирующих частиц к общей массе частиц активного агента может быть выбрано из между приблизительно 10 и приблизительно 200, между приблизительно 60 и приблизительно 200, между приблизительно 15 и приблизительно 60, между приблизительно 15 и приблизительно 170, между приблизительно 15 и приблизительно 60, приблизительно 16, приблизительно 60 и приблизительно 170.
В других вариантах осуществления, количество суспендирующих частиц, измеренных по массе, составляет менее, чем количество частиц активного агента. Например, в конкретных вариантах осуществления, масса суспендирующих частиц может составлять 20% от общей массы частиц активного агента. Однако в некоторых вариантах осуществления, общая масса суспендирующих частиц может также приближаться или быть равной общей массе частиц активного агента.
Суспендирующие частицы, пригодные для применения в композициях, описанных здесь, могут быть образованы из одного или более фармацевтически приемлемых веществ или эксципиентов, которые являются подходящими для ингаляционной доставки, и по существу не разрушаются или растворяются в суспензионной среде. В одном варианте осуществления, перфорированные микроструктуры, как определено здесь, могут применяться в качестве суспендирующих частиц. Примерные эксципиенты, которые могут применяться в готовой лекарственной форме суспендирующих частиц, описанных здесь, включают, но не ограничены лишь ими, (a) углеводы, например, моносахариды, такие как фруктоза, галактоза, глюкоза, D-манноза, сорбоза, и т.п.; дисахариды, таки как сахароза, лактоза, трегалоза, целлобиоза, и т.п.; циклодекстрины, таки как 2-гидроксипропил-β-циклодекстрин; и полисахариды, такие как раффиноза, мальтодекстрины, декстраны, крахмалы, хитин, хитозан, инулин, и т.п.; (b) аминокислоты, такие как аланин, глицин, аргинин, аспарагиновая кислота, глутаминовая кислота, цистеин, лизин, лейцин, изолейцин, валин, и т.п.; (c) металлические и органические соли, полученные из органических кислот и оснований, такие как цитрат натрия, аскорбат натрия, глюконат магния, глюконат натрия, трометамина гидрохлорид, и т.п.; (d) пептиды и белки, такие как аспартам, трилейцин, человеческий сывороточный альбумин, коллаген, желатин, и т.п.; (e) альдитолы, такие как маннит, ксилит, и т.п.; (f) синтетические или природные полимеры или их комбинации, такие как полилактиды, полилактид-гликолиды, циклодекстрины, полиакрилаты, метилцеллюлоза, карбоксиметилцеллюлоза, поливиниловые спирты, полиангидриды, полилактамы, поливинилпирролидоны, гиалуроновая кислота, полиэтиленгликоли; и (g) поверхностно-активные вещества, включающие фторированные и нефторированные соединения, такие как насыщенные и ненасыщенные липиды, неионные детергенты, неионные блоксополимеры, ионогенные поверхностно-активные вещества и их комбинации. В конкретных вариантах осуществления, суспендирующие частицы могут включать соль кальция, такую как хлорид кальция, как описано, например, в Патенте США № 7442388.
Дополнительно, фосфолипиды как из природных, так и синтетических источников могут применяться при получении суспендирующих частиц, пригодных для применения в композициях, описанных здесь. В конкретных вариантах осуществления, выбранный фосфолипид будет иметь температуру перехода от гелевой фазы в жидкокристаллтческую фазу свыше, чем приблизительно 40°C. Примерные фосфолипиды представляют собой насыщенные липиды с относительно длинной цепью (т.е. C16-C22) и могут содержать насыщенные фосфолипиды, такие как насыщенные фосфатидилхолины, имеющие длину ацильной цепи 16 C или 18 C (пальмитоил и стеароил). Примерные фосфолипиды включают фосфоглицериды, такие как дипальмитоилфосфатидилхолин, дистеароилфосфатидилхолин, диарахидоилфосфатидилхолин, дибегеноилфосфатидилхолин, дифосфатидилглицерин, фосфатидилхолины с короткой цепью, насыщенные фосфатидилэтаноламины с длинной цепью, насыщенные фосфатидилсерины с длинной цепью, насыщенные фосфатидилглицерины с длинной цепью и насыщенные фосфатидилинозиты с длинной цепью. Дополнительные эксципиенты раскрыты в Публикации международной патентной заявки № WO 96/32149 и Патентах США №№ 6358530, 6372258 и 6518239.
В конкретных вариантах осуществления, суспендирующие частицы могут быть образованы с использованием одного или более липидов, фосфолипидов или сахаридов, как описано здесь. В некоторых вариантах осуществления, суспендирующие частицы включают одно или более из поверхностно-активных веществ. Применение образованных суспендирующих частиц или включение одного или более поверхностно-активных веществ может инициировать всасывание выбранного активного агента, посредством чего увеличивается биодоступность. Суспендирующие частицы, описанные здесь, такие как, например, суспендирующие частицы образованные с использованием одного или более липидов, могут быть образованы для проявления желательной поверхностной складчатости (шероховатости), которая может дополнительно снижать межчастичные взаимодействия и улучшать аэрозолизацию посредством снижения площади поверхности, доступной для взаимодействия частица-частица. В дополнительных вариантах осуществления, если они подходят, может применяться липид, который существует естественным образом в легких при образовании суспендирующих частиц, поскольку такие суспендирующие частицы, которые имеют потенциал для снижения опсонизации (и посредством этого снижают фагоцитоз альвеолярными макрофагами), таким образом, предоставляя более продолжительное контролируемое высвобождение частиц в легких.
В еще одном другом аспекте, суспендирующие частицы, используемые в композициях, описанных здесь, могут быть выбраны для повышения стабильности при хранении выбранного активного агента, аналогично тому, как раскрыто в Публикации международной патентной заявки № WO 2005/000267. Например, в одном варианте осуществления, суспендирующие частицы могут включать фармацевтически приемлемые стекло-стабилизационные эксципиенты, имеющие Tg, равную, по меньшей мере, 55°C, по меньшей мере, 75°C, или, по меньшей мере, 100°C. Стеклообразователи, пригодные для применения в композициях, описанных здесь, включают, но не ограничены лишь ими, один или более из трилейцина, цитрата натрия, фосфата натрия, аскорбиновой кислоты, инулина, циклодекстрина, поливинилпирролидона, маннита, сахарозы, трегалозы, лактозы, и пролина. Примеры дополнительных стеклообразующих эксципиентов раскрыты в патентах США №№ RE 37872, 5928469, 6258341 и 6309671.
Суспендирующие частицы могут быть сконструированы, подобраны по размерам, и формованы желательным образом для предоставления желательной стабильности и характеристик доставки активного агента. В одном примерном варианте осуществления, суспендирующие частицы содержат перфорированные микроструктуры, как описано здесь. Там, где перфорированные микроструктуры применяют в качестве суспендирующих частиц в композициях, описанных здесь, они могут быть образованы с использованием одного или более эксципиентов, как описано здесь. Например, в конкретных вариантах осуществления, перфорированные микроструктуры могут включать, по меньшей мере, одно из следующих: липиды, фосфолипиды, неионные детергенты, неионные блоксополимеры, ионогенные поверхностно-активные вещества, биосовместимые фторированные поверхностно-активные вещества и их комбинации, особенно такие, которые разрешены для легочного применения. Конкретные поверхностно-активные вещества, которые могут применяться при получении перфорированных микроструктур, включают полоксамер 188, полоксамер 407 и полоксамер 338. Другие конкретные поверхностно-активные вещества включают олеиновую кислоту или ее соли с щелочными металлами. В одном варианте осуществления, перфорированные микроструктуры включают более чем приблизительно 10% масс./масс. поверхностно-активного вещества.
В некоторых вариантах осуществления, суспендирующие частицы могут быть получены посредством образования эмульсии масло-в воде, с использованием фторуглеродного масла (например, перфтороктилбромида, перфтордекалина), которое может быть эмульгировано с использованием поверхностно-активного вещества, такого как насыщенный фосфолипид с длинной цепью. Полученная в результате эмульсия перфторуглерода в воде может затем быть обработана с использованием гомогенизатора высокого давления для снижения размера масляных капелек. Перфторуглеродная эмульсия может подаваться в распылительную сушилку, необязательно с раствором активного агента, если это является желательным для включения активного агента в матрикс перфорированных микроструктур. Как хорошо известно, сушка с распылением представляет собой одностадийный процесс, который преобразует жидкое сырье в форму высушенных частиц. Сушка с распылением применяется для предоставления порошковидного фармацевтического вещества для разнообразных путей введения, включая ингаляцию. Условия функционирования распылительной сушилки (такие как температура ввода и вывода, скорость подачи сырья, давление атомизации, объемная скорость потока высушивающего воздуха и конфигурация распылительной насадки) могут регулироваться для получения желательного размера частиц, производя на выходе результирующие сухие микроструктуры. Такие способы получения примерных перфорированных микроструктур раскрыты в Патенте США № 6309623 на имя Weers et al.
Перфорированные микроструктуры, как описаны здесь, могут также быть образованы посредством лиофилизации и последующего размельчения или микронизации. Лиофилизация представляет собой процесс сублимационной сушки, в котором воду сублимируют из композиции после ее замораживания. Этот процесс позволяет осуществлять сушку без повышенных температур. В еще дополнительных вариантах осуществления, суспендирующие частицы могут быть получены с использованием процесса сублимации с распылением, такого как раскрыт в Патенте США 5727333.
Кроме того, суспендирующие частицы, как описаны здесь, могут включать наполнители, такие как полимерные частицы. Полимерные полимеры могут быть образованы из биосовместимых и/или биоразрушаемых полимеров, сополимеров или смесей. В одном варианте осуществления, могут применяться полимеры, способные к образованию аэродинамически легких частиц, такие как функционализироанные привитые сложноэфирные сополимеры и биоразрушаемые полиангидриды. Например, могут применяться наполняющие эродирующие полимеры на основе сложных полиэфиров, включающих поли(гидроксикислоты). Полигликолевая кислота (PGA), полимолочная кислота (PLA) или их сополимеры могут применяться для образования суспендирующих частиц. Сложный полиэфир может включать заряженную или функционализируемую группу, такую как аминокислота. Например, суспендирующие частицы могут быть образованы из поли(D,L-молочной кислоты) и/или поли(D,L-молочной-co-гликолевой кислоты) (PLGA), которая включает поверхностно-активное вещество, такое как DPPC.
Другие потенциальные полимерные кандидаты для применения в суспендирующих частицах могут включать полиамиды, поликарбонаты, полиалкилены такие как полиэтилен, полипропилен, поли(этиленгликоль), поли(этиленоксид), поли(этилентерефталат), поливиниловые соединения, такие как поливиниловые спирты, поливиниловые простые эфиры и поливиниловые сложные эфиры, полимеры акриловой и метакриловой кислот, целлюлозы и другие полисахариды, и пептиды или белки, или их сополимеры или смеси. Полимеры могут быть выбраны или модифицированы для обладания соответствующими степенями стабильности и разложения in vivo для различных применений с контролируемой доставкой лекарственного средства.
Композиции, описанные здесь, могут включать два или более вида суспендирующих частиц. Даже дополнительно, композиции в соответствии с настоящим описанием могут включать суспендирующие частицы, которые включают один или более из активных агентов, введенных в суспендирующие частицы. Там, где активный агент вводят в суспендирующие частицы, суспендирующие частицы будут иметь вдыхаемый размер, и могут быть составлены, и получены с использованием, например, способов и веществ, описанных здесь.
Композиции, составленные в соответствии с представленными рекомендациями, могут ингибировать разложение активного агента, включенного в них. Например, в конкретных вариантах осуществления, композиции, описанные здесь, ингибируют одно или более из флоккуляции, агрегации и опосредованного раствором превращения вещества активного агента, включенного в композиции. Фармацевтические композиции, описанные здесь подходят для респираторной доставки через и с MDI таким образом, который достигает желательной однородности доставляемой дозы ("DDU") для каждого активного агента, включенного в комбинацию из двух или более активных агентов, даже с комбинациями, включающими сильнодействующие и высоко сильнодействующие активные вещества. Как проиллюстрировано детально в Примерах, включенных здесь, даже при доставке очень низких доз двух или более активных агентов, композиции, описанные здесь, могут достигать DDU ±30%, или лучше, для каждого активного агента на всем протяжении опорожнения емкости MDI. В одном таком варианте осуществления, композиции, описанные здесь, достигают DDU ±25%, или лучше, для каждого активного агента на всем протяжении опорожнения емкости MDI. В еще одном другом таком варианте осуществления, композиции, описанные здесь, достигают DDU для активного агента ±20%, или лучше, для каждого активного агента на всем протяжении опорожнения емкости MDI.
Фармацевтические композиции, описанные здесь, также служат по существу для сохранения эффективности действия FPF и FPD на всем протяжении опорожнения емкости MDI, даже после подвергания условиям ускоренного разложения. Например, композиции в соответствии с настоящим описанием поддерживают 80%, 90%, 95%, или более, исходной эффективности действия FPF и FPD на всем протяжении опорожнения емкости MDI, даже после подвергания условиям ускоренного разложения. Композиции, описанные здесь, предоставляют добавленный благоприятный эффект, достигая такой эффективности действия при составлении с использованием пропеллентов без CFC и исключая или, по существу избегая фармацевтических эффектов, часто наблюдаемых с композициями, включающими множество активных агентов. В конкретных вариантах осуществления, композиции, описанные здесь, достигают желательных одного или всех намеченных эффективностей действия DDU, FPF и FPD при составлении с суспензионной средой, включающей только один или более пропеллентов без CFC и без необходимости модифицировать характеристики пропеллентов без CFC, таким образом, как посредством добавления, например, одного или более сорастворителя, антирастворителя, солюбилизирующего агента, адъюванта или другого вещества, модифицирующего пропеллент.
В одном варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду, содержащую фармацевтически приемлемый HFA пропеллент; первый вид частиц активного агента, содержащих гликопирролат, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы гликопирролата между приблизительно 15 мкг и приблизительно 80 мкг на нажатие дозирующего ингалятора; второй вид частиц активного агента содержащих формотерол, включая любые его фармацевтически приемлемы соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора; и множество вдыхаемых суспендирующих частиц, содержащих перфорированные микроструктуры, проявляющие объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм, где первый и второй вид частиц активного агента ассоциируют с множеством суспендирующих частиц с образованием со-суспензи. В одном таком варианте осуществления, отношение общей массы суспендирующих частиц к общей массе первого и второго вида частиц активного агента выбирают из между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1.
В еще одном другом варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду, содержащую фармацевтически приемлемый HFA пропеллент; первый вид частиц активного агента содержащих тиотропий, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы тиотропия между приблизительно 5 мкг и приблизительно 20 мкг на нажатие дозирующего ингалятора; второй вида частиц активного агента, содержащих формотерол, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора; и множество вдыхаемых суспендирующих частиц, содержащих перфорированные микроструктуры, проявляющих объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм, где первый и второй вид частиц активного агента ассоциируют с множеством суспендирующих частиц с образованием со-суспензии. В одном таком варианте осуществления, отношение общей массы суспендирующих частиц к общей массе первого и второго вида частиц активного агента выбирают из, между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1.
В еще одном другом варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду, содержащую фармацевтически приемлемый HFA пропеллент; множество частиц активного агента, содержащих гликопирролат, включая любые фармацевтически его приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы гликопирролата между приблизительно 15 мкг и приблизительно 80 мкг на нажатие дозирующего ингалятора; и множество вдыхаемых суспендирующих частиц, содержащих формотерол, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, где множество суспендирующих частиц проявляют объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм, включенные в суспензионную среду при концентрации, достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора, и ассоциируют с множеством частиц активного агента с образованием со-суспензии. В одном таком варианте осуществления, отношение общей массы суспендирующих частиц к общей массе первого и второго вида частиц активного агента выбирают из, между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1.
В еще одном другом варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду, содержащую фармацевтически приемлемый HFA пропеллент; множество частиц активного агента, содержащих тиотропий, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы тиотропия между приблизительно 5 мкг и приблизительно 20 мкг на нажатие дозирующего ингалятора; и множество вдыхаемых суспендирующих частиц, содержащих формотерол, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, где множество суспендирующих частиц проявляют объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм, включенных в суспензионную среду при концентрации, достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора, и ассоциируют с множеством частиц активного агента с образованием со-суспензии. В одном таком варианте осуществления, отношение общей массы суспендирующих частиц к общей массе первого и второго вида частиц активного агента выбирают из, между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1.
В еще одном другом варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду, содержащую фармацевтически приемлемый HFA пропеллент; первый вид частиц активного агента, содержащих гликопирролат, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы гликопирролата между приблизительно 15 мкг и приблизительно 80 мкг на нажатие дозирующего ингалятора; второй вид частиц активного агента, содержащих формотерол, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора; третий вид частиц активного агента, содержащих кортикостероид, выбранный из беклометазона, будесонида, циклесонида, флунизолида, флутиказона, метил-преднизолона, мометазона, преднизона и тримацинолона, включая любые их фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты; и множество вдыхаемых суспендирующих частиц, содержащих перфорированные микроструктуры, проявляющих объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм, где первый, второй и третий вид частиц активного агента ассоциируют с множеством суспендирующих частиц с образованием со-суспензии. В одном таком варианте осуществления, по меньшей мере, 90% первого, второго, и третьего вида частиц активного агента по объему проявляют оптический диаметр меньше чем 7 мкм, и отношение общей массы суспендирующих частиц к общей массе первого, второго и третьего вида частиц активного агента выбирают из между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1
В еще одном другом варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду, содержащую фармацевтически приемлемый HFA пропеллент; первый вид частиц активного агента, содержащих гликопирролат, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы гликопирролата между приблизительно 15 мкг и приблизительно 80 мкг на нажатие дозирующего ингалятора; второй вид частиц активного агента, содержащих формотерол, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора; третий вид частиц активного агента, содержащих будесонид, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы будесонида между приблизительно 30 мкг и приблизительно 50 мкг на нажатие дозирующего ингалятора; и множество вдыхаемых суспендирующих частиц, содержащих перфорированные микроструктуры, проявляющие объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм, где первый, второй и третий вид частиц активного агента ассоциируют с множеством суспендирующих частиц с образованием со-суспензии. В одном таком варианте осуществления, по меньшей мере, 90% первого, второго, и третьего вида частиц активного агента по объему проявляют оптический диаметр меньше чем 7 мкм, и отношение общей массы суспендирующих частиц к общей массе первого, второго и третьего вида частиц активного агента выбирают из между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1.
В еще одном другом варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду, содержащую фармацевтически приемлемый HFA пропеллент; первый вид частиц активного агента, содержащих тиотропий, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы тиотропия между приблизительно 5 мкг и приблизительно 20 мкг на нажатие дозирующего ингалятора; второй вид частиц активного агента содержащих формотерол, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора; третий вид частиц активного агента, содержащих будесонид, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы будесонида между приблизительно 30 мкг и приблизительно 50 мкг на нажатие дозирующего ингалятора; и множество вдыхаемых суспендирующих частиц, содержащих перфорированные микроструктуры, проявляющие объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм, где первый, второй и третий вид частиц активного агента ассоциируют с множеством суспендирующих частиц с образованием со-суспензии. В одном таком варианте осуществления, по меньшей мере, 90% первого, второго и третьего вида частиц активного агента по объему проявляют оптический диаметр меньше чем 7 мкм и отношение общей массы суспендирующих частиц к общей массе первого, второго и третьего вида частиц активного агента выбирают из между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1.
В еще одном другом варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду, содержащую фармацевтически приемлемый HFA пропеллент; первый вид частиц активного агента, содержащих гликопирролат, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы гликопирролата между приблизительно 15 мкг и приблизительно 80 мкг на нажатие дозирующего ингалятора; второй вид частиц активного агента, содержащих формотерол, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора; третий вид частиц активного агента, содержащих мометазон, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы мометазона между приблизительно 20 мкг и приблизительно 100 мкг на нажатие дозирующего ингалятора; и множество вдыхаемых суспендирующих частиц содержащих перфорированные микроструктуры, проявляющие объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм, где первый, второй и третий вид частиц активного агента ассоциируют с множеством суспендирующих частиц с образованием со-суспензии. В одном таком варианте осуществления, по меньшей мере, 90% первого, второго и третьего вида частиц активного агента по объему проявляют оптический диаметр менее 7 мкм, и отношение общей массы суспендирующих частиц к общей массе первого, второго и третьего вида частиц активного агента выбирают из между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1.
В еще одном другом варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду, содержащую фармацевтически приемлемый HFA пропеллент; первый вид частиц активного агента, содержащих тиотропий, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы тиотропия между приблизительно 5 мкг и приблизительно 20 мкг на нажатие дозирующего ингалятора; второй вид частиц активного агента, содержащих формотерол, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора; третий вид частиц активного агента, содержащих мометазон, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы мометазона между приблизительно 20 мкг и приблизительно 100 мкг на нажатие дозирующего ингалятора; и множество вдыхаемых суспендирующих частиц, содержащих перфорированные микроструктуры, проявляющие объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм, где первый, второй и третий вид частиц активного агента ассоциируют с множеством суспендирующих частиц с образованием со-суспензии. В одном таком варианте осуществления, по меньшей мере, 90% первого, второго и третьего вида частиц агента по объему проявляют оптический диаметр меньше чем 7 мкм, и отношение общей массы суспендирующих частиц к общей массе первого, второго и третьего вида частиц активного агента выбирают из между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1.
В еще одном другом варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду, содержащую фармацевтически приемлемый HFA пропеллент; первый вид частиц активного агента, содержащих гликопирролат, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы гликопирролата между приблизительно 15 мкг и приблизительно 80 мкг на нажатие дозирующего ингалятора; второй вид частиц активного агента, содержащих формотерол, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора; и множество вдыхаемых суспендирующих частиц, содержащих перфорированные микроструктуры, включающие кортикостероид, выбранный из беклометазона, будесонида, циклесонида, флунизолида, флутиказона, метил-преднизолона, мометазона, преднизона и тримацинолона, включая их любые фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, где суспендирующие частицы проявляют объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм, и ассоциируют с первым и вторым видом частиц активного агента с образованием со-суспензии. В одном таком варианте осуществления, по меньшей мере, 90% первого и второго вида частиц активного агента по объему проявляют оптический диаметр меньше чем 7 мкм, и отношение общей массы суспендирующих частиц к общей массе первого и второго вида частиц активного агента выбирают из между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1.
В еще одном другом варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду, содержащую фармацевтически приемлемый HFA пропеллент; первый вид частиц активного агента, содержащих гликопирролат, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы гликопирролата между приблизительно 15 мкг и приблизительно 80 мкг на нажатие дозирующего ингалятора; второй вид частиц активного агента, содержащих формотерол, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора; и множество вдыхаемых суспендирующих частиц, содержащих перфорированные микроструктуры, включающие будесонид, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, где суспендирующие частицы включают достаточно будесонида для предоставления доставляемой дозы будесонида между приблизительно 30 мкг и приблизительно 50 мкг на нажатие дозирующего ингалятора, проявляют объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм, и ассоциируют с первым и вторым видом частиц активного агента с образованием со-суспензии. В одном таком варианте осуществления, по меньшей мере, 90% первого и второго вида частиц активного агента по объему проявляют оптический диаметр меньше чем 7 мкм, и отношение общей массы суспендирующих частиц к общей массе первого и второго вида частиц активного агента выбирают из между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1.
В еще одном другом варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду, содержащую фармацевтически приемлемый HFA пропеллент; первый вид частиц активного агента, содержащих гликопирролат, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы гликопирролата между приблизительно 15 мкг и приблизительно 80 мкг на нажатие дозирующего ингалятора; второй вид частиц активного агента, содержащих формотерол, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора; и множество вдыхаемых суспендирующих частиц, содержащих перфорированные микроструктуры, включающие мометазон, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, где суспендирующие частицы включают достаточно мометазона для предоставления доставляемой дозы мометазона между приблизительно 20 мкг и приблизительно 100 мкг на нажатие дозирующего ингалятора, проявляют объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм, и ассоциируют с первым и вторым видом частиц активного агента с образованием со-суспензии. В одном таком варианте осуществления, по меньшей мере, 90% первого и второго вида частиц активного агента по объему проявляют оптический диаметр меньше чем 7 мкм, и отношение общей массы суспендирующих частиц к общей массе первого и второго вида частиц активного агента выбирают из между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1.
В еще одном другом варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду, содержащую фармацевтически приемлемый HFA пропеллент; первый вид частиц активного агента, содержащих тиотропий, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы тиотропия между приблизительно 5 мкг и приблизительно 20 мкг на нажатие дозирующего ингалятора; второй вид частиц активного агента, содержащих формотерол, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора; и множество вдыхаемых суспендирующих частиц, содержащих перфорированные микроструктуры, включающие кортикостероид, выбранный из беклометазона, будесонида, циклесонида, флунизолида, флутиказона, метил-преднизолона, мометазона, преднизона и тримацинолона, включая любые их фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, где суспендирующие частицы проявляют объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм и ассоциируют с первым и вторым видом частиц активного агента с образованием со-суспензии. В одном таком варианте осуществления, по меньшей мере, 90% первого и второго вида частиц активного агента по объему проявляют оптический диаметр меньше чем 7 мкм, и отношение общей массы суспендирующих частиц к общей массе первого и второго вида частиц активного агента выбирают из между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1.
В еще одном другом варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду, содержащую фармацевтически приемлемый HFA пропеллент; первый вид частиц активного агента, содержащих тиотропий, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы тиотропия между приблизительно 5 мкг и приблизительно 20 мкг на нажатие дозирующего ингалятора; второй вид частиц активного агента, содержащих формотерол, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора; и множество вдыхаемых суспендирующих частиц, содержащих перфорированные микроструктуры, включающие будесонид, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, где суспендирующие частицы включают достаточно будесонида для предоставления доставляемой дозы будесонида между приблизительно 30 мкг и приблизительно 50 мкг на нажатие дозирующего ингалятора, проявляют объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм, и ассоциируют с первым и вторым видом частиц активного агента с образованием со-суспензии. В одном таком варианте осуществления, по меньшей мере, 90% первого и второго вида частиц активного агента по объему проявляют оптический диаметр меньше чем 7 мкм, и отношение общей массы суспендирующих частиц к общей массе первого и второго вида частиц активного агента выбирают из между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1.
В еще одном другом варианте осуществления, со-суспензионная композиция, доставляемая из дозирующего ингалятора в соответствии с настоящим описанием, включает следующее: суспензионную среду содержащую фармацевтически приемлемый HFA пропеллент; первый вид частиц активного агента, содержащих тиотропий, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы тиотропия между приблизительно 5 мкг и приблизительно 20 мкг на нажатие дозирующего ингалятора; второй вид частиц активного агента, содержащих формотерол, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, суспендированные в суспензионной среде при концентрации, достаточной для предоставления доставляемой дозы формотерола между приблизительно 2 мкг и приблизительно 10 мкг на нажатие дозирующего ингалятора; и множество вдыхаемых суспендирующих частиц, содержащих перфорированные микроструктуры, включающие мометазон, включая любые его фармацевтически приемлемые соли, сложные эфиры, изомеры или сольваты, где суспендирующие частицы включают достаточно мометазона для предоставления доставляемой дозы мометазона между приблизительно 20 мкг и приблизительно 100 мкг на нажатие дозирующего ингалятора, проявляют объемный медианный оптический диаметр между приблизительно 1,5 мкм и приблизительно 10 мкм, и ассоциируют с первым и вторым видом частиц активного агента с образованием со-суспензии. В одном таком варианте осуществления, по меньшей мере, 90% первого и второго вида частиц активного агента по объему проявляют оптический диаметр меньше чем 7 мкм, и отношение общей массы суспендирующих частиц к общей массе первого и второго вида частиц активного агента выбирают из между приблизительно 3:1 и приблизительно 15:1 и между приблизительно 2:1 и 8:1.
III. Дозирующие ингаляторные системы
Как описано, в отношении к способам, предоставленным здесь, со-суспензионные композиции, раскрытые здесь, могут применяться в MDI системе. MDI сконфигурирована для доставки конкретного количества лекарственного средства в аэрозольной форме. В одном варианте осуществления, MDI система включает находящуюся под давлением емкость, заполненную жидкой фазой готовой лекарственной формы, где емкость расположена в приводном механизме, образованном с наконечником. MDI система может включать готовые лекарственные формы, описанные здесь, которые включают суспензионную среду, по меньшей мере, один вид частиц активного агента и, по меньшей мере, один вид суспендирующих частиц. Емкость, используемая в MDI, может иметь любую подходящую конфигурацию, и в одном примерном варианте осуществления, емкость может иметь объем находящийся в интервале от приблизительно 5 мл до приблизительно 25 мл, такая как, например емкость, имеющая объем 19 мл. После встряхивания устройства, наконечник вставляют в рот пациента между губами и зубами. Пациент обычно глубоко выдыхает для опорожнения легких и затем делает медленный глубокий вздох при приведении в действие картриджа.
Внутри примерного картриджа находится дозирующий клапан, включающий дозирующую камеру, способную удерживать определенный объем готовой лекарственной формы (например, 63 мкл или любой другой подходящий объем, доступный в доступных для приобретения дозирующих клапанах), который высвобождается в камеру расширения по дистальному концу штока клапана при приведении в действие. Приводной механизм удерживает емкость, и может также включать порт с распылительной насадкой приводного механизма для приема штока клапана дозирующего клапана. При приведении в действие, установленный объем готовой лекарственной формы перемещается в камеру расширения, из распылительной насадки приводного механизма и в спрэй с высокой скоростью, который втягивается в легкие пациента.
IV. Способы
Способы составления фармацевтической композиции для респираторной доставки, по меньшей мере, двух активных агентов предоставлены здесь. В одном варианте осуществления, способ включает стадии предоставления суспензионной среды, одного или более видов частиц активного агента и одного или более видов суспендирующих частиц, и объединение таких компонентов с образованием композиции, где частицы активного агента ассоциируют с суспендирующими частицами и совместно располагаются с суспендирующими частицами в суспензионной среде таким образом, что образуется со-суспензия, как описана здесь. В одном таком варианте осуществления, ассоциация частиц активного агента и суспендирующих частиц происходит таким образом, что они не разделяются вследствие их различных сил выталкивания в пропелленте. Как будет учтено, способ составления фармацевтической композиции, как описана здесь, может включать предоставление двух или более видов частиц активного агента в комбинации с одним или более видами суспендирующих частиц. В дополнительных вариантах осуществления, способ может включать предоставление двух или более видов суспендирующих частиц в комбинации с двумя или более видами частиц активного агента таким образом, который приводит в результате к со-суспензии. В еще других вариантах осуществления, один или более видов частиц активного агента может объединяться с одним или более видами суспендирующих частиц, как описано здесь. В конкретных вариантах осуществления, вещество активного агента, включенное в частицы активного агента, выбирают из одного или более LABA, LAMA или кортикостероидных активных агентов. В некоторых вариантах осуществления, частицы активного агента состоят по существу из вещества активного агента, и не содержат дополнительных эксципиентов, адъювантов, стабилизаторов и т.д.
В конкретных вариантах осуществления способов для предоставления стабилизированной композиции из комбинации двух или более активных агентов, настоящее раскрытие предоставляет способы для ингибирования опосредованного раствором превращения активных агентов в фармацевтической композиции для легочной доставки. В одном варианте осуществления, получают суспензионную среду, как описано здесь, такую как суспензионную среду, образованную HFA пропеллентом. Суспендирующие частицы также получают или готовят, как описано здесь. Также получают частицы активного агента, и суспензионную среду, суспендирующие частицы и частицы активного агента объединяют с образованием со-суспензии, где частицы активного агента ассоциируют с суспендирующими частицами, и совместно располагаются с суспендирующими частицами в непрерывной фазе, образованной суспензионной средой. При сравнении с частицами активного агента, содержащимися в той же самой суспензионной среде в отсутствии суспендирующих частиц, было обнаружено, что со-суспензии в соответствии с настоящим описанием проявляют более высокую переносимость опосредованного раствором фазового превращения, которое приводит к необратимой агрегации кристаллов, и, таким образом, могут приводить к улучшенной стабильности и однородности дозирования.
В дополнительных вариантах осуществления, способы образования стабилизированных композиций, включающих два или более активных агентов для легочной доставки, включают сохранение FPF и/или FPD для композиции на всем протяжении опорожнения емкости MDI. В конкретных вариантах осуществления способов сохранения FPF и/или FPD, предоставленных фармацевтической композицией для легочной доставки, предоставлена вдыхаемая со-суспензия, как описано здесь, которая способна к поддержанию FPD и/или FPF до пределов ±20%, ±10% или даже ±5% первоначальной FPD и/или FPF, соответственно, на всем протяжении опорожнения емкости MDI. Такая эффективность действия может быть достигнута, где два или более активных агентов включены в со-суспензию и даже после подвергания со-суспензии условиям ускоренного разложения. В одном варианте осуществления, получают суспензионную среду, как описано здесь, такую как суспензионная среда, образованная HFA пропеллентом. Суспендирующие частицы также получают или готовят, как описано здесь. Также получают частицы активного агента, и суспензионную среду, суспендирующие частицы и частицы активного агента объединяют с образованием со-суспензии, где частицы активного агента ассоциируют с суспендирующими частицами, и совместно располагаются с суспендирующими частицами в суспензионной среде. Даже после воздействия на такие композици одного или более событий циклических изменений температуры, со-суспензия поддерживает FPD или FPF в пределах ±20%, ±10%, или даже ±5% относительно значений, измеренных перед подверганием композиции воздействию множества событий циклического изменения температуры.
Раскрыты способы получения MDI для респираторной доставки двух или более активных агентов. В некоторых вариантах осуществления, такой способ может включать загрузку емкости, как описано здесь, частицами активного агента и суспендирующими частицами. Клапан приводного механизма может присоединяться к концу емкости и емкость герметично закупориваться. Клапан приводного механизма может быть приспособлен для распределения дозируемого количества активных агентов, включенных в со-суспензионные композиции на нажатие MDI. Емкость может быть заряжена фармацевтически приемлемой суспензионной средой, такой как пропеллент, как описано здесь, вследствие чего частицы активного агента и суспендирующие частицы дают стабильную со-суспензию в суспензионной среде.
В способах, включающих респираторную доставку двух или более активных агентов с использованием композиций, описанных здесь, композиции могут доставляться посредством MDI. Следовательно, в конкретных вариантах осуществления таких способов, получают MDI, загруженные композицией, описанной здесь, и два или более активных агентов вводят пациенту посредством респираторной доставки через нажатие MDI. Например, в одном варианте осуществления, включающем легочную доставку двух или более активных агентов, после встряхивания устройства MDI, наконечник вводят в рот пациента между губами и зубами. Пациент обычно глубоко выдыхает для опорожнения легких и затем делает медленный глубокий вдох во время приведения в действие картриджа MDI. При приведении в действие, установленный объем готовой лекарственной формы перемещается в камеру расширения, из распылительной насадки приводного механизма и в спрэй с высокой скоростью, который втягивается в легкие пациента. В одном варианте осуществления доза каждого активного агента, доставляемого на всем протяжении опорожнения емкости MDI, составляет не более, чем на 30% свыше, чем средняя доставляемая доза и составляет не меньше, чем на 30% меньше, чем средняя доставляемая доза. Следовательно, также предоставлены способы достижения желательной DDU двух или более активных агентов, доставляемых из MDI. В таких вариантах осуществления, способ может включать достижение DDU для каждого из двух или более активных агентов, доставляемых из MDI, выбранных из, например, DDU ±30% или лучше, DDU ±25% или лучше, и DDU ±20% или лучше, на всем протяжении опорожнения емкости MDI, из которой доставляют со-суспензионные композиции.
Здесь предоставлены способы лечения пациентов, страдающих от воспалительного или обструктивного легочного заболевания или состояния. В конкретных вариантах осуществления, такие способы включают легочную доставку фармацевтической композиции, описанной здесь, и в некоторых таких вариантах осуществления, легочное введение фармацевтической композиции выполняется посредством доставки композиции с использованием MDI. Заболевание или состояние, подлежащее лечению, может быть выбрано из любого воспалительного или обструктивного легочного заболевания или состояния, которое реагирует на введение, например, активных агентов описанных здесь. В некоторых вариантах осуществления, комбинация активных агентов включает, по меньшей мере, один активный агент, выбранный из LAMA, LABA или кортикостероидных активных агентов. В конкретных вариантах осуществления, фармацевтические композиции, описанные здесь, могут применяться при лечении заболевания или нарушения, выбранного из астмы, ХОБЛ, обострения гиперреактивности дыхательных путей вследствие терапии другими лекарственными средствами, аллергического ринита, синусита, легочной вазоконстрикции, воспаления, аллергий, затрудненного дыхания, респираторного дистресс-синдрома, легочной гипертензии, легочной вазоконстрикции, эмфиземы, и любого другого респираторного заболевания, состояния, признака, генотипа или фенотипа, которые могут реагировать на введение комбинаций активных агентов, описанных здесь. В некоторых вариантах осуществления, фармацевтические композиции, описанные здесь, могут применяться при лечении воспаления легких и обструкции, ассоциированной с кистозным фиброзом.
Дополнительно, фармацевтические композиции в соответствии с настоящим описанием, доставляемые из MDI, предоставляют желательную фармакодинамическую (PD) эффективность действия. В конкретных вариантах осуществления, легочная доставка фармацевтических композиций, описанных здесь, приводит к быстрому, значительному улучшению жизненной емкости легких, которое может быть охарактеризовано улучшением объема форсированного выдоха в одну секунду (FEV1). Например, в конкретных вариантах осуществления, предоставлены способы достижения клинически значимого увеличения FEV1, где такие способы включают предоставление со-суспензионной композиции, содержащей два или более активных агентов, где, по меньшей мере, один из этих активных агентов выбирают из LABA, LAMA или кортикостероидных активных агентов, как описаны здесь, и введение такой композиции пациенту, переносящего воспаление легких или обструкцию через MDI. В одном таком варианте осуществления, активные агенты, включенные в композицию, включают комбинацию, выбранного из одной из комбинаций LABA и LAMA активных агентов, комбинации LABA и кортикостероидных активных агентов, комбинации LAMA и кортикостероидных активных агентов, и комбинации LABA, LAMA и кортикостероидных активных агентов. Для целей настоящего раскрытия, клинически значимое увеличение FEV1 представляет собой любой увеличение, равное 100 мл или выше, и в некоторых вариантах осуществления способов описанных здесь, введение композиции в соответствии с настоящим описанием пациенту приводит к клинически существенному увеличению FEV1 в пределах 1 часа или менее. В других таких вариантах осуществления, способы введения композиции, как описано здесь, пациенту через MDI приводит к клинически существенному увеличению FEV1 в пределах 0,5 часа или менее.
В дополнительных вариантах осуществления, предоставлены способы достижения увеличения FEV1 большего, чем 100 мл. Например, в некоторых вариантах осуществления, способы, описанные здесь, включают способы достижения FEV1, равного 150 мл или выше в пределах периода времени, выбранного из 0,5 часа или менее, 1 часа или менее, и 1,5 часа или менее. В других вариантах осуществления, способы, описанные здесь, включают способы достижения FEV1, равного 200 мл или выше в пределах периода времени, выбранного из 0,5 часа или менее, 1 часа или менее, и 1,5 часа или менее, и 2 часов или менее. В некоторых таких вариантах осуществления, активные агенты, включенные в композицию, включают комбинацию, выбранную из одной из комбинаций LABA и LAMA активных агентов, комбинации LABA и кортикостероидных активных агентов, комбинации LAMA и кортикостероидных активных агентов, и комбинации LABA, LAMA и кортикостероидных активных агентов, где композицию доставляют пациенту через MDI.
В еще дополнительных вариантах осуществления, предоставлены способы достижения и поддержания клинически существенного увеличения FEV1. В конкретных вариантах осуществления, при введении единственной дозы комбинации активных агентов, составленных в композицию, как описано здесь, пациенту через MDI, клинически существенное увеличение FEV1 достигается в период времени, выбранный из 0,5 часа или менее, 1 часа или менее, и 1,5 часа или менее, и клинически существенное увеличение FEV1 поддерживается вплоть до 12 часов или более. В некоторых таких вариантах осуществления, увеличение FEV1 может быть выбрано из увеличения, равного 150 мл или выше, 200 мл или выше и 250 мл или выше, и увеличение FEV1 остается клинически существенным в течение периода времени, выбранного из до 4 часов, до 6 часов, до 8 часов, до 10 часов и до 12 часов или более. В некоторых таких вариантах осуществления, активные агенты, включенные в композицию, включают комбинацию, выбранную из одной из комбинаций LABA и LAMA активных агентов, комбинации LABA и кортикостероидных активных агентов, комбинаци LAMA и кортикостероидных активных агентов, и комбинаци LABA, LAMA и кортикостероидных активных агентов, где композицию доставляют пациенту через MDI.
Композиции, системы и способы, описанные здесь, являются не только пригодными для достижения желательной фармакодинамической эффективности действия за короткие периоды времени, но будут достигать таких результатов у высокого процента пациентов. Например, здесь предоставлены способы достижения 10% или большего увеличения FEV1 у 50% или более пациентов, переносящих воспаление легких или обструкцию. Например, в конкретных вариантах осуществления, способы достижения 10% или большего увеличения FEV1 у пациента включают предоставление со-суспензионной композиции, содержащей комбинацию активных агентов, где, по меньшей мере, один активный агент выбирают из LABA, LAMA и кортикостероидных активных агентов, как описано здесь, и введение такой композиции через MDI пациенту, переносящему воспаление легких или обструкцию. В некоторых таких вариантах осуществления, введение композиции приводит к 10% или большему увеличению FEV1 в пределах периода времени, выбранного из 0,5 часа или менее, 1 часа или менее, 1,5 часов или менее, и 2 часов у 50% или более пациентов. В других таких вариантах осуществления, введение композиции приводит к 10% или большему увеличению FEV1 в пределах периода времени, выбранного из 0,5 часа или менее, 1 часа или менее, 1,5 часов или менее и 2 или менее часов у 60% или более пациентов. В еще других таких вариантах осуществления, введение композиции приводит к 10% или большему увеличению FEV1 в пределах периода времени, выбранного из 0,5 часа или менее, 1 часа или менее, 1,5 часов или менее, и 2 часов или менее у 70% или более пациентов. В еще других таких вариантах осуществления, введение композиции приводит к 10% или большему увеличению FEV1 в пределах периода времени, выбранного из 0,5 часа или менее, 1 часа или менее, 1,5 часов или менее и 2 или менее часов у 80% или более пациентов. В некоторых таких вариантах осуществления, активные агенты, включенные в композицию, включают комбинацию, выбранную из одной из комбинации LABA и LAMA активных агентов, комбинации LABA и кортикостероидных активных агентов, комбинации LAMA и кортикостероидных активных агентов и комбинации LABA, LAMA и кортикостероидных активных агентов, где композиции доставляют пациенту через MDI.
В конкретных вариантах осуществления, способы, описанные здесь, облегчают лечение пациентов, переносящих воспаление легких или обструкцию, где такие способы включают предоставление со-суспензионной композиции, содержащей комбинацию активных агентов, как описано здесь, и введение такой композиции пациенту, переносящего воспаление легких или обструкцию, через MDI, и введение композиции через MDI приводит в результате у пациентов, переносящих либо увеличение от базовой линии FEV1, по меньшей мере, равного 200 мл или 12%, или выше, увеличение от базовой линии FEV1, сочетающегося с общим увеличением FEV1, равного, по меньшей мере, 150 мл. В некоторых таких вариантах осуществления, введение композиции приводит либо к увеличению от базовой линии FEV1, равного, по меньшей мере, 200 мл или 12%, или выше, увеличение от базовой линии FEV1, сочетающегося с общим увеличением FEV1, равным, по меньшей мере, 150 мл в пределах периода времени, выбранного из 1 часа, или менее, 1,5 часов или менее, 2 часов или менее, и 2,5 часов или менее, у 50% или более пациентов. В других таких вариантах осуществления, введение композиции приводит к увеличению от базовой линии FEV1, равного, по меньшей мере, 200 мл или 12%, или выше, увеличение от базовой линии FEV1, сочетающегося с общим увеличением FEV1, равным, по меньшей мере, 150 мл в пределах периода времени выбранного из 1 часа, или менее, 1,5 часов или менее, 2 часов, или менее, и 2,5 часов или менее, у 60% или более пациентов. В еще других таких вариантах осуществления, введение композиции приводит либо к увеличению от базовой линии FEV1, равного, по меньшей мере, 200 мл или 12%, или больше, увеличение от базовой линии FEV1, сочетающегося с общим увеличением FEV1, равным, по меньшей мере, 150 мл в пределах периода времени, выбранного из 1,5 часов или менее, 2 часов или менее 2,5 часов или менее и 3 часов или менее, у 70% или более пациентов. В еще других таких вариантах осуществления, введение композиции приводит либо к увеличению от базовой линии FEV1, равного, по меньшей мере, 200 мл или 12%, или выше, увеличению от базовой линии FEV1, сочетающегося с общим увеличением FEV1, равного, по меньшей мере, 150 мл в пределах периода времени, выбранного из 1,5 часов, или менее, 2 часов или менее, 2,5 часов или менее, и 3 часов или менее у 80% или более пациентов. В некоторых таких вариантах осуществления, активные агенты, включенные в композицию, включают комбинацию, выбранную из одной комбинации из комбинации LABA и LAMA активных агентов, комбинации LABA и кортикостероидных активных агентов, комбинации LAMA и кортикостероидных активных агентов и комбинации LABA, LAMA и кортикостероидных активных агентов, где композицию доставляют пациенту через MDI.
Конкретные примеры, включенные здесь, предназначены только для иллюстративных целей и не должны рассматриваться как ограниченные данным раскрытием. Кроме того, композиции, системы и способы, раскрытые здесь, описаны в отношении к определенным вариантам их осуществления, и многие детали изложены в целях иллюстрации, для квалифицированных специалистов в данной области будет очевидно, что изобретение подвержено дополнительным вариантам осуществления и, что определенные детали, описанные здесь, могут изменяться без отступления от основных принципов изобретения. Любые активные агенты и реагенты, используемые в следующих примерах, являются либо доступными для приобретения или могут быть получены в соответствии со стандартными литературными методиками специалистами, квалифицированными в области органического синтеза. Полное содержание всех публикаций, патентов и патентных заявок, на которые здесь ссылаются, включено здесь посредством ссылки.
Пример 1
Примерная со-суспензионная композиция, как описана здесь, была получена, и оценена. Композиция включала комбинацию активных агентов гликопирролата (GP) и формотерола фумарата (FF). GP был представлен в пропелленте в виде микронизированных, кристаллических частиц активного агента. Его co-суспендировали с высушенными распылением суспендирующими частицами, которые включали FF, расположенными в веществе, образующем суспендирующие частицы. Для достижения этого, FF растворяли в сырье, применяемом для производства суспендирующих частиц на липидной основе.
Частицы активного агента GP были образованы посредством микронизации гликопирролата с использованием вихревой мельницы. Распределение частиц по размерам частиц активного агента гликопирролата определяли посредством лазерной дифракции с использованием анализатора размера частиц по лазерной дифракции, в режиме дифракции Фраунгофера, оборудованного распределителем сухого порошка (например, Sympatec GmbH, Clausthal-Zellerfeld, Germany). 50% по объему частиц активного агента проявляли оптический диаметр меньше, чем 1,7 мкм, и 90% по объему проявляли оптический диаметр меньше, чем 3,5 мкм.
FF-содержащие суспендирующие частицы были получены следующим образом: получали 654 мл эмульсии фторуглерода-в-воде из PFOB (перфтороктилбромида), стабилизированной фосфолипидом; 26,5 г фосфолипида, DSPC (1,2-дистеароил-sn-глицеро-3-фосфохолина), и 2,4 г хлорида кальция гомогенизировали в 276 мл горячей воды (80°C) с использованием смесителя с высоким усилием сдвига; и 142 мл PFOB медленно добавляли во время гомогенизации. Полученную в результате грубую эмульсию затем дополнительно гомогенизировали с использованием гомогенизатора высокого давления (Model C3, Avestin, Ottawa, CA) при значениях давления до 170 МПа для 5 прохождений. 552 мг FF растворяли в 273 мл теплой воды (50°C) и большую часть раствора объединяли с эмульсией с использованием смесителя с высоким усилием сдвига. Эмульсию сушили с распылением в азоте с использованием следующих условий распылительной сушки: температура ввода 95°C; температура вывода 68°C; скорость подачи эмульсии 2,4 мл/мин; и общая скорость газового потока 498 л/мин. Конечная массовая фракция формотерола в порошке, полученном распылительной сушкой составляла 2%.
Вторую серию FF-содержащих суспендирующих частиц получали аналогичным образом. Массовая фракция FF в порошке, полученном распылительной сушкой, составляла 1% для данной серии. Третью серию суспендирующих частиц получали без FF.
Распределение частиц по размерам для суспендирующих частиц (VMD) определяли посредством лазерной дифракции. Для обеих серий FF содержащих суспендирующих частиц, 50% по объему составляло меньше, чем 3,5 мкм и геометрическое среднеквадратическое отклонение для распределения составляло 1,7. Для суспендирующих частиц без FF, 50% по объему составляло меньше, чем 3,2 мкм и геометрическое среднеквадратическое отклонение для распределения составляло 1,8.
MDI, содержащие FF, GP или оба получали посредством развешивания целевых масс частиц активного агента и суспендирующих частиц в алюминиевые емкости, покрытые фторированным этиленовым полимером (FEP) (Presspart, Blackburn, UK) с объемом, равным 19 мл. Емкости запрессовывали с 63 мкл клапанами (# BK 357, Bespak, King's Lynn, UK) и заполняли 12,4 г HFA 134a (1,1,1,2-тетрафторэтан) (Ineos Fluor, Lyndhurst, UK) посредством избыточного давления через шток клапана. Полученные в результате концентрации суспензий и целевая доставляемая доза, допускающая 20% осаждение в пусковом механизме, приведены в Таблице 1 для трех различных конфигураций (конфигурации 1A - 1C). После инжекции пропеллента, емкости подвергали воздействию ультразвука в течение 15 секунд, и взбалтывали на встряхивателе с поворотом в течение 30 минут. Емкости снабжали полипропиленовыми пусковыми механизмами с 0,3 мм соплом (# BK 636, Bespak, King's Lynn, UK).
|
Заполненные MDI хранили клапаном вниз при двух различных условиях: охлажденными при 5°C без внешней обертки и контролируемой комнатной температуре при 25°C/60% ОВ с внешней оберткой из фольги. Тесты на эффективность действия аэрозоля и однородность доставляемой дозы осуществляли в различное время. Эффективность действия аэрозоля оценивали после изготовления в соответствии с USP <601> (Фармакопея Соединенных Штатов Монография 601). Пробоотборник частиц Next Gene (NGI), функционирующий при объемной скорости потока 30 л/мин использовали для определения распределения частиц по размерам. Емкости для отбора проб сажали на пусковой механизм с двумя сбросовыми нажатиями и двумя дополнительными сбросовыми инициирующими нажатиями. Пять нажатий собирали в NGI с присоединенной горловиной USP. Клапан, пусковой механизм, горловина, чашки NGI, стойки и фильтр споласкивали объемно распределенным растворителем. Растворы проб анализировали с использованием специфичного для лекарственного средства хроматографического способа. Фракцию тонкодисперсных частиц определяли с использованием суммы 3 стадий через фильтр. Однородность доставляемой дозы посредством тестирования при применении определяли с использованием Устройства отбора проб для определения однородности дозы, как описано в USP <601>. Ингаляторы усаживали, и инициировали, как описано прежде. Два нажатия собирали, и анализировали в начале, середине и конце применения.
Никаких тенденций по изменению эффективности действия аэрозоля или однородности доставляемой дозы не наблюдали в течение исследования (3 месяца) или как функцию от температуры хранения. Следовательно, все результаты тестирования эффективности действия аэрозоля объединяли. В Таблице 1b приведена средняя эффективность действия различной конфигурации. Доза тонкодисперсных частиц является суммой собранной массы на стадиях 3 к фильтру пробоотборника, нормализованной по отмеренной дозе. Средняя эффективность действия аэрозоля для всех трех конфигураций была эквивалентной.
|
Однородность содержимого дозы тестировали на протяжении существования емкости для обоих активных веществ комбинированного продукта. Фигуры 1 и 2 показывает доставленную дозу для конфигурации 1A и 1 B, соответственно, нормализованную по действительным отмеренным дозам емкости. Допуская осаждение в пусковом механизме, равное 20%, целевые доставленные дозы для обоих активных веществ составляли 80%. Индивидуальные дозы FF и GP представлены точками и треугольниками, соответственно. Сплошная линия обозначает среднее значение доз формотерола, а штрихованная линия обозначает среднее значение доз гликопирролата. Фигуры 3 и 4 показывают отношение нормализованной доставленной дозы для конфигурации 1A и 1B, соответственно. Результат указывает на то, что дозовое отношение остается постоянным на протяжении эксплуатации емкости. Кроме того, изменчивость дозового отношения является значительно более низким, чем для индивидуальных доз, указывая на то, что со-суспензия с постоянным отношением носителя к активному веществу была образована, и поддерживалась в течение срока эксплуатации контейнера.
Результаты показывают, что, при составлении в соответствии с раскрытием, предоставленным здесь, со-суспензии комбинированного продукта образованы с суспендирующими частицами, содержащими один из активных фармацевтических ингредиентов, в данном случае FF. Отношения суспендирующих частиц к частицам активного агента могут регулироваться для достижения намеченной однородности содержимого дозы при поддержании аналогичной эффективности действия аэрозоля.
Пример 2
MDI содержащие FF, GP или оба получали при целевых концентрациях, равных 2,4 и 18 мкг на нажатие для FF и GP, соответственно. GP активный агент микронизировали и получали d10, d50, d90 и наибольший поперечный размер, равный 0,6, 1,7, 3,6 и 1,9 мкм соответственно, как измерено посредством лазерной дифракции, как описано в Примерее 1. FF включали в высушенные сушкой с распылением суспендирующие частицы и получали, как описано в Примерее 1, с композицией из 2% FF, 91,5% DSPC и 6,5% CaCl2. MDI с GP, FF и GP + FF получали посредством взвешивания целевых масс частиц активного агента и суспендирующих частиц в алюминиевые емкости, покрытые фторированным этиленовым полимером (FEP) (Presspart, Blackburn, UK) с объемом 19 мл. Емкости запрессовывали с 50 мкл клапанами (# BK 357, Bespak, King's Lynn, UK) и заполняли 10,2 г HFA 134a (1,1,1,2-тетрафторэтан) (Ineos Fluor, Lyndhurst, UK) посредством избыточного давления через шток клапана. После инжекции пропеллента, емкости подвергали воздействию ультразвука в течение 15 секунд, и взбалтывали на встряхивателе с поворотом в течение 30 минут. Емкости снабжали полипропиленовыми пусковыми механизмами с 0,3 мм соплом (# BK 636, Bespak, King's Lynn, UK).
Оценивали долговременную стабильность аэрозоля и характеристики доставки композиции MDI. Конкретно, распределение частиц аэрозоля по размерам и характеристики доставляемой дозы таких композиций оценивали в соответствии с USP <601>, как описано в Примере 1, при разнообразных условиях и, в некоторых случаях, в течение периодов времени, продолжительностью до 12 месяцев. Например, как показано на Фигуре 5, однородность доставляемой дозы, предоставленной композициями, полученными в соответствии с Примером 1, по существу сохранялась, даже через 12 месяцев хранения таких композиций при 5°C или через 4,5 месяца при 25°C и 60% относительной влажности (ОВ) для образцов, хранимых внутри пакетиков из алюминиевой фольги для минимизации поступления воды в емкость MDI (т.е. "защищенное хранение").
Эффективность действия аэрозоля таких композиций также оценивали на протяжении условий незащищенного хранения продолжительностью до 12 месяцев и условий защищенного хранения продолжительностью до 6 месяцев. Как показано на Фигуре 6, значения распределения по размерам частиц GP и FF, предоставленных этой со-суспензионной композицией, по существу соранялись через 12 месяцев защищенного хранения при 5°C и шести месяцев условий незащищенного хранения при 25°C и 60% ОВ. Как показано на Фигуре 7, даже при стрессовых условиях (40°C, 75% ОВ), композиции не показывали заметного ухудшения по распределению частиц по размерам для GP и FF, доставляемых из дозирующих ингаляторов через шесть месяцев.
Для того, чтобы оценить, будет ли комбинация GP и FF в единственной готовой лекарственной форме приводить к ухудшению свойств аэрозоля относительно композиций, включающих единственный активный агент, аэрозольные свойства со-суспензионных композиций оценивали относительно суспензионных композиций, включающих только единственный активный агент.
Как можно видеть на Фигуре 8, эффективность действия аэрозоля для комбинированной со-суспензионной композиции, включающей оба GP и FF активных агента не отличалась от эффективности действия аэрозоля, достигаемой посредством суспензионной композиции, включающей либо GP или FF по отдельности, демонстрируя, что аэрозольные свойства индивидуальных активных агентов являются по существу такими же, когда их достигают от единственного компонента или двойных комбинированных со-суспензий.
Пример 3
Фармакокинетику и безопасность дозирующего ингалятора с комбинированной со-суспензией, содержащей гликопирролат и формотерола фумарат, оценивали при клинических испытаниях. Клиническое испытание представляло собой одноцентровое, рандомизированное, двойное слепое, однодозовое, с четырьмя периодами, с четырьмя обработками перекрестное исследование, применяемое для оценки четырех ингаляционных обработок, вводимых посредством MDI. Четыре обработки включали Ингаляционный Аэрозоль Формотерола Фумарата (FF), Ингаляционный Аэрозоль Гликопирролата (GP), Ингаляционный Аэрозоль GP+FF, и последовательную доставку Ингаляционного Аэрозоля GP, следующую немедленно за доставкой Ингаляционного Аэрозоля FF. Ингаляционный Аэрозоль GP+FF, а также Ингаляционный Аэрозоль FF и Ингаляционный Аэрозоль GP получали, как описано в Примере 2. Ингаляционный Аэрозоль GP+FF был также помечен как "фиксированная" комбинация GP и FF, в то время как обработка для наименования последовательной доставки Ингаляционного Аэрозоля GP, следующей немедленно за доставкой Ингаляционного Аэрозоля FF, была помечена как "несвязанная" комбинация GP и FF.
Субъектов статистически распределяли в исследовании, и им присваивали одну из четырех последовательностей обработки, причем каждая последовательность обработки включала все четыре обработки исследования. Каждый субъект получал четыре однодозовых обработки, разделенных 7-21 днями. Шестнадцать субъектов были включены, и проанализированы на предмет безопасности. Три субъекта были исключены из ФК анализа в результате того, что не получали одну или более из четырех обработок, и дополнительно два субъекта были исключены из ФК анализа как не подлежащие оценке вследствие ошибок при дозировании, возникающих от несовершенства метода ингаляции.
Ингаляционный Аэрозоль GP+FF вводили для предоставления каждому субъекту 72 мкг дозы GP и 9,6 мкг дозы FF (четыре нажатия, 18 мкг GP и 2,4 мкг FF на нажатие). Ингаляционный Аэрозоль GP вводили для предоставления каждому субъекту 72 мкг дозы GP (четыре нажатия, 18 мкг GP на нажатие). Ингаляционный Аэрозоль FF вводили для предоставления каждому субъекту 9,6 мкг дозы FF (четыре нажатия, 2,4 мкг FF на нажатие). Для целей слепого исследования каждой из предшествующих трех обработок предшествовали четыре нажатия MDI с плацебо. Несвязанную комбинацию Ингаляционного Аэрозоля GP с последующим Ингаляционным Аэрозолем FF вводили для предоставления каждому субъекту 72 мкг дозы GP и 9,6 мкг дозы FF (четыре нажатия, 18 мкг GP на нажатие с последующими четырьмя дополнительными нажатиями, 2,4 мкг FF на нажатие).
Как несвязанная, так и фиксированная комбинации GP и FF были безопасными и хорошо переносимыми, причем фиксированная комбинация предоставляла профиль безопасности, аналогично наблюдаемому для других трех обработок, оцениваемых при испытании. Образец крови собирали перед дозированием и при 2, 5, 15, и 30 минутах, а также 1, 2, 4, 6, 8, и 12 часах после дозирования для определения плазменных концентраций GP и FF, которые использовали для вычисления разнообразных ФК параметров. Временные профили плазменной концентрации для обоих GP и FF в течение 12-часового периода немедленно после дозирования предоставлены на Фигуре 9. Как можно видеть на Фигуре 9, введение GP и FF из фиксированной комбинации приводило к плазменным концентрациям GP и FF после введения, сравнимыми с концентрациями, полученными в результате от введения несвязанной комбинации GP и FF. Как было отмечено для доставляемой дозы in-vitro и характеристик распределения частиц по размерам, описанных в Примере 2, не наблюдали комбинированного эффекта in-vivo для фиксированной комбинации Ингаляционного Аэрозоля GP+FF.
Пример 4
Получали примерную двойную со-суспензионную композицию в соответствии с настоящим описанием и получали дозирующие ингаляторы, включающие композицию. Композиция включала комбинацию гликопирролата (GP) и формотерола фумарата (FF), причем каждый был предоставлен в виде микронизированного, кристаллического вещества. MDI с комбинацией кристаллической со-суспензии получали посредством полуавтоматизированного суспензионного заполнения. Двойная со-суспензия состояла из комбинации двух микрокристаллических активных фармацевтических ингредиентов (также именуемых как "APIs" или "API" в единственном числе), GP и FF, co-суспендированные с суспендирующими частицами в пропелленте HFA 134a. Двойную со-суспензию составляли для предоставления доставляемой дозы 18 мкг GP на нажатие и 4,8 мкг FF на нажатие. При получении двойных со-суспензионных композиций, в определенных композициях, используемое вещество FF API обозначали как "грубый", в то время как в других композициях, используемое вещество FF API обозначали как "тонкодисперсный". Независимо от того включали ли со-суспензионные композиции грубый или тонкодисперсный FF, композиции составляли для предоставления доставленной дозы FF, равной 4,8 мкг на нажатие. Характеристики размеров частиц для грубого FF, мелкодисперсных веществ FF и GP API, используемых в готовой лекарственной форме со-суспензионных композиций, описанных в данном Примере детализированы в Таблице 2. В дополнение к двойным со-суспензионным композициям, составляли монотерапевтическую со-суспензионную композицию, включающую только вещество активного агента FF. Для монотерапевтической со-суспензии FF использовали грубый FF API. Монотерапевтический MDI получали с использованием такой монотерапевтической со-суспензии FF, и монотерапевтический MDI с FF составляли, и производили для предоставления доставляемой дозы, равной 4,8 мкг FF на нажатие.
Суспендирующие частицы производили посредством высушеной распылением эмульсии при концентрации сырья, равной 80 мг/мл с композицией из 93,44% DSPC (1,2-Дистеароил-sn-Глицеро-3-Фосфохолина) и 6,56% безводного хлорида кальция (эквивалентно отношению 2:1 DSPC:CaCl2 моль/моль). Во время получения эмульсии, DSPC и CaCl2 диспергировали с помощью смесителя с высоким усилием сдвига при 8000-10000 об./мин. в сосуде, содержащем нагретую воду (80±3°C) с PFOB медленно добавляемом во время процеса. Эмульсию затем обрабатывали с 6 прохождениями в гомогенизаторе высокого давления (10000-25000 пси). Эмульсию затем сушили с распылением посредством распылительной сушилки, снабженной 0,42" гребенкой атомайзера с уствновленным потоком газа в атомайзере, равным 18 SCFM. Скорость потока сушильного газа была установлена на 72 SCFM с температурой ввода 135°C, температурой вывода 70°C, и скорость потока эмульсии, равной 58 мл/мин.
Для производства MDI, сосуд для добавления лекарственного средства (DAV) готовили для заполнения суспензией следующим образом: сперва добавляя половину количества суспендирующих частиц, далее заполняя микрокристаллическими веществами, и окончательно добавляя оставшуюся половину суспендирующих частиц в верхнюю часть. Вещества добавляли в сосуд в окружении с контролируемой влажностью <10% ОВ. DAV затем соединяли с сосудом для суспензий с объемом 4 л и продували пропеллентом HFA 134a и затем смешивали осторожно с образованием взвеси. Взвесь затем переносили обратно в сосуд для смешивания суспензии и разбавляли дополнительным HFA-134a с образованием конечной суспензии при целевой концентрации, перемешивая осторожно с мешалкой. Температуру внутри сосуда поддерживали при 21-23°C на полном протяжении получения загрузки. После рециркуляции в течение 30 мин суспензией заполняли 14 мл алюминиевые емкости, покрытые фторированным этиленовым полимером (FEP) (Presspart, Blackburn, UK) через 50 мкл клапаны (Bespak, King's Lynn, UK). Емкости для отбора проб выбирали случайным образом для полного анализа емкости для подтверждения правильных количеств готовой лекарственной формы. Оптический диаметр и распределение частиц по размерам двух серий микронизированных частиц формотерола определяли посредством лазерной дифракции, как описано в Примере 1. В Таблице 2 приведены значения d10, d50 и d90 для различных серий использованного микронизированного вещества used. d10, d50 и d90 обозначают размер частиц, при котором кумулятивное распределение по объему, по результатам измерения прибора для определения размера частиц находится в интервале 10%, 50% и 90%, соответственно.
Распределения частиц по размерам, предоставленные обеими двойными со-суспензиями готовых лекарственных форм, полученных в соответствии с данным Примером 4, сравнивали с распределением частиц по размерам, предоставленным со-суспензионными композициями, полученными в соответствии с Примером 1. Результаты данного сравнения предоставлены в Таблице 3, где "%FPF FF" и "%FPF GP" представляют массу тонкодисперсных частиц установленного активного агента на Стадиях 3 через фильтр NGI, разделенных массой пускового механизма, и умноженную на 100.
|
|
Эффективность действия аэрозолей двойных со-суспензионных композиций, полученных в соответствии с данным Примером, оценивали, и сравнивали с co-суспензионной композицией, полученной в соответствии с Примером 1, причем эффективность действия аэрозоля оценивали, как описано в Примере 1. Результаты таких сравнений предоставлены на Фигуре 10 - Фигуре 12. Как легко можно оценить при ссылке на эти фигуры, независимо от того является ли вещество кристаллического формотерола, используемое для предоставления двойной со-суспензии тонкодисперсным или грубым, значения распределения частиц FF и GP по размерам для двойных со-суспензионных композиций были по существу такими же как характеристики, достигаемые посредством со-суспензионной композиции, полученной в соответствии с Примером 1.
В дополнение, однородность доставляемой дозы для GP и FF, предоставленная двойными со-суспензионными композициями, как описано в данном Примере, оценивали, как описано в Примере 1. Результаты данной оценки проиллюстрированы на Фигуре 13. Двойные со-суспензионные готовые лекарственные формы, представляли желательные характеристики DDU для обоих GP и FF, поскольку все нажатия доставляли ожидаемую дозу в пределах ±25% от значения.
Пример 5
Описана готовая лекарственная форма двойной со-суспензионной композиции частиц активного агента салметерола ксинафоата (SX) и частиц активного агента флутиказона пропионата (FP). Оба FP и SX присутствуют в пропелленте как микронизированные, кристаллические частицы. Два вида микронизированных частиц активного агента co-суспендировали с высушенными распылением суспендирующими частицами.
Микронизированный SX (4-гидрокси-α1-[[[6-(4-фенилбутокси)гексил]амино]метил]-1,3-бензолдиметанола, 1-гидрокси-2-нафталинкарбоксилат) получали от производителя (Inke SA, Germany) и использовали в качестве частиц активного агента. Распределение частиц SX по размерам определяли посредством лазерной дифракции. 50% по объему микронизированных частиц проявляли оптический диаметр меньше, чем 2 мкм, и 90% по объему проявляли оптический диаметр меньше, чем 3,9 мкм.
Микронизированный FP (S-(фторметил)6α,9-дифтор-11β-17-дигидрокси-16α-метил-3-оксоандроста-1,4-диен-17β-карботиоат, 17-пропионат) получали как микронизированные производителем (Hovione FarmaCiencia SA, Loures Portugal) и применяли в качестве частиц активного агента. Распределение частиц FP по размерам определяли посредством лазерной дифракции. 50% по объему микронизированных частиц проявляли оптический диаметр меньше, чем 2,6 мкм, и 90% по объему проявляли оптический диаметр меньше, чем 6,6 мкм.
Суспендирующие частицы были получены следующим образом: получали 150 мл эмульсии фторуглерода-в-воде PFOB (перфтороктилбромида), стабилизированной фосфолипидом; 12,3 г фосфолипида, DSPC (1,2-дистеароил-sn-глицеро-3-фосфохолина) и 1,2 г хлорида кальция гомогенизировали в 100 мл горячей воды (70°C) с использованием смесителя с высоким усилием сдвига; и 65 мл PFOB медленно добавляли во время гомогенизации. Полученную в результате грубую эмульсию затем дополнительно гомогенизировали с использованием гомогенизатора высокого давления (Model C3, Avestin, Ottawa, CA) при значениях давления до 140 МПа в течение 3 прохождений.
Эмульсию сушили с распылением в азоте с использованием следующих условий распылительной сушки: температура ввода 90°C; температура вывода 69°C; скорость подачи эмульсии 2,4 мл/мин; и общая скорость газового потока 498 л/мин. Распределение частиц по размерам суспендирующих частиц, VMD, определяли посредством лазерной дифракции. 50% по объему суспендирующих частиц имели меньше, чем 2,7 мкм, Геометрическое Среднеквадратическое Отклонение для распределения составляло 2,0. Дополнительно, аэродинамическое распределение частиц по размерам для суспендирующих частиц определяли с помощью времяпролетного измерителя размера частиц. 50% по объему суспендирующих частиц имели аэродинамический диаметр частиц меньше, чем 1,6 мкм. Большое различие между аэродинамическим диаметром частиц и оптическим диаметром частиц указывает на то, что суспендирующие частицы имели низкую плотность частиц < 0,5 кг/л. Это верифицировали электронной микроскопией, которая подтвердила, что суспендирующие частицы проявляли полую, тонкостенную морфологию.
MDI получали посредством развешивания целевых масс микронизированных FP, SX и суспендирующих частиц в алюминиевые емкости, покрытые фторированным этиленовым полимером (FEP) (Presspart, Blackburn, UK) с объемом 19 мл. Емкости запрессовывали с 63 мкл клапанами (# BK 357, Bespak, King's Lynn, UK) и заполняли 10 мл HFA 134a (1,1,1,2-тетрафторэтан) (Ineos Fluor, Lyndhurst, UK) посредством создания избыточного давления через шток клапана. После инжекции пропеллента, емкости подвергали воздействию ультразвука в течение 15 секунд и взбалтывали на встряхивателе с поворотом в течение 30 минут. Емкости снабжали полипропиленовыми пусковыми механизмами с 0,3 мм соплом (# BK 636, Bespak, King's Lynn, UK). Эффективность действия аэрозоля оценивали вскоре после изготовления в соответствии с USP 601, как описано в Примере 1. Результаты приведены ниже в Таблице 4.
|
Тестировали однородность доставляемой дозы на протяжении применения, и все индивидуальные доставляемые дозы находились в пределах ±20% от среднего значения, при 6,1% относительного среднеквадратичного отклонения (также именуемого "RSD"). Визуальное наблюдение со-суспензии проводили в стеклянных пузырьках, и никакого осаждения частиц активного агента не наблюдали. Пузырьки оставили осаждаться в течение 24 часов без встряхивания. Суспензия флоккулировала медленно, и образовывала гомогенный, единственный слой пены.
Пример 6
Описана готовая лекарственная форма комбинации со-суспензионной композиции частиц активного агента салметерола ксинафоата (SX) и суспендирующих частиц флутиказона пропионата (FP). SX присутствует в пропелленте в виде микронизированных, кристаллических частиц. Его co-суспендировали с высушенными распылением суспендирующими частицами, которые содержали микронизированный FP, расположенный в веществе, образующем суспендирующие частицы. Для достижения этого, кристаллы FP суспендировали в сырье, используемом для производства суспендирующих частиц на липидной основе. FP и SX применяли для образования частиц активного агента, и суспендирующие частицы, на которые ссылаются в данном примере, были такими, как описано в Примере 5.
FP-содержащие суспендирующие частицы были получены следующим образом: получали 200 мл эмульсии фторуглерода-в-воде из PFOB, стабилизированной фосфолипидом; 3,3 г фосфолипида (DSPC) и 0,8 г микронизированного FP диспергировали и 0,3 г дигидрата хлорида кальция растворяли в 100 мл теплой воды (70°С) с использованием смесителя с высоким усилием сдвига; и 44 мл PFOB медленно добавляли во время диспергирования. Полученную в результате грубую эмульсию затем дополнительно гомогенизировали с использованием гомогенизатора высокого давления при 140 МПа в течение 3 прохождений. Гомогенизация снижала размер частиц суспендированных кристаллов FP. Эмульсию сушили с распылением в азоте с использованием следующих условий распылительной сушки: температура ввода 95°C; температура вывода 72°C; скорость подачи эмульсии 2,4 мл/мин; и общая скорость газового потока 525 л/мин.
MDI получали посредством развешивания целевых масс микронизированных частиц активного агента SX и FP-содержащих суспендирующих частиц в алюминиевые емкости, покрытые фторированным этиленовым полимером (FEP) (Presspart, Blackburn, UK) с объемом 19 мл. Емкости запрессовывали с 63 мкл клапанами (# BK 357, Bespak, King's Lynn, UK) и заполняли 10 мл HFA 134a (1,1,1,2-тетрафторэтан) (Ineos Fluor, Lyndhurst, UK) посредством создания избыточного давления через шток клапана. После инжекции пропеллента, емкости подвергали воздействию ультразвука в течение 15 секунд и взбалтывали на встряхивателе с поворотом в течение 30 минут. Емкости снабжали полипропиленовыми пусковыми механизмами с 0,3 мм соплом (# BK 636, Bespak, King's Lynn, UK). Эффективность действия аэрозоля оценивали вскоре после изготовления в соответствии с USP 601, как описано ранее в Примере 1. Результаты приведены ниже в Таблице 5.
|
Тестировали однородность доставляемой дозы на протяжении применения, и все индивидуальные доставляемые дозы находились в пределах ±25% от среднего значения, при 9,0% RSD для FP и 13% RSD для SX. Визуальное наблюдение со-суспензии проводили в стеклянных пузырьках, и никакого осаждения частиц активного агента не наблюдали. Пузырьки оставили осаждаться в течение 24 часов без встряхивания. Суспензия флоккулировала медленно, и образовывала гомогенный, единственный слой пены, не проявляющий никаких признаков разделения SX и суспендирующих частиц.
Пример 7
Описана готовая лекарственная форма двойной со-суспензионной композиции, включающей частицы активного агента будесонида и частицы активного агента мометазона фуроата. Будесонид (BD) и мометазона фуроат (MF) присутствовали в пропелленте в виде микронизированных, кристаллических частиц и их co-суспендировали с высушенными распылением суспендирующими частицами.
BD, 16,17-(бутилиденбис(окси))-11,21-дигидрокси-, (11-β,16-α)-прегна-1,4-диен-3,20-дион, был получен в микронизированном виде производителем (AARTI, Mumbai, India) и его применяли как частицы активного агента. Распределение частиц BD по размерам определяли посредством лазерной дифракции. 50% по объему микронизированных частиц проявляли оптический диаметр меньше, чем 1,9 мкм, и 90% по объему проявляли оптический диаметр меньше, чем 4,3 мкм.
MF, 9α,21-дихлор-11β,17-дигидрокси-16α-метилпрегна-1,4-диен-3,20-дион 17-(2-фуроат), был получен в микронизированном виде производителем (AARTI, Mumbai, India), и его применяли как частицы активного агента. Распределение частиц MF по размерам определяли посредством лазерной дифракции. 50% по объему микронизированных частиц проявляли оптический диаметр меньше, чем 1,6 мкм, и 90% по объему проявляли оптический диаметр меньше, чем 3,5 мкм.
Суспендирующие частицы были получены следующим образом: получали 500 мл эмульсии фторуглерода-в-воде для PFOB (перфтороктил бромида), стабилизированной фосфолипидом; 18,7 г фосфолипида, DSPC (1,2-дистеароил-sn-глицеро-3-фосфохолина), и 1,3 г хлорида кальция гомогенизировали в 400 мл горячей воды (75°C) с использованием смесителя с высоким усилием сдвига; и 100 мл PFOB медленно добавляли во время гомогенизации. Полученную в результате грубую эмульсию затем дополнительно гомогенизировали с использованием гомогенизатора высокого давления (Model C3, Avestin, Ottawa, CA) при значениях давления до 170 МПа в течение 5 прохождений. Эмульсию сушили с распылением в азоте с использованием следующих условий распылительной сушки: температура ввода 95°C; температура вывода 72°C; скорость подачи эмульсии 2,4 мл/мин; и общая скорость газового потока 498 л/мин.
MDI получали посредством развешивания целевых масс микронизированных активных, и суспендирующих частиц в покрытые стеклянные пузырьки с объемом 15 мл. Емкости запрессовывали с 63 мкл клапанами (Valois, Les Vaudreuil, France) и заполняли 9,2 г HFA 134a (1,1,1,2-тетрафторэтан) (Ineos Fluor, Lyndhurst, UK) посредством создания избыточного давления через шток клапана. После инжекции пропеллента, емкости подвергали воздействию ультразвука в течение 15 секунд, и взбалтывали на встряхивателе с поворотом в течение 30 минут. Концентрации суспензий составляли 0,8 мг/мл для частиц активного агента BD, 1,1 мг/мл для частиц активного агента MF, и 6 мг/мл для суспендирующих частиц. Отношение суспендирующих частиц к частицам активного агента составляло 7,5 для BD и 5,5 для MF. Целевые доставляемые дозы составляли 40 мкг для BD и 55 мкг для MF.
Визуальное наблюдение co-суспендированных конфигураций не показало никакого осаждения частиц активного агента. Пузырьки оставили осаждаться в течение 16 часов без встряхивания. Никакие частицы активного агента не были видны на дне со-суспензионных пузырьков. Результаты показали, что кристаллическое вещество будесонида и мометазона фуроата, образующее различные виды частиц активного агента, ассоциированных с суспендирующими частицами, образовывали со-суспензию в конфигурациях, раскрытых здесь. Ассоциация между частицами активного агента и суспендирующими частицами была достаточно сильной для преодоления сил выталкивания, поскольку осаждение частиц активного агента успешно ингибировалось.
Пример 8
Двойные со-суспензионные композиции получали с суспендирующими частицами, включающими либо мометазона фуроат (MF) или будесонид (BD), и были получены MDI, включающие композицию. Со-суспензионная композиция включала комбинацию частиц активного агента кристаллического гликопирролата (GP) и формотерола фумарата (FF), co-суспендированных с суспендирующими частицами, включающими либо MF или BD. Каждый из API был предоставлен в виде микронизированного, кристаллического вещества.
Суспендирующие частицы, содержащие 50% (масс./масс.) либо BD или MF, были получены следующим образом: гомогенизацией с высоким сдвигом дисперсии, содержащей 2,8 г DSPC (1,2-Дистеароил-sn-Глицеро-3-Фосфохолина), и 0,26 г хлорида кальция в 400 мл горячей воды (75°C) с использованием смесителя с высоким усилием сдвига, при одновременном временном введении 56,6 г PFOB. Микронизированные MF или BD (при 1:1 массовом соотношении к DSPC) добавляли к полученной в результате грубой эмульсии, которую дополнительно гомогенизировали с использованием гомогенизатора высокого давления (Model C3, Avestin, Ottawa, CA) при значениях давления до 170 МПа в течение 3-5 прохождений. Эмульсию сушили с распылением с использованием следующих условий распылительной сушки: температура ввода 90-95°C; температура вывода 95-72°C; скорость подачи эмульсии 2-8 мл/мин; общая скорость потока сухого азота 525-850 л/мин. Распределение частиц по размерам полученных в результате порошков определяли посредством лазерной дифракции, 50% по объему суспендирующих частиц составляли меньше, чем 1,8 мкм, наибольший предел измерения распределения составлял 1,6 мкм.
Емкости, содержащие 50% (масс./масс.) либо MF или BD-содержащих суспендирующих частиц, заполняли пропеллентом HFA 134a, с достижением 50 или 100 мкг/нажатие MF или BD, соответственно. Их значения распределения частиц аэрозоля по размерам определяли в соответствии со способами, описанными в Примере 1, и результаты показаны в Таблице 6. Получали сравниваемые серии емкостей, содержащих MF- или BD-содержащие суспендирующие частицы, в комбинации с частицами активного агента GP и FF. Достаточно микронизированное вещество GP и FF API добавляли в такие емкости в количествах, достаточных для предоставления намеченных доставляемых доз, равных 36 мкг/нажатие и 6 мкг/нажатие для GP и FF, соответственно. Дополнительные суспендирующие частицы с плацебо полученные, как описано здесь, но не содержащие любого активного агента (также именуемые как суспендирующие частицы "плацебо") добавляли для подтверждения достижения общей со-суспензионной концентрации, равной 5,5 мг/мл.
Значения распределения по размерам частиц аэрозоля, предоставленного посредством со-суспензионных композиций, полученных в соответствии с данным Примером, определяли, как описано в Примере 1, с результатами, как показаны в Таблице 7. Среднемассовый аэродинамический диаметр кортикостероида в суспензии с единственным компонентом является эквивалентным диаметру, полученному в тройных комбинированных готовых лекарственных формах, полученных с двумя различными видами частиц активного агента, co-суспендированных с BD- или MF-содержащими суспендирующие частицы. Что характерно для со-суспензионных композиций, содержащих комбинацию двух различных активных агентов, тройные со-суспензионные композиции, полученные в соответствии с настоящим описанием, позволяли избежать комбинированного эффекта.
|
|
Пример 9
Получали тройную со-суспензионную композицию в соответствии с настоящим описанием, и были получены MDI, включающие композицию. Композиция включала комбинацию частиц активного агента гликопирролата (GP), формотерола фумарата (FF) и мометазона фуроата (MF), причем каждый был предоставлен в виде микронизированного, кристаллического вещества API.
Тройной со-суспензионный MDI получали посредством полуавтоматизированного суспензионного заполнения. Тройная со-суспензия состояла из комбинации трех микрокристаллических активных фармацевтических ингредиентов, образующих три различных вида частиц активного агента: MF (кортикостероида); GP (LAMA); и FF (LABA). Эти три различных вида частиц активного агента co-суспендировали с суспендирующими частицами в пропелленте HFA 134a. Тройную со-суспензию составляли до следующих целевых доставляемых доз: 50 мкг на нажатие MF; 36 мкг на нажатие GP; и 4,8 мкг на нажатие FF. В дополнение к тройной со-суспензии, получали монотерапевтическую со-суспензию, включающую только MF. Монотерапевтическая co-суспензия MF включала частицы активного агента MF, co-суспендированные в пропелленте с суспендирующими частицами, как описано в данном Примере, и составляли для предоставления целевой доставляемой дозы, равной 50 мкг на нажатие MF.
Суспендирующие частицы получали через высушенную распылением эмульсию при концентрации исходного сырья, равной 80 мг/мл с композицией из 93,44% DSPC (1,2-Дистеароил-sn-Глицеро-3-Фосфохолина) и 6,56% безводного хлорида кальция (эквивалентной отношению 2:1 DSPC:CaCl2 моль/моль). Во время получения эмульсии, DSPC и CaCl2 диспергировали с помощью смесителя с высоким усилием сдвига при 8000-10000 об./мин. в сосуде, содержащем нагретую воду (80±3°C) с PFOB, медленно добавляемым во время процесса. Эмульсию затем обрабатывали при 5 прохождениях в гомогенизаторе высокого давления (10000-25000 пси). Эмульсию затем сушили с распылением посредством распылительной сушилки, оборудованной 0,42" сопло атомайзера с установленным потоком газа атомайзера 18 SCFM. Скорость потока была установлена на 72 SCFM с температурой ввода 135°C, температурой вывода 70°C, и скоростью потока эмульсии 58 мл/мин.
Для производства MDI, готовили сосуд добавления лекарственного средства (DAV) для заполнения суспензей следующим образом: сначала добавляя половину количества суспендирующих частиц, далее заполняя микрокристаллическими веществами, и окончательно добавляя оставшуюся половину суспендирующих частиц в верхнюю часть. Вещества добавляли в сосуд в окружении с контролируемой влажностью <10% ОВ. DAV затем соединяли с сосудом для суспензий объемом 4 л, и продували пропеллентом HFA 134a, и затем перемешивали с магнитной мешалкой. Температуру внутри сосуда поддерживали при 21-23°C на полном протяжении получения загрузки. После рециркуляции в течение 30 мин., емкости заполняли суспензионной смесью через 50 мкл клапаны EPDM. Емкости для отбора проб были выбраны случайным образом для полного анализа емкости для подтверждения правильных количеств готовой лекарственной формы. Свежеприготовленную тройную со-суспензионную загрузку MDI затем помещали на однонедельный карантин перед первоначальным анализом эффективности действия продукта. MDI только с мометазона фуроатом получали посредством суспензионного заполнения, таким же образом.
Первичное распределение частиц по размерам всех микрокристаллических APIs определяли посредством лазерной дифракции, как описано в Примере 1, результаты показаны в Таблице 9. Аэродинамическое распределение частиц по размерам и среднемассовый аэродинамический диаметр всех компонентов при нажатии (пуске) суспензионных MDI, были определены специфичным для лекарственного средства методом каскадного импактора, как описано в Примере 1, и показано в Таблице 9.
|
|
Эффективность действия аэрозоля и однородность доставляемой дозы, достигаемые посредством тройных со-суспензий, полученных в соответствии с данным Примером, оценивали в соответствии с описанием, предоставленным в Примере 1. Фигура 14 иллюстрирует DDU GP, FF и MF, достигаемые из двух емкостей, содержащих MF только, и двух емкостей, содержащих MF, GP и FF, полученных в соответствии с данным Примером. DDU для MF, доставляемая из монотерапевтической конфигурации MF, является эквивалентной DDU, достигаемой с тройной со-суспензионной композицией. Эффективность действия аэрозоля тройной со-суспензионной композиции, полученной в соответствии с данным примером, также оценивали по отношению к готовым лекарственным формам, содержащим комбинацию только двух активных агентов, FF и GP. Аэродинамическое распределение частиц FF и GP по размерам были эквивалентными, независимо от того, доставлялись ли они из композиций, содержащих два активных агента или три активных агента, как показано на Фигурах 15 и 16, соответственно.
Как и для со-суспензионной композиции, содержащей комбинацию двух различных активных агентов, тройные со-суспензионные композиции, полученные в соответствии с настоящим описанием, были лишены комбинированного эффекта.
Пример 10
Были получены примерные тройные со-суспензионные композиции в соответствии с настоящим описанием, и получали дозирующие ингаляторы, включающие композиции. Тройные со-суспензии включали гликопирролат (GP) или тиотропия бромид (TB) в комбинации с активными агентами формотерола фумаратом (FF) и мометазона фуроатом (MF), и каждый API применяли в виде микронизированного, кристаллического вещества.
Получали две раздельных суспензионных загрузки MDI, содержащие три активных фармацевтических ингредиента (API), кортикостероид, LAMA и LABA. API были представлены в виде микрокристаллических веществ, которые служили в качестве частиц активного агента, co-суспендированных с суспендирующими частицами, полученными, как описано здесь. Тройные со-суспензионные композиции, полученные, как описано в данном Примере, получали посредством добавления частиц активного агента и суспендирующих частиц к пропелленту HFA 134a.
Первую тройную со-суспензионную загрузку (Тройную GFM) составляли для следующих назначений доставляемой дозы: 40 мкг MF на нажатие; 13 мкг GP на нажатие; и 4,8 мкг FF на нажатие. Частицы активного агента co-суспендировали с суспендирующими частицами, произведенными с использованием эмульсии, состоящей из 93,46% DSPC (1,2-Дистеароил-sn-Глицеро-3-Фосфохолина) и 6,54% безводного хлорида кальция, высушенных с распылением с концентрацией сырья, равной 80 мг/мл. Молярное отношение DSPC:CaCl2 для суспендирующих частиц составляло 2:1. Суспендирующие частицы объединяли с частицами активного агента в пропелленте для целевой готовой лекарственной формы с концентрацией суспендирующих частиц, равной 6 мг/мл. Первичные размеры частиц микрокристаллических частиц активного агента, определенных посредством измерений лазерной дифракции на Sympatec, как описано в Примере 1, представлены ниже в Таблице 11.
Вторую тройную со-суспензионную загрузку (TFM) получали с использованием отличного LAMA API, безводного тиотропия бромида (TB) для замены GP. Вторую тройную со-суспензию составляли для следующих назначений доставляемой дозы: 50 мкг MF на нажатие; 9 мкг TB на нажатие; и 4,8 мкг FF на нажатие. Суспендирующие частицы получали, как описано по отношению к Тройной со-суспензии GFM, и частицы активного агента co-суспендировали с суспендирующими частицами при намеченной концентрации суспензии равной 6 мг/мл. Первичные размеры частиц микрокристаллических частиц активного агента, определенных посредством измерений лазерной дифракции на Sympatec, как описано в Примере 1, представлены ниже в Таблице 12.
MDI получали с использованием со-суспензионных композиций Тройной GFM и Тройной TFM, и свойства аэрозоля, фракции тонкодисперсных частиц, и среднемассовый аэродинамический диаметр определяли, как описано в Примере 1. В Таблице 13 приведены показатели эффективности действия MMAD и FPF для Тройной GFM и Тройной TFM, в то время как желательные свойства аэрозоля, достигаемые посредством со-суспензий Тройной GFM и Тройной TFM, показаны на Фигуре 17 (показывающей аэродинамическое распределение частиц GP и TB по размерам, полученное от Тройной GFM и Тройной TFM, соответственно).
|
|
|
Пример 11
Были получены примерные двойные со-суспензионные композиции в соответствии с настоящим описанием, и получали MDI, включающие двойные со-суспензионные композиции. Композиции включали комбинацию гликопирролата (GP) и формотерола фумарата (FF), причем каждый был предоставлен в виде микронизированного, кристаллического вещества с распределением частиц по размерам, как показано в Таблице 14. Микрокристаллические вещества GP и FF предоставляли два вида частиц активного агента, в то время как суспендирующие частицы получали, как описано в Примере 4. При получении двойных со-суспензий, описанных в данном Примере, частицы активного агента GP, частицы активного агента FF, и суспендирующие частицы объединяли в пропелленте HFA 134a.
Двойные со-суспензии, описанные в данном примере, получали посредством первоначального распределения соответствующих количеств частиц активного агента GP и FF и суспендирующих частиц в сосуде для добавления лекарственного средства (DAV) внутри камеры с контролируемой влажностью (ОВ < 5%). DAV затем герметически закрывали в атмосфере азота, и соединяли с суспензионным сосудом, содержащим 12 кг HFA-134a. Затем была образована взвесь при добавлении 0,5-1 кг HFA-134a в DAV, которую затем удаляли из суспензионного сосуда, и осторожно крутили. Взвесь затем переносили назад в сосуд для смешивания суспензии, и разбавляли дополнительным HFA-134a с образованием окончательной суспензии при целевой концентрации, перемешивая осторожно, с помощью мешалки. Суспензию затем рециркулировали через насос к системе заполнения в течение минимального времени перед инициацией заполнения. Смешивание и рециркуляцию продолжали на протяжении всего процесса заполнения. Клапаны размещены на емкости MDI и затем выдували воздух либо посредством процесса вакуумного обжима, или процесса продувания HFA-134a, с последующей запрессовкой клапана. Опрессованные емкости затем заполняли через клапан соответствующим количеством суспензии, регулируемым мерным цилиндром.
|
Суспензию для заполнения под давлением получали посредством первоначального распределения соответствующих количеств микронизированных кристаллов гликопирролата и формотерола фумарата и суспендирующих частиц в сосуде для добавления лекарственного средства (DAV), внутри камеры с контролируемой влажностью (ОВ<5%). В настоящем примере носитель суспендирующих частиц добавляли тремя равными частями, с промежуточным добавлением GP и FF после первого и второго добавления, соответственно. DAV затем герметически закрывали в атмосфере азота и соединяли с суспензионным сосудом, содержащим 12 кг HFA-134a. Затем была образована взвесь при добавлении 0,5-1 кг HFA-134a в DAV, которую затем удаляли из суспензионного сосуда и осторожно крутили. Взвесь затем переносили назад в сосуд для смешивания суспензии, и разбавляли дополнительным HFA-134a с образованием окончательной суспензии при целевой концентрации, перемешивая осторожно с помощью мешалки. Суспензию затем рециркулировали через насос к системе заполнения в течение минимального времени перед инициацией заполнения. Смешивание и рециркуляцию продолжали на протяжении всего процесса заполнения. Клапаны размещены на емкости MDI и затем выдували воздух либо посредством процесса вакуумного обжима, или процесса продувания HFA-134a, с последующей запрессовкой клапана. Опрессованные емкости затем заполняли через клапан соответствующим количеством суспензии, регулируемым мерным цилиндром.
MDI, содержащие двойные со-суспензии, описанные в данном Примере, получали, чтобы они содержали две различные дозы GP и FF. Конкретно, первый ряд двойных со-суспензионных композиций получали для предоставления 18 мкг GP на нажатие и 4,8 мкг FF на нажатие ("низкая доза"), и второй ряд двойных со-суспензионных композиций получали для предоставления 36 мкг GP на нажатие и 4,8 мкг FF на нажатие ("высокая доза"). В дополнение к двойным со-суспензионным композициям, получали монотерапевтические FF и GP со-суспензионные композиции. Монотерапевтические со-суспензионные композиции получали, как описано, для двойных со-суспензий, за исключением того, что они включали только один вид частиц активного агента (либо GP или FF). Составляли монотерапевтические со-суспензии, и монотерапевтические MDI получали для предоставления следующих намеченных доставляемых доз: 18 мкг GP на нажатие, и 0,5, 1,0, 3,6 или 4,8 мкг FF на нажатие. Композиции и MDI, предоставляющие 0,5 мкг FF и 1 мкг FF на нажатие именуются "ультра-низкой" дозой.
Специфичные для лекарственного средства аэродинамические распределения по размерам, достигаемые с MDI, содержащими со-суспензионные композиции, полученные в соответствии с данным Примером, определяли, как описано в Примере 1. Пропорциональность аэродинамических распределений GP по размерам, полученных от двойных со-суспензий с низкой и высокой дозой, а также эквивалентность между двойной и монотерапевтической со-суспензиями продемонстрировано на Фигуре 18. Таким же образом, пропорциональность аэродинамических FF распределений по размерам, полученных от двойной и монотерапевтической со-суспензий, включающих композиции с ультранизкой, низкой и высокой дозой продемонстрировано на Фигуре 19.
Однородность доставляемой дозы монотерапевтических MDI с ультра-низкой дозой FF была также измерена, как описано в Примере 1. DDU для композиций и систем с 1 мкг/нажатие и 0,5 мкг/нажатие показаны на Фигуре 20. Желательная однородность доставляемой дозы достигается даже для ультранизких доз.