СПОСОБЫ ЛЕЧЕНИЯ МЕТОТРЕКСАТ-УСТОЙЧИВЫХ РАССТРОЙСТВ 10-ПРОПАРГИЛ-10-ДЕАЗААМИНОПТЕРИНОМ
Вид РИД
Изобретение
[0001] Метотрексат ("МТХ") применяют в составе схем комбинированной химиотерапии для лечения многих видов рака. Это обеспечивает лечение многих неопластических расстройств, включая острый лимфобластный лейкоз. Метотрексат также применяют для лечения некоторых аутоиммунных заболеваний, в том числе миастении гравис, полимиозита, дерматомиозита, миозита с включенными тельцами, болезни Бехтерева, болезни Крона, псориаза, пустулезного псориаза, псориатического артрита, ревматоидного артрита, гранулематоза Вегенера и склеродермии.
[0002] 10-пропагрил-10-деазааминоптерин (включая названия "10-пропаргил-10-dAM", "пралатрексат", "рацемический PDX", "(2S)-2-[[4-[(1/RS)-1-[(2,4-диаминоптеридин-6-ил)метил]бут-3-инил]бензоил]амино]глутаровая кислота", "(2RS)-2-[[4-[(1RS)-1-[(2,4-диаминоптеридин-6-ил)метил]бут-3-инил]бензоил]амино]глутаровая кислота" и "PDX") представляет собой соединение, которое было испытано и признано полезным при лечении рака. 10-пропаргил-10-деазааминоптерин одобрен Управлением по контролю качества продовольствия и медикаментов США (FDA) для лечения рецидивирующей и рефрактерной периферической Т-клеточной лимфомы. Кроме того, проводятся исследования возможности применения 10-пропаргил-10-деазааминоптерина при лимфоме, раке легких, раке мочевого пузыря и раке молочной железы.
[0003] 10-пропаргил-10-деазааминоптерин был первоначально описан в DeGraw et al., "Synthesis and Antitumor Activity of 10-Propargyl-10-deazaaminopterin," J. Med. Chem. 36: 2228-2231 (1993); показано, что он действует как ингибитор фермента дигидрофолатредуктазы ("DHFR") и как ингибитор роста линии клеток лимфоцитарного лейкоза мыши L1210. Кроме того, были представлены некоторые результаты о противоопухолевых свойствах этого соединения на модели опухоли молочной железы мыши Е0771.
[0004] В патенте США №6028071 и публикации РСТ №WO 1998/02163 описано, что композиции высокоочищенного 10-пропаргил-10-деазааминоптерина при исследовании на модели ксенотрансплантата были эффективны против опухолей человека. Последующие исследования 10-пропаргил-10-деазааминоптерина показали, его можно применять в чистом виде и в комбинации с другими терапевтическими агентами. Например, Sirotnak et al., Clinical Cancer Research Vol.6, 3705-3712 (2000) сообщал, что одновременное введение 10-пропаргил-10-деазааминоптерина и пробенецида, ингибитора cMOAT/MRP-подобной АТФазы плазматической мембраны, значительно повышает эффективность 10-пропаргил-10-деазааминоптерина против солидных опухолей человека. Показано, что 10-пропаргил-10-деазааминоптерин в комбинации с химиотерапевтическими агентами на основе платины был эффективен против мезотелиомы (Khokar, et al., Clin. Cancer Res. 7: 3199-3205 (2001). Совместное введение с гемцитабином (Gem) для лечения лимфомы описано в WO/2005/117892. Комбинации 10-пропаргил-10-деазааминоптерина с таксолами описаны как эффективные в патенте США №6323205. Кроме того, показано, что 10-пропаргил-10-деазааминоптерин был эффективен при лечении Т-клеточной лимфомы, см. патент США №7622470. В других исследованиях предложен способ оценки чувствительности лимфомы к лечению 10-пропаргил-10-деазааминоптерином путем определения количества восстановленного белка-переносчика фолата 1 (RFC-1), экспрессируемого образцом, причем более высокий уровень экспрессируемого RFC-1 является признаком более высокой чувствительности к 10-пропаргил-10-деазааминоптерину, описанный в публикации РСТ №WO 2005/117892.
[0005] Известно, что 10-пропаргил-10-деазааминоптерин является антифолатом/антиметаболитом. Фолатный путь играет ключевую роль в росте и пролиферации клеток (Appling, 1991; Odin et al, 2003). Фолиевая кислота (фолат) проникает в клетки с помощью восстановленного переносчика фолата 1 (RFC-1), конъюгируется с полиглутаматом фолилполиглутаматсинтетазой (FPGS) и восстанавливается до дигидрофолата, который в дальнейшем преобразуется в тетрагидрофолат (ТГФ) дигидрофолатредуктазой (ДГФР). Различные ферменты и переносчики, участвующие в этом метаболическом пути, являются мишенями важного класса цитотоксических агентов: антифолатов. Метотрексат был одним из первых агентов этого класса и впервые был использован при лечении детского острого лимфобластного лейкоза (Farber et al, 1948). С тех пор метотрексат широко применяют при гематологических и солидных раковых заболеваниях, и с помощью рационального дизайна были получены новые поколения антифолатов для использования различных аспектов фолатного пути (например, ралтитрексед при раке ободочной и прямой кишки (Cocconi и др., 1998) и пеметрексед при злокачественных плевральных мезотелиомах (Vogelzang и др., 2003) и немелкоклеточном раке легкого (НМРЛ) (Hanna et al, 2004)). В большинстве опухолевых клеток RFC-1 опосредует интернализацию аналогов фолиевой кислоты. Попав в клетку, эти аналоги либо связывают дигидрофолатредуктазу (ДГФР), тем самым истощая внутриклеточный запас восстановленного фолата, необходимый для биосинтеза пурина и тимидина, или метаболизируются в полиглутаматы перед связыванием с ДГФР. Конъюгирование с полиглутаматом катализируется фолилполиглутаматсинтетазой (FPGS). Фолилполиглутаматгидролаза (FPGH, также известная как гамма-глутамилгидролаза [GGH]), опосредует расщепление и, следовательно, последующее выведение этих внутриклеточных полиглутаматов антифолатов. Тимидилатсинтаза (TS) и глицинамидрибонуклеотидформилтрансфераза (GARFT) также участвуют в метаболизме фолата, как ферменты "рециклирования" (таким образом, непосредственно влияя на запасы нуклеотидов, доступные для синтеза ДНК).
[0006] Метотрексат является антифолатом. На основании испытаний клеточных линий считается, что 10-пропаргил-10-деазааминоптерин и метотрексат обладают аналогичной картиной цитотоксичности, причем 10-пропаргил-10-деазааминоптерин зачастую является в 3-19 раз более мощным, чем метотрексат.
[0007] Устойчивость к метотрексату обычно возникает в результате мутации или амплификации гена ДГФР. Существуют три известных пути, согласно которым клетки могут приобретать иммунитет к действию этого антагониста фолата. Можно уменьшать концентрацию метотрексата в клетке за счет изменений в транспортных системах, которые переносят лекарственный агент в клетку и из нее. Например, если происходит снижение количества переносчиков, с помощью которых метотрексат поглощается клетками, он будет находиться внутри клетки в меньшем количестве. Кроме того, концентрация лекарственного агента в клетке может регулироваться за счет измененных скоростей его конъюгирования с полиглутаматом и метаболизма. Когда агент медленнее конъюгируется с полиглутаматом или быстрее метаболизируется, он может легче удаляться из клетки, за счет чего его концентрация и активность в клетке снижаются. Амплификация гена ДГФР вызывает повышение количества присутствующей ДГФР и, как показано, коррелирует со снижением ответа на лечение метотрексатом. Метотрексат должен связаться с ДГФР для предотвращения ее активности. Если связывающая область ДГФР модифицируется за счет генетических изменений, снижая связывание метотрексата, ДГФР может продолжать активировать фолаты, и эффективность лечения будет снижаться. Последствия всего вышеуказанного приводят к повышенной устойчивости к метотрексату. Устойчивость к метотрексату может быстро развиться и привести к неэффективности лечения.
[0008] Таким образом, могут быть полезны способы преодоления приобретенной устойчивости к метотрексату.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ [0009]
В одном из вариантов реализации изобретение включает способ лечения
расстройства, устойчивого к метотрексату, у субъекта. Этот способ может включать введение указанному субъекту эффективного количества композиции, которая содержит 10-пропаргил-10-деазааминоптерин или его фармацевтически приемлемые соли.
[0010] В другом варианте реализации настоящее изобретение включает способ лечения субъекта, нуждающегося в лечении неоплазии, устойчивой к метотрексату, причем указанный способ включает введение указанному субъекту эффективного количества 10-пропаргил-10-деазааминоптерина или его фармацевтически приемлемых солей.
[0011] В некоторых вариантах реализации указанное расстройство представляет
собой рак. В других вариантах реализации расстройство представляет собой воспалительное расстройство. В одном из вариантов реализации указанную композицию составляют для внутривенного введения. В другом варианте реализации указанную композицию составляют для перорального введения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
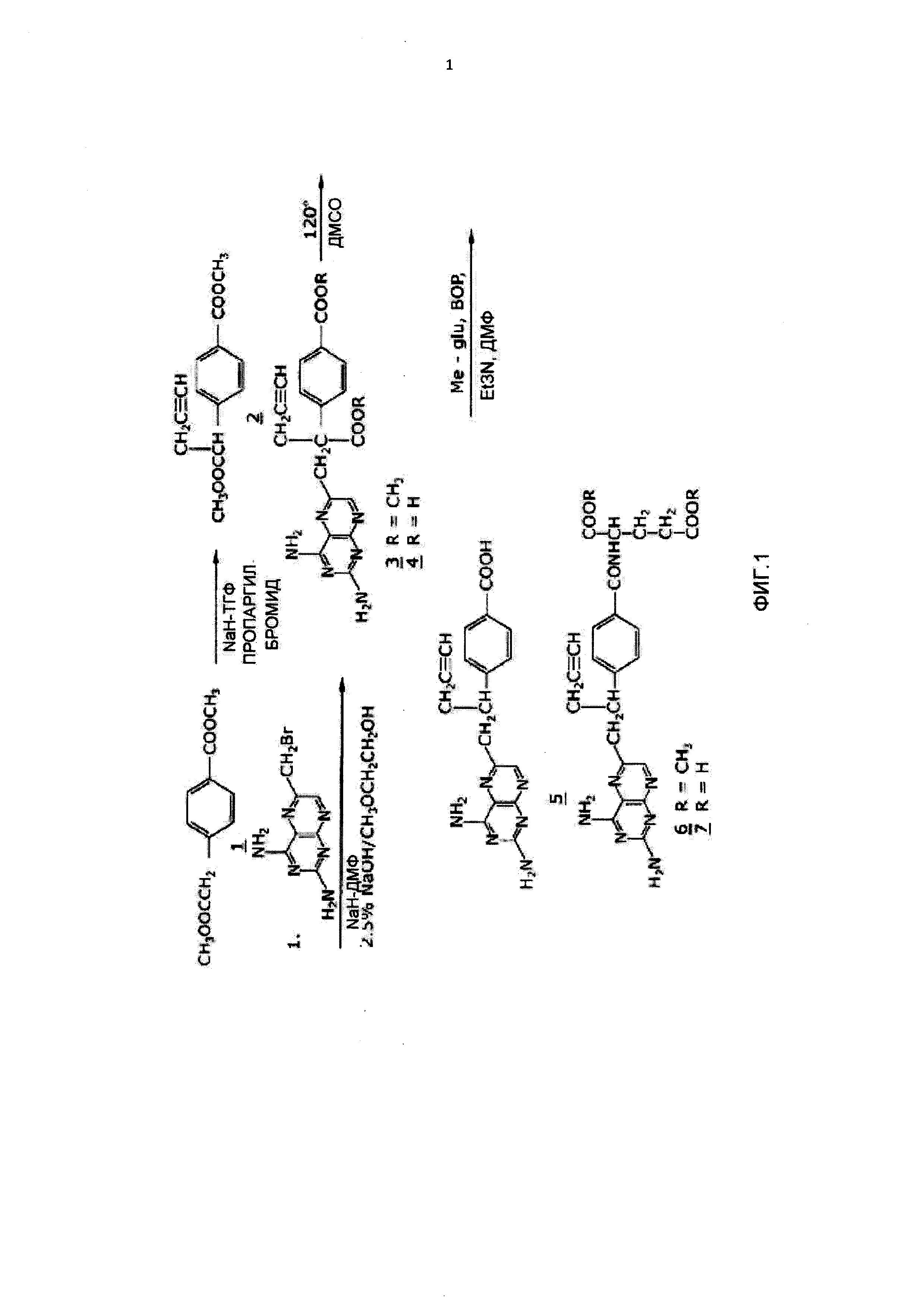
[0012] На Фиг.1 приведена схема синтеза, которую можно использовать при получении 10-пропаргил-10-деазааминоптерина;
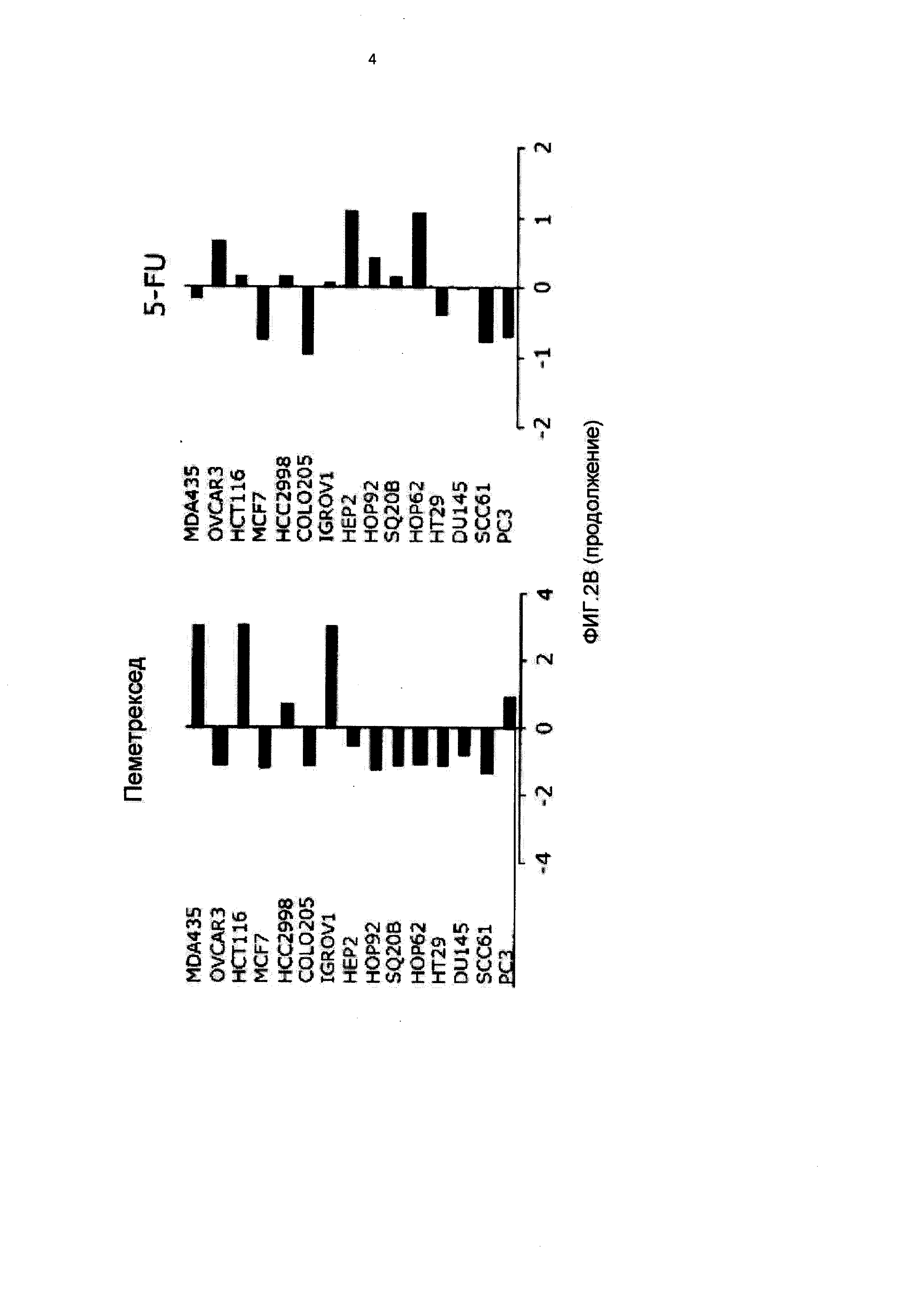
[0013] На Фиг.2 показана чувствительность 10-пропаргил-10-деазааминоптерина и других ингибиторов фолата к 15 протестированным линиям раковых клеток;
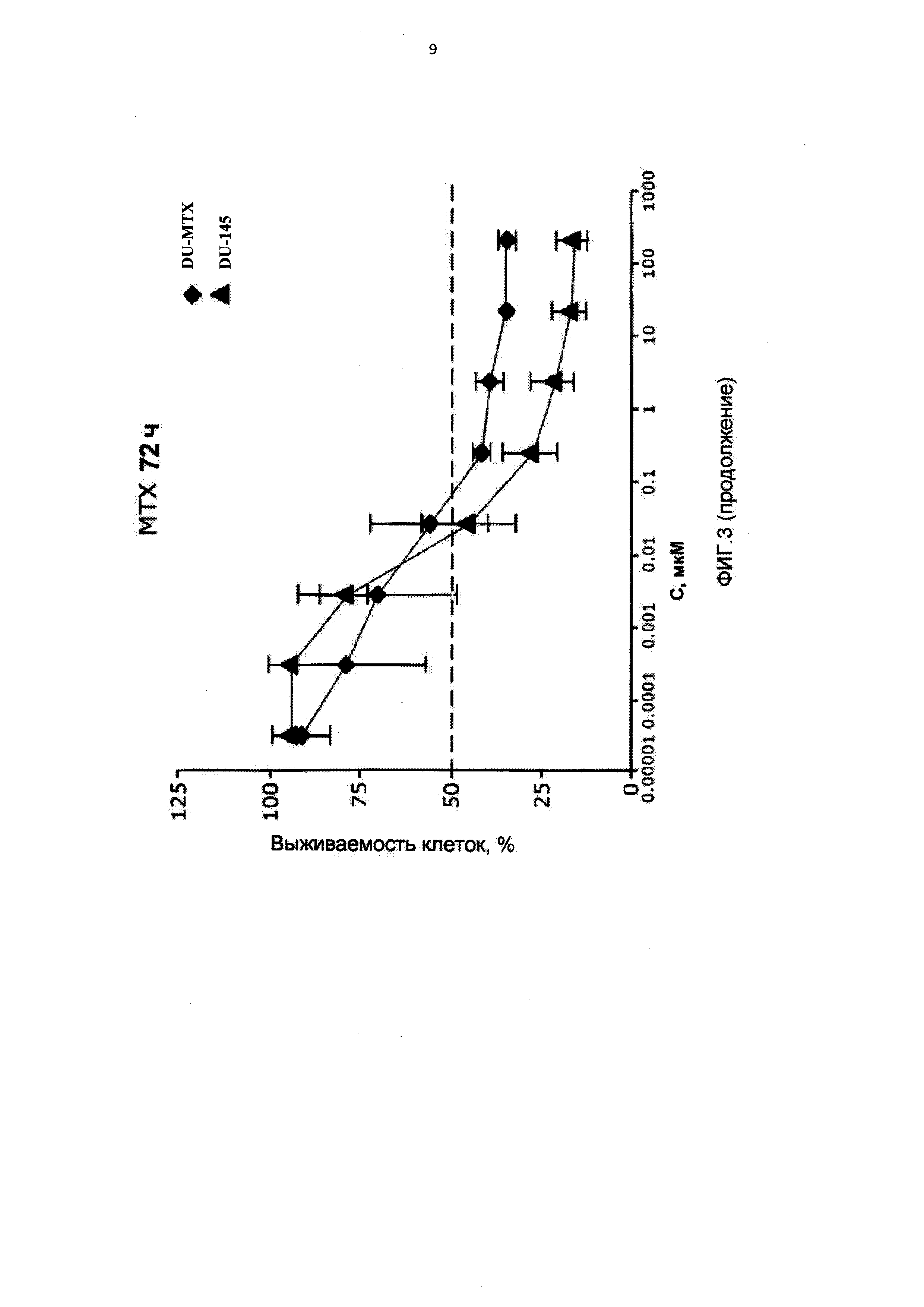
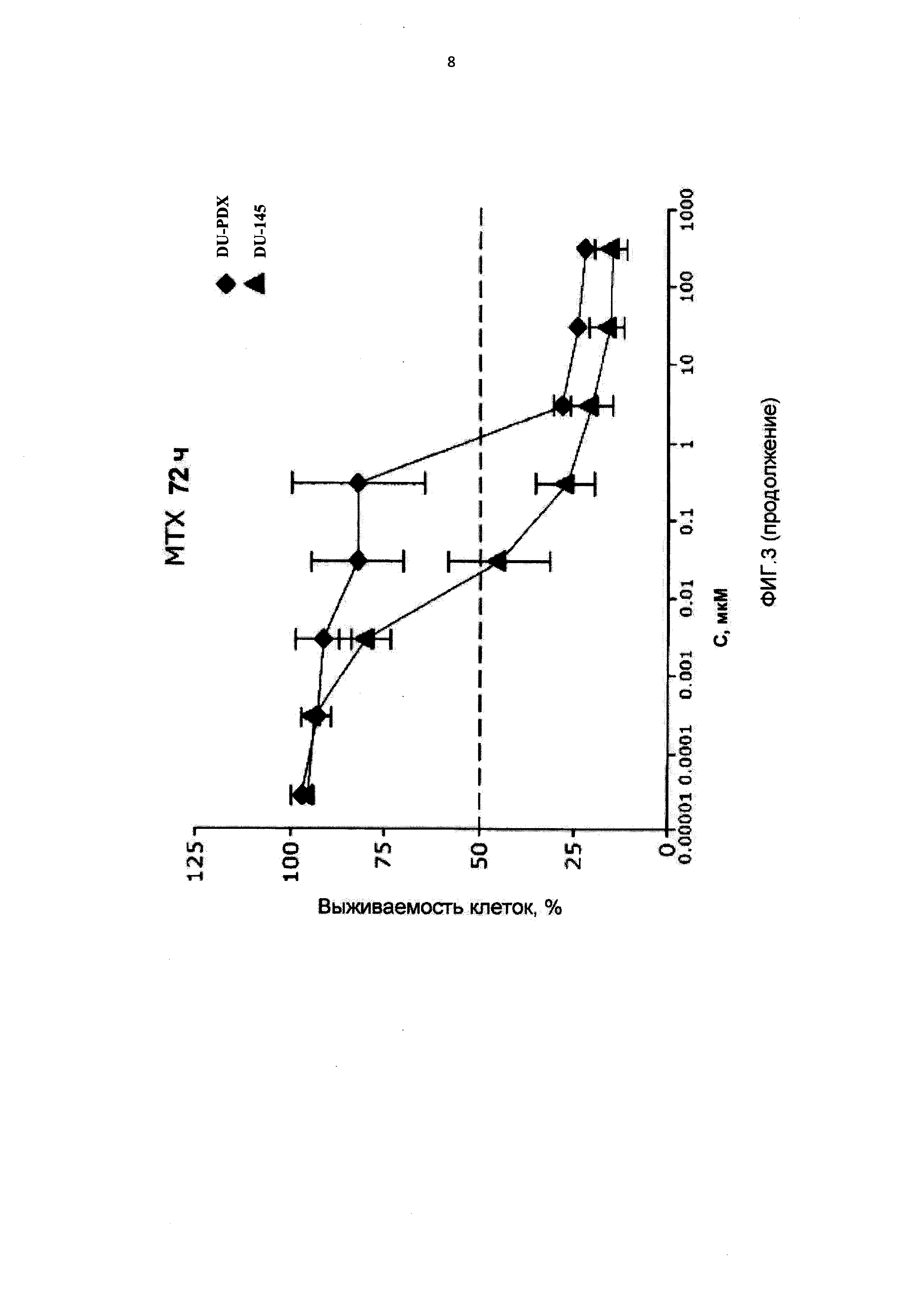
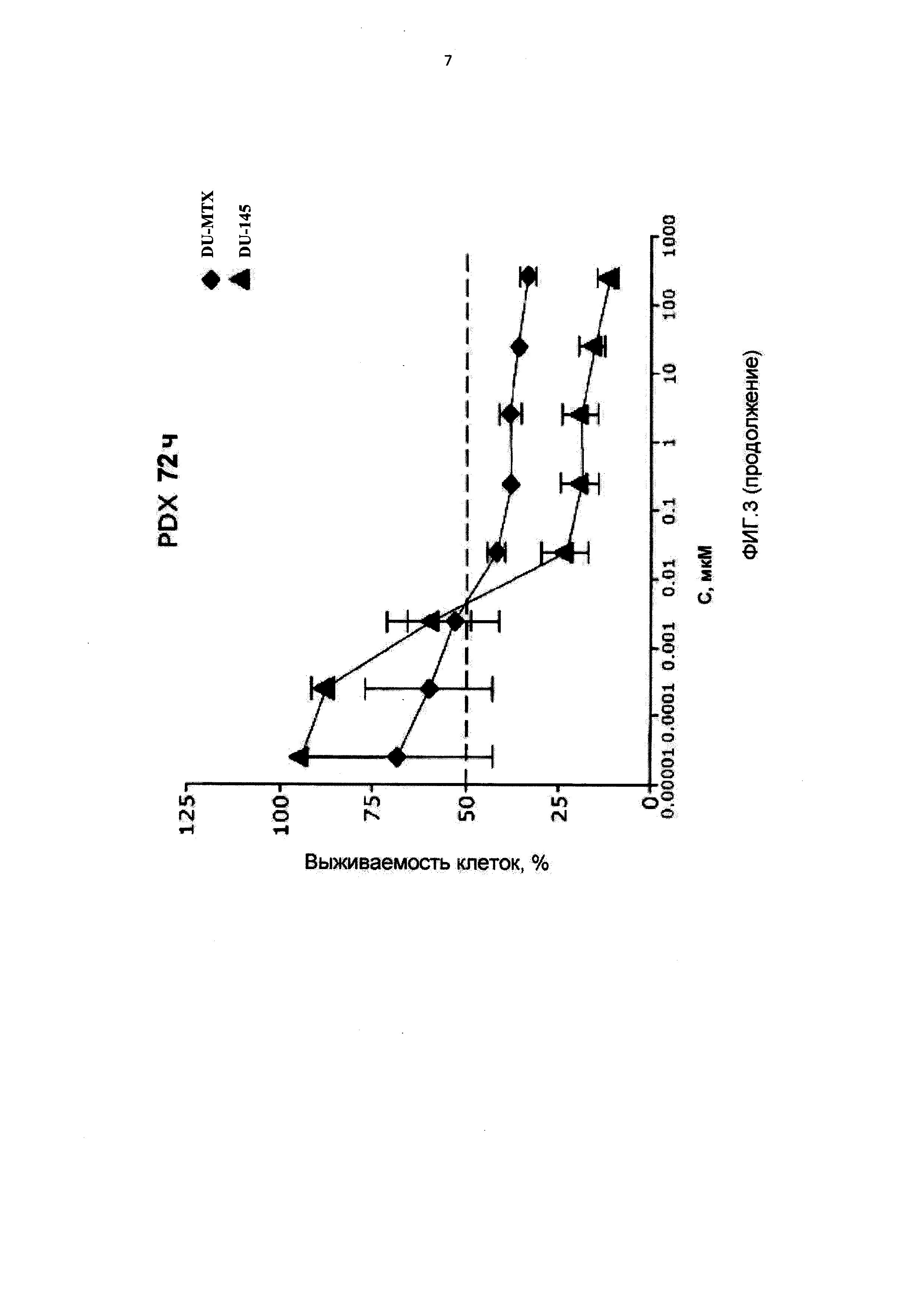
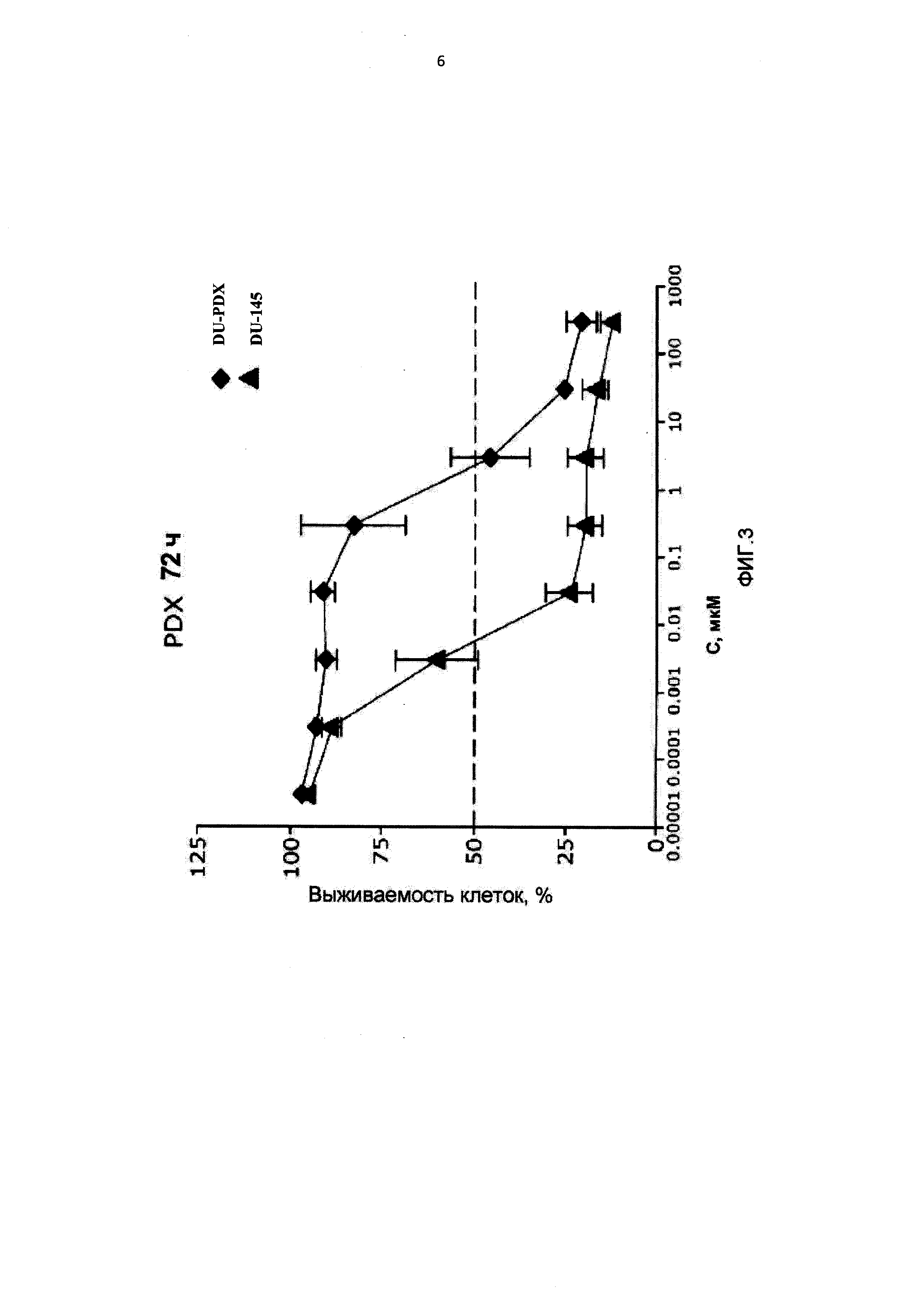
[0014] На Фиг.3 приведены значения IC50 для клеток DU-145, интактных, адаптированных к 10-пропаргил-10-деазааминоптерину (DU-PDX) и адаптированных к метотрексату (DU-MTX) при лечении 10-пропаргил-10-деазааминоптерином или метотрексатом;
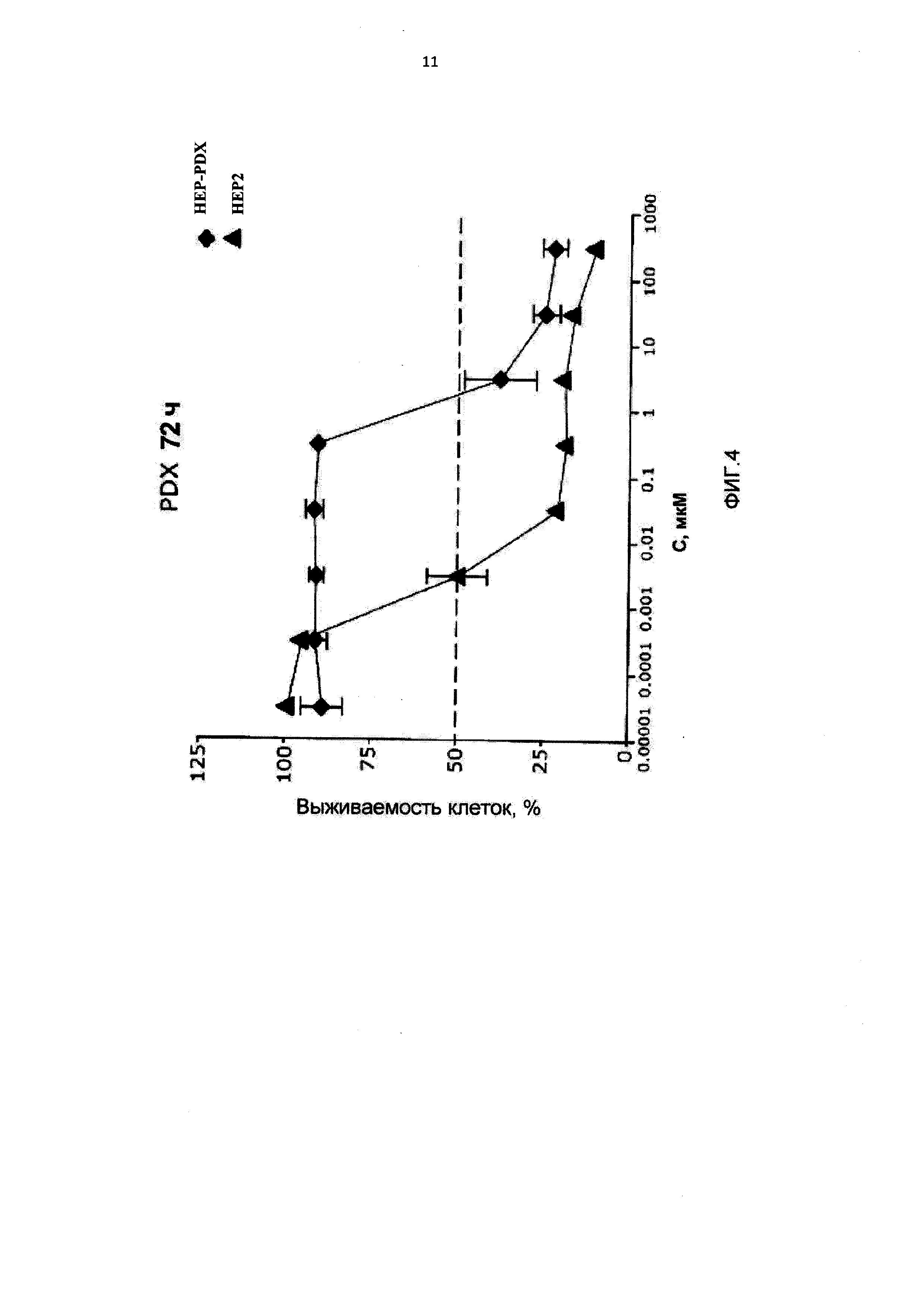
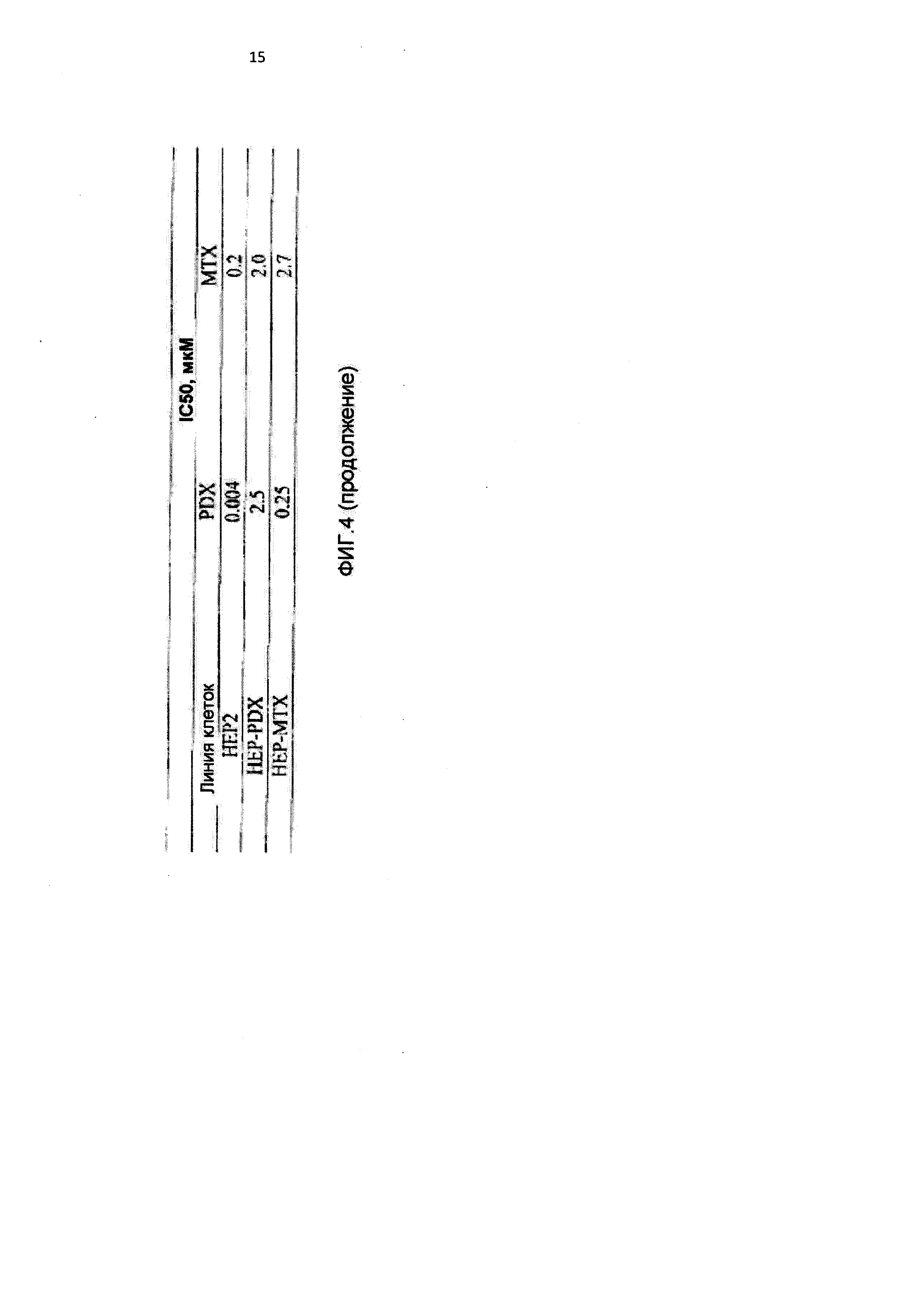
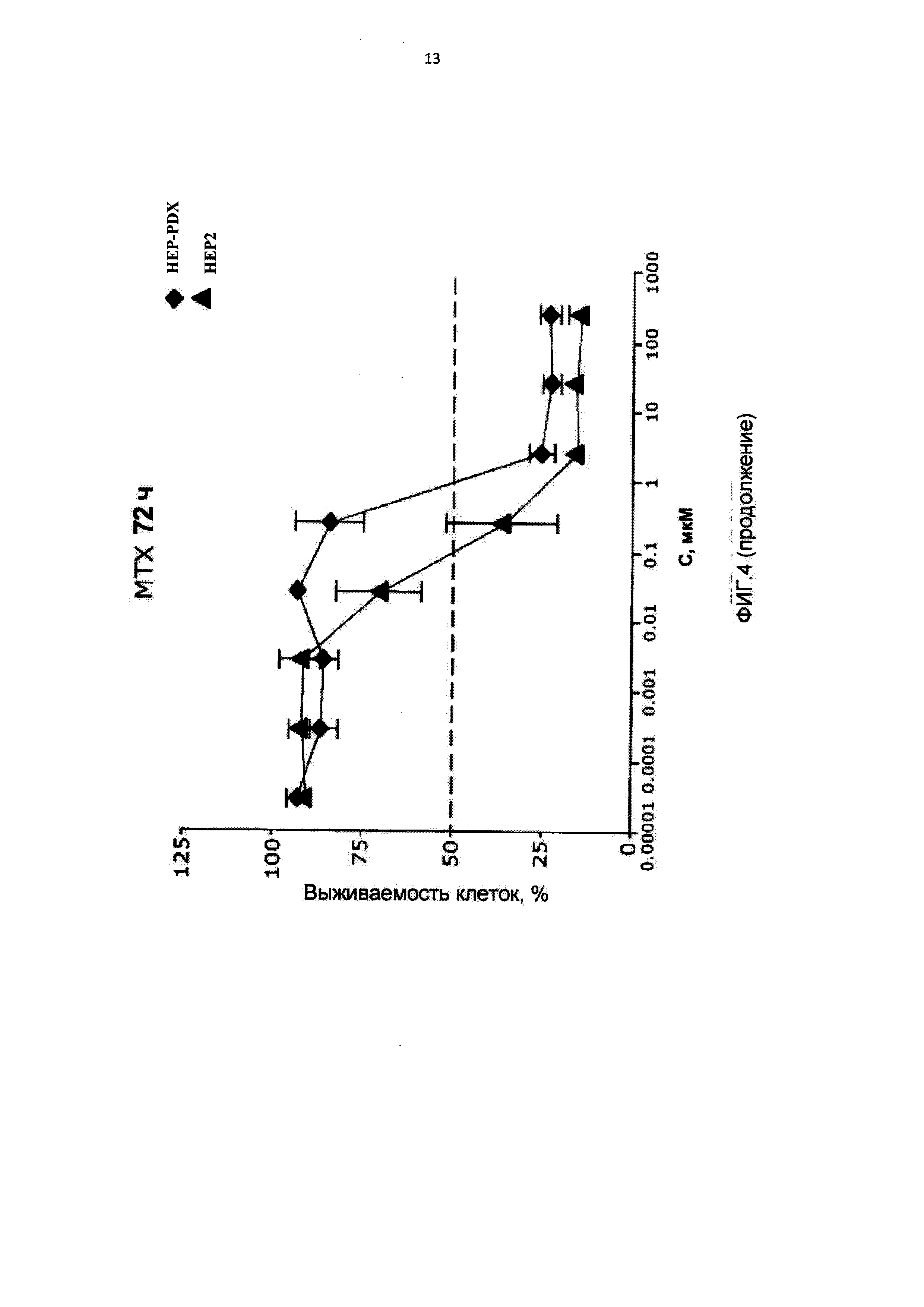
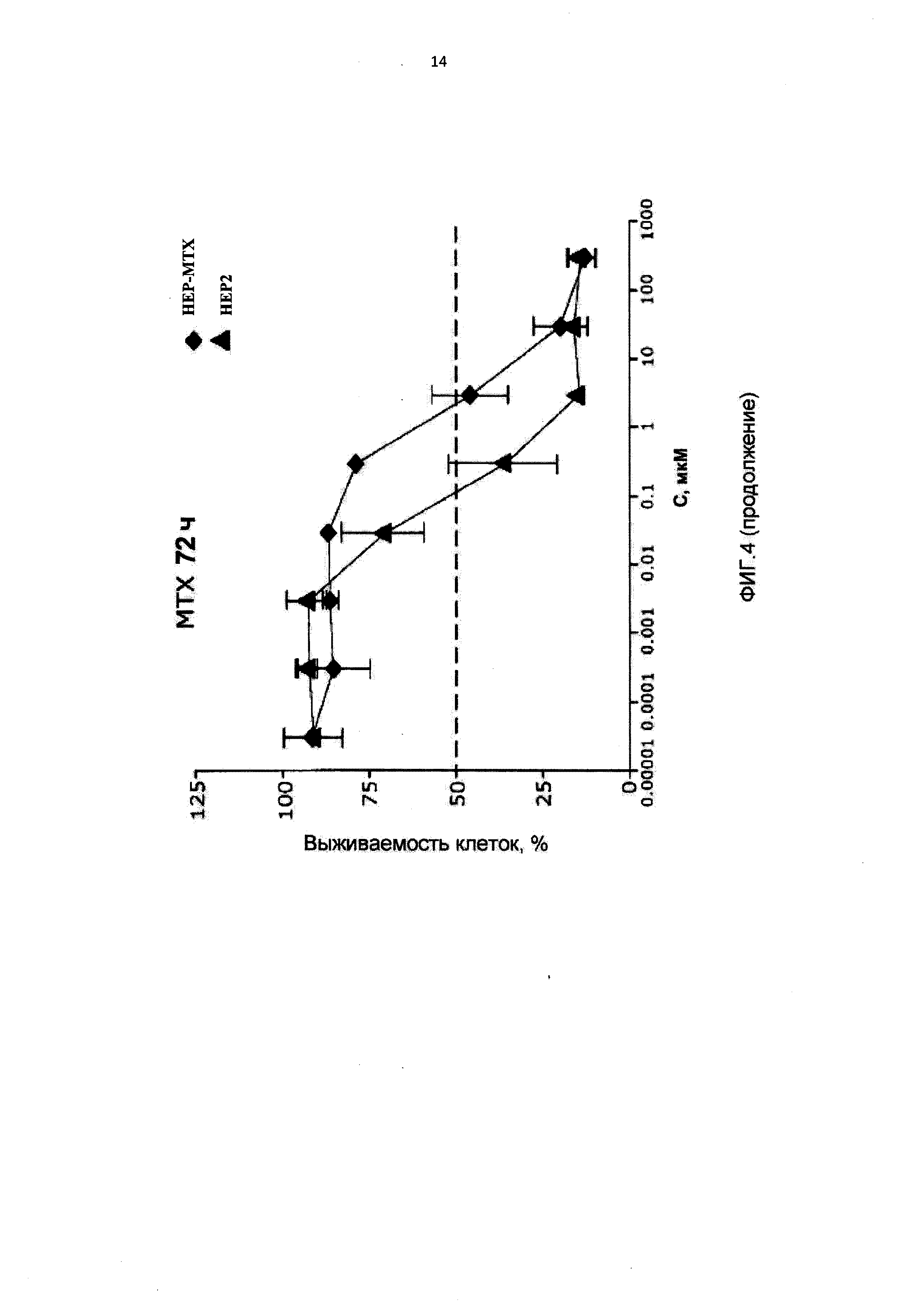
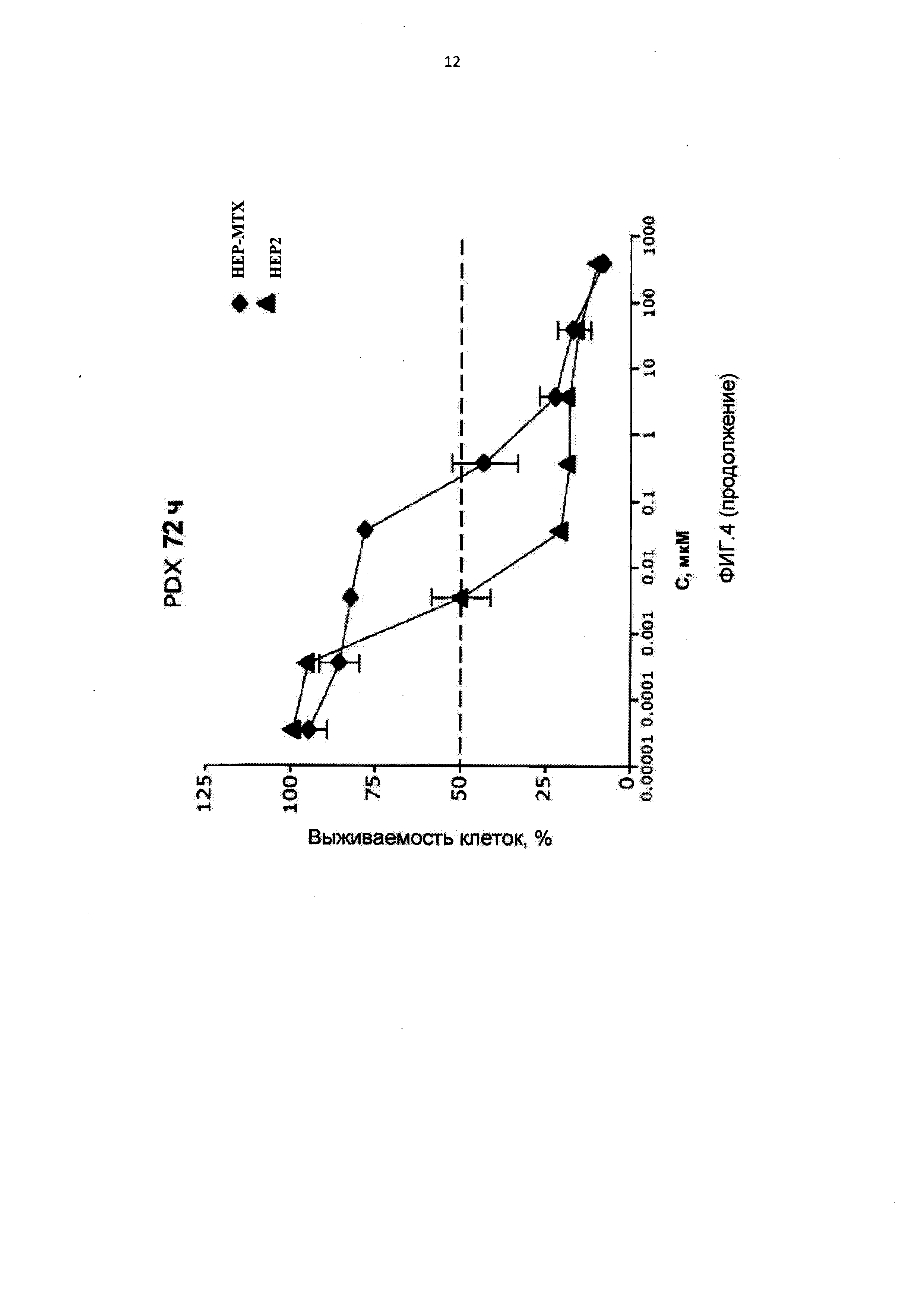
[0015] На Фиг.4 приведены значения 1С50 для клеток НЕР2, интактных, адаптированных к 10-пропаргил-10-деазааминоптерину (HEP-PDX) и адаптированных к метотрексату (НЕР-МТХ) при лечении 10-пропаргил-10-деазааминоптерином или метотрексатом;
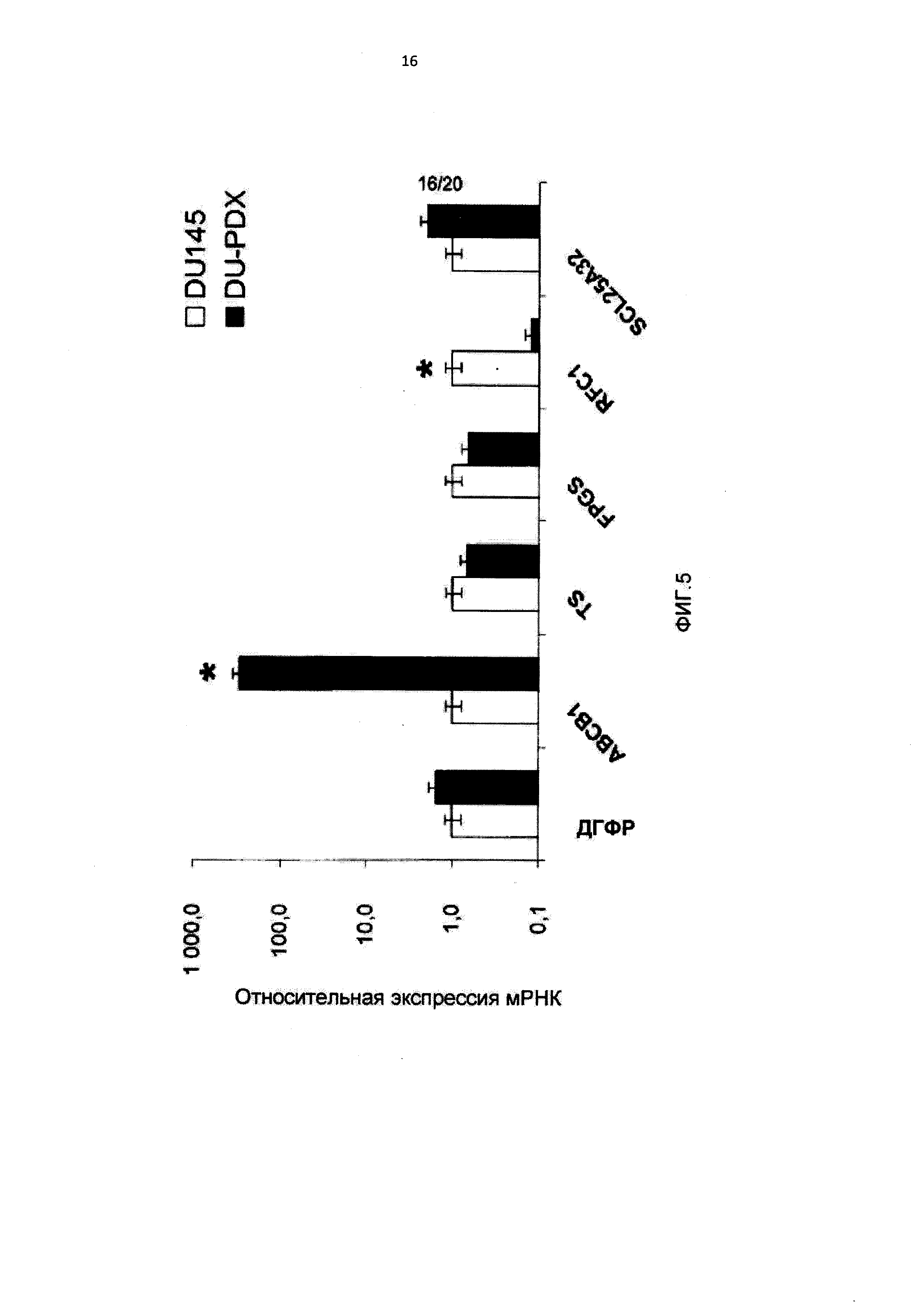
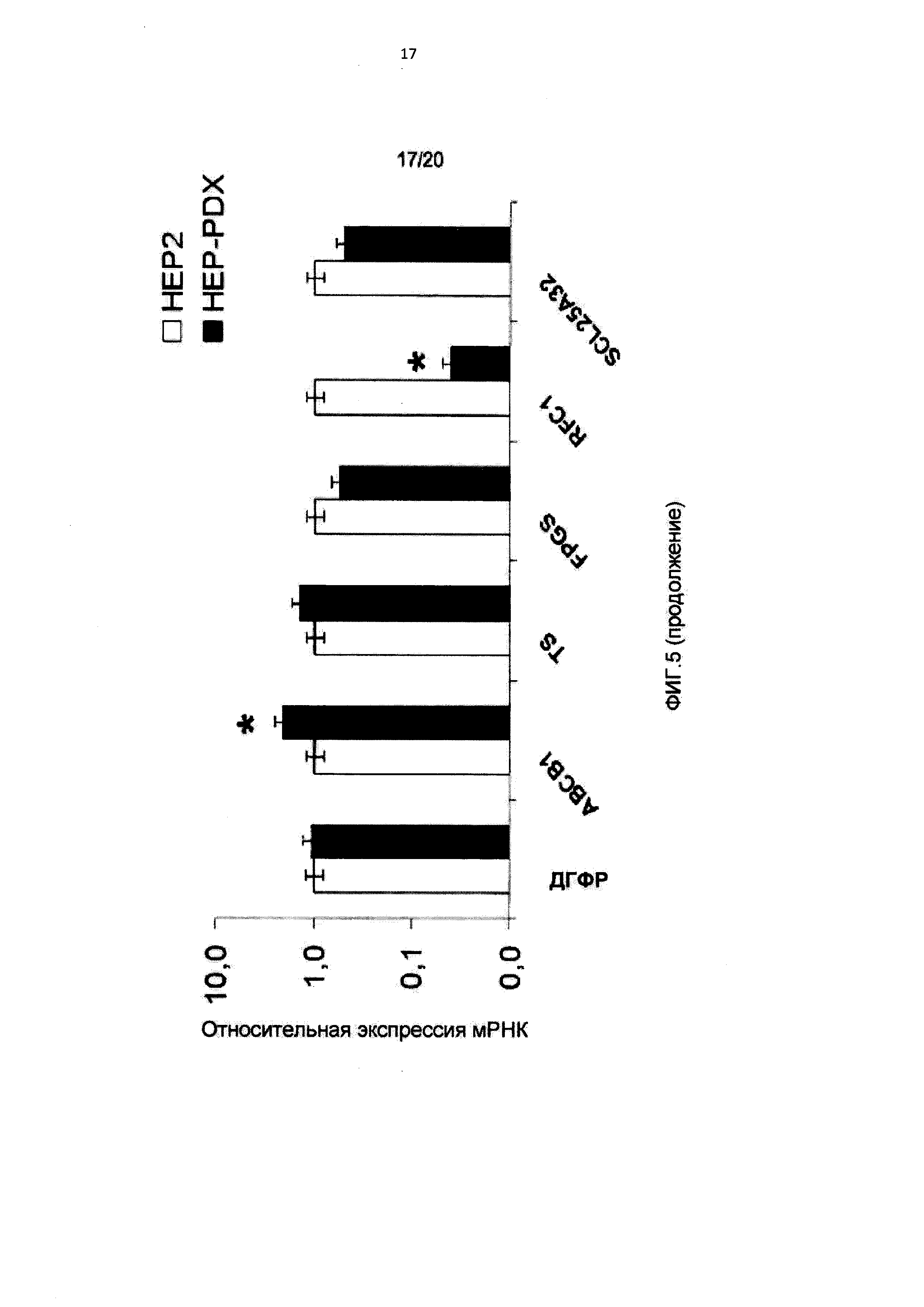
[0016] На Фиг.5 показана относительная экспрессия мРНК фолатных генов в линиях клеток, устойчивых к 10-пропаргил-10-деазааминоптерину;
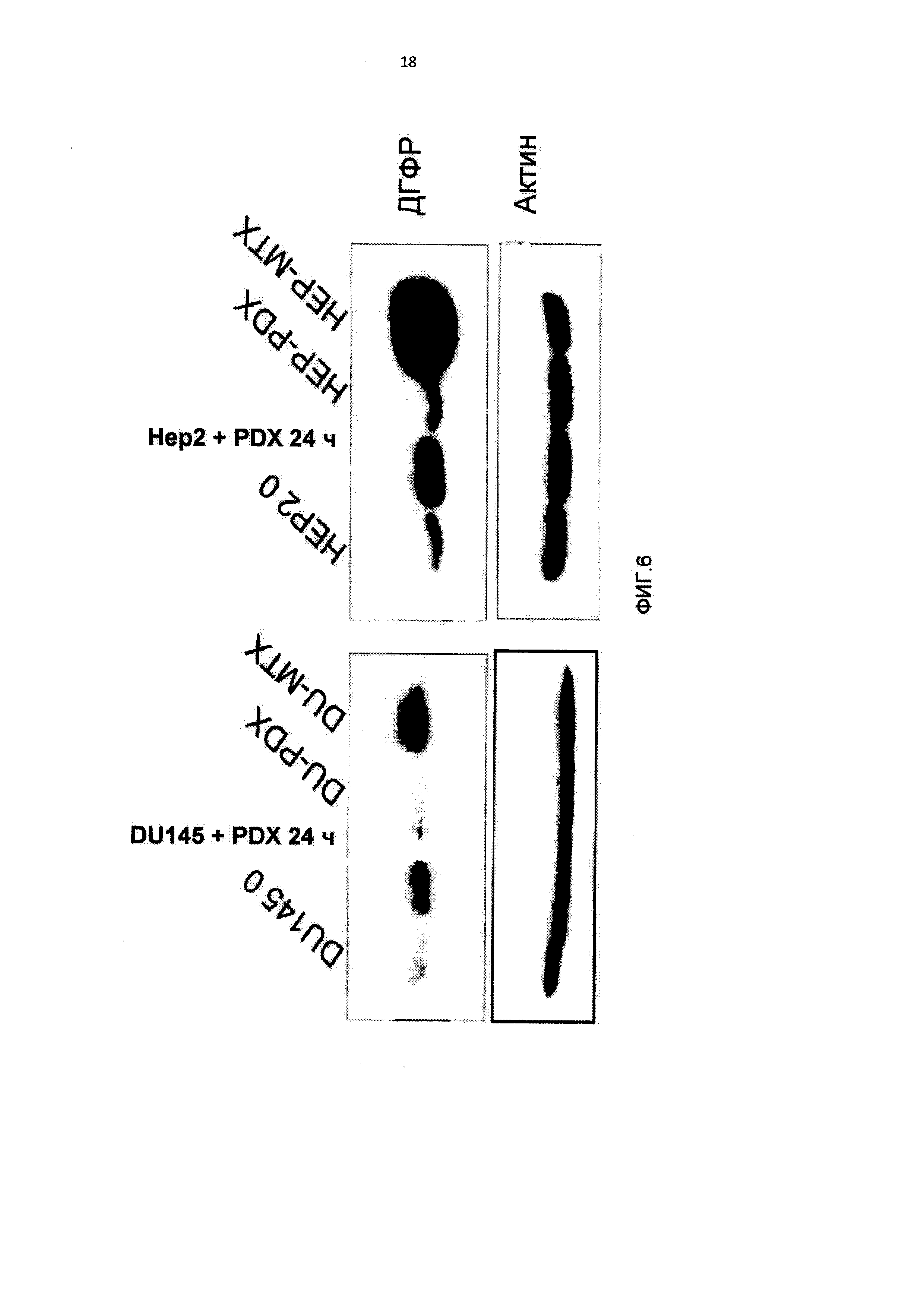
[0017] На Фиг.6 приведены данные по вестерн-блоттингу белка ДГФР в линиях клеток DU145 и НЕР2, чувствительных, и DU-PDX, DU-MTX, HEP-PDX и НЕР-МТХ, устойчивых к 10-пропаргил-10-деазааминоптерину и метотрексату;
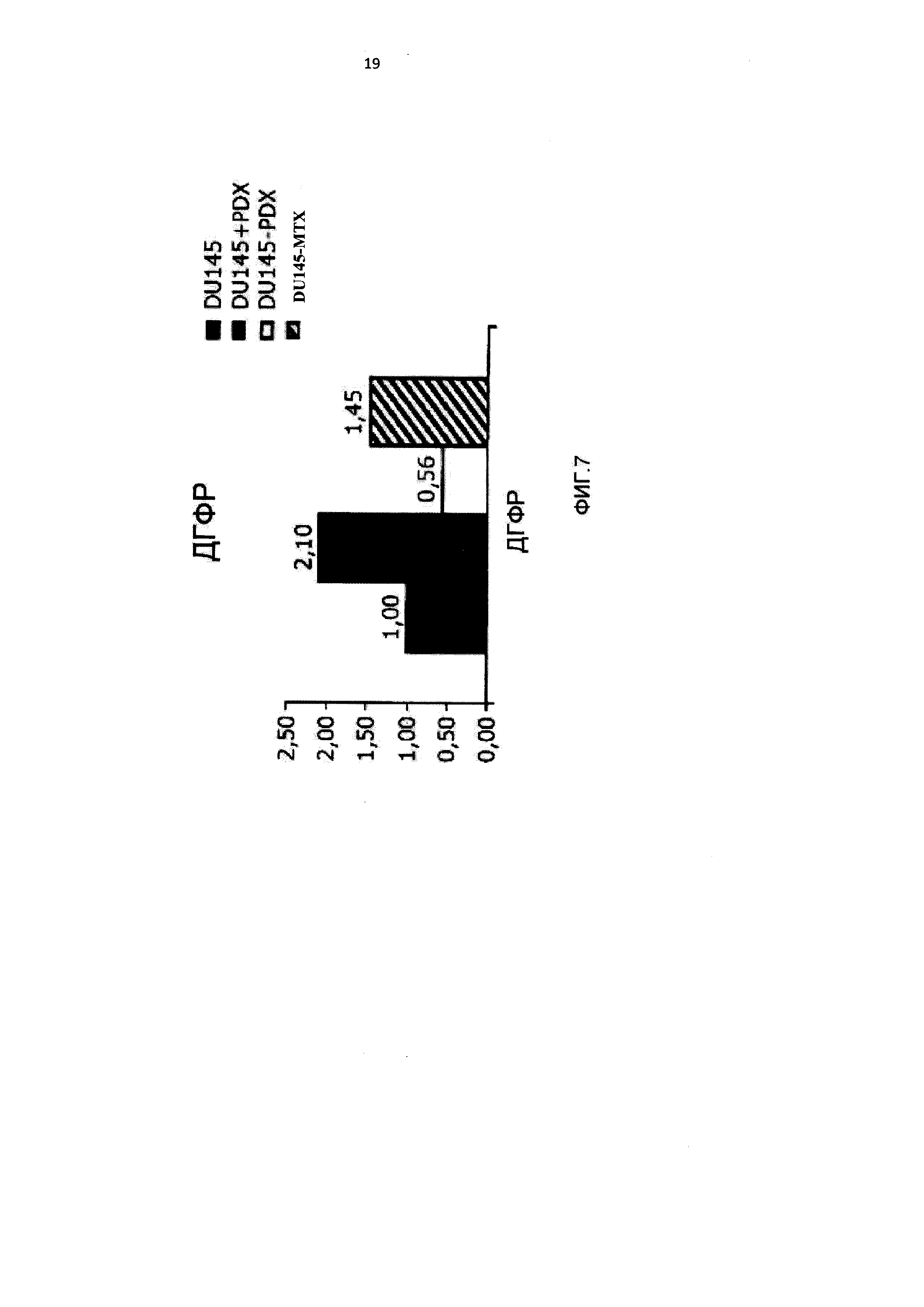
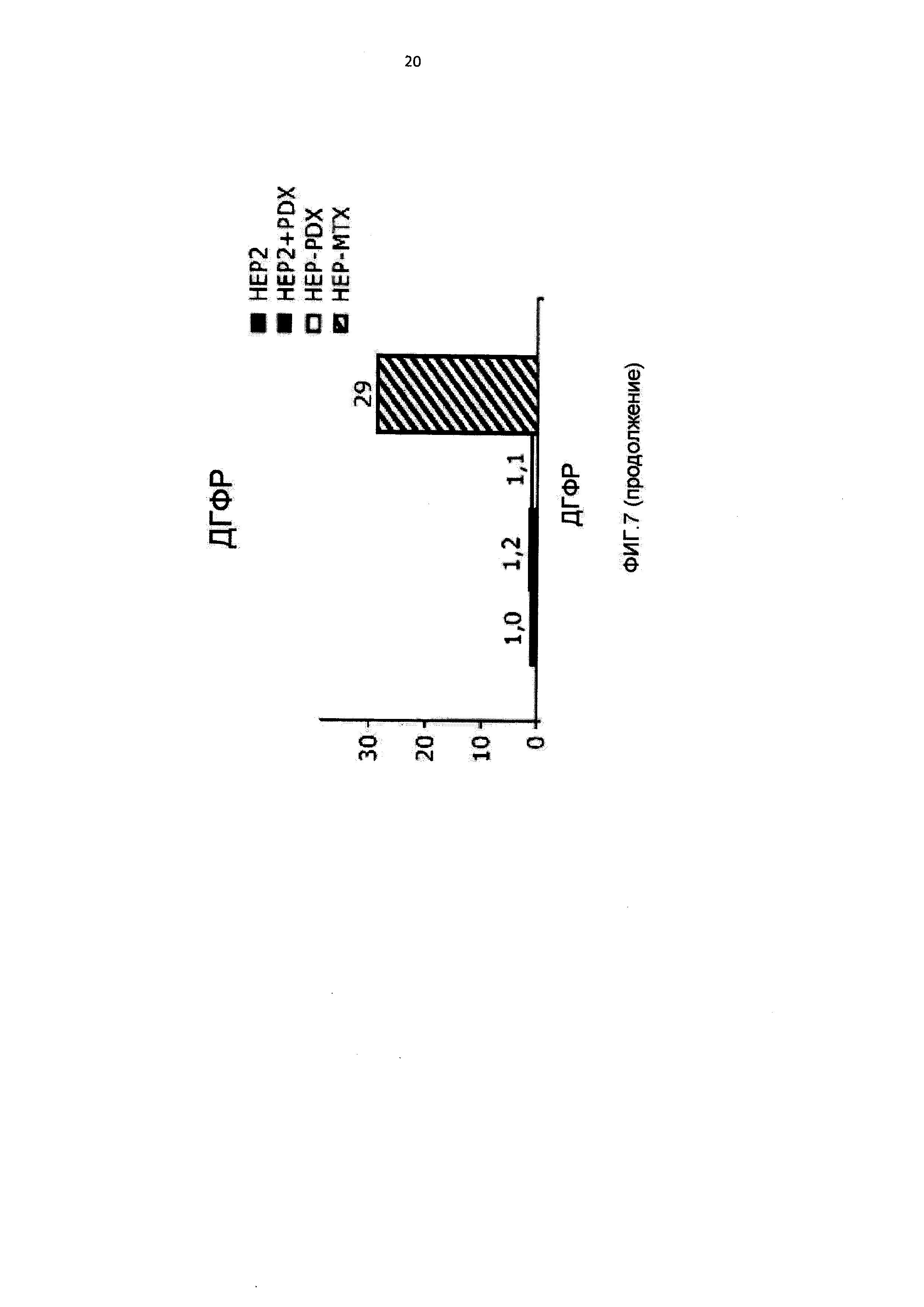
[0018] На Фиг.7 приведены данные по экспрессии мРНК ДГФР в линиях клеток DU145 и НЕР2, чувствительных, и DU-PDX, DU-MTX, HEP-PDX и НЕР-МТХ, устойчивых к 10-пропаргил-10-деазааминоптерину и метотрексату.
ПОДРОБНОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0019] Одна из сохраняющихся проблем с лечением раковых больных представляет собой индивидуальные различия реакций на лечение и генетические изменения в опухолях, приводящие к устойчивости к химиотерапии. Химиотерапия предусматривает применение лекарственных агентов, мишенью которых часто являются быстро делящиеся клетки. Многие химиотерапевтические агенты, в том числе антифолаты, препятствуют процессу репликации ДНК, происходящему перед делением клеток. Хотя существует много достижений в области химиотерапевтических агентов, генетическая нестабильность раковых клеток, особенно на поздних стадиях рака, приводит к высокой частоте устойчивости раковых опухолей к лекарственным агентам.
[0020] В настоящем изобретении разработаны клеточные линии с приобретенной устойчивостью к метотрексату и 10-пропаргил-10-деазааминоптерину на основе линий раковых клеток DU145 (рак предстательной железы) и Нер2 (рак головы и шеи). Обладая более чем 200-кратной устойчивостью к 10-пропаргил-10-деазааминоптерину, чем исходные клетки, клетки DU-PDX и HEP-PDX с приобретенной устойчивостью к 10-пропаргил-10-деазааминоптерину демонстрировали перекрестную устойчивость к метотрексату; клетки DU-MTX и НЕР-МТХ по-прежнему демонстрировали значительную чувствительность к 10-пропаргил-10-деазааминоптерину.
[0021] Наблюдали различные механизмы приобретенной устойчивости к 10-пропаргил-10-деазааминоптерину и метотрексату. Приобретенная устойчивость к 10-пропаргил-10-деазааминоптерину была связана со значительным снижением экспрессии мРНК RFC1 в обеих линиях клеток DU-PDX и HEP-PDX, кроме того, также наблюдалось незначительное увеличение экспрессии мРНК MDR1. В настоящем изобретении также показано небольшое снижение экспрессии мРНК FPGS в клетках, устойчивых к 10-пропаргил-10-деазааминоптерину, что свидетельствует о роли конъюгирования с полиглутаматом в устойчивости к 10-пропаргил-10-деазааминоптерину. В ходе исследований, проведенных три десятилетия назад, обнаружили, что частым механизмом приобретенной устойчивости к метотрексату является амплификация гена ДГФР и, как следствие, избыточная экспрессия фермента (обзор Assaraf 2007; Chen et al, 1995). Таким образом, при выборе культивируемых опухолевых клеточных линий и постепенном возрастании концентраций метотрексата приобретенная устойчивость к антифолатам часто бывает обусловлена амплификацией гена ДГФР. Фактически, в настоящем изобретении линия клеток НЕР-МТХ с приобретенной устойчивостью к метотрексату демонстрировала резкое увеличение экспрессии белка ДГФР по сравнению с исходной эквивалентной линией, что указывает на возможную амплификацию гена ДГФР в этой модели. Такого повышения количества белка не наблюдалось в линиях клеток, устойчивых к 10-пропаргил-10-деазааминоптерину. Эти данные указывают на различные молекулярные механизмы устойчивости к метотрексату и 10-пропаргил-10-деазааминоптерину в этих линиях клеток.
[0022] Рак "чувствителен" к терапевтическому агенту, или имеет место "хороший ответ" на лечение, если скорость его роста ингибируется в результате контакта с терапевтическим агентом, по сравнению с ростом рака в отсутствие контакта с терапевтическим агентом. Рост рака можно измерить различными способами, например, можно измерить размер опухоли или экспрессию опухолевых маркеров, соответствующих этому типу опухоли. Эти критерии определяют тип измеряемого ответа, а также характеризуют время до прогрессирования болезни, которое является еще одной важной мерой чувствительности опухоли к терапевтическому агенту. Параметр чувствительности к 10-пропаргил-10-деазааминоптерину является изменчивым, причем различные виды рака демонстрируют различные уровни «чувствительности» к данному терапевтическому агенту в различных условиях. Дополнительные характеристики чувствительности можно оценить с помощью дополнительных критериев, не относящихся к росту размера опухоли, в том числе качества жизни пациентов, степень метастазирования и т.д. Кроме того, в соответствующих ситуациях можно оценивать клинические прогностические маркеры и переменные.
[0023] Рак «нечувствителен» или характеризуется «плохим ответом» на терапевтический агент, например, 10-пропаргил-10-деазааминоптерин, или имеет место плохой ответ на лечение, если скорость его роста не ингибируется или ингибируется в очень низкой степени в результате контакта с терапевтическим агентом по сравнению с ростом рака в отсутствие контакта с терапевтическим агентом. Как указано выше, рост рака можно измерить различными способами, например, можно измерить размер опухоли или экспрессию опухолевых маркеров, соответствующих этому типу опухоли. Параметр нечувствительности к терапевтическому агенту является крайне изменчивым, причем различные виды рака демонстрируют различные уровни «нечувствительности» к данному терапевтическому агенту в различных условиях. Дополнительные характеристики нечувствительности можно оценить с помощью дополнительных критериев, не относящихся к росту размера опухоли, в том числе качества жизни пациентов, степень метастазирования и т.д. Кроме того, в соответствующих ситуациях можно оценивать клинические прогностические маркеры и переменные. Такие нечувствительные или плохо реагирующие виды рака могут не реагировать или первоначально реагировать на агент, но приобретать устойчивость к нему. Устойчивость или нечувствительность можно измерить по сравнению с другими, более чувствительными видами рака или линиями опухолевых клеток или по сравнению с раком или линиями опухолевых клеток этого же типа. Эти виды рака также можно называть «устойчивыми» к определенным химиотерапевтическим агентам видами рака, например, рак, устойчивый к метотрексату, может быть первоначально устойчив к метотрексату, или может приобрести устойчивость к метотрексату во время курса или курсов лечения метотрексатом или другим химиотерапевтическим агентом. Устойчивость может быть обусловлена мутацией или мутациями в белках, в одном из белков фолатного пути, пути импорта фолиевой кислоты, или возникать за счет мутации любого другого белка, имеющего отношение к ответу на метотрексат.
[0024] Соответственно, в одном варианте реализации настоящее изобретение включает способ лечения расстройства, устойчивого к метотрексату, у субъекта, причем указанный способ включает введение субъекту эффективного количества 10-пропаргил-10-деазааминоптерина и его фармацевтически приемлемых солей.
[0025] Способность опухоли приобретать устойчивость к воздействию лекарственных агентов, которые ранее были токсичны для них, может привести к устойчивости. Такая приобретенная устойчивость может являться следствием хромосомного нарушения. Снижение проницаемости является распространенной формой врожденной устойчивости. Модификация или инактивация лекарственного агента является, возможно, наиболее распространенным механизмом устойчивости к лекарствам. Устойчивость к лекарственному агенту также являться следствием изменения сайта мишени, на который действует указанный агент. Ситуации, при которых расстройство, например, рак, обладает приобретенной устойчивостью к метотрексату, можно определить путем оценки лечащим врачом или другими специалистами, и включают ремиссию или стаз расстройства после лечения, с последующим прогрессированием заболевания спустя определенное время лечения. Отмечено, что при многих расстройствах, включая рак, указанные расстройства проявляют приобретенную устойчивость к лечению.
[0026] Таким образом, в еще одном варианте реализации настоящее изобретение относится к способу лечения заболеваний или злокачественных состояний, зависимых от фолатного пути, приобретших устойчивость к метотрексату во время лечения метотрексатом, включающему введение терапевтически эффективного количества композиции, которая содержит 10-пропаргил-10-деазааминоптерин или его фармацевтически приемлемые соли.
[0027] «Лечение» может означать применение терапевтических средств для предотвращения или ингибирования дальнейшего роста опухоли, а также уменьшения опухоли и обеспечения более длительного времени выживания. Подразумевается, что лечение включает предотвращение метастазирования опухоли. Опухоль «ингибируется» или «лечится», если по меньшей мере один симптом (согласно определению чувствительности/нечувствительности, времени до прогрессирования или показателей, известных в данной области техники и описанных в настоящем документе) рака или опухоли улучшается, прекращается, замедляется, снижается до минимального значения или предотвращается. Любое уменьшение выраженности любого симптома опухоли, физическое или иное, в результате лечения с использованием курса терапии (например, 10-пропаргил-10-деазааминоптерином), как описано в настоящем документе, входит в рамки настоящего изобретения. В общем случае термины «лечение» и «лечить», используемые в настоящем документе, означают "облегчить симптомы", "ликвидировать причину рака или воспалительного расстройства на временной или постоянной основе", "замедлить появление симптомов и/или прогрессирования расстройства" или "предотвратить заболевание" (то есть осуществлять профилактическое лечение). Субъект, получающий профилактическое лечение, в общем случае является млекопитающим, подверженным риску развития рака или воспалительного состояния вследствие, например, генетической предрасположенности, диеты, воздействия агентов, вызывающих расстройство, воздействия патогенных агентов и т.п.
[0028] В одном из вариантов реализации настоящего изобретения композиция, которую применяют в способах согласно настоящему изобретению, может содержать 10-пропаргил-10-деазааминоптерин, включая «высокоочищенный» 10-пропаргил-10-деазааминоптерин, и диастереоизомеры 10-пропаргил-10-деазааминоптерина. При использовании в настоящем описании и формуле изобретения, композиции, которые являются «высокоочищенными», содержат 10-пропаргил-10-деазааминоптерин, практически не содержат других производных фолиевой кислоты, в частности, 10-деазааминоптерина, который может мешать противоопухолевой активности 10-пропаргил-10-деазааминоптерина. Композиция согласно настоящему изобретению может содержать переносчики или вспомогательные вещества для получения состава 10-пропаргил-10-деазааминоптерина в виде подходящей дозируемой формы для терапевтического применения, а также дополнительные, не являющиеся фолатами, терапевтические агенты.
[0029] 10-пропаргил-10-деазааминоптерин содержит асимметричные центры при 10 атоме углерода (С10) и 19 атоме углерода (С19). В одном из вариантов реализации 10-пропаргил-10-деазааминоптерин включает рацемические смеси R- и S-конфигураций по хиральному центру С10 в соотношении приблизительно 1:1 и ≥98,0% S-диастереомера по хиральному центру С19. 10-пропаргил-10-деазааминоптерин включает С10-диастереомеры PDX-10a [S-конфигурация] с химическим названием: (25)-2-[[4-[(15)-1-[(2,4-диаминоптеридин-6-ил)метил]бут-3-инил]бензоил]амино]глутаровая кислота и PDX-10b [R-конфигурация] с химическим названием: (25)-2-[[4-[(1R)-1-[(2,4-диаминоптеридин-6-ил)метил]бут-3-инил]бензоил]амино]глутаровая кислота.
[0030] 10-пропаргил-10-деазааминоптерин можно синтезировать с помощью способа, описанного в Примере 7 из DeGraw et al., патента США №5354751, относящегося к производству 10-пропаргил-10-деазааминоптерина, полностью включенного в настоящий документ посредством ссылки. 10-пропаргил-10-деазааминоптерин также можно синтезировать с помощью способов, представленных в патенте США №6028071, особенно в примере 1, включенном в настоящий документ посредством ссылки.
[0031] Для получения диастереоизомеров 10-пропаргил-10-деазааминоптерина можно синтезировать 10-пропаргил-10-деазааминоптерин, согласно информации из настоящего описания и других источников, а затем использовать конечный продукт или более ранний промежуточный продукт в качестве исходного материала для разделения С10-диастереоизомеров. В качестве альтернативы можно использовать хиральный синтез, при котором напрямую получают практически чистый PDX-10а и/или PDX-10b из любого числа исходных материалов. Для разделения диастереоизомеров конечного 10-пропаргил-10-деазааминоптерина или более ранних промежуточных продуктов можно использовать хиральные колонки для разделения энантиомеров или диастереоизомеров, известные в данной области техники. Подходящие хиральные колонки для разделения диастереоизомеров включают хиральные колонки CHIRALPAK AD, доступные от Daicel Chemical Industries Ltd., Япония, использующие этанол в качестве подвижной фазы.
[0032] В некоторых вариантах реализации заболевание или расстройство, зависимое от фолатного пути, представляет собой рак. В других вариантах реализации заболевание или расстройство, зависимое от фолатного пути, представляет собой воспалительное расстройство. В некоторых вариантах реализации рак или воспалительное расстройство представляет собой расстройство, которое было первоначально чувствительно к метотрексату, по меньшей мере в некоторой степени, а затем приобрело устойчивость к метотрексату. Способы определения того, обладает ли заболевание или расстройство, зависимое от фолатного пути, присущей или приобретенной устойчивостью к метотрексату, могут быть выбраны специалистом и могут включать такие способы, как культивирование или выделение соответствующих клеток, например, опухолевых клеток, из организма пациента, и определение уровня экспрессии различных ферментов фолатного пути, ассоциированных с устойчивостью или чувствительностью к метотрексату. Еще один из таких способов заключается в определении и/или мониторинге реакции больного на лечение метотрексатом для выявления врожденной или приобретенной устойчивости. Соответствующие клетки можно генотипировать или фенотипировать, для определения относительной экспрессии маркеров, указывающих на устойчивость к метотрексату.
[0033] В одном из вариантов реализации фенотипический анализ для использования в настоящем изобретении включает получение эксплантата опухоли от пациента, культивирование фрагментов эксплантата, выращивание монослоя соответствующих клеток из эксплантата, воздействие кандидата в лекарство на монослой и оценку способности кандидата в лекарство модифицировать фенотип опухолевых клеток.
[0034] Анализ генотипа согласно настоящему изобретению осуществляют любым известным способом. Предпочтительный способ включает сравнение генотипа клеток, полученных от пациента, или его части с генотипами, заведомо ассоциированными с устойчивостью к лекарствам в целом или специфической устойчивостью по отношению к оцениваемому терапевтическому средству-кандидату. Например, наличие полиморфного варианта среди клеток пациента, заведомо или предположительно придающего устойчивость к терапевтическому средству-кандидату, могло бы исключить это средство из потенциальных терапевтических агентов против этих клеток. Генетические характеристики клеток пациента определяют с помощью способов, известных в данной области техники (например, секвенирования, полиморфизмов), изложенных ниже. Влияние генотипа пациента на устойчивость к лекарственному агенту можно определить путем обращения к генетическим базам данных или библиотекам, в которых перечислены известные мутации или полиморфизмы, связанные с устойчивостью.
[0035] Независимо от механизма действия, примеры мутаций в клетках, связанных с устойчивостью или приобретенной устойчивость к метотрексату, включают увеличение экспрессии мРНК и/или белка ДГФР по сравнению с чувствительными клетками или клетками до приобретения устойчивости, но не ограничиваются ими.
[0036] В некоторых вариантах реализации рак или воспалительное расстройство обладает приобретенной устойчивостью к метотрексату. Раковые заболевания, подлежащие лечению, включают, например, рак предстательной железы, рак молочной железы, меланому, рак легких и Т-клеточную лимфому. В случае Т-клеточной лимфомы существуют разнообразные состояния, подлежащие лечению с использованием диастереоизомеров согласно настоящему изобретению, и включающие: (а) лимфобластные лимфомы, при которых злокачественность возникает в примитивных лимфоидных предшественниках из тимуса; (b) неоплазии зрелых или периферических Т-клеток, включая Т-клеточный пролимфоцитарный лейкоз, Т-клеточный гранулярно-лимфоцитарный лейкоз, агрессивный-NK-клеточный лейкоз, кожную Т-клеточную лимфому (фунгоидный микоз/синдром Сезари), анапластическую крупноклеточную лимфому Т-клеточного типа, Т-клеточную лимфому энтеропатического типа, Т-клеточный лейкоз/лимфому взрослых, в том числе связанные с HTLV-1, и ангиоиммунобластную Т-клеточную лимфому и подкожную панникулитную Т-клеточную лимфому; и (с) периферические Т-клеточные лимфомы, которые первоначально затрагивают околокорковое вещество лимфоузлов и никогда не разрастаются до истинной фолликулярной структуры. Другие виды рака, подлежащие лечению, включают гематологические злокачественные заболевания, рак головы и шеи, рак желудочно-кишечного тракта, рак яичников и остеосаркому.
[0037] Термин «воспалительное расстройство», используемый в настоящем документе, относится к любому расстройству, вызванному воспалением, или расстройству, симптомы которого включают воспаление. Например, воспалительное расстройство, вызванное воспалением, может представлять собой септический шок, а воспалительное расстройство, симптомы которого включают воспаление, может представлять собой ревматоидный артрит. Воспалительные расстройства согласно настоящему изобретению включают сердечно-сосудистые заболевания, ревматоидный артрит, рассеянный склероз, болезнь Крона, воспалительные заболевания кишечника, системную красную волчанку, полимиозит, септический шок, реакцию "трансплантат против хозяина", астму, ринит, псориаз и экзему, но не ограничиваются ими. В одном из вариантов реализации воспалительное заболевание, подлежащее лечению, включает ревматоидный артрит и ювенильный ревматоидный артрит.
[0038] Термин "пациент" или "млекопитающее", используемый в данном документе, относится к любому животному, относящемуся к млекопитающим, включая человека, домашних и сельскохозяйственных животных, а также животных, содержащихся в зоопарках или домашних условиях, например, собак, лошадей, кошек, крупный рогатый скот и т.д. Предпочтительно, млекопитающее представляет собой человека.
[0039] 10-пропаргил-10-деазааминоптерин для применения в соответствии с настоящим изобретением, как правило, вводят пациенту согласно режиму дозирования, обеспечивающему наиболее эффективное лечение (с точки зрения как эффективности, так и безопасности), которому подвергают пациента, как известно в данной области техники. При осуществлении способа лечения согласно настоящему изобретению, 10-пропаргил-10-деазааминоптерин для применения при расстройстве, устойчивом к метотрексату, и/или раке, чувствительном к 10-пропаргил-10-деазааминоптерину в соответствии с настоящим изобретением, можно вводить любым эффективным способом, известным в данной области, например, пероральным, местным, внутривенным, внутрибрюшинным, внутримышечным, внутрисуставным, подкожным, интраназальным, внутриглазным, вагинальным, ректальным, внутричерепным или внутрикожным путем, в зависимости от типа рака, подвергаемого лечению, и медицинского заключения лечащего врача, основанного, например, на результатах опубликованных клинических исследований.
[0040] 10-пропаргил-10-деазааминоптерин для применения при расстройствах, устойчивых к метотрексату, и/или раке, чувствительном к 10-пропаргил-10-деазааминоптерину, в соответствии с настоящим изобретением можно составить в виде части фармацевтического препарата. Конкретная дозированная форма зависит от способа введения, но может включать таблетки, капсулы, жидкости для перорального применения и растворы для инъекций для перорального, внутривенного, внутримышечного, внутричерепного или внутрибрюшинного введения и т.п. Дозировку можно выразить в мг/м2. В качестве альтернативы, дозировку можно выразить в мг/кг массы тела любым образом, приемлемым для специалиста. Один из способов получения эквивалентной дозировки в мг/кг массы тела включает применение коэффициента пересчета, принимающего для среднего человека дозировку 0,025 мг/кг как приблизительно эквивалентную 1 мг/м2. Согласно этому расчету, дозировка 150 мг/м2 приблизительно равна 3,75 мг/кг.
[0041] Соответствующие дозировки в онкологии для лечения расстройства, устойчивого к метотрексату, и/или рака, чувствительного к 10-пропаргил-10-деазааминоптерину, включает следующие режимы дозирования. В одном из вариантов реализации эти дозировки предназначены для внутривенного введения. Например, подходящими являются дозы порядка 10-120 мг/м2 площади поверхности тела/сут (приблизительно 0,25-3 мг/кг массы тела в сутки). Кроме того, подходящими являются дозировки 30 мг/м2 (приблизительно 0,75 мг/кг) раз в неделю в течение 3 недель, затем одна неделя отдыха, 30 мг/м2 (приблизительно 0,75 мг/кг) раз в неделю ×6 недель, затем одна неделя отдыха, или постепенно возрастающие дозировки 10-пропаргил-10-деазааминоптерина в соответствии с графиком раз в неделю ×6-недель. По мере необходимости можно использовать более низкие дозировки, основываясь на переносимости пациентом и типе злокачественного заболевания. При менее частом введении можно использовать повышенные дозировки. Таким образом, в общем смысле, дозировки от 10 до 275 мг/м2 (приблизительно 0,25-6,9 мг/кг) подходят для применения с различными графиками дозирования, например, приблизительно от 100 до 275 мг/м2 (приблизительно 2,5-6,87 мг/кг) для дозирования раз в две недели, и приблизительно от 10 до 150 мг/м2 (приблизительно 0,25-3,75 мг/кг), или, конкретнее, приблизительно 10-60 мг/м2 для дозирования раз в неделю.
[0042] Определение подходящей дозировки с использованием протоколов, аналогичных описанным в патенте США №6323205, входит в рамки настоящего изобретения. В одном из вариантов реализации 10-пропаргил-10-деазааминоптерин для применения при расстройстве, устойчивом к метотрексату, и/или раке, чувствительном к 10-пропаргил-10-деазааминоптерину, в соответствии с настоящим изобретением можно вводить в количестве от приблизительно 10 до приблизительно 275 мг/м2 (от приблизительно 0,25 до приблизительно 6,87 мг/кг) на дозу. Способы согласно настоящему изобретению также включают введение 10-пропаргил-10-деазааминоптерина для применения при расстройстве, устойчивом к метотрексату, и/или раке, чувствительном к 10-пропаргил-10-деазааминоптерину, в соответствии с настоящим изобретением еженедельно; в дозе приблизительно 10 мг/м2 (0,25 мг/кг) или 30 мг/м2 (0,75 мг/кг), в количестве от приблизительно 10 до приблизительно 150 мг/м2 (приблизительно 0,25-3,75 мг/кг) на дозу; раз в две недели; и в дозировке приблизительно 100-275 мг/м2 (приблизительно 2,5-6,9 мг/кг). В одном из вариантов реализации 10-пропаргил-10-деазааминоптерин для применения при расстройстве, устойчивом к метотрексату, и/или раке, чувствительном к 10-пропаргил-10-деазааминоптерину, в соответствии с настоящим изобретением можно вводить в количестве между приблизительно 0,25 мг/кг и приблизительно 4 мг/кг, между приблизительно 0,75 мг/кг и приблизительно 3 мг/кг, в количестве между приблизительно 1,0 мг/кг и приблизительно 2,5 мг/кг, в количестве приблизительно 0,25 мг/кг или приблизительно 0,75 мг/кг (или эквивалентном количестве в пересчете на площадь поверхности тела (ППТ)).
[0043] 10-пропаргил-10-деазааминоптерин можно применять в комбинации с другими цитотоксическими и противоопухолевыми соединениями, включая алкалоиды барвинка, например, винбластин, навелбин и виндезин, аналоги нуклеотидов, например, гемцитабин, 5-фторурацил и цитарабин; алкилирующие агенты, например, циклофосфамид или ифосфамид; цисплатин или карбоплатин; лейковорин; таксаны, например, паклитаксел или доцетаксел; моноклональные антитела против CD20, с радиоизотопами или без них, и антибиотики, например, доксорубицин и митомицин.
Кроме того, можно применять комбинации 10-пропаргил-10-деазааминоптерина с несколькими из этих других противоопухолевых агентов или ингибиторами факторов роста и антиангиогенными агентами.
[0044] 10-пропаргил-10-деазааминоптерин и другие агенты можно одновременно вводить или применять в комбинации как часть общего курса лечения, согласно которому 10-пропаргил-10-деазааминоптерин и другой(ие) агент(ы) вводят в разное время. Например, другой агент можно ввести раньше, непосредственно после или через определенный период времени (например, 24 часа) по сравнению с введением 10-пропаргил-10-деазааминоптерина. Таким образом, для целей настоящей заявки термин введение обычно относится к одновременному введению или последовательному введению лекарственных агентов и в любом порядке в соответствии с курсом параллельного лечения с разделением или без разделения препаратов во времени, если не указано иное.
[0045] Для лечения воспалительного расстройства 10-пропаргил-10-деазааминоптерин можно вводить пероральным, внутримышечным, внутривенным, внутриартериальным или интратекальным путем. Специалисты могут использовать другие пути введения. Для лечения воспалительного расстройства, включающего, без ограничений, псориаз, ревматоидный артрит и/или ювенильный ревматоидный артрит, дозировка может включать следующее. Способы согласно настоящему изобретению при ревматоидном артрите взрослых или ювенильном ревматоидном полиартрите включают пероральное введение от приблизительно 1 до приблизительно 30 мг раз в неделю; в одном из вариантов вводили приблизительно 7,5 мг раз в неделю. Другие дозировки могут включать 10 мг/м2 раз в неделю. Дозировки можно постепенно корректировать для достижения оптимального ответа. При более высоких дозировках, например, свыше 20 мг/м2/нед, или от 0,65 до 1,0 мг/кг/нед, лучшее всасывание может достигаться за счет внутримышечного или подкожного введения. Соответствующая дозировка также может включать 7,5 мг в неделю, или разделенные пероральные дозы от приблизительно 0,5 до приблизительно 10 мг; в одном из вариантов реализации доза может представлять собой пероральную дозу, разделенную на три дозы по 2,5 мг через 12-часовые интервалы в качестве еженедельного курса. Дозирование можно продолжать, пока терапия является эффективной, включая терапию в течение до двух лет и более.
[0046] 10-пропаргил-10-деазааминоптерин целесообразно применять в комбинации с добавлением фолиевой кислоты и витамина В12 для уменьшения побочных эффектов лечения. Например, пациентов можно лечить фолиевой кислотой (1 мг/м2 ежедневно, начиная с 1 недели до начала лечения 10-пропаргил-10-деазааминоптерином или, в качестве альтернативы, 1 мг периорально (п/о) ежедневно, не основываясь на площади поверхности тела (ППТ)) и В12 (1 мг/м2 ежемесячно, или, в качестве альтернативы, внутримышечно (в/м) каждые 8-10 недель по 1 мг (не основываясь на ППТ), или, в качестве альтернативы, п/о 1 мг ежедневно (не основываясь на ППТ)).
[0047] В одном из вариантов реализации 10-пропаргил-10-деазааминоптерин в соответствии с настоящим изобретением составляют для перорального введения. В еще одном варианте реализации 10-пропаргил-10-деазааминоптерин в соответствии с изобретением составляют для внутривенного введения.
[0048] 10-пропаргил-10-деазааминоптерин можно вводить в виде широкого спектра различных дозированных форм. Например, 10-пропаргил-10-деазааминоптерин в предпочтительном случае можно вводить перорально или парентерально.
[0049] 10-пропаргил-10-деазааминоптерин можно вводить с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, драже, пастилок, леденцов, порошков, спреев, кремов, бальзамов, суппозиториев, желе, гелей, паст, лосьонов, мазей, эликсиров, сиропов и т.п. Введение таких дозированных форм можно осуществлять в виде однократной или нескольких доз. Носители включают твердые разбавители или наполнители, стерильные водные среды и различные нетоксичные органические растворители и другие носители. Фармацевтические композиции для перорального применения можно соответствующим образом подсластить и/или ароматизировать. Для перорального введения 10-пропаргил-10-деазааминоптерина таблетки, содержащие одно или оба активные вещества в сочетании с любым из различных вспомогательных веществ, например микрокристаллической целлюлозой, цитратом натрия, карбонатом кальция, фосфатом кальция и глицином, а также различными разрыхлителями, например крахмалом (предпочтительно кукурузным, картофельным или крахмалом тапиоки), альгиновой кислотой и некоторыми комплексными силикатами, вместе с такими связующими для грануляции, как поливинилпирролидон, сахароза, желатин и гуммиарабик. Кроме того, очень часто для целей таблетирования используют смазывающие агенты, например стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа также можно применять в качестве наполнителей в желатиновых капсулах; предпочтительные материалы в этой связи также включают лактозу, или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Если для перорального введения желательны водные суспензии и/или эликсиры, 10-пропаргил-10-деазааминоптерин можно объединять с различными подсластителями или вкусоароматическими добавками, пигментами и красителями и, при желании, эмульгирующими и/или суспендирующими агентами, а также с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и их различные комбинации. Таблетку, содержащую композицию согласно настоящему изобретению, можно изготовить путем прессования или формования, необязательно, с одним или более вспомогательных ингредиентов или адъювантов. Прессованные таблетки можно получить прессованием в соответствующем аппарате активного ингредиента в сыпучей форме, например, в виде порошка или гранул, необязательно смешанных со связующим, скользящим веществом, инертным разбавителем, поверхностно-активным или диспергирующим агентом. Формованные таблетки можно получить формованием в соответствующем аппарате порошкообразного соединения, увлажненного инертным жидким разбавителем. Каждая таблетка предпочтительно содержит от приблизительно 0,05 мг до приблизительно 10 г активного ингредиента, и каждая облатка или капсула предпочтительно содержит от приблизительно 0,05 мг до приблизительно 10 г активного ингредиента; таблетки могут также содержать приблизительно 2,5 мг активного ингредиента на таблетку или приблизительно 7,5 мг на таблетку.
[0050] Для парентерального введения 10-пропаргил-10-деазааминоптерина можно применять растворы, а также стерильные водные растворы, содержащие активное вещество или его соответствующие водорастворимые соли. Такие стерильные водные растворы предпочтительно являются забуференными, а также предпочтительно являются изотоническими, например, с помощью физиологического раствора или глюкозы достаточной концентрации. Именно эти водные растворы особенно подходят для внутривенных, внутримышечных, подкожных и внутрибрюшинных инъекций. Масляные растворы подходят для внутрисуставных, внутримышечных и подкожных инъекций. Изготовление всех этих растворов в стерильных условиях легко осуществляется с помощью стандартных фармацевтических методик, хорошо известных специалистам.
[0051] Для ветеринарных целей активные вещества можно вводить животным по отдельности или вместе, используя любую из форм и любой из путей, описанных выше. В предпочтительном варианте реализации 10-пропаргил-10-деазааминоптерин вводят в виде капсулы, болюса, таблетки, жидкого вливания, путем инъекции или в качестве имплантата. В качестве альтернативы 10-пропаргил-10-деазааминоптерин можно вводить с кормом для животных, и для этой цели можно изготовить концентрированную кормовую добавку или премикс для нормального корма для животных. Такие составы готовят обычным способом в соответствии со стандартной ветеринарной практикой.
[0052] Настоящее изобретение также включает способ лечения субъекта, нуждающегося в лечении неоплазии, устойчивой к метотрексату, причем указанный способ включает введение указанному субъекту эффективного количества 10-пропаргил-10-деазааминоптерина и его фармацевтически приемлемых солей.
[0053] Термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований или кислот. Если соединение по настоящему изобретению является кислым, его соответствующую соль можно легко получить из фармацевтически приемлемых нетоксичных оснований, включая неорганические основания и органические основания. Соли, полученные из таких неорганических оснований, включают соли алюминия, аммония, кальция, меди (II и I), железа (III), железа (II), лития, магния, марганца (III и II), калия, натрия, цинка и т.п. Особенно предпочтительными являются соли аммония, кальция, магния, калия и натрия. В одном из вариантов реализации указанная соль представляет собой гидрохлорид. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, также включают соли первичных, вторичных и третичных аминов, а также циклических аминов и замещенных аминов, например, естественных и синтезированных замещенных аминов. Другие фармацевтически приемлемые органические нетоксичные основания, из которых можно образовать соль, включают ионообменные смолы, например, аргинин, бетаин, кофеин, холин, N',N-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и т.п.
[0054] В дополнение к обычным лекарственным формам, изложенным выше, 10-пропаргил-10-деазааминоптерин (включая фармацевтически приемлемые соли, сложные эфиры, сольваты и полиморфные формы каждого его компонента) можно также вводить с помощью средств контролируемого высвобождения и/или устройств доставки.
[0055] Если не указано иное, все числа, выражающие количества ингредиентов, размеры, условия реакции и т.д., используемые в описании и формуле изобретения, во всех случаях следует понимать как модифицированные термином «приблизительно».
[0056] В настоящей заявке и формуле изобретения использование единственного числа включает множественное число, если иное не указано недвусмысленным образом. Кроме того, использование "или" означает "и/или", если не указано иное. Кроме того, использование термина "включая", а также других форм, таких, как "включает" и "включал", не является ограничивающим. Кроме того, такие термины, как "элемент" или "компонент" охватывают как элементы и компоненты, содержащие один блок, так и элементы и компоненты, которые включают более чем одну единицу, если иное не указано недвусмысленным образом.
[0057] Настоящее изобретение частично основано на данных, свидетельствующих о том, что клетки с приобретенной устойчивостью к метотрексату сохраняют чувствительность к пралатрексату, в то время как клетки, которые приобрели устойчивость к пралатрексату, также приобрели устойчивость к метотрексату. С учетом прогнозируемых генетических факторов чувствительности к пралатрексату, разработали две клеточные линии с приобретенной устойчивостью к этому препарату из линий раковых клеток DU145 (предстательной железы) и Нер2 (головы и шеи). Обладая более чем 200-кратной устойчивостью к пралатрексату, чем исходные клетки, DU-PDX и HEP-PDX демонстрировали частичную перекрестную устойчивость к метотрексату. Приобретенная устойчивость к пралатрексату была ассоциирована со сниженной экспрессией RFC-1 и повышенной экспрессией MDR1. Fotoohi et al (2009) описали антифолат-устойчивые линии лейкоза с более чем двукратно пониженным уровнем мРНК RFC-1 в клетках, устойчивых к метотрексату, что подчеркивает важную роль входящего транспорта в устойчивости к антифолатам. Аналогичные данные были получены ранее в работах Jansen (1998), Rothen (2004) и Ifergan (2003) при использовании других моделей клеток, устойчивых к метотрексату. Повышенная экспрессия MDR1, по-видимому, не играет роли в наблюдаемой приобретенной устойчивости к пралатрексату, поскольку ингибирование MDR1 не восстанавливает чувствительности к пралатрексату. Показано, что пониженная активность FPGS ассоциирована с приобретенной устойчивостью к метотрексату в клетках лейкоза человека CCRF-CEM (Mauritz, 2002). В одном из исследований, в клетках, устойчивых к пралатрексату, наблюдали небольшое снижение экспрессии FPGS, что указывает на роль конъюгирования с полиглутаматом при устойчивости к пралатрексату. В ходе исследований, проведенных три десятилетия назад, обнаружили, что еще одним частым механизмом приобретенной устойчивости к метотрексату является амплификация гена ДГФР и, как следствие, избыточная экспрессия фермента (обзор Assaraf 2007; Chen et al, 1995). В данном исследовании линия клеток НЕР-МТХ с приобретенной устойчивостью к метотрексату демонстрировала резкое увеличение экспрессии мРНК и белка ДГФР по сравнению с исходной эквивалентной линией. В линиях клеток, устойчивых к пралатрексату, не наблюдали повышенной экспрессии DHFR. Эти данные указывают на различные молекулярные механизмы устойчивости к метотрексату и пралатрексату в этих линиях клеток.
[0058] Таким образом, настоящее изобретение показывает, что, как ни странно, линии клеток, которые стали устойчивыми к метотрексату, не стали устойчивыми к пралатрексату и/или сохранили значительно большую степень исходной чувствительности к пралатрексату.
[0059] Дополнительные цели, преимущества и новые признаки настоящего изобретения станут очевидны для специалистов при рассмотрении следующих примеров, которые не следует рассматривать как ограничивающие. Кроме того, каждый из различных вариантов реализации и аспектов настоящего изобретения, как описано выше и указано в формуле изобретения, находит экспериментальное подтверждение в следующих примерах.
ПРИМЕРЫ
[0060] Следующие примеры приведены только для иллюстративных целей и не
предназначены для ограничения рамок изобретения.
Пример 1:
[0061] На Фиг.1 показана схема синтеза, которую можно использовать при получении 10-пропаргил-10-деазааминоптерина. Смесь 60% NaH в масляной дисперсии (1,06 г, 26,5 ммоль) в 18 мл высушенного просеиванием ТГФ охлаждали до 0°С. Холодную смесь обрабатывали раствором диметилового эфира гомотерефталевой кислоты (5,0 г, 24 ммоль, соединение 1 на Фиг.1) в безводном ТГФ (7 мл) и перемешивали смесь в течение 1 часа при температуре 0°С. Вносили пропаргилбромид (26,4 ммоль) и перемешивали смесь при 0°С в течение еще 1 часа, а затем при комнатной температуре в течение 16 часов. Полученную смесь обрабатывали 2,4 мл 50% уксусной кислоты, а затем выливали в 240 мл воды. Смесь экстрагировали эфиром (2×150 мл). Эфирные экстракты объединяли, высушивали над Na2SO4 и концентрировали до оранжево-желтого масла. За счет хроматографии на силикагеле (600 мл, 230-400 меш) с элюированием циклогексан-EtOAc (8:1) получали продукт диметиловый эфир α-пропаргилгомотерефталевой кислоты (соединение 2) в виде белого твердого вещества (4,66), который, согласно ТСХ (циклогексан-EtOAc, 3:1), был однородным. В то же время данные масс-спектрометрии этого продукта показали, что он представлял собой смесь желаемого продукта 2 и дипропаргилированного соединения. Исходный материал 1 не обнаружили. ВЭЖХ показала, что соотношение моно- и дипропаргилированных продуктов составляло приблизительно 3:1. Так как дипропаргилированный продукт, в отличие от соединения 1, не мог образовывать нежелательного побочного продукта на следующем этапе реакции, этот материал являлся подходящим для преобразования в соединение 3. Отсутствие исходного соединения 1 в продукте, используемом для продолжения синтеза, было очень важно для предотвращения последующего образования 10-dAM во время преобразований, ведущих к образованию конечного продукта, поскольку полное удаление 10-dAM из 10-пропаргил-10-деазааминоптерина представляет очень сложную задачу.
[0062] Смесь формировали путем объединения 0,36 г 60% NaH (9 ммоль) в масляной дисперсии с 10 мл безводного ДМФ и охлаждали до 0-5°С. Холодную смесь обрабатывали, внося по каплям раствор продукта первой реакции (соединение 2) (2.94 г, 12 ммоль) в 10 мл безводного ДМФ и перемешивали при 0°С в течение 30 минут. После охлаждения до -25°С по каплям вносили раствор 2,4-диамино-6-(бромметил)-птеридингидробромид-0.2 2-пропанола (1.00 г, 2.9 ммоль) в 10 мл безводного ДМФ, поддерживая температуру около -25°С. Температуре перемешиваемой смеси позволяли подняться до -10°С в течение 2 часов. Спустя дополнительные 2 часа при -10°С температуре позволяли подняться до 20°С, перемешивание продолжали при комнатной температуре в течение еще 2 часов. рН реакционной смеси доводили до 7 путем добавления твердого СО2. После концентрирования в вакууме для удаления растворителя остаток перемешивали с диэтиловым эфиром, нерастворимый в эфире материал собирали, промывали водой и высушивали в вакууме, получая 1,49 г неочищенного продукта. Этот неочищенный продукт растворяли в CHCl2-МеОН (10:1) для нанесения на колонку с силикагелем. Элюирование этой же системой растворителей позволяло получить метиловый эфир 10-пропаргил-10-карбометокси-4-дезокси-4-амино-10-деазаптериновой кислоты (соединение 3), который являлся однородным согласно ТСХ, с 40% выходом (485 мг).
[0063] Перемешиваемую суспензию соединения 3 (400 мг, 0,95 ммоль) в 2-метоксиэтаноле (5 мл) обрабатывали водой (5 мл), а затем 10% раствором гидроксида натрия (3,9 мл). Смесь перемешивали при комнатной температуре в течение 4 часов, в течение которых образовывался раствор. Раствор доводили до рН 8 уксусной кислотой и концентрировали в глубоком вакууме. Полученный остаток растворяли в 15 мл воды и подкисляли до рН 5.5-5.8, что приводило к образованию осадка. Осадок собирали, промывали водой и высушивали в вакууме, восстанавливая 340 мг соединения 4 (91% выход). ВЭЖХ-анализ показал 90% чистоту продукта.
[0064] Соединение 4 (330 мг) декарбоксилировали путем нагревания в 15 мл ДМСО при 115-120°С в течение 10 минут. Проверка с помощью HPLC через 10 минут подтвердила, что преобразование было практически полным. ДМСО удаляли дистилляцией в вакууме (на бане при 40°С). Остаток перемешивали с 0,5 н. NaOH, получая прозрачный раствор. Подкисление до рН 5,0 1 н. HCl позволяло получить 10 пропаргил-4-дезокси-4-амино-10-деазаптериновую кислоту (соединение 5) в виде желтого твердого вещества с 70% выходом. ВЭЖХ показала 90% чистоту продукта на данном этапе.
[0065] Соединение 5 (225 мг, 0,65 ммоль) связывали с диметил-L-
глутаматгидрохлоридом (137 мг, 0,65 ммоль) с помощью ВОР-реагента (бензотриазол-1-илокситрис(диметиламино)фосфонийгексафторфосфата (287 мг, 0,65 ммоль, Aldrich Chemical Со.) в ДМФ (10 мл), содержащем триэтиламин (148 мг, 1,46 ммоль). Смесь перемешивали в течение 3 часов при 20-25°С, а затем выпаривали досуха. Остаток перемешивали с водой, нерастворимый в воде неочищенный продукт собирали и высушивали в вакууме. Неочищенный продукт (350 мг) очищали хромотографией на силикагеле с элюированием CHCl3-МеОН (10:1), содержащим триэтиламин (0,25% по объему), восстанавливая 165 мг диметилового эфира 10-пропаргил-10-деазааминоптерина (соединение 6, 50% выход), который был однородным согласно ТСХ (CHCl3-МеОН (5:1). [0066] Соединение 6 (165 мг, 0,326 ммоль) суспендировали в 10 мл перемешиваемого МеОН, к которому добавляли 0.72 мл (0.72 мг-экв) 1 н. NaOH. Перемешивание при комнатной температуре продолжали до образования раствора через несколько часов. Раствор хранили при 20-25°С в течение 8 часов, затем разбавляли 10 мл воды. Выпариванием при пониженном давлении удаляли метанол, а концентрированный водный раствор оставляли при 20-25°С в течение еще 24 часов. Затем ВЭЖХ показала, что гидролиз эфира был завершен. Прозрачный водный раствор подкисляли уксусной кислотой до рН 4.0, осаждая 10-пропаргил-10-деазааминоптерин в виде бледно-желтого твердого вещества. Масса собранного, промытого водой и высушенного в вакууме продукта составила 122 мг (79% выход). Элементный анализ, протонный ЯМР и масс-спектроскопия полностью согласовывались с назначенной структурой. ВЭЖХ анализ показал 98% чистоту и позволил установить, что продукт не содержал 10-деазааминоптерина.
В этом случае количество 10-пропаргил-10-деазааминоптерина (определенное по площади ВЭЖХ-пика) приближалось к 98%, а пик, соответствующий 10-деазааминоптерину, не определялся обрабатывающим программным обеспечением, хотя в этой области имели место небольшие пульсации фона.
Пример 2:
[0067] Для изучения активности 10-пропаргил-10-деазааминоптерина по
отношению к различным типам солидных опухолей исследовали чувствительность 15 линий клеток солидных опухолей человека к цитотоксической активности 10-пропаргил-10-деазааминоптерина.
[0068] Материалы и методики: Линии клеток
[0069] Панель линий клеток рака ободочной кишки (НТ29, НСТ116, COLO205, НСС2998), молочной железы (MCF7, MDA-MB-435), легких (НОР62, НОР92), яичников (OVCAR3, IGROV1), предстательной железы (DU145, РС3) и головы и шеи (SCC61, НЕР2, SQ20B) человека приобрели в коллекциях АТСС (Роквилл, штат Мэриленд, США) и Национального института рака (National Cancer Institute). Клетки выращивали в виде монослоя в среде RPMI, дополненной 10% эмбриональной телячьей сыворотки, 2 мм глутамина, 100 ед мл-1 пенициллина и 100 мкМ мл-1 стрептомицина.
[0070] Анализы цитотоксичности клеток
[0071] Все полученные данные представляли собой результат трех отдельных экспериментов, выполненных в двух повторениях. Жизнеспособность клеток определяли с помощью МТТ-анализа, который выполняли, как описано ранее (Hansen, 1989). Вкратце, клетки сеяли на 96-луночные планшеты при плотности 2×103 клеток на лунку. Клетки инкубировали в течение 120 часов, а затем добавляли 0,4 мг мл-1 красителя МТТ (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолийбромида) на 4 часа при 37°С. Монослой суспендировали в 0,1 мл ДМСО и измеряли поглощение при 560 нм с помощью считывающего устройства для микропланшетов. Положительные и отрицательные контроли включали лунки с необработанными клетками или носитель, содержащий МТТ без клеток, соответственно. Преобразование желтого водорастворимого тетразолиевого МТТ в фиолетовый нерастворимый формазан катализировалось митохондриальными дегидрогеназами и использовалось для оценки числа жизнеспособных клеток. Контрольное значение, соответствующее необработанным клеткам, принимали как 100%, и жизнеспособность обработанных образцов выражали в процентах от контроля. Значения IC50 определяли как концентрации, сокращавшие жизнеспособность клеток на 50%. [0072] Для исследований одиночных агентов клетки сеяли и позволяли колонизировать лунки за 24 часа до начала обработки возрастающими концентрациями 10-пропаргил-10-деазааминоптерина в течение 72 ч. После инкубирования клеткам позволяли восстановиться в среде, не содержавшей соединения, в течение 48 ч, после чего определяли ингибирование роста, используя МТТ-анализ.
[0073] Вестерн-блоттинг.
[0074] Клетки лизировали в буфере, содержащем 50 мм HEPES (рН 7.6), 150 мм NaCl, 1% тритона Х-100, 2 мМ ванадата натрия, 100 мм NaF и 0,4 mg.ml-1 фенилметилсульфонилфторида. Равные количества белка (20-50 мкг/дорожку) подвергали электрофорезу в ДСН-ПААГ и переносили на нитроцеллюлозные мембраны. Мембраны обрабатывали зондами, используя специфические первичные антитела против расщепленной PARP, расщепленной каспазы 3, каспазы 9 (Cell Signaling, Сен-Кантен Ивелин, Франция), ДГФР (Abcam, Франция), β-актина (Sigma-Aldrich, Сен-Кантен Фаллавье, Франция), а затем вторичные антитела, конъюгированные с пероксидазой, и визуализацию за счет хемилюминесценции.
[0075] На Фигуре 2 показана относительная чувствительность 15
протестированных линий раковых клеток человека к 10-пропаргил-10-деазааминоптерину. Обнаружено, что девять из этих линий клеток были чувствительны к цитотоксической активности 10-пропаргил-10-деазааминоптерина (IC50<0.1 мкМ), в то время как 6 из этих линий клеток были относительно устойчивы (IC50>9 мкМ).
[0076] Антипролиферативное действие одиночного агента
[0077] Антипролиферативное действие пралатрексата оценивали на 15 линиях раковых клеток, как показано в Таблице 1. Эксперименты по определению зависимости от времени показали, что оптимальное антипролиферативное действие достигалось при воздействии пралатрексата на клетки в течение 72 ч (Фигура 1А). IC50 пралатрексата находились в диапазоне от 0.0110.002 мкМ для линии клеток рака предстательной железы РС3 до >350 мкМ для линии клеток MDA-MB-435. Примечательно, что наблюдали две группы клеточных линий с более чем 100-кратным различием в IC50: одна группа, включавшая клетки РС3, SCC61, DU145, НТ29, НОР62, SQ20B, НОР92, НЕР2 и IGROV1, демонстрировавшие IC50<0.1 мкМ, в то время как клетки Colo205, НСС2998, MCF7, НСТ116, OVCAR3 и MDA-MB-435 демонстрировали значения IC50>9 мкМ.
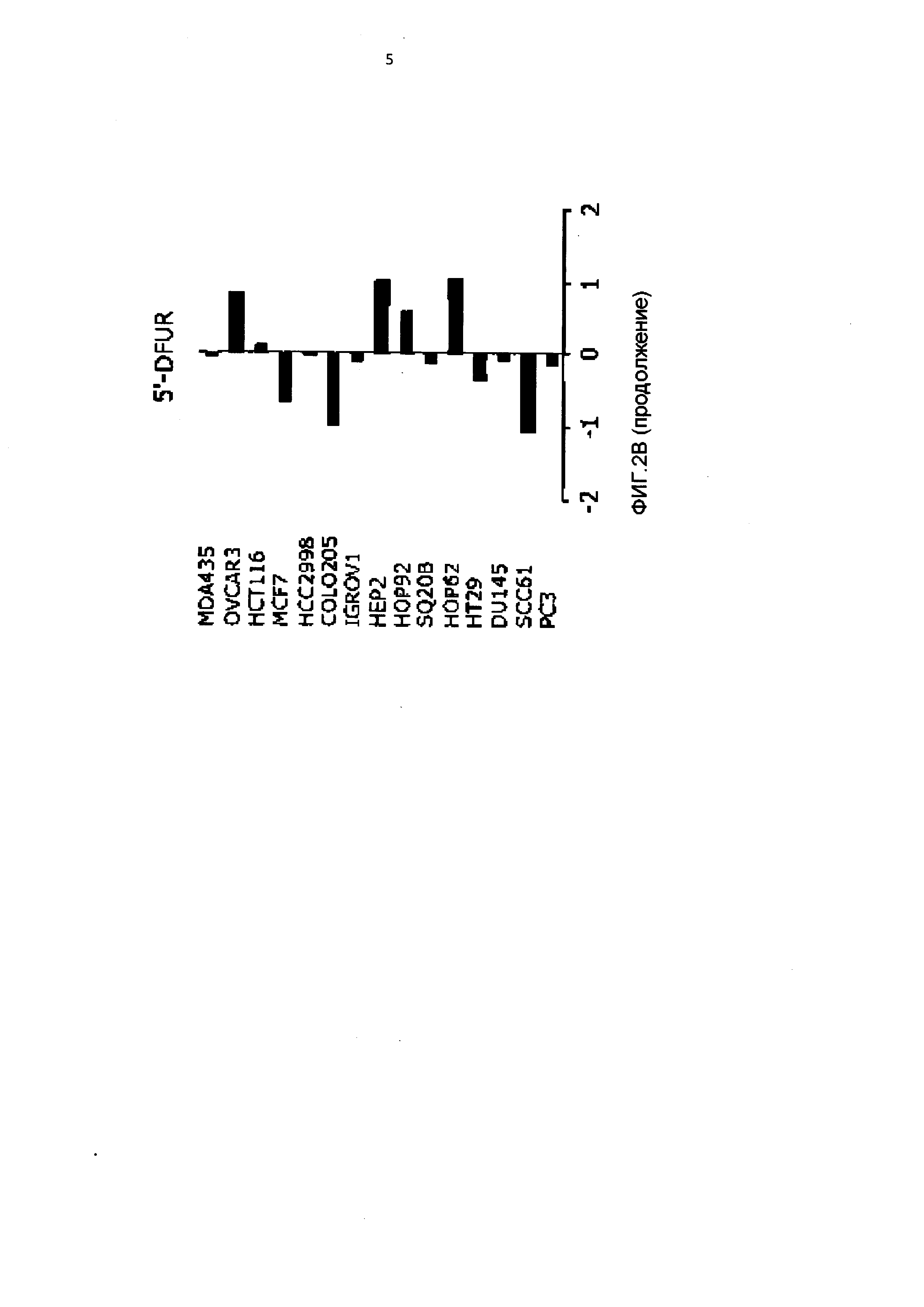
[0078] Антипролиферативное действие пралатрексата сравнивали с аналогичным действием метотрексата и нескольких широко используемых антиметаболитов, например, пеметрекседа, 5-FU и 5'-DFUR, активного метаболита капецитабина (Фигура 1 В и Таблица 1). IC50 пралатрексата были в среднем почти в 10 раз ниже, чем аналогичные значения для метотрексата. Профили цитотоксичности этих двух антифолатов были аналогичны и характеризовались одними и теми же четко различающимися группами чувствительных и устойчивых линий клеток. Профиль цитотоксичности пралатрексата отличался от профилей 5-FU, 5'-DFUR и пеметрекседа, что указывало на различия в метаболизме, механизме действия и/или устойчивости пралатрексата и других указанных антиметаболитов. Примечательно, что между пралатрексатом и пеметрекседом, антифолатом, считающимся главным образом ингибитором тимидилатсинтетазы (TS), наблюдалась ограниченная перекрестная чувствительность.
[0079] Экспрессия генов, участвующих в транспорте и метаболизме фолата [0080] Экспрессию генов, заведомо вовлеченных в механизмы чувствительности к антифолатам, анализировали с использованием панели линий раковых клеток. Экспрессию мРНК ДГФР, FPGS, TS/TYMS (тимидилатсинтетазы), SCL19A1/RFC-1, GARFT (глицинамидрибонуклеотидформилтрансферазы), SLC25A32 (митохондриального переносчика фолата) и ABC переносчика B1 (АВСВ1 или MDR1) определяли с помощью количественной ПЦР с обратной транскриптазой (Фигура 3а). Линии клеток экспрессировали различные уровни этих генов фолатного пути, однако существенной корреляции между чувствительностью к пралатрексату и экспрессией мРНК TS, SCL19A1/RFC-1, GARFT, SLC25A32 и MDR1 не обнаружено. Клетки, чувствительные к пралатрексату, экспрессировали относительно более высокий уровень ДГФР, мишени пралатрексата, чем клетки «устойчивой» группы, но этот показатель не достигал статистической значимости (р=0,083, Фигура 3А). Клетки, чувствительные к пралатрексату, экспрессировали значимо более высокий уровень мРНК FPGS, чем устойчивые клетки (t-тест, р=0,002). В целом, обнаружена тенденция к положительной корреляции между экспрессией мРНК FPGS и чувствительностью к пралатрексату (IC50s) (R2=0.47, р<0.01), что указывало на важную роль конъюгирования с полиглутаматом для антипролиферативной активности пралатрексата.
[0081] Для определения потенциальной роли переносчиков фолиевой кислоты для активности пралатрексата, авторы выполнили оценку корреляции значений IC50, полученных после воздействия лекарственного агента в течение 72 ч, с уровнем экспрессии мРНК SCL19A1/RFC-1 и SLC25A32 в девяти линиях клеток, чувствительных к пралатрексату (Фигура 3В). Клетки, экспрессировавшие высокий уровень мРНК SCL19A1/RFC-1 и SLC25A32, демонстрировали повышенную чувствительность к пралатрексату, что указывало на потенциальную роль SCL19A1/RFC-1 и SLC25A32 в поглощении пралатрексата клетками.
|
Пример 3:
[0084] Разработка линий клеток, устойчивых к 10-пропаргил-10-деазааминоптерину и метотрексату.
[0085] Для исследования характеристик прогнозируемых факторов антипролиферативного действия 10-пропаргил-10-деазааминоптерина на основе исходных клеток DU145 и НЕР2 разработали линии клеток DU-PDX и HEP-PDX, соответственно, путем воздействия поэтапно увеличивающихся концентраций 10-пропаргил-10-деазааминоптерина в течение 6 месяцев. Полученные клетки DU-PDX и HEP-PDX обладали по меньшей мере в 200 и 500 раз меньшей чувствительностью к 10-пропаргил-10-деазааминоптерину, чем исходные клетки. После 5 пересевов на среде, не содержавшей лекарственного агента, устойчивые клетки сохраняли свою устойчивость к лекарственному агенту, что указывало на стабильность этих линий клеток.
[0086] Для сравнения механизмов устойчивости к 10-пропаргил-10-деазааминоптерину и метотрексату, на основе исходных клеток DU145 и НЕР2 разработали линии клеток DU-MTX и НЕР-МТХ путем воздействия поэтапно увеличивающихся концентраций метотрексата. DU-MTX и НЕР-МТХ демонстрировали устойчивость к метотрексату и 10-пропаргил-10-деазааминоптерину по сравнению с исходными клетками. В то же время активность 10-пропаргил-10-деазааминоптерина по-прежнему оставалась выше (примерно 10-кратно более низкие IC50) активности метотрексата в раковых клетках DU-MTX и НЕР-МТХ.
[0087] На Фигуре 3 показаны IC50 для 10-пропаргил-10-деазааминоптерина или метотрексата для клеток DU145 и DU145, адаптированных к 10-пропаргил-10-деазааминоптерину или метотрексату. Эти данные показывают, что по отношению к DU-MTX 10-пропаргил-10-деазааминоптерин сохранял значительную эффективность; IC50 для 10-пропаргил-10-деазааминоптерина для линии клеток DU-145, адаптированных к метотрексату, составила 0,02 мкМ. По сравнению с этим, IC50 10-пропаргил-10-деазааминоптерина для интактных клеток DU-145 составляла 0,01 мкМ. Клетки DU-145, адаптированные к метотрексату, демонстрировали приблизительно 10-кратное увеличение IC50 метотрексата. В целом, клетки DU-145, адаптированные к 10-пропаргил-10-деазааминоптерин, также стали нечувствительны к метотрексату, в то время как клетки DU-145, адаптированные к метотрексату, по-прежнему демонстрировали приблизительно такую же чувствительность к 10-пропаргил-10-деазааминоптерин, как и интактные клетки DU-145.
[0088] На Фигуре 4 показаны IC50 для 10-пропаргил-10-деазааминоптерина или метотрексата для клеток НЕР2 и НЕР2, адаптированных к 10-пропаргил-10-деазааминоптерину или метотрексату. Эти данные показывают, что по отношению к НЕР-МТХ (адаптированным к метотрексату) 10-пропаргил-10-деазааминоптерин сохранял значительную эффективность; согласно измерениям IC50, эффективность 10-пропаргил-10-деазааминоптерина была в десять раз выше.
[0089] Генетические изменения, связанные с приобретенной устойчивостью к 10-пропаргил-10-деазааминоптерину.
[0090] ОТ-ПЦР
Теоретические и практические аспекты количественной ПЦР с обратной транскрипцией при использовании системы обнаружения последовательностей ABI Prism 7900 Sequence Detection System (Perkin-Elmer Applied Biosystems, Фостер-Сити, Калифорния, США) известны специалистам. Результаты выражали как n-кратное различие в экспрессии гена-мишени по сравнению с геном ТВР (контроль эндогенной РНК) и калибратором (1X образец), состоявшим из образца линии клеток из тестируемого набора, содержавшего наименьшее количество мРНК гена-мишени. Эксперименты выполняли в двух повторениях.
[0091] Для определения возможных механизмов устойчивости к антифолатам авторы оценивали экспрессию мРНК нескольких генов, участвующих в метаболизме фолатов, включая ДГФР, TS, FPGS, RFC1/SCL19A1, SLC25A32 и ABCB1/MDR1 в исходных и устойчивых клетках. Как показано на Фигуре 5, существенных изменений экспрессии мРНК ДГФР, TS и SLC25A32 в клетках, устойчивых к 10-пропаргил-10-деазааминоптерину, не происходило. В клетках DU-PDX и HEP-PDX наблюдали небольшое снижение экспрессии мРНК FPGS по сравнению с исходными эквивалентными линиями. И наоборот, экспрессия RFC1/SCL19A1 была более чем в 10 раз понижена в этих двух линиях клеток, устойчивых к 10-пропаргил-10-деазааминоптерину. Уровни мРНК ABCB1/MDR1 были в 40 и 2 раза выше в DU-PDX и HEP-PDX, соответственно, по сравнению с DU145 и НЕР2. Эти данные указывают на важную роль переносчиков для антипролиферативной активности 10-пропаргил-10-деазааминоптерина и приобретенной устойчивости к нему. Верапамил, блокатор кальциевых каналов, устраняет устойчивость за счет действия в качестве конкурентного субстрата MDR1, независимо от присущей ему фармакологической функции. Различные клинические исследования также показали, что такие лекарственные средства, как верапамил, могут устранять устойчивость к противораковым препаратам. Для изучения роли MDR1 в устойчивости к 10-пропаргил-10-деазааминоптерину клетки DU-PDX и HEP-PDX инкубировали с 30 мкМ верапамила и 3 мкМ циклоспорина А одновременно с 10-пропаргил-10-деазааминоптерином в течение 72 часов. Изменений цитотоксичности 10-пропаргил-10-деазааминоптерина в присутствии и при отсутствии верапамила и циклоспорина А не наблюдали, что указывает на отсутствие существенной роли сверхэкспрессии MDR1 в приобретенной устойчивости этих линий клеток (результаты не показаны).
[0092] Анализ экспрессии ДГФР, мишени 10-пропаргил-10-деазааминоптерина и метотрексата, показал значительное повышение белка в клетках НЕР-МТХ по сравнению с исходными клетками НЕР2, что указывало на возможную амплификацию гена (Фигура 6), и значительное повышение мРНК (Фигура 7). Экспрессия белка ДГФР была слегка повышена после краткого (24 часа) воздействия 10-пропаргил-10-деазааминоптерина, но не после длительного (6 месяцев) воздействия 10-пропаргил-10-деазааминоптерина, что указывало на отличие молекулярного механизма приобретенной устойчивости к 10 пропаргил-10-деазааминоптерину в клетках HEP-PDX от устойчивости к метотрексату в клетках НЕР-МТХ.
[0093] Для оценки перекрестной устойчивости клеток, устойчивых к пралатрексату, к другим лекарственным агентам, клетки DU145, DU-PDX, НЕР2 и HEP-PDX подвергали воздействию пеметрекседа и 5-FU в течение 72 ч. Для цитотоксичности 5-FU существенных различий между исходными и PDX-устойчивыми клетками не наблюдали. Воздействие пеметрекседа в течение 72 ч было лишь слегка менее цитотоксическим по отношению к клеткам DU-PDX и HEP-PDX по сравнению с их исходными эквивалентами (данные не показаны). Эти данные указывали на то, что приобретенная устойчивость к пралатрексату может не означать устойчивости к пеметрекседу и 5-FU, возможно, из-за различий в механизмах действия этих соединений.
[0094] Пралатрексат представляет собой антифолат с высоким сродством к восстановленному белку-переносчику фолата 1 (RFC-1) и фолилполиглутаматсинтетазе (FPGS), что приводит к интенсивной интернализации и накоплению в опухолевых клетках. В настоящее время ведутся исследования пралатрексата в качестве агента для монотерапии и в комбинациях с различными злокачественными заболеваниями. Для определения направления дальнейших клинических разработок, необходимо установить молекулярные механизмы чувствительности к пралатрексату и получить данные доклинических исследований о комбинированной терапии.
[0095] Пралатрексат демонстрировал мощную антипролиферативную активность (IC50<0.1 мкМ) в девяти из 15 линий клеток солидных опухолей человека. Определены две четко различающиеся группы линий клеток с более чем 100-кратным различием значений IC50 пралатрексата: чувствительные и относительно устойчивые линии клеток. Антипролиферативное действие пралатрексата in vitro с точки зрения значений IC50 было в среднем почти в 10 раз лучше, чем действие метотрексата. При сравнении цитотоксической активности этих двух сходных антифолатов с другими антиметаболитами, включая 5-FU, 5'-DFUR и пеметрекседом, оказалось, что пралатрексат сохранял активность в некоторых клетках, слабочувствительных к 5-FU и 5' DFUR, например, линии клеток НМРЛ НОР62 и НОР92. Аналогично, профиль чувствительности к пеметрекседу отличался от профиля пралатрексата, что можно объяснить различиями в молекулярных механизмах действия этих соединений.
[0096] В целом, приобретенная устойчивость к 10-пропаргил-10-деазааминоптерину ассоциировалась с пониженной экспрессией RFC-1 и повышенной экспрессией MDR1 в линиях клеток DU-PDX и HEP-PDX. Фармакологическое ингибирование MDR1 не влияло на устойчивость к 10-пропаргил-10-деазааминоптерину в этих моделях, что указывало на ограниченную роль MDR1 для наблюдаемой устойчивости. В клетках, устойчивых к 10-пропаргил-10-деазааминоптерину, не обнаружили изменений экспрессии мРНК ДГФР. И наоборот, в клетках НЕР-МТХ отмечали значительное повышение экспрессии мРНК и белка ДГФР. Наблюдались различия в механизмах приобретенной устойчивости к 10-пропаргил-10-деазааминоптерину и метотрексату; эти данные указывают на целесообразность дальнейшей разработки 10-пропаргил-10-деазааминоптерина при раковых заболеваниях, чувствительных к метотрексату, а также в условиях приобретенной устойчивости к метотрексату.
[0097] Влияние пралатрексата (PDX) и изомеров PDX-10a и PDX-10b (3 дозы), вводимых внутривенно 17 дней крысам с развивающимся коллаген-индуцированным артритом типа II (RTTC/AL-2)
Дизайн исследования:
Животные (10 особей в группе для артрита, 4 особи в группе для нормального контроля) помещались в клетки в количестве 4-5 особей в одну клетку, животным давали акклиматизироваться в течение 4-8 дней.
Группу артрита анестезировали изофлураном и животным делали инъекции коллагена (день 0, D0); каждое животное получало 400 мкл смеси, разделенной на 3 подкожных участка на спине.
На 6-й день (D6) животных снова анестезировали и делали вторую инъекцию коллагена (200 мкл, 3 участка).
Внутривенное (IV) дозирование тестируемых соединений, проводимое с интервалом в 24 часа (QD), инициировали на день 0 с использованием дозы объемом 1 мл/кг.
На 17-й день все животные были анестезированы и умерщвлены.
Коленные суставы удаляли и помещали в формалин для обработки для микроскопии.
Обработка суставов:
После выдерживания в фиксаторе в течение 1-2 дней, а затем в декальцинаторе в течение 4-5 дней, коленные суставы разрезали пополам во фронтальной плоскости, обрабатывали, закрепляли, делали срезы и окрашивали толуидиновым синим.
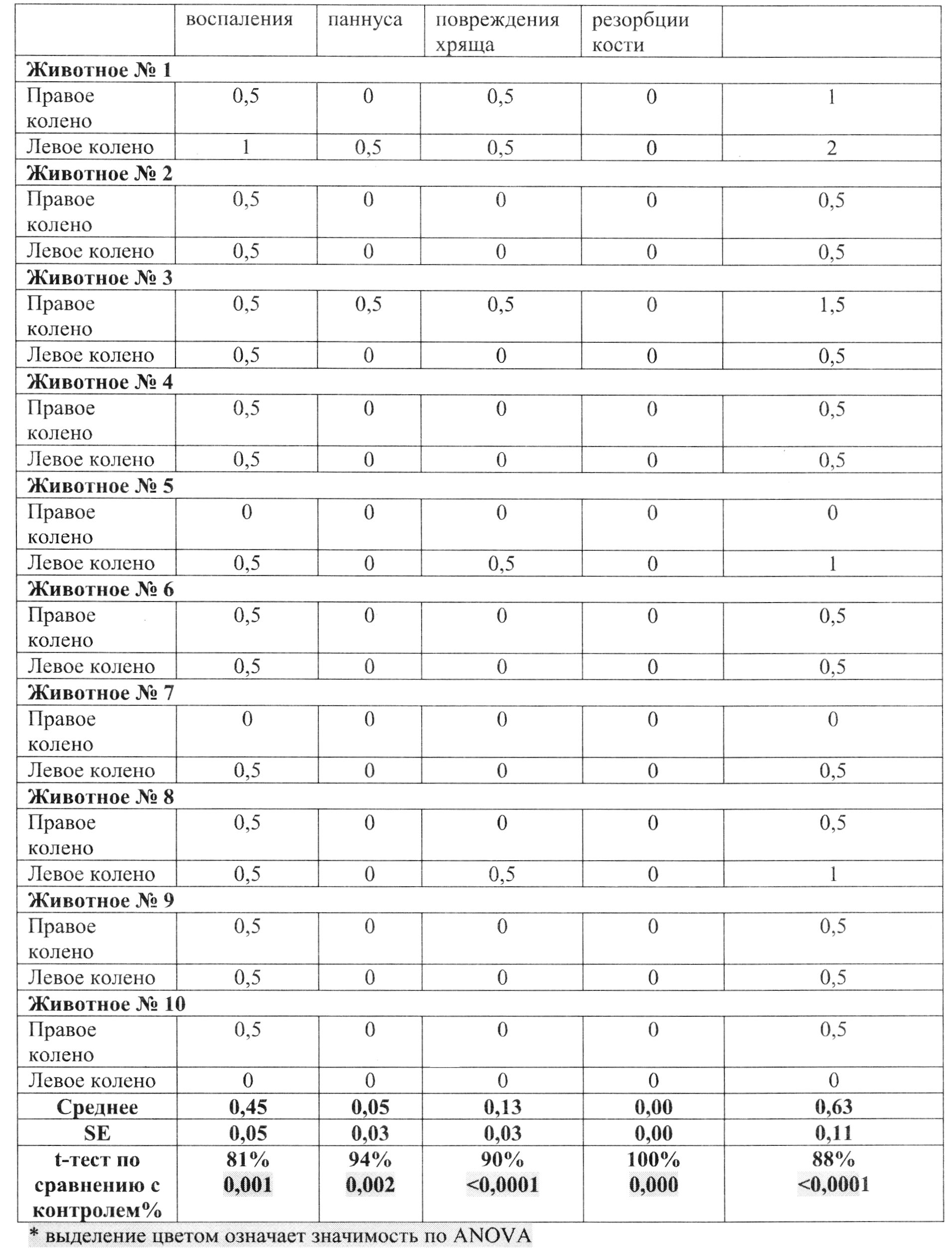
Подсчет оценки суставов:
Коленные суставы с коллаген-индуцированным артритом получали оценку от 0 до 5 за воспаление, образование паннуса, повреждение хряща и костной резорбции, как указано ниже.
Воспаление:
0 = Нормальное состояние;
0,5 = Минимальное очаговое воспаление;
1 = Минимальная инфильтрация клеток воспалительного инфильтрата клеток в синовиальную оболочку/околосуставные ткани;
2 = Легкая инфильтрация;
3 = Умеренная инфильтрация, сопровождающаяся умеренным отеком;
4 = Отчетливо выраженная инфильтрация, сопровождающаяся заметным отеком;
5 = Сильная инфильтрация, сопровождающаяся тяжелым отеком.
Паннус коленного сустава:
0 = Нормальное состояние;
0,5 = Минимальная инфильтрация паннуса в хрящ и субхондральную кость, затронуты только маргинальные зоны и затронуты только несколько суставов;
1 = Минимальная инфильтрация паннуса в хрящ и субхондральную кость, затронуто примерно 1-10% поверхности хряща или субхондральной кости;
2 = Легкая инфильтрация (распространяется на до 1/4 части поверхности или субхондральной области голени или бедра), затронуто примерно 11-25% поверхности хряща или субхондральной кости;
3 = Умеренная инфильтрация (распространяется на более чем 1/4, но менее чем 1/2 части поверхности или субхондральной области голени или бедра), затронуто примерно 26-50% поверхности хряща или субхондральной кости;
4 = Отчетливо выраженная инфильтрация (распространяется на от 1/2 до 3/4 части поверхности или субхондральной области голени или бедра), затронуто примерно 51-75% поверхности хряща или субхондральной кости;
5 = Сильная инфильтрация, затронуто примерно 76-100% поверхности хряща или субхондральной кости.
Повреждение коленного хряща:
0 = Нормальное состояние;
0,5 = Минимальное снижение толуидиновой голубой окраски, затронуты только маргинальные зоны;
1 = Минимальное = минимальное до легкого снижение толуидиновой голубой окраски, без потери хондроцитов или нарушений коллагена;
2 = Легкое = легкое снижение толуидиновой голубой окраски, с очаговой легкой (поверхностной) потерей хондроцитов и/или нарушением коллагена, на нескольких небольших зонах возможно повреждение на глубину хряща 50%;
3 = Умеренное = умеренное снижение толуидиновой голубой окраски, с многоочаговой до диффузной умеренной (глубиной до срединной зоны) потерей хондроцитов и/или нарушением коллагена, возможно наличие 1-2 небольших зон с потерей на всю толщину, затронута менее чем общая ширина поверхности и не более чем 25% общей ширины всех поверхностей;
4 = Отчетливо выраженное = отчетливо выраженное снижение толуидиновой голубой окраски, с многоочаговой до диффузной заметной (до глубинной зоны) потерей хондроцитов и/или нарушением коллагена, либо с 1 поверхностью с почти полной потерей или частичной потерей, общая потеря менее чем 50% от суммарной ширины всех поверхностей;
5 = Сильное = сильное диффузное снижение толуидиновой голубой окраски, с многоочаговой сильной (до пограничной линии) потерей хондроцитов и/или нарушением коллагена на бедренной кости и/или большеберцовой кости, общая потеря более чем 50% от суммарной ширины всех поверхностей.
Костная резорбция колена:
0 = Нормальное состояние;
0,5 = Минимальная резорбция, затронуты только маргинальные зоны;
1 = Минимальная = небольшие зоны резорбции, не легко определяются при небольшом увеличении, затронуто примерно 1-10% общей ширины сустава субхондральной кости;
2 = Легкая = более многочисленные зоны резорбции, выраженная потеря субхондральной кости, затронуто примерно 11-25% общей ширины сустава субхондральной кости;
3 = Умеренная = явная резорбция субхондральной кости, затронуто примерно 26-50% общей ширины сустава субхондральной кости;
4 = Отчетливо выраженная = явная резорбция субхондральной кости, затронуто примерно 51-75% общей ширины сустава субхондральной кости;
5 = Сильная = деформация всего сустава из-за того, что затронуто примерно 76-100% общей ширины сустава субхондральной кости.
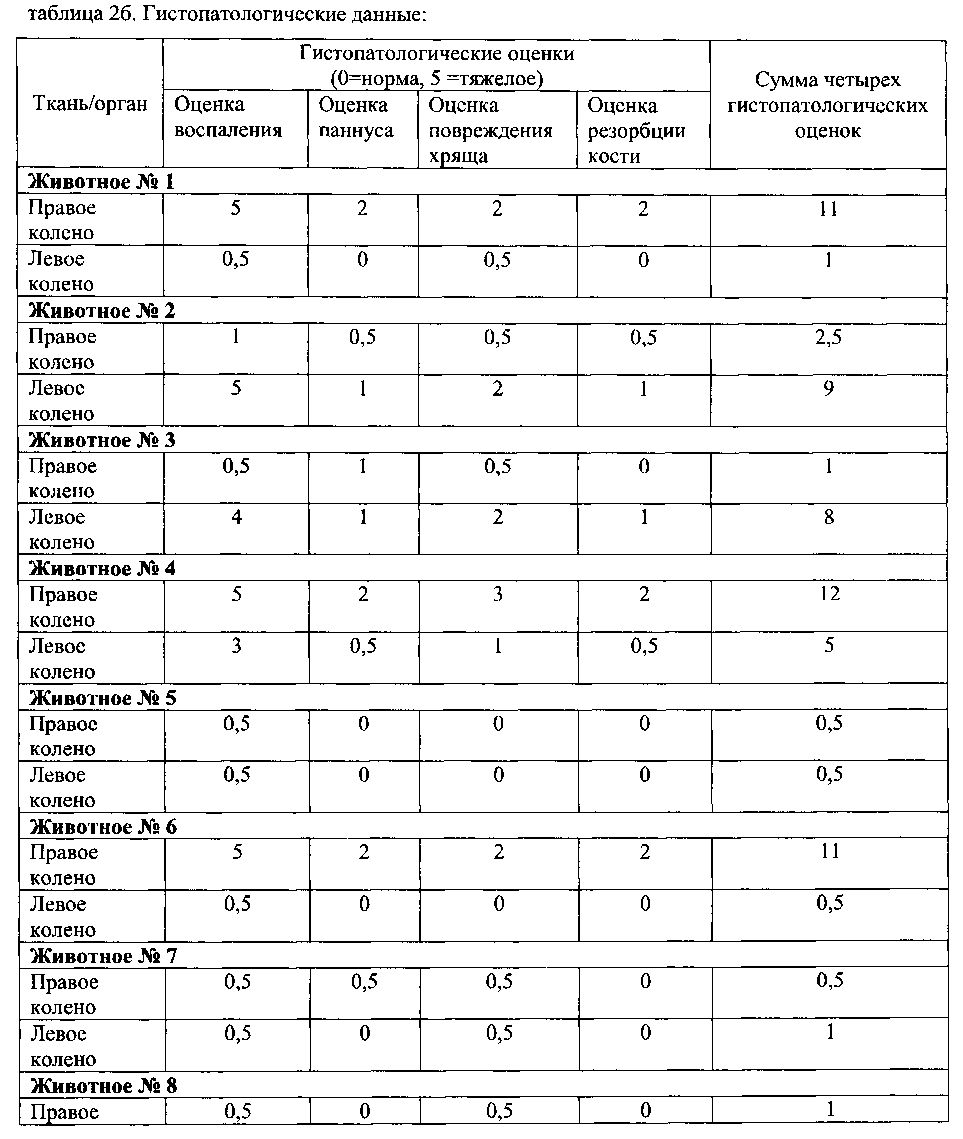
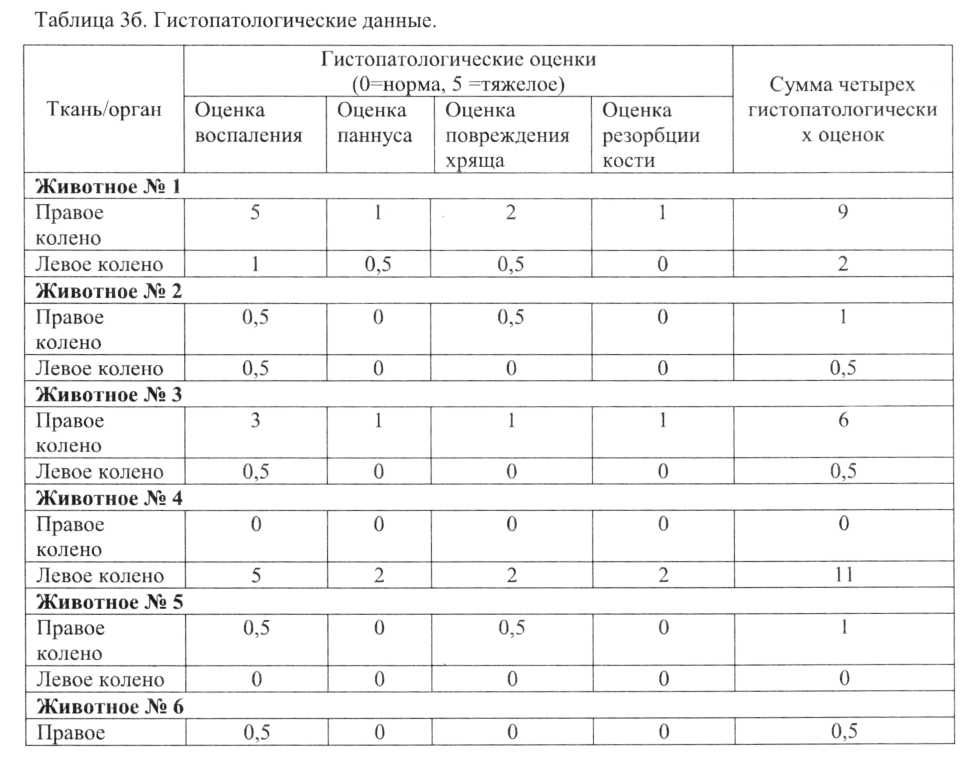
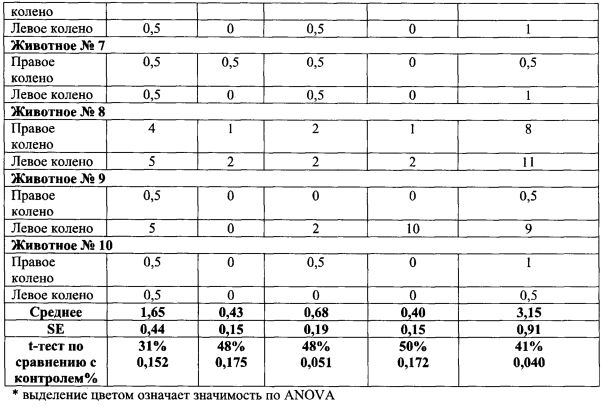
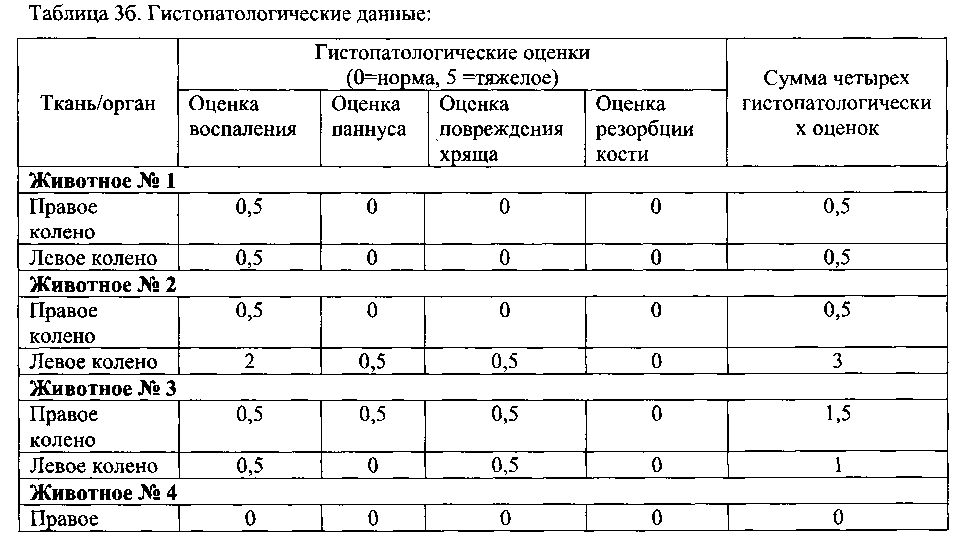
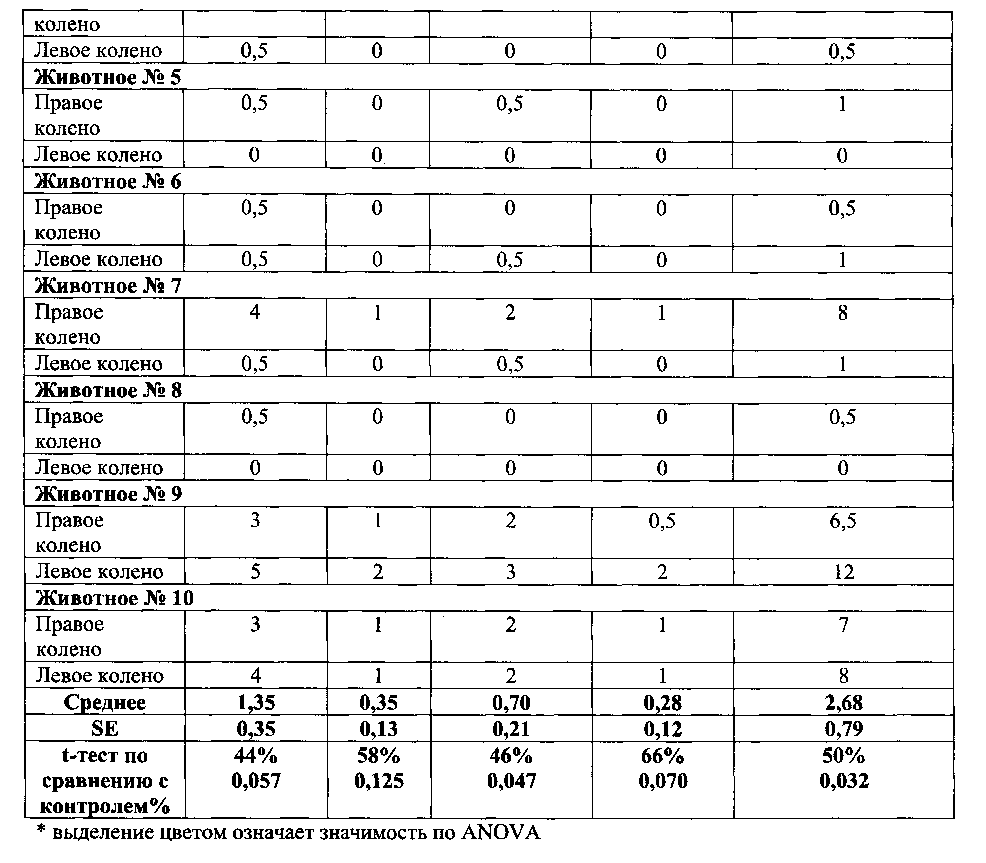
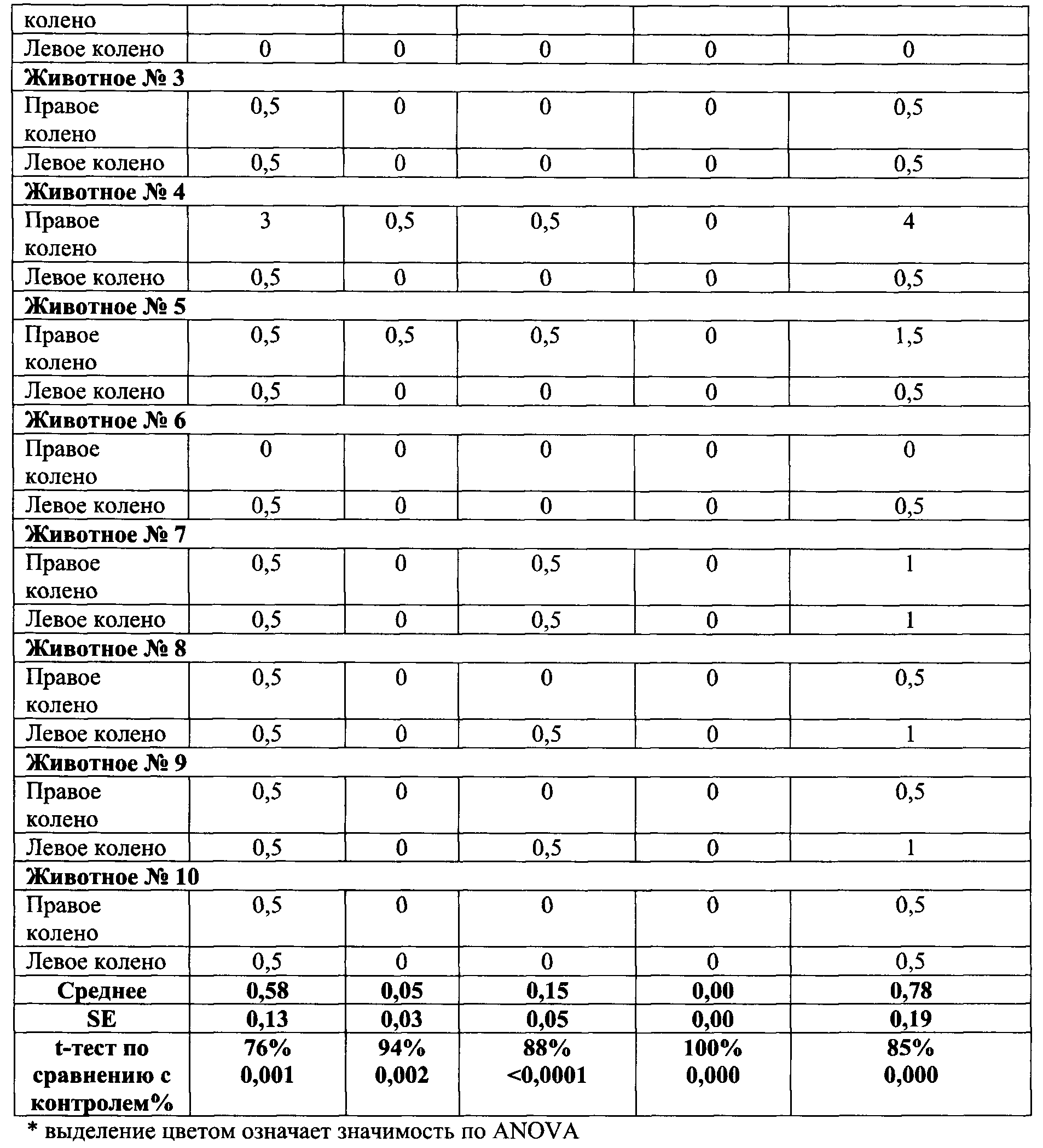
Коленные суставы животных с коллаген-индуцированным артритом типа II, гистопатологические данные:






[0098] Вышеизложенное обсуждение изобретения представлено для целей иллюстрации и описания. Вышесказанное не преследует цели ограничить изобретение формой или формами, описанными в настоящем документе. Хотя описание изобретения включает описание одного или нескольких вариантов реализации и определенные изменения и модификации, в рамки изобретения входят другие изменения и модификации, например, изменения, которые могут сделать специалисты благодаря своим навыкам и знаниям после понимания настоящего описания. Настоящая заявка предназначена для получения прав, которые включают в себя альтернативные варианты реализации в соответствии с законодательством, включая альтернативные, взаимозаменяемые и/или эквивалентные структуры, функции, диапазоны или этапы по отношению к структурам, функциям, диапазонам или этапам, изложенным в формуле изобретения, независимо от того, описаны ли такие альтернативные, взаимозаменяемые и/или эквивалентные структуры, функции, диапазоны или этапы в настоящем документе или нет, и не подразумевая публичного описания любого патентоспособного объекта.