Результат интеллектуальной деятельности: СПОСОБ ПРИГОТОВЛЕНИЯ ЧАСТИЦ НОСИТЕЛЯ ДЛЯ СУХИХ ПОРОШКОВ ДЛЯ ИНГАЛЯЦИИ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к способу приготовления частиц носителя для применения в сухих порошкообразных композициях для ингаляции и частицам носителя.
Предшествующий уровень техники
Лекарственную терапию посредством ингаляции сухих порошков (DPI) в течение многих лет используют для лечения респираторных состояний, таких как астма, хроническая обструктивная болезнь легких (COPD) и аллергический ринит.
По сравнению с пероральным приемом лекарств, необходимы лишь небольшие дозы для эффективной терапии, поскольку пресистемный метаболизм значительно снижен. Такие небольшие дозы уменьшают воздействие лекарства на организм и минимизируют побочные действия. Системные неблагоприятные эффекты также уменьшены вследствие того, что местное введение в легкое доставляет лекарство непосредственно к сайту действия. Также схемы приема с более низкими дозировками могут обеспечить значительную экономию бюджета, в частности, когда используют дорогостоящие терапевтические агенты.
Сухие порошковые формы типично готовят путем смешивания лекарственного средства в микронизированной форме с грубыми частицами носителя, получая упорядоченную смесь, в которой микронизированные активные частицы прилипают к поверхности частиц носителя при нахождении внутри ингалятора.
Носитель делает микронизированный порошок менее когезионным и улучшает его текучесть, облегчая обработку порошка во время производственного процесса (заливки, заполнения и т.д.).
Во время ингаляции частицы лекарства отделяются от поверхности частиц носителя и проникают в нижние отделы легких, в то время как более крупные частицы носителя главным образом откладываются в ротоглотке.
Повторная дисперсия частиц лекарства от поверхности носителя рассматривается как наиболее критический фактор, который управляет доступностью лекарственного средства в легких. Она будет зависеть от механической стабильности порошковой смеси, и на нее влияют адгезионные характеристики между лекарственным веществом и носителем и внешние силы, требующиеся для того, чтобы разрушать нековалентные связи, возникающие между адгезированными частицами. Слишком сильные связи между адгезированными частицами могут действительно предотвратить отделение микронизированных частиц лекарственного вещества от поверхности частиц носителя. Разные подходы, нацеленные на модуляцию адгезии, предложены в области техники, чтобы способствовать высвобождению частиц лекарственного вещества от частиц носителя и, следовательно, увеличить пригодную для вдыхания фракцию. Например, использование добавок со смазывающим агентом или антиадгезионными свойствами предложено в качестве решения технической проблемы.
Обнаружено, что особенно полезная добавка представляет собой стеарат магния.
Преимущество применения стеарата магния в сухих порошках изложено в патенте США №6528096. Конкретно, там изложено, что указанную добавку можно применять для изменения поверхностных свойств частиц носителя и, таким образом, улучшения свойств сухих порошкообразных композиций. В этом источнике сообщается о "благоприятной взаимосвязи" между поверхностным покрытием частиц носителя со стеаратом магния и фракцией мелких частиц (фракция, пригодная для вдыхания) испускаемой дозы. Важным для реализации данного изобретения является потребность в обеспечении покрытия стеаратом магния больше чем 15% поверхности частиц носителя. В примерах достигался процент покрытия до 38%.
Тем не менее, было бы очень благоприятно иметь способ, способный обеспечить более высокий процент поверхностного покрытия, поскольку это позволит улучшать характеристики композиции посредством меньшего количества добавки.
Эта задача решена посредством способа по настоящему изобретению.
Краткое изложение сущности изобретения
В первом аспекте настоящее изобретение относится к способу приготовления носителя для порошкообразных фармацевтических композиций для ингаляции, при котором на частицы, изготовленные из лактозы, имеющие массовый диаметр в диапазоне 30-1000 микрон, наносят сухим способом покрытие стеарата магния в количестве 0,1-1,3% по массе носителя, для обеспечения поверхностного покрытия частиц лактозы указанным стеаратом магния в такой степени, что покрытые частицы имеют больше чем 60% поверхностного покрытия, где стадию нанесению покрытия сухим способом осуществляют в смесителе-грануляторе с большим усилием сдвига на основе характеристик трения при скорости вращения, равной или большей чем 500 об/мин, предпочтительно равной или большей чем 1000 об/мин, но равной или меньшей чем 2500 об/мин, предпочтительно меньшей чем 2000 об/мин.
Предпочтительно, указанный смеситель-гранулятор с большим усилием сдвига представляет собой аппарат CYCLOMIX™.
Во втором аспекте изобретение относится к частицам носителя для сухих порошкообразных композиций для ингаляции, содержащим частицы лактозы, имеющие массовый диаметр в диапазоне 30-1000 микрон, покрытые стеаратом магния в количестве 0,1-1,3% по массе носителя в такой степени, что покрытые частицы имеют больше чем 60% поверхностного покрытия, где указанные частицы носителя получены способом, при котором осуществляют стадию нанесения покрытия сухим способом в смесителе-грануляторе с большим усилием сдвига на основе характеристик трения между вышеупомянутыми частицами лактозы и стеаратом магния при скорости вращения, равной или большей чем 500 об/мин, предпочтительно равной или большей чем 1000 об/мин, но равной или меньшей чем 2500 об/мин, предпочтительно меньшей чем 2000 об/мин.
В третьем аспекте изобретение относится к частицам носителя для сухих порошкообразных композиций для ингаляции, содержащим частицы лактозы, имеющие массовый диаметр в диапазоне 30-1000 микрон, покрытым стеаратом магния в количестве 0,1-1,3% по массе носителя в такой степени, что покрытые частицы имеют больше чем 60% поверхностного покрытия.
В четвертом аспекте изобретение относится к фармацевтической композиции в форме сухого порошка для ингаляции, содержащей частицы носителя по изобретению и один или более чем один активный ингредиент.
В пятом аспекте изобретение относится к сухому порошковому ингалятору, заполненному вышеупомянутой сухой порошкообразной фармацевтической композицией.
В шестом аспекте изобретение относится к способу приготовления вышеупомянутой фармацевтической композиции, при котором осуществляют стадию смешивания частиц носителя по изобретению с одним или более чем одним активным ингредиентом.
В еще одном аспекте изобретение также относится к упаковке, содержащей сухую порошкообразную фармацевтическую композицию по изобретению и сухой порошковый ингалятор.
Определения
Если не указано иное, то термины "активное лекарственное вещество", "активный ингредиент", "активный" и "активное вещество", "активное соединение" и "терапевтический агент" используются как синонимы.
Выражение "смеситель-гранулятор с большим усилием сдвига на основе характеристик трения" относится к аппарату, оснащенному смешивающими элементами в форме лопатки, где частицы ускоряются лопатками и интенсивно смешиваются путем трения о стенки сосуда.
Термин "нанесение покрытия сухим способом" относится к механическому способу, где первый материал (т.е. стеарат магния) образует физическое взаимодействие (покрытие) со вторым материалом (т.е. носителем) в сухих условиях, например, без растворителей, связывающих веществ или воды.
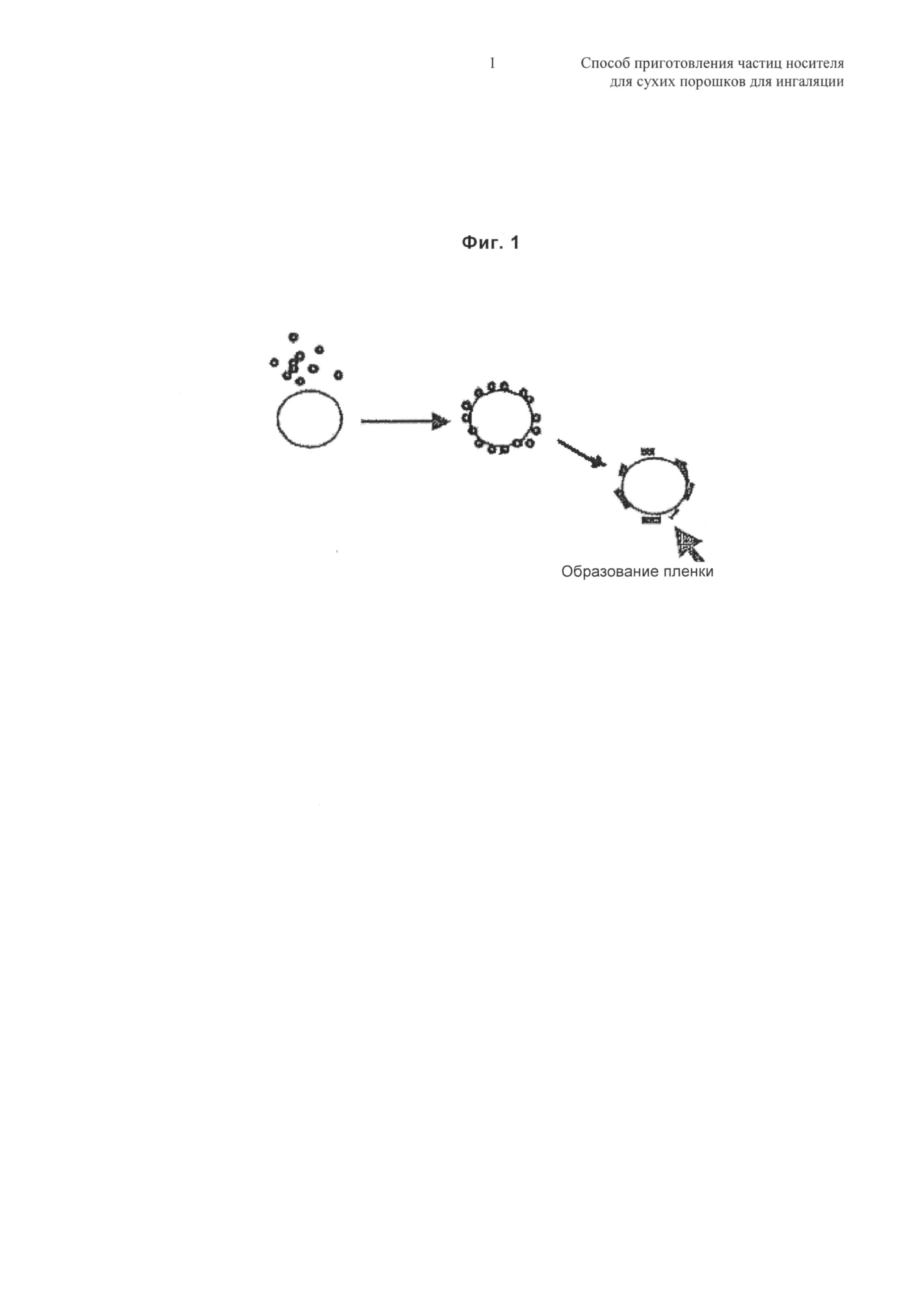
Термин "поверхностное покрытие" относится к покрытию поверхности частиц носителя путем образования пленки стеарата магния вокруг указанных частиц, как представлено на фиг.1. Толщину пленки оценивают посредством рентгеновской фотоэлектронной спектроскопии (XPS) приблизительно меньше чем 10 нм.
Процент поверхностного покрытия указывает на степень, в которой стеарат магния покрывает все частицы носителя.
Из всего вышеприведенного специалистам в данной области техники ясно, что пленочное покрытие по настоящему изобретению по меньшей мере покрывает 60% всей поверхности частиц носителя.
Термин "гигроскопический" относится к активному соединению, которое почти полностью высыхает при контакте с воздухом, имеющим содержание влаги больше 0% относительной влажности, но всегда содержит некоторое количество абсорбционно связанной воды (Н. Sucker, P. Fuchs and P. Speiser: Pharmaceutical Technology, Georg Thieme Verlag, Stuttgart, New York, 2nd edition 1991, page 85).
Термин "гидрофильный" относится к активному соединению, которое легко может увлажняться водой. Например, формотерол представляет собой типичный гидрофильный активный ингредиент.
В общих терминах размер частиц количественно оценивают путем измерения характеристического эквивалентного диаметра сферы, известного как объемный диаметр, путем лазерной дифракции.
Размер частиц также может быть количественно оценен путем измерения массового диаметра посредством подходящих известных приборов и способов, таких как просеивание.
Объемный диаметр (VD) связан с массовым диаметром (MD) за счет плотности частиц (предполагая, что размер не зависит от плотности частиц).
В настоящей заявке на изобретение интервал размеров частиц выражен в терминах массового диаметра. Иными словами, распределение размеров частиц выражено в терминах: 1) объемного срединного диаметра (VMD), который соответствует диаметру 50 процентов по массе или объему, соответственно, частиц, например d(v0.5), и 2) объемного диаметра (VD) в микронах 10% и 90% частиц, соответственно, например d(v0.1) и d(v0.9).
Термин "хорошие свойства текучести" относится к композиции, которую легко обрабатывать в процессе приготовления, и которая способна обеспечить точную и воспроизводимую доставку терапевтически эффективной дозы.
Свойства текучести могут быть оценены путем измерения индекса Kарра; индекс Kарра меньше чем 25 обычно указывает на хорошие свойства текучести.
Выражение "хорошая гомогенность" относится к композиции, в которой при смешивании однородность содержимого активного ингредиента, выражаемая как относительное стандартное отклонение (RSD), составляет меньше чем 5%, предпочтительно равна или меньше чем 2,5%.
Выражение "физически стабильный в устройстве перед использованием" относится к композиции, где активные частицы по существу не сегрегируют и/или отделяются от поверхности частиц носителя во время приготовления сухого порошка и в устройстве доставки перед использованием. Тенденция к сегрегации может быть оценена в соответствии с Staniforth et al. J. Pharm. Pharmacol. 34,700-706, 1982, и рассматривается как приемлемая, если распределение активного ингредиента в порошкообразной композиции после теста, выраженное как относительное стандартное отклонение (RSD), не изменяется существенно относительно этой композиции перед тестом.
Выражение "вдыхаемая фракция" относится к доле процента частиц активного ингредиента, которые будут достигать глубоких отделов легких пациента. Вдыхаемую фракцию, которую также называют фракцией мелких частиц (FPF), обычно оценивают, используя подходящий аппарат in vitro, как правило многостадийный каскадный импактор или многостадийный жидкостный импинджер (MLSI) в соответствии со способами, о которых сообщалось в общепринятой Фармакопее. Ее вычисляют как соотношение между вдыхаемой дозой и доставляемой (испускаемой) дозой. Доставляемую дозу вычисляют по совокупному отложению в аппарате, тогда как вдыхаемую дозу (дозу мелких частиц) вычисляют по отложению на Стадиях 3 (S3) на фильтре (AF), соответствующем частицам 4,7 микрон или меньше.
Вдыхаемая фракция больше чем 30% представляет собой показатель хороших ингаляторных свойств.
Термин "терапевтическое количество" обозначает количество активного ингредиента, которое при доставке в легкие посредством сухой порошкообразной композиции, как описано здесь, обеспечивает желаемый биологический эффект.
Под "разовой дозой" подразумевают количество активного ингредиента, вводимое одномоментно путем ингаляции при приведении в действие ингалятора.
Приведение в действие означает выпуск активного ингредиента из устройства при единичной активации (например, механической или путем дыхания).
Графические материалы
Фиг.1 - Схема процесса образования пленки вокруг единичных частиц носителя.
Фиг.2 - Картины, полученные путем SEM (сканирующей электронной микроскопии), при различных увеличениях: частицы лактозы + 0,5% стеарат магния при 1500 об/мин в течение 5 мин (слева); частицы лактозы + 0,5% стеарат магния при 1500 об/мин в течение 10 мин (в центре); частицы лактозы + 0,5% стеарат магния при 1500 об/мин в течение 15 мин (справа).
Фиг.3 - Абсорбция воды при увеличивающемся проценте относительной влажности.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к способу приготовления носителя для порошкообразных фармацевтических композиций для ингаляции, при котором на частицы, изготовленные из лактозы, наносят покрытие стеарата магния сухим способом для обеспечения поверхностного покрытия частиц лактозы, где указанное нанесение покрытия сухим способом осуществляют в смесителе-грануляторе с большим усилием сдвига на основе характеристик трения.
Обнаружено, что при использовании этого типа аппарата, где частицы подвергаются силам трения, возникновение разрушения частиц носителя менее вероятно, чем в другом аппарате, например, на основе ударных сил.
Стеарат магния представляет собой добавку со смазывающими свойствами, которую главным образом используют для увеличения вдыхаемой фракции активного ингредиента.
Может быть использован любой тип стеарата магния фармацевтического качества, имеющийся в продаже, независимо от его происхождения.
Количество стеарата магния должно составлять от 0,1 до 1,3% по массе носителя таким образом, что соответствующая композиция сохраняет свою однородность во время условий, которые сравнимы с условиями, которые могут возникать во время производственной обработки.
Предпочтительно, указанное количество может составлять от 0,15 до 1,0% по массе (масс/масс).
В этих пределах количество стеарата магния будет зависеть от сухого порошкового ингалятора и активного ингредиента, используемого в порошкообразной композиции. Специалист в данной области техники также принимает во внимание физические и химические свойства активного ингредиента и тип ингалятора, например для разовой дозы или мультидозовый, чтобы выбрать соответствующее количество.
В одном воплощении изобретения количество стеарата магния может составлять от 0,15 до 0,5%, более предпочтительно от 0,2 до 0,4% масс/масс, или от 0,1 до 0,3%. В других воплощениях оно может составлять от 0,3 до 0,5% масс/масс, или от 0,4 до 1,0% масс/масс, более предпочтительно от 0,5 до 0,8% по массе носителя. В других воплощениях оно может составлять 0,65 до 1,25%, предпочтительно от 0,7 до 1,1% масс/масс. В конкретном воплощении количество стеарата магния составляет 0,1%.
В других воплощениях количество стеарата магния будет зависеть от размера частиц и, следовательно, площади поверхности частиц носителя.
Например, для частиц носителя с большой площадью поверхности, таких как частицы, имеющие маленький размер, например, 60-90 микрон, количество стеарата магния будет составлять предпочтительно от 0,65 до 1,25%, в то время как для частиц носителя с меньшей площадью поверхности, таких как частицы, имеющие больший размер частиц, например, 90-150 микрон, количество будет составлять от предпочтительно 0,1 до 0,3%.
Частицы лактозы могут представлять собой любой тип кристаллической лактозы или их смесь. Благоприятно, частицы лактозы состоят из альфа-лактозы или бета лактозы, или их сольватов. Предпочтительно, частицы носителя представляют собой частицы моногидрата альфа-лактозы.
Все частицы лактозы имеют массовый диаметр в диапазоне 30-1000 микрон. Преимущественно могут быть использованы частицы, имеющие массовый диаметр от 50 до 500. В предпочтительном воплощении массовый диаметр составляет от 60 до 200 микрон. В конкретных воплощениях могут быть использованы частицы, имеющие массовый диаметр от 60 до 90 микрон или от 90 до 150 микрон. В других воплощениях массовый диаметр составляет от 150 до 400 микрон или от 210 до 355 микрон.
Размер частиц носителя представляет собой важный фактор в эффективности ингалятора. Желаемый размер частиц может быть получен путем просеивания.
В особенно предпочтительном воплощении распределение размеров частиц удовлетворяет следующим параметрам: d(v0.1) от 85 до 100 микрон, d(v0.5) от 125 до 135 микрон и d(v0.9) от 180 до 190 микрон.
Частицы лактозы подвергают покрытию частицами стеарата магния сухим способом до тех пор, пока степень поверхностного покрытия не станет больше 60%, преимущественно равной или большей чем 70%, более преимущественно по меньшей мере 80%, предпочтительно равной или большей чем 85%, более предпочтительно равной или большей чем 90%, еще более предпочтительно равной или большей чем 95%. В конкретных условиях возможно достижение поверхностного покрытия 100%.
Степень, в которой стеарат магния покрывает поверхность частиц лактозы, может быть определена сначала путем измерения угла контакта с водой, а затем применения уравнения, известного из литературы как уравнение Касси-Бакстера, цитированное на стр.338 в Colombo I et al // Farmaco 1984, 39(10), 328-341 и приведенное ниже.
cosϑсмесь=fMgSt cosϑMgst+fлактоза cosϑлактоза,
где
fMgSt и fлактоза представляют собой доли площади поверхности стеарата магния и лактозы;
ϑMgSt представляет собой угол контакта с водой для стеарата магния;
ϑлактоза представляет собой угол контакта с водой для лактозы
ϑсмесь представляют собой экспериментальные значения угла контакта с водой.
Измерение угла контакта с жидкостью и твердой поверхностью обычно используется в области техники для того, чтобы определить смачиваемость твердых частиц. Этот подход основан на способности жидкости распространяться спонтанно по поверхности тела, чтобы достигнуть термодинамического равновесия.
Для задач изобретения угол контакта может быть определен с использованием способов, которые по существу основаны на гониометрических измерениях. Они используют непосредственное наблюдение угла, образованного твердым телом и жидкостью при тестировании. Их довольно просто выполнить, но имеется единственное ограничение, связанное с возможным отклонением вследствие вариабельности между операторами. Нужно, однако, подчеркнуть, что этот недостаток можно преодолеть, используя полностью автоматизированную процедуру, такую как компьютерный анализ изображения.
Особенно полезный подход представляет собой метод подвешенной или статической капли, на который ссылаются на странице 332 Colombo et al (там же), который осуществляют, внося каплю жидкости на поверхность порошка в форме диска, полученного путем уплотнения (метод диска из прессованного порошка).
Как правило, процедуру осуществляют следующим образом:
Прессованный диск получают, добавляя образец в штамп пресса и применяя силу сжатия 5 кН в течение 3 минут. Затем прессованный диск помещают на пластину аппарата для тестирования смачиваемости поверхности и формируют на поверхности диска каплю воды 10 мкл.
Подходящий прибор для тестирования увлажнения представляет собой, например, прибор, поставляемый Lorentzen & Wettre GmbH.
Снимки делают с использованием видеокамеры и значения углов контакта с водой обрабатывают с использованием компьютера в процессе анализа изображения.
Если полностью автоматизированная процедура не доступна, тогда основание (b) и высоту (h) капли измеряют на дисплее, используя мобильную отсчетную шкалу, затем углы контакта с водой (WCA) вычисляют по следующей формуле:
WCA=[arctg 2h/b]×2×180/π.
Как правило, значения вычисляют как среднее для трех различных измерений, проведенных при комнатной температуре. Точность обычно составляет приблизительно ±5°.
Степень, до которой стеарат магния покрывает поверхность частиц лактозы, может также быть определена при помощи рентгеновской фотоэлектронной спектроскопии (XPS), известного инструмента для определения степени, а также однородности распределения некоторых элементов на поверхности других веществ. В приборе XPS фотоны определенной энергии используются, чтобы возбуждать электронные состояния атомов ниже поверхности образца. Электроны, которые испускаются с поверхности, фильтруются в зависимости от энергии через полусферический анализатор (HSA) прежде, чем интенсивность для определенной энергии будет зарегистрирована детектором. Так как электроны основного уровня атомов твердого состояния квантуются, получающиеся энергетические спектры отражают характеристику резонансных пиков электронной структуры для атомов поверхности образца.
Как правило, измерения XPS проводят на приборе Axis-Ultra, доступном от Kratos Analytical (Manchester, UK) с использованием монохроматического Al Кα излучения (1486,6 эВ), функционирующего при токе эмиссии 15 мА и потенциале анода 10 кВ (150 Вт). Низкоэнергетическую электронную пушку используют для компенсации зарядки изолятора. Обзорные сканы, по которым определяют количества обнаруженных элементов, получают с энергией пропускания в анализаторе 160 эВ и размере шага 1 эВ. Сканы с высокой разрешающей способностью областей С 1s, О 1s, Mg 2s, N 1s и Cl 2p получают с энергией пропускания 40 эВ и размере шага 0,1 эВ. Исследуемая область составляет приблизительно 700 мкм × 300 мкм для обзорного сканирования и 110 мкм диаметр пятна для сканов с высокой разрешающей способностью.
В контексте настоящего изобретения при помощи XPS возможно вычислить степень покрытия и глубину пленки стеарата магния вокруг частиц лактозы. Степень покрытия стеаратом магния (MgSt) оценивают, используя следующее уравнение:
% покрытия MgSt=(% Mgобразец / % Mgреф)×100,
где
Mgобразец - количество Mg в проанализированной смеси;
Mgреф представляет собой количество Mg в референсном образце, имеющегося в продаже MgSt.
Обычно значения вычисляют как среднее для двух различных измерений. Как правило, точность 10% указана для обычно выполняемых экспериментов XPS.
Измерения XPS могут быть проведены при помощи имеющихся в продаже приборов, таких как прибор Axis-Ultra от Kratos Analytical (Manchester UK), обычно с использованием монохроматического Al Kα излучения в соответствии с известными способами.
В пределах экспериментальной ошибки, хорошее соответствие выявлено между степенью покрытия, как определено измерениями XPS и как оценено в теоретических вычислениях, основанных на уравнении Касси-Бэкстера.
Другой аналитический способ, который можно преимущественно использовать для определения степени покрытия, представляет собой сканирующую электронную микроскопию (SEM).
Такая микроскопия может быть оборудована анализатором EDX (электронно-дисперсионный рентгеновский анализатор), который может обеспечивать изображение, избирательное в отношении некоторых типов атомов, например атомов магния. Таким образом возможно получить ясный набор данных на распределении стеарата магния на поверхности частиц носителя.
SEM альтернативно может быть комбинирован с IR (инфракрасной) или рамановской спектроскопией для того, чтобы определить степень покрытия в соответствии с известными способами.
Аппарат, в котором осуществляют способ по изобретению, должен представлять собой смеситель-гранулятор с большим усилием сдвига на основе трения, функционирующий при скорости вращения, равной или большей чем 500 об/мин, но равной или меньшей чем 2500 об/мин, предпочтительно от 500 до 2000 об/мин, более предпочтительно от 1000 до 1500 об/мин.
Действительно обнаружено, что, если частицы носителя имеют массовый диаметр, равный или больший чем 90 микрон, то при скорости вращения 2000 об/мин частицы лактозы начинают разрушаться, и следовательно наблюдается значительное сокращение размера частиц.
Типичный смеситель-гранулятор с большим усилием сдвига, который может использоваться для того, чтобы осуществить способ по изобретению, представляет собой аппарат CYCLOMIX™ (Hosokawa Microne Group Ltd).
Указанный аппарат включает стационарный конический сосуд, оборудованный элементами для перемешивания в формы лопатки, которые вращаются близко к внутренней стенке сосуда.
Порошок загружают в конический сосуд для смешивания сверху; степень заполнения может составлять от 30 до 100%. Вращение лопаток и коническая форма сосуда вместе выталкивают порошок от основания к верхней зоне сосуда. После достижения вершины порошок стекает вниз в центр сосуда. Это течение приводит к быстрому макросмешиванию. Во время восходящего движения, частицы порошка ускоряются лопатками и интенсивно смешиваются путем трения с сосудом. Такие эффекты достаточны для того, чтобы смягчить, разрушить, деформировать, сгладить и обернуть частицы стеарата магния вокруг частиц носителя с образованием покрытия.
Температура продукта остается постоянной во время всех экспериментов. Тем не менее, температуру можно контролировать точным и надежным путем.
Когда способ осуществляют в заявленных пределах в отношении скорости вращения, тогда размер частиц лактозы остается по существу тем же самым, и достигается высокая степень покрытия.
Тем не менее, если желательны частицы лактозы, по существу без тонкодисперсных частиц лактозы, то скорость вращения предпочтительно поддерживают равной или меньшей чем 1500, т.е. от 1000 до 1500 об/мин, тогда как при более высокой скорости вращения возможно получить in situ небольшой процент тонкодисперсных частиц носителя, как сообщается, например, в WO 00/53158.
Как правило, фракция не более чем 10% тонкодисперсных частиц может быть произведена с MMD меньше чем 20 микрон, предпочтительно меньше чем 10 микрон.
Предпочтительно в любом случае получать частицы носителя, изготовленные из лактозы, покрытые стеаратом магния, не содержащие тонкодисперсные частицы лактозы.
Время обработки зависит от типа частиц носителя и размера партии и будет корректироваться специалистом в данной области техники.
Аппарат вместимостью до 500 литров в настоящее время имеется в продаже.
Как правило, время обработки составляет от 1 до 30 минут, предпочтительно поддерживаемое от 2 до 20 минут, более предпочтительно от 5 до 15 минут.
В некоторых воплощениях время обработки составляет 10 минут.
Время обработки также влияет на степень покрытия и может быть скорректировано специалистом в данной области техники в зависимости от используемого количества стеарата магния и степени желаемого покрытия.
Носители, получаемые согласно способу по изобретению, демонстрируют хорошие свойства текучести, поскольку имеют индекс Карра меньше чем 25, который обычно берется в качестве отличающего значения для свободнотекучих порошков.
Индекс Карра вычисляют, используя следующую формулу:
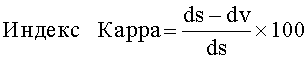 ,
,
где:
dv представляет собой насыпную плотность; и
ds представляет собой плотность после уплотнения.
Плотности вычисляют в соответствии со следующим способом.
Порошковые смеси (приблизительно 70 г) высыпают в градуированный стеклянный цилиндр и регистрируют наблюдаемый объем до усадки V0; вычисляют наблюдаемую плотность до усадки (насыпную плотность, dv) путем деления массы образца на объем V0. После 1250 перемешиваний в описанном аппарате регистрируют наблюдаемый объем после усадки (V1250) и вычисляют наблюдаемую плотность после усадки (плотность после уплотнения, ds).
Поскольку носитель обладает хорошими свойствами текучести, из этого следует, что свойства текучести для соответствующих фармацевтических композиций в форме безводных порошков являются хорошими.
Фармацевтические композиции, содержащие носитель по изобретению, также демонстрируют хорошие аэрозольные характеристики с точки зрения вдыхаемой фракции, и значительно выше, чем аэрозольные характеристики композиций, содержащих носитель, приготовленный в соответствии с патентом США №6528096.
Кроме того, процент вдыхаемых частиц MgSt, доставляемых носителем по изобретению, существенно ниже, чем процент, доставляемый носителем согласно предшествующему уровню техники. Это указывает на то, что указанная добавка адгезирует более сильно к поверхностям частицы носителя, гораздо меньше высвобождается от носителя по изобретению во время ингаляции и, следовательно, менее доступна для системной абсорбции.
Композиции, содержащие носитель по изобретению, также являются физически устойчивыми в устройстве до использования.
Наконец, из-за увеличения гидрофобных свойств, частицы носителя по изобретению имеют тенденцию адсорбировать меньше воды, что продемонстрировано в экспериментах по динамической сорбции пара, что делает их особенно полезными для приготовления сухих порошкообразных композиций, содержащих гидрофобные и/или гидрофильные активные ингредиенты.
Соответственно, изобретение относится к фармацевтической композиции в форме сухого порошка для ингаляции, содержащей частицы носителя по изобретению и один или более чем один активный ингредиент.
Активный ингредиент может быть фактически любым фармацевтически активным соединением, которое можно вводить ингаляцией сухих порошков.
В качестве примера, они могут быть выбраны из бета2-агонистов короткого и длительного действия, таких как тербуталин, репротерол, сальбутамол, салметерол, формотерол, кармотерол, милветерол, индакатерол, олодатерол, фенотерол, кленбутерол, бамбутерол, броксатерол, эпинефрин, изопреналин или гексопреналин или их солей и/или сольватированных форм; антихолинергических веществ короткого и длительного действия, таких как тиотропий, ипратропий, окситропий, оксибутинин, аклидиний, троспий, гликопирроний, или соединения, известные с кодами GSK 573719 и GSK 1160274, в форме солей и/или сольватированных форм; бифункциональных мускариновых антагонистов-бета2-агонистов (МАВА) для ингаляции, таких как GSK 961081; коритикостероидов короткого и длительного действия, таких как бутиксокарт, рофлепонид, флунизолид, будесонид, циклесонид, мометазон и его эфир, т.е. фуроат, флутиказон и его эфир, т.е. пропионат и фуроат, беклометазон и его эфир, т.е. пропионат, лотепреднол или триамцинолон ацетонид и его сольватированные формы; лейкотриеновых антагонистов, таких как андоласт, иралукаст, пранлукаст, имитродаст, сератродаст, зилейтон, зафирлукаст или монтедукаст; ингибиторов фосфодиэстеразы, таких как филаминаст, пикламиласт или рофлумиласт; ингибитора PAF (фактора агрегации тромбоцитов), такого как апафант, рорапафант или исрапафант; обезболивающих средств, таких как морфин, фентанил, пентазоцин, бупренорфин, петидин, тилидин или метадон; агентов, повышающих потенцию, таких как силденафил, алпростадил или фентоламин; или фармацевтически приемлемого производного или соли любого из вышеупомянутых соединений или классов соединений. Поскольку эти соединения имеют хиральные центры, то соединения могут быть использованы в оптически чистой форме или могут быть представлены в виде диастереоизомерных смесей или рацемических смесей.
В сухих порошкообразных композициях по настоящему изобретению также можно использовать белки, пептиды, олигопептиды, полипептиды, полиаминокислоты, нуклеиновые кислоты, полинуклеотиды, олигонуклеотиды и высокомолекулярные полисахариды.
Примеры макромолекул, которые используют в настоящем изобретении, представляют собой: альбумины (предпочтительно человеческий сывороточный инсулин; альбумин); BSA (бычий сывороточный альбумин); IgG; IgM; инсулин; GCSF (гранулоцитарный колониестимулирующий фактор); GMCSF (колониестимулирующий фактор гранулоцитов-макрофагов); LHRH (лютеинизирующий гормон-рилизинг фактор); VEGF (фактор роста эндотелия сосудов); hGH (человеческий гормон роста); лизоцим; альфа-лактоглобулин; основный фактор роста фибробластов; (bFGF); аспарагиназу; урокиназу-VEGF; химотрипсин; трипсин; стрептокиназу; интерферон; карбоангидразу; овальбумин; глюкагон; АСТН (аденокортикотропный гормон); окситоцин; фосфорилазу b; щелочную фосфатазу-секретин; вазопрессин; левотироксин; фатазу; бета-галактозидазу; паратиреоидный гормон, кальцитонин; фибриноген; полиаминокислоты (например, ДНКазу, альфа-I антитрипсин; полилизин, полиаргинин); ингибиторы ангиогенеза или проиммуноглобулины (например, антитела); соматостатин и аналоги; казеин; коллаген; желатин; соевый белок; и цитокины (например, интерферон, интерлейкин); иммуноглобулины; физиологически активные белки, такие как пептидные гормоны, цитокины, факторы роста, факторы, действующие в отношении сердечно-сосудистой системы, факторы, действующие в отношении центральной и периферической нервной системы, факторы, действующие в отношении гуморальных электролитов и кровяных веществ, факторы, действующие в отношении костей и скелета, факторы, действующие в отношении желудочно-кишечной системы, факторы, действующие в отношении иммунной системы, факторы, действующие в отношении дыхательной системы, факторы, действующие в отношении половых органов, и ферменты; гормоны и гормональные модуляторы, включая инсулин, проинсулин, С-пептид инсулина, гормон роста, паратиреоидный гормон, люлиберин (LH-RH), адренокортикотропный гормон (АСТН), амилин, окситоцин, лютеинизирующий гормон, (D-Tryp6)-LHRH, нафарелин ацетат, лейпролид ацетат, фолликулостимулирующий гормон, глюкагон, простатандины, эстрадиолы, тестостерон, и другие факторы, действующие в отношении половых органов, и их производные, аналоги и родственные соединения. В качестве аналогов указанного LH-RH могут быть упомянуты известные вещества, описанные, например, в патентах США №№4008209, 4086219, 4124577, 4317815 и 5110904; гемопоэтические или тромбопоэтические факторы включают среди прочего эритропоэтин, гранулоцитарный колониестимулирующий фактор (G-CSF), колониестимулирующий фактор гранулоцитов-макрофагов (GM-CSF) и колониестимулирующий фактор макрофагов (M-CSF), препарат фактора пролиферации лейкоцитов, тромбопоэтин, фактор стимуляции пролиферации тромбоцитов, фактор пролиферации (стимуляции) мегакариоцитов, и фактор VIII; ферменты и кофакторы ферментов, включая панкреазу, L-аспарагиназу, гиалуронидазу, химотрипсин, трипсин, стрептокиназу, урокиназу, панкреатин, коллагеназу, трипсиноген, химотрипсиноген, плазминоген, стрептокиназу, аденилциклазу и супероксиддисмутазу (SOD); вакцины, включая вакцины против гепатита В, MMR (корь, паротит и краснуха) и полиомиелита; факторы роста, включая факторы роста нервов (NGF, NGF-2/NT-3), эпидермальный фактор роста (EGF), фактор роста фибробластов (FGF), инсулиноподобный фактор роста (IGF), трансформирующий фактор роста (TGF), тромбоцитарный фактор роста (PDGF) и гепатоцитарный фактор роста (HGF); факторы, действующие в отношении сердечно-сосудистой системы, включая факторы, контролирующие давление крови, артериосклероз и т.д, такие как эндотелины, ингибиторы эндотелинов, антагонисты эндотелинов, ингибиторы эндотелинпродуцирующего фермента, вазопрессин, ренин, ангиотензин I, ангиотензин II, ангиотензин III, ингибитор ангиотензина I, антагонист рецептора ангиотензина II, атриальный натрийуретический пептид (ANP) и антиаритмический пептид; факторы, действующие на центральную и периферическую нервную систему, включая опиоидные пептиды (например, энкефалины, эндорфины), нейротропный фактор (NTF), кодируемый геном кальцитонина пептид (CGRP), тиреолиберин (TRH), соли и производные, и нейротензин; факторы, действующие в отношении желудочно-кишечной системы, включая секретин и гастрин; факторы, действующие в отношении гуморальных электролитов и кровяных веществ, включая факторы, контролирующие гемагглютинацию, уровень холестерина в плазме крови или концентрации иона металла, такие как кальцитонин, апобелок Е и гирудин. Ламинин и молекула межклеточной адгезии 1 (ICAM 1) представляют собой примеры факторов клеточной адгезии; факторы, действующие в отношении почек и мочевого тракта, включая вещества, регулирующие функцию почек, такие как мозговой натрийуретический пептид (BNP), и уротензин; факторы, действующие в отношении органов чувств, включая факторы, контролирующие чувствительность различных органов, такие как вещество Р; химиотерапевтические агенты, такие как паклитаксел, митомицин С и доксорубицин; Факторы, действующие на иммунную систему, включая факторы, контролирующие воспаление и злокачественные новообразования, и факторы, атакующие инфицирующие микроорганизмы, такие как хемотаксические пептиды; и встречающиеся в природе, химически синтезированные или рекомбинантные пептиды или белки, которые могут действовать в качестве антигенов, таких как кедровая пыльца и пыльца амброзии, и эти вещества сами по себе или вместе со связанными гаптенами, или вместе с адъювантом.
Композиции, содержащие бета2-агонист, антихолинергический агент или кортикостероид для ингаляции, сам по себе или в любой комбинации, составляют конкретные воплощения изобретения.
Эти активные вещества могут присутствовать в виде их конкретной соли и/или сольватированной форме, такие как бета2-агонисты, например дигидрат фумарата формотерола, сульфат сальбутамола, ксинафоат салметерола, гидрохлорид милветерола и малеат индакатерола; антихолинергические агенты, например как гликопиррония бромид в форме (3R.2R') энантиомера или рацемической смеси (3S.2R') и (3R.2S'), тиотропия бромид, окситропия бромид, ипратропия бромид, оксибутинина хлорид, аклидиния бромид или троспия хлорид.
Кортикостероиды для ингаляции могут быть представлены в конкретной форме эфира и/или его сольватированной форме, например, дипропионат беклометазона или его форма моногидрат, пропионат флутиказона, фуроат флутиказона или фуроат мометазона.
В конкретном воплощении предпочтительными являются композиции, содержащие форму дигидрат фумарата формотерола и его комбинации с кортикостероидами для ингаляции и/или антихолинергическими агентами.
В еще одном конкретном воплощении предпочтительной является соль вилантерола или индакатерола и ее комбинации с кортикостероидами для ингаляции и/или антихолинергическими агентами.
Для вдыхаемого активного вещества, т.е. способного проникать в глубокие отделы легких, такие как терминальные и респираторные бронхиолы, и альвеолярные ходы и мешочки, оно должно быть представлено в форме частиц, имеющих средний диаметр (измеренный как средний массовый диаметр) не более чем приблизительно 10 микрон, например от 1 до 10 микрон, и предпочтительно от 1 до 6 микрон. Такие микрочастицы могут быть получены способом, известным per se, например, путем микронизации, контролируемого осаждения из выбранных растворителей, сушки распылением, из сверхкритических жидкостей, или в соответствии со способами, описанными в WO 2004/073827, WO 2008/155570, WO 2008/114052 и WO 2010/007447.
Терапевтически эффективное количество активного вещества может варьировать в широких пределах в зависимости от природы активного вещества, типа и тяжести состояния, которое лечат, и состояния пациента, нуждающегося в лечении.
Как правило, частицы активного вещества добавляют к частицам носителя по изобретению путем смешивания. Частицы могут быть смешаны с использованием барабанного смесителя (например, смесителя Turbula) в соответствии со способами, известными в области техники.
В частности, скорость вращения смесителя и время смешивания должны быть скорректированы специалистом в данной области техники, чтобы получить хорошую однородность распределения активного ингредиента в композиции.
Превосходной однородности распределения активного ингредиента достигают, когда указанный активный ингредиент имеет распределение размеров частиц, при котором не более чем 10% частиц имеют объемный диаметр [d(v0,1)] меньше чем 0,8 микрон, предпочтительно меньше чем 0,9 микрон, более предпочтительно меньше чем 1 микрон, и не больше чем 50% частиц имеют объемный диаметр [d(v0,5)] меньше чем 1,7 микрон, предпочтительно меньше чем 1,9 микрон, более предпочтительно меньше чем 2 микрона.
Сухая порошкообразная композиция для ингаляции, содержащая частицы носителя по изобретению, может быть использована с любым сухим порошковым ингалятором.
Сухие порошковые ингаляторы могут быть главным образом разделены на: 1) ингаляторы, содержащие разовую дозу (однодозовые), для введения разовых отдельных доз активного соединения; 2) мультидозовые ингаляторы, содержащие предварительно отмеренные дозы, или ингаляторы с резервуаром, предварительно загруженные активным действующим веществом в количествах, достаточных для более длительных циклов лечения.
Сухие порошкообразные композиции могут быть представлены в стандартной лекарственной форме. Сухие порошкообразные композиции для местного введения в легкое путем ингаляции могут быть представлены, например, в капсулах и картриджах, например, из желатина, или блистерах, например, из ламинированной алюминиевой фольги, для использования в ингаляторе или инсуффляторе.
Сухая порошкообразная композиция для ингаляции по изобретению особенно подходит для мультидозовых сухих порошковых ингаляторов, содержащих резервуар, из которого отдельные терапевтические дозы могут быть отобраны по необходимости путем приведения устройства в действие.
Предпочтительное мультидозовое устройство представляет собой ингалятор, описанный в WO 2004/012801.
Другие мультидозовые устройства, которые могут быть использованы, представляют собой, например DISKUS™ от GlaxoSmithKline, TURBOHALER™ от AstraZeneca, TWISTHALER™ от Schering и CLICKHALER™ от Innovata.
В качестве представленных на рынке однодозовых устройств могут быть упомянуты ROTOHALER™ от GlaxoSmithKline и HANDIHALER™ от Boehringer Ingelheim.
Следующие примеры подробно иллюстрируют изобретение.
ПРИМЕРЫ
Пример 1 - Приготовление носителя - Исследование условий обработки
Имеющийся в продаже моногидрат альфа-лактозы просеивали с получением образца, имеющего частицы, обладающие диаметром в диапазоне от 90 до 150 мкм.
Приблизительно 450 г указанного моногидрата альфа-лактозы, смешанного с 0,5% масс/масс, стеарата магния, загружали в стационарный конический сосуд объемом 1 литр лабораторного аппарата модели CYCLOMIX™ (Hosokawa Micron Ltd).
Способ осуществляли с варьированием различных параметров (скорость вращения, время обработки).
Моногидрат альфа-лактозы и смесь моногидрата альфа-лактозы и 0,5% стеарата магния, обработанные при 2000 об/мин в течение 15 минут, также обрабатывали с целью сравнения.
Полученные частицы собирали и определяли физико-химические свойства.
В частности, определяли следующие характеристики:
1) кристалличность с использованием порошковой рентгеновской дифрактометрии (XRD);
2) стеарат магния в порошке с использованием измерений путем термогравиметрической-дифференциальной сканирующей калориметрии (ATG-DSC) и инфракрасного анализа с преобразованием Фурье (FT-IR);
3) поверхностный аспект с использованием сканирующего электронного микроскопа (SEM);
4) распределение размера частиц (PSD) путем лазерной дифракции в аппарате Мальверна;
5) угол контакта с водой с использованием метода покоящейся капли, где порошок находится в форме диска, полученного путем прессования (способ с диском из прессованного порошка) в соответствии с методикой, о которой сообщалось выше в описании;
6) адсорбцию воды при увеличении процента относительной влажности путем экспериментального определения динамической сорбции пара (DVS);
7) свойства текучести (текучесть) в соответствии с индексом Kарра. Перечень проведенных экспериментов представлен в таблице 1.
|
Пример 2 - Результаты определения характеристик композиций из Примера 1
Анализ XRD, осуществленный на образце, полученном при более жестких условиях (1500 об/мин в течение 15 минут) тестирования, указывает на то, что лактоза остается кристаллической.
Маркерная полоса при 2850 см-1 в спектре FT-IR также подтверждает присутствие в образцах стеарата магния.
Типичные картины SEM представлены на фиг.2.
Из графических материалов понятно, что обработка частиц носителя, смешанных с 0,5 масс/масс, стеарата магния при 1500 об/мин в течение 5, 10 и 15 минут, по существу не изменяет размер частиц.
Это же обнаружено для скорости вращения 1000 об/мин (данные не представлены).
Наоборот, при 2000 об/мин частицы лактозы начинают разрушаться, и наблюдают уменьшение размера частиц вместе с образованием значительного количества тонкодисперсных частиц.
Наблюдения, описанные выше, подтверждаются результатами анализа PSD, представленными в таблице 2. Эти результаты представлены в виде среднего значения для трех определений.
В таблице 2 также приведены значения угла контакта с водой и соответствующая степень поверхностного покрытия, рассчитанная в соответствии с уравнением Касси-Бэкстера.
Указанное уравнение применяли к экспериментальным значениям в предпоследней колонке, приведенной в таблице 2, с использованием референсных значений для одного стеарата магния и одного моногидрата альфа-лактозы.
Вариабельность в примерах в терминах стандартного отклонения экспериментальных значений во всех случаях была меньше чем ±10%, типично ±5%.
Результаты демонстрируют, что степень поверхностного покрытия во всех случаях была больше чем 85%.
Кроме того, из экспериментов DVS понятно, что увеличенная гидрофобность частиц носителя, покрытых стеаратом магния, по сравнению с гидрофобностью лактозы, делает их менее склонными к адсорбции воды из влаги окружающей среды (смотри фиг.3).
|
Значения плотностей и соответствующий индекс Карра для 5, 10 и 15 минут приведены в таблице 3.
|
Все образцы демонстрируют хорошие свойства текучести, поскольку имеют индекс Карра 5-8, и следовательно значительно ниже чем 25, что обычно принимают в качестве порогового значения.
Пример 3 - Приготовление других носителей
Носители по изобретению готовят, как описано в примере 1, но смешивая моногидрат альфа-лактозы с 0,3% масс/масс, стеарата магния при 1000 об/мин, и с 0,5% масс/масс, стеарата магния при 500 об/мин, при различных значениях времени смешивания. Определяли распределение размеров частиц, текучесть и угол контакта с водой для полученных образцов.
Результаты определения углов контакта с водой приведены в таблице 4.
|
Пример 4 - Ингалируемые сухие порошкообразные композиции BDP (дипропионат беклометазона), содержащие носитель по изобретению.
Носители готовили, как описано в примерах 1 и 3, при скорости вращения 1000 об/мин в течение 15 минут.
Микронизированный дипропионат беклометазона получают путем обычного измельчения в струйной мельнице.
Порошкообразную композицию по изобретению готовят с композицией, приведенной в таблице 5.
|
Окончательную композицию заполняли в мультидозовый сухой порошковый ингалятор, описанный в WO 2004/012801.
Другие порошкообразные композиции по изобретению готовят с композициями, приведенными в таблицах 6 и 7.
|
|
Аэрозольные характеристики указанных композиций оценивали с использованием многостадийного жидкостного импинджера (MSLI) в соответствии со способом, описанным в Европейской фармакопее, 2е издание, 1995, раздел V.5.9.1, стр.15-17.
Результаты в терминах доставляемой дозы (DD), массы тонкодисперсных частиц (FPM), фракции тонкодисперсных частиц (FPF) и масс-медианного аэродинамического диаметра (MMAD) представлены в таблице 8 (среднее для трех определений ±S.D. (стандартное отклонение)).
|
FPF, представляющая собой индекс вдыхаемой фракции, оказалась превосходной, свидетельствуя о том, что композиции, содержащие носители по изобретению, способны обеспечить хорошие аэрозольные характеристики.
Указанные композиции также приводят к значительно более высокой FPF по сравнению с аналогичными композициями, содержащими носитель, приготовленными путем смешивания моногидрата альфа-лактозы и стеарата магния в смесителе Turbula при 32 об/мин в течение 120 минут в соответствии с патентом США №6528096.
Пример 5 - Ингалируемая сухая порошкообразная композиция, содержащая фумарат формотерола в качестве носителя по изобретению
Носитель готовили, как описано в примере 1, при скорости вращения 1000 об/мин в течение 10 минут.
Микронизированный дигидрат фумарата формотерола получали измельчением в обычной струйной мельнице.
Порошкообразную композицию по изобретению готовили с композицией, представленной в таблице 9.
Окончательную композицию заполняли в мультидозовый сухой порошковый ингалятор, описанный в WO 2004/012801.
|
Аэрозольные характеристики указанных композиций оценивали с использованием многостадийного жидкостного импинджера (MSLI) в соответствии со способом, описанным в Европейской фармакопее, 2е издание, 1995, раздел V.5.9.1, стр.15-17.
Результаты в терминах доставляемой дозы (DD), массы тонкодисперсных частиц (FPM), фракции тонкодисперсных частиц (FPF) и масс-медианного аэродинамического диаметра (MMAD) представлены в таблице 10 (среднее для трех определений ±S.D. (стандартное отклонение)).
|
Значение FPF оказалось удовлетворительным.
Указанные композиции также приводят к значительно более высокой FPF по сравнению с аналогичными композициями, содержащими носитель, приготовленными путем смешивания моногидрата альфа-лактозы и стеарата магния в смесителе Turbula при 32 об/мин в течение 120 минут в соответствии с патентом США №6528096.
Пример 6 - Ингалируемая сухая порошкообразная композиция, содержащая срумарат формотерола + BDP и носитель по изобретению
Носитель готовили, как описано в примере 1, при скорости вращения 1000 об/мин в течение 10 минут.
Микронизированный дипропионат беклометазона и дигидрат фумарата формотерола получали обычным измельчением.
Порошкообразную композицию по изобретению готовили с композицией, представленной в таблице 11.
Окончательную композицию заполняли в мультидозовый сухой порошковый ингалятор, описанный в WO 2004/012801.
|
Пример 7 - Ингалируемая сухая порошкообразная композиция, содержащая гликопиррония бромид и носитель по изобретению.
Носитель готовят, как описано в примере 1, при скорости вращения 1000 об/мин в течение 15 минут.
Микронизированный гликопиррония бромид в форме рацемической смеси (3S.2R') и (3R.2S') получают, как описано в WO 2010/007447.
Порошкообразную композицию по изобретению готовили с композицией, представленной в таблице 12.
Окончательную композицию заполняли в мультидозовый сухой порошковый ингалятор, описанный в WO 2004/012801.
|
Пример 8 - Определение вдыхаемой фракции стеарата магния
Благоприятные свойства носителя по изобретению проиллюстрированы в следующем эксперименте, в котором исследовали высвобождение тонкодисперсных частиц Mg из композиции.
Образцы носителей по изобретению, описанные в примере 1, приготовленные путем смешивания моногидрата альфа-лактозы с 0,1%, 0,3% масс/масс, или 0,5% масс/масс, стеаратом магния в аппарате CYCLOMIX™ при 1000 об/мин в течение 10 минут, заполняли в мультидозовый сухой порошковый ингалятор, описанный в WO 2004/012801.
Для сравнения также готовили холостой образец, а также носители, приготовленные путем смешивания моногидрата альфа-лактозы с 0,3% масс/масс, или 0,5% масс/масс, стеаратом магния в смесителе Turbula при 32 об/мин в течение 120 минут в соответствии с патентом США №6528096.
Микронизированный дипропионат беклометазона (BDP) добавляли, как представлено в примере 4.
Вдыхаемую фракцию стеарата магния оценивали с использованием двухстадийного жидкостного импинджера (TSI, Copley Instruments Ltd, UK) в соответствии со способом, описанным в FU IX, 4th Supplement, 1996 и применением потока воздуха 60 л/мин.
Предельное значение аэродинамического диаметра (dae) для осаждения в нижней разделяющей камере составляет 6,4 микрон. Частицы с большим dae осаждаются на стадии 1, тогда как частицы с меньшим dae на стадии 2.
Десять доз по 15-18 мг вводили в каждом эксперименте.
После распыления в виде аэрозоля аппарат TSI снимали, и частицы, осевшие в двух отдельных камерах, собирали с использованием смеси вода:ацетонитрил:НСl(2 н.) 40:40:20 об./об./об. и доводили до объема 50 мл.
Образцы прокаливали в микроволновой печи, и количество Mg определяли при помощи пламенной атомной абсорбционной спектроскопии с использованием прибора Perkin-Elmer Analyst 800 в соответствии со стандартными способами, известными в области техники.
Оказалось, что предел обнаружения (LOD) составляет 0,062 мг/мл.
Вдыхаемую фракцию (FPF) стеарата магния рассчитывали по отношению вдыхаемой дозы и доставляемой (высвобожденной) дозы. Доставляемую дозу рассчитывают по суммарному осаждению в аппарате, тогда как вдыхаемую дозу рассчитывают по осаждению на стадии 2, соответствующую частицам с dae≤6,4 микрон.
Результаты представлены в таблице 13 (среднее ± .S.D.).
|
Указания: P.M Mg=24,31; P.M. MgSt 591,24
Понятно, что процент вдыхаемых частиц MgSt, доставляемых носителем по изобретению, значительно ниже, чем процент, доставляемый носителем, используемым для сравнения.
Последнее указывает на то, что указанная добавка в гораздо меньшей степени освобождается от носителя по изобретению во время ингаляции, поскольку адгезирована сильнее к поверхностям частиц носителя, и, следовательно, в меньшей степени доступна для системной абсорбции.