Результат интеллектуальной деятельности: СПОСОБ ВЫДЕЛЕНИЯ НУКЛЕИНОВЫХ КИСЛОТ
Вид РИД
Изобретение
Изобретение относится к молекулярной биологии, вирусологии и медицине, является способом выделения нуклеиновых кислот из крови, ткани и мазков человека и животных. Выделенная данным способом НК может быть использована при постановке полимеразной цепной реакции, также в практической медицине для диагностики наследственных заболеваний человека, судебной медицине, генной дактилоскопии, диагностике возбудителей инфекционных заболеваний человека и животных, в том числе заболеваний передающихся половым путем.
В основе диагностики и лечения многих заболеваний человека и животных лежат идентификация возбудителя и определение этиологии заболевания. Постановка полимеразной цепной реакции необходима в следующих случаях: для уточнения диагноза, в силу наличия у многих заболеваний серонегативного периода в ИФА, выявления наследственной патологии, предрасположенности к тому или иному заболеванию. ПЦР исследование отличается высокой чувствительностью и специфичностью, возможностью автоматизации процесса. Метод ПЦР включает в себя следующие основные этапы: выделение нуклеиновых кислот - ДНК и РНК, амплификация и анализ результатов. В основе ПЦР диагностики лежит многократное увеличение определенного участка последовательности нуклеиновых кислот при помощи фермента - термостабильной ДНК-полимеразы Taq-полимеразы. В случае анализа РНК этому этапу предшествует этап синтеза кДНК на матрице РНК с помощью РНК-полимеразы. Для улучшения чувствительности и специфичности ПЦР-анализа необходимо качественное и быстрое выделение и очистка нуклеиновых кислот - НК обеспечивающая минимальные потери материала. Проблема качественного получения НК для анализа наиболее остро стоит в случае с РНК, из-за ее быстрого лизиса РНК-азами. Учитывая вышесказанное, разработка нового метода для выделения НК является актуальной и практически значимой задачей.
В настоящее время существует несколько способов получения НК. Так для получения НК используются следующие методы:
1. Для выделения ДНК
Известен способ подготовки биологического материала для ДНК-ПЦР генамплификационной диагностики путем лизиса образца, многократной экстракции водонасыщенным фенолом или смесью фенол-хлороформ и осаждение ДНК этанолом в присутствии ацетата натрия (Мазин А.В. и др. Методы молекулярной генетики и генной инженерии. Новосибирск: Наука, 1990, с. 13-14). Основными недостатками данной методики является использование токсичных агентов, требующих особых условий работы, хранения и утилизации, длительностью выделения 3,5-4 часа в связи с переосаждением целевого продукта, низким выходом 25-30%.
2. Для выделения РНК
Основным способом выделения РНК является фенохлоформная экстракция по Хромински (Chomezynski P., Mackey К. Single-step method of total RNA isolation by acid Guanidine-Phenol extraction // Organelles and cellular structures. 1996. V. 10. P. 221-224).
100 мкл исследуемого образца смешивается с 600 мкл лизирующего раствора 4 M гуанидин изотиоционат, 50 мM цитрат натрия, 0.5% лаурил саркозилат, 100 мM µ-меркаптоэтанол, после чего добавляется 60 мкл 2 M NaAc pH=4.0, 600 мкл водонасыщенного фенола, тщательно перемешивается пипетированием. К полученной смеси приливается 120 мкл хлороформа, и инкубируется на льду в течение 10 минут. Смесь центрифугируется 15 минут при 12000 g. Водная (верхняя) фазу отбирается в отдельные пробирки, смешивается с равным объемом хлороформа, тщательно перемешивается и инкубируется при комнатной температуре 30 минут. Раствор отцентрифугировать 15 минут при 12000 g. Осадок двукратно промывается 80% этанолом, высушивается. После растворения РНК можно использовать для постановки обратной транскрипции. Основными недостатками данной методики является использование токсичных агентов, требующих особых условий работы, хранения и утилизации, а также с длительностью протокола 3 часа в связи с переосаждением целевого продукта, а также низким выходом около 7%.
3. Выделение ДНК и РНК
Выделение ДНК/РНК методом сорбции на силике. 100 мкл исследуемого образца смешивается со 450 мкл лизирующего раствора 6 M Guanidine thiocyanate; 50 мМ NaAc pH=5.4; 5 мМ EDTA; 5% Triton Х-100, после чего в каждую пробирку добавляется по 25 мкл 0,1% силики. Сорбент последовательно отмывают раствором 4 M гуанидинтиоционата, дважды 70%-ным этанолом, затем ацетоном и после чего проводят элюцию ДНК с сорбента. Супернатант содержит очищенные РНК и ДНК. Пробы готовы к постановке реакции обратной транскрипции и ПЦР. (см. Boom R., Sol С.J. А et al. Rapid and simple method for purification of nucleic acid. J. Clin. Microbiol., 1990, v. 28, N 3, p. 495-503). Основным недостатком данного метода является сложность подготовки сорбента и большое количество отмывок получаемого материала, кроме того, использование данного метода для получения нуклеиновых кислот требует использования дополнительного оборудования шейкера.
Наиболее близким к предлагаемому методу является следующий.
Осадок клеток ресуспендируется в лизирующем растворе 3 M натрий изотиоционат, 50 мМ Трис-HCl, pH 8.0, 15 мМ ЭДТА, pH 8.0, 1% N-лаурилсаркозил, 1% поливинилпирролидон, 10 мМ дитиотриэтол и 0.6 г Ballotini бус 0.1 мм. Образец гомогенизируется в течение 1-3 мин, из супернатанта прецитипитируется НК при помощи изопропанола в течение 20 мин на льду, после чего центрифугируется в течение 20 мин при 14,000 × g, супернатант удаляется и осадок промывается дважды этанолом, высушивается и ресуспендируется в буфере (см. S. Mcllroy, К. Porter, R. J. Seviour, and D. Tillet Appl / Environ Microbiol. 2008 November; 74(21):6806-6807). Данный метод предназначен для выделения НК из растворов с высокой концентрацией 10-15 мг биомассы, при использовании данного метода при выделении НК из клинических образцов характеризующихся низкой концентрацией НК, поливинилпирролидон ингибирует ферментативные реакции, в том числе обратную транскрипцию.
Задача изобретения - упрощение способа выделения НК из крови и тканей человека и животных, что весьма актуально при проведении массовых анализов различных образцов в процессе диагностики инфекционных заболеваний.
Существенным отличием заявляемого способа является использование линейного полиакриламида (ЛПААГ) в качестве соосадителя для очистки и концентрирования НК. ЛПААГ не ингибирует большинство ферментативных реакций, что позволяет использовать его для выделения НК, которые служат матрицей в реакциях полимеризации. Линейный 0,05% полиакриламид связывается с ДНК и хорошо осаждается спиртами, что повышает выход НК из образца.
Способ осуществляют следующим образом:
Вносят 300 мкл лизирующего раствора в пластиковую пробирку емкостью 1,5 мл, не касаясь ее края. Добавляют 100 мкл исследуемого образца и, плотно закрыв крышку пробирки, перемешивают на вортексе в течение 3-5 сек. Термостатируют пробу 15 мин при 65°C, осаждают конденсат центрифугированием при 1000 об/мин в течение 3-5 сек. Добавляют 500 мкл реагента для преципитации НК и перемешивают пробу на вортексе в течение 3-5 сек. Центрифугируют пробирку при 14000 об/мин в течение 15 мин. Не задевая осадок, полностью удаляют надосадочную жидкость отдельным наконечником из каждой пробирки. Добавляют к осадку 500 мкл промывочного раствора №1 и 3-5 раз аккуратно переворачивают пробирку. Центрифугируют пробирку при 14000 об/мин в течение 5 мин. Не задевая осадок, полностью удаляют надосадочную жидкость отдельным наконечником из каждой пробирки. Добавляют к осадку 300 мкл промывочного раствора №2 и 3-5 раз аккуратно переворачивают пробирку. Центрифугируют пробирку при 14000 об/мин в течение 5 мин. Не задевая осадок, полностью удаляют надосадочную жидкость (отдельным наконечником из каждой пробирки). Открывают крышку пробирки и высушивают осадок при 65°C в течение 5 мин. Добавляют к осадку 50 мкл буфера для растворения НК и прогревают пробу при 65°C в течение 10 мин. Осаждают капли центрифугированием пробирок при 1000 об/мин в течение 3-5 сек. Готовый препарат используют для постановки полимеразной цепной реакции.
Составы смесей для выделения НК следующие:
Лизирующий буфер
гуанидин тиоцианат 4 M,
NaAc pH=5.2 150 мМ,
EDTA 25 мМ,
Triton Х-100 5%,
b-MeEtOH* 0.1 M,
линейный ПААГ 0.05%
Буфер для преципитации
NaAc pH=5.2 400 мМ,
изопрапанол 90%
Промывочный раствор 1
Этанол 70%
Промывочный раствор 2
Ацетон 70%
Пример 1. Приготовление линейного политакриламида
Линейный полиакриламид ЛПААГ хорошо осаждается спиртом, что позволяет использовать его в качестве соосадителя для очистки и концентрирования ДНК. ЛПААГ не ингибирует большинство ферментативных реакций. Для осаждения следует брать 2-5 мкл 0.5% раствора (в зависимости от объема осаждаемой ДНК).
Приготовить 10% AA (без МБАА) в 40 мМ TrisHCl, 20 мМ NaAc, 1 мM EDTA, pH 7.8. Добавить 1/100 V 10% персульфата аммония и 1/1000 ТЕМЕД, 30 мин. Осадить 2.5 V EtOH. Центрифугировать как для осаждения ДНК. Осадок промыть 70% EtOH. Растворить с концентрацией 10 мкг/мкл 1%.
Пример 2. Обнаружение возбудителя боррелиоза
Клеща вносили в 300 мкл лизирующего раствора и прокалывали пластиковым носиком. Пробу термостатировали 15 мин при 65°C, конденсат осаждали центрифугированием при 1000 об/мин в течение 3-5 сек, после чего добавляли 500 мкл реагента для преципитации НК и пробу перемешивали на вортексе в течение 3-5 сек. Пробирку центрифугировали при 14000 об/мин в течение 15 мин. Не задевая осадок, полностью удаляли супернатант. Осадок промывали 500 мкл раствора 1, затем после центрифугирования при 14000 об/мин в течение 5 мин, осадок промывали раствором 2. Пробу центрифугировали при 14000 об/мин в течение 5 мин. Не задевая осадок, полностью удаляли супернатант, пробирки высушивали при 65°C в течение 5 мин. К осадку добавляли 50 мкл буфера для растворения НК и прогревали пробу при 65°C в течение 10 мин. Полученный препарат использовали для постановки ПЦР реакции в режиме реального времени на амплификаторе iqCycler4 Bio-rad. В качестве референс метода использовали выделение ДНК фенол хлороформной экстракцией и медом сорбции на силике (табл.1).
|
Различия в выявляемости возбудителя клещевого боррелиоза статистически достоверны отличия метода переосаждения из раствора с ЛПААГ и метода сорбции на силике p<0.05, выделения ДНК методом экстракции фенол-хлороформом и методом сорбции на силике p<0.05. Различия в выявляемости методом переосаждения из раствора с хаотропными агентами и выделение ДНК методом экстракции фенол-хлороформом статистически не достоверны.
Пример 3
Выделение РНК для обнаружения вируса клещевого энцефалита Пробы обрабатывали так, как написано в примере 2. Было проведено сравнение эффективность выделения РНК методом сорбции на силике, и методом переосаждения из раствора с ЛПААГ, и экстракцией по Хромински для выделения РНК (Таб. 2).
Проведенный эксперимент показал статистически значимые отличия в выявляемости вируса клещевого энцефалита между методом переосаждения из раствора с ЛПААГ и методом сорбции на силике p<0.05, оценено при помощи критерия Хи-квадрат с использованием программы Statistika, а также выделения РНК по Хромински и методом сорбции на силике p<0.05.
|
Различия в выявляемости методом переосаждения из раствора с ЛПААГ и выделение РНК по Хромински статистически не значимы.
Пример 4
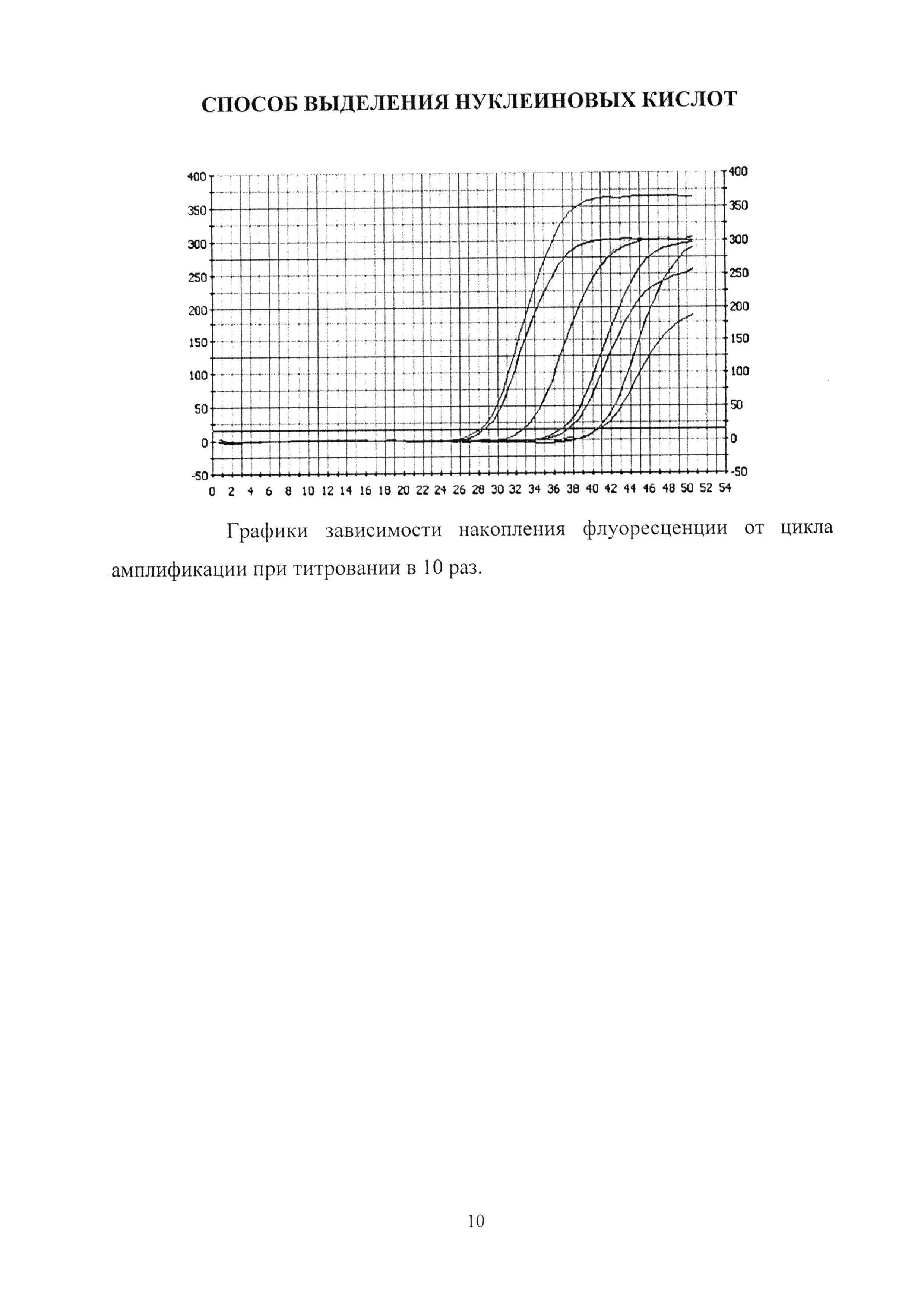
Была проведена серия экспериментов по выделению РНК из культуральной среды РНК-содержащего фага MS2. Выделение РНК проводилось одновременно тремя различными методами фенол-хлоформная экстракция по Хроминки, при помощи набора для выделения РНК «RNA-Ss», Россия и переосаждением РНК из раствора с ЛПААГ. Критериями сравнения являлись чувствительность и воспроизводимость результатов эксперимента. Наиболее предпочтительный метод выделения РНК определяли при помощи титрования, табл. 3.
Эффективность амплификации при выделении РНК методом фенол-хлороформной экстракции составила 1.84 (92%), при выделении комплектом реагентов с ЛПААГ - 1.88 (94%).
|
На рисунке показаны графики зависимости накопления флуоресценции от цикла амплификации для внутреннего контрольного образца при титровании в 10 раз при использовании комплекта реагентов с ЛПААГ.
Из полученных данных видно, что с помощью сравнения значений пороговых циклов при выделении РНК различными методами можно сделать вывод, что наиболее предпочтительными методами являются выделение РНК методом фенол - хлороформной экстракции и комплектом реагентов с ЛПААГ. Однако, метод выделение РНК методом фенол-хлороформной экстракции является достаточно трудоемким и тем самым неудобным для технологического применения. При выделении РНК набором для выделения «RNA-Ss» никаких достоверных результатов получено не было.
Как видно из предложенных примеров, обработка биологических материалов и их ПЦР-анализ позволяют быстро и надежно выявлять вирусо-и бактерионосительство не только у людей, в том числе клинически здоровых серонегативных лиц, но и проводить выделение возбудителей заболеваний в организмах-переносчиках (например в клещах).
Таким образом, применение подготовки биологических материалов предложенным способом позволяет ускорить время исследования без снижения чувствительности ПЦР теста. Чувствительность и специфичность ПЦР близки к предельно возможной, а результаты получают в течение одного дня. Данная обработка позволяет использовать для ПЦР практически любой материал: целых насекомых, гистологические препараты, сухие пятна крови и тканей, количество исследуемого материала во многих случаях составляет несколько микролитров.
Способ выделения нуклеиновых кислот с использованием изопропанола на этапе преципитации и осаждения ДНК, отличающийся тем, что при начальной обработке биологического материала используют гидрохлорид гуанидина и детергент в натрий-ацетатном буфере, а в качестве соосадителя нуклеиновых кислот применяют 0,05% линейный полиакриламид.