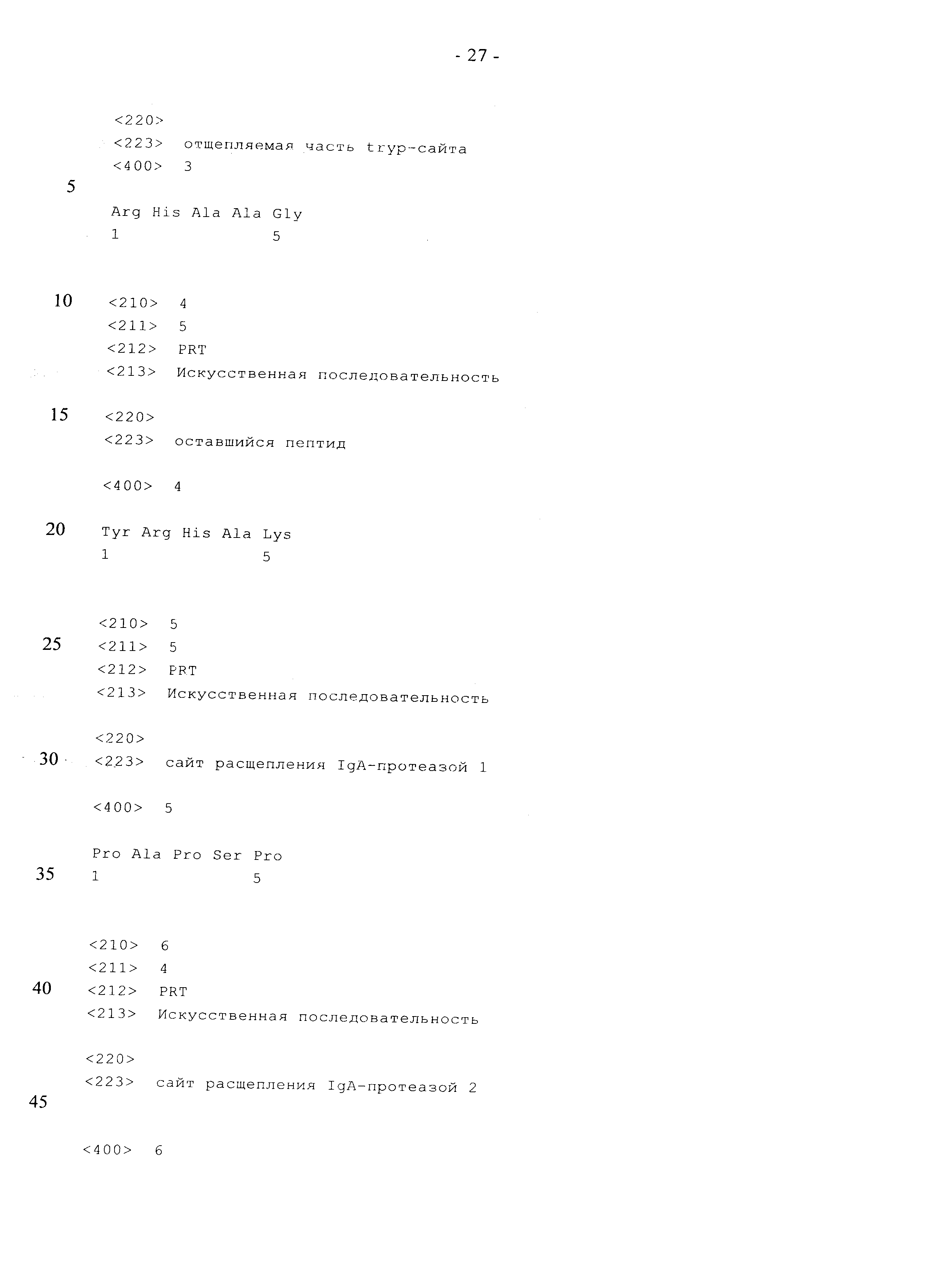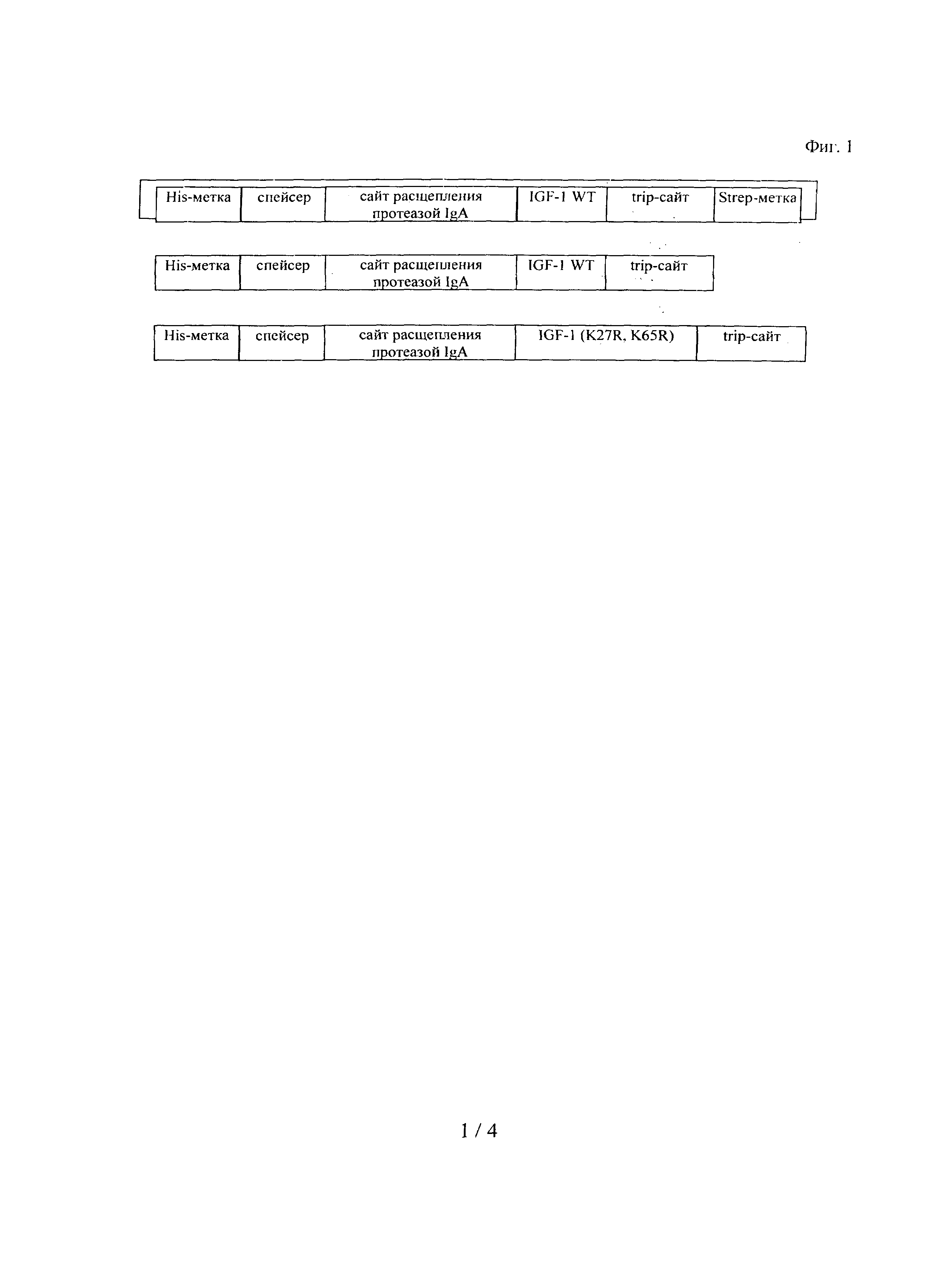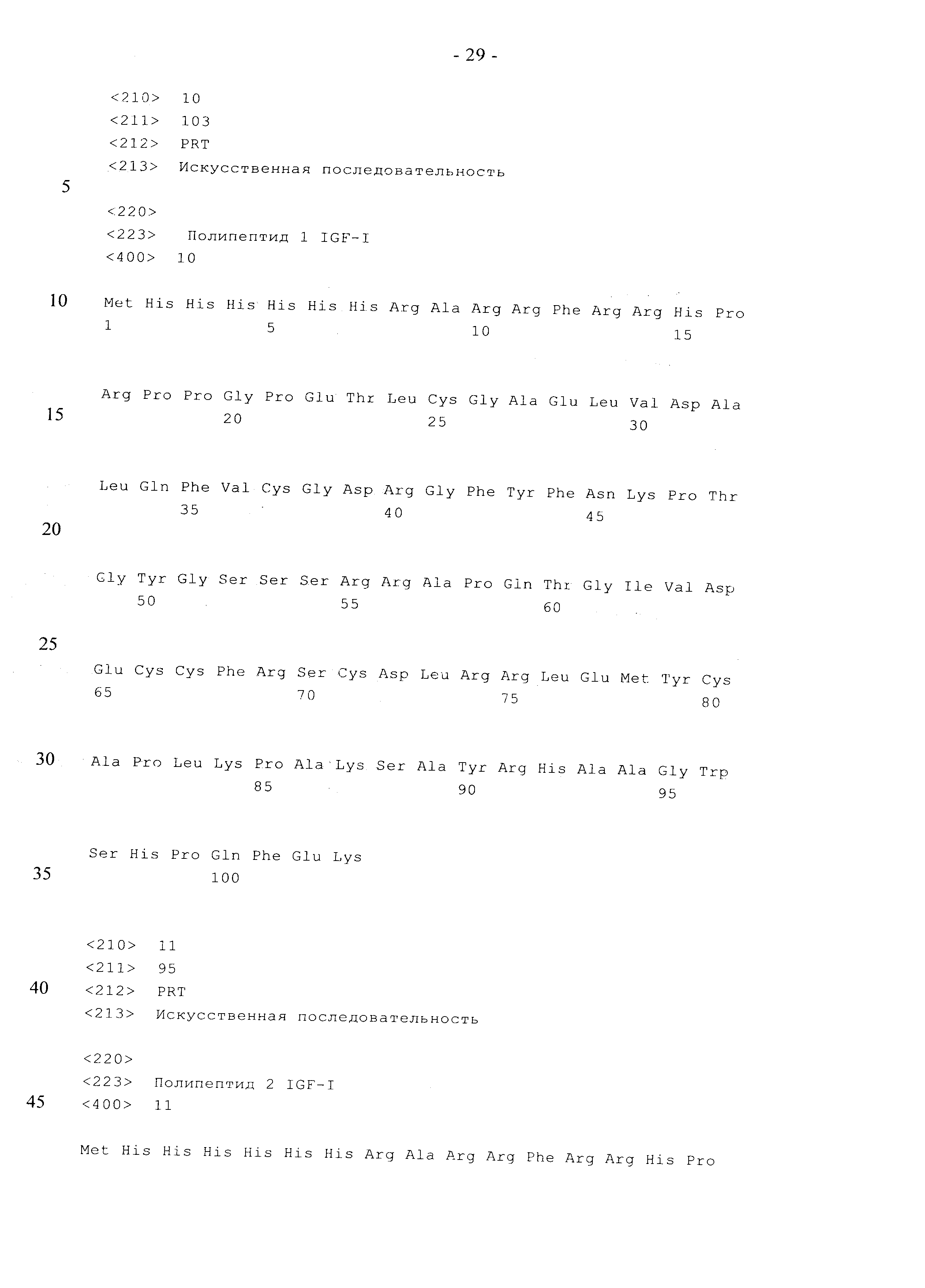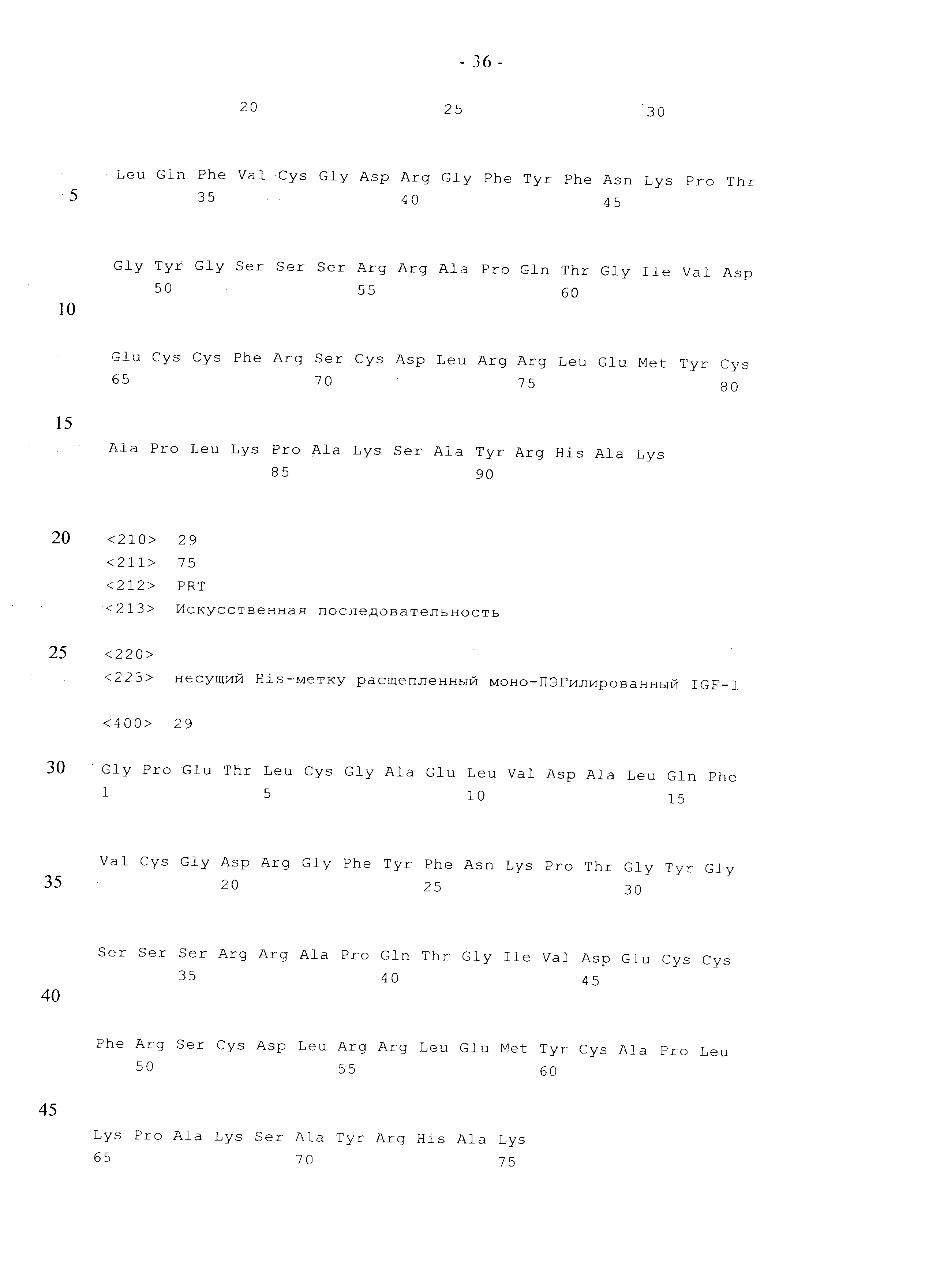Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДА, КОНЪЮГИРОВАННОГО С ПОЛИ(ЭТИЛЕНГЛИКОЛЕВЫМ) ФРАГМЕНТОМ, НУКЛЕИНОВАЯ КИСЛОТА И СЛИТЫЙ ПОЛИПЕПТИД, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ПРИМЕНЕНИЯ В СПОСОБЕ
Вид РИД
Изобретение
В настоящем изобретении предложен способ избирательного ферментативного С-концевого конъюгирования первого полипептида, который содержит поли(этиленгликолевый) фрагмент, с вторым полипептидом, т.е. способ ферментативного ПЭГилирования.
Предпосылки создания изобретения
В последние десятилетия существенно возросла важность белковых терапевтических средств, поскольку этот класс лекарственных средств оказывает целевое воздействие на заболевания, ранее не поддававшиеся лечению. Приготовление препаративных форм белковых лекарственных средств связано с проблемами, поскольку их молекулярный размер очень сильно отличается от размера традиционных низкомолекулярных субстанций. Кроме того, белки обладают некоторыми другими характеристиками, такими как вторичная и третичная структура, имеющими важное значение для требуемой функциональной активности. Они чувствительные к многим типам расщепления или модификации, и их препаративная форма должна гарантировать стабильность и сохранять их эффективность и безопасность при применении в требуемых дозах.
Другие проблемы, связанные с белками при их применении в качестве фармацевтических продуктов, зависят от организма пациента, например, они обусловлены иммуногенными реакциями, быстрым клиренсом из организма, что приводит к укороченному времени полужизни, а также протеолитическим расщеплением, которое приводит к деструкции лекарственного средства до осуществления им своего действия (Brown L.R., Expert Opinion Drug Deliv. 2, 2005, сс.29-42).
Один из подходов к решению этих проблем предусматривает интродукцию химических изменений в белковые молекулы, например, путем ковалентного присоединения одного или нескольких поли(этиленгликолевых) фрагментов к белковому лекарственному средству. Эту процедуру называют ПЭГилированием. Преимущества ПЭГилирования заключаются в увеличении молекулярной массы и гидродинамического размера полученного конъюгата. Новый конъюгат обладает меньшей чувствительностью к протеолитическим ферментам, а также к нейтрализующим антителам или клеткам иммунной системы. Таким образом, ПЭГилирование можно применять для предупреждения нежелательного расщепления лекарственного средства и также для снижения вероятности аллергических побочных действий. Увеличение размера оказывает также влияние на клиренс из организма, поскольку конъюгат белок-ПЭГ является слишком большим для удаления путем почечной ультрафильтрации (Veronese F.M. и Pasut G., Drug Discovery Today 10, 2005, сс.1451-1458; Brown L.R., Expert Opinion Drug Deliv. 2, 2005, сс.29-42). Поли(этиленгликоль) сам по себе в значительной степени улучшает свойства новых лекарственных средств. Кроме того, очень большим преимуществом является отсутствие у ПЭГ токсичности. В целом, ПЭГилирование представляет собой хорошо известный метод удлинения времени жизни в кровотоке белковых фармацевтических средств (Kozlowski А. и Harris M.J., Journal of Controlled Release 72, 2001, сс.217-224). В продажу поступают различные ПЭГилированные белковые лекарственные средства, например, PEG-Intron® фирмы Plough, Somavert® фирмы Pfizer и Pegasys® фирмы Roche Pharmaceuticals (Pasut G. и др., Expert Opinion on Therapeutic Patents 14, 2004, сс.859-894).
Очень большой интерес представляют собой ферментативные сайт-специфические модификации, которые осуществляют в мягких условиях, обеспечивающие высокую хемо- и региоспецифичность и соответствующие выходы продуктов. В этой области было предпринято несколько попыток. Мао с соавторами (Мао Н. и др., J. Am. Chem. Soc. 126, 2004, сс.2670-2671) разработали метод опосредованного сортазой лигирования белка для С-концевой модификации. Sato (Sato Н., Advanced Drug Delivery Reviews, 54, 2002, сс.487-504) разработал систему, основанную на применении трансглутаминазы, для сайт-специфической интродукции поли(этиленгликоля) в интактные и химерные белки, несущие специфическую последовательность субстрата для трансглутаминазы. Lewinska соавторами (Lewinska М. и др., Bioconjugate Chemistry, 15, 2004, сс.231-234) применяли протеазу иммуноглобулина A (IgA-протеаза) для модификации N-конца нативных белков. Мутантный фермент трипсин разработан Hoess с соавторами (WO 2006/015879).
Краткое изложение сущности изобретения
В настоящем изобретении предложен способ избирательного ковалентного С-концевого конъюгирования полипептида с одной или несколькими молекулой(ами) поли(этиленгликоля). Указанный способ заключается в том, что небольшой пептид, ковалентного конъюгированный с поли(этиленгликолем), ферментативно переносят на представляющий интерес полипептид, который подлежит ПЭГилированию. При создании изобретения было установлено, что присутствие Strep-метки, расположенной на С-конце по отношению к сайту расщепления трипсином, повышает С-концевую сайт-специфическую модификацию.
Первым объектом настоящего изобретения является способ получения полипептида, конъюгированного с поли(этиленгликолевым) фрагментом, заключающийся в том, что
а) получают нуклеиновую кислоту, кодирующую слитый полипептид, которая содержит в направлении 5'→3'
I) нуклеиновую кислоту, кодирующую полипептид, и
II) нуклеиновую кислоту, кодирующую аминокислотную последовательность, представленную в SEQ ID NO: 01,
б) экспрессируют нуклеиновую кислоту, указанную в подпункте а), в клетке и выделяют слитый полипептид из клетки и/или среды для культивирования,
в) получают пептид-мишень, аминокислотная последовательность которого представлена в SEQ ID NO: 02, ковалентно конъюгированный с поли(этиленгликолевым) фрагментом на С-концевом остатке лизина,
г) инкубируют слитый полипептид и пептид-мишень с мутантной формой трипсина D189K, K60Е, N143H, Е151Н и
д) выделяют из инкубационной смеси и тем самым получают полипептид, конъюгированный с одним поли(этиленгликолевым) фрагментом.
Согласно одному из вариантов осуществления изобретения инкубация включает
I) инкубацию слитого полипептида и пептида-мишени с гидрохлоридом гуанидиния в забуференном растворе,
II) инкубацию мутантной формы трипсина D189K, K60Е, N143H, Е151Н с Zn(II)-солью,
III) объединение и инкубацию смесей, указанных в подпунктах I) и II).
В одном из вариантов способа, предлагаемого в изобретении, слитый полипептид содержит в направлении от N- к С-концу подлежащий ПЭГилированию полипептид, сайт расщепления несущим 4 мутации трипсином («четверной» мутант трипсина) и Strep-метку. В другом варианте осуществления изобретения нуклеиновая кислота, которая кодирует слитый полипептид, содержит в направлении 5'→3' I) нуклеиновую кислоту, которая кодирует подлежащий ПЭГилированию полипептид, II) нуклеиновую кислоту, которая кодирует аминокислотную последовательность, представленную в SEQ ID NO: 01, и III) нуклеиновую кислоту, кодирующую Strep-метку, которая имеет последовательность, представленную в SEQ ID NO: 13 или 27.
В другом варианте осуществления изобретения общая продолжительность инкубации составляет от 150 до 180 мин. В другом варианте осуществления изобретения нуклеиновая кислота, которая кодирует слитый полипептид, содержит помимо нуклеиновой кислоты, указанной в подпункте III), нуклеиновую кислоту, которая кодирует аминокислотную последовательность, представленную в SEQ ID NO: 13. В одном из вариантов осуществления изобретения полипептид представляет собой человеческий IGF-I.
В одном из вариантов осуществления изобретения инкубацию осуществляют в забуференном HEPES растворе. В следующем варианте осуществления изобретения продолжительность инкубации в забуференном HEPES растворе составляет по меньшей мере 20 ч. В другом варианте осуществления изобретения продолжительность инкубации составляет от 20 до 54 ч. Еще в одном варианте осуществления изобретения инкубацию проводят при 20°С.
В одном из вариантов осуществления изобретения слитый полипептид имеет аминокислотную последовательность, выбранную из последовательностей, которые представлены в SEQ ID NO: 10, SEQ ID NO: 11 или SEQ ID NO: 12. В следующем варианте осуществления изобретения нуклеиновая кислота, которая кодирует слитый полипептид, представляет собой нуклеиновую кислоту, которая кодирует полипептид, имеющий аминокислотную последовательность, которая представлена в SEQ ID NO: 10 или SEQ ID NO: 11, или SEQ ID NO: 12.
Еще одним объектом изобретения является полипептид, который имеет аминокислотную последовательность, представленную в SEQ ID NO: 28 или SEQ ID NO: 29, и который конъюгирован с одним поли(этиленгликолевым) фрагментом на С-концевом остатке лизина.
Одним из объектов изобретения является фармацевтическая композиция, содержащая полипептид, который имеет аминокислотную последовательность, представленную в SEQ ID NO: 28 или SEQ ID NO: 29, и который конъюгирован с одним поли(этиленгликолевым) фрагментом на С-концевом остатке лизина, или полипептид, полученный способом, предлагаемым в настоящем изобретении.
Следующим объектом изобретения является применение полипептида, который имеет аминокислотную последовательность, представленную в SEQ ID NO: 28 или SEQ ID NO: 29, и который конъюгирован с одним поли(этиленгликолевым) фрагментом на С-концевом остатке лизина, или полипептида, полученного способом, предлагаемым в настоящем изобретении, для приготовления лекарственного средства, предназначенного для лечения болезни Альцгеймера.
Еще одним объектом изобретения является полипептид, который имеет аминокислотную последовательность, представленную в SEQ ID NO: 28 или SEQ ID NO: 29, и который конъюгирован с одним поли(этиленгликолевым) фрагментом на С-концевом остатке лизина, или полипептид, полученный способом, предлагаемым в настоящем изобретении, предназначенный для применения в качестве лекарственного средства.
Еще одним объектом изобретения является полипептид, который имеет аминокислотную последовательность, представленную в SEQ ID NO: 28 или SEQ ID NO: 29, и который конъюгирован с одним поли(этиленгликолевым) фрагментом на С-концевом остатке лизина, или полипептид, полученный способом, предлагаемым в настоящем изобретении, предназначенный для применения для лечения или предупреждения болезни Альцгеймера.
Еще одним объектом изобретения является способ лечения, заключающийся в том, что вводят индивидууму, который нуждается в этом, в терапевтически эффективном количестве полипептид, который имеет аминокислотную последовательность, представленную в SEQ ID NO: 28 или SEQ ID NO: 29, и который конъюгирован с одним поли(этиленгликолевым) фрагментом на С-концевом остатке лизина, или полипептид, полученный способом, предлагаемым в настоящем изобретении.
Еще одним объектом изобретения является полипептид, который содержит аминокислотную последовательность, представленную в SEQ ID NO: 28 или SEQ ID NO: 29, который конъюгирован с одним поли(этиленгликолевым) фрагментом на С-концевом остатке лизина.
Следующим объектом изобретения является фармацевтическая композиция, включающая полипептид, который содержит аминокислотную последовательность, представленную в SEQ ID NO: 28 или SEQ ID NO: 29, и который конъюгирован с одним поли(этиленгликолевым) фрагментом на С-концевом остатке лизина. Еще одним объектом изобретения является полипептид, который содержит аминокислотную последовательность, представленную в SEQ ID NO: 28 или SEQ ID NO: 29, и который конъюгирован с одним поли(этиленгликолевым) фрагментом на С-концевом остатке лизина, предназначенный для лечения нейродегенеративного нарушения. В одном из вариантов осуществления изобретения нейродегенеративное нарушение представляет собой болезнь Альцгеймера.
Подробное описание изобретения
В изобретении предложен способ избирательного ковалентного С-концевого конъюгирования полипептида с одним или несколькими поли(этиленгликолевым(и)) фрагментом(ами). Этот способ заключается в том, что небольшой пептид, ковалентно конъюгированный с поли(этиленгликолевым) фрагментом, ферментативно переносят на полипептид, подлежащий ПЭГилированию.
Предложенный в настоящем изобретении ферментативный способ является альтернативой традиционным методам, для осуществления которых требуются химические процедуры и специальные субстраты. При применении предлагаемого в изобретении способа отсутствует необходимость в разделении изоформ, поскольку получают только одну сайт-специфическую модификацию. Кроме того, мягкие реакционные условия препятствуют денатурации белка и в результате снижают потерю продукта. Кроме того, можно осуществлять сайт-специфическое моно-ПЭГилирование встречающихся в естественных условиях полипептидов, в результате чего конструирование мутантов становиться излишним.
Понятие «аминокислота» в контексте настоящего описания относится к группе карбокси-α-аминокислот, которые непосредственно или в форме предшественника могут кодироваться нуклеиновой кислотой. Индивидуальные аминокислоты кодируются нуклеиновыми кислотами, состоящим из трех нуклеотидов, так называемыми кодонами или триплетами оснований. Каждая аминокислота кодируется по меньшей мере одним кодоном. Это обозначают как «вырожденность генетического кода». Понятие «аминокислота» в контексте настоящего описания относится к группе встречающихся в естественных условиях карбокси-α-аминокислот, включающей аланин (трехбуквенный код: ala, однобуквенный код: А), аргинин (arg, R), аспарагин (asn, N), аспарагиновую кислоту (asp, D), цистеин (cys, С), глутамин (gln, Q), глутаминовую кислоту (glu, Е), глицин (gly, G), гистидин (his, Н), изолейцин (ile, I), лейцин (leu, L), лизин (lys, К), метионин (met, М), фенилаланин (phe, F), пролин (pro, Р), серин (ser, S), треоиин (thr, Т), триптофан (trp, W), тирозин (tyr, Y) и валин (val, V).
Известные специалисту в данной области методы и подходы, которые можно применять для осуществления на практике настоящего изобретения, описаны, например, в Current Protocols in Molecular Biology, тома I-III, под ред. Ausubel F.M., изд-во Wiley and Sons, 1997; Sambrook и др., Molecular Cloning: A Laboratory Manual, 2-е изд., изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989.
В контексте настоящего описания «фармацевтически приемлемый носитель» включает любой и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и замедляющие абсорбцию/резорбцию агенты и т.п., которые являются физиологически совместимыми. В одном из вариантов осуществления изобретения носитель можно применять для инъекции или инфузии. Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки, предназначенные для приготовления стерильных инъецируемых растворов и дисперсий. Применение указанных сред и агентов для фармацевтических действующих веществ известно в данной области. Помимо воды носитель может представлять собой, например, изотонический забуференный физиологический раствор.
Понятия «поли(этиленгликолевый) фрагмент» или «ПЭГ», или «молекула ПЭГ» обозначают молекулу или фрагмент, содержащую/содержащий поли(этиленгликоль) в качестве основной фракции или части. Указанный поли(этиленгликоль) может содержать одну или несколько дополнительную(ых) химическую(ие) группу(групп), необходимую(ые) для реакций связывания, которая/которые образуется(ются) в результате химического синтеза молекулы, или представляет(ют) собой спейсер для отдаления на оптимальное расстояние частей молекулы. Эти дополнительные химические группы не учитывают при расчете молекулярной массы поли(этиленгликоля). Кроме того, указанный поли(этиленгликоль) может содержать одну или несколько поли(этиленгликолевых) цепей, соединенных друг с другом. Поли(этиленгликоль), содержащий более одной поли(этиленгликолевой) цепи, называют «многоруким» или разветвленным поли(этиленгликолем). Разветвленный поли(этиленгликоль) можно получать, например, путем добавления полиэтиленоксида к различным полиолам, таким как глицерин, пентаэритриол и сорбит. Разветвленный поли(этиленгликоль) описан, например, в ЕР 0473084 и US 5932462. В одном из вариантов осуществления изобретения поли(этиленгликолевый) фрагмент представляет собой поли(этиленгликолевый) фрагмент с молекулярной массой 20-35 кДа, и он представляет собой линейный поли(этиленгликолевый) фрагмент. В другом варианте осуществления изобретения поли(этиленгликолевый) фрагмент представляет собой поли(этиленгликолевый) фрагмент с молекулярной массой более 35 кДа, прежде всего 40 кДа, и он представляет собой разветвленный поли(этиленгликолевый) фрагмент. В следующем варианте осуществления изобретения поли(этиленгликолевый) фрагмент имеет молекулярную массу 40 кДа, и он представляет собой состоящий из двух плечей («двурукий») поли(этиленгликолевый) фрагмент.
Понятие «ПЭГилирование» означает ковалентное связывание молекулы поли(этиленгликоля) с N-концом полипептида и/или внутренним остатком лизина. ПЭГилирование полипептидов хорошо известно в данной области и сведения о нем обобщены, например, у Veronese F.M., Biomaterials 22, 2001, сс.405-417. Молекулу ПЭГ можно связывать с полипептидом с помощью различных функциональных групп и с использованием молекул поли(этиленгликоля) с различной молекулярной массой, линейного и разветвленного ПЭГ, а также с использованием различных связывающих групп (см. также Francis G.E. и др., Int. J. Hematol. 68, 1998, сс.1-18; Delgado С. и др., Crit. Rev. Ther. Drug Carrier Systems 9, 1992, сс.249-304). ПЭГилирование полипептидов можно осуществлять в водном растворе с помощью реагентов для ПЭГилирования, которые описаны, например, в WO 00/44785, в одном из вариантов осуществления изобретения с использованием NHS-активированных линейных или разветвленных молекул ПЭГ с молекулярной массой от 5 до 40 кДа. ПЭГилирование можно осуществлять на твердой фазе согласно методу, описанному у Lu Y. и др., Reactive Polymers 22, 1994, сс.221-229. Конкретные ПЭГилированные на N-конце полипептиды можно получать также согласно методу, описанному в WO 94/01451.
«Полипептид» представляет собой полимер, состоящий из аминокислотных остатков, ковалентно сцепленных пептидными связями, либо встречающийся в естественных условиях, либо полученный синтетическим путем. Полипептиды, которые состоят менее чем из примерно 20 аминокислотных остатков, можно называть «пептидами», а молекулы, состоящие из двух или большего количества полипептидов, или содержащие один полипептид, состоящий более чем из 100 аминокислотных остатков, можно называть «белками». Полипептид может содержать также компоненты, не относящиеся к аминокислотам, такие как углеводные группы, ионы металлов или эфиры карбоновых кислот. Компоненты, не относящиеся к аминокислотам, могут добавляться клеткой, в которой полипептид экспрессируется, и они могут варьироваться в зависимости от типа клетки. В контексте настоящего описания полипептиды обозначают в зависимости от структуры их аминокислотного каркаса или кодирующих их нуклеиновых кислот. Дополнительные компоненты, такие как углеводные группы, как правило, не являются обязательными, но тем не менее они могут присутствовать.
Hoess с соавторами создали мутантную форму трипсина D189K, Л60Е, N143H, Е151Н (несущий 4 мутации трипсин), которая позволяет решить проблему, связанную с высокой способностью трипсина осуществлять гидролиз. Кроме того, этот мутант не характеризуется выраженной способностью к протеолизу С-концевого лизина и аргинина. Несущий 4 мутации трипсин распознает специфический мотив, имеющий последовательность тирозин - аргинин - гистидин (YRH). Несущий 4 мутации трипсин может специфически взаимодействовать с этим распознаваемым сайтом путем образования хелатных комплексов, которые включают ионы Zn2+ между остатками гистидина. Эта распознаваемая последовательность имеет очень небольшую вероятность возникновения в человеческих полипептидах. Таким образом, специфические для нескольких сайтов модификации и/или нежелательное расщепление являются относительно маловероятными. Дополнительная модификация указанной последовательности для гарантии наилучшего распознавания несущим 4 мутации трипсином приводит к созданию специфической метки, модифицированного «трипсинового сайта», состоящего из аминокислотной последовательности: тирозин - аргинин - гистидин - аланин - аланин - глицин (YRHAAG) (SEQ ID NO: 01). Этот пептид можно сливать с С-концом полипептида, создавая тем самым субстрат для несущего 4 мутации трипсина. Кроме того, пептид-метка необходим для получения возможности осуществления сайт-специфического ПЭГилирования. Этот пептид должен перекрываться с «трипсиновым сайтом», и он состоит из аминокислотной последовательности: аргинин - гистидин - аланин - лизин (RHAK) (SEQ ID NO: 02). Указанный пептид-мишень можно переносить ферментативным путем на широкое разнообразие молекул. Несущий 4 мутации трипсин расщепляет пептидную связь между остатками тирозина и гистидина, тем самым устраняя часть «трипсинового сайта» (RHAAG) (SEQ ID NO: 03). Короткая ненативная аминокислотная последовательность (YRHAK) (SEQ ID NO: 04) сохраняется между белком и присоединенным нуклеофилом. Однако указанное короткое удлинение хорошо защищено присоединенным нуклеофилом, например, поли(этиленгликолевым) фрагментом, и поэтому иммуногенная активность указанного пептида является весьма маловероятной. Модификации несущего 4 мутации трипсина не могут полностью элиминировать побочную реакцию гидролиза. При этом максимальный выход может достигаться только в том случае, когда реакцию прекращают, например, согласно одному из вариантов способа, предлагаемого в изобретении, путем добавления в требуемый момент времени этилендиаминтетрауксусной кислоты (ЭДТК) с образованием комплекса с ионами Zn2+ или путем регулирования значения рН до достижения кислого значения, что является другим вариантом способа, предлагаемого в изобретении, поддерживая значение рН в диапазоне, необходимом для соответствующей ферментативной функции.
Некоторые рекомбинантные белки содержат специальные слитые с ними метки, например, для облегчения последующих стадий очистки или для упрощения достижения требуемого уровня экспрессии конструкций, который в противном случае может быть слишком низким для того, чтобы гарантировать соответствующую продуктивность в клетке-хозяине. Некоторыми широко распространенными метками являются гексагистидиновая метка (His-метка) или Strep-метка. His-метки можно применять для очистки слитых белков с помощью аффинной хроматографии с иммобилизованным металлом, а Strep-метку применяют для очистки слитых белков с использованием колонок со стрептавидином (Terpe К., Appl. Microbiol. Biotechnol. 60, 2003, cc.523-533). В некоторых ситуациях необходимо отщеплять указанные метки, например, для фармацевтических средств или, если это необходимо, для гарантии правильного рефорлдинга. Ферментативное расщепление с помощью протеаз, имеющих определенные распознаваемые сайты, представляет собой наиболее приемлемый подход. Протеазу иммуноглобулина А (IgA-протеазу), полученную из Neisseria gonorrhoeae, применяют в одном из вариантов способа, предлагаемого в изобретении. Сайт, распознаваемый IgA-протеазой, описан в литературе и он представляет собой Yaa Pro ↓ Xaa Pro (Yaa-цепи для Pro или реже Pro в сочетании с Ala, Gly или Thr: Pro Ala, Pro Gly или Pro Thr; Хаа-цепи для Thr, Ser или Ala). Синтетические пептидные субстраты для IgA-протеазы из Neisseria gonorrhoeae, представляют собой известные аутопротеолитические сайты (см., например, Wood и Burton, Infection and Immunity 59, 1991, cc.1818-1822). Известные сайты, распознаваемые IgA-протеазами, содержат следующие последовательности, в которых символ "↓" обозначает положение расщепляемой связи:
|
из которых три первых являются наиболее широко применяемыми.
Таким образом, согласно одному из вариантов осуществления изобретения слитый полипептид содержит в направлении от N- к С-концу His-метку, спейсер, сайт расщепления IgA-протеазой (IgA-сайт), представляющий интерес полипептид, сайт расщепления несущим 4 мутации трипсином (tryp-сайт) и необязательно стрептавидиновую метку (Strep-метка).
Для осуществления способа ферментативной сайт-специфической модификации с использованием несущего 4 мутации трипсина требуется создание специальных конструкций, несущих дополнительные элементы, необходимые для этого типа модификации.
Таким образом, в одном из вариантов способа, предлагаемого в изобретении, слитый полипептид содержит в направлении от N- к С-концу полипептид, подлежащий ПЭГилированию, сайт расщепления несущим 4 мутации трипсином и Strep-метку. В другом варианте осуществления изобретения нуклеиновая кислота, которая кодирует слитый полипептид, содержит в направлении 5'→3' I) нуклеиновую кислоту, которая кодирует подлежащий ПЭГилированию полипептид, II) нуклеиновую кислоту, которая кодирует аминокислотную последовательность, представленную в SEQ ID NO: 01, и III) нуклеиновую кислоту, которая кодирует Strep-метку, имеющую последовательность, которая представлена в SEQ ID NO: 13 или SEQ ID NO: 27.
Таким образом, одним из объектов изобретения является способ получения полипептида, конъюгированного с поли(этиленгликолевым) фрагментом, заключающийся в том, что осуществляют стадии, на которых
а) инкубируют слитый полипептид, который кодируется нуклеиновой кислотой, содержащей в направлении 5'→3' I) нуклеиновую кислоту, которая кодирует полипептид, II) нуклеиновую кислоту, которая кодирует аминокислотную последовательность, представленную в SEQ ID NO: 01, и полипептид-мишень, который имеет аминокислотную последовательность, представленную в SEQ ID NO: 02, и который ковалентно конъюгирован с поли(этиленгликолевым) фрагментом на С-концевом остатке лизина с помощью содержащей мутации D189K, K60Е, N143H, Е151Н мутантной формы трипсина, и
б) выделяют из инкубационной смеси и тем самым получают полипептид, конъюгированный с одним поли(этиленгликолевым) фрагментом.
В одном из вариантов осуществления изобретения слитый полипептид кодируется нуклеиновой кислотой, содержащей в направлении 5'→3' I) нуклеиновую кислоту, которая кодирует подлежащий ПЭГилированию полипептид, II) нуклеиновую кислоту, которая кодирует аминокислотную последовательность, представленную в SEQ ID NO: 01, и III) нуклеиновую кислоту, которая кодирует аминокислотную последовательность, представленную в SEQ ID NO: 13 или 27.
Согласно одному из вариантов осуществления изобретения способ включает в качестве первой стадии стадию, на которой:
а-1) осуществляют культивирование клетки, которая включает нуклеиновую кислоту, кодирующую слитый полипептид, которая содержит в направлении 5'→3'
I) нуклеиновую кислоту, которая кодирует подлежащий ПЭГилированию полипептид,
II) нуклеиновую кислоту, которая кодирует аминокислотную последовательность, представленную в SEQ ID NO: 01, и
III) нуклеиновую кислоту, которая кодирует аминокислотную последовательность, представленную в SEQ ID NO: 13 или SEQ ID NO: 27, и выделяют слитый полипептид из клетки и/или из среды для культивирования.
В одном из вариантов осуществления изобретения инкубация включает
I) инкубацию слитого полипептида и пептида-мишени с гидрохлоридом гуанидиния в забуференном растворе,
II) инкубацию мутантной формы трипсина D189K, K60Е, N143H, Е151Н с Zn(II)-солью,
III) объединение и инкубацию смесей, указанных в подпунктах I) и II).
Настоящее изобретение описано ниже с применением в качестве примера белка IGF-I, который имелся в достаточном количестве в лаборатории заявителей в период создания изобретения. Этот белок не следует рассматривать как ограничивающий объем изобретения, его применяли только в качестве примера, поскольку при воплощении настоящего изобретения на практике можно применять практически любой полипептид. Истинный объем изобретения определяется прилагаемой формулой изобретения.
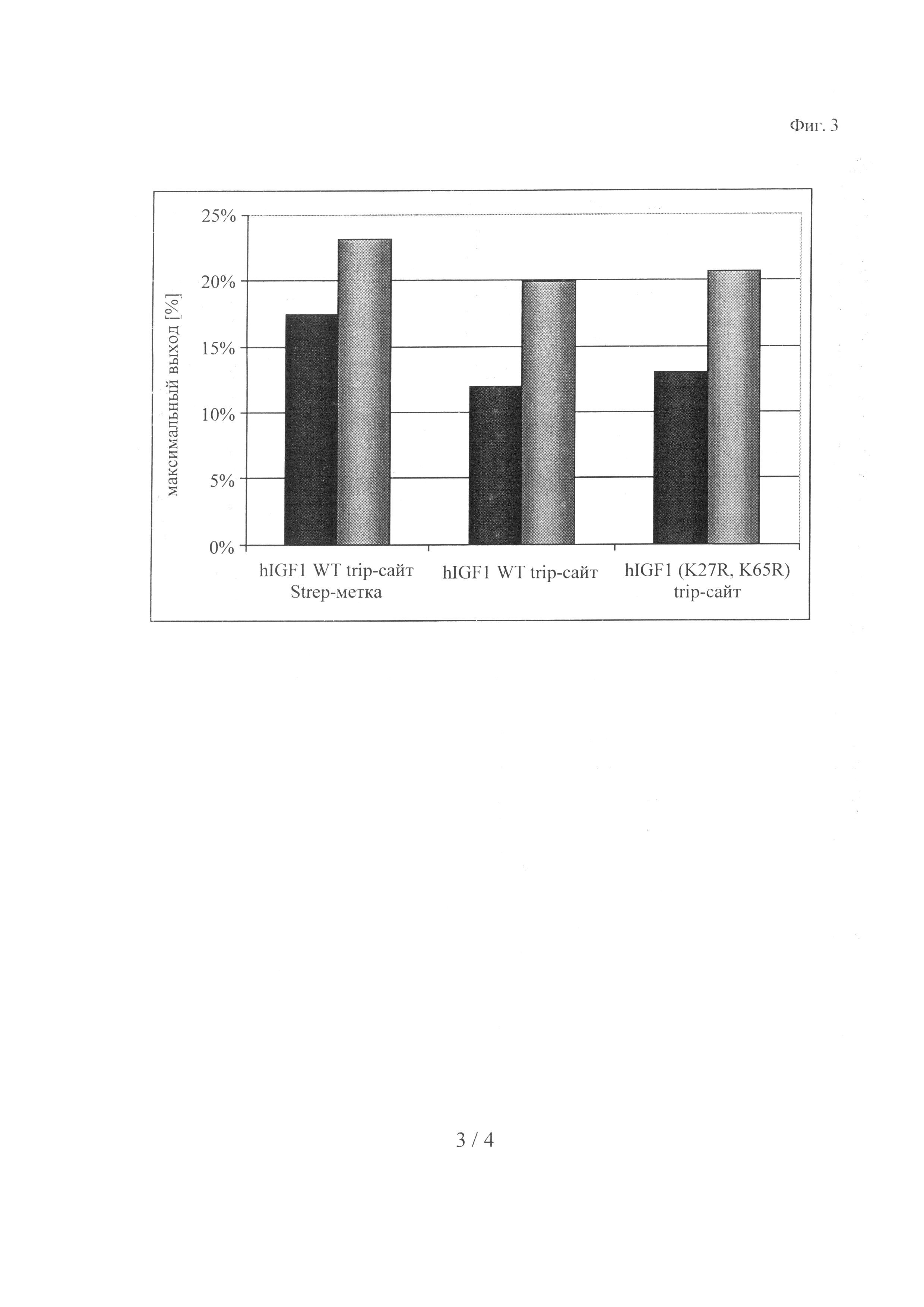
Приведенные в качестве примера конструкции содержат His-метку, спейсер и сайт расщепления IgA-протеазой (IgA-сайт) на N-конце полипептида IGF-I (фрагмент) и сайт расщепления трипсином (tryp-сайт) и необязательно стрептавидиновую метку (Strep-метка) на С-конце полипептида IGF-I-(фрагмент) (см. также фиг.1):
His-метка - спейсер - IgA-сайт - wt-hIGF - tryp-сайт - Strep-метка (SEQ ID NO: 10),
His-метка - спейсер - IgA-сайт - wt-hIGF - tryp-сайт (SEQ ID NO: 11),
His-метка - спейсер - IgA-сайт - hIGF (K27R, K65R) - tryp-сайт (SEQ ID NO: 12).
Эксперименты по определению кинетических характеристик реакции трансэтерификации, катализируемой несущим 4 мутации трипсином, можно осуществлять в конечном объеме, составляющем менее 400 мкл.
Содержащий IGF-I слитый полипептид, подлежащий сайт-специфической модификации, можно инкубировать с 2М трис(гидроксиметан)аминометаном (ТРИС)-буфером (конечная концентрация 0,2М), рН 8,0, нуклеофилом (RHAK-6CF (SEQ ID NO: 02) или RHAK-МСа-ПЭГ20000 (SEQ ID NO: 02)) и гидрохлоридом гуанидиния (Gdm-HCl) перед осуществлением ферментативной реакции. Не вдаваясь в какую-либо конкретную теорию, таким путем можно поддерживать растворимость IGF-конструкции, а невысокая концентрация гидрохлорида гуанидиния, вероятно, индуцирует частичную денатурацию и таким образом обеспечивает повышенную доступность С-конца с «трипсиновым сайтом» в процессе ферментативной реакции. Несущий 4 мутации трипсин можно предварительно инкубировать в присутствии ионов Zn2+. Для достижения высокой ферментативной активности можно объединять две реакционные смеси А и Б, где смесь А содержит включающий IGF-I слитый полипептид, а смесь Б содержит несущий 4 мутации трипсин. Реакционная смесь может иметь значение рН 8,0. Всю реакционную смесь можно инкубировать при 30°С при осторожном встряхивании. Можно использовать общую продолжительность реакции 180 мин и образцы можно изымать каждые 30 мин. Ферментативную реакцию можно прекращать посредством образования комплекса ионов Zn2+ с ЭДТК. И, наконец, объем можно регулировать, добавляя буферный раствор (S-буфер, содержащий 100 мМ ТРИС, 150 мМ NaCl, pH 8.0), до достижения конечного фактора разведения 1:2. Образцы можно анализировать с помощью SEC (гель-фильтрация). В зависимости от применяемой метки можно использовать различные SEC-колонки. Например, при использовании RHAK-6CF можно применять колонку для пептидов Superdex™, обеспечивающую разделение соединений с диапазоном молекулярной массы 100-7000 Да, при использовании RHAK-МСа-ПЭГ20000 можно применять колонку Superdex™ 75, обеспечивающую разделение соединений с диапазоном молекулярной массы 3000-70000 Да (фирма GE Healthcare).
Выход после сайт-специфической модификации при использовании RHAK-6CF можно определять следующим образом. Можно приготавливать серии разведении концентраций свободного RHAK-6CF (0,5, 1,5, 10, 25, 50 и 100 мкг/мл). В качестве растворителя можно использовать S-буфер, поскольку флуоресценция RHAK-6CF чувствительна к значениям pH. Калибровочные образцы можно анализировать с помощью SEC. Площади пиков, соответствующих RHAK-6CF, полученные путем измерения излучения при длине волны испускания 514 нм, можно определять для различных концентраций и строить график зависимости, получая тем самым калибровочную кривую. Реакционные образцы можно анализировать с помощью SEC таким же образом, что и калибровочные образцы, и можно определять площадь пика, соответствующего флуоресцентному продукту. Количество образовавшегося RHAK-6CF и, следовательно, выход после сайт-специфической модификации с использованием этого нуклеофила, можно оценивать с помощью калибровочной кривой.
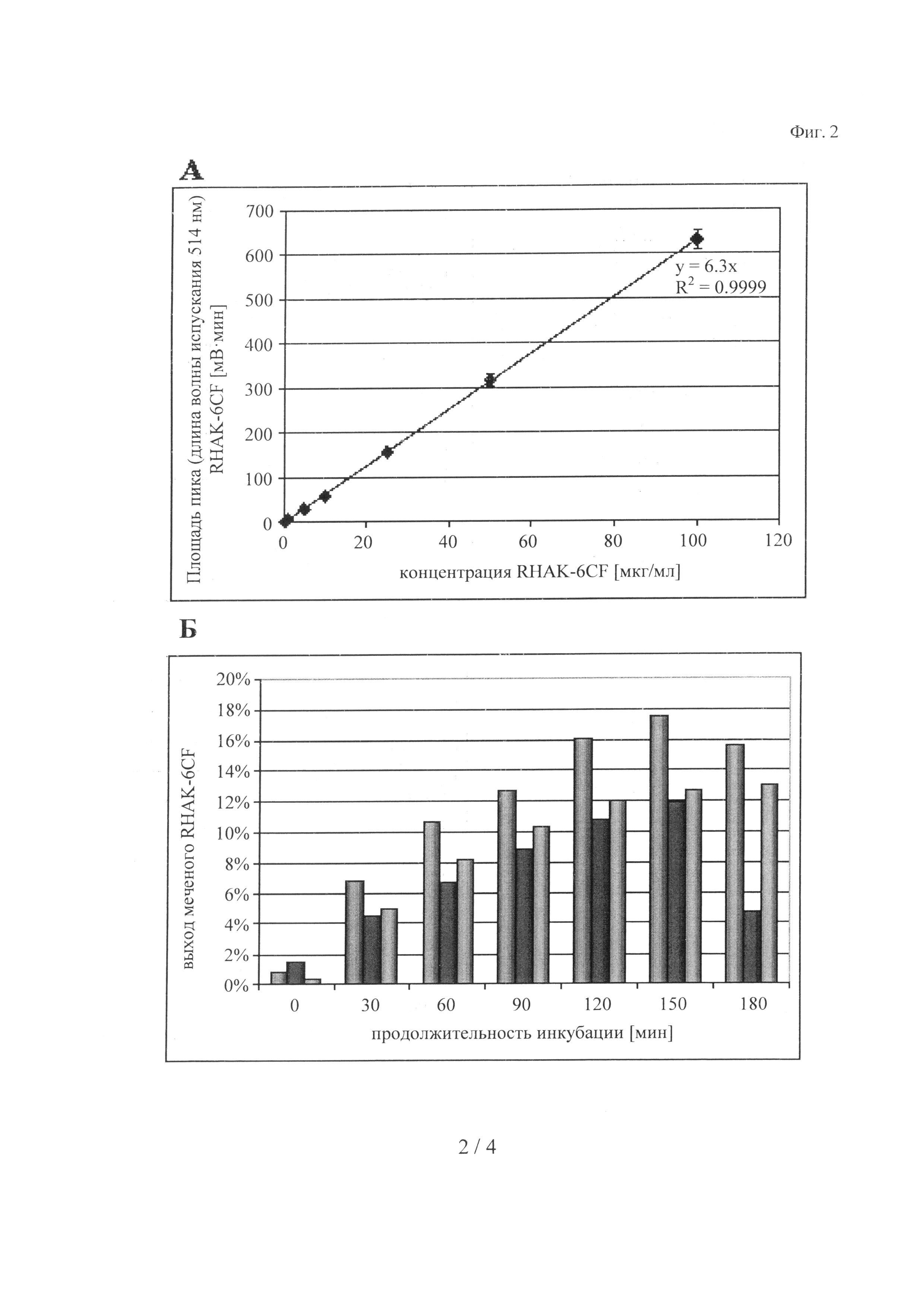
Для всех конструкций выход увеличивался со временем. Максимальный выход можно получать примерно через 150 мин. Для конструкции, содержащей wt-hIGF - трипсиновый сайт - Strep-метку, получали самый высокий выход, составляющий 17,5% через 150 мин. В отличие от этого, для конструкции wt-hIGF-трипсиновый сайт и mut-hIGF (K27R, K65R) были получены более низкие и относительно одинаковые максимальные выходы, составляющие 11,9% через 150 мин и 13,0% через 180 мин соответственно. Увеличение выхода с течением времени в процессе сайт-специфической модификации с использованием RHAK-6CF продемонстрировано на фиг.2Б.
Когда в качестве нуклеофила применяли RHAK-МСа-ПЭГ20000, возникли проблемы, связанные с разделением свободного неконъюгированного RHAK-МСа-ПЭГ20000 и меченного с помощью RHAK-МСа-ПЭГ20000 IGF-I. Это могло являться результатом близкого размера нуклеофила и конъюгированного продукта. Таким образом, в этом случае не удалось определять выход после сайт-специфической модификации по увеличению количества продукта и для этой цели потребовался другой подход. Поскольку может иметь место только одна сайт-специфическая модификация, то снижение количества немодифицированного IGF-I (выделенное вещество) может быть эквивалентно увеличению конъюгированного продукта. Снижение количества немодифицированного IGF-I оценивали по площади пиков на ЖХВР-хроматограммах, полученных в результате измерения абсорбции при длине волны 226 нм. Так же как и в случае модификации с использованием RHAK-6CF, выход после модификации с использованием RHAK-МСа-ПЭГ20000 увеличивался со временем (фиг.3 и фиг.4). Для конструкции wt-hIGF - tryp-сайт - Strep-метка неожиданно был обнаружен наиболее высокий выход через 180 мин, составляющий 23,1%. Практически одинаковые результаты получали для конструкции mut-IGF (K27R, K65R) - tryp-сайт (20,6% через 180 мин) и для конструкции wt-hIGF - tryp-сайт (19,9% через 180 мин).
|
Сравнение сайт-специфической модификации с использованием либо RHAK-6CF, либо RHAK-МСа-ПЭГ20000 различных слитых полипептидов представлено в таблице 1. В целом, после модификации с использованием RHAK-МСа-ПЭГ20000 выход был выше по сравнению с модификацией с использованием RHAK-6CF. Но, кроме того, на выход влиял полипептид, подлежащий ПЭГилированию. Для конструкции wt-hIGF - tryp-сайт - Strep-метка наиболее высокий выход можно получать вне зависимости от полипептида-мишени (или нуклеофила). Для конструкций wt-hIGF - tryp-сайт и mut-hIGF - tryp-сайт получали примерно одинаковые результаты. Так, было установлено, что присутствие Strep-метки повышало С-концевую ферментативную модификацию.
Для подтверждения моно- и С-концевой сайт-специфической модификации содержащие меченый IGF-I конструкции можно анализировать с помощью масс-спектрометрии. Для этой цели можно применять 400 мкл реакционной смеси для сайт-специфической модификации каждой конструкции с помощью RHAK-6CF. Реакционную смесь можно инкубировать в течение 150 мин при 30°С и затем прекращать реакцию, добавляя 200 мкл 10 мМ раствора ЭДТК. Затем реакционный раствор можно разводить в соотношении 1:2, добавляя 200 мкл S-буфера. Полностью меченые продукты реакции можно очищать с помощью гель-фильтрации. Содержащий RHAK-6CF слитый полипептид IGF-I можно собирать и концентрировать. Затем очищенные сайт-специфически модифицированные IGF-I-конструкции можно анализировать методом масс-спектрометрии, определяя общую молекулярную массу. Молекулярная масса фрагментов, образовавшихся после расщепления (Asp-N-расщепления), подтвердила, что имела место одна С-концевая сайт-специфическая модификация с помощью RHAK-6CF для всех конструкций.
Таким образом, разработан ферментативной способ осуществления С-концевой сайт-специфической модификации с использованием несущего 4 мутации трипсина для модификации сконструированного полипептид, например, IGF-I, который несет «трипсиновый сайт». С использованием нового способа можно осуществлять сайт-специфическую модификацию полипептида, например, человеческого IGF-I дикого типа, без риска получения гетерогенной понижающей активность модификации. Ранее эти нежелательные побочные продукты часто ограничивали применение ПЭГилирования. Указанный новый ферментативный подход целесообразно применять для получения ПЭГилированных белковоподобных фармацевтических средств. Вместо содержащих ПЭГ полипептидов-мишеней можно использовать другие нуклеофилы, такие как полипептиды-мишени, содержащие/конъюгированные с флуоресцентными красителями, биотином, сахаридами и т.д. Простое добавление короткого пептида RHAK (SEQ ID NO: 02) может сделать их пригодными для переноса с помощью системы несущего 4 мутации трипсина.
Реакционные условия ферментативного ПЭГилирования конструкции wt-hIGF - tryp-сайт - Strep-метка дополнительно оптимизировали путем снижения количества метки (RHAK-МСа-ПЭГ20000) и количества несущего 4 мутации трипсина, а также, заменяя ТРИС-буфер на HEPES-буфер.
Приведенные ниже примеры, перечень последовательностей и чертежи служат для лучшего понимания настоящего изобретения, истинный объем которого изложен в прилагаемой формуле изобретения. Следует понимать, что описанные процедуры можно подвергать модификациям без отклонения от сущности изобретения.
Описание перечня последовательностей
SEQ ID NO: 01 - модифицированный трипсиновый сайт (tryp-сайт);
SEQ ID NO: 02 - пептид-мишень, требуемый для сайт-специфического ПЭГилирования;
SEQ ID NO: 03 - отщепляемая часть трипсинового сайта;
SEQ ID NO: 04 - оставшаяся пептидная последовательность;
SEQ ID NO: 05-09 и 14-26 - сайт расщепления IgA-протеазой;
SEQ ID NO: 10 - His-метка - спейсер - IgA-сайт - wt-hIGF - tryp-сайт - Strep-метка;
SEQ ID NO: 11 - His-метка - спейсер - IgA-сайт - wt-hIGF - tryp-сайт;
SEQ ID NO: 12 - His-метка - спейсер - IgA-сайт - hIGF (K27R, K65R) - tryp-сайт;
SEQ ID NO: 13 и 27 - Strep-метка;
SEQ ID NO: 28 - аминокислотная последовательность моно-ПЭГилированного человеческого IGF-I, содержащая N-концевую His-метку и сайт расщепления IgA-протеазой;
SEQ ID NO: 29 - аминокислотная последовательность моно-ПЭГилированного человеческого IGF-I.
Описание чертежей
На чертежах показано:
на фиг.1 - схематическое изображение различных конструкций;
на фиг.2 - калибровочная кривая для RHAK-6CF (А) и выход после мечения RHAK-6CF (Б).
А: Приготавливали серийные разведения, получая указанные концентрации (0,5, 1,5, 10, 25, 50, 100 мкг/мл) в 100 мМ Трис, 150 мМ NaCl, pH 8,0, и анализировали с помощью SEC: Определяли площадь пика RHAK-6CF, полученного путем измерения излучения при длине волны испускания 514 нм, и строили график зависимости от концентрации. Представлены коэффициент детерминации (R2) и уравнение, описывающее трендовую линию. Каждая соответствующая данным точка получена по 3 повторяющимся экспериментам и представлена в виде ± стандартное отклонение;
Б: Реакции мечения осуществляли согласно 4.3.8 для мечения RHAK-6CF. Образцы анализировали с помощью SEC. (Слева): wt-hIGF - tryp-сайт - Strep-метка, (в середине): wt-hIGF - tryp-сайт, (справа): mut-hIGF (K27R, K65R) - tryp-сайт;
на фиг.3 - сравнительные данные о выходе после сайт-специфической модификации с помощью RHAK-6CF или RHAK-МСа-ПЭГ20000. (Слева): RHAK-6CF, (справа): RHAK-МСа-ПЭГ20000;
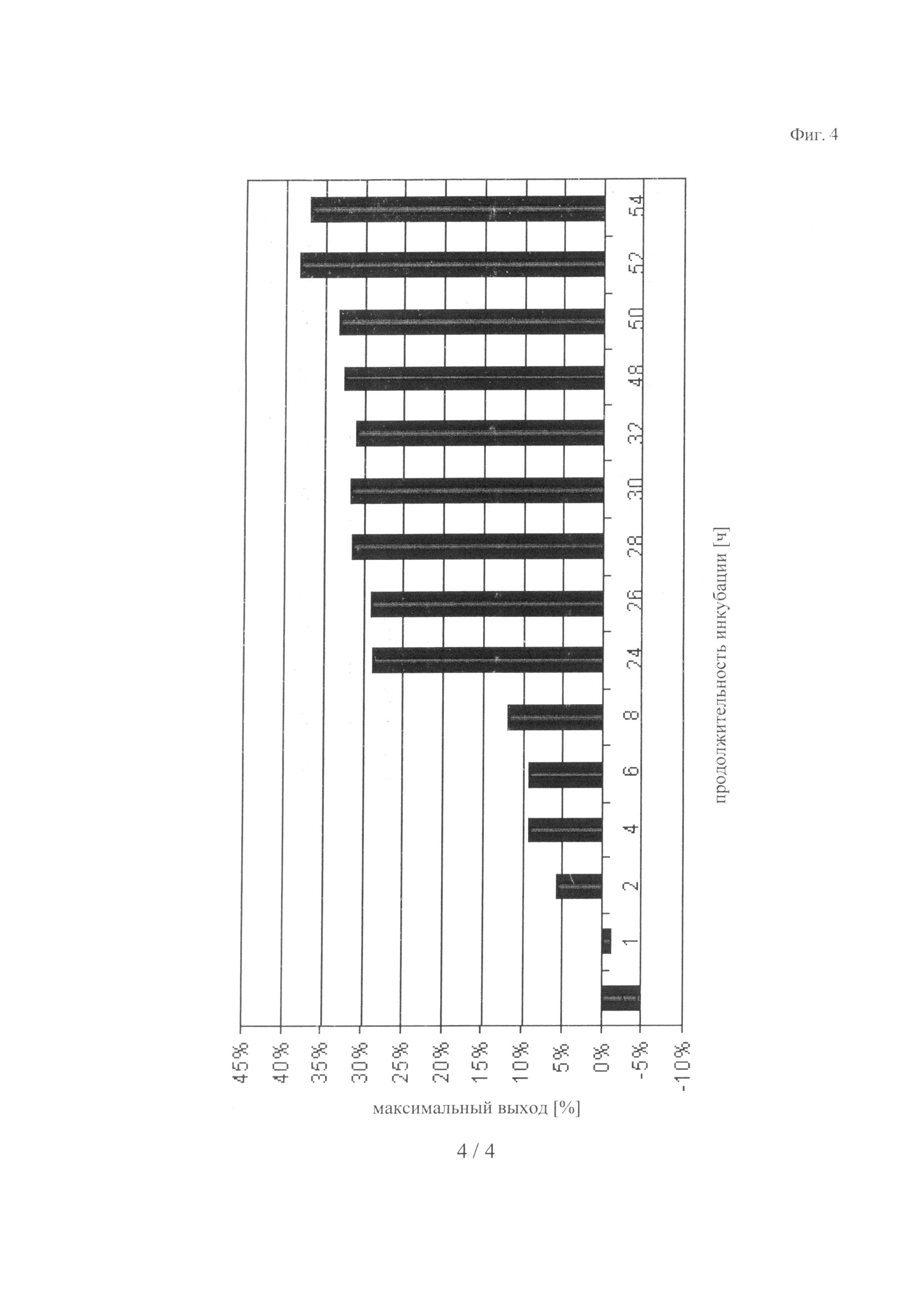
на фиг.4 - данные, демонстрирующие зависящее от времени увеличение количества модифицированного на С-конце IGF-I в оптимизированных условиях (нуклеофил: RHAK-МСа-ПЭГ20000).
Сокращения
|
|
Несущий 4 мутации трипсин: мутант трипсина, несущий D189K, K60Е, N143H, Е151Н.
Материалы и методы:
Аналитическая гель-фильтрация
Буфер: 0,5М ТРИС, 0,15М NaCl, pH 7,5
Колонка: Superdex™ Peptide 10/300 GL
Система: Dionex
Метод: Изократическую элюцию осуществляли при скорости потока 0,5 мл/мин. Общая продолжительность цикла 70 мин. Инъецировали 50 мкл образца. Мониторинг процесса разделения осуществляли на основе измерения сигналов абсорбции при 220 и 280 нм.
Гель-фильтрация в процессе мечения
|
Метод мечения с помощью RHAK-6C: Изократическую элюцию осуществляли при скорости потока 0,5 мл/мин. Общая продолжительность цикла составляла 60 мин.
Метод мечения с помощью RHAK-Мса-ПЭГ20000: Изократическую элюцию осуществляли при скорости потока 0,75 мл/мин. Общая продолжительность цикла составляла 45 мин.
Инъецировали 50 мкл образца (250 мкл для препаративного выхода). Мониторинг процесса разделения осуществляли на основе сигналов абсорбции при 220, 280, 320 нм (мечение с помощью RHAK-Мса-ПЭГ20000) и сигнала флуоресценции (длина волны возбуждения = 490 нм, длина волны испускания = 514 нм) (мечение с помощью RHAK-6CF).
Пример 1
Сайт-специфическая модификация
Сайт-специфическое мечение IGF-1-конструкций осуществляли с помощью RHAK-6CF и RHAK-Мса-ПЭГ20000.
|
|
Каждую конструкцию метили с помощью либо RHAK-6CF, либо RHAK-МСа-ПЭГ20000. Кроме того, в качестве контролей применяли компоненты, указанные в таблице 2.
Концентрации различных соединений в конечных реакциях мечения перечислены в таблице 4. Все реакции осуществляли в силиконизированных пробирках объемом 650 мкл. Белки разводили в 2М ТРИС-буфере. Затем добавляли меченый пептид и гидрохлорид гуанидиния. Указанную смесь (А) инкубировали при 30°С в течение 10 мин. Смесь Б, содержащую несущий 4 мутации трипсин, ZnCl2, S-буфер (100 мМ ТРИС, 150 мМ NaCl, pH 8,0), инкубировали в таких же условиях, что и смесь А. Необходимый объем S-буфера выбирали так, чтобы общий реакционный объем составлял 400 мкл для реакций мечения и 250 мкл для контролей. Смеси А и Б объединяли и инкубировали при 30°С с осторожным встряхиванием.
Для прекращения ферментативной реакции реакционную смесь объединяли с 10 мМ ЭДТК, взятой в объеме, составляющем половину от объема реакционной смеси (приготовленной в S-буфере), и таким же объемом S-буфера для получения фактора разведения 1:2. Общая продолжительность реакции составляла 180 мин.
|
Пример 2
Оптимизация сайт-специфической модификации
Реакцию осуществляли в объеме 1000 мкл при комнатной температуре. Несущий 4 мутации трипсин предварительно инкубировали в присутствии ZnCl2 и ПЭГ-метки в течение 10 мин при 30°С. После этого добавляли гуанидиний·HCl и конструкцию wt-hIGF - tryp-сайт - Srep-метка до достижения указанного ниже конечного объема реакции. Реакционную смесь инкубировали в течение промежутка времени, составляющего вплоть до 54 ч при 20°С. Выход продукта >25% был получен через 24 ч, он достигал максимального значения 32,6% через 52 ч (см. фиг.4).
Реакционные условия:
100 мкМ конструкция: wt hIGF-I - трипсиновый сайт - Strep-метка
2 мкМ несущий 4 мутации трипсин
500 мкМ RHAK-МСа-ПЭГ20000
100 мкМ ZnCl2
100 мМ HEPES
150 мМ NaCl
1 мМ CaCl2
200 мМ Gdm·HCl
Пример 3
Фосфорилирование in vitro IGF-IR с помощью рекомбинантных wt и мутантных вариантов IGF-I и моно-ПЭГилированного IGF-I
Осуществляли специфический для фосфо-IGF-IR ELISA для количественной оценки активации IGF-IR при использовании различных вариантов IGF-I. После выращивания в бессывороточной среде в течение ночи рекомбинантные клетки линии NIH-3T3, экспрессирующие человеческий IGF-IR, инкубировали с взятыми в различных концентрациях вариантами IGF-I, давая им связываться и активировать IGF-IR в клетках. После стимуляции клетки лизировали с помощью холодного буфера для лизиса (25 мМ MES, рН 6,5, 150 мМ NaCl, 2% Тритон-Х100, 60 мМ β-октилгликозид, 2 мМ Na3VO4, ингибитор протеаз Complete™) для сохранения статуса фосфорилирования. Применяли биотинилированное моноклональное антитело к альфа-цепи человеческого IGF-IR (MAK<huIGF-IRα>hu-1a-IgG-Bi, фирма Roche Diagnostics GmbH) для иммобилизации всего IGF-IR на поверхности сенсибилизированного стрептавидипом микропланшета, а моноклональное антитело к фосфорилированному Tyr1135/1136 в киназном домене IGF-IR (фирма Cell Signaling, №3024L) использовали для выявления фракции активированного IGF-IR. Клетки, стимулированные с помощью 10 нМ человеческого IGF-I, применяли в качестве соответствующего максимальной активации контроля (max), клетки без стимуляции применяли в качестве соответствующего минимальной активации контроля (min). Процент активации IGF-IR рассчитывали из уравнения (результат-min)/(max-min). Значения IC50/EC50 определяли путем аппроксимации кривых с помощью программы GraphPad Prism 4.0.
|