СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ/ПРОФИЛАКТИКИ ВОСПАЛИТЕЛЬНЫХ ГЛАЗНЫХ ЗАБОЛЕВАНИЙ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новому терапевтическому применению соединений формулы (I), определенных далее.
Более предпочтительно настоящее изобретение относится к применению этих соединений и их фармацевтически приемлемых солей для лечения и/или профилактики воспалительных глазных заболеваний и более предпочтительно увеита, конъюнктивита в тяжелой форме (весеннего кератоконъюнктивита), синдрома сухого глаза (сухого кератоконъюнктивита) и диабетической ретинопатии.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Воспалительные глазные заболевания являются основной причиной ухудшения зрения во всем мире.
Более точно увеит представляет собой воспаление сосудистой оболочки глаза, среднего сосудистого слоя глаза, состоящего из радужной оболочки, ресничного тела и хориоидеи. Воспаление при увеите является следствием большого числа травматических и иммуноопосредованных агрессий.
Конъюнктивит объединяет болезни, характеризующиеся опуханием, ощущением зуда или ожога или покраснением конъюнктивы, мембраны, покрывающей белок глаза. Этиология конъюнктивита включает в себя инфекционные и неинфекционные конъюнктивиты. Конъюнктивиты, как правило, являются острыми в случае бактериальных или вирусных инфекций и хроническими в случае аллергии.
Синдром сухого глаза представляет собой наиболее часто встречающееся заболевание глаз. Он называется также сухим кератоконъюнктивитом (KCS). Он характеризуется симптомами раздражения глаз и может провоцировать проблемы со зрением, причем эти симптомы увеличивают риск инфицирования и изъязвления роговицы. Патогенез сухости глаз не совсем понятен, хотя преимущественно допускают, что сухость глаз связана с воспалением поверхности глаз.
Диабетическая ретинопатия представляет собой последствие хронической гипергликемии, вызывающей повреждения капилляров с функциональными изменениями типа отека и ишемии. Лазерная фотокоагуляция по-прежнему представляет собой стандартное лечение, а витрэктомию применяют в случае отслоения сетчатки. Lucentis® (ранибизумаб) используют для лечения отека желтого пятна.
Основную терапию пациентов, больных увеитом, конъюнктивитом в тяжелой форме и синдромом сухого глаза, составляют кортикостероиды, вводимые местно или системно. Тем не менее, кортикостероиды являются причиной серьезных осложнений как при системном, так и при местном применении, таких как стероидная катаракта, стероидная глаукома, суперинфекция и задержка заживления.
Существуют также нестероидные противовоспалительные средства, такие как диклофенак или флурбипрофен. Тем не менее, многие пациенты не реагируют или становятся невосприимчивыми к стероидной или нестероидной терапии.
Существуют также антиметаболитные лекарственные средства, такие как азатиоприн и метотрексат, проявляющие гемато- и гепатотоксичность и используемые в основном для лечения увеита в упорных и очень тяжелых формах, и иммунодепрессанты, такие как циклоспорин A и такролимус, вводимые перорально и вызывающие также большое число побочных эффектов, таких как риски ухудшения функции почек, увеличение риска лимфопролиферативных синдромов и злокачественных кожных опухолей. Для ограничения побочных эффектов эти иммунодепрессанты могут быть использованы топически с учетом того, что вследствие своих макроциклических структур эти соединения являются нерастворимыми в водных средах. Предпочтительно их смешивают с маслянистыми эксципиентами, недостаток которых состоит в том, что они вызывают раздражения, болезненные ощущения и провоцируют проблемы со зрением. К тому же эти соединения плохо переносятся пациентами.
Настоящим изобретением устраняются недостатки предшествующего уровня техники за счет нового применения одного или нескольких соединений формулы (I) и их фармацевтически приемлемых солей и, в частности, их применения в лечении и/или профилактике воспалительных глазных заболеваний, таких как увеит, конъюнктивит в тяжелой форме, синдром сухого глаза или диабетическая ретинопатия.
В то же время настоящее изобретение относится к водным фармацевтическим композициям, содержащим соединения формулы (I) и позволяющим достигать задней камеры глаза, что представляет собой заметный прогресс при лечении воспалительных глазных заболеваний.
Кроме того, соединения по настоящему изобретению не оказывают или в малой степени оказывают действие на системный иммунный ответ, что, следовательно, в значительной степени ограничивает возможные побочные эффекты, связанные с введением указанных соединений.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на неожиданных результатах, показывающих, что соединения формулы (I) (далее называемые "соединения по настоящему изобретению") и их фармацевтически приемлемые соли способны в случае местного введения улучшить клинические признаки в моделях увеита, в частности, в отношении защиты гематоофтальмических барьеров и тканей передней и задней камер глаза без изменения системного иммунного ответа. Таким образом, соединения по настоящему изобретению также приемлемы для лечения конъюнктивита в тяжелой форме, синдрома сухого глаза и диабетической ретинопатии.
Полезное действие соединений по настоящему изобретению и их фармацевтически приемлемых солей, в частности тресперимуса и анисперимуса, выявленное в различных фармакологических моделях, приводит к выводу, что эти соединения способны индуцировать в глазах регулирование активации макрофагов и ответа, опосредованного лимфоцитами T.
Соединения по настоящему изобретению и их фармацевтически приемлемые соли в силу их линейной структуры являются растворимыми и стабильными в водных средах, так что они могут вводиться местно в виде водных композиций, являющихся в совершенной степени биологически совместимыми и не вызывающими раздражение или ухудшение зрения.
Таким образом, согласно первому аспекту настоящее изобретение относится к применению соединений по настоящему изобретению и их фармацевтически приемлемых солей, в частности тресперимуса и анисперимуса, для получения лекарственного средства, приемлемого для лечения и/или профилактики воспалительных глазных болезней, предпочтительно увеита, конъюнктивита в тяжелой форме, синдрома сухого глаза или диабетической ретинопатии.
Согласно второму аспекту настоящее изобретение относится к способу лечения и/или профилактики воспалительных глазных болезней, предпочтительно увеита, конъюнктивита в тяжелой форме, синдрома сухого глаза или диабетической ретинопатии, который включает в себя введение пациенту, нуждающемуся в лечении, одного или нескольких соединений по настоящему изобретению или фармацевтически приемлемых солей этих соединений. В одном из вариантов осуществления соединение по настоящему изобретению или его фармацевтически приемлемая соль представляет собой тресперимус или анисперимус. Одно или несколько соединений по настоящему изобретению могут быть введены местно. Одно или несколько соединений по настоящему изобретению предпочтительно вводят в виде глазных капель или в виде раствора, инъецируемого интраокулярно или периокулярно, или в виде имплантируемой системы.
Соединения по настоящему изобретению и их фармацевтически приемлемые соли, в частности тресперимус и анисперимус, являются предпочтительно приемлемыми для лечения и/или профилактики увеита, синдрома сухого глаза или диабетической ретинопатии.
Согласно третьему аспекту настоящее изобретение относится к соответствующим препаратам фармацевтической композиции, содержащей в качестве единственного активного вещества соединение по настоящему изобретению или его фармацевтически приемлемую соль, для осуществления местного введения пациентам с воспалительными глазными болезнями и, более точно, к фармацевтически приемлемой водной композиции для местного введения.
Согласно четвертому аспекту настоящего изобретения соединения по настоящему изобретению, в частности тресперимус и анисперимус, или их фармацевтически приемлемые соли могут вводиться в комбинации с анти-VEGF, анти-TNF, кортикостероидом, нестероидным противовоспалительным средством, антибиотиком или иммунодепрессантом.
Сущность и преимущества настоящего изобретения можно лучше понять из остальных частей описания и формулы изобретения.
ОПИСАНИЕ ФИГУР
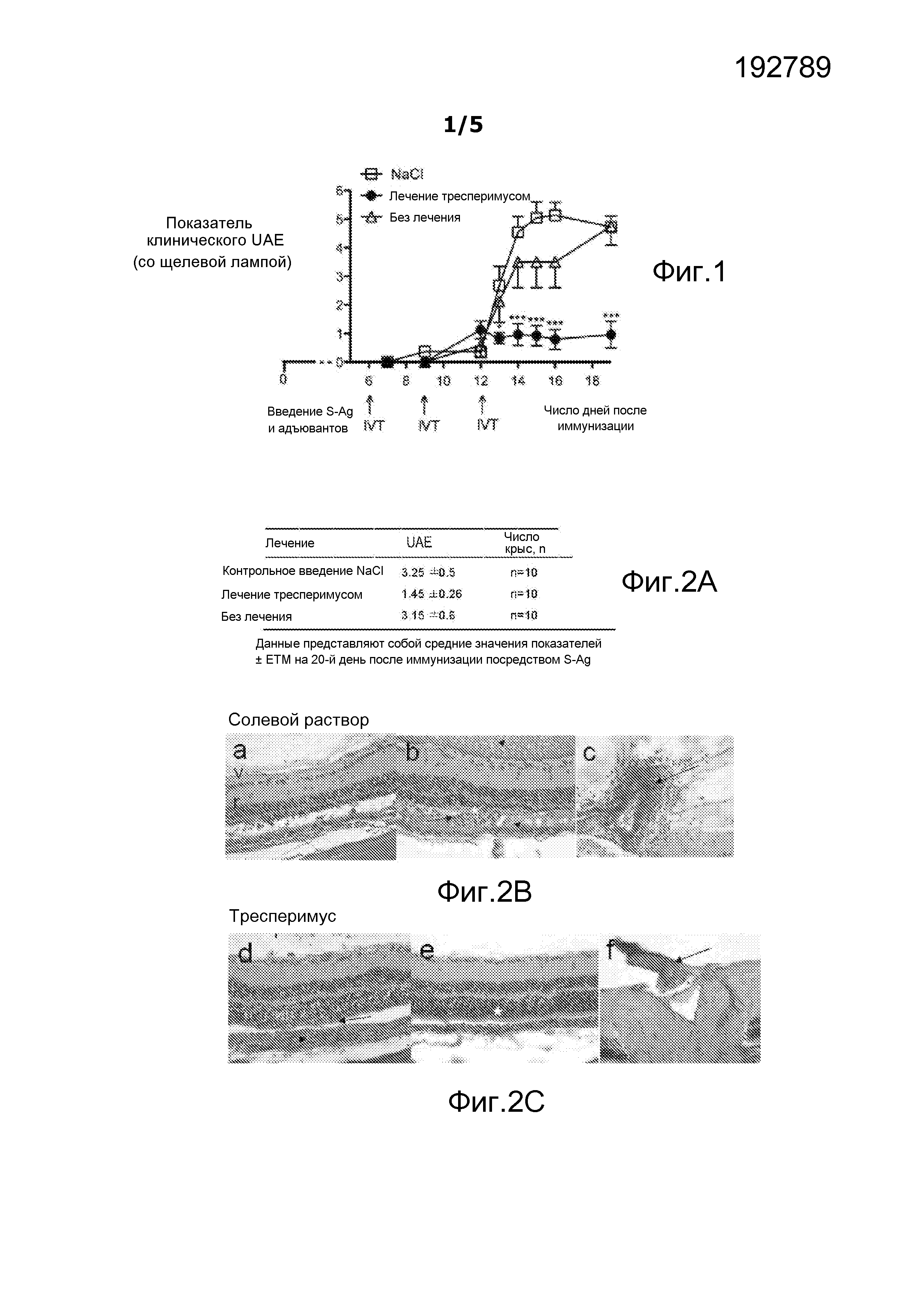
На фигуре 1 показано действие инъекции тресперимуса на клинический экспериментальный аутоиммунный увеоретинит (UAE) у крыс.
На фигуре 2 показано действие инъекции в стекловидное тело (IVT) тресперимуса на патогистологические показатели UAE (A) и патогистологические изменения UAE у крыс, которых лечили тресперимусом (C), по сравнению с крысами, которым вводили солевой раствор (B). a, b, d, e = слои фоторецепторов; c, f = диски зрительных нервов.
На фигуре 3 показано действие тресперимуса при повышенной чувствительности замедленного типа (HTR), специфичной к антигену S, у крыс, которых лечили инъекцией в стекловидное тело.
На фигуре 4 показано распределение тресперимуса в тканях глаза после инстилляции глазных капель в виде 1%-ного раствора два раза в день в течение 4 дней кролику-самцу линии New Zealand.
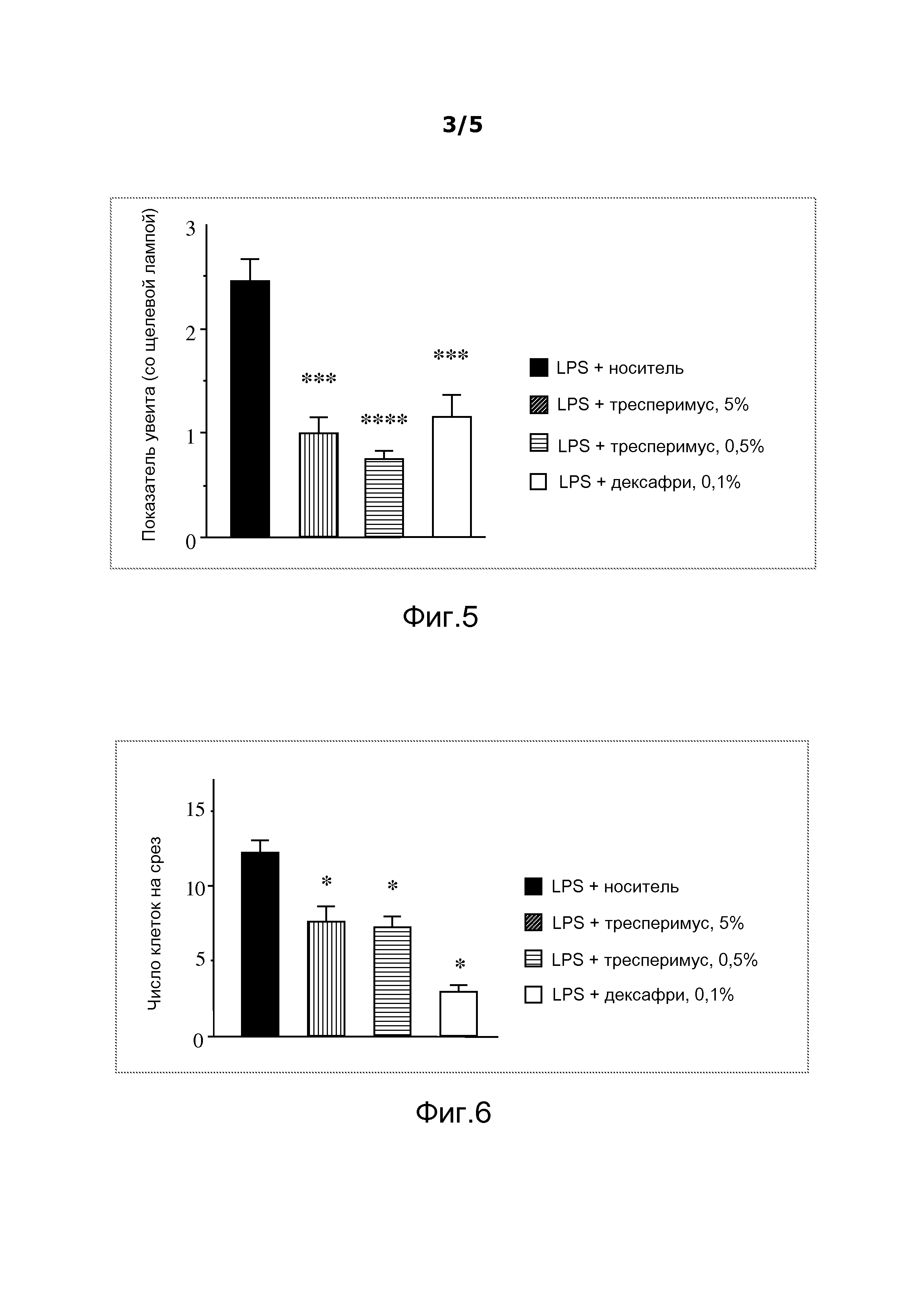
На фигуре 5 показано действие тресперимуса на клинические признаки увеита, индуцированного LPS (липополисахаридом), после лечения путем инстилляции.
На фигуре 6 показано действие тресперимуса на число инфильтрующих воспалительных клеток при увеите, индуцированном LPS, после лечения путем инстилляции.
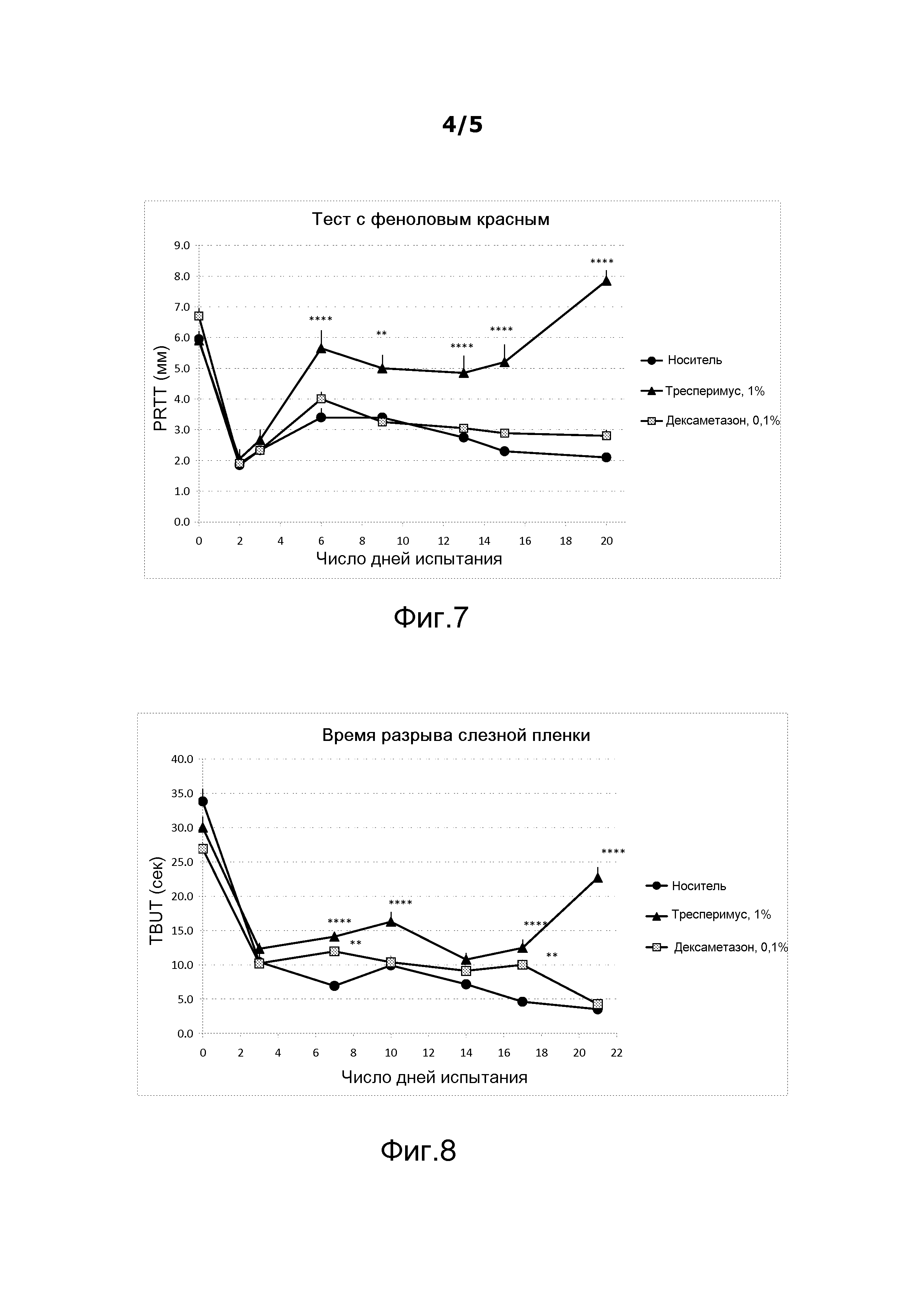
На фигуре 7 показано действие тресперимуса на объем слез, измеренный в тесте с феноловым красным.
На фигуре 8 показано действие тресперимуса на стабильность слезной пленки, измеренную по времени разрыва слезной пленки.
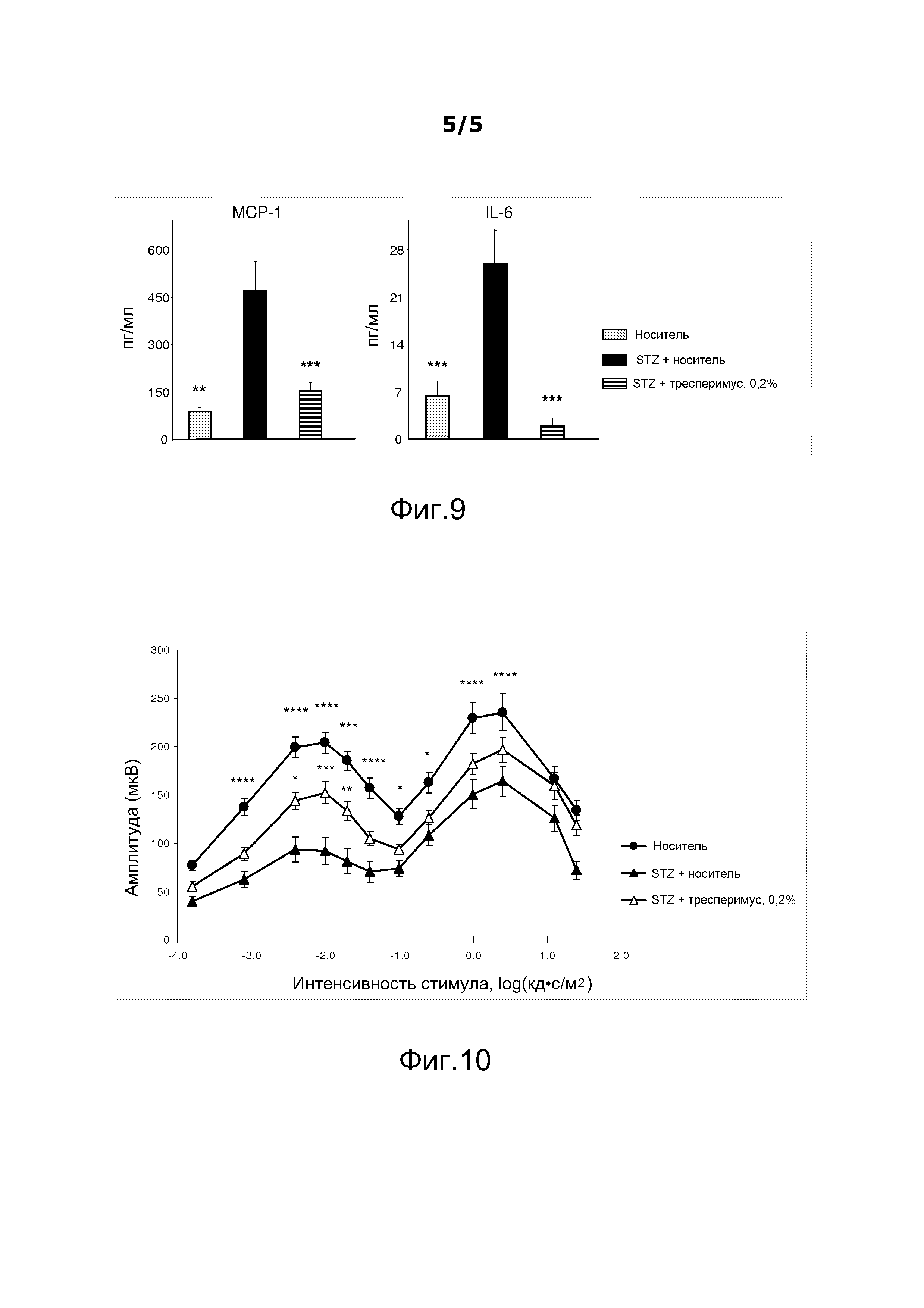
На фигуре 9 показано действие тресперимуса на продуцирование MCP-1 и IL-6 в стекловидном теле.
На фигуре 10 показано действие тресперимуса на амплитуду псевдоколебаний с различными частотами.
ПОДРОБНОЕ ОПИСАНИЕ
Если не указано иное, все технические и научные термины, используемые в настоящем описании, имеют те же самые значения, что и значения, традиционно понимаемые специалистами в данной области техники касательно этого изобретения. Кроме того, следующие определения приведены для помощи читателю при практической реализации настоящего изобретения.
"Пациент" предпочтительно представляет собой млекопитающее и более предпочтительно человека.
Терминологический оборот "предназначенный для применения в лечении и/или профилактике", используемый в настоящем описании, следует понимать как оборот, подразумевающий прямое применение соединения или его соли для лечения и/или профилактики указанной болезни.
Выражение "способ профилактики и/или лечения" следует понимать как выражение, подразумевающее способы, в которых соединение или производное, или его соль вводят для лечения и/или профилактики указанного заболевания.
Выражение "воспалительные глазные болезни" означает общий термин для обозначения воспаления, затрагивающего любую часть глаза или окружающих тканей. Воспаление, затрагивающее глаза, может включать в себя как семейный аллергический конъюнктивит типа сенной лихорадки, так и редкие заболевания, потенциально вызывающие слепоту, такие как конъюнктивит в тяжелой форме (весенний кератоконъюнктивит), увеит, склерит, эписклерит, неврит зрительного нерва, кератит, ретробульбарная псевдоопухоль, синдром Илза, синдром сухого глаза, диабетическая ретинопатия, старческая дегенерация желтого пятна (DMLA), интраокулярное проявление повреждения системной болезнью тканей глаз, то есть сетчатки, которое в конечном счете может приводить к слепоте. От местоположения воспаления зависит диагностическое название воспалительной глазной болезни. Воспалительные глазные болезни могут возникать вследствие нескольких причин.
По настоящему изобретению увеит не является инфекционным и возникает вследствие травматических причин, индуцированных лекарственными средствами, иммуноопосредованных причин, причин, обусловленных злокачественными явлениями, или причин, обусловленных офтальмохирургией.
Фармацевтические композиции по настоящему изобретению также могут быть использованы после офтальмохирургической операции, вызывающей воспаление глаза, например после трансплантации роговицы.
"Увеит" представляет собой воспаление сосудистой оболочки глаза, среднего сосудистого слоя глаза, состоящего из радужной оболочки, ресничного тела и хориоидеи. Его классифицируют в зависимости от местоположения, клинического развития и латерализации.
Термин "передний" подразумевает вовлечение радужной оболочки, роговицы, зрачка, водянистой влаги или ресничного тела. Например, в качестве переднего увеита можно назвать болезнь Кавасаки.
Термин "промежуточный" относится к стекловидному телу, задней зоне ресничного тела, периферической сетчатке и склере.
Термин "задний" относится к хориоидее или сетчатке в широком смысле, ямке сетчатки и зрительному нерву. Среди неинфекционных задних увеитов можно упомянуть болезнь Бехчета, болезнь Фогта-Коянаги-Харады, воспаление задней зоны ресничного тела, саркоидоз, идиопатический ретинальный васкулит и многоочаговое воспаление сетчатки и хориоидеи.
Термин "панувеит" используют в случае, когда поражены два сегмента или больше.
По настоящему изобретению конъюнктивит не является инфекционным и возникает, главным образом, вследствие аллергической реакции глаз в тяжелых формах, поскольку он иногда ведет к изъязвлению, которое всегда несет в себе риск значительных и необратимых потерь зрения.
Аллергический конъюнктивит представляет собой воспалительную реакцию конъюнктивы (тонкой мембраны, покрывающей глаз и внутреннюю часть века). При этом глаза могут стать красными, их может щипать, жечь, они могут чесаться, зудеть и слезиться. Становится трудно переносить свет (фотофобия). Веки часто краснеют и опухают, иногда отмечается набухание конъюнктивы (хемоз), более выраженное очерчивание контуров глаз или значительное секретирование слизи. Конъюнктивит затрагивает роговицу в малой степени. Эта форма является наиболее частой и без сомнения наименее тяжелой формой аллергической реакции глаз. Эта реакция типа I часто является следствием избытка пыльцы весной и летом (пыльца деревьев и злаков). Термин "аллергический кератоконъюнктивит" используют в случае, когда конъюнктивит относится также к роговице, а не только к конъюнктиве.
Существует другие типы аллергии, являющиеся более редкими, более специфическими и, главным образом, более тяжелыми, сочетающими иногда чувствительность типа I с типом IV. Например, весенний конъюнктивит представляет собой тяжелую форму аллергической реакции глаз, поскольку он иногда ведет к изъязвлению, которое всегда несет в себе риск значительных и необратимых потерь зрения. Эти изъязвления часто находятся в верхней части роговицы, а сосочки образуются на конъюнктиве предпочтительно в зоне верхнего века.
Аналогично увеиту конъюнктивиты в тяжелых формах лечат кортикостероидами, нестероидными противовоспалительными средствами или иммунодепрессантами.
Выражения "синдром "сухого глаза", или "сухой кератоконъюнктивит", или "сухость глаз" означают любые патологии глаз, возникающие при секреции слезными железами слез в неадекватном количестве или ненадлежащего качества. В настоящей заявке синдром сухого глаза относится также к любым формам недостаточной секреции слез (включая синдром Шегрена сухого глаза аутоиммунного происхождения и недостаточную секрецию слез, не связанную с синдромом Шегрена) и эвапоративным формам. Сухость глаз также признана как расстройство функционального отдела продуцирования слез, представляющего собой интегрированную систему, включающую в себя слезные железы, поверхность глаз (роговицу, конъюнктиву и мейбомиевы железы) и веки, а также чувствительные нервы, соединяющие их.
"Диабетическая ретинопатия" означает поражение ретинальной и хориоидальной микроциркуляции (поражаемые органы представляют собой сетчатку, хориоидею, диск зрительного нерва и радужную оболочку), обусловленное хронической гипергликемией. Существуют две формы: простая (или непролиферативная) и пролиферативная.
В некоторых случаях появляется отек сетчатки и в общем случае макулярной области. В других случаях возникающая окклюзия капилляров сетчатки вызывает таким образом ишемию сетчатки. Кроме того, две эти существенные характеристики могут сочетаться и приводить таким образом к ишемии в периферии сетчатки и экссудатам в макулярной области.
Соединения по настоящему изобретению являются также приемлемыми для лечения старческой дегенерации желтого пятна (DMLA).
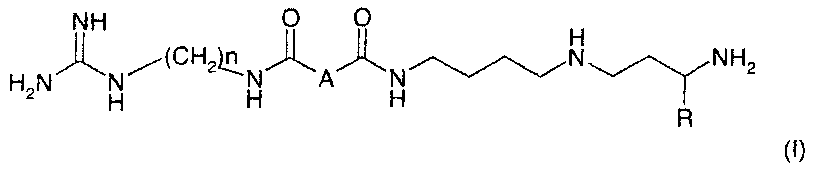
Соединения по настоящему изобретению соответствуют формуле (I):
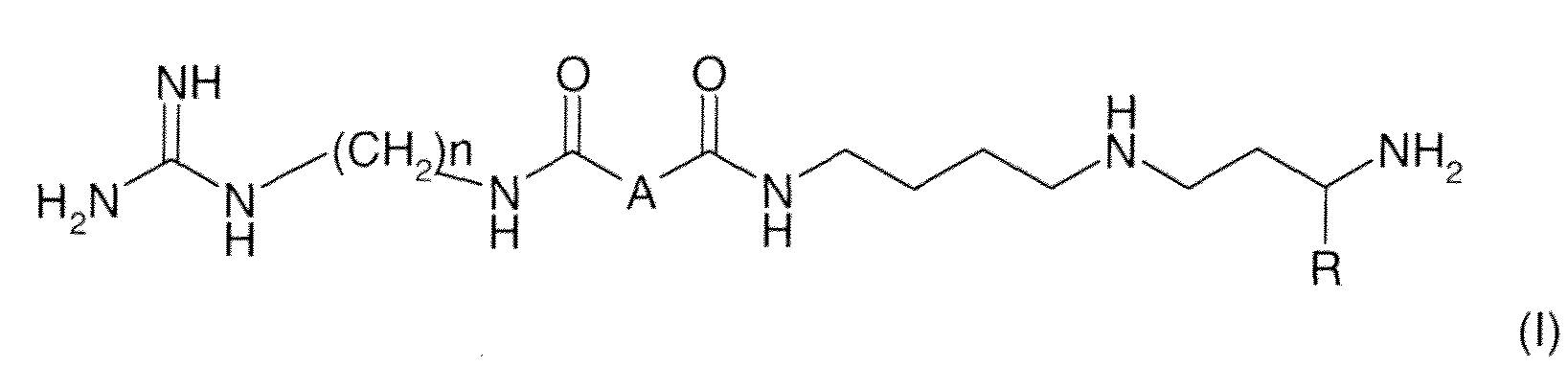
где:
- n равно 6 или 8;
- A означает связь, CH2, CH(OH), CHF, CH(OCH3), CH2NH или CH2O;
- R означает атом водорода или CH3.
"Соли" соединений по настоящему изобретению могут быть получены химическим взаимодействием между неорганической или органической кислотой и соединениями формулы (I), указанными далее.
Предпочтительные неорганические кислоты для образования солей представляют собой соляную, бромистоводородную, серную, фосфорную кислоту.
Предпочтительные органические кислоты для образования солей представляют собой фумаровую, малеиновую, щавелевую, лимонную, трифторуксусную, винную кислоту и сульфоновые кислоты (от метансульфоновой до додекансульфоновой кислоты).
Соединения формулы (I) предпочтительно выбирают из соединений, в числе которых:
2-[[6-[(аминоиминометил)амино]гексил]амино]-2-оксоэтил-N-[4-[(3-аминопропил)амино]бутил]карбамат;
N-[4-[(3-аминопропил)амино]бутил]-N'-[6-[(аминоиминометил)амино]гексил]пропандиамид;
N-[4-[(3-аминопропил)амино]бутил]-N'-[6-[(аминоиминометил)амино]гексил]-2-гидроксипропандиамид;
N-[4-[(3-аминопропил)амино]бутил]-N'-[6-[(аминоиминометил)амино]гексил]-2-фторпропандиамид;
N-[6-[(аминоиминометил)амино]гексил]-N'-[4-[(3-аминопропил)амино]бутил]-2-метоксипропандиамид;
N-[6-[(аминоиминометил)амино]гексил]-2-[[[[4-[(3-аминопропил)амино]бутил]амино]карбонил]амино]ацетамид;
N-[6-[(аминоиминометил)амино]гексил]-N'-[4-[(3-аминопропил)амино]бутил]этандиамид;
N-[8-[(аминоиминометил)амино]октил]-N'-[4-[(3-аминопропил)амино]бутил]этандиамид;
N-[8-[(аминоиминометил)амино]октил]-N'-[4-[(3-аминопропил)амино]бутил]пропандиамид;
N-[8-[(аминоиминометил)амино]октил]-N'-[4-[(3-аминопропил)амино]бутил]-2-гидроксипропандиамид;
N-[8-[(аминоиминометил)амино]октил]-N'-[4-[(3-аминопропил)амино]бутил]-2-фторпропандиамид;
N-[4-[(3-аминопропил)амино]бутил]-2-метокси-N'-[8-[(аминоиминометил)амино]октил]пропандиамид;
N-[8-[(аминоиминометил)амино]октил]-2-[[[[4-[(3-аминопропил)амино]бутил]амино]карбонил]амино]ацетамид;
2-[[8-[(аминоиминометил)амино]октил]амино]-2-оксоэтил-N-[4-[(3-аминопропил)амино]бутил]карбамат;
2-[[6-[(аминоиминометил)амино]гексил]амино]-2-оксоэтил-N-[4-[(3-аминобутил)амино]бутил]карбамат;
N-[4-[(3-аминобутил)амино]бутил]-N'-[6-[(аминоиминометил)амино]гексил]этандиамид;
N-[4-[(3-аминобутил)амино]бутил]-N'-[6-[(аминоиминометил)амино]гексил]пропандиамид;
2-[[[[4-[(3-аминобутил)амино]бутил]амино]карбонил]амино]-N-[6-[(аминоиминометил)амино]гексил]ацетамид;
N-[4-[(3-аминобутил)амино]бутил]-N'-[6-[(аминоиминометил)амино]гексил]-2-гидроксипропандиамид;
N-[4-[(3-аминобутил)амино]бутил]-N'-[6-[(аминоиминометил)амино]гексил]-2-фторпропандиамид;
N-[4-[(3-аминобутил)амино]бутил]-N'-[6-[(аминоиминометил)амино]гексил]-2-метоксипропандиамид;
N-[4-[(3-аминобутил)амино]бутил]-N'-[8-[(аминоиминометил)амино]октил]этандиамид;
N-[4-[(3-аминобутил)амино]бутил]-N'-[8-[(аминоиминометил)амино]октил]пропандиамид;
2-[[8-[(аминоиминометил)амино]октил]амино]-2-оксоэтил-N-[4-[(3-аминобутил)амино]бутил]карбамат;
2-[[[[4-[(3-аминобутил)амино]бутил]амино]карбонил]амино]-N-[8-[(аминоиминометил)амино]октил]ацетамид;
N-[4-[(3-аминобутил)амино]бутил]-N'-[8-[(аминоиминометил)амино]октил]-2-гидроксипропандиамид;
N-[4-[(3-аминобутил)амино]бутил]-N'-[8-[(аминоиминометил)амино]октил]-2-фторпропандиамид;
N-[4-[(3-аминобутил)амино]бутил]-N'-[8-[(аминоиминометил)амино]октил]-2-метоксипропандиамид;
и их фармацевтически приемлемые соли.
Предпочтительные соединения формулы (I) выбирают из 2-[[6-[(аминоиминометил)амино]гексил]амино]-2-оксоэтил-N-[4-[(3-аминопропил)амино]бутил]карбамата (тресперимус) или 2-[[6-[(аминоиминометил)амино]гексил]амино]-2-оксоэтил-N-[4-[(3-аминобутил)амино]бутил]карбамата (анисперимус) и их фармацевтически приемлемых солей.
Более предпочтительные соединения формулы (I) представляют собой тригидрохлорид 2-[[6-[(аминоиминометил)амино]гексил]амино]-2-оксоэтил-N-[4-[(3-аминопропил)амино]бутилкарбамата и тетрагидрохлорид 2-[[6-[(аминоиминометил)амино]гексил]амино]-2-оксоэтил-N-[4-[(3-аминобутил)амино]бутилкарбамата.
Фармацевтические композиции по настоящему изобретению содержат, как правило, соединение по настоящему изобретению или его фармацевтически приемлемую соль в качестве единственного активного вещества, а также один или несколько фармацевтически приемлемых носителей или эксципиентов.
"Фармацевтические носители" представляют собой эксципиент или смесь нескольких фармацевтически приемлемых эксципиентов, которые обеспечивают введение активных веществ. Они позволяют и могут облегчать или улучшать получение композиции и могут стабилизировать композицию. Кроме того, фармацевтически приемлемые носители могут повышать эффективность композиции, улучшать переносимость активного вещества при введении в глаза и/или изменять его профиль высвобождения.
Они также должны быть фармацевтически и физиологически приемлемыми в том смысле, что они должны быть совместимыми с другими ингредиентами композиции, должны быть биологически совместимыми и не быть токсичными. Такие носители могут находиться в разнообразных формах в зависимости от формы препарата, требуемого для введения, например для местного введения.
"Местное введение" следует понимать как введение, включающее в себя любые пути введения в глаза, то есть топическое введение, введение путем инъекции или введение посредством имплантируемых систем.
"Топическое введение" может осуществляться, например, неограничительным образом в виде глазных капель или примочек или инстилляций в глаза, спреев, кремов, мазей, гелей, гидрогелей, олеогелей, гидрофильных линз, вставок и имплантатов. Лекарственные формы могут, например, неограничительным образом представлять собой растворы, суспензии, коллоидные системы (например, липосомы, эмульсии, микроэмульсии, наноэмульсии, микрочастицы, наночастицы, микросферы, ниосомы, дендримеры), мицеллы, смешанные мицеллы, комплексообразующие системы, например растворы циклодекстринов, а также неимплантируемые вставки, представляющие собой, например, и неограничительным образом диски, пленки или пластины.
"Введение путем инъекции" может неограничительным образом осуществляться в виде интраокулярного введения (в стекловидное тело, IVT), периокулярного введения, включающего в себя субконъюнктивальное введение, введение под тенонову капсулу, ретробульбарное и интрасклеральное введение.
"Введение в стекловидное тело" может осуществляться в форме инъецируемых или имплантируемых систем. Лекарственные формы могут неограничительным образом представлять собой растворы, суспензии, коллоидные системы (например, липосомы, эмульсии, микроэмульсии, наноэмульсии, микрочастицы, наночастицы, микросферы, ниосомы, дендримеры), мицеллы, смешанные мицеллы, а также биодеградируемые или небиодеградируемые имплантаты, представляющие собой, например, неограничительным образом палочки, шипы, пеллеты.
В настоящей заявке, когда концентрация выражена в масс./об., считается, что плотность раствора равна 1.
В случае двух путей введения (топически и в виде инъекции) в зависимости от соединения, которое должно быть введено, большая часть указанных ранее лекарственных форм может потенциально увеличивать время пребывания действующего начала на поверхности глаза или в стекловидном теле, обеспечивать медленное и пролонгированное высвобождение инкапсулированных соединений и/или позволять избегать токсичности и повышать переносимость при введении в глаза.
По настоящему изобретению для лечения и/или профилактики воспалительных глазных болезней, предпочтительно увеита, конъюнктивита в тяжелой форме, синдрома сухого глаза или диабетической ретинопатии, соединения по настоящему изобретению или их фармацевтически приемлемые соли могут вводиться в виде фармацевтически приемлемых водных композиций или препаратов, адаптированных для топического введения, предпочтительно путем инстилляции, или для введения путем инъекции, предпочтительно для введения в стекловидное тело.
Для топического введения или введения в виде инъекции один или несколько эксципиентов должны быть приемлемыми фармацевтически и приемлемыми для такого типа введения в глаза.
Водные среды, используемые по настоящему изобретению, включают в себя воду, не содержащую физиологически и офтальмологически вредные вещества. Фармацевтическая композиция по настоящему изобретению представляет собой водную композицию, имеющую pH, физиологически приемлемый для введения в глаза. Под выражением "pH, физиологически приемлемый для введения в глаза" понимают pH, значение которого находится в интервале от приблизительно 5,5 до приблизительно 8 и предпочтительно равно приблизительно 6,0, приблизительно 7,5. Значение pH композиций регулируют кислотой, такой как, например, уксусная, борная, молочная, соляная, основанием, таким как, например, гидроксид натрия, борат натрия, цитрат натрия, ацетат натрия, или фармацевтически приемлемым буферным раствором, таким как, например, натрийфосфатный буферный раствор, калийфосфатный буферный раствор, натрийцитратный буферный раствор. Водные композиции по настоящему изобретению являются изотоническими и физиологически адаптированными для топического и интраокулярного введения в глаза. Осмотическое давление композиций является близким к физиологическому давлению и в общем случае находится в интервале от приблизительно 200 до приблизительно 400 мосмоль и предпочтительно в интервале от приблизительно 260 до приблизительно 340 мосмоль. В случае необходимости осмотическое давление может быть отрегулировано использованием соответствующего количества физиологически и офтальмологически приемлемых эксципиентов. В общем случае в качестве агента, регулирующего осмолярность, используют хлорид натрия с концентрацией (выраженной в масс./об.), не превышающей 0,9%. Также могут быть использованы эквивалентные количества одной или нескольких солей, состоящих из катиона и аниона. При необходимости и согласно терапевтическому указанию по настоящему изобретению осмотическое давление может скорректировано прибавлением сахаров или полиолов, используемых индивидуально или в смеси. Композиции по настоящему изобретению имеют вязкость в интервале от 0 до приблизительно 2000 сантипуаз, предпочтительно меньше приблизительно 100 сантипуаз и более предпочтительно меньше приблизительно 30 сантипуаз.
Композиция по настоящему изобретению может содержать агенты, увеличивающие вязкость и позволяющие продлевать время пребывания действующего начала на роговице после инстилляции. Эти загущающие агенты могут иметь также свойства мукоадгезивности. Мукоадгезивные полимеры, способные образовывать нековалентные связи с гликопротеинами, присутствующими, в частности, на уровне конъюнктивы, по настоящему изобретению могут быть использованы для ограничения распространения композиции в области глаз, для оптимизации времени локального пребывания композиции и потенциально для увеличения биодоступности действующего начала в области глаз, для уменьшения частоты введения и таким образом для улучшения соблюдения терапевтического режима. Эти полимеры в общем случае представляют собой макромолекулярные гидрофильные коллоиды. Они могут быть использованы по настоящему изобретению индивидуально или в сочетании и представляют собой, например, производные целлюлозы, такие как метилцеллюлозы, карбоксиметилцеллюлозы натрия, гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, акриловые производные, такие как, например, соли полиакриловой кислоты и ее функционализированные производные (или поликарбофилы), карбомеры, соединения природного происхождения, такие как, например, альгинаты, хитозаны, пектины, гиалуроновую кислоту и ее производные, полисахаридные производные, такие как, например, геллановая камедь и ее производные, ксантановая камедь, каррагинаны, сополимеры, такие как, например, полоксамеры. Полимеры, обладающие способностью гелеобразования по месту применения, могут быть включены в состав фармацевтической композиции по настоящему изобретению. Системы, называемые системами с фазовым переходом, являются жидкими и приводят к образованию гелей, совместимых с функцией глаз, благодаря ионной активации и в зависимости от pH или температуры. Можно упомянуть, например, такие полимеры, как производные полиакриловой кислоты, карбомеры, производные целлюлозы, метилцеллюлозы, сополимеры, полоксамеры.
Композиция по настоящему изобретению также может содержать, например, поверхностно-активные вещества, вспомогательные растворители, агенты, способствующие проницаемости, агенты гелеобразования, эмульгаторы, антиоксиданты, консерванты, полимеры для пролонгированного высвобождения, эксципиенты, хорошо известные специалистам в данной области техники.
Фармацевтическая композиция может находиться также в виде твердых вставок или имплантатов, обеспечивающих введение в глаза и пролонгированное высвобождение действующего начала. Например, получение вставок может быть осуществлено за счет использования твердого водорастворимого полимера. Инертные биологически совместимые полимеры для введения в глаза, используемые для получения вставок, адаптированных для введения в глаза, являются синтетическими, полусинтетическими или природными. Композиция твердых имплантатов также может включать в себя синтетические, полусинтетические или природные полимеры и предпочтительно биодеградируемые полимеры, такие как, например, поливиниловые спирты, полилактидгликолевые кислоты, поли-эпсилон-капролактоны, сложные эфиры гиалуроновой кислоты. Эти биодеградируемые полимеры также могут быть использованы для инкапсулирования действующего начала в микросферы, наносферы, микрокапсулы, нанокапсулы, диспергированные в водном растворе, с целью пролонгированного и целенаправленного высвобождения действующего начала.
Другие матрицы, такие как водорастворимые линзы, пропитанные действующим началом или содержащие его, могут обеспечивать увеличение времени пребывания действующего начала на поверхности глаза.
Принципы получения и стерилизации таких композиций хорошо известны в области технологии получения лекарственных форм.
В первом предпочтительном варианте осуществления фармацевтическая композиция в виде глазных капель или инъецируемого раствора содержит эффективную дозу соединения по настоящему изобретению, такого как, например, тресперимус, растворенного в водном физиологическом растворе в качестве основного носителя. Этот раствор в идеальном случае содержит водный раствор хлорида натрия с концентрацией, предпочтительно не превышающей 0,9% (масс./об.), или водный раствор глицерина с концентрацией, предпочтительно не превышающей 2,5% (масс./об.), с целью получения осмолярности фармацевтической композиции в интервале приблизительно от 260 до приблизительно 340 мосмоль. Значение pH этого раствора устанавливают около 6,5 посредством, например, гидроксида натрия. Прибавляют биоадгезивный полимер, такой как предпочтительно гиалуроновая кислота или одно из ее производных. Эту лекарственную форму стерилизуют предпочтительно обработкой гамма-лучами. Полученная лекарственная форма может быть расфасована в виде стандартной дозы.
В другом предпочтительном варианте осуществления инъецируемый раствор для введения в виде биодеградируемого имплантата содержит эффективную дозу по меньшей мере одного соединения по настоящему изобретению, предпочтительно инкапсулированного в виде микро- или наночастиц, образованных поли-эпсилон-капролактонами.
Основное преимущество настоящего изобретения состоит в том, что все ткани глаза (передней или задней камеры) подвергаются действию соединений по настоящему изобретению, например, благодаря введению фармацевтически приемлемой водной композиции. При исследовании распределения тресперимуса в тканях глаза кролика-самца линии New Zealand (фигура 4) после инстилляции глазных капель в виде 1%-ного раствора два раза в день в течение 4 дней было замечено, что сетчатка/хориоидея (задняя камера) и ресничное тело/радужная оболочка (передняя камера) подвергались действию тресперимуса с уровнями от 0,5 до 0,7 мкМ и от 0,3 до 0,7 мкМ в течение 24 ч с последующей повторной инстилляцией глазных капель два раза в день в виде простого 1%-ного водного раствора. Вследствие этого по сравнению с другим местным введением, таким как интраокулярное введение или имплантаты, и к тому же в силу лучшего соблюдения режима топическое введение соединений по настоящему изобретению может обеспечить лучшее управление концентрациями активного вещества в тканях глаз. Кроме того, было замечено, что плазматические уровни были низкими (<50 нг/мл в интервале от 5 мин до 2 ч после инстилляции) и через короткое время после инстилляции глазных капель стали меньше нижнего предела количественного определения (Blq) (2 нг/мл через 4 ч после введения). Это позволяет избегать нежелательных эффектов иммунодепрессии на системном уровне.
Концентрация терапевтически активного вещества в композициях, предназначенных для введения в стекловидное тело, может варьировать от 0,1 мкМ до 100 мМ, предпочтительно от 1 мкМ до 10 мМ и более предпочтительно от 10 мкМ до 0,1 мМ. Концентрация терапевтически активного вещества в композиции для топической инстилляции в глаза может варьировать от 0,001 до 5% (при выражении в масс./об.), предпочтительно от 0,001 до 1,5% и более предпочтительно от 0,01 до 1,5%. Эти концентрации могут быть применены и в случае других путей местного введения в глаза и могут варьировать согласно терапевтическому указанию. Способ введения и дозировка определяются по усмотрению лечащего врача в зависимости от пациента, его симптоматики и степени тяжести его патологии.
Эти композиции получают любым способом получения лекарственных форм, хорошо известным в области фармацевтической технологии.
Согласно другому варианту одно или несколько соединений по настоящему изобретению могут комбинироваться или применяться в сочетании с другими терапевтическими средствами. Например, пациент может проходить курс лечения одним или несколькими соединениями по настоящему изобретению или их фармацевтически приемлемыми солями, в частности тресперимусом и/или анисперимусом, в то же самое время, что и другими традиционными лекарственными средствами для лечения воспалительных глазных болезней. Введение разных активных веществ может осуществляться одновременно, последовательно или с разрывом во времени. Предпочтительно соединение по настоящему изобретению или его фармацевтически приемлемую соль не вводят совместно с ингибитором фермента Lck.
Таким образом, в одном из вариантов осуществления настоящее изобретение относится к фармацевтической композиции, содержащей в качестве активных веществ по меньшей мере одно соединение формулы (I) или его фармацевтически приемлемую соль в сочетании с одним или несколькими лекарственными средствами, используемыми при лечении увеита и выбранными из кортикоидов, таких как, например, дексаметазон, преднизолон и триамцинолон, из иммунодепрессантов, имеющих механизм действия, отличающийся от механизма действия соединений по настоящему изобретению, таких как, например, циклофосфамид, метотрексат, азатиоприн, циклоспорин A, такролимус, сиролимус, микофенолят мофетила, из анти-TNF, таких как, например, ритуксимаб, даклизумаб, инфликсимаб, адалимумаб и этанерцепт.
Таким образом, в одном из вариантов осуществления настоящее изобретение относится к фармацевтической композиции, содержащей в качестве активных веществ по меньшей мере одно соединение формулы (I) или его фармацевтически приемлемую соль в сочетании с одним или несколькими лекарственными средствами, используемыми при лечении конъюнктивита в тяжелой форме и выбранными из кортикоидов, таких как, например, дексаметазон, преднизолон, из нестероидных противовоспалительных средств, таких как недокромил, лодоксамид, олопатадин, из антибиотиков, противогрибковых и антибактериальных средств, таких как тобрамицин, натамицин, моксифлоксацин, из иммунодепрессантов, имеющих механизм действия, отличающийся от механизма действия соединений по настоящему изобретению, таких как, например, циклоспорин A, такролимус, сиролимус.
В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей в качестве активных веществ по меньшей мере одно соединение по настоящему изобретению или его фармацевтически приемлемую соль в сочетании с одним или несколькими лекарственными средствами, используемыми при лечении синдрома сухого глаза и выбранными из иммунодепрессантов, имеющих механизм действия, отличающийся от механизма действия соединений по настоящему изобретению, таких как, например, циклоспорин A и микофенолят мофетила, из кортикостероидов, таких как, например, лотепреднол, римокселон и фторметолон, и из тетрациклинов. Они могут быть использованы также в сочетании с искусственными слезами и веществами, усиливающими их секрецию.
В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей в качестве активных веществ по меньшей мере одно соединение по настоящему изобретению или его фармацевтически приемлемую соль в сочетании с одним или несколькими лекарственными средствами, используемыми при лечении диабетической ретинопатии и выбранными из анти-VEGF, таких как, например, ранибизумаб, пегатапниб, бевацизумаб, из анти-TNF, таких как, например, ритуксимаб, даклизумаб, инфликсимаб, адалимумаб и этанерцепт, из кортикостероидов, таких как, например, дексаметазон, преднизолон и триамцинолон, и из иммунодепрессантов, имеющих механизм действия, отличающийся от механизма действия соединений по настоящему изобретению, таких как, например, циклоспорин A, такролимус, эверолимус и сиролимус. Они могут быть использованы также в сочетании с лазерной терапией (фотокоагуляцией).
Настоящее изобретение более подробно поясняется приведенными далее примерами, относящимися к тресперимусу, но специалистам в данной области техники понятно, что настоящее изобретение не ограничивается этим соединением формулы (I).
Разумеется, примеры и варианты осуществления, описанные в настоящем тексте, представлены только с иллюстративными целями, а различные модификации или изменения, которые могут осуществлены в свете этих примеров и вариантов специалистами в данной области техники, должны быть включены в замысел и объем заявки и формулы настоящего изобретения. Описаны предпочтительные способы и материалы, хотя при практической реализации или испытаниях по настоящему изобретению могут быть использованы способы и материалы, подобные или эквивалентные способам и материалам, описанным в настоящем тексте.
Пример 1. Увеит
Глаз представляет собой привилегированное место относительно иммунологии, при этом глазные болезни, развивающиеся вследствие неуравновешенности иммунной системы, несут ответственность за ухудшение зрения, которое может заканчиваться слепотой. Модели на животных, главным образом экспериментальный аутоиммунный увеит (UAE) и увеит, индуцированный эндотоксином (UIE), считаются клинически надлежащими моделями глазных болезней и представляют собой ценные инструменты для исследования иммунологических механизмов, обеспечивающих регулирование болезней у человека:
- UAE, индуцированный у крыс иммунизацией очищенными антигенами сетчатки, главным образом антигена S (Ag-S), считается клинически надлежащей моделью для исследования механизмов заднего увеита у человека и для разработки новых стратегий терапии увеитов;
- UIE представляет собой модель острого воспалительного увеита, который самопроизвольно прекращается за счет действия компонентов врожденной иммунной системы. Он представляет собой модель, приемлемую для исследования локальных аспектов воспаления глаз, и считается надлежащей моделью переднего увеита у человека.
В настоящем изобретении заявителями впервые было доказано, что местное введение в глаза соединений формулы (I) и их фармацевтически приемлемых солей оказывает весьма благоприятное действие в двух экспериментальных моделях, считающихся клинически надлежащими моделями увеитов у человека.
Модель UAE
Модели UAE способствуют пониманию патофизиологических механизмов и, в частности, причастности лимфоцитов CD4+ (кластер дифференцировки 4), макрофагов и провоспалительных цитокинов в механизмах разрушения сетчатки.
UAE представляет собой модель воспалительной болезни, которая имеет многие общие клинические и патогистологические характеристики с увеитом человека, таким как симпатическая офтальмия, ретинохориоидопатия Бердшота, синдром Фогта-Коянаги-Харады, болезнь Бехчета и саркоидоз. Он представляет собой клинически надлежащую модель воспаления глаз человека.
UAE индуцируют иммунизацией очищенным ретинальным аутоантигеном, представляющим собой антиген S (S-Ag), распознаваемый также пациентами, больными увеитом. UAE зависит от эффекторных клеток Th1 (клетки, продуцирующие интерферон-гамма) и Th17 (клетки, продуцирующие интерлейкин-17) CD4+, при этом каждый фенотип эффекторов может индуцировать патологическую реакцию.
При этом IL-17 (интерлейкин-17) играет определяющую роль при UAE, индуцируемом белком IRBP (по-английски "interphotoreceptor retinoid-binding protein" или в переводе "интерфоторецепторный белок, связывающийся с ретинолом"). Нейтрализация IL-17 предупреждает развитие или вызывает регресс болезни. В то же время эффекторные клетки Th17 индуцируют UAE в отсутствие интерферона-гамма (IFN-гамма).
Затем макрофаги и микроглиальные клетки локальным образом усиливают реакцию и индуцируют разрушение фоторецепторов и ретинальной ткани. Моноциты/макрофаги, а также нейтрофилы представляют собой эффекторные клетки, имеющие большое значение при UAE, в то время как T-клетки действуют больше в отношении инициации и поддержания ответа. Макрофаги преодолевают гематоретинальный барьер и инфильтрируют сетчатку, в которой высвобождение медиаторов, таких как NO (оксид азота) и TNF (фактор некроза опухолей), может провоцировать серьезные повреждения сетчатки и, следовательно, потерю зрения у пациентов.
Заявителями было изучено действие местного введения тресперимуса на UAE и иммунные и системные ответы в глазах, индуцированные иммунизацией посредством S-Ag.
Материалы и методики
I. Индуцирование UAE у крыс линии Lewis
Крыс-самок линии Lewis в возрасте восьми недель (R. Janvier, Ле-Женест-Сент-Иль, Франция) системно иммунизировали посредством 40 мкг очищенного ретинального аутоантигена, представляющего собой антиген S (S-Ag), соответственно описанному ранее (De Kozak Y., Sainte-Laudy J., Benveniste J. et Faure J.-P., Eur. J. Immunol. 1981; 11: 612-617).
II. Методика лечения
Введение тресперимуса осуществляли инъекциями в стекловидное тело (IVT) (5 мкл) в оба глаза на 6-й, 9-й и 12-й день после иммунизации посредством S-Ag. В конце испытаний, то есть через 19-20 дней после иммунизации, крыс анестезировали внутрибрюшинной инъекцией пентобарбитала (Sanofi-Aventis, Франция) перед отбором крови интракардиальной пункцией. Затем осуществляли эвтаназию крыс летальной дозой пентобарбитала и отбирали для анализа оба глаза и образцы крови.
В первом эксперименте группе крыс вводили стерильный солевой раствор и практически изоосмотический и физиологический 9 мМ раствор тресперимуса для получения в стекловидном теле конечного раствора с концентрацией 1 мМ, а контрольной группе крыс вводили носитель (солевой раствор) и в контрольной группе крыс не осуществляли лечение. Клинический осмотр животных осуществляли со щелевой лампой, начиная с 9-го дня после иммунизации посредством S-Ag до момента эвтаназии. Осуществляли патогистологическое исследование глаз и иммунологическое окрашивание срезов, полученных в криостате. Для анализа цитокинов способом RT-PCR отбирали паховые лимфатические узлы.
Во втором эксперименте группе крыс осуществляли три инъекции тресперимуса в стекловидное тело, а контрольным крысам делали инъекции солевого раствора. Осуществляли клинический осмотр крыс и испытывали на повышенную чувствительность замедленного типа (HTR). Уровни тресперимуса в плазме и тканях глаз определяли через 1 час, 3 дня и 8 дней после третьей инъекции.
III. Оценка тяжести UAE
1. Клиническая оценка
Осуществляли осмотр животных со щелевой лампой на 7-й день и затем каждый день, начиная с 11-го дня до момента эвтаназии, для оценки момента прекращения болезни и тяжести болезни. Интенсивность клинического воспаления глаз оценивали по шкале от 0 до 7 для каждого глаза соответственно описанному ранее (De Kozak, Eur. J. Imm. 2004).
2. Патогистологическое исследование
В момент эвтаназии (19-20-й день после иммунизации) извлеченные глаза крыс фиксировали, обрабатывали, получали срезы в парафине и окрашивали смесью "гематоксилин-эозин-сафранин" для гистологического оценивания. Срезы осматривали и оценивали тяжесть UAE по приведенной далее полуколичественной шкале от 0 до 7: (0) разрушение ткани отсутствует, (1-2) разрушение внешних сегментов палочек и колбочек, (3-4) разрушение внешнего ядерного слоя, (5-6) разрушение внутреннего ядерного слоя и (7) разрушение слоя ганглионарных клеток.
3. Иммуногистохимическое исследование
На 19-20-й день после иммунизации отбирали глаза (2 глаза на группу), получали срезы в криостате (10 мкм) и окрашивали для иммунохимического исследования соответственно описанному ранее. Использовали первичное антитело против NOS-2 (Beckton Dickinson Biosciences, Transduction laboratories, Сан-Хосе, США), первичное антитело против NF-kBp65, далее вторичное антитело, конъюгированное с красителем Alexa Fluor® 488 (Molecular Probes, Юджин, Орегон), одно из первичных антител макросиалин анти-CD68 (клон ED1) (Serotec, Оксфорд, Великобритания) и затем вторичное антитело, конъюгированное с красителем Alexa 564 (красный). Срезы исследовали способом флуоресцентной фотомикроскопии (FXA, Microphot, Nikon, Мелвилл, Нью-Йорк) и на цифровой фотографической установке (Spot, BFI Optilas, Эври, Франция) получали микрофотографии в цифровой форме.
IV. Оценка иммунного ответа
1. Повышенная чувствительность замедленного типа
HTR оценивали в аурикулярном тесте, определяя специфический ответ на анти-S-Ag через 18 дней после иммунизации. Осуществляли сенсибилизацию крыс посредством введения 10 мкг S-Ag в правое ухо и солевого раствора в левое ухо. Специфическое опухание ушей определяли через 24 и 48 ч после сенсибилизации и рассчитывали разность толщин (мм) между двумя ушами.
2. Выделение РНК, ПЦР с обратной транскриптазой в лимфатических узлах и в клетках глаз
Общую РНК выделяли исходя из лимфатических узлов, дренируя место иммунизации через 19-20 дней после иммунизации, и исходя из клеток, собранных после центрифугирования водянистой влаги/стекловидного тела, полученных из глаз, отобранных в каждой группе.
V. Статистический анализ
Данные представляли в виде "среднее значение ± среднее квадратичное отклонение (ETM)". Клинические и гистологические оценки и HTR при UAE сравнивали с помощью непараметрического U-критерия Манна-Уитни и затем посредством теста с множественными сравнениями Бонферрони. Значение p, исправленное в тестах с множественными сравнениями, рассчитывали для каждого опыта.
VI. Результаты
1. Фармакокинетика тресперимуса в тканях глаз и плазме после инъекций в стекловидное тело
Концентрации тресперимуса в плазме, водянистой влаге/стекловидном теле и сетчатке/хориоидее после инъекций тресперимуса в стекловидное тело крысам линии Lewis приведены в таблице 1.
|
После инъекции тресперимуса в стекловидное тело плазматические уровни в испытуемом образце количественно определяли только в первой точке контроля времени через 1 ч после инъекции с низкими средними концентрациями около 0,1 мкМ (приблизительно 40 нг/мл). Ткани глаз подвергались действию высокого содержания тресперимуса со значительными уровнями (>10 мкМ) в сетчатке/хориоидее через 8 дней после инъекции.
2. Инъекция тресперимуса в стекловидное тело как эффективное лечение UAE: клиническое наблюдение
Лечение тресперимусом ведет к значительному уменьшению клинической тяжести UAE, начиная с 13-го дня после иммунизации, по сравнению с крысами, которым делали инъекции солевого раствора (13-й день: * p<0,02; с 14-го по 19-й день: *** p<0,0006), или по сравнению с крысами, которым не осуществляли никакого интраокулярного лечения (12-й день: * p<0,02; 19-й день: *** p<0,0006) (фигура 1). Тяжесть болезни была значительно уменьшена после лечения до 19-го дня после иммунизации, что указывает на то, что интраокулярная терапия является очень эффективной.
3. Интраокулярная инъекция тресперимуса как защита сетчатки от разрушения и средство управления активностью макрофагов
У крыс, которым сделали три инъекции тресперимуса, наблюдался UAE с очень низкой степенью тяжести на гистологическом уровне (средняя степень тяжести UAE: 1,45±0,26, n=10, p=0,007) по сравнению с повреждениями, наблюдаемыми у контрольных крыс, которым делали инъекции солевого раствора (средняя степень тяжести UAE: 3,25±0,5, n=10) (фигура 2A), и по сравнению с крысами, которым не осуществляли никакого интраокулярного лечения (средняя степень тяжести UAE: 3,15±0,6, n=10, p=0,08). Средний патогистологический показатель при UAE основывался на ухудшении сетчатки.
Патогистологическое исследование сетчатки, полученной от контрольных крыс, которым делали инъекции солевого раствора (фигура 2B), показало наличие заднего увеита в тяжелой форме со значительным разрушением клеточного слоя фоторецепторов (a, b, звездочки белого цвета), инфильтрацией субретинального пространства воспалительными клетками (стрелка) и экссудатами фибрина в стекловидном теле (головка стрелки). В стекловидном теле на уровне диска зрительного нерва (стрелка) (c) находились многочисленные воспалительные клетки. В противоположность этому, у крыс, прошедших лечение тресперимусом (фигура 2C), клеточный слой фоторецепторов был в значительной степени сохранен от разрушения (e, звездочки белого цвета) или характеризовался частичной потерей внешних сегментов (d, стрелка) с инфильтрацией хориоидеи воспалительными клетками (d, головка стрелки). На уровне диска зрительного нерва (f, стрелка) не было видно никакого воспаления.
Как показало иммунологическое окрашивание у контрольных крыс, которым делали инъекции солевого раствора, большое число макрофагов и лимфоцитов, положительных в отношении ED1, проявляли цитоплазматическую и ядерную экспрессию NF-kappaBp65, главным образом, в стекловидном теле, в котором были видны многочисленные инфильтрации воспалительными клетками. В противоположность этому, у крыс, прошедших лечение тресперимусом, в тканях глаз была видна слабая инфильтрация воспалительными клетками с уменьшенным числом клеток, инфильтрующих в ткани и среды глаз, и наблюдалась только цитоплазматическая экспрессия NF-kappaBp65.
4. Отсутствие действия инъекции тресперимуса в стекловидное тело на системный иммунный ответ in vivo
a. Цитокины в паховых лимфатических узлах (RT-PCR)
В паховых лимфатических узлах, полученных от крыс, прошедших лечение, и контрольных крыс, не было обнаружено какой-либо разницы в уровнях TNF-альфа, IL-2, IFN-гамма, IL-17, что указывает на то, что лечение не оказывает системного действия.
b. Повышенная чувствительность замедленного типа
HTR оценивали в аурикулярном тесте, определяя специфический ответ на анти-S-Ag. У крыс, прошедших лечение тресперимусом, отсутствовало значительное уменьшение опухания ушей через 24 ч и 48 ч по сравнению с контрольными крысами, которым делали инъекции IVT солевого раствора (p=0,8; p=0,4 соответственно), что показывает, что реактивность T-клеток в отношении S-Ag in vivo не уменьшается при лечении тресперимусом, и подтверждает, что лечение не оказывает системного действия (фигура 3).
Наконец, инъекция тресперимуса в задний полюс глаза крысы на уровне задней зоны ресничного тела обеспечила его диффузию в передний и задний сегменты глаза, что доказало его эффективность в отношении переднего и заднего воспаления глаза при UAE. Кроме того, в плазме были найдены низкие уровни (<90 нг/мл) тресперимуса, не оказывающие действия на системный иммунный ответ. Фактически действие тресперимуса было ограничено областью глаза, что подтверждает, что какая-либо существенная диффузия в общий круг кровообращения отсутствует.
Заявителями было показано, что три инъекции тресперимуса в стекловидное тело, осуществленные после иммунизации посредством S-Ag в течение афферентной фазы болезни (на 6-й, 9-й, 12-й дни), являются эффективными в отношении уменьшения клинического воспаления глаз и предохраняют ретинальные фоторецепторы.
При исследовании степени действия тресперимуса повышенная чувствительность замедленного типа (HTR) к S-Ag, оцениваемая в аурикулярном тесте, не отличалась у контрольных крыс и крыс, проходивших лечение (фигура 3), что приводит к выводу, что лечение не изменяет системную реактивность T-клеток в отношении S-Ag.
Кроме того, заявителями было показано, что лечение глаз не оказывает действия на системный иммунный ответ. На практике в паховых лимфатических узлах при дренировании места иммунизации уровень воспалительные цитокинов, таких как TNF-альфа, и цитокинов, продуцируемых T-лимфоцитами, таких как IL-2, IFN-гамма (интерферон-гамма), IL-17, не был изменен при лечении тресперимусом.
Модель UIE
Модель увеита, индуцированного эндотоксином, представляет собой модель острого воспаления глаз у крысы или мыши, индуцированного системной или местной инъекцией липополисахарида (LPS) грамотрицательных бактерий. Эта модель соответствует острым передним увеитам человека, которые часто связаны с системными нарушениями, наблюдаемыми, например, в ходе болезни Крона, анкилозирующего спондилартрита и синдрома Блау.
UIE характеризуется разрушением гематоофтальмического барьера, интраокулярной инфильтрацией воспалительными клетками передних и задних сегментов глаза и продуцированием NO, воспалительных цитокинов и химиокинов инфильтрованными воспалительными клетками, главным образом, макрофагами, нейтрофильными лейкоцитами (PMN) и клетками сосудистого эндотелия глаз, пигментного слоя сетчатки, микроглиоцитами и клетками Мюллера. Хотя такой воспалительный увеит самопроизвольно прекращается в течение нескольких дней за счет врожденной иммунной системы, он представляет собой причину значительных повреждений тканей глаз.
Заявителями было изучено действие тресперимуса в данной модели UIE у крыс после инстилляции капель с разными концентрациями.
Материалы и методики
1. Индуцирование увеита эндотоксином
Крысам-самкам линии Lewis в возрасте восьми недель (R. Janvier, Ле-Женест-Сент-Иль, Франция) с массой тела приблизительно 250 г, использованным в этом исследовании, делали в подушечки лап инъекции 200 мкг LPS Salmonella typhimurium (Sigma) в 0,1 мл стерильной воды.
2. Методика лечения
Тресперимус вводили инстилляцией капель в виде 5%-ного (масс./масс.) и 0,5%-ного (масс./масс.) раствора в 0,1%-ном (масс./масс.) водном растворе гиалуроната натрия 2 раза в день в каждый глаз в течение 4 дней.
На 3-й день в подушечки лап вводили LPS и через 24 ч последний раз вводили тресперимус. Далее животных осматривали со щелевой лампой, отбирали кровь и умерщвляли. Затем осуществляли отбор глаз для анализа.
3. Клиническое исследование
Осуществляли осмотр животных со щелевой лампой через 24 ч после введения LPS, что соответствовало максимуму клинического воспаления при увеите. Интенсивность воспаления оценивали по шкале от 1 до 6 для каждого глаза соответственно описанному ранее (De Kozak Y. et al., J. Neuroimmunol. 1998; 86(2): 171-181) следующим образом: 0, отсутствие признаков воспаления; 1 - латентное воспаление радужной оболочки и конъюнктивы; 2 - дилатация радужной оболочки и сосудов конъюнктивы; 3 - гиперемия радужной оболочки, связанная с эффектом Тиндаля, в передней камере; 4-6 - признаки, подобные признакам стадии 3, но, кроме того, наличие синехии или фибриноидной экссудации, или гипопиона. Клинический UIE считают положительным, если оценка больше или равна 1.
4. Патогистологическое исследование и подсчет воспалительных клеток
После эвтаназии животных (или через 24 ч после инъекции LPS) глаза крыс удаляли, затем фиксировали и обрабатывали. Готовили срезы в парафине для гистологического оценивания. Инфильтрованные воспалительные клетки подсчитывали на срезах, выполненных на уровне переднего сегмента глаза (5 сечений на один глаз), после окрашивания смесью "гематоксилин-эозин-сафранин" для гистологического оценивания. Число клеток выражали в виде среднего значения ± ETM общего числа клеток в каждом из глаз и для каждого животного соответственно описанному ранее (De Kozak Y. et al., IOVS 1999 Sep; 40(10): 2275-82).
5. Статистический анализ
Результаты выражали в виде среднего значения ± ETM и сравнивали с помощью U-критерия Манна-Уитни. Уровень P<0,05 считают существенно значимым.
6. Результаты
Действие тресперимуса оценивали в модели UIE у крыс. Острое двустороннее воспаление глаз, индуцированное инъекцией LPS, характеризуется инфильтрацией воспалительных клеток через 4 ч после инъекции. Воспаление имеет максимальную степень в интервале от 18 до 24 часов и исчезает через 4 дня.
Тресперимус вводили 2 раза в день в течение 4 дней инстилляцией 5%-ного (масс./масс.) и 0,5%-ного (масс./масс.) раствора в 0,1%-ном водном растворе гиалуроната натрия. Результаты (фигура 5) выражали в клинических показателях ± ETM для каждого глаза.
По сравнению с контрольными животными лечение тресперимусом позволило обеспечить значительное уменьшение воспаления глаз (соответственно p=0,001 и p=0,0001).
Для подтверждения клинического эффекта, наблюдаемого при применении тресперимуса, подсчитывали общее число клеток, наличествовавших в передней камере глаза, при этом, как показано на фигуре 6, ясно выявилось, что инфильтрация воспалительных клеток была значительно уменьшена (среднее число клеток в срезе: 7,7±0,9, n=13 срезов, p=0,003 и 7,3±0,7, n=13 срезов, p=0,0004) по сравнению с контрольными животными (среднее число клеток в срезе: 12,2±0,8, n=17 срезов).
Эти результаты иллюстрируют факт того, что инстилляция тресперимуса в глаза крыс позволила получить положительные эффекты в отношении уменьшения воспаления глаз в модели увеита, индуцированного эндотоксином, и приводят к выводу, что тресперимус позволяет путем инстилляций глазных капель устранять клинические признаки увеита и в широком смысле конъюнктивитов в тяжелых формах, при этом до настоящего времени эти патологии лечили в основном кортикоидами и иммунодепрессантами, являющимися активными в случае этих 2 фармакологических моделей на животных.
Пример 2. Синдром сухого глаза
Практикуемая до настоящего времени терапия по существу является паллиативной и предусматривает замену или сохранение слез, продуцируемых пациентом, путем частого введения искусственных слез. Сухость глаз в тяжелой форме, характеризующаяся тяжелым повреждением роговицы с повышенным риском вторичных инфекций, при необходимости может быть вылечена противовоспалительной терапией.
Для отражения различных патофизиологических механизмов, вовлеченных в KCS, было разработано несколько моделей на животных. Действие тресперимуса изучали в модели сухости глаз мыши, используя фармакологическое ингибирование продуцирования слез, индуцировавшее эпителиальные изменения поверхности глаз, которые напоминали KCS человека и которые обостряли внешним осушающим действием.
Сухость глаз индуцировали у мышей композицией скополамина, блокировавшего холинергические рецепторы слезных желез мыши, и помещением мышей в вентилируемый тепловой шкаф, который уменьшал степень влажности и увеличивал поток воздуха. Продуцирование, объем и клиренс слез и функцию роговичного барьера оценивали перед лечением и затем два раза в неделю после лечения. Результаты сравнивали между группами контрольных мышей, не проходивших лечение, и группами мышей, которых помещали в вентилируемый тепловой шкаф и которым вводили антихолинергический агент, представлявший собой скополамин, и вводили или не вводили тресперимус.
Данная модель сухости глаз, индуцированной экспериментально, ведет к эпителиальным изменениям поверхности глаз при окрашивании роговицы флуоресцеином, изменению функции эпителиального барьера роговицы, уменьшению плотности конъюнктивальных чашевидных клеток и повышению конъюнктивальной эпителиальной пролиферации. Эта модель на животном воспроизводит компоненты недостаточности воды и функции испарения при синдроме сухого глаза у человека.
I. Материалы и методики
1. Индуцирование сухости глаз блокированием холинергических рецепторов и высушивающим действием вентилируемого теплового шкафа
Мышам-самцам линии 129SV/CD-1, использованным в этом исследовании, в течение 21 дня подкожно делали три инъекции по 200 мкл раствора скополамина с концентрацией 2,5 мг/мл в солевом растворе. Мышей помещали в вентилируемый тепловой шкаф (влажность <50%) на все время эксперимента.
2. Продуцирование слез
Продуцирование слез (PRIT) определяли с помощью пропитанных феноловым красным (Zone-quick; Menicon, Япония) хлопковых нитей, которые прикладывали к поверхности глаз в боковом углу глазной щели на 60 секунд. Смачивание нити измеряли в миллиметрах по шкале, нанесенной на хлопковые нити.
3. Стабильность слезной пленки
Испытание на стабильность слезной пленки (TBUT) использовали для оценки степени сухости глаза, определяя время, проходящее между полным морганием глаза и развитием первого признака сухого пятна на слезной пленке.
Один микролитр 0,1%-ного раствора флуоресцеина натрия наносили на уровне конъюнктивального мешка и определяли время (в секундах) появления сухого пятна после трех морганий глаза. Через 90 секунд определяли повреждения роговичного эпителия и фотографировали с помощью биологического микроскопа со щелевой лампой в синем свете. Клинический показатель определяли согласно шкале Дрейза оценки состояния глаз.
II. Результаты
Объем слез определяли в течение трех недель у мышей линии C57B16, используя тест с феноловым красным. Результаты, представленные на фигуре 7, выражали как средний объем слез (в миллиметрах) ± среднее квадратичное отклонение (ETM). Результаты показывают, что объем слез катастрофически уменьшился через два дня после начала подкожных инъекций скополамина. Инстилляции тресперимуса два раза в день в виде 1%-ного (масс./масс.) раствора в 0,1%-ном растворе гиалуроната натрия в водном солевом растворе (0,6% NaCl) значительно увеличивали объем слез с 6-го по 20-й день по сравнению с мышами, которым вводили носитель, представляющий собой 0,1%-ный раствор гиалуроната натрия в водном солевом растворе (0,9% NaCl) (двухфакторный дисперсионный анализ, осуществляемый с множественными сравнениями Бонферрони, p<0,0001). При этом инстилляции 0,1%-ного дексаметазона два раза в день не оказали какого-либо значительного действия на объем слез.
На фигуре 8 показано, что введение скополамина и действие осушающего воздуха вели к уменьшению стабильности слезной пленки, измеряемой по определению времени разрыва слезной пленки, со значительным снижением в первые 3 дня и последующим постепенным уменьшением до 21-го дня. Введение тресперимуса инстилляцией 1%-ного раствора два раза в день значительно улучшало стабильность слезной пленки с 7-го по 21-й день по сравнению с мышами, которым вводили носитель, представлявший собой 0,1%-ный раствор гиалуроната натрия в водном солевом растворе (0,9% NaCl) (p≤0,0001); при этом дексаметазон оказал лишь незначительное действие, которое не проявлялось на 21-й день.
Таким образом, полученные результаты показали, что топическое применение тресперимуса оказывает полезное действие в отношении синдрома сухого глаза, увеличивая секрецию слез и повышая стабильность слезной пленки, представляющих собой два характеристических клинических параметра сухого глаза. Эти результаты показывают перспективность инстилляций тресперимуса для лечения клинических признаков сухого глаза.
Пример 3. Диабетическая ретинопатия
Лазерная фотокоагуляция по-прежнему представляет собой стандартное лечение, а витрэктомию применяют в случае отслоения сетчатки. Тем не менее, значительная часть пациентов невосприимчива к лазерной фотокоагуляции, и со временем атрофия пигментного слоя сетчатки, связанная с рубцами после лазерной обработки, прогрессирует иногда на ямке сетчатки, вызывая снижение зрения. Ранибизумаб недавно был одобрен для лечения отека желтого пятна, а другие анти-VEGF (бевамизумаб) используются без лицензии на продажу. Лечение, комбинируемое со средствами анти-VEGF, может отсрочить лечение лазером.
Кортикостероиды могут способствовать регрессии отека желтого пятна и неоваскуляризации. Однако часто наблюдаются нежелательные эффекты (гипертензия глаза, катаракта, эндофтальмит), и, кроме того, по сравнению с лечением лазером не доказана долгосрочная эффективность при диабетическом отеке желтого пятна.
Действие тресперимуса оценивали у крыс в модели диабетической ретинопатии, обычно описываемой в модели диабета типа I, индуцированного стрептозотоцином. Эта модель на крысе имитирует болезнь человека, индуцируемую гипергликемией, связанной с разрушением бета-клеток поджелудочной железы, представляющих собой клетки, которые в норме регулируют гликемию, продуцируя гормон, представляющий собой инсулин. Хотя в данной модели имеют место сосудистые изменения, васкулопатия не прогрессирует до неоваскуляризации, как это наблюдается у человека.
Стрептозотоцин вводят крысам внутривенной инъекцией натощак. Гипергликемия быстро развивается в течение пяти дней после введения стрептозотоцина. Через три недели после индуцирования диабета определяли уровни VEGF и биомаркеров воспаления в стекловидном теле. Измерения по электроретинограмме (ERG) волн a и b и колебательных потенциалов анализировали для контроля повреждений фоторецепторов. Результаты сравнивали между контрольной группой крыс без диабета и группой крыс с диабетом, которым вводили тресперимус или носитель.
Материалы и методики
I. Индуцирование диабета стрептозотоцином
Диабет индуцировали у крыс линии Sprague Dawley (SD) (200 г), не принимавших пищу в течение ночи, одной внутривенной инъекцией 60 мг/кг стрептозотоцина (Sigma) в натрийцитратном буферном растворе, pH 4,5. Контрольным животным без диабета вводили только цитратный буферный раствор. Через пять дней животных, имевших содержание сахара в крови больше 5 г/л, считали больными диабетом.
1. Маркеры воспаления
Через три недели после индуцирования диабета стрептозотоцином у крыс удаляли глаза и выделяли стекловидные тела. Некоторые биомаркеры воспаления определяли, используя набор Luminex для мультиплексного количественного анализа (VEGF, MCP-1, ICAM-1, IL-6, IL-1 бета; Procarta) у крыс согласно рекомендациям изготовителя.
2. Электроретинография (ERG)
Крыс с диабетом акклиматизировали к темноте в течение ночи перед исследованием ERG на электроретинографе компании LKC. Серию ответов в зависимости от интенсивности, адаптированной к темноте, регистрировали с помощью серии вспышек типа полного поля (по Ганцфельду) для получения ретинального ответа, опосредованного палочками. Амплитуду и латентный период индивидуальных компонентов колебаний ERG (волны a и b, псевдоколебания), а также колебательные потенциалы измеряли общепринятым образом.
II. Результаты
Действие тресперимуса оценивали в экспериментальной модели диабетической ретинопатии, индуцированной стрептозотоцином у крыс линии SD. Стрептозотоцин разрушал бета-клетки поджелудочной железы и индуцировал гипергликемию, имитируя таким образом заболевание диабетом I типа. Сетчатка животных с диабетом показала биохимические и электрофизиологические аномалии, коррелированные с воспалением.
Инстилляции тресперимуса, осуществляемые два раза в день в течение двух недель в виде 0,2%-ного (масс./масс.) раствора в 0,1%-ном растворе гиалуроната натрия в водном солевом растворе (0,9% NaCl), не влияли ни на гликемию, ни на массу тела по сравнению с крысами с диабетом, которым вводили носитель, представлявший собой 0,1%-ный раствор гиалуроната натрия в водном солевом растворе (0,9% NaCl).
Уровни цитокина и химиокина оценивали по образцам стекловидного тела, используя технологию мультиплексного количественного анализа Luminex. Результаты, представленные на фигуре 9, показывают, что уровни MCP-1 и IL-6 в среде стекловидного тела катастрофически увеличились через три недели после индуцирования диабета стрептозотоцином. Лечение в течение двух недель инстилляциями тресперимуса в виде 0,2%-ного раствора два раза в день в оба глаза с 7-го по 21-й день значительно уменьшило уровни MCP-1 и IL-6 в стекловидном теле крыс с диабетом, что приводит к выводу об ингибирующем действии на вовлечение моноцитов в ходе воспалительного процесса (однофакторный дисперсионный анализ, осуществляемый с множественными сравнениями Даннетта, p≤0,001).
Через три недели после введения стрептозотоцина исследование ERG показало, что крысы с диабетом после адаптации к темноте показывали уменьшение амплитуды волн a и b, аномалию колебательных потенциалов и сильное ухудшение амплитуды псевдоколебаний ("фликер") (фигура 10) независимо от интенсивности вспышек света. Колбочки и палочки представляют собой два типа фоторецепторов, повреждаемых при гипергликемии. На фигуре 10 показано, что после двух недель лечения инстилляциями в глаза два раза в день тресперимуса в виде 0,2%-ного раствора тресперимус значительно улучшал амплитуду псевдоколебаний по сравнению с контрольной группой (крысы с диабетом, которым вводили носитель) и также улучшал амплитуды волн a и b и колебательные потенциалы, что приводит к выводу о нейропротекторном действии на функции сетчатки, в частности на колбочки и палочки, у крыс с диабетом.
Таким образом, полученные результаты показывают, что топическое введение тресперимуса оказывает полезное действие на сетчатку крыс с диабетом, уменьшая степень воспаления на уровне сетчатки и защищая нейроретинальные функции, в частности колбочки и палочки, при гипергликемии. Таким образом, эти результаты показывают перспективность инстилляций тресперимуса для лечения диабетической ретинопатии у человека и предупреждения деградации зрения у больных диабетом.