Результат интеллектуальной деятельности: СПОСОБ ТЕСТИРОВАНИЯ И КОНТРОЛЬ КАЧЕСТВА НУКЛЕИНОВЫХ КИСЛОТ НА ПОДЛОЖКЕ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу тестирования нуклеиновых кислот на подложке, включающему иммобилизацию одной или нескольких нуклеиновых кислот путем сшивания, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований, обеспечение меченых олигонуклеотидов, комплементарных указанному участку нуклеотидов и определение значения, указывающего на состояние указанных нуклеиновых кислот.
Настоящее изобретение, кроме того, относится к набору для тестирования нуклеиновых кислот на подложке, содержащему матрицу нуклеиновых кислот, иммобилизованных на твердой подложке, где каждая иммобилизованная нуклеиновая кислота содержит участок нуклеотидов с одним видом оснований, и меченый олигонуклеотид, комплементарный указанному участку нуклеотидов.
Изобретение также относится к применению меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, для тестирования состояния нуклеиновых кислот, иммобилизованных на твердой подложке.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Биочипы или биологические микроматрицы, в частности микроматрицы ДНК, стали важным инструментом в современной молекулярной биологии и медицине. Как правило, чипы состоят из упорядоченных рядов большого количества микроскопических точек молекул нуклеиновой кислоты, где каждая содержит небольшие количества конкретной последовательности нуклеиновой кислоты. Она может представлять собой, например, короткий участок гена или другой элемент ДНК, который используют в качестве захватывающих зондов для гибридизации с образцом кДНК или кРНК (мишень или зонд-мишень) в условиях связывания захватывающего зонда и соответствующей мишени. Гибридизацию захватывающего зонда с мишенью, как правило, обнаруживают и количественно определяют за счет основанной на флуоресценции детекции меченых флуорофором мишеней для определения относительного количества последовательностей нуклеиновой кислоты в мишени.
Технология микроматриц возникла на основе саузерн-блоттинга, когда к субстрату прикрепляют фрагментированные ДНК, а затем их анализируют с помощью зонда из известного гена или фрагмента. Использование коллекции определенных ДНК на матрицах для определения профиля экспрессии впервые было описано в 1987 году, и упорядоченную матрицу ДНК использовали для идентификации генов, экспрессию которых модулировал интерферон. Эти первые генные матрицы получали посредством нанесения кДНК на фильтровальную бумагу, используя наносящее стержневое устройство. Использование миниатюризованных микроматриц, в частности, для определения параметров генной экспрессии впервые опубликовано в 1990-е годы. Информация о первом эукариотическом геноме на микроматрице была опубликована в 1997 году.
Зонды из олигомеров нуклеиновых кислот долго использовали для детекции комплементарных последовательностей нуклеиновой кислоты в представляющей интерес последовательности нуклеиновой кислоты или зонде-мишени и их использовали для детекции экспрессии конкретных генов, например, при нозерн-блоттинге. В формате микроматрицы олигонуклеотидный зонд был иммобилизован на твердой подложке. Полученные таким способом матрицы олигонуклеотидов можно использовать для детекции комплементарных последовательностей-мишеней нуклеиновой кислоты, как описано в WO 89/10977 и WO 89/11548. В олигонуклеотидных микроматрицах зонды, как правило, представляют собой короткие последовательности, созданные для совпадения с частями последовательностей с известными или предсказанными открытыми рамками считывания.
Для получения таких микроматриц можно использовать различные подходы. Эти подходы включают печать с использованием высокоострых стержней, фотолитографии с использованием предварительно изготовленных шаблонов, фотолитография с использованием динамических микрозеркальных устройств, струйная печать (Lausted C et al., 2004, Genome Biology 5: R58) или электрохимия. Как правило, захватывающие зонды прикрепляют к твердой поверхности с помощью ковалентной связи с химическим матриксом. Например, такая твердая поверхность может иметь форму микроскопических бусин.
Фотолитографический способ используют для получения олигонуклеотидных матриц посредством синтеза последовательностей непосредственно на поверхности матрицы. Способ включает фотолитографический синтез на субстрате из диоксида кремния, причем использование световых и светочувствительных маскирующих средств для получения последовательности одного нуклеотида за один раз во всей матрице (Pease et al, 1994, PNAS 91: 5022-5026). У каждого подходящего зонда перед помещением матрицы в раствор одного нуклеотида селективно удаляют маскировку, затем проводят маскирующую реакцию и удаляют маскировку со следующего набора зондов в продукте с экспозицией других нуклеотидов. После нескольких повторов полностью конструируют последовательности каждого зонда. В зависимости от желаемой цели сконструированные таким образом олигонуклеотиды могут быть длиннее (например, 60-членными) или короче (например, 25-членными).
В точечных микроматрицах олигонуклеотидные зонды наносят в виде целых последовательностей, т.е. зонды синтезируют до нанесения на поверхность матрицы, а затем наносят на субстрат. При общем подходе используют матрицу из тонких стержней или игл, контролируемую роботизированным манипулятором, которую погружают в лунки, содержащие зонды ДНК, а затем наносят каждый зонд на предназначенные участки на поверхности матрицы, или струйное печатающее устройство, которое наносит вещество зонда посредством выброса капель. Полученная матрица зондов представляет параметры нуклеиновых кислот полученных захватывающих зондов и может взаимодействовать с комплементарными зондами-мишенями кДНК или кРНК, например, полученными из экспериментальных или клинических образцов. Кроме того, эти матрицы можно легко адаптировать для конкретных экспериментов, так как зонды и участки нанесения на матрице можно выбирать особым образом.
При получении микроматриц необходимо знать присутствует ли каждая точка на субстрате и может ли она гибридизоваться.
Контроль, регулирование и корректировка способов разметки точек и нанесения для получения микроматриц описаны, например, в GB 2355716.
Однако этот подход сфокусирован на самом способе печати и включает определение вибраций в струйном устройстве или неправильного функционирования оборудования, но не предоставляет раствора, который мог бы гарантировать правильное и эффективное нанесение капель на субстрат или который мог бы обеспечить контроль поведения капель после завершения печати. Такой способ контроля печати нельзя использовать для оценки качества нанесенных зондов. В частности невозможно определить, действительно ли присутствуют нанесенные захватывающие зонды нуклеиновой кислоты или способны ли они гибридизоваться с молекулами-мишенями.
Следовательно, существует необходимость в способе, обеспечивающем тестирование состояния и качества нуклеиновых кислот, нанесенных на подложку.
ЦЕЛИ И СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение связано с этой необходимостью и относится к средствам и способам, обеспечивающим иммобилизацию и последующее тестирование и контроль качества нуклеиновых кислот, нанесенных на подложку.
Таким образом, одной из задач настоящего изобретения является получение средств и способов, позволяющих контролировать поведение нанесенных нуклеиновых кислот после завершения печати и оценивать качество нанесенных зондов.
Указанную выше задачу осуществляют способом тестирования нуклеиновых кислот на подложке, включающим иммобилизацию одной или нескольких нуклеиновых кислот на твердой подложке посредством сшивания нагреванием, или световым излучением, или посредством химической иммобилизации, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований, обеспечение меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен образовывать комплекс с каждой из иммобилизованных нуклеиновых кислот на участке нуклеотидов с одним видом оснований, и определение показателя, отражающего состояние указанных нуклеиновых кислот по количеству меченого олигонуклеотида, находящегося в комплексе с иммобилизованной нуклеиновой кислотой.
Преимуществом способа по настоящему изобретению является его дешевизна, возможность его применения и универсальность, что позволяет контролировать и проверять нанесенные нуклеиновые кислоты по простой и надежной схеме взаимодействия. Способ основан на наличии и использовании захватывающих нуклеотидных зондов, которые включают участок нуклеотидов с одним видом оснований. Такие нуклеиновые кислоты являются средством для эффективной иммобилизации на субстрате посредством указанного участка нуклеотидов с одним видом оснований, предпочтительно посредством сшивания нагреванием или световым излучением и в качестве дополнительного и независимого признака обеспечивают одинаковое и единообразное взаимодействие участка нуклеотидов с одним видом оснований и комплементарного олигонуклеотида. Таким образом, требуется только один тип олигонуклеотидов, который проще синтезировать, чем олигонуклеотиды, состоящие из нуклеотидов нескольких видов оснований, и это снижает общую стоимость схемы контроля качества. Благодаря тому, что олигонуклеотиды могут быть достаточно короткими, достигается дополнительное снижение стоимости. Таким образом, основное преимущество настоящего изобретения связано с возможностью осуществления непосредственной и простой проверки результата нанесения и процесса иммобилизации, в частности с возможностью проверки полной потери точек, неправильной мобилизации молекулы, например, вследствие природной деградации поверхности субстрата со временем, пропуска стадии иммобилизации или деградации или модификации ДНК, вследствие чего она не способна гибридизироваться. Кроме того, способ не является деструктивным и позволяет контролировать состояние нанесенных нуклеиновых кислот на субстрат, не влияя на эффективность производственного процесса. В предпочтительном варианте осуществления, кроме того, можно повторно использовать тестовые олигонуклеотиды после стадии промывки для последующих контрольных реакций. Такой порядок действий дополнительно снижает стоимость и время в контексте контроля нанесенных нуклеиновых кислот.
В конкретном аспекте настоящее изобретение относится к набору для тестирования нуклеиновых кислот на подложке. Указанный набор содержит матрицу нуклеиновых кислот, иммобилизованных на твердой подложке посредством сшивания нагреванием, или световым излучением, или посредством химической иммобилизации, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований, и меченый олигонуклеотид, комплементарный участку нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен образовывать комплекс с каждой из иммобилизованных нуклеиновых кислот на участке нуклеотидов с одним видом оснований.
В другом аспекте настоящее изобретение относится к применению меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, для тестирования состояния нуклеиновых кислот, иммобилизованных на твердой подложке посредством сшивания нагреванием, или световым излучением, или посредством химической иммобилизации, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований, и где указанный меченый олигонуклеотид способен образовывать комплекс с каждой из иммобилизованных нуклеиновых кислот в указанном участке нуклеотидов с одним видом оснований.
В предпочтительном варианте осуществления настоящего изобретения тестирование состояния нуклеиновых кислот включает определение показателя, отражающего количество меченого олигонуклеотида, находящегося в комплексе с указанной иммобилизованной нуклеиновой кислотой.
В дополнительном предпочтительном варианте осуществления настоящего изобретения нуклеиновая кислота для тестирования представляет собой одноцепочечную ДНК, РНК, ПНК, ЦНК, ГНК, ЗНК или АНК, их олигонуклеотид или любое их сочетание.
В другом предпочтительном варианте осуществления настоящего изобретения указанный участок нуклеотидов с одним видом оснований, включенный в нуклеиновые кислоты для тестирования, как указано выше, представляет собой участок из остатков тимина, урацила или гуанина.
В другом предпочтительном варианте осуществления настоящего изобретения длина указанного участка нуклеотидов с одним видом оснований, как указано выше, составляет приблизительно от 2 до приблизительно 100 нуклеотидов. В дополнительном особенно предпочтительном варианте осуществления длина указанного участка нуклеотидов с одним видом оснований составляет приблизительно 16 нуклеотидов.
В другом предпочтительном варианте осуществления настоящего изобретения указанное сшивание, используемое для иммобилизации одной или нескольких нуклеиновых кислот на твердой подложке, как указано выше, представляет собой сшивание световым излучением, проводимое при длине волны приблизительно 200-300 нм. В особенно предпочтительном варианте осуществления указанное сшивание световым излучением проводят при длине волны 254 нм.
В другом предпочтительном варианте осуществления настоящего изобретения указанное сшивание, используемое для иммобилизации одной или нескольких нуклеиновых кислот на твердой подложке, как указано выше, представляет собой сшивание световым излучением, проводимым при длине волны приблизительно 300-500 нм. В особенно предпочтительном варианте осуществления указанное сшивание световым излучением проводят при длине волны 365 нм.
В дополнительном предпочтительном варианте осуществления настоящего изобретения указанное сшивание, используемое для иммобилизации одной или нескольких нуклеиновых кислот на твердой подложке, как указано выше, представляет собой сшивание световым излучением, проводимым при длине волны приблизительно 200-300 нм или 300-500 нм, которое проводят с использованием количества энергии приблизительно от 0,1 Джоуль/см2 до приблизительно 10 Джоуль/см2.
В дополнительном предпочтительном варианте осуществления настоящего изобретения указанная химическая иммобилизация, используемая для иммобилизации одной или нескольких нуклеиновых кислот на твердой подложке, указанной выше, представляет собой связывание между модифицированной аминами нуклеиновой кислотой и соответствующей функциональной группой на твердой подложке. В особенно предпочтительном варианте осуществления указанная функциональная группа представляет собой эпоксигруппу, альдегидную, карбоксильную или NHS группу.
В другом предпочтительном варианте осуществления настоящего изобретения указанный участок нуклеотидов с одним видом оснований, как указано выше, расположен на 3'- или 5'-конце указанной нуклеиновой кислоты.
В дополнительном предпочтительном варианте осуществления настоящего изобретения нуклеиновая кислота для иммобилизации по изобретению имеет следующую формулу:
5'-Yn-Xm-Br-Xp-Zq-3',
где Y и Z представляют собой участки нуклеотидов с одним видом оснований, где Y и Z могут состоять из одного и того же или из различных видов оснований; X представляет собой спейсер, предпочтительно состоящий из нуклеотидов, лишенных азотистых оснований; B представляет собой последовательность более чем из одного вида оснований, а n, m, r, p и q представляют собой количества нуклеотидов в нуклеиновой кислоте, где можно использовать следующие условия: n, m, p, q, r >1; n, m, r > 1 и p, q=0; p, q, r >1 и n, m=0; n, q, r > 1 и m, p=0; n, r > 1 и m, p, q=0; q, r > 1 и n, m, p=0.
В дополнительном предпочтительном варианте осуществления настоящего изобретения указанный меченый олигонуклеотид, как указано выше, содержит флуоресцентную, радиоактивную или хемилюминесцентную метку.
В другом предпочтительном варианте осуществления настоящего изобретения указанная твердая подложка, как указано выше, содержит функциональные группы амина. В особенно предпочтительном варианте осуществления настоящего изобретения подложка, содержащая указанные функциональные группы амина, содержит первичные или вторичные амины.
В дополнительном особенно предпочтительном варианте осуществления настоящего изобретения подложка, содержащая указанные функциональные группы амина, содержит пористый субстрат. Даже в более предпочтительном варианте осуществления указанный выше пористый субстрат состоит из нейлона.
В дополнительном особенно предпочтительном варианте осуществления настоящего изобретения подложка, содержащая указанные функциональные группы амина, содержит непористый субстрат. Еще в одном более предпочтительном варианте осуществления настоящего изобретения указанный выше непористый субстрат состоит из стекла, покрытого поли-L-лизином вещества, нитроцеллюлозы, полистирола, циклического олефинового сополимера (COC), циклического олефинового полимера (COP), полипропилена, полиэтилена или поликарбоната.
В дополнительном предпочтительном варианте осуществления настоящего изобретения указанный меченый олигонуклеотид, комплементарный участку нуклеотидов с одним видом оснований, в указанном выше способе по настоящему изобретению получают для повторного использования на дополнительной стадии способа посредством повышения температуры выше температуры плавления указанного меченого олигонуклеотида.
В дополнительном аспекте настоящее изобретение относится к способу анализа нуклеиновых кислот, включающему стадии: (a) иммобилизации одной или нескольких нуклеиновых кислот на твердой подложке посредством сшивания нагреванием, или световым излучением, или посредством химической иммобилизации, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований; (b) получения меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен образовывать комплекс с каждой из иммобилизованных нуклеиновых кислот на участке нуклеотидов с одним видом оснований; (c) детекции присутствия специфической последовательности, комплементарной последовательности внешнего участка нуклеотидов с одним видом оснований; и (d) определения показателя, отражающего состояние указанной нуклеиновой кислоты, по количеству меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, находящегося в комплексе с иммобилизованными нуклеиновыми кислотами. Предпочтительно стадии (b) и (c) проводят одновременно.
В еще одном предпочтительном варианте осуществления настоящего изобретения качество нуклеиновых кислот, иммобилизованных по настоящему изобретению, можно дополнительно тестировать в способе, включающем дополнительные стадии:
(i) получения по меньшей мере одного меченого тестового олигонуклеотида, комплементарного заранее определенному специфическому участку нуклеотидов вне участка нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен специфически образовывать комплекс с иммобилизованными нуклеиновыми кислотами, содержащими указанный специфический участок нуклеотидов; и
(ii) определения показателя, отражающего состояние указанных нуклеиновых кислот по присутствию указанного тестового олигонуклеотида, находящегося в комплексе с заранее определенным специфическим участком нуклеотидов вне участка нуклеотидов с одним видом оснований, иммобилизованных нуклеиновых кислот, содержащих указанный специфический участок нуклеотидов.
В еще одном предпочтительном варианте осуществления настоящего изобретения набор для тестирования нуклеиновых кислот на подложке, как указано выше, дополнительно содержит по меньшей мере один меченый тестовый олигонуклеотид, комплементарный заранее определенному специфическому участку нуклеотидов вне участка нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен явным образом образовывать комплекс с иммобилизованными нуклеиновыми кислотами, содержащими указанный специфический участок нуклеотидов.
В другом предпочтительном варианте осуществления настоящего изобретения в указанном способе анализа нуклеиновых кислот в указанном способе определения качества нуклеиновых кислот, иммобилизованных по настоящему изобретению и в указанном наборе для тестирования нуклеиновых кислот на подложке, как указано выше, указанный меченый тестовый олигонуклеотид, комплементарный заранее определенному участку нуклеотидов вне участка нуклеотидов с одним видом оснований, несет метку, которая оптически или химически отличается от метки олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований.
Эти и другие признаки, свойства и задачи по настоящему изобретению будут очевидны из приведенного ниже подробного описания, вместе с сопроводительными фигурами и примерами, которые демонстрируют принципы изобретения в качестве иллюстрации. Описание приведено только в качестве примера, не ограничивая объем изобретения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 показан образец точечного шаблона, использованного в экспериментах, описанных в примерах.
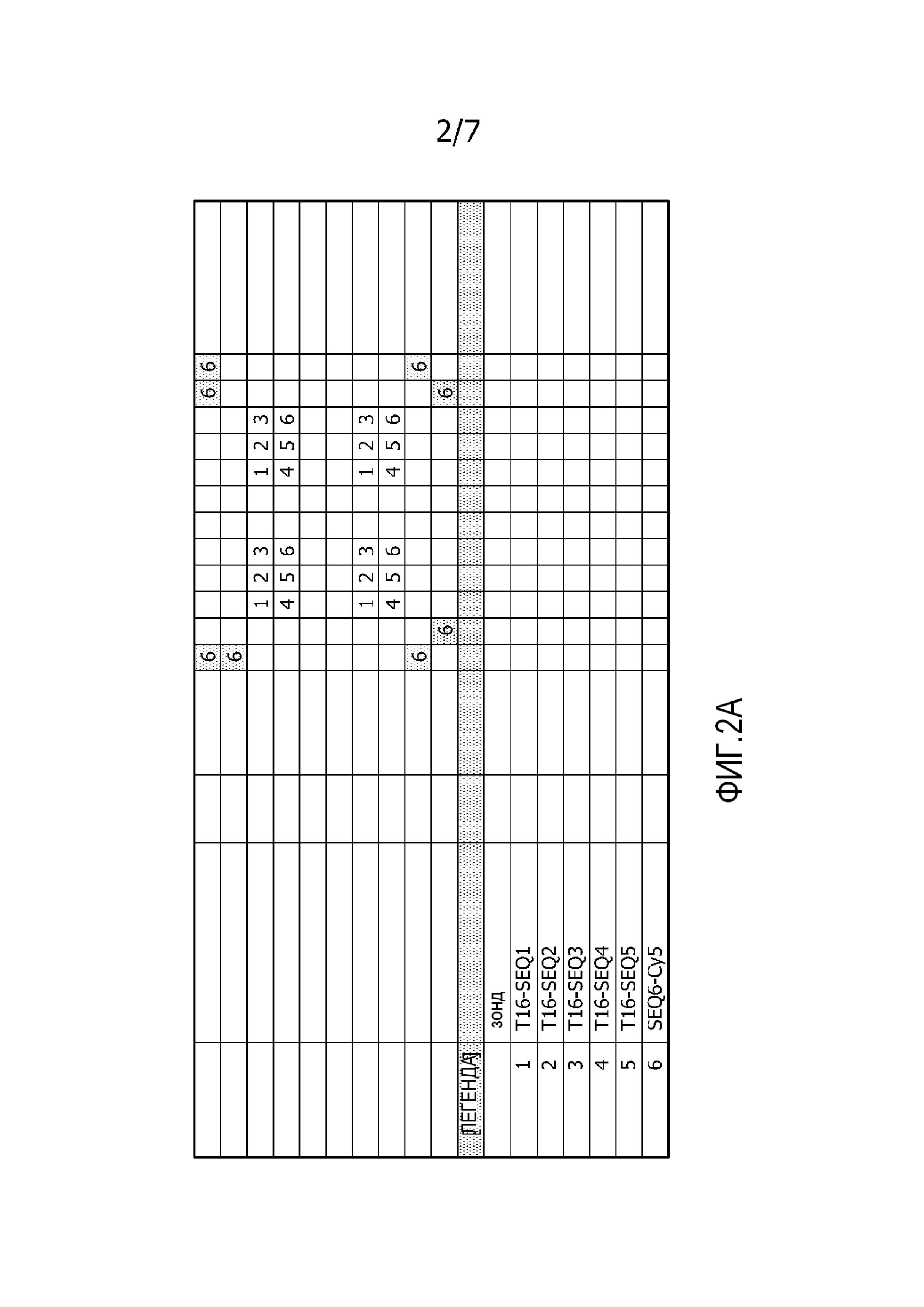
На фиг. 2A представлена схема мембраны. Точки с 1 по 5 (номер указателя от 1 до 5) представляют немеченые точки для гибридизации. Все эти точки содержат концевой участок из 16 остатков тимина (T16), но части олигонуклеотидов для гибридизации содержат различную последовательность у каждой точки. Точка 6 (номер указателя 6) содержит олигонуклеотид с флуоресцентной меткой. Этот олигонуклеотид используют для нанесения координатной сетки и калибровки.
На фиг. 2B представлено изображение мембраны, схема которой перед гибридизацией представлена на фиг. 2A. На изображении показаны только сигналы от тех точек, которые содержат олигонуклеотиды с флуоресцентной меткой (номер указателя 6), как указано на фиг. 2A.
На фиг. 2C представлено изображение мембраны, представленной на фиг. 2B после гибридизации с контрольным зондом. Мембрану инкубировали с меченым A16-олигонуклеотидом. Отчетливо видны точки гибридизации. Сигналы от точек, которые содержат олигонуклеотиды с флуоресцентной меткой (номер указателя 6), как указано на фиг. 2A, дополнительно видны в виде точек большего размера.
На фиг. 2D представлено изображение мембраны, представленной на фиг. 2C, непосредственно после нагревания для удаления контрольных олигонуклеотидов с точек с захватывающими зондами. Точки гибридизации, которые были видны на фиг. 2C, больше не демонстрируют никакого сигнала. У изображения еще видны сигналы в тех точках, которые содержат олигонуклеотиды с флуоресцентной меткой (номер указателя 6), как указано на фиг. 2A.
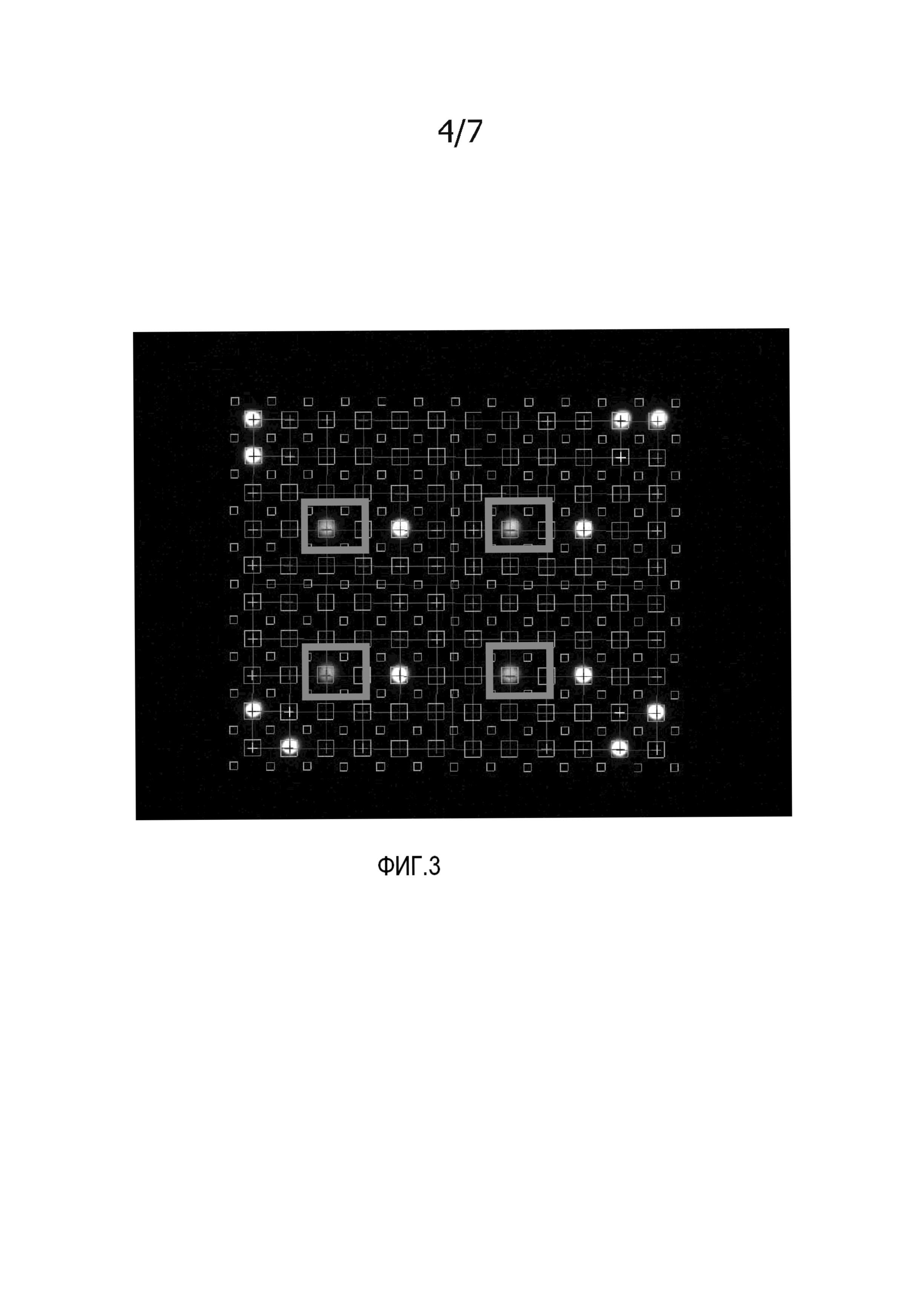
На фиг. 3 представлено изображение мембраны после гибридизации с меченым антисмысловым олигонуклеотидом, комплементарным к части для гибридизации захватывающего зонда на точке номер 4 (номер указателя 4, как указано на фиг. 2A). Мембрану использовали до контрольной и тестовой гибридизации, как представлено на фиг. 2B-2D. Жирными прямоугольниками обозначены точки, демонстрирующие сигнал после гибридизации с меченым антисмысловым олигонуклеотидом, соответствующим точке номер 4, как указано на фиг. 2A. Изображение демонстрирует, что захватывающий зонд на мембране не поврежден в течение стадии контроля качества и еще может связываться с антисмысловым олигонуклеотидом.
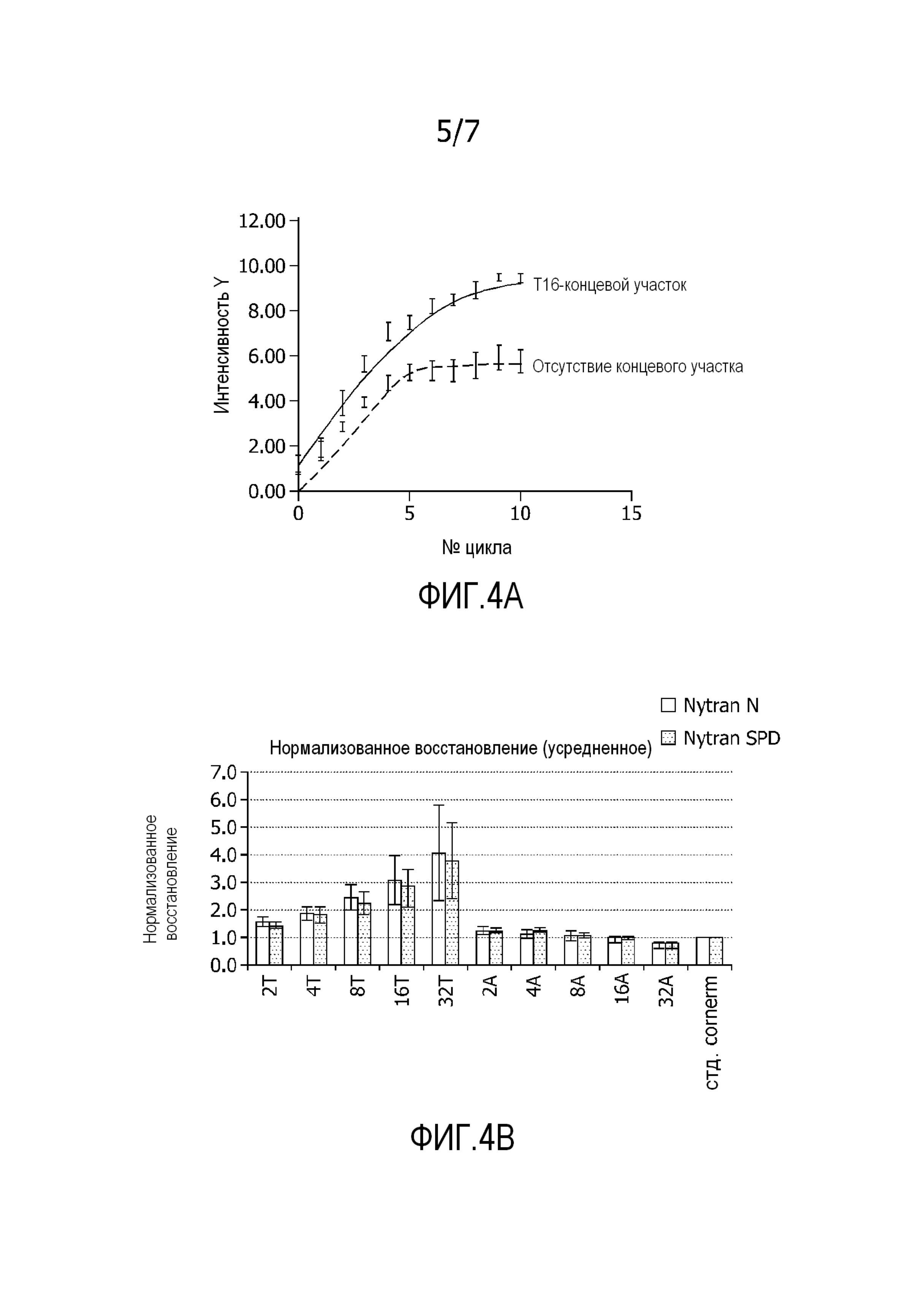
На фиг. 4A представлена кривая гибридизации в реальном времени захватывающих олигонуклеотидов с отсутствием T-концевого участка и с T16-концевой участок, т.е. содержащих участок из 16 остатков тимидина. Олигонуклеотиды, содержащие T16-концевой участок, демонстрируют усиленные гибридизационные сигналы, которые рассматривают как результат большего восстановления.
Фиг. 4B демонстрирует нормализованное восстановление нанесенных захватывающих олигонуклеотидов, содержащих нуклеотиды T или A в виде функции от вида основания (T или A) и количества оснований (2, 4, 8, 16 или 32). Показано, что когда количество T увеличено с 2 до 32, восстановление можно увеличить в 3-4 раза.
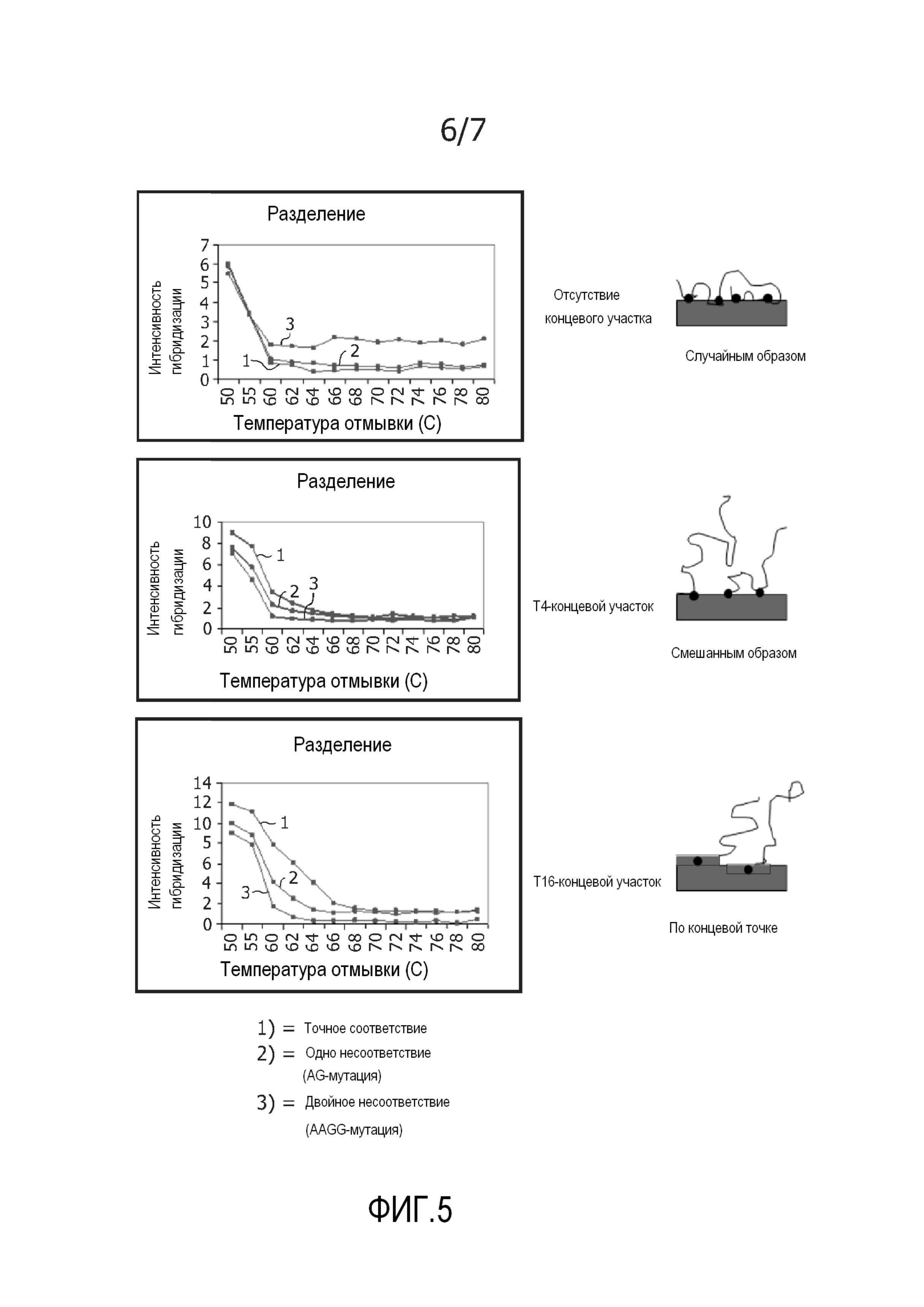
На фиг. 5 представлены кривые разделения комплементарных гибридов, гибридов с одним несоответствием ((AG)-мутация) и двойным несоответствием ((AAGG)-мутация) для захватывающих зондов с 0, 4 и 16 T. Иммобилизация захватывающих зондов схематически изображена рядом с графиками. На фигуре показано, что по сравнению с несоответствующими зондами при увеличении температур плавления достигают увеличенной селективности комплементарных зондов.
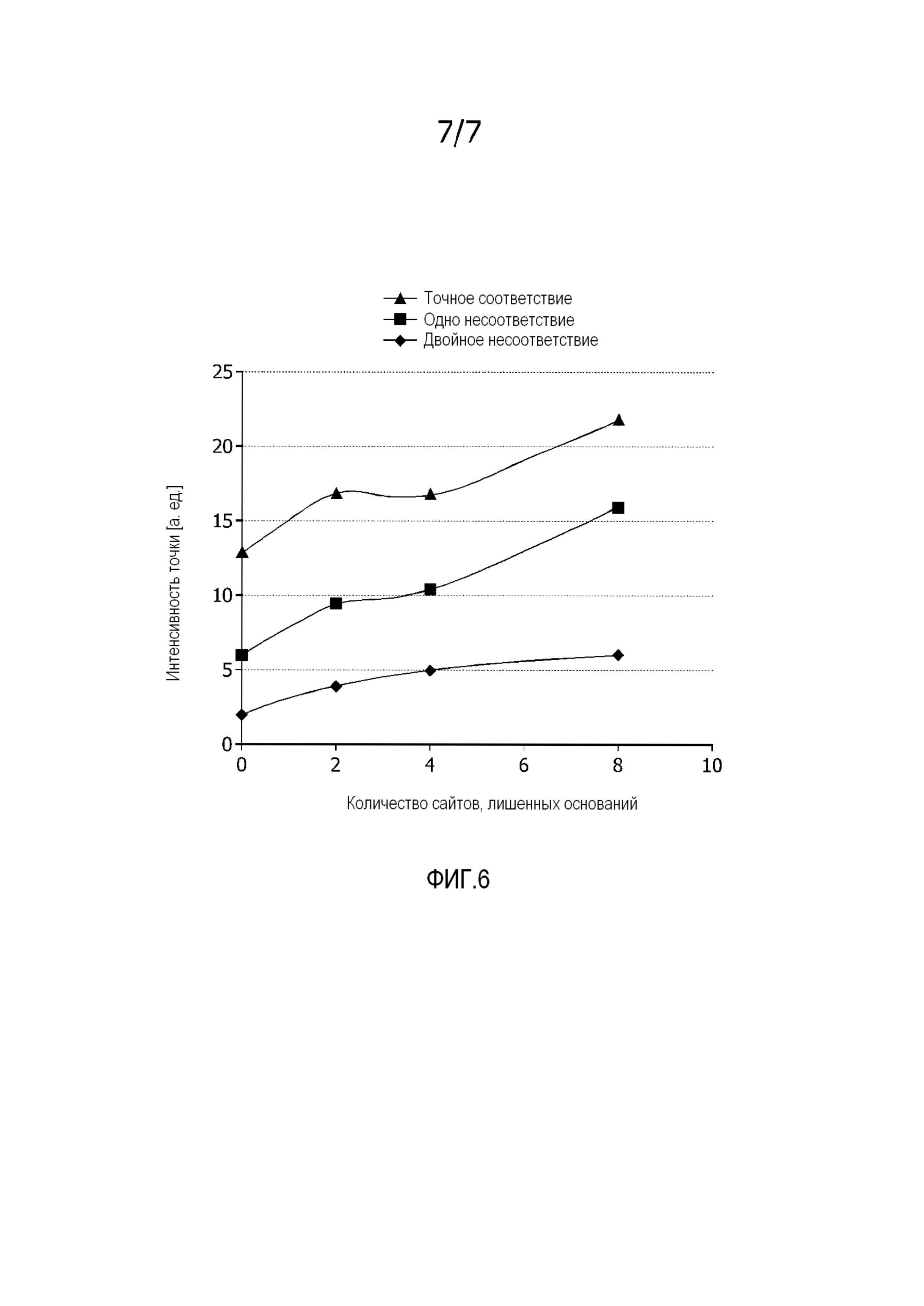
На фиг. 6 показан эффект количества сайтов, лишенных азотистых оснований (0, 2, 4 или 8) на интенсивность гибридизации ампликонов из бактериальных видов с комплементарными, а также с несоответствующими захватывающими зондами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы изобретения обнаружили, что можно определять поведение нанесенных нуклеиновых кислот после завершения печати и оценивать качество нанесенных зондов.
Хотя настоящее изобретение описано на примере конкретных вариантов осуществления, это описание не следует рассматривать как ограничивающее.
Перед подробным описанием иллюстративных вариантов осуществления настоящего изобретения приведены определения, которые важны для понимания настоящего изобретения.
Как используется в настоящей заявке и в прилагаемой формуле изобретения, если из контекста явно не следует иначе, то формы единственного числа также включают соответствующие формы множественного числа.
В контексте настоящего изобретения термины "около" и "приблизительно" означают интервал погрешности, под которым специалист в данной области должен понимать как интервал, в котором сохраняется возможность достижения технического результата рассматриваемого признака. Как правило, термин обозначает отклонение от указанного числового показателя на ±20%, предпочтительно ±15%, более предпочтительно ±10% и даже более предпочтительно ±5%.
Понятно, что термин "содержащий" не является ограничивающим. Для целей настоящего изобретения термин "состоит из" следует понимать, как предпочтительный вариант термина "содержащий". Если в настоящем документе группа определена, как содержащая по меньшей мере определенное количество вариантов осуществления, то это также обозначает группу, которая предпочтительно состоит только из этих вариантов осуществления.
Кроме того, термины "первый", "второй", "третий" или "(a)", "(b)", "(c)", "(d)" и тому подобное в описании и в формуле изобретения используют для возможности отличать сходные элементы и необязательно для описания последовательного или хронологического порядка. Понятно, что используемые таким образом термины являются взаимозаменяемыми при соответствующих условиях и что варианты осуществления изобретения, описываемые в настоящем документе, можно использовать для других последовательностей, а не только для описанных или приведенных в качестве примера в настоящем документе.
Если в заявке не указано иначе, как указано в настоящем документе ниже, в случае, если термины "первый", "второй", "третий" или "(a)", "(b)", "(c)", "(d)" и тому подобное относятся к стадиям способа или применения, между стадиями отсутствует временная связь или связи временных интервалов, т.е. стадии можно проводить одновременно или эти стадии могут быть разделены интервалами в несколько секунд, минут, часов, суток, недель, месяцев или даже лет.
Как указано выше, настоящее изобретение в одном из аспектов относится к способу тестирования нуклеиновых кислот на подложке, включающему (a) иммобилизацию одной или нескольких нуклеиновых кислот на твердой подложке посредством сшивания нагреванием, или световым излучением, или посредством химической иммобилизации, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований, (b) получения меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен образовывать комплекс с каждой из иммобилизованных нуклеиновых кислот на участке нуклеотидов с одним видом оснований, и (c) определение показателя, отражающего состояние указанных нуклеиновых кислот по количеству меченого олигонуклеотида, находящегося в комплексе с иммобилизованной нуклеиновой кислотой.
Термин "иммобилизация нуклеиновой кислоты на подложке" относится к ассоциации молекул нуклеиновой кислоты с поддерживающим субстратом посредством межмолекулярных взаимодействий с расположением нуклеиновой кислоты в конкретной области поддерживающего субстрата и одновременным предотвращением отщепления нуклеиновых кислот, например, в процессе стадии промывки или химической гибридизации. Как правило, такие межмолекулярные взаимодействия основаны на ковалентных химических связях между структурными элементами или функциональными группами вещества подложки и иммобилизуемой нуклеиновой кислоты, например, соответствующими функциональными группами нуклеиновой кислоты, что известно специалисту в данной области.
Термин "твердая подложка" означает, что вещество подложки главным образом имеет нежидкую консистенцию и, таким образом, возможно точное и прослеживаемое расположение нуклеиновой кислоты на веществе подложки.
Термин "сшивание нагреванием или световым излучением" относится ко взаимодействию между указанным веществом подложки и указанной нуклеиновой кислотой за счет формирования межмолекулярных взаимодействий или связей, которые связывают два структурных элемента под действием или за счет энергии, обеспечиваемой источником энергии, такой как нагревание или световое излучение.
Как правило, сшивание нагреванием проводят сушкой и последующим прокаливанием молекул нуклеиновой кислоты на субстрате при определенных температурах. Полагают, что сушка и прокаливание приводят к прикреплению нуклеиновых кислот к субстрату за счет гидрофобного взаимодействия, хотя точная природа связывания до конца не ясна. Этот способ можно классифицировать как один из вариантов физической адсорбции. Термин "физическая адсорбция" относится к процессу, включающему стадии начального разделения и притяжения, посредством чего нуклеиновая кислота приближается к реакционноспособным группам, которые основаны на физических адсорбционных процессах. Адсорбция биологической молекулы, например нуклеиновой кислоты, на твердую подложку может происходить практически при любом веществе подложки, так как выявлено, что любое такое вещество подложки будет взаимодействовать почти с любой поверхностью. Как правило, уровень взаимодействия между веществом подложки и молекулами нуклеиновой кислоты изменяется в зависимости от природы и формы вещества подложки и размера и химических свойств нуклеиновых кислот. Как правило, взаимодействие представляет собой пятистадийную последовательность действий, включающую стадии (i) транспорта молекулы к поверхности, (ii) адсорбции на поверхность, (iii) перестройку адсорбированной молекулы, (iv) возможную десорбцию адсорбированной молекулы и (v) транспорта десорбированной молекулы от поверхности.
Хотя последовательность действий до некоторой степени подразумевает, что возможность десорбции является обязательной, как правило, связывание является необратимым в зависимости от размера молекулы. Термин "размер молекулы" в отношении адсорбционных взаимодействий относится к количеству присутствующих участков связывания. Хотя любой участок связывания в принципе в любой момент может диссоциировать от поверхности субстрата, эффект большого количества участков связывания заключается в том, что молекула как целое остается связанной. Прилагая энергию в форме тепла, например, при температуре приблизительно от 40 до 150°C, предпочтительно от 50 до 120°C, более предпочтительно от 60 до 110°C, даже более предпочтительно от 70 до 100°C, а наиболее предпочтительно от 80 до 90°C, физическую адсорбцию молекулы нуклеиновой кислоты с веществом подложки можно усилить и время, необходимое для эффективной иммобилизации, можно уменьшить. Сшивание нагреванием можно проводить в течение любого подходящего периода времени, известного специалисту в данной области, например от 2 минут до 12 часов, предпочтительно от 10 минут до 8 часов, более предпочтительно от 30 минут до 6 часов, даже более предпочтительно от 45 минут до 4 часов, даже более предпочтительно от 1 часа до 3 часов, а наиболее предпочтительно в течение 2 часов. Сшивание нагреванием или прокаливание можно проводить любыми подходящими средствами, известными специалисту в данной области, например посредством сушильной камеры или печи. В дополнение к температуре также до подходящих значений, известных специалисту в данной области, можно регулировать другие параметры, такие как влажность, аэрация или вентиляция. Сшивание нагреванием или прокаливание также можно комбинировать с другими формами иммобилизации, такими как сшивание световым излучением или химическая иммобилизация.
Сшивание световым излучением проводят, используя световое излучение с типичной длиной волны, например, в диапазоне от 150 до 550 нм, для молекул нуклеиновой кислоты, предпочтительно в диапазоне от 200 до 500 нм для индукции взаимодействий между молекулами и веществом подложки. Как правило, индуцированное взаимодействие между молекулами и веществом подложки представляет собой ковалентное связывание нуклеиновой кислоты с веществом. Например, сшивание световым излучением можно проводить и использованием УФ-излучения. Сшивание посредством УФ-излучения является одним из простейших путей для обеспечения ковалентного связывания вещества подложки с зондом нуклеиновой кислоты. Как правило, связывание происходит между основаниями молекул нуклеиновой кислоты, например остатками тимина, гуанина, аденина, цитозина или урацила, которые реагируют с соответствующими и подходящими функциональными химическими группами в веществе подложки, как известно специалисту в данной области.
Присутствие и количество функциональных химических групп на или в веществе подложки можно контролировать и регулировать подходящими способами химической активации. Например, такие способы активации могут обеспечивать специфически локализованные функциональные группы на или в веществе подложки и облегчать специфическое взаимодействие между нуклеиновыми кислотами и веществом относительно этих локализованных функциональных групп.
Присутствие и количество функциональных химических групп на или в веществе подложки также может влиять на ориентацию и подвижность иммобилизованных нуклеиновых кислот. Например, присутствие большего количества функциональных групп может приводить к иммобилизации по различным точкам молекулы нуклеиновой кислоты. Кроме того, наличие соответствующих реакционноспособных элементов в молекуле нуклеиновой кислоты можно использовать для контроля ориентации молекулы нуклеиновой кислоты на веществе подложки, например, для иммобилизации по головной или концевой области или 5'- или 3'-области молекулы нуклеиновой кислоты или для иммобилизации только по центральной области или по центральной и концевым областям одновременно.
Дополнительный параметр, имеющий значение при сшивании молекулы нуклеиновой кислоты с веществом подложки посредством светового излучения, представляет собой количество энергии, используемой для излучения. Как правило, специалист в данной области может определить подходящую и оптимальную дозу излучения, следуя указаниям, предоставляемым производителями излучающего оборудования. Например, общую используемую для субстрата дозу можно рассчитать по формуле D=P•T, где D представляет собой общую используемую для субстрата дозу в мДж/см2, P представляет собой энергию светового излучения, используемую для вещества подложки в мВт/см2 и T представляет собой время в секундах, в течение которого применяют дозу. Энергия светового излучения, используемая для вещества подложки, зависит от источника светового излучения и дистанции между источником светового излучения и веществом подложки для облучения.
Источником светового излучения может быть любой подходящий источник светового излучения, известный специалисту в данной области, например ртутная лампа, предпочтительно ртутная УФ-лампа низкого давления или ртутная УФ-лампа высокого давления. Источником светового излучения также может быть лампа LED, например УФ-LED-лампа.
Источник светового излучения может испускать спектр длин волн с преобладающими линиями спектра испускания, например 254 нм или 365 нм. Источник светового излучения для испускания только конкретной линии спектра также можно комбинировать с конкретным фильтровальным элементом. Фильтр также можно использовать для уменьшения количества энергии, используемой для вещества подложки.
При сшивании световым излучением в дополнение к используемым длине волны и количеству энергии, до подходящих значений, известных специалисту в данной области, можно также регулировать другие параметры, такие как влажность, аэрация или вентиляция. Одним из ключевых вопросов, связанных с облучением вещества подложки, является содержание в нем влаги. Так как вода поглощает световое излучение, в частности УФ-излучение, изменение способа сушки может влиять на исход способа сшивания. Содержание влаги в веществе подложки можно регулировать любыми подходящими средствами, известными специалисту в данной области. Предпочтительно для регулировки количества воды в присутствующей жидкости сшивание световым излучением можно комбинировать со способом предварительной сушки в течение определенного периода времени.
Термин "химическая иммобилизация" относится к взаимодействию между веществом подложки и нуклеиновой кислотой на основе химических реакций. Такая химическая реакция, как правило, не основана на поступлении энергии посредством нагревания или светового излучения, но ее можно усилить, или применяя нагревание, например определенную оптимальную температуру для химической реакции, или световое излучение определенной длины волны, как описано выше в настоящем документе. Например, химическая иммобилизация может происходить между функциональными группами на веществе подложки и соответствующими функциональными элементами в молекулах нуклеиновой кислоты. Такие соответствующие функциональные элементы в молекулах нуклеиновой кислоты могут или присутствовать в молекуле, например, в качестве части химического состава молекулы нуклеиновой кислоты, или их можно вводить дополнительно. Примером такой функциональной группы является аминогруппа. Как правило, молекула нуклеиновой кислоты содержит функциональную аминогруппу или химически модифицирована так, чтобы содержать функциональную аминогруппу. Средства и способы такой химической модификации известны специалисту в данной области, и с ними можно ознакомиться, например, в руководствах по органической химии, таких как Organische Chemie by Hart et al., 2007, Wiley-Vch или Organische Chemie by Vollhardt et al., 2005, Wiley-Vch.
Расположение указанной функциональной группы в молекуле можно использовать для контроля и формирования характера связывания и/или ориентации молекулы, например функциональную группу можно помещать в концевой или хвостовой области, в 5'- и/или 3'-области молекулы или в центре молекулы.
Характерный реакционный партнер для молекулы нуклеиновой кислоты содержит группы, способные к связыванию с нуклеиновыми кислотами, предпочтительно с функционализированными аминами нуклеиновыми кислотами. Примеры таких веществ подложки представляют собой альдегидные, эпоксидные или NHS субстраты. Такие вещества известны специалисту в данной области. Функциональные группы, обеспечивающие реакцию связывания между молекулами нуклеиновой кислоты, которые химически активированы введением аминогруппы, и веществом подложки, известны специалисту в данной области.
Альтернативный реакционный партнер для молекулы нуклеиновой кислоты может нуждаться в химической активации, например, посредством активации функциональных групп, находящихся на веществе подложки. Термин "активированное вещество подложки" относится к веществу, в котором способами химической модификации, как известно специалисту в данной области, введены или активированы взаимодействующие или реакционноспособные химические функциональные группы. Например, субстрат, содержащий карбоксильные группы, перед использованием необходимо активировать.
Кроме того, существуют доступные субстраты, которые содержат функциональные группы, которые могут взаимодействовать с конкретными группами, уже присутствующими в нуклеиновых кислотах. Некоторые из этих реакций можно усилить нагреванием или УФ-излучением. Примерами являются аминогруппы на поверхности субстрата, которые могут связываться с конкретными основаниями в ДНК.
Указанные выше функциональные группы также могут располагаться или распределяться иначе, например, вещество подложки может содержать аминогруппы, а молекулы нуклеиновой кислоты можно модифицировать с целью введения соответствующих химически активных функциональных групп, таких как эпоксигруппы, альдегидные или карбоксильные группы.
Присутствие, количество и расположение функциональных химических групп, которые способны к связыванию и иммобилизации молекул нуклеиновой кислоты, на или в веществе подложки, можно использовать для контроля или регуляции характера связывания молекул нуклеиновой кислоты. Конкретное расположение реакционноспособных химических групп в веществе подложки можно использовать для облегчения специфического взаимодействия между нуклеиновыми кислотами и веществом относительно этих локализованных функциональных групп. Такой способ расположения можно использовать для обеспечения упорядоченной матрицы определенным образом расположенных молекул нуклеиновой кислоты, например посредством использования жидкостного наносящего оборудования, предпочтительно струйных устройств. Реакционноспособные химические элементы на или в веществе подложки также можно маскировать блокирующими реагентами и делать доступными для химической реакции с молекулами нуклеиновой кислоты после применения способа снятия блокады или маскировки. Альтернативно, такие химические элементы можно активировать, используя соответствующие и подходящие активирующие реагенты, известные специалисту в данной области.
В рамках настоящего изобретения термин "участок нуклеотидов с одним видом оснований" относится к части молекулы нуклеиновой кислоты, которая состоит только из одного основания, например из тимина, гуанина, аденина, цитозина или урацила или их любого химического производного, известного специалисту в данной области, которое способно взаимодействовать с комплементарным основанием. Указанная часть молекулы нуклеиновой кислоты может иметь различную длину только от нескольких оснований до более 100 оснований. Термин "только один вид оснований" относится не только к основаниям, которые являются идентичными, но также и к основаниям или их производным, которые демонстрируют сравнимое химическое поведение с точки зрения взаимодействия с комплементарными основаниями. Таким образом, в иллюстративном случае тимина термин относится не только исключительно к виду оснований или нуклеотиду тимину, но также и к его функционально эквивалентным производным или модификациями. Термин "функционально эквивалентный" относится к способности основания устанавливать нековалентное связывание с комплементарным основанием, которая химически сходна с нековалентным связыванием нуклеотида или основания, из которого оно получено. Такие функционально эквивалентные или модифицированные основания сохраняют способность осуществлять гибридизационное связывание с комплементарным основанием.
Термин "получение меченого олигонуклеотида" относится к поставке олигонуклеотида, содержащего химический или физический элемент, который позволяет отличить олигонуклеотид от фона, который не содержит такого элемента. Такая возможность проведения отличия предпочтительно может основываться на оптических различиях, например испускании света меткой после стимуляции или химической активации или радиоактивном излучении. Предпочтительно такой испускаемый свет может быть конкретного цвета, который легко отличается от контрастирующего фона. Термин "получение" также относится к началу и проведению взаимодействия между таким олигонуклеотидом и одной или несколькими или предпочтительно всеми молекулами нуклеиновой кислоты, иммобилизованными на веществе подложки по настоящему изобретению. Подробности такого взаимодействия известны специалисту в данной области, и с ними можно ознакомиться в руководстве по молекулярной биологии, таком как Sambrook et al., Molecular Cloning: A Laboratory Manual, 2001, Cold Spring Harbor Laboratory Press.
В рамках настоящего изобретения термин "олигонуклеотид, комплементарный участку нуклеотидов с одним видом оснований" относится к одноцепочечной молекуле нуклеиновой кислоты с различным количеством остатков, предпочтительно с длиной приблизительно от 2 до приблизительно 100 нуклеотидов, более предпочтительно приблизительно от 3 до приблизительно 70 нуклеотидов, даже более предпочтительно с длиной 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64 или 65 нуклеотидов, наиболее предпочтительно с длиной 16 нуклеотидов, которая обеспечивает нуклеотидную последовательность, способную к связыванию посредством гибридизации нуклеиновых кислот или нековалентного связывания по водородным связям с иммобилизованной нуклеиновой кислотой, как описано выше в настоящем документе. Термин "комплементарный" относится к способности олигонуклеотида устанавливать нековалентное связывание между олигонуклеотидом и иммобилизованной нуклеиновой кислотой посредством двух или трех водородных связей в зависимости от присутствующих оснований. Как правило, адениновые и тиминовые основания нековалентно связаны двумя водородными связями, а гуаниновые и цитозиновые основания нековалентно связаны тремя водородными связями. Урацил и аденин, как правило, нековалентно связаны двумя водородными связями. Таким образом, если, например, участок нуклеотидов с одним видом оснований состоит из тиминовых нуклеотидов или из их функционально эквивалентных производных, меченый олигонуклеотид может состоять из адениновых нуклеотидов или их функционально эквивалентных производных.
В рамках настоящего изобретения термин "комплементарный участку нуклеотидов с одним видом оснований" также относится к олигонуклеотидам или частям молекул нуклеиновой кислоты, которые демонстрируют только одно или несколько несоответствий относительно правил комплементарности химического взаимодействия, как определено выше в настоящем документе. Количество несоответствий может изменяться в зависимости от длины олигонуклеотида и размера или длины молекулы нуклеиновой кислоты. Например, олигонуклеотид может содержать в пределах участка комплементарности от 1% до 35% несоответствующих оснований, предпочтительно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29% или 30% несоответствующих оснований. Термин "несоответствующие основания" относится к основаниям или нуклеотидам, которые не способны к установлению нековалентного связывания посредством водородных связей с основанием, находящимся с противоположной стороны на второй взаимодействующей одноцепочечной молекуле нуклеиновой кислоты. Такие несоответствующие основания могут располагаться на всем протяжении олигонуклеотида или на любом из двух концов олигонуклеотида или в центре олигонуклеотида. По настоящему изобретению такие несоответствующие основания могут оказывать воздействие на общее взаимодействие между иммобилизованной нуклеиновой кислотой и меченым олигонуклеотидом, как определено выше в настоящем документе. Как правило, указанные несоответствующие основания могут уменьшать силу взаимодействия обеих молекул. Термин "уменьшать" относится к ухудшению взаимодействия в размере приблизительно от 1 до приблизительно 50%. Однако термин не относится к полному ингибированию или устранению взаимодействия между олигонуклеотидом по настоящему изобретению и иммобилизованной молекулой нуклеиновой кислоты.
Термин "формирующий комплекс с каждой из иммобилизованных нуклеиновых кислот на участке нуклеотидов с одним видом оснований" в рамках настоящего изобретения относится к взаимодействию, основанному на нековалентном связывании посредством водородных связей между комплементарными основаниями в иммобилизованных нуклеиновых кислотах и олигонуклеотиде, как определено выше в настоящем документе. Такое формирование комплекса может быть специфичным для всех молекул, содержащих области комплементарности. Специфичность зависит от химической природы участвующих оснований, длины молекул, длины и формы областей комплементарности и параметров окружающей среды, таких как температура, pH, содержание солей и концентрация солей или присутствия и концентрации дополнительных химических соединений, как известно специалисту в данной области. Указанные выше параметры и факторы по настоящему изобретению можно модифицировать и регулировать. Предпочтительно указанные параметры можно регулировать так, что олигонуклеотид, как определено выше в настоящем документе, связывается только с комплементарными участками в молекуле нуклеиновой кислоты, если в обеих молекулах присутствует от 0% до 35% несоответствующих оснований, более предпочтительно только если в обеих молекулах присутствует только 0%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29% или 30% несоответствующих оснований.
Таким образом, формирование комплекса может относиться к областям обеих молекул, которые не комплементарны, при условии, что происходит детектируемое взаимодействие между комплементарными областями. Термин "каждая из иммобилизованных нуклеиновых кислот" относится ко всем иммобилизованным нуклеиновым кислотам, несущим участок нуклеотидов или оснований с одним видом оснований, который комплементарен олигонуклеотидной последовательности, как определено выше в настоящем документе.
В рамках настоящего изобретения термин "определение показателя, отражающего состояние указанной нуклеиновой кислоты" относится к измерению степени взаимодействия между иммобилизованной нуклеиновой кислотой и комплементарным олигонуклеотидом, как определено выше в настоящем документе. Такая степень взаимодействия позволяет сделать выводы по нескольким параметрам. Например, степень взаимодействия позволяет проверить присутствует ли или нет в определенной области или в конкретной точке вещества подложки нуклеиновая кислота, содержащая комплементарную последовательность. Если степень взаимодействия является экстремально низкой или если в конкретной области или конкретной точке вещества подложки нет взаимодействия, такой результат может отражать или полное отсутствие молекулы нуклеиновой кислоты, или по меньшей мере отсутствие области комплементарности в указанной молекуле, или отсутствие функциональности молекулы нуклеиновой кислоты.
Кроме того, степень взаимодействия позволяет проверять качество иммобилизованных нуклеиновых кислот. Если степень взаимодействия является низкой или по меньшей мере не находится на оптимальном уровне, такой результат может указывать на структурное нарушение или модификацию по меньшей мере области комплементарности, присутствующей в указанной нуклеиновой кислоте. Такое структурное нарушение, в свою очередь, может указывать на общие структурные нарушения иммобилизованной нуклеиновой кислоты. Вещество подложки, биочипа или микроматрицы, содержащее такие структурно нарушенные или модифицированные нуклеиновые кислоты, как определено по настоящему изобретению, можно, например, исключать из дальнейшего применения или тщательно изучать при вторичном тестировании по настоящему изобретению, как описано в настоящем документе ниже.
Термин "степень взаимодействия" означает числовой показатель, который получают на основании измерений физического, например оптического, или химического сигнала в области или зоне субстрата, в которой иммобилизована нуклеиновая кислота после получения меченого олигонуклеотида по изобретению, как определено выше в настоящем документе, т.е. после приведения олигонуклеотида в близость с иммобилизованными молекулами нуклеиновой кислоты для обеспечения формирования комплекса, в сравнении с измерением такого сигнала в области, в которой нуклеиновая кислота не иммобилизована, т.е. в фоновой области. Таким образом, присутствие меченых элементов в олигонуклеотиде можно измерять и детектировать соответствующими подходящими способами, как известно специалисту в данной области. Таким образом, такой физический или химический сигнал можно детектировать только в областях, в которых происходит взаимодействие между меченым олигонуклеотидом и иммобилизованной нуклеиновой кислотой. Измеряемый числовой показатель зависит от метки, используемой для олигонуклеотида, т.е. от абсолютной силы сигнала. Указанный показатель также может относиться к силе сигнала, которую корректируют с учетом фонового сигнала в одной или нескольких областях субстрата, предпочтительно в нескольких различных положениях вещества подложки, которые не содержат иммобилизованных нуклеиновых кислот.
Кроме того, указанный показатель можно корректировать по контрольному показателю, полученному в реакции взаимодействия, в которой меченый олигонуклеотид оптимально взаимодействует с иммобилизованной нуклеиновой кислотой, например, в которой все основания олигонуклеотида связаны или гибридизуются с иммобилизованной молекулой нуклеиновой кислоты и/или в которой по существу не происходит отсоединения олигонуклеотида.
Степень взаимодействия в определенной конкретной области вещества подложки приблизительно от 0% до приблизительно 5%, предпочтительно приблизительно от 0% до приблизительно 3%, рассчитанную относительно контрольного показателя, как определено выше в настоящем документе, можно рассматривать как указывающую на полное отсутствие в указанной определенной области или точке вещества подложки нуклеиновой кислоты или отсутствие области комплементарности в указанной нуклеиновой кислоте. Степень взаимодействия приблизительно от 5% до приблизительно 80%, предпочтительно приблизительно от 10% до приблизительно 70% можно рассматривать как указывающую на присутствие в конкретной области или точке вещества подложки молекулы нуклеиновой кислоты, которая структурно повреждена по меньшей мере в области комплементарности, присутствующей в указанной нуклеиновой кислоте, или которая содержит только субфрагмент указанной области. Такая степень взаимодействия дополнительно указывает на проблемы, произошедшие при нанесении или иммобилизации. Нуклеиновая кислота, демонстрирующая промежуточную степень взаимодействия по настоящему изобретению приблизительно от 5% до приблизительно 80%, предпочтительно приблизительно от 10% до приблизительно 70%, может все еще быть способна к оптимальному взаимодействию со вторым олигонуклеотидом, который комплементарен к специфическому участку нуклеотидов вне участка нуклеотидов с одним видом оснований, так как степень взаимодействия, как определено выше в настоящем документе, рассчитывают только относительно участка нуклеотидов с одним видом оснований. Нуклеиновые кислоты, демонстрирующие такую промежуточную степень взаимодействия, можно дополнительно анализировать со вторым, специфически связывающимся олигонуклеотидом, например олигонуклеотидом, который комплементарен специфическому участку нуклеотидов вне участка нуклеотидов с одним видом оснований, для выяснения того, способен ли специфический участок нуклеотидов к связыванию с более высокой степенью взаимодействия, т.е. является ли указанная промежуточная степень взаимодействия следствием ограничений на участке нуклеотидов с одним видом оснований или также следствием структурного повреждения в этом втором участке. Такое второе тестирование взаимодействия также можно проводить в случаях, в которых с применением олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, можно определять только очень низкую степень взаимодействия или отсутствие взаимодействия. Подробности соответствующего второго взаимодействия описаны в настоящем документе ниже.
Степень взаимодействия в определенной конкретной области вещества подложки приблизительно от 80% до приблизительно 100%, предпочтительно приблизительно от 90% до приблизительно 100%, рассчитанную относительно контрольного показателя, как определено выше в настоящем документе, можно рассматривать как указывающую на присутствие в указанной конкретной области или точке вещества подложки молекулы нуклеиновой кислоты, которая структурно не повреждена по меньшей мере в области комплементарности, присутствующей в указанной нуклеиновой кислоте. В определенных случаях степень взаимодействия также может составлять выше 100%, например приблизительно от 100% до приблизительно 150%. Такой результат может быть получен, например, если контрольный показатель получают на основании сигнала, который является менее сильным, чем сильнейший сигнал в области детекции, или если контрольный показатель получают на основании усредненного или нормализованного сигнала, средний показатель сигнала которого меньше, чем сильнейший сигнал в области детекции.
Термин "сигнал" означает любое химическое или физическое, предпочтительно оптическое отличимое различие между двумя точками или областями на поверхности вещества подложки или в веществе подложки. Измерение или детекцию любого такого сигнала можно проводить любыми подходящими средствами, известными специалисту в данной области. Например, сигнал можно детектировать с применением устройства сканирования микроматриц или оптического оборудования CCD. Для анализа и сравнения детектируемого сигнала можно использовать подходящие компьютерное оборудование и программы в соответствии с необходимостью. Такие компьютерное оборудование и программы известны специалисту в данной области.
Термин "состояние нуклеиновой кислоты" относится к присутствию или отсутствию иммобилизованных нуклеиновых кислот, а также к качеству иммобилизованных нуклеиновых кислот в отношении структурных ограничений и повреждений в области комплементарности. Таким образом, как определено выше в настоящем документе, способ тестирования нуклеиновых кислот по настоящему изобретению обеспечивает установление "все или ничего" между наличием или отсутствием параметра нанесения и иммобилизации на субстрате, и проведение "контроля качества" при различных степенях взаимодействия между иммобилизованными молекулами нуклеиновой кислоты и меченым олигонуклеотидом, как определено выше в настоящем документе. Малые или умеренные степени взаимодействия можно рассматривать как отражение более низкого качества иммобилизованных нуклеиновых кислот, которое может приводить к дальнейшим проблемам при проведении взаимодействия со специфически связывающимися олигонуклеотидами.
Кроме того, стадии (a), (b) и (c) способа тестирования нуклеиновых кислот по настоящему изобретению, как описано выше в настоящем документе, можно проводить без каких-либо временной связи или связи временных интервалов между стадиями, т.е. все стадии или определенные подгруппы стадий можно проводить одновременно или между стадиями (a), и/или (b), и/или (c) могут существовать любые подходящие интервалы. Например, стадию (b) можно проводить через временной интервал в пределах нескольких секунд, минут, часов, суток, недель, месяцев или даже лет после проведения стадии (a). То же используется для стадии (c) относительно стадии (a) и стадии (b).
В конкретном варианте осуществления сначала проводят стадию (a) с последующией стадией (b) и стадией (c).
Предпочтительно последующие стадии от (b) до (c) проводят приблизительно через интервал, составляющий от одного часа до приблизительно 12 месяцев после начала или завершения стадии (a).
В дополнительном аспекте настоящее изобретение относится к набору для тестирования нуклеиновых кислот на подложке. Указанный набор содержит матрицу нуклеиновых кислот, иммобилизованных на твердой подложке посредством сшивания нагреванием, или световым излучением, или посредством химической иммобилизации, как определено выше в настоящем документе, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований, как определено выше в настоящем документе, и меченый олигонуклеотид, комплементарный участку нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен образовывать комплекс с каждой из иммобилизованных нуклеиновых кислот на участке нуклеотидов с одним видом оснований. Набор может дополнительно содержать ингредиенты и компоненты, необходимые для реакции тестирования, как определено выше в настоящем документе, например буферы, такие как гибридизационные буферы, промывочные жидкости и/или компоненты, способные к детекции меток, или упаковочный информационный листок, содержащий информацию о применении набора. Набор может быть в любой подходящей форме, известной специалисту в данной области. Например, набор может быть в виде открытого или закрытого картриджа. Набор в виде закрытого картриджа может содержать несколько отделений, в которых могут храниться один или несколько из указанных ингредиентов.
В другом аспекте настоящее изобретение относится к применению меченого олигонуклеотида, как определено выше в настоящем документе, который комплементарен участку нуклеотидов с одним видом оснований, как определено выше в настоящем документе, для тестирования состояния нуклеиновых кислот, иммобилизованных на твердой подложке посредством сшивания нагреванием, или световым излучением, или посредством химической иммобилизации, как определено выше в настоящем документе, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований и где указанный меченый олигонуклеотид способен образовывать комплекс с каждой из иммобилизованных нуклеиновых кислот в указанном участке нуклеотидов с одним видом оснований.
Применение меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, для тестирования состояния нуклеиновых кислот, иммобилизованных на твердой подложке посредством сшивания, может включать определение показателя, отражающего количество меченого олигонуклеотида, находящегося в комплексе с иммобилизованной нуклеиновой кислотой, как определено выше в настоящем документе.
Нуклеиновая кислота в соответствии с предпочтительным вариантом осуществления настоящего изобретения может представлять собой одноцепочечную ДНК, РНК, ПНК, ЦНК, ГНК, ЗНК или АНК. ДНК может находиться в форме, например A-ДНК, B-ДНК или Z-ДНК. РНК может находиться в форме, например, п-РНК, т.е. пиранозил-РНК, или в структурно модифицированных формах, таких как шпилечная РНК или стебельно-петлевая РНК.
Термин "ПНК" относится к пептидной нуклеиновой кислоте, т.е. к искусственно синтезированному полимеру, сходному с ДНК или РНК, который используют в биологических исследованиях и при лечении, но наличие в природе которого неизвестно. Каркас ПНК, как правило, состоит из повторяющихся N-(2-аминоэтил)глициновых единиц, связанных пептидными связями. Различные пуриновые и пиримидиновые основания связаны с каркасом метиленкарбонильными связями. Как правило, ПНК изображают подобно пептидам с N-концом в начальном (слева) положении и C-концом справа.
Термин "ЦНК" относится к нуклеиновой кислоте аминоциклогексилэтановой кислоты. Кроме того, термин относится к циклопентановой нуклеиновой кислоте, т.е. молекуле нуклеиновой кислоты, содержащей например 2-дезоксикарбагуанозин.
Термин "ГНК" относится к гекситным нуклеиновым кислотам, т.е. аналогам ДНК, состоящей из стандартных нуклеиновых оснований и фосфорилированного 1,5-ангидрогекситного каркаса.
Термин "ЗНК" относится к запертым нуклеиновым кислотам. Как правило, запертая нуклеиновая кислота представляет собой модифицированный и, таким образом, запертый нуклеотид РНК. Остаток рибозы нуклеотида ЗНК можно модифицировать посредством дополнительной связи, соединяющей 2' и 4' атомы углерода. Такая связь запирает рибозу в структурной конформации 3-эндо. Запертая конформация рибозы усиливает стэкинг оснований и предварительную организацию каркаса. Это может значительно увеличить термостабильность, т.е. температуру плавления олигонуклеотида.
Термин "АНК" относится к арабиновым нуклеиновым кислотам или их производным. Предпочтительное производное АНК в рамках настоящего изобретения представляет собой 2'-дезокси-2'-фтор-бета-D-арабинонуклеозид (2'F-АНК).
В дополнительном предпочтительном варианте осуществления молекулы нуклеиновой кислоты могут содержать комбинацию любой из одноцепочечных ДНК, РНК, ПНК, ЦНК, ГНК, ЗНК и АНК. Особенно предпочтительны смеси из нуклеотидов ЗНК с основаниями ДНК или РНК. В дополнительном предпочтительном варианте осуществления молекулы нуклеиновой кислоты, как определено выше в настоящем документе, могут находиться в форме коротких олигонуклеотидов, длинных олигонуклеотидов или полинуклеотидов.
Участок нуклеотидов из одного вида оснований в соответствии с предпочтительным вариантом осуществления настоящего изобретения может состоять только из тиминовых, урациловых, гуаниновых, адениновых или цитозиновых оснований. Также участок нуклеотидов из одного вида оснований может дополнительно состоять из функциональных эквивалентов тиминовых, урациловых, гуаниновых, адениновых или цитозиновых оснований, как определено выше в настоящем документе, или из комбинации тимина и его функциональных эквивалентов, урацила и его функциональных эквивалентов, гуанина и его функциональных эквивалентов, аденина и его функциональных эквивалентов или цитозина и его функциональных эквивалентов. Термин "функциональный эквивалент" относится к основанию, которое способно образовывать нековалентное связывание с комплементарным основанием, которое химически сходно с нековалентным связыванием нуклеотида или основания, из которого оно получено.
В особенно предпочтительном варианте осуществления участок нуклеотидов с одним видом оснований представляет собой участок из остатков тимина, урацила или гуанина или их сочетаний с их соответствующими функциональными эквивалентами. Еще более предпочтительным является участок нуклеотидов с одним видом оснований, состоящий из остатков тимина или комбинаций остатков тимина с его функциональными эквивалентами.
Длина нуклеиновых кислот с одним видом оснований по дополнительному предпочтительному варианту осуществления изобретения может составлять приблизительно от 2 до приблизительно 200 нуклеотидов, более предпочтительно приблизительно от 2 до приблизительно 100 нуклеотидов, особенно предпочтительно приблизительно от 2 до приблизительно 50 нуклеотидов, и даже более предпочтительно, приблизительно от 10 до приблизительно 20 нуклеотидов. Также предпочтительной является длина, составляющая 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 нуклеотидов. Наиболее предпочтительна длина, составляющая 16 нуклеотидов.
Сшивание, используемое для иммобилизации одной или нескольких нуклеиновых кислот на твердой подложке в соответствии с другим предпочтительным вариантом осуществления настоящего изобретения, может представлять собой сшивание световым излучением, проводимым при длине волны в диапазоне приблизительно 200-300 нм или в его поддиапазоне, например поддиапазоне от 200 до 220 нм, от 220 до 240 нм, от 240 до 260 нм, от 260 до 280 нм, от 280 до 300 нм. Такое сшивание можно рассматривать как классическое сшивание УФ-излучением. Длину волны используемого светового излучения можно определять преимущественно выбором ламп. Например, для установления длины волны в спектре 200-300 нм можно использовать ртутную УФ-лампу низкого давления. Как известно специалисту в данной области, такая лампа, как правило, испускает не только одну длину волны, а спектр длин волн. Термин "спектр 200-300 нм" относится к такому типичному спектру, испускаемому ртутной УФ-лампой низкого давления. Альтернативно, световое излучение может испускать УФ LED, который может иметь другой спектр испускания, или любая другая лампа или источник светового излучения, известный специалисту в данной области при условии, что большинство испускаемых длин волн находятся в диапазоне 200-300 нм. В особенно предпочтительном варианте осуществления главной линией в пределах указанного спектра испускания 200-300 нм является 254 нм. Кроме того, предпочтительным является подход к сшиванию, при котором используют источник светового излучения, который испускает не весь спектр длин волн, а только свет с конкретными длинами волн, особенно предпочтительно с длиной волны 254 нм. Такое ограничение может быть достигнуто с помощью особых моделей ламп или LED или используя фильтровальные элементы, обеспечивающие прохождение исключительно определенных длин волн, что известно специалисту в данной области.
Сшивание нуклеиновых кислот при длине волны 200-300 нм, в частности, при 254 нм предпочтительно можно использовать для иммобилизации молекул нуклеиновой кислоты, содержащих урациловые, тиминовые, гуаниновые, цитозиновые или адениновые основания, более предпочтительно нуклеиновые кислоты, содержащие участок с одним видом оснований, состоящий из урациловых, тиминовых, гуаниновых, цитозиновых или адениновых оснований. В более предпочтительном варианте осуществления сшивание нуклеиновых кислот при длине волны 200-300 нм, в частности при 254 нм, предпочтительно можно использовать для иммобилизации молекул нуклеиновой кислоты, содержащих участок с одним видом оснований, состоящий из урациловых, тиминовых или гуаниновых оснований, даже более предпочтительно нуклеиновых кислот, содержащих участок с одним видом оснований, состоящий из урациловых или тиминовых оснований. Наиболее предпочтительны молекулы нуклеиновой кислоты, содержащие участок с одним видом оснований, состоящий из урациловых оснований, так как выявлено, что участок с одним видом оснований, состоящий из урацила, можно более эффективно иммобилизовать на веществе подложки при длине волны 254 нм, чем участок с одним видом оснований, состоящий из тимина, который в свою очередь можно более эффективно иммобилизовать на веществе подложки при указанной длине волны, чем участок с одним видом оснований, состоящий из гуанина, цитозина или аденина.
Сшивание, используемое для иммобилизация одной или нескольких нуклеиновых кислот на твердой подложке в соответствие с другим предпочтительным вариантом осуществления настоящего изобретения, может представлять собой сшивание световым излучением, проводимым при длине волны в диапазоне приблизительно 300-500 нм или в его поддиапазоне, например в поддиапазоне от 300 до 320 нм, от 320 до 340 нм, от 340 до 360 нм, от 360 до 380 нм, от 380 до 400 нм, от 400 до 420 нм, от 420 до 440 нм, от 440 до 460 нм, от 460 до 480 нм, от 480 до 500 нм. Такое сшивание можно рассматривать как неклассическое сшивание УФ-излучением или сшивание с большой длиной волны. Длину волны используемого светового излучения можно определять преимущественно выбором ламп. Например, для установления длины волны в спектре 300-500 нм можно использовать ртутную УФ-лампу высокого давления. Как известно специалисту в данной области, такая лампа, как правило, испускает не только одну длину волны, а спектр длин волн. Термин "спектр 300-5000 нм" относится к такому типичному спектру, испускаемому ртутной УФ-лампой высокого давления. Альтернативно, световое излучение может испускать LED, который может иметь другой спектр испускания, или любая другая лампа или источник светового излучения, известный специалисту в данной области при условии, что большинство испускаемых длин волн находятся в диапазоне 300-500 нм. В особенно предпочтительном варианте осуществления главной линией в пределах указанного спектра испускания 300-500 нм является 365 нм. Кроме того, предпочтительным является подход к сшиванию, при котором используют источник светового излучения, который испускает не весь спектр длин волн, а только свет с конкретными длинами волн, особенно предпочтительно с длиной волны 365 нм. Такого ограничения можно достигать с применением особых моделей ламп или LED или применяя фильтровальные элементы, обеспечивающие прохождение исключительно определенных длин волн, как известно специалисту в данной области.
Сшивание нуклеиновых кислот при длине волны 300-500 нм, в частности при 365 нм, предпочтительно можно использовать для иммобилизации молекул нуклеиновой кислоты, содержащих урациловые, тиминовые, гуаниновые, цитозиновые или адениновые нуклеотиды, более предпочтительно нуклеиновые кислоты, содержащие участок с одним видом оснований, состоящий из урациловых, тиминовых, гуаниновых, цитозиновых или адениновых нуклеотидов. В более предпочтительном варианте осуществления сшивание нуклеиновых кислот при длине волны 300-500 нм, в частности при 365 нм, предпочтительно можно использовать для иммобилизации молекул нуклеиновой кислоты, содержащих участок с одним видом оснований, состоящий из гуаниновых, урациловых или тиминовых оснований, даже более предпочтительно нуклеиновых кислот, содержащих участок с одним видом оснований, состоящий из гуаниновых или урациловых оснований. Наиболее предпочтительны молекулы нуклеиновой кислоты, содержащие участок с одним видом оснований, состоящий из гуаниновых оснований, так как авторами настоящего изобретения выявлено, что участок с одним видом оснований, состоящий из гуанина, можно более эффективно иммобилизовать на веществе подложки при длине волны 365 нм, чем участок с одним видом оснований, состоящий из урацила, который, в свою очередь, можно более эффективно иммобилизовать на веществе подложки при указанной длине волны, чем участок с одним видом оснований, состоящий из тимина, который в свою очередь можно более эффективно иммобилизовать на веществе подложки при указанной длине волны, чем участок с одним видом оснований, состоящий из цитозина или аденина.
Сшивание, используемое для иммобилизации одной или нескольких нуклеиновых кислот на твердой подложке в соответствие с другим предпочтительным вариантом осуществления настоящего изобретения, может представлять собой сшивание световым излучением, проводимым при длине волны приблизительно 200-300 нм, проводимым с использованием количества энергии в диапазоне от приблизительно от 0,05 до приблизительно 1,5 Джоуль/см2, более предпочтительно приблизительно от 0,075 до приблизительно 1,0 Джоуль/см2, даже более предпочтительно приблизительно от 0,1 до приблизительно 0,6 Джоуль/см2, а наиболее предпочтительно, 0,3 Джоуль/см2. В особенно предпочтительном варианте осуществления сшивание проводят при длине волны 254 нм с использованием количества энергии 0,3 Джоуль/см2.
Сшивание, используемое для иммобилизации одной или нескольких нуклеиновых кислот на твердой подложке в соответствии с другим предпочтительным вариантом осуществления настоящего изобретения, может представлять собой сшивание световым излучением, проводимым при длине волны приблизительно 300-500 нм, проводимым с использованием количества энергии в диапазоне от приблизительно от 0,5 до приблизительно 15 Джоуль/см2, более предпочтительно, приблизительно от 2,0 до приблизительно 12 Джоуль/см2, даже более предпочтительно приблизительно от 4 до приблизительно 10 Джоуль/см2, а наиболее предпочтительно 5 Джоуль/см2. В особенно предпочтительном варианте осуществления сшивание проводят при длине волны 365 нм с использованием количества энергии 5 Джоуль/см2.
Как указано выше в настоящем документе, энергию светового излучения прикладывают к веществу подложки и, таким образом, прикладываемое количество энергии, кроме того, зависит от расстояния между источником светового излучения и облучаемым веществом подложки. Расстояние между используемым источником светового излучения и веществом подложки можно подходящим образом регулировать в соответствии с параметрами, известными специалисту в данной области. Предпочтительно используют расстояние от 5 см до 1 м, более предпочтительно от 10 см до 500 см, даже более предпочтительно расстояние от 20 см до 200 см. Кроме того, предпочтительным является расстояние от 10 см до 150 см. Наиболее предпочтительным является расстояние 50 см.
Химическую иммобилизацию молекулы нуклеиновой кислоты на веществе подложки в соответствии с другим предпочтительным вариантом осуществления изобретения можно проводить посредством связывания модифицированной амином нуклеиновой кислоты и элемента вещества подложки, содержащего соответствующую функциональную группу, т.е. функциональную химическую группу, которая преимущественно взаимодействует с модифицированными аминами молекулами нуклеиновой кислоты. Термин "модифицированная амином" относится к введению аминогруппы в молекулу нуклеиновой кислоты, к активации или модификации аминогруппы в молекуле нуклеиновой кислоты для получения активированной функциональной аминогруппы. Например, такие аминогруппы, можно вводить по всей длине молекулы. Предпочтительно группы вводят на любом или одном из концов молекулы или в ее центре. Такую модификацию можно использовать для контроля и формирования характера связывания молекулы на подложке. Подходящая функциональная химическая группа, которая преимущественно взаимодействует с модифицированной амином нуклеиновой кислотой, известна специалисту в данной области, и о ней можно получить информацию в руководствах по органической химии, например в Organische Chemie by Hart et al., 2007, Wiley-Vch или Organische Chemie by Vollhardt et al., 2005, Wiley-Vch. В особенно предпочтительном варианте осуществления иммобилизацию модифицированной амином молекулы нуклеиновой кислоты на веществе подложки проводят посредством взаимодействия указанной аминогруппы на молекуле нуклеиновой кислоты и эпоксигруппой, альдегидной, карбоксильной или NHS группами на веществе подложки. Термин "NHS" относится к N-гидроксисукцинимиду, который представляет собой соединение, используемое в качестве активирующего средства для карбоновых кислот. Активированные кислоты (в основном сложные эфиры с хорошо уходящей группой) могут взаимодействовать с аминами с образованием, например, амидов, тогда как обычная карбоновая кислота образовывала бы только соль с амином. Как правило, активированную NHS кислоту синтезируют, смешивая NHS с желаемой карбоновой кислотой и небольшим количеством органического основания в безводном растворителе. Затем можно добавлять дегидратирующее средство, такое как дициклогексилкарбодиимид (DCC) или этил(диметиламинопропил)карбодиимид (EDC) с образованием очень нестабильного промежуточного соединения активированной кислоты. NHS реагирует с образованием менее неустойчивой активированной кислоты. Такой сложный эфир кислоты и NHS, т.е. сложный эфир янтарной кислоты, является достаточно стабильным для очистки и хранения при низких температурах в отсутствие воды и по существу является подходящим для фиксации на веществе подложки нуклеиновых кислот, которые затем можно подвергать промывке и/или гибридизации.
Нуклеиновую кислоту для иммобилизации на веществе подложки в соответствие с другим предпочтительным вариантом осуществления можно представить формулой I:
5'-Yn-Xm-Br-Xp-Zq-3'
В формуле I Y и Z представляют собой участки нуклеотидов с одним видом оснований, где Y и Z могут состоять из одного и того же или из различных видов оснований; X представляет собой спейсер; B представляет собой последовательность более чем из одного вида оснований, а n, m, r, p и q представляют собой количества нуклеотидов в нуклеиновой кислоте, для которых можно применять следующие условия: n, m, p, q, r > 1; n, m, r > 1 и p, q=0; p, q, r >1 и n, m=0; n, q, r > 1 и m, p=0; n, r > 1 и m, p, q=0; q, r > 1 и n, m, p=0. Термин "участок нуклеотидов с одним видом оснований" уже определен выше в настоящем документе и относится к нуклеотидам, состоящим только из одного вида оснований, например тимина, гуанина, аденина, цитозина или урацила или их любого функционально эквивалентного производного.
Предпочтительно участки Y и/или Z можно использовать для иммобилизации нуклеиновой кислоты из-за присутствия нуклеотидов с одним видом оснований. Более предпочтительно, участки Y и/или Z могут состоять из урациловых или тиминовых оснований, даже более предпочтительно из урацила, если иммобилизацию необходимо проводить сшиванием при длине волны 200-300 нм, например при 254 нм, или они могут состоять из гуанина или урацила, более предпочтительно из гуанина, если иммобилизацию необходимо проводить сшиванием при длине волны 300-500 нм, например при 365 нм.
Y и Z могут одновременно присутствовать на одной и той же молекуле нуклеиновой кислоты. Такой формат можно использовать для одновременного сшивания по участкам с одним видом оснований на обоих концах молекулы. В дополнительном предпочтительном варианте осуществления Y и Z могут состоять из различных видов оснований, т.е. Y может состоять, например, из урациловых оснований, тогда как Z может состоять из гуаниновых оснований или наоборот. Такую нуклеиновую кислоту, например, можно иммобилизовать при различных длинах волн, предпочтительно при 254 нм и 365 нм, и, таким образом, обеспечивать избирательную ориентацию нуклеиновой кислоты. Такие нуклеиновые кислоты также можно использовать для тестирования влияния ориентации нуклеиновых кислот и подхода для иммобилизации на способность образовывать комплексы с комплементарным олигонуклеотидом по настоящему изобретению.
В предпочтительном варианте осуществления Y и Z могут быть идентичными по длине или могут иметь различную длину. Длина Y и/или Z может составлять приблизительно от 2 до приблизительно 100 нуклеотидов, более предпочтительно приблизительно от 4 до приблизительно 50 нуклеотидов, даже более предпочтительно приблизительно от 8 до приблизительно 30 нуклеотидов. Также предпочтительной длиной является 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 нуклеотидов. Наиболее предпочтительной является длина 16 нуклеотидов.
В формате, содержащем элементы Y и Z на обоих концах, молекула нуклеиновой кислоты содержит в своем центре область специфических нуклеотидов B, как показано выше в настоящем документе в формуле I. Альтернативно, область B можно соединять с одним из Y или Z, и, таким образом, располагать на конце молекулы. Область B можно использовать для специфических реакций детекции в подходе классической гибридизации или с микроматрицами, т.е. для реакций взаимодействия с олигонуклеотидами, специфически связывающимися с комплементарной им областью, находящейся в элементе B. Длина и химическая природа Y и/или Z может влиять на подвижность зоны B, и, таким образом, их можно использовать для оптимизации специфического взаимодействия в этой зоне, например, реакций специфической гибридизации с комплементарными олигонуклеотидами. В предпочтительном варианте осуществления длина B составляет приблизительно от 4 до приблизительно 90 нуклеотидов, более предпочтительно длина составляет приблизительно от 4 до приблизительно 50 нуклеотидов, даже более предпочтительно приблизительно от 20 до приблизительно 30 нуклеотидов. Предпочтительные длины также составляют 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 нуклеотидов. Наиболее предпочтительная длина составляет 25 нуклеотидов.
Таким образом, участок нуклеотидов с одним видом оснований, как определено выше в настоящем документе, может в соответствии с конкретным вариантом осуществления настоящего изобретения располагаться на любом из двух концов молекулы нуклеиновой кислоты, т.е. или на 3'- или на 5'-конце иммобилизованной нуклеиновой кислоты. Более предпочтительно, участок нуклеотидов с одним видом оснований может располагаться на 5'-конце молекулы нуклеиновой кислоты.
Дополнительно, могут присутствовать элемент(ы) X формулы I по настоящему изобретению в качестве спейсерного элемента(ов), т.е. в качестве области, содержащей последовательности неопределенного характера. Более предпочтительно элемент X может состоять из нуклеотидов, лишенных азотистых оснований. Термин "лишенный азотистого основания" относится к положениям в молекуле нуклеиновой кислоты, в которых не присутствует остатка основания. Таким образом, лишенные азотистых оснований области или участки нуклеиновой кислоты состоят только из сахарофосфатных каркасных элементов. Такая лишенная азотистых оснований структура может оказывать положительное влияние на подвижность всей молекулы, в частности по отношению к элементу B молекулы. Авторы изобретения смогли показать, что присутствие сайтов, лишенных азотистых оснований, оказывает положительное влияние на способность иммобилизованной молекулы специфически взаимодействовать или гибридизоваться с зондом-мишенью (см. пример 5 и фиг. 6). Отделение частей молекулы, используемых для иммобилизации, например Y или Z в формуле I, от части(ей) молекулы, используемой для специфической гибридизации, например B в формуле I, посредством введения спейсерных элементов, содержащих сайты, лишенные азотистых оснований, может значительно уменьшить реакции неспецифической гибридизации в части молекулы, используемой для специфической гибридизации, например B в формуле I.
Спейсерные элементы Xm и Xp могут полностью состоять из сайтов, лишенных азотистых оснований, или частично состоять из сайтов, лишенных азотистых оснований. Если спейсерный элемент частично состоит из сайтов, лишенных азотистых оснований, части спейсерного элемента с основаниями могут состоять из нуклеотидов с одним видом оснований или могут состоять из нуклеотидов с различными видами оснований. Сайты, лишенные азотистых оснований, как определено выше в настоящем документе, могут быть собраны в одном участке или могут быть распределены по спейсерному элементу или, альтернативно, также присутствовать на протяжении всей молекулы, представленной формулой I. Предпочтительно сайты, лишенные азотистых оснований, располагаются в спейсерных элементах X и собраны в 1 или 2 участках.
Предпочтительно количество сайтов, лишенных азотистых оснований, в молекуле, представленной формулой I, может составлять приблизительно от 1 до приблизительно 30, более предпочтительно приблизительно от 1 до приблизительно 20, даже более предпочтительно такая молекула может содержать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 сайтов, лишенных азотистых оснований.
Спейсерные элементы Xm и Xp могут быть идентичными по химической природе и длине или могут различаться по химической природе и длине. Предпочтительно спейсерные элементы Xm и Xp имеют равную длину приблизительно от 1 до приблизительно 50 нуклеотидов, более предпочтительно длину, составляющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидов. В дополнительном варианте осуществления в случае q=0, т.е. при отсутствии последовательности элемента Z, как представлено в формуле I, концевой спейсер также отсутствует, т.е. p=0. Подобным образом, в случае n=0, т.е. при отсутствии последовательности элемента Y, как представлено в формуле I, также отсутствует концевой спейсер, т.е. m=0.
Нуклеиновая кислота для иммобилизации и/или олигонуклеотид, комплементарный ей, в соответствии с другим предпочтительным вариантом осуществления изобретения на любом или обоих концах, предпочтительно на 5'-конце, может содержать одну или несколько меток. Альтернативно указанные молекулы нуклеиновой кислоты или олигонуклеотиды также могут содержать одну или несколько меток в любом положении на всем протяжении молекулы. Предпочтительно указанные молекула нуклеиновой кислоты или олигонуклеотид содержат от 1 до 10 меток, которые могут быть идентичными или различаться, или любое их сочетание. Более предпочтительно молекула нуклеиновой кислоты или олигонуклеотид содержат от 1 до 5 меток, даже более предпочтительно 2 метки, а наиболее предпочтительно только одну метку.
Указанные метки могут быть радиоактивными, флуоресцентными или хемилюминесцентными метками. Термин "радиоактивная метка" относится к меткам, испускающим радиоактивное излучение, предпочтительно состоящим из радиоактивных изотопов. Термин "радиоактивный изотоп" в контексте метки относится к любому такому фактору, известному специалисту в данной области. Более предпочтительно термин относится к N-15, C-13, P-31 или I-131.
Термин "флуоресцентная метка" относится к химически активным производным флуорофоров. Как правило, общие реакционноспособные группы включают реакционноспособные по амину производные изотиоцианата, такие как FITC и TRITC (производные флуоресцеина и родамина), реакционноспособные по амину сложные эфиры янтарной кислоты, такие как NHS-флуоресцеин и реакционноспособные по сульфгидрильной группе активированные малеинимидом флуоресцирующие средства, такие как флуоресцеин-5-малеинимид. Реакция этих реакционноспособных красителей с другой молекулой приводит к стабильной ковалентной связи, формируемой между флуорофором и меченой молекулой. После реакции флуоресцентного мечения часто из меченой молекулы-мишени необходимо удалять весь непровзаимодействующий флуорофор. Это можно осуществлять посредством гель-хроматографии, пользуясь различием размеров флуорофора и меченой нуклеиновой кислоты или олигонуклеотида. Флуорофоры могут взаимодействовать с разделяющим матриксом и снижать эффективность разделения. Поэтому можно использовать специализированные колонки для удаления красителей, учитывающие гидрофобные свойства флуоресцентных красителей. Особым преимуществом флуоресцентных меток является то, что сигналы с флуоресцентных меток не рассеиваются. Отсутствие дисперсии флуоресцентного сигнала позволяет, например, компактно располагать зонды на подложке. Другим преимуществом флуоресцентных зондов является то, что можно проводить простую многоцветную детекцию гибридизации, позволяющую прямое количественное определение относительного количества олигонуклеотидов, образующих комплекс с молекулами нуклеиновой кислоты, иммобилизованными на веществе подложке. В особенно предпочтительном варианте осуществления можно использовать флуоресцентные метки FITC, флуоресцеин, флуоресцеин-5-EX, 5-SFX, родаминовый зеленый-X, Bodipy FL-X, Cy2, Cy2-OSu, Fluor X, 5 (6) TAMRA-X, Bodipy TMR-X, родамин, родаминовый красный-X, техасский красный, техасский красный-X, Bodipy TR-X, Cy3-OSu, Cy3,5-OSu, Cy5, Cy5-Osu, флуоресцирующие средства Alexa, флуоресцирующие средства Dylight и/или Cy5,5-OSu. Эти метки можно использовать отдельно или группами в любом сочетании.
Термин "хемилюминесцентная метка" относится к метке, способной к испусканию света (люминесценции) с ограниченным выделением тепла в результате химической реакции. Предпочтительно термин относится к люминолу, циалюму, оксалилхлориду, TMAE (тетракис(диметиламино)этилен), пирогаллолу, люцигенину, сложному акридиниевому эфиру или диоксетану.
В особенно предпочтительном варианте осуществления каждую из молекул, молекулу нуклеиновой кислоты и олигонуклеотид, как определено выше в настоящем документе, можно метить особой меткой, как правило, двумя различными метками, которые являются оптически или химически различимыми. Такие различимые метки могут находиться в разных положениях молекулы нуклеиновой кислоты и олигонуклеотида. Таким образом, если нуклеотид мечен, например, Cy2, олигонуклеотид можно метить Cy5. Эти метки можно использовать, например, для детекции молекулярных процессов, происходящих при взаимодействии между иммобилизованной молекулой нуклеиновой кислоты и комплементарно связывающимся олигонуклеотидом.
Такое дифференциальное мечение дополнительно обеспечивает возможность определения совместной локализации иммобилизованной нуклеиновой кислоты и любого связывающегося олигонуклеотида. Такой подход также можно использовать для получения показателей степени взаимодействия, как определено выше в настоящем документе.
В дополнительном предпочтительном варианте осуществления контрольную нуклеиновую кислоту можно метить определенной меткой, предпочтительно флуоресцентной меткой, а тестовый олигонуклеотид по настоящему изобретению можно метить другой, оптически отличимой меткой или той же меткой. Если сигнал, полученный для контрольной нуклеиновой кислоты, взять за 100%, любой сигнал, полученный для взаимодействия между иммобилизованной нуклеиновой кислотой и указанным меченым олигонуклеотидом, можно нормализовать по указанному значению для определения альтернативного показателя степени взаимодействия. Дополнительно можно вычитать фоновый сигнал, получаемый из областей вещества подложки, где отсутствуют иммобилизованные нуклеиновые кислоты.
В соответствии с другим предпочтительным вариантом осуществления настоящего изобретения вещество подложки может представлять собой твердое вещество или субстрат, содержащие функциональные химические группы, предпочтительно, аминогруппы или функциональные группы амина. Термин "функциональная группа амина" относится к группам, которые функционализированы аминами, т.е. которым посредством химической модификации придали функцию аминов. Эти амины или аминогруппы могут быть первичными или вторичными аминами. Кроме того, вещество подложки или субстрат могут содержать фотоактивируемые соединения, которые можно использовать для взаимодействия между веществом подложки и молекулами нуклеиновой кислоты. Как известно специалисту в данной области, подходящие светочувствительные химические соединения можно использовать в качестве соединительных молекул. Примерами таких молекул являются фотобиотин или реакционноспособные молекулы, подобные сукцинимидил-6-[4'-азидо-2'-нитрофениламино]гексаноату, в веществе подложки.
Фотобиотин состоит из биотинильной группы, линкерной группы и нитрофенилазидной группы, которая является фотоактивируемой. Как правило, его используют для формирования рисунка из молекул на твердых субстратах. Как правило, УФ-лазеры активируют фотобиотин для присоединения различных поверхностей. Присоединение, как правило, проводят в водных растворах. Фотобиотин представляет собой разновидность биотина, которая является фотоактивируемой и которую можно использовать для биотинилирования нуклеиновых кислот и молекул, в частности тех из них, которые не содержат аминогрупп или сульфгидрильных групп, присутствующих для участия в связывании. При экспозиции на сильном освещении арилазидные группы биотина преобразуются в арилнитрен, который является крайне реакционноспособным. Этот способ можно использовать для мечения молекул, например молекул нуклеиновой кислоты, биотином.
Эти указанные выше соединения могут взаимодействовать с молекулами нуклеиновой кислоты и иммобилизовать молекулы на субстрате.
В дополнительном предпочтительном варианте осуществления вещество подложки содержит псорален. Псорален представляет собой бифункциональный светочувствительный сшивающий реагент для нуклеиновых кислот. Он интеркалирует в спирали нуклеиновых кислот и после облучения УФ-излучением с большой длиной волны (365 нм) образует ковалентные связи с пиримидиновыми основаниями. Предпочтительно псорален можно использовать для иммобилизации нуклеиновых кислот сшиванием посредством светового излучения при длине волны 300-500 нм, более предпочтительно при длине волны 365 нм.
Предпочтительным веществом подложки является пористое вещество подложки или пористый субстрат. Особенно предпочтительным является нейлон, например Nytran N®, или Nytran SPC®, или Biodyne C®. Дополнительным предпочтительным веществом подложки или типом субстрата является непористый субстрат. Особенно предпочтительными среди непористых субстратов являются стекло, покрытое поли-L-лизином вещество, нитроцеллюлоза, полистирол, циклические олефиновые сополимеры (COC), циклические олефиновые полимеры (COP), полипропилен, полиэтилен и поликарбонат.
Нитроцеллюлозные мембраны представляют собой обычные мембраны, которые, как правило, используют в способах переноса, таких как саузерн-блоттинг. Способы для осуществления связывания нуклеиновой кислоты с нитроцеллюлозой, как правило, посредством физической адсорбции широко известны в известном уровне техники. Принципиальными преимуществами нитроцеллюлозы являются ее легкодоступность и известность. Использование нитроцеллюлозных мембран в способах детекции сигнала с применением радиоактивных веществ хорошо известно.
В качестве альтернативы нитроцеллюлозным мембранам в качестве субстрата для связывания нуклеиновых кислот можно использовать нейлон по причине его большей физической прочности и связывающей способности, и более широкому диапазону предоставляемых доступных поверхностных химических реакций, которые оптимизируют прикрепление нуклеиновой кислоты. Иммобилизацию на нейлоновых мембранах можно проводить, например, сшиванием посредством светового излучения, в частности сшиванием под действием УФ-излучения, или посредством химической активации. Показано, что иммобилизация на нейлоне является очень устойчивой при повторных снятиях зондов.
Механизмы, посредством которых макромолекулы связываются с веществом подложки, например, таким как полистирол, понятны не до конца. Обеспечение связывающей способности для веществ подложки или ее усиление можно осуществлять, предоставляя функциональные группы, предпочтительно аминогруппы, которые делают доступными, например, посредством покрытия, или обработки поверхности, или напыления и тому подобное. Предпочтительно используемое покрывающее вещество представляет собой поли-L-лизин, который принадлежит к группе катионных поверхностно-активных веществ. Он содержит положительно заряженные гидрофильные (амино) группы и гидрофобные (метиленовые) группы, и известно, что он взаимодействует с молекулами нуклеиновой кислоты.
В качестве вещества подложки можно использовать любое подходящее вещество, известное специалисту в данной области. Как правило, используют стекло, или поликарбонат, или циклический олефиновый сополимер, или циклический олефиновый полимер, или полистирол. Полистирол представляет собой гидрофобное вещество, подходящее для связывания отрицательно заряженных макромолекул, так как он в нормальных условиях содержит несколько гидрофильных групп.
Для нуклеиновых кислот, иммобилизуемых на предметных стеклах, дополнительно известно, что, увеличивая гидрофобность поверхности стекла, можно усилить иммобилизацию ДНК. Такое усиление может обеспечить относительно более плотно упакованную систему.
В дополнение к покрытию или обработке поверхности поли-L-лизином вещество подложки, в частности стекло, можно обрабатывать посредством покрытия силаном, например эпоксисиланом или аминосиланом, или посредствои покрытия силикатами, или посредством обработки полиакриламидом.
В дополнительном конкретном варианте осуществления настоящего изобретения вещество подложки также можно покрывать или на него можно наносить мембранное вещество, как указано в настоящем документе выше.
В дополнительном предпочтительном варианте осуществления формирование комплекса по настоящему изобретению осуществляют способом гибридизации. Реакции гибридизации, как правило, в числе прочего зависят от характера и концентрации гибридизационных буферов и от температуры гибридизации.
Гибридизационный буфер, используемый в рамках настоящего изобретения, например, применительно к способу тестирования или к способу анализа, или содержащийся в наборе по настоящему изобретению, как правило, содержит соли, которые могут усилить гибридизацию отрицательно заряженных нуклеиновых кислот с отрицательно заряженными захватывающими зондами. Характерные соли, которые можно использовать в гибридизационных буферах, представляют собой SSC, SSPE или PBS. Кроме того, буфер может содержать дополнительные ингредиенты, такие как детергенты, подобные SDS (предпочтительно в количестве 0,01-0,5%) или Tween 20. Кроме того, буфер может содержать большие количества неспецифической ДНК, такой как ДНК спермы сельди (hsDNA), которую, как правило, добавляют для снижения неспецифического связывания на поверхности, или блокирующие средства, такие как BSA. Гибридизационные буферы по настоящему изобретению также могут содержать ингредиенты для стабилизации одноцепочечных нуклеиновых кислот. Примером такого ингредиента является формамид. Предпочтительный буфер содержит 5×SSC, 0,1% SDS и 0,1 мг/мл hsDNA.
Такие буферы, а также альтернативные буферы, которые также можно использовать в рамках настоящего изобретения, известны специалисту в данной области, и их можно получать в соответствии с информацией, которую можно получить в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2001, Cold Spring Harbor Laboratory Press.
Предпочтительно реакцию гибридизации проводят при температуре ниже температуры плавления комплекса, образуемого иммобилизованной молекулой нуклеиновой кислоты и комплементарным олигонуклеотидом. Более предпочтительно реакцию гибридизации проводят при температуре от 30 до 65°C. В дополнительном варианте осуществления гибридизацию, как описано выше в настоящем документе, можно комбинировать со стадией промывки или блокирования, который является обычным необходимым условием для последующей реакции гибридизации со специфически связывающимися олигонуклеотидами. В отличие от этого олигонуклеотиды по настоящему изобретению могут быть более короткими, чем специфически связывающиеся олигонуклеотиды, и, таким образом, его можно использовать при меньшей температуре, например при обязательных стадиях промывки и блокирования в начальной фазе реакции гибридизации. Таким образом, олигонуклеотиды можно использовать в соответствующих буферах для промывки или блокирования. Такой способ может сохранить время и стоимость, так как не требуется дополнительной стадии или дополнительного набора буферов.
Кроме того, в течение стадии предгибридизации для специфической реакции детекции при температуре выше температуры плавления комплекса, образуемого иммобилизованной молекулой нуклеиновой кислоты и комплементарным олигонуклеотидом, например, при 50°C, комплекс между указанными иммобилизованной молекулой нуклеиновой кислоты и комплементарным тестовым олигонуклеотидом по настоящему изобретению может разрушаться. Таким образом, тестовые олигонуклеотиды в нужное время можно удалять с вещества подложки для обеспечения эффективной реакции гибридизации со специфически связывающимися зондами.
Тестовые олигонуклеотиды по настоящему изобретению, удаляемые с вещества подложки при стадии предгибридизации, как описано выше в настоящем документе, в соответствии с другим предпочтительным вариантом осуществления настоящего изобретения можно повторно использовать для последующих взаимодействия или контрольной реакции по настоящему изобретению. Термин "повторное использование" относится к повторному использованию раствора олигонуклеотида приблизительно от 1 до приблизительно 15 раз, предпочтительно приблизительно от 1 до приблизительно 5 раз. Это представляет собой дополнительный преимущественный аспект настоящего изобретения, который обеспечивает возможность уменьшения стоимости и предусматривает высокопроизводительную схему контроля с ограниченным количеством вводимого ресурса.
В соответствии с другим предпочтительным вариантом осуществления настоящее изобретение относится к способу анализа нуклеиновых кислот, включающему стадии (a) иммобилизации одной или нескольких нуклеиновых кислот на твердой подложке посредством сшивания нагреванием, или световым излучением, или посредством химической иммобилизации, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований; (b) получения меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен образовывать комплекс с каждой из иммобилизованных нуклеиновых кислот на участке нуклеотидов с одним видом оснований; (c) детекции присутствия специфической последовательности, комплементарной последовательности вне участка нуклеотидов с одним видом оснований; и (d) определения показателя, отражающего состояние указанной нуклеиновой кислоты, по количеству меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, находящегося в комплексе с иммобилизованными нуклеиновыми кислотами.
Соответствующий способ, в частности сочетание стадии (b), предоставляющей информацию о состоянии иммобилизованных нуклеиновых кислот, и стадии (c), которая может приводить к детекции присутствия специфической последовательности, комплементарной последовательности вне участка нуклеотидов с одним видом оснований, обеспечивает параллельный контроль или контроль в реальном времени и специфическое использование молекул нуклеиновой кислоты, иммобилизованных на подложке. Такой подход предпочтительно можно использовать в любых подходящих условиях, известных специалисту в данной области, предпочтительно в условиях больниц или других медицинских учреждений, или в исследовательских лабораториях, где может быть особенно полезен контроль качества специфической гибридизации и реакций взаимодействия в реальном времени. Таким образом, в ходе специфической гибридизации можно выявить, например, повреждения иммобилизованных нуклеиновых кислот на подложке вследствие проблем при транспортировке или производстве, таким образом, обеспечивая комплексные и сохраняющие время контроль качества, тестирование и применение иммобилизованных нуклеиновых кислот.
Строгого последовательного или хронологического порядка стадий способа тестирования нуклеиновых кислот по настоящему изобретению нет, при условии, что стадию иммобилизации (a), которая является необходимым условием для последующих стадий взаимодействия и детекции, проводят первой. Важно, что стадии (b) и (c) можно проводить в порядке, где (b) следует первой, а (c) второй, или наоборот, (c) следует первой, а (b) второй. То же самое применимо к дополнительным стадиям способа, например стадиям детекции или визуализации, которые проводят в подходящих последовательностях в соответствии с последовательностью стадий способа (a) и (b).
Кроме того, стадии (a), (b), (c) и (d) способа тестирования нуклеиновых кислот по настоящему изобретению можно проводить без какой-либо временной связи или связи временных интервалов между стадиями, т.е. между стадиями (a), и/или (b), и/или (c), и/или (d) можно использовать любой подходящий временной интервал. Термин "временной интервал" относится к любому подходящему периоду времени. Например, стадию (b) можно проводить через временной интервал в пределах нескольких секунд, минут, часов, суток, недель, месяцев или даже лет после проведения стадии (a). То же применимо для стадии (c) относительно стадии (a) и стадии (b), и стадии (d) относительно стадий (a), (b) и (c).
В предпочтительном варианте осуществления стадию (a) способа анализа нуклеиновых кислот, как определено выше в настоящем документе, можно проводить в другие моменты времени, чем стадии (b), (c) или (d). Например, иммобилизацию стадии (a) можно проводить за несколько часов, суток, недель, месяцев или даже лет перед стадиями тестирования и/или специфического контроля, так как проводят стадии (b), (c) или (d). Предпочтительно стадии с (b) по (d) проводят через временной интервал приблизительно от одного часа до приблизительно 12 месяцев после начала или завершения стадии (a). Предпочтительный "временной интервал" между стадиями (b), и/или (c), и/или (d) может составлять период времени приблизительно от 1 до 60 минут, более предпочтительно период времени приблизительно от 1 до 30 минут.
В особенно предпочтительном варианте осуществления стадии (b) и (c) способа анализа нуклеиновых кислот проводят одновременно.
Стадии (a), (b) и (d), как указано выше, соответствуют способу тестирования нуклеиновых кислот на подложке, как определено выше в настоящем документе. Стадия (c) может представлять собой стадию специфической гибридизации или специфического взаимодействия, позволяющую образовывать комплексы из комплементарных молекул нуклеиновой кислоты, предпочтительно молекул, которые в процентном отношении совпадают в степени приблизительно от 55% до 100%, более предпочтительно приблизительно от 70% до 100%, приблизительно от 80% до 100%, приблизительно от 85% до 100% и даже более предпочтительно приблизительно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. Эти значения могут относиться к общему совпадению, рассчитываемому на протяжении всей молекулы, или к локальному совпадению в области специфической комплементарности, например области B, как определено выше в настоящем документе. Средства и способы проведения специфической гибридизации и расчета процента несоответствий известны специалисту в данной области, и с ними можно ознакомиться, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2001, Cold Spring Harbor Laboratory Press. Предпочтительно можно использовать буферные растворы и дополнительные ингредиенты, как указано выше в настоящем документе или в примерах.
Для стадий (b), (c) и/или (d) можно использовать одинаковые буферные условия или можно использовать различные буферные условия. В случае использования различных буферных условий стадию (c) можно проводить через временной интервал, как определено выше в настоящем документе, или наоборот, стадию (c) следует проводить после стадии (b). Между стадиями (b) и (c) и/или (d) можно проводить стадию промывки, предпочтительно стадию, которую проводят в подходящих условиях, гарантирующих связывание и сохранение гибридизованными олигонуклеотидов с иммобилизованными нуклеиновыми кислотами.
Для детекции взаимодействия или гибридизации олигонуклеотидов с иммобилизованными нуклеиновыми кислотами, как указано на стадии (b) способа анализа нуклеиновых кислот, как определено выше в настоящем документе, можно использовать метку, которая оптически или химически отличима от метки, используемой на стадии (c) указанного способа, т.е. контроль взаимодействия и специфических реакций гибридизации можно проводить с использованием двух различных отличающихся меток. Подходящие метки известны специалисту в данной области и описаны выше в настоящем документе. Предпочтительно используют две различные флуоресцентные метки.
Кроме контроля иммобилизованных нуклеиновых кислот настоящее изобретение также относится к возможности независимого контроля качества нуклеиновых кислот, иммобилизованных на веществе подложке, посредством применения дополнительного специфически связывающегося нуклеотида. В предпочтительном варианте осуществления в способе предусмотрено получение по меньшей мере одного меченого тестового олигонуклеотида, комплементарного заранее определенному специфическому участку нуклеотидов вне участка нуклеотидов с одним видом оснований. Кроме того, указанный меченый олигонуклеотид способен специфически образовывать комплекс с иммобилизованными нуклеиновыми кислотами, содержащими указанный специфический участок нуклеотидов. Затем можно определять показатель, отражающий состояние указанных нуклеиновых кислот, по присутствию указанного тестового олигонуклеотида, находящегося в комплексе с заранее определенным специфическим участком нуклеотидов вне участка нуклеотидов с одним видом оснований в иммобилизованных нуклеиновых кислотах, содержащих указанный специфический участок нуклеотидов. Такое независимое тестирование обеспечивает дополнительный уровень контроля для способа, как определено выше в настоящем документе, так как теперь можно детектировать не только взаимодействие между контрольным олигонуклеотидом и фактически всеми иммобилизованными нуклеиновыми кислотами, но также и специфическое взаимодействие между одной или несколькими иммобилизованными нуклеиновыми кислотами (в зависимости от числа раз, когда специфическая последовательность присутствует в нанесенных нуклеиновых кислотах) и специфическим тестовым олигонуклеотидом. Такую реакцию вторичного контроля можно проводить для одной или нескольких отдельных специфических последовательностей. Количество различных специфических последовательностей зависит от количества различных зондов, присутствующих на веществе подложке. В предпочтительном варианте осуществления при таком подходе вторичного тестирования для получения статистически значимой ответной реакции относительно способности иммобилизованных нуклеиновых кислот связываться со специфически связывающимися комплементарными олигонуклеотидами можно тестировать приблизительно от 0,1% до 10% всех иммобилизованных нуклеиновых кислот. Предпочтительно проводят ряд из 1, 2, 3, 4, 5 или 6 специфических реакций вторичного контроля. Любое различие между результатами способа первичного контроля с применением олигонуклеотидов, комплементарных участкам с идентичным видом оснований в иммобилизованных молекулах нуклеиновой кислоты, и результатами способа вторичного контроля с использованием специфически связывающихся олигонуклеотидов может указывать на проблемы, конкретно связанные с любым из этих способов контроля.
Предпочтительно такой способ вторичного контроля можно проводить с использованием метки, которая оптически или химически отличается от метки, используемой в способе первичного контроля. Для обеспечения различия между способами первичного и вторичного контроля эти метки не должны находиться на одном и том же олигонуклеотиде, содержащем, например, две различных области, одну, содержащую участок нуклеотидов с одним видом оснований, и еще одну, содержащую специфический участок нуклеотидов, так как при такой организации невозможно достичь различия между реакцией связывания с областью, содержащей участок нуклеотидов с одним видом оснований, и реакцией связывания с областью, содержащей специфический участок нуклеотидов.
Кроме описанного выше в настоящем документе способа настоящее изобретение в качестве дополнительного предпочтительного варианта осуществления также относится к набору для применения способа вторичного контроля. Такой набор может содержать некоторые или все ингредиенты набора по настоящему изобретению, как указано выше в настоящем документе, и дополнительно по меньшей мере один меченый тестовый олигонуклеотид, комплементарный заранее определенному специфическому участку нуклеотидов вне участка нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен специфически образовывать комплекс с иммобилизованными нуклеиновыми кислотами, содержащими указанный специфический участок нуклеотидов.
Следующие ниже примеры и фигуры предоставлены с иллюстративными целями. Таким образом, понятно, что примеры и фигуры не следует рассматривать в качестве ограничивающих. Специалист в данной области, очевидно, сможет представить дополнительные модификации принципов, изложенных в настоящем документе.
ПРИМЕРЫ
Пример 1 - Анализ с контрольным зондом
Мембрану отпечатывали и подвергали постобработке с применением УФ-излучения при длине волны 254 нм и стандартным способом предгибридизации. Со схемой нанесенных нуклеиновых кислот и тому подобное можно ознакомиться на фиг. 2A.
После постобработки на изображении мембраны видны только меченые точки (см. фиг. 2B). Затем мембрану инкубировали с меченым A16-олигонуклеотидом в течение периода времени длительностью один час при температуре 50°C. В качестве метки использовали Cy5. Гибридизационный буфер представлял собой 5×SSC, 0,1% SDS, 0,1 мг/мл ДНК спермы сельди. Гибридизацию проводили при 50°C в течение 1 часа. После гибридизации проводили кратковременную промывку 2×SSC и 0,1% SDS. Затем мембрану сушили и получали изображение матрицы.
Как можно видеть на фиг. 2C, точки гибридизации отчетливо видны. Это означает, что во всех областях, в которых наносили и иммобилизовали ДНК, ДНК присутствует. Кроме того, нанесенная и иммобилизованная ДНК способна гибридизоваться с адениновым контрольным зондом для гибридизации.
Это доказывает, что способ на основе использования контрольного зонда, комплементарного участку нуклеотидов с одним видом оснований, можно эффективно применять как меру контроля качества, например, в способах изготовления мембран.
Пример 2 - Тестирование мембраны на отсутствие у способа разрушительных свойств
Для доказательства того, что способ контроля не имеет разрушительных свойств, мембрану, используемую в примере 1, т.е. в способе контрольной и тестовой гибридизации, как представлено на фиг. 2B и 2C, затем нагревали с удалением контрольного зонда.
Изображение мембраны непосредственно после нагревания с удалением всех контрольных олигонуклеотидов из точек с захватывающими зондами демонстрирует, что в точках гибридизации больше нет никакого сигнала (см. фиг. 2D).
Для доказательства того, что способ контроля, как описано в примере 1, не наносит вреда последовательности иммобилизованной нуклеиновой кислоты, которую нужно использовать для специфической гибридизации и связывания специфического олигонуклеотида, мембрану затем инкубировали с 10 нМ меченой антисмысловой молекулы, которая комплементарна ДНК, нанесенной на точку № 4. Мембрану инкубировали в течение периода времени длительностью один час при температуре 50°C в течение 1 часа. Гибридизационный буфер представлял собой 5×SSC, 0,1% SDS, 0,1 мг/мл ДНК спермы сельди. После гибридизации проводили кратковременную промывку 2×SSC и 0,1% SDS. Затем мембрану сушили и получали изображение матрицы.
После инкубации мембраны можно отчетливо видеть гибридизационные сигналы (см. фиг. 3; жирными прямоугольниками обозначены точки, демонстрирующие сигнал после гибридизации с меченым антисмысловым олигонуклеотидом, соответствующим точке номер 4, как указано на фиг. 2A.).
Результат позволяет заключить, что иммобилизованная молекула нуклеиновой кислоты в течение стадии первичного контроля не повреждалась и все еще может связываться со специфическим антисмысловым олигонуклеотидом.
Пример 3 - Тестирование восстановления и тестирование чувствительности нуклеиновых кислот, содержащих T-концевой участок
Чувствительность, т.е. количество аналитов в единицу времени, тестировали в анализе гибридизации в реальном времени. Для экспериментов использовали нейлоновые мембраны Nytran N или Nytran SPC.
Анализ проводили с захватывающими олигонуклеотидами (т.е. нанесенными молекулами нуклеиновой кислоты для иммобилизации), не содержащими T-концевого участка или содержащими T16-концевой участок, т.е. участок из 16 остатков тимидина. Эти эксперименты проводили в проточной ячейке, представляющей собой устройство, в котором фиксировали мембрану, и вдоль мембраны прокачивали жидкость для гибридизации. На фигуре 4A, на оси X, приведено количество циклов, что эквивалентно времени (1 цикл занимает 1 минуту). Гибридизацию проводили с комплементарной ДНК. Гибридизационный буфер представлял собой 5×SSC, 0,1% SDS, 0,1 мг/мл ДНК спермы сельди. Температуру устанавливали на 50°C.
Как можно видеть на фиг. 4A, олигонуклеотиды, содержащие T16-концевой участок, демонстрируют усиленные гибридизационные сигналы, которые относят за счет большего восстановления. Восстановление представляет собой отношение между иммобилизованными олигонуклеотидами и нанесенными олигонуклеотидами.
Эксперимент демонстрирует, что восстановление и, следовательно, чувствительность с увеличением в захватывающей молекуле количества нуклеотидов с одним видом оснований возрастает.
Нормализация результатов, как можно видеть на фиг. 4B, демонстрирующей усредненный коэффициент восстановления нанесенных захватывающих олигонуклеотидов, содержащих нуклеотиды T или A, как функцию от вида оснований (T или A) и количества оснований (2, 4, 8, 16 или 32), делает понятным, что когда количество нуклеотидов с одним видом оснований в захватывающем олигонуклеотиде, т.е. количество T, возрастает от 2 до 32, восстановление можно увеличить в 3-4 раза.
Пример 4 - Тестирование специфичности иммобилизованных нуклеиновых кислот
Специфичность иммобилизованных нуклеиновых кислот, т.е. способность различать соответствующие и несоответствующие мишени, тестировали в анализе связывания.
Анализ проводили с иммобилизованными нуклеиновыми кислотами (захватывающими зондами), содержащими 0, 4 или 16 T. Использовали различные захватывающие зонды, содержащие точное совпадение, одно несоответствие ((AG)-мутацию) и двойные несоответствия ((AAGG)-мутацию). Гибридизацию проводили с использованием продукта ПЦР. Гибридизацию проводили в проточной ячейке, представляющей собой устройство, в котором фиксировали мембрану, и вдоль мембраны прокачивали жидкость для гибридизации. Температуру устанавливали на 50°C. Гибридизацию проводили в течение одного часа. После гибридизации буфер заменяли на 2×SSC и для получения кривой плавления и для оценки специфичности температуру повышали на 1°C/мин.
Как можно видеть на фиг. 5, на которой представлены кривые разделения комплементарных гибридов, гибридов с одним несоответствием и двойным несоответствием для различных захватывающих зондов, увеличение селективности обеспечивали посредством увеличения температур плавления комплементарных зондов по сравнению с несовпадающими зондами.
Пример 5 - Влияние сайтов, лишенных азотистых оснований, на интенсивность гибридизации
Влияние сайтов, лишенных азотистых оснований, на интенсивность гибридизации молекул нуклеиновой кислоты из ДНК с точным соответствием и одним несоответствием ((AG)-мутация), и двойными несоответствиями ((AAGG)-мутация) тестировали в анализе связывания. Захватывающий зонд содержал 0, 2, 4 или 8 сайтов, лишенных азотистых оснований. Анализ связывания проводили с комплементарными олигонуклеотидами-мишенями на нейлоновых мембранах NytranN.
Как можно видеть на фиг. 6, интенсивность гибридизации с увеличением количества сайтов, лишенных азотистых оснований, возрастала во всех тестируемых вариантах, т.е. при гибридизации с комплементарными олигонуклеотидами-мишенями, олигонуклеотидами-мишенями с одним несоответствием или олигонуклеотидами-мишенями с двойными несоответствиями. Эффект рассматривают как результат более эффективного разделения последовательностей, используемых для специфической иммобилизации и специфической гибридизации, которое снижает неспецифическую гибридизацию.