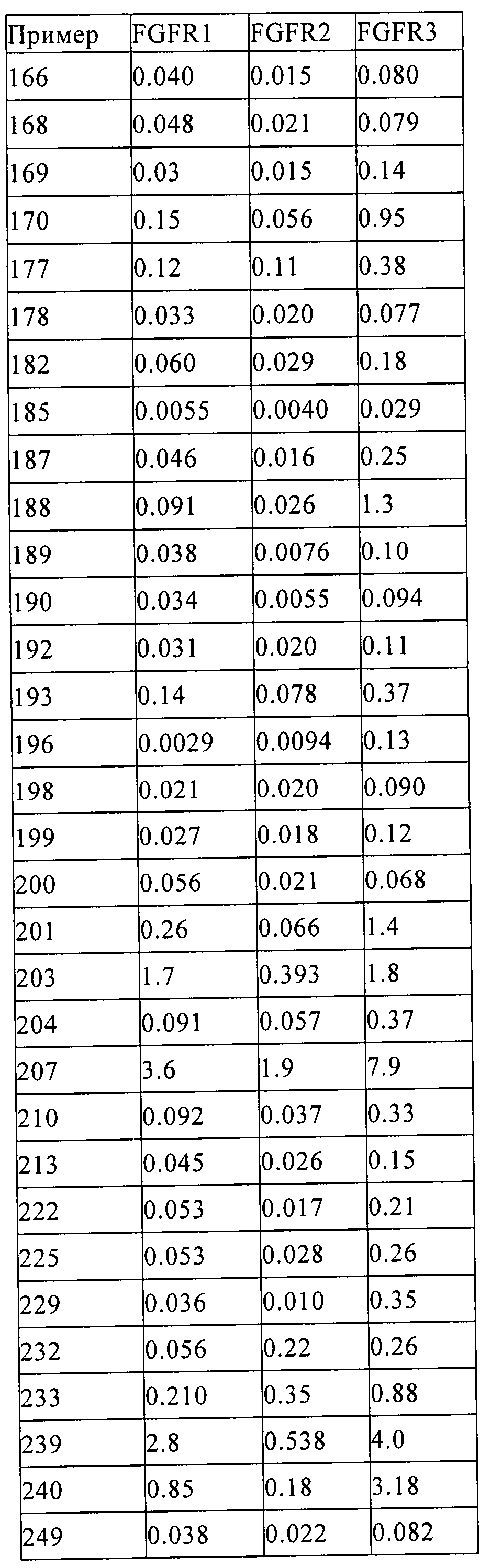
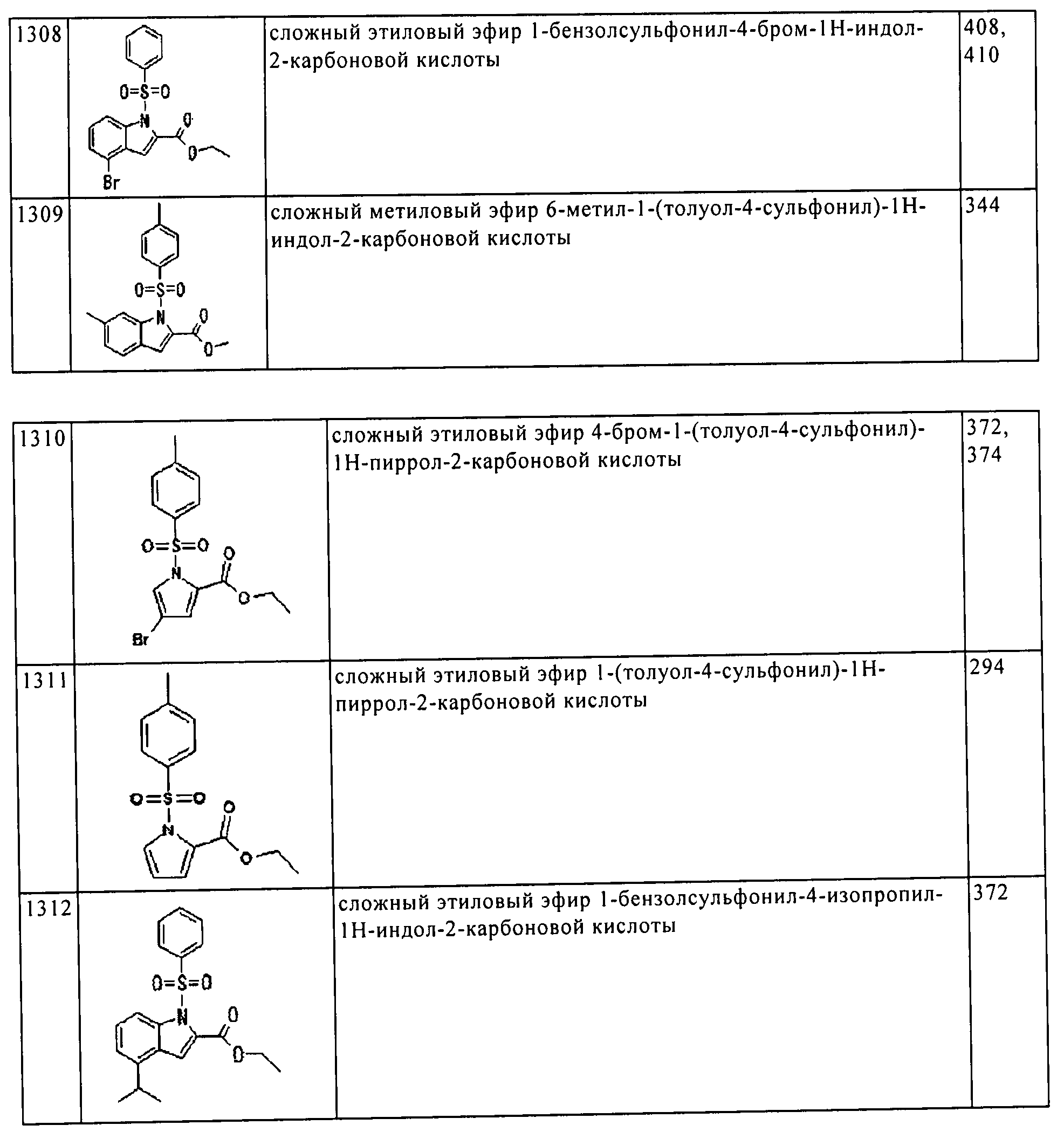
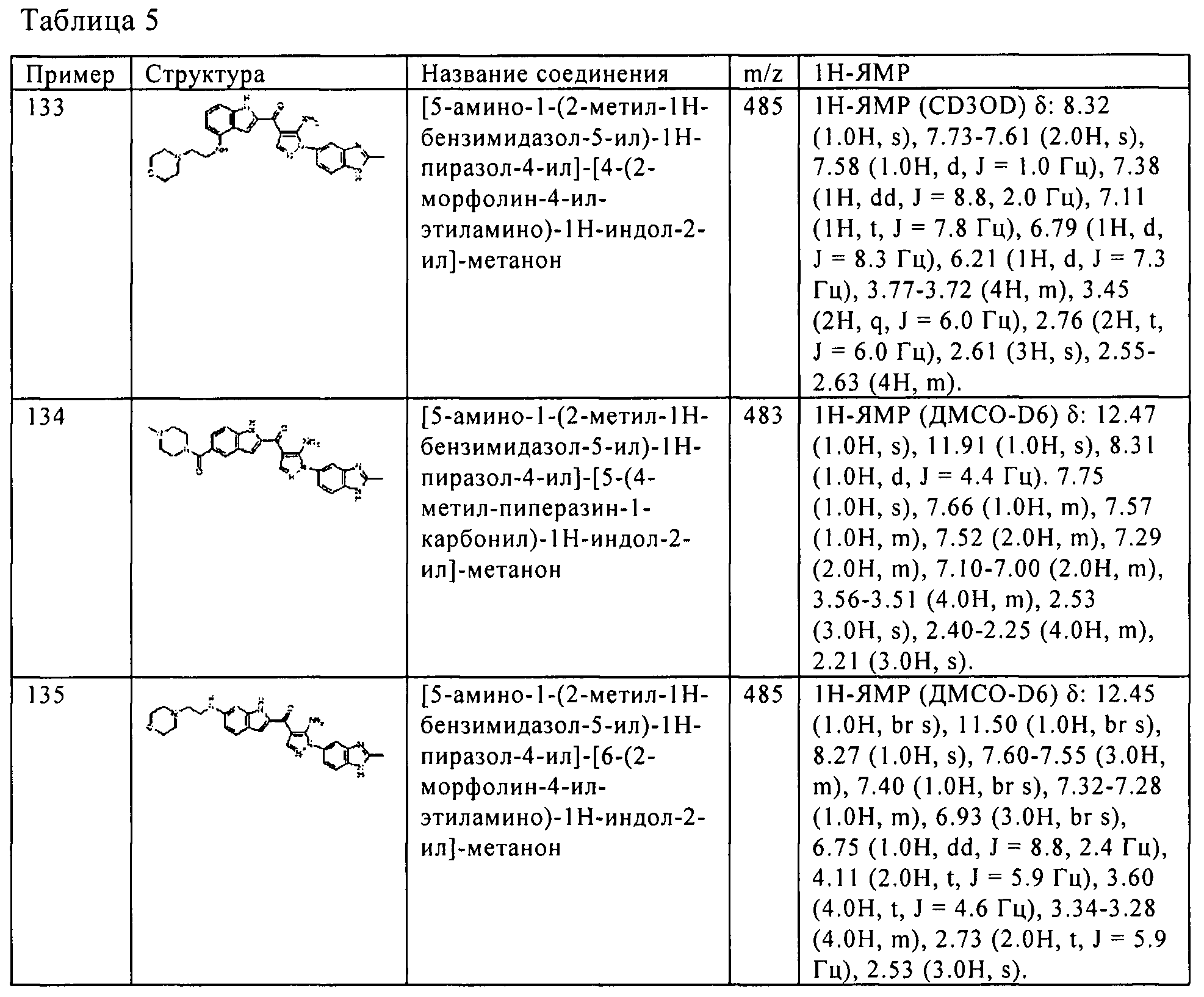
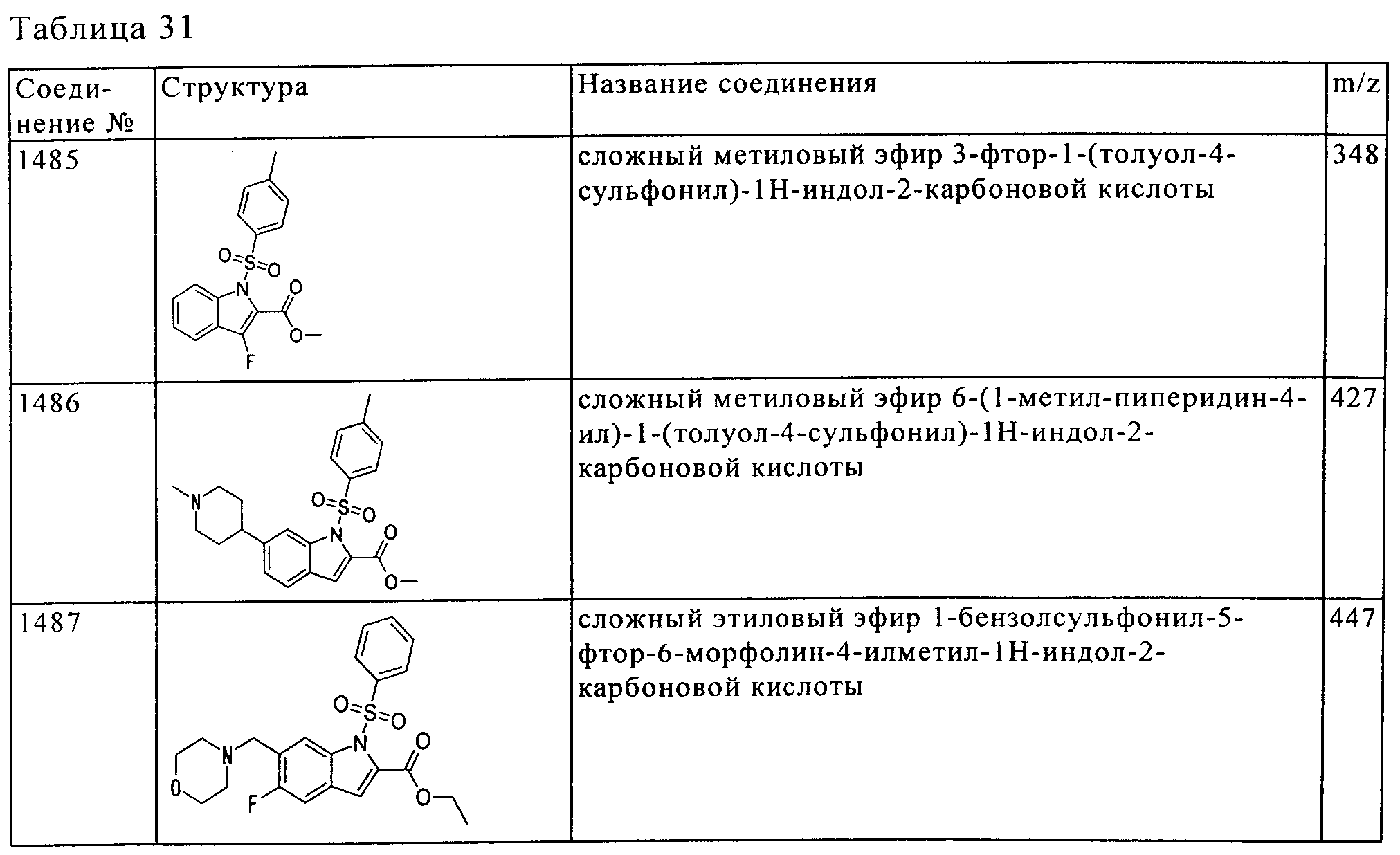
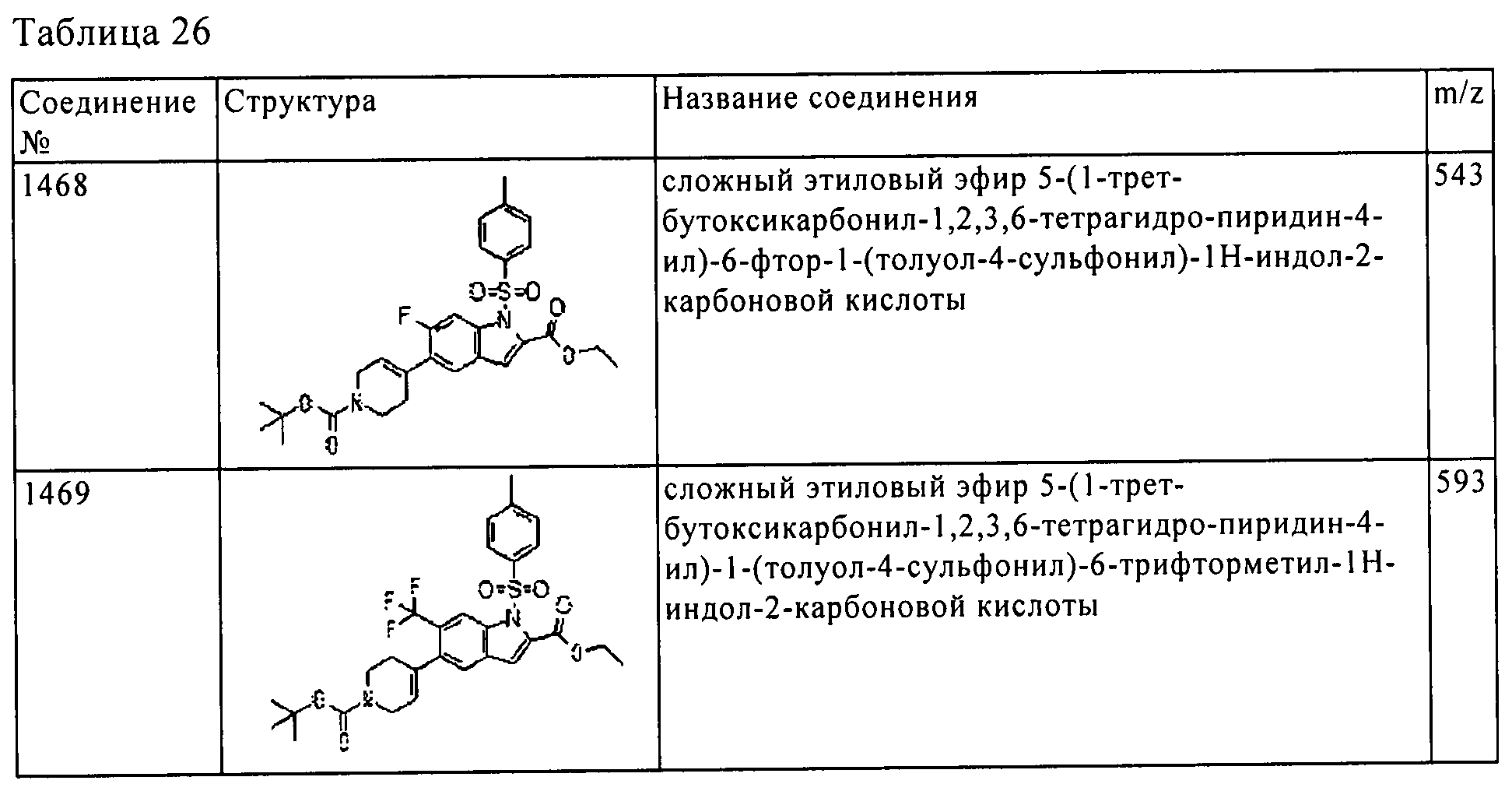
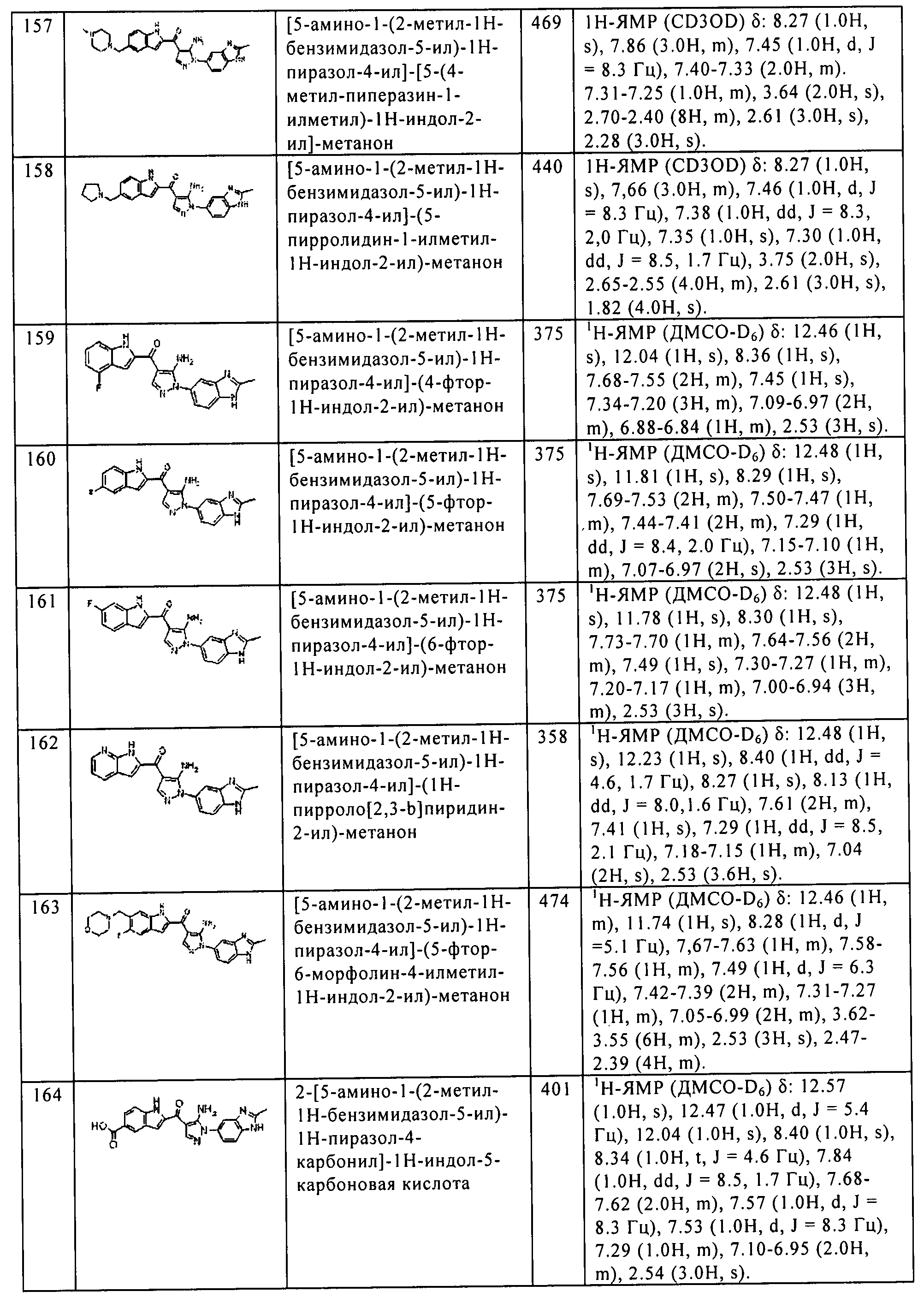
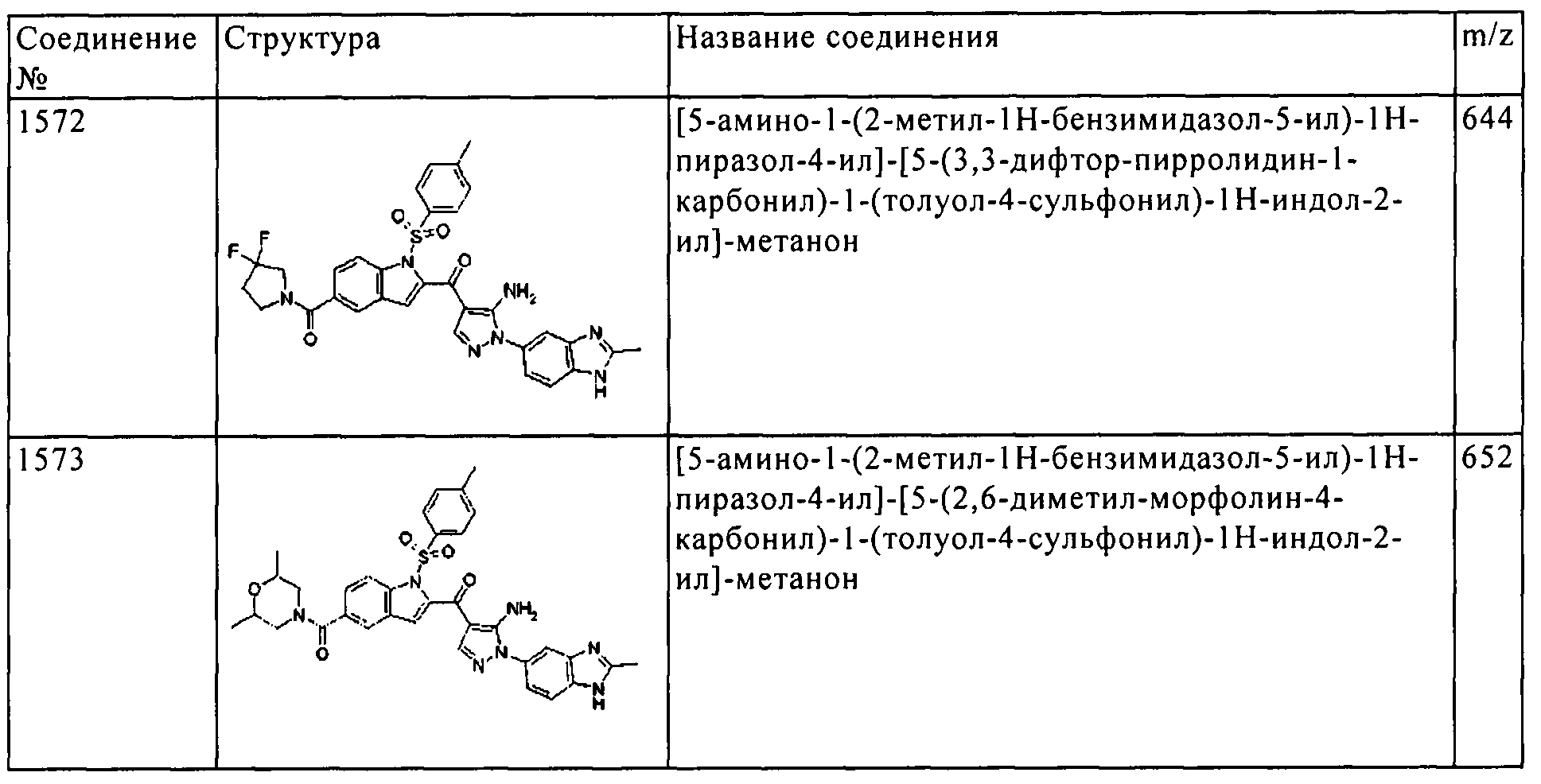
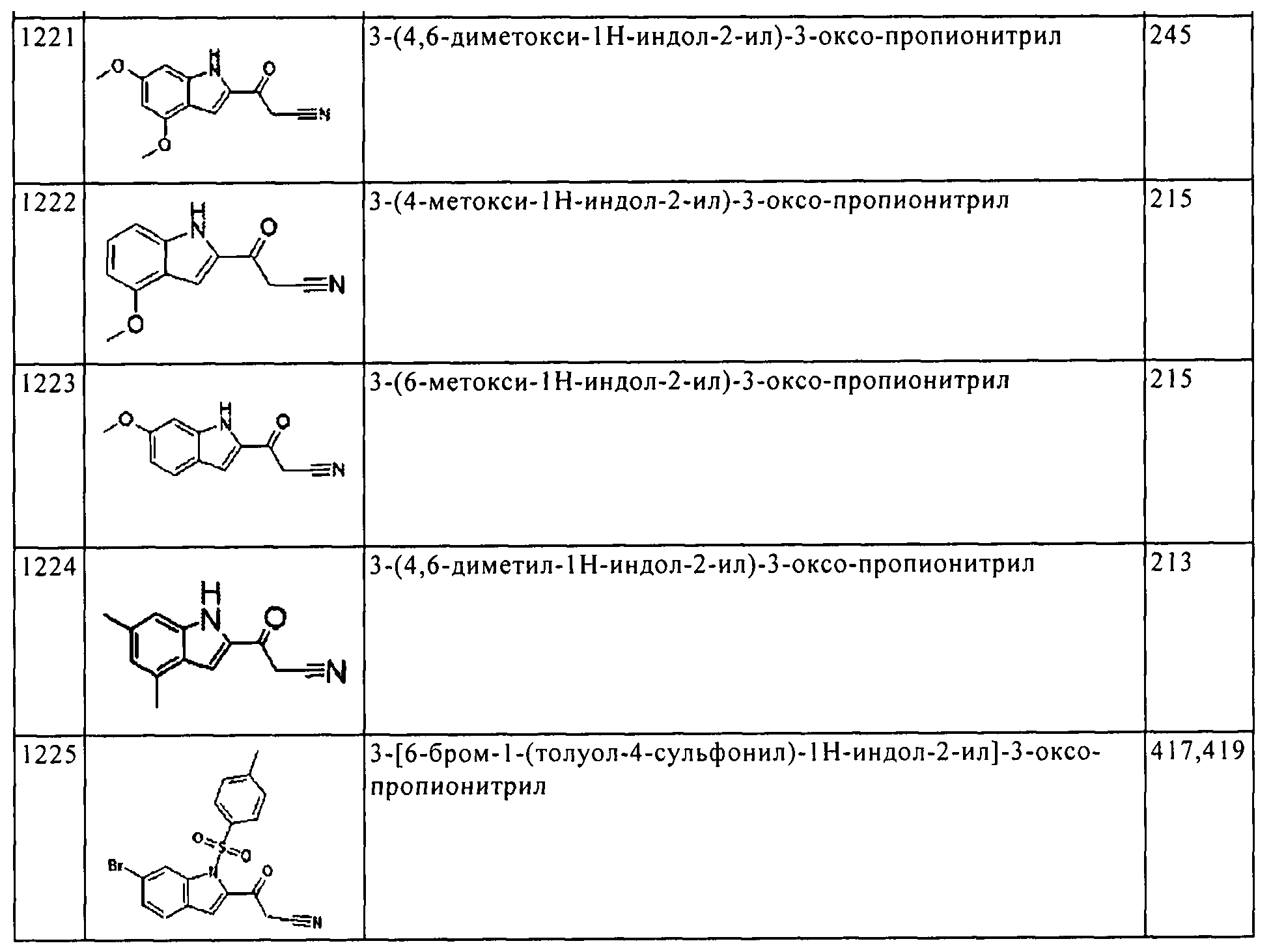
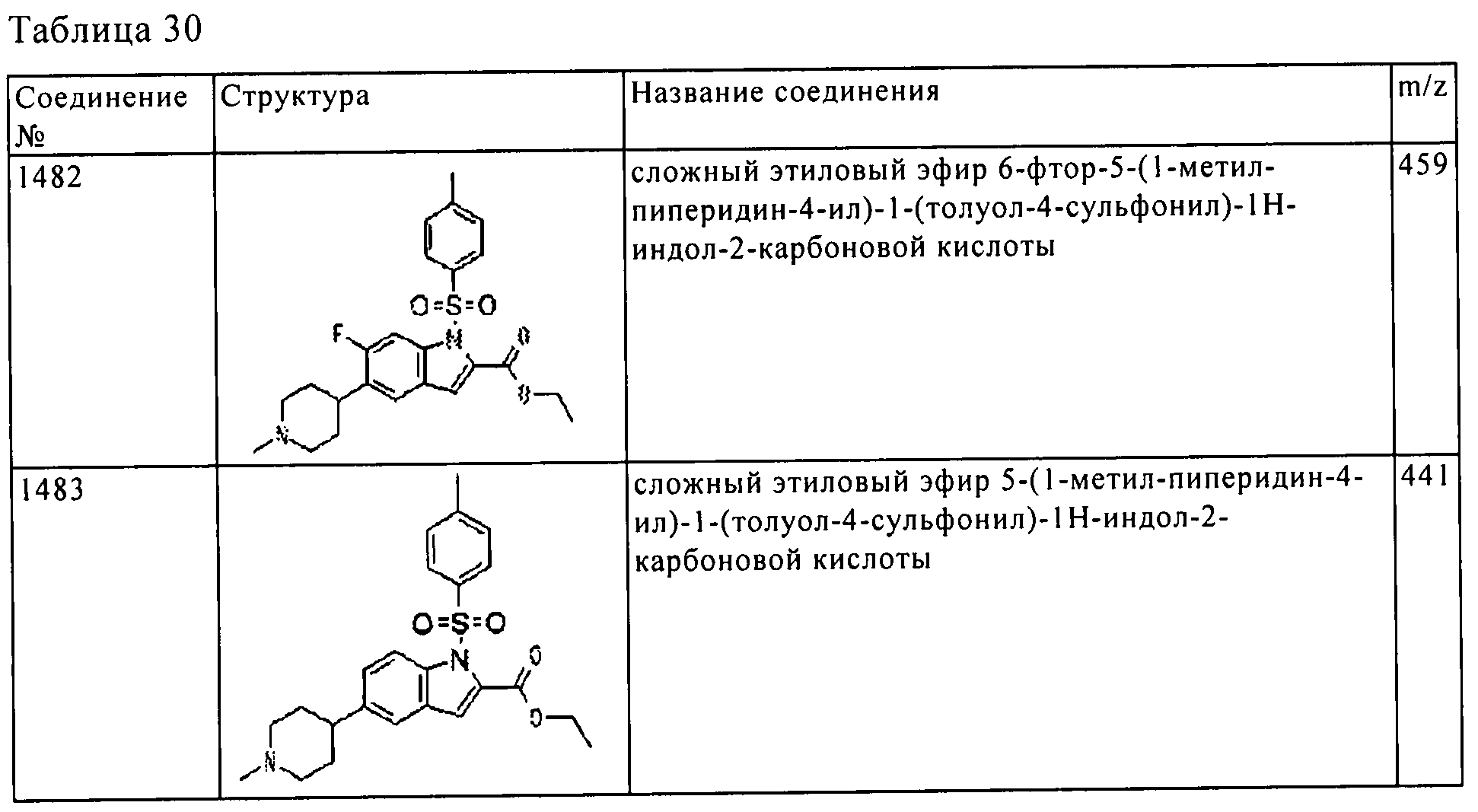
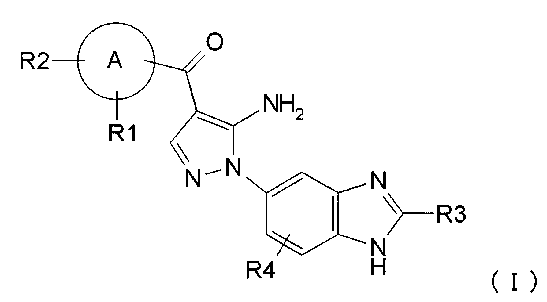
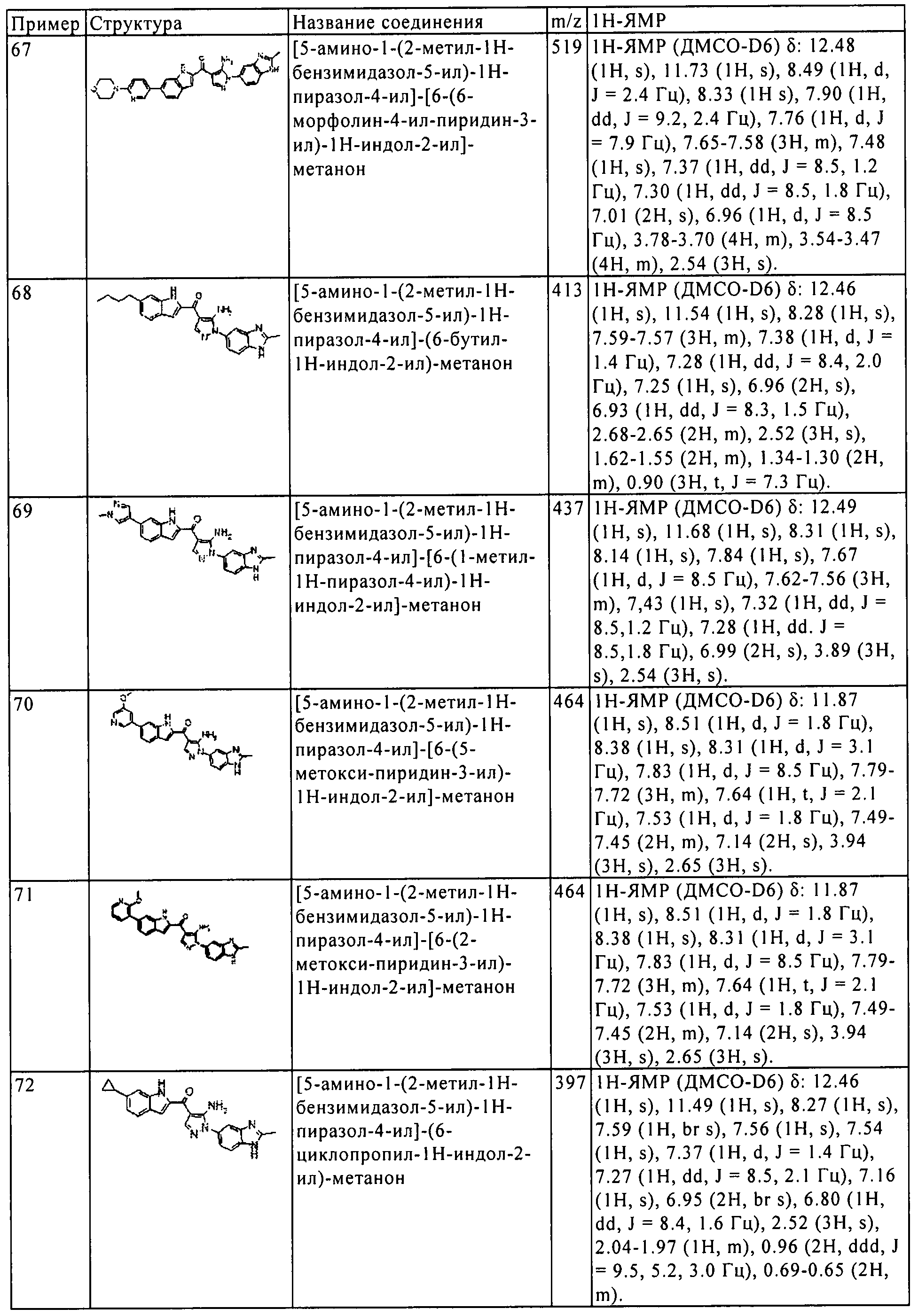
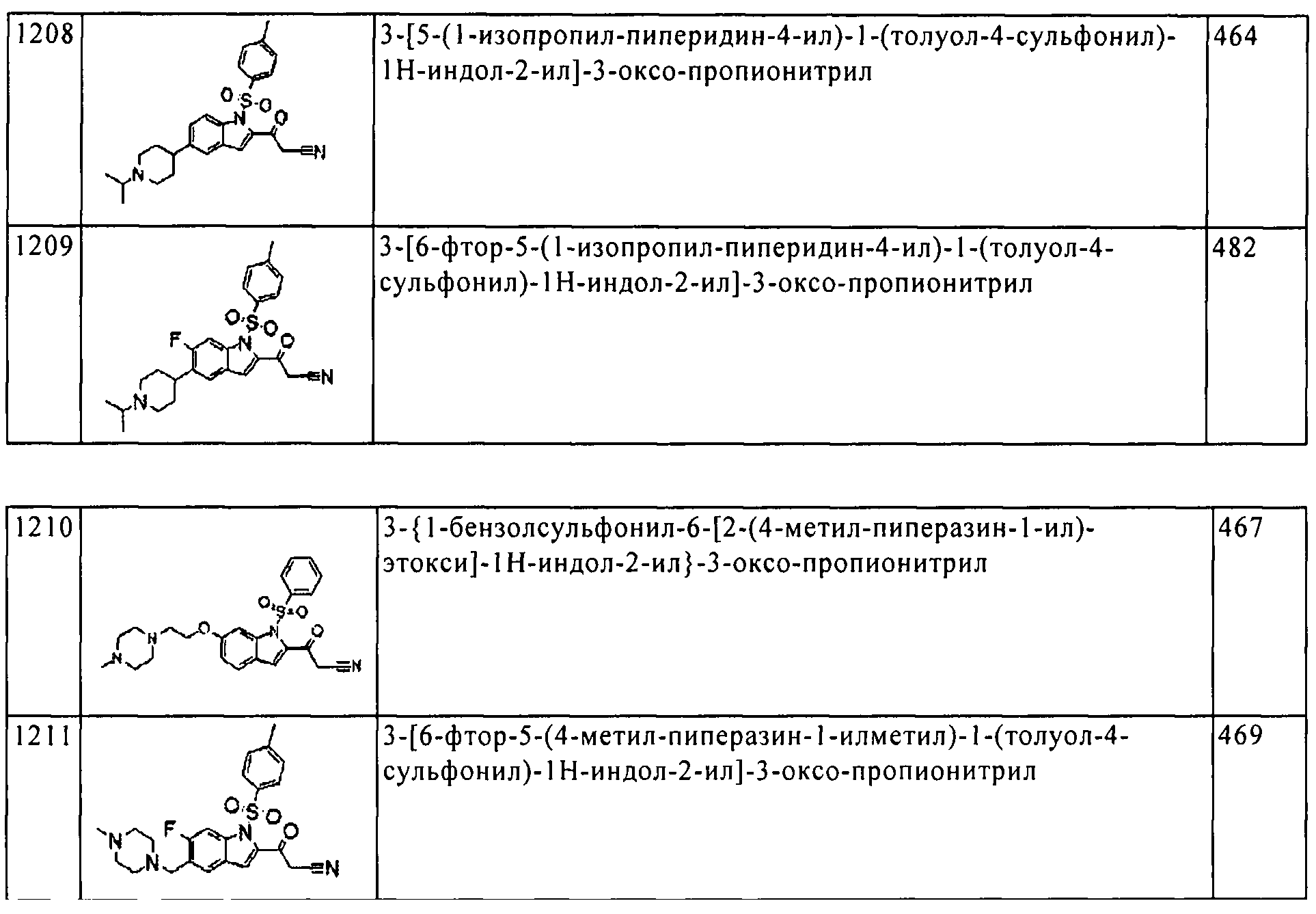
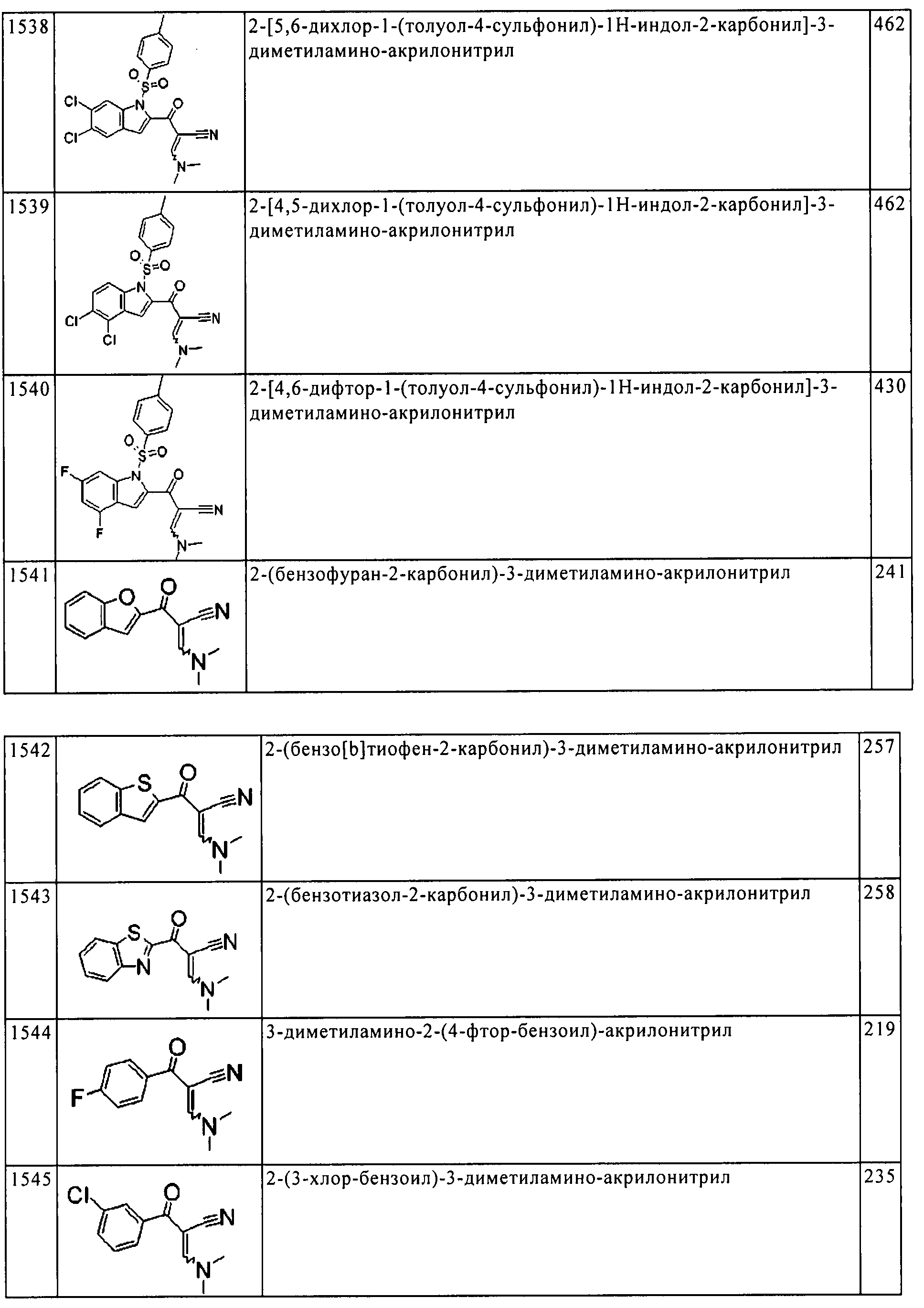
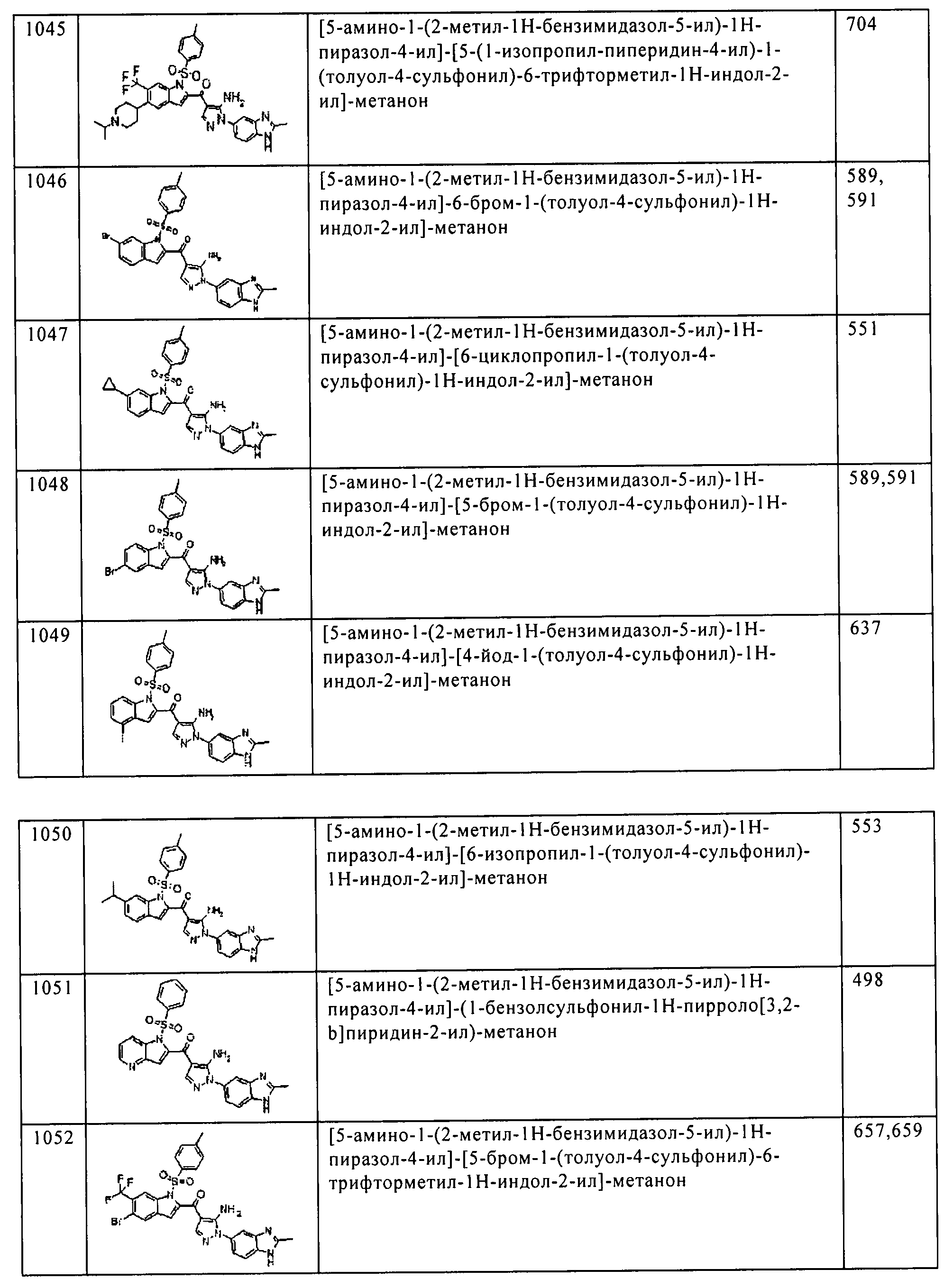
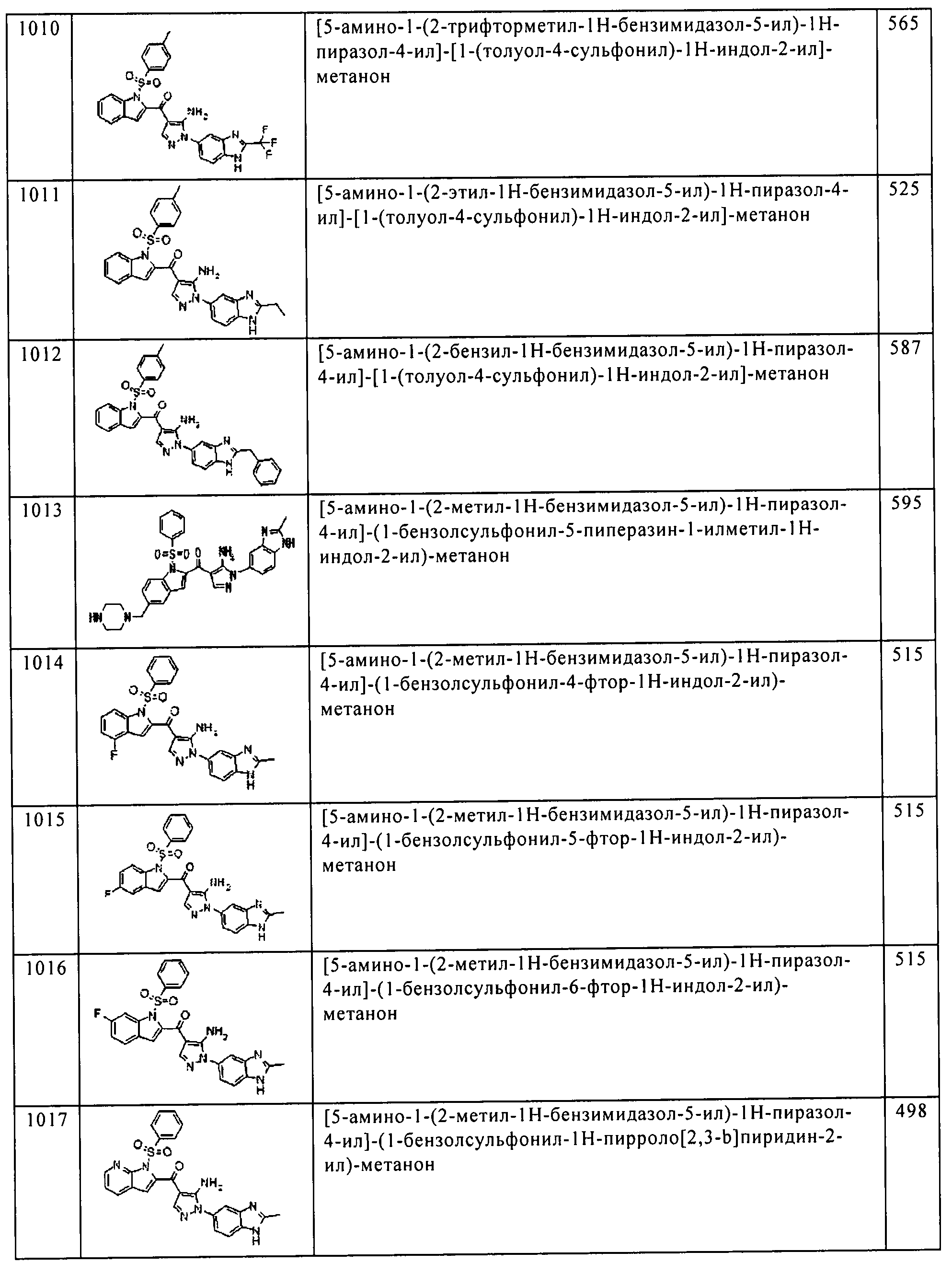
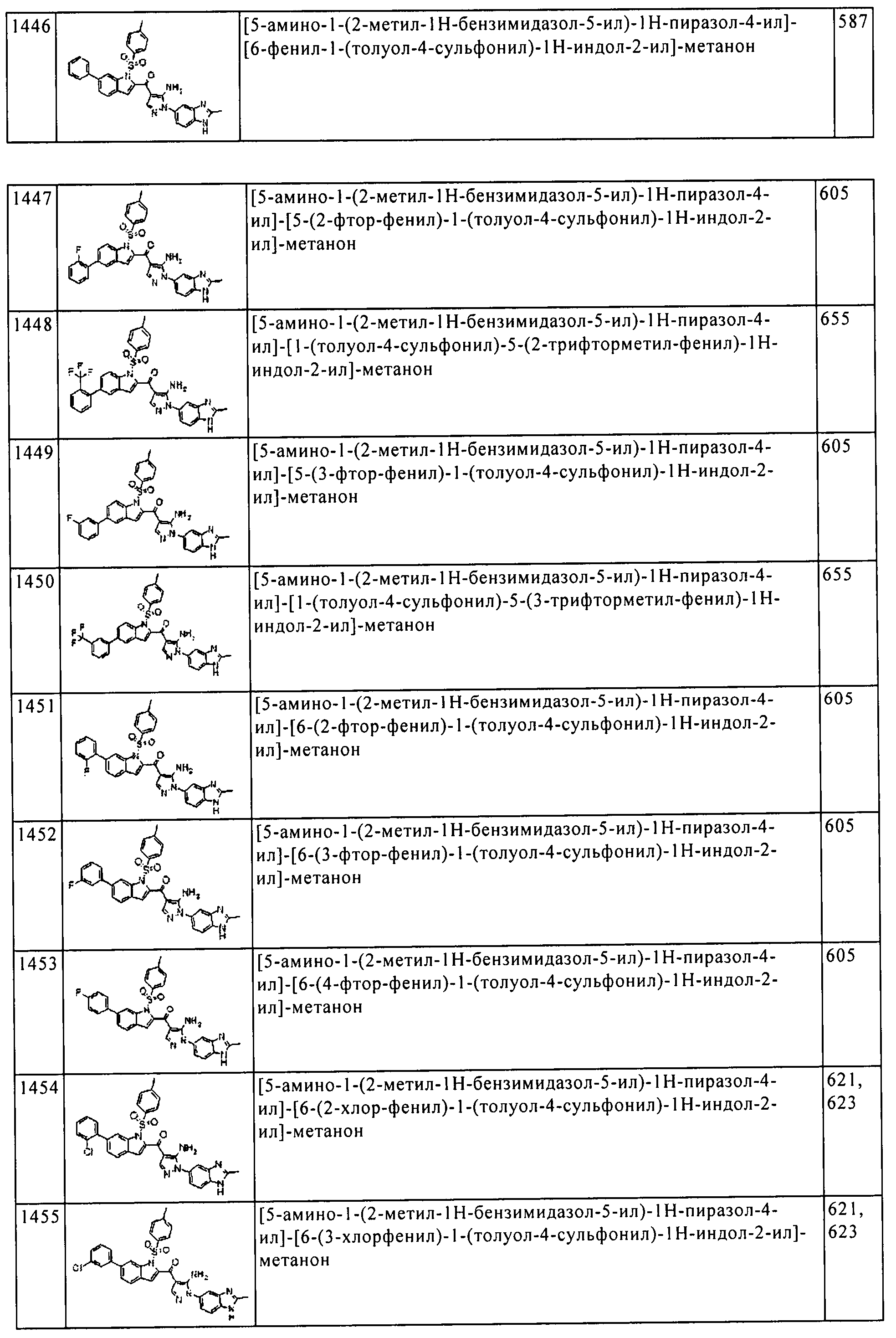
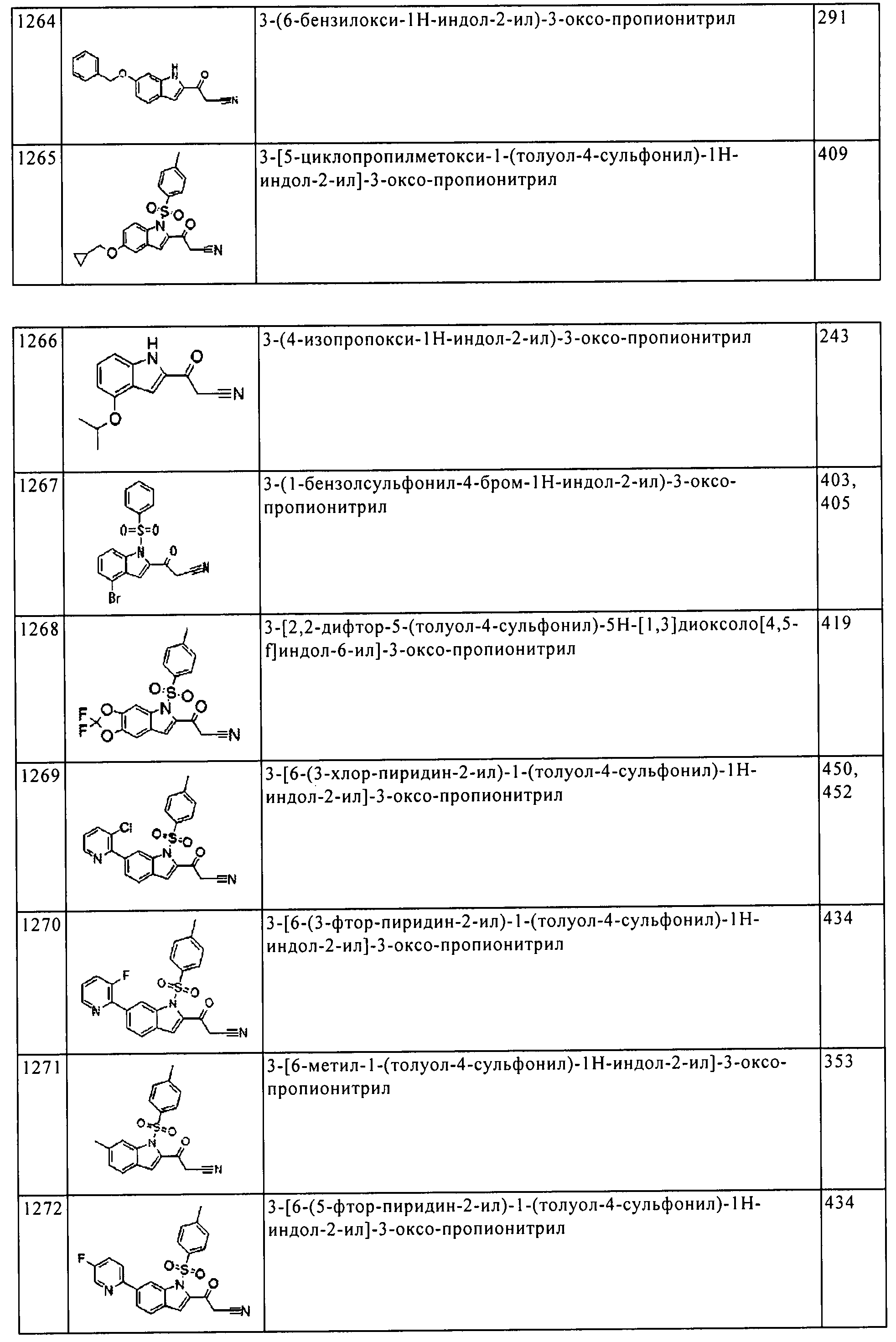
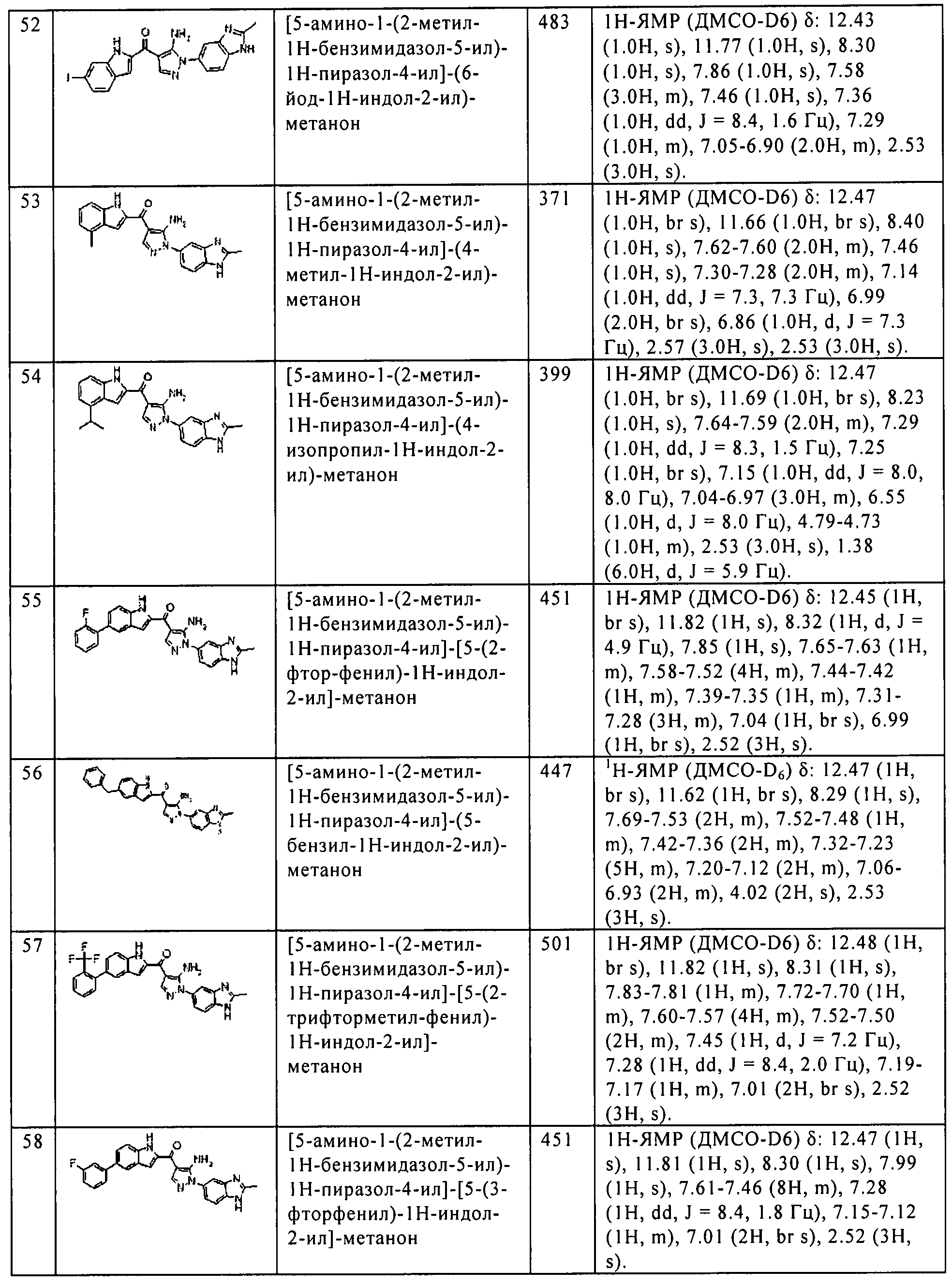
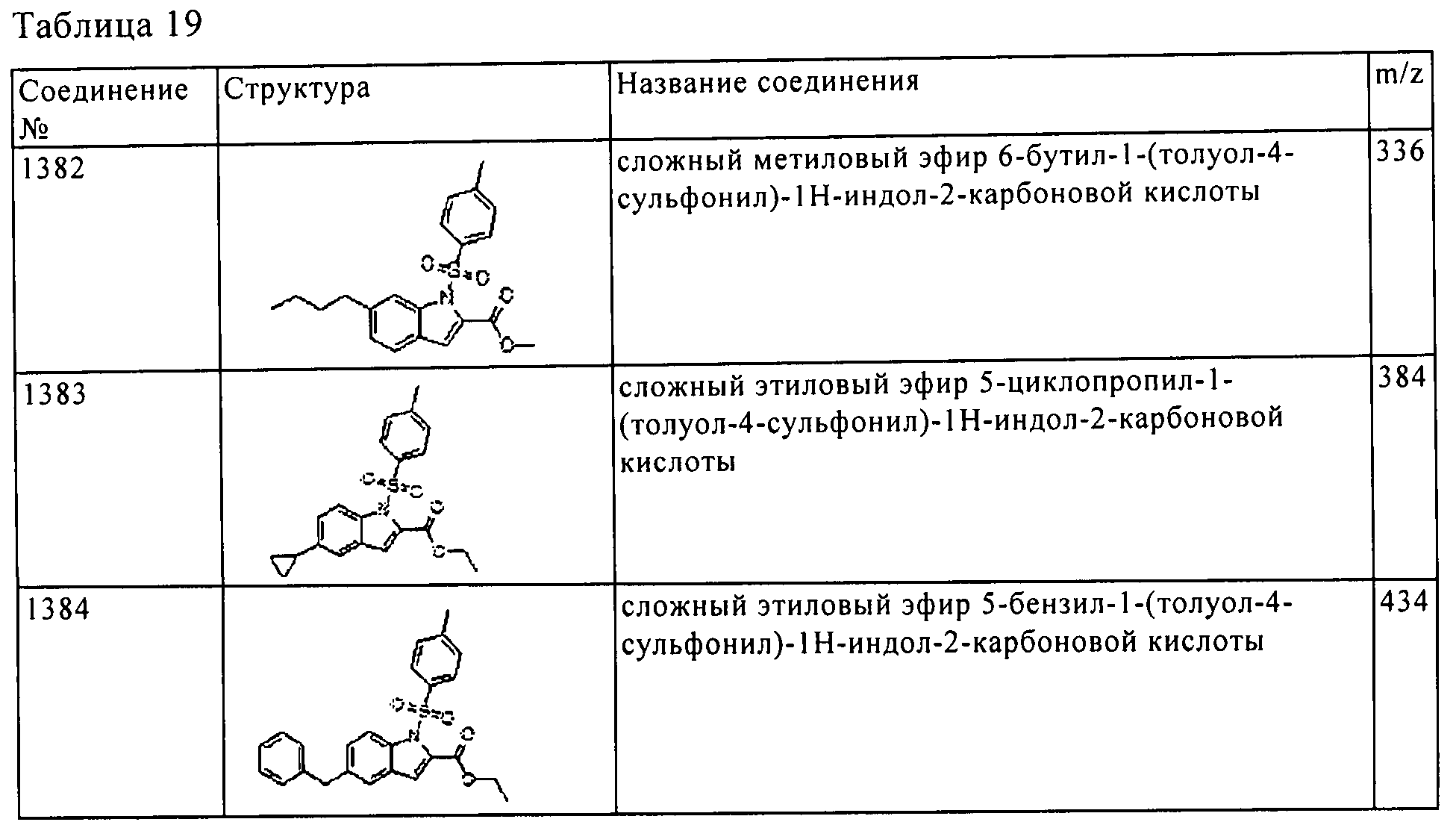
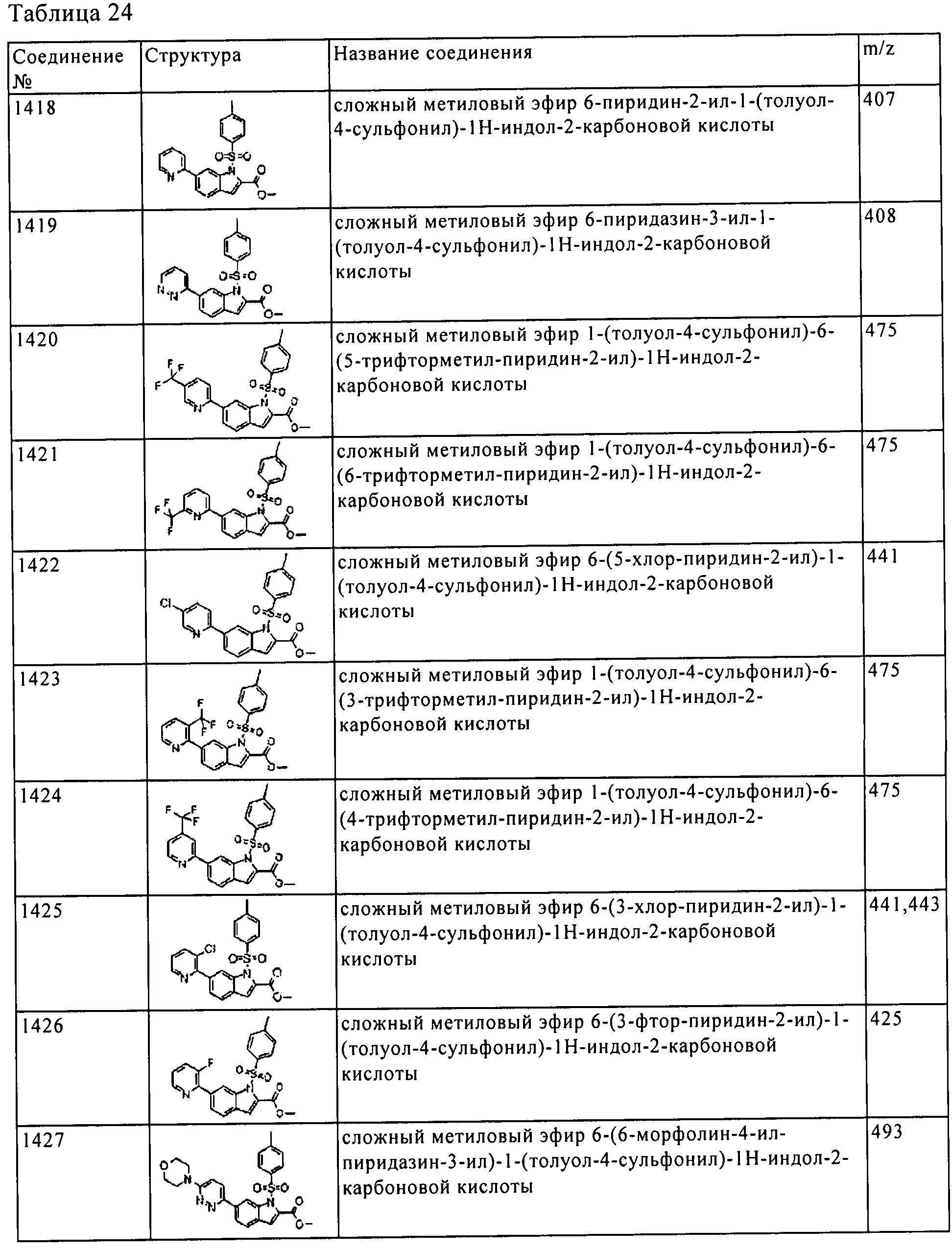
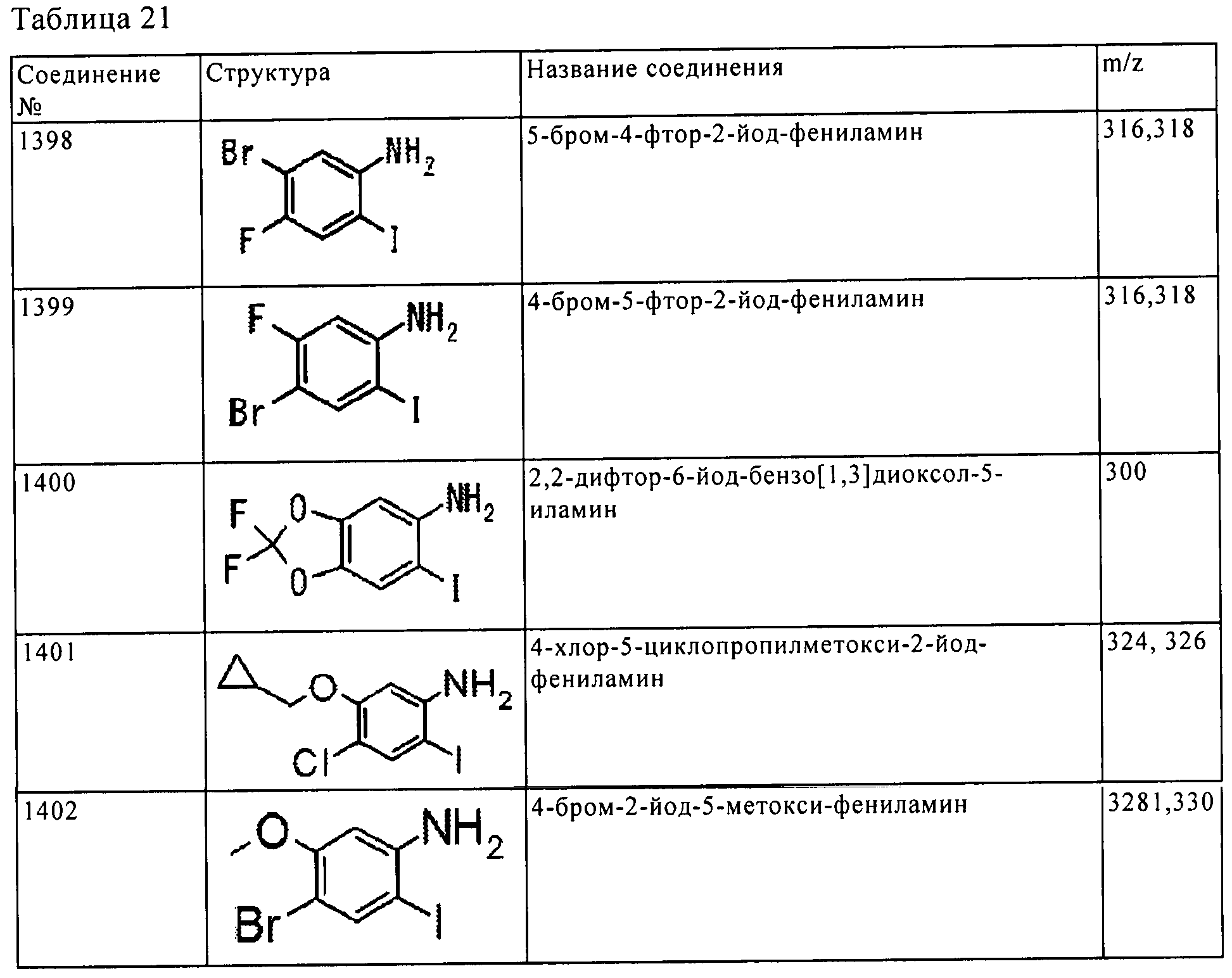
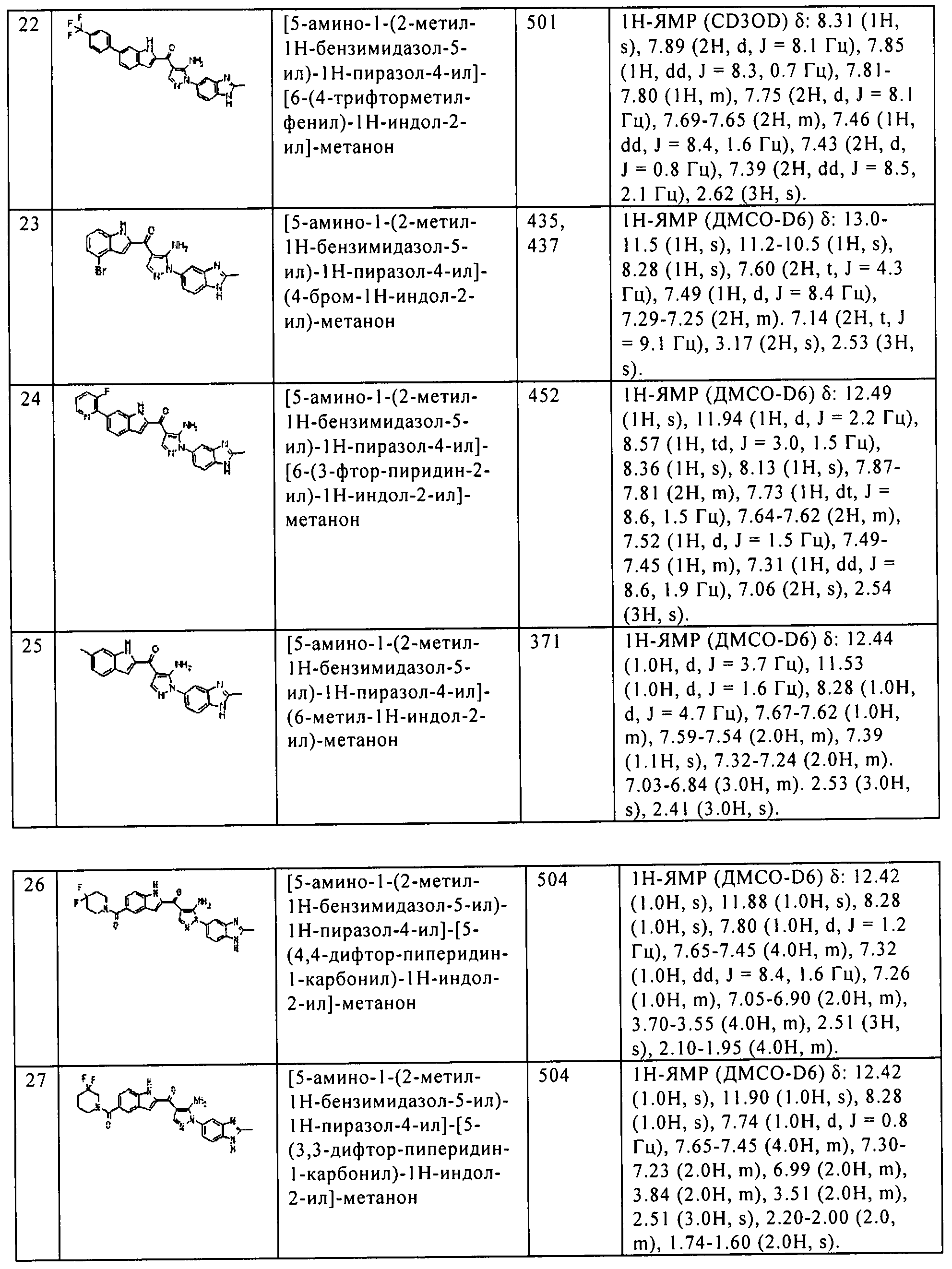
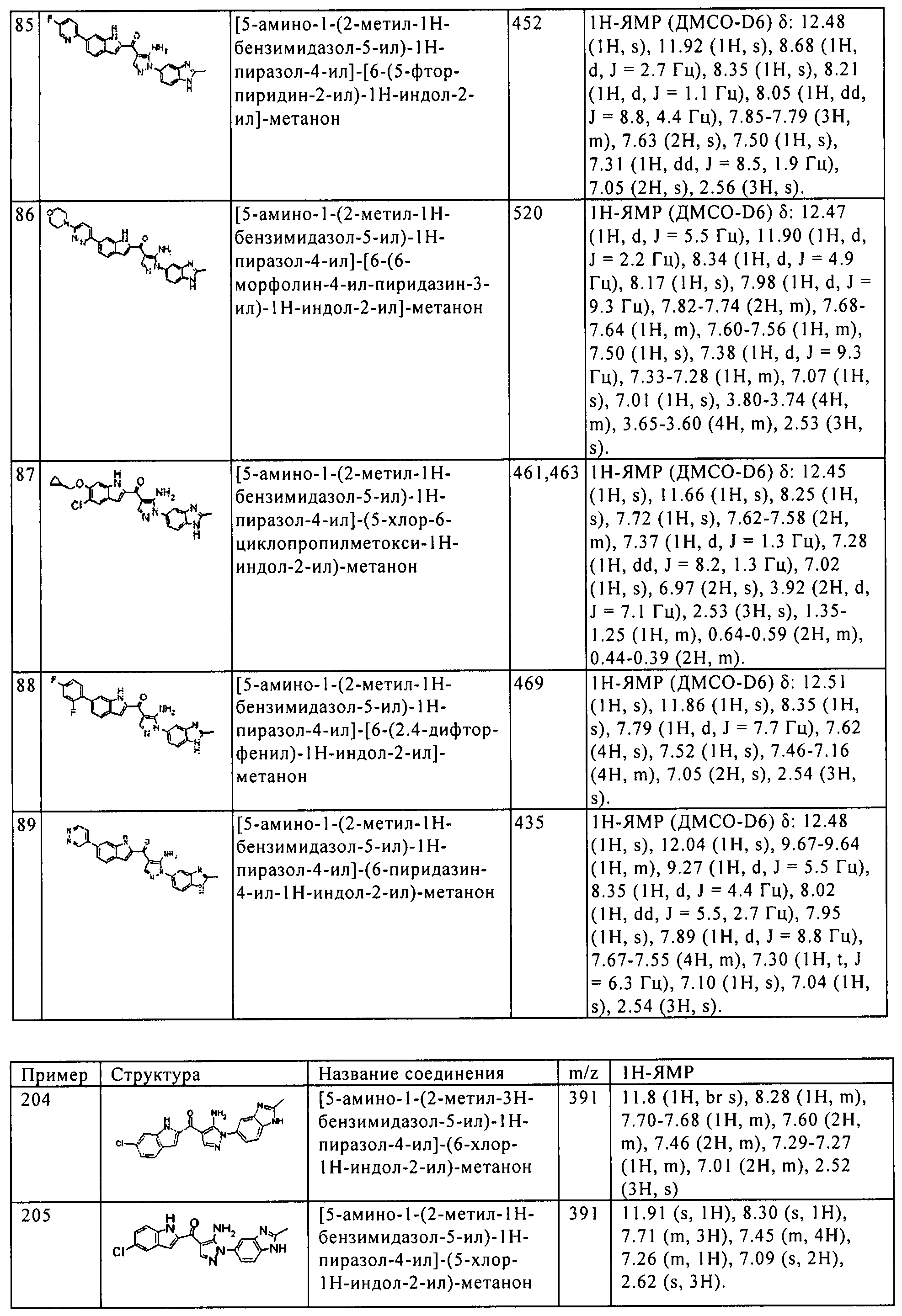
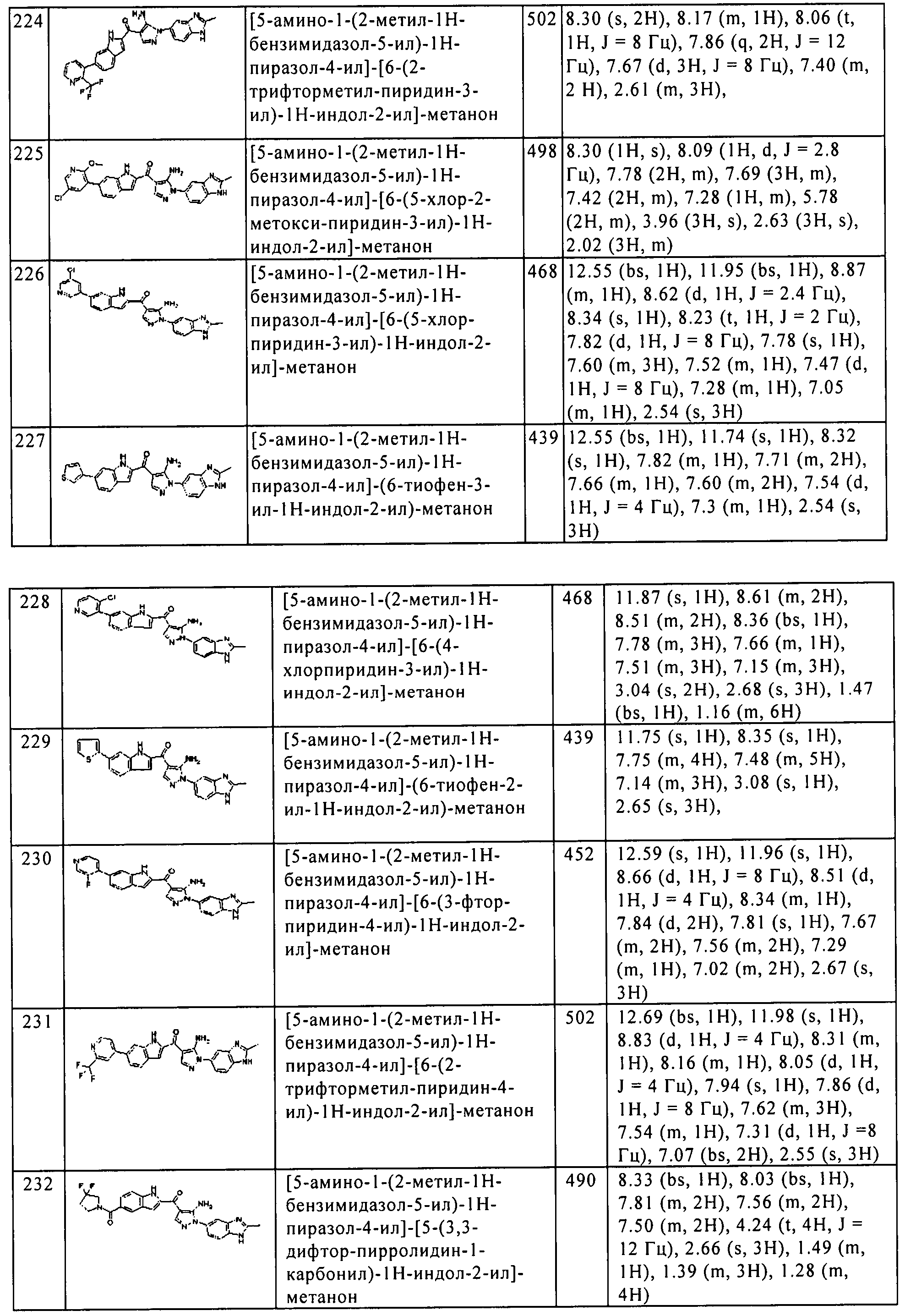
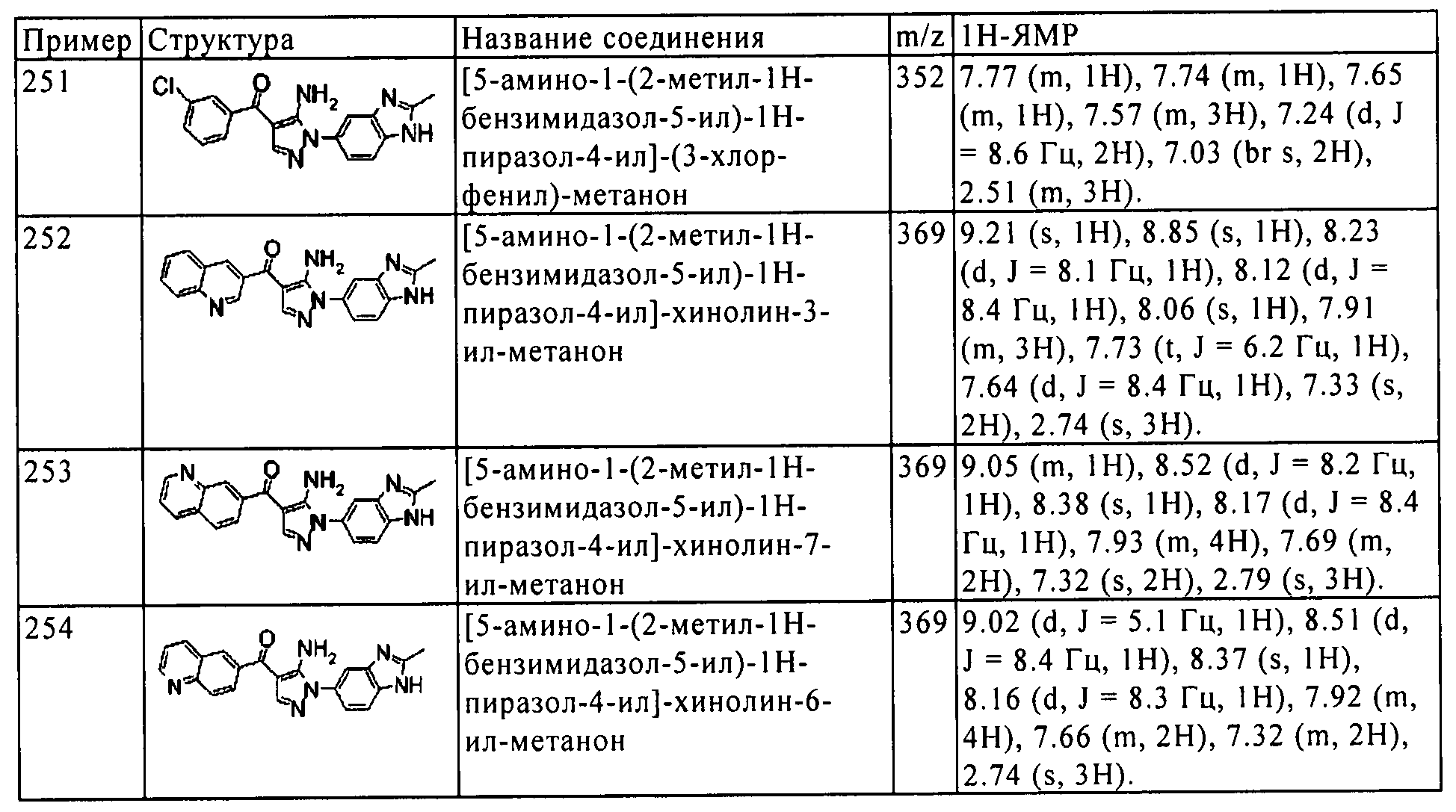
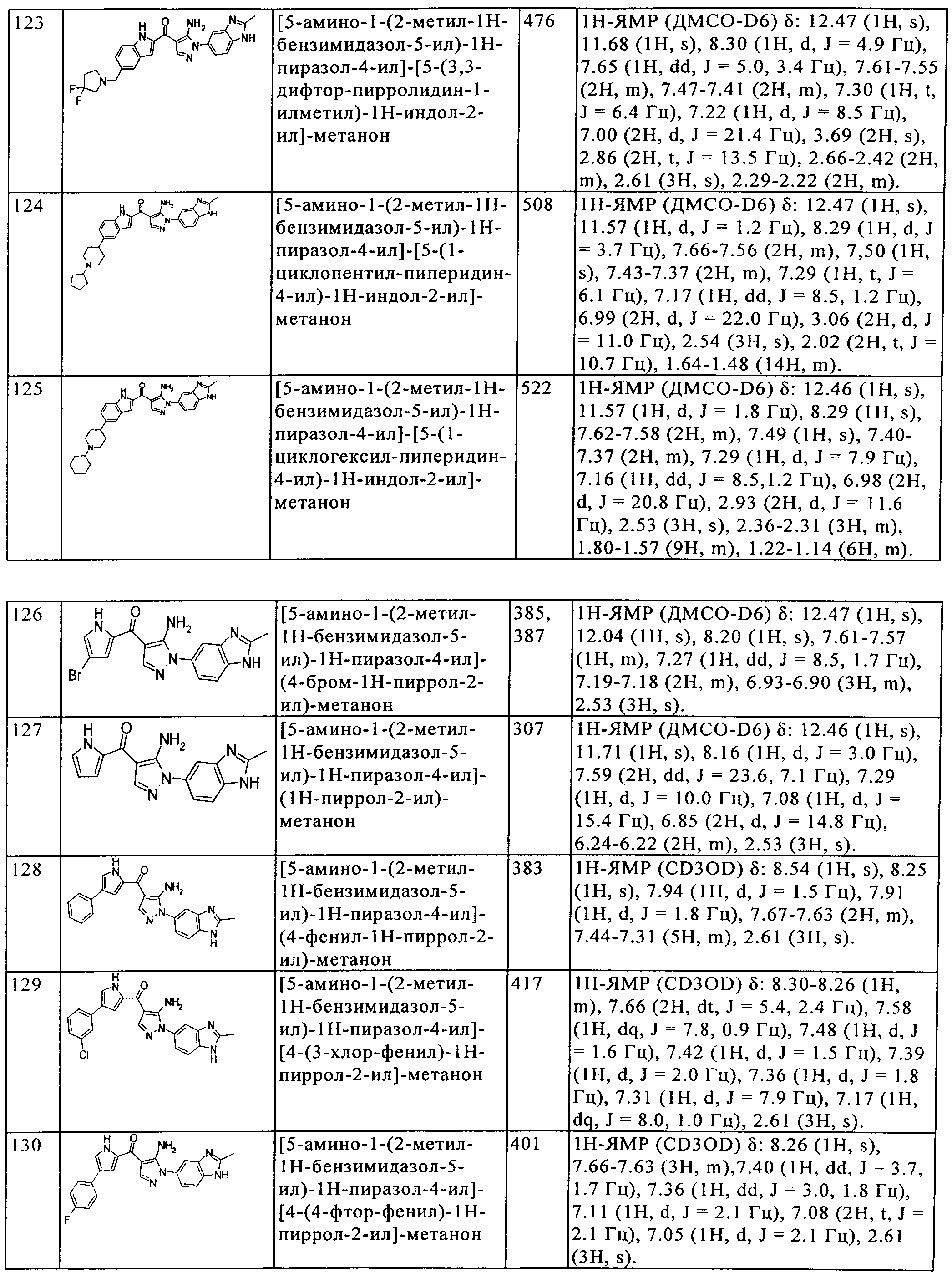
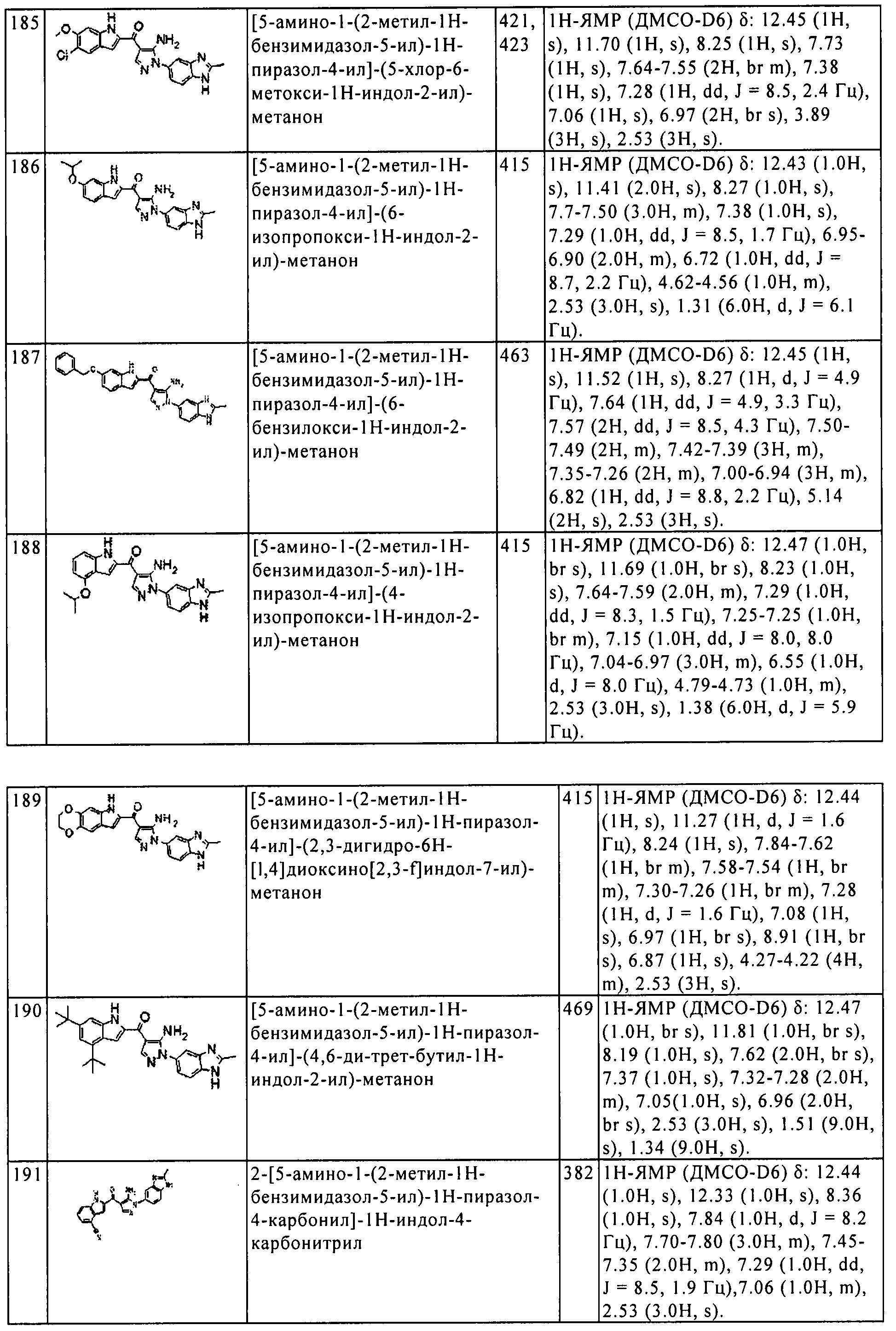
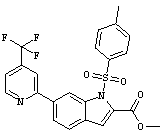
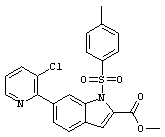
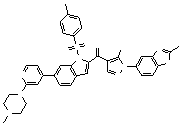
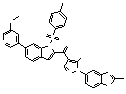
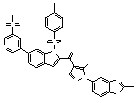
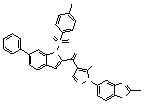
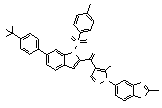
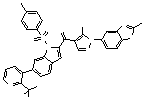
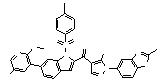
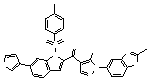
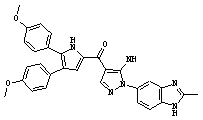
Результат интеллектуальной деятельности: ПРОИЗВОДНОЕ АМИНОПИРАЗОЛА
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к производным аминопиразола и их применению.
Предпосылки создания изобретения
В настоящее время большая часть из многообещающих молекулярно-нацеленных медикаментов против злокачественных новообразований являются ингибиторами рецепторной тирозинкиназы, например эрлотиниб и лапатиниб. Многие из них высокоэффективны против злокачественных новообразований с мутацией, амплификацией, или сверхэкспрессией целевых генов. Однако такие молекулярно-нацеленные средства не могут проявить действенность по отношению к злокачественным новообразованиям, в которых изменены гены, не являющиеся их целями. Таким образом все еще нет признанного терапевтического метода, который эффективен по отношению к таким злокачественным новообразованиям. Ингибиторы по отношению к новым генам, измененным при злокачественных новообразованиях, как ожидают, сделают большой вклад в лечение пациентов со злокачественными новообразованиями, на которые обычные медикаменты не действуют.
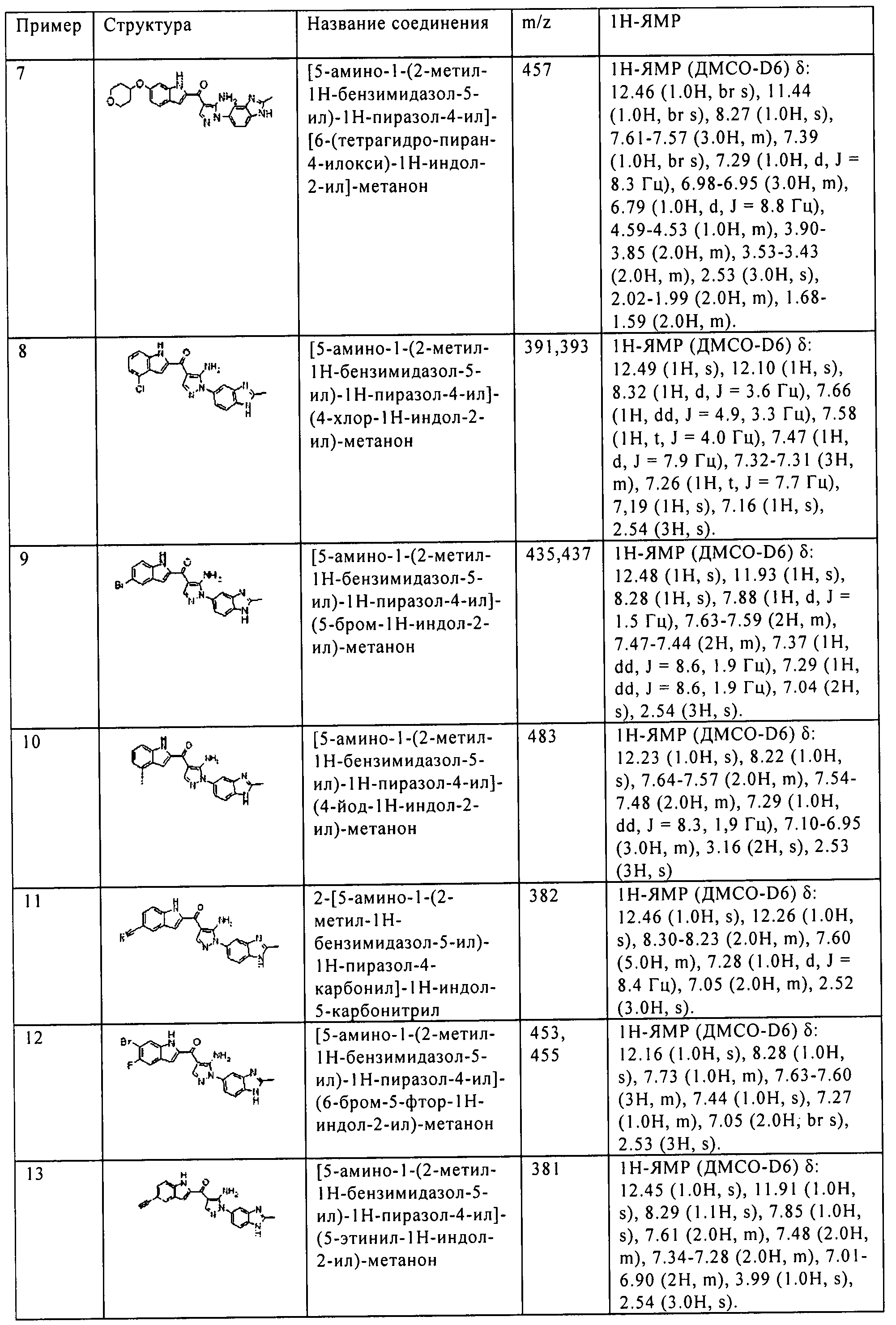
Рецепторы фактора роста фибробластов (FGFR) являются киназами, принадлежащими к семейству рецепторной тирозинкиназы. FGFR1, FGFR2, FGFR3, и FGFR4 составляют FGFR семейство. Лиганд - фактор роста фибробластов (FGF) и 22 типа структурно похожих белков формируют семейство. Известно, что каждый FGFR активируется после сверхэкспрессии, амплификации гена, мутации, или транслокации, и служит причиной злокачественного новообразования. Сигнал FGFR следует МАРК путем или PI3K/AKT путем. При раке, как известно, сигнал вовлечен в рост клеток, ангиогенез, миграцию клеток, инвазию, метастазы, и т.п. (непатентный документ 1).
Известно, что ген FGFR1 амплифицируется при раке молочной железы и немелкоклеточном раке легкого (непатентные документы 2 и 3); мутирует в глиобластоме (непатентный документ 4); транслоцируется для генерирования слитого белка при острой миелоцитарной лейкемии (непатентный документ 5); и сверхэкспрессируется при раке поджелудочной железы, раке мочевого пузыря, раке предстательной железы, и раке пищевода. Кроме того, известно, что FGFR1 экспрессируется в новых сосудах и сильно содействует ангиогенезу (непатентный документ 6). Известно, что ген FGFR2 амплифицируется при раке желудка и раке молочной железы (непатентные документы 7 и 8); мутирует при эндометриальном раке (непатентный документ 9); и сверхэкспрессируется при раке предстательной железы, раке пищевода, раке яичников, раке поджелудочной железы, опухоли головного мозга, и раке ободочной кишки. Известно, что ген FGFR3 транслоцируется при множественной миеломе (непатентный документ 10); мутирует при раке мочевого пузыря (непатентный документ 11); и сверхэкспрессируется при раке яичников, немелкоклеточном раке легкого, и гепатоцеллюлярном раке. В заключение, известно, что ген FGFR4 мутирует при раке легких, раке яичников, раке предстательной железы, и т.д.; и сверхэкспрессируется при раке щитовидной железы, раке яичников, и т.д.
Как описано выше, убедительно указано на то, что все киназы FGFR семейства задействованы в злокачественном новообразовании. Таким образом, ингибирование киназ семейства FGFR в раковых тканях может быть многообещающим терапевтическим методом для лечения вышеуказанных типов злокачественного новообразования.
[Документы уровня техники]
[Непатентный документ 1] Cytokine & Growth Factor Reviews 16 (2005) 139-149
[Непатентный документ 2] Breast Cancer Research 2007, 9:R23
[Непатентный документ 3] Cancer Res 2005; 65(13): 5561-70
[Непатентный документ 4] PNAS (2005), 102(40), 14344-14349.
[Непатентный документ 5] Acta Haematol 2002; 107:101-107
[Непатентный документ 6] Nature Medicine 3, 887-89, 1997
[Непатентный документ 7] J Pathol. 2003 Ноябрь; 201(3):439-50
[Непатентный документ 8] Anal Cell Pathol. 2001; 22(4):229-34
[Непатентный документ 9] Cancer Res 2008; 68(17);6902-7
[Непатентный документ 10] Blood. 2003; 101: 4569-4575
[Непатентный документ 11] Nat Genet. 1999 Сентябрь; 23(1):18-20.
Краткое изложение сущности изобретения
[Задачи, решаемые настоящим изобретением]
Задачей настоящего изобретения является обеспечение соединений с низкой молекулярной массой, способных ингибировать киназы семейства рецептора фактора роста фибробластов (FGFR) в раковых тканях.
[Средства для решения задач]
В особенности, настоящее изобретение включает следующие объекты:
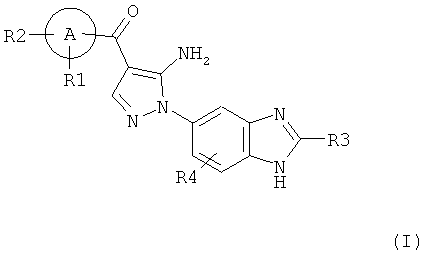
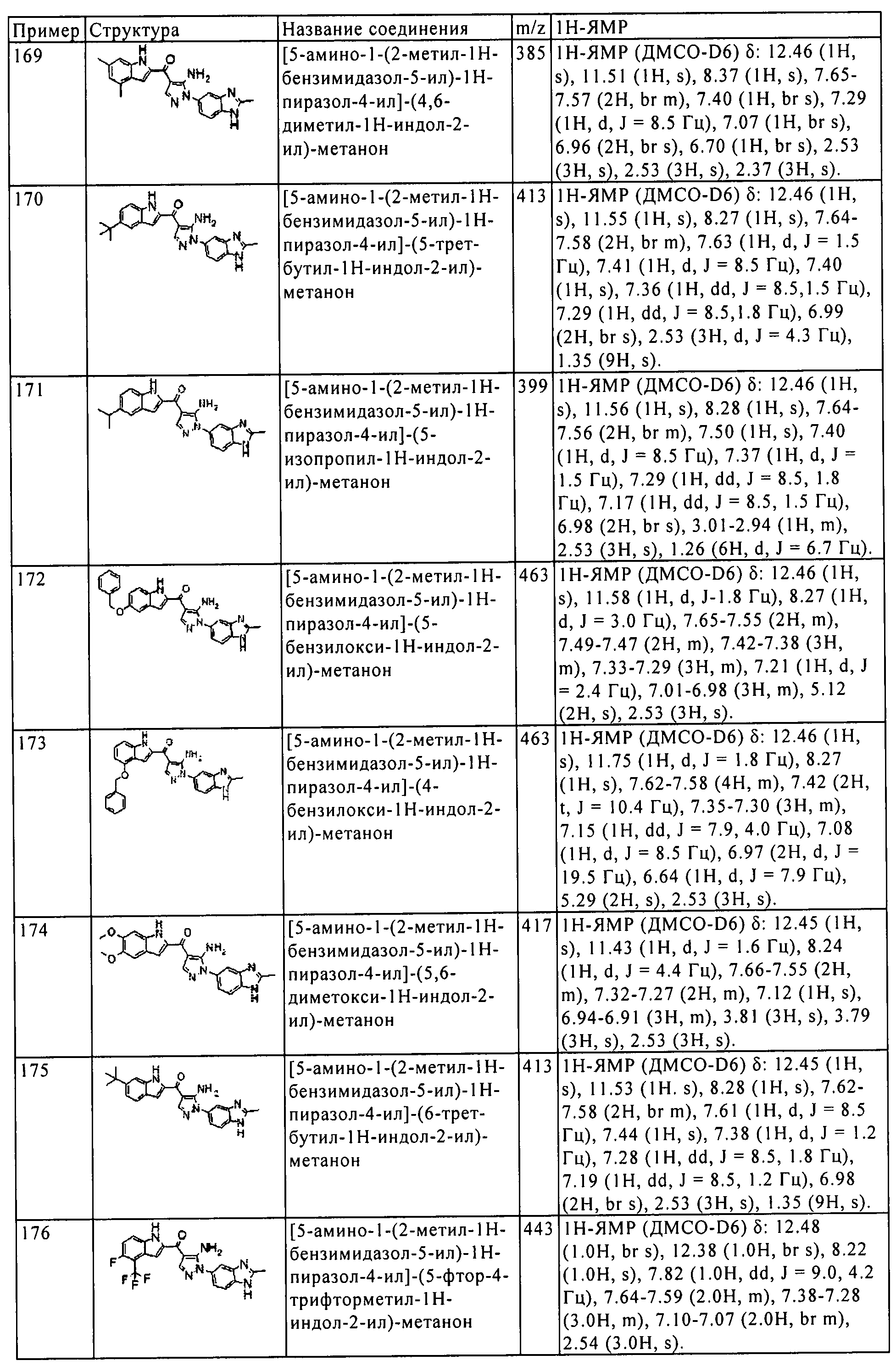
[1] Соединение, изображаемое следующей общей формулой (I), или его фармацевтически приемлемая соль:

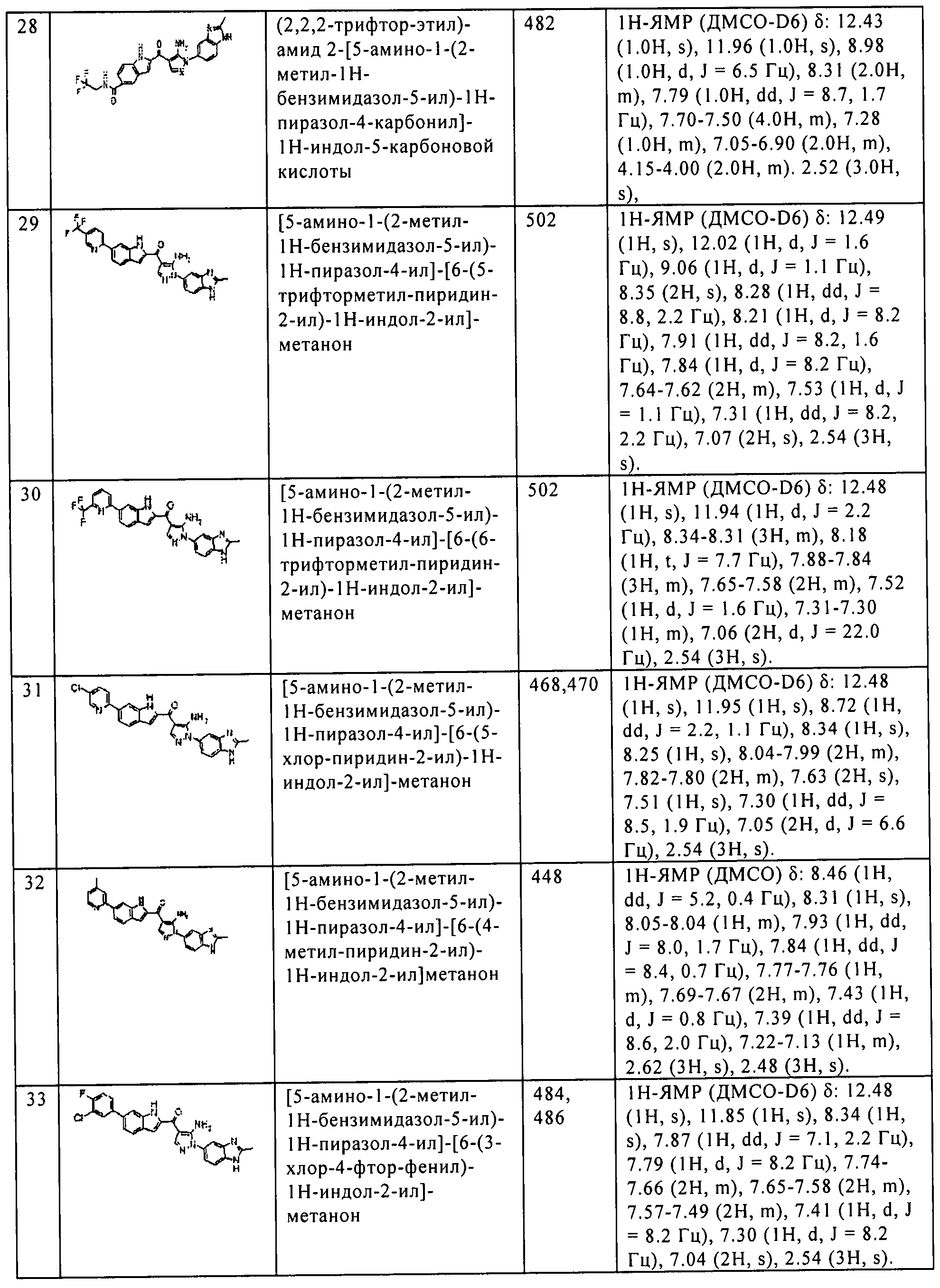
где R1, R2, R3, и R4 каждый независимо означает группу, перечисленную ниже:
R1 означает водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-7 циклоалкил, C6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1,
-C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы P, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27,
-SO2NR28R29, -OSO2R30, -SO3R31, или -Si(R32)3;
R2 означает водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, С3-7 циклоалкил, С6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1,
-C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы P, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27,
-SO2NR28R29, -OSO2R30, -SO3R31, или -Si(R32)3; или
R1 и R2, вместе с атомом, соединенным с ними, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, где гетероциклил или гетероарил необязательно замещен галогеном;
R3 означает водород, C1-5 алкил, C6-10 арил C1-6 алкил, или C1-4 галоалкил;
R4 означает водород, галоген, C1-3 алкил, C1-4 галоалкил, гидрокси, циано, нитро, C1-4 алкокси, -(CH2)nZ1, -NR6R7, -OR5, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, NR17SO2R18, COOH, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27,
-SO2NR28R29, -OSO2R30, -SO3R31, или -Si(R32)3;
А означает 5-10-членное гетероарильное кольцо или C6-10 арильное кольцо;
R5 означает C1-5 алкил, C3-7 циклоалкил, C3-7 циклоалкил C1-3 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, C1-3 алкокси C1-4 алкокси C1-4 алкил, C1-4 аминоалкил, C1-4 алкиламино C1-4 алкил, ди(C1-4 алкил)амино C1-4 алкил, C6-10 арил, C6-10 арил C1-3 алкил, или 3-10-членный гетероциклил C1-3 алкил, 3-10-членный гетероциклил, 5-10-членный гетероарил, 5-10-членный гетероарил C1-3 алкил, C1-6 моногидрокси алкил, C1-6 дигидрокси алкил, или C1-6 тригидрокси алкил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R6 и R7 являются одинаковыми или разными и каждый означает водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, C6-10 арил C1-3 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, C1-6 моногидрокси алкил, C1-6 дигидрокси алкил, C1-6 тригидрокси алкил, 3-10-членный гетероциклил, C1-4 аминоалкил, C1-4 алкиламино C1-4 алкил, ди(C1-4 алкил)амино C1-4 алкил, или циано(C1-3 алкил); или R6 и R7, вместе с атомом азота, соединенным с ними, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
n принимает значение 1-3;
R8 и R9 являются одинаковыми или разными и каждый означает водород, C1-4 алкил, или галоген; или альтернативно, R8 и R9, вместе с атомом углерода, соединенным с ними, образуют циклоалифатическое кольцо;
Z1 означает водород, NR10R11, -OH, или 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R10 и R11 являются одинаковыми или разными и каждый означает C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, циано(C1-3 алкил), или C1-3 алкилсульфонил C1-4 алкил; или альтернативно, R10 и R11, вместе с атомом азота, соединенным с ними, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R12 и R13 являются одинаковыми или разными и каждый означает водород, C1-4 алкил, C3-6 алкенил, C3-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил), C1-3 алкилсульфонил C1-4 алкил, 3-10-членное циклоалифатическое кольцо, 5-10-членный гетероарил, или 3-10-членный гетероциклил; или альтернативно, R12 и R13, вместе с атомом азота, соединенным с ними, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R14 означает C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R15 означает C1-4 алкил, C3-6 алкенил, C3-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы P, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R16 означает C1-4 алкил, C3-6 алкенил, C3-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы P, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R17 означает водород или C1-4 алкил;
R18 означает C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы P, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R19 означает водород, С1-4 алкил, С3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R20 означает C1-4 алкил, C3-7 циклоалкил, С1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R21 означает C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R22 означает водород, C1-4 алкил, или C1-4 галоалкил;
R23 означает водород, C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R24 означает водород, C1-4 алкил, или C1-4 галоалкил;
R25 означает C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R26 и R27 являются одинаковыми или разными и каждый означает водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкоксил C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил),
C1-3 алкилсульфонил C1-4 алкил, или 3-10-членное циклоалифатическое кольцо;
или альтернативно, R26 и R27, вместе с атомом азота, соединенным с ними, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R28 и R29 являются одинаковыми или разными и каждый означает водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкоксил C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил),
C1-3 алкилсульфонил C1-4 алкил, или 3-10-членное циклоалифатическое кольцо;
или альтернативно, R28 и R29, вместе с атомом азота, соединенным с ними, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R30 означает C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R31 означает C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R32 означает C1-4 алкил или C6-10 арил;
<группа P>
галоген, C1-4 алкил, C1-4 галоалкил, -OH, C1-3 алкокси, C1-3 галоалкокси, 3-10-членный гетероциклиламино, -SO2R16, -CN, -NO2, и 3-10-членный гетероциклил;
<группа Q>
галоген, C1-4 алкил, C1-4 галоалкил, -OH, C1-3 алкокси, C1-6 моногидрокси алкил, C1-6 дигидрокси алкил, C1-6 тригидрокси алкил, 3-10-членный гетероциклиламино, -SO2R16,
-CN, -NO2, C3-7 циклоалкил, -COR19, и 3-10-членный гетероциклил, который необязательно замещен C1-4 алкилом.
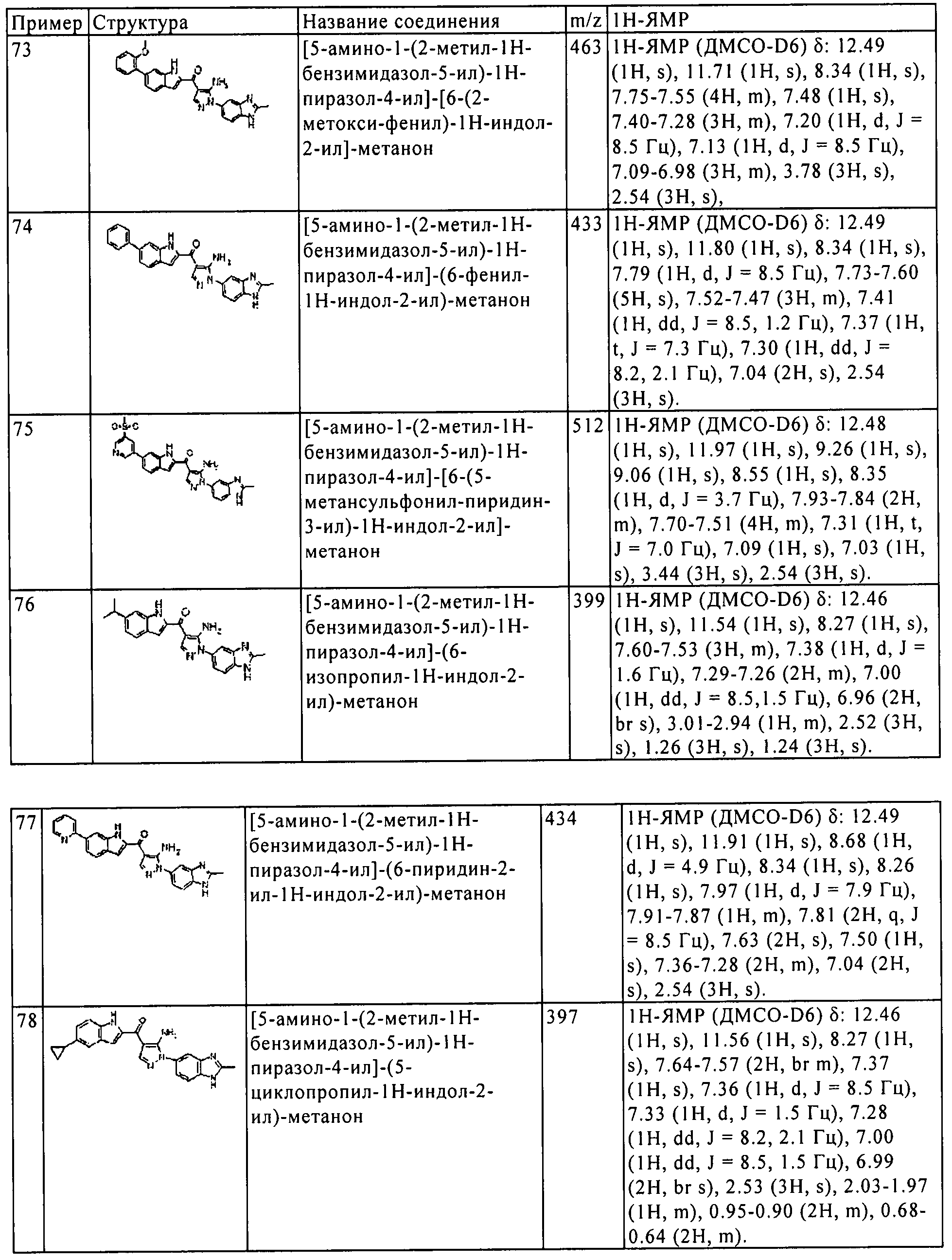
[2] Соединение пункта [1] или его фармацевтически приемлемая соль, где А означает бензол, индол, азаиндол, бензофуран, бензотиофен, бензотиазол, хинолин или пиррол.
[3] Соединение пункта [1] или [2], или его фармацевтически приемлемая соль, где R3 означает водород, C1-4 алкил, C6-10 арил C1-4 алкил, или C1-3 перфторалкил.
[4] Соединение любого из пунктов [1]-[3], или его фармацевтически приемлемая соль, где R4 означает водород, галоген, C1-3 алкил, C1-3 перфторалкил, циано, метансульфонил, гидроксил, алкокси, или амино.
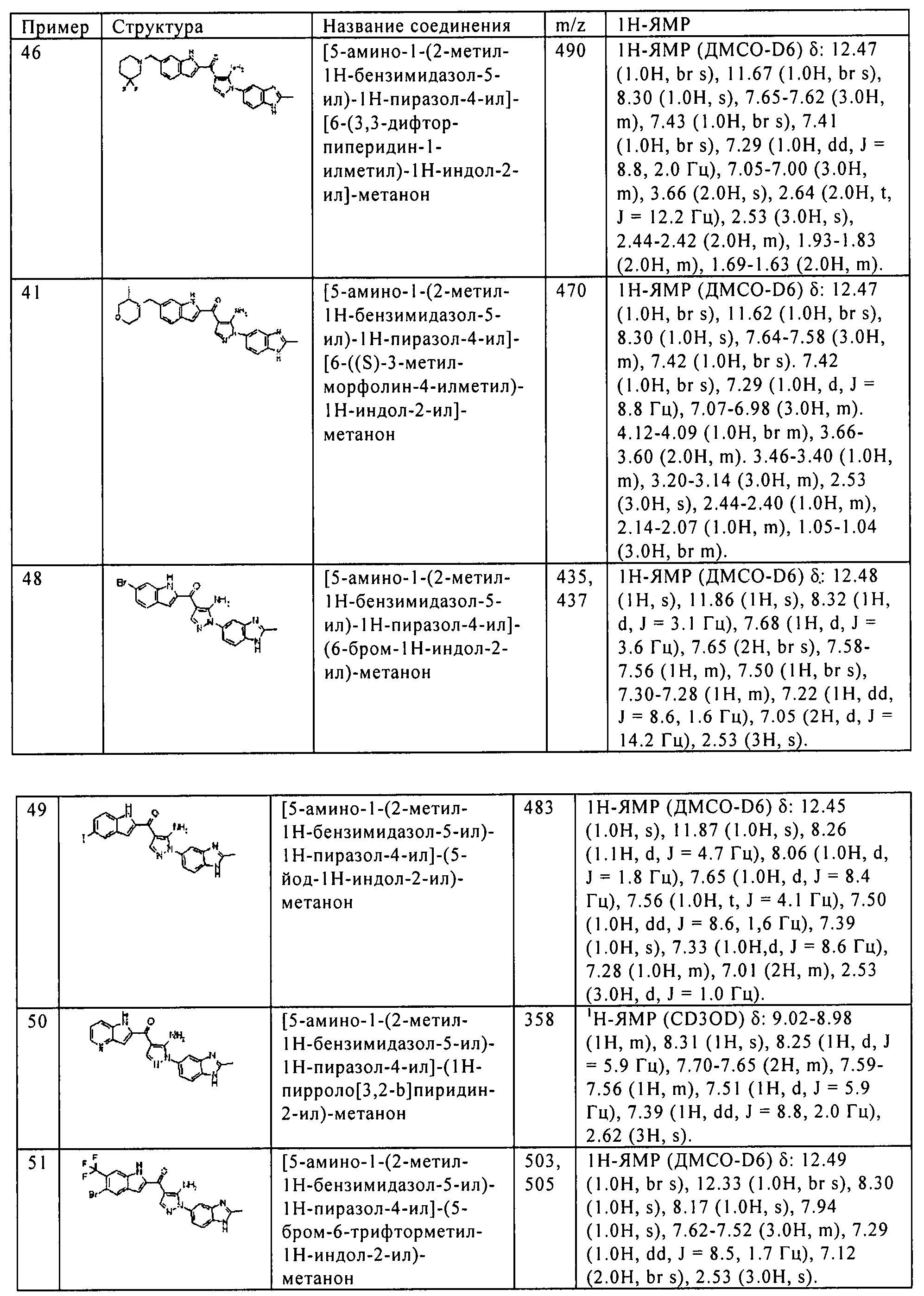
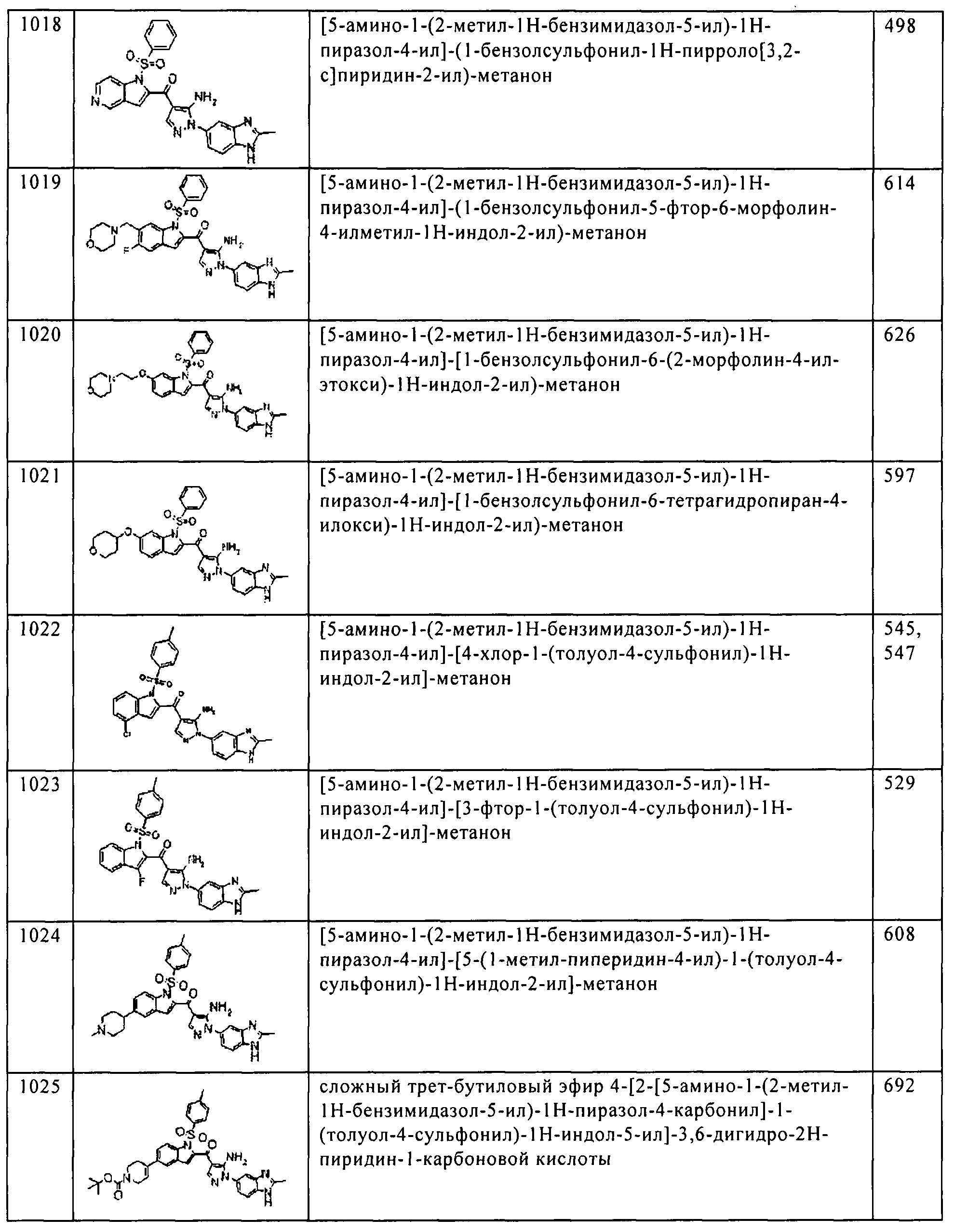
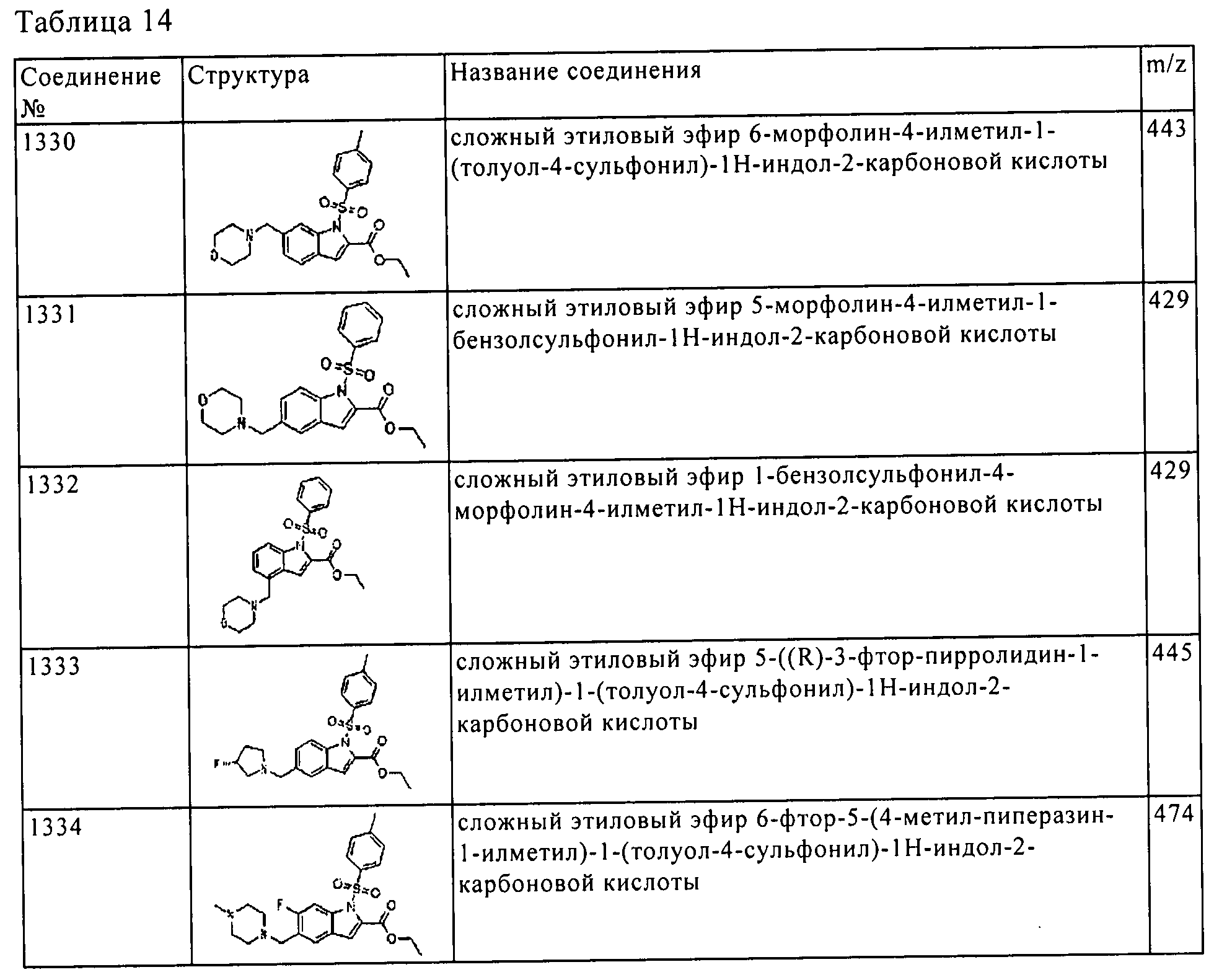
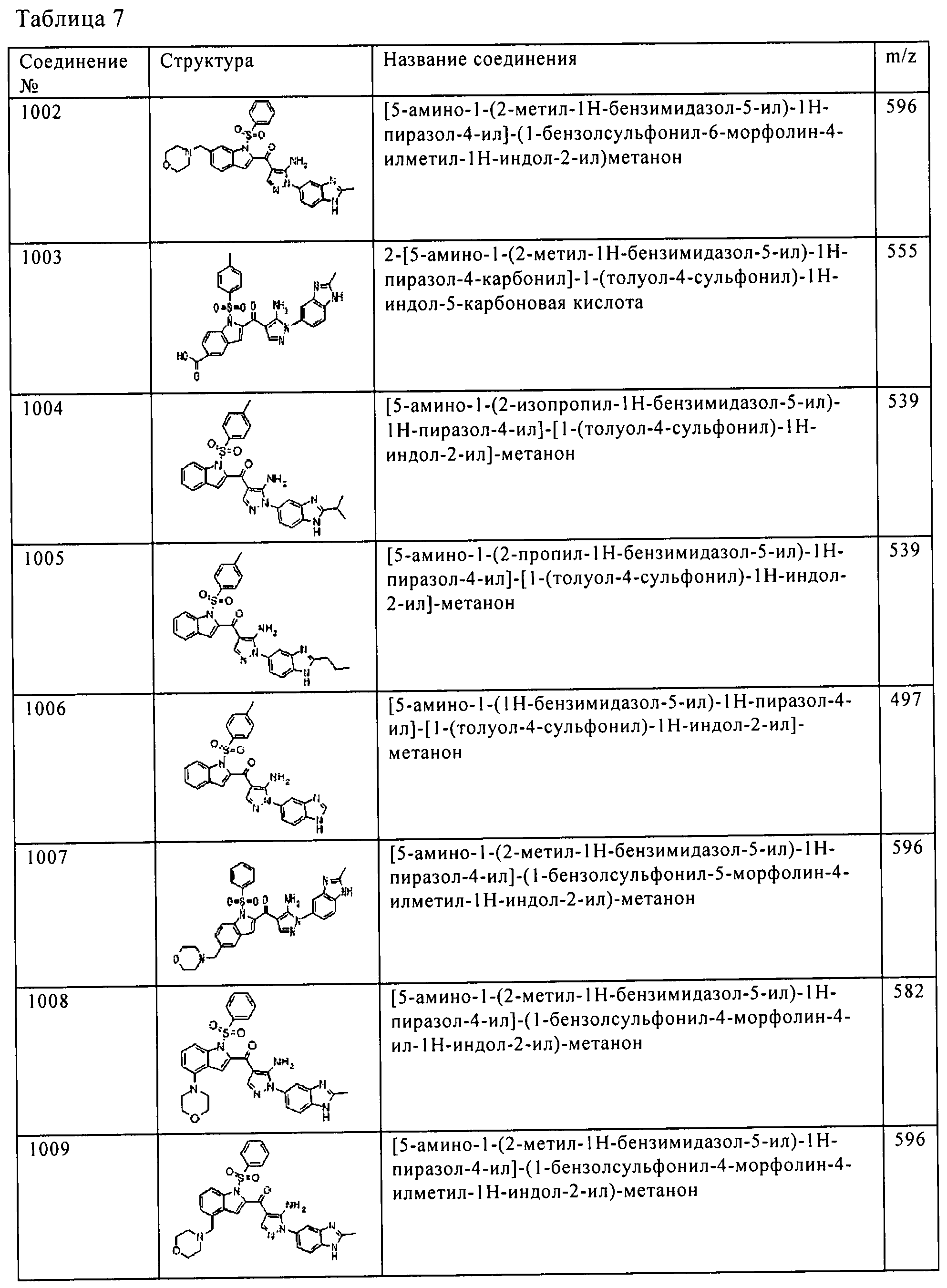
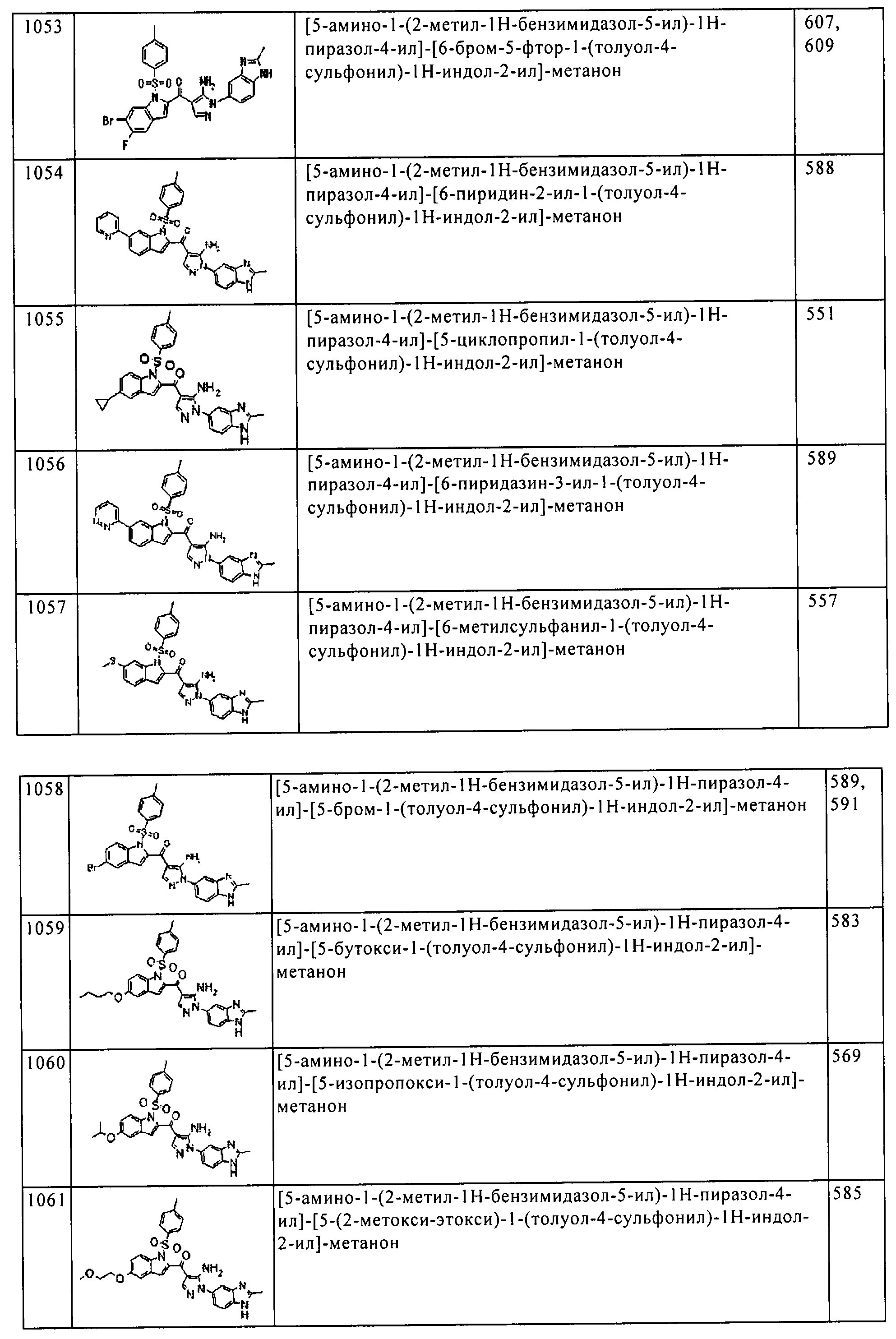
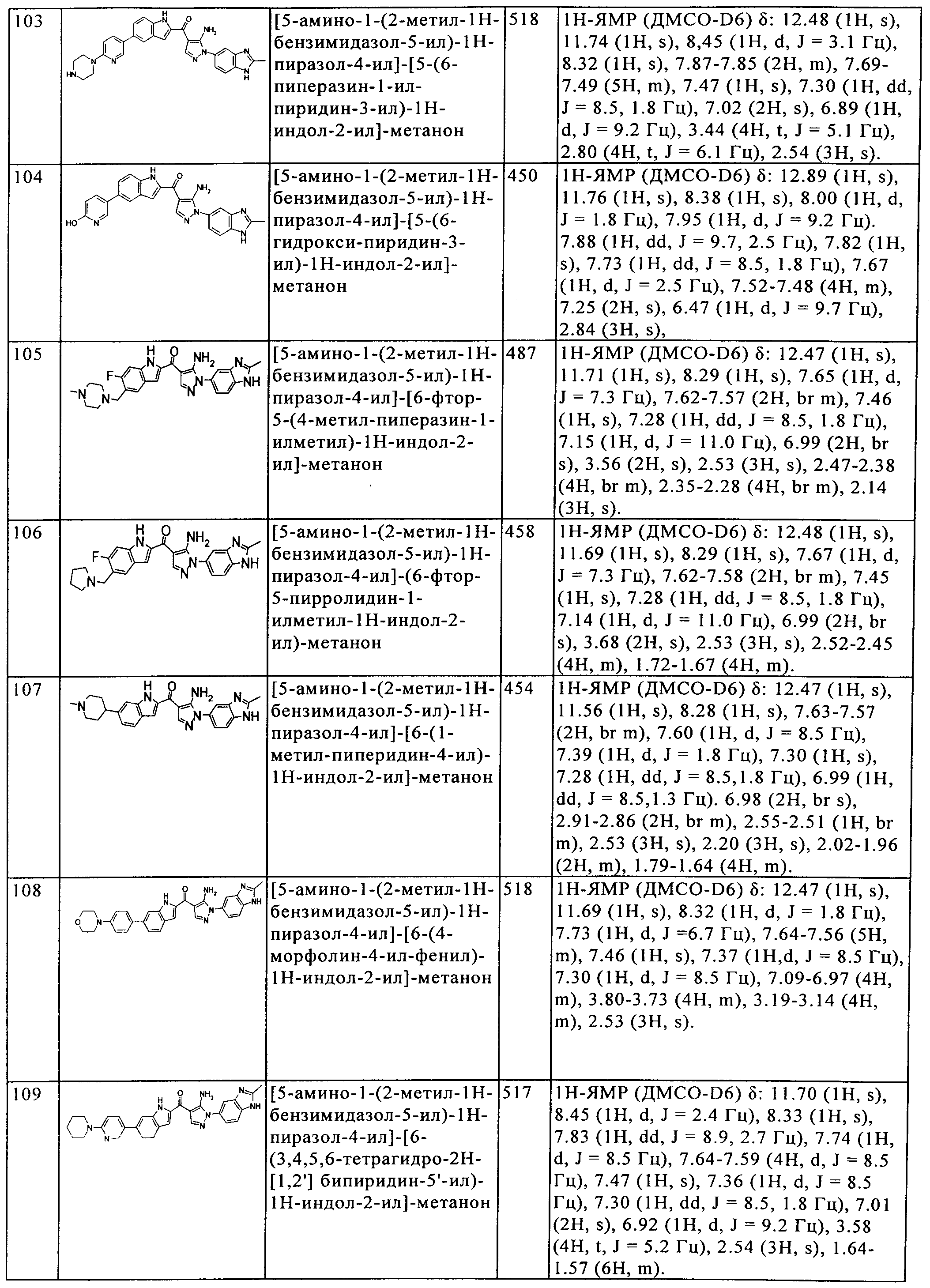
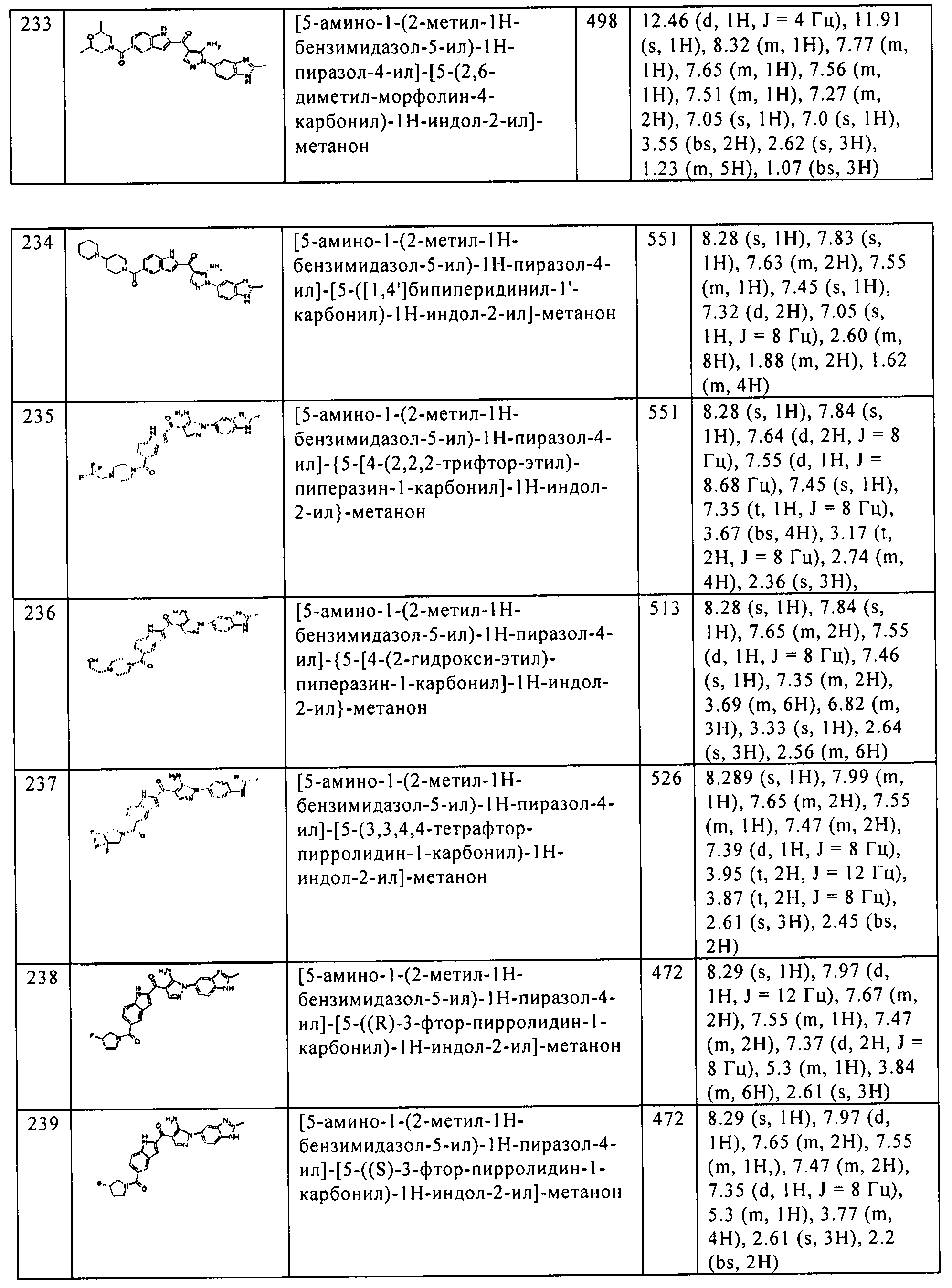
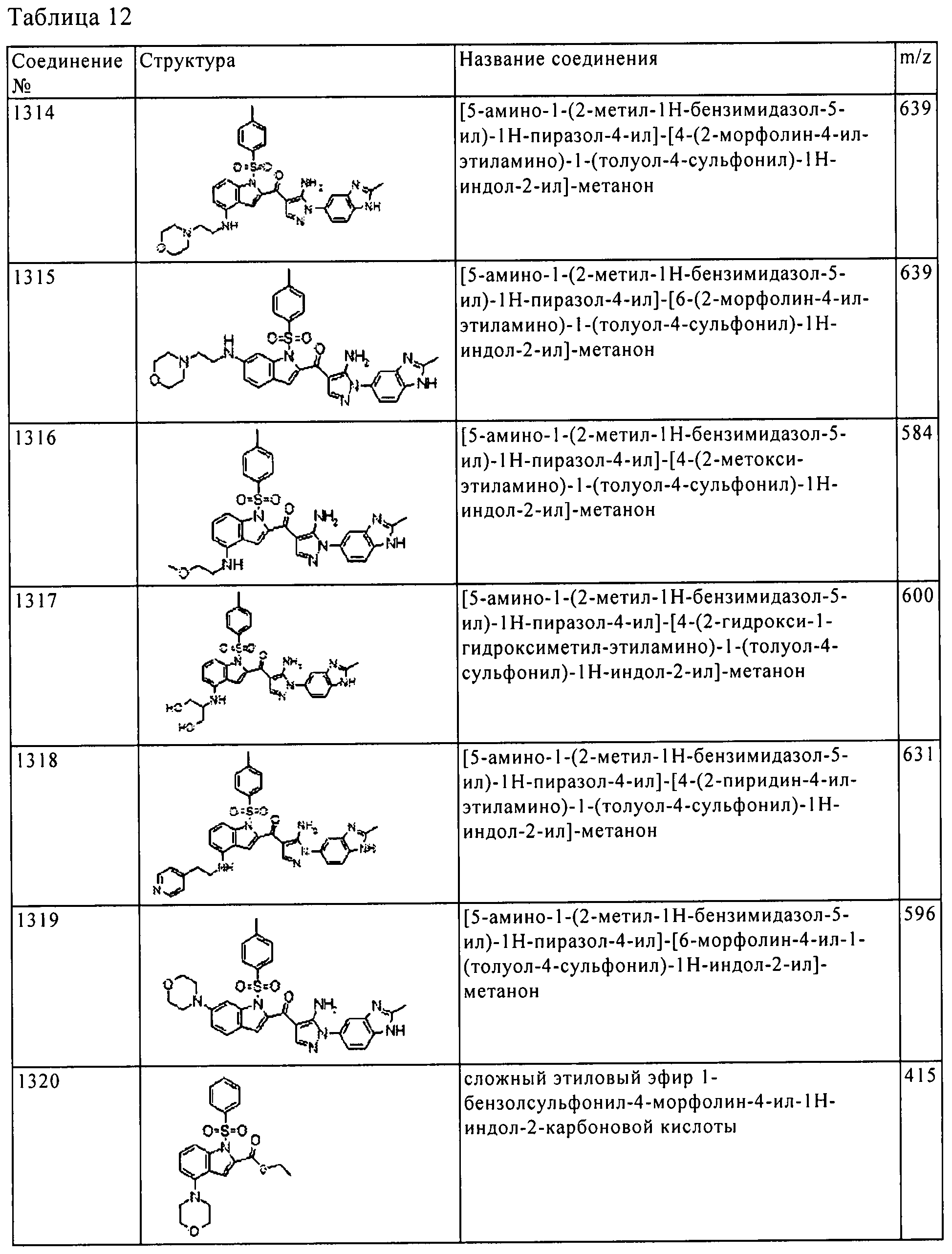
[5] Соединение пункта [1] или его фармацевтически приемлемая соль, которое выбрано из группы, состоящей из:
(1) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
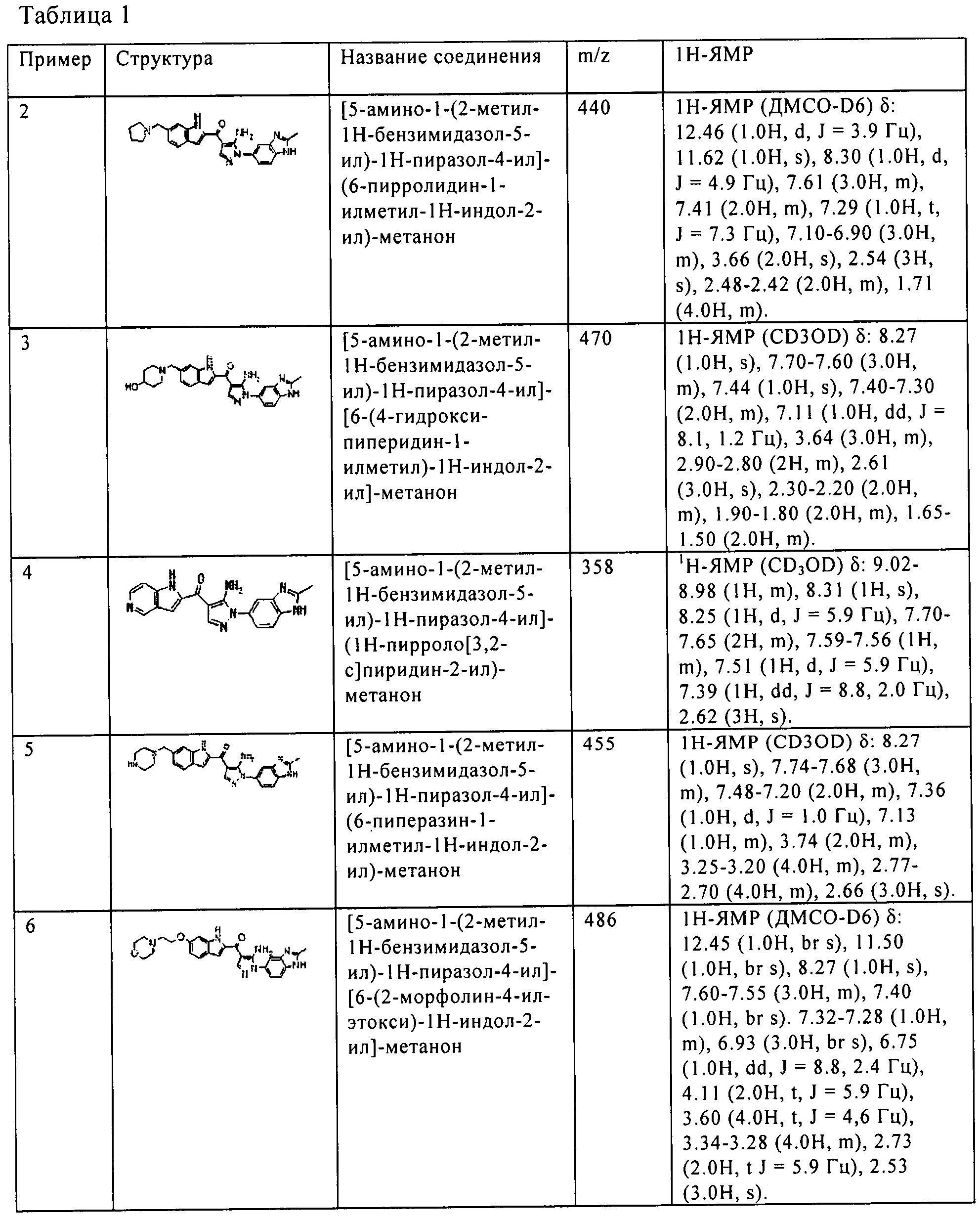
(2) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пирролидин-1-илметил-1H-индол-2-ил)-метанона;
(3) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-гидрокси-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(4) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-пирроло[3,2-с]пиридин-2-ил)-метанона;
(5) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пиперазин-1-илметил-1H-индол-2-ил)-метанона;
(6) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-морфолин-4-ил-этокси)-1H-индол-2-ил]-метанона;
(7) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(тетрагидро-пиран-4-илокси)-1H-индол-2-ил]-метанона;
(8) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-хлор-1H-индол-2-ил)-метанона;
(9) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-бром-1H-индол-2-ил)-метанона;
(10) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-йод-1H-индол-2-ил)-метанона;
(11) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1H-индол-5-карбонитрила;
(12) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-бром-5-фтор-1H-индол-2-ил)-метанона;
(13) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-этинил-1H-индол-2-ил)-метанона;
(14) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-фтор-фенил)-1H-индол-2-ил]-метанона;
(15) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-фтор-фенил)-1H-индол-2-ил]-метанона;
(16) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-фтор-фенил)-1H-индол-2-ил]-метанона;
(17) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-хлор-фенил)-1H-индол-2-ил]-метанона;
(18) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-хлор-фенил)-1H-индол-2-ил]-метанона;
(19) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-хлор-фенил)-1H-индол-2-ил]-метанона;
(20) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-трифторметил-фенил)-1H-индол-2-ил]-метанона;
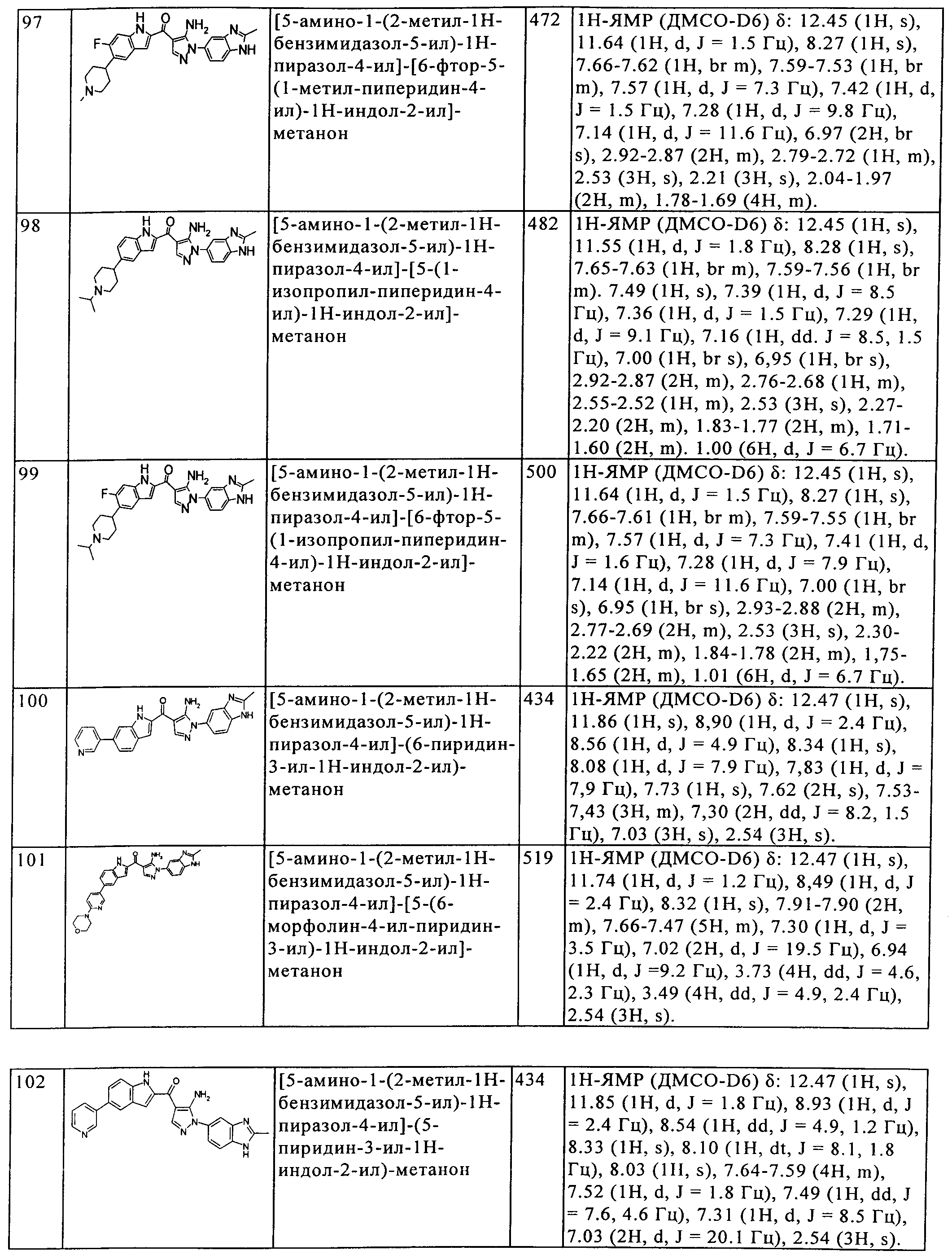
(21) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-трифторметил-фенил)-1H-индол-2-ил]-метанона;
(22) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-трифторметил-фенил)-1H-индол-2-ил]-метанона;
(23) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-бром-1H-индол-2-ил)-метанона;
(24) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-фтор-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(25) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-метил-1H-индол-2-ил)-метанона;
(26) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(4,4-дифтор-пиперидин-1-карбонил)-1H-индол-2-ил]-метанона;
(27) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(3,3-дифтор-пиперидин-1-карбонил)-1H-индол-2-ил]-метанона;
(28) (2,2,2-трифтор-этил)-амида 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-5-карбоновой кислоты;
(29) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-трифторметил-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(30) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(6-трифторметил-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(31) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-хлор-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(32) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-метил-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(33) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-хлор-4-фтор-фенил)-1H-индол-2-ил]-метанона;
(34) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-трифторметил-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(35) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-трифторметил-пиридин-2-ил)-1H-индол-2-ил]-метанона;
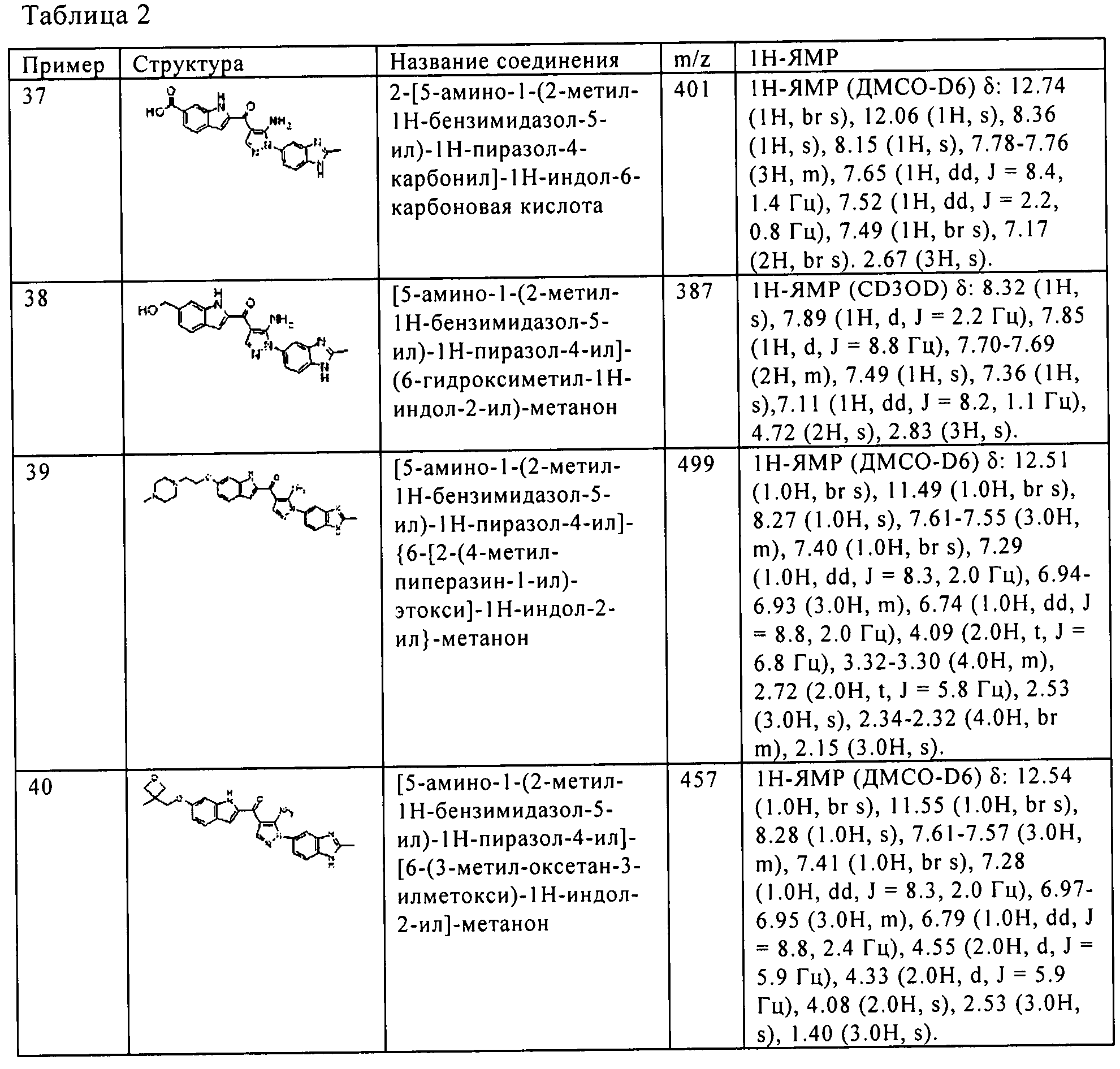
(36) [5-амино-1-(6-фтор-2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(37) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-6-карбоновой кислоты;
(38) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-гидроксиметил-1H-индол-2-ил)-метанона;
(39) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-{6-[2-(4-метил-пиперазин-1-ил)-этокси]-1H-индол-2-ил} -метанона;
(40) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-метил-оксетан-3-илметокси)-1H-индол-2-ил]-метанона;
(41) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-фтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(42) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-{[бис(2-метокси-этил)амино]-метил}-1H-индол-2-ил)-метанона;
(43) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-{6-[(метил-проп-2-инил-амино)метил]-1H-индол-2-ил}-метанона;
(44) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3,3-дифтор-пирролидин-1-илметил)-1H-индол-2-ил] -метанона;
(45) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2,5-диметил-пирролидин-1-илметил)-1H-индол-2-ил]-метанона;
(46) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3,3-дифтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(47) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-((8)-3-метил-морфолин-4-илметил)-1H-индол-2-ил]-метанона;
(48) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-бром-1H-индол-2-ил)-метанона;
(49) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-йод-1H-индол-2-ил)-метанона;
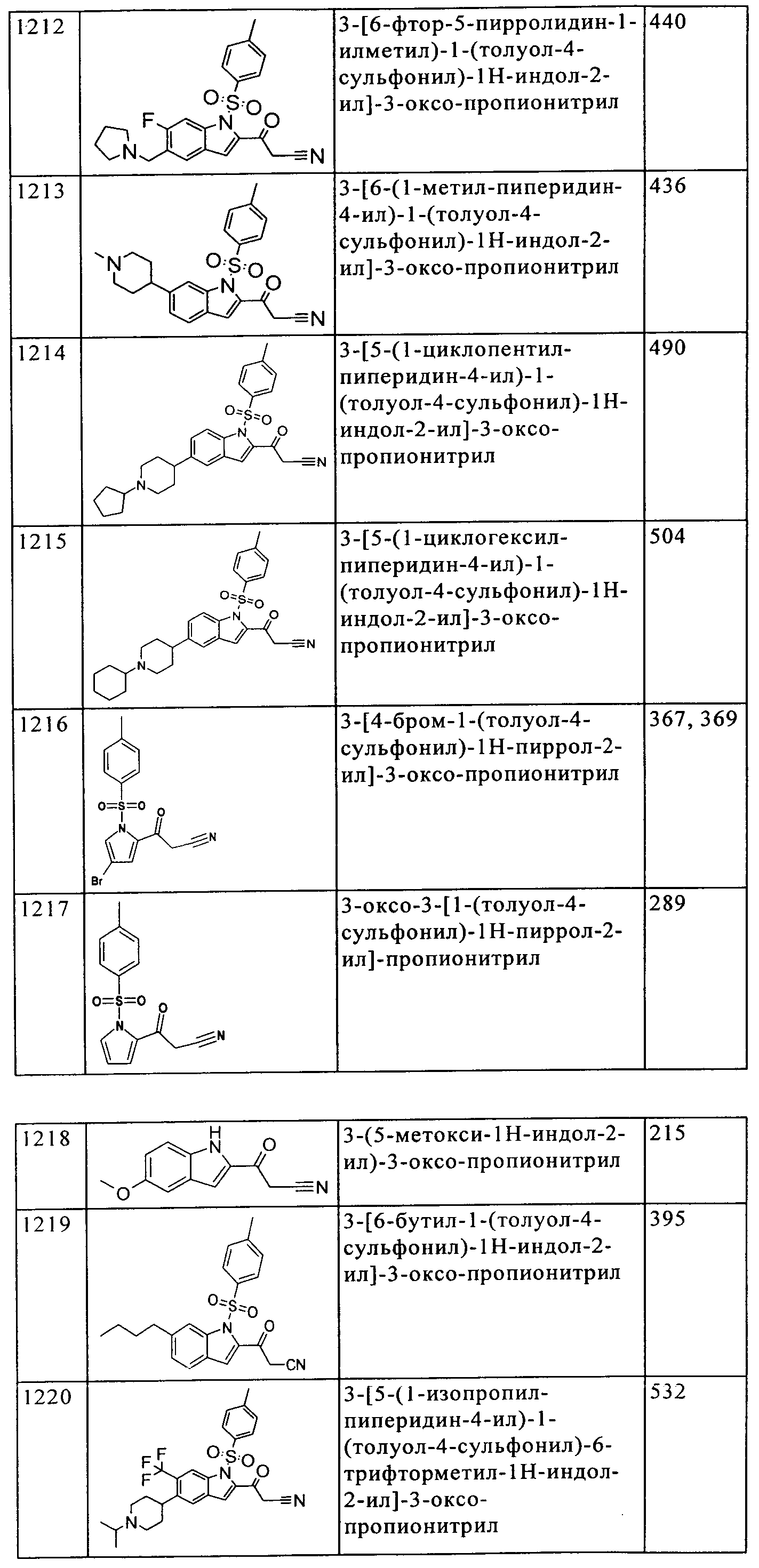
(50) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-пирроло[3,2-b]пиридин-2-ил)-метанона;
(51) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-бром-6-трифторметил-1H-индол-2-ил)-метанона;
(52) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-йод-1H-индол-2-ил)-метанона;
(53) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-метил-1H-индол-2-ил)-метанона;
(54) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-изопропил-1H-индол-2-ил)-метанона;
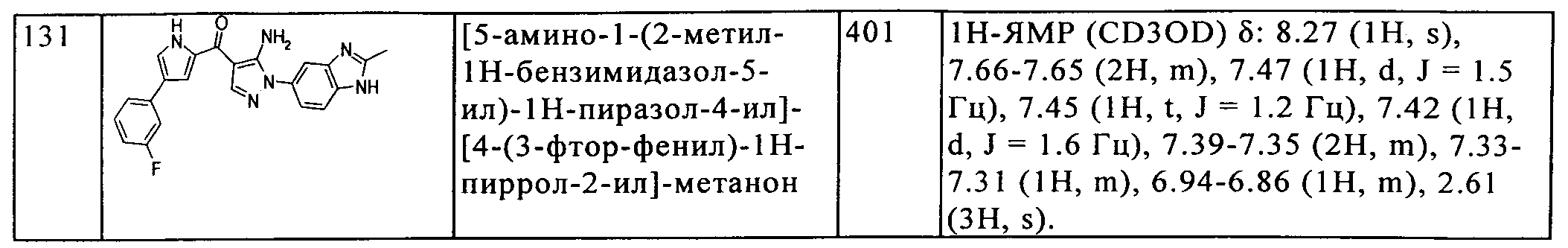
(55) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(2-фтор-фенил)-1H-индол-2-ил]-метанона;
(56)[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-бензил-1H-индол-2-ил)-метанона;
(57) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(2-трифторметил-фенил)-1H-индол-2-ил]-метанона;
(58) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(3-фторфенил)-1H-индол-2-ил]-метанона;
(59) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(3-трифторметил-фенил)-1H-индол-2-ил]-метанона;
(60) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-этинил-1H-индол-2-ил)-метанона;
(61) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5Н-[1,3]диоксоло[4,5-f]индол-6-ил)-метанона;
(62) [5-амино-1-(7-фтор-2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(63) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(4-трифторметил-фенил)-1H-индол-2-ил]-метанона;
(64) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бутокси-1H-индол-2-ил)-метанона;
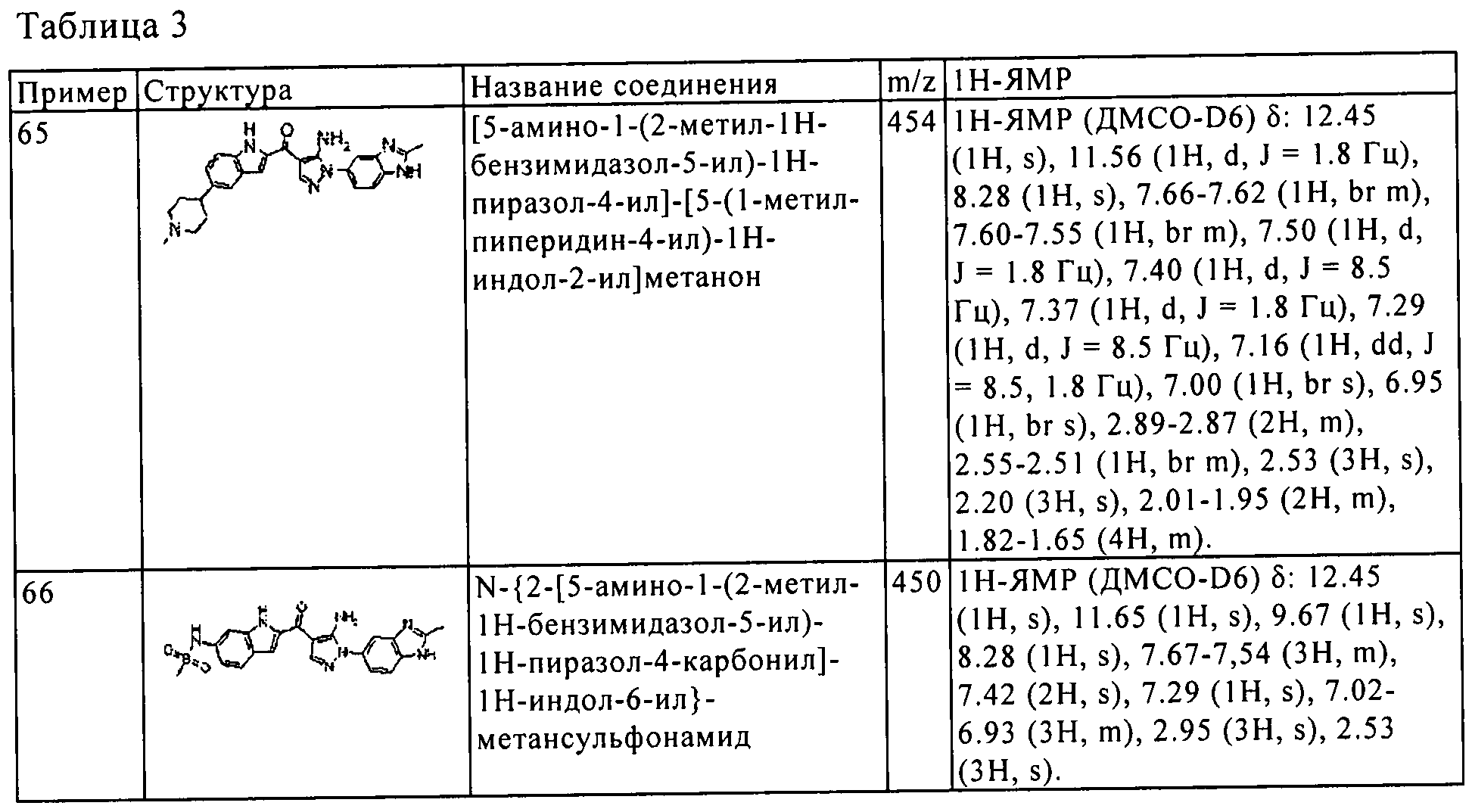
(65) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1-метил-пиперидин-4-ил)-1Н-индол-2-ил]-метанона;
(66) N-{2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-6-ил}-метансульфонамида;
(67) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(6-морфолин-4-ил-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(68) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-бутил-1H-индол-2-ил)-метанона;
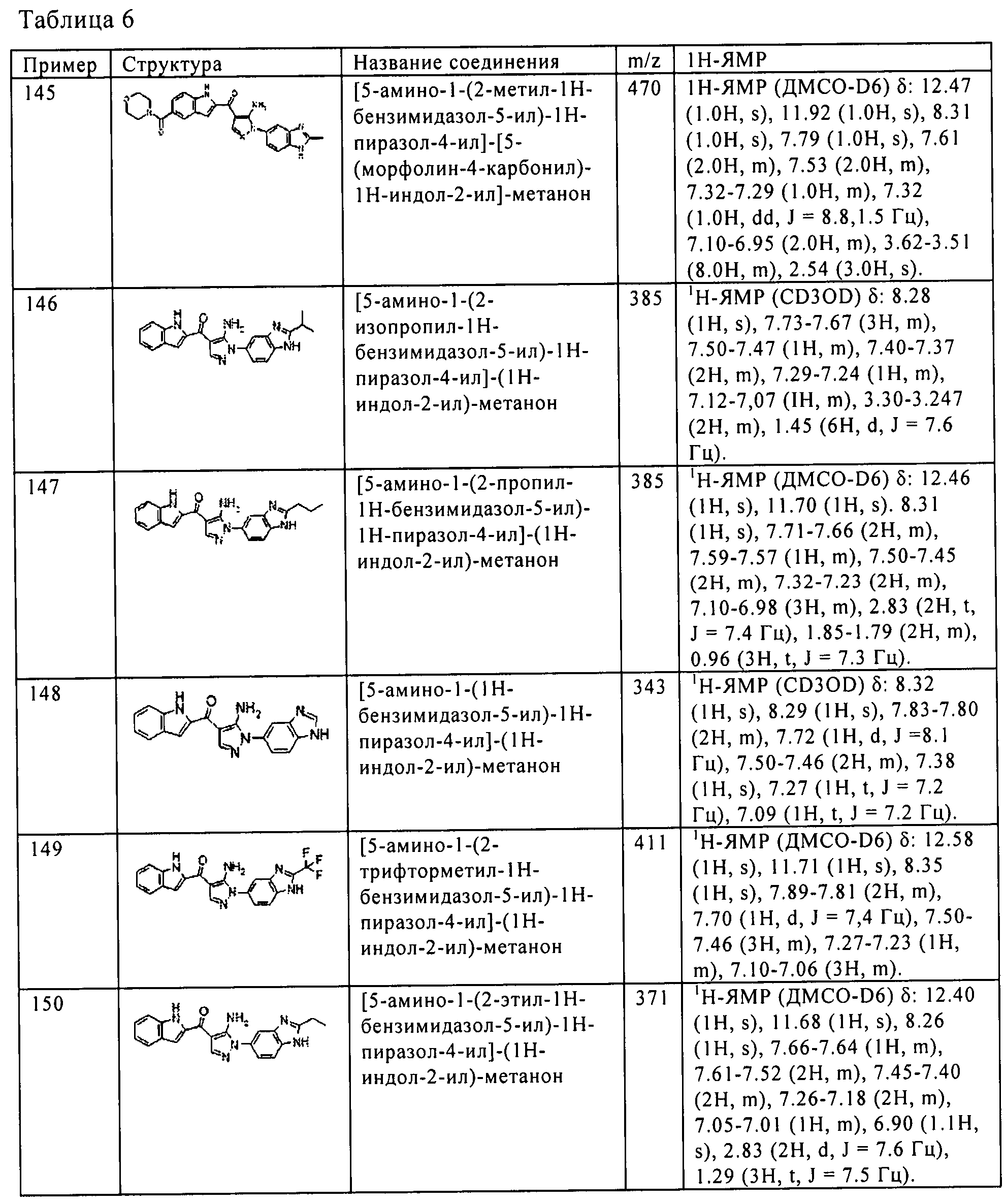
(69) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(1-метил-1H-пиразол-4-ил)-1H-индол-2-ил]-метанона;
(70) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-метокси-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(71) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-метокси-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(72) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-циклопропил-1H-индол-2-ил)-метанона;
(73) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-метокси-фенил)-1H-индол-2-ил]-метанона;
(74) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-фенил-1H-индол-2-ил)-метанона;
(75) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-метансульфонил-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(76) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-изопропил-1H-индол-2-ил)-метанона;
(77) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пиридин-2-ил-1H-индол-2-ил)-метанона;
(78) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-циклопропил-1H-индол-2-ил)-метанона;
(79) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пиридазин-3-ил-1H-индол-2-ил)-метанона;
(80) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-изопропокси-1H-индол-2-ил)-метанона;
(81) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(2-метокси-этокси)-1H-индол-2-ил]-метанона;
(82) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-циклопропилметокси-1H-индол-2-ил)-метанона;
(83) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(2,2-дифтор-5Н-[1,3]диоксоло[4,5-1]индол-6-ил)-метанона;
(84) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-хлор-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(85) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-фтор-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(86) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(6-морфолин-4-ил-пиридазин-3-ил)-1H-индол-2-ил]-метанона;
(87) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-хлор-6-циклопропилметокси-1H-индол-2-ил)-метанона;
(88) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2,4-дифтор-фенил)-1H-индол-2-ил]-метанона;
(89) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пиридазин-4-ил-1H-индол-2-ил)-метанона;
(90) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(3-фтор-1H-индол-2-ил)-метанона;
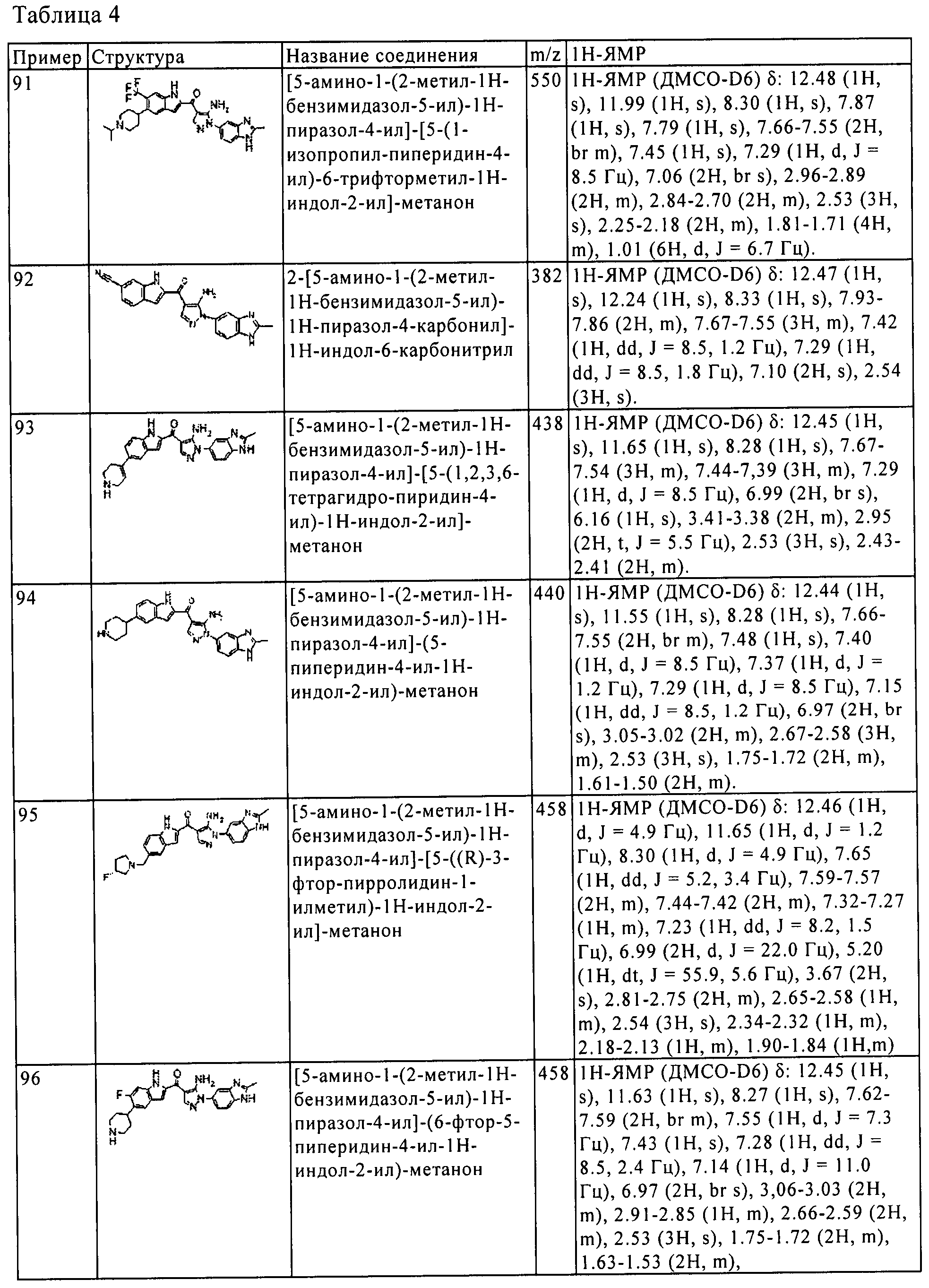
(91) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1-изопропил-пиперидин-4-ил)-6-трифторметил-1H-индол-2-ил]-метанона;
(92) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-6-карбонитрила;
(93) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1,2,3,6-тетрагидро-пиридин-4-ил)-1H-индол-2-ил]-метанона;
(94) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-пиперидин-4-ил-1H-индол-2-ил)-метанона;
(95) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-((R)-3-фтор-пирролидин-1-илметил)-1H-индол-2-ил]-метанона;
(96) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-фтор-5-пиперидин-4-ил-1H-индол-2-ил)-метанона;
(97) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-фтор-5-(1-метил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
(98) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1-изопропил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
(99) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-фтор-5-(1-изопропил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
(100) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пиридин-3-ил-1H-индол-2-ил)-метанона;
(101) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(6-морфолин-4-илпиридин-3-ил)-1H-индол-2-ил]-метанона;
(102) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-пиридин-3-ил-1H-индол-2-ил)-метанона;
(103) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(6-пиперазин-1-ил-пиридин-3-ил)-1H-индол-2-ил]-метанона;
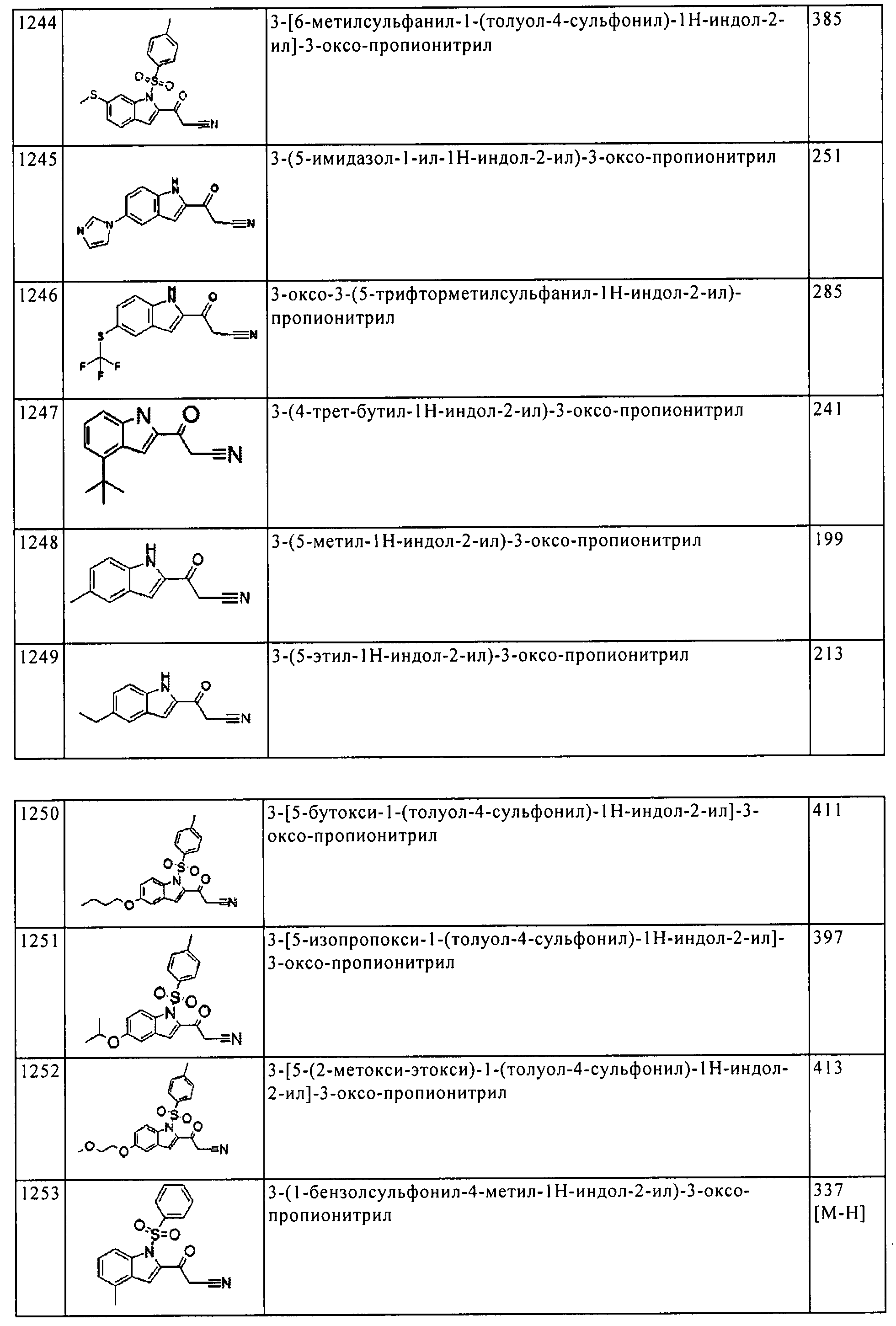
(104) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(6-гидрокси-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(105) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-фтор-5-(4-метил-пиперазин-1-илметил)-1H-индол-2-ил]-метанона;
(106) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-фтор-5-пирролидин-1-илметил-1H-индол-2-ил)-метанона;
(107) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(1-метил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
(108) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-морфолин-4-ил-фенил)-1H-индол-2-ил]-метанона;
(109) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3,4,5,6-тетрагидро-2Н-[1,2′]бипиридин-5′-ил)-1H-индол-2-ил]-метанона;
(110) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(6-пиперазин-1-ил-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(111) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(6-метокси-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(112) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-((S)-3-метил-морфолин-4-илметил)-1H-индол-2-ил]-метанона;
(113) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-((R)-3-фтор-пирролидин-1-илметил)-1H-индол-2-ил]-метанона;
(114) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(2,5-диметил-пирролидин-1-илметил)-1H-индол-2-ил]-метанона;
(115) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(3-фтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
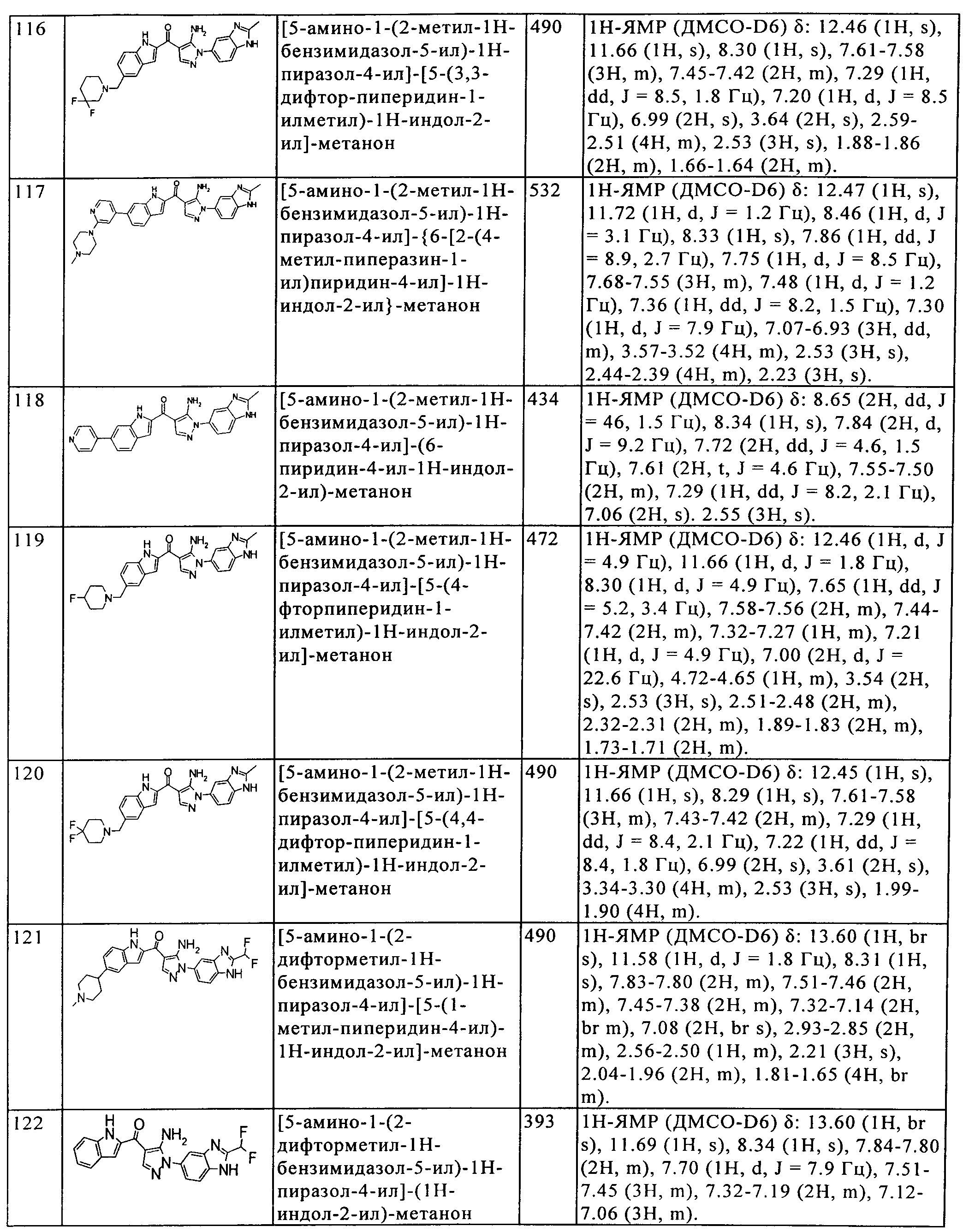
(116) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(3,3-дифтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(117) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-{6-[2-(4-метил-пиперазин-1-ил)пиридин-4-ил]-1H-индол-2-ил}-метанона;
(118) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пиридин-4-ил-1H-индол-2-ил)-метанона;
(119) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(4-фторпиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(120) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(4,4-дифтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(121) [5-амино-1-(2-дифторметил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1-метил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
(122) [5-амино-1-(2-дифторметил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
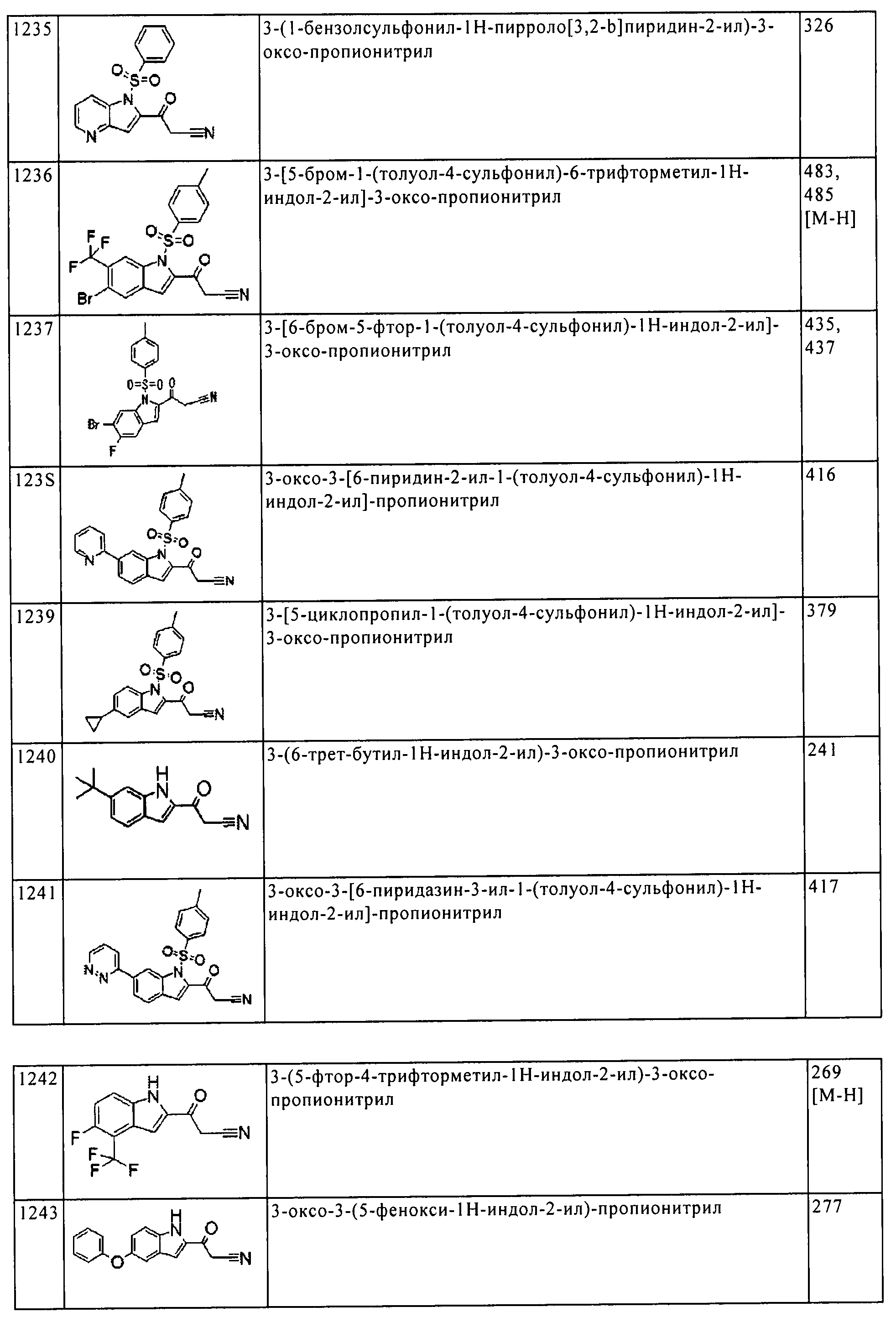
(123) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3,3-дифтор-пирролидин-1-илметил)-1H-индол-2-ил]-метанона;
(124) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1-циклопентил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
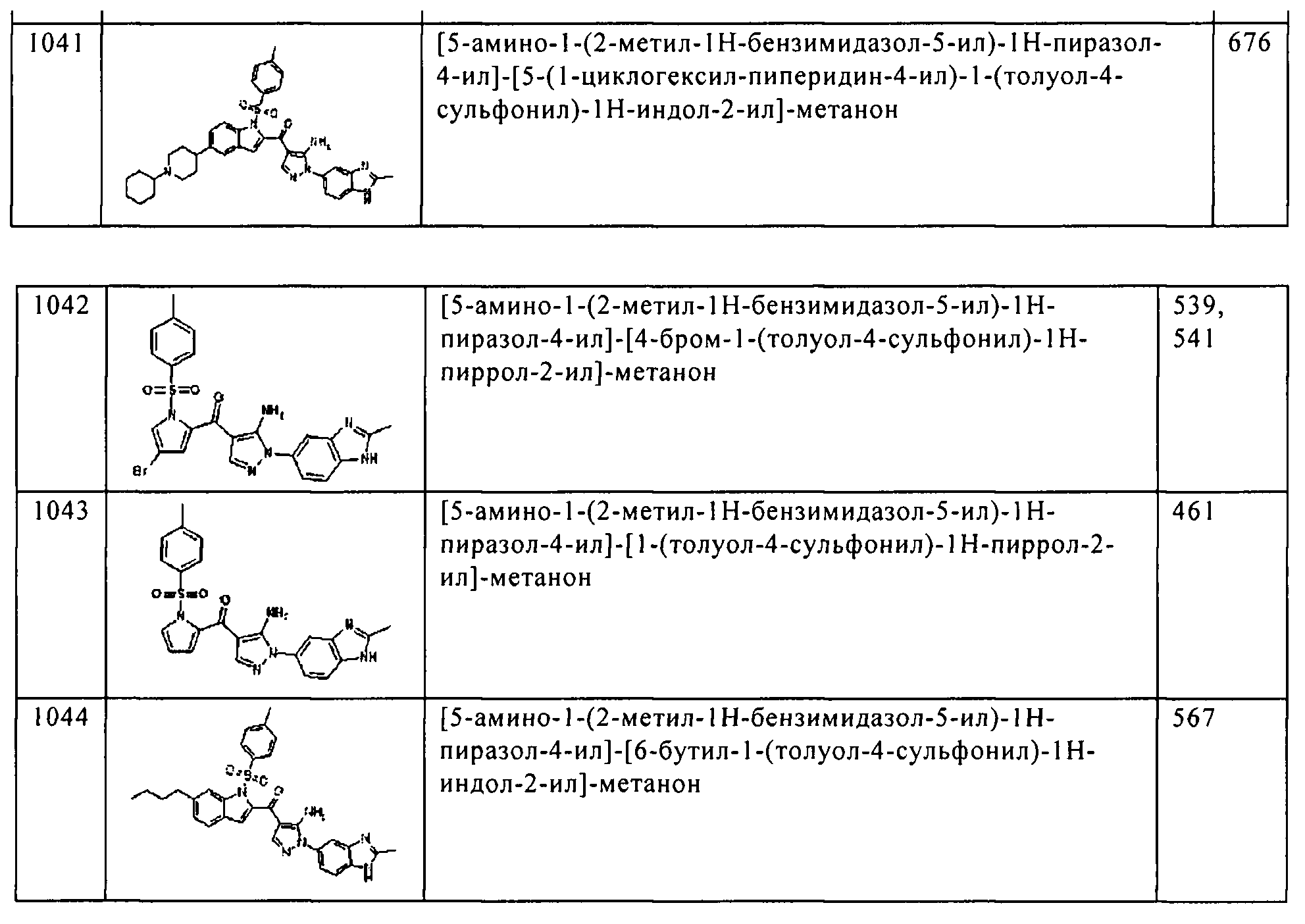
(125) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1-циклогексил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
(126) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-бром-1H-пиррол-2-ил)-метанона;
(127) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-пиррол-2-ил)-метанона;
(128) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-фенил-1H-пиррол-2-ил)-метанона;
(129) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(3-хлор-фенил)-1H-пиррол-2-ил]-метанона;
(130) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(4-фтор-фенил)-1H-пиррол-2-ил]-метанона;
(131) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(3-фтор-фенил)-1H-пиррол-2-ил]-метанона;
(132) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-морфолин-4-илметил-1H-индол-2-ил)-метанона;
(133) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(2-морфолин-4-ил-этиламино)-1H-индол-2-ил]-метанона;
(134) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(4-метил-пиперазин-1-карбонил)-1H-индол-2-ил]-метанона;
(135) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-морфолин-4-ил-этиламино)-1H-индол-2-ил]-метанона;
(136) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(пиперазин-1-карбонил)-1H-индол-2-ил]-метанона;
(137) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(2-метокси-этиламино)-1H-индол-2-ил]-метанона;
(138) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(2-гидрокси-1-гидроксиметил-этиламино)-1H-индол-2-ил]-метанона;
(139) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(2-пиридин-4-ил-этиламино)-1H-индол-2-ил]-метанона;
(140) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-метокси-этиламино)-1H-индол-2-ил]-метанона;
(141) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-морфолин-4-ил-1H-индол-2-ил)-метанона;
(142) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-морфолин-4-ил-1H-индол-2-ил)-метанона;
(143) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-морфолин-4-илметил-1H-индол-2-ил)-метанона;
(144) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-морфолин-4-илметил-1H-индол-2-ил)-метанона;
(145) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(морфолин-4-карбонил)-1H-индол-2-ил]-метанона;
(146) [5-амино-1-(2-изопропил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(147) [5-амино-1-(2-пропил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(148) [5-амино-1-(1Н-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(149) [5-амино-1-(2-трифторметил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(150) [5-амино-1-(2-этил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(151) [5-амино-1-(2-бензил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(152) 1-(4-{2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-5-илметил}-пиперазин-1-ил)-этанона;
(153) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(4-метансульфонил-пиперазин-1-илметил)-1H-индол-2-ил]-метанона;
(154) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-пиперазин-1-илметил-1H-индол-2-ил)-метанона;
(155) 1-(4-{2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1H-индол-6-илметил}пиперазин-1-ил)-этанона;
(156) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-метил-пиперазин-1-илметил)-1H-индол-2-ил]-метанона;
(157) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4-метил-пиперазин-1-илметил)-1H-индол-2-ил]-метанона;
(158) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-пирролидин-1-илметил-1H-индол-2-ил)-метанона;
(159) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-фтор-1H-индол-2-ил)-метанона;
(160) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-фтор-1H-индол-2-ил)-метанона;
(161) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-фтор-1H-индол-2-ил)-метанона;
(162) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-пирроло[2,3-b]пиридин-2-ил)-метанона;
(163) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-фтор-6-морфолин-4-илметил-1H-индол-2-ил)-метанона;
(164) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-5-карбоновой кислоты;
(165) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-метокси-1H-индол-2-ил)-метанона;
(166) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,6-диметокси-1H-индол-2-ил)-метанона;
(167) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-метокси-1H-индол-2-ил)-метанона;
(168) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-метокси-1H-индол-2-ил)-метанона;
(169) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,6-диметил-1H-индол-2-ил)-метанона;
(170) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-трет-бутил-1H-индол-2-ил)-метанона;
(171) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-изопропил-1H-индол-2-ил)-метанона;
(172) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-бензилокси-1H-индол-2-ил)-метанона;
(173) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-бензилокси-1H-индол-2-ил)-метанона;
(174) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5,6-диметокси-1H-индол-2-ил)-метанона;
(175) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-трет-бутил-1H-индол-2-ил)-метанона;
(176) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-фтор-4-трифторметил-1H-индол-2-ил)-метанона;
(177) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-фенокси-1H-индол-2-ил)-метанона;
(178) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-метилсульфанил-1H-индол-2-ил)-метанона;
(179) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-трет-бутил-1H-индол-2-ил)-метанона;
(180) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-метил-1H-индол-2-ил)-метанона;
(181) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-этил-1H-индол-2-ил)-метанона;
(182) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-фтор-6-трифторметил-1H-индол-2-ил)-метанона;
(183) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-фтор-5-метокси-1H-индол-2-ил)-метанона;
(184) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-хлор-5-метокси-1H-индол-2-ил)-метанона;
(185) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-хлор-6-метокси-1H-индол-2-ил)-метанона;
(186) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-изопропокси-1H-индол-2-ил)-метанона;
(187) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-бензилокси-1H-индол-2-ил)-метанона;
(188) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-изопропокси-1H-индол-2-ил)-метанона;
(189) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(2,3-дигидро-6Н-[1,4]диоксино[2,3-1]индол-7-ил)-метанона;
(190) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,6-ди-трет-бутил-1H-индол-2-ил)-метанона;
(191) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-4-карбонитрила;
(192) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-имидазол-1-ил-1H-индол-2-ил)-метанона;
(193) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-трифторметилсульфанил-1H-индол-2-ил)-метанона;
(194) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-метилсульфанил-1H-индол-2-ил)-метанона;
(195) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-метансульфонил-1H-индол-2-ил)-метанона;
(196) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4,4-дифтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(197) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-фтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(198) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(оксетан-3-илокси)-1H-индол-2-ил]-метанона;
(199) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-гидрокси-1H-индол-2-ил)-метанона;
(200) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-метансульфонил-1H-индол-2-ил)-метанона;
(201) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,5-дибром-1H-пиррол-2-ил)-метанона;
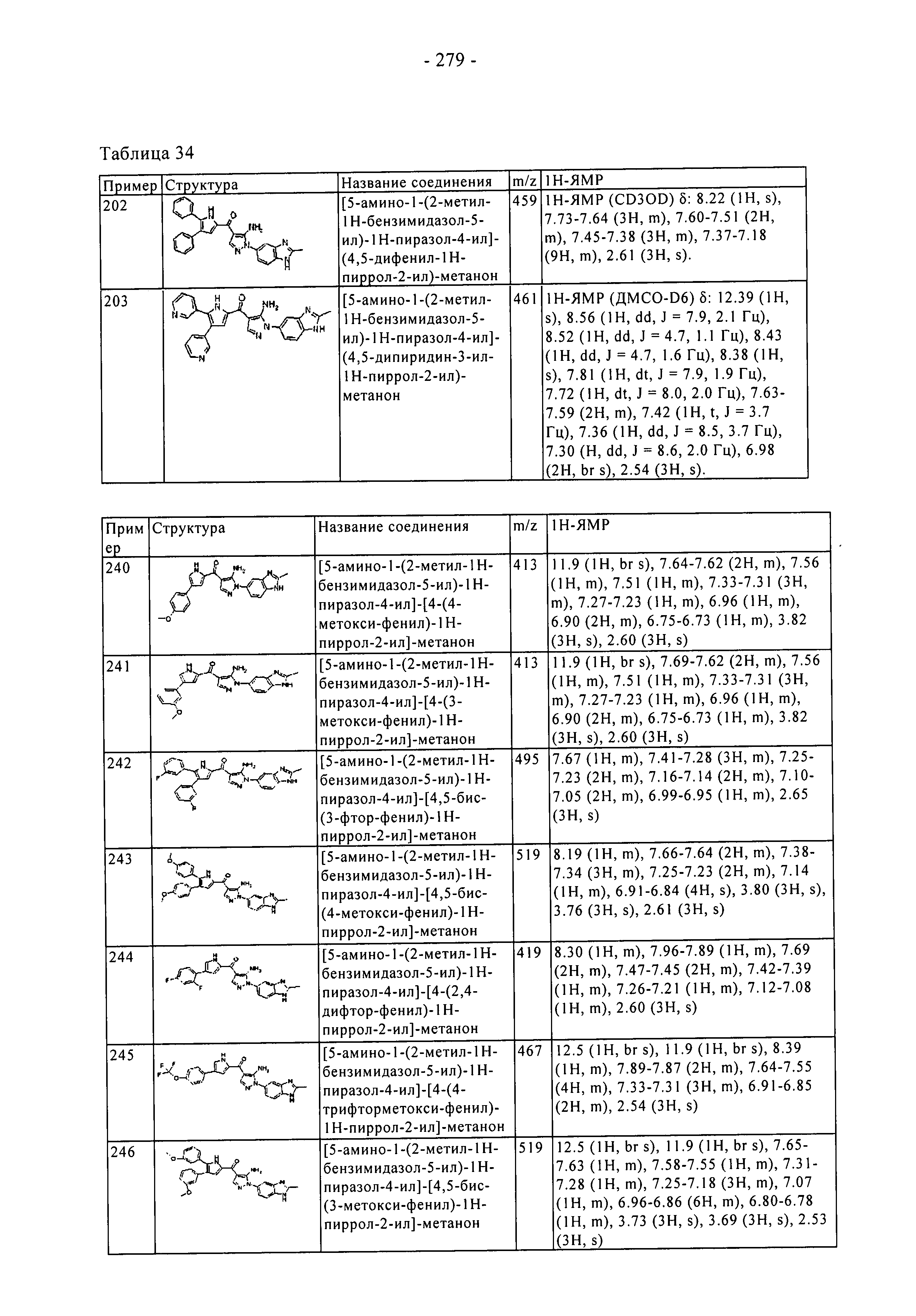
(202) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,5-дифенил-1H-пиррол-2-ил)-метанона;
(203) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,5-дипиридин-3-ил-1H-пиррол-2-ил)-метанона;
(204) [5-амино-1-(2-метил-3H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-хлор-1H-индол-2-ил)-метанона;
(205) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-хлор-1H-индол-2-ил)-метанона;
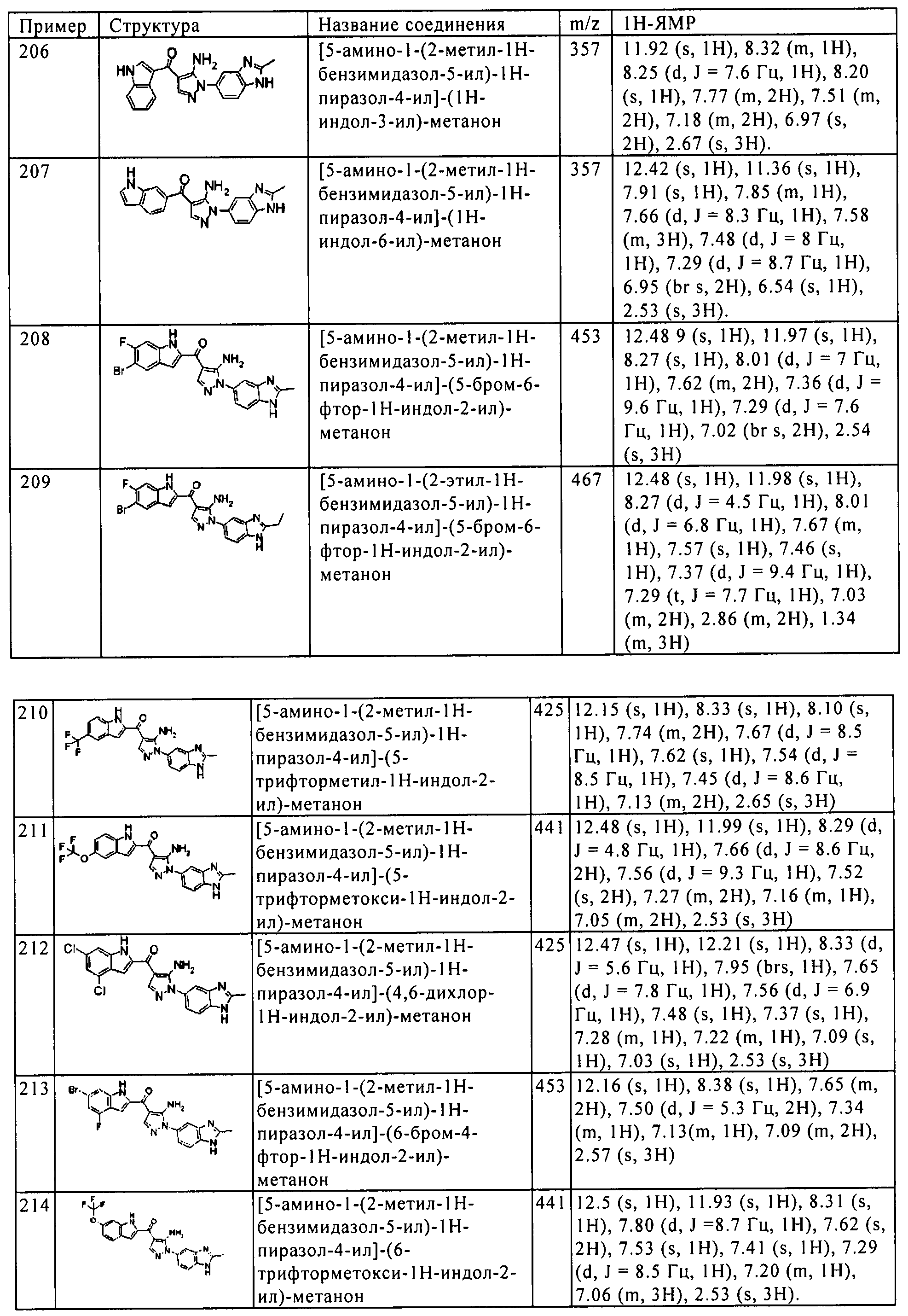
(206) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-3-ил)-метанона;
(207) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1H-индол-6-ил)-метанона;
(208) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-бром-6-фтор-1H-индол-2-ил)-метанона;
(209) [5-амино-1-(2-этил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-бром-6-фтор-1H-индол-2-ил)-метанона;
(210) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-трифторметил-1H-индол-2-ил)-метанона;
(211) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-трифторметокси-1H-индол-2-ил)-метанона;
(212) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,6-дихлор-1H-индол-2-ил)-метанона;
(213) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-бром-4-фтор-1H-индол-2-ил)-метанона;
(214) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-трифторметокси-1H-индол-2-ил)-метанона;
(215) [5-амино-1-(2-этил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-трифторметокси-1H-индол-2-ил)-метанона;
(216) [5-амино-1-(2-этил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-трифторметил-1H-индол-2-ил)-метанона;
(217) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5,6-дихлор-1H-индол-2-ил)-метанона;
(218) [5-амино-1-(2-этил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-бром-5-фтор-1H-индол-2-ил)-метанона;
(219) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,5-дихлор-1H-индол-2-ил)-метанона;
(220) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,6-дифтор-1H-индол-2-ил)-метанона;
(221) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-хлор-пиридин-4-ил)-1H-индол-2-ил]-метанона;
(222) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(6-метил-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(223) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-фтор-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(224) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-трифторметил-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(225) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-хлор-2-метокси-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(226) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-хлор-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(227) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-тиофен-3-ил-1H-индол-2-ил)-метанона;
(228) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-хлорпиридин-3-ил)-1H-индол-2-ил]-метанона;
(229) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-тиофен-2-ил-1H-индол-2-ил)-метанона;
(230) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-фтор-пиридин-4-ил)-1H-индол-2-ил]-метанона;
(231) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-трифторметил-пиридин-4-ил)-1H-индол-2-ил]-метанона;
(232) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(3,3-дифтор-пирролидин-1-карбонил)-1H-индол-2-ил]-метанона;
(233) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(2,6-диметил-морфолин-4-карбонил)-1H-индол-2-ил]-метанона;
(234) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-([1,4′]бипиперидинил-1′-карбонил)-1H-индол-2-ил]-метанона;
(235) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-{5-[4-(2,2,2-трифтор-этил)-пиперазин-1-карбонил]-1H-индол-2-ил}-метанона;
(236) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-{5-[4-(2-гидрокси-этил)-пиперазин-1-карбонил] -1H-индол-2-ил}-метанона;
(237) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(3,3,4,4-тетрафтор-пирролидин-1-карбонил)-1H-индол-2-ил]-метанона;
(238) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-((R)-3-фтор-пирролидин-1-карбонил)-1H-индол-2-ил]-метанона;
(239) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-((S)-3-фтор-пирролидин-1-карбонил)-1H-индол-2-ил]-метанона;
(240) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(4-метокси-фенил)-1H-пиррол-2-ил]-метанона;
(241) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(3-метокси-фенил)-1H-пиррол-2-ил]-метанона;
(242) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4,5-бис-(3-фтор-фенил)-1H-пиррол-2-ил]-метанона;
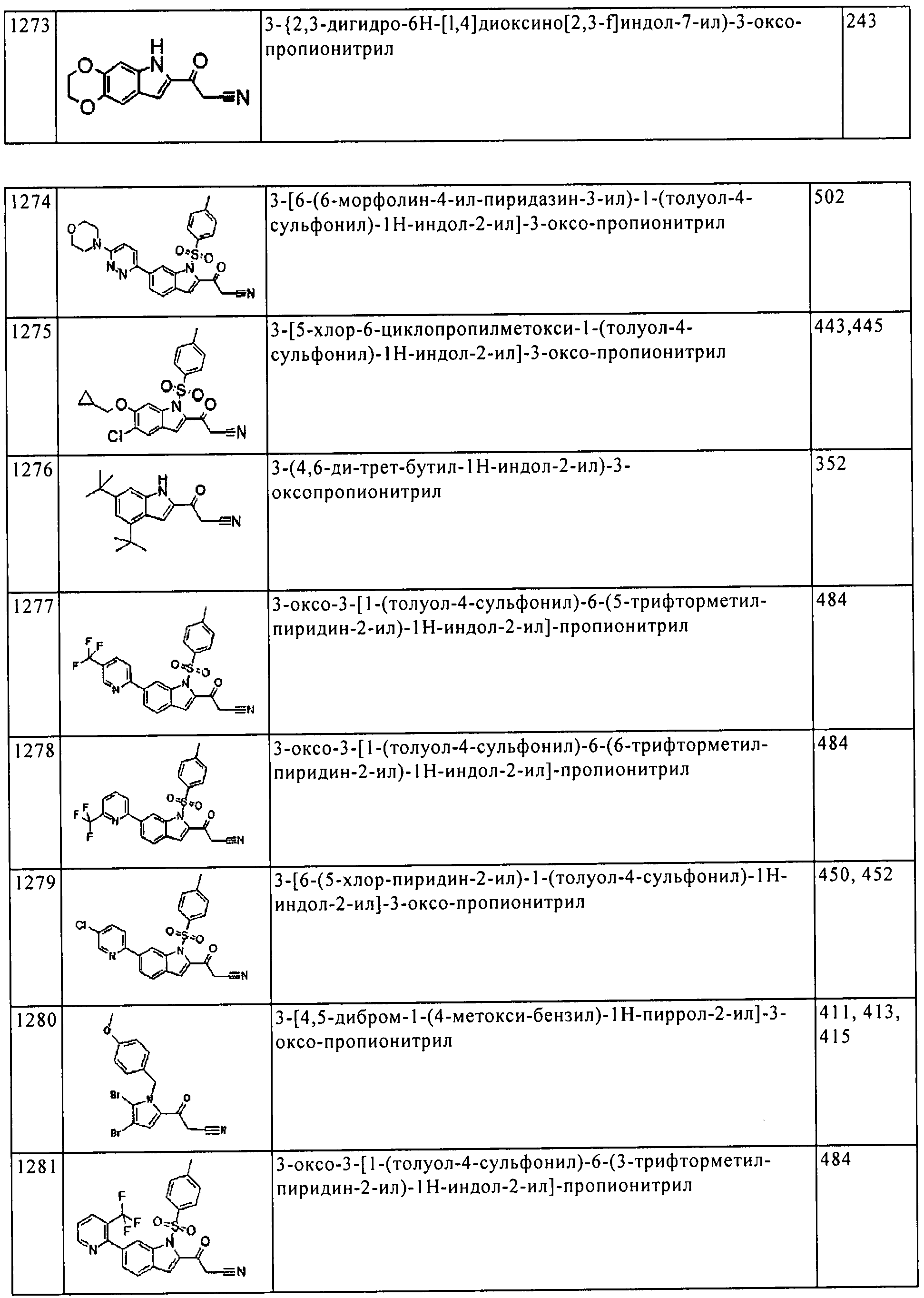
(243) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4,5-бис-(4-метокси-фенил)-1H-пиррол-2-ил]-метанона;
(244) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(2,4-дифтор-фенил)-1H-пиррол-2-ил]-метанона;
(245) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(4-трифторметокси-фенил)-1H-пиррол-2-ил]-метанона;
(246) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4,5-бис-(3-метокси-фенил)-1H-пиррол-2-ил]-метанона;
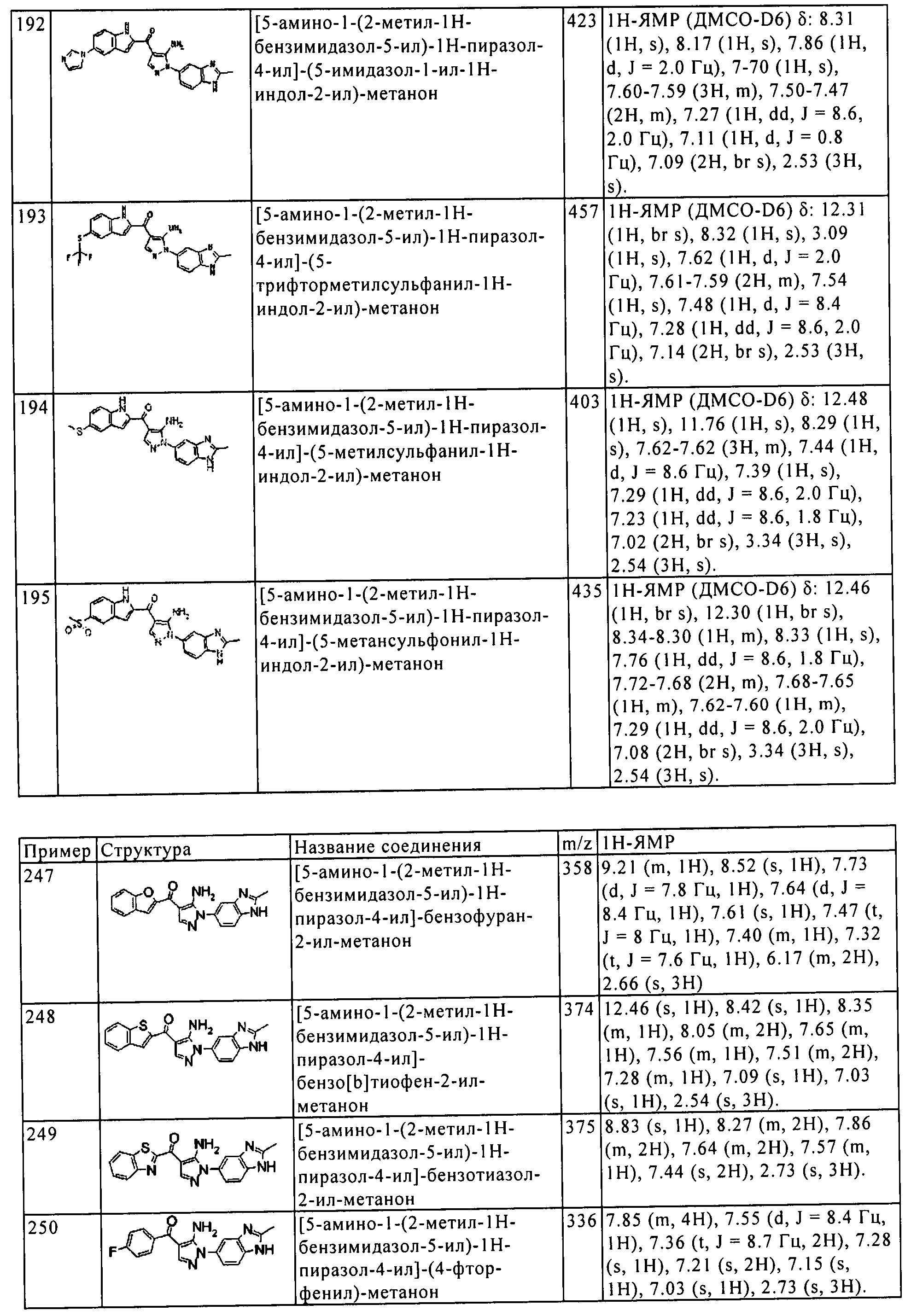
(247) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-бензофуран-2-ил-метанона;
(248) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-бензо[b]тиофен-2-ил-метанона;
(249) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-бензотиазол-2-ил-метанона;
(250) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-фтор-фенил)-метанона;
(251) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил] -(3 -хлор-фенил)-метанона;
(252) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-хинолин-3-ил-метанона;
(253) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-хинолин-7-ил-метанона; и
(254) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-хинолин-6-ил-метанона.
[6] Фармацевтическая композиция, включающая соединение любого из пунктов [1]-[5], или его фармацевтически приемлемую соль; и носитель.
[7] Средство для ингибирования FGFR активности, которое включает в качестве активного ингредиента соединение любого из пунктов [1]-[5], или его фармацевтически приемлемую соль.
[8] Средство для предотвращения или лечения злокачественного новообразования, которое включает в качестве активного ингредиента соединение любого из пунктов [1]-[5], или его фармацевтически приемлемую соль.
[9] Средство для предотвращения или лечения злокачественного новообразования пункта [8], где злокачественное новообразование представляет собой по меньшей мере одно новообразование, выбранное из группы, состоящей из:
рака молочной железы, острой миелоцитарной лейкемии, рака поджелудочной железы, рака мочевого пузыря, рака предстательной железы, рака пищевода, ангиогенеза, рака желудка, рака тела матки, рака яичников, опухоли головного мозга, рака ободочной кишки, множественной миеломы, гепатоцеллюлярного рака, рака легкого и рака щитовидной железы.
[10] Способ предотвращения или лечения злокачественного новообразования, который включает введение фармацевтически эффективного количества композиции, включающей соединение любого из пунктов [1]-[5] или его фармацевтически приемлемую соль, пациенту, нуждающемуся в предотвращении или лечении злокачественного новообразования.
[11] Применение соединения любого из пунктов [1]-[5] или его фармацевтически приемлемой соли для изготовления средства для предотвращения или лечения злокачественного новообразования.
[12] Соединение любого из пунктов [1]-[5] или его фармацевтически приемлемая соль, для применения для предотвращения или лечения злокачественного новообразования.
Настоящее изобретение также включает следующие объекты:
[101] Соединение, изображаемое следующей общей формулой (I), или его фармацевтически приемлемая соль:
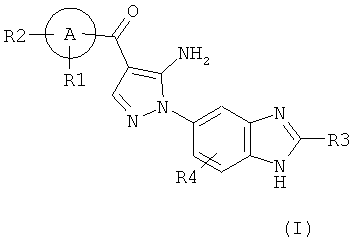
где R1, R2, R3, и R4 каждый независимо означает группу, перечисленную ниже:
R1 означает водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13,
-SR14, -SOR15, -SO2R16, -NR17SO2R18; COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, выбранными из группы P, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23,
-NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31, или -Si(R32)3;
R2 означает водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13,
-SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, выбранными из группы P, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23,
-NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31, или -Si(R32)3; или
R1 и R2, вместе с атомом, соединенным с ними, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, где гетероциклил или гетероарил необязательно замещен галогеном;
R3 означает водород, C1-5 алкил, C6-10 арил C1-6 алкил, или C1-4 галоалкил;
R4 означает водород, галоген, C1-3 алкил, С1-4 галоалкил, гидрокси, циано, нитро, C1-4 алкокси, -(CH2)nZ1, -NR6R7, -OR5, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, NR17SO2R18, COOH, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27,
-SO2NR28R29, -OSO2R30-SO3R31, или -Si(R32)3;
А означает 5-10-членное гетероарильное кольцо или C6-10 арильное кольцо;
R5 означает C1-5 алкил, C3-7 циклоалкил, C3-7 циклоалкил C1-3 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C2-4 алкил, C1-3 алкокси C2-4 алкокси C2-4 алкил, C2-4 аминоалкил, C1-4 алкиламино C2-4 алкил, ди(C1-4 алкил)амино C2-4 алкил, C6-10 арил, C6-10 арил C1-3 алкил, или 3-10-членный гетероциклил C1-3 алкил, 3-10-членный гетероциклил, 5-10-членный гетероарил, 5-10-членный гетероарил C1-3 алкил, C1-6 моногидрокси алкил, C1-6 дигидрокси алкил, или C1-6 тригидрокси алкил, который необязательно замещен одной или несколькими группами, выбранными из группы Q;
R6 и R7 являются одинаковыми или разными и каждый означает водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C2-4 алкил, C6-10 арил C1-3 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, C2-6 моногидрокси алкил, C2-6 дигидрокси алкил, C2-6 тригидрокси алкил, 3-10-членный гетероциклил, C2-4 аминоалкил. C1-4 алкиламино C2-4 алкил, ди(C1-4 алкил)амино C2-4 алкил, или циано(C1-3 алкил); или R6 и R7, вместе с атомом азота, соединенным с ними, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
n принимает значение 1-3;
R8 и R9 являются одинаковыми или разными и каждый означает водород, C1-4 алкил, или галоген; или альтернативно, R8 и R9, вместе с атомом углерода, соединенным с ними, образуют циклоалифатическое кольцо;
Z1 означает водород, NR10R11, гидроксил, или 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R10 и R11 являются одинаковыми или разными и каждый означает C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C2-4 алкил, циано(C1-3 алкил), или C1-3 алкилсульфонил C2-4 алкил; или альтернативно, R10 и R11, вместе с атомом азота, соединенным с ними, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R12 и R13 являются одинаковыми или разными и каждый означает водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C2-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил), C1-3 алкилсульфонил C2-4 алкил, 3-10-членное циклоалифатическое кольцо, 5-10-членный гетероарил, или 3-10-членный гетероциклил; или альтернативно, R12 и R13, вместе с атомом азота, соединенным с ними, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, выбранными из группы Q;
R14 означает C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, выбранными из группы P, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, выбранными из группы Q;
R15 означает C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, выбранными из группы P, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, выбранными из группы Q;
R16 означает C1-4 алкил, C2-6 алкенил, C3-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, выбранными из группы P, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, выбранными из группы Q;
R17 означает водород или C1-4 алкил;
R18 означает C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, выбранными из группы P, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен группой(-ами) выбранной(-ыми) из группы Q;
R19 означает водород, C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, выбранными из группы Q;
R20 означает C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R21 означает C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R22 означает водород, C1-4 алкил, или C1-4 галоалкил;
R23 означает водород, C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R24 означает водород, C1-4 алкил, или C1-4 галоалкил;
R25 означает C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R26 и R27 являются одинаковыми или разными и каждый означает водород, C1-4 алкил, C2-6 алкенил, C3-6 алкинил, C1-4 галоалкил, C1-3 алкоксил C2-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил), C1-3 алкилсульфонил C2-4 алкил, или 3-10-членное циклоалифатическое кольцо; или альтернативно, R26 и R27, вместе с атомом азота, соединенным с ними, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R28 и R29 являются одинаковыми или разными и каждый означает водород, C1-4 алкил, C2-6 алкенил, C3-6 алкинил, C1-4 галоалкил, C1-3 алкоксил C2-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил), C1-3 алкилсульфонил C2-4 алкил, или 3-10-членное циклоалифатическое кольцо; или альтернативно, R28 и R29, вместе с атомом азота, соединенным с ними, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R30 означает C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R31 означает C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R32 означает C1-4 алкил или C6-10 арил;
<группа P>
водород, галоген, C1-4 алкил, C1-4 галоалкил, -OH, C1-3 алкокси, 3-10-членный гетероциклиламино, -SO2R16, -CN, -NO2, и 3-10-членный гетероциклил;
<группа Q>
водород, галоген, C1-4 алкил, C1-4 галоалкил, -OH, C1-3 алкокси, 3-10-членный гетероциклиламин, -SO2R16, -CN, -NO2, C3-7 циклоалкил, -COR19, и 3-10-членный гетероциклил.
[102] Соединение пункта [101] или его фармацевтически приемлемая соль, где А означает индол, азаиндол, или пиррол.
[103] Соединение пункта [101] или [102], или его фармацевтически приемлемая соль, где R3 означает водород, C1-4 алкил, C6-10 арил C1-4 алкил, или C1-3 перфторалкил.
[104] Соединение любого из пунктов [101]-[103], или его фармацевтически приемлемая соль, где R4 означает водород, галоген, C1-3 алкил, C1-3 перфторалкил, циано, метансульфонил, гидроксил, алкокси, или амино.
[105] Соединение пункта [101] или его фармацевтически приемлемая соль, которое выбрано из группы, состоящей из:
(1) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(2) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пирролидин-1-илметил-1H-индол-2-ил)-метанона;
(3) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-гидрокси-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(4) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-пирроло[3,2-с]пиридин-2-ил)-метанона;
(5) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пиперазин-1-илметил-1H-индол-2-ил)-метанона;
(6) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[б-(2-морфолин-4-ил-этокси)-1H-индол-2-ил]-метанона;
(7) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(тетрагидро-пиран-4-илокси)-1H-индол-2-ил]-метанона;
(8) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-хлор-1H-индол-2-ил)-метанона;
(9) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-бром-1H-индол-2-ил)-метанона;
(10) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-йод-1H-индол-2-ил)-метанона;
(11) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-5-карбонитрила;
(12) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-бром-5-фтор-1H-индол-2-ил)-метанона;
(13) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-этинил-1H-индол-2-ил)-метанона;
(14) [5-амино-!-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-фтор-фенил)-1H-индол-2-ил]-метанона;
(15) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-фтор-фенил)-1H-индол-2-ил]-метанона;
(16) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-фтор-фенил)-1H-индол-2-ил]-метанона;
(17) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-хлор-фенил)-1H-индол-2-ил]-метанона;
(18) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-хлор-фенил)-1H-индол-2-ил]-метанона;
(19) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-хлор-фенил)-1H-индол-2-ил]-метанона;
(20) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-трифторметил-фенил)-1H-индол-2-ил]-метанона;
(21) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-трифторметил-фенил)-1H-индол-2-ил]-метанона;
(22) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-трифторметил-фенил)-1H-индол-2-ил]-метанона;
(23) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-бром-1H-индол-2-ил)-метанона;
(24) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-фтор-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(25) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-метил-1H-индол-2-ил)-метанона;
(26) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4,4-дифтор-пиперидин-1-карбонил)-1H-индол-2-ил]-метанона;
(27) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(3,3-дифтор-пиперидин-1-карбонил)-1H-индол-2-ил]-метанона;
(28) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-5-карбоновой кислоты (2,2,2-трифтор-этил)-амида;
(29) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-трифторметил-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(30) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(6-трифторметил-пиридин-2-ил)-1Н-индол-2-ил]-метанона;
(31) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-хлор-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(32) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-метил-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(33) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-хлор-4-фтор-фенил)-1H-индол-2-ил]-метанона;
(34) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-трифторметил-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(35) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-трифторметил-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(36) [5-амино-1-(6-фтор-2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(37) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-6-карбоновой кислоты;
(38) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-гидроксиметил-1H-индол-2-ил)-метанона;
(39) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-{6-[2-(4-метил-пиперазин-1-ил)-этокси]-1H-индол-2-ил}-метанона;
(40) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-метил-оксетан-3-илметокси)-1H-индол-2-ил]-метанона;
(41) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-фтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(42) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-{[бис(2-метокси-этил)амино]-метил}-1H-индол-2-ил)-метанона;
(43) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-{6-[(метил-проп-2-инил-амино)метил]-1H-индол-2-ил}-метанона;
(44) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3,3-дифтор-пирролидин-1-илметил)-1H-индол-2-ил]-метанона;
(45) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2,5-диметил-пирролидин-1-илметил)-1H-индол-2-ил]-метанона;
(46) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3,3-дифтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(47) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-((S)-3-метил-морфолин-4-илметил)-1H-индол-2-ил]-метанона;
(48) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-бром-1H-индол-2-ил)-метанона;
(49) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-йод-1H-индол-2-ил)-метанона;
(50) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-пирроло[3,2-b]пиридин-2-ил)-метанона;
(51) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-бром-6-трифторметил-1H-индол-2-ил)-метанона;
(52) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-йод-1H-индол-2-ил)-метанона;
(53) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-метил-1H-индол-2-ил)-метанона;
(54) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-изопропил-1H-индол-2-ил)-метанона;
(55) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(2-фтор-фенил)-1H-индол-2-ил]-метанона;
(56)[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-бензил-1H-индол-2-ил)-метанона;
(57) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(2-трифторметил-фенил)-1H-индол-2-ил]-метанона;
(58) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(3-фторфенил)-1H-индол-2-ил]-метанона;
(59) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(3-трифторметил-фенил)-1H-индол-2-ил]-метанона;
(60) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-этинил-1H-индол-2-ил)-метанона;
(61) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5Н-[1,3]диоксоло[4,5-1]индол-6-ил)-метанона;
(62) [5-амино-1-(7-фтор-2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(63) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(4-трифторметил-фенил)-1H-индол-2-ил]-метанона;
(64) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-бутокси-1H-индол-2-ил)-метанона;
(65) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1-метил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
(66) N-{2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1H-индол-6-ил}-метансульфонамида;
(67) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(6-морфолин-4-ил-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(68) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-бутил-1H-индол-2-ил)-метанона;
(69) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(1-метил-1H-пиразол-4-ил)-1H-индол-2-ил]-метанона;
(70) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-метокси-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(71) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-метокси-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(72) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-циклопропил-1H-индол-2-ил)-метанона;
(73) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-метокси-фенил)-1H-индол-2-ил]-метанона;
(74) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-фенил-1H-индол-2-ил)-метанона;
(75) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-метансульфонил-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(76) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-изопропил-1H-индол-2-ил)-метанона;
(77) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пиридин-2-ил-1H-индол-2-ил)-метанона;
(78) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-циклопропил-1H-индол-2-ил)-метанона;
(79) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пиридазин-3-ил-1H-индол-2-ил)-метанона;
(80) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-изопропокси-1H-индол-2-ил)-метанона;
(81) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(2-метокси-этокси)-1H-индол-2-ил]-метанона;
(82) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-циклопропилметокси-1H-индол-2-ил)-метанона;
(83) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(2,2-дифтор-5Н-[1,3]диоксоло[4,5-f]индол-6-ил)-метанона;
(84) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-хлор-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(85) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-фтор-пиридин-2-ил)-1H-индол-2-ил]-метанона;
(86) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(6-морфолин-4-ил-пиридазин-3-ил)-1H-индол-2-ил]-метанона;
(87) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-хлор-6-циклопропилметокси-1H-индол-2-ил)-метанона;
(88) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2,4-дифтор-фенил)-1H-индол-2-ил]-метанона;
(89) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пиридазин-4-ил-1H-индол-2-ил)-метанона;
(90) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(3-фтор-1H-индол-2-ил)-метанона;
(91) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1-изопропил-пиперидин-4-ил)-6-трифторметил-1H-индол-2-ил]-метанона;
(92) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)- 1Н-пиразол-4-карбонил]-1H-индол-6-карбонитрила;
(93) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1,2,3,6-тетрагидро-пиридин-4-ил)-1H-индол-2-ил]-метанона;
(94) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-пиперидин-4-ил-1H-индол-2-ил)-метанона;
(95) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-((R)-3-фтор-пирролидин-1-илметил)-1H-индол-2-ил]-метанона;
(96) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-фтор-5-пиперидин-4-ил-1H-индол-2-ил)-метанона;
(97) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-фтор-5-(1-метил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
(98) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1-изопропил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
(99) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-фтор-5-(1-изопропил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
(100) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пиридин-3-ил-1H-индол-2-ил)-метанона;
(101) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(6-морфолин-4-илпиридин-3-ил)-1H-индол-2-ил]-метанона;
(102) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-пиридин-3-ил-1H-индол-2-ил)-метанона;
(103) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(6-пиперазин-1-ил-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(104) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(6-гидрокси-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(105) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-фтор-5-(4-метил-пиперазин-1-илметил)-1H-индол-2-ил]-метанона;
(106) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-фтор-5-пирролидин-1-илметил-1H-индол-2-ил)-метанона;
(107) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(1-метил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
(108) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-морфолин-4-ил-фенил)-1H-индол-2-ил]-метанона;
(109) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3,4,5,6-тетрагидро-2Н-[1,2′]бипиридин-5′-ил)-1H-индол-2-ил]-метанона;
(110) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(6-пиперазин-1-ил-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(111) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(6-метокси-пиридин-3-ил)-1H-индол-2-ил]-метанона;
(112) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-((S)-3-метил-морфолин-4-илметил)-1H-индол-2-ил]-метанона;
(113) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-((R)-3-фтор-пирролидин-1-илметил)-1H-индол-2-ил]-метанона;
(114) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(2,5-диметил-пирролидин-1-илметил)-1H-индол-2-ил]-метанона;
(115) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3-фтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(116) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(3,3-дифтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(117) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-{6-[2-(4-метил-пиперазин-1-ил)пиридин-4-ил]-1H-индол-2-ил}-метанона;
(118) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пиридин-4-ил-1H-индол-2-ил)-метанона;
(119) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(4-фторпиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(120) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(4,4-дифтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(121) [5-амино-1-(2-дифторметил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1-метил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
(122) [5-амино-1-(2-дифторметил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(123) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(3,3-дифтор-пирролидин-1-илметил)-1H-индол-2-ил]-метанона;
(124) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(1-циклопентил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
(125) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1-циклогексил-пиперидин-4-ил)-1H-индол-2-ил]-метанона;
(126) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-бром-1H-пиррол-2-ил)-метанона;
(127) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-пиррол-2-ил)-метанона;
(128) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-фенил-1H-пиррол-2-ил)-метанона;
(129) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(3-хлор-фенил)-1H-пиррол-2-ил]-метанона;
(130) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(4-фтор-фенил)-1H-пиррол-2-ил]-метанона;
(131) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(3-фтор-фенил)-1H-пиррол-2-ил]-метанона;
(132) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-морфолин-4-илметил-1H-индол-2-ил)-метанона;
(133) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(2-морфолин-4-ил-этиламино)-1H-индол-2-ил]-метанона;
(134) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(4-метил-пиперазин-1-карбонил)-1H-индол-2-ил]-метанона;
(135) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-морфолин-4-ил-этиламино)-1H-индол-2-ил]-метанона;
(136) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(пиперазин-1-карбонил)-1H-индол-2-ил]-метанона;
(137) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(2-метокси-этиламино)-1H-индол-2-ил]-метанона;
(138) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(2-гидрокси-1-гидроксиметил-этиламино)-1H-индол-2-ил]-метанона;
(139) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(2-пиридин-4-ил-этиламино)-1H-индол-2-ил]-метанона;
(140) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-метокси-этиламино)-1H-индол-2-ил]-метанона;
(141) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-морфолин-4-ил-1H-индол-2-ил)-метанона;
(142) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-морфолин-4-ил-1H-индол-2-ил)-метанона;
(143) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-морфолин-4-илметил-1H-индол-2-ил)-метанона;
(144) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-морфолин-4-илметил-1H-индол-2-ил)-метанона;
(145) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(морфолин-4-карбонил)-1H-индол-2-ил]-метанона;
(146) [5-амино-1-(2-изопропил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(147) [5-амино-1-(2-пропил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(148) [5-амино-1-(1Н-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(149) [5-амино-1-(2-трифторметил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(150) [5-амино-1-(2-этил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(151) [5-амино-1-(2-бензил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанона;
(152) 1-(4-{2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-5-илметил}-пиперазин-1-ил)-этанона;
(153) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(4-метансульфонил-пиперазин-1-илметил)-1H-индол-2-ил]-метанона;
(154) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-пиперазин-1-илметил-1H-индол-2-ил)-метанона;
(155) 1-(4-{2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-6-илметил} пиперазин-1-ил)-этанона;
(156) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-метил-пиперазин-1-илметил)-1H-индол-2-ил]-метанона;
(157) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4-метил-пиперазин-1-илметил)-1H-индол-2-ил]-метанона;
(158) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-пирролидин-1-илметил-1H-индол-2-ил)-метанона;
(159) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-фтор-1H-индол-2-ил)-метанона;
(160) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-фтор-1H-индол-2-ил)-метанона;
(161) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-фтор-1H-индол-2-ил)-метанона;
(162) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-пирроло[2,3-b]пиридин-2-ил)-метанона;
(163) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-фтор-6-морфолин-4-илметил-1H-индол-2-ил)-метанона;
(164) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-5-карбоновой кислоты;
(165) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-метокси-1H-индол-2-ил)-метанона;
(166) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,6-диметокси-1H-индол-2-ил)-метанона;
(167) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-метокси-1H-индол-2-ил)-метанона;
(168) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-метокси-1H-индол-2-ил)-метанона;
(169) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,6-диметил-1H-индол-2-ил)-метанона;
(170) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-трет-бутил-1H-индол-2-ил)-метанона;
(171) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-изопропил-1H-индол-2-ил)-метанона;
(172) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-бензилокси-1H-индол-2-ил)-метанона;
(173) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-бензилокси-1H-индол-2-ил)-метанона;
(174) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5,6-диметокси-1H-индол-2-ил)-метанона;
(175) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-трет-бутил-1H-индол-2-ил)-метанона;
(176) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-фтор-4-трифторметил-1H-индол-2-ил)-метанона;
(177) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-фенокси-1H-индол-2-ил)-метанона;
(178) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-метилсульфанил-1H-индол-2-ил)-метанона;
(179) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-трет-бутил-1H-индол-2-ил)-метанона;
(180) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-метил-1H-индол-2-ил)-метанона;
(181) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-этил-1H-индол-2-ил)-метанона;
(182) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-фтор-6-трифторметил-1H-индол-2-ил)-метанона;
(183) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-фтор-5-метокси-1H-индол-2-ил)-метанона;
(184) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-хлор-5-метокси-1H-индол-2-ил)-метанона;
(185) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-хлор-6-метокси-1H-индол-2-ил)-метанона;
(186) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-изопропокси-1H-индол-2-ил)-метанона;
(187) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-бензилокси-1H-индол-2-ил)-метанона;
(188) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-изопропокси-1H-индол-2-ил)-метанона;
(189) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(2,3-дигидро-6Н-[1,4]диоксино[2,3-f]индол-7-ил)-метанона;
(190) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,6-ди-трет-бутил-1H-индол-2-ил)-метанона;
(191) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-4-карбонитрила;
(192) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-имидазол-1-ил-1H-индол-2-ил)-метанона;
(193) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-трифторметилсульфанил-1H-индол-2-ил)-метанона;
(194) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-метилсульфанил-1H-индол-2-ил)-метанона;
(195) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-метансульфонил-1H-индол-2-ил)-метанона;
(196) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4,4-дифтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(197) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-фтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанона;
(198) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[б-(оксетан-3-илокси)-1H-индол-2-ил]-метанона;
(199) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-гидрокси-1H-индол-2-ил)-метанона;
(200) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-метансульфонил-1H-индол-2-ил)-метанона;
(201) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,5-дибром-1H-пиррол-2-ил)-метанона;
(202) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,5-дифенил-1H-пиррол-2-ил)-метанона; и
(203) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,5-дипиридин-3-ил-1H-пиррол-2-ил)-метанона.
[106] Фармацевтическая композиция, включающая соединение любого из пунктов [101]-[105], или его фармацевтически приемлемую соль; и носитель.
[107] Средство для ингибирования FGFR активности, которое включает в качестве активного ингредиента соединение любого из пунктов [101]-[105], или его фармацевтически приемлемую соль.
[108] Средство для предотвращения или лечения злокачественного новообразования, которое включает в качестве активного ингредиента соединение любого из пунктов [101]-[105], или его фармацевтически приемлемую соль.
[109] Средство для предотвращения или лечения злокачественного новообразования пункта [108], где злокачественное новообразование представляет собой по меньшей мере одно новообразование, выбранное из группы, состоящей из:
рака молочной железы, острой миелоцитарной лейкемии, рака поджелудочной железы, рака мочевого пузыря, рака предстательной железы, рака пищевода, ангиогенеза, рака желудка, рака тела матки, рака яичников, опухоли головного мозга, рака ободочной кишки, множественной миеломы, гепатоцеллюлярного рака, рака легкого, и рака щитовидной железы.
[110] Способ предотвращения или лечения злокачественного новообразования, который включает введение фармацевтически эффективного количества композиции, включающей соединение любого из пунктов [101]-[105] или его фармацевтически приемлемую соль, пациенту, нуждающемуся в предотвращении или лечении злокачественного новообразования.
[111] Применение соединения любого из пунктов [101]-[105] или его фармацевтически приемлемой соли для изготовления средства для предотвращения или лечения злокачественного новообразования.
[112] Соединение любого из пунктов [101]-[105] или его фармацевтически приемлемая соль, для предотвращения или лечения злокачественного новообразования.
[Следствия изобретения]
Соединения настоящего изобретения и их фармацевтически приемлемые соли обладают активность ингибирования FGFR семейства киназ в тканях злокачественных новообразований. Кроме того, соединения настоящего изобретения могут проявить эффективность на новых генах (нецелевых генах), измененных в злокачественном новообразовании, и таким образом могут предотвращать и/или лечить злокачественные новообразования, для лечения которых эффективной терапии не существовало.
Способ осуществления изобретения
Настоящее изобретение относится к производным аминопиразола и их применениям. Данные изобретатели впервые синтезировали соединения, изображаемые показанной выше формулой (I), или их фармацевтически приемлемые соли, и обнаружили, что эти соединения или их соли обладают активностью ингибирования FGFR семейства киназ.
В этом документе, "алкил" относится к моновалентной группе, полученной из алифатического углеводорода путем удаления произвольного атома водорода. Он не содержит ни гетероатома, ни ненасыщенной углерод-углеродной связи в скелете, и имеет подмножество структур гидрокарбильных или углеводородных групп, которые содержат атомы водорода и углерода. Алкильная группа включает линейные и разветвленные структуры. Предпочтительные алкильные группы включают алкильные группы с одним - шестью атомами углерода (C1-6; в дальнейшем, "Cp-q" означает, что число атомов углерода составляет от p до q), С1-5 алкильные группы, С1-4 алкильные группы, и C1-3 алкильные группы.
В особенности, алкил включает, например, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, т-бутильную группу, пентильную группу, изопентильную группу, 2,3-диметилпропильную группу, 3,3-диметилбутильную группу, и гексильную группу.
В этом документе, "алкенил" относится к моновалентной углеводородной группе, которая имеет по меньшей мере одну двойную связь (два расположенных рядом SP2 атома углерода), и включает такие группы в линейной и разветвленной формах. В зависимости от конфигурации двойной связи и заместителей (если таковые имеются), геометрия двойной связи может быть "напротив" (entgegen, (E)) или "вместе" (zusammen, (Z)), либо цис- или транс. Предпочтительные алкенильные группы включают C2-6 алкенильные группы.
В особенности, алкенил включает, например, винильную группу, аллильную группу, 1-пропенильную группу, 2-пропенильную группу, 1-бутенильную группу, 2-бутенильную группу (включая цис- и транс-), 3-бутенильную группу, пентенильную группу, и гексенильную группу.
В этом документе, "алкинил" относится к моновалентной углеводородной группе, которая имеет по меньшей мере одну тройную связь (два расположенных рядом SP атома углерода), и включает такие группы в линейной и разветвленной формах. Предпочтительный алкинильные группы включают C2-6 алкинильные группы.
В особенности, алкинил включает, например, этинильную группу, 1-пропинильную группу, пропаргильную группу, 3-бутинильную группу, пентинильную группу, и гексинильную группу.
Алкенил и алкинил каждый может иметь одну или нескольких двойных связей или тройных связей.
В этом документе, "циклоалкил" относится к насыщенной или частично насыщенной циклической моновалентной алифатической углеводородной группе, и включает моноциклические группы, бициклические кольца, и спиро-кольца. Предпочтительный циклоалкил включает C3-7 циклоалкильные группы. В особенности, циклоалкильная группа включает, например, циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу, и циклогептильную группу.
В этом документе, "циклоалкилалкил" относится к группе, в которой произвольный атом водорода "алкила", определенного выше, замещен "циклоалкилом", определенным выше. Предпочтительный циклоалкилалкильные группы включают C3-7 циклоалкил C1-3 алкил, и в особенности включают, например, циклопропилметильную группу и циклопропилэтильную группу.
В этом документе, "гетероатом" относится к атому азота (N), атому кислорода (О), или атому серы (S).
В этом документе, "атом галогена" относится к атому фтора, атому хлора, атому брома, или атому йода.
В этом документе, "галоалкил" относится к группе, в которой предпочтительно от одного до девяти, более предпочтительно от одного до пяти одинаковых или разных "атомов галогена", определенных выше, присоединены к "алкилу", определенному выше.
В особенности, галоалкил включает, например, хлорметильную группу, дихлорметильную группу, трихлорметильную группу, фторметильную группу, дифторметильную группу, перфторалкильную группу (такую как трифторметильную группу и -CF2CF3), и 2,2,2-трифторэтильную группу.
В этом документе, "алкокси" относится к окси группе, связанной с "алкилом", определенным выше. Предпочтительный алкокси включает C1-4 алкокси группы и C1-3 алкокси группы. В особенности, алкокси включает, например, метокси группу, этокси группу, 1-пропокси группу, 2-пропокси группу, н-бутокси группу, изо-бутокси группу, втор-бутокси группу, и трет-бутокси группу.
В этом документе, "галоалкокси" относится к группе, в которой предпочтительно от одного до девяти, более предпочтительно от одного до пяти одинаковых или разных атомов галогена, определенных выше, присоединены к "алкокси", определенному выше.
В особенности, галоалкокси включает, например, хлорметокси группу, трихлорметокси группу, и трифторметокси группу.
В этом документе, "арил" относится к моновалентному ароматическому углеводородному кольцу. Арил предпочтительно включает C6-10 арил. В особенности, арил включает, например, фенильную группу и нафтильные группы (например, 1-нафтильную группу и 2-нафтильную группу).
В этом документе, "алициклическое кольцо" относится к моновалентному неароматическому углеводородному кольцу. Алициклическое кольцо может иметь ненасыщенные связи в своем кольце, и может быть мультициклической группой, которая имеет два или нескольких колец. Атомы углерода, образующие кольцо, могут быть окислены с образованием карбонила. Число атомов, образующих алициклическое кольцо, предпочтительно колеблется от трех до десяти (3-10-членное алифатическое кольцо). Алициклическое кольцо включает, например, циклоалкильное кольцо, циклоалкенильное кольцо, и циклоалкинильное кольцо.
В этом документе, "гетероарил" относится к моновалентной ароматической гетероциклической группе, в которой атомы, образующие кольцо, включают предпочтительно от одного до пяти гетероатомов. Гетероарил может быть частично насыщенным, и может быть моноциклическим или конденсированным кольцом (например, бициклическим гетероарилом, конденсированным с бензольным кольцом или моноциклическим гетероарильным кольцом). Число атомов, образующих кольцо, предпочтительно колеблется от пяти до десяти (5-10-членный гетероарил).
В особенности, гетероарил включает, например, фурильную группу, тиенильную группу, пирролильную группу, имидазолильную группу, пиразолильную группу, тиазолильную группу, изотиазолильную группу, оксазолильную группу, изооксазолильную группу, оксадиазолильную группу, тиадиазолильную группу, триазолильную группу, тетразолильную группу, пиридильную группу, пиримидильную группу, пиридазинильную группу, пиразинильную группу, триазинильную группу, бензофуранильную группу, бензотиенильную группу, бензотиадиазолильную группу, бензотиазолильную группу, бензоксазолильную группу, бензоксадиазолильную группу, бензоимидазолильную группу, индолильную группу, изоиндолильную группу, азаиндолильную группу, индазолильную группу, хинолильную группу, изохинолильную группу, циннолинильную группу, хиназолинильную группу, хиноксалинильную группу, бензодиоксолильную группу, индолидинильную группу, и имидазопиридильную группу.
В этом документе, "гетероциклил" относится к неароматической моновалентной гетероциклической группе, в которой атомы, образующие кольцо, включают предпочтительно от одного до пяти гетероатомов. Гетероциклил может содержать двойные или тройные связи в своем кольце. Атомы углерода могут быть окислены с образованием карбонила. Кольцо может быть моноциклическим или конденсированным кольцом. Число атомов, образующих кольцо, предпочтительно колеблется от трех до десяти (3-10-членный гетероциклил).
В особенности, гетероциклил включает, например, оксетанильную группу, дигидрофурильную группу, тетрагидрофурильную группу, дигидропиранильную группу, тетрагидропиранильную группу, тетрагидропиридильную группу, морфолинильную группу, тиоморфолинильную группу, пирролидинильную группу, пиперидинильную группу, пиперазинильную группу, пиразолидинильную группу, имидазолинильную группу, имидазолидинильную группу, оксазолидинильную группу, изооксазолидинильную группу, тиазолидинильную группу, изотиазолидинильную группу, тиадиазолидинильную группу, азетидинильную группу, оксазолидоновую группу, бензодиоксанильную группу, бензоксазолильную группу, диоксоланильную группу, и диоксанильную группу.
В этом документе, "арилалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен "арилом", определенным выше. Арилалкил предпочтительно включает C6-10 арил C1-4 алкил и C6-10 арил C1-3 алкил. В особенности, арилалкил включает, например, бензильную группу, фенэтильную группу, и нафтилметильную группу.
В этом документе, "гетероарилалкил" относится к группе, в которой произвольный атом водорода в алкиле, определенном выше, замещен "гетероарилом", определенным выше. Гетероарилалкил предпочтительно включает 5-10-членный гетероарил C1-3 алкил. В особенности, гетероарилалкил включает, например, пирролилметильную группу, имидазолилметильную группу, тиенилметильную группу, пиридилметильную группу, пиримидилметильную группу, хинолилметильную группу, и пиридилэтильную группу.
В этом документе, "гетероциклилалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен "гетероциклилом", определенным выше. Гетероциклилалкил предпочтительно включает 3-10-членный гетероциклил C1-3 алкил. В особенности, гетероциклилалкил включает, например, морфолинилметильную группу, морфолинилэтильную группу, тиоморфолинилметильную группу, пирролидинилметильную группу, пиперидинилметильную группу, пиперазинилметильную группу, пиперазинилэтильную группу, и оксетанилметильную группу.
В этом документе, "моногидроксиалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен гидроксильной группой. Моногидроксиалкил предпочтительно включает C1-6 моногидроксиалкил и C2-6 моногидроксиалкил. В особенности, моногидроксиалкил включает, например, гидроксиметильную группу, 1-гидроксиэтильную группу, и 2-гидроксиэтильную группу.
В этом документе, "дигидроксиалкил" относится к группе, в которой два произвольных атома водорода в "алкиле", определенном выше, замещены двумя гидроксильными группами. Дигидроксиалкил предпочтительно включает C1-6 дигидроксиалкил и C2-6 дигидроксиалкил. В особенности, дигидроксиалкил включает, например, 1,2-дигидроксиэтильную группу, 1,2-дигидроксипропильную группу, и 1,3-дигидроксипропильную группу.
В этом документе, "тригидроксиалкил" относится к группе, в которой три произвольных атома водорода в "алкиле", определенном выше, замещены тремя гидроксильными группами. Тригидроксиалкил предпочтительно включает C1-6 тригидроксиалкил и C2-6 тригидроксиалкил.
В этом документе, "алкоксиалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен "алкокси", определенным выше. Алкоксиалкил предпочтительно включает C1-3 алкокси C1-4 алкил и C1-3 алкокси C2-4 алкил. В особенности, алкоксиалкил включает, например, метоксиэтил.
В этом документе, "алкоксиалкоксиалкил" относится к группе, в которой произвольный атом водорода в концевом алкиле "алкоксиалкила", определенного выше, замещен "алкокси", определенным выше. Алкоксиалкоксиалкил предпочтительно включает C1-3 алкокси C1-4 алкокси C1-4 алкил и C1-3 алкокси C2-4 алкокси C2-4 алкил.
В этом документе, "аминоалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен аминогруппой. Аминоалкильная группа предпочтительно включает C1-4 аминоалкил и C2-4 аминоалкил.
В этом документе, "алкиламино" относится к аминогруппе, связанной с "алкилом", определенным выше. Алкиламино предпочтительно включает C1-4 алкиламино.
В этом документе, "диалкиламино" относится к аминогруппе, связанной с двумя "алкилами", определенными выше. Две алкильные группы могут быть одинаковыми или разными. Диалкиламино предпочтительно включает ди(C1-4 алкил)амино.
В этом документе, "алкиламиноалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен "алкиламино", определенным выше. Алкиламиноалкил предпочтительно включает C1-4 алкиламино C1-4 алкил и C1-4 алкиламино C2-4 алкил.
В этом документе, "диалкиламиноалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен "диалкиламино", определенным выше. Диалкиламиноалкил предпочтительно включает ди(C1-4 алкил)амино C1-4 алкил и ди(C1-4 алкил)амино C2-4 алкил.
В этом документе, "гетероциклиламино" относится к аминогруппе, связанной с "гетероциклилом", определенным выше. Гетероциклиламино предпочтительно включает 3-10-членный гетероциклиламино.
В этом документе, "цианоалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен цианогруппой. Цианоалкил предпочтительно включает циано(C1-3 алкил).
В этом документе, "алкилсульфонил" относится к сульфонильной группе, связанной с "алкилом", определенным выше (то есть к алкил-SO2-). Алкилсульфонил предпочтительно включает C1-3 алкилсульфонил. В особенности, алкилсульфонил включает метилсульфонил, этилсульфонил, н-пропилсульфонил, и изо-пропилсульфонил.
В этом документе, "алкилсульфонилалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен "алкилсульфонилом", определенным выше. Алкилсульфонилалкил предпочтительно включает C1-3 алкилсульфонил C1-4 алкил и C1-3 алкилсульфонил C2-4 алкил.
Соединения настоящего изобретения включать их свободные формы и фармацевтически приемлемые соли. Такие "соли" включают, например, соли неорганической кислоты, соли органической кислоты, соли неорганического основания, соли органического основания, и соли кислых или основных аминокислот.
Предпочтительные соли неорганической кислоты включают, например, гидрохлорид, гидробромид, сульфат, нитрат, и фосфат. Предпочтительные соли органической кислоты включают, например, ацетат, сукцинат, фумарат, малеат, тартрат, цитрат, лактат, малат, стеарат, бензоат, метансульфонат, и п-толуолсульфонат. Особенно предпочтительной солью в настоящем изобретении является малат.
Предпочтительные соли неорганического основания включают, например, соли щелочных металлов, такие как соли натрия и соли калия; соли щелочноземельных металлов, такие как соли кальция и соли магния; соли алюминия; и соли аммония. Предпочтительные соли органических оснований включают, например, соли диэтиламина, соли диэтаноламина, соли меглумина, и соли N,N-дибензилэтилендиамина.
Предпочтительные соли кислых аминокислот включают, например, аспартат и глутамат. Предпочтительные соли основных аминокислот включают, например, соли аргинина, соли лизина, и соли орнитина.
В случае, когда соединения настоящего изобретения оставляют стоять на воздухе, они могут абсорбировать влагу до некоторого содержания адсорбированной воды или образования гидратов. Такие гидраты также включаются в соли настоящего изобретения.
Кроме того, соединения настоящего изобретения могут абсорбировать другие растворители с образованием сольватов. Такие сольваты также включаются в соли настоящего изобретения.
Все структурно возможные изомеры (геометрические изомеры, оптические изомеры, стереоизомеры, таутомеры, и т.д.) соединений настоящего изобретения и смеси таких изомеров включаются в настоящее изобретение.
Соединения настоящего изобретения могут иметь полиморфные кристаллические формы. Такие полиморфы все включаются в настоящее изобретение.
Соединения настоящего изобретения включают пролекарства. Пролекарства относятся к производным соединений настоящего изобретения, которые обладают химически или метаболически разлагаемой группой, и после введения живому организму, снова превращаются в исходные соединения и демонстрируют эффективность исходного медикамента. Пролекарства включают нековалентные комплексы и соли.
Соединения настоящего изобретения включают соединения, в которых один или несколько атомов в рамках молекулы замещено изотопами. В этом документе, изотоп относится к атому, который имеет одинаковый атомный номер (число протонов), но отличается массовым числом (суммой протонов и нейтронов). Целевые атомы, подлежащие замене изотопом в соединениях настоящего изобретения, включают, например, атом водорода, атом углерода, атом азота, атом кислорода, атом фосфора, атом серы, атом фтора, и атом хлора. Их изотопы включают 2H, 3H, 13С, 14C, 15N, 17O, 18O, 31P, 32P, 35S, 18F, и 36Cl. В частности, радиоизотопы, такие как 3H и 14C, которые распадаются с излучением радиации, являются пригодными для применения в in vivo исследованиях распределение в тканях и т.д. лекарственных средств или соединений. Стабильные изотопы не распадаются, почти постоянно находятся в изобилии, и не испускают радиацию. В связи с этим, стабильные изотопы могут применяться безопасно. Соединения настоящего изобретения могут быть превращены в изотоп-замещенные соединения в соответствии с обычными методами путем замены реагентов, используемых в синтезе, реагентами, содержащими соответствующие изотопы.
Предпочтительно, соединениями настоящего изобретения, изображаемыми формулой (I), указанной выше, являются следующие:
R1, указанный выше, предпочтительно означает водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-7 циклоалкил, C6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы P, 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21,
-NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31, или - Si(R32)3.
R1, указанный выше более предпочтительно означает водород, гидрокси, галоген, циано, C1-4 галоалкил, C1-6 алкил, C2-6 алкинил, C3-7 циклоалкил, C6-10 арил C1-4 алкил,
-OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q. В особенности, вышеуказанный 5-10-членный гетероарил особенно предпочтительно представляет собой имидазолильную группу, тиенильную группу, пиридильную группу, пиридазинильную группу, или пиразолильную группу. Вышеуказанный 3-10-членный гетероциклил особенно предпочтительно представляет собой морфолинильную группу, тетрагидропиридильную группу, или пиперидинильную группу.
R2, указанный выше, предпочтительно означает водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-7 циклоалкил, C6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21,
-NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31, или -Si(R32)3.
R2, указанный выше более предпочтительно означает водород, галоген, C1-4 галоалкил, C1-6 алкил, -OR5, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы P, или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q. В особенности, этот 5-10-членный гетероарил особенно предпочтительно представляет собой пиридильную группу.
R1 и R2, указанные выше, предпочтительно могут быть взяты вместе с атомами, к которым они присоединены, с образованием 3-10-членного гетероциклила или 5-10-членного гетероарила. Гетероциклил или гетероарил могут иметь в качестве заместителя атом галогена. В особенности, 3-10-членный гетероциклил, образованный вместе с атомами, к которым присоединены R1 и R2, особенно предпочтительно представляет собой диоксоланильную группу или диоксанильную группу.
R3, указанный выше, предпочтительно означает водород, C1-5 алкил, C6-10 арил C1-6 алкил, или C1-4 галоалкил, более предпочтительно водород, C1-4 алкил, C6-10 арил C1-4 алкил, или C1-3 перфторалкил, и особенно предпочтительно C1 алкил.
R4, указанный выше, предпочтительно означает водород, галоген, C1-3 алкил, C1-4 галоалкил, гидрокси, циано, нитро, C1-4 алкокси, -(CH2)nZ1, -NR6R7, -OR5, -C(O)NR12R13,
-SR14, -SOR15, -SO2R16, NR17SO2R18, COOH, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23,
-NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30-SO3R31, или -Si(R32)3.
R4, указанный выше более предпочтительно означает водород, галоген, C1-3 алкил, C1-3 перфторалкил, циано, метансульфонил, гидроксил, алкокси, или амино, и особенно предпочтительно водород или галоген.
Кольцо А, указанное выше, изображается следующей формулой:
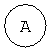
(в этом документе, оно может быть просто рассматриваться как "А"). Кольцо А предпочтительно означает 5-10-членное гетероарильное кольцо или C6-10 арильное кольцо, более предпочтительно бензол, индол, азаиндол, бензофуран, бензотиофен, бензотиазол, хинолин или пиррол, и особенно предпочтительно индол или пиррол.
R5, указанный выше, предпочтительно означает C1-5 алкил, C3-7 циклоалкил, C3-7 циклоалкил C1-3 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, C1-3 алкокси C1-4 алкокси C1-4 алкил, C1-4 амино алкил, C1-4 алкиламино C1-4 алкил, ди(C1-4 алкил)амино C1-4 алкил, C6-10 арил, C6-10 арил C1-3 алкил, или 3-10-членный гетероциклил C1-3 алкил, 3-10-членный гетероциклил, 5-10-членный гетероарил, или 5-10-членный гетероарил C1-3 алкил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, C1-6 моногидроксиалкил, C1-6 дигидроксиалкил, или C1-6 тригидроксиалкил.
R5, указанный выше более препочтительно означает C1-5 алкил, C3-7 циклоалкил C1-3 алкил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, C6-10 арил, C6-10 арил C1-3 алкил, или 3-10-членный гетероциклил C1-3 алкил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q. В особенности, вышеуказанный 3-10-членный гетероциклилалкил особенно предпочтительно представляет собой пиперазинилэтильную группу, оксетанилметильную группу, или морфолинилэтильную группу. Вышеуказанный 3-10-членный гетероциклил особенно предпочтительно представляет собой оксетанильную группу или тетрагидропиранильную группу.
R6 и R7, указанные выше, могут быть одинаковыми или разными, и каждый предпочтительно означает водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C2-4 алкил, C6-10 арил C1-3 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, C1-6 моногидроксиалкил, C1-6 дигидроксиалкил, C1-6 тригидроксиалкил, 3-10-членный гетероциклил, C1-4 аминоалкил, C1-4 алкиламино C1-4 алкил, ди(C1-4 алкил)амино C1-4 алкил, или циано(C1-3 алкил).
R6 и R7, указанные выше, более предпочтительно каждый независимо представляет собой водород, C1-3 алкокси C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, или C1-6 дигидроксиалкил. В особенности, 3-10-членный гетероциклилалкил особенно предпочтительно представляет собой морфолинилэтильную группу, и 5-10-членный гетероарилалкил особенно предпочтительно представляет собой пиридилэтильную группу.
Альтернативно, R6, и R7, указанные выше, предпочтительно могут быть взяты вместе с атомами азота, к которым они присоединены, с образованием 3-10-членного гетероциклила или 5-10-членного гетероарила.
"n", указанный выше, означает целое число от 1 до 3. Предпочтительно, n означает 1.
R8 и R9, указанные выше, предпочтительно могут быть одинаковыми или разными, и каждый означает водород, C1-4 алкил, или галоген, и более предпочтительно водород.
Альтернативно, R8 и R9, указанные выше, предпочтительно могут быть взяты вместе с атомами углерода, к которым они присоединены, с образованием алициклического кольца.
Z1, указанный выше, предпочтительно означает водород, NR10R11, -OH, или 3-10-членный гетероциклил или 5-10-членный гетероарил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, более предпочтительно NR10R11 или -OH, или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q. В особенности, вышеуказанный 3-10-членный гетероциклил особенно предпочтительно представляет собой пирролидинильную группу, пиперазинильную группу, пиперидинильную группу, или морфолинильную группу.
R10 и R11, указанные выше, предпочтительно могут быть одинаковыми или разными, и каждый предпочтительно означает C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, циано(C1-3 алкил), или C1-3 алкилсульфонил C1-4 алкил, более предпочтительно C1-4 алкил, C2-6 алкинил, или C1-3 алкокси C2-4 алкил.
Альтернативно, R10 и R11, указанные выше, предпочтительно могут быть взяты вместе с атомами азота, к которым они присоединены, с образованием 3-10-членного гетероциклила или 5-10-членного гетероарила.
R12 и R13, указанные выше, предпочтительно могут быть одинаковыми или разными, и каждый означает водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил), C1-3 алкилсульфонил C1-4 алкил, или 3-10-членное алициклическое кольцо, более предпочтительно водород, C1-4 алкил, или C1-4 галоалкил.
Альтернативно, R12 и R13, указанные выше, предпочтительно могут быть взяты вместе с атомами азота, к которым они присоединены, с образованием 3-10-членного гетероциклила или 5-10-членного гетероарила, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, и особенно предпочтительно 3-10-членного гетероциклилалкила. В особенности, пиперазинильная группа, морфолинильная группа, пирролидинильная группа, и пиперидинильная группа являются более предпочтительными.
R14, указанный выше, предпочтительно означает C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы P, или 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, и более предпочтительно означает C1-4 алкил или C1-4 галоалкил.
R15, указанный выше, предпочтительно означает C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы P, или 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q.
R16, указанный выше, предпочтительно означает C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы P, или 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, и более предпочтительно означает C1-4 алкил.
R17, указанный выше, предпочтительно означает водород или C1-4 алкил, и более предпочтительно водород.
R18, указанный выше, предпочтительно означает C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы P, или 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, и более предпочтительно означает C1-4 алкил.
R19, указанный выше, предпочтительно означает водород, C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, или 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, и более предпочтительно означает водород, или 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q. В особенности, этот 3-10-членный гетероциклил более предпочтительно представляет собой пиперазинильную группу, морфолинильную группу, пирролидинильную группу, или пиперидинильную группу.
R20, указанный выше, предпочтительно означает C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил.
R21, указанный выше, предпочтительно означает C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил.
R22, указанный выше, предпочтительно означает водород, C1-4 алкил, или C1-4 галоалкил.
R23, указанный выше, предпочтительно означает водород, C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил.
R24, указанный выше, предпочтительно означает водород, C1-4 алкил, или C1-4 галоалкил.
R25, указанный выше, предпочтительно означает C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил.
R26 и R27, указанные выше, предпочтительно могут быть одинаковыми или разными, и каждый означает водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил), C1-3 алкилсульфонил C1-4 алкил, или 3-10-членное алициклическое кольцо.
Альтернативно, R26 и R27, указанные выше, предпочтительно могут быть взяты вместе с атомами азота, к которым они присоединены, с образованием 3-10-членного гетероциклила или 5-10-членного гетероарила.
R28 и R29, указанные выше, предпочтительно могут быть одинаковыми или разными, и каждый означает водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил), C1-3 алкилсульфонил C1-4 алкил, или 3-10-членное алициклическое кольцо.
Альтернативно, R28 и R29, указанный выше, предпочтительно могут быть взяты вместе с атомами азота, к которым они присоединены, с образованием 3-10-членного гетероциклила или 5-10-членного гетероарила.
R30, указанный выше, предпочтительно означает C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил.
R31, указанный выше, предпочтительно означает C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил.
R32, указанный выше, предпочтительно означает C1-4 алкил, или C6-10 арил.
Предпочтительные заместители, включенные в группу P, определенную выше, представляют собой галоген, C1-4 алкил, C1-4 галоалкил, -OH, C1-3 алкокси, C1-3 галоалкокси, 3-10-членный гетероциклиламино, -SO2R, -CN, -NO2, и 3-10-членный гетероциклил; и более предпочтительно галоген, C1-4 галоалкил, C1-3 алкокси, C1-3 галоалкокси, и 3-10-членный гетероциклил. В особенности, этот 3-10-членный гетероциклил особенно предпочтительно представляет собой морфолинильную группу.
Предпочтительные заместители, включенные в группу Q, определенную выше, представляют собой галоген, C1-4 алкил, C1-4 галоалкил, -OH, C1-3 алкокси, C1-6 моногидроксиалкил, C1-6 дигидроксиалкил, C1-6 тригидроксиалкил, 3-10-членный гетероциклиламино, -SO2R, -CN, -NO2, C3-7 циклоалкил, -COR19, и 3-10-членный гетероциклил, который необязательно замещен C1-4 алкилом; и более предпочтительно галоген, C1-4 алкил, C1-4 галоалкил, -OH, C1-3 алкокси, C1-6 моногидроксиалкил, -SO2R16, C3-7 циклоалкил, -COR19, и 3-10-членный гетероциклил, который необязательно замещен C1-4 алкилом. В особенности, этот 3-10-членный гетероциклил более предпочтительно представляет собой пиперазинильную группу, пиперидинильную группу, или морфолинильную группу.
В особенности, соединения настоящего изобретения включают, например:
(1) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(2) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-пирролидин-1-илметил-1Н-индол-2-ил)-метанон;
(3) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-гидрокси-пиперидин-1-илметил)-1Н-индол-2-ил]-метанон;
(4) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-пирроло[3,2-с]пиридин-2-ил)-метанон;
(5) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-пиперазин-1-илметил-1Н-индол-2-ил)-метанон;
(6) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-морфолин-4-ил-этокси)-1Н-индол-2-ил]-метанон;
(7) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(тетрагидро-пиран-4-илокси)-1Н-индол-2-ил]-метанон;
(8) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-хлор-1H-индол-2-ил)-метанон;
(9) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бром-1H-индол-2-ил)-метанон;
(10) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-йод-1H-индол-2-ил)-метанон;
(11) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-5-карбонитрил;
(12) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-бром-5-фтор-1Н-индол-2-ил)-метанон;
(13) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-этинил-1H-индол-2-ил)-метанон;
(14) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-фтор-фенил)-1H-индол-2-ил]-метанон;
(15) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-фтор-фенил)-1Н-индол-2-ил]-метанон;
(16) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-фтор-фенил)-1Н-индол-2-ил]-метанон;
(17) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-хлор-фенил)-1Н-индол-2-ил]-метанон;
(18) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-хлор-фенил)-1H-индол-2-ил]-метанон;
(19) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-хлор-фенил)-1H-индол-2-ил]-метанон;
(20) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-трифторметил-фенил)-1Н-индол-2-ил]-метанон;
(21) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-трифторметил-фенил)-1Н-индол-2-ил]-метанон;
(22) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-трифторметил-фенил)-1Н-индол-2-ил]-метанон;
(23) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-бром-1H-индол-2-ил)-метанон;
(24) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-фтор-пиридин-2-ил)-1Н-индол-2-ил]-метанон;
(25) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-метил-1H-индол-2-ил)-метанон;
(26) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4,4-дифтор-пиперидин-1-карбонил)-1H-индол-2-ил]-метанон;
(27) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(3,3-дифтор-пиперидин-1-карбонил)-1Н-индол-2-ил]-метанон;
(28) (2,2,2-трифтор-этил)-амид 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1H-индол-5-карбоновой кислоты;
(29) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(5-трифторметил-пиридин-2-ил)-1Н-индол-2-ил]-метанон;
(30) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(6-трифторметил-пиридин-2-ил)-1Н-индол-2-ил]-метанон;
(31) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(5-хлор-пиридин-2-ил)-1Н-индол-2-ил]-метанон;
(32) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-метил-пиридин-2-ил)-1Н-индол-2-ил]метанон;
(33) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-хлор-4-фтор-фенил)-1Н-индол-2-ил]-метанон;
(34) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-трифторметил-пиридин-2-ил)-1Н-индол-2-ил]-метанон;
(35) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-трифторметил-пиридин-2-ил)-1Н-индол-2-ил]метанон;
(36) [5-амино-1-(6-фтор-2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(37) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1Н-индол-6-карбоновую кислоту;
(38) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-гидроксиметил-1H-индол-2-ил)-метанон;
(39) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-{6-[2-(4-метил-пиперазин-1-ил)-этокси]-1H-индол-2-ил} -метанон;
(40) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-метил-оксетан-3-илметокси)-1Н-индол-2-ил]-метанон;
(41) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-фтор-пиперидин-1-илметил)-1Н-индол-2-ил]-метанон;
(42) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-{[бис(2-метокси-этил)-амино]-метил}-1Н-индол-2-ил)-метанон;
(43) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-{6-[(метил-проп-2-инил-амино)-метил]-1H-индол-2-ил}-метанон;
(44) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3,3-дифтор-пирролидин-1-илметил)-1Н-индол-2-ил]-метанон;
(45) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2,5-диметил-пирролидин-1-илметил)-1H-индол-2-ил]-метанон;
(46) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3,3-дифтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанон;
(47) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-((S)-3-метил-морфолин-4-илметил)-1Н-индол-2-ил]-метанон;
(48) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-бром-1H-индол-2-ил)-метанон;
(49) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-йод-1H-индол-2-ил)-метанон;
(50) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1H-пирроло[3,2-b]пиридин-2-ил)-метанон;
(51) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-бром-6-трифторметил-1Н-индол-2-ил)-метанон;
(52) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-йод-1H-индол-2-ил)-метанон;
(53) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-метил-1H-индол-2-ил)-метанон;
(54) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-изопропил-1H-индол-2-ил)-метанон;
(55) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(2-фтор-фенил)-1H-индол-2-ил]-метанон;
(56) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бензил-1H-индол-2-ил)-метанон;
(57) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(2-трифторметил-фенил)-1Н-индол-2-ил]-метанон;
(58) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3-фторфенил)-1Н-индол-2-ил]-метанон;
(59) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(3-трифторметил-фенил)-1Н-индол-2-ил]-метанон;
(60) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-этинил-1H-индол-2-ил)-метанон;
(61) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5Н-[1,3]диоксоло[4,5-1]индол-6-ил)-метанон;
(62) [5-амино-1-(7-фтор-2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(63) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(4-трифторметил-фенил)-1Н-индол-2-ил]-метанон;
(64) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бутокси-1H-индол-2-ил)-метанон;
(65) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1-метил-пиперидин-4-ил)-1Н-индол-2-ил]метанон;
(66) N-{2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-6-ил}-метансульфонамид;
(67) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(6-морфолин-4-ил-пиридин-3-ил)-1H-индол-2-ил]-метанон;
(68) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-бутил-1H-индол-2-ил)-метанон;
(69) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(1-метил-1H-пиразол-4-ил)-1Н-индол-2-ил]-метанон;
(70) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(5-метокси-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(71) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-метокси-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(72) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-циклопропил-1H-индол-2-ил)-метанон;
(73) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-метокси-фенил)-1H-индол-2-ил]-метанон;
(74) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-фенил-1H-индол-2-ил)-метанон;
(75) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-метансульфонил-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(76) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-изопропил-1H-индол-2-ил)-метанон;
(77) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-пиридин-2-ил-1H-индол-2-ил)-метанон;
(78) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-циклопропил-1H-индол-2-ил)-метанон;
(79) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-пиридазин-3-ил-1H-индол-2-ил)-метанон;
(80) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-изопропокси-1H-индол-2-ил)-метанон;
(81) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(2-метокси-этокси)-1Н-индол-2-ил]-метанон;
(82) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-циклопропилметокси-1H-индол-2-ил)-метанон;
(83) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(2,2-дифтор-5Н-[1,3]диоксоло[4,5-f]индол-6-ил)-метанон;
(84) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(3-хлор-пиридин-2-ил)-1Н-индол-2-ил]-метанон;
(85) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-фтор-пиридин-2-ил)-1Н-индол-2-ил]-метанон;
(86) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(6-морфолин-4-ил-пиридазин-3-ил)-1Н-индол-2-ил]-метанон;
(87) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-хлор-6-циклопропилметокси-1H-индол-2-ил)-метанон;
(88) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2,4-дифтор-фенил)-1Н-индол-2-ил]-метанон;
(89) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-пиридазин-4-ил-1H-индол-2-ил)-метанон;
(90) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(3-фтор-1H-индол-2-ил)-метанон;
(91) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(1-изопропил-пиперидин-4-ил)-6-трифторметил-1H-индол-2-ил]-метанон;
(92) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-6-карбонитрил;
(93) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(1,2,3,6-тетрагидро-пиридин-4-ил)-1Н-индол-2-ил]-метанон;
(94) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-пиперидин-4-ил-1H-индол-2-ил)-метанон;
(95) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-((R)-3-фтор-пирролидин-1-илметил)-1H-индол-2-ил]-метанон;
(96) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-фтор-5-пиперидин-4-ил-1Н-индол-2-ил)-метанон;
(97) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-фтор-5-(1-метил-пиперидин-4-ил)-1H-индол-2-ил]-метанон;
(98) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1-изопропил-пиперидин-4-ил)-1Н-индол-2-ил]-метанон;
(99) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-фтор-5-(1-изопропил-пиперидин-4-ил)-1Н-индол-2-ил]-метанон;
(100) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-пиридин-3-ил-1Н-индол-2-ил)-метанон;
(101) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(6-морфолин-4-ил-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(102) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-пиридин-3-ил-1Н-индол-2-ил)-метанон;
(103) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(6-пиперазин-1-ил-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(104) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(6-гидрокси-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(105) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-фтор-5-(4-метил-пиперазин-1-илметил)-1H-индол-2-ил]-метанон;
(106) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-фтор-5-пирролидин-1-илметил-1H-индол-2-ил)-метанон;
(107) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(1-метил-пиперидин-4-ил)-1Н-индол-2-ил]-метанон;
(108) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-морфолин-4-ил-фенил)-1Н-индол-2-ил]-метанон;
(109) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3,4,5,6-тетрагидро-2Н-[1,2′]бипиридин-5′-ил)-1Н-индол-2-ил]-метанон;
(110) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(6-пиперазин-1-ил-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(111) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(6-метокси-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(112) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-((S)-3-метил-морфолин-4-илметил)-1Н-индол-2-ил]-метанон;
(113) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-((R)-3-фтор-пирролидин-1-илметил)-1H-индол-2-ил]-метанон;
(114) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(2,5-диметил-пирролидин-1-илметил)-1H-индол-2-ил]-метанон;
(115) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3-фтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанон;
(116) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3,3-дифтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанон;
(117) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-{6-[2-(4-метил-пиперазин-1-ил)пиридин-4-ил]-1Н-индол-2-ил}-метанон;
(118) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-пиридин-4-ил-1H-индол-2-ил)-метанон;
(119) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4-фторпиперидин-1-илметил)-1H-индол-2-ил]-метанон;
(120) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4,4-дифтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанон;
(121) [5-амино-1-(2-дифторметил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(1-метил-пиперидин-4-ил)-1H-индол-2-ил]-метанон;
(122) [5-амино-1-(2-дифторметил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(123) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3,3-дифтор-пирролидин-1-илметил)-1H-индол-2-ил]-метанон;
(124) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(1-циклопентил-пиперидин-4-ил)-1Н-индол-2-ил]-метанон;
(125) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(1-циклогексил-пиперидин-4-ил)-1H-индол-2-ил]-метанон;
(126) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-бром-1H-пиррол-2-ил)-метанон;
(127) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-пиррол-2-ил)-метанон;
(128) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-фенил-1H-пиррол-2-ил)-метанон;
(129) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(3-хлор-фенил)-1Н-пиррол-2-ил]-метанон;
(130) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(4-фтор-фенил)-1H-пиррол-2-ил]-метанон;
(131) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(3-фтор-фенил)-1H-пиррол-2-ил]-метанон;
(132) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-морфолин-4-илметил-1Н-индол-2-ил)-метанон;
(133) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(2-морфолин-4-ил-этиламино)-1Н-индол-2-ил]-метанон;
(134) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4-метил-пиперазин-1-карбонил)-1Н-индол-2-ил]-метанон;
(135) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-морфолин-4-ил-этиламино)-1Н-индол-2-ил]-метанон;
(136) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(пиперазин-1-карбонил)-1H-индол-2-ил]-метанон;
(137) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(2-метокси-этиламино)-1Н-индол-2-ил]-метанон;
(138) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(2-гидрокси-1-гидроксиметил-этиламино)-1H-индол-2-ил]-метанон;
(139) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(2-пиридин-4-ил-этиламино)-1Н-индол-2-ил]-метанон;
(140) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(2-метокси-этиламино)-1Н-индол-2-ил]-метанон;
(141) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-морфолин-4-ил-1Н-индол-2-ил)-метанон;
(142) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4-морфолин-4-ил-1H-индол-2-ил)-метанон;
(143) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-морфолин-4-илметил-1H-индол-2-ил)-метанон;
(144) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-морфолин-4-илметил-1H-индол-2-ил)-метанон;
(145) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(морфолин-4-карбонил)-1Н-индол-2-ил]-метанон;
(146) [5-амино-1-(2-изопропил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(147) [5-амино-1-(2-пропил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(148) [5-амино-1-(1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(149) [5-амино-1-(2-трифторметил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(150) [5-амино-1-(2-этил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(151) [5-амино-1-(2-бензил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)метанон;
(152) 1-(4-{2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1H-индол-5-илметил}-пиперазин-1-ил)-этанон;
(153) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4-метансульфонил-пиперазин-1-илметил)-1Н-индол-2-ил]-метанон;
(154) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-пиперазин-1-илметил-1H-индол-2-ил)-метанон;
(155) 1-(4-{2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1H-индол-6-илметил}-пиперазин-1-ил)-этанон;
(156) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-метил-пиперазин-1-илметил)-1H-индол-2-ил]-метанон;
(157) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4-метил-пиперазин-1-илметил)-1H-индол-2-ил]-метанон;
(158) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-пирролидин-1-илметил-1H-индол-2-ил)-метанон;
(159) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-фтор-1H-индол-2-ил)-метанон;
(160) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-фтор-1H-индол-2-ил)-метанон;
(161) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-фтор-1H-индол-2-ил)-метанон;
(162) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-пирроло[2,3-b]пиридин-2-ил)-метанон;
(163) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-фтор-6-морфолин-4-илметил-1Н-индол-2-ил)-метанон;
(164) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1Н-индол-5-карбоновая кислота;
(165) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-метокси-1H-индол-2-ил)-метанон;
(166) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,6-диметокси-1H-индол-2-ил)-метанон;
(167) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-метокси-1H-индол-2-ил)-метанон;
(168) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-метокси-1H-индол-2-ил)-метанон;
(169) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,6-диметил-1H-индол-2-ил)-метанон;
(170) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-трет-бутил-1H-индол-2-ил)-метанон;
(171) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-изопропил-1H-индол-2-ил)-метанон;
(172) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бензилокси-1H-индол-2-ил)-метанон;
(173) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-бензилокси-1H-индол-2-ил)-метанон;
(174) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5,6-диметокси-1H-индол-2-ил)-метанон;
(175) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-трет-бутил-1H-индол-2-ил)-метанон;
(176) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-фтор-4-трифторметил-1Н-индол-2-ил)-метанон;
(177) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-фенокси-1H-индол-2-ил)-метанон;
(178) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-метилсульфанил-1H-индол-2-ил)-метанон;
(179) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-трет-бутил-1Н-индол-2-ил)-метанон;
(180) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-метил-1H-индол-2-ил)-метанон;
(181) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-этил-1H-индол-2-ил)-метанон;
(182) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-фтор-6-трифторметил-1H-индол-2-ил)-метанон;
(183) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-фтор-5-метокси-1Н-индол-2-ил)-метанон;
(184) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-хлор-5-метокси-1H-индол-2-ил)-метанон;
(185) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-хлор-6-метокси-1H-индол-2-ил)-метанон;
(186) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-изопропокси-1H-индол-2-ил)-метанон;
(187) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-бензилокси-1H-индол-2-ил)-метанон;
(188) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-изопропокси-1H-индол-2-ил)-метанон;
(189) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(2,3-дигидро-6Н-[1,4]диоксино[2,3-f]индол-7-ил)-метанон;
(190) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,6-ди-трет-бутил-1H-индол-2-ил)-метанон;
(191) 2-[5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1H-индол-4-карбонитрил;
(192) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-имидазол-1-ил-1Н-индол-2-ил)-метанон;
(193) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-трифторметилсульфанил-1H-индол-2-ил)-метанон;
(194) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-метилсульфанил-1H-индол-2-ил)-метанон;
(195) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-метансульфонил-1H-индол-2-ил)-метанон;
(196) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4,4-дифтор-пиперидин-1-илметил)-1H-индол-2-ил]-метанон;
(197) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-фтор-пиперидин-1-илметил)-1Н-индол-2-ил]-метанон;
(198) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(оксетан-3-илокси)-1Н-индол-2-ил]-метанон;
(199) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-гидрокси-1H-индол-2-ил)-метанон;
(200) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-метансульфонил-1H-индол-2-ил)-метанон;
(201) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,5-дибром-1H-пиррол-2-ил)-метанон;
(202) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,5-дифенил-1H-пиррол-2-ил)-метанон; и
(203) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,5-дипиридин-3-ил-1Н-пиррол-2-ил)-метанон,
(204) [5-амино-1-(2-метил-3H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-хлор-1H-индол-2-ил)-метанон;
(205) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-хлор-1H-индол-2-ил)-метанон;
(206) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-3-ил)-метанон;
(207) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1H-индол-6-ил)-метанон;
(208) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бром-6-фтор-1H-индол-2-ил)-метанон;
(209) [5-амино-1-(2-этил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бром-6-фтор-1H-индол-2-ил)-метанон;
(210) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-трифторметил-1H-индол-2-ил)-метанон;
(211) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(5-трифторметокси-1H-индол-2-ил)-метанон;
(212) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(4,6-дихлор-1H-индол-2-ил)-метанон;
(213) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-бром-4-фтор-1H-индол-2-ил)-метанон;
(214) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-трифторметокси-1H-индол-2-ил)-метанон;
(215) [5-амино-1-(2-этил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-трифторметокси-1H-индол-2-ил)-метанон;
(216) [5-амино-1-(2-этил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-трифторметил-1H-индол-2-ил)-метанон;
(217) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5,6-дихлор-1H-индол-2-ил)-метанон;
(218) [5-амино-1-(2-этил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-бром-5-фтор-1H-индол-2-ил)-метанон;
(219) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,5-дихлор-1H-индол-2-ил)-метанон;
(220) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,6-дифтор-1H-индол-2-ил)-метанон;
(221) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-хлор-пиридин-4-ил)-1Н-индол-2-ил]-метанон;
(222) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(6-метил-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(223) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-фтор-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(224) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-трифторметил-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(225) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(5-хлор-2-метокси-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(226) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(5-хлор-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(227) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-тиофен-3-ил-1Н-индол-2-ил)-метанон;
(228) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-хлорпиридин-3-ил)-1Н-индол-2-ил]-метанон;
(229) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-(6-тиофен-2-ил-1Н-индол-2-ил)-метанон;
(230) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-фтор-пиридин-4-ил)-1Н-индол-2-ил]-метанон;
(231) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-трифторметил-пиридин-4-ил)-1Н-индол-2-ил]-метанон;
(232) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3,3-дифтор-пирролидин-1-карбонил)-1Н-индол-2-ил]-метанон;
(233) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(2,6-диметил-морфолин-4-карбонил)-1Н-индол-2-ил]-метанон;
(234) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-([1,4′]бипиперидинил-1′-карбонил)-1H-индол-2-ил]-метанон;
(235) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-{5-[4-(2,2,2-трифтор-этил)-пиперазин-1-карбонил]-1Н-индол-2-ил}-метанон;
(236) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-{5-[4-(2-гидрокси-этил)-пиперазин-1-карбонил]-1Н-индол-2-ил}-метанон;
(237) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3,3,4,4-тетрафтор-пирролидин-1-карбонил)-1H-индол-2-ил]-метанон;
(238) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-((R)-3-фтор-пирролидин-1-карбонил)-1H-индол-2-ил]-метанон;
(239) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-((S)-3-фтор-пирролидин-1-карбонил)-1H-индол-2-ил]-метанон;
(240) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(4-метокси-фенил)-1Н-пиррол-2-ил]-метанон;
(241) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(3-метокси-фенил)-1Н-пиррол-2-ил]-метанон;
(242) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4,5-бис-(3-фтор-фенил)-1Н-пиррол-2-ил]-метанон;
(243) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4,5-бис-(4-метокси-фенил)-1H-пиррол-2-ил]-метанон;
(244) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(2,4-дифтор-фенил)-1Н-пиррол-2-ил]-метанон;
(245) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[4-(4-трифторметокси-фенил)-1Н-пиррол-2-ил]-метанон;
(246) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4,5-бис-(3-метокси-фенил)-1Н-пиррол-2-ил]-метанон;
(247) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-бензофуран-2-ил-метанона;
(248) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-бензо[b]тиофен-2-ил-метанона;
(249) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-бензотиазол-2-ил-метанона;
(250) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-фтор-фенил)-метанон;
(251) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(3-хлор-фенил)-метанон;
(252) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-хинолин-3-ил-метанона;
(253) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-хинолин-7-ил-метанона; и
(254) [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-хинолин-6-ил-метанона.
Вышеуказанные соединения настоящего изобретения, изображаемые формулой (I), и их фармацевтически приемлемые соли являются пригодными в качестве соединений, которые обладают активностью ингибирования киназ семейства рецептора фактора роста фибробластов (FGFR). Таким образом, соединения пригодны для предотвращения и/или лечения злокачественного новообразования (например, рака молочной железы, острой миелоцитарной лейкемии, рака поджелудочной железы, рака мочевого пузыря, рака предстательной железы, рака пищевода, ангиогенеза, рака желудка, рака тела матки, рака яичников, опухоли головного мозга (включая глиобластому), рака ободочной кишки, множественной миеломы, гепатоцеллюлярного рака, рака легкого (включая мелкоклеточный и немелкоклеточный рак легкого), и рака щитовидной железы.
Соединения настоящего изобретения и их соли могут быть составлены в виде таблеток, порошков, мелких гранул, гранул, покрытых таблеток, капсул, сиропов, пастилок, лекарственных форм для ингаляции, суппозиториев, инъекционных растворов, мазей, глазных мазей, глазных капель, капель для носа, ушных капель, горячих компрессов, лосьонов, и т.п. с помощью стандартных методов. Для приготовления препарата можно использовать обычные наполнители, связующие вещества, смазывающие вещества, красители, вкусовые вещества, и при необходимости, стабилизаторы, эмульгаторы, вещества, способствующие всасыванию, поверхностно-активные вещества, средства для регулирования уровня рН, консерванты, антиоксиданты, и т.п. Соединения настоящего изобретения вводят в препарат путем объединения компонентов, которые обычно используют в качестве веществ для фармацевтический препаратов, используя обычные методы.
Например, для приготовления пероральных препаратов, соединения настоящего изобретения или их фармацевтически приемлемые соли объединяют с наполнителями, и при необходимости, связующими веществами, дезинтегрирующими средствами, смазывающими веществами, красителями, вкусовыми веществами, и т.п.; и затем смеси переводят в порошки, мелкие гранулы, гранулы, таблетки, покрытые таблетки, капсулы, и т.п. с помощью стандартных методов.
Компоненты включают, например, животные и растительные масла, такие как соевое масло, говяжье сало, и синтетические глицериды; углеводороды, такие как жидкий парафин, сквалан, и твердый парафин; сложные эфиры масел, такие как октилдодецилмиристат и изопропилмиристат; высшие спирты, такие как цетостеариловый спирт и бегениловый спирт; силиконовые смолы;
силиконовые масла; поверхностно-активные вещества, такие как полиоксиэтиленовые сложные эфиры жирной кислоты, сорбитановые сложные эфиры жирной кислоты, глицериновые сложные эфиры жирной кислоты, полиоксиэтиленсорбитановые сложные эфиры жирной кислоты, полиоксиэтиленовые производные гидрированных касторовых масел, и блок-сополимеры полиоксиэтилен/полиоксипропилена; водорастворимые полимеры, такие как гидроксиэтилцеллюлоза, полиакриловые кислоты, карбоксивиниловые полимеры, полиэтиленгликоль, поливинилпирролидон, и метилцеллюлоза; низшие спирты, такие как этанол и изопропанол; полиспирты, такие как глицерин, пропиленгликоль, дипропиленгликоль, и сорбит; сахариды, такие как глюкоза и сахароза; неорганические порошки, такие как кремниевый ангидрид, алюмосиликат магния, и алюмосиликат; и очищенная вода.
Наполнители включают, например, лактозу, кукурузный крахмал, сахарозу, глюкозу, маннит, сорбит, кристаллическую целлюлозу, и диоксид кремния.
Связующие вещества включают, например, поливиниловый спирт, поливиниловый простой эфир, метилцеллюлозу, этилцеллюлозу, гуммиарабик, трагакант, желатин, шеллак, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, поливинилпирролидон, блок-сополимер полипропиленгликоль/полиоксиэтилена, и меглумин.
Дезинтегрирующие средства включают, например, крахмал, агар, желатиновый порошок, кристаллическую целлюлозу, карбонат кальция, бикарбонат натрия, цитрат кальция, декстран, пектин, и карбоксиметилцеллюлозу кальция.
Смазывающие вещества включают, например, стеарат магния, тальк, полиэтиленгликоль, диоксид кремния, и отвержденное растительное масло.
Используют красители, одобренные для применения в качестве добавок для лекарственных средств. Используемые вкусовые вещества включают, например, какао-порошок, ментол, ароматические порошки, масло перечной мяты, борнеол, и порошок корицы.
Несомненно, эти таблетки и гранулы могут быть покрыты сахаром, или, при необходимости, другим подходящим покрытием. Альтернативно, когда приготовляют жидкие препараты, такие как сиропы и инъекционные растворы, соединения настоящего изобретения или их фармацевтически приемлемые соли объединяют со средствами для регулирования уровня рН, солюбилизаторами, агентами для придания изотоничности, или подобными средствами, и при необходимости, солюбилизирующими средствами, стабилизаторами, и подобными средствами, и затем приготовляют препарат, используя обычные методы.
Способы приготовления наружных препаратов не ограничены, и они могут быть приготовлены с помощью стандартных методов. Различные вещества, обычные для лекарственных средств, препаратов общего воздействия, косметических средств и т.п. могут быть использованы в качестве основных веществ для их изготовления. В особенности, примеры используемых в качестве основы веществ включают животные и растительные масла, минеральные масла, сложноэфирные масла, воск, высшие спирты, жирные кислоты, силиконовые масла, поверхностно-активные вещества, фосфолипиды, спирты, полиспирты, водорастворимые полимеры, глинистые минералы, и очищенную воду. Кроме того, при необходимости, возможно добавление средств для регулирования уровня рН, антиоксидантов, хелатирующих агентов, консервантов, красителей, вкусовых веществ, и т.п. Однако основные вещества для наружных препаратов настоящего изобретения не ограничены перечисленным.
Кроме того, при необходимости, препараты можно объединять с компонентами, которые проявляют активность индуцирования дифференцировки, или компонентами, такими как улучшающие кровообращение средства, антибактериальные средства, противовоспалительные средства, клеточные активаторы, витамины, аминокислоты, смачивающие средства, кератолитические средства. Вышеописанные основные вещества могут быть добавлены в количестве, которое обеспечивает концентрацию, типично выбираемую при изготовлении наружных препаратов.
При введении соединений настоящего изобретения, их солей или гидратов, их лекарственные формы практически не ограничены, и они могут быть введены перорально или парентерально обычно используемыми методами. Соединения можно приготовить и вводить в виде таблеток, порошков, гранул, капсул, сиропов, пастилок, лекарственных форм для ингаляции, суппозиториев, инъекционных растворов, мазей, глазных мазей, глазных капель, капель для носа, ушных капель, горячих компрессов, лосьонов, и т.п.
Дозировка лекарственных средств настоящего изобретения может быть надлежащим образом выбрана в зависимости от тяжести симптома, возраста, пола, массы тела, метода введения, типа соли, конкретного типа заболевания и подобного.
Дозировка сильно изменяется в зависимости от типа заболевания, тяжести симптома, возраста, пола, восприимчивости пациента к средству и т.п. Типично, средство вводят взрослым один или несколько раз в сутки при суточной дозе приблизительно 0.03-1000 мг, предпочтительно 0.1-500 мг, и более предпочтительно 0.1-100 мг. При применении путем инъекции, суточная доза типично составляет приблизительно 1-3000 мкг/кг, предпочтительно приблизительно 3-1000 мкг/кг.
При получении соединений настоящего изобретения, вещества - соединения и различные реагенты могут образовывать соли, гидраты, или сольваты. Тип варьируется в зависимости от используемого исходного вещества, растворителя и т.п., и особым образом не ограничен, при условии отсутствия ингибирующего действия на реакции.
Используемые растворители варьируют в зависимости от исходного вещества, реагента и т.п., и, как и следовало ожидать, они практически не ограничены при условии, что они могут растворять исходные вещества в определенной степени без ингибирования реакций.
Различный изомеры (например, геометрические изомеры, оптические изомеры на основе асимметрических атомов углерода, поворотные изомеры, стереоизомеры, и таутомеры) могут быть очищены и выделены с помощью обычных методов разделения, таких как перекристаллизация, методы с использованием солей диастереоизомеров, методы разделения с использованием ферментов, различные хроматографические методы (например, тонкослойная хроматография, колоночная хроматография, высокоэффективная жидкостная хроматография, и газовая хроматография).
В случае, если соединение настоящего изобретения получают в свободной форме, оно может быть превращено с помощью стандартных методов в его соль или гидрат, который может образовываться из соединения настоящего изобретения. В случае, если соединение настоящего изобретения получают в виде его соли или гидрата, последние могут быть превращены с помощью стандартных методов в свободную форму соединения настоящего изобретения.
Соединения настоящего изобретения могут быть очищены и выделены с использованием обычных методов химии, таких как экстрагирование, концентрирование, отгонка, кристаллизация, фильтрация, перекристаллизация, и различные хроматографические методы.
Все документы известного уровня техники, цитируемые в этом описании, включены в этот документ посредством ссылки.
Общие методы получения соединений настоящего изобретения и рабочие примеры описываются ниже.
Соединения настоящего изобретения могут быть синтезированы с помощью различных методов. Некоторые из них иллюстрируются со ссылкой на схемы, приведенные ниже. Схемы предназначены для иллюстративных целей, и настоящее изобретение не ограничивается химическими реакциями и условиями, показанными в этом документе. В схемах, показанных ниже, некоторые заместители могут быть упущены для ясности, но это не предназначено для ограничения раскрытия данных схем. Репрезентативные соединения настоящего изобретения могут быть синтезированы с использованием подходящих промежуточных соединений, известных соединений и реагентов.
Получение соединения, изображаемого формулой (I)
Схема А показывает способ получения соединения, изображаемого формулой (I).
В схемах и общих способах получения ниже, определения R1 и других переменных показываются в каждой схеме или общем способе получения. R33-R37 принимаю значения, определенные ниже:
R33 означает алкильную группу.
R34 и R35 каждый означает алкильную группу. Альтернативно, множество R34 или множество R35 вместе образует кольцо.
R36 означает алкильную группу. Альтернативно, множество R36 вместе образует кольцо.
R37 означает алкильную или арильную группу.
Схема А
Соединение формулы (I), в которой R1, R2, R3, и R4 определяются, как в соединении, изображаемом общей формулой (I), указанной выше, может быть получено с помощью способа, описанного ниже.

2-Кетоацетонитрил формулы (2) получают по реакции между сложным эфиром карбоновой кислоты, изображаемым формулой (1), и анионом ацетонитрила, который образуют путем обеспечения действия основания на ацетонитрил.
Соединение, изображаемое формулой (1), является доступным для приобретения или может быть получено методами, известными в данной области техники. Например, сложные эфиры арил/гетероарилкарбоновой кислоты формулы (1), такие как сложный этиловый эфир индол-2-карбоновой кислоты, сложный этиловый эфир бензофуран-2-карбоновой кислоты, сложный метиловый эфир бензотиофен-2-карбоновой кислоты, сложный метиловый эфир пиррол-2-карбоновой кислоты, и сложный метиловый эфир хинолин-6-карбоновой кислоты, являются доступными для приобретения. Другие соединения могут быть получены путем нагревания соответствующих карбоновых кислот в спирте (R33OH) в присутствии кислоты (например, серной кислоты). Альтернативно, метиловый сложный эфир формулы (1), в которой R33 означает метильную группу, может быть получен по реакции с триметилсилилдиазометаном или диазометаном в растворителе (например, дихлорметане или метаноле).
Соединение формулы (2) может быть получено методами, известными в данной области техники. Его можно получить путем обработки ацетонитрила основанием (например, диизопропиламидом лития или н-бутиллитием), и затем реакции получающегося в результате аниона ацетонитрила со сложным эфиром арил/гетероарилкарбоновой кислоты.
Соединение формулы (3) может быть получено методами, известными в данной области техники. 2-Кето-3-диметиламино-акрилонитрил формулы (3) может быть получен с помощью реакции 2-кетоацетонитрила формулы (2) с диметилацеталем N,N-диметилформамида в растворителе (например, толуоле или тетрагидрофуране).
Соединение формулы (4) может быть получено методами, известными в данной области техники. 2-Кето-3-алкокси-акрилонитрил формулы (4) может быть получен с помощью реакции 2-кетоацетонитрила формулы (2) и триалкилортоформиата в растворителе (например, ацетонитриле, хлороформе, или уксусном ангидриде) при нагревании.
Соединение формулы (I) может быть получено методами, известными в данной области техники. 5-Амино-кетопиразол формулы (I) может быть получен с помощью реакции 2-кето-3-диметиламино-акрилонитрила формулы (3) с бензимидазол-5-илгидразином формулы (5) в присутствии или отсутствии основания (например, триэтиламина или пиридина) в растворителе (например, этаноле или N,N-диметилацетамиде); или реакции 2-кето-3-алкокси-акрилонитрила формулы (4) с бензимидазол-5-илгидразином формулы (5) или соединением, в котором гидразин в формуле (5) защищен (например, N-бензгидрилиден-N′-(2-метил-1Н-бензимидазол-5-ил)-гидразином, сложным трет-бутиловым эфиром N′-(2-метил-1Н-бензимидазол-5-ил)-гидразинкарбоновой кислоты, или сложным трет-бутиловым эфиром N-трет-бутоксикарбонил-N'-(2-метил-1Н-бензимидазол-5-ил)-гидразинкарбоновой кислоты), в присутствии или отсутствии основания (например, триэтиламина или пиридина) в растворителе (например, в этаноле или N,N-диметилацетамиде).
Когда синтезируют соединения с кольцом А, содержащим NH группу, такую как индол или пиррол, в некоторых случаях используют сложный эфир формулы (1) с образованием аминопиразольного кольца по реакциям соединения формулы (3) или (4) и соединения формулы (5), и затем проводят снятие защитных групп с получением соединения формулы (I) с кольцом А, содержащим NH группу.
Защитные группы для индола включают арилсульфонильные группы (например, бензолсульфонильную группу и толуолсульфонильную группу).
Соединение формулы (1), в которой кольцо А означает индольное кольцо, защищенное арилсульфонильной группой может быть получено с помощью реакции соединения формулы (I), в которой кольцо А означает незащищенный индол, с арилсульфонилхлоридом (например, бензилгалогенидом или п-метоксибензилгалогенидом) в растворителе (например, тетрагидрофуране или диметилформамиде) в присутствии основания (например, гидрида натрия или диизопропилэтиламина).
Защитные группы для пиррола включают бензильные группы (например, бензильную группу и п-метоксибензильную группу). Соединение формулы (1), в которой А означает пиррольное кольцо, защищенное бензильной группой, может быть получено с помощью реакции соединения формулы (I), в которой А означает незащищенный пиррол, с бензилгалогенидом (например, бензилхлоридом, бензилбромидом, или 4-метоксибензилбромидом) в растворителе (например, тетрагидрофуране или диметилформамиде).
Если соединение формулы (1) с требуемым R1 или R2 не доступно для приобретения, можно синтезировать сложный эфир формулы (1), содержащий требуемый R1 или R2 с помощью любого из способов (а)-(y), описанных ниже, и затем синтезировать соединение формулы (I) способом, аналогичным приведенному на схеме А. Альтернативно, соединение формулы (I) с изменяемым заместителем R1 или R2 может быть синтезировано и затем превращено в соединение с требуемым заместителем R1 или R2.
Превращение заместителя R1 или R2 может быть достигнуто с помощью любого из способов (а)-(y), описанных ниже.

Способ (а)
Если R1 означает эфир (-OR5), соединение формулы (I) может быть получено по реакции Мицунобу между спиртом (R5OH) и соединением формулы (6), в которой R1 означает гидроксильную группу, или посредством реакции этерификации в присутствии основания между соединением формулы (6), в которой R1 означает гидроксильную группу, и R5X, содержащим уходящую группу X, такую как галоген или алкилсульфонилокси группа.
Альтернативно, сложный эфир формулы (1), в которой R1 означает эфир (-OR5) может быть получен по реакции Мицунобу между спиртом (R5OH) и сложным эфиром формулы (7), в которой R1 имеет гидроксильную группу, или посредством этерификации в присутствии основания между сложным эфиром формулы (7) и R5X, содержащим уходящую группу X, такую как галоген или алкилсульфонилокси группа.
Сложный эфир формулы (1), в которой R1 означает эфир (-OR5), может быть использован для получения соединения формулы (I), в которой R1 означает эфир (-OR5), способом, аналогичным приведенному на схеме А.
В общем, реакцию Мицунобу можно проводить с использованием спирта (R5OH) и соединения, содержащего гидроксильную группу, в растворителе (например, тетрагидрофуране или диоксане) в присутствии азосоединения (например, диэтилазодикарбоксилата или диизопропилазодикарбоксилата), фосфина (например, трифенилфосфина или три-н-бутилфосфина).
В общем, этерификация может быть проведена путем нагревания соединения, содержащего гидроксильную группу, и R5X, содержащего уходящую группу X, такую как галоген или алкилсульфонилокси группа, в растворителе (например, диметилформамиде или тетрагидрофуране) в присутствии основания (например, гидрида натрия или карбоната калия).

Способ (b)
Соединение формулы (I), в которой R1 означает аминогруппу (NR6R7), может быть получено с помощью реакции соединения формулы (8), содержащего галоген, с амином (NR6R7) при комнатной температуре или при нагревании в присутствии основания (например, карбоната цезия, трет-бутилата натрия, или фосфата калия) и лиганда (например, N,N-диметилглицина, 1,10-фенантролина, или три-трет-бутилфосфина) в растворителе (например, диметилсульфоксиде, диметилформамиде, толуоле, или диоксане), с использованием медного катализатора (например, йодида меди) или палладиевого катализатора (например, ацетата палладия).

Способ (с)
Соединение формулы (I), в которой R1 означает аминометильную группу (-(CR8R9)nZ1, R8=R9=H), может быть получено посредством реакции восстановительного аминирования между амином (NHR8R9) и соединением формулы (9), содержащим альдегидную группу. Альтернативно, сложный эфир формулы (1), в которой R1 означает аминометильную группу (-(CR8R9)nZ1, R8=R9=H), может быть получен посредством реакции восстановительного аминирования между амином (NHR8R9) и сложным эфиром формулы (10), содержащим альдегидную группу. Соединение формулы (I), в которой R1 означает аминометильную группу (-(CR8R9)nZ1, R8=R9=H), может быть получено способом, аналогичным приведенному на схеме А, с использованием сложного эфира формулы (1), в которой R1 означает аминометильную группу (-(CR8R9)nZ1, R8=R9=H).
В общем, реакция восстановительного аминирования может быть проведена с альдегидом и амином (NHR8R9), с использованием восстановителя (например, триацетоксиборогидрида натрия, цианоборогидрида натрия, или борогидрида натрия) в растворителе (например, дихлорметане, 1,2-дихлорэтане, или метаноле), в присутствии кислоты (например, уксусной кислоты) в некоторых случаях, при температуре в диапазоне от 0°C до комнатной температуры.

Способ (d)
Соединение формулы (I), в которой R1 означает амид (CONR12R13), может быть получено с помощью реакции карбоновой кислоты формулы (11) с амином (NHR12R13) в присутствии конденсирующего средства.
В общем, синтез амида выполняют путем превращения карбоновой кислоты в ацилгалогенид или активированный сложный эфир с использованием галогенирующего средства (например, тионилхлорида или оксалилхлорида) или активатора (например, этилхлорформиата), соответственно, и затем реакции промежуточного продукта с амином (NHR12R13) в растворителе (например, тетрагидрофуране, диметилформамиде, или дихлорметане).
Альтернативно, синтез амида выполняют путем синтеза активного сложного эфира из карбоновой кислоты с использованием конденсирующего средства (например, дициклогексилкарбодиимида) в присутствии основания (например, триэтиламина) в растворителе (например, тетрагидрофуране, диметилформамиде, или дихлорметане), и затем обработки получающегося активного сложного эфира амином (NHR12R13).

Способ (e)
Соединение формулы (I), в которой R1 означает сульфид (-SR14), может быть получено с помощью реакции тиола с соединением формулы (8), содержащим галоген, в присутствии основания (например, карбоната цезия, гексаметилдисилазида лития или фосфата калия) и катализатора (например, йодида меди, или ацетата палладия) в растворителе (например, диметилсульфоксиде или 1,2-диметоксиэтане) при нагревании.
Сложный эфир формулы (1), в которой R1 означает сульфид (-SR14), может быть получен с помощью реакции тиола со сложным эфиром формулы (12), содержащим галоген, в присутствии основания (например, карбоната цезия, гексаметилдисилазида лития или фосфата калия) и катализатора (например, йодида меди, или ацетата палладия) в растворителе (например, диметилсульфоксиде или 1,2-диметоксиэтане) при нагревании.
Альтернативно, сложный эфир формулы (1) может быть получен с помощью реакции сложного эфира формулы (12) с основанием (например, н-бутиллитием) при низкой температуре (от -80 до 0°C) в растворителе (например, диэтиловом эфире или тетрагидрофуране), и затем реакции промежуточного продукта с алкилсульфидом или диалкилдисульфидом. Сложный эфир формулы (1), в которой R1 означает сульфид (-SR14), может быть использован для получения соединения формулы (I), в которой R1 означает сульфид (-SR14), способом, аналогичным приведенному на схеме А.

Способ (f)
Соединение формулы (I), в которой R1 означает сульфоксид (-SO2R15), может быть получено путем обработки соединения формулы (13), содержащего сульфидную группу (-SR15), окислителем (например, м-хлорпербензойной кислотой, оксоном, или пероксидом водорода) в растворителе (например, дихлорметане, метаноле, или воде).

Способ (g)
Соединение формулы (I), в которой R1 означает сульфон (-SO2R16), может быть получено путем обработки соединения формулы (14), содержащего сульфид (-SR16), окислителем (например, м-хлорпербензойной кислотой, оксоном, или пероксидом водорода) в растворителе (например, дихлорметане, метаноле, или воде).
Сложный эфир формулы (1), в которой R1 означает сульфон (-SO2R16), может быть получен путем обработки сульфида формулы (15) окислителем (например, м-хлорпербензойной кислотой, оксоном, или пероксидом водорода) в растворителе (например, дихлорметане, метаноле, или воде). Сложный эфир формулы (1), в которой в качестве R1 присутствует сульфон (-SO2R16), может быть использован для получения соединения формулы (I), в которой R1 означает сульфон (-SO2R16), способом, аналогичным приведенному на схеме А.

Способ (h)
Соединение формулы (I), в которой R1 означает алкилсульфонамид (-NR17SO2R18), может быть получено с помощью реакции соединения формулы (8), в которой R1 означает галоген, с алкилом или арилсульфонамидом (HNR17SO2R18) в присутствии металла, такого как медь. Альтернативно, оно может быть получено с помощью реакции соединения формулы (16), содержащего аминогруппу (-NHR17), с алкил- или арилсульфонилгалогенидом.
Альтернативно, сложный эфир формулы (I), в которой R1 означает алкилсульфонамид (-NR17SO2R18); может быть получен с помощью реакции сложного эфира формулы (12), содержащего галоген, с алкил- или арилсульфонамидом (HNR17SO2R18) в присутствии металла, такого как медь.
Альтернативно, он может быть получен с помощью реакции сложного эфира формулы (17), содержащего аминогруппу (-NHR17), с алкилом, арилсульфонилгалогенидом, или т.п. Сложный эфир формулы (1), в которой R1 означает алкилсульфонамид (-NR17SO2R18), может быть использован для получения соединения формулы (I), в которой R1 означает алкилсульфонамид (-NR17SO2R18), способом, аналогичным приведенному на схеме А.
В общем, синтез из галогенного соединения выполняют с помощью реакции галогенного соединения с алкил- или арилсульфонамидом в присутствии основания (например, карбоната цезия или фосфата калия), катализатора (например, ацетата палладия или йодида меди), и, в некоторых случаях, лиганда (например, три-т-бутилфосфина или N,N-диметилглицина) в растворителе (например, диоксане, толуоле, или диметилформамиде) при нагревании.
В общем, синтез из аминного соединения выполняют с помощью реакции аминного соединения с алкил- или арил-сульфонилгалогенидом в присутствии основания (например, триэтиламина) в растворителе (например, дихлорметане).

Способ (i)
Соединение формулы (I), в которой R1 означает арил или гетероарил, может быть получено по реакции сочетания Сузуки между соединением формулы (8), содержащим галоген, и арилбороновой кислотой, гетероарилбороновой кислотой, сложным эфиром арилбороновой кислоты, или сложным эфиром гетероарилбороновой кислоты.
Альтернативно, сложный эфир формулы (1), в которой R1 означает арил или гетероарил, может быть получен по реакции сочетания Сузуки между сложным эфиром формулы (12), содержащим галоген, и арилбороновой кислотой, гетероарилбороновой кислотой, сложным эфиром арилбороновой кислоты, или сложным эфиром гетероарилбороновой кислоты. Сложный эфир формулы (1), в которой R1 означает арил или гетероарил, может быть использован для получения соединения формулы (I), в которой R1 означает арил или гетероарил, способом, аналогичным приведенному на схеме А.
В общем, реакцию сочетания Сузуки проводят путем нагревания арилгалогенида или гетероарилгалогенида вместе с арилбороновой кислотой, гетероарилбороновой кислотой, сложным эфиром арилбороновой кислоты, или сложным эфиром гетероарилбороновой кислоты в присутствии основания (например, фосфата калия или карбоната цезия) и катализатора (например, ацетата палладия или тетракистрифенилфосфина) в растворителе (например, диоксане или толуоле).

Способ (j)
Соединение формулы (I), в которой R1 означает цианогруппу, может быть получено с помощью реакции соединения формулы (8), содержащего галоген (X), с цианидом, таким как цианид меди.
В общем, цианидирование проводят путем нагревания галогенного соединения, алкилсульфонилокси соединения, или арилсульфонилокси соединения вместе с цианидирующим средством (например, цианидом меди(I) или цианидом калия) в растворителе (например, диметилформамиде или N-метилпирролидоне).

Способ (k)
Соединение формулы (I), в которой R1 означает алкильную группу, может быть получено по реакции Сузуки между соединением формулы (8), содержащим галоген, и алкилбороновой кислотой, сложным эфиром алкилбороновой кислоты, или трифторид бора-алкильным комплексом.
Сложный эфир формулы (1), в которой R1 означает алкильную группу, может быть получен по реакции Сузуки между сложным эфиром формулы (12), содержащим галоген, и алкилбороновой кислотой, сложным эфиром алкилбороновой кислоты, или трифторид бора-алкильным комплексом. Сложный эфир формулы (1), в которой R1 означает алкильную группу, может быть использован для получения соединения формулы (I), в которой R1 означает алкильную группу, способом, аналогичным приведенному на схеме А.
В общем, реакцию Сузуки проводят путем нагревания смесь галогенного соединения, производного бора (например, алкилбороновой кислоты, сложного эфира алкилбороновой кислоты, или трифторид бора-алкильного комплекса), и основания (например, карбоната калия или фосфата калия) в растворителе (например, ксилоле, толуоле, диметилформамиде, диоксане, или тетрагидрофуране) в присутствии палладиевого катализатора (например, ацетата палладия) и, в некоторых случаях, лиганда (например, трифенилфосфина).

Способ (l)
Соединение формулы (I), в которой R1 означает перфторалкильную группу, может быть получено с помощью реакции соединения формулы (8), содержащего галоген, с перфторалкилирующим средством.
Сложный эфир формулы (12), в которой R1 означает перфторалкильную группу, может быть получен с помощью реакции сложного эфира формулы (11), содержащего галоген, с перфторалкилирующим средством. Сложный эфир формулы (1), в которой R1 означает перфторалкильную группу, может быть использован для получения соединения формулы (I), в которой R1 означает перфторалкильную группу, способом, аналогичным приведенному на схеме А.
В общем, перфторалкилирование выполняют с помощью реакции галогенного соединения, меди (например, меди или йодида медь (I)), перфторалкилирующего средства (такого как перфторалкилкарбоксилат калия, триэтилсилилперфторалкил, или перфторалкилйодид) в растворителе (например, диметилсульфоксиде или диметилформамиде) при нагревании.

Способ (m)
Соединение формулы (I), в которой R1 означает алкинильную группу, может быть получено по реакции Соногашира соединения формулы (8), содержащего галоген.
Сложный эфир формулы (1), в которой R1 означает алкинильную группу, может быть получен по реакции Соногашира сложного эфира формулы (12), содержащего галоген. Сложный эфир формулы (1), в которой R1 означает алкинильную группу, может быть использован для получения соединения формулы (I), в которой R1 означает алкинильную группу, способом, аналогичным приведенному на схеме А.
В общем, реакцию Соногашира проводят путем реакции арилгалогенида или гетероарилгалогенида с алкинилирующим средством (например, триметилсилилацетиленом) в присутствии основания (например, триэтиламина или карбоната калия), медного катализатора (например, йодида меди(I)), и палладиевого катализатора (например, дихлорида бис(трифенилфосфин)палладия) в растворителе (например, тетрагидрофуране или толуоле) при нагревании.

Способ (n)
Соединение формулы (I), в которой R1 означает карбоксильную группу, может быть получено по реакции введения моноксида углерода в соединение формулы (8), содержащее галоген.
Сложный эфир формулы (1), в которой R1 означает карбоксильную группу, может быть получен по реакции введения моноксида углерода в сложный эфир формулы (12), содержащий галоген. Сложный эфир формулы (1), в которой R1 означает карбоксильную группу, может быть защищен по карбоксильной группе (например, трет-бутиловым сложным эфиром) и затем использован для получения соединения формулы (I), в которой R1 означает карбоксильную группу, способом, аналогичным приведенному на схеме А.
В общем, введение моноксида углерода выполняют с помощью реакции арилгалогенида или гетероарилгалогенида в присутствии основания (например, триэтиламина или карбоната натрия), палладиевого катализатора (например, ацетата палладия), и лиганда (например, трифенилфосфина) в растворителе (например, диметилсульфоксиде или воде) в атмосфере моноксида углерода. Альтернативно, введение выполняют с помощью реакции арилгалогенида или гетероарилгалогенида с основанием (например, н-бутиллитием) в растворителе (например, диэтиловом эфире или тетрагидрофуране) при низкой температуре (от -80 до 0°C), и затем реакции с моноксидом углерода.

Способ (о)
Соединение формулы (I), в которой R1 означает гидроксильную группу, может быть получено через деалкилирование соединения формулы (18), содержащего метокси группу или бензилокси группу.
В общем, деметилирование метокси группы выполняют с помощью реакции смеси метокси соединения и растворителя (например, дихлорметана) с кислотой Льюиса (например, трифторидом бора или хлоридом алюминия). Альтернативно, деметилирование выполняют с помощью реакции метокси соединения в присутствии гидрохлорида пиридина при нагревании.
В общем, дебензилирование бензилокси группы выполняют с помощью реакции в присутствии катализатора (например, палладия на угле или гидроксида палладия) в растворителе (например, метаноле) в атмосфере водорода.

Способ (p)
Соединение формулы (I), в которой R1 означает алифатический гетероциклил, может быть получено по реакции сочетания Сузуки соединения формулы (8), содержащего галоген, с (алифатический гетероциклил)бороновой кислотой или сложным эфиром (алифатический гетероциклил)бороновой кислоты.
Сложный эфир формулы (1), в которой R1 означает алифатический гетероциклил, может быть получен по реакции сочетания Сузуки сложного эфира формулы (12), содержащего галоген, с (алифатический гетероциклил)бороновой кислотой или сложным эфиром (алифатический гетероциклил)бороновой кислоты. Получающийся сложный эфир формулы (1), в которой R1 означает алифатический гетероциклил, может быть использован для получения соединения формулы (I), в которой R1 означает алифатический гетероциклил, способом, аналогичным приведенному на схеме А.
В общем, реакцию сочетания Сузуки алифатического гетероциклила выполняют с помощью реакции арилгалогенида или гетероарилгалогенида с (алифатический гетероциклил)бороновой кислотой или сложным эфиром (алифатический гетероциклил)бороновой кислоты в присутствии основания (например, фосфата калия) и палладиевого катализатора (например, тетракистрифенилфосфина) в растворителе (например, диоксане или воде) при нагревании.

Способ (q)
Соединение формулы (I), в которой R1 означает ацилокси (-OC(O)R21) может быть получено посредством реакции ацилирования между соединением формулы (6), в которой R1 означает гидроксильную группу, и ацилгалогенидом или ангидридом карбоновой кислоты.
В общем, ацилирование гидроксильной группы выполняют с помощью реакции гидроксильного соединения и ацилгалогенида или безводной карбоновой кислоты в присутствии основания (например, триэтиламина) в растворителе (например, дихлорметане или пиридине).

Способ (r)
Соединение формулы (I), содержащее карбамид (-NR22C(O)R23) в качестве R1, может быть получено с помощью ацилирования соединения формулы (19), содержащего аминогруппу (-NHR22).
Сложный эфир формулы (1), содержащий карбамид (-NR22C(O)R23) в качестве R1, может быть получен с помощью ацилирования сложного эфира формулы (20), содержащего аминогруппу (-NHR22).
В общем, ацилирование аминогруппы выполняют с помощью реакции аминного соединения с ацилгалогенидом или ангидридом карбоновой кислоты в присутствии основания (например, триэтиламина) в растворителе (например, дихлорметане или пиридине). Альтернативно, ацилирование выполняют с помощью реакции аминного соединения с карбоновой кислотой в присутствии основания (например, триэтиламина) и конденсирующего средства (например, дициклогексилкарбодиимида) в растворителе (например, тетрагидрофуране или дихлорметане).

Способ (s)
Соединение формулы (I), содержащее альдегид (C(O)R19; R19=H) или кетон (C(O)R19; R19 означает радикал другой, чем H) в качестве R1, может быть получено с помощью реакции введения источника карбонила в соединение формулы (8), содержащее галоген.
В общем, в синтезе альдегида, реакцию введения источника карбонила выполняют путем нагревания галогенного соединения в присутствии катализатора (например, ацетата палладия или тетракис(трифенилфосфин)палладия), основания (например, карбоната натрия или триэтиламина), и восстановителя (например, триэтилсилана) в растворителе (например, тетрагидрофуране или N,N-диметилформамиде), в атмосфере моноксида углерода при давлении окружающей среды или повышенном давлении. В то же время, в синтезе кетона, реакцию введения источника карбонила выполняют с использованием альдегида, производного енола - простого эфира, производного гидразона, или т.п., взамен моноксида углерода, в качестве источника карбонила.
Альтернативно, реакцию выполняют с помощью введения галогенного соединения в реакцию обмена галоген/металл с использованием основания (например, трет-бутиллития), с последующей реакцией с источником карбонила (например, N,N-диметилформамидом, N,N-диметилалкиламидом, или сложным эфиром карбоновой кислоты).

Способ (t)
Соединение формулы (I), содержащее тиоамид (-NR24C(S)R25) в качестве R1 может быть получено путем обработки соединения формулы (21), содержащего амид (-NR24C (O)R25), сульфирующим средством (например, реагентом Лавессона). Альтернативно, соединение формулы (I) может быть получено с помощью реакции между соединением формулы (22), содержащим аминогруппу (NHR24), и сложным эфиром тиокарбоновой кислоты.
В общем, тиокарбонилирование выполняют с помощью реакции карбамидного соединения с сульфирующим средством (например, Лавессона реагент), в растворителе (например, толуоле) при нагревании.
Реакцию между соединением формулы (22), содержащим аминогруппу (NHR24), и сложным эфиром тиокарбоновой кислоты выполняют путем реакции аминного соединения со сложным эфиром тиокарбоновой кислоты в растворителе (например, метаноле) при нагревании.

Способ (u)
Соединение формулы (I), содержащее тиоамид (-C(S)NR26R27) в качестве R1, может быть получено путем обработки соединения формулы (23), содержащего амид (-C(O)NR26R27), сульфирующим средством (например, реагентом Лавессона). Альтернативно, соединение формулы (I) может быть получено с помощью реакции между тиоизоцианатным производным и соединением формулы (8), содержащим галоген.
В общем, тиокарбонилирование выполняют с помощью реакции карбамидного соединения с сульфирующим средством (например, реагентом Лавессона) в растворителе (например, толуоле) при нагревании.
В общем, реакцию с тиоизоцианатным производным проводят путем обработки галогенного соединения основанием (например, т-бутиллитием) в растворителе (например, тетрагидрофуране или диэтиловом эфире) при низкой температуре (например, от -80 до 0°C), и затем реакции с тиоизоцианатным производным.

Способ (v)
Соединение формулы (I), содержащее сульфонамид (-SO2NR28R29) в качестве R1 может быть получено путем превращения соединения формулы (24), содержащего сульфоновую кислоту, в сульфонилгалогенид с использованием галогенирующего средства (например, тионилхлорида или оксихлорида фосфора), с последующей реакцией с амином (NHR28R29) в присутствии основания (например, триэтиламина) в растворителе (например, дихлорметане или пиридине).

Способ (w)
Соединение формулы (I), содержащее сложный эфир сульфоновой кислоты (-OSO2R30) в качестве R1, может быть получено с помощью реакции соединения формулы (6), содержащего гидроксильную группу, с сульфонилгалогенидом (R30SO2X) или ангидридом сульфоновой кислоты ((R30SO2)O) в присутствии основания (например, триэтиламина, пиридина, или гидрида натрия) в растворителе (например, дихлорметане или диметилформамиде).

Способ (х)
Соединение формулы (I), содержащее сложный эфир сульфоновой кислоты (-SO3R31) в качестве R1, может быть получено с помощью реакции соединения формулы (25), содержащего сульфонилгалогенид в качестве R1, со спиртом (R31OH) в присутствии основания (например, триэтиламина или 4-диметиламинопиридина) в растворителе (например, дихлорметане или диэтиловом эфире).
Альтернативно, соединение формулы (I) может быть получено с помощью реакции соединения формулы (24), содержащего сульфоновую кислоту в качестве R1, со спиртом (R31OH) в присутствии основания (например, триэтиламина, 4-диметиламинопиридина, или гидрида натрия) или катализатора (например, хлорида кобальта), в растворителе (например, дихлорметане или диэтиловом эфире). Альтернативно, соединение формулы (I) может быть получено с помощью реакции соединения формулы (24), содержащего сульфоновую кислоту в качестве R1, с галогенным соединением (R31X) в растворителе (например, ацетонитриле).

Способ (y)
Соединение формулы (I), содержащее триалкилсилильную группу (-Si(R32)3) в качестве R1 может быть получено путем обработки соединения формулы (8), содержащего галоген, основанием (например, н-бутиллитием) в растворителе (например, тетрагидрофуране) при низкой температуре (от -80 до 0°C), с последующей обработкой триалкилгалогенидом (XSi(R32)3).

Сложный эфир формулы (1), содержащий индол в качестве кольца А, является доступным для приобретения, или может быть получен с помощью способов, хорошо известных в данной области техники, например, с помощью способов (1)-(3), описанных ниже.

Способ (1)
Индол формулы (27), содержащий алкоксикарбонильную группу (C(O)OR33), может быть получен путем алкоксикарбонилирования индольного соединения формулы (26), которое защищают с помощью алкилсульфонильной или арилсульфонильной группы.
В общем, алкоксикарбонилирование выполняют с помощью реакции основания (например, диизопропиламида лития) с индольным соединением формулы (26), которое защищают с помощью алкилсульфонильной или арилсульфонильной группы, в растворителе (например, тетрагидрофуране), и затем реакции промежуточного продукта с источником карбонила (например, этилхлорформиатом).

Способ (2)
Индол формулы (29), содержащий алкоксикарбонильную группу (C(O)OR33), может быть получен как изложено ниже: пируватный сложный эфир вводят в реакцию с производным гидразина формулы (28) в растворителе (например, метаноле или этаноле) в кислых условиях (например, в соляной кислоте или уксусной кислоте) с получением производного гидразона; и это производное гидразона вводят в реакцию в растворителе (например, этаноле, дихлорметане, или толуоле) в кислых условиях (например, в соляной кислоте или метансульфоновой кислоте).

Способ (3)
Индол формулы (29), содержащий алкоксикарбонильную группу (C(O)OR33), может быть получен путем нагревания о-этиниланилинового производного формулы (30) в присутствии катализатора (например, ацетата меди) в растворителе (например, дихлорэтане) как описано в документе Hiroya, K. и др. (J. Org. Chem., 69, 1126, (2004)) или Hiroya, K. и др. (Tetra Hedron Letters, 43, 1277, (2002)).

Сложный эфир формулы (1), содержащий азаиндол в качестве кольца А, является доступным для приобретения, или может быть получен с помощью способов, хорошо известных в данной области техники, например, с помощью способов (4)-(7), описанных ниже.

Способ (4)
Азаиндол формулы (32), содержащий алкоксикарбонильную группу (C(O)OR33), может быть получен, как изложено ниже: пируватный сложный эфир вводят в реакцию с аминогалопиридином формулы (31) в растворителе (например, пиридине), как описано в Lachance, N. и др.. Synthesis, 15, 2571, (2005); и получающийся енамин нагревают в присутствии палладиевого катализатора (например, тетракис(трифенилфосфин)палладия) и основания (например, дициклогексилметиламина).
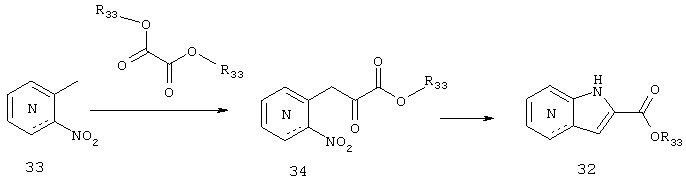
Способ (5)
Азаиндол формулы (32), содержащий алкоксикарбонильную группу (C(O)OR33), может быть получен, как описано в документе Romanelli, M.N. и др., Arkivoc, 286, (2004), путем синтеза промежуточного соединения формулы (34) с помощью реакции сложного эфира щавелевой кислоты с метилнитропиридином формулы (33) в присутствии основания (этилата натрия или т.п.) в растворителе (например, этаноле); с последующим каталитическим восстановлением в атмосфере водорода.

Способ (6)
Азаиндол формулы (32), содержащий алкоксикарбонильную группу (C(O)OR33), может быть получен путем термического разложения сложного эфира 2-азидо-3-пиридинакриловой кислоты формулы (35) в растворителе (например, мезитилене) путем нагревания, как описано в документе Roy, P.J. и др., Synthesis, 16, 2751, (2005).

Способ (7)
Азаиндол формулы (37), содержащий алкоксикарбонильную группу (C(O)OR33), может быть получен с помощью алкоксикарбонилирования азаиндольного соединения формулы (36), которое защищают с помощью алкилсульфонильной группы или арилсульфонильной группы.
В общем, алкоксикарбонилирование азаиндола в положение 2 выполняют, как изложено ниже: основание (например, диизопропиламид лития) вводят в реакцию с азаиндольным соединением формулы (36), которое защищают с помощью алкилсульфонильной группы или арилсульфонильной группы, в растворителе (например, тетрагидрофуране); и затем промежуточный продукт вводят в реакцию с источником карбонила (например, этилхлорформиатом).

Сложный эфир формулы (1), в которой А означает пиррольное кольцо, и либо один, либо оба R1 и R2 означают арильную (-ые) или гетероарильную (-ые) группу (-ы), может быть получен с помощью реакции сочетания Сузуки между монобромпирролом формулы (38) или дибромпирролом формулы (39), и арилбороновой кислотой, гетероарилбороновой кислотой, сложным эфиром арилбороновой кислоты, или сложным эфиром гетероарилбороновой кислоты.
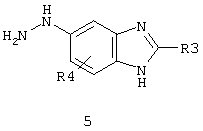
Бензимидазолил-5-гидразин формулы (5) является доступным для приобретения, или может быть получен с помощью способов, хорошо известных в данной области техники, например, с помощью способов (8)-(11), описанных ниже.

Бензимидазолил-5-гидразин формулы (5) может быть получен с помощью способов, хорошо известных в данной области техники.
Способ (8)
5-Нитробензимидазол формулы (41) получают с помощью реакции 4-нитро-1,2-фенилендиамина формулы (40) с карбоновой кислотой (R3COOH), альдегидом (R3CHO), сложным триэфиром ортокарбоновой кислоты (R3C(OR)3), или ацилгалогенидом (R3COX) в кислых условиях (например, в соляной кислоте или серной кислоте), или в присутствии кислоты Льюиса (например, комплекса трифторид бора/диэтиловый эфир или дихлороксоциркония (IV)), в растворителе (например, метаноле или ксилоле).
Анилиновое производное формулы (42) получают с помощью каталитического восстановления полученного соединения формулы (41) в атмосфере водорода в присутствии катализатора (например, палладия на угле или гидроксида палладия) в растворителе (например, метаноле или этаноле).
5-Бензимидазолил-5-гидразин формулы (5) получают путем последующего диазотирования в кислых условиях (например, в соляной кислоте) и восстановления с использованием хлорида олова(II) или т.п. (например, хлорида олова(II)). В то же время, 5-нитробензимидазол формулы (41) также можно получить с помощью нитрования бензимидазола формулы (43).
Функциональные группы могут быть изменены, например, с помощью способов, описанных в "Smith and March, March′s Advanced Organic Chemistry (пятое изд., John Wiley & Sons, 2001)" или "Richard C. Larock, Comprehensive Organic Transformations (VCH Publishers, Inc., 1989)". Соединения, использованные в качестве вещества для получения, могут быть доступными для приобретения, или при необходимости, могут быть получены с помощью общепринятых методов.
(Способ 9)
Альтернативно, соединение формулы (46) получали путем введения защитной группы в бензимидазольный фрагмент 5-галобензимидазола формулы (44) в реакционной системе. Используемой защитной группой предпочтительно является группа, которая может быть быстро и селективно удалена с целью снятия защиты на последующих стадиях. Методы выбора защитных групп и снятия защитных групп описываются, например, в Greene and Wuts, Protective Groups in Organic Synthesis (третье изд., John Wiley & Sons, 1999). Конкретные методы используются в зависимости от реакционных условий. Например, диметоксиметильную группу, триметилсилильную группу, п-метоксибензильную группу, тетрагидропиранильную группу, формильную группу, бензолсульфонильную группу или подобную группу моно вводить в качестве защитной группы в кислых или основных условиях. Когда вводят защитную группу, кислоты предпочтительно используют в диапазоне от приблизительно 1% до приблизительно 1 эквивалента. Кислоты включают неорганические кислоты, такие как соляная кислота; серная кислота или сульфоновые кислоты, такие как толуолсульфоновая кислота; карбоновые кислоты, такие как уксусная кислота, пропионовая кислота, и бензойная кислота; соли сильных кислот, такие как толуолсульфонат пиридиния; и вещества, которые образуют соляную кислоту в реакционной системе, такие как триметилсилилхлорид. Дополнительно к вышеуказанным кислотам Бренстеда, кислоты Льюиса, такие как галогениды металлов, включая хлорид цинка, хлорид магния, и хлорид лития также эффективно используют в реакции введения защитных групп. Когда вводят защитную группу, основания предпочтительно используют в количестве одного или более эквивалентов; или в некоторых случаях, в избыточном количестве, таком как приблизительно три эквивалента. Предпочтительно используемые основания включают гидриды металлов, такие как гидрид натрия и гидрид калия; карбонаты металлов, такие как карбонат калия и карбонат цезия; и алкоголяты металлов, такие как т-бутилат калия и т-бутилат натрия.
Затем добавляли основание для осуществления реакции обмена галоген/металл с получением промежуточного соединения, в котором галогенная группа формулы (46) замещена металлом. Галогенид алкиллития или алкилмагния предпочтительно используют в качестве основания. Более предпочтительные основания включают галогениды (низший алкил) магния, такие как хлорид изопропилмагния, бромид изопропилмагния, хлорид втор-бутилмагния, и хлорид циклогексилмагния. В реакции обмена галоген/металл предпочтительно используют растворители, которые обеспечивают стабильность металлосодержащих реагентов в реакционной системе. Растворители включают, например, эфирные растворители, такие как диэтиловый эфир, диметоксиэтан, и тетрагидрофуран. Предпочтительной температурой реакции является та, которая обеспечивает стабильность металлсодержащих реагентов в реакционной системе. Принимая во внимание известные реакции обмена галоген/металл, описанные в документах, предпочтительная температура колеблется от приблизительно -80°C до комнатной температуры, более предпочтительно от приблизительно -78°C до 15°C. Используемые в этом случае основания представляют собой доступные для приобретения растворы, или получены с использованием алкилгалогенидов и металлического лития или металлического магния. Промежуточное соединение, полученное в результате замены галогенной группы соединения формулы (46) металлом, обрабатывают производным азодикарбоновой кислоты (например, ди-трет-бутиловым сложным эфиром азодикарбоновой кислоты или сложным диэтиловым эфиром азодикарбоновой кислоты) с получением соединения формулы (47). Затем защитную группу для бензимидазола удаляют с целью снятия защиты с обеспечением защищенного гидразина формулы (45). Защищенный гидразин формулы (45) может быть очищен и выделен из реакционного раствора в свободной форме или в виде соли с подходящей кислотой. Подходящие кислоты включают не только неорганические кислоты, такие как соляная кислота, бромисто-водородная кислота, и серная кислота, но также и любые кислоты, которые полезны для кристаллизации и очистки. Кислоты включают, например, сульфоновые кислоты, такие как метансульфоновая кислота и толуолсульфоновая кислота, и карбоновые кислоты, такие как уксусная кислота, бензойная кислота, яблочная кислота, малеиновая кислота, и фумаровая кислота. В заключение, защитную группу для гидразина удаляют с целью снятия защиты с обеспечением бензимидазолилгидразина формулы (5). Снятие защитных групп может быть проведено в известных кислых или основных условиях, описанных в документах. Кислоты, используемые для снятия защитных групп, включают не только неорганические кислоты, такие как соляная кислота, бромисто-водородная кислота, и серная кислота, но также и сильные кислоты, включая карбоновые кислоты, такие как трифторуксусная кислота и пентафторпропионовая кислота, и сульфоновые кислоты, такие как метансульфоновая кислота и толуолсульфоновая кислота. При необходимости, реакционный раствор может быть разбавлен подходящим растворителем, и может быть проведено снятие защитных групп. Растворители, предпочтительно используемые в данном случае, включают амидные растворители, такие как ДМФА, DMA, и NMP. Представляющий интерес бензоимидазолилгидразин формулы (5) может быть получен путем обработки в таком растворителе в диапазоне температур приблизительно от температуры льда до температуры кипения растворителя. В то же время, основания, соответствующим образом используемые для снятия защитных групп, включают гидроксиды щелочных металлов, такие как гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия. Представляющий интерес бензоимидазолилгидразин формулы (5) может быть получен путем обработки в присутствии такого основания в спирту, таком как метанол или этанол, в диапазоне температур приблизительно от температуры льда до температуры кипения растворителя.
(Способ 10)
Альтернативно, бензимидазольный фрагмент 5-галобензимидазола формулы (44) защищают вышеописанной защитной группой в реакционной системе с обеспечением соединения формулы (46). Указанное соединение затем нагревают в присутствии производного гидразина (например, ди-трет-бутилоксикарбонилгидразина), основания (например, карбоната цезия или карбоната калия), катализатора на основе переходного металла (например, ацетата палладия, йодида меди, или бромида меди), лиганда (например, трифенилфосфина, N,N-диметилглицина, или N,N′-диметилэтилендиамина), в растворителе (например, N,N-диметилацетамиде). Таким образом, получают соединение формулы (47). Затем защитную группу для бензимидазола удаляют с целью снятия защиты с обеспечением защищенного гидразина формулы (45). В заключение, защитную группу для гидразина удаляют с целью снятия защиты с помощью способа, описанного выше, с обеспечением бензимидазолилгидразина формулы (5).
Способ (11)
Альтернативно, производное бороновой кислоты формулы (48) и производное гидразина (например, ди-трет-бутилоксикарбонилгидразин или ди-трет-бутиловый сложный эфир азодикарбоновой кислоты) перемешивают в присутствии основания (например, тетраметилэтилендиамина), медного катализатора (например, йодида меди, фторида меди, или ацетата меди) в растворителе (например, метаноле, тетрагидрофуране, или 1,2-диметоксиэтане) под атмосферой азота или на воздухе, в диапазоне температур от приблизительно комнатной температуры до температуры кипения растворителя. Таким образом получают защищенный гидразин формулы (45). В заключение, защитную группу для гидразина удаляют с целью снятия защиты с помощью способа, описанного выше с обеспечением бензимидазолилгидразина формулы (5).
Примеры
Настоящее изобретение более точно описано ниже со ссылкой на примеры и тестовые примеры, которые, однако, не предназначены для ограничения его объема. Все исходные вещества и реагенты быль получены от коммерческих поставщиков или синтезированы с помощью известных методов. Типично, Н-ЯМР спектры получали путем измерения, с или без Me4Si в качестве внутреннего стандарта, с использованием прибора ЕХ270 (JEOL), Mercury300 (Varian), ЕСР-400 (JEOL), или 400-MR (Varian) (s = синглет; d = дублет; t = триплет; brs = широкий синглет; m = мультиплет). Масс-спектрометрические измерения проводили с использованием масс спектрометра LCQ Classic (Thermo Electron), ZQ2000 (Waters), или ZMD4000 (Waters). Микроволны генерировали с использованием прибора Initiator™ (Biotage).
[Пример 1: Синтез
[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанона]


Водный раствор (1.67 мл) 4 М гидроксида натрия добавляли к этанольному раствору (17 мл) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1-бензолсульфонил-1Н-индол-2-ил)метанона (87 мг). Получающуюся смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в воду. Получающееся твердое вещество собирали с помощью фильтрования, промывали водой, и сушили с получением [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)метанона (40 мг, 63%).
1Н-ЯМР (ДМСО-D6) δ: 12.47 (1Н, s), 11.70 (1H, s), 8.32 (1H, s), 7.70 (1H, d, J = 8.0 Гц), 7.66-7.55 (2H, m), 7.50-7.45 (2H, m), 7.31-7.23 (2H, m), 7.10-7.06 (1H, m), 7.01 (2H, brs), 2.53 (3H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 357 [(М+Н)+]
[Пример 1А]
Синтез L-малата [5-амино-1-(2-метил-3H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанона
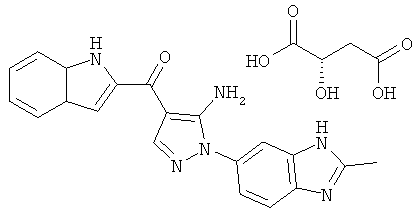
Заданные заранее количества L-яблочной кислоты (68 г, 0.507 моль) и гидрата [5-амино-1-(2-метил-3H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанона (190 г, 0.507 моль) растворяли в диметилсульфоксиде (0.418 л, 2.2 об./мас.) и ацетоне (0.418 л, 2.2 об./мас.). Затем получающийся раствор фильтровали с использованием фильтра Kiriyama rohto (№4 бумажный фильтр), и помещали в 10-л разборную колбу с рубашкой. Реакционный раствор нагревали при 50°C для растворения.
Заданное заранее количество L-яблочной кислоты (544.4 г, 4.06 моль) растворяли в ацетоне (1.25 л, 6.6 об./мас.) и уксусной кислоте (0.418 л, 2.2 об./мас.). Затем получающийся раствор фильтровали с использованием фильтра Kiriyama rohto (№4 бумажный фильтр), и помещали в 10-л разборную колбу с рубашкой при удержании внутренней температуры на значении 45°C или выше. Затравочные кристаллы (0.95 г, 0.5%) суспендировали в ацетоне (7.5 мл), и затем суспензию помещали в 10-л разборную колбу с рубашкой.
Через семь часов, суспензию охлаждали до 25°C. Кристаллы собирали с помощью фильтрования, используя фильтр Kiriyama rohto, и дважды промывали ацетоном (0.85 л, 5 об./мас.). Получающийся влажный порошок помещали в 10-л разборную колбу с рубашкой.
Ацетон (2.85 л, 15 об./мас.) добавляли в колбу, и суспензию перемешивали в течение трех часов при 50°C. Получающиеся кристаллы собирали с помощью фильтрования, используя фильтр Kiriyama rohto, и дважды промывали ацетоном (0.85 л, 5 об./мас.).
Получающийся влажный порошок сушили в течение трех часов при пониженном давлении при внешней температуре 40°C с обеспечением L-малата [5-амино-1-(2-метил-3H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанона (556.9 г, 73%).
1Н-ЯМР (ДМСО-D6) δ: 11.69 (1H, s), 8.31 (1H, s), 8.25-7.00 (10Н, m), 4.25-4.22 (1H, m), 3.33 (2H, brs), 2.69-2.32 (9H, m)
FAB режим определения положительных ионов m/z 157.1, 232.1, 289.2, 357.2 [(M+H)+]
[Пример 1В]
Синтез гидрохлорида [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанона

[5-Амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон (194 мг) растворяли в диметилформамиде (1.94 мл). Водный раствор 2 М соляной кислоты (300 мкл) разделяли на пять частей и отдельно по каплям добавляли к реакционной смеси при 25°C. 2-Пропанол (4 мл) разделяли на три части и отдельно добавляли к реакционному раствору за пятиминутные интервалы. Получающийся осадок собирали с помощью фильтрования, и промывали 2-пропанолом (1 мл). Затем порошок сушили при пониженном давлении при 40°C. Это давало опалесцирующий порошок (188 мг, 88%).
11.72 (1H, s), 8.39 (1H, s), 7.96 (1H, d, J = 2.1 Гц), 7.92 (1H, d, J = 8.7 Гц), 7.71 (1H, t, J = 2.1 Гц), 7.68 (1H, t, J = 2.1 Гц), 7.51 (1H, s), 7.48 (1H, d, J = 2.1 Гц), 7.28 (1H, d, J = 7.6 Гц), 7.23 (3 H, s), 7.09 (1H, t, J = 7.6 Гц), 2.82 (3 H, s).
ESI (ЖХ-МС режим определения положительных ионов) m/z 357 [(М+Н)+]
[Пример 1C]
Синтез моногидрата 1-метансульфоната [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанона

Водный раствор (64.9 мл) 2 М метансульфоновой кислоты добавляли к диметилформамидному раствору (420 мл) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанона (42 г). Смесь перемешивали при комнатной температуре в течение 20 минут. Затем к реакционному раствору добавляли метил-т-бутиловый эфир (105 мл). К раствору добавляли 3.0 мг затравочных кристаллов, и смесь перемешивали при комнатной температуре. После подтверждения осаждения кристаллов, метил-т-бутиловый эфир (105 мл) разделяли на четыре части и отдельно добавляли к реакционному раствору за 15-минутные интервалы. Реакционный раствор перемешивали при комнатной температуре в течение 1.5 часов. Получающиеся кристаллы собирали с помощью фильтрования, используя фильтр Kiriyama rohto. Твердое вещество собирали с помощью фильтрования, трижды промывали метил-т-бутиловым эфиром (210 мл), и сушили с обеспечением моногидрата 1-метансульфоната [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанона (42.68 г, 84%).
1Н-ЯМР (ДМСО-D6) δ: 11.70 (1Н, s), 8.39 (1H, s), 7.99 (1H, d, J = 1.6 Гц), 7.94 (1H, d, J = 8.8 Гц), 7.74-7.68 (2H, m), 7.51-7.46 (2H, m), 7.29-7.18 (3H, m), 7.11-7.06 (1H, m), 2.84 (3H, s), 2.37 (3H, s) □
ESI (ЖХ-МС режим определения положительных ионов) m/z 357 [(М+Н)+]
Соединения Примеров 2-35, перечисленные в Таблице 1 (см. графическую часть), синтезировали способом, подобным приведенному в Примере 1.
[Пример 36: Синтез
[5-амино-1-(6-фтор-2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанона]

[5-Амино-1-(6-фтор-2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1-бензолсульфонил-1Н-индол-2-ил)метанон (114 мг, 0.22 ммоль) растворяли в изопропаноле (2.2 мл), и к смеси добавляли 1 М водный раствор гидроксида натрия (2.2 мл). Получающуюся смесь нагревали при 90°C при перемешивании под атмосферой азота в течение двух часов. После реакционную смесь охлаждали до комнатной температуры, к ней добавляли воду и насыщенный водный раствор дигидрофосфата натрия. Продукт экстрагировали этилацетатом. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия, и сушили над сульфатом магния. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении, и получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (амино-силикагель; дихлорметан/метанол = 100/5) с получением [5-амино-1-(6-фтор-2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)метанона в виде желтого твердого вещества (75 мг, 89.8%).
1Н-ЯМР (ДМСО-D6) δ: 12.60 (1.0 H, brs), 11.70 (1.0 H, brs), 8.31 (1.0 Н, s), 7.69 (1.0 H, d, J = 7.6 Гц), 7.62 (1.0 H, d, J = 6.8 Гц), 7.55 (1.0 H, d, J = 10.7 Гц), 7.50-7.45 (2.0 H, m), 7.25 (1.0 H, dd, J = 7.6, 7.6 Гц), 7.08 (1.0 H, dd, J = 7.6, 7.6 Гц), 7.02 (2.0 Н, brs), 2.53 (3.0 Н, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 375 [(М+Н)+]
Соединения Примеров 37-63, перечисленные в Таблице 2 (см. графическую часть), синтезировали способом, подобным приведенному в Примере 36.
[Пример 64: Синтез
[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бутокси-1Н-индол-2-ил)-метанона]

Смесь, состоящую из [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-бутокси-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанона (70 мг), диоксана (3 мл), и водного раствора 5 М гидроксида натрия (300 мкл) перемешивали с обратным холодильником в течение двух часов. Реакционную смесь охлаждали в ванне со льдом, и подкисляли водным раствором 5 М соляной кислоты. Растворитель отгоняли при пониженном давлении. К остатку, полученному путем концентрирования при пониженном давлении, добавляли воду. Твердое вещество собирали с помощью фильтрования, промывали водой, и сушили с получением [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бутокси-1Н-индол-2-ил)-метанона (35 мг, 65%).
1Н-ЯМР (ДМСО-D6) δ: 12.45 (1Н, s), 11.54 (1Н, d, J = 1.8 Гц), 8.25 (1Н, s), 7.65-7.63 (1Н, brm), 7.57-7.55 (1Н, brm), 7.36 (1Н, d, J = 8.8 Гц), 7.32 (1Н, d, J = 1.8 Гц), 7.30-7.28 (1Н, brm), 7.12 (1Н, d, J = 2.4 Гц), 7.01 (1Н, brs), 6.95 (1Н, brs), 6.90 (1Н, dd, J = 8.8, 2.4 Гц), 3.98 (2Н, t, J = 6.4 Гц), 2.53 (3H, s), 1.76-1.69 (2H, m), 1.51-1.44 (2H, m), 0.95 (3H, t, J = 7.3 Гц)
ESI (ЖХ-МС режим определения положительных ионов) m/z 429 [(М+Н)+]
Соединения Примеров 65-89, и 204-239, перечисленные в Таблице 3 (см. графическую часть), синтезировали способом, подобным приведенному в Примере 64.
[Пример 90: Синтез
[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(3-фтор-1Н-индол-2-ил)-метанона]

[5-Амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[3-фтор-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанон (25.0 мг, 0.041 ммоль) растворяли в метансульфоновой кислоте (0.25 мл), и перемешивали при комнатной температуре в течение одного часа. Значение рН реакционной смеси устанавливали на 6, используя 1 М водный раствор гидроксида натрия. После экстрагирования этилацетатом, экстракт сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении, и получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол = 60/1-40/1) с получением [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(3-фтор-1Н-индол-2-ил)-метанона в виде бледно-желтого твердого вещества (8.7 г, с выходом 55%).
1Н-ЯМР (ДМСО-D6) δ: 12.48 (1H, s), 11.50 (1Н, s), 8.03 (1H, d, J = 3.1 Гц), 7.69 (1H, d, J = 8.5 Гц), 7.62 (2H, s), 7.45 (1Н, d, J = 8.5 Гц), 7.25-7.35 (2Н, m). 7.15 (1Н, t, J = 7.3 Гц). 7.05 (2H, s), 2.53 (3H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 375 [(М+Н)+]
Соединения Примеров 91-131, перечисленные в Таблице 4 (см. графическую часть), синтезировали способом, подобным приведенному в Примере 90.
[Пример 132: Синтез
[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-морфолин-4-илметил-1Н-индол-2-ил)-метанона]

[5-Амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1-бензолсульфонил-6-морфолин-4-илметил-1Н-индол-2-ил)-метанон (132 мг, 0.22 ммоль) растворяли в тетрагидрофуране (ТГФ) (1.0 мл), и затем к смеси добавляли 1 М тетрагидрофурановый (ТГФ) раствор фторида тетрабутиламмония (0.46 мл, 0.46 ммоль). Смесь нагревали при 65°C при перемешивании в течение 22 часов. Реакционную смесь затем охлаждали до комнатной температуры, и концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол=100/10) с получением [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-морфолин-4-илметил-1Н-индол-2-ил)-метанона в виде желтого твердого вещества (74 мг, 75%).
1Н-ЯМР (ДМСО-D6) δ: 12.48 (1.0Н, brs), 11.64 (1.0Н, brs), 8.30 (1.0Н, s), 7.64-7.60 (3.0H, m), 7.42-7.41 (2.0H, m), 7.29 (1.0H, dd, J=8.5, 2.2 Гц), 7.06 (1.0H, dd, J=8.3, 1.0 Гц), 6.99 (2.0H, brs), 3.58 (4.0H, t, J=4.4 Гц), 3.55 (2.0H, s), 2.53 (3.0H, s), 2.39-2.37 (4.0H, brm)
ESI (ЖХ-МС режим определения положительных ионов) m/z 456 [(М+Н)+]
Соединения Примеров 133-143, перечисленные в Таблице 5 (см. графическую часть), синтезировали способом, подобным приведенному в Примере 132.
[Пример 144: Синтез
[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-морфолин-4-илметил-1Н-индол-2-ил)-метанона]
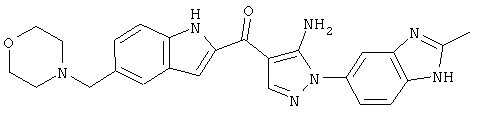
Карбонат цезия (1.29 г) добавляли к метанольному раствору (20 мл) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1-бензолсульфонил-5-морфолин-4-илметил-1Н-индол-2-ил)-метанона (110 мг), и перемешивали при комнатной температуре в течение 16 часов. Затем к реакционной смеси добавляли воду (5 мл) и водный раствор аммиака (3 мл) и перемешивали в течение трех часов. Реакционную смесь концентрировали при пониженном давлении. К получающемуся остатку добавляли воду. После экстрагирования этилацетатом, экстракт промывали насыщенным водным раствором хлорида натрия, и затем сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (метанол/дихлорметан = 0/100-20/100) с получением [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-морфолин-4-илметил-1Н-индол-2-ил)-метанона (33 мг).
1Н-ЯМР (ДМСО-D6) δ: 12.47 (1.0 H, s), 11.67 (1.0 H, s), 8.30 (1.0 H, s), 7.60 (3.0 H, m), 7.44 (2.0 Н, m), 7.30 (1.0 H, dd, J = 8.4, 2.1 Гц), 7.23 (1.0 H, dd, J = 8.4, 1.5 Гц), 7.01 (2.0 Н, m), 3.58 (4.0 Н, t, J = 4.4 Гц), 3.54 (2.0 Н, s), 2.55 (3.0 H, s), 2.38 (4.0 Н, m)
ESI (ЖХ-МС режим определения положительных ионов) m/z 456 [(М+Н)+]
Соединения Примеров 145-164, перечисленные в Таблице 6 (см. графическую часть), синтезировали способом, подобным приведенному в Примере 144.
Стадия 1: Синтез [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1-бензолсульфонил-1Н-индол-2-ил)-метанона (1001)

Дигидрохлорид (2-метил-1Н-бензимидазол-5-ил)-гидразина (830 мг) добавляли к этанольному раствору (15 мл) сырого 2-(1-бензолсульфонил-1Н-индол-2-карбонил)-3-диметиламиноакрилонитрила (1.17 г). Реакционную смесь нагревали при перемешивании с обратным холодильником в течение четырех часов. После охлаждения до комнатной температуры, смеси позволяли стоять при комнатной температуре. Осажденное твердое вещество собирали с помощью фильтрования, и промывали этанолом с получением [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1-бензолсульфонил-1Н-индол-2-ил)-метанона в виде желтого твердого вещества (1.5 г, с двухстадийным выходом 91%).
1Н-ЯМР (ДМСО-D6) δ: 8.15-8.13 (2Н, m), 8.02 (1Н, dd, J = 8.4, 0.8 Гц), 7.97 (1Н, d, J = 2.0 Гц), 7.92 (1Н, d, J = 8.8 Гц), 7.87 (1Н, s), 7.76-7.62 (5H, m), 7.49-7.45 (1Н, m), 7.36-7.26 (4H, m), 2.82 (3H, m)
ESI (ЖХ-МС режим определения положительных ионов) m/z 497 [(М+Н)+]
Соединения под номерами 1002-1082, и 1511-1527, перечисленные в Таблице 7 (см. графическую часть), синтезировали способом, подобным приведенному в описании Стадии 1.
[Примеры 165-195, и 247-254]
Соединения Примеров 165-195, и 247-254, перечисленные в Таблице 8 (см. графическую часть), синтезировали с использованием соединений, содержащих индольное кольцо с незащищенными атомами азота, способом, подобным приведенному в описании Стадии 1.
Стадия 2: Синтез 2-(1-бензолсульфонил-1Н-индол-2-карбонил)-3-диметиламино-акрилонитрила (1083)

Диметилацеталь N,N-диметилформамида (620 мкл) добавляли при комнатной температуре к тетрагидрофурановому (ТГФ) раствору (8.5 мл) 3-(1-бензолсульфонил-1Н-индол-2-ил)-3-оксо-пропионитрила (1.0 г, 3.08 ммоль), и перемешивали в течение десяти минут. Реакционную смесь затем концентрировали при пониженном давлении с получением сырого 2-(1-бензолсульфонил-1Н-индол-2-карбонил)-3-диметиламино-акрилонитрила в виде желтого аморфного вещества. Полученный сырой продукт использовали в последующих реакциях без очистки.
ESI (ЖХ-МС режим определения положительных ионов) m/z 380 [(М+Н)+]
Соединения под номерами 1084-1184, и 1528-1549, перечисленные в Таблице 9 (см. графическую часть), синтезировали способом, подобным приведенному в описании Стадии 2.
Стадия 3: Синтез 3-(1-бензолсульфонил-1Н-индол-2-ил)-3-оксо-пропионитрила (1185)

Ацетонитрил (10.6 г, 0.202 моль) добавляли к тетрагидрофурановому (ТГФ) раствору (135 мл) сложного этилового эфира 1-бензолсульфонил-1Н-индол-2-карбоновой кислоты (33.4 г, 0.101 моль), и охлаждали до -78°C. К смеси по каплям добавляли 1 М тетрагидрофурановый (ТГФ) раствор бис(триметилсилил)амида лития (213 мл, 0.213 моль), и перемешивали в течение 30 минут. К реакционной смеси добавляли насыщенный водный раствор (83 мл) хлорида аммония, и перемешивали в течение 10 минут. К смеси добавляли воду (50 мл) и нагревали до комнатной температуры. Растворитель отгоняли при пониженном давлении, и получающийся остаток экстрагировали этилацетатом.
Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении. Получающийся сырой продукт промывали этанолом с получением 3-(1-бензолсульфонил-1Н-индол-2-ил)-3-оксо-пропионитрила (47.3 г, 70%).
1Н-ЯМР (CDCl3) δ: 8.12 (1.0 H, dq, J = 8.5, 0.8 Гц), 7.79-7.76 (2.0 H, m), 7.56-7.48 (3.0 H, m), 7.42-7.38 (2.0 H, m), 7.32-7.28 (1.0 H, m), 7.20 (1.0 H, d, J = 0.8 Гц), 4.16 (2.0 H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 325 [(М+Н)+]
Соединения под номерами 1186-1284, и 1550-1571, перечисленные в Таблице 10 (см. графическую часть), синтезировали способом, подобным приведенному в описании Стадии 3.
Стадия 4: Синтез сложного этилового эфира 1-бензолсульфонил-1Н-индол-2-карбоновой кислоты (1285)

При охлаждении на льду, безводный N,N-диметилформамидный (ДМФА) раствор (70 мл) сложного этилового эфира 1Н-индол-2-карбоновой кислоты (45 г, 0.238 моль) добавляли по каплям к раствору 50% гидрида натрия (13.7 г, 0.286 моль) в безводном N,N-диметилформамиде (ДМФА) (90 мл). Через полтора часа перемешивания при охлаждении на льду, реакционную смесь нагревали до комнатной температуры, и затем перемешивали в течение одного часа. После охлаждения на льду, по каплям добавляли безводный N,N-диметилформамидный (ДМФА) раствор бензолсульфонилхлорида (50.4 г), и получающуюся смесь перемешивали в течение одного часа. К реакционной смеси добавляли по каплям водный раствор 0.5 н. соляной кислоты, и затем к смеси добавляли воду. Смесь перемешивали в течение 30 минут. Получающееся твердое вещество собирали с помощью фильтрования, и промывали водой и затем н-гексаном. Твердое вещество растворяли в этилацетате, и промывали насыщенным водным раствором бикарбоната натрия и затем насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении с получением сырого сложного этилового эфира 1-бензолсульфонил-1Н-индол-2-карбоновой кислоты. Полученный сырой продукт перекристаллизовывали (этилацетат/гексан) с получением сложного этилового эфира 1-бензолсульфонил-1Н-индол-2-карбоновой кислоты (68.9 г, 79%).
1Н-ЯМР (CDCl3) δ: 8.12 (1Н, d, J = 8.3 Гц), 8.04 (2H, d, J = 7.8 Гц), 7.60-7.52 (2Н, m), 7.51-7.40 (3H, m), 7.31-7.21 (1Н, m), 7.17 (1Н, s), 4.40 (2H, q, J = 7.0 Гц), 1.39 (3H, t, J = 7.0 Гц)
ESI (ЖХ-МС режим определения положительных ионов) m/z 330 [(М+Н)+]
Соединения под номерами 1286-1312, перечисленные в Таблице 11 (см. графическую часть), синтезировали способом, подобным приведенному в описании Стадии 4.
Стадия 5: Синтез [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(2-метокси-этиламино)-1-(толуол-4-сульфонил)-1H-индол-2-ил]-метанона (1313)
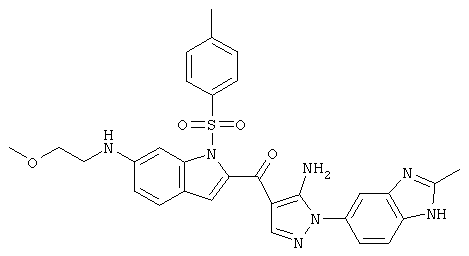
Йодид меди(I) (16 мг, 0.086 ммоль), L-пролин (37 мг, 0.32 ммоль), и [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-йод-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанон (104 мг) растворяли в безводном диметилсульфоксиде (ДМСО), и затем к смеси добавляли 1,8-диазабицикло[5.4.0]ундец-7-ен (49 мкл) и 2-метоксиэтиламин (43 мкл). Смесь нагревали при 80°C при перемешивании под атмосферой азота в течение 18 часов. После реакционную смесь охлаждали до комнатной температуры, и к смеси добавляли 25% водный раствор аммиака. Получающуюся смесь экстрагировали этилацетатом. Органический слой отделяли, промывали водным раствором 1 М соляной кислоты и затем насыщенным водным раствором хлорида натрия, и сушили над безводным сульфатом магния. После высушивающее средство удаляли с помощью фильтрования, растворитель отгоняли при пониженном давлении. Получающийся остаток очищали с помощью хроматографии (дихлорметан/метанол = 100/5), используя небольшое количество силикагеля с получением сырого продукта - [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(2-метокси-этиламино)-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанона. Полученный сырой продукт использовали в последующих реакциях без очистки.
ESI (ЖХ-МС режим определения положительных ионов) m/z 584 [(М+Н)+]
Соединения под номерами 1314-1320, перечисленные в Таблице 12 (см. графическую часть), синтезировали способом, подобным приведенному в описании Стадии 5.
Стадия 6: Синтез [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(морфолин-4-карбонил)-1-(толуол-4-сульфонил)-1H-индол-2-ил]метанона 5 (1321)

2-[5-Амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1-(толуол-4-сульфонил)-1Н-индол-5-карбоновую кислоту (113 мг) растворяли в воде (5 мл) и к смеси добавляли тетрагидрофуран (ТГФ) (10 мл), и затем морфолин (53.5 мкл) и гидрохлорид Н-(3-диметиламинопропил)-N′-этилкарбодиимида (WSC-HCl) (43 мг). Смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь затем концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (метанол/дихлорметан = 0/100-17/100) с получением [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[5-(морфолин-4-карбонил)-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанона (59 мг).
1Н-ЯМР (ДМСО-D6) δ: 12.49 (1.0Н, d, J=9.3 Гц), 8.08 (3.0Н, m), 7.82-7.74 (2.0Н, m), 7.70-7.64 (1.0H, m), 7.58 (1.0H, d, J=8.3 Гц), 7.53-7.42 (3.0H, m), 7.35-7.25 (2.0H, m), 7.13-6.89 (2.0H, m), 3.69-3.51 (4.0H, m), 3.40-3.28 (4.0H, m), 2.54 (3.0H, s), 2.38 (3.0H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 624 [(М+Н)+]
Соединения под номерами 1322-1326, 1572-1579, перечисленные в Таблице 13 (см. графическую часть), синтезировали способом, подобным приведенному в описании Стадии 6.
Стадия 7: Синтез 2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1-(толуол-4-сульфонил)-1H-индол-6-карбальдегида (1327)

В герметичной емкости, ацетат палладия (1.0 мг, 0.0044 ммоль), 1,3-бис(дифенилфосфино)пропан (1.8 мг, 0.0044 ммоль), [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-йод-1-(толуол-4-сульфонил)-1H-индол-2-ил]-метанон (100 мг, 0.16 ммоль), и карбонат натрия (18 мг, 0.17 ммоль) растворяли в безводном N,N-диметилформамиде (ДМФА) (0.22 мл). После добавляли триэтилсилан (52 мкл, 0.33 ммоль), и воздух внутри емкости замещали моноксидом углерода. Затем реакционную смесь нагревали при 60°C при перемешивании под давлением моноксида углерода (3 атм) в течение 24 часов. После реакционную смесь охлаждали до комнатной температуры, давление сбрасывали до давления окружающей среды. Реакционную смесь разбавляли этилацетатом. Карбонат натрия удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол = 100/5) с получением 2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1-(толуол-4-сульфонил)-1H-индол-6-карбальдегида в виде желтого твердого вещества (80 мг, 85%).
1Н-ЯМР (CDCl3) δ: 10.14 (1.0 H, s), 9.81-9.40 (1.0 H, brm), 8.61 (1.0 H, d, J = 3.9 Гц), 8.09 (2.0 H, d, J = 7.3 Гц), 7.86-7.72 (4.0 Н, m), 7.52-7.30 (4.0 Н, m), 7.02 (1.0 H, s), 6.07 (1.0 H, brs), 6.04 (1.0 H, brs), 2.67 (3.0 H, s), 2.40 (3.0 H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 539 [(M+H)+]
Синтез 2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1-(толуол-4-сульфонил)-1H-индол-5-карбальдегида (1328)

2-[5-Амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1-(толуол-4-сульфонил)-1Н-индол-5-карбальдегид синтезировали способом, подобным приведенному в описании Стадии 7.
ESI (ЖХ-МС режим определения положительных ионов) m/z 539 [(М+Н)+]
Стадия 8: Синтез 2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1Н-индол-6-карбальдегида (1329)

2-[5-Амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1-(толуол-4-сульфонил)-1Н-индол-6-карбальдегид (29 мг, 0.054 ммоль), 1-метилпиперазин (7 мкл, 0.066 ммоль), и триацетоксиборогидрид натрия (17 мг, 0.083 ммоль) растворяли в безводном дихлорметане (0.5 мл) и перемешивали при комнатной температуре под атмосферой азота в течение 14 часов. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия. Затем смесь экстрагировали этилацетатом. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия, и сушили над безводным сульфатом магния. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол = 100/15) с получением [5-амино-1-(2-метил-1H-бензимидазол-5-ил)-1H-пиразол-4-ил]-[6-(4-метил-пиперазин-1-илметил)-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанона в виде желтого твердого вещества (29 мг, 86%).
ESI (ЖХ-МС режим определения положительных ионов) m/z 623 [(М+Н)+]
Соединения под номерами 1330-1358, перечисленные в Таблице 14 (см. графическую часть), синтезировали способом, подобным приведенному в описании Стадии 8.
[Примеры 196 и 197]
Соединения Примеров 196 и 197, перечисленные в Таблице 15, синтезировали способом, подобным приведенному в описании Стадии 8.
|
Стадия 9: Синтез 1-(4-{2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1-бензолсульфонил-1-индол-5-илметил}-пиперазин-1-ил)-5 этанона(1359)

[5-Амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-пиперазин-1-илметил-1Н-индол-2-ил)-метанон (103 мг) растворяли в насыщенном водном растворе бикарбоната натрия (25 мл), содержащем дихлорметан (20 мл) и метанол (3 мл), и охлаждали до 0°C, Затем к реакционной смеси тремя частями добавляли ацетилхлорид (326 мкл), и перемешивали в течение 1.5 часа. Реакционную смесь экстрагировали дихлорметаном. Экстракт сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и фильтрат концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (метанол/дихлорметан = 0/100-10/100) с получением 1-(4-{2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1-бензолсульфонил-1-индол-5-илметил}-пиперазин-1-ил)-этанона (32 мг).
1Н-ЯМР (CDCl3) δ: 8.18-8.14 (2.0 H, m), 8.05 (1.0 H, d, J = 8.8 Гц), 7.78 (1.1 Н, s), 7.60-7.56 (1.0 H, m), 7.50 (3.0 H, m), 7.40 (1.0 H, dd, J = 8.8, 1.5 Гц), 7.35 (1.0 H, m), 6.98 (1.0 H, s), 6.03 (2.0 H, m), 3.62 (2.0 H, t, J = 5.0 Гц), 3.58 (2.0 H, s), 3.45 (2.0 H, t, J = 5.0 Гц), 2.64 (3.0 H, s), 2.42 (4.0 H, m), 2.07 (3.0 H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 637 [(М+Н)+]
Стадия 10: Синтез 5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[1-бензолсульфонил-5-(4-метансульфонилпиперазин-1-илметил)-1H-индол-2-ил]-метанона (1360)

[5-Амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-пиперазин-1-илметил-1Н-индол-2-ил)-метанон (94 мг) растворяли в тетрагидрофуране (ТГФ) (5 мл) и насыщенном водном растворе бикарбоната натрия (5 мл), и охлаждали до 0°C. Затем к реакционной смеси добавляли метансульфонилхлорид (94 мкл), и перемешивали при 0°C в течение 1.5 часа. Затем к смеси добавляли водный раствор аммиака (5 мл), и перемешивали при 0°C в течение двух часов. Реакционную смесь экстрагировали этилацетатом, и экстракт промывали насыщенным раствором хлорида натрия и сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (метанол/дихлорметан = 0/100-15/100) с получением 5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[1-бензолсульфонил-5-(4-метансульфонилпиперазин-1-илметил)-1Н-индол-2-ил]-метанона (39 мг).
1Н-ЯМР (CD3OD) δ: 8.09 (2.0 H, m), 7.98 (2.0 H, m), 7.84 (1.0 H, m), 7.75 (1.0 H, m), 7.65-7.57 (3.0 H, m), 7.53-7.40 (3.0 H, m), 7.12 (1.0 H, d, J = 3.9 Гц), 3.64 (2.0 H, m), 3.25-3.15 (4.0 H, m), 2.86 (3.0 H, s), 2.82 (3.0 H, s), 2.54 (4.0 Н, m)
ESI (ЖХ-МС режим определения положительных ионов) m/z 673 [(M+H)+]
Стадия 11: Синтез сложного этилового эфира 5-изопропокси-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты (1361)

Диизопропилазодикарбоксилат (0.15 мл, 0.75 ммоль) добавляли к безводному тетрагидрофурановому (ТГФ) раствору (2.5 мл) сложного этилового эфира 5-гидрокси-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты (175 мг, 0.48 ммоль), трифенилфосфина (197 мг, 0.75 ммоль), и 2-пропанола (0.2 мл, 4.0 ммоль), и перемешивали при комнатной температуре в течение одного часа. Реакционную смесь концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле с получением сложного этилового эфира 5-изопропокси-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты в виде бесцветного смолообразного вещества (166.7 мг, 87%).
1Н-ЯМР (ДМСО-D6) δ: 7.86 (1Н, d, J = 9.1 Гц), 7.79 (2Н, d, J = 8.5 Гц), 7.39 (2Н, d, J = 8.5 Гц), 7.25 (1Н, s), 7.15 (1Н, d, J = 2.4 Гц), 7.04 (1Н, dd, J = 9.1, 2.4 Гц), 4.62-4.53 (1Н, m), 4.34 (2Н, q, J = 7.1 Гц), 2.34 (3Н, s), 1.31 (3H, t, J = 7.1 Гц), 1.25 (6H, d, J = 6.1 Гц)
ESI (ЖХ-МС режим определения положительных ионов) m/z 402 [(М+Н)+]
Соединения под номерами 1362-1367, перечисленные в Таблице 16, синтезировали способом, подобным приведенному в описании Стадии 11.
|
Стадия 12: Синтез сложного этилового эфира 5-циклопропилметокси-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты (1368)

Циклопропилметилбромид (0.072 мл, 0.75 ммоль) добавляли к суспензии (5.0 мл) сложного этилового эфира 5-гидрокси-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты (173 мг, 0.48 ммоль) и карбоната калия (276 мг, 1.0 ммоль) в ацетонитриле, и перемешивали при 80°C в течение пяти часов. После охлаждения до комнатной температуры, реакционную смесь объединяли с этилацетатом и водой и экстрагировали этилацетатом. Экстракт промывали водой и насыщенным водным раствором хлорида натрия, и сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле с получением сложного этилового эфира 5-циклопропилметокси-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты в виде бесцветного смолообразного вещества (112.5 мг, 56%).
1Н-ЯМР (ДМСО-D6) δ: 7.87 (1Н, d, J = 9.2 Гц), 7.76 (2Н, d, J = 8.2 Гц), 7.38 (2Н, d, J = 8.2 Гц), 7.25 (1Н, s), 7.11 (1Н, d, J = 2.6 Гц), 7.07 (1Н, dd, J = 9.2, 2.6 Гц), 4.33 (2Н, q, J = 8.1 Гц), 3.80 (2Н, d, J = 6.6 Гц), 2.33 (3Н, s), 1.32 (3H, t, J = 8.1 Гц), 1.25-1.19 (1Н, m), 0.58-0.52 (2Н, m), 0.33-0.28 (2Н, m)
ESI (ЖХ-МС режим определения положительных ионов) m/z 414 [(М+Н)+]
[Пример 198: Синтез [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(оксетан-3-илокси)-1Н-индол-2-ил]-метанона]

[5-Амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-гидрокси-1Н-индол-2-ил)-метанон (21 мг, 0.056 ммоль), оксетан-3-иловый сложный эфир толуол-4-сульфоновой кислоты (19 мг, 0.084 ммоль), и карбонат калия (13 мг, 0.095 ммоль) растворяли в безводном N,N-диметилформамиде (ДМФА), и нагревали при 80°C при перемешивании под атмосферой азота в течение шести дней. После охлаждения до комнатной температуры, реакционную смесь объединяли с водой, и экстрагировали раствором этилацетат/метанол (10/1). Органический слой отделяли, промывали водой, и сушили над безводным сульфатом магния. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол = 100/3) с получением [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(оксетан-3-илокси)-1Н-индол-2-ил]-метанона в виде желтого твердого вещества (6.9 мг, 29%).
1Н-ЯМР (ДМСО-D6) δ: 12.48 (1.0 H, brs), 11.48 (1.0 H, brs), 8.28 (1.0 H, s), 7.62-7.60 (3.0 H, m), 7.41 (1.0 H, brs), 7.28 (1.0 H, dd, J = 8.3, 2.0 Гц), 6.96 (1.0 H, brs), 6.94 (1.0 H, brs), 6.71 (1.0 H, dd, J = 8.5, 2.2 Гц), 6.67 (1.0 H, brs), 5.34-5.29 (1.0 H, m), 4.94 (2.0 H, dd, J = 6.8, 6.8 Гц), 4.60 (2.0 H, dd, J = 6.8, 5.1 Гц), 2.53 (3.0 H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 429 [(М+Н)+]
[Пример 199: Синтез [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-гидрокси-1Н-индол-2-ил)-метанона1

2-[5-Амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1-(толуол-4-сульфонил)-1Н-индол-6-карбальдегид (650 мг, 1.0 ммоль), дихлорид 1,1′-бис(дифенилфосфино)ферроцен палладия(II) (42 мг, 0.051 ммоль), бис(пинаколато)дибор (312 мг, 1.23 ммоль), и ацетат калия (323 мг, 3.3 ммоль) растворяли в безводном N,N-диметилформамиде (ДМФА) (4.1 мл). После деаэрации, смесь нагревали при 100°C при перемешивании под атмосферой азота в течение восьми часов. Реакционную смесь охлаждали до комнатной температуры, и затем к ней добавляли воду. Осажденное твердое вещество собирали с помощью фильтрования, промывали водой, и затем сушили с получением коричневого твердого вещества (538 мг). Полученный сырой продукт использовали в последующих реакциях без очистки.
Полученный коричневый твердый сырой продукт - 4-метил-морфолин N-оксид (256 мг, 2.2 ммоль) растворяли в тетрагидрофуране (ТГФ) (7.0 мл), и нагревали при 70°C при перемешивании под атмосферой азота в течение трех с половиной часов. После реакционную смесь охлаждали до комнатной температуры, добавляли к ней воду и этилацетат. Смесь фильтровали через целит®, и фильтрат разделяли на органический и водный слой. Органический слой концентрировали при пониженном давлении, и получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (амино-кремнезем; дихлорметан/метанол = 100/5-100/10) с получением [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-гидрокси-1Н-индол-2-ил)-метанона в виде желтого аморфного вещества (123 мг, с двухстадийным выходом 23%).
1Н-ЯМР (ДМСО-D6) δ: 12.51 (1.0 H, brs), 11.30 (1.0 H, brs), 9.40 (1.0 H, brs), 8.26 (1.0 H, s), 7.61-7.59 (2.0 H, m), 7.47 (1.0 H, d, J = 8.8 Гц), 7.34 (1.0 H, s), 7.28 (1.0 H, d, J = 8.8 Гц), 6.91 (2.0 H, brs), 6.82 (1.0 H, s), 6.62 (1.0 H, d, J = 8.8 Гц), 2.53 (3.0 Н, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 373 [(М+Н)+]
Стадия 13: Синтез [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-йод-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанона (1369)
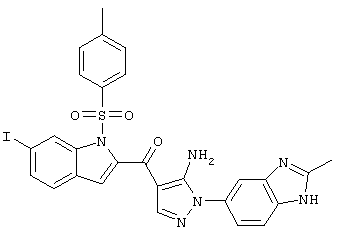
Смесь, состоящую из [5-амино-1-(2-метил-3Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-бром-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанона (1 г), йодида меди(I) (161 мг), йодида натрия (508 мг), транс-N,N′-диметилциклогексан-1,2-диамина (267 мкл), и безводного диоксана (5 мл) перемешивали в герметичной емкости при температуре 105-112°C под атмосферой азота в течение 20 часов. Реакционную смесь выливали в 2 М водный раствор аммиака, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, и сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (метанол/дихлорметан = 0/100-20/100) с получением [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-йод-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанона (0.67 г, 62%).
1Н-ЯМР (ДМСО-D6) δ: 12.44 (1.0 H, s), 8.30 (1.0 H, d, J = 0.6 Гц), 7.98 (2.0 H, d, J = 8.5 Гц), 7.75 (1.0 H, s), 7.66 (1.0 H, dd, J = 8.2, 1.4 Гц), 7.51 (1.0 H, d, J = 8.0 Гц), 7.46 (2.0 H, d, J = 8.5 Гц), 7.28 (1.0 H, d, J = 7.6 Гц), 7.23 (1.0 H, d, J = 0.4 Гц), 7.10-6.92 (2.0 H, m), 2.53 (3.0 H, s), 2.37 (3.0 H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 637 [(М+Н)+]
Соединения под номерами 1370 и 1371, перечисленные в Таблице 17, синтезировали способом, подобным приведенному в описании Стадии 13.
Таблица 17
|
Стадия 14: Синтез 2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1-(бензолсульфонил)-1Н-индол-5-карбонитрила (1372)

Смесь 2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1-(бензолсульфонил)-5-йод-1Н-индола (117 мг), цианида меди(I) (84 мг), и 1-метил-2-пирролидинона подвергали реакции в микроволновом реакторе (190°C, 20 минут). Реакционную смесь выливали в перемешиваемый раствор 2 М водного раствора аммиака (40 мл), этилацетата (60 мл), и метанола (7 мл), и подвергали действию ультразвука в течение пяти минут. После экстрагирования этилацетатом, экстракт промывали водой и затем сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (метанол/дихлорметан = 0/100-20/100) с получением 2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1-(бензолсульфонил)-1Н-индол-5-карбонитрила (87 мг, 89%).
1Н-ЯМР (ДМСО-D6) δ: 12.47 (1.0 H, d, J = 8.4 Гц), 8.27-8.21 (4.0 Н, m), 7.86 (1.0 H, dd, J = 8.8, 1.8 Гц), 7.80-7.76 (2.0 H, m), 7.72-7.64 (3.0 Н, m), 7.60-7.55 (1.0 H, m), 7.35-7.25 (2.0 H, m), 7.12-7.02 (2.0 H, m), 2.54 (3.0 Н, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 522 [(М+Н)+]
Соединения под номерами 1373 и 1374, перечисленные в Таблице 18, синтезировали способом, подобным приведенному в описании Стадии 14.
|
Стадия 15: Синтез 2-этилового эфира 1-(толуол-4-сульфонил)-1Н-индол-2,5-дикарбоновой кислоты (1375)

Смесь сложного этилового эфира 5-бром-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты (948.4 мг, 2.24 ммоль), трис(дибензилиденацетон) дипалладия(0) (0.112 ммоль, 103 мг), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (Xantphos) (0.225 ммоль, 130 мг), моногидрата формиата лития (5.6 ммоль, 394 мг), хлорида лития (286 мг, 6.75 ммоль), и безводного N,N-диметилформамида (ДМФА) (5.9 мл) вакуумировали, и заполняли аргоном. Затем к смеси добавляли N,N-диизопропилэтиламин (4.5 ммоль, 0.78 мл) и уксусный ангидрид (4.5 ммоль, 0.43 мл), и деаэрацию и замену аргоном выполняли вновь. Лабораторный стакан помещали в реакционный аппарат, предварительно подогретый при 80°C, и реакционную смесь перемешивали в течение 20 часов. После охлаждения до комнатной температуры, реакционную смесь разбавляли этилацетатом и 1 М водным раствором соляной кислоты, и фильтровали через целит. Получающийся фильтрат промывали 1 М соляной кислотой, водой, и насыщенным водным раствором хлорида натрия, и затем сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении, и получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат = 5/1-1/3, и в заключение этилацетат/метанол = 15/1) с получением 2-этилового эфира 1-(толуол-4-сульфонил)-1Н-индол-2,5-дикарбоновой кислоты в виде желтого аморфного вещества (930 мг).
1Н-ЯМР (ДМСО-D6) δ: 8.32 (1Н, d, J = 1.5 Гц), 8.13 (1Н, d, J = 8.8 Гц), 8.05 (1Н, dd, J = 8.8, 1.5 Гц), 7.93 (2Н, d, J = 8.2 Гц), 7.50 (1Н, s), 7.46 (2H, d, J = 8.2 Гц), 4.38 (2H, q, J = 7.1 Гц), 2.37 (3Н, s), 1.34 (3H, t, J = 7.1 Гц)
ESI (ЖХ-МС режим определения положительных ионов) m/z 388 [(М+Н)+]
Синтез 2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1-(толуол-4-сульфонил)-1Н-индол-6-карбоновой кислоты (1376)

2-[5-Амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1H-индол-6-карбоновую кислоту синтезировали способом, подобным приведенному в описании Стадии 15.
ESI (ЖХ-МС режим определения положительных ионов) m/z 555 [(М+Н)+]
Стадия 16: Синтез 5-трет-бутилового эфира 2-этилового эфира 1-(толуол-4-сульфонил)-1Н-индол-2,5-дикарбоновой кислоты (1377)

2-Этиловый эфир 1 -(толуол-4-сульфонил)-1H-индол-2,5-дикарбоновой кислоты (690 мг, 1.85 ммоль) растворяли в ди-трет-бутилацетале N,N-диметилформамида (3.0 мл), и перемешивали при 80°C в течение двух с половиной часов. Затем к смеси дополнительно добавляли ди-трет-бутилацеталь N,N-диметилформамида (2.0 мл) и перемешивали при 80°C в течение трех часов. После охлаждения до комнатной температуры, реакционную смесь разбавляли этилацетатом (150 мл) и водой (75 мл). Органический слой отделяли, промывали водой и насыщенным водным раствором хлорида натрия, и затем сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат = 25/1-5/1) с получением 5-трет-бутилового эфира 2-этилового эфира 1-(толуол-4-сульфонил)-1Н-индол-2,5-дикарбоновой кислоты (551 мг, 69%).
1Н-ЯМР (ДМСО-D6) δ: 8.25 (1H, d, J = 1.4 Гц), 8.12 (1H, d, J = 8.8 Гц), 8.00 (1H, dd, J = 8.8, 1.4 Гц), 7.88 (2Н, d, J - 8.0 Гц), 7.48 (1H, s), 7.43 (2H, d, J = 8.0 Гц), 4.37 (2H, q, J = 7.2 Гц), 2.37 (3Н, s), 1.56 (9H, s), 1.34 (3H, t, J = 7.2 Гц)
ESI (ЖХ-МС режим определения положительных ионов) m/z 444 [(M+H)+]
Стадия 17: Синтез [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[1-(толуол-4-сульфонил)-5-триметил-силанилэтинил-1Н-индол-2-ил]метанона (1378)

[5-Амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-бром-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанон (150 мг), дихлор-бис(трифенилфосфин)палладий(II) (54 мг), йодид меди(I) (10 мг), триэтиламин (0.7 мл), и безводный N,N-диметилформамид (ДМФА) (0.7 мл) объединяли вместе в герметичной емкости, и к смеси добавляли триметилсилилацетилен (150 мг). Смесь перемешивали при температуре 80-85°C под азотом в течение 15 часов. После охлаждения до комнатной температуры, реакционную смесь разбавляли этилацетатом, промывали насыщенным водным раствором хлорида натрия, и сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (метанол/дихлорметан = 0/100-20/100) с получением [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[1-(толуол-4-сульфонил)-5-триметил-силанилэтинил-1Н-индол-2-ил]-метанона (65 мг, 42%).
1Н-ЯМР (ДМСО-D6) δ: 12.48 (1Н, d, J = 8.4 Гц), 8.04-7.95 (3H, m), 7.80 (1H, s), 7.75 (1H, d, J = 3.7 Гц), 7.69-7.62 (1H, m), 7.62-7.54 (1H, m), 7.50 (1H, dd, J = 8.7, 1.7 Гц), 7.44 (2Н, d, J = 8.6 Гц), 7.29 (1H, t, J = 7.9 Гц), 7.20 (1H, s), 7.09-6.97 (2H, m), 2.54 (3H, s), 2.36 (3.0 H, s), 0.23 (9.0 H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 607 [(М+Н)+]
Синтез сложного этилового эфира 1-бензолсульфонил-4-триметил-силанилэтинил-1Н-индол-2-карбоновой кислоты (1379)

Сложный этиловый эфир 1-бензолсульфонил-4-триметил-силанилэтинил-1Н-индол-2-карбоновой кислоты синтезировали способом, подобным приведенному в описании Стадии 17.
ESI (ЖХ-МС режим определения положительных ионов) m/z 426 [(М+Н)+]
Стадия 18: Синтез N-[2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1-(толуол-4-сульфонил)-1H-индол-6-ил]-метансульфонамида (1380)

[5-Амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-йод-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанон (80.3 мг, 0.126 ммоль), йодид меди(I) (37.5 мг, 0.197 ммоль), метансульфонамид (37.5 мг, 0.394 ммоль), саркозин (36.2 мг, 0.406 ммоль), и трифосфат калия (86.0 мг, 9.405 ммоль) растворяли в безводном 1-метил-2-пирролидиноне (0,36 мл), и нагревали при 140°C при перемешивании под атмосферой аргона в течение 30 минут. Реакционную смесь добавляли по каплям к водному раствору (20 мл) 20% хлорида аммония, и экстрагировали этилацетатом, органический слой промывали водным раствором 20% хлорида натрия и сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования. Фильтрат концентрировали при пониженном давлении, и получающийся остаток очищали с помощью колоночной амино-гель-хроматографии (дихлорметан/метанол = 15/1) с получением N-[2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1H-пиразол-4-карбонил]-1-(толуол-4-сульфонил)-1H-индол-6-ил] метансульфонамида в виде желтого аморфного вещества (17.9 мг с выходом 24%).
1Н-ЯМР (ДМСО-D6) δ: 12.47 (1Н, s), 9.93 (1H, brs), 7.97 (1H, s), 7.94 (2H, d, J = 7.9 Гц), 7.77 (1H, s), 7.64-7.59 (3H, m), 7.43 (2H, d, J = 6.7 Гц), 7.29 (1H, d, J = 7.9 Гц), 7.22-7.15 (2H, t, J = 5.2 Гц), 7.01 (2H, brs), 2.97 (3H, s), 2.53 (3H, s), 2.35 (3H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 604 [(М+Н)+]
[Пример 200: Синтез [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-метансульфонил-1Н-индол-2-ил)-метанона]

[5-Амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-метил-сульфанил-1Н-индол-2-ил)-метанон (23 мг, 0.057 ммоль) растворяли в трифторэтаноле (5 мл), и к смеси добавляли водный раствор (0.5 мл) оксона (105 мг, 0.171 ммоль). Смесь перемешивали при комнатной температуре под атмосферой азота в течение 1.75 часа. Реакционную смесь фильтровали, и фильтрат концентрировали. Получающийся остаток очищали с помощью колоночной амино-гель-хроматографии (дихлорметан/метанол = 99/1-92/8). Таким образом, [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-метансульфонил-1Н-индол-2-ил)-метанон получали в виде бледно-желтого твердого вещества (8 мг, 32%).
1Н-ЯМР (ДМСО-D6) δ: 12.48 (1Н, d, J = 4.9 Гц), 12.33 (1Н, s), 8.35 (1H, d, J = 4.9 Гц), 8.05 (1H, s), 7.94 (1H, d, J = 8.5 Гц), 7.65-7.59 (4H, m), 7.31-7.27 (1H, m),7.11 (2H, d, J = 21.4 Гц), 3.22 (3Н, s), 2.54 (3Н, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 435 [(М+Н)+]
Стадия 19: Синтез сложного метилового эфира 6-циклопропил-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты (1381)
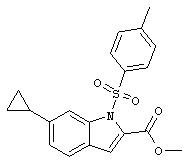
Заданные заранее количества сложного метилового эфира 6-бром-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты (300 мг, 0.73 ммоль), ацетата палладия (16.5 мг, 0.07 ммоль), бис(1,1-диметилэтил)фенилфосфина (0.028 мл, 0.12 ммоль), циклопропилтрифторбората калия (163 мг, 1.1 ммоль), и карбоната цезия (718 мг, 2.2 ммоль) помещали в лабораторный стакан, и к смеси добавляли толуол (5 мл) и воду (0.5 мл). Получающуюся смесь затем перемешивали при 100°C в течение 14 часов. После охлаждения смеси до комнатной температуры, смесь разбавляли этилацетатом, и дважды промывали водой, и затем сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Затем остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат = 97/3-7/3). Таким образом, получали желтое твердое вещество (208 мг, 77%).
1Н-ЯМР (ДМСО-D6) δ: 7.82-7.80 (2Н, m), 7.68 (1Н, brs), 7.52 (1H, d, J = 8.2 Гц), 7.42-7.39 (2Н, m), 7.32 (1H, d, J = 0.8 Гц), 7.00 (1H, dd, J = 8.3, 1.5 Гц), 3.83 (3Н, s), 2.33 (3Н, s), 2.11-2.09 (1H, m), 1.03 (2Н, ddd, J = 9.6, 5.2, 3.1 Гц), 0.73-0.70 (2Н, m)
ESI (ЖХ-МС режим определения положительных ионов) m/z 370[(M+H)+]
Соединения под номерами 1382-1384, перечисленные в Таблице 19, синтезировали, как описано для Стадии 19.
|
|
Стадия 20: Синтез сложного этилового эфира 5-имидазол-1-ил-1H-индол-2-карбоновой кислоты(1385)

[Метод синтеза на основе гидразона]
Синтез сложного этилового эфира 2-[(Е)-4-имидазол-1-ил-фенилимино]-пропионовой кислоты
4-Имидазол-1-ил-фениламин (637 мг) растворяли в 2 М соляной кислоте/МеОН (3 мл), и смесь концентрировали при пониженном давлении. Остаток суспендировали в концентрированной соляной кислоте (1 мл), и к смеси в течение 30 минут при 0°C на льду по каплям добавляли водный раствор нитрита натрия (304 мг, 2.5 мл). Реакционную смесь медленно по каплям добавляли к водному раствору, приготовленному заранее из водных растворов гидросульфита натрия (2.3 г, 13 мл) и 5 М гидроксида натрия (400 мкл), поддерживая при этом температуру реакционной смеси 5°C или ниже. Затем смесь перемешивали при 25°C в течение одного часа. К реакционной смеси по каплям добавляли этанольный раствор (5 мл) этилпирувата (465 мкл). После перемешивания при 50°C в течение 30 минут, смесь дополнительно перемешивали при 25°C в течение 10 часов. Значение рН смеси устанавливали на 11, используя водный раствор (приблизительно 10 мл) 20% фосфата калия. Получающийся осадок собирали с помощью фильтрования, и сушили. Таким образом, сложный этиловый эфир 2-[(Е)-4-имидазол-1-ил-фенилимино]-пропионовой кислоты получали в виде бледного желтого порошка (1.1 г, 99%).
[Метод синтеза на основе индола]
Синтез сложного этилового эфира 5-имидазол-1-ил-1Н-индол-2-карбоновой кислоты
Сложный этиловый эфир 2-[(Е)-4-имидазол-1-ил-фенилимино]-пропионовой кислоты (842 мг) добавляли к реагенту Итона (Baton′s) (4 мл), и смесь перемешивали при 100°C в течение одного часа. После установки значения рН реакционной смеси на 11, используя 20% водный раствор (приблизительно 10 мл) фосфата калия, смесь экстрагировали этилацетатом (30 мл). Органический слой промывали насыщенным водным раствором хлорида натрия (20 мл), и органический слой концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол). Таким образом, сложный этиловый эфир 5-имидазол-1-ил-1Н-индол-2-карбоновой кислоты получали в виде желтого аморфного вещества (370 мг, 47%).
ESI (ЖХ-МС режим определения положительных ионов) m/z 256[(M+H)+]
Соединения под номерами 1386-1394, перечисленные в Таблице 20, синтезировали, как описано для Стадии 20.
|
|
Стадия 21: Синтез 1-хлор-2-циклопропилметокси-4-нитро-бензола (1395)

Циклопропилметилбромид (2.0 мл, 20 ммоль, 2.0 экв.) добавляли к смеси 2-хлор-5-нитро-фенола (1.7 г, 10 ммоль), карбоната калия (2.7 г, 20 ммоль), и безводного ацетонитрила (20 мл). Смесь перемешивали при 80°C в течение восьми часов. После охлаждения смеси до комнатной температуры, реакционную смесь фильтровали через целит, и промывали этилацетатом. Фильтрат концентрировали при пониженном давлении. Это давало сырой 1-хлор-2-циклопропил-метокси-4-нитро-бензол в виде бледно-красного твердого вещества. Сырой продукт использовали в последующих реакциях без проведения очистки.
1Н-ЯМР (ДМСО-D6) δ: 7.84 (1Н, dd, J = 8.4, 2.5 Гц), 7.81 (1Н, d, J = 2.5 Гц), 7.74 (1H, d, J = 8.4 Гц), 4.08 (2H, d, J = 7.1 Гц), 1.33-1.23 (1Н, m), 0.63-0.59 (2H, m), 0.41-0.37 (2H,m)
Стадия 22: Синтез 4-хлор-3-циклопропилметокси-фениламина (1396)

1-хлор-2-циклопропилметокси-4-нитро-бензол (2.3 г, 10 ммоль) растворяли в этаноле (30 мл) и воде (30 мл), и затем понемногу добавляли дитионит натрия. Смесь перемешивали при 80°C в течение четырех с половиной часов. После охлаждения смеси до комнатной температуры, к реакционной смеси добавляли 5 М водный раствор гидрохлорида (40 мл). Смесь перемешивали при комнатной температуре в течение одного часа. Затем добавляли 5 М водный раствор (42 мл) гидроксида натрия, и раствор подщелачивали и экстрагировали этилацетатом. Экстракт промывали водой и водным насыщенным раствором хлорида натрия, и сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Затем остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле. Таким образом, 4-хлор-3-циклопропилметокси-фениламин получали в виде бледно-желтого смолообразного вещества (1.4 г).
1Н-ЯМР (ДМСО-D6) δ: 6.95 (1Н, d, J = 8.3 Гц), 6.28 (1H, d, J = 2.4 Гц), 6.11 (1Н, dd, J = 8.3, 2.4 Гц), 5.19 (2Н, s), 3.76 (2H, d, J = 7.1 Гц), 1.24-1.18 (1Н, m), 0.59-0.54 (2H, m), 0.35-0.30 (2H, m)
ESI (ЖХ-МС режим определения положительных ионов) m/z 198, 200 [(M+H)+]
Стадия 23: Синтез 4-бром-2-йод-5-трифторметил-фениламина (1397)

Йод (1.4 г, 5.5 ммоль, 1.1 экв.) понемногу добавляли к смеси раствора 4-бром-3-трифторметиланилина (1.2 г, 1.0 ммоль), сульфата серебра (1.72 г, 5.5 ммоль, 1.1 экв.), и безводного этанола (35 мл). Смесь перемешивали при комнатной температуре в течение двух с половиной часов. Реакционную смесь фильтровали через целит, и промывали этилацетатом. Промывной раствор промывали водными растворами 10% тиосульфата натрия, насыщенного бикарбоната натрия, и насыщенного хлорида натрия, и затем сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Сырое твердое вещество - 4-бром-2-йод-5-трифторметил-фениламин получали путем концентрирования при пониженном давлении. Получающийся сырой продукт использовали в последующих реакциях без проведения очистки.
1Н-ЯМР (ДМСО-D6) δ: 7.94 (1Н, s), 7.15(1H, s), 5.86 (2H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 366, 368 [(М+Н)+]
Соединения под номерами 1398-1402, перечисленные в Таблице 21, синтезировали, как описано для Стадии 23.
|
|
Стадия 24: Синтез N-(4-бром-2-йод-5-трифторметил-фенил)-4-метил бензолсульфонамида (1403)

4-Бром-2-йод-5-трифторметил-фениламин (366 мг, 1.0 ммоль) и п-толуол сульфонилхлорид (286 мг, 1.5 ммоль, 1.5 экв.) растворяли в безводном пиридине (2.5 мл). Смесь перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли 1 М водный раствор гидроксида натрия, и смесь перемешивали в течение пяти минут. Реакционную смесь разбавляли этилацетатом. Органический слой отделяли, и промывали водным раствором 1 М соляной кислоты и водным насыщенным раствором хлорида натрия, и сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Затем остаток, полученный путем концентрирования при пониженном давлении, растворяли в тетрагидрофуране (ТГФ) (2.5 мл), и затем к смеси добавляли 1 М тетрагидрофурановый (ТГФ) раствор фторида тетрабутиламмония. Смесь перемешивали при комнатной температуре в течение 17 часов. Реакционную смесь разбавляли этилацетатом. Органический слой отделяли, и промывали водой и водным насыщенным раствором хлорида натрия, и затем сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Затем остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле. Таким образом, N-(4-бром-2-йод-5-трифторметил-фенил)-4-метил бензолсульфонамид получали в виде бледно-коричневого твердого вещества (494 мг, трехстадийный выход 95%).
1Н-ЯМР (ДМСО-D6) δ: 10.10 (1Н, s), 8.34 (1Н, s), 7.58 (2Н, d, J = 8.2 Гц), 7.39 (2Н, d, J = 8.2 Гц), 7.27 (1Н, s), 2.38 (3H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 520, 522 [(M+H)+]
Соединения под номерами 1404-1408, перечисленные в Таблице 22, синтезировали, как описано для Стадии 24.
|
Стадия 25: Синтез сложного этилового эфира 5-бром-1-(толуол-4-сульфонил)-6-трифторметил-1Н-индол-2-карбоновой кислоты (1409)

N,N-диизопропилэтиламин (0.42 мл, 2.4 ммоль), этилпропионат (0.12 мл, 1.2 ммоль), и тетракис(трифенилфосфин)палладий (46 мг, 0.04 ммоль) добавляли к безводному тетрагидрофурановому (ТГФ) раствору (3.2 мл), содержащему N-(4-бром-2-йод-5-трифторметил-фенил)-4-метил-бензолсульфонамид (208 мг, 0.4 ммоль) и бромид цинка (270 мг, 1.2 ммоль). Затем смесь вакуумировали, и заполняли аргоном. Смесь перемешивали при 80°C в течение 13 часов. После охлаждения смеси до комнатной температуры, реакционную смесь фильтровали через целит, и промывали этилацетатом. Промывной раствор промывали водным насыщенным раствором бикарбоната натрия и водным насыщенным раствором хлорида натрия, и сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Затем остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле. Таким образом, сложный этиловый эфир 5-бром-1-(толуол-4-сульфонил)-6-трифторметил-1Н-индол-2-карбоновой кислоты получали в виде бледно-коричневого твердого вещества (195 мг, 50%).
1Н-ЯМР (ДМСО-D6) δ: 8.37 (1Н, s), 8.29 (1H. s), 7.89 (2H, d, J = 8.2 Гц), 7.47 (2Н, d, J = 8.2 Гц), 7.43 (1H, s), 4.36 (2H, q, J = 7.1 Гц), 2.38 (3Н, s), 1.30 (3H, t, J = 7.1 Гц)
ESI (ЖХ-МС режим определения положительных ионов) m/z 490, 492 [(М+Н)+]
Соединения под номерами 1410-1414, перечисленные в Таблице 23, синтезировали, как описано для Стадии 25.
|
Стадия 26: Синтез N-бензгидрилиден-N′-(3,5-ди-трет-бутил-фенил)-гидразина (1415)

Ацетат палладия (8.4 мг, 0.037 ммоль) и 2-дициклогексилфосфино-2′,4′,6′-три-изо-пропил-1,1′-бифенил (X-PHOS) (35.6 мг, 0.074 ммоль) растворяли в трет-амиловом спирте (10 мкл, 0.093 ммоль) и безводном диметиловом эфире этиленгликоля (0.25 мл). Смесь нагревали и перемешивали при 60°C в течение пяти минут под атмосферой азота для приготовления катализатора. В отдельном лабораторном стакане под атмосферой азота, 1-бром-3,5-ди-т-бутил-бензол (501 мг, 1.9 ммоль), бис(триметилсилил)амид лития (475 мг, 2.8 ммоль), и гидразон бензофенона (401 мг, 2.0 ммоль) растворяли в безводном диметиловом эфире этиленгликоля (2.5 мл). Затем к смеси добавляли раствор, содержащий приготовленный катализатор. После деаэрации, смесь нагревали и перемешивали при 90°C в течение двух часов под атмосферой азота. Реакционную смесь охлаждали до комнатной температуры, и затем концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат = 100/5). Таким образом, N-бензгидрилиден-N′-(3,5-ди-трет-бутил-фенил)-гидразин получали в виде желтого аморфного вещества (699 мг, 97.7%).
1Н-ЯМР (ДМСО-D6) δ: 8.72 (1.0 H, s), 7.63-7.53 (3.0 H, m), 7.42-7.25 (7.0 H, m), 7.11 (2.0 H, s), 6.83 (1.0 H, s), 1.26 (18.0 Н, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 385 [(М+Н)+]
Стадия 27: Синтез сложного этилового эфира 4,6-ди-трет-бутил-1Н-индол-2-карбоновой кислоты (1416)

N-Бензгидрилиден-N′-(3,5-ди-трет-бутил-фенил)-гидразин (617 мг, 1.6 ммоль) растворяли в этаноле (12 мл). Затем к смеси добавляли этилпируват (212 мкл, 1.9 ммоль) и моногидрат п-толуолсульфоновой кислоты (914 мг, 4.8 ммоль). Смесь нагревали и перемешивали при нагревании до 150°C с помощью микроволновой печи под атмосферой азота в течение одного часа. После охлаждения смеси до комнатной температуры, реакционную смесь объединяли с водой и водным насыщенным раствором бикарбоната натрия. Продукт экстрагировали в этилацетат. Органический слой отделяли, и промывали водным насыщенным раствором хлорида натрия, и сушили над сульфатом магния. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Затем остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат = 100/5). Таким образом, сложный этиловый эфир 4,6-ди-трет-бутил-1Н-индол-2-карбоновой кислоты получали в виде коричневого твердого вещества (268 мг, 56%).
1Н-ЯМР (ДМСО-D6) δ: 11.76 (1.0 H, brs), 7.27 (1.0 H, s), 7.22-7.22 (1.0 H, brm), 7.04-7.03 (1.0 H, brm), 4.33 (2.0 H, q, J = 7.2 Гц), 1.44 (9.0 Н, s), 1.36-1.32 (12.0 H, m)
ESI (ЖХ-МС режим определения положительных ионов) m/z 302 [(М+Н)+]
Стадия 28: Синтез сложного метилового эфира 6-(5-фтор-пиридин-2-ил)-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты (1417)

Смешивали сложный метиловый эфир 6-бром-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты (202.0 мг, 0.495 ммоль), дихлорбис(трифенилфосфин)палладий(II) (35.6 мг, 0.051 ммоль), бис(пинакол)диборан (189.3 мг, 0.745 ммоль), ацетат калия (147.3 мг, 1.51 ммоль), и диоксан (1.6 мл). Воздух трижды замещали аргоном при пониженном давлении. Смесь нагревали в микроволновой печи при 120°C в течение 30 минут. К реакционной смеси добавляли дихлорбис(трифенилфосфин)палладий(II) (35.6 мг, 0.051 ммоль) и 2-бром-5-фтор-пиридин (206.9 мг, 1.48 ммоль). После деаэрации, воздух трижды замещали аргоном. Смесь нагревали и перемешивали при 100°C в течение трех часов. Реакционную смесь экстрагировали этилацетатом, и экстракт сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Затем остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной амино-гель-хроматографии (н-гексан/этилацетат = 7/100-63/100). Таким образом, сложный метиловый эфир 6-(5-фтор-пиридин-2-ил)-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты получали в виде бледно-желтого аморфного вещества (150.5 мг, выход 72%).
1Н-ЯМР (CDCl3) δ: 8.70 (1Н, s), 8.59 (1H, d, J = 2.7 Гц), 7.93 (3H, d, J = 8.2 Гц), 7.83 (1H, dd, J = 8.8, 3.8 Гц), 7.65 (1H, d, J = 8.2 Гц), 7.53 (1H, td, J = 8.4, 2.9 Гц), 7.29-7.25 (2Н, m), 7.19 (1H, s), 3.95 (3H, s), 2.37 (3H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 425 [(М+Н)+]
Соединения под номерами 1418-1427, перечисленные в Таблице 24, синтезировали, как описано для Стадии 28.
|
|
Стадия 29: Синтез [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(6-метокси-пиридин-3-ил)-1-(толуол-4-сульфонил)-1Н-индол-2-ил]метанона(1428)

Смесь диоксана (0.6 мл), [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-бром-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанона (60 мг, 0.102 ммоль), дихлорбис(трифенилфосфин)палладия (П) (14 мг, 0.020 ммоль), 2-метокси-5-пиридинбороновой кислоты (39 мг, 0.255 ммоль), и 2 М водного раствора бикарбоната натрия (0.255 мл, 0.51 ммоль) перемешивали при 140°C в течение шести минут в микроволновом реакторе. Реакционную смесь фильтровали через целит, и промывали этилацетатом и затем метанолом. Фильтрат сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Полученный остаток очищали с помощью амино-гель-хроматографии (дихлорметан/метанол = 99/1-92/8). Таким образом, [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(6-метокси-пиридин-3-ил)-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанон получали в виде бледно-желтого твердого вещества (54 мг, 85%).
1Н-ЯМР (ДМСО-D6) δ: 12.50 (1H, s), 8.50 (1H, d, J = 2.4 Гц), 8.08-8.04 (4H, m). 7.94 (1H, d, J = 1.8 Гц), 7,77 (1H, s), 7.74 (1H, dd, J = 9.1, 1.8 Гц), 7.63-7.61 (2Н, m), 7.46-7.40 (2Н, m), 7.30 (1H, dd, J = 8.5, 1.8 Гц), 7.25 (1H, s), 7.06 (2Н, s), 6.93 (1H, d, J = 8.5 Гц), 3.90 (3Н, s), 2.54 (3H, s), 2.37 (3H, s)
ESI (ЖХ-МС режим определения положительных ионов) т/г 618 [(М+Н)+]
Соединения под номерами 1429-1462, и 1580-1590, перечисленные в Таблице 25, синтезировали, как описано для Стадии 29.
|
|
|
|
|
|
Стадия 30: Синтез [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-пиридазин-4-ил-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанона (1463)

Смесь [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-йод-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанона (194.9 мг, 0.306 ммоль), аддукта [1,1′-бис(дифенилфосфино)ферроцен] дихлор-палладий(II)/дихлорметан (14.4 мг, 0.015 ммоль), бис(пинакол)диборана (100.9 мг, 0.397 ммоль), ацетата калия (132.3 мг, 1.35 ммоль), и безводного диметилсульфоксида (ДМСО) (1.5 мл) деаэрировали. Затем воздух трижды замещали аргоном, и нагревали и перемешивали при 110°C в течение шести часов. Затем реакционную смесь экстрагировали этилацетатом. Экстракт сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Затем остаток, полученный путем концентрирования при пониженном давлении, подвергали колоночной хроматографии на силикагеле (дихлорметан/метанол = 15/1). Получающийся сырой продукт смешивали с 4-бром-пиридазином (78.0 мг, 0.491 моль), дихлорбис(трифенилфосфин)палладием(II) (17.2 мг, 0.025 ммоль), 2 М водным раствором бикарбоната натрия (0.325 ммоль), и диоксаном (0.4 мл). После деаэрации, воздух трижды замещали аргоном, и смесь нагревали в микроволновой печи при 150°C в течение пяти минут. Затем реакционную смесь экстрагировали этилацетатом. Экстракт сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Затем остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол = 1% - 12%). Таким образом, [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-пиридазин-4-ил-1-(толуол-4-сульфонил)-1Н-индол-2-ил]-метанон получали в виде бледно-желтого аморфного вещества (20.0 мг, выход 11%).
ESI (ЖХ-МС режим определения положительных ионов) m/z 589 [(М+Н)+]
Стадия 31: Синтез (1-бензолсульфонил-1Н-индол-6-ил) метанола (1464)

Заданное заранее количество алюмогидрида лития (167 мг, 4.42 ммоль) помещали в лабораторный стакан, к нему добавляли безводный тетрагидрофуран (ТГФ) (15 мл), и смесь охлаждали до 0°C. К смеси добавляли безводный тетрагидрофурановый (ТГФ) раствор (5 мл) сложного метилового эфира 1-бензолсульфонил-1Н-индол-6-карбоновой кислоты (930 мг, 2.95 ммоль). Смесь перемешивали при 0°C в течение 30 минут. К смеси добавляли водный насыщенный раствор хлорида аммония (1 мл). После фильтрования на целите, целит промывали дихлорметаном. Фильтрат сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Затем путем концентрирования при пониженном давлении, получали (1-бензолсульфонил-1Н-индол-6-ил)-метанол в виде маслянистого коричневого вещества (859 мг, 100%).
1Н-ЯМР (ДМСО-D6) δ: 7.96-7.92 (3H, m), 7.74 (1H, d, J = 3.7 Гц), 7.68-7.67 (1H, m), 7.60-7.55 (2H, m), 7.52 (1H, d, J = 8.0 Гц), 7.19-7.17 (1H, m), 6.80 (1H, dd, J = 3.7, 0.8 Гц), 5.30 (1H, t, J = 5.7 Гц), 4.59 (2H, d, J = 5.7 Гц)
ESI (ЖХ-МС режим определения положительных ионов) m/z 288 [(М+Н)+]
Стадия 32: Синтез 1-бензолсульфонил-6-(трет-бутил-дифенил-силанилоксиметил)-1H-индола (1465)
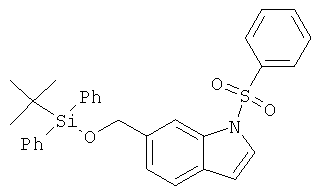
Заданные заранее количества 1-бензолсульфонил-1Н-индол-6-ил)-метанола (859 мг, 2.99 ммоль), трет-бутил дифенилхлорсилана (2.3 мл, 8.97 ммоль), и имидазола (1.2 г, 17.9 ммоль) помещали в лабораторный стакан, и к смеси добавляли диметилформамид (30 мл). Смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь разбавляли этилацетатом (60 мл). Смесь дважды промывали водой, и сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Получающийся сырой продукт использовали в последующих реакциях.
ESI (ЖХ-МС режим определения положительных ионов) m/z 526 [(М+Н)+]
Стадия 33: Синтез сложного метилового эфира 1-бензолсульфонил-6-(трет-бутил-дифенил-силанилоксиметил)-1Н-индол-2-карбоновой кислоты (1466)

Тетрагидрофурановый (ТГФ) раствор диизопропиламида лития (LDA) приготовляли путем добавления по каплям гексанового раствора 1.0 М н-бутиллития (2.8 мл, 4.49 ммоль) к предварительно охлажденному (0°C) безводному тетрагидрофурановому (ТГФ) раствору (5 мл) N,N-диизопропиламина (0.64 мл, 4.49 ммоль).
Безводный тетрагидрофурановый (ТГФ) раствор (20 мл) сырого 1-бензолсульфонил-6-(трет-бутил-дифенил-силанилоксиметил)-1Н-индола охлаждали до -78°C, и к смеси добавляли приготовленный тетрагидрофурановый (ТГФ) раствор диизопропиламида лития (LDA). Смесь перемешивали при -78°C в течение 30 минут. К смеси добавляли метилхлорформиат (0.43 мл, 5.98 ммоль), и смесь перемешивали при -78°C в течение 30 минут. К реакционной смеси добавляли водный насыщенный раствор хлорида аммония, и смесь нагревали до комнатной температуры. После экстрагирования этилацетатом, органический слой сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Затем остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат = 98/2-4/1). Таким образом, сложный метиловый эфир 1-бензолсульфонил-6-(трет-бутил-дифенил-силанилоксиметил)-1Н-индол-2-карбоновой кислоты получали в виде коричневого аморфного вещества (882 мг, 51%).
ESI (ЖХ-МС режим определения положительных ионов) m/z 584 [(М+Н)+]
Стадия 34: Синтез сложного этилового эфира 5-(1-трет-бутоксикарбонил-1,2,3,6-тетрагидро-пиридин-4-ил)-1-(толуол-4-сульфонил)-1H-индол-2-карбоновой кислоты (1467)

Сложный этиловый эфир 5-бром-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты (844 мг, 2.0 ммоль), трет-бутиловый сложный эфир 4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты (742 мг, 2.4 ммоль), фосфат калия (848 мг, 4.0 ммоль), и тетракис(трифенилфосфин) палладий (116 мг, 0.1 ммоль) помещали в колбу. После деаэрации, воздух замещали азотом. В колбу добавляли безводный диоксан (16 мл) и воду (4 мл), и смесь перемешивали при 80°C в течение 15 часов. После охлаждения смеси до комнатной температуры, реакционную смесь фильтровали через целит, и затем промывали этилацетатом. Фильтрат концентрировали, и остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле. Таким образом, сложный этиловый эфир 5-(1-трет-бутоксикарбонил-1,2,3,6-тетрагидро-пиридин-4-ил)-1-(толуол-4-сульфонил)-1H-индол-2-карбоновой кислоты получали в виде бесцветного аморфного вещества (1.0 г, 97.2%).
1Н-ЯМР (ДМСО-D6) δ: 7.96 (1Н, d, J = 9.1 Гц), 7.84 (2Н, d, J = 8.2 Гц), 7.68 (1Н, d, J = 1.8 Гц), 7.60 (1Н, dd, J = 9.1. 1.8 Гц), 7.41 (2Н, d, J = 8.2 Гц), 7.34 (1Н, s), 6.17 (1Н, s), 4.34 (2Н, q, J = 7.0 Гц), 4.02-3.98 (2Н, m), 3.57-3.51 (2Н, m), 2.51-2.45 (1Н, m), 2.34 (3H, s), 1.42 (9H, s), 1.32 (3H, t, J = 7.0 Гц)
ESI (ЖХ-МС режим определения положительных ионов) m/z 525 [(М+Н)+]
Соединения под номерами 1468 и 1469, перечисленные в Таблице 26 синтезировали, как описано для Стадии 34.
|
Стадия 35: Синтез сложного этилового эфира 5-(1-трет-бутоксикарбонил-пиперидин-4-ил)-1-(толуол-4-сульфонил)-1H-индол-2-карбоновой кислоты (1470)

Смесь сложного этилового эфира 5-(1-трет-бутоксикарбонил-1,2,3,6-тетрагидро-пиридин-4-ил)-1-(толуол-4-сульфонил)-1H-индол-2-карбоновой кислоты (495 мг, 0.9 ммоль), 5% палладия на угле (100 мг), и метанола (20 мл) перемешивали под атмосферой водорода в течение 13 часов. Реакционную смесь фильтровали через целит, и промывали этилацетатом, и фильтрат концентрировали. Остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле. Таким образом, сложный этиловый эфир 5-(1-трет-бутоксикарбонил-пиперидин-4-ил)-1-(толуол-4-сульфонил)-1H-индол-2-карбоновой кислоты получали в виде бесцветного аморфного вещества (315.9 мг, 64%).
1Н-ЯМР (ДМСО-D6) δ: 7.92 (1Н, d, J = 8.8 Гц), 7.87 (2H, d, J = 7.9 Гц), 7.53 (1Н, d, J = 1.5 Гц), 7.42 (2H, d, J = 7.9 Гц), 7.39 (1Н, dd, J = 8.8, 1.5 Гц), 7.30 (1Н, s), 4.33 (2H, q, J = 7.0 Гц), 4.12-4.00 (2H, m), 2.85-2.70 (3H, m), 2.35 (3H, s), 1.78-1.70 (2H, m), 1.54-1.44 (2H, m), 1.41 (9H, s), 1.31 (3H, t, J = 7.0 Гц)
ESI (ЖХ-МС режим определения положительных ионов) m/z 527 [(М+Н)+]
Соединения под номерами 1471 и 1472, перечисленные в Таблице 27 синтезировали, как описано для Стадии 35.
|
Стадия 36: Синтез сложного этилового эфира 5-пиперидин-4-ил-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты (1473)

Сложный этиловый эфир 5-(1-трет-бутоксикарбонил-пиперидин-4-ил)-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты (362 мг, 0.687 ммоль) растворяли в смеси раствора этилацетата (4 мл) и 4 М соляной кислоты/этилацетате (8 мл). Смесь перемешивали при комнатной температуре под атмосферой азота в течение 1.5 часов. Реакционную смесь концентрировали при пониженном давлении. Таким образом, гидрохлорид сложного этилового эфира 5-пиперидин-4-ил-1-(толуол-4-сульфонил)-1H-индол-2-карбоновой кислоты получали в виде бесцветного аморфного вещества (332 мг).
1Н-ЯМР (ДМСО-D6) δ: 8.78 (1Н, brs), 7.98 (1H, d, J = 8.5 Гц), 7.90 (2H, d, J = 8.5 Гц), 7.51 (1H, s), 7.44 (2H, d. J = 8.5 Гц), 7.38-7.36 (2H, m), 4.34 (2H, q, J = 7.1 Гц), 3.02-2.90 (4Н, m), 2.36 (3H, s), 1.95-1.78 (5H, m), 1.31 (3H, t, J = 7.1 Гц)
ESI (ЖХ-МС режим определения положительных ионов) m/z 427 [(M+H)+]
Соединения под номерами 1474 и 1475, перечисленные в Таблице 28, синтезировали, как описано для Стадии 36.
|
Стадия 37: Синтез сложного этилового эфира 5-(1-изопропил-пиперидин-4-ил)-1-(толуол-4-сульфонил)-1H-индол-2-карбоновой кислоты (1476)

Смесь гидрохлорида сложного этилового эфира 5-пиперидин-4-ил-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты (253 мг, 0.592 ммоль) в дихлорэтане (4 мл), триэтиламина (0.17 мл, 1.18 ммоль), ацетона (1.44 мл, 19.6 ммоль), уксусной кислоты (0,28 мл, 4.89 ммоль), и триацетоксиборогидрида натрия (318 мг, 1.50 ммоль) перемешивали при комнатной температуре в течение 14.5 часов. Значение рН реакционной смеси устанавливали на 9 (основная), используя насыщенный водный раствор бикарбоната натрия. Смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия, и затем сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Получающийся остаток очищали с помощью колоночной амино-гель-хроматографии (гексан/этилацетат = 92/8 - 35/65). Таким образом, сложный этиловый эфир 5-(1-изопропил-пиперидин-4-ил)-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты получали в виде бесцветного смолообразного вещества (191 мг, 69%).
1Н-ЯМР (ДМСО-D6) δ: 7.91 (1Н, d, J = 8.5 Гц), 7.87 (2Н, d, J = 8.5 Гц), 7.52 (1Н, d, J = 1.8 Гц), 7.42 (2Н, d, J = 8.5 Гц), 7.39 (1Н, dd, J = 9.2, 1.8 Гц), 7.31 (1Н, s), 4.34 (2Н, q, J = 7.1 Гц), 2.87 (2Н, d, J = 11.6 Гц), 2.74-2.67 (1Н, m), 2.56-2.53 (1Н, m), 2.35 (3H, s), 2.21 (2Н, dd, J = 11.6, 5.8 Гц), 1.77-1.74 (2Н, m), 1.63-1.57 (2Н, m), 1.31 (3H, t, J = 7.1 Гц), 0.98 (6Н, d, J = 6.7 Гц)
ESI (ЖХ-МС режим определения положительных ионов) m/z 469 [(М+Н)+]
Соединения под номерами 1477-1480, перечисленные в Таблице 29, синтезировали, как описано для Стадии 37.
|
Стадия 38: Синтез 6-(1-метил-пиперидин-4-ил)-1-(толуол-4-сульфонил)-1Н-индола (1481)
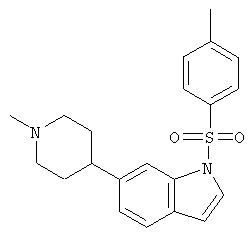
Получение цинкового реагента:
Безводный тетрагидрофурановый (ТГФ) раствор (3.5 мл) 4-хлор-1-метил-пиперидина (8.56 ммоль, 1.1 мл) добавляли при 80°C к суспензии (0.5 мл) магния (234 мг, 9.6 ммоль) в безводном тетрагидрофуране (ТГФ). Смесь перемешивали в течение одного часа. После охлаждения смеси до комнатной температуры, реакционную смесь добавляли по каплям к перемешиваемому раствору бромида цинка (1.1 г, 4.8 ммоль) в безводном тетрагидрофуране (ТГФ) (2.0 мл) и безводном 1-метил-2-пирролидиноне (0.6 мл). Смесь перемешивали в течение 30 минут.
Реакция сочетания:
6-Бром-1-(толуол-4-сульфонил)-1Н-индол (340 мг, 0.97 ммоль), трис(дибензилиденацетон)дипалладий(0) (23 мг, 0.025 ммоль), и (3-диэтоксифосфинотиоилсульфанил-1,4-диоксан-2-ил)сульфанил-диэтокси-сульфанилиден-фосфоран (Ruphos) (47 мг, 0.1 ммоль) помещали в лабораторный стакан. После деаэрации, воздух замещали азотом. К смеси добавляли безводный тетрагидрофуран (ТГФ) (5.0 мл) и полученную суспензию цинкового реагента, и смесь перемешивали при 70°C в течение 17 часов. После охлаждения смеси до комнатной температуры, реакционную смесь подщелачивали насыщенным водным раствором бикарбоната натрия. Осажденное твердое вещество удаляли с помощью фильтрования. Фильтрат экстрагировали этилацетатом. Экстракт промывали водой и водным насыщенным раствором хлорида натрия, и сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле. Таким образом, 6-(1-метил-пиперидин-4-ил)-1-(толуол-4-сульфонил)-1Н-индол получали в виде воскообразного твердого вещества (293.7 мг, 82%).
1Н-ЯМР (ДМСО-D6) δ: 7.83 (2Н, d, J = 8.2 Гц), 7.75 (1Н, d, J = 1.5 Гц), 7.71 (1H, d, J = 3.7 Гц), 7.48 (1H, d, J = 8.1 Гц),7.38 (2Н, d, J = 8.2 Гц), 7.14 (1H, dd, J = 8.1, 1.5 Гц), 6.76 (1H, d, J = 3.7 Гц), 2.89-2.87 (2Н, m), 2.61-2.52 (1H, m), 2.31 (3H, s), 2.21 (3H, s), 1.99 (2H, td, J = 11.4,5.7 Гц), 1.76-1.62 (4H, m)
ESI (ЖХ-МС режим определения положительных ионов) m/z 369 [(М+Н)+]
Соединения под номерами 1482 и 1483, перечисленные в Таблице 30, синтезировали, как описано для Стадии 38.
|
Стадия 40: Синтез сложного метилового эфира 4-хлор-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты (1484)

Раствор диизопропиламида лития приготовляли путем добавления, при -78°C, 1.0 М гексанового раствора н-бутиллития к безводному тетрагидрофурановому (ТГФ) раствору (1.5 мл) диизопропиламина (370 мкл). Приготовленный раствор добавляли при -78°C к тетрагидрофурановому (ТГФ) раствору (6 мл) 4-хлор-1-(толуол-4-сульфонил)-1Н-индола. Смесь перемешивали в течение 15 минут. После добавления к смеси метилхлорформиата (169 мкл), реакционную смесь перемешивали при -78°C в течение 15 минут, и затем к реакционной смеси при -78°C добавляли водный раствор (4 мл) 1 М соляной кислоты. После нагревания смеси до комнатной температуры, реакционную смесь экстрагировали этилацетатом (10 мл). Органический слой промывали насыщенным водным раствором хлорида натрия, и органический слой концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат). Таким образом, сложный метиловый эфир 4-хлор-1-(толуол-4-сульфонил)-1Н-индол-2-карбоновой кислоты получали в виде бесцветного твердого вещества (591 мг, 82%).
ESI (ЖХ-МС режим определения положительных ионов) m/z 364, 366 [(М+Н)+]
Соединения под номерами 1485-1490, перечисленные в Таблице 31, синтезировали, как описано для Стадии 39.

|
Стадия 40: Синтез дигидрохлорида (2-метил-1Н-бензимидазол-5-ил)-гидразина (1491)

Гидрохлорид 5-амино-2-метил-1Н-бензимидазола (16.51 г) растворяли в концентрированной соляной кислоте (200 мл), и смесь охлаждали до 0°C.По каплям при 0°C в течение 20 минут к смеси добавляли водный раствор (15 мл) нитрита натрия (7.59 г). Смесь перемешивали в течение 20 минут. Затем к смеси при 0°C в течение одного часа добавляли по каплям дигидрат хлорида олова(II) (55.7 г) в концентрированном растворе соляной кислоты (20 мл), и затем смесь перемешивали в течение 30 минут. Осажденное твердое вещество собирали с помощью фильтрования, и промывали водой, и сушили. Таким образом, получали сырой дигидрохлорид (2-метил-1Н-бензимидазол-5-ил)-гидразина.
ESI (ЖХ-МС режим определения положительных ионов) m/z 163 [(М+Н)+]
Соединения под номерами 1492-1496, перечисленные в Таблице 32, синтезировали, как описано для Стадии 40.
|
Стадия 41: Синтез дигидрохлорида (7-фтор-2-метил-1Н-бензимидазол-5-ил)-гидразина (1497)

Катализатор приготовляли, как изложено ниже. Ацетат палладия (1.2 мг, 0.0052 ммоль) и 2-дициклогексил фосфино-2′,4′,6′-три-изо-пропил-1,1′-бифенил (X-PHOS) (4.2 мг, 0.0088 ммоль) растворяли в трет-амиловом спирте (2.4 мкл, 0.022 ммоль) и N-метил-морфолине (0.05 мл). Получающийся раствор нагревали и перемешивали при 60°C под атмосферой азота в течение пяти минут.
В отдельном лабораторном стакане, 7-фтор-2-метил-3H-бензимидазол-5-иламин (100 мг, 0.44 ммоль), бис(триметилсилил)амид лития (190 мг, 1.1 ммоль), и гидразон бензофенона (94.3 мг, 0.48 ммоль) растворяли в N-метил-морфолине (0.5 мл) под атмосферой азота. Затем к смеси добавляли приготовленный раствор, содержащий катализатор. После деаэрации, смесь нагревали и перемешивали при 100°C под атмосферой азота в течение двух часов. Реакционную смесь охлаждали до комнатной температуры, и затем к смеси добавляли водный 6 М раствор соляной кислоты (0.5 мл). Органический слой отделяли, и концентрировали при пониженном давлении. Таким образом, получали сырой N-бензгидрилиден-N′-(7-фтор-2-метил-1Н-бензимидазол-5-ил)-гидразин. Полученный сырой продукт использовали в последующих реакциях без проведения очистки.
Концентрированную соляную кислоту (0.7 мл) добавляли к смеси сырого N-бензгидрилиден-N′-(7-фтор-2-метил-1Н-бензимидазол-5-ил)-гидразина (325 мг) и этанола (0.7 мл). Смесь перемешивали при температуре 59-64°C в течение одного часа, и реакционную смесь охлаждали до комнатной температуры. Затем осажденное твердое вещество собирали с помощью фильтрования и сушили. Таким образом, получали дигидрохлорид 7-фтор-2-метил-1Н-бензимидазол-5-ил-гидразина (90 мг, 80%).
1Н-ЯМР (ДМСО-D6) 6: 7.11 (1.0 H, d, J = 1.8 Гц), 6.99 (1.0 H, dd, J = 12.4, 1.8 Гц), 2.69 (3.1 H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 181 [(М+Н)+]
Дигидрохлорид 6-фтор-2-метил-1H-бензимидазол-5-ил-гидразина (1498) синтезировали, как описано для Стадии 41.

ESI (ЖХ-МС режим определения положительных ионов) m/z 181 [(М+Н)+]
Стадия 42: Синтез 6-бром-2-дифторметил-1Н-бензимидазола (1499)
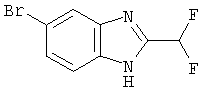
4-Бромфенилендиамин (935 мг, 5.0 ммоль) и дифторуксусную кислоту (0.47 мл, 7.5 ммоль, 1.5 экв.) растворяли в 5 М водном растворе (10 мл) соляной кислоты. Смесь перемешивали при 100°C в течение 24 часов. После охлаждения смеси до комнатной температуры, реакционную смесь подщелачивали путем добавления к ней 5 М водного раствора (10 мл) гидроксида натрия. После экстрагирования этилацетатом, экстракт сушили над безводным сульфатом натрия. Высушивающее средство удаляли с помощью фильтрования, и выполняли концентрирование. Остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле. Таким образом, 6-бром-2-дифтор-метил-1Н-бензимидазол получали в виде бледно-желтого твердого вещества (1.0 г, 85.4%).
1Н-ЯМР (ДМСО-D6) δ: 13.51 (1Н, brs), 7.86 (1H, d, J = 1.8 Гц), 7.62 (1H, d, J = 8.5 Гц), 7.44 (1H, dd, J = 8.5, 1.8 Гц), 7.41-7.14 (1H, m)
ESI (ЖХ-МС режим определения положительных ионов) m/z 247, 249 [(М+Н)+]
Стадия 43: Синтез 6-бром-2-дифторметил-1-(2-триметилсиланил-этоксиметил)-1H-бензимидазола (1500)

(2-Хлор-метокси-этил)-триметил-силан (1.1 мл, 6.4 ммоль, 1.5 экв.) добавляли к безводному дихлорметановому раствору (22 мл) 6-бром-2-дифторметил-1H-бензимидазола (1.0 г, 4.27 ммоль) и N,N-диизопропилэтиламина (1.9 мл, 10.6 ммоль, 2.5 экв.). Смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали. Остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле. Таким образом, 6-бром-2-дифторметил-1-(2-триметилсиланил-этоксиметил)-1Н-бензимидазол получали в виде желтого твердого вещества (1.37 г, 85%).
1Н-ЯМР (ДМСО-D6) δ: 8.07-8.02 (1Н, m), 7.78-7.74 (1H, m), 7.60-7.28 (2H, m), 5.76 (2H, s), 3.52 (2H, td, J = 8.4, 2.6 Гц), 0.83 (2H, td, J = 8.4, 2.6 Гц), -0.10 (9Н, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 377, 379 [(М+Н)+]
Стадия 44: Синтез гидрохлорида 2-дифторметил-3-(2-триметилсиланил-этоксиметил)-3H-бензимидазол-5-ил]-гидразина (1501)

6-Бром-2-дифторметил-1-(2-триметилсиланил-этоксиметил)-1H-бензимидазол (754 мг, 2.0 ммоль), трис(дибензилиденацетон)дипалладий (0) (92 мг, 0.1 ммоль), 2-дициклогексилфосфино-2′,4′,6′-три-изо-пропил-1,1′-бифенил (X-PHOS) (143 мг, 0.3 ммоль), карбонат цезия (1.3 г, 4.0 ммоль), и трет-бутилкарбазат (794 мг, 6.0 ммоль) помещали в колбу. После деаэрации воздух замещали аргон. К смеси добавляли безводный толуол (8.0 мл), и смесь перемешивали при 100°C в течение 20 часов. После охлаждения смеси до комнатной температуры, реакционную смесь фильтровали через целит, и промывали этилацетатом. Фильтрат концентрировали. Остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле. Таким образом, трет-бутоксикарбонилированный гидразин получали в виде бледно-желтого смолообразного вещества (220 мг, 26%). 4 М раствор соляной кислоты в этилацетате (6.0 мл) добавляли к этилацетатному раствору (3.0 мл) полученного трет-бутоксикарбонилированного гидразина. Смесь перемешивали при комнатной температуре в течение полутора часов. Осажденное твердое вещество собирали с помощью фильтрования, промывали этилацетатом, и сушили. Таким образом, сырой гидрохлорид [2-дифторметил-3-(2-триметилсиланил-этоксиметил)-3H-бензимидазол-5-ил]-гидразина получали в виде желтого твердого вещества. Сырой продукт использовали в последующих реакциях без проведения очистки.
ESI (ЖХ-МС режим определения положительных ионов) m/z 329 [(М+Н)+]
Синтез ди-трет-бутилмезилата 1-(2-метил-1Н-бензо[с1]имидазол-5-ил)гидразин-1,2-дикарбоновой кислоты

Стадия А
Смесь раствор 5-йод-2-метил-1Н-бензимидазола (10 г, 39 ммоль), триметокси-метана (200 мл), и хлортриметилсилана (0.075 мл, 0.59 ммоль) нагревали и перемешивали при 100°C в течение пяти часов под атмосферой азота, по мере того, как отгоняли растворитель (реакционный показатель превращения 97%). Реакционную смесь охлаждали до 40°C, и затем к смеси добавляли тетрагидрофурановый раствор (0.87 мл, 0.87 ммоль) трет-бутилата калия. Смесь концентрировали при пониженном давлении с обеспечением сырого 1-диметоксиметил-5-йод-2-метил-1Н-бензимидазола.
Стадия В
Тетрагидрофурановый раствор (44 мл, 47 ммоль) 1.06 М циклогексилмагнийхлорида добавляли к перемешиваемому раствору сырого 1-диметоксиметил-5-йод-2-метил-1Н-бензимидазола и тетрагидрофурана (79 мл). Смесь перемешивали при -20°C под атмосферой азота в течение двух часов. К реакционной смеси добавляли толуольный раствор (40 мл) ди-трет-бутилазодикарбоксилата (10.7 г, 46 ммоль), и смесь перемешивали под атмосферой азота при -20°C в течение одного часа и при 0°C в течение еще одного часа (реакционный показатель превращения 96%). К реакционной смеси добавляли 15% водный раствор (60 мл) хлорида аммония. После экстрагирования раствором изопропилацетата/гептане (1/1; 50 мл), органический слой промывали водным раствором (50 мл) 2% бикарбоната натрия. Затем к смеси добавляли 1-метил-пирролидин-2-он (15 мл), и смесь концентрировали при пониженном давлении с обеспечением сырого 1-метил-пирролидин-2-онового раствора (48 мл) ди-трет-бутил 1-(1-(диметоксиметил)-2-метил-1Н-бензо[d]имидазол-5-ил)гидразин-1,2-дикарбоновой кислоты.
Изопропил ацетат (61 мл), воду (0.2 мл), и метансульфоновую кислоту (0.87 мл) добавляли к 1-метил-пирролидин-2-оновому раствору (16 мл) сырой ди-трет-бутил 1-(1-(диметоксиметил)-2-метил-1Н-бензо[d]имидазол-5-ил)гидразин-1,2-дикарбоновой кислоты. Смесь перемешивали при 40°C в течение двух часов. После охлаждения смеси до 5°C, осажденное твердое вещество собирали с помощью фильтрования, и сушили с обеспечением ди-трет-бутилмезилата 1-(2-метил-1Н-бензо[d]имидазол-5-ил)гидразин-1,2-дикарбоновой кислоты (4.3 г, 73%).
1Н-ЯМР (CD3OD) δ: 7.87 (1.0 H, m), 7.69-7.53 (2.0 H, m), 2.84 (3.0 H, s), 2.70 (3.0 Н, s), 1.52-1.47 (18H, m)
Сырой 1-диметоксиметил-5-йод-2-метил-1Н-бензимидазол приготовляли, используя хлорид магния взамен хлортриметилсилана на стадии А (реакционный показатель превращения 98%).
Сырой 1-диметоксиметил-5-йод-2-метил-1Н-бензимидазол приготовляли, используя хлорид лития взамен хлортриметилсилана на стадии А (реакционный показатель превращения 98%).
Сырой 1-диметоксиметил-5-йод-2-метил-1Н-бензимидазол приготовляли, используя бензойную кислоту взамен хлортриметилсилана на стадии А (реакционный показатель превращения 97%).
Сырую ди-трет-бутил 1-(1-(диметоксиметил)-2-метил-1Н-бензо[d]имидазол-5-ил)гидразин-1,2-дикарбоновую кислоту приготовляли, используя тетрагидрофурановый раствор изопропилмагнийхлорида взамен тетрагидрофуранового раствора циклогексилмагнийхлорида на стадии В (реакционный показатель превращения 96%).
Синтез тетрагидрофуранового-ди-трет-бутилмалатного сольвата 1-(2-метил-1Н-бензо[d]имидазол-5-ил)гидразин-1,2-дикарбоновой кислоты

Ди-трет-бутилмалатный-тетрагидрофурановый сольват 1-(2-метил-1Н-бензо[d]имидазол-5-ил)гидразин-l,2-дикарбоновой кислоты приготовляли, используя тетрагидрофуран, малеиновую кислоту, и гептан взамен метансульфоновой кислоты и изопропилацетата на стадии В (выход 62%).
1Н-ЯМР (CD3OD) δ: 7.77 (1.0 H, m), 7.64-7.53 (2.0 H, m), 6.26 (2.0 H, s), 3.74-3.71 (4.0 Н, m), 2.80 (3.0 Н, s), 1.90-1.85 (4.0 Н, m), 1.51-1.48 (18H, m)
Стадия 45: Синтез сложного этилового эфира 1-(4-метокси-бензил)-1Н-пиррол-2-карбоновой кислоты (1502)

60% гидрид натрия в масле (362 мг) промывали гексаном, и суспендировали в безводном N,N-диметилформамиде (ДМФА) (5 мл). N,N-Диметилформамидный (ДМФА) раствор (15 мл) сложного этилового эфира 1Н-пиррол-2-карбоновой кислоты (1.05 г) добавляли по каплям к суспензии при 0°C в токе аргона. Реакционную смесь перемешивали при 25°C в течение одного часа, и затем 4-метоксибензилхлорид (1.5 мл) добавляли к реакционной смеси при 0°C.Реакционную смесь перемешивали при 25°C в течение 10 часов. Затем лед (приблизительно 10 г) добавляли к реакционной смеси, и последнюю экстрагировали этилацетатом (20 мл). Органический слой промывали водным насыщенным раствором (60 мл) хлорида натрия, и затем концентрировали. Остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат). Таким образом, получали желтое масляное вещество (1.64 г, 83%).
ESI (ЖХ-МС режим определения положительных ионов) m/z 260 [(M+H)+]
Стадия 46: Синтез сложного этилового эфира 4-бром-1Н-пиррол-2-карбоновой кислоты(1503)

Сложный этиловый эфир 1Н-пиррол-2-карбоновой кислоты (10 г) растворяли в четыреххлористом углероде (50 мл). Раствор брома в четыреххлористом углероде (50 мл) добавляли по каплям к реакционной смеси на льду в течение 30 минут. Реакционную смесь перемешивали при 25°C в течение одного часа. Суспензию реакционной смеси добавляли по каплям к этанольному раствору (100 мл) 10% этилата натрия на льду в течение 20 минут. Растворитель концентрировали при пониженном давлении. Получающийся остаток разбавляли этилацетатом (40 мл) и водой (20 мл). Органический слой промывали насыщенным водным раствором хлорида натрия (10 мл), и затем концентрировали. Остаток, полученный путем концентрирования при пониженном давлении, очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат). Таким образом, получали коричневое твердое вещество (10 г, 99%).
ESI (ЖХ-МС режим определения положительных ионов) m/z 218, 220 [(М+Н)+]
Стадия 47: Синтез сложного этилового эфира 4,5-дибром-1-(4-метокси-бензил)-1Н-пиррол-2-карбоновой кислоты (1504)

Безводный N,N-диметилформамидный (ДМФА) раствор (9 мл) N-бромсукцинимида (2.7 г) добавляли по каплям к безводному N,N-диметилформамидному (ДМФА) раствору (8 мл) сложного этилового эфира 1-(4-метокси-бензил)-1Н-пиррол-2-карбоновой кислоты (2 г) при 0°C в токе аргона. Реакционную смесь перемешивали при 0°C, и затем к смеси добавляли воду (20 мл). После экстрагирования этилацетатом (30 мл), органический слой промывали насыщенным водным раствором хлорида натрия (70 мл), и органический слой концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат). Таким образом, сложный этиловый эфир 4,5-дибром-1-(4-метокси-бензил)-1Н-пиррол-2-карбоновой кислоты получали в виде маслянистого бледно-коричневого вещества (2.99 г, 92%).
ESI (ЖХ-МС режим определения положительных ионов) m/z 416, 418, 420 [(M+H)+]
Стадия 48: Синтез [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-фенил-1-(толуол-4-сульфонил)-1Н-пиррол-2-ил]-метанона(1505)

Диоксан (1.5 мл) и 1 М водный раствор (1.5 мл) бикарбоната натрия добавляли к [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-бром-1-(толуол-4-сульфонил)-1Н-пиррол-2-ил]-метанону (57 мг), комплексу хлорид палладия - бис-трифенилфосфин (10 мг), и фенилбороновой кислоте (37 мг). Смесь подвергали реакции при 140°C в микроволновом реакторе в течение десяти минут. Реакционную смесь разбавляли водой (5 мл), и затем экстрагировали этилацетатом. Органические слои объединяли, и концентрировали при пониженном давлении. После ЖХВР очистки, элюат обессоливали, используя картридж PLHC03 (PolymerLabs), и затем концентрировали при пониженном давлении. Таким образом, [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-фенил-1-(толуол-4-сульфонил)-1Н-пиррол-2-ил]-метанон получали в виде желтого порошка (15 мг, 26%).
ESI (ЖХ-МС режим определения положительных ионов) m/z 537 [(М+Н)+]
Соединения под номерами 1506-1510, и 1591-1598, перечисленные в Таблице 33, синтезировали, как описано для Стадии 48.
|
|
|
[Пример 201: Синтез [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,5-дибром-1Н-пиррол-2-ил)-метанона]

[5-Амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4,5-дибром-1-(4-метокси-бензил)-1Н-пиррол-2-ил]-метанон (317 мг) растворяли в смеси этилацетате/серная кислота (4/1; 5 мл). Смесь перемешивали при 80°C в течение четырех часов. Значение рН реакционной смеси устанавливали на 11 (основная), используя 5 М водный раствор гидроксида натрия при охлаждении на льду. Реакционную смесь экстрагировали смесью этилацетат/тетрагидрофуран (ТГФ) (10 мл). Органический слой промывали насыщенным водным раствором хлорида натрия (5 мл), и органический слой концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол). Таким образом, получали коричневое твердое вещество (135 мг, 54%).
1Н-ЯМР (ДМСО-D6) δ: 12.88 (1Н, s), 12.46 (1H, s), 8.19 (1H, s), 7.63 (1H, d, J = 8.7 Гц), 7.56-7.54 (1H, m), 7.27-7.26 (3H, m), 6.90 (1H, t, J = 14.2 Гц), 2.53 (3H, s)
ESI (ЖХ-МС режим определения положительных ионов) m/z 463, 465, 467 [(M+H)+]
[Примеры 202 и 203]
Соединения Примеров 202, 203, и 240-246, перечисленные в Таблице 34, синтезировали, как описано в Примере 201.
|
|
Методики фармакологических испытаний
1. Ингибирующая активность по отношению к ферменту FGFR1
Активность FGFR1-ингибирования измеряли на основании активности ингибирования фосфорилирования биотинилированного пептида EGPWLEEEEEAYGWMDF с помощью фермента человека FGFR1 (Carna Biosciences, кат. 08-133). Фосфорилированные биотинилированные пептиды детектировали путем измерения флуоресценции с временным разрешением с использованием связанного с криптатом европия анти-фосфотирозинового антитела и стрептавидина, к которому было присоединено XL665, производное аллофикоцианина. 50%-ную ингибирующую концентрацию (IC50) рассчитывали на основе уровня ингибирования по отношению к контрольной группе без исследуемых веществ.
2. Ингибирующая активность по отношению к ферменту FGFR2
Активность FGFR2-ингибирования измеряли на основании активности ингибирования фосфорилирования биотинилированного пептида EGPWLEEEEEAYGWMDF с помощью фермента человека FGFR2, полученного с использованием бакуловирусной системы экспрессии. Фосфорилированные биотинилированные пептиды детектировали путем измерения флуоресценции с временным разрешением с использованием связанного с криптатом европия анти-фосфотирозинового антитела и стрептавидина, к которому было присоединено XL665, производное аллофикоцианина. 50%-ную ингибирующую концентрацию (IC50) рассчитывали на основе уровня ингибирования по отношению к контрольной группе без исследуемых веществ.
3. Ингибирующая активность по отношению к ферменту FGFR3
Активность FGFR3-ингибирования измеряли на основании активности ингибирования фосфорилирования биотинилированного пептида EGPWLEEEEEAYGWMDF с помощью фермента человека FGFR3 (Carna Biosciences, кат. 08-135). Фосфорилированные биотинилированные пептиды детектировали путем измерения флуоресценции с временным разрешением с использованием связанного с криптатом европия анти-фосфотирозинового антитела и стрептавидина, к которому было присоединено XL665, производное аллофикоцианина. 50%-ную ингибирующую концентрацию (IC50) рассчитывали на основе уровня ингибирования по отношению к контрольной группе без исследуемых веществ.
Результаты испытаний
Соединения, которые проявляют активность ингибирования FGFR1 (IC50 - 0.3 мкМ или меньше):
Примеры 1-14, 16-18, 23-25, 27-32, 35-62, 64-87, 89-108, 110, 112-125, 130-161, 163-175, 177-191, и 192-201
Соединения, которые проявляют активность ингибирования FGFR2 (IC50 0.3 мкМ или меньше):
Примеры 1-14, 16-62,64-108, 110, 112-126, 128-150, 152-161, 163-191, и 192-201 Соединения, которые проявляют активность ингибирования FGFR3 (IC50 0.3 мкМ или меньше):
Примеры 1-3, 5-9, 12-13, 25, 27-29, 32, 36, 38-50, 52-54, 56, 61, 64-67, 69-72, 74-81, 85-87, 89, 91-100, 102-108, 110, 112-121, 123-125, 132-150, 152-161, 163-169, 174-176, 178, 180-187, 189-191, 192, и 194-200
|
|
|
|
|
[Промышленная применимость]
Настоящее изобретение обеспечивает соединения, которые обладают ингибирующей активностью на FGFR семейство киназ. Кроме того, настоящее изобретение обеспечивает фармацевтические средства для предотвращения и/или лечения злокачественных новообразований (например, рака молочной железы, острой миелоцитарной лейкемии, рака поджелудочной железы, рака мочевого пузыря, рака предстательной железы, рака пищевода, ангиогенеза, рака желудка, рака тела матки, рака яичников, опухоли головного мозга, включая глиобластому, рака ободочной кишки, множественной миеломы, гепатоцеллюлярного рака, рака легкого, включая мелкоклеточный и немелкоклеточный рак легкого, и рака щитовидной железы).