КУЛЬТУРАЛЬНАЯ СРЕДА ДЛЯ ОМОЛАЖИВАНИЯ СТВОЛОВЫХ КЛЕТОК
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение касается композиции среды для трансформации стволовых клеток пожилого субъекта в молодые стволовые клетки, и более конкретно композиции среды для культивирования стволовых клеток, для омолаживания стволовых клеток пожилого субъекта, которые приобретают характеристики, близкие к таковым стволовых клеток молодых людей, и способа для омолаживания стволовых клеток, который включает культивирование стволовых клеток пожилого субъекта в среде данного состава.
Уровень техники
Мезенхимальные стволовые клетки представляют собой плюрипотентные стволовые клетки, ведущие свое происхождение от различных клеток взрослого организма, таких как клетки костного мозга, клетки крови пуповины, клетки плаценты (клетки плацентарной ткани) или жировые клетки (или клетки жировой ткани). Например, мезенхимальные стволовые клетки костного мозга обладают плюрипотентностью и могут дифференцироваться в жировую ткань, костную/хрящевую ткань и мышечную ткань, поэтому проводятся многочисленные исследования по созданию клеточных терапевтических агентов с использованием мезенхимальных стволовых клеток.
В последние годы по мере роста внимания к технологии клеточной терапии с использованием мезенхимальных стволовых клеток возникла потребность в технологии активации мезенхимальных стволовых клеток организма человека для того, чтобы они были пригодными для терапевтических целей. В частности, в клеточной терапии значительную часть пациентов составляют пожилые люди, и мезенхимальные стволовые клетки, выделяемые из ткани пожилого субъекта, обладают низкой терапевтической эффективностью вследствие их низкой способность к пролиферации и дифференцировке. Кроме того, необходима технология активации мезенхимальных стволовых клеток пожилых субъектов для того, чтобы они приобрели характеристики, близкие к таковым мезенхимальных стволовых клеток молодых людей.
Известно, что мезенхимальные стволовые клетки очень медленно делятся вследствие действия механизма старения, не связанного с укорочением теломер, при их культивировании in vitro, подобно другим клеткам человека в первичной культуре (Shibata, K.R. et al., Stem cells, 25; 2371-2382, 2007). Этот механизм старения пока еще не раскрыт, но известно, что он связан, главным образом, с воздействием окружающей среды, которое накапливается при длительном культивировании in vitro и приводит к тому, что в клетках экспрессируется и накапливается белок p16 (INK4a), являющийся ингибитором белка Cdk, и это ингибирует активность белка Cdk, который вовлечен в процесс роста клеток. Было установлено, что когда в мезенхимальных стволовых клетках индуцировалась экспрессия опухолевого гена Bmi-1 с целью ингибирования экспрессии p16, старение клеток замедлялось (Zhang, X. et al. Biochemical and biophysical research communications, 351; 853-859, 2006). Кроме того, сообщалось, что когда мезенхимальные стволовые клетки во время культивирования были обработаны FGF-2 для того, чтобы заингибировать экспрессию мРНК белков стволовых клеток p21 (Cip1), р53 и p16 (INK4a), снималась остановка мезенхимальных стволовых клеток в фазе G1 (Ito, T. et al., Biochemical and biophysical research communications, 359; 108-114, 2007). Более того, открытая корейская патентная публикация №10-2009-0108141 раскрывает способ ингибирования старения мезенхимальных стволовых клеток путем трансформации мезенхимальных стволовых клеток геном, кодирующим белок Wip1.
Однако о способе омолаживания старых мезенхимальных стволовых клеток, полученных из ткани пожилого субъекта, пока не сообщалось.
В соответствии с этим в настоящем изобретении было установлено, что когда мезенхимальные стволовые клетки, полученные из жировой ткани, выделенной из пожилого пациента, культивируются в среде, содержащей антиоксидант и фактор роста, могут быть получены мезенхимальные стволовые клетки, обладающие активностью, подобной таковой мезенхимальных стволовых клеток молодых людей, что и является предметом настоящего изобретения.
Раскрытие изобретения
Целью настоящего изобретения является предоставление композиции среды для омолаживания мезенхимальных стволовых клеток пожилого субъекта.
Другой целью настоящего изобретения является предоставление способа для омолаживания мезенхимальных стволовых клеток, который включает культивирование мезенхимальных стволовых клеток пожилого субъекта в среде данного состава.
Для достижения указанных выше целей настоящее изобретение предоставляет композицию среды для омолаживания мезенхимальных стволовых клеток пожилого субъекта, которая включает FBS (фетальную сыворотку теленка), антиоксидант, цитокин и NAC (N-ацетил-L-цистеин).
Настоящее изобретение также предоставляет способ для омолаживания мезенхимальных стволовых клеток пожилого субъекта, который включает культивирование мезенхимальных стволовых клеток пожилого субъекта в описанной выше среде данного состава.
Краткое описание чертежей
Фиг. 1 показывает микрофотографии жировых стволовых клеток из 20- и 30-летних субъектов, которые культивировались в каждой среде до пассажа 4.
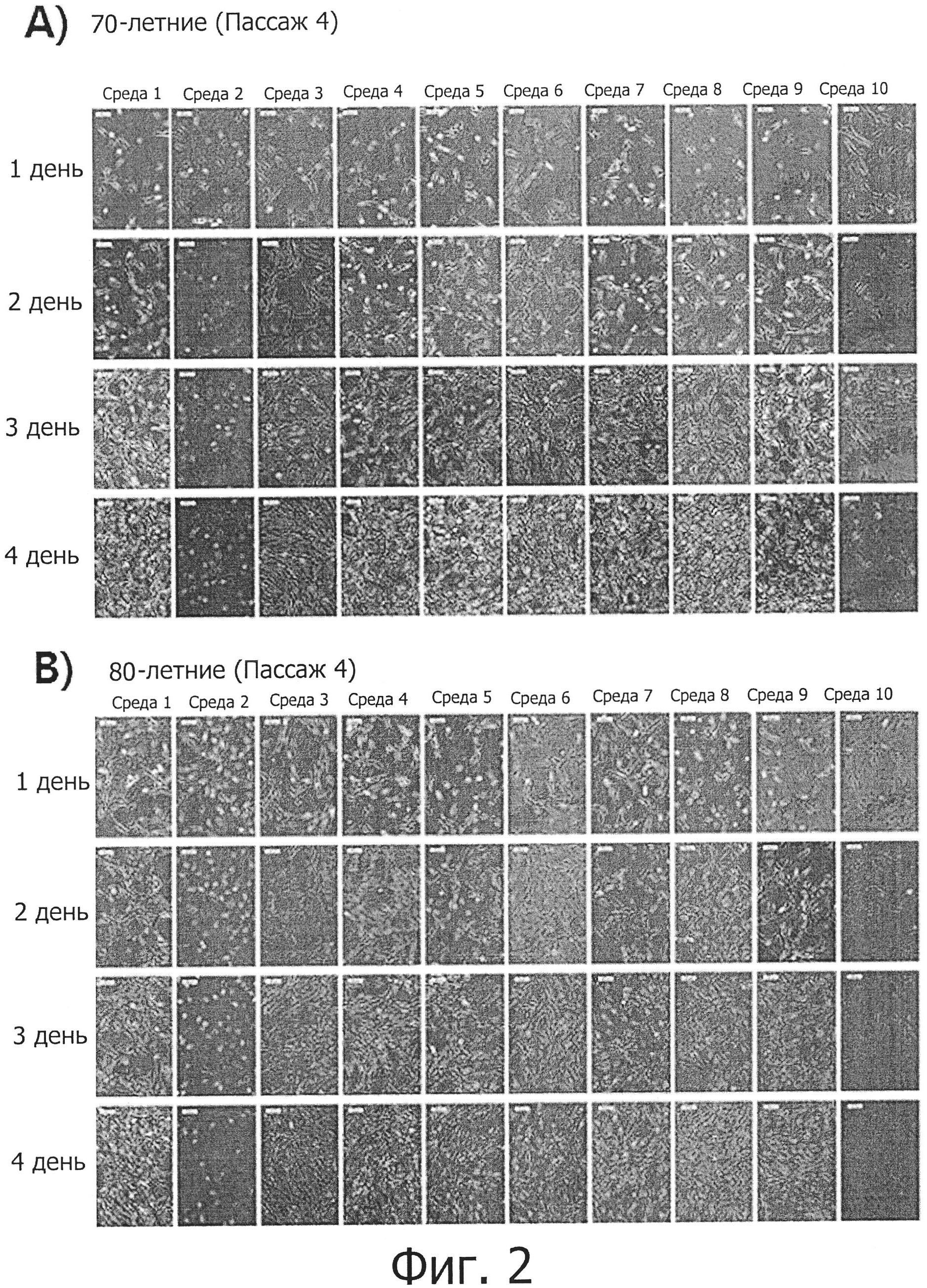
Фиг. 2 показывает микрофотографии жировых стволовых клеток из 70- и 80-летних субъектов, которые культивировались в их средах до пассажа 4.
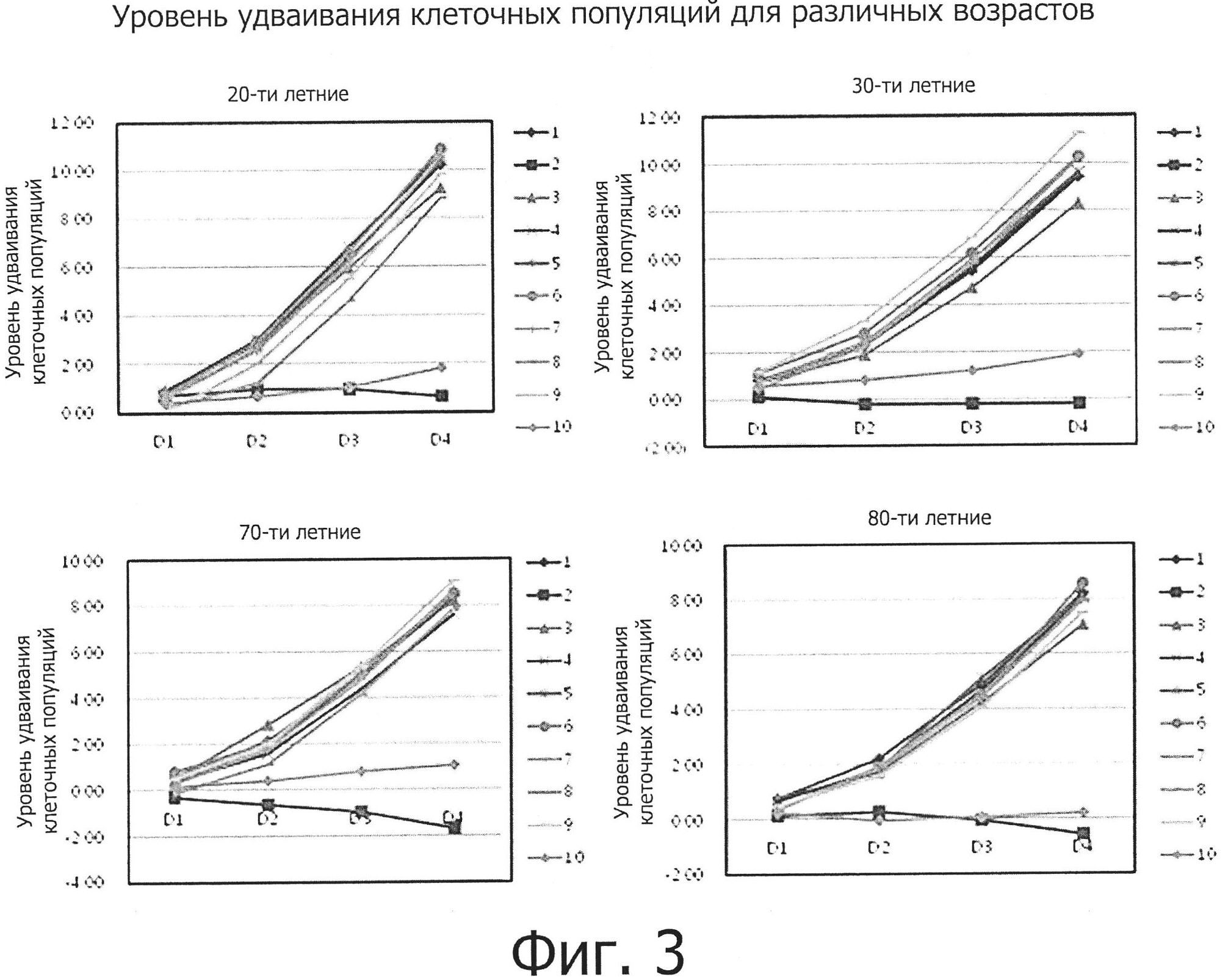
Фиг. 3 представляет собой графическую диаграмму, демонстрирующую уровни удваивания клеточных популяций (cell population doubling levels, CPDLs) клеток молодых людей (20- и 30-летних) и пожилых людей (70- и 80-летних), которые культивировались в 10 разных средах.
Фиг. 4 представляет собой графическую диаграмму, демонстрирующую уровни удваивания клеточных популяций (cell population doubling levels, CPDLs) клеток молодых людей (20- и 30-летних) и пожилых людей (70- и 80-летних), которые культивировались в разных средах.
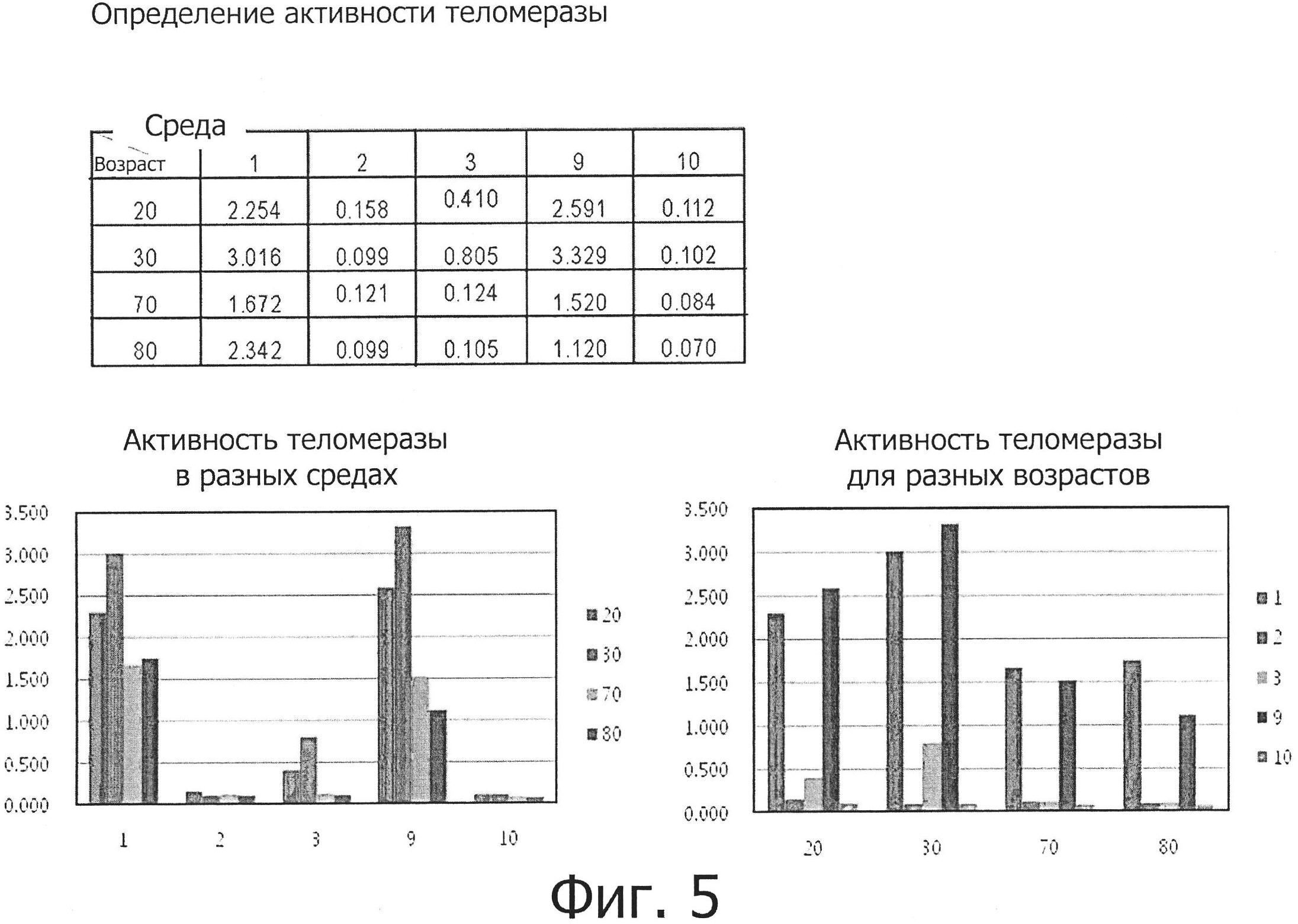
Фиг. 5 представляет собой графическую диаграмму, показывающую активности теломеразы жировых стволовых клеток, полученных от людей разного возраста и культивируемых в пяти разных средах.
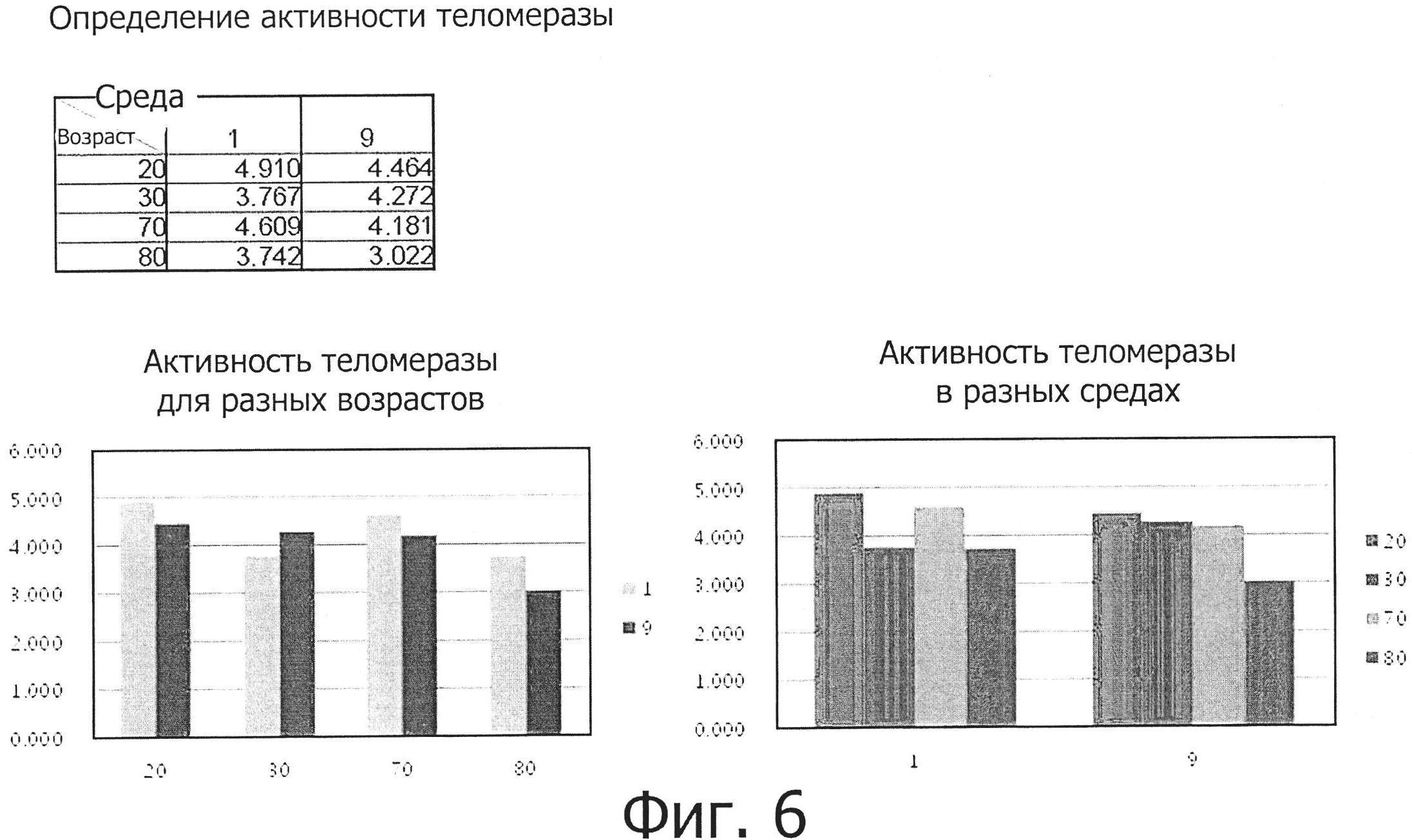
Фиг. 6 представляет собой графическую диаграмму, показывающую активности теломеразы жировых стволовых клеток, полученных от 20-, 30-, 70- и 80-летних людей, которые культивировались в двух разных средах (среда №1 и среда №9).
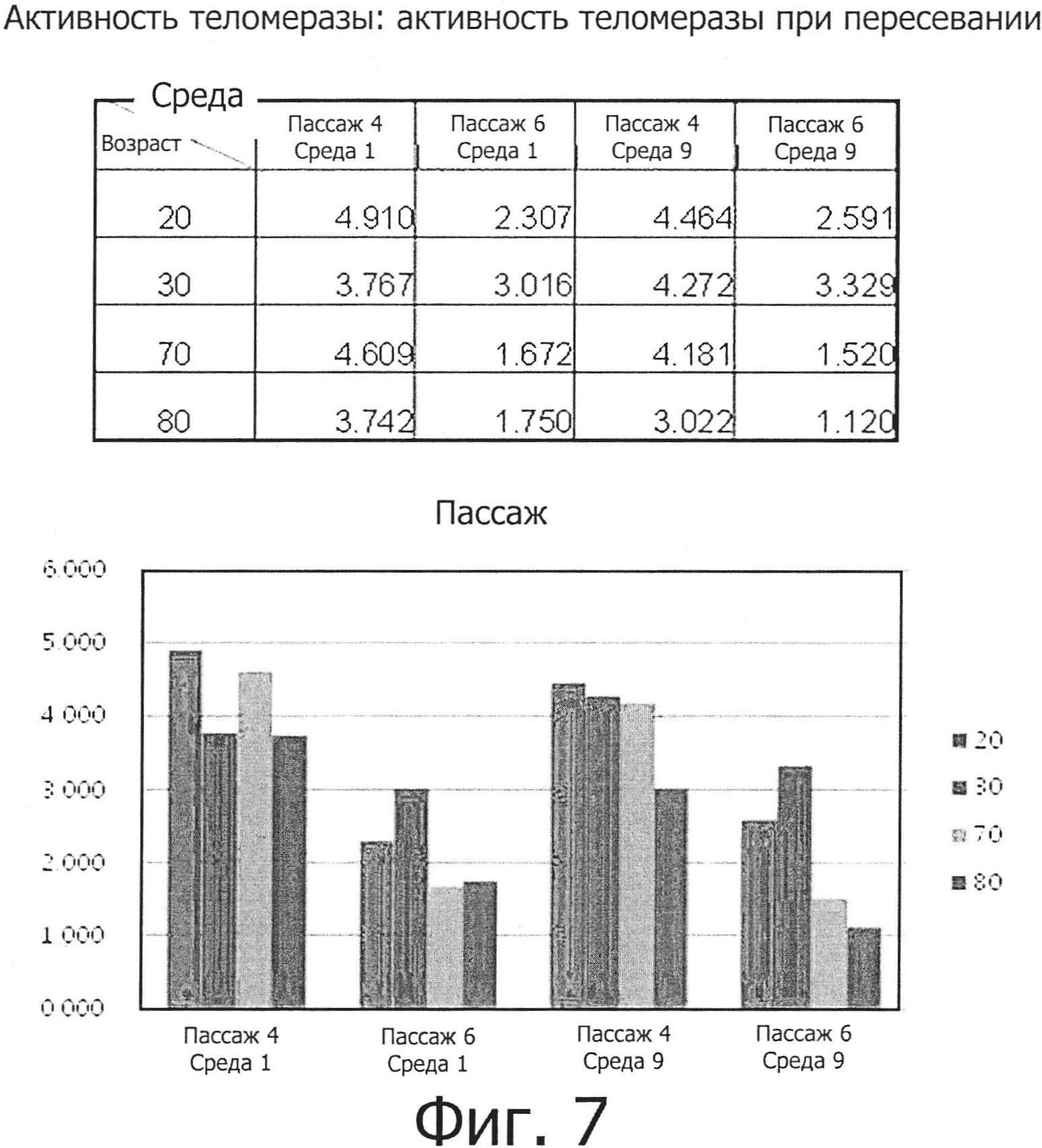
Фиг. 7 представляет собой графическую диаграмму, показывающую результаты измерения изменения активности теломеразы для ряда культур при их пересевании до пассажа 4 и пассажа 6 с использованием среды №1 и среды №9.
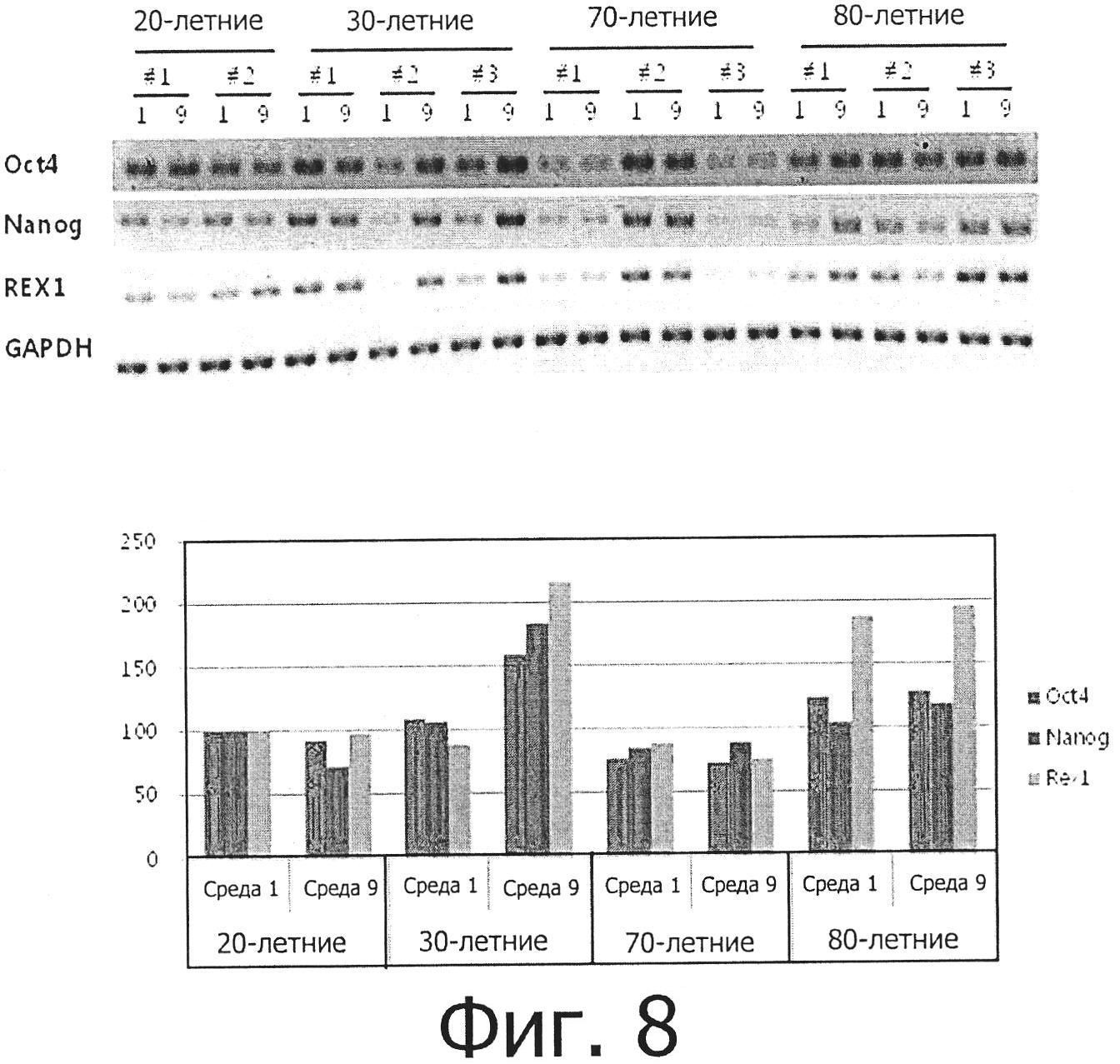
Фиг. 8 показывает результаты измерения уровней экспрессии маркеров плюрипотентности oct4, nanog и Rex1 в жировых стволовых клетках, культивируемых в среде №1 и среде №9 до пассажа Р3.
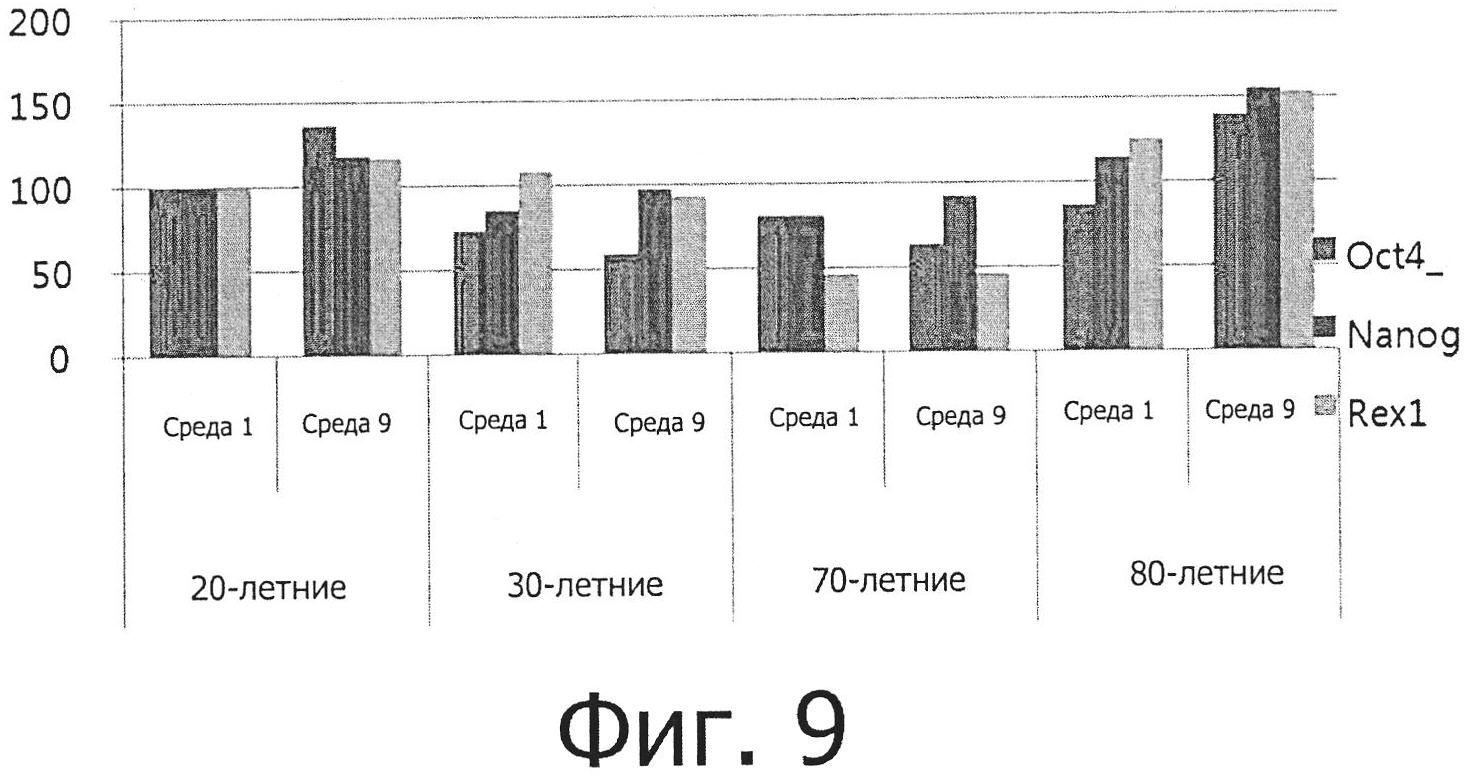
Фиг. 9 показывает результаты измерения уровней экспрессии маркеров плюрипотентности oct4, nanog и Rex1 в жировых стволовых клетках, культивируемых в среде №1 и среде №9 до пассажа 4.
Предпочтительное осуществление изобретения
В одном аспекте настоящее изобретение направлено на композицию среды для омолаживания мезенхимальных стволовых клеток пожилого субъекта, которая содержит FBS (фетальную сыворотку теленка), антиоксидант, цитокин и NAC (N-ацетил-L-цистеин).
В используемом здесь значении термин «стволовые клетки» обозначает клетки, обладающие не только способностью к самовоспроизведению, но также способностью дифференцироваться по меньшей мере в два типа клеток, и термин «взрослые стволовые клетки» обозначает клетки, которые появляются или на стадии, когда в процессе развития сформировался каждый орган эмбриона, или во взрослом возрасте.
В используемом здесь значении термин «мезенхимальные стволовые клетки» обозначает недифференцированные стволовые клетки, полученные из различных тканей человека или млекопитающих. В частности, в настоящем изобретении мезенхимальные стволовые клетки могут представлять собой мезенхимальные стволовые клетки из пуповины, мезенхимальные стволовые клетки из пуповинной крови, мезенхимальные стволовые клетки из костного мозга, мезенхимальные стволовые клетки из жировой ткани, мезенхимальные стволовые клетки из мышц, мезенхимальные стволовые клетки из нервной ткани, мезенхимальные стволовые клетки из кожи, мезенхимальные стволовые клетки из амниона и мезенхимальные стволовые клетки из плаценты. Технология выделения стволовых клеток из каждой ткани известна в данной области техники.
В используемом здесь значении термин «мезенхимальные стволовые клетки из жировой ткани» обозначает недифференцированные стволовые клетки, выделенные из жировой ткани. В частности, стволовые клетки из жировой ткани могут быть выделены путем суспендирования жировой ткани, полученной при липосакции, в физиологическом растворе, культивирования суспензии, обработки трипсином слоя адипоцитов, прикрепившихся к стенкам сосуда, такого как колба, и сбора обработанных адипоцитов или сбора небольшого количества адипоцитов, суспендированных в физиологическом растворе, с помощью скребка.
В используемом здесь значении выражение «омолаживание стволовых клеток» обозначает превращение фенотипов мезенхимальных стволовых клеток пожилых людей в фенотипы, подобные таковым мезенхимальных стволовых клеток молодых людей. Фенотипы включают в себя морфологию клеток, скорость пролиферации клеток, активность теломеразы, уровень экспрессии маркеров стволовых клеток (Oct4, SSEA-1, Tra 1-60, Tra 1-81, Nanog и т.д.) и способность стволовых клеток к дифференцировке. В настоящем изобретении мезенхимальные стволовые клетки из пожилого субъекта предпочтительно представляют собой клетки, выделенные из субъекта возрастом 60-120 лет.
В используемом здесь значении выражение «превращение фенотипов мезенхимальных стволовых клеток пожилых людей в фенотипы, подобные таковым мезенхимальных стволовых клеток молодых людей» означает либо состояние, в котором фенотипы становятся более похожими на таковые стволовых клеток из ткани молодых людей по сравнению с таковыми на первом пассаже, когда мезенхимальные стволовые клетки из пожилых людей были выделены, либо состояние, в котором фенотипы становятся более похожими на таковые стволовых клеток молодых людей по сравнению с таковыми мезенхимальных стволовых клеток, культивируемых в средах, отличающихся от культуральной среды настоящего изобретения.
В настоящем изобретении композиция среды может дополнительно содержать инсулин или инсулиноподобный фактор и гидрокортизон, и цитокин в композиции среды может представлять собой EGF (эпидермальный фактор роста) и/или bFGF (основной фактор роста фибробластов).
Антиоксидант, который применяется в композиции среды настоящего изобретения, может представлять собой селен, витамин Е, аскорбиновую кислоту, катехин, ликопин, бета-каротин, кофермент Q-10, ЕРА (эйкозапентаеновую кислоту), DHA (докозагексаеновую кислоту) и тому подобное. Предпочтительно антиоксидант может представлять собой селен.
Таким образом, в настоящем изобретении было установлено, что FBS, bFGF и EGF являются необходимыми факторами для культуры жировых стволовых клеток людей всех возрастных групп. Также было установлено, что плюрипотентность, скорость дифференцировки или активность теломеразы были выше в стволовых клетках молодых людей, чем в клетках пожилых людей, и что клетки, культивируемые в среде, не содержащей FBS, bFGF или EGF, демонстрируют пониженные скорость роста, скорость дифференцировки и активность теломеразы, что позволяет считать, что FBS, bFGF и EGF являются необходимыми элементами для роста и активности клеток.
Более того, в настоящем изобретении было установлено, что скорость дифференцировки стволовых клеток, полученных из молодой группы и пожилой группы, была сходной в среде, не содержащей селен, и в контрольной среде, содержащей селен. Однако результаты измерения активности теломеразы в этих двух средах указывают на то, что активность теломеразы была ниже в клетках пожилой группы, культивируемых в среде, не содержащей селен, чем в клетках из молодой группы, что позволяет считать, что селен должен быть обязательно включен в культуральную среду для клеток пожилых людей для обеспечения высокой активности теломеразы.
В другом аспекте настоящее изобретение направлено на способ омолаживания мезенхимальных стволовых клеток пожилого субъекта, который включает культивирование мезенхимальных стволовых клеток пожилого субъекта в среде описанного выше состава.
Основной средой, которая применяется для культивирования мезенхимальных стволовых клеток, может быть обычная среда, известная в данной области техники как пригодная для культивирования стволовых клеток, например среда DMEM, MEM или К-SFM. Предпочтительно среда не должна содержать сыворотку. Наиболее предпочтительно это может быть среда K-SFM (SFM для кератиноцитов, не содержащая сыворотки среда для кератиноцитов).
Среда, которая применяется для культивирования мезенхимальных стволовых клеток, может быть обогащена добавками, известными в данной области техники, для ингибирования дифференцировки мезенхимальных стволовых клеток с одновременным стимулированием пролиферации их недифференцированных фенотипов.
Кроме того, среда может содержать нейтральный буфер (например, фосфат и/или высокую концентрацию бикарбоната) в изотоническом растворе и белковое питательное вещество (например, сыворотку, такую как FBS, заменитель сыворотки, альбумин или заменимые и незаменимые аминокислоты, такие как глутамин). Кроме того, она может содержать липиды (жирные кислоты, холестерин, содержащий ЛВП или ЛНП экстракт сыворотки) и другие ингредиенты, входящие в состав большинства основных сред такого типа (например, инсулин или трансферрин, нуклеозиды или нуклеотиды, пируват, источник сахаров, такой как глюкоза, селен в виде любой ионизированной формы или соли, глюкокортикоид, такой как гидрокортизон, и/или восстанавливающий агент, такой как β-меркаптоэтанол).
Кроме того, с целью предотвращения адгезии клеток друг к другу или к стенке сосуда или образования больших кластеров среда может предпочтительно содержать антикоагулирующие агенты, например, такие, которые продаются фирмой Invitrogen (Cat #0010057АЕ).
Среди добавок могут преимущественно использоваться одна или более дополнительных добавок, выбираемых из следующего списка:
- фактор стволовых клеток (SCF, Steel factor), другие лиганды или антитела, которые димеризуют c-kit, и другие активаторы того же пути передачи сигнала;
- лиганды для других рецепторов, связанных с тирозинкиназами, таких как рецептор фактора роста тромбоцитов (PDGF), колониестимулирующего фактора макрофагов, лиганда Flt-3 и фактора роста эндотелия сосудов (VEGF);
- факторы, которые увеличивают уровни циклического АМФ, такие как форсколин;
- факторы, которые индуцируют gpl30, такие как LIF или онкостатин-М;
- гематопоэтические ростовые факторы, такие как тромбопоэтин (ТРО);
- трансформирующие ростовые факторы, такие как TGFβ1;
- нейротрофины, такие как CNTF.
Мезенхимальные стволовые клетки для культивирование согласно настоящему изобретению могут быть получены, например, следующим способом.
Жировая ткань человека, полученная из брюшного отдела путем липосакции или подобным образом, отделяется и промывается фосфатным буфером (PBS). Затем ткань мелко измельчается и разрушается в среде DMEM, содержащей коллагеназу, после чего промывается PBS и центрифугируется при 1000 об/мин в течение 5 минут. Супернатант удаляется и полученный осадок промывается PBS и центрифугируется при 1000 об/мин в течение 5 минут. Супернатант сливается через фильтр с размером пор 100 мкм, и оставшиеся клетки промываются PBS. После этого клетки культивируются в течение ночи в среде DMEM (10% FBS, 2 мМ NAC, 0,2 мМ аскорбиновой кислоты) и после такого культивирования клетки, которые не прикрепились к стенкам сосуда для культивирования, промываются PBS и культивируются в среде SFM для кератиноцитов (содержащей NAC, аскорбиновую кислоту, кальций, rEGF, ΒΡΕ, инсулин и гидрокортизон), при этом среда заменяется с интервалами 2 дня. Мезенхимальные стволовые клетки отделяются от среды и пересеваются, обеспечивая получение мезенхимальных стволовых клеток. Кроме того, мезенхимальные стволовые клетки могут быть получены также любым методом, известным в данной области техники.
В одном воплощении настоящего изобретения в качестве антиоксиданта предпочтительно применяется селен в количестве 0,5-1 нг/мл. Если содержание селена в среде меньше чем 0,5 мкг/л, среда будет подвержена кислородной токсичности, и если содержание селена больше чем 10 мкг/л, это будет приводить к серьезной цитотоксичности.
В настоящем изобретении в качестве заменителя инсулина может применяться инсулиноподобный фактор. Он обеспечивает усиление метаболизма глюкозы и метаболизма белков для стимуляции роста клеток. Предпочтительно в настоящем изобретении применяется рекомбинантный IGF-1 (инсулиноподобный фактор роста-1). Содержание инсулиноподобного фактора роста в среде предпочтительно составляет 10-50 нг/мл. Если содержание инсулиноподобного фактора роста меньше чем 10 нг/мл, будет происходить апоптоз, и если содержание инсулиноподобного фактора роста больше чем 50 мкг/л, он будет вызывать цитотоксичность и увеличивать стоимость среды.
Кроме того, в воплощении настоящего изобретения в среде применяется эпидермальный фактор роста (EGF). EGF может индуцировать пролиферацию разных типов клеток in vivo и предпочтительно представляет собой рекомбинантный EGF. Содержание EGF в среде предпочтительно составляет 10-50 нг/мл. Если содержание EGF в среде меньше чем 10 нг/мл, это не будет приводить к какому-либо заметному эффекту, и если содержание EGF в среде больше чем 50 нг/мл, он будет цитотоксичным.
Кроме того, в настоящем изобретении в среде применяется основной фактор роста фибробластов (bFGF). Он может индуцировать пролиферацию разных типов клеток in vivo и предпочтительно представляет собой рекомбинантный bFGF. Содержание bFGF в среде предпочтительно составляет 1-100 нг/мл.
В одном примере настоящего изобретения можно видеть, что FBS, bFGF и EGF являются незаменимыми факторами для культивирования жировых стволовых клеток людей всех возрастных групп. В частности, было установлено, что дефицит bFGF оказывает существенное влияние на культуру жировых стволовых клеток. Кроме того, было установлено, что скорость роста клеток увеличивается по мере того, как уменьшается возраст людей, от которых эти клетки были получены.
В другом примере настоящего изобретения было установлено, что FBS, bFGF и EGF являются важными факторами, которые определяют активность теломеразы жировых стволовых клеток. Также можно видеть, что активность теломеразы была выше в клетках 20-летних людей и что клетки, культивируемые в среде без селена, имели низкую активность теломеразы. Кроме того, было установлено, что когда жировые стволовые клетки пожилых людей культивировались в среде с селеном, они обладали активностью теломеразы, подобной активности этого фермента в жировых стволовых клетках, полученных от молодых людей.
Примеры
Далее настоящее изобретение будет описано более детально с помощью примеров. Специалисту в данной области техники должно быть очевидно, что эти примеры приведены в иллюстративных целях и не должны рассматриваться как ограничивающие рамки настоящего изобретения.
Пример 1
Выделение мезенхимальных стволовых клеток из жировой ткани человека
Жировую ткань выделяли путем липосакции из брюшного отдела пациентов возрастом 20, 30, 70 и 80 лет и промывали PBS. Промытую жировую ткань мелко измельчали и разрушали в среде DMEM, содержащей коллагеназу типа 1 (1 мг/мл) при 37°С в течение 2 часов. Обработанную коллагеназой ткань промывали PBS, после чего центрифугировали при 1000 об/мин в течение 5 минут. Супернатант удаляли, после чего полученные осадки промывали PBS и центрифугировали при 1000 об/мин в течение 5 минут. Отцентрифугированную ткань фильтровали через фильтр с размером пор 100 мкм для удаления супернатанта, после чего промывали PBS и культивировали в течение ночи в среде DMEM, содержащей 10% FBS, 2 мМ NAC (N-ацетил-L-цистеина) и 0,2 мМ аскорбиновой кислоты.
После этого неприкрепившиеся клетки промывали PBS, после чего культивировали в среде SFM для кератиноцитов (RKCM), содержащей 5% FBS, 2 мМ NAC, 0,2 мМ аскорбиновой кислоты, 0,09 мМ кальция, 5 нг/мл rEGF, 5 мкг/мл инсулина, 10 нг/мл bFGF, 74 нг/мл гидрокортизона и 1 нг/мл селена, при этом среда заменялась с интервалами в 2 дня. После того как клетки пересевались три раза, была исследована активность жировых стволовых клеток людей возрастом 20, 40 и 70 лет.
Для исследования активности стволовых клеток была исследована их морфология на микроскопическом уровне, измерены маркеры дифференцировки, активность теломеразы, длина теломер и определена способность стволовых клеток к дифференцировке.
В результате было установлено, что жировые стволовые клетки, выделенные из людей возрастом 20, 40 и 70 лет, обладали сходными активностями после того, как они были пересеяны три раза.
Пример 2
Выявление компонентов среды, которые омолаживают стволовые клетки
Были приготовлены среды, не содержащие один из компонентов - FBS, NAC, аскорбиновую кислоту, кальций, rEGF, 5 мкг/мл инсулина, bFGF, гидрокортизон и селен, которые являются активными компонентами, добавляемыми к средам RKCM, используемым в примере 1. Также были исследованы фенотипы жировых стволовых клеток из пациентов возрастом 20, 30, 70 и 80 лет в средах, не содержащих каждый из этих активных компонентов.
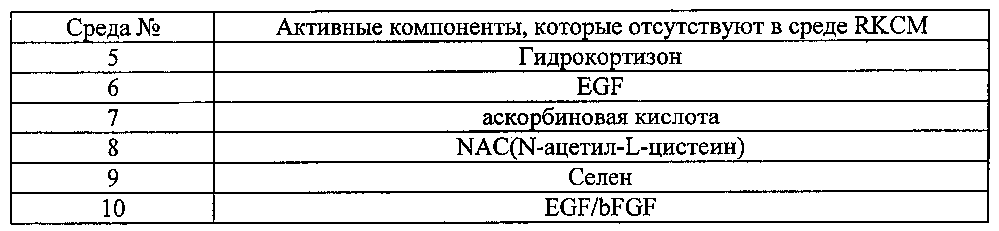
Были приготовлены среды №№ от 1 до 10. Среда №1 представляла собой среду RKCM и среды от №2 до №10 представляли собой среды, в которых в среде RKCM отсутствовал каждый из активных ингредиентов. Активные компоненты, которые отсутствовали в средах, перечислены ниже в таблице 1.

(1) Исследование морфологии и скорости пролиферации
Жировые стволовые клетки, выделенные из пациентов возрастом 20, 30, 70 и 80 лет по методу, описанному в примере 1, пересевались до 4 пассажа, после чего под микроскопом была проанализирована их морфология (фиг. 1 и 2). Также при каждом пересеве для определения скорости пролиферации клеток число клеток подсчитывалось с помощью гемоцитометра.
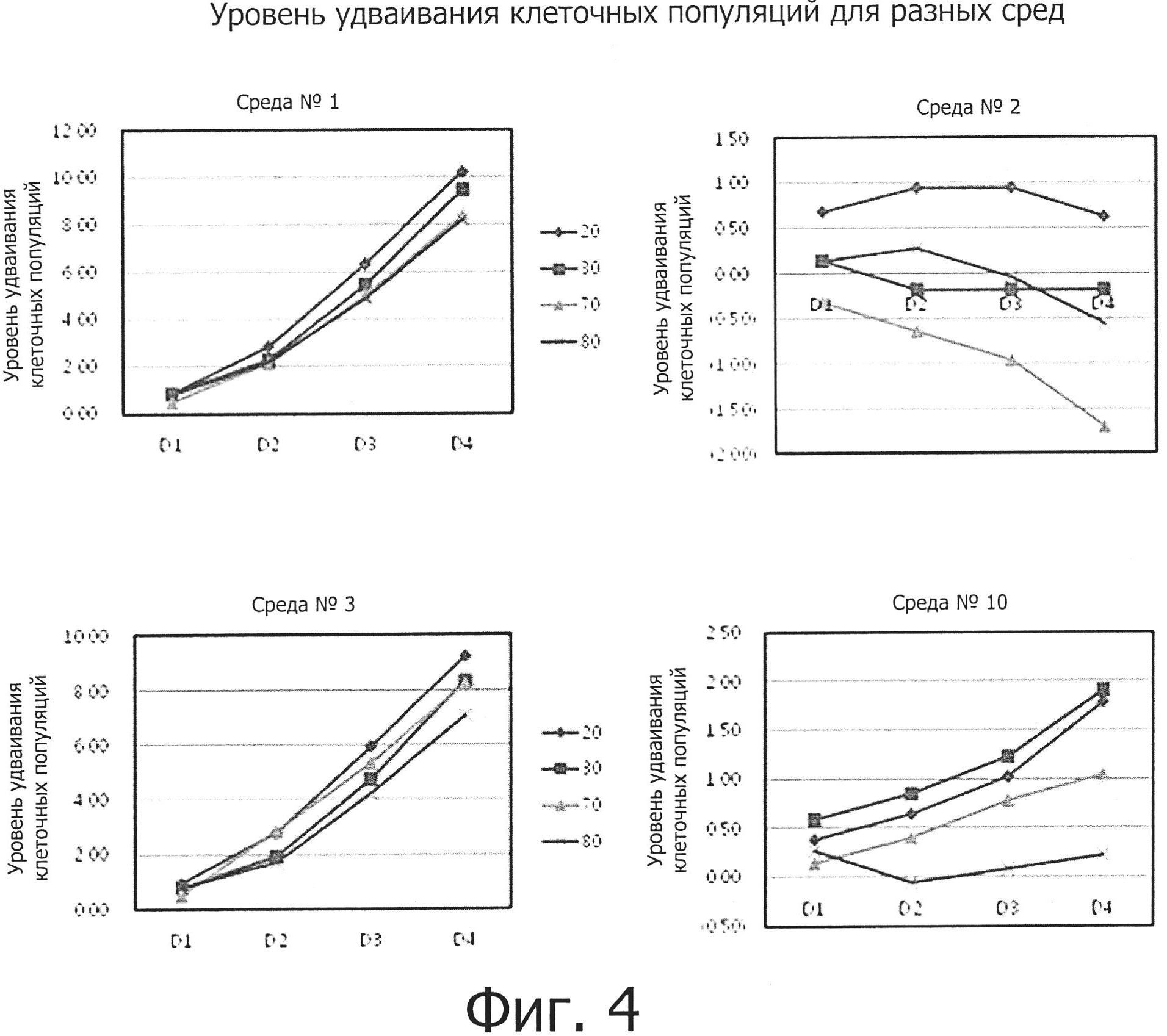
На фиг. 3 и 4 показаны уровни удваивания клеточных популяций (CPDL) клеток молодых людей (20- и 30-летних) и пожилых людей (70- и 80-летних), которые культивировались в 10 разных средах, и показаны CPDL в зависимости от возраста и среды соответственно. Как можно видеть, CPDL жировых мезенхимальных стволовых клеток молодых людей (20- и 30-летних) и пожилых людей (70- и 80-летних), которые культивировались в 10 разных средах, из которых было удалено по одному из активных компонентов, были сравнительно высокими для 20-, 30-, 70- и 80-летних возрастов, за исключением таковых в средах №2 и №10. Скорость роста клеток слегка различалась в разных средах и была наивысшей в средах №№1, 6 или 7 и самой низкой в среде №2.
По результатам исследования морфологии или скорости роста жировых стволовых клеток в 10 разных средах можно видеть, что компоненты, отсутствующие в средах №№2, 3 и 10, являются необходимыми факторами для культивирования жировых мезенхимальных стволовых клеток людей всех возрастных групп и что компонент, отсутствующий в среде №3, оказывает более значительное влияние на культивирование жировых мезенхимальных стволовых клеток по сравнению с компонентами, отсутствующими в средах №№2 и 10. Кроме того, было установлено, что скорость роста клеток увеличивается по мере того, как уменьшается возраст людей, от которых эти клетки были получены.
(2) Анализ активности теломеразы
Жировые стволовые клетки, выделенные из 20-, 30-, 70- и 80-летних пациентов по методу, описанному в примере 1, культивировали в пяти разных средах (№№1, 2, 3, 9 и 10) до 3 пассажа, после чего в них измерялась активность теломеразы.
Жировые мезенхимальные стволовые клетки, культивируемые в определенной среде, были промыты PBS, после чего были обработаны содержащей коллагеназу средой DMEM при 37°С в течение 2 часов. После этого клетки промывали PBS и центрифугировали при 3000×g в течение 10 минут. Супернатант удаляли, а оставшиеся клетки лизировали в лизирующем буфере из набора Telo TAGGG Telomerase PCR ELISA kit (Roche) и оставляли на льду на 30 минут. Клеточный лизат центрифугировали при 16000×g в течение 20 минут и часть супернатанта смешивали с реакционной средой из данного набора и проводили реакцию ПЦР в следующих условиях: элонгация при 25°С в течение 10 минут, инактивация при 94°С в течение 5 минут, денатурация при 94°С в течение 30 секунд, отжиг при 50°С в течение 30 секунд и полимеризация при 72°С в течение 90 секунд. Амплифицированный ПЦР образец в количестве 5 мкл смешивали с 25 мкл денатурирующего реагента из данного набора и оставляли реагировать при комнатной температуре в течение 10 минут, после чего смешивали с 225 мкл раствора для гибридизации. Смесь в количестве 100 мкл распыляли на покрытый микропланшет и оставляли реагировать при 37°С в течение 2 часов при скорости 300 об/мин, после чего удаляли раствор для гибридизации. Полученный материал несколько раз промывали буфером для промывания, после чего к нему добавляли 100 мкл раствора анти-DIG-POD и оставляли реагировать при комнатной температуре при скорости 300 об/мин в течение 30 минут. После этого раствор удаляли и оставшийся материал несколько раз промывали буфером для промывания. Добавляли к нему 100 мкл раствора субстрата ТМВ и оставляли реагировать при комнатной температуре при скорости 300 об/мин в течение 30 минут. Затем к нему добавляли 100 мкл стоп-раствора (раствора для остановки реакции) и регистрировали изменение цвета смеси. После добавления стоп-раствора цвет изменялся с синего на желтый, для регистрации этого изменения в течение 30 минут измеряли оптическую плотность при 450 нм на спектрофотометре для чтения микропланшетов (ELISA).
В результате было установлено, как показано на фиг. 5, что активность теломеразы жировых стволовых клеток, культивируемых в пяти разных средах, была самой высокой в среде №9 в случае клеток людей возрастом 20 и 30 лет, а клетки в средах №№2, 3 и 10 имели низкую активность или совсем не обладали активностью теломеразы. В случае клеток из пожилых людей клетки, культивируемые в среде №1, показывали слегка более высокую активность, чем таковые, культивируемые в среде №9. Также в случае клеток из пожилых людей активности теломеразы клеток, культивируемых в средах №№2, 3 и 10, были низкими.
Фиг. 6 показывает активности теломеразы клеток 20-, 30-, 70- и 80-летних людей, которые культивировались в двух разных средах (среда №1 и среда №9).
В результате было установлено, что активности теломеразы жировых стволовых клеток, культивируемых в средах №№1 и 9, были самыми высокими в клетках 20-летних людей и были выше в клетках, культивируемых в среде №1, чем в клетках, культивируемых в среде №9, за исключением клеток 30-летних людей.
Кроме того, когда клетки культивировались в средах №№1 и 9 до пассажа Р4, плюрипотентность культивируемых клеток была самой высокой в клетках 80-летних людей, тогда как активность теломеразы была самой высокой в клетках 20-летних людей. Основываясь только на результатах анализа активности теломеразы, можно видеть, что компонент, отсутствующий в среде №9, более значительно снижает активность стволовых клеток по сравнению с компонентом, отсутствующим в среде №1, хотя это различие и является незначительным. Кроме того, было установлено, что когда клетки из пожилых людей культивируются в среде, содержащей компонент, отсутствующий в среде №9, клетки могут обладать активностью, сходной с таковой для клеток молодых людей, что позволяет предполагать, что данный компонент является важным компонентом.
Кроме того, клетки культивировали в средах №№1 и 9 до пассажа Р4 и пассажа Р6, после чего определяли изменение активности теломеразы в зависимости от числа пассажей (пересеваний культуры).
В результате было установлено, как показано на фиг. 7, что активность теломеразы была выше на пассаже Р4, чем на пассаже Р6, во всех возрастных группах в двух данных средах.
(3) Исследование экспрессии маркеров стволовых клеток
Жировые стволовые клетки, выделенные из 20-, 30-, 70- и 80-летних людей по методу, описанному в примере 1, пересевались в средах №№1 и 9 до 3 пассажа, после чего выращивались до 90% конфлюэнтности (слияния). После удаления среды выросшие стволовые клетки промывали один или более раз PBS, после чего лизировали лизирующим буфером (Intron Biotechnolgy, Sungnam, Korea) для экстракции РНК и РНК экстрагировали из клеток с использованием набора для полной экстракции (total extraction kit, Intron Biotechnolgy). С использованием экстрагированной РНК получали кДНК (набор Intron Biotechnology cDNA syntheis kit), которую затем подвергали ПЦР с использованием сконструированных праймеров для маркеров плюрипотентности oct-4, Nanog и Rex1. Продукты ПЦР разделяли электрофорезом и оценивали их количество с использованием анализатора изображений.
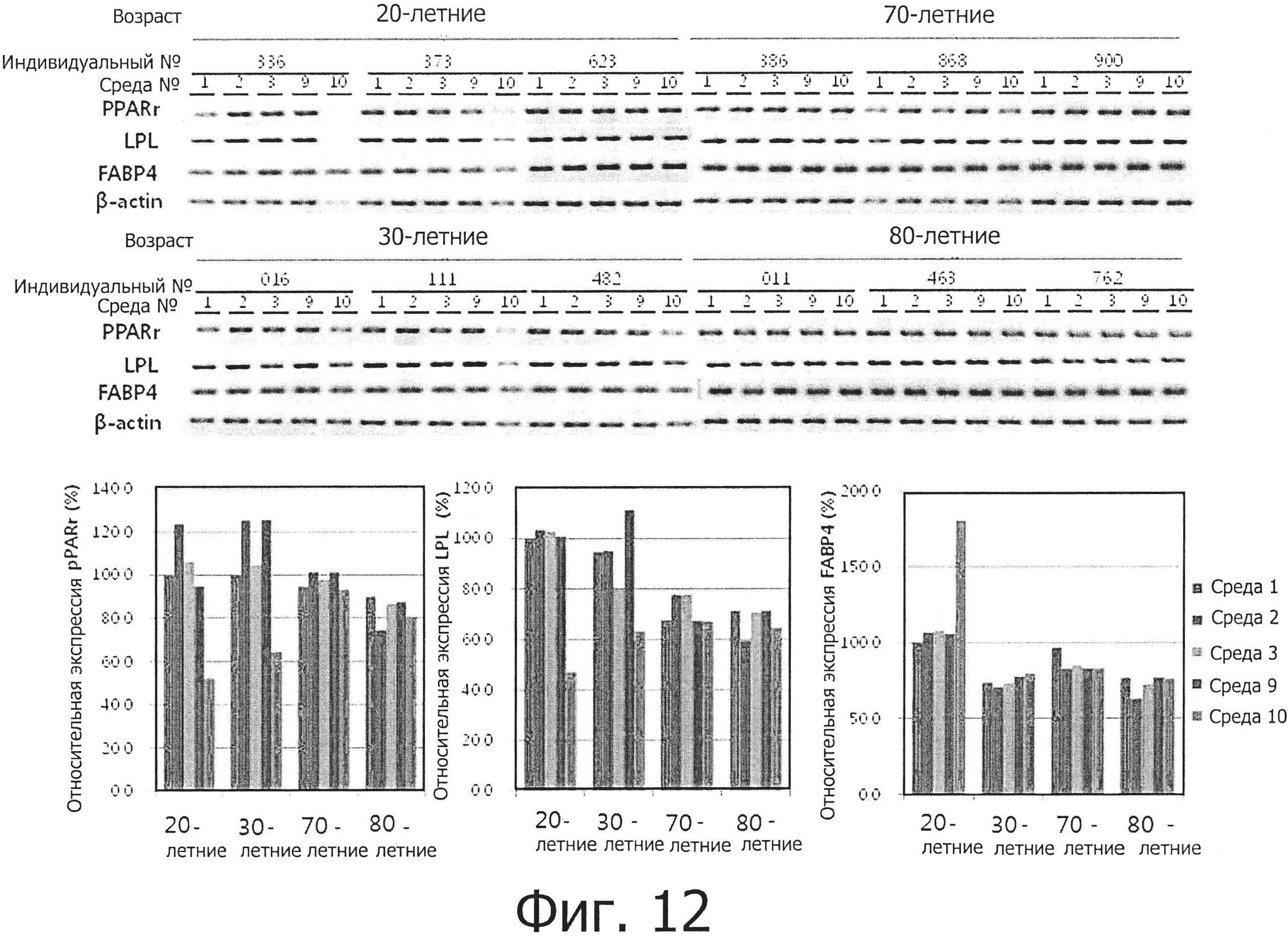
В результате было установлено, как показано на фиг. 8, что жировые стволовые клетки, культивируемые в средах №№1 и 9, все демонстрировали наличие маркеров плюрипотентности oct4, nanog и Rex1, хотя различие в экспрессии данных маркеров между стволовыми клетками было значительным. Уровень экспрессии данных маркеров в клетках 80- летних людей был выше, чем в клетках из других возрастных групп. Уровень экспрессии был также выше в среде №9, чем в среде №1, только в случае клеток 30-летних людей, а другие возрастные группы демонстрировали близкие уровни экспрессии маркеров.
Кроме того, жировые мезенхимальные стволовые клетки, культивируемые в средах №№1 и 9, экспрессировали маркеры плюрипотентности oct4, nanog и Rex1, хотя уровень экспрессии данных маркеров значительно различался между клетками (фиг. 9). Уровень экспрессии данных маркеров в клетках 80-летних людей был выше, чем в клетках других возрастных групп, и был выше в среде №9, чем в среде №1, в случае всех возрастных групп.
(4) Исследование способности к дифференцировке
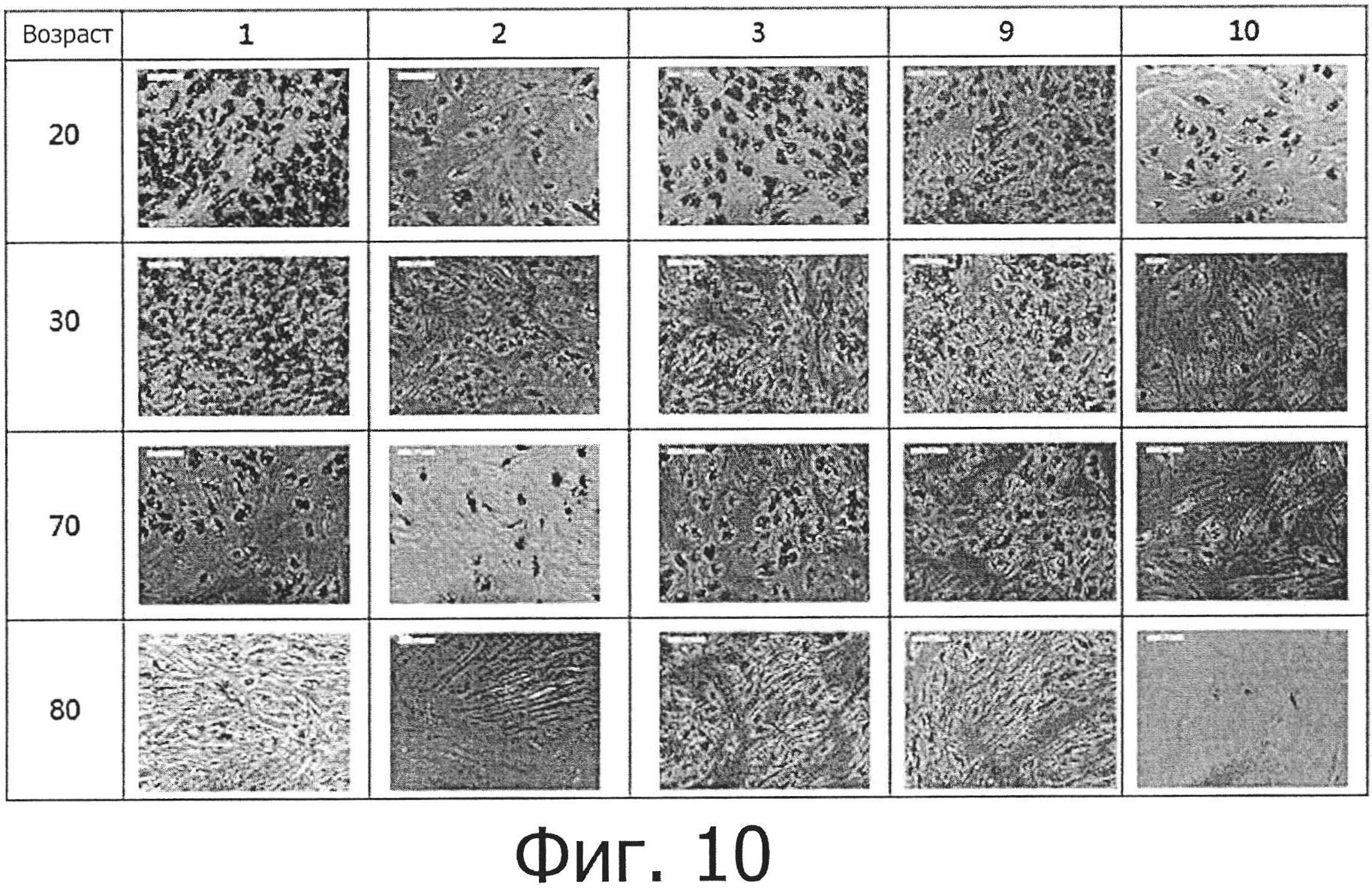
Жировые стволовые клетки, выделенные из 20-, 30-, 70- и 80-летних людей по методу, описанному в примере 1, пересевались в пяти разных средах (№№1, 2, 3, 9 и 10) и затем культивировались в среде NH Adipodiff medium (среда дифференцировки жировых клеток) (Miltenyi Biotec, Bergisch Gladbach, Germany) при 37°C и 5% CO2 в течение 21 дня, при этом среда дифференцировки жировых клеток заменялась с интервалом в 2 дня. Через 21 день после начала культивирования в среде дифференцировки жировых клеток была проанализирована способность жировых стволовых клеток дифференцироваться в адипоциты с помощью окрашивания красителем масляный красный О.
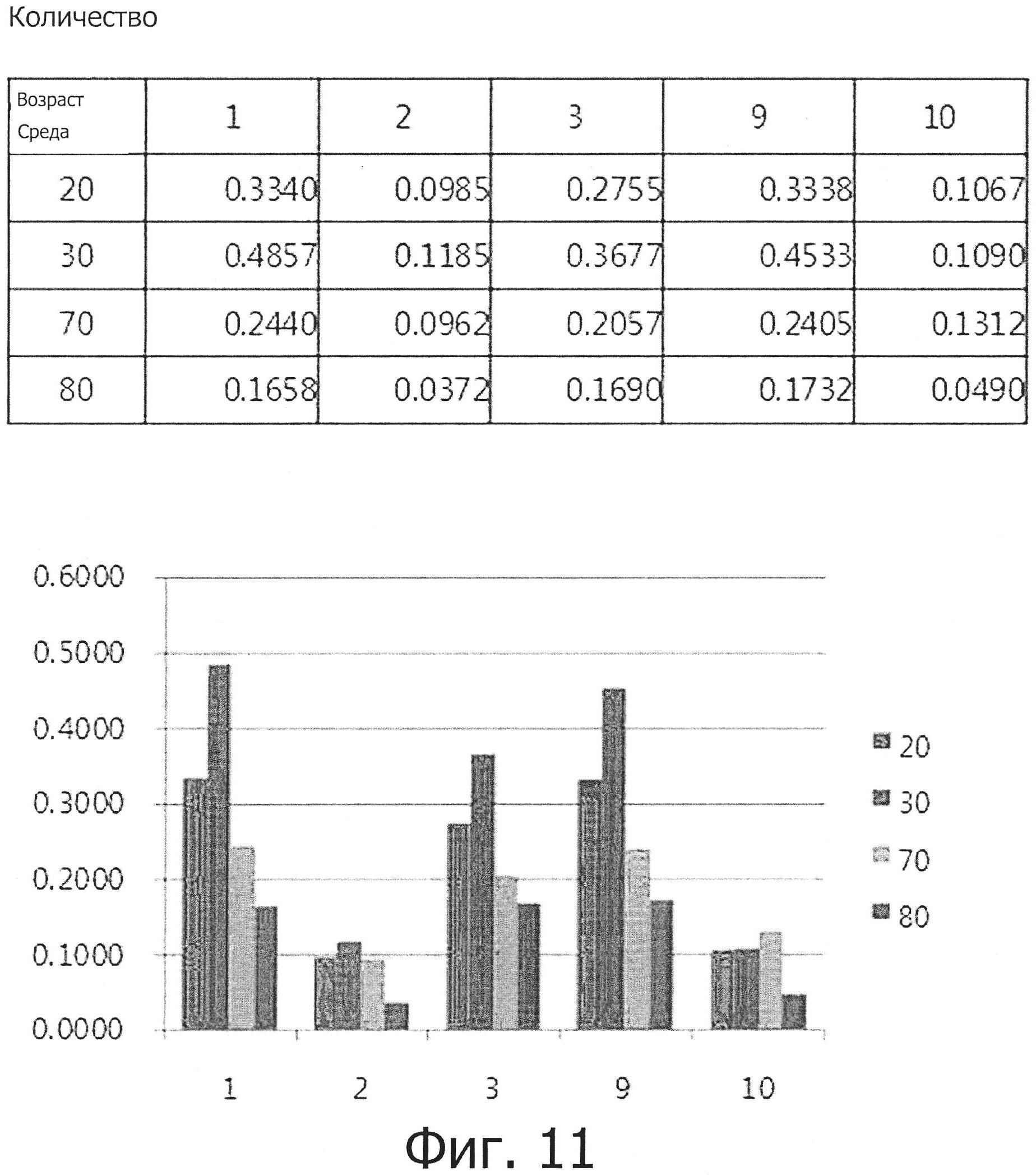
В результате было установлено, как показано на фиг. 10, что жировые капли (характеристика жировой дифференцировки) и окрашивание масляным красным О наблюдается в клетках, которые были взяты у всех возрастных групп и культивировались во всех средах. Фиг. 11 показывает результаты количественного анализа жировой дифференцировки. Как можно видеть, скорость дифференцировки была выше (в порядке убывания) в средах №№9, 1 и 3 и была ниже и примерно одинаковой в средах №№2 и 10. Кроме того, скорость дифференцировки зависела от возраста и убывала в следующем ряду: 30-, 20-, 70- и 80-летние.
Уровни экспрессии маркеров жировой дифференцировки PPARr, LPL и FABP4d были проанализированы на молекулярном уровне с помощью ПЦР в реальном времени. В результате было установлено, как показано на фиг. 12, что уровень экспрессии был несколько выше в молодой возрастной группе, чем в пожилой группе, даже с учетом того, что различие в уровне экспрессии между отдельными индивидуумами было значительным. Кроме того, уровень экспрессии был сходным во всех средах или был несколько выше в средах №№2 и 9.
На основании описанных выше результатов было установлено, что активные компоненты, которые отсутствовали в средах №№2, 3 и 10, являются незаменимыми факторами для культивирования жировых мезенхимальных стволовых клеток из людей всех возрастных групп. Кроме того, было обнаружено, что плюрипотентность, скорость дифференцировки или активность теломеразы были выше в клетках молодых людей, чем в клетках из старых людей, и что клетки, культивируемые в средах №№2, 3 и 10, демонстрируют сниженные скорость роста, скорость дифференцировки и активность теломеразы, что позволяет заключить, что компоненты, которые отсутствуют в этих средах, являются незаменимыми элементами для роста и активности клеток.
Кроме того, было установлено, что скорость дифференцировки клеток в среде №9 в отсутствие селена была сходной между молодой группой и пожилой группой, однако результаты измерения активности теломеразы при использовании двух сред показывают, что активность теломеразы была ниже в клетках группы пожилого возраста, культивируемых в среде №9 в отсутствие селена, чем в клетках из молодой группы, что позволяет заключить, что селен, который отсутствовал в среде №9, должен обязательно присутствовать в культуральной среде для клеток из пожилых людей для того, чтобы обеспечить активность теломеразы, сходную с таковой в клетках, культивируемых в среде №1.
Применимость в промышленности
Согласно настоящему изобретению даже мезенхимальные стволовые клетки, полученные от пациентов старше 60 лет, могут быть трансформированы в молодые мезенхимальные стволовые клетки, обладающие высокой способностью к дифференцировке, высокой активностью теломеразы и высокой способностью экспрессировать маркеры стволовых клеток. Таким образом, настоящее изобретение может значительно увеличить эффективность клеточной терапии с применением мезенхимальных стволовых клеток.
Хотя настоящее изобретение было раскрыто в деталях с помощью конкретных примеров, специалисту в данной области техники должно быть очевидно, что это описание касается только предпочтительного воплощения и не ограничивает рамок настоящего изобретения. Таким образом, рамки настоящего изобретения определяются пунктами формулы изобретения и их эквивалентами.