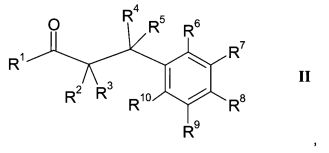
Результат интеллектуальной деятельности: 1-ГИДРОКСИИМИНО-3-ФЕНИЛ-ПРОПАНЫ
Вид РИД
Изобретение
Настоящее изобретение относится к новым 1-гидроксиимино-3-фенил-пропанам, обладающим фармацевтической активностью, их производству, фармацевтическим композициям их содержащим и их потенциальному применению в качестве лекарственных средств.
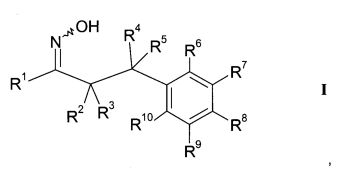
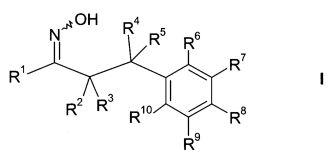
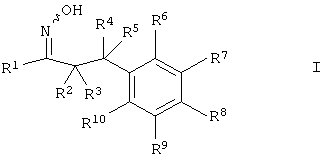
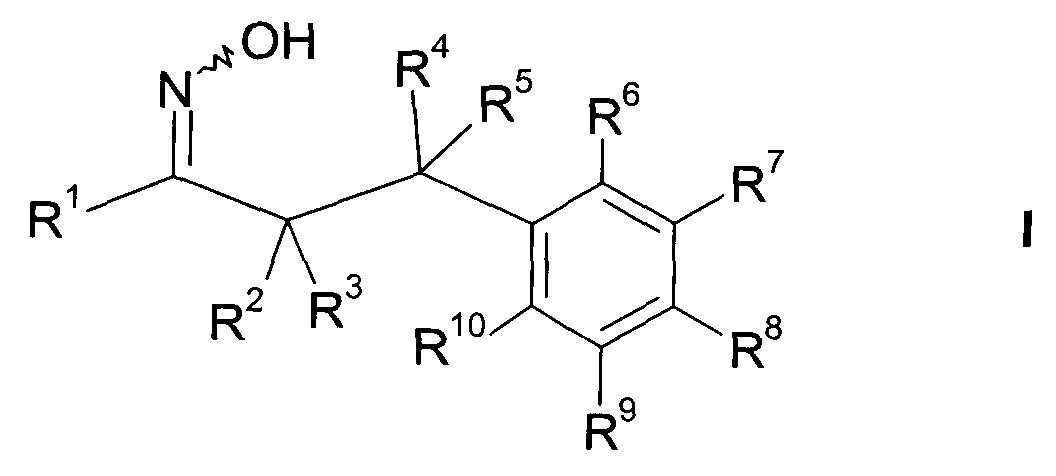
В частности, настоящее изобретение относится к соединениям формулы
где R1-R10 являются такими, как описано ниже, или их фармацевтически приемлемым солям.
Соединения являются модуляторами или лигандами рецептора GPBAR1. Более конкретно, соединения являются сильными агонистами GPBAR1 и могут быть полезны для лечения и профилактики болезней обмена веществ и воспалительных заболеваний, в частности диабета II типа.
Сахарный диабет является все возрастающей угрозой для здоровья человека. Например, в Соединенных Штатах текущие оценки утверждают, что около 16 миллионов человек страдают от сахарного диабета. Диабет второго типа, также известный как инсулиннезависимый сахарный диабет, составляет примерно 90-95% случаев диабета, убивая около 193000 жителей США каждый год. Диабет второго типа является седьмой ведущей причиной всех смертей. В западных обществах, тип II диабета в настоящее время наблюдается у 6% взрослого населения, во всем мире частота будет расти на 6% в год. Хотя есть определенные наследуемые признаки, которые могут предрасполагать отдельных лиц к развитию диабета II типа, движущей силой нынешнего роста заболеваемости является увеличение сидячего образа жизни, диеты и ожирение, распространенных в настоящее время в развитых странах. Около 80% пациентов с диабетом II типа обладают избыточным весом. Кроме того, все большее число молодых людей подвергаются болезни. Диабет второго типа в настоящее время международно признан в качестве одной из главных угроз для здоровья человека в 21 веке.
Диабет второго типа проявляется как неспособность адекватно регулировать уровень глюкозы в крови и может быть характеризоваться дефектом секреции инсулина или резистентностью к инсулину. В частности те, кто страдает сахарным диабетом II типа, обладают слишком малым количеством инсулина или не могут эффективно использовать инсулин. Резистентность к инсулину относится к неспособности тканей тела надлежащим образом реагировать на эндогенный инсулин. Резистентность к инсулину развивается из-за нескольких факторов, включая генетические, ожирение, увеличение возраста и наличие повышенного уровня сахара в крови в течение длительного периода времени. Диабет второго типа, который иногда называют зрелым, может развиться в любом возрасте, но чаще всего проявляется во взрослом возрасте. Тем не менее, частота диабета II типа у детей растет. У диабетиков уровень глюкозы повышается в крови и моче, вызывая чрезмерное мочеиспускание, жажду, голод и проблемы жирового и белкового обмена. Без лечения сахарный диабет может привести к опасным для жизни осложнениям, в том числе слепоте, почечной недостаточности и сердечной недостаточности.
Диабет второго типа в настоящее время лечится на нескольких уровнях. Первый уровень терапии - с помощью диеты и/или упражнений, либо самостоятельно, либо в комбинации с лекарственными средствами. Такие средства могут включать инсулин или лекарственные средства, которые снижают уровень глюкозы в крови. Около 49% людей с диабетом типа II нуждаются в пероральных препаратах, около 40% нуждаются в инъекциях инсулина или сочетании инъекций инсулина и пероральных препаратов, и 10% используют только диету и физические упражнения.
Современные способы лечения включают: стимуляторы секреции инсулина, такие как сульфонилмочевины, которые увеличивают продукцию инсулина бета-клетками поджелудочной железы; сахароснижающие препараты, такие как метформин, которые снижают продукцию глюкозы в печени; активаторы рецептора, активируемого пролифератором пероксисом у (PPARγ), такие как тиазолидиндионы, которые усиливают действие инсулина и ингибиторы α-глюкозидазы, которые препятствуют продукции глюкозы в пищеварительном тракте. Есть, однако, недостатки, связанные с имеющимися в настоящее время методами лечения. Например, сульфонилмочевины и инъекции инсулина могут быть связаны со случаями гипогликемии и увеличения веса. Кроме того, пациенты часто теряют восприимчивость к сульфонилмочевинам с течением времени. Метформин и ингибиторы α-глюкозидазы часто приводят к проблемам с желудочно-кишечным трактом, a PPARγ агонисты, как правило, вызывают увеличение веса и отечность
Желчные кислоты (ЖК) являются амфипатическими молекулы, которые синтезируются в печени из холестерина и хранятся в желчном пузыре до секреции в двенадцатиперстную кишку и кишечник, играя важную роль в солюбилизации и поглощение жиров и жирорастворимых витаминов. Приблизительный 99% ЖК поглощается снова путем пассивной диффузии и активного транспорта в подвздошной кишке и транспортируются обратно в печень через портальную вену (кишечно-печеночная циркуляция). В печени, ЖК уменьшают свой собственный биосинтез из холестерина путем активации фарнезоидного Х рецептора альфа (FXR α) и малых гетеродимерных партнеров (SHP), что приводит к транскрипционной репрессии 7α-гидроксилазы холестерина, лимитирующей стадии биосинтеза ЖК из холестерина.
GPBAR1, в литературе называемые также TGR5, M-BAR или BG37, недавно был идентифицирован как G-белок сопряженный рецептор (GPCR), реагирующий на ЖК (Kawamata et al., J. Biol. Chem. 2003, 278, 9435-9440; Maruyama et al., Biochem. Biophys. Res. Commun. 2002, 298, 714-719). GPBAR1 является C(альфа)s сопряженным GPCR и стимуляция связыванием лиганда приводит к активации аденилатциклазы, что в свою очередь приводит к повышению внутриклеточного цАМФ и последующей активации нижележащих сигнальных путей. Рецепторы человека обладают 86, 90, 82 и 83% аминокислотной идентичности с рецепторами крупного рогатого скота, кроликов, крыс и мышей, соответственно. GPBAR1 обширно экспрессируется в желудочно-кишечном тракте, моноцитах и макрофагах, легких, селезенке, плаценте (Kawamata et al., J. Biol. Chem. 2003, 278, 9435-9440). ЖК индуцируют интернализацию рецепторов, внутриклеточную продукцию цАМФ и активацию внеклеточной сигнал-регулируемой киназы в GPBAR1 экспрессирующих HEK293 и CHO клетках.
Было установлено, что GPBAR1 сильно экспрессируются в моноцитах/макрофагах людей и кроликов (Kawamata et al., J. Biol. Chem. 2003, 278, 9435-9440), и лечение ЖК подавляло ЛПС-индуцированную продукцию цитокинов у альвеолярных макрофагов кролика и человека ТНР-1 клеток, экспрессирующих GPBAR1. Эти данные позволяют предположить, что желчные кислоты могут подавлять функцию макрофагов через активацию GPBAR1. В печени функциональный GPBAR1 был найден в плазматической мембране клеток Купфера, опосредуя ингибируя ЛПС-индуцированную экспрессию цитокинов (Keitel, Biochem. Biophys. Res. Commun. 2008, 372, 78-84), и синусоидальных эндотелиальных клеток, где соли желчных кислот приводят к увеличению внутриклеточного цАМФ и активации и повышенной экспрессии эндотелиальной синтазы окиси азота (NO) (Keitel, Hepatology 2007, 45, 695-704). Кроме того, GPBAR1 был обнаружен в холангиоцитах печени крыс (Keitel, Biochem. Biophys. Res. Commun. 2008, 372, 78-84). гидрофобные желчные кислоты, такие как тауролитохолевая кислота, увеличивают цАМФ в холангиоцитах, предполагая, что GPBAR1 может модулировать дуктальную секрецию и выделение желчи. Действительно, GPBAR1 окраска колокализуется с цАМФ регулируемыми хлоридным каналом муковисцидозного трансмембранного регулятора проводимости (CFTR) и апикальным натрий-зависимым транспортером желчных кислот (ASBT). Функциональная связь GPBAR1 с секрецией хлоридов и желчи была показана использованием GPBAR1 агонистов (Keitel et al., Hepatology 2009 50, 861-870; Pellicciari et al., J Med Chem 2009, 52(24), 7958-7961). Таким образом, GPBAR1 агонисты могут вызвать защитный, а также лечебный механизмы в холестатической печени.
GPBAR1 экспрессируется в кишечных аргентаффинных клеточных линиях, происходящих от человека (NCI-H716) и мыши (Maruyama et al., Biochem. Biophys. Res. Commun. 2002, 298, 714-719). Стимуляция GPBAR1 посредством ЖК стимулировало продукцию цАМФ в клетках NCI-H716. Увеличение внутриклеточного цАМФ предполагает, что ЖК могут вызвать секрецию глюкагон-подобного пептида-1 (GLP-1). Действительно, активация GPBAR1 посредством ЖК. способствовала секреции GLP-1 в STC-1 клетках (Katsuma et al., Biochem. Biophys. Res. Commun. 2005, 329, 386-390). Рецептор-специфичность была продемонстрирована с помощью РНК-интерференционных экспериментов, которые показали, что снижение экспрессии GPBAR1 привело к уменьшению секреции GLP-1. Существуют убедительные доказательства того, что GPBAR1-опосредованное высвобождение GLP-1 и PYY из кишечных L-клеток распространяется и на естественные условия. В изолированной васкулярно перфузируемой толстой кишке крысы ЖК, как было показано, вызывают GLP-1 секрецию (Plaisancie et al., J. Endocrin. 1995, 145, 521-526). Используя комбинацию фармакологических и генетических экспериментов усиления и потери функции в естественных условиях, было показано, что GPBAR1 сигнализация вызывает высвобождение GLP-1, что приводит к улучшению функционирования печени и поджелудочной железы и повышению толерантности к глюкозе у мышей с ожирением (Thomas et al., Cell Metabolism, 2009, 10, 167-177). У людей, внутрикишечное введение дезоксихолата показало заметное увеличение плазменных уровней GLP-1 и совместно секретируемого PYY (Adrian et at., Gut 1993, 34, 1219-1224).
GLP-1 представляет собой пептид секретируемый аргентаффинными L клетками, и было показано, что он стимулируют высвобождение инсулина глюкозо-зависимым образом у людей (Kreymann et al., Lancet 1987, 2, 1300-1304), также исследования на подопытных животных показали, что этот инкретиновый гормон является необходимым для нормального гомеостаза глюкозы. Кроме того, GLP-1 может оказывать некоторое благотворное действие при диабете и ожирении, включая 1) увеличение утилизации глюкозы, 2) подавление продукции глюкозы, 3) уменьшение опорожнения желудка, 4) сокращение приема пищи и 5) потерю веса. В последнее время много исследований было сосредоточено на использовании GLP-1 при лечении состояний и заболеваний, таких как сахарный диабет, стресс, ожирение, контроль аппетита и насыщения, болезнь Альцгеймера, воспаление и заболевания центральной нервной системы (см., например, Bojanowska et al., Med. Sci. Monit. 2005, 8, RA271-8; Perry et al., Current Alzheimer Res. 2005, 3, 377-385; and Meier et al., Diabetes Metab. Res. Rev. 2005, 2, 91-117). Тем не менее, применение пептида в клинической практике ограничено в связи с трудным введением и стабильностью в естественных условиях. Таким образом, малые молекулы, которые либо имитируют эффект GLP-1 непосредственно, либо увеличивают секрецию GLP-1, могут быть полезны при лечении различных заболеваний или нарушений, описанных выше, а именно сахарного диабета.
PYY совместно секретируется с GLP-1 из кишечных L-клеток после еды. Продуктом расщепления PYY дипептидилпептидазой-IV (DPP4) является PYY [3-36] (Eberlein et al. Peptides 1989, 10, 797-803) (Grandt et al. Regul Pept 1994, 51, 151-159). Этот фрагмент составляет около 40% от общего числа PYY-иммунореактивности человеческих и собачьих кишечных экстрактов и около 36% от общей иммунореактивности PYY плазмы натощак до чуть более 50% после еды. PYY [3-36], как сообщается, является селективным лигандом Y2 и Y5 рецепторов. Периферическое введение PYY, как сообщается, снижает секрецию желудочных кислот, моторику желудка, экзокринную секрецию поджелудочной железы (Yoshinaga et al. Am J Physiol 1992, 263, G695-701), сокращение желчного пузыря и перистальтику кишечника (Savage et al. Gut 1987, 28, 166-170). Было продемонстрировано, что внутри дугообразное (IC) или внутрибрюшинное (IP) введение PYY3-36 уменьшало аппетит крыс и, как постоянное лечение, снижало вес тела. Внутривенная (IV) инфузия (0,8 пмоль/кг/мин) в течение 90 мин PYY3-36 снижала потребление пищи у тучных и нормальных людей на 33% в течение 24 часов. Эти исследования предполагают, что PYY система может быть терапевтической мишенью для лечения ожирения (Bloom et. al. Nature 2002, 418, 650-654).
Более того, активация GPBAR1 может быть полезна для лечения ожирения и метаболического синдрома. Мышей, кормленных пищей с высоким содержанием жиров (HFD), содержащей 0,5% желчных кислот, весили меньше, чем контрольные мыши только на HFD независимо от приема пищи (Watanabe et al., Nature 2006, 439, 484-489). Эти эффекты не зависят от FXR-альфа, и, скорее всего, являются результатом связывания ЖК с GPBAR1. Предлагаемый GPBAR1-опосредованный механизм приводит к последующей индукции цАМФ-зависимого активируемого тироидным гормоном фермента типа 2 (D2), который преобразует неактивный Т3 в активную форму Т4, приводя в результате к стимуляции рецепторов гормонов щитовидной железы и содействию расхода энергии. Мыши, лишенные гена D2, были устойчивы к вызванной желчными кислотами потере веса. Как у грызунов, так и у человека, наиболее важные термогенные ткани (бурая жировая ткань и скелетные мышцы) специально ориентированы на этот механизм, т.к. они совместно экспрессируют D2 и GPBAR1. ЖК-GPBAR1-цАМФ-D2 сигнальный путь является критическим механизмом для тонкой настройки энергетического гомеостаза, который может быть направлен на улучшение метаболического контроля.
Соответственно задачей настоящего изобретения является разработка селективных, непосредственно действующих GPBAR1 агонистов. Такие агонисты полезны в качестве терапевтически активных веществ, в частности, для лечения и/или профилактики заболеваний, которые связаны с активацией GPBAR1.
Новые соединения настоящего изобретения превосходят соединения, известные в данной области, поскольку они представляют собой небольшие молекулы, и они связывают и избирательно активируют GPBAR1 очень эффективно. Ожидается, что они обладают повышенным терапевтическим потенциалом по сравнению с соединениями, уже известными в данной области, и могут применяться для лечения сахарного диабета, ожирения, метаболического синдрома, гиперхолестеринемии, дислипидемии и широкого спектра острых и хронических воспалительных заболеваний
Краткое изложение сущности изобретения
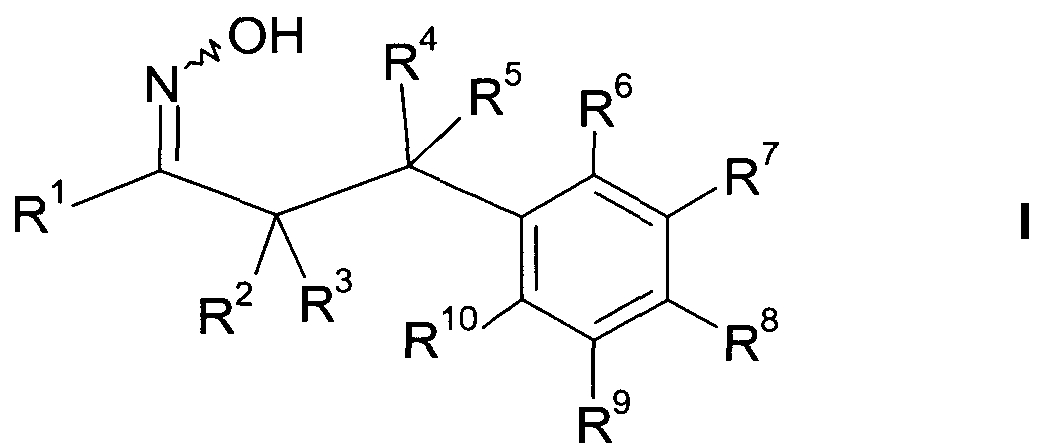
Настоящее изобретение относится к 1-гидроксиимино-3-фенил-пропанам формулы
где
R1 представляет собой -(CH2)m-фенил, где m представляет собой 0 или 1 и фенил замещен одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, гидрокси и галогена, или
-(CH2)n-гетероарил, где n представляет собой 0 или 1, и гетероарил выбран из группы, состоящей из пиридина, 1H-пиридин-2-она, 1-окси-пиридина, 1H-пиримидин-2-она, хинолина и пиразина, и является незамещенным или замещенным одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, C1-7-алкокси, C1-7-алкокси-C1-7-алкила,
C1-7-алкокси-C1-7-алкокси-C1-7-алкила, C3-7-циклоалкила, C3-7-цикл оал кил-C1-7-алкила, карбоксил-C1-7-алкила и аминокарбонил-C1-7-алкила;
R2 представляет собой водород или C1-7-алкил,
или в случае когда R4 представляет собой водород, тогда R2 представляет собой незамещенный фенил или фенил, замещенный C1-7-алкилом;
R3 представляет собой водород, R5 представляет собой водород или гидрокси, или R3 и R5 заменены двойной связью;
R4 выбран из группы, состоящей из водорода, C1-7-алкила, C3-7-циклоалкила, C2-7-алкенила, галоген-C1-7-алкила,
незамещенного фенила или фенила, замещенного одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила, галоген-C1-7-алкокси и C1-7-алкилсульфонила,
фенил-C1-7-алкила, где фенил незамещен или замещен одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила и галоген-C1-7-алкокси,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом или оксо, и
гетероциклила, указанный гетероциклил выбран из морфолинила, пиперазинила и пиперидинила и является незамещенным или замещенным C1-7-алкилом, оксо или C1-7-алкилкарбонилом
или R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-7-циклоалкильное кольцо;
R6 выбран из группы, состоящей из водорода, галогена и C1-7-алкила;
или R4 и R6 вместе с атомом углерода, к которому они присоединены, образуют циклическую группу
где m представляет собой 0 или 2;
R7 и R9 независимо выбраны из группы, состоящей из
водорода,
галогена, галоген-C1-7-алкила,
циано, циано-C1-7-алкила,
C1-7-алкила, C3-7-алкенила, C1-7-алкинила,
C1-7-алкокси, C1-7-алкокси-C1-7-алкила,
гидрокси, гидрокси-C1-7-алкила, гидрокси-C3-7-алкенила, гидрокси-C3-7-алкинила,
гидрокси-C1-7-алкокси,
карбоксил, карбоксил-C1-7-алкила, карбоксил-C3-7-алкенила, карбоксил-C1-7-алкинила,
карбоксил-C1-7-алкокси,
тетразолила,
C1-7-алкоксикарбонила,
C1-7-алкилсульфонила, C1-7-алкилсульфонилокси,
C1-7-алкилсульфониламино, C3-7-циклоалкилсульфониламино,
-аминосульфонила, (C1-7-алкил)-аминосульфонила, ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила,
C1-7-алкил-амино, ди-(C1-7-алкил)-амино, C1-7-алкокси-C1-7-алкил-амино,
С1-7-алкокси-C1-7-алкил-C1-7-алкил-амино, C1-7-алкокси-галоген-C1-7-алкил-амино
гидрокси-C1-7-алкил-C1-7-алкил-амино, аминокислоты, присоединенной через аминогруппу аминокислоты,
C3-7-циклоалкил-амино, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
карбоксил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-(C1-7-алкил)-аминокарбонила,
C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила,
C1-7-алкил-аминокарбонила, ди-(C1-7-алкил)-аминокарбонила,
C1-7-алкилсульфонил-C1-7-алкил-аминокарбонила,
галоген-C1-7-алкил-аминокарбонила, гидрокси-C1-7-алкил-аминокарбонила,
гидрокси-C1-7-алкил-C1-7-алкил-аминокарбонила, галоген-гидрокси-C1-7-алкил-аминокарбонила,
C1-7-алкокси-C1-7-алкил-аминокарбонила,
C3-7-циклоалкиламинокарбонила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклил-аминокарбонила, где гетероциклил является незамещенным или замещенным C1-7-алкилом или оксо,
гетероциклил-C1-7-алкил-аминокарбонила, где гетероциклил является незамещенным или замещенным C1-7-алкилом или оксо,
гидрокси-C1-7-алкил-аминокарбонил-C1-7-алкила,
C1-7-алкоксикарбонил-C1-7-алкила,
ди-(C1-7-алкоксикарбонил)-C1-7-алкила,
C1-7-алкилкарбониламино-C1-7-алкиламинокарбонила,
C1-7-алкилкарбониламино, карбоксил-C1-7-алкилкарбониламино,
C1-7-алкоксикарбонил-C1-7-алкилкарбониламино,
C3-7-циклоалкила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
C3-7-Циклоалкил-C1-7-алкила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклила, указанный гетероцикпил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкоксикарбонилом, аминокарбонилом, C1-7-алкилсульфонилом, аминосульфонилом, C1-7-алкилкарбонилом, карбоксил-C1-7-алкил-аминокарбонилом или гидроксисульфонил-C1-7-алкил-аминокарбонилом,
гетероциклилкарбонила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом или C1-7-алкилсульфонилом,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом, C3-7-циклоалкилом, тетрагидропиранилом, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкокси-C1-7-алкилом или C1-7-алкоксикарбонилом,
фенилокси, где фенил является незамещенным или замещенным от одной до трех групп, выбранных из галогена или карбоксила, и
фенила, указанный фенил является незамещенным или замещенным от одной до трех групп, выбранных из группы, состоящей из галогена, C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, циано, циано-C1-7-алкила, амино, C1-7-алкокси, карбоксил, карбоксил-C1-7-алкила, C1-7-алкокси-карбонила, тетразолила, карбоксил-C1-7-алкил-карбониламино,
C1-7-алкокси-карбонил-C1-7-алкил-карбониламино, C1-7-алкилсульфонила,
C1-7-алкил-сульфониламино, аминосульфонила, C1-7-алкил-аминосульфонила,
ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила, C1-7-алкоксикарбонил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-аминокарбонила,
C1-7-алкоксикарбонил-C1-7-алкил-карбониламино-C1-7-алкилсульфонила,
фенил-C1-7-алкил-аминокарбонила, тетразолил-аминокарбонила,
тетразолил-C1-7-алкил-аминокарбонила и карбоксил-C1-7-алкил-аминокарбонила;
R8 выбран из группы, состоящей из водорода,
галогена, галоген-C1-7-алкила,
циано, циано-C1-7-алкила,
C1-7-алкила, C3-7-алкенила, C1-7-алкинила,
C1-7-алкокси, C1-7-алкокси-C1-7-алкила,
гидрокси, гидрокси-C1-7-алкила, гидрокси-C3-7-алкенила, гидрокси-C3-7-алкинила,
гидрокси-C1-7-алкокси,
карбоксила, карбоксил-C1-7-алкила, карбоксил-C3-7-алкенила, карбоксил-C1-7-алкинила,
карбоксил-C1-7-алкокси,
тетразолила,
C1-7-алкоксикарбонила,
C1-7-алкилсульфонила, C1-7-алкилсульфонилокси,
C1-7-алкилсульфониламино, C3-7-циклоалкилсульфониламино,
-аминосульфонила, (C1-7-алкил)-аминосульфонила, ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила,
C1-7-алкил-амино, ди-(C1-7-алкил)-амино, C1-7-алкокси-C1-7-алкил-амино,
C1-7-алкокси-C1-7-алкил-C1-7-алкил-амино, C1-7-алкокси-галоген-C1-7-алкил-амино
гидрокси-C1-7-алкил-C1-7-алкил-амино, аминокислоты, присоединенной через аминогруппу аминокислоты,
C3-7-циклоалкил-амино, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
карбоксил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-(C1-7-алкил)-аминокарбонила,
C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила,
C1-7-алкил-аминокарбонила, ди-(C1-7-алкил)-аминокарбонила,
C1-7-алкилсульфонил-C1-7-алкил-аминокарбонила,
галоген-C1-7-алкил-аминокарбонила, гидрокси-C1-7-алкил-аминокарбонила,
гидрокси-C1-7-алкил-C1-7-алкил-аминокарбонила, галоген-гидрокси-C1-7-алкил-аминокарбонила,
C1-7-алкокси-C1-7-алкил-аминокарбонила,
C3-7-циклоалкиламинокарбонила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклил-аминокарбонила, где гетероциклил является незамещенным или замещенным
C1-7-алкилом или оксо,
гетероциклил-C1-7-алкил-аминокарбонила, где гетероциклил является незамещенным или замещенным C1-7-алкилом или оксо,
гидрокси-C1-7-алкил-аминокарбонил-C1-7-алкила,
C1-7-алкоксикарбонил-C1-7-алкила,
ди-(C1-7-алкоксикарбонил)-C1-7-алкила,
C1-7-алкилкарбониламино-C1-7-алкиламинокарбонила,
C1-7-алкилкарбониламино, карбоксил-C1-7-алкилкарбониламино,
C1-7-алкоксикарбонил-C1-7-алкилкарбониламино,
C3-7-циклоалкила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
C3-7-циклоалкил-C1-7-алкила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкоксикарбонилом, аминокарбонилом, C1-7-алкилсульфонилом, аминосульфонилом, C1-7-алкилкарбонилом, карбоксил-C1-7-алкил-аминокарбонилом или гидроксисульфонил-C1-7-алкил-аминокарбонилом,
гетероциклилкарбонила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом или C1-7-алкилсульфонилом,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом, C3-7-циклоалкилом, тетрагидропиранилом, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкокси-C1-7-алкилом или C1-7-алкоксикарбонилом,
фенилокси, где фенил является незамещенным или замещенным от одной до трех групп, выбранных из галогена или карбоксила, и
фенила, указанный фенил является незамещенным или замещенным от одной до трех групп, выбранных из группы, состоящей из галогена, C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, циано, циано-C1-7-алкила, амино, C1-7-алкокси, карбоксила, карбоксил-C1-7-алкила,
C1-7-алкокси-карбонила, тетразолила, карбоксил-C1-7-алкил-карбониламино,
C1-7-алкокси-карбонил-C1-7-алкил-карбониламино, C1-7-алкилсульфонила,
C1-7-алкил-сульфониламино, аминосульфонила, C1-7-алкил-аминосульфонила,
ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила, C1-7-алкоксикарбонил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-аминокарбонила, C1-7-алкоксикарбонил-C1-7-алкил-карбониламино-C1-7-алкилсульфонила, фенил-C1-7-алкил-аминокарбонила, тетразолил-аминокарбонила, тетразолил-C1-7-алкил-аминокарбонила и карбоксил-C1-7-алкил-аминокарбонила; и
R10 выбран из группы, состоящей из водорода, галогена и C1-7-алкила;
или их фармацевтически приемлемым солям.
Изобретение также относится к способам получения соединений формулы I.
Изобретение также относится к фармацевтическим композициям, содержащим соединения, как описано выше, и фармацевтически приемлемый носитель и/или адъювант.
Еще одним аспектом изобретения является применение соединений формулы I в качестве терапевтически активных веществ для лечения заболеваний, ассоциированных с модуляцией активности GPBAR1. Таким образом, настоящее изобретение относится к способу лечения заболевания, ассоциированного с модуляцией активности GPBAR1, такого как, например, сахарный диабет, в частности диабет II типа или гестационный диабет.
Подробное описание изобретеения
Если не указано иначе, все технические и научные термины, используемые в настоящем изобретении, имеют тот же смысл, как обычно понимается квалифицированным специалистом в области техники, к которой относится данное изобретение. Кроме того, следующие далее определения приведены для иллюстрации и определения значения и объема различных терминов, используемых для описания изобретения.
Номенклатура, используемая в настоящем изобретении основана на систематической номенклатуре ИЮПАК, если не указано иное.
Термин "соединение (соединения) данного изобретения» и «соединение (соединения) по настоящему изобретению" относится к соединениям формулы I и их стереоизомерам, сольватам или солям (например, фармацевтически приемлемые соли).
Термин "заместитель" обозначает атом или группу атомов заменяющих атом водорода на исходной молекуле.
Термин "галоген" означает фтор, хлор, бром и йод, фтор, при этом хлор и бром представляют особый интерес. Более конкретно, галоген относится к фтору и хлору.
Термин "алкил", отдельно или в комбинации с другими группами, относится к разветвленному или прямоцепочечному одновалентному насыщенному алифатическому углеводородному радикалу из от одного до двадцати атомов углерода, в частности от одного до шестнадцати атомов углерода, более конкретно одного до десяти атомов углерода. Термин "C1-10-алкил" относится к разветвленному или прямоцепочечному одновалентному насыщенному алифатическому углеводородному радикалу из от одного до десяти атомов углерода, такому как, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, пентил, 1,1,3,3-тетраметил-бутил и т.п. Более конкретно, термин "алкил" включает в себя также низшие алкильные группы, как описано ниже.
Термин "низший алкил" или "C1-7-алкил", отдельно или в комбинации, означает прямоцепочечную или разветвленную алкильную группу с 1-7 атомами углерода, в частности, прямоцепочечную или разветвленную алкильную группу с 1-6 атомами углерода, и более конкретно прямоцепочечную или разветвленную алкильную группу с 1-4 атомами углерода. Примерами неразветвленной и разветвленной C1-7 алкильной группы являются метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, изомерные пентилы, изомерные гексилы и изомерные гептилы, в частности, метил и этил.
Термин "низший алкенил" или "С2-7-алкенил" означает прямоцепочечный или разветвленный углеводородный остаток, содержащий олефиновую связь и от 2 до 7, предпочтительно от 3 до 6, особо предпочтительно от 3 до 4 атомов углерода. Примерами алкенильных групп являются этенил, 1-пропенил, 2-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил и изобутенил, в частности, 2-пропенил(аллил).
Термин "низший алкинил" или "C2-7-алкинил" означает прямоцепочечный или разветвленный углеводородный остаток, содержащий тройную связь и от 2 до 7 атомов углерода. Примерами низших алкинильных групп являются этинил и 1-пропинил (-C≡C-CH2).
Термин "циклоалкил" или "С3-7-циклоалкил" означает насыщенную моноциклическую углеводородную группу, содержащую от 3 до 7 атомов углерода, такую как циклопропил, циклобутил, циклопентил, циклогексил или циклогептил, более конкретно циклопропил. Кроме того, термин «циклоалкил» включает в себя также бициклические углеводородные группы, содержащие от 3 до 10 атомов углерода. Бициклические означает состоящие из двух насыщенных карбоциклов, имеющих один или более общих атомов углерода. Примерами бициклических циклоалкилов являются [2,2,1]гептанил или бицикло[2.2.2]октанил.
Термины "низший циклоалкилалкил" или "C3-7-циклоалкил-C1-7-алкил" относятся к низшим алкильным группам, как определено выше, где по крайней мере один из атомов водорода низшей алкильной группы заменен на циклоалкильную группу. Среди низших циклоалкилалкильных групп, представляющих особый интерес, находится циклопропилметил.
Термин "низший алкокси" или "C1-7-алкокси" относится к группе R'-O-, где R' представляет собой низший алкил, а термин "низший алкил" имеет значение, данное ранее. Примерами низших алкоксигрупп являются метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси, в частности метокси.
Термин "низший алкоксиалкил" или "C1-7-алкокси-C1-7-алкил" относится к низшим алкильным группам, как определено выше, где по крайней мере один из атомов водорода низшей алкильной группы замещен низшей алкокси группой. Среди низших алкоксиалкильных групп особый интерес представляют метоксиметил и 2-метоксиэтил.
Термин "низший алкоксиалкоксиалкил" или "C1-7-алкокси-C1-7-алкокси-C1-7-алкил" относится к низшим алкильным группам, как определено выше, где по крайней мере один из атомов водорода низшей алкильной группы замещен на низшую алкокси группу, которая сама также дополнительно замещена низшей алкокси группой. Среди низших алкоксиалкоксиалкильных группы особый интерес представляет-(CH2)2-O-(CH2)2-O-CH3.
Термин гидрокси означает группу -OH.
Термин "низший гидроксиалкил" или "гидрокси-C1-7-алкил" относится к низшим алкильным группам, как определено выше, где по крайней мере один из атомов водорода низшей алкильной группы замещен гидроксильной группой. Среди особо интересных низших гидроксиалкильных групп находятся гидроксиметил или гидроксиэтил.
Термин "низший гидроксиалкенил" или "гидрокси-C1-7-алкенил" относится к низшим алкенильным группам, как определено выше, где по крайней мере один из атомов водорода низший алкенильной группы замещен гидроксильной группой. Среди особо интересных низших гидроксиалкенильных групп находится 3-гидрокси-пропенил.
Термин "низший гидроксиалкинил" или "гидрокси-C1-7-алкинил" относится к низшим алкинильным группам, как определено выше, где по крайней мере один из атомов водорода низшей алкинильной группы замещен гидроксильной группой. Среди особо интересных низших гидроксиалкинильных групп находится 3-гидрокси-пропинил.
Термин "низший галогеналкил" или "галоген-C1-7-алкил" относится к низшим алкильным группам, как определено выше, где по крайней мере один из атомов водорода низшей алкильной группы замещен атомом галогена, в частности, фтором или хлором, особо фтором. Среди низших галогеналкильных групп особый интерес представляют трифторметил, дифторметил, трифторэтил, 2,2-дифторэтил, фторметил и хлорметил, и особо интересными являются трифторметил или дифторметил.
Термин "низший галогеналкокси" или "галоген-C1-7-алкокси" относится к низшим алкоксигруппам, как определено выше, где по крайней мере один из атомов водорода низшей алкоксигруппы заменен на атом галогена, в частности, фтор или хлор, особо фтор. Среди низших галогеналкоксигрупп особый интерес представляют трифторметокси, дифторметокси, фторметокси и хлорметокси, более конкретно трифторметокси.
Термин "карбоксил" означает группу -COOH.
Термин "низший карбоксилалкил" или "карбоксил-C1-7-алкил" относится к низшим алкильным группам, как определено выше, где по крайней мере один из атомов водорода низшей алкильной группы замещен карбоксильной группой. Среди низших карбоксилалкильных групп особый интерес представляют карбоксилметил (-CH2-COOH) и карбоксилэтил (-CH2-CH2-COOH).
Термин "низший карбоксилалкенил" или "карбоксил-C1-7-алкенил" относится к низшим алкенильным группам, как определено выше, где по крайней мере один из атомов водорода низшей алкенильной группы замещен карбоксильной группой. Среди особо интересных низших карбоксилалкенильных групп находится 3-карбоксил-пропенил(-CH=CH-CH2-COOH).
Термин "низший карбоксилалкинил" или "карбоксил-C1-7-алкинил" относится к низшим алкинильным группам, как определено выше, где по крайней мере один из атомов водорода низшей алкинильной группы замещен карбоксильной группой. Среди особо интересных низших карбоксилалкинильных групп находится 3-карбоксил-пропинил.
Термин "низший карбоксилалкокси" или "карбоксил-C1-7-алкокси" относится к низшим алкоксигруппам, как определено выше, где по крайней мере один из атомов водорода низшей алкоксигруппы замещен карбоксильной группой. Особо интересной низшей карбоксилалкоксигруппой является карбоксилметокси (-O-CH2-COOH).
Термин "низший карбоксилалкиламинокарбонил" или "карбоксил-C1-7-алкиламинокарбонил" относится к аминокарбонилу, как определено выше, где один из атомов водорода аминогруппы замещен карбоксил-C1-7-алкилом. Предпочтительной низшей карбоксилалкиламинокарбонильной группой является -CO-NH-CH2-COOH.
Термин "низший алкоксикарбонил" или "C1-7-алкоксикарбонил" относится к группе-COOR, где R представляет собой низший алкил, а термин "низший алкил" имеет данное ранее значение. Особо интересными низшими алкоксикарбонильными группами являются этоксикарбонил или метоксикарбонил.
Термин "низший алкоксикарбонилалкил" или "C1-7-алкоксикарбонил-C1-7-алкил" означает низшие алкильные группы, как определено выше, где один из атомов водорода низшей алкильной группы замещен C1-7-алкоксикарбонилом. В частности низшей алкоксикарбонилалкильной группой является -CH2-COOCH3.
Термин "ди-(низший алкоксикарбонил)-алкил" или "ди-(C1-7-алкоксикарбонил)-C1-7-алкил" означает низшие алкильные группы, как определено выше, где два атома водорода низшей алкильной группы заменены на C1-7-алкоксикарбонил. В частности ди-(низший алкоксикарбонил)-алкильной группой является -CH-(COOCH3)2.
Термин "низший алкоксикарбонилалкокси" или "C1-7-алкоксикарбонил-C1-7-алкокси" означает низшую алкоксигруппу, как определено выше, в которой один из атомов водорода низшей алкоксигруппы замещен C1-7-алкоксикарбонилом. Примером низшей алкоксикарбонилалкокси группы является -O-CH2-COOCH3.
Термин "низший алкоксикарбонилалкиламинокарбонил " или "C1-7-алкоксикарбонил-C1-7-алкиламинокарбонил" относится к аминокарбонилу, как определено выше, где один из атомов водорода аминогруппы замещен C1-7-алкоксикарбонил-C1-7-алкилом. Предпочтительной низшей алкоксикарбонилалкиламинокарбонильной группой является -CO-NH-CH2-COOCH3.
Термин "низший алкилсульфонил" или "C1-7-алкилсульфонил" означает группу -S(O)2-R, где R представляет собой низшую алкильную группу, как определено выше. Низшей алкилсульфонильной группой особого интереса является метилсульфонил.
Термин "низший алкилкарбонил" или "C1-7-алкилкарбонил" означает группу -C(O)-R, где R представляет собой низшую алкильную группу, как определено выше. Низшей алкилкарбонильной группой особого интереса является метилкарбонил или ацетил.
Термин "C1-7-алкилсульфонилокси" означает группу -O-S(O)2-R, где R представляет собой низшую алкильную группу, как определено выше.
Термин "аминосульфонил" означает группу -S(O)2-NH2.
Термин "низший алкиламиносульфонил" или "C1-7-алкил-аминосульфонил" означает группу -S(O)2-NH-R, где R представляет собой низший алкил, а термин "низший алкил" имеет данное ранее значение. Примером низшей алкиламиносульфонильной группы является метиламиносульфонил.
Термин "ди-низший алкиламиносульфонил" или "ди-(C1-7-алкил)-аминосульфонил" определяет группу -S(O)2-NRR', где R и R' являются низшими алкильными группами, как определено выше. Примером ди-низшей алкиламиносульфонильной группы является диметиламиносульфонил.
Термин "гетероциклилсульфонил" определяет группу -S(O)2-Het, где Het представляет собой гетероциклическую группу, как определено здесь ниже.
"Амино" относится к группе-NH2. Термин "C1-7-алкиламино" означает группу -NHR, где R представляет собой низший алкил, а термин "низший алкил" имеет данное ранее значение. Термин "ди-(C1-7-алкил)-амино" означает группу -NRR', где R и R' являются низшими алкильными группами, как определено выше.
Термин "C1-7-алкокси-C1-7-алкил-C1-7-алкиламино" относится к группе -NRR'', где R представляет собой низшую алкильную группу, как определено выше, и R'' представляет собой низшую алкоксиалкильную группу, как определено здесь.
Термин "C1-7-гидроксиалкил-C1-7-алкиламино" относится к группе -NRR''', где R представляет собой низшую алкильную группу, как определено выше, и R''' представляет собой низшую гидроксиалкильную группу, как определено здесь.
Термин "C1-7-алкокси-галоген-C1-7-алкил-амино" относится к группе -NRxRy, где Rx представляет собой низшую алкильную группу, как определено выше, и Ry представляет собой низшую галогеналкильную группу, как определено здесь.
Термин "циклоалкил-амино" или "C3-7-циклоалкил-амино" означает группу -NH-RC, где RC представляет собой циклоалкильную группу, как определено выше.
Термин "карбоксилалкил-алкиламино" или "карбоксил-C1-7-алкил-C1-7-алкил-амино" определяет группу -NR-RB, где R представляет собой низший алкил как определено выше и RB представляет собой низший карбоксилалкил и имеет данное ранее значение.
Термин "низший алкилсульфониламино" или "C1-7-алкилсульфониламино" определяет группу -NH-S(O)2-R, где R представляет собой низший алкил, и термин "низший алкил" имеет данное ранее значение.
Термин "циклоалкилсульфониламино" или "C3-7-циклоалкилсульфониламино" определяет группу -NH-S(O)2-RC, где RC представляет собой циклоалкил и имеет данное ранее значение. Примером является циклопропилсульфониламино.
Термин "низший алкилкарбониламино" или "C1-7-алкилкарбониламино" определяет группу -NH-CO-R, где R представляет собой низший алкил и термин "низший алкил " имеет данное ранее значение.
Термин "низший карбоксилалкилкарбониламино" или "карбоксил-C1-7-алкилкарбониламино" определяет группу -NH-CO-RB, где RB представляет собой низший карбоксилалкил и имеет данное ранее значение.
Термин "низший алкоксикарбонил-карбониламино" или "C1-7-алкоксикарбонил-карбониламино" определяет группу -NH-CO-RE, где RE представляет собой низший алкоксикарбонил и имеет данное ранее значение.
Термин "низший алкоксикарбонил-алкилкарбониламино" или "C1-7-алкоксикарбонил-C1-7-алкилкарбониламино" определяет группу -NH-CO-R-RE где R представляет собой низшую алкильную группу, как определено выше и по меньшей мере один из атомов водорода низшей алкильной группы замещен на низшую алкоксикарбонильную группу RE как определено выше.
Термин "низший алкоксикарбонил-алкилкарбониламино-алкилсульфонил" или "C1-7-алкоксикарбонил-C1-7-алкил-карбониламино-C1-7-алкилсульфонил" относится к группе -S(O)2-R-NH-CO-R'-RE где R и R' представляют собой низшие алкильные группы, как определено выше, и по меньшей мере один из атомов водорода низшей алкильной группы R' замещен на низшую алкоксикарбонильную группу RE, как определено выше.
Термин "аминокислота, присоединенная через аминогруппу аминокислоты" означает заместитель -NR-CHRA-COOH, где R представляет собой водород или низший алкил, как определено выше, и RA представляет собой боковую цепь аминокислоты, в частности боковую цепь натуральной аминокислоты, но RA обозначает также другой органический заместитель, такой как хлорметил.
Термин "аминокарбонил" относится к группе -CO-NH2.
Термин "низший алкиламинокарбонил" или "C1-7-алкил-аминокарбонил" относится к группе -CONH-R, где R представляет собой низший алкил, как определено здесь ранее.
Термин "низший диалкиламинокарбонил" или "ди-(C1-7-алкил)-аминокарбонил" относится к группе -CONRR', где R и R' представляют собой низшие алкильные группы, как определено выше.
Термин "низший алкилсульфонил-низший алкиламинокарбонил" или "C1-7-алкилсульфонил-C1-7-алкил-аминокарбонил" относится к группе -CONR-RS где R представляет собой низший алкил, как определено здесь ранее, и RS представляет собой низшую алкилсульфонильную группу, как определено выше.
Термин "гидроксисульфонил" означает группу -S(O)2-OH.
Термин "низший гидроксисульфонилалкил-аминокарбонил" или "гидроксисульфонил-C1-7-алкил-аминокарбонил" означает группу -CONH-RW, где RW представляет собой низшую алкильную группу, как определено выше, и где один из атомов водорода низшей алкильной группы замещен на -S(O)2-OH. Примером является -CONH-CH2-CH2-S(O)2-OH.
Термин "низший аминокарбонилалкил" или "аминокарбонил-C1-7-алкил" означает низшие алкильные группы, как определено выше, где один из атомов водорода низшей алкильной группы замещен на аминокарбонил. Низшей аминокарбонильной группой особого интереса является -CH2-CONH2.
Термин "низший галогеналкил-аминокарбонил" или "галоген-C1-7-алкил-аминокарбонил" относится к группе -CONH-RY, где RY представляет собой низшую галогеналкильную группу, как определено выше.
Термин "низший гидроксиалкил-аминокарбонил" или "гидрокси-C1-7-алкил-аминокарбонил" означает группу -CONH-R''', где R''' представляет собой низшую гидроксиалкильную группу, как определено выше.
Термин "низший гидроксиалкил-аминокарбониалкил" или "гидрокси-C1-7-алкил-аминокарбонил-C1-7-алкил" означает низшую алкильную группу, как определено выше, где один из атомов водорода низшей алкильной группы замещен на группу -CONH-R''', где R''' представляет собой низшую гидроксиалкильную группу, как определено выше.
Термин "низший галогенгидроксиалкил-аминокарбонил" или "галоген-гидрокси-C1-7-алкил-аминокарбонил" означает группу -CONH-RN где RN представляет собой низшую гидроксиалкильную группу, как определено выше, и где по меньшей мере один из атомов водорода низшей гидроксиалкильной группы замещен на атом галогена, в частности фтор или хлор.
Термин "(низший гидроксиалкил)-низший алкиламинокарбонил" или "гидрокси-C1-7-алкил-C1-7-алкиламинокарбонил" означает группу -CONR-R''', где R представляет собой низшую алкильную группу, как определено здесь ранее, в частности метил, и R''' представляет собой низшую гидроксиалкильную группу, как определено выше.
Термин "низший алкоксиалкил-аминокарбонил" или "(C1-7-алкокси-C1-7-алкил)-аминокарбонил" означает группу -CONH-RZ, где RZ представляет собой низшую алкоксиалкильную группу, как определено выше.
Термин "циклоалкил-аминокарбонил" или "C3-7-циклоалкил-аминокарбонил" означает группу -CONH-RC, где RC представляет собой циклоалкильную группу, как определено выше.
Термин "низший карбоксилалкил-аминокарбонил" или "карбоксил-C1-7-алкил-аминокарбонил" означает группу -CONH-RD, где RD представляет собой низшую карбоксилалкильную группу, как определено выше, например, -CONH-CH2-COOH.
Термин "низший алкоксикарбонил-алкил-аминокарбонил" или "C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонил" определяет группу -CO-NH-R-RE где R представляет собой низшую алкильную группу, как определено выше, и по меньшей мере один из атомов водорода низшей алкильной группы замещен на низшую алкоксикарбонильную группу, как определено выше.
Термин "гетероциклил-аминокарбонил" означает группу -CONH-Het, где Het представляет собой гетероциклическую группу, как определено здесь далее.
Термин "низший гетероциклилалкил-аминокарбонил" или "гетероциклил-C1-7-алкил-аминокарбонил" относится к группе -CONH-RH, где RH представляет собой низшую алкильную группу, как определено выше, где по меньшей мере один из атомов водорода низшей алкильной группы замещен на гетероциклическую группу, как определено здесь далее.
Термин "низший алкилкарбониламино-алкиламинокарбонил" или "C1-7-алкилкарбониламино-C1-7-алкиламинокарбонил" относится к аминокарбонилу, как определено выше, где один из атомов водорода аминогруппы замещен на C1-7-алкилкарбониламино-C1-7-алкил. Примером низшей алкилкарбониламино-алкиламинокарбонильной группы является -CO-NH-CH2-NH-CO-CH3.
Термин "фенилокси" относится к группе -O-Ph, где Ph представляет собой фенил.
Термин "низший фенилалкил" или "фенил-С1-7-алкил" означает низшую алкильную группу, как определено выше, где один из атомов водорода низшей алкильной группы замещен на возможно замещенную фенильную группу.
Термин "низший фенилалкил-аминокарбонил" или "(фенил-C1-7-алкил)-аминокарбонил" означает группу -CONH-RV, где RV представляет собой низшую фенилалкильную группу, как определено выше.
Термин "гетероциклил" относится к насыщенному или частично ненасыщенному моноциклическому или бициклическому кольцу, содержащему от 3 до 10 кольцевых атомов, которые могут содержать один, два или три атома, выбранных из азота, кислорода и/или серы. Бициклическое означает, состоящее из двух циклов с двумя общими атомами в кольце, то есть мост, разделяющий два кольца либо одинарной связью, либо цепочкой из одного или двух кольцевых атомов. Примеры моноциклических гетероциклов включают азиринил, азетидинил, оксетанил, пиперидинил, пиперазинил, азепинил, диазепанил, пирролидинил, пиразолидинил, имидазолинил, имидазолидинил, пиридинил, пиридазинил, пиримидинил, оксазолидинил, изоксазолидинил, морфолинил, тиазолидинил, изотиазолидинил, тиадиазолидинил, дигидрофурил, тетрагидрофурил, дигидропиранил, тетрагидропиранил, тиоморфолинил и 1,1-диоксо-1λ6-тиоморфолинил. Примерами бициклических гетероциклилов являются 8-аза-бицикло[3.2.1]октил, хинуклидинил, 8-оксо-3-аза-бицикло[3.2.1]октил, 9-аза-бицикло[3.3.1]нонил, 3-окса-9-аза-бицикло[3.3.1]нонил и 3-тиа-9-аза-бицикло[3.3.1]нонил. Примеры частично ненасыщенных гетероциклилов являются дигидрофурил, имидазолинил, дигидро-оксазолил, тетрагидро-пиридинил или дигидропиранил.
Термин "низший гетероциклилалкил" или "гетероциклил-C1-7-алкил" относится к низшим алкильным группам, как определено выше, где по меньшей мере один из атомов водорода низшей алкильной группы замещен на гетероциклическую группу, как определено выше.
Термин "гетероциклилкарбонил" относится к группе -CO-Het, где Het представляет собой гетероциклическую группу, как определено выше.
Термин "гетероарил" в общем относится к ароматическому 5- или 6-членному кольцу, которое состоит из одного, двух, трех или четырех атомов, выбранных из азота, кислорода и/или серы, таким как пиридил, пиразинил, пиримидинил, 2,4-диоксо-1H-пиримидинил, пиридазинил, 2-оксо-1,2-дигидропиридинил, пирролил, оксазолил, оксадиазолил, изоксазолил, тиадиазолил, тетразолила, пиразолил, имидазолил, фуранил, тиазолил, изотиазолил, триазолил, тетразолила, тиенил, азепинил, диазепинил. Термин "гетероарил" дополнительно относится к бициклическим ароматическим группам, содержащим от 5 до 12 кольцевых атомов, в которых один или оба кольца могут содержать один, два или три атома, выбранных из азота, кислорода или серы, таким как хинолинил, изохинолинил, циннолинил, хиназолинил, пиразоло[1,5-a]пиридил, имидазо[1,2-a]пиридил, хиноксалинил, бензофуранил, бензотиенил, бензотиазолил, бензотриазолил, индолил и индазолил.
Термин "низший гетероарилалкил" или "гетероарил-C1-7-алкил" относится к низшим алкильным группам, как определено выше, где по меньшей мере один из атомов водорода низшей алкильной группы замещен на гетероарильную группу, как определено выше. Конкретным примером низшей гетероарилалкильной группы является тетразолил-C1-7-алкил.
Термин "гетероарил-аминокарбонил" означает группу -CONH-RU, где RU представляет собой гетероарильную группу, как определено выше. Конкретным примером гетероарил-аминокарбонильной группы является тетразолиламинокарбонил.
Термин "оксо" означает, что C-атом гетероциклического или гетероарильного кольца может быть замещен =O, таким образом означая, что гетероциклическое или гетероарильное кольцо может содержать одну или более карбонильных (-CO-) групп.
Термин "фармацевтически приемлемый" означает из материала, который используется при получении фармацевтической композиции, который, как правило, безопасен, нетоксичен и ни биологически, ни каким-либо другим образом не является нежелательным и является приемлемым для фармацевтического применения в ветеринарии а также для человека.
Соединения формулы I могут образовывать фармацевтически приемлемые соли. Термин "фармацевтически приемлемые соли" относится к таким солям, которые сохраняют биологическую эффективность и свойства свободных оснований или свободных кислот, которые не являются ни биологически, ни каким-либо другим образом нежелательными. Фармацевтически приемлемые соли включают в себя как кислотно-аддитивные соли, так и соли присоединения основания. Солями являются, например, кислотно-аддитивные соли соединений формулы I с физиологически совместимыми минеральными кислотами, такими как соляная кислота, бромистоводородная кислота, азотная кислота, угольная кислота, серная кислота, сернистая кислота или фосфорная кислота, или с органическими кислотами, такими как метансульфоновая, этансульфокислота, п-толуолсульфоновая кислота, муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, молочная кислота, трифторуксусная кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, малоновая кислота, винная кислота, бензойной кислота, коричная кислота, миндальная кислота, эмбоновая кислота, янтарная кислота или салициловая кислота. Кроме того, фармацевтически приемлемые соли могут быть получены с добавлением неорганического или органического основания к свободной кислоте. Соли, полученные из неорганических оснований, включают, без ограничения, соли натрия, калия, лития, аммония, кальция, магния, цинка, меди, марганца и алюминия и т.п. Соли, полученные из органических оснований, включают, без ограничения, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и основных ионообменных смол, таких как изопропиламиновые, триметиламиновые, диэтиламиновые, триэтиламиновые, трипропиламиновые, этаноламиновые, лизиновые, аргининовые, гистидиновые, кофеиновые, прокаиновые, гидрабаминовые, холиновые, бетаиновые, этилендиаминовые, глюкозаминовые, метилглюкаминовые, теоброминовые, пиперазиновые, N-этилпиперидиновые, пиперидиновые и полиаминовые смолы. Соединение формулы I также может присутствовать в виде цвиттерионов. Фармацевтически приемлемыми солями соединений формулы I особого интереса являются соли натрия или соли третичных аминов.
Соединения формулы I также могут быть сольватированы, например, гидратированы. Сольватация может быть проведена в ходе производственного процесса или может иметь место, например, вследствие гигроскопических свойств изначально безводного соединения формулы I (гидратация). Термин "фармацевтически приемлемые соли" также включает в себя физиологически приемлемые сольваты.
"Изомеры" являются соединениями, которые имеют одинаковую молекулярную формулу, но которые отличаются по характеру или последовательности связывания их атомов или по расположению атомов в пространстве. Изомеры, отличающиеся расположением атомов в пространстве, называются "стереоизомеры". Стереоизомеры, не являющиеся зеркальным отражением друг друга называют "диастереоизомеры". Диастереомеры имеют два или более хиральных центра и характеризуются различными физическими свойствами, например, температурой плавления, температурой кипения, спектральными свойствами и реакционноспособностью. Стереоизомеры, которые не являются зеркально наложимыми называют "энантиомеры", или иногда оптические изомеры. Атом углерода, связанный с четырьмя неодинаковыми заместителями называется "хиральный центр".
Термин "модулятор" означает молекулу, которая взаимодействует с мишенью. Взаимодействия включают например, агонистическую, антагонистическую или обратную агонистической активность.
Термин "агонист" означает соединение, которое усиливает активность других соединений или сайтов для рецепторов, как определено, например, в Goodman и Gilman's "The Pharmacological Basis of Therapeutics, 7th ed." на с.35, Macmillan Publ. Company, Canada, 1985. «Полный агонист" обладает полным ответом, в то время как "частичный агонист" действует меньше, чем полная активация даже тогда, когда взаимодействует со всей популяцией рецепторов. "Обратный агонист" обладает эффектом противоположным агонисту, хотя связывается с тем же рецептор-связывающим сайтом.
Термин "половины максимальной эффективной концентрации" (EC50) означает концентрацию конкретного соединения в плазме, необходимую для получения 50% от максимума определенного эффекта in vivo.
Термин "терапевтически эффективное количество" означает количество соединения по настоящему изобретению, которое при введении субъекту, (i) лечит или предотвращает конкретное заболевание, состояние или расстройство, (ii), смягчает, улучшает или устраняет один или более симптомов конкретного заболевания, состояния или расстройства, или (iii) предотвращает или задерживает начало одного или более симптомов конкретного заболевания, состояния или расстройства, описанных в настоящем изобретении. Терапевтически эффективное количество будет варьироваться в зависимости от соединения, состояния заболевания, которое лечат, тяжести или лечения при заболевании, возраста и относительного здоровья субъекта, пути и формы введения, мнения лечащего или ветеринарного врача, и других факторов.
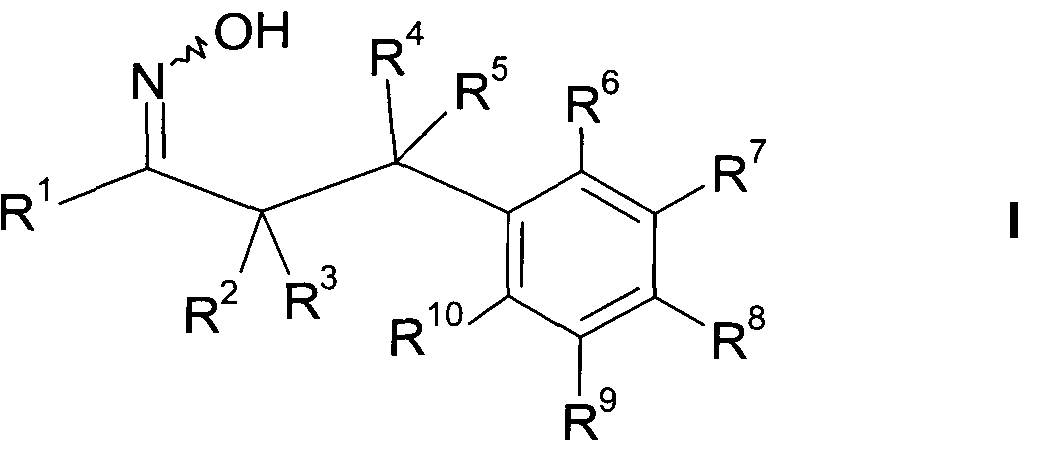
Детально, настоящее изобретение относится к соединениям формулы
где
R1 представляет собой -(CH2)m-фенил, где m представляет собой 0 или 1, и фенил замещен одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, гидрокси и галогена, или
-(CH2)n-гетероарил, где n представляет собой 0 или 1, и гетероарил выбран из группы, состоящей из пиридина, 1H-пиридин-2-она, 1-окси-пиридина, 1H-пиримидин-2-она, хинолина и пиразина, и является незамещенным или замещенным одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, C1-7-алкокси, C1-7-алкокси-C1-7-алкила,
C1-7-алкокси-C1-7-алкокси-C1-7-алкила, C3-7-циклоалкила, C3-7-циклоалкил-C1-7-алкила, карбоксил-C1-7-алкила и аминокарбонил-C1-7-алкила;
R2 представляет собой водород или C1-7-алкил,
или в случае когда R4 представляет собой водород, R2 представляет собой незамещенный фенил или фенил, замещенный C1-7-алкилом;
R3 представляет собой водород,
R5 представляет собой водород или гидрокси,
или R3 и R5 заменены двойной связью;
R4 выбран из группы, состоящей из водорода, C1-7-алкила,
C3-7-циклоалкила, С2-7-алкенила, галоген-C1-7-алкила,
незамещенного фенила или фенила, замещенного одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила, галоген-C1-7-алкокси и C1-7-алкилсульфонила,
фенил-C1-7-алкила, где фенил незамещен или замещен одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила и галоген-C1-7-алкокси,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом или оксо, и
гетероциклила, указанный гетероциклил выбран из морфолинила, пиперазинила и пиперидинила и является незамещенным или замещенным C1-7-алкилом, оксо или C1-7-алкилкарбонилом
или R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-7-циклоалкильное кольцо;
R6 выбран из группы, состоящей из водорода, галогена и C1-7-алкила;
или R4 и R6 вместе с атомом углерода, к которому они присоединены, образуют циклическую группу
где m представляет собой 0 или 2;
R7 и R9 независимо выбраны из группы, состоящей из
водорода,
галогена, галоген-C1-7-алкила,
циано, циано-C1-7-алкила,
C1-7-алкила, C3-7-алкенила, C1-7-алкинила,
C1-7-алкокси, C1-7-алкокси-C1-7-алкила,
гидрокси, гидрокси-C1-7-алкила, гидрокси-C3-7-алкенила, гидрокси-C3-7-алкинила,
гидрокси-C1-7-алкокси,
карбоксила, карбоксил-C1-7-алкила, карбоксил-C3-7-алкенила, карбоксил-C1-7-алкинила,
карбоксил-C1-7-алкокси,
тетразолила,
C1-7-алкоксикарбонила,
C1-7-алкилсульфонила, C1-7-алкилсульфонилокси,
C1-7-алкилсульфониламино, C3-7-циклоалкилсульфониламино,
аминосульфонила, (C1-7-алкил)-аминосульфонила, ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила,
C1-7-алкил-амино, ди-(С1-7-алкил)-амино, C1-7-алкокси-C1-7-алкил-амино,
C1-7-алкокси-C1-7-алкил-C1-7-алкил-амино, C1-7-алкокси-галоген-C1-7-алкил-амино
гидрокси-C1-7-алкил-C1-7-алкил-амино, аминокислоты, присоединенной через аминогруппу аминокислоты,
C3-7-циклоалкил-амино, где С3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
карбоксил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-(C1-7-алкил)-аминокарбонила,
C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила,
C1-7-алкил-аминокарбонила, ди-(C1-7-алкил)-аминокарбонила,
C1-7-алкилсульфонил-C1-7-алкил-аминокарбонила,
галоген-C1-7-алкил-аминокарбонила, гидрокси-C1-7-алкил-аминокарбонила,
гидрокси-C1-7-алкил-C1-7-алкил-аминокарбонила, галоген-гидрокси-C1-7-алкил-аминокарбонила,
C1-7-алкокси-C1-7-алкил-аминокарбонила,
C3-7-циклоалкиламинокарбонила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклил-аминокарбонила, где гетероциклил является незамещенным или замещенным C1-7-алкилом или оксо,
гетероциклил-C1-7-алкил-аминокарбонила, где гетероциклил является незамещенным или замещенным C1-7-алкилом или оксо,
гидрокси-C1-7-алкил-аминокарбонил-C1-7-алкила,
С1-7-алкоксикарбонил-C1-7-алкила,
ди-(C1-7-алкоксикарбонил)-C1-7-алкила,
C1-7-алкилкарбониламино-C1-7-алкиламинокарбонила,
C1-7-алкилкарбониламино, карбоксил-C1-7-алкилкарбониламино,
C1-7-алкоксикарбонил-C1-7-алкилкарбониламино,
C3-7-циклоалкила, где C3-7-циклоалкил является незамещенным или амещенным гидрокси, гидрокси-С1-7-алкилом или карбоксилом,
C3-7-циклоалкил-C1-7-алкила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкоксикарбонилом, аминокарбонилом, C1-7-алкилсульфонилом, аминосульфонилом, C1-7-алкилкарбонилом, карбоксил-C1-7-алкил-аминокарбонилом или гидроксисульфонил-C1-7-алкил-аминокарбонилом,
гетероциклилкарбонила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом или C1-7-алкилсульфонилом,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом, C3-7-циклоалкилом, тетрагидропиранилом, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкокси-C1-7-алкилом или C1-7-алкокси карбонилом,
фенилокси, где фенил является незамещенным или замещенным от одной до трех групп, выбранных из галогена или карбоксила, и
фенила, указанный фенил является незамещенным или замещенным от одной до трех групп, выбранных из группы, состоящей из галогена, C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, циано, циано-C1-7-алкила, амино, C1-7-алкокси, карбоксила, карбоксил-C1-7-алкила, C1-7-алкокси-карбонила, тетразолила, карбоксил-C1-7-алкил-карбониламино,
C1-7-алкокси-карбонил-C1-7-алкил-карбониламино, C1-7-алкилсульфонила, C1-7-алкил-сульфониламино, аминосульфонила, C1-7-алкил-аминосульфонила,
ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила, C1-7-алкоксикарбонил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-аминокарбонила, C1-7-алкокси карбонил-C1-7-алкил-карбониламино-C1-7-алкилсульфонила, фенил-C1-7-алкил-аминокарбонила, тетразолил-аминокарбонила, тетразолил-C1-7-алкил-аминокарбонила и карбоксил-C1-7-алкил-аминокарбонила;
R8 выбран из группы, состоящей из водорода,
галогена, галоген-C1-7-алкила,
циано, циано-C1-7-алкила,
C1-7-алкила, C3-7-алкенила, C1-7-алкинила,
C1-7-алкокси, C1-7-алкокси-C1-7-алкила,
гидрокси, гидрокси-C1-7-алкила, гидрокси-C3-7-алкенила, гидрокси-C3-7-алкинила,
гидрокси-C1-7-алкокси,
карбоксила, карбоксил-C1-7-алкила, карбоксил-C3-7-алкенила, карбоксил-C1-7-алкинила,
карбоксил-C1-7-алкокси,
тетразолила,
C1-7-алкоксикарбонила,
C1-7-алкилсульфонила, C1-7-алкилсульфонилокси,
C1-7-алкилсульфониламино, C3-7-циклоалкилсульфониламино, аминосульфонила, (C1-7-алкил)-аминосульфонила, ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила,
C1-7-алкил-амино, ди-(C1-7-алкил)-амино, C1-7-алкокси-C1-7-алкил-амино,
C1-7-алкокси-C1-7-алкил-C1-7-алкил-амино, C1-7-алкокси-галоген-C1-7-алкил-амино,
гидрокси-C1-7-алкил-C1-7-алкил-амино, аминокислоты, присоединенной через аминогруппу аминокислоты,
C3-7-циклоалкил-амино, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
карбоксил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-(C1-7-алкил)-аминокарбонила,
C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила,
C1-7-алкил-аминокарбонила, ди-(C1-7-алкил)-аминокарбонила,
C1-7-алкилсульфонил-C1-7-алкил-аминокарбонила,
галоген-C1-7-алкил-аминокарбонила, гидрокси-C1-7-алкил-аминокарбонила, гидрокси-C1-7-алкил-C1-7-алкил-аминокарбонила, галоген-гидрокси-C1-7-алкил-аминокарбонила, С1-7-алкокси-C1-7-алкил-аминокарбонила,
C3-7-циклоалкиламинокарбонила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклил-аминокарбонила, где гетероциклил является незамещенным или замещенным
C1-7-алкилом или оксо,
гетероциклил-C1-7-алкил-аминокарбонила, где гетероциклил является незамещенным или замещенным C1-7-алкилом или оксо,
гидрокси-C1-7-алкил-аминокарбонил-C1-7-алкила,
C1-7-алкоксикарбонил-C1-7-алкила,
ди-(C1-7-алкоксикарбонил)-C1-7-алкила,
C1-7-алкилкарбониламино-C1-7-алкиламинокарбонила,
C1-7-алкилкарбониламино, карбоксил-C1-7-алкилкарбониламино,
C1-7-алкоксикарбонил-C1-7-алкилкарбониламино,
C3-7-циклоалкила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
C3-7-циклоалкил-C1-7-алкила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкоксикарбонилом, аминокарбонилом, C1-7-алкилсульфонилом, аминосульфонилом, C1-7-алкилкарбонилом, карбоксил-C1-7-алкил-аминокарбонилом или гидроксисульфонил-C1-7-алкил-аминокарбонилом,
гетероциклилкарбонила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом или C1-7-алкилсульфонилом,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом, C3-7-циклоалкилом, тетрагидропиранилом, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкокси-C1-7-алкилом или C1-7-алкоксикарбонилом,
фенилокси, где фенил является незамещенным или замещенным от одной до трех групп, выбранных из галогена или карбоксила, и
фенила, указанный фенил является незамещенным или замещенным от одной до трех групп, выбранных из группы, состоящей из галогена, C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, циано, циано-C1-7-алкила, амино, C1-7-алкокси, карбоксил, карбоксил-C1-7-алкила, C1-7-алкокси-карбонила, тетразолила, карбоксил-C1-7-алкил-карбониламино,
C1-7-алкокси-карбонил-C1-7-алкил-карбониламино, C1-7-алкилсульфонила,
C1-7-алкил-сульфониламино, -аминосульфонила, C1-7-алкил-аминосульфонила,
ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила, C1-7-алкоксикарбонил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-аминокарбонила,
C1-7-алкоксикарбонил-C1-7-алкил-карбониламино-C1-7-алкилсульфонила, фенил-C1-7-алкил-аминокарбонила, тетразолил-аминокарбонила, тетразолил-C1-7-алкил-аминокарбонила и карбоксил-C1-7-алкил-аминокарбонила; и
R10 выбран из группы, состоящей из водорода, галогена и C1-7-алкила или их фармацевтически приемлемым солям.
Одной из групп соединений формулы 1 в соответствии с настоящим изобретением являются соединения, где R1 представляет собой -(CH2)n-гетероарил, где N представляет собой 0 или 1, и гетероарил выбран из группы, состоящей из пиридина, 1H-пиридин-2-она, 1-окси-пиридина, 1H-пиримидин-2-она, хинолина и пиразина, и является незамещенным или замещенным одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, C1-7-алкокси, C1-7-алкокси-C1-7-алкила, C1-7-алкокси-C1-7-алкокси-C1-7-алкила, C3-7-циклоалкила, C3-7-циклоалкил-C1-7-алкила, карбоксил-C1-7-алкила и аминокарбонил-C1-7-алкила.
В частности, настоящее изобретение относится к соединениям формулы I в соответствии с настоящим изобретением, где R1 представляет собой -(CH2)n-гетероарил, где n представляет собой 0 или 1, и гетероарил выбран из группы, состоящей из пиридина, 1H-пиридин-2-она, 1-окси-пиридина, хинолина и пиразина, и является незамещенным или замещенным одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, C1-7-алкокси, C1-7-алкокси-C1-7-алкила, C1-7-алкокси-C1-7-алкокси-C1-7-алкила, C3-7-циклоалкила, C3-7-циклоалкил-C1-7-алкила, карбоксил-C1-7-алкила и аминокарбонил-C1-7-алкила.
В частности, настоящее изобретение относится к соединениям формулы I как определено выше, где R1 представляет собой -(CH2)n-гетероарил, где n представляет собой 0 или 1 и гетероарил представляет собой пиридин или 1-окси-пиридин, и является незамещенным или замещенным одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, C1-7-алкокси, C1-7-алкокси-C1-7-алкила, C1-7-алкокси-C1-7-алкокси-C1-7-алкила, C3-7-циклоалкила, C3-7-циклоалкил-C1-7-алкила, карбоксил-C1-7-алкила и аминокарбонил-C1-7-алкила.
Более того, настоящее изобретение относится к соединениям формулы I как определено выше, где R1 представляет собой -(CH2)n-гетероарил, где n представляет собой 0 или 1 и гетероарил представляет собой 1H-пиридин-2-он, который является незамещенным или замещенным одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, C1-7-алкокси, C1-7-алкокси-C1-7-алкила, C1-7-алкокси-C1-7-алкокси-C1-7-алкила, C3-7-циклоалкила, C3-7-циклоалкил-C1-7-алкила, карбоксил-C1-7-алкила и аминокарбонил-C1-7-алкила.
Более конкретно, настоящее изобретение относится к соединениям формулы I в соответствии с настоящим изобретением, где R1 представляет собой -(CH2)n-гетероарил, где n представляет собой 0 и гетероарил представляет собой пиридин или 1H-пиридин-2-он, и является незамещенным или замещенным C1-7-алкилом.
Настоящее изобретение также относится к соединениям формулы I как определено выше, где R1 представляет собой -(CH2)m-фенил, где m представляет собой 0 или 1 и фенил замещен одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, гидрокси и галогена.
Соединениями формулы I в соответствии с настоящим изобретением являются также те соединения, где R2 и R3 представляют собой водород.
В частности, настоящее изобретение также относится к соединениям формулы I, где R5 представляет собой водород.
Одной группой соединений формулы I являются те соединения, где R4 выбран из группы, состоящей из C1-7-алкила, C3-7-циклоалкила, C2-7-алкенила и галоген-C1-7-алкила.
Другой группой соединений формулы I в соответствии с настоящим изобретением являются в частности те соединения, где R4 выбран из группы, состоящей из
незамещенного фенила или фенила, замещенного одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила, галоген-C1-7-алкокси и C1-7-алкилсульфонила,
фенил-C1-7-алкила, где фенил незамещен или замещен одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила и галоген-C1-7-алкокси,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом или оксо, и
гетероциклила, указанный гетероциклил выбран из морфолинила, пиперазинила и пиперидинила и является незамещенным или замещенным C1-7-алкилом, оксо или C1-7-алкилкарбонилом. Изобретение также относится к соединениям формулы I, где R4 выбран из группы, состоящей из
незамещенного фенила или фенила, замещенного одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила, галоген-C1-7-алкокси и C1-7-алкилсульфонила,
фенил-C1-7-алкила, где фенил незамещен или замещен одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила и галоген-C1-7-алкокси,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом или оксо,
пиперидинила и 1,1-диметилпиперидиниума.
Более конкретно, настоящее изобретение относится к соединениям формулы I, где R4 выбран из группы, состоящей из
незамещенного фенила или фенила, замещенного одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила, галоген-C1-7-алкокси и C1-7-алкилсульфонила, и
и фенил-C1-7-алкила, где фенил незамещен или замещен одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила и галоген-C1-7-алкокси. Еще более конкретно, R4 представляет собой незамещенный фенил или фенил, замещенный одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила, галоген-C1-7-алкокси и C1-7-алкилсульфонила.
Настоящее изобретение также относится к соединениям формулы I, где R4 представляет собой гетероарил, указанный гетероарил незамещен или замещен C1-7-алкилом или оксо. В частности, R4 представляет собой гетероарил, выбранный из группы, состоящей из пиридила, индолила и тиазолила, в особости пиридила, указанный гетероарил является незамещенным или замещенным C1-7-алкилом или оксо.
Изобретение также относится к соединениям формулы I, где R4 представляет собой гетероциклил, указанный гетероциклил выбран из морфолинила, пиперазинила и пиперидинила и является незамещенным или замещенным C1-7-алкилом, оксо или C1-7-алкилкарбонилом. Более конкретно, R4 представляет собой гетероциклил, выбранный из пиперидинила и 1,1-диметилпиперидиниума.
Дополнительно группой соединений формулы I в соответствии с настоящим изобретением являются те соединения, где
R7 и R9 представляют собой водород и
R8 выбран из группы, состоящей из
галогена, галоген-C1-7-алкила,
циано, циано-C1-7-алкила,
C1-7-алкила, C3-7-алкенила, C1-7-алкинила,
C1-7-алкокси, C1-7-алкокси-C1-7-алкила,
гидрокси, гидрокси-C1-7-алкила, гидрокси-C3-7-алкенила, гидрокси-C3-7-алкинила,
гидрокси-C1-7-алкокси,
карбоксила, карбоксил-C1-7-алкила, карбоксил-C3-7-алкенила, карбоксил-C1-7-алкинила,
карбоксил-C1-7-алкокси,
тетразолила,
C1-7-алкоксикарбонила,
C1-7-алкилсульфонила, C1-7-алкилсульфонилокси,
C1-7-алкилсульфониламино, C3-7-циклоалкилсульфониламино,
аминосульфонила, (C1-7-алкил)-аминосульфонила, ди-(C1-7-алкил)-
аминосульфонила, гетероциклилсульфонила,
C1-7-алкил-амино, ди-(C1-7-алкил)-амино, C1-7-алкокси-C1-7-алкил-амино,
C1-7-алкокси-C1-7-алкил-C1-7-алкил-амино, C1-7-алкокси-галоген-C1-7-алкил-амино
гидрокси-C1-7-алкил-C1-7-алкил-амино, аминокислоты, присоединенной через аминогруппу аминокислоты,
C3-7-циклоалкил-амино, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-С1-7-алкилом или карбоксилом,
карбоксил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-(C1-7-алкил)-аминокарбонила,
C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила,
C1-7-алкил-аминокарбонила, ди-(C1-7-алкил)-аминокарбонила,
C1-7-алкилсульфонил-C1-7-алкил-аминокарбонила,
галоген-C1-7-алкил-аминокарбонила, гидрокси-C1-7-алкил-аминокарбонила,
гидрокси-C1-7-алкил-C1-7-алкил-аминокарбонила, галоген-гидрокси-C1-7-алкил-аминокарбонила,
C1-7-алкокси-C1-7-алкил-аминокарбонила,
C3-7-циклоалкиламинокарбонила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклил-аминокарбонила, где гетероциклил является незамещенным или замещенным
C1-7-алкилом или оксо,
гетероциклил-C1-7-алкил-аминокарбонила, где гетероциклил является незамещенным или замещенным C1-7-алкилом или оксо,
гидрокси-C1-7-алкил-аминокарбонил-C1-7-алкила,
C1-7-алкоксикарбонил-C1-7-алкила,
ди-(C1-7-алкоксикарбонил)-C1-7-алкила,
C1-7-алкилкарбониламино-C1-7-алкиламинокарбонила,
C1-7-алкилкарбониламино, карбоксил-C1-7-алкилкарбониламино,
C1-7-алкоксикарбонил-C1-7-алкилкарбониламино,
C3-7-циклоалкила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
C3-7-циклоалкил-C1-7-алкила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкоксикарбонилом, аминокарбонилом, C1-7-алкилсульфонилом, аминосульфонилом, C1-7-алкилкарбонилом, карбоксил-C1-7-алкил-аминокарбонилом или гидроксисульфонил-C1-7-алкил-аминокарбонилом,
гетероциклилкарбонила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом или C1-7-алкилсульфонилом,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом, C3-7-циклоалкилом, тетрагидропиранилом, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкокси-С1-7-алкилом или C1-7-алкоксикарбонилом,
фенилокси, где фенил является незамещенным или замещенным от одной до трех групп, выбранных из галогена или карбоксила, и
фенила, указанный фенил является незамещенным или замещенным от одной до трех групп, выбранных из группы, состоящей из галогена, C1-7-алкила, гидрокси, гидрокси-С1-7-алкила, циано, циано-C1-7-алкила, амино, C1-7-алкокси, карбоксил, карбоксил-C1-7-алкила, C1-7-алкокси-карбонила, тетразолила, карбоксил-C1-7-алкил-карбониламино,
C1-7-алкокси-карбонил-C1-7-алкил-карбониламино, C1-7-алкилсульфонила,
C1-7-алкил-сульфониламино, аминосульфонила, C1-7-алкил-аминосульфонила,
ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила, C1-7-алкоксикарбонил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-аминокарбонила, С1-7-алкоксикарбонил-C1-7-алкил-карбониламино-C1-7-алкилсульфонила, фенил-C1-7-алкил-аминокарбонила, тетразолил-аминокарбонила, тетразолил-C1-7-алкил-аминокарбонила и карбоксил-C1-7-алкил-аминокарбонила.
В частности, настоящее изобретение относится к соединениям формулы I, где R8 представляет собой фенил, указанный фенил является незамещенным или замещенным от одной до трех групп, выбранных из группы, состоящей из галогена, C1-7-алкила, гидрокси, гидрокси-С1-7-алкила, циано, циано-C1-7-алкила, амино, C1-7-алкокси, карбоксила, карбоксил-C1-7-алкила, C1-7-алкокси-карбонила, тетразолила, карбоксил-C1-7-алкил-карбониламино, C1-7-алкокси-карбонил-C1-7-алкил-карбониламино, C1-7-алкилсульфонила, C1-7-алкил-сульфониламино, аминосульфонила, C1-7-алкил-аминосульфонила, ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила, C1-7-алкоксикарбонил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-аминокарбонила, C1-7-алкоксикарбонил-C1-7-алкил-карбониламино-C1-7-алкилсульфонила, фенил-C1-7-алкил-аминокарбонила, тетразолил-аминокарбонила, тетразолил-C1-7-алкил-аминокарбонила и карбоксил-С1-7-алкил-аминокарбонила.
Настоящее изобретение также относится к соединениям формулы I, где R8 выбран из группы, состоящей из
галогена, галоген-C1-7-алкила,
циано, циано-C1-7-алкила,
C1-7-алкила, C3-7-алкенила, C1-7-алкинила,
C1-7-алкокси, C1-7-алкокси-C1-7-алкила,
гидрокси, гидрокси-C1-7-алкила, гидрокси-C3-7-алкенила, гидрокси-C3-7-алкинила,
гидрокси-C1-7-алкокси,
карбоксил, карбоксил-C1-7-алкила, карбоксил-C3-7-алкенила, карбоксил-C1-7-алкинила,
карбоксил-C1-7-алкокси,
тетразолила,
C1-7-алкоксикарбонила,
C1-7-алкилсульфонила, C1-7-алкилсульфонилокси,
C1-7-алкилсульфониламино, C3-7-циклоалкилсульфониламино,
аминосульфонила, (C1-7-алкил)-аминосульфонила, ди-(С1-7-алкил)-аминосульфонила, гетероциклилсульфонила,
C1-7-алкил-амино, ди-(C1-7-алкил)-амино, C1-7-алкокси-C1-7-алкил-амино,
C1-7-алкокси-C1-7-алкил-C1-7-алкил-амино, C1-7-алкокси-галоген-C1-7-алкил-амино
гидрокси-С1-7-алкил-С1-7-алкил-амино, аминокислоты, присоединенной через аминогруппу аминокислоты,
C3-7-циклоалкил-амино, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
карбоксил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-(C1-7-алкил)-аминокарбонила,
C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила,
C1-7-алкил-аминокарбонила, ди-(C1-7-алкил)-аминокарбонила,
C1-7-алкилсульфонил-C1-7-алкил-аминокарбонила,
галоген-C1-7-алкил-аминокарбонила, гидрокси-C1-7-алкил-аминокарбонила,
гидрокси-C1-7-алкил-C1-7-алкил-аминокарбонила, галоген-гидрокси-C1-7-алкил-аминокарбонила,
C1-7-алкокси-C1-7-алкил-аминокарбонила,
C3-7-циклоалкиламинокарбонила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклил-аминокарбонила, где гетероциклил является незамещенным или замещенным
C1-7-алкилом или оксо,
гетероциклил-C1-7-алкил-аминокарбонила, где гетероциклил является незамещенным или замещенным C1-7-алкилом или оксо,
гидрокси-C1-7-алкил-аминокарбонил-C1-7-алкила,
C1-7-алкокси карбонил-C1-7-алкила,
ди-(C1-7-алкоксикарбонил)-C1-7-алкила,
C1-7-алкилкарбониламино-C1-7-алкиламинокарбонила,
C1-7-алкилкарбониламино, карбоксил-C1-7-алкилкарбониламино,
C1-7-алкоксикарбонил-C1-7-алкилкарбониламино,
C3-7-циклоалкила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом, и
C3-7-циклоалкил-C1-7-алкила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом.
Настоящее изобретение, кроме того, относится к соединениям формулы I, где R8 выбран из группы, состоящей из
гетероциклила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкоксикарбонилом, аминокарбонилом, C1-7-алкилсульфонилом, аминосульфонилом, C1-7-алкилкарбонилом, карбоксил-C1-7-алкил-аминокарбонилом или гидроксисульфонил-C1-7-алкил-аминокарбонилом,
гетероциклилкарбонила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом или C1-7-алкилсульфонилом,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом, C3-7-циклоалкилом, тетрагидропиранилом, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкокси-C1-7-алкилом или C1-7-алкоксикарбонилом, и
фенилокси, где фенил является незамещенным или замещенным от одной до трех групп, выбранных из галогена или карбоксила. Более конкретно, настоящее изобретение относится к соединениям формулы I, где R8 представляет собой гетероциклил, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкокси-карбонилом, аминокарбонилом, C1-7-алкилсульфонилом, аминосульфонилом, C1-7-алкилкарбонилом, карбоксил-C1-7-алкил-аминокарбонилом или гидроксисульфонил-C1-7-алкил-аминокарбонилом. Более конкретно, указанный гетероциклил выбран из группы, состоящей из азетидинила, пирролидинила, пиперидинила, тетрагидропиридинила, морфолинила, пиперазинила, тетрагидропиримидинила, тиоморфолинила и 2-тиа-6-азаспиро[3,3] гептан-ила.
Также более конкретно, настоящее изобретение относится к соединениям формулы I, где R8 представляет собой гетероарил, указанный гетероарил незамещен или замещен C1-7-алкилом, C3-7-циклоалкилом, тетрагидропиранилом, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкокси-C1-7-алкилом или C1-7-алкоксикарбонилом. Более конкретно, указанный гетероарил выбирают из группы, состоящей из пиридила, пиримидинила, тиенила и тиазолила.
Более конкретно, R8 выбран из группы, состоящей из галогена, гидрокси-C1-7-алкила, карбоксила, карбоксил-C1-7-алкила, C1-7-алкилсульфонила,
C3-7-циклоалкила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкоксикарбонилом, аминокарбонилом, C1-7-алкилсульфонилом, аминосульфонилом, C1-7-алкилкарбонилом, карбоксил-C1-7-алкил-аминокарбонилом или гидроксисульфонил-C1-7-алкил-аминокарбонилом,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом, C3-7-циклоалкилом, тетрагидропиранилом, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкокси-C1-7-алкилом или C1-7-алкоксикарбонилом,
фенилокси, где фенил является незамещенным или замещенным от одной до трех групп, выбранных из галогена или карбоксила, и
фенила, указанный фенил является незамещенным или замещенным от одной до трех групп, выбранных из группы, состоящей из галогена, C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, циано, циано-C1-7-алкила, амино, C1-7-алкокси, карбоксила, карбоксил-C1-7-алкила, C1-7-алкокси-карбонила, тетразолила, карбоксил-C1-7-алкил-карбониламино,
C1-7-алкокси-карбонил-C1-7-алкил-карбониламино, C1-7-алкилсульфонила,
C1-7-алкил-сульфониламино, -аминосульфонила, C1-7-алкил-аминосульфонила,
ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила, C1-7-алкоксикарбонил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-аминокарбонила, C1-7-алкоксикарбонил-C1-7-алкил-карбониламино-C1-7-алкилсульфонила, фенил-C1-7-алкил-аминокарбонила, тетразолил-аминокарбонила, тетразолил-C1-7-алкил-аминокарбонила и карбоксил-C1-7-алкил-аминокарбонил.
Другой группой соединений формулы I в соответствии с настоящим изобретением являются те соединения, где
R7 и R8 представляют собой водород и
R9 выбран из группы, состоящей из
галогена, галоген-C1-7-алкила,
циано, циано-C1-7-алкила,
C1-7-алкила, C3-7-алкенила, C1-7-алкинила,
C1-7-алкокси, C1-7-алкокси-C1-7-алкила,
гидрокси, гидрокси-C1-7-алкила, гидрокси-C3-7-алкенила, гидрокси-C3-7-алкинила,
гидрокси-C1-7-алкокси,
карбоксил, карбоксил-C1-7-алкила, карбоксил-C3-7-алкенила, карбоксил-C1-7-алкинила,
карбоксил-C1-7-алкокси,
тетразолила,
C1-7-алкоксикарбонила,
C1-7-алкилсульфонила, C1-7-алкилсульфонилокси,
C1-7-алкилсульфониламино, C3-7-циклоалкилсульфониламино,
аминосульфонила, (C1-7-алкил)-аминосульфонила, ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила,
C1-7-алкил-амино, ди-(C1-7-алкил)-амино, C1-7-алкокси-C1-7-алкил-амино,
C1-7-алкокси-C1-7-алкил-C1-7-алкил-амино, C1-7-алкокси-галоген-C1-7-алкил-амино
гидрокси-C1-7-алкил-C1-7-алкил-амино, аминокислоты, присоединенной через аминогруппу аминокислоты,
C3-7-циклоалкил-амино, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
карбоксил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-(C1-7-алкил)-аминокарбонила,
C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила,
C1-7-алкил-аминокарбонила, ди-(C1-7-алкил)-аминокарбонила,
C1-7-алкилсульфонил-C1-7-алкил-аминокарбонила,
галоген-C1-7-алкил-аминокарбонила, гидрокси-C1-7-алкил-аминокарбонила,
гидрокси-C1-7-алкил-C1-7-алкил-аминокарбонила, галоген-гидрокси-C1-7-алкил-аминокарбонила,
C1-7-алкокси-C1-7-алкил-аминокарбонила,
C3-7-циклоалкиламинокарбонила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклил-аминокарбонила, где гетероциклил является незамещенным или замещенным
C1-7-алкилом или оксо,
гетероциклил-C1-7-алкил-аминокарбонила, где гетероциклил является незамещенным или замещенным C1-7-алкилом или оксо,
гидрокси-C1-7-алкил-аминокарбонил-C1-7-алкила,
C1-7-алкоксикарбонил-C1-7-алкила,
ди-(C1-7-алкоксикарбонил)-C1-7-алкила,
C1-7-алкилкарбониламино-C1-7-алкиламинокарбонила,
C1-7-алкилкарбониламино, карбоксил-C1-7-алкилкарбониламино,
C1-7-алкоксикарбонил-C1-7-алкилкарбониламино,
C3-7-циклоалкила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
С3-7-циклоалкил-C1-7-алкила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкоксикарбонилом, аминокарбонилом, C1-7-алкилсульфонилом, аминосульфонилом, C1-7-алкилкарбонилом, карбоксил-C1-7-алкил-аминокарбонилом или гидроксисульфонил-C1-7-алкил-аминокарбонилом,
гетероциклилкарбонила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом или C1-7-алкилсульфонилом,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом, C3-7-циклоалкилом, тетрагидропиранилом, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкокси-C1-7-алкилом или C1-7-алкоксикарбонилом,
фенилокси, где фенил является незамещенным или замещенным от одной до трех групп, выбранных из галогена или карбоксила, и
фенила, указанный фенил является незамещенным или замещенным от одной до трех групп, выбранных из группы, состоящей из галогена, C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, циано, циано-C1-7-алкила, амино, C1-7-алкокси, карбоксил, карбоксил-C1-7-алкила, C1-7-алкокси-карбонила, тетразолила, карбоксил-C1-7-алкил-карбониламино,
C1-7-алкокси-карбонил-C1-7-алкил-карбониламино, C1-7-алкилсульфонила,
C1-7-алкил-сульфониламино, -аминосульфонила, C1-7-алкил-аминосульфонила,
ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила, C1-7-алкоксикарбонил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-аминокарбонила, C1-7-алкоксикарбонил-C1-7-алкил-карбониламино-C1-7-алкилсульфонила, фенил-C1-7-алкил-аминокарбонила, тетразолил-аминокарбонила, тетразолил-C1-7-алкил-аминокарбонила и карбоксил-C1-7-алкил-аминокарбонила.
В частности, настоящее изобретение относится к тем соединениям формулы I, где
R7 и R8 представляют собой водород и R9 выбран из группы, состоящей из галогена, гидрокси-C1-7-алкила, гидрокси-C3-7-алкинила, карбоксила, карбоксил-C1-7-алкила, гидрокси-C1-7-алкил-аминокарбонила, гидрокси-C1-7-алкил-C1-7-алкил-аминокарбонила,
гетероциклилкарбонила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, галогеном, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, оксо, карбоксилом, карбоксил-C1-7-алкилом или C1-7-алкилсульфонилом, и
фенила, указанный фенил является незамещенным или замещенным от одной до трех групп, выбранных из группы, состоящей из галогена, C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, циано, циано-C1-7-алкила, амино, C1-7-алкокси, карбоксила, карбоксил-C1-7-алкила, C1-7-алкокси-карбонила, тетразолила, карбоксил-C1-7-алкил-карбониламино,
C1-7-алкокси-карбонил-C1-7-алкил-карбониламино, C1-7-алкилсульфонила,
C1-7-алкил-сульфониламино, -аминосульфонила, C1-7-алкил-аминосульфонила,
ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила, C1-7-алкоксикарбонил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-аминокарбонила, C1-7-алкокси карбонил-C1-7-алкил-карбониламино-C1-7-алкилсульфонила, фенил-C1-7-алкил-аминокарбонила, тетразолил-аминокарбонила, тетразолил-C1-7-алкил-аминокарбонила и карбоксил-C1-7-алкил-аминокарбонил.
Более конкретно, настоящее изобретение относится к соединениям формулы I, где указанный фенил незамещен или замещен от одной до трех группами, выбранными из группы, состоящей из галогена, C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, циано, циано-C1-7-алкила, амино, C1-7-алкокси, карбоксил, карбоксил-C1-7-алкила, C1-7-алкокси-карбонила, тетразолила, карбоксил-C1-7-алкил-карбониламино, C1-7-алкокси-карбонил-C1-7-алкил-карбониламино, C1-7-алкилсульфонила, C1-7-алкил-сульфониламино, аминосульфонила, C1-7-алкил-аминосульфонила, ди-(C1-7-алкил)-аминосульфонила, гетероциклилсульфонила, C1-7-алкоксикарбонил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-аминокарбонила, C1-7-алкоксикарбонил-C1-7-алкил-карбониламино-C1-7-алкилсульфонила, фенил-C1-7-алкил-аминокарбонила, тетразолил-аминокарбонила, тетразолил-C1-7-алкил-аминокарбонила и карбоксил-C1-7-алкил-аминокарбонил.
В одном аспекте настоящее изобретение относится к соединениям формулы
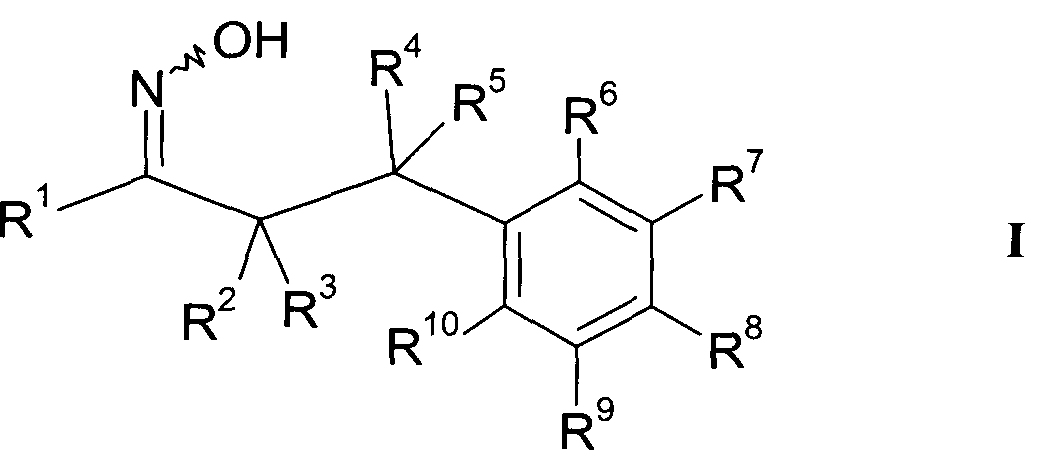
где
R1 представляет собой -(CH2)m-фенил, где m представляет собой 0 или 1 и фенил замещен одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, гидрокси и галогена, или
-(CH2)n-гетероарил, где n представляет собой 0 или 1, и гетероарил выбран из группы, состоящей из пиридина, 1H-пиридин-2-она, 1-окси-пиридина, хинолина и пиразина, и является незамещенным или замещенным одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, C1-7-алкокси, C1-7-алкокси-C1-7-алкила,
C1-7-алкокси-C1-7-алкокси-C1-7-алкила, C3-7-циклоалкила, C3-7-циклоалкил-C1-7-алкила, карбоксил-C1-7-алкила и аминокарбонил-C1-7-алкила;
R2 представляет собой водород или C1-7-алкил,
или в случае когда R4 представляет собой водород, R2 представляет собой незамещенный фенил или фенил, замещенный C1-7-алкилом;
R3 представляет собой водород,
R5 представляет собой водород или гидрокси,
или R3 и R5 заменены двойной связью;
R4 выбран из группы, состоящей из водорода, C1-7-алкила, C3-7-циклоалкила, C2-7-алкенила, галоген-C1-7-алкила,
незамещенного фенила или фенила, замещенного одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила, галоген-C1-7-алкокси и C1-7-алкилсульфонила,
фенил-C1-7-алкила, где фенил незамещен или замещен одной, двумя или тремя группами, независимо выбранными из группы, состоящей из C1-7-алкила, галогена, галоген-C1-7-алкила и галоген-C1-7-алкокси,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом или оксо,
пиперидинила и 1,1-диметилпиперидиниума;
или R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-7-циклоалкильное кольцо;
R6 выбран из группы, состоящей из водорода, галогена и C1-7-алкила;
или R4 и R6 вместе с атомом углерода, к которому они присоединены, образуют циклическую группу
где m представляет собой 0 или 2;
R7 и R9 независимо выбраны из группы, состоящей из водорода, галогена, галоген-C1-7-алкила, циано, циано-C1-7-алкила, C1-7-алкила, C1-7-алкокси,
C1-7-алкокси-C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, гидрокси-C3-7-алкенила,
гидрокси-C3-7-алкинила, гидрокси-C1-7-алкокси, карбоксил, карбоксил-C1-7-алкила,
карбоксил-C3-7-алкенила, карбоксил-C1-7-алкинила, карбоксил-C1-7-алкокси, тетразолила, C1-7-алкоксикарбонила, C1-7-алкилсульфонила, C1-7-алкилсульфонилокси,
C1-7-алкилсульфониламино, C3-7-циклоалкилсульфониламино, -аминосульфонила, C1-7-алкиламиносульфонила, ди-C1-7-алкиламиносульфонила, гетероциклилсульфонила, C1-7-алкиламино, ди-C1-7-алкиламино, C1-7-алкокси-C1-7-алкиламино, C1-7-гидроксиалкил-C1-7-алкиламино, аминокислоты, присоединенной через аминогруппу аминокислоты,
карбоксил-C1-7-алкиламинокарбонила, C1-7-алкоксикарбонил-C1-7-алкиламинокарбонила,
C1-7-алкиламинокарбонила, C1-7-алкилсульфонил-C1-7-алкиламинокарбонила,
галоген-C1-7-алкиламинокарбонила, гидрокси-C1-7-алкиламинокарбонила,
гидрокси-C1-7-алкил-C1-7-алкиламинокарбонила, C1-7-алкокси-C1-7-алкиламинокарбонила,
C3-7-циклоалкиламинокарбонила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-C1-7-алкилом или карбоксилом,
гетероциклиламинокарбонила, где гетероциклил является незамещенным или замещенным C1-7-алкилом, гетероциклил-C1-7-алкиламинокарбонила, C1-7-алкилкарбониламино-C1-7-алкиламинокарбонила, C1-7-алкилкарбониламино, карбоксил-C1-7-алкилкарбониламино, C1-7-алкоксикарбонил-C1-7-алкилкарбониламино, C3-7-циклоалкила, C3-7-циклоалкил-C1-7-алкила,
гетероциклила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкоксикарбонилом или C1-7-алкилсульфонилом,
гетероциклилкарбонила,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом, карбоксилом или карбоксил-C1-7-алкилом,
фенилокси, где фенил является незамещенным или замещенным от одной до трех групп, выбранных из галогена или карбоксила, и
фенила, указанный фенил является незамещенным или замещенным от одной до трех групп, выбранных из группы, состоящей из галогена, C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, циано, циано-C1-7-алкила, амино, C1-7-алкокси, карбоксила, карбоксил-C1-7-алкила, C1-7-алкокси-карбонила, тетразолила, карбоксил-C1-7-алкил-карбониламино,
C1-7-алкилсульфонила, аминосульфонила, C1-7-алкиламиносульфонила, ди-C1-7-алкиламиносульфонила, гетероциклилсульфонила, C1-7-алкоксикарбонил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила,
фенил-C1-7-алкил-аминокарбонила, тетразолил-аминокарбонила,
тетразолил-C1-7-алкил-аминокарбонила и карбоксил-C1-7-алкил-аминокарбонила;
R8 выбран из группы, состоящей из водорода, галогена, галоген-C1-7-алкила, циано, циано-C1-7-алкила, C1-7-алкила, C1-7-алкокси,
C1-7-алкокси-C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, гидрокси-C3-7-алкенила,
гидрокси-C3-7-алкинила, гидрокси-C1-7-алкокси, карбоксил, карбоксил-C1-7-алкила,
карбоксил-C3-7-алкенила, карбоксил-C1-7-алкинила, карбоксил-C1-7-алкокси, тетразолила, C1-7-алкоксикарбонила, C1-7-алкилсульфонила, C1-7-алкилсульфонилокси,
C1-7-алкилсульфониламино, C3-7-циклоалкилсульфониламино, аминосульфонила, C1-7-алкиламиносульфонила, ди-C1-7-алкиламиносульфонила, гетероциклилсульфонила, C1-7-алкиламино, ди-C1-7-алкиламино, C1-7-алкокси-C1-7-алкиламино,
C1-7-гидроксиалкил-C1-7-алкиламино, аминокислоты, присоединенной через аминогруппу аминокислоты,
карбоксил-C1-7-алкиламинокарбонила, C1-7-алкоксикарбонил-C1-7-алкиламинокарбонила,
C1-7-алкиламинокарбонила, C1-7-алкилсульфонил-C1-7-алкиламинокарбонила, галоген-C1-7-алкиламинокарбонила, гидрокси-C1-7-алкиламинокарбонила, гидрокси-C1-7-алкил-C1-7-алкиламинокарбонила, C1-7-алкокси-C1-7-алкиламинокарбонила,
C3-7-циклоалкиламинокарбонила, где C3-7-циклоалкил является незамещенным или замещенным гидрокси, гидрокси-С1-7-алкилом или карбоксилом,
гетероциклиламинокарбонил, где гетероциклил является незамещенным или замещенным
C1-7-алкила,
гетероциклил-C1-7-алкиламинокарбонила,
C1-7-алкилкарбониламино-C1-7-алкиламинокарбонила,
C1-7-алкилкарбониламино, карбоксил-C1-7-алкилкарбониламино,
C1-7-алкоксикарбонил-C1-7-алкилкарбониламино,
C3-7-циклоалкила, C3-7-циклоалкил-C1-7-алкила,
гетероциклила, указанный гетероциклил является незамещенным или замещенным C1-7-алкилом, гидрокси, гидрокси-C1-7-алкилом, C1-7-алкокси, карбоксилом, карбоксил-C1-7-алкилом, C1-7-алкоксикарбонилом или C1-7-алкилсульфонилом, гетероциклилкарбонила,
гетероарила, указанный гетероарил незамещен или замещен C1-7-алкилом, карбоксилом или карбоксил-C1-7-алкилом,
фенилокси, где фенил является незамещенным или замещенным от одной до трех групп, выбранных из галогена или карбоксила, и
фенила, указанный фенил является незамещенным или замещенным от одной до трех групп, выбранных из группы, состоящей из галогена, C1-7-алкила, гидрокси, гидрокси-C1-7-алкила, циано, циано-C1-7-алкила, амино, C1-7-алкокси, карбоксил, карбоксил-C1-7-алкила, C1-7-алкокси-карбонила, тетразолила, карбоксил-C1-7-алкил-карбониламино,
C1-7-алкилсульфонила, -аминосульфонила, C1-7-алкиламиносульфонила, ди-C1-7-алкиламиносульфонила, гетероциклилсульфонила, C1-7-алкоксикарбонил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила,
фенил-C1-7-алкил-аминокарбонила, тетразолил-аминокарбонила,
тетразолил-C1-7-алкил-аминокарбонила и карбоксил-C1-7-алкил-аминокарбонила; и
R10 выбран из группы, состоящей из водорода, галогена и C1-7-алкила;
или их фармацевтически приемлемым солям.
Конкретными соединениями формулы 1 являются следующие соединения:
(E)-3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим,
(Z)-3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим,
(+)-(E)-3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим,
(-)-(E)-3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим,
(E)-3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим,
(E)- 3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим,
3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-m-толил-пропан-1-она оксим,
(+)-(E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она оксим,
(-)-(E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она оксим,
(Z)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она оксим,
3-(3-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим,
(E)-3-(3-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим,
3-(3-бром-фенил)-1-пиридин-4-ил-пентан-1-она оксим,
(E)-3,3-дифенил-1-пиридин-4-ил-пропан-1-она оксим,
(E)-3-(4-бром-фенил)-1-(1-окси-пиридин-4-ил)-3-фенил-пропан-1-она оксим,
(E)-3-(4-циклопропил-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим,
3-(4-диметиламино-фенил)-3-(3,4-диметил-фенил)-1-пиридин-4-ил-пропан-1-она оксим,
3-(4-диметиламино-фенил)-3-(3,5-диметил-фенил)-1 -пиридин-4-ил-пропан-1-она оксим,
(E)-3-(3'-метансульфонил-бифенил-4-ил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим,
(E)-3-(4'-метансульфонил-бифенил-4-ил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим,
4'-{3-[(E)-гидроксиимино]-1-фенил-3-пиридин-4-ил-пропил}-бифенил-4-сульфоновой кислоты метиламид,
(E)-3-фенил-1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-пропан-1-она оксим,
(E)-3-(3'-метансульфонил-бифенил-3-ил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим,
(E)-3-(4'-метансульфонил-бифенил-3-ил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим,
(E)-3-[4-(6-метил-пиридин-3-ил)-фенил]-3-фенил-1-пиридин-4-ил-пропан-1-она оксим,
(E)-3-(4'-этансульфонил-бифенил-4-ил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим,
(E)-3-(4'-гидроксиметил-бифенил-4-ил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим,
(4'-{3-[(E)-гидроксиимино]-1-фенил-3-пиридин-4-ил-пропил}-бифенил-3-илокси)-уксусной кислоты этиловый эфир,
3-(4'-метансульфонил-бифенил-3-ил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим,
3-(3'-метансульфонил-бифенил-3-ил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим,
3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим,
3-(3'-метансульфонил-бифенил-4-ил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим,
3-(4'-метансульфонил-бифенил-4-ил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим,
1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим,
(+)-(E)-1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим,
(-)-(E)-1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим,
(-)-(7)-1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим,
(+)-(7)-1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим,
(E)-3-{4-[(2-метокси-этил)-метил-амино]-фенил}-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим,
3-(4-пиперидин-1-ил-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим,
3-(4-морфолин-4-ил-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим,
3-(4-диэтиламино-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим,
(Z)-3-(4-бром-фенил)-1-пиридин-4-ил-2-о-толил-пропан-1-она оксим,
(E)-3-(4-бром-фенил)-1-пиридин-4-ил-2-о-толил-пропан-1-она оксим,
3-(4-бром-фенил)-1-(2,6-диметил-пиридин-4-ил)-2-фенил-пропан-1-она оксим,
3-(4-бром-фенил)-1-(2-хлор-пиридин-4-ил)-3-фенил-пропан-1-она оксим,
(E)-3-(4-бром-фенил)-1-(2,6-дихлор-пиридин-4-ил)-3-фенил-пропан-1-она оксим,
(E)-3-(4-бром-фенил)-3-о-толил-1-(2,3,5-трифтор-фенил)-пропан-1-она оксим,
3-(4-бром-фенил)-1-(2,5-дихлор-фенил)-3-о-толил-пропан-1-она оксим,
(+)-(E)-3-(4-бром-фенил)-1-(2,5-дихлор-фенил)-3-о-толил-пропан-1-она оксим,
(-)-(-E)-3-(4-бром-фенил)-1-(2,5-дихлор-фенил)-3-о-толил-пропан-1-она оксим,
(E)-3-(4-бром-фенил)-1 -(2,5-дифтор-фенил)-3-о-толил-пропан-1 -она оксим,
(Е)-3-(4-бром-фенил)-1-(3,5-дифтор-фенил)-3-о-толил-пропан-1-она оксим,
(E)-1-(3,5-дифтор-фенил)-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим,
1-(2-хлор-5-фтор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим,
(E)-1-(2-фтор-6-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим,
1-(2-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим,
1-(5-хлор-2-фтор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим,
1-(2-фтор-5-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим,
(E)-2-(10,11-дигидро-5H-дибензо[a,d]циклогептен-5-ил)-1-пиридин-4-ил-этанона оксим,
2-(9H-флуорен-9-ил)-1-пиридин-4-ил-этанона оксим,
3-(4-диметиламино-фенил)-3-(1H-индол-3-ил)-1-пиридин-4-ил-пропан-1-она оксим,
3-(4-диметиламино-фенил)-3-(2-метил-1H-индол-3-ил)-1-пиридин-4-ил-пропан-1-она оксим,
(E)-3-(4-диметиламино-фенил)-3-пиридин-2-ил-1-пиридин-4-ил-пропан-1-она оксим,
(E)-3-(4-диметиламино-фенил)-3-(3-метил-пиридин-2-ил)-1-пиридин-4-ил-пропан-1-она оксим,
1-(2,6-диметил-пиридин-4-ил)-3,3-дифенил-пропенона оксим,
1-(2,6-диметил-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим,
(E)-1-(2,6-диметил-пиридин-4-ил)-3-фенил-3-пиридин-2-ил-пропан-1-она оксим,
3-{3-[(E)-гидроксиимино]-1-фенил-3-пиридин-4-ил-пропил}-бензойная кислота,
4-{3-[гидроксиимино]-3-пиридин-4-ил-1-о-толил-пропил}-бензойная кислота,
3-{3-[гидроксиимино]-3-пиридин-4-ил-1-о-толил-пропил}-бензойная кислота,
(E)-1-(2,6-дихлор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим,
(Z)-1-(2,6-дихлор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим,
4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир,
4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
4'-{3-[(E)-гидроксиимино]-1-фенил-3-пиридин-4-ил-пропил}-бифенил-3-карбоновая кислота,
4'-{3-[(E)-гидроксиимино]-1-фенил-3-пиридин-4-ил-пропил}-бифенил-4-карбоновая кислота,
4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбоновой кислоты этиловый эфир,
4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбоновая кислота,
{4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-уксусная кислота,
2-фтор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир,
2-фтор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
3-хлор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир,
3-хлор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
3-[4-(3-гидрокси-проп-1-инил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бензойная кислота,
3-{4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-акриловая кислота,
3-[4-(3-гидрокси-пропил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
3-({4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-пропионовая кислота,
({4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусная кислота,
4'-[(S)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
4'-[(S)-3-[(Z)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
4'-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
4'-[(R)-3-[(Z)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
(S)-2-({4'-[(S)-3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-пропионовая кислота,
({4'-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусная кислота,
4'-[(S)-3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота ((К)-1-фенил-этил)-амид,
3-(3-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
5-{3-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пиридин-2-карбоновая кислота,
3-фтор-3'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир,
3-фтор-3'-[3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
3'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбоновая кислота,
(E)-3'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
3-(4'-метансульфонил-бифенил-3-ил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
{3-[3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-уксусная кислота,
3-[3-(3-гидрокси-проп-1-инил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
3-[3-(3-гидрокси-пропил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
({3'-[3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбонил}-амино)-уксусная кислота,
3-(4-бром-фенил)-1-(2-метокси-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
4-{3-(4-бром-фенил)-1 -[(E)-гидроксиимино]-3-о-толил-пропил}-1 -метил-1H-пиридин-2-он,
5-{4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пент-4-иноевая кислота,
3-фтор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
4-фтор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбоновая кислота,
3-(4-бром-фенил)-5-метил-1 -пиридин-4-ил-гексан-1-она оксим,
5-{4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пентановая кислота,
(E)-3-(4-бром-фенил)-3-(3-метил-пиридин-2-ил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим,
(E)-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-(3-метил-пиридин-2-ил)-пропил]-бифенил-4-карбоновая кислота,
3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
3-(4-бром-фенил)-1-(2-хлор-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
(E)-3-(4-бром-фенил)-1-(2,6-дихлор-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
3-(4-бром-фенил)-1-(5-хлор-2-фтор-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
(E)-3-(3-бром-фенил)-1-(2-фтор-6-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
(E)-3-(3-бром-фенил)-1 -(5-бром-пиридин-3-ил)-3-о-толил-пропан-1 -она оксим,
3-(4-бром-фенил)-1-(2-фтор-5-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
3-(4-бром-фенил)-1-хинолин-6-ил-3-о-толил-пропан-1-она оксим,
3-(4-бром-фенил)-1-(2-фтор-6-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
3-(4-бром-фенил)-1-(2-хлор-5-фтор-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
(E)-3-(4-бром-фенил)-1-(2-фтор-5-метил-пиридин-3-ил)-3-о-толил-пропан-1-она оксим,
3-(4-бром-фенил)-4,4-диметил-1-(2-метил-пиридин-4-ил)-пентан-1-она оксим,
4'-{3-(2-фтор-5-метил-пиридин-4-ил)-3-[гидроксиимино]-1-о-толил-пропил}-бифенил-4-карбоновая кислота,
3-фтор-4'-[3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
(E)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-(2-трифторметил-фенил)-пропан-1-она оксим,
(E)-3-(4'-метансульфонил-бифенил-4-ил)-1-(2-метил-пиридин-4-ил)-3-(2-трифторметил-фенил)-пропан-1-она оксим,
4'-[3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-(2-трифторметил-фенил)-пропил]-бифенил-4-карбоновая кислота,
3-фтор-4'-[3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-(2-трифторметил-фенил)-пропил]-бифенил-4-карбоновая кислота,
(E)-3-[4-(4-метансульфонил-пиперазин-1-ил)-фенил]-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим,
(E)-3-[4-(4-метансульфонил-пиперазин-1-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-(2-трифторметил-фенил)-пропан-1 -она оксим,
(E)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она оксим,
(E)-4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)бифенил-4-карбоновая кислота,
(E)-3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она оксим,
(E)-4'-(1-(4-фтор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)бифенил-4-карбоновая кислота,
(E,R)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим,
(E,R)-1-(2-метилпиридин-4-ил)-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим,
(E,R)-1-(2-метилпиридин-4-ил)-3-(4-(4-(метилсульфонил)пиперазин-1-ил)фенил)-3-о-толилпропан-1 -она оксим,
(E,E)-3-(4-(4-гидроксипиперидин-1-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим,
(E,R)-4'-(3-(2,6-дихлорпиридин-4-ил)-3-(гидроксиимино)-1-о-толилпропил)бифенил-4-карбоновая кислота,
(E)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим,
4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота,
4-{4-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-тиофен-2-карбоновой кислоты этиловый эфир,
4-{4-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-тиофен-2-карбоновая кислота,
(E)-3-(4-бром-фенил)-1-(4-гидрокси-фенил)-3-о-толил-пропан-1-она оксим,
(E)-3-(4-бром-фенил)-1-(4-гидрокси-3,5-диметил-фенил)-3-о-толил-пропан-1-она оксим,
(E)-2-метил-3,3-дифенил-1-пиридин-4-ил-пропан-1-она оксим,
(E)-3-гидрокси-3,3-дифенил-1-пиридин-4-ил-пропан-1-она оксим,
(Z)-3-гидрокси-3,3-дифенил-1-пиридин-4-ил-пропан-1-она оксим,
(E)-3-(4-бром-фенил)-1-пиразин-2-ил-3-о-толил-пропан-1-она оксим,
3-(4-бром-фенил)-1-(7-хлор-хинолин-4-ил)-3-о-толил-пропан-1-она оксим,
(E)-2-[1-(4-метокси-фенил)-циклогексил]-1-(2-метил-пиридин-4-ил)-этанона оксим,
(Z)-2-[1-(4-метокси-фенил)-циклогексил]-1-(2-метил-пиридин-4-ил)-этанона оксим,
5-{1-[(E)-гидроксиимино]-3,3-дифенил-пропил}-1H-пиридин-2-он,
5-{1-[(E)-гидроксиимино]-3,3-дифенил-пропил}-1-метил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1 -[(Е)-гидроксиимино]-3-о-толил-пропил}-1 -метил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1-[(7)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-этил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1-[(7)-гидроксиимино]-3-о-толил-пропил}-1-этил-1H-пиридин-2-он,
4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
4'-[(S)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
4'-[(R)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
3-фтор-4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1 -о-толил-пропил]-бифенил-4-карбоновая кислота,
5-{3-(4-бром-фенил)-1 -[(E)-гидроксиимино]-5-метил-гексил}-1 -метил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1-[(7)-гидроксиимино]-5-метил-гексил}-1-метил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-3-циклопентил-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-3-циклопентил-1-[(Z)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-гексил}-1 -метил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-7,7,7-трифтор-1-[(E)-гидроксиимино]-пэптил}-1-метил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-гекс-5-енил}-1-метил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-гептил}-1-метил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-3-циклогексил-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-3-циклобутил-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
5-[3-(4-бром-фенил)-1-[(E)-гидроксиимино]-4-(4-трифторметокси-фенил)-бутил]-1-метил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-изопропил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1-[(Z)-гидроксиимино]-3-о-толил-пропил}-1-изопропил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-циклопропилметил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1-[(Z)-гидроксиимино]-3-о-толил-пропил}-1-циклопропилметил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-(2-метокси-этил)-1H-пиридин-2-он,
2-(5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-2-оксо-2H-пиридин-1-ил)-ацетамид,
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-циклобутил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1-[(Z)-гидроксиимино]-3-о-толил-пропил}-1-циклобутил-1H-пиридин-2-он,
3-(5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-2-оксо-2H-пиридин-1-ил)-пропионовая кислота,
4-(5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-2-оксо-2H-пиридин-1-ил)-масляная кислота,
5-{3-(4-бром-2-фтор-фенил)-1-[(E)-гидроксиимино]-гексил}-1-метил-1H-пиридин-2-он,
5-{3-(4-бром-2-фтор-фенил)-3-циклопентил-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
5-{3-(4-бром-2-фтор-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он,
3'-фтор-4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
3,3'-дифтор-4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир,
3,3'-дифтор-4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
5-{3-(2-хлор-фенил)-3-циклопентил-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
4-[1-(2-хлор-фенил)-3-[(Е)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-1,1-диметил-пиперидиниума йодид,
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1,4-диметил-1H-пиридин-2-он,
5-{3-(4-бром-фенил)-1-[(Z)-гидроксиимино]-3-о-толил-пропил}-1,4-диметил-1H-пиридин-2-он,
4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-3-карбоновая кислота,
3-{4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-ил}-пропионовая кислота,
5-{3-(4-бром-фенил)-3-(2-хлор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
4'-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота,
4'-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновой кислоты метиловый эфир,
4'-[1-(2-хлор-фенил)-3-[(Е)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота,
5-{1-[(E)-гидроксиимино]-3-[4-(морфолин-4-карбонил)-фенил]-3-о-толил-пропил}-1-метил-1 Н-пиридин-2-он,
N-(2-гидрокси-этил)-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензамид,
N-(2-гидрокси-этил)-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-o-толил-пропил]-N-метил-бензамид,
(1-{4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоил}-пиперидин-4-ил)-уксусная кислота,
({4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоил}-метил-амино)-уксусная кислота,
4-{4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоиламино}-масляной кислоты этиловый эфир,
4-{4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоиламино}-масляная кислота,
3-{4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоиламино}-пропионовая кислота,
{4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоиламино}-уксусная кислота,
(E/Z)-4-(1 -(2-хлорфенил)-3-(гидроксиимино)-3-(1 -метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фтор-N-(2-гидроксиэтил)бензамид,
транс-4-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-фтор-N-(4-гидрокси-циклогексил)-бензамид,
(E)-4-(1-(2-хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фтор-N-метил-N-(1-метилпиперидин-4-ил)бензамид,
(E)-4-(1-(2-хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фтор-N-(тетрагидро-2H-пиран-4-ил)бензамид,
(E)-4-(1-(2-хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фтор-N-(оксетан-3-ил)бензамид,
{3-фтор-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-фенокси}-уксусная кислота,
2-фтор-4-{3-фтор-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-фенокси}-бензойная кислота,
5-{(R)-3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он,
(E)-5-(3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он,
(E)-4'-(1-(4-фтор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоновая кислота,
5-{3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
(E)-4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоновая кислота,
(E)-метил 2-(4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-илкарбоксамидо)ацетат,
(E)-2-(4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-илкарбоксамидо)уксусная кислота,
(E)-N-((1H-тетразол-5-ил)метил)-4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоксамид,
транс-4-{4-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-фтор-бензоиламино}-циклогексанкарбоновая кислота,
(E)-4-(1-(2-хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фтор-N-(2-метоксиэтил)бензамид,
(E)-4-(1-(2-хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-циклопропил-2-фторбензамид,
(E)-4-(1-(2-хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фтор-N-(2,2,2-трифторэтил)бензамид,
3-{3-фтор-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-фенокси}-бензойная кислота,
3'-фтор-4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-2-карбоновая кислота,
5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота,
(+)-5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
(-)-5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
(+)-4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота,
(-)-4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота,
(E)-5-(3-(4-бромфенил)-3-(2-фторфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он,
(E)-4'-(1-(2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоновая кислота,
(E)-4-(1-(2-хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-этил-2-фторбензамид,
(E)-N-(2-ацетамидоэтил)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид,
4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-((S)-2-гидроксипропил)бензамид,
4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-((R)-2-гидроксипропил)бензамид,
(E)-5-(3-(2-хлорфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он,
(E)-5,5'-(1-(2-хлорфенил)-3-(гидроксиимино)пропан-1,3-диил)бис(1-метилпиридин-2(1H)-он),
(E)-4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбонитрил,
3-бром-5-{(R)-3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он,
(-)-({4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты метиловый эфир,
(+)-({4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты метиловый эфир,
(-)-({4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусная кислота,
(+)-({4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусная кислота,
({4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты метиловый эфир,
({4'-[1-(4-фтор-2-метил-фенил)-3-[(Е)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусная кислота,
5-{3-(4'-амино-бифенил-4-ил)-3-(4-фтор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
5-{3-(4-фтор-2-метил-фенил)-1-[(E)-гидроксиимино]-3-[4'-(1H-тетразол-5-ил)-бифенил-4-ил]-пропил}-1-метил-1H-пиридин-2-он,
(E,R)-4-(4-бромфенил)-1-(пиридин-4-ил)-4-о-толилбутан-2-она оксим,
(Z,R)-4-(4-бромфенил)-1-(пиридин-4-ил)-4-о-толилбутан-2-она оксим,
(E,R)-4-(4-бромфенил)-1-(пиридин-2-ил)-4-о-толилбутан-2-она оксим,
(E,R)-1-(2-метил-пиридин-4-ил)-3-(4-морфолин-4-ил-фенил)-3-о-толил-пропан-1-она оксим,
1-{4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пиперидин-4-карбоновой кислоты этиловый эфир,
1-{4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пиперидин-4-карбоновая кислота,
(E,R)-3-{4-[(2-метокси-этил)-метил-амино]-фенил}-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
(E,R)-3-{4-[(2-гидрокси-этил)-метил-амино]-фенил}-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
(E,R)-3-[4-(4-гидроксиметил-пиперидин-1-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
(E,R)-3-[4-(3-метокси-азетидин-1-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
(E,R)-3-[4-(1,1-диоксо-1λ6-тиоморфолин-4-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
или их фармацевтически приемлемым солям.
Также конкретными соединениями формулы I являются следующие соединения:
(R,E)-N-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)бензойная кислота,
(R,E)-N-(2-гидроксиэтил)-4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)бензамид,
(R,E)-N-(2-гидроксиэтил)-4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)-М-метилбензамид,
4-((R,E)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)-N-((S)-2-гидроксипропил)бензамид,
транс-4-(4-((R,E)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)бензамидо)-циклогексанкарбоновая кислота,
(R,E)-4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)-N,N-диметилбензамид,
(R,E)-4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)-N-метилбензамид,
(R,E)-1-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)азетидин-3-карбоновая кислота,
3-хлор-2-((4-((R,E)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил-амино)метил)пропановая кислота,
(S,E)-1-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоновая кислота,
4-[(S)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензойная кислота,
4-[(S)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-N,N-диметил-бензамид,
1-{4-[(К)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновая кислота,
1-{4-[(3)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновая кислота,
(S,E)-диэтил 2-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)малонат,
(R,E)-3-(4-этинилфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим,
(R,E)-2-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)уксусная кислота,
(R,E)-N-(2-гидроксиэтил)-2-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)ацетамид,
(R,Е)-4'-(3-(2-хлорпиридин-4-ил)-3-(гидроксиимино)-1-о-толилпропил)бифенил-4-карбоновая кислота,
(R,E)-4'-(3-(гидроксиимино)-1-о-толил-3-(2-(трифторметил)пиридин-4-ил)пропил)бифенил-4-карбоновая кислота,
(R)-4'-(3-(2-хлор-5-фторпиридин-4-ил)-3-(гидроксиимино)-1-о-толилпропил)бифенил-4-карбоновая кислота,
(R)-4'-(3-(5-хлор-2-фторпиридин-4-ил)-3-(гидроксиимино)-1-о-толилпропил)бифенил-4-карбоновая кислота,
(R,E)-4'-(3-(2,6-диметилпиридин-4-ил)-3-(гидроксиимино)-1-о-толилпропил)бифенил-4-карбоновая кислота,
3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1 -она оксим,
(+)4'-[(S)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота,
(-)-4'-[(R)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота,
(R,E)-4'-(3-(гидроксиимино)-4-(пиридин-4-ил)-1-о-толилбутил)бифенил-4-карбоновая кислота,
(R,E)-1-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)пирролидин-2-он
(1S,3s)-3-(4-((R,E)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил-амино)циклобутанкарбоновая кислота,
4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-((R)-1-гидроксипропан-2-ил)бензамид,
4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-((S)-1-гидроксипропан-2-ил)бензамид,
(E)-N-(1-гидрокси-2-метилпропан-2-ил)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид,
(E)-N-(1,3-дигидроксипропан-2-ил)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид,
N-((R)-1-гидрокси-3-метилбутан-2-ил)-4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид,
N-((S)-1-гидрокси-3-метилбутан-2-ил)-4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид,
N-((R)-2,3-дигидроксипропил)-4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид,
(E)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-(1-(гидроксиметил)циклопропил)бензамид,
(E)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-(3,3,3-трифтор-2-гидроксипропил)бензамид,
(E)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-(2-(метилсульфонил)этил)бензамид,
(RS)-4-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-N-(2-гидрокси-этил)-бензамид,
4-((E)-1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-((R)-2,3-дигидроксипропил)бензамид,
(RS)-4-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-N-(2-метансульфонил-этил)-бензамид,
(E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он,
(E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(3-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он,
(E)-5-(3-(4-хлор-2-фторфенил)-3-(4-(этилсульфонил)фенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1Н)-он,
(E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(4-(гидроксиметил)фенил)пропил)-1-метилпиридин-2(1H)-он,
(E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(4-гидроксифенил)пропил)-1-метилпиридин-2(1H)-он,
(E)-N-(3-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)фенил)ацетамид,
(E)-3-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-(2-гидроксиэтил)бензамид,
(E)-3-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-(2-гидроксиэтил)-N-метилбензамид,
(E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(3-(морфолин-4-карбонил)фенил)пропил)-1-метилпиридин-2(1H)-он,
(RS)-5-{3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-изопропокси-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
(RS)-5-{3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-гидрокси-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
(RS)-3-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-фтор-фенокси}-бензойная кислота,
(RS)-2-хлор-5-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-фтор-фенокси}-бензойная кислота,
(RS)-4-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-фтор-фенокси}-масляная кислота,
(RS)-5-{3-(4-хлор-2-метил-фенил)-3-[3-фтор-4-(2-гидрокси-этокси)-фенил]-1-[(E)-гидроксиимино]-пропил}-1 -метил-1H-пиридин-2-он,
(RS)-метансульфоновой кислоты 4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-фтор-фениловый эфир,
(E)-5-(3-(4-бромфенил)-1-(гидроксиимино)-3-(4-метилтиазол-5-ил)пропил)-1-метилпиридин-2(1H)-он,
(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он,
(E)-4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-(2-гидроксиэтил)бензамид,
(R,E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он,
(S,E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он,
4-((E)-1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-((R)-2,3-дигидроксипропил)бензамид,
(E)-4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-(2-(метилсульфонил)этил)бензамид,
(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(гидроксиметил)фенил)пропил)-1-метилпиридин-2(1H)-он,
(E)-4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бензолсульфонамид,
(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-(2-(2-метоксиэтокси)этил)пиридин-2(1H)-он,
(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-(2-этоксиэтил)пиридин-2(1H)-он,
(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-(2-метоксиэтил)пиридин-2(1H)-он,
(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-(2-гидроксиэтил)пиридин-2(1H)-он,
(E)-2-(5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-2-оксопиридин-1(2H)-ил)ацетамид,
(E)-3-(5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-2-оксопиридин-1(2H)-ил)пропанамид,
(E)-3-(5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-2-оксопиридин-1(2H)-ил)пропановая кислота,
(RS)-3-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенокси}-бензойная кислота,
(RS)-2-хлор-5-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенокси}-бензойная кислота,
(RS)-5-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенокси}-2-фтор-бензойная кислота,
(RS)-4-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенокси}-масляная кислота,
(Е)-5-(3-(2,5-дихлорфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он,
(Е)-5-(3-(3,5-дифторфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он,
(E)-5-(3-(3,5-дихлорфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он,
(RS)-N-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенил}-метансульфонамид,
(RS)-циклопропансульфоновой кислоты {4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенил}-амид,
(RS)-5-{3-(4-хлор-2-метил-фенил)-1-[(E)-гидроксиимино]-3-[4-(2-оксо-pyrrolidin-1-ил)-фенил]-пропил}-1-метил-1H-пиридин-2-он,
(1R,3r)-3-(4-((R,E)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фениламино)циклобутанкарбоновая кислота,
(3R,E)-3-(4-(3-хлор-2-метоксипропиламино)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим,
(R,R)-1-(2-метилпиридин-4-ил)-3-(4-(метилсульфонил)фенил)-3-о-толилпропан-1-она оксим,
(R,E)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)-3-(4-(метилсульфонил)фенил)-пропан-1-она оксим,
(E)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензойная кислота,
(E)-4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бензойная кислота,
(R,E)-4-(4-бромфенил)-4-(4-хлор-2-метилфенил)-1-(пиридин-2-ил)бутан-2-она оксим,
(R,Е)-3-(4-гидроксифенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим,
(R,E)-3-(4-этоксифенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим,
(S,E)-3-(4-хлор-2-метилфенил)-3-(4-гидроксифенил)-1-(2-метилпиридин-4-ил)пропан-1-она оксим,
(S,E)-3-(4-хлор-2-метилфенил)-3-(4-этоксифенил)-1-(2-метилпиридин-4-ил)пропан-1-она оксим,
(R,E)-1-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоксамид,
(R,E)-1-(2-метилпиридин-4-ил)-3-фенил-3-о-толилпропан-1-она оксим,
(R,E)-2-(1-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоксамидо)уксусная кислота,
(R,E)-2-(1-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоксамидо)этансульфоновая кислота,
(3R,E)-3-(4-(2-тиа-6-азаспиро[3.3]гептан-6-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим,
(R)-трет-бутил 4-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)-5,6-дигидропиридин-1(2H)-карбоксилат,
(R,E)-4-(3-(4-(4-карбоксипиперидин-1-ил)фенил)-1-(гидроксиимино)-3-о-толилпропил)-2-метилпиридина 1 -оксид,
(R,E)-1-(4-(3-(гидроксиимино)-3-(2-(гидроксиметил)пиридин-4-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоновая кислота,
(R,E)-1-(2-метилпиридин-4-ил)-3-(4-(1,2,3,6-тетрагидропиридин-4-ил)фенил)-3-о-толилпропан-1-она оксим,
(R,E)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)-3-о-толилпропан-1-она оксим,
(R,E)-4-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)-5,6-дигидропиридин-2(1H)-он,
(R,E)-1-(2-метилпиридин-4-ил)-3-(4-(пиперидин-4-ил)фенил)-3-о-толилпропан-1-она оксим,
(R,E)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)пиперидин-4-ил)фенил)-3-о-толилпропан-1-она оксим,
(S,E)-2-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)уксусная кислота,
(S,E)-1-(2-метилпиридин-4-ил)-3-(4-морфолинофенил)-3-о-толилпропан-1-она оксим,
{4-[(R)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-уксусная кислота,
(R,E)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-(гидроксиметил)пиридин-4-ил)пропан-1-она оксим,
(R,E)-4-(3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(гидроксиимино)пропил)-2-метилпиридина 1 -оксид,
(3R,E)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-2-метил-1-(2-метилпиридин-4-ил)пропан-1-она оксим,
(R,E)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она оксим,
(R,E)-трет-бутил 4-(4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)пиперидин-1-карбоксилат,
(R,E)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)-3-(4-(пиперидин-4-ил)фенил)-пропан-1-она оксим,
(R,E)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)пиперидин-4-ил)фенил)пропан-1-она оксим,
(S)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-3-фенил-пропан-1-она оксим,
(E)-1-(2-метилпиридин-4-ил)-3-(3-(метилсульфонил)фенил)-3-о-толилпропан-1-она оксим,
N-{4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}-полуамид янтарной кислоты,
(+)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота,
(-)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота,
(+)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота,
(-)4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота,
(+)-4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота,
(-)-4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота,
N-{4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}полуамида малоновой кислоты метиловый эфир,
N-{4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}полуамид малоновой кислоты,
4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-сульфоновой кислоты амид,
5-{3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
4'-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота,
5-{(R)-3-(4-бром-фенил)-3-(4-фтор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
5-{(S)-3-(4-бром-фенил)-3-(4-фтор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
4'-[(R)-1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-сульфоновой кислоты амид,
4'-[(S)-1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-сульфоновой кислоты амид,
(E)-5-(3-(4-бромфенил)-3-(2-фтор-4-метилфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он,
5-{3-(4-бром-фенил)-3-(4-фтор-2-метансульфонил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
(E)-5-(3-(4-бромфенил)-3-(2-хлор-4-фторфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он,
(E)-4'-(1-(2-фтор-4-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоновая кислота
(E)-4'-(1-(2-хлор-4-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоновая кислота
4'-[(R или S)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-сульфоновой кислоты амид,
4'-[(R или S)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-сульфоновой кислоты амид,
5-{(R или S)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он,
N-{4'-[(R или S)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}-метансульфонамид,
(R,E)-3-(4-(5-метил-1,3,4-оксадиазол-2-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим,
(R,E)-3-(4-(5-циклопропил-1,3,4-оксадиазол-2-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим,
(R,E)-3-(4-(5-(метоксиметил)-1,3,4-оксадиазол-2-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим,
(R,E)-3-(4-(5-(2-метоксиэтил)-1,3,4-оксадиазол-2-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим,
(R,E)-1-(2-метилпиридин-4-ил)-3-(4-(5-(тетрагидро-2H-пиран-4-ил)-1,3,4-оксадиазол-2-ил)фенил)-3-о-толилпропан-1-она оксим,
(R,E)-2-(5-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)-1,3,4-оксадиазол-2-ил)уксусная кислота,
(R,E)-1-(2-метилпиридин-4-ил)-3-(4-(оксазол-2-ил)фенил)-3-о-толилпропан-1-она оксим,
(R,E)-3-(4-(1-метил-1H-1,2,3-триазол-4-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим,
(R,E)-2-(4-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)-1H-1,2,3-триазол-1-ил)уксусная кислота,
(+)-(R,E)-3-(4-бромфенил)-3-(2,4-дифторфенил)-1-(2-метилпиридин-4-ил)пропан-1-она оксим,
(-)-(R,E)-1-(4-(1-(2,4-дифторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)пиперидин-4-карбоновая кислота,
(S,E)-1-(4-(1-(2,4-дифторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)пиперидин-4-карбоновая кислота,
(1R,5S)-3-(4-((R,E)-1-(2,4-дифторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)-3-азабицикло[3.1.0]гексан-6-карбоновая кислота,
(1-{4-[(S)-1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-ил)-уксусная кислота,
(E)-4-(1-(2,4-дифторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)бензойная кислота,
(E)-N-циклопропил-4-(1-(2,4-дифторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)бензамид,
(E)-4-(1-(2,4-дифторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)-N-(2-гидроксиэтил)бензамид,
4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-N-((R)-2-гидрокси-пропил)-бензамид,
(E)-4-(1-(2,4-дифторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)-N-(1-гидрокси-2-метилпропан-2-ил)бензамид,
(E)-N-циклогексил-4-(1-(2,4-дифторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)бензамид,
(E)-(4-(1-(2,4-дифторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)(4,4-дифторпиперидин-1-ил)метанон,
(E)-(4-(1-(2,4-дифторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)-(морфолино)метанон,
(E)-(4-(1-(2,4-дифторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)(4-(метилсульфонил)пиперазин-1-ил)метанон,
4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-N-(1,1-диоксо-гексагидро-1λ6-тиопиран-4-ил)-бензамид,
4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-N-[2-(1,1-диоксо-1λ6-тиоморфолин-4-ил)-этил]-бензамид,
(E)-3-(2,4-дифторфенил)-1-(2-метилпиридин-4-ил)-3-(4-(трифторметил)фенил)пропан-1-она оксим,
(E)-3-(2,4-дифторфенил)-1-(2-метилпиридин-4-ил)-3-(6-морфолинопиридин-3-ил)пропан-1-она оксим,
(E)-1-(4-(5-(1-(2,4-дифторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)пиридин-2-ил)пиперазин-1-ил)этанон,
(E)-3-(4-бромфенил)-3-(3,5-дифторфенил)-1-(2-метилпиридин-4-ил)пропан-1-она оксим,
(E)-метил, 4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)-3-фторбифенил-4-карбоксилат,
(рац)-(E)-4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)-3-фторбифенил-4-карбоновая кислота,
(-)-4'-[(R)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота,
(+)-4'-[(S)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота,
(E)-метил, 3-хлор-4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)бифенил-4-карбоксилат,
(рац)-(E)-3-хлор-4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)бифенил-4-карбоновая кислота,
(-)-3-хлор-4'-[(R)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота,
(+)-3-хлор-4'-[(S)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота,
(E)-метил, 4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)-3-метоксибифенил-4-карбоксилат,
(рац)-(E)-4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)-3-метоксибифенил-4-карбоновая кислота,
(E)-4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)-2-метилбифенил-4-карбоновая кислота,
(E)-5-(4-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)тиофен-2-карбоновая кислота,
(E)-5-(4-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)пиримидин-2,4(1H,3H)-дион,
(E)-2-(4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-ил)ацетонитрил,
(E)-2-(4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-ил)уксусная кислота,
(-)-(R,E)-2-(4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-ил)уксусная кислота,
(+)-(S,E)-2-(4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-ил)уксусная кислота,
(-)-(R,E)-4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-3-фторбифенил-4-карбоновая кислота,
(+)-(S,E)-4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-3-фторбифенил-4-карбоновая кислота,
(-)-(R,E)-4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-метилбифенил-4-карбоновая кислота,
(+)-(S,E)-4'-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-метилбифенил-4-карбоновая кислота,
(-)-(R,E)-этил 4-(4-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)фенил)тиофен-2-карбоксилат,
(-)-(R,E)-4-(4-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)фенил)тиофен-2-карбоновая кислота,
(+)-(S,E)-этил 4-(4-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)фенил)тиофен-2-карбоксилат,
(+)-(S,E)-4-(4-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)фенил)тиофен-2-карбоновая кислота,
(E)-5-(4-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)фенил)пиримидин-2,4(1H,3H)-дион,
(E)-5-(3-(4-бромфенил)-3-(2,4-дихлорфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он,
(E)-4'-(1-(2,4-дихлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-3-фторбифенил-4-карбоновая кислота,
(-)-4'-[(R)-1-(2,4-дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота,
(+)-4'-[(S)-1-(2,4-дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота,
(E)-4'-(1-(2,4-дихлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-метилбифенил-4-карбоновая кислота,
(-)-4'-[(R)-1-(2,4-дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-метил-бифенил-4-карбоновая кислота,
(+)-4'-[(S)-1-(2,4-дихлор-фенил)-3-[(Е)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-метил-бифенил-4-карбоновая кислота,
(E)-5-(3-(4-бромфенил)-3-(4-фторфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он,
(R,E)-4-(4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)пиперидин-1-сульфонамид,
(R,E)-трет-бутил 3-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)азетидин-1-карбоксилат,
(R,E)-3-(4-(азетидин-3-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим,
(R,E)-1-(3-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)азетидин-1-ил)этанон,
(R,E)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)азетидин-3-ил)фенил)-3-о-толилпропан-1-она оксим,
(R,E)-3-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)азетидин-1-сульфонамид,
(S,E)-5-(3-(4-бромфенил)-1-(гидроксиимино)-3-о-толилпропил)-1-метилпиридин-2(1H)-он,
(S,E)-4-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)циклогексанкарбоновая кислота,
(1R,4s)-4-(4-((S,E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)циклогексанкарбоновая кислота,
(1S,4r)-4-(4-((S,E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)циклогексанкарбоновая кислота,
(R,E)-4-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)циклогексанкарбоновая кислота,
4-{4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-циклогексанкарбоновая кислота,
4-{4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-циклогексанкарбоновая кислота,
(R,E)-2-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)уксусная кислота,
(R,Е)-5-(1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1H)-он,
(R,Z)-5-(1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1H)-он,
5-[(S)-1-[(E)-гидроксиимино]-3-(4-метансульфонил-фенил)-3-о-толил-пропил]-1-метил-1H-пиридин-2-он,
натрия (R,E)-1-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоксилат,
(R,E)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-бензонитрил,
(R,Z)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-бензонитрил
(R,E)-5-(3-(4-(1H-тетразол-5-ил)фенил)-1-(гидроксиимино)-3-о-толилпропил)-1-метилпиридин-2(1H)-он,
(S,E)-5-(3-(4-бромфенил)-1-(гидроксиимино)-3-о-толилпропил)-1-метилпиримидин-2(1H)-он,
(S,E)-5-(1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-3-о-толилпропил)-1-метилпиримидин-2(1 Н)-он,
(R,E)-4-(4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)циклогексанкарбоновая кислота,
(1R,4r)-4-(4-((R,E)-1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)циклогексанкарбоновая кислота,
(1S,4s)-4-(4-((R,E)-1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)циклогексанкарбоновая кислота,
(R,E)-трет-бутил 4-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)пиперидин-1-карбоксилат,
(R,E)-5-(1-(гидроксиимино)-3-(4-(пиперидин-4-ил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1H)-он,
(R,E)-5-(3-(4-(1-ацетилпиперидин-4-ил)фенил)-1-(гидроксиимино)-3-о-толилпропил)-1-метилпиридин-2(1H)-он,
(R,E)-5-(1-(гидроксиимино)-3-(4-(1-(метилсульфонил)пиперидин-4-ил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1H)-он,
(R,E)-4-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)пиперидин-1-сульфонамид,
(R,E)-1-(4-(4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)пиперидин-1-ил)этанон,
или их фармацевтически приемлемым солям.
Более конкретно, настоящее изобретение относится к следующим соединениям формулы I:
{4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-уксусная кислота,
3-[4-(3-гидрокси-пропил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
({4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусная кислота,
4'-[(S)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
4'-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
(E)-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-(3-метил-пиридин-2-ил)-пропил]-бифенил-4-карбоновая кислота,
3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим,
3-фтор-4'-[3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
(E,R)-1-(2-метил-пиридин-4-ил)-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим,
(E,R)-1-(2-метилпиридин-4-ил)-3-(4-(4-(метилсульфонил)пиперазин-1-ил)фенил)-3-о-толилпропан-1-она оксим,
(E,R)-3-(4-(4-гидроксипиперидин-1-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим,
4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота
4'-[(R)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
3,3'-дифтор-4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
4'-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота,
N-(2-гидрокси-этил)-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензамид,
(E)-4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоновая кислота,
3-{3-фтор-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-фенокси}-бензойная кислота,
4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота,
(E)-5-(3-(2-хлорфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он,
1-{4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пиперидин-4-карбоновая кислота,
или их фармацевтически приемлемым солям.
Более конкретно, настоящее изобретение также относится к следующим соединениям формулы I:
1-{4-[(R)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновая кислота,
(R,E)-2-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)уксусная кислота,
(R,E)-2-(1-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоксамидо)уксусная кислота,
(R,E)-2-(1-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоксамидо)этансульфоновая кислота,
4-{4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-циклогексанкарбоновая кислота,
(R,E)-5-(1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1H)-он,
или их фармацевтически приемлемым солям.
Фармацевтически приемлемые соли соединений формулы I также отдельно составляют соединения осбого интереса настоящего изобретения.
Примерами таких соединений являются следующие:
(R,E)-5-(3-(4-(1H-тетразол-5-ил)фенил)-1-(гидроксиимино)-3-о-толилпропил)-1-метилпиридин-2(1H)-он, натриевая соль,
(+)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота; соединение с триэтиламином 1:0.9,
(-)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота; соединение с триэтиламином 1:0.85,
(+)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота; соединение с триэтиламином 1:1,
(-)4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота; соединение с триэтиламином 1:0.7,
(+)-4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота; соединение с триэтиламином 1: 0.75, и
(-)-4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота; соединение с триэтиламином 1:0.75.
Соединения формулы I могут иметь один или несколько асимметричных атомов углерода и могут существовать в виде оптически чистых энантиомеров, смесей энантиомеров, таких как, например, рацематы, оптически чистых диастереоизомеров, смесей диастереоизомеров, рацематов диастереоизомеров или смесей диастереомерных рацематов. Оптически активные формы могут быть получены, например, разделением рацематов, путем асимметричного синтеза или асимметричной хроматографией (хроматография с хиральным адсорбентом или элюентом). Изобретение охватывает все эти формы.
В частности, соединения формулы I настоящего изобретения являются оксимами и, следовательно, могут существовать в виде двух изомерных форм по двойной связи C=N-OH, т.е. в виде Е-(или анти) и Z-(или син) изомеров.
Следует понимать, что соединения общей формулы I в настоящем изобретении могут быть дериватизированы по функциональным группам с получением производных, которые способны превращаться обратно в исходное соединение в естественных условиях. Физиологически приемлемые и метаболически лабильные производные, которые способны превращаться в исходные соединения общей формулы I в естественных условиях, также входят в объем данного изобретения.
Дополнительным аспектом настоящего изобретения является способ получения соединений формулы I, как определено выше, который включает
взаимодействие кетона формулы II
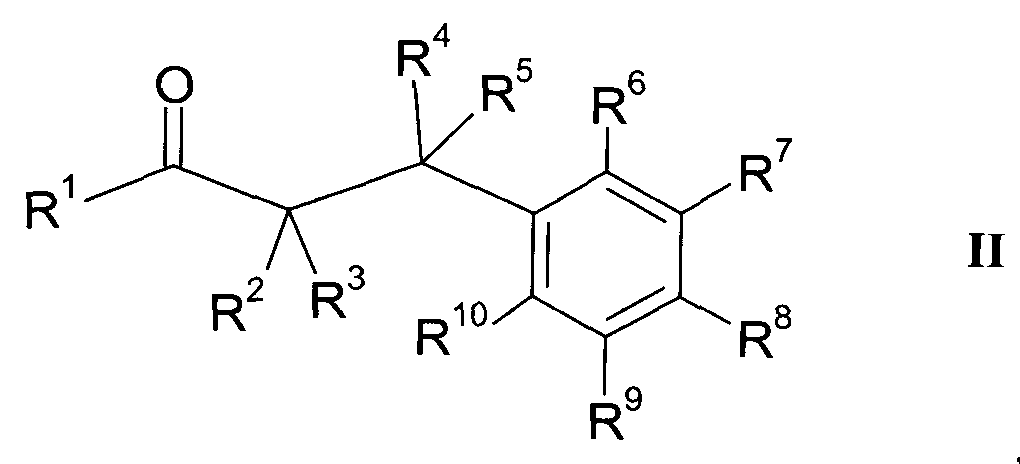
где R1-R12 являются такими, как определено выше, с гидроксиламингидрохлоридом в присутствии основания с получением соединения формулы I
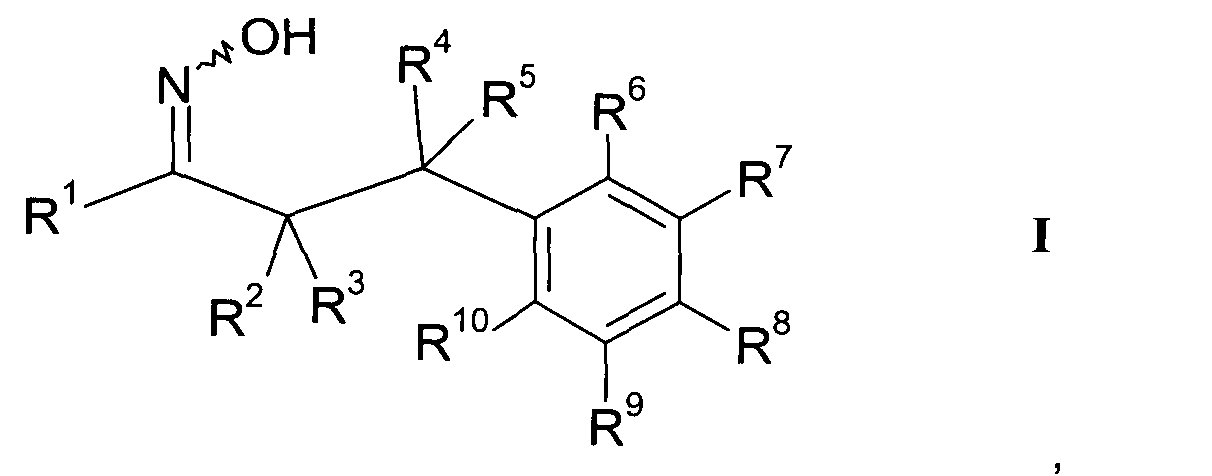
где R1-R12 являются такими, как определено выше, и, если необходимо, конвертацию полученного соединения в фармацевтически приемлемую соль.
Подходящими основаниями являются, например, гидроксид натрия, гидрокарбонат натрия или ацетата натрия. Реакцию проводят в подходящем растворителе, таком как, например, этанол или метанол, при температуре от комнатной температуры до температуры кипения растворителя.
Необязательно, отношение E и Z изомеров соединения формулы I можно изменить посредством обработки полученного оксима формулы I кислотами, такими как соляная кислота в растворителях, таких как этанол, диметиловый эфир и диоксан или их смеси при температурах от комнатной температуры и до температуры кипения растворителя. E и Z изомеры можно разделить колоночной хроматографией или ВЭЖХ.
Настоящее изобретение также относится к соединениям формулы I, как определено выше, полученным способом, как определено выше.
Более подробно, соединения формулы I могут быть получены, как описано ниже на схемах 1-12, или по аналогии со способами, описанными ниже и способами, известными в данной области. Все исходные материалы являются либо коммерчески доступными, описанными в литературе либо могут быть получены способами, хорошо известными в данной области или по аналогии с описанным ниже способами. Если не указано иного, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 являются такими, как определено выше.
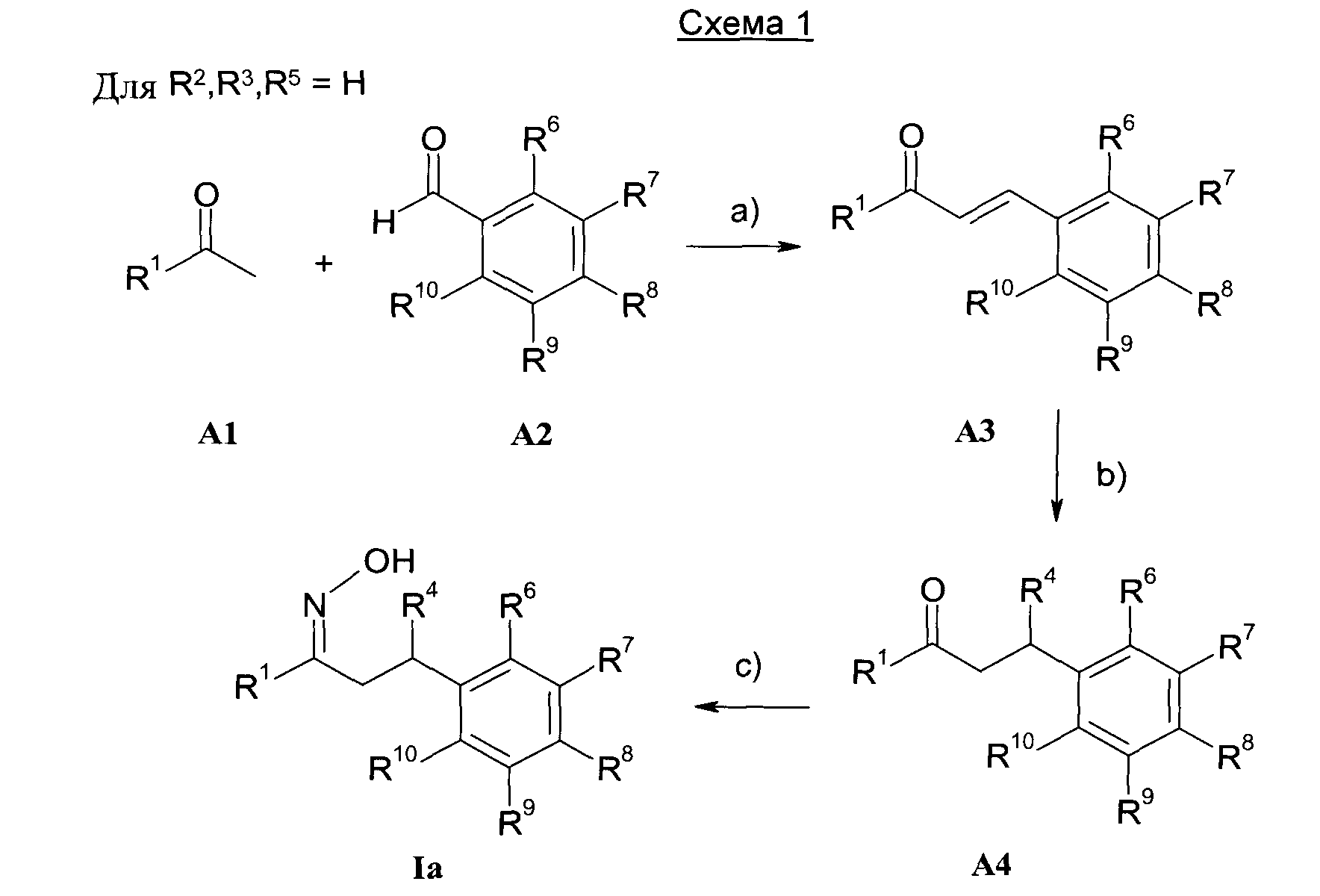
На Схеме I описан синтез соединений общей формулы Ia, где R2, R3 и R5 представляют собой водород. Синтез начинают из кетона А1 и альдегида А2, которые превращают в соответствующие еноны (халконы) A3 посредством обработки основанием, таким как гадроксид натрия или калия или пиперидином в растворителе, таком как метанол или этанол при комнатной температуре с повышением до кипения с обратным холодильником (стадия а). Альтернативно, модно использовать условия микроволнового облучения. В некоторых случаях может использоваться превращение исходных материалов без использования растворителя в присутствии гидроксида натрия (например, Cave, G.W.V.; Raston, C.L. J. Chem. Soc., Perkin Trans. 1, 2001, 3258-3264). Сопряженное присоединение к енону A3 может быть достигнуто использованием цинкорганических реагентов, которые являются как коммерчески доступными, так и могут быть получены in situ из соответствующих арилбороновых кислот и диэтилцинка (например Dong, L; Xu, Y.-J.; Gong, L.-Z.; Mi, A.-Q.; Jiang, Y.-Z. Synthesis 2004, 1057-1061), в растворителе, таком как толуол при повышенной температуре с получением кетона А4 (стадия b). Альтернативно, катализируемая родием реакция с арилбороновой кислотой в смеси диоксана и воды при повышенной температуре в присутствии такого катализатора, как хлор(1,5-циклооктадиен)родий(I)димер, приводит к получению кетона А4 (Itooka, R.; Iguchi, Y.; Miyaura, N. Chemistry Letters, 2001, 722-723). Еще один метод использует реагенты Гриньяра R4MgX (с X=Br, Cl) в присутствии йодида меди в растворителе, таком как диэтиловый эфир или ТГФ при 0°C (Skytte, D.М.; Nielsen, S.F.; Chen, M.; Zhai, L.; Olsen, С.E.; Christensen, S.B. Journal of Medicinal Chemistry, 2006, 49, 436-440). Кроме того, для сопряженного присоединения к енону A3 могут использоваться органокупраты, которые могут быть получены, например, из CuBr DMS и R4Li в растворителе, таком как диэтиловый эфир или ТГФ при температуре между -78°C комнатной температурой (например Malmberg, Н.; Nilsson, M. Tetrahedron 1982, 38, 1509-1510). Другим способом является добавление аллилсиланов к енону A3, катализируемое кислотой Льюиса, такой как TiCl4 в растворителе, таком как дихлорметан (Hosomi, A.; Kobayashi, Н.; Sakurai, Н.; Tetrahedron Letters, 1980, 21, 955-958).
В случае, когда R4 представляет собой 3-замещенныйиндоловый остаток, сопряженное присоединение может быть достигнуто с использованием индолов в присутствиии каталитического количества треххлористой сурьмы в растворителе, таком как ацетонитрил, в условиях кипячения с обратным холодильником с получением соединений А4 (например, Maiti, G-; Кипой, Р. Synthetic Communications 2007, 37, 2309-2316). Превращение кетона А4 в соединения формулы la достигается использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия, в растворителе, таком как этанол, метанол или вода (или их смеси) при комнатной температуре, нагревая до 200°C (стадия c), необязательно в условиях микроволнового излучения. Если необходимо или желательно соотношение E и Z изомеров может быть изменено обработкой выделенного оксима кислотой, такой как соляная кислота, в растворителе, таком как этанол, DME и диоксан или в их смеси при температуре между комнатной температурой и температурой кипения растворителя. Разделение E и Z изомеров может быть осуществлено как хроматографией на колонках, так и посредством ВЭЖХ. Соединения общей формулы Ia кроме того могут содержать один или более стереоцентров и необязательно могут быть разделены на оптически чистые энантиомеры или диастереомеры с помощью способов, хорошо известных в уровне техники, например с помощью ВЭЖХ хроматографии, хроматографии на хиральных ВЭЖХ колонках или хроматографией с хиральным элюентом. Рацемические соединения, несущие карбоксилатную или тетразоловую группу также могут быть разделены на свои антиподы, например, через диастереомерные соли посредством кристаллизации с оптически чистыми аминами, соединения, несущие остаток амина также могут быть разделены на свои антиподы, например, через диастереомерные соли посредством кристаллизации с оптически чистыми хиральными кислотами. Это хиральное разделение может проводиться как на стадии конечного продукта формулы Ia, так и на стадии хирального промежуточного соединения А4.
Если R1 представляет собой пиридиновый остаток, дополнительно он может быть трансформирован в соответствующий пиридин-N-оксид посредством окисления с использованием m-хлорпербензойную кислоту в растворителе, таком как CH2Cl2, MeOH или их смеси при комнатной температуре. Для получения соединений, в которых R1 представляет собой пиридин-4-он, пиридин-3-он или пиримидин-2-он, они могут быть получены из соответствующих 4-метокси-пиридиновых, 2-метокси-пиридиновых или 2-метоксипиримидиновых производных, посредством отщепления метоксигруппы с помощью обработки соляной кислотой в диоксане/воде при повышенной температуре или обрабоки трехбромистым бором в дихлорметане при от -78°C до 0°C. Дальнейшее N-алкилирование пиридинона можно провести с помощью обработки алкилгалидами в растворителе, таком как ДМА, ацетон или ТГФ в присутствии основания, такого как карбонат калия.
Если R1 является метоксигруппой, она может быть расщеплена в соответствующий фенол обработкой трибромидом бора в дихлорметане при от -78°C до 0°C.
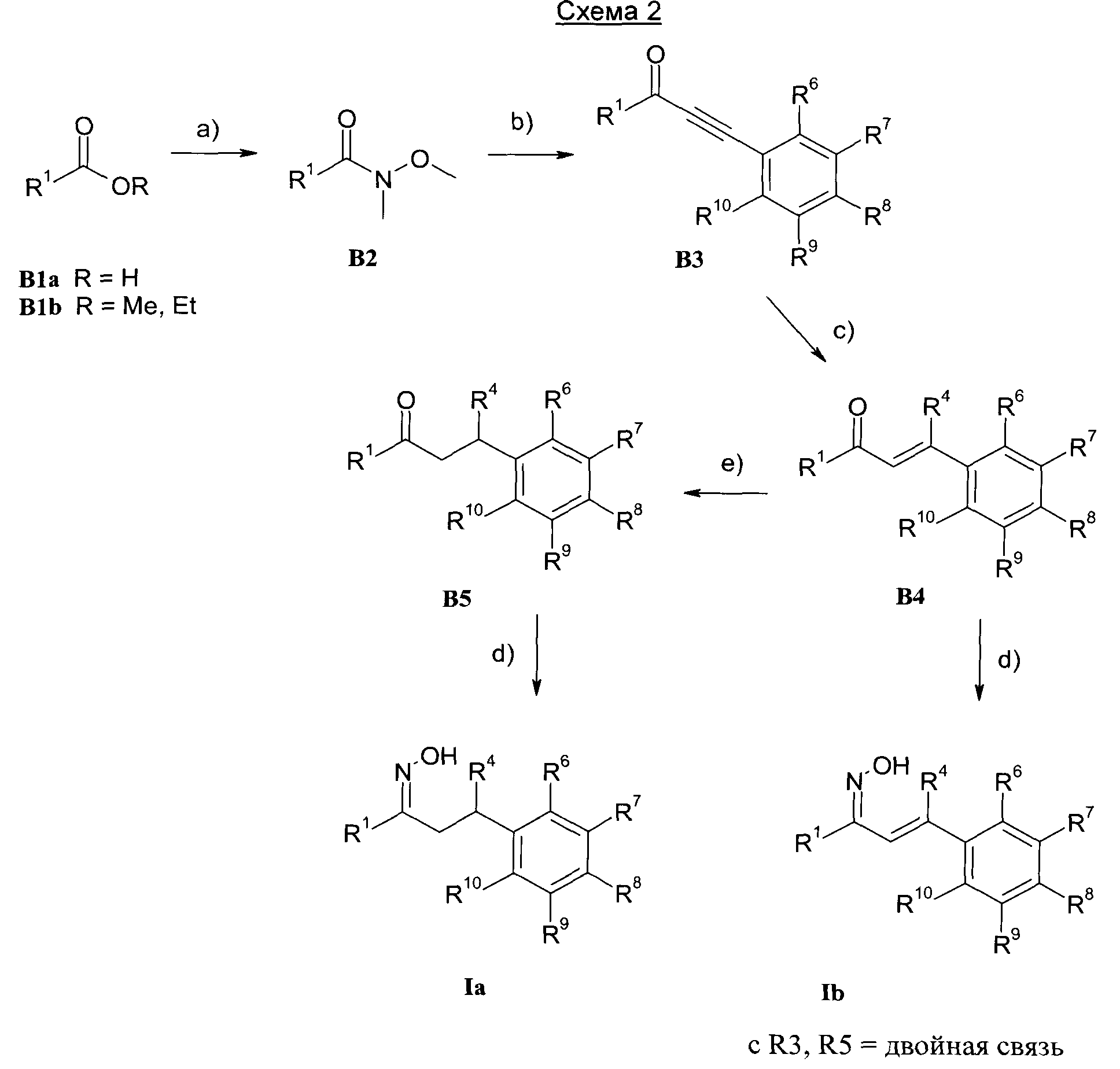
На Схеме 2 описан альтернативный путь синтеза соединений формулы (I) начиная или с кислоты B1a (R=H) или с эфира B1b (R=Me, Et). Кислоту B1a концертируют в соответствующий амид Вейнреба В2 посредством обработки N,O-диметилгидроксиламина гидрохлоридом в присутствии связующего реагента, такого как N-(3-диметиламинопропил)-N'-этил-карбодиимид-гидрохлорид (EDCI), 2-(бензотриазол-1-ил)-N,N,N',N'-тетраметил-уроний гексафторфосфат (HBTU), 0-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N,N-тетраметил-уроний тетрафторборат (TPTU), O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметил-уроний гексафторфосфат (HATU) или бензотриазол-1-илокситрис(диметиламино)-фосфоний гексафторфосфат (BOP) и основания, такого как этил-диизопропил-амин, триэтиламин или N-метилморфолин, возможно в присутствии 4-диметиламино-пиридина или 1-гидроксибензо-триазола (HOBt), в растворителе, таком как дихлорметан, диметилформамид, диметилацетамид или диоксан при температуре между 0°С и комнатной температурой. Альтернативно амид Вейнреба В2 может быть получен из эфира B1b посредством обработки N,O-диметилгидроксиламина гидрохлоридом в присутствии изопропилмагния хлорида в растворителе, таком как диэтиловый эфир или ТГФ при от -10°C до 0°C (стадия a). Из этих амидов Вейнреб B2 получили кетон B3 посредством добавления реагента Гриньяра R'-алкилена MgBr (с R'=R6-10 замещенный фенил) в растворителе, таком как ТГФ или диэтиловый эфир при температруе от 0°C до комнатной температуры или посредством добавления литийорганических реагентов, полученных из R'алкин-Н с n-BuLi в ТГФ при температруе от -78°C до комнатной температуры (стадия b). Катализируемое медью сопряженное присоединение алкинонов B3 с использованием R4 магний галидов в присутствии йодид меди в растворителях, таких как ТГФ или диэтиловый эфир привело к получению алкенонов B4. Альтернативно, алкеноны B4 могут быть синтезированы добавлением купратов R4CuLi, предварительно полученных из CuBr DMS, R4Li в растворителе, таком как ТГФ при -78°C. Насыщенное производное B5 может быть получено из енона B4 посредством 1,4-гидроборирования 9-борабицикло[3.3.1]нонаном (9-BBN) в растворителе, таком как дихлорметан с последующим гидролизом метанолом (например Matsumoto, Y.; Hayashi, Т. Synlett 1991, 349-350) (стадия e).
Превращение кетона B4 или B5 в соединения формулы Ia или Ib достигается использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия в растворителе, таком как этанол или метанол при комнатной температуре с повышением до кипения с обратным холодильником (стадия a). Если необходимо или желательно, соотношение E и Z изомеров может быть изменено обработкой выделенного оксима кислотой, такой как соляная кислота, в растворителе, таком как этанол, DME и диоксан или в их смеси при температуре между комнатной температурой и температурой кипения растворителя. Разделение E и Z изомеров может быть осуществлено как хроматографией на колонках, так и посредством ВЭЖХ. Соединения общей формулы Ia/Ib кроме того могут содержать один или более стереоцентров и необязательно могут быть разделены на оптически чистые энантиомеры или диастереомеры с помощью способов, хорошо известных в уровне техники, например, с помощью ВЭЖХ хроматографии, хроматографии на хиральных ВЭЖХ колонках или хроматографией с хиральным элюентом. Рацемические соединения, несущие карбоксилатную или тетразоловую группу также могут быть разделены на свои антиподы, например, через диастереомерные соли посредством кристаллизации с оптически чистыми аминами, соединения, несущие остаток амина также могут быть разделены на свои антиподы, например, через диастереомерные соли посредством кристаллизации с оптически чистыми кислотами. Это хиральное разделение может проводиться как на стадии конечного продукта формулы Ia, так и на стадии хирального промежуточного соединения B5.
Если R1 представляет собой пиридиновый остаток, дополнительно он может быть трансформирован в соответствующий пиридин-ЛУ-оксид посредством окисления с использованием m-хлорпербензойной кислоты в растворителе, таком как CH2Cl2, MeOH или их смеси, при комнатной температуре. Для получения соединений, в которых R1 представляет собой пиридин-4-он или пиридин-3-он, они могут быть получены из соответствующих 2-метокси-пиридиновых производных посредством отщепления метоксигруппы с помощью обработки соляной кислотой в диоксане при повышенной температуре или обрабоки трехбромистым бором в дихлорметане при от -78°C до 0°C. Дальнейшее N-алкилирование пиридинона можно провести с помощью обработки алкилгалидами в растворителе, таком как ДМА, ацетон или ТГФ в присутствии основания, такого как карбонат калия.
Если R1 несет метоксигруппу, она может быть расщеплена в соответствующий фенол обработкой трибромидом бора в дихлорметане при от -78°C до 0°C.
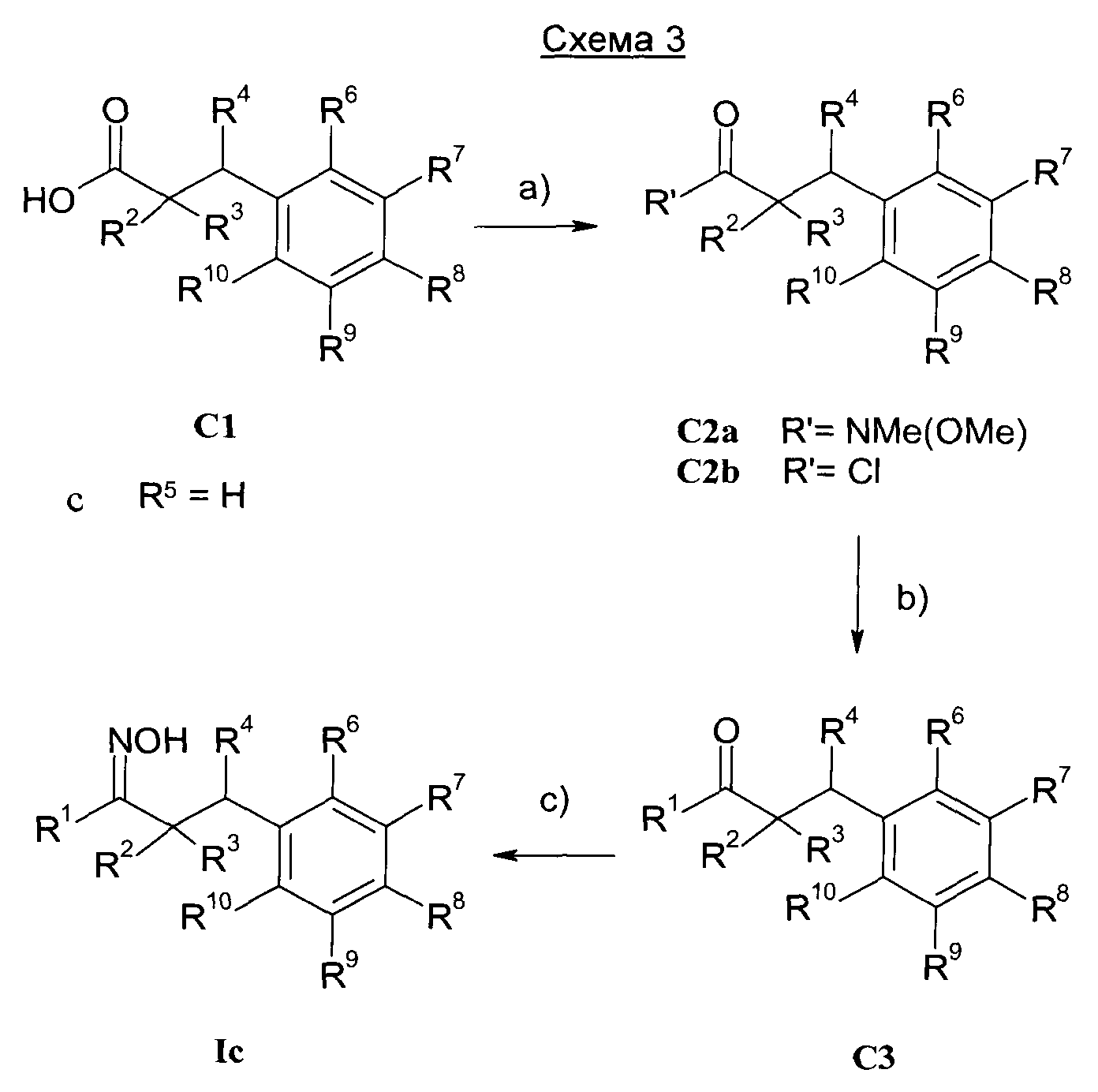
Еще один способ получения соединений формулы (I) изображен на Схеме 3. Синтез начинают с кислоты C1, которая может быть конвертирована в амид Вейнреба C2a (R'=NMeOMe) или в ангидрид C2b (R'=Cl). Кислоту C1 конвертируют в соответствующий амид Вейнреба C2a посредством обработки N,O-диметилгидроксиламина гидрохлоридом в присутствии связующего реагента, такого как N-(3-диметиламинопропил)-N'-этил-карбодиимид-гидрохлорид (EDCI), 2-(бензотриазол-1-ил)-N,N,N',N'-тетраметил-уроний гексафторфосфат (HBTU), 0-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N,N-тетраметил-уроний тетрафторборат (TPTU), O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат (HATU) или бензотриазол-1-илокситрис(диметиламино)фосфоний гексафторфосфат (ВОР) и основания, такого как этил-диизопропил-амин, триэтиламин или N-метил-морфолин, возможно, в присутствии 4-диметиламино-пиридина или 1-гидроксибензо-триазола (HOBt), в растворителе, таком как дихлорметан, диметилформамид, диметилацетамид или диоксан при температуре между 0°C и комнатной температурой. Альтернативно, кислота C1 может быть превращена в ангидрид C2 посредством обработки оксалилхлоридом в CH2Cl2 в присутствии небольшого количества ДМФ при комнатной температуре. Обработка амида Вейнреба C2a или хлорангидрида C2b органолитиевым соединением R1Li или органомагниевым соединением R1MgX (X=Cl, Br, I) приводит к получению промежуточного соединения кетона C3 (стадия b).
Если органолитиевое R1Li или органомагниевое соединения R1MgX (with X=Cl, Br, I) не являются коммерчески доступными, они могут быть получены in situ из соответствующих R1-X (с X=Cl, Br, I) посредством обработки n-BuLi или i-PrMgCl или i-PrMgCl LiCl при от -100°С до 0° в растворителе, таком как ТГФ. Превращение кетона C3 в соединения формулы (I) достигается использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия в растворителе, таком как этанол или метанол при комнатной температуре с повышением до кипения с обратным холодильником (стадия c). Если необходимо или желательно, соотношение E и Z изомеров может быть изменено обработкой выделенного оксима кислотой, такой как соляная кислота, в растворителе, таком как этанол, DME и диоксан или в их смеси, при температуре между комнатной температурой и температурой кипения растворителя. Разделение E и Z изомеров может быть осуществлено как хроматографией на колонках, так и посредством ВЭЖХ. Соединения общей формулы I кроме того могут содержать один или более стереоцентров и необязательно могут быть разделены на оптически чистые энантиомеры или диастереомеры с помощью способов, хорошо известных в уровне техники, например, с помощью ВЭЖХ хроматографии, хроматографии на хиральных ВЭЖХ колонках или хроматографией с хиральным элюентом. Рацемические соединения, несущие карбоксилатную или тетразоловую группу также могут быть разделены на свои антиподы, например, через диастереомерные соли посредством кристаллизации с оптически чистыми аминами, соединения, несущие остаток амина также могут быть разделены на свои антиподы, например, через диастереомерные соли посредством кристаллизации с оптически чистыми кислотами. Это хиральное разделение может проводиться как на стадии конечного продукта формулы I так и на стадии хирального промежуточного соединенияз C2 или C3.
Если R1 представляет собой пиридиновый остаток, дополнительно он может быть трансформирован в соответствующий пиридин-N-оксид посредством окисления с использованием m-хлорпербензойной кислоты в растворителе, таком как CH2Cl2, MeOH или их смеси, при комнатной температуре. Для получения соединений, в которых R1 представляет собой пиридин-4-он, пиридин-2-он или пиримидин-2-он, они могут быть получены из соответствующих 2-метокси-пиридиновых производных посредством отщепления метоксигруппы с помощью обработки соляной кислотой в диоксане при повышенной температуре или обрабоки трехбромистым бором в дихлорметане при от -78°C до 0°C. Дальнейшее N-алкилирование пиридинона можно провести с помощью обработки алкилгалидами в растворителе, таком как ДМА, ацетон или ТГФ в присутствии основания, такого как карбонат калия.
Если R1 несет метоксигруппу, она может быть расщеплена в соответствующий фенол обработкой трибромидом бора в дихлорметане при от -78°C до 0°C.
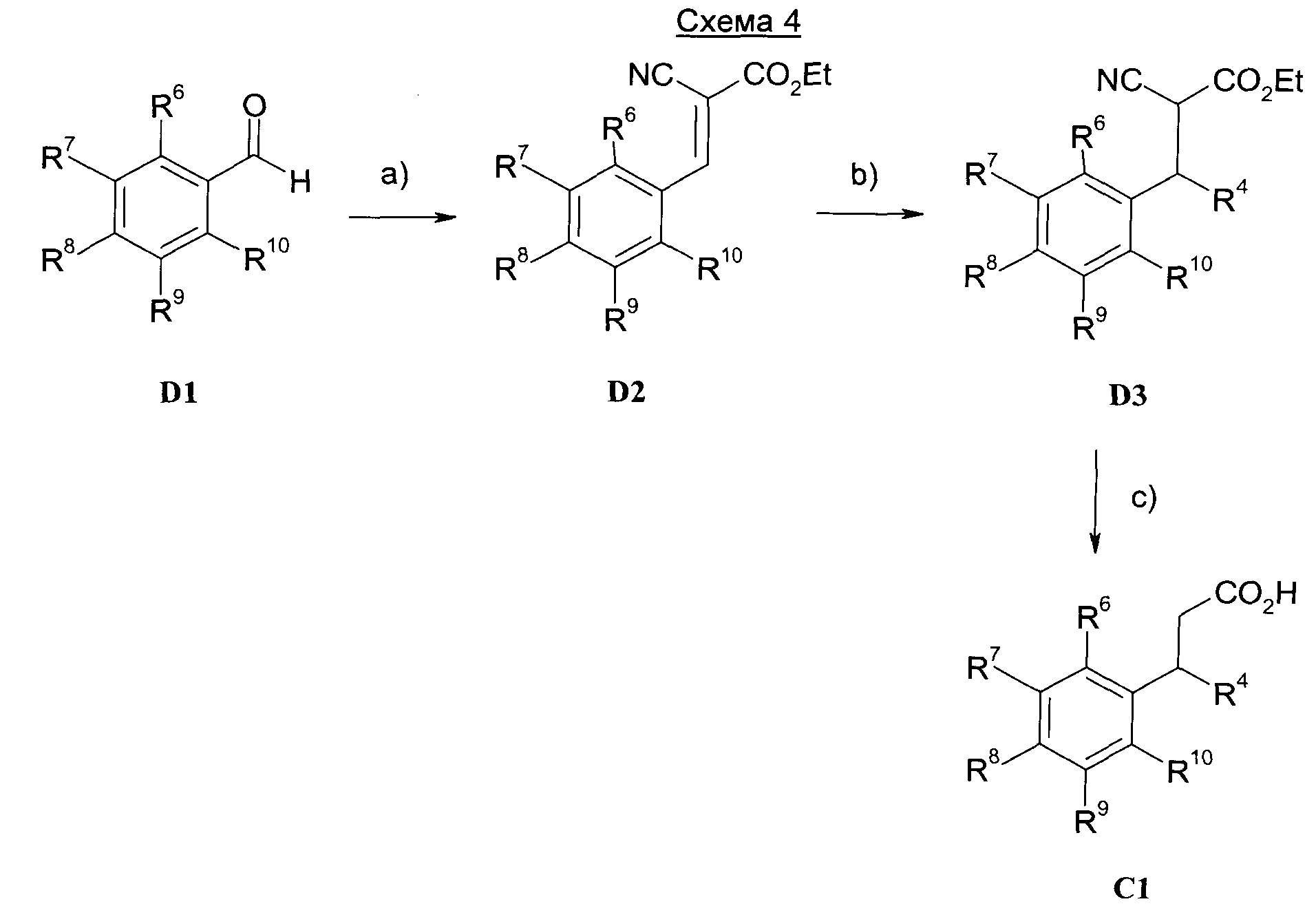
Исходное вещество C1 (R2R3=H) для синтеза, описанного на Схеме 3 может быть получено в соответствии со Схемой 4. Альдегид D1 конденсируют с этилцианоацетатом в присутствии основания, такого как пиперидин при повышенной температуре или в присутствии гидроксида натрия или калия в растворителе, таком как этанол с получением альфа,бета-ненасыщенных производных D2. 1,4-добавление R4-магний галида к соединению D2 в растворителе, таком как толуол или ТГФ при температуре между 0°C и температурой кипения растворителя приводит к этил-2-циано-пропаноату D3. гидролиз и декарбоксилирование в кислой среде в уксусной кислоте в присутствии H2SO4 при повышенной температуре приводит к получению кислоты C1 (R2R3=H).
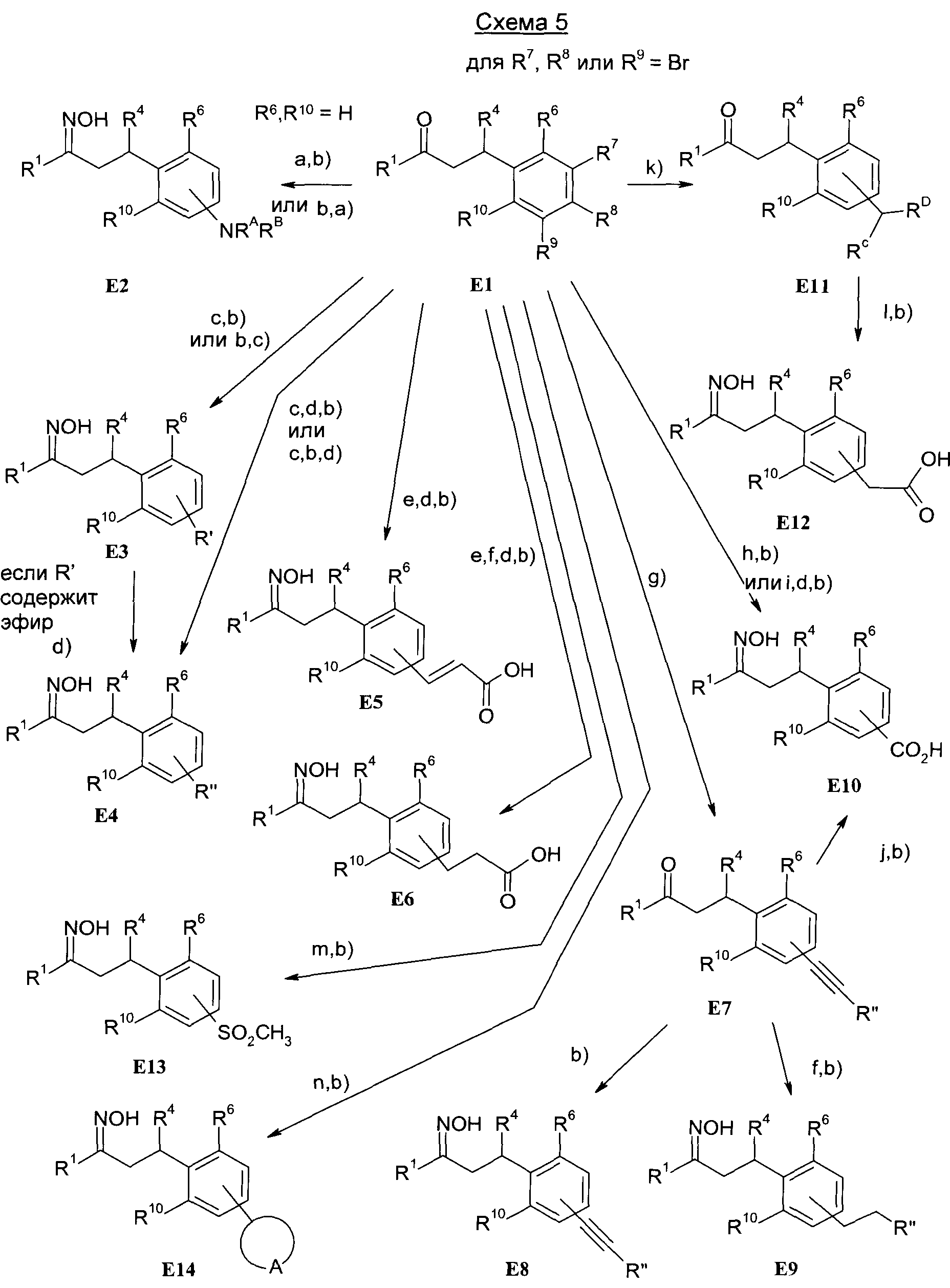
Дальнейшие модификации заместителей R7, R8 или R9 по арилу могут быть проведены в соответствии со способами синтеза, описанными на схеме 5. Для введения аминогруппы могут быть использованы условия реакции Бухвальда-Хартвига. Таким образом бромокетон E1 (R7, R8 или R9=Br) взаимодействует с первичным или вторичным амином в присутствии катализатора, такого как трис(дибензилиден-ацетон)дипалладий(0), и лиганда, такого как 2-(ди-трет-бутилфосфино)бифенил или 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил в толуоле в присутствии основания, такого как трет-бутилат натрия (стадия а). Это промежуточное соединение таким образом ковертируют в соединения E2 с использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия, в растворителе, таком как этанол или метанол, при комнатной температуре, нагревая до 200°C, возможно под микроволновым излучением (стадия b). Альтернативно, последовательность двух стадий реакции может быть обратной.
Реакция сопряжения Сузуки бромокетона E1 (R7, R8 или R9=Br) и подходяще замещенного арила или гетероарила R'- бороновой кислоты или эфира R'- бороновой кислоты, такого как, например метиловые эфиры бороновой кислоты, этиленгликолевые эфиры бороновой кислоты или пинаколиновые эфиры бороновой кислоты, в присутствии подходящего катализатора, предпочтительно палладиевого катализатора, такого как дихлоро[1,1'-бис(дифенилфосфино)-ферроцен]палладия(II) дихлорметановый аддукт или тетракис(трифенилфосфин)палладий(0) и основания, предпочтительно карбоната натрия, гидрокарбоната натрия, фторида калия, карбоната калия или триэтиламина в растворителях, таких как диоксан, вода, толуол, N,N-диметилформамид или их смеси могут использоваться для введения подходящих арильных и гетероарильных остатков. Альтернативно, в катализируемом палладием кросс-сочетании могут использоваться органотрифторбораты, такие как R'BF3K, в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0), палладия(II)ацетат или дихлоро[1,1'-бис(дифенилфосфино)ферроцен]палладия(II) дихлорметановый аддукт в присутствии карбоната цезия или фосфата калия в растворителях, таких как толуол, ТГФ, диоксан, вода или их смеси при повышенных температурах. Это промежуточное соединение, таким образом, ковертируют в соединения E3 с использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия, в растворителе, таком как этанол или метанол, при комнатной температуре, нагревая до 200°C, возможно под микроволновым излучением (стадия b).
Если R' содержит эфирную группу, она может быть гидролизована в соответствии со стандартными процедурами, например, посредством обработки гидроксидами щелочных металлов, таких как LiOH или NaOH, в смеси полярных растворителей, такой как тетрагидрофуран/этанол/вода, или, для трет-бутиловых эфиров, посредством обработки, например, трифторуксусной кислотой, возможно в присутствии анизола в растворителе, таком как дихлорметан или дихлорэтан между 0°C и температурой кипения растворителей (стадия d). Эти кислоты в дальнейшем могут быть трансформированы в амиды посредством обработки подходящими аминами или эфирами аминокислот в присутствии связующего реагента, такого как N-(3-диметиламинопропил)-N'-этил-карбодиимид-гидрохлорид (EDCI), 2-(бензотриазол-1-ил)-N,N,N',N'-тетраметил-уроний гексафторфосфат (HBTU), O-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N,N-тетраметил-уроний тетрафторборат (TPTU), O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат (HATU) или бензотриазол-1-илокситрис(диметиламино)-фосфоний гексафторфосфат (BOP) и основания, такого как этил-диизопропил-амин, триэтиламин, N-метилморфолин, возможно в присутствии 4-диметиламино-пиридина или 1-гидроксибензо-триазола (HOBt), в растворителе, таком как дихлорметан, диметилформамид, диметилацетамид или диоксан, при температуре между 0°C и комнатной температурой. Альтернативно, последовательность реакционных стадий для получения E4 может быть обратной.
Дополнительная модификация бромокетона E1 (R7, R8 или R9=Br) также возможна с помощью реакции Хека с алкилакрилатом в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0) или палладия(II)ацетат в присутствии основания, такого как триэтиламин, карбонат калия или гидрокарбонат натрия в растворителях, таких как диметилформамид, диметилацетамид, ацетонитрил, толуол или диоксан (стадия e). Это промежуточное соединение таким образом ковертируют за две стадии в соединения E5 посредством гидролиза эфира, в стандартных условиях с использованием гидроксидов щелочных металлов, таких как LiOH или NaOH, в смеси полярных растворителей, такой как тетрагидрофуран/этанол/вода с последующим образованием оксима с использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия, в растворителе, таком как этанол или метанол, при комнатной температуре с повышением до кипения с обратным холодильником (стадии d, b). Соответствующее насыщенное производное E6 может быть получено из продукта реакции Хека с помощью гидрогенизирования, используя стандартные условия, такие как Pd/C в растворителе, таком как этанол, метанол или этилацетат до проведения гидролиза эфира и образования оксима (стадии f, d, b). Альтернативно, последовательность реакционных стадий может быть обратной.
Реакция Соногаширы арилбромида E1 с подходящими алкинами ТГФ в присутствии основания, такого как триэтиламин или пиперидин, с каталитическим количеством, например, Pd(PPh3)4/Cul или Pd(OAc)2/Cul или PdCl2(PPh3)2/Cul при от 45°C до 80°C приводит к получению алкинов E7. Для синтеза соединений E7 с R''=H, может быть необходимо проведение этой реакции с алкинами, содержащими подходящую защитную группу, например, триметилсилил или триизопропилсилил, с последующим отщеплением этой защитной группы с использванием способов и реагентов, известных из уровня техники, например, карбонат калия в метаноле при комнатной температуре, в случае, когда R'' представляет собой триметилсилил (стадия g). Это промежуточное соединение E7 приводит к получению оксима E8 после обработки гидроксиламина гидрохлоридом в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия, в растворителе, таком как этанол или метанол, при комнатной температуре с повышением до кипения с обратным холодильником (стадия b). гидрогенизация аклинов E7 с использованием стандарных условий, таких как Pd/C в растворителе, таком как этанол, метанол или этилацетат приводит к получению соответствующих алканов с последующей конверсией в оксимы посредством обработки гидроксиламина гидрохлоридом в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия, в растворителе, таком как этанол или метанол, при комнатной температуре с повышением до кипения с обратным холодильником дает соединения E9 (стадии f, b). Промежуточные соединения алкинов, полученные после стадии g могут быть конвертированы в соответствующие N(1)-замещенные [1,2,3]-триазоловые производные. Предпочтительно, такие превращения проводятся в реакторе непрерывного действия, как описано в экспериментальном разделе, в присутствии азида натрия и алкилбромида или йодида. Это превращение приводит к образованию оксима (стадия b), как описано выше.
Получение кислотного производного Е10 может быть проведено из арилбромида E1 посредством катализируемого палладием гидроксикарбонилирования с последующим образованием оксима (стадии h, b) или посредством катализируемого палладием меткосикарбонилирования, гидролиза эфира и образования оксима (стадии i, d, b). Для гидроксикарбонилирования арилбромид E1 может быть обработан формиатом лития в качестве источника моксида углерода в присутствии палладиевого катализатора, такого как палладия(II) ацетат и лиганда, такого как 1,1'-бис(дифенилфосфино) ферроцен (dppf) в присутствии уксусного ангидрида и основания, такого как N,N-диизопропилэтиламин в растворителе, таком как ДМФ (например Berger, Р.; Bessmernykh, A.; Caille, J.-C.; Mignonac, S. Synthesis 2006, 3106-3110). Для метксикарбонилирования арилбромид E1 взаимодействует с моноксидом углерода и метанолом в этилацетате в присутствии а палладиевого катализатора, такого как дихлоро[1,1'-бис(дифенилфосфино)-ферроцен]палладия(II) в присутствии основания, такого как триэтиламин. Затем проводят гиролиз эфира в соответствии с обычными методами, например, посредством обработки гидроксидами щелочных металлов, таких как LiOH или NaOH в смеси полярных растворителей, такой как тетрагидрофуран/этанол/вода. Промежуточные соединения, полученные любым из указанных способов, затем превращают в оксимы с использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия в растворителе, таком как этанол или метанол, при комнатной температуре с повышением до кипения с обратным холодильником.
Альтернативно, производные кислоты E10 могут быть получены из промежуточного соединения E7 (при R''=CH2OH) посредством катализируемого тетроксидом рутения окисления с использованием RuCl3, NaIO4 в смеси растворителей CH3CN, воды и CCl4 (стадия j) с последующим образованием оксимов с использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия, в растворителе, таком как этанол или метанол, при комнатной температуре, нагревая до 200°C, возможно под микроволновым излучением (стадия b).
Карбоксигруппа в синтетических промежуточных соединениях, полученных после стадий h, (i, d), или (g, j) может быть дополнена до ароматических гетероциклов с использованием способов и реагентов, описанных в уровне техники. Например, [1,3,4]-оксадиазолы могут быть получены реакцией промежуточного соединения карбоновой кислоты и ацилгидразида в присутствии O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата и диизопропилэтиламина в N,N-диметилформамиде при температуре между 20°C и 150°C, с последующей катализируемой кислотой дегидроциклизацией при температуре между 60°C и 150°C, возможно под микроволновым излучением. Синтез гетероциклов сопровождается образованием оксимов (стадия b) как описано выше.
Получение производных кислоты E11 осуществляется из кетона E1 посредством катализируемого палладием кросс-сочетания с алкилцианоацетатом (RC=CN, RD=COOMe или COOEt) или диалкилмалонатом (RC=RD=COOMe или COOEt) в присутствии а палладиевого катализатора, такого как дихлоро[1,1'-бис(дифенилфосфино)-ферроцен]палладия(II) дихлорметановый аддукт или тетракис(трифенилфосфин)палладия(0) или палладия(II)ацетата, в присутствии лиганда, такого как 1,1'-бис(дифенилфосфино) ферроцен (dppf), и основания, такого как рет-бутилат калия в растворителях, таких как диоксан, вода, толуол, N,N-диметилформамид или их смеси (стадия к), гидролиз и декарбоксилирование E11 в кислотных условиях в уксусной кислоте в присутствии H2SO4 при повышенной температуре, с последующим образованием оксимов с использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия, в растворителе, таком как этанол или метанол, при комнатной температуре с повышением до кипения с обратным холодильником приводит к получению кислоты E12 (стадии I, b).
Получение метилсульфонового производного E13 осуществляют из кетона E1 посредством реакции из метансульфината в присутствии йодида меди (I), гидроксида натрия и пролина, в растворителе, таком как диметилсульфоксид, при температуре между 60°C и 150°C, с последующим образованием оксимов, как описано выше (стадии m, b).
Гетероциклические производные формулы E14 (А представляет собой гетероатом, такой как кислород, азот или сера, в частности N-трет-бутоксикарбонил) могут быть получены из кетона E1 посредством катализируемого палладием/медью кросс-сочетания с галидом гетероцклилцинка (II), предпочтительно йодидом гетероциклилцинка (II), как описано в уровне техники (например, Corley и соавт., J. Org. Chem. 2004, 69, 5120). Эта реакция осуществляется в присутствии подходящей системы катализаторов, например, [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) дихлорметановый аддукт и йодид меди (I), в растворителе, таком как N,N-диметилацетамид, при температуре между 60°C и 100°C (стадия n), с последующим образованием оксимов, как описано выше (стадия b). Галиды гетероциклилцинка (II) могут быть получены из соответствующих гетероцклилгалидов, как описано в экспериментальном разделе. В случае, когда A представляет собой N-трет-бутоксикарбонил, защитная группа может быть отщеплена, используя способы, известные в уровне техники (например, соляная кислота в 1,4-диоксане или трифторуксусная кислота в дихлорметане при температуре между 0°C и 30°C) и получившийся вторичный амин может быть превращен в соответствующий амид, сульфонамид или сульфамид, используя реагенты и условия, описанные в экспериментальном разделе.
Реакции кросс-сочетания, начинающиеся с арилбромида E1, описанные на схеме 5, в особенности стадии b, g, и n, также могут быть выполнены для предшественников E1, например, амидов Вейнреба C2a (R7, R8, или R9=Br или I) или альдегидов D1 (R7, R8, или R9=Br, I или Cl).
Если необходимо или желательно, соотношение E и Z изомеров может быть изменено обработкой выделенного оксима кислотой, такой как соляная кислота, в растворителе, таком как этанол, DME и диоксан или в их смеси, при температуре между комнатной температурой и температурой кипения растворителя. Разделение E и Z изомеров может быть осуществлено как хроматографией на колонках, так и посредством ВЭЖХ. Соединения общей формулы I, кроме того, могут содержать один или более стереоцентров и необязательно могут быть разделены на оптически чистые энантиомеры или диастереомеры с помощью способов, хорошо известных в уровне техники, например, с помощью ВЭЖХ хроматографии, хроматографии на хиральных ВЭЖХ колонках или хроматографией с хиральным элюентом. Рацемические соединения, несущие карбоксилатную или тетразоловую группу также могут быть разделены на свои антиподы, например, через диастереомерные соли посредством кристаллизации с оптически чистыми аминами, соединения, несущие остаток амина также могут быть разделены на свои антиподы, например, через диастереомерные соли посредством кристаллизации с оптически чистыми кислотами. Это хиральное разделение может проводиться как на стадии конечного продукта формулы I, так и на стадии хирального промежуточных соединений.
Если R1 представляет собой пиридиновый остаток, он дополнительно может быть трансформирован в соответствующий пиридин-N-оксиды посредством окисления с использованием m-хлорпербензойной кислоты в растворителе, таком как CH2Cl2, MeOH или их смеси, при комнатной температуре. Для получения соединений, в которых R1 представляет собой пиридин-4-он или пиридин-3-он, они могут быть получены из соответствующих 2-метокси-пиридиновых производных посредством отщепления метоксигруппы с помощью обработки соляной кислотой в диоксане при повышенной температуре или обрабоки трехбромистым бором в дихлорметане при от -78°C до 0°C. Дальнейшее N-алкилирование пиридинона можно провести с помощью обработки алкилгалидами в растворителе, таком как ДМА, ацетон или ТГФ, в присутствии основания, такого как карбонат калия.
Если R1 несет метоксигруппу, она может быть расщеплена в соответствующий фенол обработкой трибромидом бора в дихлорметане при от -78°C до 0°C.
Другой синтез соединений формулы Id, в которых R2 представляет собой Ph-R'' с R''=H или C1-7-алкил изображен на схеме 6. Синтез начинается с кислоты F1, которая может быть конвертирована в амид Вейнреба F2a (R'=NMeOMe) или в ангидрид F2b (R'=Cl). Для конверсии в амид Вейнреба F2a кислоту F1 обрабатывают N,O-диметилгидроксиламина гидрохлоридом в присутствии связующего реагента, такого как N-(3-диметиламинопропил)-N'-этил-карбодиимид-гидрохлорид (EDCI), 2-(бензотриазол-1-ил)-N,N,N',N'-тетраметил-уроний гексафторфосфат (HBTU), O-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N,N-тетраметил-уроний тетрафторборат (TPTU), O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат (HATU) или бензотриазол-1-илокситрис(диметиламино)фосфоний гексафторфосфат (ВОР), и основания, такого как этил-диизопропил-амин, триэтиламин, N-метилморфолин, возможно в присутствии 4-диметиламино-пиридина или 1-гидроксибензо-триазола (HOBt), в растворителе, таком как дихлорметан, диметилформамид, диметилацетамид или диоксан при температуре между 0°C и комнатной температурой. Обработка амида Вейнреба F2a органолитиевым соединением R2CH2Li или органомагниевым соединением R2CH2MgX (X=Cl, Br, I) приводит к получению промежуточного соединения кетона F3 (стадия b).
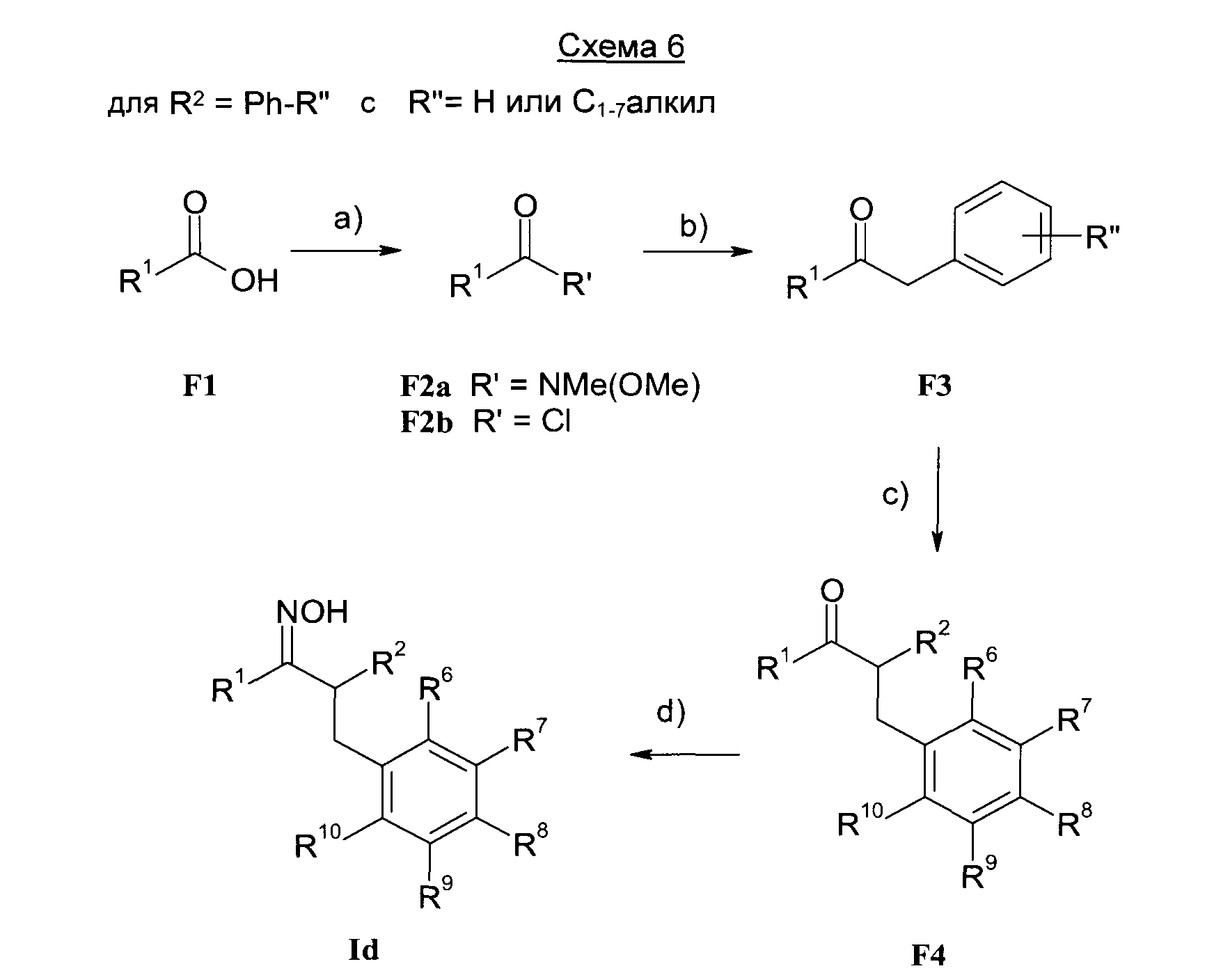
Альтернативно, кислота F1 может быть конвертирована в ангидрид F2b посредством обработки оксалилхлоридом в CH2Cl2 в присутствии следоваго количества ДМФ при комнатной температуре или посредством обработки SOCl2 (стадия a). Реакция Негиши может быть использована для получения кетона F3. Таким образом хлорид кислоты F2b обрабатывабт цинковым порошком и подходящим палладиевым катализатором, таким как тетракис(трифенилфосфин)палладия(0), с последующим добавлением подходящего бензилгалида R2CH2X (X=Cl, Br, I) в растворителях, таких как толуол, ТГФ, DMA при температуре между -78°C и комнатной температурой (стадия b).
Алкилирование F3 подходящим бензилгалидом R6R7R8R9R10PhCH2Br (X=Cl, Br, I) в присутствии основания, такого как n-BuLi, LDA, трет-BuOK, NaH, LiHMDS при температуре в диапазоне от -78 до 100°C в растворителе, таком как ДМФ, ТГФ или CH2Cl2 приводит к получению кетона F4 (стадия c).
Превращение кетона F4 в соединения формулы Id достигается использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия, в растворителе, таком как этанол или метанол, при комнатной температуре с повышением до кипения с обратным холодильником (стадия d). Если необходимо или желательно соотношение E и Z изомеров может быть изменено обработкой выделенного оксима кислотой, такой как соляная кислота, в растворителе, таком как этанол, DME и диоксан или в их смеси, при температуре между комнатной температурой и температурой кипения растворителя. Разделение E и Z изомеров может быть осуществлено как хроматографией на колонках, так и посредством ВЭЖХ. Соединения общей формулы Id, кроме того, могут содержать один или более стереоцентров и необязательно могут быть разделены на оптически чистые энантиомеры или диастереомеры с помощью способов, хорошо известных в уровне техники, например, с помощью ВЭЖХ хроматографии, хроматографии на хиральных ВЭЖХ колонках или хроматографией с хиральным элюентом. Рацемические соединения, несущие карбоксилатную или тетразоловую группу также могут быть разделены на свои антиподы, например, через диастереомерные соли посредством кристаллизации с оптически чистыми аминами, соединения, несущие остаток амина также могут быть разделены на свои антиподы, например, через диастереомерные соли посредством кристаллизации с оптически чистыми кислотами. Это хиральное разделение может проводиться как на стадии конечного продукта формулы Id, так и на стадии хирального промежуточного соединения F4.
Если R1 представляет собой пиридиновый остаток, он дополнительно может быть трансформирован в соответствующий пиридин-N-оксид посредством окисления с использованием m-хлорпербензойной кислоты в растворителе, таком как CH2Cl2, MeOH или их смеси, при комнатной температуре. Для получения соединений, в которых R1 представляет собой пиридин-4-он или пиридин-3-он, они могут быть получены из соответствующих 2-метокси-пиридиновых производных посредством отщепления метоксигруппы с помощью обработки соляной кислотой в диоксане при повышенной температуре или обрабоки трехбромистым бором в дихлорметане при от -78°C до 0°C. Дальнейшее N-алкилирование пиридинона можно провести с помощью обработки алкилгалидами в растворителе, таком как ДМА, ацетон или ТГФ, в присутствии основания, такого как карбонат калия. Если R1 несет метоксигруппу, она может быть расщеплена в соответствующий фенол обработкой трибромидом бора в дихлорметане при от -78°C до 0°C.
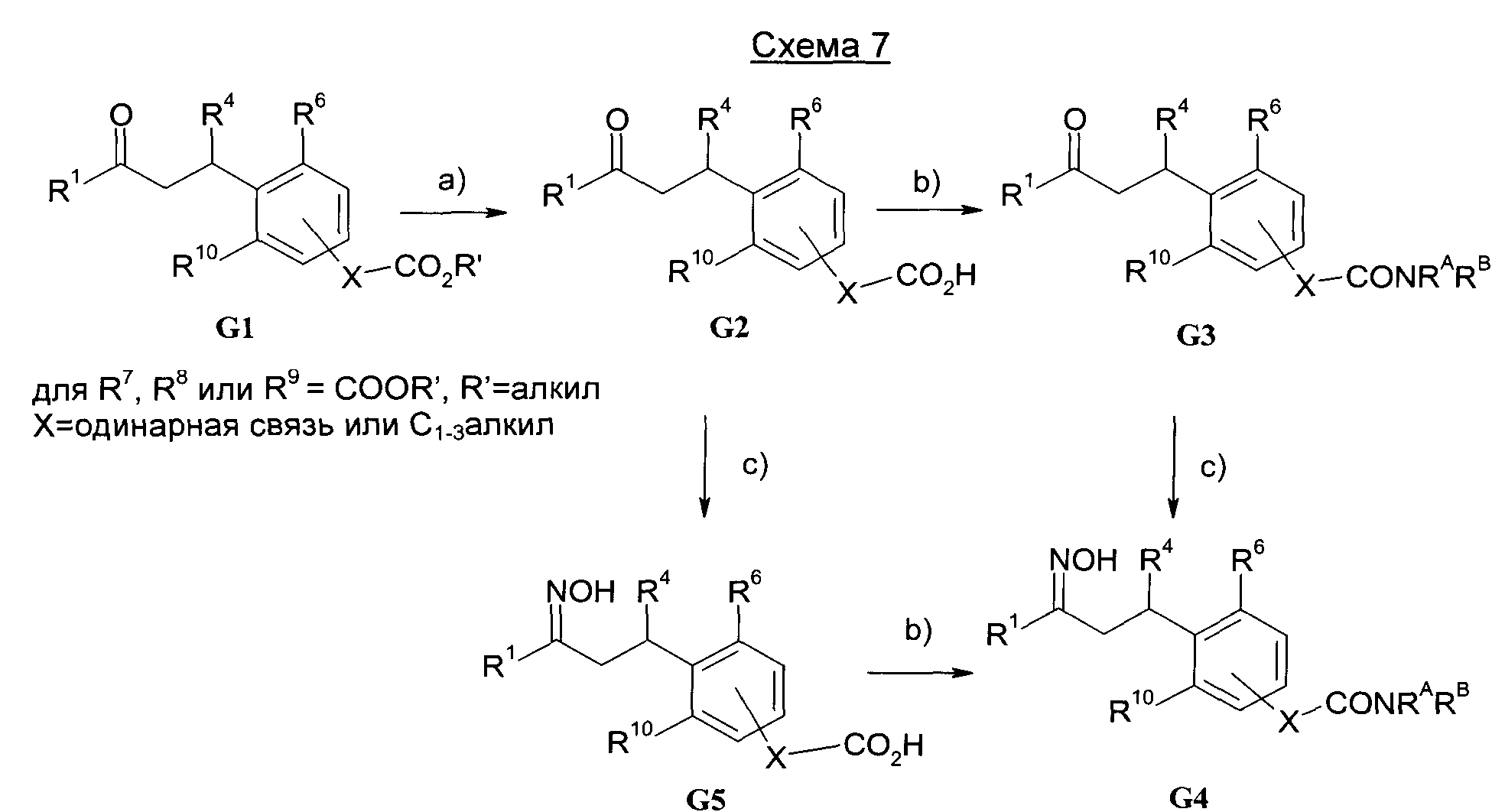
Получение соединений формулы (I), содержащих амидные заместители R7, R8 или R9 на ариле может быть достигнуто синтезами, описанными на схеме 7. Эфирные остатки соединений G1 (R7, R8 или R9=COOR', R' представляет собой алкил, предпочтительно метил, этил или трет-бутил) гидролизуют с использованием стандартных условий, например, посредством обработки гидроксидами щелочных металлов, таких как LiOH или NaOH, в смеси полярных растворителей, такой как тетрагидрофуран/этанол/вода, или, для трет-бутиловых эфиров, посредством обработки, например, трифторуксусной кислотой, возможно в присутствии анизола, в растворителе, таком как дихлорметан или дихлорэтан, между комнатной температурой и температурой кипения растворителя с получением соединений G2 (стадия a). Эти кислоты в дальнейшем могут быть трансформированы в амиды G3 посредством обработки подходящим амином или эфиром аминокислоты в присутствии связующего реагента, такого как N-(3-диметиламинопропил)-N'-этил-карбодиимид-гидрохлорид (EDCI), 2-(бензотриазол-1-ил)-N,N,N',N'-тетраметил-уроний гексафторфосфат (HBTU), O-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N,N-тетраметил-уроний тетрафторборат (TPTU), O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат (HATU) или бензотриазол-1-илокситрис(диметиламино)фосфоний гексафторфосфат (BOP) и основания, такого как этил-диизопропил-амин, триэтиламин, N-метилморфолин, возможно в присутствии 4-диметиламино-пиридина или 1-гидроксибензо-триазола (HOBt), в растворителе, таком как дихлорметан, диметилформамид, диметилацетамид или диоксан, при температуре между 0°C и комнатной температурой (стадия b). Если G3 содержит эфирную группу, оно может быть превращено в кислоту, как описано на стадии a. Превращение кетона G3 в соединения формулы G4 или G5 достигается использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия, в растворителе, таком как этанол или метанол, при комнатной температуре с повышением до кипения с обратным холодильником (стадия c). Если необходимо или желательно, соотношение E и Z изомеров может быть изменено обработкой выделенного оксима кислотой, такой как соляная кислота, в растворителе, таком как этанол, DME и диоксан или в их смеси, при температуре между комнатной температурой и температурой кипения растворителя. Разделение E и Z изомеров может быть осуществлено как хроматографией на колонках, так и посредством ВЭЖХ. Альтернативно, последовательность реакционных стадий для получения G4 может быть обратной.
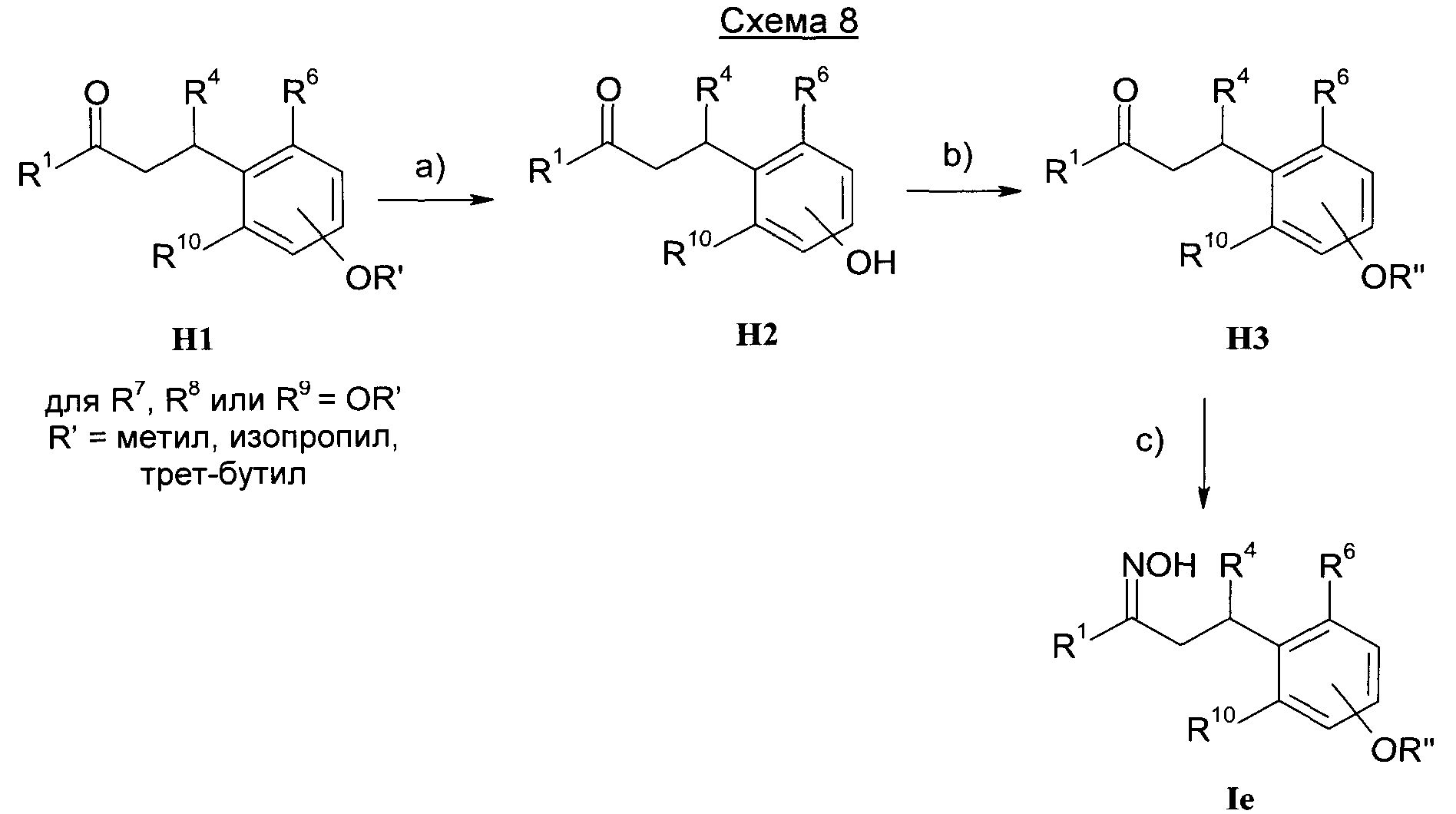
Получение соединений формулы (I), содержащих OR'' заместители R7, R8 или R9 по арилу может быть осуществлено синтезами, описанными на схеме 8. Если арильное кольцо промежуточного соединения H1 содержит защищенный фенольный остаток (R7, R8 или R9=OR', R' предпочтительно представляет собой метил, изипропил или трет-бутил) оно может быть превращено в свободный фенол H2 как посредством обработки сильными минеральными кислотами, такими как HBr, HCl или аналогичными, при повышенной температурез в диапазоне от 20 до 150°C или альтернативно в более мягких условиях с использованием, например, BBr3 или BCl3 в апротонных растворителях, таких как дихлорметан, ТГФ или аналогичные, при температурах в диапазоне от -50 до 50°C (стадия a). Свободный фенол H2 сам по себе является подходящим для различных реакций связывания (стадия b): С одной стороны, он может быть использован, например, для катализируемого медью (II) связывания с подходящими замещенными бороновыми кислотами (или соответствующими пинаколиновыми эфирами) в присутствии пиридина, DMAP или триэтиламина или аналогичных, в апротонных растворителях, таких как дихлорметан, ацетонитрил илианалогичные, с получением диарилэфиров H3. С другой стороны, различные гетероарилфенилэфиры H3 могут быть получены, например посредством обработки фенола H2 подходящим замещенным хлорпиридином, хлорпиразином или хлорпиримидином в присутствии основания, такого как DABCO, триэтиламин, диизопропиламин, NaH или трет-BuOK в подходящем растворителе, таком как ДМФ, ТГФ или аналогичном при 0°C с повышением температуры до температуры кипения растворителя. Другой возможностью для синтеза диариловых эфиров формулы H3 является взаимодействие фенолов H2 с подходящим арилгалидом, предпочтительно арилфторидом, используя подходящее основание, такое как карбонат цезия, гидрид натрия, карбонат калия или аналогичного в подходящем ратворителе, таком как ДМФ, DMSO, DMA или аналогичном при различных температурах, предпочтительно в диапазоне от комнатной температуры до температуры кипения растворителя. Другим способом получения соединений H3 является алкилирование фенолов H2 посредством обработки основанием, таким как гидрид натрия, трет-бутилат калия, карбонат калия, карбонат серебра или аналогичным, с последующей обработкой алкилирующим агентом, таким как, например, замещенный алкил или арилалкилгалид или трифлат в подходящих растворителях, таких как ТГФ, ДМФ или аналогичных при различных температурах. Еще одним способом синтеза соединений H3 является реакция Мицунобу фенолов H2 с подходящим замещенным спиртом в присутствии диалкилазодикарбоксилатов и трифенилфосфина в растворителе, таком как ТГФ или диоксан. Если H3 содержит эфирную группу, оно может быть конвертировано в кислоту, как описано на схеме 7 (стадия a). Превращение кетона H3 в соединения формулы Ie достигается использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия, в растворителе, таком как этанол или метанол, при комнатной температуре с повышением до кипения с обратным холодильником (стадия c). Если необходимо или желательно, соотношение E и Z изомеров может быть изменено обработкой выделенного оксима кислотой, такой как соляная кислота, в растворителе, таком как этанол, DME и диоксан или в их смеси, при температуре между комнатной температурой и температурой кипения растворителя. Разделение E и Z изомеров может быть осуществлено как хроматографией на колонках, так и посредством ВЭЖХ.
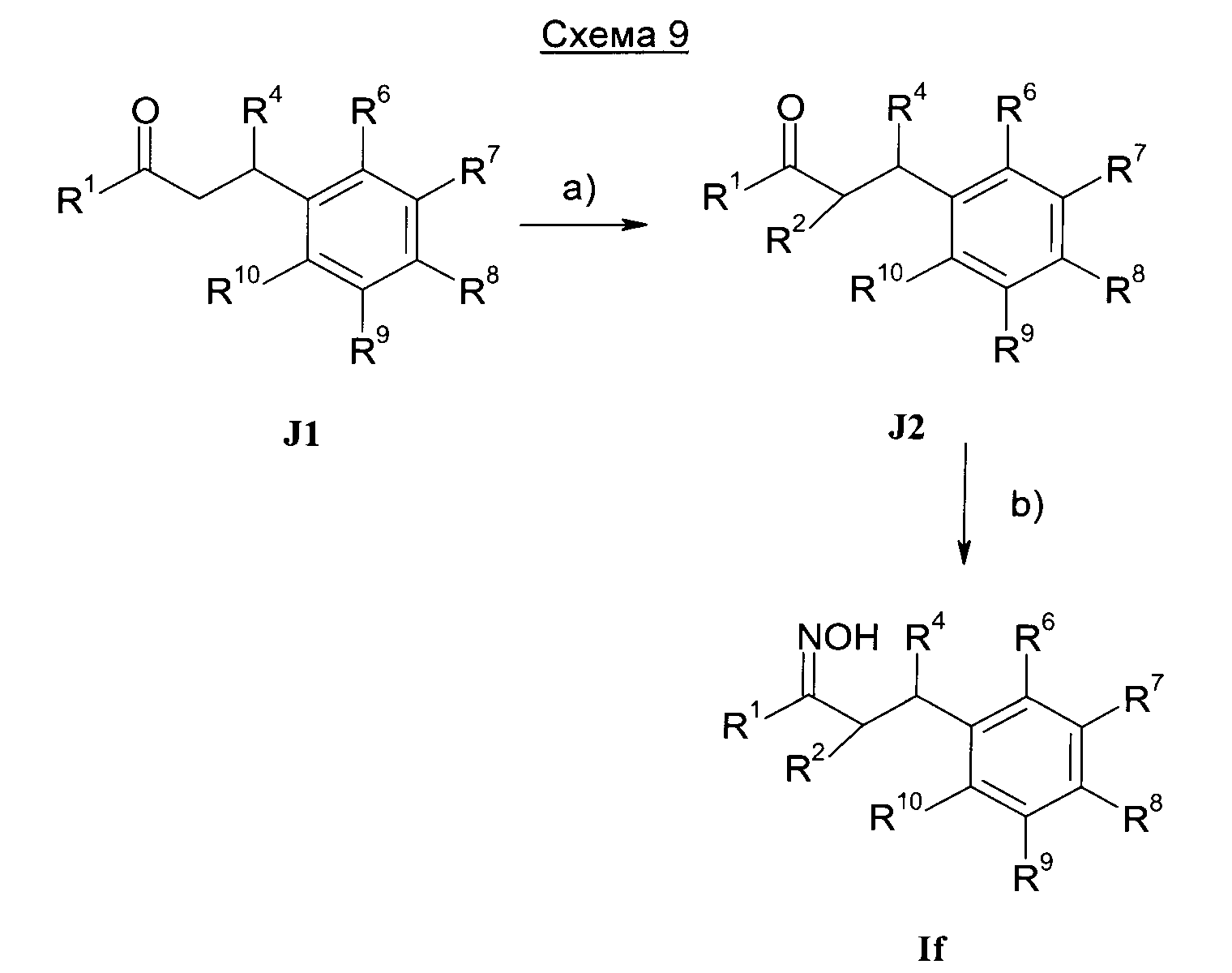
Получение соединений формулы If, содержащих алкильные заместители R2 может быть достигнуто синтезами, описанными на схеме 9. Алкилирование J1 подходящим алкилгалидом R2X (X=Cl, Br, I) или алкилтрифлатом в присутствии основания, такого как n-BuLi, LDA, трет-BuOK, NaH, LiHMDS при температурах в диапазоне от -78 до 100°C в растворителе, таком как ДМФ, DMA или ТГФ, приводит к получению кетона J2 (стадия a). Превращение кетона J2 в соединения формулы If достигается использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия, в растворителе, таком как этанол или метанол при комнатной температуре с повышением до кипения с обратным холодильником (стадия b). Если необходимо или желательно, соотношение E и Z изомеров может быть изменено обработкой выделенного оксима кислотой, такой как соляная кислота, в растворителе, таком как этанол, DME и диоксан или в их смеси, при температуре между комнатной температурой и температурой кипения растворителя. Разделение E и Z изомеров может быть осуществлено как хроматографией на колонках, так и посредством ВЭЖХ.
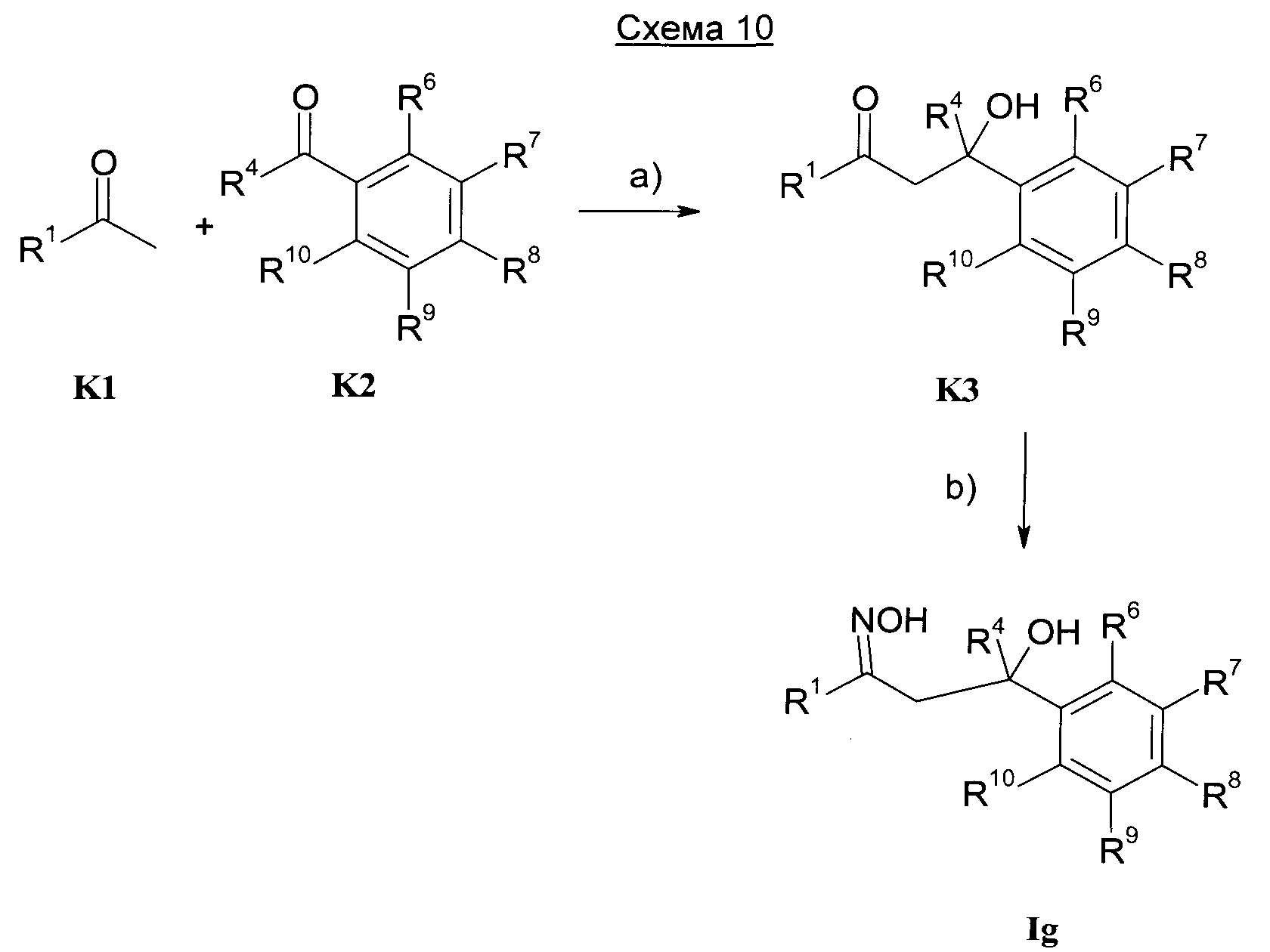
Получение соединений формулы Ig, содержащих ОН заместители R5 можно осуществить синтезами, описанными на схеме 10. Обработка кетона K1 основанием, таким как NaH или LDA в растворителе, таком как ДМФ, DMA или ТГФ при температурах от -78°C до комнатной температуры с последующей обработкой кетоном K2 приводит к получению гидрокси-кетонов K3 (стадия a). Превращение кетона K3 в соединения формулы Ig достигается использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия, в растворителе, таком как этанол или метанол, при комнатной температуре с повышением до кипения с обратным холодильником (стадия b). Разделение E и Z изомеров может быть осуществлено как хроматографией на колонках, так и посредством ВЭЖХ.
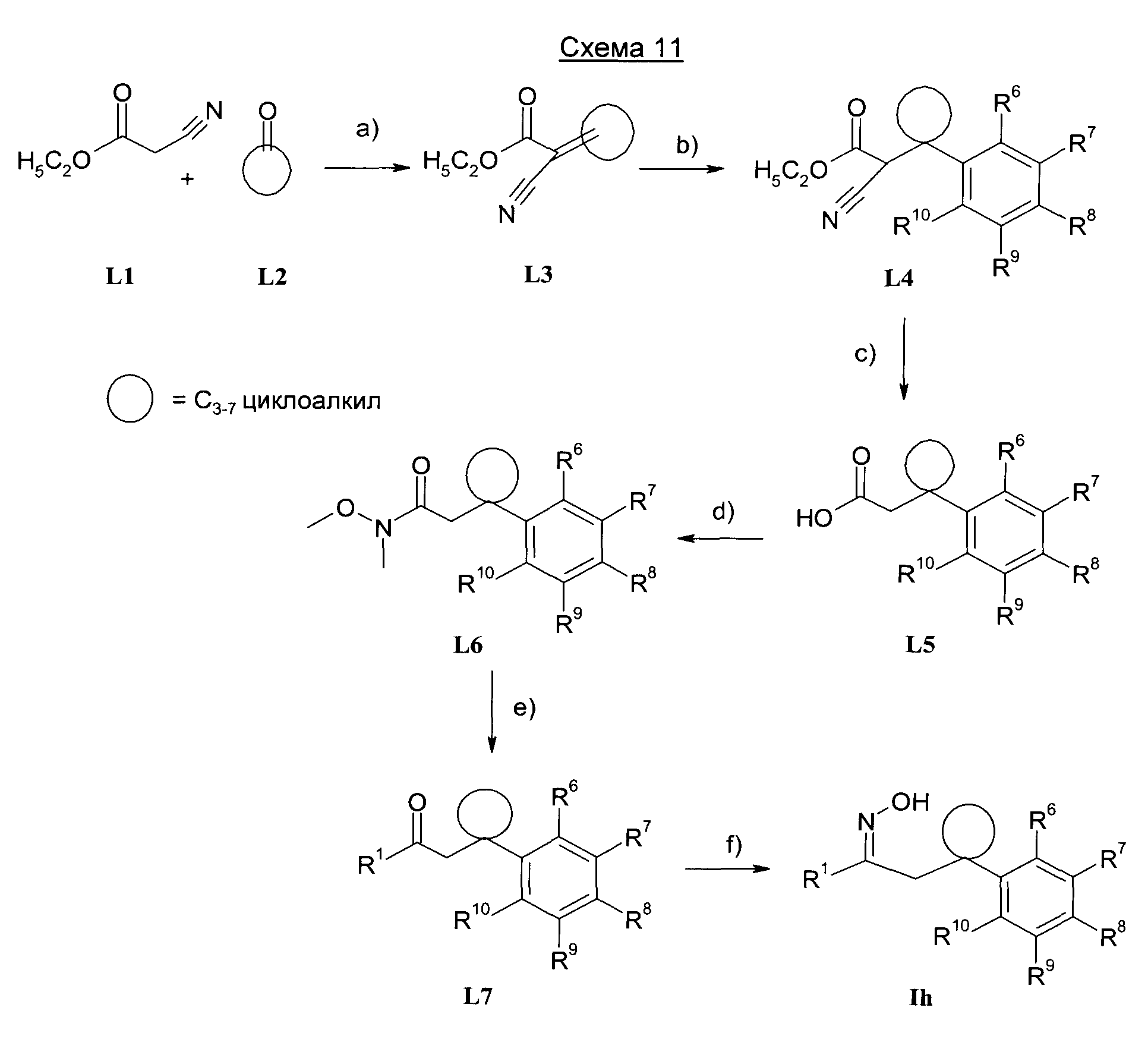
Получение соединений формулы Ih, соедржащих заместители R4 и R5, которые образуют С3-7-циклоалкильное кольцо вместе с атомом, к которому они присоединены, можно осуществить синтезами, описанными на схеме 11. Циклический кетон L2 конденсируют с этилцианоацетатом L1 в присутствии основания, такого как фторид цезия, гидроксид натрия или калия, при повышенной температуре в растворителе, таком как этанол с получением альфа, бета-ненасыщенных производных L3 (стадия a). 1,4-присоелинение галида арилмагния к соединению L3 в растворителе, таком как толуол или ТГФ, при температуре между 0°C и температурой кипения растворителя приводит к получению этил 2-циано-пропаноата L4 (стадия b). Гидролиз и декарбоксилирование приводящие к образованию кислоты L5, могут быть проведены в щелочной среде, например, посредством обработки KOH в смеси растворителей, такой как этиленгликоль/вода при повышенной температуре (стадия c). Кислоту L5 конвертируют в соответствующий амид Вейнреба L6 посредством обработки N,O-диметилгидроксиламина гидрохлоридом в присутствии связующего реагента, такого как N-(3-диметиламинопропил)-N'-этил-карбодиимид-гидрохлорид (EDCI), 2-(бензотриазол-1-ил)-N,N,N',N'-тетраметил-уроний гексафторфосфат (HBTU), O-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N,N-тетраметил-уроний тетрафторборат (TPTU), O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат (HATU) или бензотриазол-1-илокситрис(диметил-амино)фосфоний гексафторфосфат (BOP), и основания, такого как этил-диизопропил-амин, триэтиламин, N-метилморфолин, возможно в присутствии 4-диметиламино-пиридина или 1-гидроксибензо-триазола (HOBt), в растворителе, таком как дихлорметан, диметилформамид, диметилацетамид или диоксан, при температуре между 0°C и комнатной температурой (стадия d). Обработка амида Вейнреба L6 органолитиевым соединением R1Li или органомагниевым соединением R1MgX (X=Cl, Br, I) приводит к получению промежуточного соединения кетона L7 (стадия е). Если органолитиевое R1Li или органомагниевое соединения R1MgX не являются коммерчески доступными, они могут быть получены in situ из соответствующих R1-Х посредством обработки n-BuLi или i-PrMgCl или i-PrMgCl LiCl при -100°C до 0°C в растворителе, таком как ТГФ. Превращение кетона L7 в соединения формулы Ih достигается использованием гидроксиламина гидрохлорида в присутствии основания, такого как гидроксид натрия, гидрокарбонат натрия или ацетат натрия, в растворителе, таком как этанол или метанол, при комнатной температуре с повышением до кипения с обратным холодильником (стадия f). Если необходимо или желательно, соотношение Е и Z изомеров может быть изменено обработкой выделенного оксима кислотой, такой как соляная кислота, в растворителе, таком как этанол, DME и диоксан или в их смеси, при температуре между комнатной температурой и температурой кипения растворителя. Разделение Е и Z изомеров может быть осуществлено как хроматографией на колонках, так и посредством ВЭЖХ.
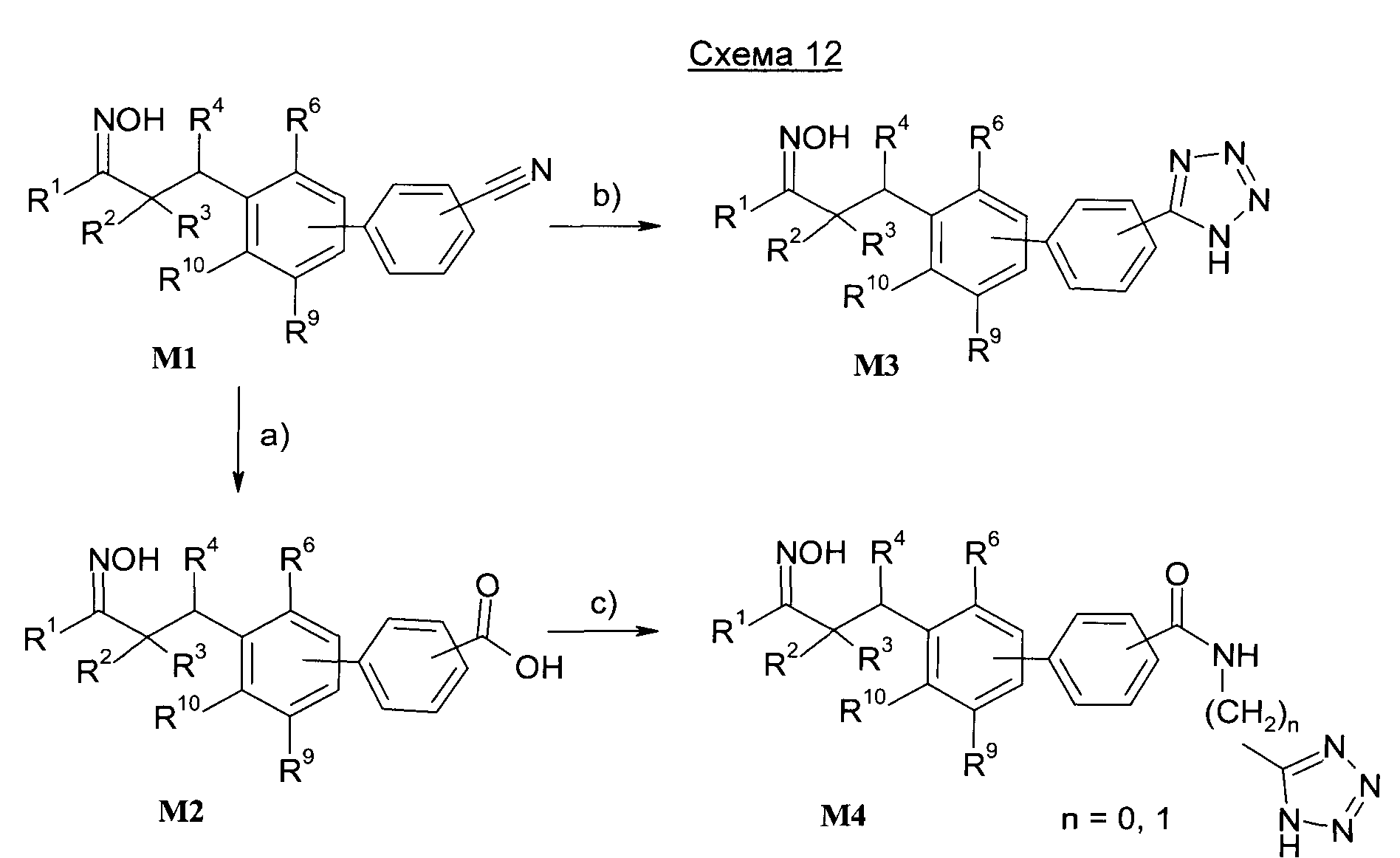
В случаях, когда заместитель R7 или R8 в соединениях общей формулы 1 представляет собой цианогруппу, которая может быть как напрямую, так и через алкил или арил присоединена к фенилу (соединения M1, Схема 12), цианогруппа может быть как гидролизована в карбоновую кислоту в щелочной (например, в водном растворе гидроксида натрия или лития) или кислой среде (например, уксусная или серная кислота) с получением соединений M2 (стадия а), или может быть конвертирована в соответствующие тетразолы M3 (стадия b) с использованием стандартных способов, например, посредством обработки азидом натрия в присутствии кислоты Льюиса (например, бромид цинка (II)) или хлорида аммония в воде или органических растворителях, таких как дихлорметан или N,N-диметилформамид при температуре между 0°C и температурой кипения растворителя. Карбоксигруппу в соединениях формулы M2 можно подвергнуть амидному связыванию с амино- или амино-алкил-замещенными тетразолами (которые как коммерчески доступны, так и могут быть получены способами, описанными в литературе) с использованием условий, описанных на схеме 7, с получением соединений M4 (стадия c). Тетразоловая группа в амино- или амино-алкил-замещенных тетразолах может быть возможно защищена, например трифенилметил(тритил) защитной группой, которая может быть отщеплена после проведения реакционных стадий с использованием способов, известных квалифицированному специалисту и описанными в литературе.
Как описано ранее в настоящем изобретении, соединения формулы 1 настоящего изобретения могут применяться в качестве лекарственных средств (медикаментов) для лечения заболеваний, ассоциированных с модуляцией активности GPBAR1.
Поскольку соединения формулы I настоящего изобретения являются агонистами рецепторов GPBAR1, соединения будет полезны для снижения глюкозы, липидов и резистентности к инсулину у больных сахарным диабетом и не страдающих диабетом пациентов, у которых присутствует нарушение толерантности к глюкозе или которые находятся в пред-диабетическом состоянии. Соединения формулы I являются также полезными для облегчения гиперинсулинемии, которая часто встречается у больных сахарным диабетом или пред-диабетических пациентов, модулируя колебания уровня глюкозы в крови, которые часто наблюдаются у таких пациентов. Соединения формулы I также полезны в снижении рисков, связанных с метаболическим синдромом, в снижении риска развития атеросклероза или задержке начала атеросклероза, снижении риска стенокардии, хромоты, инфаркта, инсульта и ишемической болезни сердца. Держа под контролем гипергликемию, соединения являются полезными для задержки или предотвращения рестеноза сосудов и диабетической ретинопатии.
Соединения формулы I настоящего изобретения являются полезными для улучшения или восстановлении β-клеток, поэтому что они могут быть полезны в лечении сахарного диабета 1 типа или в отсрочке или предотвращении необходимости инсулинотерапии у пациентов с сахарным диабетом 2 типа. Соединения могут быть полезны для снижения аппетита и массы тела у тучных субъектов, и поэтому могут быть полезны для снижения риска сопутствующих заболеваний, связанных с ожирением, таких как гипертония, атеросклероз, диабет и дислипидемия. Повышая уровень активного ГПП-1 (глюкагоноподобного пептида-1) in vivo, соединения полезны при лечении неврологических расстройств, таких как болезнь Альцгеймера, рассеянный склероз и шизофрения.
Так, выражение "заболевания, которые ассоциированы с модуляцией активности GPBAR1" означает заболевания, такие как нарушения обмена веществ, сердечно-сосудистые и воспалительные заболевания, например диабет, в частности диабет 2 типа, гестационный диабет, нарушение гликемии натощак, нарушенная толерантность к глюкозе, резистентность к инсулину, гипергликемия, ожирение, метаболический синдром, ишемия, инфаркт миокарда, ретинопатия, рестеноз сосудов, гиперхолестеринемия, гипертриглицеридемия, дислипидемия или гиперлипидемия, нарушения липидного обмена, такие как низкий уровень холестерина ЛПВП или высокий уровень холестерина ЛНП, высокое кровяное давление, стенокардия, ишемическая болезнь сердца, атеросклероз, гипертрофия сердца, ревматоидный артрит, бронхиальная астма, хроническая обструктивная болезнь легких (ХОБЛ), псориаз, язвенный колит, болезнь Крона, нарушения, связанные с парентеральным питанием, особенно при заболеваниях тонкой кишки, синдром раздраженного кишечника (СРК), аллергические заболевания, жировая дистрофия печени (например неалкогольный стеатоз печени, NAFLD), фиброз печени (например неалкогольные стеатогепатиты, NASH), первичный склерозирующий холангит (ПСХ), цирроз печени, первичный желчный цирроз печени (ПЖЦП), холестаз печени, фиброз почек, нервная анорексия, булимия и неврологические расстройства, такие как болезнь Альцгеймера, рассеянный склероз, шизофрения и нарушения познавательных способностей.
В частном аспекте, выражение "заболевания, которые ассоциированы с модуляцией активности GPBAR1" относятся к диабету, в частности диабету 2 типа, гестационному диабету, нарушению гликемии натощак, нарушенной толерантности к глюкозе, гипергликемии, метаболическому синдрому, ожирению, гиперхолестеринемии и дислипидемии.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединение, как определено выше, и фармацевтически приемлемый носитель и/или адъювант. Более конкретно, изобретение относится к фармацевтическим композициям, полезным для лечения заболеваний, ассоциированных с модуляцией активности GPBAR1.
Дополнительно, настоящее изобретение относится к соединениям формулы I, как определено выше, для применения в качестве терапевтически активных веществ, в частности, терапевтически активных веществ для лечения заболеваний, ассоциированных с модуляцией активности GPBAR1. В частности, настоящее изобретение относится к соединениям формулы I для применения при диабете, в частности диабете 2 типа, гестационном диабете, нарушении гликемии натощак, нарушении толерантности к глюкозе, гипергликемии, метаболическом синдроме, ожирении, гиперхолестеринемии и дислипидемии, более конкретно для применения при диабете, в частности диабете 2 типа, гестационном диабете или гипергликемии.
В другом аспекте настоящее изобретение относится к способу лечения заболеваний, которые ассоциированы с модуляцией активности GPBAR1, который включает введение терапевтически активного количества соединения формулы I человеку или животному. В частности, изобретение относится к способу лечения диабета, в частности диабета 2 типа, гестационного диабета, нарушения гликемии натощак, нарушения толерантности к глюкозе, гипергликемии, метаболического синдрома, ожирения, гиперхолестеринемии и дислипидемии, более конкретно для лечения диабета, в частности диабета 2 типа, гестационного диабета или гипергликемии.
Изобретение также относится к применению соединений формулы I, как определено выше, для лечения заболеваний, ассоциированных с модуляцией активности GPBAR1.
Дополнительно, изобретение относится к применению соединений формулы I, как определено выше, для получения лекарственных средств для лечения заболеваний, ассоциированных с модуляцией активности GPBAR1. В частности, изобретение относится к применению соединений формулы I, как определено выше, для получения лекарственных средств для лечения диабета, в частности диабета 2 типа, гестационного диабета, нарушения гликемии натощак, нарушения толерантности к глюкозе, гипергликемии, метаболического синдрома, ожирения, гиперхолестеринемии и дислипидемии, более конкретно для получения лекарственных средств для лечения диабета, в частности диабета 2 типа, гестационного диабета или гипергликемии.
Кроме того, настоящим изобретением предусмотрена комбинированная терапия с использованием одного или более соединений формулы I или композиции по настоящему изобретению, или его фармацевтически приемлемой соли, в комбинации с одним или несколькими другими фармацевтически активными соединениями, независимо выбранными из группы, состоящей из следующих:
(a) антагонисты рецептора человека, активируемого пролифератором пероксисом гамма (PPAR) (например, тиазолидиндионы и глитазоны, например, розиглитазон, троглитазон, пиоглитазон, энглитазон, балаглитазон и нетоглитазон),
(b) бигуаниды, такие как метформин, метформина гидрохлорид, буформин и фенформин,
(c) ингибиторы дипептидилпептидазы IV (DPP-4), такие как ситаглиптин, ситаглиптина фосфат, саксаглиптин, вилдаглиптин, алоглиптин, кармеглиптин и денаглиптин,
(d) инкретины, такие как агонисты рецепторов глюкагон-подобного пептида-1 (GLP-1), такие как экзенатид (Byetta™), лираглутид (Victoza™), GLP-1 (7-36) амид и его аналоги, GLP-1 (7-37) и его аналоги, AVE-0010 (ZP-10), R1583 (таспоглютид), GSK-716155 (албиглютид, GSK/Human Genome Sciences), BRX-0585 (Pfizer/Biorexis) и CJC-1134-PC (экзендин-4: PC-DAC™) или глюкозо-зависимый инсулинотропный полипептид (GIP),
(e) инсулин или аналоги инсулина, такие как инсулин ЛизПро или ингаляционные препараты, содержащие инсулин,
(f) сульфонилмочевины, такие как толазамид, хлорпропамид, глипизид, глимепирид, глибенкламид, глибенкламид, толбутамид, ацетогексамид или глипизид,
(g) ингибиторы α-глюкоз ид азы, такие как миглитол, акарбоза, эпалрестат или воглибоза,
(h) ингибиторы биосинтеза холестерина, такие как ингибиторы ГМГ KoA-редуктазы, например, ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, розувастатин, церивастатин, итавастатин, нисвастатин и ривастатин или ингибиторы сквален эпоксидазы, например, тербинафин, (I) разрыхлители плазменных ЛПВП, такие как ингибиторы СЕТР например, анацетрапиб, торцетрапиб и далцетрапиб, или PPAR альфа-агонисты, например, гемфиброзил, клофибрат, фенофибрат и безафибрат,
(j) двойные агонисты PPAR альфа /гамма, такие как мураглитазар, навеглитазар, алеглитазар, тесаглитазар, пелиглитазар, фарглитазар и JT-501,
(k) вщества, усиливающие экскрецию желчных кислот, например, анионобменные смолы или четвертичные амины (например, холестирамин или колестипол), или ингибиторы транспортера желчных кислоты подвздошной кишки (BATi);
(l) никотиниловый спирт, никотиновая кислота, ниацинамид или их соли,
(m) ингибиторы всасывания холестерина, такие как эзетимиб или ингибиторы ацил-коэнзим А: холестерин O-ацилтрансферазы (ACAT), такие как авзимиб,
(n) селективные модуляторы рецепторов эстрогена, такие как ралоксифен, или тамоксифен, или LXR альфа- или бета-агонисты, антагонисты или частичные агонисты (например, 22 (R)-гидроксихолестерин, 24 (S)-гидроксихолестерин, Т0901317 или GW3965);
(o) ингибиторы микросомального белка-переносчика триглицеридов (MTP), альфа-2-антагонисты и имидазолины (например, мидаглизол, изаглидол, дериглидол, идазоксан, эфароксан, флупароксан),
(p) стимуляторы секреции инсулина, такие как линоглирид, натеглинид, репаглинид, митиглинидкальция гидрат или меглитинид);
(q) SGLT-2 ингибиторы (например, дапаглифлозин, серглифлозин и тофоглифозин),
(s) активаторы глюкокиназы, такие как соединения, описанные в например, WO 00/58293 A1;
(t) ингибиторы белковой тирозинфосфатазы-1B (PTP-1B),
(u) антагонисты рецепторов глюкагона,
(v) средства против ожирения, такие как фенфлюрамин, дексфенфлурамин, фентирамин, сибутрамин, орлистат, антагонисты нейропептида Y1 или Y5, агонисты нейропептида Y2, агонисты MC4R (рецептор меланокортина 4), антагонисты/обратные агонисты каннабиноидных рецепторов 1 (CB-L), и агонисты β3 адренергических рецепторов (например, GW-320659), агонисты фактора роста нервов (например, аксокин), агонисты гормона роста (например, AOD-9604), ингибиторы обратного захвата/транспортера 5-НТ (серотонин) (например, прозак), ингибиторы обратного захвата DA (дофамина) (например, бупроприон), блокаторы обратного захвата 5-НТ, NA и DA, стероидные растительные экстракты (например, Р57), агонисты CCK-A (холецистокинина-A), антагонисты/обратные агонисты GHSRIa (рецепторы усиления секреции гормона роста), грелиновые антитела, антагонисты MCH1R (рецепторов меланинконцентрирующего гормона 1R) (например, SNAP 7941), агонисты/антагонисты MCH2R (рецепторов меланинконцентрирующего гормона 2R), обратные агонисты или антагонисты H3 (рецепторы гистамина 3), агонисты Н1 (рецепторы гистамина-1), ингибиторы FAS (синтазы жирных кислот), ингибиторы АСС-2 (ацетил-KoA карбоксилазы-1), ингибиторы DGAT-2 (диацилглицерол ацилтрансферазы 2), ингибиторы DGAT-1 (диацилглицерол ацилтрансферазы 1), агонисты CRF (кортикотропин рилизинг-фактор), галаниновые антагонисты, активаторы UCP-1 (разобщающий белок-1), 2 или 3, лептин или производные лептина, опиоидные антагонисты, антагонисты орексина, агонисты BRS3, агонисты IL-6, a-MSH агонисты, антагонисты AGRP, агонисты BRS3 (рецептор бомбезина подтип 3), агонисты 5-НТ1 В, антагонисты РОМС, CNTF (цилиарного нейротрофического фактора или CNTF производные), топирамат, глюкокортикоидные антагонисты, агонисты 5-HT2C (рецептора серотонина 2С) (например, лоркасерин), ингибиторы ФДЭ (фосфодиэстеразы), ингибиторы транспортеров жирных кислот, ингибиторы транспортера дикарбоксилата, ингибиторы транспортера глюкозы,
(w) противовоспалительные средства, такие как ингибиторы циклооксигеназы-2 (COX-2) (например, рофекоксиб и целекоксиб), глюкокортикоиды, азулфидин, ингибиторы тромбина (например, гепарин, аргатробан, мелагатран, дабигатрана) и ингибиторы агрегации тромбоцитов (например, антагонисты фибриногеновых рецепторов гликопротеина IIb/IIIa или аспирин) и урсодезоксихолевая кислота (УДХК) и неурсодезоксихолеваяй кислота (нУДХК) и
(y) гипотензивные средства, такие как бета-блокаторы (например, антагонисты рецепторов ангиотензина II, такие как лозартан, эпросартан, ирбесартан, тазосортан, телмисартан или валсартан; ингибиторы ангиотензин-превращающего фермента, такие как эналаприл, каптоприл, цилазаприла, рамаприл, зофеноприл, лизиноприл и фозиноприла, блокаторы кальциевых каналов, такие как нифедипин и дилтиазам и эндотелиальные антагонисты.
Такие другие фармацевтически активные соединения можно вводить в количестве, обычно используемом с этой целью, одновременно или последовательно с соединением формулы I или его фармацевтически приемлемой солью. При лечении пациентов с сахарным диабетом 2 типа, инсулинорезистентности, ожирения, метаболического синдрома, неврологических расстройств и сопутствующих заболеваний, которые сопровождают эти заболевания, обычно вводят более одного фармацевтически активного соединения. Соединения формулы I настоящего изобретения в основном могут быть введены пациентам, которые уже принимают один или несколько других препаратов для этих заболеваний. Когда соединение формулы I используется одновременно с одним или несколькими другими фармацевтически активными соединениями, предпочтительной является фармацевтическая композиция в единичной дозированной форме, содержащей такие другие фармацевтически активные соединения и соединение формулы I. Таким образом, изобретение также относится к фармацевтической композиции, содержащей соединение формулы I в комбинации с одним или несколькими другими фармацевтически активными соединениями, как определено выше. При использовании в комбинации с одним или несколькими другими активными ингредиентами, соединения формулы I настоящего изобретения и другие фармацевтически активные соединения могут быть использованы в более низких дозах, чем в случаях, когда каждое соединение используется по отдельности. Такие фармацевтические композиции, также включены в изобретение.
Тем не менее, комбинированная терапия также включает в себя лечение, при котором соединение формулы I и одно или несколько других фармацевтически активных соединений вводятся в различных дозированных формах, но с совмещенным графиком. Таким образом, изобретение также относится к способу лечения от заболевания, которые ассоциированы с модуляцией активности GPBAR1, который включает введение терапевтически активного количества соединения формулы I в сочетании с одним или несколькими другими фармацевтически активными соединениями человеку или животному.
Следующий тест выполнялся для определения активности соединений формулы I:
КДНК рецептора GPBAR1 человека (Genbank: NM_170699 за исключением молчащей мутации C:G в позиции 339 от стартового кодона) амплифицировали с помощью полимеразной цепной реакции (PCR) из кДНК человека и ввели в pCineo (Promega) обычными способами (Current Protocols in Molecular Biology, Wiley Press, ред. Ausubel и соавт.). Конечный клон верифицировали ДНК-секвенированием. Плазмиду трансфицировали в клетки CHO, дефицитные по активности дишидрофолатредуктазы (CHO-dhfr-), используя Lipofectamine plus (Invitrogen). Клоны выделили в условиях ограниченного разведения и идентифицировали по активностям в анализе цАМФ, используя литохолевую кислоту в качестве агониста. Клонированная клеточная линия, демонстрирующая более высокую активность в увеличении цАМФ была выбрана и идентифицирована в качестве дающей стабильно хорошие ответы в течение по меньшей мере 20 пассажей.
Анализ цАМФ
CHO-dhfr(MHHyc) клетки, экспрессирующие человеческий рецептор GPBAR1 посеяли за 17-24 часа до начала эксперимента с плотностью 50.000 клеток на лунку в черные 96-луночные планшеты с плоски прозрачным дном (Corning Costar # 3904) в среде DMEM (Invitrogen №31331), 1х НТ поддержкой, с 10% эмбриональной телячьей сывороткой и инкубировали при 5% CO2 и 37°C во влажной камере. Ростовую среду заменили на буфер Krebs Ringer Bicarbonate с 1 мМ IBMX и инкубировали при 30°C в течение 30 мин. Соединения добавили к конечному объему для анализа 100 мкл и инкубировали в течение 30 мин при температуре 30°C. Анализ остановили добавлением 50 мкл лизирующего реагента (Tris, NaCl, 1.5% Тритон Х100, 2.5% NP40, 10% NaN3) и 50 мкл раствора детекции (20 мкМ моноклональных антител Alexa700-цАМФ 1:1, и 48 мкМ Рутений-2-АНА-цАМФ) и взбалтывали в течение 2 ч при комнатной температуре. Перенос энергии с временным разрешением (time-resolved energy transfer) измеряли на TRF ридере (Evotec Technologies GmbH, Hamburg Germany), оснащенном ND.-YAG лазером в качестве источника возбуждения. Планшеты измеряли дважды с возбуждением при 355 нм и эмиссией с задержкой в 100 не и длительностью импульса 100 не, общее время экспозиции 10 с при 730 (ширина полосы 30 нм) или 645 нм (ширина полосы 75 нм), соответственно. Измеренный при 730 нм сигнал корректировали по отношению к фону рутения, прямому излучению Alexa и контрольному буферу. Сигнал FRET подсчитывали следующим образом: FRET=T730-Alexa730-P(T645-В645) с P=Ru730-B730/Ru645-B645, где Т730 представляет собой тестовую лунку, измеренную при 730 нм, T645 представляет собой тестовую лунку, измеренную при 645 нм, B730 и B645 являются буфферными контролями при 730 нм и 645 нм, соответственно. Содержание цАМФ определяли как функцию стандартной кривой в интервале от 10 мкМ до 0.13 нм цАМФ.
Значения EC50 определяли с использованием анализа Activity Base (ID Business Solution, Limited). Значения EC50 для широкого спектра желчных кислот полученные из этого анализа не противоречили значениям, опубликованным в научной литературе. Специфичность в отношении рецепторов GPBAR1 теститровали на нетрансфицированных клетках CHO, аналогичным указанному выше способом.
Соединения в соответствии с формулой I обладали активностью по данным вышеуказанного анализа (EC50) в диапазоне предпочтительно от 0.5 нМ до 10 мкМ, более предпочтительно от 0.5 нМ до 1 мкМ и наиболее предпочтительно от 0.5 нМ до 100 нМ.
Например, следующие соединения показали приведенные ниже значения EC50 для человека по данным функционального анализа цАМФ, описанного выше:
|
|
|
|
|
|
|
|
|
Соединения формулы I и их фармацевтически приемлемые соли могут применяться в качестве лекарственных средств, например, в виде фармацевтических препаратов для энтерального, парентерального или местного введения. Их можно вводить, например, перорально, например, в форме таблеток, покрытых оболочкой таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий, ректально, например, в виде суппозиториев, парентерально, например, в форме инъекционных растворов или суспензий или инфузионных растворов, или местно, например, в виде мазей, кремов или масел. Пероральное введение является предпочтительным.
Производство фармацевтических препаратов может быть осуществлено способами, знакомыми любому квалифицированному специалисту в данной области посредством использования описанных соединений формулы I и их фармацевтически приемлемых солей, возможно в комбинации с другими терапевтически ценными веществами, в галеновых формах введения вместе с подходящими, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими носителями и, при желании, обычными фармацевтическими адъювантами.
Подходящими материалами для носителей являются не только неорганические вещества-носители, но также и органические вещества-носители. Так, например, лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли могут быть использованы в качестве материалов-носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры и полутвердые и жидкие полиолы (в зависимости от природы активного ингредиента, однако, в случае мягких желатиновых капсул может не требоваться никакого носителя). Подходящими материалами носителей для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар и т.п.Подходящими материалами носителей для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин и растительные масла. Подходящими носителями для суппозиториев являются, например, природные или гидрогенизированные масла, воски, жиры и полужидкие или жидкие полиолы. Подходящими материалами носителей для местных препаратов являются глицериды, полусинтетические и синтетические глицериды, гидрогенизированные масла, жидкие воски, жидкие парафины, жидкие жирные спирты, стеролы, полиэтиленгликоли и производные целлюлозы.
Обычные стабилизаторы, консерванты, увлажняющие агенты и эмульгаторы, улучшающие консистенцию средства, улучшающие аромат средства, соли для изменения осмотического давления, буферные вещества, растворители, красители и маскирующие агенты и антиоксиданты могут использоваться в качестве фармацевтических адъювантов.
Дозировка соединений формулы 1 может варьироваться в широких пределах в зависимости от заболевания, которые подлежат лечению, возраста и индивидуального состояния пациента и способа введения, и, конечно, должны подбираться под отдельные требования в каждом конкретном случае. Для взрослых пациентов рассматриваются суточные дозы от 1 до 1000 мг, особенно от 1 до 300 мг. В зависимости от тяжести заболевания и точного фармакокинетического профиля соединение может вводиться ежедневно одной или несколькими единичными дозированными формами, например, от 1 до 3 единичных дозированных форм.
Фармацевтические препараты обычно содержат около 1-500 мг, предпочтительно 1-100 мг соединения формулы I.
Следующие примеры служат для более подробной иллюстрации настоящего изобретения. Они, однако, не предназначены для ограничения объема изобретения в любой форме.
Примеры
Аббревиатуры:
CAS RN= регистрационный номер Chemical Abstracts, 9-BBN= 9-борабицикло[3.3.1]нонан, BBr3= трибромид бора, BOP= бензотриазол-1-илокситрис(диметиламино)фосфоний, CuBr DMS= бромида меди диметилсульфидный комплекс, Cul= йодид меди, DMA= диметилацетамид, DME= 1,2-диметоксиэтан, ДМФ= N,N-диметилформамид, EI= электронным ударом, ESI-= отрицательная ионизация электрораспылением, ESI+= положительная ионизация электрораспылением, Et3N= триэтиламин, EtOAc= этилацетат, ч= час, HATU= 1-[бис(диметиламино)метилен]-1H-1,2,3-триазол [4,5-b]пиридин-3-оксид гексафторфосфат, HCl= соляная кислота, ВЭЖХ= высокоэффективная жидкостная хроматография, мин= минуты, KHSO4= гидросульфат калия, LiOH= гидроксид лития, MgSO4= сульфат магния, MPLC= жидкостная хроматография среднего давления, MS= масс-спектр, NaH= гидрид натрия, NaHCO3= гидрокарбонат натрия, NaOH= гидроксид натрия, Na2SO4= сульфат натрия, NHLtCl= хлорид аммония, P= защитная группа, R= любая группа, KT= комнатная температура, SiO2= силикагель, TBME= трет-бутилметиловый эфир, TBTU= O-бензотриазолил тетраметилизоуроний тетрафторборат, TiCl4= четыреххлористый титан, ТГФ= тетрагидрофуран, X= галоген.
Примеры 1 и 2
(E)-3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим и (Z)-3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим (E и Z оксимы)
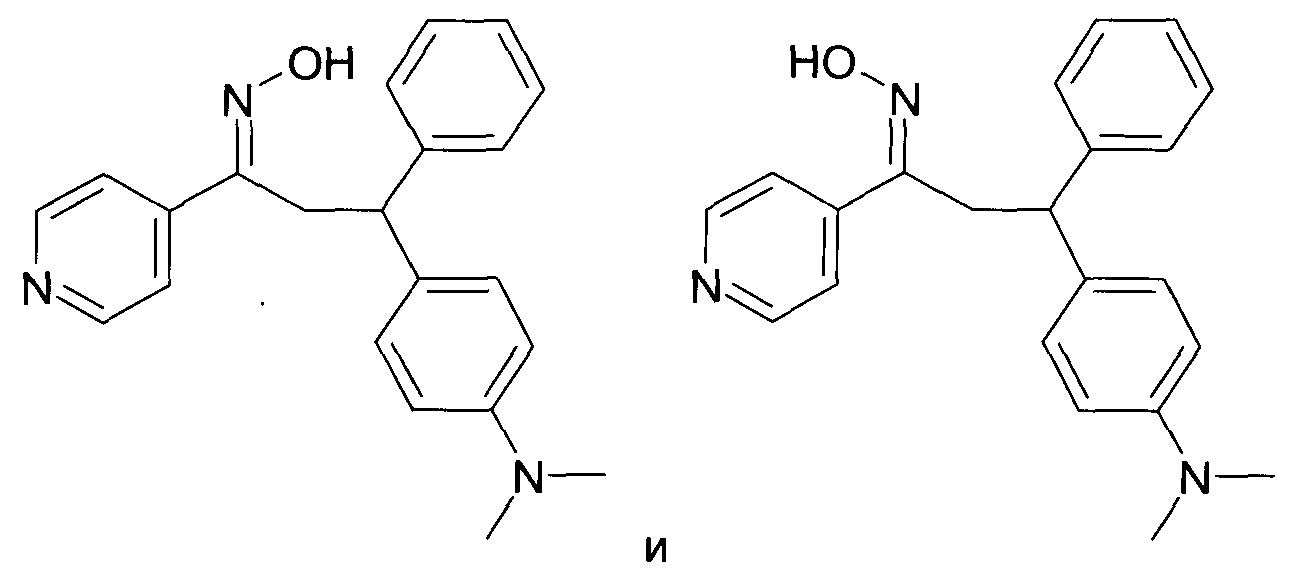
Стадия 1: 3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-он
В атмосфере аргона, раствор диэтилцинка в гексане (1.0 М, 31 мл) добавили к раствору фенилбороновой кислоты (1.26 г) в безводном толуоле (80 мл). Смесь перемешивали при 60°C в течение ночи, охладили до 0°C и добавили раствор (E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-пропенона (CAS RN: [18461-18-2], 1.05 г) в безводном толуоле (20 мл). После перемешивания при комнатной температуре в течение 3 ч, добавили насыщенный водный раствор NH4Cl, фазы разделили и неорганический слой экстрагировали EtOAc. Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Колоночная хроматография на силикагеле (EtOAc/n-гептан 2:1) с последующим тритурированием из л-гептана дала соединение, указанное в заголовке (840 мг, 62%), в виде желтого осадка, MS (ESI+): m/z=331.2 ([M+H]+).
Стадия 2: (E)-3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим и (Z)-3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим
Раствор 3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она (838 мг), гидроксиламина гидрохлорида (353 мг) и гидрокарбоната натрия (426 мг) в смеси этанол/вода (21 мл, 20:1) нагревали до кипения с обратным холодильником в течение 2 часов. Насыщенный водный раствор NH4Cl добавили к реакционной смеси и провели экстракцию с помощью EtOAc (2х). Органические слои объединили, промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Колоночная хроматография на силикагеле (EtOAc/n-гептан 2:1) дала (E)-3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим (420 мг, 48%) в виде белой пены, MS(ESI+): m/z=346.1 ([M+H]+), (Z)-3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим (20 мг, 2%,) в виде бесцветного масла, MS (ESI+): m/z=346.1 ([M+H]+) и 3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим в виде смеси изомеров (313 мг, 36%), MS (ESI+): m/z=346.1 ([M+H]+).
Примеры 3 и 4
(+)-(Е)-3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим и (-)-(Е)-3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим
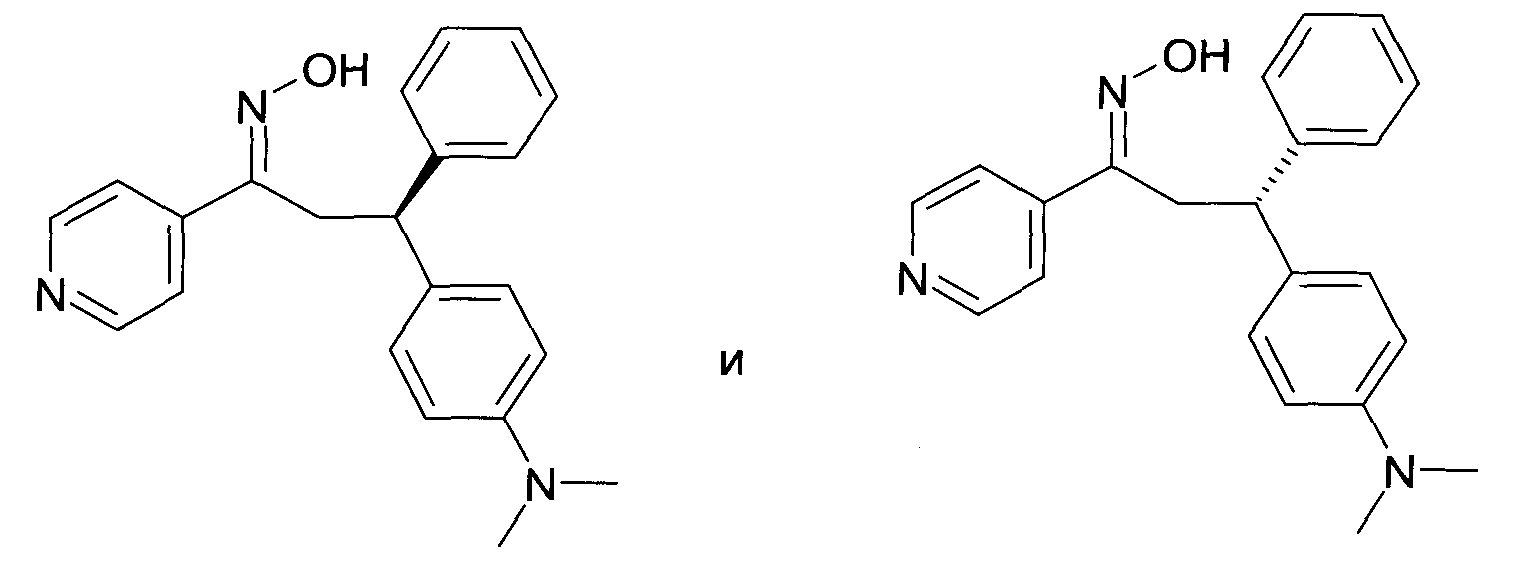
Хиральное ВЭЖХ разделение 3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (Chiralpak AD, 10% EtOH/n-гептан) дала (+)-(Е)-3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим в виде белой пены, MS (ESI+): m/z=346.1 ([M+H]+) и (-)-(E)-3-(4-диметиламино-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим в виде белой пены, MS (ESI+): m/z=346.1 ([M+H]+).
Пример 5
(E)-3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим
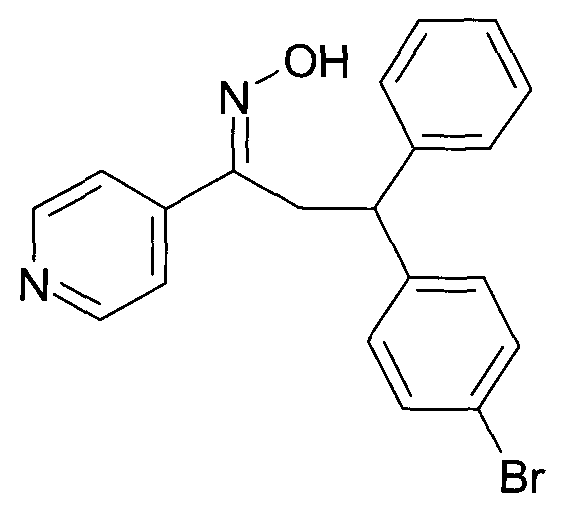
Стадия 1: 3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-он По аналогии с примером 1, стадия 1, из (E)-3-(4-бром-фенил)-1-пиридин-4-ил-пропенона (CAS RN: [16232-03-4]) и фенилбороновой кислоты получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=366.1 ([M+H]+, 1Br).
Стадия 2: (E)-3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили (E)-3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим в виде белого осадка, MS (ESI+): m/z=381.1 ([M+H]+, 1Br).
Пример 6 (E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
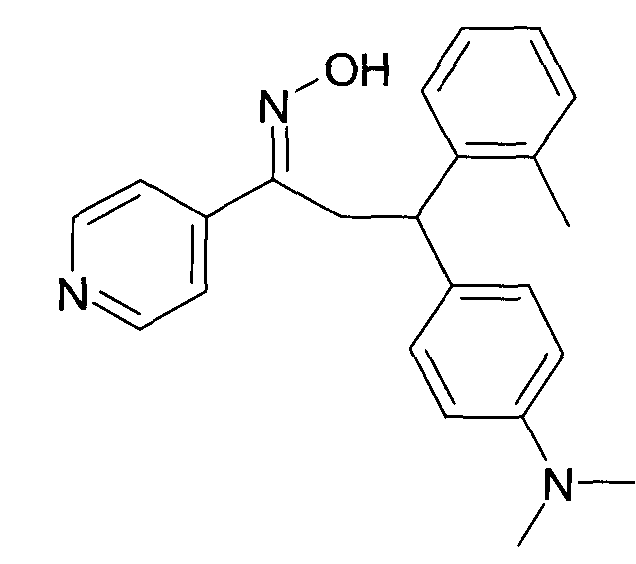
Стадия 1: 3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-он
По аналогии с примером 1, стадия 1, из (E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-пропенона (CAS RN: [18461-18-2]) и o-толилбороновой кислоты получили соединение, указанное в заголовке, в виде желтого осадка, MS (ESI+): m/z=345.2 ([M+H]+).
Стадия 2: (E)-3-(4-диметиламино-фенил)-1 -пиридин-4-ил-3-о-толил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=360.2 ([M+H]+).
Пример 7
3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-m-толил-пропан-1-она оксим
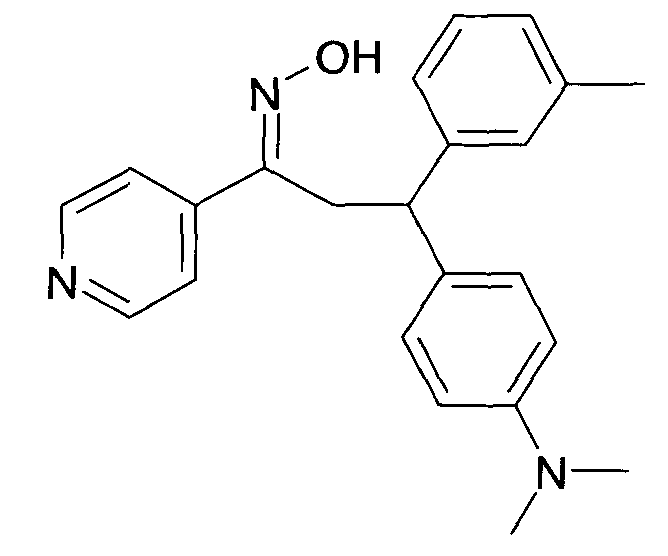
Стадия 1: 3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-m-толил-пропан-1-он
По аналогии с примером 1, стадия 1, из (E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-пропенона (CAS RN: [18461-18-2]) и m-толилбороновой кислоты получили соединение, указанное в заголовке, в виде оранжевой жидкости, MS (ESI+): m/z=345.1 ([M+H]+)
Стадия 2: 3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-m-толил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-лп-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси Е и Z изомеров (3:1) в виде желтой пены, MS (ESI+): m/z=360.1 ([M+H]+).
Примеры 8-10
(+)-(E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она оксим, (-)-(Е)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она оксим и (Z)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она оксим
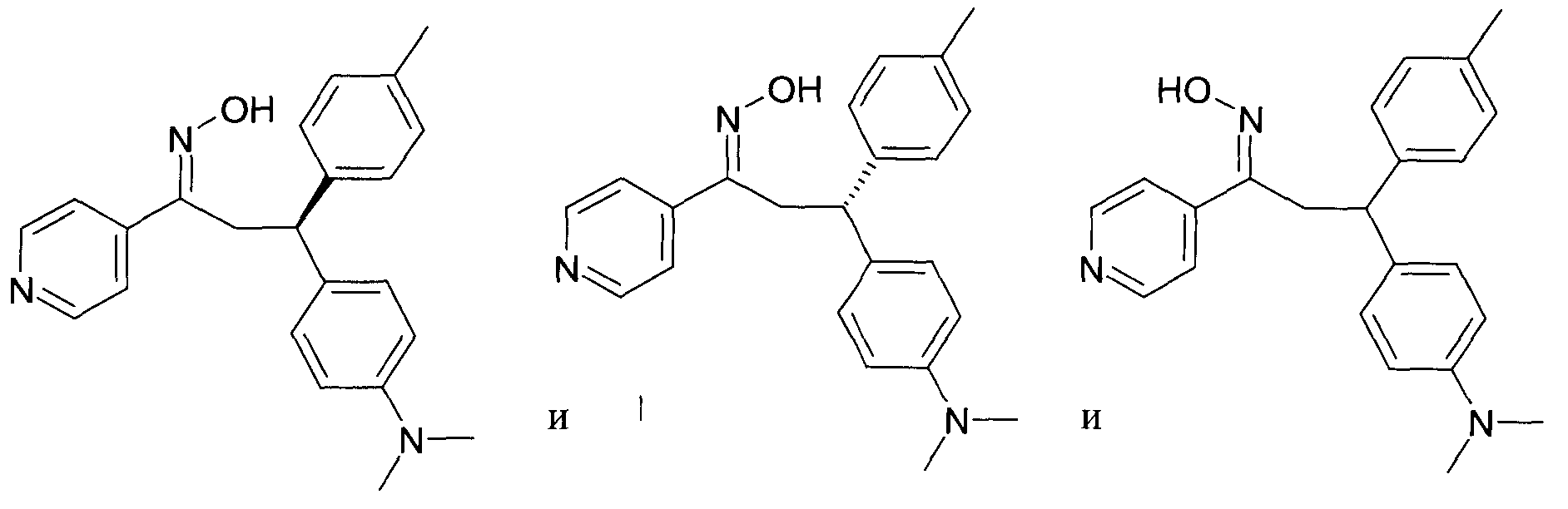
Стадия 1: 3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-он
По аналогии с примером 1, стадия 1, из (E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-пропенона (CAS RN: [18461-18-2]) и p-толил бороновой кислоты получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=345.2 ([M+H]+).
Стадия 2: 3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров в виде желтого масла, MS (ESI+): m/z=360.2 ([M+H]+).
Стадия 3: (+)-(E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она оксим, (-)-(E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она оксим и (2)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она оксим
Хиральное ВЭЖХ разделение 3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она оксима (Chiralpak AD, 15% этанол в л-гептане) дало (+)-(E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она оксим в виде бесцветного масла, MS (ESI+): m/z=360.2 ([М+H]+) (-)-(E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она оксим в виде белого осадка, MS (ESI+): m/z=360.1 ([M+H]+) и (Z)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-3-р-толил-пропан-1-она оксим в виде бесцветного масла, MS (ESI+): m/z=360.2 ([M+H]+).
Пример 11
3-(3-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
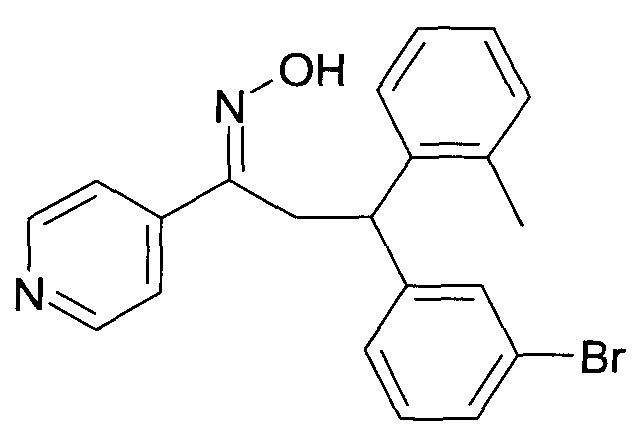
Стадия 1: 3-(3-бром-фенил)-1-пиридин-4-ил-пропенон
3-бромбензальдегид (6.3 мл), 4-ацетилпиридин (6.0 мл) и гранулы гидроксида натрия (2.16 г) смешали, используя ступку и пестик, и смесь агрегировали до образования бледно-желтого порошка (10-15 мин). Порошок промыли смесью вода/этанол (10:3) и неочищенный продукт очистили с помощью колоночной хроматографии на силикагеле (EtOAc/л-гептан 1:1), получив соединение, указанное в заголовке (1.54 г, 10%), в виде желтого осадка, MS (ESI+): m/z=287.9 ([M+H]+, 1Br).
Стадия 2: 3-(3-бром-фенил)-3-о-толил-1-пиридин-4-ил-пропан-1-он По аналогии с примером 1, стадия 1, из (E)-3-(3-бром-фенил)-1-пиридин-4-ил-пропенона и o-толилбороновой кислоты получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=380.1 ([M+H]+, 1Br).
Стадия 3: 3-(3-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим По аналогии с примером 1, стадия 2, из 3-(3-бром-фенил)-3-о-толил-1-пиридин-4-ил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси Е и Z изомеров (3:1) в виде белой пены, MS (ESI+): m/z=395.0 ([M+H]+, 1Br).
Пример 12 (E)-3-(3-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим
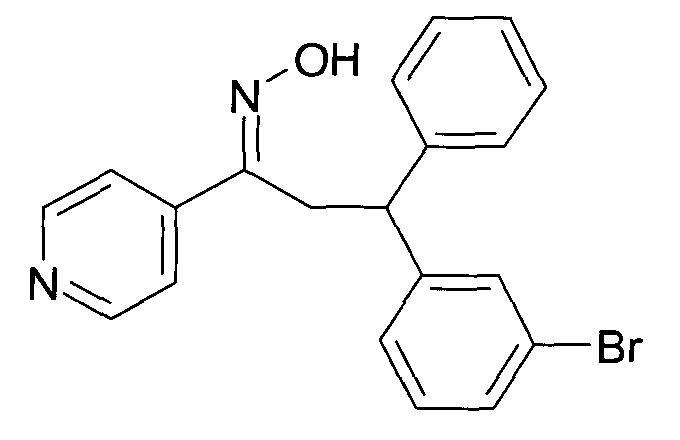
Стадия 1: 3-(3-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-он По аналогии с примером 1, стадия 1, из (E)-3-(3-бром-фенил)-1-пиридин-4-ил-пропенона (пример 11) и фенилбороновой кислоты получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=380.1 ([M+H]+,1Br).
Стадия 2: (Е)-3-(3-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим По аналогии с примером 1, стадия 2, из 3-(3-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=381.0 ([M+H]+, 1Br).
Пример 13 3-(3-бром-фенил)-1-пиридин-4-ил-пентан-1-она оксим
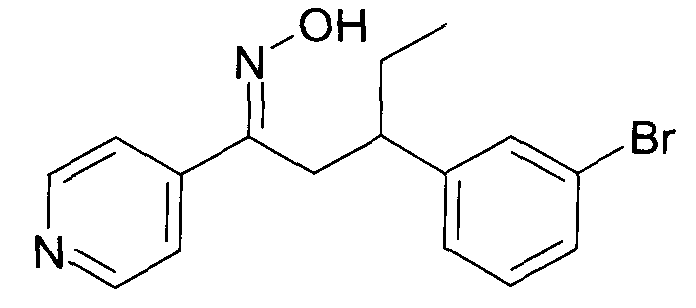
В качестве побочного продукта неочищенной реакционной смеси примера 12, стадия 2, ВЭЖХ разделение (Chiralpak AD колонка, 10% изопропанол в n-гептане)дало 3-(3-бром-фенил)-1-пиридин-4-ил-пентан-1-она оксим в виде смеси Е и Z изомеров (4:1) в виде бесцветного масла, MS (ESI+): m/z=333.0 ([M+H]+, 1Br).
Пример 14
(E)-3,3-дифенил-1-пиридин-4-ил-пропан-1-она оксим
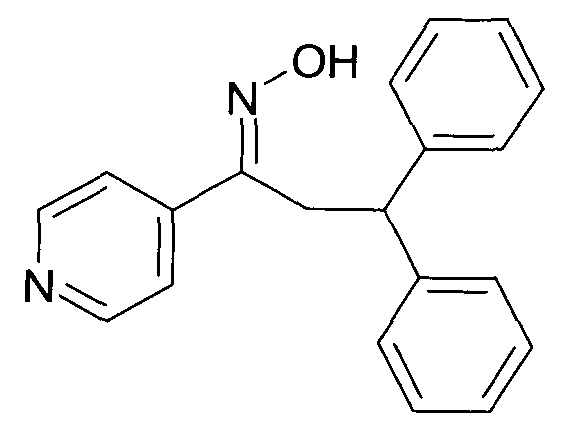
Стадия 1: 3.3-дифенил-1-пиридин-4-ил-пропан-1-он
По аналогии с примером 1, стадия 1, из (E)-3-фенил-1-пиридин-4-ил-пропенона (CAS RN: [53940-08-2]) и фенилбороновой кислоты получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=288.0 ([M+H]+.
Стадия 2: (Е)-3.3-дифенил-1-пиридин-4-ил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3,3-дифенил-1-пиридин-4-ил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCOs получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=303.1 ([M+H]+.
Пример 15
(E)-3-(4-бром-фенил)-1-(1-окси-пиридин-4-ил)-3-фенил-пропан-1-она оксим
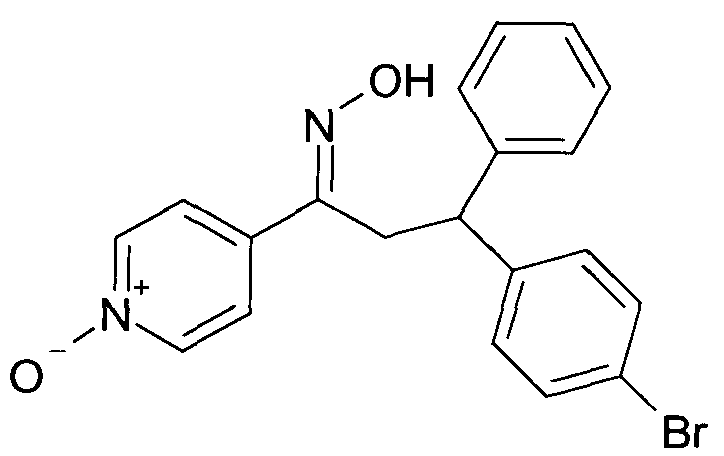
К раствору (E)-3-(4-бром-фенил)-3-фенил-1 -пиридин-4-ил-пропан-1 -она оксима (пример 5, 75 мг) в дихлорметане (2 мл) и метаноле (0.5 мл) добавили 3-хлорпероксибензойную кислоту (57 мг). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, добавили насыщенный водный раствор NaHCO3, фазы разделили и неорганическую фазу экстрагировали EtOAc (2х).
Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc до CH2Cl2/MeOH 9:1) с получением (E)-3-(4-бром-фенил)-1-(1-окси-пиридин-4-ил)-3-фенил-пропан-1-она оксима (78 мг, 98%) в виде бесцветного масла, MS (ESI+): m/z=397.0 ([M+H]+, 1Br).
Пример 16
(E)-3-(4-циклопропил-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим
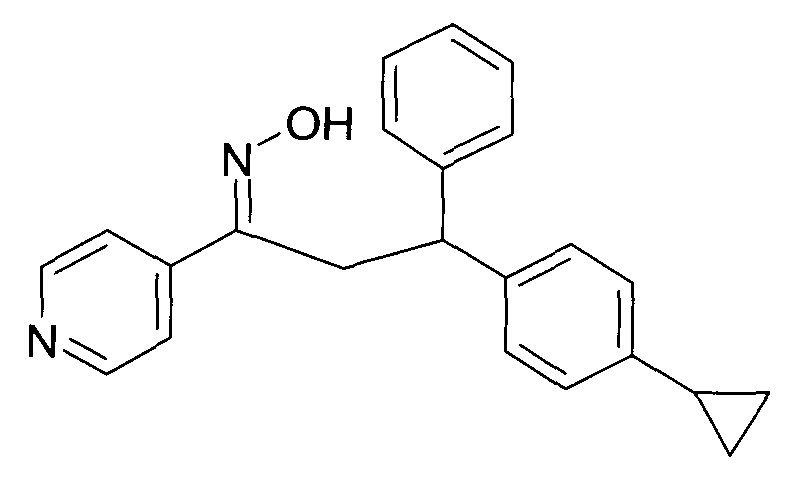
К раствору (E)-3-(4-бром-фенил)-3-фенил-1 -пиридин-4-ил-пропан-1 -она оксима (пример 5, 100 мг) в толуоле (0.9 мл) и воде (0.1 мл) добавили циклопропилтрифторборат калия (47 мг), трикалия фосфат моногидрат (199 мг) и тетракис(трифенилфосфин)палладий (0) (6 мг). Смесь нагревали при 100°C в течение ночи. После охлаждения до KT добавили насыщенный водный раствор NaHCO3, фазы разделили и неорганическую фазу экстрагировали EtOAc (2х). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 1:1) с получением (E)-3-(4-циклопропил-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (43 мг, 49%) в виде белой пены, MS (ESI+): m/z=343.3 ([M+H]+).
Пример 17
3-(4-диметиламино-фенил)-3-(3,4-диметил-фенил)-1-пиридин-4-ил-пропан-1-она оксим
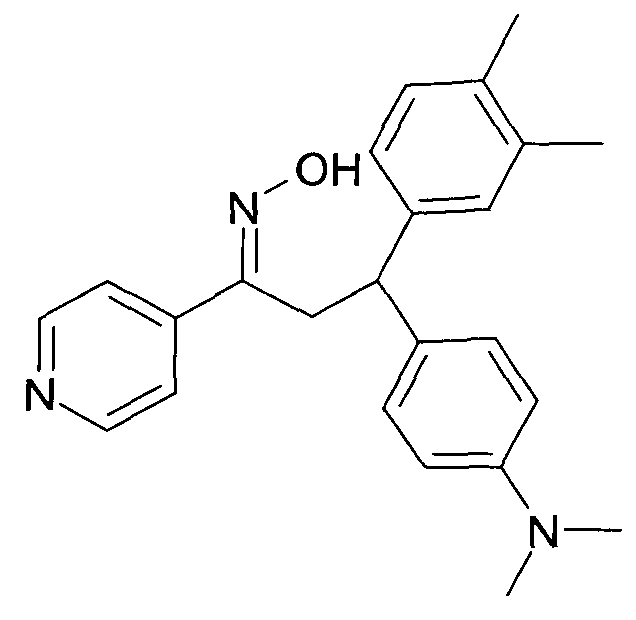
Стадия 1: 3-(4-диметиламино-фенил)-3-(3.4-диметил-фенил)-1-пиридин-4-ил-пропан-1-он
По аналогии с примером 1, стадия 1, из (E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-пропенона (CAS RN: [18461-18-2]) и 3,4-диметилбензолбороновой кислоты получили соединение, указанное в заголовке, в виде оранжевого масла, MS (ESI+): m/z=359.3 ([M+H]+).
Стадия 2: 3-(4-диметиламино-фенил)-3-(3.4-диметил-фенил)-1 -пиридин-4-ил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-диметиламино-фенил)-3-(3,4-диметил-фенил)-1-пиридин-4-ил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (2.3:1) в виде желтой пены, MS (ESI+): m/z=374.3 ([M+H]+).
Пример 18
3-(4-диметиламино-фенил)-3-(3,5-диметил-фенил)-1-пиридин-4-ил-пропан-1-она оксим
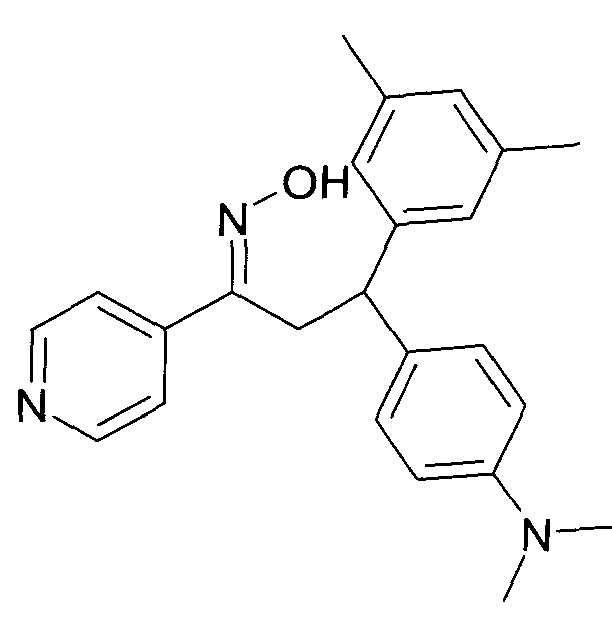
Стадия 1: 3-(4-диметиламино-фенил)-3-(3,5-диметил-фенил)-1-пиридин-4-ил-пропан-1-он
По аналогии с примером 1, стадия 1, из (Е)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-пропенона (CAS RN: [18461-18-2]) и 3,5-диметил-фенилбороновой кислоты получили соединение, указанное в заголовке, в виде оранжевого масла, MS (ESI+): m/z=359.3 ([M+H]+).
Стадия 2: 3-(4-диметиламино-фенил)-3-(3.5-диметил-фенил)-1 -пиридин-4-ил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-диметиламино-фенил)-3-(3,5-диметил-фенил)-1-пиридин-4-ил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси Е и Z изомеров (2.9:1) в виде светло-желтой пены, MS (ESI+): m/z=374.3 ([M+H]+).
Пример 19
(E)-3-(3'-метансульфонил-бифенил-4-ил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим
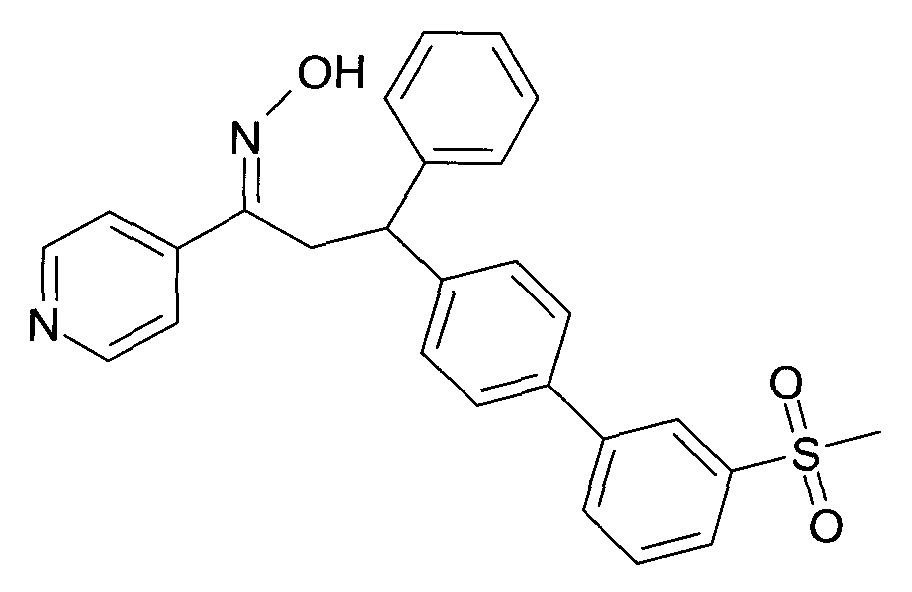
К перемешанному раствору (E)-3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (пример 5, 10 мг), (3-метилсульфонилфенил)бороновой кислоты (58 мг), тетракис-(трифенилфосфин)палладия (0) (30 мг) в 1,2-диметоксиметане (2 мл) добавили карбонат калия (90 мг). Смесь перемешивали при 80°C в течение ночи. Добавили воду, фазы разделили и неорганическую фазу экстрагировали диэтиловым эфиром (2х). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 2:1 до EtOAc) с получением (E)-3-(3'-метансульфонил-бифенил-4-ил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (21 мг, 18%) в виде светло-желтой пены, MS (ESI+): m/z=457.2 ([M+H]+).
Пример 20
(E)-3-(4'-метансульфонил-бифенил-4-ил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим
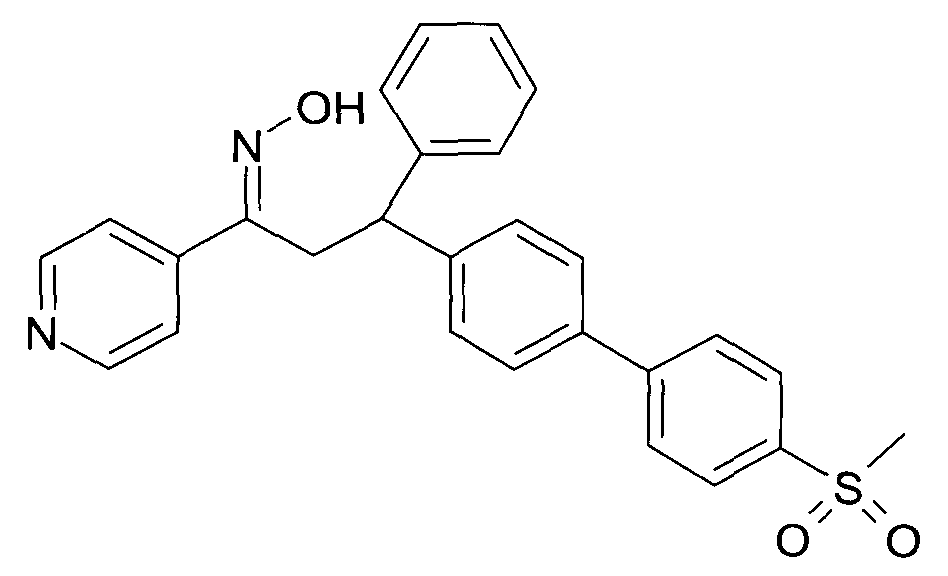
По аналогии с примером 19, из (E)-3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (пример 5) и (4-метилсульфонилфенил)бороновой кислоты получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=457.2 ([M+H]+).
Пример 21
4'-{3-[(E)-гидроксимино]-1-фенил-3-пиридин-4-ил-пропил}-бифенил-4-сульфоновой кислоты метиламид
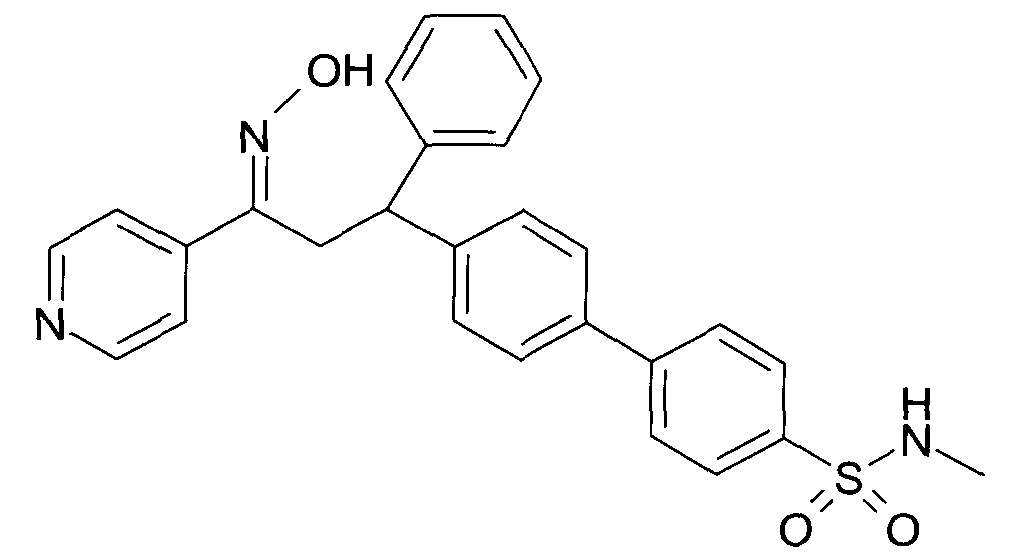
По аналогии с примером 19, из (E)-3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (пример 5) и (4-метиламиносульфонил)бензолбороновой кислоты получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=472.3 ([M+H]+.
Пример 22
(E)-3-фенил-1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-пропан-1-она оксим
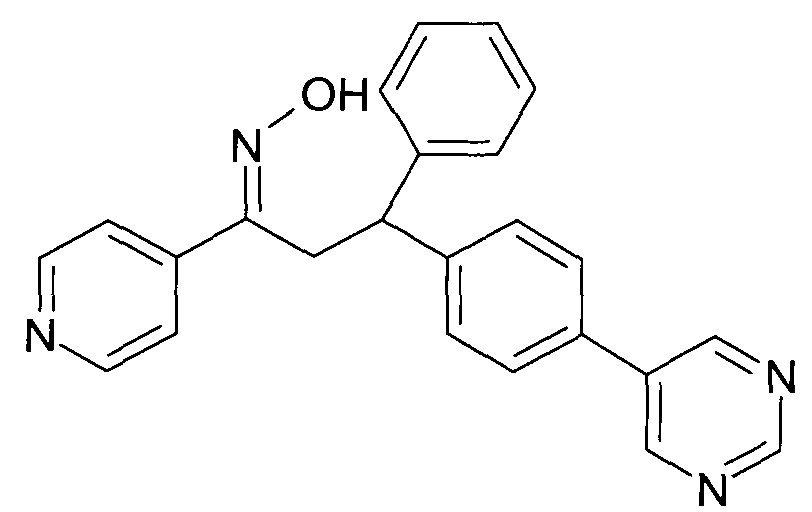
К перемешанному раствору (E)-3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (пример 5, 10 мг) и пиримидин-5-бороновой кислоты (49 мг) в смеси DMA/H2O (2.1 мл, 20:1) добавили тетракис(трифенилфосфин)палладий (0) (36 мг), трифенилфосфин (17 мг) и фторид калия (31 мг). Смесь подвергали излучению в микроволновой печи при 140°C в течение 15 минут. Добавили насыщенный водный раствор NH4Cl, фазы разделили и неорганическую фазу экстрагировали EtOAc (2х). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на ISOLUTE Flash NH2 картридже (EtOAc) с получением соединения, указанного в заголовке, (45 мг, 45%) в виде белой пены, MS (ESI+): m/z=381.1 ([M+H]+.
Пример 23
(E)-3-(3'-метансульфонил-бифенил-3-ил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим
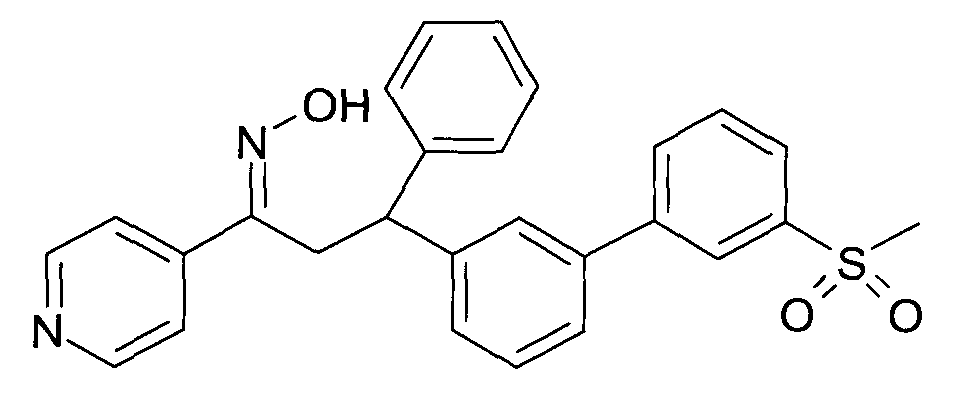
По аналогии с примером 22, из (E)-3-(3-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (пример 12) и (3-метилсульфонилфенил)бороновой кислоты получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=457.2 ([M+H]+.
Пример 24
(E)-3-(4'-метансульфонил-бифенил-3-ил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим
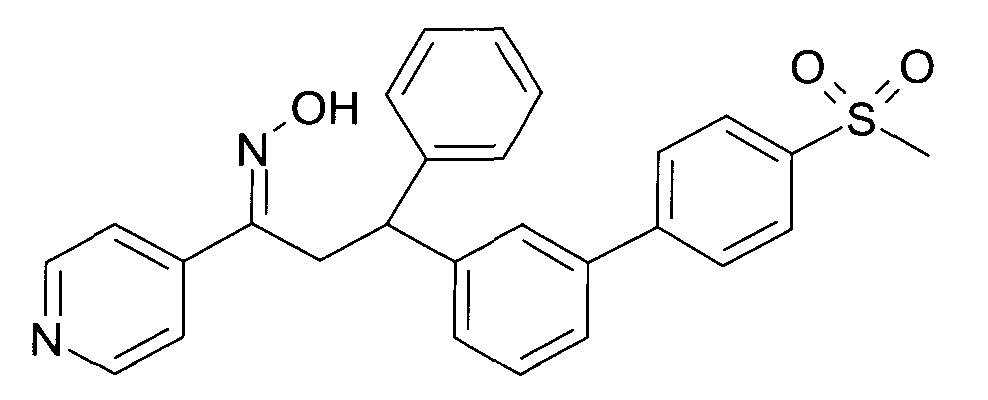
По аналогии с примером 22, из (Е)-3-(3-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (пример 12) и (4-метилсульфонилфенил)бороновой кислоты получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+); m/z=457.3 ([M+H]+.
Пример 25
(E)-3-[4-(6-метил-пиридин-3-ил)-фенил]-3-фенил-1-пиридин-4-ил-пропан-1-она оксим
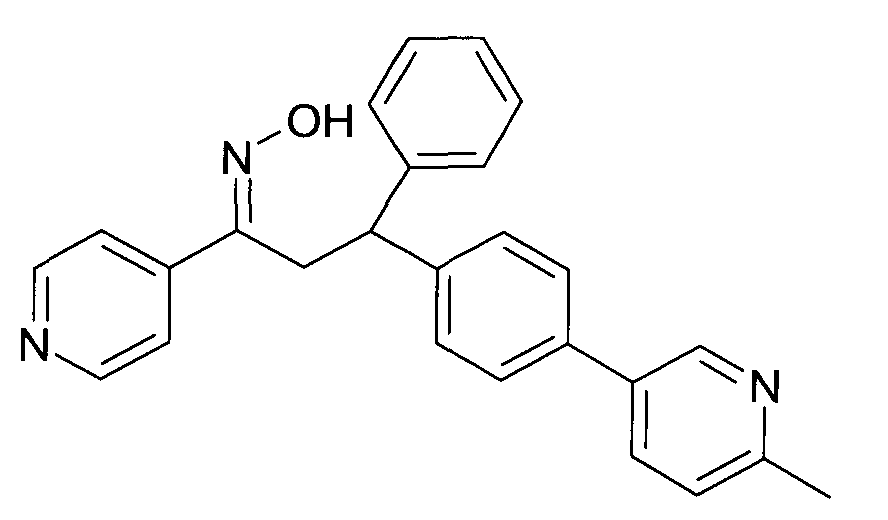
По аналогии с примером 22, из (E)-3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (пример 5) и 6-метилпиридин-3-бороновой кислоты получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=394.1 ([M+H]+.
Пример 26
(E)-3-(4'-этансульфонил-бифенил-4-ил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим
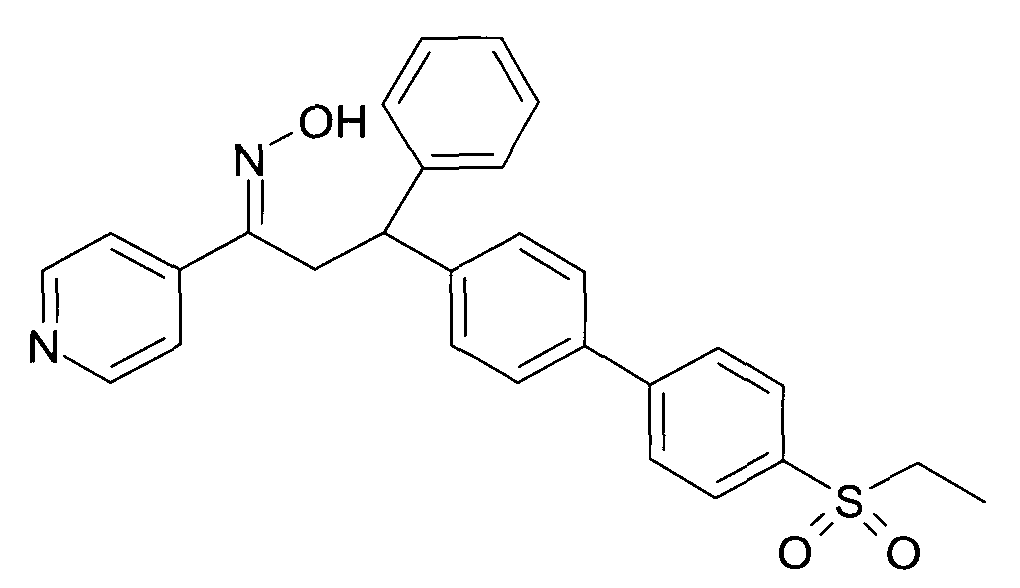
По аналогии с примером 22, из (E)-3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (пример 5) и 4-(этансульфонил)бензолбороновой кислоты получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=471.1 ([M+H]+).
Пример 27
(E)-3-(4'-гидроксиметил-бифенил-4-ил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксим
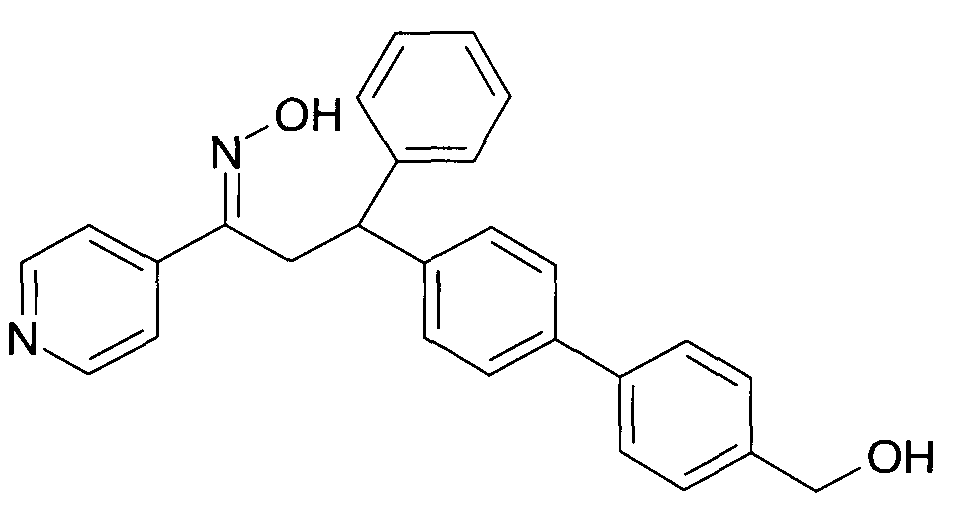
По аналогии с примером 22, из (E)-3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (пример 5) и 4-(гидроксиметил)фенилбороновой кислоты получили соединение, указанное в заголовке, в виде желтой пены, MS (ESI+): m/z=409.2 ([M+H]+).
Пример 28
(4'-{3-[(E)-гидроксимино]-1-фенил-3-пиридин-4-ил-пропил}-бифенил-3-илокси)-уксусной кислоты этиловый эфир
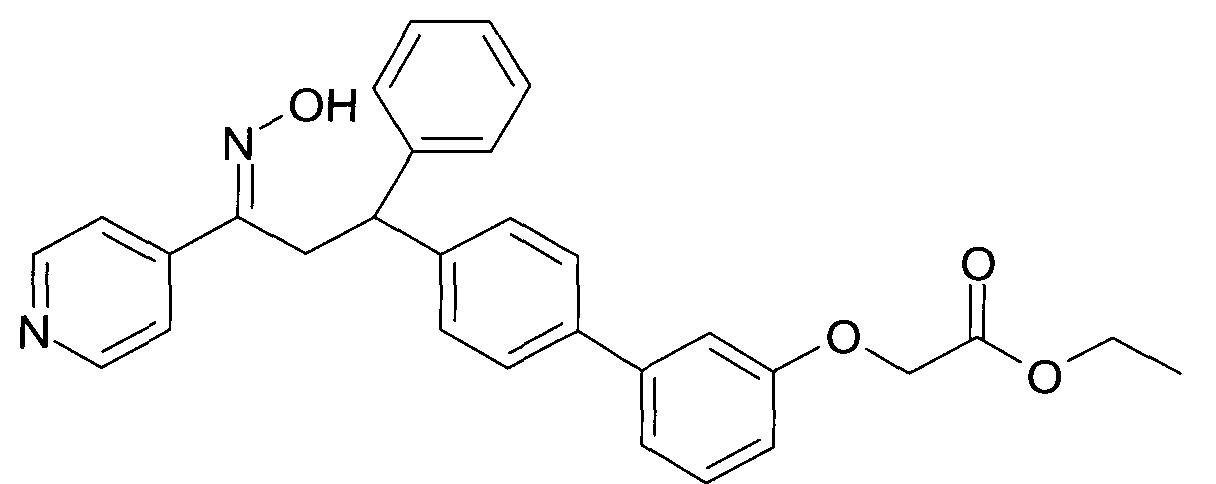
По аналогии с примером 22, из (E)-3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (пример 5) и 3-(этоксикарбонил)метоксифенилбороновой кислоты пинаколинового эфира получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=481.3 ([M+H]+).
Пример 29
3-(4'-метансульфонил-бифенил-3-ил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
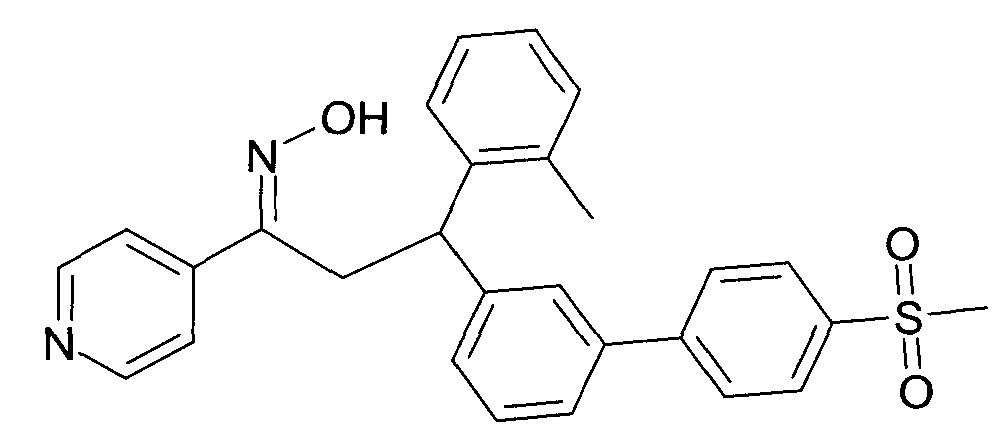
По аналогии с примером 22, из 3-(3-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксима (пример 11) и (4-метилсульфонилфенил)бороновой кислоты получили соединение, указанное в заголовке, в виде смеси Е и Z изомеров (3:1) в виде желтого масла, MS (ESI+): m/z=471.1 ([M+H]+).
Пример 30
3-(3'-метансульфонил-бифенил-3-ил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
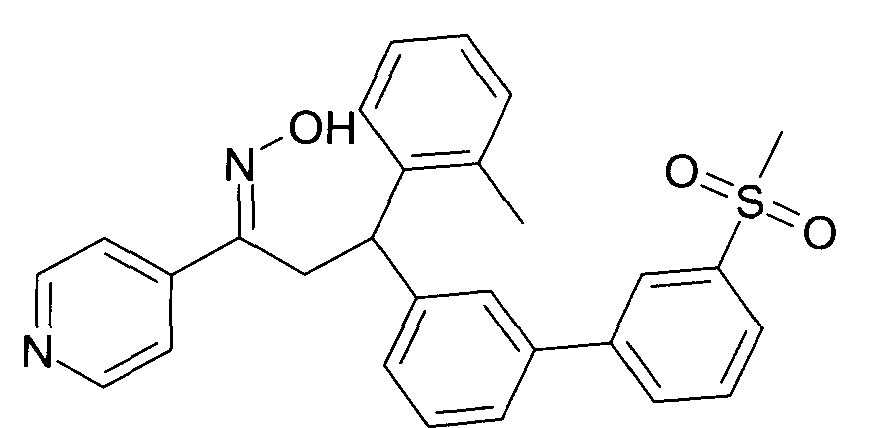
По аналогии с примером 22, из 3-(3-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксима (пример 11) и (3-метилсульфонилфенил)бороновой кислоты получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (3:1) в виде белой пены, MS (ESI+): m/z=471.2 ([M+H]+).
Пример 31
3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
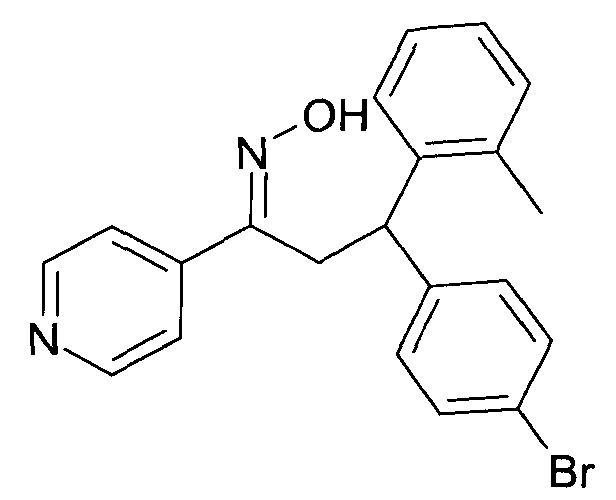
Стадия 1: 3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-он По аналогии с примером 1, стадия 1, из 3-(4-бром-фенил)-1-пиридин-4-ил-пропенона (CAS RN: [16232-03-4]) и о-толилбороновой кислоты получили соединение, указанное в заголовке, в виде желтой пены, MS (ESI+): m/z=380.1 ([M+H]+, 1Br).
Стадия 2: 3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (2.5:1) в виде белой пены, MS (ESI+): m/z=395.1 ([M+H]+, 1Br).
Пример 32 3-(3'-метансульфонил-бифенил-4-ил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
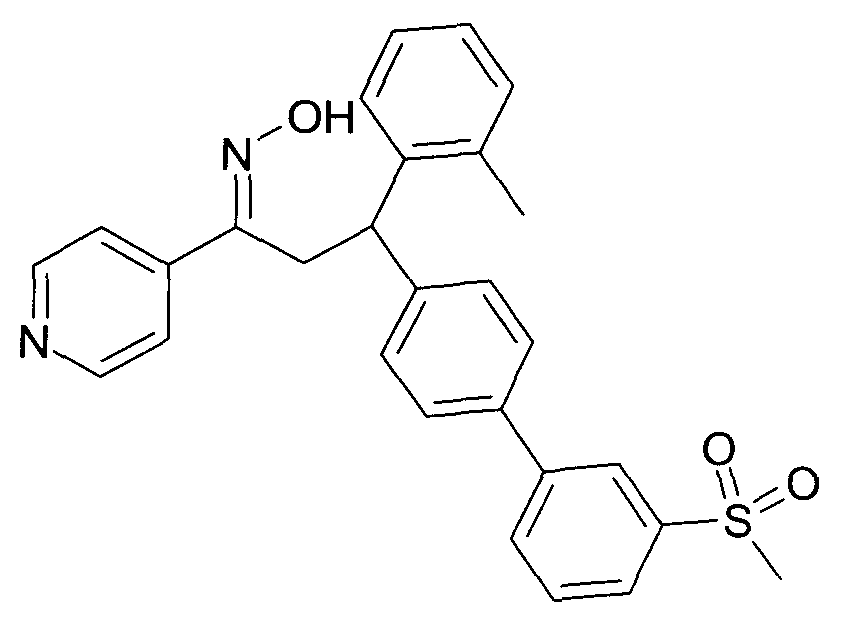
По аналогии с примером 22, из 3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксима (пример 31) и (3-метилсульфонилфенил)бороновой кислоты получили соединение, указанное в заголовке, в виде смеси Е и Z изомеров (2:1) в виде белой пены, MS (ESI+): m/z=471.1 ([M+H]+).
Пример 33
3-(4'-метансульфонил-бифенил-4-ил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
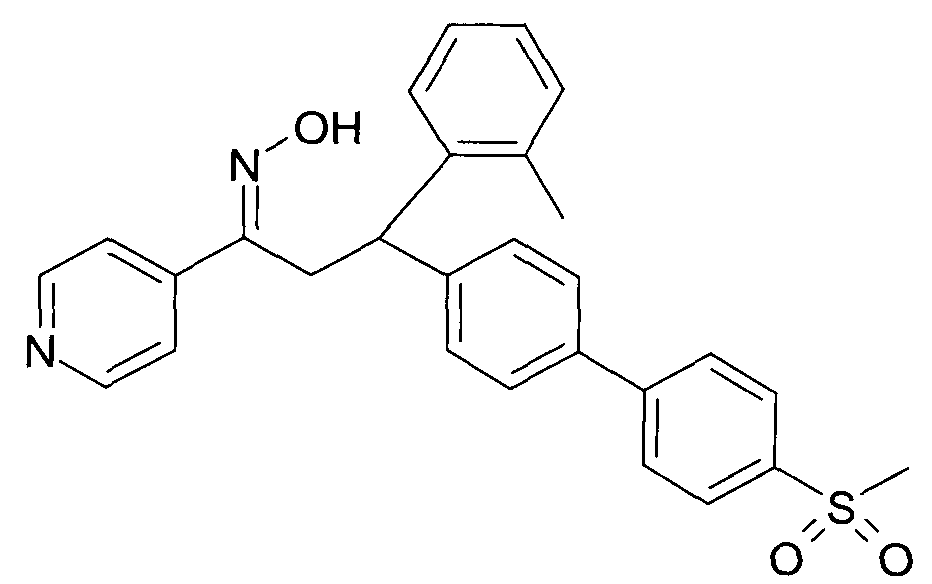
По аналогии с примером 22, из 3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксима (пример 31) и 4-(метилсульфонил)фенилбороновой кислоты получили соединение, указанное в заголовке, в виде смеси Е и Z изомеров (2:1) в виде белого осадка, MS (ESI+): m/z=471.1 ([M+H]+).
Пример 34
1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим
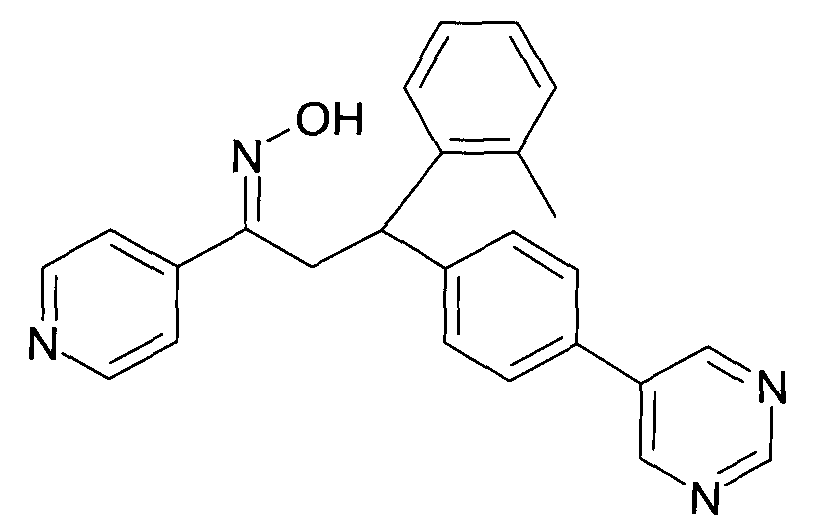
По аналогии с примером 22, из 3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксима (пример 31) и пиримидин-5-бороновой кислоты получили соединение, указанное в заголовке, в виде смеси Е и Z изомеров (2.3:1) в виде белой пены, MS (ESI+): m/z=395.2 ([M+H]+).
Примеры с 35 по 38
(+)-(E)-1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим,
(-)-(E)-1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим,
(-)-(Z)-1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим и
(+)-(Z)-1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим

Разделение 1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксима (пример 34) с помощью хиральной ВЭЖХ на Chiralpak AD колонке с 30% этанолом в л-гептане дало (+)-(E)-1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим в виде белого осадка, MS (ESI+): m/z=395.2 ([M+H]+), (-)-(E)-1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим в виде белого осадка, MS (ESI+): m/z=395.2 ([M+H]+), (-)-(Z)-1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим в виде белого осадка, MS (ESI+): m/z=395.2 ([M+H]+) и (+)-(Z)-1-пиридин-4-ил-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим в виде белого осадка, MS (ESI+): m/z=395.2 ([M+H]+).
Пример 39
(E)-3-{4-[(2-метокси-этил)-метил-амино]-фенил}-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
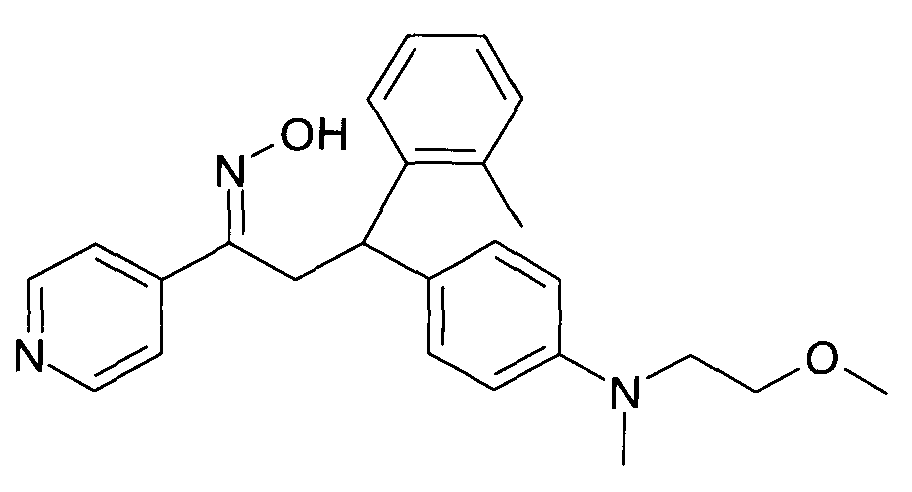
К суспензии трис(дибензилиденацетон)дипалладия (23 мг), трет-бутилата натрия (83 мг), 2(ди-трет-бутилфосфино)бифенила (15 мг) и 3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксима (пример 31, 200 мг) в толуоле (10 мл) добавили раствор N-(2-метоксиэтил)метиламина (158 мг) в толуоле (10 мл). Реакционную смесь перемешивали при 80°C в течение ночи, охладили до комнатной температуры и добавили насыщенный водный раствор NH4Cl. Фазы разделили и неорганический слой экстрагировали EtOAc (2x). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Колоночная хроматография на силикагеле (EtOAc/n-гептан 2:1 до EtOAc) дала (E)-3-{4-[(2-метокси-этил)-метил-амино]-фенил}-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим, содержащий менее чем 10% Z изомера (88 мг, 43%), в виде желтой пены, MS (ESI+): m/z=404.3 ([M+H]+).
Пример 40
3-(4-Piperidin-1-ил-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
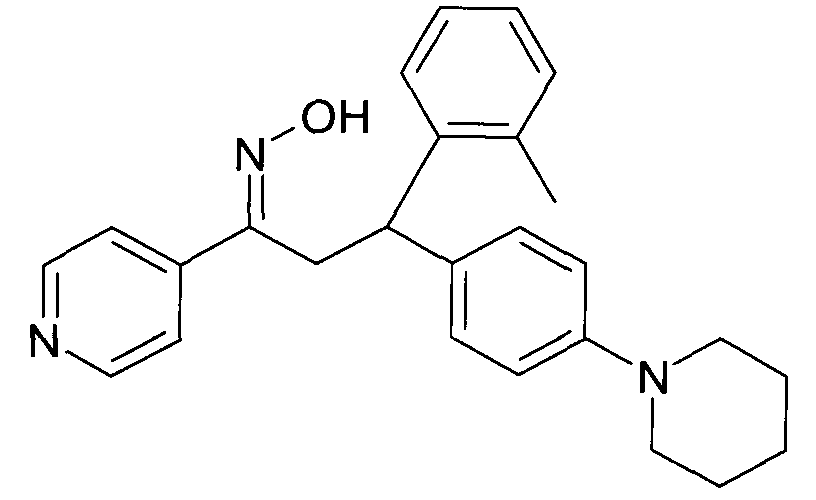
По аналогии с примером 39, из 3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксима (пример 31) и пиперидина получили 3-(4-пиперидин-1-ил-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим в виде смеси E и Z изомеров (2:1) в виде светло-желтого масла, MS (ESI+): m/z=400.3 ([M+H]+).
Пример 41
3-(4-Морфолин-4-ил-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
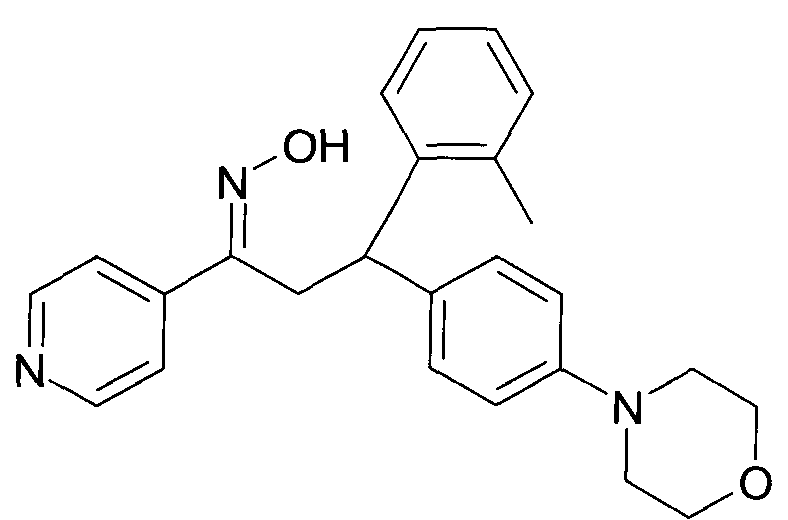
По аналогии с примером 39, из 3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксима (пример 31) и морфолина получили 3-(4-морфолин-4-ил-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим в виде смеси Е и Z изомеров (2:1) в виде желтого масла, MS (ESI+): m/z=402.3 ([M+H]+).
Пример 42 3-(4-диэтиламино-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
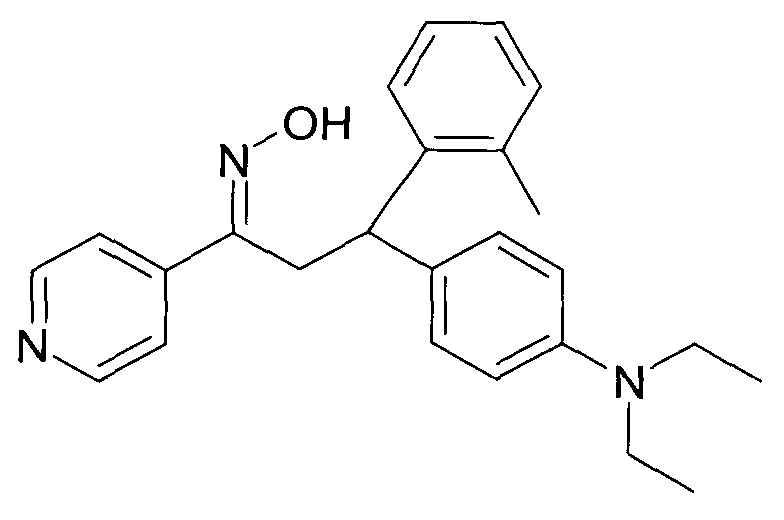
По аналогии с примером 39, из 3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксима (пример 31) и диэтиламина получили 3-(4-диэтиламино-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим в виде смеси Е и Z изомеров (6:1) в виде желтого масла, MS (ESI+): m/z=388.2 ([M+H]+).
Примеры 43 и 44
(Z)-3-(4-бром-фенил)-1-пиридин-4-ил-2-о-толил-пропан-1-она оксим и (E)-3-(4-бром-фенил)-1-пиридин-4-ил-2-о-толил-пропан-1-она оксим
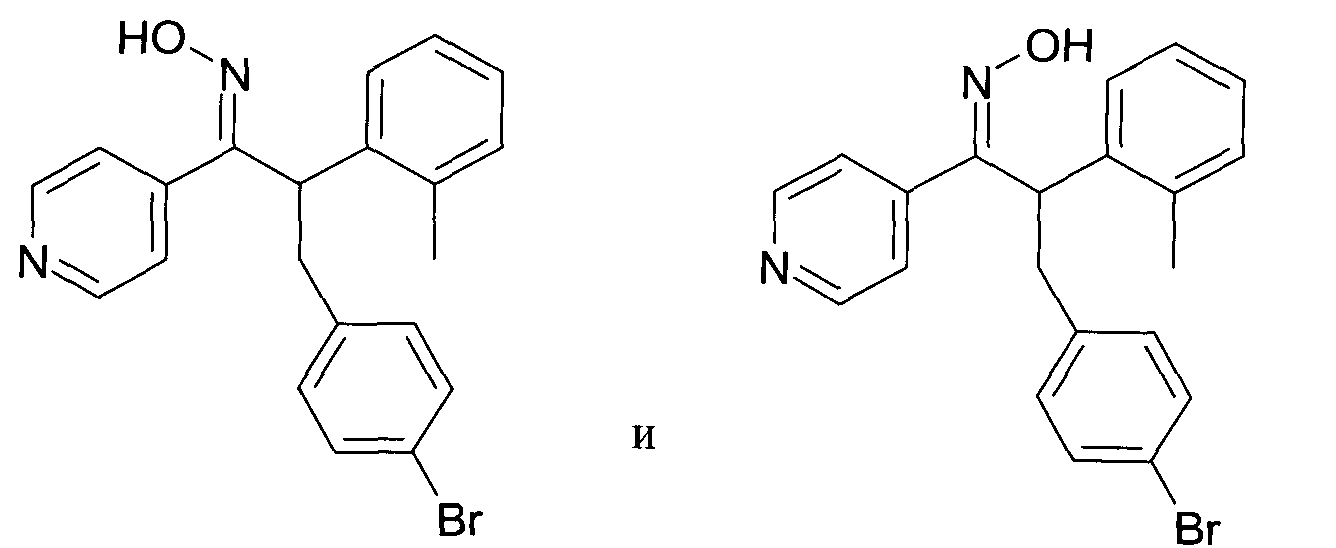
Стадия 1: 3-(4-бром-фенил)-1-пиридин-4-ил-2-о-толил-пропан-1-он К раствору 1-пиридин-4-ил-2-о-толил-этанона (CAS RN: [1184032-72-1]) (300 мг) в ТГФ (10 мл) добавили гидрид натрия (55% в минеральном масле, 65 мг) при комнатной температуре, и смесь нагревали при 45°C в течение 3 часов. Затем реакционную смесь охладили до 0°C, и по каплям добавили раствор 4-бромбензилбромида (390 мг) в ТГФ (2 мл). Затем смесь перемешивали при 50°C в течение 3 часов. К реакционной смеси добавили лед и воду, фазы разделили и неорганический слой экстрагировали EtOAc (2х). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Колоночная хроматография на силикагеле (EtOAc/n-гептан 1:2) дала соединение, указанное в заголовке, (105 мг, 19%) в виде желтого масла, MS (EI+): m/z=379 ([M]+, 1Br).
Стадия 2: (Z)-3-(4-бром-фенил)-1-пиридин-4-ил-2-о-толил-пропан-1 -она оксим и (Е)-3-(4-бром-фенил)-1-пиридин-4-ил-2-о-толил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-бром-фенил)-1-пиридин-4-ил-2-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили (Z)-3-(4-бром-фенил)-1-пиридин-4-ил-2-о-толил-пропан-1-она оксим в виде белой пены, MS (ESI+): m/z=395.0 ([M+H]+, 1Br) и (E)-3-(4-бром-фенил)-1-пиридин-4-ил-2-о-толил-пропан-1-она оксим в виде белой пены, MS (ESI+): m/z=395.0 ([M+H]+, 1Br).
Пример 45
3-(4-бром-фенил)-1-(2,6-диметил-пиридин-4-ил)-2-фенил-пропан-1-она оксим
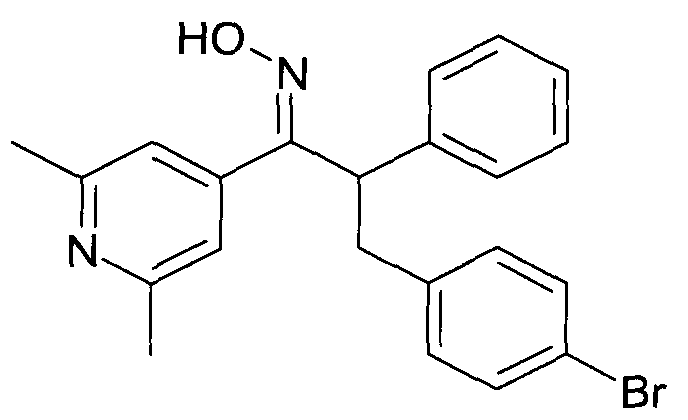
Стадии 1 и 2: 2.6-диметил-изоникотиновой кислоты бутиловый эфир К суспензии 2,6-дихлорпиридин-4-карбоновой кислоты (16 г) (CAS RN: [5398-44-7]) в n-бутаноле (150 мл) по каплям добавили тионилхлорид (9.1 мл). Реакционную смесь нагревали до кипения с обратным холодильником в течение 1,5 часов, охладили до комнатной температуры и затем добавили насыщенный водный раствор NaHCO3 (160 мл) (рН~7). Смесь экстрагировали EtOAc (2х 150 мл). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом с получением 2,6-дихлор-изоникотиновой кислоты бутилового эфира (21.51 г) в виде неочищенного продукта, который сразу использовали на следующей стадии.
К раствору неочищенного 2,6-дихлор-изоникотиновой кислоты бутилового эфира (21.51 г) и тетракис(трифенилфосфин)палладия(0) (3.0 г) в толуоле (250.0 мл) по каплям добавили диметилцинк (2М в толуоле, 65.0 мл). Реакционную смесь перемешивали при кипении с обратным холодильником в течение 2,5 часов, охладили до комнатной температуры и затем по каплям добавили насыщенный водный раствор NaHCO3 (250 мл). Фазы разделили и неорганическую фазу экстрагировали диэтиловым эфиром (2х 200 мл). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 1:4) с получением 2,6-диметил-изоникотиновой кислоты бутилового эфира (16,67 г, 96%, 2 стадии) в виде желтой жидкости, MS (ESI+): m/z=208.0 ([M+H]+).
Стадия 3: N-метокси-2,6,N-триметил-изоникотинамид
В атмосфере аргона суспензию 2,6-диметил-изоникотиновой кислоты бутилового эфира (16.67 г) и N,O-диметилгидроксиламина гидрохлорида (12.2 г) в ТГФ (150 мл) охладили до -20°C. Через 20 минут добавили раствор изопропилмагния хлорида (2М в ТГФ, 120.6 мл), поддерживая температуру ниже -5°C. Смесь перемешивали в течение 2,5 часов при -10°C и погасили насыщенным водным раствором NH4Cl (200 мл). Фазы разделили и неорганическую фазу экстрагировали EtOAc (2х). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Колоночная хроматография на силикагеле (EtOAc/n-гептан 2:1 до EtOAc) дала соединение, указанное в заголовке, (14.1 г, 90%) в виде желтой жидкости, MS (ESI+): m/z=195.0 ([M+H]+).
Стадия 4: 1-(2,6-диметил-пиридин-4-ил)-2-фенил-этанон
При -78°C, к раствору N-метокси-2,6,N-триметил-изоникотинамида (1 г) и бензилбромида (0.73 мл) в ТГФ (30 мл) по каплям добавили n-BuLi (1.6M в гексане, 6.6 мл). Реакционную смесь перемешивали при -78°C в течение 3 часов. Добавили насыщенный водный раствор NH4Cl (200 мл), фазы разделили и неорганическую фазу экстрагировали EtOAc (2х). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Колоночная хроматография на силикагеле (EtOAc/n-гептан 1:2) дала соединение, указанное в заголовке, (1.8 г, 99%) в виде бесцветной жидкости, MS (ESI+): m/z=226.1 ([M+H]+).
Стадия 5: 3-(4-бром-фенил)-1-(2,6-диметил-пиридин-4-ил)-2-фенил-пропан-1-он
По аналогии с примером 43, стадия 1, из 1-(2,6-диметил-пиридин-4-ил)-2-фенил-этанона и 4-бромбензилбромида получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=394.0 ([M+H]+), 1Br).
Стадия 6: 3-(4-бром-фенил)-1-(2,6-диметил-пиридин-4-ил)-2-фенил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-бром-фенил)-1-(2,6-диметил-пиридин-4-ил)-2-фенил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили 3-(4-бром-фенил)-1-(2,6-диметил-пиридин-4-ил)-2-фенил-пропан-1-она оксим в виде смеси E и Z изомеров (1:2) в виде белой пены, MS (ESI+): m/z=409.2 ([M+H]+), 1Br).
Пример 46
3-(4-бром-фенил)-1-(2-хлор-пиридин-4-ил)-3-фенил-пропан-1-она оксим
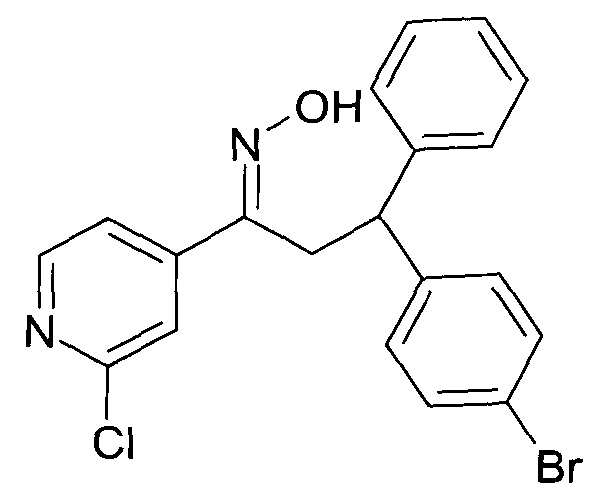
Стадия 1: 3-(4-бром-фенил)-1-(2-хлор-пиридин-4-ил)-пропенон
По аналогии с примером 11, стадия 1, из 4-бромбензальдегида и 1-(2-хлорпиридин-4-ил)этанона (CAS RN: [23794-15-2]) получили соединение, указанное в заголовке, в виде желтого осадка, MS (EI+): m/z=321 ([М]+, 1Br, 1Cl).
Стадии 2 и 3: 3-(4-бром-фенил)-1-(2-хлор-пиридин-4-ил)-3-фенил-пропан-1-она оксим
По аналогии с примером 1, стадия 1, из 3-(4-бром-фенил)-1-(2-хлор-пиридин-4-ил)-пропенона и фенилбороновой кислоты получили 3-(4-бром-фенил)-1-(2-хлор-пиридин-4-ил)-3-фенил-пропан-1-он в виде желтого осадка, который сразу использовали на следующей стадии.
По аналогии с примером 1, стадия 2, из 3-(4-бром-фенил)-1-(2-хлор-пиридин-4-ил)-3-фенил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (2.6:1) в виде бесцветного масла, MS (ESI-): m/z=413.0 ([М-Н]-, 1Br, 1Cl).
Пример 47
(E)-3-(4-бром-фенил)-1-(2,6-дихлор-пиридин-4-ил)-3-фенил-пропан-1-она оксим
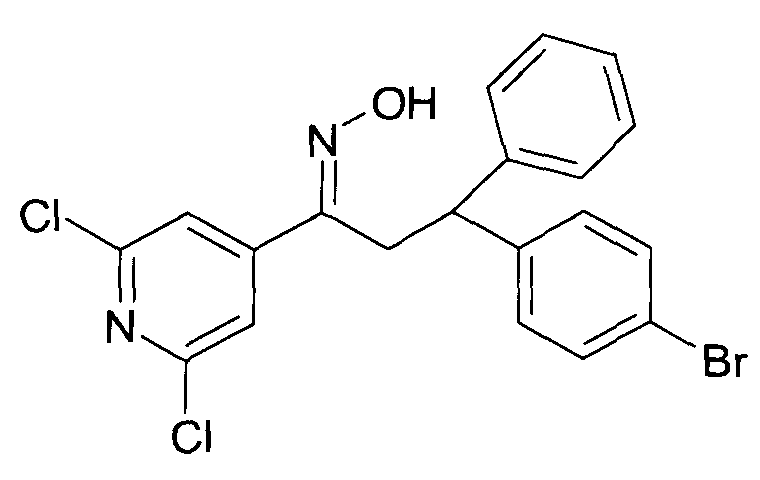
Стадии 1 и 2: 3-(4-бром-фенил)-1-(2.6-дихлор-пиридин-4-ил)-3-фенил-пропан-1-он
По аналогии с примером 11, стадия 1, из 4-бромбензальдегида и 1-[2,6-дихлорпиридин-4-ил]этанона (CAS RN: [185319-20-4]) получили 3-(4-бром-фенил)-1-(2,6-дихлор-пиридин-4-ил)-пропенон в виде желтого осадка, который сразу использовали на следующей стадии.
По аналогии с примером 1, стадия 1, из 3-(4-бром-фенил)-1-(2,6-дихлор-пиридин-4-ил)-пропенона и фенилбороновой кислоты получили соединение, указанное в заголовке, в виде бесцветного масла, MS (EI+): m/z=433 ([М]+, 1Br, 1Cl).
Стадия 3: 3-(4-бром-фенил)-1-(2,6-дихлор-пиридин-4-ил)-3-фенил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из (E)-3-(4-бром-фенил)-1-(2,6-дихлор-пиридин-4-ил)-3-фенил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=449.0 ([M+H]+, 1Br, 1Cl).
Пример 48
(E)-3-(4-бром-фенил)-3-о-толил-1-(2,3,5-трифтор-фенил)-пропан-1-она оксим
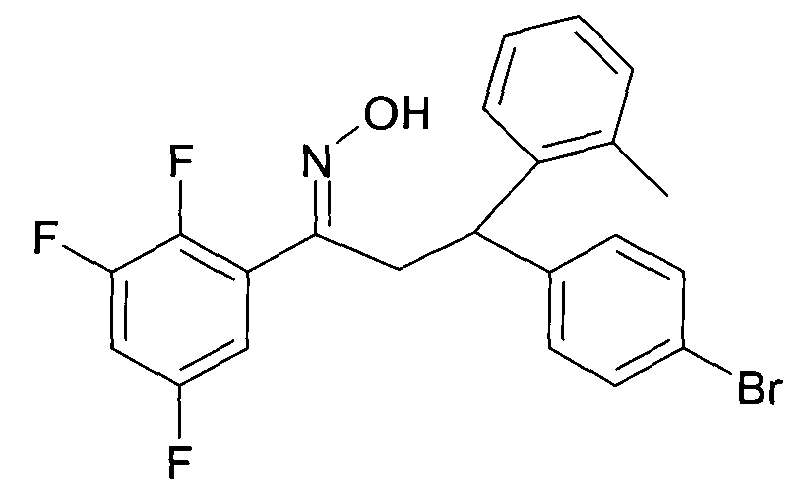
Стадии 1 и 2: 3-(4-бром-фенил)-3-о-толил-1-(2,3,5-трифтор-фенил)-пропан-1-он
По аналогии с примером 11, стадия 1, из 4-бромбензальдегида и 2,3,5-трифторацетофенона (CAS RN: [243459-93-0]) получили (E)-3-(4-бром-фенил)-1-(2,3,5-трифтор-фенил)-пропенон в виде желтого осадка, который сразу использовали на следующей стадии.
По аналогии с примером 1, стадия 1, из (E)-3-(4-бром-фенил)-1-(2,3,5-трифтор-фенил)-пропенона и фенилбороновой кислоты получили соединение, указанное в заголовке, в виде бесцветного масла, MS (EI): m/z=432 ([M]+, 1Br).
Стадия 3: (E)-3-(4-бром-фенил)-3-о-толил-1 -(2,3,5-трифтор-фенил)-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-бром-фенил)-3-о-толил-1-(2,3,5-трифтор-фенил)-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде белой пены, MS (ESI-): m/z=446.0 ([М-Н]-, 1Br).
Пример 49
3-(4-бром-фенил)-1-(2,5-дихлор-фенил)-3-о-толил-пропан-1-она оксим
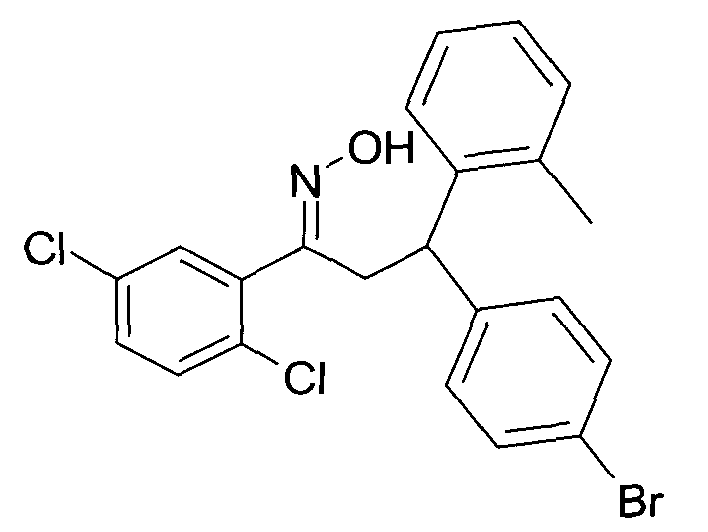
Стадии 1-3: 3-(4-бром-фенил)-1-(2.5-дихлор-фенил)-3-о-толил-пропан-1-она оксим
К раствору 4-бромбензальдегида (1.5 г) и 2,5-дихлорацетофенона (2.30 г) в MeOH (12 мл) добавили 2М NaOH (12.16 мл) при 0°C. Раствор перемешивали при 50°C в течение 2 часов и при комнатной температуре в течение ночи. Преципитат удалили фильтрацией и промыли смесью MeOH:вода (1:1). Неочищеный продукт очистили колоночной хроматографией на силикагеле (EtOAc) с получением 3-(4-бром-фенил)-1-(2,5-дихлор-фенил)-пропенона в виде желтого масла (2.98 г), который сразу использовали в следующей реакции.
По аналогии с примером 1, стадия 1, из 3-(4-бром-фенил)-1-(2,5-дихлор-фенил)-пропенона и o-толилбороновой кислоты получили 3-(4-бром-фенил)-1-(2,5-дихлор-фенил)-3-о-толил-пропан-1-он в виде светло-желтого масла, который сразу использовали на следующей стадии.
По аналогии с примером 1, стадия 2, из 3-(4-бром-фенил)-1-(2,5-дихлор-фенил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (2,4:1) в виде белой пены, MS (EI): m/z=463 ([M]+, 1Br).
Примеры 50 и 51
(+)-(E)-3-(4-бром-фенил)-1-(2,5-дихлор-фенил)-3-о-толил-пропан-1-она оксим и (-)-(E)-3-(4-бром-фенил)-1-(2,5-дихлор-фенил)-3-о-толил-пропан-1-она оксим
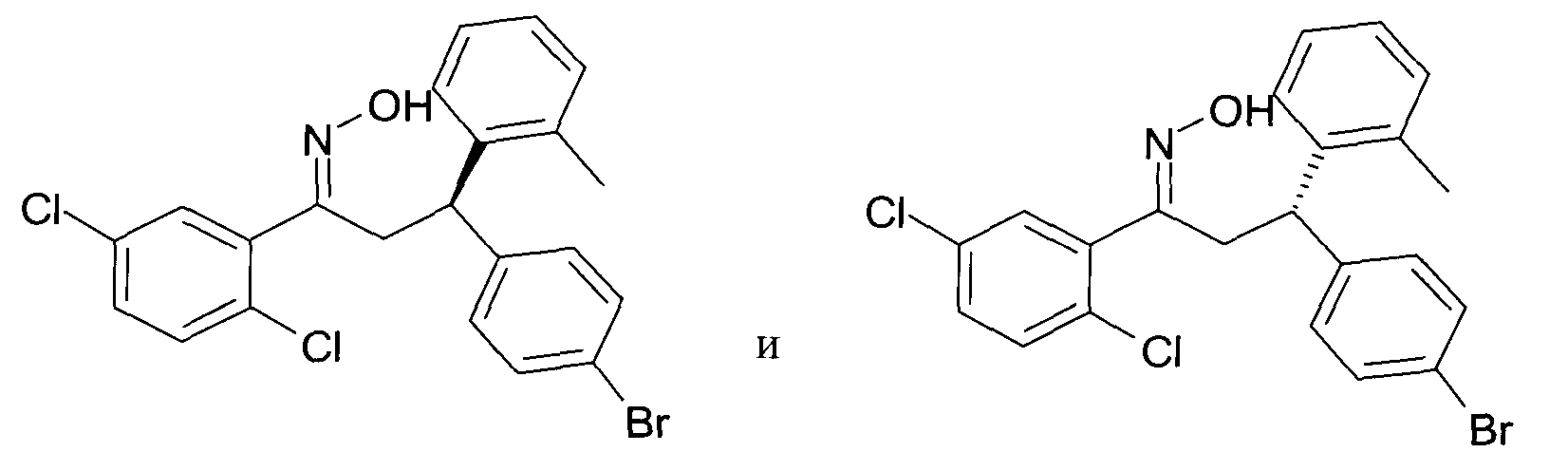
Разделение 3-(4-бром-фенил)-1-(2,5-дихлор-фенил)-3-о-толил-пропан-1-она оксима (пример 49) с помощью хиральной ВЭЖХ на Chiralpak AD колонке 5% изопропанолом в n-гептане дало (+)-(E)-3-(4-бром-фенил)-1-(2,5-дихлор-фенил)-3-о-толил-пропан-1-она оксим в виде белой пены, MS (ESI-): m/z=459.9 ([М-Н]-, 1Br, 1Cl) и (-)-(E)-3-(4-бром-фенил)-1-(2,5-дихлор-фенил)-3-о-толил-пропан-1-она оксим в виде белой пены, MS (ESI-): m/z=460.0 ([М-Н]-, 1Br, 1Cl).
Пример 52
(E)-3-(4-бром-фенил)-1-(2,5-дифтор-фенил)-3-о-толил-пропан-1-она оксим
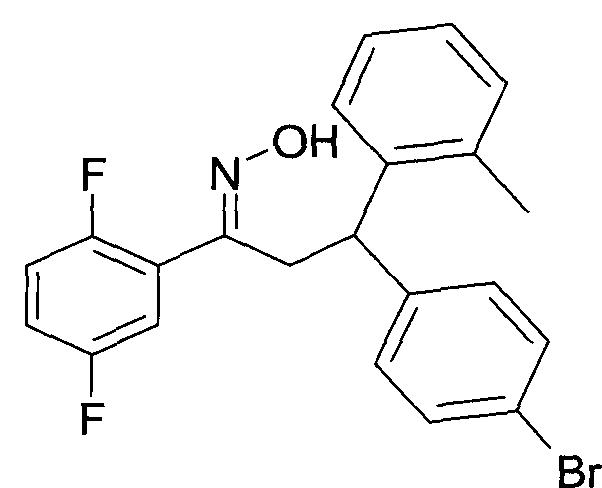
Стадия 1: 3-(4-бром-фенил)-1-(2,5-дифтор-фенил)-пропенон
По аналогии с примером 49, стадия 1, из 4-бромбензальдегида и 2,5-дифтор-ацетофенона получили соединение, указанное в заголовке, в виде желтого осадка, MS (ESI+): m/z=323.1 ([M+H]+, 1Br).
Стадия 2: 3-(4-бром-фенил)-1-(2,5-дифтор-фенил)-3-о-толил-пропан-1-он
По аналогии с примером 1, стадия 1, из 3-(4-бром-фенил)-1-(2,5-дифтор-фенил)-пропенона и о-толилбороновой кислоты получили соединение, указанное в заголовке, в виде бесцветного масла, MS (EI): m/z=414 ([M]+, 1Br).
Стадия 3: (E)-3-(4-бром-фенил)-1-(2,5-дифтор-фенил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-бром-фенил)-1-(2,5-дифтор-фенил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде белой пены, MS (ESI-): m/z=428.0 ([М-Н]-, 1Br).
Пример 53
(E)-3-(4-бром-фенил)-1-(3,5-дисртор-фенил)-3-о-толил-пропан-1-она оксим

Стадия 1: 3-(4-бром-фенил)-1-(3,5-дифтор-фенил)-пропенон
По аналогии с примером 49, стадия 1, из 4-бромбензальдегида и 3,5-дифторацетофенона получили соединение, указанное в заголовке, в виде желтого осадка, MS (EI): m/z=322 ([M]+, 1Br).
Стадия 2: 3-(4-бром-фенил)-1-(3,5-дифтор-фенил)-3-о-толил-пропан-1-он
По аналогии с примером 1, стадия 1, из 3-(4-бром-фенил)-1-(3,5-дифтор-фенил)-пропенона и о-толилбороновой кислоты получили соединение, указанное в заголовке, в виде бесцветного осадка, MS (EI): m/z=414 ([M]+, 1Br).
Стадия 3: (E)-3-(4-бром-фенил)-1-(3,5-дифтор-фенил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-бром-фенил)-1-(3,5-дифтор-фенил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде белой пены, MS (EI): m/z=429 ([M]+, 1 Br).
Пример 54
(Е)-1-(3,5-дифтор-фенил)-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим
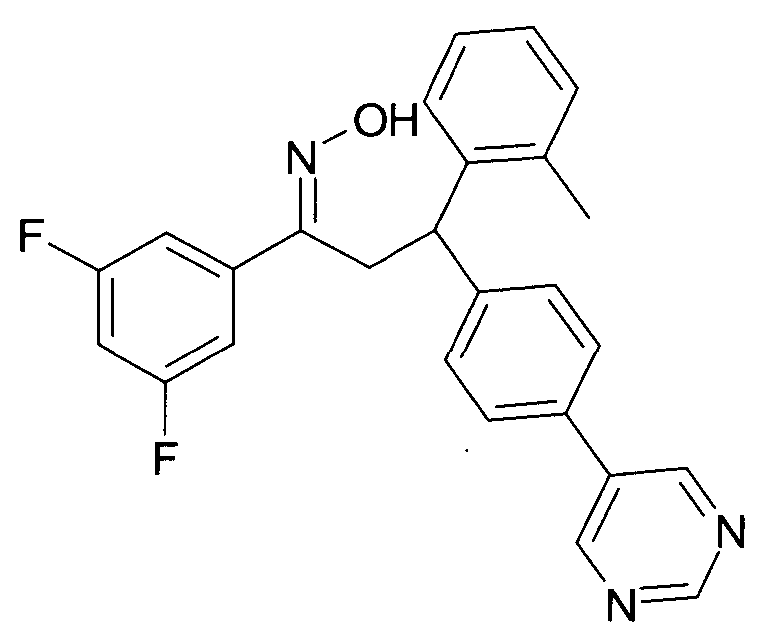
По аналогии с примером 22, из (Е)-3-(4-бром-фенил)-1-(3,5-дифтор-фенил)-3-о-толил-пропан-1-она оксима (пример 53) и пиримидин-5-бороновой кислоты получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=430.3 ([M+H]+).
Пример 55
1-(2-хлор-5-фтор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим
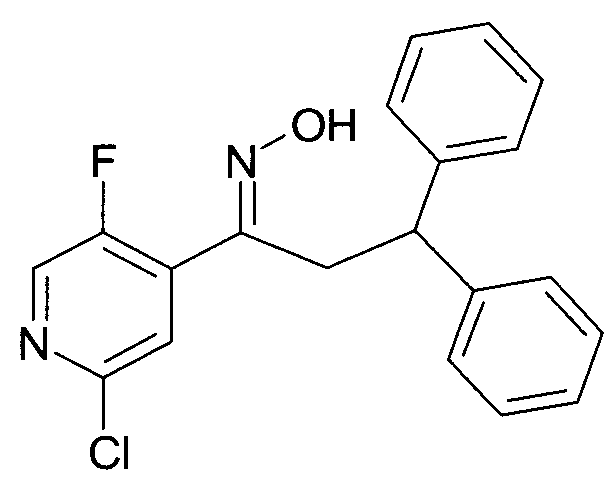
Стадия 1: N-метокси-N-метил-3,3-дифенил-пропионамид
К раствору 3,3-дифенилпропионовой кислоты ((CAS RN: [606-83-7]), 1.5 г) in ДМФ (17 мл) добавили TBTU (3.0 г) и Et3N (2.8 мл) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и снова охладили до 0°C. Добавили N,O-диметилгидроксиламина гидрохлорид (0.78 г) и смесь перемешивали при KT в течение 2 дней. Добавили насыщенный раствор NaHCO3 и ТВМЕ, фазы разделили и неорганическую фазу экстрагировали ТВМЕ. Объединенные органические слои промыли 1M KHSO4 и затем солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 1:1) с получением соединения, указанного в заголовке, в виде светло-коричневого масла (1.5 г, 84%), MS (ESI+): m/z=270.2 ([M+H]+).
Стадия 2: 1-(2-хлор-5-фтор-пиридин-4-ил)-3,3-дифенил-пропан-1-он
При -70°C к раствору 2-хлор-5-фтор-4-йодопиридина (873 мг) в ТГФ (20 мл) добавили n-бутиллитий (2.2 мл, 1.6М в гексане) медленно в течение 15 мин. К этому раствору добавили N-метокси-N-метил-3,3-дифенил-пропионамид (200 мг) в ТГФ (8 мл) и перемешивание продолжили при этой температуре в течение 1 ч. Добавили насыщенный раствор NH4Cl, смесь разбавили EtOAc, фазы разделили и неорганическую фазу экстрагировали EtOAc (2х). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (CH2Cl2/n-гептан 1:2) с получением соединения, указанного в заголовке, в виде белого осадка, MS (ESI+): m/z=340.09 ([М+H]+, 1Cl).
Стадия 3: 1-(2-хлор-5-фтор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 1-(2-хлор-5-фтор-пиридин-4-ил)-3,3-дифенил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили 1-(2-хлор-5-фтор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим в виде смеси Е и Z изомеров (1.8:1) в виде белой пены, MS (EI): m/z=354 ([M]+, 1Cl).
Пример 56
(E)-1-(2-фтор-6-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим
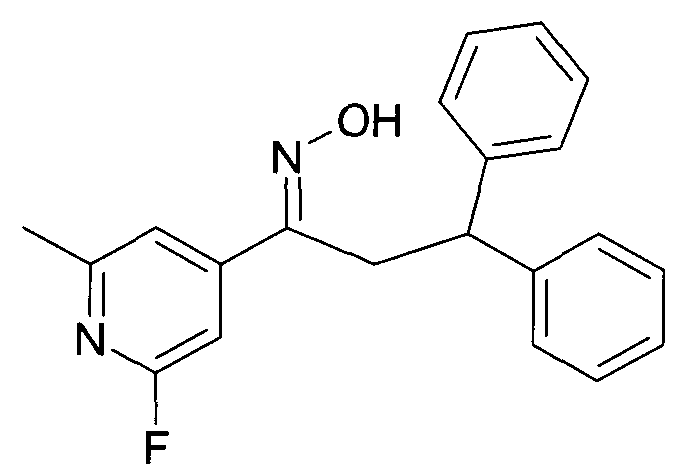
Стадия 1: 1-(2-фтор-6-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-он
По аналогии с примером 55, стадия 2, из N-метокси-N-метил-3,3-дифенил-пропионамида и 2-фтор-4-йодо-6-пиколина получили соединение, указанное в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=320.1449 ([M+H]+).
Стадия 2: (E)-1-(2-фтор-6-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 1-(2-фтор-6-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде белого масла, MS (ESI+): m/z=335.1553 ([M+H]+).
Пример 57
1-(2-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим
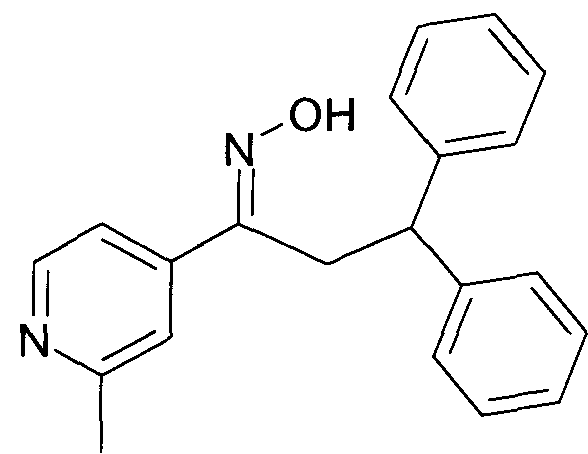
Стадия 1; 1-(2-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-он
По аналогии с примером 55, стадия 2, соединение, указанное в заголовке, получили из N-метокси-N-метил-3,3-дифенил-пропионамида и 4-бром-2-метилпиридина в виде бесцветного масла, MS (ESI+): m/z=302.15 ([M+H]+).
Стадия 2: 1-(2-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим По аналогии с примером 1, стадия 2, из 1-(2-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили 1-(2-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим в виде смеси E и Z изомеров (3:1) в виде белой пены, MS (ESI+): m/z=317.16 ([M+H]+).
Пример 58
1-(5-хлор-2-сртор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим
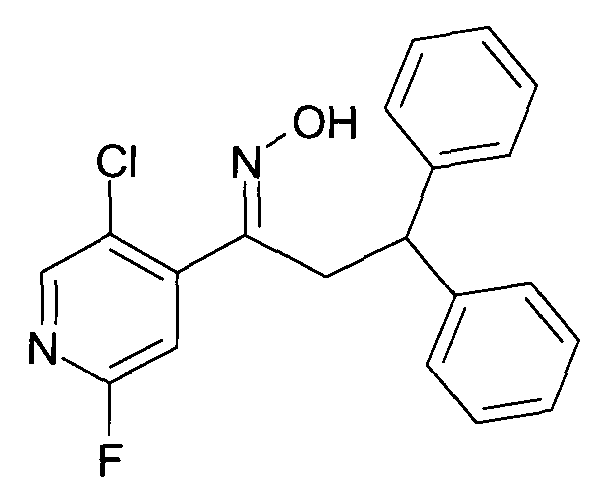
Стадия 1: 1-(5-хлор-2-фтор-пиридин-4-ил)-3,3-дифенил-пропан-1-он
По аналогии с примером 55, стадия 2,соединение, указанное в заголовке, получили из N-метокси-N-метил-3,3-дифенил-пропионамида и 5-хлор-2-фтор-4-йодопиридина в виде светло-желтой жидкости, MS (EI): m/z=339 ([M]+, 1Cl).
Стадия 2: 1-(5-хлор-2-фтор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 1-(5-хлор-2-фтор-пиридин-4-ил)-3,3-дифенил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили 1-(5-хлор-2-фтор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим в виде смеси E и Z изомеров (1.5:1) в виде белой пены, MS (EI): m/z=354 ([M]+ 1Cl).
Пример 59
1-(2-фтор-5-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим
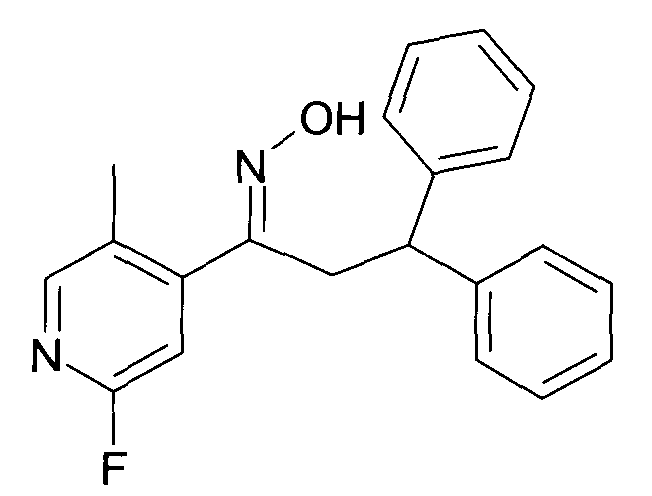
Стадия 1: 1-(2-фтор-5-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-он
По аналогии с примером 55, стадия 2, соединение, указанное в заголовке, получили из N-метокси-N-метил-3,3-дифенил-пропионамида и 2-фтор-4-йодо-5-пиколина (CAS RN: [153034-94-7]) в виде желтой жидкости, MS (ESI+): m/z=320.1 ([M+H]+).
Стадия 2: 1-(2-фтор-5-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 1-(2-фтор-5-метил-пиридин-4-ил)-3,3-дифенил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси ε и Z изомеров (1.5:1) в виде белого масла, MS (ESI+): m/z=335.1 ([M+H]+).
Пример 60
(E)-2-(10,11-дигидро-5H-дибензо[a,d]циклогептен-5-ил)-1-пиридин-4-ил-этанона оксим
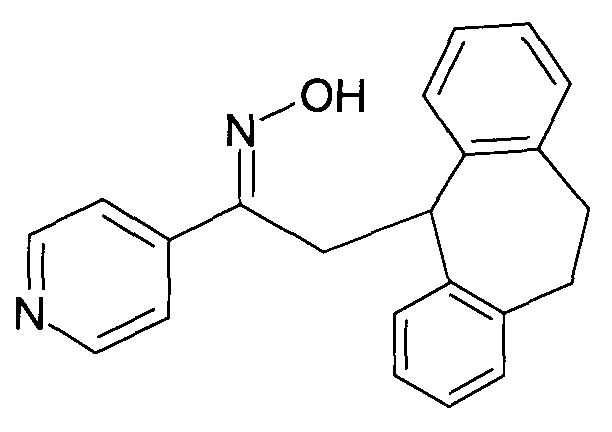
Стадия 1: 2-(10,11-дигидро-5H-дибензо[a,d]циклогептен-5-ил)-N-метокси-N-метил-ацетамид
По аналогии с примером 55, стадия 1, из 10,11-дигидро-5H-дибензо[a,d]циклогептен-5-уксусной кислоты (CAS RN: [4037-50-7]) и N,O-диметилгидроксиламина гидрохлорида получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=296.3 ([M+H]+).
Стадия 2: 2-(10,11-дигидро-5H-дибензо[a,d]циклогептен-5-ил)-1-пиридин-4-ил-этанон
По аналогии с примером 55, стадия 2, из 2-(10,11-дигидро-5H-дибензо[a,d]циклогептен-5-ил)-N-метокси-N-метил-ацетамида и 4-йодопиридина получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=314.1 ([M+H]+).
Стадия 3: 2-(10,11-дигидро-5Н-дибензо[a,d]циклогептен-5-ил)-1-пиридин-4-ил-этанона оксим
По аналогии с примером 1, стадия 2, из 2-(10,11 -дигидро-5H-дибензо[a,d]циклогептен-5-ил)-1-пиридин-4-ил-этанона и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, содержащее менее чем 5% Z-изомера, в виде белого осадка, MS (ESI+): m/z= ([M+H]+).
Пример 61
2-(9H-Флуорен-9-ил)-1-пиридин-4-ил-этанона оксим
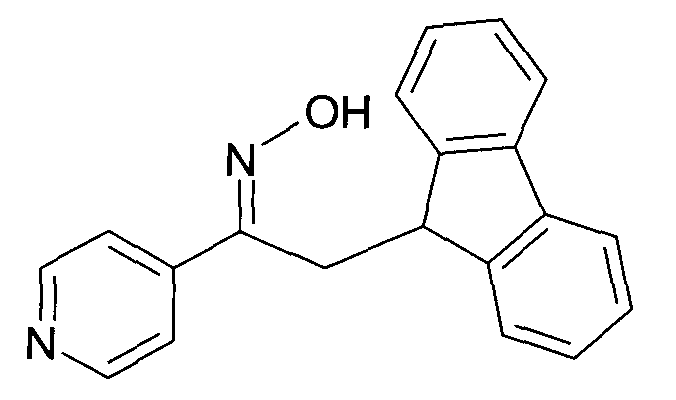
Стадия 1: 2-(9H-Флуорен-9-ил)-N-метокси-N-метил-ацетамид
По аналогии с примером 55, стадия 1, из флуорен-9-уксусной кислоты (CAS RN: [6284-80-6]) и N,O-диметилгидроксиламина гидрохлорид получили соединение, указанное в заголовке, в виде серо-белого масла, MS (ESI+): m/z=268.1 ([M+H]+).
Стадия 2: 2-(9H-Флуорен-9-ил)-1-пиридин-4-ил-этанон
По аналогии с примером 55, стадия 2, из 2-(9H-флуорен-9-ил)-N-метокси-N-метил-ацетамида и 4-йодопиридина с использованием изопропилмагния хлорид лития хлоридного комплекса в ТГФ при комнатной температуре (вместо n-BuLi при -70°C) получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=286.1 ([M+H]+).
Стадия 3: 2-(9H-Флуорен-9-ил)-1-пиридин-4-ил-этанона оксим
По аналогии с примером 1, стадия 2, из 2-(9H-флуорен-9-ил)-1-пиридин-4-ил-этанона и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси Е и Z изомеров (1:1) в виде белой пены, MS (ESI+): m/z=301.3 ([M+H]+).
Пример 62
3-(4-диметиламино-фенил)-3-(1H-индол-3-ил)-1-пиридин-4-ил-пропан-1-она оксим
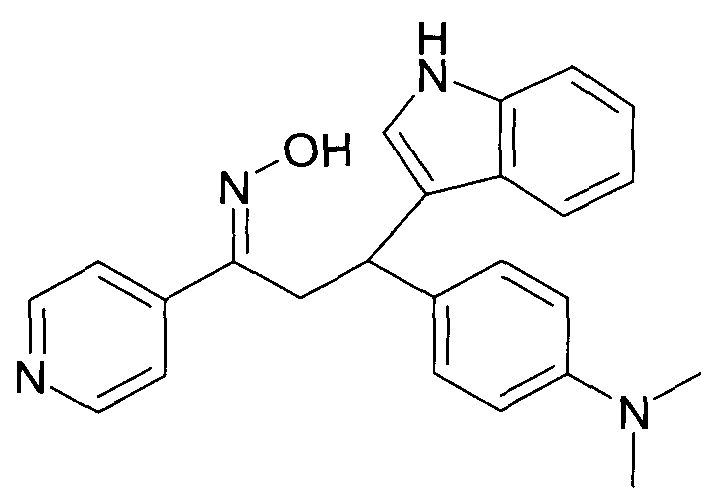
Стадия 1: 3-(4-диметиламино-фенил)-3-(1H-индол-3-ил)-1-пиридин-4-ил-пропан-1-он
К перемешанному раствору (E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-пропенона (CAS RN: [18461-18-2], 200 мг) и индола (93 мг) в ацетонитриле (2 мл) добавили хлорид сурьмы (III) (181 мг), и реакционную смесь нагревали до кипения с обратным холодильником в течение 4 часов. К реакционной смеси добавили воду, и смесь экстрагировали EtOAc (2х). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Колоночная хроматография на силикагеле (EtOAc/n-гептан 1:1 to EtOAc) дала соединение, указанное в заголовке, в виде желтого осадка (150 мг, 51%), MS (ESI+): m/z=370.2 ([M+H]+).
Стадия 2: 3-(4-диметиламино-фенил)-3-(1H-индол-3-ил)-1-пиридин-4-ил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-диметиламино-фенил)-3-(1H-индол-3-ил)-1-пиридин-4-ил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (2.8:1) в виде желтой пены, MS (ESI+): m/z=385.4 ([М+Н]+).
Пример 63
3-(4-диметиламино-фенил)-3-(2-метил-1H-индол-3-ил)-1-пиридин-4-ил-пропан-1-она оксим
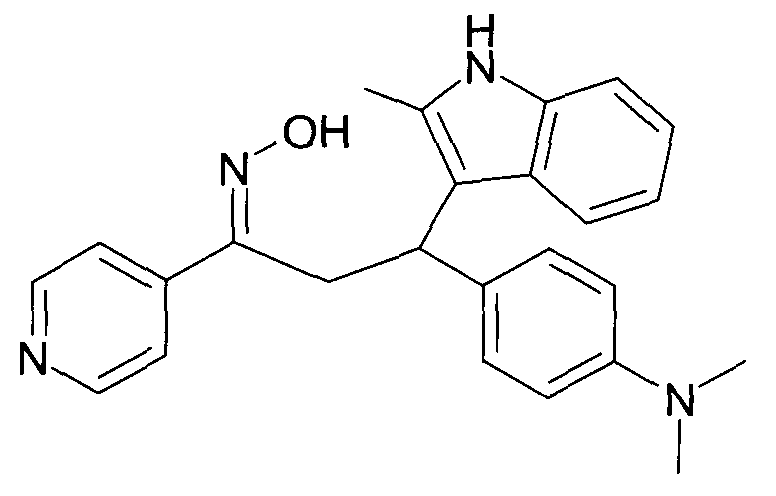
Стадия 1: 3-(4-диметиламино-фенил)-3-(2-метил-1H-индол-3-ил)-1-пиридин-4-ил-пропан-1-он
По аналогии с примером 62, стадия 1, из (E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-пропенона (CAS RN: [18461-18-2]) и 2-метилиндола (CAS RN: [90-25-5]) получили соединение, указанное в заголовке, в виде желтой пены, MS (ESI+): m/z=384.3 ([M+H]+).
Стадия 2: 3-(4-диметиламино-фенил)-3-(2-метил-1H-индол-3-ил)-1-пиридин-4-ил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-диметиламино-фенил)-3-(2-метил-1H-индол-3-ил)-1-пиридин-4-ил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (8.8:1) в виде желтой пены, MS (ESI+): m/z=399.3 ([M+H]+).
Пример 64
(E)-3-(4-диметиламино-фенил)-3-пиридин-2-ил-1-пиридин-4-ил-пропан-1-она оксим
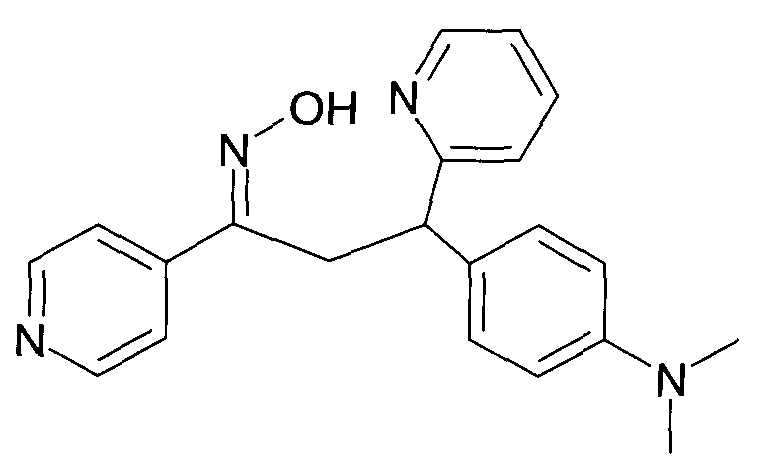
Стадия 1: 3-(4-диметиламино-фенил)-3-пиридин-2-ил-1-пиридин-4-ил-пропан-1-он
К йодиду меди (I) (151 мг), растворенному в дипропилсульфиде (0.226 мл), добавили диэтиловый эфир (7 мл) и полученный раствор охладили до 0°C. К этому раствору через воронку добавили свежеприготовленный раствор 2-пиридиллития (полученный из 2-бромпиридина (0.15 мл) в эфире (1 мл) с n-BuLi (1.6М в гексане, 0.99 мл) при -70°C, и перемешивали в течение 5 мин перед использованием). The dark раствор перемешивали в течение дополнительных 15 мин и затем добавили к раствору (E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-пропенона (CAS RN: [18461-18-2], 200 мг) в диэтиловом эфире (1.5 мл) при 0°C. Реакционную смесь перемешивали при 0°C в течение 3 часов и KT в течение ночи. Дополнительно получили реагент 2-пиридила меди и добавили при 0°C. Перемешивание продолжили при 0°C в течение 2 часов и при комнатной температуре в течение ночи. Реакционную смесь погасили насыщенным водным раствором NaHCO3, фазы разделили и неорганическую фазу экстрагировали EtOAc (2x). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Колоночная хроматография на силикагеле (EtOAc/n-гептан 2:1) дала соединение, указанное в заголовке, (41 мг, 16%) в виде оранжевого масла, MS (ESI+): m/z=332.3 ([M+H]+).
Стадия 2; (E)-3-(4-диметиламино-фенил)-3-пиридин-2-ил-1-пиридин-4-ил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-диметиламино-фенил)-3-пиридин-2-ил-1-пиридин-4-ил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде желтой пены, MS (ESI+): m/z=347.2 ([M+H]+).
Пример 65
(E)-3-(4-диметиламино-фенил)-3-(3-метил-пиридин-2-ил)-1-пиридин-4-ил-пропан-1-она оксим
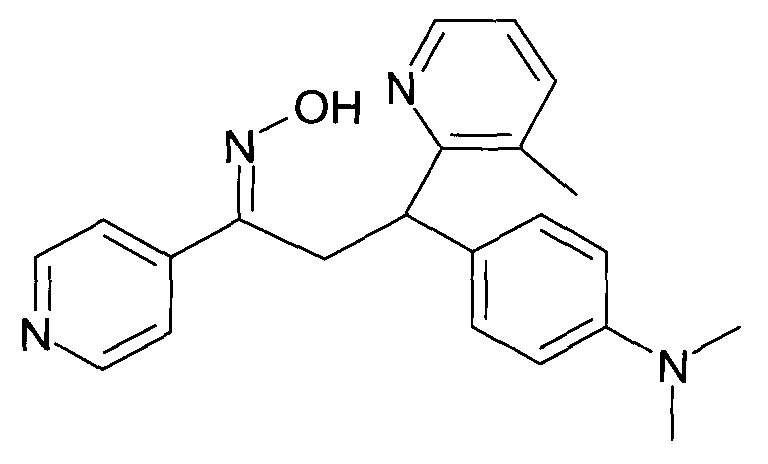
Стадия 1: 3-(4-диметиламино-фенил)-3-(3-метил-пиридин-2-ил)-1-пиридин-4-ил-пропан-1-он
По аналогии с примером 64, стадия 1, из (E)-3-(4-диметиламино-фенил)-1-пиридин-4-ил-пропенона (CAS RN: [18461-18-2]) и 2-бром-3-метилпиридина (CAS RN: [3430-17-9]) получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=346.1 ([M+H]+).
Стадия 2: (E)-3-(4-диметиламино-фенил)-3-(3-метил-пиридин-2-ил)-1-пиридин-4-ил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 3-(4-диметиламино-фенил)-3-(3-метил-пиридин-2-ил)-1-пиридин-4-ил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде желтой пены, MS (ESI+): m/z=361.3 ([M+H]+).
Пример 66
1-(2,6-диметил-пиридин-4-ил)-3,3-дифенил-пропенона оксим

Стадия 1; 1-(2,6-диметил-пиридин-4-ил)-3-фенил-пропинон
К раствору N-метокси-2,6,N-триметил-изоникотинамида (пример 45, стадия 3, 3.0 г) в ТГФ (75 мл) добавили фенилэтинилмагния бромид (1M в ТГФ, 30.9 мл) при 0°C. Реакционную смесь перемешивали при 0°C в течение 1 часа, при комнатной температуре в течение 1,5 часов и затем погасили добавлением насыщенного водного раствора NH4Cl (20 мл). Смесь перемешивали в течение дополнительных 30 мин. Фазы разделили и неорганическую фазу экстрагировали EtOAc (2х). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Колоночная хроматография на силикагеле (EtOAc/n-гептан 1:1) дала соединение, указанное в заголовке, (2.77 г, 76%) в виде серо-белого осадка, MS (ESI+): m/z=236.1 ([M+H]+).
Стадия 2: 1-(2,6-диметил-пиридин-4-ил)-3,3-дифенил-пропенон
При -78°C, к суспензии CuBr.DMS (2.9 г) в ТГФ (60 мл) по каплям добавили фениллитий (2M в дибутилэфире, 7.1 мл). После перемешивания смеси в течение 1,5 часов при -78°C, добавили 1-(2,6-диметил-пиридин-4-ил)-3-фенил-пропинон (2.77 г) в ТГФ (15 мл) и перемешивание продолжили при -78°C в течение 1,5 часов. Реакцию погасили добавлением насыщенного водного раствора NH4Cl. Фазы разделили и неорганическую фазу экстрагировали EtOAc (2х). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Колоночная хроматография на силикагеле (EtOAc/n-гептан 1:2) дала соединение, указанное в заголовке, (2.22 г, 60%) в виде желтого осадка, MS (ESI+): m/z=314.1 ([M+H]+).
Стадия 3: 1-(2,6-диметил-пиридин-4-ил)-3,3-дифенил-пропенона оксим
По аналогии с примером 1, стадия 2, из 1-(2,6-диметил-пиридин-4-ил)-3,3-дифенил-пропенона и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (1:1) в виде белой пены, MS (ESI+): m/z=329.2 ([M+H]+).
Пример 67
1-(2,6-диметил-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим
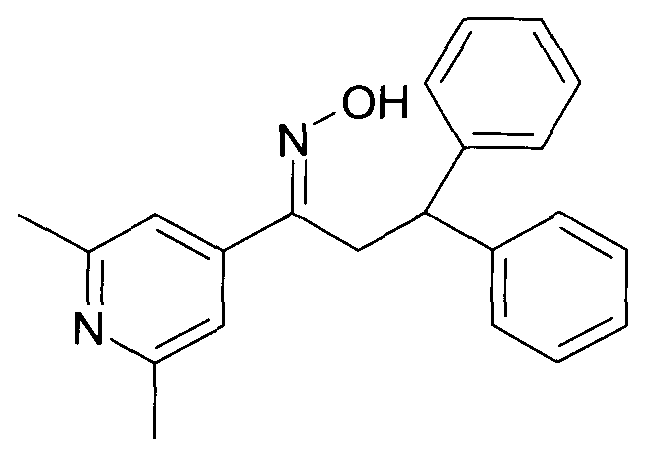
Стадия 1: 1-(2,6-диметил-пиридин-4-ил)-3,3-дифенил-пропан-1-он
В атмосфере аргона, к раствору 9-борабицикло[3,3.1]нонана (9-BBN, 0.5M в ТГФ, 0.7 мл) (CAS RN: [280-64-8]) в безводном дихлорметане (0.5 мл) по каплям добавили раствор 1-(2,6-диметил-пиридин-4-ил)-3,3-дифенил-пропенона (100 мг, пример 66, стадия 2) в безводном дихлорметане (0.5 мл). Смесь перемешивали при комнатной температуре в течение ночи. Добавили метанол (1 мл) и реакционную смесь интенсивно перемешивали в течение 10 мин. Раствор сконцентрировали и неочищенный продукт очистили с помошью колоночной хроматографии на силикагеле (EtOAc/n-гептан 1:1) с получением соединения, указанного в заголовке, (60 мг, 60%) в виде светло-желтого осадка, MS (ESI+): m/z=316.1 ([M+H]+).
Стадия 2: 1-(2,6-диметил-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 1-(2,6-диметил-пиридин-4-ил)-3,3-дифенил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (3:1) в виде белой пены, MS (ESI+): m/z=331.2 ([M+H]+).
Пример 68
(E)-1-(2,6-диметил-пиридин-4-ил)-3-фенил-3-пиридин-2-ил-пропан-1-она оксим
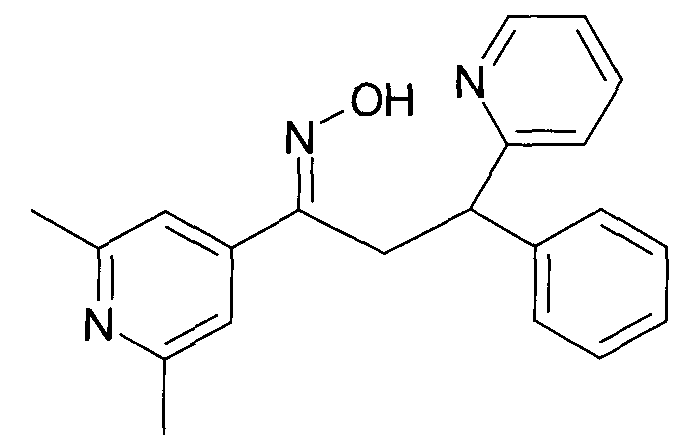
Стадия 1: 1-(2,6-диметил-пиридин-4-ил)-3-пиридин-2-ил-пропинон
К раствору 2-этинилпиридина (80 мг) в ТГФ (4 мл) добавили n-BuLi (1.6М в гексане, 0.39 мл) при -78°C. Реакционную смесь перемешивали при этой температуре в течение 15 минут и затем добавили раствор N-метокси-2,6,N-триметил-изоникотинамида (100 мг, пример 45, стадия 3) в ТГФ (1 мл). Реакционную смесь перемешивали при -78°C в течение 5 мин, при 0°C в течение 1,5 часов и затем погасили добавлением воды. Фазы разделили и неорганическую фазу экстрагировали EtOAc (3x). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Колоночная хроматография на силикагеле (EtOAc/n-гептан 1:2 до EtOAc) дала соединение, указанное в заголовке, (77 мг, 66%) в виде коричневого масла, MS (ESI+): m/z=237.2 ([M+H]+).
Стадия 2: 1-(2,6-диметил-пиридин-4-ил)-3-фенил-3-пиридин-2-ил-пропенон
По аналогии с примером 66, стадия 2, из 1-(2,6-диметил-пиридин-4-ил)-3-пиридин-2-ил-пропинона и фениллития получили соединение, указанное в заголовке, в виде оранжевого масла, MS (ESI+): m/z=315.0 ([M+H]+).
Стадия 3: 1-(2,6-диметил-пиридин-4-ил)-3-фенил-3-пиридин-2-ил-пропан-1-он
По аналогии с примером 67, стадия 1, из 1-(2,6-диметил-пиридин-4-ил)-3-фенил-3-пиридин-2-ил-пропенона с 9-BBN получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=317.2 ([M+H]+).
Стадия 4: (E)-1-(2,6-диметил-пиридин-4-ил)-3-фенил-3-пиридин-2-ил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из 1-(2,6-диметил-пиридин-4-ил)-3-фенил-3-пиридин-2-ил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=332.3 ([M+H]+).
Пример 69
3-{3-[(E)-гидроксимино]-1-фенил-3-пиридин-4-ил-пропил}-бензойная кислота
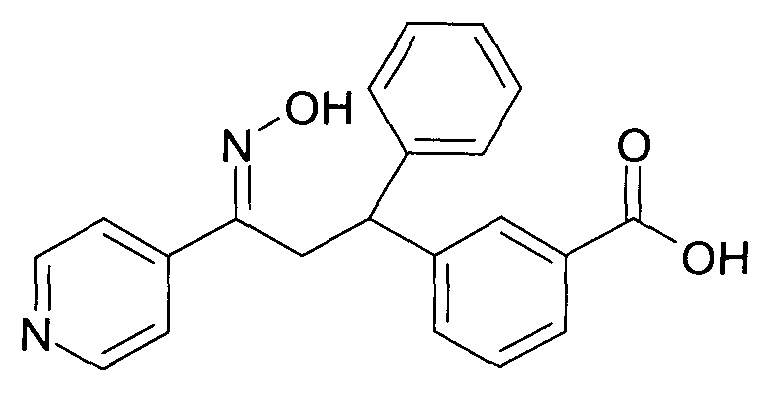
При -78°C, к раствору (E)-3-(3-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (60 мг, пример 12) в ТГФ (1.5 мл) по каплям добавили n-BuLi (1.6 М в гексане, 0.11 мл). После перемешивания в течении 30 мин при этой температуре раствор барботировали диоксидом углерода в течение 5 мин при -78°C. Реакционную смесь затем нагревали до 0°C и перемешивали в течение 15 минут. Реакцию погасили добавлением 1н водного раствора KHSO4, фазы разделили и неорганическую фазу экстрагировали EtOAc (2х). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Колоночная хроматография на силикагеле (CH2Cl/MeOH 97:3) привела к 3-{3-[(E)-гидроксиимино]-1-фенил-3-пиридин-4-ил-пропил}-бензойной кислоте (16 мг, 29%) в виде желтой пены, MS (ESI+): m/z=347.1391 ([M+H]+).
Пример 70
4-{3-[гидроксиимино]-3-пиридин-4-ил-1-о-толил-пропил}-бензойная кислота
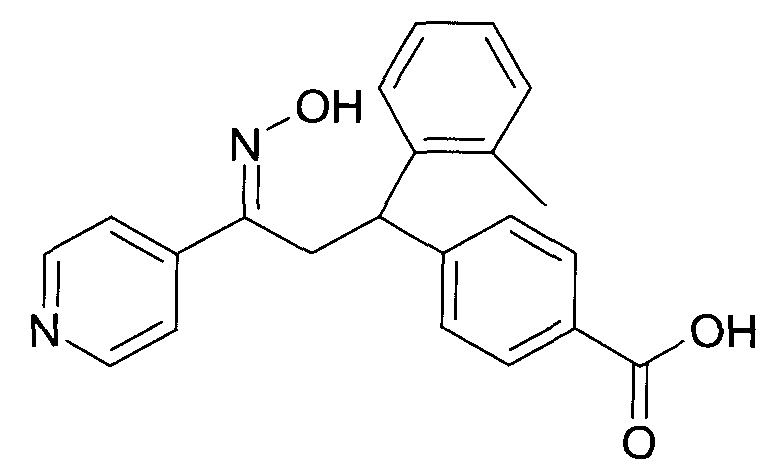
По аналогии с примером 69, из 3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима получили 4-{3-[гидроксиимино]-3-пиридин-4-ил-1-о-толил-пропил}-бензойную кислоту в виде смеси E и Z изомеров (1.5:1) в виде белого осадка, MS (ESI+): m/z=361.1532 ([M+H]+).
Пример 71
3-{3-[гидроксиимино]-3-пиридин-4-ил-1-о-толил-пропил}-бензойная кислота
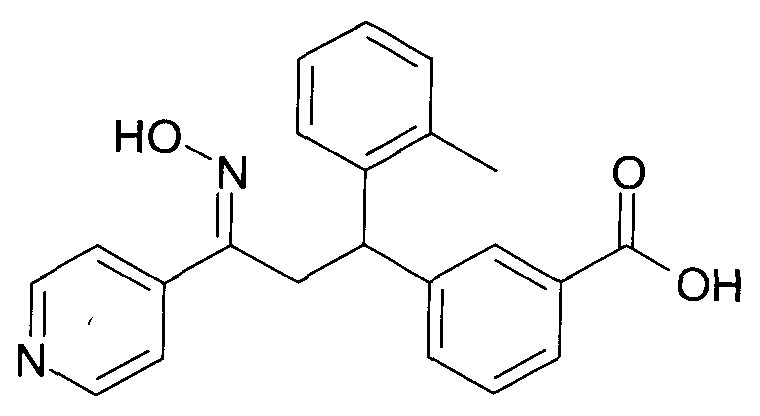
По аналогии с примером 69, из 3-(3-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксима (пример 12) получили 3-{3-[гидроксиимино]-3-пиридин-4-ил-1-о-толил-пропил}-бензойную кислоту в виде смеси Е и Z изомеров (1:2.5) в виде светло-желтой пены, MS (ESI+): m/z=361.1538 ([M+H]+).
Примеры 72 и 73
(E)-1-(2,6-дихлор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим и (Z)-1-(2,6-дихлор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим
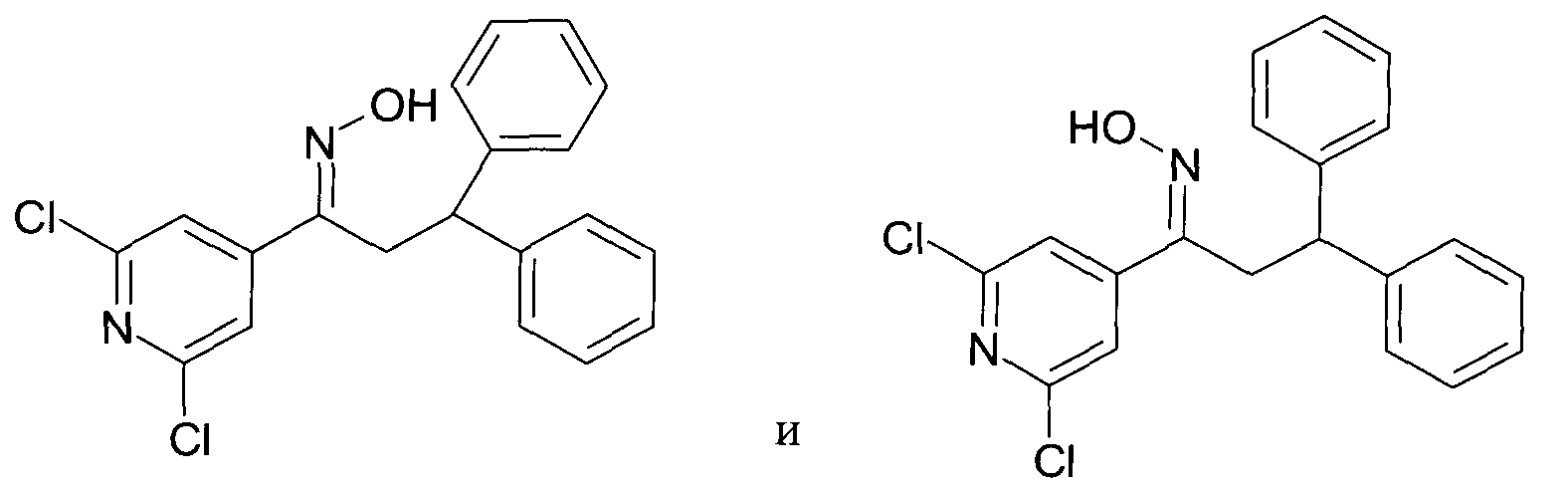
Стадия 1: N-метокси-N-метил-3,3-дифенил-пропионамид
К раствору 3,3-дифенилпропионовой кислоты (CAS RN: [606-83-7], 1.5 г) в ДМФ (17 мл) добавили TBTU (2.98 г) и EtsN (2.1 мл) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и снова охладили до 0°C. Добавили N,O-диметилгидроксиламина гидрохлорид (0.78 г) и смесь перемешивали при KT в течение 1 часа. Насыщенный водный раствор NaHCO3 добавили, фазы разделили и неорганическую фазу экстрагировали ТВМЕ (2х). Объединенные органические слои промыли 1н. водным KHSO4 и солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 1:1) с получением соединения, указанного в заголовке, (1.52 г, 85%) в виде бесцветного масла, MS (ESI+): m/z=270.2 ([M+H]+).
Стадии 2 и 3: (E)-1-(2,6-дихлор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим и (Z)-1-(2,6-дихлор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим
При -70°C к раствору 2,6-дихлор-4-йодопиридина (1.02 г) в ТГФ (20 мл) по каплям добавили n-BuLi (1.6M в гексане, 2.3 мл). Смесь перемешивали в течение дополнительных 15 мин и в этот момент добавили раствор N-метокси-N-метил-3,3-дифенил-пропионамида (200 мг) в ТГФ (10 мл). Реакционную смесь перемешивали в течение 1 часа при -70°C. Насыщенный водный раствор NH4Cl добавили, фазы разделили и неорганическую фазу экстрагировали EtOAc (2х). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 1:10) с получением 1-(2,6-дихлор-пиридин-4-ил)-3,3-дифенил-пропан-1-она (465 мг, 88%) в виде желтого масла, который сразу использовали на следующей стадии.
По аналогии с примером 1, стадия 2, из 1-(2,6-дихлор-пиридин-4-ил)-3,3-дифенил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили (E)-1-(2,6-дихлор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим в виде белого осадка, MS (ESI-): m/z=368.9 ([М-Н]-, 1Cl) и (Z)-1-(2,6-дихлор-пиридин-4-ил)-3,3-дифенил-пропан-1-она оксим в виде бесцветного масла, MS (ESI-): m/z=368.9 ([М-Н]-, 1Cl).
Пример 74
4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
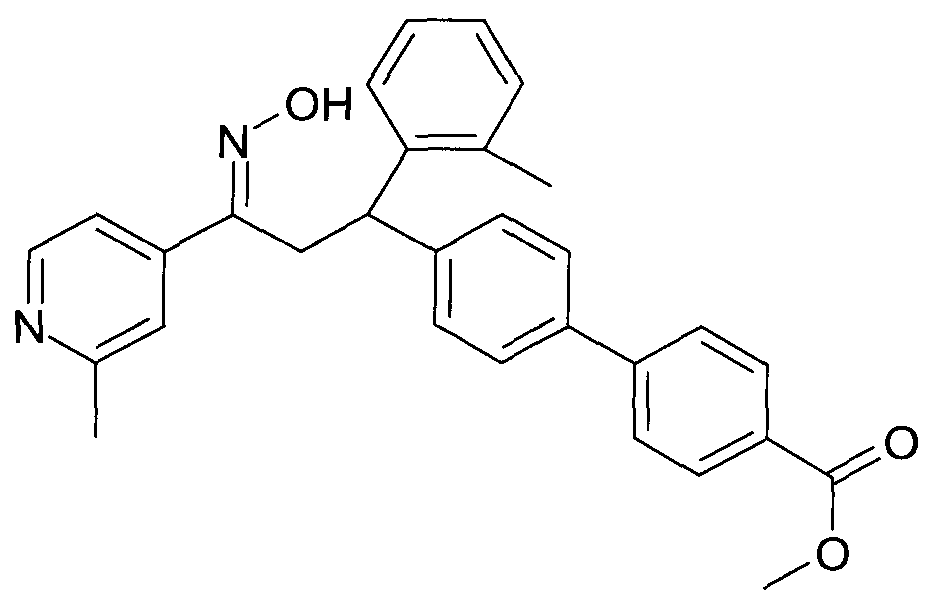
Стадия 1: 3-(4-бром-фенил)-2-циано-акриловой кислоты этиловый эфир
К раствору 4-бром-бензальдегида (5 г) и этилцианоацетат (2.9 мл) в толуоле (50 мл) добавили пиперидин (0.046 мл), и смесь перемешивали при температуре кипения растворителя с обратным холодильником в течение 2 ч с насадкой Дина-Старка. Смесь охладили до KT, перемешивали в течение ночи и толуол выпарили под вакуумом. Неочищенный осадок кристаллизовали из EtOAc с получением соединения, указанного в заголовке, (6.77 г, 90%) в виде светло-желтого осадка, MS (EI): m/z=279 ([M+H]+).
Стадия 2: 3-(4-бром-фенил)-2-циано-3-о-толил-пропионовой кислоты этиловый эфир
Раствор 3-(4-бром-фенил)-2-циано-акриловой кислоты этилового эфира (6.65 г) в толуоле (50 мл) добавили к раствору о-толилмагния хлорида в ТГФ (1М, 30.9) при 0°C. После завершения добавления, раствор нагревали при 85°C в течение 1,5 часов, и перемешивание продолжили при комнатной температуре в течение ночи. Смесь нагревали в течение дополнительных 2 часов при 85°C, охладили и вылили на лед. Добавили 1M HCl, фазы разделили и неорганическую фазу экстрагировали EtOAc (2x). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (Et2O/n-гептан 1:3) с получением соединения, указанного в заголовке, (6.45 г, 73%) в виде светло-желтого масла, MS (ESI-): m/z=370.0444 ([M-H]-, 1Br).
Стадия 3: 3-(4-бром-фенил)-3-о-толил-пропионовая кислота
К раствору 3-(4-бром-фенил)-2-циано-3-о-толил-пропионовой кислоты этилового эфира (6.65 г) в уксусной кислоте (48 мл) добавили воду (18 мл) и концентрированную H2SO4 (17.6 мл) при 0°C. Смесь кипятили с обратным холодильником в течение 2 дней, охладили и вылили на лед, экстрагировали EtOAc (3x) и метиленхлоридом. Органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт преципитировали из смеси EtOAc:n-гептан с получением соединения, указанного в заголовке, (3.8 г, 67%) в виде белого осадка, MS (ESI-): m/z=317.0181 ([M-H]-).
Стадия 4: 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамид К раствору 3-(4-бром-фенил)-3-о-толил-пропионовой кислоты (3.7 г) в ДМФ (45 мл) добавили TBTU (5.2 г) и Et2N (4.8 мл) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и снова охладили до 0°C. N,O-диметилгидроксиламина гидрохлорид (1.36 г) добавили и смесь перемешивали при KT в течение 1.5 часов. Насыщенный раствор NH4Cl добавили, фазы разделили и неорганическую фазу экстрагировали EtOAc (2x). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 1:2) с получением соединения, указанного в заголовке, в виде бесцветного масла (4.1 г, 97%), MS (ESI+): m/z=362.0750 ([M+H]+, 1Br).
Стадия 5: 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
К раствору n-BuLi (12.9 мл 1.6M в гексане) по каплям добавили раствор 4-бром-2-метилпиридина (3.56 г) в ТГФ (170 мл) при -70°C в течение перида 20 мин. Реакционную смесь перемешивали при -70°C в течение 5 мин, перед тем как по каплям добавили раствор 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (2.5 г) в ТГФ (100 мл). После завершения добавления, смесь перемешивали при -70°C в течение 3 часов. Насыщенный раствор NH4Cl добавили, фазы разделили и неорганическую фазу экстрагировали EtOAc (2x). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 1:1) получив соединение, указанное в заголовке, в виде желтого масла (1.49 г, 55%), MS (ESI+): m/z=394.0797 ([M+H]+, 1Br).
Стадия 6: 4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
К перемешанному раствору 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (400 мг), (4-метоксикарбонилфенил)бороновой кислоты (275 мг), дихлор (1,1'-бис(дифенил-фосфино)-ферроцен)палладий (И)дихлорметанового аддукта (41 мг) в диоксане (3 мл) и воде (2.6 мл) добавили а 2 М водный раствор карбоната натрия (1.52 мл). Смесь перемешивали при 80°C в течение 1,5 ч. Добавили насыщенный раствор NH4Cl, фазы разделили и неорганическую фазу экстрагировали EtOAc (2x). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 1:1) с получением соединения, указанного в заголовке, в виде желтой пены (400 мг, 88%), MS (ESI+): m/z=450.2063 ([M+H]+).
Стадия 7: 4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
Раствор 4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метилового эфира (36 мг), гидроксиламина гидрохлорида (11 мг) и гидрокарбоната натрия (14 мг) в смеси этанола (0.5 мл) и воды (0.1 мл) нагревали до кипения с обратным холодильником в течение 1,5 часов. Насыщенный раствор NH4Cl добавили, фазы разделили и неорганическую фазу экстрагировали EtOAc (2x). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 2:1) с получением соединения, указанного в заголовке, в виде смеси E и Z изомеров (3,3:1) в виде белой пены (28 мг, 75%), MS (ESI+): m/z=465.2 ([M+H]+).
Пример 75
4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
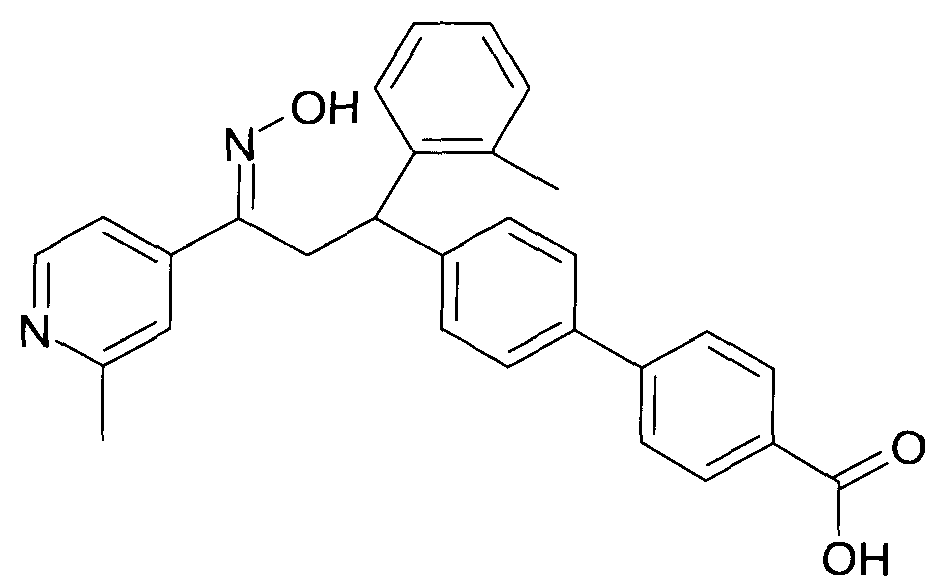
К раствору 4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метилового эфира (352 мг) в ТГФ (7.5 мл) добавили каплю метанола и 1M водный раствор гидроксида лития (7.6 мл) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Добавили 1M водный раствор KHSO4 (7.5 мл), фазы разделили и провели экстракцию с помощью EtOAc и насыщенного раствора NH4Cl. Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (CH2Cl/MeOH 9:1) с получением 4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты в виде смеси Е и Z изомеров (3:1) в виде белой пены (288 мг, 84%), MS (ESI-): m/z=449.2 ([M-H]-).
Пример 76
4'-{3-[(E)-гидроксимино]-1-фенил-3-пиридин-4-ил-пропил}-бифенил-3-карбоновая кислота
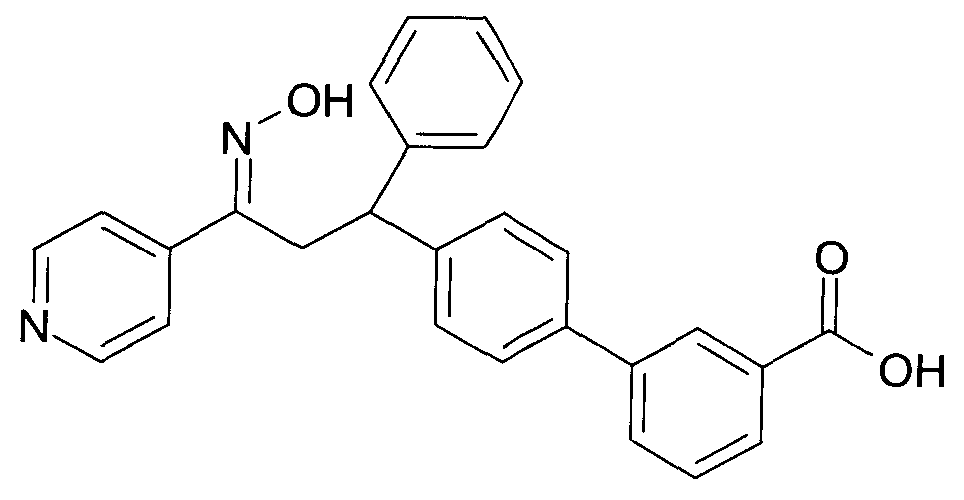
По аналогии с примером 19, из (E)-3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (пример 5) и 3-метоксикарбонилфенилбороновой кислоты получили 4'-{3-[(E)-гидроксиимино]-1-фенил-3-пиридин-4-ил-пропил}-бифенил-3-карбоновой кислоты метиловый эфир, который сразу использовали на следующей стадии.
По аналогии с примером 75, из 4'-{3-[(E)-гидроксиимино]-1-фенил-3-пиридин-4-ил-пропил}-бифенил-3-карбоновой кислоты метилового эфира получили 4'-{3-[(E)-гидроксиимино]-1-фенил-3-пиридин-4-ил-пропил}-бифенил-3-карбоновую кислоту в виде бесцветного масла, MS (ESI-): m/z=421.0 ([M-H]-).
Пример 77
4'-{3-[(E)-гидроксимино]-1-фенил-3-пиридин-4-ил-пропил}-бифенил-4-карбоновая кислота
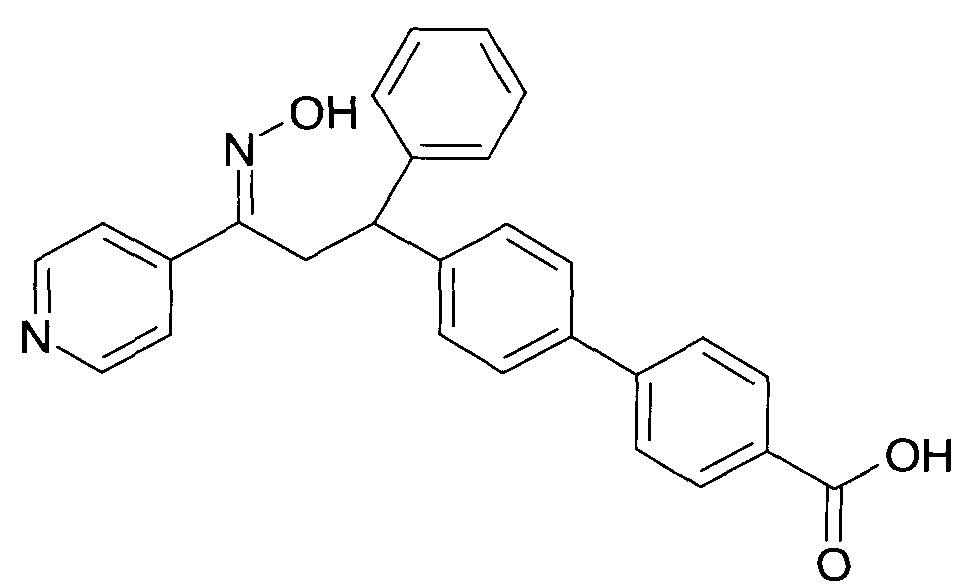
Стадия 1: 4'-{3-[(Е)-гидроксимино]-1-фенил-3-пиридин-4-ил-пропил}-бифенил-4-карбоновой кислоты метиловый эфир
По аналогии с примером 19, из (E)-3-(4-бром-фенил)-3-фенил-1-пиридин-4-ил-пропан-1-она оксима (пример 5) и 4-метоксикарбонилфенилбороновой кислоты получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=437.2 ([M+H]+).
Стадия 2: 4'-{3-[(E)-гидроксимино]-1-фенил-3-пиридин-4-ил-пропил}-бифенил-4-карбоновая кислота
По аналогии с примером 75, из 4'-{3-[(E)-гидроксиимино]-1-фенил-3-пиридин-4-ил-пропил}-бифенил-3-карбоновой кислоты метилового эфира получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=423,3 ([M+H]+).
Пример 78
4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбоновой кислоты этиловый эфир
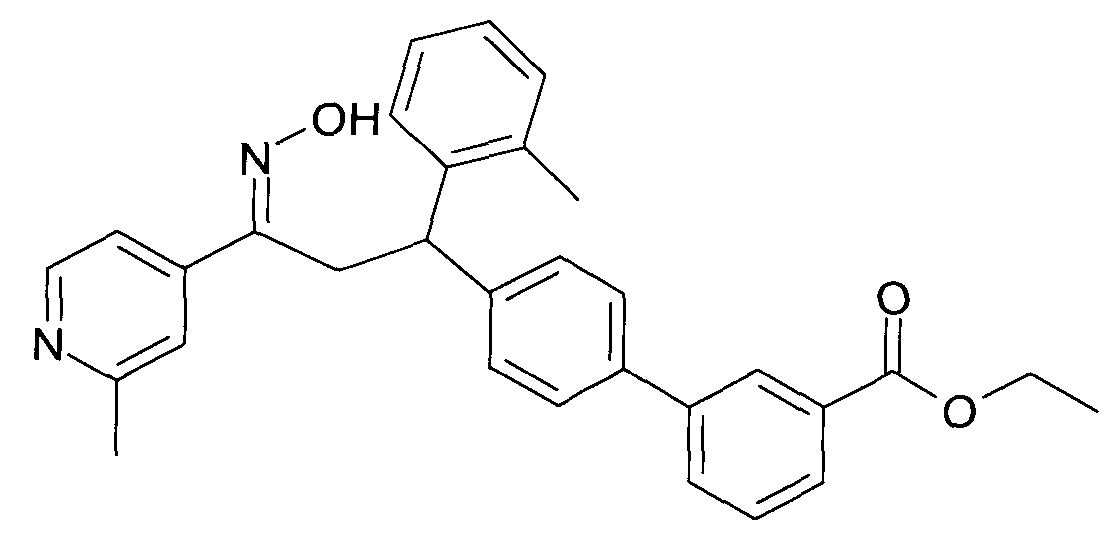
Стадия 1: 4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-3-карбоновой кислоты этиловый эфир
По аналогии с примером 74, стадия 6, из 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 74, стадия 5) и 3-этоксикарбонилфенилбороновой кислоты получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=464.22 ([M+H]+).
Стадия 2: 4'-[3-[гидроксиимино1-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбоновой кислоты этиловый эфир
По аналогии с примером 74, стадия 7, из 4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-3-карбоновой кислоты этилового эфира и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (3.4:1) в виде белой пены, MS (ESI+): m/z=479.2319 ([M+H]+).
Пример 79
4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбоновая кислота
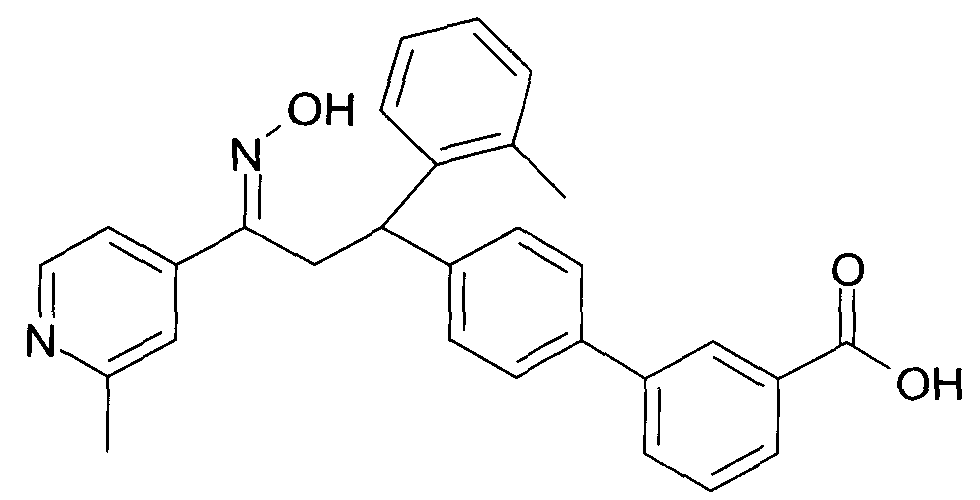
По аналогии с примером 75, из 4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбоновой кислоты этилового эфира получили 4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбоновую кислоту в виде смеси E и Z изомеров (3.5:1) в виде бесцветного масла, MS (ESI+): m/z=451.20 ([M+H]+).
Пример 80
{4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-уксусная кислота
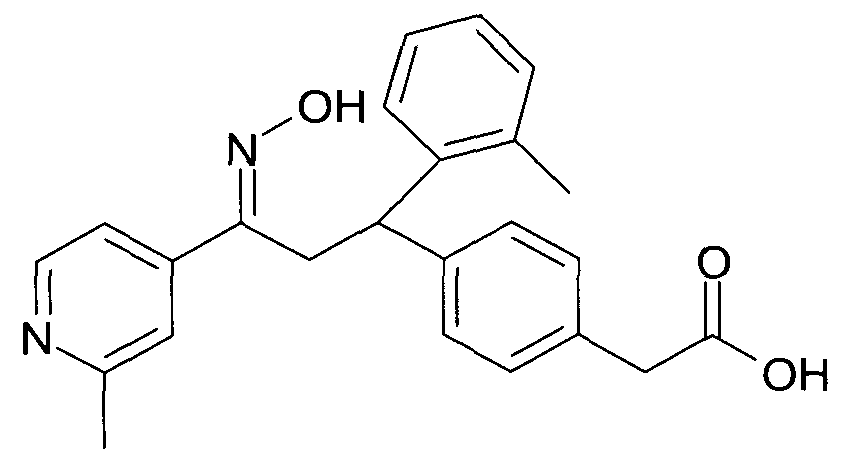
Стадии 1 и 2: {4-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-уксусная кислота
К раствору 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 74, стадия 5) (70 мг) в диоксане (2 мл) добавили этилцианоацетат (30.1 мг). К этой смеси добавили дихлор (1,1'-бис(дифенилфосфино)ферроцен)палладий (II) дихлорметановый аддукт (7.2 мг) и трет-бутоксид калия (60 мг). Реакционную смесь перемешивали при 80°C в течение 2 часов. Насыщенный раствор NH4Cl добавили, фазы разделили и неорганическую фазу экстрагировали EtOAc (2x). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 1:1 до EtOAc) с получением циано-{4-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-уксусной кислоты этилового эфира (28 мг, 37%) в виде светло-желтого масла, которое сразу использовали на следующей стадии.
По аналогии с примером 74, стадия 3, из циано-{4-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-уксусной кислоты этилового эфира получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI-): m/z=372.1 ([M-H]-).
Стадия 3: {4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-уксусная кислота
По аналогии с примером 74, стадия 7, из {4-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-уксусной кислоты и гидроксиламина гидрохлорида
в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (3.6:1) в виде бесцветного масла, MS (ESI+): m/z=389.19 ([M+H]+).
Пример 81
2-фтор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
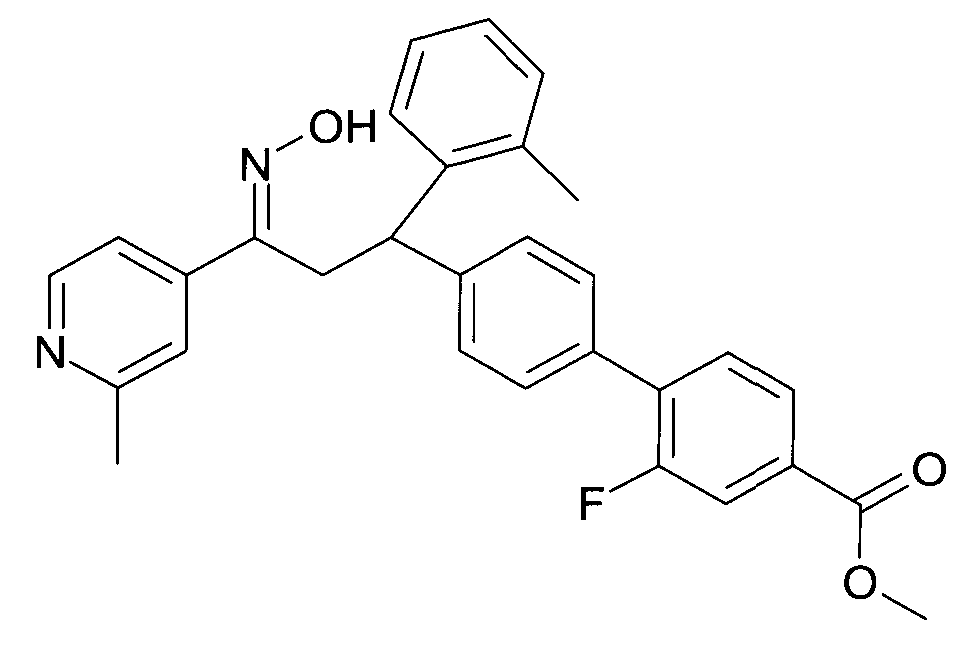
Стадия 1: 2-фтор-4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
По аналогии с примером 74, стадия 6, из 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 74, стадия 5) и 2-фтор-4-(метоксикарбонил)фенилбороновой кислоты получили соединение, указанное в заголовке, в виде светло-коричневого масла, MS (ESI+): m/z=468.1961 ([M+H]+).
Стадия 2: 2-фтор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
По аналогии с примером 74, стадия 7, из 2-фтор-4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метилового эфира и гидроксиламина гидрохлорида в присутствии NaHCOs получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (2.8:1) в виде белой пены, MS (ESI+): m/z=483.2073 ([M+H]+).
Пример 82
2-фтор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота

По аналогии с примером 75, из 2-фтор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метилового эфира получили 2-фтор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновую кислоту в виде смеси E и Z изомеров (2.4:1) в виде белой пены, MS (ESI+): m/z=469.1922 ([M+H]+).
Пример 83
3-хлор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
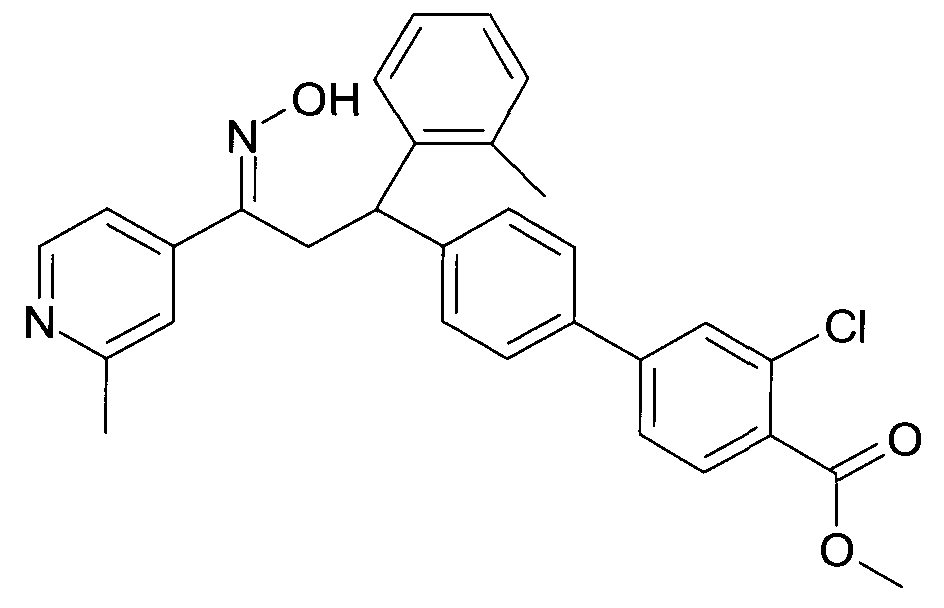
Стадия 1: 3-хлор-4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
По аналогии с примером 74, стадия 6, из 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он (пример 74, стадия 5) и (3-хлор-4-метоксикарбонил)бензолбороновой кислоты получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=484.1680 ([M+H]+, 1Cl).
Стадия 2: 3-хлор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
По аналогии с примером 74, стадия 7, из 3-хлор-4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метилового эфира и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (4.2:1) в виде бесцветного масла, MS (ESI+): m/z=499.3 ([M+H]+, 1Cl).
Пример 84
3-хлор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
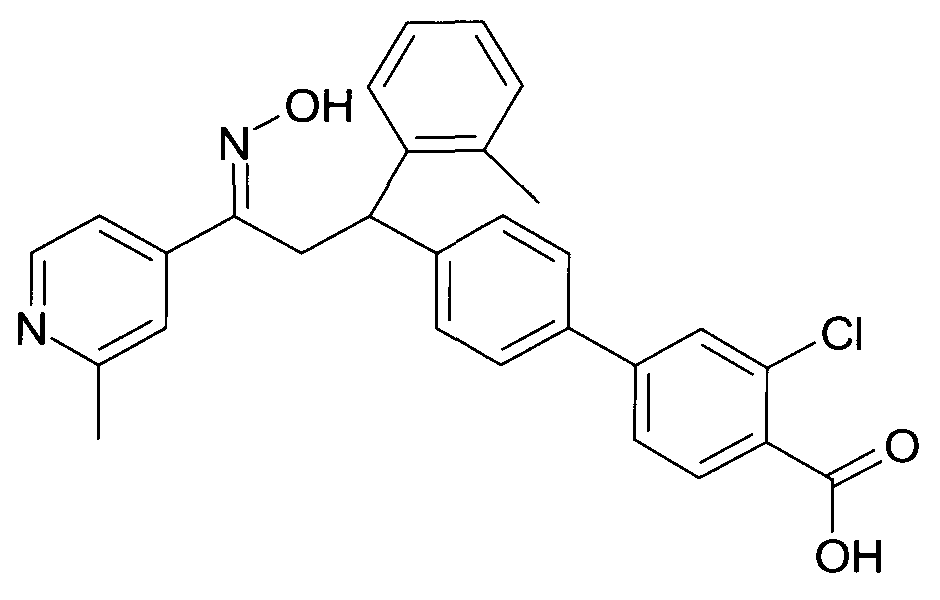
По аналогии с примером 75, из 3-хлор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метилового эфира (пример 83) получили 3-хлор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновую кислоту в виде смеси E и Z изомеров (4.2:1) в виде бесцветного масла, MS (ESI+); m/z=485.1626 ([M+H]+).
Пример 85
3-[4-(3-гидрокси-проп-1-инил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
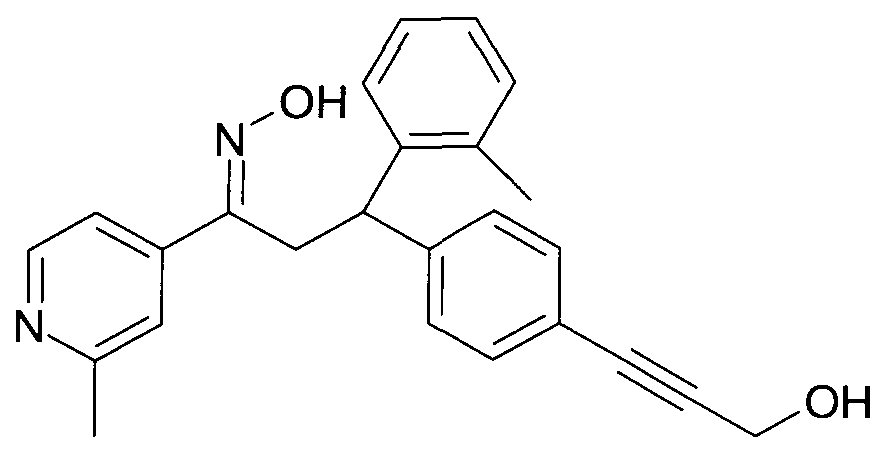
Стадия 1: 3-[4-(3-гидрокси-проп-1-инил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
К 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-ону ((пример 74, стадия 5), 400 мг) в триэтиламине (4.1 мл) добавили тетракис(трифенилфосфин)палладий (59 мг) и Cul (10 мг). При 80°C медленно добавили 2-пропин-1-ол (0.12 мл), и раствор перемешивали при этой температуре в течение 3 часов. Раствор сконцентрировали под вакуумом и перерастворили в EtOAc и насыщенном растворе NH4Cl. Фазы разделили и неорганическую фазу экстрагировали EtOAc. Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 2:1) с получением соединения, указанного в заголовке, (264 мг, 70%) в виде желтого масла, MS (ESI+): m/z=370.1 ([M+H]+).
Стадия 2: 3-[4-(3-гидрокси-проп-1-инил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-[4-(3-гидрокси-проп-1-инил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (6.4:1) в виде бесцветного масла, MS (ESI+): m/z=385.1908 ([M+H]+).
Пример 86
4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бензойная кислота
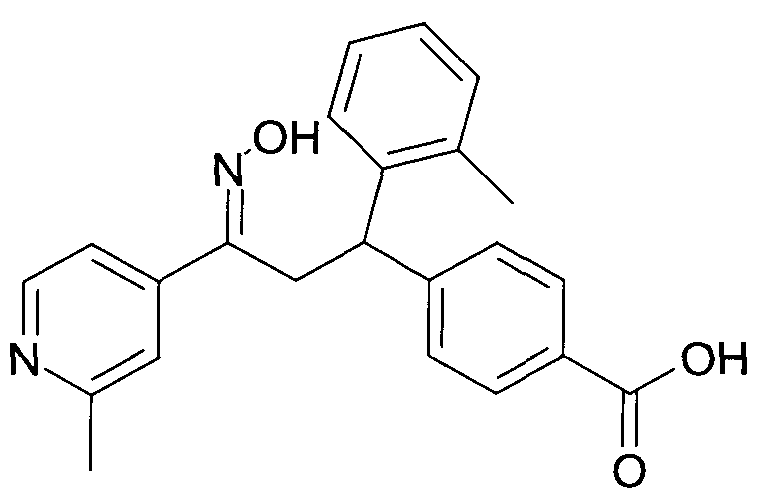
Стадия 1: 4-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензойная кислота
3-[4-(3-гидрокси-проп-1-инил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он (60 мг) растворили в тетрахлориде углерода (0.6 мл), ацетонитриле (0.6 мл) и воде (0.9 мл). К этому двухфазному раствору добавили метаперйодат натрия (143 мг) и гидрат хлорида рутения (III) (24 мг) при комнатной температуре и смесь перемешивали при KT в течение 1 часа. Добавили воду к неочищенной смеси и неорганическую фазу экстрагировали дихлорметаном (2x). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (CH2Cl2/MeOH 9:1) с получением соединения, указанного в заголовке, (20 мг, 34%) в виде белого осадка, MS (ESI-): m/z=358.0 ([M-H]-).
Стадия 2: 4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бензойная кислота
По аналогии с примером 74, стадия 7, из 4-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензойной кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (3,3:1) в виде бесцветного масла, MS (ESI+): m/z=375.1702 ([M+H]+).
Пример 87
3-{4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-акриловая кислота
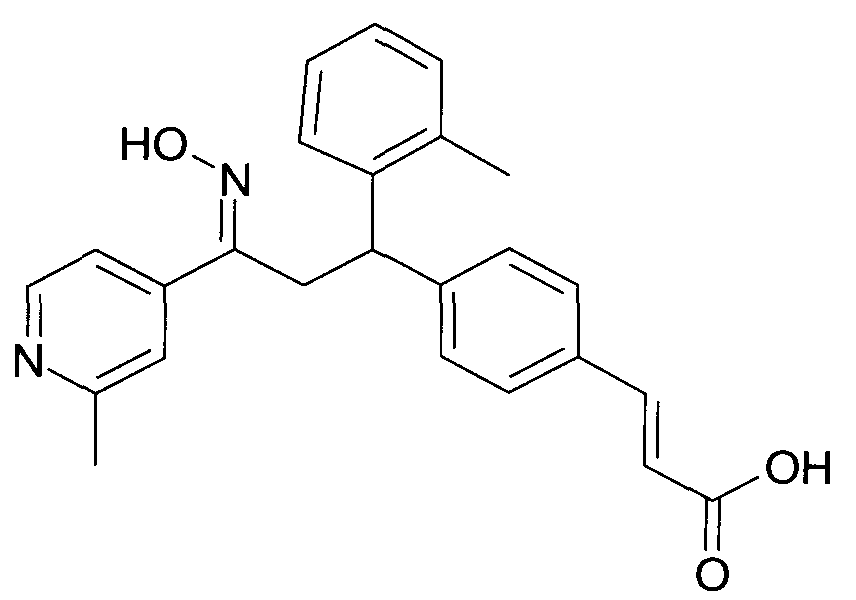
Стадия 1: 3-{4-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-акриловой кислоты метиловый эфир
К 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-ону ((пример 74, стадия 5), 300 мг) в ДМФ (3 мл) добавили тетракис(трифенилфосфин)палладий (130 мг), метилакрилат (0.103 мл) и триэтиламин (0.16 мл). Реакционную смесь перемешивали при 100°C в течение ночи, охладили до комнатной температуры и разбавили EtOAc и насыщенным раствором хлорида аммония. Фазы разделили и неорганическую фазу экстрагировали EtOAc. Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 1:1) с получением соединения, указанного в заголовке, (62 мг, 20%) в виде желтого масла, MS (ESI+): m/z=400.1912 ([M+H]+).
Стадия 2: 3-{4-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-акриловая кислота
По аналогии с примером 75, из 3-{4-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-акриловой кислоты метилового эфира получили соединение, указанное в заголовке, MS (ESI+): m/z=386.2 ([M+H]+).
Стадия 3: 3-{4-[3-[гидроксиимино1-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-акриловая кислота
По аналогии с примером 74, стадия 7, из 3-{4-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-акриловой кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси Z и Е изомеров (1.7:1) в виде бесцветного масла, MS (ESI+): m/z=401.1859 ([M+H]+).
Пример 88
3-[4-(3-гидрокси-пропил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
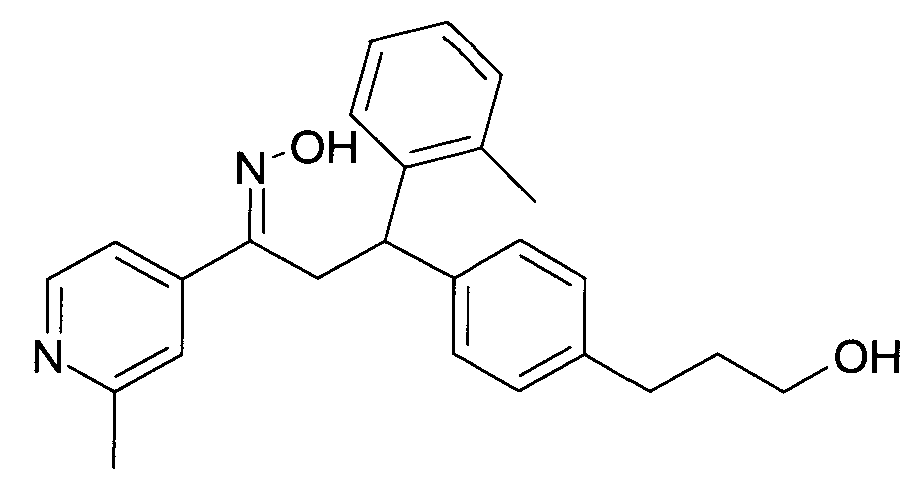
Стадии 1 и 2: 3-[4-(3-гидрокси-пропил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
3-[4-(3-гидрокси-проп-1-инил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он (пример 85, стадия 1; 40 мг) в этилацетате (6 мл) гидрогенизировали в присутствии Pd (5% на угле, 7 мг) при комнатной температуре в течение 1,5 часов. Раствор отфильтровали через дикалит, фильтрационный остаток промыли этилацетатом, и раствор выпарили с получением 3-[4-(3-гидрокси-пропил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (41 мг, 64%) в виде бесцветного масла, которое сразу использовали на следующей стадии.
По аналогии с примером 74, стадия 7, из 3-[4-(3-гидрокси-пропил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили 3-[4-(3-гидрокси-пропил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим в виде смеси E и Z изомеров (2.7:1) в виде бесцветного масла, MS (ESI+): m/z=389.2 ([M+H]+).
Пример 89
3-({4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-пропионовая кислота
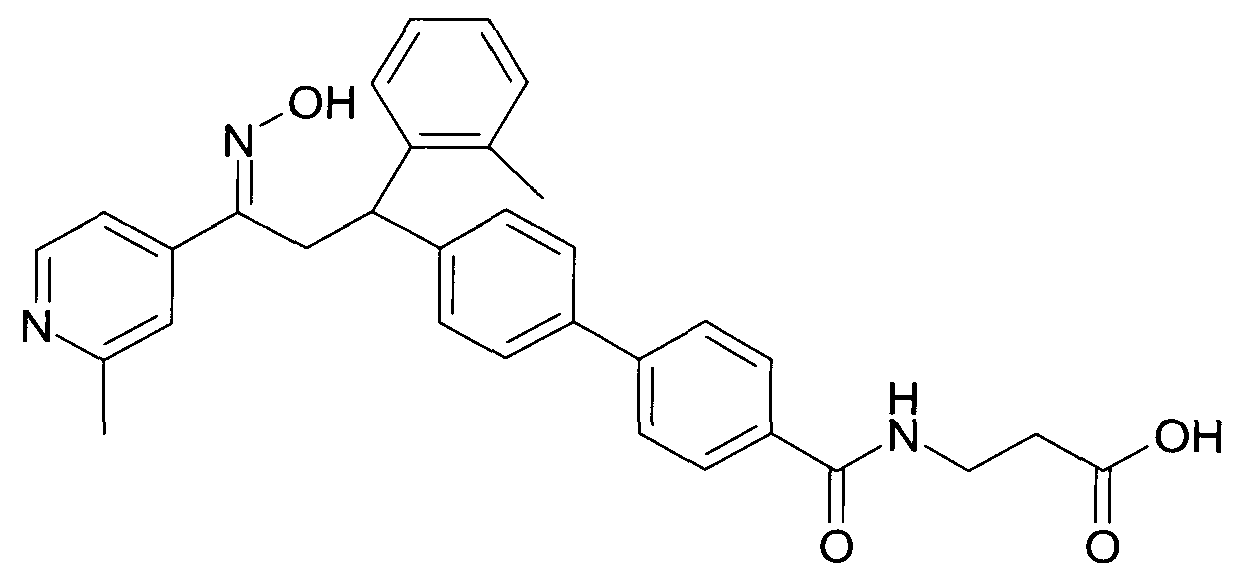
Стадия 1: 4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 75, из 4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метилового эфира (пример 74, стадия 6) получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=436.1906 ([M+H]+).
Стадия 2: 3-({4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-пропионовой кислоты этиловый эфир
К раствору 4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты (50 мг) в ТГФ (1 мл) добавили TBTU (41 мг) и триэтиламин (0.048 мл) и полученную смесь перемешивали при комнатной температуре в течение 10 мин. Добавили гидрохлорид этилового эфира бета-аланина (21.2 мг) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавили насыщенный раствор NH4Cl и EtOAc, фазы разделили и неорганическую фазу экстрагировали EtOAc (2x). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом с получением соединения, указанного в заголовке, (72 мг) в виде светло-желтого масла, MS (ESI+): m/z=535.3 ([M+H]+).
Стадия 3: 3-({4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-пропионовая кислота
По аналогии с примером 75, из 3-({4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-пропионовой кислоты этилового эфира получили соединение, указанное в заголовке,, MS (ESI+): m/z=507.2 ([M+H]+).
Стадия 4: 3-({4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-пропионовая кислота
По аналогии с примером 74, стадия 7, из 3-({4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-пропионовой кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (4:1) в виде бесцветного масла, MS (ESI+): m/z=522.2376 ([M+H]+).
Пример 90
({4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусная кислота
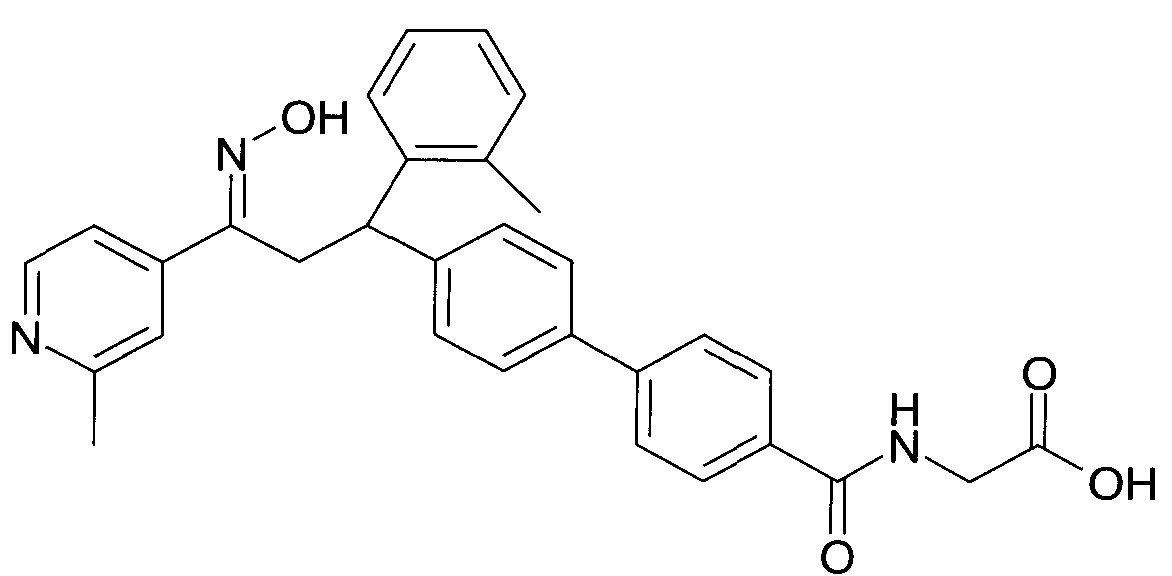
Стадия 1: ({4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты метиловый эфир
По аналогии с примером 89, стадия 2, из 4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты и гидрохлорида метилового эфира глицина получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=507.2 ([M+H]+).
Стадии 2 и 3: ({4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусная кислота
По аналогии с примером 89, стадия 3, из ({4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты метилового эфира получили ({4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусную кислоту, которую сразу использовали на следующей стадии.
По аналогии с примером 74, стадия 7, из ({4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (3.8:1) в виде белого осадка, MS (ESI+): m/z=508.2 ([M+H]+).
Примеры 91 to 94
4'-[(S)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
4'-[(S)-3-[(Z)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота,
4'-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота и
4'-[(R)-3-[(Z)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
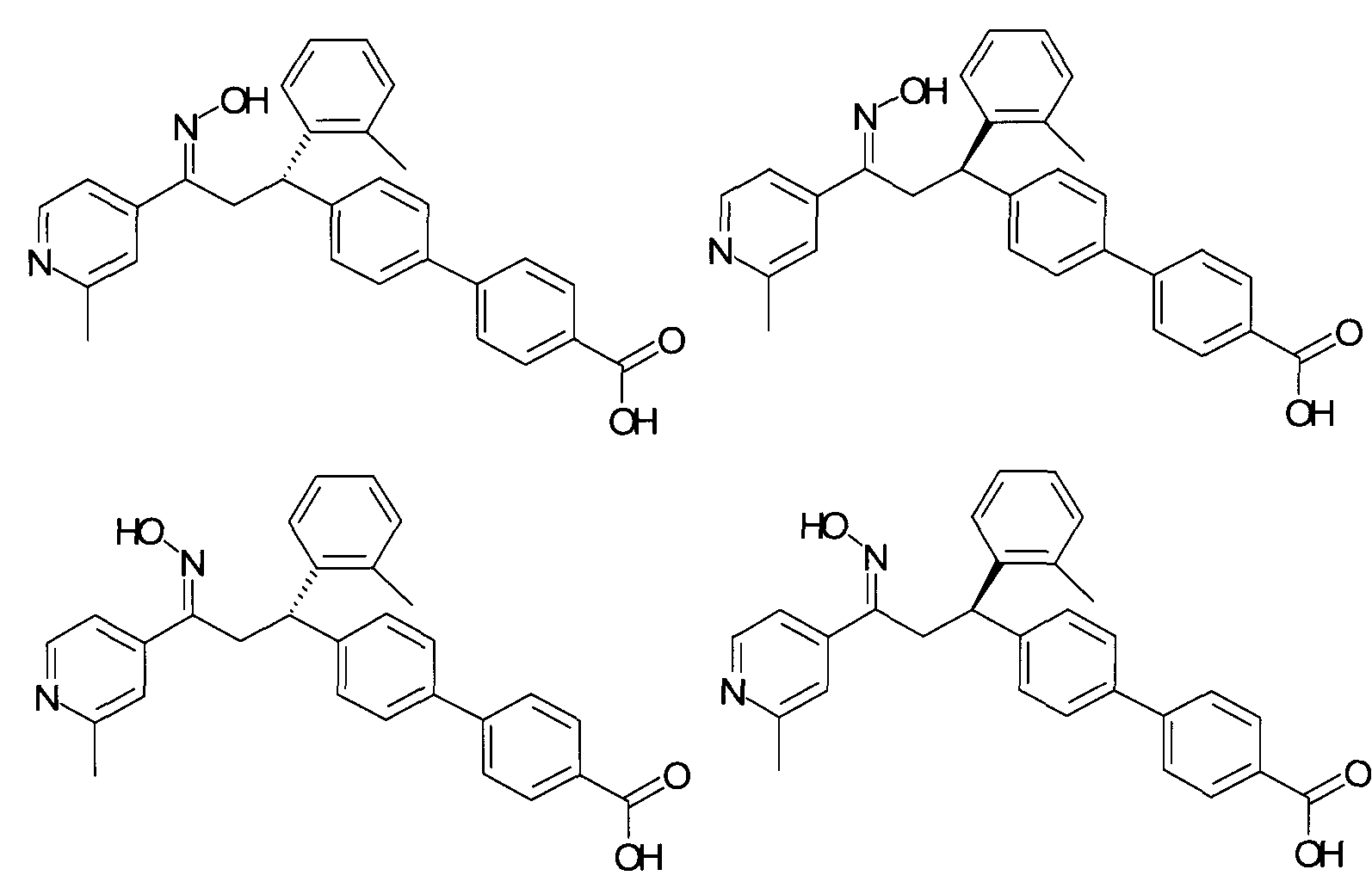
Разделение 4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты (пример 75) с помощью хиральной ВЭЖХ (Chiralpak AD, 15%(этанол+0.5% муравьиная кислота) в гептане) дала 4'-[(S)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновую кислоту в виде бесцветного масла, MS (ESI+): m/z=451.2010 ([M+H]+) и 4'-[(3)-3-[(Z)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновую кислоту в виде бесцветного масла, MS (ESI+): m/z=451.2013 ([M+H]+), и дополнительная фракция, которую затем разделили с помощью хиральной ВЭЖХ (Reprosil-Chiral-NR, 15% (этанол +0.5% муравьиная кислота)/гептан) дала 4'-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновую кислоту в виде бесцветного масла, MS (ESI+): m/z=451.2010 ([M+H]+), и 4'-[(R)-3-[(Z)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновую кислоту в виде бесцветного масла, MS (ESI+): m/z 451.2017([M+H]+).
Пример 95
(S)-2-({4'-[(S)-3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-пропионовая кислота
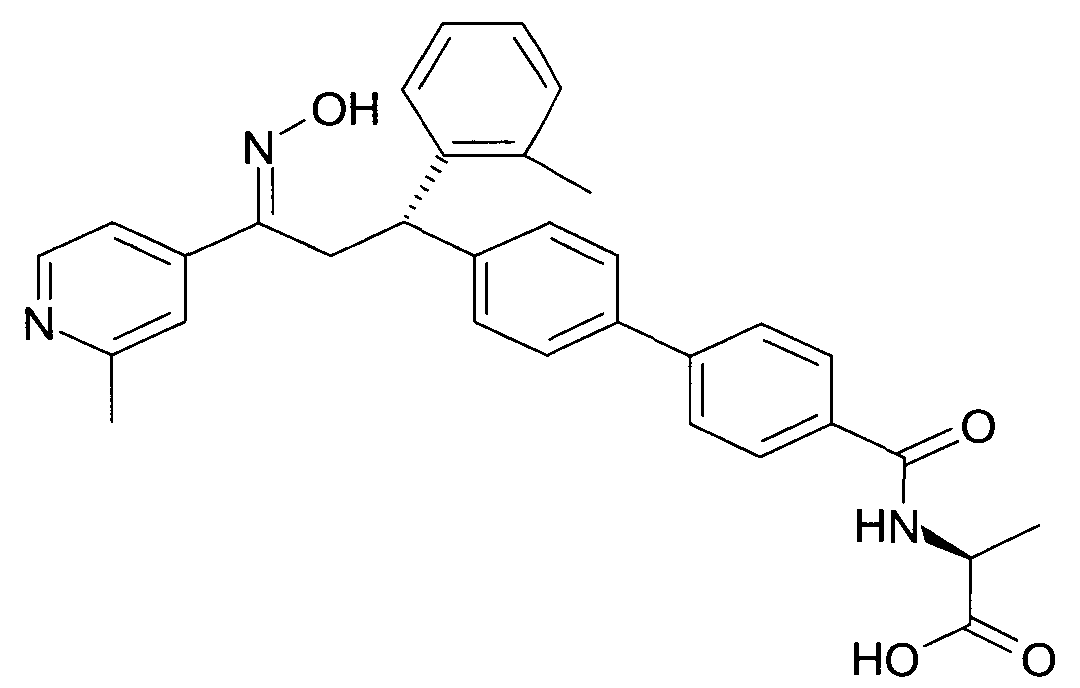
Стадия 1: 4'-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновая кислота и 4'-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновая кислота
Разделение 4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты (пример 89, стадия 1) с помощью хиральной ВЭЖХ (Chiralpak AD-H, 20% (этанол +0.5% муравьиная кислота)/гептан) дала 4'-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновую кислоту, MS (ESI+): m/z=436.1913 ([M+H]+), и 4'-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновую кислоту в виде белого осадка, MS (ESI+): m/z=436.1918 ([M+H]+).
Стадия 2: (S)-2-({4'-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-пропионовой кислоты этиловый эфир
По аналогии с примером 89, стадия 2, из 4'-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты и гидрохлорида этилового эфира L-аланина получили соединение, указанное в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=535.3 ([М+Н]+).
Стадия 3: (S)-2-({4'-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-пропионовая кислота
По аналогии с примером 75, из (S)-2-({4'-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-пропионовой кислоты этилового эфира получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=507.2281 ([M+H]+).
Стадия 4: (3)-2-({4'-[(3)-3-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил[-бифенил-4-карбонил}-амино)-пропионовая кислота
По аналогии с примером 74, стадия 7, из (S)-2-({4'-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-пропионовой кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (3:1) в виде белого осадка, MS (ESI+): m/z=522.3 ([M+H]+).
Пример 96
({4'-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусная кислота
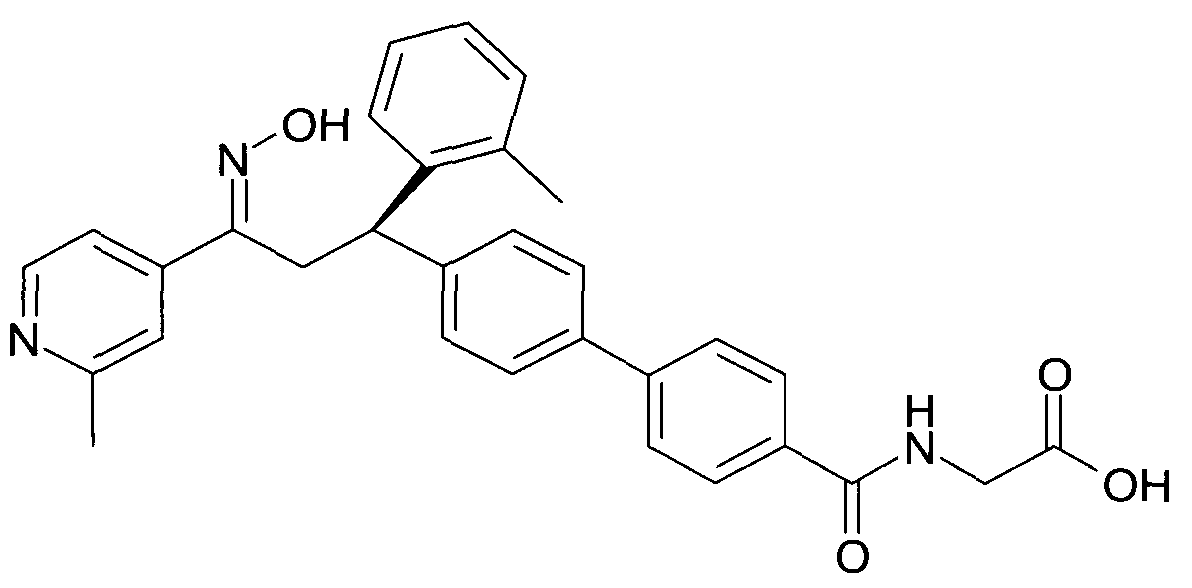
Стадия 1: ({4'-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил1-бифенил-4-карбонил}-амино)-уксусной кислоты метиловый эфир
По аналогии с примером 89, стадия 2, из 4'-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты (пример 95, стадия 1) и гидрохлорида глицинметилового эфира получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=507.2282 ([M+H]+).
Стадии 2 и 3: ({4'-[(R)-3-[(E)-гидроксимино1-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусная кислота
По аналогии с примером 75, из ({4'-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты метилового эфира получили ({4'-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусную кислоту, которую сразу использовали на следующей стадии.
По аналогии с примером 74, стадия 7, из ({4'-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили ({4'-[(R)-3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбонил}-амино)-уксусную кислоту в виде смеси изомеров, которую разделили с помощью хиральной ВЭЖХ (Reprosil-Chiral-NR, 70% n-гептан, 30% этанол+0.5% муравьиная кислота), получив соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=508.3 ([M+H]+).
Пример 97
4'-[(S)-3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота ((R)-1-фенил-этил)-амид
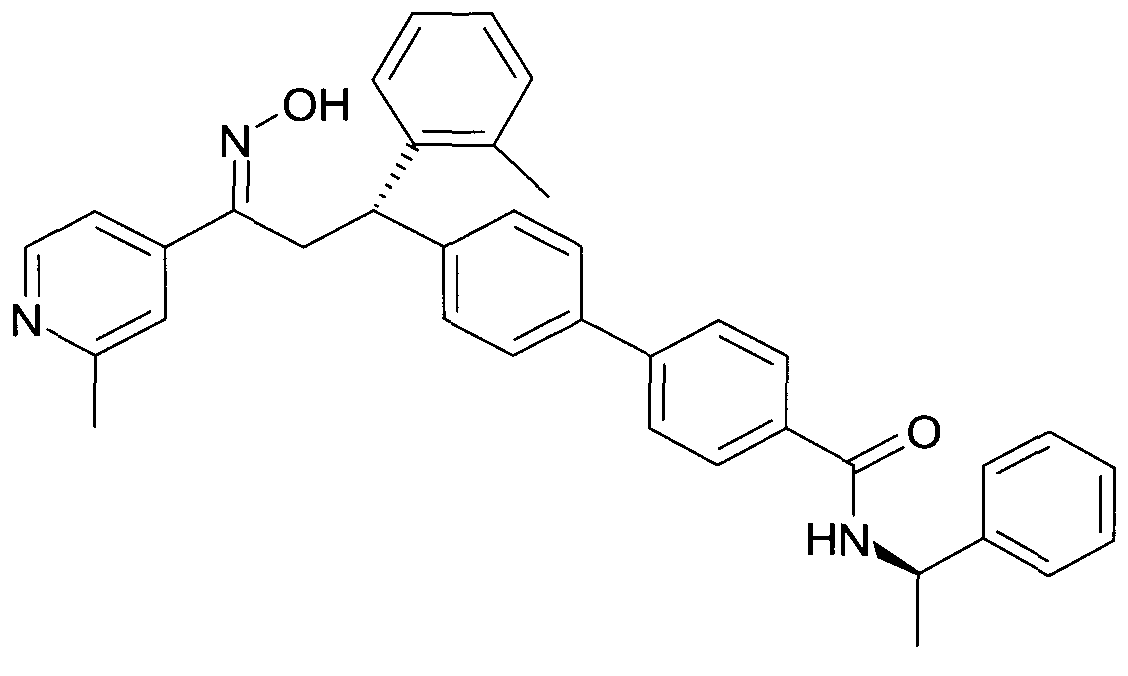
Стадия 1: 4'-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты ((R)-1-фенил-этил)-амид
По аналогии с примером 89, стадия 2, из 4'-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты (пример 95, стадия 1) и (R)-(+)-1-фенилэтиламина получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=539.4 ([M+H]+).
Стадия 2: 4'-[(S)-3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты ((R)-1-фенил-этил)-амид
По аналогии с примером 74, стадия 7, из 4'-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты ((R)-1-фенил-этил)-амида и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (3.4:1) в виде бесцветного масла, MS (ESI+): m/z=553.702 ([M+H]+).
Пример 98
3-(3-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
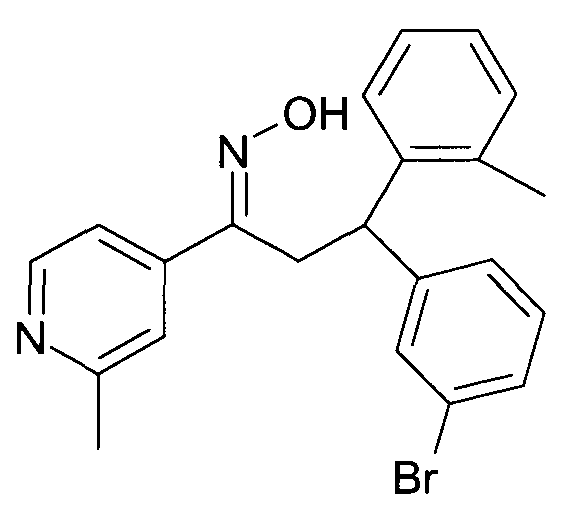
Стадия 1: 3-(3-бром-фенил)-2-циано-акриловой кислоты этиловый эфир
По аналогии с примером 74, стадия 1, из 3-бромбензальдегида и этилцианоацетата получили соединение, указанное в заголовке, в виде белого осадка, MS (EI+): m/z=279 ([M]+, 1Br).
Стадия 2: 3-(3-бром-фенил)-2-циано-3-о-толил-пропионовой кислоты этиловый эфир
По аналогии с примером 74, стадия 2, из 3-(3-бром-фенил)-2-циано-акриловой кислоты этилового эфира и о-толилмагния хлорида получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI-): m/z=370.04 ([M-H]-), 1Br).
Стадия 3: 3-(3-бром-фенил)-3-о-толил-пропионовая кислота По аналогии с примером 74, стадия 3, из 3-(3-бром-фенил)-2-циано-3-о-толил-пропионовой кислоты этилового эфира получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=317.02 ([М-Н]-), 1Br).
Стадия 4: 3-(3-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамид
По аналогии с примером 74, стадия 4, из 3-(3-бром-фенил)-3-о-толил-пропионовой кислоты и N,O-диметилгидроксиламина гидрохлорида получили соединение, указанное в заголовке, в виде белого осадка, mp 89°C, MS (ESI+): m/z=362.07 ([M+H]+, 1Br).
Стадия 5: 3-(3-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 74, стадия 5, из 3-(3-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида и 4-бром-2-метилпиридина получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=394.08 ([M+H]+, 1Br).
Стадия 6: 3-(3-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-(3-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (5.7:1) в виде белой пены, MS (ESI+): m/z=409.0895 ([M+H]+, 1Br).
Пример 99
5-{3-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пиридин-2-карбоновая кислота
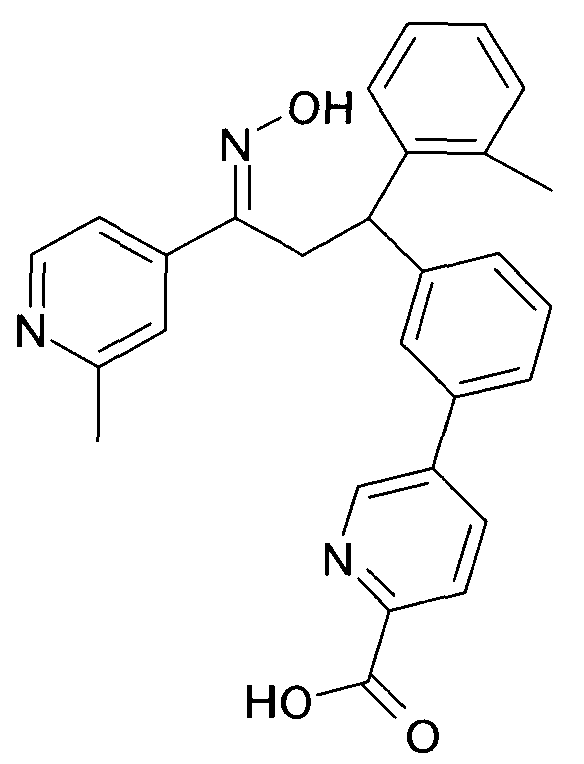
Стадия 1: 5-{3-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-пиридин-2-карбоновая кислота
По аналогии с примером 74, стадия 6, из 3-(3-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 98, стадия 5) и 2-(метилкарбокси)пиридин-5-бороновой кислоты (4 ч при 80°C, 40 ч при комнатной температуре) получили соединение, указанное в заголовке, в виде серо-белого полутвердого вещества, MS (ESI-): m/z=435.2 ([М-Н]-, 1Br).
Стадия 2: 5-{3-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пиридин-2-карбоновая кислота
По аналогии с примером 74, стадия 7, из 5-{3-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-пиридин-2-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси Е и Z изомеров (3:1) в виде белого осадка, MS (ESI+): m/z=452.4 [M+H]+.
Пример 100
3-фтор-3'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
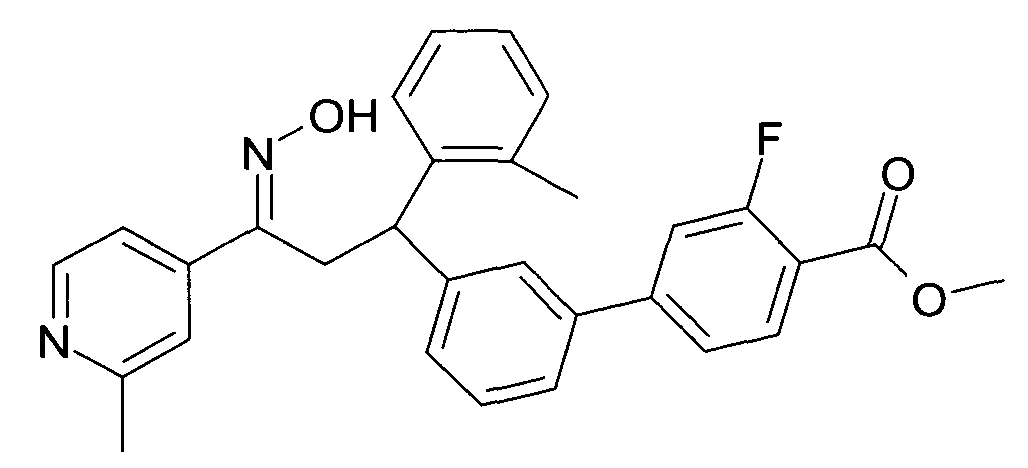
Стадия 1: 3-фтор-3'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
По аналогии с примером 74, стадия 6, из 3-(3-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 98, стадия 5) и (3-фтор-4-метоксикарбонил)фенилбороновой кислоты получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=468.2 ([M+H]+).
Стадия 2: 3-фтор-3'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
По аналогии с примером 74, стадия 7, из 3-фтор-3'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метилового эфира и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (4.4:1) в виде белой пены, MS (ESI+): m/z=483.2 ([M+H]+).
Пример 101
3-фтор-3'-[3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота

По аналогии с примером 75, из 3-фтор-3'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метилового эфира получили 3-фтор-3'-[3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновую кислоту, которая содержала менее чем 8% Z изомера, в виде белого осадка, MS (ESI+): m/z=469.19 ([M+H]+).
Пример 102
3'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбоновая кислота
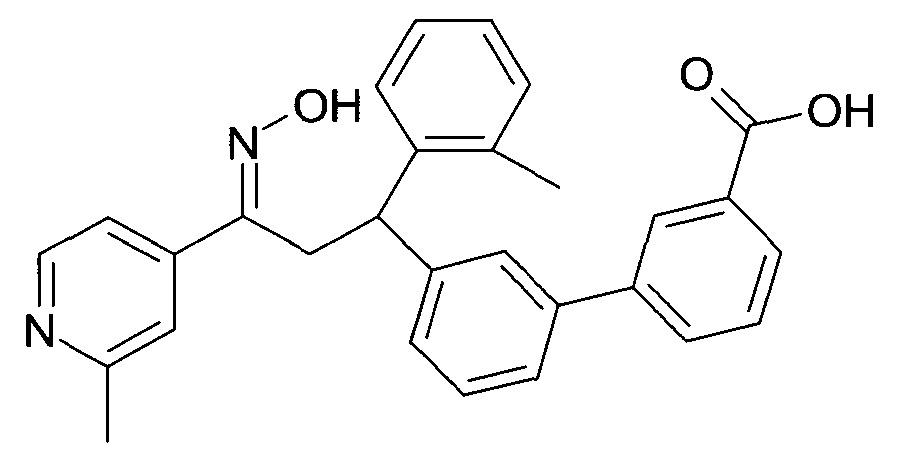
Стадия 1: 3'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-3-карбоновая кислота
По аналогии с примером 74, стадия 6, из 3-(3-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он (пример 98, стадия 5) и 3-карбоксифенилбороновой кислоты получили соединение, указанное в заголовке, в виде серо-белого осадка, MS (ESI-): m/z=434.3 ([M-H]-).
Стадия 2: 3'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбоновая кислота
По аналогии с примером 74, стадия 7, из 3'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-3-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (8.5:1) в виде серо-белого осадка, MS (ESI+): m/z=451.20 ([M+H]+).
Пример 103
(E)-3'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
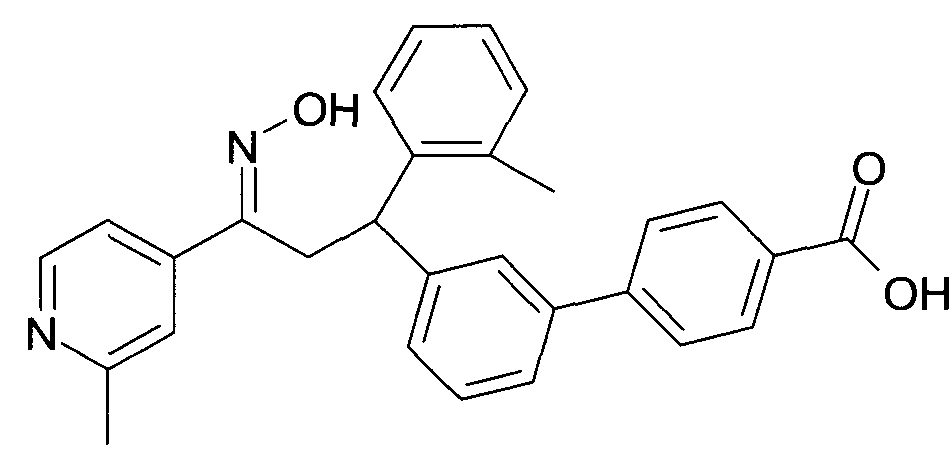
Стадия 1: 3'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил1-бифенил-4-карбоновой кислоты метиловый эфир
По аналогии с примером 19, из 3-(3-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 98, стадия 5) и 4-метоксикарбонил-фенилбороновой кислоты получили соединение, указанное в заголовке, в виде желтой пены, MS (ESI+): m/z=450.3 ([M+H]+).
Стадии 2 и 3: (E)-3'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 74, стадия 7, из 3'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метилового эфира и гидроксиламина гидрохлорида в присутствии NaHCO3 получили 3'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир, который сразу использовали на следующей стадии.
По аналогии с примером 75, из 3'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метилового эфира получили (E)-3'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновую кислоту, которая содержала менее чем 10% Z изомера, в виде серо-белого осадка, MS (ESI+): m/z=451.20 ([M+H]+).
Пример 104
3-(4'-метансульфонил-бифенил-3-ил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
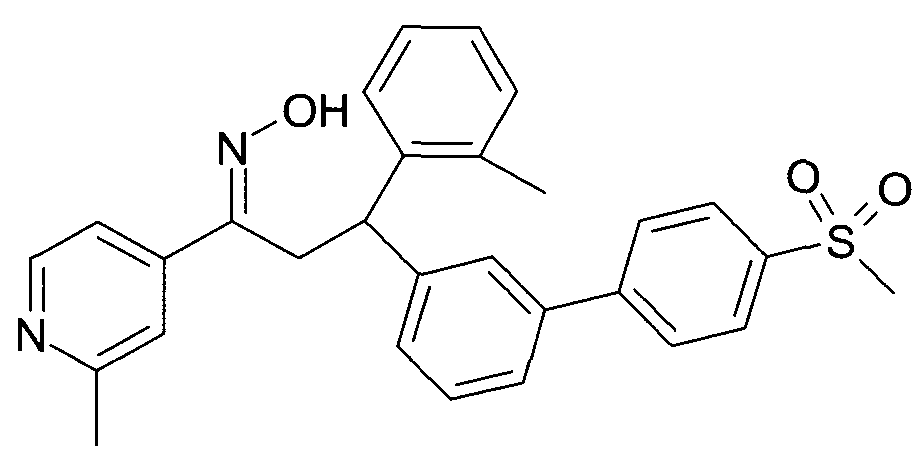
Стадия 1: 3-(4'-метансульфонил-бифенил-3-ил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 22, из 3-(3-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 98, стадия 5) и 4-(метилсульфонил)фенилбороновой кислоты получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=470.2 ([M+H]+).
Стадия 2: 3-(4'-метансульфонил-бифенил-3-ил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 74, стадия 7, 3-(4'-метансульфонил-бифенил-3-ил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (4.8:1) в виде белой пены, MS (ESI+): m/z=485.19 ([M+H]+).
Пример 105
{3-[3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-уксусная кислота

Стадия 1: Циано-{3-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-Фенил}-уксусной кислоты этиловый эфир
По аналогии с примером 80, стадия 1, из 3-(3-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 98, стадия 5) и этилцианоацетата получили соединение, указанное в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=427.2 ([M+H]+).
Стадия 2: {3-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-уксусная кислота
По аналогии с примером 74, стадия 3, из циано-{3-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-уксусной кислоты этилового эфира получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=374.17 ([M+H]+).
Стадия 3: {3-[3-[(Е)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-уксусная кислота
По аналогии с примером 74, стадия 7, из {3-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-уксусной кислоты получили соединение, указанное в заголовке, которое содержало менее чем 6% Z изомера, в виде белого осадка, MS (ESI+): m/z=389.19 ([M+H]+).
Пример 106
3-[3-(3-гидрокси-проп-1-инил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим

Стадия 1: 3-[3-(3-гидрокси-проп-1-инил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 85, стадия 1, из 3-(3-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 98, стадия 5) и 2-пропин-1-ола получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=370.18 ([M+H]+).
Стадия 2: 3-[3-(3-гидрокси-проп-1-инил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-[3-(3-гидрокси-проп-1-инил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (3:1) в виде белой пены, MS (ESI+): m/z=385.1 ([M+H]+).
Пример 107
3-[3-(3-гидрокси-пропил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
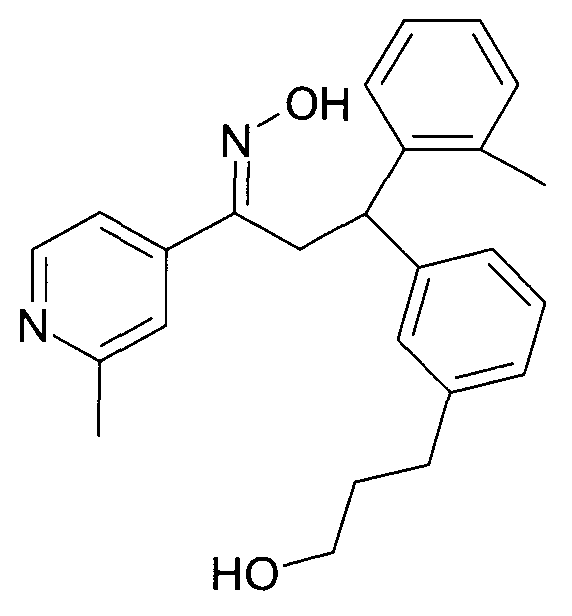
Стадия 1: 3-[3-(3-гидрокси-пропил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 88, стадия 1, из 3-[3-(3-гидрокси-проп-1-инил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=374.2 ([M+H]+).
Стадия 2: 3-[3-(3-гидрокси-пропил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-[3-(3-гидрокси-пропил)-сренил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (3:1) в виде бесцветного масла, MS (ESI+): m/z=389.2 ([M+H]+).
Пример 108
({3'-[3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбонил}-амино)-уксусная кислота
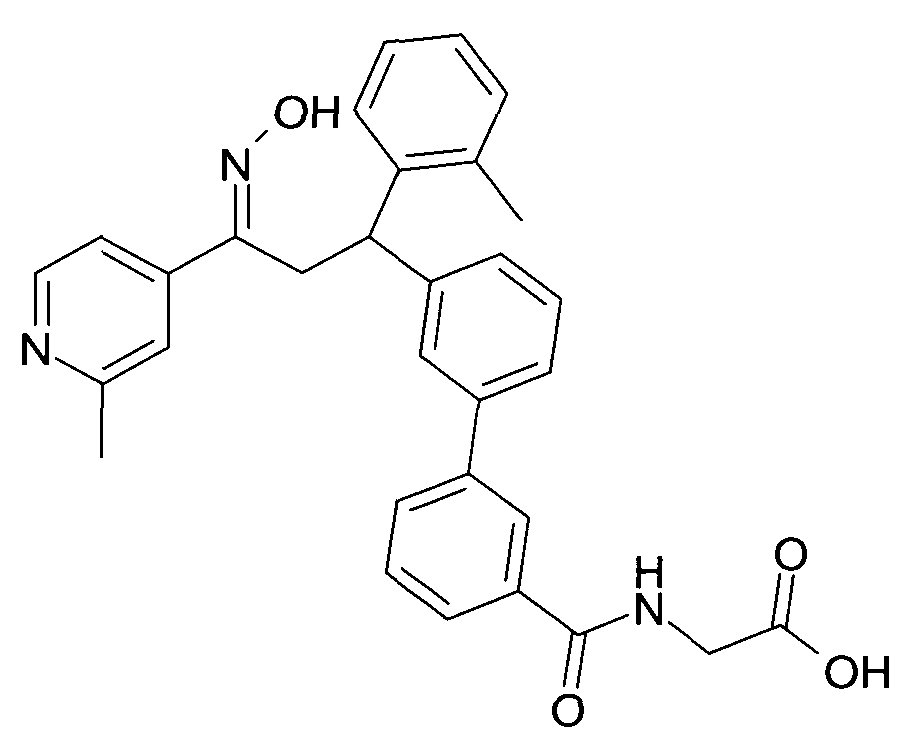
Стадия 1 и 2: ({3'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-3-карбонил}-амино)-уксусная кислота
По аналогии с примером 89, стадия 2, из 3'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-3-карбоновой кислоты (пример 102, стадия 1) и гидрохлорида глицинметилового эфира получили ({3'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-3-карбонил}-амино)-уксусной кислоты метиловый эфир в виде белой пены, который сразу использовали на следующей стадии.
По аналогии с примером 75, из ({3'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-3-карбонил}-амино)-уксусной кислоты метилового эфира получили соединение, указанное в заголовке, в виде белой пены, MS (ESI-): m/z=491.3 ([M-H]-).
Стадия 3: ({3'-[3-[(Е)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбонил}-амино)-уксусная кислота
По аналогии с примером 74, стадия 4, из ({3'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-3-карбонил}-амино)-уксусной кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, которое преципитировалось в виде белого осадка в процессе получения, MS (ESI-): m/z=506.2 ([M-H]-).
Пример 109
3-(4-бром-фенил)-1-(2-метокси-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
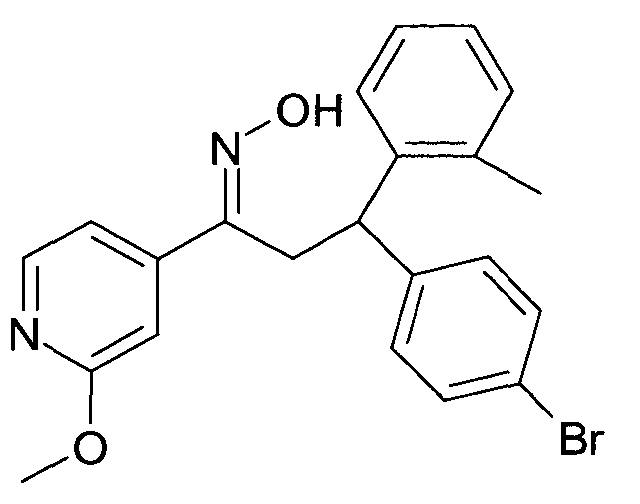
Стадия 1: 3-(4-бром-фенил)-1-(2-метокси-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 74, стадия 5, из 3-(3-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (пример 98, стадия 4) и 4-бром-2-метоксипиридина получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=410.2 ([M+H]+, 1Br).
Стадия 2: 3-(4-бром-фенил)-1-(2-метокси-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-(4-бром-фенил)-1-(2-метокси-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси Е и Z изомеров (2.7:1) в виде белой пены, MS (ESI+): m/z=425.1 ([M+H]+, 1Br).
Пример 110
4-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он
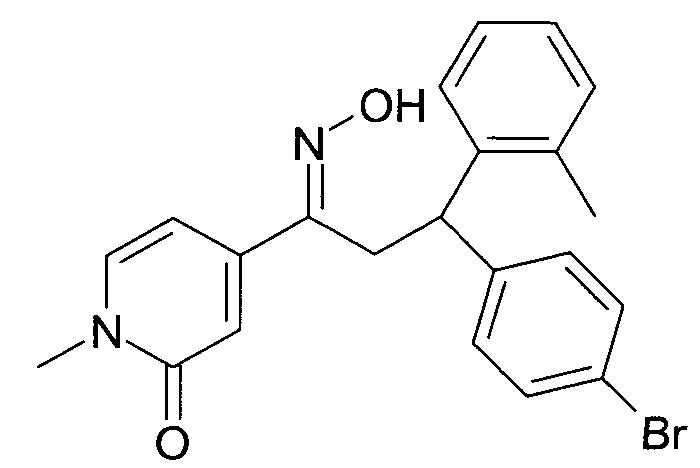
Стадия 1: 4-[3-(4-бром-фенил)-3-о-толил-пропионил]-1H-пиридин-2-он
К раствору 3-(4-бром-фенил)-1-(2-метокси-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 109, стадия 1; 190 мг) в диоксане (9 мл) добавили концентрированную соляную кислоту (1 мл) и смесь нагревали при 100°C в течение 2 ч. Раствор охладили до KT и добавили к смеси воды и EtOAc. Неорганическую фазу экстрагировали EtOAc и объединенные органические фазы промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом с получением неочищенного соединения, указанного в заголовке, в виде белой пены, MS (ESI+): m/z=396.1 ([M+H]+, 1Br).
Стадия 2: 4-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он
К раствору 4-[3-(4-бром-фенил)-3-о-толил-пропионил]-1H-пиридин-2-она (150 мг) в DMA (1 мл) добавили карбонат калия (58 мг) и метилйодид (0.06 мл). Смесь перемешивали при KT в течение 6 ч, добавили воду и ТВМЕ. Фазы разделили и неорганическую фазу экстрагировали ТВМЕ и EtOAc. Объединенные органические фазы промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 1:10 до EtOAc) с получением соединения, указанного в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=410.2 ([M+H]+, 1Br).
Стадия 3: 4-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 74, стадия 7, из 4-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=425.1 ([M+H]+, 1Br).
Пример 111
5-{4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пент-4-иноевая кислота
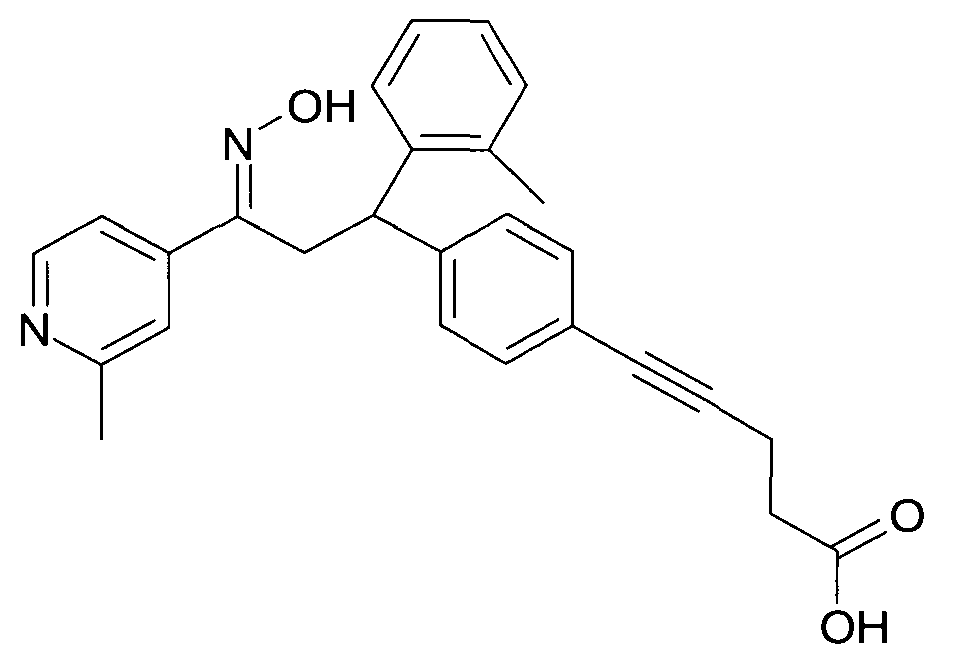
Стадия 1: 5-{4-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-пент-4-иноевой кислоты метиловый эфир
По аналогии с примером 85, стадия 1, из 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 74, стадия 5) и пент-4-иноевой кислоты метилового эфира получили соединение, указанное в заголовке, в виде коричневого масла, MS (ESI+): m/z=426.2067 ([M+H]+).
Стадии 2 и 3: 5-{4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пент-4-иноевая кислота
По аналогии с примером 75, из 5-{4-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-пент-4-иноевой кислоты метилового эфира получили 5-{4-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-пент-4-иноевую кислоту, который сразу использовали на следующей стадии.
По аналогии с примером 74, стадия 7, из 5-{4-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-пент-4-иноевой кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (4.2:1) в виде бесцветного масла, MS (ESI-): m/z=425.1862 ([M-H]-].
Пример 112
3-фтор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота

Стадия 1: 3-фтор-4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
По аналогии с примером 74, стадия 6, из 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и 3-фтор-4-метоксикарбонилфенил бороновой кислоты получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=468.1977 ([M+H]+).
Стадии 2 и 3: 3-фтор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 75, из 3-фтор-4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метилового эфира получили 3-фтор-4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновую кислоту, которую сразу использовали в следующей реакции.
По аналогии с примером 74, стадия 7, из 3-фтор-4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (5.8:1) в виде бесцветного масла, MS (ESI+): m/z=469.1917 ([M+H]+).
Пример 113
4-фтор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбоновая кислота
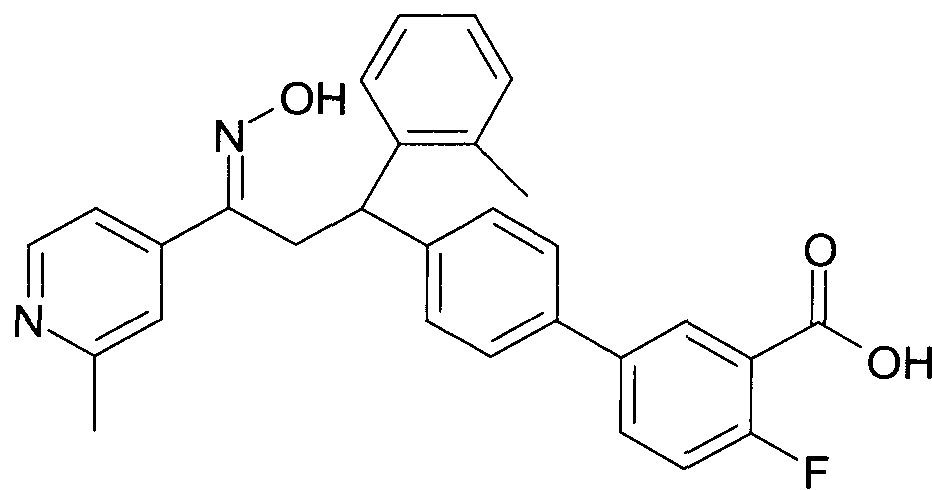
Стадия 1: 4-фтор-4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-3-карбоновой кислоты метиловый эфир
По аналогии с примером 74, стадия 6, из 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и (4-фтор-3-метоксикарбонилфенил) бороновой кислоты получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=468.1977 ([M+H]+).
Стадии 2 и 3: 4-фтор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-3-карбоновая кислота
По аналогии с примером 75, из 4-фтор-4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-3-карбоновой кислоты метилового эфира получили 4-фтор-4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-3-карбоновую кислоту, которую сразу использовали на следующей стадии.
По аналогии с примером 74, стадия 7, из 4-фтор-4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-3-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (3:1) в виде бесцветного масла, MS (ESI+): m/z=469.1910 ([M+H]+).
Пример 114
3-(4-бром-фенил)-5-метил-1-пиридин-4-ил-гексан-1-она оксим
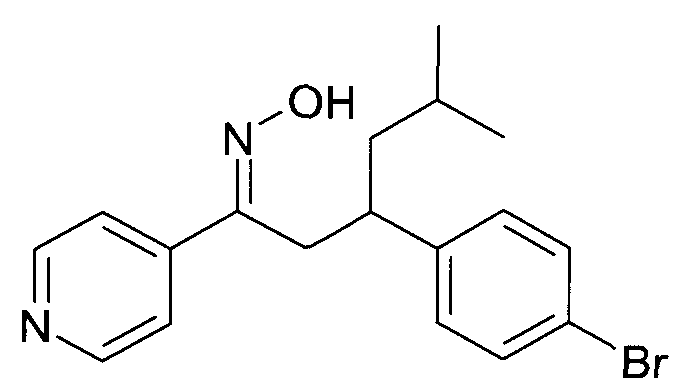
Стадия 1: 3-(4-бром-фенил)-5-метил-1-пиридин-4-ил-гексан-1-он При 0°C, к суспензии Cul (73 мг) в ТГФ (1 мл) по каплям добавили изобутилмагния хлорид (0.38 мл, 2М в диэтиловом эфире). Реакционную смесь перемешивали при 0°C в течение 1 часа, в этот момент суспензия стала коричневой. К этой реакционной смеси добавили суспензию Cul (66 мг) и 3-(4-бром-фенил)-1-пиридин-4-ил-пропенона (100 мг) в ТГФ (1 мл) при 0°C, и смесь перемешивали при 0°C в течение 2 часов. Насыщенный раствор NH4Cl добавили, фазы разделили и неорганическую фазу экстрагировали EtOAc (2x). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 1:2 до EtOAc) с получением соединения, указанного в заголовке, (30 мг, 25%) в виде желтого масла, MS (ESI+): m/z=346.0 ([M+H]+, 1Br).
Стадия 2: 3-(4-бром-фенил)-5-метил-1-пиридин-4-ил-гексан-1-она оксим По аналогии с примером 74, стадия 7, из 3-(4-бром-фенил)-5-метил-1-пиридин-4-ил-гексан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (2.7:1) в виде бесцветного масла, MS (ESI+): m/z=361.2 ([M+H]+, 1Br).
Пример 115 5-{4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пентановая кислота
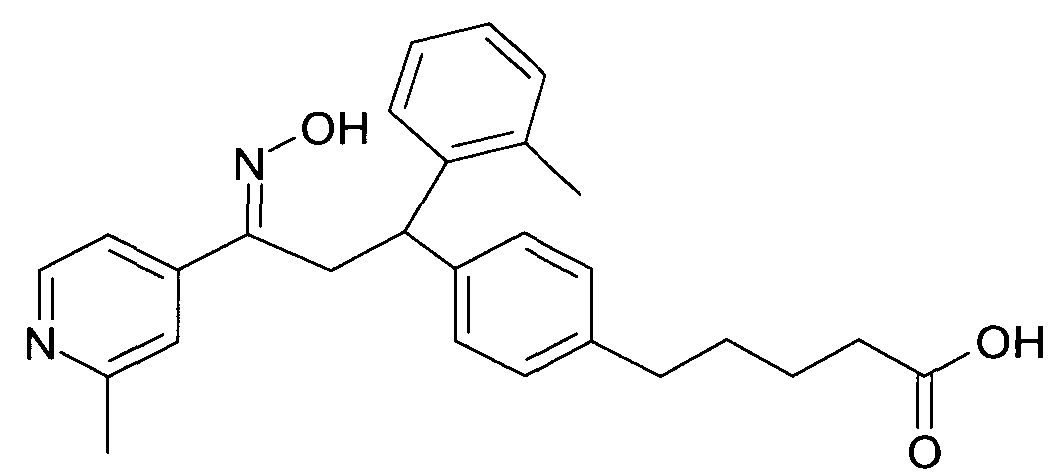
5-{4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пент-4-иноевая кислота в виде смеси E и Z изомеров (4.2:1) (пример 84; 50 мг) в метаноле (2 мл) гидрогенизировали в присутствии Pd (5% на угле, 6 мг) при комнатной температуре в течение 5 часов. Раствор отфильтровали через дикалит, фильтрационный остаток промыли метанолом, и раствор выпарили. Неочищенный продукт очистили флеш-хроматографией на силикагеле (градиент CH2Cl2 до CH2Cl2/MeOH 1:1) с получением 5-{4-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пентановой кислоты в виде смеси E и Z изомеров (4.4:1) в виде бесцветного масла, MS (ESI+): m/z=431.4 ([M+H]+).
Пример 116
(E)-3-(4-бром-фенил)-3-(3-метил-пиридин-2-ил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
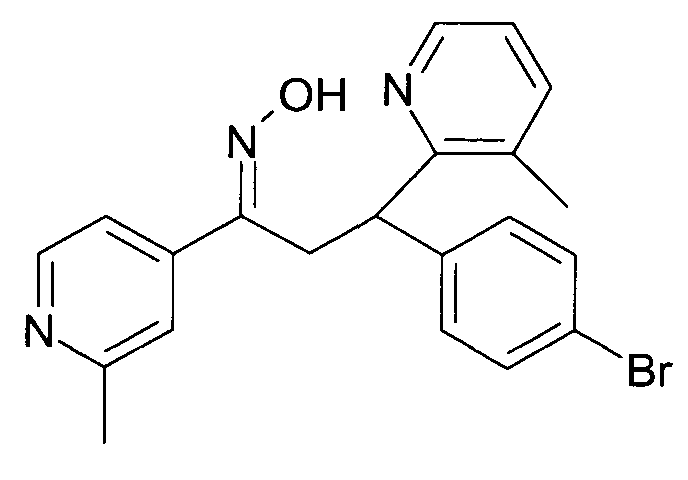
Стадия 1: 3-(4-бром-фенил)-3-(3-метил-пиридин-2-ил)-1-(2-метил-пиридин-4-ил)-пропан-1-он
К раствору 2-бром-3-метилпиридина (0.35 мл) в диэтиловом эфире (4 мл) добавили n-BuLi (2.4 мл, 1.6M в гексане) при -70°C и раствор перемешивали в течение 10 мин при этой температуре. Затем этот раствор добавили к раствору, предварительно полученному из йодида меди (I) (296 мг) и диизопропилсульфида (0.44 мл) в диэтиловом эфире (28 мл) при 0°C. Объединенный раствор перемешивали в течение 15 минут при 0°C, и добавили раствор 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-пропенона (470 мг) в диэтиловом эфире (8 мл). Смесь перемешивали при 0°C в течение 3 часов, затем добваили дополнительное количество медного раствора (полученного, как описано выше). Перемешивание продолжили в течение 2 ч при 0°C и KT в течение ночи. Насыщенный раствор NaHCO3 добавили, фазы разделили и неорганическую фазу экстрагировали EtOAc (2x). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (EtOAc/n-гептан 1:9 до EtOAc) с получением соединения, указанного в заголовке, в виде желтого масла, MS (ESI+): m/z=395.0 ([M+H]+, 1Br).
Стадия 2: (E)-3-(4-бром-фенил)-3-(3-метил-пиридин-2-ил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-(4-бром-фенил)-3-(3-метил-пиридин-2-ил)-1-(2-метил-пиридин-4-ил)-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, которое содержало менее чем 6% Z изомера, в виде бесцветного масла, MS (ESI+): m/z=410.0872 ([M+H]+, 1Br).
Пример 117
(E)-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-(3-метил-пиридин-2-ил)-пропил]-бифенил-4-карбоновая кислота
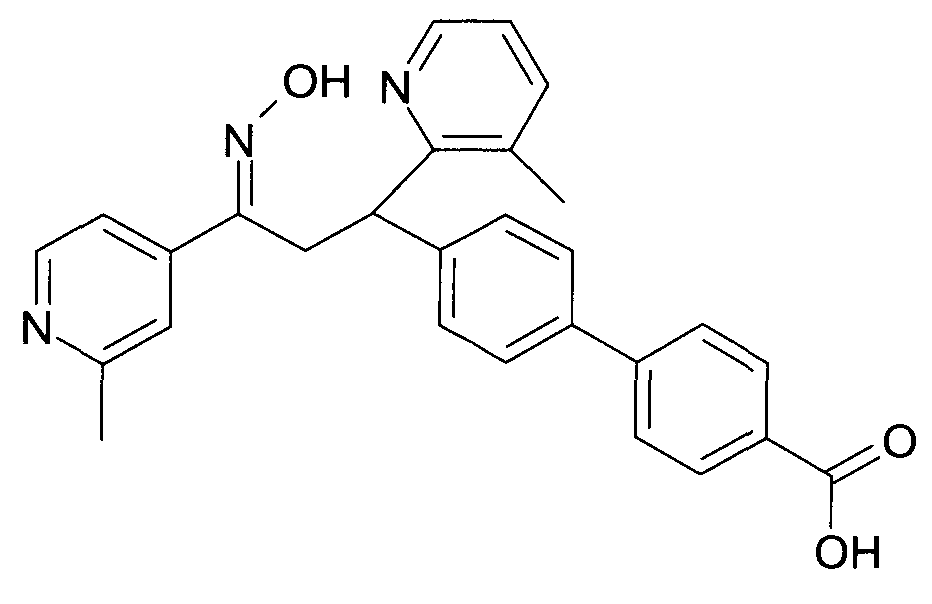
По аналогии с примером 74, стадия 6, из 3-(4-бром-фенил)-3-(3-метил-пиридин-2-ил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксима (пример 116) и 4-карбоксифенилбороновой кислоты получили (Е)-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-(3-метил-пиридин-2-ил)-пропил]-бифенил-4-карбоновую кислоту, которая содержала менее чем 6% Z изомера, в виде белого порошка, MS (ESI+): m/z=452.1971 ([M+H]+).
Пример 118
3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
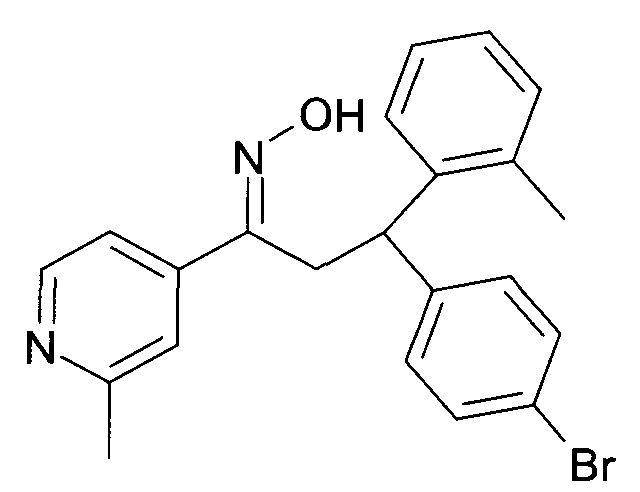
По аналогии с примером 74, стадия 7, из 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 74, стадия 6) и гидроксиламина гидрохлорида в присутствии NaHCO3 получили 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим в виде смеси E и Z изомеров (3,3:1) в виде белой пены, MS (ESI+): m/z=409.0895 ([M+H]+, 1Br).
Пример 119
3-(4-бром-фенил)-1-(2-хлор-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
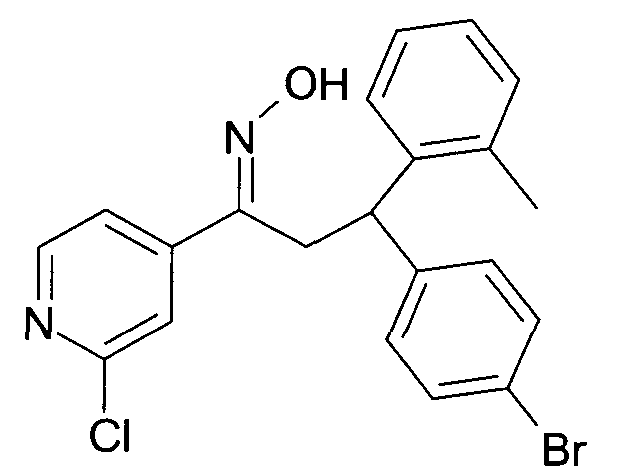
По аналогии с примером 74, стадия 5, из 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (пример 74, стадия 4) и 2-хлор-4-йодопиридина (CAS RN: [153034-86-7]) получили 3-(4-бром-фенил)-1-(2-хлор-пиридин-4-ил)-3-о-толил-пропан-1-он в виде бесцветного масла, который сразу использовали на следующей стадии.
По аналогии с примером 74, стадия 7, из 3-(4-бром-фенил)-1-(2-хлор-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили 3-(4-бром-фенил)-1-(2-хлор-пиридин-4-ил)-3-о-толил-пропан-1-она оксим в виде смеси E и Z изомеров (2.1:1) в виде белого осадка, MS (EI): m/z=428 ([M]+, 1Br, 1Cl).
Пример 120
(E)-3-(4-бром-фенил)-1-(2,6-дихлор-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
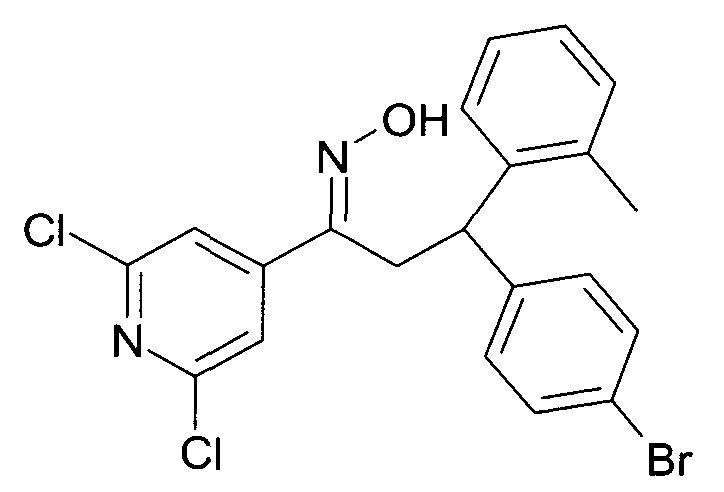
По аналогии с примером 74, стадия 5, из 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (пример 74, стадия 4) и 2,6-дихлор-4-йодопиридина (CAS RN: [98027-84-0]) получили 3-(4-бром-фенил)-1-(2,6-дихлор-пиридин-4-ил)-3-о-толил-пропан-1-он в виде белого осадка, который сразу использовали в следующей реакции.
По аналогии с примером 74, стадия 7, из 3-(4-бром-фенил)-1-(2,6-дихлор-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили (E)-3-(4-бром-фенил)-1-(2,6-дихлор-пиридин-4-ил)-3-о-толил-пропан-1-она оксим в виде белого осадка, MS (ESI-): m/z=460.9832 ([М-Н]-, 1Br).
Пример 121
3-(4-бром-фенил)-1-(5-хлор-2-фтор-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
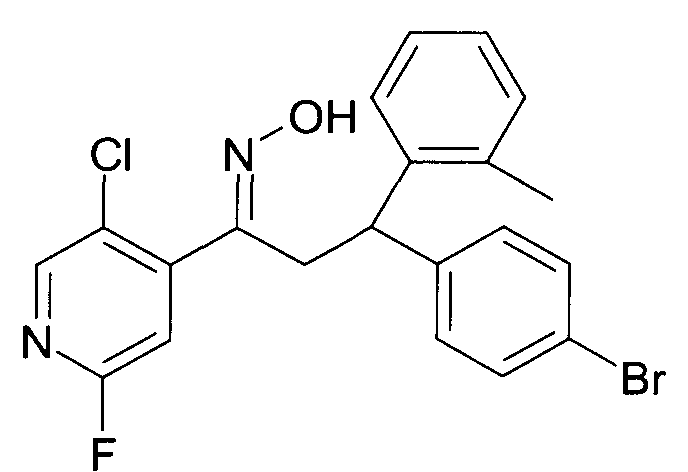
Стадия 1: 3-(4-бром-фенил)-1-(5-хлор-2-фтор-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 74, стадия 5, из 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (пример 74, стадия 4) и 5-хлор-2-фтор-4-йодопиридина (CAS RN: [659731-48-3]) получили соединение, указанное в заголовке, в виде светло-желтого масла, MS (ESI-): m/z=430.0014 ([M-H]-, 1Br).
Стадия 2: 3-(4-бром-фенил)-1 -(5-хлор-2-фтор-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-(4-бром-фенил)-1-(5-хлор-2-фтор-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (1.6:1) в виде белой пены, MS (ESI-): m/z=445.0124 ([M-H]-, 1Br).
Пример 122
(E)-3-(3-бром-фенил)-1-(2-фтор-6-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
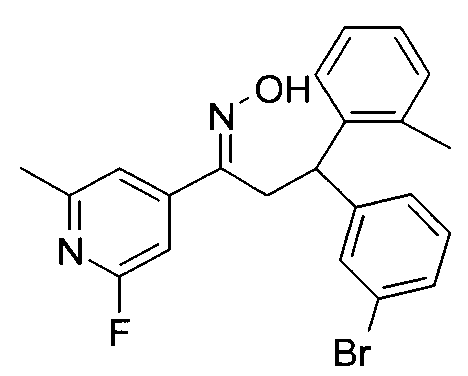
Стадия 1: 3-(3-бром-фенил)-1-(2-фтор-6-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 74, стадия 5, из 3-(3-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (пример 98, стадия 4) и 2-фтор-4-йодо-6-пиколина (CAS RN: [884494-45-5]) получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=412.1 ([M+H]+, 1Br).
Стадия 2: (E)-3-(3-бром-фенил)-1-(2-фтор-6-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-(3-бром-фенил)-1-(2-фтор-6-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=427.0801 ([M+H]+, 1Br).
Пример 123
(E)-3-(3-бром-фенил)-1-(5-бром-пиридин-3-ил)-3-о-толил-пропан-1-она оксим
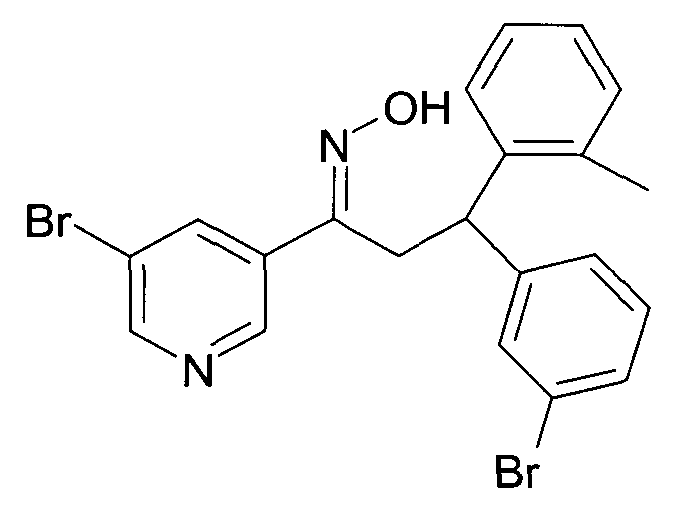
Стадия 1: 3-(3-бром-фенил)-1-(5-бром-пиридин-3-ил)-3-о-толил-пропан-1-он
По аналогии с примером 74, стадия 5, из 3-(3-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (пример 98, стадия 4) и 3,5-дибромпиридина (CAS RN:[625-92-3]), используя изопропилмагния бромид вместо n-бутиллития, получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=457.9738 ([M+H]+, 1Br).
Стадия 2: (E)-3-(3-бром-фенил)-1-(5-бром-пиридин-3-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-(3-бром-фенил)-1-(5-бром-пиридин-3-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=472.9850 ([M+H]+, 1Br).
Пример 124
3-(4-бром-фенил)-1-(2-фтор-5-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
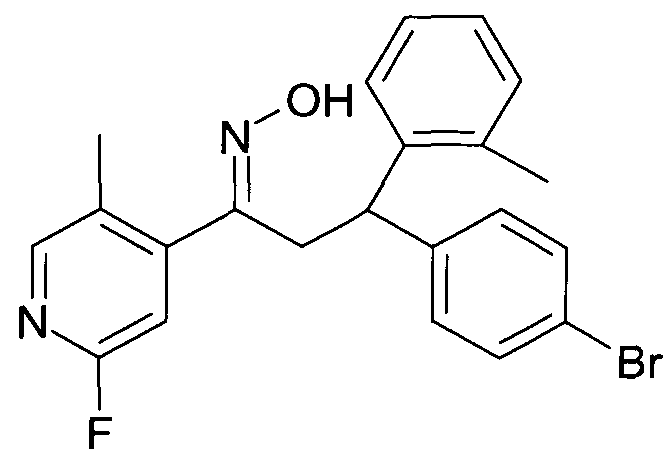
Стадия 1: 3-(4-бром-фенил)-1-(2-фтор-5-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 74, стадия 5, из 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (пример 74, стадия 4) и 2-фтор-4-йодо-5-пиколина (CAS RN: [153034-94-7]) получили соединение, указанное в заголовке, в виде светло-желтого масла, MS (ESI-): m/z=410.0558 ([M-H]-, 1Br).
Стадия 2: 3-(4-бром-фенил)-1-(2-фтор-5-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-(4-бром-фенил)-1-(2-фтор-5-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (1.6:1) в виде бесцветного масла, MS (ESI+): m/z=427.0813 ([M+H]+, 1Br).
Пример 125
3-(4-бром-фенил)-1-хинолин-6-ил-3-о-толил-пропан-1-она оксим
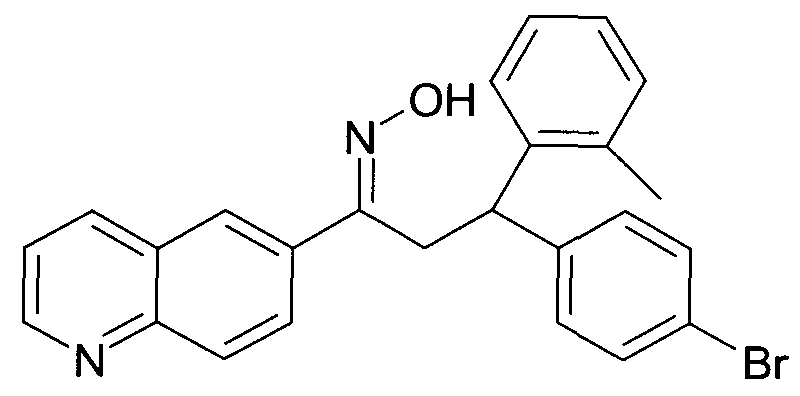
Стадия 1: 3-(4-бром-фенил)-1-хинолин-6-ил-3-о-толил-пропан-1-он
По аналогии с примером 74, стадия 5, из 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (пример 74, стадия 4) и 6-бромхинолина (CAS RN: [5332-25-2]) получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=430.0791 ([M+H]+, 1Br).
Стадия 2: 3-(4-бром-фенил)-1-хинолин-6-ил-3-о-толил-пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-(4-бром-фенил)-1-хинолин-6-ил-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (5.6:1) в виде белой пены, MS (ESI+): m/z=445.0907 ([M+H]+, 1Br).
Пример 126
3-(4-бром-фенил)-1-(2-фтор-6-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
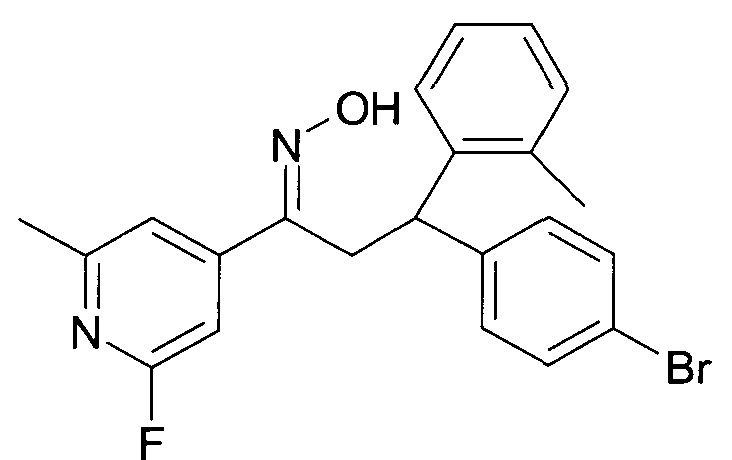
Стадия 1: 3-(4-бром-фенил)-1-(2-фтор-6-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 74, стадия 5, из 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (пример 74, стадия 4) и 2-фтор-4-йодо-6-пиколина (CAS RN: [884494-45-5]) получили соединение, указанное в заголовке, в виде бесцветного масла, MS (EI): m/z=411 ([M]+, 1Br).
Стадия 2: 3-(4-бром-фенил)-1-(2-фтор-6-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-(4-бром-фенил)-1-(2-фтор-6-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (2.4:1) в виде бесцветного масла, MS (ESI+): m/z=427,0804 ([M+H]+, 1Br).
Пример 127
3-(4-бром-фенил)-1-(2-хлор-5-фтор-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
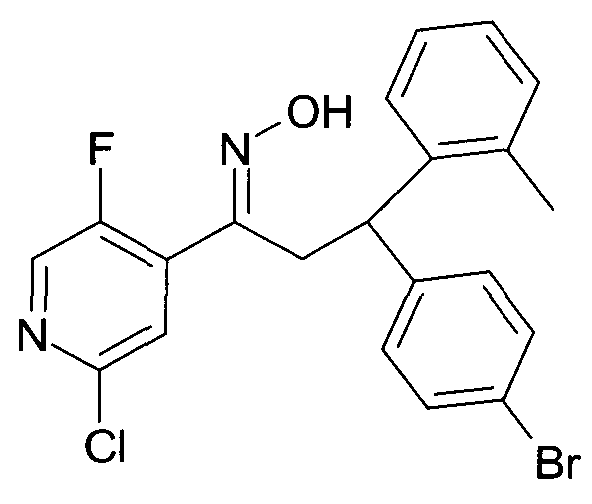
Стадия 1: 3-(4-бром-фенил)-1-(2-хлор-5-фтор-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 74, стадия 5, из 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (пример 74, стадия 4) и 2-хлор-5-фтор-4-йодопиридина (CAS RN: [659731-48-3]) получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI-): m/z=430.0013 ([M-H]-, 1Br).
Стадия 2: 3-(4-бром-фенил)-1 -(2-хлор-5-фтор-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-(4-бром-фенил)-1-(2-хлор-5-фтор-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (1.6:1) в виде бесцветного масла, MS (ESI+): m/z=447.733 ([M+H]+).
Пример 128
(E)-3-(4-бром-фенил)-1-(2-фтор-5-метил-пиридин-3-ил)-3-о-толил-пропан-1-она оксим
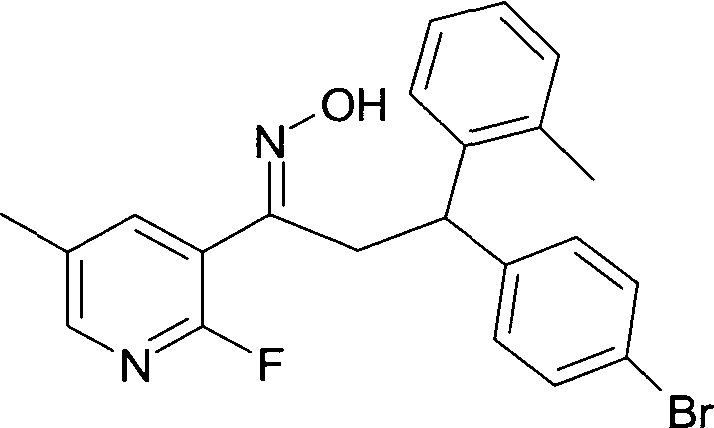
Стадия 1: 3-(4-бром-фенил)-1-(2-фтор-5-метил-пиридин-3-ил)-3-о-толил-пропан-1-он
По аналогии с примером 74, стадия 5, из 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (пример 74, стадия 4) и 2-фтор-5-метилпиридина (CAS RN: [2369-19-9]) получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=411 ([M]+, 1Br).
Стадия 2: (E)-3-(4-бром-фенил)-1-(2-фтор-5-метил-пиридин-3-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-(4-бром-фенил)-1-(2-фтор-5-метил-пиридин-3-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=427.0814 ([M+H]+, 1Br).
Пример 129
3-(4-бром-фенил)-4,4-диметил-1-(2-метил-пиридин-4-ил)-пентан-1-она оксим

Стадия 1: 3-(4-бром-фенил)-4.4-диметил-пентановой кислоты метокси-метил-амид
По аналогии с примером 74, стадия 4, из 3-(4-бром-фенил)-4,4-диметил-пентановой кислоты (CAS RN: [1017356-66-9]) и N,O-диметилгидроксиламина гидрохлорида получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=328.0895 ([M+H]+, 1Br).
Стадии 2 и 3: 3-(4-бром-фенил)-4,4-диметил-1-(2-метил-пиридин-4-ил)-пентан-1-она оксим
По аналогии с примером 74, стадия 5, из 3-(4-бром-фенил)-4,4-диметил-пентановой кислоты метокси-метил-амида и 2-фтор-4-йодо-5-пиколина (CAS RN:
[153034-94-7]) получили 3-(4-бром-фенил)-1 -(2-фтор-5-метил-пиридин-4-ил)-4,4-диметил-пентан-1-он в виде бесцветного масла, которое сразу использовали на следующей стадии.
По аналогии с примером 74, стадия 7, из 3-(4-бром-фенил)-1-(2-фтор-5-метил-пиридин-4-ил)-4,4-диметил-пентан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (3.7:1) в виде белой пены, MS (ESI+): m/z=375.1062 ([M+H]+, 1Br).
Пример 130
4'-{3-(2-фтор-5-метил-пиридин-4-ил)-3-[гидроксиимино]-1-о-толил-пропил}-бифенил-4-карбоновая кислота
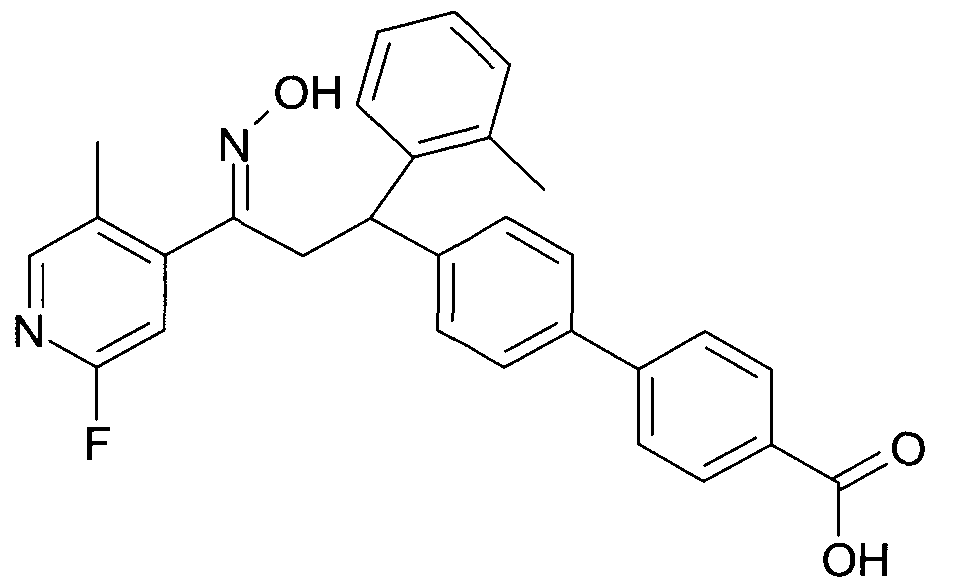
Стадия 1: 4'-[3-(2-фтор-5-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
По аналогии с примером 74, стадия 6, из 3-(4-бром-фенил)-1-(2-фтор-5-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 124, стадия 1) и 4-метоксикарбонилфенил)бороновой кислоты получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=468.1961 ([M+H]+).
Стадия 2: 4'-[3-(2-фтор-5-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 75, из 4'-[3-(2-фтор-5-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метилового эфира получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI-): m/z=452.1661 ([M-H]-).
Стадия 3: 4'-{3-(2-фтор-5-метил-пиридин-4-ил)-3-[гидроксиимино]-1-о-толил-пропил}-бифенил-4-карбоновая кислота
По аналогии с примером 74, стадия 7, из 4'-[3-(2-фтор-5-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (1.7:1) в виде бесцветного масла, MS (ESI+): m/z=469.1924 ([M+H]+).
Пример 131
3-фтор-4'-[3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
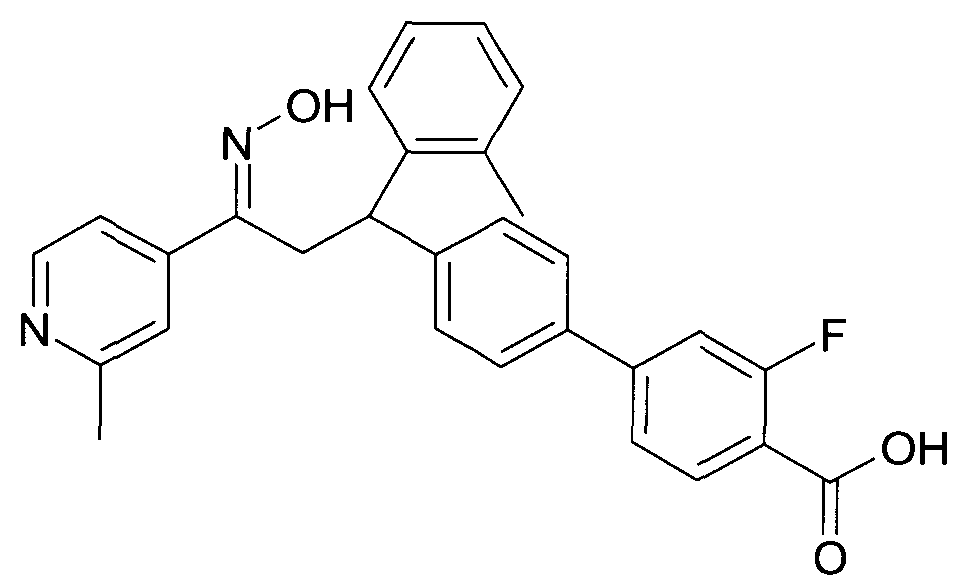
К суспензии 3-фтор-4'-[3-[гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты (пример 112; 151 мг) в DME (2.5 мл) добавили HCl в диоксане (4М, 0.8 мл) при комнатной температуре. Реакционную смесь перемешивали при 50°C в течение 4 часов, сконцентрировали и растворили в этилацетате (5 мл) и насыщенном водном растворе NaHCO3 (0.1 мл). Добавили насыщенный водный раствор NH4Cl, фазы разделили и неорганическую фазу экстрагировали EtOAc (2х). Объединенные органические фазы промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом с получением 3-фтор-4'-[3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты в виде желтого осадка, MS (ESI+): m/z=469.3 ([M+H]+).
Пример 132
(E)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-(2-трифторметил-фенил)-пропан-1-она оксим
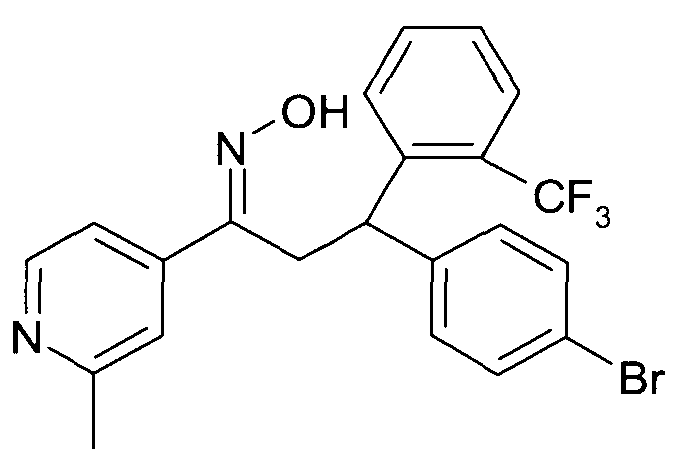
Стадии 1 и 2: 3-(4-бром-фенил)-2-циано-3-(2-трифторметил-фенил)-пропионовой кислоты этиловый эфир
По аналогии с примером 74, стадия 1, из 4-бромбензальдегида и этилцианоацетата получили (E)-3-(4-бром-фенил)-2-циано-акриловой кислоты этиловый эфир в виде желтого осадка, который сразу использовали на следующей стадии.
По аналогии с примером 74, стадия 2, из (E)-3-(4-бром-фенил)-2-циано-акриловой кислоты этилового эфира и 2-бромбензотрифорида (CAS RN: [392-83-6]) получили соединение, указанное в заголовке, в виде коричневого масла, MS (ESI-): m/z=424.0 ([M-H]-, 1Br).
Стадии 3 и 4: 3-(4-бром-фенил)-N-метокси-N-метил-3-(2-трифторметил-фенил)-пропионамид
По аналогии с примером 74, стадия 3, из 3-(4-бром-фенил)-2-циано-3-(2-трифторметил-фенил)-пропионовой кислоты этилового эфира получили 3-(4-бром-фенил)-3-(2-трифторметил-фенил)-пропионовую кислоту в виде коричневого порошка, который сразу использовали на следующей стадии.
По аналогии с примером 74, стадия 4, из 3-(4-бром-фенил)-3-(2-трифторметил-фенил)-пропионовой кислоты и М,0-диметилгидроксиламина гидрохлорида получили соединение, указанное в заголовке, в виде коричневого вязкого масла, MS (ESI+): m/z=416.2 ([M+H]+, 1Br).
Стадия 5: 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-(2-трифторметил-Фенил)-пропан-1-он
По аналогии с примером 74, стадия 5, из 3-(4-бром-фенил)-N-метокси-N-метил-3-(2-трифторметил-фенил)-пропионамида и 4-бром-2-метилпиридина получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=448.0 ([M+H]+, 1Br).
Стадия 6: (E)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-(2-трифторметил-фенил)-пропан-1-она оксим
Раствор 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-(2-трифторметил-фенил)-пропан-1-она (80 мг), гидроксиламина гидрохлорида (37 мг) и гидрокарбоната натрия (45 мг) в смеси этанола (4 мл) и воды (0.7 мл) нагревали до кипения с обратным холодильником в течение 2 часов. Насыщенный раствор NH4Cl добавили, фазы разделили и неорганическую фазу экстрагировали EtOAc (2x). Объединенные органические слои промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт растворили в DME (5 мл) и добавили HCl в диоксане (4М, 0.45 мл) при комнатной температуре. Реакционную смесь перемешивали при 50°C в течение ночи, сконцентрировали и растворили в этилацетате (5 мл) и насыщенном водном растворе NaHCO3 (0.1 мл). Добавили насыщенный водный раствор NH4Cl, фазы разделили и неорганическую фазу экстрагировали EtOAc (2х). Объединенные органические фазы промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (CH2Cl2/MeOH 95:5) с получением соединения, указанного в заголовке, (65 мг, 79%) в виде белой пены, MS (ESI+): m/z=463.1 ([M+H]+, 1Br).
Пример 133
(E)-3-(4'-метансульфонил-бифенил-4-ил)-1-(2-метил-пиридин-4-ил)-3-(2-трифторметил-фенил)-пропан-1-она оксим
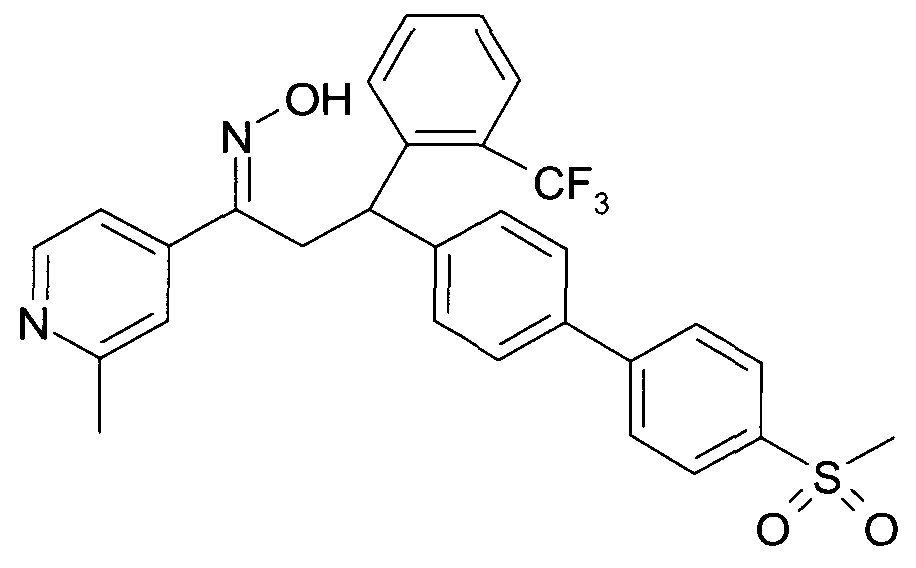
Стадия 1: 3-(4'-метансульфонил-бифенил-4-ил)-1-(2-метил-пиридин-4-ил)-3-(2-трифторметил-фенил)-пропан-1-он
По аналогии с примером 74, стадия 6, из 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-(2-трифтор-метил-фенил)-пропан-1-она (пример 132, стадия 5) и 4-(метилсульфонил)-фенилбороновой кислоты (CAS RN: [149104-88-1]) получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=524.2 ([M+H]+).
Стадия 2: (E)- 3-(4'-метансульфонил-бифенил-4-ил)-1-(2-метил-пиридин-4-ил)-3-(2-трифторметил-фенил)-пропан-1 -она оксим
По аналогии с примером 132, стадия 6, из 3-(4'-метансульфонил-бифенил-4-ил)-1-(2-метил-пиридин-4-ил)-3-(2-трифторметил-фенил)-пропан-1 -она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=539.2 ([M+H]+).
Пример 134
4'-[3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-(2-трифторметил-фенил)-пропил]-бифенил-4-карбоновая кислота
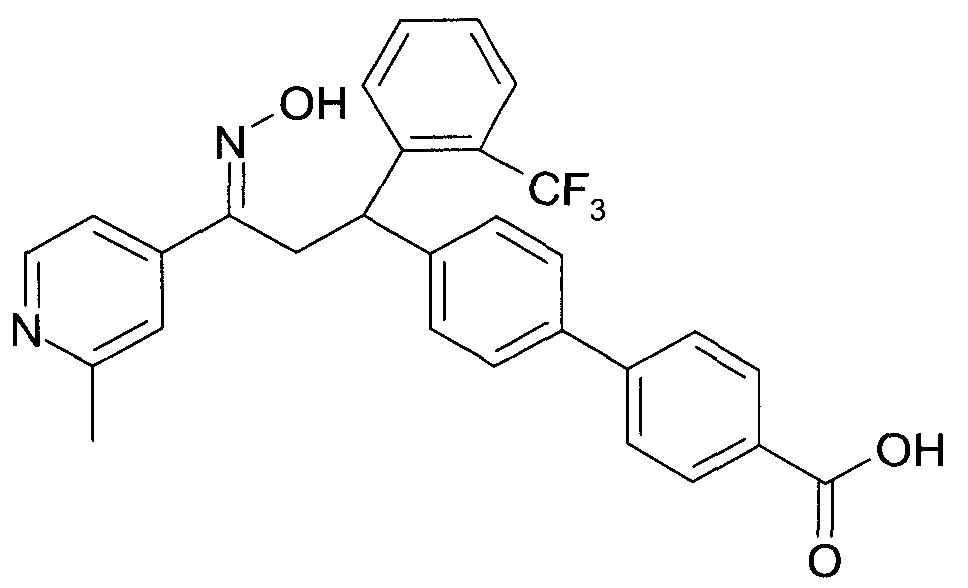
Стадия 1: 4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-(2-трифторметил-фенил)-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 74, стадия 6, из 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-(2-трифтор-метил-фенил)-пропан-1-она (пример 132, стадия 5) и 4-карбоксифенилбороновой кислоты (CAS RN: [14047-29-1]) получили соединение, указанное в заголовке, в виде желтого осадка, MS (ESI-): m/z=488.148 ([M-H]-).
Стадия 2: 4'-[3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-(2-трифторметил-фенил)-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 132, стадия 6, из 4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1 -(2-трифторметил-фенил)-пропил]-бифенил-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=505.173 ([M+H]+).
Пример 135
3-фтор-4'-[3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-(2-трифторметил-фенил)-пропил]-бифенил-4-карбоновая кислота
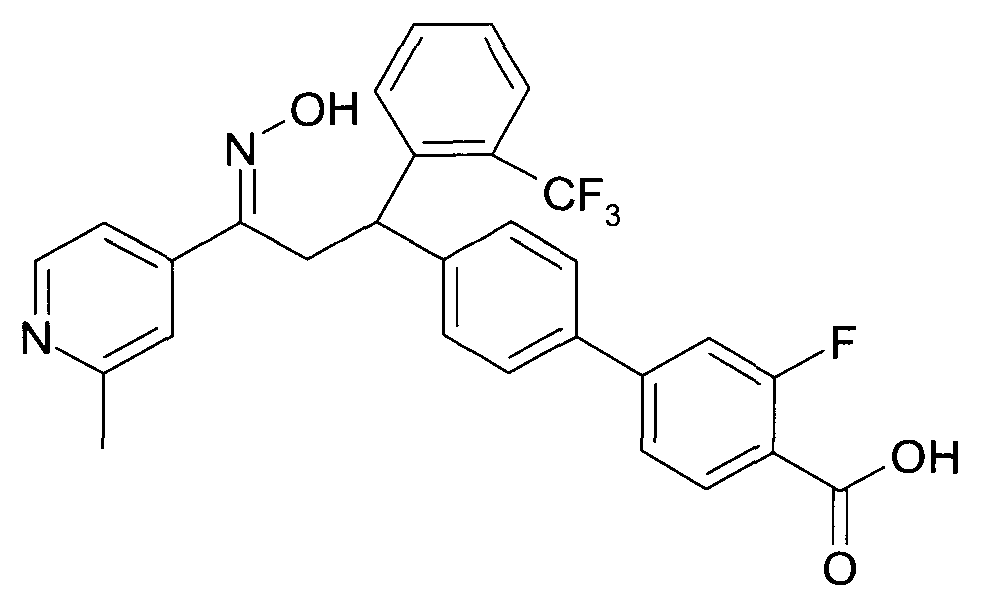
Стадия 1: 3-фтор-4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-(2-трифторметил-фенил)-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 74, стадия 6, из 3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-(2-трифтор-метил-фенил)-пропан-1-она (пример 132, стадия 5) и 4-карбокси-3-фтор-фенилбороновой кислоты (CAS RN: [120153-08-4]) получили соединение, указанное в заголовке, в виде коричневой пены, MS (ESI+): m/z=508.1 ([M+H]+).
Стадия 2: 3-фтор-4'-[3-[(E)-гидроксиимино1-3-(2-метил-пиридин-4-ил)-1-(2-трифторметил-фенил)-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 132, стадия 6, из 3-фтор-4'-[3-(2-метил-пиридин-4-ил)-3-оксо-1-(2-трифторметил-фенил)-пропил]-бифенил-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI-): m/z=521.2 ([M-H]-).
Пример 136
(E)-3-[4-(4-метансульфонил-пиперазин-1-ил)-фенил]-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
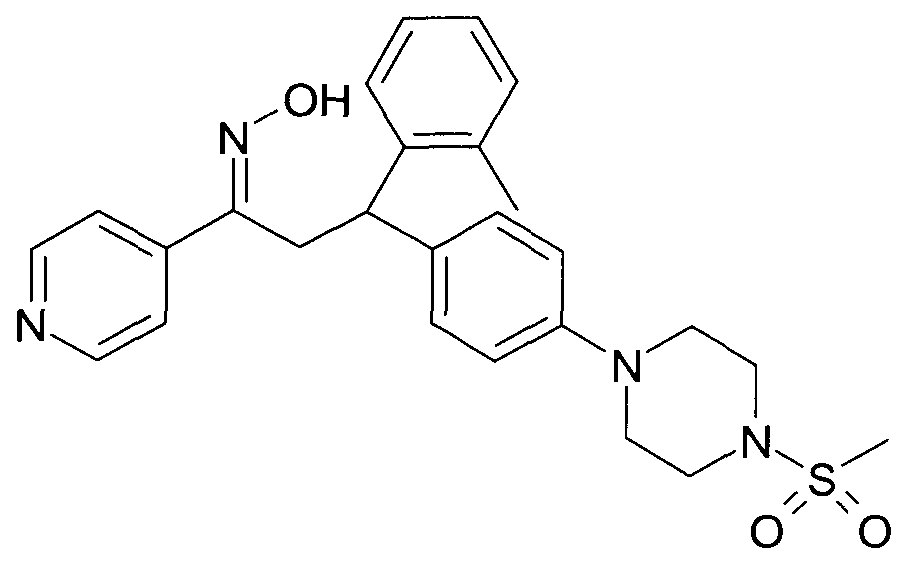
По аналогии с примером 39, из (E)-3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксима (пример 31) и 1-метансульфонил-пиперазина (CAS RN: [55276-43-2]) получили соединение, указанное в заголовке, в виде серо-белой пены, MS (ESI+): m/z=479.2 ([M+H]+).
Пример 137
(E)-3-[4-(4-метансульфонил-пиперазин-1-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-(2-трифторметил-фенил)-пропан-1-она оксим
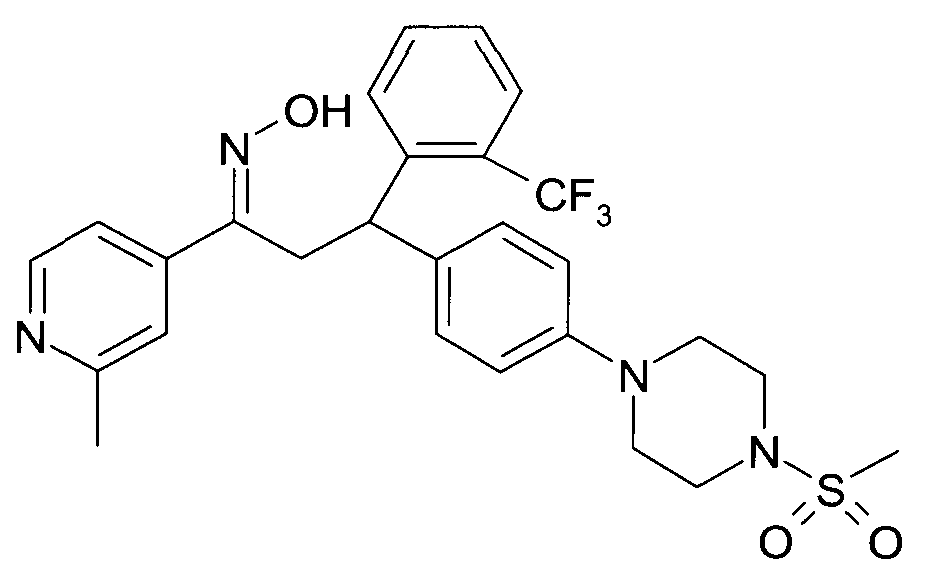
По аналогии с примером 39, из (E)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-(2-трифторметил-фенил)-пропан-1-она оксима (пример 132) и 1-метансульфонил-пиперазин (CAS RN: [55276-43-2]) получили соединение, указанное в заголовке, в виде желтой пены, MS (ESI+): m/z=547.3 ([M+H]+).
Пример 138
(E)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она оксим
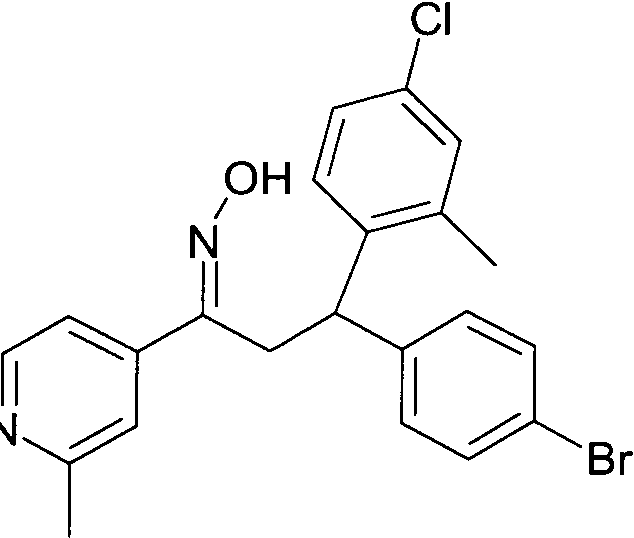
Стадия 1: Этил 3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-2-цианопропаноат
По аналогии с примером 74, стадия 2, из 3-(4-бром-фенил)-2-циано-акриловой кислоты этилового эфира (пример 74, стадия 1) и 4-хлор-2-толилмагния бромида получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=406.00 [M+H]+.
Стадия 2: 3-(4-бромфенил)-3-(4-хлор-2-метилфенил)пропановая кислота
По аналогии с примером 74, стадия 3, из этил 3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-2-цианопропаноата получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=352.98 [M+H]+.
Стадия 3: 3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-N-метокси-N-метилпропанамид
По аналогии с примером 74, стадия 4, из 3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-пропановой кислоты и N,O-диметилгидроксиламина гидрохлорида получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=398.03 [M+H]+.
Стадия 4: 3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-он
По аналогии с примером 74, стадия 5, из 3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-N-метокси-N-метилпропанамида и 4-бром-2-метилпиридина получили соединение, указанное в заголовке, в виде светло-коричневого осадка, MS (ESI+): m/z=430.04 [M+H]+.
Стадия 5: (E)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1 -(2-метилпиридин-4-ил)пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, которое содержало менее чем 10% Z изомера, в виде белой пены, MS (ESI+): m/z=445.05 [M+H]+.
Пример 139
(E)-4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)бифенил-4-карбоновая кислота
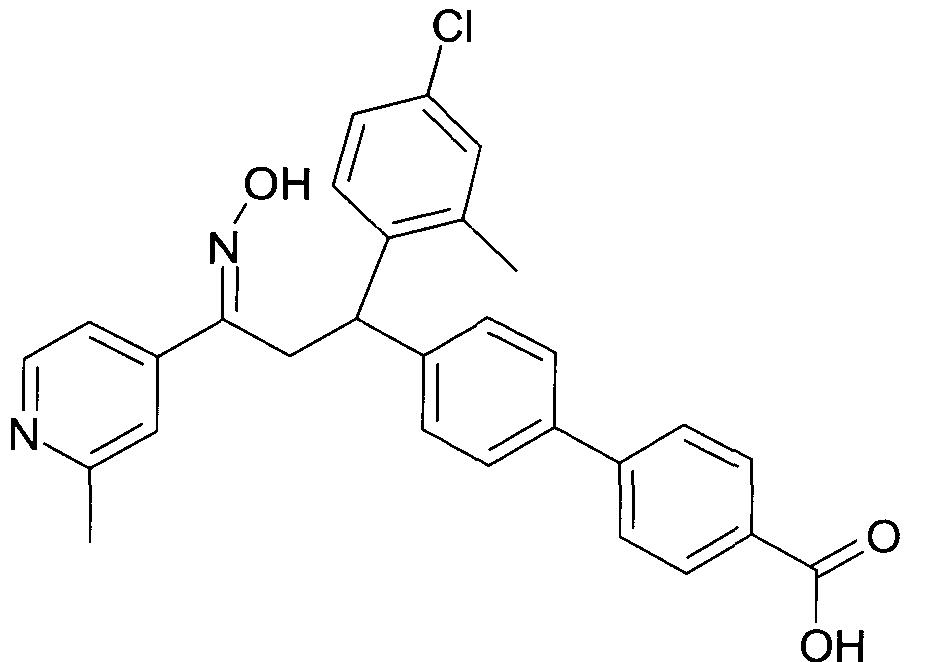
По аналогии с примером 74, стадия 6, из 3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она оксима (пример 138) и 4-карбоксифенилбороновой кислоты получили соединение, указанное в заголовке, в виде светло-коричневой пены, MS (ESI+): m/z=485.162 [M+H]+.
Пример 140
(E)-3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она оксим
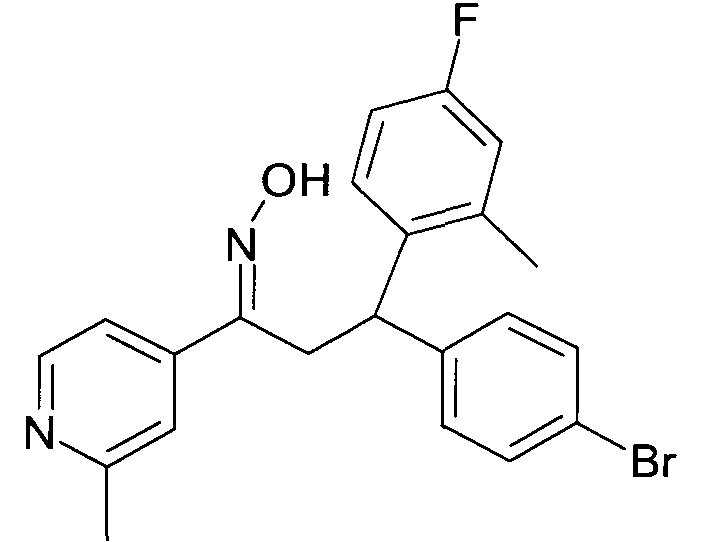
Стадия 1: Этил 3-(4-бромфенил)-2-циано-3-(4-фтор-2-метилфенил)пропаноат
По аналогии с примером 74, стадия 2, из 3-(4-бром-фенил)-2-циано-акриловой кислоты этилового эфира (пример 74, стадия 1) и 4-фтор-2-толилмагния бромида получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI-): m/z=390.03 [M-H]-.
Стадия 2: 3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-пропановая кислота
По аналогии с примером 74, стадия 3, из этил 3-(4-бромфенил)-2-циано-3-(4-фтор-2-метилфенил)пропаноата получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=335.01 [M+H]-.
Стадия 3: 3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-N-метокси-N-метилпропанамид
По аналогии с примером 74, стадия 4, из 3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-пропановой кислоты и N,O-диметилгидроксиламина гидрохлорида получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=382.06 [M+H]+.
Стадия 4: 3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-он
По аналогии с примером 74, стадия 5, из 3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-N-метокси-N-метилпропанамида и 4-бром-2-метилпиридина
получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=414.07 [M+H]+.
Стадия 5: (E)-3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1 -(2-метилпиридин-4-ил)пропан-1-она оксим
По аналогии с примером 74, стадия 7, из 3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3. Получили соединение, указанное в заголовке, которое содержало менее чем 10% Z изомера, в виде белой пены, MS (ESI+): m/z=427.08 [M+H]+.
Пример 141
(E)-4'-(1-(4-фтор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)бифенил-4-карбоновая кислота
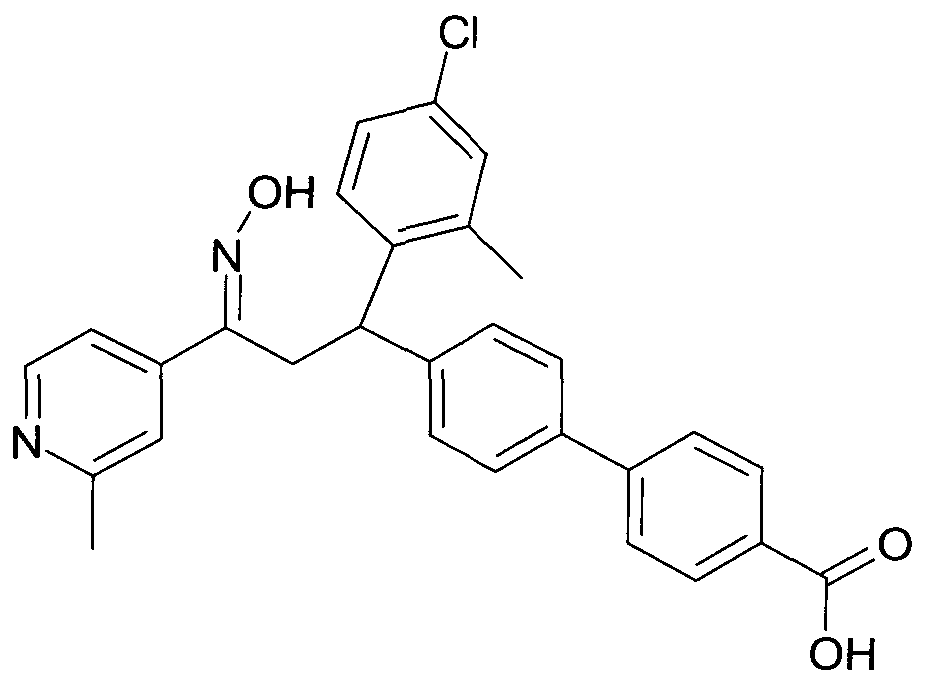
По аналогии с примером 74, стадия 6, из 3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она оксима (пример 140) и 4-карбоксифенилбороновой кислоты получили (E)-4'-(1-(4-фтор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)бифенил-4-карбоновую кислоту, которая содержала менее чем 10% Z изомера, в виде серо-белой пены, MS (ESI+): m/z=469.1 [M+H]+.
Пример 142
(E,R)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим

Стадия 1: (S)-3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамид и (R)-3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамид
Разделение 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (пример 74, стадия 4) с помощью хиральной ВЭЖХ (Chiralpak, 3% этанол/гептан) дало (3)-3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамид в виде светло-желтого масла, MS (ESI+): m/z=362.0752 ([M+H]+, 1Br) и (R)-3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамид в виде светло-желтого масла, MS (ESI+): m/z=362.0751 ([M+H]+, 1Br).
Стадия 2: (R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 74, стадия 5, из (R)-3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида и 4-бром-2-метилпиридина получили соединение, указанное в заголовке, в виде желтого осадка, MS (ESI+): m/z=394.0797 ([M+H]+, 1Br).
Стадия 3: (E,R)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим
По аналогии с примером 132, стадия 6, из (R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=409.2 ([M+H]+, 1Br).
Пример 143
(E,R)-1-(2-метил-пиридин-4-ил)-3-(4-пиримидин-5-ил-фенил)-3-о-толил-пропан-1-она оксим
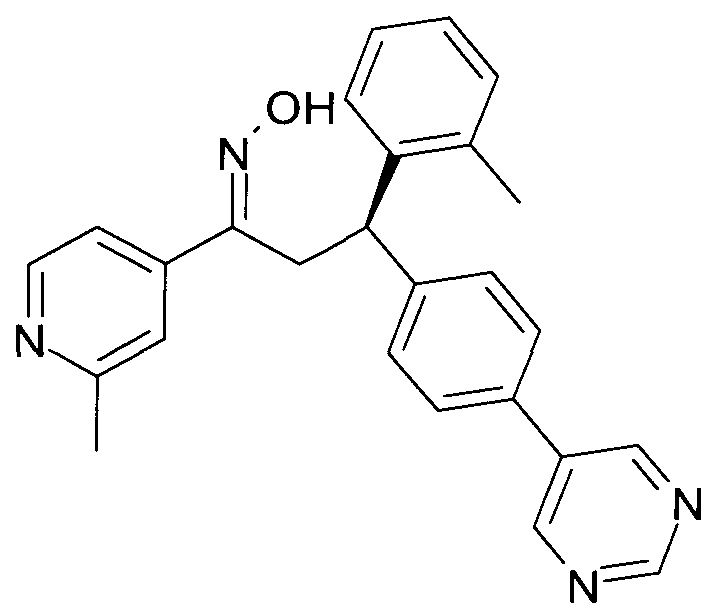
По аналогии с примером 22, из (E,R)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксима (пример 142, стадия 1) и пиримидин-5-бороновой кислоты получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=409.3 ([M+H]+).
Пример 144
(E,R)-1-(2-метилпиридин-4-ил)-3-(4-(4-(метилсульфонил)пиперазин-1-ил)фенил)-3-о-толилпропан-1-она оксим
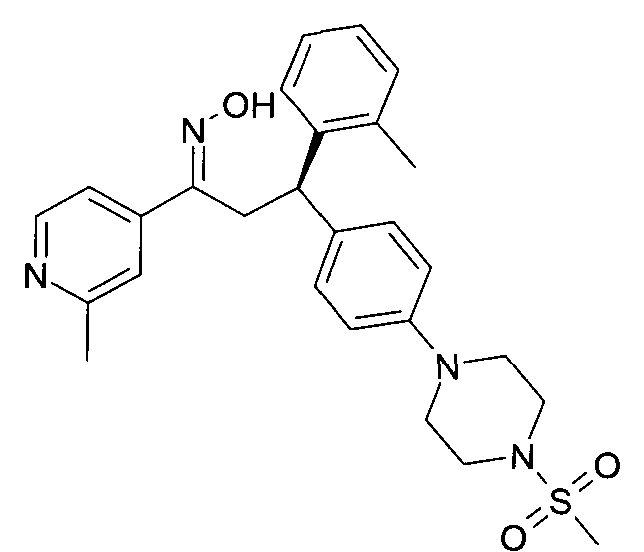
По аналогии с примером 39, из (E,R)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксима (пример 142, стадия 1) и 1-метансульфонил-пиперазина (CAS RN: [55276-43-2]) получили соединение, указанное в заголовке, в виде желтого осадка, MS (ESI+): m/z=493.3 ([M+H]+).
Пример 145
(E,R)-3-(4-(4-гидроксипиперидин-1-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим
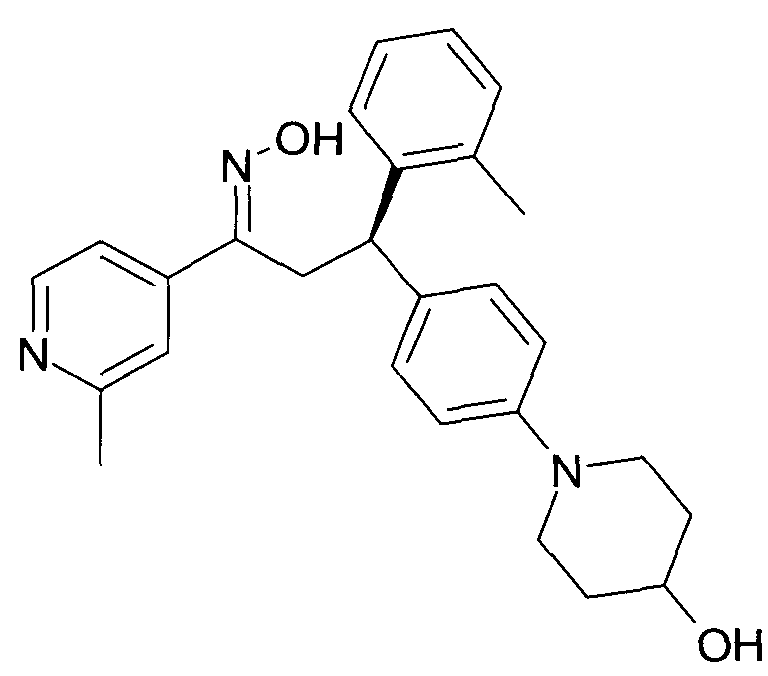
По аналогии с примером 39, из (E,R)-3-(4-бромсренил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксима (пример 142, стадия 1) и 4-гидроксипиперидина получили соединение, указанное в заголовке, в виде желтой пены, MS (ESI+): m/z=430.2 ([M+H]+).
Пример 146
(E,R)-4'-(3-(2,6-дихлорпиридин-4-ил)-3-(гидроксиимино)-1-о-толилпропил)бифенил-4-карбоновая кислота
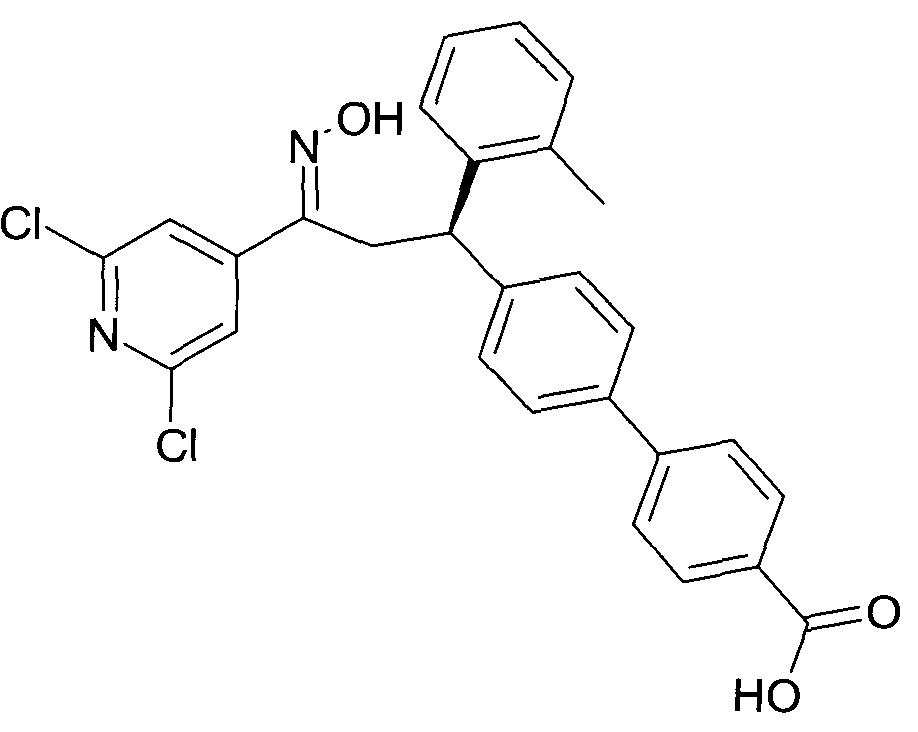
Стадия 1: (R)-4'-(3-(метокси(метил)амино)-3-оксо-1-о-толилпропил)бисЬенил-4-карбоновая кислота
По аналогии с примером 74, стадия 6, из (R)-3-(4-бромфенил)-N-метокси-N-метил-3-о-толилпропанамид (пример 142, стадия 1) и 4-боронобензойной кислоты (CAS RN: [14047-29-1]) получили (R)-4'-(3-(метокси(метил)амино)-3-оксо-1-о-толилпропил)бифенил-4-карбоновую кислоту в виде светло-коричневой пены, MS (ESI-): m/z=402.1 ([M-H]-).
Стадии 2 и 3: (R)-4'-(3-(2.6-дихлорпиридин-4-ил)-3-оксо-1-о-толилпропил)бифенил-4-карбоновая кислота
К раствору (R)-4'-(3-(метокси(метил)амино)-3-оксо-1-о-толилпропил)бифенил-4-карбоновой кислоты (1.59 г) в диоксане (10 мл) добавили LiOH в диоксане/воде (0.067M, 52.9 мл). Смесь перемешивали при KT и сконцентрировали под вакуумом с получением неочищенной (R)-4'-(3-(метокси(метил)амино)-3-оксо-1-о-толилпропил)бифенил-4-карбоновой кислоты литиевой соли, которую сразу использовали в следующей реакции.
По аналогии с примером 74, стадия 5, из (R)-4'-(3-(метокси(метил)амино)-3-оксо-1-о-толилпропил)бифенил-4-карбоновой кислоты литиевой соли и 2,6-дихлор-4-йодопиридина получили соединение, указанное в заголовке, в виде светло-коричневой пены, MS (ESI-): m/z=488.2 ([M-H]-, 1Cl).
Стадия 3: (E,R)-4'-(3-(2.6-дихлорпиридин-4-ил)-3-(гидроксиимино)-1-о-толилпропил)бифенил-4-карбоновая кислота
По аналогии с примером 132, стадия 6, из (R)-4'-(3-(2,6-дихлорпиридин-4-ил)-3-оксо-1-о-толилпропил)бифенил-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде серо-белой пены, MS (ESI-): m/z=503.09 ([M-H]-, 1Cl).
Пример 147
(E)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
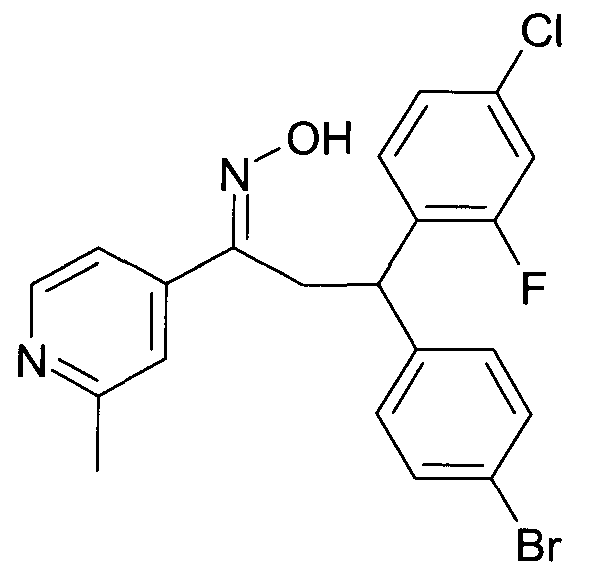
Стадия 1: 2-метил-изоникотиновой кислоты этиловый эфир Раствор 2-метил-изоникотиновой кислоты (2.50 г) в тионилхлориде (43.4 г, 26.5 мл) нагревали до кипения с обратным холодильником в течение 2 ч. Реакционную смесь сконцентрировали при пониженном давлении, оставив удаляться тионилхлорид с помощью азеотропной дистилляции с толуолом и остаток растворили в этаноле (70 мл). После нагревания до кипения с обратным холодильником в течение 12 ч, этанол удалили дистилляцией и к остатку добавили насыщенный раствор NaHCO3 (100 мл). Экстракция этилацетатом (3×50 мл) и сушка объединенных органических фаз над MgSO4 дали после эвапорации органического растворителя соединение, указанное в заголовке, в виде светло-коричневой жидкости (3.20 г, 96%), которую использовали для следующей стадии без дополнительной очистки, MS (ESI+): m/z=166.1 [M+H]+
Стадия 2: 1-(2-метил-пиридин-4-ил)-этанон
К раствору 2-метил-изоникотиновой кислоты этилового эфира (3.20 г) и трет-бутил ацетата в н-гептане при -5°C медленно добавили гексаметилдисилазид лития (46.5 мл; 1 М раствор в ТГФ). После перемешивания в течение 2 ч, добавили раствор серной кислоты (4.13 мл) в воде (20 мл) в течение 20 мин, сохраняя температуру реакции ниже 10°C. После завершения добавления, реакционную смесь нагревали до кипения с обратным холодильником в течение ночи. Экстракция через насыщенный раствор NaHCO3 (100 мл) этилацетатом (3×50 мл) и сушка объединенных органических фаз над Na2SO4 дали после эвапорации органического растворителя соединение, указанное в заголовке, в виде светло-коричневой жидкости (2.40 г, 92%), которую использовали для следующей стадии без дополнительной очистки, MS (ESI+): m/z=136.0 [M+H]+.
Стадия 3: (E)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропенон
К раствору 1-(2-метил-пиридин-4-ил)-этанона (1.10 г) и 4-хлор-2-фторбензальдегида (1.55 г) в этаноле (12.5 мл) добавили пиперидин (0.21 г, 0.24 мл) и реакционную смесь нагревали под микроволновым излучением при 110°С в течение 1 ч. Эвапорация растворителя при пониженном давлении и очистка неочищенного продукта реакции с помощью хроматографии на колонках с элюцией смесью n-гептан/этилацетат (2:1) дала 0.70 г (31%) соединения, указанного в заголовке, в виде светло-коричневого осадка, MS (ESI+): m/z=276.0 [M+H]+.
Стадия 4: 3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-он
По аналогии с примером 1, стадия 1, 4-бромбензолбороновая кислота взаимодействовала сначала с диэтилцинком. Продукт этой реакции обработали (E)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропеноном, получив соединение, указанное в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=434.0 [M+H]+.
Стадия 5: (E)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
По аналогии с примером 1, стадия 2, 3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3, получив соединение, указанное в заголовке, содержащее 10% соответствующего Z изомера, в виде серо-белого порошка, MS (ESI+): m/z=448.9 [M+H]+.
Пример 148
4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота
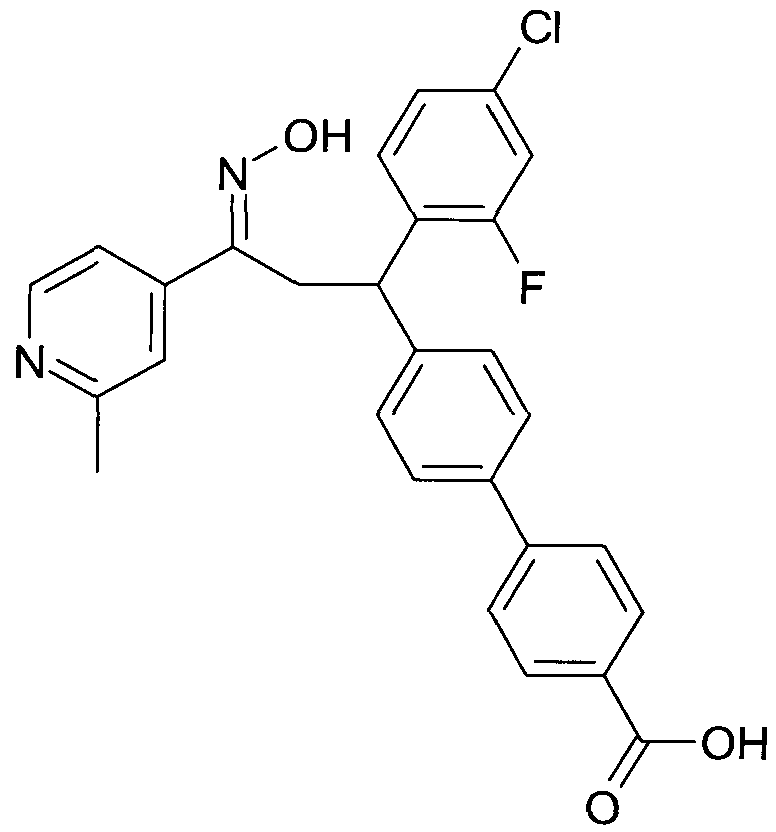
По аналогии с примером 74, стадия 6, (E)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим (пример 147, стадия 5) взаимодействовал с 4-карбоксифенилбороновой кислотой в присутствии дихлор(1,1'-бис(дифенилфосфино) ферроцен)палладия(II) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2 М водного раствора карбоната натрия, получив соединение, указанное в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=489.3 [M+H]+.
Пример 149
4-{4-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-тиофен-2-карбоновой кислоты этиловый эфир
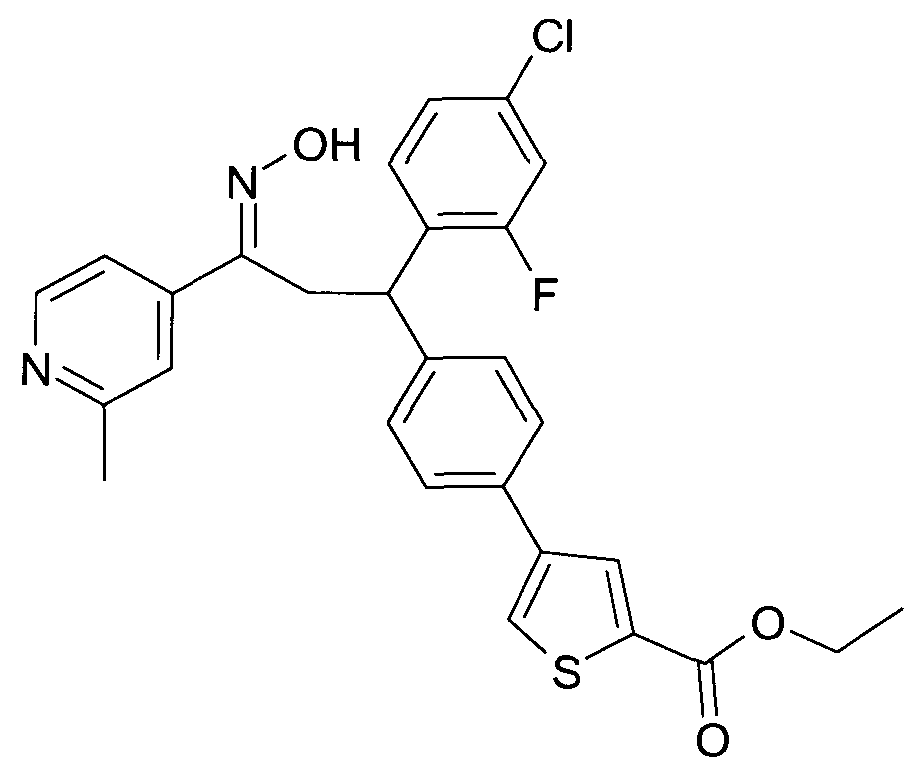
По аналогии с примером 74, стадия 6, (E)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим (пример 147, стадия 5) взаимодействовал с 5-(этоксикарбонил)тиофен-3-илбороновой кислотой в присутствии дихлор(1,1'-бис(дифенилфосфино)ферроцен)палладия(11) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2М водного раствора карбоната натрия при нагревании микроволновым излучением до 100°C в течении 30 мин с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=523.2 [M+H]+.
Пример 150
4-{4-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-тиофен-2-карбоновая кислота
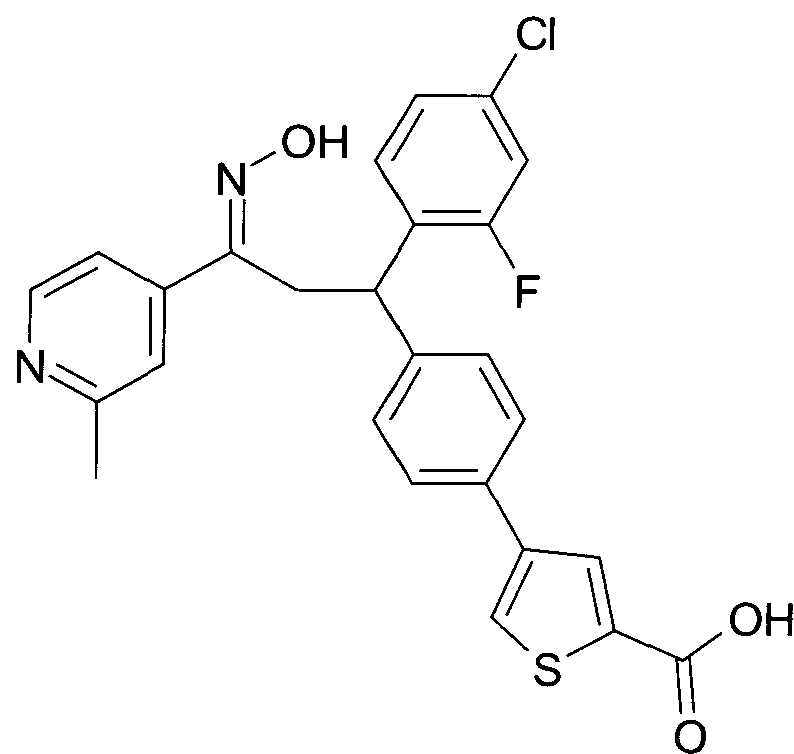
К раствору 4-{4-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-тиофен-2-карбоновой кислоты этилового эфира (15 мг) в диоксане/воде (1.5 мл, 1:1) добавили LiOH (7.2 мг) и реакционную смесь нагревали под микроволновым излучением при 100°C в течении 30 мин. Муравьиную кислоту добавили для нейтрализации LiOH и удалили смесь растворителей с помощью эвапорации при пониженном давлении. Очистка неочищенного реакционного продукта с помощью хроматографии на колонках с элюцией смесью дихлорметан/метанол (95:5, содержащей 4% муравьиную кислоту) дала 14 мг (98%) соединения, указанного в заголовке, в виде серо-белого порошка, MS (ESI+): m/z=495.1 [M+H]+.
Пример 151
(E)-3-(4-бром-фенил)-1-(4-гидрокси-фенил)-3-о-толил-пропан-1-она оксим
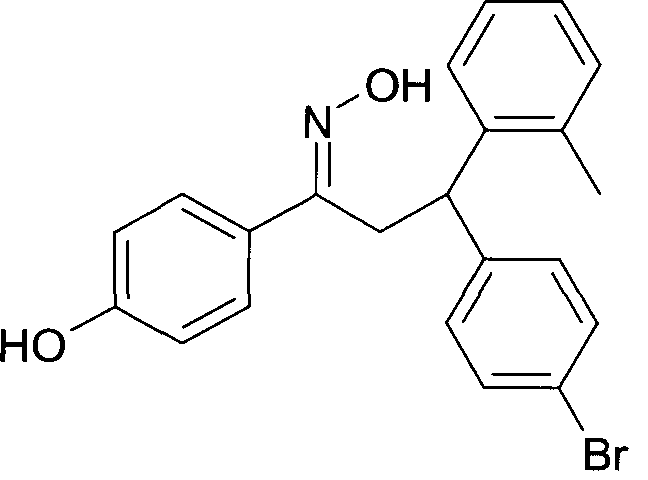
Стадия 1: 3-(4-бром-фенил)-1-(4-метокси-фенил)-3-о-толил-пропан-1-он перемешанный раствор 4-броманизола (639 мг) в ТГФ (15 мл) в атмосфере аргона охладили до -78°C. Медленно добавили раствор n-бутиллития (2.07 мл, 1.6 М в гексане), поддерживая температуру ниже -70°C. После перемешивания в течение 40 мин, добавили раствор 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (400 мг, пример 74, стадия 4) в ТГФ (15 мл), поддерживая температуру ниже -70°C. Смесь перемешивали при этой температуре в течение 1 часа. Реакцию остановили добавлением насыщенного водного раствора хлорида аммония (15 мл). Добавили воду и смесь экстрагировали этилацетатом (3x). Объединенную органическую фазу промыли водой и солевым раствором, высушили с использованием MgSO4, отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, циклогексан/этилацетат 1:0 до 3:2) получив соединение, указанное в заголовке, (390 мг) в виде светло-желтого масла, MS (ESI+): m/z=409.2 [M+H]+.
Стадия 2: 3-(4-бром-фенил)-1-(4-гидрокси-фенил)-3-о-толил-пропан-1-он
Перемешанный раствор 3-(4-бром-фенил)-1-(4-метокси-фенил)-3-о-толил-пропан-1-он (214 мг) в дихлорметане (5.1 мл) в атмосфере аргона охладили до -78°C. По каплям добавили раствор BBr3 (2.09 мл, 1 М в дихлорметане). Смесь перемешивали при -78°C в течение 45 минут, при 0°C в течение 4 ч и при комнатной температуре в течении 30 мин. Поскольку реакция не завершилась, смесь снова охладили до -78°C и добавили раствор BBr3 (1 мл, 1 М в дихлорметане). Смесь перемешивали при -78°C в течении 30 мин и при 0°C в течение 4.5 ч. Добавили воду и насыщенный водный раствор NaHCO3 и смесь экстрагировали дихлорметаном. Органическую фазу промыли водой, высушили с использованием MgSO4, отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, циклогексан/этилацетат 1:0 до 7:3), получив соединение, указанное в заголовке, (21 мг) в виде светло-коричневого осадка, MS (ESI-): m/z=394.8 [M-H]-.
Стадия 3: (E)-3-(4-бром-фенил)-1-(4-гидрокси-фенил)-3-о-толил-пропан-1-она оксим
Суспензию 3-(4-бром-фенил)-1-(4-гидрокси-фенил)-3-о-толил-пропан-1-она (16 мг), гидроксиламина гидрохлорида (7 мг) и NaHCO3 (6.8 мг) в этаноле (0.455 мл) и воде (0.016 мл) нагревали до кипения с обратным холодильником в течение 2,5 ч. После охлаждения до комнатной температуры, добавили насыщенный водный раствор хлорида аммония и смесь экстрагировали дихлорметаном. Органическую фазу промыли солевым раствором, высушили с использованием MgSO4, отфильтровали и сконцентрировали досуха. Продукт очистили препаративной ТСХ (SiO2, дихлорметан/метанол 9:1), получив соединение, указанное в заголовке, содержащее менее чем 10% соответствующего Z изомера (13 мг), в виде серо-белой пены, MS (ESI-): m/z=408.1 [M-H]-.
Пример 152
(E)-3-(4-бром-фенил)-1-(4-гидрокси-3,5-диметил-фенил)-3-о-толил-пропан-1-она оксим
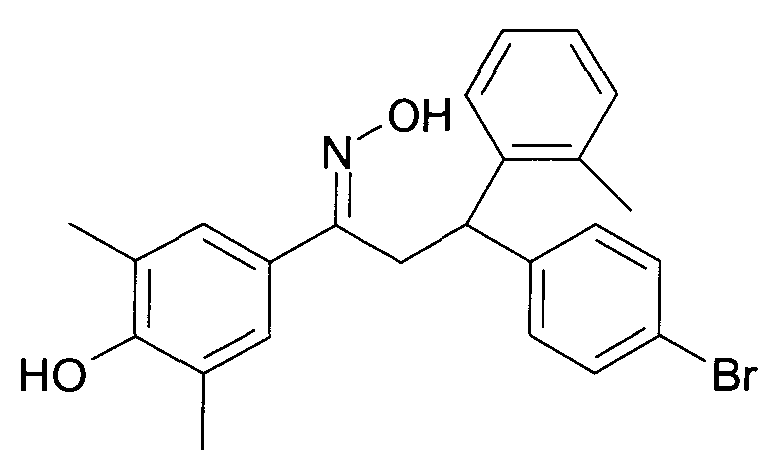
Стадия 1: 3-(4-бром-фенил)-1-(4-метокси-3.5-диметил-фенил)-3-о-толил-пропан-1-он
По аналогии с примером 151, стадия 1, 4-бром-2,6-диметиланизол сначала взаимодействовал с n-бутиллитием и затем с 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамидом (пример 74, стадия 4), с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=437.4 [M+H]+.
Стадия 2: 3-(4-бром-фенил)-1-(4-гидрокси-3.5-диметил-фенил)-3-о-толил-пропан-1-он
По аналогии с примером 151, стадия 2, 3-(4-бром-фенил)-1-(4-метокси-3,5-диметил-фенил)-3-о-толил-пропан-1-он обработали BBr3 в дихлорметане, получив соединение, указанное в заголовке, в виде светло-желтого осадка, MS (ESI-): m/z=420.9 [M-H]-.
Стадия 3: (E)-3-(4-бром-фенил)-1-(4-гидрокси-3,5-диметил-фенил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 151, стадия 3, 3-(4-бром-фенил)-1-(4-гидрокси-3,5-диметил-фенил)-3-о-толил-пропан-1-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде серо-белого осадка, MS (ESI-): m/z=436.2 [M-H]-.
Пример 153
(E)-2-метил-3,3-дифенил-1-пиридин-4-ил-пропан-1-она оксим
Стадия 1: 2-метил-3.3-дифенил-1-пиридин-4-ил-пропан-1-он К раствору 3,3-дифенил-1-пиридин-4-ил-пропан-1-она (200 мг, пример 14, стадия 1) в ТГФ (11 мл) добавили NaH (33 мг в виде 55% суспензии в минеральном масле) при комнатной температуре. Смесь перемешивали в течение 1,5 ч и поместили на ледяную ванну. Добавили йодометан (109 мг). Смесь перемешивали в течение 1 ч при 0°C и в течение 2 ч при комнатной температуре. Добавили N,N-диметилацетамид (0.5 мл) и смесь перемешивали в течение ночи при комнатной температуре. Добавили ледяную воду и смесь экстрагировали этилацетатом. Органическую фазу высушили с использованием MgSO4, отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, цикл о гексан/этил ацетат 1:0 до 0:1), получив соединение, указанное в заголовке, (148 мг) в виде серо-белого осадка, MS (ESI+): m/z=302.3 [M+H]+.
Стадия 2: (E)-2-метил-3.3-дифенил-1-пиридин-4-ил-пропан-1-она оксим
По аналогии с примером 151, стадия 3, 2-метил-3,3-дифенил-1-пиридин-4-ил-пропан-1-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=317.16 [M+H]+.
Пример 154
(E)-3-гидрокси-3,3-дифенил-1-пиридин-4-ил-пропан-1-она оксим
Стадия 1: 3-гидрокси-3.3-дифенил-1-пиридин-4-ил-пропан-1-он
К перемешанному раствору 4-ацетилпиридина (1.25 г) в N,N-диметилацетамиде (10 мл) добавили NaH (0.413 г, в виде 55% суспензии в минеральном масле) при 0°C. После перемешивания в течении 30 мин, добавили бензофенон (1.882 г). Через 30 мин, охлаждающую ванну убрали. Смесь перемешивали в течение ночи при комнатной температуре. Смесь охладили до 0°C. Добавили NaH (0.413 г, в виде 55% суспензии в минеральном масле) и смесь перемешивали в течение 3 ч. Добавили воду и этилацетат. Значение pH довели до 8, используя 1M водную HCl. Смесь экстрагировали этилацетатом. Органическую фазу высушили с использованием MgSO4, отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, циклогексан/этилацетат 1:0 до 0:1) получив соединение, указанное в заголовке, (119 мг) в виде бесцветного осадка, MS (ESI+): m/z=304.2 [M+H]+.
Стадия 2: (E)-3-гидрокси-3.3-дифенил-1-пиридин-4-ил-пропан-1-она оксим
К раствору 3-гидрокси-3,3-дифенил-1-пиридин-4-ил-пропан-1-она (115 мг) в метаноле (4 мл) добавили гидроксиламина гидрохлорид (63 мг) и ацетат натрия (75 мг). Смесь перемешивали при комнатной температуре в течении 6 ч. Добавили воду и смесь экстрагировали этилацетатом. Органическую фазу высушили с использованием MgSO4, отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, циклогексан/этилацетат 4:1 до 1:3), получив соединение, указанное в заголовке, (60 мг) в виде бесцветного осадка, MS (ESI+): m/z=319.1 [M+H]+.
Пример 155
(Z)-3-гидрокси-3,3-дифенил-1-пиридин-4-ил-пропан-1-она оксим
Соединение, указанное в заголовке, (38 мг) получили в виде побочного продукта примера 154, стадия 2 в виде бесцветного осадка, MS (ESI+): m/z=319.1 [M+H]+.
Пример 156
(E)-3-(4-бром-фенил)-1-пиразин-2-ил-3-о-толил-пропан-1-она оксим
Стадия 1: 3-(4-бром-фенил)-1-пиразин-2-ил-3-о-толил-пропан-1-он
По аналогии с примером 151, стадия 1, 2-бромпиразин сначала взаимодействовал с n-бутиллитием и затем с 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамидом (пример 74, стадия 4), получив соединение, указанное в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=381.2 [M+H]+.
Стадия 2: (E)-3-(4-бром-фенил)-1-пиразин-2-ил-3-о-толил-пропан-1-она оксим
По аналогии с примером 151, стадия 3, 3-(4-бром-фенил)-1-пиразин-2-ил-3-о-толил-пропан-1-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего около 10% соответствующего Z изомера, в виде бесцветной пены, MS (ESI-): m/z=393.8 [M-H]-.
Пример 157
(E)-3-(4-бром-фенил)-1-(7-хлор-хинолин-4-ил)-3-о-толил-пропан-1-она оксим
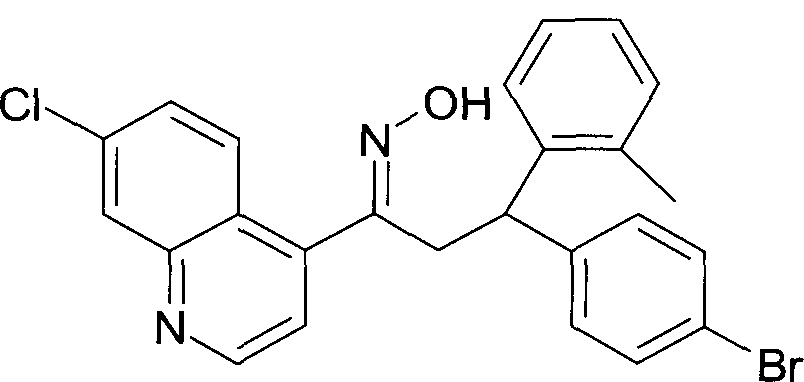
По аналогии с примером 151, стадия 1, 7-хлор-4-йодохинолин сначала взаимодействовал с n-бутиллитием и затем с 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамидом (пример 74, стадия 4). Продукт этой реакции не может быть получен чистым и взаимодействовал по аналогии с примером 151, стадия 3, с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI-): m/z=478.9 [M-H]-.
Пример 158
(E)-2-[1-(4-метокси-фенил)-циклогексил]-1-(2-метил-пиридин-4-ил)-этанона оксим
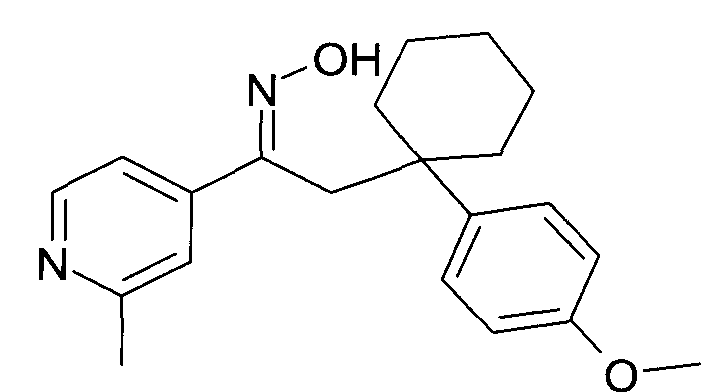
Стадия 1: Циано-[1-(4-метокси-фенил)-циклогексил1-уксусной кислоты этиловый эфир
К перемешанному раствору 4-анизилмагния бромида (33.64 мл, 1M в ТГФ) охлажденному в ванне со льдом добавили раствор циано-циклогексилиден-уксусной кислоты этилового эфира (5 г, CAS RN: [6802-76-2]) в толуоле (55 мл) при максимальной температуре 5°C. Смесь перемешивали в течение 5 мин и нагревали при 85°C в течение 3.5 ч. Смесь перемешивали в течение ночи при комнатной температуре, смесь вылили на лед. Добавили 1M HCl и смесь экстрагировали этилацетатом. Органическую фазу промыли солевым раствором, высушили (MgSO4), отфильтровали и сконцентрировали досуха. Продукт очистили фильтрацией через стеклянный фильтр, заполненный силикагелем, используя n-гептан/диэтиловый эфир 1:0 до 88:12 в качестве растворителя. Чистый продукт (4.7 г) и немного загрязненный продукт (1.8 г) получили в виде светло-желтых масел, MS (ESI+): m/z=319.2 [M+NH4]+.
Стадия 2: [1-(4-метокси-фенил)-циклогексил]-уксусная кислота
Смесь циано-[1-(4-метокси-фенил)-циклогексил]-уксусной кислоты этилового эфира (1.84 г), гидроксида калия (1.27 г), этиленгликоля (5 мл) и воды (0.025 мл) нагревали при 180°С в течение 21 ч. После охлаждения до комнатной температуры, добавили воду и промыли диэтиловым эфиром. Водную фазу закислили, используя концентрированную HCl, и экстрагировали дихлорметаном. Органическую фазу промыли солевым раствором, высушили (MgSO4), отфильтровали и сконцентрировали досуха с получением соединения, указанного в заголовке, в виде серо-белого осадка (1.21 г), MS (ESI-): m/z=247.1 [M-H]-.
Стадия 3: N-метокси-2-[1-(4-метокси-фенил)-циклогексил]-N-метил-ацетамид
К раствору [1-(4-метокси-фенил)-циклогексил]-уксусной кислоты (1.2 г) в дихлорметане (9.7 мл) добавили N,O-диметилгидроксиламина гидрохлорид (577 мг). Смесь охладили в ванне со льдом. Добавили 1,1'-карбонилдиимидазол (1.01 г). Смесь перемешивали в течение 5 мин при 0°C и в течение 2 дней при комнатной температуре. Добавили смесь воды и 1M HCl и смесь экстрагировали этилацетатом. Органическую фазу промыли солевым раствором, высушили (MgSO4), отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (20 г NH3-модифицированного SiO2, циклогексан/этилацетат 1:0 до 3:2) с получением соединения, указанного в заголовке, (1.13 г) в виде бесцветного масла, MS (ESI+): m/z=292.2 [M+H]+.
Стадия 4: 2-[1-(4-метокси-фенил)-циклогексил]-1-(2-метил-пиридин-4-ил)-этанон
По аналогии с примером 151, стадия 1, 4-бром-2-метилпиридин сначала взаимодействовал с n-бутиллитием и затем с N-метокси-2-[1-(4-метокси-фенил)-циклогексил]-N-метил-ацетамидом с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=324.3 [M+H]+.
Стадия 5: (E)-2-N-(4-метокси-фенил)-циклогексил1-1-(2-метил-пиридин-4-ил)-этанона оксим
По аналогии с примером 151, стадия 3, 2-[1-(4-метокси-фенил)-циклогексил]-1-(2-метил-пиридин-4-ил)-этанон взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=339.3 [M+H]+.
Пример 159
(Z)-2-[1-(4-метокси-фенил)-циклогексил]-1-(2-метил-пиридин-4-ил)-этанона оксим

Соединение, указанное в заголовке, получили в виде побочного продукта примера 158, стадия 5 в виде бесцветной пены, MS (ESI+): m/z=339.3 [M+H]+.
Пример 160
S-{1-[(E)-гидроксимино]-3,3-дифенил-пропил}-1Н-пиридин-2-он
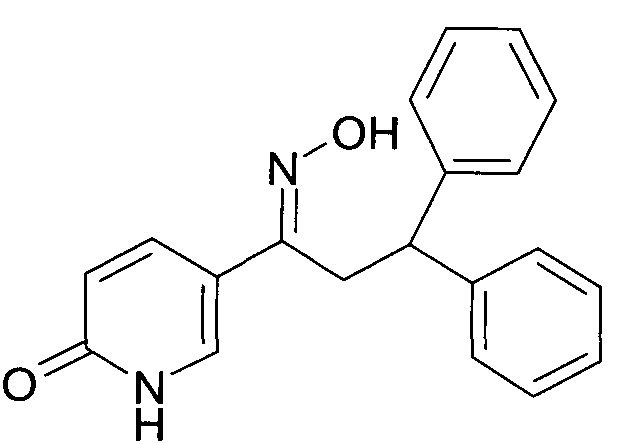
Стадия 1: 6,N-диметокси-N-метил-никотинамид
По аналогии с примером 158, стадия 3, 6-метоксиникотиновая кислота взаимодействовала с М,0-диметилгидроксиламина гидрохлоридом и 1,1'-карбонилдиимидазолом с получением соединения, указанного в заголовке, в виде бесцветного масла, MS (ESI+): m/z=197.3 [M+H]+.
Стадия 2: 1-(6-метокси-пиридин-3-ил)-3-фенил-пропинон
К раствору 6,N-диметокси-N-метил-никотинамида (1.14 г) в ТГФ (20 мл) добавили раствор фенилэтинилмагния бромида (11.62 мл, 1M в ТГФ) при 0°C. Смесь перемешивали при 0°C в течение 1,5 ч и при комнатной температуре в течение 3 ч. Раствор фенилэтинилмагния бромид (2.91 мл, 1M в ТГФ) добавили и смесь перемешивали в течение ночи при комнатной температуре. Добавили раствор фенилэтинилмагния бромида (5.81 мл, 1M в ТГФ) и смесь перемешивали в течение 24 ч при комнатной температуре. Добавили водный раствор хлорида аммония и смесь перемешивали в течении 30 мин. Добавили ледяную воду и смесь экстрагировали этилацетатом. Органическую фазу промыли водой, высушили (MgSO4), отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, циклогексан/этилацетат 1:0 до 0:1) с получением соединения, указанного в заголовке, (0.934 г) в виде серо-белого осадка, MS (ESI+): m/z=238.1 [M+H]+.
Стадия 3: 1-(6-метокси-пиридин-3-ил)-3.3-дифенил-пропенон
К раствору 1-(6-метокси-пиридин-3-ил)-3-фенил-пропинона (275 мг) в 1,4-диоксане (2.5 мл) добавили фенилбороновую кислоту (170 мг), тетракис(трифенилфосфин) палладий(0) (41 мг) и уксусную кислоту (7 мг). Смесь перемешивали при комнатной температуре в течение 10 мин, при 80°C в течение 10 ч и при 60°C в течение ночи. Смесь сконцентрировали досуха. Продукт очистили хроматографией (SiO2, циклогексан/этилацетат 1:0 до 85:15) с получением соединения, указанного в заголовке, (144 мг) в виде желтого масла, MS (ESI+): m/z=316.2 [M+H]+.
Стадия 4: 1-(6-метокси-пиридин-3-ил)-3.3-дифенил-пропан-1-он
К раствору 1-(6-метокси-пиридин-3-ил)-3,3-дифенил-пропенона (135 мг) в дихлорметане (1.7 мл) добавили катехолборан (81 мг, 95% чистоты). Смесь перемешивали в течение 2,5 ч при комнатной температуре. Добавили воду (5 мл) и смесь перемешивали в течение 1 ч. Смесь экстрагировали дихлорметаном. Органическую фазу высушили (MgSO4), отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, циклогексан/этилацетат 1:0 до 85:15) с получением соединения, указанного в заголовке, (56 мг) в виде серо-белого осадка, MS (ESI+): m/z=318.2 [M+H]+.
Стадия 5: 5-(3,3-дифенил-пропионил)-1H-пиридин-2-он
К раствору 1-(6-метокси-пиридин-3-ил)-3,3-дифенил-пропан-1-она (468 мг) в 1,4-диоксане (25 мл) добавили концентрированную водную HCl (2.69 мл). Смесь перемешивали в течение 2 ч при 100°C. После охлаждения до комнатной температуры, смесь вылили на лед и экстрагировали этилацетатом. Органическую фазу высушили (MgSO4), отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, дихлорметан/метанол 1:0 до 4:1) с получением соединения, указанного в заголовке, (127 мг) в виде бесцветного осадка, MS (ESI-): m/z=302.0 [M-H]-.
Стадия 6: 5-{1-[(E)-гидроксимино]-3,3-дифенил-пропил}-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-(3,3-дифенил-пропионил)-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI-): m/z=317.1 [M-H]-.
Пример 161
5-{1-[(E)-гидроксимино]-3,3-дифенил-пропил}-1-метил-1H-пиридин-2-он
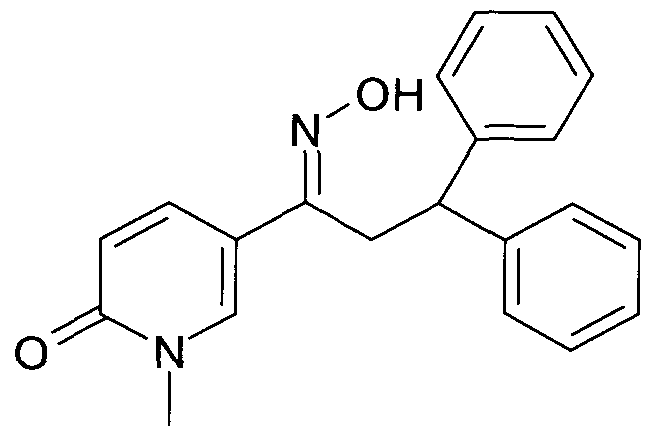
Стадия 1: 5-(3,3-дифенил-пропионил)-1-метил-1H-пиридин-2-он
К раствору 5-(3,3-дифенил-пропионил)-1H-пиридин-2-она (60 мг, пример 160, стадия 5) в N,N-диметилацетамиде (1 мл) добавили порошкооразный карбонат калия (30 мг) и йодометан (30 мг). Смесь перемешивали при комнатной температуре в течение 5.5 ч. Добавили воду и смесь экстрагировали этилацетатом. Органическую фазу высушили (MgSO4), отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, дихлорметан/метанол 1:0 до 85:15) с получением соединения, указанного в заголовке, (54 мг) в виде бесцветного осадка, MS (ESI+): m/z=318.2 [M+H]+.
Стадия 2: 5-{1-[(E)-гидроксимино]-3.3-дифенил-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-(3,3-дифенил-пропионил)-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=333.3 [M+H]+.
Пример 162
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он
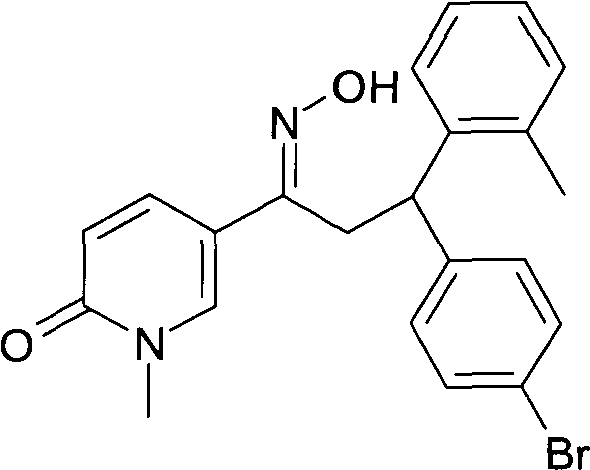
Стадия 1: 3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-3-о-толил-пропан-1-он
По аналогии с примером 151, стадия 1, 5-бром-2-метоксипиридин сначала взаимодействовал с n-бутиллитием и затем с 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамидом (пример 74, стадия 4) с получением соединения, указанного в заголовке, в виде бесцветного масла, MS (ESI+): m/z=410.2 [M+H]+.
Стадия 2: 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1H-пиридин-2-он
К раствору 3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-3-о-толил-пропан-1-она (384 мг) в 1,4-диоксане (16 мл) добавили концентрированную водную HCl (17 мл). Смесь перемешивали в течение 1,5 ч при 100°C. После охлаждения до комнатной температуры, смесь вылили на лед и экстрагировали этилацетатом. Органическую фазу высушили (MgSO4), отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, дихлорметан/метанол 1:0 до 9:1) с получением соединения, указанного в заголовке, (338 мг) в виде бесцветной пены, MS (ESI-): m/z=393.8 [M-H]-.
Стадия 3: 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=410.2 [M+H]+.
Стадия 4: 5-{3-(4-бром-фенил)-1-[(Е)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=425.1 [M+H]+.
Пример 163
5-{3-(4-бром-фенил)-1-[(Z)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он
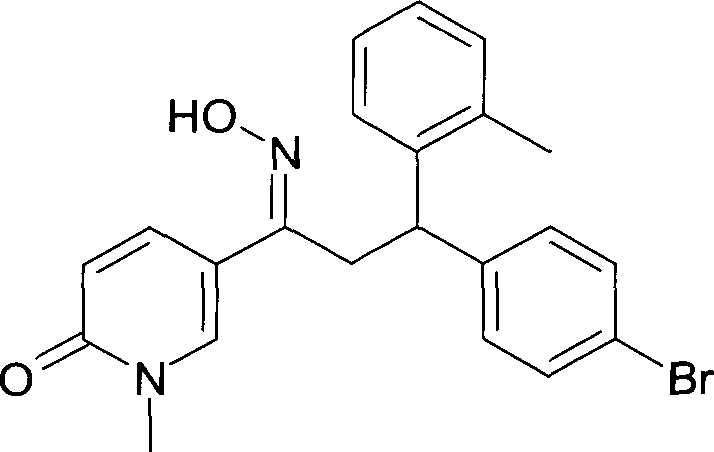
Соединение, указанное в заголовке, получили в виде побочного продукта примера 162, стадия 4 в виде бесцветного осадка, MS (ESI+): m/z=425.1 [M+H]+.
Пример 164
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-этил-1H-пиридин-2-он
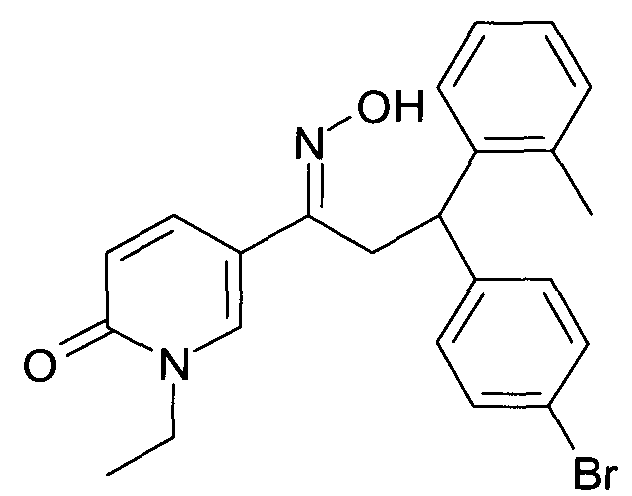
Стадия 1: 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-этил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он (пример 162, стадия 3) взаимодействовал с йодэтаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=424.1 [M+H]+.
Стадия 2: 5-{3-(4-бром-фенил)-1-[(Е)-гидроксиимино1-3-о-толил-пропил]-этил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-этил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=439.3 [M+H]+.
Пример 165
5-{3-(4-бром-фенил)-1-[(2)-гидроксиимино]-3-о-толил-пропил}-1-этил-1H-пиридин-2-он
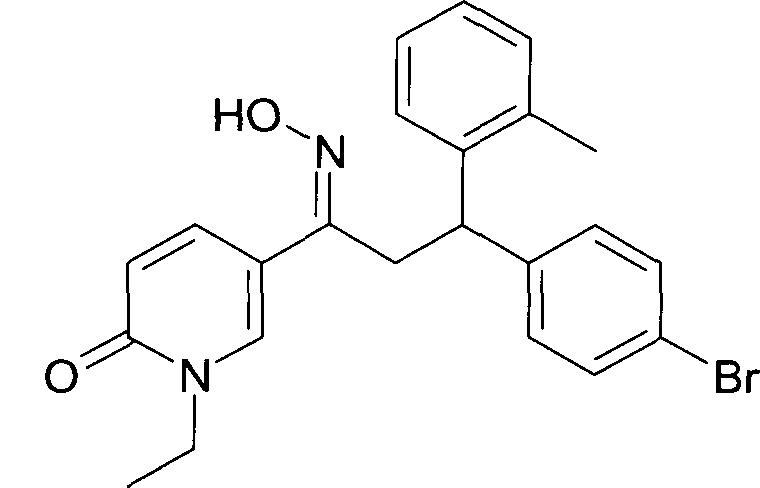
Соединение, указанное в заголовке, получили в виде побочного продукта примера 164, стадия 2 в виде бесцветного осадка, MS (ESI+): m/z=439.1 [M+H]+.
Пример 166
4'-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
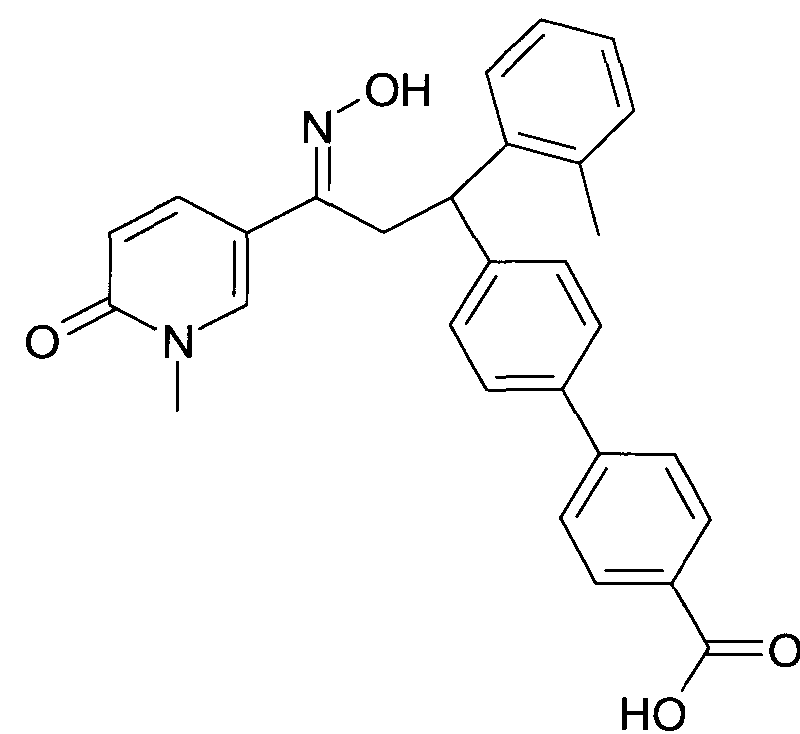
Стадия 1: 4'-[3-(1-метил-6-оксо-1.6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновая кислота
К перемешанной суспензии 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-она (50 мг, пример 162, стадия 3) и 4-карбоксифенилбороновой кислоты (32 мг) в 1,4-диоксане (0.4 мл) в атмосфере аргона добавили дихлор(1,1'-бис(дифенилфосфино)ферроцен)-палладия(II) дихлорметановый аддукт (4.5 мг), воду (0.3 мл) и 2M водного раствора карбоната натрия (0.18 мл). Смесь перемешивали при 80°C в течение 2 ч. После охлаждения до комнатной температуры, смесь отфильтровали. Фильтрационный остаток промыли этилацетатом и насыщенным раствором KHSO4. Объединенный фильтрат экстрагировали этилацетатом. Органическую фазу высушили (MgSO4), отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, дихлорметан/метанол 1:0 до 9:1) с получением соединения, указанного в заголовке, (75 мг, не весь чистый) в виде бесцветного осадка, MS (ESI-): m/z=450.2 [M-H]-.
Стадия 2: 4'-[3-[(Е)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 151, стадия 3, 4'-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновая кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=467.3 [M+H]+.
Пример 167
4'-[(S)-3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
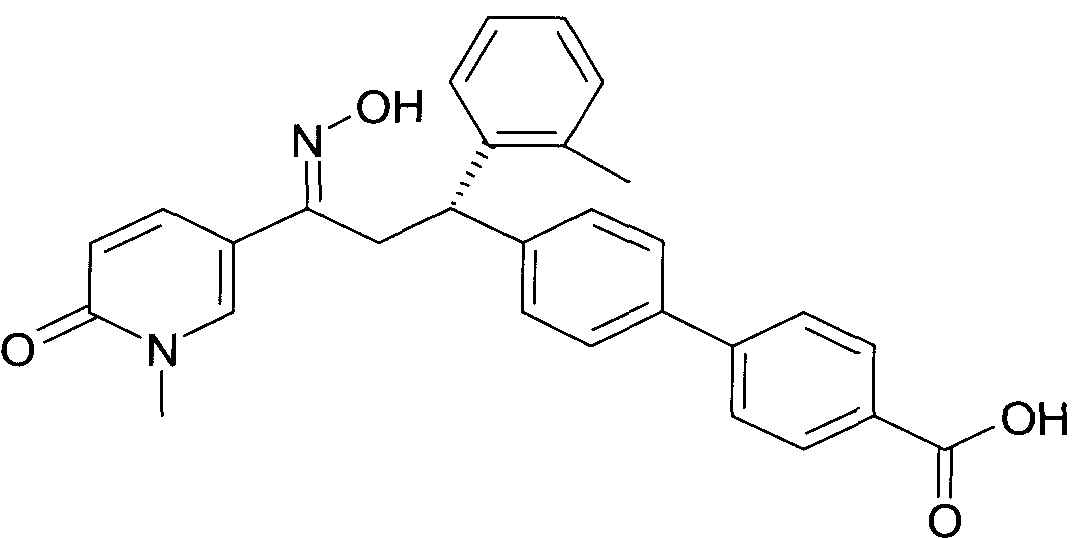
и
Пример 168
4'-[(R)-3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
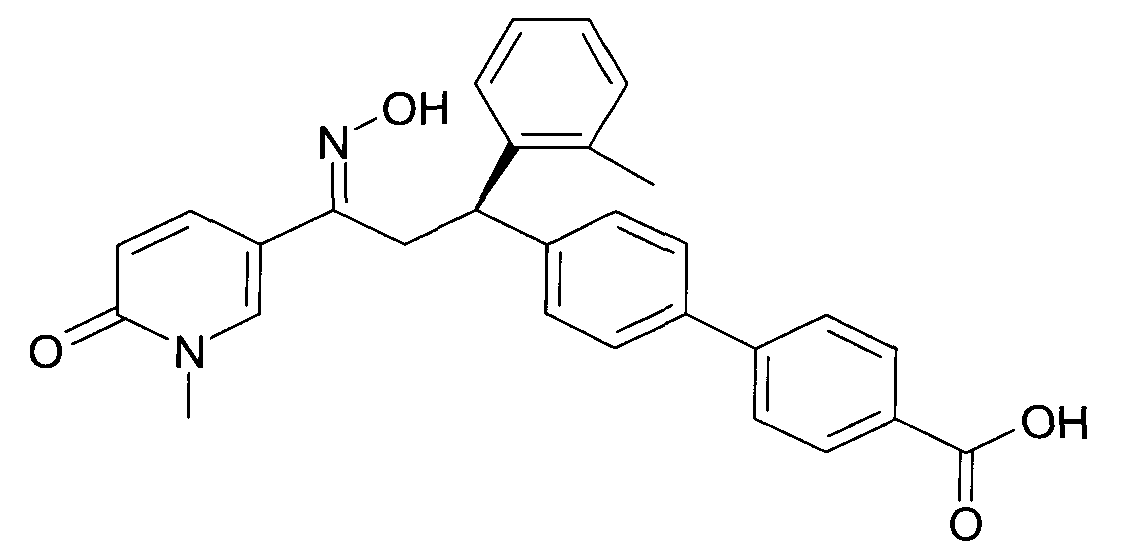
4'-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновую кислоту (пример 166) разделили на энантиомеры, используя Chiralpak AD в качестве неподвижной фазы и 30% (этанол +0.5% НСООН)/70% n-гептан в качестве подвижной фазы с получением соединений, указанных в заголовке, в виде осадков серо-белого цвета.
Пример 169
3-фтор-4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
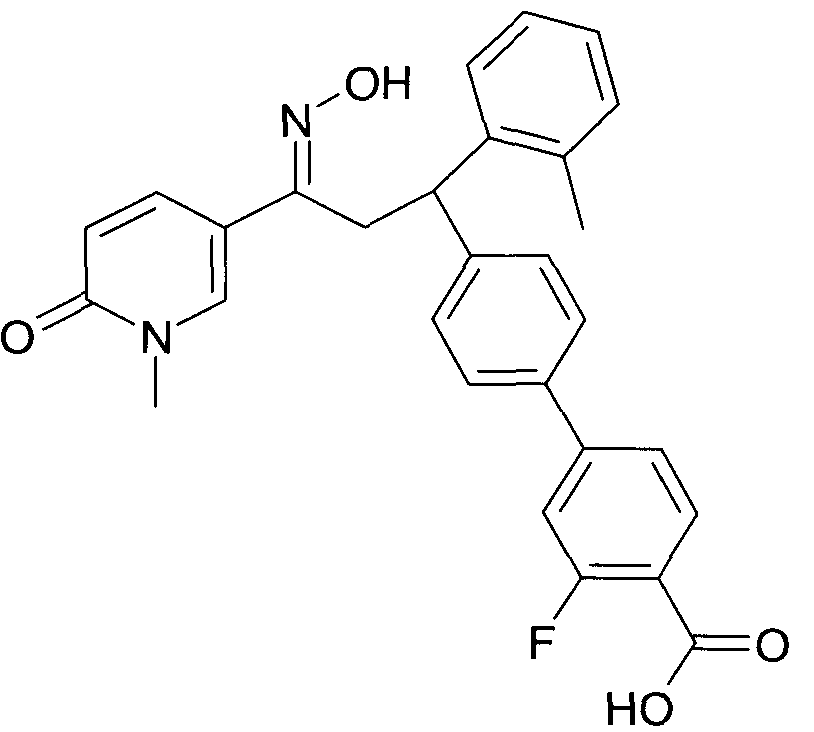
Стадия 1: 3-фтор-4'-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
По аналогии с примером 166, стадия 1, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он (пример 162, стадия 3) взаимодействовал с 3-фтор-4-метоксикарбонилфенилбороновой кислотой в присутствии дихлор(1,1'-бис(дифенилфосфино)ферроцен)палладия(II) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2M водного раствора карбоната натрия с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=484.3 [M+H]+.
Стадия 2: 3-фтор-4'-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил1-бифенил-4-карбоновая кислота
К суспензии 3-фтор-4'-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метилового эфира (35 мг) в ТГФ (0.2 мл) и MeOH (0.2 мл) добавили 1M водный раствор LiOH (0.145 мл) при 0°C. Смесь перемешивали при 0°C в течении 30 мин и при комнатной температуре в течение 1 ч. Поскольку реакция не закончилась, по порциям добавили 1M водный раствор LiOH (0.435 мл) при перемешивании в течение других 24 ч при комнатной температуре. Реакционную смесь закислили, используя 1M HCl. Органически растворители удалили под вакуумом. Преципитированный осадок собрали фильтрацией, промыли водой и высушили с получением соединения, указанного в заголовке (29 мг), в виде бесцветного осадка, MS (ESI-): m/z=468.2 [M-H]-.
Стадия 3: 3-фтор-4'-[3-[(Е)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 151, стадия 3, 3-фтор-4'-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновая кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=485.3 [M+H]+.
Пример 170
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-5-метил-гексил}-1-метил-1H-пиридин-2-он
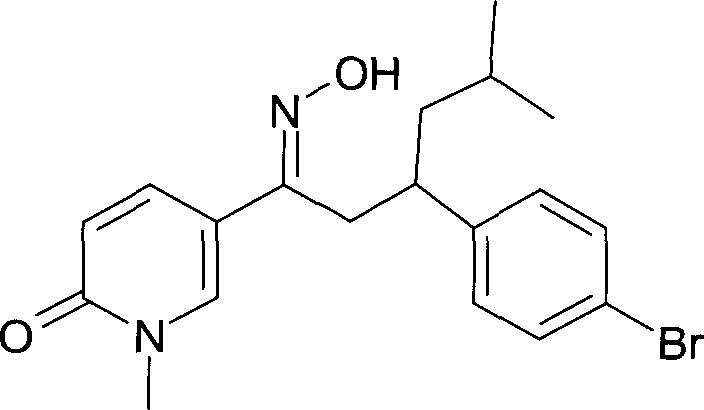
Стадия 1: (E)-3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон
К раствору 5-ацетил-2-метоксипиридина (2.317 г) в метаноле (50 мл) добавили 4-бромбензальдегид (3.120 г) и гидроксид калия (0.946 г). Смесь перемешивали при комнатной температуре в течение 2,5 ч. Смесь поместили в ледяную ванную. Преципитированный осадок собрали фильтрацией, промыли метанолом и высушили с получением соединения, указанного в заголовке, в виде бесцветного осадка (4.281 г), MS (ESI+): m/z=318.1 [M+H]+.
Стадия 2: 3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-5-метил-гексан-1-он
К перемешанной суспензии Cul (18 мг) в ТГФ (3 мл) в атмосфере аргона при 0°C добавили изобутилмагния хлорид (1.04 мл, 2 М раствор в диэтиловом эфире). Смесь перемешивали при 0°C в течение 50 мин с получением темной суспензии. Добавили (E)-3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (300 мг). Смесь перемешивали при 0°C в течение 140 мин. Добавили насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органическую фазу высушили (MgSO4), отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, циклогексан/этилацетат 1:0 до 7:3) с получением соединения, указанного в заголовке, (279 мг) в виде светло-желтого масла, MS (ESI+): m/z=376.2 [M+H]+.
Стадия 3: 5-[3-(4-бром-фенил)-5-метил-гексаноил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-5-метил-гексан-1-он взаимодействовал с концентрированной водной HCI в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветного масла, MS (ESI+): m/z=362.1 [M+H]+.
Стадия 4: 5-[3-(4-бром-фенил)-5-метил-гексаноил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-5-метил-гексаноил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного масла, MS (ESI+): m/z=376.2 [M+H]+.
Стадия 5: 5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино1-5-метил-гексил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-5-метил-гексаноил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=391.1 [M+H]+.
Пример 171
5-{3-(4-бром-фенил)-1-[(Z)-гидроксиимино]-5-метил-гексил}-1-метил-1H-пиридин-2-он
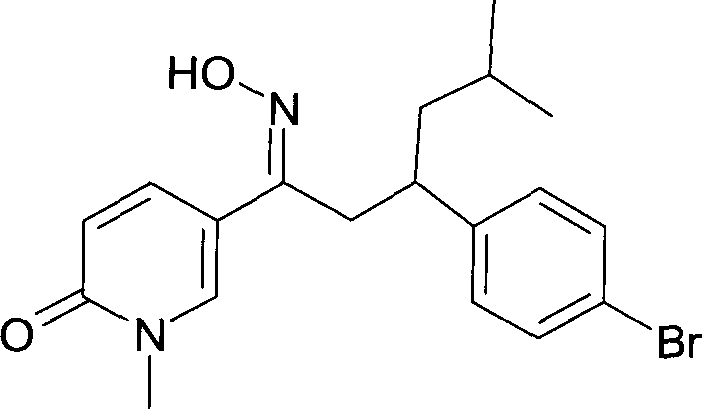
Соединение, указанное в заголовке, получили в виде побочного продукта примера 170, стадия 5 в виде бесцветного осадка, MS (ESI+): m/z=391.1 [M+H]+.
Пример 172
5-{3-(4-бром-фенил)-3-циклопентил-1-[(E)-гидроксиимино]-пропил}-1-метил-1Н-пиридин-2-он
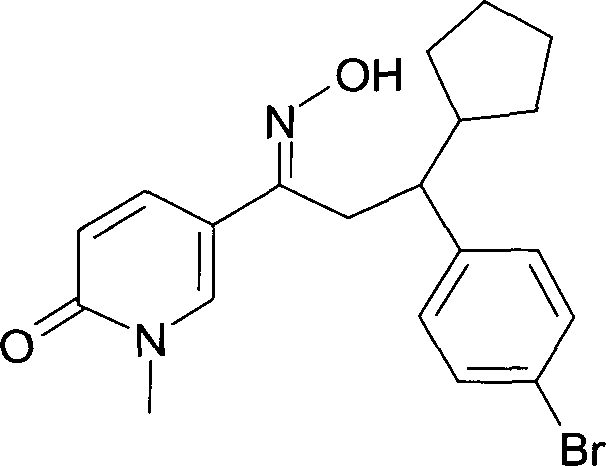
Стадия 1: 3-(4-бром-фенил)-3-циклопентил-1-(6-метокси-пиридин-3-ил)-пропан-1-он
По аналогии с примером 170, стадия 2, (E)-3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (пример 170, стадия 1) взаимодействовал с циклопентилмагния бромидом в присутствии Cul с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=388.2 [M+H]+.
Стадия 2: 5-[3-(4-бром-фенил)-3-циклопентил-пропионил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(4-бром-фенил)-3-циклопентил-1-(6-метокси-пиридин-3-ил)-пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=374.0 [M+H]+.
Стадия 3: 5-[3-(4-бром-фенил)-3-циклопентил-пропионил]-1-метил-1Н-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-циклопентил-пропионил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=388.2 [M+H]+.
Стадия 4: 5-{3-(4-бром-фенил)-3-циклопентил-1-[(Е)-гидроксиимино]-пропил}-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-3-циклопентил-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=403.2 [M+H]+.
Пример 173
5-{3-(4-бром-фенил)-3-циклопентил-1-[(Z)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
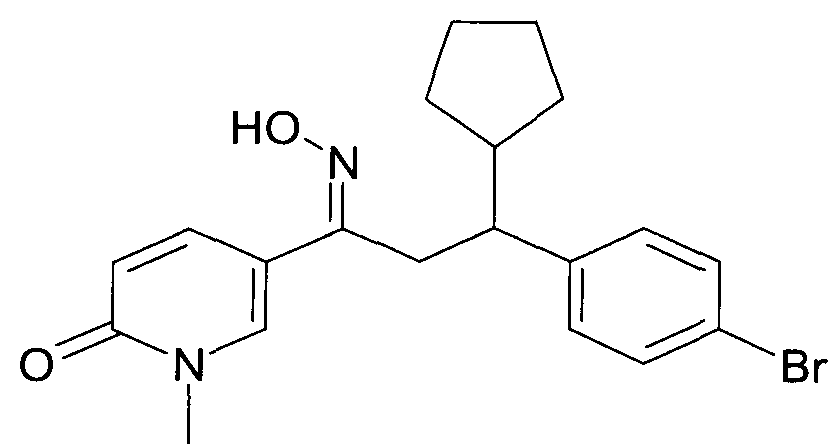
Соединение, указанное в заголовке, получили в виде побочного продукта примера 172, стадия 4 в виде бесцветного осадка, MS (ESI+): m/z=403.2 [M+H]+.
Пример 174
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-гексил}-1-метил-1H-пиридин-2-он
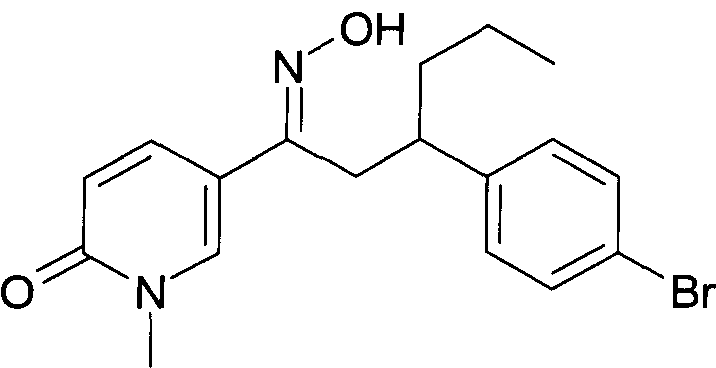
Стадия 1: 3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-гексан-1-он
По аналогии с примером 170, стадия 2, (E)-3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (пример 170, стадия 1) взаимодействовал с n-пропилмагния бромидом в присутствии Cul с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=362.1 [M+H]+.
Стадия 2: 5-[3-(4-бром-фенил)-гексаноил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-гексан-1-он взаимодействовал с концентрированной водной HCI в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=350.2 [M+H]+.
Стадия 3: 5-[3-(4-бром-фенил)-гексаноил]-1-метил-1H-пиридин-2-он По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-гексаноил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=362 [M+H]+.
Стадия 4: 5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-гексил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-гексаноил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=377.1 [M+H]+.
Пример 175
5-{3-(4-бром-фенил)-7,7,7-трифтор-1-[(E)-гидроксиимино]-гептил}-1-метил-1H-пиридин-2-он
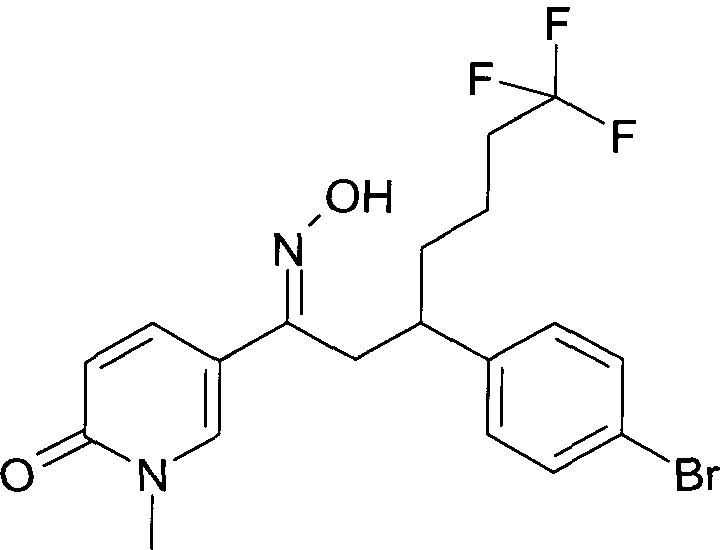
Стадия 1: 3-(4-бром-фенил)-7,7,7-трифтор-1-(6-метокси-пиридин-3-ил)-гептан-1-он
По аналогии с примером 170, стадия 2, (E)-3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (пример 170, стадия 1) взаимодействовал в присутствии Cul с реагентом Гриньяра, полученным из 1-бром-4,4,4-трифторбутана, с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=430.2 [M+H]+.
Стадия 2: 5-[3-(4-бром-фенил)-7,7,7-трифтор-гептаноил-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(4-бром-фенил)-7,7,7-трифтор-1-(6-метокси-пиридин-3-ил)-гептан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=416.1 [M+H]+.
Стадия 3: 5-[3-(4-бром-фенил)-7,7,7-трифтор-гептаноил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-7,7,7-трифтор-гептаноил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=430.2 [M+H]+.
Стадия 4: 5-{3-(4-бром-фенил)-7,7,7-трифтор-1-[(E)-гидроксиимино]-гептил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-7,7,7-трифтор-гептаноил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего 14% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=445.3 [M+H]+.
Пример 176
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-гекс-5-енил}-1-метил-1H-пиридин-2-он
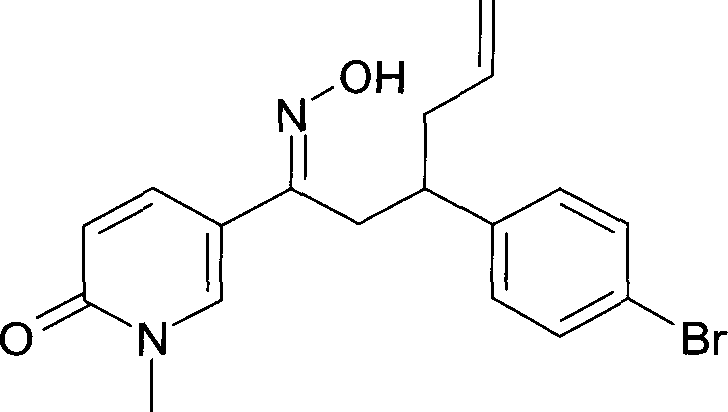
Стадия 1: 3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-гекс-5-ен-1-он
К суспензии (E)-3-(4-бром-фенил)-1 -(б-метокси-пиридин-3-ил)-пропенона (пример 170, стадия 1, 200 мг) в дихлорметане (3 мл) медленно добавили TiCl4 (1M в дихлорметане, 0.63 мл). Смесь перемешивали при комнатной температуре в течение 5 мин. Медленно добавили аллилтриметилсилан (79 мг). Смесь перемешивали при комнатной температуре в течении 30 мин. Добавили ледяную воду и смесь экстрагировали этилацетатом. Органическую фазу высушили с использованием MgSO4, отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, циклогексан/этилацетат 1:0 до 7:3) с получением соединения, указанного в заголовке, (135 мг) в виде светло-желтого масла, MS (ESI+): m/z=360.1 [M+H]+.
Стадия 2: 5-[3-(4-бром-фенил)-гекс-5-еноил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-гекс-5-ен-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде серо-белой пены, MS (ESI-): m/z=344.0 [M-H]-.
Стадия 3: 5-[3-(4-бром-Фенил)-гекс-5-еноил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-гекс-5-еноил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного масла, MS (ESI+): m/z=360.1 [M+H]+.
Стадия 4: 5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино1-гекс-5-енил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-гекс-5-еноил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=373.1 [M-H]-.
Пример 177
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-гептил}-1-метил-1H-пиридин-2-он

Стадия 1: 3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-гептан-1-он По аналогии с примером 170, стадия 2, (E)-3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (пример 170, стадия 1) взаимодействовал с n-бутилмагния хлоридом в присутствии Cul с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=376.2 [M+H]+.
Стадия 2: 5-[3-(4-бром-фенил)-гептаноил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-гептан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=362.1 [M+H]+.
Стадия 3: 5-[3-(4-бром-фенил)-гептаноил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-гептаноил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=376.2 [M+H]+.
Стадия 4: 5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-гептил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-гептаноил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего 4% соответствующего Z изомера, в виде бесцветной пены, MS (ESI+): m/z=391.3 [M+H]+.
Пример 178
5-{3-(4-бром-фенил)-3-циклогексил-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
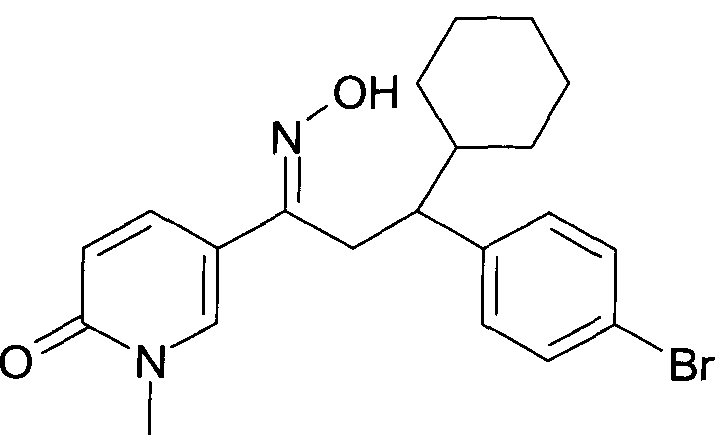
Стадия 1: 3-(4-бром-фенил)-3-циклогексил-1-(6-метокси-пиридин-3-ил)-пропан-1-он
По аналогии с примером 170, стадия 2, (E)-3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (пример 170, стадия 1) взаимодействовал с циклогексилмагния хлоридом в присутствии Cul с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=402.3 [M+H]+.
Стадия 2: 5-[3-(4-бром-фенил)-3-циклогексил-пропионил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(4-бром-фенил)-3-циклогексил-1-(6-метокси-пиридин-3-ил)-пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=388.2 [M+H]+.
Стадия 3: 5-[3-(4-бром-фенил)-3-циклогексил-пропионил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-циклогексил-пропионил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде светло-розового осадка, MS (ESI+): m/z=402.2 [M+H]+.
Стадия 4: 5-{3-(4-бром-фенил)-3-циклогексил-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-3-циклогексил-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=417.2 [M+H]+.
Пример 179
5-{3-(4-бром-фенил)-3-циклобутил-1-[(E)-гидроксиимино]-пропил}-1-метил-1Н-пиридин-2-он
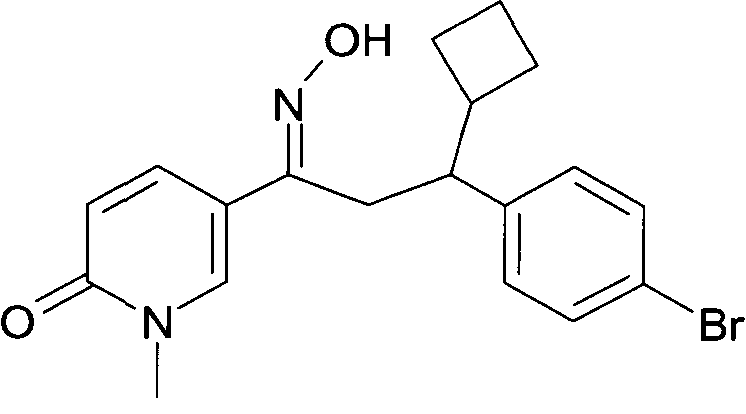
Стадия 1: 3-(4-бром-фенил)-3-циклобутил-1-(6-метокси-пиридин-3-ил)-пропан-1-он
По аналогии с примером 170, стадия 2, (E)-3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (пример 170, стадия 1) взаимодействовал в присутствии Cul с реагентом Гриньяра, полученным из циклобутилбромида, с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=374.2 [M+H]+.
Стадии 2-3: 5-[3-(4-бром-фенил)-3-циклобутил-пропионил]-1-метил-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(4-бром-фенил)-3-циклобутил-1-(6-метокси-пиридин-3-ил)-пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением 5-[3-(4-бром-фенил)-3-циклобутил-пропионил]-1H-пиридин-2-она в виде светло-желтого масла, которое сразу использовали на следующей стадии.
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-циклобутил-пропионил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=374.1 [M+H]+.
Стадия 4: 5-{3-(4-бром-фенил)-3-циклобутил-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-3-циклобутил-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=389.1 [M+H]+.
Пример 180
5-[3-(4-бром-фенил)-1-[(E)-гидроксиимино]-4-(4-трифторметокси-фенил)-бутил]-1-метил-1H-пиридин-2-он
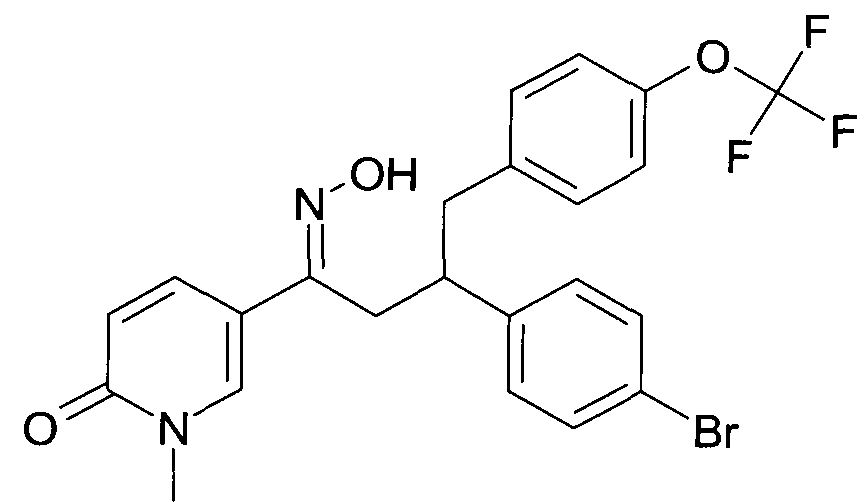
По аналогии с примером 170, стадия 2, (E)-3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (пример 170, стадия 1) взаимодействовал с 4-(трифторметокси)бензилмагния бромидом в присутствии Cul. Продукт этой реакции не может быть получен чистым и взаимодействовал по аналогии с примером 162, стадия 2, с концентрированной водной HCl в 1,4-диоксане. Продукт этой реакции взаимодействовал по аналогии с примером 161, стадия 1, с йодометаном в присутствии карбоната калия. В заключение, продукт этой реакции взаимодействовал по аналогии с примером 151, стадия 3, с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=509.3 [M+H]+.
Пример 181
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-изопропил-1H-пиридин-2-он

Стадия 1: 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-изопропил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он (пример 162, стадия 3) взаимодействовал с изопропилйодидом в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=438.2 [M+H]+.
Стадия 2: 5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино1-3-о-толил-пропил}-1-изопропил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-изопропил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=453.2 [M+H]+.
Пример 182
5-{3-(4-бром-фенил)-1-[(2)-гидроксиимино]-3-о-толил-пропил}-1-изопропил-1H-пиридин-2-он
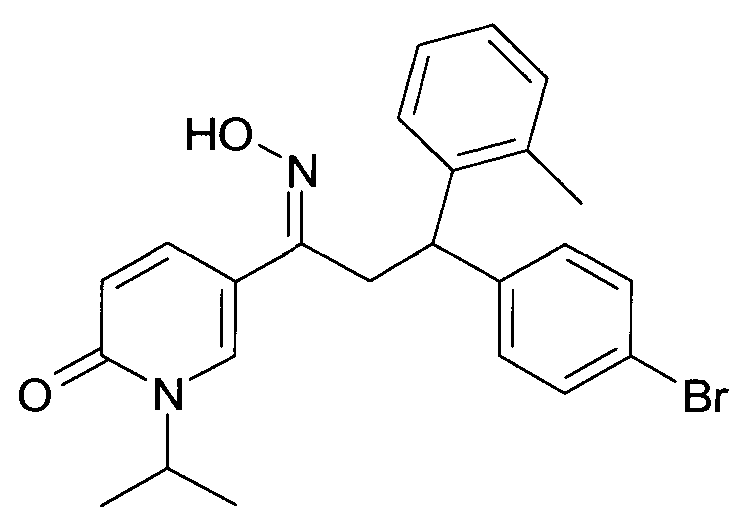
Соединение, указанное в заголовке, получили в виде побочного продукта примера 181, стадия 2 в виде бесцветной пены, MS (ESI+): m/z=453.2 [M+H]+.
Пример 183
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-циклопропилметил-1H-пиридин-2-он
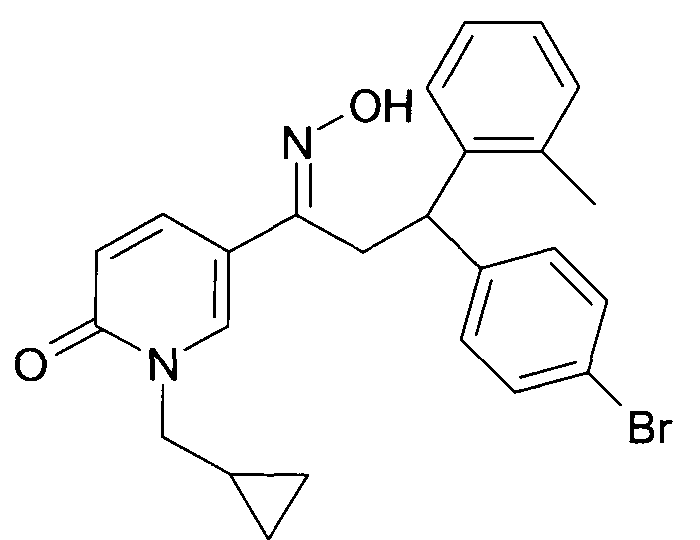
Стадия 1: 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-циклопропилметил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он (пример 162, стадия 3) взаимодействовал с (бромметил)циклопропаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=450.2 [M+H]+.
Стадия 2: 5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино1-3-о-толил-пропил}-1-циклопропилметил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-циклопропилметил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=465.1 [M+H]+.
Пример 184
5-{3-(4-бром-фенил)-1-[(Z)-гидроксиимино]-3-о-толил-пропил}-1-циклопропилметил-1H-пиридин-2-он
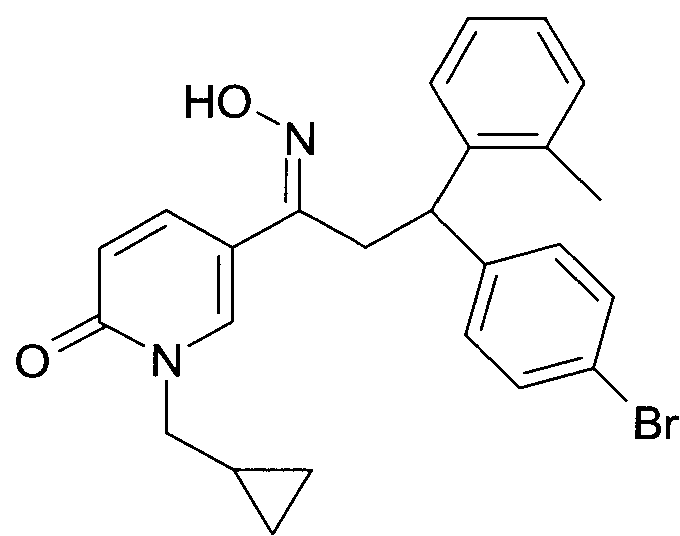
Соединение, указанное в заголовке, получили в виде побочного продукта примера 183, стадия 2 в виде бесцветной пены, MS (ESI+): m/z=465.1 [M+H]+.
Пример 185
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-(2-метокси-этил)-1H-пиридин-2-он
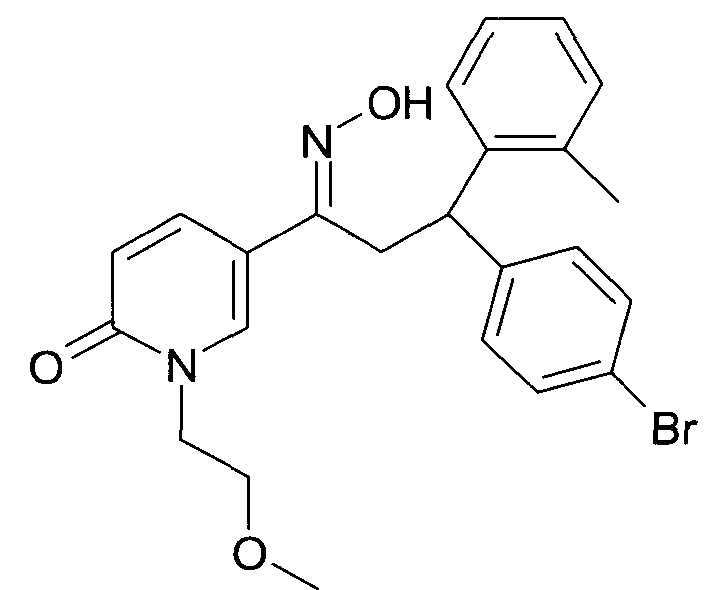
Стадия 1: 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-(2-метокси-этил)-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он (пример 162, стадия 3) взаимодействовал с 2-бромоэтилметиловым эфиром в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=454.1 [M+H]+.
Стадия 2: 5-{3-(4-бром-фенил)-1-[(Е)-гидроксиимино]-3-о-толил-пропил}-1-(2-метокси-этил)-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-(2-метокси-этил)-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного аморфного осадка, MS (ESI+): m/z=469.2 [M+H]+.
Пример 186
2-(5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-2-оксо-2H-пиридин-1-ил)-ацетамид
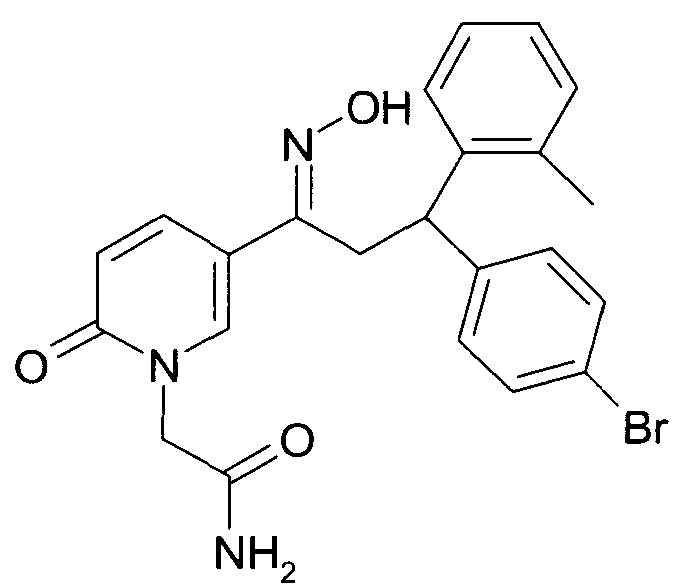
Стадия 1: 2-{5-[3-(4-бром-фенил)-3-о-толил-пропионил]-2-оксо-2H-пиридин-1-ил}-ацетамид
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он (пример 162, стадия 3) взаимодействовал с йодацетамидом в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=453.1 [M+H]+.
Стадия 2: 2-(5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-2-оксо-2H-пиридин-1-ил)-ацетамид
По аналогии с примером 151, стадия 3, 2-{5-[3-(4-бром-фенил)-3-о-толил-пропионил]-2-оксо-2H-пиридин-1-ил}-ацетамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI-): m/z=466.1 [M-H]-.
Пример 187
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-циклобутил-1H-пиридин-2-он
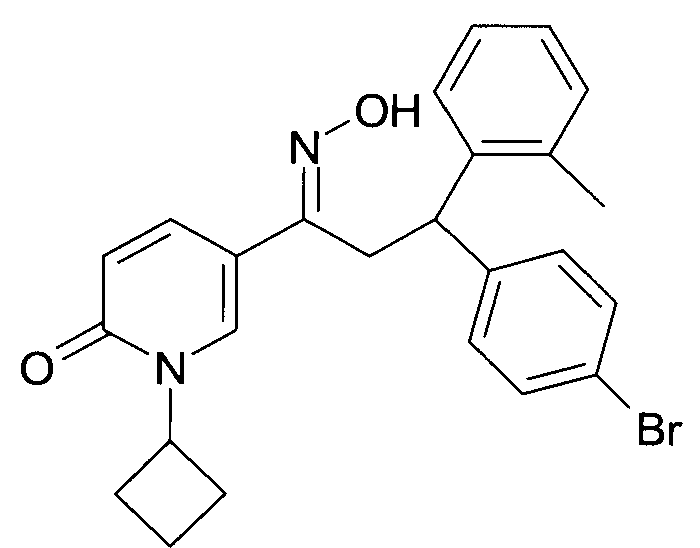
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он (пример 162, стадия 3) взаимодействовал с циклобутилбромидом в присутствии карбоната калия. Продукт этой реакции взаимодействовал, по аналогии с примером 151, стадия 3, с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=465.2 [M+H]+.
Пример 188
5-{3-(4-бром-фенил)-1-[(Z)-гидроксиимино]-3-о-толил-пропил}-1-циклобутил-1H-пиридин-2-он
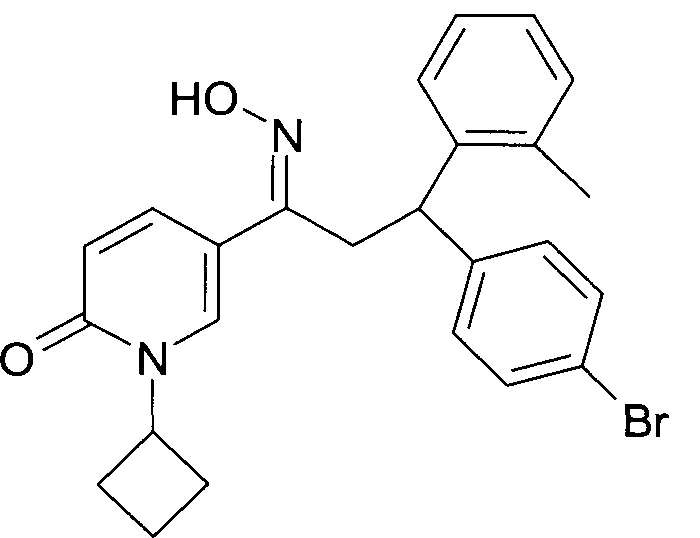
5 Соединение, указанное в заголовке, получили в виде побочного продукта примера 187 в виде бесцветного осадка, MS (ESI+): m/z=465.2 [M+H]+.
Пример 189
3-(5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-2-оксо-2H-пиридин-1-ил)-пропионовая кислота
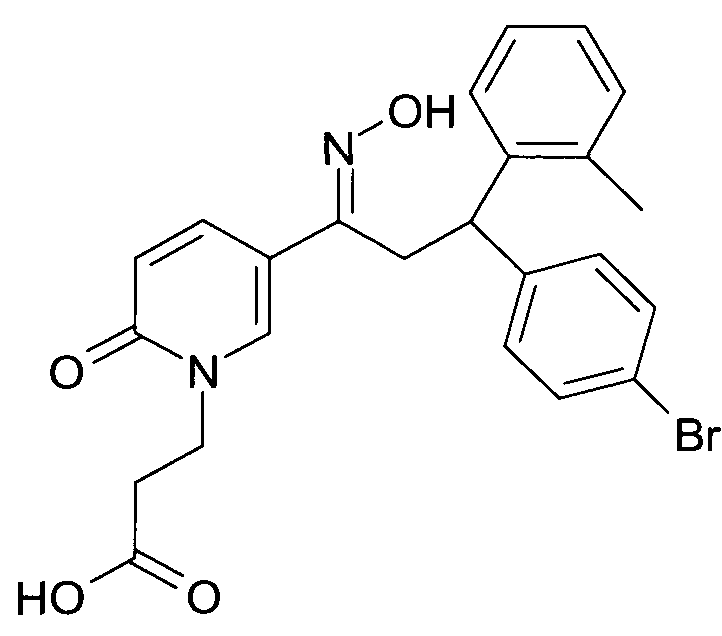
Стадия 1: 3-{5-[3-(4-бром-фенил)-3-о-толил-пропионил]-2-оксо-2H-пиридин-1-ил}-пропионовой кислоты метиловый эфир
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он (пример 162, стадия 3) взаимодействовал с метил-3-бромпропиноатом в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=482.2 [M+H]+.
Стадия 2: 3-{5-[3-(4-бром-фенил)-3-о-толил-пропионил]-2-оксо-2H-пиридин-1-ил}-пропионовая кислота
По аналогии с примером 169, стадия 2, 3-{5-[3-(4-бром-фенил)-3-о-толил-пропионил]-2-оксо-2H-пиридин-1-ил}-пропионовой кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=466.0 [M-H]-.
Стадия 3: 3-(5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил]-2-оксо-2H-пиридин-1 -ил)-пропионовая кислота
По аналогии с примером 151, стадия 3, 3-{5-[3-(4-бром-фенил)-3-о-толил-пропионил]-2-оксо-2H-пиридин-1-ил}-пропионовая кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=481.0 [M-H]-.
Пример 190
4-(5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-2-оксо-2H-пиридин-1-ил)-масляная кислота
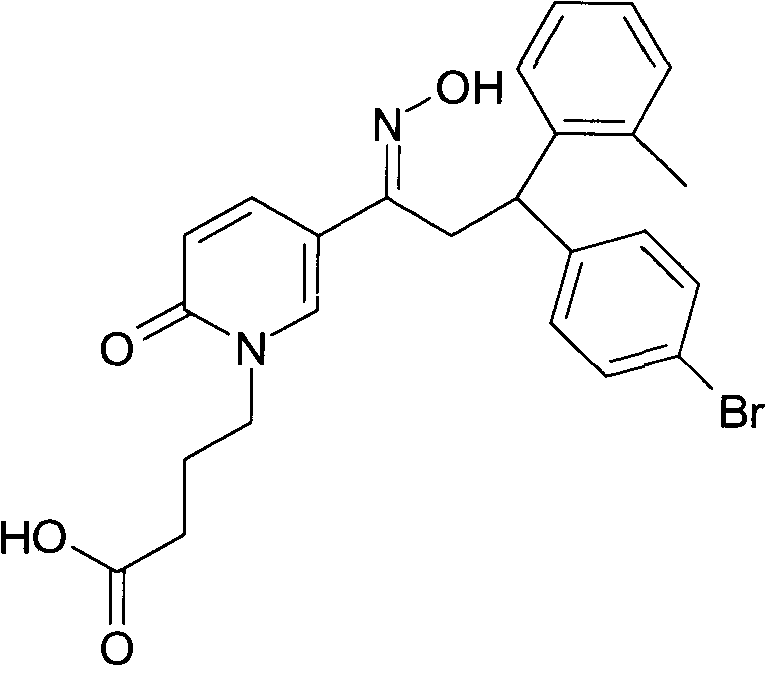
Стадия 1: 4-{5-[3-(4-бром-фенил)-3-о-толил-пропионил]-2-оксо-2H-пиридин-1-ил}-масляной кислоты метиловый эфир
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он (пример 162, стадия 3) взаимодействовал с метил-4-бромбутиратом в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=496.2 [M+H]+.
Стадия 2: 4-{5-[3-(4-бром-фенил)-3-о-толил-пропионил]-2-оксо-2H-пиридин-1-ил}-масляная кислота
По аналогии с примером 169, стадия 2, 4-{5-[3-(4-бром-фенил)-3-о-толил-пропионил]-2-оксо-2H-пиридин-1-ил}-масляной кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=480.1 [M-H]-.
Стадия 3: 4-(5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-2-оксо-2H-пиридин-1-ил)-масляная кислота
По аналогии с примером 151, стадия 3, 4-{5-[3-(4-бром-фенил)-3-о-толил-пропионил]-2-оксо-2H-пиридин-1-ил}-масляная кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=495.1 [M-H]-.
Пример 191
5-{3-(4-бром-2-фтор-фенил)-1-[(E)-гидроксиимино]-гексил}-1-метил-1H-пиридин-2-он
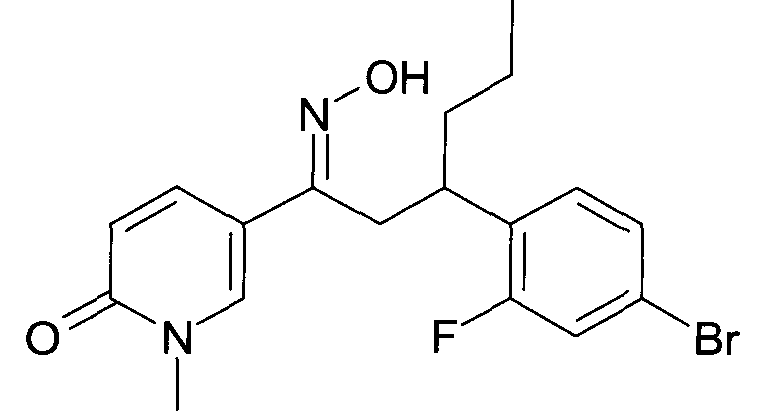
Стадия 1: (E)-3-(4-бром-2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон
По аналогии с примером 170, стадия 1, 5-ацетил-2-метоксипиридин взаимодействовал с 4-бром-2-фторбензальдегидом в присутствии гидроксида калия с получением соединения, указанного в заголовке, в виде бесцветного осадка. MS (ESI+): m/z=336.2 [M+H]+.
Стадия 2: 3-(4-бром-2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-гексан-1-он
По аналогии с примером 170, стадия 2, (E)-3-(4-бром-2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон взаимодействовал с n-пропилмагния бромидом в присутствии Cul с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=380.0 [M+H]+.
Стадия 3: 5-[3-(4-бром-2-фтор-фенил)-гексаноил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(4-бром-2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-гексан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=366.0 [M+H]+.
Стадия 4: 5-[3-(4-бром-2-фтор-фенил)-гексаноил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-2-фтор-фенил)-гексаноил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного масла, MS (ESI+): m/z=380.2 [M+H]+.
Стадия 5: 5-{3-(4-бром-2-фтор-фенил)-1-[(E)-гидроксиимино]-гексил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-2-фтор-фенил)-гексаноил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=395.1 [M+H]+.
Пример 192
5-{3-(4-бром-2-фтор-фенил)-3-циклопентил-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
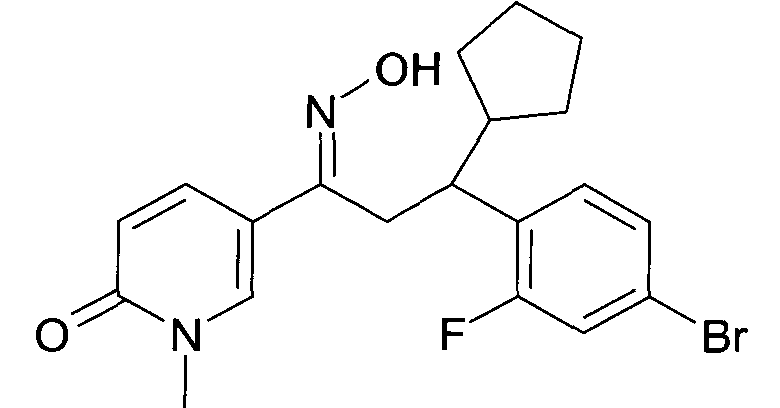
Стадия 1: 3-(4-бром-2-фтор-фенил)-3-циклопентил-1-(6-метокси-пиридин-3-ил)-пропан-1-он
По аналогии с примером 170, стадия 2, (E)-3-(4-бром-2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (пример 191, стадия 1) взаимодействовал с циклопентилмагния бромидом в присутствии Cul с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=406.2 [M+H]+.
Стадия 2: 5-[3-(4-бром-2-фтор-фенил)-3-циклопентил-пропионил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(4-бром-2-фтор-фенил)-3-циклопентил-1-(6-метокси-пиридин-3-ил)-пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=392.2 [M+H]+.
Стадия 3: 5-[3-(4-бром-2-фтор-фенил)-3-циклопентил-пропионил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-2-фтор-фенил)-3-циклопентил-пропионил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного масла, MS (ESI+): m/z=406.3 [M+H]+.
Стадия 4: 5-{3-(4-бром-2-фтор-фенил)-3-циклопентил-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-2-фтор-фенил)-3-циклопентил-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=421.1 [M+H]+.
Пример 193
5-{3-(4-бром-2-фтор-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он
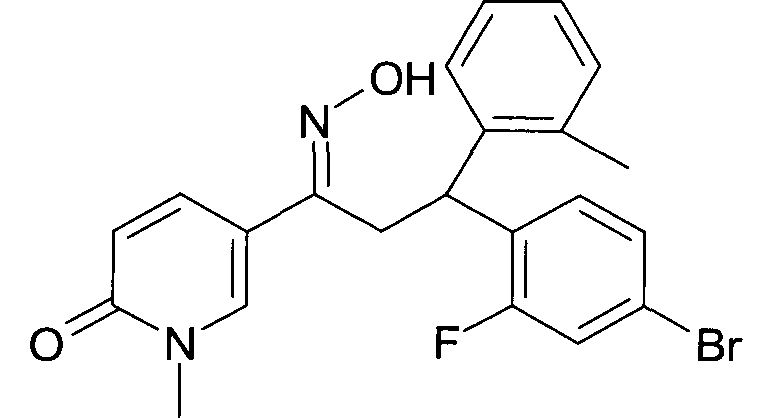
Стадия 1: 3-(4-бром-2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-3-о-толил-пропан-1-он
К раствору о-толилбороновой кислоты (506 мг) в толуоле (32 мл) добавили диэтилцинк (11.2 мл, 1 М раствор в гексане) при 0°C. Смесь нагрели до комнатной температуры и затем перемешивали при 60°C в течение ночи. После охлаждения в ванне со льдом, добавили раствор (E)-3-(4-бром-2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенона (500 мг, пример 191, стадия 1) в толуоле (21 мл). Реакционную смесь перемешивали при комнатной температуре в течении 6 ч. Добавили насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органическую фазу высушили (MgSO4), отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, циклогексан/этилацетат 1:0 до 1:1) с получением соединения, указанного в заголовке (392 мг), в виде бесцветного масла, MS (ESI+): m/z=428.0 [M+H]+.
Стадия 2: 5-[3-(4-бром-2-фтор-фенил)-3-о-толил-пропионил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(4-бром-2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-3-о-толил-пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=414.1 [M+H]+.
Стадия 3: 5-[3-(4-бром-2-фтор-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-2-фтор-фенил)-3-о-толил-пропионил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=428.0 [M+H]+.
Стадия 4: 5-{3-(4-бром-2-фтор-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-2-фтор-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=443.1 [M+H]+.
Пример 194
3'-фтор-4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
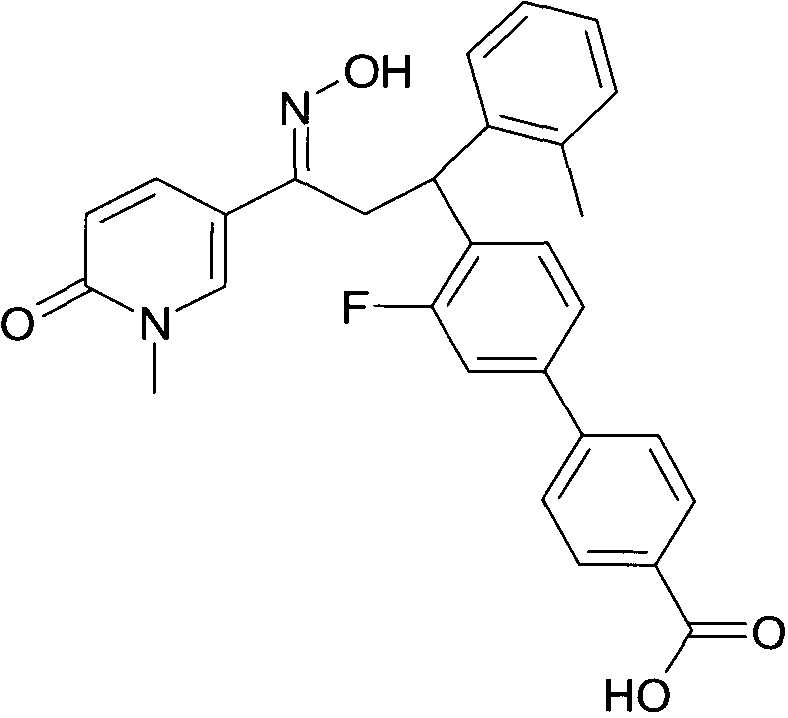
По аналогии с примером 166, стадия 1, 5-{3-(4-бром-2-фтор-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он (пример 193, стадия 4) взаимодействовал с 4-карбоксифенилбороновой кислотой в присутствии дихлор(1,1'-бис(дифенилфосфино)ферроцен)-палладия(II) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2 М водного раствора карбоната натрия с получением соединения, указанного в заголовке, в виде светло-коричневого осадка, MS (ESI+): m/z=485.2 [M+H]+.
Пример 195
3,3'-дифтор-4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
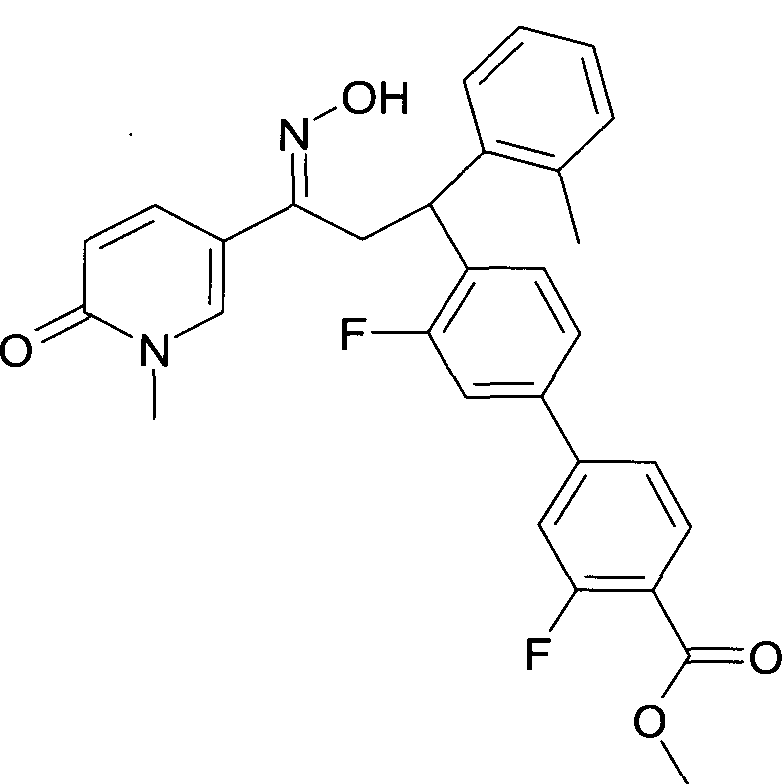
По аналогии с примером 166, стадия 1, 5-{3-(4-бром-2-фтор-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он (пример 193, стадия 4) взаимодействовал с 3-фтор-4-метоксикарбонилфенилбороновой кислотой в присутствии дихлор(1,1'-бис(дифенилфосфино)-ферроцен)палладия(II) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2 М водного раствора карбоната натрия с получением соединения, указанного в заголовке, в виде светло-коричневого осадка, MS (ESI+): m/z=517.4 [M+H]+.
Пример 196
3,3'-дифтор-4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновая кислота
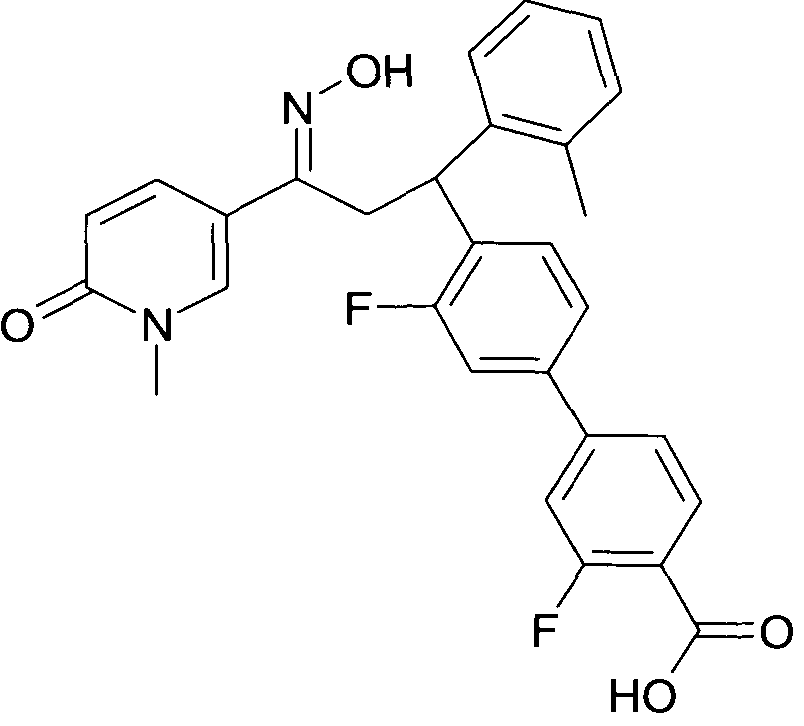
По аналогии с примером 169, стадия 2, 3,3'-дифтор-4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-карбоновой кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде светло-коричневого осадка, MS (ESI-): m/z=501.1 [M-H]-.
Пример 197
5-{3-(2-хлор-фенил)-3-циклопентил-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он

Стадия 1: (E)-3-(2-хлор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон
По аналогии с примером 170, стадия 1, 5-ацетил-2-метоксипиридин взаимодействовал с 2-хлорбензальдегидом в присутствии гидроксида калия с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=274.2 [M+H]+.
Стадия 2: 3-(2-хлор-фенил)-3-циклопентил-1-(6-метокси-пиридин-3-ил)-пропан-1-он
По аналогии с примером 170, стадия 2, (E)-3-(2-хлор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон взаимодействовал с циклопентилмагния бромидом в присутствии CuI с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=344.2 [M+H]+.
Стадия 3: 5-[3-(2-хлор-фенил)-3-циклопентил-пропионил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(2-хлор-фенил)-3-циклопентил-1-(6-метокси-пиридин-3-ил)-пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=330.2 [M+H]+.
Стадия 4: 5-[3-(2-хлор-фенил)-3-циклопентил-пропионил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(2-хлор-фенил)-3-циклопентил-пропионил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=344.2 [M+H]+.
Стадия 5: 5-{3-(2-хлор-фенил)-3-циклопентил-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(2-хлор-фенил)-3-циклопентил-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=359.2 [M+H]+.
Пример 198
4-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-1,1-диметил-пиперидиниума йодид
Стадия 1: 3-(2-хлор-фенил)-1-(6-метокси-пиридин-3-ил)-3-(1-метил-пиперидин-4-ил)-пропан-1-он
По аналогии с примером 170, стадия 2, (E)-3-(2-хлор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (пример 197, стадия 1) взаимодействовал с реагентом Гриньяра, полученным из 4-хлор-1-метил-пиперидина, в присутствии CuI с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=373.1 [M+H]+.
Стадия 2: 5-[3-(2-хлор-фенил)-3-(1-метил-пиперидин-4-ил)-пропионил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(2-хлор-фенил)-1-(6-метокси-пиридин-3-ил)-3-(1-метил-пиперидин-4-ил)-пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=359.2 [M+H]+.
Стадии 3 и 4: 4-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-1,1-диметил-пиперидиниума йодид
По аналогии с примером 161, стадия 1, 5-[3-(2-хлор-фенил)-3-(1-метил-пиперидин-4-ил)-пропионил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия. Продукт этой реакции взаимодействовал по аналогии с примером 151, стадия 3, с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=402.4 [M+H]+.
Пример 199
5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1,4-диметил-1H-пиридин-2-он
Стадии 1 и 2: 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-4-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 1, 5-бром-2-метокси-4-метилпиридин сначала взаимодействовал с n-бутиллитием и затем с 3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамидом (пример 74, стадия 4). Продукт этой реакции взаимодействовал с концентрированной водной HCl в 1,4-диоксане по аналогии с примером 162, стадия 2, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=410.2 [M+H]+.
Стадия 3: 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1,4-диметил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-4-метил-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=424.2 [M+H]+.
Стадия 4: 5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино1-3-о-толил-пропил}-1,4-диметил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1,4-диметил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=439.2 [M+H]+.
Пример 200
5-{3-(4-бром-фенил)-1-[(2)-гидроксиимино]-3-о-толил-пропил}-1,4-диметил-1H-пиридин-2-он
Соединение, указанное в заголовке, получили в виде побочного продукта примера 199, стадия 4 в виде бесцветного осадка, MS (ESI+): m/z=439.3 [M+H]+.
Пример 201
4'-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-3-карбоновая кислота
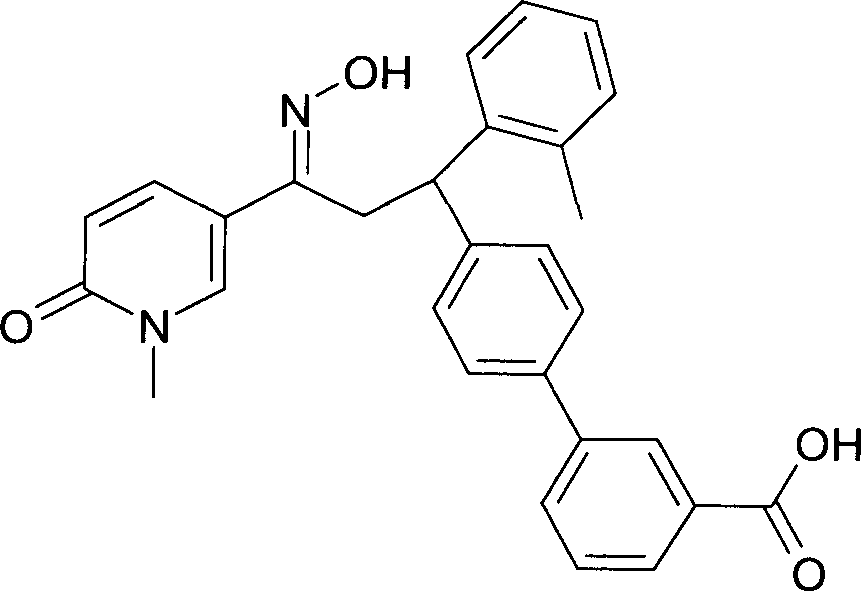
По аналогии с примером 166, стадия 1, 5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он (пример 162, стадия 4) взаимодействовал с 3-карбоксифенилбороновой кислоты в присутствии дихлор(1,1'-бис(дифенилфосфино)ферроцен)-палладия(II) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2М водного раствора карбоната натрия с получением соединения, указанного в заголовке, в виде светло-желтой пены, MS (ESI-): m/z=465.1 [M-H]-.
Пример 202
3-{4'-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-4-ил}-пропионовая кислота
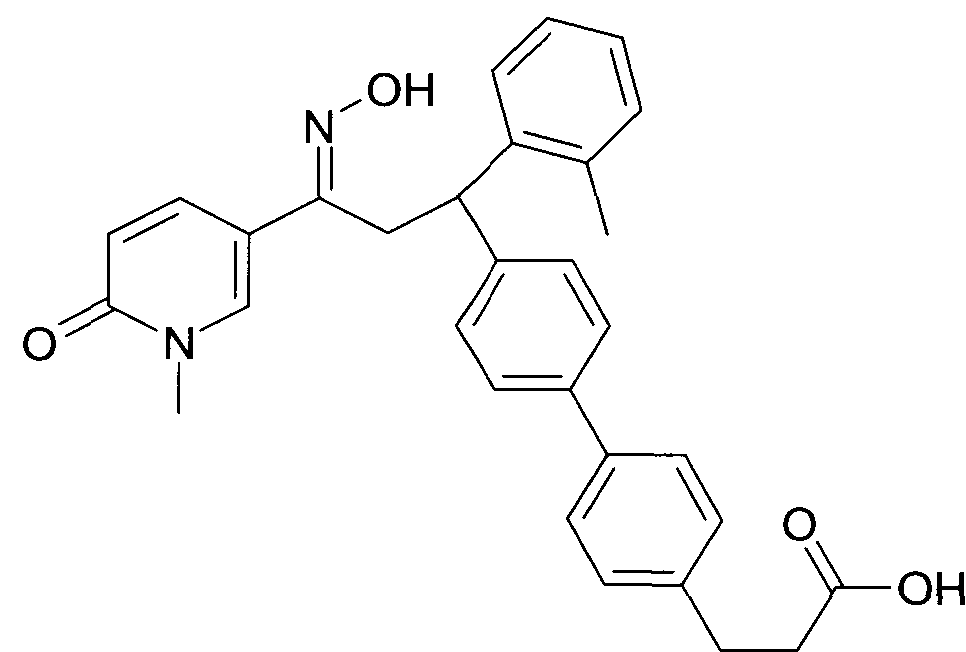
По аналогии с примером 166, стадия 1, 5-{3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он (пример 162, стадия 4) взаимодействовал с 4-(2-карбоксиэтил)бензолбороновой кислотой в присутствии дихлор(1,1'-бис(дифенилфосфино)-ферроцен)палладия(II) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2M водного раствора карбоната натрия с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI-): m/z=493.2 [M-H]-.
Пример 203
5-{3-(4-бром-фенил)-3-(2-хлор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
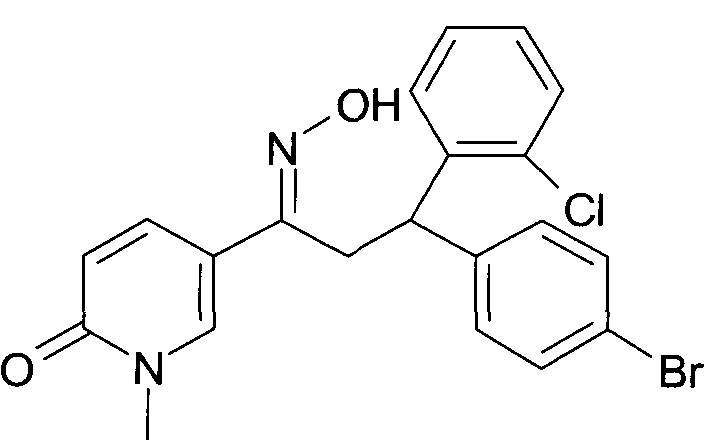
Стадия 1: 3-(4-бром-фенил)-3-(2-хлор-фенил)-1-(6-метокси-пиридин-3-ил)-пропан-1-он
4-бромбороновую кислоту (220 мг) и хлор(1,5-циклооктадиен)родий(I)димер (29 мг) поместили в колбу в атмосфере аргона. Добавили диоксан (1.9 мл), воду (0.21 мл), (Е)-3-(2-хлор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (200 мг, пример 197, стадия 1) и NaHCO3 (6.1 мг) и смесь перемешивали при 60°C в течение 4.5 ч. После охлаждения до комнатной температуры, добавили воду и смесь экстрагировали этилацетатом. Органическую фазу высушили (MgSO4), отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, циклогексан/этилацетат 1:0 до 3:2) с получением соединения, указанного в заголовке, (331 мг, не весь чистый) в виде светло-желтого масла, MS (ESI+): m/z=430.1 [M+H]+.
Стадия 2: 5-[3-(4-бром-фенил)-3-(2-хлор-фенил)-пропионил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(4-бром-фенил)-3-(2-хлор-фенил)-1-(6-метокси-пиридин-3-ил)-пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде серо-белой пены, MS (ESI-): m/z=413.9 [M-H]-.
Стадия 3: 5-[3-(4-бром-фенил)-3-(2-хлор-фенил)-пропионил]-1 -метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-(2-хлор-фенил)-пропионил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=429.9 [M-H]-.
Стадия 4: 5-{3-(4-бром-фенил)-3-(2-хлор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-3-(2-хлор-фенил)-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=445.1 [M+H]+.
Пример 204
4'-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота
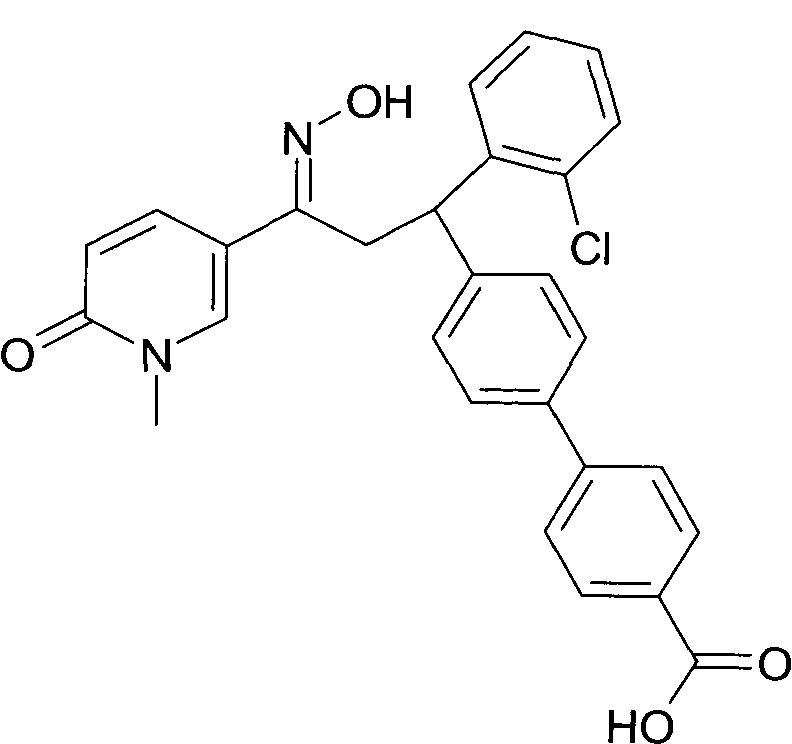
По аналогии с примером 166, стадия 1, 5-{3-(4-бром-фенил)-3-(2-хлор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он (пример 203, стадия 4) взаимодействовал с 4-карбоксифенилбороновой кислотой в присутствии дихлор(1,1'-бис(дифенилфосфино)ферроцен)-палладия(11) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2M водного раствора карбоната натрия с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI-): m/z=485.2 [M-H]-.
Пример 205
4'-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновой кислоты метиловый эфир
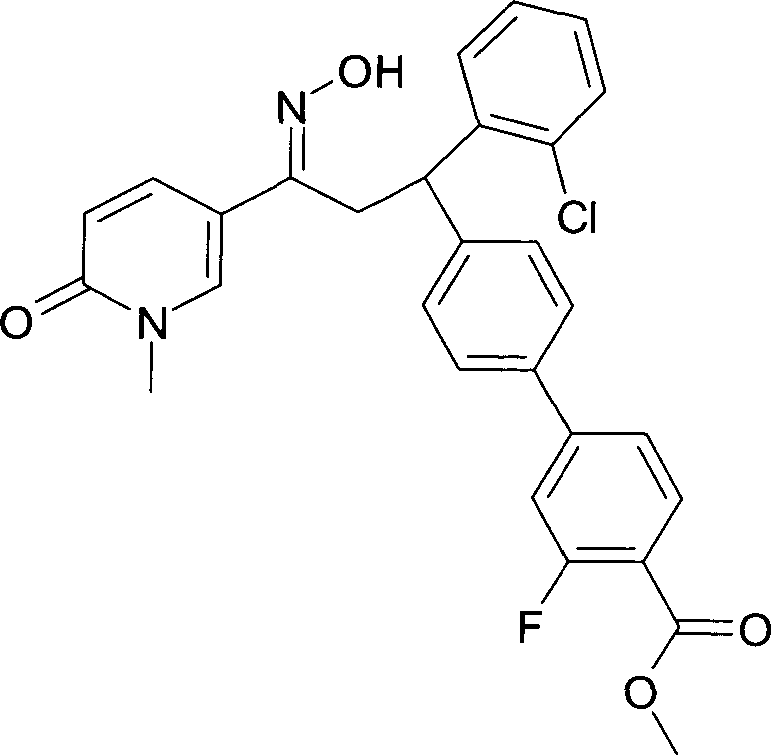
По аналогии с примером 166, стадия 1, 5-{3-(4-бром-фенил)-3-(2-хлор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он (пример 203, стадия 4) взаимодействовал с 3-фтор-4-метоксикарбонилфенилбороновой кислотой в присутствии дихлор(1,1'-бис(дифенилфосфино)ферроцен)палладия(II) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2M водного раствора карбоната натрия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=519.2 [M+H]+.
Пример 206
4'-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота
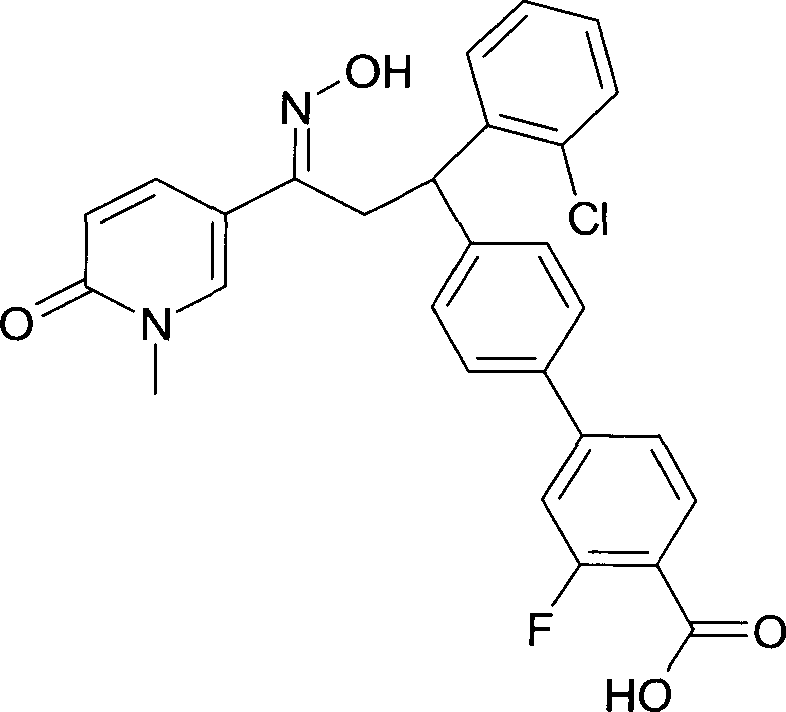
По аналогии с примером 169, стадия 2, 4'-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновой кислоты метиловый эфир (пример 205) гидролизовали с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI-): m/z=503.0 [M-H]-.
Пример 207
5-{1-[(Е)-гидроксимино]-3-[4-(морфолин-4-карбонил)-фенил]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он
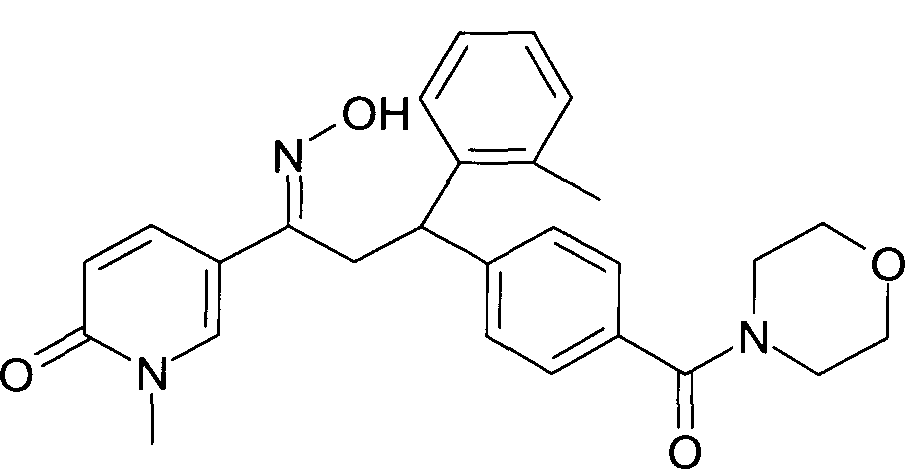
Стадия 1: 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойная кислота
Смесь 5-[3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-она (150 мг, пример 162, стадия 3), дихлор(1,1'-бис(дифенилфосфино)ферроцен)палладия(II) дихлорметанового аддукта (30 мг), NaHCO3 (77 мг), этилацетата (4.5 мл) и воды (1.5 мл) обработали монооксидом углерода при 150°C/80 бар в течение 20 ч. После охлаждения до комнатной температуры, смесь отфильтровали. Фильтрационный остаток промыли этилацетатом и водным раствором KHSO4. Объединенный фильтрат экстрагировали этилацетатом. Органическую фазу промыли солевым раствором, высушили (MgSO4), отфильтровали и сконцентрировали досуха. Остаток растворили в 1M водном растворе NaOH и промыли диэтиловым эфиром. Водную фазу закислили, используя концентрированную водную HCl и экстрагировали этилацетатом. Органическую фазу промыли солевым раствором, высушили (MgSO4), отфильтровали и сконцентрировали досуха с получением соединения, указанного в заголовке, (129 мг) в виде светло-коричневого осадка, MS (ESI-): m/z=374.1 [M-H]-.
Стадия 2: 1-метил-5-{3-[4-(морфолин-4-карбонил)-фенил]-3-о-толил-пропионил}-1H-пиридин-2-он
Смесь 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойной кислоты (60 мг), морфолина (17 мг), бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфата (108 мг, ВОР реагент) и N-этилдиизопропиламина (62 мг) в тетрагидрофуране (0.6 мл) перемешивали в течение ночи при комнатной температуре. Смесь сконцентрировали досуха. Продукт очистили хроматографией (SiO2, дихлорметан/метанол 1:0 до 9:1) с получением соединения, указанного в заголовке, (75 мг) в виде бесцветной пены, MS (ESI+): m/z=445.4 [M+H]+.
Стадия 3: 5-{1-[(E)-гидроксимино]-3-[4-(морфолин-4-карбонил)-фенил]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 1-метил-5-{3-[4-(морфолин-4-карбонил)-фенил]-3-о-толил-пропионил}-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=460.4 [M+H]+.
Пример 208
N-(2-гидрокси-этил)-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензамид
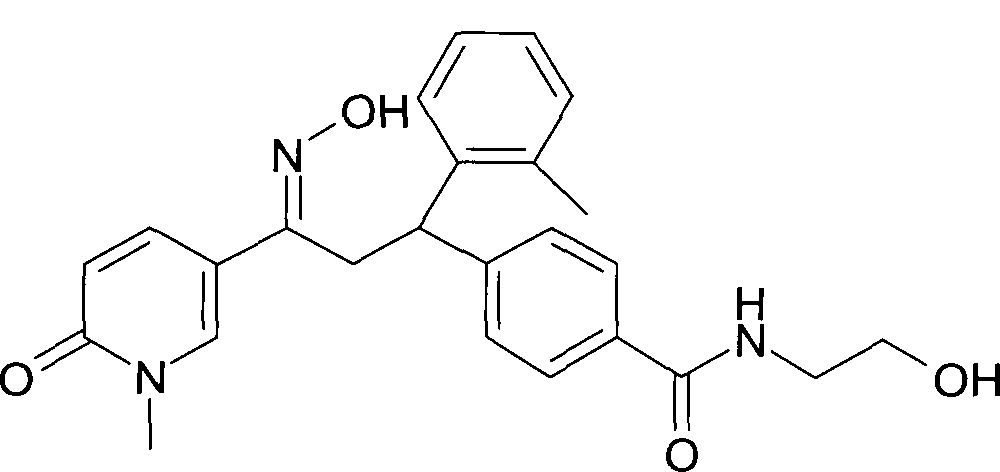
Стадия 1: N-(2-гидрокси-этил)-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензамид
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с этаноламином, используя ВОР реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=419.3 [M+H]+.
Стадия 2: N-(2-гидрокси-этил)-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензамид
По аналогии с примером 151, стадия 3, N-(2-гидрокси-этил)-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=434.4 [M+H]+.
Пример 209
N-(2-гидрокси-этил)-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-N-метил-бензамид
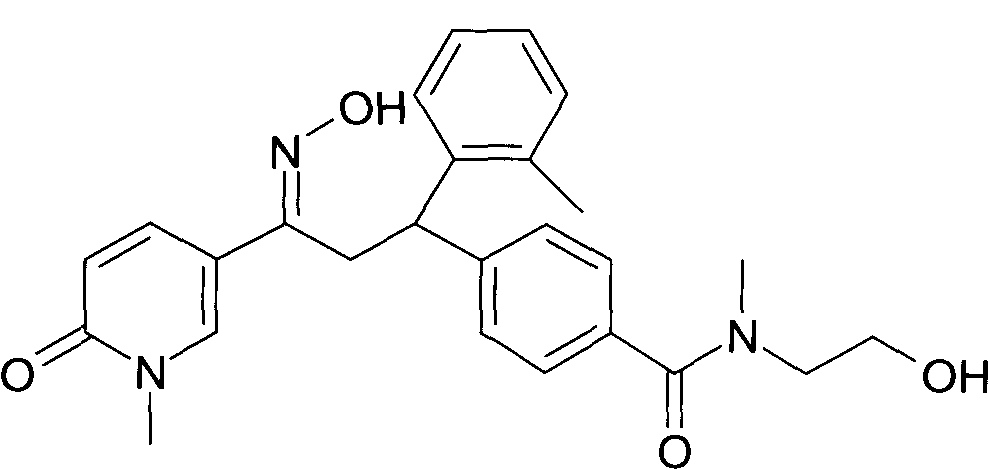
Стадия 1: N-(2-гидрокси-этил)-N-метил-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензамид
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с 2-(метиламино)этанолом, используя ВОР реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белой пены, MS (ESI+): m/z=433.4 [M+H]+.
Стадия 2: N-(2-гидрокси-этил)-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-N-метил-бензамид
По аналогии с примером 151, стадия 3, N-(2-гидрокси-этил)-N-метил-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=448.2 [M+H]+.
Пример 210
(1-{4-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоил}-пиперидин-4-ил)-уксусная кислота
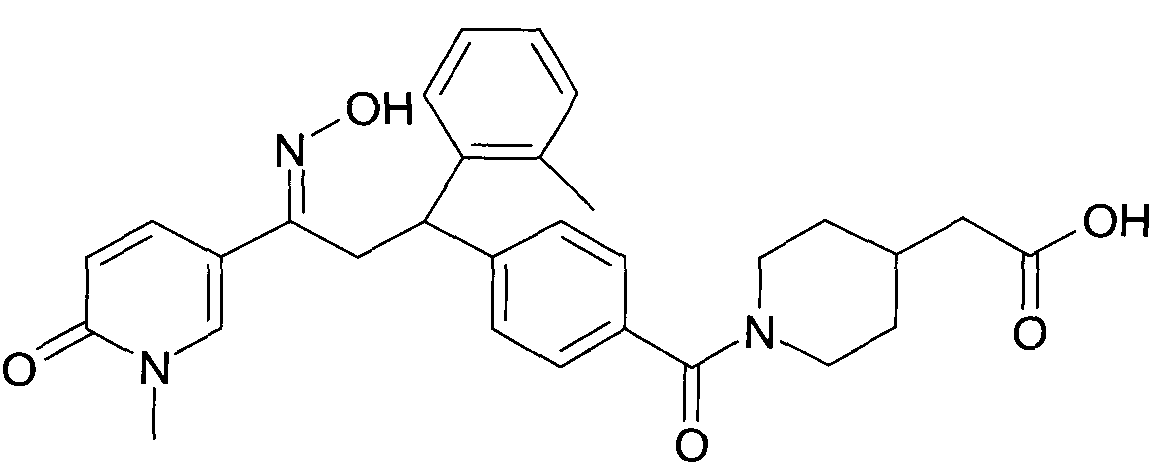
Стадия 1: (1-{4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил1-бензоил}-пиперидин-4-ил)-уксусной кислоты этиловый эфир
По аналогии с примером 207, стадия 2, 4-[3-(1 -метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с 2-(пиперидин-4-ил)-уксусной кислоты этиловым эфиром, используя ВОР реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде светло-коричневой пены, MS (ESI+): m/z=529.3 [M+H]+.
Стадия 2: (1-{4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоил}-пиперидин-4-ил)-уксусная кислота
По аналогии с примером 169, стадия 2, (1-{4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоил}-пиперидин-4-ил)-уксусной кислоты этиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде светло-коричневой пены, MS (ESI-): m/z=499.3 [M-H]-.
Стадия 3: (1-{4-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1.6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоил}-пиперидин-4-ил)-уксусная кислота
По аналогии с примером 151, стадия 3, (1-{4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоил}-пиперидин-4-ил)-уксусная кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI-): m/z=514.4 [M-H]-.
Пример 211
({4-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоил}-метил-амино)-уксусная кислота
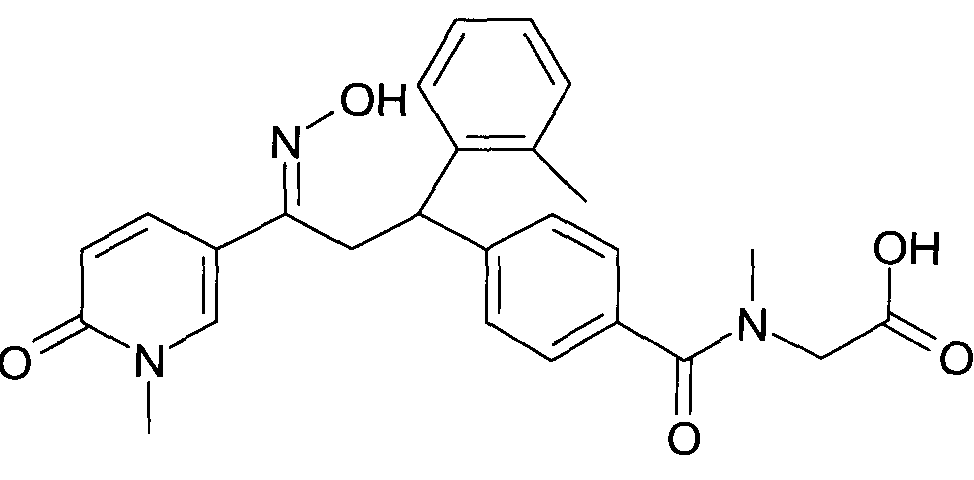
Стадия 1: (метил-{4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил1-бензоил}-амино)-уксусной кислоты метиловый эфир
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с гидрохлоридом метилового эфира метилглицина, используя ВОР реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=461.3 [M+H]+.
Стадия 2: (метил-{4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоил}-амино)-уксусная кислота
По аналогии с примером 169, стадия 2, (метил-{4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоил}-амино)-уксусной кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=445.3 [M-H]-.
Стадия 3: ({4-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоил}-метил-амино)-уксусная кислота
По аналогии с примером 151, стадия 3, (метил-{4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоил}-амино)-уксусная кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=460.3 [M-H]-.
Пример 212
4-{4-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоиламино}-масляной кислоты этиловый эфир
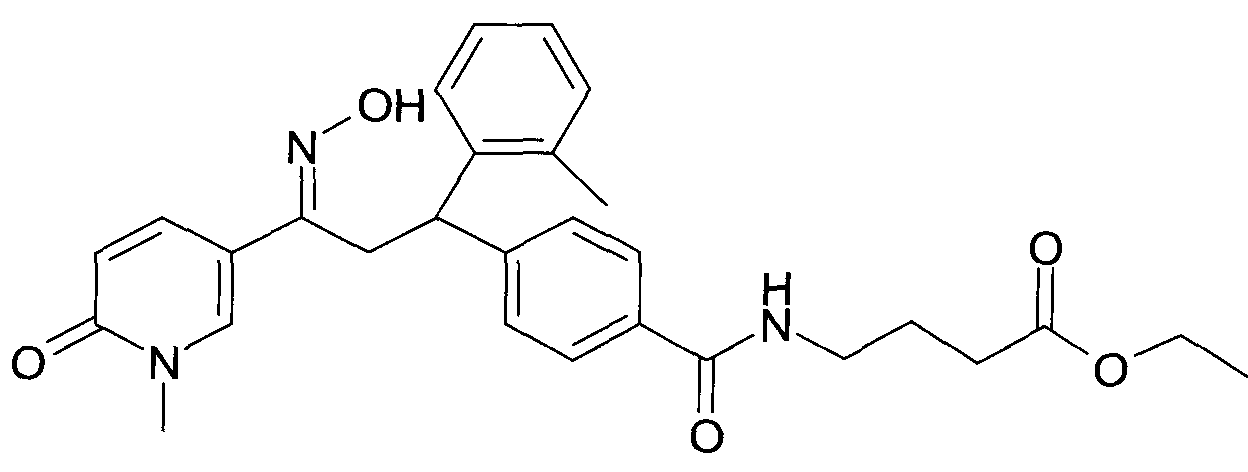
Стадия 1: 4-{4-[3-(1-метил-6-оксо-1.6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоиламино}-масляной кислоты метиловый эфир
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с метил-4-аминобутират гидрохлоридом, используя BOP реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=475.1 [M+H]+.
Стадия 2: 4-{4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил1-бензоиламино}-масляная кислота
По аналогии с примером 169, стадия 2, 4-{4-[3-(1-метил-6-оксо-1,6-д и гид ро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоиламино}-масляной кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде светло-коричневой пены, MS (ESI-): m/z=449.3 [M-H]-.
Стадия 3: 4-{4-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил1-бензоиламино}-масляной кислоты этиловый эфир
По аналогии с примером 151, стадия 3, 4-{4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоиламино}-масляная кислота взаимодействовала с гидроксиламина гидрохлоридом в этаноле и воде в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=504.3 [M+H]+.
Пример 213
4-{4-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоиламино}-масляная кислота
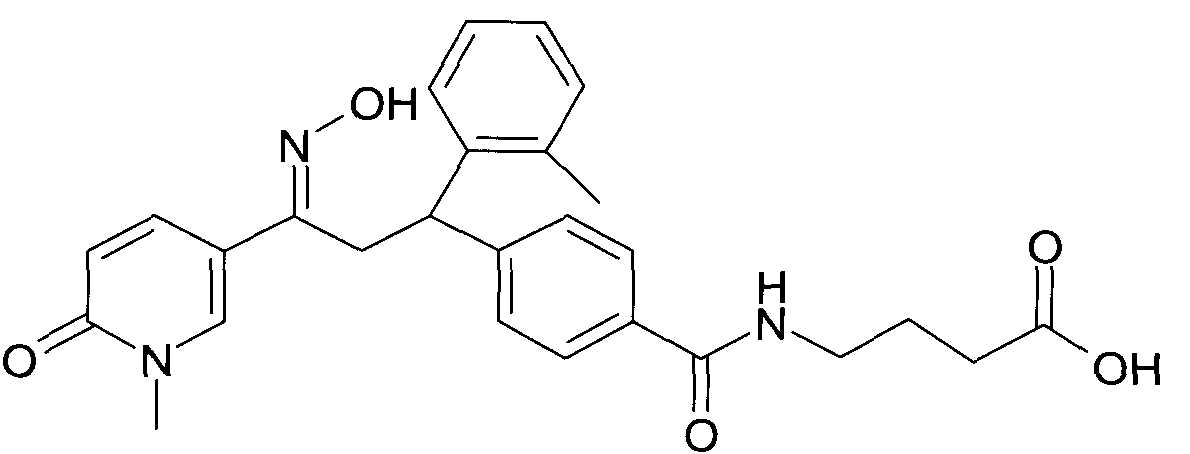
По аналогии с примером 169, стадия 2, 4-{4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоиламино}-масляной кислоты этиловый эфир (пример 212, стадия 3) гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=474.3 [M+H]+.
Пример 214
3-{4-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоиламино}-пропионовая кислота
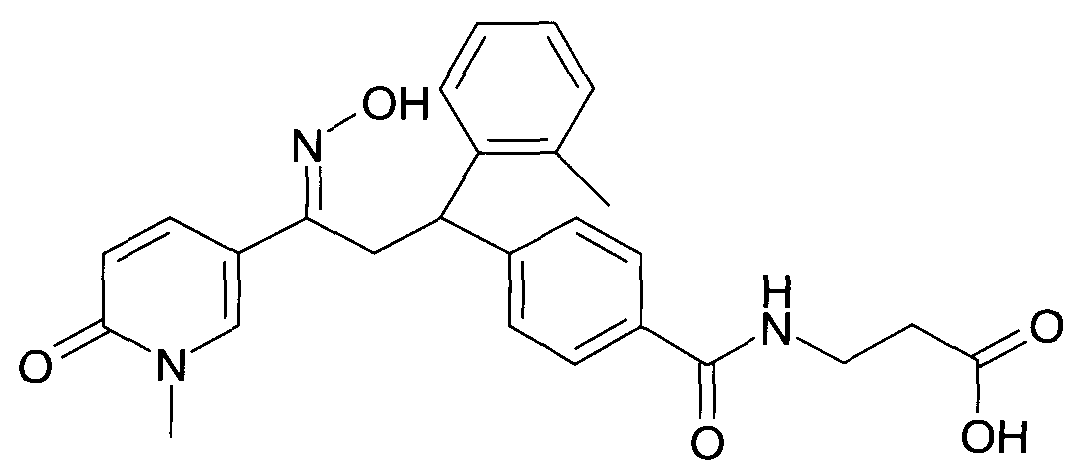
Стадия 1: 3-{4-[3-(1 -метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1 -о-толил-пропил1-бензоиламино}-пропионовой кислоты этиловый эфир
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с гидрохлоридом этилового эфира бета-аланина, используя ВОР реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде светло-коричневого осадка, MS (ESI+): m/z=475.2 [M+H]+.
Стадия 2: 3-{4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоиламино}-пропионовая кислота
По аналогии с примером 169, стадия 2, 3-{4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоиламино}-пропионовой кислоты этиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=445.3 [M-H]-.
Стадия 3: 3-{4-[3-[(E)-гидроксимино1-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоиламино}-пропионовая кислота
По аналогии с примером 151, стадия 3, 3-{4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоиламино}-пропионовая кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI-): m/z=460.3 [M-H]-.
Пример 215
{4-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензоиламино}-уксусная кислота

Стадия 1: {4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоиламино}-уксусной кислоты метиловый эфир
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с гидрохлоридом глицинметилового эфира, используя ВОР реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=447.3 [M+H]+.
Стадия 2: {4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоиламино}-уксусная кислота
По аналогии с примером 169, стадия 2, {4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоиламино}-уксусной кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=431.2 [M-H]-.
Стадия 3: {4-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил1-бензоиламино}-уксусная кислота
По аналогии с примером 151, стадия 3, {4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензоиламино}-уксусная кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI-): m/z=446.3 [M-H]-.
Пример 216
(E/Z)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фтор-N-(2-гидроксиэтил)бензамид
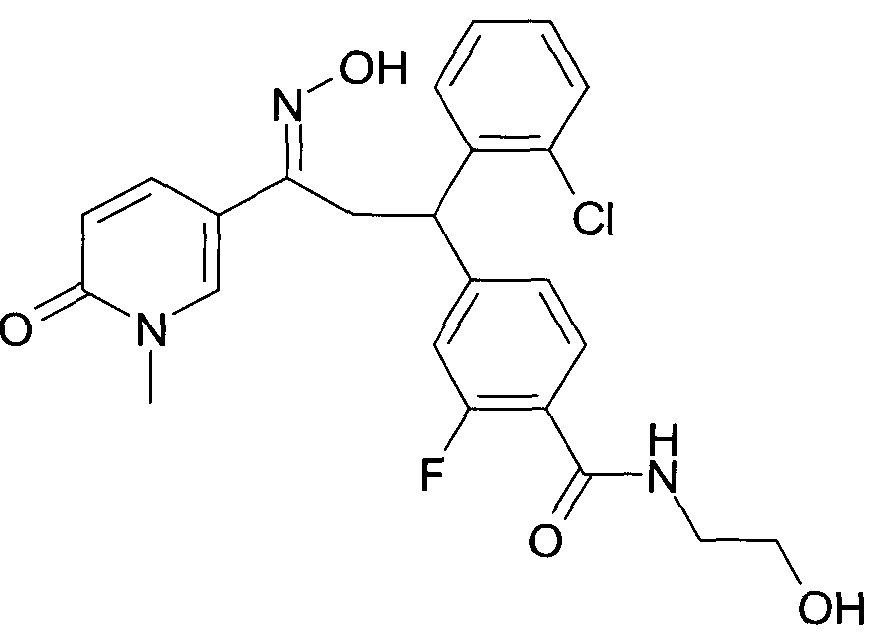
Стадия 1: Метил 4-(1-(2-хлорфенил)-3-(6-метоксипиридин-3-ил)-3-оксопропил)-2-фторбензоат
По аналогии с примером 203, стадия 1, (E)-3-(2-хлор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (пример 197, стадия 1) взаимодействовал с 3-фтор-4-(метоксикарбонил)фенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и NaHCO3 в диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде бесцветного масла, MS (ESI+): m/z=428.2 [M+H]+.
Стадия 2: Метил 4-(1-(2-хлорфенил)-3-оксо-3-(6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фторбензоат
По аналогии с примером 162, стадия 2, метил 4-(1-(2-хлорфенил)-3-(6-метоксипиридин-3-ил)-3-оксопропил)-2-фторбензоата взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=414.2 [M+H]+.
Стадия 3: Метил 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фторбензоат
По аналогии с примером 161, стадия 1, метил 4-(1-(2-хлорфенил)-3-оксо-3-(6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фторбензоат взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде серо-белой пены, MS (ESI+): m/z=428.2 [M+H]+.
Стадия 4: 4-(1-(2-Хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фторбензойная кислота
По аналогии с примером 169, стадия 2, метил 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фторбензоат гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=412.0 [M-H]-.
Стадия 5: 4-(1-(2-Хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фтор-N-(2-гидроксиэтил)бензамид
По аналогии с примером 207, стадия 2, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фторбензойную кислоту связывали с 2-аминоэтанолом, используя BOP реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=457.2 [M+H]+.
Стадия 6: (E/Z)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фтор-N-(2-гидроксиэтил)бензамид
По аналогии с примером 151, стадия 3, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фтор-N-(2-гидроксиэтил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветной пены. Соотношение E/Z изомеров составляло 4:1, MS (ESI+): m/z=472.2 [M+H]+.
Пример 217
транс-4-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-фтор-N-(4-гидрокси-циклогексил)-бензамид
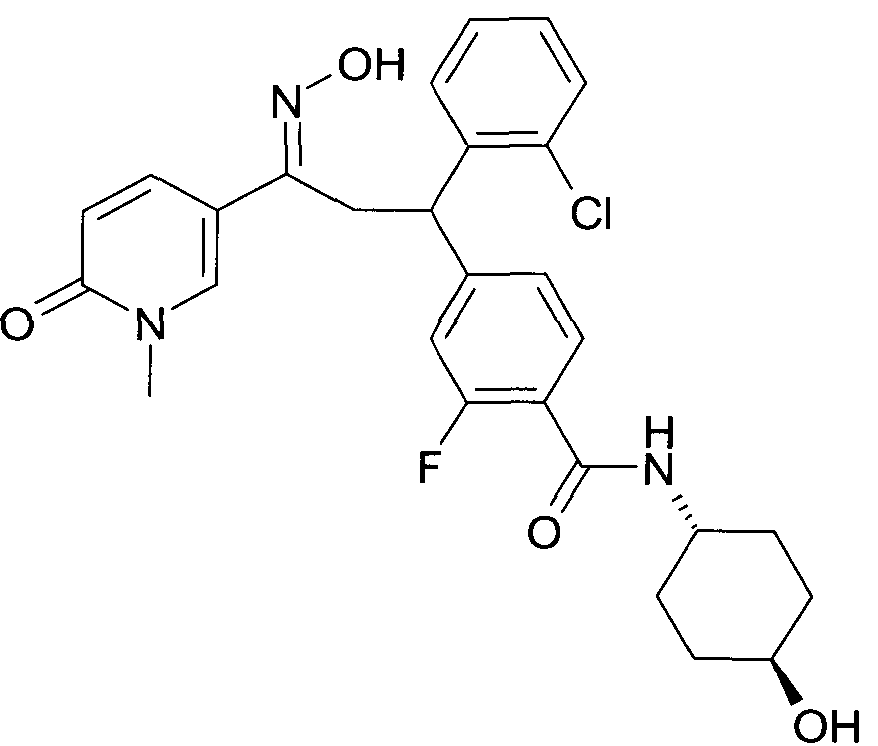
Стадия 1: транс-4-[1-(2-хлор-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-N-(4-гидрокси-циклогексил)-бензамид
По аналогии с примером 207, стадия 2, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фторбензойную кислоту (пример 216, стадия 4) связывали с транс-4-аминоциклогексанолом, используя BOP реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=511.3 [M+H]+.
Стадия 2: транс-4-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1.6-дигидро-пиридин-3-ил)-пропил]-2-фтор-N-(4-гидрокси-ииклогексил)-бензамид
По аналогии с примером 151, стадия 3, транс-4-[1-(2-хлор-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-N-(4-гидрокси-циклогексил)-бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветной пены. Соотношение E/Z изомеров составляло 87:13, MS (ESI+): m/z=526.4 [M+H]+.
Пример 218
(E)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фтор-N-метил-N-(1-метилпиперидин-4-ил)бензамид
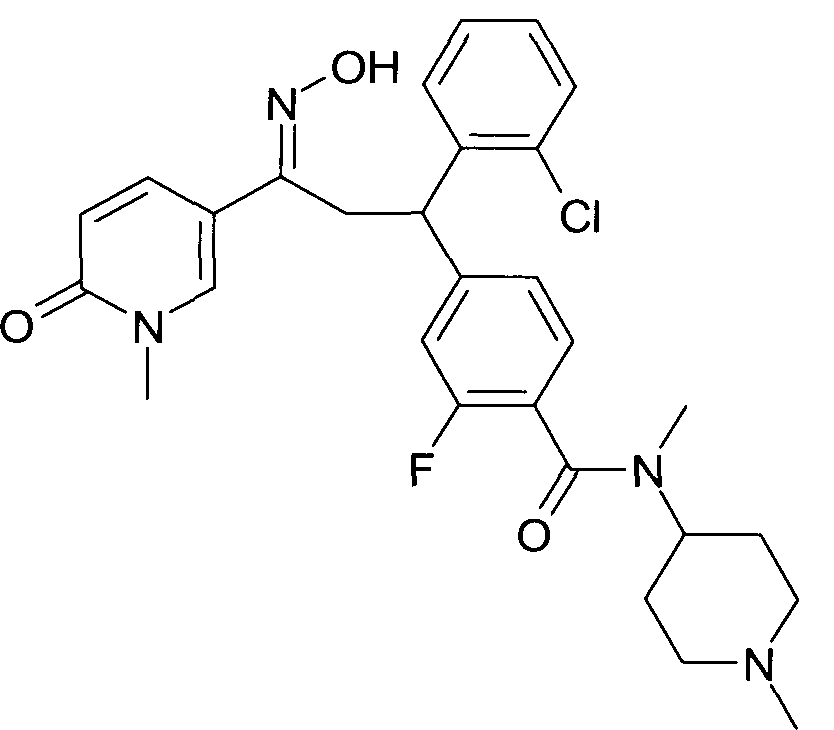
Стадия 1: 4-(1-(2-Хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фтор-N-метил-N-(1-метилпиперидин-4-ил)бензамид
По аналогии с примером 207, стадия 2, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фторбензойную кислоту (пример 216, стадия 4) связывали с 1-метил-4-(метиламино)пиперидином, используя ВОР реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=524.3 [M+H]+.
Стадия 2: (E)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1 -метил-6-оксо-1.6-дигидропиридин-3-ил)пропил)-2-фтор-N-метил-N-(1-метилпиперидин-4-ил)бензамид
По аналогии с примером 151, стадия 3, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фтор-N-метил-N-(1-метилпиперидин-4-ил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего 10% соответствующего Z изомера, в виде бесцветной пены, MS (ESI+): m/z=539.3 [M+H]+.
Пример 219
(E)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фтор-N-(тетрагидро-2H-пиран-4-ил)бензамид
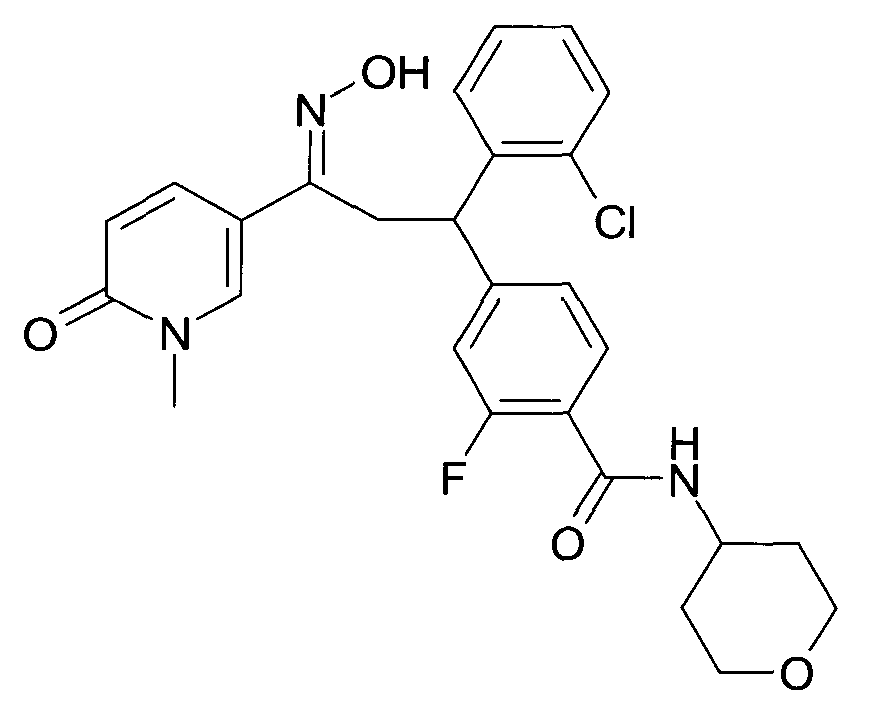
Стадия 1: 4-(1-(2-Хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фтор-N-(тетрагидро-2H-пиран-4-ил)бензамид
По аналогии с примером 207, стадия 2, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фторбензойную кислоту (пример 216, стадия 4) связывали с тетрагидро-2Н-пиран-4-амином, используя ВОР реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=497.2 [M+H]+.
Стадия 2: (E)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фтор-N-(тетрагидро-2H-пиран-4-ил)бензамид
По аналогии с примером 151, стадия 3, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фтор-N-(тетрагидро-2H-пиран-4-ил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего 4% соответствующего Z изомера, в виде бесцветной пены, MS (ESI+): m/z=512.3 [M+H]+.
Пример 220
(E)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фтор-N-(оксетан-3-ил)бензамид
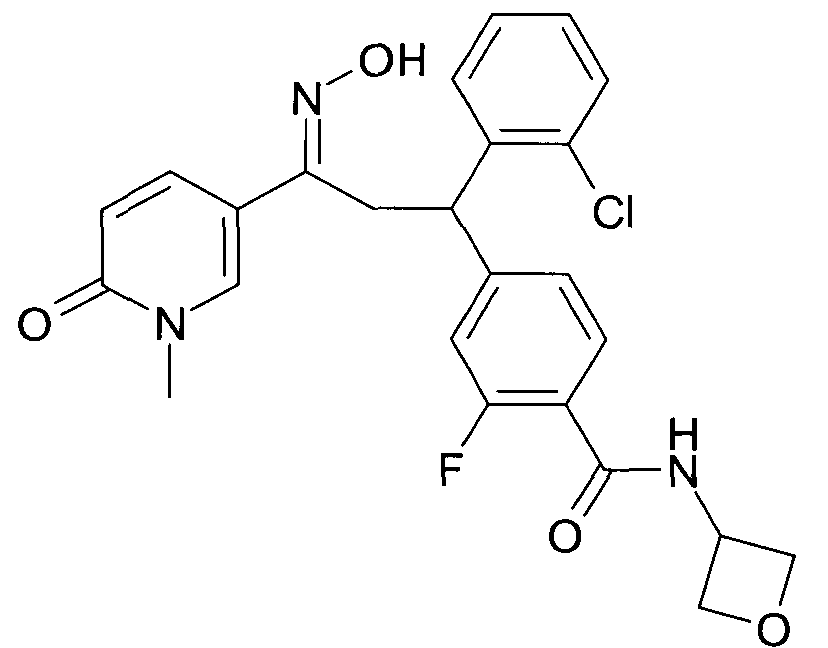
Стадия 1: 4-(1-(2-Хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фтор-N-(оксетан-3-ил)бензамид
По аналогии с примером 207, стадия 2, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фторбензойную кислоту (пример 216, стадия 4) связывали с оксетан-3-амином, используя ВОР реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=469.2 [M+H]+.
Стадия 2: (E)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)пропил)-2-фтор-N-(оксетан-3-ил)бензамид
По аналогии с примером 151, стадия 3, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фтор-N-(оксетан-3-ил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего 7% соответствующего Z изомера, в виде бесцветной пены, MS (ESI+): m/z=484.2 [M+H]+.
Пример 221
{3-фтор-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-фенокси}-уксусная кислота
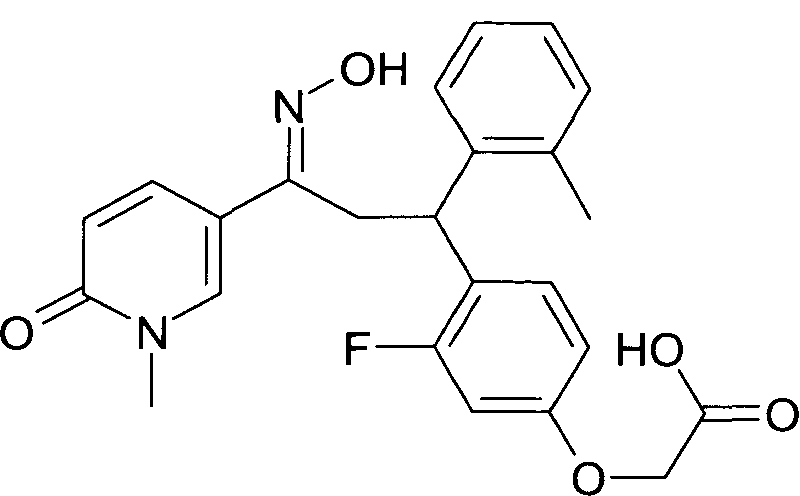
Стадия 1: (E)-3-(2-фтор-4-метокси-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон
По аналогии с примером 170, стадия 1, 5-ацетил-2-метоксипиридин взаимодействовал с 2-фтор-4-метоксибензальдегидом в присутствии гидроксида калия с получением соединения, указанного в заголовке, в виде желтого осадка, MS (ESI+): m/z=288.1 [M+H]+.
Стадия 2: 3-(2-фтор-4-метокси-фенил)-1-(6-метокси-пиридин-3-ил)-3-о-толил-пропан-1 -он
По аналогии с примером 203, стадия 1, (E)-3-(2-фтор-4-метокси-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон взаимодействовал с о-толилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и NaHCO3 в диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=380.3 [M+H]+.
Стадия 3: 5-[3-(2-фтор-4-метокси-фенил)-3-о-толил-пропионил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(2-фтор-4-метокси-фенил)-1-(6-метокси-пиридин-3-ил)-3-о-толил-пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=366.2 [M+H]+.
Стадия 4: 5-[3-(2-фтор-4-метокси-фенил)-3-о-толил-пропионил]-1 -метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(2-фтор-4-метокси-фенил)-3-о-толил-пропионил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=380.3 [M+H]+.
Стадия 5: 5-[3-(2-фтор-4-гидрокси-фенил)-3-о-толил-пропионил]-1 -метил-1H-пиридин-2-он
К перемешанному раствору 5-[3-(2-фтор-4-метокси-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-она (200 мг) в дихлорметане (5 мл) добавили 1M раствор трибромида бора в дихлорметане (4.22 мл) при - 78°C. Смесь перемешивали при - 78°C в течении 30 мин и при 0°C в течении 30 мин. Осторожно добавили водный раствор NaHCO3 и смесь экстрагировали дихлорметаном. Органическую фазу высушили (MgSO4), отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, дихлорметан/метанол 1:0 до 4:1) с получением соединения, указанного в заголовке, (157 мг) в виде светло-коричневой пены, MS (ESI+): m/z=366.2 [M+H]+.
Стадия 6: {3-Фтор-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-фенокси}-уксусной кислоты этиловый эфир
К перемешанному раствору 5-[3-(2-фтор-4-гидрокси-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-она (71 мг) в N,N-диметилацетамиде (1.5 мл) добавили этилбромацетат (36 мг) и карбонат цезия (69 мг). Смесь перемешивали в течение 3.5 ч при комнатной температуре. Добавили воду и смесь экстрагировали диэтиловым эфиром. Органическую фазу высушили (MgSO4), отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, циклогексан/этилацетат 1:0 до 0:1) с получением соединения, указанного в заголовке, (77 мг) в виде светло-коричневого масла, MS (ESI+): m/z=452.2 [M+H]+.
Стадия 7: {3-фтор-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил1-фенокси}-уксусная кислота
По аналогии с примером 169, стадия 2, {3-фтор-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-фенокси}-уксусной кислоты этиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=424.2 [M+H]+.
Стадия 8: {3-фтор-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-фенокси}-уксусная кислота
По аналогии с примером 151, стадия 3, {3-фтор-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-фенокси}-уксусная кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде светло-коричневого осадка, MS (ESI+): m/z=439.2 [M+H]+.
Пример 222
2-фтор-4-{3-фтор-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-фенокси}-бензойная кислота
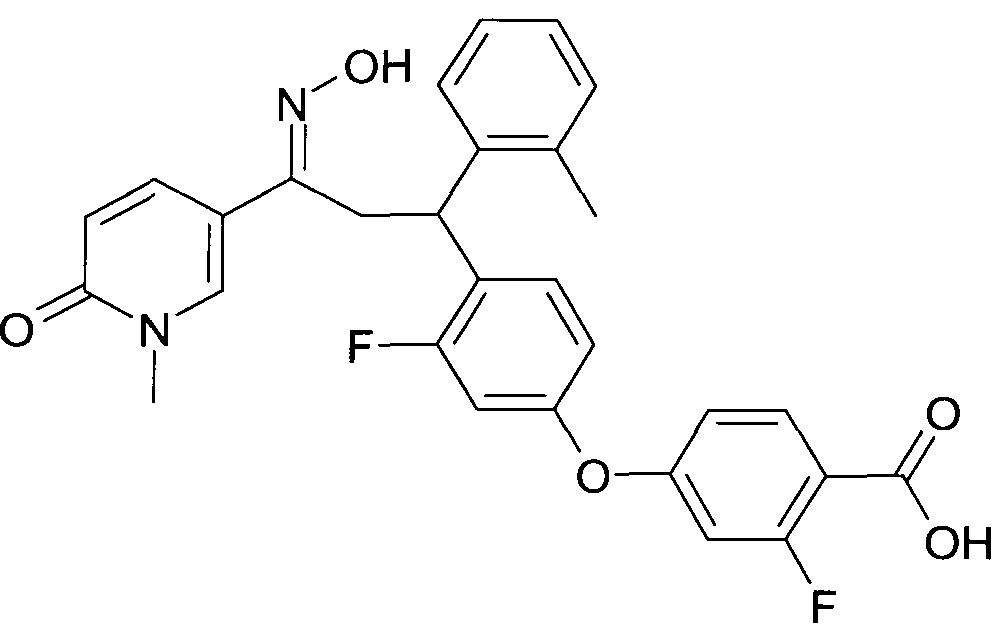
Стадия 1: 2-фтор-4-{3-фтор-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-фенокси}-бензойной кислоты метиловый эфир
К раствору 5-[3-(2-фтор-4-гидрокси-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он (50 мг, пример 221, стадия 5) в дихлорметане (1.2 мл) добавили 3-фтор-4-метоксикарбонилфенилбороновую кислоту (83 мг), ацетат меди(II) (75 мг), пиридин (54 мг) и молекулярные сита. Смесь перемешивали в атмосфере воздуха с исключением влажности в течение ночи. Смесь отфильтровали и фильтрат промыли 1M HCl. Органическую фазу высушили (MgSO4), отфильтровали и сконцентрировали досуха. Продукт очистили хроматографией (SiO2, циклогексан/этилацетат 1:0 до 1:1) с получением соединения, указанного в заголовке, (35 мг) в виде бесцветной пены, MS (ESI+): m/z=518.3 [M+H]+.
Стадия 2: 2-фтор-4-{3-фтор-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-фенокси}-бензойная кислота
По аналогии с примером 169, стадия 2, 2-фтор-4-{3-фтор-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-фенокси}-бензойной кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=504.2 [M+H]+.
Стадия 3: 2-фтор-4-{3-фтор-4-[3-[(E)-гидроксиимино1-3-(1-метил-6-оксо-1.6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-фенокси}-бензойная кислота
По аналогии с примером 151, стадия 3, 2-фтор-4-{3-фтор-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-фенокси}-бензойная кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=519.2 [M+H]+.
Пример 223
5-{(R)-3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он
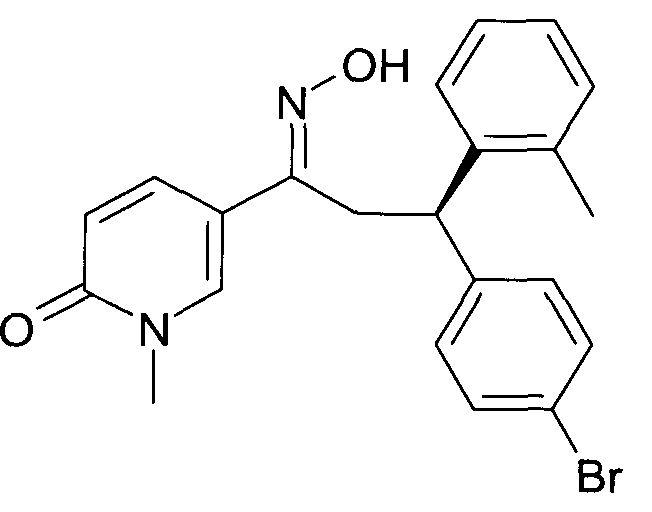
Стадия 1: (R)-3-(4-бромфенил)-1-(6-метоксипиридин-3-ил)-3-о-толилпропан-1-он
По аналогии с примером 151, стадия 1, 5-бром-2-метоксипиридин сначала взаимодействовал с n-бутиллитием и затем с (R)-3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамидом (пример 142, стадия 1) с получением соединения, указанного в заголовке, в виде бесцветного масла, MS (ESI+): m/z=410.1 [M+H]+.
Стадия 2: 5-[(R)-3-(4-бром-фенил)-3-о-толил-пропионил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, (R)-3-(4-бромфенил)-1-(6-метоксипиридин-3-ил)-3-о-толил-пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=396.0 [M+H]+.
Стадия 3: 5-[(R)-3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[(R)-3-(4-бром-фенил)-3-о-толил-пропионил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=410.2 [M+H]+.
Стадия 4: 5-{(R)-3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[(R)-3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=425.1 [M+H]+.
Пример 224
(E)-5-(3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(гидроксиимино)пропил)-1H-метилпиридин-2(1H)-он
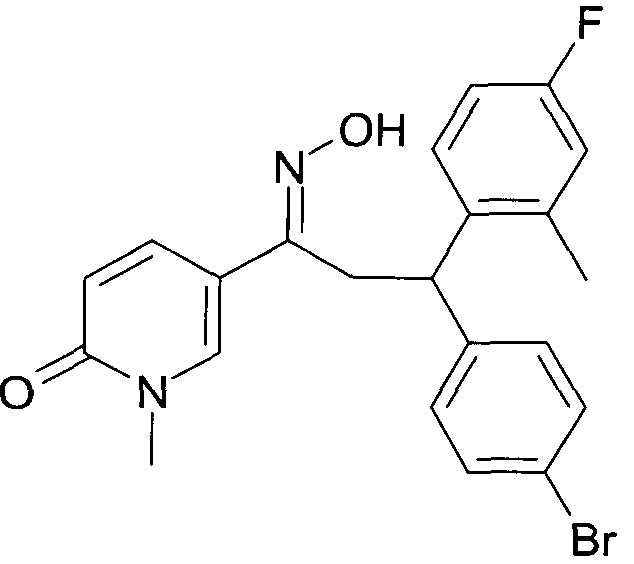
Стадия 1: 3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(6-метоксипиридин-3-ил)пропан-1-он
По аналогии с примером 151, стадия 1, 5-бром-2-метоксипиридин сначала взаимодействовал с n-бутиллитием и затем с 3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-N-метокси-N-метилпропанамидом (пример 141, стадия 3) с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=430.06 [M+H]+.
Стадия 2: 5-(3-(4-бромфенил)-3-(4-фтор-2-метилфенил)пропаноил)пиридин-2(1H)-он
По аналогии с примером 162, стадия 2, 3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(6-метоксипиридин-3-ил)пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=416.05 [M+H]+.
Стадия 3: 5-(3-(4-бромфенил)-3-(4-фтор-2-метилфенил)пропаноил)-1 -метилпиридин-2(1H)-он
По аналогии с примером 161, стадия 1, 5-(3-(4-бромфенил)-3-(4-фтор-2-метилфенил)пропаноил)пиридин-2(1H)-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=428.07 [M+H]+.
Стадия 4: (E)-5-(3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-(3-(4-бромфенил)-3-(4-фтор-2-метилфенил)пропаноил)-1-метилпиридин-2(1H)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего 10% соответствующего Z изомера, в виде бесцветной пены, MS (ESI+): m/z=443.08 [M+H]+.
Пример 225
(E)-4'-(1-(4-фтор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоновая кислота

По аналогии с примером 166, стадия 1, (E)-5-(3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он (пример 224, стадия 4) взаимодействовал с 4-карбоксифенилбороновой кислотой в присутствии дихлор(1,1'-бис(дифенилфосфино)ферроцен) палладия(II) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2 М водного раствора карбоната натрия с получением соединения, указанного в заголовке, содержащего 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=485.19 [M+H]+.
Пример 226
5-{3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
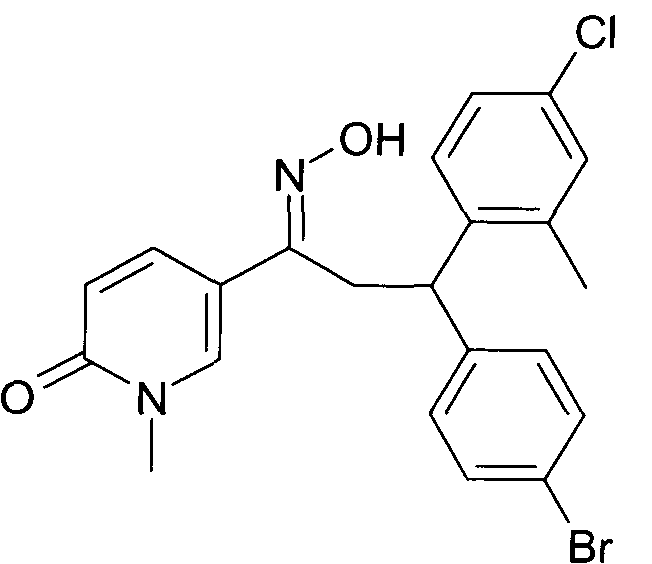
Стадия 1: 3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(6-метоксипиридин-3-ил)пропан-1-он
По аналогии с примером 151, стадия 1, 5-бром-2-метоксипиридин сначала взаимодействовал с n-бутиллитием и затем с 3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-N-метокси-N-метилпропанамидом (пример 138, стадия 3) с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=446.03 [M+H]+.
Стадия 2: 5-(3-(4-бромфенил)-3-(4-хлор-2-метилфенил)пропаноил)пиридин-2(1H)-он
По аналогии с примером 162, стадия 2, 3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(6-метоксипиридин-3-ил)пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+)=432,019 [M+H]+.
Стадия 3: 5-(3-(4-бромфенил)-3-(4-хлор-2-метилфенил)пропаноил)-1 -метилпиридин-2(1H)-он
По аналогии с примером 161, стадия 1, 5-(3-(4-бромфенил)-3-(4-хлор-2-метилфенил)пропаноил)пиридин-2(1H)-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=446.03 [M+H]+.
Стадия 4: 5-{3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-[(E)-гидроксиимино1-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-(3-(4-бромфенил)-3-(4-хлор-2-метилфенил)пропаноил)-1-метилпиридин-2(1H)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего 10% соответствующего Z изомера, в виде бесцветной пены, MS (ESI+): m/z=461.05 [M+H]+.
Пример 227
(E)-4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоновая кислота
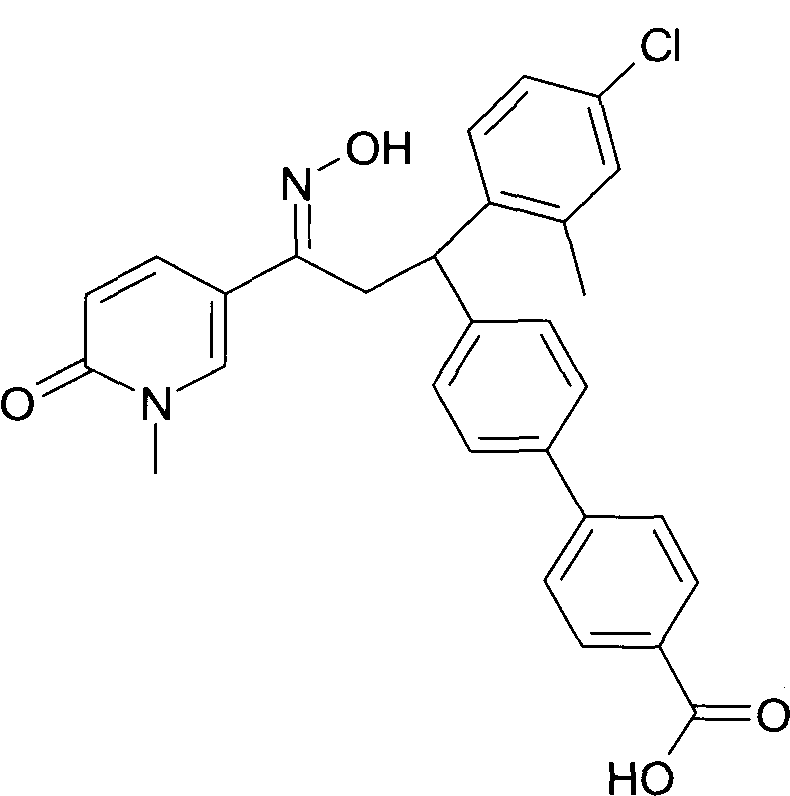
По аналогии с примером 166, стадия 1, 5-{3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он (пример 226, стадия 4) взаимодействовал с 4-карбоксифенилбороновой кислотой в присутствии дихлор(1,1'-бис(дифенилфосфино) ферроцен)палладия(II) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2M водного раствора карбоната натрия с получением соединения, указанного в заголовке, содержащего 10% соответствующего Z изомера, в виде светло-коричневого осадка, MS (ESI+): m/z=501.16 [M+H]+.
Пример 228
(E)-метил, 2-(4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-илкарбоксамидо)ацетат
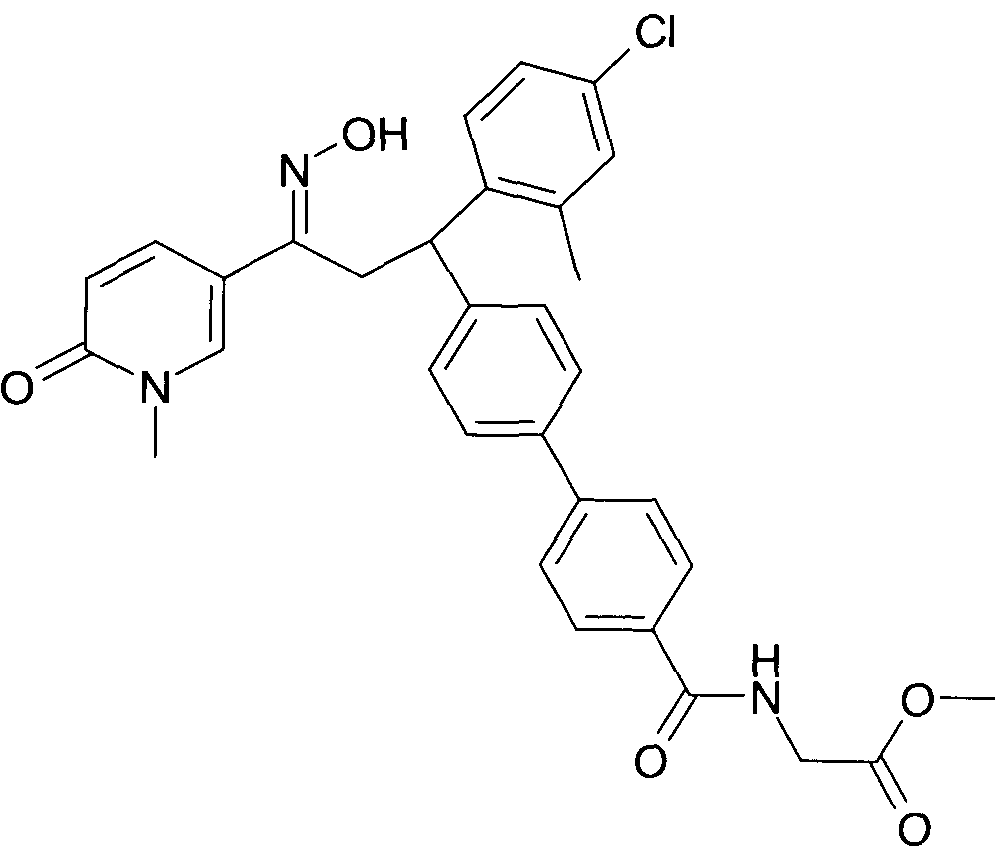
К раствору (E)-4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоновой кислоты (0.15 г, пример 227) в диметилформамиде (2 мл) добавили HATU (125 мг), диизопропилэтиламин (155 мг) и гидрохлорид глицинметилового эфира (41.4 мг) и реакционную смесь перемешивали в течение 3.5 ч при комнатной температуре. Реакционную смесь влили в воду и этилацетат и слои разделили. Водный слой экстрагировали 2 раза этилацетатом. Органические слои промыли 2x водой и один раз солевым раствором, высушили над MgSO4, отфильтровали, обработали силикагелем и выпарили. Соединение очистили посредством двух хроматографий на силикагеле на 20 г и на 10 г колонках, используя систему ЖХСД с элюцией градиентом дихлорметан: метанол (100: 0 до 90: 10) с получением соединения, указанного в заголовке, (0.122 г) в виде светло-коричневой пены, MS (ESI+): m/z=572.19 [M+H]+.
Пример 229
(E)-2-(4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-илкарбоксамидо)уксусная кислота
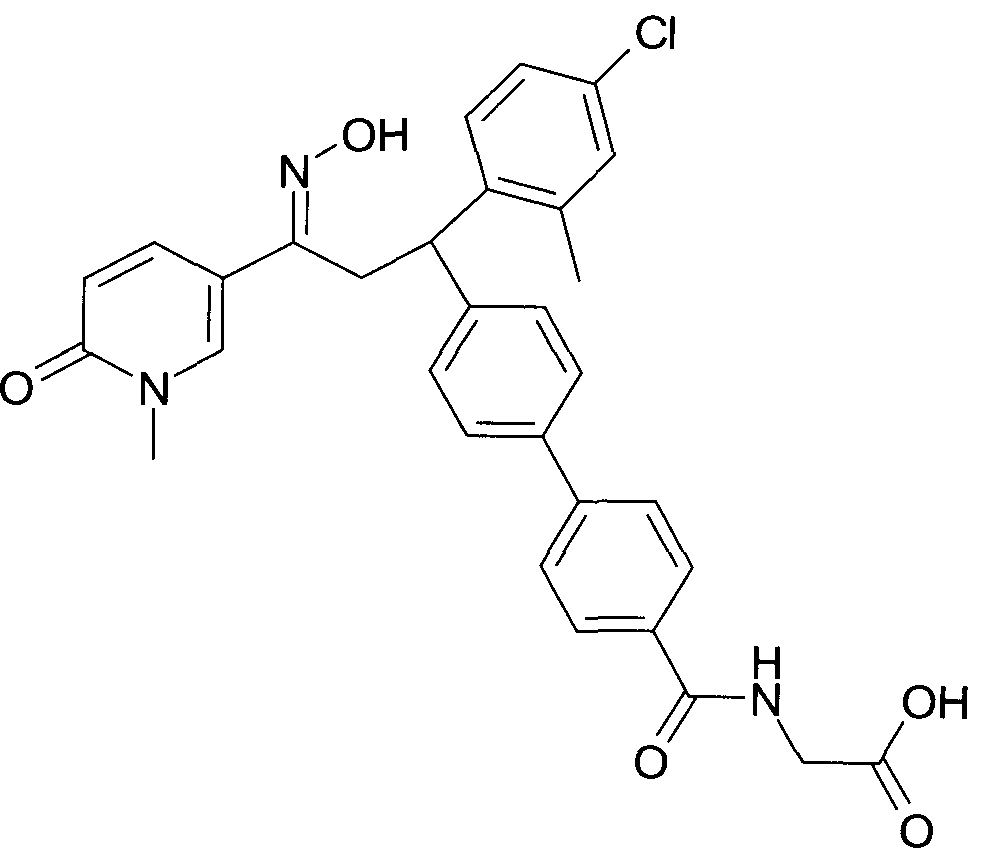
К раствору (E)-метил, 2-(4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-илкарбоксамидо)ацетата (0.1 г, пример 228) в диоксане (1 мл) и воде (1 мл) добавили моногидрат гидроксида лития (9.17 мг) и прозрачный раствор перемешивали при комнатной температуре в течение 3.5 ч. Затем раствор выпарили и разбавили 2 мл воды. Прозрачный раствор обработали несколькими каплями HCl 1M. Преципитат отфильтровали, промыли водой и высушили с получением соединения, указанного в заголовке, (62 мг) в виде серо-белого осадка, MS (ESI+): m/z=556.16 [M+H]+.
Пример 230
(E)-N-((1H-тетразол-5-ил)метил)-4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоксамид
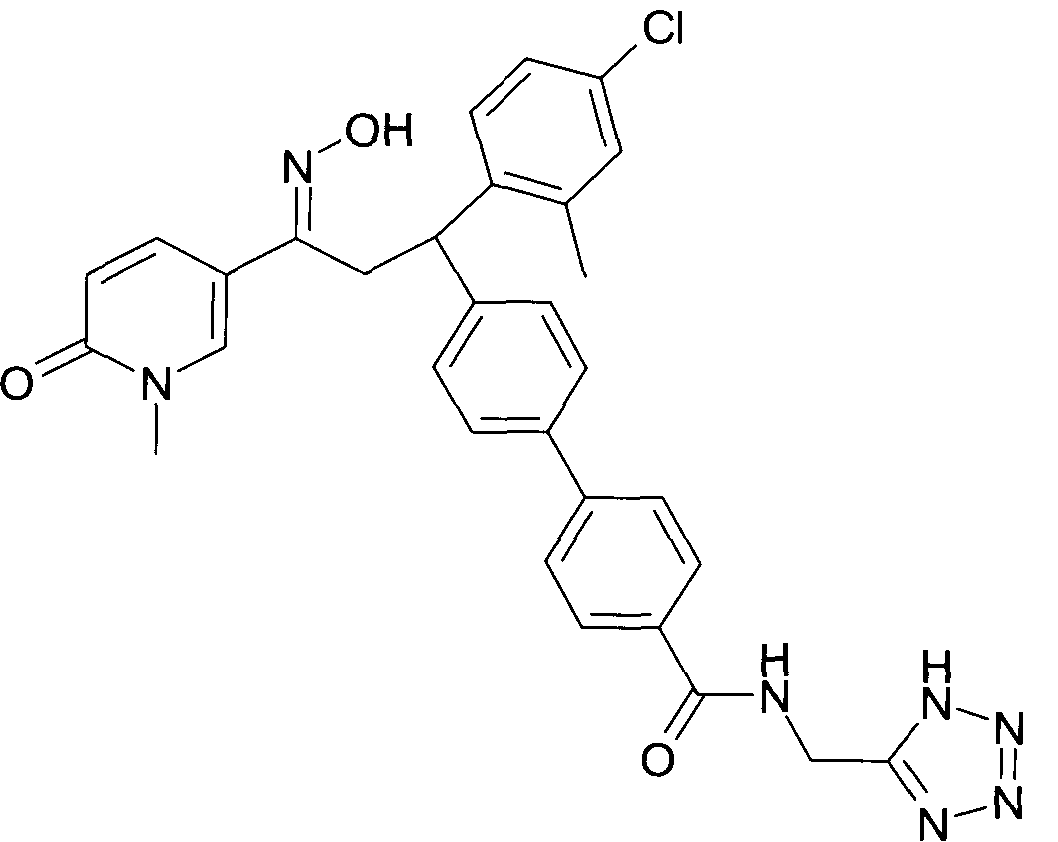
По аналогии с примером 228, (E)-4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоновая кислота (пример 227) взаимодействовала с 5-аминометилтетразолом в присутствии HATU с получением соединения, указанного в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=582.2 [M+H]+.
Пример 231
транс-4-{4-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-фтор-бензоиламино}-циклогексанкарбоновая кислота
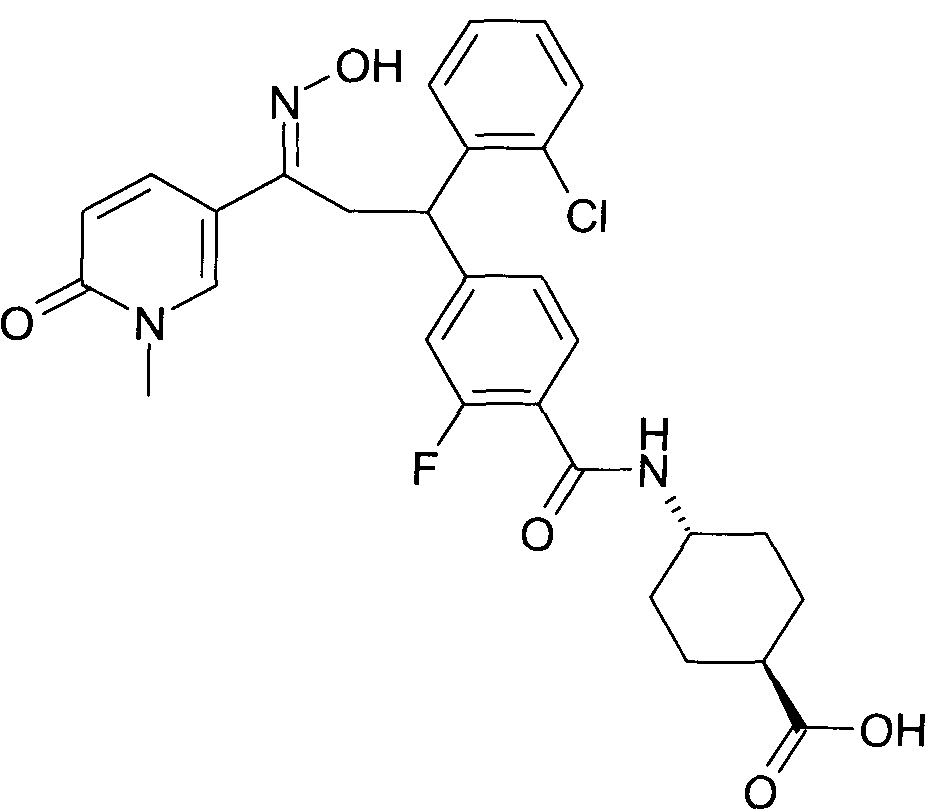
Стадия 1: транс-4-{4-[1-(2-хлор-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил1-2-фтор-бензоиламино}-циклогексанкарбоновой кислоты метиловый эфир
По аналогии с примером 207, стадия 2, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фторбензойную кислоту (пример 216, стадия 4) связывали с транс-4-амино-циклогексикарбоновой кислоты метилового эфира гидрохлоридом, используя BOP реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=553.3 [M+H]+.
Стадия 2: транс-4-{4-[1-(2-хлор-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-бензоиламино}-циклогексанкарбоновая кислота
По аналогии с примером 169, стадия 2, транс-4-{4-[1-(2-хлор-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-бензоиламино}-циклогексанкарбоновой кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=537.3 [M-H]-.
Стадия 3: тюанс-4-{4-[1-(2-хлор-фенил)-3-[(E)-гидроксиимино1-3-(1-метил-6-оксо-1.6-дигидро-пиридин-3-ил)-пропил]-2-фтор-бензоиламино}-циклогексанкарбоновая кислота
По аналогии с примером 151, стадия 3, транс-4-{4-[1-(2-хлор-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-бензоиламино}-циклогексанкарбоновая кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего 13% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=552.3 [M+H]+.
Пример 232
(E)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фтор-N-(2-метоксиэтил)бензамид
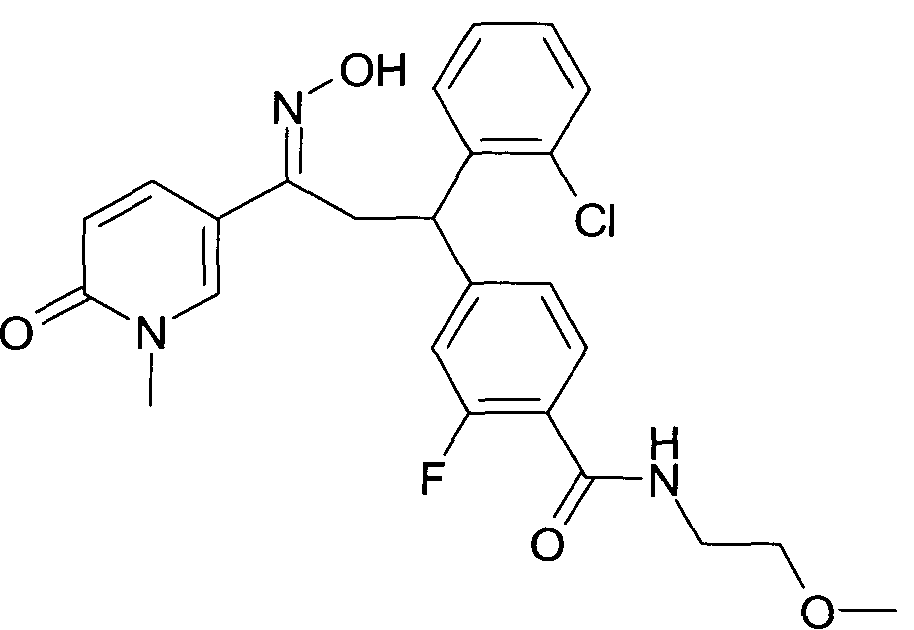
Стадия 1: 4-(1-(2-Хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фтор-N-(2-метоксиэтил)бензамид
По аналогии с примером 207, стадия 2, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фторбензойную кислоту (пример 216, стадия 4) связывали с 2-метоксиэтиламином, используя ВОР реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=471.1 [M+H]+.
Стадия 2: (E)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)пропил)-2-фтор-N-(2-метоксиэтил)бензамид
По аналогии с примером 151, стадия 3, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фтор-N-(2-метоксиэтил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=486.2 [M+H]+.
Пример 233
(E)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-циклопропил-2-фторбензамид
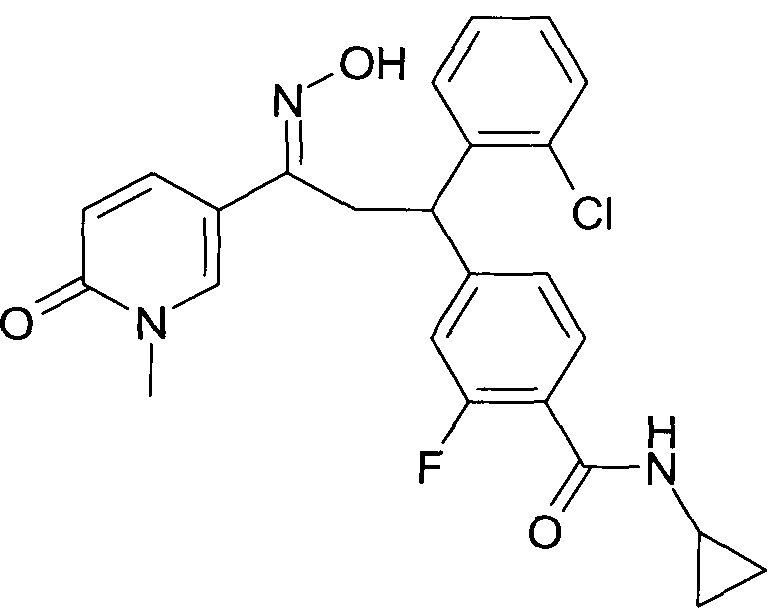
Стадия 1: 4-(1-(2-Хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-N-циклопропил-2-фторбензамид
По аналогии с примером 207, стадия 2, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фторбензойную кислоту (пример 216, стадия 4) связывали с циклопропиламином, используя BOP реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=453.1 [M+H]+.
Стадия 2: (E)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)пропил)-N-ииклопропил-2-фторбензамид
По аналогии с примером 151, стадия 3, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-N-циклопропил-2-фторбензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего 4% соответствующего Z изомера, в виде бесцветного воскообразного вещества, MS (ESI+): m/z=468.2 [M+H]+.
Пример 234
(E)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-2-фтор-N-(2,2,2-трифторэтил)бензамид
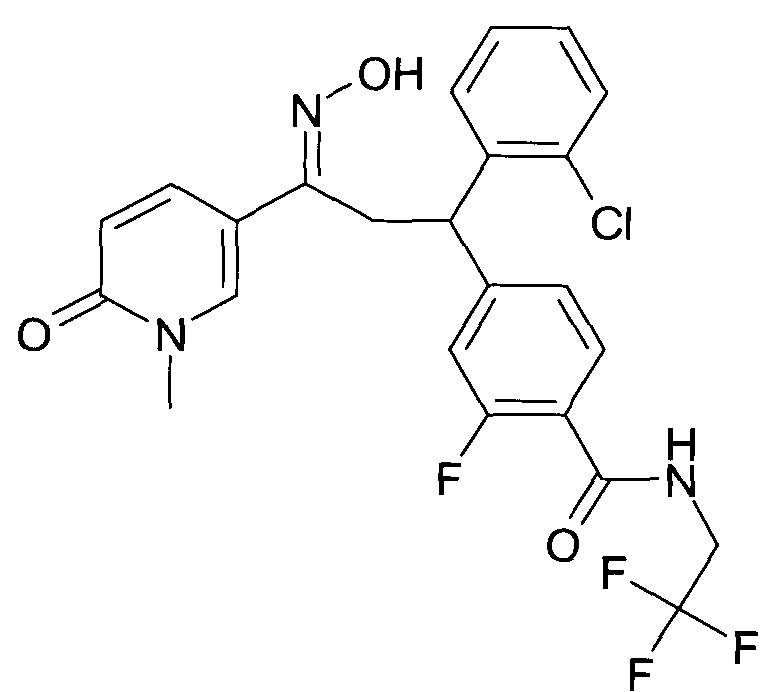
Стадия 1: 4-(1-(2-Хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фтор-N-(2,2,2-трифторэтил)бензамид
По аналогии с примером 207, стадия 2, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фторбензойную кислоту (пример 216, стадия 4) связывали с 2,2,2-трифтор-этиламином, используя BOP реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=495.1 [M+H]+.
Стадия 2: (E)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)пропил)-2-фтор-N-(2,2,2-трифторэтил)бензамид
По аналогии с примером 151, стадия 3, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фтор-N-(2,2,2-трифторэтил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего 8% соответствующего Z изомера, в виде бесцветного воскообразного вещества, MS (ESI+): m/z=510.2 [M+H]+.
Пример 235
3-{3-фтор-4-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-сренокси}-бензойная кислота
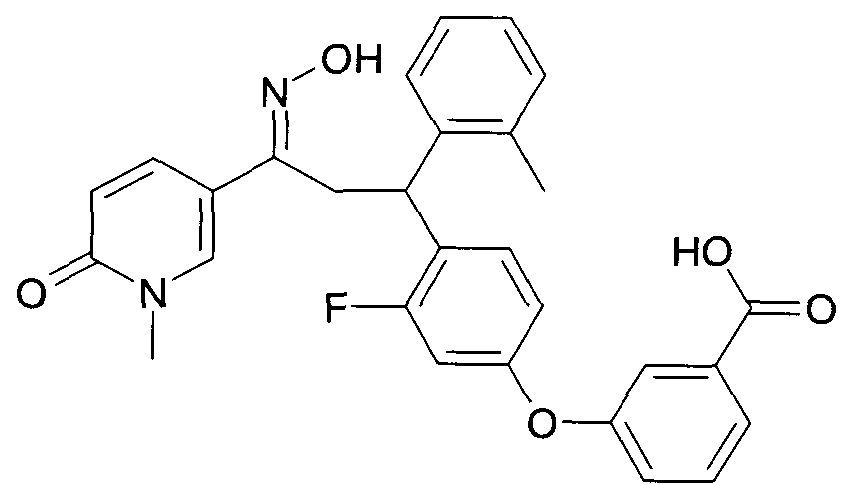
Стадия 1: 3-{3-фтор-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-фенокси}-бензойной кислоты метиловый эфир
По аналогии с примером 222, стадия 1, 5-[3-(2-фтор-4-гидрокси-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он (пример 221, стадия 5) взаимодействовал с 3-метоксикарбонилфенилбороновой кислотой в дихлорметане в присутствии ацетата меди (II), пиридина и на воздухе с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=500.3 [M+H]+.
Стадия 2: 3-{3-фтор-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-фенокси}-бензойная кислота
По аналогии с примером 169, стадия 2, 3-{3-фтор-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-фенокси}-бензойной кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=486.3 [M+H]+.
Стадия 3: 3-{3-фтор-4-[3-[(E)-гидроксиимино1-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил1-фенокси}-бензойная кислота
По аналогии с примером 151, стадия 3, 3-{3-фтор-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-фенокси}-бензойная кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии (NaHCO3 с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=501.2.2 [M+H]+.
Пример 236
3'-фтор-4'-[3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бифенил-2-карбоновая кислота
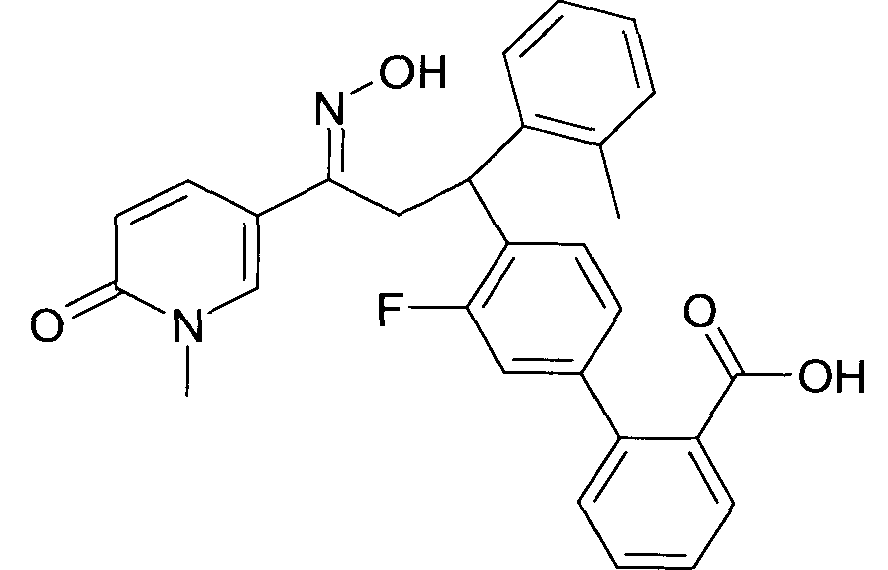
По аналогии с примером 166, стадия 1, 5-{3-(4-бром-2-фтор-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он (пример 193, стадия 4) взаимодействовал с 2-карбоксифенилбороновой кислоты в присутствии дихлор(1,1'-бис(дифенилфосфино)-ферроцен)палладия(II) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2 М водного раствора карбоната натрия с получением соединения, указанного в заголовке, содержащего 10% соответствующего Z изомера, в виде светло-коричневого осадка, MS (ESI-): m/z=483.1 [M-H]-.
Пример 237
5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
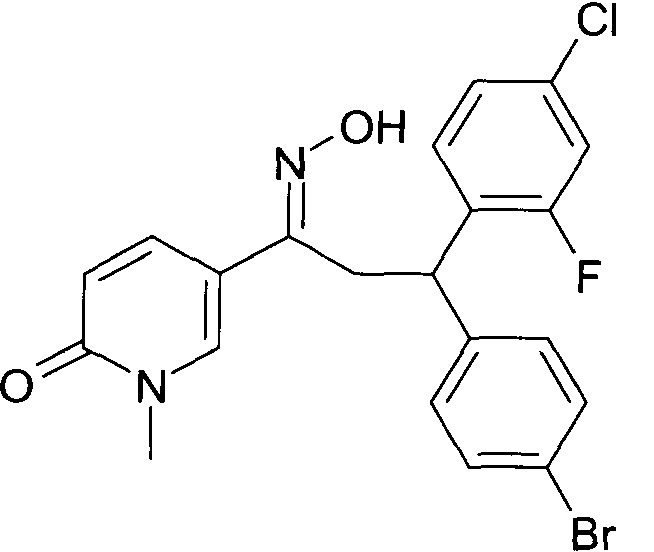
Стадия 1: (E)-3-(4-хлор-2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон
По аналогии с примером 170, стадия 1, 5-ацетил-2-метоксипиридин взаимодействовал с 4-хлор-2-фторбензальдегидом в присутствии гидроксида калия с получением соединения, указанного в заголовке, в виде бесцветного осадка. MS (ESI+): m/z=292.1 [M+H]+.
Стадия 2: 3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропан-1-он
По аналогии с примером 193, стадия 1, 4-бромбензолбороновая кислота сначала взаимодействовала с диэтилцинком. Продукт этой реакции обработали (E)-3-(4-хлор-2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропеноном с получением соединения, указанного в заголовке, в виде бесцветного масла, MS (ESI+): m/z=449.9 [M+H]+.
Стадия 3: 5-[3-(4-бром-Фенил)-3-(4-хлор-2-фтор-фенил)-пропионил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде серо-белого порошка, MS (ESI+): m/z=435.8 [M+H]+.
Стадия 4: 5-[3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-пропионил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-пропионил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=450.0 [M+H]+.
Стадия 5: 5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего 12% соответствующего Z изомера, в виде серо-белой пены, MS (ESI+): m/z=463.0 [M+H]+.
Пример 238
4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота
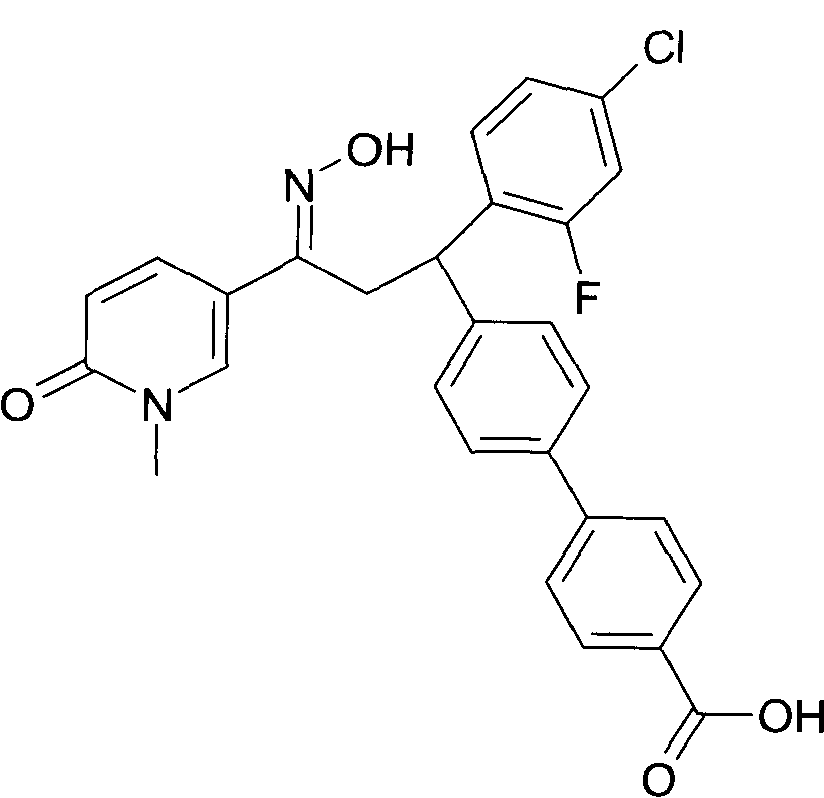
По аналогии с примером 166, стадия 1, 5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(Е)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он (пример 237, стадия 5) взаимодействовал с 4-карбоксифенилбороновой кислотой в присутствии дихлор(1,1'-бис(дифенилфосфино)-ферроцен)палладия(11) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2M водного раствора карбоната натрия с получением соединения, указанного в заголовке, содержащего 12% соответствующего Z изомера, в виде серо-белого осадка, MS (ESI-): m/z=502.8 [M-H]-.
Пример 239 и 240
(+)-5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он и (-)-5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
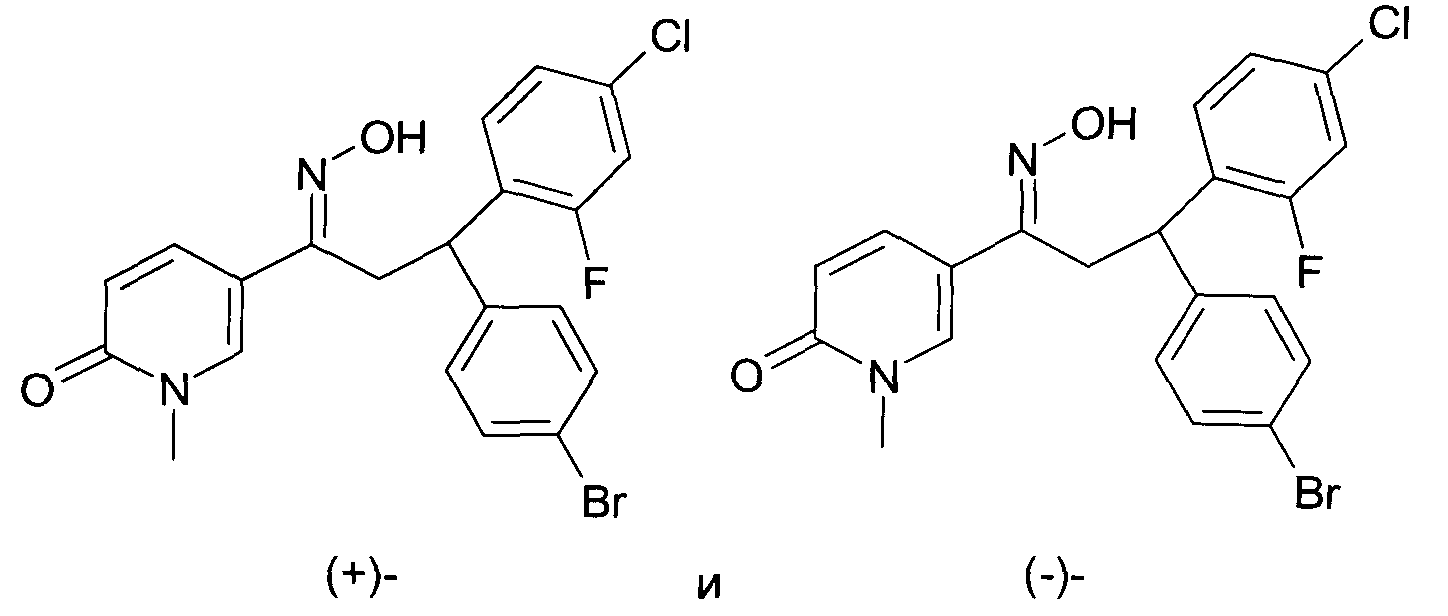
Разделение 5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(Е)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-она (пример 237) с помощью хиральной ВЭЖХ на Chiralpak-AD колонке с использованием смеси растворителей n-гептан/этанол (7/3 об/об) дала (+)-5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он, MS (ESI+): m/z=463.02 [M+H]+ в виде белого осадка и (-)-5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он, MS (ESI+): m/z=463.02 [M+H]+ в виде белого осадка.
Пример 241
(+)-4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота
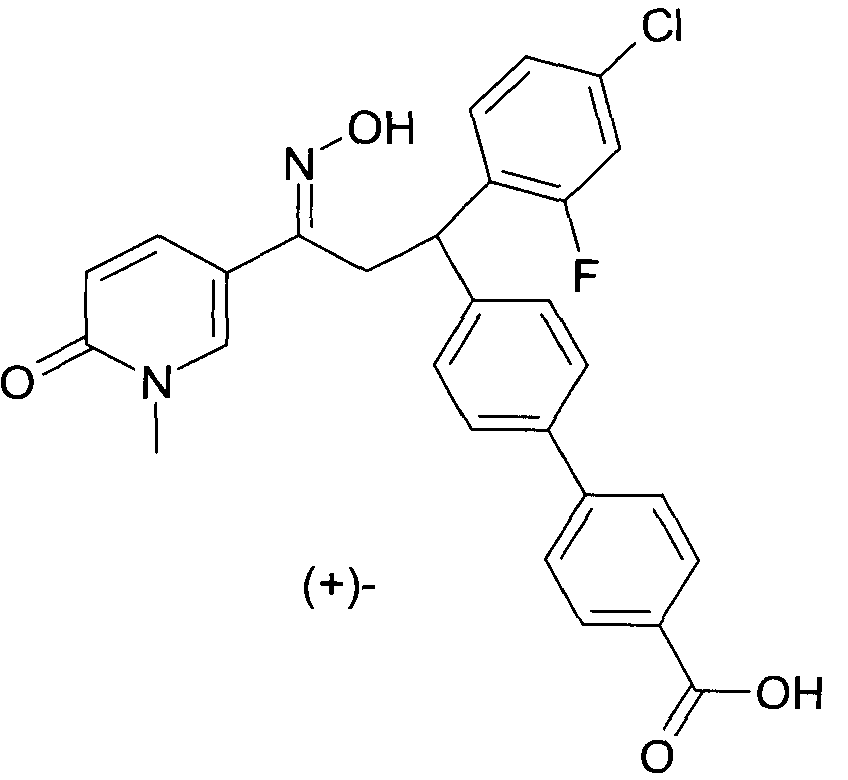
По аналогии с примером 166, стадия 1, (+)-5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он (пример 239) взаимодействовал с 4-карбоксифенилбороновой кислотой в присутствии дихлор(1,1'-бис(дифенилфосфино)-ферроцен)палладия(II) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2M водного раствора карбоната натрия с получением соединения, указанного в заголовке, в виде осадка серо-белого цвета, MS (ESI+): m/z=505.3 [M+H]+.
Пример 242
(-)-4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота
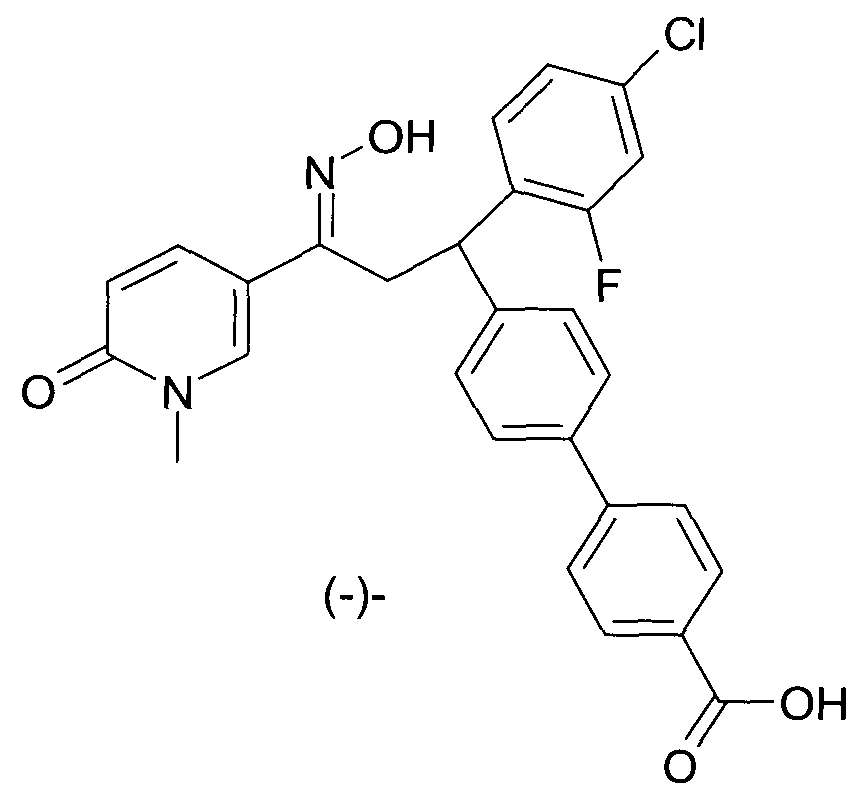
По аналогии с примером 166, стадия 1, (-)-5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он (пример 240) взаимодействовал с 4-карбоксифенилбороновой кислотой в присутствии дихлор(1,1'-бис(дифенилфосфино)-ферроцен)палладия(II) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2M водного раствора карбоната натрия с получением соединения, указанного в заголовке, в виде осадка серо-белого цвета, MS (ESI+): m/z=505.1 [M+H]+.
Пример 243
(E)-5-(3-(4-бромфенил)-3-(2-фторфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он
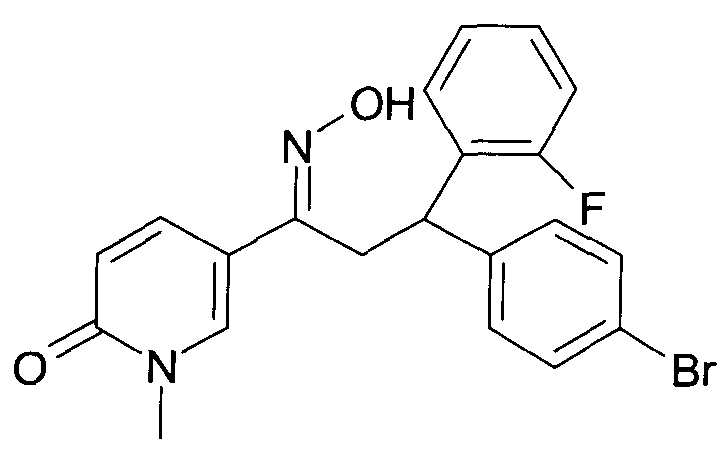
Стадия 1: (E)-3-(2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон
По аналогии с примером 170, стадия 1, 5-ацетил-2-метоксипиридин взаимодействовал с 2-фторбензальдегидом в присутствии гидроксида калия с получением соединения, указанного в заголовке, в виде серо-белого осадка. MS (ESI+): m/z=258.2 [M+H]+.
Стадия 2: 3-(4-бром-фенил)-3-(2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропан-1-он
По аналогии с примером 203, стадия 1, (E)-3-(2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон взаимодействовал с 4-бромфенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(1)димера и NaHCO3 в диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=414.1 [M+H]+.
Стадия 3: 5-(3-(4-бромфенил)-3-(2-фторфенил)пропаноил)пиридин-2(1H)-он
По аналогии с примером 162, стадия 2, 3-(4-бром-фенил)-3-(2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=400.0 [M+H]+.
Стадия 4: 5-[3-(4-бром-фенил)-3-(2-фтор-фенил)-пропионил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-(3-(4-бромфенил)-3-(2-фторфенил)пропаноил)-пиридин-2(1H)-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=414.0 [M+H]+.
Стадия 5: (E)-5-(3-(4-бромфенил)-3-(2-фторфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-[3-(4-бром-фенил)-3-(2-фтор-фенил)-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=429.0 [M+H]+.
Пример 244
(E)-4'-(1-(2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоновая кислота
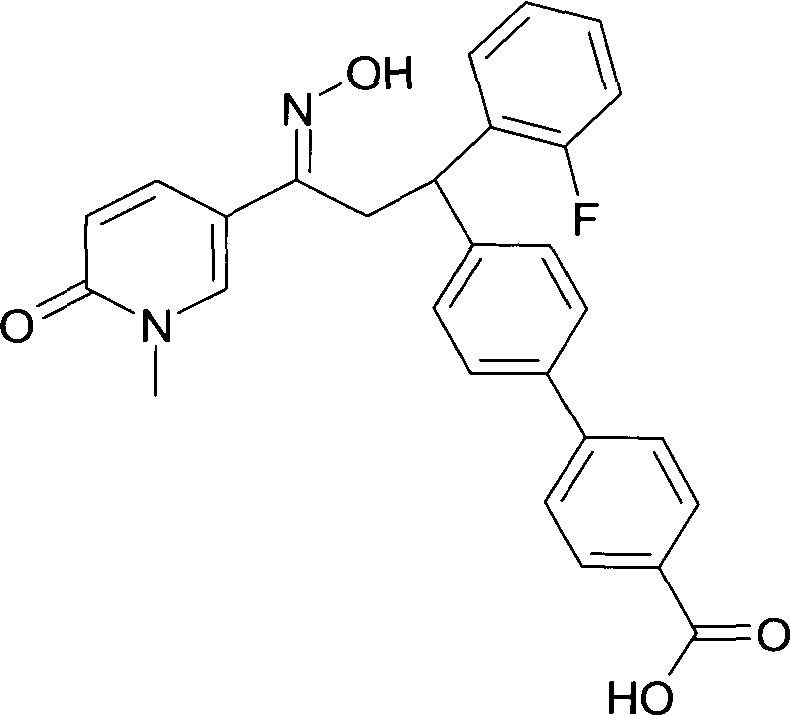
По аналогии с примером 166, стадия 1, (E)-5-(3-(4-бромфенил)-3-(2-фторфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он (пример 243, стадия 5) взаимодействовал с 4-карбоксифенилбороновой кислотой в присутствии дихлор(1,1'-бис(дифенилфосфино)-ферроцен)палладия(II) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2M водного раствора карбоната натрия с получением соединения, указанного в заголовке, в виде светло-коричневого осадка, MS (ESI-): m/z=469.1 [M-H]-.
Пример 245
(E)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-этил-2-фторбензамид
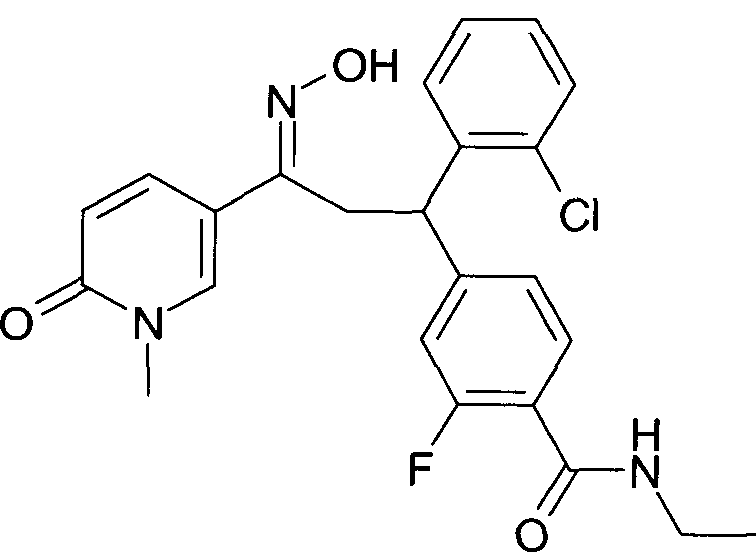
Стадия 1: 4-(1-(2-Хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-N-этил-2-фторбензамид
По аналогии с примером 207, стадия 2, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-2-фторбензойную кислоту (пример 216, стадия 4) связывали с гидрохлоридом этиламина, используя BOP реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=441.3 [M+H]+.
Стадия 2: (E)-4-(1-(2-Хлорфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)пропил)-N-этил-2-фторбензамид
По аналогии с примером 151, стадия 3, 4-(1-(2-хлорфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-N-этил-2-фторбензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего 4% соответствующего Z изомера, в виде бесцветного воскообразного вещества, MS (ESI+): m/z=456.2 [M+H]+.
Пример 246
(E)-N-(2-Ацетамидоэтил)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид
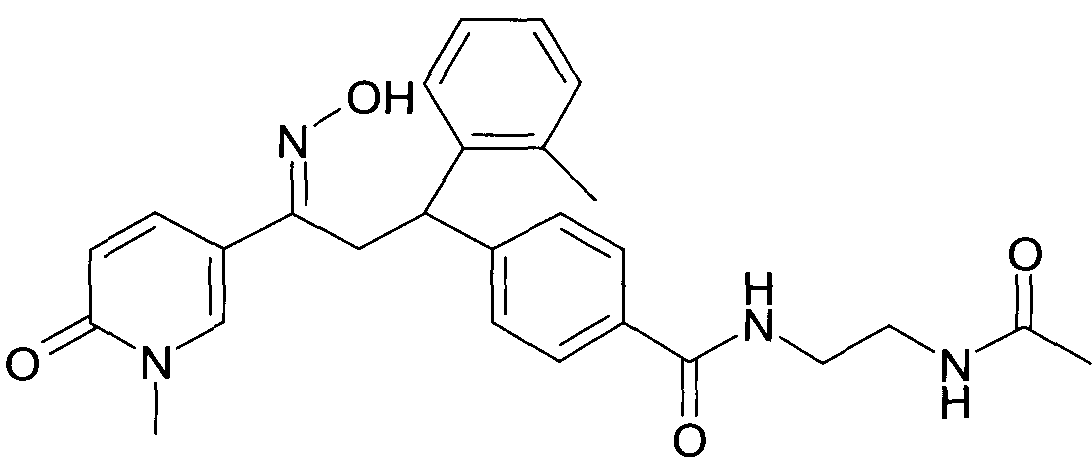
Стадия 1: N-(2-Ацетиламино-этил)-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензамид
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с N-ацетилэтилендиамином, используя ВОР реагент в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=460.4 [M+H]+.
Стадия 2: (E)-N-(2-Ацетамидоэтил)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид
По аналогии с примером 151, стадия 3, N-(2-ацетиламино-этил)-4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=475.2 [M+H]+.
Пример 247
4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-((S)-2-гидроксипропил)бензамид
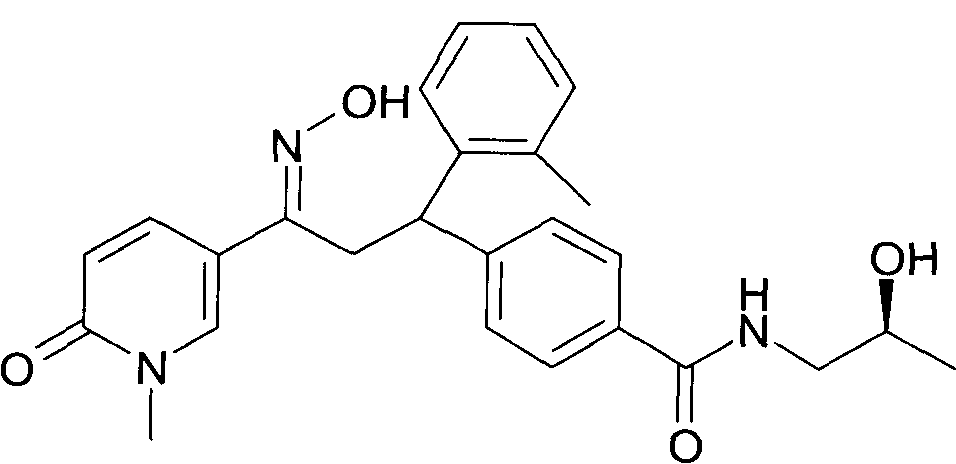
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с (R)-(-)-1-амино-2-пропанолом, используя BOP реагент в тетрагидрофуране. Продукт этой реакции взаимодействовал по аналогии с примером 151, стадия 3, с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего 5% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=448.2 [M+H]+.
Пример 248
4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-((R)-2-гидроксипропил)бензамид
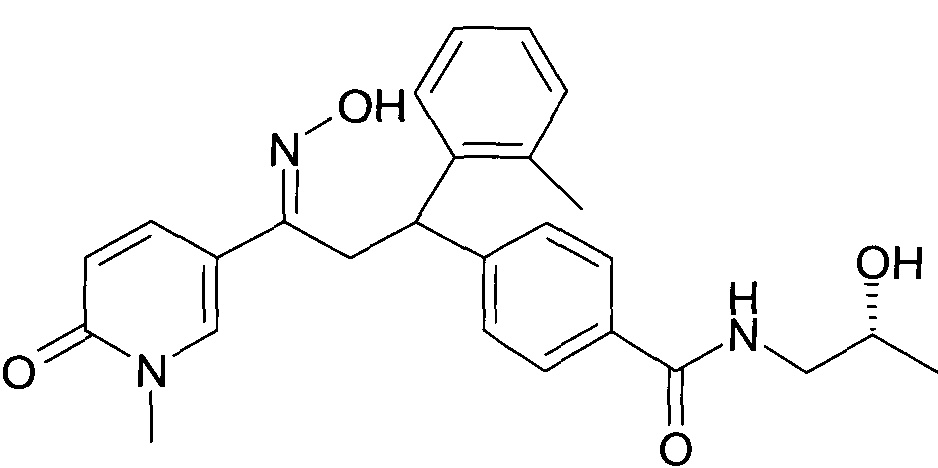
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с (S)-(+)-1-амино-2-пропанолом, используя ВОР реагент в тетрагидрофуране. Продукт этой реакции взаимодействовал по аналогии с примером 151, стадия 3, с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего 5% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=448.2 [M+H]+.
Пример 249
(E)-5-(3-(2-Хлорфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он
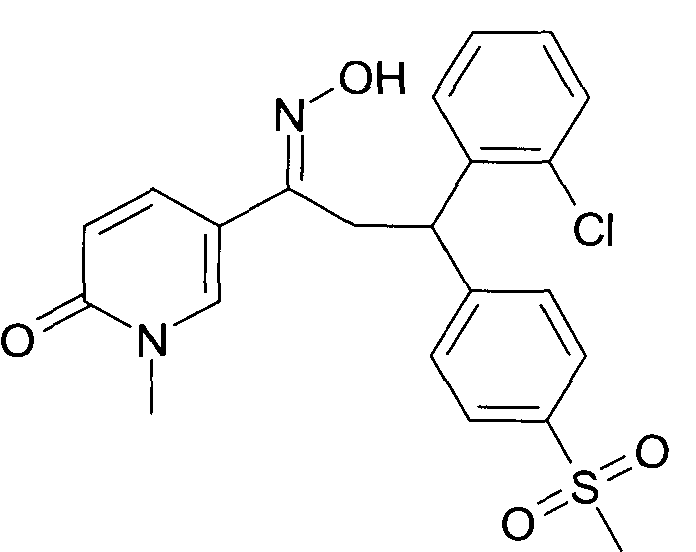
Стадия 1: 3-(2-хлор-фенил)-3-(4-метансульфонил-фенил)-1-(6-метокси-пиридин-3-ил)-пропан-1-он
По аналогии с примером 203, стадия 1, (E)-3-(2-хлор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (пример 197, стадия 1) взаимодействовал с 4-(метилсульфонил)фенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и NaHCO3 в диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=430.1 [M+H]+.
Стадия 2: 5-[3-(2-хлор-фенил)-3-(4-метансульфонил-фенил)-пропионил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, 3-(2-хлор-фенил)-3-(4-метансульфонил-фенил)-1-(6-метокси-пиридин-3-ил)-пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=416.0 [M+H]+.
Стадия 3: 5-[3-(2-хлор-фенил)-3-(4-метансульфонил-фенил)-пропионил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[3-(2-хлор-фенил)-3-(4-метансульфонил-фенил)-пропионил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=430.1 [M+H]+.
Стадия 4: (E)-5-(3-(2-Хлорфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-[3-(2-хлор-фенил)-3-(4-метансульфонил-фенил)-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=445.2 [M+H]+.
Пример 250
(E)-5,5'-(1-(2-Хлорфенил)-3-(гидроксиимино)пропан-1,3-диил)бис(1-метилпиридин-2(1 Н)-он)
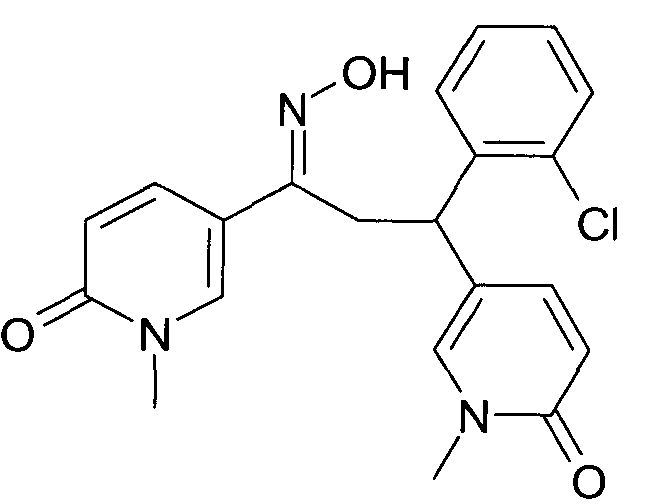
Стадия 1: 3-(2-хлор-фенил)-1,3-бис-(6-метокси-пиридин-3-ил)-пропан-1-он
По аналогии с примером 203, стадия 1, (E)-3-(2-хлор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (пример 197, стадия 1) взаимодействовал с 2-метокси-5-пиридинбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(1)димера и NaHCO3 в диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=381.1 [M+H]+.
Стадия 2: 5,5'-[1-(2-Хлорфенил)-3-оксопропан-1.3-диил]дипиридин-2(1H)-он
По аналогии с примером 162, стадия 2, 3-(2-хлор-сренил)-1,3-бис-(6-метокси-пиридин-3-ил)-пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=355.1 [M+H]+.
Стадия 3: 5,5'-[1-(2-Хлорфенил)-3-оксопропан-1,3-диил]бис(1-метилпиридин-2(1H)-он)
По аналогии с примером 161, стадия 1, 5,5'-[1-(2-хлорфенил)-3-оксопропан-1,3-диил]дипиридин-2(1H)-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=383.1 [M+H]+.
Стадия 4: (E)-5,5'-(1-(2-Хлорфенил)-3-(гидроксиимино)пропан-1.3-диил)бис(1-метилпиридин-2(1H)-он)
По аналогии с примером 151, стадия 3, 5,5'-[1-(2-хлорфенил)-3-оксопропан-1,3-диил]бис(1-метилпиридин-2(1H)-он) взаимодействовал с гидроксиламина гидрохлоридом в присутствии NaHCO3 с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде серо-белого осадка, MS (ESI+): m/z=398.1 [M+H]+.
Пример 251
(E)-4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбонитрил
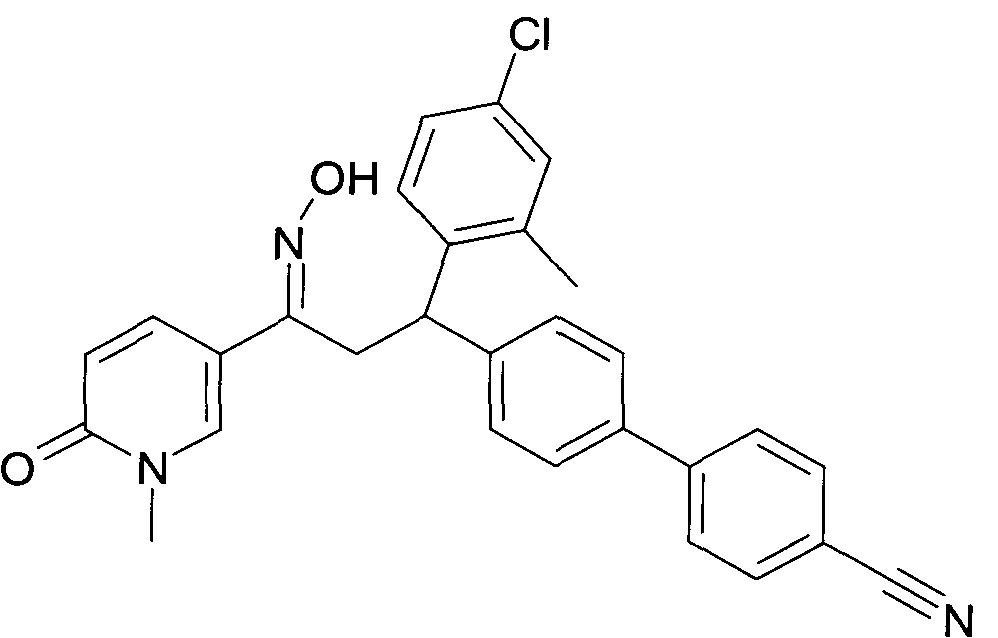
По аналогии с примером 166, стадия 1, 5-{3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он (пример 226, стадия 4) взаимодействовал с 4-цианофенилбороновой кислотой (CAS RN: [126747-14-6]) в присутствии дихлор(1,1'-бис(дифенилфосфино)ферроцен) палладия(II) дихлорметанового аддукта в смеси 1,4-диоксана, воды и 2M водного раствора карбоната натрия с получением соединения, указанного в заголовке, содержащего 10% соответствующего Z изомера, в виде белого осадка, MS (ESI+): m/z=482.16 [M+H]+.
Пример 252
3-бром-5-{(R)-3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он
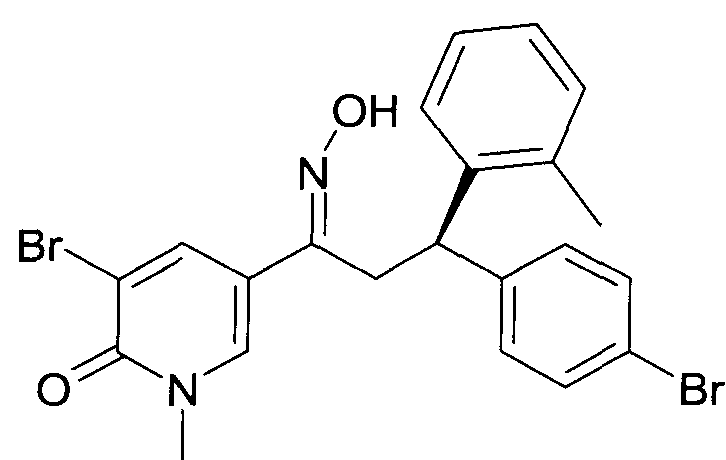
Стадия 1: (R)-3-бром-5-(3-(4-бромфенил)-3-о-толилпропаноил)-1-метилпиридин-2(1H)-он
К раствору (R)-5-(3-(4-бромфенил)-3-о-толилпропаноил)-1-метилпиридин-2(1H)-она (0.1 г, пример 223) в ДМФ (1 мл) по каплям добавили пиридин (217 мкл) и затем бром (12.6 мкл). Полученный раствор перемешивали при комнатной температуре в течение 2.25 ч. Реакционную смесь влили в воду и этилацетат и слои разделили. Водный слой экстрагировали 2x этилацетатом. Органические слои промыли водой и один раз солевым раствором, высушили над MgSO4, отфильтровали, обработали силикагелем и выпарили. Соединение очистили посредством хроматографии (SiO2, n-гептан/этилацетат 100:0 до 50:50) с получением соединения, указанного в заголовке, в виде светло-коричневого осадка (0.093 г; 78%), MS (ESI+): m/z=489.0 [M+H]+.
Стадия 2: 3-бром-5-{(R)-3-(4-бром-фенил)-1-[(E)-гидроксиимино]-3-о-толил-пропил}-1-метил-1H-пиридин-2-он
К суспензии (R)-3-бром-5-(3-(4-бромфенил)-3-о-толилпропаноил)-1-метилпиридин-2(1H)-она в этаноле (2.5 мл) и воде (0.1 мл) добавили бикарбонат натрия (30.9 мг) и гидроксиламина гидрохлорид (32.0 мг) и реакционную смесь перемешивали при кипении с обратным холодильником (100°C температура масляной бани) в течение 2 часов. Реакционную смесь влили в воду и дихлорметан и слои разделили. Водный слой экстрагировали дважды дихлорметаном. Объединенные органические слои промыли солевым раствором, высушили над сульфатом магния, отфильтровали, обработали силикагелем и выпарили. Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД (10 г колонка с силикагелем, CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (100:0 до 50:50) с получением соединения, указанного в заголовке, в виде белого осадка, MS (ESI+): m/z=504.99 [M+H]+.
Примеры 253 и 254
(-)-({4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты метиловый эфир и (+)-({4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты метиловый эфир

Разделение (E)-метил, 2-(4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-илкарбоксамидо) ацетата (пример 228) с помощью хиральной ВЭЖХ на Chiralpak-AD колонке с использованием смеси растворителей л-гептан: 2-пропанол (3:2 об/об) дала (-)-({4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты метиловый эфир в виде светло-коричневого осадка, MS (ESI+): m/z=572.19 [M+H]+ и (+)-({4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты метиловый эфир в виде светло-коричневого осадка, MS (ESI+): m/z=572.19 [M+H]+.
Пример 255
(-)-({4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусная кислота
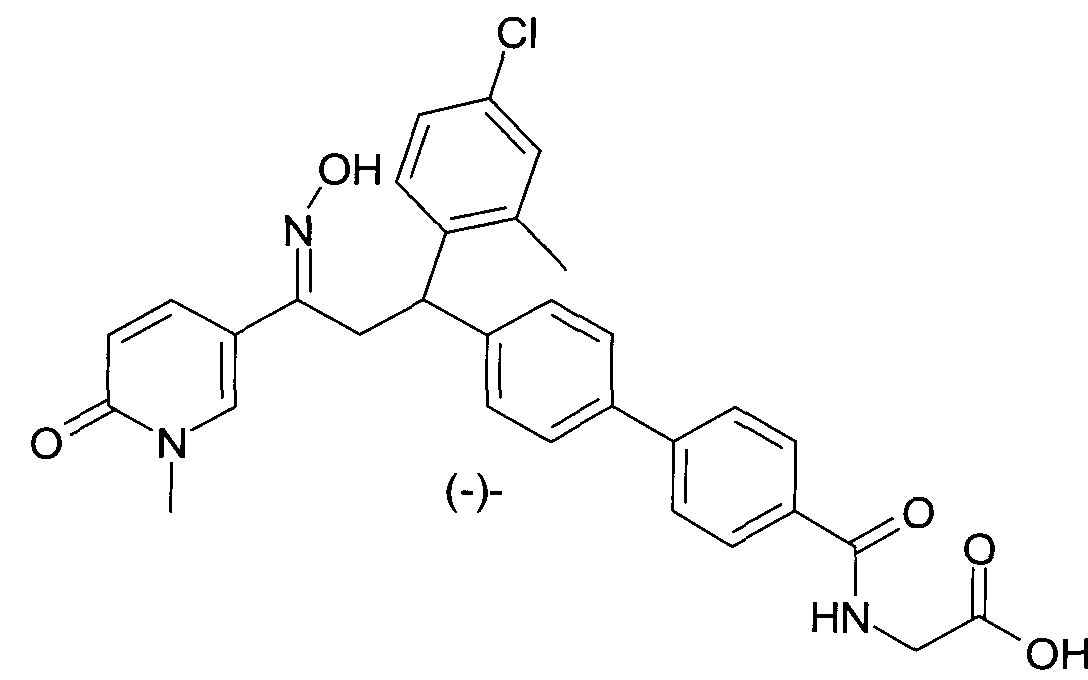
По аналогии с примером 229, из (-)-({4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты метилового эфира получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+: m/z=558.18 [M+H]"".
Пример 256
(+)-({4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусная кислота
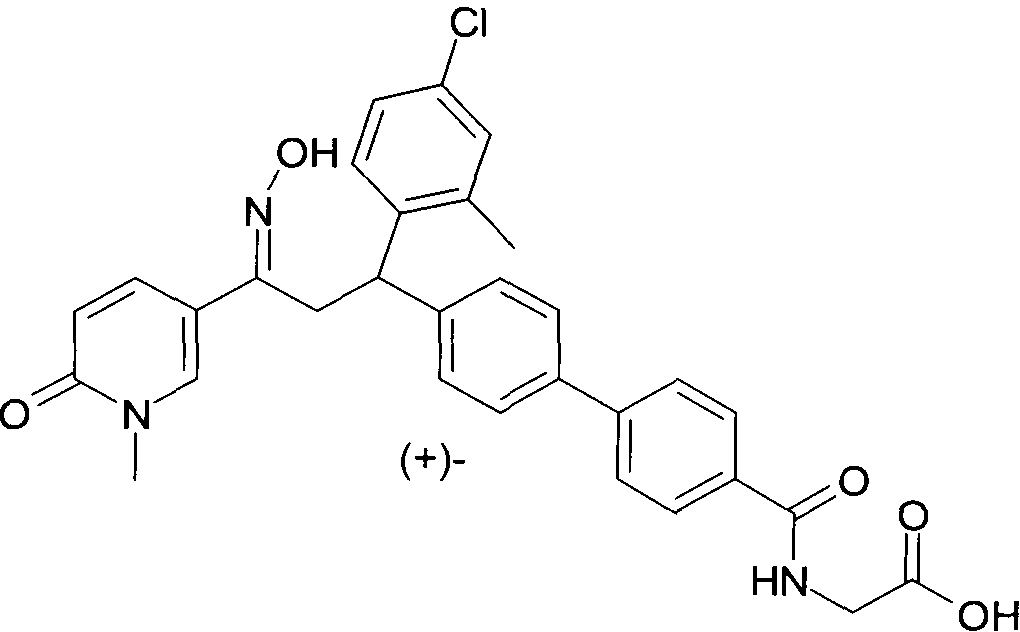
По аналогии с примером 229, из (+)-({4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты метилового эфира получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=558.18 [M+H]+.
Пример 257
({4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты метиловый эфир
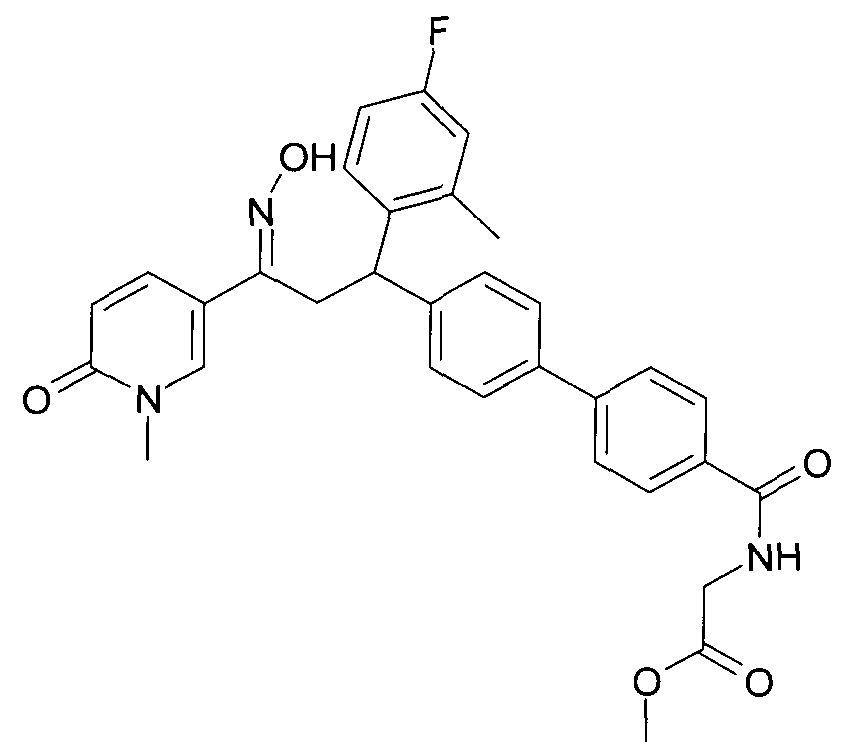
По аналогии с примером 228, из (E)-4'-(1-(4-фтор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоновой кислоты (пример 225) и гидрохлорида глицинметилового эфира получили соединение, указанное в заголовке, в виде светло-коричневой пены, MS (ESI+): m/z=556.22 [M+H]+.
Пример 258
({4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусная кислота

По аналогии с примером 229, из ({4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбонил}-амино)-уксусной кислоты метилового эфира (пример 225) получили соединение, указанное в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=542.21 [M+H]+.
Пример 259
5-{3-(4'-амино-бифенил-4-ил)-3-(4-фтор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
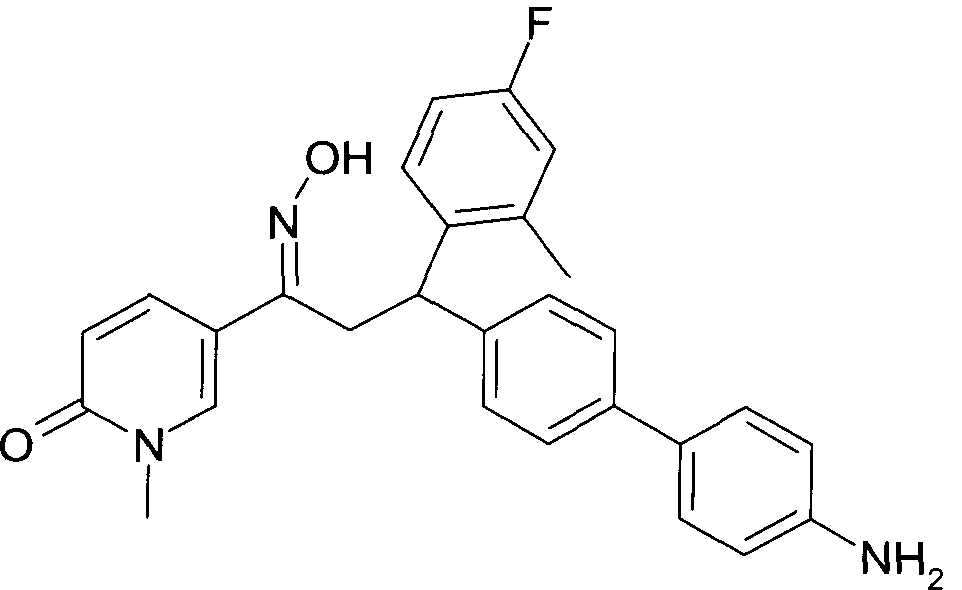
По аналогии с примером 166, из (E)-5-(3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-она (пример 224) и 4-аминофенилбороновой кислоты пинаколинового эфира (CAS RN: [214360-73-3]) получили соединение, указанное в заголовке, в виде светло-коричневой пены, MS (ESI+): m/z=456.21 [M+H]+.
Пример 260
5-{3-(4-фтор-2-метил-фенил)-1-[(E)-гидроксиимино]-3-[4'-(1H-тетразол-5-ил)-бифенил-4-ил]-пропил}-1-метил-1H-пиридин-2-он
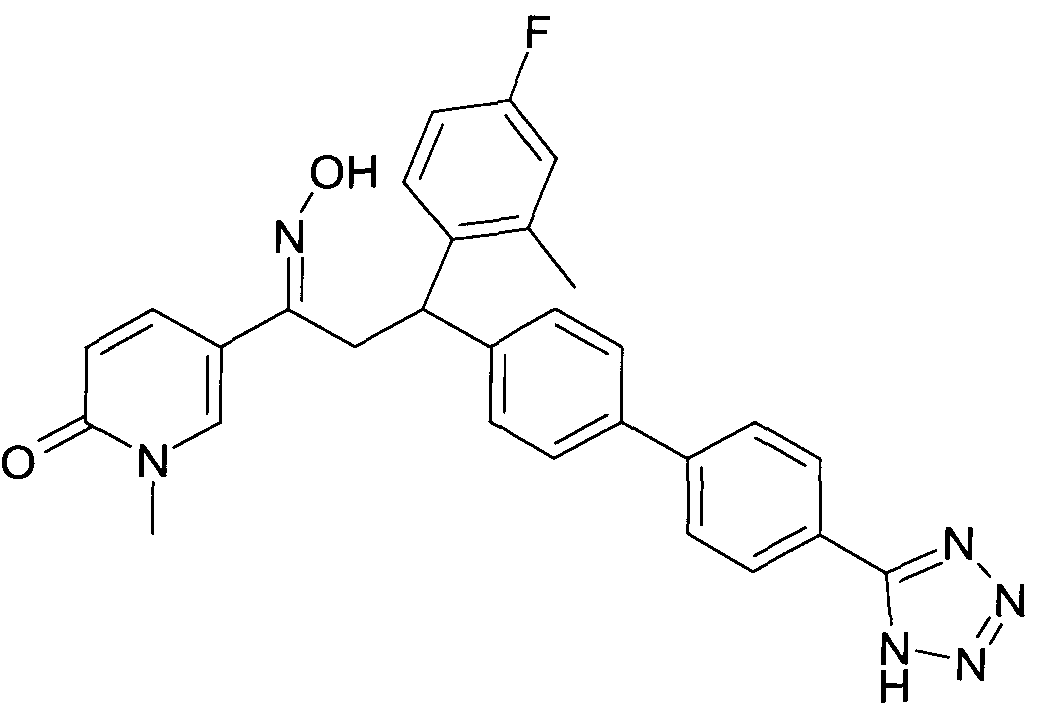
К раствору (E)-5-(3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-она (0.1 г, пример 224) в диоксане (1 мл) добавили [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия дихлорметановый аддукт (CAS RN: [95464-05-4]) (9.21 мг), 4-(1H-тетразол-5-ил)фенилбороновую кислоту (64.3 мг, CAS RN: [179942-55-3]), воду (0.65 мл) и водный 2M раствор карбоната натрия (338 мкл) и реакционную смесь нагревали в течение 23 часов при 80°C. Реакционную смесь влили в 10% водный раствор лимонной кислоты и этилацетат и слои разделили. Водный слой экстрагировали дважды этилацетатом. Объединенные органические слои высушили над сульфатом магния, отфильтровали, обработали силикагелем и выпарили. Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД (20 г колонка с силикагелем, CombiFlash Companion, Isco Inc.) с элюцией градиентом дихлорметан : метанол (100:0 до 75:25). Продукт очистили второй раз препаративной ВЭЖХ (phenomenex gemini колонка) с градиентом ацетонитрил: вода (содержащим 0.5% муравьиной кислоты) (10:90 до 98:2) с получением соединения, указанного в заголовке, содержащего 10% соответствующего Z изомера, в виде белой пены, MS (ESI+): m/z=509.21 [M+H]+.
Пример 261 и 262
(E,R)-4-(4-бромфенил)-1-(пиридин-4-ил)-4-о-толилбутан-2-она оксим и (Z,R)-4-(4-бромфенил)-1-(пиридин-4-ил)-4-о-толилбутан-2-она оксим
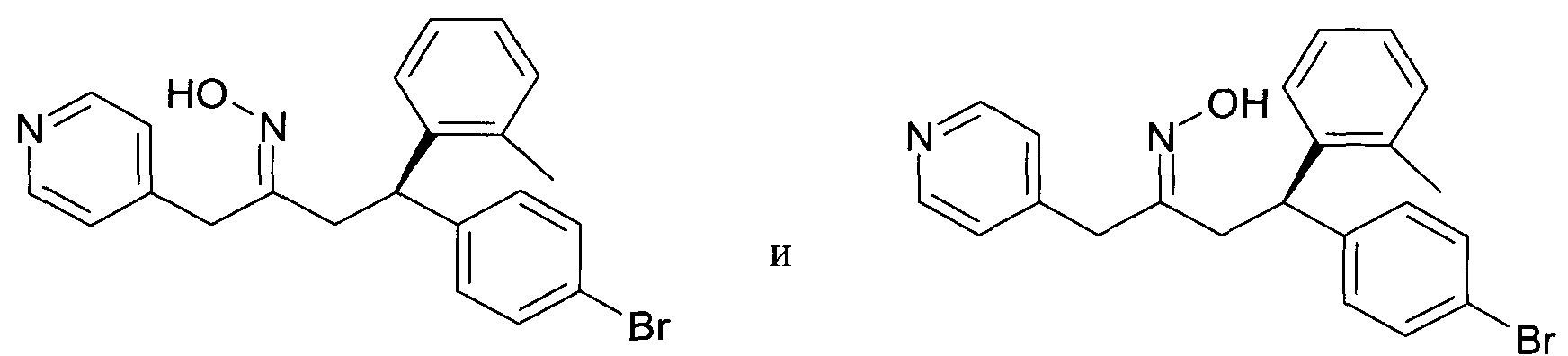
Стадия 1: (R)-4-(4-бромфенил)-1-(пиридин-4-ил)-4-о-толилбутан-2-он
При -78°С, к раствору 4-метилпиридина (308 мг) в ТГФ (7 мл) добавили n-бутиллитий (1.6M в гексане, 2.07 мл). Реакционную смесь медленно нагрели до KT, перемешивали в течение 1 ч при этой температуре, и снова охладили до -78°C. Медленно добавили (R)-3-(4-бромфенил)-N-метокси-N-метил-3-о-толилпропанамид (пример 142, стадия 1; 400 мг) в ТГФ (3 мл) и реакционную смесь нагрели до KT и перемешивали в течение 3 ч. Смесь влили в насыщенный водный раствор NaHCO3 (10 мл), фазы разделили, и неорганическую фазу экстрагировали EtOAc (2×10 мл). Органические слои объединили, промыли солевым раствором, высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенный материал очистили флеш-хроматографией на силикагеле (30% до 60% EtOAc в n-гептане до CH2Cl2/MeOH 9:1) с получением соединения, указанного в заголовке, в виде желтого масла (220 мг, 51%), MS (ESI+): m/z=394.0 ([M+H]+, 1Br).
Стадия 2: (E,R)-4-(4-бромфенил)-1-(пиридин-4-ил)-4-о-толилбутан-2-она оксим и (Z,R)-4-(4-бромфенил)-1-(пиридин-4-ил)-4-о-толилбутан-2-она оксим
По аналогии с примером 74, стадия 7, из (R)-4-(4-бромфенил)-1-(пиридин-4-ил)-4-о-толилбутан-2-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили (E,R)-4-(4-бромфенил)-1-(пиридин-4-ил)-4-о-толилбутан-2-она оксим в виде бесцветного масла, MS (ESI+): m/z=409.0908 ([M+H]+, 1Br) и (Z,R)-4-(4-бромфенил)-1-(пиридин-4-ил)-4-о-толилбутан-2-она оксим в виде бесцветного масла, MS (ESI+): m/z=409.0909 ([M+H]+, 1Br).
Пример 263 (E,R)-4-(4-бромфенил)-1-(пиридин-2-ил)-4-о-толилбутан-2-она оксим
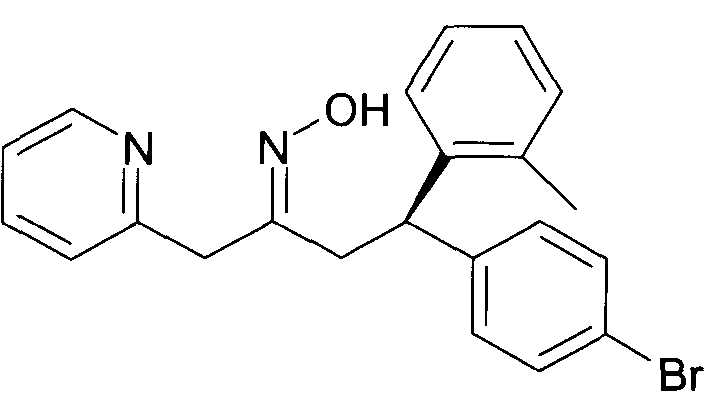
Стадия 1: (R)-4-(4-бромфенил)-1-(пиридин-2-ил)-4-о-толилбутан-2-он
По аналогии с примером 261, стадия 1, из (R)-3-(4-бромфенил)-N-метокси-N-метил-3-о-толилпропанамида (пример 142, стадия 1) и 2-метил-пиридина получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=394.0 ([M+H]+, 1Br).
Стадия 2: (E,R)-4-(4-бромфенил)-1-(пиридин-2-ил)-4-о-толилбутан-2-она оксим
По аналогии с примером 74, стадия 7, из (R)-4-(4-бромфенил)-1-(пиридин-2-ил)-4-о-толилбутан-2-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ES1+): m/z=409.0904 ([M+H]+, 1Br).
Пример 264
(E,R)-1-(2-метил-пиридин-4-ил)-3-(4-морсролин-4-ил-фенил)-3-о-толил-пропан-1-она оксим
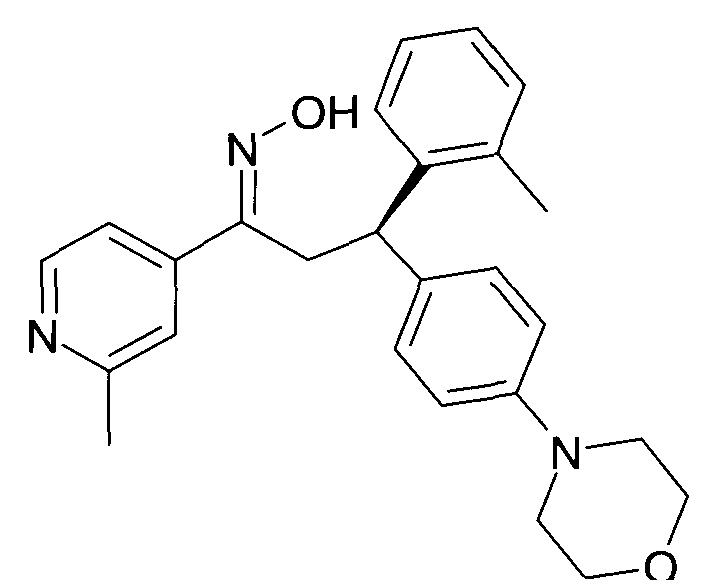
По аналогии с примером 39, из (E,R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксима (пример 142) и морфолина получили (E,R)-1-(2-метил-пиридин-4-ил)-3-(4-морфолин-4-ил-фенил)-3-о-толил-пропан-1-она оксим в виде светло-желтого полутвердого вещества, MS (ESI+): m/z=416.3 ([M+H]+).
Пример 265
1-{4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пиперидин-4-карбоновой кислоты этиловый эфир
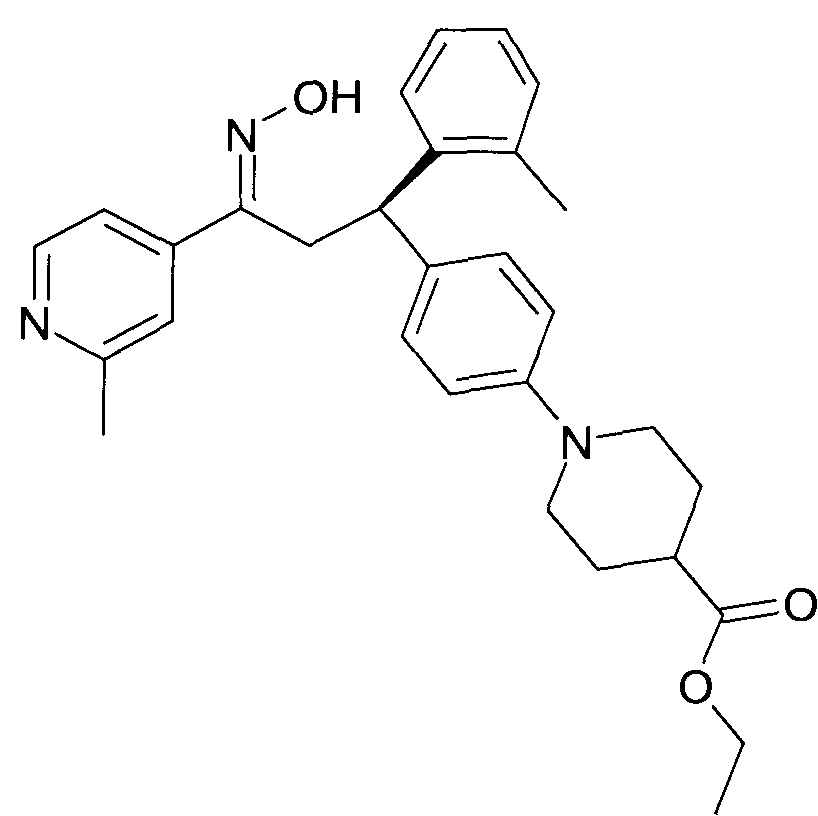
По аналогии с примером 39, из (E,R)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксима (пример 142) и этил пиперидин-4-карбоксилата, используя карбонат цезия вместо трет-бутилата натрия в качестве основания в диоксане вместо толуола, получили 1-{4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пиперидин-4-карбоновой кислоты этиловый эфир в виде желтого полутвердого вещества, MS (ESI+): m/z=486.5 ([M+H]+.
Пример 266
1-{4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пиперидин-4-карбоновая кислота
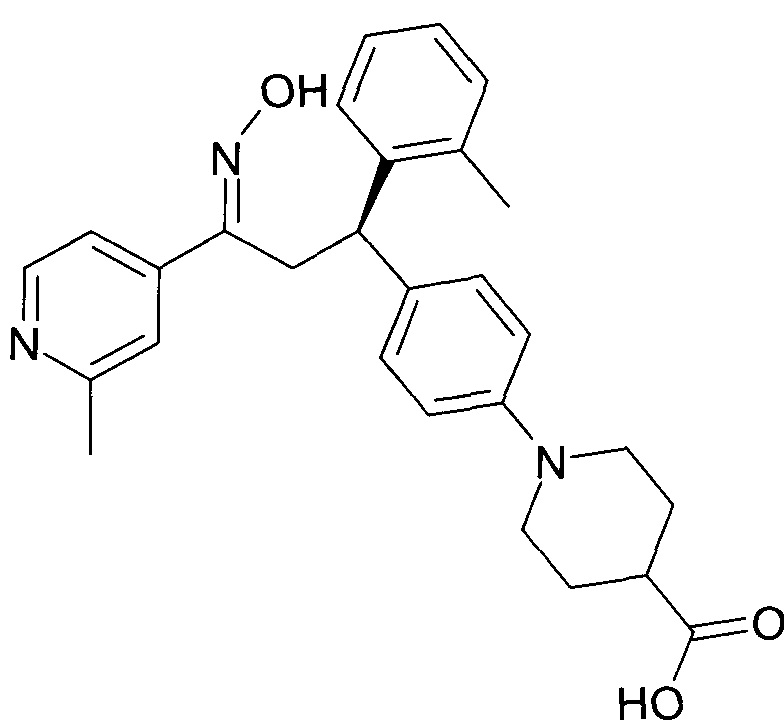
По аналогии с примером 75, из 1-{4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пиперидин-4-карбоновой кислоты этилового эфира получили 1-{4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пиперидин-4-карбоновую кислоту в виде светло-желтой пены, MS (ESI-): m/z=456.2 ([M-H]-).
Пример 267
(E,R)-3-{4-[(2-метокси-этил)-метил-амино]-фенил}-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
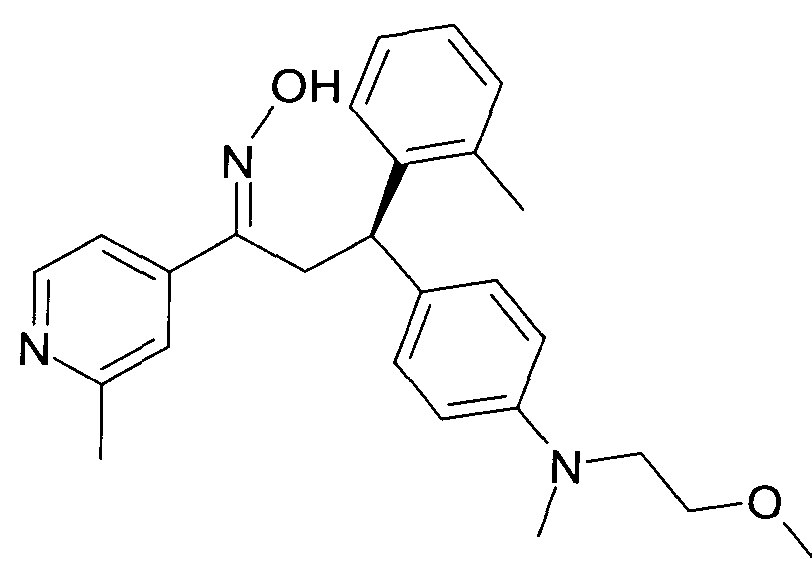
По аналогии с примером 39, из (E,R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксима (пример 142) и 2-метокси-М-метилэтанамина получили (E,R)-3-{4-[(2-метокси-этил)-метил-амино]-фенил}-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим в виде желтой пены, MS (ESI+): m/z=418.4 ([M+H]+).
Пример 268
(E,R)-3-{4-[(2-гидрокси-этил)-метил-амино]-фенил}-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
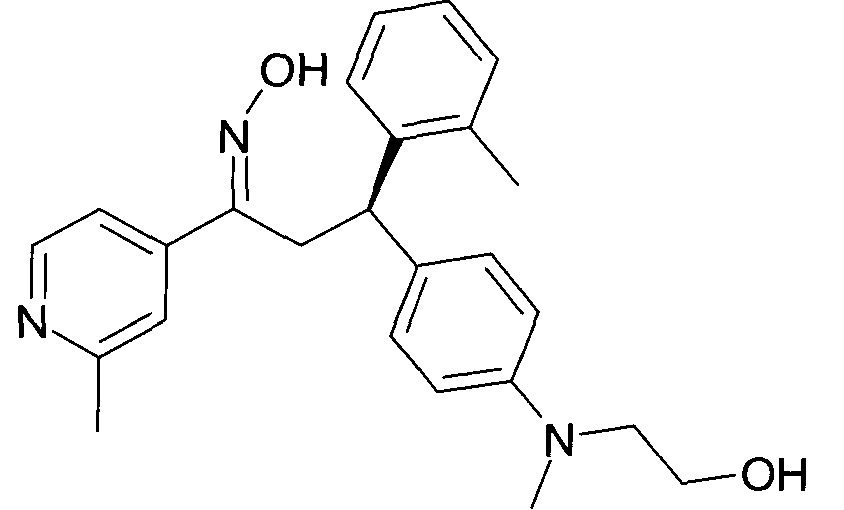
По аналогии с примером 39, из (E,R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксима (пример 142) и 2-(метиламино)этанола получили (E,R)-3-{4-[(2-гидрокси-этил)-метил-амино]-фенил}-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим в виде желтого масла, MS (ESI+): m/z=404.3 ([M+H]+).
Пример 269
(E,R)-3-[4-(4-гидроксиметил-пиперидин-1-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
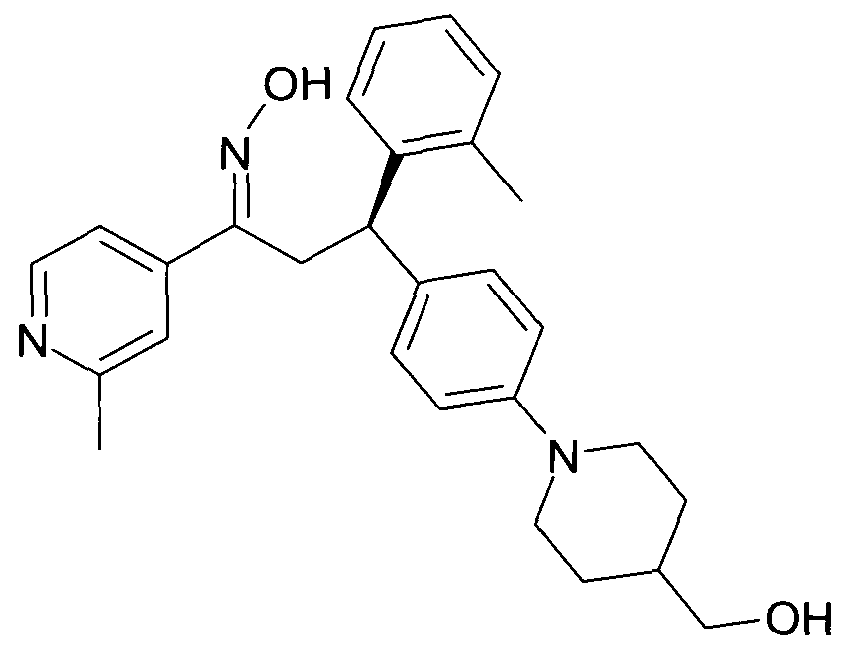
Стадия 1: (R)-3-[4-(4-гидроксиметил-пиперидин-1-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 39, из (R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 142, стадия 2) и пиперидин-4-ил-метанола получили (R)-3-[4-(4-гидроксиметил-пиперидин-1-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он в виде светло-желтой пены, MS (ESI+): m/z=429.3 ([M+H]+).
Стадия 2: (E,R)-3-[4-(4-гидроксиметил-пиперидин-1-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 132, стадия 6, из (R)-3-[4-(4-гидроксиметил-пиперидин-1-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=444.4 ([M+H]+).
Пример 270
(E,R)-3-[4-(3-метокси-азетидин-1-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
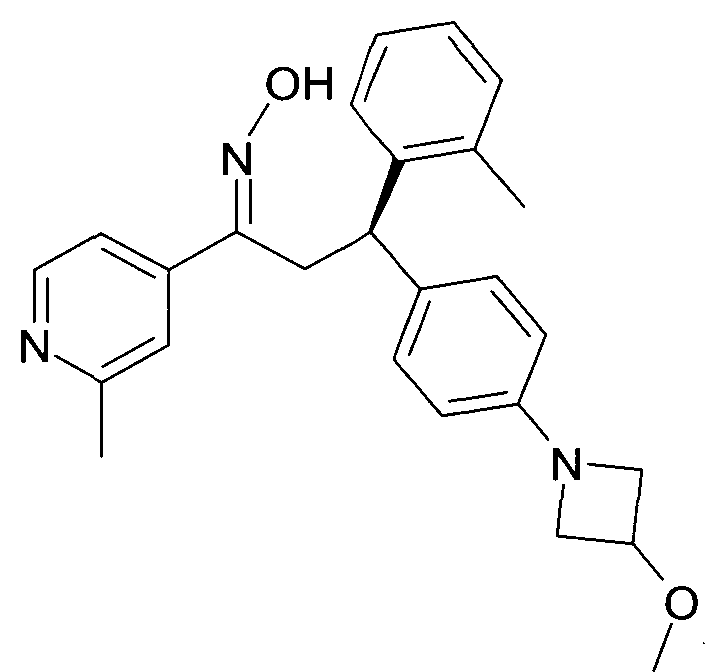
Стадия 1: (R)-3-[4-(3-метокси-азетидин-1-ил)-фенил1-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 39, из (R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 142, стадия 2) и 3-метоксиазетидина гидрохлорида в присутствии трис(дибензилиденацетон) дипалладия(0) хлороформного аддукта, 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила (X-PHOS) и карбоната цезия в трет-бутаноле получили (R)-3-[4-(3-метокси-азетидин-1-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он в виде желтого масла, MS (ESI+): m/z=401.3 ([M+H]+.
Стадия 2: (E,R)-3-[4-(3-метокси-азетидин-1-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 1, стадия 2, из (R)-3-[4-(3-метокси-азетидин-1-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=416.3 ([M+H]+).
Пример 271
(E,R)-3-[4-(1,1-Диоксо-1λ6-тиоморфолин-4-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
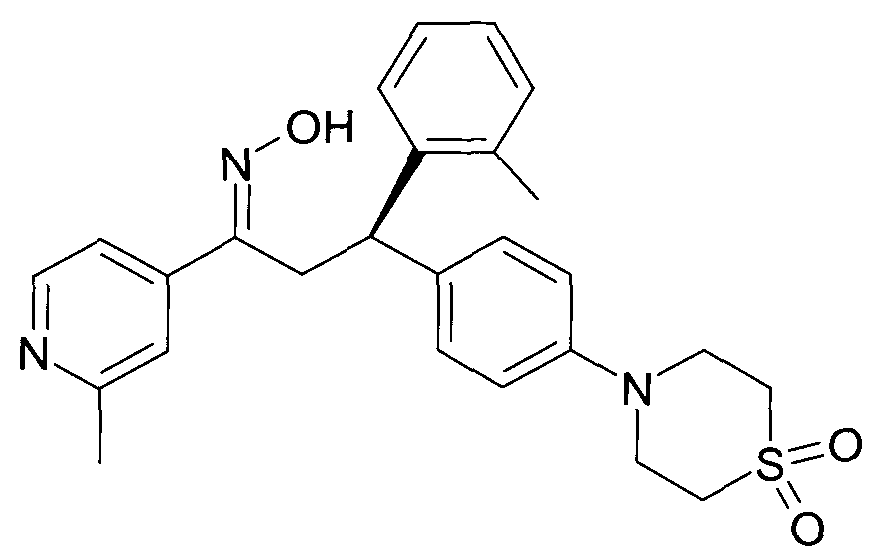
Стадия 1: (R)-3-[4-(1,1-Диоксо-1λ6-тиоморфолин-4-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 39, из (R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 142, стадия 2) и тиоморфолина 1,1-диоксида в присутствии трис(дибензилиденацетон) дипалладий (0) хлороформного аддукта, 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила (X-PHOS) и карбоната цезия в трет-бутаноле получили (R)-3-[4-(1,1-диоксо-1λ6-тиоморфолин-4-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он в виде желтого масла, MS (ESI+): m/z=449.2 ([M+H]+).
Стадия 2: (E,R)-3-[4-(1,1-Диоксо-1λ6-тиоморфолин-4-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 132, стадия 6, из (R)-3-[4-(1,1-диоксо-1λ6-тиоморфолин-4-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии NaHCO3 получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=464.2 ([M+H]+).
Пример 272
4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бензойная кислота
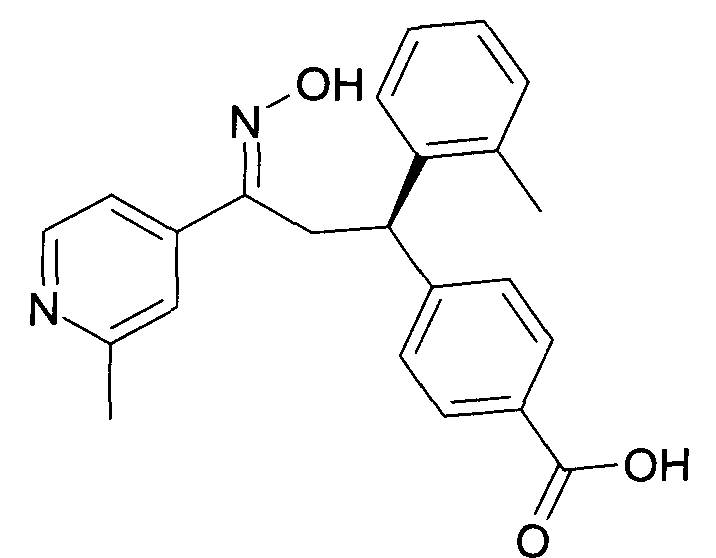
Стадия 1: 4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензойной кислоты метиловый эфир
К раствору (R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 142, стадия 2, 100 мг) в метаноле (1.5 мл) и этилацетате (1.5 мл) добавили [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(11) дихлорметановый аддукт (10 мг), триэтиламин (53.3 мкл) при комнатной температуре. Реакционную смесь перемешивали при 130°C в течение 20 ч в атмосфере монооксида углерода (70 бар). Добавили насыщенный водный раствор хлорида аммония, фазы разделили и неорганическую фазу экстрагировали этилацетатом (2x). Объединенные органические слои промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (этилацетат/n-гептан 0:1 до 1:0) с получением соединения, указанного в заголовке, в виде бесцветного масла (95 мг, 87%), MS (ESI+): m/z=374.1 ([M+H]+).
Стадия 2: 4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бензойная кислота
К раствору 4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензойной кислоты метилового эфира (98 мг) в тетрагидрофуране (3 мл) добавили 1 М водный раствор гидроксида лития (2.62 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Добавили насыщенный водный раствор хлорида аммония и этилацетат, фазы разделили и неорганическую фазу экстрагировали этилацетатом (2x). Объединенные органические слои промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и сконцентрировали под вакуумом с получением 4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензойной кислоты в виде белого осадка. Она взаимодействовала по аналогии с примером 132, стадия 6, с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде белого осадка (98 мг, 60%), MS (ESI-): m/z=372.9 ([M-H]-).
Пример 273
N-(2-гидрокси-этил)-4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бензамид
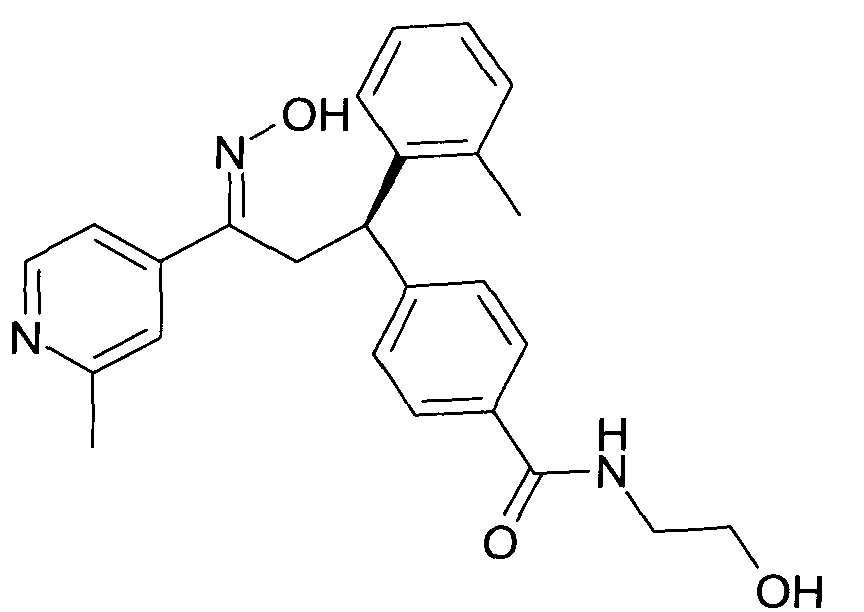
По аналогии с примером 207, стадия 2, 4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бензойную кислоту (пример 272) связывали с 2-аминоэтанолом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=418.3 [M+H]+.
Пример 274
N-(2-гидрокси-этил)-4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-N-метил-бензамид
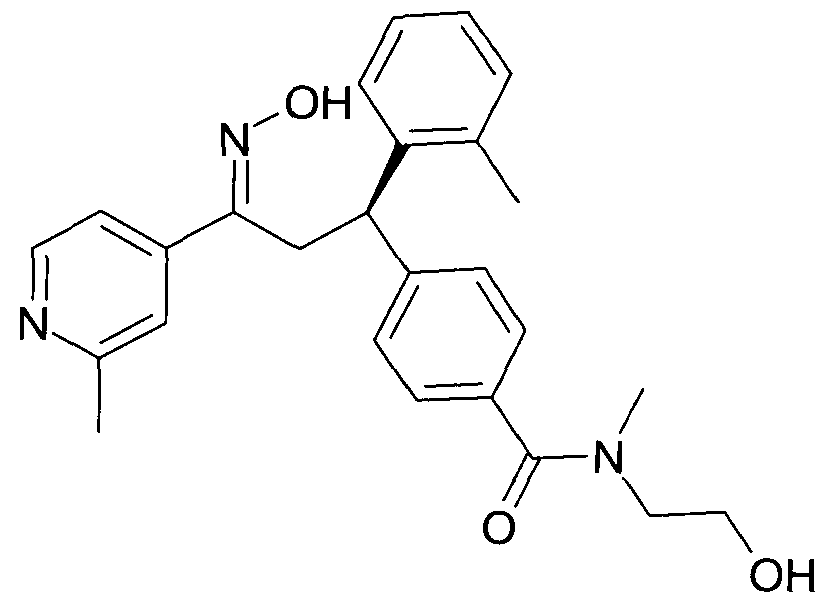
По аналогии с примером 207, стадия 2, 4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бензойную кислоту (пример 272) связывали с 2-(метиламино)этанолом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=432.4 [M+H]+.
Пример 275
4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-N-((S)-2-гидрокси-пропил)-бензамид
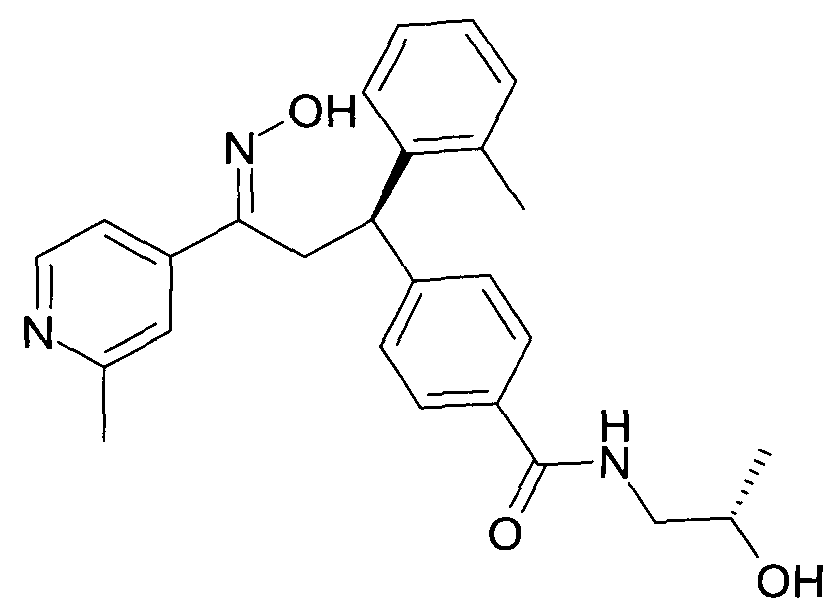
По аналогии с примером 207, стадия 2, 4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бензойную кислоту (пример 272) связывали с (S)-1-аминопропан-2-олом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде желтого осадка, MS (ESI+): m/z=432.4 [M+H]+.
Пример 276
транс-4-{4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бензоиламино}-циклогексанкарбоновая кислота
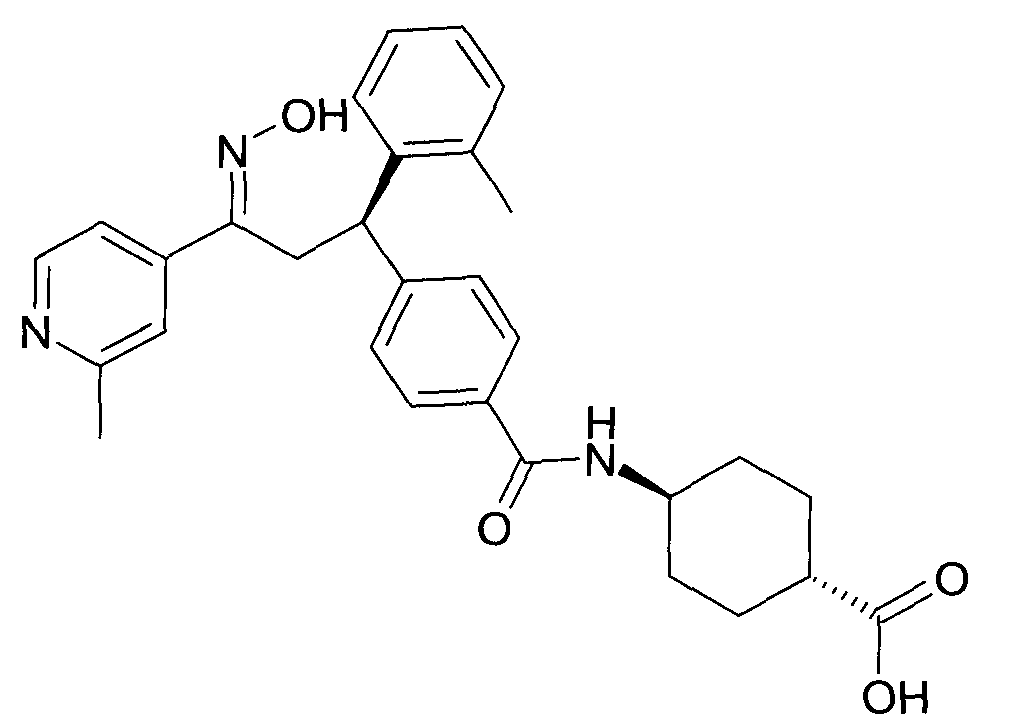
Стадия 1: 4-{4-[(R)-3-[(E)-гидроксимино1-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бензоиламино}-циклогексанкарбоновой кислоты метиловый эфир
По аналогии с примером 207, стадия 2, 4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бензойную кислоту (пример 272) связывали с транс-метил 4-аминоциклогексанкарбоксилата гидрохлоридом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде светло-желтого вязкого масла.
Стадия 2: транс-4-{4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бензоиламино}-ииклогексанкарбоновая кислота
По аналогии с примером 169, стадия 2, 4-{4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-бензоиламино}-циклогексанкарбоновой кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде белого осадка, MS (ESI-): m/z=498.2 [M-H]-.
Пример 277
4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-N,N-диметил-бензамид
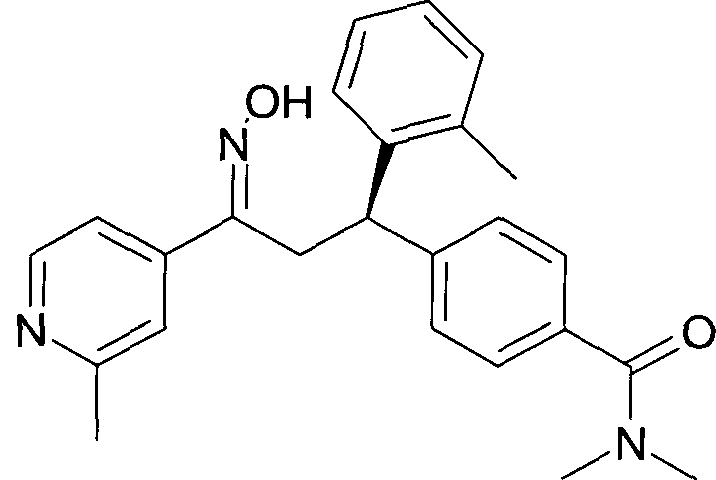
Стадия 1: N,N-диметил-4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензамид
По аналогии с примером 207, стадия 2, 4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (промежуточное соединение примера 272, стадия 2) связывали с диметиламина гидрохлоридом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белой пены, MS (ESI+): m/z=387.2 [M+H]+.
Стадия 2: 4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-N,N-диметил-бензамид
По аналогии с примером 132, стадия 6, из N,N-диметил-4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензамида и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=402.4 ([M+H]+).
Пример 278
4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-N-метил-бензамид
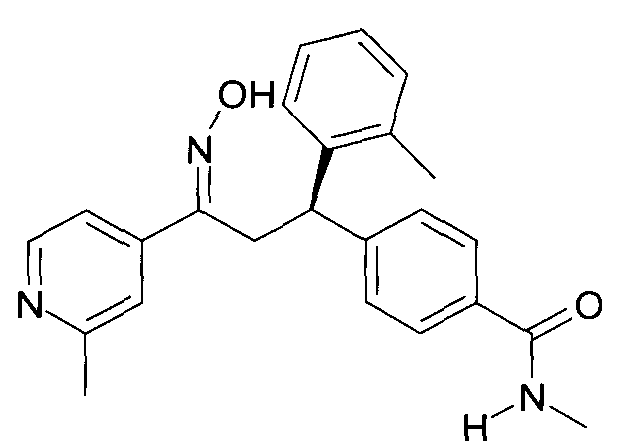
Стадия 1: N-метил-4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензамид
По аналогии с примером 207, стадия 2, 4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (промежуточное соединение примера 272, стадия 2) связывали с метиламином, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде белой пены, MS (ESI+): m/z=373.1 [M+H]+.
Стадия 2: 4-[(R)-3-[(E)-гидроксимино1-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-N-метил-бензамид
По аналогии с примером 132, стадия 6, из N-метил-4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензамида и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=388.2 ([M+H]+).
Пример 279
1-{4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-азетидин-3-карбоновая кислота
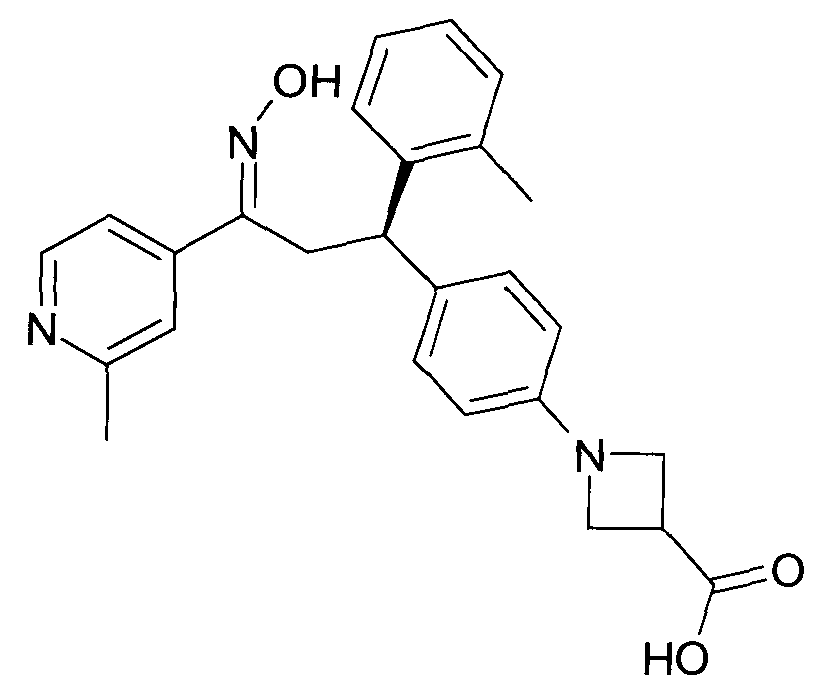
Стадия 1: 1-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил1-фенил}-азетидин-3-карбоновая кислота
По аналогии с примером 39, из (R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 142, стадия 2) и метила азетидин-3-карбоксилата гидрохлорида в присутствии трис(дибензилиденацетон)дипалладий(0) хлороформного аддукта, 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила и карбоната цезия в трет-бутаноле получили 1-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-азетидин-3-карбоновой кислоты метиловый эфир.
По аналогии с примером 169, стадия 2, 1-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-азетидин-3-карбоновой кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде желтой пены.
Стадия 2: 1 -{4-[(R)-3-[(E)-гидроксимино1-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил1-фенил}-азетидин-3-карбоновая кислота
По аналогии с примером 1, стадия 2, из 1-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-азетидин-3-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=430.3 ([M+H]+).
Пример 280
2-хлорметил-3-{4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фениламино}-пропионовая кислота
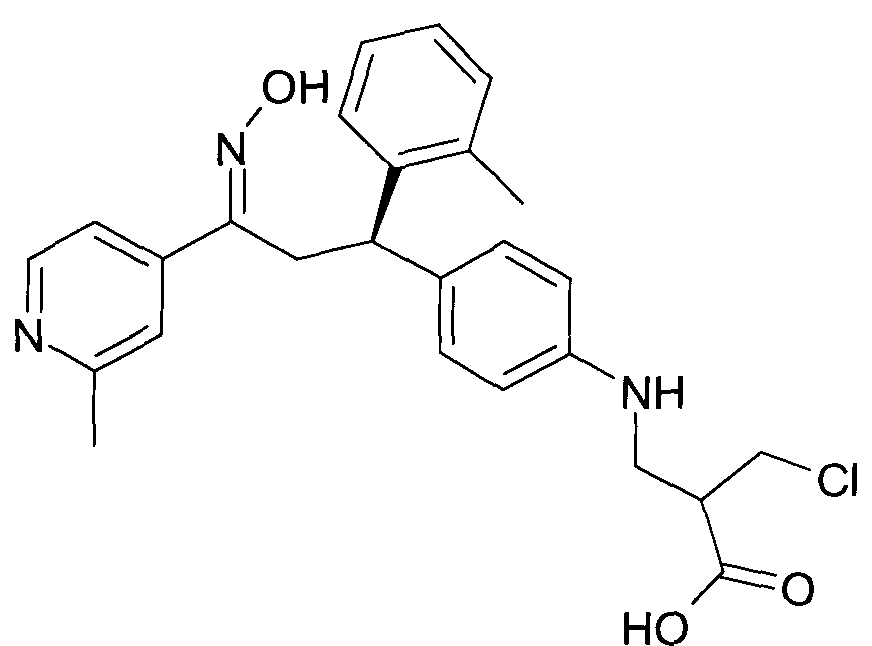
По аналогии с примером 132, стадия 6, из 1-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-азетидин-3-карбоновой кислоты (пример 279, стадия 1) и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде желтой пены, MS (ESI+): m/z=466.2 ([M+H]+).
Пример 281
1-{4-[(S)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пиперидин-4-карбоновая кислота
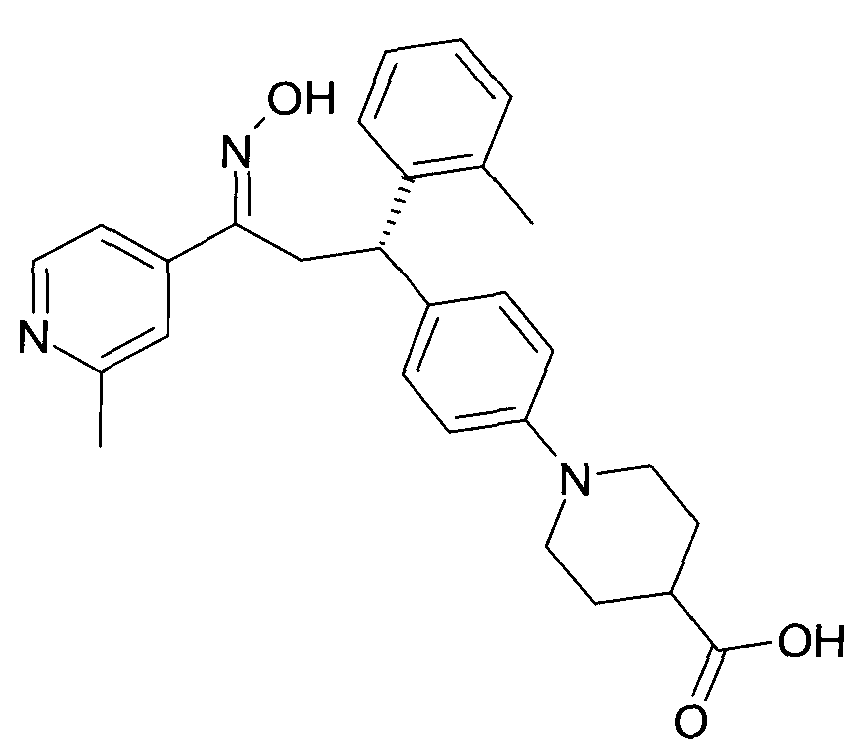
Стадия 1: 1-{4-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил1-фенил}-пиперидин-4-карбоновая кислота
По аналогии с примером 39, из (S)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и этила пиперидин-4-карбоксилата в присутствии трис(дибензилиденацетон)дипалладия(0), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила и трет-бутоксида натрия в толуоле получили 1-{4-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-пиперидин-4-карбоновой кислоты этиловый эфир.
По аналогии с примером 169, стадия 2, из 1-{4-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-пиперидин-4-карбоновой кислоты этилового эфира в присутствии 1M водного раствора гидроксида лития в тетрагидрофуране получили 1-{4-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-пиперидин-4-карбоновую кислоту в виде светло-желтого осадка, MS (ESI-): m/z=441.3 ([M-H]-).
Стадия 2: 1-{4-[(S)-3-[(E)-гидроксимино1-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил1-фенил}-пиперидин-4-карбоновая кислота
По аналогии с примером 132, стадия 6, из 1-{4-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-пиперидин-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде желтой пены, MS (ESI-): m/z=456.3 ([M-H]-).
Пример 282
4-[(S)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензойная кислота
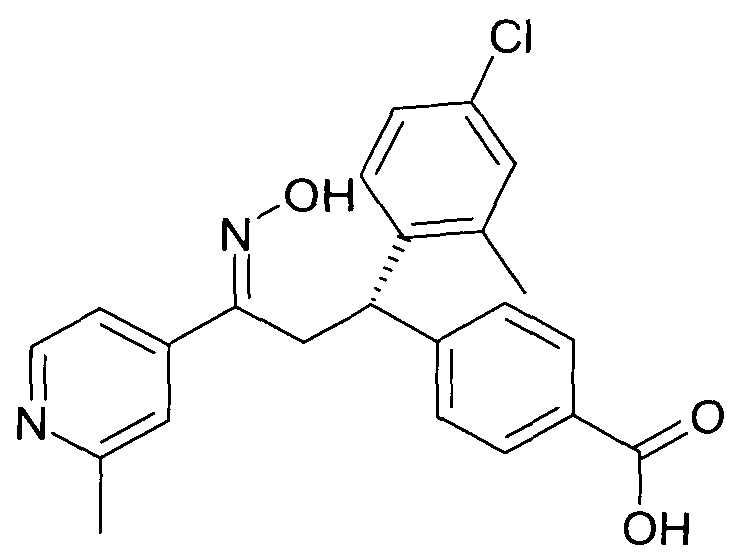
Стадия 1: (S)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-он
Разделение 3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она (пример 138, стадия 4) с помощью хиральной ВЭЖХ (Chiralcel OD, гептан/изопропанол 3:1) дало (S)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-он (светло-желтое масло, MS (ESI+): m/z=428.0 ([M+H]+) и (R)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-он (светло-желтое масло, MS (ESI+): m/z=428.0 ([M+H]+).
Стадия 2: 4-[(S)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-бензойной кислоты метиловый эфир
По аналогии с примером 272, стадия 1, из (S)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) дихлорметанового аддукта в присутствии триэтиламина и газообразного монооксида углерода получили соединение, указанное в заголовке, в виде светло-красной пены, MS (ESI-): m/z=408.3 ([M+H]+).
Стадия 3: 4-[(S)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-бензойная кислота
По аналогии с примером 272, стадия 2, из 4-[(S)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-бензойной кислоты метилового эфира в присутствии 1M водного раствора гидроксида лития получили соединение, указанное в заголовке, в виде серо-белого осадка, MS (ESI-): m/z=392.0 ([M-H]-).
Стадия 4: 4-[(S)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензойная кислота
По аналогии с примером 132, стадия 6, из 4-[(3)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-бензойной кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=409.3 ([M+H]+).
Пример 283
4-[(S)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-N,N-диметил-бензамид
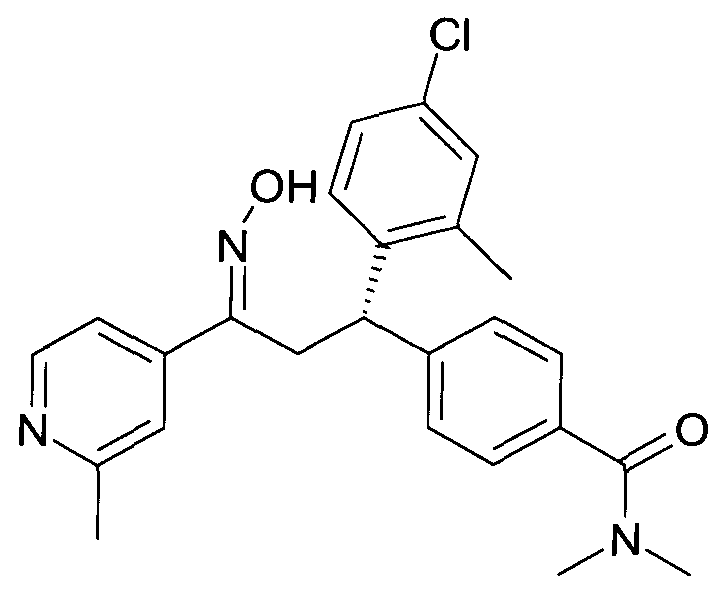
Стадия 1: 4-[(S)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-N,N-диметил-бензамид
По аналогии с примером 207, стадия 2, 4-[(S)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-бензойную кислоту (пример 282, стадия 3) связывали с диметиламина гидрохлоридом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белой пены, MS (ESI+): m/z=421.1 [M+H]+.
Стадия 2; 4-[(S)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-N,N-диметил-бензамид
По аналогии с примером 132, стадия 6, из 4-[(S)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-N,N-диметил-бензамида и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=436.3 ([M+H]+).
Пример 284
1-{4-[(R)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновая кислота
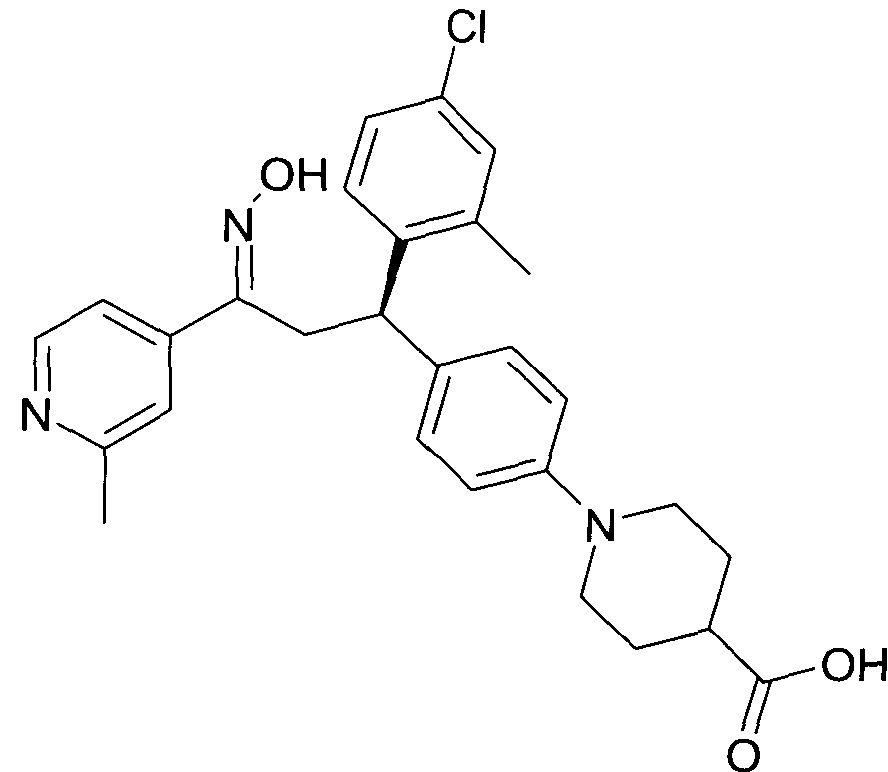
Стадия 1: 1-{4-[(R)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-фенил}-пиперидин-4-карбоновая кислота
По аналогии с примером 39, из (R)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она (пример 282, стадия 1) и этил пиперидин-4-карбоксилата в присутствии трис(дибензилиденацетон)дипалладия(0), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила и трет-бутоксида натрия в толуоле получили 1-{4-[(R)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-фенил}-пиперидин-4-карбоновой кислоты этиловый эфир.
По аналогии с примером 169, стадия 2, из 1-{4-[(R)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-фенил}-пиперидин-4-карбоновой кислоты этилового эфира в присутствии 1M водного раствора гидроксида лития в тетрагидрофуране получили 1-{4-[(R)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-фенил}-пиперидин-4-карбоновую кислоту в виде желтого осадка, MS (ESI-): m/z=475.1 ([M-H]-).
Стадия 2: 1-{4-[(R)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновая кислота
По аналогии с примером 132, стадия 6, из 1-{4-[(R)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-фенил}-пиперидин-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде желтого полутвердого вещества, MS (ESI-): m/z=490.3 ([M-H]-).
Пример 285
1-{4-[(S)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновая кислота
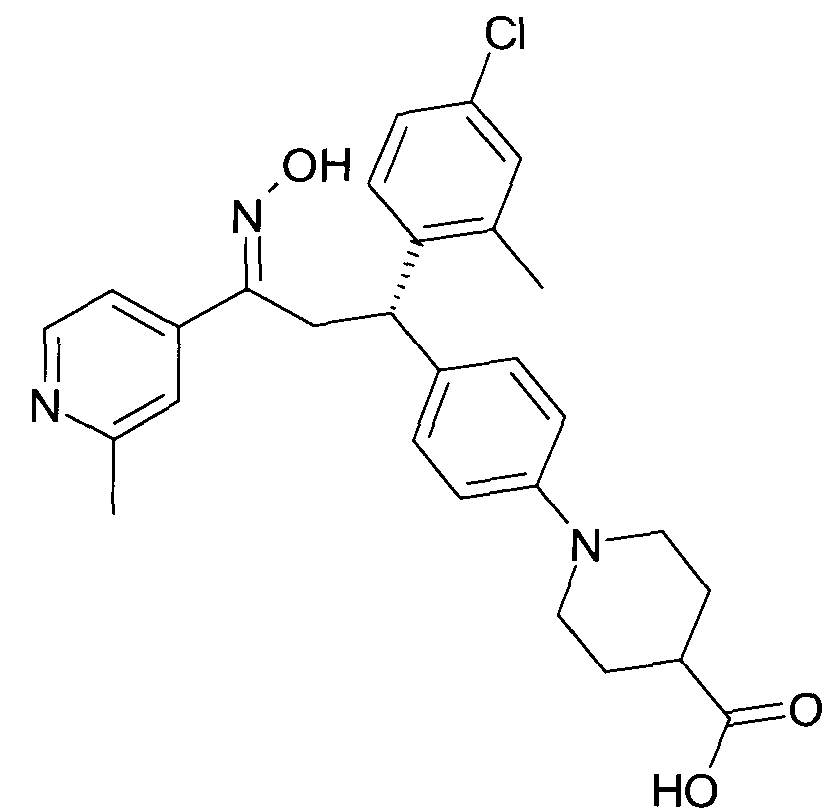
Стадия 1: 1-{4-[(S)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил1-фенил}-пиперидин-4-карбоновая кислота
По аналогии с примером 39, из (S)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она (пример 282, стадия 1) и этил пиперидин-4-карбоксилата в присутствии трис(дибензилиденацетон)дипалладия(0), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила и трет-бутоксида натрия в толуоле получили 1 -{4-[(S)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-фенил}-пиперидин-4-карбоновой кислоты этиловый эфир.
По аналогии с примером 169, стадия 2, из 1-{4-[(S)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-фенил}-пиперидин-4-карбоновой кислоты этилового эфира в присутствии 1M водного раствора гидроксида лития в тетрагидрофуране получили 1-{4-[(S)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-фенил}-пиперидин-4-карбоновую кислоту в виде желтой пены, MS (ESI+): m/z=477.2 ([M+H]+).
Стадия 2: 1-{4-[(3)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновая кислота
По аналогии с примером 132, стадия 6, из 1-{4-[(S)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-фенил}-пиперидин-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=490.3 ([M-H]-).
Пример 286
2-{4-[(S)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-малоновой кислоты диэтиловый эфир
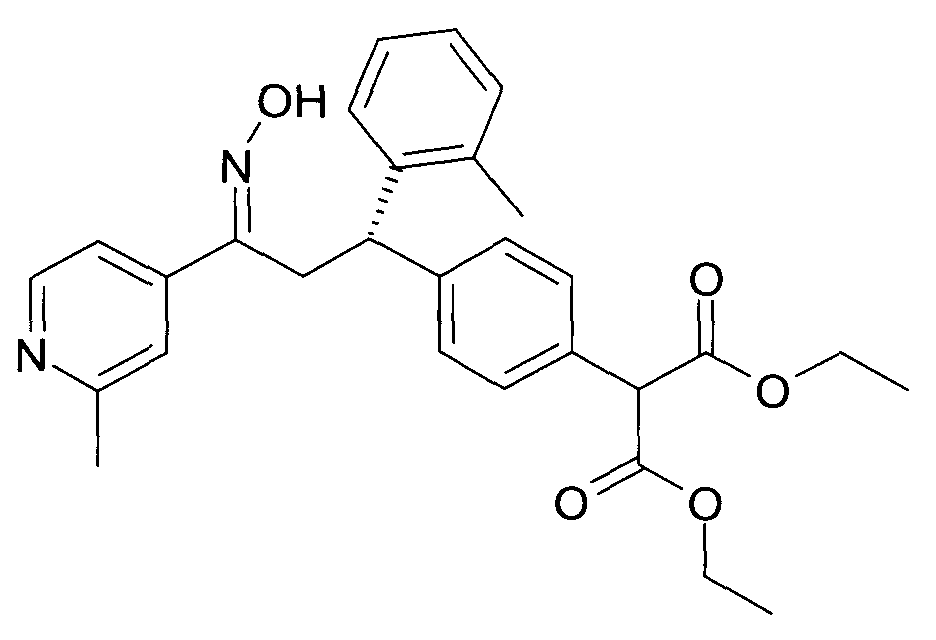
Стадия 1: (S)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
По аналогии с примером 74, стадия 5, из (S)-3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (пример 142, стадия 1) и 4-бром-2-метилпиридина получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=394.0 ([M+H]+, 1Br).
Стадия 2: 2-{4-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропилЧ-фенил}-малоновой кислоты диэтиловый эфир
К раствору (S)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он (600 мг) в диэтилмалонате (11 мл) добавили гидрид натрия (124 мг), трис(дибензилиденацетон)дипалладий(0) (81.4 мг) и 2-(ди-трет-бутилфосфино)бифенил (26.5 мг) при комнатной температуре. Реакционную смесь перемешивали при 135°С в течение 11/2 ч. Добавили насыщенный водный раствор хлорида аммония и этилацетата, фазы разделили и неорганическую фазу экстрагировали этилацетатом (2x). Объединенные органические слои промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (10% до 70% этилацетат в n-гептане) с получением соединения, указанного в заголовке, в виде светло-желтого масла (514 мг, 71%), MS (ESI+): m/z=474.3 ([M+H]+).
Стадия 3: 2-{4-[(S)-3-[(E)-гидроксимино1-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил1-фенил}-малоновой кислоты диэтиловый эфир
По аналогии с примером 1, стадия 2, из 2-{4-[(S)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-малоновой кислоты диэтилового эфира и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде смеси E и Z изомеров (2.7:1) в виде белого масла, MS (ESI+): m/z=489.3 ([M+H]+).
Пример 287
(R)-3-(4-этинил-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
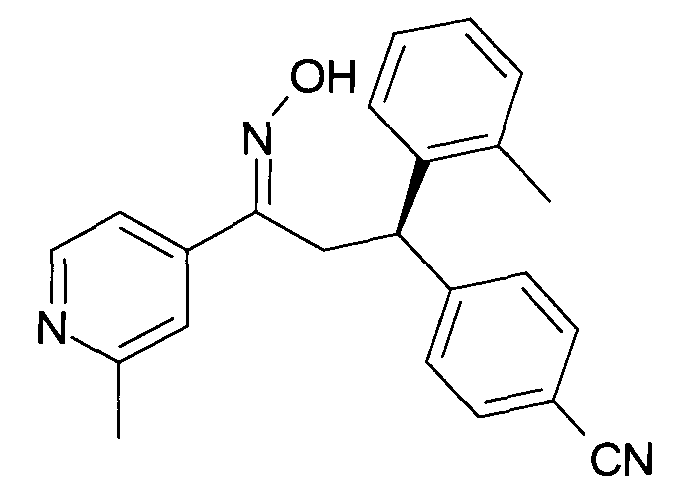
Стадия 1 (R)-1-(2-метил-пиридин-4-ил)-3-о-толил-3-(4-
триметилсиланилэтинил-фенил)-пропан-1-он
К раствору (R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 142, стадия 2, 150 мг) в пиперидине (3 мл) добавили в атмосфере аргона йодид меди(I) (3.6 мг) и тетракис-трифенилфосфин палладия(0) (22 мг). Реакционную смесь нагревали при 50°C и добавили этинилтриметилсилан (480 мкл) добавили. Реакционную смесь перемешивали при 50°C в течение ночи. Добавили воду и трет-бутилметиловый эфир, фазы разделили и неорганическую фазу экстрагировали трет-бутилметиловым эфиром (2x). Объединенные органические слои промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (15% до 50% этилацетат в n-гептане) с получением соединения, указанного в заголовке, в виде светло-желтого масла (105 мг, 61%), MS (ESI+): m/z=412.4 ([M+H]+).
Стадия 2: (R)-3-(4-Этинил-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
К раствору (R)-1-(2-метил-пиридин-4-ил)-3-о-толил-3-(4-триметилсиланилэтинил-фенил)-пропан-1-она (100 мг) в метаноле (5 мл) добавили при 0°C карбонат калия (3.4 мг). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Добавили насыщенный водный раствор хлорида аммония и этилацетата, фазы разделили и неорганическую фазу экстрагировали этилацетатом (2x). Объединенные органические слои промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (15% to 50% этилацетат в n-гептане) с получением соединения, указанного в заголовке, в виде бесцветного масла (60 мг, 95%), MS (ESI+): m/z=340.2 ([M+H]+).
Стадия 3: (R)-3-(4-Этинил-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 132, стадия 6, из (R)-3-(4-этинил-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=355.4 ([M+H]+).
Пример 288
{4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-уксусная кислота
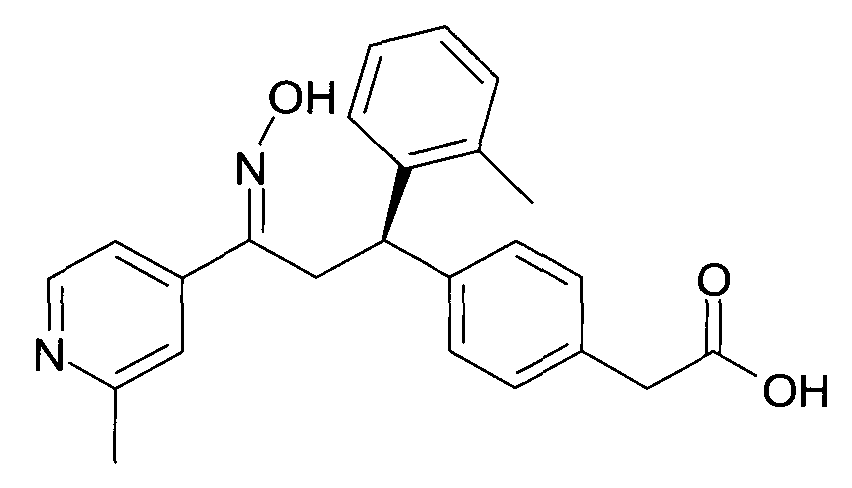
Стадия 1: (R)-2-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил) фенил)уксусная кислота
Смесь (R)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она (пример 142, стадия 2; 3.5 г, 8.88 ммоль), диэтилмалоната (67.5 г, 421 ммоль) гидрида натрия (724 мг, 18.1 ммоль), трис(дибензилиденацетон)дипалладия(0) (475 мг, 518 мкмоль) и 2-(ди-трет-бутилфосфино)бифенил (155 мг, 518 мкмоль) нагревали при 135°C в течение 90 мин. После охлаждения реакционную смесь разделили между нас.водн. раствором хлорида аммония и этилацетатом. Органический слой промыли солевым раствором, высушили над сульфатом магния, отфильтровали, и сконцентрировали. Остаток растворили в воде (13 мл) и по каплям добавили уксусную кислоту (19 мл, 19.8 ммоль) затем при охлаждении конц. серную кислоту (11.9 г, 116 ммоль) при температуре ниже 30°C. Реакционную смесь нагревали при 120°C в течение 16 ч, затем разделили между 2 М водным раствором гидроксида натрия и этилацетата. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали, и сконцентрировали под вакуумом. Остаток растворили в тетрагидрофуране (110 мл), после добавления 1M водного раствора гидроксида лития (350 мл, 350 ммоль) и метанола (110 мл) Реакционную смесь перемешивали в течение 3 ч при комнатной температуре. После добавления 1 М водного раствора гидросульфата калия (60 мл) и нас.водн. раствора хлорида аммония (100 мл) реакционную смесь экстрагировали этилацетатом. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали, и сконцентрировали. Хроматография (SiO2) дала соединение, указанное в заголовке, (1.96 г, 59%). Белая пена, MS (ESI+): m/z=374.3 ([M+H]+).
Стадия 2: {4-[(R)-3-[(E)-гидроксимино1-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-уксусная кислота
По аналогии с примером 132, стадия 6, из {4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-уксусной кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=389.4 ([M+H]+).
Пример 289
N-(2-гидрокси-этил)-2-{4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-ацетамид
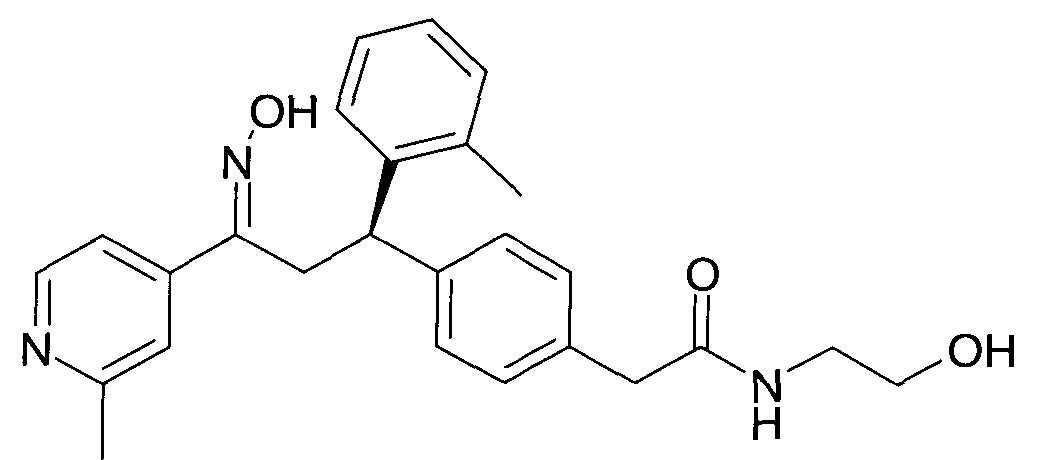
По аналогии с примером 207, стадия 2, {4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-уксусную кислоту (пример 288) связывали с 2-аминоэтанолом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветного масла, MS (ESI+): m/z=432.3 [M+H]+.
Пример 290
4'-{(R)-3-(2-хлор-пиридин-4-ил)-3-[(E)-гидроксиимино]-1-о-толил-пропил}-бифенил-4-карбоновая кислота
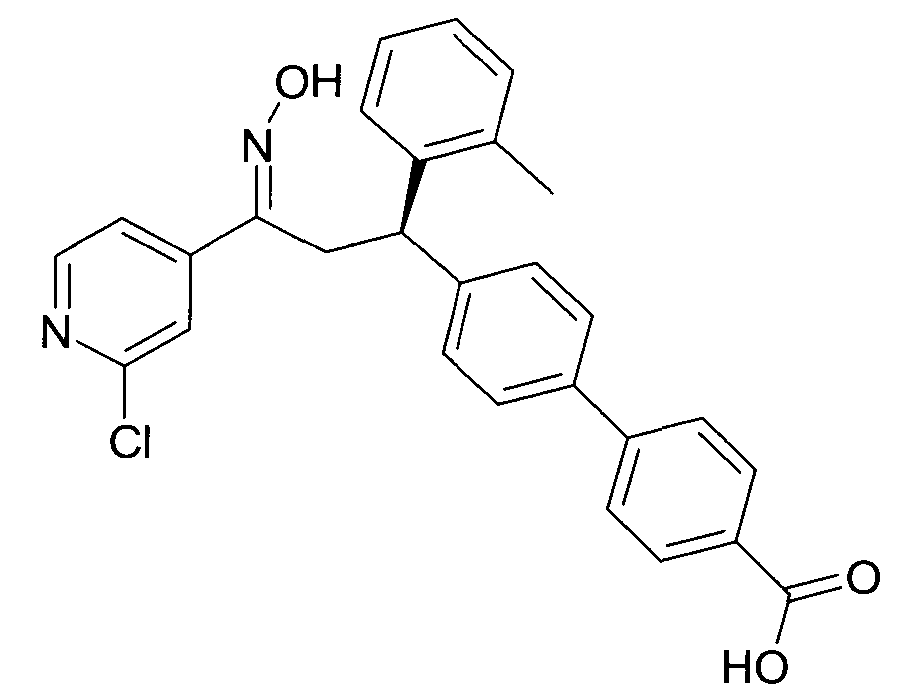
Стадия 1: 4'-[(R)-2-(метокси-метил-карбамоил)-1-о-толил-этил]-бифенил-4-карбоновая кислота
По аналогии с примером 74, стадия 6, из (R)-3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамида (пример 142, стадия 1) и 4-боронобензойной кислоты получили соединение, указанное в заголовке, в виде светло-коричневой пены, MS (ESI+): m/z=404.2 [M+H]+.
Стадия 2: 4'-[(R)-2-(метокси-метил-карбамоил)-1-о-толил-этил]-бифенил-4-карбоновая кислота, соль лития
К раствору 4'-[(R)-2-(метокси-метил-карбамоил)-1-о-толил-этил]-бифенил-4-карбоновой кислоты (1.59 г) в 1,4-диоксане (10 мл) добавили раствор гидроксида лития (0.067 М в 1,4-диоксане/воде, 52.9 мл), затем реакционную смесь перемешивали в течение 10 мин и сконцентрировали под вакуумом с получением соединения, указанного в заголовке,.
Стадия 3: 4'-[(R)-3-(2-хлор-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 74, стадия 5, из 4'-[(R)-2-(метокси-метил-карбамоил)-1-о-толил-этил]-бифенил-4-карбоновой кислоты литиевой соли, 2-хлор-4-йодопиридина и N,N-диизопропилэтиламина получили соединение, указанное в заголовке, в виде коричневой пены, MS (ESI-): m/z=454.1 [M-H]-.
Стадия 4: 4'-{(R)-3-(2-хлор-пиридин-4-ил)-3-[(E)-гидроксиимино]-1-о-толил-пропил}-бифенил-4-карбоновая кислота
По аналогии с примером 132, стадия 6, из 4'-[(R)-3-(2-хлор-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде серо-белой пены, MS (ESI-): m/z=469.1 ([M+H]+).
Пример 291
4'-[(R)-3-[(E)-гидроксимино]-1-о-толил-3-(2-трифторметил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота
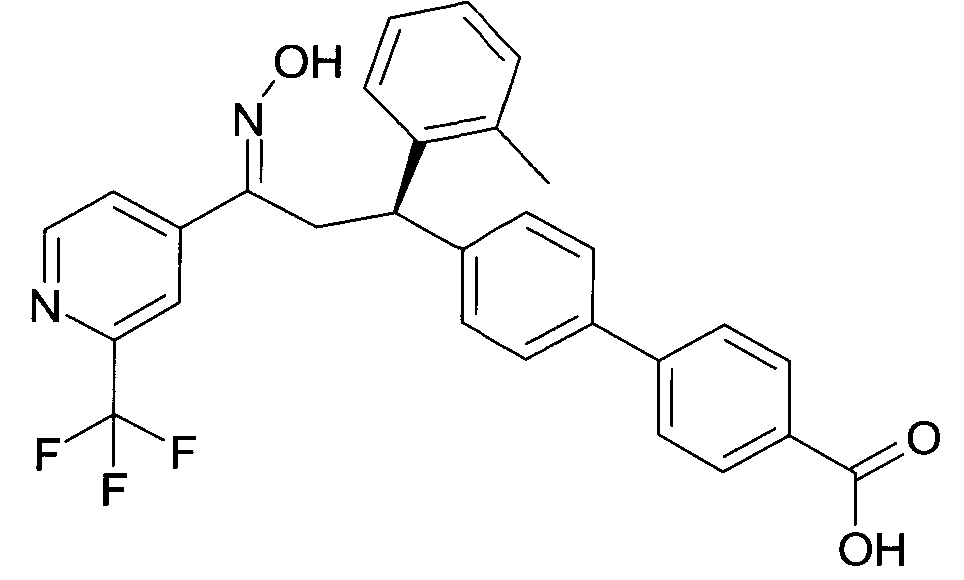
Стадия 1: 4'-[(R)-3-оксо-1-о-толил-3-(2-трифторметил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 74, стадия 5, из 4'-[(R)-2-(метокси-метил-карбамоил)-1-о-толил-этил]-бифенил-4-карбоновой кислоты литиевой соли (пример 290, стадия 2), 4-йодо-2-(трифторметил)пиридина и N,N-диизопропилэтиламина получили соединение, указанное в заголовке, в виде коричневой пены, MS (ESI-): m/z=488.3 [M-H]-.
Стадия 2: 4'-[(R)-3-[(E)-гидроксимино]-1-о-толил-3-(2-трифторметил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 132, стадия 6, из 4'-[(R)-3-оксо-1-о-толил-3-(2-трифторметил-пиридин-4-ил)-пропил]-бифенил-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде светло-коричневой пены, MS (ESI-): m/z=503.0 ([M-H]-).
Пример 292
4'-{(R)-3-(2-хлор-5-фтор-пиридин-4-ил)-3-[(E)-гидроксиимино]-1-о-толил-пропил}-бифенил-4-карбоновая кислота

Стадия 1; 4'-[(R)-3-(2-хлор-5-фтор-пиридин-4-ил)-3-оксо-1-о-толил-пропил1-бифенил-4-карбоновая кислота
По аналогии с примером 74, стадия 5, из 4'-[(R)-2-(метокси-метил-карбамоил)-1-о-толил-этил]-бифенил-4-карбоновой кислоты литиевой соли (пример 290, стадия 2), 2-хлор-5-фтор-4-йодопиридина и N,N-диизопропилэтиламина получили соединение, указанное в заголовке, в виде серо-белой пены, MS (ESI-): m/z=472.1 [M-H]-.
Стадия 2: 4'-{(R)-3-(2-хлор-5-фтор-пиридин-4-ил)-3-[(E)-гидроксиимино]-1-о-толил-пропил}-бифенил-4-карбоновая кислота
По аналогии с примером 132, стадия 6, из 4'-[(R)-3-(2-хлор-5-фтор-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде серо-белой пены, MS (ESI-): m/z=487.2 ([M-H]-).
Пример 293
4'-{(R)-3-(5-хлор-2-фтор-пиридин-4-ил)-3-[(E)-гидроксиимино]-1-о-толил-пропил}-бифенил-4-карбоновая кислота
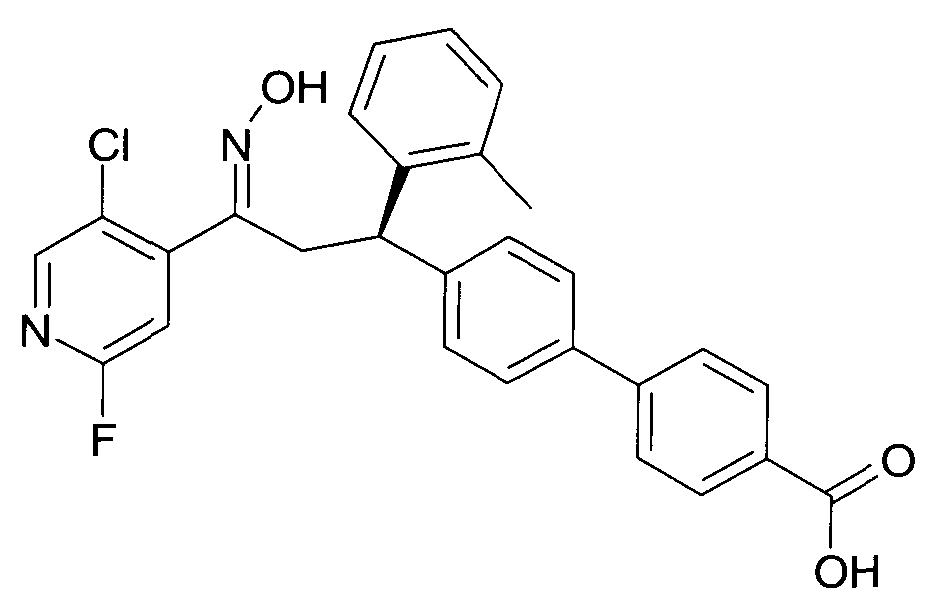
Стадия 1: 4'-[(R)-3-(5-хлор-2-фтор-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 74, стадия 5, из 4'-[(R)-2-(метокси-метил-карбамоил)-1-о-толил-этил]-бифенил-4-карбоновой кислоты литиевой соли (пример 290, стадия 2) и 5-хлор-2-фтор-4-йодопиридина при -90°C получили соединение, указанное в заголовке, в виде серо-белой пены, MS (ESI-): m/z=472.0 [M-H]-.
Стадия 2: 4'-{(R)-3-(5-хлор-2-фтор-пиридин-4-ил)-3-[(E)-гидроксиимино]-1-о-толил-пропилИзифенил-4-карбоновая кислота
По аналогии с примером 132, стадия 6, из 4'-[(R)-3-(5-хлор-2-фтор-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде светло-желтого масла, MS (ESI-): m/z=487.3 ([M-H]-).
Пример 294
4'-{(R)-3-(2,6-диметил-пиридин-4-ил)-3-[(E)-гидроксиимино]-1-о-толил-пропил}-бифенил-4-карбоновая кислота
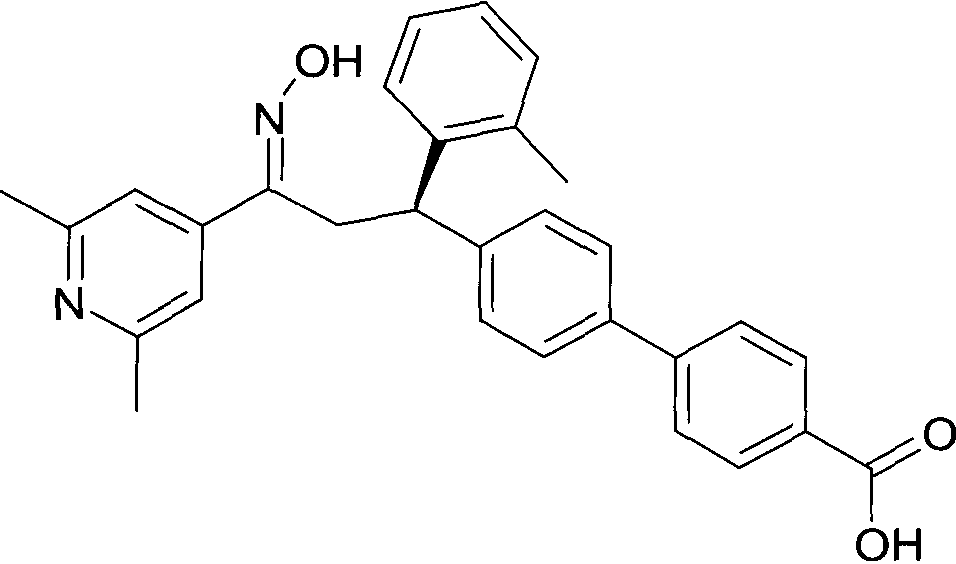
Стадия 1: 4'-[(R)-3-(2,6-диметил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 74, стадия 5, из 4'-[(R)-2-(метокси-метил-карбамоил)-1-о-толил-этил]-бифенил-4-карбоновой кислоты литиевой соли (пример 290, стадия 2) и 4-бром-2,6-диметилпиридина при -90°C получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI-): m/z=448.1 [M-H]-.
Стадия 2: 4'-{(R)-3-(2,6-диметил-пиридин-4-ил)-3-[(E)-гидроксиимино]-1-о-толил-пропил}-бифенил-4-карбоновая кислота
По аналогии с примером 132, стадия 6, из 4'-[(R)-3-(2,6-диметил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бифенил-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белого полутвердого вещества, MS (ESI): m/z 463.3 ([M-H]-).
Пример 295
3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
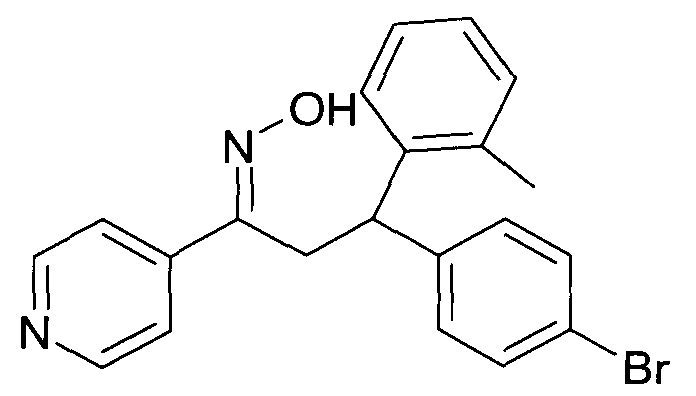
Стадия 1: 3-(4-бром-фенил)-1-пиридин-4-ил-пропенон
По аналогии с примером 11, стадия 1, из 4-бромбензальдегида и 4-ацетилпиридина в присутствии гранулы гидроксида натрия получили соединение, указанное в заголовке, в виде желтого осадка.
Стадия 2: 3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-он
По аналогии с примером 1, стадия 1, из (E)- 3-(4-бром-фенил)-1-пиридин-4-ил-пропенона и о-толилбороновой кислоты получили соединение, указанное в заголовке, в виде желтой пены, MS (ESI+): m/z=380.1 ([M+H]+, 1Br).
Стадия 3: 3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она оксим
По аналогии с примером 132, стадия 6, из 3-(4-бром-фенил)-1-пиридин-4-ил-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=395.1 ([M+H]+, 1Br).
Пример 296
4'-[(S)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота
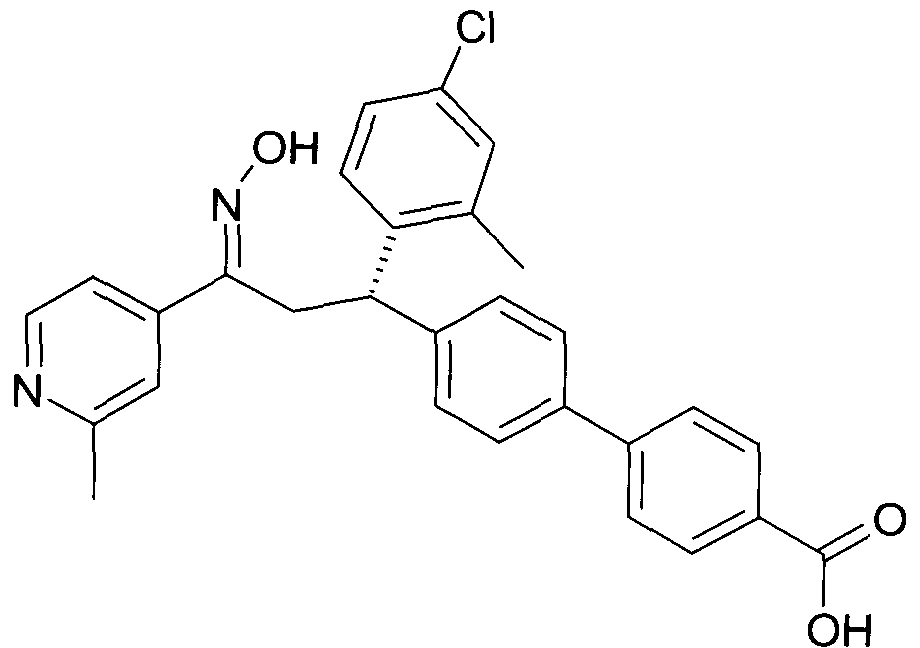
Стадия 1: 4'-[(S)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 74, стадия 6, из (S)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она (пример 282, стадия 1) и 4-боронобензойной кислоты получили соединение, указанное в заголовке, в виде желтой пены.
Стадия 2: 4'-[(S)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 132, стадия 6, из 4'-[(S)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-бифенил-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=483.1 ([M-H]-).
Пример 297
4'-[(R)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота

Стадия 1: 4'-[(R)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-бифенил-4-карбоновая кислота
По аналогии с примером 74, стадия 6, из (R)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она (пример 282, стадия 1) и 4-боронобензойной кислоты получили соединение, указанное в заголовке, коричневая пена, MS (ESI+): m/z=470.1 ([M-H]-).
Стадия 2: 4'-[(R)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил1-бифенил-4-карбоновая кислота
По аналогии с примером 132, стадия 6, из 4'-[(R)-1-(4-хлор-2-метил-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-бифенил-4-карбоновой кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=485.3 ([M+H]+).
Пример 298
4'-{(R)-3-[(E)-гидроксимино]-4-пиридин-4-ил-1-о-толил-бутил}-бифенил-4-карбоновая кислота
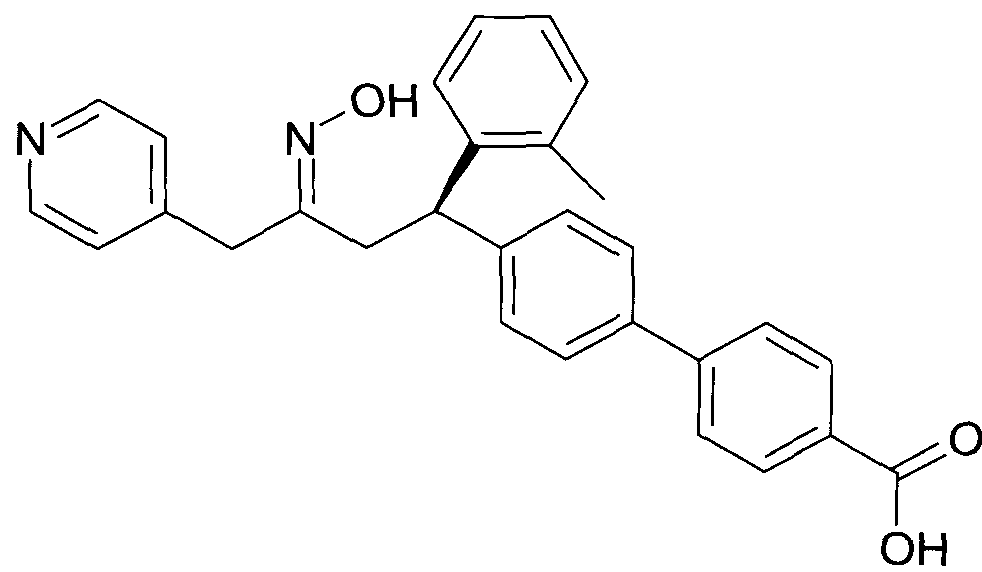
Стадия 1: (R)-4-(4-бром-фенил)-1-пиридин-4-ил-4-о-толил-бутан-2-он
К раствору 4-метилпиридина (308 мг, 3.31 ммоль) в тетрагидрофуране при -78°C по каплям добавили раствор n-бутиллития (1.6 М в гексане, 2.07 мл, 3.31 ммоль). Реакционную смесь перемешивали в течение 1 часа при комнатной температуре и снова охладили до -78°C. Добавили (R)-3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамид (пример 142, стадия 1; 400 мг, 1.1 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Добавили насыщенный раствор гидрокарбоната натрия и этилацетата, фазы разделили и неорганическую фазу экстрагировали этилацетатом (2х). Объединенные органические слои промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (10% метанол в дихлорметане) с получением соединения, указанного в заголовке, в виде желтого масла (51%), MS (ESI+): m/z=394.0 ([M+H]+).
Стадия 2: (R,Z)-4-(4-бром-фенил)-1-пиридин-4-ил-4-о-толил-бутан-2-она оксим
По аналогии с примером 1, стадия 2, из (R)-4-(4-бром-фенил)-1-пиридин-4-ил-4-о-толил-бутан-2-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=409.1 ([M+H]+, 1Br).
Стадия 3: 4'-{(R)-3-[(E)-гидроксимино1-4-пиридин-4-ил-1-о-толил-бутил}-бифенил-4-карбоновая кислота
По аналогии с примером 74, стадия 6, из (R,Z)-4-(4-бром-фенил)-1-пиридин-4-ил-4-о-толил-бутан-2-она оксима и 4-боронобензойной кислоты получили 4'-{(R)-3-[(2)-гидроксиимино]-4-пиридин-4-ил-1-о-толил-бутил}-бифенил-4-карбоновую кислоту.
Неочищенный продукт растворили в 1,2-диметоксиметане и добавили раствор соляной кислоты (4 М в 1,4-диоксане). Реакционную смесь перемешивали при 50°C в течение 16 часов. Добавили насыщенный водный раствор хлорида аммония и этилацетата, фазы разделили и неорганическую фазу экстрагировали этилацетатом (2х). Объединенные органические слои промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (0% до 10% метанол в дихлорметане) с получением соединения, указанного в заголовке, в виде желтого осадка (68%), MS (ESI+): m/z=451.2 ([M+H]+).
Пример 299
1-{4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пирролидин-2-он
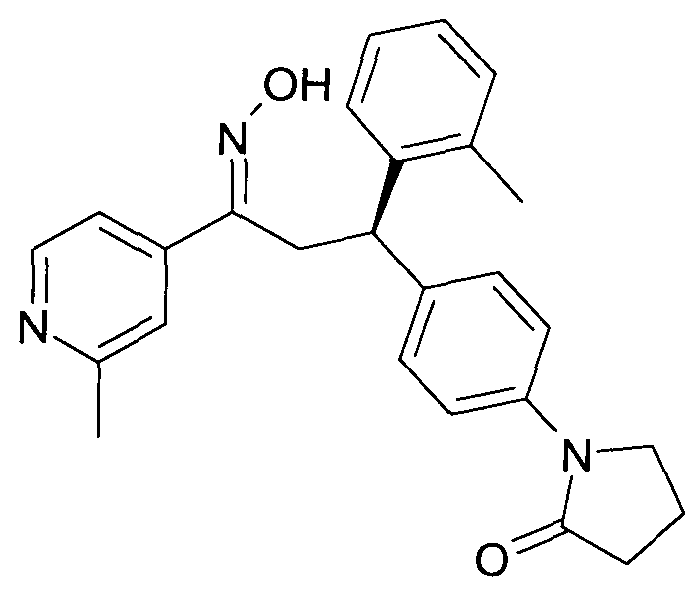
Стадия 1: 1-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил1-фенил}-пирролидин-2-он
По аналогии с примером 39, из (R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 142, стадия 2) и пирролидин-2-он в присутствии трис(дибензилиденацетон)дипалладия(0), 4,5-бис(дифенилфосфино)-9,9-диметилксантена и карбоната цезия в 1,4-диоксане получили соединение, указанное в заголовке, в виде белого полутвердого вещества, MS (ESI+): m/z=399.1 ([M+H]+).
Стадия 2: 1 -{4-[(R)-3-[(E)-гидроксимино1-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-пирролидин-2-он
По аналогии с примером 132, стадия 6, из 1-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-пирролидин-2-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=414.3 ([M+H]+).
Пример 300
3-{4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фениламино}-циклобутанкарбоновая кислота
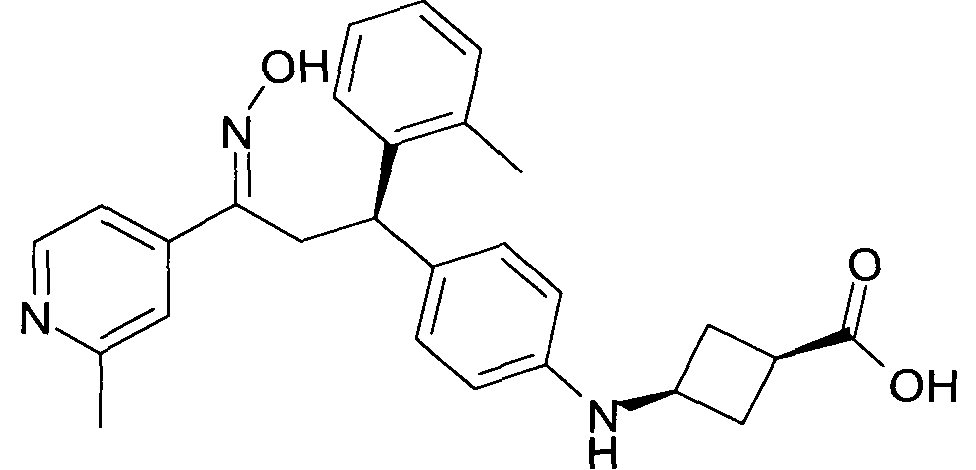
Стадия 1: 3-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фениламино}-циклобутанкарбоновая кислота
По аналогии с примером 39, из (R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 142, стадия 2) и цис-этила 3-аминоциклобутанкарбоксилата гидрохлорида в присутствии трис(дибензилиденацетон)дипалладия(0), 4,5-бис(дифенилфосфино)-9,9-диметилксантена и карбоната цезия в 1,4-диоксане получили 3-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фениламино}-циклобутанкарбоновой кислоты этиловый эфир.
По аналогии с примером 169, стадия 2, из 3-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фениламино}-циклобутанкарбоновой кислоты этилового эфира в присутствии 1M водного раствора гидроксида лития в тетрагидрофуране получили 3-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фениламино}-циклобутанкарбоновую кислоту в виде желтой пены, MS (ESI+): m/z=429.2 ([M+H]+).
Стадия 2: 3-{4-[(R)-3-[(E)-гидроксимино1-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил1-фениламино}-циклобутанкарбоновая кислота
По аналогии с примером 132, стадия 6, из 3-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фениламино}-циклобутанкарбоновой кислоты в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=444.2 ([M+H]+).
Пример 301
4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-((R)-1-гидроксипропан-2-ил)бензамид
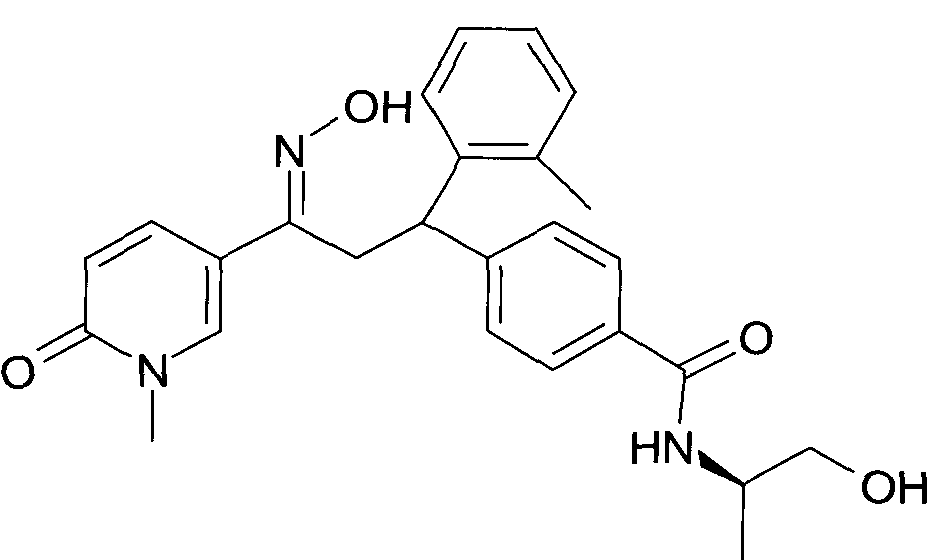
Стадия 1: N-((R)-1-Гидроксипропан-2-ил)-4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с (R)-2-аминопропан-1-олом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=433.3 [M+H]+.
Стадия 2: 4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-((R)-1-гидроксипропан-2-ил)бензамид
По аналогии с примером 151, стадия 3, N-((R)-1-гидроксипропан-2-ил)-4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=448.2 [M+H]+.
Пример 302
4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-((S)-1-гидроксипропан-2-ил)бензамид
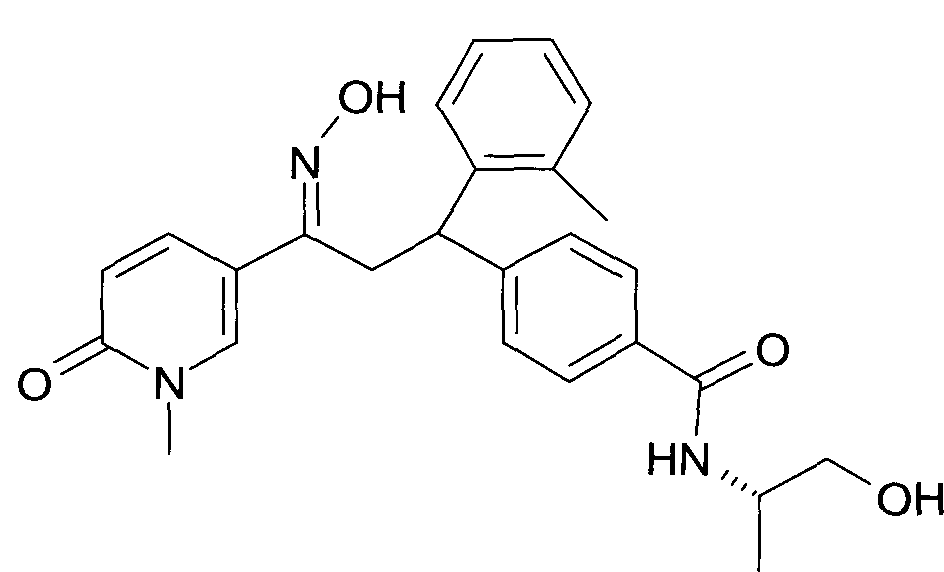
Стадия 1: N-((S)-1-Гидроксипропан-2-ил)-4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с (S)-2-аминопропан-1-олом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=433.3 [M+H]+.
Стадия 2: 4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-((S)-1-гидроксипропан-2-ил)бензамид
По аналогии с примером 151, стадия 3, N-((S)-1-гидроксипропан-2-ил)-4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=448.2 [M+H]+.
Пример 303
(E)-N-(1-гидрокси-2-метилпропан-2-ил)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид
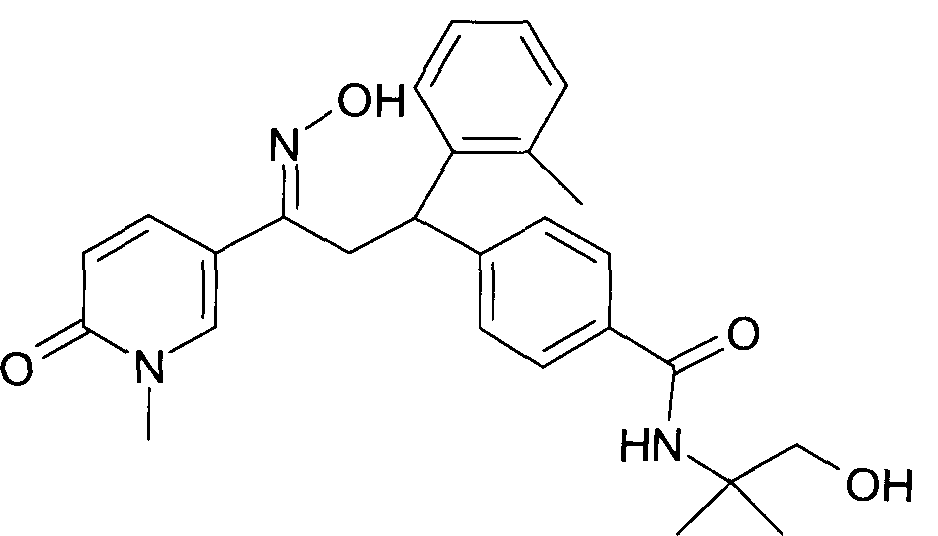
Стадия 1: N-(1-гидрокси-2-метилпропан-2-ил)-4-(3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с 2-амино-2-метилпропан-1-олом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=447.3 [M+H]+.
Стадия 2: (E)-N-(1-гидрокси-2-метилпропан-2-ил)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид
По аналогии с примером 151, стадия 3, N-(1-гидрокси-2-метилпропан-2-ил)-4-(3-(1 -метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде серо-белого осадка содержащего <10% соответствующего Z изомера, MS (ESI+): m/z=462.3 [M+H]+.
Пример 304
(E)-N-(1,3-дигидроксипропан-2-ил)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид
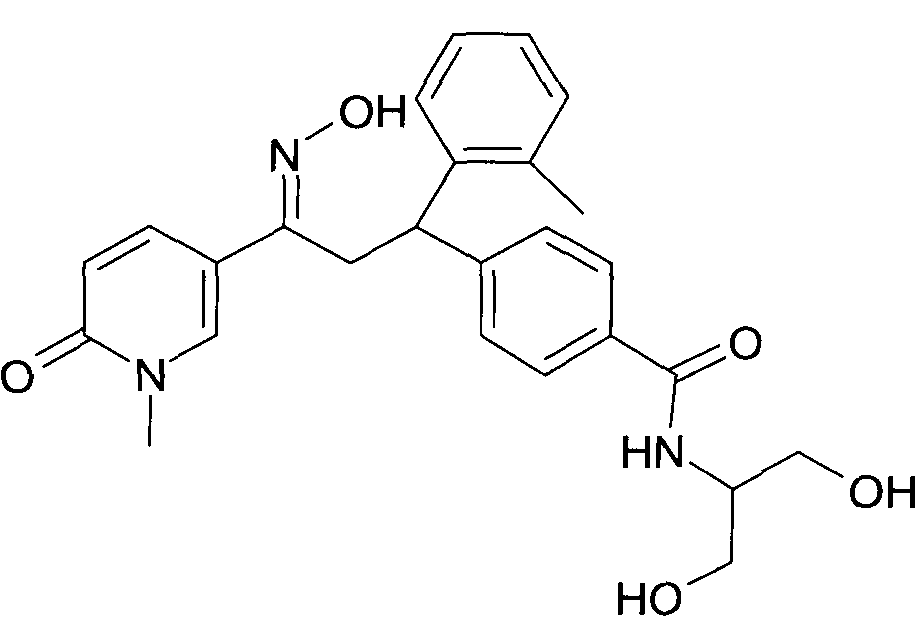
Стадия 1: N-(1,3-дигидроксипропан-2-ил)-4-(3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойная кислота (пример 207, стадия 1) связывали с 2-аминопропан-1,3-диолом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=449.2 [M+H]+.
Стадия 2: (E)-N-(1,3-дигидроксипропан-2-ил)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид
По аналогии с примером 151, стадия 3, N-(1,3-дигидроксипропан-2-ил)-4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде серо-белого осадка содержащего <10% соответствующего Z изомера, MS (ESI+): m/z=464.2 [M+H]+.
Пример 305
N-((R)-1-гидрокси-3-метилбутан-2-ил)-4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид
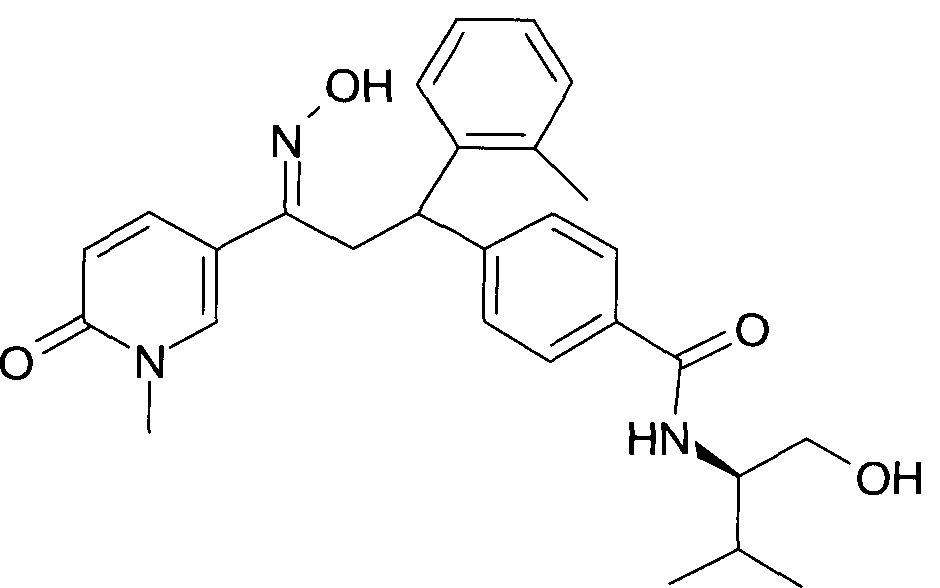
Стадия 1: N-((R)-1-гидрокси-3-метилбутан-2-ил)-4-(3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с (R)-2-амино-3-метилбутан-1-олом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=461.3 [M+H]+.
Стадия 2: N-((R)-1-гидрокси-3-метилбутан-2-ил)-4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид
По аналогии с примером 151, стадия 3, N-((R)-1-гидрокси-3-метилбутан-2-ил)-4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде серо-белого осадка содержащего <10% соответствующего Z изомера, MS (ESI+): m/z=476.2 [M+H]+.
Пример 306
N-((R)-1-гидрокси-3-метилбутан-2-ил)-4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид

Стадия 1: N-((3)-1-гидрокси-3-метилбутан-2-ил)-4-(3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с (3)-2-амино-3-метилбутан-1-олом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=461.3 [M+H]+.
Стадия 2: N-((S)-1-гидрокси-3-метилбутан-2-ил)-4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид
По аналогии с примером 151, стадия 3, N-((S)-1-гидрокси-3-метилбутан-2-ил)-4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде серо-белого осадка содержащего <10% соответствующего Z изомера, MS (ESI+): m/z=476.2 [M+H]+.
Пример 307
N-((R)-2,3-дигидроксипропил)-4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толилпропил)бензамид
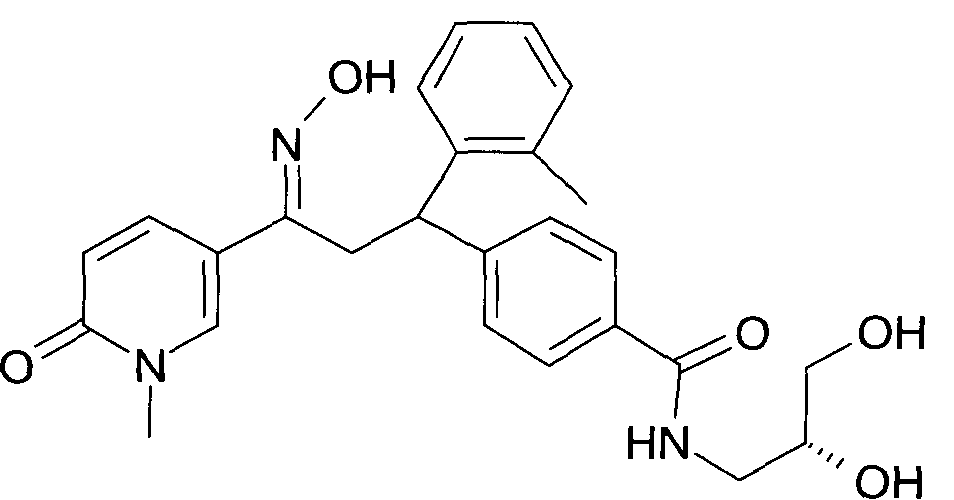
Стадия 1: N-((R)-2,3-дигидроксипропил)-4-(3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с (R)-3-аминопропан-1,2-диолом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=449.3 [M+H]+.
Стадия 2; N-((R)-2.3-дигидроксипропил)-4-((E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензамид
По аналогии с примером 151, стадия 3, N-((R)-2,3-дигидроксипропил)-4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде серо-белого осадка содержащего <10% соответствующего Z изомера, MS (ESI+): m/z=464.3 [M+H]+.
Пример 308
(E)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-(1-(гидроксиметил)циклопропил)бензамид
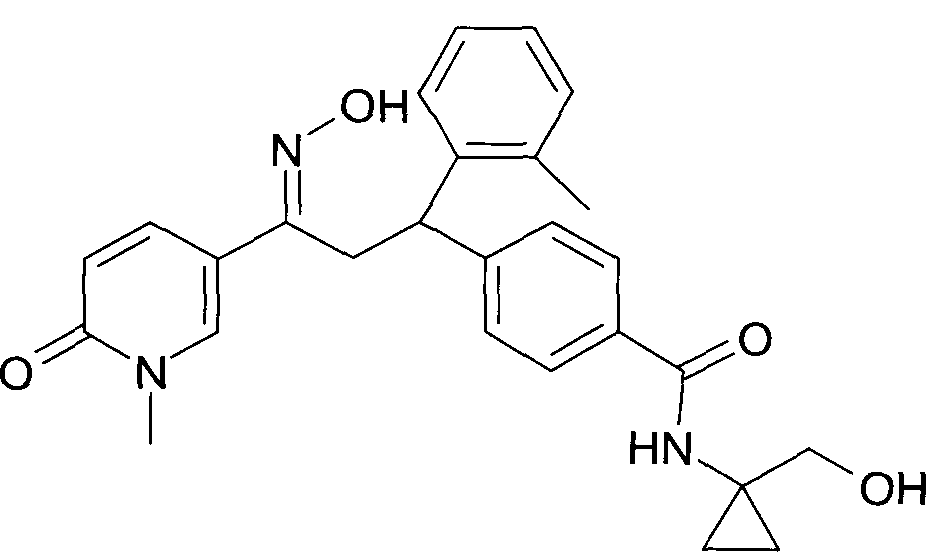
Стадия 1: N-(1-(гидроксиметил)циклопропил)-4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с (1-аминоциклопропил)метанола гидрохлоридом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=445.4 [M+H]+.
Стадия 2: (E)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-(1-(гидроксиметил)циклопропил)бензамид
По аналогии с примером 151, стадия 3, N-(1-(гидроксиметил)циклопропил)-4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде серо-белого осадка содержащего <10% соответствующего Z изомера, MS (ESI+): m/z=460.4 [M+H]+.
Пример 309
(E)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-(3,3,3-трифтор-2-гидроксипропил)бензамид
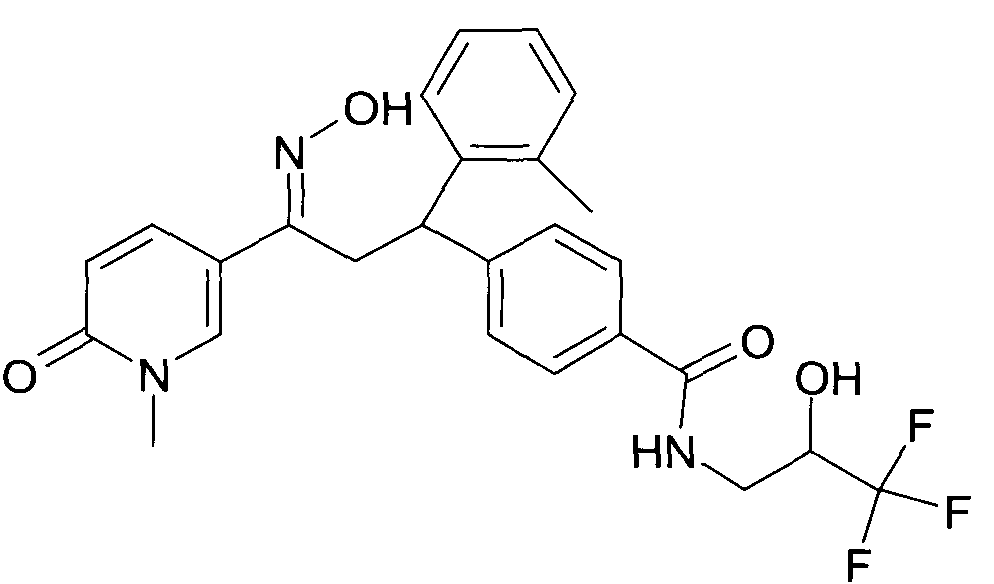
Стадия 1: 4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)-N-(3,3,3-трифтор-2-гидроксипропил)бензамид
По аналогии с примером 207, стадия 2, 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с 3-амино-1,1,1-трифторпропан-2-олом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=487.4 [M+H]+.
Стадия 2: (E)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-(3,3,3-трифтор-2-гидроксипропил)бензамид
По аналогии с примером 151, стадия 3, 4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)-N-(3,3,3-трифтор-2-гидроксипропил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде серо-белого осадка содержащего <10% соответствующего Z изомера, MS (ESI+): m/z=502.2 [M+H]+.
Пример 310
(E)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-(2-(метилсульфонил)этил)бензамид
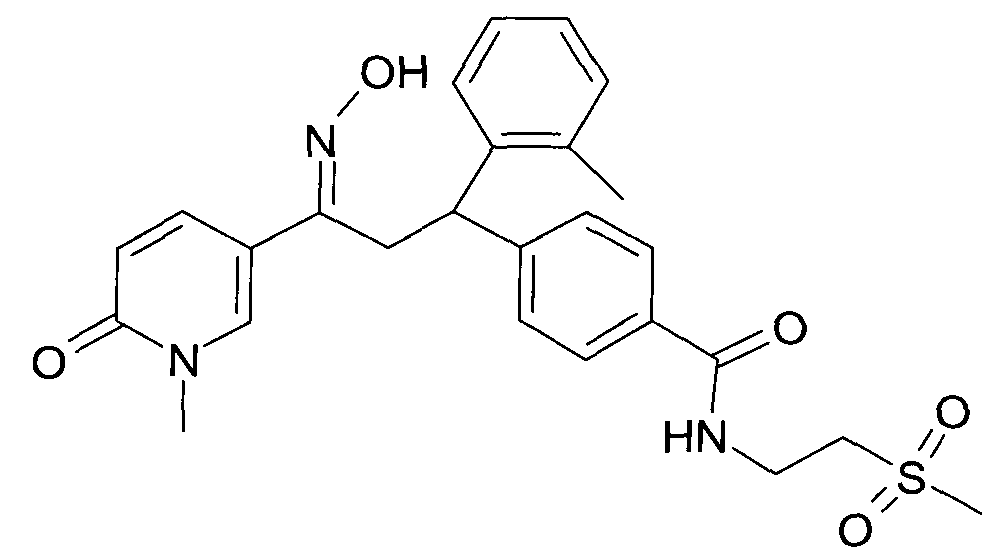
Стадия 1: 4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)-N-(2-(метилсульфонил)этил)бензамид
По аналогии с примером 207, стадия 2, 4-[3-(1 -метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойную кислоту (пример 207, стадия 1) связывали с 2-(метилсульфонил)этанамином, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде светло-коричневого полутвердого вещества, MS (ESI-): m/z=479.1 [M-H]-.
Стадия 2: (E)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)-N-(2-(метилсульфонил)этил)бензамид
По аналогии с примером 151, стадия 3, 4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)-N-(2-(метилсульфонил)этил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде серо-белого осадка содержащего <10% соответствующего Z изомера, MS (ESI+): m/z=496.2 [M+H]+.
Пример 311
4-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-N-(2-гидрокси-этил)-бензамид
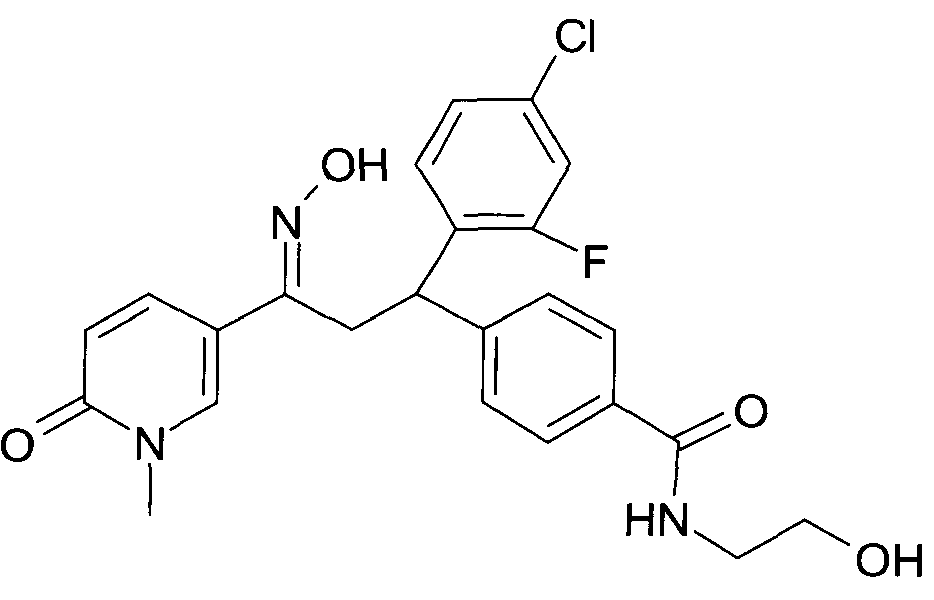
Стадии 1-4: 4-[1-(4-хлор-2-фтор-фенил)-3-(1-метил-6-оксо-1.6-дигидро-пиридин-3-ил)-3-оксо-пропил1-бензойная кислота
По аналогии с примером 203, стадия 1, (Е)-3-(4-хлор-2-фторфенил)-1-(6-метоксипиридин-3-ил)проп-2-ен-1-он (пример 237, стадия 1) взаимодействовал с 4-метоксикарбонилфенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C. Продукт этой реакции не может быть получен чистым и взаимодействовал по аналогии с примером 162, стадия 2 с концентрированной водной HCl в 1,4-диоксане с получением светло-желтого осадк, который использовали на следующей стадии без дополнительной очистки. По аналогии с примером 161, стадия 1, указанное соединение взаимодействовало с йодометаном в присутствии карбоната калия. По аналогии с примером 169, стадия 2, метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде серо-белого осадка, котоый очистили экстракцией. MS (ESI-): m/z=412.0 [M-H]-.
Стадия 5: 4-[1-(4-хлор-2-фтор-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-N-(2-гидрокси-этил)-бензамид
По аналогии с примером 207, стадия 2, 4-[1-(4-хлор-2-фтор-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-бензойную кислоту связывали с этаноламином, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=457.1 [M+H]+.
Стадия 2: 4-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино1-3-(1 -метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-N-(2-гидрокси-этил)-бензамид
По аналогии с примером 151, стадия 3, 4-[1-(4-хлор-2-фтор-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-N-(2-гидрокси-этил)-бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветной пены, содержащего 7% соответствующего Z изомера, MS (ESI+): m/z=472.2 [M+H]+.
Пример 312
4-((E)-1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-((R)-2,3-дигидроксипропил)бензамид
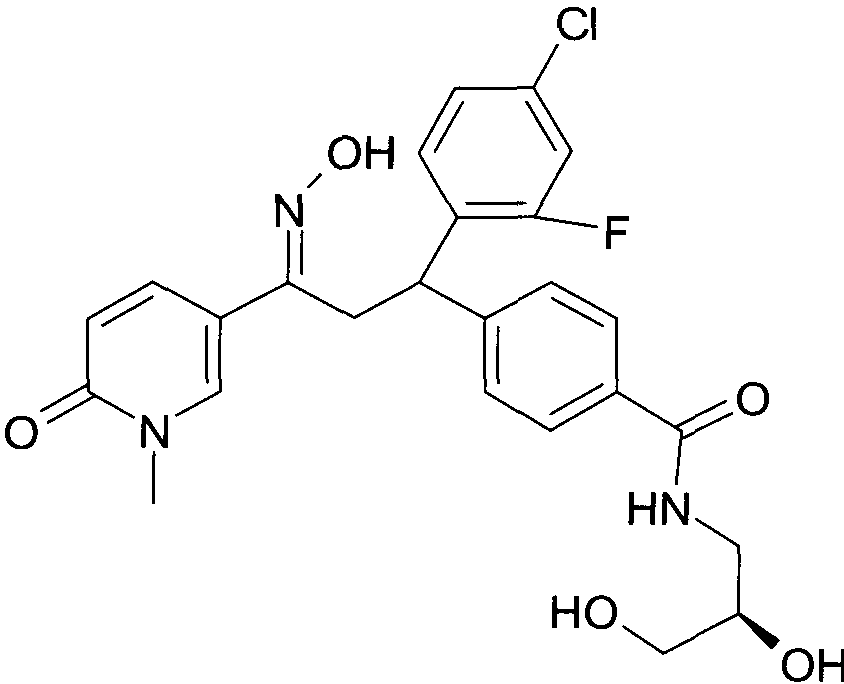
Стадия 1: 4-(1-(4-хлор-2-фторфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-N-((R)-2,3-дигидроксипропил)бензамид
По аналогии с примером 207, стадия 2, 4-[1-(4-хлор-2-фтор-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-бензойную кислоту (пример 311, стадия 4) связывали с (R)-3-амино-1,2-пропандиолом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=487.3 [M+H]+.
Стадия 2: 4-((E)-1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-((R)-2,3-дигидроксипропил)бензамид
По аналогии с примером 151, стадия 3, 4-(1-(4-хлор-2-фторфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-N-((R)-2,3-дигидроксипропил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, содержащего <10% соответствующего Z изомера, MS (ESI+): m/z=502.1 [M+H]+.
Пример 313
4-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-N-(2-метансульфонил-этил)-бензамид
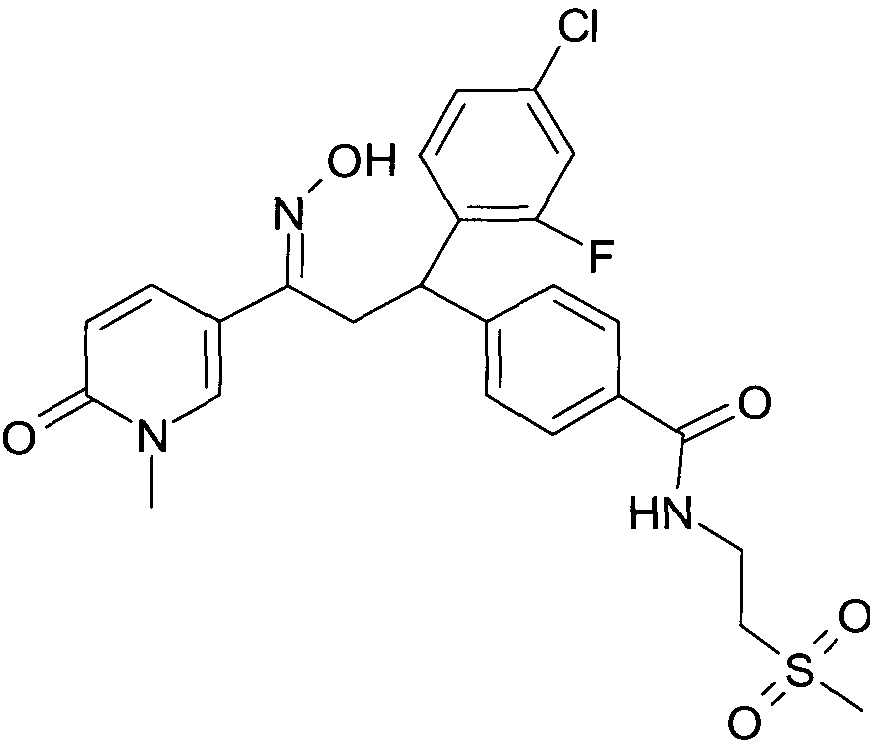
Стадия 1: 4-[1-(4-хлор-2-фтор-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-N-(2-метансульфонил-этил)-бензамид
По аналогии с примером 207, стадия 2, 4-[1-(4-хлор-2-фтор-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-бензойную кислоту (пример 311, стадия 4) связывали с 2-метансульфонил-этиламином, используя бензотриазол-1 -илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=519.2 [M+H]+.
Стадия 2: 4-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино1-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-N-(2-метансульфонил-этил)-бензамид
По аналогии с примером 151, стадия 3, 4-[1-(4-хлор-2-фтор-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-N-(2-метансульфонил-этил)-бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветной пены, содержащего 3% соответствующего Z изомера, MS (ESI+): m/z=534.1 [M+H]+.
Пример 314
(E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он
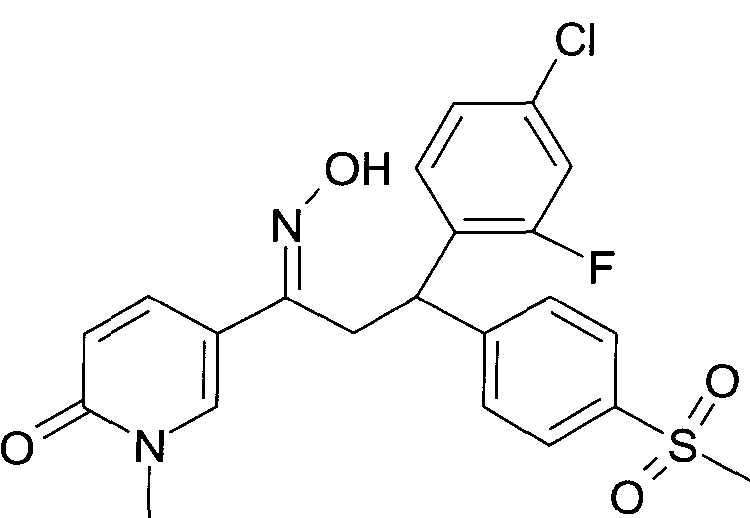
Стадия 1: (E)-5-(3-(4-хлор-2-фторфенил)акрилоил)пиридин-2(1H)-он
По аналогии с примером 162, стадия 2, (E)-3-(4-хлор-2-фторфенил)-1-(6-метоксипиридин-3-ил)проп-2-ен-1-он (пример 237, стадия 1) взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=278.0 [M+H]+.
Стадия 2: (E)-5-(3-(4-хлор-2-фторфенил)акрилоил)-1-метилпиридин-2(1H)-он
По аналогии с примером 161, стадия 1, (E)-5-(3-(4-хлор-2-фторфенил)акрилоил)пиридин-2(1H)-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде желтого осадка, MS (ESI+): m/z=292.0 [M+H]+.
Стадия 3: 5-(3-(4-хлор-2-фторфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-1-метилпиридин-2(1H)-он
По аналогии с примером 203, стадия 1, (E)-5-(3-(4-хлор-2-фторфенил)акрилоил)-1-метилпиридин-2(1H)-он (пример 314, стадия 2) взаимодействовал с 4-(метилсульфонил)фенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=448.0 [M+H]+.
Стадия 4: (E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-(3-(4-хлор-2-фторфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-1-метилпиридин-2(1H)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=463.1 [M+H]+.
Пример 315
(E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(3-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он
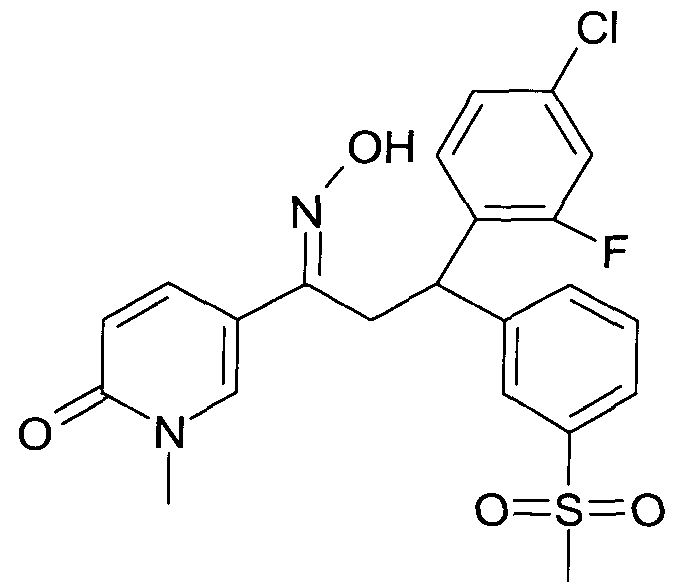
Стадия 1: 5-(3-(4-хлор-2-фторфенил)-3-(3-(метилсульфонил)фенил) пропаноил)-1-метилпиридин-2(1H)-он
По аналогии с примером 203, стадия 1, (E)-5-(3-(4-хлор-2-фторфенил)акрилоил)-1-метилпиридин-2(1H)-он (пример 314, стадия 2) взаимодействовал с 3-(метилсульфонил)фенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде желтого осадка, MS (ESI+): m/z=448.0 [M+H]+.
Стадия 2: (E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(3-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-(3-(4-хлор-2-фторфенил)-3-(3-(метилсульфонил)фенил)пропаноил)-1-метилпиридин-2(1H)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=463.1 [M+H]+.
Пример 316
(E)-5-(3-(4-хлор-2-фторфенил)-3-(4-(этилсульфонил)фенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он
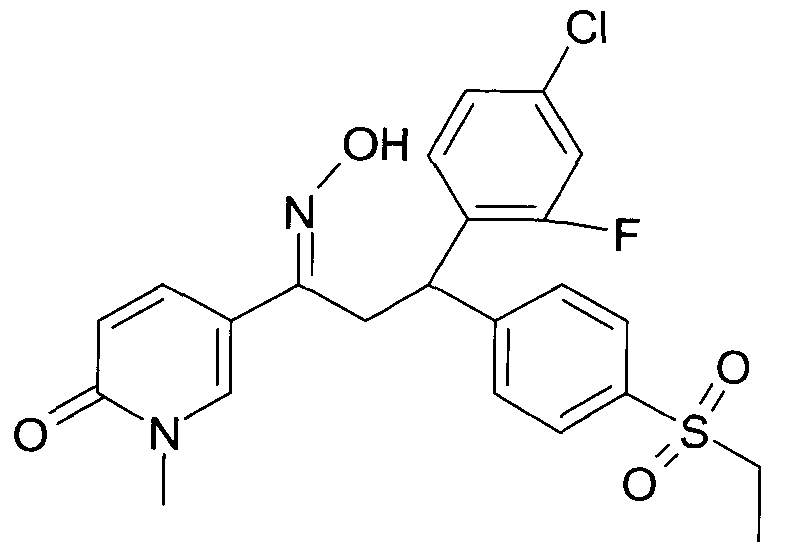
Стадия 1: 5-(3-(4-хлор-2-фторфенил)-3-(4-(этилсульфонил)фенил) пропаноил)-1-метилпиридин-2(1H)-он
По аналогии с примером 203, стадия 1, (E)-5-(3-(4-хлор-2-фторфенил)акрилоил)-1-метилпиридин-2(1H)-он (пример 314, стадия 2) взаимодействовал с 4-(этилсульфонил)фенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(1)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде желтой пены, MS (ESI+): m/z=462.2 [M+H]+.
Стадия 2: (E)-5-(3-(4-хлор-2-фторфенил)-3-(4-(этилсульфонил)фенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-(3-(4-хлор-2-фторфенил)-3-(4-(этилсульфонил)фенил)пропаноил)-1-метилпиридин-2(1H)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=477.0 [M+H]+.
Пример 317
(E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(4-(гидроксиметил)фенил)пропил)-1-метилпиридин-2(1H)-он

Стадия 1: 5-(3-(4-хлор-2-фторфенил)-3-(4-(гидроксиметил)фенил)пропаноил)-1-метилпиридин-2(1H)-он
По аналогии с примером 203, стадия 1, (E)-5-(3-(4-хлор-2-фторфенил)акрилоил)-1-метилпиридин-2(1H)-он (пример 314, стадия 2) взаимодействовал с 4-(гидроксиметил)фенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=400.2 [M+H]+.
Стадия 2: (E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(4-(гидроксиметил)фенил)-пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-(3-(4-хлор-2-фторфенил)-3-(4-(гидроксиметил)фенил)пропаноил)-1-метилпиридин-2(1 Н)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, содержащего 15% соответствующего Z изомера, MS (ESI+): m/z=415.2 [M+H]+.
Пример 318
(E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(4-гидроксифенил)пропил)-1-метилпиридин-2(1H)-он
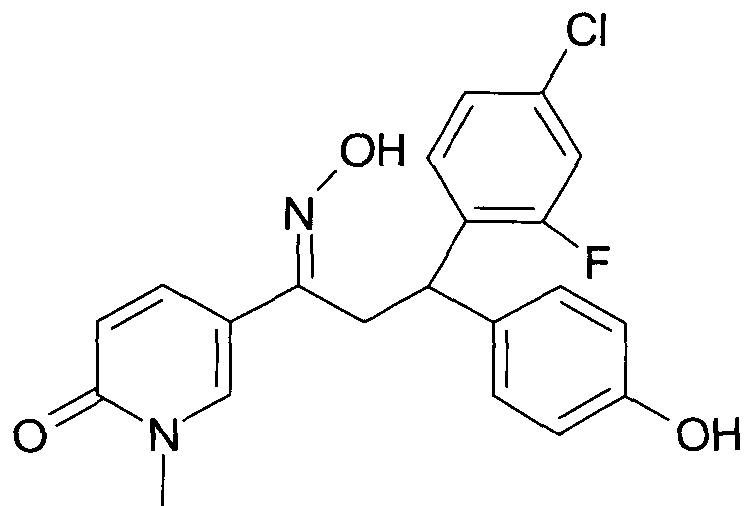
Стадия 1: 5-(3-(4-хлор-2-фторфенил)-3-(4-гидроксифенил)пропаноил)-1-метилпиридин-2(1H)-он
По аналогии с примером 203, стадия 1, (E)-5-(3-(4-хлор-2-фторфенил)акрилоил)-1-метилпиридин-2(1H)-он (пример 314, стадия 2) взаимодействовал с 4-гидроксифенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=386.0 [M+H]+.
Стадия 2: (E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(4-гидроксифенил)пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 151, стадия 3, (E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(4-гидроксифенил)пропил)-1-метилпиридин-2(1H)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=401.1 [M+H]+.
Пример 319
(E)-N-(3-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)фенил)ацетамид
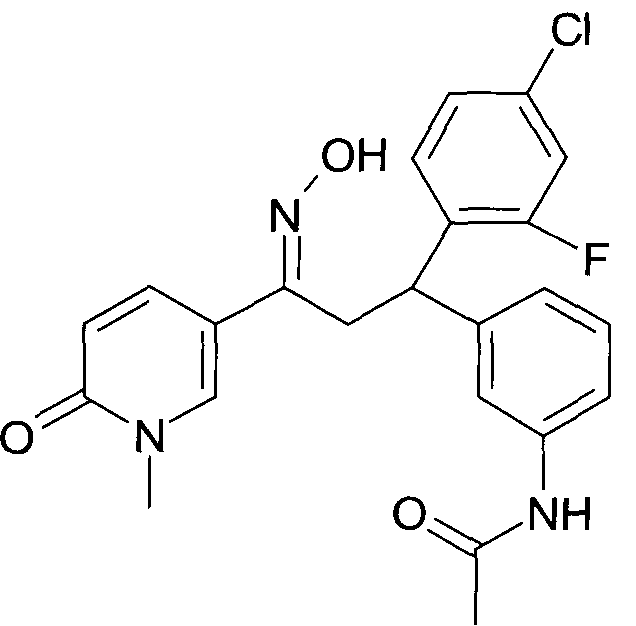
Стадия 1: N-(3-(1-(4-хлор-2-фторфенил)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-3-оксопропил)фенил)ацетамид
По аналогии с примером 203, стадия 1, (E)-5-(3-(4-хлор-2-фторфенил)акрилоил)-1-метилпиридин-2(1H)-он (пример 319, стадия 2) взаимодействовал с 3-ацетамидофенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде коричневого осадка, MS (ESI+): m/z=427.1 [M+H]+.
Стадия 2: (E)-N-(3-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)фенил)ацетамид
По аналогии с примером 151, стадия 3, N-(3-(1-(4-хлор-2-фторфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)фенил)ацетамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=442.2 [M+H]+.
Пример 320
(E)-3-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-(2-гидроксиэтил)бензамид
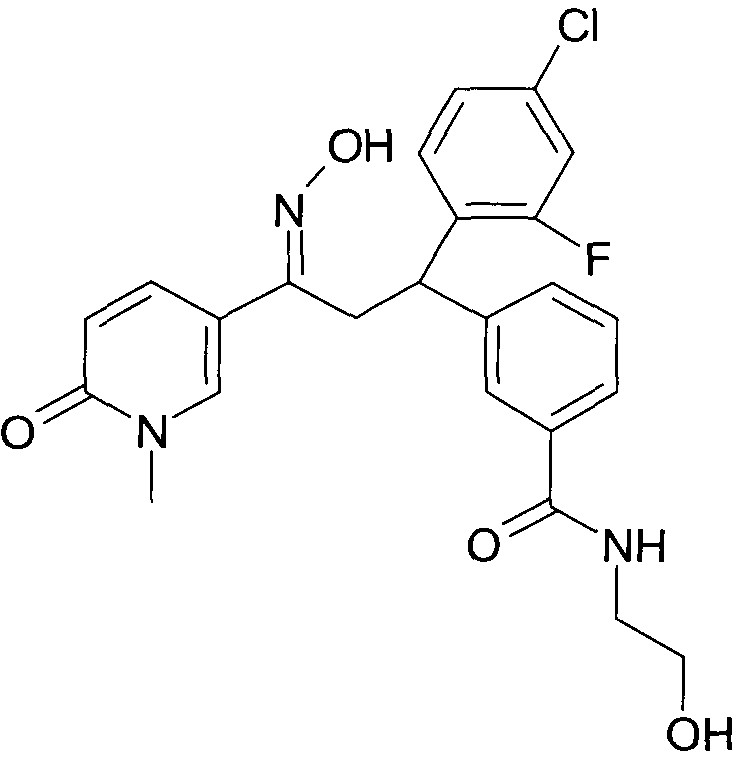
Стадия 1: Этил 3-(1-(4-хлор-2-фторфенил)-3-(6-метоксипиридин-3-ил)-3-оксопропил)бензоат
По аналогии с примером 203, стадия 1, (E)-3-(4-хлор-2-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (пример 237, стадия 1) взаимодействовал с 3-(этоксикарбонил)фенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=442.2 [M+H]+.
Стадия 2: Этил 3-(1-(4-хлор-2-фторфенил)-3-оксо-3-(6-оксо-1,6-дигидропиридин-3-ил)пропил)бензоат
По аналогии с примером 162, стадия 2, этил 3-(1-(4-хлор-2-фторфенил)-3-(6-метоксипиридин-3-ил)-3-оксопропил)бензоат взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=426.0 [M+H]+.
Стадия 3: Этил 3-(1-(4-хлор-2-фторфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)бензоат
По аналогии с примером 161, стадия 1, этил 3-(1-(4-хлор-2-фторфенил)-3-оксо-3-(6-оксо-1,6-дигидропиридин-3-ил)пропил)бензоат взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=442.2 [M+H]+.
Стадия 4: 3-(1-(4-хлор-2-фторфенил)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-3-оксопропил)бензойная кислота
По аналогии с примером 169, стадия 2, этил 3-(1-(4-хлор-2-фторфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)бензоат гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=412.0 [M-H]-.
Стадия 5: 3-(1-(4-хлор-2-фторфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-N-(2-гидроксиэтил)бензамид
По аналогии с примером 207, стадия 2, 3-(1-(4-хлор-2-фторфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)бензойную кислоту (пример 320, стадия 4) связывали с 2-аминоэтанолом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=457.3 [M+H]+.
Стадия 6: (E)-3-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-(2-гидроксиэтил)бензамид
По аналогии с примером 151, стадия 3, 3-(1-(4-хлор-2-фторфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-N-(2-гидроксиэтил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, содержащего 8% соответствующего Z изомера, MS (ESI+): m/z=472.1 [M+H]+.
Пример 321
(E)-3-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-(2-гидроксиэтил)-N-метилбензамид
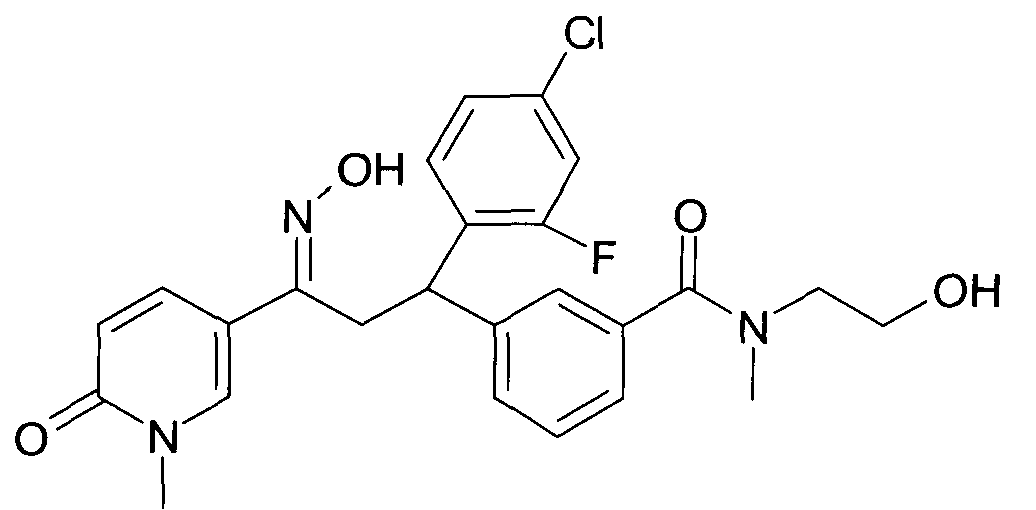
Стадия 1: 3-(1-(4-хлор-2-фторфенил)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-3-оксопропил)-N-(2-гидроксиэтил)-N-метилбензамид
По аналогии с примером 207, стадия 2, 3-(1-(4-хлор-2-фторфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)бензойную кислоту (пример 320, стадия 4) связывали с 2-(метиламино)этанолом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=471.4 [M+H]+.
Стадия 2: (E)-3-(1-(4-хлор-2-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-(2-гидроксиэтил)-N-метилбензамид
По аналогии с примером 151, стадия 3, 3-(1-(4-хлор-2-фторфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-N-(2-гидроксиэтил)-N-метилбензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, содержащего 7% соответствующего Z изомера, MS (ESI+): m/z=486.4 [M+H]+.
Пример 322
(E)-5-(3-(4-хлор-2-фторфенил)-1-(гидроксиимино)-3-(3-(морфолин-4-карбонил)фенил)пропил)-1-метилпиридин-2(1H)-он
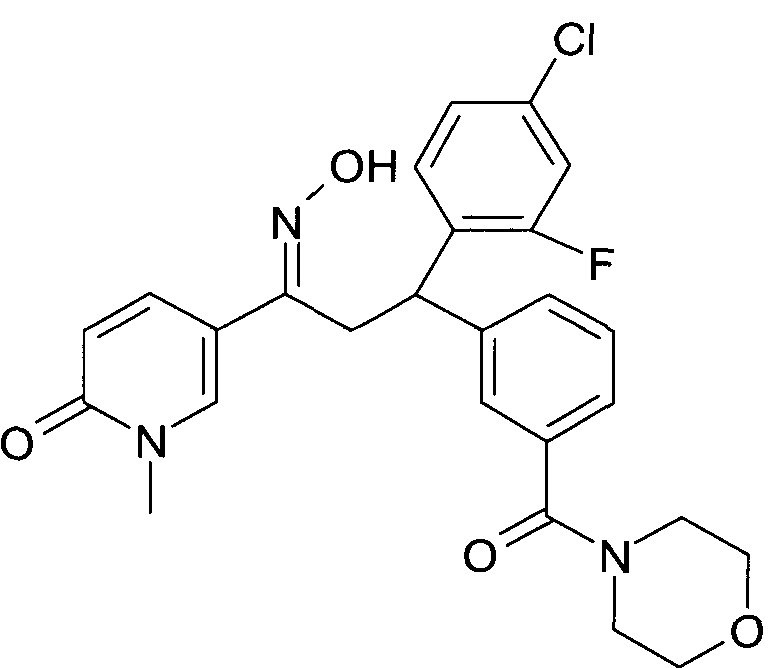
Стадия 1: 5-(3-(4-хлор-2-фторфенил)-3-(3-(морфолин-4-карбонил)фенил) пропаноил)-1-метилпиридин-2(1H)-он
По аналогии с примером 207, стадия 2, 3-(1-(4-хлор-2-фторфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)бензойную кислоту (пример 320, стадия 4) связывали с морфолином, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=483.2 [M+H]+.
Стадия 2: (E)-5-(3-(4-хлор-2-фторфенил)-1 -(гидроксиимино)-3-(3-(морфолин-4-карбонил)фенил)пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-(3-(4-хлор-2-фторфенил)-3-(3-(морфолин-4-карбонил)фенил)пропаноил)-1-метилпиридин-2(1H)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, содержащего 7% соответствующего Z изомера, MS (ESI+): m/z=498.2 [M+H]+.
Пример 323
5-{3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-изопропокси-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
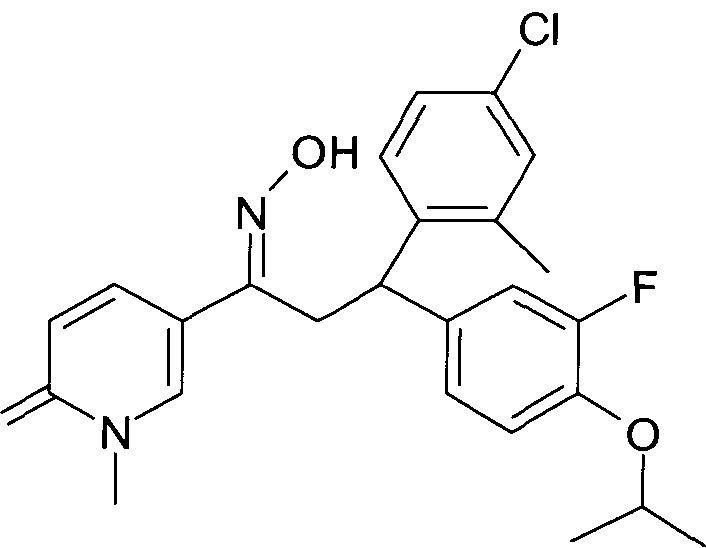
Стадия 1: (E)-3-(4-хлор-2-метил-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон
По аналогии с примером 170, стадия 1, 5-ацетил-2-метоксипиридина взаимодействовал с 4-хлор-2-метилбензальдегид в присутствии гидроксида калия с получением соединения, указанного в заголовке, в виде светло-желтого осадка. MS (ESI+): m/z=288.1 [M+H]+.
Стадия 2: 5-[(E)-3-(4-хлор-2-метил-фенил)-акрилоил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, (E)-3-(4-хлор-2-метил-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=274.2 [M+H]+.
Стадия 3: 5-[(E)-3-(4-хлор-2-метил-фенил)-акрилоил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[(E)-3-(4-хлор-2-метил-фенил)-акрилоил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=288.0 [M+H]+.
Стадия 4: 5-[3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-изопропокси-фенил)-пропионил]-1-метил-1H-пиридин-2-он
По аналогии с примером 203, стадия 1, 5-[(E)-3-(4-хлор-2-метил-фенил)-акрилоил]-1-метил-1H-пиридин-2-он взаимодействовал с 3-фтор-4-изопропоксифенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=442.2 [M+H]+.
Стадия 5: 5-{3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-изопропокси-фенил)-1-[(Е)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-изопропокси-фенил)-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=457.2 [M+H]+.
Пример 324
5-{3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-гидрокси-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
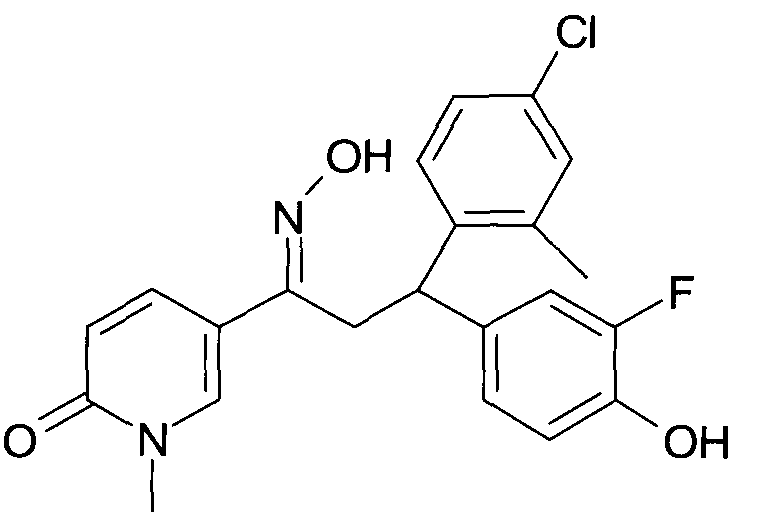
Стадия 1: 5-[3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-гидрокси-фенил)-пропионил]-1-метил-1H-пиридин-2-он
Раствор 5-[3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-изопропокси-фенил)-пропионил]-1-метил-1H-пиридин-2-она (пример 323, стадия 4, 1.969 г)в дихлорметане (32.5 мл) охладили до -10°C. При этой температуре медленно добавили раствор трихлорида бора (1M в дихлорметане, 13.4 мл). Реакционную смесь перемешивали при -10°C в течение 1 ч. Неочищенную реакционную смесь влили в воду/нас, раствор гидрокарбоната натрия, экстрагировали 3× этилацетатом, Органические слои промыли 2× водой, высушили над сульфатом магния и сконцентрировали под вакуумом с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI-): m/z=397.9 [M-H]-.
Стадия 2: 5-{3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-гидрокси-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-гидрокси-фенил)-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего <5% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI-): m/z=413.0 [M-H]-.
Пример 325
3-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-фтор-фенокси}-бензойная кислота
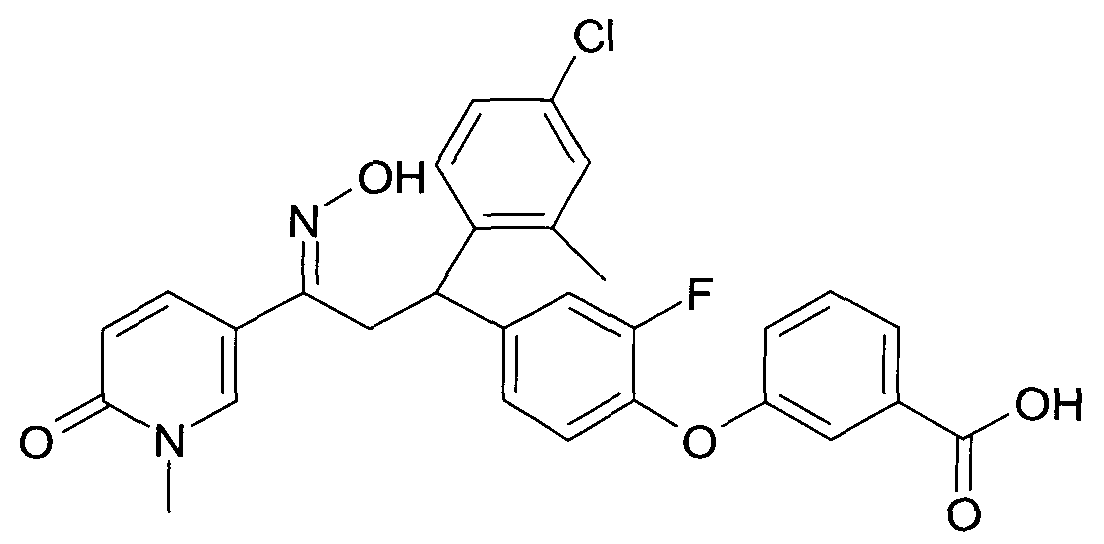
Стадия 1: 3-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-фенокси}-бензойной кислоты метиловый эфир
По аналогии с примером 222, стадия 1, 5-[3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-гидрокси-фенил)-пропионил]-1-метил-1H-пиридин-2-он (пример 324, стадия 1) взаимодействовал с 3-метоксикарбонилфенилбороновой кислотой в дихлорметане в присутствии меди(II)ацетата, пиридина и воздуха с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=534.1 [M+H]+.
Стадия 2: 3-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-фенокси}-бензойная кислота
По аналогии с примером 169, стадия 2, 3-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-фенокси}-бензойной кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=518.2 [M-H]-.
Стадия 3: 3-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-фтор-фенокси}-бензойная кислота
По аналогии с примером 151, стадия 3, 3-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-фенокси}-бензойная кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI-): m/z=532.9 [M-H]-.
Пример 326
2-хлор-5-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-фтор-фенокси}-бензойная кислота
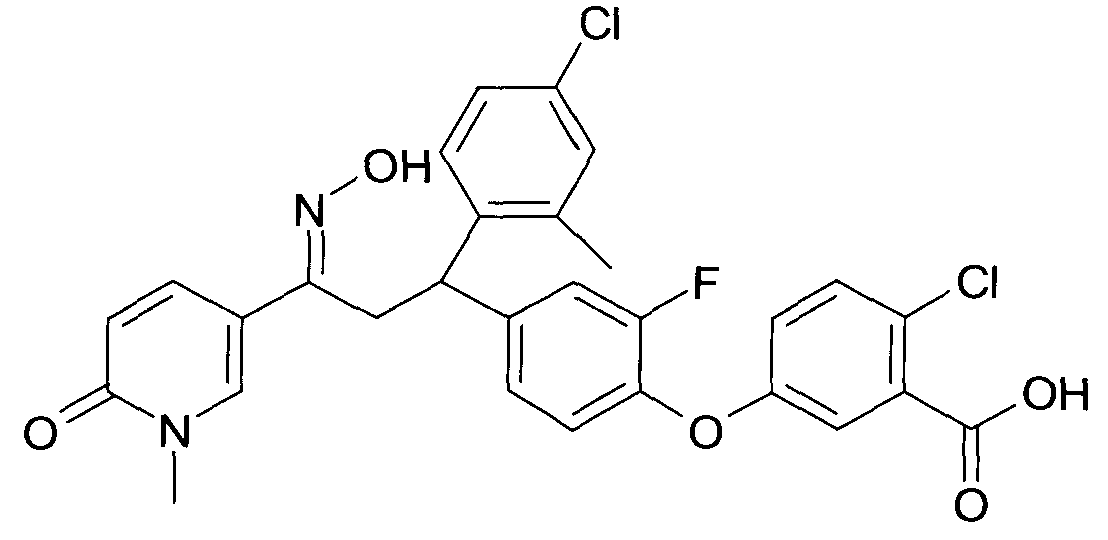
Стадия 1: 2-хлор-5-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил1-2-фтор-фенокси}-бензойной кислоты этиловый эфир
По аналогии с примером 222, стадия 1, 5-[3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-гидрокси-фенил)-пропионил]-1-метил-1H-пиридин-2-он (пример 324, стадия 1) взаимодействовал с 4-хлор-3-этоксикарбонилфенилбороновой кислотой в дихлорметане в присутствии ацетата меди(П), пиридина и воздуха с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=582.2 [M+H]+.
Стадия 2: 2-хлор-5-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил1-2-фтор-фенокси}-бензойная кислота
По аналогии с примером 169, стадия 2, 2-хлор-5-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-фенокси}-бензойной кислоты этиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=552.2 [M-H]-.
Стадия 3: 2-хлор-5-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-фтор-фенокси}-бензойная кислота
По аналогии с примером 151, стадия 3, 2-хлор-5-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-фенокси}-бензойная кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI-): m/z=567.2 [M-H]".
Пример 327
4-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-фтор-фенокси}-масляная кислота
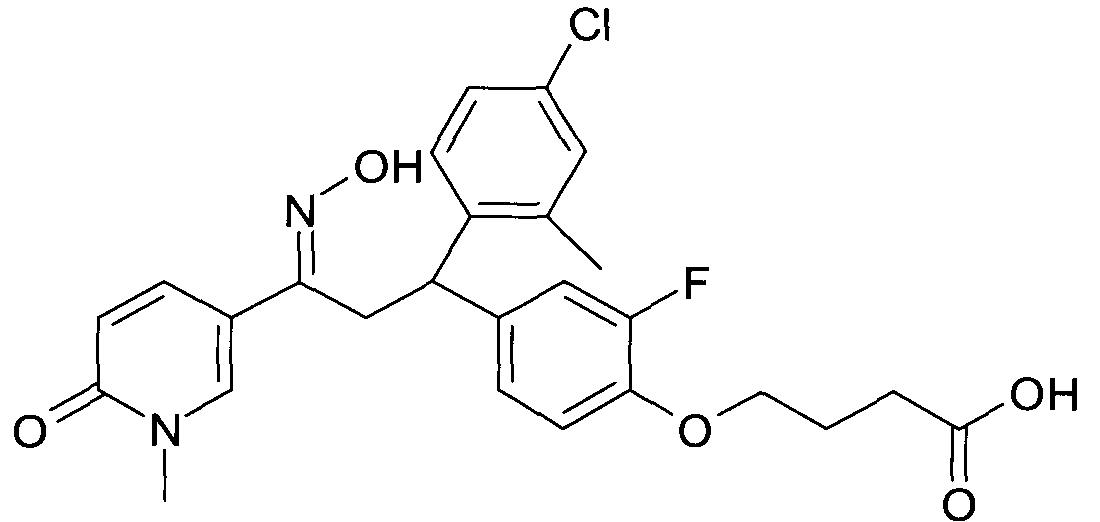
Стадия 1; 4-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил1-2-фтор-фенокси}-масляной кислоты метиловый эфир
По аналогии с примером 221, стадия 6, 5-[3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-гидрокси-фенил)-пропионил]-1-метил-1H-пиридин-2-он (пример 324, стадия 1) взаимодействовал с метил 4-бромбутиратом в N,N-диметилацетамиде в присутствии карбоната цезия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=500.3 [M+H]+.
Стадия 2: 4-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил1-2-фтор-фенокси}-масляная кислота
По аналогии с примером 169, стадия 2, 4-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-фенокси}-масляной кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI-): m/z=484.1 [M-H]-.
Стадия 3: 4-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино1-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил1-2-фтор-фенокси}-масляная кислота
По аналогии с примером 151, стадия 3, 4-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-фенокси}-масляная кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=499.2 [M-H]-.
Пример 328
5-{3-(4-хлор-2-метил-фенил)-3-[3-фтор-4-(2-гидрокси-этокси)-фенил]-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
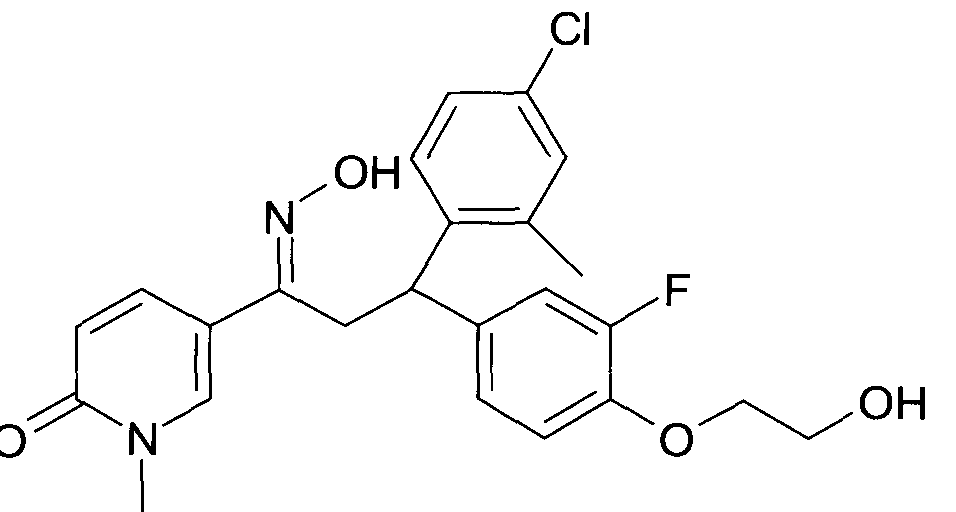
Стадия 1: 5-{3-(4-хлор-2-метил-Фенил)-3-[3-фтор-4-(2-гидрокси-этокси)-фенил]-пропионил}-1-метил-1H-пиридин-2-он
По аналогии с примером 221, стадия 6, 5-[3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-гидрокси-фенил)-пропионил]-1-метил-1H-пиридин-2-он (пример 324, стадия 1) взаимодействовал с 2-бромэтанолом в N,N-диметилацетамиде в присутствии карбоната цезия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=444.2 [M+H]+.
Стадия 2: 5-{3-(4-хлор-2-метил-фенил)-3-[3-фтор-4-(2-гидрокси-этокси)-фенил]-1-[(E)-гидроксиимино1-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-{3-(4-хлор-2-метил-фенил)-3-[3-фтор-4-(2-гидрокси-этокси)-фенил]-пропионил}-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=459.3 [M+H]+.
Пример 329
Метансульфоновой кислоты-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-фтор-фениловый эфир
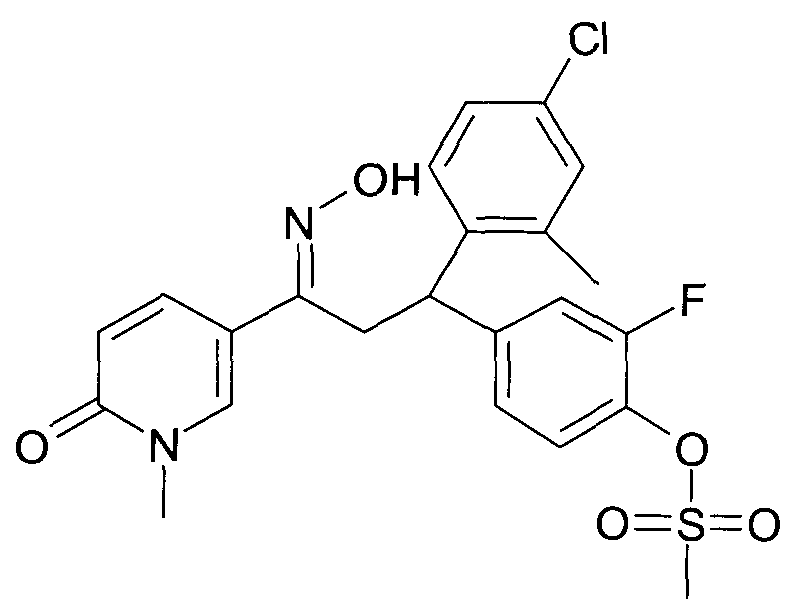
Стадия 1: Метансульфоновой кислоты-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-фениловый эфир
По аналогии с примером 221, стадия 6, 5-[3-(4-хлор-2-метил-фенил)-3-(3-фтор-4-гидрокси-фенил)-пропионил]-1-метил-1H-пиридин-2-он (пример 324, стадия 1) взаимодействовал с 2-(метилсульфонил)этил метансульфонатом в ацетоне в присутствии карбоната цезия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=478.1 [M+H]+.
Стадия 2: Метансульфоновой кислоты-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино1-3-(1-метил-6-оксо-1.6-дигидро-пиридин-3-ил)-пропил]-2-фтор-Фениловый эфир
По аналогии с примером 151, стадия 3, метансульфоновой кислоты-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-2-фтор-фениловый эфир взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=493.1 [M+H]+.
Пример 330
(E)-5-(3-(4-бромфенил)-1-(гидроксиимино)-3-(4-метилтиазол-5-ил)пропил)-1-метилпиридин-2(1H)-он
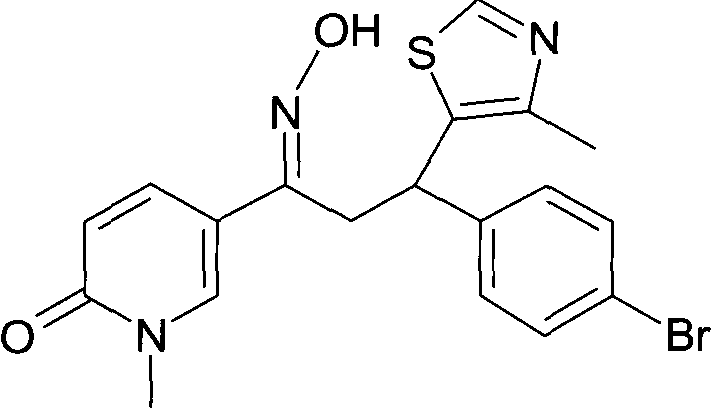
Стадия 1: (E)-1-(6-метоксипиридин-3-ил)-3-(4-метилтиазол-5-ил)проп-2-ен-1-он
По аналогии с примером 170, стадия 1, 6-ацетил-2-метоксипиридин взаимодействовал с 4-метилтиазол-6-карбальдегидом в присутствии гидроксида калия с получением соединения, указанного в заголовке, в виде серо-белого осадка. MS (ESI+): m/z=261.1 [M+H]+.
Стадия 2: 3-(4-бромфенил)-1-(6-метоксипиридин-3-ил)-3-(4-метилтиазол-5-ил)пропан-1-он
По аналогии с примером 203, стадия 1, (E)-1-(6-метоксипиридин-3-ил)-3-(4-метилтиазол-5-ил)проп-2-ен-1-он взаимодействовал с 4-бромфенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде желтого осадка, MS (ESI+): m/z=419.1 [M+H]+.
Стадия 3: 5-(3-(4-бромфенил)-3-(4-метилтиазол-5-ил)пропаноил)пиридин-2(1H)-он
По аналогии с примером 162, стадия 2, 3-(4-бромфенил)-1-(6-метоксипиридин-3-ил)-3-(4-метилтиазол-5-ил)пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде желтого осадка, MS (ESI+): m/z=405.2 [M+H]+.
Стадии 4 и 5: (E)-5-(3-(4-бромфенил)-1-(гидроксиимино)-3-(4-метилтиазол-5-ил)пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 161, стадия 1, 5-(3-(4-бромфенил)-3-(4-метилтиазол-5-ил)пропаноил)пиридин-2(1H)-он взаимодействовал с йодометаном в присутствии карбоната калия. Продукт этой реакции взаимодействовал по аналогии с примером 151, стадия 3, с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде серо-белого осадка, MS (ESI+): m/z=432.1 [M+H]+.
Пример 331
(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он
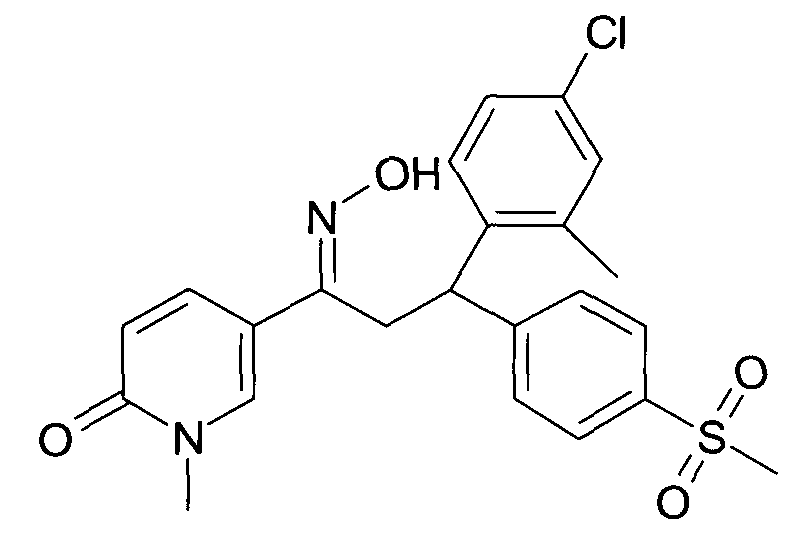
Стадия 1: 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил) пропаноил)-1-метилпиридин-2(1H)-он
По аналогии с примером 203, стадия 1, 5-[(Е)-3-(4-хлор-2-метил-фенил)-акрилоил]-1-метил-1H-пиридин-2-он (пример 323, стадия 3) взаимодействовал с 4-(метилсульфонил)фенил-бороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=444.2 [M+H]+.
Стадия 2: (E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-1-метилпиридин-2(1H)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=459.2 [M+H]+.
Пример 332
(E)-4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-(2-гидроксиэтил)бензамид
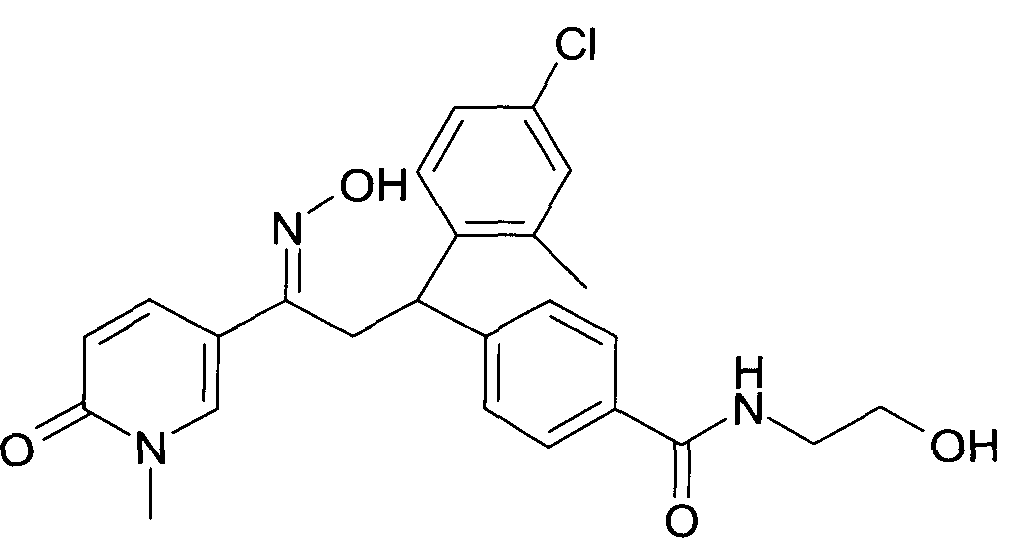
Стадия 1: Метил 4-(1-(4-хлор-2-метилфенил)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-3-оксопропил)бензоат
По аналогии с примером 203, стадия 1, 5-[(E)-3-(4-хлор-2-метил-фенил)-акрилоил]-1-метил-1H-пиридин-2-он (пример 323, стадия 3) взаимодействовал с 4-(метоксикарбонил)фенил-бороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде оранжевого осадка, MS (ESI+): m/z=424.1 [M+H]+.
Стадия 2: 4-(1-(4-хлор-2-метилфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)бензойная кислота
По аналогии с примером 169, стадия 2, метил 4-(1-(4-хлор-2-метилфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)бензоат гидролизовали с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI-): m/z=408.1 [M-H]-.
Стадия 03: 4-(1-(4-хлор-2-метилфенил)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-3-оксопропил)-N-(2-гидроксиэтил)бензамид
По аналогии с примером 207, стадия 2, 4-(1-(4-хлор-2-метилфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)бензойную кислоту связывали с 2-аминоэтанолом, используя бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=453.2 [M+H]+.
Стадия 4: (E)-4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)пропил)-N-(2-гидроксиэтил)бензамид
По аналогии с примером 151, стадия 3, 4-(1-(4-хлор-2-метилфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-N-(2-гидроксиэтил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде серо-белого осадка, MS (ESI+): m/z=468.2 [M+H]+.
Примеры 333 и 334
(-)-(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-пропил)-1-метилпиридин-2(1H)-он и (+)-(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-пропил)-1-метилпиридин-2(1H)-он
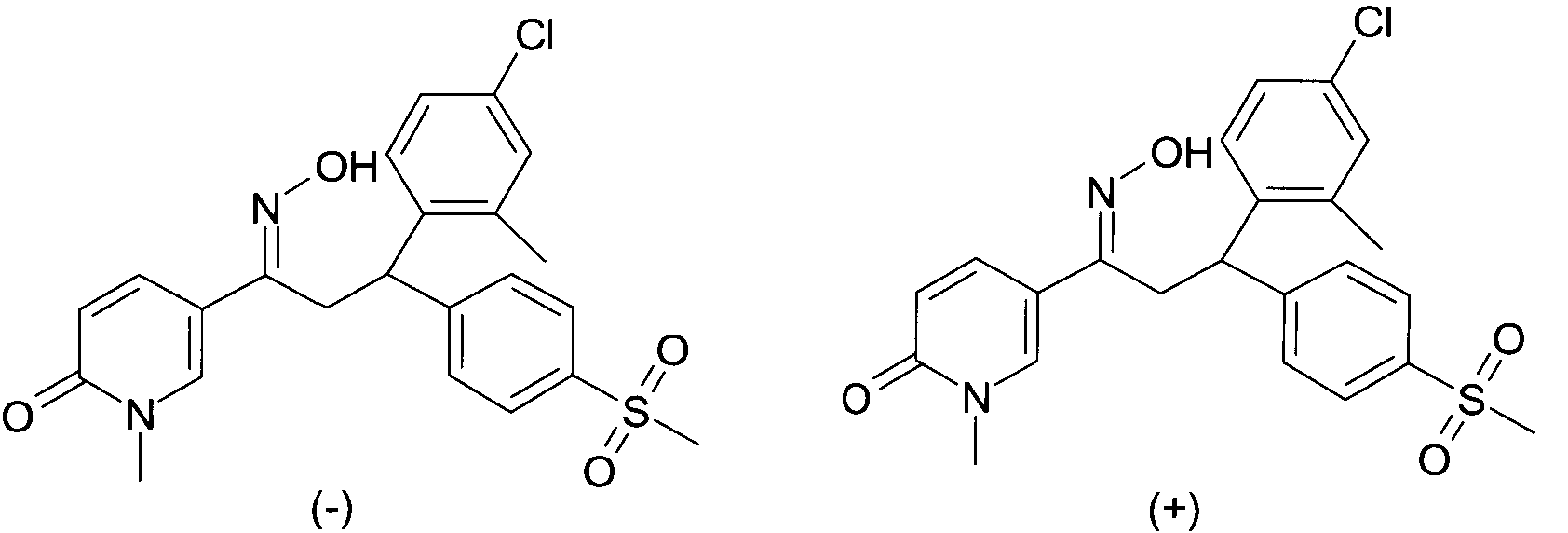
Разделение (E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метил-сульфонил)фенил)пропил)-1-метилпиридин-2(1H)-она (пример 331) с помощью хиральной ВЭЖХ на Chiralpak-AD колонке с использованием смеси растворителей n-гептан/изопропанол (65:35 об/об) дало (-)-(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он, MS (ESI+): m/z=459.0 [M+H]+ в виде бесцветного осадка и (+)-(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он, MS (ESI+): m/z=459.0 [M+H]+ в виде бесцветного осадка.
Пример 335
4-((E)-1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-((Р)-2,3-дигидроксипропил)бензамид

Стадия 1: 4-(1-(4-хлор-2-метилфенил)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-3-оксопропил)-N-((R)-2,3-дигидроксипропил)бензамид
По аналогии с примером 207, стадия 2, 4-(1-(4-хлор-2-метилфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)бензойную кислоту (пример 332, стадия 2) связывали с (R)-3-аминопропан-1,2-диолом, используя бензотриазол-1 -илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=483.2 [M+H]+.
Стадия 2: 4-((E)-1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-((R)-2,3-дигидроксипропил)бензамид
По аналогии с примером 151, стадия 3, 4-(1-(4-хлор-2-метилфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-N-((R)-2,3-дигидроксипропил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде серо-белого осадка, MS (ESI+): m/z=498.2 [M+H]+.
Пример 336
(E)-4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-(2-(метилсульфонил)этил)бензамид
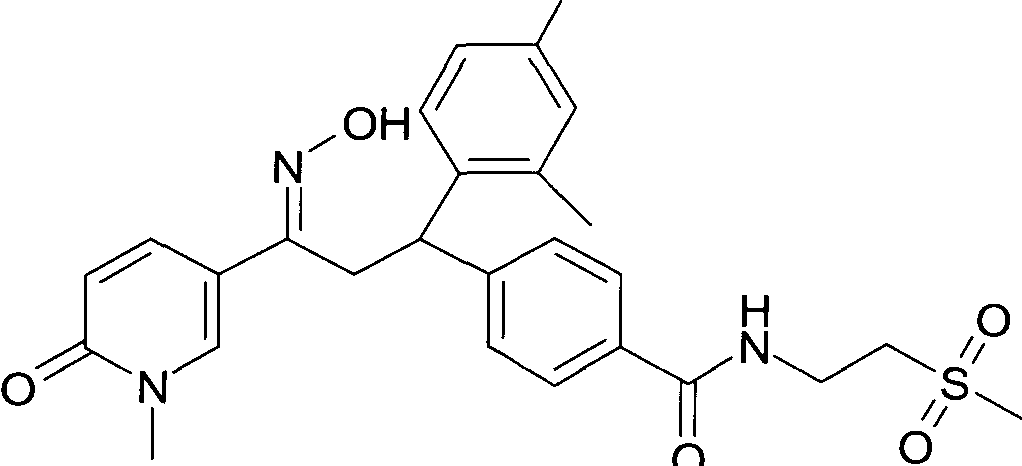
Стадия 1: 4-(1-(4-хлор-2-метилфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-N-(2-(метилсульфонил)этил)бензамид
По аналогии с примером 207, стадия 2, 4-(1-(4-хлор-2-метилфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)бензойную кислоту (пример 332, стадия 2) связывали с 2-(метилсульфонил)этанамином, используя бензотриазол-1 -илокситрис(диметиламино)фосфония гексафторфосфат в тетрагидрофуране, с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=515.3 [M+H]+.
Стадия 2: (E)-4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)-N-(2-(метилсульфонил)этил)бензамид
По аналогии с примером 151, стадия 3, 4-(1-(4-хлор-2-метилфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)-N-(2-(метилсульфонил)этил)бензамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=530.1 [M+H]+.
Пример 337
(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(гидроксиметил)фенил)пропил)-1-метилпиридин-2(1H)-он
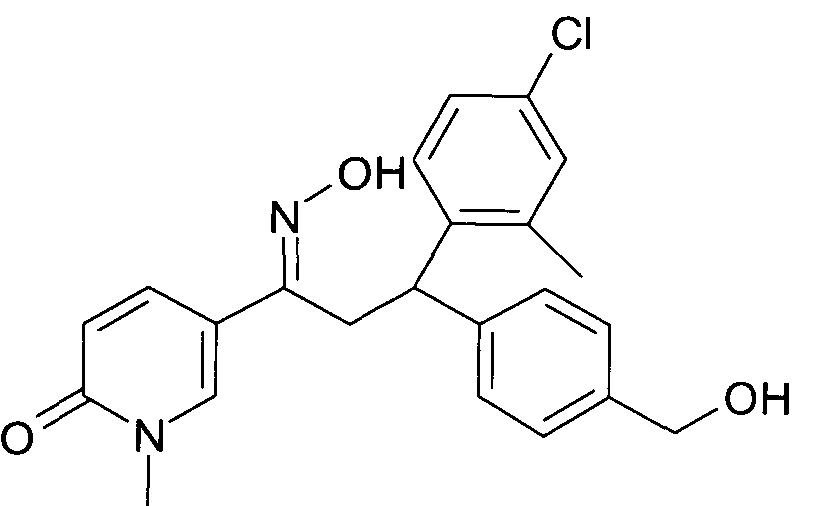
Стадия 1: 5-(3-(4-хлор-2-метилфенил)-3-(4-(гидроксиметил)фенил)пропаноил)-1-метилпиридин-2(1H)-он
По аналогии с примером 203, стадия 1, 5-[(E)-3-(4-хлор-2-метил-фенил)-акрилоил]-1-метил-1H-пиридин-2-он (пример 323, стадия 3) взаимодействовал с 4-(гидроксиметил)фенил-бороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде желтой пены, MS (ESI+): m/z=396.1 [M+H]+.
Стадия 2: (E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(гидроксиметил)фенил)пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-(3-(4-хлор-2-метилфенил)-3-(4-(гидроксиметил)фенил)пропаноил)-1-метилпиридин-2(1H)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=411.2 [M+H]+.
Пример 338
(E)-4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бензолсульфонамид
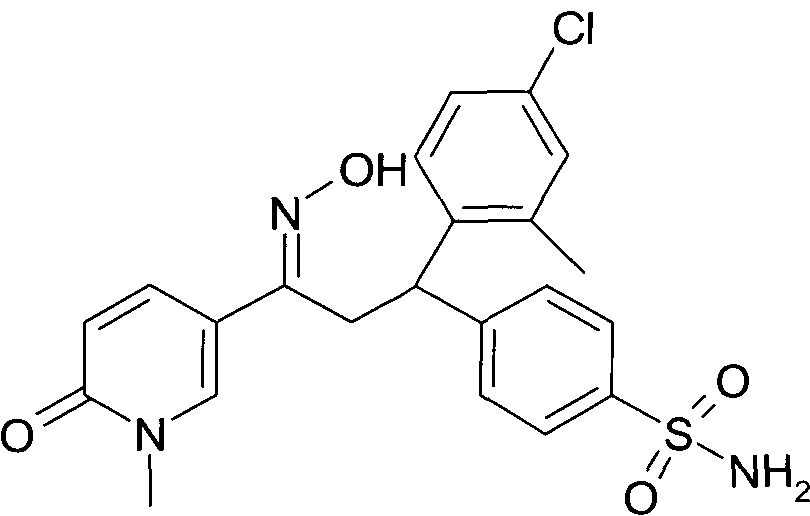
Стадия 1: 4-(1-(4-хлор-2-метилфенил)-3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-3-оксопропил)бензолсульфонамид
По аналогии с примером 203, стадия 1, 5-[(E)-3-(4-хлор-2-метил-фенил)-акрилоил]-1-метил-1H-пиридин-2-он (пример 323, стадия 3) взаимодействовал с 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензолсульфонамидом в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=445.3 [M+H]+.
Стадия 2: (E)-4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бензолсульфонамид
По аналогии с примером 151, стадия 3, 4-(1-(4-хлор-2-метилфенил)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксопропил)бензолсульфонамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=460.2 [M+H]+.
Пример 339
(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-(2-(2-метоксиэтокси)этил)пиридин-2(1H)-он
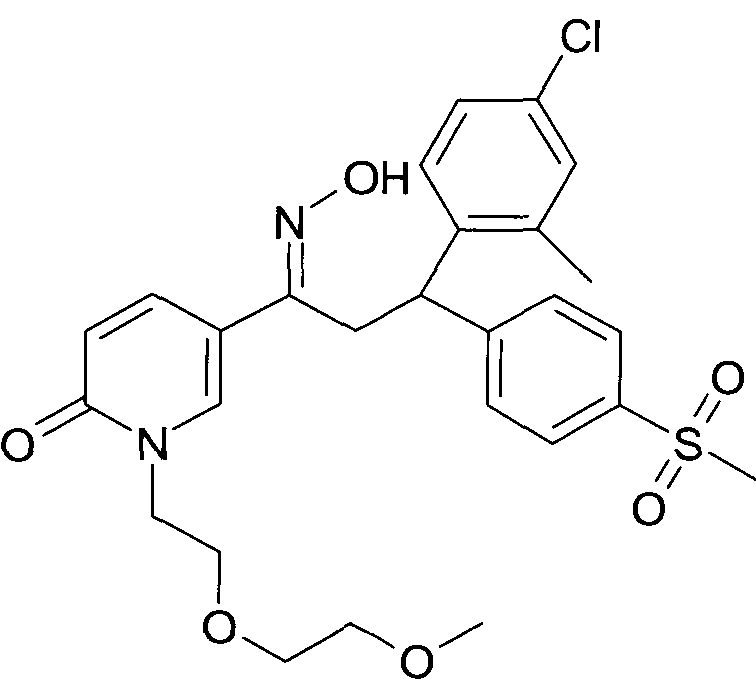
Стадия 1: 3-(4-хлор-2-метилфенил)-1-(6-метоксипиридин-3-ил)-3-(4-(метилсульфонил)фенил)пропан-1-он
По аналогии с примером 203, стадия 1, (E)-3-(4-хлор-2-метил-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон (пример 323, стадия 1) взаимодействовал с 4-(метилсульфонил)фенил-бороновой кислоты в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=444.2 [M+H]+.
Стадия 2: 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил) пропаноил)пиридин-2(1H)-он
По аналогии с примером 162, стадия 2, 3-(4-хлор-2-метилфенил)-1-(6-метоксипиридин-3-ил)-3-(4-(метилсульфонил)фенил)пропан-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=430.2 [M+H]+.
Стадия 3: 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил) пропаноил)-1-(2-(2-метоксиэтокси)этил)пиридин-2(1H)-он
По аналогии с примером 161, стадия 1, 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)пиридин-2(1H)-он взаимодействовал с 1-бром-2-(2-метоксиэтокси)этаном в присутствии карбоната калия и каталитического количества тетрабутиламмония йодида с получением соединения, указанного в заголовке, в виде светло-коричневого масла, MS (ESI+): m/z=532.2 [M+H]+.
Стадия 4: (E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)-фенил)пропил)-1-(2-(2-метоксиэтокси)этил)пиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-1-(2-(2-метоксиэтокси)этил)пиридин-2(1Н)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего 12% соответствующего Z изомера, в виде светло-желтого осадка, MS (ESI+): m/z=547.3 [M+H]+.
Пример 340
(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-пропил)-1-(2-этоксиэтил)пиридин-2(1H)-он
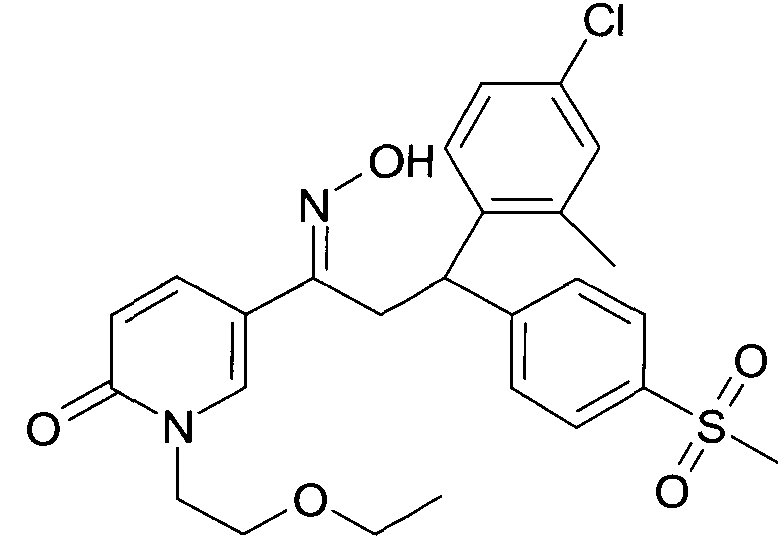
Стадия 1: 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил) пропаноил)-1-(2-этоксиэтил)пиридин-2(1H)-он
По аналогии с примером 161, стадия 1, 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)пиридин-2(1Н)-он (пример 339, стадия 2) взаимодействовал с 1-бром-2-этоксиэтаном в присутствии карбоната калия и каталитического количества тетрабутиламмония йодида с получением соединения, указанного в заголовке, в виде светло-коричневого осадка, MS (ESI+): m/z=502.2 [M+H]+.
Стадия 2: (E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-(2-этоксиэтил)пиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-1-(2-этоксиэтил)пиридин-2(1H)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS(ESI+): m/z=517.1 [M+H]+.
Пример 341
(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-(2-метоксиэтил)пиридин-2(1H)-он
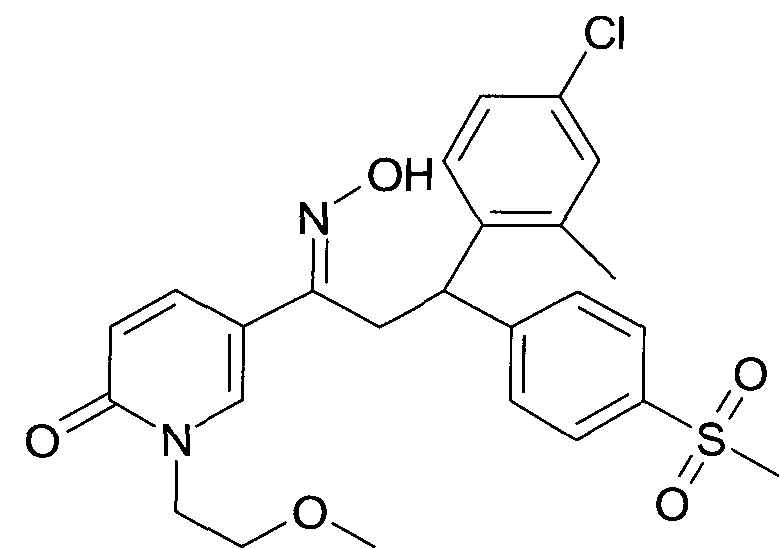
По аналогии с примером 161, стадия 1, 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)пиридин-2(1H)-он (пример 339, стадия 2) взаимодействовал с 1-бром-2-метоксиэтаном в присутствии карбоната калия и каталитического количества тетрабутиламмония йодида. Продукт этой реакции взаимодействовал по аналогии с примером 151, стадия 3, с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, содержащего менее чем 10% соответствующего Z изомера, MS (ESI+): m/z=503.2 [M+H]+.
Пример 342
(E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-пропил)-1-(2-гидроксиэтил)пиридин-2(1H)-он
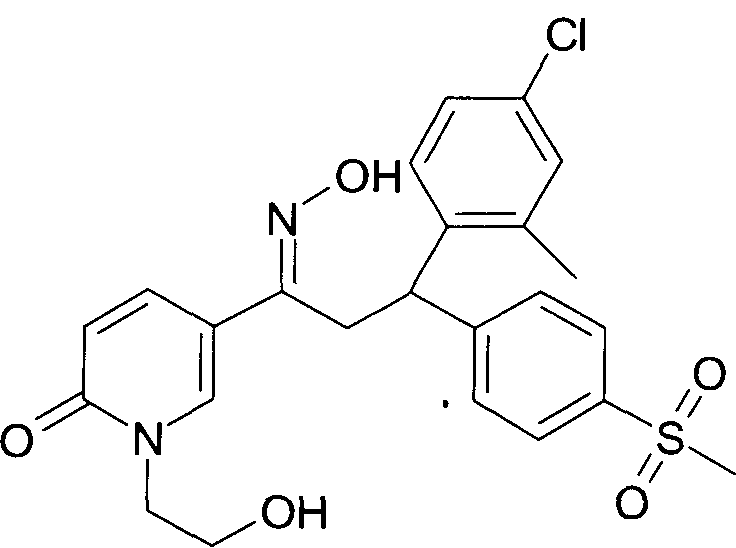
Стадия 1: 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил) пропаноил)-1-(2-гидроксиэтил)пиридин-2(1H)-он
По аналогии с примером 161, стадия 1, 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)пиридин-2(1H)-он (пример 339, стадия 2) взаимодействовал с 2-бромэтанолом в присутствии карбоната калия и каталитического количества тетрабутиламмония йодида с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=474.2 [M+H]+.
Стадия 2: (E)-5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-(2-гидроксиэтил)пиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-1-(2-гидроксиэтил)пиридин-2(1H)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде серо-белого осадка, MS (ESI+): m/z=489.3 [M+H]+.
Пример 343
(E)-2-(5-(3-(4-хлор-2-метилсренил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-2-оксопиридин-1(2H)-ил)ацетамид

Стадия 1: 2-(5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил) пропаноил)-2-оксопиридин-1(2H)-ил)ацетамид
По аналогии с примером 161, стадия 1, 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)пиридин-2(1H)-он (пример 339, стадия 2) взаимодействовал с 2-йодацетамидом в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=487.3 [M+H]+.
Стадия 2; (E)-2-(5-(3-(4-хлор-2-метилфенил)-1 -(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-2-оксопиридин-1(2H)-ил)ацетамид
По аналогии с примером 151, стадия 3, 2-(5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-2-оксопиридин-1(2H)-ил)ацетамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI-): m/z=500.1 [M-H]-.
Пример 344
(E)-3-(5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-2-оксопиридин-1(2H)-ил)пропанамид
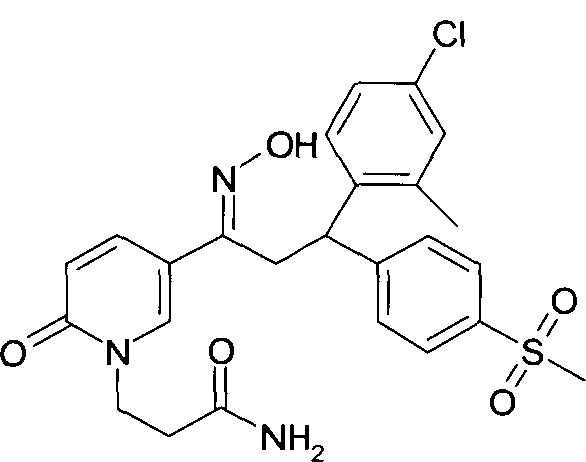
Стадия 1: 3-(5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил) пропаноил)-2-оксопиридин-1(2H)-ил)пропанамид
По аналогии с примером 161, стадия 1, 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)пиридин-2(1Н)-он (пример 339, стадия 2) взаимодействовал с 3-бромпропанамид в присутствии карбоната калия и каталитического количества тетрабутиламмония йодида с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI-): m/z=499.1 [M-H]-.
Стадия 2: (E)-3-(5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-2-оксопиридин-1(2H)-ил)пропанамид
По аналогии с примером 151, стадия 3, 3-(5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-2-оксопиридин-1(2H)-ил)пропанамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде серо-белого осадка, MS (ESI+): m/z=516.4 [M+H]+.
Пример 345
(E)-3-(5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-2-оксопиридин-1(2H)-ил)пропановая кислота
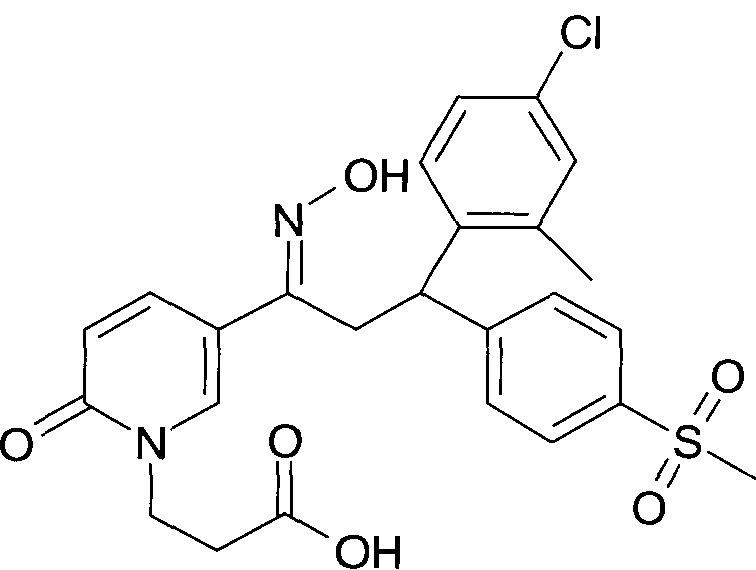
Стадия 1: Метил 3-(5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил) Фенил)пропаноил)-2-оксопиридин-1(2H)-ил)пропаноат
По аналогии с примером 161, стадия 1, 5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)пиридин-2(1H)-он (пример 339, стадия 2) взаимодействовал с метил 3-бромпропаноатом в присутствии карбоната калия и каталитического количества тетрабутиламмония йодида с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=518.4 [M+H]+.
Стадия 2: 3-(5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-2-оксопиридин-1(2H)-ил)пропановая кислота
По аналогии с примером 169, стадия 2, метил 3-(5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-2-оксопиридин-1(2H)-ил)пропаноат гидролизовали с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI-): m/z=500.2 [M-H]-.
Стадия 3: (E)-3-(5-(3-(4-хлор-2-метилфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-2-оксопиридин-1(2H)-ил)пропановая кислота
По аналогии с примером 151, стадия 3, 3-(5-(3-(4-хлор-2-метилфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-2-оксопиридин-1(2H)-ил)пропановая кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде серо-белого осадка, MS (ESI-): m/z=515.3 [M-H]-.
Пример 346
3-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенокси}-бензойная кислота
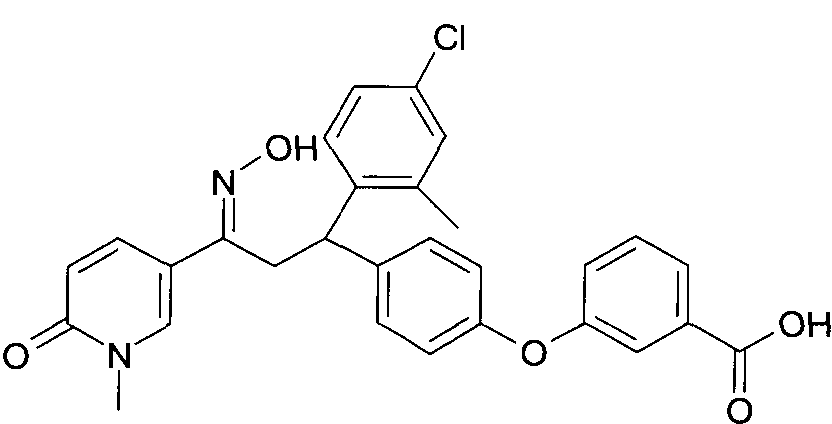
Стадия 1: 5-[3-(4-хлор-2-метил-фенил)-3-(4-гидрокси-фенил)-пропионил]-1-метил-1Н-пиридин-2-он
По аналогии с примером 203, стадия 1, 5-[(E)-3-(4-хлор-2-метил-фенил)-акрилоил]-1-метил-1H-пиридин-2-он (пример 323, стадия 3) взаимодействовал с 4-гидроксифенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=380.1 [M-H]-.
Стадия 2: 3-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-бензойной кислоты метиловый эфир
По аналогии с примером 222, стадия 1, 5-[3-(4-хлор-2-метил-фенил)-3-(4-гидрокси-фенил)-пропионил]-1-метил-1H-пиридин-2-он (пример 346, стадия 1) взаимодействовал с 3-метоксикарбонилфенилбороновой кислотой в дихлорметане в присутствии ацетата меди(II), пиридина и воздуха с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=516.4 [M+H]+.
Стадия 3: 3-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-бензойная кислота
По аналогии с примером 169, стадия 2, 3-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-бензойной кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=500.1 [M-H]-.
Стадия 4: 3-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенокси}-бензойная кислота
По аналогии с примером 151, стадия 3, 3-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-бензойная кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего 9% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI-): m/z=515.3 [M-H]-.
Пример 347
2-хлор-5-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенокси}-бензойная кислота
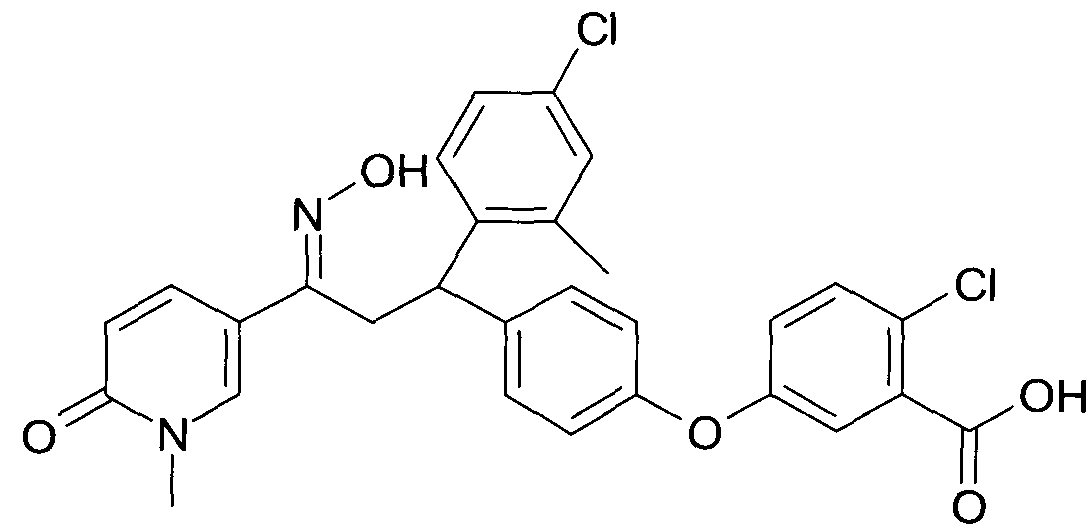
Стадия 1: 2-хлор-5-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил1-фенокси}-бензойной кислоты этиловый эфир
По аналогии с примером 222, стадия 1, 5-[3-(4-хлор-2-метил-фенил)-3-(4-гидрокси-фенил)-пропионил]-1-метил-1H-пиридин-2-он (пример 346, стадия 1) взаимодействовал с 4-хлор-3-этоксикарбонилфенилбороновой кислотой в дихлорметане в присутствии ацетата меди(II), пиридина и воздуха с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=564.2 [M+H]+.
Стадия 2: 2-хлор-5-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-бензойная кислота
По аналогии с примером 169, стадия 2, 2-хлор-5-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-бензойной кислоты этиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=534.1 [M-H]-.
Стадия 3: 2-хлор-5-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенокси}-бензойная кислота
По аналогии с примером 151, стадия 3, 2-хлор-5-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-бензойная кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESP-): m/z=549.2 [M-H]-.
Пример 348
5-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенокси}-2-фтор-бензойная кислота
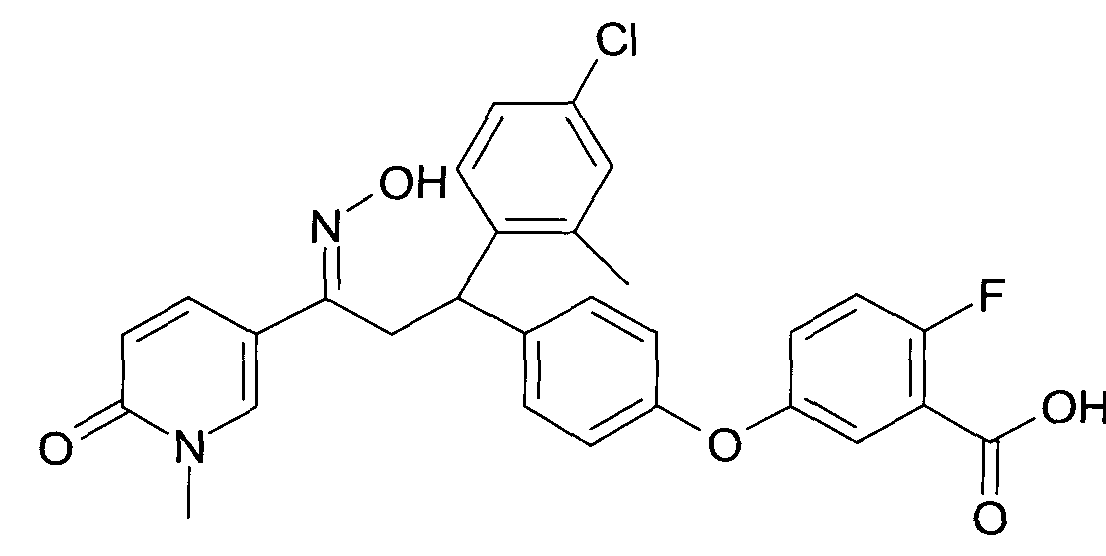
Стадия 1: 5-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-2-фтор-бензойной кислоты метиловый эфир
По аналогии с примером 222, стадия 1, 5-[3-(4-хлор-2-метил-фенил)-3-(4-гидрокси-фенил)-пропионил]-1-метил-1H-пиридин-2-он (пример 346, стадия 1) взаимодействовал с 4-фтор-3-метоксикарбонилфенилбороновой кислотой в дихлорметане в присутствии ацетата меди(II), пиридина и воздуха с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=534.2 [M+H]+.
Стадия 2: 5-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-2-фтор-бензойная кислота
По аналогии с примером 169, стадия 2, 5-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-2-фтор-бензойной кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=518.1 [M-H]-.
Стадия 3: 5-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенокси}-2-фтор-бензойная кислота
По аналогии с примером 151, стадия 3, 5-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-2-фтор-бензойная кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=533.1 [M-H]-.
Пример 349
4-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенокси}-масляная кислота
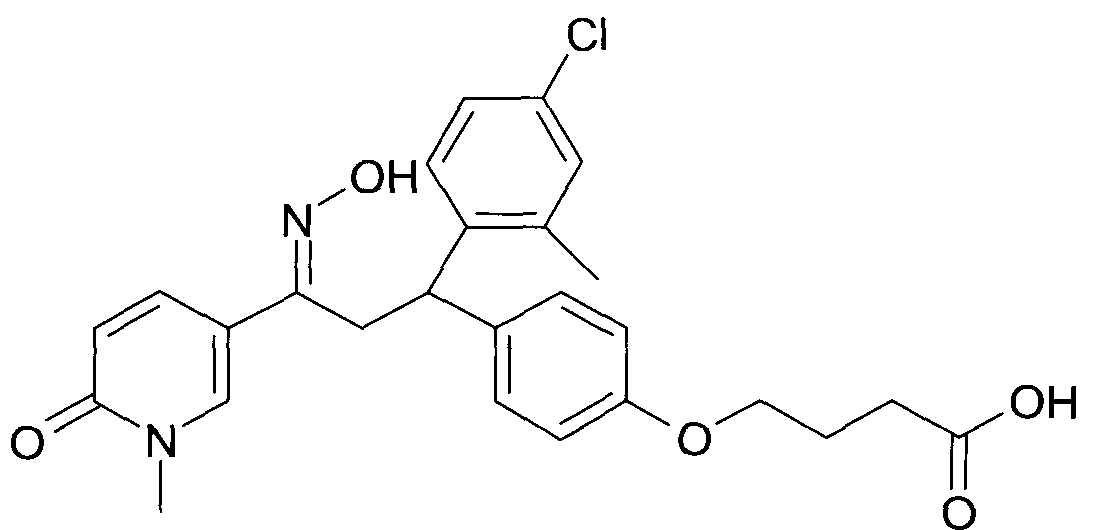
Стадия 1: 4-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-масляной кислоты метиловый эфир
По аналогии с примером 221, стадия 6, 5-[3-(4-хлор-2-метил-фенил)-3-(4-гидрокси-фенил)-пропионил]-1-метил-1H-пиридин-2-он (пример 346, стадия 1) взаимодействовал с метил 4-бромбутиратом в N,N-диметилацетамиде в присутствии карбоната цезия с получением соединения, указанного в заголовке, в виде бесцветной пены, MS (ESI+): m/z=482.2 [M+H]+.
Стадия 2: 4-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-масляная кислота
По аналогии с примером 169, стадия 2, 4-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-масляной кислоты метиловый эфир гидролизовали с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI-): m/z=466.1 [M-H]-.
Стадия 3: 4-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенокси}-масляная кислота
По аналогии с примером 151, стадия 3, 4-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенокси}-масляная кислота взаимодействовала с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI-): m/z=481.1 [M-H]-.
Пример 350
(E)-5-(3-(2,5-дихлорфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1Н)-он
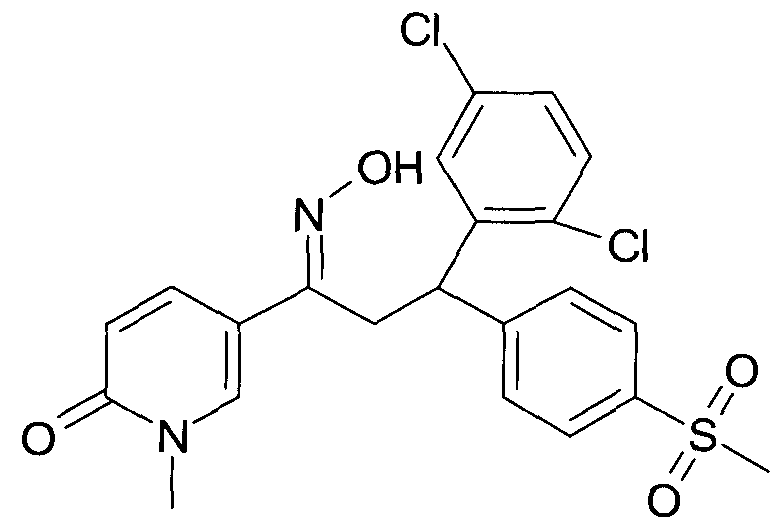
Стадия 1: (E)-3-(2.5-дихлорфенил)-1-(6-метоксипиридин-3-ил)проп-2-ен-1-он
По аналогии с примером 170, стадия 1, 5-ацетил-2-метоксипиридин взаимодействовал с 2,5-дихлорбензальдегидом в присутствии гидроксида калия с получением соединения, указанного в заголовке, в виде бесцветного осадка. MS (ESI+): m/z=308.1 [M+H]+.
Стадия 2: (E)-5-(3-(2.5-дихлорфенил)акрилоил)пиридин-2(1H)-он
По аналогии с примером 162, стадия 2, (E)-3-(2,5-дихлорфенил)-1-(6-метоксипиридин-3-ил)проп-2-ен-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде светло-желтого осадка, MS (ESI+): m/z=294.0 [M+H]+.
Стадия 3: (E)-5-(3-(2.5-дихлорфенил)акрилоил)-1-метилпиридин-2(1H)-он
По аналогии с примером 161, стадия 1, (E)-5-(3-(2,5-дихлорфенил)акрилоил)пиридин-2(1H)-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде светло-желтого осадка.
Стадия 4: 5-(3-(2.5-дихлорфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-1-метилпиридин-2(1H)-он
По аналогии с примером 203, стадия 1, (E)-5-(3-(2,5-дихлорфенил)акрилоил)-1-метилпиридин-2(1H)-он взаимодействовал с 4-(метилсульфонил)фенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=464.1 [M+H]+.
Стадия 5: (E)-5-(3-(2.5-дихлорфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-(3-(2,5-дихлорфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-1-метилпиридин-2(1H)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего 3% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=479.1 [M+H]+.
Пример 351
(E)-5-(3-(3,5-дифторфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он
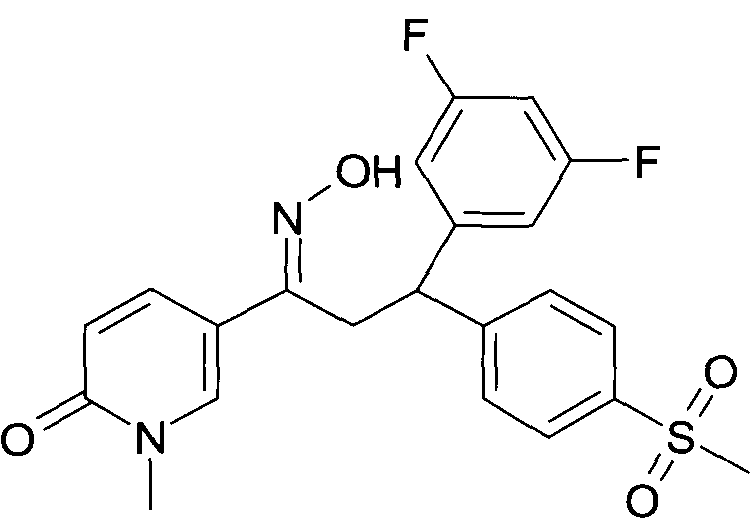
Стадия 1: (E)-3-(3.5-дифторфенил)-1-(6-метоксипиридин-3-ил)проп-2-ен-1-он По аналогии с примером 170, стадия 1, 5-ацетил-2-метоксипиридин взаимодействовал с 3,5-дифторбензальдегида в присутствии гидроксида калия с получением соединения, указанного в заголовке, в виде бесцветного осадка. MS (ESI+): m/z=276.2 [M+H]+.
Стадия 2: (E)-5-(3-(3.5-дифторфенил)акрилоил)пиридин-2(1H)-он По аналогии с примером 162, стадия 2, (Е)-3-(3,5-дифторфенил)-1-(6-метоксипиридин-3-ил)проп-2-ен-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветного осадка, MS (ESI+): m/z=262.1 [M+H]+.
Стадия 3: (E)-5-(3-(3.5-дифторфенил)акрилоил)-1-метилпиридин-2(1H)-он По аналогии с примером 161, стадия 1, (E)-5-(3-(3,5-дифторфенил)акрилоил)пиридин-2(1H)-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде светло-желтого осадка. MS (ESI+): m/z=276.1 [M+H]+.
Стадия 4: 5-(3-(3,5-дифторфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-1-метилпиридин-2(1H)-он
По аналогии с примером 203, стадия 1, (E)-5-(3-(3,5-дифторфенил)акрилоил)-1-метилпиридин-2(1H)-он взаимодействовал с 4-(метилсульфонил)фенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде желтого осадка, MS (ESI+): m/z=432.3 [M+H]+.
Стадия 5: (E)-5-(3-(3,5-дифторфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 151, стадия 3, 5-(3-(3,5-дифторфенил)-3-(4-(метилсульфонил)фенил)пропаноил)-1-метилпиридин-2(1H)-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=447.2 [M+H]+.
Пример 352
(E)-5-(3-(3,5-дихлорфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он
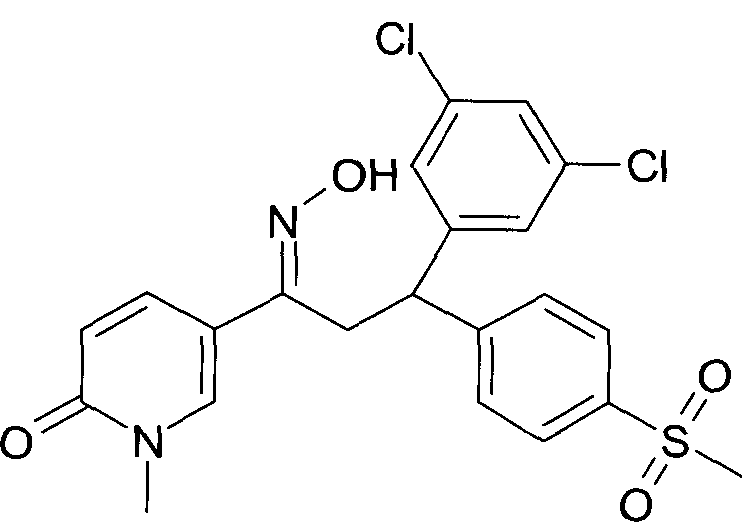
Стадия 1: (E)-3-(3.5-дихлорфенил)-1-(6-метоксипиридин-3-ил)проп-2-ен-1-он
По аналогии с примером 170, стадия 1, 6-ацетил-2-метоксипиридин взаимодействовал с 3,5-дихлорбензальдегидом в присутствии гидроксида калия с получением соединения, указанного в заголовке, в виде бесцветного осадка. Стадия 2: (E)-5-(3-(3.5-дихлорфенил)акрилоил)пиридин-2(1H)-он По аналогии с примером 162, стадия 2, (E)-3-(3,5-дихлорфенил)-1-(6-метоксипиридин-3-ил)проп-2-ен-1-он взаимодействовал с концентрированной водной HCl в 1,4-диоксане с получением соединения, указанного в заголовке, в виде бесцветного осадка.
Стадии 3-5: (E)-5-(3-(3.5-дихлорфенил)-1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)пропил)-1-метилпиридин-2(1H)-он
По аналогии с примером 161, стадия 1, (E)-5-(3-(3,5-дихлорфенил)акрилоил)пиридин-2(1H)-он взаимодействовал с йодометаном в присутствии карбоната калия. Продукт этой реакции обработали по аналогии с примером 203, стадия 1, 4-(метилсульфонил)фенилбороновой кислотой в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C. Продукт этой реакции взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде серо-белого осадка, MS (ESI+): m/z=479.1 [M+H]+.
Пример 353
N-{4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенил}-метансульфонамид
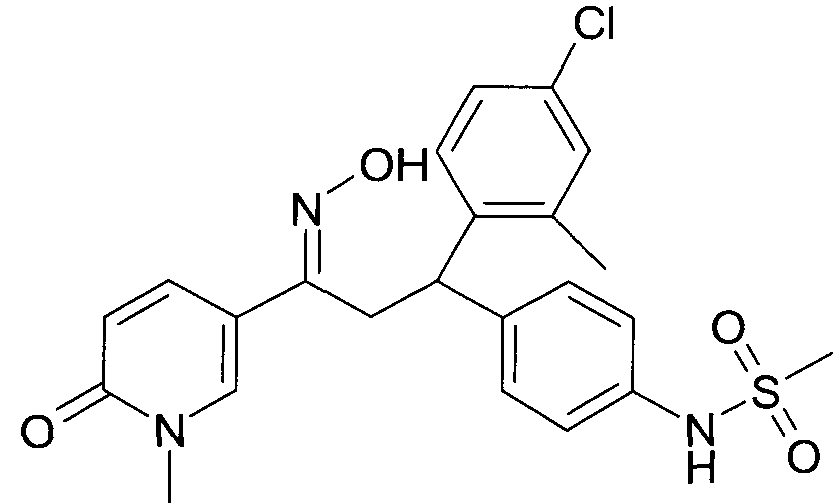
Стадия 1: 5-[3-(4-амино-фенил)-3-(4-хлор-2-метил-фенил)-пропионил]-1-метил-1H-пиридин-2-он
По аналогии с примером 203, стадия 1, 5-[(E)-3-(4-хлор-2-метил-фенил)-акрилоил]-1-метил-1H-пиридин-2-он (пример 323, стадия 3) взаимодействовал с 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилином в присутствии хлор(1,5-циклооктадиен)родий(I)димера и гидрокарбоната натрия в 1,4-диоксане и воде при 60°C с получением соединения, указанного в заголовке, в виде светло-коричневого осадка, MS (ESI+): m/z=381.3 [[M+H]+.
Стадия 2: N-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенил}-метансульфонамид
В 10 мл круглодонной колбе 5-[3-(4-амино-фенил)-3-(4-хлор-2-метил-фенил)-пропионил]-1-метил-1H-пиридин-2-он (88 мг) и метансульфонилхлорид (40.1 мг) смешали с пиридином (0.87 мл) с получением коричневого раствора. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Неочищенную реакционную смесь сконцентрировали под вакуумом. Реакционную смесь экстрагировали 3x этилацетатом, Органические слои промыли 3x водой и высушили над сульфатом магния и сконцентрировали под вакуумом. Неочищенный материал очистили флеш-хроматографией (силикагель, 20 г, 0% до 10% метанол в дихлорметане) с получением соединения, указанного в заголовке, (68 мг) в виде бесцветной пены, MS (ESI+): m/z=459.3 [M+H]+.
Стадия 3: N-{4-[1-(4-хлор-2-метил-фенил)-3-[(Е)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенил}-метансульфонамид
По аналогии с примером 151, стадия 3, N-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенил}-метансульфонамид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего 4% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=474.2 [M+H]+.
Пример 354
Циклопропансульфоновой кислоты {4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенил}-амид
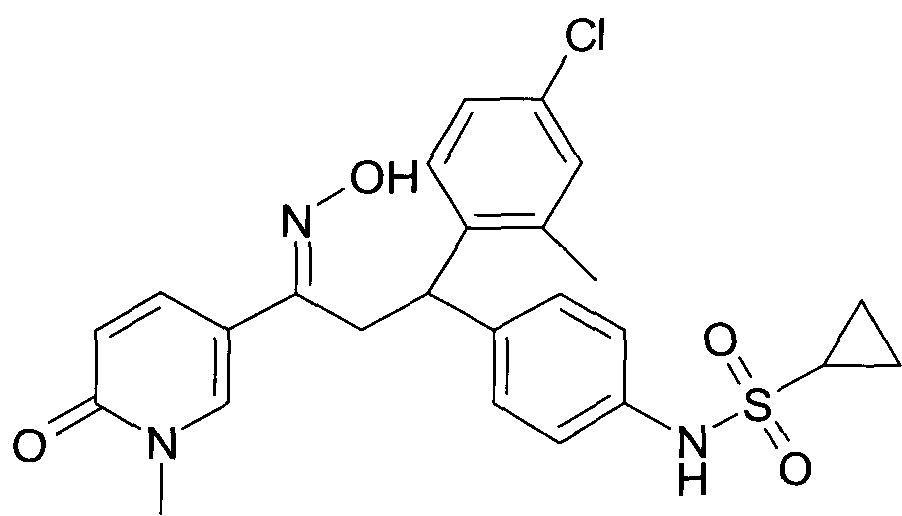
Стадия 1: Циклопропансульфоновой кислоты {4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1.6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенил}-амид
По аналогии с примером 353, стадия 2, 5-[3-(4-амино-фенил)-3-(4-хлор-2-метил-фенил)-пропионил]-1-метил-1H-пиридин-2-он (пример 353, стадия 1) взаимодействовал с циклопропансульфонилхлоридом в пиридине с получением соединения, указанного в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=485.2 [M+H]+.
Стадия 2: Циклопропансульфоновой кислоты {4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино1-3-(1-метил-6-оксо-1.6-дигидро-пиридин-3-ил)-пропил1-фенил}-амид
По аналогии с примером 151, стадия 3, циклопропансульфоновой кислоты {4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенил}-амид взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего 7% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=500.3 [M+H]+.
Пример 355
5-{3-(4-хлор-2-метил-фенил)-1-[(E)-гидроксиимино]-3-[4-(2-оксо-пирролидин-1-ил)-фенил]-пропил}-1-метил-1H-пиридин-2-он
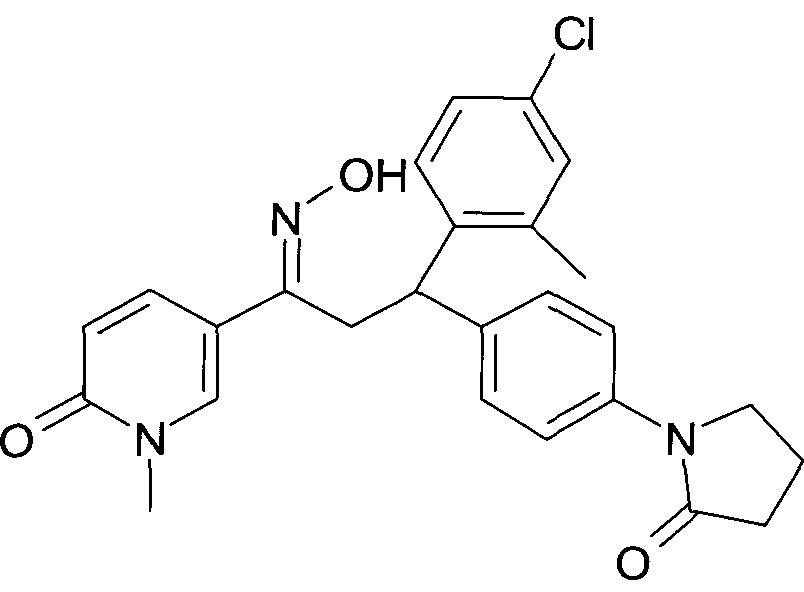
Стадия 1: 4-хлор-N{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1.6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенил}-бутирамид
В 10 мл круглодонной колбе 5-[3-(4-амино-фенил)-3-(4-хлор-2-метил-фенил)-пропионил]-1-метил-1H-пиридин-2-он (пример 353, стадия 1, 100 мг) растворили в дихлорметане (1.3 мл) и пиридине (41 мг). Затем реакционную смесь охладили в ванне со льдом и медленно добавили 4-хлорбутирилхлорид (41.6 мг). Ванну со льдом удалили и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь разбавили этилацетатом. Органический слой промыли 1x 1M HCl и 2x водой. Водные слои экстрагировали 2x этилацетатом, объединенные органические слои высушили над сульфатом магния и сконцентрировали под вакуумом. Неочищенный материал очистили флеш-хроматографией (силикагель, 20 г, 0% до 10% метанол в дихлорметане) с получением соединения, указанного в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=485.3 [M+H]+.
Стадия 2: 5-{3-(4-хлор-2-метил-фенил)-3-[4-(2-оксо-пирролидин-1-ил)-фенил]-пропионил}-1-метил-1H-пиридин-2-он
В 5 мл круглодонной колбе 4-хлор-N-{4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-фенил}-бутирамид (87 мг) смешали с тетрагидрофураном (1.15 мл) с получением бесцветного раствора. Реакционную смесь охладили в ванне со льдом и добавили трет-бутоксид калия (20.1 мг) с получением желтого раствора, который перемешивали в течение 2 ч при 0°C и в течение 11/2 ч при комнатной температуре. Реакционную смесь влили в воду, затем экстрагировали 3x этилацетатом, органические фазы промыли 2х водой, высушили над сульфатом магния и сконцентрировали под вакуумом. Неочищенный материал очистили флеш-хроматографией (силикагель, 20 г, 0% до 10% метанол в дихлорметане) с получением соединения, указанного в заголовке, (58 мг) в виде серо-белого осадка, MS (ESI+): m/z=449.2 [M+H]+.
Стадия 3: 5-{3-(4-хлор-2-метил-фенил)-1-[(E)-гидроксиимино1-3-[4-(2-оксо-пирролидин-1-ил)-фенил]-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-{3-(4-хлор-2-метил-фенил)-3-[4-(2-оксо-пирролидин-1-ил)-фенил]-пропионил}-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, содержащего менее чем 10% соответствующего Z изомера, в виде бесцветного осадка, MS (ESI+): m/z=464.2 [M+H]+.
Пример 356
3-{4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фениламино}-циклобутанкарбоновая кислота
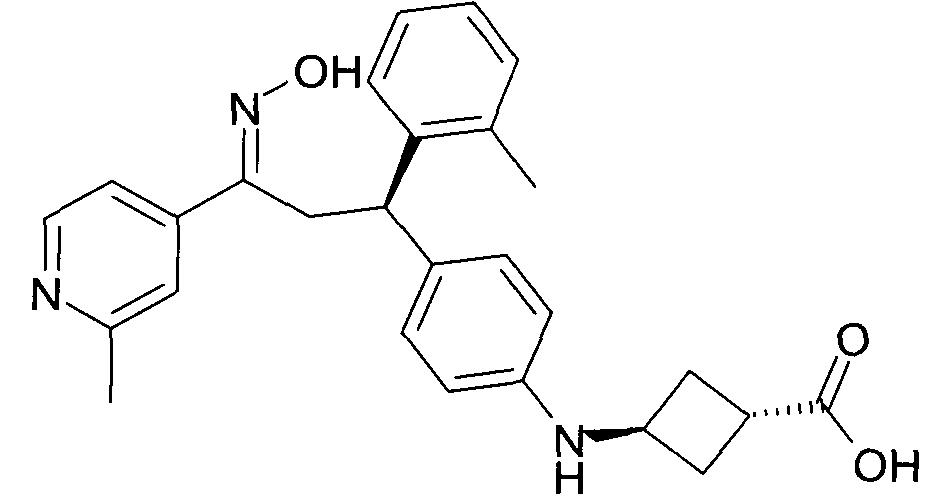
Стадия 1: 3-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фениламино}-циклобутанкарбоновая кислота
По аналогии с примером 39, из (R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 142, стадия 2) и транс-этил 3-аминоциклобутанкарбоксилата гидрохлорида в присутствии трис(дибензилиденацетон) дипалладия(О), 4,5-бис(дифенилфосфино)-9,9-диметилксантена и карбоната цезия в 1,4-диоксане получили 3-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фениламино}-циклобутанкарбоновой кислоты этиловый эфир.
По аналогии с примером 169, стадия 2, из 3-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фениламино}-циклобутанкарбоновой кислоты этилового эфира в присутствии 1M водного раствора гидроксида лития в тетрагидрофуране получили 3-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фениламино}-циклобутанкарбоновую кислоту в виде желтой пены, MS (ESI+): m/z=429.2 ([M+H]+).
Стадия 2: 3-{4-[(R)-3-[(Е)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фениламино}-циклобутанкарбоновая кислота
По аналогии с примером 132, стадия 6, из 3-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фениламино}-циклобутанкарбоновой кислоты в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде желтой пены, MS (ESI+): m/z=444.4 ([M+H]+).
Пример 357
(R)-3-[4-(3-хлор-2-метокси-пропилатшо)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
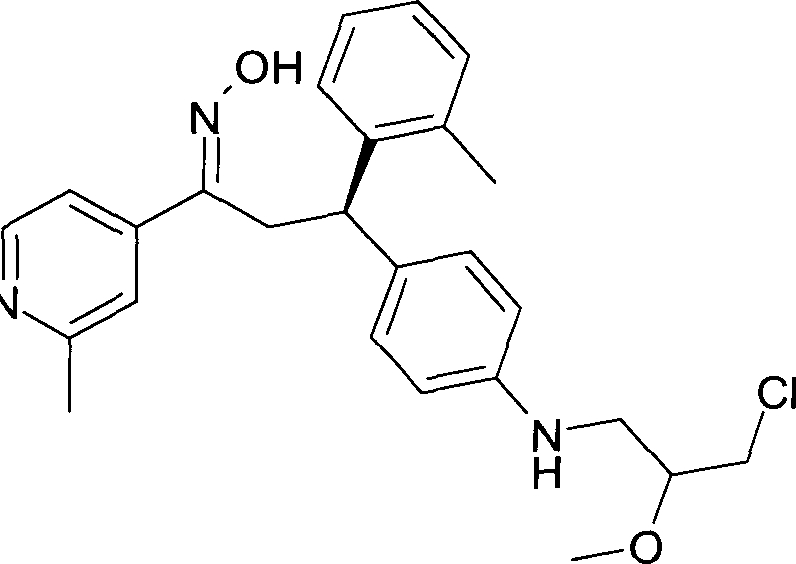
К раствору (R)-3-[4-(3-метокси-азетидин-1-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксима (пример 270, 31 мг) в 1,4-диоксане (2 мл) добавили при комнатной температуре 4M соляную кислоту в 1,4-диоксане (187 мкл). Реакционную смесь нагревали при 50°C и перемешивали в течение 4 часов. Насыщенный раствор гидрокарбоната натрия (2 мл) добавили для нейтрализации неочищенного раствора с последующим насыщенным водным раствором хлорида аммония. Добавили этилацетат, фазы разделили и неорганическую фазу экстрагировали этилацетатом (2x). Объединенные органические слои промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (25% до 100% этилацетат в n-гептане) с получением соединения, указанного в заголовке, в виде светло-желтой пены (89%), MS (ESI+): m/z=452.3 ([M+H]+).
Пример 358
(R)-3-(4-метансульфонил-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим

Стадия 1: (R)-3-(4-метансульфонил-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
К раствору L-пролина (35 мг) в диметилсульфоксиде (4 мл) добавили при комнатной температуре гидроксид натрия (12 мг). Реакционную смесь перемешивали при комнатной температуре в течении 30 мин. Добавили (R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он (пример 142, стадия 2, 150 мг), метансульфинат натрия (311 мг) и йодид меди(I) (58 мг). Реакционную смесь нагревали при 110°C и перемешивали в течение 4 часов. Добавили воду и этилацетат, фазы разделили и неорганическую фазу экстрагировали этилацетатом (2x). Объединенные органические слои промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (50% до 100% этилацетат в л-гептане) с получением соединения, указанного в заголовке, в виде желтого масла (57%), MS (ESI+): m/z=394.0 ([M+H]+).
Стадия 2: (R)-3-(4-метансульфонил-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 132, стадия 6, из (R)-3-(4-метансульфонил-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=409.2 ([M+H]+).
Пример 359
(R)-3-(4-хлор-2-метил-фенил)-3-(4-метансульфонил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
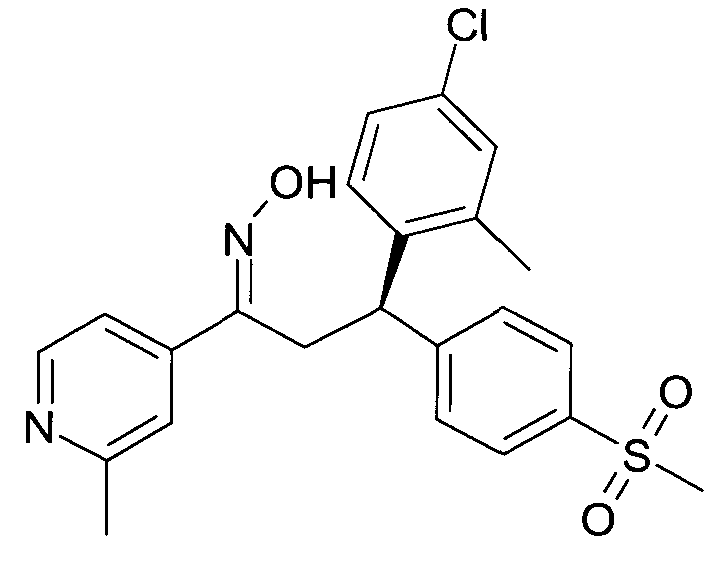
Стадия 1: (R)-3-(4-хлор-2-метил-фенил)-3-(4-метансульфонил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-он
По аналогии с примером 358, стадия 1, из (R)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она (пример 282, стадия 1) в присутствии метансульфинат натрия, L-пролина, гидроксида натрия и йодида меди(I) в 1,4-диоксане получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=428.1 ([M+H]+).
Стадия 2: (R)-3-(4-хлор-2-метил-фенил)-3-(4-метансульфонил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
По аналогии с примером 132, стадия 6, из (R)-3-(4-хлор-2-метил-фенил)-3-(4-метансульфонил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=443.2 ([M+H]+).
Пример 360
4-[3-[(E)-гидроксимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-1-о-толил-пропил]-бензойная кислота
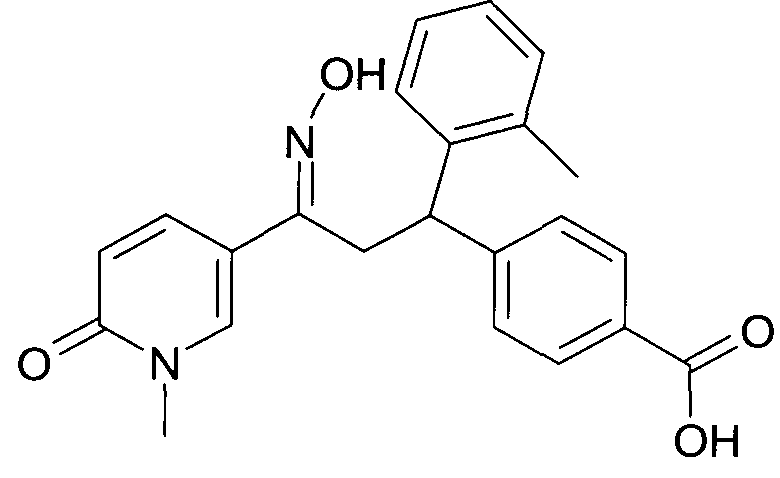
По аналогии с примером 1, стадия 2, из 4-[3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-1-о-толил-пропил]-бензойной кислоты (пример 207, стадия 1) и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=391.3 ([M+H]+).
Пример 361
4-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бензойная кислота
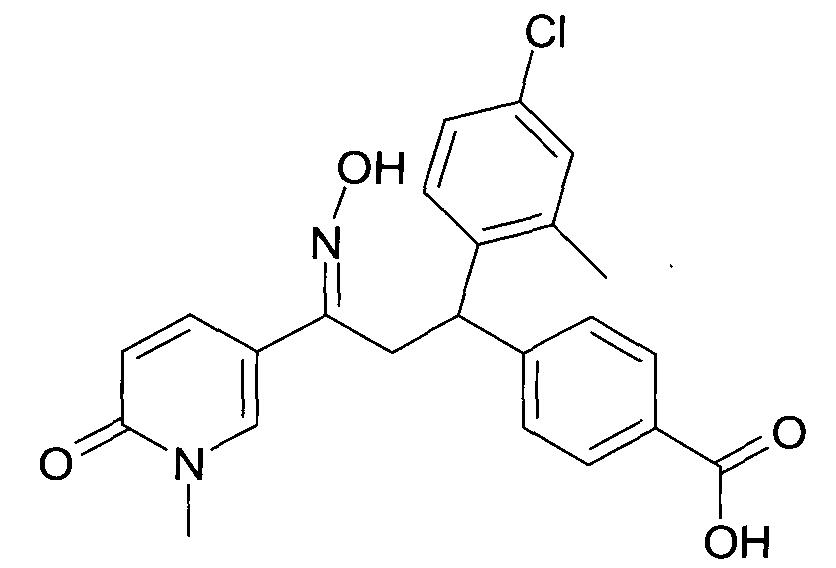
По аналогии с примером 1, стадия 2, из 4-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-бензойной кислоты (пример 332, стадия 2) и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде светло-желтого масла, MS (ESI+): m/z=425.1 ([M+H]+).
Пример 362
(E,R)-4-(4-бром-фенил)-4-(4-хлор-2-метил-фенил)-1-пиридин-2-ил-бутан-2-она оксим
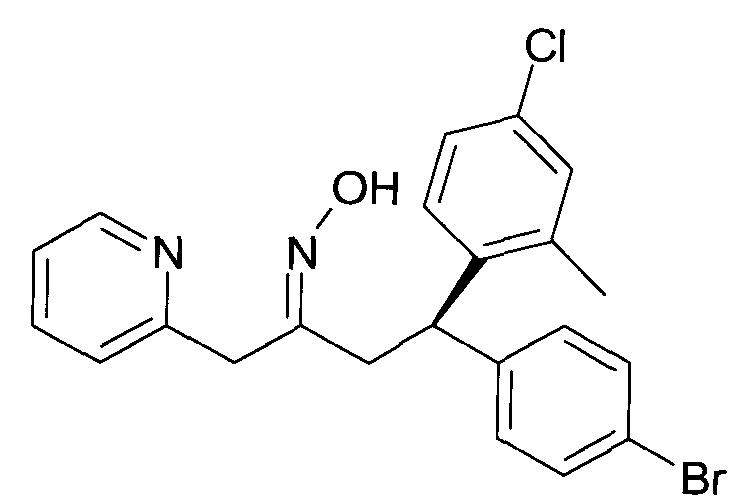
Стадия 1: (R)-4-(4-бром-фенил)-4-(4-хлор-2-метил-фенил)-1-пиридин-2-ил-бутан-2-он
По аналогии с примером 261, стадия 1, из (Р)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-N-метокси-N-метил-пропионамида и 2-метил-пиридина получили соединение, указанное в заголовке, в виде желтого масла, MS (ESI+): m/z=430.0 ([M+H]+, 1Br).
Стадия 2: (E,R)-4-(4-бром-фенил)-4-(4-хлор-2-метил-фенил)-1-пиридин-2-ил-бутан-2-она оксим
По аналогии с примером 74, стадия 7, из (R)-4-(4-бром-фенил)-4-(4-хлор-2-метил-фенил)-1-пиридин-2-ил-бутан-2-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили (E,R)-4-(4-бром-фенил)-4-(4-хлор-2-метил-фенил)-1-пиридин-2-ил-бутан-2-она оксим в виде белой пены, MS (ESI+): m/z=445.1 ([M+H]+, 1Br).
Пример 363
(R)-3-(4-гидрокси-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
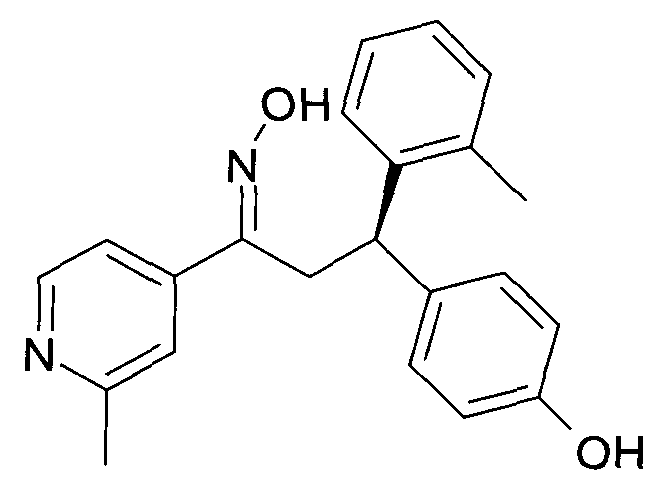
Стадия 1: (R)-3-(4-гидрокси-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
TK белой суспензии (R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 142, стадия 2, 200 мг) и гидроксида калия (62.6 мг) в 1,4-диоксане (1 мл) и воде (0.6 мл) в атмосфере аргона добавили 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил (17.2 мг) и трис(дибензилиденацетон)дипалладий(0) (9.3 мг). Реакционную смесь нагрели 100°C и перемешивали в течение 3 часов. Добавили насыщенный водный раствор хлорида аммония и этилацетата, фазы разделили и неорганическую фазу экстрагировали этилацетатом (2x). Объединенные органические слои промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (30% до 100% этилацетат в гептане) с получением соединения, указанного в заголовке, в виде светло-желтого полутвердого вещества (77%), MS (ESI+): m/z=332.1 ([M+H]+).
Стадия 2: (R)-3-(4-гидрокси-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 132, стадия 6, из (R)-3-(4-гидрокси-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=347.2 ([M+H]+).
Пример 364
(R)-3-(4-Этокси-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
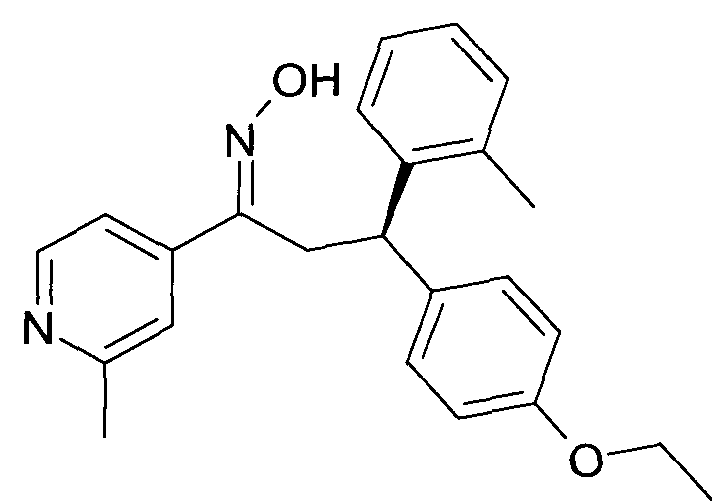
Стадия 1: (R)-3-(4-Этокси-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
К белой суспензии (R)-3-(4-бром-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 142, стадия 2, 200 мг) и гидроксида калия (171 мг) в 1,4-диоксане (1 мл) и воде (2 мл) в атмосфере аргона добавили 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил (17.2 мг) и трис(дибензилиденацетон)дипалладий(0) (9.3 мг). Реакционную смесь нагрели до 100°C и перемешивали в течение 3 часов. После охлаждения при комнатной температуре добавили цетилтриметиламмония бромид (18.5 мг) и йодометан (158 мг). Реакционную смесь нагревали до 100°C в течение 1 часа. Добавили насыщенный водный раствор хлорида аммония и этилацетата, фазы разделили и неорганическую фазу экстрагировали этилацетатом (2x). Объединенные органические слои промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и сконцентрировали под вакуумом. Неочищенный продукт очистили флеш-хроматографией на силикагеле (0% до 50% этилацетат в гептане) с получением соединения, указанного в заголовке, в виде бесцветной жидкости (90%), MS (ESI+): m/z=360.2 ([M+H]+).
Стадия 2: (R)-3-(4-Этокси-фенил)-1 -(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
По аналогии с примером 132, стадия 6, из (R)-3-(4-этокси-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=375.2 ([M+H]+).
Пример 365
(S)-3-(4-хлор-2-метил-фенил)-3-(4-гидрокси-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
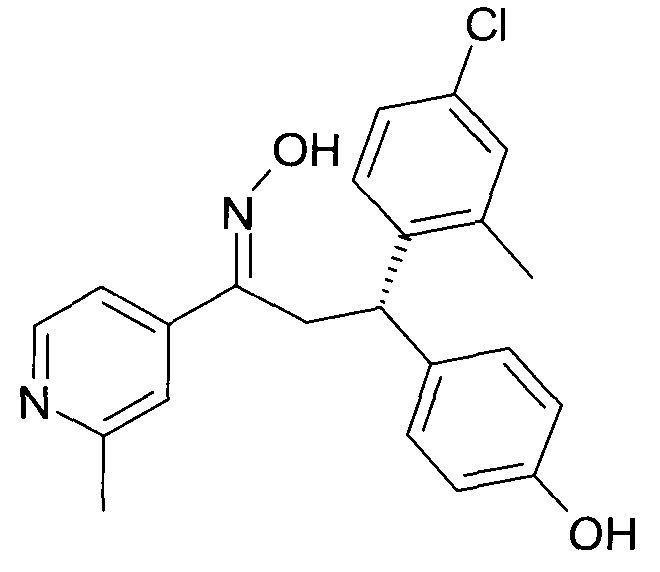
Стадия 1: (S)-3-(4-хлор-2-метил-фенил)-3-(4-гидрокси-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1 -он
По аналогии с примером 363, стадия 1, из (S)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она (пример 282, стадия 1) в присутствии гидроксида калия, 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенила и трис(дибензилиден-ацетон)дипалладия(0) получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=366.1 ([M+H]+).
Стадия 2: (S)-3-(4-хлор-2-метил-фенил)-3-(4-гидрокси-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
По аналогии с примером 132, стадия 6, из (S)-3-(4-хлор-2-метил-фенил)-3-(4-гидрокси-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=381.2 ([M+H]+).
Пример 366
(S)-3-(4-хлор-2-метил-фенил)-3-(4-этокси-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
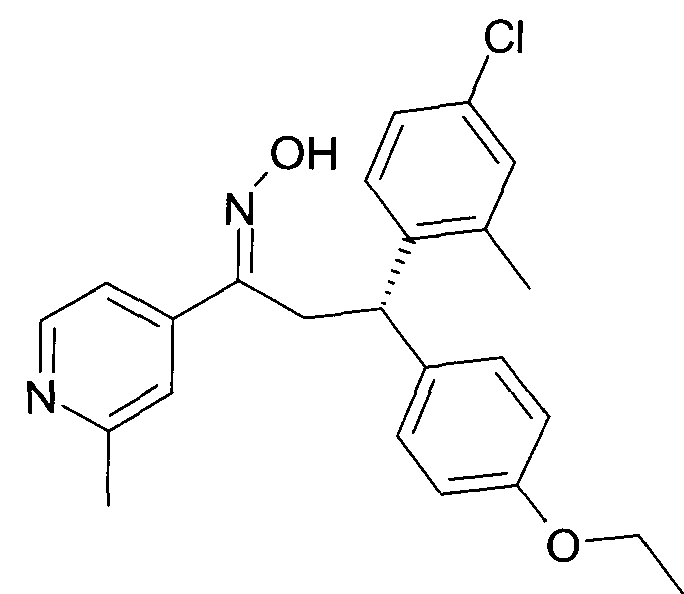
Стадия 1: (S)-3-(4-хлор-2-метил-фенил)-3-(4-этокси-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-он
По аналогии с примером 364, стадия 1, из (3)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она в присутствии гидроксида калия, 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенила, трис(дибензилиденацетон)дипалладия(0), цетилтриметиламмония бромида и йодоэтана получили соединение, указанное в заголовке, в виде желтой пены, MS (ESI+): m/z=394.0 ([M+H]+).
Стадия 2: (3)-3-(4-хлор-2-метил-фенил)-3-(4-этокси-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
По аналогии с примером 132, стадия 6, из (8)-3-(4-хлор-2-метил-фенил)-3-(4-этокси-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде серо-белой пены, MS (ESI+): m/z=409.4 ([M+H]+).
Пример 367
(R,E)-1-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоксамид
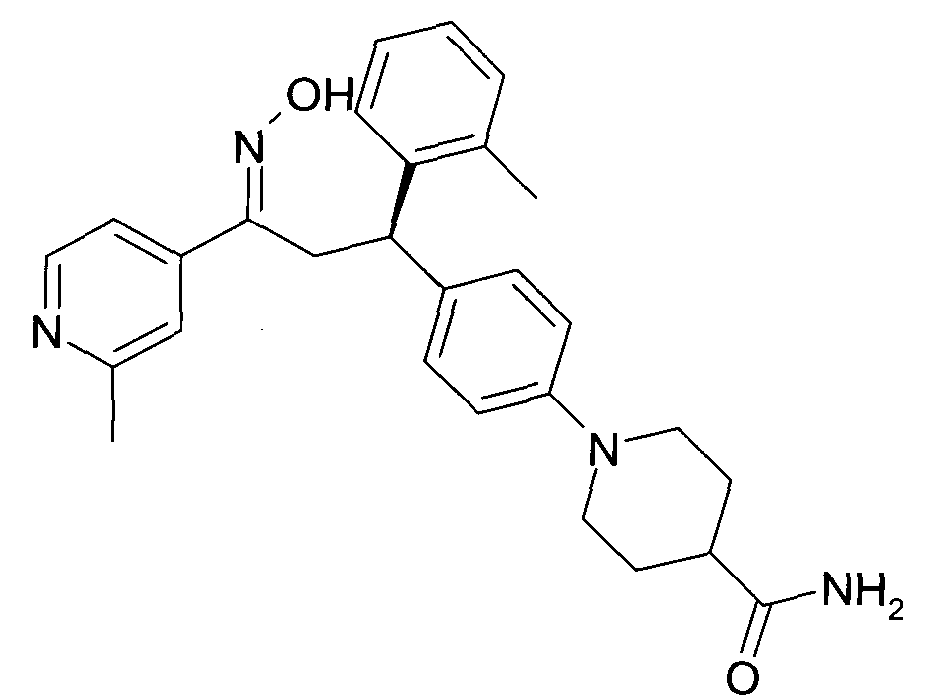
Стадия 1: (R)-1-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил) пиперидин-4-карбоновая кислота
Смесь (R)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она (пример 142, стадия 2; 2.00 г, 5.07 ммоль), этил пиперидин-4-карбоксилата (1.2 г, 7.61 ммоль), трет-бутоксид натрия (975 мг, 10.1 ммоль), 2-дициклогексилфосфино-2',4',6'-триизопропил-бифенила (484 мг, 1.01 ммоль) и трис(дибензилиденацетон)дипалладия(0) (464 мг, 507 мкмоль) в толуоле (100 мл) нагревали при 85°C в течение 4 ч и при комнатной температуре в течение 17 ч, затем отфильтровали диатомит. После эвапорации летучих веществ, остаток растворили в тетрагидрофуране (50 мл), 1 М водном растворе гидроксида лития (50 мл, 50 ммоль) и метаноле (15 мл), затем через 2 ч обработали 1M водным раствором гидросульфата калия (40 мл) и нас.водн. раствором хлорида аммония (50 мл). Смесь экстрагировали этилацетатом, Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали, и выпарили. Хроматография (SiO2; дихлорметан-метаноловый градиент) дала соединение, указанное в заголовке, (2.24 г, 66%). Светло-желтый осадок, MS (ESI-): m/z=441.3 ([M-H]-).
Стадия 2: (R)-1-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил) пиперидин-4-карбоксамид
Смесь (R)-1-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)-пиперидин-4-карбоновой кислоты (100 мг, 226 мкмоль), триэтиламина (229 мг, 2.26 ммоль) и O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторбората (218 мг, 678 мкмоль) в тетрагидрофуране (5 мл) перемешивали при комнатной температуре в течение 15 минут, затем обработали хлоридом аммония (96.7 мг, 1.81 ммоль), затем через 20 ч разделили между нас.водн. раствором хлорида аммония и этилацетатом. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали, и выпарили с получением неочищенного соединения, указанного в заголовке, (131 мг), которое сразу использовали на следующей стадии. Желтое масло, MS (ESI+): m/z=442.4 ([M+H]+).
Стадия 3: (R,E)-1-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоксамид
По аналогии с примером 132, стадия 6, из (R)-1-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-4-карбоксамида и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=457.5 ([M+H]+).
Пример 368
(R,E)-1-(2-метилпиридин-4-ил)-3-фенил-3-о-толилпропан-1-она оксим
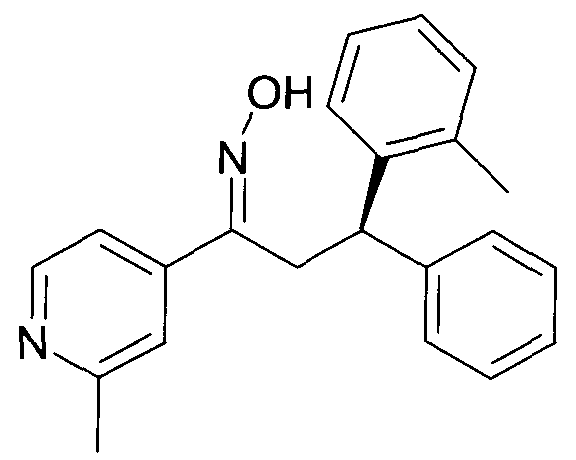
Стадия 1: (R)-1-(2-метилпиридин-4-ил)-3-фенил-3-о-толилпропан-1-ол
Соединение, указанное в заголовке, получили в виде побочного продукта примера 367, стадия 1. Светло-желтая пена, MS (ESI+): m/z=318.2 ([M+H]+).
Стадия 2: (R)-1-(2-метилпиридин-4-ил)-3-фенил-3-о-толилпропан-1-он
Смесь (R)-1-(2-метилпиридин-4-ил)-3-фенил-3-о-толилпропан-1-ола (110 мг, 347 мкмоль) и диоксида марганца (121 мг, 1.39 ммоль) в толуоле (2 мл) нагревали при 90°C в течение 3 ч, затем отфильтровали диатомит и сконцентрировали под вакуумом. Хроматография (силикагель, 10 г, от 10% до 50% этилацетат в гептане) дала соединение, указанное в заголовке, (60 мг, 55%). Белое полутвердое вещество, MS (ESI+): m/z=316.3 ([M+H]+).
Стадия 3: (R,E)-1-(2-метилпиридин-4-ил)-3-фенил-3-о-толилпропан-1-она оксим
По аналогии с примером 132, стадия 6, из (R)-1-(2-метилпиридин-4-ил)-3-фенил-3-о-толилпропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=331.2 ([M+H]+). Пример 369
(R,E)-2-(1-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоксамидо)уксусная кислота
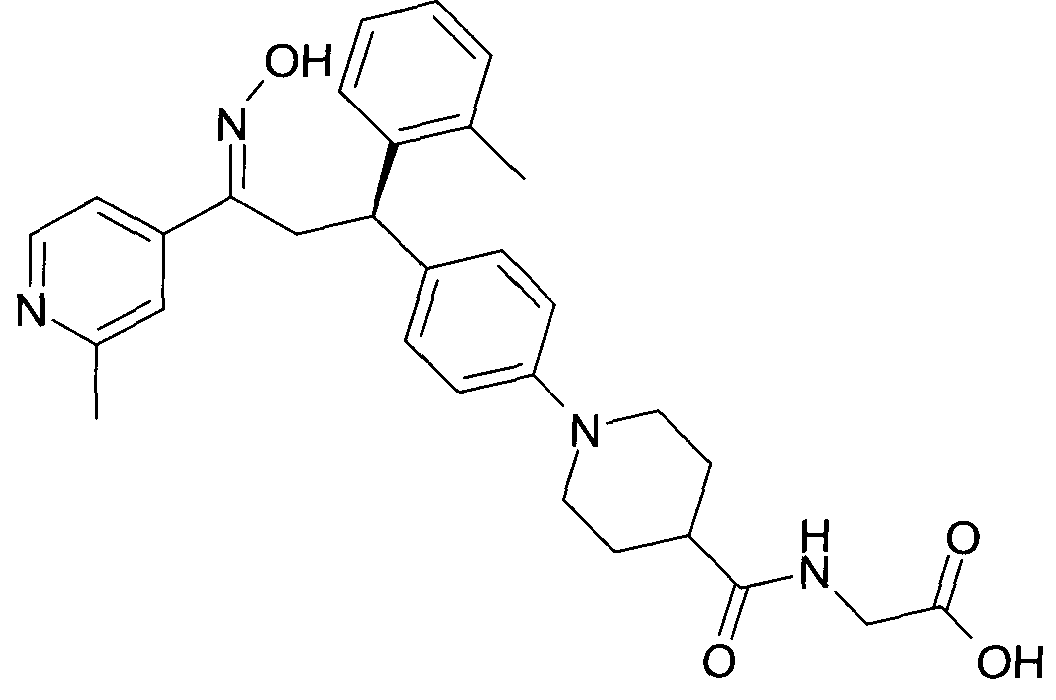
Стадия 1: (R)-метил, 2-(1-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-4-карбоксамидо)ацетат
Смесь (R)-1-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)-пиперидин-4-карбоновой кислоты (пример 367, стадия 1; 100 мг, 226 мкмоль) триэтиламина (68.6 мг, 94.5 мкл, 678 мкмоль) и O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторбората (79.8 мг, 249 мкмоль) в тетрагидрофуране (5 мл) перемешивали при комнатной температуре в течение 15 минут, затем обработали метил 2-аминоацетата гидрохлоридом (42.6 мг, 339 мкмоль). Реакционную смесь перемешивали в течение 20 ч при комнатной температуре, затем разделили между нас.водн. раствором хлорида аммония и этилацетата. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали, и выпарили с получением неочищенного соединения, указанного в заголовке, (130 мг), которое сразу использовали на следующей стадии. Желтое масло, MS (ESI+): m/z=514.6 ([M+H]+).
Стадия 2: (R,E)-2-(1-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоксамидо)уксусная кислота
Раствор (R)-метил, 2-(1-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-4-карбоксамидо)ацетата (116 мг, 226 мкмоль) в тетрагидрофуране (3 мл), 1M водный раствор гидроксида лития (2.26 мл, 2.26 ммоль) и метанола (1 мл) перемешивали в течение 2 ч при комнатной температуре, затем после добавления 1M водного раствора гидросульфата калия (2.5 мл) и нас.водн. раствора хлорида аммония (5 мл) реакционную смесь экстрагировали этилацетатом. Органический слой высушили над сульфатом натрия, отфильтровали, и сконцентрировали под вакуумом с получением [(1-{4-[(R)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-пиперидин-4-карбонил)-амино]-уксусной кислоты. Это соединение взаимодействовало по аналогии с примером 132, стадия 6, с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, (42 мг, 36%). Желтое полутвердое вещество, MS (ESI+): m/z=515.6 ([M+H]+).
Пример 370
(R,E)-2-(1-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоксамидо)этансульфоновая кислота
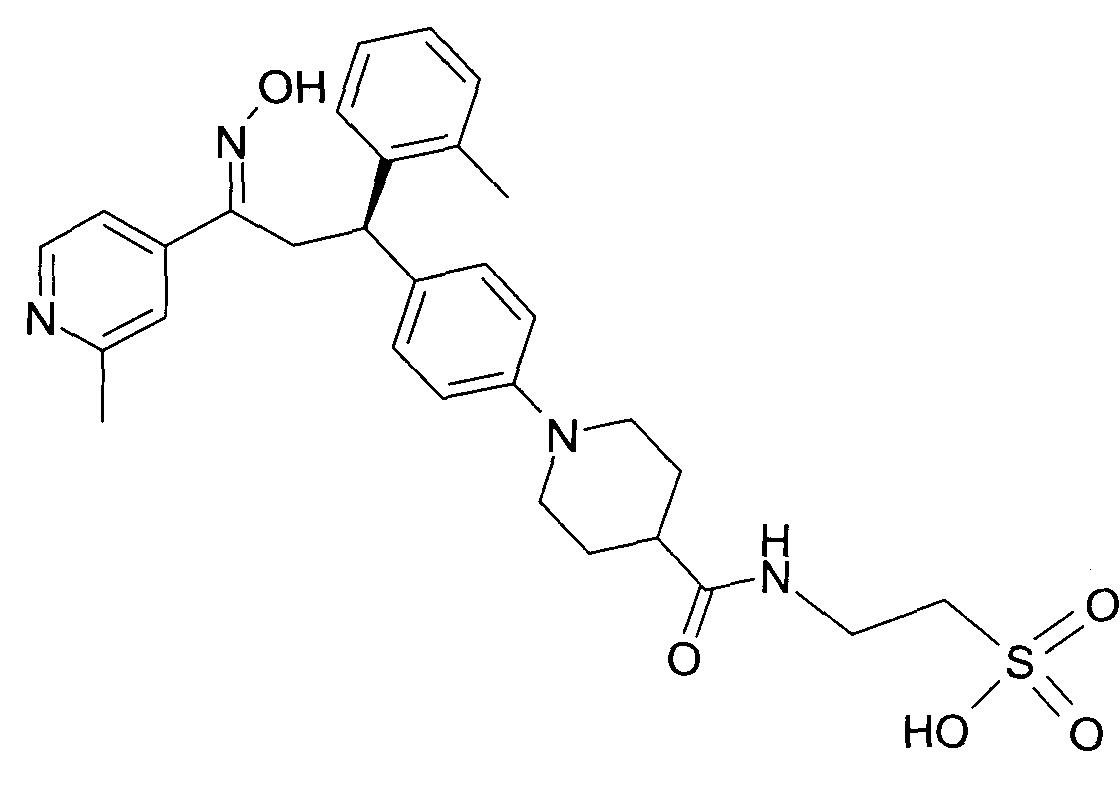
Смесь (R)-1-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)-пиперидин-4-карбоновой кислоты (100 мг, 226 мкмоль), триэтиламина (68.6 мг, 678 мкмоль) и 0-(бензотриазол-1-ил)-N,N,N',N' -тетраметилурония тетрафторбората (79.8 мг, 249 мкмоль) в тетрагидрофуране (5 мл) перемешивали в течение 15 минут при комнатной температуре, затем обработали 2-аминоэтансульфоновой кислотой (42.4 мг, 339 мкмоль), затем через 20 ч летучие вещества удалили под вакуумом с получением неочищенного соединения, указанного в заголовке, (303 мг, желтое масло, MS (ESI+): m/z=550.4 ([M+H]+). Его растворили в этаноле (5 мл), воде (1 мл) и обработали бикарбонатом натрия (57 мг, 0.68 ммоль) и гидроксиламина гидрохлоридом (47 мг, 0.68 ммоль). Реакционную смесь нагревали при 90°C в течение 2 ч, затем обработали нас.водн. раствором хлорида аммония (10 мл) и сконцентрировали под вакуумом. Остаток суспендировали в 1,4-диоксане (5 мл), затем после добавления раствора соляной кислоты (4 М в 1,4-диоксане; 0.56 мл, 2.3 ммоль) реакционную смесь нагревали при 50°С в течение 4 ч. После охлаждения добавили нас.водн. раствор бикарбоната натрия (4 мл) и нас.водн. раствор хлорида аммония (10 мл) и смесь выпарили досуха. Остаток хроматографировали (обратная фаза [C18] SiO2; водно-метаноловый градиент) с получением соединение, указанного в заголовке, (92 мг, 72%). Желтое полутвердое вещество, MS (ESI+): m/z=565.3 ([M+H]+).
Пример 371
(3R,E)-3-(4-(2-тиа-6-азаспиро[3,3]гептан-6-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим
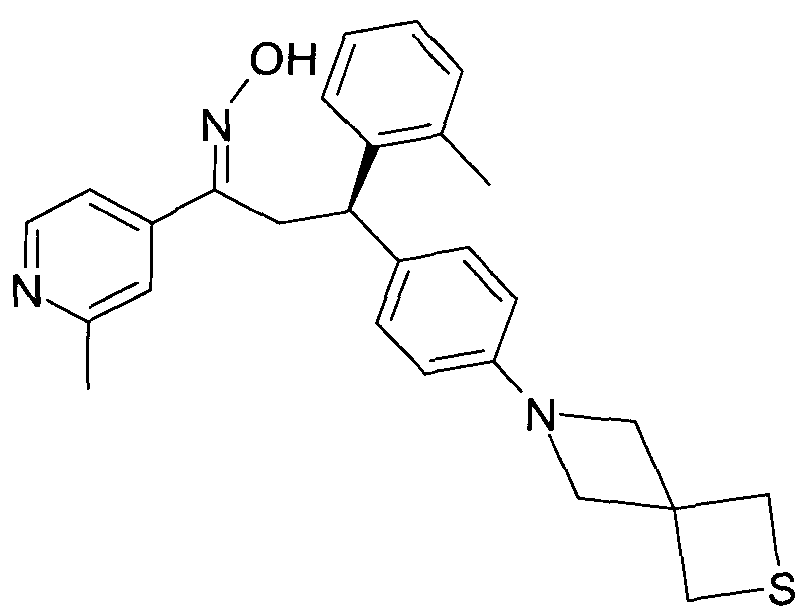
Стадия 1: (3R,E)-3-(4-(2-тиа-6-азаспиро[3.3]гептан-6-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 270, стадия 1, из (R)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она (пример 142, стадия 2) и 2-тиа-6-азаспиро[3.3]гептане гемиоксалата (Angew. Chem. Int. Ed. 2010, 49, 3524). Желтое масло, MS (ESI+): m/z=429.3 ([M+H]+).
Стадия 2: (3R,E)-3-(4-(2-тиа-6-азаспиро[3.3]гептан-6-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим
Соединение, указанное в заголовке, получили по аналогии с примером 1, стадия 2, из (3R)-3-(4-(2-тиа-6-азаспиро[3.3]гептан-6-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она. Белое полутвердое вещество, MS (ESI+): m/z=444.5 ([M+H]+).
Пример 372
(R)-трет-бутил 4-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)-5,6-дигидропиридин-1(2H)-карбоксилат
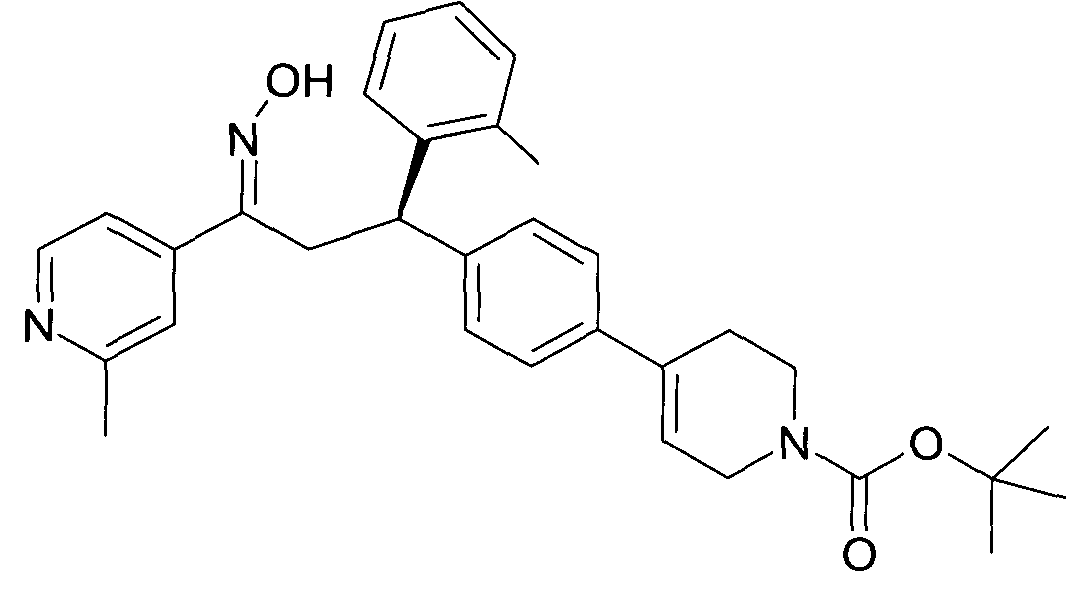
Стадия 1: (R)-трет-бутил 4-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)-5,6-дигидропиридин-1(2H)-карбоксилат
Смесь (R)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она (пример 142, стадия 2; 300 мг, 761 мкмоль), трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2H)-карбоксилата (353 мг, 1.14 ммоль), [1,1'-бис(дифенил-фосфино)ферроцен]дихлорпалладия(II)дихлорметанового аддукта (27.8 мг, 38.0 мкмоль) в 1,4-диоксане (7.5 мл), воды (5 мл) и 2M водн. раствор карбоната натрия (1.14 мл, 2.28 ммоль) нагревали при 85°C в течение 4 ч, затем после охлаждения разделили между нас.водн. раствором хлорида аммония и этилацетатом. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и выпарили. Хроматография (SiO2; градиент гептан-этилацетат) дала соединение, указанное в заголовке, (365 мг, 97%). Белая пена, MS (ESI+): m/z=497.4 ([M+H]+)
Стадия 2: (R)-трет-бутил 4-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)-5,6-дигидропиридин-1(2H)-карбоксилат
Соединение, указанное в заголовке, получили по аналогии с примером 1, стадия 2, из (R)-трет-бутил 4-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)-5,6-дигидропиридин-1(2H)-карбоксилата. Бесцветная пена, MS (ESI+): m/z=512.5 ([M+H]+).
Пример 373
(R,E)-4-(3-(4-(4-Карбоксипиперидин-1-ил)фенил)-1-(гидроксиимино)-3-о-толилпропил)-2-метилпиридин 1-оксид
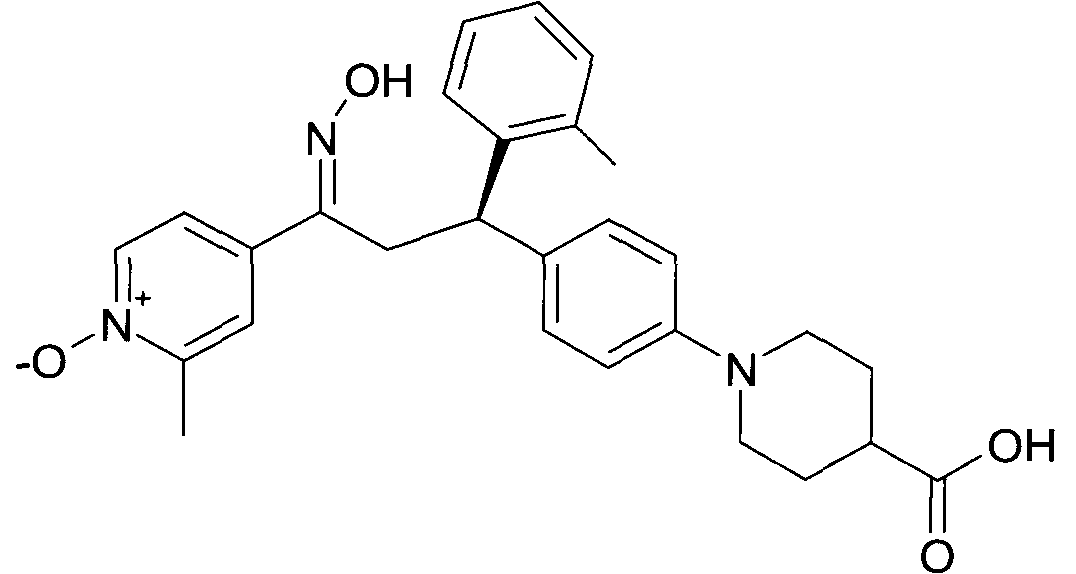
Раствор (R,E)-1-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоновой кислоты (пример 266; 95 мг, 208 мкмоль) в дихлорметане (3 мл) и метаноле (0.75 мл) обработали 3-хлорпербензойной кислотой (42 мг, 241 мкмоль) при 0°C. Реакционную смесь дали нагреться до комнатной температуры в течение 3 ч, затем после добавления нас.водн. раствора бикарбоната натрия (3 капли) и нас.водн. раствора хлорида аммония (5 капель) сконцентрировали под вакуумом. Остаток очистили препаративной ВЭЖХ с получением соединения, указанного в заголовке, (49 мг, 50%). Белая пена, MS (ESI+): m/z=474.1 ([M+H]+).
Пример 374
(R,E)-1-(4-(3-(гидроксиимино)-3-(2-(гидроксиметил)пиридин-4-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоновая кислота
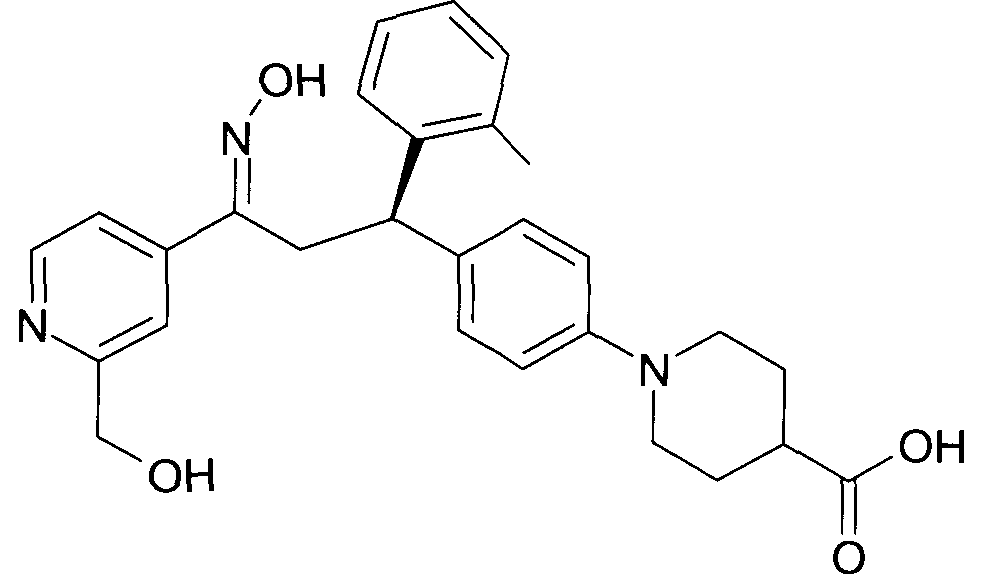
Ангидрид трифторуксусной кислоты (421 мг, 2.01 ммоль) добавили при 0°C к суспензии (R,E)-4-(3-(4-(4-карбоксипиперидин-1-ил)фенил)-1-(гидроксиимино)-3-о-толилпропил)-2-метилпиридин 1-оксида (95 мг, 201 мкмоль) в дихлорметане (3 мл) с получением белой суспензии, затем через 1 ч добавили другую порцию ангидрида трифторуксусной кислоты (421 мг, 2.01 ммоль). Реакционной смеси дали нагреться до комнатной температуры в течение 1 ч, затем обработали 1M водн. раствором гидроксида натрия и перемешивали в течение дополнительных 90 мин. После экстракции дихлорметаном, органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и выпарили. Остаток очистили препаративной ВЭЖХ с получением соединения, указанного в заголовке, (13 мг, 14%). Светло-желтое масло, MS (ESI+): m/z=474.4 ([M+H]+).
Пример 375
(R,E)-1-(2-метилпиридин-4-ил)-3-(4-(1,2,3,6-тетрагидропиридин-4-ил)фенил)-3-о-толилпропан-1-она оксим
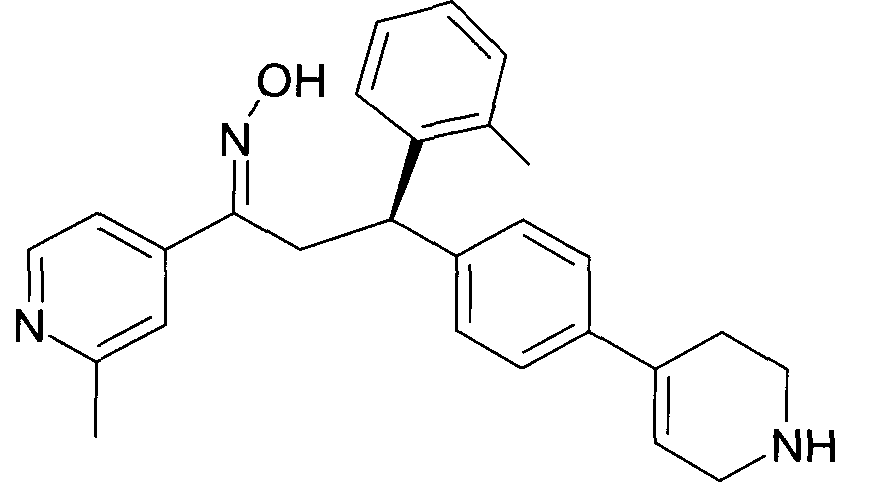
Раствор соляной кислоты (4M в 1,4-диоксане, 0.22 мл, 0.88 ммоль) добавили к раствору (R,E)-трет-бутил 4-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)-5,6-дигидропиридин-1(2H)-карбоксилата (45 мг, 87.9 мкмоль) в 1,4-диоксане (4 мл). Реакционную смесь нагревали в течение 17 ч при 50°C, затем обработали нас.водн. раствором бикарбоната натрия (4 мл) и разделили между нас.водн. раствором хлорида аммония и этилацетатом. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали, и выпарили. Неочищенный материал тритурировали с этилацетатом с получением соединения, указанного в заголовке, (20 мг, 55%). Серо-белый осадок, MS (ESI+): m/z=412.4 ([M+H]+).
Пример 376
(R,E)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)-3-о-толилпропан-1-она оксим
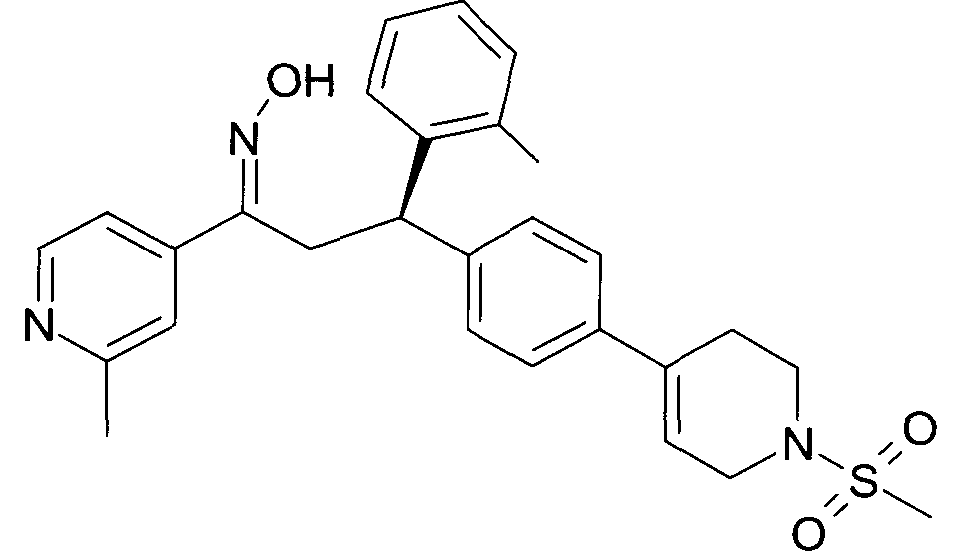
Стадия 1: (R)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)-1,2.3.6-тетрагидропиридин-4-ил)фенил)-3-о-толилпропан-1-он
Раствор соляной кислоты (4M в 1,4-диоксане, 2 мл) добавили к раствору (R)-трет-бутил 4-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)-5,6-дигидропиридин-1(2H)-карбоксилата (пример 372, стадия 1; 100 мг, 201 мкмоль). Реакционную смесь нагревали при 50°C в течение 17 ч, затем разделили между нас.водн. раствором бикарбоната натрия и этилацетатом. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали, и выпарили. Остаток растворили в дихлорметане (5 мл), затем охладили до 0°C и обработали N,N-диизопропилэтиламином (78 мг, 604 мкмоль) и метансульфонилхлоридом (34.6 мг, 302 мкмоль). Ванну со льдом удалили, затем через 3 ч реакционную смесь разделили между нас.водн. раствором хлорида аммония и дихлорметаном. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали, и выпарили. Хроматография (SiO2; градиент гептан-этилацетат) дала соединение, указанное в заголовке, (24 мг, 25%). Белая пена, MS (ESI+): m/z=475.1 ([M+H]+)
Стадия 2: (R,E)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)-3-о-толилпропан-1-она оксим
По аналогии с примером 132, стадия 6, из (R)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)-3-о-толилпропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде бесцветной пены, MS (ESI+): m/z=490.4 ([M+H]+).
Пример 377
(R,E)-4-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)-5,6-дигидропиридин-2(1H)-он
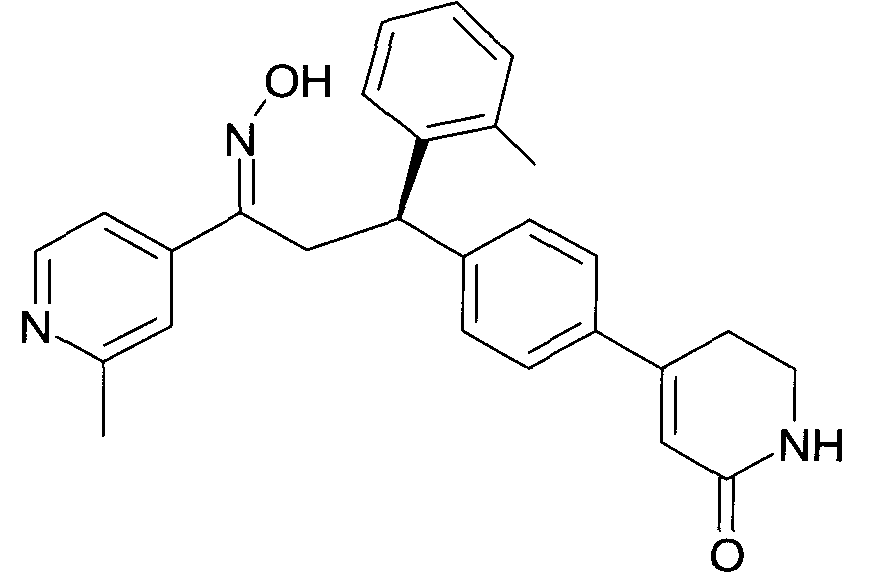
Стадия 1: (R)-4-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)-5,6-дигидропиридин-2(1 Н)-он
Раствор соляной кислоты (4M в 1,4-диоксане, 1.5 мл, 6.0 ммоль) добавили при комнатной температуре к раствору (R)-трет-бутил 4-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толил-пропил)фенил)-5,6-дигидропиридин-1(2H)-карбоксилата (пример 372, стадия 1; 200 мг, 403 мкмоль) в 1,4-диоксане (4 мл), затем через 2 ч реакционную смесь выпарили. Остаток суспендировали в дихлорметане (8 мл), затем обработали N,N-диизопропилэтиламином (312 мг, 2.42 ммоль) и метансульфонилхлоридом (92 мг, 805 мкмоль) при 0°C. Ванну со льдом удалили, затем через 16 ч реакционную смесь разделили между нас.водн. раствором хлорида аммония и дихлорметаном. Органический слой высушили над сульфатом натрия, отфильтровали и выпарили. Хроматография (SiO2; градиент гептан-этилацетат, затем дихлорметан-метанол 9:1) дала соединение, указанное в заголовке, (27 мг, 16%; светло-коричневая пена, MS (ESI+): m/z=411.2 ([M+H]+) и (R)-3-[4-(1-метансульфонил-1,2,3,6-тетрагидро-пиридин-4-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он (66 мг, 35%).
Стадия 2: (R,E)-4-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)-5,6-дигидропиридин-2(1H)-он
По аналогии с примером 132, стадия 6, из (R)-4-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)-5,6-дигидропиридин-2(1H)-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=426.1 [M+H]+.
Пример 378
(R,E)-1-(2-метилпиридин-4-ил)-3-(4-(пиперидин-4-ил)фенил)-3-о-толилпропан-1-она оксим
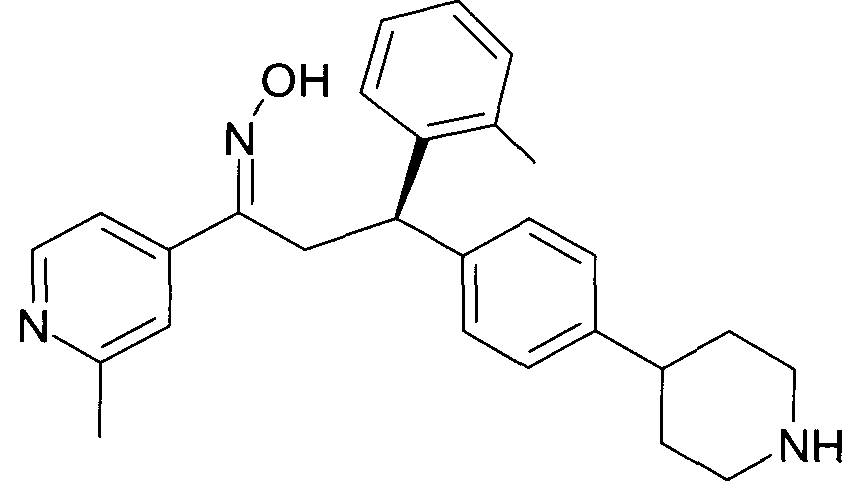
Стадия 1: (R)-трет-бутил 4-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-1-карбоксилат
Раствор йодида (1-(трет-бутоксикарбонил)пиперидин-4-ил)цинка (II) (0.5 М в N,N-диметилацетамиде, 2.0 мл, 1.0 ммоль; получение в соответствии с J. Org. Chem. 2004, 69, 5120) добавили при комнатной температуре в атмосфере аргона к смеси (R)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она (пример 142, стадия 2; 200 мг, 507 мкмоль), йодида меди(I) (9.7 мг, 51 мкмоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(11) дихлорметанового аддукта (18.6 мг, 25.4 мкмоль) в N,N-диметилацетамиде (3 мл). Реакционную смесь нагревали при 85°C, затем через 4 ч разделили между нас.водн. раствором хлорида аммония и этилацетатом. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали, и выпарили. Хроматография (SiO2; градиент гептан-этилацетат) дала соединение, указанное в заголовке, (144 мг, 57%). Серо-белая пена, MS (ESI+): m/z=499.3 ([M+H]+).
Стадия 2: (R,E)-1-(2-метилпиридин-4-ил)-3-(4-(пиперидин-4-ил)фенил)-3-о-толилпропан-1-она оксим
По аналогии с примером 132, стадия 6, из (R)-трет-бутил 4-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-1-карбоксилата и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=414.4 ([M+H]+).
Пример 379
(R,E)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)пиперидин-4-ил)фенил)-3-о-толилпропан-1-она оксим
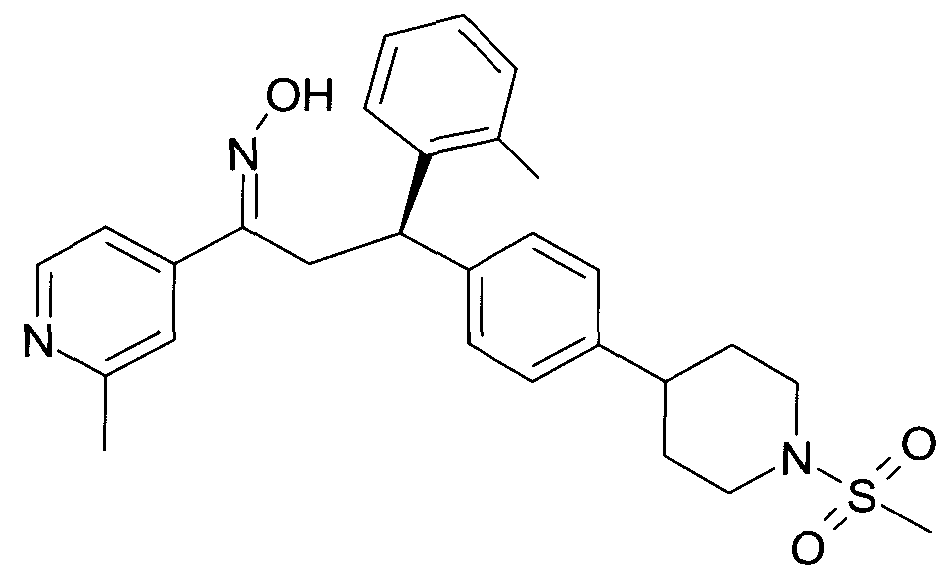
Стадия 1: (R)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)пиперидин-4-ил)фенил)-3-о-толилпропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 376, стадия 1, из (R)-трет-бутил 4-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-1-карбоксилата (пример 378, стадия 1) и метансульфонилхлорида. Белая пена, MS (ESI+): m/z=477.2 ([M+H]+).
Стадия 2: (R,E)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)пиперидин-4-ил)фенил)-3-о-толилпропан-1-она оксим
По аналогии с примером 132, стадия 6, из (R)-трет-бутил 4-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-1-карбоксилата и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=492.3 ([M+H]+).
Пример 380
(S,E)-2-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)уксусная кислота
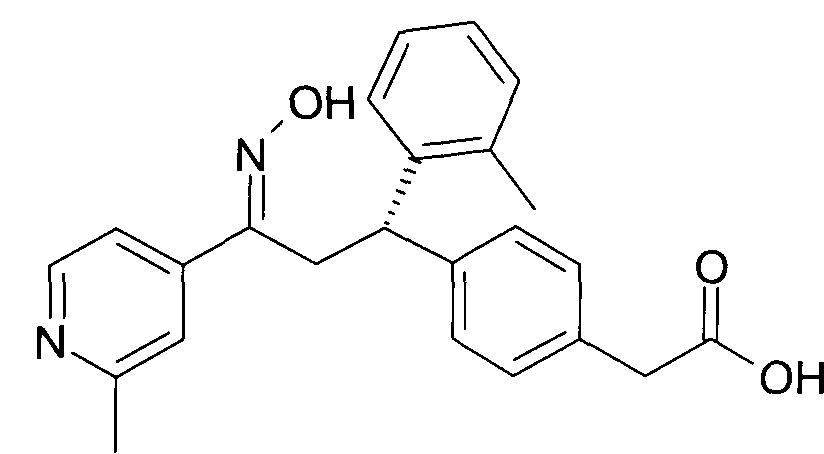
Стадия 1: (S)-2-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил) фенил)уксусная кислота
Соединение, указанное в заголовке, получили по аналогии с примером 288, стадия 1, из (R)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она (пример 286, стадия 1) и диэтилмалоната. Белая пена, MS (ESI-): m/z=372.3 ([M-H]-).
Стадия 2: (S,E)-2-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)уксусная кислота
По аналогии с примером 132, стадия 6, из (S)-2-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)сренил)уксусной кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=389.2 ([M+H]+).
Пример 381
(S,E)-1-(2-метилпиридин-4-ил)-3-(4-морфолинофенил)-3-о-толилпропан-1-она оксим
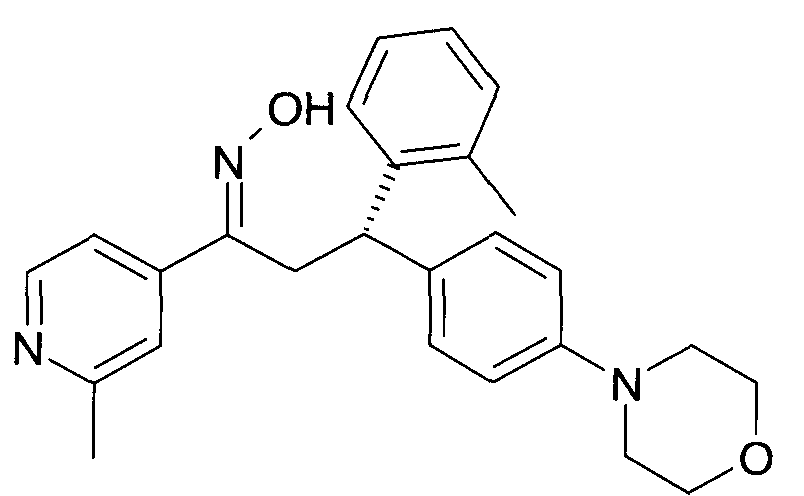
Стадия 1: (S)-1-(2-метилпиридин-4-ил)-3-(4-морфолинофенил)-3-о-толилпропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 271, стадия 1, из (S)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она (пример 286, стадия 1) и морфолина. Желтая пена, MS (ESI+): m/z=401.4 ([M+H]+).
Стадия 2: (S,E)-1-(2-метилпиридин-4-ил)-3-(4-морфолинофенил)-3-о-толилпропан-1-она оксим
По аналогии с примером 132, стадия 6, из (S)-1-(2-метилпиридин-4-ил)-3-(4-морфолинофенил)-3-о-толилпропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=416.5 ([M+H]+).
Пример 382
{4-[(R)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-уксусная кислота
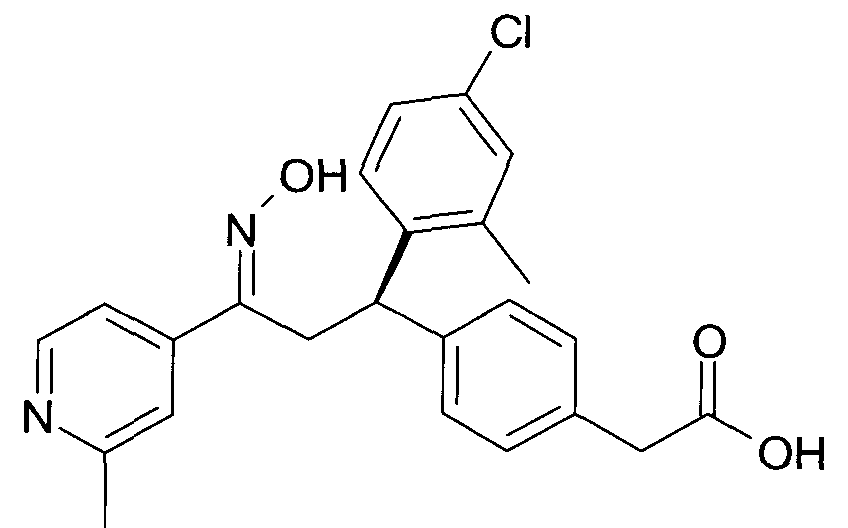
Стадия 1: (R)-2-(4-(1-(4-хлор-2-метилфенил)-3-(2-метилпиридин-4-ил)-3-оксопропил)фенил)уксусная кислота
Соединение, указанное в заголовке, получили по аналогии с примером 288, стадия 1, из (S)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она (пример 282, стадия 1) и этилцианоацетата. Светло-желтый осадок.
Стадия 2: {4-[(R)-1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-уксусная кислота
По аналогии с примером 132, стадия 6, из (R)-2-(4-(1-(4-хлор-2-метилфенил)-3-(2-метилпиридин-4-ил)-3-оксопропил)фенил)уксусной кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=423.2 ([M+H]+).
Пример 383
(R,E)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-(гидроксиметил)пиридин-4-ил)пропан-1-она оксим

Стадия 1: (R)-4-(3-(4-бромфенил)-3-(4-хлор-2-метилфенил)пропаноил)-2-метилпиридин 1-оксид
Соединение, указанное в заголовке, получили по аналогии с примером 373, из (S)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она (пример 282, стадия 1). Белый осадок, MS (ESI+): m/z=444.2 ([M+H]+).
Стадия 2: (R)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-(гидроксиметил)пиридин-4-ил)пропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 374, из (R)-4-(3-(4-бромфенил)-3-(4-хлор-2-метилфенил)пропаноил)-2-метилпиридина 1-оксида. Белая пена, MS (ESI+): m/z=444.2 ([M+H]+)
Стадия 3: (R,E)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-(гидроксиметил)пиридин-4-ил)пропан-1-она оксим
По аналогии с примером 132, стадия 6, из (R)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-(гидроксиметил)пиридин-4-ил)пропан-1-она (пример 282, стадия 1) и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=459.2 ([M+H]+).
Пример 384
(R,E)-4-(3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(гидроксиимино) пропил)-2-метилпиридин 1-оксид
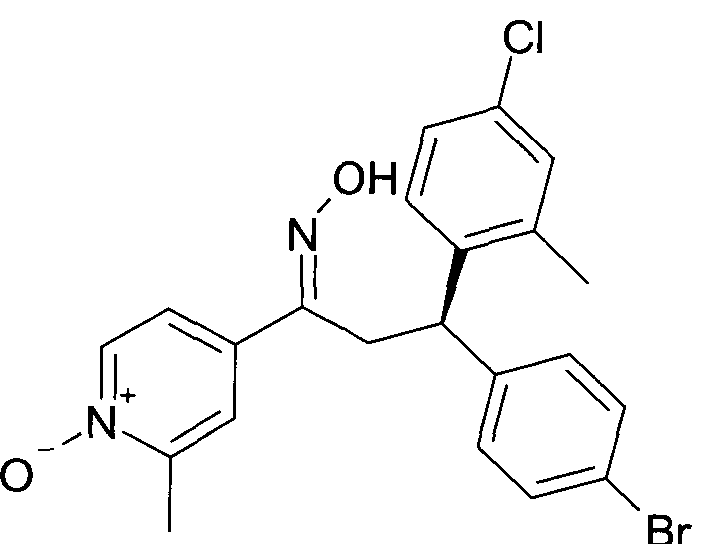
По аналогии с примером 132, стадия 6, из (R)-4-(3-(4-бромфенил)-3-(4-хлор-2-метилфенил)пропаноил)-2-метилпиридин 1-оксида (пример 383, стадия 1) и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=459.1 ([M+H]+).
Пример 385
(3R,Е)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-2-метил-1-(2-метилпиридин-4-ил)пропан-1-она оксим
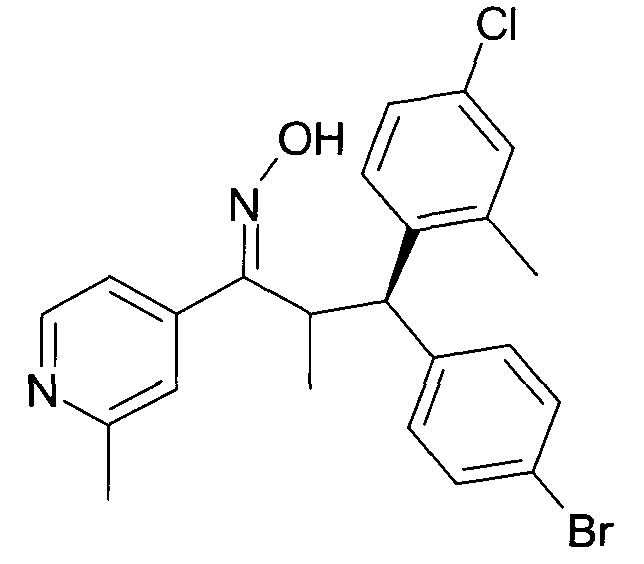
Стадия 1: (3R)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-2-метил-1-(2-метилпиридин-4-ил)пропан-1-он
Гидрид натрия (60% дисперсия в минеральном масле, 23 мг, 0.54 ммоль) добавили к раствору (R)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она (пример 282, стадия 1; 208 мг, 0.49 ммоль) в тетрагидрофуране (7 мл), затем через 90 мин реакционную смесь охладили до 0°C и обработали йоометаном (73 мг, 0.54 ммоль). Ванну со льдом удалили, затем через 2 ч реакционную смесь разделили между нас.водн. раствором хлорида аммония и этилацетатом. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали, и выпарили. Хроматография (SiO2; гептан-этилацетат 1:1) дала соединение, указанное в заголовке, (149 мг, 70%). Светло-желтое масло, MS (ESI+): m/z=442.3 ([M+H]+).
Стадия 2: (3R,E)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-2-метил-1-(2-метилпиридин-4-ил)пропан-1 -она оксим
По аналогии с примером 132, стадия 6, из (3R)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-2-метил-1-(2-метилпиридин-4-ил)пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=457.0 ([M+H]+).
Пример 386
(R,E)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она оксим
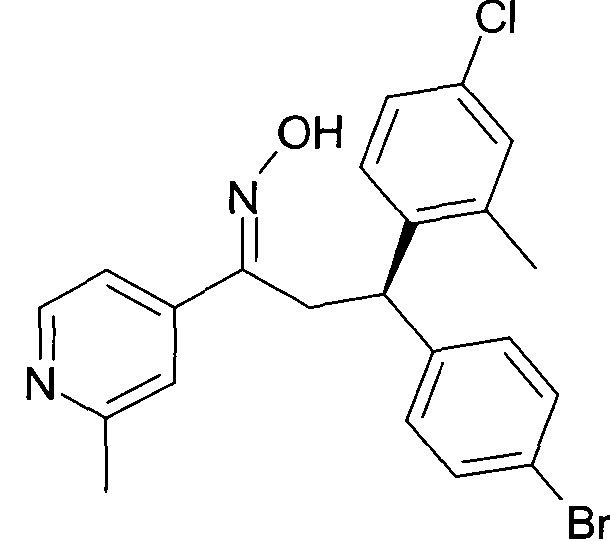
По аналогии с примером 132, стадия 6, из (R)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она (пример 282, стадия 1) и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=443.0 ([M+H]+).
Пример 387
(R,E)-трет-бутил 4-(4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)пиперидин-1-карбоксилат
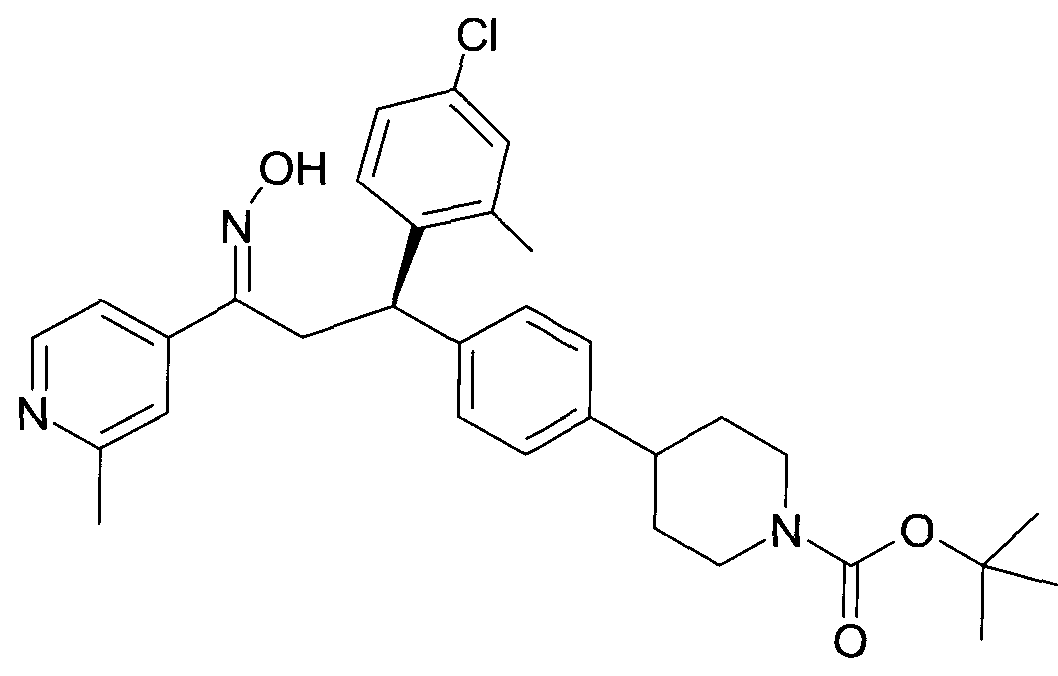
Стадия 1: (R)-трет-бутил 4-(4-(1-(4-хлор-2-метилфенил)-3-(2-метилпиридин-4-ил)-3-оксопропил)фенил)пиперидин-1-карбоксилат
Соединение, указанное в заголовке, получили по аналогии с примером 378, стадия 1, из (R)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она (пример 282, стадия 1) и (1-(трет-бутоксикарбонил)пиперидин-4-ил)цинка (II) йодида. Серо-белая пена, MS (ESI+): m/z=533.2 ([M+H]+).
Стадия 2: (R,E)-трет-бутил 4-(4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)пиперидин-1-карбоксилат
По аналогии с примером 1, стадия 2, из (R)-трет-бутил 4-(4-(1-(4-хлор-2-метилфенил)-3-(2-метилпиридин-4-ил)-3-оксопропил)фенил)пиперидин-1-карбоксилата и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=548.0 ([M+H]+).
Пример 388
(R,E)-3-(4-хлор-2-метилсренил)-1-(2-метилпиридин-4-ил)-3-(4-(пиперидин-4-ил)фенил)пропан-1-она оксим
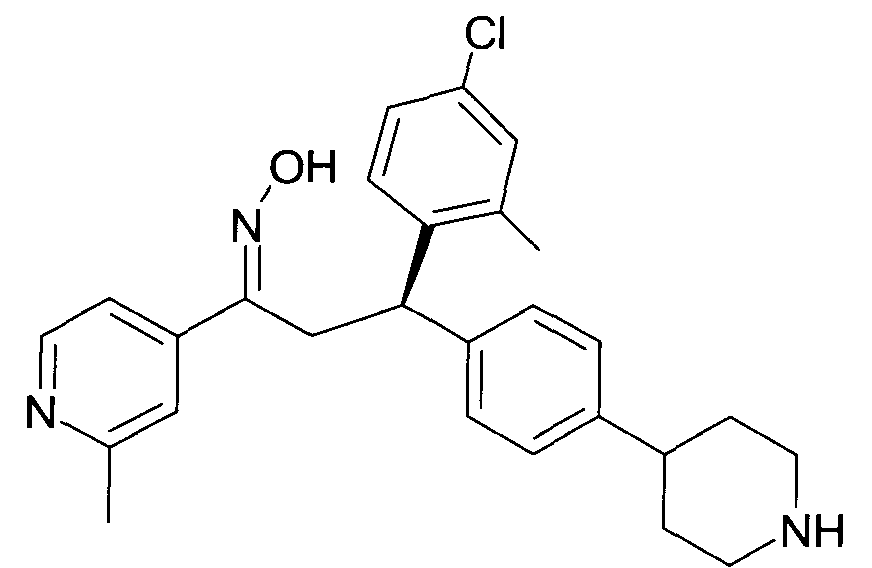
Раствор соляной кислоты (4M в 1,4-диоксане, 0.4 мл, 1.6 ммоль) добавили при комнатной температуре к раствору (R,E)-трет-бутил 4-(4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)пиперидин-1-карбоксилата (пример 387; 90 мг, 164 мкмоль) в 1,4-диоксане (5 мл). Реакционную смесь нагревали при 50°C в течение 17 ч, затем разделили между нас.водн. раствором бикарбоната натрия и этилацетатом. Органический слой высушили над сульфатом натрия, отфильтровали и выпарили с получением соединения, указанного в заголовке, (33 мг, 45%). Белый осадок, MS (ESI+): m/z=448.0 ([M+H]+).
Пример 389
(R,E)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)пиперидин-4-ил)фенил)пропан-1-она оксим
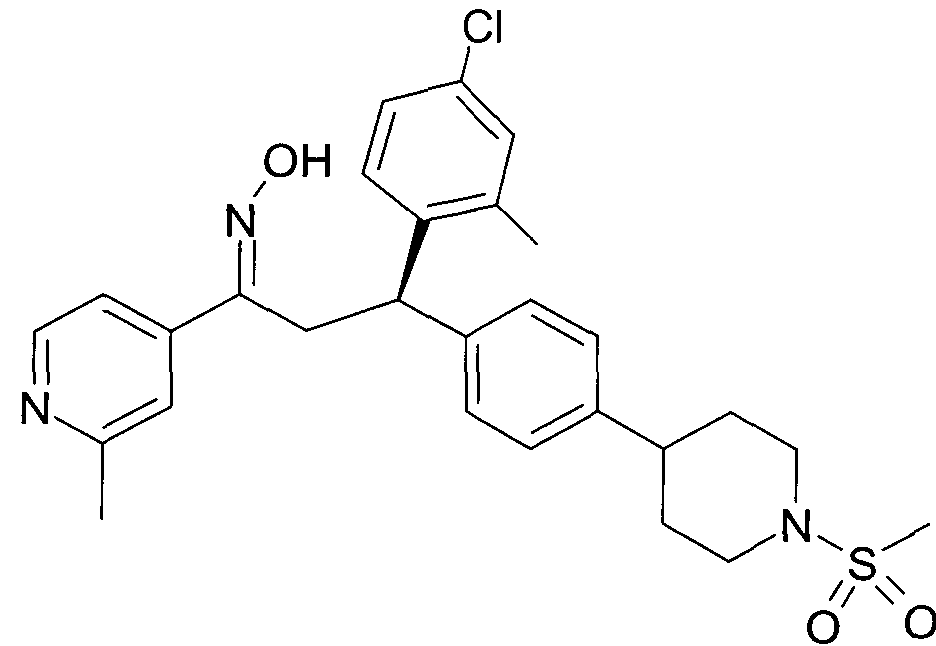
Стадия 1: (R)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)пиперидин-4-ил)фенил)пропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 376, стадия 1, из (R)-трет-бутил 4-(4-(1-(4-хлор-2-метилфенил)-3-(2-метилпиридин-4-ил)-3-оксопропил)фенил)пиперидин-1-карбоксилата (пример 387, стадия 1) и метансульфонилхлорида. Белая пена, MS (ESI+): m/z=511.3 ([M+H]+).
Стадия 2: (R,E)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)пиперидин-4-ил)фенил)пропан-1 -она оксим
По аналогии с примером 132, стадия 6, из (R)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)пиперидин-4-ил)фенил)пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=526.3 ([M+H]+)
Пример 390
(S)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-3-фенил-пропан-1-она оксим
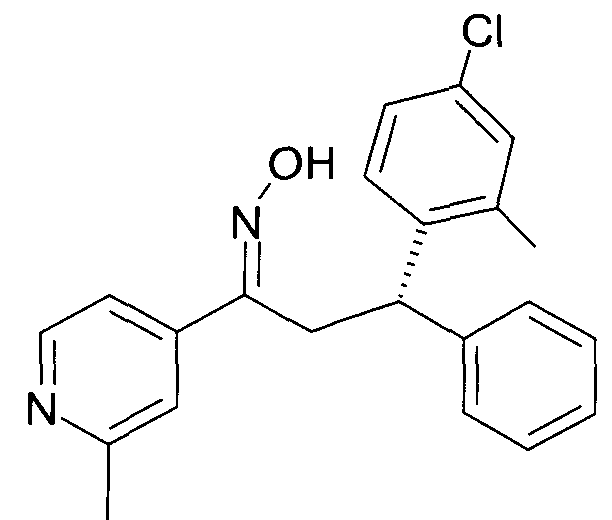
Стадия 1: (S)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)-3-фенилпропан-1 -он
Смесь (S)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она (пример 282, стадия 1; 200 мг, 466 мкмоль), диэтилмалоната (112 мг, 700 мкмоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II)дихлорметанового аддукта (19 мг, 23 мкмоль) и трет-бутоксида калия (157 мг, 1.4 ммоль) в 1,4-диоксане (4 мл) нагревали при 80°C в течение 5 ч, затем разделили между нас.водн. раствором хлорида аммония и этилацетатом. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и выпарили. Хроматография (SiO2; градиент гептан-этилацетат) дала соединение, указанное в заголовке, (129 мг, 79%). Светло-желтое масло, MS (ESI+): m/z=350.2 ([M+H]+).
Стадия 2: (S)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-3-фенил-пропан-1-она оксим
По аналогии с примером 132, стадия 6, из (S)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)-3-фенилпропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белого осадка, MS (ESI+): m/z=365.1 ([M+H]+).
Пример 391
(E)-1-(2-метилпиридин-4-ил)-3-(3-(метилсульфонил)фенил)-3-о-толилпропан-1-она оксим
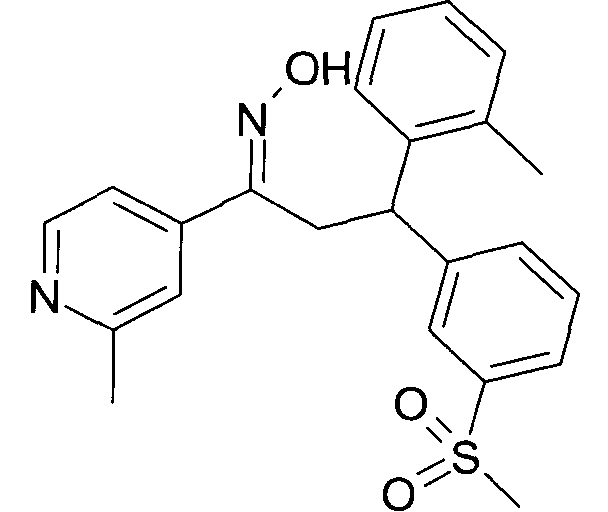
Стадия 1: 1-(2-метилпиридин-4-ил)-3-(3-(метилсульфонил)фенил)-3-о-толилпропан-1 -он
Соединение, указанное в заголовке, получили по аналогии с примером 358, стадия 1, из 3-(3-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она (пример 98, стадия 5) и метансульфината натрия. Желтое масло, MS (ESI+): m/z=394.3 ([M+H]+).
Стадия 2: (E)-1-(2-метилпиридин-4-ил)-3-(3-(метилсульфонил)фенил)-3-о-толилпропан-1-она оксим
По аналогии с примером 132, стадия 6, из 1-(2-метилпиридин-4-ил)-3-(3-(метилсульфонил)фенил)-3-о-толилпропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=409.3 ([M+H]+).
Пример 392
N-{4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}-полуамид янтарной кислоты
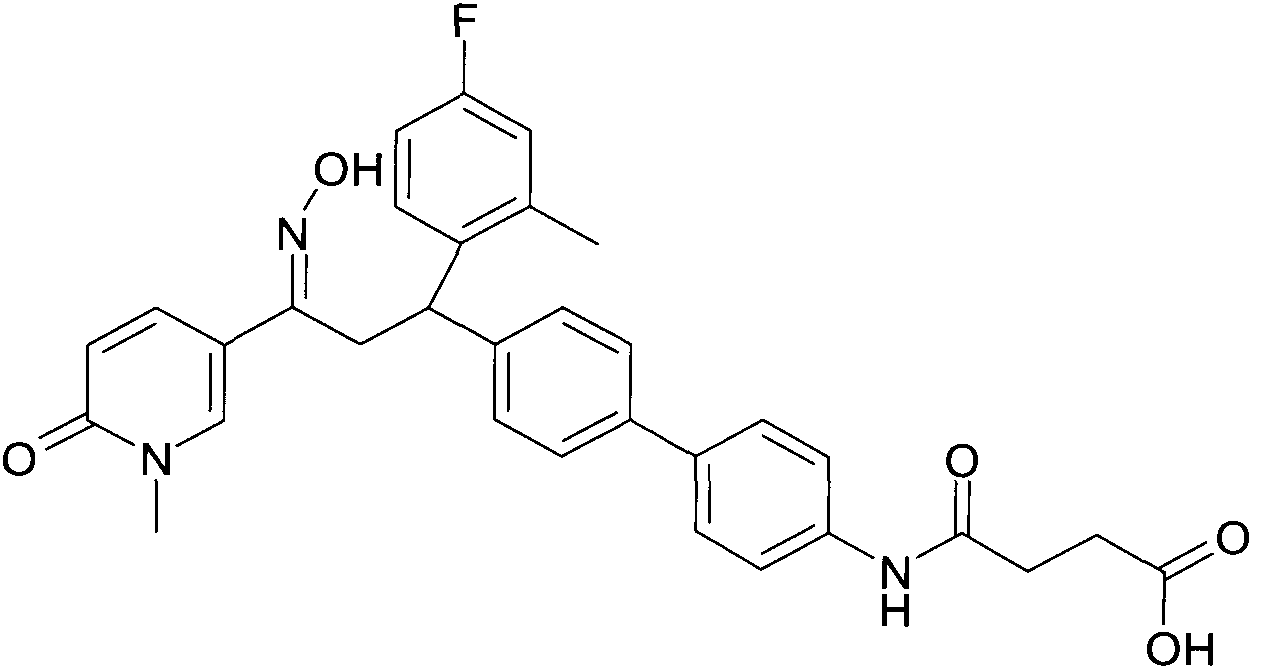
К раствору (E)-5-(3-(4'-аминобифенил-4-ил)-3-(4-фтор-2-метилфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-она (0.05 г, 110 мкмоль, пример 259) в N,N-диметилформамиде добавили при комнатной температуре янтарный ангидрид (12.1 мг, 121 мкмоль) и полученный раствор перемешивали при комнатной температуре в течение 26 часов. Реакционную смесь влили в воду и этилацетат и слои разделили. Водный слой экстрагировали дважды этилацетатом и органические слои дважды промыли водой и один раз солевым раствором, высушили над сульфатом магния, отфильтровали, обработали силикагелем и выпарили. Соединение очистили посредством хроматографии на силикагеле на 10 г колонке, используя систему ЖХСД с элюцией градиентом дихлорметан : метанол (100:0 до 90:10). Светло-коричневая пена (0.043 г, 70%). MS (ESI+): m/z=556.2 ([M+H]+).
Примеры 393 и 394
(+)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота; соединение с триэтиламином 1:0.9
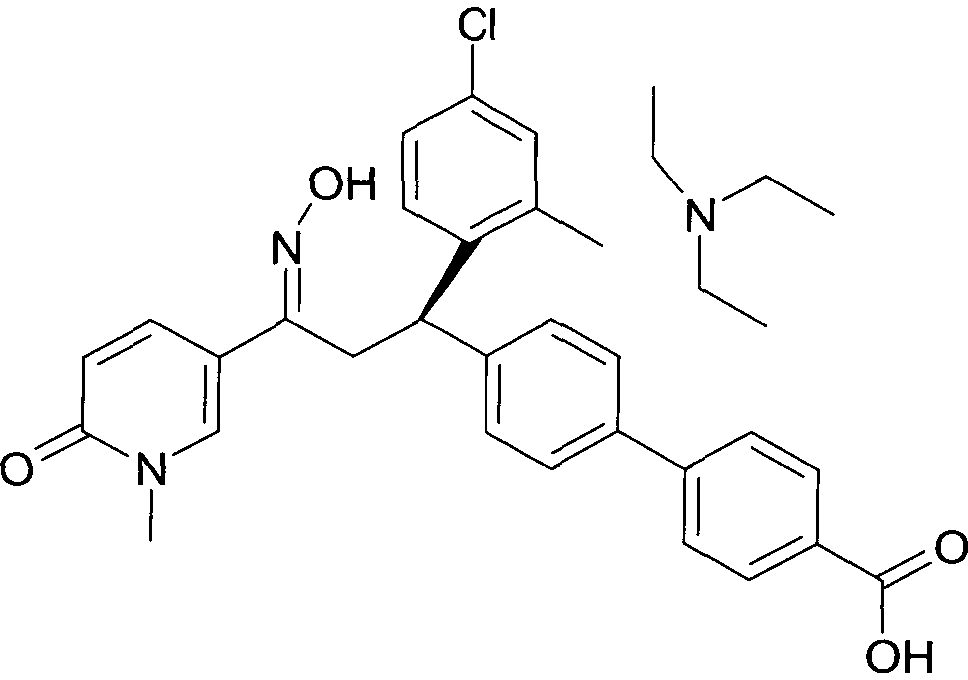
и (-)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1 -метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота; соединение с триэтиламином 1:0.85
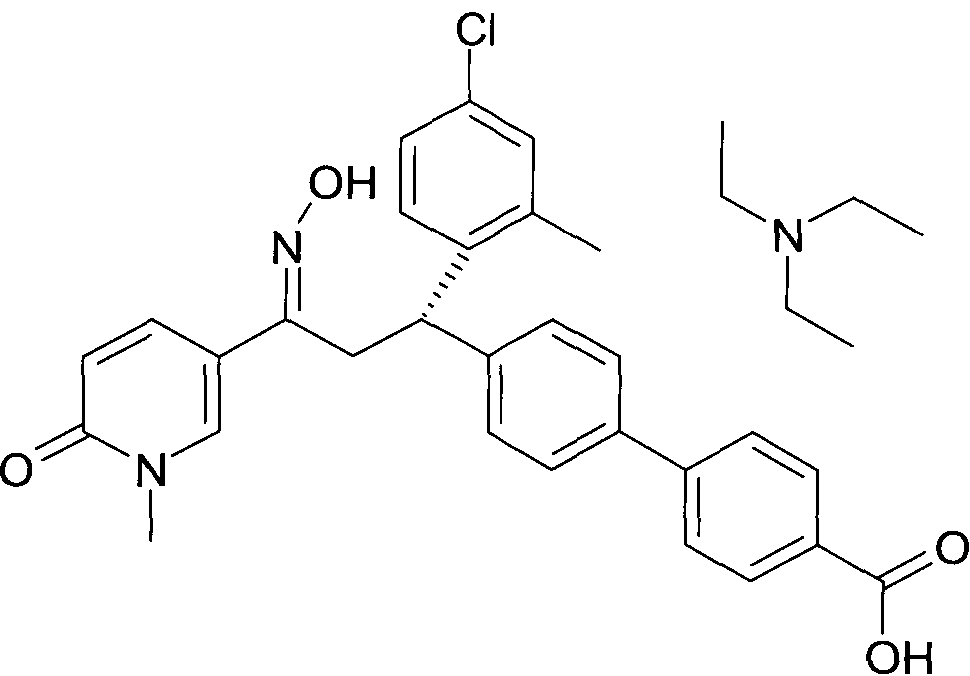
Разделение (E)-4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоновой кислоты (пример 227) на СКЖХ (сверхкритическая жидкостная хроматография) системе с использованием Daicel AD колонке, элюируя 50% метанолом (содержащим 0.2% триэтиламина)/CO2 дало (+)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновую кислоту; соединение с триэтиламином 1:0.9 в виде светло-коричневого осадка, MS (ESI+): m/z=501.16 ([M+H]+) и (-)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновую кислоту; соединение с триэтиламином 1:0.85 в виде коричневого осадка, MS (ESI+): m/z=501.2 ([M+H]+).
Примеры 395 и 396
(+)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота; соединение с триэтиламином 1:1
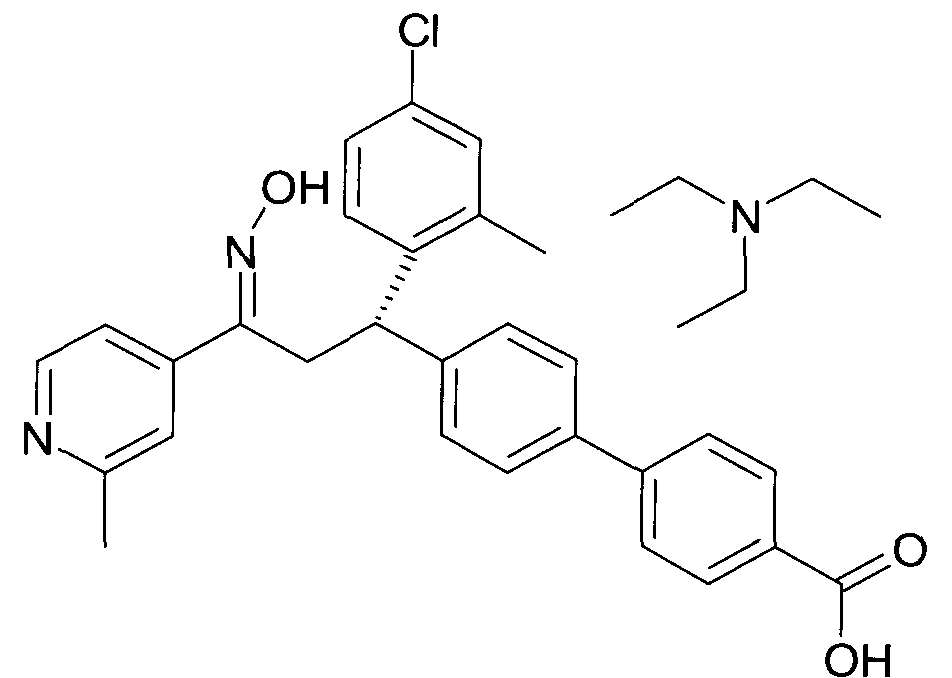
и (-)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота; соединение с триэтиламином 1:0.7
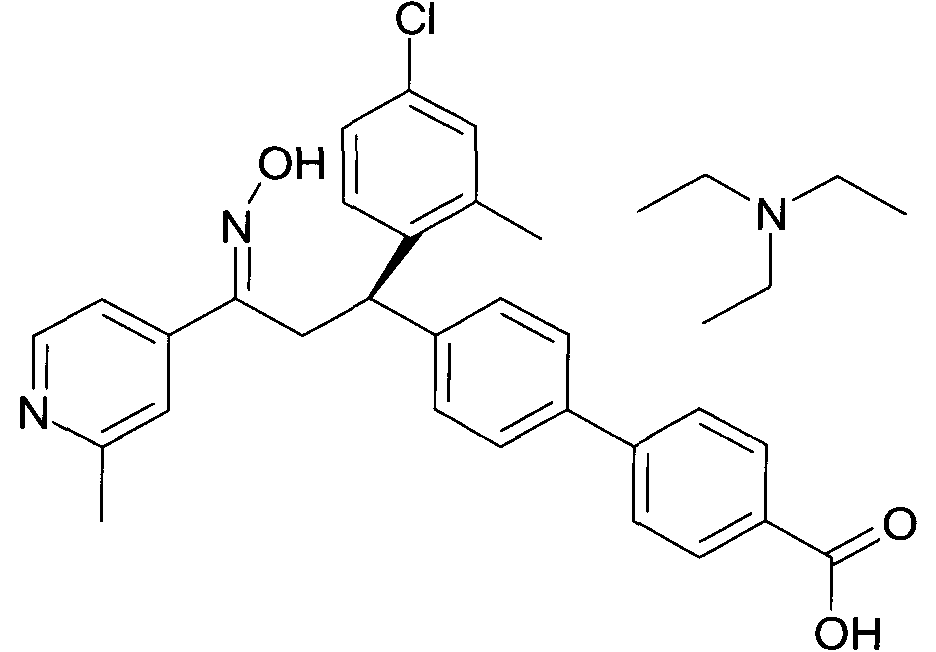
Разделение (E)-4'-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)бифенил-4-карбоновой кислоты (пример 139) на СКЖХ системе с использованием Daicel AD колонки, элюируя 40% метанолом (содержащим 0.2% триэтиламина)/CO2 дало (+)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновую кислоту;
соединение с триэтиламином 1:1 в виде светло-коричневого осадка, MS (ESI+): m/z=485.16 ([M+H]+) и (-)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновую кислоту; соединение с триэтиламином 1:0.7 в виде светло-коричневого осадка, MS (ESI+): m/z=485.2 ([M+H]+).
Примеры 397 и 398
(+)-4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота; соединение с триэтиламином 1:0.75
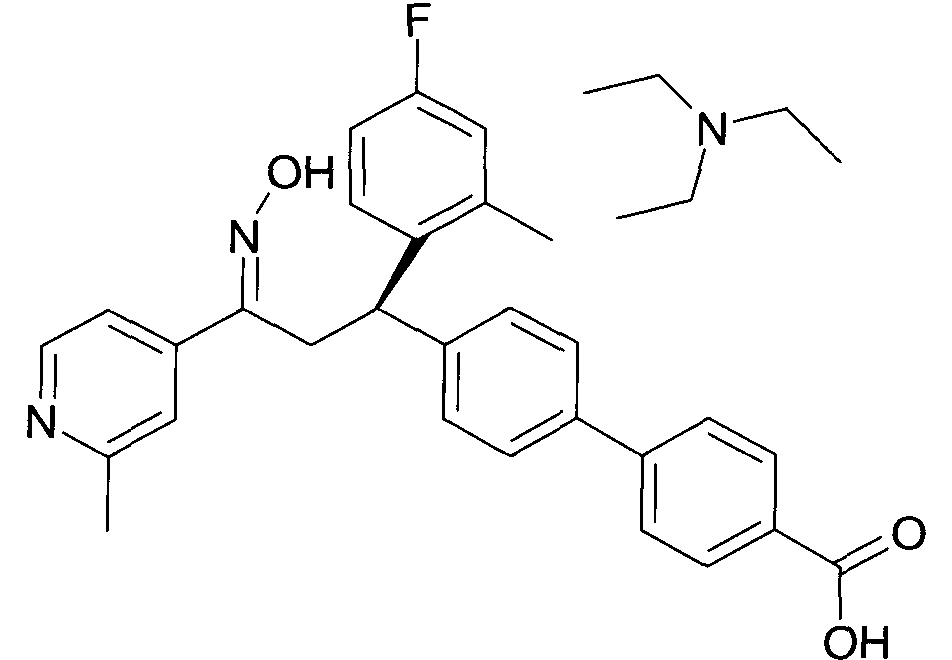
и (-)-4'-[1-(4-фтор-2-метил-фенил)-3-[(Е)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота; соединение с триэтиламином 1:0.75
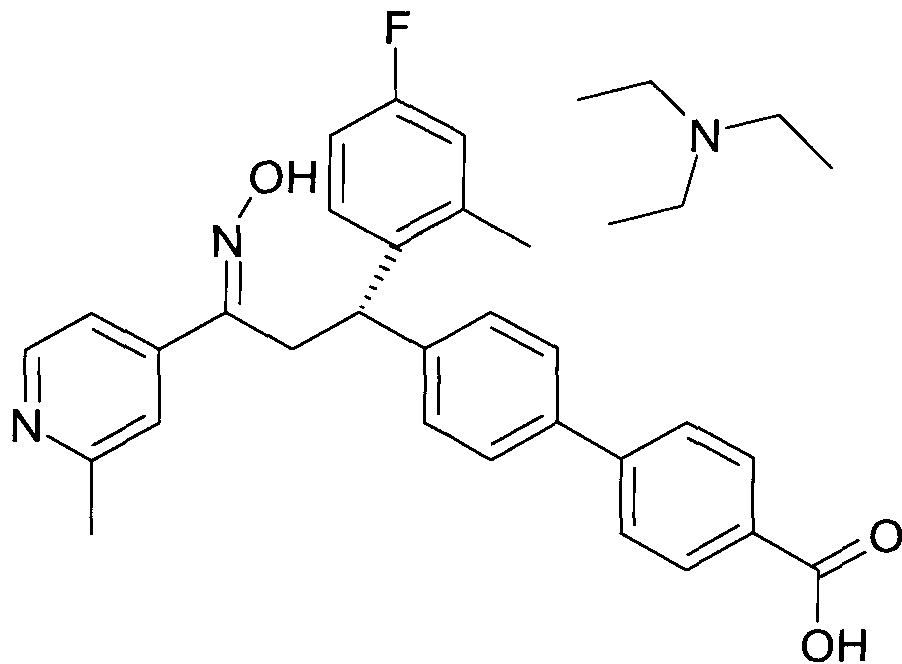
Разделение (E)-4'-(1-(4-фтор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)бифенил-4-карбоновой кислоты (пример 141) с помощью хиральной ВЭЖХ на СКЖХ системе с использованием Daicel AD колонке, элюируя 40% метанолом (содержащим 0.2% триэтиламина)/CO2 дало (+)-4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновую кислоту; соединение с триэтиламином 1: 0.75 в виде бесцветного осадка, MS (ESI+): m/z=469.19 ([M+H]+) и (-)-4'-[1 -(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновую кислоту; соединение с триэтиламином 1:0.75 в виде бесцветного осадка, MS (ESI+): m/z=469.2 [M+H]+.
Пример 399
N-{4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}-полуамида малоновой кислоты метиловый эфир
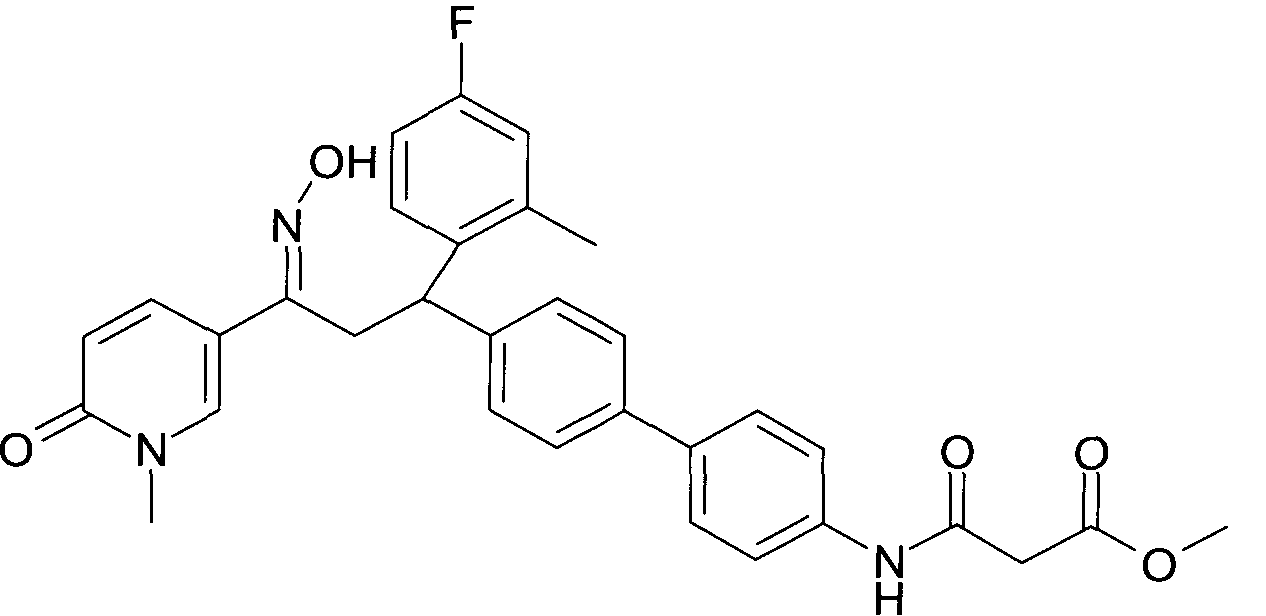
К ледяному раствору (E)-5-(3-(4'-аминобифенил-4-ил)-3-(4-фтор-2-метилфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1Н)-она (0.1 г, 220 мкмоль, пример 259) в дихлорметане (2 мл) добавили триэтиламин (48.9 мг, 67.3 мкл, 483 мкмоль) с последующим метилмалонилхлоридом (33.0 мг, 25.9 мкл, 241 мкмоль). Коричневый раствор перемешивали при 0°C в течение 75 мин., охлаждающую ванну убрали и перемешивание продолжили в течение 1.25 часа при комнатной температуре. Раствор снова охладили до 0°C и добавили другую порцию метилмалонилхлорида (33.0 мг, 25.9 мкл, 241 мкмоль). Охлаждающую ванну убрали и перемешивание продолжили в течение 20 часов при комнатной температуре. Реакционную смесь влили в воду и дихлорметан и слои разделили. Водный слой экстрагировали дважды дихлорметаном. Органические слои промыли солевым раствором, высушили над сульфатом магния, отфильтровали, обработали силикагелем и выпарили. Соединение очистили посредством хроматографии на силикагеле на 20 г колонке, используя систему ЖХСД с элюцией градиентом дихлорметан: метанол (100:0 до 90:10) с получением соединения, указанного в заголовке, в виде светло-коричневой пены (0.045 г; 33%). MS (ESI+): m/z=556.2 ([M+H]+). Дополнительно, выделили (E)-метил, 3-(4'-(1-(4-фтор-2-метилфенил)-3-(3-метокси-3-оксопропаноилоксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-иламино)-3-охопропаноат (0.044 г, 36%) в виде светло-коричневой пены. MS (ESI+): m/z=656.2 ([M+H]+).
Пример 400
N-{4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}-полуамид малоновой кислоты
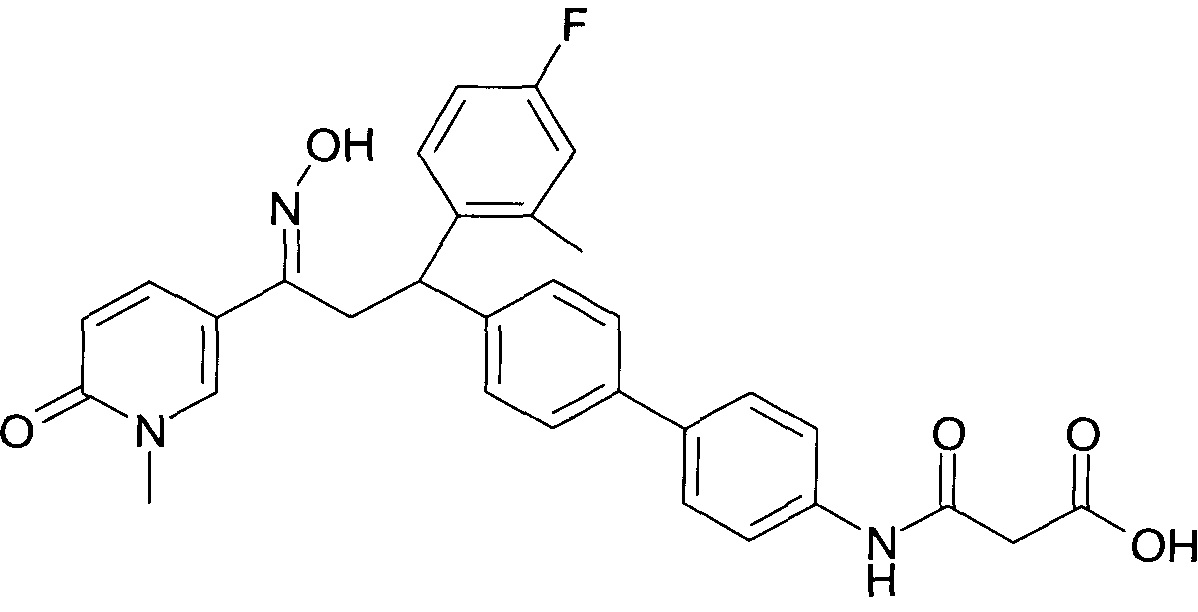
К раствору (E)-метил, 3-(4'-(1-(4-фтор-2-метилфенил)-3-(3-метокси-3-оксопропаноилоксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-иламино)-3-охопропаноата (0.044 г, 67.1 мкмоль, из примера 399) в диоксане (1 мл) и воде (1 мл) добавили моногидрат гидроксида лития (7.04 мг, 168 мкмоль). Получившийся прозрачный раствор перемешивали при комнатной температуре в течение 2.25 часов, и затем растворители удалили. Остаток растворили в воде (2 мл) и pH раствора довели до приблизительно 3, используя 1M водный раствор соляной кислоты. Получившуюся суспензию отфильтровали, промыли водой и фильтрационный осадок высушили под глубоким вакуумом. Бесцветный осадок (0.023 г, 63%). MS (ESI+): m/z=542.2 ([M+H]+).
Пример 401
4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-сульфоновой кислоты амид

Соединение, указанное в заголовке, получили по аналогии с примером 166, из (E)-5-(3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-она (пример 224) и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензолсульфонамида (CAS RN 214360-51-7). Соединение очистили посредством хроматографии на силикагеле на 20 г колонке, используя систему ЖХСД с элюцией градиентом дихлорметан:метанол (100:0 до 90:10). Светло-коричневая пена. MS (ESI+): m/z=520.2 ([M+H]+).
Пример 402
5-{3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
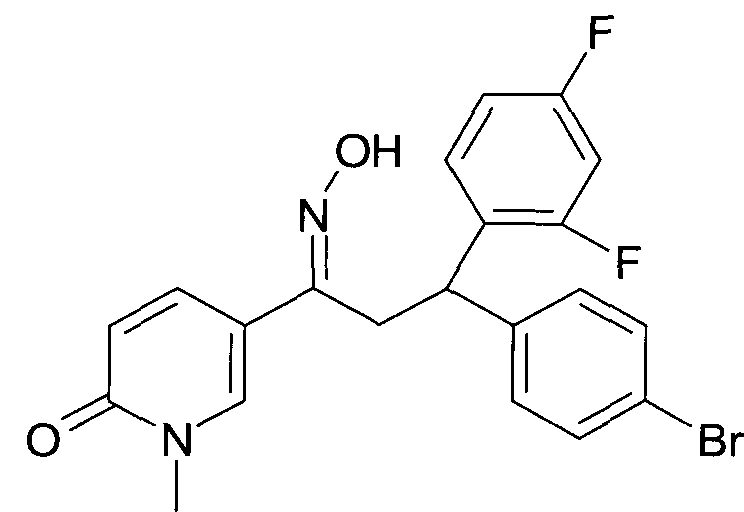
Стадия 1: (E)-3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон
К раствору 5-ацетил-2-метоксипиридина (5.0 г, 33.1 ммоль, CAS RN 213193-32-9) в метаноле (100 мл) добавили 4-бромбензальдегид (6.73 г, 36.4 ммоль, CAS RN 1122-91-4). К этому раствору добавили гидроксид калия (2.04 г, 36.4 ммоль) и получившуюся суспензию перемешивали при комнатной температуре в течение 8 часов. После перемешивания на ледяной ванне в течении 30 мин. белую суспензию отфильтровали и промыли 30 мл ледяного метанола с получением требуемого соединения в виде бесцветного осадка (9.76 г, 92%). MS (ESI-): m/z=318.1 ([M-H]-).
Стадия 2: 3-(4-бромфенил)-3-(2.4-дифторфенил)-1-(6-метоксипиридин-3-ил)пропан-1-он
К суспензии 2,4-дифторофенилбороновой кислоты (620 мг, 3.93 ммоль, CAS RN 100124-06-9) в толуоле (30 мл) по каплям добавили в течение 10 мин. диэтилцинк (1M раствор в гексанах, 11.8 мл, 11.8 ммоль, CAS RN 557-20-0) поддерживая температуру ниже 30°C. Реакционную смесь нагревали до 60°C и перемешивали в течение ночи. Через 16 часов нагревание остановили и мутный раствор (E)-3-(4-бром-фенил)-1-(6-метокси-пиридин-3-ил)-пропенона (0.5 г, 1.57 ммоль) в толуоле (30 мл) добавили по каплям в течение 5 мин. После перемешивания при комнатной температуре в течение 24.5 часов реакционную смесь влили в насыщенный водный раствор хлорида аммония и этилацетата и слои разделили. Водный слой экстрагировали дважды этилацетатом и объединенные органические слои высушили над сульфатом магния, отфильтровали и выпарили. Соединение очистили посредством хроматографии на силикагеле на 20 г колонке, используя систему ЖХСД с элюцией градиентом n-гептан : этилацетат (100:0 до 70:30). Бесцветное масло (0.263 г, 38%). MS (ESI+): m/z=432.0 ([M+H]+).
Стадия 3: 5-[3-(4-бром-фенил)-3-(2.4-дифтор-фенил)-пропионил]-1H-пиридин-2-он
К раствору 3-(4-бромфенил)-3-(2,4-дифторфенил)-1-(6-метоксипиридин-3-ил)пропан-1-она (0.245 г, 567 мкмоль) в диоксане (6 мл) добавили 37% соляную кислоту (1.23 г, 1.04 мл, 12.5 ммоль) и полученную смесь нагревали при 100°C в течение 11/2 ч. После охлаждения до комнатной температуры, реакционную смесь влили в воду и этилацетат и слои разделили. Водный слой экстрагировали дважды этилацетатом. Органические слои промыли солевым раствором, высушили над сульфатом магния, отфильтровали, и выпарили. Серо-белый осадок (0.227 г, 95%). MS (ESI-): m/z=418.0 ([M-H]-).
Стадия 4: 5-[3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-пропионил]-1-метил-1H-пиридин-2-он
К раствору 5-(3-(4-бромфенил)-3-(2,4-дифторфенил)пропаноил)пиридин-2(1H)-она (0.225 г, 538 мкмоль) в N,N-диметилацетамиде (3 мл) добавили карбонат калия (81.8 мг, 592 мкмоль) и йодометан (80.2 мг, 35.3 мкл, 565 мкмоль) и полученную смесь перемешивали при комнатной температуре в течение 17 часов. Реакционную смесь влили в воду и этилацетат и слои разделили. Водный слой экстрагировали дважды этилацетатом. Органические слои промыли дважды водой и один раз солевым раствором, высушили над сульфатом магния, отфильтровали, обработали силикагелем и выпарили. Соединение очистили посредством хроматографии на силикагеле на 10 г колонке, используя систему ЖХСД с элюцией градиентом n-гептан : этилацетат (100:0 до 0:100). Бесцветная пена (0.20 г, 86%). MS (ESI+): m/z=432.0 ([M+H]+).
Стадия 5: 5-{3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
К раствору 5-(3-(4-бромфенил)-3-(2,4-дифторфенил)пропаноил)-1-метилпиридин-2(1H)-она (0.2 г, 463 мкмоль) в этаноле (5 мл) и воде (0.2 мл) добавили гидроксиламина гидрохлорид (80.4 мг, 1.16 ммоль) и гидрокарбонат натрия (77.7 мг, 925 мкмоль) и получившуюся бесцветную суспензию нагревали до кипения с обратным холодильником (100°C температура масляной бани) в течение 4.5 часов. После охлаждения реакционную смесь влили в воду и этилацетат и слои разделили. Водный слой экстрагировали дважды этилацетатом. Органические слои промыли солевым раствором, высушили над сульфатом магния, отфильтровали, обработали силикагелем и выпарили. Соединение очистили посредством хроматографии на силикагеле на 20 г колонке, используя систему ЖХСД с элюцией градиентом n-гептан : этилацетат (100:0 до 0:100). Бесцветная пена (0.205 г, 99%). MS (ESI+): m/z=449.1 ([M+H]+).
Пример 403
4'-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-карбоновая кислота

Соединение, указанное в заголовке, получили по аналогии с примером 166, из 5-{3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-она (пример 402) и 4-карбоксифенилбороновой кислоты (CAS RN 14047-29-1). Соединение очистили посредством двух хроматографии на силикагеле, используя 20 г колонку и ЖХСД систему с элюцией градиентом дихлорметан : метанол (100:0 до 70:30). Светло-коричневая пена. MS (ESI+): m/z=489.2 ([M+H]+).
Примеры 404 и 405
(-)-5-{3-(4-бром-фенил)-3-(4-фтор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
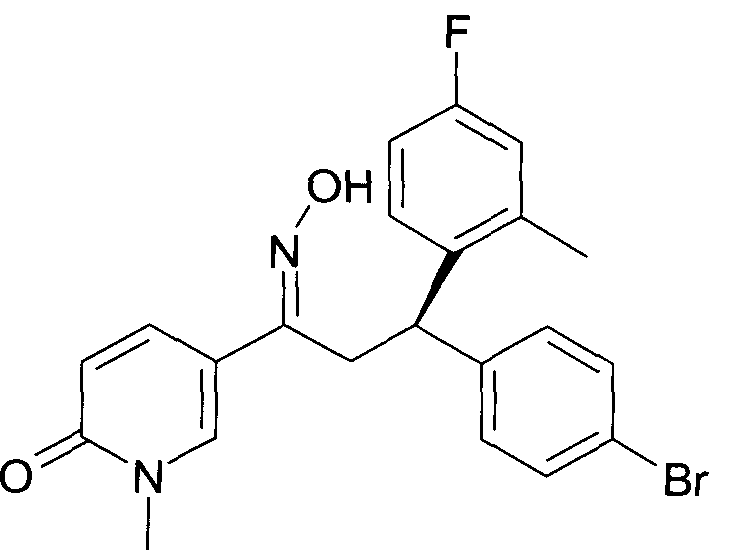
и (+)-5-{3-(4-бром-фенил)-3-(4-фтор-2-метил-фенил)-1-[(E)- гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он

Разделение (E)-5-(3-(4-бромфенил)-3-(4-фтор-2-метилфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-она (пример 224) с помощью хиральной ВЭЖХ на Chiralpak-AD колонке, используя изократическую смесь растворителя 2-пропанола (20%) в n-гептане дала (-)-5-{3-(4-бром-фенил)-3-(4-фтор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он в виде светло-коричневой пены, MS (ESI+): m/z=443.08 [M+H]+ и (+)-5-{3-(4-бром-фенил)-3-(4-фтор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он в виде светло-коричневой пены, MS (ESI+): m/z=443.1 [M+H]+.
Пример 406
(-)-4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-сульфоновой кислоты амид
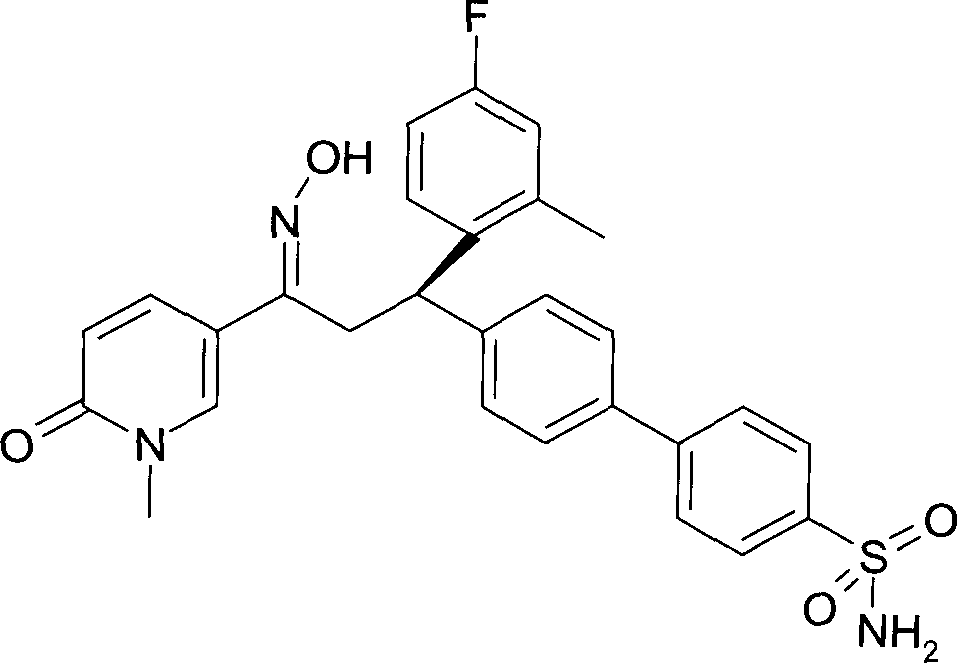
Соединение, указанное в заголовке, получили по аналогии с примером 166, из (-)-5-{3-(4-бром-фенил)-3-(4-фтор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-она (пример 404) и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензолсульфонамида (CAS RN 214360-51-7). Соединение очистили посредством хроматографии на силикагеле на 10 г колонке, используя систему ЖХСД с элюцией градиентом дихлорметан:метанол (100:0 до 90:10). Светло-коричневый осадок. MS (ESI+): m/z=520.2 ([M+H]+).
Пример 407
(+)-4'-[1-(4-фтор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-сульфоновой кислоты амид

Соединение, указанное в заголовке, получили по аналогии с примером 166, из (+)-5-{3-(4-бром-фенил)-3-(4-фтор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-она (пример 405) и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензолсульфонамида (CAS RN 214360-51-7). Соединение очистили посредством хроматографии на силикагеле на 10 г колонке, используя систему ЖХСД с элюцией градиентом дихлорметан : метанол (100:0 до 90:10). Светло-коричневый осадок. MS (ESI+): m/z=520.2 ([M+H]+).
Пример 408
(E)-5-(3-(4-бромфенил)-3-(2-фтор-4-метилфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он
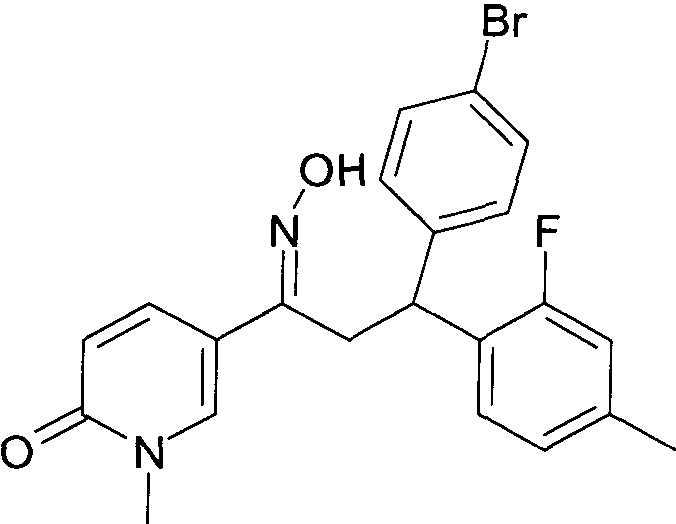
Стадия 1: (E)-3-(2-фтор-4-метил-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 1, из 5-ацетил-2-метоксипиридина и 2-фтор-4-метилбензальдегида (CAS RN 146137-80-6). Серо-белый осадок. MS (ESI+): m/z=272.1 ([M+H]+).
Стадия 2: 3-(4-бром-фенил)-3-(2-фтор-4-метил-фенил)-1-(6-метокси-пиридин-3-ил)-пропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 2, из (E)-3-(2-фтор-4-метил-фенил)-1-(6-метокси-пиридин-3-ил)-пропенона и 4-бромбензолбороновой кислоты (CAS RN 5467-74-3). Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан : этилацетат (100:0 до 60:40). Бесцветное масло. MS (ESI+): m/z=430.1 ([M+H]+).
Стадия 3: 5-[3-(4-бром-фенил)-3-(2-фтор-4-метил-фенил)-пропионил]-1H-пиридин-2-он
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 3, из 3-(4-бром-фенил)-3-(2-фтор-4-метил-фенил)-1-(6-метокси-пиридин-3-ил)-пропан-1-она. Светло-коричневый осадок. MS (ESI+): m/z=414.0 ([M+H]+).
Стадия 4: 5-[3-(4-бром-фенил)-3-(2-фтор-4-метил-фенил)-пропионил]-1-метил-1H-пиридин-2-он
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 4, из 5-[3-(4-бром-фенил)-3-(2-фтор-4-метил-фенил)-пропионил]-1H-пиридин-2-она. Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан : этилацетат (100:0 до 0:100). Бесцветный осадок. MS (ESI+): m/z=474.1 ([M+HCOO]-).
Стадия 5: (E)-5-{3-(4-бром-фенил)-3-(2-фтор-4-метил-фенил)-1-(гидроксиимино)-пропил}-1-метил-1H-пиридин-2-он
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из 5-[3-(4-бром-фенил)-3-(2-фтор-4-метил-фенил)-пропионил]-1-метил-1H-пиридин-2-она. Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан : этилацетат (100:0 до 0:100). Бесцветный осадок. MS (ESI+): m/z=445.1 ([M+H]+).
Пример 409
(E)-5-{3-(4-бром-фенил)-3-(4-фтор-2-метансульфонил-фенил)-1-(гидроксиимино)-пропил}-1-метил-1H-пиридин-2-он
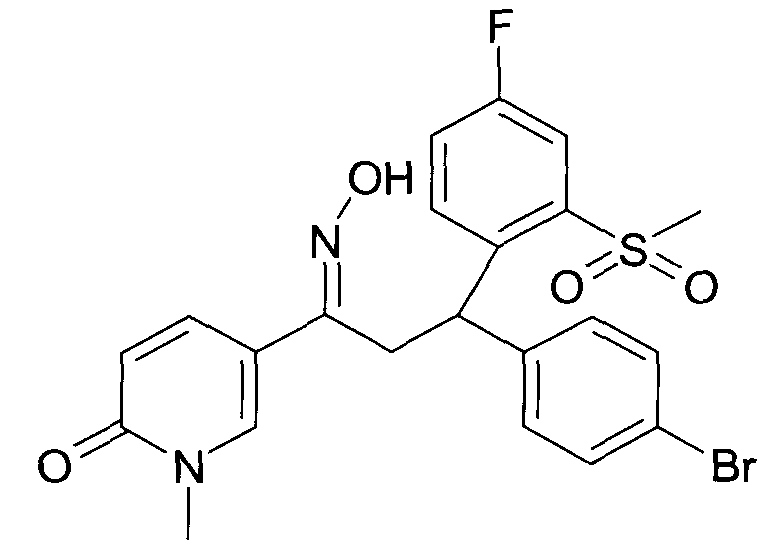
Стадия 1: 4-фтор-2-метилсульфанил-бензальдегид
К раствору 2,4-дифторбензальдегида (3.0 г, 21.1 ммоль, CAS RN 1550-35-2) в толуоле (29 мл) добавили тиометоксид натрия (2.03 г, 28.9 ммоль) и получившуюся суспензию перемешивали при 80°C в течение 7 часов. Нагревание прекратили и перемешивание продолжили при комнатной температуре в течение дополнительных 18 часов. Реакционную смесь обработали диэтиловым эфиром (50 мл) и водой (15 мл) и слои разделили. Водный слой экстрагировали дважды этилацетатом (50 мл каждый раз). Органические слои промыли насыщенным водным раствором бикарбоната натрия и солевым раствором, высушили над сульфатом магния, отфильтровали и выпарили. Остаток растворили в 50 мл n-гептана и 50 мл диэтилового эфира, и прозрачный раствор медленно выпарили до образования мутного раствора. Первоначальная масляная преципитация дала белый осадок, который отфильтровали, промыли n-гептаном и высушили под глубоким вакуумом с получением соединения в виде бесцветного осадка (1.35 г, 37%). MS (ESI+): m/z=170.0 ([M+H]+).
Стадия 2: (E)-3-(4-фтор-2-метилсульфанил-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 1, из 1-(6-метокси-пиридин-3-ил)-этанона (CAS RN 213193-32-9) и 4-фтор-2-метилсульфанил-бензальдегида. Желтый осадок. MS (ESI+)): m/z=304.1 ([М+Нр.
Стадия 3: 3-(4-бром-фенил)-3-(4-фтор-2-метилсульфанил-фенил)-1 -(6-метокси-пиридин-3-ил)-пропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 2, из (E)-3-(4-фтор-2-метилсульфанил-фенил)-1-(6-метокси-пиридин-3-ил)-пропенона и 4-бромфенилбороновой кислоты (2.14 г, 10.7 ммоль, CAS RN 5467-74-3).Соединение очистили посредством хроматографии на силикагеле на 50 г колонке, используя систему ЖХСД с элюцией градиентом n-гептан : этилацетат (100:0 до 50:50). Светло-коричневая пена. MS (ESI+)): m/z=462.0 ([M+H]+).
Стадия 4: 5-[3-(4-бром-фенил)-3-(4-фтор-2-метилсульфанил-фенил)-пропионил]-1H-пиридин-2-он
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 3, из 3-(4-бром-фенил)-3-(4-фтор-2-метилсульфанил-фенил)-1-(6-метокси-пиридин-3-ил)-пропан-1-она. Светло-коричневая пена. MS (ESI+): m/z=448.0 ([M+H]+).
Стадия 5: 5-[3-(4-бром-фенил)-3-(4-фтор-2-метилсульфанил-фенил)-пропионил]-1-метил-1H-пиридин-2-он
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 4, из 5-[3-(4-бром-фенил)-3-(4-фтор-2-метилсульфанил-фенил)-пропионил]-1H-пиридин-2-она. Соединение очистили посредством хроматографии на силикагеле на 10 г колонке, используя систему ЖХСД с элюцией градиентом n-гептан : этилацетат (100:0 до 0:100). Для удаления остатков растворителя соединение растворили в этилацетате, промыли пять раз водой, высушили над сульфатом магния, отфильтровали и выпарили. Бесцветный осадок (0.232 г, 84%). MS (ESI+): m/z=462.0 ([M+H]+).
Стадия 6: 5-[3-(4-бром-фенил)-3-(4-фтор-2-метансульфонил-фенил)-пропионил]-1-метил-1H-пиридин-2-он
К раствору 5-[3-(4-бром-фенил)-3-(4-фтор-2-метилсульфанил-фенил)-пропионил]-1-метил-1H-пиридин-2-она (0.222 г, 482 мкмоль) в дихлорметане (3 мл) добавили 3-хлорпероксибензойную кислоту (238 мг, 964 мкмоль) и получившийся прозрачный раствор перемешивали при комнатной температуре в течение 2% ч. Через 30 мин. образовался преципитат. Реакционную смесь влили в насыщенный водный раствор бикарбоната натрия и дихлорметана и слои разделили. Водный слой экстрагировали дважды дихлорметаном. Органические слои промыли дважды насыщенным водным раствором бикарбоната натрия и один раз солевым раствором, высушили над сульфатом магния и основным оксидом алюминия, отфильтровали, обработали силикагелем и выпарили. Соединение очистили посредством хроматографии на силикагеле на 20 г колонке, используя систему ЖХСД с элюцией градиентом n-гептан : этилацетат (100:0 до 0:100). Бесцветная пена (0.121 г, 51%). MS (ESI+): m/z=494.0 ([M+H]+).
Стадия 7: (E)-5-{3-(4-бром-фенил)-3-(4-фтор-2-метансульфонил-фенил)-1-(гидроксиимино)-пропил}-1-метил-1H-пиридин-2-он
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из 5-[3-(4-бром-фенил)-3-(4-фтор-2-метансульфонил-фенил)-пропионил]-1-метил-1H-пиридин-2-она. Соединение очистили посредством хроматографии на силикагеле на 20 г колонке, используя систему ЖХСД с элюцией градиентом дихлорметан: метанол (100:0 до 90:10). Бесцветная пена. MS (ESI+): m/z=509.0 ([M+H]+).
Пример 410
(E)-5-(3-(4-бромфенил)-3-(2-хлор-4-фторфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-он
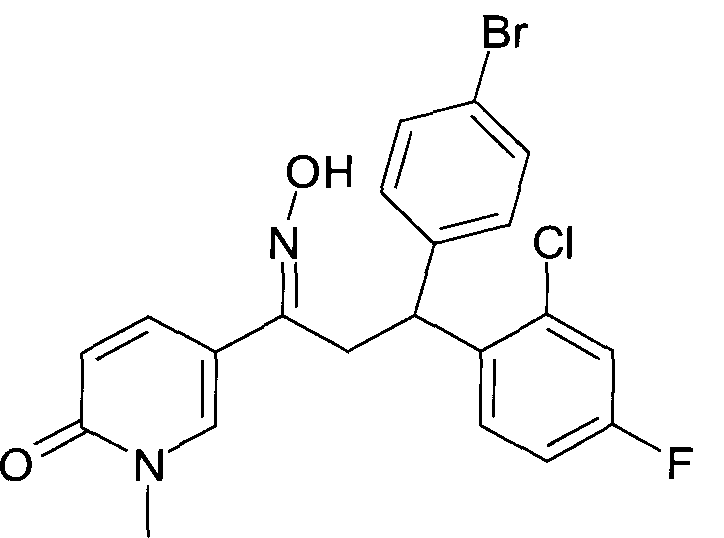
Стадия 1: (E)-3-(2-хлор-4-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенон Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 1, из 1-(6-метокси-пиридин-3-ил)-этанона (CAS RN 213193-32-9) и 2-хлор-4-фторбензальдегида (CAS RN 84194-36-5). Бесцветный осадок. MS (ESI+)): m/z=292.1 ([M+HD.
Стадия 2: 3-(4-бром-фенил)-3-(2-хлор-4-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 2, из (E)-3-(2-хлор-4-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропенона и 4-бромфенилбороновой кислоты (CAS RN 5467-74-3). Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан : этилацетат (100:0 до 50:50). Бесцветное вязкое масло. MS (ESI+): m/z=450.0 ([M+H]+).
Стадия 3: 5-[3-(4-бром-фенил)-3-(2-хлор-4-фтор-фенил)-пропионил]-1H-пиридин-2-он
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 3, из 3-(4-бром-фенил)-3-(2-хлор-4-фтор-фенил)-1-(6-метокси-пиридин-3-ил)-пропан-1-она. Серо-белый осадок. MS (ESI+): m/z=436.0 ([M+H]+).
Стадия 4: 5-[3-(4-бром-фенил)-3-(2-хлор-4-фтор-фенил)-пропионил]-1-метил-1H-пиридин-2-он
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 4, из 5-[3-(4-бром-фенил)-3-(2-хлор-4-фтор-фенил)-пропионил]-1H-пиридин-2-она. Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан : этилацетат (100:0 до 0:100). Бесцветный осадок. MS (ESI+): m/z=450.0 ([M+H]+).
Стадия 5: (E)-5-{3-(4-бром-фенил)-3-(2-хлор-4-фтор-фенил)-1-(гидроксиимино)-пропил}-1-метил-1H-пиридин-2-он
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из 5-[3-(4-бром-фенил)-3-(2-хлор-4-фтор-фенил)-пропионил]-1-метил-1H-пиридин-2-она. Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан : этилацетат (100:0 до 0:100) с получением требуемого соединения в виде бесцветного осадка, MS (ESI+): m/z=465.0 ([M+H]+).
Пример 411
(E)-4'-(1-(2-фтор-4-метилфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,б-дигидропиридин-3-ил)пропил)бифенил-4-карбоновая кислота
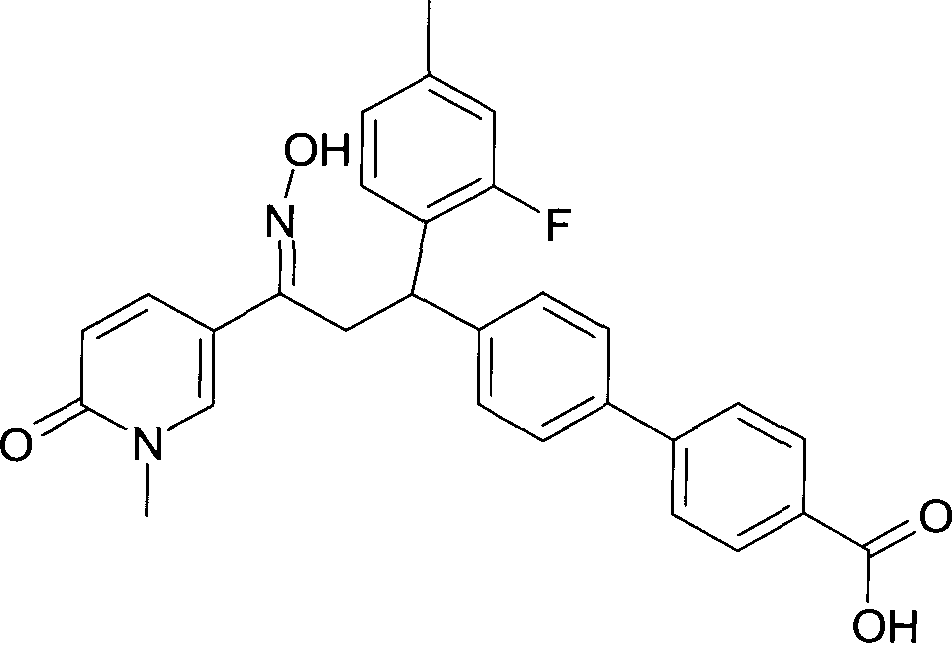
Соединение, указанное в заголовке, получили по аналогии с примером 166, из (E)-5-(3-(4-бромфенил)-3-(2-фтор-4-метилфенил)-1-(гидроксиимино)пропил)-1-метилпиридин-2(1H)-она и 4-карбоксифенилбороновой кислоты (CAS RN 14047-29-1). Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД с элюцией градиентом дихлорметан: метанол (100:0 до 90:10). Желтый осадок. MS (ESI+): m/z=485.2 ([M+H]+).
Пример 412
(E)-4'-(1-(2-хлор-4-фторфенил)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пропил)бифенил-4-карбоновая кислота
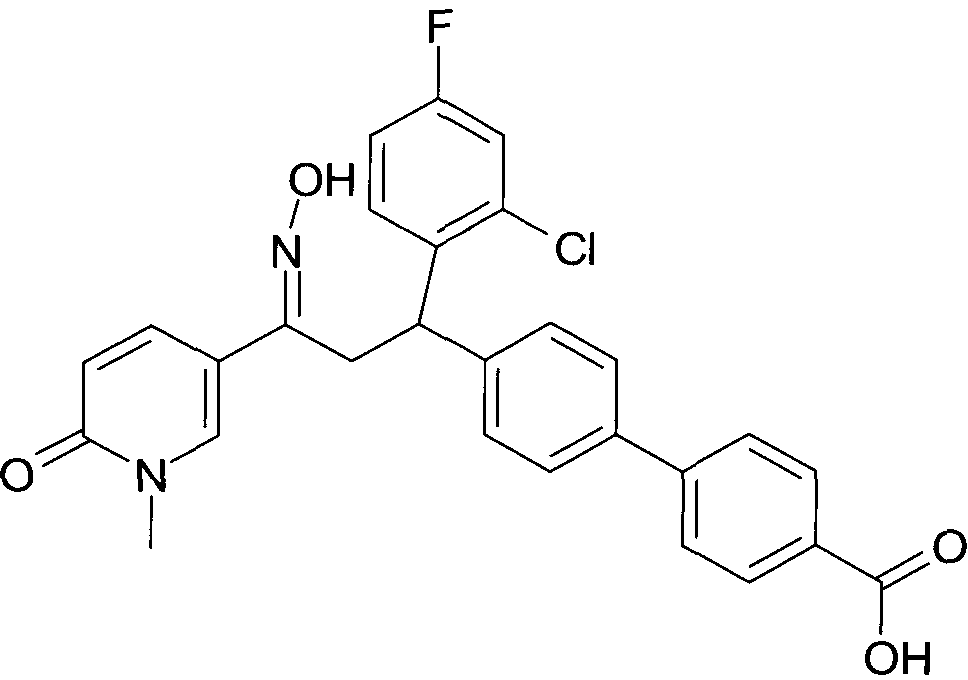
Соединение, указанное в заголовке, получили по аналогии с примером 166, из (E)-5-{3-(4-бром-фенил)-3-(2-хлор-4-фтор-фенил)-1-(гидроксиимино)-пропил}-1-метил-1H-пиридин-2-она (пример 410) и 4-карбоксифенилбороновой кислоты (CAS RN 14047-29-1). Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД с элюцией градиентом дихлорметан: метанол (100:0 до 90:10). Получившийся желтый осадок очистили препаративной ВЭЖХ (phenomenex gemini колонка) с градиентом ацетонитрил:вода (10:90 до 95:5) с последующей дополнительной препаративной ВЫЖХ очисткой (Reprosil Chiral-NR колка), используя 80% n-гептан : 20% EtOH (содержащий 0.5% муравьиной кислоты) в качестве элюента, с получением требуемого соединения в виде бесцветного осадка, MS (ESI+): m/z=505.1 ([M+H]+).
Пример 413
(-)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-сульфоновой кислоты амид
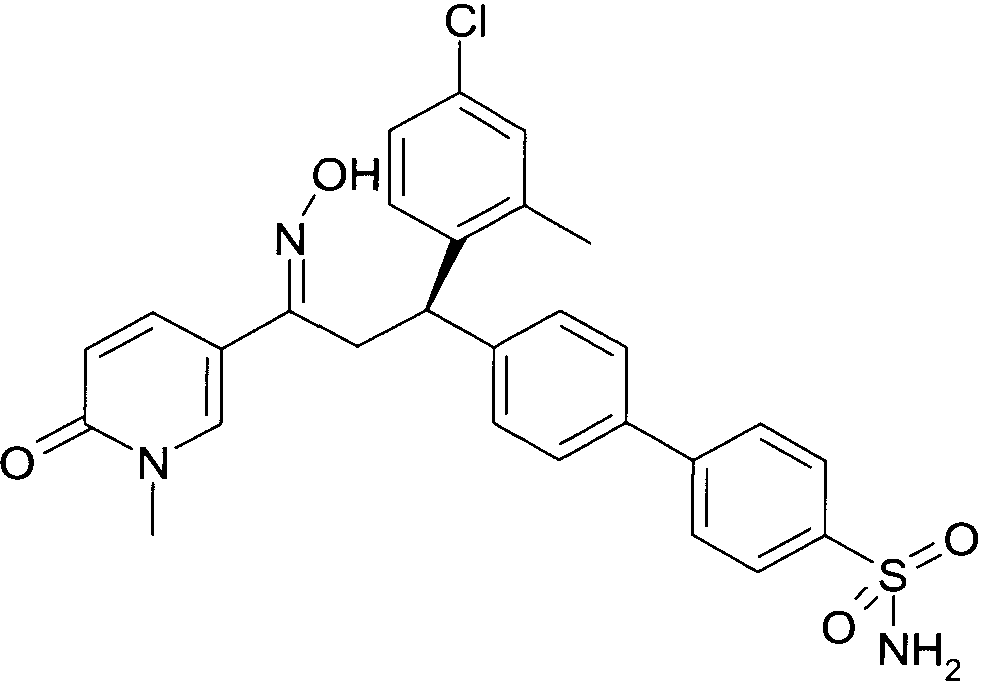
Стадия 1: (-)-5-[3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-пропионил]-1-метил-1H-пиридин-2-он и (+)-5-[3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-пропионил]-1-метил-1H-пиридин-2-он
Разделение 5-[3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-пропионил]-1-метил-1H-пиридин-2-она (пример 226, стадия 3) с помощью хиральной Chiralpak-AD колонки, используя изократическую смесь 30% этанола в n-гептане дало (-)-5-[3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-пропионил]-1-метил-1H-пиридин-2-он в виде бесцветного осадка, MS (ESI+): m/z=446.03 ([M+H]+) и (+)-5-[3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-пропионил]-1-метил-1H-пиридин-2-он в виде бесцветного осадка, MS (ESI+): m/z=446.0 ([M+H]+)
Стадия 2: (-)-4'-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-бифенил-4-сульфоновой кислоты амид
Соединение, указанное в заголовке, получили по аналогии с примером 166, из (-)-5-[3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-пропионил]-1-метил-1H-пиридин-2-она и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензолсульфонамида (CAS RN 214360-51-7). Соединение очистили посредством хроматографии на силикагеле на 10 г колонке, используя систему ЖХСД с элюцией градиентом n-гептан : этилацетат (100:0 до 100:0). Светло-коричневый осадок. MS (ESI+): m/z=521.1 ([M+H]+).
Стадия 3: (-)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-сульфоновой кислоты амид
Соединение, указанноре в заголовке, получили по аналогии с примером 402, стадия 5, из (-)-4'-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-бифенил-4-сульфоновой кислоты амида.
Соединение очистили посредством хроматографии на силикагеле на 20 г колонке, используя систему ЖХСД с элюцией градиентом дихлорметан : метанол (100:0 до 90:10). Бесцветный осадок. MS (ESI+): m/z=536.1 ([M+H]+).
Пример 414
(+)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-сульфоновой кислоты амид
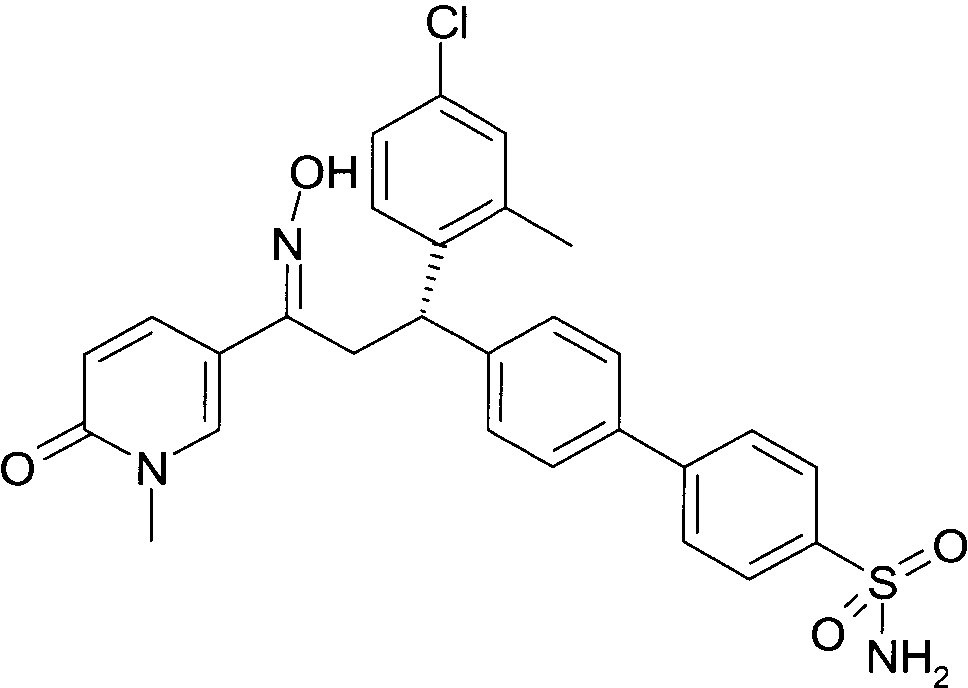
Стадия 1: (+)-4'-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил1-бифенил-4-сульфоновой кислоты амид
Соединение, указанное в заголовке, получили по аналогии с примером 166, из (+)-5-[3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-пропионил]-1-метил-1H-пиридин-2-она (пример 413, стадия 1) и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензолсульфонамида (CAS RN 214360-51-7). Соединение очистили посредством хроматографии на силикагеле на 10 г колонке, используя систему ЖХСД с элюцией градиентом n-гептан : этилацетат (100:0 до 100:0). Светло-коричневый осадок. MS (ESI+): m/z=521.1 ([M+H]+).
Стадия 2: (+)-4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-сульфоновой кислоты амид
Соединение, указанноре в заголовке, получили по аналогии с примером 402, стадия 5, из (+)-4'-[1-(4-хлор-2-метил-фенил)-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-3-оксо-пропил]-бифенил-4-сульфоновой кислоты амида. Соединение очистили посредством хроматографии на силикагеле на 20 г колонке, используя систему ЖХСД с элюцией градиентом дихлорметан : метанол (100:0 до 90:10). Бесцветный осадок. MS (ESI+): m/z=536.1 ([M+H]+).
Пример 415
(+)-5-{3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
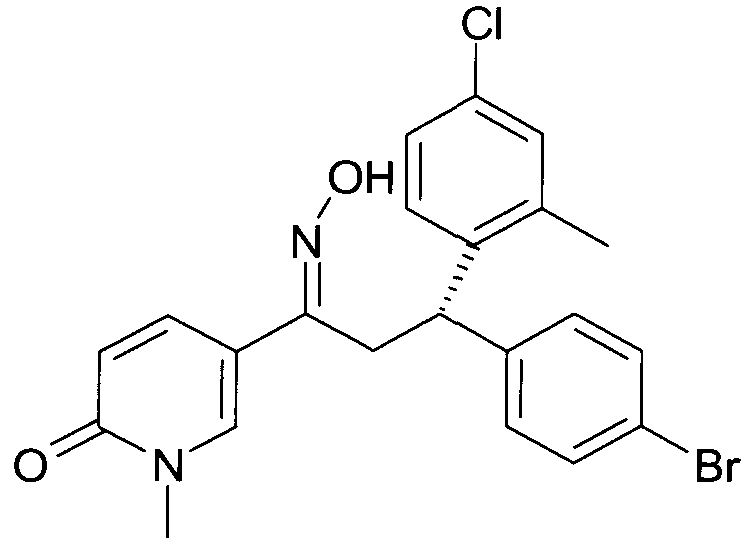
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из (+)-5-[3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-пропионил]-1-метил-1H-пиридин-2-она (пример 413, стадия 1). Соединение очистили посредством хроматографии на силикагеле на 10 г колонке, используя систему ЖХСД с элюцией градиентом n-гептан : этилацетат (100:0 до 0:100). Бесцветная пена. MS (ESI+): m/z=461.0 ([M+H]+).
Пример 416
(+)-N-{4'-[1-(4-хлор-2-метил-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}-метансульфонамид

Соединение, указанное в заголовке, получили по аналогии с примером 166, из (+)-5-{3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-она (пример 415) и 4-(метансульфониламино)фенилбороновой кислоты (CAS RN 380430-57-9). Соединение очистили посредством хроматографии на силикагеле на 20 г колонке, используя систему ЖХСД с элюцией градиентом дихлорметан : метанол (100:0 до 90:10). Светло-коричневая пена. MS (ESI+): m/z=550.2 ([M+H]+)
Пример 417
((-),Е)-3-[4-(5-метил-[1,3,4]оксадиазол-2-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
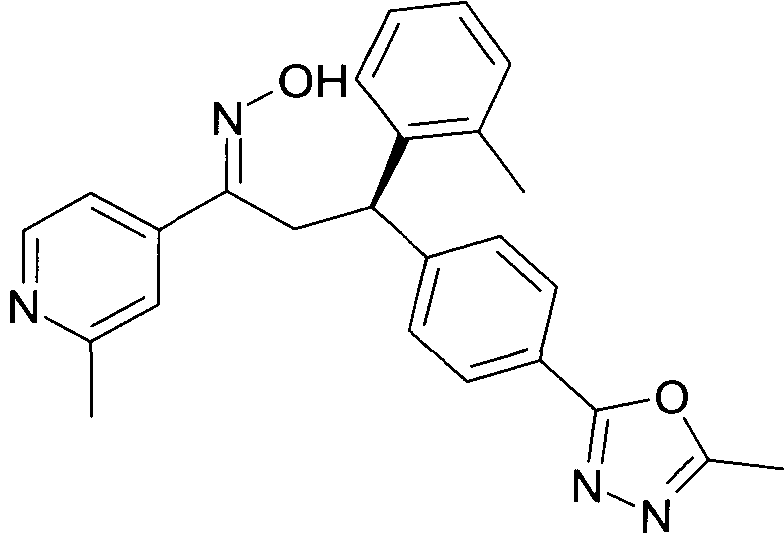
Стадия 1: (-)-3-[4-(5-метил-[1,3.4]оксадиазол-2-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
К раствору 4-[(-)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензойной кислоты (80 мг; пример 272, стадия 2) и диизопропилэтиламина (0.078 мл) в N,N-диметилформамиде (2.6 мл) добавили O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (102 мг) и реакционную смесь перемешивали при комнатной температуре. Через 5 мин добавили гидразид уксусной кислоты (35 мг; CAS RN 1068-57-1) и реакционную смесь нагревали под микроволновым излучением при 100°C в течение 10 мин. К реакционной смеси добавили конц. серную кислоту (0.24 мл; сильно экзотермично!) и нагревали посредством микроволнового излучения при 140°C в течение дополнительных 10 мин. Реакционную смесь экстрагировали насыщенным раствором гидрокарбоната натрия (50 мл) и этилацетатом (3×50 мл) и объединенные органические фазы высушили над сульфатом натрия. Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (100:0 до 50:50) с получением соединения, указанного в заголовке, в виде светло-красного масла. MS (ESI+): m/z=398.1 ([M+H]+)
Стадия 2: ((-),Е)-3-[4-(5-метил-[1,3.4]оксадиазол-2-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из (-)-3-[4-(5-метил-[1,3,4]оксадиазол-2-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она. Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом дихлорметан : метанол (100:0 до 98:2). Светло-розовый осадок. MS (ESI+)): m/z=413.1 ([M+H]+).
Пример 418
((-),Е)-3-(4-(5-циклопропил-1,3,4-оксадиазол-2-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим
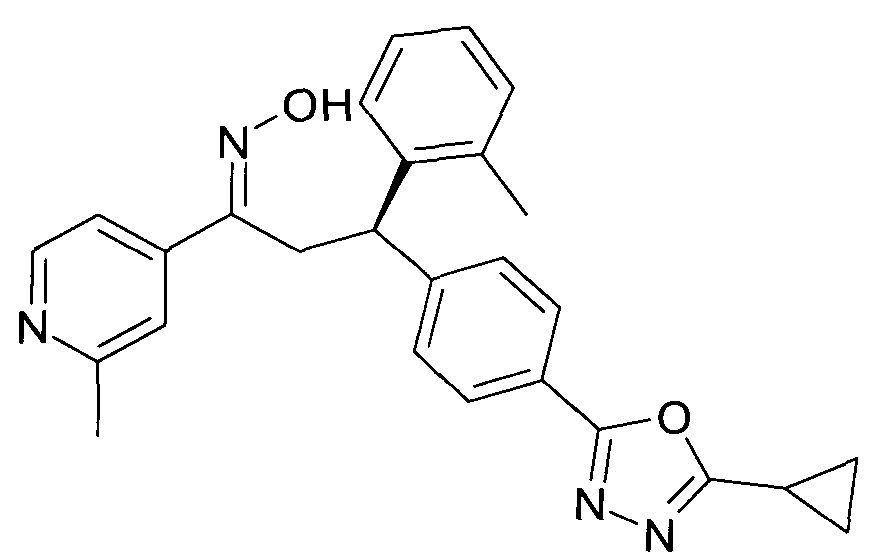
Стадия 1: (-)-3-[4-(5-циклопропил-[1,3.4]оксадиазол-2-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 417, стадия 1, из 4-[(-)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензойной кислоты (пример 272, стадия 2) и гидразида циклопропанкарбоновой кислоты (CAS RN 6952-93-8). Светло-желтое масло. MS (ESI+): m/z=424.1 ([M+H]+).
Стадия 2: ((-),E)-3-(4-(5-циклопропил-1,3,4-оксадиазол-2-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим
Соединение, указанное в заголовке, получили по аналогии с примером 417, стадия 2, из (-)-3-[4-(5-циклопропил-[1,3,4]оксадиазол-2-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Белый осадок. MS (ESI+): m/z=439.1 ([M+H]+).
Пример 419
((-),E)-3-[4-(5-Метоксиметил-[1,3,4]оксадиазол-2-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
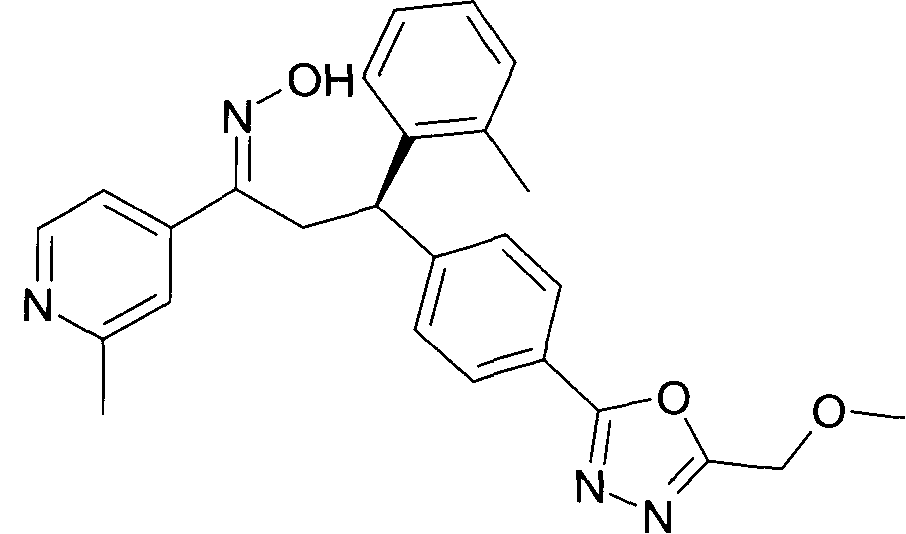
Стадия 1: (-)-3-[4-(5-Метоксиметил-[1,3,4]оксадиазол-2-ил)-фенил]-1 -(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 417, стадия 1, из 4-[(-)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензойной кислоты (пример 272, стадия 2) и гидразида метокси-уксусной кислоты (CAS RN 20605-41-8). Светло-красное масло. MS (ESI+): m/z=428.1 ([M+H]+).
Стадия 2: ((-),E)-3-[4-(5-Метоксиметил-[1.3.4]оксадиазол-2-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
Соединение, указанное в заголовке, получили по аналогии с примером 417, стадия 2, из (-)-3-[4-(5-метоксиметил-[1,3,4]оксадиазол-2-ил)-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Светло-розовый осадок. MS (ESI+): m/z=443.5 ([M+H]+).
Пример 420
((-),E)-3-{4-[5-(2-метокси-этил)-[1,3,4]оксадиазол-2-ил]-фенил}-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
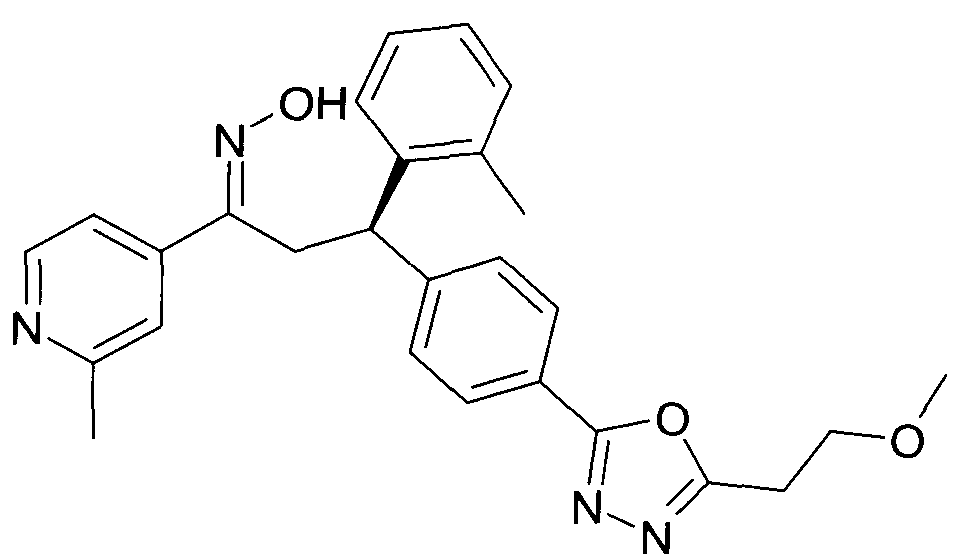
Стадия 1: (-)-3-{4-[5-(2-метокси-этил)-[1,3,4]оксадиазол-2-ил]-фенил}-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 417, стадия 1, из 4-[(-)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензойной кислоты (пример 272, стадия 2) и гидразида 3-метокси-пропионовой кислоты (CAS RN 21920-89-8). Светло-желтое масло. MS (ESI+): m/z=442.4 ([M+H]+).
Стадия 2: ((-),E)-3-{4-[5-(2-метокси-этил)-[1,3,4]оксадиазол-2-ил]-фенил]-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она оксим
Соединение, указанное в заголовке, получили по аналогии с примером 417, стадия 2, из (-)-3-{4-[5-(2-метокси-этил)-[1,3,4]оксадиазол-2-ил]-фенил}-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Белый осадок. MS (ESI+): m/z=457.4 ([M+H]+).
Пример 421
((-),E)-1-(2-метил-пиридин-4-ил)-3-{4-[5-(тетрагидро-пиран-4-ил)-[1,3,4]оксадиазол-2-ил]-фенил}-3-о-толил-пропан-1-она оксим
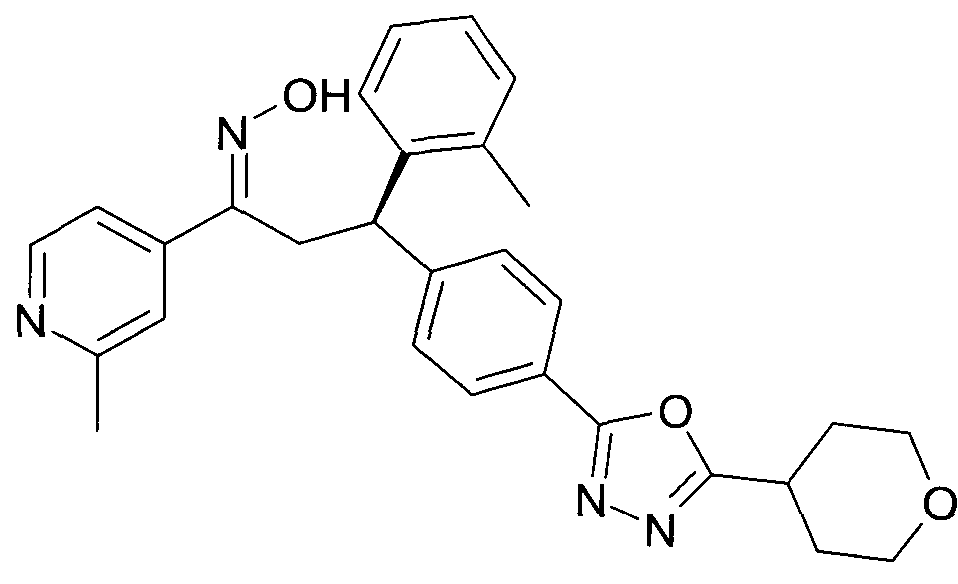
Стадия 1: (-)-1-(2-метил-пиридин-4-ил)-3-{4-[5-(тетрагидро-пиран-4-ил)-[1,3,4]оксадиазол-2-ил]-фенил}-3-о-толил-пропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 417, стадия 1, из 4-[(-)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензойной кислоты (пример 272, стадия 2) и гидразида тетрагидро-пиран-4-карбоновой кислоты (CAS RN 59293-18-4). Светло-желтое масло. MS (ESI+): m/z=468.4 ([M+H]+).
Стадия 2: ((-),E)-1-(2-метил-пиридин-4-ил)-3-{4-[5-(тетрагидро-пиран-4-ил)-[1,3,4]оксадиазол-2-ил]-фенил}-3-о-толил-пропан-1-она оксим
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из (-)-1-(2-метил-пиридин-4-ил)-3-{4-[5-(тетрагидро-пиран-4-ил)-[1,3,4]оксадиазол-2-ил]-фенил}-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Белый осадок. MS (ESI+): m/z=483.3 ([M+H]+).
Пример 422
(5-{4-[(-)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-[1,3,4]оксадиазол-2-ил)-уксусная кислота
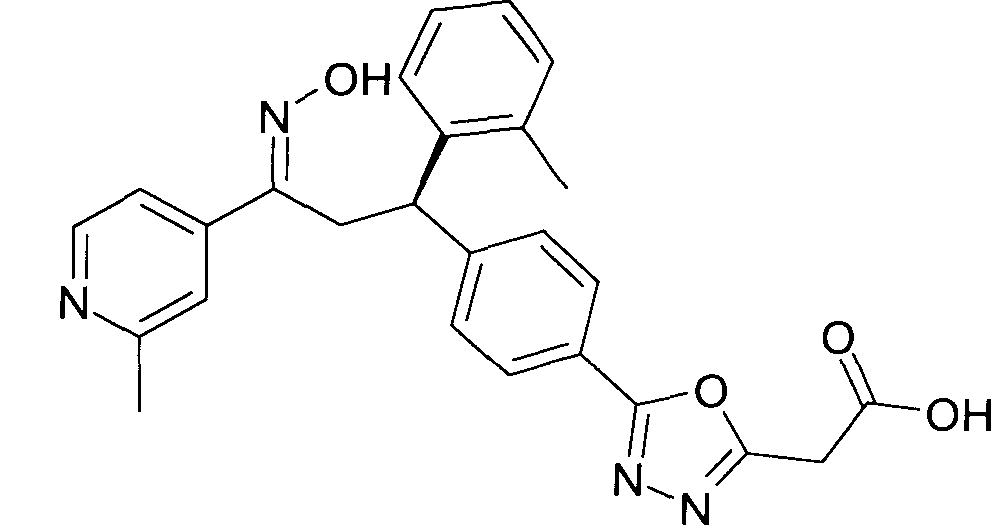
Стадия 1: (5-{4-[(-)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил[1,3,4]оксадиазол-2-ил)-уксусной кислоты этиловый эфир
Соединение, указанное в заголовке, получили по аналогии с примером 417, стадия 1, из 4-[(-)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-бензойной кислоты (пример 272, стадия 2) и гидразинокарбонил-уксусной кислоты этилового эфира (CAS RN 30866-24-1). Светло-желтое масло. MS (ESI+): m/z=470.4 ([M+H]+).
Стадия 2: (5-{4-[(-)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-Фенил[1,3,4]оксадиазол-2-ил)-уксусная кислота
К раствору (5-{4-[(-)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-[1,3,4]оксадиазол-2-ил)-уксусной кислоты этилового эфира (146 мг) в смеси этанола (5 мл) и воды (1.25 мл) добавили бикарбонат натрия (104 мг) и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. pH раствора довели до значения, приблизительно равного 3, используя 1M водный раствор соляной кислоты, и затем экстрагировали насыщенным солевым раствором (50 мл) и этилацетатом (3×50 мл). Объединенные органические фазы высушили над сульфатом натрия и неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом дихлорметан : метанол (100:0 до 90:10). Светло-желтый осадок. MS (ESI+): m/z=442.4 ([M+H]+).
Стадия 3: (5-{4-[(-)-3-[(E)-гидроксимино1-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-Фенил}-[1,3.4]оксадиазол-2-ил)-уксусная кислота
Соединение, указанное в заголовке, получили по аналогии с примером 417, стадия 2, из (5-{4-[(-)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-[1,3,4]оксадиазол-2-ил)-уксусной кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Белый осадок. MS (ESI+): m/z=457.2 ([M+H]+).
Пример 423
(-)-1-(2-метил-пиридин-4-ил)-3-(4-(оксазол-2-ил)-фенил)-3-о-толил-пропан-1-она оксим
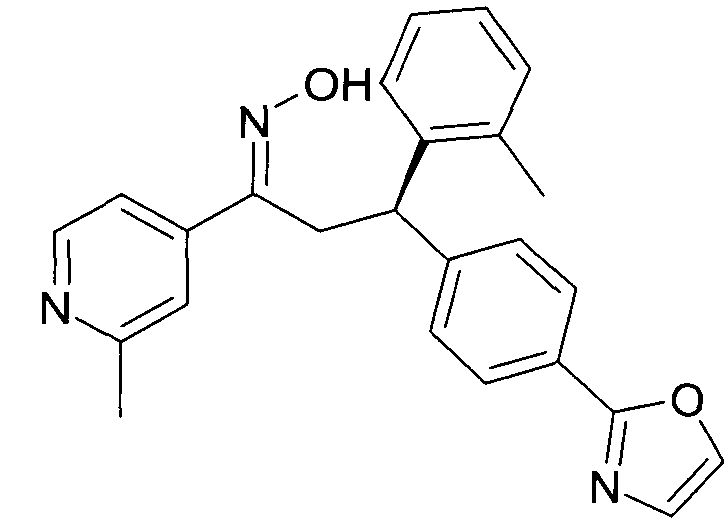
Стадия 1: (-)-1-(2-метил-пиридин-4-ил)-3-(4-оксазол-2-ил-фенил)-3-о-толил-пропан-1-он
К раствору (-)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она (120 мг; пример 142, стадия 2), оксазола (126 мг) и тетракис(трифенилфосфин) палладия(0) (68 мг) добавили трет-бутоксид лития (141 мг) и реакционную смесь нагревали под микроволновым излучением при 120°C в течении 30 мин. Реакционную смесь экстрагировали насыщенным раствором гидрокарбоната натрия (50 мл) и этилацетатом (3×50 мл) и объединенные органические фазы высушили над сульфатом натрия. Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этил ацетат (1:1 до 2:1) с получением соединения, указанного в заголовке, в виде бесцветного масла. MS (ESI+): m/z=383.0 ([M+H]+).
Стадия 2: (-)-1-(2-метил-пиридин-4-ил)-3-(4-оксазол-2-ил-фенил)-3-о-толил-пропан-1-она оксим
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из (-)-1-(2-метил-пиридин-4-ил)-3-(4-оксазол-2-ил-фенил)-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Белый осадок. MS (ESI+): m/z=398.1 ([M+H]+).
Пример 424
(-)-1-(2-метил-пиридин-4-ил)-3-[4-(1-метил-1H-[1,2,3]триазол-4-ил)-фенил]-3-о-толил-пропан-1-она оксим
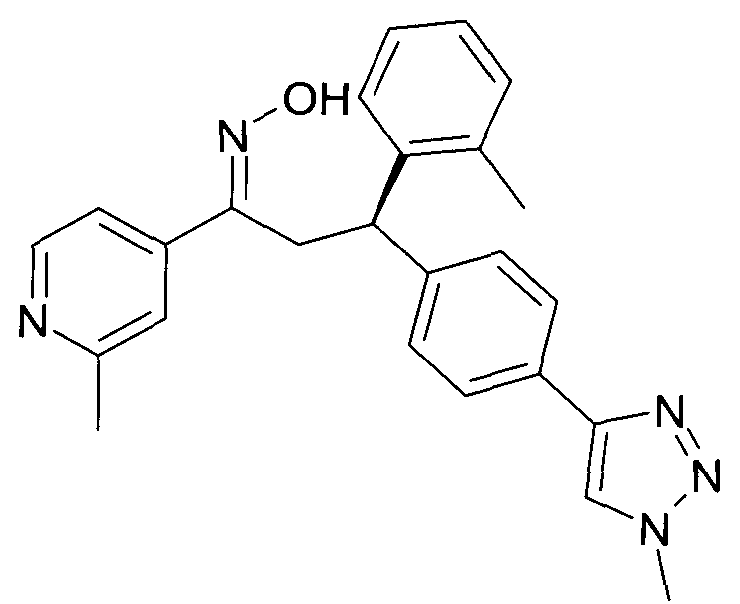
Стадия 1: (-)-1-(2-метил-пиридин-4-ил)-3-[4-(1-метил-1H-[1,2,3] триазол-4-ил)-фенил]-3-о-толил-пропан-1-он
Синтез проводили в потоке, используя поточную систему FlowSyn (Uniqsis), оснащенную изготовленным вручную реактором с медным теплообменником, стандартным T-образным тройником и 250 фунт/кв. дюйм регулятором давления всасывания:
Поток раствора, содержащего (-)-3-(4-этинил-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-он (150 мг в 5 мл, c=0.088 моль/л; пример 287, стадия 2) и йодометан (125 мг в 5 мл, c=0.177 моль/л) в этилацетате смешали со вторым потоко азида натрия (58 мг в 5 мл, c=0.177 моль/л) в воде направили через теплообменник (объем=21 мл) при 150°C. Оба канала работали со скоростью потока 0.4 мл/мин, что эквивалентно времени нахождения в реакции 26 мин. Поток продукта собрали в 25% раствор гидроксида аммония и экстрагировали этилацетатом (3×50 мл). Объединенные органические фазы высушили над сульфатом натрия и неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (1:1 to 2:1) с получением соединения, указанного в заголовке, в виде бесцветного осадка. MS (ESI+): m/z=397.3 ([M+H]+).
Стадия 2: (-)-1-(2-метил-пиридин-4-ил)-3-[4-(1-метил-1H-[1,2,3]триазол-4-ил)-Фенил]-3-о-толил-пропан-1-она оксим
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из (-)-1-(2-метил-пиридин-4-ил)-3-[4-(1-метил-1Н-[1,2,3]триазол-4-ил)-фенил]-3-о-толил-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (NH2-силикагель колонка, CombiFlash Companion, Isco Inc.) с элюцией градиентом л-гептан/этилацетат (1:4 до 0:1) с получением соединения, указанного в заголовке, в виде бесцветного осадка. Белый осадок. MS (ESI+): m/z=412.4 ([M+H]+).
Пример 425
(4-{4-[(-)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-[1,2,3]триазол-1 -ил)-уксусная кислота
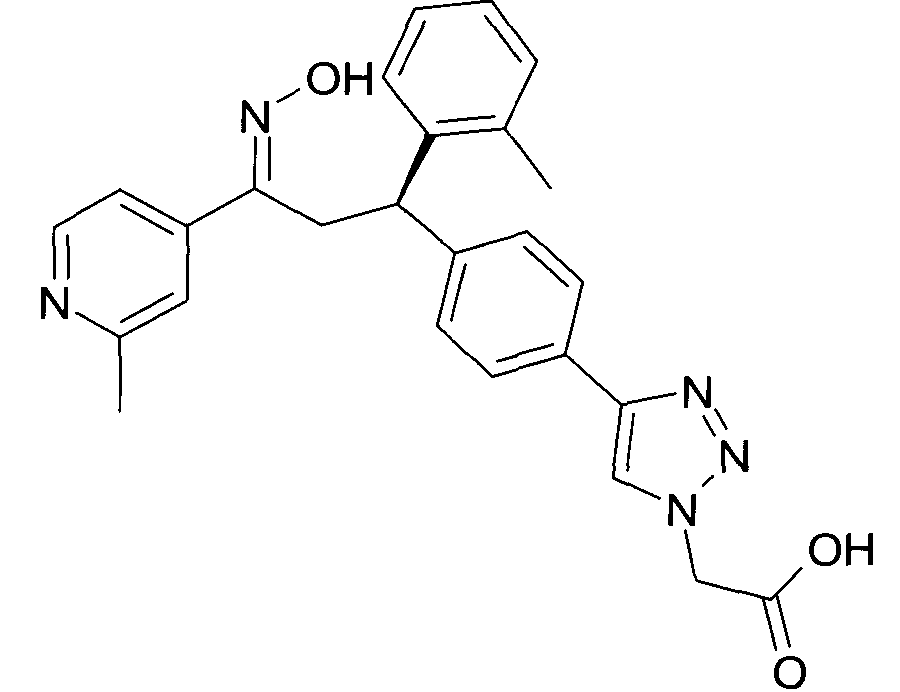
Стадия 1: (4-{4-[(-)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-[1,2,3]триазол-1-ил)-уксусной кислоты этиловый эфир
Соединение, указанное в заголовке, получили по аналогии с примером 424, стадия 1, из (-)-3-(4-этинил-фенил)-1-(2-метил-пиридин-4-ил)-3-о-толил-пропан-1-она (пример 287, стадия 2) и бромуксусной кислоты этилового эфира (CAS RN 105-36-2), используя скорость потока 0.25 мл/мин на канал, что эквивалентно времени нахождения в реакции 42 мин. Светло-коричневый осадок. MS (ESI+): m/z=469.4 ([M+H]+).
Стадия 2: (4-{4-[(-)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-[1,2,3]триазол-1-ил)-уксусной кислоты этиловый эфир
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из (4-{4-[(-)-3-(2-метил-пиридин-4-ил)-3-оксо-1-о-толил-пропил]-фенил}-[1,2,3]триазол-1-ил)-уксусной кислоты этилового эфира и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Светло-желтый осадок. MS (ESI+): m/z=484.4 ([M+H]+).
Стадия 3: (4-{4-[(-)-3-[(E)-гидроксимино1-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил1-фенил}-[1,2,3] триазол-1-ил)-уксусная кислота
К раствору (4-{4-[(-)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-[1,2,3]триазол-1-ил)-уксусной кислоты этилового эфира (35 мг) в смеси диоксана (1 мл) и воды (1 мл) добавили гидроксид лития (14 мг) и реакционную смесь нагревали под микроволновым излучением при 120°C в течение 20 мин. РН раствора довели до значения, приблизительно равного pH 3, используя 1M водный раствор соляной кислоты, и затем экстрагировали насыщенным солевым раствором (50 мл) и этилацетатом (3×50 мл). Объединенные органические фазы высушили над сульфатом натрия и неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом дихлорметан/метанол (100:0 до 90:10). Светло-желтый осадок. MS (ESI-): m/z=454.1 ([M-H]-).
Пример 426
(-)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
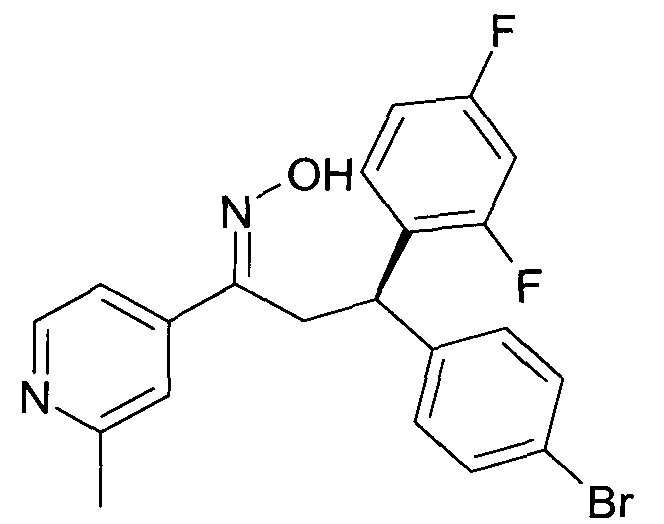
Стадия 1: 3-(4-бром-фенил)-2-циано-3-(2.4-дифтор-фенил)-пропионовой кислоты этиловый эфир
К раствору 2,4-дифтор-1-йодо-бензола (12.0 г) в безводном ТГФ (200 мл) медленно добавили раствор изопропилмагния хлорид - литий хлоридного комплекса (52.9 мл, 14% раствор в ТГФ) в течение 10 мин при комнатной температуре. После перемешивания в течение 1 ч, добавили раствор 3-(4-бром-фенил)-2-циано-акриловой кислоты этиловый эфир (10.0 г; пример 74, стадия 1) в безводном ТГФ (100 мл) и перемешивание продолжили при комнатной температуре. Через 1 ч добавили насыщенный водный раствор хлорида аммония (100 мл), фазы разделили и водный слой экстрагировали этилацетатом (3×100 мл). Объединенные органические фазы высушили над сульфатом натрия и неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (1:0 до 3:1) с получением соединения, указанного в заголовке, в виде светло-желтого масла. MS (ESI-): m/z=391.9 ([M-H]-).
Стадия 2: 3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-пропионовая кислота
К раствору 3-(4-бром-фенил)-2-циано-3-(2,4-дифтор-фенил)-пропионовой кислоты этиловый эфир (2.4 г) в уксусной кислоте (11 мл) добавили воду (6 мл) и концентрированную H2SO4 (6.83 мл) при 0°C. Реакционную смесь нагревали при 120°C в течение ночи, затем охладили и вылили на лед и экстрагировали этилацетатом (3×100 мл). Органические слои промыли солевым раствором, высушили над сульфатом магния, отфильтровали и сконцентрировали под вакуумом. Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (1:0 до 1:1) с получением соединения, указанного в заголовке, в виде серо-белого осадка. MS (ESI-): m/z=339.0 ([M-H]-).
Стадия 3: 3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-N-метокси-N-метил-пропионамид. (-)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-N-метокси-N-метил-пропионамид и (+)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-N-метокси-N-метил-пропионамид
Соединения, указанные в заголовке, получили по аналогии с примером 74, стадия 4, из 3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-пропионовой кислоты и N,O-диметилгидроксиламина гидрохлорида. Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (1:0 до 1:1) с получением 3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-N-метокси-N-метил-пропионамида в виде светло-желтого масла. MS (ESI+): m/z=386.3 ([M+H]+). Разделение 3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-N-метокси-N-метил-пропионамида с помощью хиральной ВЭЖХ (Chiralpak-AD, 8% изопропанол в n-гептане) дало (-)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-N-метокси-N-метил-пропионамид в виде светло-желтого масла, MS (ESI+): m/z=386.1 ([M+H]+) и (+)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-N-метокси-N-метил-пропионамид в виде светло-желтого масла, MS (ESI+): m/z=386.1 ([M+H]+)
Стадия 4: (-)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 74, стадия 5, из (-)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-N-метокси-N-метил-пропионамида и 4-бром-2-метилпиридина. Светло-желтое масло. MS (ESI+): m/z=416.3 ([M+H]+).
Стадия 5: (-)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из (-)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Белый осадок. MS (ESI+): m/z=431.3 ([M+H]+)
Пример 427
1-{4-[(-)-1-(2,4-дифтор-фенил)-3-[(Е)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновая кислота
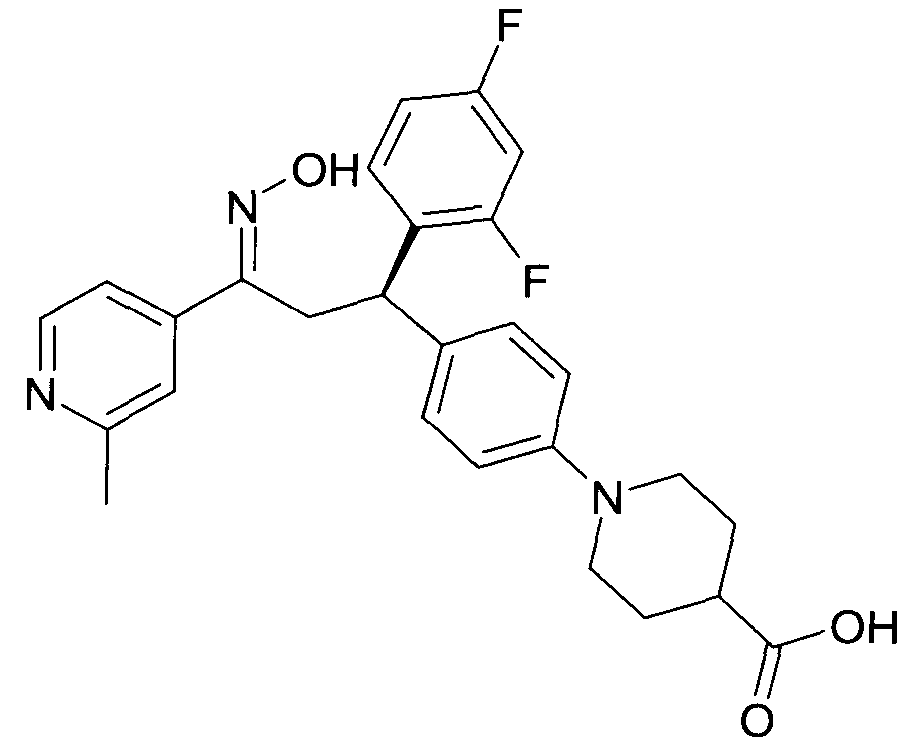
Стадия 1: 1-{4-[(-)-1-(2,4-дифтор-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-фенил}-пиперидин-4-карбоновой кислоты этиловый эфир
Соединение, указанное в заголовке, получили по аналогии с примером 39, из (-)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она (пример 426, стадия 4) и пиперидин-4-карбоновой кислоты этилового эфира (CAS RN 1126-09-6) в присутствии трис(дибензилиденацетон)дипалладия(0) хлороформного аддукта, 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила (X-PHOS) и трет-бутоксида натрия. Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (2:1 до 1:1) с получением соединения, указанного в заголовке, в виде светло-желтого масла. MS (ESI+): m/z=493.5 ([M+H]+).
Стадия 2: 1-{4-[(-)-1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновой кислоты этиловый эфир
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из 1-{4-[(-)-1-(2,4-дифтор-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-фенил}-пиперидин-4-карбоновой кислоты этилового эфира и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (NH2-силикагель колонка, CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этил ацетат (1:4 до 0:1) с получением соединения, указанного в заголовке, в виде светло-желтого осадка. MS (ESI+): m/z=508.5 ([M+H]+).
Стадия 3: 1-{4-[(-)-1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновая кислота
Соединение, указанное в заголовке, получили по аналогии с примером 425, стадия 3, из 1-{4-[(-)-1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновой кислоты этилового эфира. Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (1:4 до 0:1) с получением соединения, указанного в заголовке, в виде светло-желтого осадка. MS (ESI-): m/z=478.3 ([M-H]-).
Пример 428
1-{4-[(+)-1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновая кислота
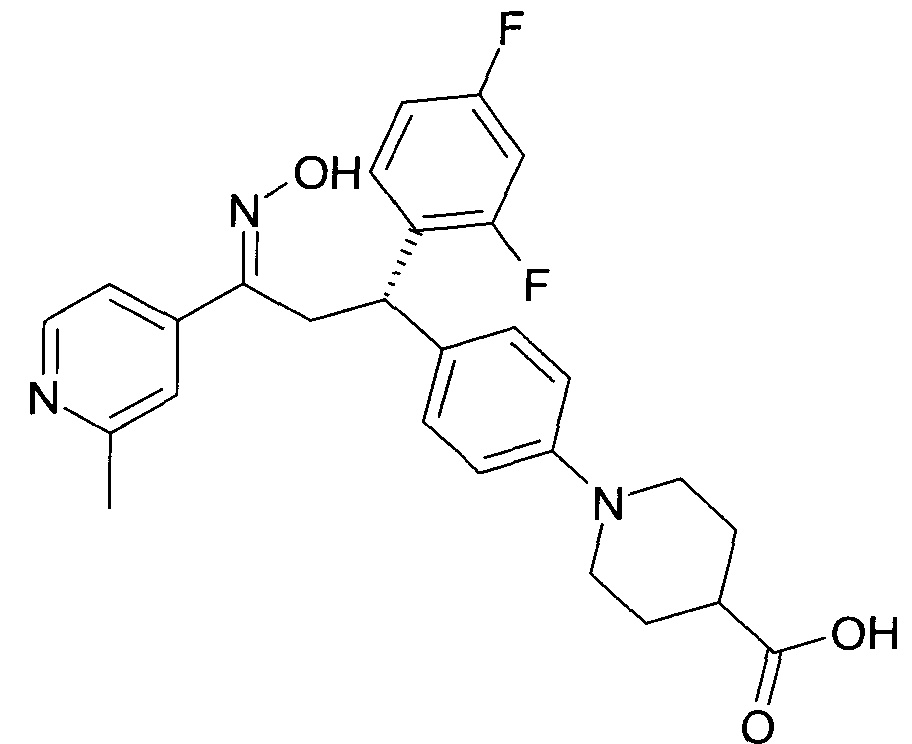
Стадия 1: (+)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 74, стадия 5, из (+)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-пропионовой кислоты (пример 426, стадия 3) и 4-бром-2-метилпиридина. Светло-желтое масло. MS (ESI+): m/z=416.3 ([M+H]+).
Стадия 2: 1-{4-[(+)-1-(2,4-дифтор-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил1-фенил}-пиперидин-4-карбоновой кислоты этиловый эфир
Соединение, указанное в заголовке, получили по аналогии с примером 427, стадия 1, из (+)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она и пиперидин-4-карбоновой кислоты этилового эфира (CAS RN 1126-09-6). Светло-желтый осадок. MS (ESI-): m/z=491.0 ([M-H]-).
Стадия 3: 1-{4-[(+)-1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил1-фенил}-пиперидин-4-карбоновой кислоты этиловый эфир
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из 1-{4-[(+)-1-(2,4-дифтор-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-фенил}-пиперидин-4-карбоновой кислоты этилового эфира и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (NH2-силикагель колонки, CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (1:4 до 0:1) с получением соединения, указанного в заголовке, в виде светло-желтого осадка. MS (ESI+): m/z=508.3 ([M+H]+).
Стадия 4: 1-{4-[(+)-1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновая кислота
Соединение, указанное в заголовке, получили по аналогии с примером 425, стадия 3, из 1-{4-[(+)-1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновой кислоты этилового эфира. Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом дихлорметан/метанол (100:1 до 50:3) с получением соединения, указанного в заголовке, в виде светло-желтого осадка. MS (ESI+): m/z=480.1 ([M+H]+).
Пример 429
(1S,5R)-3-{4-[(-)-1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-3-азабицикло[3.1.0]гексан-6-карбоновая кислота
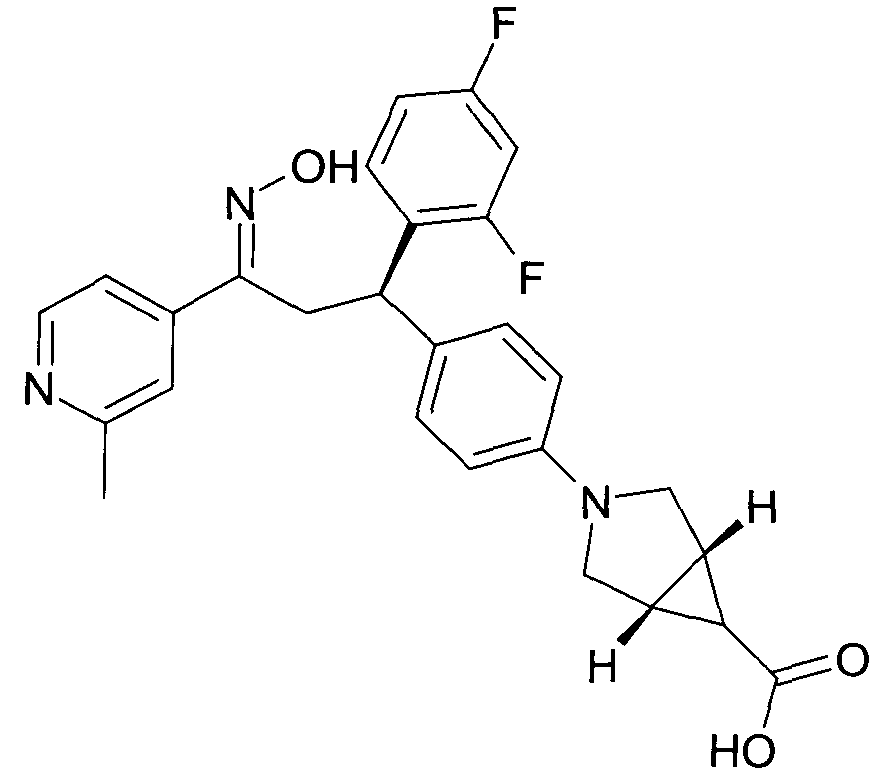
Стадия 1: (1S,5R)-3-{4-[(-)-1-(2,4-дифтор-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил1-фенил}-3-аза-бицикло[3.1.0]гексан-6-карбоновой кислоты этиловый эфир
Соединение, указанное в заголовке, получили по аналогии с примером 427, стадия 1, из (-)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она (пример 426, стадия 4) и (1S,5R)-3-аза-бицикло[3.1.0]гексан-6-карбоновой кислоты этилового эфира (CAS RN 174456-77-0) и сразу использовали на следующей реакционной стадии. Светло-желтый осадок.
Стадия 2: (1S,5R)-3-{4-[(-)-1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-3-аза-бицикло[3.1.0]гексан-6-карбоновой кислоты этиловый эфир
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из (1S,5R)-3-{4-[(-)-1-(2,4-дифтор-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-фенил}-3-аза-бицикло[3.1.0]гексан-6-карбоновой кислоты этилового эфира и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (NH2-силикагель колонка, CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этил ацетат (1:4 до 0:1) с получением соединения, указанного в заголовке, в виде светло-желтого осадка. MS (ESI+): m/z=506.5 ([M+H]+).
Стадия 3: (1S,5R)-3-{4-[(-)-1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-3-аза-бицикло[3.1.0]гексан-6-карбоновая кислота
Соединение, указанное в заголовке, получили по аналогии с примером 425, стадия 3, из (1S,5R)-3-{4-[(-)-1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-3-аза-бицикло[3.1.01 гексан-6-карбоновой кислоты этилового эфира. Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом дихлорметан/метанол (100:1 до 50:3) с получением соединения, указанного в заголовке, в виде светло-желтого осадка. MS (ESI-): m/z=478.2 ([M-H]-).
Пример 430
(1-{4-[(+)-1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-ил)-уксусная кислота
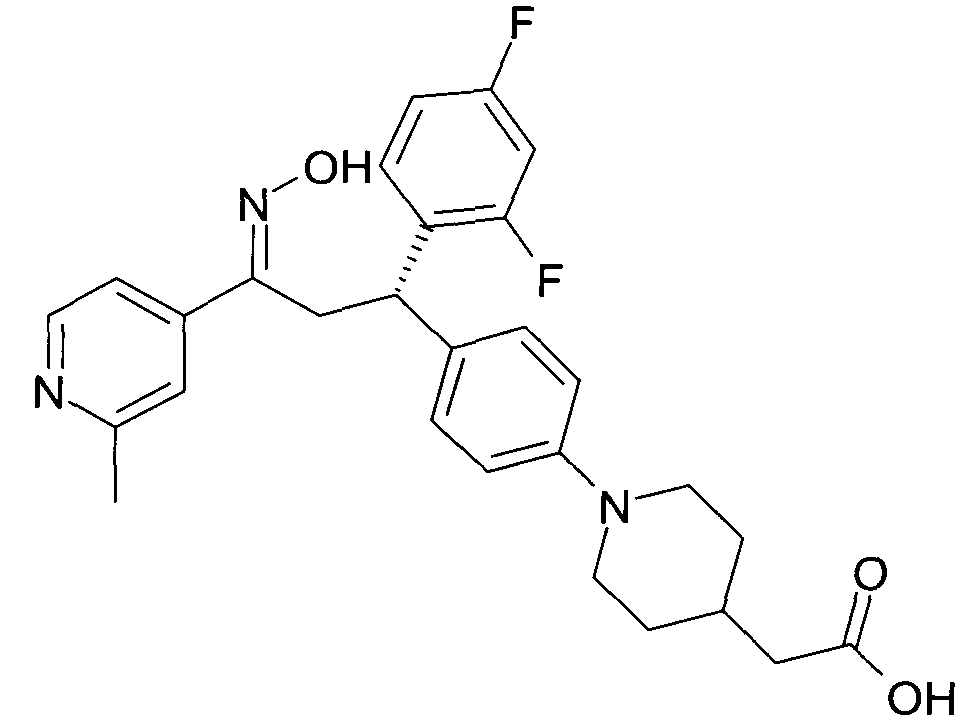
Соединение, указанное в заголовке, получили по аналогии с 1-{4-[(+)-1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-пиперидин-4-карбоновой кислотой (пример 428) заменив на стадии 2 пиперидин-4-карбоновой кислоты этиловый эфир на пиперидин-4-ил-уксусной кислоты этиловый эфир (CAS RN 59184-90-6). Светло-желтый осадок. MS (ESI+): m/z=494.3 ([M+H]+).
Пример 431
4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензойная кислота
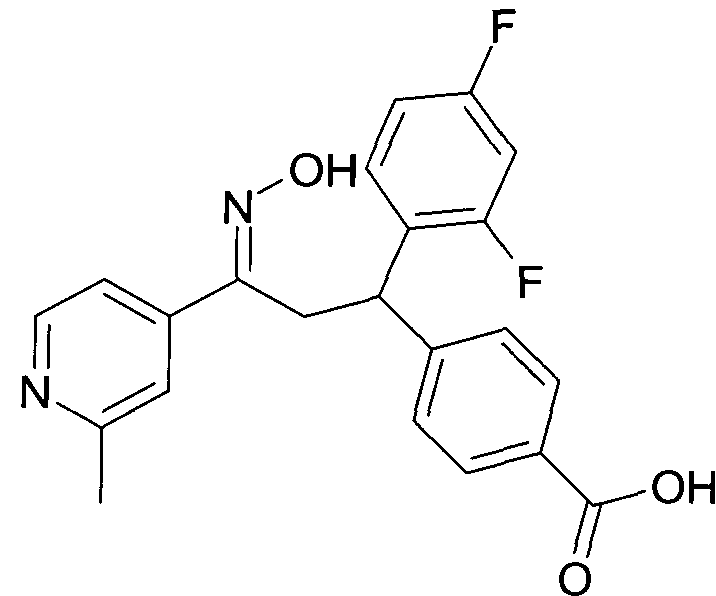
Стадия 1: 3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 74, стадия 5, из 3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-N-метокси-N-метил-пропионамида (пример 426, стадия 3) и 4-бром-2-метилпиридина. Светло-желтое масло. MS (ESI+): m/z=416.2 ([M+H]+).
Стадия 2: 4-[1-(2,4-дифтор-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-бензойной кислоты метиловый эфир
Соединение, указанное в заголовке, получили по аналогии с примером 272, стадия 1, из 3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она. Светло-желтое масло. MS (ESI+): m/z=396.0 ([M+H]+).
Стадия 3: 4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензойной кислоты метиловый эфир
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из 4-[1-(2,4-дифтор-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-бензойной кислоты метилового эфира и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Светло-желтый осадок. MS (ESI+): m/z=411.5 ([M+H]+).
Стадия 4: 4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензойная кислота
Соединение, указанное в заголовке, получили по аналогии с примером 425, стадия 3, из 4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензойной кислоты метилового эфира. Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом дихлорметан/метанол (98:2 до 85:15) с получением соединения, указанного в заголовке, в виде светло-желтого осадка. MS (ESI+): m/z=397.1 ([M+H]+).
Пример 432
N-циклопропил-4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензамид
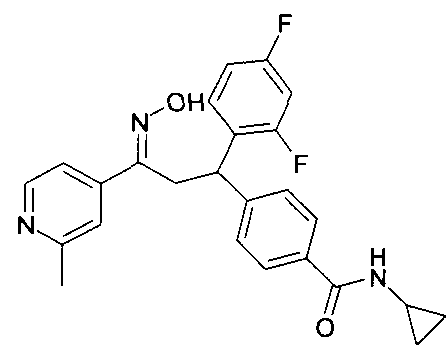
Стадия 1: 4-[1-(2,4-дифтор-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил1-бензойная кислота
Соединение, указанное в заголовке, получили по аналогии с примером 431, стадия 2, из 4-[1-(2,4-дифтор-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-бензойной кислоты метилового эфира (пример 431, стадия 2). Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом дихлорметан/метанол (98:2 до 85:15) с получением соединения, указанного в заголовке, в виде светло-желтого масла. MS (ESI+): m/z=382.1 ([M+H]+).
Стадия 2: N-циклопропил-4-[1-(2,4-дифтор-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил1-бензамид
К раствору 4-[1-(2,4-дифтор-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-бензойной кислоты (40 мг) в дихлорметане (1.5 мл) добавили O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (48 мг) и триэтиламин (29 мкл) и реакционную смесь перемешивали при 40°С. Через 15 мин, добавили циклопропиламин (157 мкл; CAS RN 765-30-0) и перемешивание продолжили в течение 2 ч при 40°С. Добавили насыщенный водный раствор бикарбоната натрия (50 мл), фазы разделили и водный слой экстрагировали этилацетатом (3×100 мл). Объединенные органические фазы высушили над сульфатом натрия и неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (100:0 до 50:50) с получением соединения, указанного в заголовке, в виде светло-желтого осадка. MS (ESI+): m/z=421.1 ([M+H]+).
Стадия 3: N-циклопропил-4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензамид
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из N-циклопропил-4-[1-(2,4-дифтор-фенил)-3-(2-метил-пиридин-4-ил)-3-оксо-пропил]-бензамида и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом дихлорметан/метанол (100:0 до 90:10). Серо-белый осадок. MS (ESI+): m/z=436.3 ([M+H]+).
Пример 433
4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-N-(2-гидрокси-этил)-бензамид

Соединение, указанное в заголовке, получили по аналогии с N-циклопропил-4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензамидом (пример 432), заменив на стадии 2 циклопропиламин на 2-амино-этанол (CAS RN 141-43-5). Серо-белый осадок. MS (ESI+): m/z=440.1 ([M+H]+).
Пример 434
4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-N-((R)-2-гидрокси-пропил)-бензамид
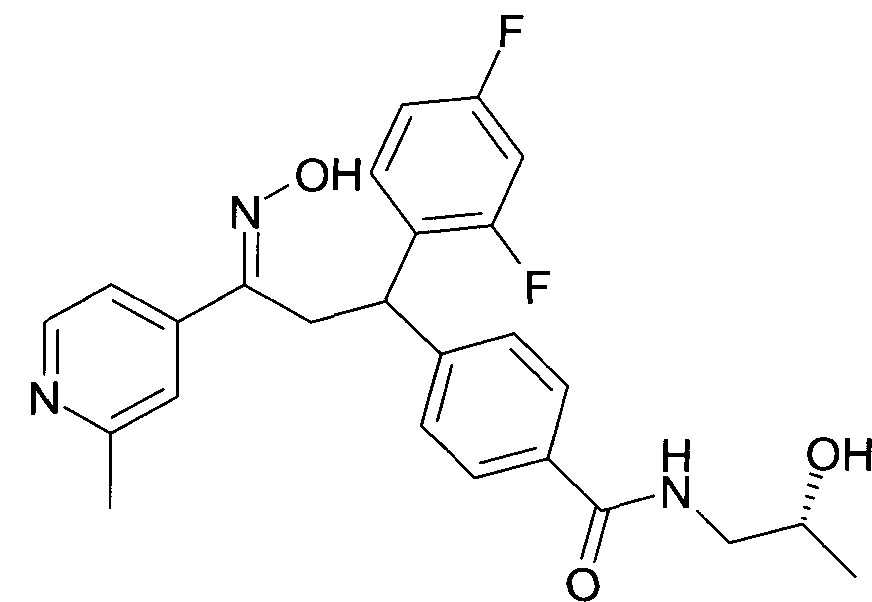
Соединение, указанное в заголовке, получили по аналогии с N-циклопропил-4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензамидом (пример 432), заменив на стадии 2 циклопропиламин на (R)-1-амино-пропан-2-ол (CAS RN 2799-16-8). Серо-белый осадок. MS (ESI+): m/z=454.3 ([M+H]+).
Пример 435
4-[1-(2,4-Дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-N-(2-гидрокси-1,1-диметил-этил)-бензамид
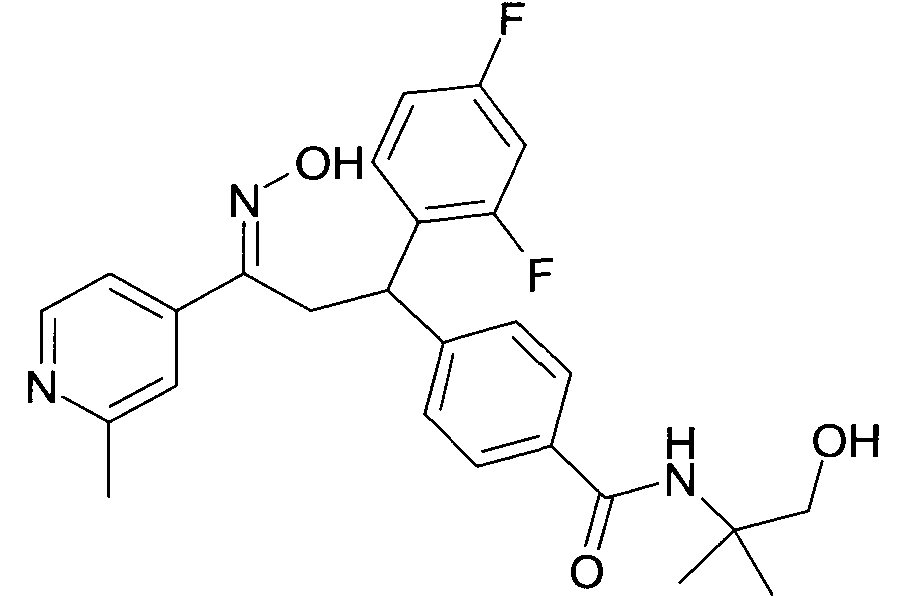
Соединение, указанное в заголовке, получили по аналогии с N-циклопропил-4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензамидом (пример 432), заменив на стадии 2 циклопропиламин на 2-амино-2-метил-пропан-1-ол (CAS RN 124-68-5). Серо-белый осадок. MS (ESI+): m/z=468.4 ([M+H]+).
Пример 436
N-циклогексил-4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензамид
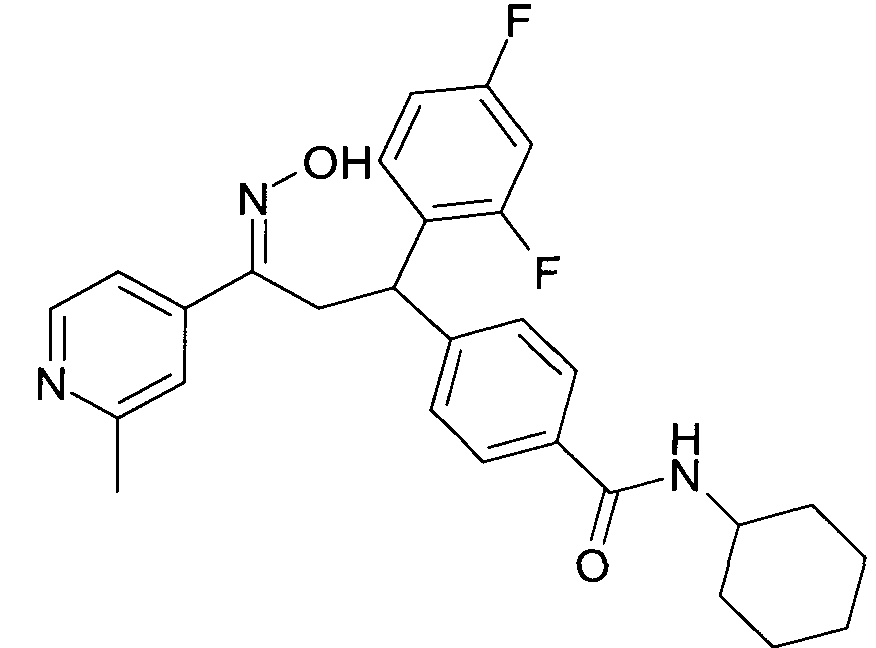
Соединение, указанное в заголовке, получили по аналогии с N-циклопропил-4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензамидом (пример 432), заменив на стадии 2 циклопропиламин на циклогексиламин (CAS RN 108-91-8). Белый осадок. MS (ESI+): m/z=478.1 ([M+H]+).
Пример 437
3-(2,4-дифтор-фенил)-3-[4-(4,4-дифтор-пиперидин-1-карбонил)-фенил]-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
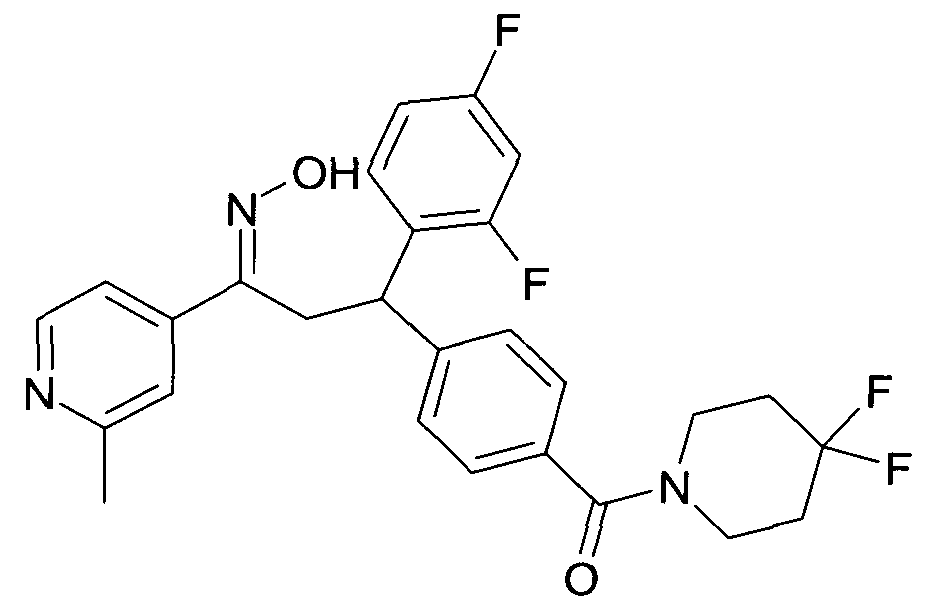
Соединение, указанное в заголовке, получили по аналогии с N-циклопропил-4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензамидом (пример 432), заменив на стадии 2 циклопропиламин на 4,4-дифтор-пиперидина гидрохлорид (CAS RN 144230-52-4). Белый осадок. MS (ESI+): m/z=500.3 ([M+H]+).
Пример 438
3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-3-[4-(морфолин-4-карбонил)-фенил]-пропан-1-она оксим
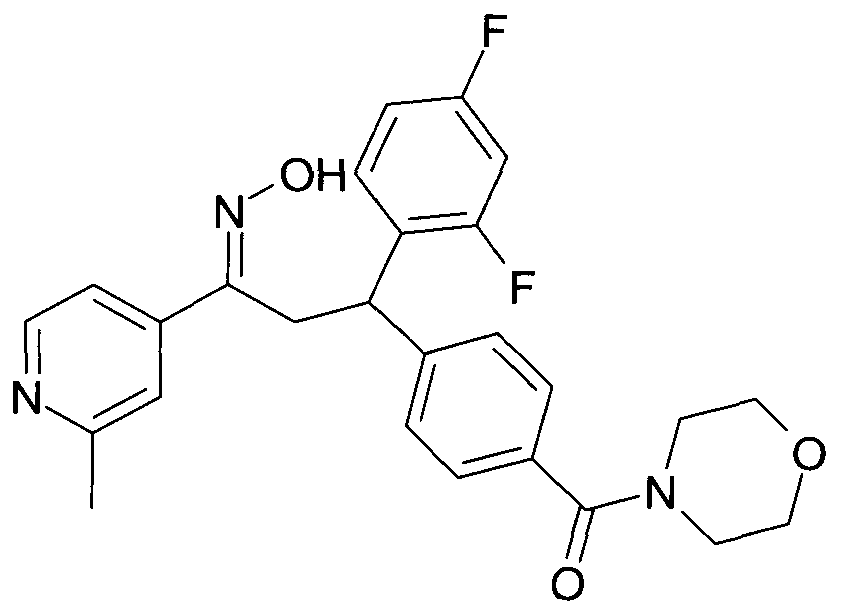
Соединение, указанное в заголовке, получили по аналогии с N-циклопропил-4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензамидом (пример 432), заменив на стадии 2 циклопропиламин на морфолин (CAS RN 110-91-8). Серо-белый осадок. MS (ESI+): m/z=466.1 ([M+H]+).
Пример 439
3-(2,4-дифтор-фенил)-3-[4-(4-метансульфонил-пиперазин-1-карбонил)-фенил]-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
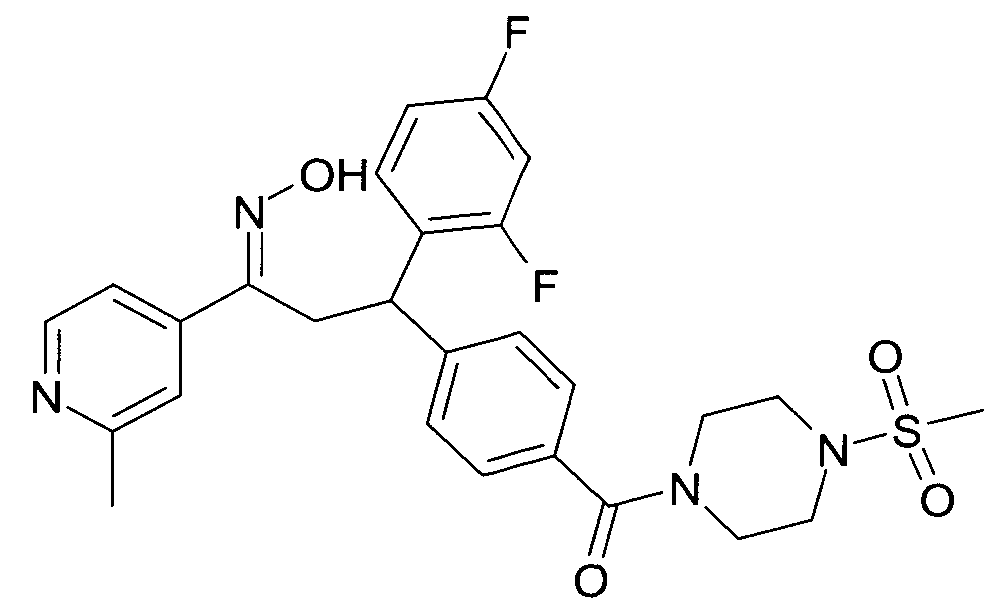
Соединение, указанное в заголовке, получили по аналогии с N-циклопропил-4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензамидом (пример 432), заменив на стадии 2 циклопропиламин на 1-метансульфонил-пиперазин (CAS RN 55276-43-2). Серо-белый осадок. MS (ESI+): m/z=543.3 ([M+H]+).
Пример 440
4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-N-(1,1-диоксо-гексагидро-1λ6-тиопиран-4-ил)-бензамид
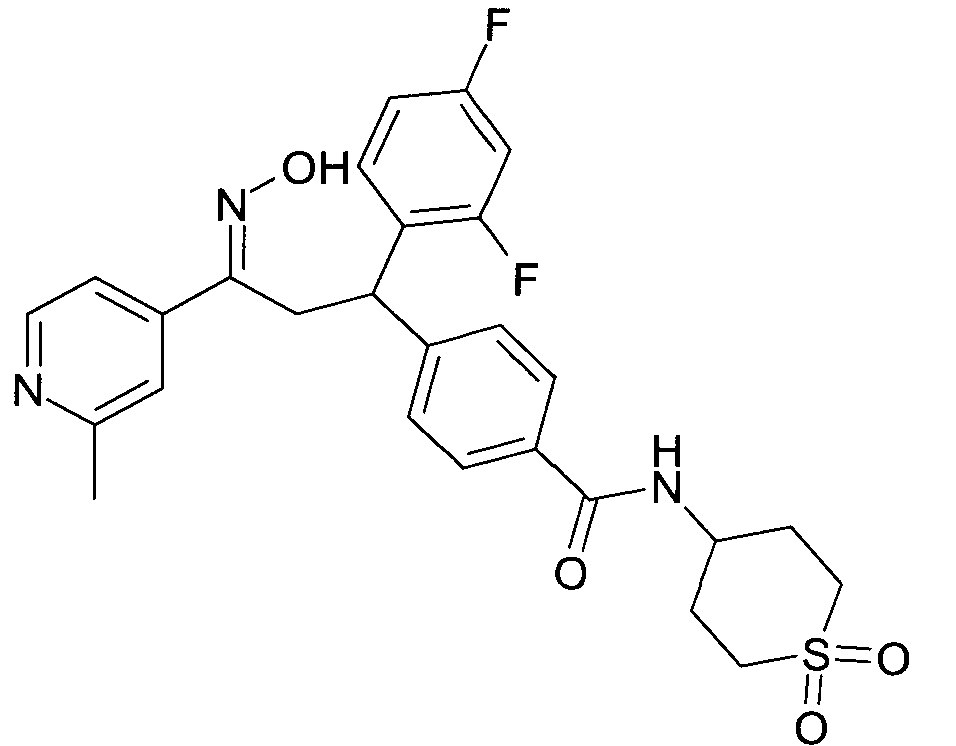
Соединение, указанное в заголовке, получили по аналогии с N-циклопропил-4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензамидом (пример 432), заменив на стадии 2 циклопропиламин на 1,1-диоксо-гексагидро-1λ6-тиопиран-4-иламин (CAS RN 210240-20-3). Белый осадок. MS (ESI+): m/z=528.3 ([M+H]+).
Пример 441
4-[1-(2,4-дифтор-фенил)-3-((E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-N-[2-(1,1-диоксо-1λ6-тиоморфолин-4-ил)-этил]-бензамид
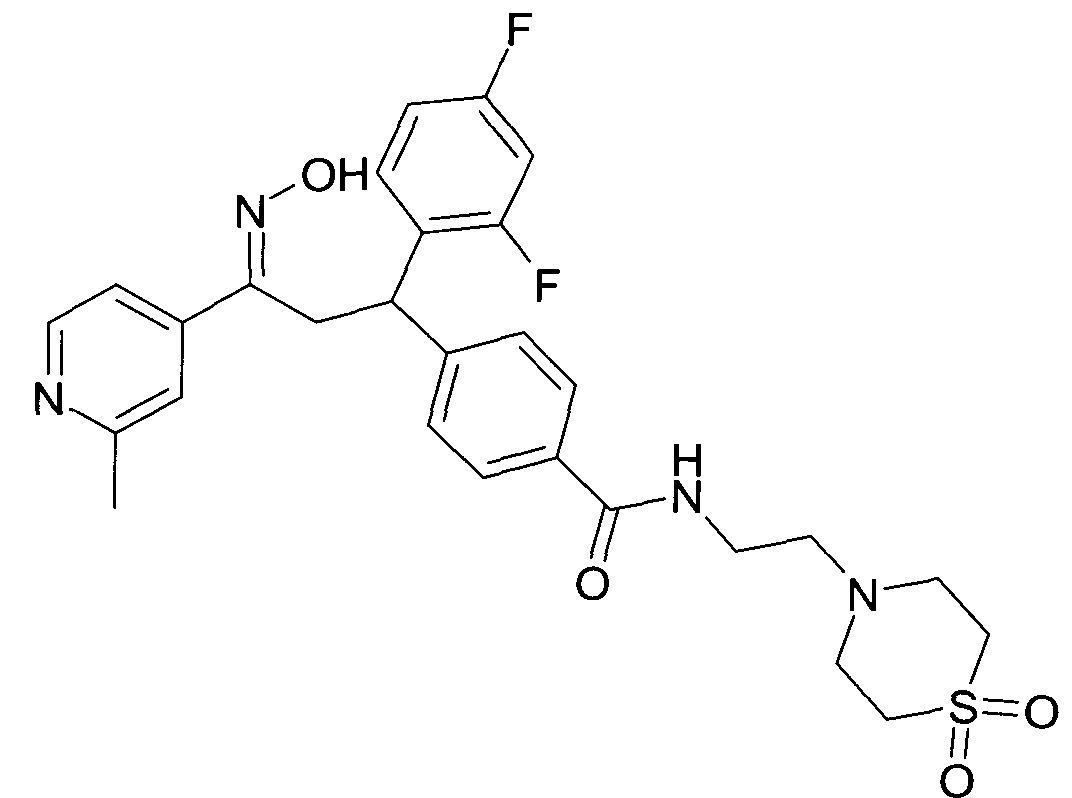
Соединение, указанное в заголовке, получили по аналогии с N-циклопропил-4-[1-(2,4-дифтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бензамидом (пример 432), заменив на стадии 2 циклопропиламин на 2-(1,1-диоксо-1λ6-тиоморфолин-4-ил)-этиламин (CAS RN 89937-52-0). Белый осадок. MS (ESI+): m/z=528.3 ([M+H]+).
Пример 442
3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-3-(4-трифторметил-фенил)-пропан-1-она оксим
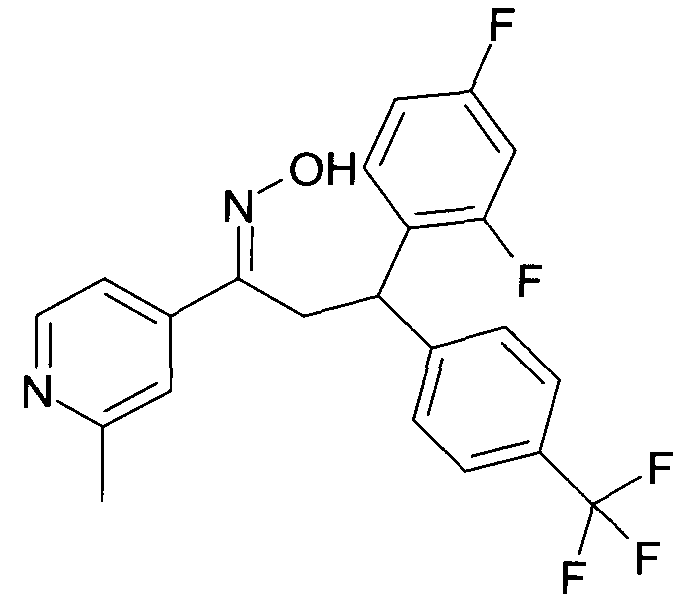
Стадия 1: (E)-3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропенон
К раствору 1-(2-метил-пиридин-4-ил)-этанона (2.0 г; CAS RN 2732-28-7) и 2,4-дифтор-бензальдегида (2.31 г; CAS RN 1550-35-2) в этаноле (16 мл) добавили пиперидин (0.88 мл). Реакционную смесь нагревали до кипения с обратным холодильником в течение ночи. Эвапорация смеси растворителя и очистка неочищенного продукта реакции с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом л-гептан/этилацетат (1:1 до 1:4), дала соединение, указанное в заголовке, в виде светло-желтого осадка. MS (ESI+): m/z=260.1 ([M+H]+).
Стадия 2: 3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-3-(4-трифторметил-фенил)-пропан-1-он
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 2, из (E)-3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропенона и 4-(трифторметил)фенилбороновой кислотой (CAS RN 128796-39-4). Светло-желтое масло. MS (ESI+): m/z=406.4 ([M+H]+).
Стадия 3: 3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-3-(4-трифторметил-фенил)-пропан-1-она оксим
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из 3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-3-(4-трифторметил-фенил)-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (1:1 до 1:4) с получением соединения, указанного в заголовке, в виде белого осадка. MS (ESI+): m/z=421.1 ([M+H]+).
Пример 443
3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-3-(6-морфолин-4-ил-пиридин-3-ил)-пропан-1-она оксим
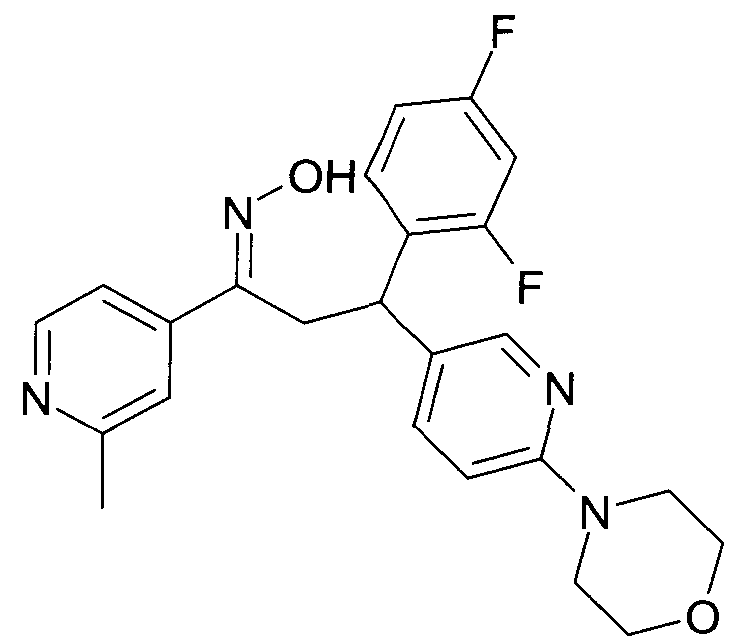
Соединение, указанное в заголовке, получили по аналогии с 3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-3-(4-трифторметил-фенил)-пропан-1 -она оксимом (пример 442), заменив на стадии 2 4-(трифторметил)фенилбороновую кислоту на 4-[5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин-2-ил]-морфолин (CAS RN 485799-04-0). Светло-желтый осадок. MS (ESI+): m/z=439.1 ([M+H]+).
Пример 444
3-[6-(4-ацетил-пиперазин-1-ил)-пиридин-3-ил]-3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
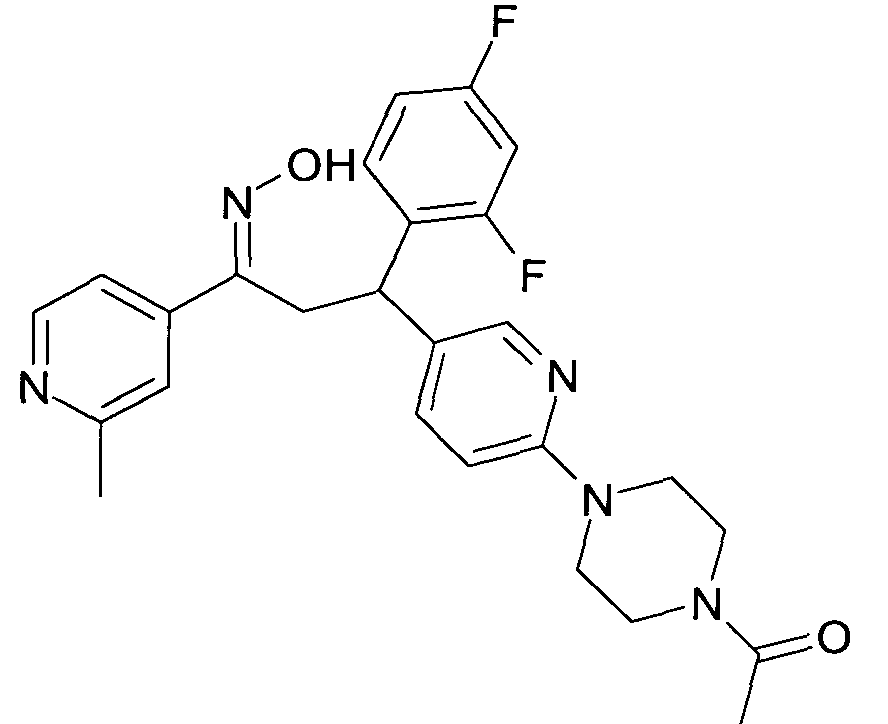
Соединение, указанное в заголовке, получили по аналогии с 3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-3-(4-трифторметил-фенил)-пропан-1-она оксимом (пример 442) заменив на стадии 2 4-(трифторметил)фенилбороновую кислоту на 1-{4-[5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин-2-ил]-пиперазин-1-ил}-этанон (CAS RN 1073372-01-6). Белый осадок. MS (ESI+): m/z=480.3 ([M+H]+).
Пример 445
3-(4-бром-фенил)-3-(3,5-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
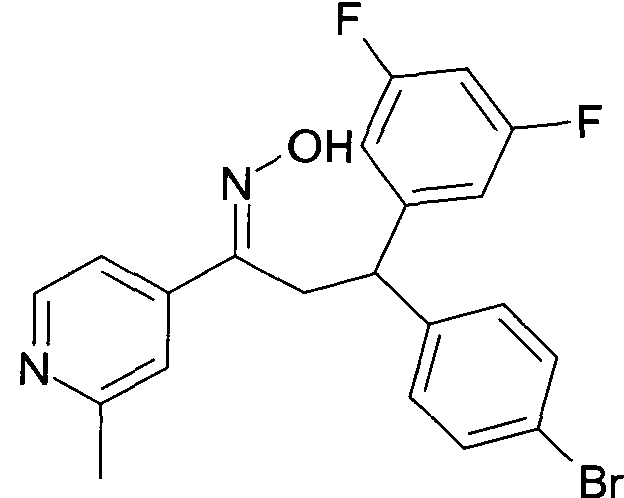
Соединение, указанное в заголовке, получили по аналогии с (-)-3-(4-бром-фенил)-3-(2,4-дифтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксимом (пример 426) заменив на стадии 1 2,4-дифтор-1-йодо-бензол на 1,3-дифтор-5-йодо-бензол (CAS RN 2265-91-0). Светло-желтый осадок. MS (ESI+): m/z=431.1 ([M+H]+).
Пример 446
4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-3-фтор-бифенил-4-карбоновой кислоты метиловый эфир
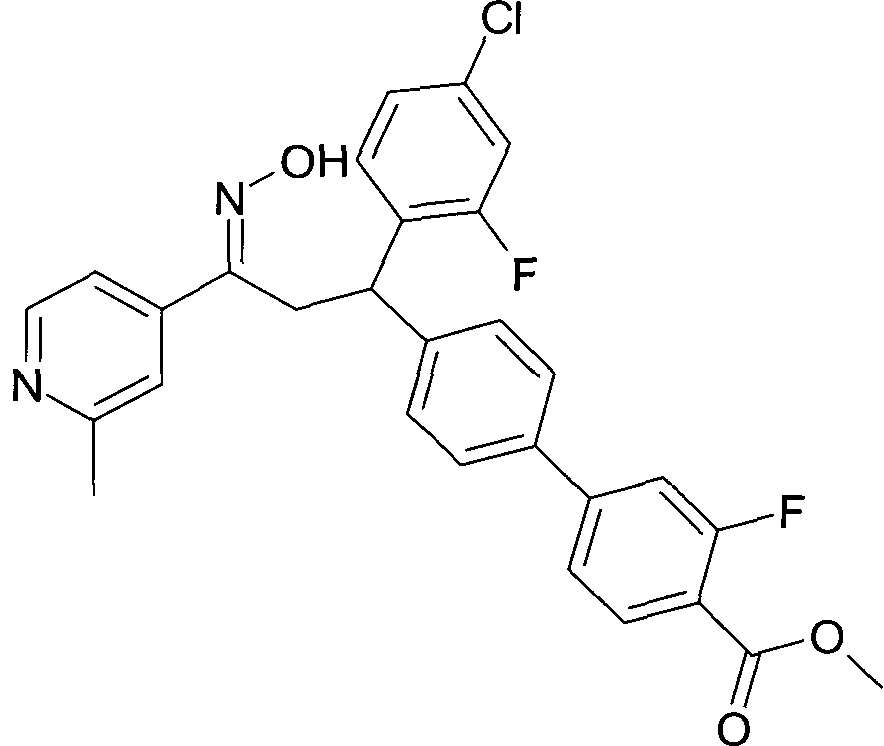
Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из (E)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксима (пример 147) и 3-фтор-4-метоксикарбонилфенил-бороновой кислоты (CAS RN 505083-04-5). Светло-желтый осадок. MS (ESI+): m/z=521.0 ([M+H]+).
Пример 447
4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота
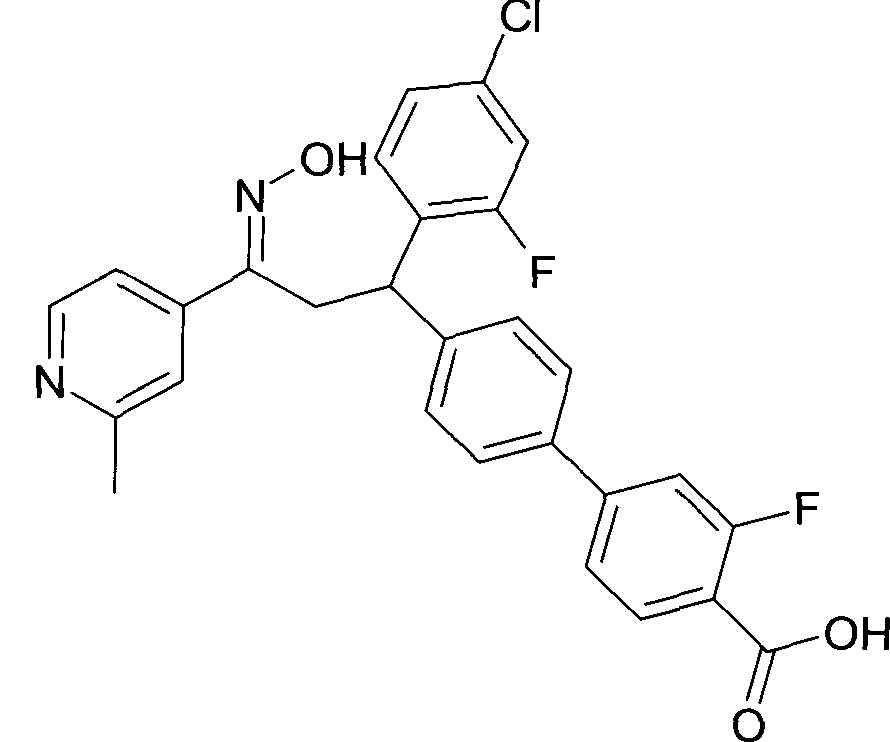
Соединение, указанное в заголовке, получили по аналогии с примером 425, стадия 3, из 4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-3-фтор-бифенил-4-карбоновой кислоты метилового эфира (пример 446). Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (1:9 до 0:1) с получением соединения, указанного в заголовке, в виде светло-желтого осадка. MS (ESI+): m/z=507.0 ([M+H]+).
Пример 448
4'-[(-)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота
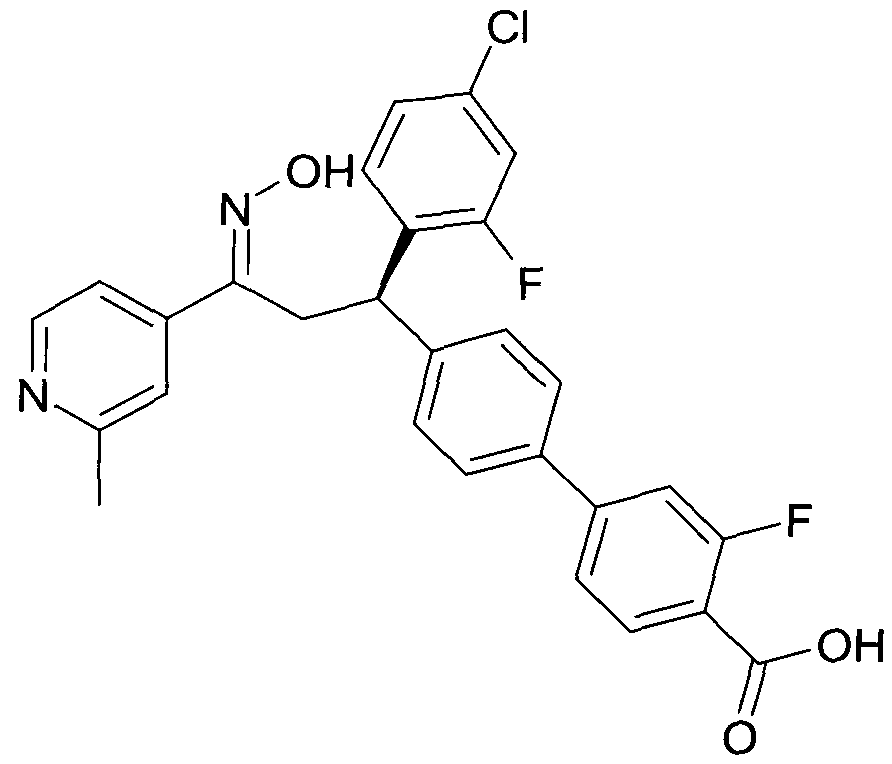
Стадия 1: (-)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-он и (+)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1 -он
Разделение 3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она (пример 147, стадия 4) с помощью хиральной ВЭЖХ (Reprosil Chiral NR, 10% изопропанол в n-гептане) дало (-)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-он в виде бесцветного масла, MS (ESI+): m/z=434.1 ([M+H]+) и (+)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-он в виде бесцветного масла, MS (ESI+): m/z=434.0 ([M+H]+).
Стадия 2: (-)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из (-)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (1:4 до 0:1) с получением соединения, указанного в заголовке, в виде белого осадка. MS (ESI+): m/z=449.0 ([M+H]+).
Стадия 3: 4'-(-)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил1-3-фтор-бифенил-4-карбоновая кислота
Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из (-)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксима и (3-фтор-4-карбоксифенил)бороновой кислоты (CAS RN 120153-08-4). Белый осадок. MS (ESI-): m/z=505.1 ([M-H]-).
Пример 449
4'-[(+)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота
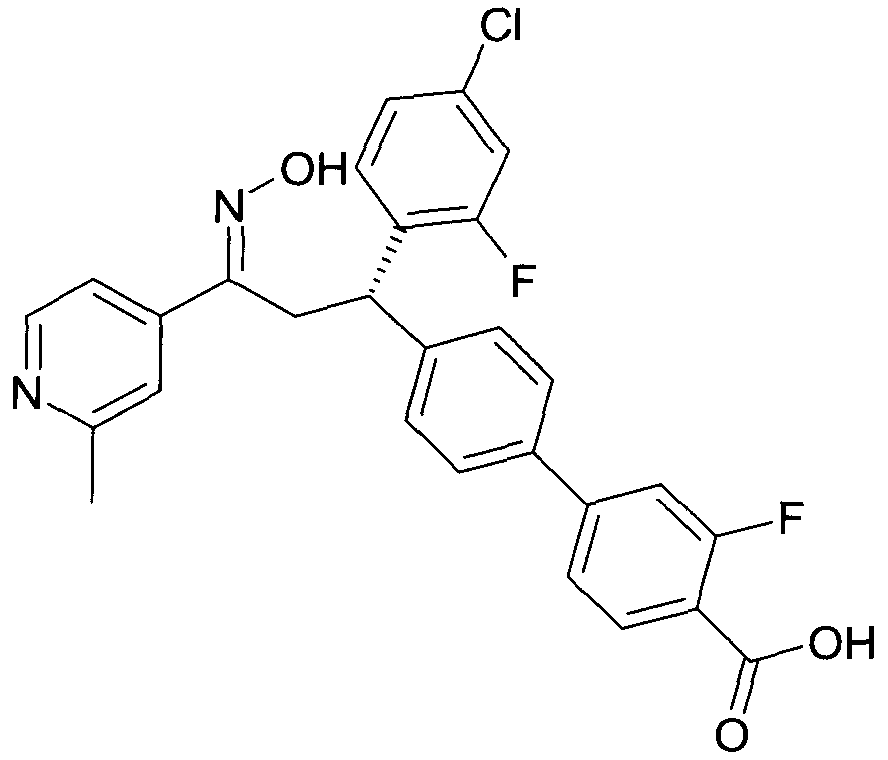
Стадия 1: (+)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим
Соединение, указанное в заголовке, получили по аналогии с примером 402, стадия 5, из (+)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она (пример 448, стадия 1) и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Соединение очистили посредством хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (1:4 до 0:1) с получением соединения, указанного в заголовке, в виде белого осадка. MS (ESI+): m/z=449.0 ([M+H]+).
Стадия 2: 4'-[(+)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота
Соединение, указанное в заголовке, получили по аналогии с 4'-[(-)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-3-фтор-бифенил-4-карбоновой кислотой (пример 448), заменив на стадии 2 (-)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим на (+)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим. Светло-желтый осадок. MS (ESI-): m/z=505.3 ([M-H]-).
Пример 450
3-хлор-4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновой кислоты метиловый эфир
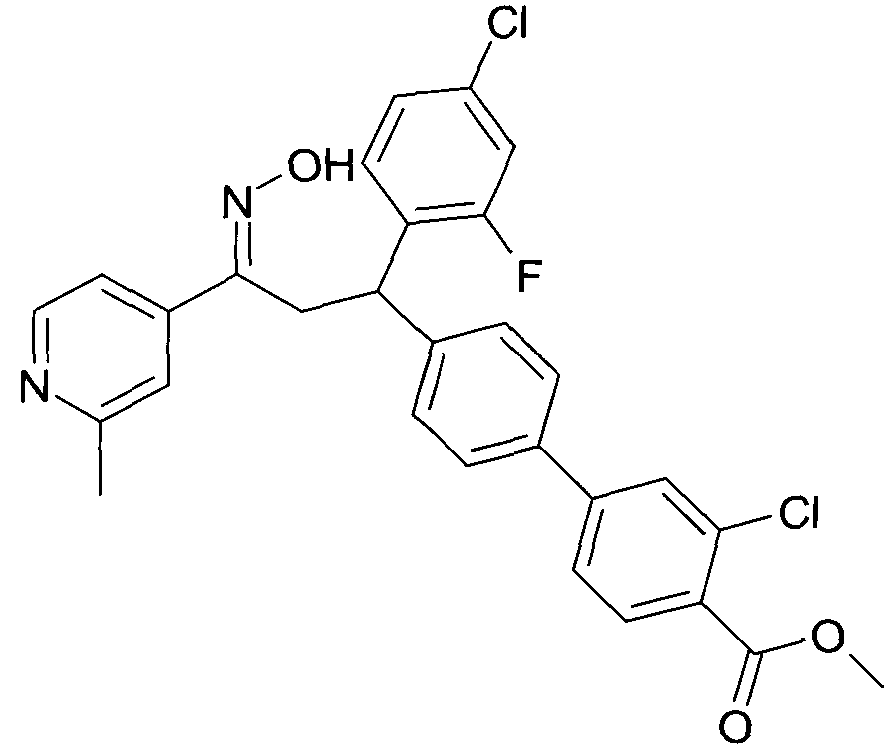
Соединение, указанное в заголовке, получили по аналогии с 4'-[1 -(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-3-фтор-бифенил-4-карбоновой кислоты метиловым эфиром (пример 446), заменив 3-фтор-4-метоксикарбонилфенилбороновую кислоту на 3-хлор-4-метоксикарбонилфенилбороновую кислоту (CAS RN 603122-82-3). Светло-желтый осадок. MS (ESI+): m/z=537.2 ([M+H]+).
Пример 451
3-хлор-4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота
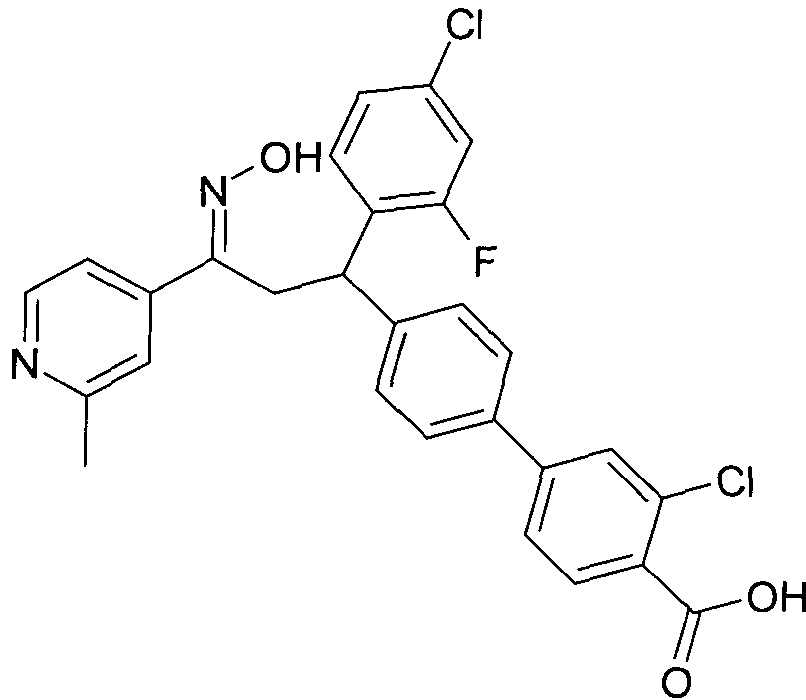
Соединение, указанное в заголовке, получили по аналогии с примером 425, стадия 3, из 3-хлор-4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновой кислоты метилового эфира (пример 450). Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (1:9 до 0:1), с получением соединения, указанного в заголовке, в виде серо-белого осадка. MS (ESI+): m/z=523.0 ([M+H]+).
Пример 452
(-)-3-хлор-4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота
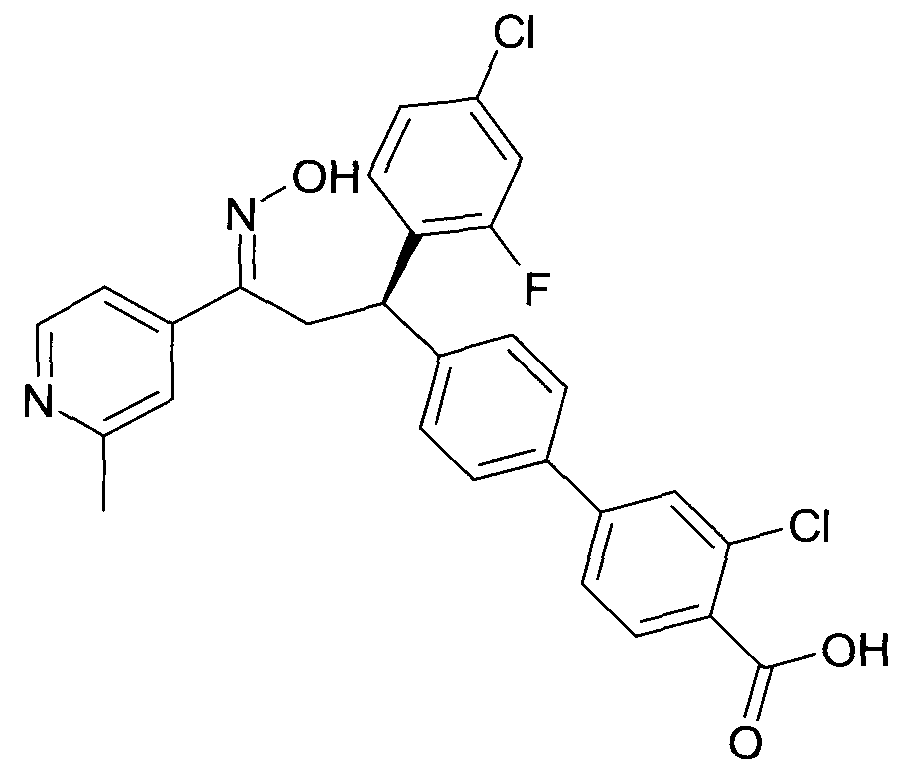
Стадия 1: 3-хлор-4'-[(-)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил1-бифенил-4-карбоновой кислоты метиловый эфир
Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из (-)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксима (пример 448, стадия 2) и 3-хлор-4-метоксикарбонилфенилбороновой кислоты (CAS RN 603122-82-3). Серо-белый осадок. MS (ESI+): m/z=537.3 ([M+H]+).
Стадия 2: (-)-3-хлор-4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота
Соединение, указанное в заголовке, получили по аналогии с примером 425, стадия 3, из 3-хлор-4'-[(-)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновой кислоты метилового эфира. Серо-белый осадок. MS (ESI-): m/z=521.2 ([M-H]-).
Пример 453
(+)-3-хлор-4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновая кислота
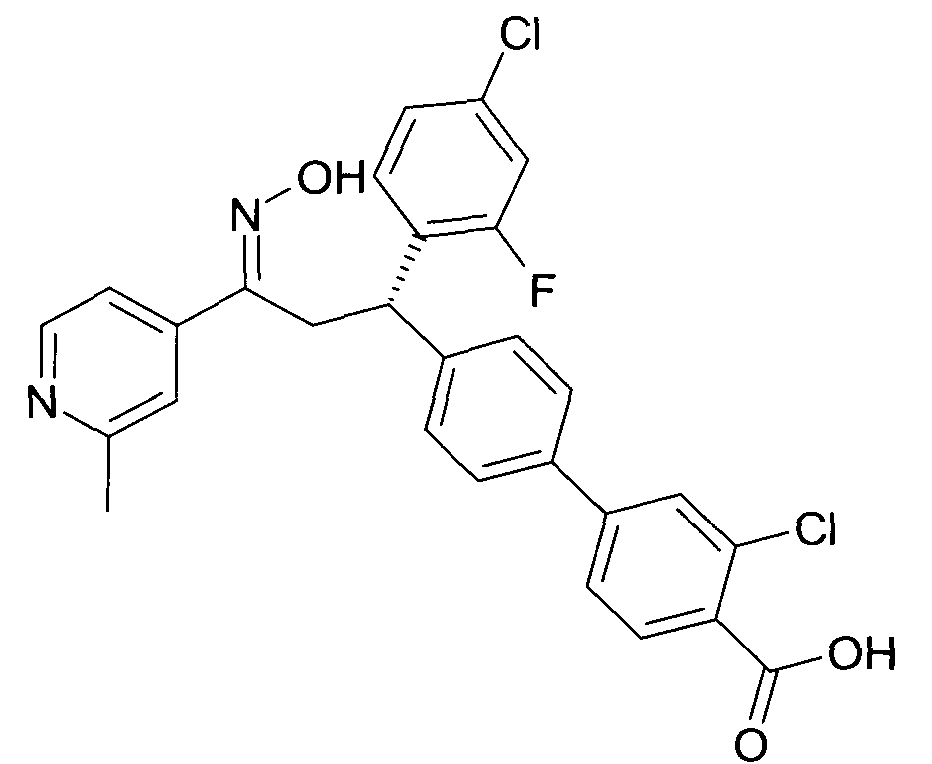
Соединение, указанное в заголовке, получили по аналогии с (-)-3-хлор-4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-бифенил-4-карбоновой кислотой (пример 452), заменив на стадии 1 (-)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим на (+)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксим (пример 449, стадия 1). Серо-белый осадок. MS (ESI-): m/z=521.0 ([M-H]-.
Пример 454
4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-3-метокси-бифенил-4-карбоновой кислоты метиловый эфир
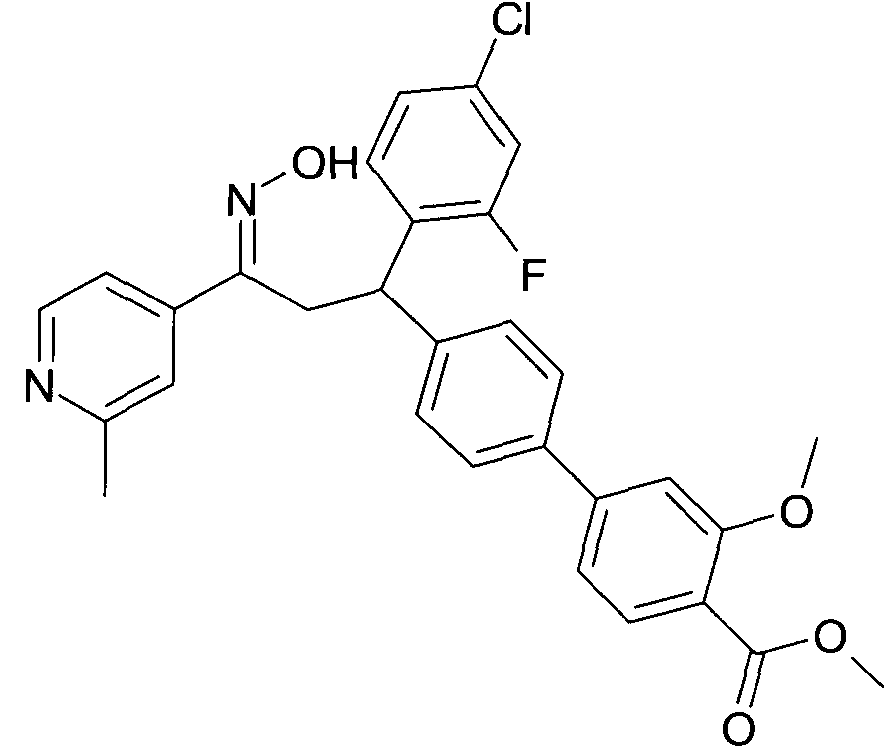
Соединение, указанное в заголовке, получили по аналогии с 4'-[1 -(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-3-фтор-бифенил-4-карбоновой кислоты метиловым эфиром (пример 446), заменив 3-фтор-4-метоксикарбонилфенилбороновую кислоту на 3-метокси-4-метоксикарбонилфенилбороновую кислоту (CAS RN 603122-41-4). Белый осадок. MS (ESI+): m/z=533.3 ([M+H]+).
Пример 455
4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-3-метокси-бифенил-4-карбоновая кислота
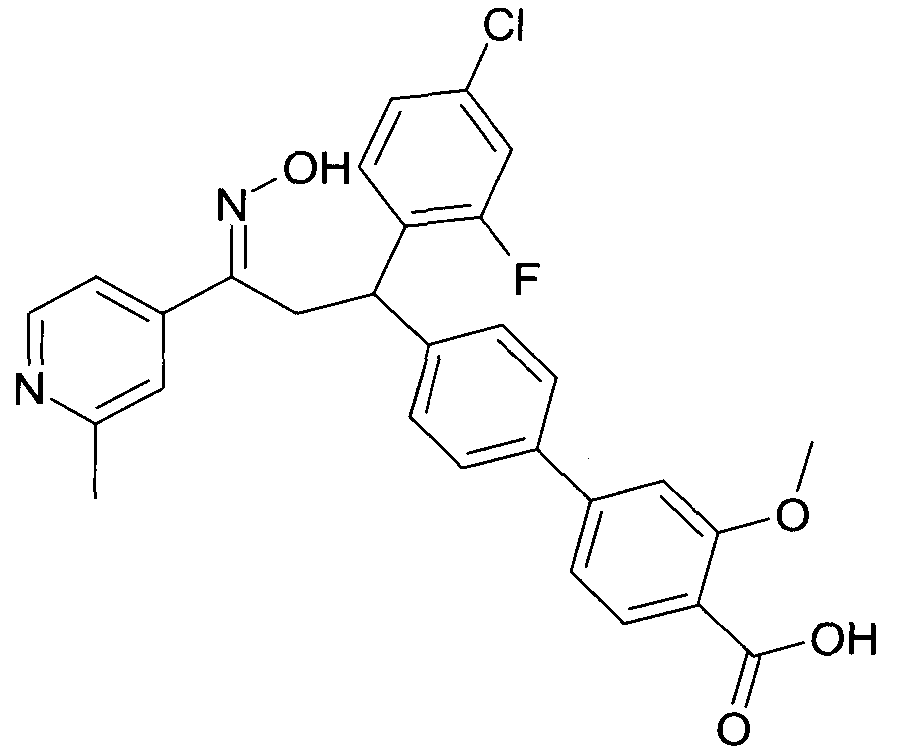
Соединение, указанное в заголовке, получили по аналогии с примером 425, стадия 3, из 4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-3-метокси-бифенил-4-карбоновой кислоты метилового эфира (пример 454). Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом n-гептан/этилацетат (1:9 до 0:1), с получением соединения, указанного в заголовке, в виде серо-белого осадка. MS (ESI+): m/z=519.0 ([M+H]+).
Пример 456
4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-2-метил-бифенил-4-карбоновая кислота
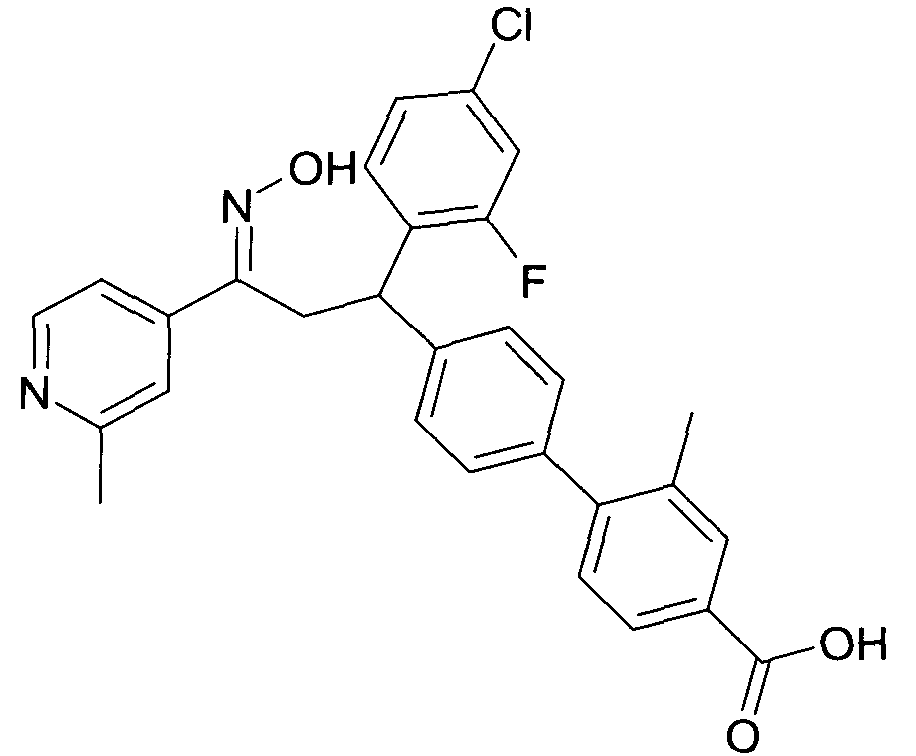
Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из (E)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксима (пример 147) и (2-метил-4-карбоксифенил)бороновой кислоты (CAS RN 158429-66-4). Светло-желтый осадок. MS (ESI+): m/z=503.3 ([M+H]+).
Пример 457
5-{4-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-тиофен-2-карбоновая кислота
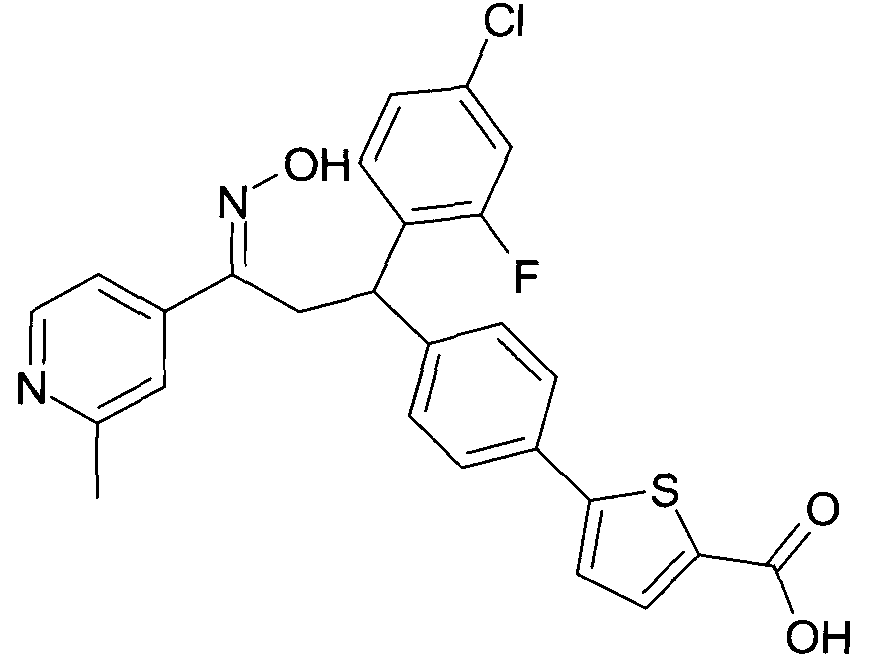
Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из (E)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксима (пример 147) и (5-карбокситиен-2-ил)бороновой кислоты (CAS RN 465515-31-5). Серо-белый осадок. MS (ESI+): m/z=495.0 ([M+H]+).
Пример 458
5-{4-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-пропил]-фенил}-1H-пиримидин-2,4-дион

Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из (E)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксима (пример 147) и урацил-5-бороновой кислоты (CAS RN 70523-22-7). Серо-белый осадок. MS (ESI+): m/z=479.0 ([M+H]+).
Пример 459
{4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}-ацетонитрил

Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из 5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-она (пример 237) и 4-(цианометил)фенилбороновой кислотой (CAS RN 91983-26-5). Серо-белый осадок. MS (ESI+): m/z=500.1 ([M+H]+).
Пример 460
{4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}-уксусная кислота
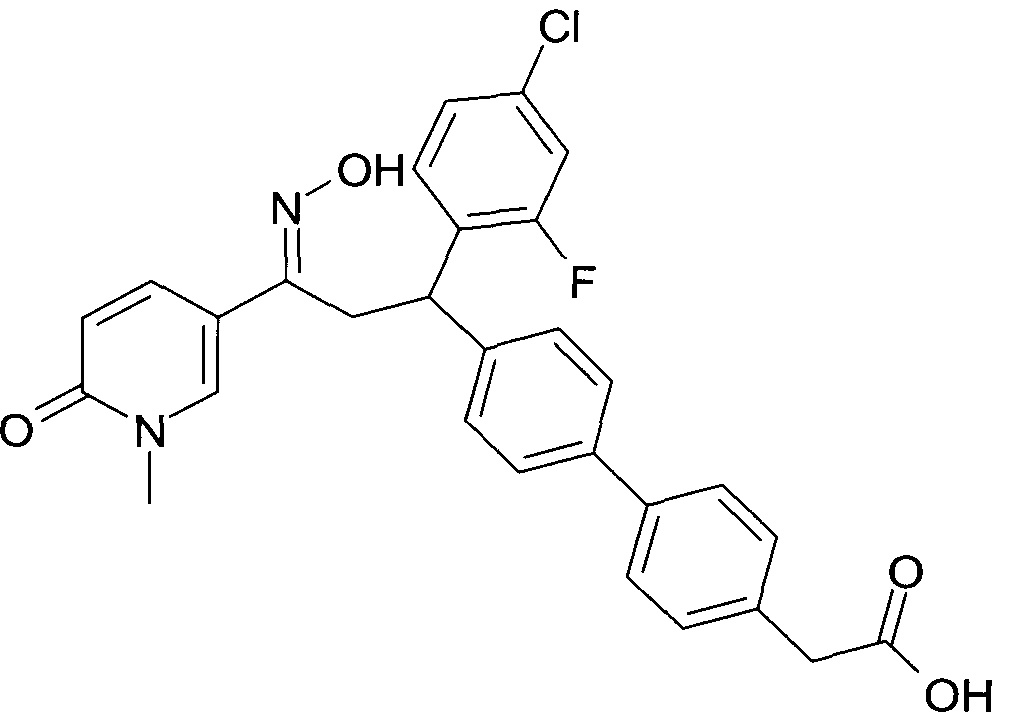
Соединение, указанное в заголовке, получили по аналогии с примером 425, стадия 3, из {4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}-ацетонитрила (пример 459). Серо-белый осадок. MS (ESI+): m/z=519.3 ([M+H]+).
Примеры 461 и 462
{4'-[(-)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}-уксусная кислота и {4'-[(+)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}-уксусная кислота
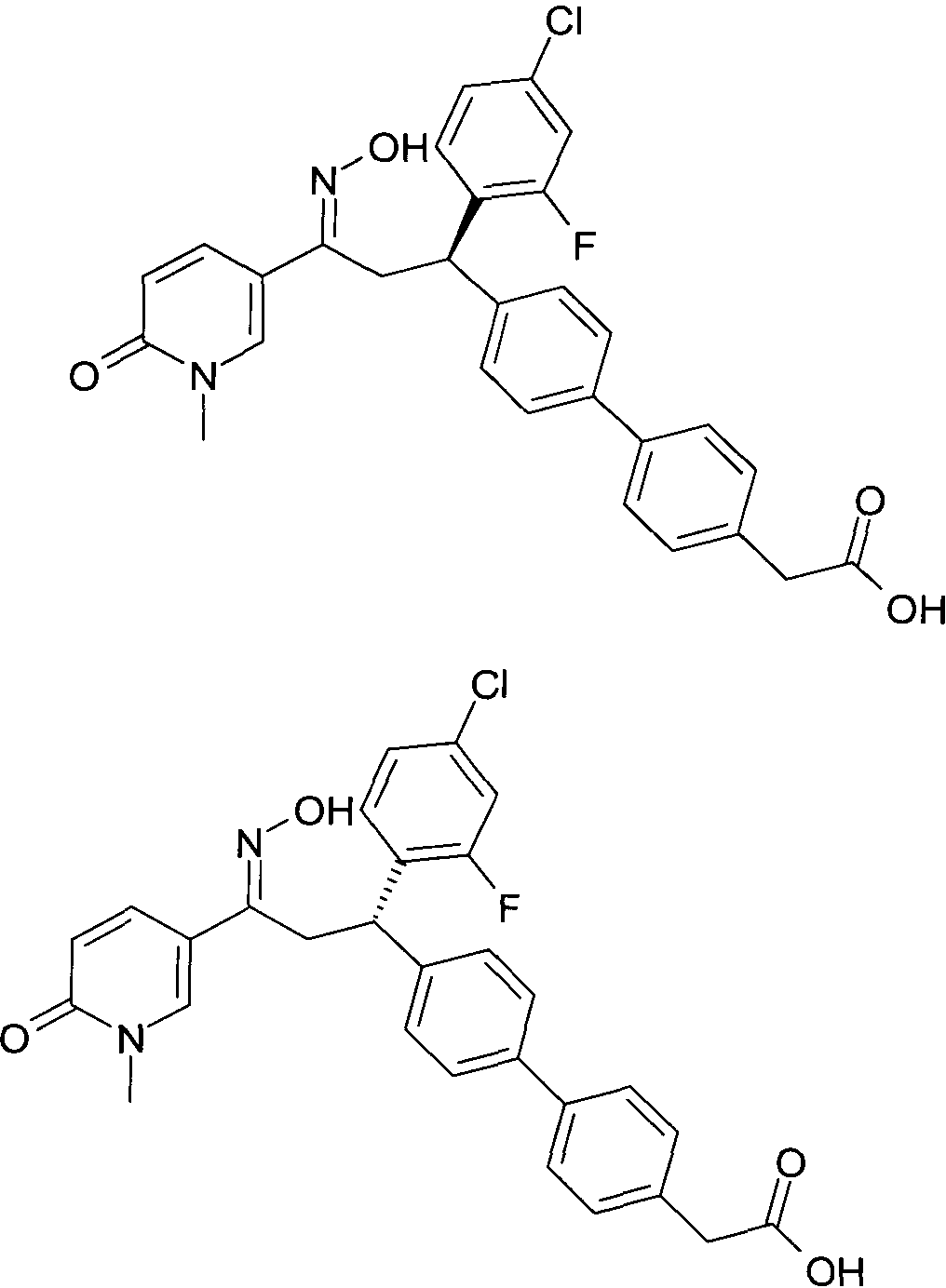
Разделение {4'-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}-уксусной кислоты (пример 460) с помощью хиральной ВЭЖХ (Chiralpak-AD, 30% этанол (+0.5% муравьиная кислота) в n-гептане) дала {4'-[(-)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}-уксусную кислоту в виде серо-белого осадка, MS (ESI+): m/z=519.3 ([M+H]+) и {4'-[(+)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-бифенил-4-ил}-уксусную кислоту в виде серо-белого осадка, MS (ESI+): m/z=519.5 ([M+H]+).
Пример 463
4'-[(-)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота
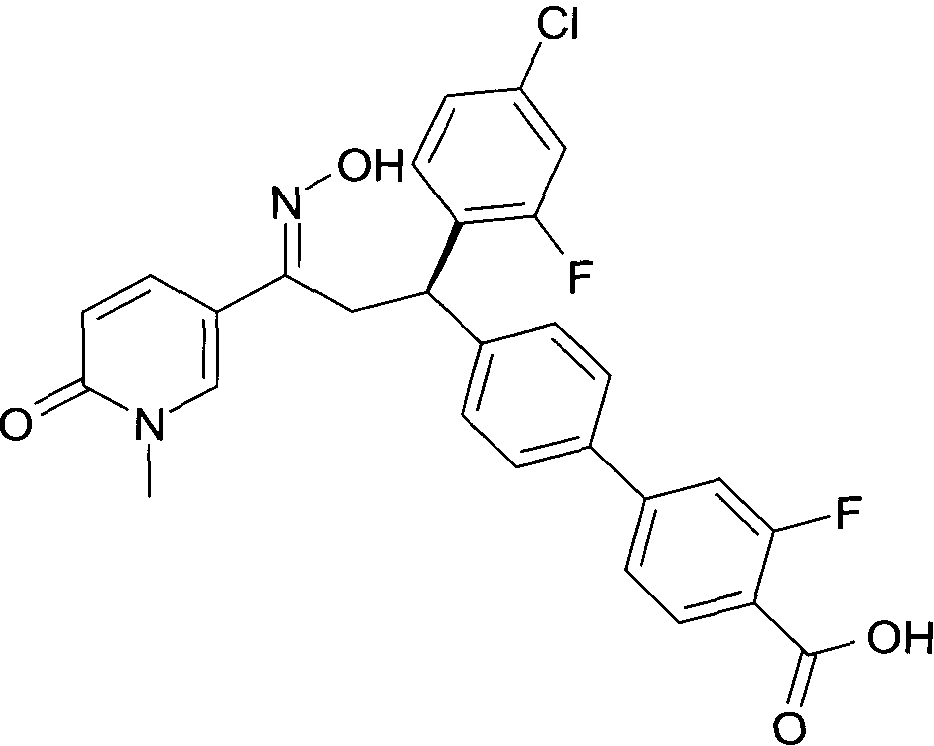
Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из (-)-5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-она (пример 240) и (3-фтор-4-карбоксифенил)бороновой кислоты (CAS RN 120153-08-4). Светло-желтый осадок. MS (ESI+): m/z=523.2 ([M+H]+).
Пример 464
4'-[(+)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота
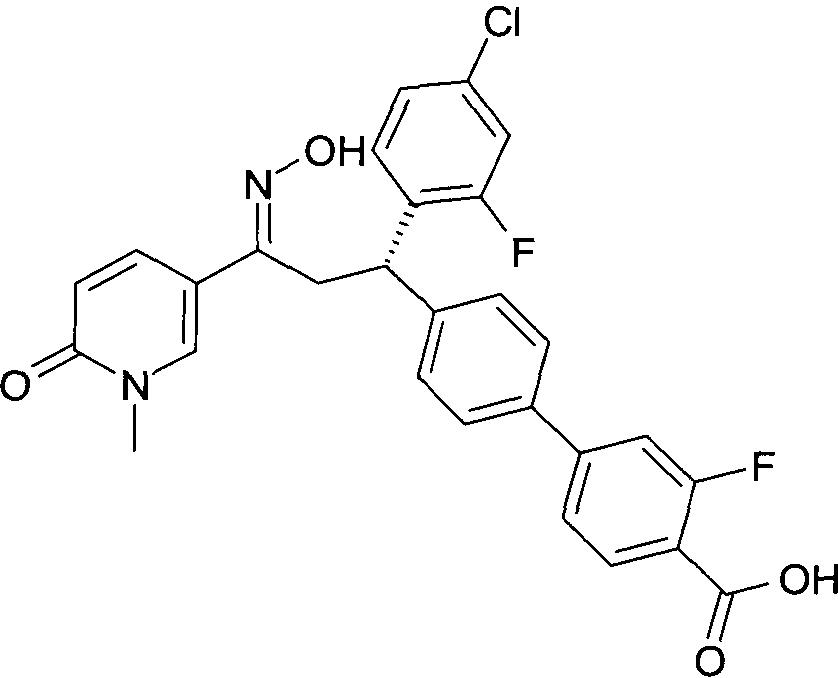
Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из (+)-5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-она (пример 239) и (3-фтор-4-карбоксифенил)бороновой кислоты (CAS RN 120153-08-4). Серо-белый осадок. MS (ESI+): m/z=523.3 ([M+H]+).
Пример 465
4'-[(-)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-метил-бифенил-4-карбоновая кислота
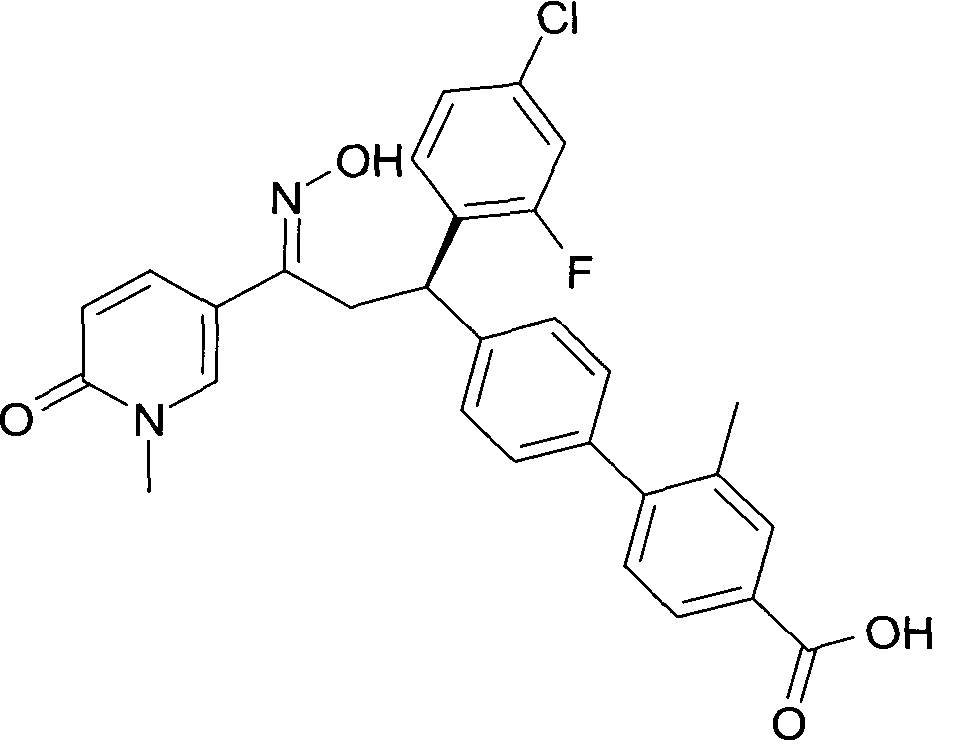
Соединение, указанное в заголовке, получили по аналогии с примером 372,
стадия 1, из (-)-5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-она (пример 240) и (2-метил-4-карбоксифенил)бороновой кислоты (CAS RN 158429-66-4). Светло-желтый осадок. MS (ESI+): m/z=519.5 ([M+H]+).
Пример 466
4'-[(+)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-метил-бифенил-4-карбоновая кислота
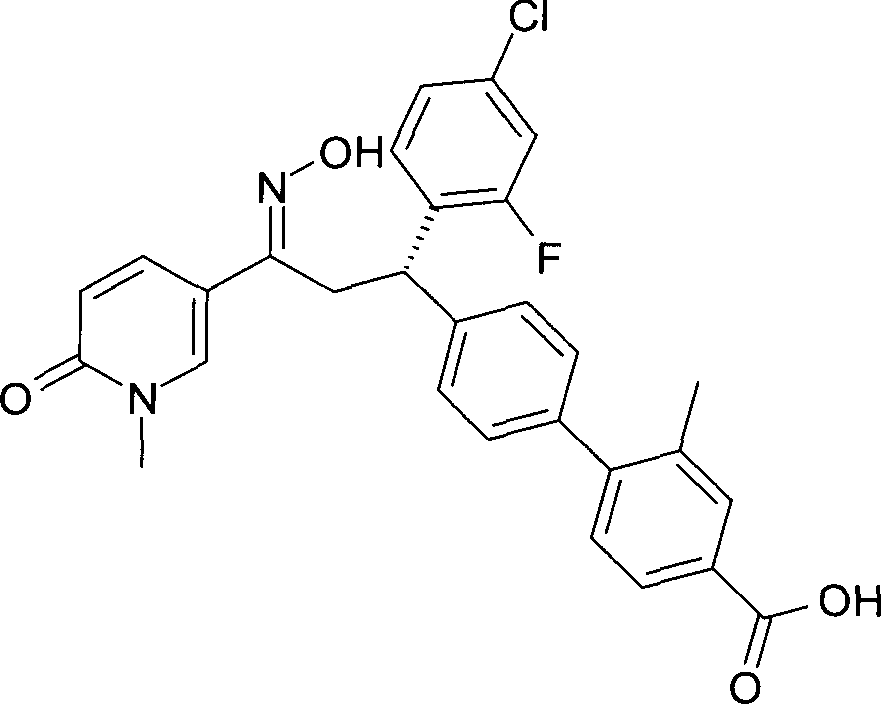
Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из (+)-5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-она (пример 239) и (2-метил-4-карбоксифенил)бороновой кислоты (CAS RN 158429-66-4). Светло-желтый осадок. MS (ESI+): m/z=519.0 ([M+H]+).
Пример 467
5-{4-[(-)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенил}-тиофен-2-карбоновой кислоты этиловый эфир
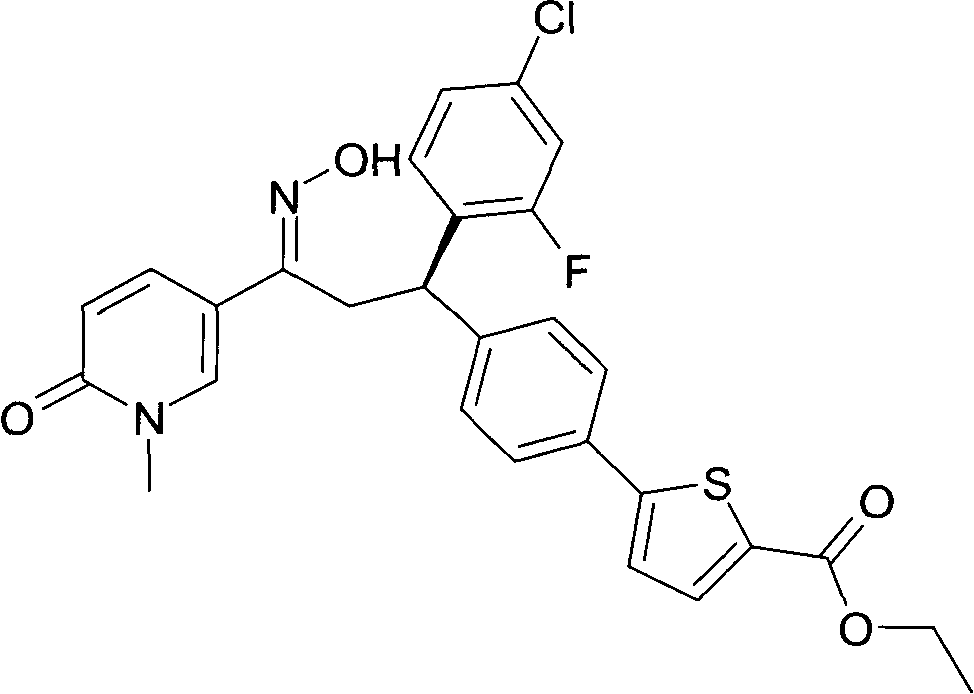
Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из (-)-5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-она (пример 240) и 5-(этоксикарбонил)тиофен-3-бороновой кислоты (CAS RN 957121-19-6). Светло-коричневый осадок. MS (ESI+): m/z=539.3 ([M+H]+).
Пример 468
5-{4-[(-)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенил}-тиофен-2-карбоновая кислота
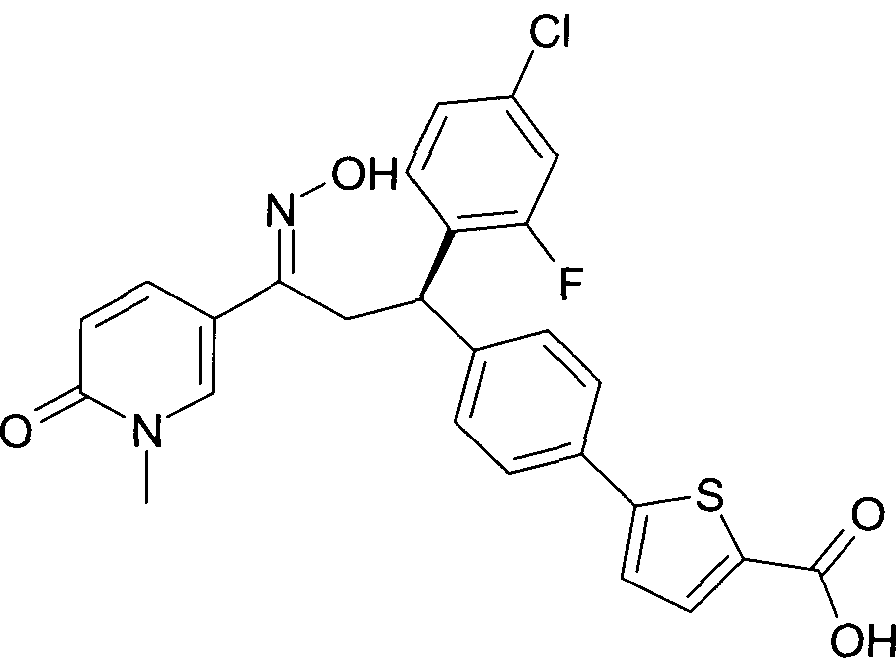
Соединение, указанное в заголовке, получили по аналогии с примером 425, стадия 3, из 5-{4-[(-)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенил}-тиофен-2-карбоновой кислоты этилового эфира (пример 467). Серо-белый осадок. MS (ESI+): m/z=511.1 ([M+H]+).
Пример 469
5-{4-[(+)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенил}-тиофен-2-карбоновой кислоты этиловый эфир
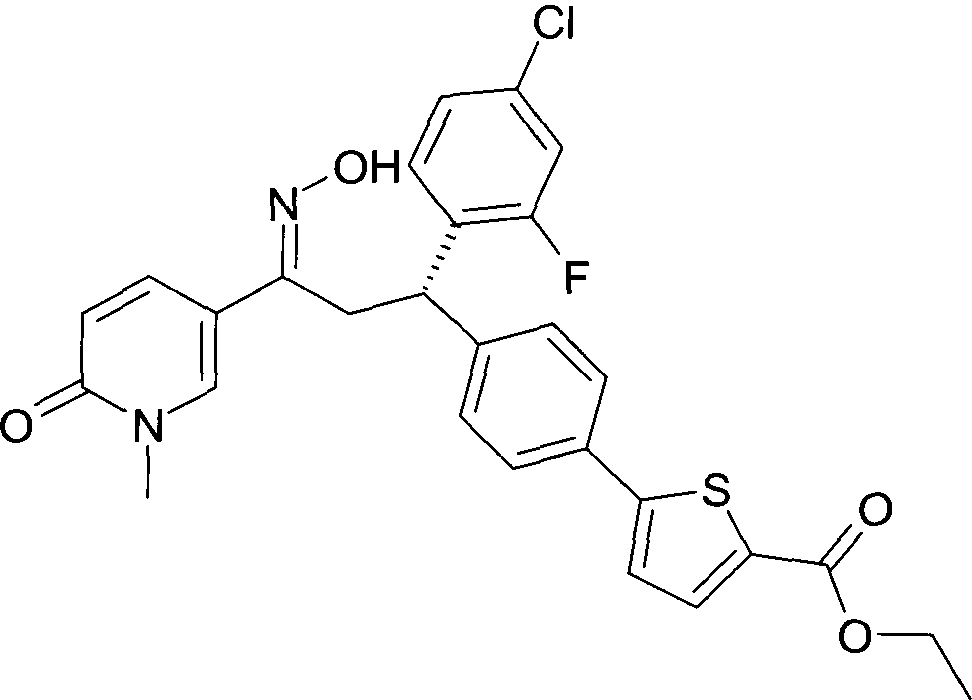
Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из (+)-5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1R-пиридин-2-она (пример 239) и 5-(этоксикарбонил)тиофен-3-бороновой кислоты (CAS RN 957121-19-6). Светло-коричневый осадок. MS (ESI+): m/z=539.3 ([M+H]+).
Пример 470
5-{4-[(+)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенил}-тиофен-2-карбоновая кислота
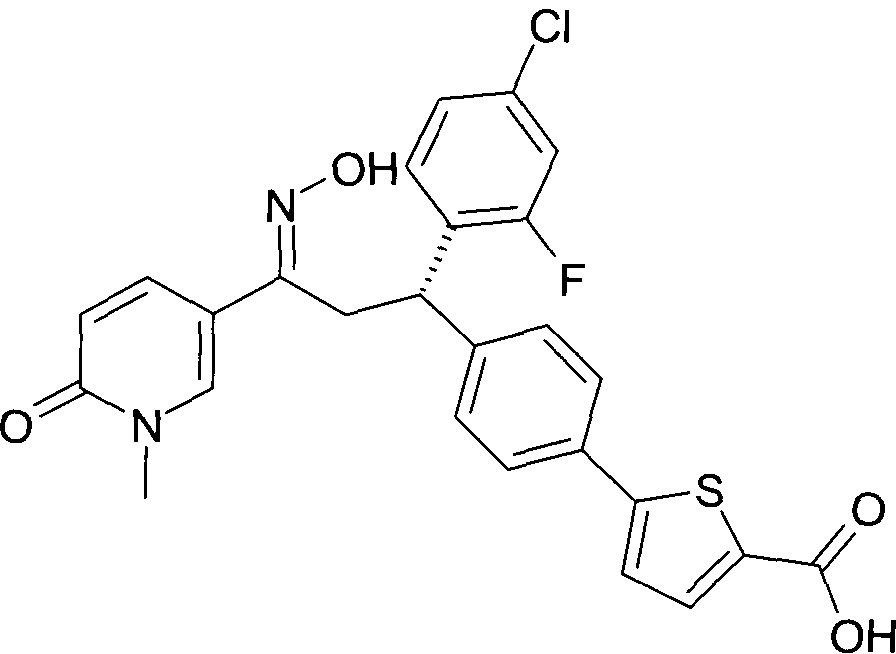
Соединение, указанное в заголовке, получили по аналогии с примером 425, стадия 3, из 5-{4-[(+)-1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенил}-тиофен-2-карбоновой кислоты этилового эфира (пример 469). Серо-белый осадок. MS (ESI+): m/z=511.0 ([M+H]+).
Пример 471
5-{4-[1-(4-хлор-2-фтор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-фенил}-1H-пиримидин-2,4-дион
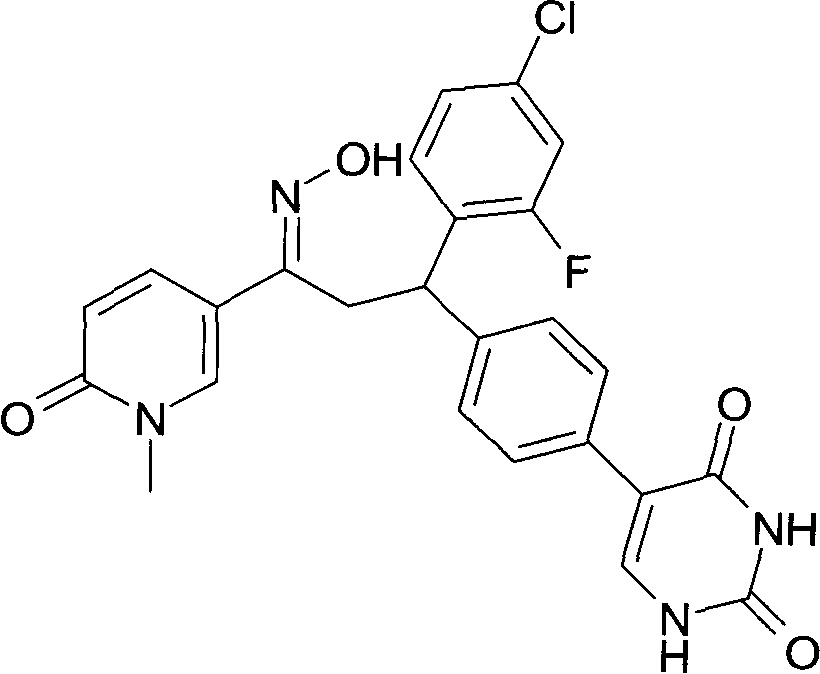
Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из 5-{3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-она (пример 237) и урацил-5-бороновой кислоты (CAS RN 70523-22-7). Серо-белый осадок. MS (ESI+): m/z=495.3 ([M+H]+).
Пример 472
5-{3-(4-бром-фенил)-3-(2,4-дихлор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-он
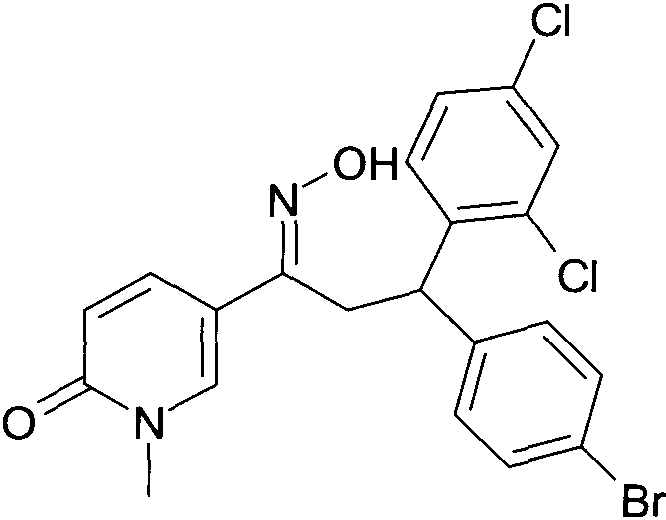
Соединение, указанное в заголовке, получили по аналогии с (E)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксимом (пример 147), заменив на стадии 3 4-хлор-2-фторбензальдегид на 2,4-дихлор-бензальдегид (CAS RN 874-42-0). Белая пена. MS (ESI-): m/z=478.9 ([M-H]-).
Пример 473
4'-[1-(2,4-Дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота
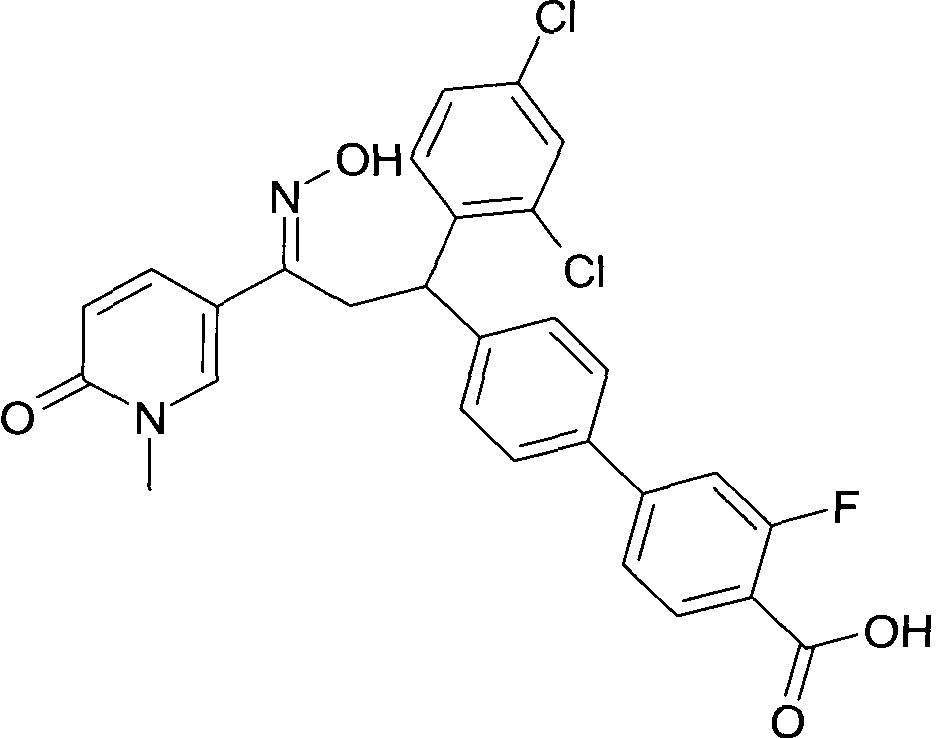
Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из 5-{3-(4-бром-фенил)-3-(2,4-дихлор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-она (пример 472) и (3-фтор-4-карбоксифенил)бороновой кислоты (CAS RN 120153-08-4). Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом дихлорметан (+2% муравьиная кислота)/метанол (100:0 до 95:5) с получением соединения, указанного в заголовке, в виде серо-белого осадка. MS (ESI+): m/z=539.3 ([M+H]+).
Примеры 474 и 475
4'-[(-)-1-(2,4-дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота и 4'-[(+)-1-(2,4-дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновая кислота
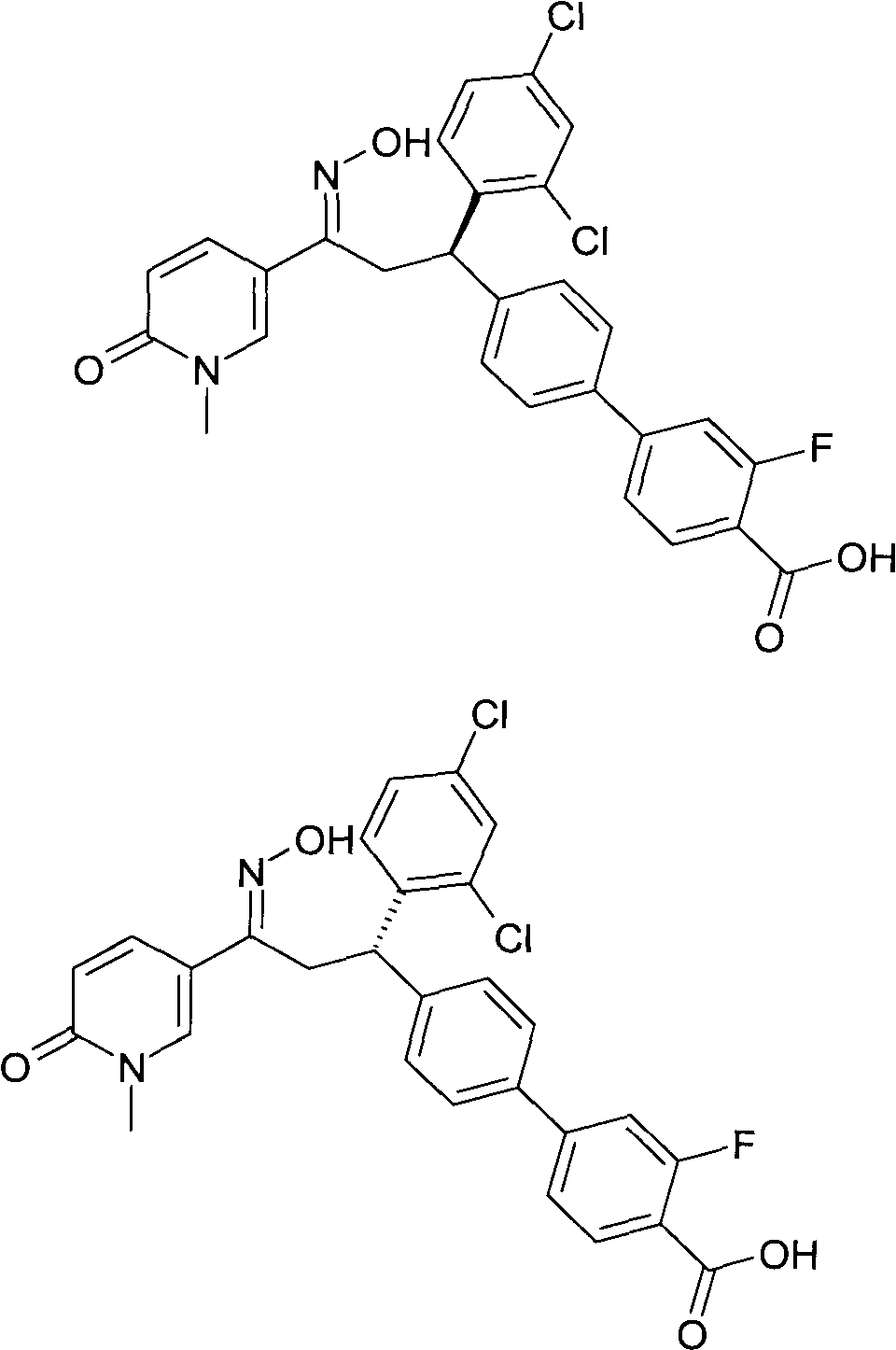
Разделение 4'-[1-(2,4-дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновой кислоты (пример 473) с помощью хиральной ВЭЖХ (Chiralpak-AD, 20% этанол (+0.5% муравьиной кислоты) в n-гептане) дало 4'-[(-)-1-(2,4-дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновую кислоту в виде светло-желтого осадка, MS (ESI+): m/z=539.3 ([M+H]+) и 4'-[(+)-1-(2,4-дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-3-фтор-бифенил-4-карбоновую кислоту в виде светло-желтого осадка, MS (ESI+): m/z=539.3 ([M+H]+).
Пример 476
4'-[1-(2,4-дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-метил-бифенил-4-карбоновая кислота
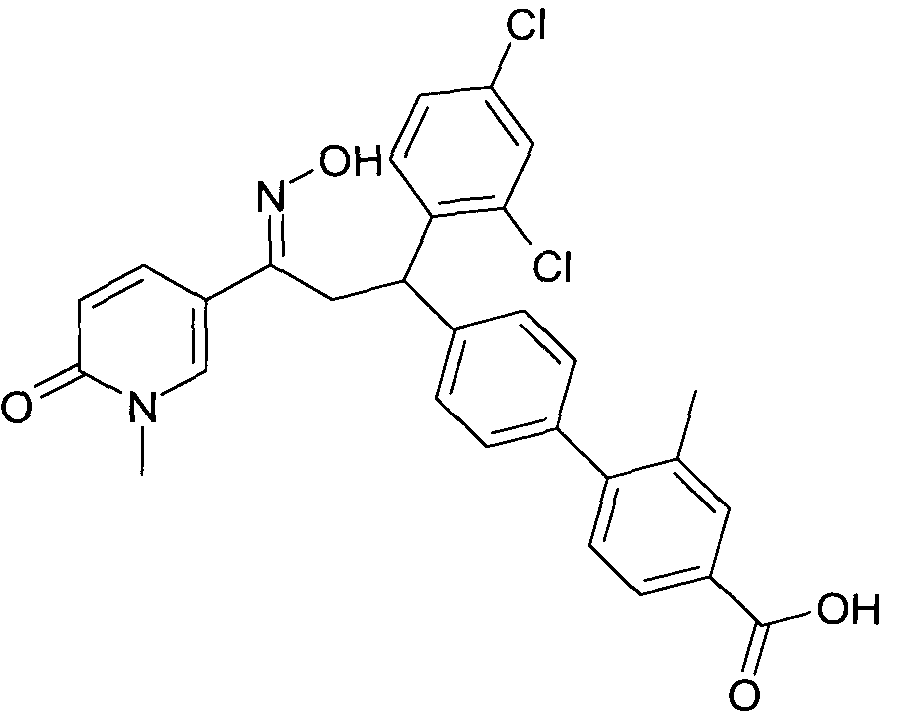
Соединение, указанное в заголовке, получили по аналогии с примером 372, стадия 1, из 5-{3-(4-бром-фенил)-3-(2,4-дихлор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1H-пиридин-2-она (пример 472) и (2-метил-4-карбоксифенил)бороновой кислоты (CAS RN 158429-66-4). Неочищенный реакционный продукт очистили с помощью хроматографии на силикагеле, используя систему ЖХСД (CombiFlash Companion, Isco Inc.) с элюцией градиентом дихлорметан (+2% муравьиная кислота)/метанол (100:0 до 95:5), с получением соединения, указанного в заголовке, в виде серо-белого осадка. MS (ESI+): m/z=535.2 ([M+H]+).
Примеры 477 и 478
4'-[(-)-1-(2,4-дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-метил-бифенил-4-карбоновая кислота и 4'-[(+)-1-(2,4-дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-метил-бифенил-4-карбоновая кислота
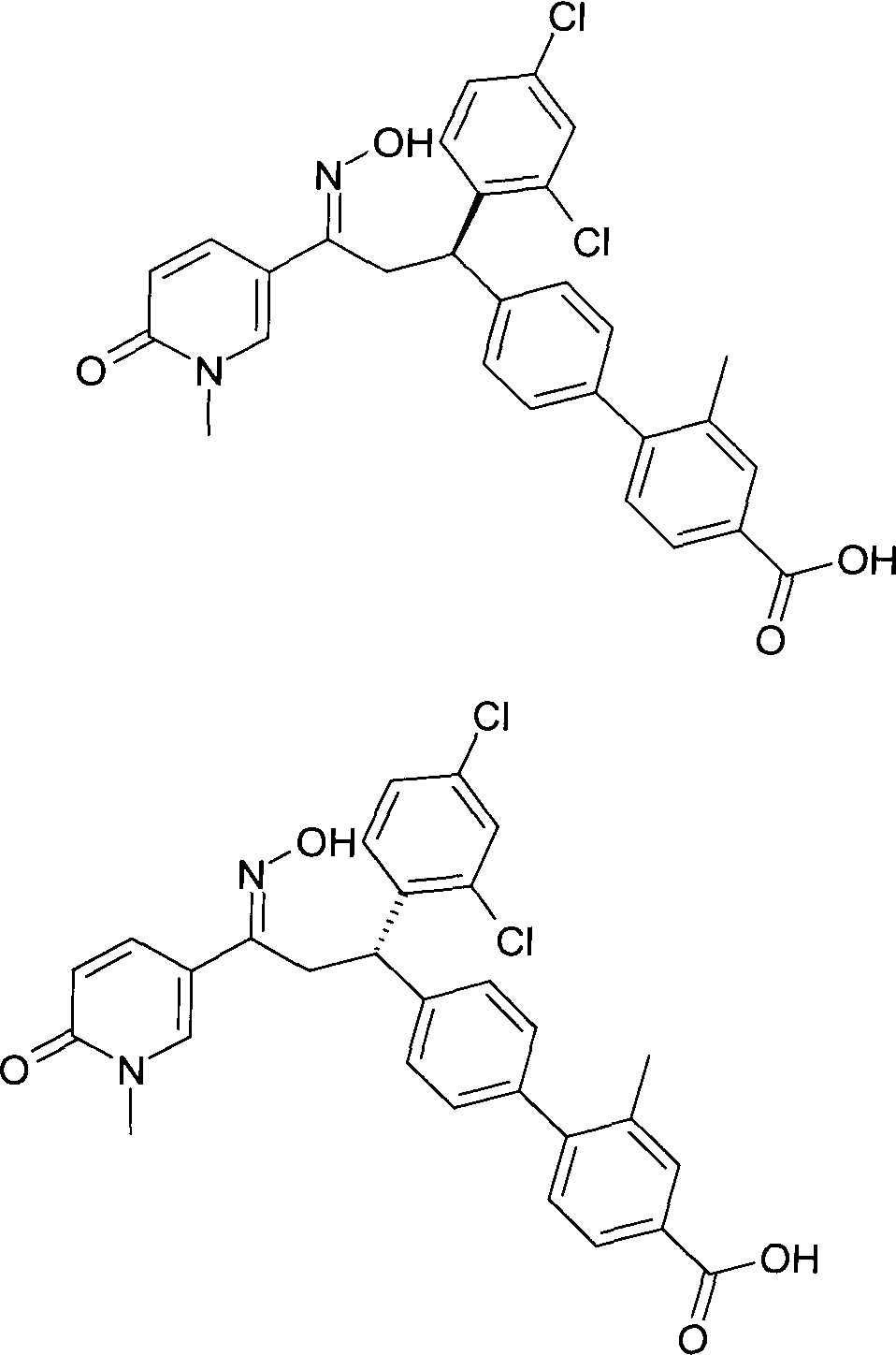
Разделение 4'-[1-(2,4-дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-метил-бифенил-4-карбоновой кислоты (пример 476) с помощью хиральной ВЭЖХ (Chiralpak-AD, 20% этанол (+0.5% муравьиная кислота) в л-гептане) дало 4'-[(-)-1-(2,4-дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-метил-бифенил-4-карбоновую кислоту в виде светло-желтого осадка, MS (ESI+): m/z=535.2 ([M+H]+) и 4'-[(+)-1-(2,4-дихлор-фенил)-3-[(E)-гидроксиимино]-3-(1-метил-6-оксо-1,6-дигидро-пиридин-3-ил)-пропил]-2-метил-бифенил-4-карбоновую кислоту в виде светло-желтого осадка, MS (ESI+): m/z=535.2 ([M+H]+).
Пример 479
5-{3-(4-бром-фенил)-3-(4-фтор-фенил)-1-[(E)-гидроксиимино]-пропил}-1-метил-1R-пиридин-2-он
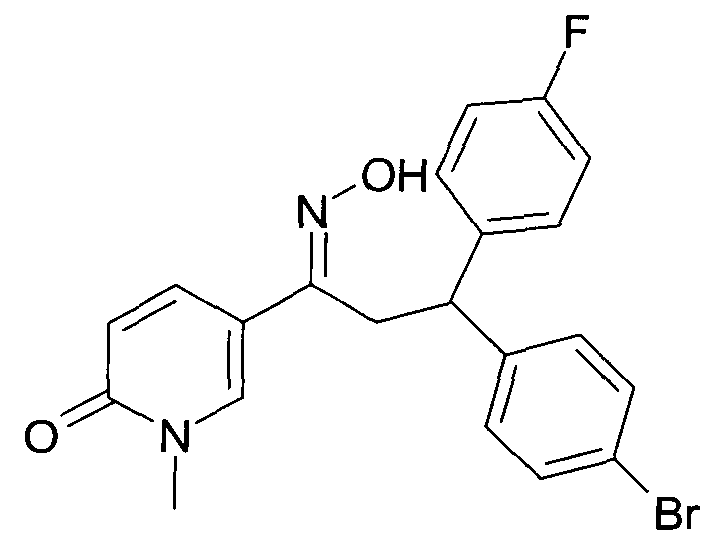
Соединение, указанное в заголовке, получили по аналогии с (E)-3-(4-бром-фенил)-3-(4-хлор-2-фтор-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она оксимом (пример 147), заменив на стадии 3 4-хлор-2-фторбензальдегид на 4-фтор-бензальдегид (CAS RN 459-57-4). Светло-желтый осадок. MS (ESI+): m/z=431.1 ([M+H]+).
Пример 480
(R,E)-4-(4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)пиперидин-1-сульфонамид
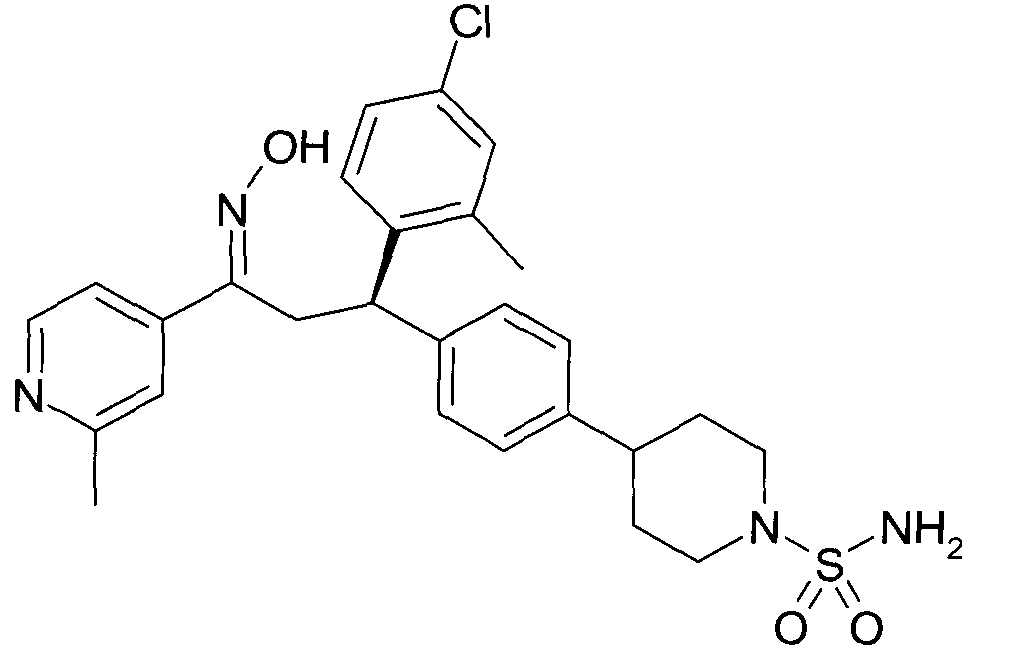
Стадия 1: (R)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)-3-(4-(пиперидин-4-ил)фенил)пропан-1-он
Раствор соляной кислоты (4M в 1,4-диоксане, 0.66 мл, 2.6 ммоль) добавили к раствору (R)-трет-бутил 4-(4-(1-(4-хлор-2-метилфенил)-3-(2-метилпиридин-4-ил)-3-оксопропил)фенил)пиперидин-1-карбоксилата (пример 387, стадия 1; 140 мг, 263 мкмоль) в этаноле (4 мл) с получением бесцветного раствора, затем через 20 ч реакционную смесь разделили между нас.водн. раствором бикарбоната натрия и этилацетатом. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и выпарили с получением соединения, указанного в заголовке, (123 мг), которое использовали без дополнительной очистки. Серо-белая пена, MS (ESI+): m/z=433.1 ([M+H]+).
Стадия 2: (R)-4-(4-(1-(4-хлор-2-метилфенил)-3-(2-метилпиридин-4-ил)-3-оксопропил)фенил)пиперидин-1-сульфонамид
Раствор (R)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)-3-(4-(пиперидин-4-ил)фенил)пропан-1-она (60 мг, 0.14 ммоль) и сульфамида (20 мг, 0.21 ммоль) в 1,4-диоксане (5 мл) перемешивали в течение 17 ч при 108°C, затем разделили между нас.водн. раствором хлорида аммония и этилацетатом. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали, и выпарили. Флеш хроматография (силикагель, 50% до 100% EtOAc в гептане) дала соединение, указанное в заголовке (59 мг, 83%). Белая пена, MS (ESI+): m/z=512.3 ([M+H]+).
Стадия 3: (R,E)-4-(4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)пиперидин-1-сульфонамид
По аналогии с примером 1, стадия 2, из (R)-4-(4-(1-(4-хлор-2-метилфенил)-3-(2-метилпиридин-4-ил)-3-оксопропил)фенил)пиперидин-1-сульфонамида и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=527.3 ([M+H]+).
Пример 481
(R,E)-трет-бутил 3-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)азетидин-1-карбоксилат
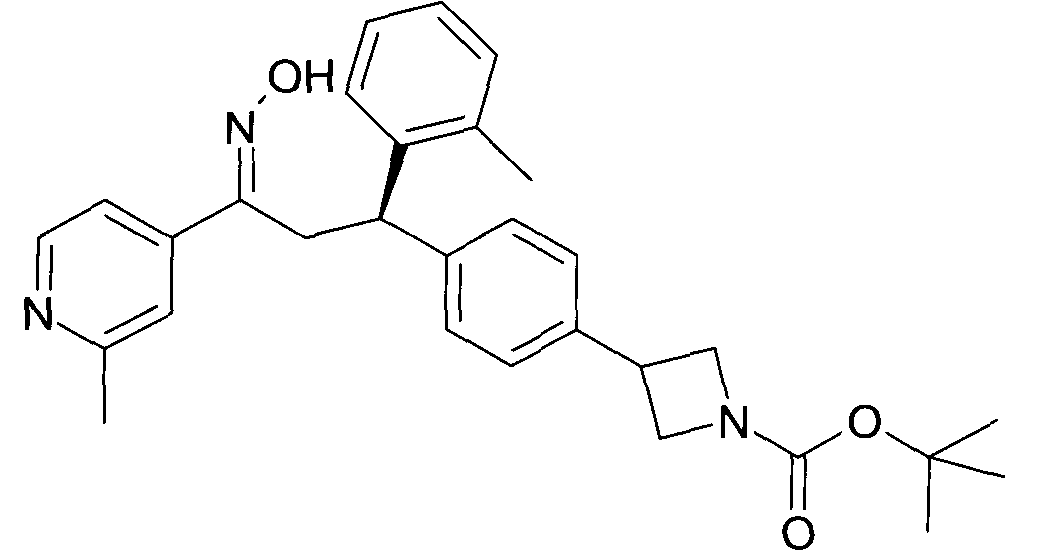
Стадия 1: (1-(трет-бутоксикарбонил)азетидин-3-ил)цинка(II)йодид К суспензии цинковой пыли (390 мг, 5.5 ммоль) в N,N-диметилацетамиде (3 мл) добавили раствор хлортриметилсилана (70 мкл) и 1,2-дибромэтана (48 мкл) в N,N-диметилацетамиде (1.5 мл) со скоростью, сохраняющей температуру в пределах 45-65°C. Получившуюся суспензию выдержали в течение 15 минут, затем медленно добавили раствор 3-йодо-азетидин-1-карбоновой кислоты трет-бутилового эфира (1.42 г, 5.0 ммоль) в N,N-диметилацетамиде (5.5 мл) к смеси, описанной выше со скоростью, сохраняющей температуру ниже 40°C. Получившуюся реакционную смесь выдержали в течении 30 мин при комнатной температуре, затем поместили супернатант в высушенную огнем колбу с получением соединения, указанного в заголовке, в виде 0.5 М раствора.
Стадия 2: (R)-трет-бутил 3-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)азетидин-1-карбоксилат
Соединение, указанное в заголовке, получили по аналогии с примером 378, стадия 1, из (R)-3-(4-бромфенил)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она (пример 282, стадия 1) и (1-(трет-бутоксикарбонил)азетидин-3-ил)цинка(II)йодида. Светло-коричневая пена, MS (ESI+): m/z=471.1 ([M+H]+).
Стадия 3: (R,E)-трет-бутил 3-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)азетидин-1-карбоксилат
По аналогии с примером 1, стадия 2, из (R)-трет-бутил 3-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)азетидин-1-карбоксилата и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=486.3 ([M+H]+).
Пример 482
(R,E)-3-(4-(Азетидин-3-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим
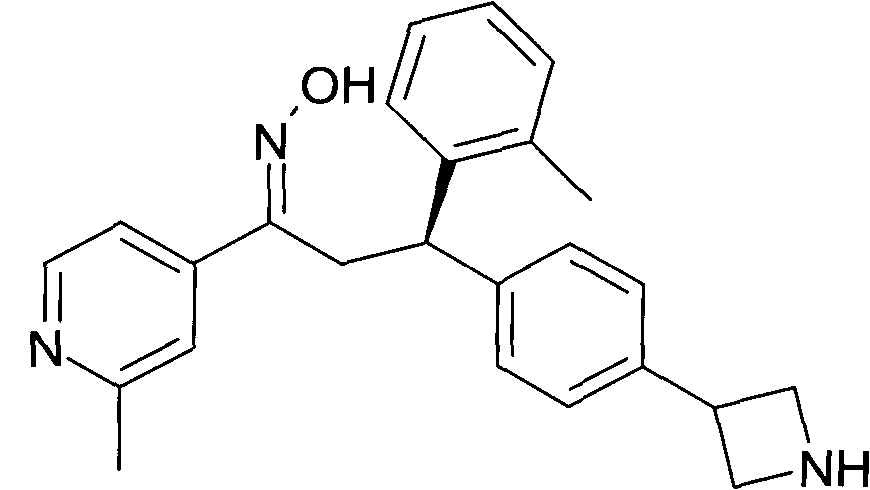
Стадия 1: (R)-3-(4-(Азетидин-3-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-он
Трифторуксусную кислоту (1.37 г, 927 мкл, 12.0 ммоль) добавили при 0°C к раствору (R)-трет-бутил 3-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)азетидин-1-карбоксилата (283 мг, 601 мкмоль, Eq: 1.00) в дихлорметане (2 мл). Ванну со льдом удалили, затем через 2 ч реакционную смесь разделили между нас.водн. раствором бикарбоната натрия и дихлорметаном. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и выпарили с получением соединения, указанного в заголовке, (258 мг, чистота 85%), которое использовали на следующей стадии без очистки. Серо-белая пена, MS (ESI+): m/z=371.0 ([M+H]+).
Стадия 2: (R,E)-3-(4-(Азетидин-3-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она оксим
По аналогии с примером 1, стадия 2, из (R)-3-(4-(азетидин-3-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=386.0 ([M+H]+).
Пример 483
(R,E)-1-(3-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)азетидин-1-ил)этанон
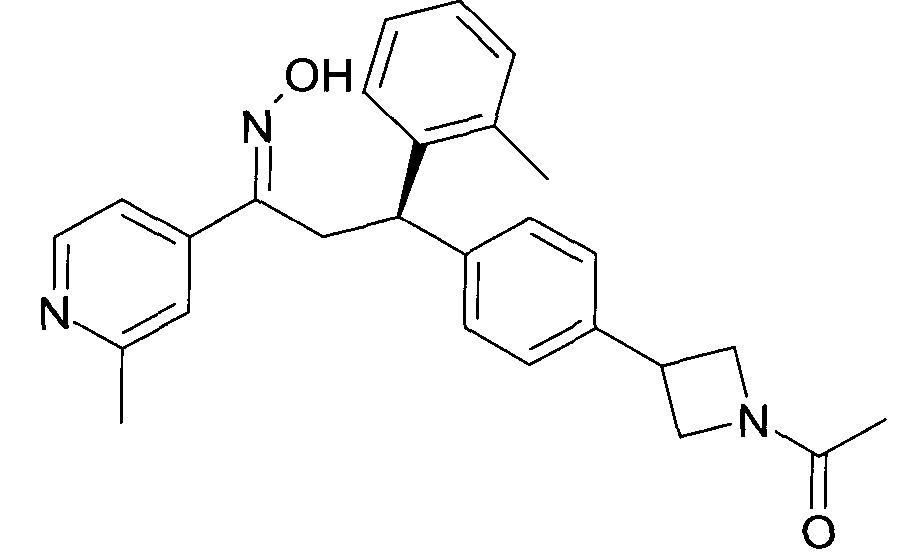
Стадия 1: (R)-3-(4-(1-Ацетилазетидин-3-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1 -он
Ацетилхлорид (30 мг) добавили при комнатной температуре к раствору (R)-3-(4-(азетидин-3-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она (пример 482, стадия 1; 70 мг) и N,N-диизопропилэтиламина (98 мг) в дихлорметане (4 мл), затем через 2 ч реакционную смесь разделили между нас.водн. раствором бикарбоната натрия и дихлорметаном. Органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и выпарили. Флеш хроматография (силикагель, 10 г, от 2% до 5% метанол в дихлорметане) дала соединение, указанное в заголовке (19 мг). Бесцветное масло, MS (ESI+): m/z=413.0 [M+H]+.
Стадия 2: (R,E)-1-(3-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)азетидин-1-ил)этанон
По аналогии с примером 1, стадия 2, из (R)-3-(4-(1-ацетилазетидин-3-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=428.1 ([M+H]+).
Пример 484
(R,E)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)азетидин-3-ил)фенил)-3-о-толилпропан-1-она оксим
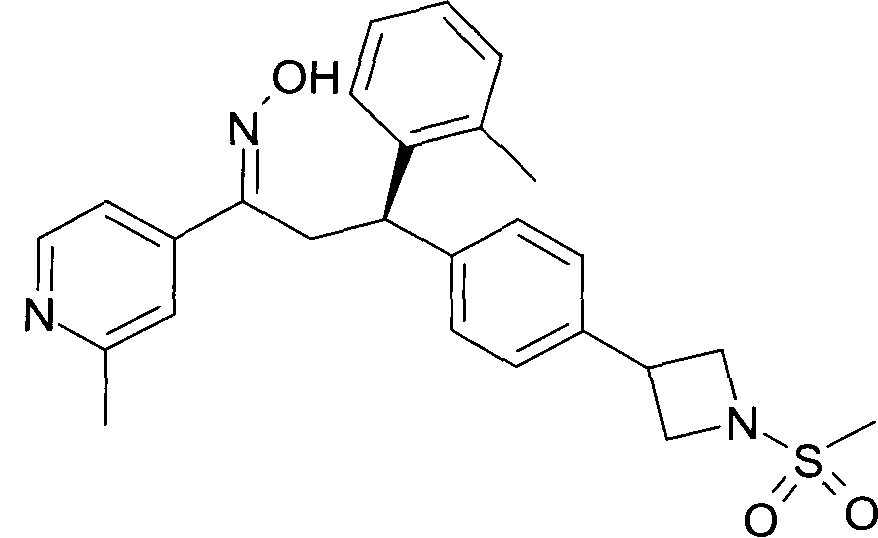
Стадия 1: (R)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)азетидин-3-ил)Фенил)-3-о-толилпропан-1 -он
Соединение, указанное в заголовке, получили по аналогии с примером 483, стадия 1, из (R)-3-(4-(азетидин-3-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она (пример 482, стадия 1) и метансульфонилхлорида. Светло-желтое масло, MS (ESI+): m/z=449.0 ([M+H]+).
Стадия 2: (R,E)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)азетидин-3-ил)фенил)-3-о-толилпропан-1 -она оксим
По аналогии с примером 1, стадия 2, из (R)-1-(2-метилпиридин-4-ил)-3-(4-(1-(метилсульфонил)азетидин-3-ил)фенил)-3-о-толилпропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде бесцветного масла, MS (ESI+): m/z=464.1 ([M+H]+).
Пример 485
(R,E)-3-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)азетидин-1-сульфонамид

Стадия 1: (R)-3-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил) азетидин-1 -сульфонамид
Соединение, указанное в заголовке, получили по аналогии с примером 480, стадия 2, из (R)-3-(4-(азетидин-3-ил)фенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она (пример 482, стадия 1) и сульфамида. Белая пена, MS (ESI+): m/z=450.1 ([M+H]+).
Стадия 2: (R,E)-3-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)азетидин-1-сульфонамид
По аналогии с примером 1, стадия 2, из (R)-3-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)азетидин-1-сульфонамида и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=465.3 ([M+H]+).
Пример 486
(S,E)-5-(3-(4-бромфенил)-1-(гидроксиимино)-3-о-толилпропил)-1-метилпиридин-2(1H)-он
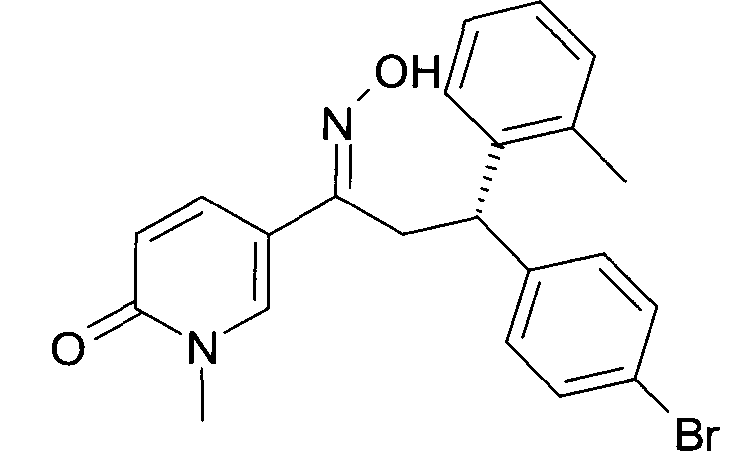
Стадия 1: (S)-3-(4-бромфенил)-1-(6-метоксипиридин-3-ил)-3-о-толилпропан-1-он
По аналогии с примером 151, стадия 1, 5-бром-2-метоксипиридин сначала взаимодействовал с n-бутиллитием и затем с (S)-3-(4-бром-фенил)-N-метокси-N-метил-3-о-толил-пропионамидом (пример 142, стадия 1) с получением соединения, указанного в заголовке, в виде бесцветного масла, MS (ESI+): m/z=410.1 [M+H]+.
Стадия 2: 5-[(S)-3-(4-бром-фенил)-3-о-толил-пропионил]-1H-пиридин-2-он
По аналогии с примером 162, стадия 2, (S)-3-(4-бромфенил)-1-(6-метоксипиридин-3-ил)-3-о-толил-пропан-1-он взаимодействовал с 37% водным раствором соляной кислоты в 1,4-диоксане с получением соединения, указанного в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=396.0 [M+H]+.
Стадия 3: 5-[(S)-3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он
По аналогии с примером 161, стадия 1, 5-[(3)-3-(4-бром-фенил)-3-о-толил-пропионил]-1H-пиридин-2-он взаимодействовал с йодометаном в присутствии карбоната калия с получением соединения, указанного в заголовке, в виде белого осадка, MS (ESI+): m/z=410.1 [M+H]+.
Стадия 4: 5-{(S)-3-(4-бром-фенил)-1-[(E)-гидроксиимино1-3-о-толил-пропил}-1-метил-1H-пиридин-2-он
По аналогии с примером 151, стадия 3, 5-[(S)-3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-он взаимодействовал с гидроксиламина гидрохлоридом в присутствии гидрокарбоната натрия с получением соединения, указанного в заголовке, в виде белой пены, MS (ESI+): m/z=425.0 [M+H]+.
Пример 487
(S,E)-4-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)циклогексанкарбоновая кислота
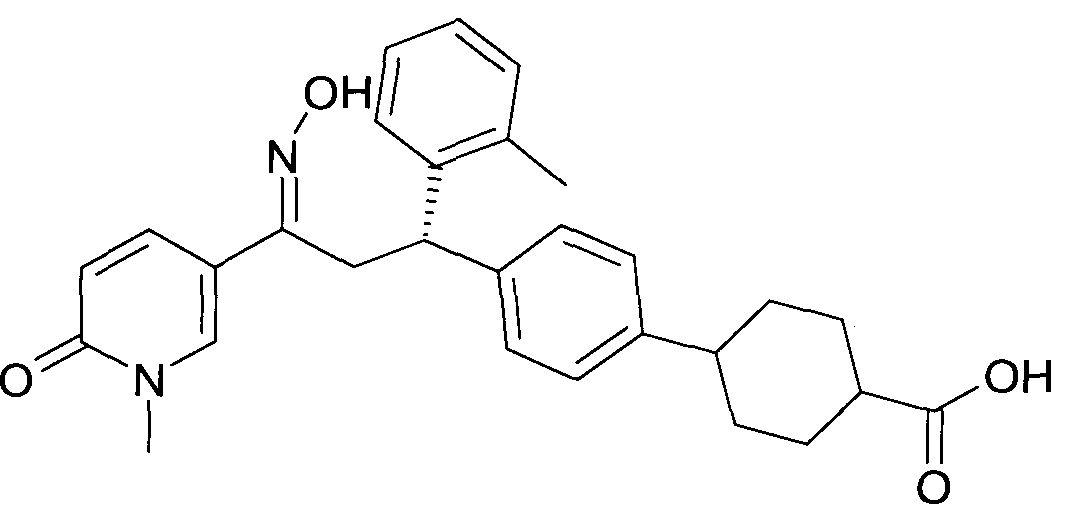
Стадия 1: 4-(Этоксикарбонил)-1-циклогексилцинка (II) йодид
Соединение, указанное в заголовке, получили в виде са. 0.5 М раствора в N,N-диметилацетамиде по аналогии с примером 481, стадия 1, из 4-йодо-циклогексанкарбоновой кислоты этилового эфира (CAS RN 524734-42-7) и цинка.
Стадия 2: (S)-этил 4-(4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)циклогексанкарбоксилат
Соединение, указанное в заголовке, получили по аналогии с примером 378, стадия 1, из 5-[(S)-3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-она (пример 486, стадия 3) и 4-(этоксикарбонил)-1-циклогексилцинка(II)йодида. Светло-коричневое масло, MS (ESI+): m/z=486.3 [M+H]+.
Стадия 3: (S)-4-(4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)циклогексанкарбоновая кислота
Соединение, указанное в заголовке, получили по аналогии с примером 169, стадия 2, из (S)-этил 4-(4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)циклогексанкарбоксилата. Светло-желтая пена, MS (ESI-): m/z=456.1 [M-H]-.
Стадия 4: (S,E)-4-(4-(3-(гидроксиимино)-3-(1 -метил-6-оксо-1,6-дигидропиридин-3-ил)-о-толилпропил)фенил)циклогексанкарбоновая кислота
По аналогии с примером 1, стадия 2, из (S)-4-(4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)циклогексанкарбоновой кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI-): m/z=471.4 [M-H]-.
Примеры 488 и 489
транс-4-(4-((S,E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)циклогексанкарбоновая кислота

и цис-4-(4-((S,E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)циклогексанкарбоновая кислота
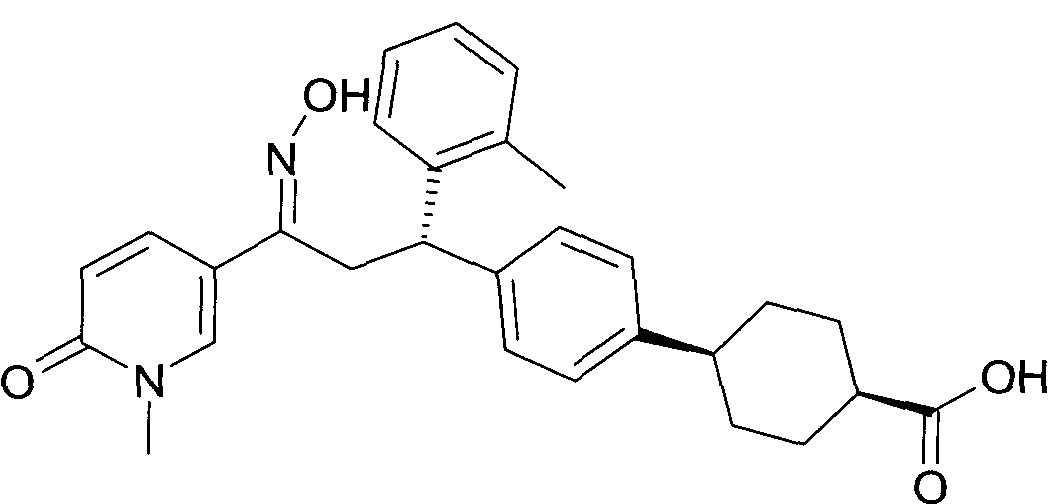
ВЭЖХ разделение (S,E)-4-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)циклогексанкарбоновой кислоты (пример 487; 99 мг) на колонке Chiralpak AD-H (гептан/этанол/муравьиная кислота 60:40:0.2) дало транс-4-(4-((S,E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)циклогексанкарбоновую кислоту (40 мг, 40%; белая пена, MS (EI) 472.2 (М+)) и цис-4-(4-((S,E)-3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)-циклогексанкарбоновую кислоту (55 мг, 56%; белая пена, MS (EI) 472.2 (М+)).
Пример 490
(R,E)-4-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-5 толилпропил)фенил)циклогексанкарбоновая кислота
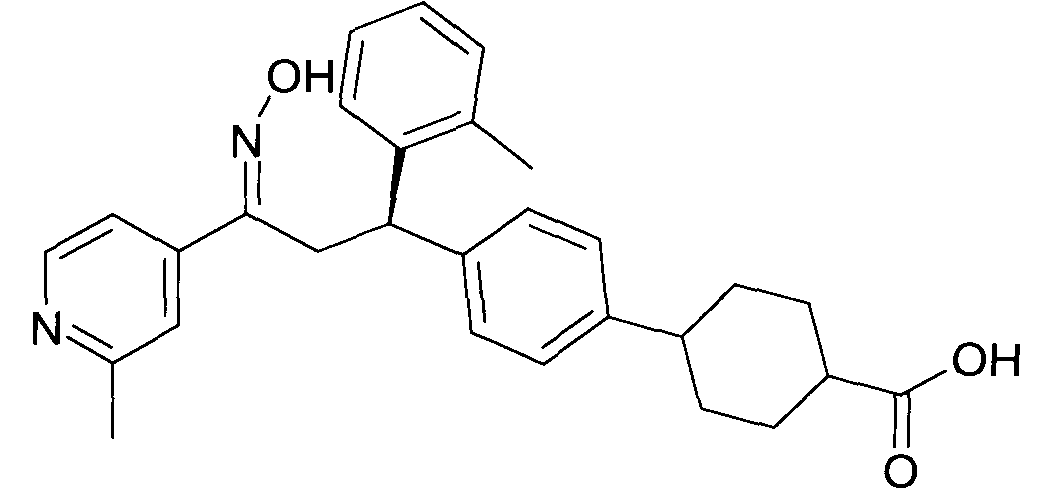
Стадия 1: (R)-этил 4-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил) фенил)циклогексанкарбоксилат
Соединение, указанное в заголовке, получили по аналогии с примером 378, стадия 1, из (R)-3-(4-бромфенил)-1-(2-метилпиридин-4-ил)-3-о-толилпропан-1-она (пример 142, стадия 2) и 4-(этоксикарбонил)-1-циклогексилцинка(II)йодида (пример 487, стадия 1). Оранжевое масло, MS (ESI+): m/z=470.1 ([M+H]+).
Стадия 2: (R)-4-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил) циклогексанкарбоновая кислота
Соединение, указанное в заголовке, получили по аналогии с примером 169, стадия 2, из (R)-этил 4-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)циклогексанкарбоксилата. Желтая пена, MS (ESI+): m/z=442.0 ([M+H]+).
Стадия 3: (R,E)-4-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)циклогексанкарбоновая кислота
По аналогии с примером 132, стадия 6, из (R)-4-(4-(3-(2-метилпиридин-4-ил)-3-оксо-1-о-толилпропил)фенил)циклогексанкарбоновой кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде светло-желтой пены, MS (ESI+): m/z=457.2 ([M+H]+).
Примеры 491 и 492
транс-4-{4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-циклогексанкарбоновая кислота
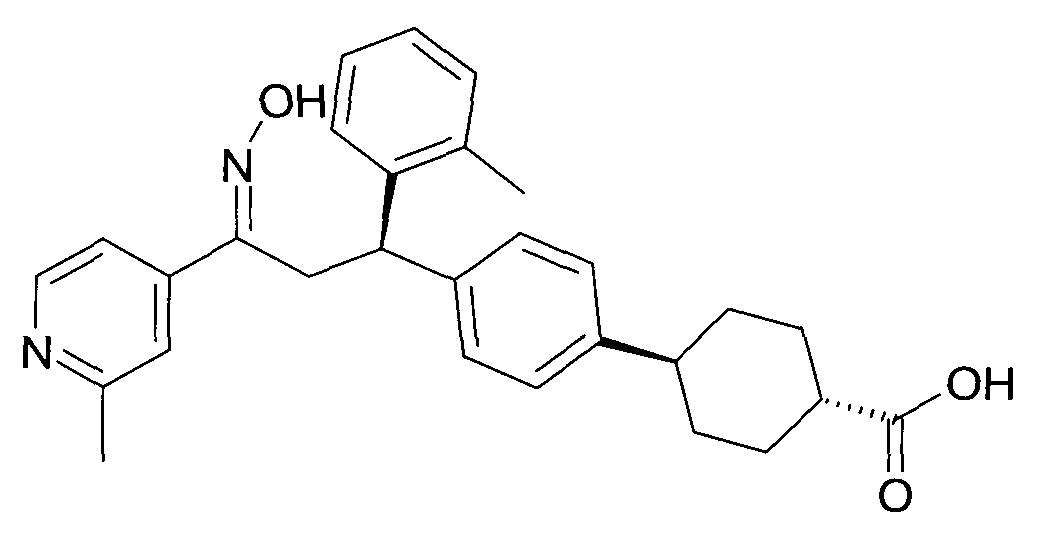
и цис-4-{4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-циклогексанкарбоновая кислота
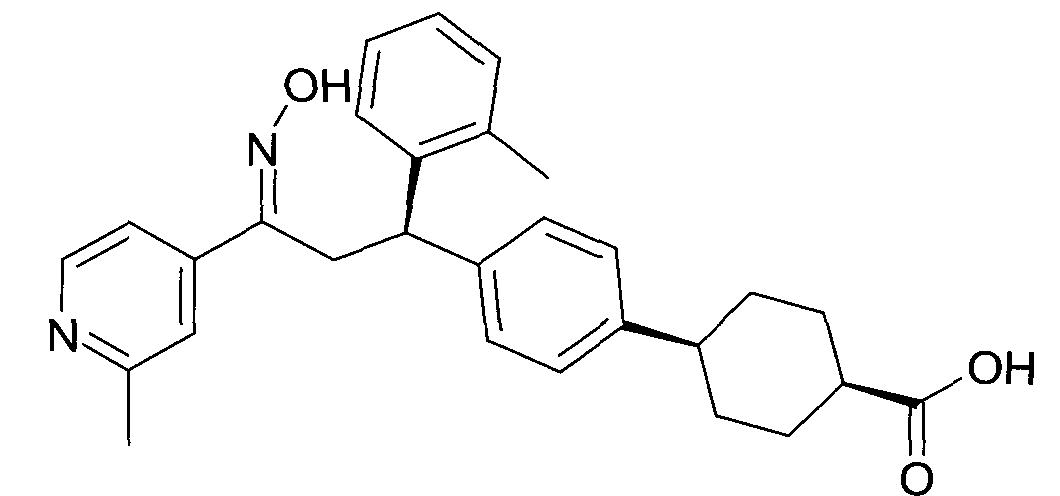
ВЭЖХ разделение (R,E)-4-(4-(3-(гидроксиимино)-3-(2-метилпиридин-4-ил)-1-о-толилпропил)фенил)циклогексанкарбоновой кислоты (пример 490; 107 мг) на колонке Chiralpak AD-H (гептан/этанол/муравьиная кислота 90:10:0.05) дало транс-4-{4-[(R)-3-[(E)-гидроксимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-циклогексанкарбоновую кислоту (32 мг, 29%; белая пена, MS (ESI+): m/z=457.2 [M+H]+) и цис-4-{4-[(R)-3-[(E)-гидроксиимино]-3-(2-метил-пиридин-4-ил)-1-о-толил-пропил]-фенил}-циклогексанкарбоновую кислоту (32 мг, 29%; белая пена, MS (ESI+): m/z=457.2 [M+H]+).
Пример 493
(R,E)-2-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)уксусная кислота
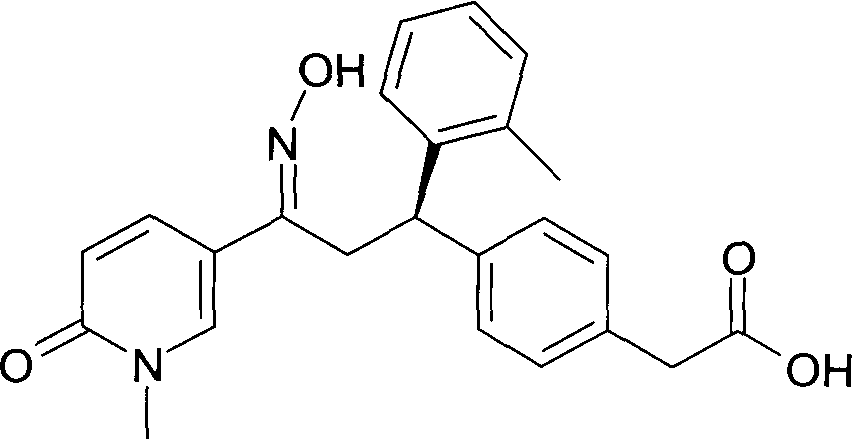
Стадия 1: (R)-2-(4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)уксусная кислота
Соединение, указанное в заголовке, получили по аналогии с примером 288, стадия 1, из 5-[(R)-3-(4-бром-фенил)-3-о-толил-пропионил]-1-метил-1H-пиридин-2-она (пример 223, стадия 3) и этилцианоацетата. Серо-белая пена, MS (ESI+): m/z=390.3 [M+H]+.
Стадия 2: (R,E)-2-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)уксусная кислота
По аналогии с примером 1, стадия 2, из (R)-2-(4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)уксусной кислоты и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде серо-белого осадка, MS (ESI+): m/z=405.4 [M+H]+.
Примеры 494 и 495
(R,E)-5-(1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1H)-он
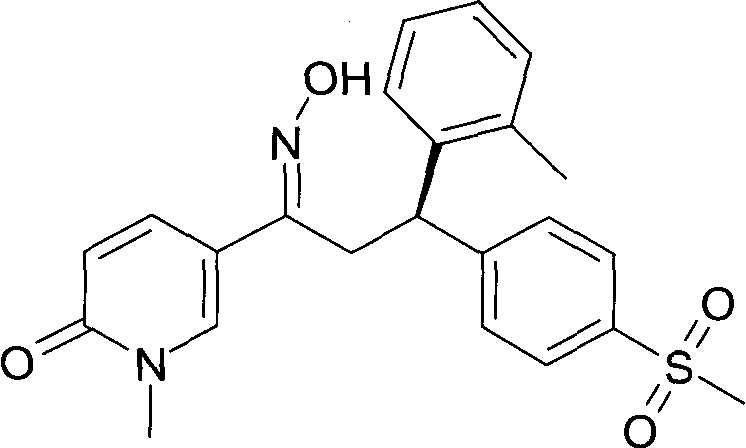
и (R,Z)-5-(1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1H)-он
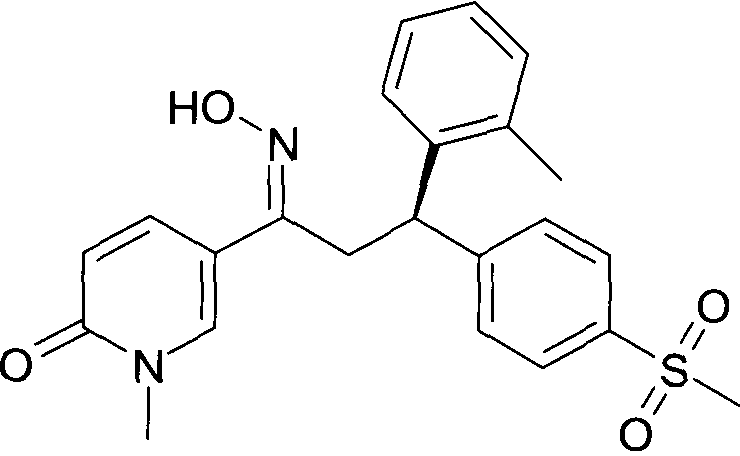
Стадия 1: (R)-1-метил-5-(3-(4-(метилсульфонил)фенил)-3-о-толилпропаноил)пиридин-2(1H)-он
L-пролин (44.9 мг, 390 мкмоль) смешали с диметил сульфоксидом (5 мл), затем добавили гидроксид натрия (15.6 мг, 390 мкмоль) и реакционную смесь перемешивали при комнатной температуре в течении 30 мин. Затем добавили (R)-5-(3-(4-бромфенил)-3-о-толилпропаноил)-1-метилпиридин-2(1H)-он (пример 223, стадия 3; 200 мг, 487 мкмоль), метансульфинат натрия (410 мг, 3.9 ммоль) и йодид меди(1) (74.3 мг, 390 мкмоль). Реакционную смесь нагревали при 120°C в течение 21 ч, затем разделили между водой и этилацетатом. Органический слой промыли солевым раствором, высушили над сульфатом магния и выпарили. Хроматография (SI02; градиент этилацетат/гептан 1:1 до этил ацетата) дала соединение, указанное в заголовке, (176 мг, 88%). Белая пена, MS (ESI+): m/z=410.2 [M+H]+.
Стадия 2: (R)-5-(1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1H)-он
В пробирку для микроволновой печи добавили (R)-1-метил-5-(3-(4-(метилсульфонил)фенил)-3-о-толилпропаноил)пиридин-2(1H)-он (168 мг, 410 мкмоль), гидроксиламина гидрохлорид (85.5 мг, 1.23 ммоль) и гидрокарбонат натрия (103 мг, 1.23 ммоль) в этаноле (3 мл) и воде (0.2 мл). Пробирку закрыли и нагревали в микроволновой печи при 120°C в течение 15 минут. Реакционную смесь разбавили этилацетатом и влили в воду. Органический слой промыли солевым раствором, высушили над сульфатом магния и выпарили с получением соединения, указанного в заголовке, (169 мг, 97%) в виде смеси E и Z изомеров (соотношение са. 85:15). Светло-желтая пена, MS (ESI+): m/z=425.2 [M+H]+.
Стадия 3: (R,E)-5-(1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1H)-он и (R,Z)-5-(1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1H)-он
ВЭЖХ разделение (R)-5-(1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1Н)-она (168 мг), используя Chiralpak AD колонку (гептан/этанол 3:2), дало (R,E)-5-(1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1Н)-он (130 мг, 77%; Светло-желтая пена, MS (ESI+): m/z=425.2 [M+H]+ и (R,Z)-5-(1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1H)-он (18 мг, 11%; Светло-желтый осадок, MS (ESI+): m/z=425.2 [M+H]+).
Пример 496
5-[(S)-1-[(E)-гидроксимино]-3-(4-метансульфонил-фенил)-3-о-толил-пропил]-1-метил-1H-пиридин-2-он
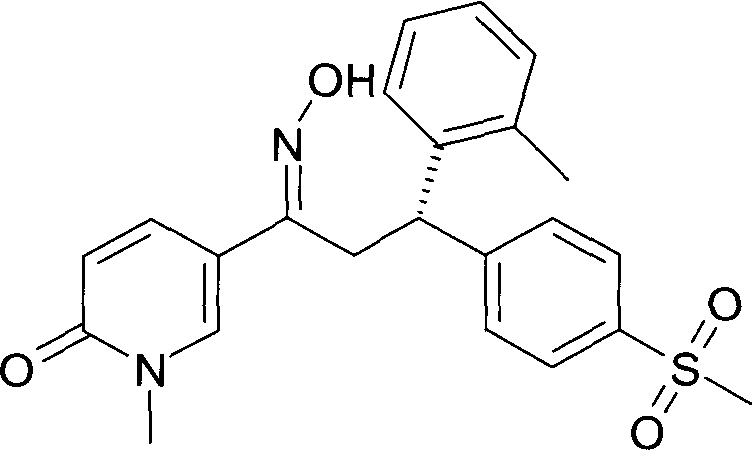
Стадия 1: (S)-1-метил-5-(3-(4-(метилсульфонил)фенил)-3-о-толилпропаноил)пиридин-2(1H)-он
Соединение, указанное в заголовке, получили по аналогии с примером 495, стадия 1, из (S)-5-(3-(4-бромфенил)-3-о-толилпропаноил)-1-метилпиридин-2(1H)-она (пример 486, стадия 3). Белая пена, MS (ESI+): m/z=: 410.3 [M+H]+.
Стадия 2: 5-[(S)-1-[(E)-гидроксимино1-3-(4-метансульФонил-фенил)-3-о-толил-пропил]-1-метил-1H-пиридин-2-он
В пробирку для микроволновой печи добавили (R)-1-метил-5-(3-(4-(метилсульфонил)фенил)-3-о-толилпропаноил)пиридин-2(1H)-он (168 мг, 410 мкмоль), гидроксиламина гидрохлорид (85.5 мг, 1.23 ммоль) и гидрокарбонат натрия (103 мг, 1.23 ммоль) в этаноле (3 мл) и воде (0.2 мл). Пробирку закрыли и нагревали при 120°C в течение 15 минут. Реакционную смесь разбавили этилацетатом и влили в воду. Органический слой промыли солевым раствором, высушили над сульфатом магния и выпарили с получением соединения, указанного в заголовке, (169 мг, 97%) в виде смеси Е и Z изомеров (соотношение около 85:15). Светло-желтая пена, MS (ESI+): m/z=425.2 [M+H]+.
Пример 497
Натрия (R,E)-1-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоксилат
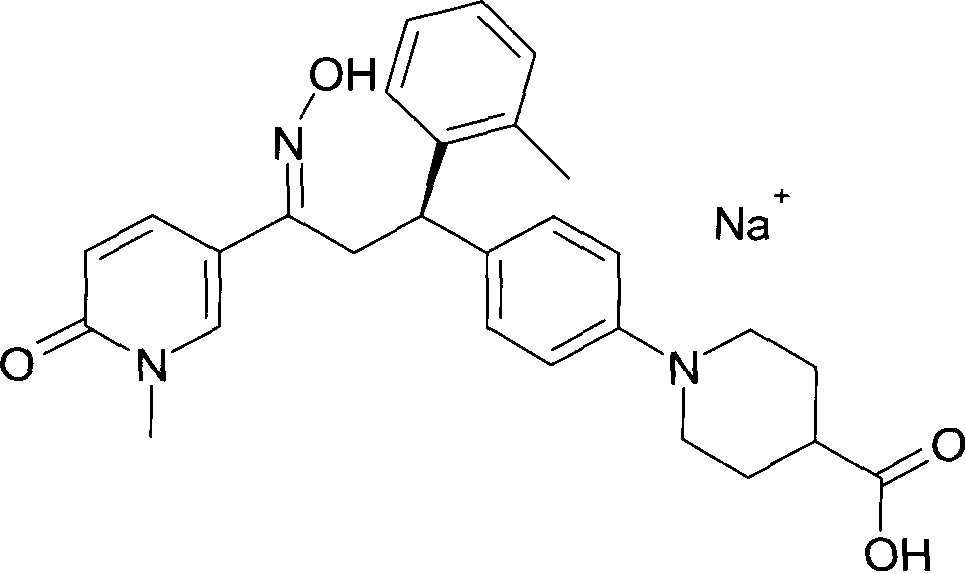
Стадия 1: (R)-1-(4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-4-карбоновая кислота
К раствору (R)-5-(3-(4-бромфенил)-3-о-толилпропаноил)-1-метилпиридин-2(1H)-она (пример 223, стадия 3; 500 мг, 1.22 ммоль) в толуоле (7 мл) добавили этил пиперидин-4-карбоксилата (293 мг, 1.83 ммоль), трет-бутоксид натрия (234 мг, 2,44 ммоль), трис(дибензилиденацетон)дипалладий(0) (22.3 мг, 24.4 мкмоль) и 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (23.7 мг, 48.7 мкмоль) и реакционную смесь перемешивали в течение 1 ч при 85°C. Реакционную смесь выпарили и остаток хроматографировали с получением соединения, указанного в заголовке, (101 мг, 18%; Светло-желтая пена, MS (ESI+): m/z=457.4 [M-H]-) и (R)-метил,1-(4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-4-карбоксилата (174 мг, 30%; Светло-желтая пена, MS (ESI+): m/z=487.4 [M+H]+.
Стадия 2: Натрия (R,E)-1-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)пиперидин-4-карбоксилат
В пробирку для микроволновой печи добавили (R)-1-(4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-4-карбоновую кислоту (100 мг, 218 мкмоль), гидроксиламина гидрохлорид (45.5 мг, 654 мкмоль) и гидрокарбонат натрия (91,6 мг, 1.09 ммоль) в этаноле (2 мл) и воде (0.2 мл). Пробирку закрыли и нагревали при 120°C в течение 15 минут, затем еще добавили гидроксиламина гидрохлорид (45.5 мг, 654 мкмоль) и гидрокарбонат натрия (91,6 мг, 1.09 ммоль). Пробирку закрыли и нагревали при 120°C в течение 10 мин, затем реакционную смесь выпарили. Остаток промыли дихлорметаном, затем суспендировали в дихлорметане/метаноле 9:1 и отфильтровали. Фильтрат сконцентрировали и очистили хроматографией (SiO2; градиент дихлорметан/метанол 19:1 до дихлорметан/метанол 4:1) с получением соединения, указанного в заголовке, (66 мг, 61%). Светло-коричневый осадок, MS (ESI-): m/z=472,4 (M-H)-.
Примеры 498 и 499
(R,E)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензонитрил
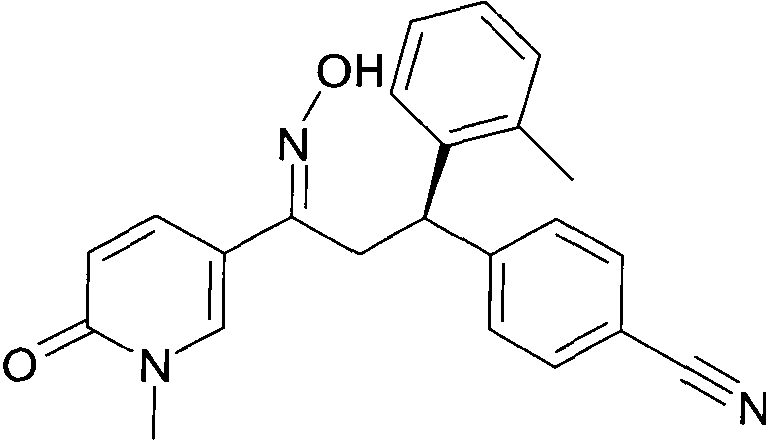
и (R,Z)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензонитрил
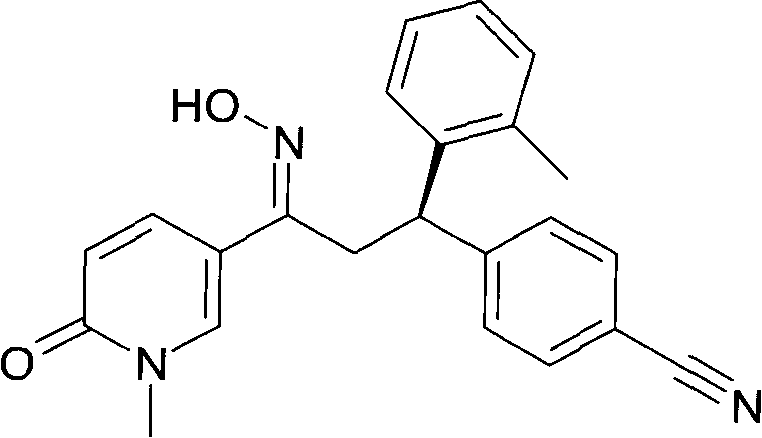
В пробирку для микроволновой печи добавили (R)-5-(3-(4-бромфенил)-1-(гидроксиимино)-3-о-толилпропил)-1-метилпиридин-2(1Н)-он (пример 223; 98 мг, 230 мкмоль), 1,1'-бис(дифенилфосфино)ферроцен (3.83 мг, 6.91 мкмоль), трис(дибензилиденацетон)дипалладий(0) (2.11 мг, 2.3 мкмоль), цианид цинка (14.9 мг, 127 мкмоль), цинк (0.6 мг, 9 мкмоль) и ацетат цинка (1,69 мг, 9.22 мкмоль) в N,N-диметилформамиде (1.5 мл) и воде (15 мкл). Пробирку закрыли и нагревали при 180°C в течение 35 мин, затем при 200°C в течение 10 мин, затем реакционную смесь сконцентрировали под вакуумом и остаток очистили хроматографией (SiO2, градиент от дихлорметана до дихлорметан/метанол/25% водн. раствор аммиака 95:5:0.25) с получением (R,E)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензонитрила (8 мг, 9%; темно-коричневая смола, MS (ESI+): m/z=372.2 [M+H]+ и (R,Z)-4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)бензонитрила (6 мг, 6%; темно-коричневая смола, MS (ESI+): m/z=372.2 [M+H]+).
Пример 500
(R,E)-5-(3-(4-(1H-Тетразол-5-ил)фенил)-1-(гидроксиимино)-3-о-толилпропил)-1-метилпиридин-2(1H)-он, натриевая соль
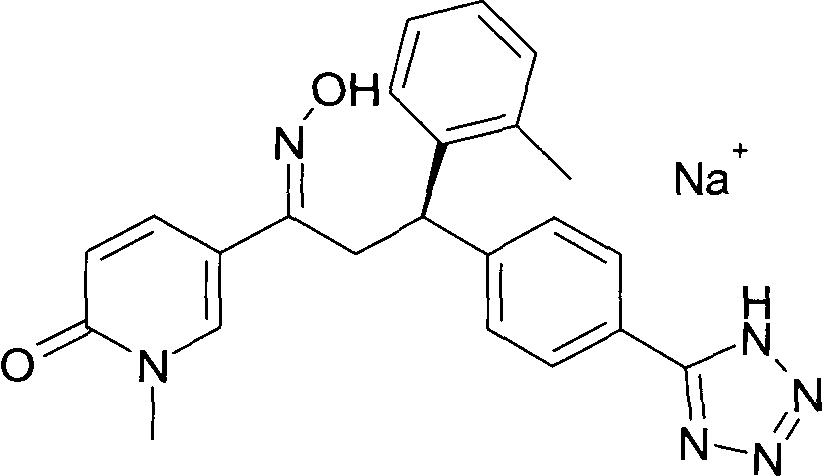
Стадия 1: (R)-5-(3-(4-(1H-Тетразол-5-ил)фенил)-3-о-толилпропаноил)-1-метилпиридин-2(1H)-он
К раствору (R)-4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)бензонитрила (60 мг, 168 мкмоль) в N,N-диметилформамиде (1 мл) добавили азид натрия (54.7 мг, 842 мкмоль) и хлорид аммония (45.0 мг, 842 мкмоль). Реакционную смесь нагревали при 80°C в течение 24 ч, затем добавили другую порцию азида натрия (54.7 мг, 842 мкмоль) и хлорида аммония (45.0 мг, 842 мкмоль) и реакционную смесь перемешивали при 80°C в течение дополнительных 72 ч, затем сконцентрировали под вакуумом. Остаток суспендировали в дихлорметане/метаноле 19:1, отфильтровали, и фильтрат очистили хроматографией (SiO2, градиент от дихлорметана до дихлорметан/метанол 9:1) с получением продукта в виде соли. Его разделили между этилацетатом и 1M водн. раствором соляной кислоты. После удаления водного слоя, органический слой высушили над сульфатом магния, отфильтровали, выпарили и преципитировали дихлорметаном и гептаном с получением соединения, указанного в заголовке, (25 мг, 37%). Белый осадок, MS (ESI+): m/z=400.2 [M+H]+.
Стадия 2: (R,E)-5-(3-(4-(1H-Тетразол-5-ил)фенил)-1-(гидроксиимино)-3-о-толилпропил)-1-метилпиридин-2(1H)-он, натриевая соль
В пробирку для микроволновой печи добавили (R)-5-(3-(4-(1H-тетразол-5-ил)фенил)-3-о-толилпропаноил)-1-метилпиридин-2(1H)-он (22 мг, 55.1 мкмоль), гидроксиламина гидрохлорид (11.5 мг, 165 мкмоль) и гидрид натрия (23.1 мг, 275 мкмоль) в этаноле (0.5 мл) и воде (50 мкл). Пробирку закрыли и нагревали при 120°C в течение 15 минут, затем реакционную смесь выпарили. Хроматография (SiO2, градиент дихлорметан/метанол 9:1 до дихлорметан/метанол 4:1), с последущей преципитацией дихлорметаном и гептаном с получением соединения, указанного в заголовке, (11 мг, 46%). Серо-белый осадок MS (ESI+): m/z=415.2 [M+H]+.
Пример 501
(S,E)-5-(3-(4-бромфенил)-1-(гидроксиимино)-3-о-толилпропил)-1-метилпиримидин-2(1H)-он
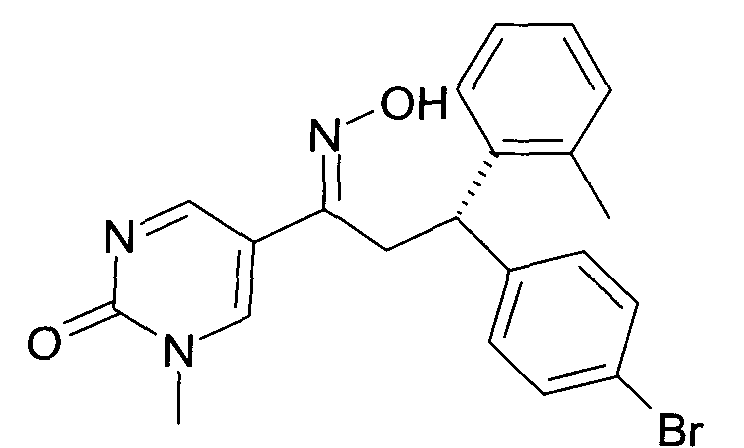
Стадия 1: (S)-3-(4-бромфенил)-1-(2-метоксипиримидин-5-ил)-3-о-толилпропан-1-он
Раствор n-бутиллития (1,6M в гексане, 3.31 мл, 5.3 ммоль) в тетрагидрофуране (12 мл) охладили до -95°C и добавили по каплям, в атмосфере азота, к перемешанному, охлажденному (-95°C) раствору 5-бром-2-метокси-пиримидина (1.00 г, 5.3 ммоль) в безводном тетрагидрофуране (40 мл). К полученному желтому раствору немедленно добавили раствор (S)-3-(4-бромфенил)-N-метокси-N-метил-3-о-толилпропанамида (пример 142, стадия 1; 1,6 г, 4.42 ммоль) в безводном ТГФ (12 мл), с поддержанием температуры реакционной смеси между -90°C и -100°C. Раствор перемешивали и дали нагреться до комнатной температуры в течение 2 ч. Реакционную смесь влили в нас.водн. раствор хлорида аммония и экстрагировали этилацетатом. Органический слой промыли солевым раствором, высушили над сульфатом магния, отфильтровали и выпарили. Хроматография (SiO2; гептан - этилацетат градиент) дала соединение, указанное в заголовке, (700 мг, 35%), бесцветная смола, MS (ESI+): m/z=411.2 [M+H]+.
Стадия 2: (S)-5-(3-(4-бромфенил)-3-о-толилпропаноил)пиримидин-2(1H)-он
К раствору (S)-3-(4-бромфенил)-1-(2-метоксипиримидин-5-ил)-3-о-толилпропан-1-она (700 мг, 1.53 ммоль, Экв: 1.00) в диоксане (18 мл) добавили 37% водн. раствор соляной кислоты (2.56 мл, 30.6 ммоль) и полученный раствор сначала перемешивали при комнатной температуре в течение 45 минут и затем 21/2 при 60°C, затем влили в нас.водн. раствор бикарбоната натрия и этилацетат. Органический слой промыли солевым раствором, высушили над сульфатом магния, отфильтровали и выпарили. Хроматография (SiO2; градиент от дихлорметана до дихлорметан/метанол/25% водн. раствор аммиака 90:10:0.25) дала соединение, указанное в заголовке, (592 мг, 97%). Белый осадок, MS (ESI+): m/z=397.0 [M+H]+.
Стадия 3: (S)-5-(3-(4-бромфенил)-3-о-толилпропаноил)-1-метилпиримидин-2(1H)-он
Соединение, указанное в заголовке, получили по аналогии с примером 161, стадия 1, из (S)-5-(3-(4-бромфенил)-3-о-толилпропаноил)пиримидин-2(1H)-она и йодометана. Серо-белый осадок, MS (ESI+): m/z=411.1 [M+H]+.
Стадия 4: (S,E)-5-(3-(4-бромфенил)-1-(гидроксиимино)-3-о-толилпропил)-1-метилпиримидин-2(1H)-он
Соединение, указанное в заголовке, получили по аналогии с примерами 494 и 495, стадия 2, из (S)-5-(3-(4-бромфенил)-3-о-толилпропаноил)-1-метилпиримидин-2(1H)-она и гидроксиламина гидрохлорида. Белый осадок, MS (ESI+): m/z=426.0 [M+H]+.
Пример 502
(S,E)-5-(1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-3-о-толилпропил)-1-метилпиримидин-2(1H)-он
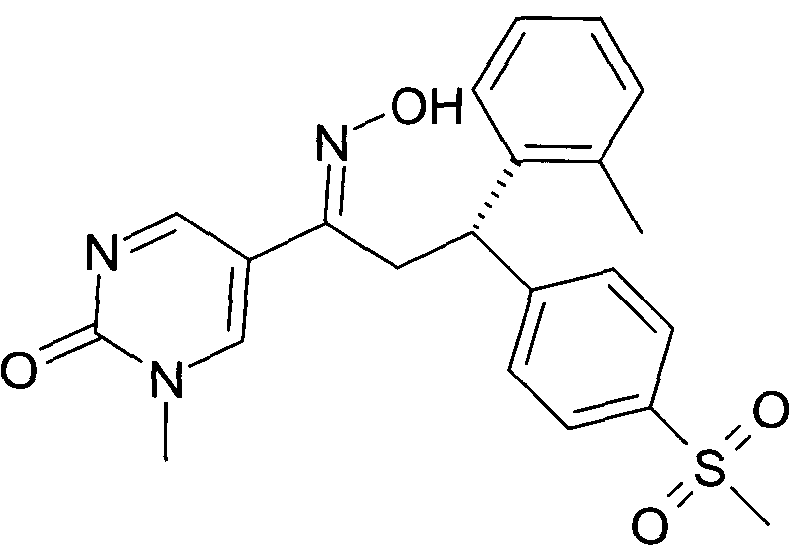
Стадия 1: (S)-1-метил-5-(3-(4-(метилсульфонил)фенил)-3-о-толилпропаноил) пиримидин-2(1H)-он
Соединение, указанное в заголовке, получили по аналогии с примерами 494 и 495, стадия 1, из (3)-5-(3-(4-бромфенил)-3-о-толилпропаноил)-1-метилпиримидин-2(1H)-она (пример 501, стадия 3). Светло-коричневый осадок, MS (ESI+): m/z=411.1 [M+H]+.
Стадия 2: (S,E)-5-(1-(гидроксиимино)-3-(4-(метилсульфонил)фенил)-3-о-толилпропил)-1-метил-'пиримидин-2(1Н)-он
Соединение, указанное в заголовке, получили по аналогии с примерами 494 и 495, стадия 2, из (S)-1-метил-5-(3-(4-(метилсульфонил)фенил)-3-о-толилпропаноил)пиримидин-2(1H)-она и гидроксиламина гидрохлорида. Белый осадок, MS (ESI+): m/z=: 426.0 [M+H]+.
Пример 503
(R,E)-4-(4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)циклогексанкарбоновая кислота
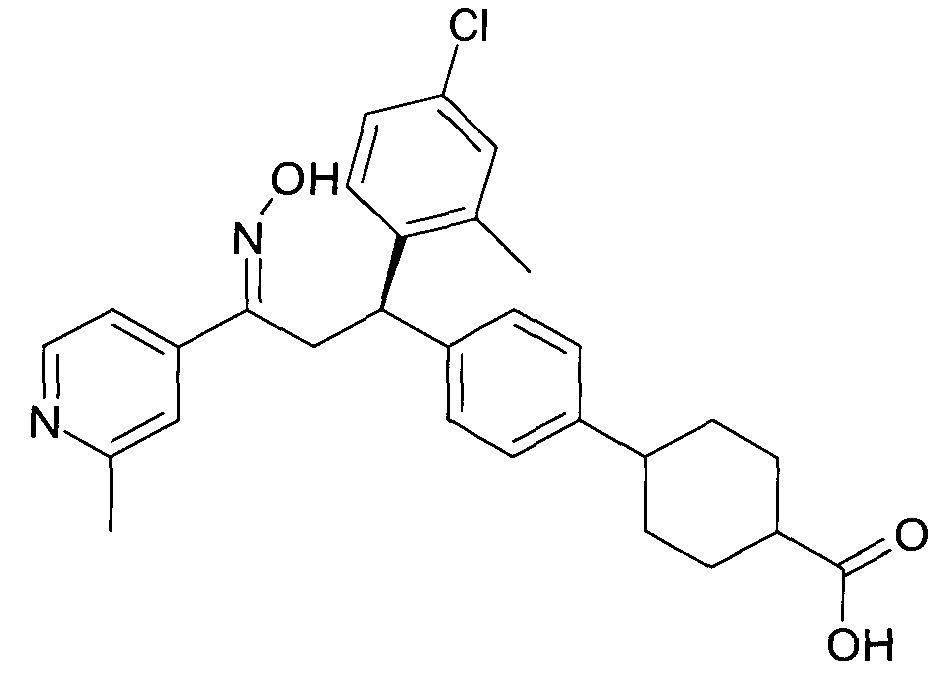
Стадия 1: (R)-этил 4-(4-(1-(4-хлор-2-метилфенил)-3-(2-метилпиридин-4-ил)-3-оксопропил)фенил)циклогексанкарбоксилат
Соединение, указанное в заголовке, получили по аналогии с примером 378, стадия 1, из (R)-3-(4-бром-фенил)-3-(4-хлор-2-метил-фенил)-1-(2-метил-пиридин-4-ил)-пропан-1-она (пример 282, стадия 1) и 4-(этоксикарбонил)-1-циклогексилцинк(II)йодида (пример 487, стадия 1). Коричневая смола, MS (ESI+): m/z=504.3 [M+H]+.
Стадия 2: (R)-4-(4-(1-(4-хлор-2-метилфенил)-3-(2-метилпиридин-4-ил)-3-оксопропил)фенил)цикпогексанкарбоновая кислота
Соединение, указанное в заголовке, получили по аналогии с примером 169, стадия 2, из (R)-этил 4-(4-(1-(4-хлор-2-метилфенил)-3-(2-метилпиридин-4-ил)-3-оксопропил)фенил)циклогексанкарбоксилат. Желтая смола, MS (ESI+): m/z=476.2 [M+H]+.
Стадия 3: (R,E)-4-(4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)циклогексанкарбоновая кислота
Соединение, указанное в заголовке, получили по аналогии с примерами 494 и 495, стадия 2, из (R)-4-(4-(1-(4-хлор-2-метилфенил)-3-(2-метилпиридин-4-ил)-3-оксопропил)фенил)циклогексанкарбоновой кислоты и гидроксиламина гидрохлорида. Светло-желтая пена, MS (ESI+): m/z=: 491.2 [M+H]+.
Примеры 504 и 505
транс-4-(4-((R,R)-1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)циклогексанкарбоновая кислота
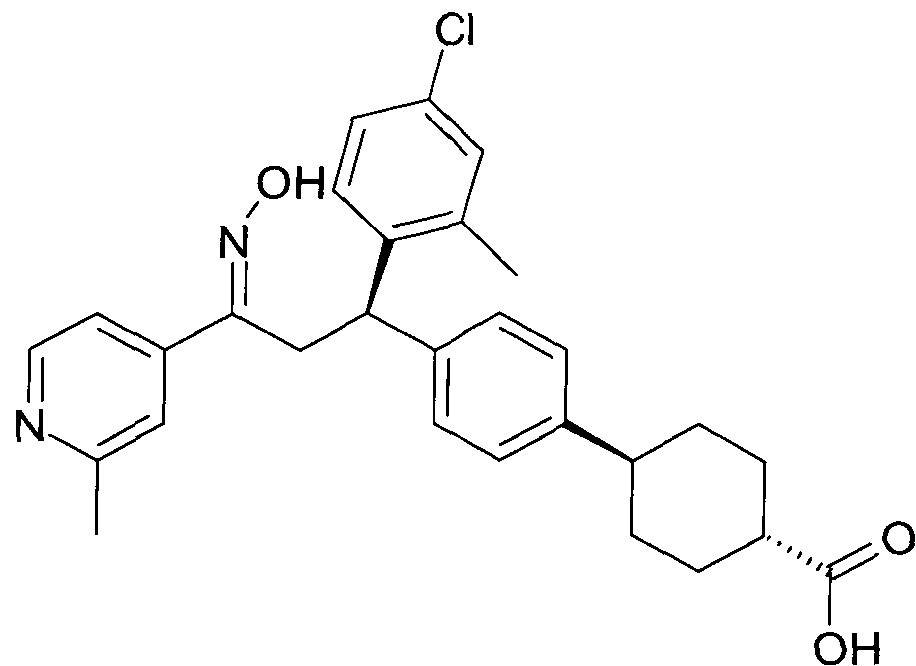
и цис-4-(4-((R,E)-1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)циклогексанкарбоновая кислота
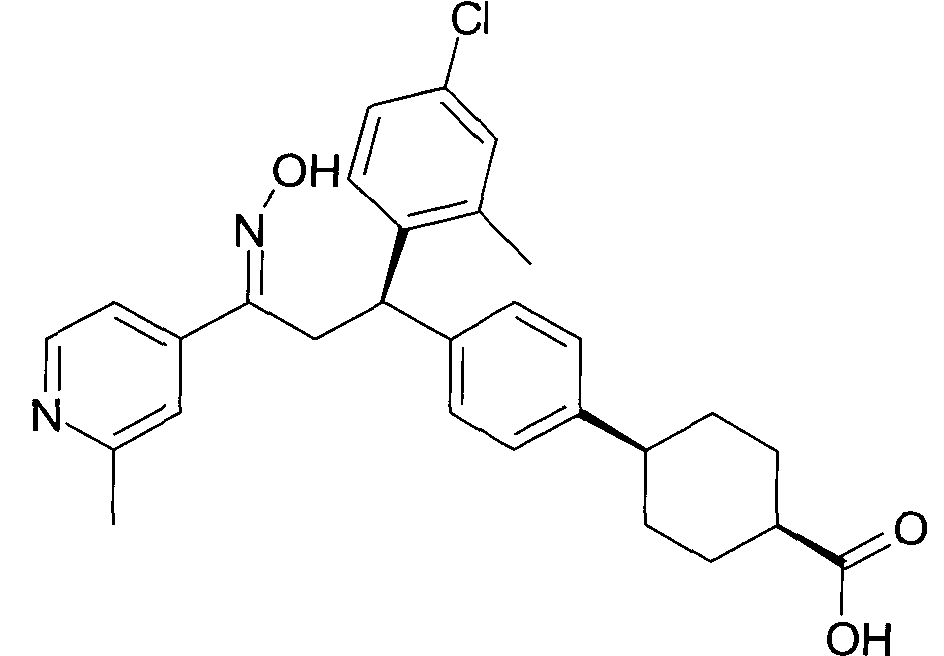
ВЭЖХ разделение (R,E)-4-(4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)циклогексанкарбоновой кислоты (185 мг) на колонке Reprosil Chiral NR (гептан/этанол/муравьиная кислота 90:10:0.05) дало транс-4-(4-((R,E)-1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)циклогексанкарбоновую кислоту (56 мг, 30%; Белый осадок, MS (ESI+): m/z=491.2 [M+H]+ и цис-4-(4-((R,E)-1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)циклогексанкарбоновую кислоту (75 мг, 39%; Белый осадок, MS (ESI+): m/z=491.2 [M+H]+).
Пример 506
(R,E)-трет-бутил 4-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)пиперидин-1-карбоксилат
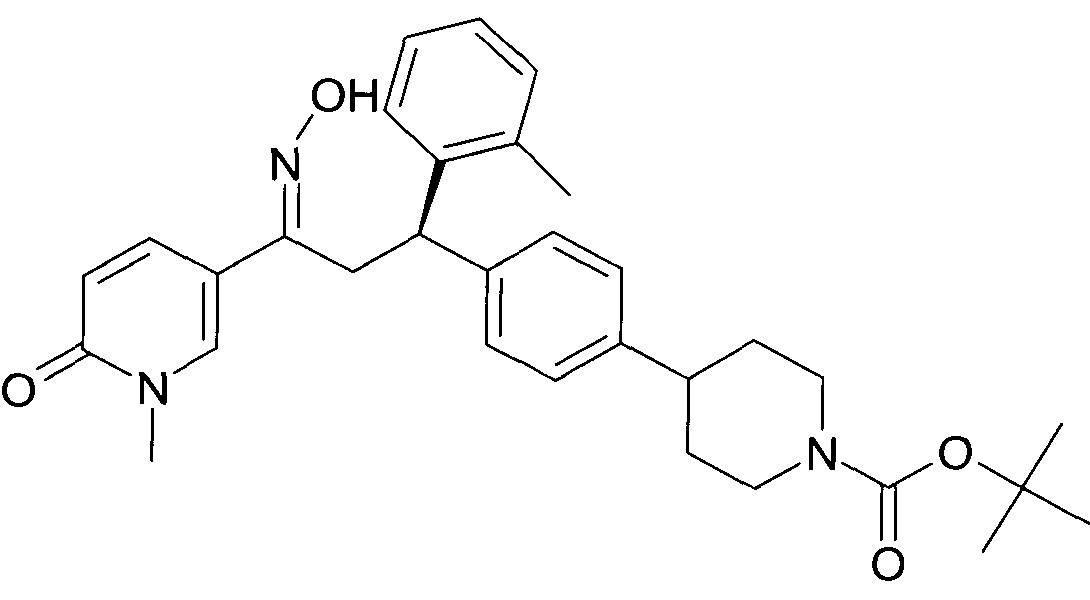
Стадия 1: (R)-трет-бутил 4-(4-(3-(метокси(метил)амино)-3-оксо-1-о-толилпропил)фенил)-пиперидин-1-карбоксилат
Соединение, указанное в заголовке, получили по аналогии с примером 378, стадия 1, из (R)-3-(4-бромфенил)-N-метокси-N-метил-3-о-толилпропанамида (пример 142, стадия 1) и (1-(трет-бутоксикарбонил)пиперидин-4-ил)цинка(II)йодида. Темно-коричневая смола, MS (ESI+): m/z=467.3 ([M+H]+).
Стадия 2: (R)-трет-бутил 4-(4-(3-(6-метоксипиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-1-карбоксилат
Соединение, указанное в заголовке, получили по аналогии с примером 151, стадия 1, из (R)-трет-бутила 4-(4-(3-(метокси(метил)амино)-3-оксо-1-о-толилпропил)фенил)пиперидин-1-карбоксилата и 5-бром-2-метоксипиридина. Светло-желтая пена, MS (ESI+): m/z=515.4 ([M+H]+).
Стадия 3: (R)-трет-бутил 4-(4-(3-оксо-3-(6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)-пиперидин-1-карбоксилат
Раствор (R)-трет-бутил 4-(4-(3-(6-метоксипиридин-3-ил)-3-оксо-1 -о-толилпропил)-фенил)пиперидин-1-карбоксилата (260 мг, 505 мкмоль), раствор соляной кислоты (4.0M в 1,4-диоксане, 3.03 мл, 12.1 ммоль) и воды (0.5 мл) нагрели до 100°C, затем через 90 мин реакционную смесь продули аргоном и сконцентрировали с получением (R)-5-(3-(4-(пиперидин-4-ил)фенил)-3-о-толилпропаноил)пиридин-2(1Н)-она гидрохлорида (272 мг, Светло-желтая пена, MS (ESI+): m/z=401.4 [M+H]+). Его растворили в дихлорметане (4 мл) и N,N-диметилформамиде (0.4 мл), затем добавили N,N-диизопропилэтиламин (326 мг, 2.53 ммоль) и раствор ди-трет-бутил-дикарбоната (121 мг, 0.56 ммоль) при 0°C. Через 30 мин реакционную смесь разделили между нас.водн. раствором бикарбоната натрия и этилацетатом. Органический слой промыли солевым раствором, высушили над сульфатом магния и выпарили. Хроматография (SiO2; градиент этилацетат/гептан 1:1 до этилацетата) дала соединение, указанное в заголовке, (204 мг, 81%). Светло-желтая пена, MS (ESI+): m/z=501.1 [M+H]+.
Стадия 4: (R)-трет-бутил 4-(4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-1-карбоксилат
Соединение, указанное в заголовке, получили по аналогии с примером 161, стадия 1, из (R)-трет-бутил 4-(4-(3-оксо-3-(6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)пиперидин-1-карбоксилата. Белая пена, MS (ESI+): m/z=515.4 [M+H]+.
Стадия 5: (R,E)-трет-бутил 4-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)пиперидин-1-карбоксилат
В пробирку для микроволновой печи добавили (R)-трет-бутил 4-(4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-1-карбоксилат (35 мг, 68.0 мкмоль), бикарбонат натрия (17.1 мг, 204 мкмоль) и гидроксиламина гидрохлорид (14.2 мг, 204 мкмоль) в этаноле (1 мл) и воде (0.02 мл). Пробирку закрыли и нагревали при 120°C в течение 15 минут. Реакционную смесь влили в водн.нас. раствор бикарбоната натрия и экстрагировали этилацетатом. Объединенные органические слои промыли солевым раствором, высушили над сульфатом магния, отфильтровали и выпарили с получением соединения, указанного в заголовке, (37 мг), которое содержало около 15% (Z)-стереоизомера. Белая пена; MS (ESI+): m/z=530.3 [M+H]+).
Пример 507
(R,E)-5-(1-(гидроксиимино)-3-(4-(пиперидин-4-ил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1H)-он
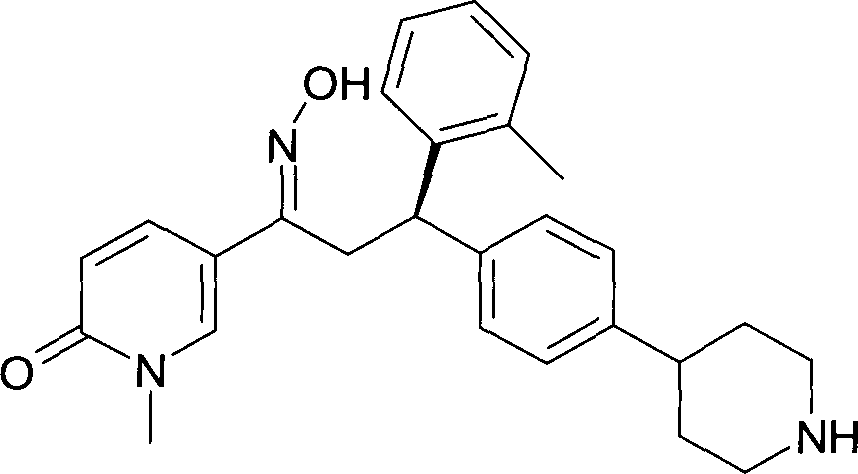
(R,E)-трет-бутил 4-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1 -о-толилпропил)фенил)пиперидин-1 -карбоксилат (пример 506, 30 мг) растворили в этаноле (0.8 мл) и добавили раствор соляной кислоты (4.0 М в 1,4-диоксане (170 мкл, 680 мкмоль), затем через 14 ч реакционную смесь влили в водн.нас. раствор бикарбоната натрия и экстрагировали 2 раза дихлорметаном. Объединенные органические слои промыли солевым раствором, высушили над сульфатом магния, отфильтровали и выпарили. Остаток тритурировали с этил ацетатом/гептаном с получением соединения, указанного в заголовке, (12 мг, 41%). Светло-желтый осадок; MS (ESI+): m/z=430.5 [M+H]+).
Пример 508
(R,E)-5-(3-(4-(1-Ацетилпиперидин-4-ил)фенил)-1-(гидроксиимино)-3-о-толилпропил)-1-метилпиридин-2(1H)-он
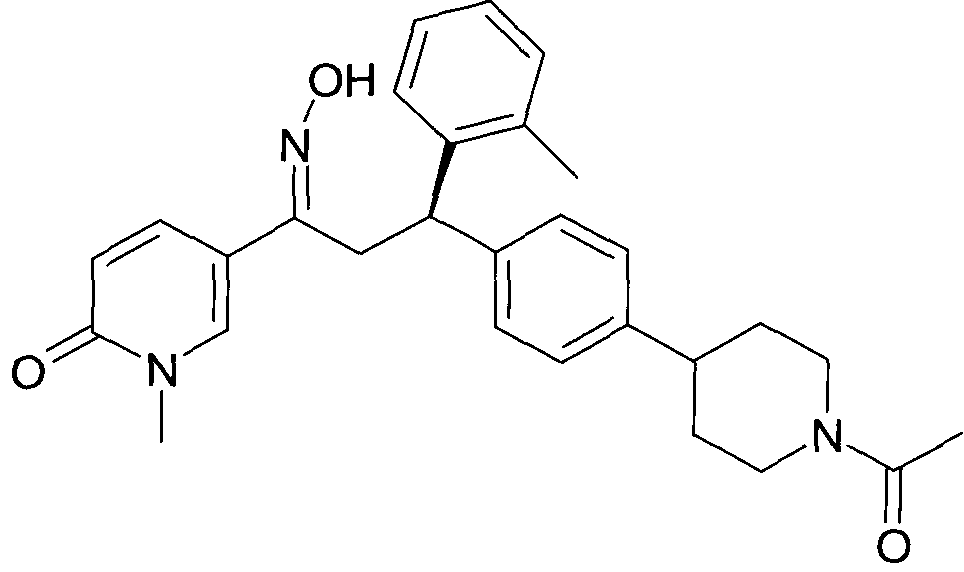
Стадия 1: (R)-1-метил-5-(3-(4-(пиперидин-4-ил)фенил)-3-о-толилпропаноил)пиридин-2(1H)-он
Соединение, указанное в заголовке, получили по аналогии с примером 480, стадия 1, из (R)-трет-бутил 4-(4-(3-(1-метил-6-оксо-1.6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-1-карбоксилата (пример 506, стадия 4). Светло-желтая пена, MS (ESI+): m/z=415.4 [M+H]+.
Стадия 2: (R)-5-(3-(4-(1-Ацетилпиперидин-4-ил)фенил)-3-о-толилпропаноил)-1-метилпиридин-2(1H)-он
Соединение, указанное в заголовке, получили по аналогии с примером 483, стадия 1, из (R)-1-метил-5-(3-(4-(пиперидин-4-ил)фенил)-3-о-толилпропаноил)пиридин-2(1H)-она и ацетилхлорида. Белая пена, MS (ESI+): m/z=457.4 [M+H]+).
Стадия 3: (R,E)-5-(3-(4-(1-Ацетилпиперидин-4-ил)фенил)-1-(гидроксиимино)-3-о-толилпропил)-1-метилпиридин-2(1H)-он
Соединение, указанное в заголовке, получили по аналогии с примером 506, стадия 5, из (R)-5-(3-(4-(1-ацетилпиперидин-4-ил)фенил)-3-о-толилпропаноил)-1-метилпиридин-2(1H)-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Белая пена, MS (ESI+): m/z=472.3 [M+H]+).
Пример 509
(R,E)-5-(1-(гидроксиимино)-3-(4-(1-(метилсульфонил)пиперидин-4-ил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1H)-он
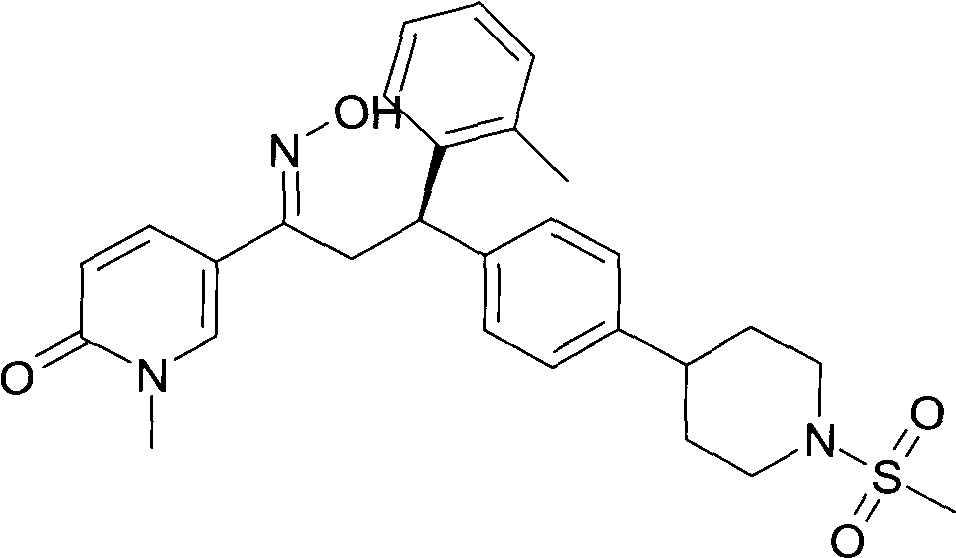
Стадия 1: (R)-1-метил-5-(3-(4-(пиперидин-4-ил)фенил)-3-о-толилпропаноил) пиридин-2(1H)-он
Соединение, указанное в заголовке, получили по аналогии с примером 483, стадия 1, из (R)-1-метил-5-(3-(4-(пиперидин-4-ил)фенил)-3-о-толилпропаноил)-пиридин-2(1H)-она (пример 508, стадия 1) и метансульфонилхлорида. Белая пена, MS (ESI+): m/z=493.2 [M+H]+.
Стадия 2: (R,E)-5-(1-(гидроксиимино)-3-(4-(1-(метилсульфонил)пиперидин-4-ил)фенил)-3-о-толилпропил)-1-метилпиридин-2(1H)-он
Соединение, указанное в заголовке, получили по аналогии с примером 506, стадия 5, из (R)-1-метил-5-(3-(4-(пиперидин-4-ил)фенил)-3-о-толилпропаноил)-пиридин-2(1H)-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Белая пена, MS (ESI+): m/z=508.3 [M+H]+.
Пример 510
(R,E)-4-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)пиперидин-1-сульфонамид
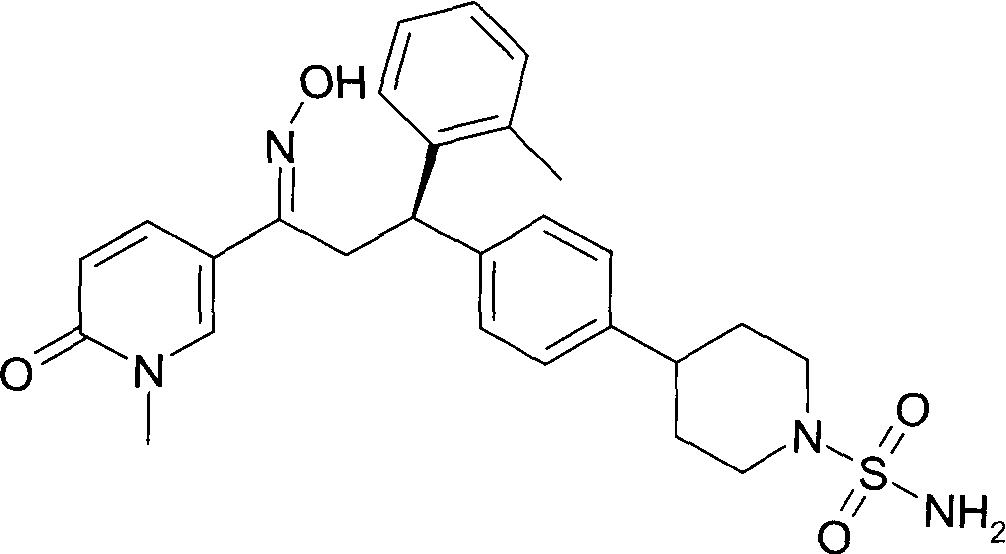
Стадия 1: (R)-4-(4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-1-сульфонамид
Соединение, указанное в заголовке, получили по аналогии с примером 480, стадия 2, из (R)-1-метил-5-(3-(4-(пиперидин-4-ил)фенил)-3-о-толилпропаноил)-пиридин-2(1H)-она (пример 508, стадия 1) и сульфамида. Белая пена, MS (ESI+): m/z=494.3 ([M+H]+).
Стадия 2: (R,E)-4-(4-(3-(гидроксиимино)-3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-1-о-толилпропил)фенил)пиперидин-1-сульфонамид
Соединение, указанное в заголовке, получили по аналогии с примером 506, стадия 5, из (R)-4-(4-(3-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-3-оксо-1-о-толилпропил)фенил)пиперидин-1-сульфонамида и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия. Светло-желтая смола, MS (ESI+): m/z=509.3 ([M+H]+).
Пример 511
(R,E)-1-(4-(4-(1-(4-хлор-2-метилфенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)пиперидин-1-ил)этанон

Стадия 1: (R)-3-(4-(1-Ацетилпиперидин-4-ил)фенил)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1 -он
Соединение, указанное в заголовке, получили по аналогии с примером 483, стадия 1, из (R)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)-3-(4-(пиперидин-4-ил)фенил)пропан-1-она (пример 480, стадия 1) и ацетилхлорида. Белая пена, MS (ESI+): m/z=475.0 [M+H]+.
Стадия 2: (R,E)-1-(4-(4-(1-(4-хлор-2-метилФенил)-3-(гидроксиимино)-3-(2-метилпиридин-4-ил)пропил)фенил)пиперидин-1-ил)этанон
По аналогии с примером 132, стадия 6, из (R)-3-(4-(1-ацетилпиперидин-4-ил)фенил)-3-(4-хлор-2-метилфенил)-1-(2-метилпиридин-4-ил)пропан-1-она и гидроксиламина гидрохлорида в присутствии гидрокарбоната натрия получили соединение, указанное в заголовке, в виде белой пены, MS (ESI+): m/z=490.0 [M+H]+.
Пример A
Покрытые оболочкой таблетки, содержащие следующие ингредиенты, могут быть изготовлены обычными способами:
|
Активный ингредиент просеивают и смешивают с микрокристаллической целлюлозой и смесь гранулируют с раствором поливинилпирролидона в воде. Гранулят смешивают с карбоксиметилкрахмалом натрия и стеаратом магния и прессуют с получением ядер весом 120 или 350 мг соответственно. Ядра покрывают водным раствором/суспензией вышеупомянутого пленочного покрытия.
Пример B
Капсулы, содержащие следующие ингредиенты могут быть изготовлены обычными способами:
|
Компоненты просеивают и смешивают и помещают в капсулы 2-го размера.
Пример C
Раствор для инъекций обладает следуюим составом:
|
Активный ингредиент растворили в смеси Полиэтиленгликоля 400 и воды для инъекций (часть). РН довели до 5,0 уксусной кислотой. Объем довели до 1,0 мл добавлением остаточного количества воды. Раствор отфильтровали, разлили в ампулы с использованием необходимого избытка и стерилизовали.
Пример D
Мягкие желатиновые капсулы, содержащие следующие ингредиенты, могут быть изготовлены обычными способами:
Содержимое капсулы
|
Желатиновая капсула
|
Активный ингредиент растворили в теплой расплавленной массе других ингредиентов, и смесь залили в мягкие желатиновые капсулы подходящего размера. Заполненные мягкие желатиновые капсулы обработали в соответствии с обычными процедурами.
Пример E
Сашеты, содержащие следующие ингредиенты могут быть изготовлены обычными способами:
|
Активный ингредиент смешивают с лактозой, микрокристаллической целлюлозой и карбоксиметилцеллюлозой натрия и гранулируют со смесью поливинилпирролидона в воде. Гранулят смешивают со стеаратом магния и вкусовыми добавками и помещают в сашеты.