СПОСОБ БИОЛОГИЧЕСКОГО КОНТРОЛЯ ЛИСТЕРИЙ
Вид РИД
Изобретение
Настоящее изобретение относится к новому способу биологической борьбы с Listeria и, в частности, с Listeria monocytogenes, а также к новой композиции, предназначенной для борьбы с быстрым размножением Listeria monocytogenes.
Listeria monocytogenes - грамположительная бактерия, принадлежащая к семейству Listeriaceae. У человека эта бактерия вызывает листериоз, прогноз которого часто летальный (10). У выживших часто наблюдают серьезные последствия. Патогенная бактерия может пересекать кишечный барьер и плацентарный барьер, тем самым вызывая инфицирование плода или новорожденного или преждевременные роды. Listeria monocytogenes является также основной причиной нейроинвазивной инфекции с повышающейся в последние пять лет распространенностью (5), (10). Следовательно, мониторинг и предотвращение листериоза составляют чрезвычайно важную задачу.
Listeria monocytogenes - бактерия с повсеместным распространением: она присутствует в почве, в воде, как эпифит на растениях и т.д. Очень устойчивая к очищающе-дезинфицирующим обработкам, она может, таким образом, проникать, например, в детали машин пищеперерабатывающей промышленности, или, например, в систему кондиционирования воздуха или водораспределительные сети.
В целом, и несмотря на медицинское значение этой бактерии, знания относительно экологии Listeria остаются относительно ограниченными (1). Однако известно, что в окружающей среде Listeria monocytogenes распространены повсеместно (15), т.к. эта бактерия выделена из почвы, из сточных вод или промышленных отработанных вод (4), характерно, что она связана со свободно живущими амебами. Кроме того, способность Listeria monocytogenes противостоять разрушению макрофагами человека дала возможность некоторым ученым выдвинуть гипотезу, что эта патогенная бактерия могла бы быть устойчива к свободно живущим в окружающей среде амебам, по аналогии с известными данными, касающимися взаимосвязей между паразитическими бактериями и амебами-хозяевами (6). Так, Ly и Muller предположили, что Listeria могла бы быть устойчива к свободно живущим амебам (6, 9). Эти гипотезы могли бы быть подтверждены, если бы эти авторы продемонстрировали, что Listeria monocytogenes была в состоянии размножаться в присутствии свободно живущей амебы, принадлежащей к роду Acanthamoeba (9, 6). Более того, цитотоксическое действие Listeria monocytogenes на амеб-хозяев было продемонстрировано после того, как наблюдали инцистирование Acanthamoeba, когда последнюю помещали в условия совместной культуры с патогенными бактериями (6, 9). Zhou et al. также смогли показать, что Listeria monocytogenes обладает способностью быть устойчивой к амебе Acanthamoeba castellanii (16). Также было продемонстрировано, что Listeria monocytogenes способна расти в присутствии биологического материала, выделенного амебой во время ее инцистирования или ее лизиса (1). Авторы этого наблюдения предположили, что эти факторы могли бы обеспечить Listeria благоприятные условия для поддержания и/или увеличения ее численности в окружающей среде (1). Другие наблюдения, проведенные Pushkareva и Ermolaeva, дали возможность продемонстрировать на другом свободно живущем простейшем (Tetrahymena pyriformis), что Listeria monocytogenes фактически поглощаются ими (11). Заражение Tetrahymena pyriformis паразитом Listeria monocytogenes вызывает инцистирование простейшего (11). Данные, полученные этими исследователями, также показывают, что Listeria monocytogenes, проникшие внутрь цист этих простейших, остаются жизнеспособными, сохраняют свою вирулентность и способны вызывать инфекции у модельных животных (11).
Таким образом, ясно видно, что свободно живущие простейшие и амебы составляют важный элемент экологии Listeria monocytogenes, способствуя их поддержанию и росту в окружающей среде и способствуя появлению свойств бактериальной вирулентности. Кроме того, способность Listeria инфицировать простейших и выживать в их цистических формах (11) является мощным признаком того, что простейшие - это факторы, которые поддерживают устойчивость Listeria к биоцидным обработкам, используемым в настоящее время (7, 8, 14). Биоцидные обработки, применяемые на сегодняшний день для предотвращения риска Listeria, не удовлетворительны, т.к. в дополнение к развитию видов устойчивости, присущих бактериям самим по себе (12, 13), бактерии, находящиеся внутри простейших или биопленок (2) относительно защищены, и будут, следовательно, продолжать размножаться/заселять окружающую их среду.
В этом контексте изобретатели продемонстрировали, совершенно неожиданно, что амебы рода Willaertia magna уничтожают бактерии Listeria monocytogenes. Этот биоцидный эффект добавляется к уже продемонстрированной способности Willaertia magna к хищничеству в отношении других амебных агентов, которые могут служить как переносчики для Listeria monocytogenes (3).
Объектом настоящего изобретения, следовательно, является, прежде всего, способ борьбы с быстрым размножением Listeria и, в частности, Listeria monocytogenes, который использует простейшие вида Willaertia magna. Способы изобретения не включают в себя способы обработки, применяемые к телу человека или животного. В способе изобретения чаще всего используют газ или поток жидкости, который обработан простейшими рода Willaertia и, в частности, вида Willaertia magna.
Для целей изобретения термин "Listeria" предназначен, чтобы обозначить любой вид Listeria и, в частности, Listeria monocytogenes.
Способ изобретения может, в частности, быть использован для дезинфекции канализационной воды или промышленных водораспределительных сетей, систем охлаждения циркулирующей водой промышленных предприятий, или сетей кондиционирования воздуха, или как дезинфектант поверхности. Простейшие могут быть непосредственно добавлены к воде или жидкостям, циркулирующим в трубах или сетях, подлежащих обработке. Также возможно распылить их, например, в форме жидкого раствора как аэрозоль, в промышленных сетях, дымоходах и предприятиях, и на промышленных поверхностях, которые следует дезинфицировать.
Преимущественно простейшие, использованные в контексте изобретения, соответствуют штамму, депонированному 26 августа 2006 г. под номером РТА 7824 в АТСС, или штамму, депонированному 26 августа 2006 г. под номером РТА 7825 в АТСС, эти два штамма были депонированы по поручению Centre National de la Recherche Scientifique (CNRS) [Французского национального центра научных исследований] - 3 rue Michel Ange - 75794 Paris Cedex 16 / France - и the Universite Lyon 1 Claude Bernard [Lyon 1 Claude Bernard University] - 43 Boulevard du 11 Novembre 1918-69622 Villeurbanne Cedex / France.
Простейшие, принадлежащие к роду Willaertia, соответствующие штамму, депонированному под номером РТА 7824 в АТСС, или штамму, депонированному под номером РТА 7825 в АТСС, являются неотъемлемой частью изобретения. Упомянутые депонированные штаммы РТА 7824 и РТА 7825 также описаны в публикации РСТ в международной заявке WO 2008/043969.
Такие простейшие могут, таким образом, быть использованы в дезинфицирующих средствах, в частности, предназначенных для уничтожения Listeria и, в частности, бактерий Listeria monocytogenes и для борьбы с размножением и с контаминацией листериозом.
Задача изобретения согласно другому его объекту - дезинфицирующее средство, содержащее простейшие рода Willaertia и, в частности, вида Willaertia magna. Простейшие, соответствующие штамму, депонированному под номером РТА 7824 в АТСС, или штамму, депонированному под номером РТА 7825 в АТСС, будут предпочтительны.
Преимущественно, дезинфицирующее средство изобретения находится в форме водного раствора или суспензии, например, в дистиллированной воде. Дезинфицирующее средство может быть в распыляемой форме, как, например, аэрозоль или любое другое средство применения.
Активность ингибирования быстрого размножения Listeria monocytogenes простейшими рода Willaertia и, в частности, вида Willaertia magna была продемонстрирована изобретателями путем сравнения репликации Listeria monocytogenes в родах Acanthamoeba и Hartmannella, использованных как амебные модели, с той, что наблюдалась в роде амеб Willaertia.
Учитывая ключевую роль, играемую амебами в размножении и поддержании численности Listeria и, в частности, Listeria monocytogenes, во внешней окружающей среде, элементы которой обуславливают эпидемиологию листериоза, так как передача от человека к человеку отсутствует, способ и дезинфицирующее средство изобретения обладают многочисленными преимуществами, в частности, в отношении затрат, эффективности и экологичности.
Примеры ниже дают возможность проиллюстрировать изобретение, но не носят ограничивающий характер.
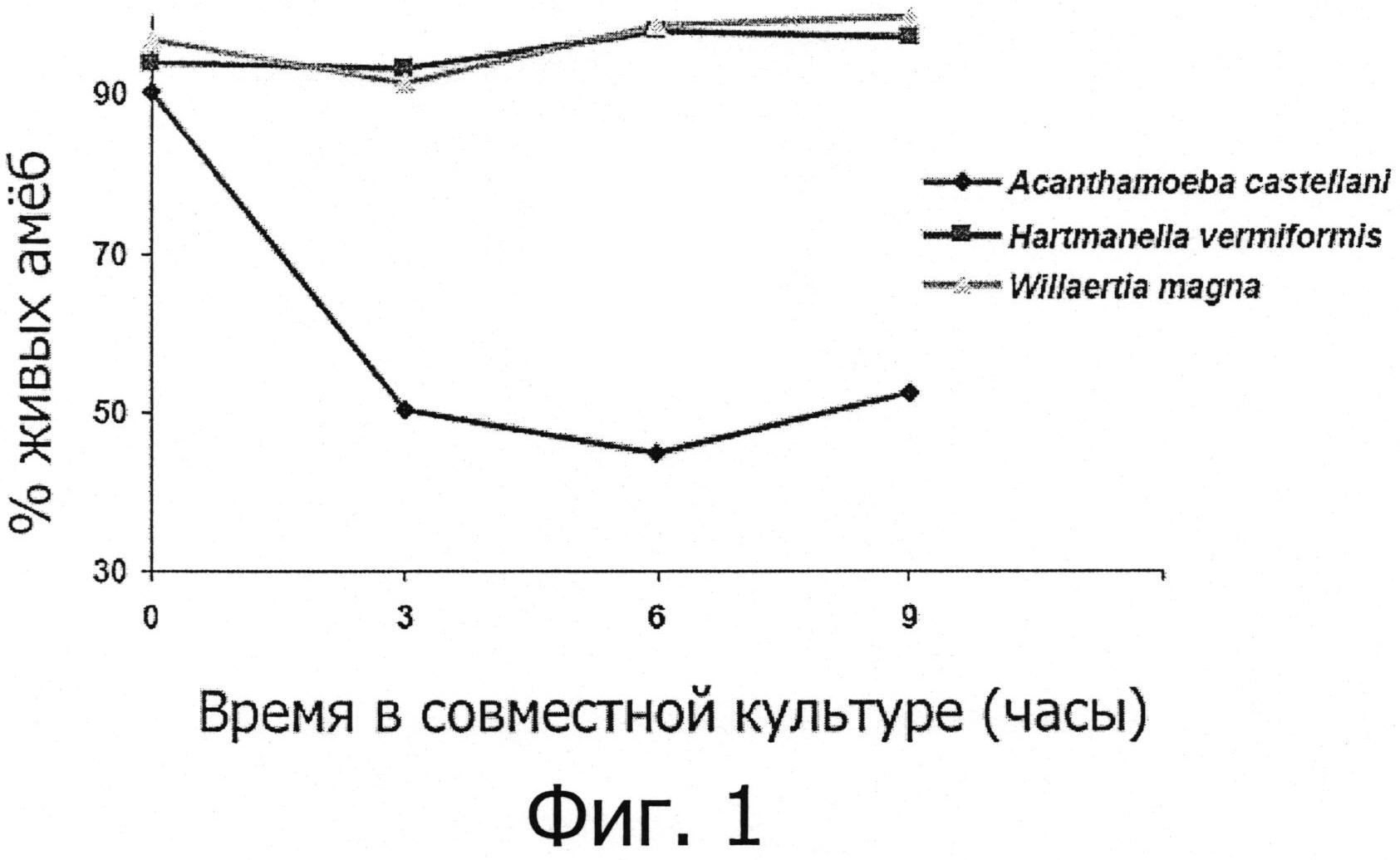
Фигура 1 демонстрирует самопроизвольное развитие соответствующих популяций амеб Hartmannella, Acanthamoeba и Willaertia после размещения в совместной культуре с Listeria monocytogenes при начальном соотношении амеба/бактерия 10.
Различные виды свободно живущих амеб помещали в совместную культуру (время 0 ч) с Listeria monocytogenes при соотношении 10 (10 бактерий / 1 амеба), как описано в разделе «Материалы и методы». Аликвоты суспензий клеток затем отбирали каждые 3 часа, следующие за размещением в совместной культуре, и процент живых амеб определяли посредством теста на вытеснение трипанового синего и наблюдений под микроскопом, используя камеру Малазеса. Данные выражали как % живых клеток, отрицательных по тесту на вытеснение трипанового синего.
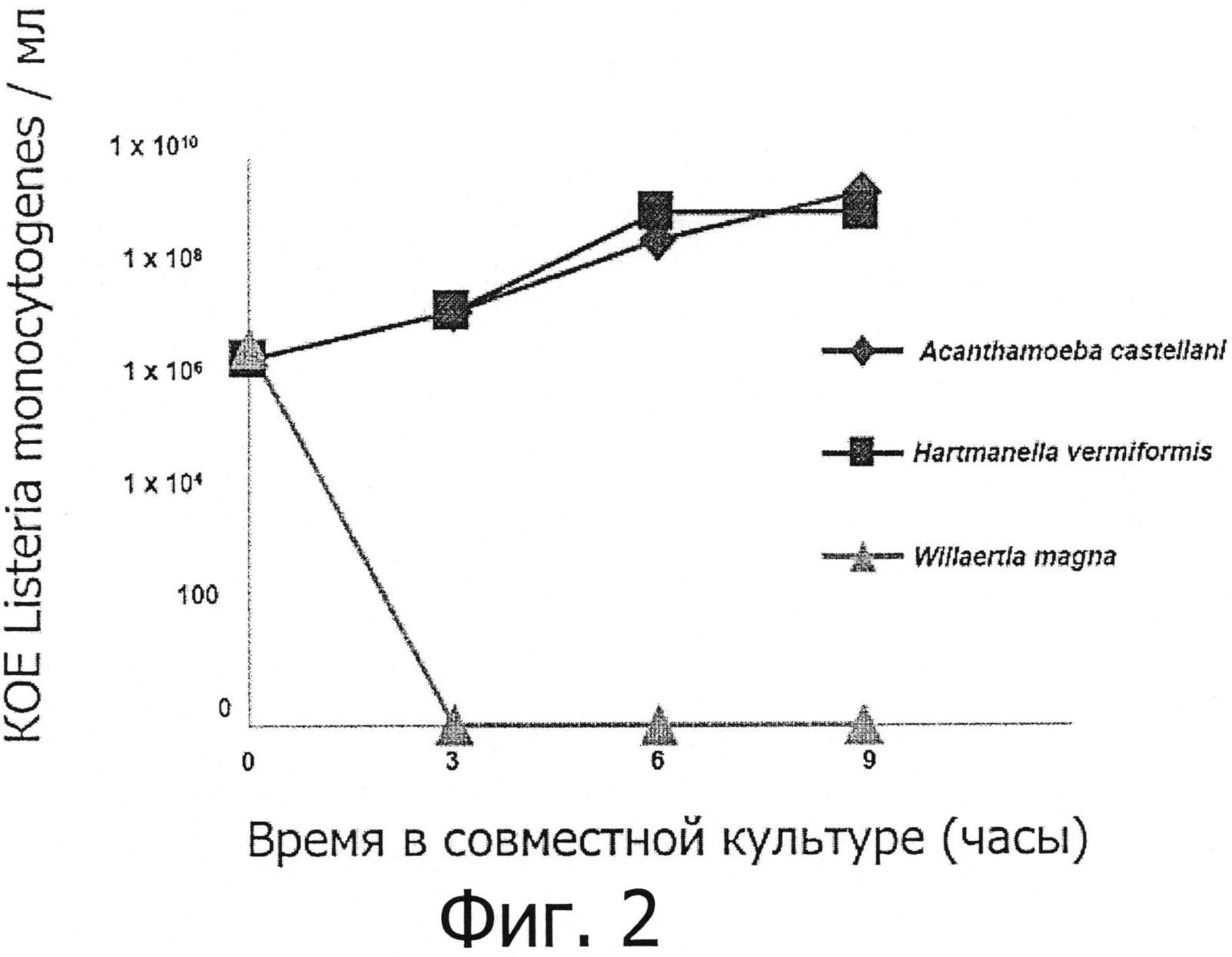
Фигура 2 демонстрирует сравнительные кинетики развития Listeria monocytogenes полученные в совместных культурах с различными родами амеб, включая род Willaertia.
Различные виды свободно живущих амеб по отдельности помещали в совместные культуры (время 0 ч) с Listeria monocytogenes при соотношении 10 (10 бактерий / 1 амеба). Аликвоты суспензий клеток затем отбирали каждые 3 часа, следующие за размещением в совместной культуре, и концентрации Listeria monocytogenes определяли, как описано в разделе «Материалы и методы».
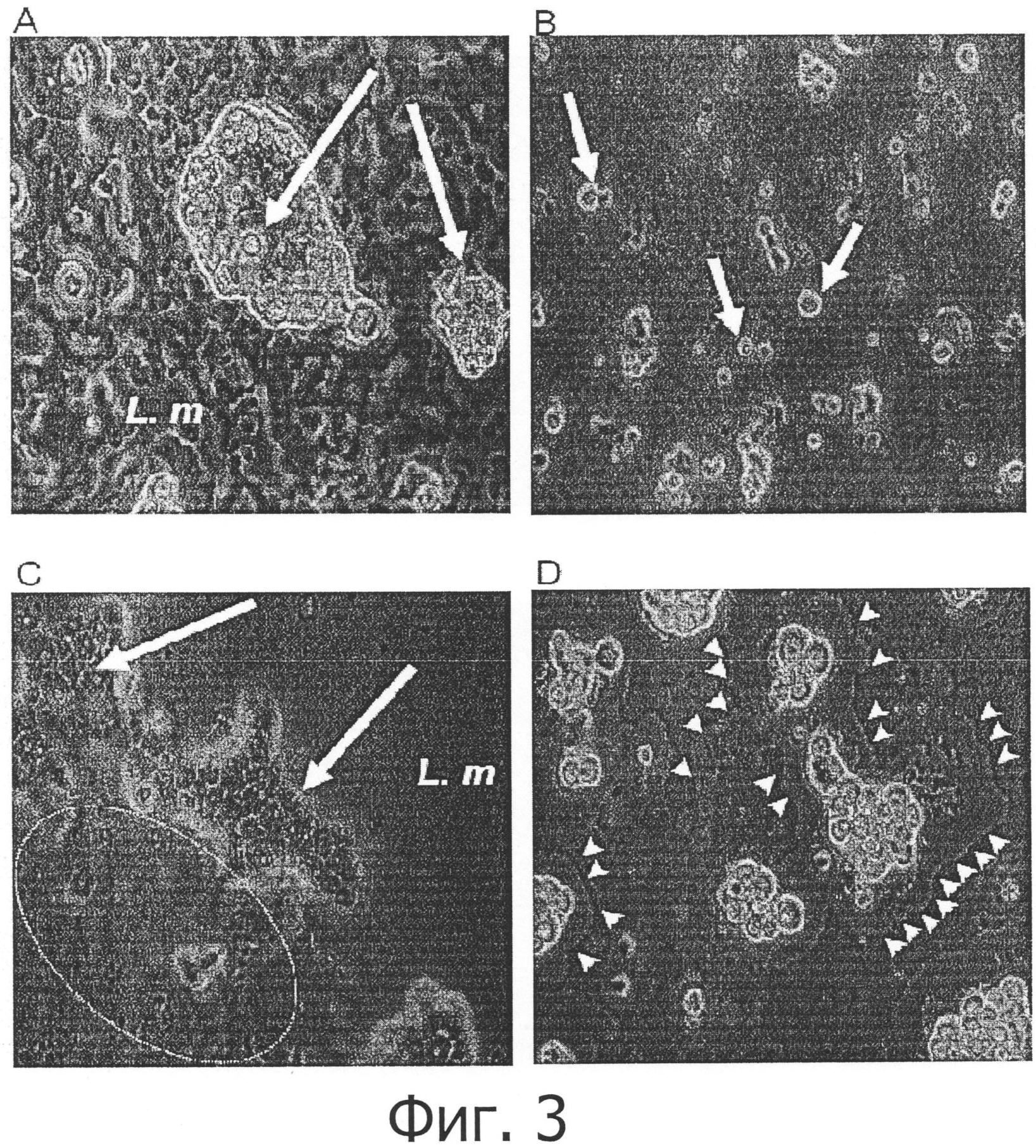
Фигура 3 демонстрирует биоцидное действие Willaertia magna на биопленку, образованную Listeria monocytogenes. Эта фигура также показывает отсутствие влияния свободно живущих амеб Acanthameoba castellanii и Hartmanella vermiformis.
Listeria monocytogenes инокулировали в ТСА (триптоно-соевый агар), который инкубировали при 30°С в течение 48 часов, чтобы обеспечить образование плотной биопленки бактерий на агаре. Затем 1×105 амеб (Acanthamoeba castellanii, панель А; Hartmanella vermiformis, панель В; Willaertia magna, панели С и D) ресуспендировали в 100 мкл стерильной деионизированной воды и инокулировали в центре агара. После 24 часов при 30°С агары исследовали под микроскопом, чтобы определить появление амеб и влияние последних на биопленку.
А: Белые стрелки показывают на появление групп цист, образованных Acanthamoeba castellanii в присутствии Listeria monocytogenes (L. m.). Следует обратить внимание на отсутствие бляшек лизиса бактериального слоя вокруг групп амебных цист.
В: Отмечаем присутствие многочисленных цистических форм Hartmanella vermiformis, некоторые примеры которых указаны белыми стрелками. Также отмечаем очень высокую плотность Listeria monocytogenes, окружающих цисты Hartmanella vermiformis, и полное отсутствие бляшек лизиса бактериальной биопленки.
С: Влияние Willaertia magna на биопленку, образованную Listeria monocytogenes. Белые стрелки указывают группы трофозоитов Willaertia magna, размещенных спереди бляшек лизиса биопленки. Обращаем внимание на отсутствие бактериальной пленки (зона, обведенная белым кругом в левом нижнем углу микрофотографии) позади групп Willaertia magna и плотную бактериальную пленку (показанную инициалами L. m.) перед группами амеб (верхний правый угол микрофотографии).
D: другая микрофотография, показывающая образование бляшек лизиса биопленки, образованной Listeria monocytogenes. Отмечаем группы Willaertia magna и фронты бляшек лизиса бактериальной биопленки (показаны белыми точками).
1. МАТЕРИАЛЫ И МЕТОДЫ
1.1. Используемые штаммы
Listeria monocytogenes: используемый штамм является штаммом CL 3970 (Oxoid, France).
Он поддерживается на ТСА (триптоно-соевом агаре) (ref РО 5012, Oxoid, France) при интенсивности 1 пересев в неделю. Штамм инокулируют в широкие полосы на пластины ТСА и инкубируют в течение 2 дней при 30°С.
Amoebae: используемые штаммы принадлежат к трем различным видам амеб:
- Hartrnannella vermiformis,
- Acanthamoeba castellanii, штаммы, депонированные в АТСС под номером 30010,
- Willaertia magna (штаммы, депонированные в АТСС под номерами РТА7824 и РТА 7825).
Эти три штамма культивируют в чистой культуре, в присутствии 10% фетальной телячьей сыворотки, на среде SCGYEM (среда, содержащая сыворотку, казеин, глюкозу, дрожжевой экстракт), распространяемой в пробирках Falcon (3033) в количестве 3 мл на пробирку. Для поддержания [культуры] вегетативные формы пересевали каждые 8-9 дней. Для сокультивирования использовали субкультуры возрастом от 3 до 4 дней, так, чтобы в них имелись трофозоиты непосредственно в фазе экспоненциального роста.
Среду SCGYEM получали, как указано ниже:
|
2,5 мл NaOH (IN), затем Na2HPO4 и КН2РO4 добавляли к 900 мл дистиллированной воды. Смесь слегка нагревали на плите, и затем постепенно добавляли казеин при магнитном перемешивании. После полного растворения казеина в состав вводили глюкозу и дрожжевой экстракт.
После полного растворения смесь последовательно фильтровали на стекловолокне (Sartorius SM 6513400) и затем на мембране 1 мкм (Whatman 7190 004). Аликвоты среды затем помещали в стеклянные бутылки. Бутылки стерилизовали в автоклаве в течение 20 минут при 120°С перед окончательным использованием и розливом среды, стерильно добавляли фетальную телячью сыворотку под вытяжным шкафом с ламинарным потоком в количестве 10% от конечного объема.
1.2. Сокультивирование Listeria monocytogenes с одним видом амеб
1.2.1. Подготовка бактериального инокулята
Суспензию Listeria monocytogenes в стерильной дистиллированной воде готовили из 2-дневной культуры на ТСА так, чтобы получить 1 единицу оптической плотности при 550 нм, т.е. концентрацию 109 КОЕ/мл.
1.2.2. Проведение сокультивирования с одним видом амеб
Сокультивирование проводили в пробирках для культуры клеток (Falcon® 3033), содержащих 3 мл стерилизованной в автоклаве воды. Инокуляцию пробирок осуществляли в пропорции 1×105 амеб/мл, из суспензии чистой амебной культуры предварительно наклоненной на гемоцитометре Малазеса. Заражение амеб Listeria monocytogenes проводили при фиксации соотношения Listeria monocytogenes/амебы, равном 10, т.е. 1×106 бактерий/мл инкубационной среды. Непосредственно после заражения пробирки с совместными культурами центрифугировали при низкой скорости (760 g в течение 10 мин), чтобы способствовать взаимодействию между амебами и бактериями. После 10 мин пробирки суспендировали повторно вручную и инкубировали в наклонном положении в инкубаторе при 30°С.
Судьбу амеб и Listeria monocytogenes, помещенных в совместную культуру, определяли следующим способом:
За совместными культурами наблюдали в течение 9 часов после бактериального заражения. В каждом промежутке времени (каждые 3 часа) отбирали образцы из пробирок с культурами и исследовали как в отношении амеб, так и в отношении бактерий после энергичного перемешивания на воронке, чтобы отделить амеб от стенок. Для каждой пробирки оценивали:
- Количество амеб, подсчитанное непосредственно в камере Малазеса;
- Концентрации Listeria monocytogenes определяли прямым засевом культуральной среды на ТСА после 10-кратного последовательного разведения в стерильной дистиллированной воде, в микропробирках Эппендорфа. Каждое разведение засевали на ТСА в 3-кратной повторности в количестве 100 мкл на планшет. Планшеты затем инкубировали при 30°С в течение как минимум 48 часов. Первую оценку ТСА проводили 24 часа после засева, путем подсчета колоний; за этим следовала вторая оценка на 2-й день для подтверждения. Концентрации Listeria monocytogenes выражали в КОЕ/мл инкубационной среды, принимая во внимание фактор разведения и подразумевая, что каждая колония соответствует одной бактерии, изначально присутствующей в разведенной суспензии.
Для каждого рода амеб кривые роста Listeria monocytogenes представлены как функция от времени.
В дополнение, возможное цитотоксическое действие Listeria monocytogenes на различные виды амеб определяли следующим способом:
- подсчетом доли амеб, которые позитивны в тесте на вытеснение трипанового синего. Этот тест проводили под микроскопом путем подсчета в камере Малазеса количества клеток, позитивных в тесте на вытеснение трипанового синего/общего количества клеток;
- определением склонности амеб к инцистированию в присутствии Listeria monocytogenes.
1.3. Действие Willaertia masna на биопленки Listeria monocytogenes
Биопленки Listeria monocytogenes формировали следующим способом: заданное количество Listeria monocytogenes в 100 мл стерильной воды осаждали и помещали на ТСА. Агары выдерживали при 30°С в течение 48 часов, так, чтобы позволить образование плотной и однородной бактериальной пленки над полной поверхностью агара. Затем 1×105 амеб (Acanthamoeba castellanii, Hartmanella vermiformis или Willaertia magnd) размещали по центру агара, который выдерживали при 30°С в течение 24 часов. Агары затем наблюдали под световым микроскопом (увеличение × 400), чтобы обнаружить на них образование возможных бляшек лизиса бактериального слоя.
2. РЕЗУЛЬТАТЫ
2.1. Willaertia masna проявляет устойчивость к Listeria monocytosenes
Влияние Listeria monocytogenes на выживаемость различных видов протестированных амеб определяли посредством теста на вытеснение трипанового синего. Очень быстро после помещения Acanthamoeba castellanii в совместную культуру с бактерией, сильный цитотоксический эффект наблюдали у этих видов амеб, с падением ~ 50% жизнеспособности после 3 часов совместного культивирования (см. фигуру 1). Наоборот, это явление никогда не наблюдали, когда Willaertia magna помещали в совместную культуру с Listeria monocytogenes, включая вплоть до 9 часов инкубации с жизнеспособностью, которая поддерживалась на уровне, близком к 100% (фигура 1). Подобно Willaertia magna, свободно живущая амеба Hartmanella vermiformis не проявляет какого-либо ухудшения в отношении жизнеспособности, определяемого тестом на вытеснение трипанового синего (фигура 1). Однако микроскопическое исследование совместных культур амеб и Listeria monocytogenes демонстрирует сильную склонность к инцистированию у Hartmanella vermiformis и у жизнеспособных форм Acanthamoeba castellanii (см. таблицу 1). Это явление инцистирования никогда не наблюдали у Willaertia magna, если ее помещали в совместную с патогенной бактерией культуру (см. таблицу 1).
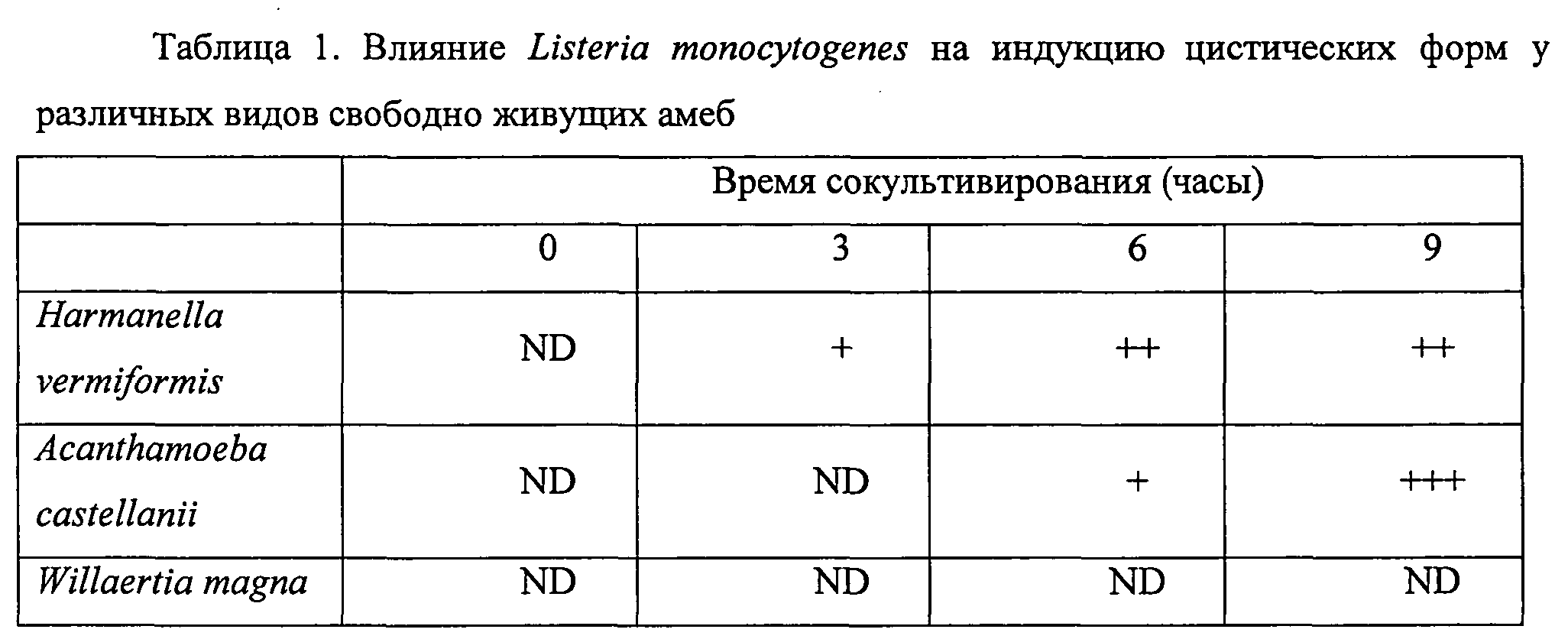
Свободно живущих бактерий помещали в совместную культуру (продолжительность 0 часов) с Listeria monocytogenes при соотношении 10 (10 бактерий / 1 амеба), как описано в разделе «Материалы и методы». Аликвоты суспензий клеток затем отбирали каждые 3 часа следующие за размещением в совместной культуре, как показано в таблице выше. Плотность амебных цист выражали следующим способом.
ND: цисты не обнаружены; +: присутствие цист (доля меньше чем 10% жизнеспособных форм); ++: присутствие цист (доля между 10% и 30% жизнеспособных форм); +++: присутствие цист (доля больше чем 30% жизнеспособных форм).
Все эти наблюдения (отсутствие инцистирования и цитотоксичности, индуцируемых Listeria monocytogenes) ясно демонстрируют, что Willaertia magna, в противоположность другим видам амеб, проявляет изначальную способность быть устойчивой к Listeria monocytogenes.
2.2. Хищничество Willaertia таупа в отношении Listeria monocytosenes
Результаты совместного культивирования Listeria monocytogenes, проведенного в присутствии амеб, принадлежащих к родам Hartmannella и Acanthamoeba демонстрируют значительное увеличение количества бактерий в присутствии этих двух амебных родов, т.к. увеличение, достигающее ~ 3 log в концентрациях бактерий, отмечено через 9 часов (см. фигуру 2). Напротив, хотя совместные культуры вели в строго одинаковых условиях, полное исчезновение поддающихся обнаружению Listeria monocytogenes отмечено в присутствии амебы Willaertia magna (см. фигуру 2). Измеренное падение концентраций Listeria monocytogenes составляет ~ 6 log через 3 часа, демонстрируя мощное хищническое действие Willaertia magna в отношении Listeria monocytogenes.
Влияние Willaertia magna на Listeria monocytogenes дополнительно проиллюстрировано на фигуре 3. Так, после 24 часов в присутствии Willaertia magna, поверхность агара, на которой исчез бактериальный слой выявляется очень ясно (эти зоны рассматриваются здесь как бляшки лизиса бактериального слоя/биопленки). Микроскопическое исследование также показывает, что Willaertia magna концентрируется в пределах этой бляшки лизиса; этот эффект проиллюстрирован на фигуре 3, панель С. Разрушение бактериального слоя амебами Willaertia magna также проиллюстрировано на панели D фигуры 3, где явно различимы группы амеб, окруженные бактериальным слоем, который разрушен или находится в процессе разрушения. Наоборот, в присутствии Acanthamoeba castellanii или Hartmanella vermiformis, никогда невозможно наблюдать это явление. Микроскопическое исследование агаров показывает, что амебы Acanthamoeba castellanii и Hartmanella vermiformis быстро образуют цисты если попадают на пленку Listeria monocytogenes. Это явление проиллюстрировано на панелях А и В фигуры 3. Также отмечается полное отсутствие каких-либо бляшек лизиса бактериального слоя вокруг цист Acanthamoeba castellanii и Hartmanella vermiformis, в противоположность явлению, наблюдаемому на Willaertia magna. Все эти данные и наблюдения ясно показывают хищническое действие Willaertia magna в отношении патогенной бактерии Listeria monocytogenes.
Ссылки на литературу
1. Akya A, Pointon A, and Thomas С. Viability of Listeria monocytogenes in coculture with Acanthamoeba spp. FEMS Microbiol Ecol 70: 20-29, 2009.
2. Belessi CE, Gounadaki AS, Psomas AN, and Skandamis PN. Efficiency of different sanitation methods on Listeria monocytogenes biofilms formed under various environmental conditions. Int JFood Microbiol 145 Suppi 1: S46-52, 2011.
3. Bodennec J, Dey R, and Pemin P. Novel method for biologically combating the proliferation of Legionella pneumophila, and novel disinfecting agent containing amoebic protozoa рода Willaertia. edited by University CBL. France: 2010.
4. Dijkstra RG. The occurence of Listeria monocytogenes in surface water of canals and lakes, in ditches of one big polder and in the effluents and canals of a sewage treatment plant. Zentralbl Bakteriol Mikrobiol Hyg[B] 176: 202-205, 1982.
5. Goulet V, Hedberg С, Le Monnier A, and de Valk H. Increasing incidence of listeriosis in France and other European countries. Emerg Infect Dis 14: 734-740, 2008.
6. Greub G, and Raoult D. Microorganisms resistant to free-living amoebae, din Microbiol Rev 17: 413-433, 2004.
7. Khunkitti W, Lloyd D, Furr JR, and Russell AD. Acanthamoeba castellanii: growth, encystment, excystment and biocide susceptibility. J Infect 36: 43-48, 1998.
8. Lloyd D, Turner NA, Khunkitti W, Hann AC, Furr JR, and Russell AD. Encystation in Acanthamoeba castellanii: development of biocide resistance. J Eukaryot Microbiol 48:11-16, 2001.
9. Ly TMC, and Muller HE. Ingested Listeria monocytogenes survive and multiply in protozoa. J Med Microbiol 33: 51-54, 1990.
10. Mailles A, Lecuit M, Goulet V, Leclercq A, and Stahl JP. Listeria monocytogenes encephalitis in France. MedMal Infect hi Press.
11. Pushkareva VI, and Ermolaeva SA. Listeria monocytogenes virulence factor Listeriolysin O favors bacterial growth in coculture with the ciliate Tetrahymena pyrifonnis, causes protozoan encystment and promotes bacterial survival inside cysts. BMC Microbiol 10: 26, 2010.
12. Rajkovic A, Smigic N, Uyttendaele M, Medic H, de Zutter L, and Devlieghere F. Resistance of Listeria monocytogenes, Escherichia coli 0157:H7 and Campylobacterjejuni after exposure to repetitive cycles of mild bactericidal treatments. Food Microbiol 26: 889-895, 2009.
13. Rakic-Martinez M, Drevets DA, Dutta V, Katie V, and Kathariou S. Listeria monocytogenes strains selected on ciprofloxacin or the disinfectant benzalkonium chloride exhibit reduced susceptibility to ciprofloxacin, gentamicin, benzalkonium chloride and other toxic compounds. Appi Environ Microbiol In Press, 2011.
14. Thomas V, Bouchez Т, Nicolas V, Robert S, Loret JF, and Levi Y. Amoebae in domestic water systems: resistance to disinfection treatments and implication in Legionella persistence. JAppi Microbiol 97: 950-963, 2004.
15. Weis J, and Seeliger HP. Incidence of Listeria monocytogenes in nature. Appi Microbiol 30: 29-32, 1975.
16. Zhou X, Elmose J, and Call DR. Interactions between the environmental pathogen Listeria monocytogenes and a free-living protozoan (Acanthamoeba castellanii). Environ Microbiol 9: 913-922, 2007.