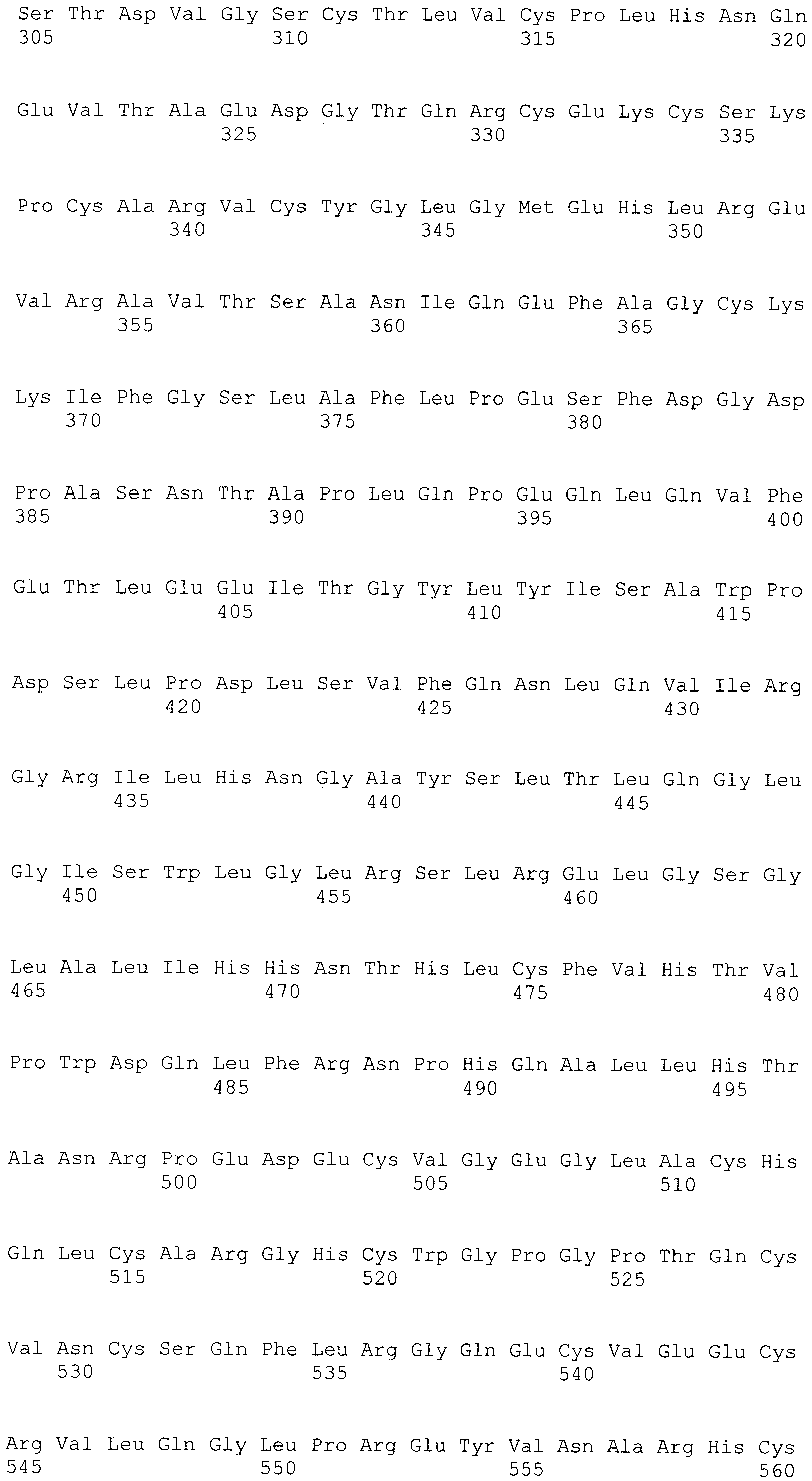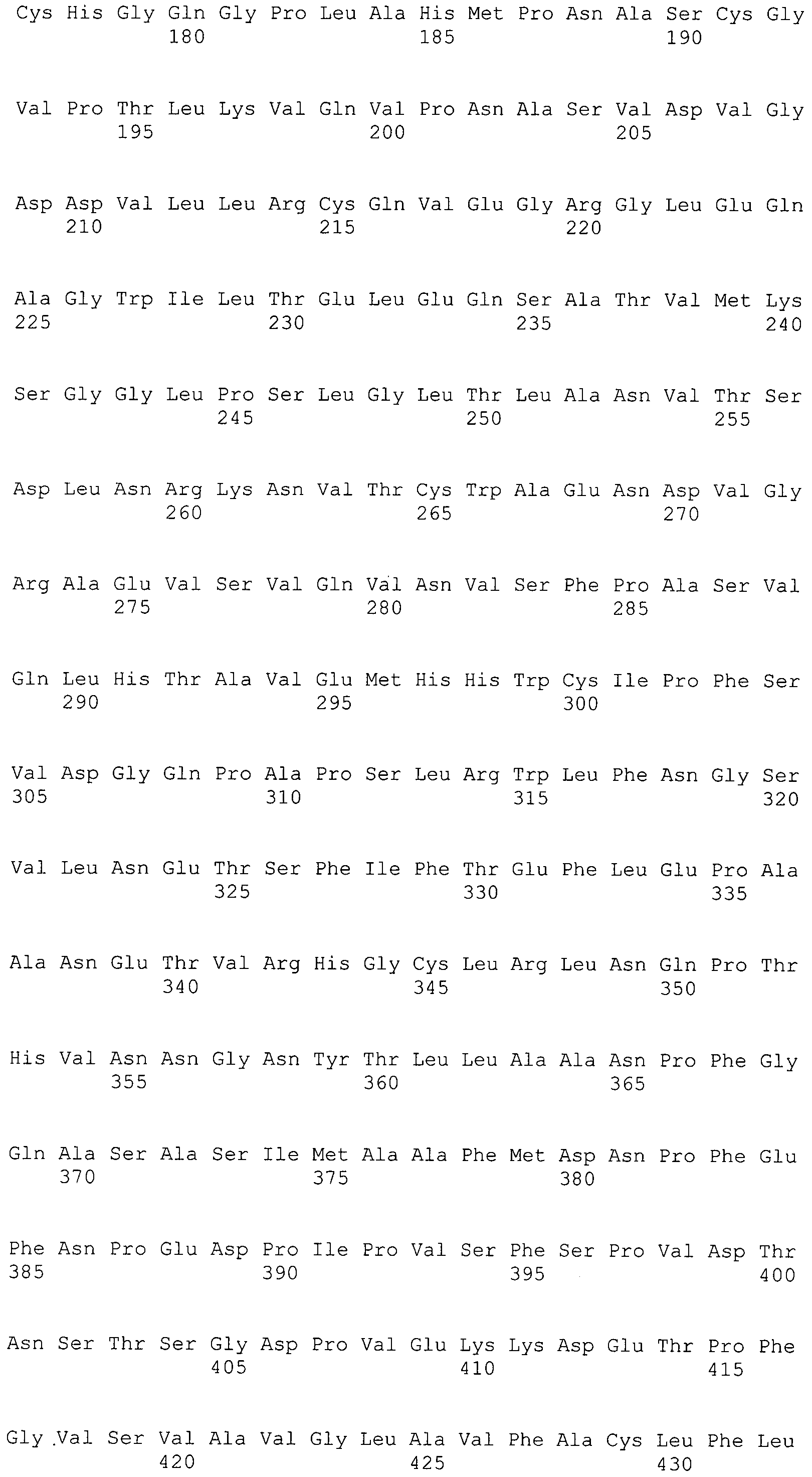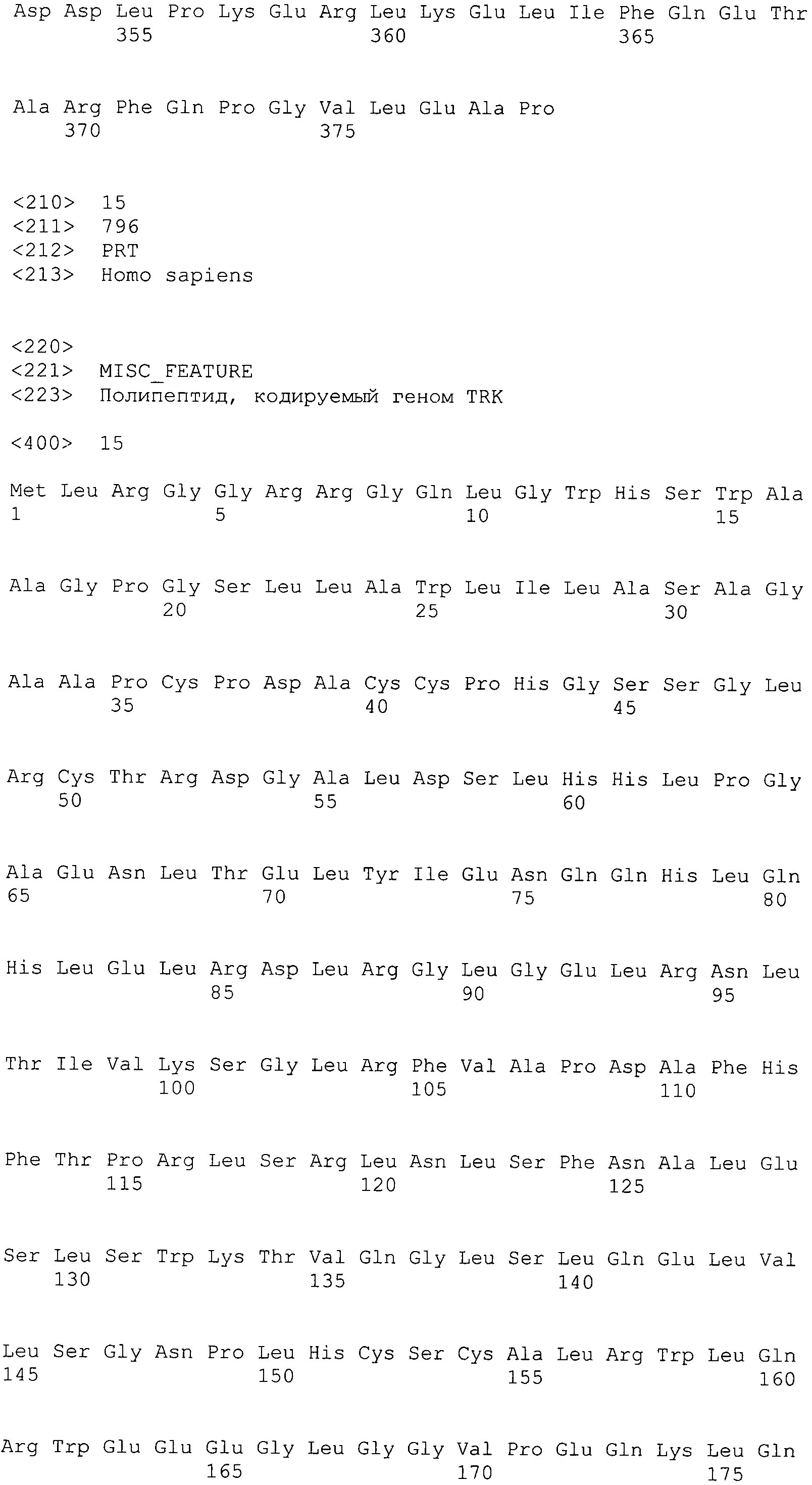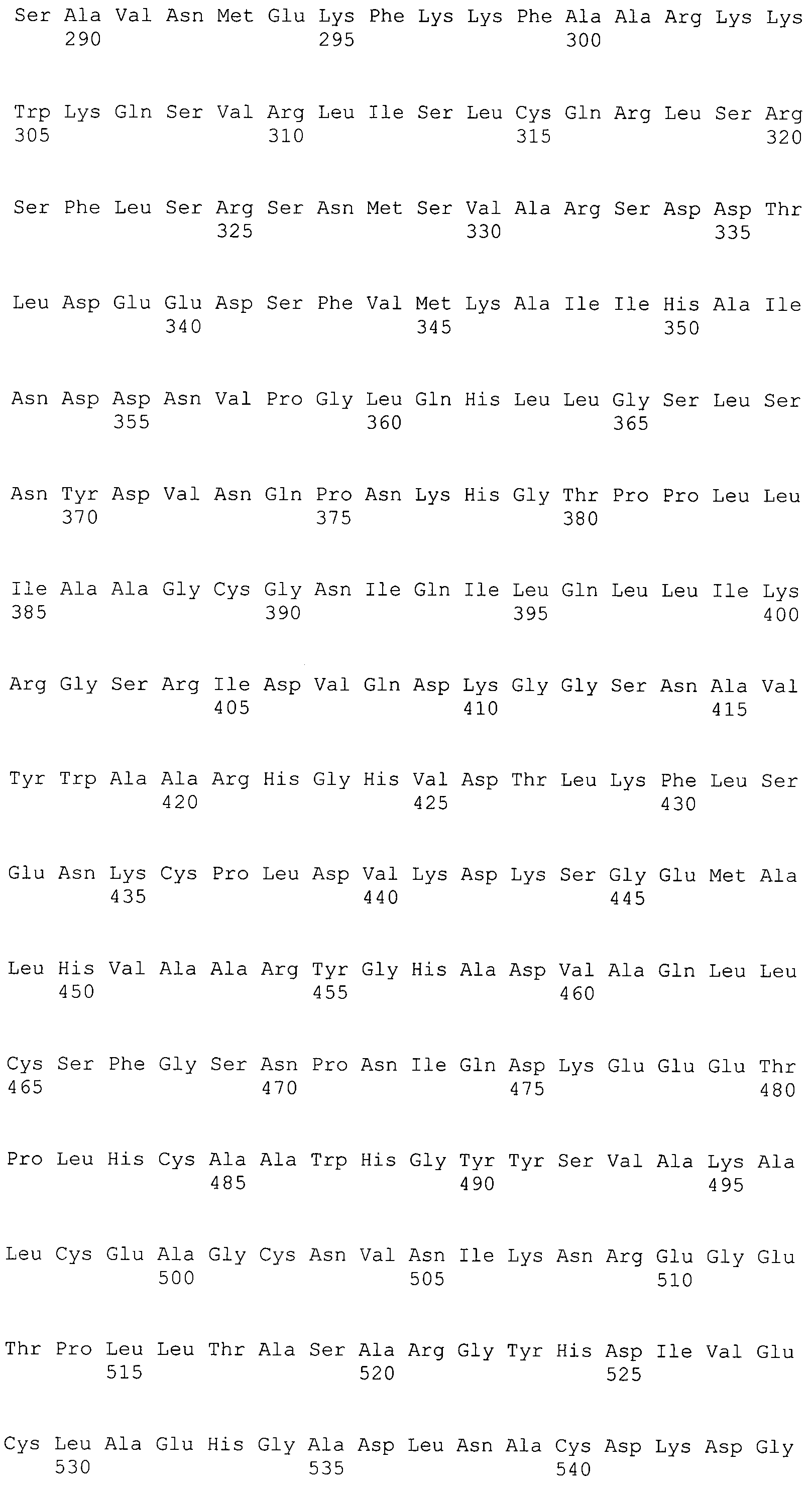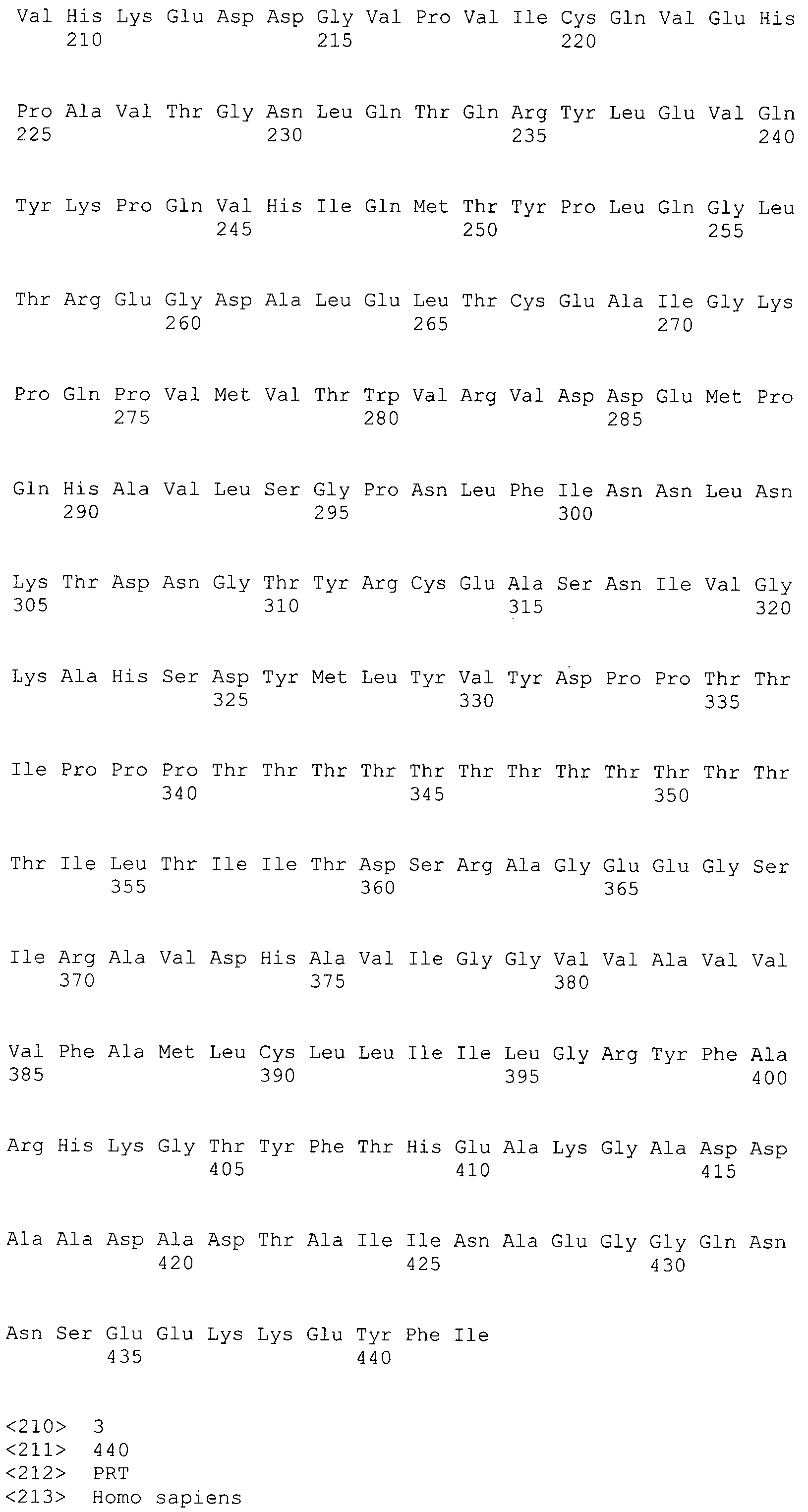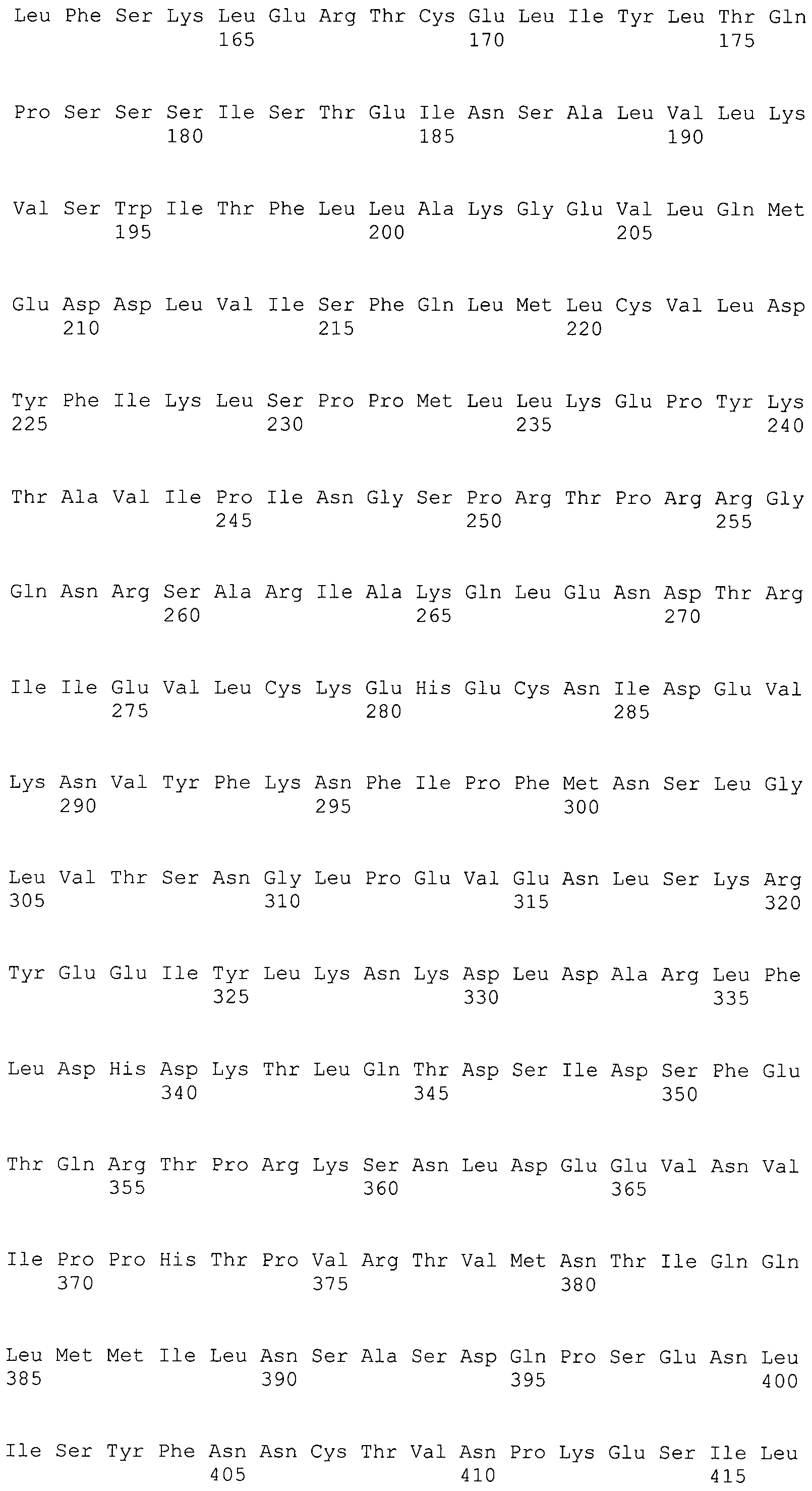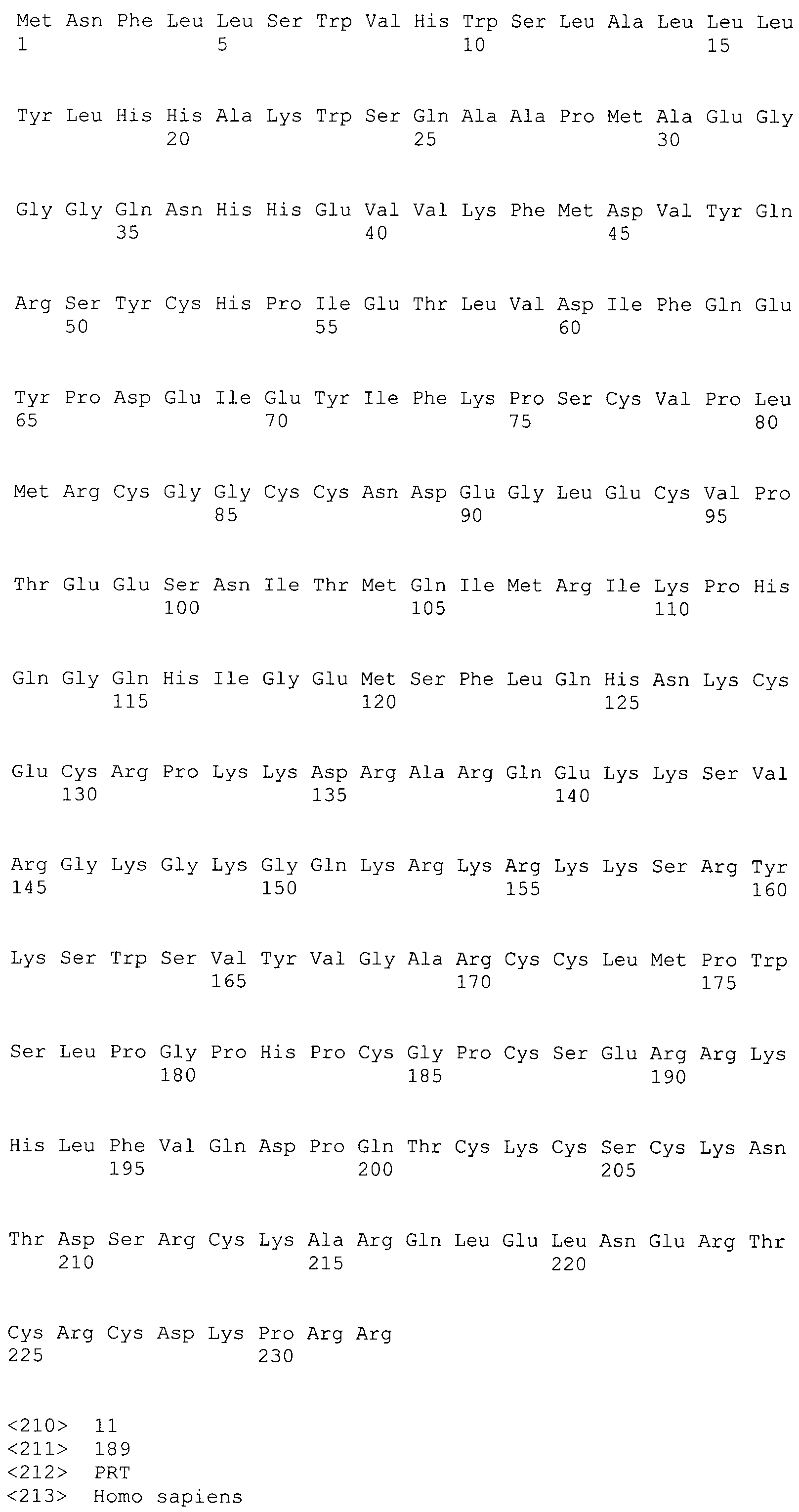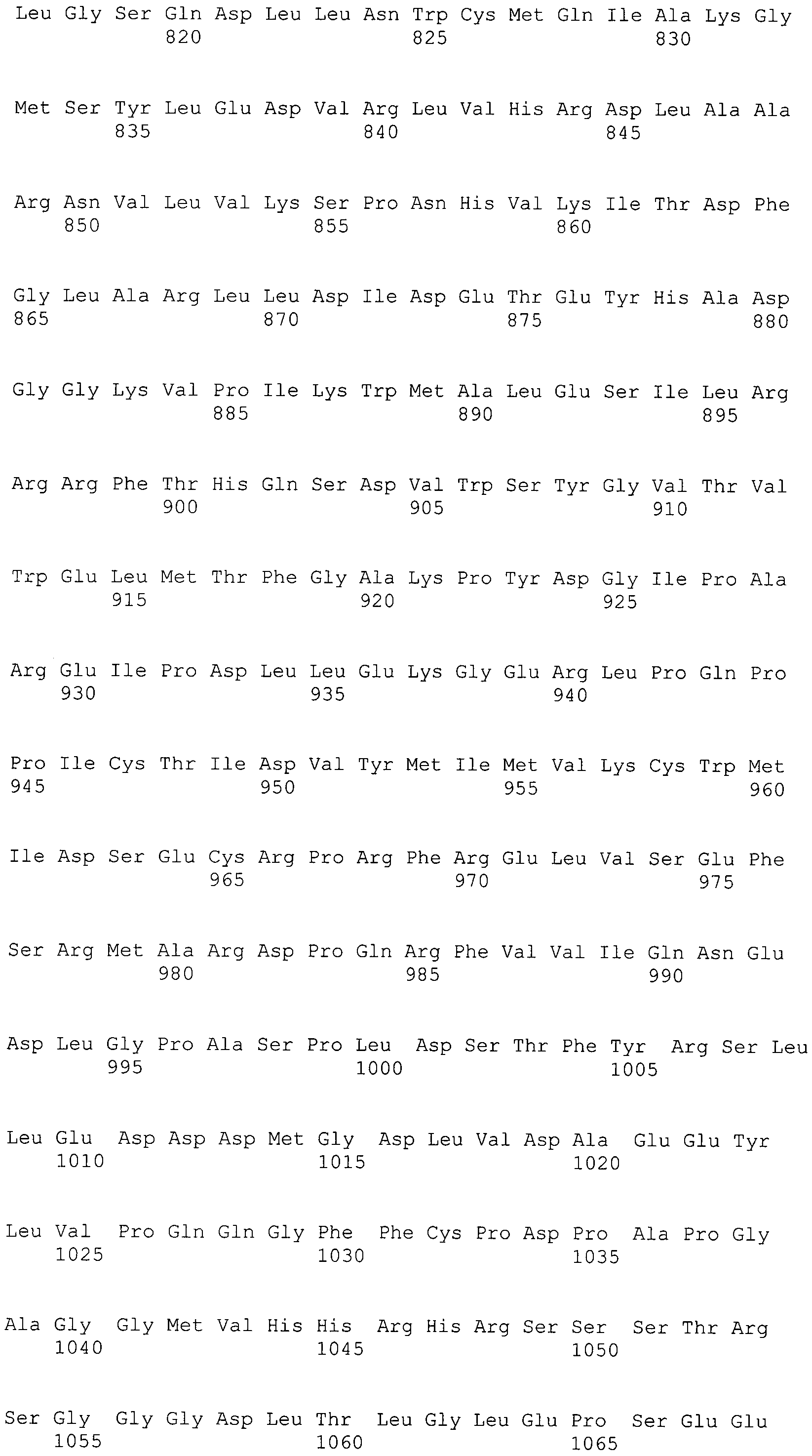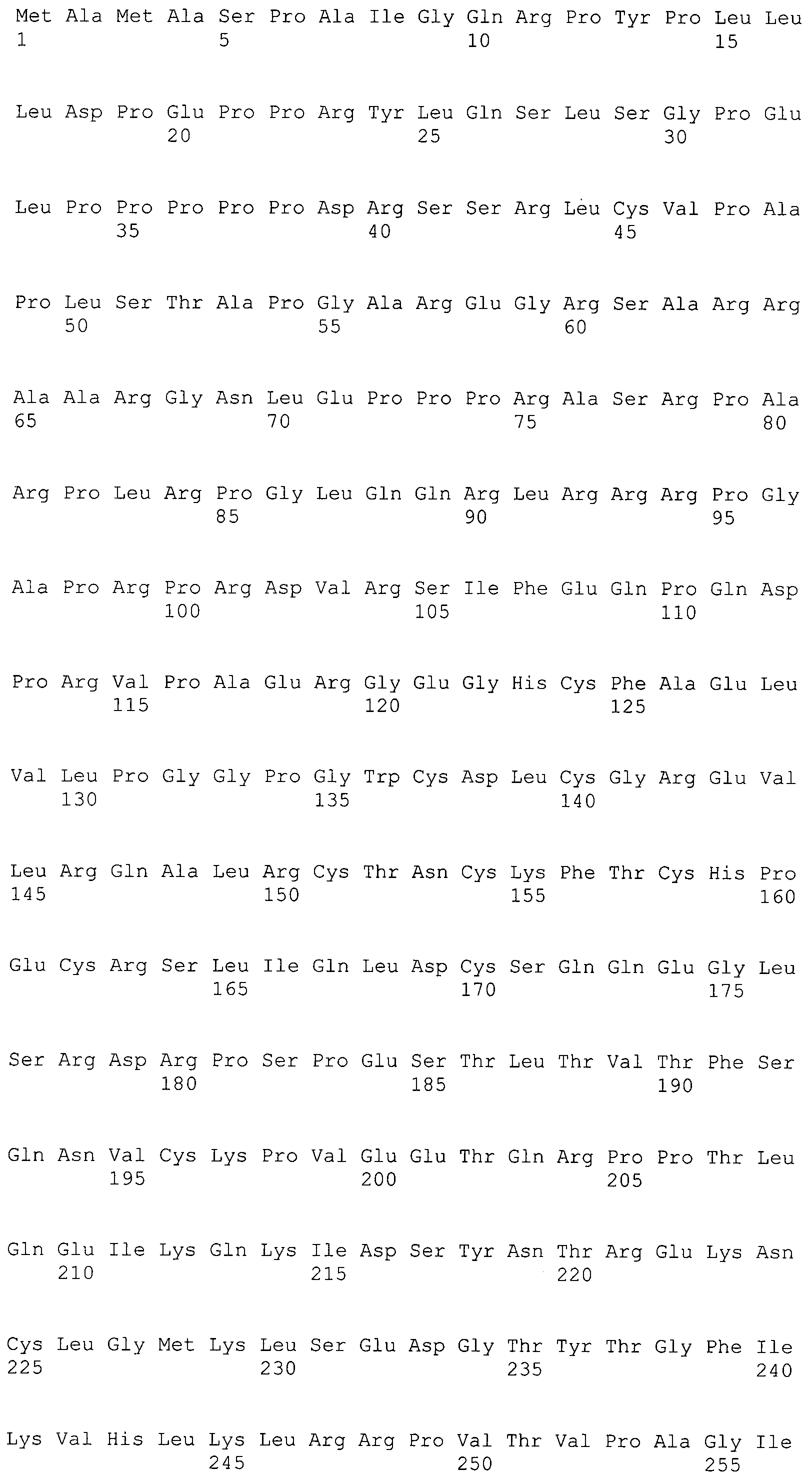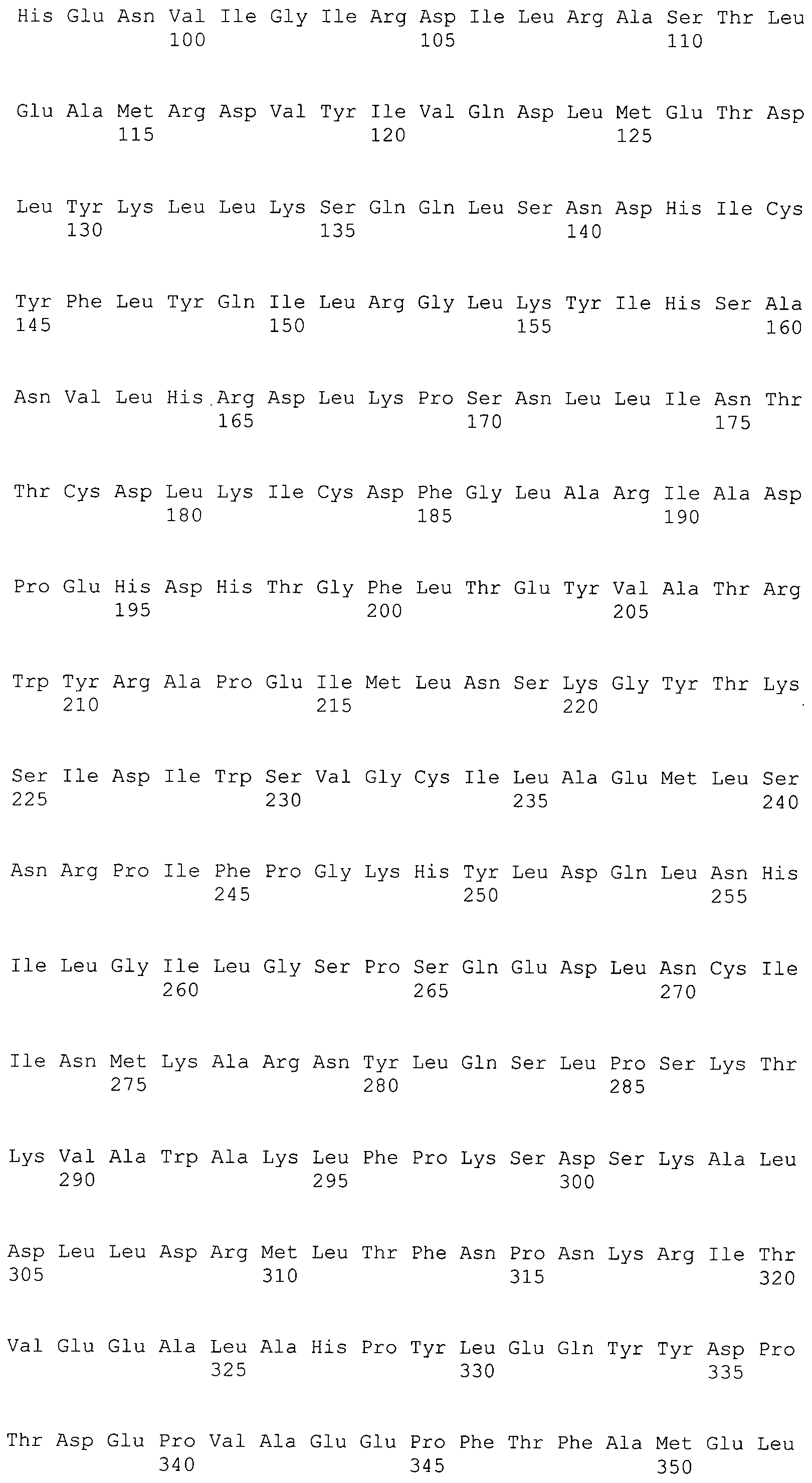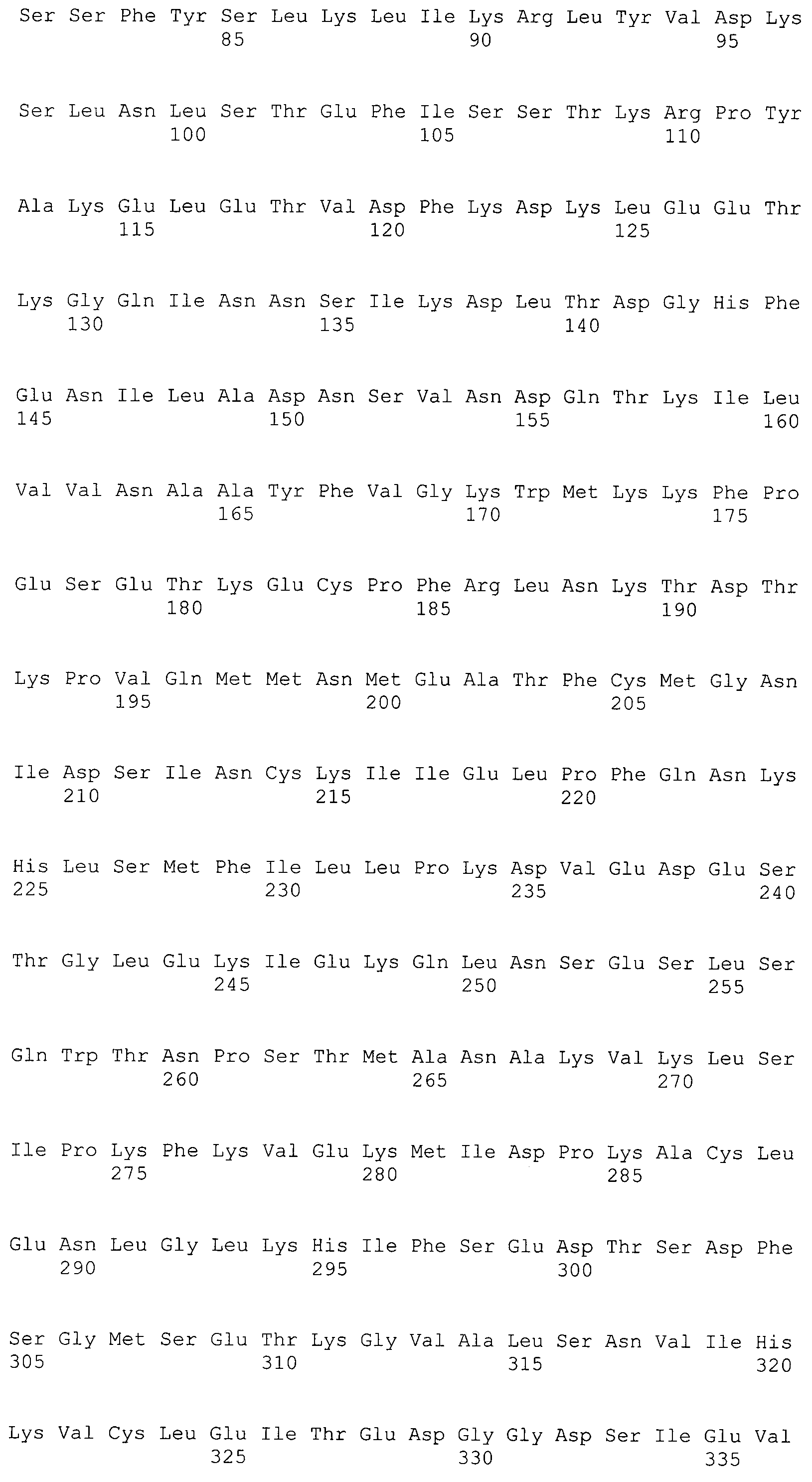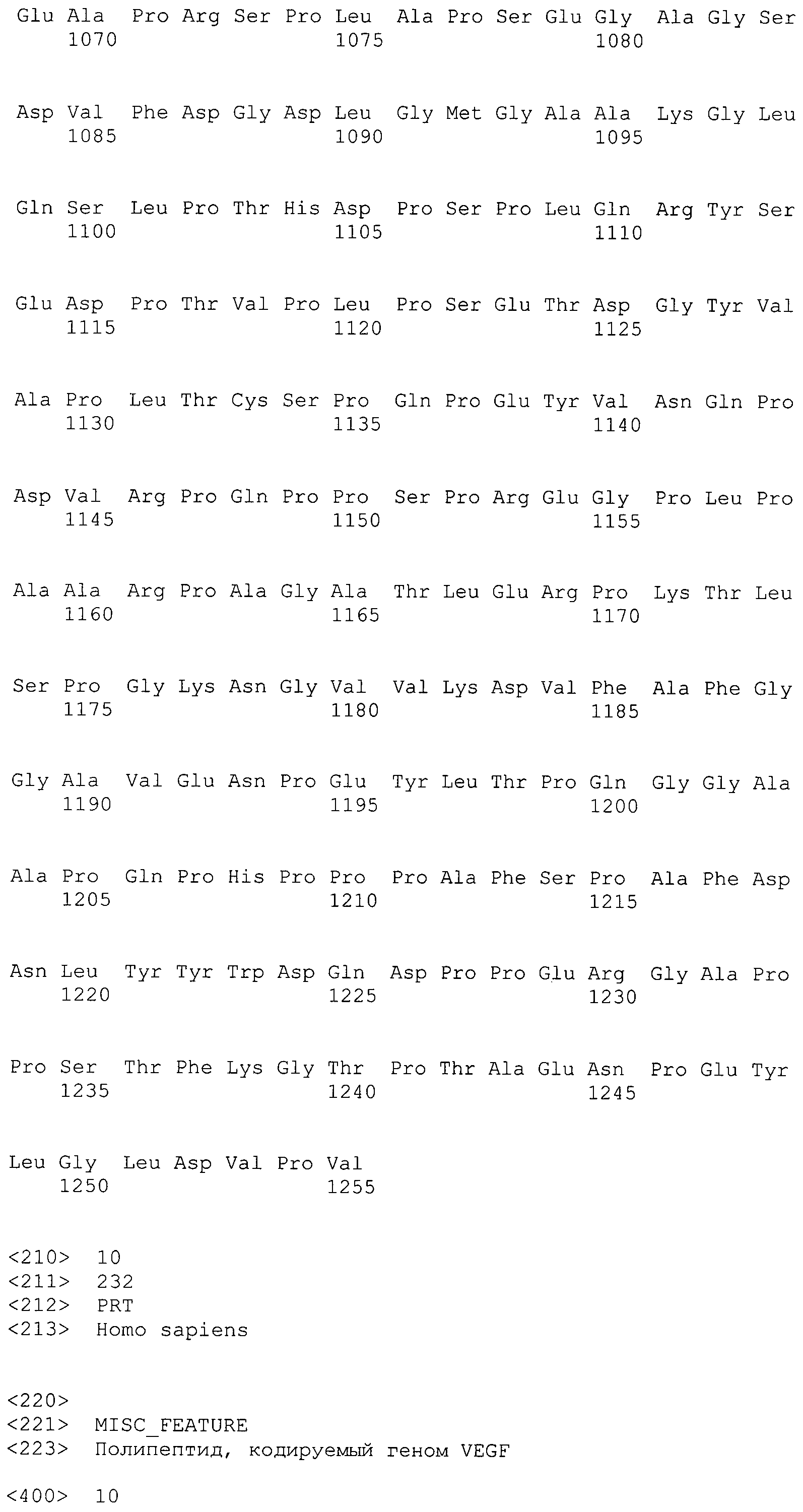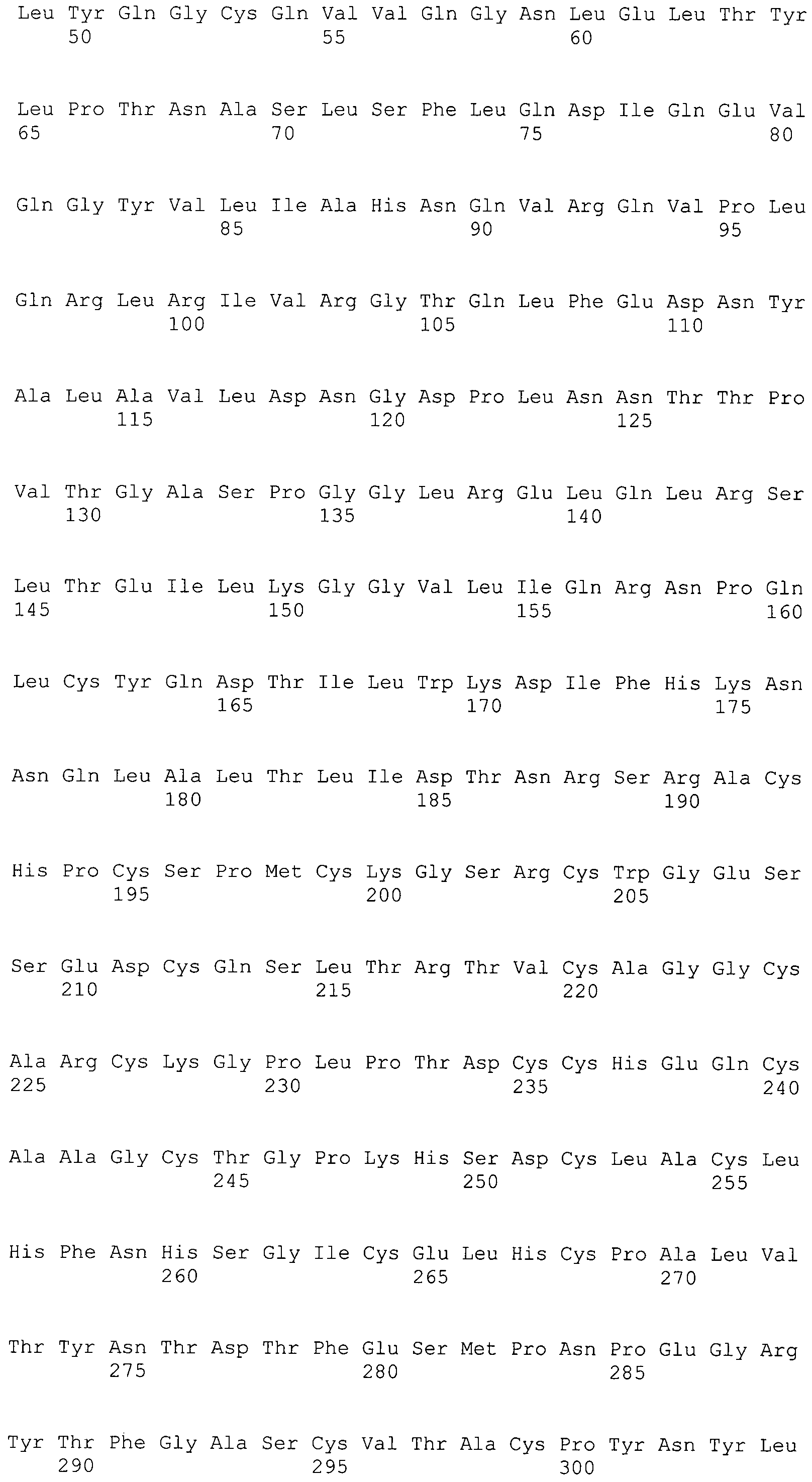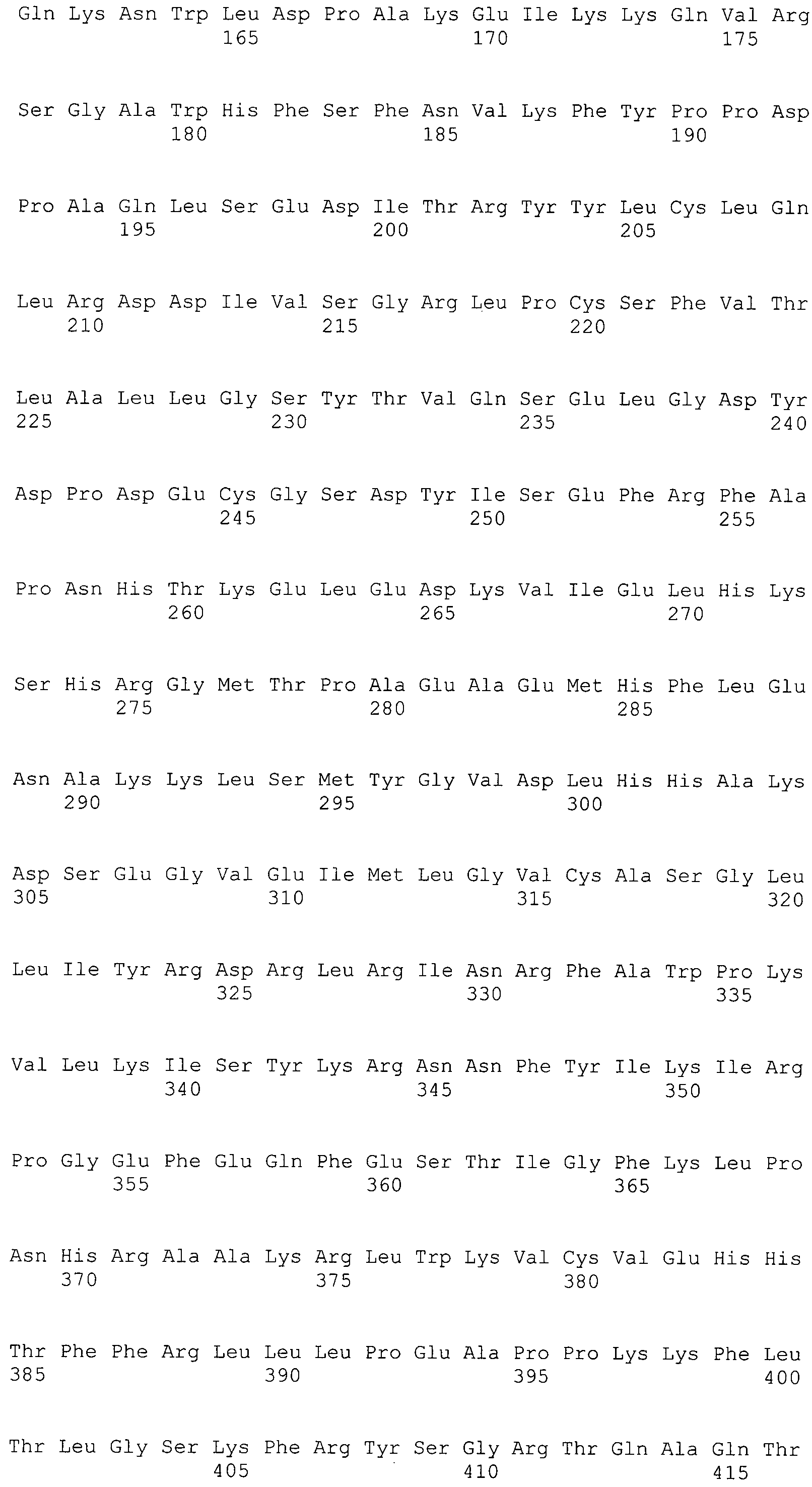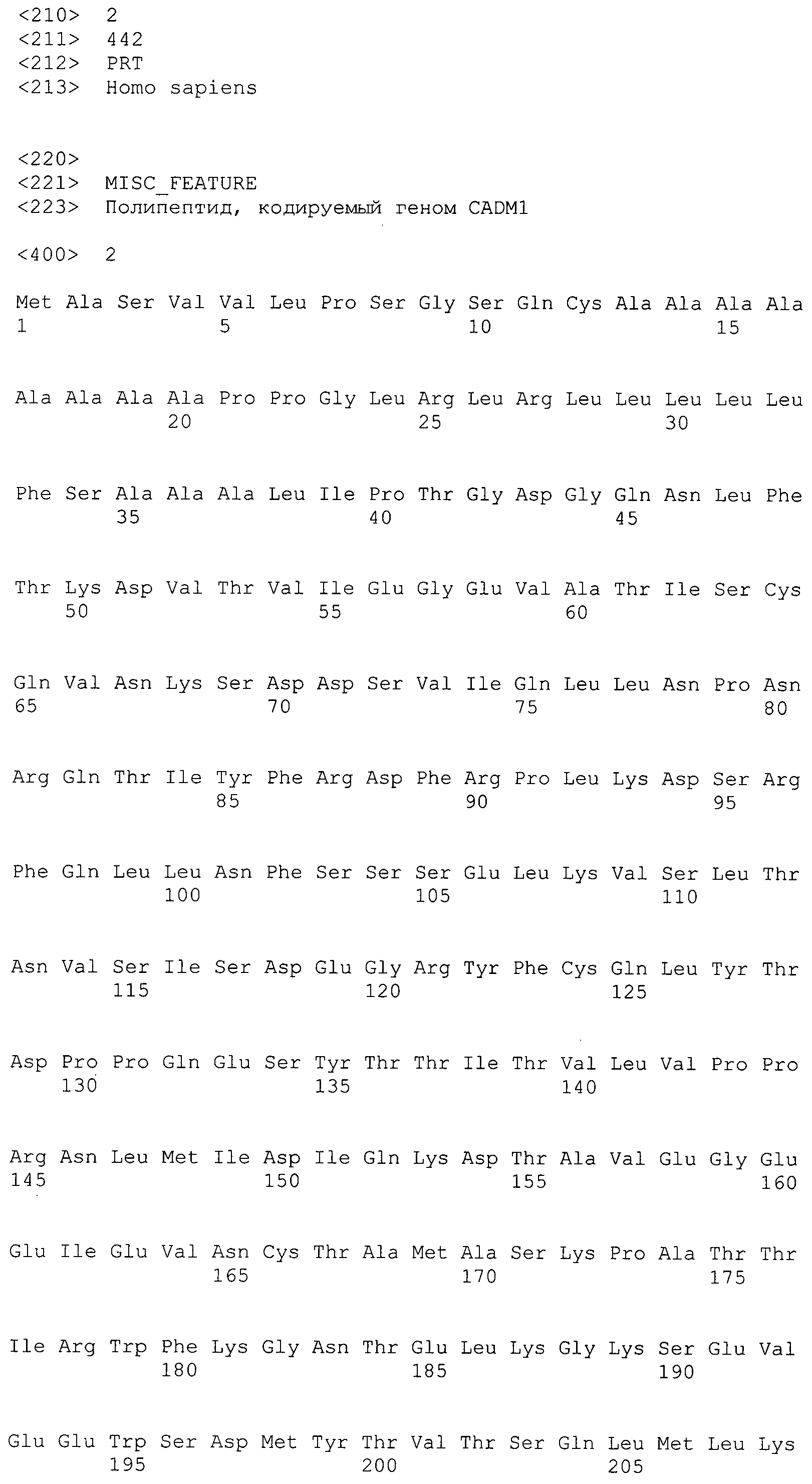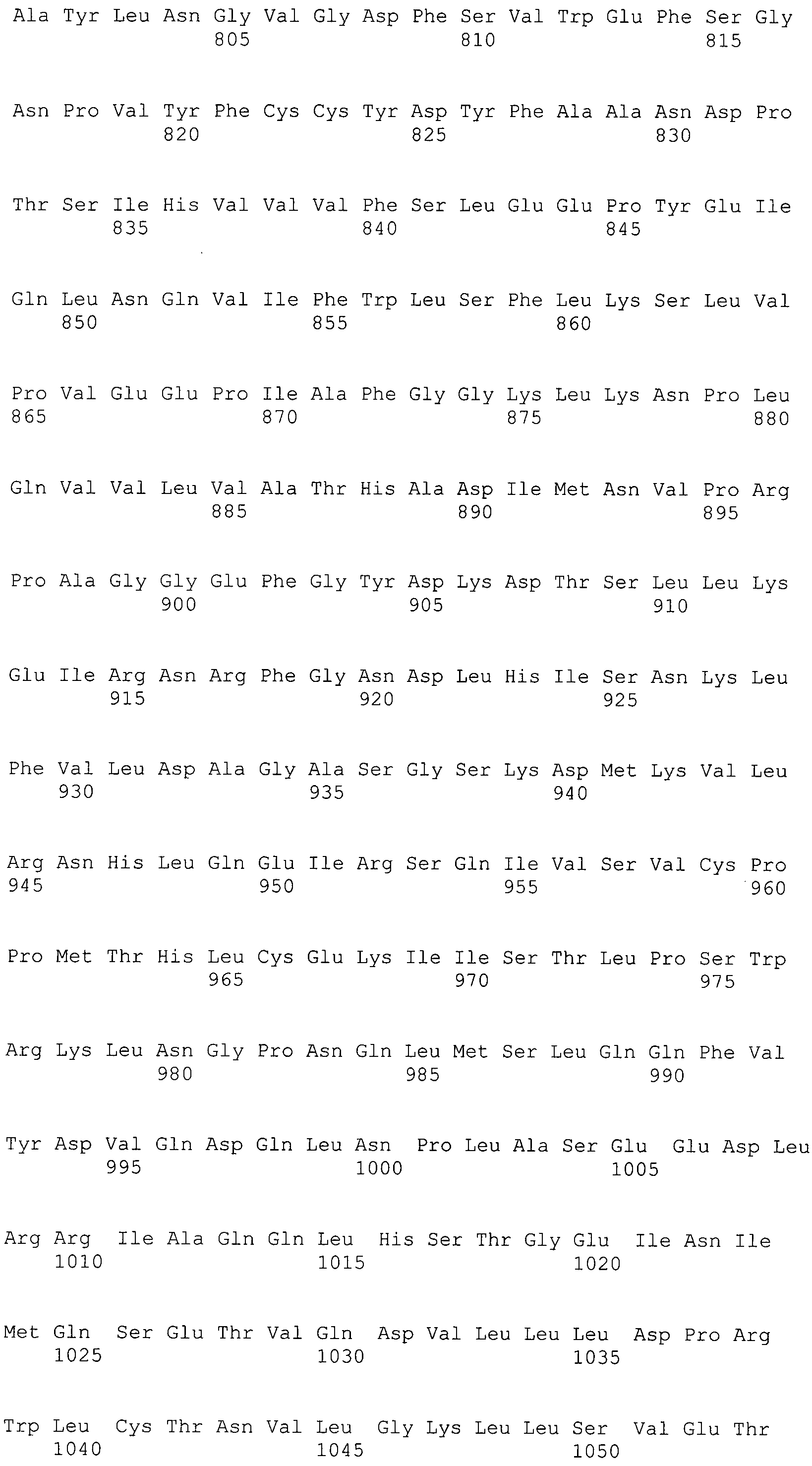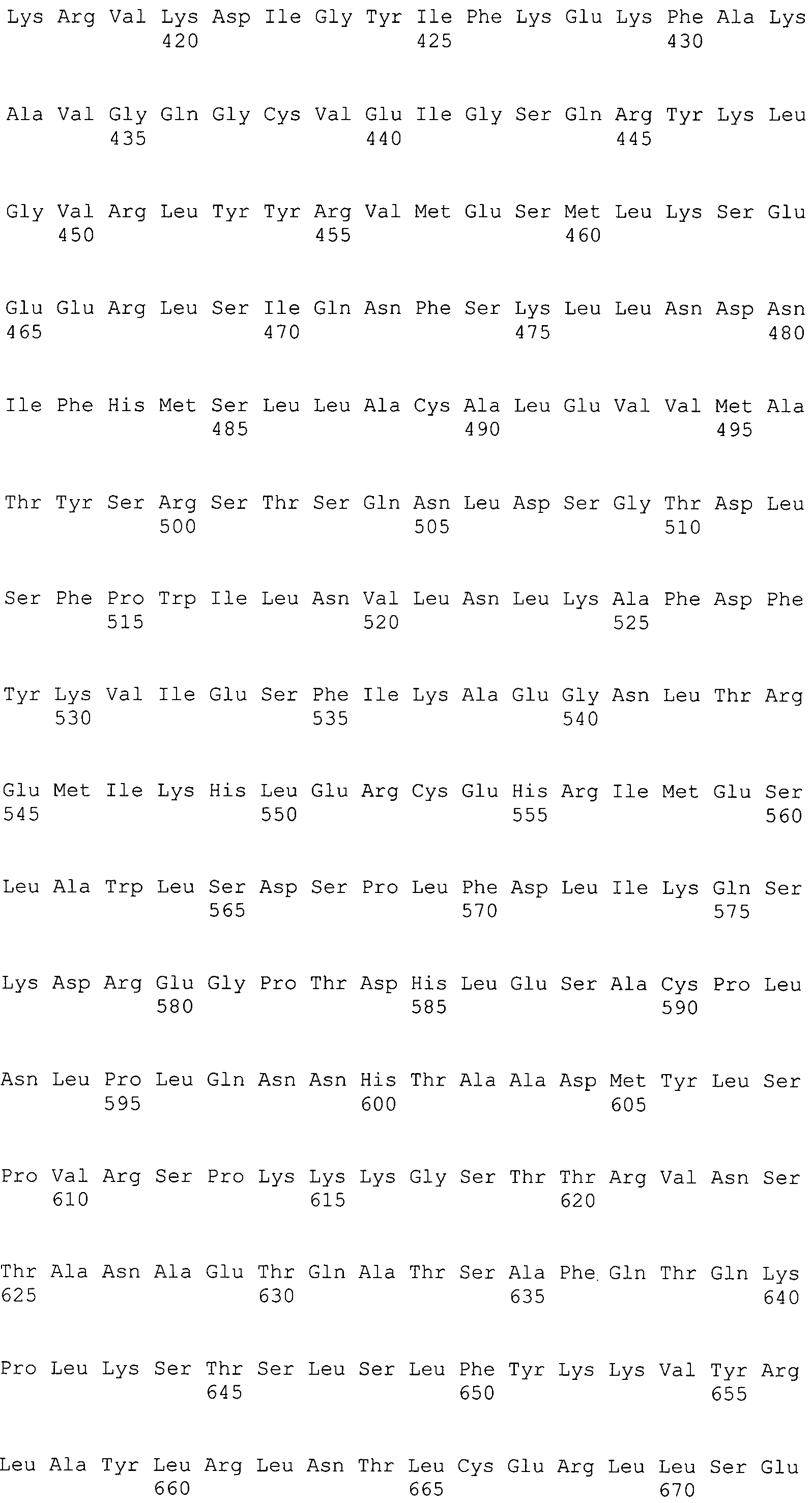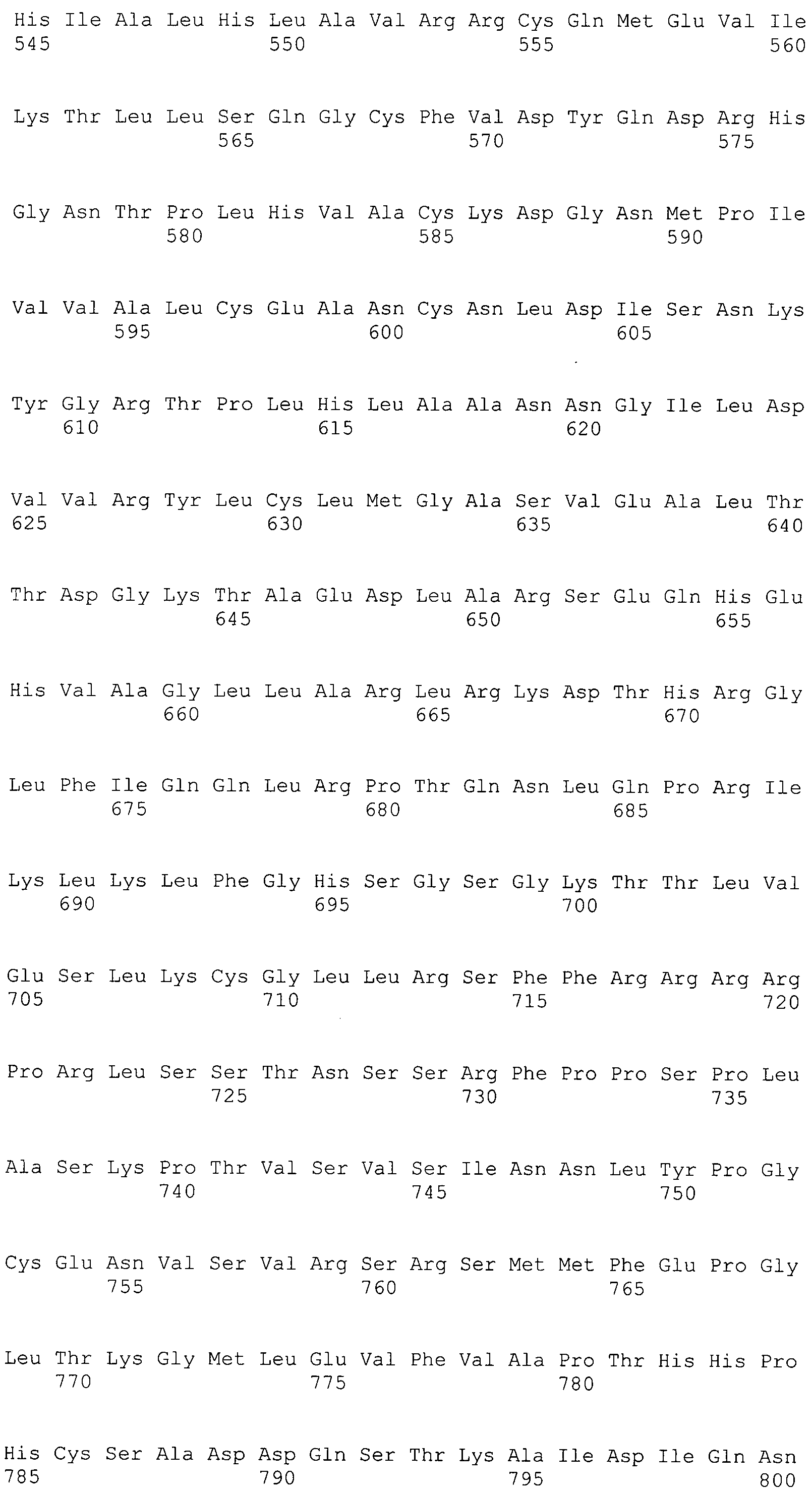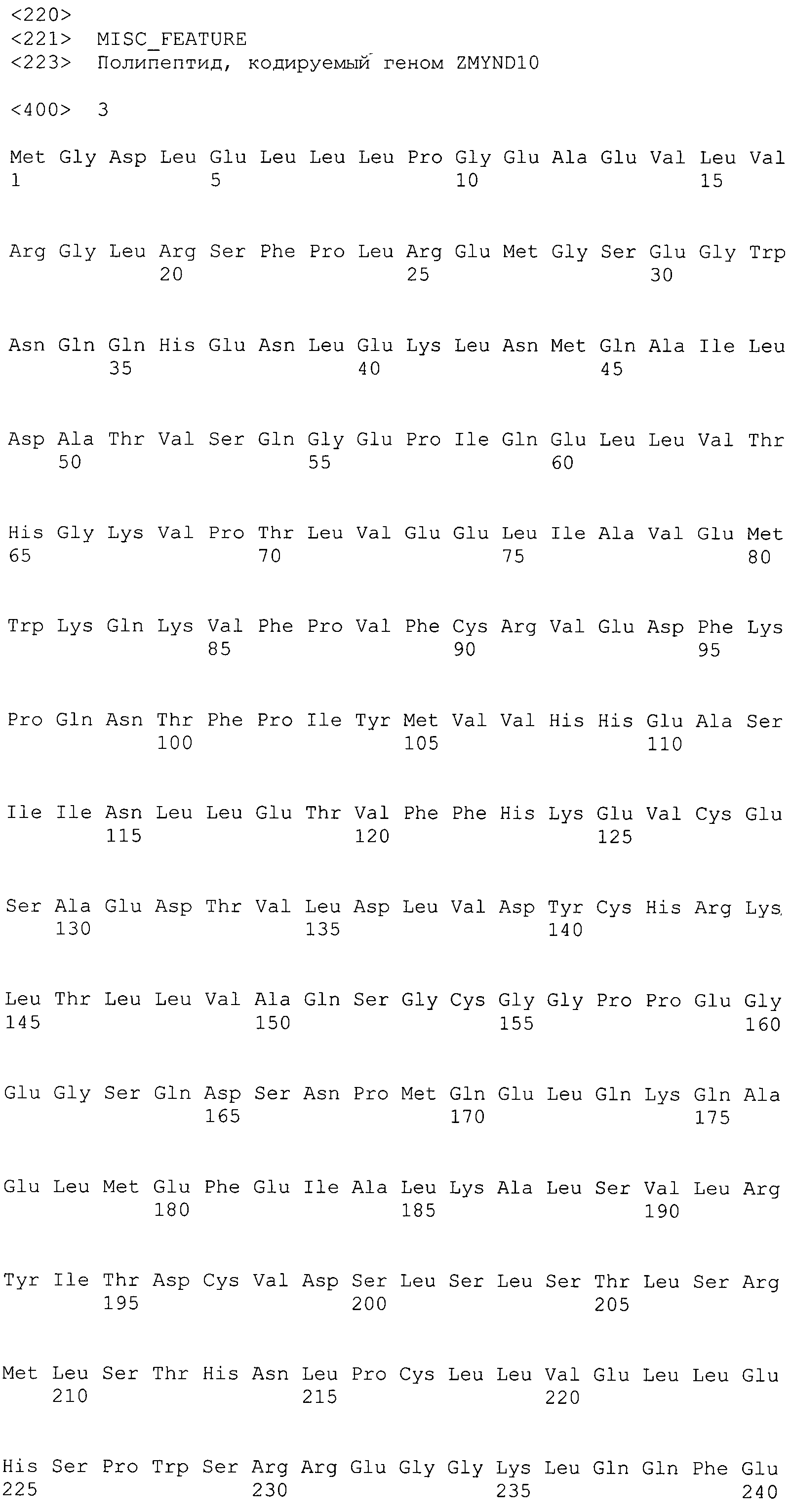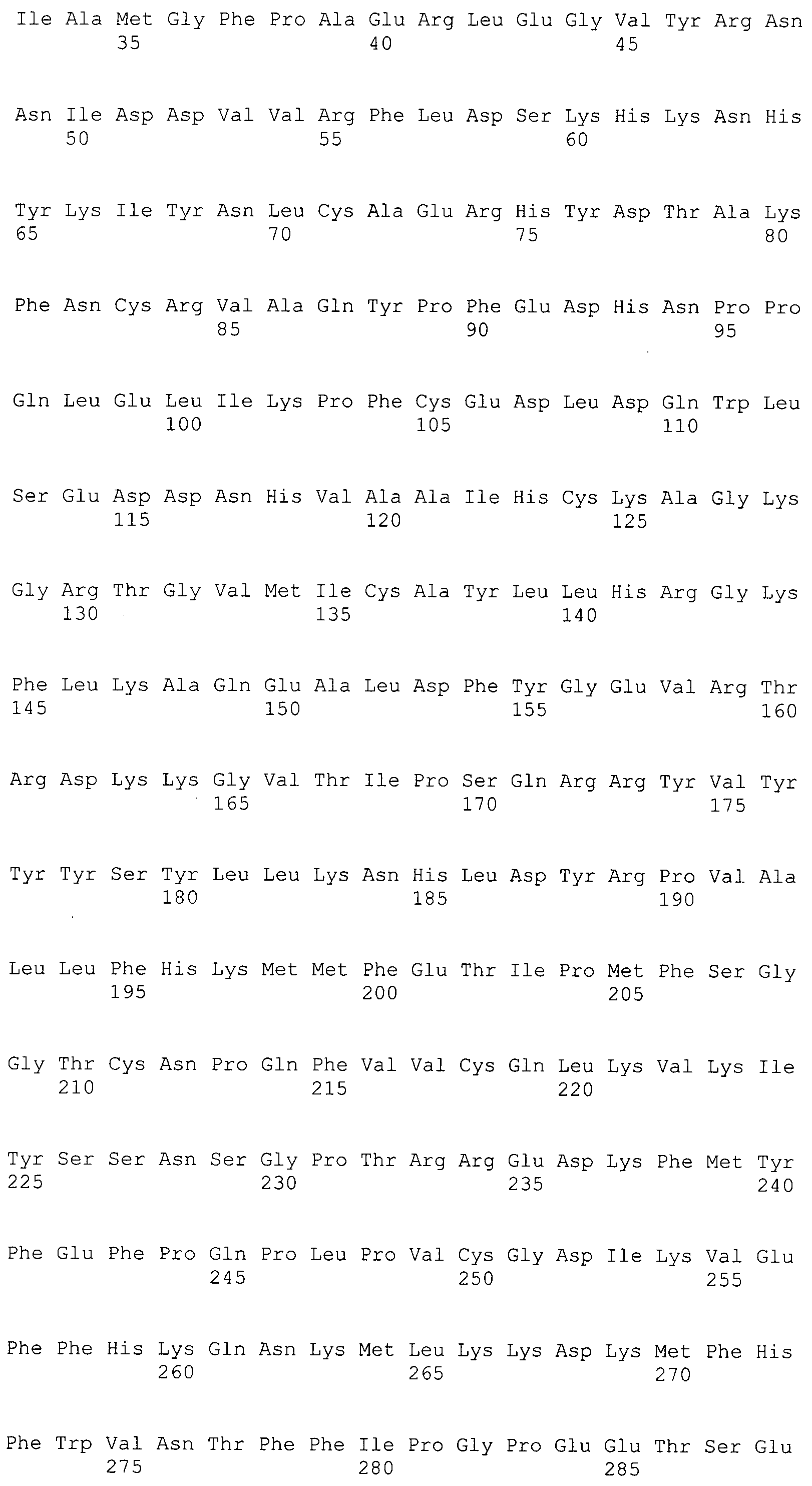Результат интеллектуальной деятельности: ТЕРАПЕВТИЧЕСКАЯ ДОСТАВКА И МОНИТОРИНГ С ИСПОЛЬЗОВАНИЕМ ПРЕДСТАВЛЯЮЩЕГО ИНТЕРЕС ГЕНА БЕЛКА, СЛИТОГО С РЕПОРТЕРОМ, И ОПТИЧЕСКОГО ОТОБРАЖЕНИЯ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу неинвазивного мониторинга экспрессии представляющего интерес гена в клетке при контактировании указанной клетки с соединением, влияющим на экспрессию указанного представляющего интерес гена.
Таким образом, изобретение относится к способу мониторинга увеличения экспрессии представляющего интерес гена в клетке при контактировании указанной клетки с деметилирующим лекарственным средством. Изобретение также относится к мониторингу уменьшения экспрессии представляющего интерес гена в клетке при контактировании указанной клетки с РНКи. Указанные способы могут быть реализованы in vivo или вне организма человека или животного.
Уровень техники
Одной из основных задач современной медицины является разработка терапевтической системы, которая способна оказывать селективное влияние на экспрессию гена, в отношении которого имеется подозрение или относительно которого известно, что его регуляция подверглась изменениям. В зависимости от пораженного гена(генов) это может проявляться в виде серьезных заболеваний, таких как, например, рак. Хотя в этой области было проведено немало исследований, все еще имеется потребность в улучшении результатов, полученных к настоящему времени, и объединении этих результатов, например, с системой, благодаря которой можно с легкостью осуществлять мониторинг терапевтического эффекта и/или доставки терапевтического соединения.
В целом, понятие генной экспрессии можно кратко охарактеризовать в виде процесса, содержащего несколько этапов: на уровне ДНК происходит кодирование определенной последовательности для белка или РНК, обе из которых могут проявлять определенную функцию. На первом этапе ДНК транскрибируется в соответствующую РНК. Этот этап находится под жестким управлением, включающим так называемые промоторные области, зачастую расположенные на 5'-концах в непосредственной близости от кодирующей последовательности, а также регуляторные элементы ДНК и факторы транскрипции, расположенные выше и ниже кодирующей последовательности и оказывающие стимулирующее или подавляющее влияние на транскрипцию. В случае если белок представляет собой конечный продукт экспрессии гена, транскрибируемая РНК называется мРНК. На втором этапе эта мРНК транслируется в белок, и затем, на следующем этапе, указанный белок необязательно подвергается дальнейшей пост-трансляционной модификации. В случае если белок представляет собой конечный продукт, транскрибируемая РНК может быть перестроена и подвергнута процессингу, а также может быть включена в комплексы, содержащие, например, белки. Таким образом, на уровне ДНК можно оказывать влияние на экспрессию гена, например, используя факторы направленного воздействия, оказывающие влияние на первый этап, а именно, транскрипцию. Оказывать воздействие также можно и на втором этапе: в случае если конечным продуктом является белок, можно заблокировать трансляцию мРНК, а в случае если конечным продуктом является РНК, можно заблокировать процессинг и т.д. Если способ, в конечном счете, приводит к деградации транскрибируемой РНК, то невозможно будет получить никакого конечного продукта, и таким образом второй этап будет заблокирован.
В случае, если заболевание вызвано подавлением экспрессии (даун-регуляция, downregulation) гена или даже его полным выключением (сайлесинг), терапевтический эффект должен представлять собой усиление экспрессии (апрегуляция, upregulation) указанного эндогенного гена до нормального уровня. Для некоторых типов рака, например, известно, что выключены важные гены-супрессоры опухоли, и таким образом они не способны проявлять соответствующую им функцию подавления опухоли. Было установлено, что ДНК-метилирование является главной причиной подавления экспрессии/выключения гена. Указанное метилирование часто происходит в промоторных областях соответствующих генов. В этих случаях экспрессия гена может быть восстановлена путем удаления из ДНК метильной группы. Подавление экспрессии/выключение гена также может происходить в результате активации фактора транскрипции, который в отношении этого гена действует в качестве негативного фактора транскрипции, таким образом, блокируя его экспрессию. В этих случаях терапия должна быть направлена на подавление экспрессии гена, кодирующего фактор транскрипции, снижая таким образом уровень фактора транскрипции.
Если заболевание вызвано усилением экспрессии гена, терапевтический эффект должен представлять собой соответственно подавление экспрессии указанного эндогенного гена до нормального уровня. Известно, что практически во всех типах раковых образований наблюдается усиленная экспрессия генов, которые обычно называются онкогенами или протоонкогенами. При этом, протоонкогены, вероятно, не имеют непосредственного влияния, например, на пролиферацию клетки, но опосредованно вызывают, например, усиленную экспрессию других генов. Для подавления экспрессии генов можно использовать способы с применением РНКи (РНКи-способ). В отличие от деметилирующих лекарственных средств, которые оказывают непосредственное воздействие на "уровне ДНК", действие РНКи-способов обычно происходит на втором этапе экспрессии генов, а именно, на этапе трансляции белка или на этапе процессинга соответствующей РНК. В конечном счете, эти способы приводят к деградации транскрибируемой РНК. Таким образом, весь процесс экспрессии гена блокируется РНКи. Это также может называться "выключением" гена с помощью РНКи. С механической точки зрения, искусственно введенная "РНК" (например транскрибированная из вектора, введенного в виде РНК-дуплекса и т.д.) подвергается процессингу, и одна нить встраивается в комплекс, который специфическим образом распознает в последовательности транскрибируемую РНК. Таким образом, последовательность введенной РНК определяет целевой "предназначенный для выключения ген". После гибридизации, узнавания и формирования комплекса целевая РНК разрушается под действием дальнейших механизмов.
Существующие способы мониторинга эффекта терапевтических систем, влияющих на экспрессию генов, основаны в основном на сравнении состояния заболевания, например опухоли, до и после применения терапевтической системы. Таким образом, для определения размера опухоли до и после лечения можно использовать, например, рентгеновские или ультразвуковые способы. Однако с помощью таких систем невозможно ни осуществление мониторинга прямого влияния указанного лечения на экспрессию генов, ни проведение анализа того, является ли вообще соответствующее соединение локализованным в пораженной ткани. Для определения результатов лечения с помощью других способов требуются образцы ткани. Таким образом, необходима биопсия или даже хирургическое вмешательство, которые часто связаны с дополнительными проблемами, такими как инфекции. Более того, возможен только анализ по факту.
Как следствие, существует потребность в создании или улучшении способов лечения, влияющих на экспрессию генов, и способов, которые позволяют осуществлять неинвазивный мониторинг применения и влияния этих способов лечения на экспрессию генов.
Объекты и сущность изобретения
Целью настоящего изобретения является предоставление способов для неинвазивного мониторинга экспрессии представляющего интерес гена в клетке при контактировании указанной клетки с соединением, влияющим на экспрессию указанного представляющего интерес гена.
Эти и другие цели настоящего изобретения, которые станут очевидными из нижеследующего описания, решаются объектом изобретения, охарактеризованным в независимых пунктах формулы изобретения. Зависимые пункты формулы изобретения относятся к некоторым предпочтительным вариантам осуществления изобретения.
Согласно одному из аспектов изобретения предоставляется способ неинвазивного мониторинга экспрессии представляющего интерес гена в клетке, включающий по меньшей мере этапы:
a) введения молекулы нуклеиновой кислоты, содержащей:
aa) промоторную последовательность;
bb) функционально связанную с ней последовательность, кодирующую полипептид указанного представляющего интерес гена;
cc) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
в указанную клетку;
b) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения;
с) контактирования указанной клетки с соединением, влияющим на экспрессию указанного представляющего интерес гена;
d) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения на этапе c);
е) сравнения уровня флуоресцентного полипептида-репортера, детектированного на этапе b) с уровнем флуоресцентного полипептида-репортера, детектированного на этапе d);
f) определения изменения экспрессии указанного представляющего интерес гена, индуцированного указанным соединением, на основании сравнения, выполненного на этапе e).
В предпочтительном варианте осуществления, относящемся к описанному выше способу, настоящее изобретение описывает способ неинвазивного мониторинга in vivo экспрессии представляющего интерес гена в клетке, включающего по меньшей мере этапы:
a) введения молекулы нуклеиновой кислоты, содержащей:
aa) метилированную промоторную последовательность;
bb) функционально связанную с ней последовательность, кодирующую полипептид указанного представляющего интерес гена;
cc) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
в указанную клетку;
b) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения;
с) контактирования указанной клетки с деметилирующим лекарственным средством;
d) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения на этапе c);
е) сравнения уровня флуоресцентного полипептида-репортера, детектированного на этапе b), с уровнем флуоресцентного полипептида-репортера, детектированного на этапе d);
f) определения усиления экспрессии указанного представляющего интерес гена, индуцированного деметилирующим лекарственным средством, на основании сравнения, выполненного на этапе e).
В другом предпочтительном варианте осуществления настоящее изобретение описывает способ неинвазивного мониторинга экспрессии представляющего интерес гена, включающий по меньшей мере этапы:
a) введения молекулы нуклеиновой кислоты, содержащей:
aa) метилированную промоторную последовательность;
bb) функционально связанную с ней последовательность, кодирующую полипептид указанного представляющего интерес гена;
cc) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
в клетку, которая находится вне организма человека или животного;
b) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения;
с) контактирования указанной клетка с деметилирующим лекарственным средством;
d) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения на этапе c);
е) сравнения уровня флуоресцентного полипептида-репортера, детектированного на этапе b), с уровнем флуоресцентного полипептида-репортера, детектированного на этапе d);
f) определения усиления экспрессии указанного представляющего интерес гена, индуцированного деметилирующим лекарственным средством, на основании сравнения, выполненного на этапе e).
Кодирующая последовательность, содержащая последовательность, кодирующую полипептид представляющего интерес гена, слитая с последовательностью, кодирующей флуоресцентный полипептид-репортер, содержит один старт-кодон на 5'-конце и один стоп-кодон на 3'-конце. Термин "один старт-кодон" в настоящем описании, не исключает наличия других внутренних кодонов ATG. Однако эти последние кодоны не должны инициировать трансляцию.
В предпочтительном варианте осуществления настоящего изобретения представляющий интерес ген в этом аспекте изобретения представляет собой ген-супрессор опухоли или ген, в отношении которого имеется подозрение, что его выключение является причиной возникновения заболевания.
В другом предпочтительном варианте осуществления настоящее изобретение описывает способ неинвазивного мониторинга уменьшения экспрессии представляющего интерес гена в клетке in vivo, содержащий по меньшей мере этапы:
a) введения молекулы нуклеиновой кислоты, содержащей:
aa) промоторную последовательность;
bb) функционально связанную с ней последовательность, кодирующую нефункциональный полипептид указанного представляющего интерес гена;
cc) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
в указанную клетку;
b) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения;
с) контактирования указанной клетки с РНКи, структура которой соответствует указанному представляющему интерес гену;
d) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения на этапе c);
е) сравнения уровня флуоресцентного полипептида-репортера, детектированного на этапе b), с уровнем флуоресцентного полипептида-репортера, детектированного на этапе d);
f) определения уменьшения экспрессии указанного представляющего интерес гена, индуцированного РНКи, на основании сравнения, выполненного на этапе e).
Кодирующая последовательность, содержащая последовательность, кодирующую нефункциональный полипептид представляющего интерес гена, слитую с последовательностью, кодирующей флуоресцентный полипептид-репортер, содержит один старт-кодон на 5'-конце и один стоп-кодон на 3'-конце. Термин "один старт-кодон" в настоящем описании, не исключает наличия других внутренних кодонов ATG. Однако эти последние кодоны не должны инициировать трансляцию.
В предпочтительном варианте осуществления этого аспекта изобретения последовательность представляющего интерес гена, кодирующая нефункциональный полипептид представляющего интерес гена, содержит либо часть последовательности, представляющего интерес гена, либо полную последовательность представляющего интерес гена, содержащую по меньшей мере одну вставку, по меньшей мере одну делецию, по меньшей мере одну замену нуклеотида или их комбинации. Таким образом получают нефункциональный полипептид представляющего интерес гена. Однако область представляющего интерес гена не содержит стоп-кодоны.
Кроме того, в более предпочтительном варианте осуществления этого аспекта настоящее изобретение раскрывает молекулу нуклеиновой кислоты, как описано в общих чертах выше в двух предыдущих параграфах, причем представляющий интерес ген представляет собой онкоген, протоонкоген или ген, в отношении которого имеется подозрение, что усиление его экспрессии является причиной заболевания.
В другом аспекте настоящего изобретения раскрыт способ, в котором выполняют неинвазивный мониторинг уменьшения экспрессии представляющего интерес гена в клетке, находящейся вне организма человека или животного, включающий по меньшей мере этапы:
a) введения молекулы нуклеиновой кислоты, содержащей:
aa) промоторную последовательность;
bb) функционально связанную с ней последовательность, кодирующую полипептид указанного представляющего интерес гена;
cc) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
в клетку, которая находится вне организма животного или человека;
b) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения;
c) контактирования указанной клетки с РНКи, структура которой соответствует указанному представляющему интерес гену;
d) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения на этапе c);
e) сравнения уровня флуоресцентного полипептида-репортера, детектированного на этапе b), с уровнем флуоресцентного полипептида-репортера, детектированного на этапе d);
f) определения уменьшения экспрессии указанного представляющего интерес гена, индуцированного РНКи, на основании сравнения, выполненного на этапе e).
В вариантах осуществления способов in vivo и in vitro, как описано выше в общих чертах, указанная молекула нуклеиновой кислоты и/или указанная РНКи может вводиться в указанную клетку методом трансфекции с помощью сонопорации, локальной инъекции или липосомных капсул, несущих антитела к антигенам клетки-хозяина для правильного нацеливания, идентификации и локализации, или их комбинации.
Другой аспект изобретения относится к применению раскрытых выше способов.
Указанные способы могут применяться in vivo или вне организма животного или человека. В одном из вариантов осуществления указанный способ используется для мониторинга экспрессии представляющего интерес гена в клетке в течение времени контактирования указанной клетки с соединением, влияющим на экспрессию указанного представляющего интерес гена, и таким образом указанный способ используется для мониторинга эффекта указанного соединения.
В другом варианте осуществления раскрытый выше способ может использоваться для доставки соединения, влияющего на экспрессию представляющего интерес гена в клетке, мониторинга доставки указанного соединения, и в то же время для мониторинга его влияния на экспрессию указанного представляющего интерес гена, индуцированного указанным соединением. И в этом случае он может применяться in vivo, а также в виде способа, выполняемого в клетке, находящейся вне организма человека или животного.
В другом предпочтительном варианте осуществления описанный выше способ для случая применения in vivo или вне организма человека или животного используется для подбора дозы соединения, влияющего на экспрессию представляющего интерес гена с целью получения дальнейшего изменения экспрессии указанного представляющего интерес гена.
В другом аспекте изобретения способ, относящийся к применению деметилирующего лекарственного средства, используется для исследования в одном из вариантов осуществления различных деметилирующих лекарственных средств для идентификации самого эффективного деметилирующего лекарственного средства, взятого отдельно или в комбинации.
Этот аспект относится к другому предпочтительному варианту осуществления способов, в которых используется РНКи. Таким образом, указанный способ используется для исследования различных РНКи, структура которых соответствует одному представляющему интерес гену, с целью выявления самой эффективной РНКи, взятой отдельно или в комбинации.
Краткое описание чертежей
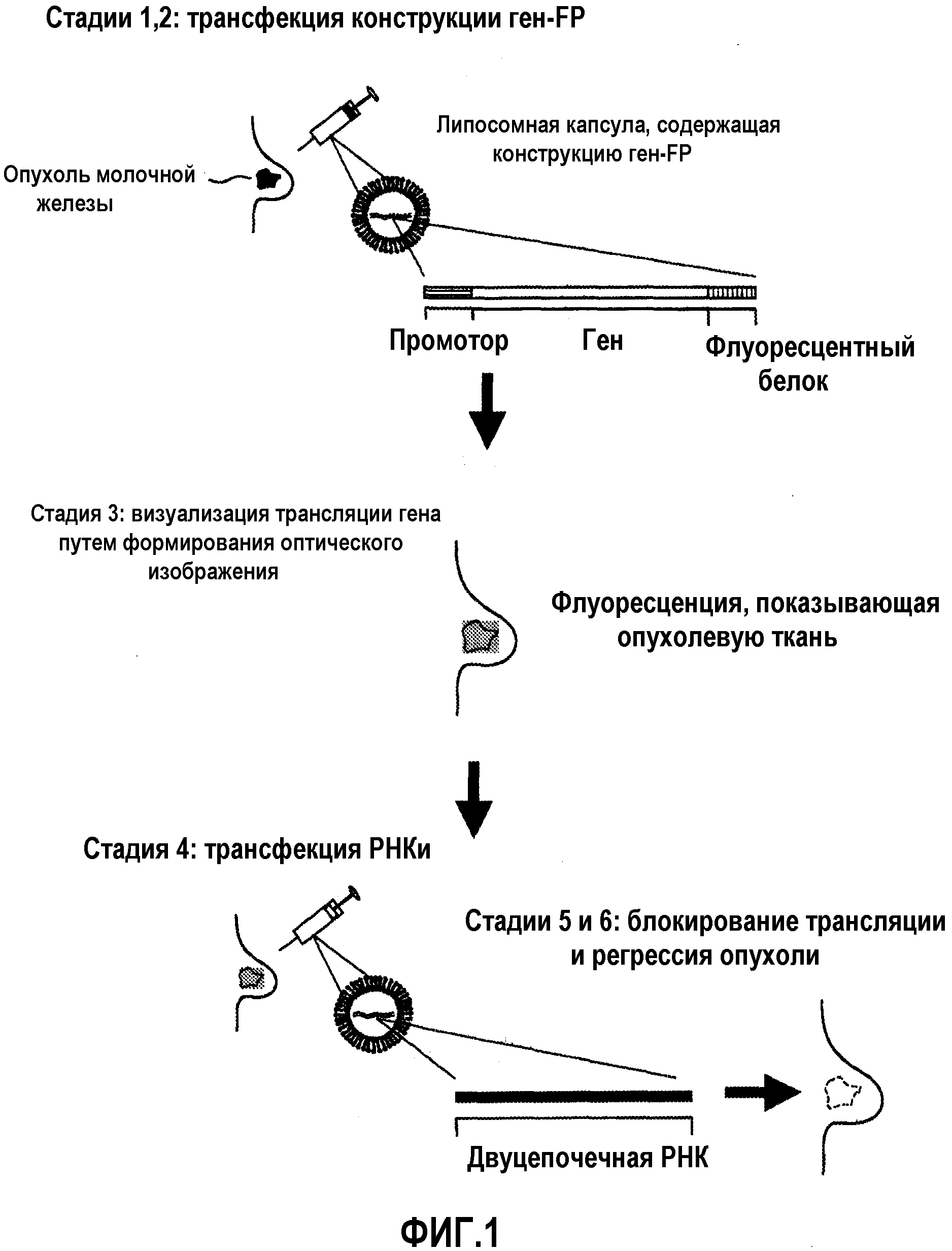
На фиг.1 схематично изображены приведенные в качестве примера этапы возможного применения настоящего изобретения, а именно, терапии с использованием РНКи и ее мониторинга в ткани рака молочной железы.
Этапы подробно описаны в разделе “Примеры” настоящей заявки.
Подробное описание изобретения
Авторы настоящего изобретения обнаружили возможность неинвазивного мониторинга экспрессии представляющего интерес гена в клетке. Эта система может использоваться при контактировании клетки с соединением, влияющим на экспрессию указанного представляющего интерес гена.
Для подробного описания приведенных в качестве примера вариантов осуществления настоящего изобретения даны определения, важные для понимания настоящее изобретение.
В настоящем описании и прилагаемой формуле изобретения, форма единственного числа также включает соответствующее ей множественное число, если контекстом не определено иное.
В контексте настоящего изобретения термины "примерно" и "приблизительно" означают диапазон точности, который, как это ясно специалисту в данной области, все еще гарантирует получение технического эффекта рассматриваемого признака. Этот термин обычно указывает на отклонение от указанного числового значения на величину ±10% и предпочтительно ±5%.
Следует иметь в виду, что термин "содержащий" не является ограничивающим. В целях настоящего изобретения считается, что термин "состоящий из" является предпочтительным вариантом по отношению к термину “содержащий”. Если в дальнейшем группа определена как содержащая по меньшей мере определенное число вариантов осуществления, это также означает, что охвачена группа, которая предпочтительно состоит только из этих вариантов осуществления.
Как было указано выше, настоящее изобретение относится к способу неинвазивного мониторинга экспрессии представляющего интерес гена в клетке при контактировании указанной клетки с соединением, влияющим на экспрессию указанного представляющего интерес гена. Таким образом, в одном из вариантов осуществления изобретение относится к способу неинвазивного мониторинга экспрессии представляющего интерес гена в клетке, содержащему по меньшей мере этапы:
a) введения молекулы нуклеиновой кислоты, содержащей:
aa) промоторную последовательность;
bb) функционально связанную с ней последовательность, кодирующую полипептид указанного представляющего интерес гена;
cc) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
в указанную клетку;
b) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения;
с) контактирования указанной клетки с соединением, влияющим на экспрессию указанного представляющего интерес гена;
d) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения на этапе c);
е) сравнения уровня флуоресцентного полипептида-репортера, детектированного на этапе b), с уровнем флуоресцентного полипептида-репортера, детектированного на этапе d);
f) определения изменения экспрессии указанного представляющего интерес гена, индуцированного указанным соединением, на основании сравнения, выполненного на этапе e).
В контексте настоящего изобретения, термин "неинвазивный" мониторинг означает, что на этапах детекции b) и d) способа по настоящему изобретению отсутствует необходимость в прямом физическом контактировании с клеткой и/или наблюдаемой тканью пациента для мониторинга экспрессии представляющего интерес гена. Таким образом, во время проведения этапов детекции нет необходимости ни в хирургическом вмешательстве, ни в биопсии, ни в каком другом способе, включающем контактирование с клеткой (таком как пэтч-клемп (метод фиксации потенциала) в исследовании in vitro).
"Мониторинг" в общем значении относится к процессу определения параметра и отслеживания этого параметра в течение некоторого времени.
Термин "экспрессия представляющего интерес гена" в настоящем описании содержит по меньшей мере два этапа. Таким образом, транскрипция представляющего интерес гена с образованием соответствующей РНК представляет собой один из этапов генной экспрессии. В случае кодирования белка этим геном указанная РНК называется мРНК. В дальнейшем РНК может быть подвергнута процессингу (например, сплайсингу) и, на втором этапе, мРНК транслируется в белок. Белки, таким образом, могут быть конечными продуктами генной экспрессии. Количество белка, как конечного продукта, может коррелировать с уровнем генной экспрессии. Однако молекулы РНК также могут быть конечными продуктами генной экспрессии. Указанные РНК также могут подвергаться процессингу и модификации на втором этапе.
Термин "соединение, влияющее на экспрессию гена" в настоящем описании, содержит любое соединение, имеющее положительное или отрицательное воздействие на экспрессию эндогенного гена.
Такое соединение может действовать на уровне ДНК. Это означает, что указанное соединение может влиять, например, на состояние метилирования ДНК или приводить к структурным перестройкам ДНК, например, из закрытой в открытую конформацию, не влияя на последовательность ДНК. Поскольку ДНК-метилирование (особенно в промоторной области), как известно, приводит к выключению соответствующего гена, соединения, действующие как деметилирующие лекарственные средства, как известно, усиливают экспрессию генов в результате удаления из ДНК метильных групп. Гистондеацетилазы (HDAC) удаляют ацетильные группы из ДНК, что приводит к подавлению гена. Таким образом, соединения, ингибирующие HDAC, также могут оказывать положительное влияние на генную экспрессию. Эти лекарственные средства, обычно называемые HDAC-ингибиторы, также упоминаются ниже. Однако в одном из вариантов осуществления настоящего изобретения охвачены соединения, оказывающие положительное влияние на генную экспрессию.
В другом предпочтительном варианте осуществления настоящего изобретения могут использоваться соединения, которые оказывают воздействие на втором этапе генной экспрессии, а именно, на транскрибируемую РНК. В случае деградации указанной РНК на генную экспрессию оказывается негативное влияние. В этом варианте осуществления изобретения, например, для подавления этапа трансляции могут использоваться РНКи. Такие РНКи включают миРНК (малые интерферирующие РНК, siRNA), РНК-шпильку (shRNA), микроРНК (miRNA) и т.д., как более подробно описано ниже.
"Контактирование с клеткой" в настоящем описании, включает любой способ доставки соединения, известный специалисту в данной области, при котором это соединение может оказывать влияние на клетку. Это может быть сделано in vivo, например, с помощью внутривенной инъекции, топического нанесения, ингаляции и т.д. Для систем культивирования клеток соединение, такое как деметилирующее лекарственное средство, может быть просто добавлено в среду, используемую для культивирования клеток. Однако для контактирования соединения с клеткой также могут использоваться способы трансфекции, как в общих чертах описано ниже, и на следующем этапе указанное соединение может быть введено в указанную клетку.
Термин "молекула нуклеиновой кислоты" в контексте настоящего изобретения относится к ДНК, РНК или их производным. Предпочтительно оно относится к двухцепочечной молекуле ДНК. Указанные молекулы нуклеиновой кислоты могут быть кольцевыми или линейными в зависимости от механизма, который используется для введения в клетку указанной молекулы нуклеиновой кислоты.
Термин "введение в клетку" в контексте настоящего изобретения определяет, какую молекулу нуклеиновой кислоты, например ДНК или РНК, вводят в соответствующую клетку любым способом, известным специалисту в данной области. Кроме того, "введение" подразумевает, что указанная молекула нуклеиновой кислоты присутствует в клетке таким образом, что кодирование последовательностей, имеющихся в указанной молекуле нуклеиновой кислоты, может происходить в зависимости от того, как происходит регулирование этих областей. Наконец, могут использоваться такие методы, как методы трансфекции, как более подробно описано ниже.
В контексте настоящего изобретения термин "кодирующая область" или "кодирующая последовательность" охватывает последовательность ДНК, которая начинается на 5'-конце старт-кодоном, т.е. ATG. Этот триплет кодирует первую аминокислоту, метионин, соответствующего белка при инициации трансляции мРНКа. Следовательно, кодирующая область заканчивается на 3'-конце стоп-кодоном, например TAG, для завершения трансляции белка. Следует отметить, что для настоящего изобретения нигде в пределах кодирующей последовательности не присутствуют никакие стоп-кодоны, за исключением упомянутого выше стоп-кодона на 3'-конце. Таким образом, вся кодирующая последовательность транскрибируется в одну соответствующую мРНК. Трансляция этой мРНКа дает в результате один белок, который может состоять по меньшей мере из двух различных доменов/полипептидов/частей. Однако, как более подробно описано ниже, указанные полипептиды не обязательно должны быть функциональными; однако для всех кодирующих последовательностей в пределах указанной кодирующей последовательности могут находиться по меньшей мере две последовательности, кодирующие по меньшей мере два полипептида.
В предпочтительном варианте осуществления настоящего изобретения указанная кодирующая последовательность молекулы нуклеиновой кислоты содержит один старт-кодон на 5'-конце и один стоп-кодон на 3'-конце. Термин “один старт-кодон” в настоящем описании, означает, что последовательность может содержать дополнительные внутренние кодоны ATG, которые, однако, не могут использоваться для инициации трансляции.
Термины "последовательность представляющего интерес гена", "область представляющего интерес гена" и "последовательность, кодирующая полипептид указанного представляющего интерес гена" относятся к ДНК-последовательности представляющего интерес гена, предназначенного для мониторинга с помощью способа по настоящему изобретению. В контексте настоящего изобретения указанным термином предпочтительно охвачены гены, которые транслируются в белки и относительно которых имеется подозрение, что нарушение их экспрессии является причиной определенных заболеваний. Более подробно об этом написано ниже. Таким образом, такие последовательности предпочтительно содержат только кодирующую область гена, т.е. только экзоны, и не содержат никаких интронов. Однако в некоторых вариантах осуществления также могут использоваться интронные области представляющего интерес гена.
Ниже приводится более подробное пояснение термина "полипептид-репортер", а также термина "репортер". Этот параграф относится ко всем вариантам осуществления настоящего изобретения, т.е. ко всем способам, более подробно описанным ниже, а также ко всем молекулам нуклеиновой кислоты, которые охвачены настоящим изобретением. Следует отметить, что последовательность, кодирующая полипептид-репортер, всегда находится внутри рамки считывания с одной ATG на 5'-конце кодирующей последовательности так, что экспрессия соответствующего полипептида всегда выполняется правильно, т.е. продуцируется функциональный полипептид/белок. Кроме того, во всех вариантах осуществления настоящего изобретения последовательности нуклеиновой кислоты, кодирующие полипептиды-репортера, кодируют флуоресцентные полипептиды-репортеры. Указанный флуоресцентный полипептид-репортер может быть выбран из синего, зеленого, голубого, красного или инфракрасного флуоресцентного белка. В особо предпочтительном варианте осуществления настоящего изобретения последовательность репортера кодирует зеленый флуоресцентный белок.
Термин "функционально слитый" в настоящем изобретении, определяет, что по меньшей мере две области ДНК (например последовательность, кодирующая полипептид представляющего интерес гена, а также последовательность, кодирующая полипептид-репортер) связаны друг с другом. Таким образом, в одном из предпочтительных вариантов изобретения они могут формировать одну кодирующую последовательность для одного продукта экспрессии, т.е. одного белка, который состоит по меньшей мере из двух различных доменов/полипептидов. Таким образом, как упоминалось выше, существует только одна открытая рамка считывания, кодирующая соответствующий белок, причем для получения функционального экспрессируемого полипептида-репортера последовательность, кодирующая полипептид-репортер, всегда находится внутри указанной открытой рамкой считывания. Для кодирования белка, который получают из полипептида, представляющего интерес гена за которым следует флуоресцентный полипептид-репортер, предпочтительным является случай, когда последовательность представляющего интерес гена на 5'-конце слита с последовательностью репортера.
В другом предпочтительном варианте осуществления настоящего изобретения кодирующие области таких молекул нуклеиновых кислот могут дополнительно содержать спейсерную область, кодирующую полипептидный спейсер, находящийся между слитыми последовательностями представляющего интерес гена и репортера. В этом случае для получения функционального экспрессируемого спейсерного полипептида спейсерная область также всегда находится внутри указанной открытой рамки считывания.
Термин "функционально связанный" означает, что экспрессия кодирующей области, как определено выше, механически управляется другими областями, такими как промоторы или энхансеры. Эти области обычно представляют собой другую область ДНК, также присутствующую в молекуле нуклеиновой кислоты. Такие функционально связанные области могут находиться в любом месте молекулы нуклеиновой кислоты; однако предпочтительно они присутствуют в регуляторных областях, таких как промоторы на 5'-конце кодирующей последовательности.
В контексте управления экспрессией кодирующей последовательности термин "промоторная последовательность" или просто "промотор" относится к определенной ДНК-последовательности, которая влияет на экспрессию генов. Таким образом, обычная промоторная последовательность состоит из определенной последовательности оснований определенной длины, узнаваемой определенными клеточными факторами. Часто, эти факторы связаны с такими консервативными последовательностями и действуют как положительные или отрицательные регуляторы генной экспрессии и, следовательно, обычно называются "факторами транскрипции". Специалисту в данной области техники известны многие промоторные последовательности, а в искусственных молекулах нуклеиновой кислоты возможна даже комбинация различных промоторных последовательностей.
В зависимости от способа по настоящему изобретению могут использоваться различные промоторы. Таким образом, в предпочтительном варианте осуществления молекула нуклеиновой кислоты по изобретению может содержать промоторную последовательность, где указанная промоторная последовательность представляет собой человеческий промотор, идентифицируемый по меньшей мере одним человеческим фактором транскрипции, индуцирующим экспрессию указанной кодирующей последовательности. Кроме того, указанный человеческий промотор может быть сильным, конституитивно активным промотором. В других вариантах осуществления указанный человеческий промотор может быть сильным индуцируемым, например тканеспецифическим, промотором. В некоторых вариантах осуществления он также может быть вирусным промотором. В наиболее предпочтительном варианте осуществления изобретения промоторная последовательность молекулы нуклеиновой кислоты, регулирующая экспрессию кодирующей последовательности, содержащей среди прочего последовательность представляющего интерес гена, может быть эндогенной промоторной последовательностью (т.е. последовательностью, регулирующей экспрессию представляющего интерес эндогенного гена), таким образом отражая эндогенную ситуацию.
Термин "детектирование неинвазивным способом формирования оптического изображения" относится к любому способу, который можно использовать для неинвазивного детектирования в клетке флуоресцентных полипептидов-репортеров. Поскольку способ зависит от полипептида-репортера, это позволяет глубже изучить функциональные и биохимические свойства указанного полипептида, а также клетки, в которой происходит экспрессия данного полипептида. Способы "формирования оптического изображения", как правило, основаны на таких агентах, которые обычно называются контрастными агентами; в настоящем изобретении указанными контрастными агентами являются флуоресцентные полипептиды-репортеры.
Предпочтительно, детекцию флуоресцентных полипептидов-репортеров согласно способу по настоящему изобретению выполняют с помощью флуоресцентной микроскопии, формированием флуоресцентного изображения, однофотонной и многофотонной конфокальной микроскопии, лазерной индуцированной флуоресценции и т.д. Поскольку при возбуждении флуоресцентный белок испускает свет определенной длины волны, находящийся в клетке флуоресцентный белок необходимо привести в возбужденное состояние, используя свет, имеющий определенную длину волны возбуждения, с последующим детектированием света испускаемой длины волны (GFP, например, возбуждается УФ светом и испускает свет, длина волны которого соответствует зеленому цвету). Таким образом, способы детекции, используемые в настоящем изобретении, относятся к устройствам, которые испускают свет определенной длины волны для приведения флуоресцентных полипептидов в возбужденное состояние и детектирования света определенной длины волны, испускаемого флуоресцирующими полипептидами. Устройства, конечно, могут быть соединены с обычным оптическим микроскопом, монитором, устройствами хранения данных и т.п. Указанные устройства можно размещать в зависимости от предназначенного для мониторинга представляемого интерес места. Указанная область может быть, например, одной клеткой, кластером клеток на определенном участке чашки для культивирования клеток или клеткой в организме человека или животного, предпочтительно, тканью, состоящей из нескольких клеток в организме человека или организма животного, мониторинг которых осуществляется способом по настоящему изобретению. Можно использовать любое устройство с возможностью детекции флуоресцентных полипептидов, известных специалисту в данной области.
На этапе b) способа по настоящему изобретению уровень флуоресцентного полипептида-репортера детектируют до контактирования клетки с соединением, влияющим на экспрессию представляющего интерес гена. Затем, на следующем этапе, полипептид-репортер снова детектируют после контактирования указанного соединения, влияющего на экспрессию представляющего интерес гена, с указанной клеткой. Таким образом, можно детектировать два различных уровня полипептидов-репортеров. Затем можно "сравнить" эти два уровня, как описано в общих чертах на этапе e). Однако настоящее изобретение не зависит исключительно от этих двух этапов детектирования. В другом предпочтительном варианте осуществления настоящего изобретения второй этап детектирования можно повторять по меньшей мере 2, 3, 4, 5, 6, 10 или 100 раз для получения данных в течение некоторого времени. Таким образом, в одном из вариантов осуществления настоящее изобретение относится к способу, в котором второй этап детектирования d) выполняют несколько раз для определения изменения экспрессии представляющего интерес гена в течение некоторого времени. Таким образом, в указанных вариантах осуществления уровни полипептида-репортера можно анализировать в течение некоторого времени.
В другом предпочтительном варианте осуществления также можно записывать сигналы в режиме реального времени, получая видеоизображение считываемых данных, т.е. детектирование флуоресцентного белка. Это можно называть "получением живого изображения клетки" или "получением живого изображения ткани".
Конечно, временные точки могут подбираться в зависимости от соединения, влияющего на экспрессию представляющего интерес гена. Например, если соединение известно как медленно действующее на экспрессию представляющего интерес гена, возможно, более предпочтительно выполнять детектирование уровня флуоресцентного полипептида-репортера через какое-то время, например, через 5, 10, 20, 30 или 60 минут после введения указанного соединения. В случае если используется быстро действующее соединение, второй этап детектирования может быть выполнен через несколько секунд после введения соединения.
Кроме того, термин "сравнение" следует понимать как сравнение относительных количеств полипептидов-репортеров по меньшей мере на двух этапах детектирования. В одном из предпочтительных вариантов осуществления изобретения описан способ, как описано в общих чертах выше, в котором этап сравнения e) выполняется путем анализа относительных количеств пептидов-репортеров, детектирование которых проводилось на этапах b) и d). Таким образом, нет необходимости в определении абсолютных количеств указанных полипептидов. Однако, для получения нормализованных относительных количеств при использовании таких относительных количеств необходима гарантия того, что количества нормализованы относительно контроля или значения, которое является идентичным по меньшей мере на двух этапах детектирования.
Термин "определение изменения" в контексте настоящего изобретения означает, что после указанного сравнения разница и различия, соответственно, по меньшей мере на двух этапах детектирования выражены, например, в виде процентов. Это может включать выраженное в процентах уменьшение или выраженное в процентах увеличение уровня полипептида-репортера в течение некоторого времени детектирования. Также может быть сделано заключение, что уровень полипептида-репортера не меняется в течение некоторого времени или не изменилось в двух временных точках детектирования по меньшей мере двух полипептидов-репортеров.
Способ по настоящему изобретению можно использовать либо in vivo, либо in vitro.
В "случае in vivo" клетка, упомянутая в способе по настоящему изобретению, может быть частью ткани организма человека или животного или может быть клеткой, циркулирующей в организме человека или животного. В этом контексте, целью настоящего изобретения могут быть не только одна клетка, а предпочтительно клетки определенной ткани или клетки, в отношении которых имеется подозрение или относительно которых известно, что они являются причиной определенного заболевания. Как в общих чертах описано выше, нарушение экспрессии некоторых важных клеточных регуляторов (например, регуляторов клеточного цикла, таких как pRB, циклины, CdK и т.д.) может привести к заболеванию, такому как, например, рак. В случае in vivo, способ по настоящему изобретению можно использовать для мониторинга экспрессии представляющего интерес гена, например, в злокачественной ткани или опухоли при введении влияющего на экспрессию соединения. Предпочтительные варианты осуществления такого случая in vivo, согласно настоящему изобретению, более подробно описаны ниже.
Таким образом, в предпочтительном варианте осуществления настоящее изобретение описывает способ неинвазивного мониторинга in vivo экспрессии представляющего интерес гена в клетке, включающего по меньшей мере этапы:
a) введения нуклеиновой кислоты, содержащей:
aa) промоторную последовательность;
bb) функционально связанную с ней последовательность, кодирующую полипептид указанного представляющего интерес гена;
cc) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
в указанную клетку;
b) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения;
с) контактирования указанной клетки с соединением, влияющим на экспрессию указанного представляющего интерес гена;
d) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения на этапе c);
е) сравнения уровня флуоресцентного полипептида-репортера, детектированного на этапе b), с уровнем флуоресцентного полипептида-репортера, детектированного на этапе d);
f) определения изменения экспрессии указанного представляющего интерес гена, индуцированного указанным соединением, на основании сравнения, проведенного на этапе e).
В предпочтительном варианте осуществления случая in vivo настоящее изобретение описывает способ, как в общих чертах описано выше, в котором указанная молекула нуклеиновой кислоты и/или указанное соединение, влияющее на экспрессию представляющего интерес гена (например, РНКи), может быть введено в указанную клетку методом трансфекции с помощью сонопорации, местной инъекции или липосомных капсул, несущих антитела к антигенам клетки-хозяина, для правильного нацеливания, идентификации и локализации, или их комбинации. Такие способы известны специалисту в данной области техники.
Кроме того, в предпочтительном варианте осуществления in vivo настоящее изобретение относится к способу, в котором флуоресцентный полипептид-репортер, кодируемый последовательностью репортера, выбирают в зависимости от глубины расположения предназначенной для мониторинга ткани, т.е. для поверхностной ткани флуоресцентный белок выбирают из синего, зеленого или голубого флуоресцентных белков, а для глубоко расположенной ткани выбирают из красного или инфракрасного флуоресцентных белков.
Способ по настоящему изобретению также может использоваться in vitro. Такие случаи in vitro относятся предпочтительно к системам, использующим клетки млекопитающих, культивируемые в системах для культивирования клеток/тканей, или клетки, выделенные из организма человека или животного и используемые и/или обрабатываемые вне организма человека или животного.
"Системы для культивирования клеток млекопитающих" по настоящему изобретению охватывают все клеточные линии, известные и используемые специалистами в данной области техники. Эти клеточные линии могут быть линиями клеток человека, мыши, крысы, хомяка или курицы и могут быть культивированы стандартными способами. Конечно, могут использоваться различные клеточные линии человека, например, клетки HeLa, клетки 293, клетки WI-38, клетки U2OS и т.д.
Таким образом, один из вариантов осуществления настоящего изобретения включает способ неинвазивного мониторинга экспрессии представляющего интерес гена в клетке, включающий по меньшей мере этапы:
a) введения молекулы нуклеиновой кислоты, содержащей:
aa) промоторную последовательность;
bb) функционально связанную с ней последовательность, кодирующую полипептид указанного представляющего интерес гена;
cc) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
в клетку, которая находится вне организма человека или животного;
b) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения;
с) контактирования указанной клетки с соединением, влияющим на экспрессию указанного представляющего интерес гена;
d) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения на этапе c);
е) сравнения уровня флуоресцентного полипептида-репортера, детектированного на этапе b), с уровнем флуоресцентного полипептида-репортера, детектированного на этапе d);
f) определения изменения экспрессии указанного представляющего интерес гена, индуцированного указанным соединением, на основании сравнения, выполненного на этапе e).
В предпочтительном варианте осуществления в случае in vitro настоящее изобретение описывает способ, как в общих чертах описано выше, в котором указанная молекула нуклеиновой кислоты и/или указанное соединение, влияющее на экспрессию представляющего интерес гена (например, РНКи), может быть введено в указанную клетку методом трансфекции с помощью сонопорации, липосомной капсулы, электропорации или их комбинацией. Такие методы известны специалисту в данной области техники.
Изменение экспрессии представляющего интерес гена, мониторинг которого осуществляется способом по настоящему изобретению, может представлять собой усиление экспрессии или подавление экспрессии указанного представляющего интерес гена. Как изложено выше, это можно проанализировать либо in vivo, либо in vitro. В первом случае или при заболевании, экспрессия представляющего интерес гена может быть подавлена и, таким образом, целью может быть усиление экспрессии указанного представляющего интерес гена и мониторинг указанного усиления экспрессии. Второй случай может представлять собой случай усиления экспрессии представляющего интерес гена при заболевании. В такой ситуации целью может быть подавление экспрессии соответствующего гена и мониторинг указанного подавления экспрессии способом по настоящему изобретению. Ниже описаны предпочтительные варианты осуществления молекул нуклеиновой кислоты, а также способов по настоящему изобретению для любой ситуации. Эти варианты осуществления предназначены для иллюстрации указанных ситуаций. Таким образом, могут использоваться другие соединения, в целом имеющие такое же влияние либо подавления, либо усиления экспрессии гена.
В случае если экспрессия представляющего интерес гена подавляется, в предпочтительном варианте осуществления способы по настоящему изобретению могут включать применение деметилирующего лекарственного средства для усиления экспрессии такого гена. В противоположном случае, когда целью может быть подавление экспрессии представляющего интерес гена, в предпочтительных вариантах осуществления способы по настоящему изобретению относятся к применению РНКи. Ниже более подробно описаны эти две группы предпочтительных вариантов осуществления.
С целью анализа, является ли экспрессия гена подавленной/выключенной в результате ДНК-метилирования, до принятия решения относительно способа лечения и до использования способа мониторинга по изобретению можно провести исследование дифференциального метилирования. Это может быть сделано с помощью тонкоигольной аспирационной цитологии. С помощью такого тонкоигольного аспирационного метода могут быть получены образцы ДНК и проанализированы их метильные группы. Специалисту в данной области техники известны такие методы.
В приведенных ниже параграфах упомянуты предпочтительные варианты осуществления настоящего изобретения, относящиеся к способам мониторинга увеличения экспрессии представляющего интерес гена.
Таким образом, настоящее изобретение раскрывает в способе выделенную молекулу нуклеиновой кислоты, содержащую:
а) метилированную промоторную последовательность;
b) функционально связанную с ней последовательность, кодирующую полипептид представляющего интерес гена;
с) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер.
Кодирующая последовательность, состоящая из последовательностей b) и c), содержит один старт-кодон на 5'-конце и один стоп-кодон на 3'-конце. Термин «один старт-кодон» в настоящем описании, означает, что последовательность может содержать дополнительные внутренние кодоны ATG, которые, однако, не могут использоваться для инициации трансляции.
Как уже упоминалось выше, известно, что метилирование ДНК, в частности, промоторов, ингибирует экспрессию генов, которыми управляют указанные промоторы. Метилирование ДНК предпочтительно следует понимать как метилирование оснований, предпочтительно цитозинов. Ген функционально связанный с метилированной промоторной последовательностью не может быть описан и, таким образом, не может быть активным. Для вышеупомянутой молекулы нуклеиновой кислоты соответствующая кодирующая последовательность, состоящая из b) и c), не будет экспрессироваться, если промоторная последовательность является и остается метилированной. Однако если указанная область больше не модифицируется метильными группами, указанная последовательность является человеческой промоторной последовательностью, идентифицируемой по меньшей мере одним человеческим фактором транскрипции, индуцирующим экспрессию указанной кодирующей области. Таким образом, деметилирование указанной метилированной промоторной области дает неметилированную область, которая способна стимулировать экспрессию гена, функционально связанного с указанной областью. Настоящее изобретение раскрывает такую вышеописанную молекулу нуклеиновой кислоты, в которой под действием диметилирующего лекарственного средства неметилированная промоторная последовательность становится человеческим промотором, идентифицируемым по меньшей мере одним человеческим фактором транскрипции, индуцирующим экспрессию кодирующей последовательности. В предпочтительном варианте осуществления указанный метилированный промотор молекулы нуклеиновой кислоты идентичен эндогенному метилированному промотору представляющего интерес гена.
В предпочтительном варианте осуществления настоящего изобретения раскрытая молекула нуклеиновой кислоты, как описано в выше приведенных параграфах, содержит последовательность представляющего интерес гена, где представляющий интерес ген представляет собой ген-супрессор опухоли или ген, в отношении которого имеется подозрение, что его выключение послужило причиной развития заболевания. В одном из примеров такого варианта осуществления представляющий интерес ген может представлять собой RB. В других случаях представляющий интерес ген может представлять собой CADM1, ZMYND10, RASSF5, PTEN, SERPINB5, EPB41L3, DAPK1 и т.п.
В других вариантах осуществления указанная конструкция/молекула нуклеиновой кислоты может использоваться либо в in vivo способе, либо в in vitro способе по изобретению. Термин "деметилирующее лекарственное средство" или "деметилирующее соединение" в настоящем описании, охватывает любое лекарственное средство, способное выполнять в клетке ДНК-деметилирование, т.е. удалять метильные группы из ДНК и предпочтительно из цитозинов. Указанное соединение может быть выбрано из группы соединений, содержащей 5-азацитидин и т.п. Систематическим названием 5-азацитидина согласно IUPAC является 4-амино-1-[3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-1,3,5-триазин-2-он). Указанный химический аналог цитидина встраивается в ДНК и РНК во время репликации ДНК и транскрипции ДНК, соответственно. Такое встраивание ингибирует активность ферментов метилтрансфераз, таких как, например, DNMT1. Таким образом, встраивание приводит к деметилированию. Конечно, специалист в данной области техники знаком с другими аналогами цитидина и/или соединениями цитидина, действующими аналогично 5-азацитидину, такими как 5-аза-2'дезоксицитидин, 1-(бета-D-рибофуранозил), дегидро-5-азацитидин, [1-(бета-D-рибофуранозил)-1,2-дигидропиримидин-2-он], который также известен как Зебуларин (Zebularine), и т.п. Механизмы их действия также могут быть основаны на ингибировании метилтрансфераз путем формирования комплексов и/или элиминации метилтрансфераз и т.д. Как уже описано выше, действие таких лекарственных средств на метилированные промоторные области представляет собой активацию регулируемого гена.
Таким образом, в предпочтительном варианте осуществления настоящее изобретение относится к способу неинвазивного мониторинга in vivo экспрессии представляющего интерес гена в клетке, включающему по меньшей мере этапы:
a) введения молекулы нуклеиновой кислоты, содержащей:
aa) метилированную промоторную последовательность;
bb) функционально связанную с ней последовательность, кодирующую полипептид указанного представляющего интерес гена;
cc) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
в указанную клетку;
b) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения;
с) контактирования указанной клетки с деметилирующим лекарственным средством;
d) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения на этапе c);
е) сравнения уровня флуоресцентного полипептида-репортера, детектированного на этапе b), с уровнем флуоресцентного полипептида-репортера, детектированного на этапе d);
f) определения усиления экспрессии указанного представляющего интерес гена, индуцированного деметилирующим лекарственным средством, на основании сравнения, выполненного на этапе e).
В другом предпочтительном варианте осуществления настоящее изобретение относится к способу, включающему по меньшей мере этапы:
a) введения молекулы нуклеиновой кислоты, содержащей:
aa) метилированную промоторную последовательность;
bb) функционально связанную с ней последовательность, кодирующую полипептид указанного гена;
cc) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
в клетку, которая находится вне организма человека или животного;
b) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения;
с) контактирования указанной клетки с деметилирующим лекарственным средством;
d) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения на этапе c);
е) сравнения уровня флуоресцентного полипептида-репортера, детектированного на этапе b), с уровнем флуоресцентного полипептида-репортера, детектированного на этапе d);
f) определения усиления экспрессии указанного представляющего интерес гена, индуцированного деметилирующим лекарственным средством, на основании сравнения, выполненного на этапе e).
Как в случае in vivo, так и в случае in vitro, в предпочтительном варианте осуществления настоящее изобретение описывает способ, в котором дозирование деметилирующего лекарственного средства можно увеличивать или уменьшать в зависимости от определения, выполненного на этапе f), как упомянуто выше. Кроме того, в предпочтительном варианте осуществления настоящее изобретение также описывает способ, в котором может проводиться исследование, отдельно или в комбинации, различных деметилирующих лекарственных средств для получения самого сильного увеличения экспрессии указанного представляющего интерес гена в зависимости от определения, выполненного на этапе f), как упомянуто выше.
Подавление экспрессии представляющего интерес гена также может происходить из-за конформационных ограничений соответствующей ДНК-последовательности. Известно, что закрытая конформация, в частности, в промоторных областях может отрицательно влиять на экспрессию гена. Указанная закрытая или "упакованная" конформация ДНК, по-видимому, коррелирует с состоянием ацетилирования ДНК. Таким образом, ацетильные группы в ДНК, по-видимому, приводят к формированию более открытой конформации ДНК и, таким образом, положительно влияют на экспрессию гена. Такие ацетильные группы переносятся в ДНК с помощью гистон-ацетилтрансфераз (HAT) и удаляются из ДНК с помощью гистон-деацетилаз (HDAC). Путем ингибирования HDAC можно усиливать состояние ацетилирования ДНК и, таким образом, может быть увеличена экспрессия гена. Обычные HDAC-ингибиторы, используемые в способе по настоящему изобретению, могут представлять собой 3-(1-метил-4-фенилацетил-1H-2-пирролил)-N-гидрокси-2-пропенамид, цикло[(2S)-2-амино-8-оксодеканолил-1-метокси-L-триптофил-L-изолейцил-(2R)-2-пиперидинэкскарбонил], бутират натрия, 4,5:8,9-диангидро-1,2,6,7,11-пентадиокси-D-трео-D-идо-ундека-1,6-диенитол, гидроксиамид 6-(1,3-диоксо-1H,3H-бензо[де]изохинолин-2-ил)гексановой кислоты, 2-[(2-гидроксинафтален-1-илметилен) амино]-N-(1-фенетил)бензамид, [R-(E,E)]-7-[4-(диметиламино)фенил]-N-гидрокси-4,6-диметил-7-оксо-2,4-гептадиенамид и т.п. Эти ингибиторы предоставляет, например, фирма SigmaAldrich (см. <http://www.sigmaaldrich.com/Area_of_Interest/Life_Science/Cell_Signaling/Product_>Highlights/HistoneDeacetylaselnhibitors.html). Другие примеры HDAC-ингибиторов представляют собой PXD101 (также называемый белиностат (Belinostat)) и SAHA. В частности, в этом варианте осуществления изобретения промоторная область молекулы нуклеиновой кислоты, используемой в способе по настоящему изобретению, соответствует эндогенному промотору представляющего интерес гена, таким образом отражая конформацию ДНК эндогенного промотора.
В предпочтительном варианте осуществления настоящее изобретение, таким образом, относится к способу неинвазивного мониторинга in vivo экспрессии представляющего интерес гена в клетке, включающего по меньшей мере этапы:
a) введения молекулы нуклеиновой кислоты, содержащей:
aa) промоторную последовательность указанного представляющего интерес гена;
bb) функционально связанную с ней последовательность, кодирующую полипептид указанного представляющего интерес гена;
cc) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
в указанную клетку;
b) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения;
с) контактирования указанной клетки с HDAC-ингибитором;
d) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения на этапе c);
е) сравнения уровня флуоресцентного полипептида-репортера, детектированного на этапе b), с уровнем флуоресцентного полипептида-репортера, детектированного на этапе d);
f) определения усиления экспрессии указанного представляющего интерес гена, индуцированного HDAC-ингибитором, на основе сравнения, выполненного на этапе e).
В другом предпочтительном варианте осуществления настоящее изобретение относится к способу, включающему по меньшей мере этапы:
a) введения молекулы нуклеиновой кислоты, содержащей:
aa) промоторную последовательность представляющего интерес гена;
bb) функционально связанную с ней последовательность, кодирующую полипептид указанного представляющего интерес гена;
cc) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
в клетку, которая находится вне организма человека или животного;
b) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения;
c) контактирования указанной клетки с HDAC-ингибитором;
d) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения на этапе c);
e) сравнения уровня флуоресцентного полипептида-репортера, детектированного на этапе b), с уровнем флуоресцентного полипептида-репортера, детектированного на этапе d);
f) определения усиления экспрессии указанного представляющего интерес гена, индуцированного HDAC-ингибитором, на основании сравнения, выполненного на этапе e).
В приведенных ниже параграфах описаны предпочтительные варианты осуществления настоящего изобретения, относящиеся к способам мониторинга уменьшения экспрессии представляющего интерес гена.
Таким образом, настоящее изобретение раскрывает молекулу нуклеиновой кислоты, используемую в in vivo способе по настоящему изобретению, содержащую:
а) промоторную последовательность;
b) функционально связанную с ней последовательность, кодирующую нефункциональный полипептид представляющего интерес гена;
с) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
где кодирующая область, состоящая из b) и c), содержит по меньшей мере один старт-кодон на 5'-конце и один стоп-кодон на 3'-конце.
В предпочтительном варианте осуществления настоящего изобретения раскрытая молекула нуклеиновой кислоты, как описано в выше приведенных параграфах, содержит последовательность представляющего интерес гена, где представляющий интерес ген представляет собой онкоген или протоонкоген или ген, в отношении которого имеется подозрение, что усиление его экспрессии является причиной заболевания. В одном из примеров такого варианта осуществления представляющий интерес ген может представлять собой Her-2neu. В других примерах представляющий интерес ген может представлять собой VEGF, RAS, Wnt, MYC, ERK, TRK и т.д.
Ссылаясь на предпочтительные варианты осуществления изобретения, причина, по которой полипептид представляющего интерес гена может быть предпочтительно нефункциональным в ситуации in vivo, является очевидной. В случае если бы он был функциональным, это привело бы к усилению общей экспрессии гена (в большинстве случаев онкогена) в результате усиления экспрессии эндогенного гена и последовательность представляющего интерес экзогенного гена. Это может быть губительным для клеток/ткани.
Таким образом, в предпочтительном варианте осуществления, относящемся к in vivo способу, последовательность представляющего интерес гена, кодирующий нефункциональный полипептид, содержит либо часть последовательности представляющего интерес гена, либо полную последовательность представляющего интерес гена, содержащую по меньшей мере одну вставку, по меньшей мере одну делецию, по меньшей мере одну замену нуклеотида или их комбинации для получения нефункционального полипептида представляющего интерес гена. Однако он не содержит стоп-кодоны. Таким образом, нефункциональный полипептид представляющего интерес гена может быть получен, например, путем сдвига рамки считывания в результате по меньшей мере одной вставки или по меньшей мере одной делеции в последовательности представляющего интерес гена. Он также может быть получен путем одной замены нуклеотида, приводящей к замене аминокислоты в соответствующем полипептиде, которая приводит к нарушению трехмерной структуры полученного белка. В случае если онкоген представляет собой представляющий интерес ген, могут быть удалены последовательности, кодирующие функциональные части полученного онкогена (такие как каталитический домен, связывающий домен, домен димеризации и т.д.), а в качестве последовательности представляющего интерес гена в молекуле нуклеиновой кислоты по настоящему изобретению может использоваться оставшаяся кодирующая последовательность, при этом полученный полипептид не будет функциональным. Специалист в данной области техники, несомненно, знает, что может быть удалено множество последовательностей, и что длина удаленной последовательности(последовательностей) может меняться в зависимости от представляющего интерес гена.
В случае если представляющий интерес ген кодирует фактор транскрипции, в другом варианте осуществления промоторная последовательность молекулы нуклеиновой кислоты, как описано в этом аспекте изобретения, может представлять собой человеческий промотор, узнаваемый исключительно указанным фактором транскрипции человека, кодируемым представляющим интерес геном. Таким образом, в случае подавления экспрессии указанного представляющего интерес гена экспрессия кодирующей последовательности (и, таким образом, флуоресцентного полипептида-репортера) также будет подавлена в результате сниженного уровня полипептида представляющего интерес гена, который представляет собой соответствующий фактор транскрипции.
В других вариантах осуществления указанная конструкция/молекула нуклеиновой кислоты может использоваться либо в in vivo способе, либо в in vitro способе по изобретению.
В данном контексте настоящее изобретение описывает способ мониторинга уменьшения экспрессии представляющего интерес гена. Указанное уменьшение может быть достигнуто с помощью соединений/молекул, содержащих антисмысловые РНК, РНК-шпильки, миРНК, микроРНК или другие молекулы нуклеиновой кислоты с подобной функцией, которые имеют общее название "РНКи" или "РНК-интерференции" или "молекулы-ингибиторы". Указанные молекулы могут быть дополнительно модифицированы, например, с помощью наночастиц.
Используя такие стратегии РНК-интерференции, крайне важно использовать молекулы, которые определенным образом препятствуют экспрессии только представляющего интерес гена, но не экспрессии другого неродственного клеточного фактора. Выбор, идентификация и продуцирование таких ингибиторов на основе РНК известны специалисту в данной области.
Обычно, идентификацию последовательности выполняют в пределах кодирующей последовательности представляющего интерес гена, которая может достигаться путем использования подхода антисмысловой стратегии или подхода с применением миРНК в случае отсутствия, например, вторичных структурных элементов, которые, вероятно, препятствовали бы in vivo взаимодействию между молекулами ингибиторной РНК и соответствующей мРНК. Такие отрезки нуклеиновых кислот могут быть идентифицированы с помощью компьютерных программ, таких как SFOLD.
Затем на втором этапе такие последовательности сравнивают с другими последовательностями для определения, являются ли они уникальными для соответствующего представляющего интерес гена. Это может осуществляться, например, путем выполнения BLAST поиска в национальном центре биотехнологической информации (National Center for Biotechnology Information) (<http://www.ncbi.nlm.nih.gov/>).
После идентификации уникальных последовательностей могут быть выбраны ингибиторные антисмысловые или миРНК с помощью комплементарной последовательности, которая предпочтительно точно соответствует идентифицированным последовательностям. Конечно, могут использоваться более низкие степени комплементарности при условии, что комплементарность не уменьшается до уровня, на котором может происходить неспецифическое взаимодействие между ингибиторными антисмысловыми или миРНК и матричными РНК других клеточных факторов.
Обычно, уровни комплементарности между молекулами ингибиторной РНК и идентифицированными определенными последовательностями составляют по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99%.
Термин "комплементарность" конечно известен специалисту в данной области техники, поскольку он относится к основным свойствам молекул нуклеиновой кислоты, их гибридизации друг с другом благодаря способности аденозина образовывать пару с тимином и урацилом, а гуанидина образовывать пару с цитидином.
Специалист в данной области, конечно, понимает, что последовательность нуклеиновой кислоты, комплементарная всей кодирующей последовательности или частям последовательности представляющего интерес гена, должна иметь определенную минимальную длину с тем, чтобы гарантировать, что комплементарная последовательность является действительно специфичной для представляющего интерес гена.
Следовательно, последовательность нуклеиновой кислоты в пределах ингибиторной молекулы, которая комплементарна представляющему интерес гену, должна состоять из по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23, по меньшей мере 24, по меньшей мере 25, по меньшей мере 26, по меньшей мере 27, по меньшей мере 28, по меньшей мере 29, по меньшей мере 30, по меньшей мере 50, по меньшей мере 75, по меньшей мере 100, по меньшей мере 150, по меньшей мере 200, по меньшей мере 300 или по меньшей мере 400 нуклеотидов в длину и быть непрерывной.
Специалист в данной области, конечно, также знает, что минимальная степень комплементарности, необходимая для получения гарантии того, что комплементарная последовательность нуклеиновой кислоты действительно специфически нацелена на представляющий интерес ген, меняется в зависимости от длины последовательности нуклеиновой кислоты, комплементарной кодирующим последовательностям или частям этой последовательности представляющего интерес гена. Таким образом, если используется довольно длинная молекула нуклеиновой кислоты, состоящая из 30, 50, 60, 75, 100 нуклеотидов, может использоваться более низкая степень комплементарности, которая все еще будет гарантировать специфичность между ингибиторной молекулой и кодирующей последовательностью или частями этой последовательности представляющего интерес гена, тогда как, если комплементарная последовательность нуклеиновой кислоты в ингибиторной молекуле содержит в длину, например, только по меньшей мере 14, 15, 16, 17 или 19 нуклеотидов, конечно, требуется более высокая степень комплементарности.
Как упоминалось выше, уменьшение экспрессии представляющего интерес гена может достигаться с помощью "РНКи" или "РНК-интерференции" или "молекул-ингибиторов", разработанных, как в общих чертах описано выше.
Следовательно, один из классов таких молекул-ингибиторов может представлять собой молекулы, содержащие рекомбинантную молекулу нуклеиновой кислоты, имеющую последовательность нуклеиновой кислоты, которая комплементарна полным кодирующим последовательностям или частям этих последовательностей представляющего интерес гена. Молекулы последовательности нуклеиновой кислоты могут быть получены из ДНК, РНК или другой молекулы на основе нуклеиновой кислоты, которая, однако, вместо нуклеотидов может включать по меньшей мере частично нуклеотидные аналоги, при условии, что полученная молекула способна к специфической гибридизации с полной кодирующей последовательностью или частями этой последовательности представляющего интерес гена.
В предпочтительном варианте осуществления выше описанные ингибиторные молекулы предпочтительно содержат антисмысловую РНК, РНК-шпильку, миРНК, микроРНК или другие молекулы нуклеиновой кислоты с аналогичной функцией в отношении представляющего интерес гена.
Эти термины ясно указывают специалисту в данной области на то, каким образом эти молекулы должны быть синтезированы, какой должна быть степень комплементарности и т.д. Следует иметь в виду, что антисмысловые РНК, а также РНК-шпильки и миРНК по изобретению соответствуют вышеуказанным критериям, относящимся к длине этих молекул нуклеиновой кислоты, их степени комплементарности и т.д.
Антисмысловая молекула обычно содержит в длину 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 50, 70, 100, 150, 200, 300 или более нуклеотидов.
Для РНК-интерференции можно использовать так называемую короткую РНК-шпильку или олигонуклеотиды синтетической двуцепочечной миРНК.
Молекула миРНК обычно содержит в длину 20, 21, 22, 23, 24 или 25 нуклеотидов.
Как правило, в качестве молекулы РНК-шпильки экспрессируются одноцепочечные молекулы РНК, которые формируют внутримолекулярную шпилечную структуру. Путем внутримолекулярного процессинга с участием фермента Dicer из нее получают молекулы миРНК.
Внутриклеточная транскрипция молекул РНК-шпилек может быть получена в случае экспрессии обеих нитей дуплекса РНК-шпильки с помощью вектора экспрессии в виде одной молекулы РНК или молекулы ДНК. Для этой цели, нить транскрибированной РНК теоретически должна содержать 19-21 нуклеотидов смысловой последовательности РНК-шпильки и теоретически 19-21 нуклеотидов соответствующей комплементарной последовательности. Обе последовательности теоретически могут быть выделены, например, с помощью спейсера длиной в шесть нуклеотидов.
Известно, что эффективность миРНК опосредованная подавлением клеточных целевых транскриптов зависит от выбора подходящих последовательностей миРНК. Для создания эффективных молекул миРНК были разработаны основные принципы. Эти основные принципы были разработаны для синтетических олигонуклеотидов миРНК, но их также следует применять для формы молекул РНК-шпильки, подвергнутой процессингу.
Другие олигонуклеотиды синтетической миРНК, отличные от РНК-шпильки, которые получают только после экспрессии и процессинга внутри клеток, состоят из двуцепочечных молекул РНК, которые обычно имеют длину от 19 до 21 нуклеотидов. Эти молекулы миРНК, например, могут быть внедрены в клеточные системы с помощью трансфекции, как упомянуто выше, и таким образом инициировать процесс РНКи.
Определение целевой последовательности и мотива последовательности миРНК можно, например, выполнять согласно известным публикациям, таким как Tuschl and et al. Таким образом, для идентификации только подходящих целевых последовательностей миРНК можно использовать кодирующую область целевой мРНК. Хотя предпочтительным является, чтобы выбранный мотив последовательности миРНК был направлен на кодирующую область целевой мРНК, он также может быть разработан против регуляторных областей представляющего интерес гена, таких как 5'- и 3'-нетранслируемые области.
Если в качестве целевых последовательностей используются кодирующие последовательности матричной РНК, как правило, можно использовать последовательности, начиная с 70-го нуклеотида, расположенного ниже старт-кодона, и заканчивая 50-м нуклеотидом, расположенным выше стоп-кодона.
Затем эта область последовательности может быть исследована на предмет поиска мотива AA (N19) последовательности, в котором N означает любой нуклеотид. В этом случае, полученная последовательность миРНК будет содержать 19 нуклеотидов после мотива AA и предпочтительно два дополнительно добавленных остатка тимидина или уридина. В случае олигонуклеотидов синтетической миРНК остатки уридина предпочтительно могут быть заменены тимидином.
В другом подходе можно использовать основные принципы, разработанные Reynolds and et al.
Reynolds and et al. предлагает следующие критерии выбора потенциальных целевых последовательностей РНК-шпильки или синтетических миРНК:
1. 30-50% содержание цитозина-гуанина
2. по меньшей мере три аденина или урацила в положениях 15-19 смысловой нити
3. отсутствие межмолекулярных шпилечных структур
4. аденин в положении 19 смысловой нити
5. аденин в положении 3 смысловой нити
6. урацил в положении 10 смысловой нити
7. отсутствие гуанина или цитозина в положении 19 смысловой нити
8. отсутствие гуанина в положении 13 смысловой нити.
Эти восемь критериев могут быть взвешенными согласно следующей схеме:
(i) 1 балл для критериев 1, 3, 4, 5 и 6;
(ii) 1 балл для каждого аденина или уридина в положении 15-19, по меньшей мере 3 соответствующих основания (критерий 2);
(iii) каждое несоответствие критериям 7-8 дает по 1 баллу.
Согласно Reynolds, следует рассматривать только последовательности миРНК или РНК-шпильки, которые согласно этой схеме имеют величину баллов, равную по меньшей мере 6. Затем такие последовательности миРНК могут использоваться для поиска гомологии с помощью программы BLAST. Следуя этому подходу, могут быть исключены миРНК, которые исходя из их гомологии с другими кодирующими мРНК последовательностями могут приводить к неспецифической репрессии целевых структур.
При таком способе определения последовательностей миРНК или РНК-шпильки их можно клонировать в плазмиду для экспрессии. Таким образом, последовательности РНК могут быть клонированы в плазмиду pSuppressor (pSHH, Imgenex, Сан-Диего, Калифорния, США). Для клонирования последовательностей миРНК в конструкции pSHH можно использовать гибридизованные ДНК-олигонуклеотиды, которые содержат смысловую последовательность миРНК, спейсер, соответствующую антисмысловую последовательность и последовательность терминации.
Таким образом, в предпочтительном варианте осуществления настоящее изобретение относится к способу неинвазивного мониторинга in vivo экспрессии представляющего интерес гена в клетке, включающему по меньшей мере этапы:
a) введения молекулы нуклеиновой кислоты, содержащей:
aa) промоторную последовательность;
bb) функционально связанную с ней последовательность, кодирующую нефункциональный полипептид упомянутого представляющего интерес гена;
cc) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
в указанную клетку;
b) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения;
с) контактирования упомянутой клетки с РНКи, структура которой соответствует представляющему интерес гену;
d) детекции флуоресцентного полипептида-репортера в упомянутой клетке неинвазивным способом формирования оптического изображения на этапе c);
е) сравнения уровня флуоресцентного полипептида-репортера, детектированного на этапе b), с уровнем флуоресцентного полипептида-репортера, детектированного на этапе d);
f) определения уменьшения экспрессии указанного представляющего интерес гена, индуцированного РНКи, на основании, выполненного на этапе e).
В другом предпочтительном варианте осуществления настоящее изобретение относится к способу, включающему по меньшей мере этапы:
a) введения молекулы нуклеиновой кислоты, содержащей:
aa) промоторную последовательность;
bb) функционально связанную с ней последовательность, кодирующую полипептид упомянутого представляющего интерес гена;
cc) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
в клетку, которая находится вне организма человека или животного;
b) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения;
с) контактирования упомянутой клетка с РНКи, структура которой соответствует представляющему интерес гену;
d) детекции флуоресцентного полипептида-репортера в указанной клетке неинвазивным способом формирования оптического изображения на этапе c);
e) сравнения уровня флуоресцентного полипептида-репортера, детектированного на этапе b), с уровнем флуоресцентного полипептида-репортера, детектированного на этапе d);
f) определения уменьшения экспрессии упомянутого представляющего интерес гена, индуцированного РНКи, на основании сравнения, выполненного на этапе e).
В контексте мониторинга эффекта РНКи в клетке, находящейся вне организма человека или животного, один из вариантов осуществления настоящего изобретения относится к способу нацеливания РНКи на этапе c) на клетку, которая уже экспрессирует полипептид-репортер; при этом в упомянутую клетку уже была введена таким образом молекула нуклеиновой кислоты. Указанный вариант осуществления содержит либо вторую молекулу нуклеиновой кислоты, содержащую вторую кодирующую последовательность, либо вторую кодирующую последовательность в первой молекуле нуклеиновой кислоты, причем указанная вторая кодирующая последовательность функционально связана с сильным конститутивным промотором. В случае наличия второй молекулы, она вводится в клетку вместе с первой молекулой нуклеиновой кислоты. Указанная вторая кодирующая область кодирует трансмембранный белок, который также экспрессируется при введении. Таким образом, клетка, экспрессирующая полипептид представляющего интерес гена и полипептида-репортера, также экспрессирует трансмембранный белок. Белок нацеливается на мембрану посредством сигналов клеточной локализации и процессинга. Однако внеклеточная часть указанного трансмембранного белка является искусственной и, таким образом, обычно не присутствует вне клетки. Таким образом, эта внеклеточная часть "маркирует" клетку как уже имеющую интернализированную и экспрессированную молекулу нуклеиновой кислоты этапа a). Она также может служить участком “причаливания” для любых антител, специфически нацеленных на эту внеклеточную часть трансмембранного белка. Такие антитела могут быть легко получены согласно стандартными процедурами, известными специалисту в данной области. Теперь, для специфического нацеливания РНКи на этапе c) на и в клетку, уже экспрессирующей кодирующую последовательность молекулы нуклеиновой кислоты, искусственная часть трансмембранного белка может использоваться в качестве якорной области. Как упомянуто выше, РНКи может быть введена методами трансфекции, включая методы, использующие липосомные капсулы, несущие антитела к внешним антигенам клетки. Эти антитела могут быть направлены против внеклеточной части трансмембранного белка, и таким образом РНКи специфически нацеливается на соответствующие клетки-мишени.
Следует иметь в виду, что в любом способе по настоящему изобретению, относящемуся к РНКи, последовательности представляющего интерес гена молекулы нуклеиновой кислоты, используемой в указанном способе, содержат по меньшей мере область представляющего интерес гена, которому соответствует эта РНКи.
Как в случаях in vivo, так и в случаях in vitro, в предпочтительном варианте осуществления настоящее изобретение описывает способ, в котором можно увеличивать или уменьшать дозирование РНКи согласно определению, выполняемому на этапе f), как упомянуто выше. Кроме того, в предпочтительном варианте осуществления настоящее изобретение также описывает способ, в котором различные РНКи, структура которых соответствует одному из представляющих интерес генов, могут быть исследованы отдельно или в комбинации для получения самого сильного увеличения экспрессии указанного представляющего интерес гена согласно определению, выполняемому на этапе f), как упомянуто выше.
В другом аспекте изобретение относится к применению способа, как описано выше.
В одном из вариантов осуществления, относящемуся к случаю in vivo, изобретение таким образом относится к применению способа для мониторинга увеличения экспрессии представляющего интерес гена, индуцируемого, например, деметилирующим лекарственным средством в течение некоторого времени in vivo в случае лечения болезни, например, с помощью деметилирующего лекарственного средства. Таким образом, способ может использоваться для мониторинга терапевтического эффекта деметилирующего лекарственного средства. Следовательно, в другом варианте осуществления изобретение относится к применению способа для мониторинга уменьшения экспрессии представляющего интерес гена, индуцируемого РНКи в течение некоторого времени in vivo в случае лечения болезни с помощью РНКи. В этом случае способ может использоваться для мониторинга терапевтического эффекта РНКи. Очевидно, что в случае РНКи, первый этап детектирования должен показать увеличение сигнала в способе формирования оптического изображения, поскольку в ином случае, уменьшение сигнала детектироваться не будет. Таким образом, в случае отсутствия полипептида-репортера, детектируемого на первом этапе детектирования, условия предыдущих этапов могут быть оптимизированы для подбора подходящих условий, при которых возможно обнаружение. Только затем может быть введено терапевтическое соединение.
В случае если функциональный полипептид представляющего интерес гена экспрессируется молекулой нуклеиновой кислоты по изобретению, указанный функциональный полипептид представляющего интерес гена также может использоваться как терапевтический. Как в общих чертах описано выше, в случае выключения генов, например, при раке, часто оказывается, что гены-супрессоры опухоли выключены. Это можно лечить с помощью деметилирующего лекарственного средства или HDAC-ингибитора и проводить мониторинг способом по настоящему изобретению. При применении указанного способа может быть введен функциональный полипептид-супрессор опухоли, кодируемый последовательность представляющего интерес гена и проявляющий дополнительные положительные терапевтические эффекты.
Кроме того, в одном из вариантов осуществления способ по изобретению может использоваться для подбора дозы деметилирующего лекарственного средства или РНКи с целью получения уменьшения или увеличения экспрессии представляющего интерес гена. Кроме того, способ может использоваться для тестирования различных метилирующих агентов или РНКи для выявления самого мощного деметилирующего лекарственного средства/РНКи отдельно или в комбинации с другими деметилирующими лекарственными средствами и РНКи, соответственно. Это относится как к случаям in vivo, так и in vitro. В случаях in vitro, подобных системам для культивирования клеток, как упомянуто выше, способ изобретения предпочтительно может использоваться для осуществления скрининга соединений, оказывающих влияние на изменение экспрессии представляющего интерес гена. Таким образом, он может использоваться в качестве системы для осуществления быстрого скрининга с целью тестирования лекарственных средств, которые могут оказывать воздействие на экспрессию генов.
В одном из вариантов осуществления способ по изобретению может использоваться для доставки деметилирующего лекарственного средства, а также для мониторинга доставки указанного лекарственного средства и в то же время для мониторинга увеличения экспрессии представляющего интерес гена, индуцированного указанным лекарственным средством. Следовательно, в другом варианте осуществления способ по изобретению может использоваться для предоставления РНКи, мониторинга доставки указанной РНКи, и в то же время для мониторинга уменьшения экспрессии представляющего интерес гена, индуцированного указанной РНК. Это также относится как к случаям in vivo, так и случаям in vitro.
Следует иметь в виду, что приведенный в данном описании пример и чертежи не должны рассматриваться в качестве ограничения. Специалист в данной области будет в состоянии предвидеть дальнейшие модификации приведенных здесь принципов.
Пример
Протокол способа неинвазивного мониторинга экспрессии Her-2neu (ген, о котором известно, что усиление его экспрессии приводит к раку молочной железы) в ткани рака молочной железы при трансфекции в указанную ткань РНКи, структура которой соответствует Нее-2neu.
Схематическая блок-схема стадий осуществления способа приведена на фиг.1.
Стадия 1: получение конструкции ДНК. Указанная конструкция содержала человеческий промотор, который, как известно, является активным в ткани рака молочной железы, функционально связанную с полипептидов, содержащей VEGF (SEQ ID N0:10), RAS (SEQ ID N0:11), Wnt (SEQ ID N0:12), MYC (SEQ ID N0:13), ERK (SEQ ID N0:14) и TRK (SEQ ID N0:15);
c) функционально слитую с ней последовательность, кодирующую флуоресцентный полипептид-репортер;
причем кодирующая последовательность, состоящая из b) и c), содержит один старт-кодон на 5'-конце и один стоп-кодон на 3'-конце.
Предпочтительно последовательность, указанную выше в п.b), выбирают из VEGF (SEQ ID N0:10) и/или Wnt (SEQ ID N0:12).
Таким образом, в соответствующем предпочтительном варианте осуществления этого аспекта изобретения, последовательность, кодирующая нефункциональный полипептид, выбранный из группы полипептидов, содержащей VEGF (SEQ ID N0:10), RAS (SEQ ID N0:11), Wnt (SEQ ID N0:12), MYC (SEQ ID N0:13), ERK (SEQ ID N0:14) и TRK (SEQ ID N0:15), содержит либо часть всей последовательности, либо всю последовательность, содержащую по меньшей мере одну вставку, по меньшей мере одну делецию, по меньшей мере одну замену нуклеотида, или их комбинацию для получения нефункционального полипептида. Однако эта последовательность не содержит стоп-кодоны.
В другом варианте осуществления, относящемся к этому аспекту, настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, содержащей:
a) промоторную последовательность;
b) функционально связанную с ней последовательность, кодирующую нефункциональный полипептид Her-2neu (SEQ ID N0:9),
14. Применение молекулы нуклеиновой кислоты по пп.7-11 для подбора дозы соединения, влияющего на экспрессию представляющего интерес гена для получения дальнейшего изменения экспрессии указанного представляющего интерес гена.
15. Применение молекулы нуклеиновой кислоты по пп.7-11 для тестирования различных деметилирующих лекарственных средств с целью выявления самого мощного деметилирующего лекарственного средства отдельно или в комбинации.
16. Применение молекулы нуклеиновой кислоты по пп.7-11 для тестирования различных РНКи, структура которых соответствует одному из представляющих интерес генов, для выявления самой мощной РНКи отдельно или в комбинации.
Следует иметь в виду, что приведенный в данном описании пример и чертежи не должны рассматриваться в качестве ограничения. Специалист в данной области будет в состоянии предвидеть дальнейшие модификации приведенных здесь принципов.
Пример
Протокол способа неинвазивного мониторинга экспрессии Нег-2neu (ген, о котором известно, что усиление его экспрессии приводит к раку молочной железы) в ткани рака молочной железы при трансфекции в указанную ткань РНКи, структура которой соответствует Her-2neu.
Схематическая блок-схема стадий осуществления способа приведена на фиг.1.
Стадия 1: получение конструкции ДНК. Указанная конструкция содержала человеческий промотор, который, как известно, является активным в ткани рака молочной железы, функционально связанную с указанным промотором кодирующую область. Эта кодирующая область состояла из гена Her-2neu, слитого с геном флуоресцентного белка (например, GFP). Последовательность Her-2neu была изменена таким образом, чтобы экспрессировался нефункциональный полипептид Нег-2neu, например, посредством мутации, приводящей к сдвигу рамки считывания. На 3'-конце последовательность гена флуоресцентного белка была слита с последовательностью Her-2neu таким образом, что полученный белок транскрибировался в виде одного слитого белка и получающийся флуоресцентный полипептид был функциональным. Это означает, что в настоящем примере мутация, приводящая к сдвигу рамки считывания, введенная в последовательность Her-2neu, компенсировалась другой мутацией, приводящей к сдвигу рамки считывания, введенной в начале кодирующей последовательности флуоресцентного белка, с тем, чтобы кодировался функциональный флуоресцентный белок, например, GFP.
Стадия 2: затем описанную выше конструкцию переносили методом трансфекции в ткань рака молочной железы, например путем впрыскивания липосомной капсулы, несущей данную конструкцию и предпочтительно предназначенной для нацеливания антител, направленных на антигены клеток рака молочной железы. Следует отметить, что эта стадия нацеливания может быть полезной на следующей стадии визуализации, поскольку детектируется только злокачественная ткань. Однако это также может быть получено для случая, если промотор, как описано выше, является функциональным только в клетках рака молочной железы, и таким образом кодирующая область (и, следовательно, флуоресцентный белок) экспрессируется только в этих клетках. В любом случае слитый ген экспрессировался в злокачественных клетках, содержащих нефункциональный домен Her-2neu, а также функциональный домен флуоресцентного белка, например, GFP.
Стадия 3: домен флуоресцентного белка визуализировали, и таким образом выявляли ткань рака молочной железы. Это может быть выполнено путем использования устройства формирования оптического изображения, приводящего флуоресцентный белок в возбужденное состояние при определенной длине волны, с последующим детектированием испускаемого света при
соответствующей длине волны. Для возбуждения GFP, сопровождаемого детектированием испускаемого света в виде зеленого цвета, можно использовать ультрафиолетовый свет. Предпочтительно, можно использовать соединения, которые переходят в возбужденное состояние под воздействием инфракрасного света, и/или соединения, такие как яркий флуоресцентный белок дальнего красного спектра [описанный, например, у Shcherbo D. et al., Nature Methods 4, 741-746 (2007)].
Стадия 4: Затем двуцепочечную РНКи, структура которой соответствовала Her-2neu, переносили методом трансфекции в ткань рака молочной железы. Это снова может быть выполнено путем впрыскивания липосомной капсулы, несущей конструкцию РНКи и предпочтительно предназначенную для нацеливания антител, направленных на антигены клеток рака молочной железы.
Стадия 5: теперь экспрессия слитого гена, введенного на стадии 2, также была заблокирована, как и экспрессия эндогенного гена Her-2neu. Это было получено благодаря тому, что РНКи осуществляло селективное блокирование трансляции соответствующей мРНК. В результате сплавления гена Her-2neu с кодирующей последовательностью флуоресцентного белка также блокировалась экспрессия флуоресцентного белка. Таким образом, при трансфекции РНКи в ткани рака молочной железы флуоресцентный белок полностью отсутствовал либо можно было обнаружить лишь незначительное количество флуоресцентного белка.
Стадия 6: Снова, визуализировали домен флуоресцентного белка в соответствующей ткани. Как указывалось выше, для приведения GFP в возбужденное состояние с последующим детектированием испускаемого света в виде зеленого цвета, можно использовать ультрафиолетовый свет. Предпочтительно, также можно использовать соединение, которое переходит в возбужденное состояние под воздействием инфракрасного света. В случае полного блокирования трансляции мРНК, транскрибируемой из сплавленного гена, путем введения РНКи, не детектируется никакой флуоресцентный белок. Таким образом, ткань рака молочной железы больше не может быть визуализирована. В случае уменьшения сигнал является более слабым по сравнению с сигналом, детектируемым на стадии 3. В целом, это является весомым подтверждением того, что экспрессия эндогенного Her-2neu также заблокирована, и таким образом достигнут регресс опухоли.
В заключение можно отметить, что мониторинг in vivo терапевтического эффекта РНКи в ткани рака молочной железы осуществлялся неинвазивным способом.