Результат интеллектуальной деятельности: СИСТЕМА ДЛЯ УВЕЛИЧЕНИЯ ЭКСПРЕССИИ ГЕНОВ И ВЕКТОР, СОДЕРЖАЩИЙ УКАЗАННУЮ СИСТЕМУ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к способу увеличения экспрессии генов с использованием промоторов, энхансеров и т.п. и экспрессионной кассете для увеличения экспрессии генов, содержащей промоторы, энхансеры и т.п.
УРОВЕНЬ ТЕХНИКИ
Различные промоторы экспрессии генов, такие как промоторы CMV и промоторы CAG, были разработаны для увеличения эффективности экспрессии генов (патентные документы 1-4). Однако применение этих общепринятых способов вызывает ежедневные проблемы в области биотехнологии, такие как ситуации, в которых почти не происходит экспрессии генов или количество экспрессированного таким образом белка является чрезвычайно низким, в зависимости от типа клетки или типа гена. Кроме того, эти проблемы служат в качестве существенных барьеров для развития медицинской науки, в которой экспрессию генов используют для диагностики или лечения.
Патентный документ 1 Публикация патента Японии № 2814433
Патентный документ 2 Публикация патента Японии № 2814434
Патентный документ 3 Патент США № 5168062
Патентный документ 4 Патент США № 5385839.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью данного изобретения является обеспечение способа увеличения экспрессии генов с использованием промоторов, энхансеров и т.п., и экспрессионной кассеты, способной увеличивать экспрессию генов, содержащей промоторы, энхансеры и т.п.
Авторы данного изобретения пытались развить новую систему экспрессии генов с использованием промоторов, которые позволяют генам экспрессироваться с более высокой эффективностью. Конкретно, они сравнили и испытали активность промоторов, происходящую из комбинаций промоторов и энхансеров для различных генов. В результате, авторы этого изобретения обнаружили, что ген может быть экспрессирован с высокой эффективностью заставлением такого гена быть фланкированным двумя промоторами или промотором и энхансером с использованием экспрессионной кассеты генов. Эта экспрессионная кассета генов содержит ДНК-конструкт, содержащий ген, который должен быть экспрессирован, и последовательность добавления поли А, которые локализованы справа (по ходу транскрипции) от 1-го промотора, а также энхансер или 2-й промотор, лигированный справа (по ходу транскрипции) от этого ДНК-конструкта. Кроме того, авторы этого изобретения обнаружили, что ген может быть экспрессирован даже с более высокой эффективностью заставлением вышеуказанной экспрессионной кассеты дополнительно содержать такой элемент, как последовательность добавления поли А, RU5', UAS или SV40-ori.
Посредством развития “системы увеличения экспрессии генов и вектора, содержащего эту систему” данного изобретения экспрессия белков может быть сильно увеличена почти во всех клетках и генах.
Данное изобретение является следующим:
[1] Экспрессионная кассета гена, содержащая:
ДНК-конструкт, содержащий ген, который должен быть экспрессирован, и последовательность добавления поли А, которые локализованы ниже по ходу транскрипции (справа) от 1-го промотора, и дополнительно содержащая энхансер или 2-й промотор ниже по ходу транскрипции (справа) от этого ДНК-конструкта.
[2] Экспрессионная кассета по [1], которая не имеет другого механизма для экспрессии гена ниже по ходу транскрипции от лигированного энхансера или 2-го промотора, но имеет структуру, в который ген, который должен быть экспрессирован, фланкирован одним 1-м промотором и одним энхансером или одним 1-м промотором и одним 2-м промотором.
[3] Экспрессионная кассета по [1], где этот промотор выбран из группы, состоящей из промотора CMV i, промотора SV40, промотора hTERT, промотора β-актина и промотора CAG.
[4] Экспрессионная кассета по любому из [1]-[3], где этот энхансер является по меньшей мере одним энхансером, выбранным из группы, состоящей из энхансера CMV, энхансера SV40 и энхансера hTERT.
[5] Экспрессионная кассета по любому из [1]-[4], где 1-4 энхансеров CMV лигированы выше по ходу транскрипции (слева) от ДНК-конструкта, содержащего ДНК, кодирующую белок, который должен быть экспрессирован, и последовательность добавления поли А, которые локализованы ниже по ходу транскрипции (справа) от этого промотора.
[6] Экспрессионная кассета по любому из [1]-[5], содержащая по меньшей мере один из следующих элементов:
(i) RU5', лигированный непосредственно выше по ходу транскрипции (слева) от ДНК, кодирующей чужеродный белок;
(ii) UAS, лигированный непосредственно выше по ходу транскрипции (слева) от энхансера и/или промотора; и
(iii) SV40-ori, лигированный с наиболее левой по ходу транскрипции частью экспрессионной кассеты.
[7] Экспрессионная кассета по любому из [1]-[6], где ген, который должен быть экспрессирован, является терапевтическим геном, который может быть использован для лечения заболеваний, или геном белка, который может быть использован для лекарственного средства, диагностического агента или реагента.
[8] Экспрессионная кассета по [7], где этот терапевтический ген является геном супрессора рака, который может быть использован для лечения опухолей.
[9] Экспрессионная кассета по [8], где этим геном супрессора рака является ген REIC/Dkk-3.
[10] Экспрессионная кассета по [9], где ген, который должен быть экспрессирован, является ДНК-фрагментом гена REIC/Dkk-3.
[11] Экспрессионная кассета по [10], где этот ДНК-фрагмент гена REIC/Dkk-3 является ДНК, кодирующая аминокислоты 1-78 аминокислотной последовательности SEQ ID NO: 18.
[12] Экспрессионная кассета для чужеродного гена по [1], имеющая структуру конструктов № 2 (фиг. 8), № 4 (фиг. 10), № 6 (фиг. 12), № 8 (фиг. 14), № 10 (фиг. 16), № 12 (фиг. 18) и № 14 (фиг. 20).
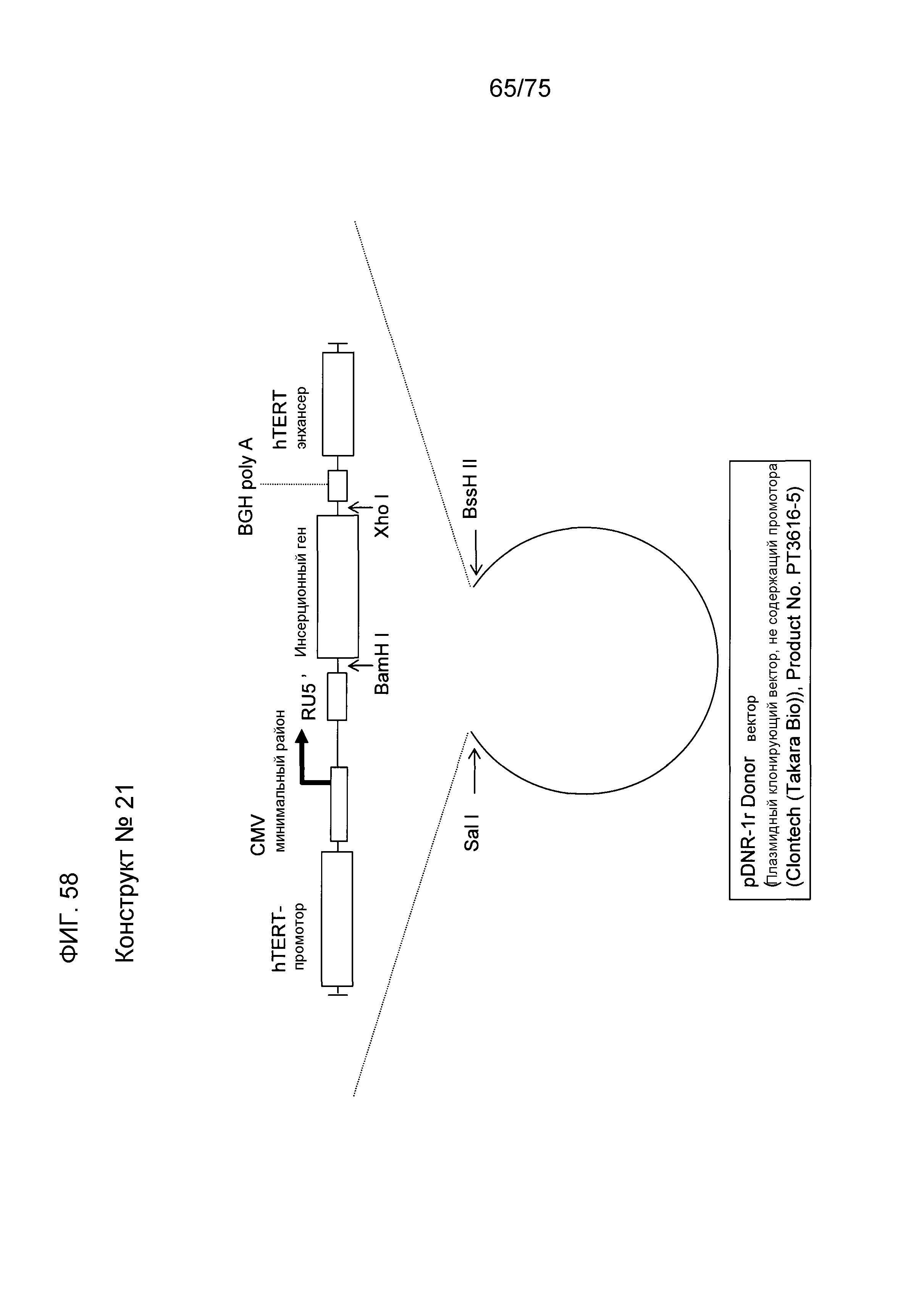
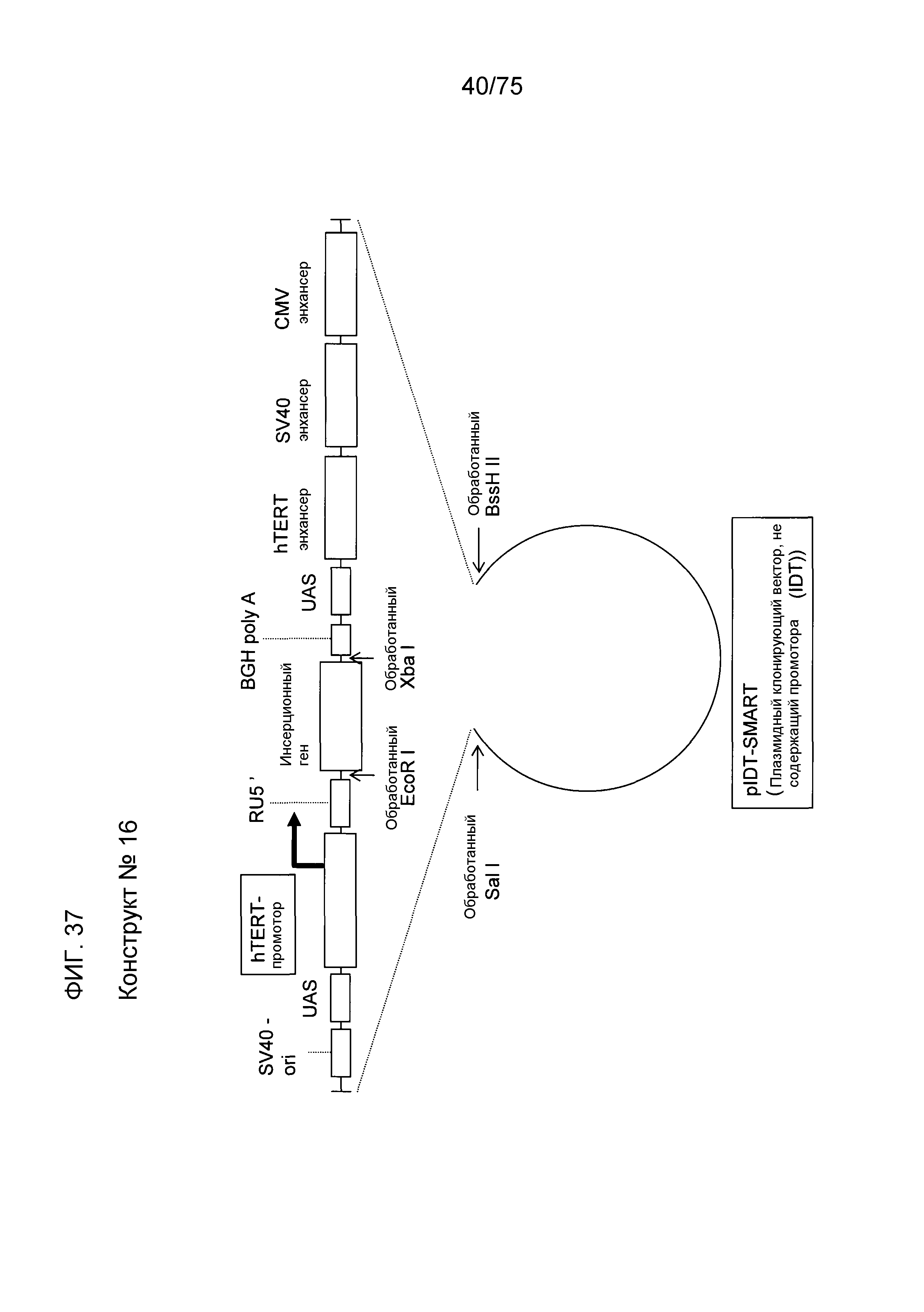
[13] Экспрессионная кассета для чужеродного гена по [1], имеющая структуру конструктов № 15 (фиг. 16), № 16 (фиг. 37), № 17 (фиг. 49), № 20 (фиг. 57) и № 21 (фиг. 58).
[14] Вектор, содержащий экспрессионную кассету для чужеродного гена по любому из [1]-[13].
[15] Вектор по [14], который является аденовирусным вектором или аденоассоциированным вектором.
[16] Клетка-хозяин, содержащая вектор по [14] или [15].
[17] Препарат для детектирования или лечения заболевания, содержащий вектор по [14] или [15].
[18] Способ для экспрессии гена, который должен быть экспрессирован, с использованием экспрессионной кассеты по любому из [1]-[13] или вектора по [14] или [15].
[19] Способ экспрессии генов, предусматривающий:
лигирование энхансера или 2-го промотора с сайтом ниже по ходу транскрипции (справа) от ДНК-конструкта, содержащего ген, который должен быть экспрессирован, и последовательность добавления поли А, которые локализованы ниже по ходу транскрипции (слева) от 1-го промотора;
введение полученной конструкции в вектор и затем экспрессирование этого гена с использованием этого вектора.
[20] Способ получения белка, кодируемого геном, который должен быть экспрессирован, предусматривающий введение экспрессионной кассеты по любому из [1]-[13], или вектора по [14] или [15] в клетку и затем культивирование этой клетки.
Это описание включает в себя часть содержания или все содержание, представленное в описательной части и/или рисунках Заявки на патент Японии № 2009-264299, которая является приоритетным документом данной заявки.
КРАТКОЕ ОПИСАНИЕ ФИГУР
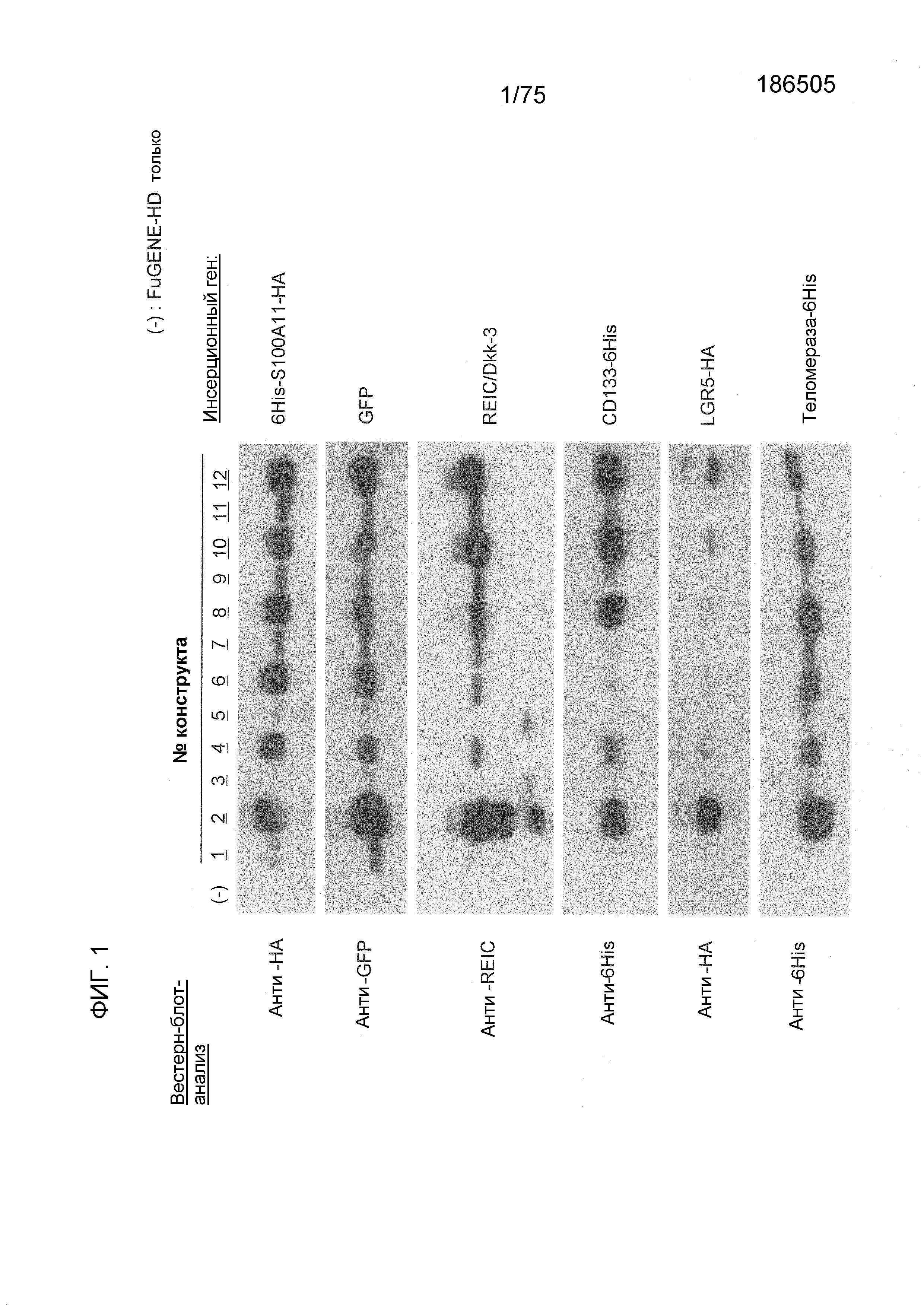
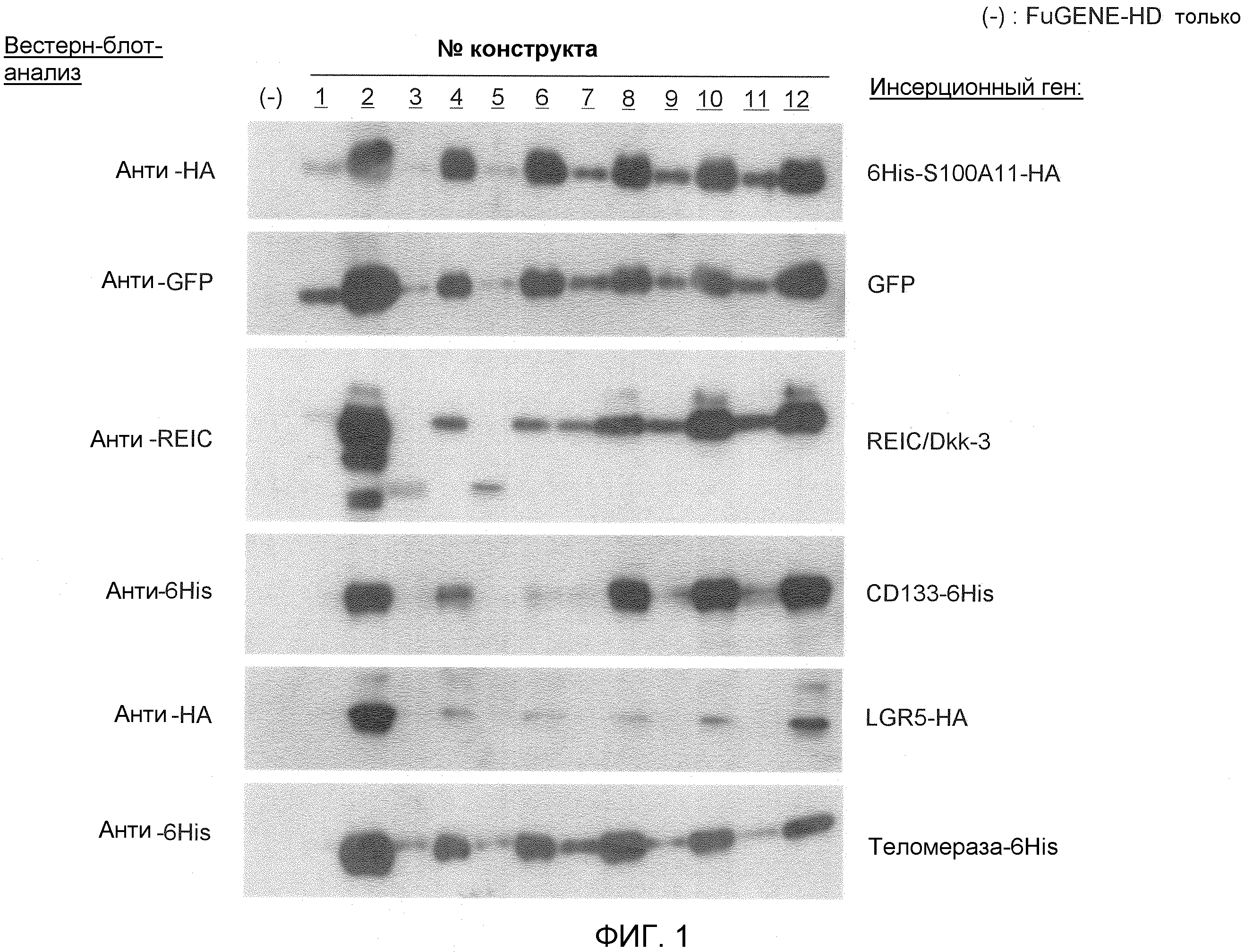
Фиг. 1 показывает экспрессию различных чужеродных генов, трансфицированных в течение 36 часов в клеточную линию HEK293 с использованием FuGENE (товарный знак)-HD.
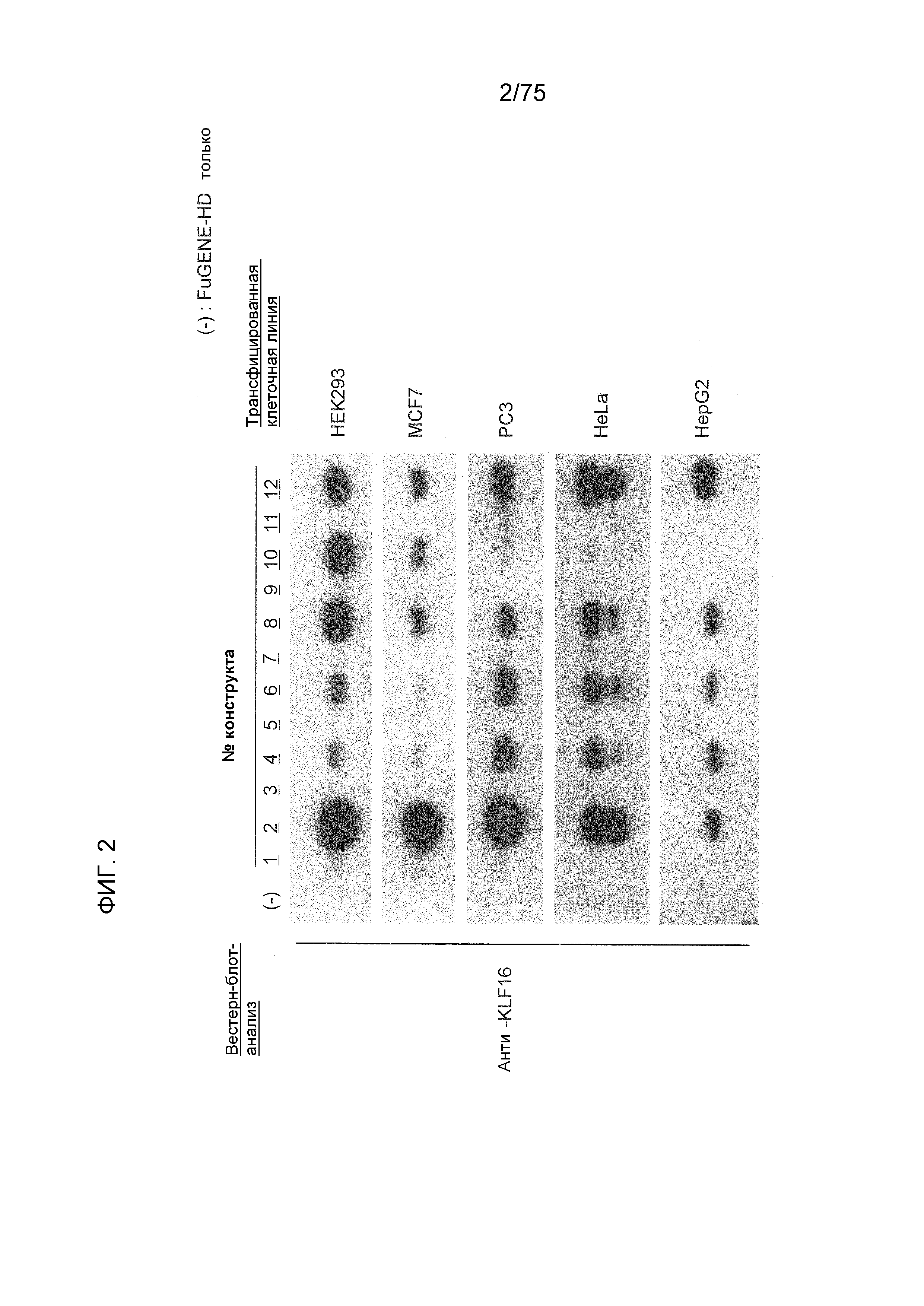
Фиг. 2 показывает экспрессию гена KLF, трансфицированного в течение 36 часов в различные клеточные линии с использованием FuGENE (товарный знак)-HD.
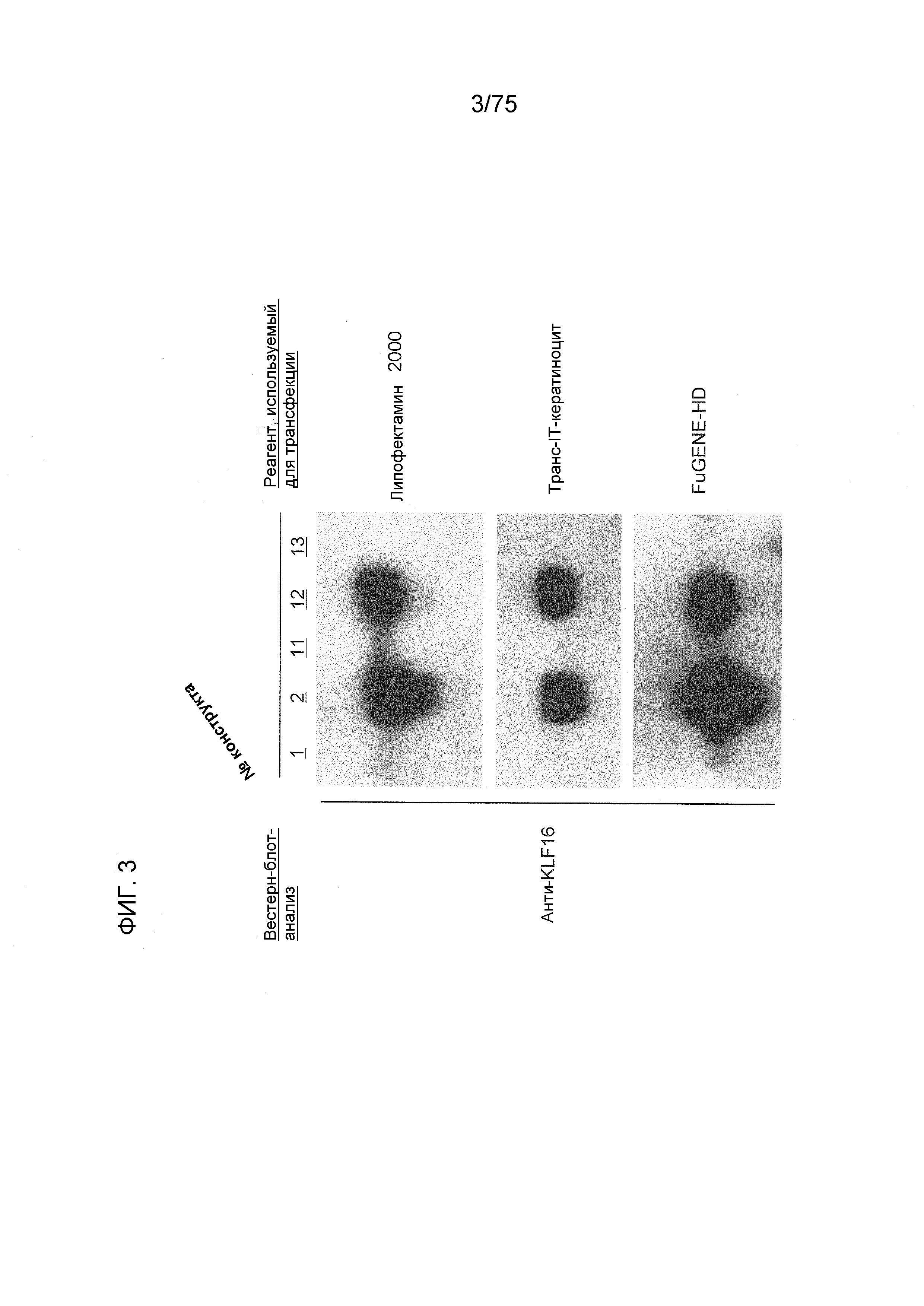
Фиг. 3 показывает экспрессию гена KLF, трансфицированного в течение 36 часов в клеточную линию HEK293 с использованием различных реагентов для трансфекции.
Фиг. 4 показывает экспрессию полноразмерного гена REIC и N78-REIC-кодирующего гена в течение 36 часов в клеточную линию HEK293 с использованием FuGENE (товарный знак)-HD.
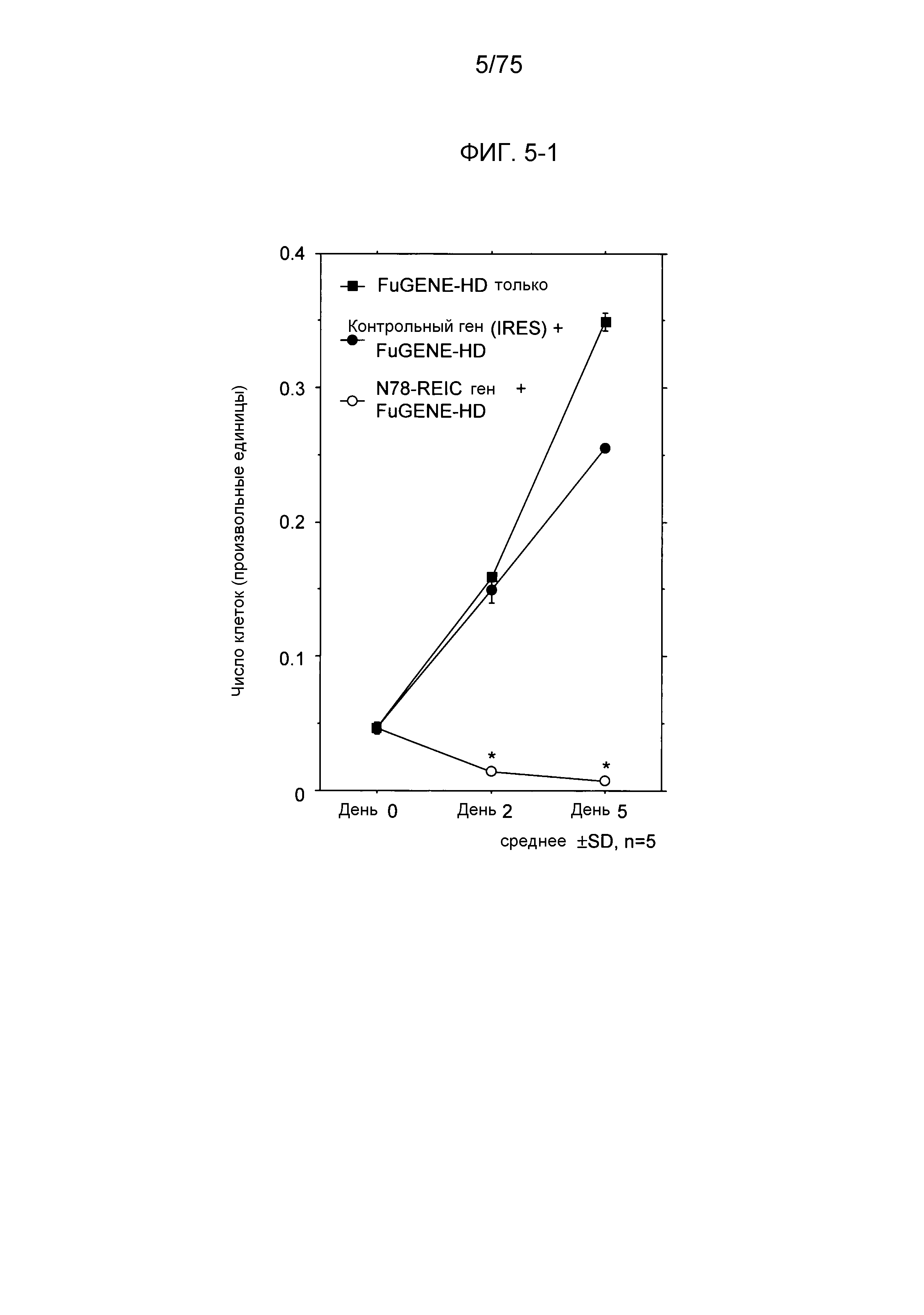
Фиг. 5-1 является графиком, показывающим супрессированную пролиферацию клеток и индукцию смерти клеток в клеточной линии РС3 рака предстательной железы человека конструктом № 14, в который была инсертирована N78-REIC-кодирующая ДНК (график).
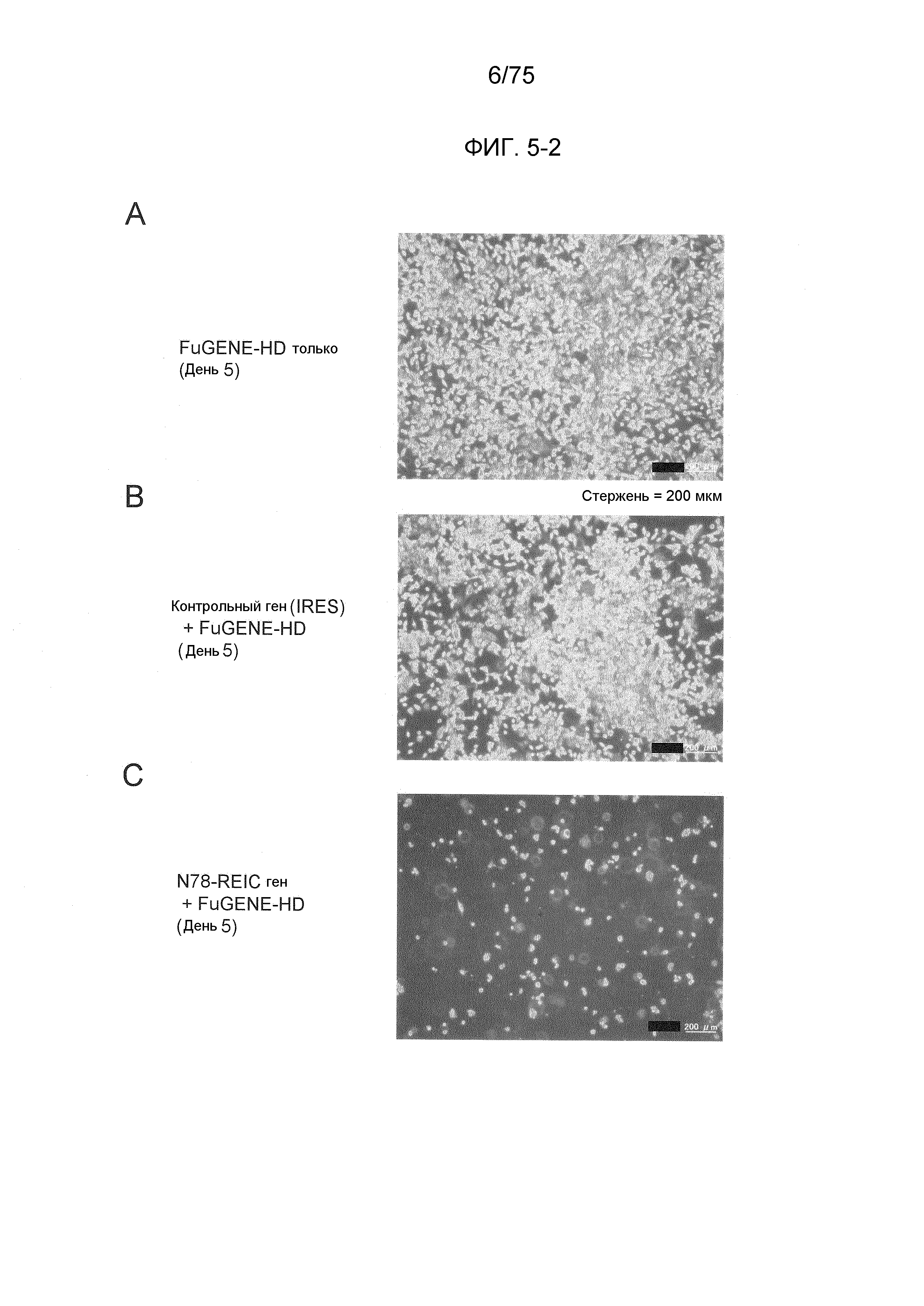
Фиг. 5-2 показывает фотографии, показывающие супрессированную пролиферацию клеток и индукцию смерти клеток в клеточной линии РС3 рака предстательной железы человека конструктом № 14, в который была инсертирована N78-REIC-кодирующая ДНК.
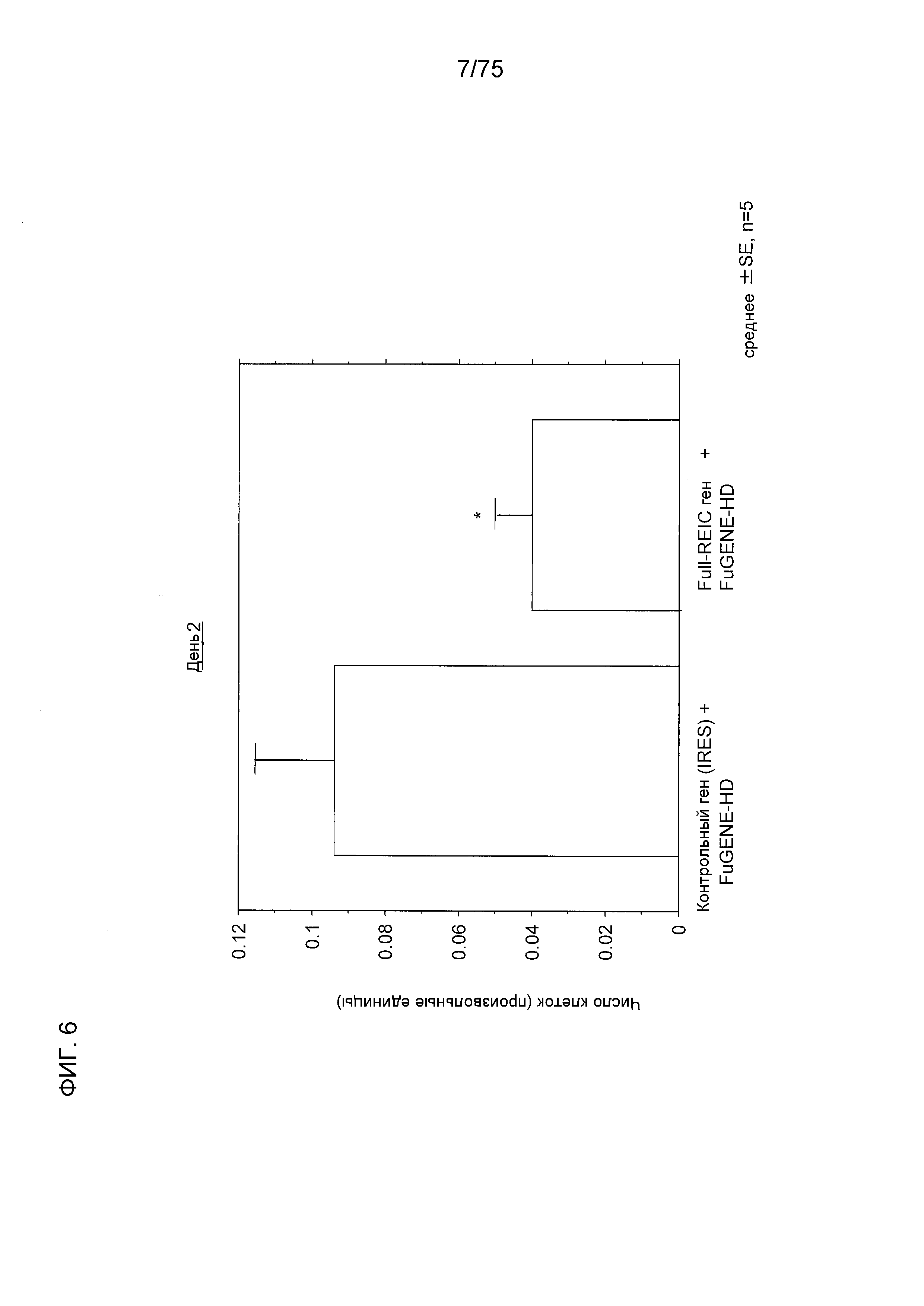
Фиг. 6 показывает супрессированную пролиферацию клеток и индукцию смерти клеток в клеточной линии РС3 рака предстательной железы человека конструктом № 14, в который был инсертирован полноразмерный ген REIC.
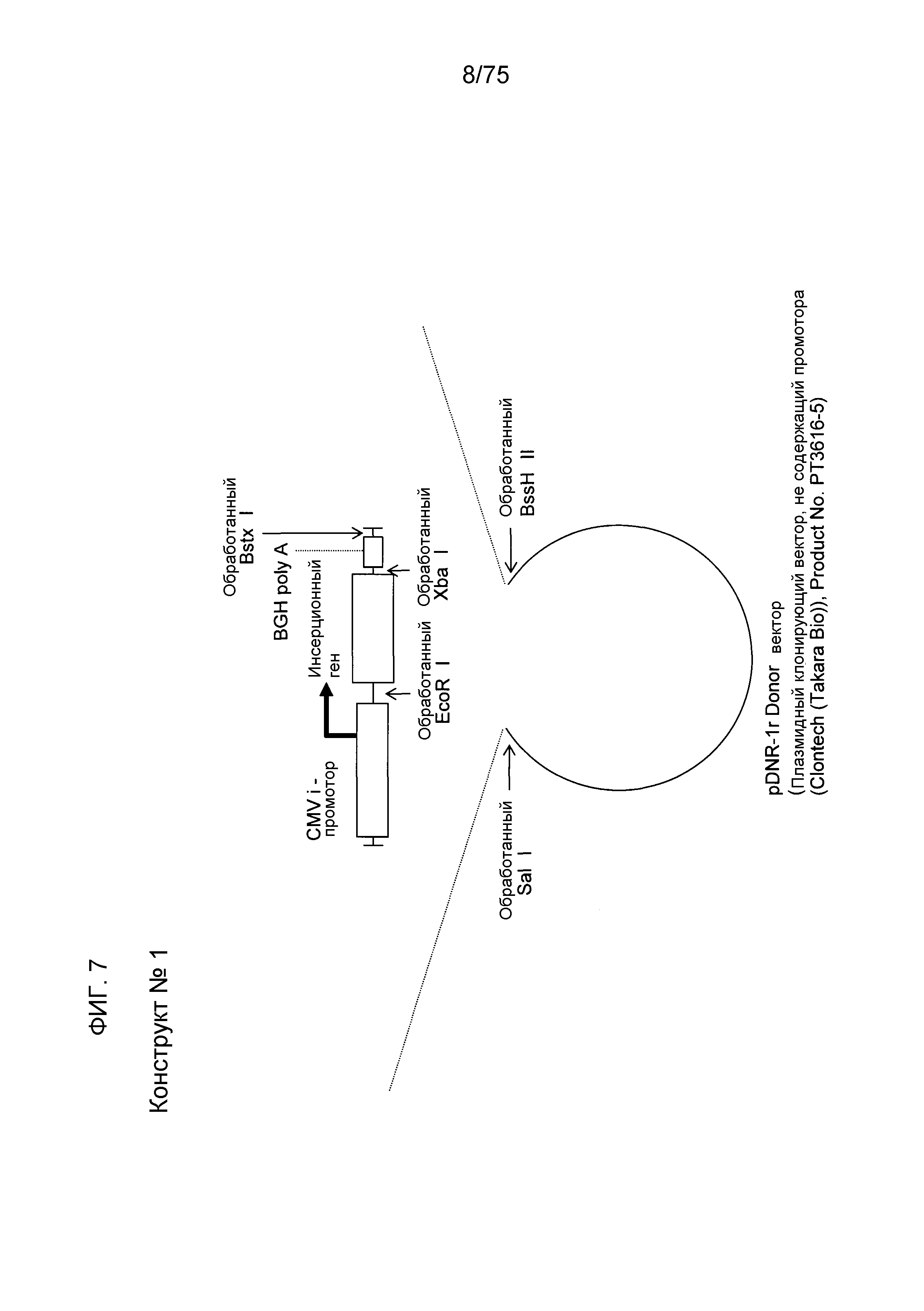
Фиг. 7 показывает структуру конструкта № 1.
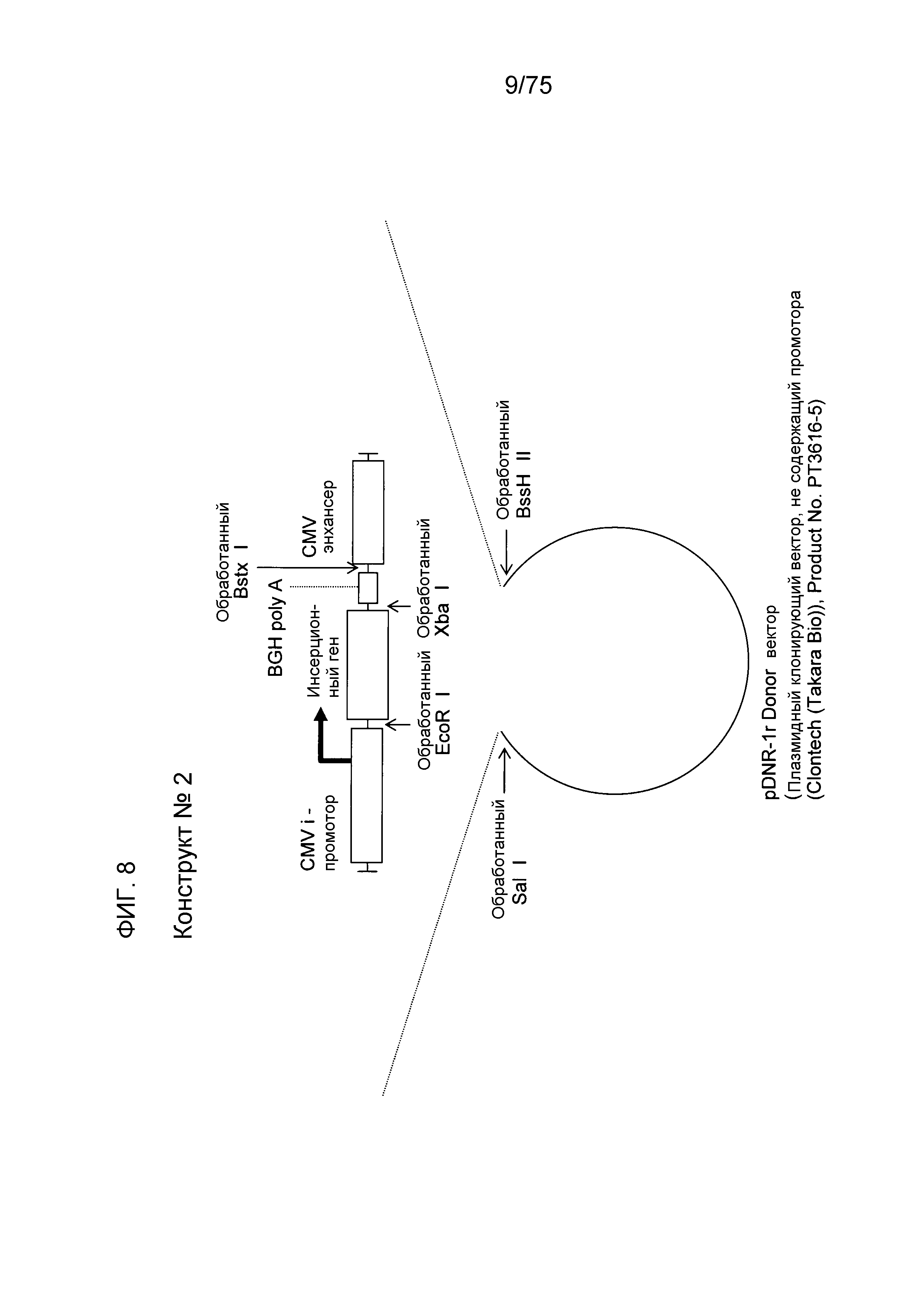
Фиг. 8 показывает структуру конструкта № 2.
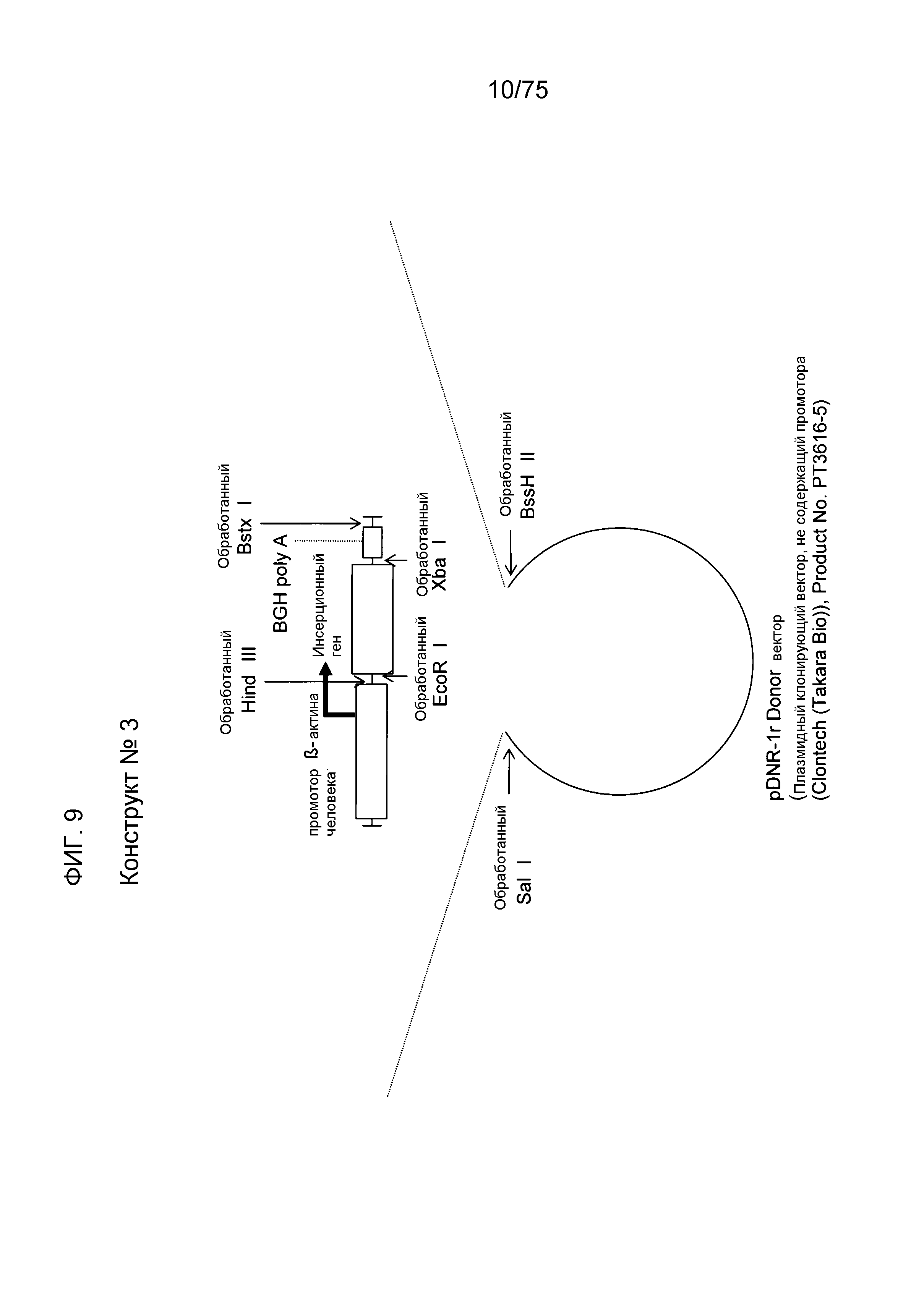
Фиг. 9 показывает структуру конструкта № 3.
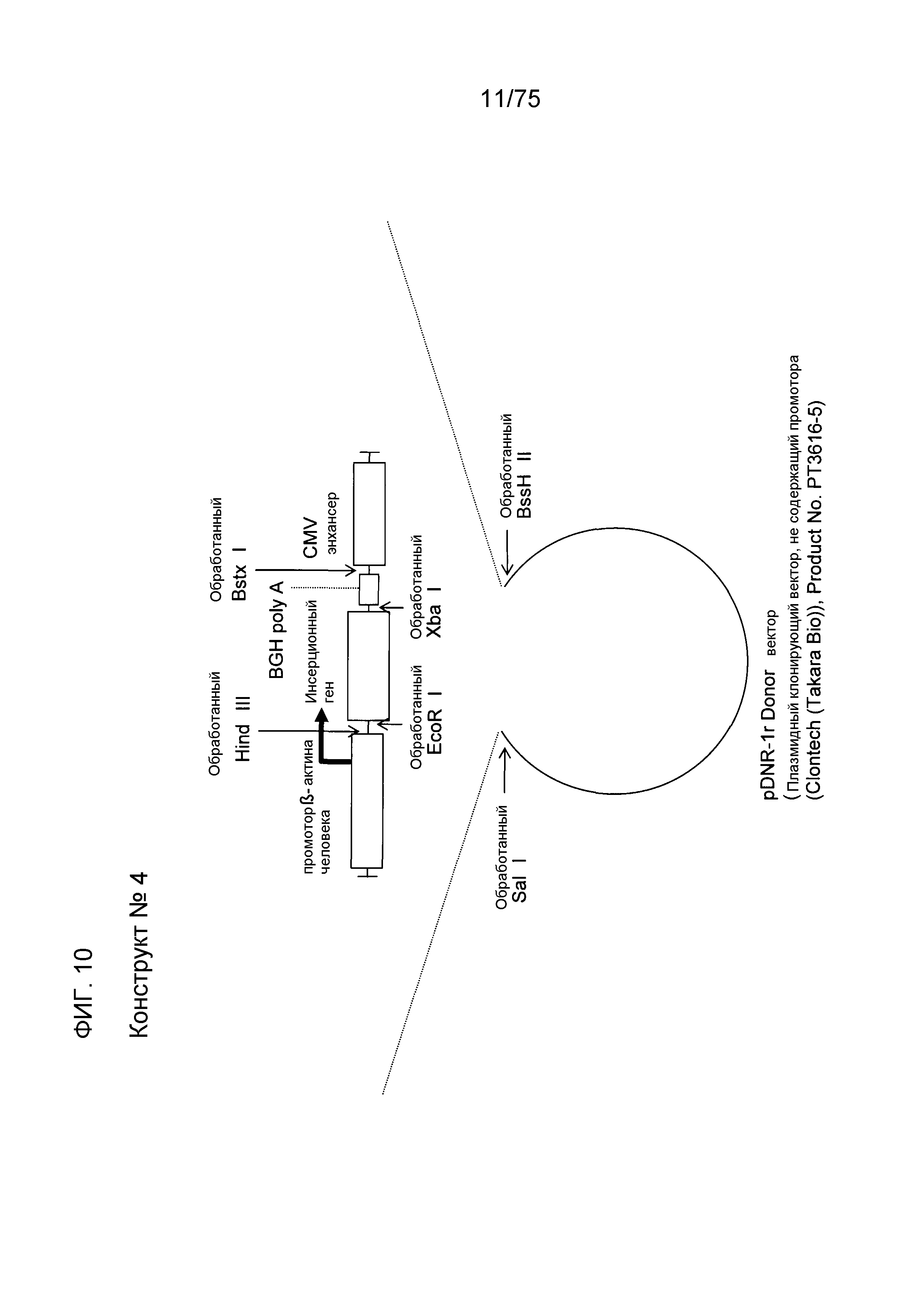
Фиг. 10 показывает структуру конструкта № 4.
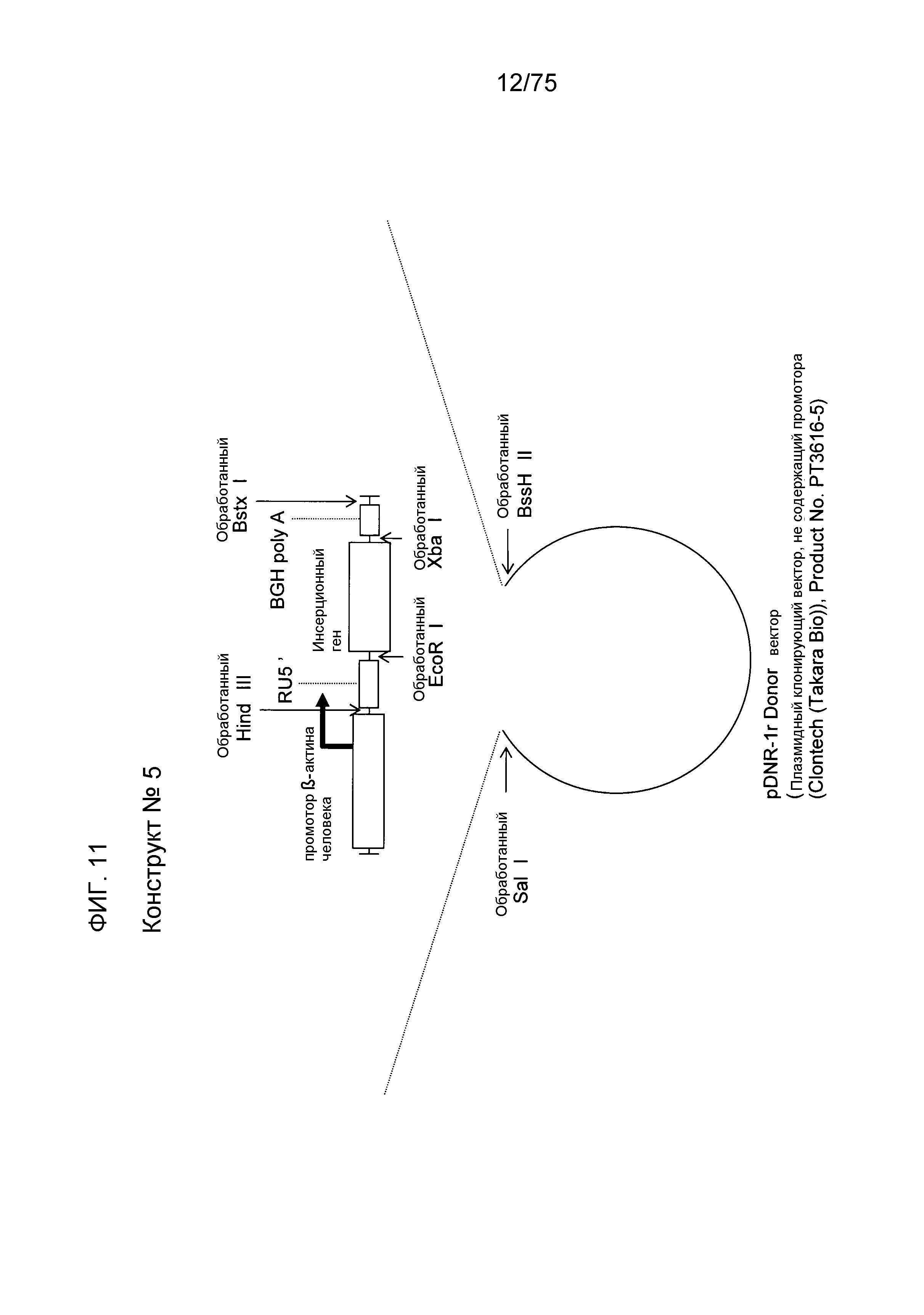
Фиг. 11 показывает структуру конструкта № 5.
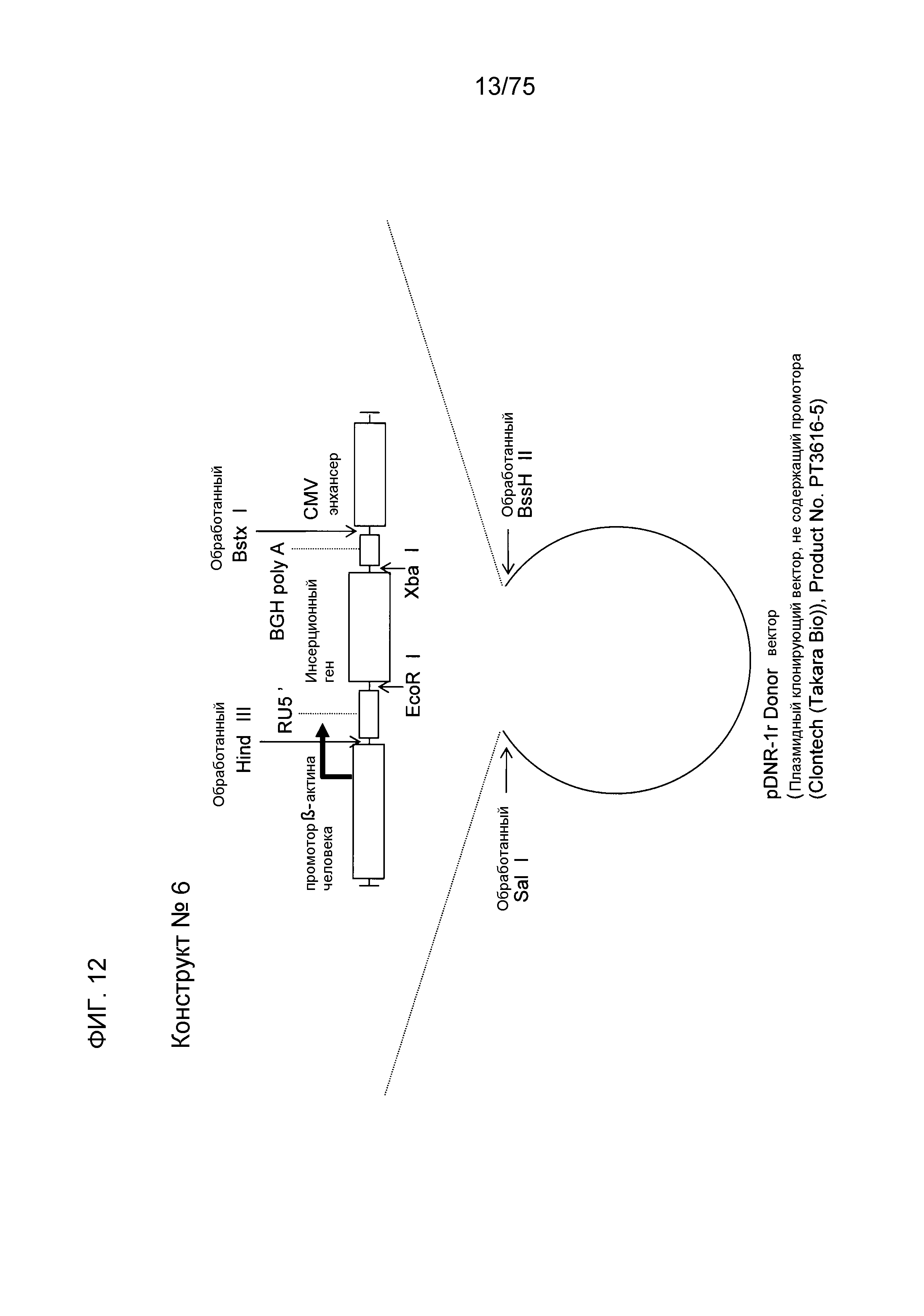
Фиг. 12 показывает структуру конструкта № 6.
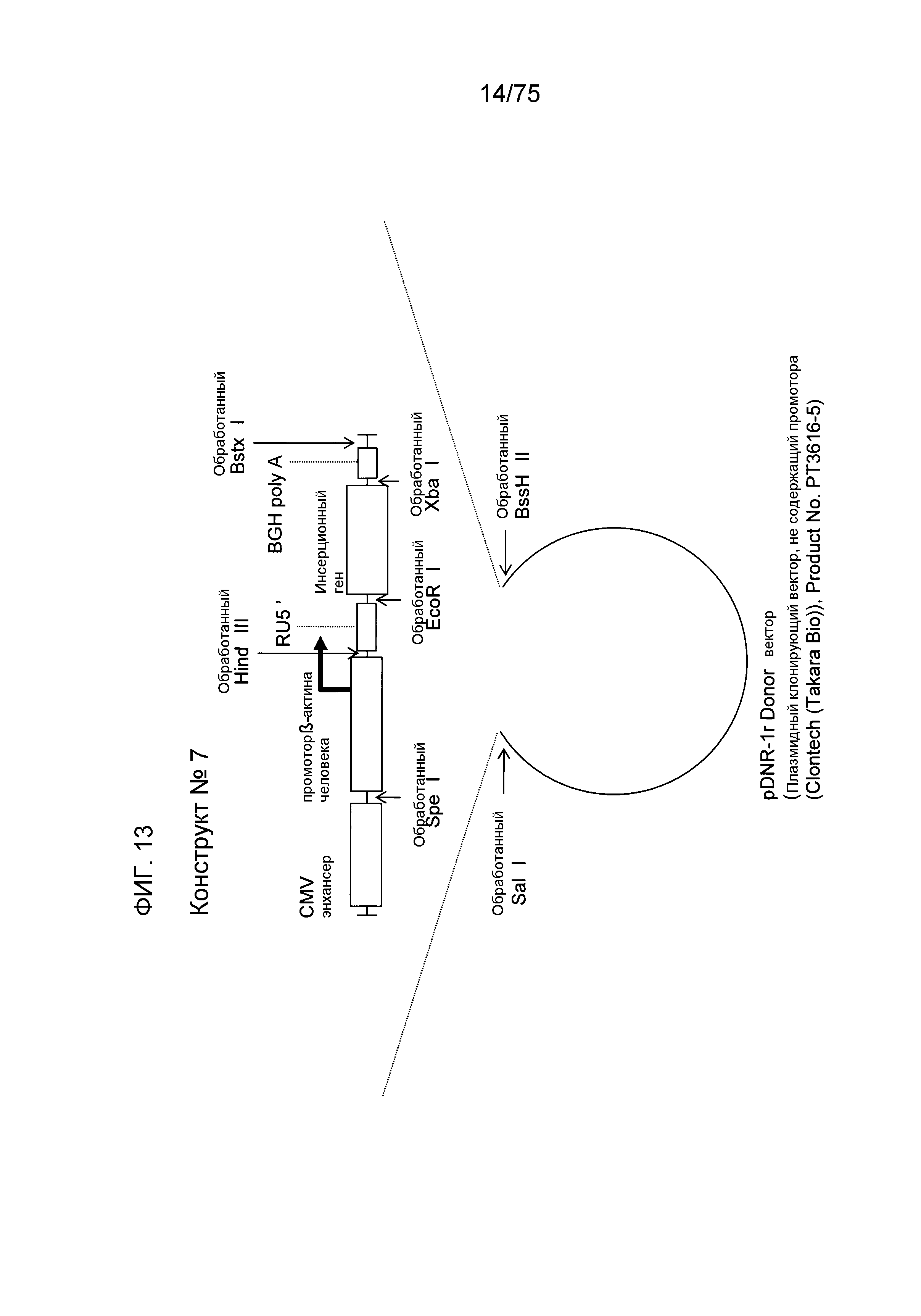
Фиг. 13 показывает структуру конструкта № 7.
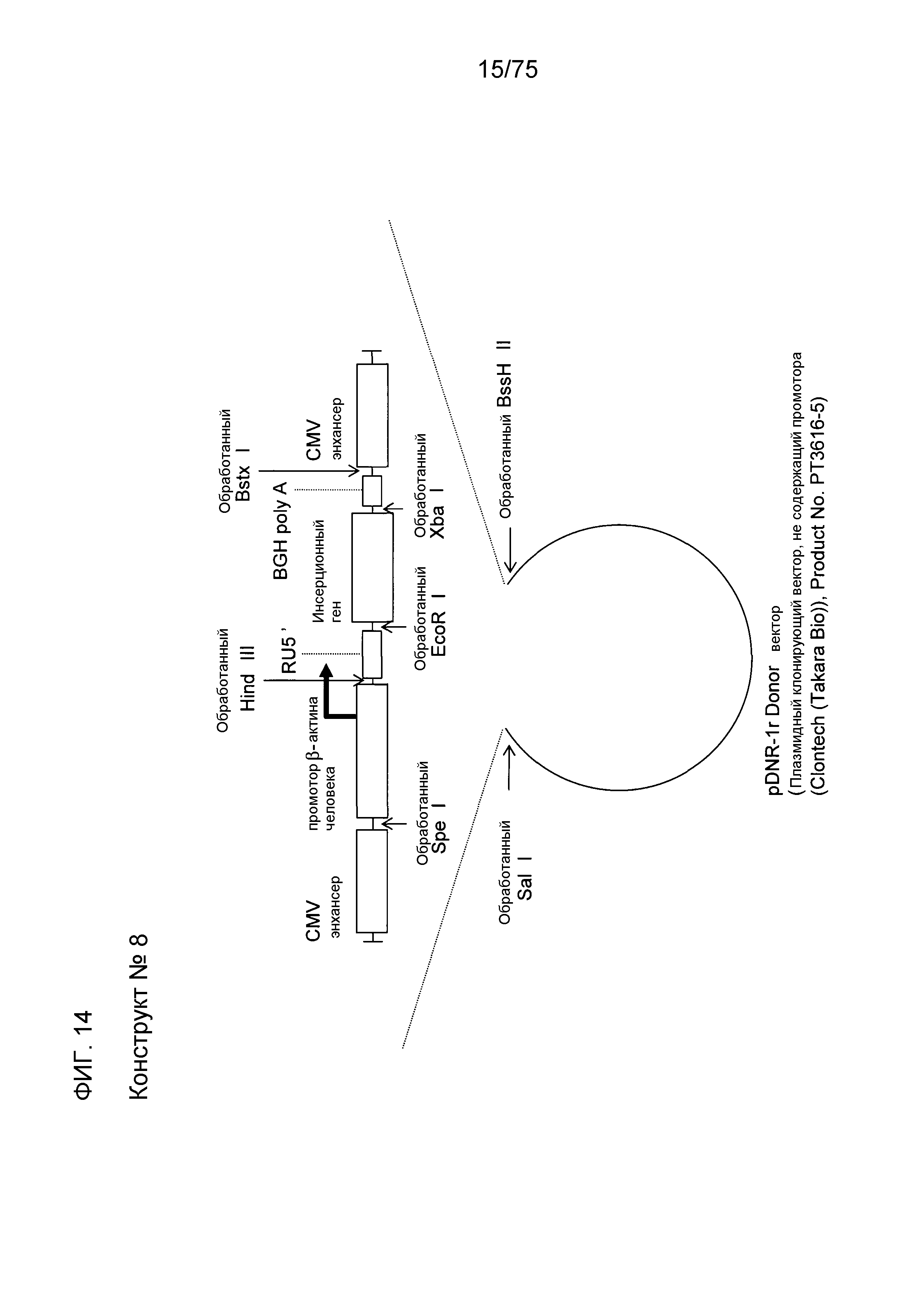
Фиг. 14 показывает структуру конструкта № 8.
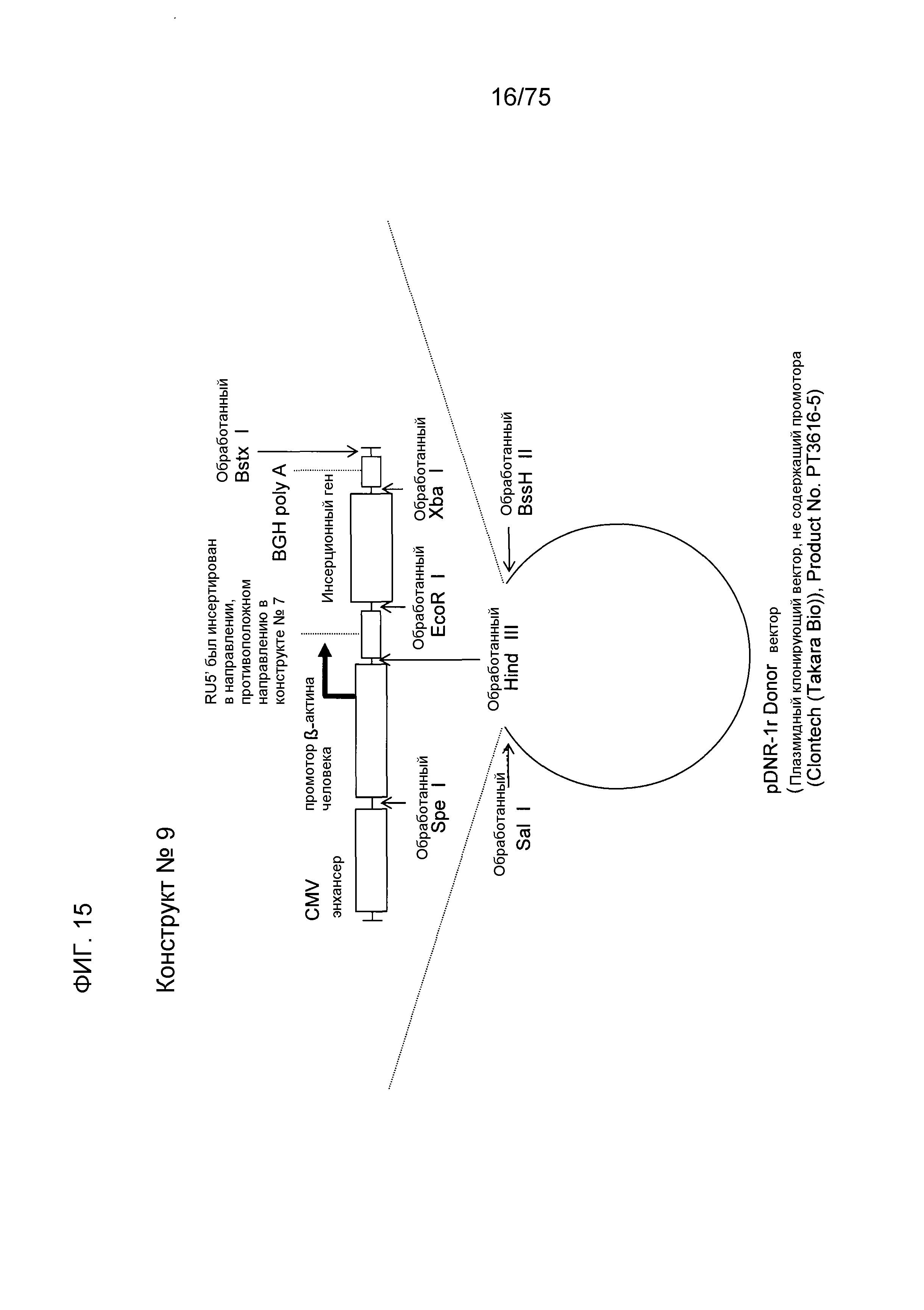
Фиг. 15 показывает структуру конструкта № 9.
Фиг. 16 показывает структуру конструкта № 10.
Фиг. 17 показывает структуру конструкта № 11.
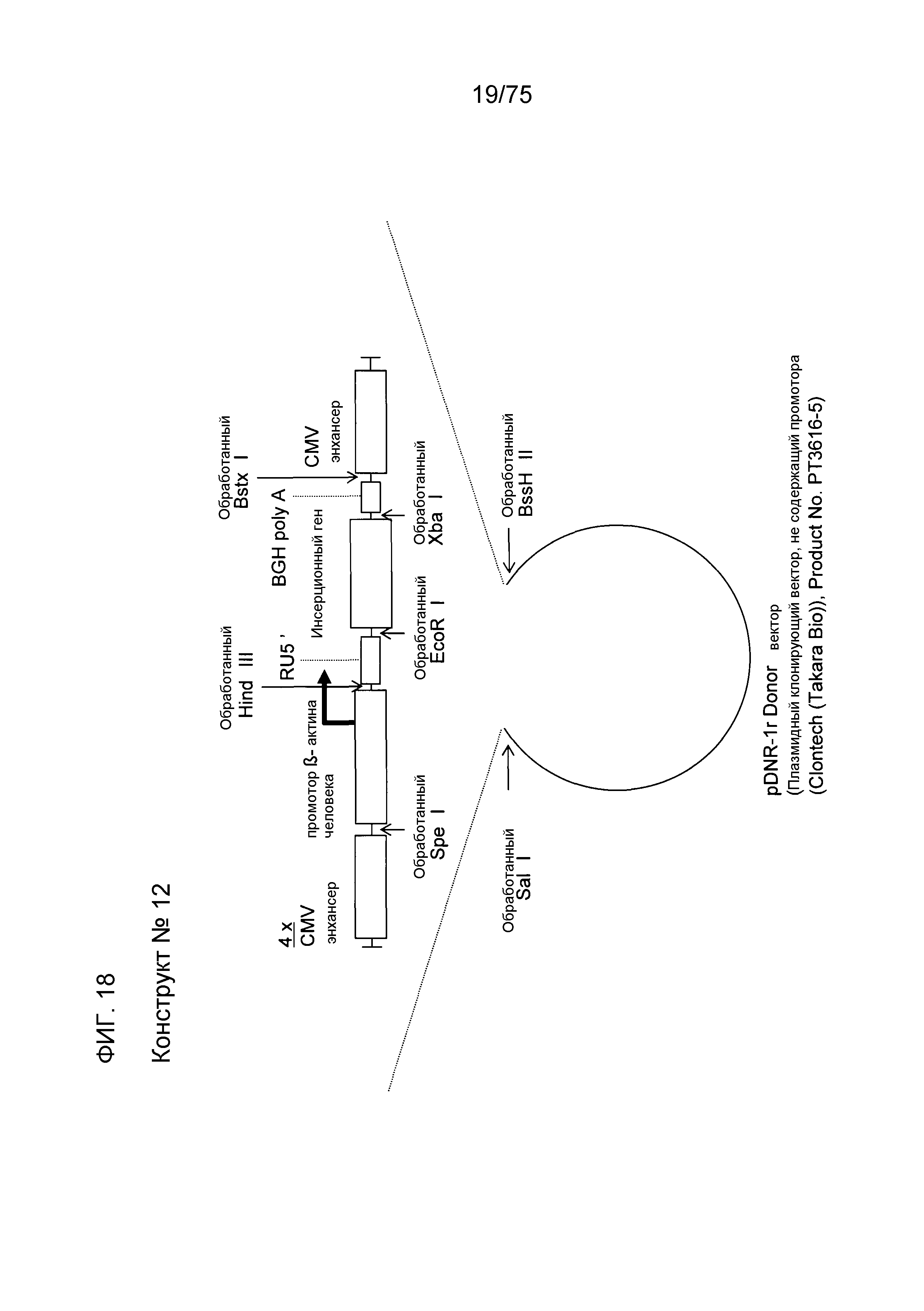
Фиг. 18 показывает структуру конструкта № 12.
Фиг. 19 показывает структуру конструкта № 13.
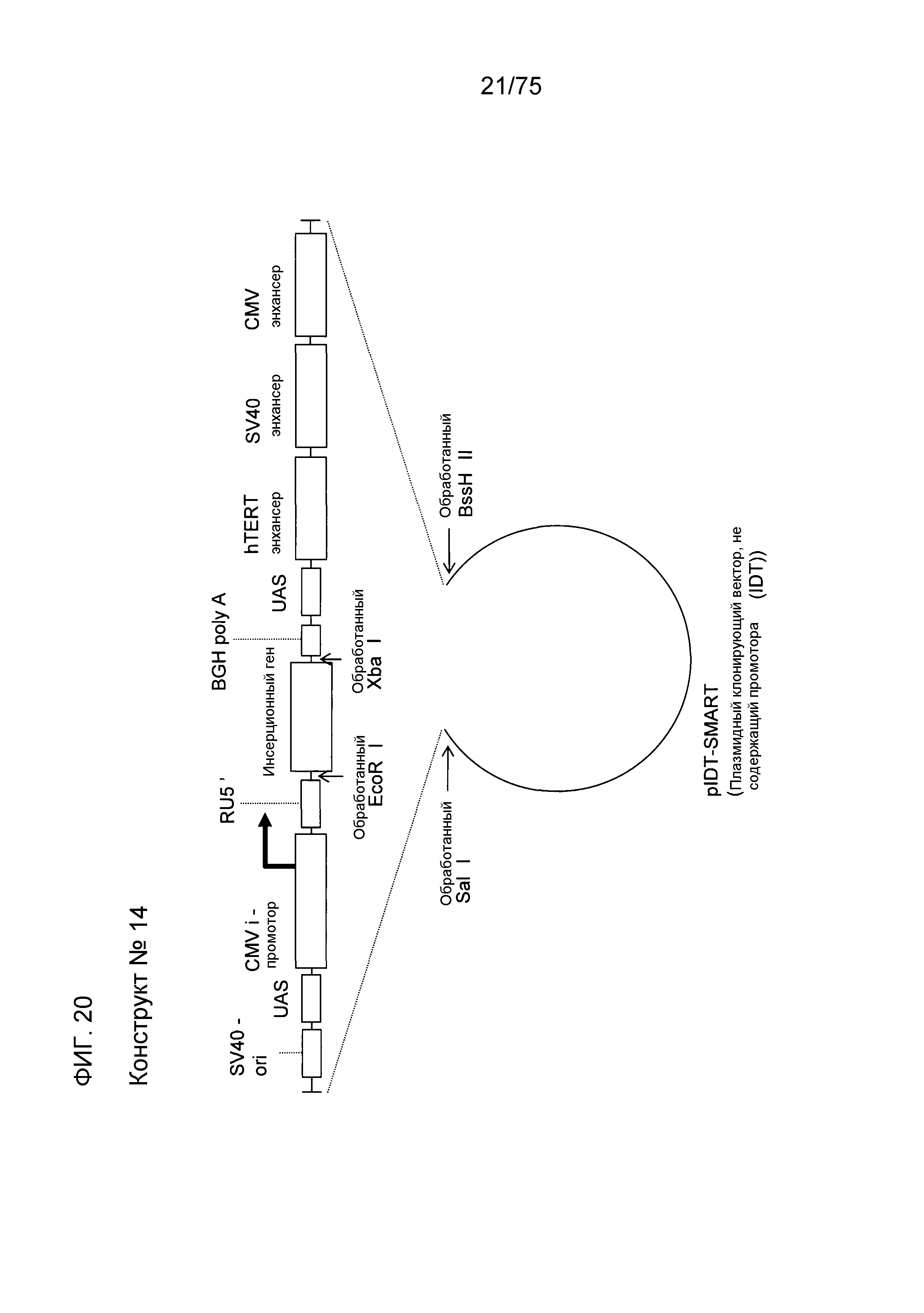
Фиг. 20 показывает структуру конструкта № 14.
Фиг. 21 показывает аденовирусный конструкт, кодирующий полноразмерный ген REIC/Dkk-3.
Фиг. 22-1 показывает полную нуклеотидную последовательность вектора pDNR-1r Donor.
Фиг. 22-2 показывает полную нуклеотидную последовательность вектора pDNR-1r Donor (продолжение фиг. 22-1).
Фиг. 23 показывает полную нуклеотидную последовательность вектора pIDT-SMART.
Фиг. 24 показывает нуклеотидную последовательность района промотора CMV-i (hCMV + интрон-промотор).
Фиг. 25 показывает нуклеотидную последовательность района BGH polyA (3 x stop + BGH polyA).
Фиг. 26 показывает нуклеотидную последовательность района энхансера CMV.
Фиг. 27 показывает нуклеотидную последовательность района промотора β-актина человека.
Фиг. 28 показывает нуклеотидную последовательность прямого RU5' {R-сегмент длинного концевого повтора HTLV Типа 1 и часть (R-U5') последовательности U5}.
Фиг. 29 показывает нуклеотидную последовательность обратного RU5' {R-сегмент длинного концевого повтора HTLV Типа 1 и часть (R-U5') последовательности U5}.
Фиг. 30 показывает нуклеотидную последовательность района энхансера 4 x CMV.
Фиг. 31 показывает нуклеотидную последовательность района промотора CAG.
Фиг. 32 показывает нуклеотидную последовательность района инсерта 2IRES.
Фиг. 33 показывает нуклеотидную последовательность района SV40ori-UAS-CMVi-RU5'.
Фиг. 34 показывает нуклеотидную последовательность района энхансер 3 x stop-BGH-polyA-UAS-hTERT + энхансер SV40 + энхансер CMV.
Фиг. 35-1 показывает полную нуклеотидную последовательность конструкта № 14 вектора.
Фиг. 35-2 показывает полную нуклеотидную последовательность конструкта № 14 вектора (продолжение фиг. 35-1).
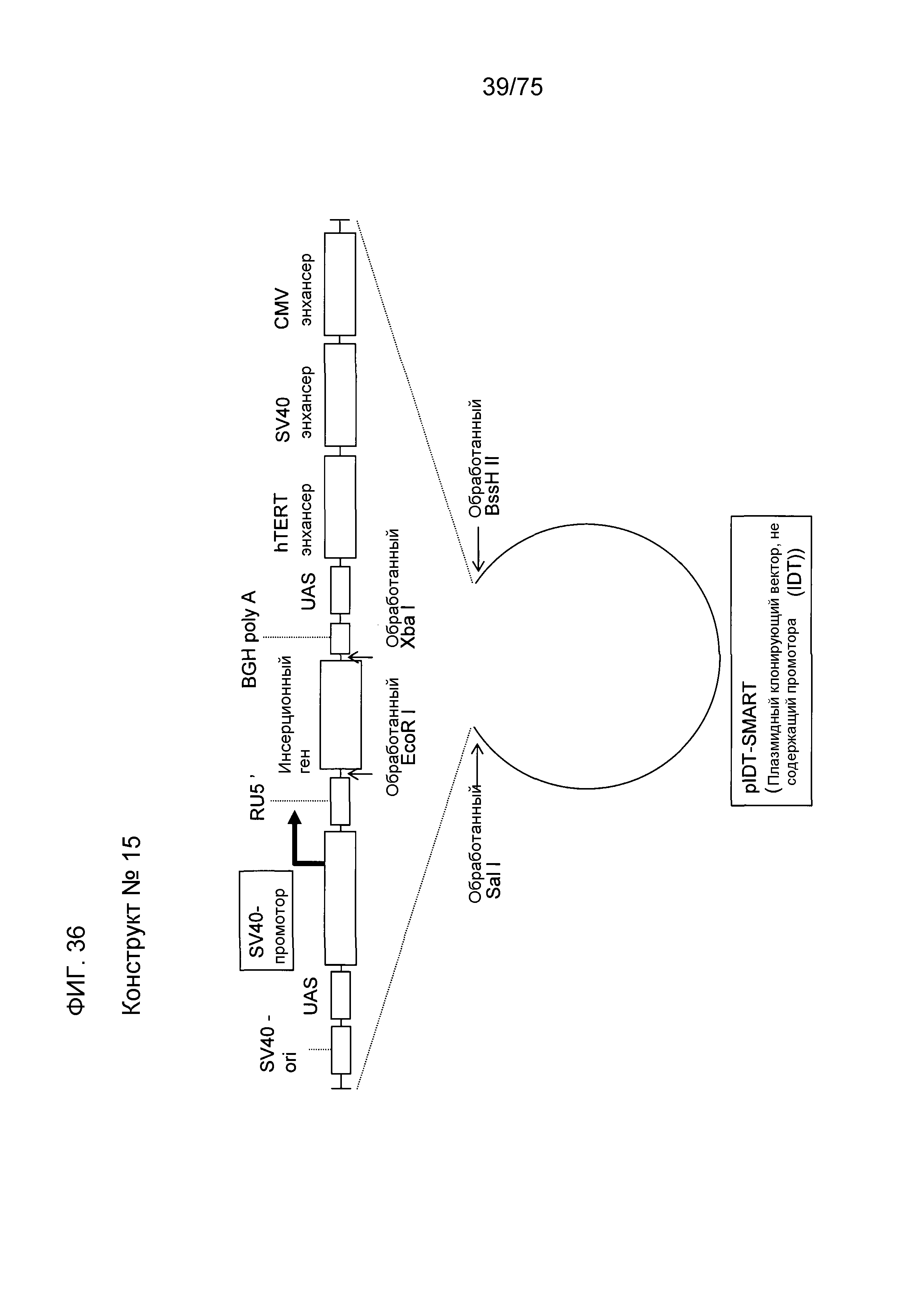
Фиг. 36 показывает конструкт № 15.
Фиг. 37 показывает конструкт № 16.
Фиг. 38 показывает нуклеотидную последовательность района SV40ori-UAS-SV40 enh-intron A-RU5'. Фиг. 38 показывает конкретно нуклеотидную последовательность инсерционной части слева (выше по ходу транскрипции) от инсерционного гена (представляющего интерес гена) в конструкте № 15.
Фиг. 39 показывает нуклеотидную последовательность района SV40ori-UAS-SV40 enh-intron A-RU5'. Фиг. 39 показывает конкретно нуклеотидную последовательность инсерционной части слева (выше по ходу транскрипции) от инсерционного гена (представляющего интерес гена) в конструкте № 16.
Фиг. 40 показывает нуклеотидную последовательность района GFP в плазмиде.
Фиг. 41-1 показывает нуклеотидную последовательность плазмиды, в которой была инсертирована ДНК гена GFP в район инсерционного гена (представляющего интерес гена) в конструкте № 14.
Фиг. 41-2 показывает нуклеотидную последовательность плазмиды, в которой была инсертирована ДНК гена GFP в район инсерционного гена (представляющего интерес гена) в конструкте № 14 (продолжение фиг. 41-1).
Фиг. 42-1 показывает нуклеотидную последовательность плазмиды, в которой была инсертирована ДНК гена GFP в район инсерционного гена (представляющего интерес гена) в конструкте № 15.
Фиг. 42-2 показывает нуклеотидную последовательность плазмиды, в которой была инсертирована ДНК гена GFP в район инсерционного гена (представляющего интерес гена) в конструкте № 15 (продолжение фиг. 42-1).
Фиг. 43-1 показывает нуклеотидную последовательность плазмиды, в которой была инсертирована ДНК гена GFP в район инсерционного гена (представляющего интерес гена) в конструкте № 16.
Фиг. 43-2 показывает нуклеотидную последовательность плазмиды, в которой была инсертирована ДНК гена GFP в район инсерционного гена (представляющего интерес гена) в конструкте № 16 (продолжение фиг. 43-1).
Фиг. 44 показывает интенсивность экспрессии гена GFP при использовании плазмиды, содержащей промотор SV40 (конструкт № 15) и промотор hTERT (конструкт № 16).
Фиг. 45 показывает нуклеотидную последовательность района эритропоэтина человека в плазмиде.
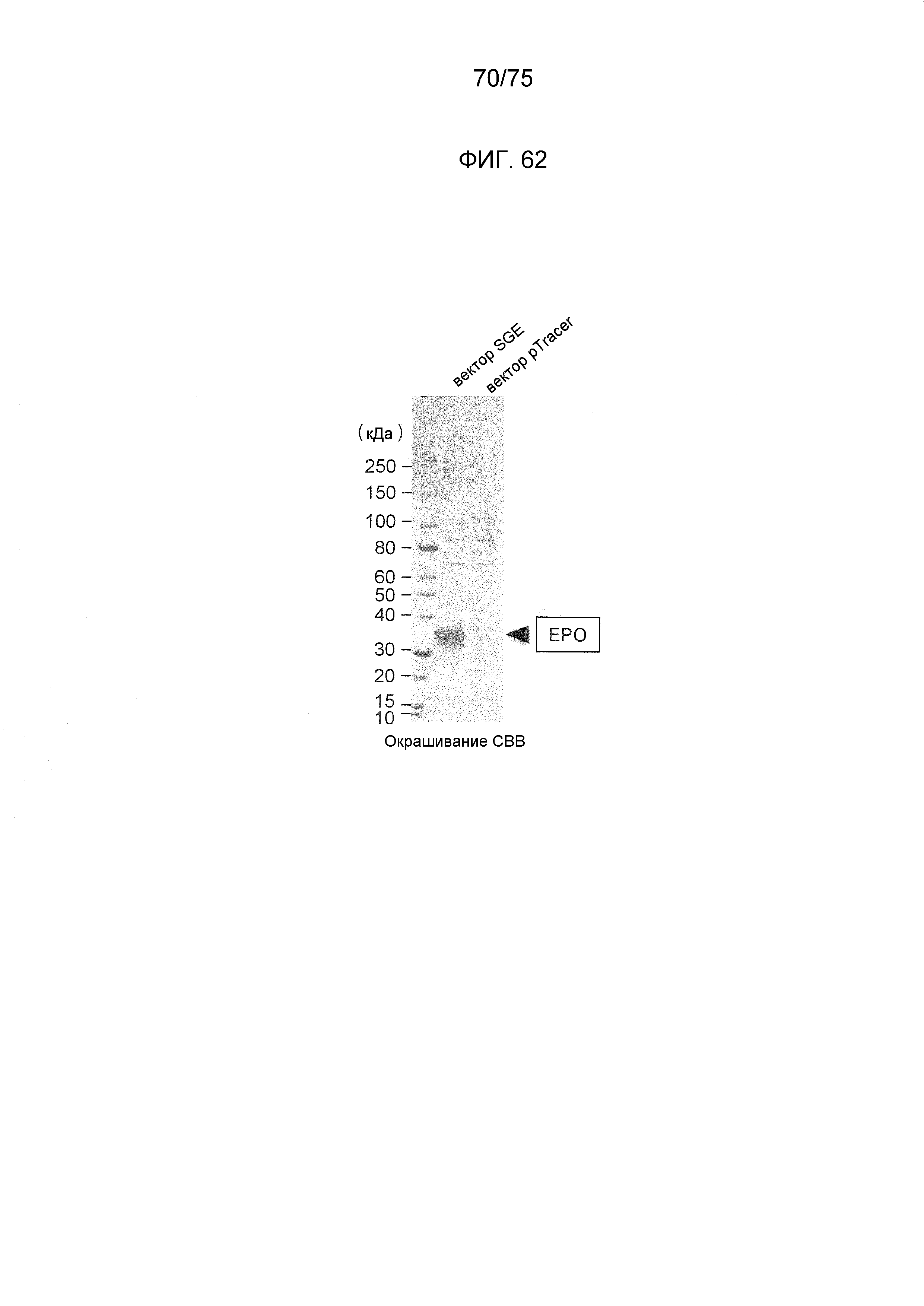
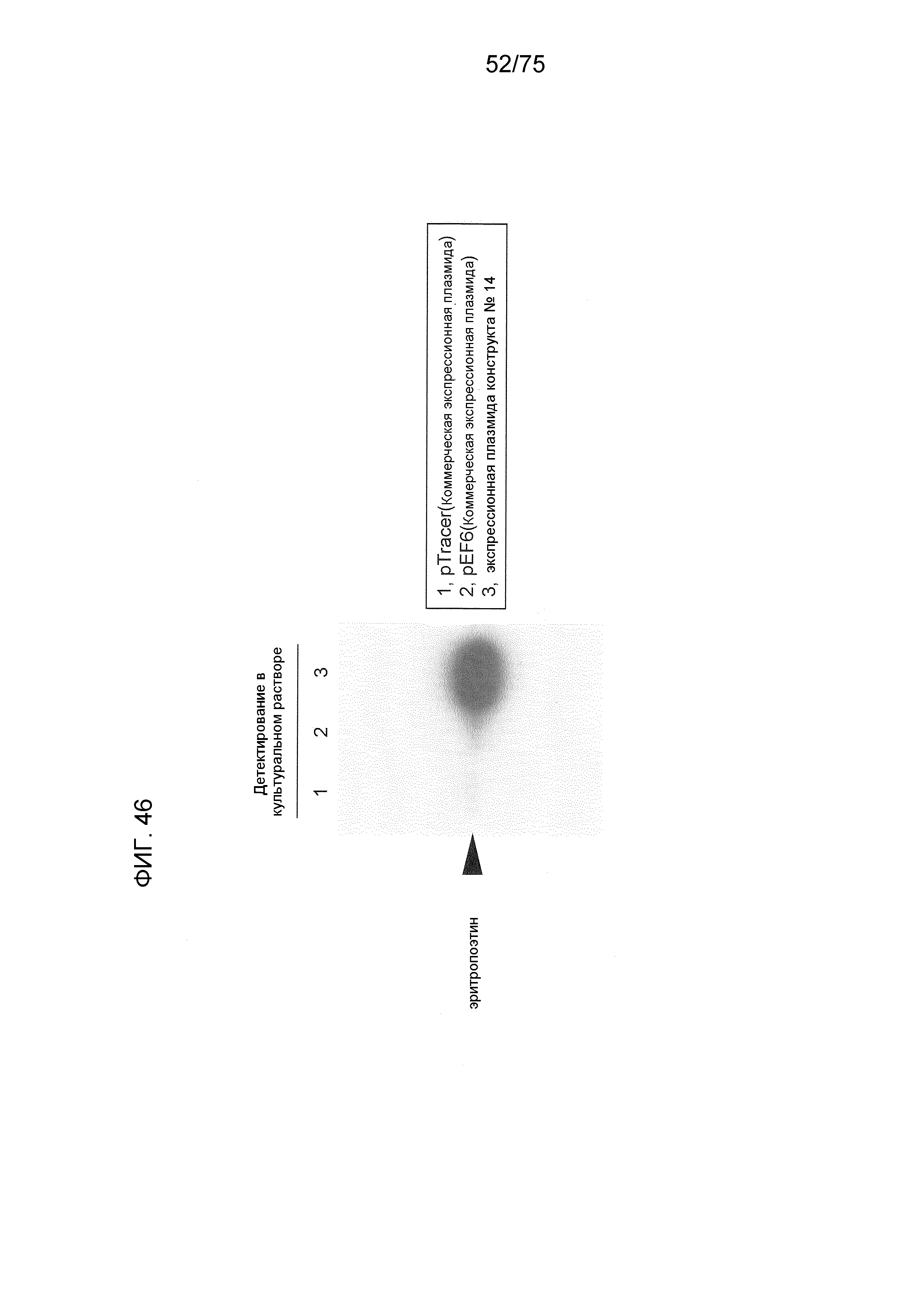
Фиг. 46 показывает результат экспрессии эритропоэтина человека с использованием плазмидного конструкта № 14.
Фиг. 47A показывает нуклеотидную последовательность района легкой цепи IgG человека (фиг. 44A) в плазмиде.
Фиг. 47В показывает нуклеотидную последовательность района тяжелой цепи IgG человека (фиг. 44В) в плазмиде.
Фиг. 48 показывает результат экспрессии легкой цепи IgG человека (фиг. 48A) и тяжелой цепи IgG человека (фиг. 48B) с использованием плазмидного конструкта № 14.
Фиг. 49 показывает структуру конструкта № 17.
Фиг. 50 показывает нуклеотидную последовательность плазмиды, в которой была инсертирована ДНК полноразмерного REIC человека, в район инсерционного гена (представляющего интерес гена) в конструкте № 17.
Фиг. 51 показывает результат экспрессии полноразмерного REIC человека с использованием плазмидного конструкта № 17.
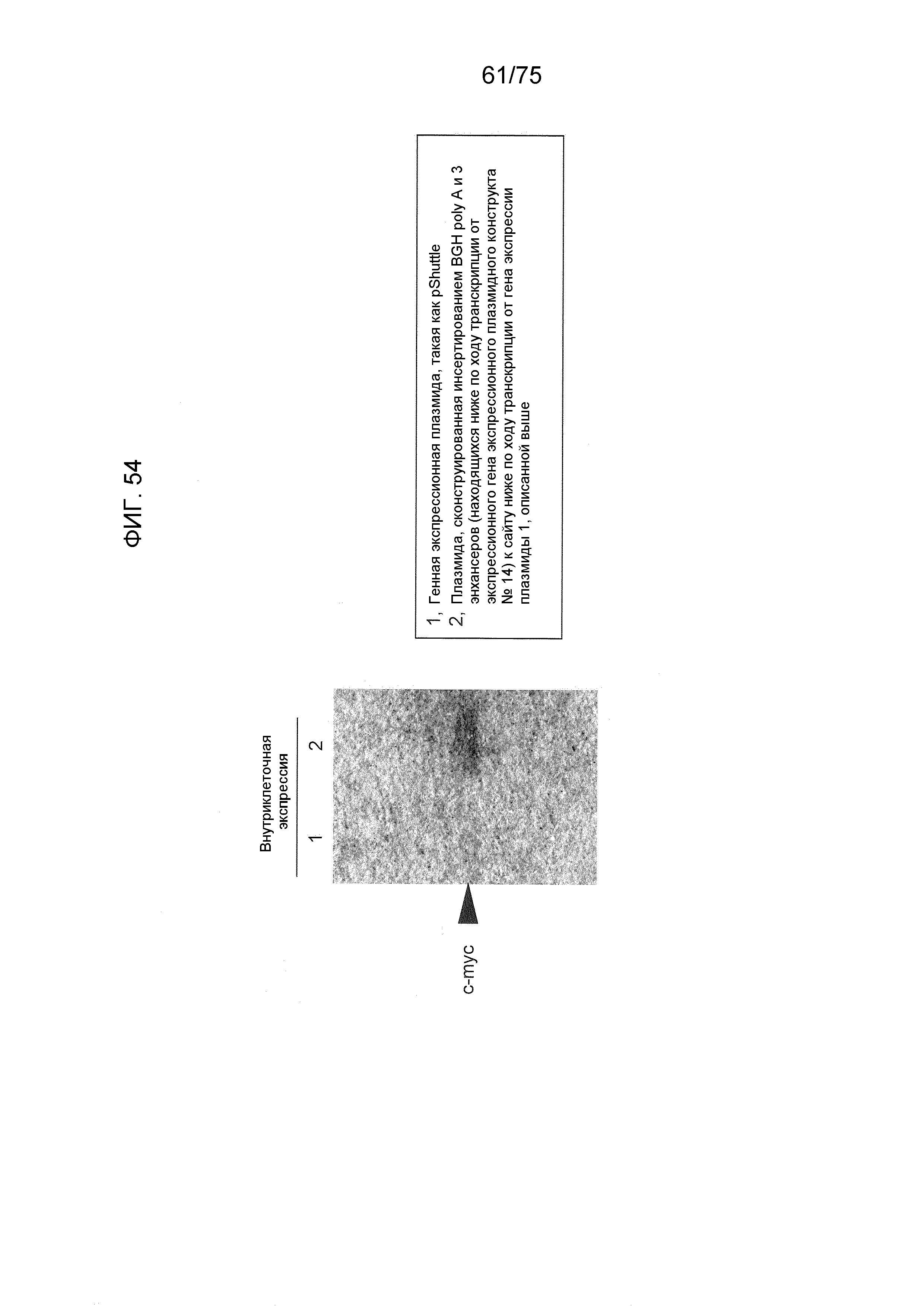
Фиг. 52 показывает последовательность гена c-myc.
Фиг. 53 показывает нуклеотидную последовательность, полученную связыванием BGH polyA, находящегося ниже по ходу транскрипции (справа) от экспрессирующего гена в экспрессионном плазмидном конструкте № 14, и 3 энхансеров.
Фиг. 54 показывает результат экспрессии гена c-myc после включения этой нуклеотидной последовательности (полученной связыванием BGH polyA, находящегося ниже по ходу транскрипции (справа) от экспрессирующего гена в экспрессионном плазмидном конструкте № 14, и 3 энхансеров) в коммерческую плазмиду.
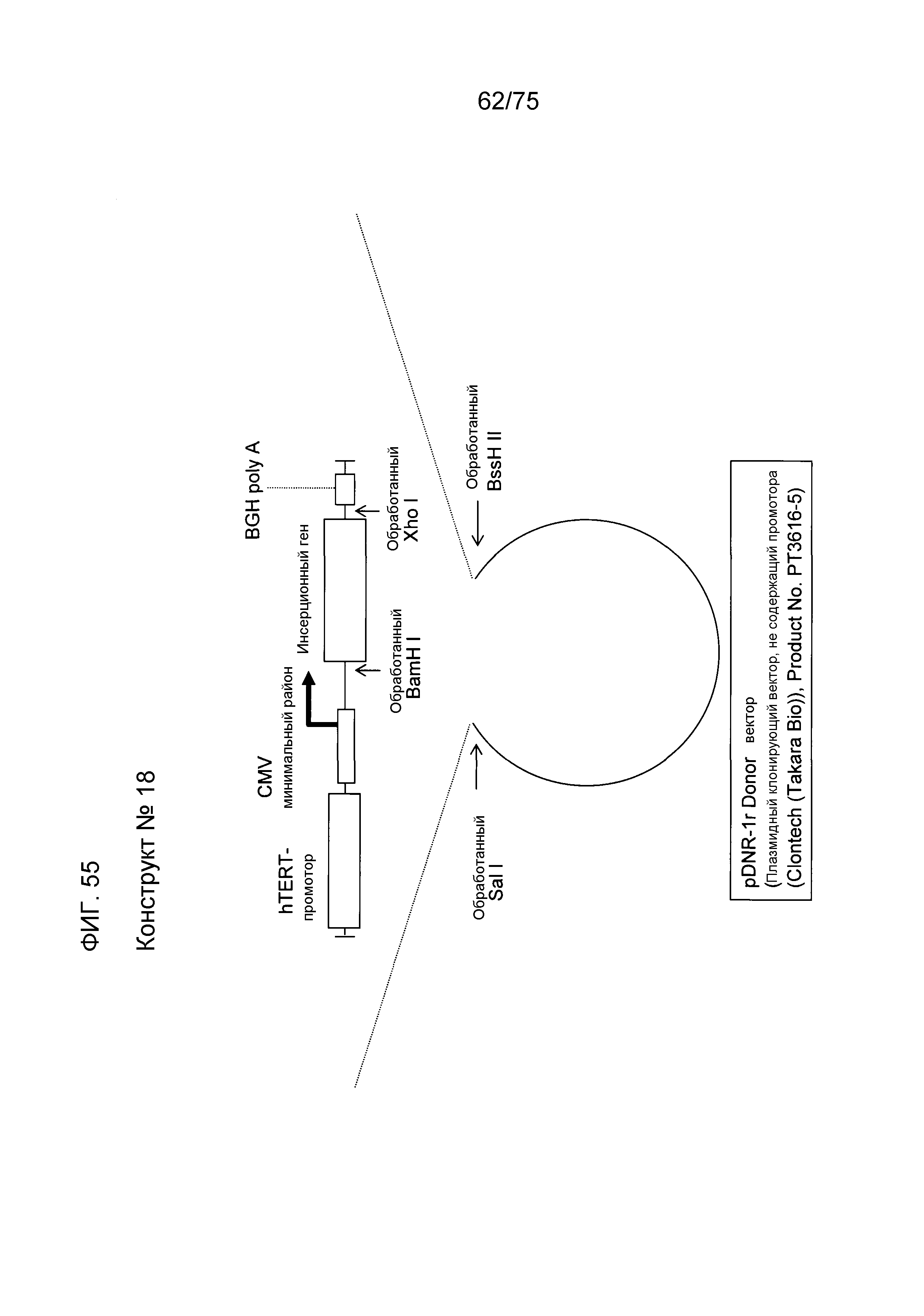
Фиг. 55 показывает структуру конструкта № 18.
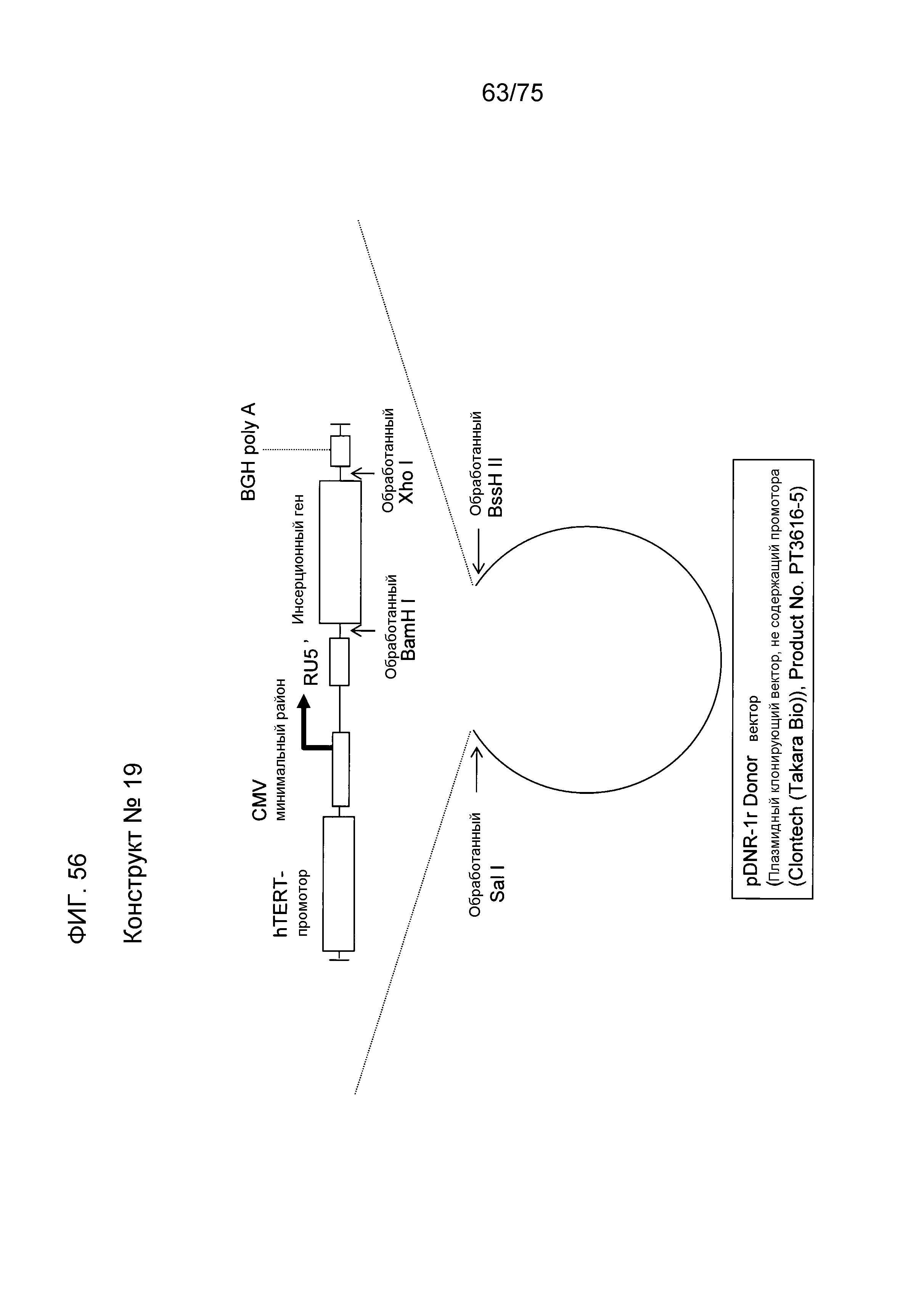
Фиг. 56 показывает структуру конструкта № 19.
Фиг. 57 показывает структуру конструкта № 20.
Фиг. 58 показывает структуру конструкта № 21.
Фиг. 59-1 показывает нуклеотидную последовательность плазмиды, в которой ДНК гена GFP была инсертирована в район инсерционного гена (представляющего интерес гена) конструкта № 20.
Фиг. 59-2 показывает нуклеотидную последовательность плазмиды, в которой ДНК гена GFP была инсертирована в район инсерционного гена (представляющего интерес гена) конструкта № 21 (продолжение фиг. 59-1).
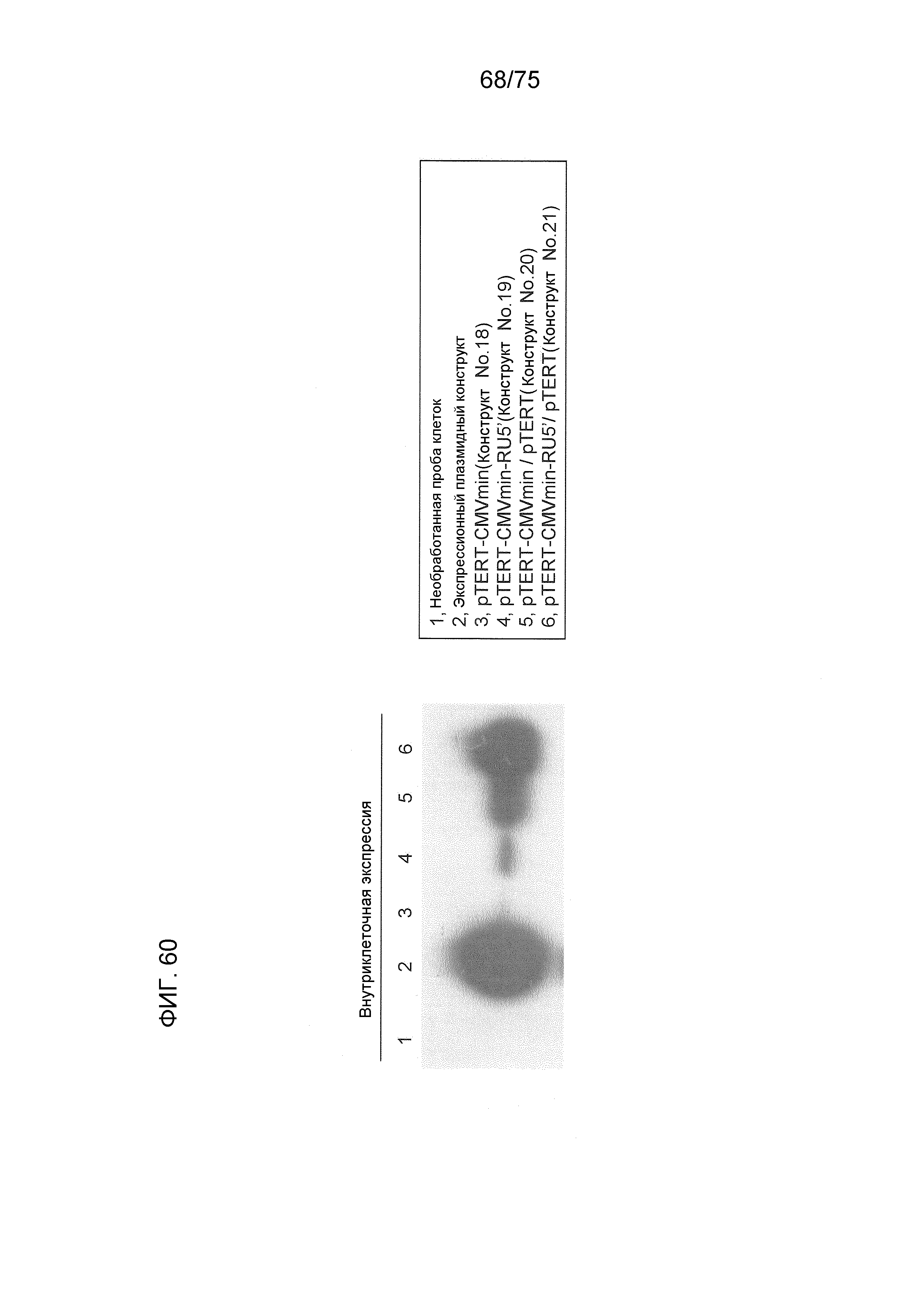
Фиг. 60 показывает результат инсертирования представляющего интерес гена в плазмиду, содержащую промотор hTERT, и его последующей экспрессии.
Фиг. 61 показывает экспрессию после одновременной трансфекции множества экспрессирующих векторов, в которые были включены различные чужеродные гены.
Фиг. 62 показывает получение эритропоэтина человека с использованием экспрессирующих векторов данного изобретения.
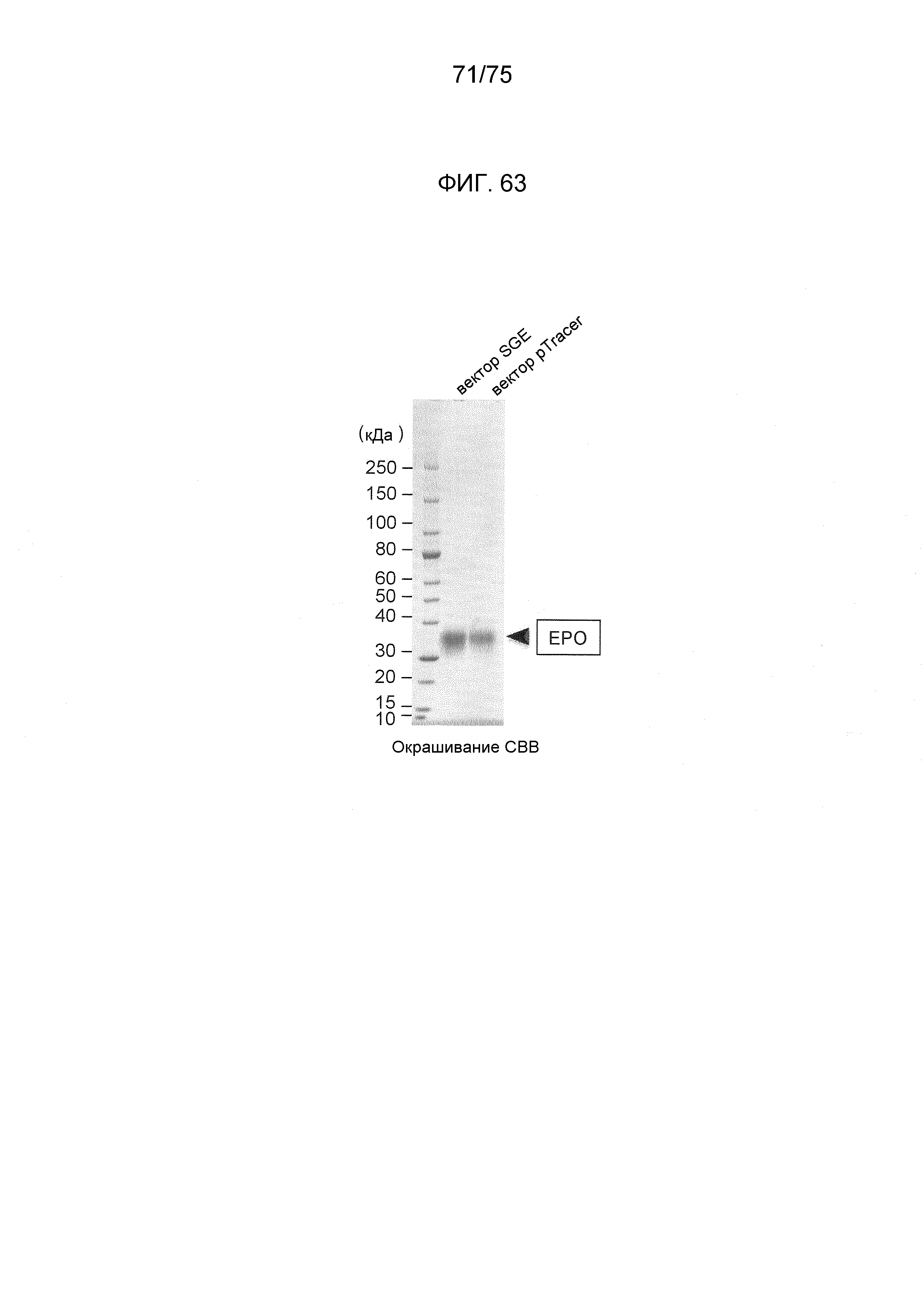
Фиг. 63 показывает чистоту эритропоэтина человека, полученного с использованием экспрессирующих векторов данного изобретения.
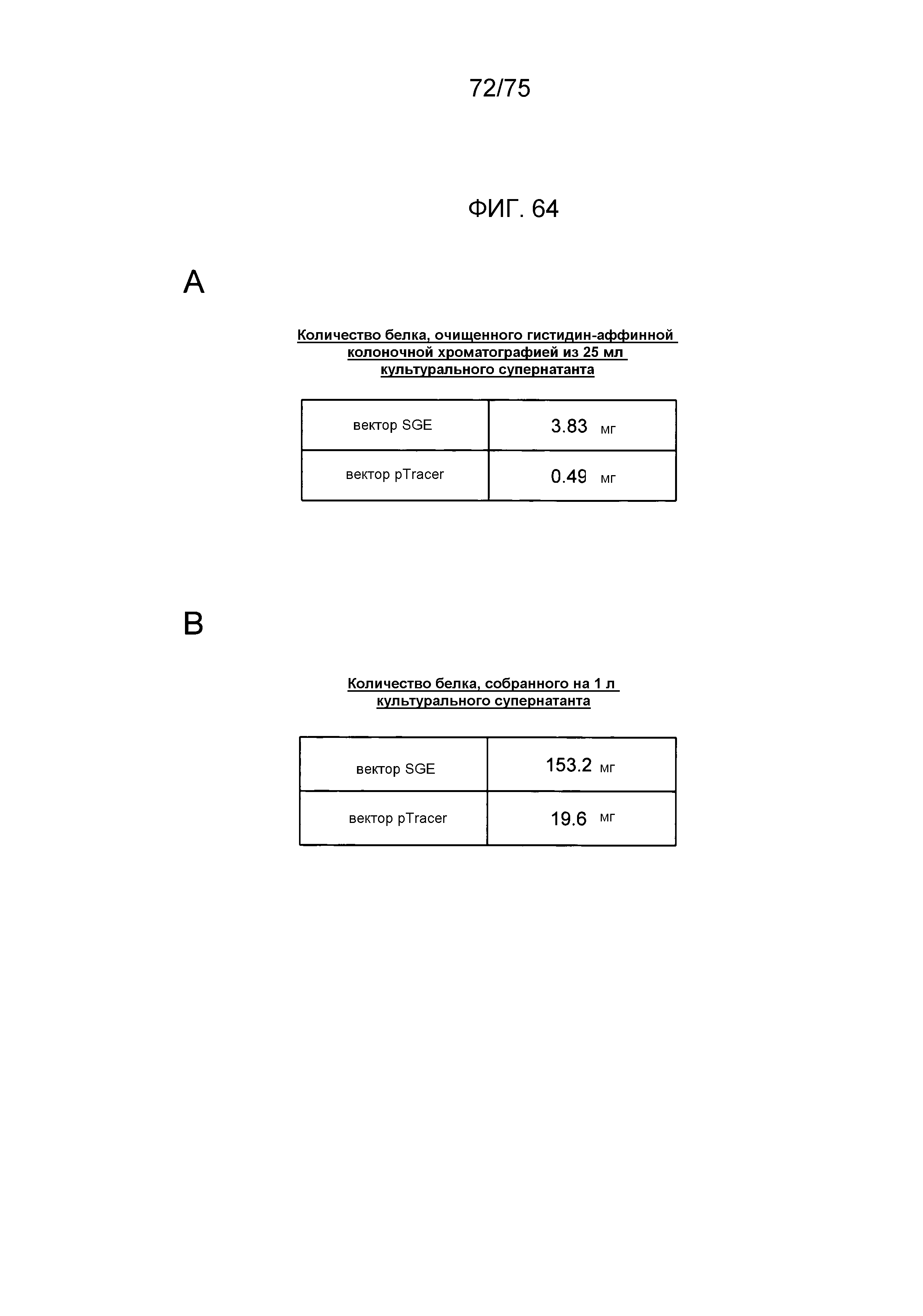
Фиг. 64 показывает количества эритропоэтина человека, полученного с использованием экспрессирующих векторов данного изобретения. Фиг. 64А показывает количество эритропоэтина, продуцированное в 25 мл каждого культурального супернатанта, и фиг. 64В показывает количество эритропоэтина, продуцированное в расчете на 1 л культурального супернатанта.
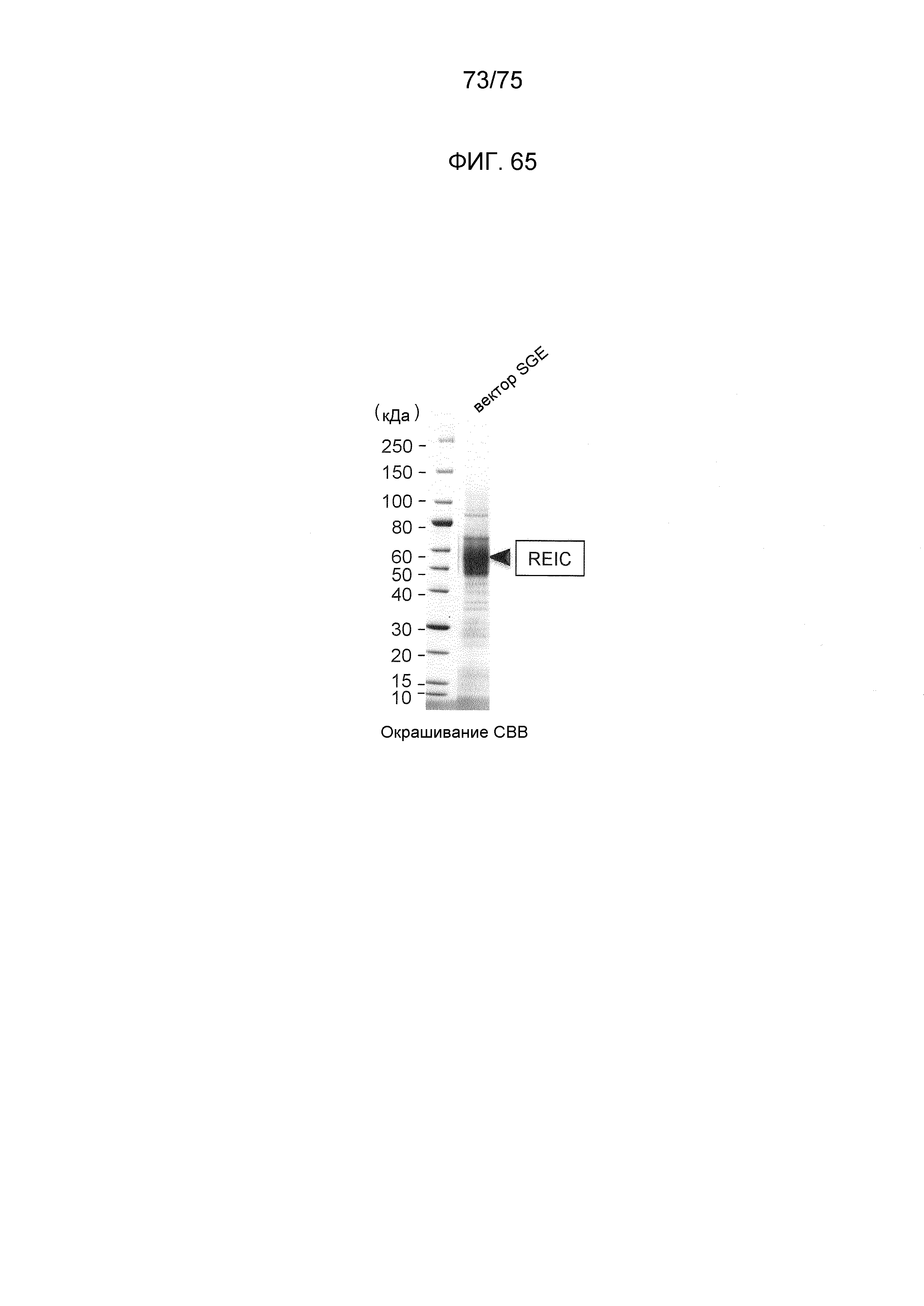
Фиг. 65 показывает получение белка REIC человека с использованием экспрессирующего вектора данного изобретения.
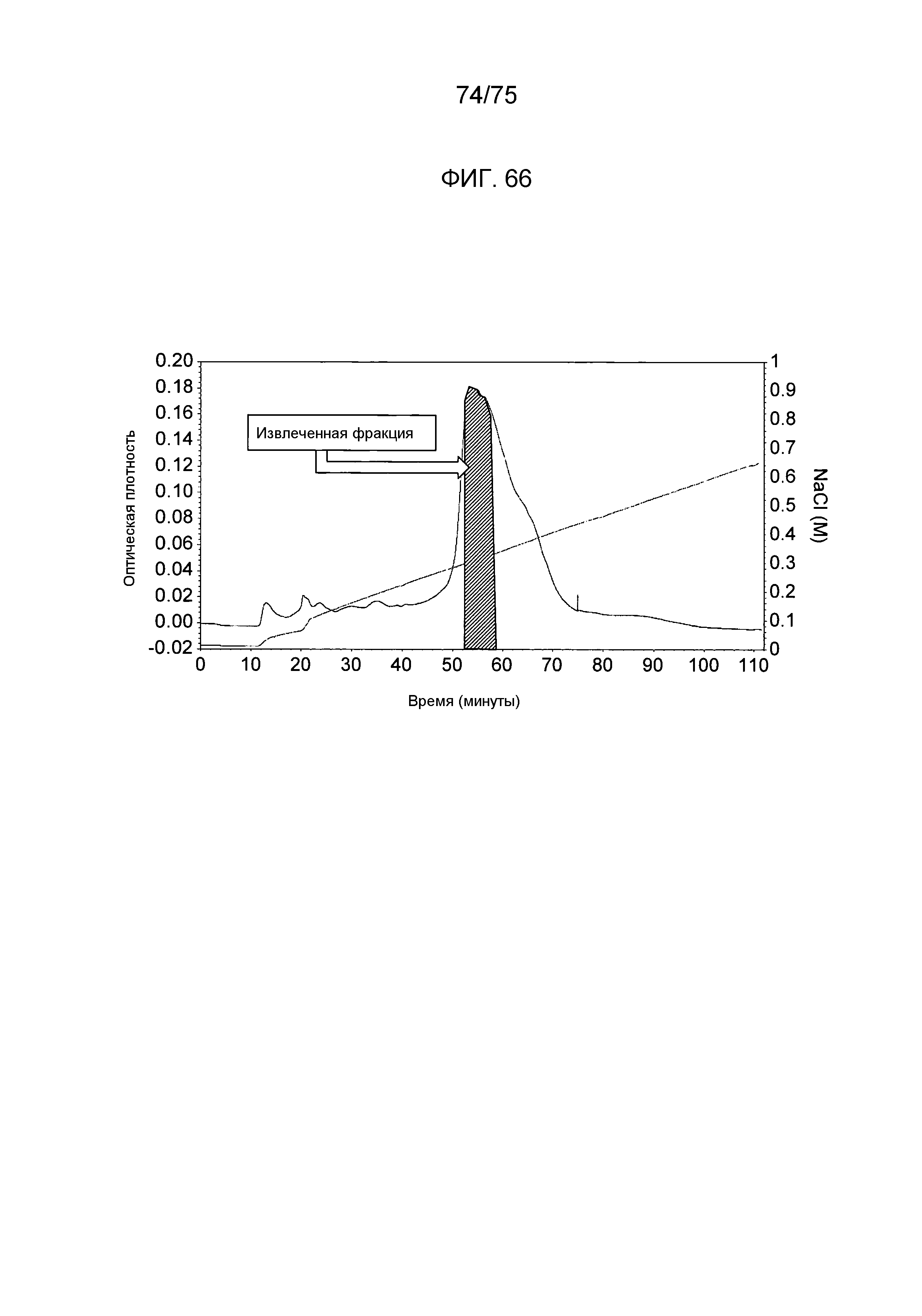
Фиг. 66 показывает ионообменную колоночную хроматограмму для белка REIC человека, полученного с использованием экспрессирующего вектора данного изобретения.
Фиг. 67 показывает количества белка REIC человека, полученные с использованием экспрессирующего вектора данного изобретения (количество белка, продуцированное в 520 мл культурального супернатанта, и количество белка, продуцированное в расчете на 1 л культурального супернатанта).
НАИЛУЧШИЙ СПОСОБ ПРОВЕДЕНИЯ ИЗОБРЕТЕНИЯ
Данное изобретение будет подробно описано далее.
В данном изобретении термин “экспрессионная кассета для белка, который должен быть экспрессирован” относится к совокупности ДНК для возможности экспрессии белка, который должен быть экспрессирован.
Экспрессионная кассета имеет структуру, в которой ДНК-конструкт содержит ген белка, который должен быть экспрессирован (ген, который должен быть экспрессирован), и последовательность добавления поли А, которые локализованы ниже по ходу транскрипции (справа) по меньшей мере от 1-го промотора, и
энхансер или 2-й промотор лигирован ниже по ходу транскрипции (справа) от этого ДНК-конструкта. Любой ген может быть также использован в качестве гена, который должен быть экспрессирован. В этой экспрессионной кассете данного изобретения, сайт, в который инсертируют ген, который должен быть экспрессирован, может существовать в виде мультиклонирующего сайта. В этом случае, ген, который должен быть экспрессирован, может быть инсертирован в такой мультиклонирующий сайт (сайт инсерции) с использованием последовательности, которая узнается рестрикционным ферментом. Такая экспрессионная кассета, которая сама не содержит ген (ДНК), который должен быть экспрессирован, но содержит сайт, в который инсертируется эта ДНК, в качестве мультиклонирующего сайта, включена в примерах экспрессионной кассеты данного изобретения. Кроме того, ген, который должен быть экспрессирован, может называться геном-мишенью или представляющим интерес геном, и белок, который должен быть экспрессирован, может также называться белком-мишенью или представляющим интерес белком. Кроме того, в связи с конструированием этой экспрессионной кассеты, эти гены называют также инсерционными генами, так как их инсертируют в районы генов-мишеней в этой экспрессионной кассете. Альтернативно, эти гены могут также называться чужеродными генами.
Кроме того, вышеуказанный энхансер или 2-й промотор присутствует в наиболее правом по ходу транскрипции сайте экспрессионной кассеты данного изобретения, и никакой механизм экспрессии гена не присутствует ниже по ходу транскрипции (справа). Конкретно, экспрессионная кассета данного изобретения имеет структуру, в которой по меньшей мере один ген, который должен быть экспрессирован, фланкирован одним 1-м промотором и по меньшей мере одним энхансером, или ген, который должен быть экспрессирован, фланкирован одним 1-м промотором и одним 2-м промотором. Здесь, термин “(другой) механизм для экспрессии гена” относится к механизму для экспрессии гена, другого, чем вышеуказанный ген, который должен быть экспрессирован, который содержит промотор, энхансер и т.п. для экспрессии такого гена, другого, чем ген, который должен быть экспрессирован. В экспрессионной кассете данного изобретения, промоторы могут присутствовать ниже по ходу транскрипции и выше по ходу транскрипции гена, который должен быть экспрессирован. Эти два промотора используются для увеличения эффективности экспрессии гена, который должен быть экспрессирован.
Экспрессионную кассету данного изобретения включают в экспрессирующий вектор и затем используют. Данное изобретение включает в себя также такой вектор, содержащий экспрессионную кассету данного изобретения. Как описано выше, вышеуказанный энхансер или 2-ой промотор присутствует в наиболее правом (по ходу транскрипции) сайте экспрессионной кассеты данного изобретения, и механизм для экспрессии гена не существует справа от него. Вектор, содержащий экспрессионную кассету данного изобретения, не имеет никакого механизма для экспрессии гена в сайте ниже по ходу транскрипции от экспрессионной кассеты.
В данном изобретении, примеры гена, который должен быть экспрессирован, включают в себя искусственно инсертированный ген (ДНК), кодирующий чужеродный белок. Примеры этого включают в себя также такой ген из источника, отличающегося от источника клетки-хозяина, и ген из того же самого источника, что и клетка-хозяин. В этом случае, в данном изобретении, такой чужеродный ген также называют инсерционным геном. Типы гена, который должен быть экспрессирован, являются неограниченными. Могут быть использованы ДНК, кодирующие все белки, из которых получают рекомбинанты, и ДНК, кодирующие белки, которые должны быть экспрессированы in vivo таким образом, что они могут быть использованы для лечения конкретных заболеваний. Кроме того, примеры терапевтических генов, которые могут быть использованы для лечения конкретных заболеваний включают в себя ген REIC/Dkk-3 (его нуклеотидная последовательность показана в SEQ ID NO: 17), гены супрессоров опухолей, такие как p53 и Rb, и гены, кодирующие белки, которые могут быть использованы в качестве лекарственных средств, такие как биологически активные вещества (например, интерлейкин 1 (IL-1), IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, α-интерферон, β-интерферон, γ-интерферон, ангиостатин, тромбостатин, эндостатин, METH-1, METH-2, GM-CSF, G-CSF, M-CSF, фактор некроза опухолей, фактор роста гепатоцитов, эритропоэтин, тромбопоэтин, инсулин, гормон роста, антитело (легкая цепь IgG или тяжелая цепь IgG), белок G и белок A), гены, кодирующие белки, применимые в качестве диагностических агентов для применения для детектирования заболеваний и т.п., или реагентов для использования для экспериментов, исследований и т.п. в лабораториях. Белок-мишень, который должен быть экспрессирован, является предпочтительно внеклеточным секреторным белком. Посредством искусственного лигирования энхансера или промотора с сайтом ниже по ходу транскрипции (справа) от первоначального гена организма, экспрессия такого первоначального гена организма также может быть усилена. Конкретно, примеры гена, который должен быть экспрессирован в данном изобретении, включают в себя первоначальные гены организмов. Данное изобретение дополнительно включает в себя инсерцию энхансера или промотора в сайте ниже по ходу экспрессии (справа) от эмбрионально активного гена организма для регуляции экспрессии этого гена. Данное изобретение дополнительно включает в себя клетку, в которую энхансер или промотор инсертируют ниже по ходу транскрипции (справа) от эмбрионально активного гена (релевантного организма). Дополнительные примеры гена, который должен быть экспрессирован, включают в себя ДНК и т.п., кодирующие siRNA, shRNA, miRNA и т.п., имеющие функцию интерференции РНК. При использовании РНК, имеющей функцию интерференции РНК, такая РНК транскрибируется и продуцируется с использованием промотора транспортной РНК, так что становится возможной супрессированная экспрессия конкретного гена.
Например, из этих генов, ген белка REIC/Dkk-3 и подобные гены могут быть использованы для лечения опухолей. Конкретно, может быть использован не только его полноразмерный ген, но также его фрагмент. Примером этого является ДНК, кодирующая полипептид, который состоит из аминокислотной последовательности, начинающейся от аминокислоты 1 и заканчивающейся в любой из аминокислот 39-78 в аминокислотной последовательности белка REIC/Dkk-3, показанной в SEQ ID NO: 18, или аминокислотной последовательности, которая имеет замену, делецию или добавление 1 или нескольких аминокислот в отношении аминокислотной последовательности, начинающейся от аминокислоты 1 и заканчивающейся в любой из 39-78 в аминокислотной последовательности белка REIC/Dkk-3, показанной в SEQ ID NO: 18, и имеет апоптотическую активность. Среди таких ДНК, предпочтительно используется ДНК (ДНК N78-REIC), кодирующая пептид, состоящий из аминокислот 1-78 аминокислотной последовательности белка REIC/Dkk-3, показанной в SEQ ID NO: 18.
Для детектирования или диагностики заболевания может также содержаться репортерный ген.
Промотор является специфической нуклеотидной последовательностью ДНК для инициации транскрипции с ДНК в качестве матрицы и обычно имеет обычную последовательность. Например, прокариоты, такие как Escherichia coli, обычно имеют последовательность TATAATG в сайте из 10 пар оснований, который является сайтом инициации транскрипции, и последовательность TTGACA в сайте из 35 пар оснований. Кроме того, эукариоты обычно имеют TATA-бокс в сайте из 20 пар оснований. Экспрессионная кассета данного изобретения может всегда иметь 1-й промотор в сайте выше по ходу транскрипции (слева) от гена, который должен быть экспрессирован, и может иметь 2-й промотор в сайте ниже по ходу транскрипции (справа) от гена, который должен быть экспрессирован. Эти промоторы, которые должны быть использованы в качестве 1-го промотора и 2-го промотора, не ограничиваются и промотор 1 и промотор 2 могут быть одинаковыми или отличающимися один от другого. Не специфические промоторы, которые могут ускорять экспрессию чужеродных генов во всех клетках или тканях, ткане- или органоспецифические промоторы, опухолеспецифические и специфические или селективные промоторы, такие как специфические в отношении развития или специфические в отношении дифференцировки промоторы, могут быть также использованы здесь. Например, специфический промотор может быть использован в качестве 1-го промотора, а неспецифический промотор может быть использован в качестве 2-го промотора. Промоторы, которые должны быть использованы в данном изобретении, являются следующими. Примеры специфического для рака или опухолеспецифического промотора включают в себя промотор hTERT (обратной транскриптазы-теломеразы человека), PSA (промотор простата-специфического антигена), промотор c-myc и промотор GLUT. Примеры специфического для ES-клеток или раковых стволовых клеток промотора включают в себя промоторы OCT3/4 и NANOG. Одним примером специфического для невральных стволовых клеток промотора является промотор Нестина. Примеры чувствительного к клеточному стрессу промотора включают в себя промоторы HSP70, HSP90 и p53. Одним примером гепатоцит-специфического промотора является промотор альбумина. Одним примером радиочувствительного промотора является промотор TNF-альфа. Одним примером промотора для увеличения копийности инфекционной плазмиды является промотор SV40 и т.п. Одним примером специфического для пролиферативных клеток промотора является промотор EF1-альфа. Кроме того, конкретно, в качестве 1-го промотора, используют промотор CMV-i (hCMV + интрон-промотор) (SEQ ID NO: 5), промотор β-актина, промотор CAG (SEQ ID NO: 12), промотор CMV или т.п. и в качестве 2-го промотора используют промотор CMV или т.п. Виды животных, из которых получают промотор β-актина не ограничиваются. Используются промоторы β-актина млекопитающих, такие как промотор β-актина человека (SEQ ID NO: 8) и промотор куриного актина. Кроме того, может быть также использован искусственный гибридный промотор, такой как вышеуказанный промотор CMV-i. Этот промотор CMV-i может быть синтезирован на основе открытия в описании Патента США № 5168062 или описания Патента США № 5385839. Может быть использован промотор как таковой, коровая (сердцевинная) часть промотора, состоящая из минимальной последовательности, имеющей промоторную активность. Термин “коровый промотор” относится к району промотора, способному функционировать с получением точной инициации транскрипции, который может содержать TATA-бокс. Среди вышеупомянутых промоторов, специфический для рака или опухолеспецифический промотор, такой как промотор hTERT, может быть предпочтительно использован для нацеленной на рак генной терапии или диагностики рака с использованием генной экспрессии. Конструкт № 21, содержащий промотор hTERT, может быть использован для таких целей.
Происхождение последовательности добавления поли А (последовательности полиаденилирования, полиА) является неограниченным. Примеры такой последовательности добавления поли А включают в себя последовательность добавления поли А, полученная из гена гормона роста, такая как полученная из бычьего гормона роста последовательность добавления поли А (содержащаяся в нуклеотидной последовательности, показанной в SEQ ID NO: 6 (последовательности после 13-го основания)) и полученная из гена гормона роста человека последовательность добавления поли А, полученная из вируса SV40 последовательность добавления поли А и полученная из гена β-глобина человека или кролика последовательность добавления поли А. Содержание такой последовательности добавления поли А в экспрессионной кассете приводит к увеличенной эффективности транскрипции.
Примеры энхансера являются неограниченными, пока он приводит к увеличенному количеству мессенджер РНК (мРНК), генерируемому транскрипцией. Энхансер является нуклеотидной последовательностью, имеющей влияние на ускорение действия промотора, и обычно имеет длину приблизительно 100 пар оснований в большинстве случаев. Энхансер может ускорять транскрипцию независимо от направления релевантной последовательности. Один тип энхансера может быть использован в данном изобретении. Конкретно, могут быть использованы два или более (множество) одних и тех же энхансеров или множество различных энхансеров могут использоваться в комбинации. При использовании множества различных энхансеров, их порядок также не является ограниченным. Например, могут быть использованы энхансер CMV (SEQ ID NO: 7), энхансер SV40, энхансер hTERT (теломеразы-обратной транскриптазы), и т.п. Одним примером их является продукт, полученный из связывания энхансера hTERT, энхансера SV40 и энхансера CMV в таком порядке.
Кроме того, множество энхансеров (например, 1-4 энхансера) могут быть лигированы выше по ходу транскрипции (слева) от ДНК-конструкта, содержащего ДНК, кодирующую белок, который должен быть экспрессирован, и последовательность добавления поли А. Энхансеры, которые должны быть лигированы выше по ходу транскрипции от него, являются неограниченными и предпочтительным является энхансер CMV.
При инсертировании энхансера непосредственно ниже по ходу транскрипции (слева) от ДНК-конструкта, состоящего из “промотора-гена, который должен быть экспрессирован, - последовательности добавления поли А”, белок этого гена (который должен быть более сильно экспрессирован) может экспрессироваться более сильно, чем белок в случае обычной общепринятой системы экспрессии генов.
В частности, посредством использования комбинации промотора CMV-i и энхансера CMV, почти во всех клетках (клетках-хозяевах) становится возможной сильная экспрессия белка гена, который должен быть экспрессирован, независимо от типа используемого здесь реагента транскрипции, хотя инсертируется любой ген.
Инсертирование одного или нескольких энхансеров CMV в сайты выше по ходу транскрипции (слева) от промотора приводит к дополнительно усиленной экспрессии конкретного гена (например, гена REIC/Dkk-3 или гена CD133 в примерах ниже) в конкретных клетках (например, линии клеток HEK293 или линии клеток MCF7 в примерах ниже). Четыре энхансера CMV инсертируют также выше по ходу транскрипции (слева) от промотора, так что экспрессия дополнительно усиливается в зависимости от конкретных клеток (например, линии клеток HepG2 или линии клеток HeLa в примерах ниже).
Кроме того, инсертирование только энхансера CMV в сайт выше по ходу транскрипции (слева) от промотора приводит только к слегка увеличенной экспрессии гена или слабому изменению в нем (фиг. 1 и фиг. 2). Для экспрессионной кассеты данного изобретения важно, что энхансер CMV инсертируется и лигируется непосредственно ниже по ходу транскрипции (справа) от последовательности добавления поли А.
Кроме того, RU5' (SEQ ID NO: 9) может быть лигирован непосредственно выше по ходу транскрипции (слева) от ДНК, кодирующей белок, который должен быть экспрессирован. Выражение “..(в сайт) непосредственно выше по ходу транскрипции (слева)” означает, что релевантная последовательность лигирована непосредственно без других элементов, имеющих специфические функции. Однако между ними может содержаться короткая последовательность, в качестве линкера. RU5' является полученным из HTLV LTR и является элементом, который увеличивает экспрессию белка посредством его инсертирования (Mol. Cell. Biol., Vol. 8 (1), p. 466-472, 1988). Инсертирование RU5' в направлении, противоположном направлению, сообщенному ранее, может элиминировать промоторное действие усиления экспрессии вследствие инсертирования энхансера.
Кроме того, UAS может быть лигирован в сайт непосредственно выше по ходу транскрипции (слева) от энхансера и/или промотора. UAS является районом связывания для гена GAL4. Инсерция гена GAL4 в сайт ниже по ходу транскрипции (справа) от UAS может приводить к увеличенной экспрессии белка.
Кроме того, с наиболее левой частью этой экспрессионной кассеты может быть лигирован SV40-ori. SV40-ori является районом связывания гена SV40. Инсертирование гена SV40 в сайт ниже по ходу транскрипции (справа) от SV40-ori приводит к увеличенной экспрессии белка.
Каждый из вышеуказанных элементов должен быть функционально лигирован. Здесь, термин “функционально лигирован” означает, что каждый элемент лигирован таким образом, что он может проявлять его функции, и, следовательно, экспрессия гена, который должен быть экспрессирован, повышается.
Фиг. 7-21, фиг. 36, фиг. 37, фиг. 49 и фиг. 55-58 показывают различные конструкты экспрессионной кассеты. В данном изобретении, такой конструкт может также называться скелетом плазмиды. Примеры конструктов данного изобретения для усиления экспрессии генов, которые должны быть экспрессированы, включают в себя конструкт № 2 (фиг. 8), конструкт № 4 (фиг.10), конструкт № 6 (фиг.12), конструкт № 8 (фиг. 14), конструкт № 10 (фиг. 16), конструкт № 12 (фиг. 18), конструкт № 14 (фиг. 20), конструкт № 15 (фиг. 36), конструкт № 16 (фиг. 37), конструкт № 17 (фиг. 49), конструкт № 20 (фиг. 57) и конструкт № 21 (фиг. 58). Другим примером является конструкт, показанный на фиг. 21.
Среди этих конструктов, с целью увеличения экспрессии гена, наилучшими являются конструкт № 14, конструкт № 15 и конструкт № 16, в которых 3 энхансера лигированы ниже по ходу транскрипции (справа) от каждого представляющего интерес гена. Например, в результате применения полноразмерного гена REIC в качестве представляющего интерес гена в конструкте № 14, уровень экспрессии этого белка является эквивалентным уровню экспрессии в случае аденовирусного вектора (100 MOI, кодирующего полноразмерный REIC/Dkk-3 гена). Скелет плазмиды конструкта № 14 проявляет также действие увеличения экспрессии гена даже в случае фрагмента гена, такого как ДНК, кодирующая N78-REIC.
Например, посредством трансфекции клеток рака предстательной железы человека (PC3) препаратом, в котором конструкт № 14 содержит ДНК-фрагмент, кодирующий N78-REIC, наблюдали значимые эффекты супрессии пролиферации раковых клеток и значимые эффекты индукции смерти раковых клеток. Посредством трансфекции клеток рака предстательной железы человека (PC3) препаратом, в котором полноразмерный ген REIC кодируется конструктом № 14, наблюдали эффекты супрессии пролиферации раковых клеток.
Кроме того, ДНК, кодирующую такой белок, как эритропоэтин человека, инсертировали в конструкт № 14, конструировали экспрессирующий вектор и затем клетки трансфицировали этим экспрессионным вектором, и, следовательно, этот белок мог продуцироваться в большом количестве с использованием этих клеток.
В данном изобретении, ДНК, представленные нуклеотидными последовательностями, показанными в вышеуказанных SEQ ID NO, могут иметь мутацию (мутации) в нуклеотидных последовательностях, пока они сохраняют активность каждой ДНК или активность белка или полипептида, кодируемого каждой ДНК. Примеры такой ДНК, которая может быть использована для конструирования ДНК-конструкта данного изобретения, включают в себя ДНК, гибридизующуюся при строгих условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную нуклеотидной последовательности, показанной в каждой SEQ ID NO, ДНК, имеющую по меньшей мере 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95% и особенно предпочтительно по меньшей мере 97% гомологию с нуклеотидной последовательностью, показанной в каждой из SEQ ID NO, как рассчитано при помощи программы BLAST (Basic Local Alignment Search Tool в Национальном Центре Биологической Информации (NCBI)) или т.п. (например, с использованием данных по умолчанию; т.е. исходно установленных параметров), и ДНК, кодирующую белок или полипептид, содержащий аминокислотную последовательность, имеющую замену, делецию и/или добавление одной или множества или нескольких (1-10, предпочтительно 1-5, более предпочтительно 1 или 2 аминокислоты) аминокислот относительно аминокислотной последовательности белка или полипептида, кодируемого этой ДНК. Термин “строгие условия”, используемый здесь, относится, например, к строгим условиям приблизительно 1 x SSC, 0,1% SDS и 37°C, более строгим условиям приблизительно 0,5 x SSC, 0,1% SDS и 42°C, или даже более строгим условиям приблизительно 0,2 x SSC, 0,1% SDS и 65°C. При более строгих условиях гибридизации, соответственно, может ожидаться выделение ДНК, имеющей более высокую гомологию относительно последовательности зонда. Следует отметить, что вышеуказанные комбинации SSC, SDS и температурных условий являются примерами, и необходимая строгость может быть реализована адекватным комбинированием концентрации ДНК, длины ДНК, времени реакции гибридизации и других условий.
Примеры вектора для инсертирования экспрессионной кассеты данного изобретения включают в себя вирусные векторы, такие как плазмида, аденовирусный вектор, аденоассоциированный вирусный вектор, лентивирусный вектор, ретровирусный вектор, вектор вируса герпеса и вектор вируса Сендай, и невирусные векторы, такие как биодеградируемый полимер. Вектор, в который может быть введена экспрессионная кассета, может быть введен в клетки известным способом, таким как инфекция или электропорация.
В настоящее время, этот вектор может быть также введен с использованием известного реагента трансфекции.
Вектор, сконструированный инсертированием экспрессионной кассеты данного изобретения, вводят в клетки трансфекцией, так что представляющий интерес ген может быть экспрессирован в этих клетках и может продуцироваться представляющий интерес белок. Для введения экспрессионной кассеты данного изобретения и получения белка-мишени могут быть использованы линии эукариотических клеток или линии прокариотических клеток. Примеры эукариотических клеток включают в себя клетки установленных линий клеток млекопитающих, клетки линий клеток насекомых, грибные клетки или клетки нитчатых бактерий и клетки дрожжей. Примеры прокариотических клеток включают в себя клетки бактерий, таких как Escherichia coli, Bacillus subtilis и Brevibacillus brevis. Предпочтительно, используют клетки млекопитающих, такие как клетки Hela, клетки HEK193, клетки CHO, клетки COS, клетки BHK или клетки Vero. Вышеописанные трансформированные клетки-хозяева культивируют in vitro или in vivo, так что может продуцироваться представляющий интерес белок. Клетки-хозяева культивируют известным способом. Например, в качестве культурального раствора может быть использована известная культуральная среда, такая как DMEM, MEM, RPMI1640 или IMDM. Экспрессированный таким образом белок может быть очищен известным способом из культурального раствора, когда он является секреторным белком, или из клеточного экстракта, когда он является несекреторным белком. После экспрессии и продуцирования представляющего интерес белка, этот белок может быть также получен одновременной трансфекцией клеток множеством векторов, содержащих различные представляющие интерес гены. С применением такого способа, может быть одновременно продуцировано множество белков.
Кроме того, коммерческий вектор может быть модифицирован таким образом, что он содержит экспрессионную кассету данного изобретения. Например, энхансер включают в район ниже по ходу транскрипции (справа) экспрессионной кассеты гена в коммерческом векторе, таком как вектор pShuttle, и затем этот вектор может быть использован. Примеры вектора данного изобретения включают в себя коммерческие кассеты, которые были модифицированы.
Данное изобретение дополнительно включает в себя аденовирусный (Ad) вектор и аденоассоциированный вирусный (AAV) вектор, содержащие вышеуказанные экспрессионные кассеты для генов, которые должны быть экспрессированы. Эти векторы делают возможными специфическую диагностику или лечение заболевания, такого как рак. Эти векторы могут быть сконструированы инсертированием вышеуказанной экспрессионной кассеты для генов, которые должны быть экспрессированы, в аденовирус или аденоассоциированный вирус.
Аденовирусные векторы характеризуются тем, что: (1) трансфекция может выполняться в различных клетках; (2) трансфекция может эффективно выполняться даже для клеток в стационарной фазе; (3) они могут концентрироваться центрифугированием, так что может быть получен вирус с высоким титром (10-11 БОЕ/мл или более); и (4) они пригодны для применения в прямой трансфекции в клетки тканей in vivo.
В качестве аденовирусного вектора, который должен использоваться для генной терапии, были развиты следующие векторы: аденовирусный вектор второй генерации (Lieber, A., et al., J. Virol., 70, 8944, 1996; Mizuguchi, H. & Kay, M. A., Hum. Gene Ther., 10, 2013, 1999), полученный делетированием домена E2 или E4, наряду с доменом E1/E3 из аденовирусного вектора первой генерации (Miyake, S., et al., Proc. Natl. Acad. Sci. U.S.A., 93, 1320, 1996), лишенный домена E1/E3; и аденовирусный вектор третьей генерации (Steinwaerder, D. S. et al., J. Virol., 73, 9303, 1999), почти полностью лишенный генома аденовируса (GUTLESS). Однако, для трансфекции этого гена в соответствии с данным изобретением, может быть использован любой аденовирусный вектор без конкретного ограничения.
Аденоассоциированный вирус является одноцепочечным ДНК-вирусом рода Parvovirus, который характеризуется тем, что: (1) он подвергается долгосрочной экспрессии генов; (2) он проявляет низкую токсичность; и (3) он делает возможной трансфекцию делящихся и не делящихся клеток. Считается, что образование конкатамера (комплекса, полученного лигированием одноцепочечных ДНК) позволяет долгосрочную экспрессию генов.
Аденовирусный (Ad) вектор и аденоассоциированный вирусный (AAV) вектор, содержащие вышеуказанные экспрессионные кассеты для гена, который должен быть экспрессирован, и делающие возможной экспрессию гена-мишени, который должен быть экспрессирован, могут быть использованы для детектирования или лечения заболевания. Примером заболевания является рак. С применением пептида (инсертированного в наружной оболочке аденовирусного вектора или аденоассоциированного вирусного вектора), такого как RGD, селективно связывающегося с белком, экспрессируемым в специфических клетках, этот вектор направляется в эти клетки. Эти клетки инфицируются и ген, который должен быть экспрессирован, экспрессируется. Когда ген, который должен быть экспрессирован, является репортерным геном, таким как ген люциферазы, специфические клетки могут быть детектированы испусканием света или т.п. Когда специфические клетки являются раковыми клетками, посредством введения этого вектора субъекту раковые клетки в этом субъекте могут быть детектированы и затем этот субъект может быть диагностирован как имеющий или не имеющий рака. Отдельная клетка может быть детектирована аденовирусным вектором и аденоассоциированным вирусным вектором данного изобретения, и, следовательно, они могут быть использованы для детектирования, например, микрорака.
Кроме того, когда ген, который должен быть экспрессирован, является терапевтическим геном, такой ген-мишень, который должен быть экспрессирован, экспрессируется в специфических клетках, так что он может проявлять терапевтические эффекты. Например, когда специфические клетки являются раковыми клетками и используется ген супрессора рака, такой как ген REIC/Dkk-3 человека, посредством введения его субъекту, такой терапевтический в отношении рака ген доставляется в раковые клетки этого субъекта, этот ген экспрессируется в раковых клетках и, следовательно, обнаруживает терапевтические действия. Данное изобретение включает в себя диагностический или терапевтический вирусный препарат, содержащий аденовирусный вектор или аденоассоциированный вирусный вектор. Примеры рака, который должен лечиться в данном изобретении, когда в качестве терапевтического гена используется ген супрессора рака, такой как ген REIC/Dkk-3 человека, включают в себя опухоль черепного нерва, рак кожи, желудочный рак, рак легкого, рак печени, лимфому/лейкоз, рак ободочной кишки, рак поджелудочной железы, анальный/ректальный рак, рак пищевода, рак матки, рак молочной железы, рак надпочечников, рак почки, рак почечных лоханок и мочеиспускательного канала, рак мочевого пузыря, рак предстательной железы, рак мочеиспускательного канала, рак полового члена, тестикулярный рак, остеому/остеосаркому, лейомиому, рабдомиому и мезотелиому. Аденовирусный вектор и аденоассоциированный вирусный вектор данного изобретения могут быть также использованы для лечения первичного рака и метастатического рака.
Аденовирусный вектор и аденоассоциированный вирусный вектор данного изобретения могут вводиться способами, которые могут быть использованы в области генной терапии, такими как интраваскулярное введение (например, внутривенное введение и внутриартериальное введение), пероральное введение, интраперитонеальное введение, интратрахеальное введение, интрабронхиальное введение, подкожное введение или трансдермальное введение. В частности, аденовирусный вектор и аденоассоциированный вирусный вектор данного изобретения имеют сильную направленность в отношении специфических тканей или клеток, которая позволяет им эффективно доставлять ген-мишень к специфическим тканям или клеткам. Таким образом, возможны эффективные диагностика и лечение внутривенным введением аденовирусного вектора и аденоассоциированного вирусного вектора.
Аденовирусный вектор и аденоассоциированный вирусный вектор данного изобретения могут вводиться в терапевтически эффективной дозе. Их терапевтически эффективная доза может быть легко определена лицами с квалификацией в области генной терапии. Кроме того, доза может адекватно варьироваться в зависимости от тяжести патологических состояний, пола, возраста, массы тела, общей практики и т.п. субъекта. Например, аденовирусный вектор и аденоассоциированный вирусный вектор данного изобретения могут вводиться при 0,5x1011-2,0x1012 вирусного генома на кг массы тела, предпочтительно при 1,0x1011-1,0x1012 вирусного генома на кг массы тела, и более предпочтительно при 1,0x1011-5,0x1011 вирусного генома на кг массы тела. Вирусный геном представлен молекулярностью (количеством вирусных частиц) аденовирусного или аденоассоциированного вирусного генома и может также называться “частицей (частицами)”. Этот вектор содержит носитель, разбавитель и эксципиент, которые обычно используются в области фармацевтического приготовления. Например, в качестве носителей для таблеток и в качестве эксципиентов, используют лактозу, стеарат магния и т.п. В качестве водной жидкости для инъекции используют, например, солевой раствор или изотонический раствор, содержащий декстрозу и другие адъюванты. Такой раствор может быть использован в комбинации с подходящим солюбилизирующим агентом, таким как спирт, полиспирт (например, пропиленгликоль) или неионогенное поверхностно-активное вещество. В качестве масляной жидкости, используют кунжутное масло, соевое масло или т.п. В качестве солюбилизирующего агента может быть использован, например, бензилбензоат или бензиловый спирт в комбинации.
Кроме того, экспрессирующий вектор, который содержит представляющий интерес ген, может быть также использован в качестве вакцины или ДНК-вакцины для рака и т.п. (Kaufman, H. L. et al., J. Clin. Oncol. 22, 2122-2132 (2004); McNeel, D. G. et al., J. Clin. Oncol. 27, 425-430 (2009)). Например, экспрессирующий вектор, который содержит экспрессионную кассету данного изобретения, в которой был включен ген, кодирующий белок-мишень специфического для рака антигена, вводят in vivo подкожной инъекцией или т.п., этот антиген экспрессируется in vivo, и, следовательно, может быть индуцирована активация клеточного иммунитета хозяина или иммунитета в виде антител против этого антигена. Экспрессионная кассета данного изобретения может быть использована для предотвращения или лечения заболевания, такого как рак, посредством применения в виде вакцины, как описано выше.
Данное изобретение описано далее подробно со ссылкой на следующие примеры, хотя данное изобретение не ограничивается ими.
Пример 1. Экспрессионная кассета, содержащая промотор CMV
Экспрессионные кассеты данного изобретения получали и затем трансфицировали. Экспрессированные таким образом белки анализировали Вестерн-блоттингом.
(1) Конструкты экспрессионных кассет
Конструкт № 1 (фиг. 7)
Конструкт № 1 является плазмидой экспрессии генов, загруженной промотором CMV-i выше по ходу транскрипции (слева) от гена, который должен быть экспрессирован. Кроме того, BGH polyA (последовательность добавления поли А бычьего гормона роста) лигировали ниже по ходу транскрипции (справа) от этого гена. Конкретно, считается, что конструкт № 1 имеет способность экспрессии белка, эквивалентную способности экспрессии белка обычно применяемой экспрессионной плазмиды, содержащей промотор CMV-i.
Конструкт № 2 (фиг. 8)
Конструкт № 2 конструировали инсертированием энхансера CMV в сайт непосредственно ниже по ходу транскрипции (справа) от BGH poly A конструкта № 1.
Конструкт № 3 (фиг. 9)
Конструкт № 3 конструировали заменой промотора CMV-i промотором β-актина человека.
Конструкт № 4 (фиг. 10)
Конструкт № 4 конструировали инсертированием энхансера CMV в сайт непосредственно ниже по ходу транскрипции (справа) от BGH poly A конструкта № 3.
Конструкт № 5 (фиг. 11)
Конструкт № 5 конструировали инсертированием района RU5' в сайт, непосредственно ниже по ходу транскрипции (справа) от промотора β-актина человека конструкта № 3.
Конструкт № 6 (фиг. 12)
Конструкт № 6 конструировали инсертированием энхансера CMV в сайт непосредственно ниже по ходу транскрипции (справа) от BGH poly A конструкта № 5.
Конструкт № 7 (фиг. 13)
Конструкт № 7 конструировали инсертированием энхансера CMV в сайт непосредственно ниже по ходу транскрипции (справа) от промотора β-актина человека конструкта № 5.
Конструкт № 8 (фиг. 14)
Конструкт № 8 конструировали инсертированием энхансера CMV в сайт непосредственно ниже по ходу транскрипции (справа) от BGH poly A конструкта № 7.
Конструкт № 9 (фиг. 15)
Конструкт № 9 конструировали обращением направления нуклеотидной последовательности района RU5' конструкта № 7.
Конструкт № 10 (фиг. 16)
Конструкт № 10 конструировали инсертированием энхансера CMV в сайт непосредственно ниже по ходу транскрипции (справа) от BGH poly A конструкта № 9.
Конструкт № 11 (фиг. 17)
Конструкт № 11 конструировали инсертированием энхансера 4×CMV (четыре энхансера CMV) в сайт непосредственно выше по ходу транскрипции (слева) от промотора β-актина человека конструкта № 5.
Конструкт № 12 (фиг. 18)
Конструкт № 12 конструировали инсертированием энхансера CMV в сайт непосредственно ниже по ходу транскрипции (справа) от BGH poly A конструкта № 11.
Конструкт № 13 (фиг. 19)
Конструкт № 13 является плазмидой экспрессии гена, загруженной промотором CAG. Конкретно, считается, что конструкт № 13 имеет способность экспрессии белка, эквивалентную способности экспрессии белка обычно применяемой экспрессионной плазмиды, содержащей промотор CAG.
Конструкт № 14 (фиг. 20)
Результаты испытания вышеуказанных различных конструктов выявили, что экспрессия гена значимо увеличивалась инсертированием энхансера CMV в сайт непосредственно ниже по ходу транскрипции от BGH poly A. Конструкт № 14 конструировали дополнительным лигированием других энхансеров (энхансера hTERT и энхансера SV40). В результате считается, что конструкт № 14 является лучшим, чем конструкт № 2.
Аденовирусный конструкт, кодирующий полноразмерный ген REIC/Dkk-3 (фиг. 21)
Полноразмерную кДНК REIC/Dkk-3 (Ad-REIC) включали в космидный вектор pAxCAwt и затем переносили в аденовирусный вектор по способу COS-TPC (TAKARA Bio). В это время, аденовирусный вектор (Ad-LacZ), сохраняющий ген LacZ, использовали в качестве контрольного вектора. Аденовирусные векторы, используемые здесь, были теми же самыми, что и аденовирусные векторы, описанные в Патенте Японии № 3813872.
Фиг. 22-35 показывают нуклеотидные последовательности следующих элементов или конструктов.
Фиг. 22-1 и Фиг. 22-2 (продолжение из Фиг. 22-1) показывают полную нуклеотидную последовательность вектора pDNR-1r Donor (Плазмидный клонирующий вектор, не имеющий промотора (Clontech, Product No. PT3616-5)).
Фиг. 23 показывает полную нуклеотидную последовательность вектора pIDT-SMART (Плазмидный клонирующий вектор, не имеющий промотора (IDT)).
Фиг. 24 показывает нуклеотидную последовательность района промотора CMV-i (hCMV + интрон-промотор). Этот район был искусственно синтезирован на основе известной информации нуклеотидной последовательности района промотора CMV-i.
Фиг. 25 показывает нуклеотидную последовательность района BGH polyA (3 x stop + BGH polyA).
“TAATAAA”-часть в этой нуклеотидной последовательности является очень важной частью в последовательности BGH polyA. Эта последовательность была искусственно синтезирована на основе известной информации нуклеотидной последовательности района BGH polyA.
Фиг. 26 показывает нуклеотидную последовательность района энхансера CMV. Эта последовательность была искусственно синтезирована на основе известной информации нуклеотидной последовательности этого района энхансера CMV.
Фиг. 27 показывает нуклеотидную последовательность района промотора β-актина человека. Эту последовательность получали получением плазмиды pDRIVE-h β-Actin-RU5' (InvivoGen) и затем амплификацией нуклеотидной последовательности релевантной части при помощи ПЦР.
Фиг. 28 показывает нуклеотидную последовательность прямого района RU5' {R-сегмента длинного концевого повтора HTLV Типа 1 и части (R-U5') U5-последовательности}. Эта последовательность была искусственно синтезирована на основе известной информации нуклеотидной последовательности района {R-сегмента длинного концевого повтора HTLV Типа 1 и части (R-U5') U5-последовательности}.
Фиг. 29 показывает нуклеотидную последовательность обратного района RU5' {R-сегмента длинного концевого повтора HTLV Типа 1 и части (R-U5') U5-последовательности}. Эта последовательность была искусственно синтезирована на основе известной информации нуклеотидной последовательности района {R-сегмента длинного концевого повтора HTLV Типа 1 и части (R-U5') U5-последовательности}.
Фиг. 30 показывает нуклеотидную последовательность района энхансера 4xCMV. В нуклеотидной последовательности, показанной на фиг. 30, каждая подчеркнутая часть называется конкретно “коротким энхансером CMV”. Вследствие присутствия четырех подчеркнутых частей, этот район обозначается как “район энхансера 4xCMV”. Кроме того, подразумевается, что термин “энхансер CMV”, используемый выше, включает в себя “короткий энхансер CMV”. Термин “энхансер CMV” обычно обозначает длинный энхансер CMV. Эта последовательность была искусственно синтезирована на основе известной информации нуклеотидной последовательности района энхансера CMV.
Фиг. 31 показывает нуклеотидную последовательность района промотора CAG, который является нуклеотидной последовательностью района известного промотора CAG. Эту последовательность получали получением плазмиды pCAGGS, которая была экспрессирующим вектором генов, загруженным промотором CAG, обеспеченным Oriental Yeast Co., ltd., и затем амплификацией при помощи ПЦР нуклеотидной последовательности релевантной части на основе полученной таким образом плазмиды.
Фиг. 32 показывает нуклеотидную последовательность района инсерта 2IRES, который является нуклеотидной последовательностью регуляторного гена IRES на Фиг. 5 и Фиг. 6 (описанного далее). Эта последовательность была получена связыванием двух нуклеотидных последовательностей нормальной ДНК человека, района BiP-IRES (строчные буквы, окруженные рамкой (1) в нуклеотидной последовательности на Фиг. 32) и района Myc-IRES (строчные буквы, окруженные рамкой (2) в нуклеотидной последовательности на Фиг. 32) в таком порядке. Этот ген является геном, который должен быть использован в качестве контрольного гена для инсерционного гена. Эта последовательность была искусственно синтезирована на основе информации нуклеотидных последовательностей района BiP-IRES и района Myc-IRES.
Фиг. 33 показывает нуклеотидную последовательность района SV40ori-UAS-CMVi-RU5', которая является нуклеотидной последовательностью инсерционной части слева от гена инсерции (чужеродного гена) в конструкте № 14 (наилучшем конструкте). Эта последовательность была искусственно синтезирована на основе известной информации нуклеотидной последовательности каждого района, содержащегося в релевантной части. Часть, окруженная рамкой (1) в нуклеотидной последовательности на Фиг. 33, показывает район SV40 ori, часть, окруженная рамкой (2) в той же последовательности показывает район промотора CMV-i и часть, окруженная рамкой (3) в той же последовательности, показывает район RU5'.
Фиг. 34 показывает нуклеотидную последовательность района 3 x stop-BGH-polyA-UAS-hTERT-энхансер + SV40-энхансер + CMV-энхансер, которая является нуклеотидной последовательностью инсерционной части справа (ниже по ходу транскрипции) гена инсерционного гена (чужеродного гена) в конструкте № 14 (наилучшем конструкте). Эта последовательность была искусственно синтезирована на основе известной информации нуклеотидной последовательности каждого района, содержащегося в релевантной части. В нуклеотидной последовательности на Фиг. 34, заглавные буквы, окруженные рамкой (1), показывают район BGH polyA, строчные буквы, окруженные рамкой (2), показывают район энхансера hTERT, заглавные буквы, окруженные рамкой (3), показывают район энхансера SV40, и строчные буквы, окруженные рамкой (4), показывают район энхансера CMV.
Фиг. 35-1 и Фиг. 35-2 показывают полную нуклеотидную последовательность вектора конструкта № 14 и конкретно показывают нуклеотидную последовательность конструкта № 14 (наилучшего конструкта), показанного на Фиг. 20. Эта полная нуклеотидная последовательность содержит также часть вектора pIDT-SMART (этот район терминируется при части с жирным шрифтом на строке 10 нуклеотидной последовательности на Фиг. 35-1 и районе после GCGCGC, окруженном рамкой на строке 24 от нижней части в нуклеотидной последовательности Фиг. 35-2). Эту последовательность получали включением инсерционной части слева и той же самой части справа от инсерционного гена (чужеродного гена в конструкте № 14), показанного в двух предшествующих фигурах, в вышеупомянутый вектор pIDT-SMART. На Фиг. 35-1 и Фиг. 35-2 (1) показывает район SV-40 ori, (2) показывает район промотора CMV-i, (3) показывает район RU5', (4) показывает район BiP IRES, (5) показывает район Myc IRES region, (6) показывает район энхансера hTERT и (7) показывает район энхансера SV40.
(2) Чужеродные гены (инсерционные гены)
6His-S100A11-HA
6His-S100A11-HA получали при помощи ПЦР с использованием кДНК фибробласта здорового человека в качестве матрицы, праймера с 6-His-линкером, добавленным к 5'-стороне, и праймера с HA-линкером, добавленным на 3'-стороне.
GFP (зеленый флуоресцентный белок)
GFP получали при помощи ПЦР с использованием pEGFP-N2 (GFP-экспрессирующего вектора (продукта Clontech)) в качестве матрицы и праймеров, сконструированных на основе этой матрицы.
REIC/Dkk-3 (полноразмерный)
REIC/Dkk-3 получали при помощи ПЦР с использованием кДНК фибробласта здорового человека в качестве матрицы и праймеров, сконструированных на основе этой матрицы.
N78-REIC-6His
N78‐REIC-6His получали при помощи ПЦР с использованием праймеров, сконструированных таким образом, что 6His добавлялся к 3'-стороне полученного, как описано выше, полноразмерного гена REIC/Dkk-3.
Контрольный ген (IRES)
Термин “контрольный ген IRES”, используемый здесь, относится к гену, полученному связыванием известных нуклеотидных последовательностей двух ДНК здорового человека, гена BiP-IRES и гена Myc-IRES, в таком порядке. Этот ген синтезировали искусственно. Этот ген инсертировали в часть инсерционного гена (чужеродного гена) конструкта № 14, с получением посредством этого контрольного гена для гена REIC/Dkk-3 (полноразмерного) и N78-REIC-6His-кодирующей ДНК на Фиг. 5 и Фиг. 6, описанной позднее.
CD133-6His
CD133-6His получали при помощи ПЦР с использованием кДНК фибробласта здорового человека в качестве матрицы и праймеров, сконструированных на основе этой матрицы.
LGR5-HA
LGR5-HA получали при помощи ПЦР с использованием кДНК фибробласта здорового человека в качестве матрицы и праймеров, сконструированных на основе этой матрицы.
Теломераза-6His
Теломеразу-6His получали при помощи ПЦР с использованием кДНК фибробласта здорового человека в качестве матрицы и праймеров, сконструированных на основе этой матрицы.
KLF16
KLF16 получали при помощи ПЦР с использованием кДНК фибробласта здорового человека в качестве матрицы и праймеров, сконструированных на основе этой матрицы.
(3) Трансфекция и Вестерн-блот-анализ (WB-способ)
Различные клетки (культивируемые в 6-луночных чашках до 70-80% конфлюэнтности) трансфицировали различными генами с использованием реагентов трансфекции, FuGENE (товарный знак)-HD (Roche)), Липофектамина (товарный знак) 2000 (Invitrogen) и Транс-IT-Кератиноцита (TAKARA Bio). Для этого проводили процедуры, описанные в руководствах для этих продуктов.
Вестерн-блот-анализ экспрессированных таким образом чужеродных генов (инсерционных генов) проводили с использованием следующих способов.
Клетки промывали дважды с использованием ЗФР (забуференного фосфатом солевого раствора) и затем лизировали лизирующим буфером (50 мМ HEPES, pH 7,4, 250 мМ NaCl, 1 мМ ЭДТА, 1% NP-40, 1 мМ DTT, 1 мМ PMSF, 5 мкг/мл лейпептин, 5 мкг/мл апротинин, 2 мМ Na3VO4, 1 мМ NaF, 10 мМ β-GP), для проведения экстракции белка. После центрифугирования, количества белка в супернатантах, для применения для каждого эксперимента, доводили до одной и той же концентрации, разводили одним и тем же количеством буфера для проб 2 х SDS и затем подвергали 5-минутной тепловой обработке при 95°C. Каждую пробу (10 мкг белка) разделяли при помощи 7,5% или градиентного геля для электрофореза в ДСН-ПААГ (Bio Rad) и затем переносили на поливинилидендифторидную (PVDF) мембрану. Этот блот подвергали 1-часовому блокированию при комнатной температуре с использованием TBS (забуференного Трисом солевого раствора), содержащего 10% обезжиренное сухое молоко, 6% глицин и 0,1% Твин-20. Затем, эти белки идентифицировали с использованием следующих первичных антител (разведение 1:1000).
Анти-HA-антитело (Cell Signaling Technology)
Анти-GFP-антитело (Clontech)
Анти-REIC-антитело (кроличье поликлональное антитело против REIC/Dkk-3 человека)
Анти-6His-антитело (MBL)
Анти-KLF16-антитело (Abcam)
Каждый из полученных продуктов промывали 0,1% Tween-20-содержащим TBS (T-TBS), блот заставляли взаимодействовать с конъюгированным с пероксидазой хрена вторичным антителом. После достаточного промывания Т-TBS проводили детектирование способом детектирования усиленной хемилюминесценции (набор ECL, Amersham Pharmacia Biotech).
Клетки культивировали с использованием следующего способа.
Линии клеток HEK293 (полученные из почки здорового человека), MCF7 (полученные из рака молочной железы человека), PC3 (полученные из рака предстательной железы человека), HeLa (полученные из рака матки человека), HepG2 (полученные из рака печени человека) получали из ATCC (Американской Коллекции Типовых Культур (Rockville, MD)). Используемые здесь среды являются следующими.
HEK293: DMEM среда с высоким содержанием глюкозы (Invitrogen)
MCF7: DMEM среда с высоким содержанием глюкозы (Invitrogen)
PC3: среда F12 (Invitrogen)
HeLa: DMEM среда с высоким содержанием глюкозы (Invitrogen)
HepG2: DMEM среда с высоким содержанием глюкозы (Invitrogen)
Каждую из вышеуказанных клеточных линий выращивали в вышеуказанной среде, дополненной 10% (о/о) фетальной телячьей сывороткой, пенициллином (100 ИЕ/мл) и стрептомицином (100 мкг/мл), и затем инкубировали в условиях 5% CO2.
Фиг. 1-6 показывают эти результаты.
Фиг. 1 показывает экспрессию различных чужеродных генов, которые трансфицировали в клеточную линию HEK293 в течение 36 часов с использованием FuGENE (товарный знак)-HD. Способность экспрессии белка конструкта № 1 была эквивалентна способности экспрессии белка обычно используемой (продаваемой) экспрессирующей плазмиды, содержащей промотор CMV-i. Конкретно, можно сказать, что способность экспрессии белка конструкта № 1 была значимо более сильной, чем способность экспрессии белка таких экспрессирующих плазмид. Сходные результаты получали также для следующих генов. Можно сказать, что конструкт № 2 превосходил системы экспрессии генов, которые в настоящее время широко используются, в отношении экспрессии всех типов генов.
S100A11: возможное участие в росте рака; цитоплазматический-ядерный импортный белок
GFP: флуоресцентный белок; цитоплазматический белок
REIC/Dkk-3 (полноразмерный): белок-супрессор рака; секреторный белок
N78-REIC: фрагмент белка, полученного на основе вышеуказанного фрагмента гена (пептидный фрагмент, состоящий из аминокислот 1-78 аминокислотной последовательности белка REIC/Dkk-3, показанного в SEQ ID NO: 2)
CD133: маркер стволовых клеток рака; экспрессируемый на клеточной поверхности
LGR5: маркер стволовых клеток для нормальных клеток и раковых клеток; трансмембранный белок
Теломераза: участие в старении или анти-старении клеток; цитоплазматический белок
KLF16: участие в транскрипции белков; ядерный белок
Фиг. 2 показывает экспрессию гена KLF после 36 часов трансфекции различных клеточных линий с использованием FuGENE (товарный знак)-HD. Можно сказать, что во всех клетках (клетках HEK293, клетках MCF7, клетках PC3, клетках HeLa и клетках HepG2), показанных на Фиг. 2, способность экспрессии белка конструкта № 2 (экспрессии гена KLF16) была значимо более сильной, чем способность экспрессии белка конструкта № 1. Конкретно, можно сказать, что конструкт № 2 превосходит системы экспрессии генов, которые в настоящее время широко используются, в отношении экспрессии генов во всех типах клеток.
Фиг. 3 показывает экспрессию гена KLF, трансфицированного в клеточную линию HEK293 в течение 36 часов с использованием различных реагентов трансфекции. С применением любого реагента трансфекции, в случае конструкта № 2, белок KLF16 экспрессировался при самом высоком уровне при использовании WB-способа. Конструкт № 1 является конструктом, содержащим промотор CMV-i, который является обычно доступным и часто используемым. Конструкт № 13 является конструктом, сходным образом содержащим промотор CAG, который является обычно доступным и часто используемым. Конкретно, применение конструкта № 2 данного изобретения реализовало уровень экспрессии белка, значимо более высокий (значимо улучшенную эффективность во всех процессах экспрессии гена), чем уровень экспрессии белка, полученный с применением плазмидных конструктов, которые в настоящее время являются широко распространенными во всем мире, для экспрессии генов.
Фиг. 4 показывает экспрессию после 36 часов трансфекции клеточной линии HEK293 полноразмерным геном REIC и N78-REIC-кодирующим геном FuGENE (товарный знак)-HD. Левая панель показывает, что белок REIC/Dkk-3 (полноразмерный) экспрессировался до значимо более высокой степени в случае конструкта № 14, чем в случае конструкта № 2, как показано с использованием WB-способа. Конкретно, на основании результатов для WB-способа на Фиг. 1 (конструкт № 2 обнаруживал наивысший уровень экспрессии белка среди конструктов № 1-12) и результатов для WB-способа на Фиг. 3 (конструкт № 2 обнаруживал наивысший уровень экспрессии белка среди конструктов № 1, № 2, № 11, № 12 и № 13), среди плазмидных конструктов, испытанных здесь, применимым конструктом, способным проявлять наивысший уровень экспрессии белка, был конструкт № 14. Способность экспрессии белка конструкта № 14 была сильной и эквивалентной способности экспрессии белка, возможной с введением Ad-REIC (кодирующего полноразмерный ген REIC/Dkk-3 аденовируса) при 100 MOI (множественности заражения). Правая панель показывает, что результаты, сходные с результатами в левой панели, получали при инсертировании фрагмента гена, N78-REIC-6His, в конструкт № 14. Конкретно, применимым конструктом, способным проявлять наивысший уровень экспрессии белка среди плазмидных конструктов, представленных здесь, был конструкт № 14.
Фиг. 5 показывает супрессированную пролиферацию и индукцию смерти клеток в клеточной линии РС3 рака предстательной железы человека конструктом № 14, в который была инсертирована N78-REIC-кодирующая ДНК.
Анализ выживания клеток
Линию клеток PC3 высевали в полную среду при плотности 50000 клеток на лунку 6-луночных чашек. После 24 часов инкубирования клетки трансфицировали предварительно заданной плазмидой в полной среде с использованием реагента FuGENE (товарный знак)-HD и затем инкубировали в течение заданного количества дней. После инкубирования, степень выживания клеток измеряли с использованием CellTiter 96 (зарегистрированный товарный знак) Aqueous One Solution Cell Proliferation Assay (Promega).
Статистический анализ
U-тест Манна-Уитни проводили между двумя группами. Было определено, что значимое различие присутствует при результате р<0,05.
Как показано на Фиг. 5, пролиферация клеточной линии РС3 была значимо супрессирована в дни 2 и 5 после введения конструкта № 14, в который была инсертирована N78-REIC-кодирующая ДНК, в сравнении с группой, в которую был введен конструкт № 14, содержащий инсертированный в него контрольный ген (IRES) (можно сказать, что значимо были индуцированы многочисленные случаи смерти клеток, так как количество клеток PC3 уменьшалось вследствие введения N78-REIC-кодирующего ДНК-конструкта № 14.
Фиг. 6 показывает супрессированную пролиферацию клеточной линии РС3 рака предстательной железы человека конструктом № 14, в который был инсертирован полноразмерный ген REIC.
Анализ выживания клеток
Линию клеток PC3 высевали в полную среду при плотности 50000 клеток на лунку 6-луночных чашек. После 24 часов инкубирования клетки трансфицировали предварительно заданными плазмидами в сбалансированных солевых растворах Хенка с использованием реагента FuGENE (товарный знак)-HD и затем инкубировали в течение заданного количества дней. После инкубирования, степень выживания клеток измеряли с использованием CellTiter 96 (зарегистрированный товарный знак) Aqueous One Solution Cell Proliferation Assay (Promega).
Статистический анализ
U-тест Манна-Уитни проводили между двумя группами. Было определено, что значимое различие присутствует при результате р<0,05.
Как показано на Фиг. 6, в день 2 после введения конструкта № 14, в который был инсертирован полноразмерный ген REIC, пролиферация клеток РС3 была значимо супрессирована в сравнении с группой, которой был введен конструкт № 14, содержащий инсертированный в него контрольный ген (IRES).
Пример 2 Экспрессионная кассета, содержащая промотор SV40 или промотор hTERT
Готовили экспрессионные кассеты данного изобретения, содержащие GFP (Зеленый флуоресцентный белок) в качестве гена-мишени (инсерционного гена). Клетки HeLa трансфицировали этими экспрессионными кассетами и затем наблюдали экспрессию GFP для анализа интенсивности экспрессии. Трансфекцию проводили с использованием Липофектамина 2000. Спустя 48 часов экспрессию GFP наблюдали под флуоресцентным микроскопом.
Конструктами экспрессионных кассет, используемых здесь, были: конструкт № 14 (Фиг. 20), используемый в Примере 1; конструкт № 15 (Фиг. 36), где промотор CMV-i конструкта № 14 был заменен промотором SV40; и конструкт № 16 (Фиг. 37), где промотор CMV-i конструкта № 14 был заменен промотором hTERT. Ген GFP получали при помощи ПЦР с использованием праймеров, сконструированных с применением GFP-экспрессирующего вектора (продукта Clontech) pEGFP-N2, в качестве матрицы. Ген GFP инсертировали в инсерционную часть гена-мишени каждого конструкта и затем использовали. Коммерческую плазмиду pEGFP-N1 экспрессии GFP (Clontech) использовали в качестве контроля.
Фиг. 38 показывает нуклеотидную структуру частичного фрагмента, содержащего район SV40 ori+UAS+SV40 enh+intron A+RU5' экспрессионного векторного конструкта № 15. Его нуклеотидная последовательность показана в SEQ ID NO: 19. Кроме того, Фиг. 39 показывает структуру частичного фрагмента, содержащего район экспрессионного векторного конструкта № 16. Его нуклеотидная последовательность показана в SEQ ID NO: 20. Кроме того, Фиг. 40 показывает нуклеотидную последовательность (SEQ ID NO: 21) GFP-кодирующей ДНК, с которой был лигирован сайт рестрикционного фермента. Части, окруженные рамками (1), (2), (3) и (4), показанные в нуклеотидной последовательности Фиг. 38, показывают SV40 ori, промотор SV40, интрон A и RU5', соответственно. Части, окруженные рамками (1), (2), (3) и (4), показанные в нуклеотидной последовательности Фиг. 39, показывают SV40 ori, промотор SV40, hTERT, интрон A и RU5', соответственно. Полноразмерная нуклеотидная последовательность экспрессионного векторного конструкта № 14, в который был инсертирован ген GFP, показана на Фиг. 41-1 и Фиг. 41-2 (продолжение Фиг. 41-1) (SEQ ID NO: 22). Кроме того, полноразмерная нуклеотидная последовательность экспрессионного векторного конструкта № 15, в который был инсертирован ген GFP, показана на Фиг. 42-1 и Фиг. 42-2 (продолжение Фиг. 42-1) (SEQ ID NO: 23). Кроме того, полноразмерная нуклеотидная последовательность экспрессионного векторного конструкта № 16, в который был инсертирован ген GFP, показана на Фиг. 43-1 и Фиг. 43-2 (продолжение Фиг. 43-1) (SEQ ID NO: 24). Части, окруженные рамками (1), (2), (3) и (4) в нуклеотидной последовательности на Фиг. 41-1 и Фиг. 41-2 показывают промотор CMV-i (P-CMViRU), ген GFP, Myc IRES и 3 энхансера (pA-3enh), соответственно. Части, окруженные рамками (1), (2), (3) и (4) в нуклеотидной последовательности на Фиг. 42, показывают промотор SV40 (P-SViRU), ген GFP, Myc IRES и 3 энхансера (pA-3enh), соответственно. Части, окруженные рамками (1), (2), (3) и (4) в нуклеотидной последовательности на Фиг. 43, показывают промотор hTERT (P-TiRU), ген GFP, Myc IRES и 3 энхансера (pA-3enh), соответственно.
Конструкт № 15 является плазмидным вектором, который является предпочтительным в сильной экспрессии гена в среде, где белок SV40 экспрессируется при высоком уровне. Конструкт № 16 является плазмидным вектором, который является предпочтительным в сильной экспрессии гена в среде, где белок hTERT экспрессируется при высоком уровне в раковых клетках или подобных клетках.
Фиг. 44 показывает эти результаты. Фиг. 44 A, B, C и D показывают результаты коммерческой GFP-экспрессирующей плазмиды (pEGFP-N1), GFP-экспрессирующего плазмидного конструкта № 14, GFP-экспрессирующего плазмидного конструкта № 15 и GFP-экспрессирующего плазмидного конструкта № 16, соответственно. Панели в верхнем ряду на Фиг. 44 показывают яркое поле микроскопа. Как показано на Фиг. 44, наблюдали, что промотор CMV, промотор SV40 и промотор hTERT, все, обнаруживают сильную экспрессию гена GFP в сравнении с коммерческой плазмидой. Этот пример демонстрирует, что эта система (скелет конструкта № 14) может быть использована для усиления экспрессии гена, даже в случае, когда промоторы варьируются таким образом.
Пример 3. Экспрессия эритропоэтина человека
Получали экспрессионную кассету данного изобретения, содержащую ген эритропоэтина человека в качестве чужеродного гена (инсерционного гена). Клетки HEK293 трансфицировали этой экспрессионной кассетой и затем экспрессированный таким образом белок анализировали при помощи Вестерн-блоттинга. Трансфекцию проводили с использованием FuGENE (товарный знак)-HD. Спустя 24 часа эритропоэтин человека в культуральном растворе клеток детектировали Вестерн-блоттингом.
Конструктом этой экспрессионной кассеты, используемой здесь, был конструкт № 14 (Фиг. 20), используемый в Примере 1, в который была инсертирована ДНК, кодирующая эритропоэтин человека в качестве гена-мишени (инсерционного гена). Фиг. 45 показывает нуклеотидную последовательность (SEQ ID NO: 25) ДНК, кодирующей эритропоэтин человека, с которой был лигирован сайт рестрикционного фермента. В качестве контролей, с использованием коммерческого pTracer (зарегистрированный товарный знак)-EF/V5-His-A (Invitrogen) и экспрессионных плазмид pEF6/Myc-His-A (Invitrogen), ДНК, кодирующую эритропоэтин человека, инсертировали в сайт рестрикционного фермента EcoR 1-Xba 1 каждой плазмиды.
Вестерн-блоттинг проводили с использованием анти-6His-антитела. При 24 часах после трансфекции, 1 мл культурального раствора подвергали трэппингу с 6His-аминокислотными остатками. Общее количество собранного таким образом белка использовали для Вестерн-блоттинга.
Фиг. 46 показывает эти результаты. Дорожка 1 показывает результаты экспрессии с использованием pTracer (зарегистрированный товарный знак)-EF/V5-His-A, дорожка 2 показывает результаты экспрессии с использованием pEF6/Myc-His-A и дорожка 3 показывает результаты экспрессии с использованием экспрессионного плазмидного конструкта № 14. Как показано на Фиг. 46, самую сильную экспрессию наблюдали с использованием экспрессионного плазмидного конструкта № 14. Этот результат демонстрирует, что эта система (скелет конструкта № 14) применима для получения белков, для применения в качестве фармацевтических продуктов, таких как эритропоэтин, диагностические агенты или реагенты, в связи с крупномасштабным производством на основе усиления экспрессии гена.
Пример 4. Экспрессия Ig человека
Получали экспрессионную кассету данного изобретения, содержащую гены легкой цепи IgG человека и тяжелой цепи IgG человека в качестве генов-мишеней (инсерционных генов). Клетки HEK293 трансфицировали этой экспрессионной кассетой и затем экспрессированный таким образом белок анализировали Вестерн-блоттингом. Трансфекцию проводили с использованием FuGENE (товарный знак)-HD. После 24 часов, легкую цепь IgG человека и тяжелую цепь IgG человека в экстракте клеток и культуральном растворе клеток детектировали Вестерн-блоттингом.
Конструктом экспрессионной кассеты, используемым здесь, был конструкт № 14 (Фиг. 20), используемый в Примере 1, в который была инсертирована ДНК, кодирующая легкую цепь IgG человека или тяжелую цепь IgG человека, в качестве гена-мишени (инсерционного гена). Фиг. 47 показывает нуклеотидную последовательность (SEQ ID NO: 26 или SEQ ID NO: 27) ДНК, кодирующей легкую цепь IgG человека (Фиг. 47А) или тяжелую цепь IgG человека (Фиг. 47B), с которой был лигирован сайт рестрикционного фермента. В качестве контроля, с использованием коммерческих pTracer (зарегистрированный товарный знак)-EF/V5-His-A (Invitrogen) и pEF6/Myc-His-A (Invitrogen) экспрессированных плазмид эту ДНК, кодирующую легкую цепь IgG человека или тяжелую цепь IgG человека, инсертировали в сайт рестрикционных ферментов EcoR 1-Xba 1 каждой плазмиды.
Вестерн-блоттинг проводили с использованием анти-6His-антитела (MBL). При 24 часах после трансфекции, клеточный экстракт (количество общего белка: 10 мкг) и 1 мл культурального раствора подвергали трэппингу с 6His-аминокислотными остатками. Использовали общее количество собранного таким образом белка.
Фиг. 48 показывает эти результаты. Фиг. 48А показывает результат для легкой цепи IgG человека и Фиг. 48B показывает результат для тяжелой цепи IgG человека. Как на Фиг. 48А, так и на Фиг. 48, дорожка 1 показывает результат экспрессии с использованием pTracer (зарегистрированный товарный знак)-EF/V5-His-A, дорожка 2 показывает результат экспрессии с использованием pEF6/Myc-His-A и дорожка 3 показывает результат экспрессии с использованием конструкта № 14. Фиг. 48 показывает также результаты внутриклеточной экспрессии с использованием клеточного экстракта и результаты экспрессии с использованием культурального раствора. Как показано на Фиг. 48, самую сильную экспрессию наблюдали в случае использования конструкта № 14. Эти результаты демонстрируют, что эта система (скелет конструкта № 14) применима для получения белков, которые могут быть использованы для фармацевтических продуктов, таких как антитела, диагностические агенты или реагенты в связи с крупномасштабным производством на основе усиления экспрессии гена.
Пример 5. Экспрессия белка REIC с использованием экспрессирующего вектора, сконструированного модификацией коммерческого плазмидного вектора
Получали экспрессионную кассету данного изобретения, содержащую ген REIC человека в качестве чужеродного гена (инсерционного гена). Клетки HEK293 трансфицировали этой экспрессионной кассетой и затем экспрессированный таким образом белок анализировали при помощи Вестерн-блоттинга. Трансфекцию проводили с использованием FuGENE (товарный знак)-HD. Спустя 24 часа белок REIC в клеточном экстракте детектировали Вестерн-блоттингом.
Конструкт этой экспрессионной кассеты, используемый здесь, был конструктом № 17 (Фиг. 49). Конструкт № 17 конструировали инсертированием REIC-кодирующей ДНК в сайт инсерции Xba 1-Kpn 1 коммерческого плазмидного вектора pShuttle (Clontech) и затем инсертированием 3 энхансеров (энхансера hTERT, энхансера SV40 и энхансера CMV), локализованных ниже по ходу транскрипции (справа) от экспрессирующего гена экспрессионного плазмидного конструкта № 14 (Фиг. 20), используемого в Примере 1, в сайт инсерции Kpn 1-EcoR 1 ниже по ходу транскрипции (справа) от REIC-кодирующей ДНК в форме BGH poly A + 3 энхансера. В качестве контроля, использовали вектор, сконструированный инсертированием REIC-кодирующей ДНК в сайт инсерции Xba 1-Kpn 1 коммерческого плазмидного вектора pShuttle (Clontech). Фиг. 50 показывает полную нуклеотидную последовательность (SEQ ID NO: 28) экспрессионного векторного конструкта № 17, в который была инсертирована REIC-кодирующая ДНК. Части, окруженные рамками (1) и (2) в нуклеотидной последовательности на Фиг. 50, показывают REIC-кодирующую ДНК и 3 энхансера (3xenh), соответственно.
Вестерн-блоттинг проводили с использованием анти-REIC-антитела и клеточного экстракта (количество общего белка: 10 мкг), полученного при 24 часах после трансфекции.
Фиг. 51 показывает эти результаты. Дорожка 1 показывает результат клеточного экстракта клеток, не заставляемых экспрессировать какой-либо чужеродный белок, дорожка 2 показывает результат клеточного экстракта клеток, трансфицированных коммерческим вектором pShuttle, в который была инсертирована REIC-кодирующая ДНК, дорожка 3 показывает результат клеточного экстракта клеток, трансфицированных экспрессирующим вектором, который был сконструирован инсертированием REIC-кодирующей ДНК в коммерческий вектор pShuttle и затем инсертированием 3 энхансеров в сайт ниже по ходу транскрипции (справа) от REIC-кодирующей ДНК (ниже по ходу транскрипции от BGH poly A). Как показано на Фиг. 51, самую сильную экспрессию наблюдали в случае применения конструкта № 17. Эти результаты демонстрируют, что включение части из 3 энхансеров этой системы (скелета конструкта № 14) в сайт ниже по ходу транскрипции (справа) от экспрессионной кассеты генов коммерческой плазмиды, такой как вектор pShuttle, позволяет усиливать экспрессию гена. Конкретно, эти результаты демонстрируют, что экспрессия гена-мишени может быть усилена инсертированием района из 3 энхансеров в различные генные конструкты.
Пример 6. Экспрессия гена c-myc с применением экспрессирующего вектора, сконструированного модификацией коммерческого плазмидного вектора
Получали экспрессионную кассету данного изобретения, содержащую ген c-myc человека в качестве чужеродного гена (инсерционного гена). Клетки HEK293 трансфицировали этой экспрессионной кассетой. Экспрессированный таким образом белок анализировали при помощи Вестерн-блоттинга. Трансфекцию проводили с использованием FuGENE (товарный знак)-HD. Спустя 24 часа белок c-myc в клеточном экстракте детектировали Вестерн-блоттингом.
Конструкт этой экспрессионной кассеты, используемый здесь, был сконструирован инсертированием c-myc-кодирующей ДНК в сайт инсерции Xba 1-Kpn 1 коммерческого плазмидного вектора pShuttle (Clontech) и затем инсертированием 3 энхансеров (энхансера hTERT, энхансера SV40 и энхансера CMV), локализованных ниже по ходу транскрипции (справа) от экспрессирующего гена экспрессионного плазмидного конструкта № 14 (Фиг. 20), используемого в Примере 1, в сайт инсерции Kpn 1-EcoR 1 ниже по ходу транскрипции (справа) от c-myc-кодирующей ДНК в форме BGH poly A + 3 энхансера. В качестве контроля, использовали вектор, сконструированный инсертированием c-myc-кодирующей ДНК в сайт инсерции Xba 1-Kpn 1 коммерческого плазмидного вектора pShuttle (Clontech). Фиг. 52 показывает нуклеотидную последовательность (SEQ ID NO: 29) инсертированного гена c-myc. Фиг. 53 показывает нуклеотидную последовательность (SEQ ID NO: 30) района, содержащего BGH poly A и 3 энхансера, содержащихся в конструкте № 14.
Вестерн-блоттинг проводили с использованием анти-c-myc-антитела (Santa Cruz Biotechnology, Inc., Cat No.: sc-70469) и клеточного экстракта (количество общего белка: 10 мкг), полученного при 24 часах после трансфекции.
Фиг. 54 показывает эти результаты. Дорожка 1 показывает результат клеточного экстракта клеток, трансфицированных коммерческим вектором c-myc, в который была инсертирована c-myc-кодирующая ДНК, дорожка 2 показывает результат клеточного экстракта клеток, трансфицированных экспрессирующим вектором, сконструированным инсертированием c-myc-кодирующей ДНК в коммерческий вектор pShuttle и затем инсертированием 3 энхансеров в сайт ниже по ходу транскрипции (справа) (ниже по ходу транскрипции от BGH poly A) от c-myc-кодирующей ДНК. Как показано на Фиг. 54, самую сильную экспрессию наблюдали, когда использовали экспрессирующий вектор, сконструированный инсертированием c-myc-кодирующей ДНК в коммерческий вектор pShuttle и затем инсертированием 3 энхансеров в сайт ниже по ходу транскрипции (справа) от c-myc-кодирующей ДНК (ниже по ходу транскрипции (справа) от BGH poly A). Этот результат демонстрирует, что экспрессия гена может быть усилена включением части из 3 энхансеров этой системы (скелета конструкта № 14) в сайт ниже по ходу транскрипции (справа) от экспрессионной кассеты генов коммерческой плазмиды, такой как вектор pShuttle. Конкретно, этот результат демонстрирует, что инсертирование этого района из 3 энхансеров в различные генные конструкты может усиливать экспрессию гена-мишени. Результат этого примера демонстрирует, что экспрессия гена c-myc усиливается включением части из 3 энхансеров этой системы (скелета конструкта № 14) в сайт ниже по ходу транскрипции (справа) от экспрессионной кассеты генов плазмиды для экспрессии гена c-myc, который может быть использован для получения клеток iPS. Считается, что клетки iPS являются применимыми для различных типов регенерационной медицины. Конкретно, этот результат демонстрирует, что энхансерная часть применима для регенерационной медицины и т. п. в качестве средства для возможности более сильной экспрессии, а именно, экспрессии перепрограммируемых генов, таких как c-myc, или средства для использования экспрессированного таким образом самого белка в качестве фактора регенерации in vivo или in ex vivo.
Пример 7. Усиленная экспрессия после применения hTERT в качестве промотора
Получали экспрессионные кассеты данного изобретения, содержащие (Зеленый флуоресцентный белок) в качестве чужеродного гена (инсерционного гена). Клетки HEK293 трансфицировали этими экспрессионными кассетами и экспрессированный таким образом белок анализировали при помощи Вестерн-блоттинга. Трансфекцию проводили с использованием FuGENE (товарный знак)-HD. Спустя 24 часа GFP в культуральных растворах клеток детектировали Вестерн-блоттингом.
Конструктами экспрессионных кассет, используемых здесь, были: конструкт № 2 (Фиг. 8), используемый в Примере 1, и конструкты № 18, 19, 20 и 21. Конструкты № 18, 19, 20 и 21 показаны на Фиг. 55, Фиг. 56, Фиг. 57 и Fig. 58, соответственно. Конструкт № 18 является экспрессирующим вектором основного гена, содержащим промотор hTERT. Такой экспрессирующий вектор гена является предпочтительным в сильной экспрессии гена в среде, в которой hTERT экспрессируется при высоком уровне; т.е., в раковых клетках, и используется, когда ожидается экспрессия специфического для раковых клеток гена. Однако, применение этого вектора (конструкта № 18) приводит к чрезвычайно слабой экспрессии гена и это препятствует клиническому применению этого вектора для генной терапии, продуцированию белка (лекарственного средства) в специфических клетках и т.п. Конструкт № 19 является плазмидой, сконструированной инсертированием последовательности RU5 в сайт выше по ходу транскрипции (слева) от экспрессирующего вектора основного гена (конструкта № 18), содержащего промотор hTERT. Конструкт № 20 является плазмидой, сконструированной инсертированием последовательности энхансера hTERT в сайт ниже по ходу транскрипции (справа) от последовательности BGH poly A экспрессирующего вектора основного гена (конструкта № 18), содержащего промотор hTERT. Конструкт № 21 является плазмидой, сконструированной инсертированием последовательности RU5' в сайт выше по ходу транскрипции (слева) от экспрессирующего вектора основного гена (конструкта № 18), содержащего промотор hTERT, и дополнительно инсертированием последовательности энхансера hTERT в сайт ниже по ходу транскрипции (справа) от последовательности BGH poly A. Фиг. 59-1 и Фиг. 59-2 (продолжение Фиг. 59-1) показывают полную нуклеотидную последовательность (SEQ ID NO: 31) экспрессионного векторного конструкта № 21. Части, окруженные рамками (1), (2), (3), (4) и (5) в нуклеотидной последовательности, показанной на Фиг. 59-1 и Фиг. 59-2, показывают коровый промотор hTERT, минимальный промотор CMV, RU5', ген GFP, BGH poly A и коровый промотор hTERT, соответственно.
Фиг. 60 показывает эти результаты экспрессии. Дорожка 1 показывает результаты для клеточного экстракта клеток, не заставляемых экспрессировать какой-либо чужеродный белок, и дорожки 2 - 6 показывают результаты экспрессии с использованием конструктов № 2, № 18, № 19, № 20 и №. 21, по отдельности. Как показано на Фиг. 60, наблюдали экспрессию снижающегося порядка силы в конструктах № 18, № 19, № 20, № 21 и № 2. Результаты этого примера демонстрируют, что эта система (форма конструктов, в которых ген-мишень экспрессии фланкирован промотором и энхансером) применима для значимого усиления генной экспрессии промотора hTERT, которое делает возможной экспрессию специфического для рака гена, но имеет чрезвычайно слабую способность экспрессии гена.
Пример 8. Экспрессия после одновременной трансфекции множества экспрессирующих векторов, имеющих различные чужеродные гены, включенные в них
Клетки трансфицировали одновременно плазмидой, сконструированной включением ДНК, кодирующей DsRed (красный флуоресцентный белок), в конструкт № 2 (Фиг. 20), плазмидой, сконструированной включением ДНК, кодирующей GST дрожжей (глутатион S-трансферазу), в конструкт № 21 (Фиг. 58) и плазмидой, сконструированной включением ДНК, кодирующей GFP, в конструкт № 21 (Фиг. 58). Экспрессированные таким образом белки анализировали Вестерн-блоттингом. Трансфекцию проводили с использованием FuGENE (товарный знак)-HD. В качестве клеток использовали клетки раковых клеточных линий, клетки HEK293, клетки Hela, клетки PC3, клетки HepG2, клетки HCT116 и клетки MCF7. Кроме того, в качестве клеток линии здоровых клеток использовали клетки OUMS-24 (полученные из человека фибробласты) и клетки NHK (полученные из человека кератиноциты). При 48 часах после трансфекции, каждый белок в клеточных экстрактах детектировали Вестерн-блоттингом. Для DsRed-кодирующей ДНК и GST дрожжей-кодирующей ДНК, получали кДНК искусственным синтезом на основе известных последовательностей кДНК.
Вестерн-блоттинг проводили с использованием анти-GFP-антитела, анти-6His-антитела (MBL, используемого для детектирования 6His-дополненной теломеразы), анти-тубулин-антитела (Sigma), анти-DsRed-антитела (Clontech) и анти-GST дрожжей-антитела и клеточные экстракты получали при 24 часах после трансфекции (количество общего белка: 10 мкг).
Фиг. 61 показывает эти результаты. Как показано на Фиг. 61, плазмидный конструкт (конструкт № 21), содержащий промотор hTERT, применим для проведения экспрессии генов, специфических только для раковых клеток в различных раковых клетках и здоровых клетках. Конкретно, в этом случае, гены экспрессировались сильно только в раковых клетках, а экспрессия генов в нормальных клетках может быть супрессирована. В этом отношении, например, экспрессия генов наблюдается как в раковых клетках, так и в здоровых клетках человека в случае плазмидного конструкта (конструкта № 2), содержащего промотор CMV, так что не может быть достигнута специфическая для раковых клеток экспрессия генов. Как описано выше, плазмида, содержащая промотор hTERT, полезна в том смысле, что может быть достигнута специфическая для раковых клеток экспрессия генов.
Пример 9. Исследование продуцируемого количества эритропоэтина человека (Human EPO) клетками HEK293 (клетками почки эмбриона человека), трансфицированными экспрессирующим вектором, содержащим генную экспрессионную кассету данного изобретения
Для секреторной экспрессии эритропоэтина человека, ДНК-фрагмент EPO-His tag, имеющий His-меченый С-конец, включали в вектор (называемый SGE (вектор суперэкспрессии гена)), содержащий конструкт № 14, то же самое включали в вектор pTracer (зарегистрированный товарный знак)-EF (промотор EF-1α, Invitrogen) в качестве контроля.
В качестве клеток-хозяев для секреторной экспрессии эритропоэтина человека, 30 мл полученных из почки человека клеток-хозяев (клеток FreeStyle 293-F (Invitrogen)) в логарифмической фазе роста высевали при концентрации 5-6x105 клеток на мл в колбу на 125 мл. Эти клетки культивировали со встряхиванием (125 об/мин) в течение ночи при 37°C в присутствии 8% CO2 с использованием среды Freestyle 293 Expression 1 (Invitrogen). На следующий день, концентрацию клеток доводили до 1x106 клеток на мл. В колбе на 125 мл, в которую были посеяны 30 мл клеток 293-F, 30 мкг каждой из плазмидной ДНК SGE-EPO-His-tag и плазмидной ДНК pTracer (зарегистрированный товарный знак)-EF-EPO-His-tag смешивали с реагентом трансфекции: 293 Fectin (Invitrogen) и затем проводили трансфекцию. Во время 4 дней после трансфекции эти клетки культивировали при встряхивании при 37°C в присутствии 8% CO2, и затем собирали культуральный супернатант. 18 мкл этого культурального супернатанта разделяли электрофорезом на ДСН-ПААГ и затем детектировали белок EPO гликозилированного типа с молекулярной массой приблизительно 35 кДа окрашиванием с использованием CBB (Фиг. 62).
Для оценивания продуцируемого количества ЕРО, белок эритропоэтина человека, секретированный в 25 мл культурального супернатанта, собранный спустя 4 часа после этого, очищали с использованием гистидин-аффинной колоночной хроматографии (TALON-Affinity Resin (Clontech)). Элюат разделяли электрофорезом на ДСН-ПААГ и затем эту чистоту подтверждали окрашиванием СВВ (Фиг. 63). Количество белка этого очищенного белка ЕРО определяли анализом Бредфорда и затем количество белка, полученное в случае 1 л культурального раствора, рассчитывали из количества очищенного белка в случае 25 мл культурального раствора (Фиг. 64А и В). В результате, эритропоэтин человека мог продуцироваться с использованием вектора SGE при уровне экспрессии, приблизительно в 8 раз более высоком, чем уровень экспрессии в случае использования вектора pTracer (зарегистрированный товарный знак)-EF. Таким образом, был достигнут чрезвычайно высокий эффективный уровень экспрессии; т.е. приблизительно 150 мг (относительно уровня в случае 1 л культурального раствора).
Пример 10. Исследование продуцируемого количества белка REIC человека (Уменьшенная Экспрессия в Иммортализованных Клетках) клетками HEK293 (клетками почки эмбриона человека), трансфицированными экспрессирующим вектором, содержащим генную экспрессионную кассету данного изобретения
Согласно способу, описанному в Примере 1, клетки 293-F доводили до 1x106 клеток на мл и затем 180 мл этого раствора высевали в каждую из трех колб на 500 мл. Каждую колбу подвергали транзиторной трансфекции REIC-экспрессирующим вектором SGE (вектором, содержащим конструкт № 14) (180 мкг) с использованием реагента трансфекции: 293 Fectin (Invitrogen). Во время 4 дней после трансфекции эти клетки культивировали при встряхивании при 37°C в присутствии 8% CO2, и затем собирали культуральный супернатант. Каждый культуральный супернатант (18 мкл) разделяли электрофорезом на ДСН-ПААГ и затем гликозилированный белок REIC с молекулярной массой приблизительно 55 кДа детектировали окрашиванием с использованием CBB (Фиг. 65).
Собранные культуральные супернатанты, каждый, концентрировали ультрафильтрацией с 520 мл до 35 мл. Растворитель заменяли 20 мМ Hepes-буфером (pH 7,2) с использованием колоночной хроматографии на Sephadex (товарный знак) G25M (GE Healthcare) и затем собирали REIC-белок-содержащую фракцию. После этого, проводили адсорбцию белка с использованием анионообменной хроматографии (DEAE-Toyopearl (зарегистрированный товарный знак) 650 M, TOSOH Corporation), и затем проводили элюцию в 20 мМ Hepes-буфере (pH 7,2) с линейным градиентом концентраций (0 M - 0,7 M) хлорида натрия. При условиях концентрации хлорида натрия приблизительно 0,35 M, подтверждали фракции пиков белка REIC. Фракцию каждого пика анализировали электрофорезом на ДСН-ПААГ и, следовательно, собирали фракции, состоящие только из белка REIC с высокой чистотой (Фиг. 66). Количество белка очищенного REIC-белка рассчитывали с использованием оптической плотности (280 нм) и количества очищенного белка в случае 520 мл культурального раствора, так что было рассчитано количество белка, полученного в случае 1 л (Фиг. 67). В результате, приблизительно 50 мг очищенного белка с высокой чистотой могло быть получено из культурального супернатанта, подвергнутого трансфекции REIC-экспрессирующим вектором SGE. Конкретно, было показано, что этот очищенный белок мог быть действительно собран в таком большом количестве, как приблизительно 100 мг в расчете на 1 л культурального раствора.
Промышленная применимость
Генная экспрессионная кассета данного изобретения содержит ДНК-конструкт, содержащий ген, который должен быть экспрессирован, и последовательность добавления поли А, которые локализованы ниже по ходу транскрипции (справа) от 1-го промотора, где энхансер или 2-й промотор лигирован ниже по ходу транскрипции (справа) от этого ДНК-конструкта. Эта генная экспрессионная кассета реализует крупномасштабное производство белка-мишени посредством сверхвысокой экспрессии, независимо от типа клетки, типа гена и типа реагента трансфекции. Эта генная экспрессионная кассета может быть применима в качестве реагента в области биотехнологии и может также применяться экстенсивно в качестве терапевтического белкового лекарственного средства или для клинического лечения, обследования и диагностики с использованием генов. Например, эта генная экспрессионная кассета может способствовать революционным способам в области биотехнологии, таким как: (1) функциональный анализ неизвестных генов в конкретных клетках или тканях, которые обычно оставались не анализируемыми; (2) улучшение терапевтических эффектов посредством загрузки как вирусных, так и невирусных векторов генной экспрессионной кассетой в генной терапии; (3) получение суперклеток, способных продуцировать большие количества специфического функционального белка человека с использованием клеток человека, в качестве способа получения биофармацевтических продуктов, таких как содержащие антитела лекарственные средства, используемые в недавние годы; и (4) применение для эффективного и недорогого способа получения реагентов или диагностических агентов для применения для различных форм анализа или клинической диагностики.
Экспрессионная кассета ДНК данного изобретения может применяться в качестве реагента в области биотехнологии и может также экстенсивно применяться для клинического лечения, обследования и диагностики с использованием генов.