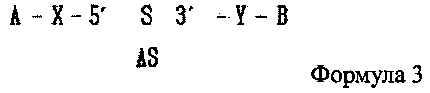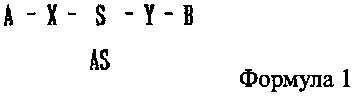Результат интеллектуальной деятельности: ВЫСОКОЭФФЕКТИВНАЯ ДВУХСПИРАЛЬНАЯ ОЛИГО-РНК КОНСТРУКЦИЯ ТИПА НАНОЧАСТИЦЫ И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к синтезированной химически высокоэффективной двухцепочечной олиго-РНК конструкции, которая успешно используется для лечения рака, инфекционных заболеваний и т.п.
Чтобы эффективно доставляться в клетку, двухцепочечная олиго-РНК конструкция может иметь структуру, в которой гидрофильные вещества и гидрофобные вещества конъюгированы к обоим концам двухцепочечной РНК простой ковалентной связью или опосредованной ковалентной связью через линкер; и в водном растворе из них могут образовываться наночастицы за счет гидрофобного взаимодействия двухцепочечных олиго-РНК конструкций.
Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей двухцепочечную олиго-РНК конструкцию, способу изготовления конструкции, и технологии доставки двухцепочечной олиго-РНК, где используется двухцепочечная олиго-РНК конструкция.
Уровень техники
С тех пор как была установлена роль РНК-интерференции (ниже называемая ′РНКи′), было обнаружено, что в целом ряде клеток млекопитающих РНК-интерференция специфичным к последовательности образом оказывает воздействие на мРНК (Silence of the transcripts: RNA interference in medicine. J. Mol. Med., 2005, 83: 764-773).
Когда двухцепочечная РНК с большой длиной цепи доставляется в клетку, за счет процессинга эндонуклеазой Dicer она превращается в малую интерферирующую РНК (ниже называемую ′миРНК′), фрагменты которой имеют длину от 21 до 23 пар оснований (по). миРНК содержит двухцепочечную РНК с короткой цепью, имеющую от 19 до 27 оснований, и присоединяется к РНК-индуцированному комплексу сайленсинга (РИСК), посредством чего ведущая (антисмысловая) цепь распознает и разрушает целевую мРНК, что приводить к ингибированию экспрессии целевого гена специфичным к последовательности образом (Nucleic-acid therapeutics: basic principles and recent applications. Nature Reviews Drug Discovery. 2002. 1, 503-514).
Проблема доставленной снаружи двухцепочечной РНК с большой длинной цепи заключается в том, что она вызывает неспецифическую иммунностимуляцию в виде экспрессии интерферона в клетках млекопитающих; однако было установлено, что эту проблему можно устранить с помощью короткоцепочечных миРНК (Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001. 411, 494-498).
Известно, что химически синтезированная миРНК содержит двойную цепь из примерно 19-27 пар оснований и выступающий конец из 2 нуклеотидов на 3′-конце, и для того, чтобы эта двухцепочечная миРНК проявляла активность, конструкция может содержать 3′-гидроксильную группу (ОН) и 5′-фосфатную группу (РO4) (Effect of asymmetric terminal structures of short RNA duplexes on the RNA interference activity and strand selection. Nucleic Acids Res 1 October 2008: 5812-5821; Strand-specific 5′-O-methylation of миРНК duplexes controls guide strand selection and targeting specificity. RNA 1 February 2008: 263-274).
Известно, что производимая серийно и синтезированная миРНК имеет структуру, в которой гидроксильные группы присутствуют на обоих концах, и когда синтезированная миРНК доставляется в клетку, 5′-конец миРНК фосфорилируется ферментом фосфорилирования (киназой), чтобы проявить функции миРНК (siRNA function in RNAi: A chemical modification analysis. RNA 2003. 9: 1034-1048).
Bertrand et al. обнаружили, что по сравнению с воздействием антисмыслового олигонуклеотида (АСО) на тот же самый целевой ген, миРНК значительно эффективней ингибирует экспрессию мРНК in vitro и in vivo, и соответствующий эффект сохраняется в течение длительного времени (Comparison of antisense oligonucleotides and siRNAs in cell culture and in vivo. Biochem. Biophys. Res. Commun. 2002. 296: 1000-1004).
Кроме того, поскольку миРНК комплементарно присоединяется к целевой мРНК, для регуляции экспрессии целевого гена специфичным к последовательности образом, она имеет преимущество в том, что количество мишеней, на которые она может воздействовать значительно больше по сравнению с существующими медицинскими продуктами на основе антител или химическими веществами (низкомолекулярные лекарства) (Progress Towards in Vivo Use of siRNAs. MOLECULAR THERAPY. 2006 13(4):664-670).
Несмотря на отличную эффективность и множество миРНК, которые можно использовать, для того чтобы разработать лекарственное средство на основе миРНК также необходимо, чтобы миРНК эффективно доставлялась в целевую клетку, что может быть сделано за счет улучшения стабильности миРНК и эффективности клеточной доставки (Harnessing in vivo siRNA delivery for drug discovery and therapeutic development. Drug Discov Today. 2006 Jan; 11(l-2):67-73).
Кроме того, миРНК все еще вызывают неспецифическую врожденную иммуностимуляцию, поэтому были разработаны 2-метокси-, 2-фтор-заместители, чтобы преодолеть неспецифическую врожденную иммуностимуляцию.
Поскольку миРНК не в состоянии проходить через гидрофобный фосфолипидный бислой клетки, вследствие его отрицательного заряда, ее сложно доставить в клетку путем простой диффузии.
Чтобы повысить эффективность доставки миРНК in vivo или in vitro, были разработаны различные виды материалов для клеточной доставки. Часто для этого используются липосомы, катионные поверхносто-активные вещества, и тому подобное, а также переносчики. При этом известны способы слияния гена с липосомой, а также способы, где используются липиды или полимеры, содержащие катионы, или способы химической модификации миРНК, или способы использования конъюгата (Mechanisms and strategies for effective delivery of antisense and siRNA oligonucleotides. Nucleic Acids Res. 2008 Jul; 36(12):4158-71).
Поскольку миРНК не в состоянии проходить через гидрофобный фосфлипидный бислой клетки вследствие его отрицательного заряда, ее сложно доставить в клетку путем простой диффузии, поэтому для того, чтобы преодолеть это затруднение, используют метилфосфонат или пептидо-нуклеиновую кислоту (PNA) в основной связывающей структуре миРНК. Дополнительно используют переносчик, например, путем слияния гена с липосомой, или используются липиды или полимеры, содержащие катионы (Chemically modified siRNA: tools and applications. Drug Discov. Today. 2008 Oct; 13(19-20):842-855).
Среди них, можно выделить способы, в которых используется нанопереносчик, или различные полимеры, такие, как липосомы, комплекс катионных полимеров, и т.п., которые используются для того, чтобы перенести миРНК на нанопереносчике путем образования наночастиц для доставки миРНК. Среди этих способов наиболее широко используются те, в которых применяют полимерные наночастицы, полимерные мицеллы, липоплексы и т.п., где липоплекс состоит из катионного липида, который взаимодействует с анионным липидом эндосомы клетки, тем самым вызывая дестабилизацию эндосомы, чтобы доставить миРНК в клетку (Mechanism of oligonucleotide release from cationic liposomes. Proc. Natl. Acad. Sci. USA. 1996 Oct 15; 93(21):11493-8).
Кроме того, известно, что химические вещества и т.п., присоединяются к концевому участку миРНК «пассажира» (смысловая цепь), чтобы обеспечить улучшенные фармакокинетические характеристики и высокую эффективность in vivo (Therapeutic silencing of an endogenous gene by systemic administration of modified siRNAs. Nature. 2004 Nov 11; 432(7014):173-8). Итак, стабильность миРНК может варьировать в зависимости от свойств химических веществ, присоединенных к концам смысловой (пассажир) или антисмысловой (направляющей) цепи миРНК. Например, миРНК, содержащая связанное с ней полимерное соединение, такое, как полиэтилнгликоль (ПЭГ), взаимодействует с анионной фосфатной группой миРНК в присутствии катионных веществ с образованием комплекса, тем самым становясь переносчиком миРНК, обладающим повышенной стабильностью (Local and systemic delivery of VEGF siRNA using polyelectrolyte complex micelles for effective treatment of cancer. J Control Release. 2008 Jul 14; 129(2):107-16). В частности, мицелла, состоящая из полимерного комплекса, имеет необычайно малый размер, характеризуется по существу однородным распределением по размеру, и образуется спонтанно, тем самым облегчая управление качеством смеси и обеспечивая воспроизводимость по сравнению с другими системами для доставки лекарства, такими, как микросферы, наночастицы, и т.п.
Недавно, чтобы улучшить эффективность внутриклеточной доставки миРНК, была разработана технология использования конъюгата миРНК, в котором гидрофильное вещество, которое является биосовместимым полимером (например, полиэтилнгликолем (ПЭГ)), присоединяют к миРНК простой ковалентной связью или опосредованной ковалентной связью через линкер, чтобы тем самым обеспечить стабильность миРНК и эффективнее проникать через клеточную мембрану (см. Korean Patent Publication No. 883471).
Однако, химическая модификация миРНК и соединение с полиэтиленгликолем (ПЭГ) (ПЭГилирование) все еще имеет недостатки, заключающиеся в том, что стабильность in vivo и доставка в целевой орган неравномерная. В случае химической модификации миРНК, связь с РИСК не содержащей модификации на 5′-конце антисмысловой (ведущей) цепи, распознающей целевую мРНК, особенно важна для инициации механизма РНКи. В случае смысловой (пассажир) цепи, существующими исследованиями подтверждается функционирование миРНК даже в случае, когда конъюгаты связаны с обоими концам, так что смысловая (пассажир) цепь используется для конъюгации (siRNA Conjugate Delivery Systems. Bioconjugate Chem., 2009, 20 (1), pp 5-14).
В случае двухцепочечной олиго-РНК конструкции, в которой гидрофильные вещества и гидрофобные вещества присоединены к двухцепочечной олиго-РНК, самособирающиеся наночастицы образуются за счет гидрофобного взаимодействия гидрофобных веществ, при этом самособирающаяся наночастица называется ′SAMiRNA′ (Korean Patent Laid-Open Publication No. 2009-0042297).
Технология образования самособирающихся наночастиц SAMiRNA путем связывания гидрофобных веществ и гидрофильных веществ с концами двухцепочечной олиго-РНК, однако, позволяет сместить цепи РНК в двухцепочечной олиго-РНК, при этом функции РНКи могут быть ингибированы в зависимости от положения, в котором гидрофильные вещества и гидрофобные вещества присоединены к концам. Следовательно, необходимо разработать технология доставки двухцепочечной олиго-РНК, способной к эффективному проникновению через клеточную мембрану без ингибирования функций двухцепочечной олиго-РНК посредством оптимизации двухцепочечной олиго-РНК конструкции.
Сущность изобретения
Целью настоящего изобретения является обеспечить конструкцию, представляющую собой самособирающуюся наночастицу (SAMiRNA) с максимизированной эффективностью in vivo. SAMiRNA настоящего изобретения означает наночастицу, образованную за счет гидрофобных взаимодействий между гидрофобными составляющими двухцепочечной олиго-РНК конструкции, в которой гидрофильные вещества и гидрофобные вещества связаны с концами двухцепочечной олиго-РНК.
Задача настоящего изобретения была решена также за счет того, что было выявлено, что функционирование РНКи варьирует в зависимости от положений, в которых гидрофильные вещества и гидрофобные вещества связываются с двухцепочечной олиго-РНК, что позволило разработать технологию доставки SAMiRNA, в которой функции РНКи максимизированы путем оптимизации двухцепочечной олиго-РНК конструкции, образующей SAMiRNA.
Двухцепочечная олиго-РНК конструкция по настоящему изобретению имеет форму, в которой гидрофильные вещества и гидрофобные вещества, способствующие доставке в клетку, связаны с РНК простой ковалентной связью или опосредованной ковалентной связью через линкер, чтобы быть в состоянии образовать самособирающуюся наночастицу (SAMiRNA) в водном растворе, которая может быть использована как высокоэффективный ингибитор РНК, в значительной степени пригодный к использованию при лечении рака и инфекционных заболеваний, и так далее, и может быть также использована в составе фармацевтической композиции для лечения заболеваний. В частности, РНК-ингибирующая активность может быть достаточно высокой даже при низкой концентрации SAMiRNA, что позволяет использовать их как средство лечения рака и инфекционных заболеваний, и так далее.
В частности, двухцепочечная олиго-РНК конструкция по настоящему изобретению может использоваться в SAMiRNA, которая является наноразмерным синтетическим ингибитором олиго-РНК и может максимально увеличивать эффективность в геноспецифичном ингибировании РНК, за счет присоединения гидрофильных веществ и гидрофобных веществ и 5′-фосфорилирования антисмысловой цепи в SAMiRNA таким образом, чтобы иметь оптимизированную активность in vivo.
Описание чертежей
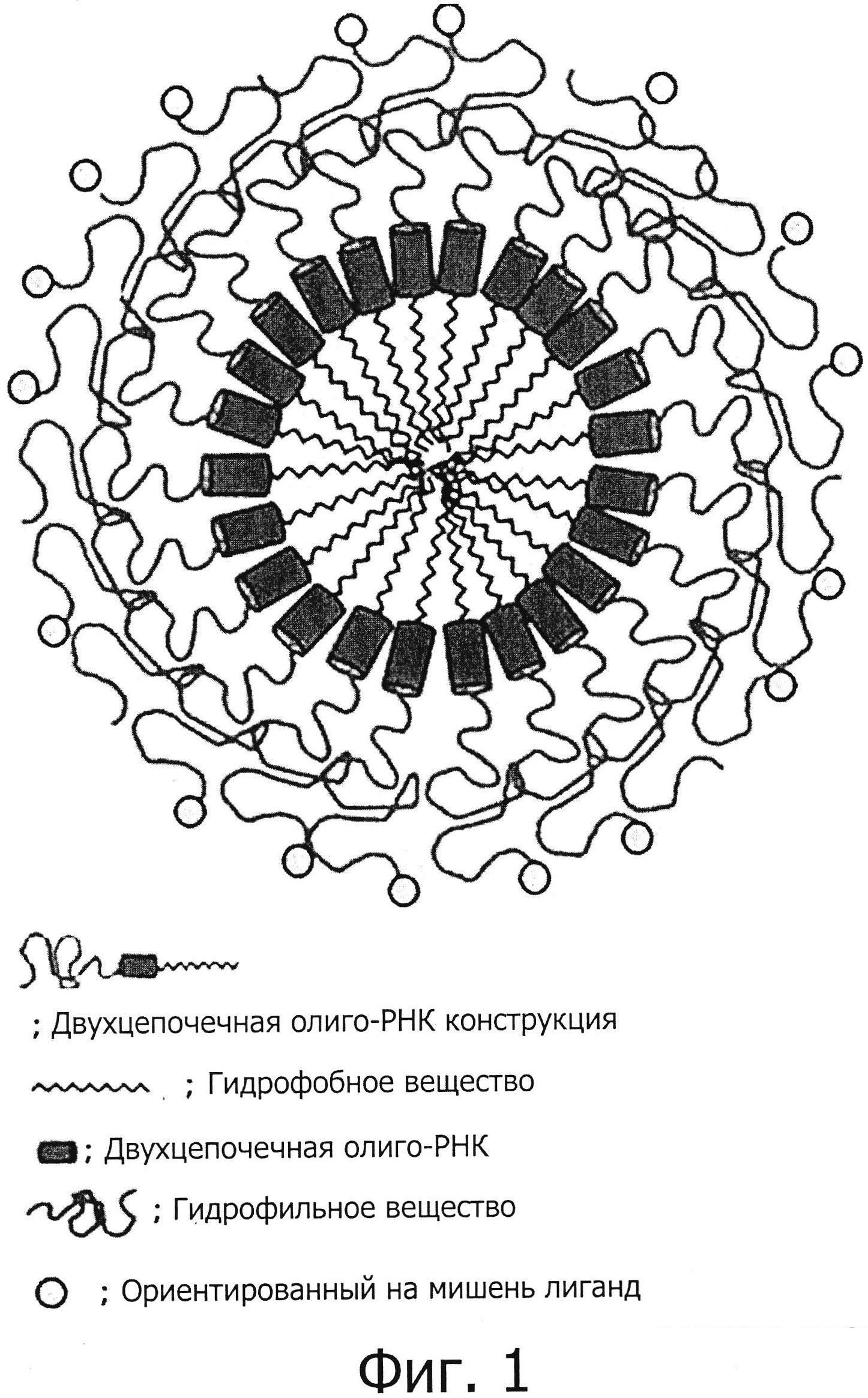
Фиг. 1 является схематическим изображением наночастиц (SAMiRNA), содержащих двухцепочечную олиго-РНК конструкцию;
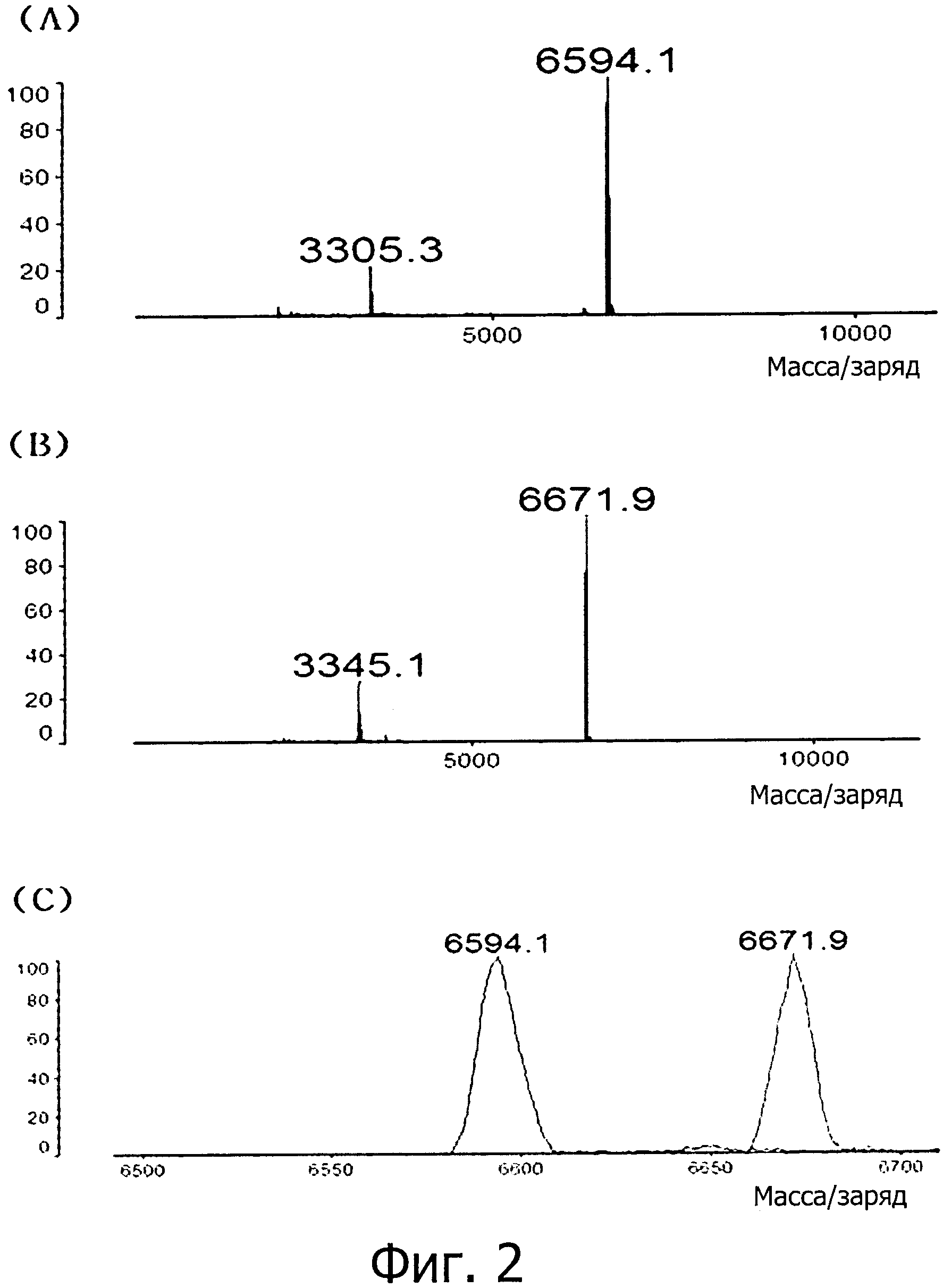
фиг. 2 является изображением, показывающим результат изготовления антисмысловой цепи S-SAMiRNALP-PO4;
(A) результат анализа MALDI-TOF MS одиночной цепи РНК (blue, M.W. 6593.1) последовательности, комплементарной SEQ ID NO: 1;
(B) результат анализа MALDI-TOF MS формы (Red, M.W. 6673.1), в которой одна фосфатная группа присоединена к 5′-концу одиночной цепи РНК последовательности, комплементарной SEQ ID NO: 1;
(C) сравнение графиков MALDI-TOF MS в зависимости от фосфатной группы, присоединенной к одиночной цепи РНК последовательности, комплементарной SEQ ID NO: 1, которое подтверждает, что по сравнению с последовательностью, в которой фосфатная группа не присоединена (показано голубым), случай, где одна фосфатная группа присоединена (показано красным), показывает увеличение на величину молекулярной массы фосфатной группы (MB около 80);
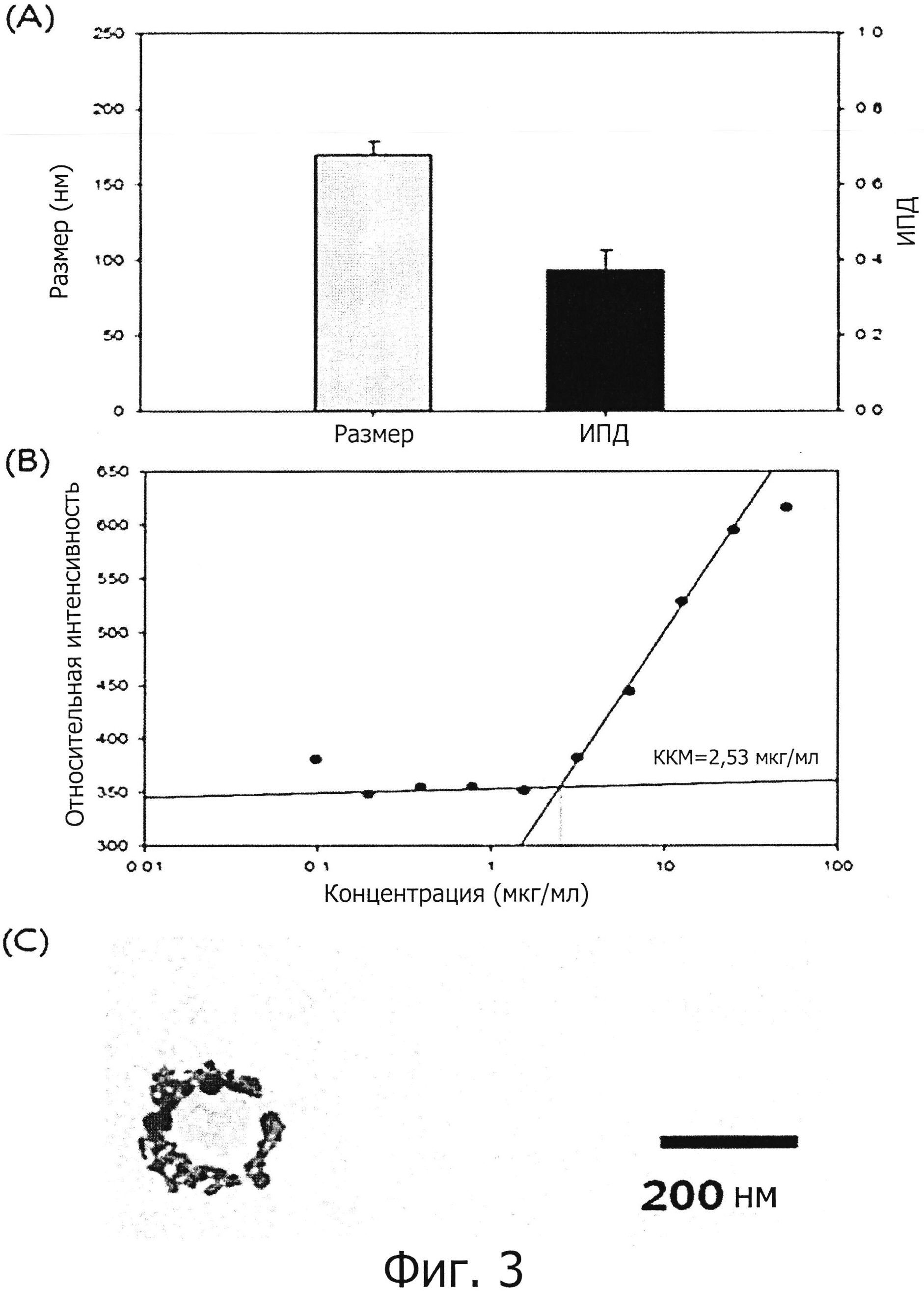
фиг. 3 показывает результат анализа физических свойств наночастицы (SAMiRNA) двухцепочечной олиго-РНК конструкции, оптимизированной по настоящему изобретению;
(A) График размера наночастицы и индекс полидисперсности (ИПД);
(B) График критической концентрации мицеллы наночастицы;
(C) Электронно-микроскопическая фотография наночастицы;
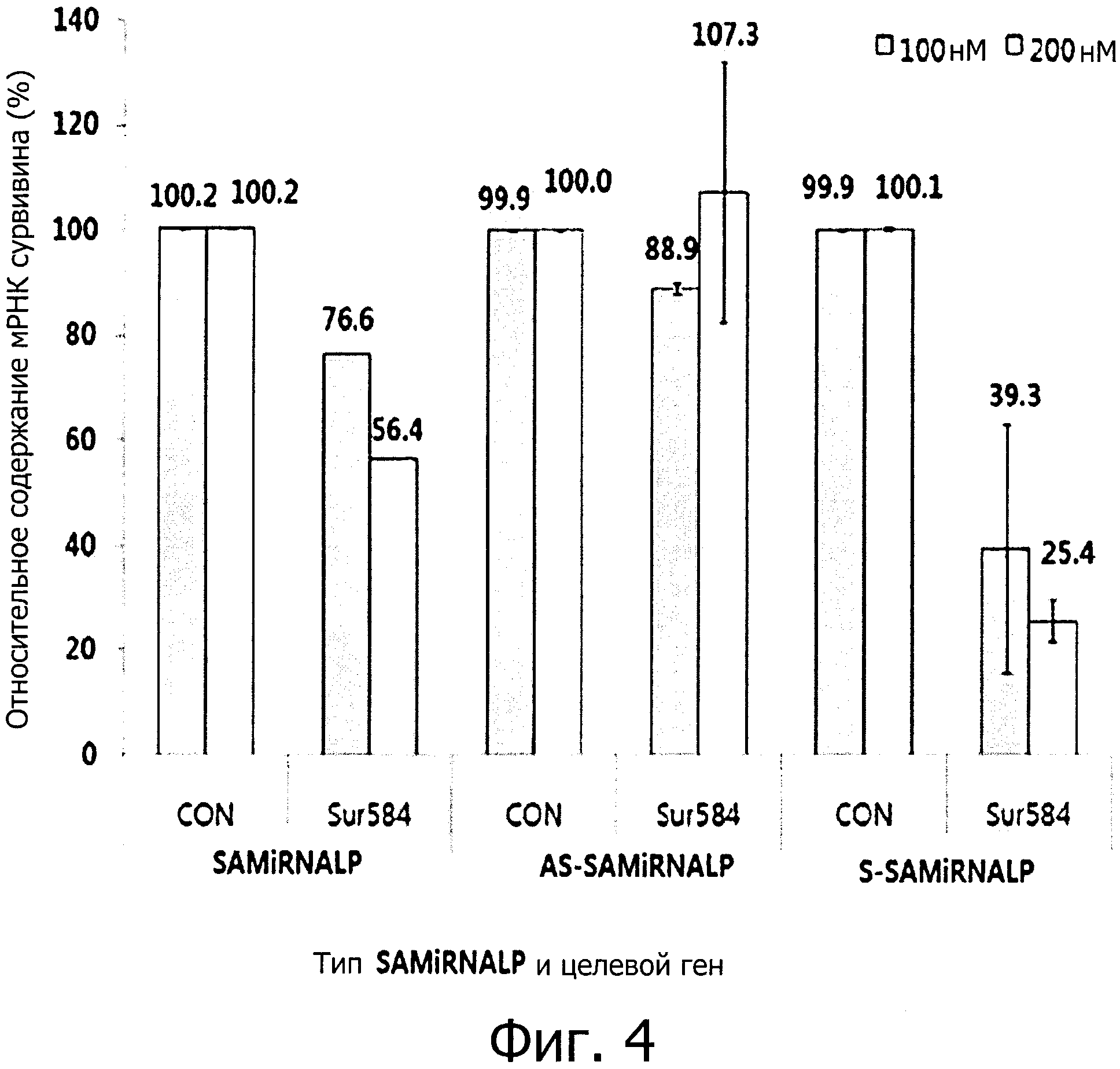
фиг. 4 является графиком, полученным при обработке клеточной линии HeLa наночастицами (SAMiRNA), состоящими из двухцепочечной олиго-РНК конструкции, и подтверждающим ингибирование экспрессии целевого гена, что было выявлено с помощью метода количественной ПЦР в реальном времени; и
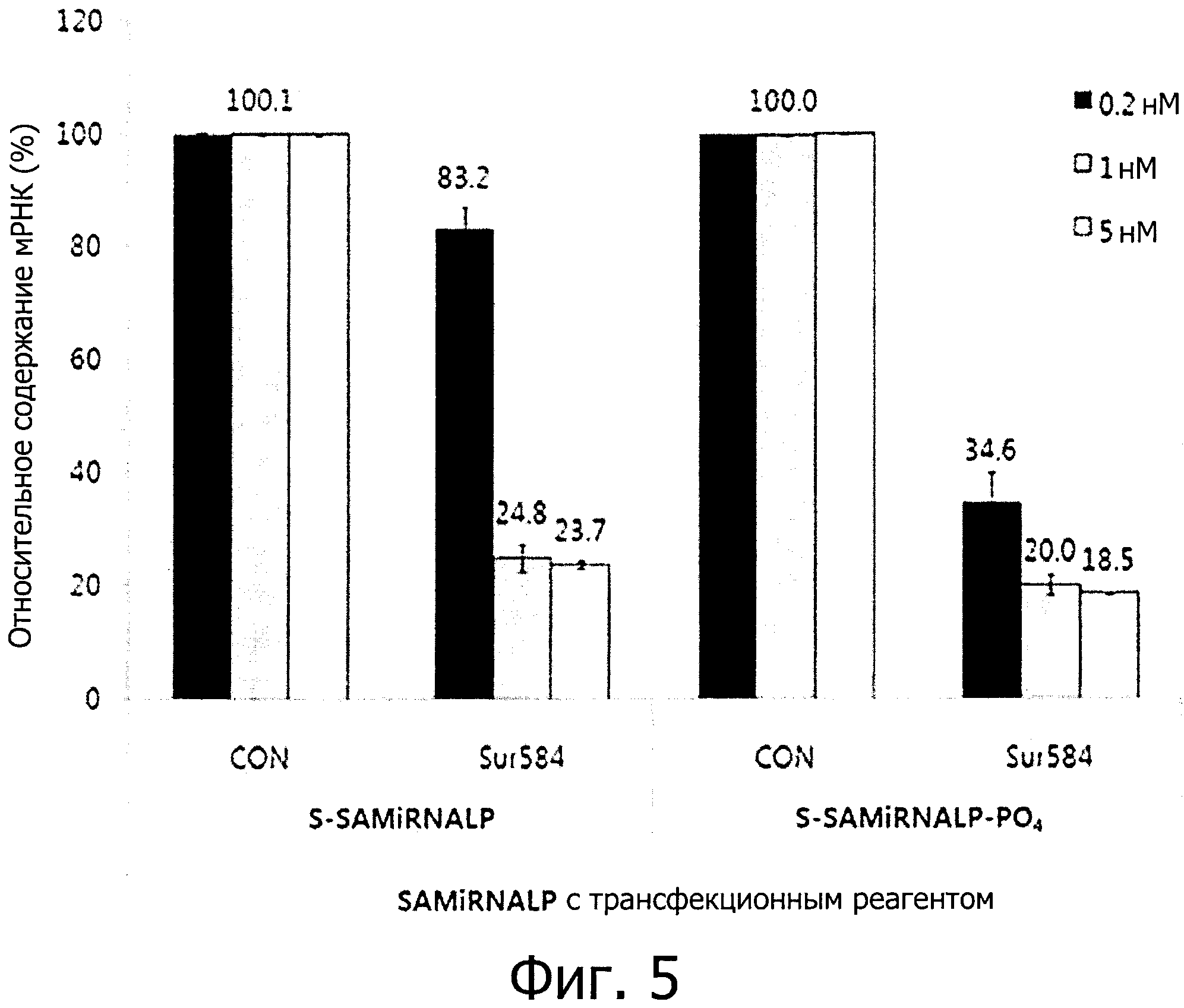
фиг. 5 является графиком, полученным путем обработки клеточной линии HeLa двухцепочечной олиго-РНК конструкцией вместе с трансфекционным материалом, и подтверждающим ингибирование экспрессии целевого гена, что было выявлено с помощью метода количественной ПЦР в реальном времени.
Подробное описание изобретения
Ниже настоящее изобретение будет описано подробно.
В настоящем изобретении предлагается двухцепочечная олиго-РНК конструкция, к которой присоединено химическое вещество, имеющее строение, представленное следующей формулой 1:
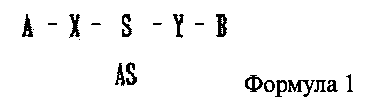
где одно из А и В является гидрофильным веществом, другое является гидрофобным веществом, X и Υ независимо друг от друга являются простой ковалентной связью или ковалентной связью через линкер, S является смысловой цепью двухцепочечной олиго-РНК, и AS является антисмысловой цепью двухцепочечной олиго-РНК. S и AS образуют двухцепочечную структуру путем комплементарного связывания, где комплементарное связывание не обязательно является полностью комплементарным (полное совпадение) связыванием и может включать в себя случай, когда последовательности частично различаются (ошибочное спаривание).
В дополнение, в настоящем изобретении предлагается двухцепочечная олиго-РНК конструкция, имеющая строение, представленное следующей формулой 2:
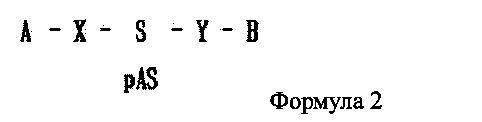
где одно из А и В является гидрофильным веществом, другое является гидрофобным веществом, X и Υ независимо друг от друга являются простой ковалентной связью или ковалентной связью через линкер, S является смысловой цепью двухцепочечной олиго-РНК, и pAS является антисмысловой цепью, в которой фосфатная группа связана с 5′ концевым участком двухцепочечной олиго-РНК. Причем от одной до трех фосфатных групп может быть связано с 5′ концевым участком.
Предпочтительно, чтобы двухцепочечная олиго-РНК цепь состояла из от 19 до 31 нуклеотидов в двухцепочечной олиго-РНК конструкции настоящего изобретения. В качестве двухцепочечной олиго-РНК, пригодной для использования в настоящем изобретении, может использоваться двухцепочечная олиго-РНК к любому гену, которую используют в генной терапии или в генетических исследованиях, или которые потенциально могут быть так использованы.
Чтобы улучшить стабильность in vivo двухцепочечная олиго-РНК содержит различные модификации для обеспечения устойчивости к нуклеазам и снижения неспецифической иммуностимуляции. При этом модификация может быть одним, или двумя, или большим числом сочетаний, выбранными из модификации, в которой -ОН группа при 2′ атоме углерода в структуре сахара в одном или более нуклеотидах замещена на: -СН3(метил), -ОСН3(метокси), -NH2, -F(фтор), -O-2-метоксиэтил-О-пропил, -O-2-метилтиоэтил, -O-3-аминопропил, -O-3-диметиламинопропил, -O-N-метилацетамидо или -О-диметиламидооксиэтил; модификация, в которой кислород в структуре сахара в нуклеотидах замещен серой; и модификация до фосфотиоата или борфосфоната, метилфосфоната связывания из связывания среди нуклеотидов, или может быть модификацией до пептидной нуклеиновой кислоты (PNA), закрытой нуклеиновой кислоты (LNA) или незакрытой нуклеиновой кислоты (UNA) (см. Crooke et al., Ann. Rev. Med. Vol. 55: pp 61-65 2004, US 5,660,985, US 5,958,691, US 6,531,584, US 5,808,023, US 6,326,358, US 6,175,001 Braasch D.A. et al., Bioorg. Med. Chem. Lett. 14:1139-1143, 2003; Chiu Y.L. et al., RNA, 9:1034-1048, 2003; Amarzguioui M. et al., Nucleic Acid Res. 31:589-595, 2003, Nucleic Acids Research, 2010, Vol. 38, No. 17 5761-5773, Nucleic Acids Research, 2011, Vol. 39, No. 5 1823-1832).
Гидрофобное вещество служит для генерации гидрофобного взаимодействия, чтобы образовать наночастицу (SAMiRNA), состоящую из двухцепочечных олиго-РНК конструкций. Среди гидрофобных веществ, углеродная цепь или холестерин способны легко связываться при синтезе двухцепочечной олиго-РНК конструкции, что в значительной степени подходит для изготовления двухцепочечной олиго-РНК конструкции настоящего изобретения.
В дополнение, предпочтительно, чтобы гидрофобное вещество имело молекулярную массу от 250 до 1000.
В частности, гидрофобное вещество может включать в себя стероидное производное, глицеридное производное, простой эфир глицерина, полипропиленгликоль, насыщенные или ненасыщенные углеводороды, содержащие от 12 до 50 атомов углерода в случае углеводородной цепи, диацилфосфатидилхолин, жирную кислоту, фосфолипид, липополиамин, и т.п., как пример; но не ограничивается этим. Специалистам ясно, что любые гидрофобные вещества пригодны для использования при условии, что вещество соответствует задачам настоящего изобретения.
В частности, стероидное производное может быть выбрано из группы, состоящей из холестерина, холестанола, холевой кислоты, холестерилформиата, холестанилформиата и холестаниламина, и глицеридное производное может быть выбрано из моно- ди- и триглицеридов, и т.п., где жирная кислота глицерида является насыщенной или ненасыщенной жирной кислотой от С12 до С50.
Кроме того, гидрофильное вещество является предпочтительно катионным или неионным полимерным веществом, имеющим молекулярную массу от 200 до 10000, более предпочтительно, неионным полимерным веществом, имеющим молекулярную массу от 1000 до 2000. Например, неионные гидрофильные полимерные соединения, такие, как полиэтиленгиколь, поливинилпирролидон, полиоксазолин и т.п., предпочтительно используют как гидрофильное полимерное соединение, но не обязательно этим ограничиваются.
При необходимости гидрофильное вещество может быть модифицировано путем введения функциональных групп, необходимых для связывания с другими веществами, такими, как направленный на мишень лиганд и так далее. Для изготовления двухцепочечной олиго-РНК конструкции настоящего изобретения среди всех гидрофильных веществ хорошо подходит, в частности, полиэтиленгликоль (ПЭГ), т.к. его молекулярная масса может варьировать, в него могут быть введены функциональные группы, он проявляет отличное сродство in vivo, не вызывает иммуностимуляцию, обладает отличной биосовместимостью, повышает стабильность двухцепочечной олиго-РНК in vivo, и повышает эффективностью доставки.
Кроме того, опосредующий ковалентную связь линкер, который ковалентно связан с гидрофильным веществом (или с гидрофобным веществом) на конце двухцепочечной олиго-РНК также не особенно ограничен, до тех пор, пока обеспечивается связь, которая распадается в специфическом окружении. Следовательно, в качестве линкера может быть использовано любое соединение для связывания, чтобы активировать олиго-РНК и/или гидрофильное вещество (или гидрофобное вещество) в изготовлении двухцепочечной олиго-РНК конструкции.
Ковалентная связь может быть любой: разрушаемой или неразрушаемой. Примеры неразрушаемой связи могут включать в себя амидную связь или фосфориляционную связь, и примеры разрушаемой связи могут включать в себя дисульфидную связь, разлагаемую кислотой связь, сложноэфирную связь, ангидридную связь, биоразлагаемую связь или ферментативно разлагаемую связь, и т.п., но настоящее изобретение не обязательно ограничивается этим.
В настоящем изобретении предлагается двухцепочечная олиго-РНК конструкция, в которой гидрофобное вещество связано с 5′ концом смысловой цепи двухцепочечной олиго-РНК и гидрофильное вещество связано с 3′ ее концом, как показано в следующей формуле 3, и способ изготовления двухцепочечной олиго-РНК конструкции может включать в себя:
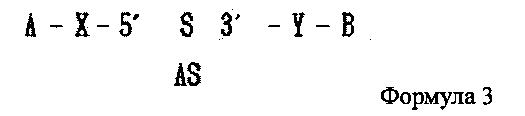
где А является гидрофобным веществом, В является гидрофильным веществом, X и Υ независимо друг от друга являются простой ковалентной связью или ковалентной связью через линкер, S является смысловой цепью двухцепочечной олиго-РНК, и AS является антисмысловой цепью двухцепочечной олиго-РНК;
(1) синтезирование одиночной цепи РНК на твердой подложке, содержащей гидрофильное вещество, присоединенное к ней;
(2) изготовление РНК-полимерной конструкции путем ковалентного связывания гидрофобного вещества с 5′ концом РНК, содержащей гидрофильное вещество, связанное с ней;
(3) отделение РНК-полимерной конструкции от твердой подложки; и
(4) образование двухцепочечной олиго-РНК конструкции путем гибридизации РНК-полимерной конструкции и комплементарной ей одиночной цепи РНК.
Более предпочтительно, способ может включать в себя:
(1′) связывание гидрофильного вещества на твердой подложке, предпочтительно, CPG;
(2)′) синтезирование одиночной цепи РНК на твердой подложке (CPG), содержащей гидрофильное вещество, связанное с ней;
(3′) изготовление РНК-полимерной конструкции путем ковалентного связывания гидрофобного вещества с 5′ концом одиночной цепи РНК;
(4′) отделение РНК-полимерной конструкции от твердой подложки (CPG), когда синтез завершен;
(5′) образование двухцепочечной олиго-РНК конструкции путем гибридизации РНК-полимерной конструкции и комплементарной ей одиночной цепи РНК.
После этапа (4) или (5′) выше, когда изготовление завершено, реактант может быть очищен с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), и его молекулярная масса может быть измерена методом MALDI-TOF масс-спектрометрии, чтобы подтвердить, изготовлены ли или нет желаемые двухцепочечная олиго-РНК и двухцепочечная олиго-РНК конструкция.
В вышеописанном способе изготовления, синтез одиночной цепи РНК, последовательность которой комплементарна последовательности одиночной цепи РНК, синтезированной на этапе (1) или (2′), который является независимым процессом синтеза, может быть осуществлен до этапа (1) или этапа (2′), или может быть осуществлен во время любого из этапов от (1) до (4) или (1′) до (5′).
В дополнение, одиночная цепь РНК, последовательность которой комплементарна последовательности одиночной цепи РНК, синтезированной на этапе (1) или (2′), может содержать фосфатную группу, связанную с ее 5′ концом, как показано в следующей формуле 4:
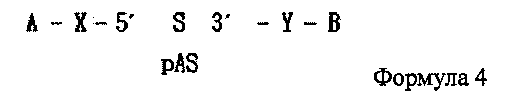
где А является гидрофобным веществом, В является гидрофильным веществом, X и Υ независимо друг от друга являются простой ковалентной связью или ковалентной связью через линкер, S является смысловой цепью двухцепочечной олиго-РНК, и pAS является антисмысловой цепью, в которой фосфатная группа связана с 5' концевым участком двухцепочечной олиго-РНК. Здесь от одной до трех фосфатных групп может быть связано с 5′ концевым участком.
В настоящем изобретении предлагается двухцепочечная олиго-РНК конструкция, в которой гидрофильное вещество связано с 5′ концом смысловой цепи двухцепочечной олиго-РНК и гидрофобное вещество связано с 3′ ее концом, как показано в следующей формуле 5, и способ изготовления двухцепочечной олиго-РНК конструкции может включать в себя:
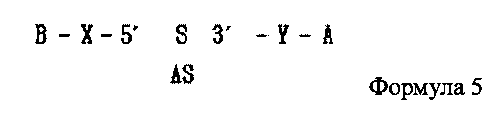
где А является гидрофобным веществом, В является гидрофильным веществом, X и Υ независимо друг от друга являются простой ковалентной связью или ковалентной связью через линкер, S является смысловой цепью двухцепочечной олиго-РНК, и AS является антисмысловой цепью двухцепочечной олиго-РНК;
(1′′) синтезирование одиночной цепи РНК на твердой подложке, содержащей функциональную группу, присоединенную к ней;
(2′′) ковалентное связывание гидрофильного вещества с веществом, полученным на этапе (1′′);
(3′′) отделение вещества, полученного на этапе (2′′), от твердой подложки;
(4′′) образование РНК-полимерной конструкции путем ковалентного связывания гидрофобного вещества через функциональную группу, связанную с 3′ концом вещества, полученного на этапе (3′′); и
(5′′) образование двухцепочечной олиго-РНК конструкции путем гибридизации РНК-полимерной конструкции, изготовленной на этапе (4′′) и комплементарной ей одиночной цепи РНК.
Функциональная группа настоящего изобретения не ограничена при условии, что могут быть достигнуты задачи настоящего изобретения, предпочтительно, она может быть выбрана из амина, тиола, карбоксила, альдегида, биотина и т.п.
В дополнение, способ изготовления двухцепочечной олиго-РНК конструкции может включать в себя: изготовление одноцепочечной РНК на твердой подложке, содержащей гидрофобное вещество, связанное с ней, ковалентное присоединение гидрофильного вещества, чтобы тем самым изготовить РНК-полимерную конструкцию и образование двухцепочечной олиго-РНК конструкции путем гибридизации одиночной цепи РНК и комплементарной ей одиночной цепи РНК.
После этапа (5′′) выше, когда изготовление завершено, реактант может быть очищен с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), и его молекулярная масса может быть измерена методом MALDI-TOF масс-спектрометрии, чтобы подтвердить, изготовлены ли или нет желаемые двухцепочечная олиго-РНК и двухцепочечная олиго-РНК конструкция.
В вышеописанном способе, синтез одиночной цепи РНК, последовательность которой комплементарна последовательности одиночной цепи РНК, синтезированной на этапе (1′′), который является независимым процессом синтеза, может быть осуществлен до этапа (1′′) или может быть осуществлен во время любого из этапов от (1′′) до (5′′).
В дополнение, одиночная цепь РНК, последовательность которой комплементарна одиночной цепи РНК, синтезированной на этапе (1′′), может содержать фосфатную группу, связанную с ее 5′ концом как показано в следующей формуле 6:
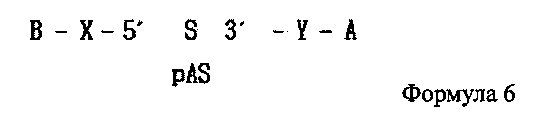
где А является гидрофобным веществом, В является гидрофильным веществом, X и Υ независимо друг от друга являются простой ковалентной связью или ковалентной связью через линкер, S является смысловой цепью двухцепочечной олиго-РНК, и pAS является антисмысловой цепью, в которой фосфатная группа связана с 5′ концевым участком двухцепочечной олиго-РНК.
Между тем, в двухцепочечной олиго-РНК конструкции по изобретению, которая содержит присоединенный к ней лиганд, специфичный к мишени лиганд может быть присоединен в особом положении, в частности, на конце гидрофильного вещества, присоединенного к двухцепочечной олиго-РНК конструкции. Направляющая группа может специфично связываться с рецептором, способствующем попаданию внутрь целевой клетки путем опосредованного рецепторами эндоцитоза (ОРЭ). Вещества могут быть специфическим к мишени антителом, аптамером, пептидом; иди химическими веществами, включающими в себя фолат, N-ацетилгалактозамин (АГ) и маннозу, и т.п., которые выбирают из специфичного к рецептору лиганда. Здесь направляющая группа может быть любым веществом, до тех пор, пока оно специфично присоединяется целевому рецептору, чтобы осуществить доставку, и тем самым, оно не ограничено антителом, аптамером, пептидом и химическими веществами.
Способ изготовления двухцепочечной олиго-РНК конструкции содержащей лиганд, присоединенный к ней, может включать в себя:
(1′′′) связывание гидрофильного вещества с твердой подложкой (CPG), содержащей функциональную группу, связанную к ней;
(2′′′) синтезирование одиночной цепи РНК, на твердой подложке (CPG), содержащей функциональную группу - гидрофильное вещество, связанное с ней;
(3′′′) изготовление функциональной группы - РНК-полимерной конструкции путем ковалентного связывания гидрофобного вещества с 5′ концом одиночной цепи РНК;
(4′′′) отделение функциональной группы - РНК-полимерной конструкции от твердой подложки (CPG);
(5′′′) связывание лиганда с концом гидрофильного вещества, используя функциональную группу, чтобы изготовить РНК-полимерную конструкцию, содержащую лиганд, присоединенный к ней; и
(6′′′) изготовление двухцепочечной олиго-РНК конструкции, содержащей лиганд, присоединенный к ней, путем гибридизации изготовленной РНК-полимерной конструкции, содержащей лиганд, присоединенный к ней, и комплементарной ей одиночной цепи РНК.
Функциональная группа настоящего изобретения не ограничена до тех пор пока могут быть достигнуты задачи настоящего изобретения, предпочтительно, может быть выбрана из амина, тиола, карбоксила, альдегида, биотина, и т.п.
После этапа (6′′′) выше, когда изготовление завершено, двухцепочечная олиго-РНК конструкция, содержащая реактант, присоединенный к ней лиганд и комплементарную ей одиночную цепь РНК, может быть отделена и очищена с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), и молекулярная масса могут быть измерена методом MALDI-TOF масс-спектрометрии, чтобы подтвердить, изготовлены ли или нет желаемая двухцепочечная олиго-РНК конструкции, содержащая присоединенный к ней лиганд и комплементарную ей РНК. В вышеописанном способе изготовления, синтез одиночной цепи РНК, последовательность которой комплементарна последовательности одиночной цепи РНК, синтезированной на этапе (2′′′), который является независимым процессом синтеза, может быть осуществлен до этапа (1′′′) или может быть осуществлен во время любого из этапов от (1′′′) до (6′′′).
Кроме того, настоящее изобретение предоставляет наночастицу (SAMiRNA), состоящую из двухцепочечной олиго-РНК конструкции, содержащей лиганд, присоединенный к ней. Двухцепочечная олиго-РНК конструкция является амфипатической, содержащей как гидрофобные вещества, так и гидрофильные вещества, причем гидрофильные вещества обладают сродством посредством взаимодействия, такого, как водородная связь, и т.п., к молекуле воды, присутствующей в теле, располагаясь на внешней стороне, а гидрофобные вещества располагаются внутри, путем гидрофобного взаимодействия между собой, тем самым образуя термодинамически стабильную наночастицу (SAMiRNA). Другими словами, гидрофобное вещество размещено в центре наночастицы, и гидрофильное вещество размещено снаружи от двухцепочечной олиго-РНК, тем самым образуя наночастицу, защищающую двухцепочечную олиго-РНК (см. фиг. 1). Образованная наночастица может улучшить внутриклеточную доставку двухцепочечной олиго-РНК и ее функционирование, и может быть использована в целях лечения болезней. Более конкретные примеры синтеза конструкции, и ее характеристики, внутриклеточная эффективность доставки и эффекты наночастицы (SAMiRNA), состоящей из двухцепочечной олиго-РНК конструкции, будут описаны более подробно в последующих примерах.
В дополнение, настоящее изобретение предоставляет способ лечения, используя двухцепочечную олиго-РНК конструкцию или SAMiRNA.
Конкретно, настоящее изобретение предоставляет способ лечения, включающий в себя: изготовление наночастицы (SAMiRNA), состоящей из двухцепочечных олиго-РНК конструкций и введение наночастицы (SAMiRNA) в тело животного.
Кроме того, настоящее изобретение предоставляет фармацевтическую композицию, содержащую фармацевтически эффективное количество двухцепочечной олиго-РНК конструкции или наночастицу (SAMiRNA), состоящую из двухцепочечных олиго-РНК конструкций.
Композиция настоящего изобретения может быть изготовлена путем дополнительного включения в состав по меньшей мере одного вида фармацевтически приемлемого переносчика в дополнение к вышеописанным эффективным компонентам. Требуемый фармацевтически приемлемый переносчик должен быть совместим с эффективными компонентами настоящего изобретения. Один компонент выбирают из соли, стерильной воды, раствора Рингера, забуференного физраствора, раствора дестрозы, раствора мальтодекстрина, глицерина, этилового спирта и других компонентов, или может быть использовано сочетание двух и более компонентов, и другие традиционные добавки, такие, как антиоксидант, буфер, фунгистатик и т.п., могут быть добавлены к ней по мере необходимости. В дополнение, композиция может быть изготовлена как лекарственная форма для инъекций, например, водный раствор, суспензия, эмульсия и т.п., путем дополнительного добавления к ней разбавителя, диспергатора, ПАВа, связующего и смазочного средства. В частности, предпочтительно, чтобы композиция была изготовлена как лиофилизированная лекарственная форма. Чтобы изготовить лиофилизированную лекарственную форму, может быть использован любой способ, в основном известный в соответствующей области настоящего изобретения, причем к ней может быть добавлен стабилизатор для лиофилизации.
В дополнение, подходящие в данной области способы или способы, раскрываемые в Remington′s pharmaceutical Science, Mack Publishing company, Easton PA, могут быть предпочтительно использованы для создания лекарственной композиции в зависимости от каждого заболевания или компонента.
Состав фармацевтической композиции настоящего изобретения может быть определен обычными экспертами в данной области, основываясь на симптомах пациентов и тяжести заболевания. В дополнение, композиция может быть произведена в различных видах, таких, как порошок, таблетка, капсула, раствор, доза для инъекции, мазь, сироп, и т.п., и может быть предоставлена как в однодозовом, так и в многодозовом контейнере, например, запечатанной ампуле, бутылке и т.п.
Фармацевтическая композиция настоящего изобретения может вводиться орально или парентерально. Примеры путей введения фармацевтической композиции по настоящему изобретению могут включать в себя оральное, внутривенное, внутримышечное, внутриартериальное, внутрикостное, интрадуральное, интракардиальное, внутрикожное, подкожное, внутрибрюшинное, кишечное, подъязычное или местное введение, но настоящее изобретение этим не ограничено.
Для клинического введения, как описано выше, фармацевтическая композиция настоящего изобретения может быть изготовлена как соответствующая лекарственная форма по известной технологии. Дозировка композиции может находиться в различных интервалах в зависимости от массы, возраста, пола, состояния здоровья, рациона, продолжительности приема, способа, интенсивности выведения, тяжести заболевания и т.п. пациента, и может быть легко определена обычными экспертами в данной области.
В настоящем изобретении предлагается способ регуляции экспрессии генов in vivo или in vitro, где используется двухцепочечная олиго-РНК конструкция. Кроме того, в настоящем изобретении предлагается способ регуляции экспрессии генов in vivo или in vitro, где используется наночастица, содержащая двухцепочечную олиго-РНК конструкцию.
Ниже настоящее изобретение будет описано подробно со ссылками на последующие примеры. Эти примеры являются лишь иллюстрацией настоящего изобретения, и специалистам очевидно, что объем настоящего изобретения не ограничивается этими примерами.
Пример 1. Изготовление двухцепочечной олиго-РНК конструкции
В дальнейшем, чтобы ингибировать сурвивин, была использована двухцепочечная олиго-РНК к сурвивину. Сурвивин считается важной мишенью в лечении рака, поскольку этот белок обычно экспрессируется в большинстве вновь образующихся опухолей или трансформированных клеточных линиях, протестированных до сего момента (Survivin: а new target for anti-cancer therapy. Cancer Treat Rev. 2009 Nov; 35(7):553-62).
Двухцепочечная олиго-РНК к сурвивину настоящего изобретения состоит из смысловой цепи SEQ ID NO: 1 [(последовательность №1)] и антисмысловой цепи комплементарной ей последовательности, и двухцепочечная олиго-РНК, использованная как контрольная группа, состоит из смысловой цепи SEQ ID NO: 2 [(последовательность. №2)] и антисмысловой цепи комплементарной ей последовательности. Последовательность олиго-РНК, использованная в настоящих примерах, следующая:
(SEQ ID NO: 1) 5′-AAG GAG AUC AAC AUU UUC A-3′
(SEQ ID NO: 2) 5′-CUU ACG CUG AGU ACU UCG A-3′
В двухцепочечной олиго-РНК одиночная нить была синтезирована с помощью способа, где используется β-цианоэтилфосфорамидит, чтобы соединить простые фосфодиэфирные связи, тем самым создавая конфигурацию каркаса РНК (Polymer support oligonucleotide synthesis XVIII: use of beta-cyanoethyl-N,N-dialkylamino- /N-morpholinophosphoramidite of deoxynucleosides for the synthesis of DNA fragments simplifying deprotection and isolation of the final product. Nucleic Acids Res. 1984 Jun 11; 12(11):4539-57).
Желаемую последовательность одиночной цепи РНК получают, включая в ее состав нуклеозидную связь и повторяя цикл, включающий в себя разблокирование, образование пары, блокирование и окисление. Синтезатор РНК RNA 384 Synthesizer (BIONEER, Корея) был использован для ряда соответствующих процессов синтеза двухцепочечной олиго-РНК.
После сравнения двухцепочечной олиго-РНК, имеющей конфигурацию двухцепочечной олиго-РНК конструкции, и двухцепочечной олиго-РНК отличающихся стороной связывания полимерного вещества с точки зрения эффективности ингибирования экспрессии целевого гена, были изготовлены двухцепочечные олиго-РНК конструкции, имеющие следующее строение, для оптимизации двухцепочечной олиго-РНК конструкции.
Двухцепочечные олиго-РНК конструкции, изготовленные в настоящем изобретении, имеют строение, показанное в следующей таблице 1, соответственно.
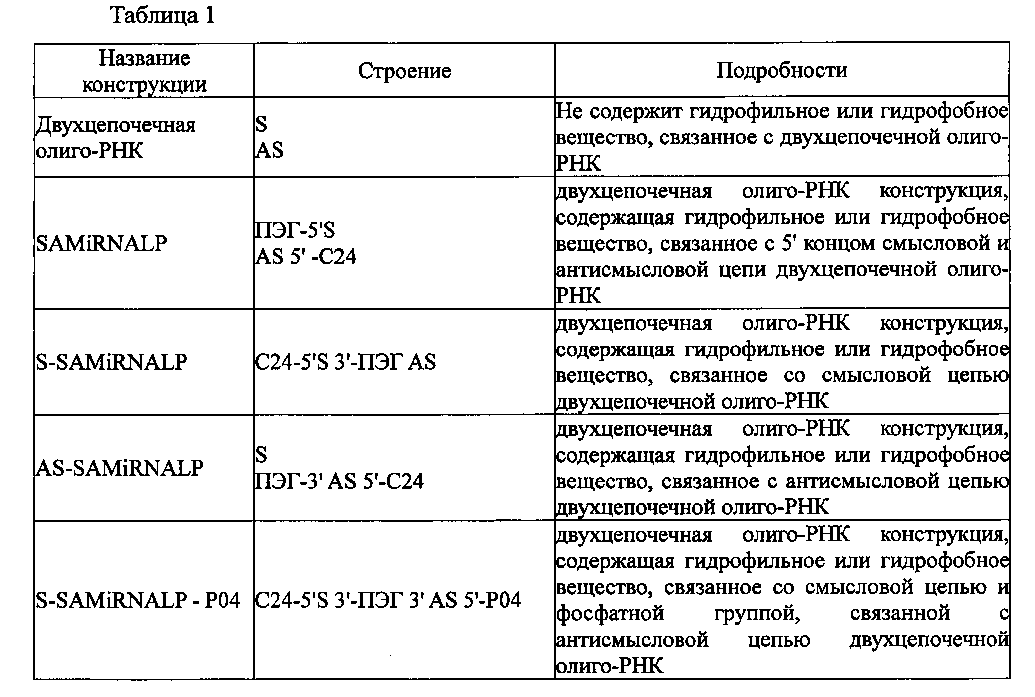
В таблице 1 S является смысловой цепью двухцепочечной олиго-РНК; AS является антисмысловой цепью двухцепочечной олиго-РНК; РO4 является фосфатной группой; ПЭГ является гидрофильным веществом - полиэтиленгликолем; С24 является гидрофобным веществом - тетракозаном, содержащим дисульфидную связь; и 5′ и 3′ означают направления концов двухцепочечной олиго-РНК.
Синтез смысловой цепи двухцепочечной олиго-РНК конструкции осуществляли, используя β-цианоэтилфосфорамидит, чтобы соединить простые фосфодиэфирные связи, тем самым создавая конфигурацию каркаса РНК, как описано выше, и полиэтиленгликоль (ПЭГ) дополнительно связывали с его 5′ концевым участком, тем самым изготовляя смысловую цепь SAMiRNALP двухцепочечной олиго-РНК конструкции.
Когда получали антисмысловую цепь, которая гибридизуется со смысловой цепью двухцепочечной олиго-РНК конструкции, ее синтез осуществляли, используя β-цианоэталфосфорамидит, чтобы соединить простые фосфодиэфирные связи, тем самым создавая конфигурацию каркаса РНК, как описано выше, затем тетракозан (С24), содержащий дисульфидную связь, который является гидрофобным веществом, дополнительно связывали с его 5′ концевым участком, тем самым изготовляя антисмысловую цепь SAMiRNALP.
Желаемую смысловую цепь S-SAMiRNALP изготавливали путем проведения реакции, где 3′ полиэтиленгликоль (ПЭГ)-CPG, изготовленный в согласно примеру 1 другого документа на ту же тему (Korean Patent Laid-Open Publication No. 2009-0042297) использовался как подложка, чтобы синтезировать конструкцию двухцепочечная олиго-РНК - гидрофильное вещество, содержащую смысловую цепь, содержащую ПЭГ, связанную с его 3′ концевым участком, и связывание тетракозана(С24), содержащего дисульфидную связь, с 5′ концом. Когда получали антисмысловую цепи, которая гибридизуется со смысловой цепью S-SAMiRNALP, где последовательность антисмысловой цепи комплементарна последовательности смысловой цепи, использовали способ, где применяется β-цианоэтилфосфорамидит, чтобы соединить простые фосфодиэфирные связи, тем самым создавая конфигурацию каркаса РНК, как описано выше.
Смысловая цепь AS-SAMiRNALP была изготовлена способом, где используют β-цианоэтилфосфорамидит, чтобы соединить простые фосфодиэфирные связи, тем самым создавая конфигурацию каркаса РНК, как описано выше.
Желаемая антисмысловая цепь, которая гибридизуется со смысловой цепью AS-SAMiRNALP, была изготовлена путем проведения реакции, где 3′ полиэтиленгликоль (ПЭГ)-CPG, который был изготовлен как показано в примере 1 другого документа на ту же тему (Korean Patent Laid-Open Publication No. 2009-0042297) использовался как подложка, чтобы синтезировать двухцепочечную олиго-РНК - гидрофильное вещество конструкцию содержащую антисмысловую цепь, содержащую ПЭГ, связанный с его 3′ концевым участком, и связывание тетракозана(С24), содержащего дисульфидную связь, с 5′ концом.
Чтобы до максимума увеличить эффект двухцепочечной олиго-РНК, S-SAMiRNALP-PO4 содержит смысловую цепь, содержащую связанные с ней гидрофильные вещества и гидрофобные вещества, и антисмысловую цепь, содержащую фосфатную группу, связанную ее 5′ концевым участком.
Смысловая цепь S-SAMiRNALP-PO4 была изготовлена тем же способом, что и смысловая цепь S-SAMiRNALP, и антисмысловая цепь, которая гибридизуется с S-SAMiRNALP-PO4, содержащей фосфатную группу, связанную с 5′ концом, была изготовлена путем проведения реакции с использованием β-цианоэтилфосфорамидита, чтобы соединить простые фосфодиэфирные связи, тем самым создавая конфигурацию каркаса РНК, как описано выше, и затем с помощью реагента химического фосфорилирования (CPR), который является [3-(4,4′диметокситритилокси)-2,2-дикарбоксиэтил]пропил-(2-цианоэтил)-(N,N-диизопропил)-фосфорамидитом, чтобы присоединить фосфатную группу к 5′ концу (см. фиг. 2). Другими словами, антисмысловая цепь S-SAMiRNALP-PO4, содержащая фосфатную группу, связанную с ней, была изготовлена путем использования способа, в котором одиночные цепи РНК накапливаются на подложке CPG и обрабатываются фосфорилирующим ферментом (киназой), чтобы связать фосфатную группу с 5′ концом.
Когда синтез был завершен, синтезированные одиночная цепь РНК и РНК-полимерная конструкция были отделены от подложки CPG с помощью 28% (об./об.) аммония на водяной бане при 60°C и защитную функциональную группу удаляли реакцией снятия защиты. Одиночная цепь РНК и РНК-полимерная конструкция, из которых была удалена защитная функциональная группа, обрабатывались N-метилпироллидоном, триэтиламином и триэтиламинтригидрофторидом при объемном соотношении 10:3:4, в печи при 70°С, чтобы удалить 2′ ТБДМС(терт-бутилдиметилсилил).
В дополнение, чтобы связать лиганд с концевым участком гидрофильного полимера двухцепочечной олиго-РНК конструкции, функциональные группы, способные к связыванию лиганда, были связаны с 3′ CPG, гидрофильный полимер был присоединен туда же, и была проведена реакция, тем самым была получена смысловая цепь SAMiRNALP, к которой может быть присоединен лиганд. Более подробно, 3′ амино-ПЭГ-РНК была синтезирована с использованием реагента ПЭГ фосфорамидита в амино-CPG содержащих функциональных группах, таких, как аминогруппы и т.п., связанные с ней, и гидрофобного вещества, такого, как С24, которое было присоединено к 3′ амино-ПЭГ-РНК олиго, чтобы синтезировать 3′ амино-ПЭГ-РНК-С24, с последующей обработкой 28% (об./об.) аммонием на водяной бане при 60°C, чтобы отделить синтезированные одиночную цепь РНК и РНК-полимерную конструкцию от CPG, и защитную функциональную группу удаляли реакцией снятия защиты. Одиночная цепь РНК и РНК-полимерная конструкция, из которых была удалена защитная функциональную группа, обрабатывались N-метилпироллидоном, триэтиламином и триэтиламинтригидрофторидом при объемном соотношении 10:3:4, в печи при 70°C, чтобы удалить 2′ ТБДМС(терт-буталдиметилсилил). Собранная 3′ амино-ПЭГ-РНК-С24 была подвергнута реакции этерификации с поддающимся связыванию лигандным веществом, состоящим из N-гидроксисукцинимидного лиганда, чтобы синтезировать 3′ связанную с лигандом ПЭГ-РНК-С24 олиго. Одиночная цепь РНК, РНК-полимерная конструкция, и РНК-полимерная конструкция, содержащая присоединенный к ней лиганд, были отделены от реактанта методом ВЭЖХ, и их молекулярная масса была измерена методом MALDI-TOF-MS (SHIMADZU, Japan), чтобы подтвердить, соответствуют или нет последовательность и РНК-полимерная конструкция тем, которые должны были быть синтезированы.
Затем, чтобы изготовить каждую двухцепочечную олиго-РНК конструкцию, смысловую цепь и антисмысловую цепь в эквивалентных количествах смешивали друг с другом и помещали в 1X ренатурирующий буфер (30 мМ ГЭПЭС, 100 мМ ацетата калия, 2 мМ ацетата магния, рН от 7.0 до 7.5), с последующим проведением реакции при постоянной температуре 90°C на водяной бане в течение 3 минут и затем проведением реакции при 37°C, тем самым изготавливая желаемую SAMiRNALP и желаемую S-SAMiRNALP-PO4, содержащую фосфатную группу, связанную с ней, соответственно. Гибридизацию изготовленной SAMiRNALP подтверждали электрофорезом.
Пример 2. Анализ физических свойств наночастицы (SAMiRNA), состоящей из SAMiRNALP
S-SAMiRNALP и S-SAMiRNALP-PO4 образуют наночастицу, которая является мицеллой, путем гидрофобного взаимодействия между гидрофобными веществами, связанными с концом двухцепочечной олиго-РНК (см. фиг. 1).
Образование наночастицы (SAMiRNA), состоящей из соответствующих SAMiRNALP, было подтверждено путем анализа размера наночастиц, критической концентрации мицеллы (ККМ) и трансмиссионной электронной микроскопией (ТЭМ) частицы S-SAMiRNALP, изготовленной в примере 1 выше.
Пример 2-1. Измерение размера частицы и индекса полидисперсности (ИПД) наночастицы, состоящей из SAMiRNALP
Размер наночастицы измеряли с помощью зета-потенциала. Подробнее, SAMiRNALP растворяли в 1,5 мл фосфатного солевого буфера Дульбекко (ФСБД) так, чтобы иметь концентрацию 50 мкг/мл, и затем обрабатывали ультразвуковым гомогенизатором (Wiseclean, DAIHAN, Корея) так, чтобы размер наночастиц стал единообразным (700 Вт; амплитуда: 20%). Размер гомогенизированной наночастицы измеряли с помощью зета-потенциала (Nano-ZS, MALVERN, England) в условиях, в которых показатель преломления к веществу составил 1,459, индекс адсорбции - 0,001 и температура растворителя: ФСБ - 25°C и соответствующие вязкость и показатель преломления составили 1,0200 и 1,335 соответственно. Одно измерение проводили в 20 повторах, и затем повторяли трижды.
Было подтверждено, что наночастица, состоящая из S-SAMiRNALP, имеет размер около 150 нм и ИДП около 0,4 (см. фиг. 3(A)). Поскольку ИДП низкий, соответствующие частицы распределены единообразно, и, следовательно, может придти к выводу, что наночастица, состоящая из S-SAMiRNALP, имеет относительно однородный размер. Было подтверждено, что наночастица, состоящая из конструкций, имеет размер, подходящий для того, чтобы попасть в клетку путем эндоцитоза (Nanotoxicology: nanoparticles reconstruct lipids.Nat. Nanotechnol. 2009 Feb; 4(2):84-5).
Пример 2-2. Измерение критической концентрации мицеллы (ККМ) наночастицы, состоящей из SAMiRNALP
Амфифилом, содержащим как гидрофобные вещества, так и гидрофильные вещества в одной молекуле, может быть поверхностно активное вещество (ПАВ), причем если ПАВ растворен в водном растворе, его гидрофобные группы движутся в направлении центра, чтобы предотвратить контакт с водой, а его гидрофильные группы движутся в направлении наружной стороны, чтобы образовать мицеллу. Концентрация, при которой изначально формируется мицелла, называется критической концентрацией мицеллы (ККМ). Способ измерения ККМ с помощью флуоресцентного пигмента основан на свойствах флуоресцентного пигмента, где угол кривой графика интенсивности флуоресценции быстро изменяется до/после того, как образуется мицелла.
Чтобы измерить ККМ наночастицы, состоящей из S-SAMiRNALP, 0,04 мМ ДФГ (1,6-дифенил-1,3,5-гексатриен, SIGMA, USA) была использован в качестве флуоресцентного пигмента. 1 нмоль/мл S-SAMiRNALP разбавляли до концентрации от 0,0977 мкг/мл до максимум 50 мкг/мл с помощью ФСБД на каждом этапе, чтобы изготовить образцы S-SAMiRNALP, имеющие суммарный объем 180 мл. 20 мл 0,04 мМ ДФГ и метилового спирта, который служил растворителем ДФГ для контрольной группы, добавляли к приготовленным образцам, соответственно, и тщательно смешивали, и обрабатывали ультразвуковым гомогенизатором (Wiseclean, DAIHAN, Корея) согласно способу из примера 2-1, так, чтобы размер наночастиц стал единообразным (700 Вт; амплитуда: 20%). Гомогенизированные образцы оставляли для взаимодействия при комнатной температуре без доступа света в течение 24 часов, и измеряли значения флуоресценции (возбуждение: 355 нм, испускание: 428 нм, верхнее считывание). Чтобы подтвердить относительные значения флуоресценции среди измеренных значений флуоресценции, значение флуоресценции образца, содержащего ДФГ, и значение флуоресценции образца, содержащего только метанол (ось Y), измеряли и отображали в виде графика по отношению к логарифмическому значению обработанной концентрации S-SAMiRNALP (ось X) (см. фиг. 3(B)).
Значение флуоресценции, измеренное для каждой концентрации, быстро повышалось, в то же время перемещаясь от отрезка с низкой концентрацией до отрезка с высокой концентрацией, при этом концентрация в быстро повышающейся точке является ККМ концентрацией. Следовательно, если нарисовать тренды путем разделения отрезка с низкой концентрацией, в котором интенсивность флуоресценции не повышается, и отрезка с высокой концентрацией, в котором интенсивность флуоресценции повышается, на несколько отрезков, значение X в точке пересечения двух трендов является ККМ концентрацией. Наблюдали, что измеренная ККМ наночастицы, состоящей из S-SAMiRNALP составляет 2,53 мкг/мл, что довольно мало, и, таким образом, было подтверждено, что мицелла может быть образована наночастицей, состоящей из S-SAMiRNALP даже при достаточно малой концентрации.
Пример 2-3. Исследование наночастицы, состоящей из SAMiRNALP, методом ТЭМ
Наночастицу, состоящую из S-SAMiRNALP, исследовали методом ТЭМ, чтобы подтвердить ее форму.
Подробно, SAMiRNALP растворяли в ФСБД так, чтобы иметь конечную концентрацию 100 мкг/мл и обрабатывали ультразвуковым гомогенизатором (Wiseclean, DAIHAN, Корея) так, чтобы размер наночастиц стал единообразным (700 Вт; амплитуда: 20%). Наночастицу, состоящую из S-SAMiRNALP, исследовали с помощью вещества, имеющего высокую электронную плотность, способом негативного окрашивания (см. фиг. 3(C)).
Было подтверждено, что наночастица, исследуемая методом ТЭМ, хорошо сформирована и имеет размер, сходный с размером наночастицы, измеренной в примере 2-1.
Пример 3. Ингибирование экспрессии целевого гена в опухолевой клеточной линии с использованием наночастицы, состоящей из SAMiRNALP
Экспрессию гена сурвивина в трансфицированной опухолевой клеточной линии анализировали с использованием наночастиц, состоящих из SAMiRNALP, S-SAMiRNALP, или AS-SAMiRNALP, изготовленных в примере 1 выше.
Пример 3-1. Культура опухолевой клеточной линии
10% (об./об.) фетальной бычьей сыворотки, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина добавляли к культуральной среде ЕМЕМ (разработанная АТСС минимальная поддерживающая среда Игла), содержащей клетки линии HeLa приобретенные в Американской коллекции типовых культур (АТСС) и культивировали при 37°C и 5% (об./об.) СO2.
Пример 3-2. Трансформация опухолевой клеточной линии с использованием наночастицы, состоящей из SAMiRNALP
Опухолевую клеточную линию (1.3×105), из примера 3-1 выше, культивировали в 6-луночном планшете на среде ЕМЕМ в течение 18 часов в тех же самых условиях, как в примере 3-1 выше, среду удаляли, и эквивалентное количество среды Opti-MEM помещали в каждую лунку.
100 мл среды Opti-MEM и 50 мкг/мл SAMiRNALP, S-SAMiRNALP и AS-SAMiRNALP добавляли к ФСБД, и затем обрабатывали ультразвуковым гомогенизатором (Wiseclean, DAIHAN, Корея) согласно тому же способу, что в примере 2-1, чтобы тем самым гомогенизировать (700 Вт; амплитуда: 20) каждую наночастицу, состоящую из SAMiRNALP, S-SAMiRNALP и AS-SAMiRNALP, тем самым получая растворы. Затем, каждую лунку с опухолевой клеточной линией, в которые добавлена среда Opti-MEM, обрабатывали трансфекционным раствором при концентрации 100 нМ и 200 нМ, и культивировали при 37°C и 5% (об./об.) СO2 всего в течение 48 часов.
Пример 3-3. Относительный количественный анализ мРНК гена сурвивина
Тотальную РНК экстрагировали из трансфицированной клеточной линии из примера 3-2 выше, синтезировали кДНК и количество экспрессии мРНК сурвивина подвергали относительному количественному анализу методом ПЦР в реальном времени, согласно способу, раскрытому в Korean Patent Laid-Open Publication No. 2009-0042297 (см. фиг. 4).
Наночастица, состоящая из AS-SAMiRNALP, в которой компоненты конструкции связаны только с антисмысловой цепью, присоединенной к целевой мРНК в двухцепочечной олиго-РНК конструкции, проявляет низкую эффективность ингибирования по сравнению с наночастицей, состоящей из SAMiRNALP. Наночастица, состоящая из S-SAMiRNALP, в которой компоненты конструкции связана только со смысловой цепью, противоположно описанному выше случаю с наночастицей, состоящей из AS-SAMiRNALP, проявляет высокую эффективность ингибирования даже при низкой концентрации по сравнению с наночастицей, состоящей из SAMiRNALP (см. фиг. 4).
Sur584 означает SAMiRNALP, содержащую двухцепочечную олиго-РНК последовательность (SEQ ID NO: 1), специфичную к целевому гену сурвивина, согласно каждой из конструкций SAMiRNALP, и CON означает SAMiRNALP, включающую в себя последовательность контрольной группы (SEQ ID NO: 2), не влияющую на экспрессию целевого гена. Степень ингибирования экспрессии мРНК целевого гена рассчитывали с помощью количества экспрессии целевого гена образца, обработанного Sur584, по отношению к количеству экспрессии целевого гена образца, обработанного CON методом сравнительного количественного анализа.
Наночастица, состоящая из S-SAMiRNALP, которая является оптимизированной конструкцией, хорошо доставлялась в клетку без трансфекционного материала и таким образом наблюдался эффект ингибирования экспрессии мРНК целевого гена, который подтверждает, что эффект от двухцепочечной олиго-РНК примерно в три раза или более выше (группы наночастиц, состоящих из SAMiRNALP - 23,4% ингибирования против группы наночастиц, состоящих из S-SAMiRNALP - 77% ингибирования) при обработке 100 нМ, по сравнению с наночастицей, состоящих из SAMiRNALP. В дополнение, наблюдали, что наночастицы экспериментальной группы, состоящей из AS-SAMiRNALP, в которой все конструкции присоединены к антисмысловой цепи, которая является группой негативного контроля, имеет низкий эффект ингибирования экспрессии мРНК целевого гена даже при высокой концентрации.
Пример 4. Ингибирование экспрессии целевого гена в опухолевой клеточной линии с использованием SAMiRNALP
Каждую из S-SAMiRNALP последовательности SEQ ID NO: 1 и S-SAMiRNALP-РO4 последовательности SEQ ID NO: 2, изготовленные в примере 1 выше, использовали в качестве трансфекционного материала для трансфицирования клеток HeLa, и затем анализировали экспрессию сурвивина в трансфицированной опухолевой клеточной линии.
Пример 4-1. Трансфекция опухолевой клеточной линии с использованием SAMiRNALP
Опухолевую клеточную линию (1.3×105), из примера 3-1 выше, культивировали на 6-луночном планшете на среде ЕМЕМ в течение 18 часов в тех же самых условиях, как в примере 3-1 выше, среду удаляли, и помещали 800 мл среды of Opti-MEM в каждую лунку.
В то же время, 2 мл LipofectamineTM RNAiMax (Invitrogen, USA) и 198 мл среды Opti-MEM смешивали и оставляли взаимодействовать при комнатной температуре в течение 5 минут, и обрабатывали каждым из S-SAMiRNALP и S-SAMiRNALP-PO4 (25 пмоль/мл), изготовленным в примере 1 выше, так, чтобы иметь итоговую концентрацию 0,2, 1 и 5 нМ соответственно, с последующим взаимодействием при комнатной температуре в течение 20 минут, тем самым изготовляя раствор.
Затем 200 мл каждого трансфекционного раствора помещали в каждую лунку, содержащую опухолевую клеточную линию в которую добавили среду Opti-MEM, и культивировали в течение 6 часов, и удаляли среду Opti-MEM. Здесь 2,5 мл культуральной среды ЕМЕМ помещали на нее и культивировали при 37°C и 5%(об./об.) CO2 в течение 24 часов.
Пример 4-2. Относительный количественный анализ мРНК гена сурвивина
Тотальную РНК экстрагировали из трансфицированной клеточной линии, полученной в примере 4-1 выше, синтезировали кДНК и количество экспрессии мРНК гена сурвивина анализировали, основываясь на относительном количественном анализе методом ГЩР в реальном времени, согласно способу, раскрытому в Korean Patent Laid-Open Publication No. 2009-0042297.
Чтобы проанализировать влияние ингибирования экспрессии целевого гена частицами S-SAMiRNALP и S-SAMiRNALP-PO4, проводили трансформацию трансфекционным материалом, и измеряли степень экспрессии мРНК гена сурвивина. Таким образом было подтверждено, что случаи, обработанные частицами S-SAMiRNALP и S-SAMiRNALP-PO4, показывают эффект ингибирования экспрессии целевого гена, сходный с таковым «голой» двухцепочечной олиго-РНК, в которой ничего не связано с концом двухцепочечной олиго-РНК. S-SAMiRNALP-PO4 проявляла относительно высокую эффективность ингибирования экспрессии по сравнению с S-SAMiRNALP, и в частности, высокий эффект ингибирования экспрессии целевого гена был проявлен при низкой концентрации 0,2 нМ (см. фиг. 5). Наблюдали, что РНК конструкция, содержащая S-SAMiRNALP полимер, связанный с ней, не ингибируют систему действия РНКи, и в частности, и S-SAMiRNALP-PO4, и влияние двухцепочечной олиго-РНК повышается путем дополнительного связывания с фосфатной группой.
Промышленная применимость
Двухцепочечная олиго-РНК конструкция или содержащая ее фармацевтическая композиция, по настоящему изобретению, могут быть эффективно использованы для лечения различных заболеваний, и в частности, могут проявлять РНК-ингибирующую активность с высокой эффективностью даже при низкой концентрации SAMiRNA и могут быть использованы как средство лечения рака или инфекционных заболеваний и т.п.