СПОСОБ НАНЕСЕНИЯ ПОКРЫТИЯ НА НАНОЧАСТИЦЫ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу нанесения покрытия связывающего компонента на наночастицы, в результате чего требуется меньшее количество связывающего компонента. В определенных осуществлениях изобретение предлагает способы покрытия наночастиц одним слоем связывающего компонента, например, белка. В частности, изобретение относится к способу покрытия наночастиц одним слоем белка, в котором требуются лишь небольшие количества белка.
Известный уровень техники
Наночастицы в настоящее время широко используется во многих применениях, в медицинских и биомедицинских науках, таких как доставка лекарственных средств, лечение и диагностика. Для многих из этих применений наночастицы покрыты белками. Наночастицы покрытые белками, такими как антитела к раковым клеткам, могут быть использованы, например, для обнаружения раковых клеток в организме. Аналогично для анализа in vitro, зонды, такие как антитела, связываются наночастицами, причем детектируется связывание аналита с антителом на наночастице. К тому же, в частности, металлические наночастицы покрытые белками могут быть использованы для передачи события связывания за счет изменения их поглощения, по меньшей мере, в видимой части спектра. Это явление локализованного поверхностного плазменного резонанса (LSPR) обеспечивает контроль взаимодействия биомолекул. Таким образом, металлические наночастицы покрытые белками могут быть использованы при обнаружении взаимодействия антитело-лиганд, рецептор-лиганд, фермент-лиганд и кинетики ассоциации-диссоциации антиген-антитело.
Наночастицы покрытые связывающими компонентами, такими как белки, а также способы покрытия наночастиц были описаны в известном уровне техники. Например, US 2010/0029902 описывает способ покрытия наночастиц, который включает смешивание наночастиц и одного или нескольких типов белков с диспергированным раствором, в котором белки адсорбируются на всей поверхности наночастиц для контроля и предотвращения агрегации наночастиц.
Недостатком известных способов является необходимость в большом количестве связывающего компонента, чтобы полностью покрыть наночастицы. Часто доступны только небольшие количества целевого связывающего компонента.
Кроме того, поскольку некоторые способы известного уровня техники в результате дают наночастицы, покрытые несколькими слоями связывающего компонента, взаимодействие связанного белка с другим соединением происходит на увеличенном расстоянии от поверхности наночастицы, что влияет на силу сигнала в методах обнаружения. В связи с этим существует потребность в создании способов покрытия наночастиц связывающими компонентами, такими как белки, в которых требуются лишь небольшие количества связывающего компонента, и в определенных осуществлениях может быть достигнуто покрытие одним слоем связывающего компонента.
Краткое изложение существа изобретения
Авторы настоящего изобретения нашли способ покрытия наночастиц, который предполагает использование ограниченного количества связывающего компонента. Кроме того, изобретатели нашли способы, которые позволяют наносить целевое покрытие одним слоем связывающего компонента. Таким образом, способы изобретения преодолевают одну или несколько из вышеуказанных проблем известного уровня техники.
В первом аспекте изобретение относится к способам покрытия наночастиц связывающим компонентом, в котором способы включают концентрированно связывающего компонента на поверхности наночастиц. В определенных осуществлениях способ включает обеспечение концентрации связующего агента вблизи наночастицы. В определенных осуществлениях изобретения способы включают обеспечение электростатического взаимодействия между наночастицами и связующим агентом.
В определенных осуществлениях изобретение относится к способам покрытия наночастиц связывающим компонентом, в которых способы включают контактирование указанных наночастиц с неионным, катионным и/или цвиттерионным детергентом до или после контакта наночастиц с раствором указанного связывающего компонента.
Изобретатели установили, что описанные в изобретении способы позволяют покрывать наночастицы ограниченным количеством связывающего компонента. Кроме того, в определенных осуществлениях способы могут быть использованы для получения одного слоя связующего агента, такого как белок, с использованием малых количеств связующего агента. Эти способы, таким образом, являются предпочтительными, потому что часто имеются, например, только небольшие количества целевого белка. Кроме того, в определенных осуществлениях способы настоящего изобретения позволяют контролировать толщину слоя белка на наночастицах. Например, в определенных осуществлениях способы позволяют готовить стабильные наночастицы, покрытые только одним слоем белка. Это представляет особый интерес, например, когда предусмотрено дальнейшее нанесение покрытия другой молекулы на наночастицы, поскольку расстояние от этой молекулы до поверхности наночастицы уменьшается. Кроме того, если необходимо изучить взаимодействие между белком покрытия и другим соединением, расстояние этого взаимодействия от поверхности наночастиц уменьшается, тем самым улучшая оптическое детектирование взаимодействия.
Кроме того, в определенных осуществлениях способы настоящего изобретения обладают преимуществами, когда требуется покрытие при высоких значениях pH. В. отсутствие неионного, катионного и/или цвиттерионного детергента, регулировка до высоких значений pH может привести к агглютинации наночастиц. Определенные осуществления вышеописанных способов также могут обладать преимуществами, когда раствор связующего агента должен быть забуференным. В отсутствие неионного, катионного и/или цвиттерионного детергента, даже небольшие концентрации соли в растворе могут привести к агглютинации наночастиц, особенно, когда связующим агентом является белок. Если наночастицы контактируют с неионным, катионным и/или цвиттерионным детергентом до (и необязательно, во время) нанесения покрытия, агглютинация не происходит даже в присутствии умеренной концентрации соли. Еще одним преимуществом определенных осуществлений способов настоящего изобретения является то, что может быть обеспечено однородное покрытие, даже если белком является небольшое количество белка или небольшое количество пептида. Кроме того, определенные осуществления вышеописанного способа могут обладать преимуществами, когда связующий агент является белком, который агрегатируется перед нанесением покрытия. Инкубация белка с неионным, катионным и/или цвиттерионным детергентом перед нанесением покрытия будет способствовать стабилизации белка в неагрегированной форме, тем самым улучшая получающееся покрытие.
В определенных осуществлениях настоящее изобретение относится к способам, которые включают стадию смешивания раствора, включающего наночастицы, с раствором, включающим связующий агент, в которых указанный раствор, включающий наночастицы и/или указанный раствор, включающий связующий агент, включает указанный неионный, катионный и/или цвиттерионный детергент. Способы настоящего изобретения дополнительно включают контактирование раствора, включающего наночастицы, с раствором, включающим связующий агент, друг с другом так, чтобы обеспечить взаимодействие между указанным связующим агентом и указанными наночастицами. В дальнейших определенных осуществлениях способы изобретения дополнительно включают стадию обеспечения связывания указанных наночастиц с указанным связующим агентом.
В определенных осуществлениях стадия контактирования раствора, включающего наночастицы, с раствором, включающим связующий агент, обеспечивает связывание указанных наночастиц с указанным связующим агентом. В определенных осуществлениях связующий агент является белком и указанный способ включает контактирование указанных наночастиц с указанным белком в присутствии раствора, включающего наночастицы и/или указанный раствор, включающий белки, включает указанный неионный, катионный и/или цвиттерионный детергент, позволяя тем самым белку формировать один слой на поверхности указанных наночастиц.
В определенных осуществлениях настоящее изобретение относится к способам, которые дополнительно включают до нанесения покрытия на указанные наночастицы стадию определения минимального количества белка необходимого для получения стабильных наночастиц в присутствии указанного неионного, катионного и/или цвиттерионного детергента.
В определенных осуществлениях настоящее изобретение относится к способам, как описано выше, в которых указанный неионный детергент выбран из группы, включающей полисорбаты, этоксилаты октилфенола, глюкамины, lubrol, Brij®, Nonidet®, Pluronic®, Genapol® и Igepal®.
В определенных осуществлениях настоящее изобретение относится к способам, как описано выше, в которых указанный катионный детергент выбран из бромида гексадецилтриметиламмония (СТАВ) или бромида триметил(тетрадецил)аммония (ТТАВ).
В определенных осуществлениях настоящее изобретение относится к способам, как описано выше, в которых указанный цвиттерионный детергент выбран из амидосульфобетаинов, алкилбетаинов и аммониопропансульфонатов.
В определенных осуществлениях настоящее изобретение предлагает способы, как описано выше, в которых концентрация указанного неионного, катионного и/или цвиттерионного детергента составляет 0,0001-1% об./об.
В определенных осуществлениях настоящее изобретение относится к способам, как описано выше, в которых количество белка, используемого в покрытии больше, чем минимальное количество белка, необходимого для получения стабильных наночастиц.
В определенных осуществлениях настоящее изобретение относится к способам, как описано выше, в которых указанные наночастицы включают коллоидный проводящий полимер, коллоидный благородный металл, коллоидный металл/проводящий полимерный композит, диоксид кремния или латекс.
В определенных осуществлениях настоящее изобретение относится к способам, как описано выше, в которых указанные наночастицы включают переходный металл, выбранный из Au, Ag, Cu, Ta, Pt, Pd и Rh и, в которых предпочтительно указанный переходный металл является золотом, серебром или медью.
В определенных осуществлениях настоящее изобретение относится к композициям, включающим наночастицы, получаемые одним или несколькими вышеописанными способами.
В определенных осуществлениях настоящее изобретение относится к наборам, включающим наночастицы и инструкции по нанесению покрытия на указанные наночастицы любым вышеописанным способом.
В определенных осуществлениях настоящее изобретение предлагает вышеописанные наборы, которые дополнительно включают неионный, катионный и/или цвиттерионный детергент или раствор, включающий неионный, катионный и/или цвиттерионный детергент.
В определенных осуществлениях настоящее изобретение относится к способам детектирования путем локализованного поверхностного плазменного резонанса взаимодействия соединения с белком, связанным с наночастицами, причем способ включает нанесение покрытия на указанные наночастиц связующего агента, такого как белок, но не ограничивается им, любым вышеописанным способом.
Краткое описание чертежей
Изобретение будет описано, в частности, со ссылкой на прилагаемые чертежи, которые предоставляются только в качестве примера и не должны рассматриваться как ограничивающие объем притязаний настоящего изобретения.
Фиг.1 и 2 демонстрируют влияние неионного детергента Tween 20 на количество белка G, необходимого для стабилизации наночастиц золота (GNP), в соответствии с конкретным осуществлением изобретения.
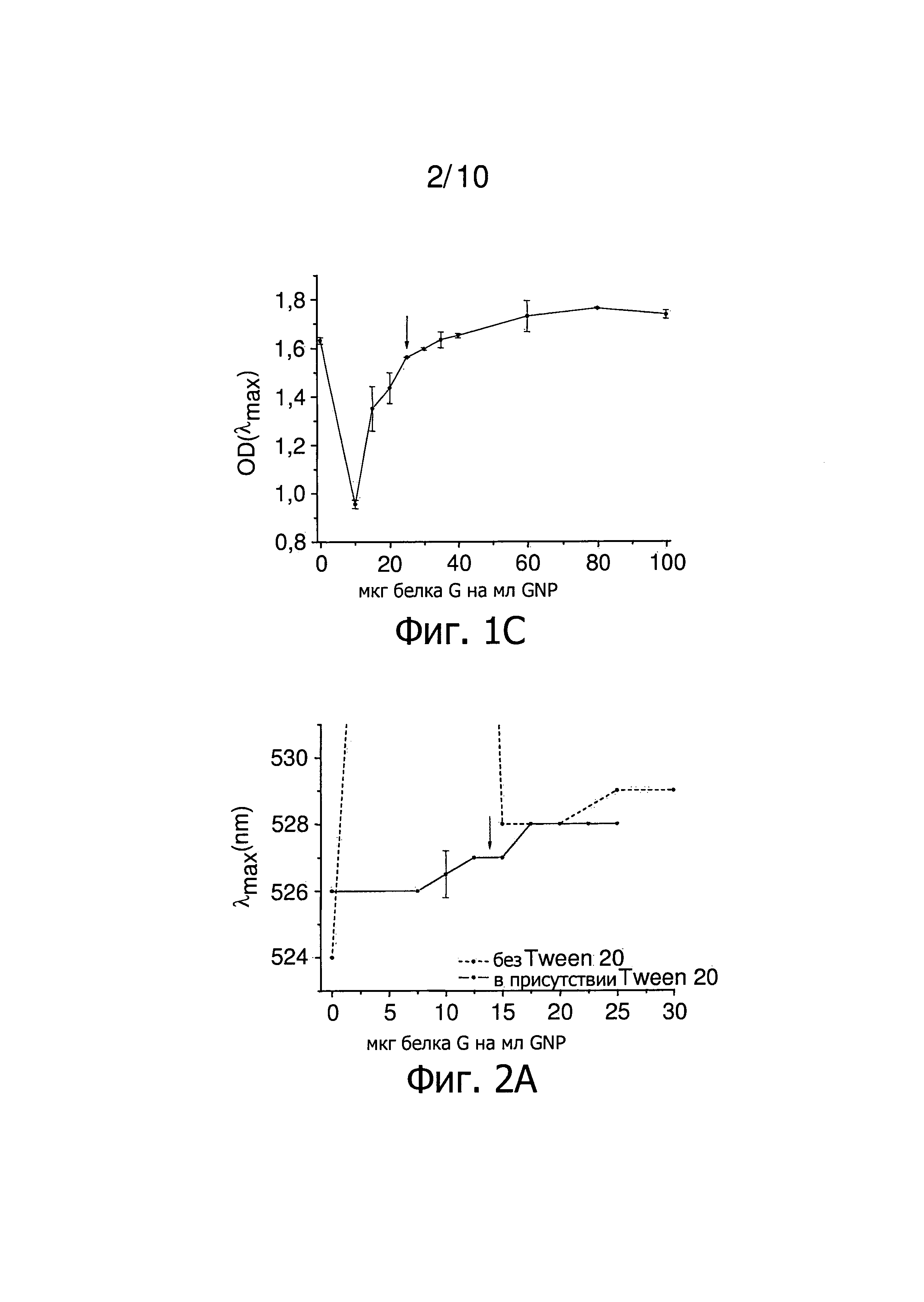
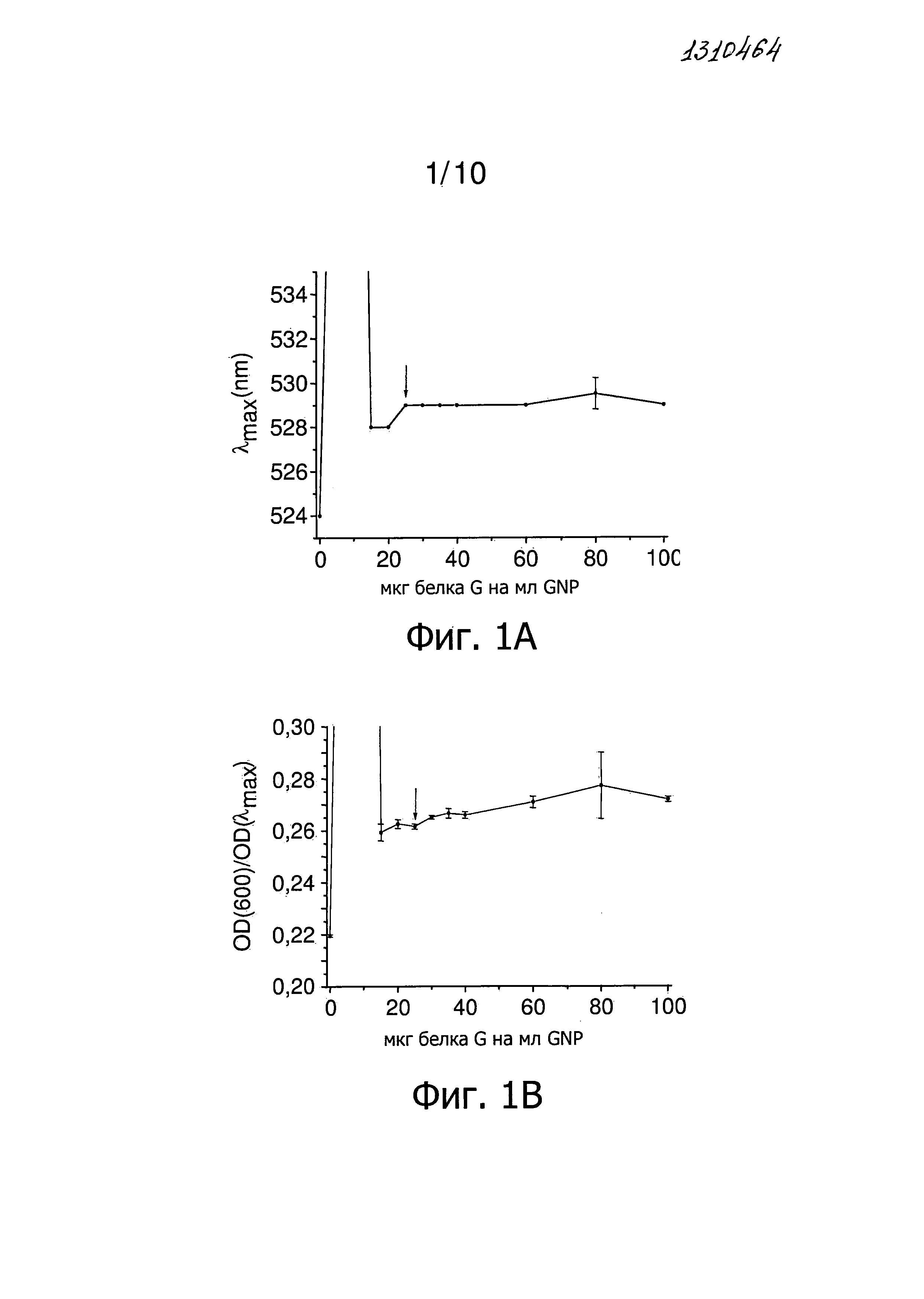
Фиг.1 представляет результаты титрования белка G в отсутствие Tween 20. Стрелка указывает на низкое количество белка G, который стабилизирует GNP. Фиг.1A представляет график зависимости λmax от количества белка G на мл GNP. Фиг.1B представляет зависимость OD(600)/OD(λmax) от количества белка G на мл GNP. Фиг.1C представляет собой участок OD (λmax) от количества белка G на мл GNP.
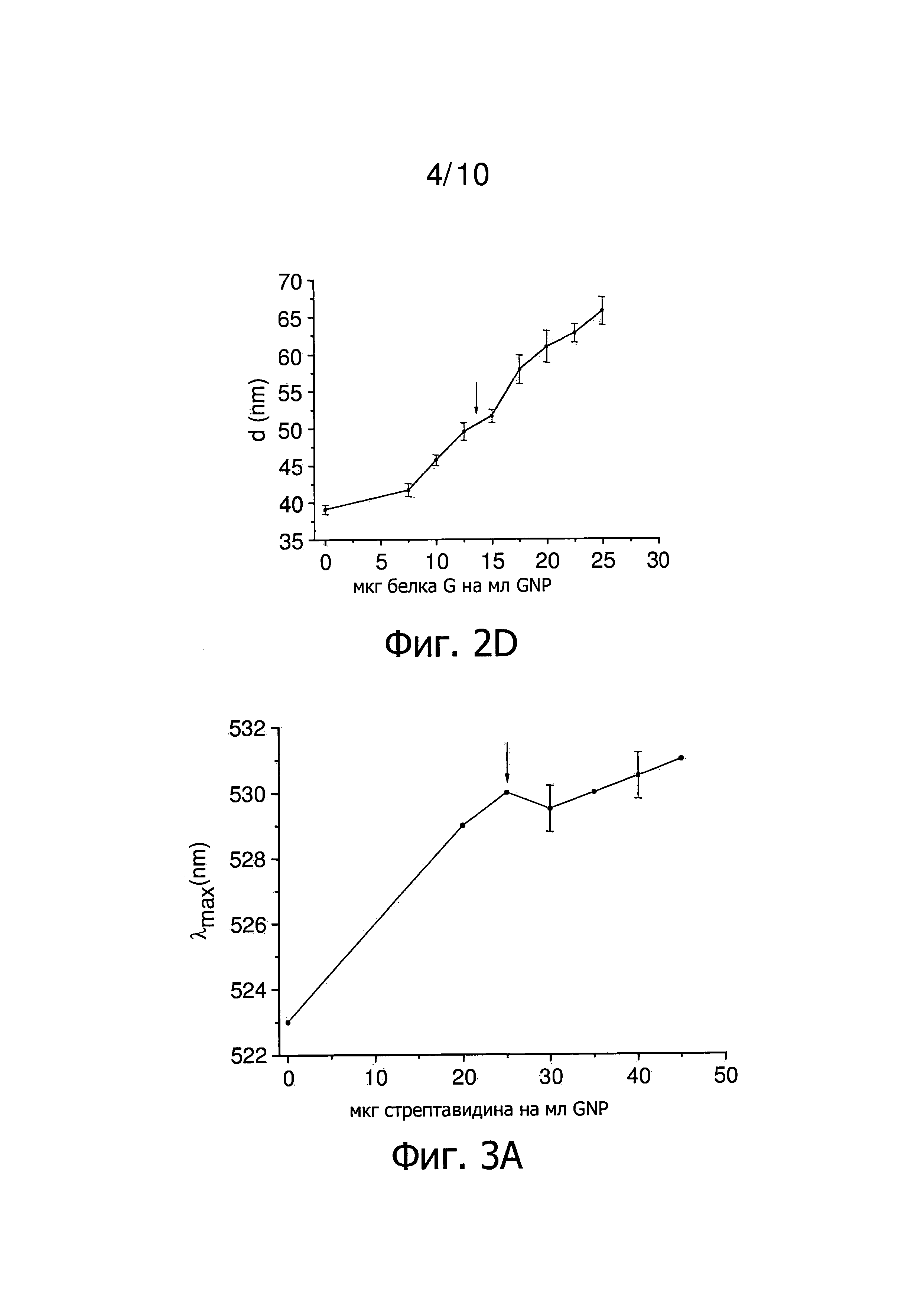
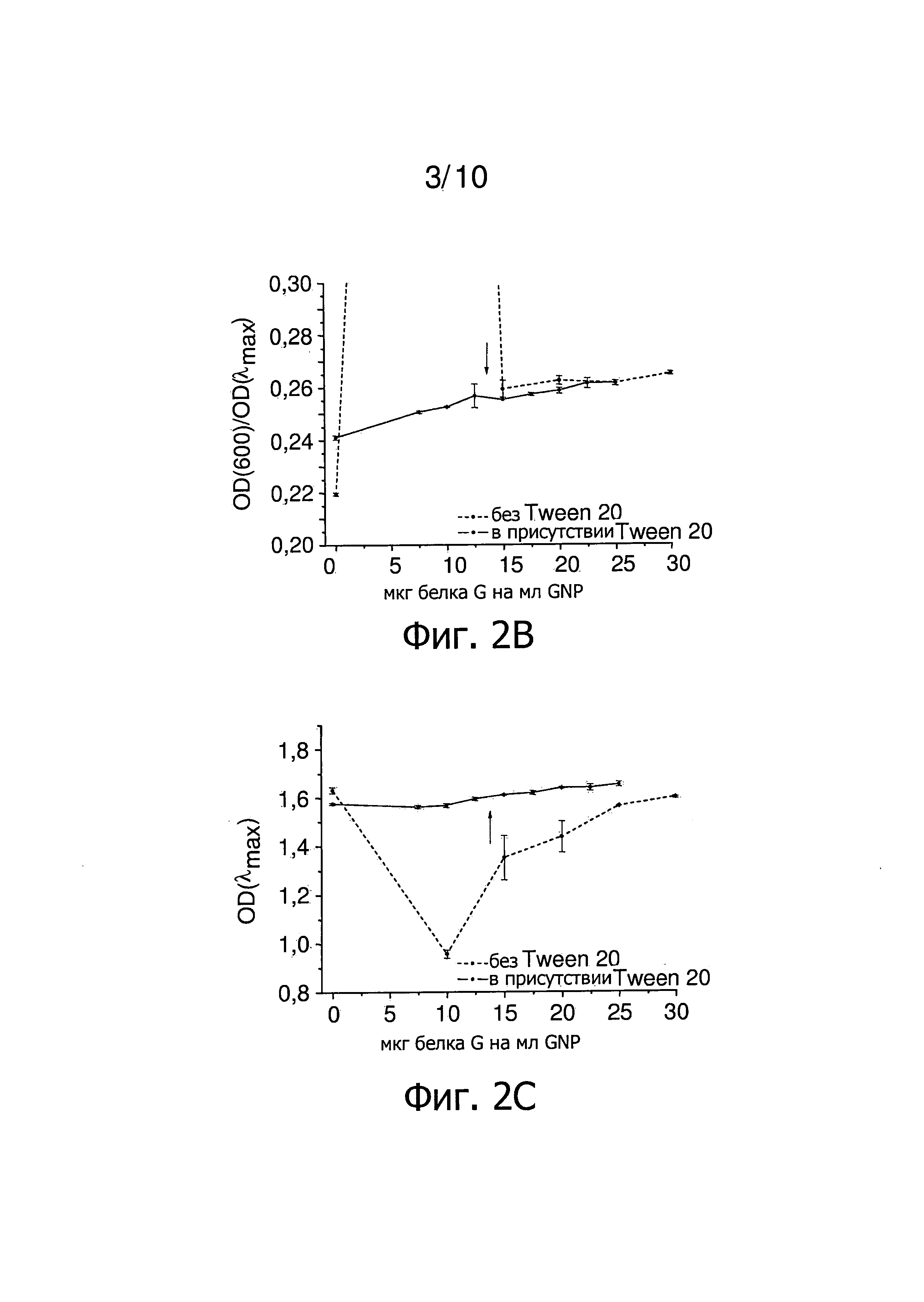
Фиг.2 представляет результаты титрования концентрации белка G в присутствии Tween 20. Стрелка указывает на низкое количество белка G, который стабилизирует GNP. Фиг.2A представляет зависимость λmax от количества белка G на мл GNP. Фиг.2B представляет зависимость OD(600)/OD(λmax) от количества белка G на мл GNP. Фиг.2C представляет зависимость OD(λmax) от количества белка G на мл GNP. Фиг.2D представляет зависимость гидродинамического диаметра GNP от количества белка G на мл GNP.
Фиг.3 и 4 представляют эффект Tween-20 на количество стрептавидина, необходимого для стабилизации наночастиц золота (GNP), в соответствии с конкретным осуществлением изобретения.
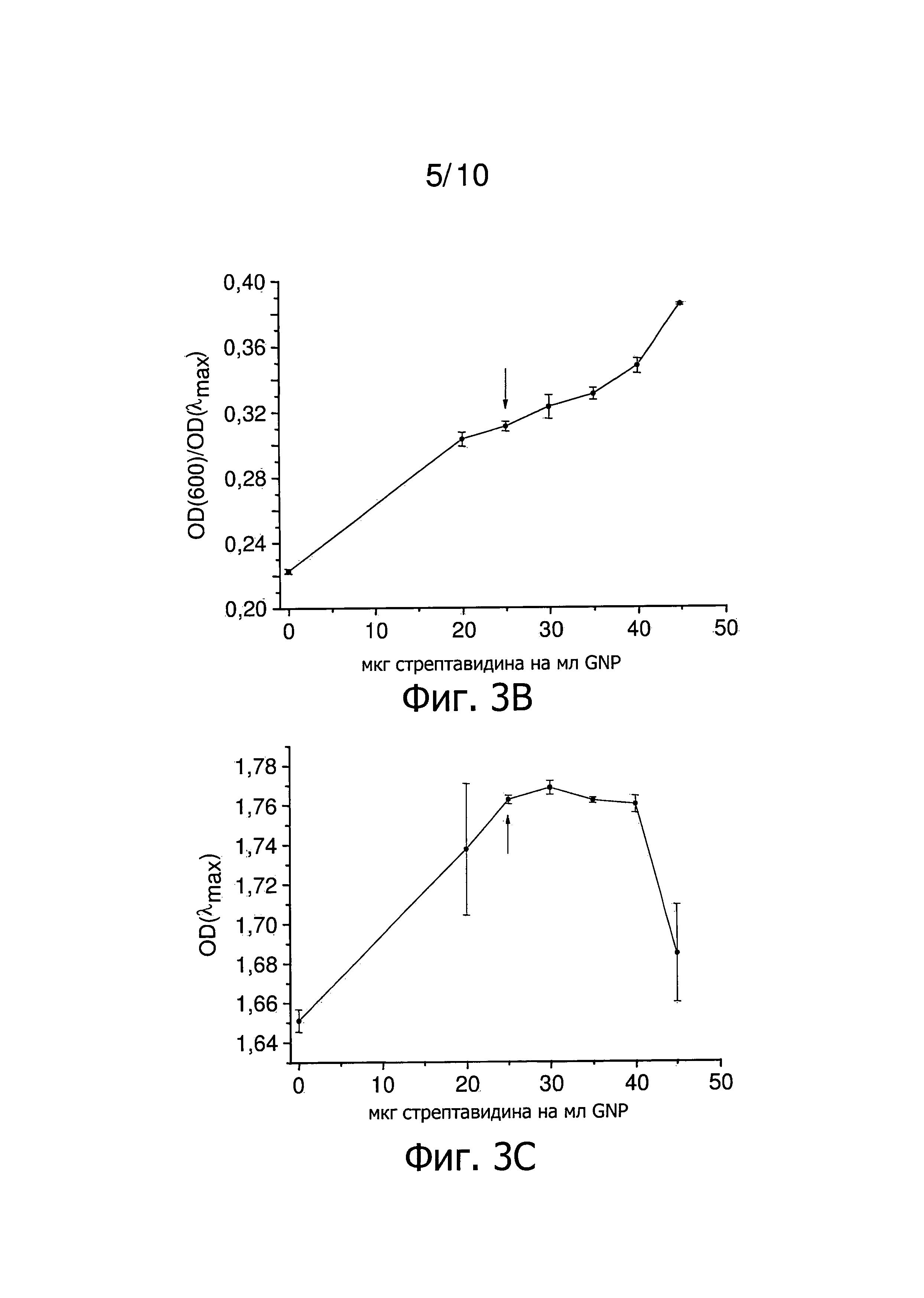
Фиг.3 представляет результаты титрования концентрации стрептавидина в отсутствие Tween 20. Стрелка указывает наименьшее количество стрептавидина, которое стабилизирует GNP. 3A представляет зависимость λmax от количества стрептавидина на мл GNP. Фиг.3B представляет зависимость OD(600)/OD(λmax) от количества стрептавидина на мл GNP. Фиг.3C представляет зависимость OD(λmax) от количества стрептавидина на мл GNP.
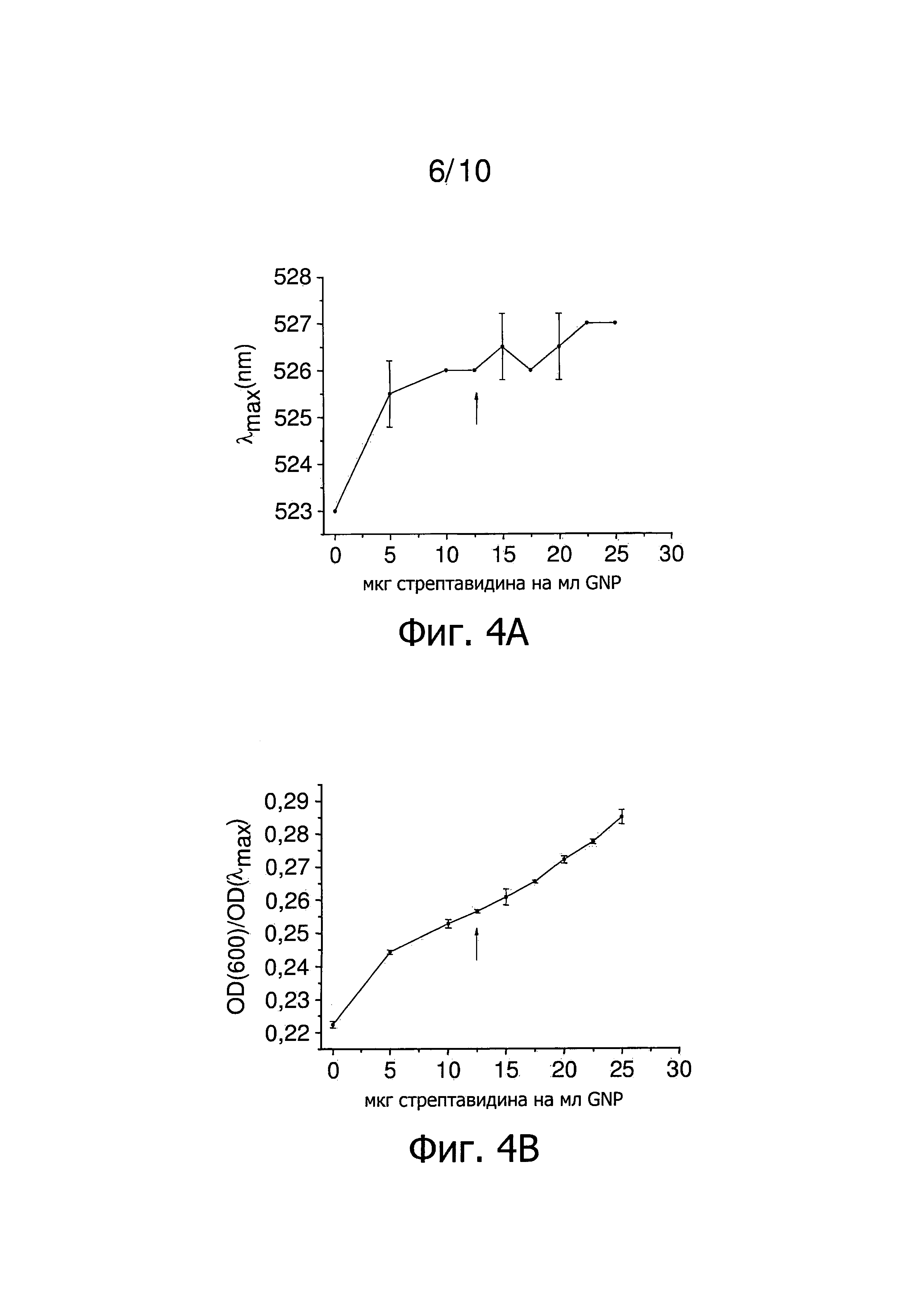
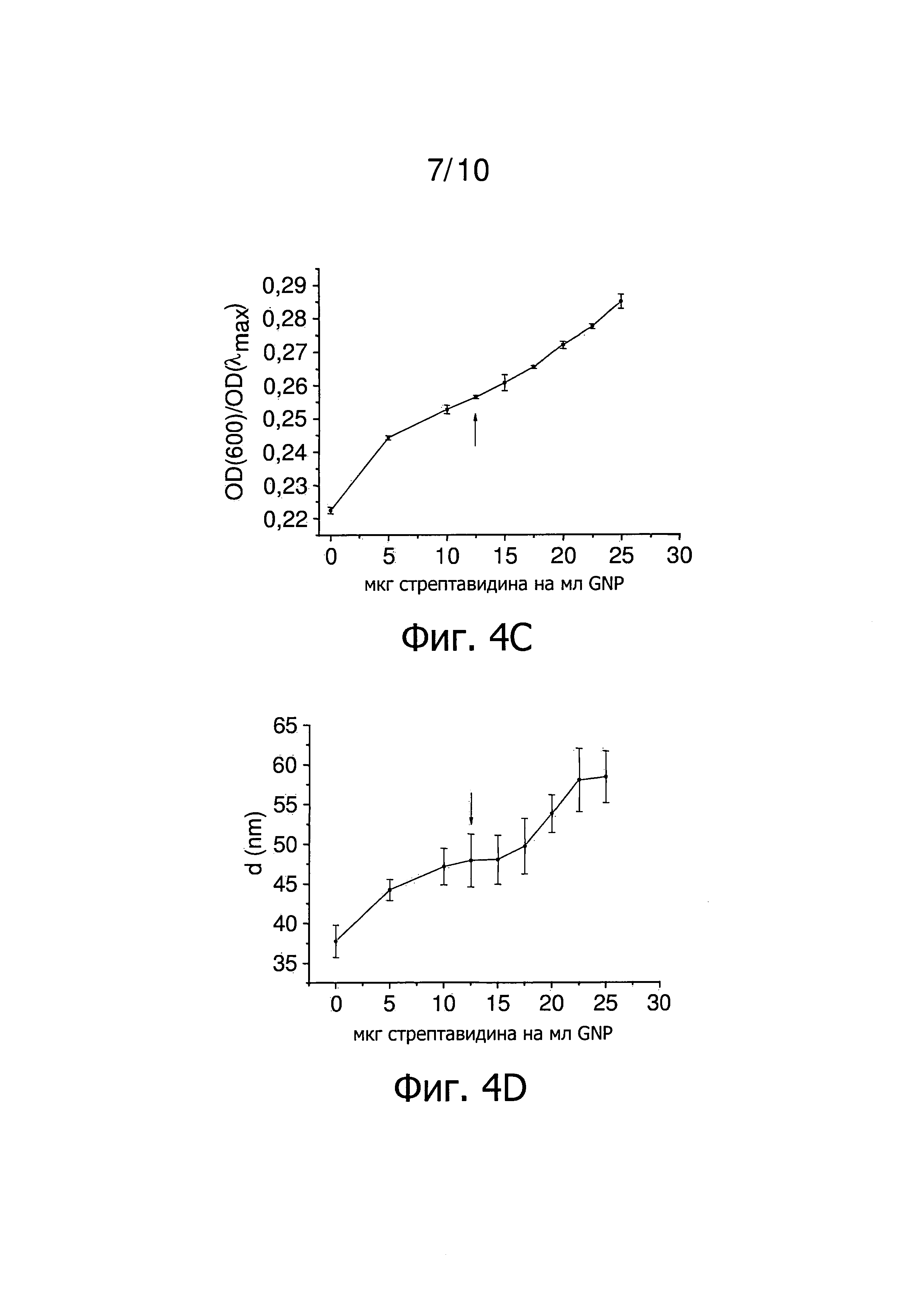
Фиг.4 представляет результаты титрования концентрации стрептавидина в присутствии Tween 20. Стрелка указывает наименьшее количество стрептавидина, которое стабилизирует GNP в присутствии Tween 20. Фиг.4А представляет зависимость λmax от количества стрептавидина на мл GNP. Фиг.4B представляет зависимость OD(600)/OD(λmax) от количества стрептавидина на мл GNP. Фиг.4C представляет зависимость OD(λmax) от количества стрептавидина на мл GNP. Фиг.4D представляет зависимость гидродинамического диаметра GNP от количества стрептавидина на мл GNP.
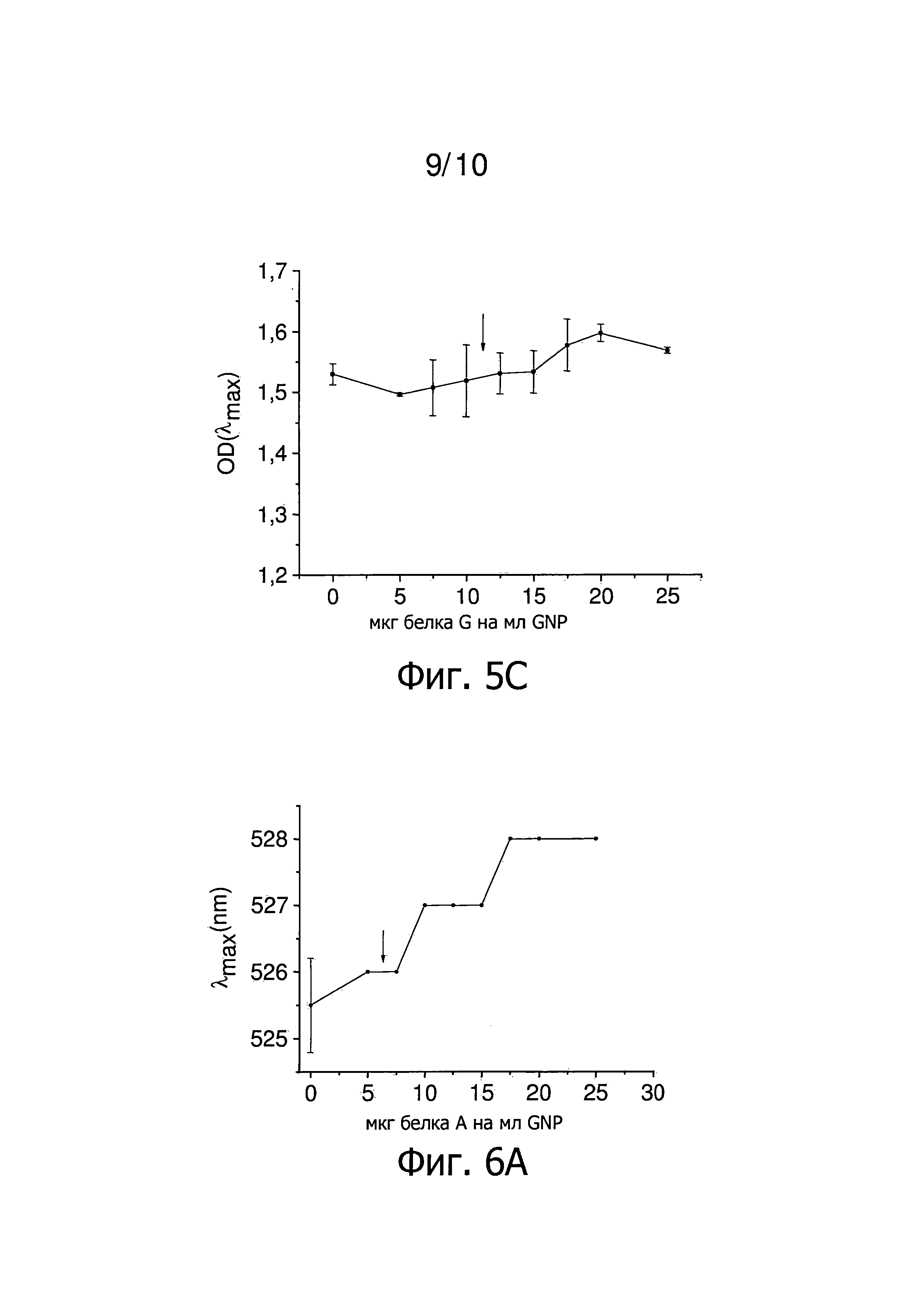
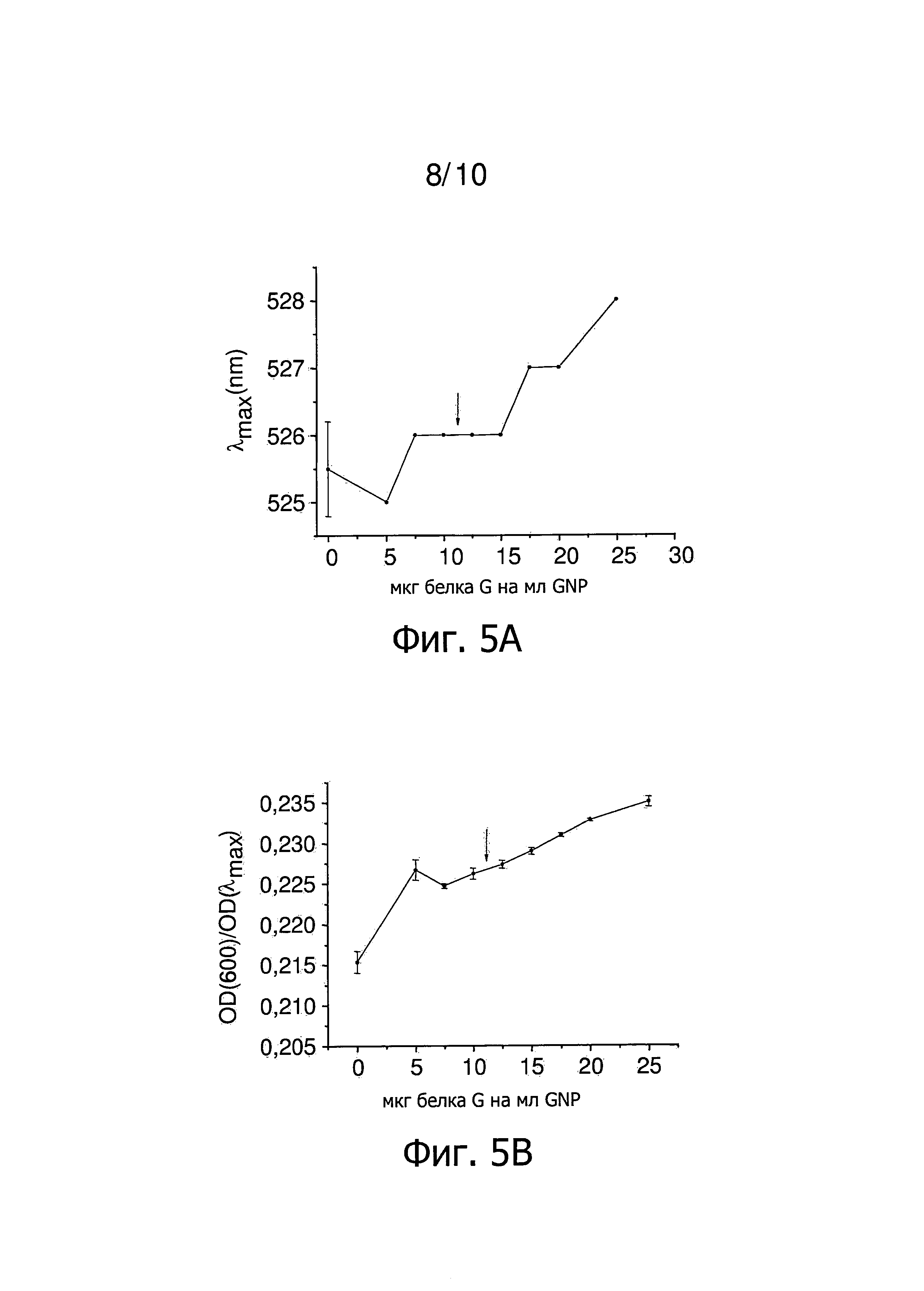
Фиг.5 представляет результаты титрования концентрации GNP, покрытых Tween 20 белком G, в соответствии с конкретным осуществлением изобретения. Стрелка указывает наименьшее количество белка G, которое стабилизирует GNP, покрытые Tween 20. Фиг.5A представляет зависимость λmax от количества белка G на мл GNP. Фиг.5B представляет зависимость OD(600)/OD(λmax) от количества белка G на мл GNP. Фиг.5C представляет зависимость OD(λmax) от количества белка G на мл GNP.
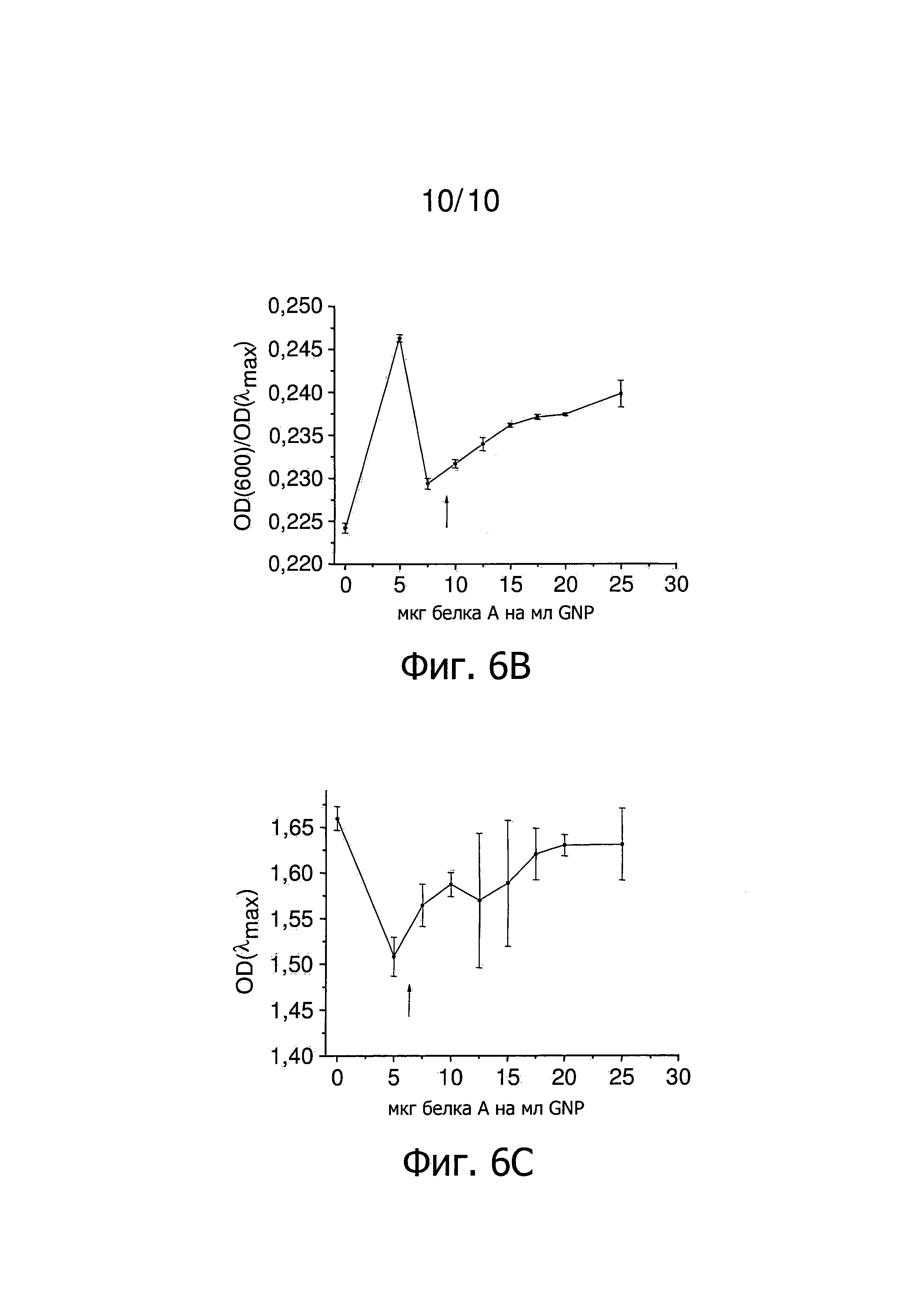
Фиг.6 представляет результаты титрования концентрации GNP, покрытых Tween 20 белком A, в соответствии с конкретным осуществлением изобретения. Стрелка указывает наименьшее количество белка A, которое стабилизирует GNP, покрытые. Фиг.6A представляет зависимость λmax от количества белка A на мл GNP. Фиг.6B представляет зависимость OD(600)/OD(λmax) от количества белка A на мл GNP. Фиг.6C представляет зависимость OD(λmax) от количества белка A на мл GNP.
Подробное описание изобретения
Далее различные аспекты изобретения описаны более подробно. Каждый аспект описанный таким образом может быть объединен с любым другим аспектом или аспектами, если явно не оговорено обратное. В частности, любой признак, указанный в качестве предпочтительного или преимущественного, может быть объединен с любым другим признаком или признаками, указанными в качестве предпочтительных или преимущественных.
В контексте настоящего изобретения, используемые термины должны толковаться в соответствии со следующими определениями, если контекст не требует иного.
В соответствии с использованием в описании, формы единственного числа включают и единственное и множественное число, если контекст явно не требует иного.
Термины "включающий", "содержит", "состоит из" используются в описании как синонимы "включая", "включает" или "включающий", "содержит" и являются объединяющими или открытым и не исключают дополнительных, не указанных членов, элементов или стадий способа. Когда осуществления относятся к "включающим", признаки, элементы и стадии предполагают, в частности, включение осуществлений, которые состоят из перечисленных признаков, элементов или стадий.
Представление числовых диапазонов конечными точками включает все цифры и части, включенные в соответствующие диапазоны, также как указанные конечные точки.
Термин "около" в соответствии с использованием в описании, относящийся к измеряемой величине, такой как параметры, количество, временная продолжительность и т.п., должен включать погрешность +/- 10% или менее, предпочтительно +/- 5% или менее, более предпочтительно +/- 1% или менее и еще более предпочтительно +/- 0,1% или менее от указанного значения, поскольку такие погрешности являются подходящими для осуществления раскрытого изобретения. Следует понимать, что значение, которое модифицируется словом "около", само также, в частности, и предпочтительно, раскрыто.
Настоящее изобретение относится к способам покрытия наночастиц связующим агентом, в которых требуется сниженное количество связующего агента. Более конкретно, изобретение предлагает способы, в которых взаимодействие между наночастицами и связующим агентом обеспечивается до или на стадии нанесения покрытия. В определенных осуществлениях взаимодействие обеспечивает эффективное покрытие наночастиц. В других осуществлениях, способы могут включать формирование ковалентной связи связующего агента с наночастицами после концентрирования связующего агента на поверхности наночастиц.
Термин «связующий агент», в соответствии с использованием в описании, относится к целевой молекуле, которая должна быть нанесена на наночастицы, и которая сама может обеспечить связь с другой частицей. Как правило, связывающий компонент является членом определенной известной или предполагаемой парной связи или пары, например, антиген-антитело, рецептор-лиганд, фермент-лиганд, сахар-лектин, рецептор-рецепторный связывающий агент, белок-олигонуклеотид и т.д. В определенных осуществлениях связывающим компонентом является белок или пептид. В дальнейших определенных осуществлениях связывающий компонент содержит, по меньшей мере, 5 аминокислот, в частности, по меньшей мере, 10, по меньшей мере, 20, по меньшей мере, 50 аминокислот и более.
В одном аспекте изобретение предлагает способы покрытия наночастиц, в которых требуется только небольшое количество белка, и наночастицы с однослойным покрытием, полученные этими способами.
Согласно этому аспекту изобретение относится к способам покрытия наночастиц белками, в котором способы включают контактирование указанных наночастиц с неионным, катионным и/или цвиттерионным детергентом до или после контакта наночастиц с раствором указанного белка.
Термин "неионогенный детергент" в соответствии с использованием в описании относится к детергенту, у которого отсутствуют ионные группы. В осуществлениях способов изобретения, неионогенный детергент выбирают из полисорбатов, этоксилатов октилфенола, глюкаминов, lubrol, Brij®, Nonidet®, Pluronic®, Genapol® и Igepal®. В определенных осуществлениях, полисорбат выбран из группы, включающей полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 65, полисорбат 80 и полисорбат 85. В определенных осуществлениях этоксилат октилфенола выбран из TRITON® Х-15, TRITON® X-35, TRITON® X-45, TRITON® X-100, TRITON® X-102, TRITON® X-114, TRITON X-165 (70%), TRITON® X-305 (70%), TRITON® X-405 (70%) и TRITON® X-705 (70%). В определенных осуществлениях глюкамин выбирается из N-октаноил-N-метилглюкамина (MEGA-8), N-нонаноил-N-метилглюкамина (MEGA-9) и N-деканоил-N-метилглюкамина (MEGA-10).
Термин "катионный детергент" в соответствии с использованием в описании относится к детергенту с положительным ионным зарядом. В осуществлениях способов изобретения, катионный детергент выбран из бромида гексадецилтриметиламмония (СТАВ) или бромида триметил(тетрадецил)аммония (ТТАВ).
Термин "цвиттерионный детергент" в соответствии с использованием в описании относится к детергенту, который имеет ионные группы, но при этом отсутствует заряд. В осуществлениях способов изобретения, цвиттерионный детергент выбран из амидосульфобетаинов, алкилбетаинов и аммониопропансульфонатов. В предпочтительных осуществлениях цвиттерионный детергент выбран из амидосульфобетаина-14, амидосульфобетаина-16, 3-[(3-холамидопропил)диметиламмонио]-1-пропансульфоната (CHAPS), 3-[(3-холамидопропил)диметиламмонио]-2-гидрокси-1-пропансульфоната (CHAPSO), 3-(4-гептил)фенил-3-гидроксипропил)диметиламмониопропансульфоната (C7BzO), EMPIGEN® ВВ, внутренней соли 3-(N,N-диметилоктиламмонио)пропансульфоната, внутренней соли 3-(децилдиметиламмонио)пропансульфоната, внутренней соли 3-(додецилдиметиламмонио)пропансульфоната, внутренней соли 3-(N,N-диметилмиристиламмонио)пропансульфоната, внутренней соли 3-(N,N-диметилпальмитиламмонио)пропансульфоната, внутренней соли 3-(N,N-диметилоктилдециламмонио)пропансульфоната.
Специалистам в данной области техники следует понимать, что ссылка в описании на использование неионного, катионного и/или цвиттерионного детергента включает использование комбинации различных неионных, катионных и/или цвиттерионных детергентов.
В определенных осуществлениях способов изобретения, детергент является неионным детергентом.
Способы настоящего изобретения характеризуется тем, что наночастицы контактируют с неионным, катионным и/или цвиттерионным детергентом до или во время нанесения целевого белка. Действительно, в известном уровне техники неионные, катионные и/или цвиттерионные детергенты были использованы в буферах при работе с покрытыми наночастицами. Однако в соответствии со способами настоящего изобретения наночастицы контактируют с неионным, катионным и/или цвиттерионным детергентом до или во время процесса нанесения покрытия, например, для улучшения процесса нанесения покрытия.
Концентрация неионного, катионного и/или цвиттерионного детергента не является критической, но обычно составляет 0,0001-1% об./об. В частности, неионный, катионный и/или цвиттерионный детергент может быть использован с концентрацией 0,005-0,5% об./об. Предпочтительно неионный, катионный и/или цвиттерионный детергент может быть использован с концентрацией 0,001-0,1% об./об. Более предпочтительно концентрация неионного, катионного и/или цвиттерионного детергента может составлять 0,001, 0,002, 0,005, 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09 или 0,1% об./об. или значение в диапазоне между любыми двумя из вышеупомянутых значений.
В определенных осуществлениях связующий агент является белком и изобретение предлагает и способы, которые позволяют покрывать наночастицы одним слоем белка, и наночастицы получаемые этими способами. В частности, в этих осуществлениях изобретение относится к способам покрытия наночастиц одним слоем белка. В этих осуществлениях способы включают стадию смешивания раствора, включающего наночастицы, с раствором, включающим белки, тем самым позволяя белкам формировать один слой на поверхности указанных наночастиц, в которых указанный раствор, включающий наночастицы и/или указанный раствор, включающий белки, включает указанный неионный, катионный и/или цвиттерионный детергент.
В способах настоящего изобретения, предполагается, что наночастицы могут контактировать с неионным, катионным и/или цвиттерионным детергентом до контакта наночастиц с белками, или одновременно. Соответственно, в одном осуществлении изобретение предлагает способы, в которых раствор, включающий белок, включает неионный, катионный и/или цвиттерионный детергент. В определенных осуществлениях преимущество может заключаться в том, что белки стабилизируются. После этого наночастицы контактируют с раствором или суспензией, включающей белки и неионный, катионный и/или цвиттерионный детергент.
В других осуществлениях способы изобретения включают подготовку раствора, включающего наночастицы и добавление к нему неионного, катионного и/или цвиттерионного детергента. В этих осуществлениях наночастицы контактируют с неионным, катионным и/или цвиттерионным детергентом до их контакта с раствором белка. Способы затем включают смешивание раствора, включающего белки, с раствором, включающим наночастицы и неионный, катионный и/или цвиттерионный детергент.
Предполагается, что эти осуществления способов настоящего изобретения в целом улучшают покрытие наночастиц белками. Природа белка не является критической для этого аспекта изобретения и, следовательно, он может быть любого размера и включает, но не ограничивается антителами или их фрагментами, антигенами, ферментами или субстратами, рецепторами или лигандами и т.д. Термин белки, таким образом, включает пептиды.
Изобретатели установили, что в этом аспекте изобретения способы представляют особый интерес для покрытия наночастиц белками, которые чувствительны к гидрофобным взаимодействиям и/или белками, которые легко агрегируются при низкой ионной силе. В частности, способы настоящего изобретения являются пригодными для покрытия белками, которые являются чувствительными к гидрофобным взаимодействиям при концентрации солей менее 10 мМ или для покрытия белками, которые не выдерживают такой низкой ионной силы и должны быть конъюгированы при более высокой ионной силе для сохранения их активности и/или конформации. Обычно белки, чувствительные к гидрофобным взаимодействиям, включают неполярные группы, которые взаимно отталкивают воду и другие полярные группы, что приводит к общему притяжению неполярных групп друг к другу. Известно, что белки, включающие алкильные углеводородные группы в составе Ala, Val, Leu и Не и/или бензольные (ароматические) кольца в составе Phe и Tyr, часто чувствительны к гидрофобным взаимодействиям. Примерами таких белков являются белки ассоциированные с клеточной мембраной и белки, участвующие в транспортных функциях. Изобретение иллюстрируется в описании стрептавидином, белком А и белком G. Таким образом, в определенных осуществлениях белки, используемые в способах настоящего изобретения, являются белками чувствительными к гидрофобным взаимодействиям при низкой концентрации соли. Соответственно в определенных осуществлениях белки, используемые в способах настоящего изобретения, являются белками чувствительными к гидрофобным взаимодействиям в присутствии высоких концентраций соли. Соответственно определенные осуществления способов покрытия наночастиц белком включает стадию нанесения, выполняемую в присутствии более высокой концентрации соли. Хотя термин более высокая концентрация соли, как правило, зависит от целевого белка, он обычно включает концентрации соли более 10 мМ, в частности, более 50 мМ, в особенности, более 100 мМ. В дальнейших определенных осуществлениях способы настоящего изобретения включают покрытие белками с pI 9 или более, предпочтительно 10 или более. Термин "pI" относится в описании к изоэлектрической точке белка, являющейся pH, при котором белок или его поверхность не несет электрического заряда.
В определенных осуществлениях способы настоящего изобретения включают стадию определения гидрофобности белков до смешивания раствора, включающего наночастицы, с раствором, включающим белки. Гидрофобность белка может быть определена расчетом зависимости гидропатичности от аминокислотной последовательности белка или хроматографией гидрофобных взаимодействий или хроматографией с обращенной фазой.
В альтернативных осуществлениях способы настоящего изобретения включают стадию контактирования связующего агента с наночастицами в присутствии неионного, катионного и/или цвиттерионного детергента для обеспечения концентрирования связующего агента на поверхности наночастиц и стадию обеспечения связывания связующего агента с поверхностью наночастиц. В дальнейших определенных осуществлениях стадия обеспечения связывания связующего агента с поверхностью наночастиц осуществляется активацией функциональных групп (например, карбоксильные группы) на наночастицах, тем самым делая их реакционноспособными относительно связывающего компонента (например, амины). В определенных осуществлениях лиганд является аминосодержащей молекулой, такой как белок или пептид и связывание с наночастицами обеспечивается активацией карбоксильной группы на наночастицах.
Предполагается, что способы настоящего изобретения представляют особый интерес, когда связующий агент является белком. Это будет проиллюстрировано далее.
Предполагается, что определенные осуществления способов настоящего изобретения представляют интерес, когда требуется покрытие белком при высоких значениях pH. В отсутствии неионного, катионного и/или цвиттерионного детергента, регулировка высоких значениях pH может привести к агглютинации наночастиц. В соответствии с определенными осуществлениями способы настоящего изобретения включают покрытие белком в неионном, катионном и/или цвиттерионном детергенте при высоком pH и корректировку pH после нанесения покрытия.
Кроме того, предполагают, что определенные осуществления способов настоящего изобретения представляют особый интерес, когда раствор белка должен быть забуференным, но является чувствительным к агглютинации даже при низкой концентрации соли. В соответствии с определенными осуществлениями, способы настоящего изобретения включают контактирование наночастиц с раствором белка в присутствии умеренных концентраций соли и неионного, катионного и/или цвиттерионного детергента.
Для обеспечения оптимального покрытия в способах настоящего изобретения может представлять интерес контактирование наночастиц с определенным количеством белка. Как указано выше, способы настоящего изобретения обладают особенными преимуществами, заключающимися в том, что они позволяют нанести покрытие минимальным количеством белка. Тем не менее в определенных осуществлениях предполагается, что количество белка, необходимое для покрытия поверхности наночастиц должно быть определено.
Соответственно, в определенных осуществлениях изобретение предлагает способы покрытия наночастиц, в которых способ дополнительно включает до покрытия указанных наночастиц стадию определения минимального количества белка, необходимого для получения стабильных наночастиц в присутствии указанного неионного, катионного и/или цвиттерионного детергента. Стадия определения оптимального количества белка для покрытия поверхности наночастиц, как правило, выполняется определением концентрации титрованием. Наночастицы смешивают с различным количеством белка и регистрируют спектры поглощения. Например, в определенных осуществлениях наночастицы смешивают с увеличивающимся количеством белка, обычно в диапазоне 0-1000 мкг белка на мл наночастиц.
В определенных осуществлениях стадия определения концентрации титрованием включает, после инкубационного периода обычно 10 мин, добавление соли (например, NaCl, 1 M) и после дополнительных 10 мин, спектры поглощения этих образцов регистрируют между 350 и 900 нм. Минимальное количество белка, необходимое для стабилизации наночастиц, может быть определено по графикам зависимости λmax, OD(λmax) и/или отношения OD(600)/OD(λmax) от количества белка на мл наночастиц. Самое низкое количество белка, когда все зависимости наиболее близки к холостой пробе, является количеством белка, необходимым для стабилизации частиц. В альтернативных осуществлениях стадия определения концентрации титрованием включает непосредственно добавление белка к наночастицам в различных концентрациях (без добавления соли), при условии, что спектр регистрируют, например, через 30 мин.
В определенных осуществлениях способы настоящего изобретения могут включать стадию определения оптимального количества белка для покрытия наночастиц. В общем, оптимальное количество белка (обычно выражается как концентрация белка, например мкг/мл) для покрытия наночастиц будет зависеть от структуры и молекулярной массы белка. Для более крупных белков относительная масса белка по сравнению с частицами будет уменьшаться. В определенных осуществлениях количество используемых белков, выше указанного минимального количества белка, необходимого для получения стабильных наночастиц. В другом осуществлении количество используемых белков выше количества белка, которое может быть адсорбировано всей поверхностью наночастиц.
Способы настоящего изобретения также позволяют контролировать покрытие дискретным количеством целевого белка (т.е. белка, предназначенного для покрытия и используемого в дальнейших применениях, например, для взаимодействия с другим соединением, см. ниже). Это может быть достигнуто, в том числе, осуществлением способов настоящего изобретения и с использованием композиций, содержащих только целевой белок, или композиций белка в сочетании с белком, который не является реакционноспособным в предполагаемом использовании (в дальнейшем применении покрытых наночастиц).
В настоящей заявке ссылка на "белок" или "белки" в основном предназначена для обозначения белка. Однако в определенных осуществлениях это относится к комбинации целевого белка и инертного белка, в частности, в четко определенных пропорциях. В этих осуществлениях можно еще больше сократить и контролировать количество целевого белка, нанесенного на наночастицы.
В определенных осуществлениях способы настоящего изобретения могут дополнительно включать стадию регулирования адсорбции и/или связывания белков с наночастицами. Это может быть выполнено различными способами детектирования, включая, но без ограничения, оптические способы обнаружения. В определенных осуществлениях связывание белка с наночастицами контролируется фиксированием сдвига длины волны методом локализованного поверхностного плазменного резонанса (LSPR). В соответствии с использованием в описании термин "метод локализованного поверхностного плазменного резонанса" или "LSPR" относится к методам, которые регистрируют оптические изменения на поверхности наночастиц из благородных металлов. Когда поверхности металлических наночастиц возбуждаются электромагнитным излучением, у них появляются коллективные колебания электронов проводимости, известные как локализованные поверхностные плазмоны (LSP). При возбуждении таким образом наночастицы действуют как нано-антенны, концентрируя электромагнитное поле в очень малых объемах, прилегающих к наночастицам. Таким способом может быть получено исключительно большое увеличение интенсивности электромагнитного излучения. Наночастицы, используемые в LSPR, вызывают резонансные колебания. Термин "поглощение" относится к степени, в которой образец поглощает свет. В LSPR изменения поглощения могут быть измерены регистрацией изменений показателя преломления. Интенсивность и длина волны максимума поглощения могут быть определены для полосы возбуждения LSPR.
Способы настоящего изобретения, как правило, применимы к покрытию наночастиц, которые могут быть наночастицами из любого подходящего материала или формы, такие как, например, но без ограничения, наночастицы, наношарики, наносферы, нанопирамиды, нанопроволока, нанопризмы, нанокубы, наностержни, сетка и т.д. Специалистам в данной области понятно, что другие наноструктуры также быть могут пригодными в настоящем изобретении. В определенных осуществлениях наночастицы имеют круглую наноструктуру. В дальнейших определенных осуществлениях наночастицы имеют диаметр 1-1000 нм, в частности, 25-750 нм, более предпочтительно 50-500 нм. Диаметр наночастиц может составлять, например, 50, 75, 100, 150, 200, 250, 300, 350, 400, 450 или 500 нм, или любое значение в диапазоне между любыми двумя из вышеуказанных значений. В определенных осуществлениях наночастицы являются наностержнями. В других осуществлениях наностержни имеют отношение сторон (т.е. длина, деленная на ширину) 1,1-10, более предпочтительно 1,5-5. В некоторых осуществлениях наностержни имеют ширину или диаметр 2-10 нм. В определенных осуществлениях наностержни имеют длину 4-45 нм.
Способы настоящего изобретения могут быть выполнены с любым типом коллоидных частиц, которые могут быть покрыты электростатическими взаимодействиями. В определенных осуществлениях наночастицы, используемые в контексте настоящего изобретения, включают металл, проводящий коллоидный полимер, коллоидный благородный металл, коллоидный металл/проводящий полимерный композит, диоксид кремния или латекс. Термин "коллоидный", используемый в описании, относится к жидкой композиции микроскопических наночастиц, суспендированных в жидкой среде. Термин "проводящий полимер" относится к электропроводящему полимерному материалу. В осуществлении проводящие полимеры являются органическими полимерами или пи-сопряженными органическими полимерами. Например, проводящими полимерами могут быть полипирролы, такие как полипиррол, поли(N-замещенный пиррол), поли(3-замещенный пиррол) и поли(3,4-дизамещенный пиррол); политиофены, такие как политиофен, поли(3-замещенный тиофен), поли(3,4-дизамещенный тиофен) и полибензотиофен; полиизотионафталины такие как полиизонафталин; политиениленвинилены, такие как политиениленвинилен; поли(п-фениленвинилены), такие как поли(п-фениленвинилен); полианилины, такие как полианилин, поли(N-замещенный анилин), поли(3-замещенный анилин) и поли(2,3-замещенный анилин); полиацетилены, такие как полиацетилен, полидиацетилены, такие как полидиацетилен; полиазулены, такие как полиазулен; полипирены, такие как полипирен; поликарбазолы, такие как поликарбазол и поли(N-замещенный карбазол), полиселенофены, такие как полиселенофен; полифураны, такие как полифуран и полибензофуран; поли(п-фенилены), такие как поли(п-фенилен); полииндолы, такие как подиндол; полипиридазины, такие как полипиридазин; полиацены, таких как нафтацен, пентацен, гексацен, гептацен, дибензпентацен, тетрабензпентацен, пирен, дибензопирен, хризен, перилен, коронен, терплен, овален, квотерилен и циркумантрацен; производные (например, трифенодиоксазин, трифенодитиазин, гексацен-6,15-хинон), полученные замещением некоторых атомов углерода в полиаценах такими атомами, как N, S и О, или функциональной группой, например, карбонилом; такие полимеры, как поливинилкарбазолы, полифениленсульфид и поливиниленсульфид. В определенном осуществлении проводящими полимерами являются полипиррол, политиофен, полианилин или их производные.
Как известно в технике, электропроводящий полимер может быть допирован введением в полимер материалов с функциональными группами, например, диметиламиногруппой, цианогруппой, карбоксильной группой и нитрогруппой, материалов, таких как производные бензохинона, и тетрацианоэтилена а также тетрацианхинодиметана и их производные, которые действуют как акцепторы электронов, или, например, материалов с функциональными группами, таких как аминогруппа, алкильная группа, гидроксильная группа, алкокси группа и фенильная группа, замещенных аминов, таких как фенилендиамин, антрацен, бензантрацен, замещенные бензантрацены, пирен, замещенные пирены, карбазол и их производные и тетратиафульвален и его производные, которые действуют в качестве донора электронов. Термин "допирование", используемый в описании, означает, что электроноакцепторные молекулы (акцепторы) или электронодонорные молекулы (доноры) включены в полимерную цепь. Когда допант является замещающей группой мономера, используемого для синтеза полимера, используется термин самодопирующийся полимер. В других случаях допант является внешним и включается после синтеза в полимерную цепь (как правило, в виде пленки), например, пары йода. В настоящем изобретении, как акцепторы так и доноры могут быть использованы в качестве допанта.
Термин "коллоидный металл" в соответствии с использованием в описании относится к коллоиду, в котором суспендированы микроскопические наночастицы металлических наночастиц. Термин "благородный металл" относится к металлам VIII группы Периодической таблицы, включая, но без ограничения: платину, иридий, палладий и т.п., а также золото, серебро и т.д.
Термин "коллоидный металл/проводящий полимерный композит" в соответствии с использованием в описании относится к коллоиду, приготовленному из металлических наночастиц, имеющих проводящий полимер на их поверхности.
В определенных осуществлениях наночастицы, используемые в контексте настоящего изобретения, включают один или более металлов, выбранных из Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd, La, Hf, Та, W, Re, Os, Ir, Pt, Au и/или Ac. Специалистам в данной области техники понятно, что каждый вышеописанный переходный металл может находиться в различных степенях окисления, которые могут быть использованы в настоящем изобретении. В некоторых случаях образуются наиболее устойчивые степени окисления, но и другие степени окисления могут быть использованы в настоящем изобретении. Кроме того, переходные металлы настоящего изобретения могут находиться в виде оксидов металлов. В осуществлении изобретение относится к способу, в котором указанные наночастицы включают переходный металл, выбранный из группы, включающей Au, Ag, Cu, Ta, Pt, Pd и Rh и предпочтительно, в котором указанный переходный металл является золотом, серебром или медью.
Как описано выше, в определенных осуществлениях способы нанесения покрытия в соответствии с изобретением основаны на электростатическом взаимодействии между связующими агентами, в частности, белковыми молекулами и наночастицами. Однако для некоторых применений могут быть необходимы более стабильные конъюгаты белок-наночастица. Такие стабильные конъюгаты могут быть получены с образованием ковалентной связи между молекулами белка и наночастицами. Для создания такой ковалентной связи поверхность наночастиц, как правило, снабжают функциональными группами, такими как, например, карбоксильные или аминогруппы, или пептидами, или азидами или алкенами и др. В обычных методиках ковалентного присоединения известного уровня техники, первая стадия формирования ковалентной связи является активацией функциональных групп, например, карбоксильных групп на наночастицах, что делает их реакционноспособными относительно связывающего компонента, например, белка. Затем добавляют связывающий компонент. Как правило, необходим избыток связывающего компонента для достижения полной степени покрытия наноматериала связывающим компонентом. После завершения реакции связывания, избыток связывающего компонента удаляют очисткой.
Однако в соответствии с определенными осуществлениями настоящего изобретения предложены оптимизированные способы покрытия, включающие ковалентное присоединение белков с наночастицами. Действительно, в определенных осуществлениях способ покрытия в соответствии с настоящим изобретением обеспечивает формирование монослоя белка вокруг наночастицы, тем самым обеспечивая тесный контакт между белком и любой (активированной) функциональной группой на наночастицах, концентрируя таким образом белок на поверхности наночастиц и ускоряя формирование ковалентной связи. В отличие от способов ковалентного присоединения известного уровня техники, способам в соответствии с настоящим изобретением требуется незначительный избыток белка или избыток совсем не требуется.
Соответственно в определенных осуществлениях на поверхности наночастиц создаются одна или несколько функциональных групп. Способы функционализации наночастиц хорошо известны специалистам и могут, например, включать присоединение лигандов к поверхности наночастиц, в котором указанные лиганды включают, по меньшей мере, один сшивающий агент с первой частью, связанной с наночастицами, и второй частью, которая является функциональной группой, способной связываться с родственной молекулой, например, белком. В определенных осуществлениях поверхности наночастиц функционализированные одной или несколькими функциональными группами, выбранными из группы, состоящей из карбоксила, амино, полиэтиленгликоля, пептида, ДНК и РНК. Карбоксильные группы особенно пригодны для белков, так как карбоксильная группа может вступать в реакцию с аминным фрагментом белка, образуя амидную связь. Таким образом, в определенных осуществлениях, функциональные группы включают карбоксильные группы. В определенных осуществлениях функциональные группы активируются до или после контакта наночастиц с раствором, включающим белок. Активация функциональных групп хорошо известна специалистам.
Если функциональные группы являются карбоксильными, карбоксил может быть активирован с помощью одной или нескольких групп, активирующих карбоксил. Примеры пригодных групп, активирующих карбоксил, включают, но без ограничения, карбодиимидные реагенты, фосфониевые реагенты, такие как гексафторофосфат бензотриазолилокси-трис-(диметиламино)фосфония (ВОР) и т.п., урониевые или карбониевые реагенты, такие как гексафторфосфат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU), N-гидроксисукцинимид (NHS), гексафторофосфат бензотриазол-1-ил-окси-трипирролидинфосфония (PyBOP) и т.п.; 1-этоксикарбонил-2-этокси-1,2-дигидрохинолин (EEDQ), йодид 1-метил-2-хлорпиридиния (реагент Мукаямы Mukaiyama) и т.п.
В другом аспекте изобретение относится к композиции наночастиц, включающей наночастицы, полученные одним или несколькими способами настоящего изобретения.
Действительно, в определенных осуществлениях способы настоящего изобретения предлагают уникальный способ получения наночастиц, которые покрыты одним слоем белка. Толщина слоя белка может быть определена измерением гидродинамического диаметра частиц методом динамического рассеяния света (DLS). Увеличение гидродинамического диаметра эквивалентно увеличению толщины слоя белка. Наночастицы, покрытые одним слоем белка, создают ряд преимуществ. Улучшается покрытие наночастиц, покрытых белком, другим соединением, потому что расстояние между этим соединением и поверхностью наночастиц уменьшается. Кроме того, если должно быть изучено взаимодействие между белком покрытия и другим соединением, расстояние до поверхности наночастиц уменьшается, тем самым улучшая оптическое детектирование белковых взаимодействий LSPR. В соответствии с определенными осуществлениями изобретение предлагает композиции наночастиц, включающие наночастицы, покрытые одним или несколькими белками, в которых один или несколько белков каждый нанесен одним слоем на наночастицы.
В другом аспекте, изобретение предлагает наборы, включающие наночастицы и дополнительные компоненты и/или инструкции для покрытия наночастиц белком в соответствии с одним или несколькими способами настоящего изобретения. В определенных осуществлениях наборы в соответствии с настоящим изобретением включают наночастицы в растворе, в котором указанный раствор включает неионный, катионный и/или цвиттерионный детергент. Дополнительно или альтернативно, наборы в соответствии с настоящим изобретением включают наночастицы и отдельный неионный, катионный и/или цвиттерионный детергент или отдельный раствор, включающий неионный, катионный и/или цвиттерионный детергент. В определенных осуществлениях наборы включают инструкции для покрытия наночастиц способами настоящего изобретения.
Другой аспект настоящего изобретения относится к использованию в различных применениях наночастиц с покрытием, полученных в соответствии с настоящим изобретением. Действительно, наночастицы, полученные способами покрытия настоящего изобретения, могут быть использованы во всех применениях известного уровня техники, включающих наночастицы, покрытые белками, включая, но без ограничения, доставку лекарства, лечение, диагностику, способы анализа, способы таргетинга и т.д.
Более того, было установлено, что наночастицы, полученные определенными осуществлениями способов настоящего изобретения, имеют определенные преимущества в определенных применениях. Действительно, установлено, что для оптического детектирования взаимодействия первого белка со вторым соединением (включая второй белок) с использованием наночастиц необходимо, чтобы взаимодействие происходило как можно ближе к поверхности наночастицы. Таким образом, однослойное покрытие первым белком на поверхности наночастиц обеспечивает оптимальное обнаружение взаимодействия указанного белка с другим соединением или белком. В определенных осуществлениях покрытые наночастицы настоящего изобретения используются в методах анализа. В определенных осуществлениях способы покрытия являются оптическими способами обнаружения, в частности, способами, связанными с детектированием рассеяния света наночастицами. В дальнейших определенных осуществлениях наночастицы, которые могут быть получены или полученные способами настоящего изобретения, используются в детектировании методом LSPR.
Детектирование методом LSPR обычно используется в контексте измерения взаимодействий между первым и вторым соединением, в контексте определения специфических свойств одного или обоих соединений или специфических свойств взаимодействия между двумя соединениями. В способах настоящего изобретения, первое соединение, которое связано с наночастицами, является белком. В определенных осуществлениях первое и второе соединения являются членами определенных известных или предполагаемых связующих компонентов или пар. Таким образом, второе соединение (или потенциальные когнатные лиганды) относится к соединению, которое может потенциально взаимодействовать с первым соединением, связанным с наночастицами. Как правило, первое соединение и второе соединение являются чувствительными участками, которые являются членами связующих компонентов, таких как антиген-антитело, рецептор-лиганд, фермент-лиганд, сахар-лектин, рецептор-рецептор, связывающий агент, и другие. В этих осуществлениях детектирование методом LSPR может служить для обнаружения взаимодействия между двумя членами связующих компонентов.
Настоящее изобретение иллюстрируется следующими не ограничивающими примерами
Примеры
Пример 1. Контактирование наночастиц с неионогенным детергентом после покрытия наночастиц белком G
Первое количество белка G, необходимое для стабилизации заданного объема наночастиц золота (GNP) в отсутствие неионного, катионного и/или цвиттерионного детергента, определяют титрованием. Раствор GNP 30 нм в диаметре, с OD 4 при длине волны максимума, содержит 6×1011 GNP/мл. GNP смешивают с различным количеством белка обычно в диапазоне 0-100 мкг белка на мл GNP. После инкубации в течение 10 минут добавляют NaCl (1 М в H2O) и еще через 10 минут регистрируют спектры поглощения этих образцов при 350-900 нм. Для определения наименьшего количества белка, необходимого для стабилизации наночастиц, строят три графика; зависимость λmax, OD(λmax) и OD(600)/OD(λmax) от количества белка на мл GNP. Самая низкая концентрация белка, где все три графики наиболее близки к графику холостого опыта, является минимальным количеством белка, необходимым для стабилизации наночастиц.
В частности, отношение OD(600)/OD(λmax) должно быть как можно меньше. Можно ожидать небольшой сдвиг λmax в длинноволновую область и тем самым небольшое увеличение OD(600)/OD(λmax) после нанесения покрытия белка. Обычно OD(λmax) также немного увеличивается или уменьшается. Титрованием определяют наименьшее количество белка, равное 25 мкг белка G на мл GNP, которое стабилизирует наночастицы (фиг.1).
После определения минимального количества белка, необходимого для стабилизации наночастиц в отсутствии неионного, катионного и/или цвиттерионного детергента, титрование проводят в присутствии неионного, катионного и/или цвиттерионного детергента. В настоящих примерах неионогенный детергент Tween 20 используют с конечной концентрацией 0,05%. Самое высокое количество белка, определенное титрованием в Tween 20, является самым низким количеством белка, которое стабилизирует наночастицы в отсутствии неионного, катионного и/или цвиттерионного детергента. Титрование проводят аналогично титрованию в отсутствие неионного, катионного и/или цвиттерионного детергента за исключением того, что белок смешивают с фиксированным количеством Tween 20 до добавления GNP. Регистрируют спектры поглощения этих образцов и снова сроят три графика; зависимость λmax, OD(λmax) и OD(600)/OD(λmax) от количества белка На мл GNP.
Благодаря Tween 20, все образцы являются стабильными после добавления NaCl (1 М в H2O). Связывание белка с поверхностью наночастиц можно контролировать по изменению λmax с увеличением количества белка на мл GNP. Чем больше белка связано с поверхностью наночастиц, тем больше сдвиг λmax в длинноволновую область. Это изменение также влияет на OD(600)/OD(λmax). С увеличением λmax отношение OD(600)/OD (λmax) также слегка возрастает.
Результаты определения концентрации титрованием в присутствии Tween 20 представлены на фиг.2. В дополнение к спектрам поглощения (фиг.2A, 2B, 2C), проводят измерения методом динамического рассеяния света (DLS проводились) для каждого образца (фиг.2D). Количество 12,5-15 мкг белка G на мл GNP достаточно, чтобы покрыть наночастицы примерно одним слоем белка G (фиг.2, показано стрелками). Два плато, относящихся соответственно к первому и второму слою белка на наночастицах, могут быть четко определены (фиг.2D). Использование 12,5 мкг белка G на мл GNP, которые необходимы для стабилизации наночастиц в присутствии Tween 20, приводят к наночастицам с толщиной слоя белка 5 нм. Использование 25 мкг белка G на мл GNP, которые необходимы для получения стабильных наночастиц в отсутствии неионного, катионного и/или цвиттерионного детергента, приводит к наночастицам со слоем толщиной 12,5 нм, который более чем в два раза больше (фиг.2D). Использование Tween 20 в процессе нанесения покрытия позволяет таким образом готовить стабильный GNP, покрытый белком G, только с одним слоем белка на поверхности наночастиц. Тем самым это в два раза снижает необходимое количество белка G на мл GNP и если далее предполагается покрытие наночастиц другими молекулами, расстояние от этой молекулы до поверхности наночастиц уменьшается.
Сравнение изменения λmax (фиг.2А) и гидродинамического диаметра (фиг.2D) наночастиц с увеличением количества белка показывает, что изменение толщины слоя белка с увеличением количества белка также может быть установлено из зависимости λmax от количества белка на мл GNP. Увеличение гидродинамического диаметра, что эквивалентно увеличению толщины слоя белка, приводит к небольшому красному смещению λmax. Учитывая, что измерения методом DLS требуют времени, возможность использовать только спектры поглощения для получения информации о толщине слоя белка значительно сокращает время, необходимое для определения оптимального количества белка для покрытия.
Пример 2. Контактирование наночастиц с неионогенным детергентом после покрытия наночастиц стрептавидином
Титрованием определяют количество белка, равное 25 мкг стрептавидина на мл GNP, как наименьшее количество, которое все еще стабилизирует наночастицы в отсутствии неионного, катионного и/или цвиттерионного детергента (фиг.3). На фиг.4 представлены результаты титрования близких концентраций стрептавидина в присутствии Tween 20. Количество 12,5 мкг стрептавидина на мл GNP необходимо для покрытия наночастиц примерно одним слоем стрептавидина (фиг.4). Использование 25 мкг стрептавидина на мл GNP, которые необходимы для получения стабильных наночастицы в отсутствии неионного, катионного и/или цвиттерионного детергента, приводит к наночастицам с толщиной слоя, которая в два раза больше (фиг.4D). Измерения методом DLS, представленные на фиг.4D, ясно показывают получение двух последовательных слоев белка, что подтверждают спектроскопические данные, представленные на фиг.4A, 4B и 4C. Таким образом, способ настоящего изобретения снижает вдвое необходимое количество стрептавидина на мл GNP.
Пример 3. Контактирование наночастиц с неионогенным детергентом до нанесения покрытия наночастиц белком G
Пример 3 аналогичен примеру 1 за исключением того, что Tween 20 добавляют к наночастицам до добавления белка.
Сначала определяют минимальное количество белка, необходимое для покрытия заданного объема GNP в отсутствии неионного, катионного и/или цвиттерионного детергента. Как уже было описано в примере 1, белок в количестве 25 мкг белка G на мл GNP определяют как наименьшее количество, которое все еще стабилизирует наночастицы в отсутствие Tween 20 (фиг.1).
Затем титруют GNP, покрытые Tween 20. Наибольшее количество белка, определенное этим титрованием, снова является наименьшим количеством белка, которое стабилизирует наночастицы в отсутствие Tween 20. В отличие от примера 1, GNP покрывают Tween 20 до начала титрования. Титрование проводят аналогично титрованию в отсутствии неионного, катионного и/или цвиттерионного детергента за исключением того, что используют наночастицы, стабилизированные Tween 20, вместо GNP, покрытого цитратом. Использование наночастиц, стабилизированных Tween 20, позволяет постепенно замещать неионогенный детергент белком. Это является преимущественным, когда белок покрытия является небольшим пептидом или забуференным. Регистрируют спектры поглощения этих образцов и результаты титрования GNP, покрытых Tween 20, показаны на фиг.5. Количество 7,5-15 мкг белка G на мл GNP необходимо для покрытия наночастиц примерно одним слоем белка G (фиг.5). По сравнению с 25 мкг белка G на мл GNP, которые необходимы для синтеза стабильных GNP, покрытых белком G в отсутствие Tween 20, это опять является значительным снижением количества белка на наночастицу. Этот результат сопоставим с результатом, полученным в примере 1, учитывая, что другая партия коллоида используется для этого титрования.
Пример 4. Контактирование наночастиц с неионогенным детергентом до нанесения покрытия наночастиц белком А
На фиг.6 представлены результаты титрования белком А GNP, покрытых Tween 20. Количество 5-7,5 мкг белка на мл GNP необходимо для покрытия наночастиц примерно одним слоем белка А.