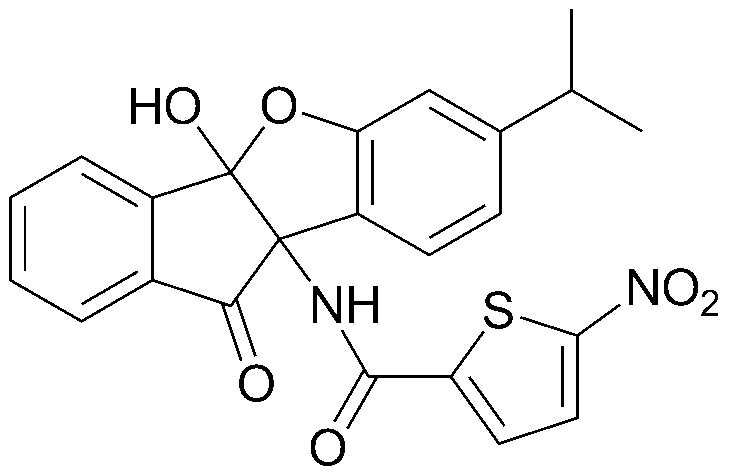
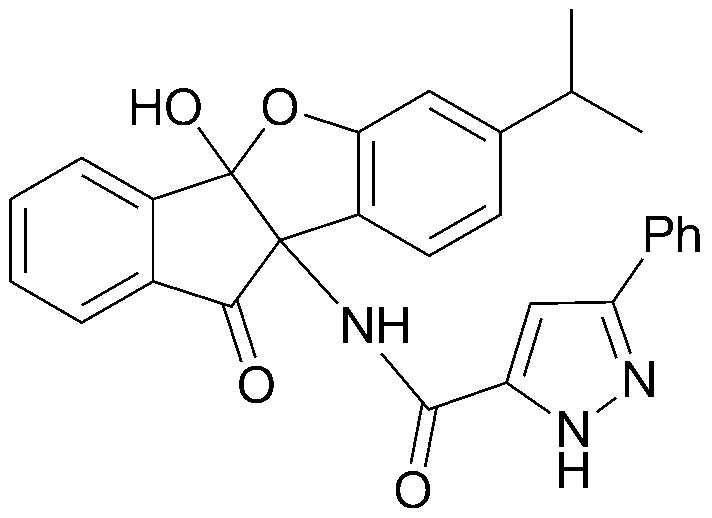
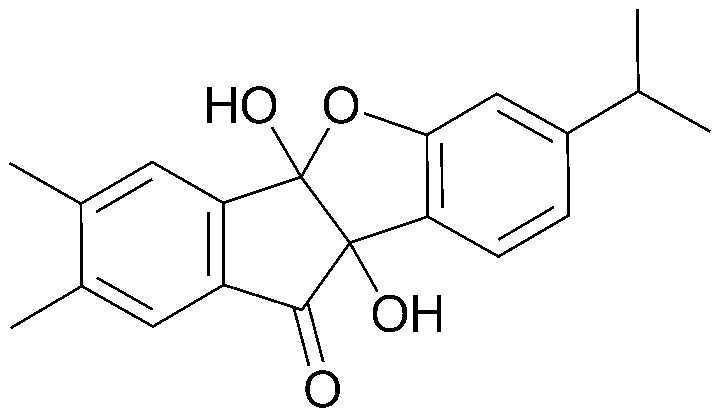
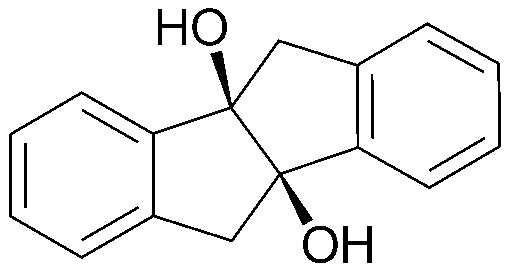
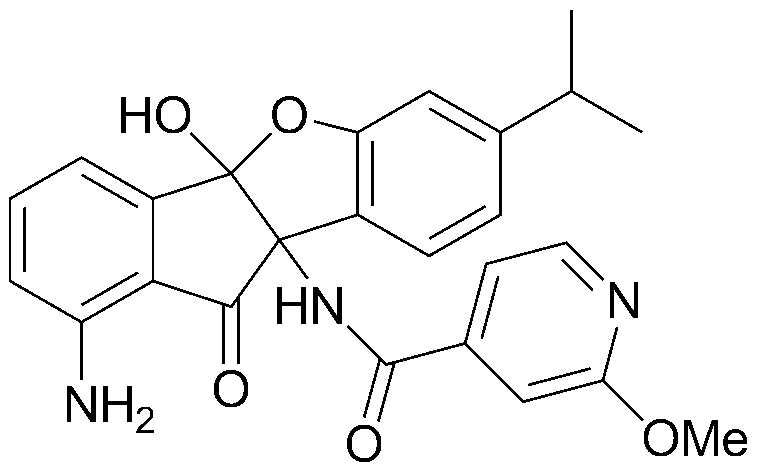
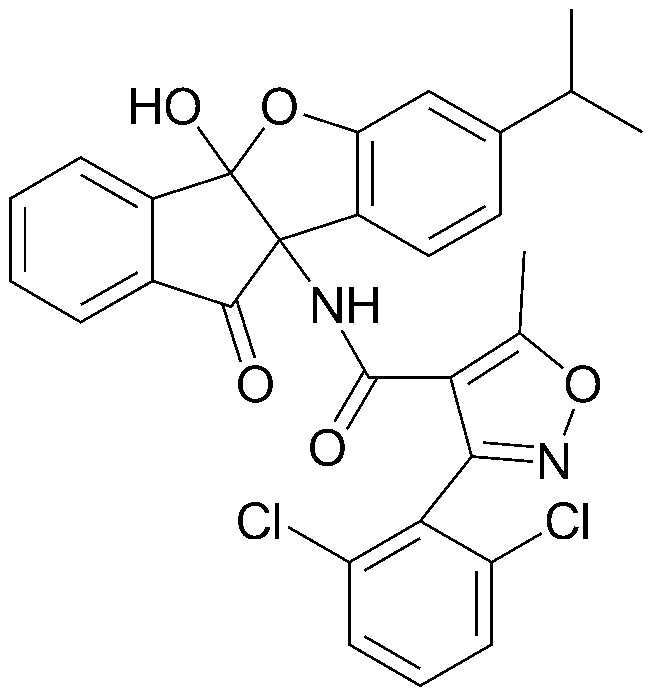
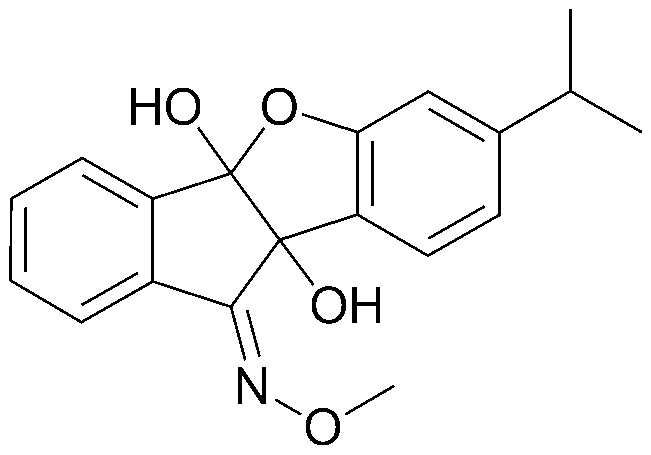
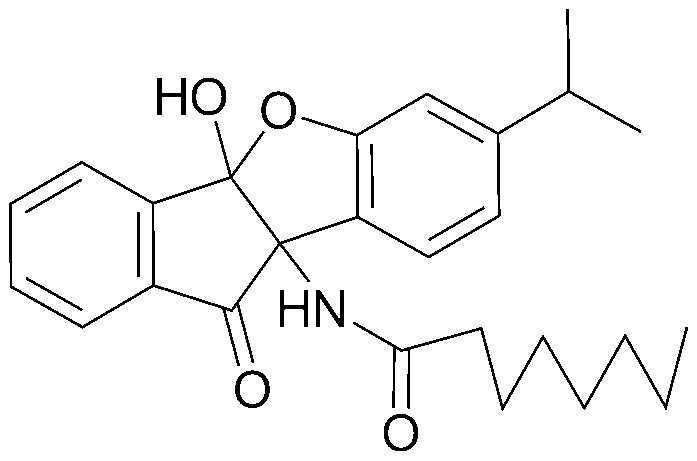
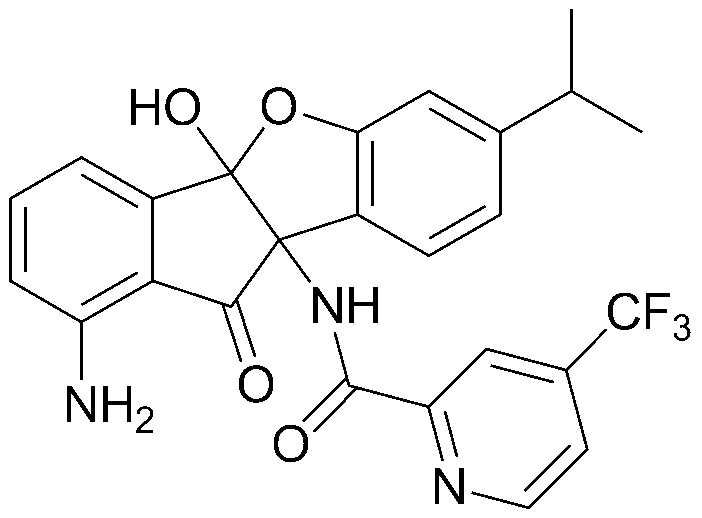
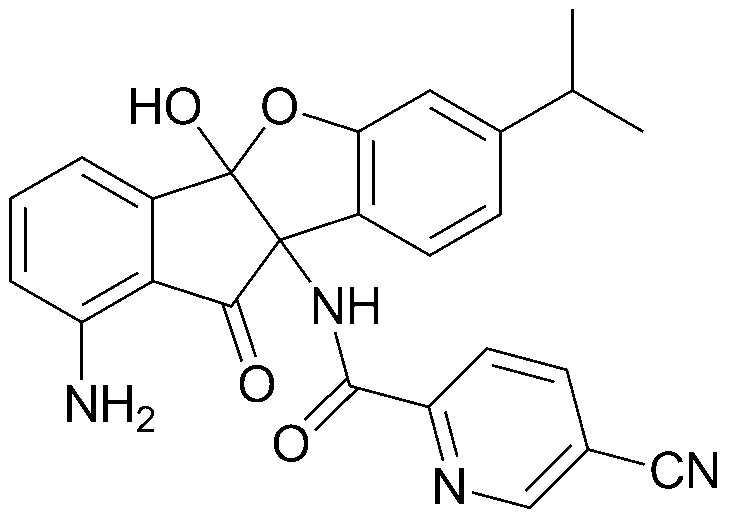
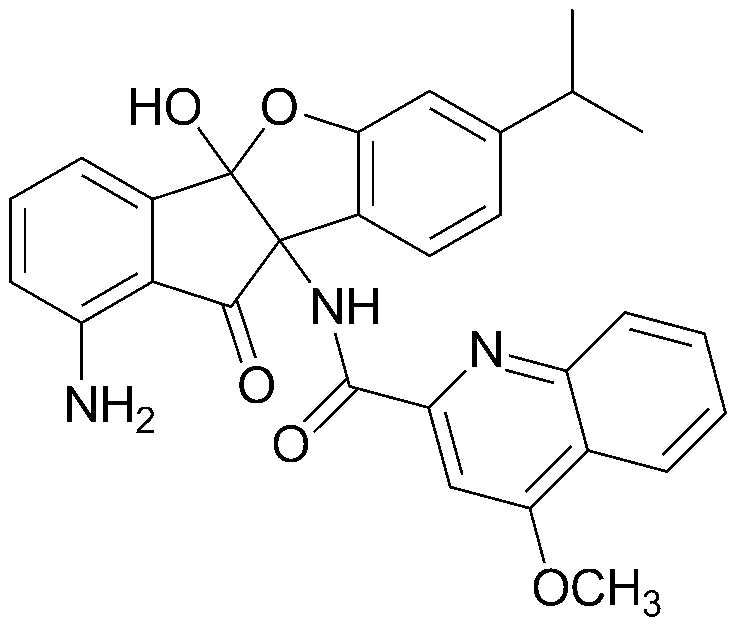
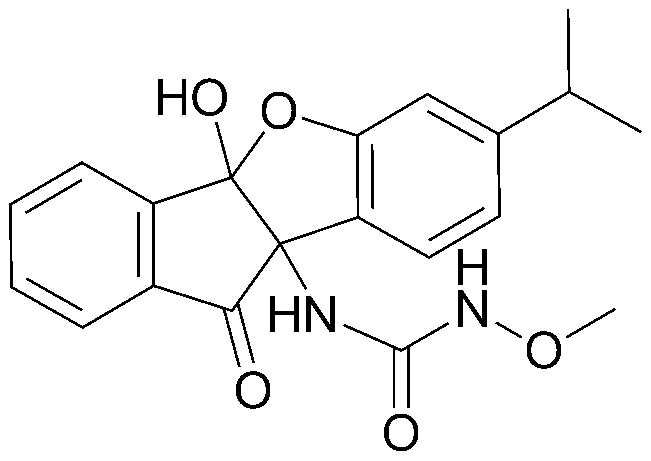
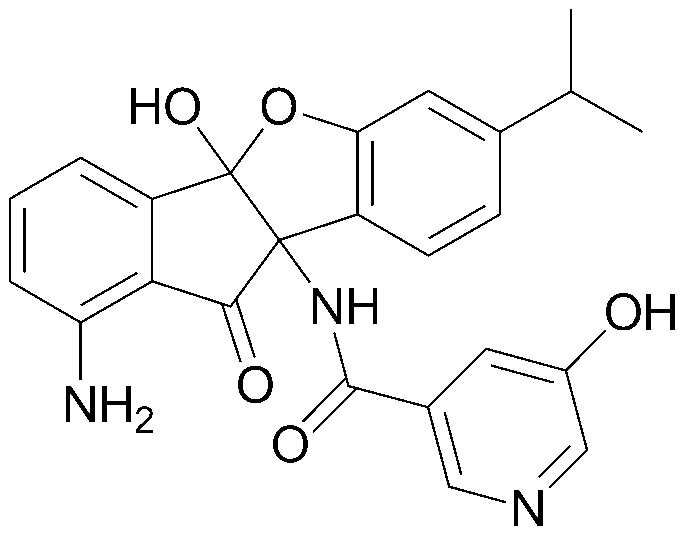
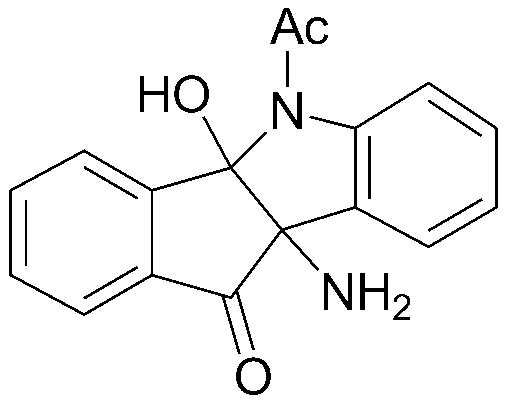
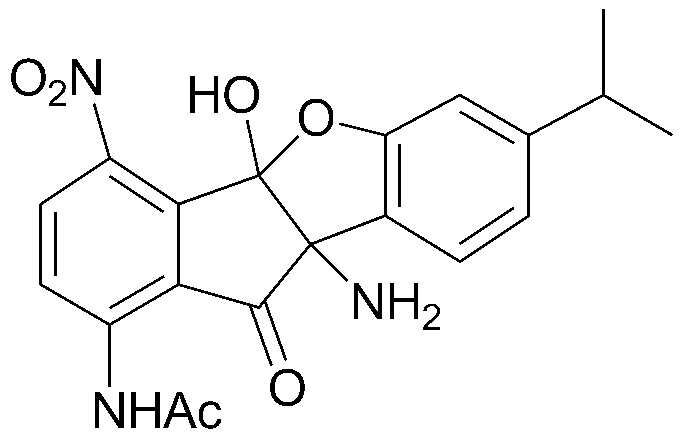
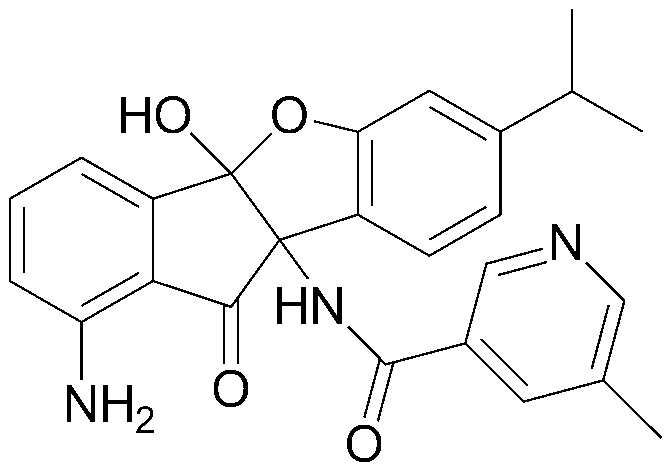
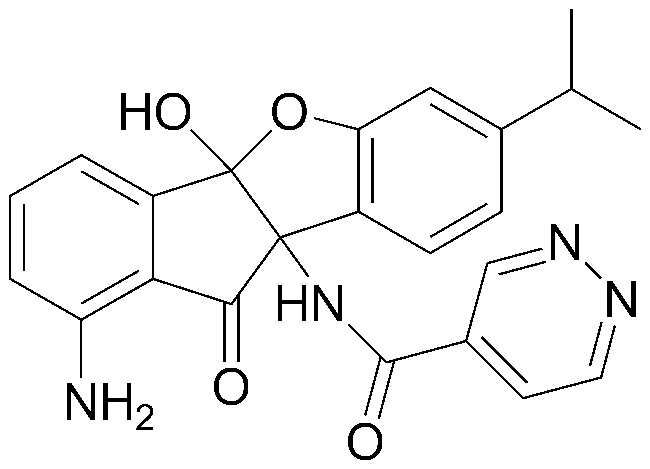
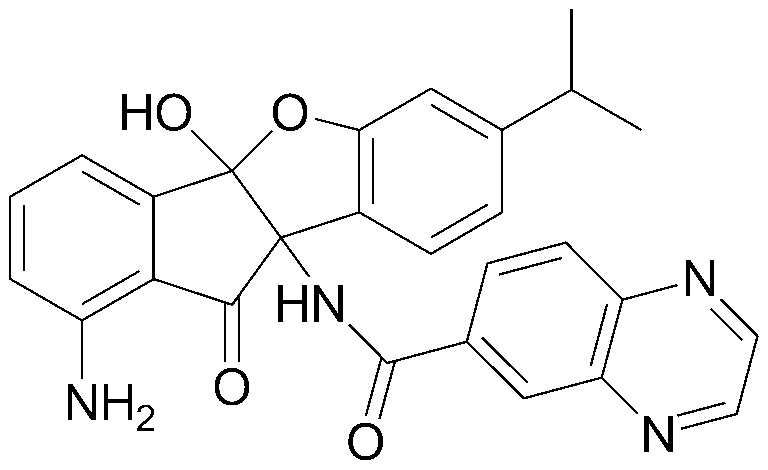
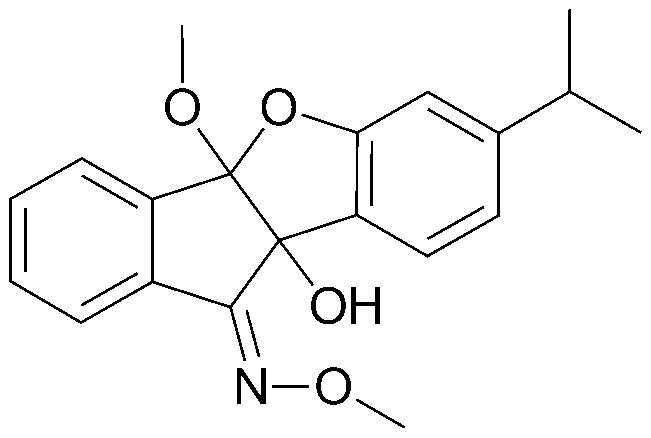
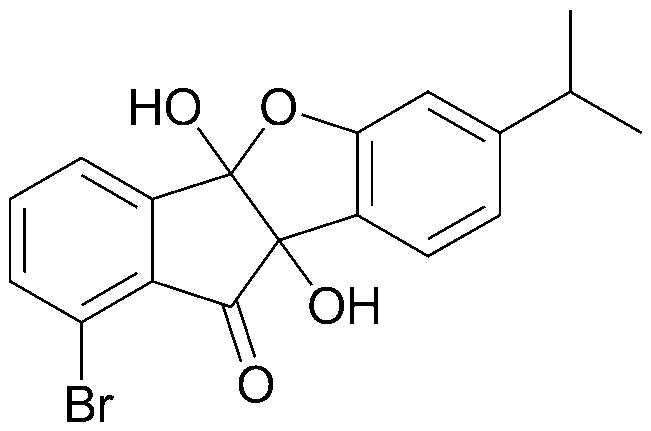
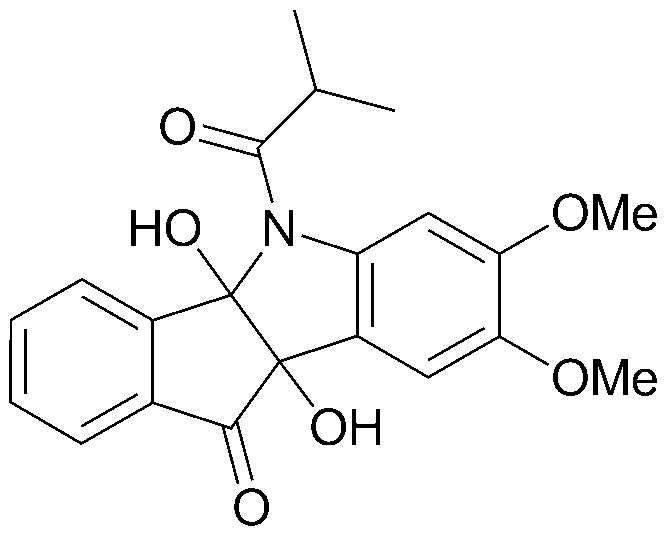
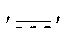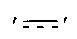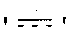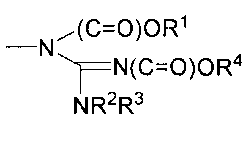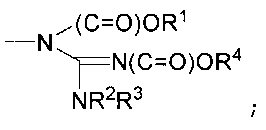Результат интеллектуальной деятельности: ПРОИЗВОДНОЕ ИНДАНОНА, ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ ИЛИ ЭНАНТИОМЕР, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ВИРУСНОГО ЗАБОЛЕВАНИЯ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к производным инданона, к их фармацевтически приемлемым солям или энантиомерам, к способам их получения и к фармацевтическим композициям, их содержащим, для профилактики и лечения вирусного заболевания.
Предшествующий уровень техники
Пикорнавирусы являются безоболочечными положительными одноцепочечными РНК-вирусами, длина геномной РНК которых составляет 7,2-8,5 т.о. Эти вирусы являются очень маленькими и имеют глобулярный размер, равный приблизительно 22-30 нм, и впервые были идентифицированы очень давно. Среди вирусов, принадлежащих семейству Picornaviridae, выделяют энтеровирусы, включая риновирус, полиовирус, вирус коксаки A, вирус коксаки B и эховирус и вирус гепатита A.
Заболевания, которые вызывают пикорнавирусы, варьируются в диапазоне от респираторных заболеваний до кишечных заболеваний, от циркуляторных заболеваний до кожных заболеваний, примеры которых включают полиомиелит, паралич, острый геморрагический конъюнктивит, вирусный менингит, вирусную пузырчатку полости рта и конечностей, пузырчатку, гепатит А, миозит, миокардит, панкреатит, диабет, эпидемическую миалгию, энцефалит, грипп, везикулярный фарингит и ящур. Однако для лечения этих заболеваний отсутствуют терапевтические средства. Большинство лекарственных средств, находящихся на стадии разработки, представляют собой ингибиторы декапсидации. Вирусы, принадлежащие семейству Picornaviridae, вызывают различные заболевания, включая вышеуказанные респираторные заболевания, которые вызывают гигиенические, социальные и экономические проблемы. Пикорнавирусы являются основными причинными факторами заболеваний, передающихся через воду. Будучи крайне стабильными и трудно поддающимися дезинфекции, РНК-вирусы постоянно вызывают соответствующие заболевания.
Риновирусы человека (hRV) недавно были связаны с большим количеством случаев обострения астмы, и известно, что они присутствуют даже в бронхиальной ткани большинства больных астмой в фазе стабильной ремиссии. Сравнение соответствующих образцов биопсии слизистой оболочки бронхов, взятых у пациентов, больных астмой, и пациентов, не страдающих астмой, показало значительно более высокую частоту обнаружения риновирусов человека в нижних дыхательных путях у пациентов, больных астмой, по сравнению с пациентами, не страдающими астмой. Также сообщалось о корреляции между наличием риновируса человека и клинической тяжестью астмы. Кроме того, риновирусы вызывают хроническое обструктивное заболевание легких, пневмонию, синусит и отит среднего уха, так же как и астму.
Риновирусы являются основной причиной простуды, а заболевания, которые вызываются энтеровирусом, включают менингит, инфекцию дыхательных путей и тому подобное. Широкомасштабные усилия в проведении вакцинации против полиовируса значительно сократили возникновение полиомиелита во всем мире, но до сих пор сообщается о случаях заболевания в Нигере, Нигерии, Египте, Индии, Пакистане и Афганистане. Гепатит А в настоящее время можно до некоторой степени контролировать благодаря наличию вакцин против вируса гепатита А. Однако вакцин против вирусов коксаки, эховирусов или риновирусов до настоящего времени разработано не было.
В частности, вирус коксаки B является главным возбудителем миокардита, который может развиваться в тяжелых случаях до идиопатической дилатационной кардиомиопатии, при которой требуется трансплантация сердца.
Производные энвироксима считают наиболее перспективными кандидатами с широкой антиэнтеровирусной и антириновирусной активностью. Энвироксим препятствует синтезу «плюс»-цепи РНК посредством связывания с вирусным белком 3А, необходимым для образования промежуточных РНК при репродукции вируса (Heinz B.A. и Vance L.M.: J Virol, 1995, 69(7), 4189-97). В клинических исследованиях, однако, наблюдались незначительные эффекты соединения или их малое число с сопутствующим обнаружением плохой фармакокинетики и нежелательных побочных эффектов (Miller F.D. et al.: Antimicrob Agents Chemother, 1985, 27(1), 102-6).
Ингибитор протеазы AG 7088 был разработан на основе знаний о тонкой структуре и функции вирусной протеазы 2С. В культуре клеток с наномолярным диапазоном концентраций ингибитор А 7088 имел эффект против риновируса типа 48 и вируса коксаки A21, B3, энтеровируса 70 и эховируса 11 (Pattick A.K. et al.: Antimicrobila Agents Chemother, 1999, 43(10), 2444-50).
Благодаря выяснению молекулярной структуры вирусных капсидов были получены предпосылки для целенаправленного создания блокаторов капсида, «веществ WIN» (Diana G.D.: Curr Med Chem 2003, 2, 1-12). Они ингибируют адсорбцию и/или декапсидацию риновирусов и энтеровирусов. Некоторые из веществ WIN обладают весьма специфичным эффектом только в отношении отдельных родов или вирусных типов пикорнавируса. Другие производные ингибируют репликацию как риновируса, так и энтеровирусов. К веществам WIN, например, относятся арилдон, дизоксарил и пиродавир. Эти соединения показывают очень сильные противовирусные эффекты в культуре клеток. Однако плохая растворимость (арилдон), низкая биодоступность (арилдон и дизоксарил), быстрое метаболизирование и выведение (дизоксарил и WIN 54954), а также побочные эффекты, такие как кожная сыпь (WIN 54954), делают их клиническое применение невозможным.
Плеконарил, разновидность вещества WIN, обладает очень хорошей пероральной биодоступностью, и после его связывания с гидрофобным карманом в капсиде вируса он ингибирует проникновение рино-, эховирусов и вирусов коксаки (Pevear D.C. et al.: Antimicrob Agents Chemother 1999, 43(9), 2109-15; McKinlay M.A. et al.: Annu Rev Microbiol 1992, 46, 635-54). Таким образом, плеконарил потенциально эффективен в отношении широкого спектра вирусных заболеваний в диапазоне от простуды до вирусного менингита или миокардита. Резистентность к нему была отмечена для риновирусов, энтеровируса 71 и вируса коксаки В3 (Ledford R.M. et al.: J Virol 2004, 78(7), 3663-74; Groarke J.M. et al.: J Infect Dis 1999, 179(6), 1538-41). Однако доказанный терапевтический эффект не был достаточным для регистрации плеконарила (Picovir, ViroPharma, США) в качестве средства для лечения риновирусных инфекций в США. В марте 2002 года соответствующее ходатайство было отклонено Администрацией по контролю за продуктами питания и лекарствами (FDA), так как терапевтическая польза была очень низкой и наблюдались побочные эффекты.
Было обнаружено, что BTA-798 обладает более высокой противовирусной активностью по сравнению с плеконарилом, по данным in vitro и in vivo анализов с риновирусами, и в настоящее время он находится на стадии клинических испытаний (Ryan, J. et al. Antiviral Res [18th Intl Conf Antiviral Res (April 11-14, Barcelona) 2005] 2005, 65(3): Abst LB-11).
Однако до сих пор не было разработано противовирусных лекарственных средств, которые были бы одобрены для применения для лечения энтеро- или риновирусов.
Интенсивные и доскональные исследования эффективных вирусостатических средств против пикорнавирусов, включая вирусы коксаки, энтеро-, эхо-, полио- и риновирусы, которые привели к созданию настоящего изобретения, завершились тем, что было обнаружено, что производные инданона обладают высокой ингибирующей активностью против пикорнавирусов, включая вирусы коксаки, энтеро-, эхо-, полио- и риновирусы.
Описание
Техническая задача
Таким образом, цель настоящего изобретения - предоставить новое производное инданона или его фармацевтически приемлемую соль или его энантиомер.
Другая цель настоящего изобретения предоставить - способ получения производного инданона или его фармацевтически приемлемой соли или его энантиомера.
Еще одна цель настоящего изобретения - предоставить фармацевтическую композицию для профилактики или лечения вирусного заболевания, содержащую производное инданона или его фармацевтически приемлемую соль или его энантиомер в качестве активного ингредиента.
Техническое решение
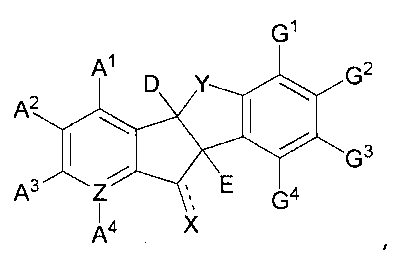
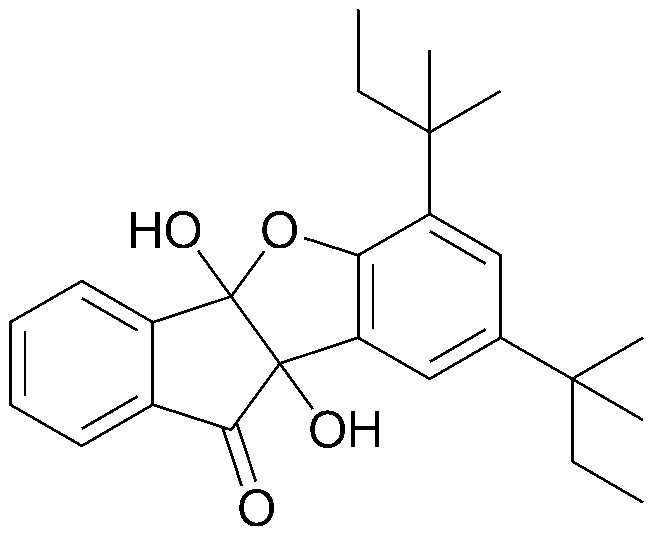
В соответствии с одним из аспектов настоящее изобретение предоставляет производное инданона, представленное следующей химической формулой 1, его фармацевтически приемлемую соль или его энантиомер:
[Химическая формула 1]

(где
A1, A2, A3, A4, D, E, Z, G1, G2, G3, G4, X и Y такие, как соответственно определены ниже в описании.)
В соответствии с другим аспектом настоящее изобретение предоставляет способ получения производного инданона, фармацевтически приемлемой соли или энантиомера.
В соответствии с еще одним аспектом настоящее изобретение предоставляет фармацевтическую композицию для профилактики или лечения вирусного заболевания, содержащую производное инданона, фармацевтически приемлемую соль или энантиомер в качестве активного ингредиента.
Преимущества изобретения
Благодаря прекрасной ингибирующей активности в отношении пикорнавирусов, включая вирусы коксаки, энтеро-, эхо-, полио- и риновирусы, а также низкой цитотоксичности, производное инданона химической формулы 1 может использоваться в качестве активного ингредиента в фармацевтической композиции для профилактики или лечения вирусного заболевания, включая полиомиелит, паралич, острый геморрагический конъюнктивит, вирусный менингит, вирусную пузырчатку полости рта и конечностей, пузырчатку, гепатит А, миозит, миокардит, панкреатит, диабет, эпидемическую миалгию, энцефалит, грипп, везикулярный фарингит, ящур, астму, хроническое обструктивное заболевание легких, пневмонию, синусит или отит среднего уха.
Наилучший вариант осуществления
Ниже приведено подробное описание настоящего изобретения.
В соответствии с одним из аспектов настоящее изобретение предоставляет производное инданона, представленное с помощью следующей химической формулы 1, его фармацевтически приемлемую соль или его оптический изомер:
[Химическая формула 1]
 ,
,
где
A1, A2, A3 и A4 независимо или необязательно выбраны из группы, состоящей из -H, галогена, -OH, -CN, -N3, C1-C10 алкокси, линейного или разветвленного C1-C10 алкила, незамещенного или замещенного -OH или метоксифенилалкилом 5-7-членного гетероциклоалкила, C6-C12 арила, -O(C=O)R1, -(C=O)R1, -(C=O)OR1, -O(C=O)OR1, -O(C=O)NR1R2, -NO2, -NR1R2, -NR1(C=O)R2, -NR1(C=S)R2, -NR1(C=O)OR2, -NR1(C=O)NR2R3, -NR1(SO2)R2 и -NR1(C=S)NR2R3, два или более расположенных рядом заместителей из A1, A2, A3 и A4 вместе могут образовывать кольцо;
D представляет собой -OH, галоген, линейный или разветвленный C1-C10 алкил, незамещенный или замещенный фенилом C1-C10 алкокси, -O(CH2)nOH, -O(C=O)R1, -(C=O)R1, -(C=O)OR1, -O(C=O)OR1, -O(C=O)NR1R2, -NO2, -NR1R2, -NR1(O)R2, -NR1(C=O)R2, -NR1(C=S)R2, -NR1(C=O)OR2, -NR1(C=O)NR1R2 или -NR1(C=S)NR1R2;
E представляет собой галоген, -OH, -CN, -N=C=O, -N3, C1-C10 алкокси, -O(C=O)R1, -(C=O)R1, -(C=O)OR1, -O(C=O)OR1, -O(C=O)NR1R2, -NO2, -NR1R2, -NR1(C=O)R2, -NR1(C=S)R2, -NR1(C=O)OR2, -NR1(C=O)NR1R2, -NR1(C=O)NR2OR3, -NR1(SO2)R2, -NR1(C=S)NR1R2, -NR1(P=O)(OR2)2 или  ;
;
G1, G2, G3 и G4 независимо или необязательно выбраны из группы, состоящей из -H, галогена, -OH, CN, C1-C10 алкокси, линейного или разветвленного C1-C20 алкила, C6-C12 арила, -O(C=O)R1, -(C=O)R1, -(C=O)OR1, -(CH2)n-(C=O)OR1, -O(C=O)OR1, -O(C=O)NR1R2, -NO2, -NR1R2, -NR1(C=O)R2, -NR1(C=S)R2, -NR1(C=O)OR2, -NR1(C=O)NR2R3 и -NR1(C=S)NR2R3, при условии, что по меньшей мере два или более расположенных рядом заместителя из G1, G2, G3 и G4 вместе могут образовывать кольцо;
X представляет собой водород, кислород, серу, гидрокси, линейный или разветвленный C1-C10 алкил, линейный или разветвленный C1-C10 алкилен, =N-NR1R2, -NR1-OR2 или =N-OR1;
Y представляет собой -O-, -CH2-, -NH- или -(NR5)-;
R5 представляет собой -(C=O)H, -(C=O)OH, -(C=O)R1, -(C=S)R1 или -(C=O)OR1;
Z представляет собой C или N;
R1, R2, R3 и R4 независимо представляют собой водород, линейный или разветвленный C1-C10 алкил, линейный или разветвленный C1-C10 алкенил, не замещенный или замещенный фенилом, C3-C7 циклоалкил, C3-C7 гетероциклоалкил, C6-C12 арил или 5-14-членный гетероарил;
где гетероциклоалкил может быть замещен одним или более атомами кислорода через двойную связь,
арил является моно- или бициклическим и может иметь один или более заместителей, выбранных из группы, состоящей из галогена, -CN, фенила, линейного или разветвленного C1-C6 алкила, R5 и C1-C6 алкокси,
гетероарил является моно-, би- или трициклическим и может иметь один или более заместителей, выбранных из группы, состоящей из галогена, -OH, -NO2, -NH2, -CN, =O или -O-, линейного или разветвленного C1-C10 алкила, линейного или разветвленного C1-C10 алкокси и фенила,
линейный или разветвленный алкил может быть не замещен или замещен одним или более заместителями, выбранными из группы, состоящей из фенила, галогена, 5-7-членного гетероарила и -NHBoc,
фенил может быть замещен одним или более заместителями, выбранными из группы, состоящей из галогена, фенила или фенил-замещенного C1-C6 алкокси,
гетероциклоалкил или гетероарил содержит по меньшей мере один гетероатом, выбранный из группы, состоящей из N, O и S,
галоген представляет собой F, Cl, Br или I,
n представляет собой целое число от 1 до 10, и
′ ′ обозначает одинарную или двойную связь.
′ обозначает одинарную или двойную связь.
В предпочтительном варианте осуществления
A1, A2, A3 и A4 независимо или необязательно выбраны из группы, состоящей из -H, C1-C5 алкокси, линейного или разветвленного C1-C5 алкила, незамещенного или замещенного -OH или метоксифенилалкилом 5-7-членного гетероциклоалкила, C6-C12 арила, -NO2 и -NR1R2;
D представляет собой -OH, галоген, линейный или разветвленный C1-C5 алкил или незамещенный или замещенный фенилом C1-C5 алкокси;
E представляет собой галоген, -OH, C1-C5 алкокси, -NR1(C=O)R2, -NR1(C=O)OR2 или -NR1(C=O)NR1R2;
G1, G2, G3 и G4 независимо или необязательно выбраны из группы, состоящей из -H, C1-C5 алкокси и линейного или разветвленного C1-C16 алкила;
X представляет собой кислород, гидроксил или линейный или разветвленный C1-C5 алкил;
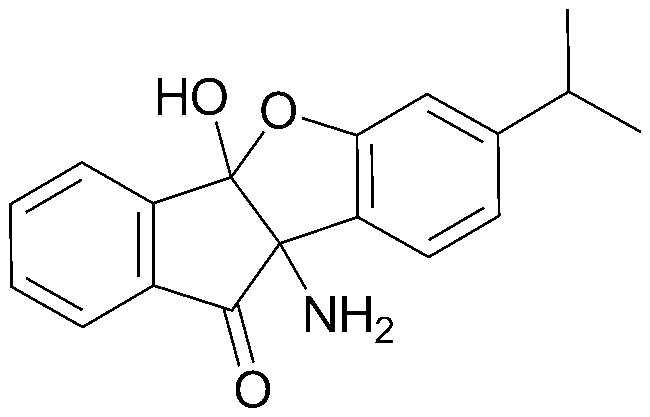
Y представляет собой -O- или -CH2-;
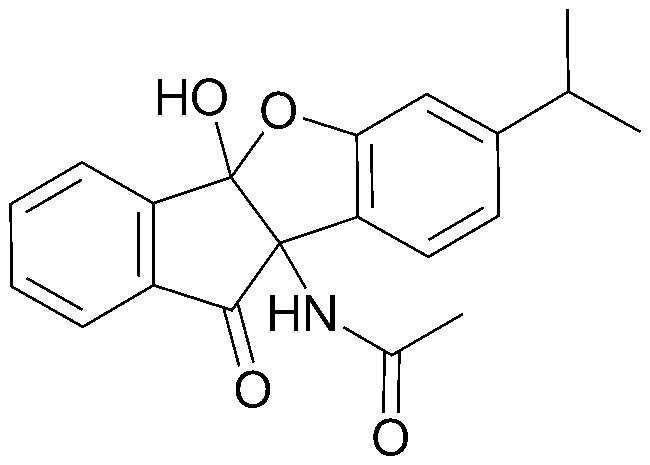
Z представляет собой C или N;
R1, R2, R3 и R4 независимо представляют собой водород, линейный или разветвленный C1-C7 алкил, C3-C7 гетероциклоалкил, C6-C12 арил или 5-14-членный гетероарил;
где гетероциклоалкил может быть замещен одним или более атомами кислорода через двойную связь,
арил является моно- или бициклическим и может иметь один или более заместителей, выбранных из группы, состоящей из галогена, фенила, линейного или разветвленного C1-C3 алкила и C1-C3 алкокси,
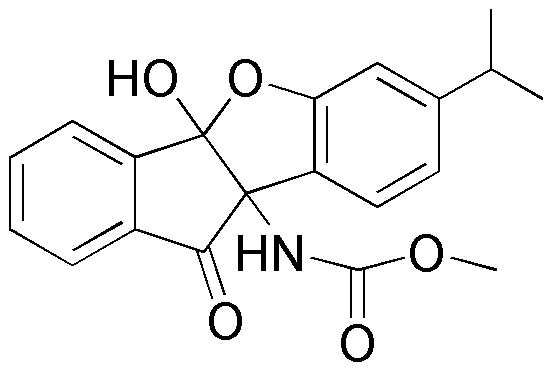
гетероарил является моно-, би- или трициклическим и может иметь один или более заместителей, выбранных из группы, состоящей из галогена, -OH, -NO2, -NH2, -CN, =O или -O-, линейного или разветвленного C1-C10 алкила, линейного или разветвленного C1-C10 алкокси и фенила,
линейный или разветвленный алкил может быть незамещен или замещен одним или более заместителями, выбранными из группы, состоящей из фенила, галогена и 5-7-членного гетероарила,
фенил может быть замещен одним или более заместителями, выбранным из группы, состоящей из галогена и фенила,
гетероциклоалкил или гетероарил содержит по меньшей мере один гетероатом, выбранный из группы, состоящей из N, O и S,
галоген представляет собой F или Cl, и
′ ′ обозначает одинарную или двойную связь.
′ обозначает одинарную или двойную связь.
В более предпочтительном варианте осуществления
A1, A2, A3 и A4 независимо или необязательно выбраны из группы, состоящей из -H и -NR1R2;
D представляет собой -OH;
E представляет собой -OH или -NR1(C=O)R2;
G1, G2, G3 и G4 независимо или необязательно представляют собой линейный или разветвленный C1-C15 алкил;
X представляет собой кислород;
Y представляет собой -O-;
Z представляет собой C;
R1, R2, R3 и R4 независимо представляют собой водород или 5-14-членный гетероарил;
где 5-14-членный гетероарил является моноциклическим, бициклическим или трициклическим и может быть замещен одним или более заместителями, выбранными из группы, состоящей из галогена, -OH, -NO2, -NH2, -CN, =O или -O-, линейного или разветвленного C1-C10 алкила, линейного или разветвленного C1-C10 алкокси и фенила,
фенил может быть замещен одним или более заместителями, выбранными из группы, состоящей из галогена и фенила,
гетероарил содержит по меньшей мере один гетероатом, выбранный из группы, состоящей из N, O и S, и
галоген представляет собой F или Cl, и
′ ′ обозначает одинарную или двойную связь.
′ обозначает одинарную или двойную связь.
В дополнительном, еще более предпочтительном варианте осуществления
A1, A2 и A3 представляют собой -H, а A4 представляет собой -NH2;
D представляет собой -OH;
E представляет собой -NR1(C=O)R2;
G1, G3 и G4 представляют собой -H, а G2 представляет собой изопропил;
X представляет собой кислород;
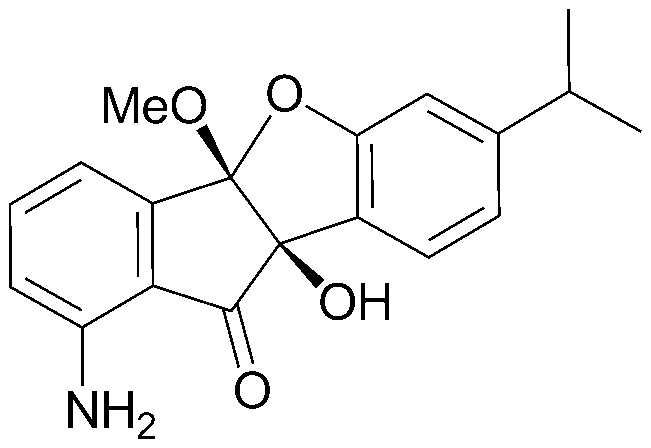
Y представляет собой -O-;
Z представляет собой C;
R1 представляет собой водород, и R2 представляет собой 5-14-членный гетероарил;
где гетероарил представляет собой фуран, бензофуран, пиридин, пиразолопиридин, пиримидин, пиразолопиримидин, пиразин, тиофен, хинолин, изохинолин, триазол, тиазол, индол, пиразол, индазол, тетразол, бензотриазол, хромен, пиран, пиррол, бензопиразол, изоксазол, ксантен, циннолин, имидазол, бензоимидазол, акридин, имидазопиридин, имидазопиримидин, хиноксалин, пиридазин, тетразолопиридин, триазолопиридин, триазолопиримидин или индолизин и может быть замещен одним или более заместителями, выбранными из группы, состоящей из галогена, -OH, -NO2, -NH2, -CN, =O или -O-, линейного или разветвленного C1-C10 алкила, линейного или разветвленного C1-C10 алкокси и фенила, и
галоген представляет собой F или Cl, и
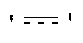 обозначает двойную связь.
обозначает двойную связь.
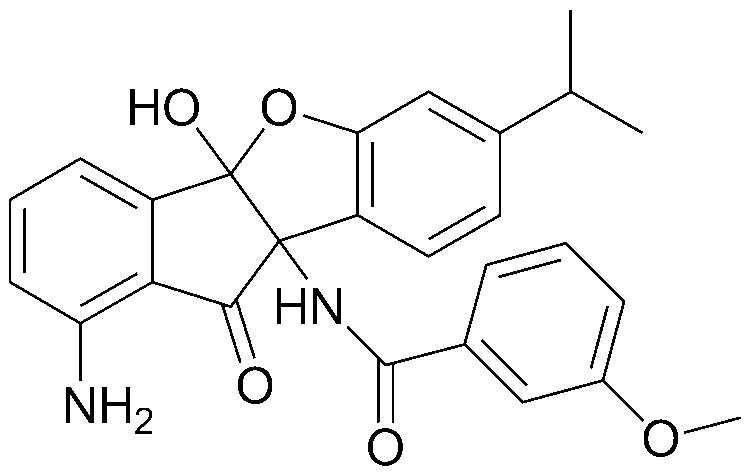
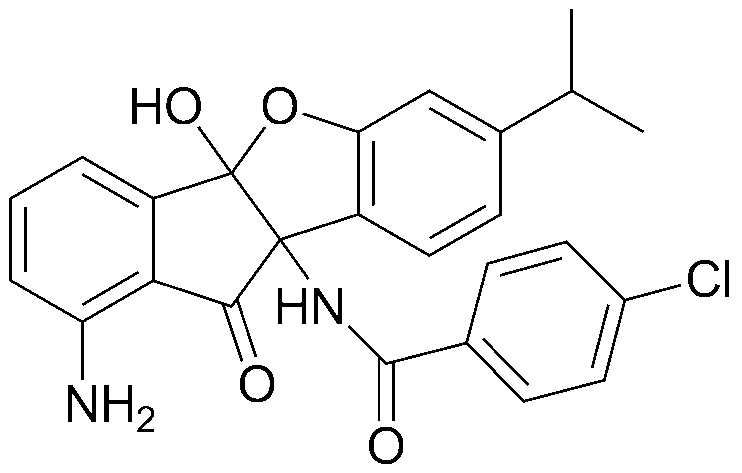
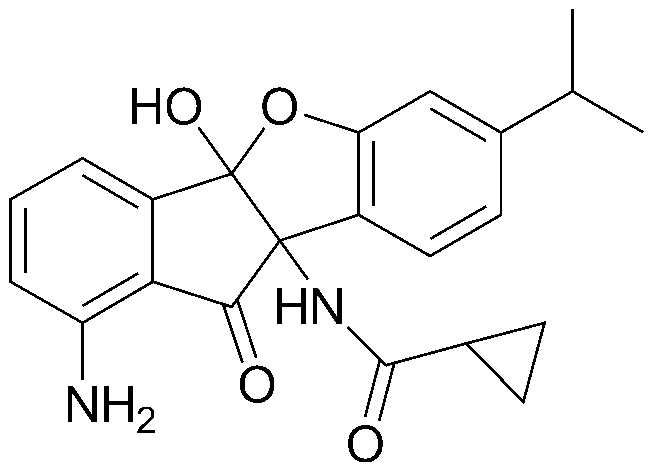
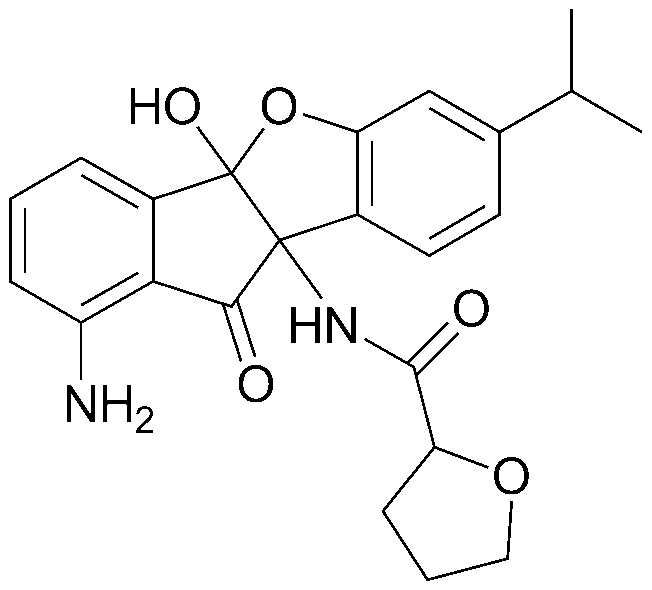
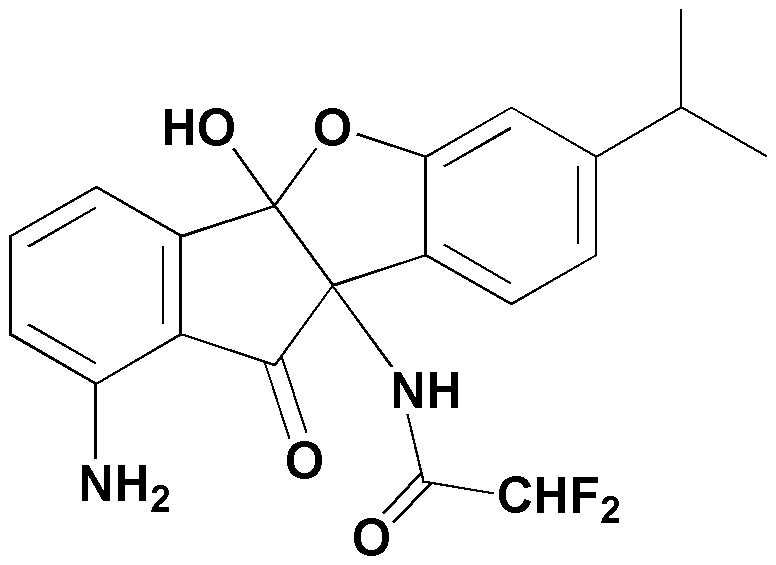
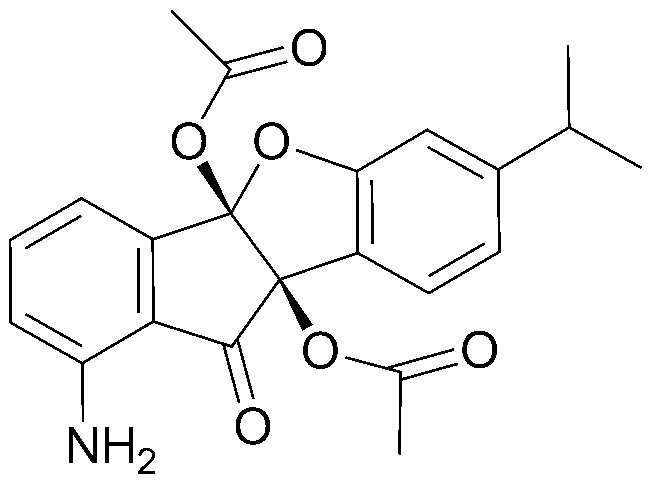
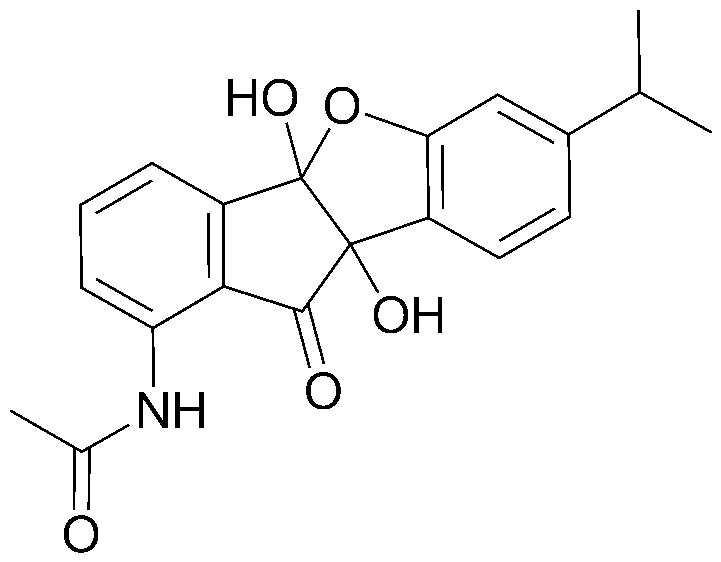
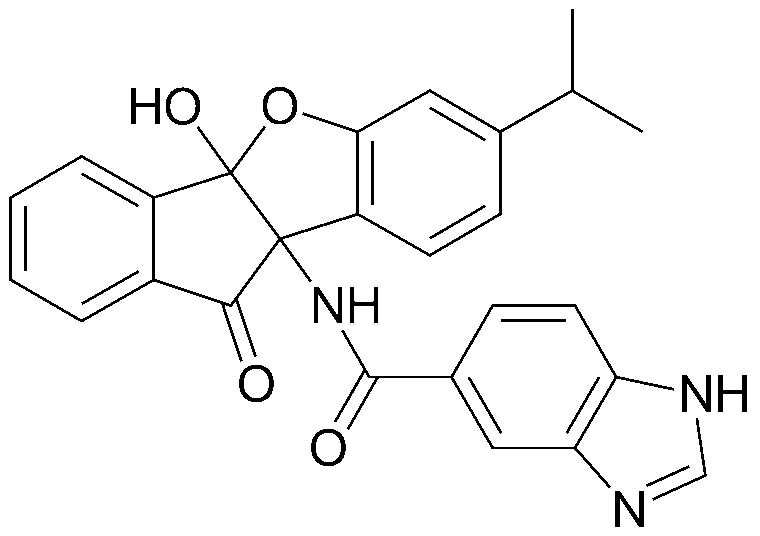
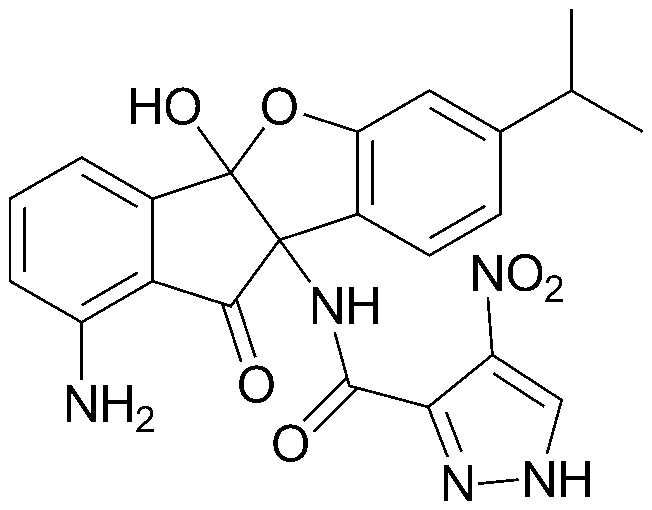
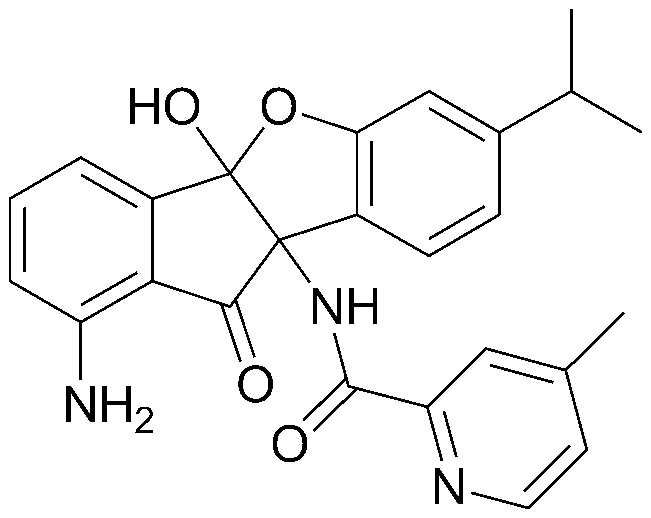
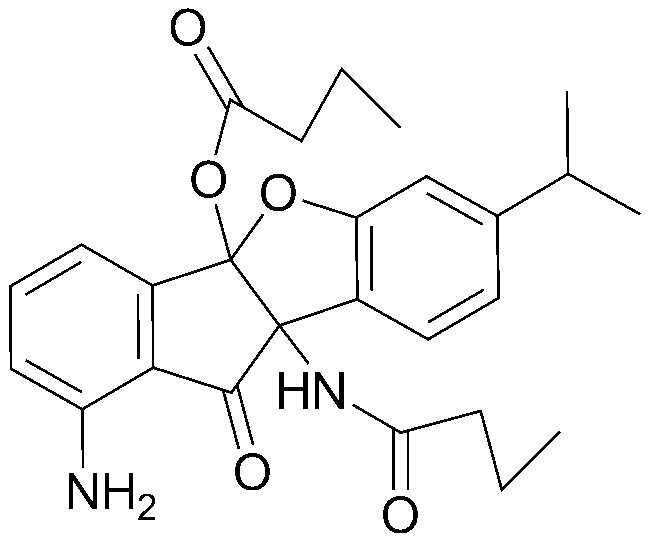
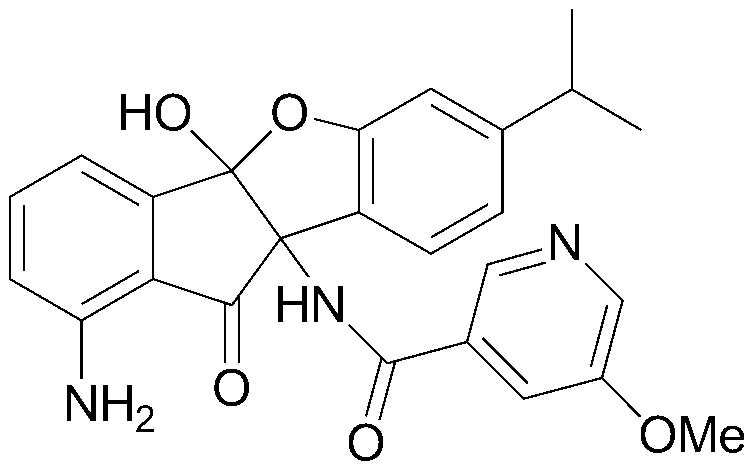
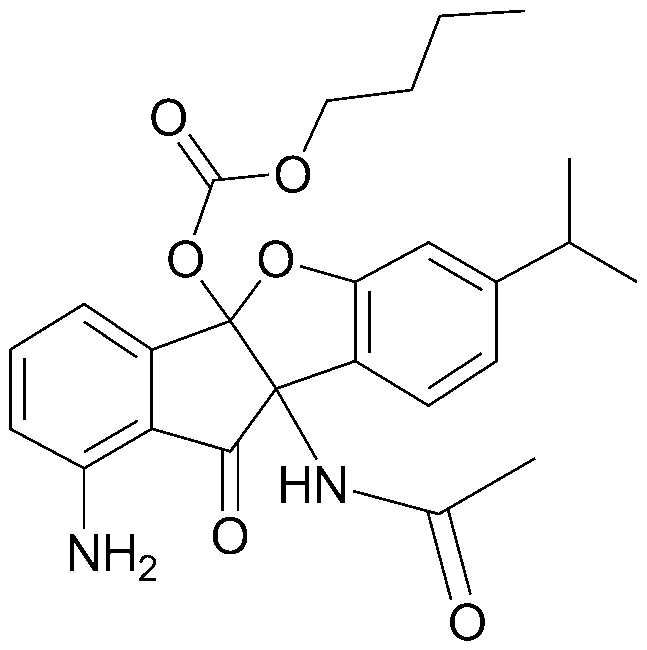
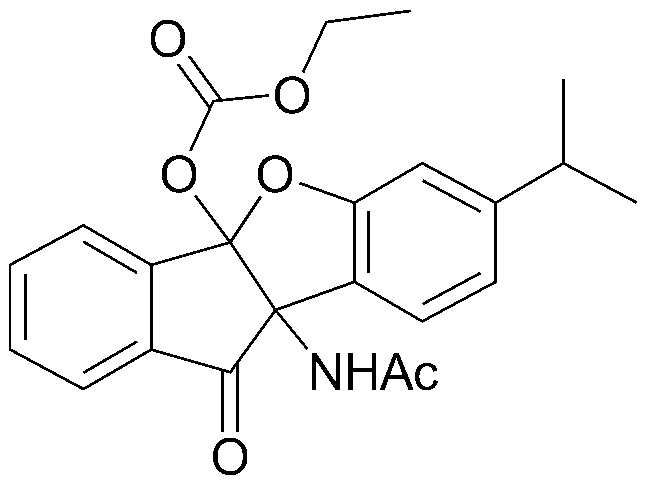
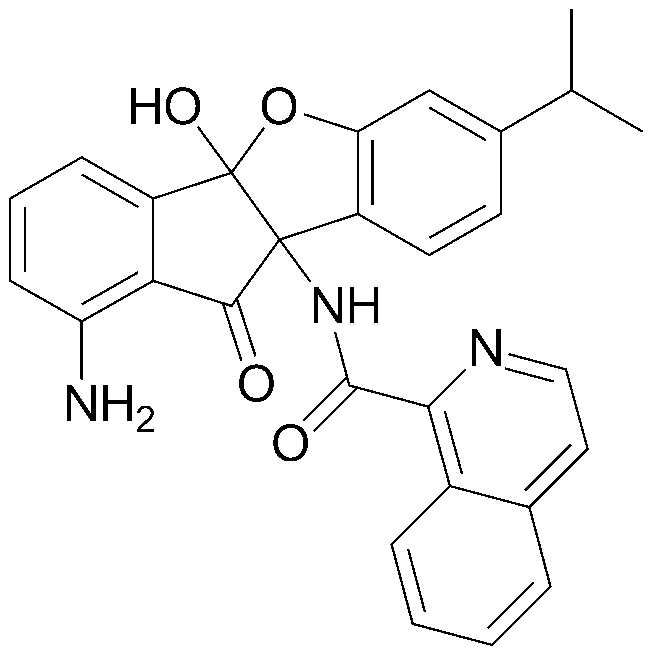
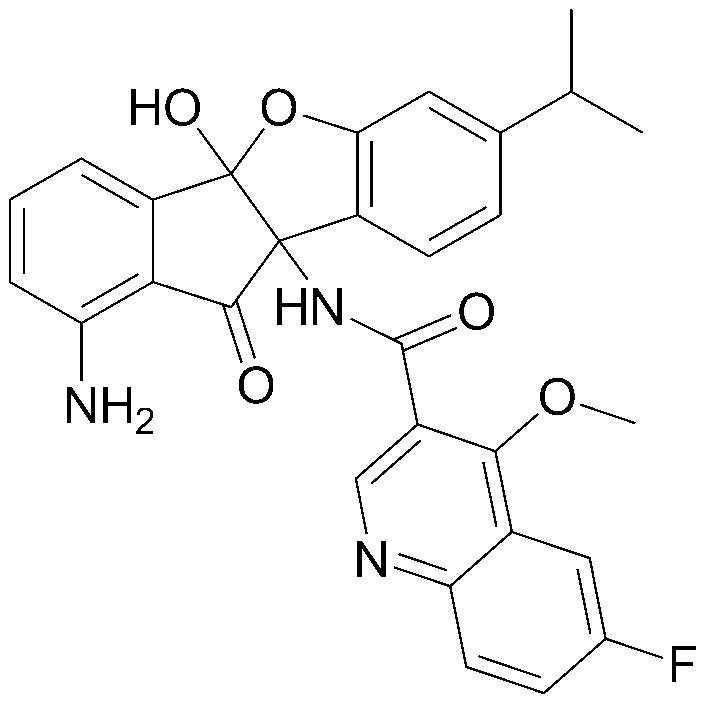
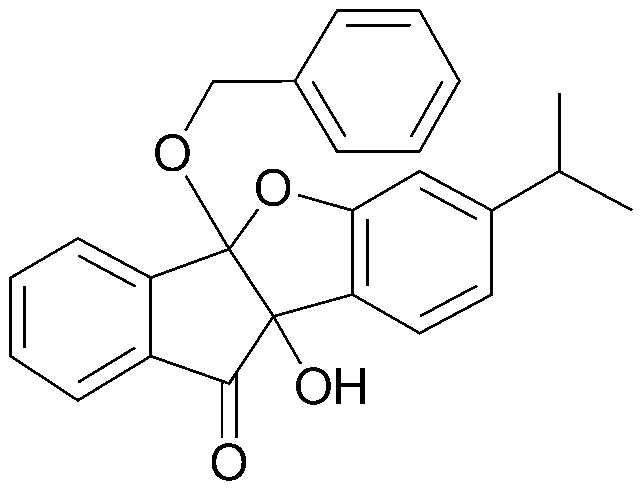
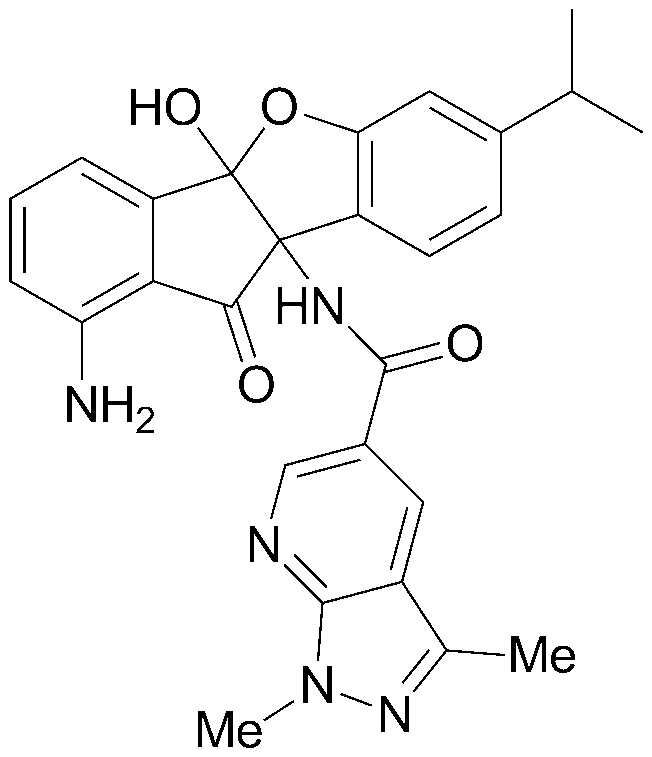
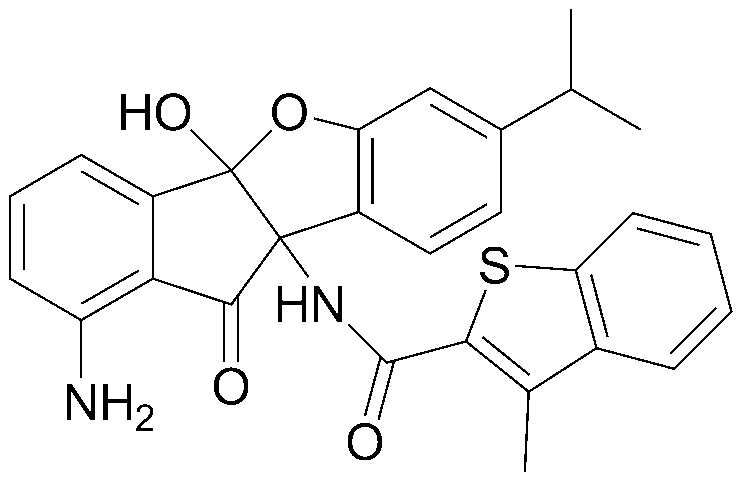
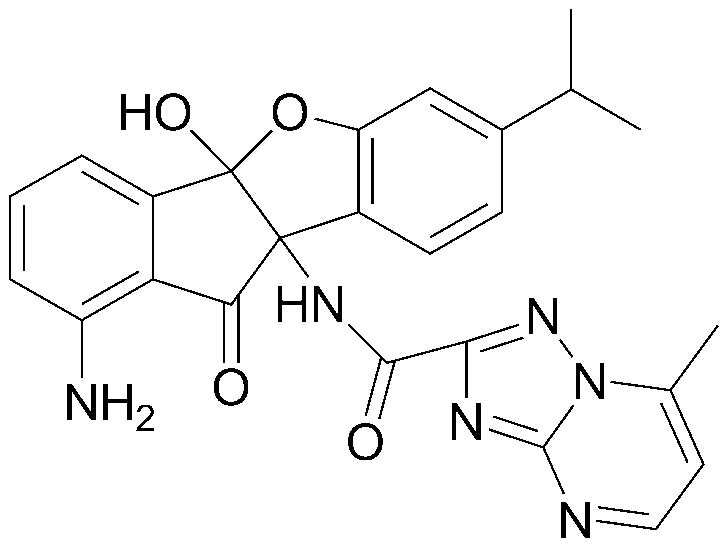
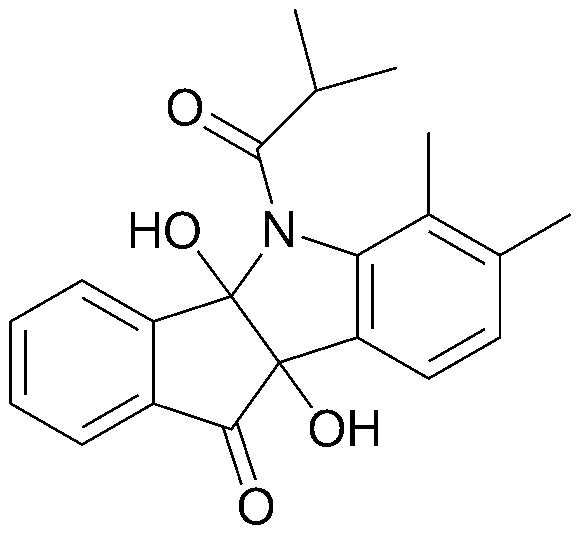
Конкретные примеры соединения, представленного химической формулой 1, включают:
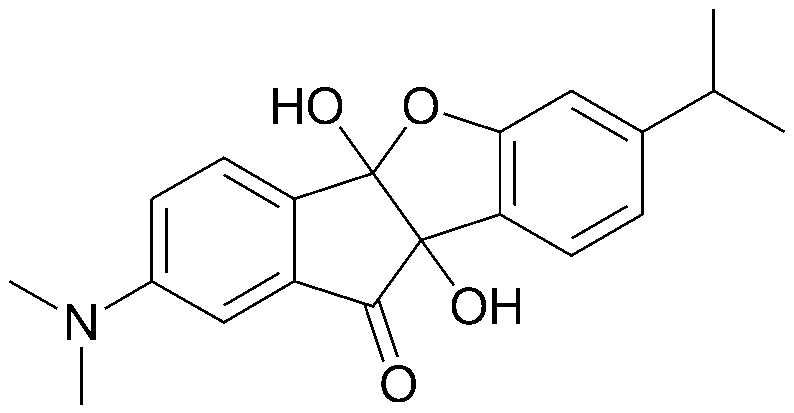
1) 4b,9b-дигидрокси-7-метил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
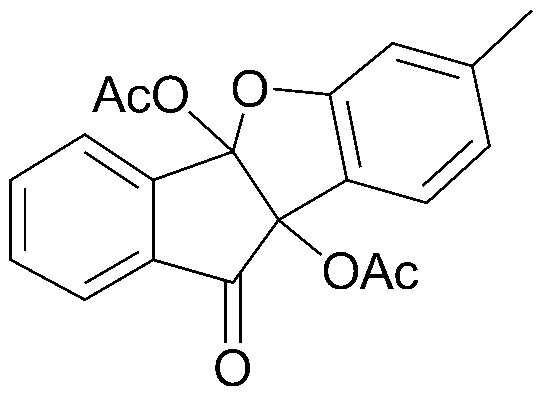
2) 7-метил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диилдиацетат;
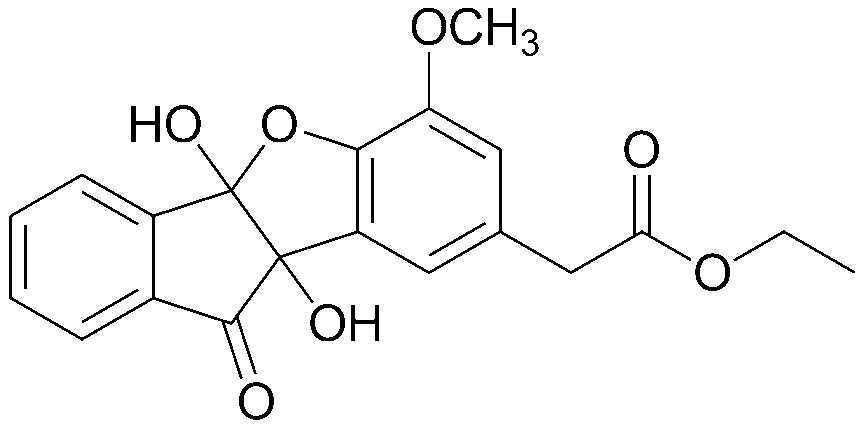
3) этил-2-(4b,9b-дигидрокси-6-метокси-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-8-ил)ацетат;
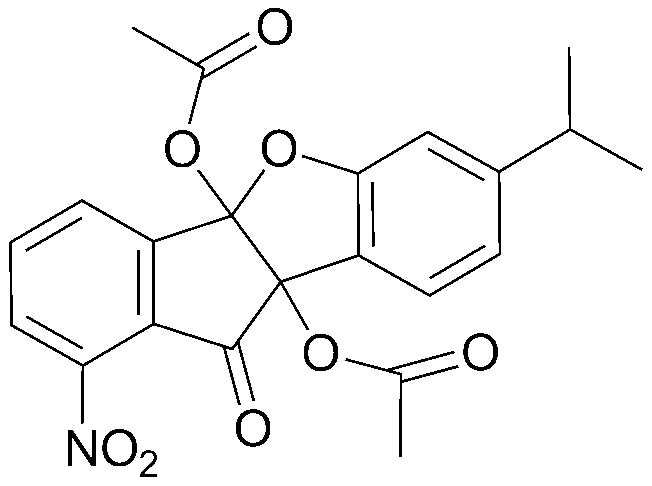
4) 4b,9b-дигидрокси-7,8-диметил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
5) 4b,9b-дигидрокси-4b,9b-дигидро-10Н-индено[1,2-b]бензофуран-10-он;
6) 8-фтор-4b,9b-дигидрокси-4b,9b-дигидро-10Н-индено[1,2-b]бензофуран-10-он;
7) 4b,9b-дигидрокси-7-метокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
8) 6,7-дихлор-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
9) 7-этил-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
10) 4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
11) 7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диилдиацетат;
12) 4b,9b-дигидрокси-8-метокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
13) 4b,9b-дигидрокси-6-фенил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
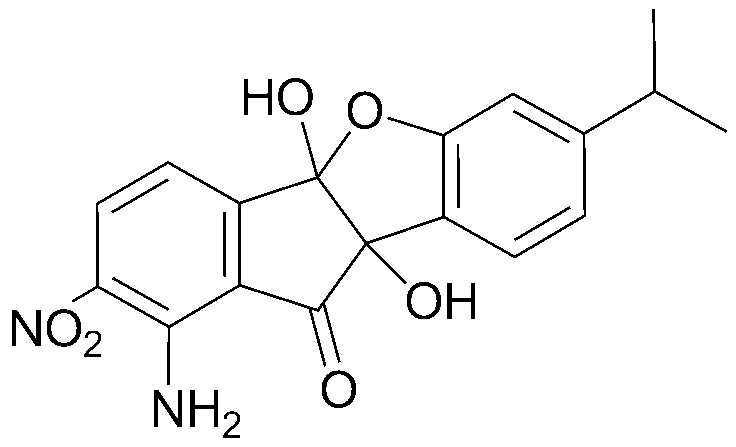
14) 4b,9b-дигидрокси-8-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
15) 4b,11b-дигидрокси-4bH-индено[1,2-b]нафто[2,3-d]фуран-12(11bH)-он;
16) 6b,11b-дигидрокси-6bH-индено[1,2-b]нафто[2,1-d]фуран-7(11bH)-он;
17) 4b,9b-дигидрокси-8-пропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
18) 8-этил-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
19) 8-втор-бутил-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
20) 8-трет-бутил-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
21) 6-трет-бутил-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
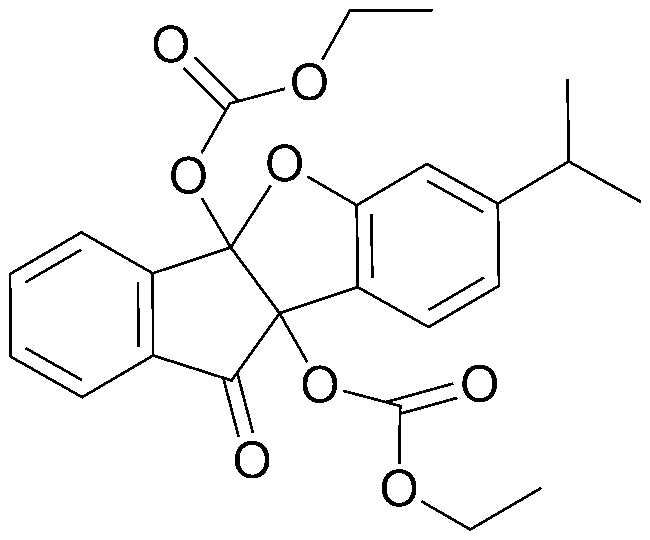
22) 4b,9b-дигидрокси-7,8,9-триметил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
23) 4b,9b-дигидрокси-8-трет-пентил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
24) 6,8-ди-трет-бутил-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
25) 6,8-ди-трет-бутил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диилдиацетат;
26) 4b,9b-дигидрокси-8-нонил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
27) 4b,9b-дигидрокси-8-пентадецил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
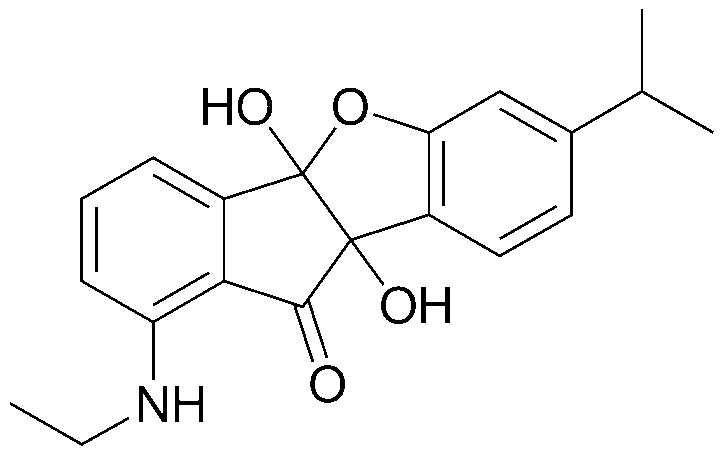
28) 6,8-бис-(1,1-диметилпропил)-4b,9b-дигидрокси-4b,9b-дигидро-5-оксаиндено[2,1-а]инден-10-он;
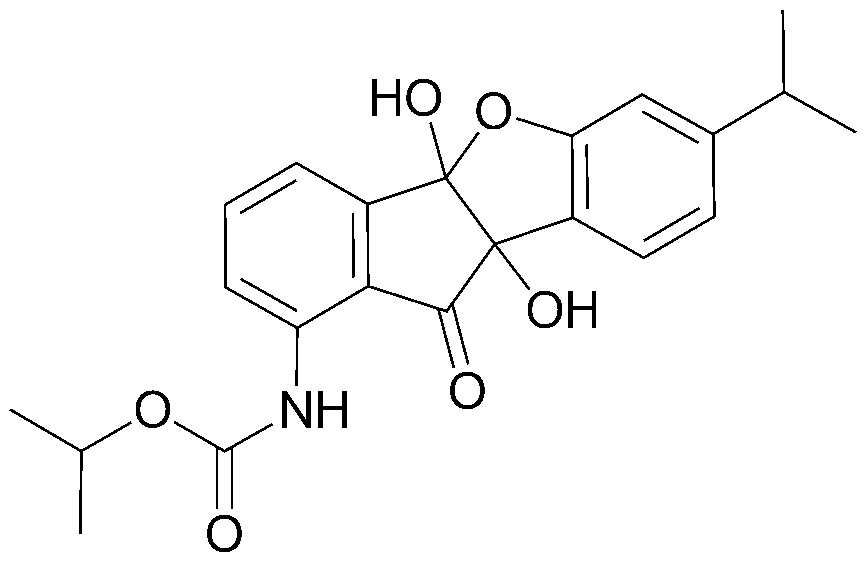
29) изопропил-4b,9b-дигидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-илкарбамат;
30) 5а,10а-дигидрокси-2,3,5а,10а-тетрагидродииндено[1,2-b:5′,6′-d]фуран-10(1Н)-он;
31) 6b,11b-дигидрокси-1,2,3,4,6b,11b-гексагидро-12-окса-бензо[4,5]пенталено[2,1-а]нафталин-7-он;
32) 4b,9b-дигидрокси-7-изопропил-2-метокси-4b,9b-дигидро-5-оксаиндено[2,1-а]инден-10-он;
33) 7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диил-бис(2,2-диметилпропаноат);
34) (2Е,2′Е)-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диил-бис(3-фенилакрилат);
35) 9b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илакрилат;
36) 9b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено-b]фуран-4b-ил-фуран-2-карбоксилатфуран-2-карбоновая кислота;
37) диэтил-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диилдикарбонат;
38) этил-9b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илкарбонат;
39) метил-4b,9b-дигидрокси-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-8-карбоксилат;
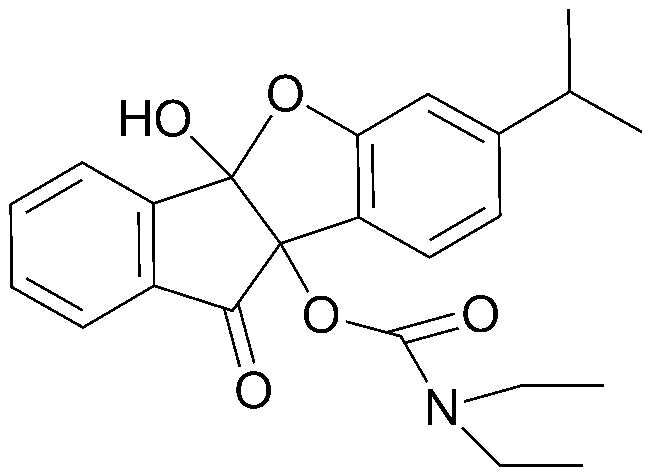
40) 9b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илдиэтилкарбамат;
41) 4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-илдиэтилкарбамат;
42) 2,3-дифтор-4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
43) 1,4b,9b-тригидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
44) 4b,9b-дигидрокси-7-изопропил-1H-циклопента[b]нафталино[1,2-b]фуран-10(9bH)-он;
45) 9b-гидрокси-7-изопропил-4b-метокси-1-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
46) 1-амино-4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
47) 1-амино-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диилдиацетат;
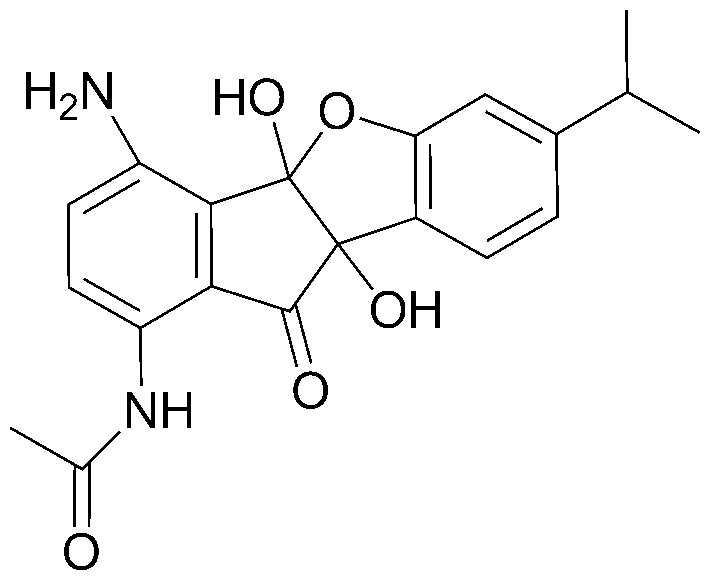
48) N-(4b,9b-дигидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-ил)ацетамид;
49) метил-4b,9b-дигидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-илкарбамат;
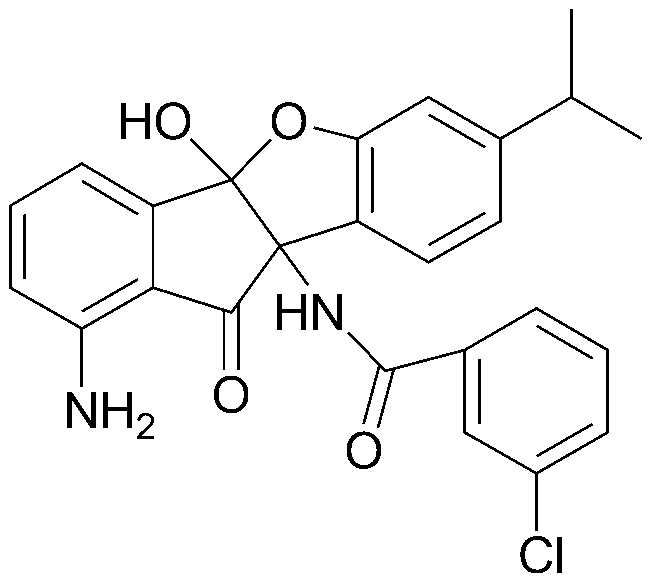
50) 1-амино-7-этил-4b,9b-дигидрокси-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он;
51) 7-этил-4b,9b-дигидрокси-1-нитро-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он;
52) 7-этил-2,4b,9b-тригидрокси-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он;
53) 4b-ацетокси-1-амино-7-изопропил-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-a]инден-9b-иловый эфир уксусной кислоты;
54) 4b-ацетокси-7-изопропил-1-метансульфониламино-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-a]инден-9b-иловый эфир уксусной кислоты;
55) 1-(4b,9b-дигидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-ил)-3-изопропилмочевина;
56) N-(9b-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-ил)ацетамид;
57) N,N′-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1,9b-диил)диацетамид;
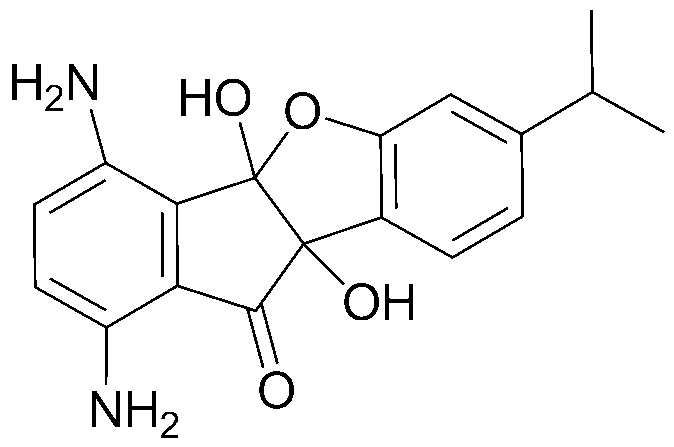
58) N-(7-амино-2-гидрокси-2-(4-изопропил-2-гидроксифенил)-1,3-диоксо-2,3-дигидро-1H-инден-4-ил)ацетамид;
59) N-(2-амино-4b,9b-дигидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-ил)ацетамид;
60) 1-амино-4b,9b-дигидрокси-7-изопропил-2-нитро-4bH-индено[1,2-b]бензофуран-10(9bH)-он;
61) 1,4-диамино-4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
62) 1,2-диамино-4b,9b-дигидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-он;
63) 2-(2-гидрокси-4-изопропилфенил)-1,3-диоксо-2,3-дигидро-1H-инден-2-илдиметилкарбамат;
64) 4b,9b-дигидрокси-6,8-диизопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он;
65) 9b-амино-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он;
66) N-(4b-гидрокси-7-изопропил-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-а]инден-9b-ил)ацетамид;
67) 9b-гексиламино-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-а]инден-10-он;
68) 9b-амино-4b-гидрокси-6,8-диизопропил-4b,9b-дигидро-5-оксаиндено[2,1-а]инден-10-он;
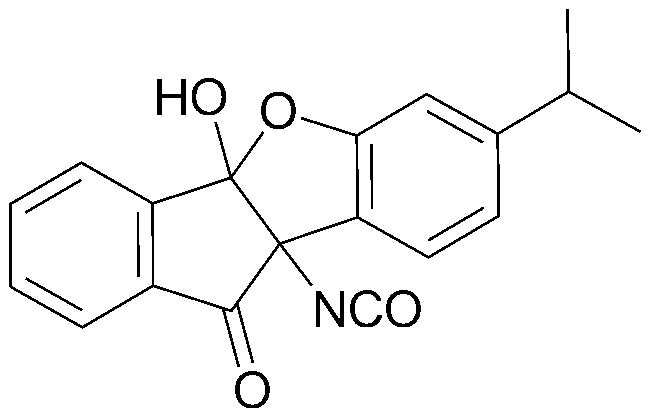
69) 4b-гидрокси-9b-изоцианато-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-а]инден-10-он;
70) метил-((4b,9b)-4b-гидрокси-7-изопропил-10-оксо-4b,10-дигидро-9bH-индено[1,2-b]бензофуран-9b-ил)карбамат;
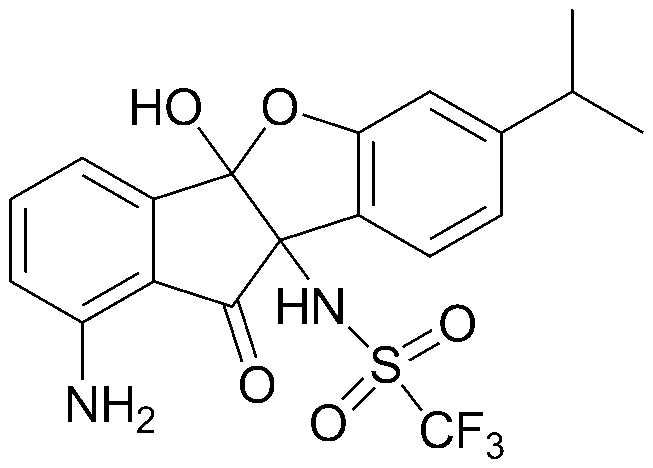
71) (9b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-а]инден-4b-ил)амид пентановой кислоты;
72) N-(9b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-а]инден-4b-ил)изобутиламид;
73) N-(1-амино-9b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-а]инден-4b-ил)ацетамид;
74) N-(9b-гидрокси-6,8-диизопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-а]инден-4b-ил)ацетамид;
75) N-(9b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-а]инден-4b-ил)-N-метилацетамид;
76) 1-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-а]инден-9b-ил)-3-изопропилмочевина;
77) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-а]инден-9b-ил)изобутиламид;
78) (1-амино-4b-гидрокси-7-изопропил-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-а]инден-9b-ил)амид пентановой кислоты;
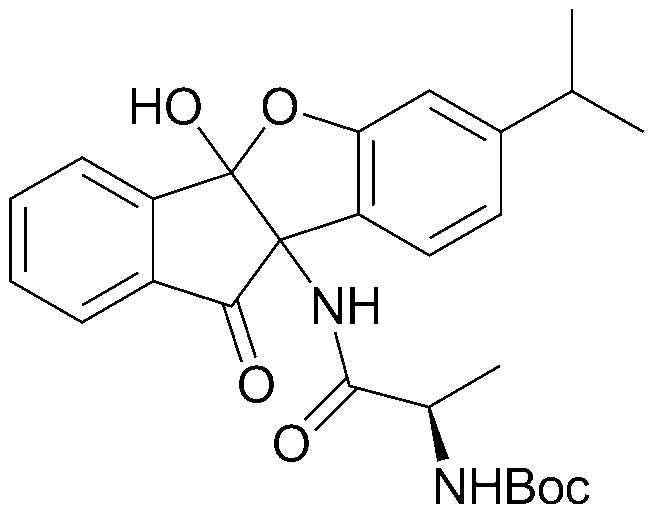
79) 9b-гидрокси-4b-(2-гидроксиэтокси)-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
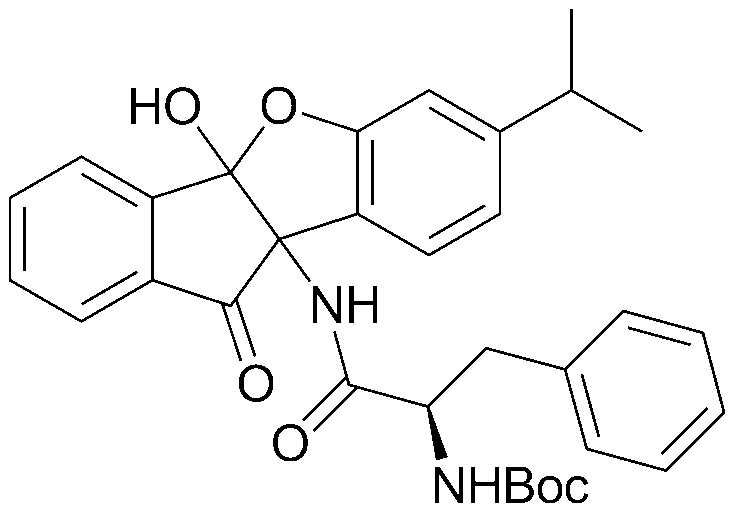
80) 4b,9b-дигидрокси-7-изопропил-1-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
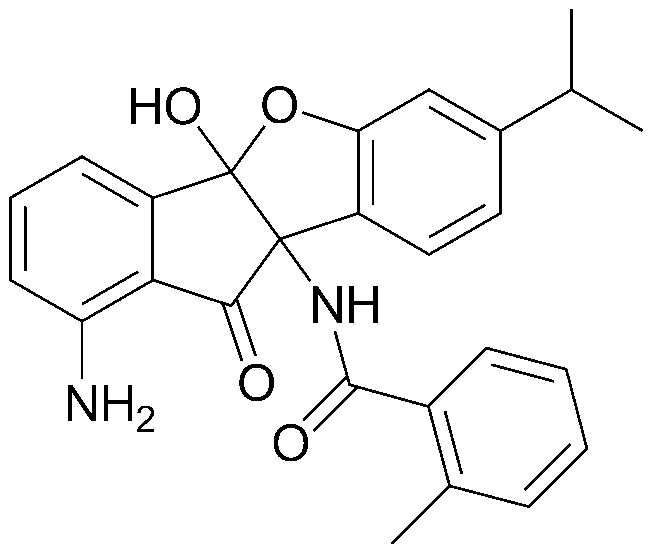
81) 4b,9b-дигидрокси-7-изопропил-2,3-диметокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
82) 4b,9b-дигидрокси-7-изопропил-2,3-диметил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
83) смесь 6:4 (4bS,9bS)-2-бром-4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она и
(4bS,9bS)-3-бром-4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она;
84) индено[2,1-а]инден-4b,9b(5Н,10Н)-диол;
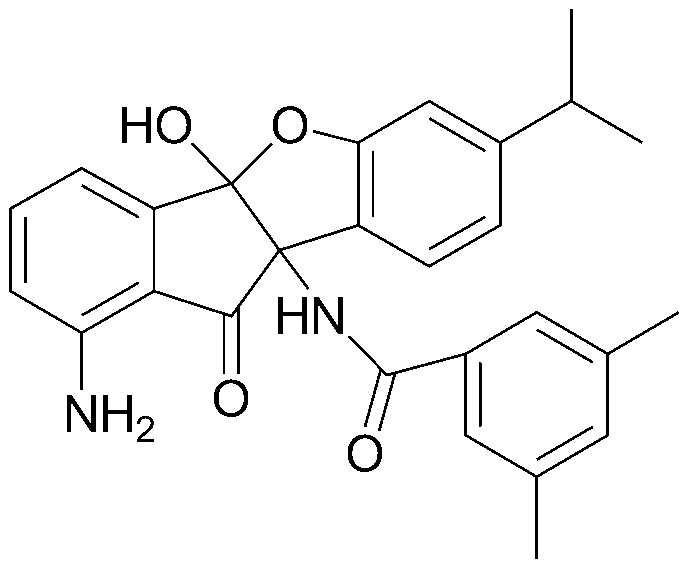
85) изопропил-(4bS,9bS)-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-илкарбамат;
86) этил(4bS,9bS)-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-илкарбамат;
87) N,N′-((4bS,9bS)-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1,9b-диил)диацетамид;
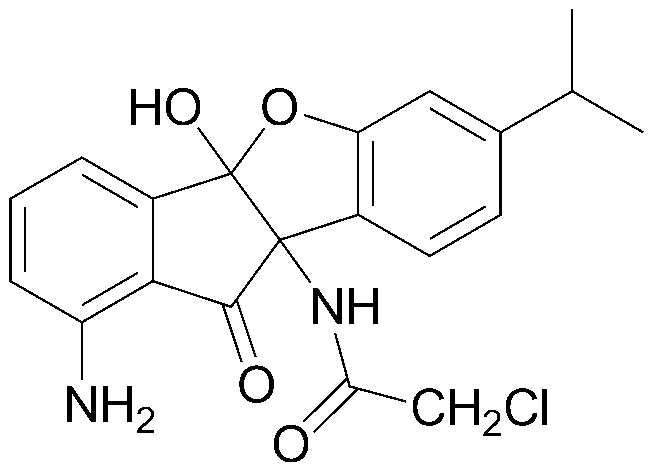
88) О-метилоксим 4b,9b-дигидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-она;
89) 9b-бутириламино-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-а]инден-4b-иловый эфир масляной кислоты;
90) [2-(2-гидрокси-4-изопропилфенил)-1,3-диоксоиндан-2-ил]амид октановой кислоты;
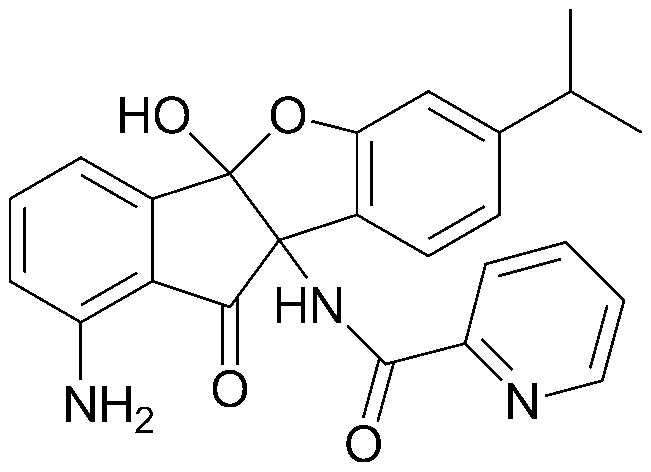
91) 9b-гексаноиламино-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-а]инден-4b-иловый эфир гексановой кислоты;
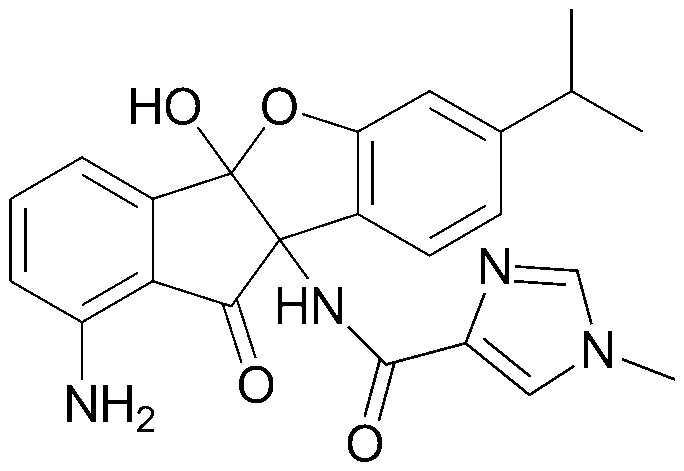
92) 9b-гептаноиламино-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-иловый эфир гептановой кислоты;
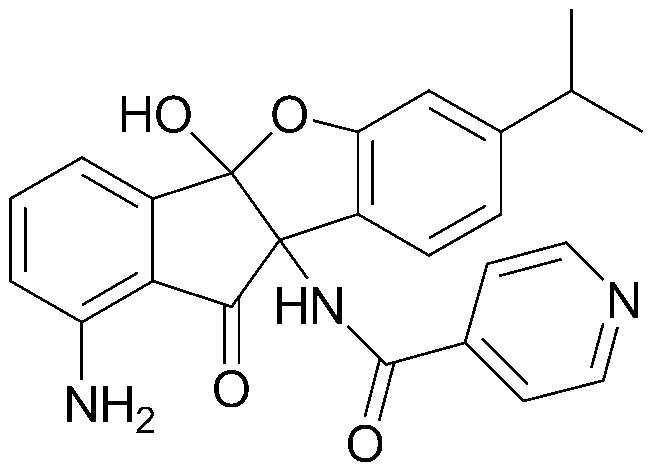
93) N-((4bS,9bS)-1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)октанамид;
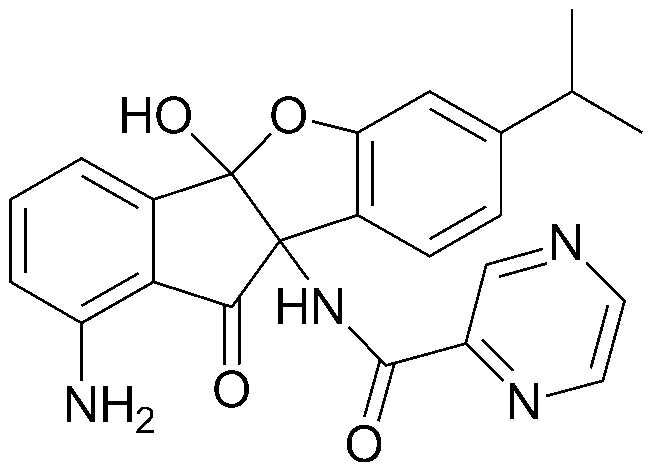
94) (4bR,9bS)-1-амино-7-изопропил-10-оксо-9b-пропионамидо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b-илпропионат;
95) (4bR,9bS)-1-амино-9b-бутирамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b-илбутират;
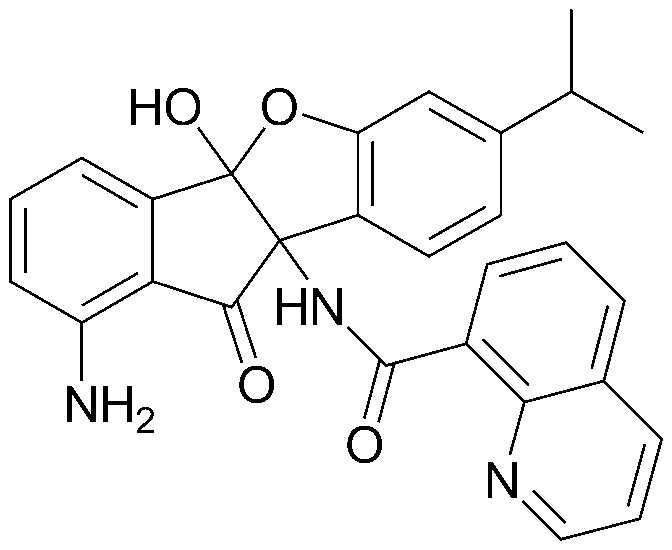
96) 1-амино-7-изопропил-10-оксо-9b-пентанамидо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илпентаноат;
97) 1-амино-9b-гексанамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илгексаноат;
98) (4bS,9bS)-4b-гидрокси-7-изопропил-9b-метокси-4bH-индено[1,2-b]бензофуран-10(9bH)-он;
99) 1-амино-9b-гептанамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илгептаноат;
100) 1-((4bS,9bS)-7-изопропил-4b-метокси-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)мочевина;
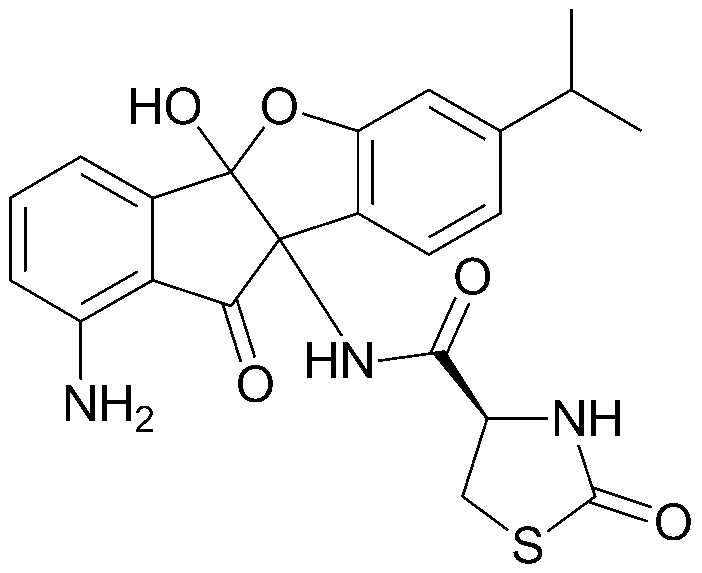
101) 1-((4bS,9bS)-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-метилмочевина;
102) 1-этил-3-((4bS,9bS)-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)мочевина;
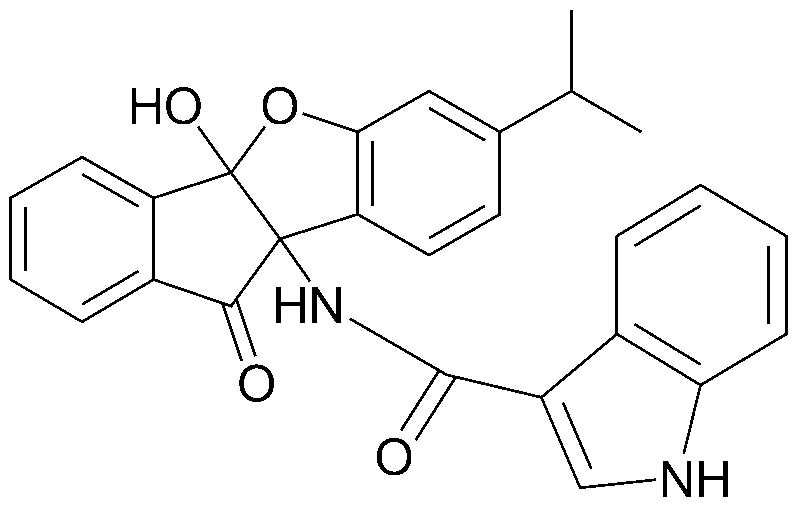
103) 1-((4bS,9bS)-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-метоксимочевина;
104) 5-ацетил-4b,9b-дигидрокси-7,8-диметил-4b,5-дигидроиндено[1,2-b]индол-10(9bH)-он;
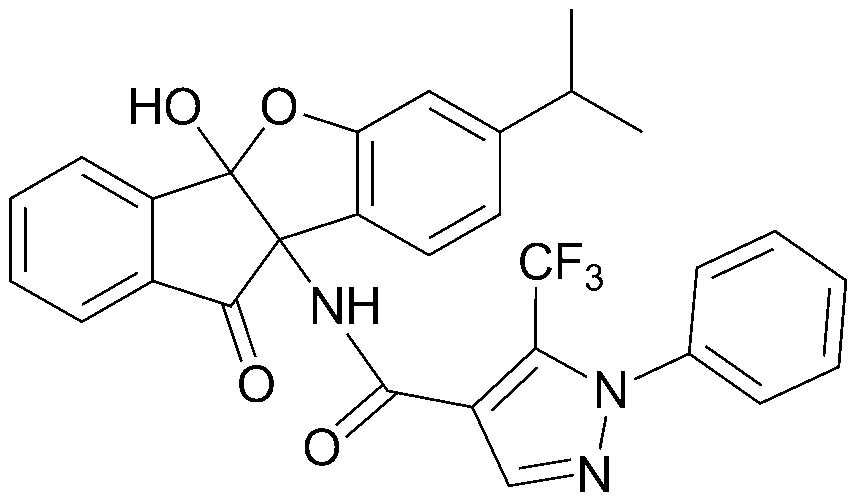
105) 4b,9b-дигидрокси-7,8-диметил-5-пропионил-4b,5-дигидроиндено[1,2-b]индол-10(9bH)-он;
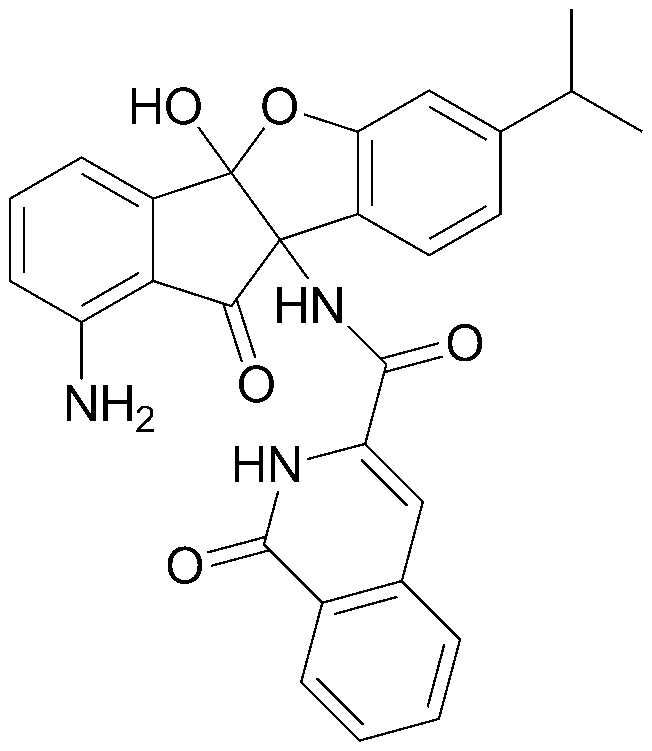
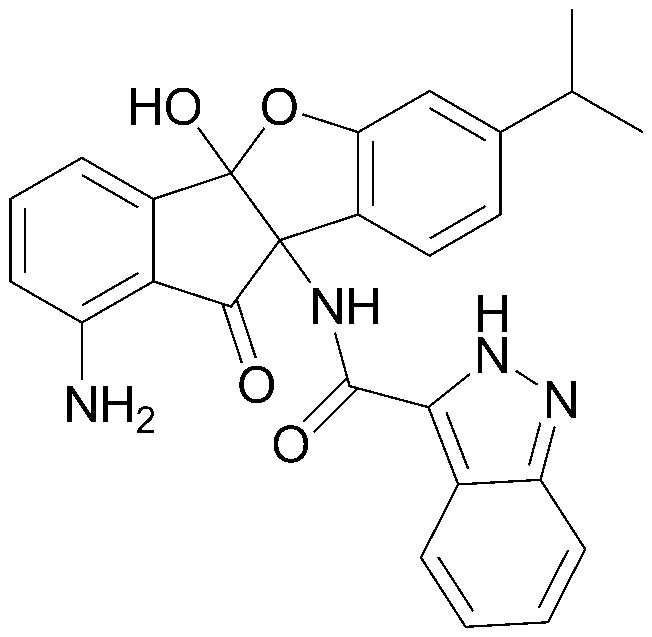
106) 4b,9b-дигидрокси-7,8-диметил-4b,5-дигидроиндено[1,2-b]индол-10(9bH)-он;
107) 5-ацетил-7,8-диметил-10-оксо-4b,5,9b,10-тетрагидроиндено[1,2-b]индол-4b,9b-диилдиацетат;
108) 5-ацетил-9b-амино-4b-гидрокси-5,9b-дигидро-4bH-индено[1,2-b]индол-10-он;
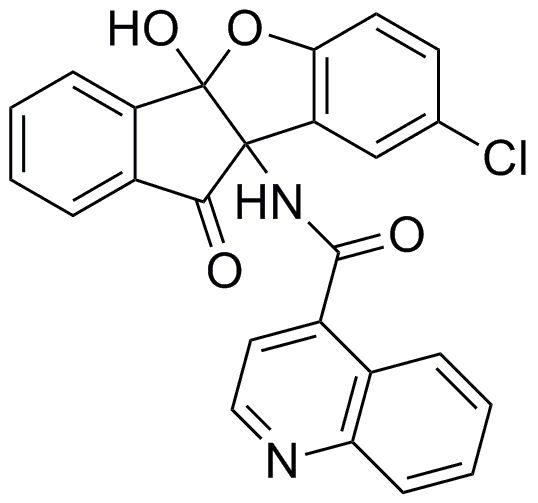
109) N-(9b-амино-4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-5-оксаиндено[2,1-a]инден-1-ил)ацетамид;
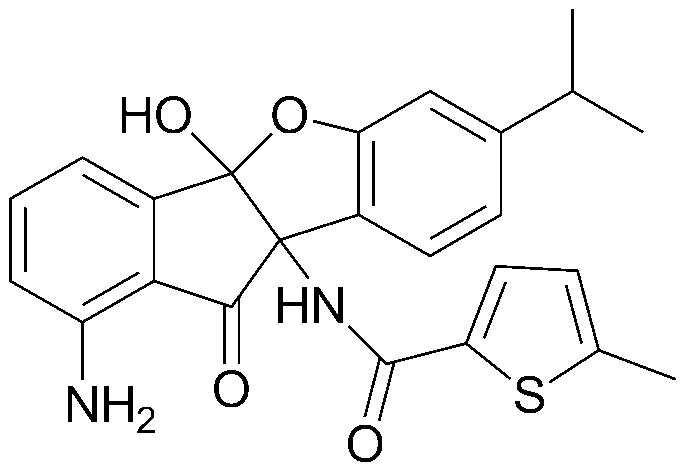
110) 1,9b-бис-ацетиламино-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-иловый эфир уксусной кислоты;
111) 9b-ацетамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b-илметилкарбонат;
112) 9b-ацетамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b-илпентаноат;
113) 9b-ацетамидо-1-амино-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b-илметилкарбонат;
114) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)пиваламид;
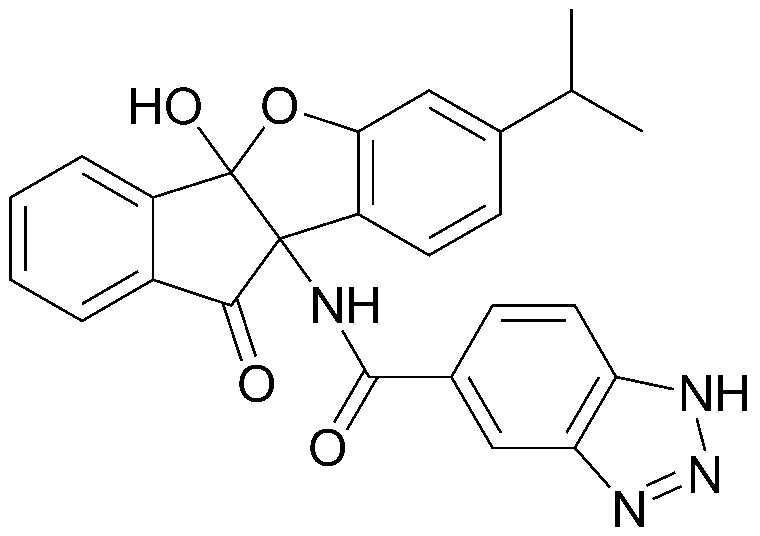
115) 9b-ацетамидо-1-амино-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илбутилкарбонат;
116) 9b-ацетамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илэтилкарбонат;
117) 9b-ацетамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илпивалат;
118) 9b-ацетамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илметилкарбамат;
119) N,N′-(7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b,9b-диил)диацетамид;
120) 4b-(бензилокси)-9b-гидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-он;
121) 9b-ацетиламино-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-иловый эфир фенилового эфира угольной кислоты;
122) O-(9b-азидо-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-иловый) эфир фенилтиокарбаминовой кислоты;
123) этил-9b-ацетамидо-1-амино-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илкарбонат;
124) N,N′-(7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b,9b-диил)дипропионамид;
125) N,N′-(7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b,9b-диил)бис(2-метилпропанамид);
126) 4b,9b-дигидрокси-7-изопропил-4bH-бензофуро[2′,3′:3,4]циклопента[1,2-b]пиридин-10(9bH)-он;
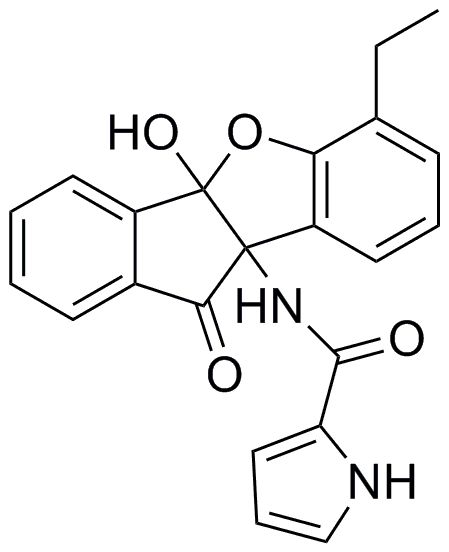
127) 10-гидрокси-7-изопропил-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b,9b-диилдиацетат;
128) O-метилоксим 9b-гидрокси-7-изопропил-4b-(метоксиамино)-4bH-индено[1,2-b]бензофуран-10(9bH)-она;
129) 7-изопропил-4b-метокси-10-метилен-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ол;
130) O-метилоксим 9b-гидрокси-7-изопропил-4b-метокси-4bH-индено[1,2-b]бензофуран-10(9bH)-она;
131) смесь 1-бром и 4-бром-4b,9b-дигидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-она;
132) 1-(бензиламино)-4b,9b-дигидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-он;
133) 1-(этиламино)-4b,9b-дигидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-он;
134) 9b-гидрокси-7-изопропил-4b-метил-4bH-индено[1,2-b]бензофуран-10(9bH)-он;
135) 4b,9b-дигидрокси-5-изобутирил-7,8-диметил-4b,5-дигидроиндено[1,2-b]индол-10(9bH)-он;
136) 7-изопропил-10-метил-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b,9b-диол;
137) N-(1-бром-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)ацетамид;
138) 4b,9b-дигидрокси-5-изобутирил-7,8-диметокси-5,9b-дигидро-4bH-индено[1,2-b]индол-10-он;
139) 4b,9b-дигидрокси-7-изопропил-2-пиперидинил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
140) 4b,9b-дигидрокси-7-изопропил-2-морфолинил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
141) 4b,9b-дигидрокси-7-изопропил-1-пиперидинил-4bH-бензо[d]индено-[1,2-b]фуран-10(9bH)-он;
142) 4b,9b-дигидрокси-7-изопропил-1-морфолинил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
143) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пропионамид;
144) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)бутирамид;
145) 4b,9b-дигидрокси-5-изобутирил-7-изопропил-5,9b-дигидро-4bH-индено[1,2-b]индол-10-он;
146) 4b,9b-дигидрокси-7-изопропил-2-(гидроксипиперидинил)-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
147) 4b,9b-дигидрокси-1-(4-гидроксипиперидин-1-ил)-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
148) 4b,9b-дигидрокси-7-изопропил-2-(4-(4-метоксибензил)пиперазин-1-ил)-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
149) 4b,9b-дигидрокси-7-изопропил-1-(4-(4-метоксибензил)пиперазин-1-ил)-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
150) 2-(диметиламино)-4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
151) 1-(диметиламино)-4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
152) 10-гидразоно-7-изопропил-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диол;
153) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)бензамид;
154) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-метоксибензамид;
155) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-хлорбензамид;
156) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-нитробензамид;
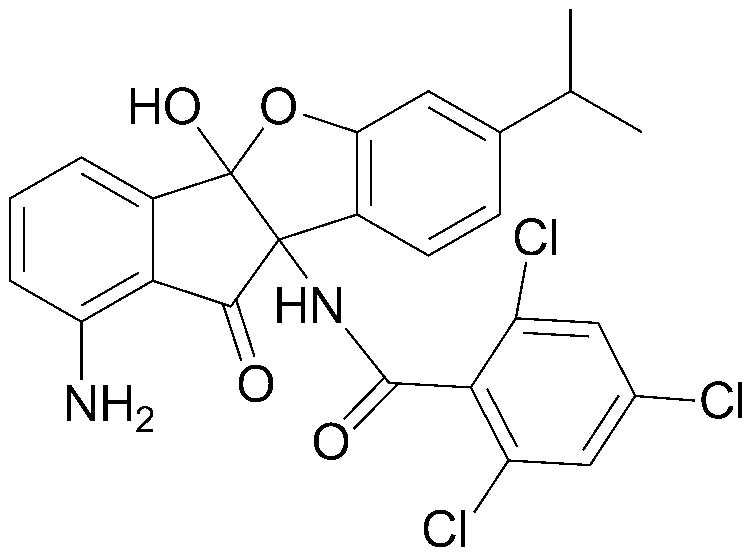
157) 1-амино-4b,9b-дигидрокси-6,8-диизопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он;
158) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)циклопропанкарбоксамид;
159) 1-(4b-гидрокси-6,8-диизопропил-1-амино-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-(4-метоксифенил)тиомочевина;
160) 1-(4b-гидрокси-6,8-диизопропил-1-амино-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-(фенил)тиомочевина;
161) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)тиофен-2-карбоксамид;
162) 1-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-(4-метоксифенил)мочевина;
163) 1-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-бутилмочевина;
164) 1-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-(4-фторфенил)мочевина;
165) 1-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-(трет-бутил)мочевина;
166) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)формамид;
167) N-(1-формамидо-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)ацетамид;
168) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)метансульфонамид;
169) диэтил-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)фосфоамидат;
170) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-цианобензамид;
171) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-нафтамид;
172) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-[1,1′-бифенил]-4-карбоксамид;
173) 1-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-этилмочевина;
174) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)тетрагидрофуран-2-карбоксамид;
175) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2,2,2-трифторацетамид;
176) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1,1,1-трифторметансульфонамид;
177) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)формамид;
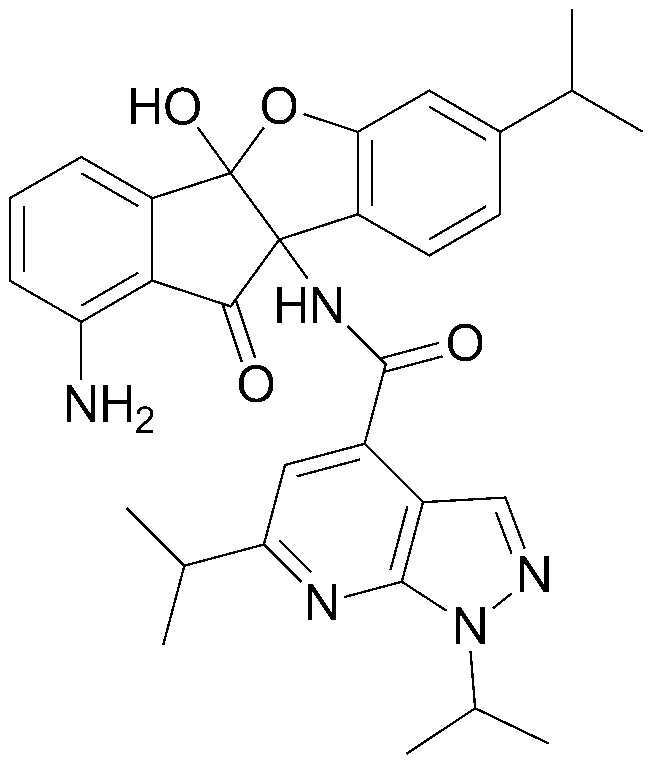
178) 1,1,1-трифтор-N-(4b-гидрокси-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)метансульфонамид;
179) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-фенилацетамид;
180) (E)-N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-(3,4-дихлорфенил)акриламид;
181) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-(бензилокси)бензамид;
182) 2-([1,1′-бифенил]-4-ил)-N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)ацетамид;
183) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-метоксибензамид;
184) трет-бутил(2R)-1-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-иламино)-1-оксопропан-2-илкарбамат;
185) трет-бутил(2R)-1-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-иламино)-1-оксо-3-фенилпропан-2-илкарбамат;
186) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-метилбензамид;
187) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-метилбензамид;
188) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-метилбензамид;
189) метил-4-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-илкарбамоил)бензоат;
190) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-хлорбензамид;
191) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3,5-диметилбензамид;
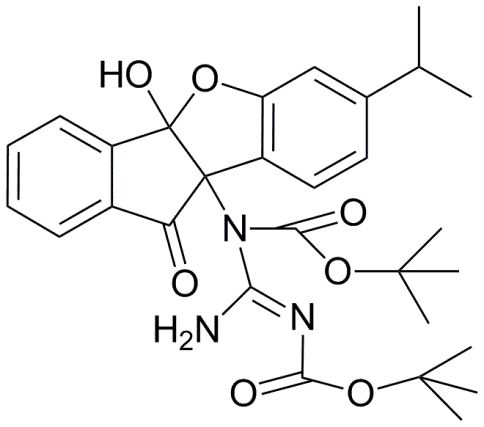
192) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2,4,6-трихлорбензамид;
193) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-фторацетамид;
194) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-хлорацетамид;
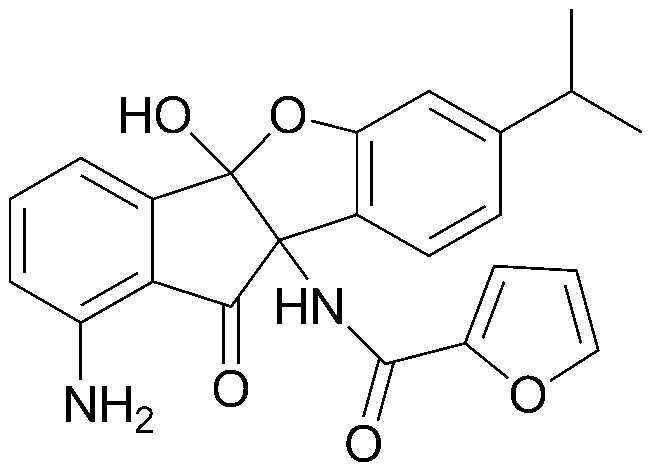
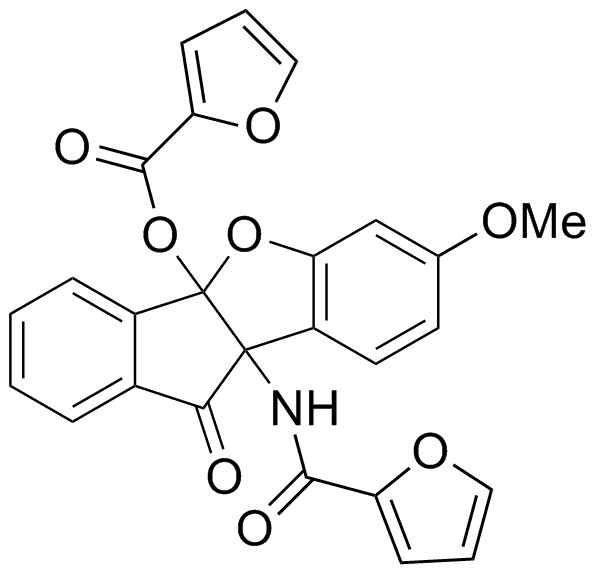
195) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2,2-дихлорацетамид;
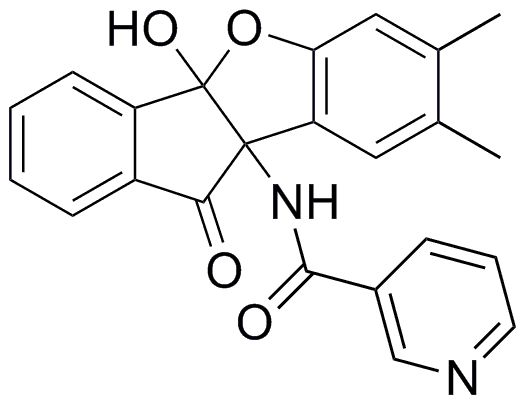
196) 1-амино-9b-(4-бутил-1H-1,2,3-триазол-1-ил)-4b-гидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-он;
197) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиколинамид;
198) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)никотинамид;
199) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)изоникотинамид;
200) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиразин-2-карбоксамид;
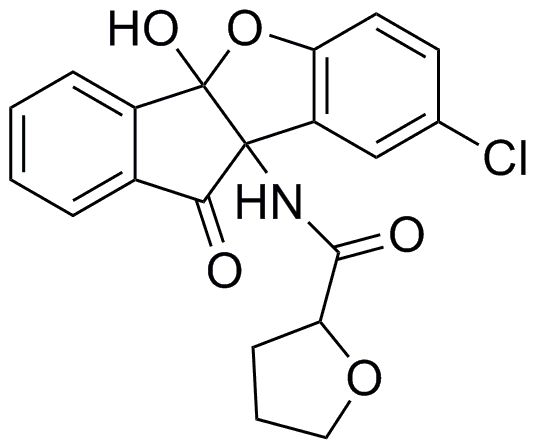
201) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)фуран-2-карбоксамид;
202) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-8-карбоксамид;
203) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-6-карбоксамид;
204) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)бензофуран-2-карбоксамид;
205) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-метилбензофуран-2-карбоксамид;
206) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-метилтиазол-5-карбоксамид;
207) (4R)-N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-оксотиазолидин-4-карбоксамид;
208) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-индол-2-карбоксамид;
209) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-индол-3-карбоксамид;
210) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)формамид;
211) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-фенил-5-(трифторметил)-1H-пиразол-4-карбоксамид;
212) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-индазол-3-карбоксамид;
213) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-(1H-тетразол-1-ил)ацетамид;
214) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-3-карбоксамид;
215) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-4-карбоксамид;
216) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5-метилтиофен-2-карбоксамид;
217) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-метокситиофен-3-карбоксамид;
218) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиколинамид;
219) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиримидин-4-карбоксамид;
220) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-(1H-тетразол-5-ил)ацетамид;
221) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-бензо[d][1,2,3]триазол-5-карбоксамид;
222) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-1,2,4-триазол-3-карбоксамид;
223) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-5-нитротиофен-2-карбоксамид;
224) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2,6-диоксо-1,2,3,6-тетрагидропиримидин-4-карбоксамид;
225) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-оксо-2H-хромен-3-карбоксамид;
226) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-оксо-2H-пиран-5-карбоксамид;
227) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-бензо[d]имидазол-2-карбоксамид;
228) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-карбоксамид;
229) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-фенил-1H-пиразол-5-карбоксамид;
230) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)никотинамид;
231) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-оксо-2-(тиофен-2-ил)ацетамид;
232) 5-амино-N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)фуран-2-карбоксамид;
233) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-пиррол-2-карбоксамид;
234) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-метоксиизоникотинамид;
235) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)бензо[b]тиофен-2-карбоксамид;
236) 3-(2,6-дихлорфенил)-N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-5-метилизоксазол-4-карбоксамид;
237) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-9H-ксантен-9-карбоксамид;
238) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)циннолин-4-карбоксамид;
239) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)циннолин-4-карбоксамид;
240) N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-бензо[d]имидазол-5-карбоксамид;
241) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)акридин-9-карбоксамид;
242) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-нитро-1H-пиразол-3-карбоксамид;
243) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-метилпиколинамид;
244) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-(трифторметил)пиколинамид;
245) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-5-цианопиколинамид;
246) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-хлорпиколинамид;
247) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-метоксихинолин-2-карбоксамид;
248) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)изохинолин-3-карбоксамид;
249) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-метилизоникотинамид;
250) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-фторизоникотинамид;
251) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-хлоризоникотинамид;
252) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-метил-1H-имидазол-2-карбоксамид;
253) 2-((1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)карбамоил)пиридин 1-оксид;
254) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-хлорникотинамид;
255) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5-фторникотинамид;
256) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5-гидроксиникотинамид;
257) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-гидроксипиколинамид;
258) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-метилникотинамид;
259) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5-метилникотинамид;
260) N-(1-амино-4b-гидрокси-7,8-диметил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)никотинамид;
261) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5-метоксиникотинамид;
262) N-(1-амино-4b-гидрокси-7,8-диметил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-6-карбоксамид;
263) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)хинолин-2-карбоксамид;
264) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-бромбензо[b]тиофен-2-карбоксамид;
265) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-индол-2-карбоксамид;
266) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)изохинолин-1-карбоксамид;
267) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-6-фтор-4-метоксихинолин-3-карбоксамид;
268) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-метил-1H-индол-2-карбоксамид;
269) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-хлор-6-фторбензо[b]тиофен-2-карбоксамид;
270) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-хлор-6-метилбензо[b]тиофен-2-карбоксамид;
271) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1,3-диметил-1H-пиразоло[3,4-b]пиридин-5-карбоксамид;
272) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)имидазо[1,2-a]пиридин-6-карбоксамид;
273) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиразоло[1,5-a]пиримидин-2-карбоксамид;
274) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-метилбензо[b]тиофен-2-карбоксамид;
275) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хиноксалин-2-карбоксамид;
276) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиридазин-4-карбоксамид;
277) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хиноксалин-6-карбоксамид;
278) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)тетразоло[1,5-a]пиридин-6-карбоксамид;
279) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)тетразоло[1,5-a]пиридин-8-карбоксамид;
280) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-7-метилимидазо[1,2-a]пиридин-2-карбоксамид;
281) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-7-метил[1,2,4]триазоло[1,5-a]пиримидин-2-карбоксамид;
282) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид;
283) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)индолизин-2-карбоксамид;
284) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1,6-диизопропил-1H-пиразоло[3,4-b]пиридин-4-карбоксамид;
285) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)имидазо[1,2-a]пиримидин-2-карбоксамид;
286) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-оксо-1,2-дигидроизохинолин-3-карбоксамид;
287) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-метилимидазо[1,5-a]пиридин-1-карбоксамид;
288) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2H-индазол-3-карбоксамид;
289) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-7-метилпиразоло[1,5-a]пиримидин-6-карбоксамид;
290) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-бензо[d]имидазол-2-карбоксамид;
291) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5-фтор-1H-бензо[d]имидазол-2-карбоксамид;
292) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)тетразоло[1,5-a]пиридин-5-карбоксамид;
293) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-метил-1H-индазол-3-карбоксамид;
294) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-индол-5-карбоксамид;
295) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-метил-3a,7a-дигидро-1H-индазол-3-карбоксамид;
296) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-метил-1H-имидазол-4-карбоксамид;
297) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-пиррол-3-карбоксамид;
298) трет-бутил(трет-бутоксикарбониламино)(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-иламино)метиленкарбамат;
299) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-индазол-5-карбоксамид;
300) N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-метил-1H-пиразол-5-карбоксамид;
301) 1-амино-9b-(фуран-2-карбоксамидо)-7-метокси-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b-ил фуран-2-карбоксилат;
302) N-(4b-гидрокси-7,8-диметил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)никотинамид;
303) N-(4b-гидрокси-7,8-диметил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-пиррол-2-карбоксамид;
304) N-(6-этил-4b-гидрокси-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-пиррол-2-карбоксамид;
305) N-(6-этил-4b-гидрокси-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)фуран-2-карбоксамид;
306) N-(8-хлор-4b-гидрокси-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-4-карбоксамид; и
307) N-(8-хлор-4b-гидрокси-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)тетрагидрофуран-2-карбоксамид.
Предпочтительными примерами производного инданона, представленного химической формулой 1, являются следующие:
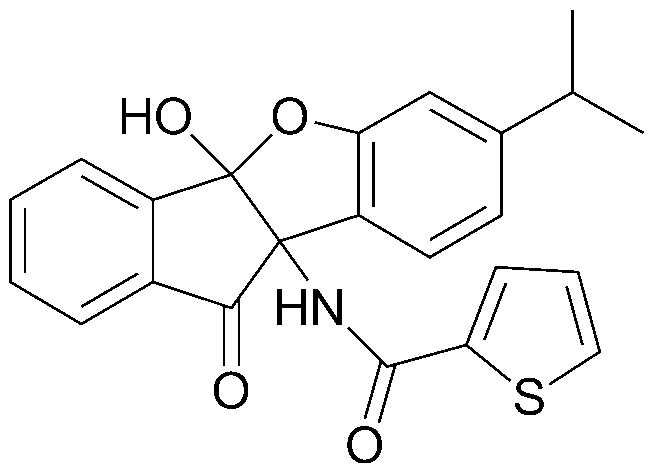
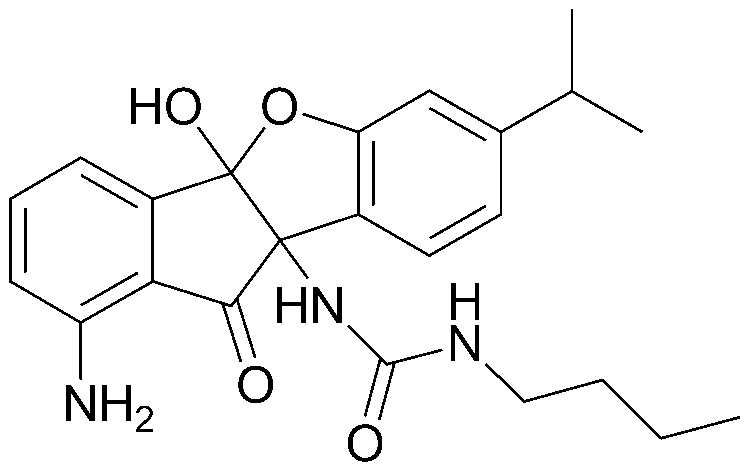
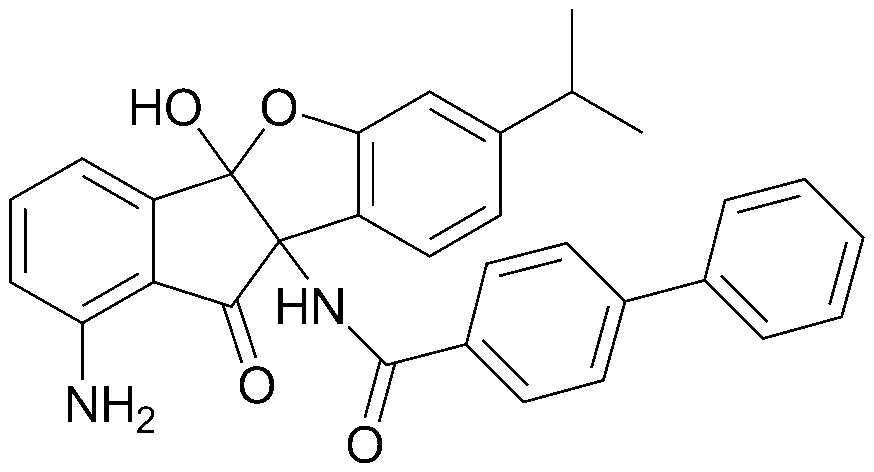
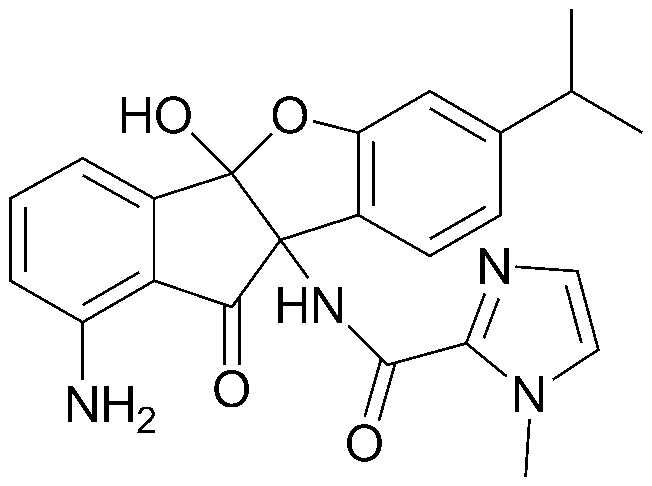
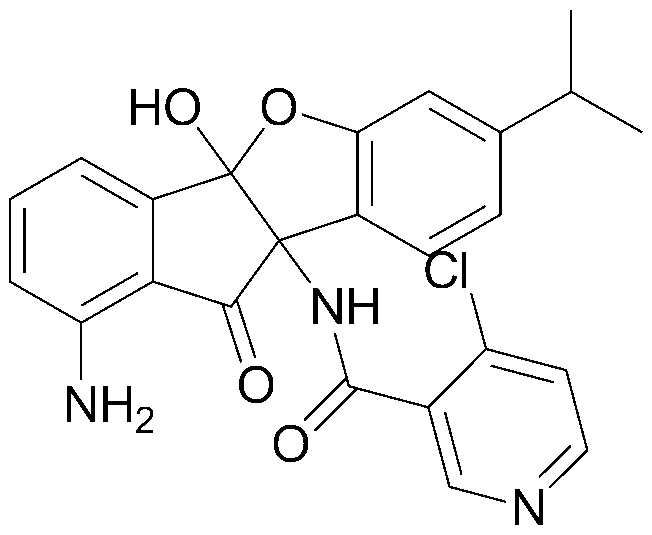
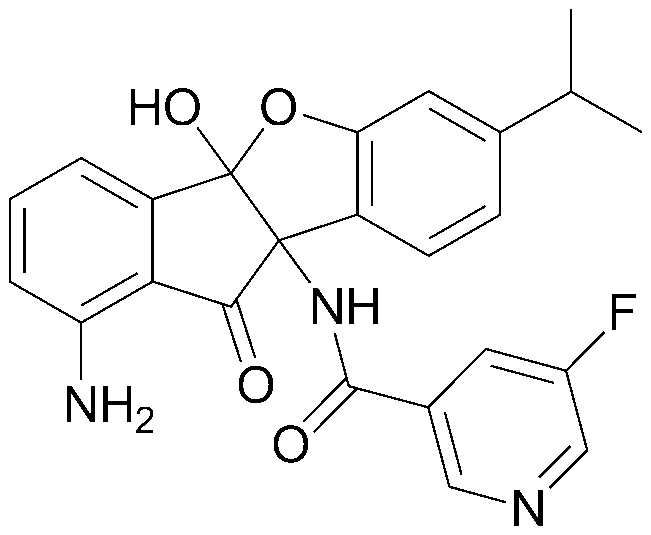
соединения 29), 45)-47), 49)-63), 65)-67), 70)-75), 77)-78) и 87)-307).
Более предпочтительные примеры производного инданона, представленного химической формулой 1, включают:
соединения 196)-207), 212)-217), 228), 231)-235), 237)-238) и 241)-307).
Производные инданона, представленные химической формулой 1, по настоящему изобретению можно использовать в форме фармацевтически приемлемых солей. Пригодными являются кислотно-аддитивные соли, образованные с фармацевтически приемлемыми свободными кислотами. Как используется в настоящем описании, термин «фармацевтически приемлемая соль» относится к любой органической или неорганической соли основных соединений химической формулы 1, не проявляющей побочных эффектов, при которых полезная активность основных соединений химической формулы 1 деградирует, если соль присутствует в концентрации, не вызывающей токсичности и вреда организму. Свободные кислоты могут быть неорганическими или органическими. Примеры пригодных неорганических свободных кислот включают соляную кислоту, бромноватую кислоту, азотную кислоту, серную кислоту, хлорную кислоту и фосфорную кислоту. В качестве органических кислот могут быть использованы лимонная кислота, уксусная кислота, молочная кислота, малеиновая кислота, фумаровая кислота, глюконовая кислота, метансульфоновая кислота, глюконовая кислота, янтарная кислота, винная кислота, галактуроновая кислота, эмбоновая кислота, глутаминовая кислота, аспарагиновая кислота, щавелевая кислота, (D)- или (L)-яблочная кислота, малеиновая кислота, метансульфоновая кислота, этансульфоновая кислота, 4-толуолсульфоновая кислота, салициловая кислота, бензойная кислота или малоновая кислота. Фармацевтически приемлемые соли могут включать соли щелочных металлов (натриевая соль, калиевая соль и тому подобное) и соли щелочноземельных металлов (кальциевая соль, магниевая соль и тому подобное). Кислотно-аддитивные соли, которые могут использоваться в настоящем изобретении, в качестве неограничивающих примеров включают ацетат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камзилат, цитрат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, сахарат, стеарат, сукцинат, тартрат, тозилат, трифторацетат, алюминиевую, аргининовую, бензатиновую, кальциевую, холиновую, диэтиламиновую, диоламиновую, глициновую, лизиновую, магниевую, меглуминовую, аламиновую, калиевую, натриевую, трометаминовую и цинковую соль, причем гидрохлорид или трифторацетат являются предпочтительными. Аддитивные соли по настоящему изобретению могут быть получены обычными способами. Например, они могут быть получены путем растворения соединения химической формулы 1 в органическом растворителе, таком как метанол, этанол, ацетон, метиленхлорид или ацетонитрил, и добавлением избыточного количества органических кислот или избыточного количества водных растворов неорганических кислот, так, чтобы осаждались или кристаллизовались соли. Эти аддитивные соли могут быть получены путем осаждения или кристаллизации, или путем упаривания растворителя или избыточного количества кислоты и сушкой или отсасывающим фильтрованием осажденной соли.
Также фармацевтически приемлемые соли металлов, сформированные с основаниями, могут находиться в диапазоне фармацевтически приемлемых солей соединения по настоящему изобретению. Примеры солей металлов, пригодных в настоящем изобретении, включают соли щелочных металлов и соли щелочноземельных металлов. Например, соединение по настоящему изобретению может быть растворено в избыточном количестве гидроксида щелочного металла или гидроксида щелочноземельного металла в воде, и, после фильтрования раствора для удаления нерастворенных солей соединения, фильтрат может быть высушен с получением фармацевтически приемлемых солей соединения по настоящему изобретению. Подходящими для применения в фармацевтических средствах являются натриевые, калиевые или кальциевые соли. Соответствующие соли серебра могут быть получены путем взаимодействия солей щелочных металлов или солей щелочноземельных металлов с подходящей солью серебра (например, нитратом серебра).
В объем настоящего изобретения входят не только производные инданона соединения химической формулы 1 и их фармацевтически приемлемые соли, но также сольваты, гидраты и изомеры, полученные из них, если они имеют тот же эффект.
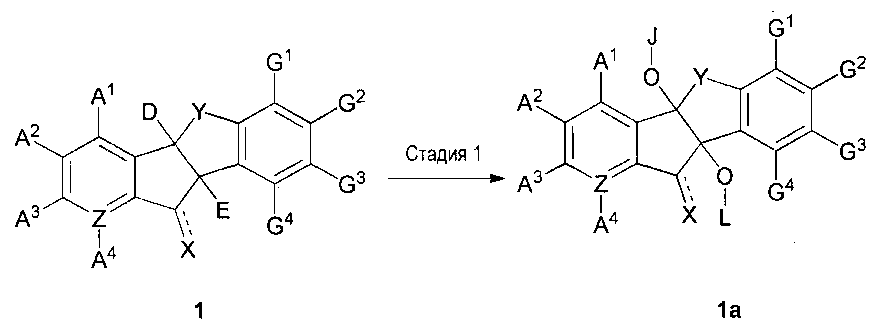
Также настоящее изобретение относится к способу получения производного инданона по настоящему изобретению. В одном из вариантов осуществления способ включает ацилирование или алкилирование соединения химической формулы 1 с помощью основания в растворителе с получением соединения химической формулы 1a (стадия 1), как проиллюстрировано на следующей реакционной схеме 1:
[Реакционная схема 1]


 ,
,
где
соединение химической формулы 1a представляет собой производное химической формулы 1, его фармацевтически приемлемую соль или его оптический изомер,
A1, A2, A3, A4, D, E, G1, G2, G3, G4, Х, Y и Z такие, как определено в химической формуле 1,
J и L, независимо или необязательно, являются такими же, как A1, A2, A3, A4, D, E, G1, G2, G3 или G4.
В качестве растворителя, пригодного в реакционной схеме 1, может быть использован диизопропиловый эфир, диэтиловый эфир, диоксан, тетрагидрофуран (ТГФ), диметилформамид (ДМФ), диметилацетамид (ДМА), диметилсульфоксид (ДМСО), метиленхлорид (MC), хлорбензол, толуол или бензол.
Основанием, использованным в этой реакции, может быть пиридин (PPT), 4-диметиламинопиридин, триметиламин или этиламин.
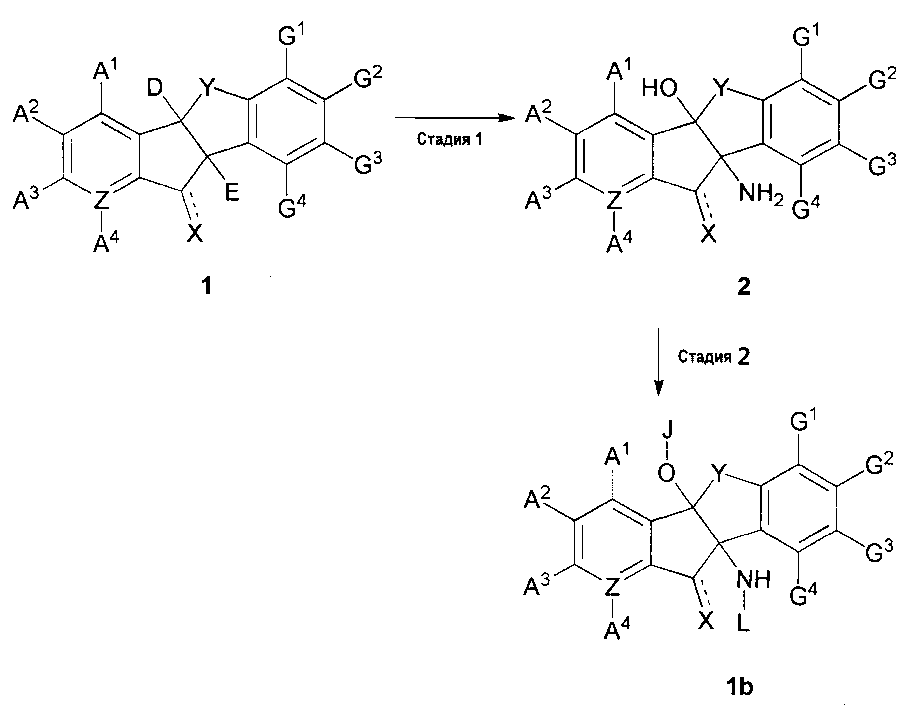
В другом варианте осуществления способ включает:
взаимодействие соединения химической формулы 1 с тионилхлоридом или оксалилхлоридом в присутствии основания в растворителе и затем взаимодействие с аммиаком с получением соединения химической формулы 2 (стадия 1); и
ацилирование или алкилирование соединения химической формулы 2 в присутствии основания в растворителе с получением соединения химической формулы 1b (стадия 2), как проиллюстрировано на следующей реакционной схеме 2:
[Реакционная схема 2]

 ,
,
где
соединение химической формулы 1b представляет собой производное химической формулы 1, его фармацевтически приемлемую соль или его оптический изомер,
A1, A2, A3, A4, D, E, G1, G2, G3, G4, Х, Y и Z такие, как определено в химической формуле 1,
J и L, независимо или необязательно, являются такими же, как A1, A2, A3, A4, D, E, G1, G2, G3 или G4.
Растворители, использованные в стадиях 1 и 2 реакционной схемы 2 этого способа, могут быть независимо выбраны из диизопропилового эфира, диэтилового эфира, диоксана, тетрагидрофурана (ТГФ), диметилформамида (ДМФ), диметилацетамида (ДМА), диметилсульфоксида (ДМСО), метиленхлорида (MC), хлорбензола, толуола или бензола.
В качестве основания для реакции ацилирования или алкилирования в этом способе может быть использован пиридин (PPT), триметиламин, этиламин или трифосген.
В соответствии с одним из аспектов настоящего изобретения также рассматривается фармацевтическая композиция для профилактики или лечения вирусного заболевания, содержащая производное инданона, представленного химической формулой 1, его фармацевтически приемлемую соль или его оптический изомер в качестве активного ингредиента.
Вирусное заболевание, на которое нацелена фармацевтическая композиция по настоящему изобретению, представляет собой заболевание, вызываемое пикорнавирусами, включая вирусы коксаки, энтеро-, полио- и риновирусы. Примеры вирусного заболевания включают полиомиелит, паралич, острый геморрагический конъюнктивит, вирусный менингит, вирусную пузырчатку полости рта и конечностей, пузырчатку, гепатит A, миозит, миокардит, панкреатит, эпидемическую миалгию, энцефалит, грипп, везикулярный фарингит и ящур.
Обладая прекрасной противовирусной активностью в отношении пикорнавирусов, таких как вирусы коксаки, энтеро-, эхо-, полио- и риновирусы, а также имея низкую цитотоксичность, производное инданона химической формулы 1 может использоваться в качестве активного ингредиента фармацевтической композиции для профилактики или лечения различных вирусных заболеваний, включая полиомиелит, паралич, острый геморрагический конъюнктивит, вирусный менингит, вирусную пузырчатку полости рта и конечностей, пузырчатку, гепатит A, миозит, миокардит, панкреатит, диабет, эпидемическую миалгию, энцефалит, грипп, везикулярный фарингит, ящур, астму, хроническое обструктивное заболевание легких, пневмонию, синусит и отит среднего уха.
Клинически соединение по настоящему изобретению можно вводить в форме различных составов. Для этого соединение, как правило, вводят в состав с разбавителем или эксципиентом, таким как наполнитель, загуститель, связывающее средство, увлажняющий агент, дезинтегрант, поверхностно-активное вещество и тому подобное.
Твердые препараты, предназначенные для перорального введения соединения по настоящему изобретению, могут быть в форме таблеток, пилюль, порошков, гранул, капсул, пастилок и тому подобного. Такие твердые препараты составлены в комбинации с по меньшей мере одним эксципиентом, таким как крахмал, карбонат кальция, сахароза, лактоза или желатин. Кроме простого эксципиента может быть также добавлен лубрикант, такой как стеарат магния, тальк или тому подобное. Жидкие препараты, предназначенные для перорального введения, включают суспензии, растворы для применения внутрь, эмульсию, сиропы и тому подобное. Кроме простого разбавителя, такого как вода или парафиновое масло, в жидких препаратах для перорального введения соединения по настоящему изобретению могут содержаться различные эксципиенты, такие как смачивающие агенты, подсластители, ароматические добавки, консерванты и тому подобное.
Также соединение по настоящему изобретению может быть в парентеральной лекарственной форме, такой как стерильные водные растворы, неводные растворители, суспензии, эмульсии, лиофилизаты, суппозитории и тому подобное. Для неводных растворителей и суспензий могут подходить пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и сложные эфиры, такие как этилолеат. Основные вещества суппозиториев включают витепсол, макрогол, твин 61, масло какао, лавровое масло и глицерожелатин.
Соединение по настоящему изобретению вводят в терапевтически эффективном количестве. Эффективная доза соединения по настоящему изобретению изменяется в зависимости от различных факторов, в том числе от возраста, массы, пола и состояния здоровья пациента, пути введения и тяжести заболевания. Как правило, соединение по настоящему изобретению можно вводить в суточной дозе от 0,001 до 100 мг/кг и, предпочтительно, в суточной дозе от 0,01 до 35 мг/кг. Для взрослого пациента весом 70 кг доза соединения по настоящему изобретению может, как правило, находиться в диапазоне от 0,07 до 7000 мг/сутки и предпочтительно от 0,7 до 2500 мг/сутки. Составы соединения можно вводить однократной дозой или можно разделять на несколько доз с регулярным временным интервалом в соответствии с инструкцией врача или фармацевта, который отвечает за контроль или осуществляет наблюдение за введением лекарственного средства.
Варианты осуществления
Лучшего понимания настоящего изобретения можно достичь с помощью нижеследующих примеров, которые приведены в качестве иллюстрации и не должны быть истолкованы, как ограничивающие настоящее изобретение.
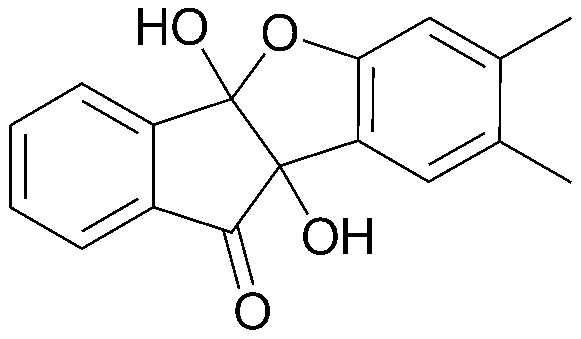
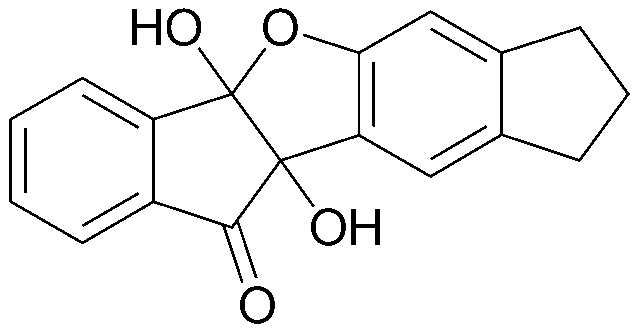
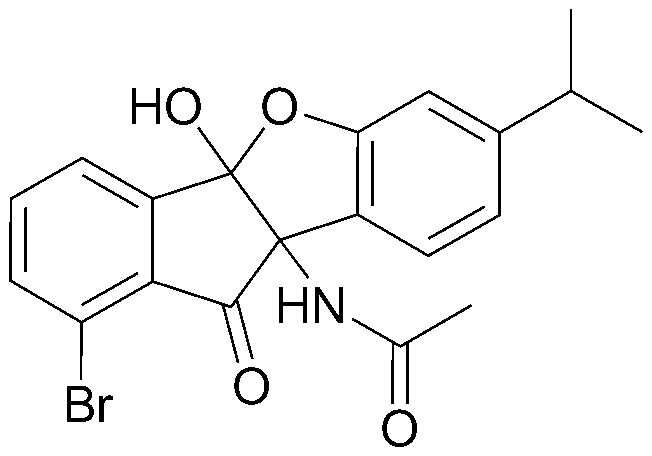
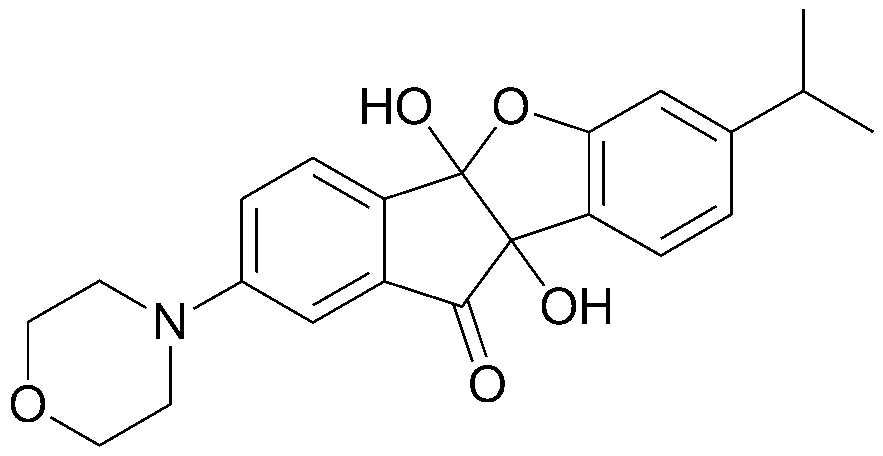
<ПРИМЕР 1> 4b,9b-Дигидрокси-7-метил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (6,00 г, 33,6 ммоль) и м-крезол (3,78 мл, 33,6 ммоль) растворяли в уксусной кислоте (30 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После охлаждения образованный таким образом осадок промывали уксусной кислотой и водой в указанном порядке с получением указанного в заголовке соединения в виде белого твердого вещества. 7,55 г (83%).
Точка плавления: 145-147°C.
1H-ЯМР (300 МГц, CDCl3) δ 2,26 (с, 3H, CH3) 6,63 (с, 1H, ArH) 6,75 (д, J=7,8 Гц, 1H, ArH) 7,34 (д, J=7,8 Гц, 1H, ArH) 7,54 (т, J=7,5 Гц, 1H, ArH) 7,74-7,81 (м, 2H, ArH) 7,97-8,00 (д, J=7,8 Гц, 1H, ArH). MS (EI): 268.
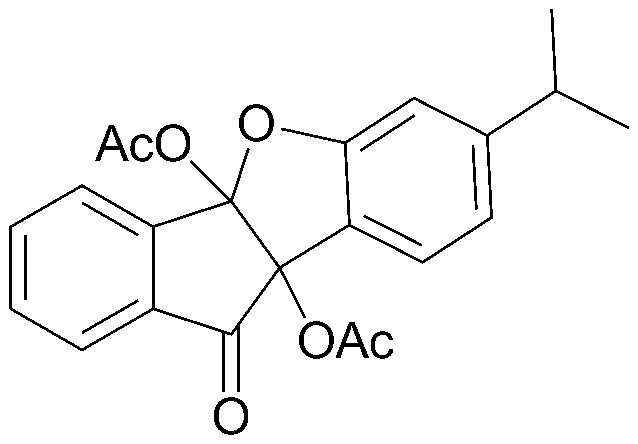
<ПРИМЕР 2> 7-Метил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диилдиацетат
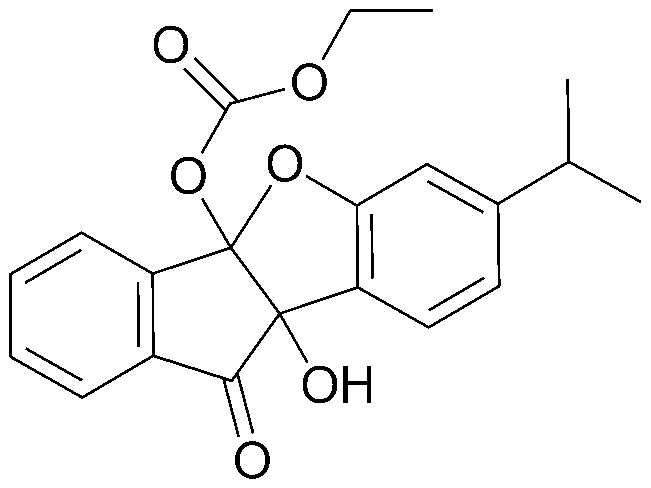
4b,9b-Дигидрокси-7-метил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он (1,00 г, 3,7 ммоль) полностью растворяли в безводном дихлорметане (50 мл). К этому раствору добавляли безводную уксусную кислоту (0,7 мл, 7,4 ммоль), пиридин (0,3 мл, 3,7 ммоль) и 4-диметиламинопиридин (0,1 г) и перемешивали при комнатной температуре в течение 3 часов. Затем реакционную смесь экстрагировали дихлорметаном, органический слой концентрировали и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:8) с получением указанного в заголовке соединения. 0,04 г (3%).
Точка плавления: 167-169°C.
1H-ЯМР (300 МГц, CDCl3) δ 2,15 (с, 3H, OAc) 2,16 (с, 3H, OAc) 2,30 (с, 3H, CH3) 6,69 (с, 1H, ArH) 6,88 (д, J=7,8 Гц, 1H, ArH) 7,47 (д, J=7,7 Гц, 1H, ArH) 7,58 (т, J=7,4 Гц, 1H, ArH) 7,75-7,84 (м, 2H, ArH) 8,14 (д, J=7,7 Гц, 1H, ArH). MS (EI): 352.
<ПРИМЕР 3> Этил 2-(4b,9b-дигидрокси-6-метокси-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-8-ил)ацетат
Нингидрин (2,54 г, 14,2 ммоль) и этил-2-(4-гидрокси-3-метоксифенил)ацетат (3,00 г, 14,2 ммоль) растворяли в уксусной кислоте (15 мл) и нагревали в течение 21 часа при кипячении с обратным холодильником с последующей экстракцией этилацетатом. Концентрат очищали при помощи хроматографии на колонке (этилацетат:гексан=1:1) с получением указанного в заголовке соединения. 1,46 г (29%).
Точка плавления: 133-136°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,20 (т, J=7,2 Гц, 3H, CH3) 3,56 (с, 2H, CH2) 3,82 (с, 3H OCH3) 4,11-4,18 (кв., J=7,2 Гц, 14,4H, 2H, OCH2) 6,89 (с, 1H, ArH) 7,12 (с, 1H, ArH) 7,56-8,14 (м, 4H, ArH). MS (EI): 370.
<ПРИМЕР 4> 4b,9b-Дигидрокси-7,8-диметил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (4,37 г, 24,5 ммоль) и 3,4-диметилфенол (3,00 г, 24,5 ммоль) растворяли в уксусной кислоте (15 мл) и нагревали в течение 23 часов при кипячении с обратным холодильником. После охлаждения образовавшийся таким образом осадок промывали уксусной кислотой и водой в указанном порядке с получением указанного в заголовке соединения в виде белого твердого вещества. 5,43 г (78%).
Точка плавления: 198-200°С.
1H-ЯМР (300 МГц, CDCl3) δ 2,15 (м, 6Н, СН3) 6,55 (с, 1Н, ArH) 7,22 (с, 1Н, ArH) 7,70-7,88 (м, 4Н, ArH). MS (EI): 282.
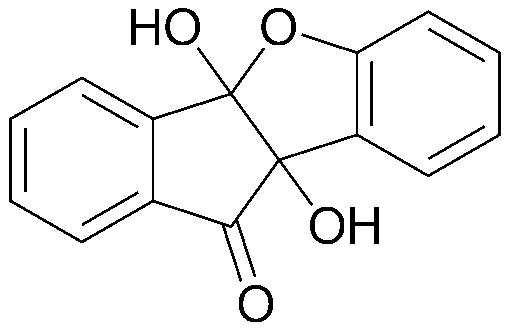
<ПРИМЕР 5> 4b,9b-Дигидрокси-4b,9b-дигидро-10Н-индено[1,2-b]бензофуран-10-он
Нингидрин (1,00 г, 5,6 ммоль) и фенол (0,53 г, 5,6 ммоль) растворяли в уксусной кислоте (20 мл) и нагревали в течение 23 часов при кипячении с обратным холодильником. Реакционную смесь охлаждали, промывали уксусной кислотой и водой, а затем перекристаллизовывали из дихлорметана с получением указанного в заголовке соединения в виде белого твердого вещества. 0,37 г (26%).
Точка плавления: 155-159°C.
1H-ЯМР (300 МГц, ацетон-d6) δ 5,87 (с, 1Н, ОН) 6,72 (с, 1Н, ОН) 6,78 (д, J=8,4 Гц, 1Н, ArH) 6,95 (т, J=6,6 Гц, 1Н, ArH) 7,27 (т, J=6,9 Гц, 1Н, ArH) 7,48 (д, J=7,3 Гц, 1Н, ArH) 7,64 (т, J=7,5 Гц, 1Н, ArH) 7,75 (д, J=7,8 Гц, 1Н, ArH) 7,91 (т, J=13,4 Гц, 1Н, ArH) 8,01 (д, J=4,8 Гц, 1Н, ArH). MS (EI): 254.
<ПРИМЕР 6> 8-фтор-4b,9b-дигидрокси-4b,9b-дигидро-10Н-индено[1,2-b]бензофуран-10-он
Нингидрин (1,00 г, 5,6 ммоль) и 4-фторфенол (0,63 г, 5,6 ммоль) растворяли в уксусной кислоте (20 мл) и нагревали в течение 23 часов при кипячении с обратным холодильником. После охлаждения, образовавшийся таким образом осадок промывали уксусной кислотой и водой и перекристаллизовывали из дихлорметана с получением белого твердого вещества. Осадок очищали при помощи хроматографии на колонке (этилацетат:гексан = 1:4) и промывали дихлорметаном с получением указанного в заголовке соединения. 0,57 г (37%).
Точка плавления: 189-193°C.
1H-ЯМР (300 МГц, ацетон-d6) δ 5,98 (с, 1H, OH) 6,81 (кв., J=9,0 Гц, 4,0 Гц, 1H, ArH) 6,88 (с, 1H, OH) 7,06(дт, J=9,0, 2,7 Гц, 1H, ArH) 7,20 (дд, J=7,8 Гц, 3,0 Гц, 1H, ArH) 7,66 (т, J=6,9 Гц, 1H, ArH) 7,77 (д, J=7,8 Гц, 1H, ArH) 7,92 (т, J=7,8 Гц, 1H, ArH) 8,00-8,03 (м, 1H, ArH). MS (EI): 272.
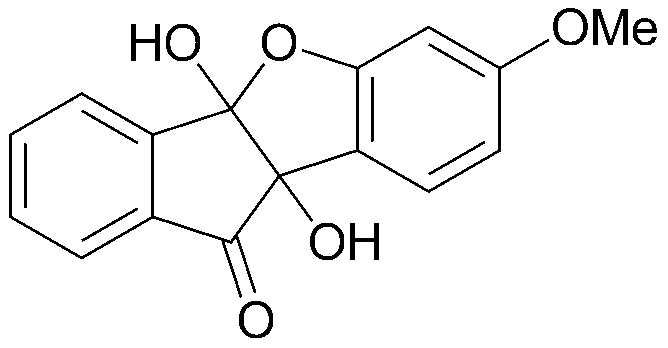
<ПРИМЕР 7> 4b,9b-Дигидрокси-7-метокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
3-Метоксифенол (2,09 г, 16,8 ммоль) и нингидрин (3,00 г, 16,8 ммоль) растворяли в уксусной кислоте (20 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Затем реакционную смесь экстрагировали этилацетатом, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с последующей перекристаллизацией из этилацетата и гексана с получением указанного в заголовке соединения. 1,25 г (26%).
Точка плавления: 98-100°C.
1H-ЯМР (300 МГц, CDCl3) δ 3,82 (с, 3H, OCH3) 6,39 (с, 1H, ArH) 6,52 (д, 1H, J=9,0 Гц, ArH) 7,37 (д, 1H, J=9,0 Гц, ArH) 7,57 (т, 1H, J=9,0 Гц, ArH) 7,78-7,81 (м, 2H, ArH) 7,99 (д, J=9,0 Гц, 1H, ArH). MS (EI): 284.
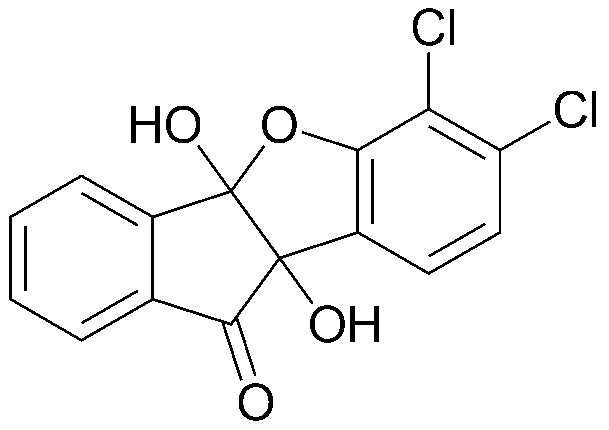
<ПРИМЕР 8> 6,7-Дихлор-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (3,00 г, 16,8 ммоль) и 2,3-хлорфенол (2,16 г, 16,8 ммоль) растворяли в уксусной кислоте (20 мл) и нагревали в течение 28 часов при кипячении с обратным холодильником. Образовавшийся таким образом осадок промывали дихлорметаном с получением указанного в заголовке соединения в виде белого твердого вещества. 2,35 г (43%).
Точка плавления: 142-150°C.
1H-ЯМР (300 МГц, CDCl3) δ 7,06 (д, J=8,1 Гц, 1H, ArH) 7,33 (д, J=8,1 Гц, 1H, ArH) 7,61 (т, J=7,5 Гц, 1H, ArH) 7,80-7,88 (м, 2H, ArH) 8,07 (д, J=7,8 Гц, 1H, ArH). MS (EI): 323.
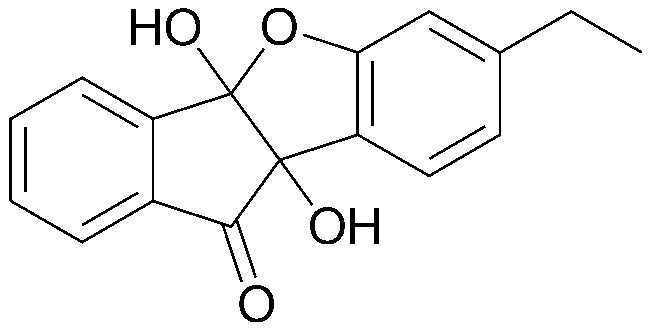
<ПРИМЕР 9> 7-Этил-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (3,00 г, 16,8 ммоль) и м-этилфенол (2,05 г, 16,8 ммоль) растворяли в уксусной кислоте (20 мл) и нагревали в течение 4 часов при кипячении с обратным холодильником. После охлаждения, образовавшийся таким образом осадок промывали дихлорметаном с получением указанного в заголовке соединения в виде белого твердого вещества. 2,80 г (59%).
Точка плавления: 168-169°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,15 (т, J=7,8 Гц, 3H, CH3) 2,53-2,60 (кв., J=15,3 Гц, 7,5 Гц, CH2) 3,93 (с, 1H, OH) 4,75 (с, 1H, OH) 6,68 (с, 1H, ArH) 6,80 (д, J=6,0 Гц, 1H, ArH) 7,38 (д, J=7,8 Гц, 1H, ArH) 7,55 (т, J=7,5 Гц, 1H, ArH) 7,79 (т, J=9,0 Гц, 2H, ArH) 8,00 (д, J=7,8 Гц, 1H, ArH). MS(EI): 282.
<ПРИМЕР 10> 4b,9b-Дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (3,00 г, 16,8 ммоль) и м-изопропилфенол (2,29 г, 16,8 ммоль) растворяли в уксусной кислоте (20 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. После охлаждения, образовавшийся таким образом осадок промывали дихлорметаном с получением указанного в заголовке соединения в виде белого твердого вещества. 2,82 г (56%).
Точка плавления: 195-198°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (д, J=8,1 Гц, 6H, CH3) 2,77-2,86 (м, 1H, CH) 4,14 (с, 1H, OH) 4,85 (с, 1H, OH) 6,70 (с, 1H, ArH) 6,82 (д, J=7,8 Гц, 1H, ArH) 7,40 (д, J=7,8 Гц, 1H, ArH) 7,54 (т, J=7,8 Гц, 1H, ArH) 7,75-7,82 (м, 2H, ArH) 8,00 (д, J=7,8 Гц, 1H, ArH). MS(EI): 296.
<ПРИМЕР 11> 7-Изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диилдиацетат
4b,9b-Дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он (2,00 г, 6,7 ммоль) полностью растворяли в безводном тетрагидрофуране (20 мл) и смешивали с безводной уксусной кислотой (1,38 г, 13,5 ммоль), пиридином (0,53 г, 6,7 ммоль), 4-диметиламинопиридином (0,2 г) при комнатной температуре в течение 12 часов при перемешивании. Реакционную смесь концентрировали и многократно экстрагировали дихлорметаном, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 0,27 г (11%).
Точка плавления: 138-140°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,14 (с, 3H, OAc) 2,16 (с, 3H, OAc) 2,83-2,87 (м, 1H, CH) 6,75 (с, 1H, ArH) 6,94 (д, J=7,8 Гц, 1H, ArH) 7,51 (д, J=7,5 Гц, 1H, ArH) 7,59 (т, J=7,5 Гц, 1H, ArH) 7,75-7,85 (м, 2H, ArH) 8,16 (д, J=7,8 Гц, 1H, ArH). MS(EI): 380.
<ПРИМЕР 12> 4b,9b-Дигидрокси-8-метокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (3,00 г, 16,8 ммоль) и п-метоксифенол (2,09 г, 16,8 ммоль) растворяли в уксусной кислоте (20 мл) и нагревали в течение 6 часов при кипячении с обратным холодильником. После охлаждения, образовавшийся таким образом осадок промывали уксусной кислотой и водой в указанном порядке с получением указанного в заголовке соединения в виде желтого твердого вещества. 4,00 г (83%).
Точка плавления: 186-189°C.
1H-ЯМР (300 МГц, CDCl3) δ 3,72 (с, 3H, OCH3) 6,59 (д, J=8,8 Гц, 1H, ArH) 6,70 (дд, J=8,8 Гц, 1H, ArH) 6,97 (д, J=2,8 Гц, 1H, ArH) 7,43 (т, J=7,9 Гц, 1H, ArH) 7,64-7,71 (м, 2H, ArH) 7,84-7,87 (д, J=7,7 Гц, 1H, ArH). MS(EI): 284.
<ПРИМЕР 13> 4b,9b-Дигидрокси-6-фенил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (3,00 г, 16,8 ммоль) и м-фенилфенол (2,86 г, 16,8 ммоль) добавляли к уксусной кислоте (20 мл) и нагревали в течение 20 часов при кипячении с обратным холодильником. После удаления растворителя путем концентрации в вакууме, концентрат многократно экстрагировали дихлорметаном. Концентрированный органический слой кристаллизовали дихлорметаном и гексаном с получением указанного в заголовке соединения в виде белого твердого вещества. 4,10 г (73%).
Точка плавления: 182-183°C.
1H-ЯМР (300 МГц, CDCl3) δ 7,03 (т, J=6,0 Гц, 1H, ArH) 7,30-7,41 (м, 1H, ArH) 7,42-7,48 (м, 4H, ArH) 7,54 (т, J=7,8 Гц, 1H, ArH) 7,63 (д, J=8,4 Гц, 2H, ArH) 7,76-7,81 (м, 2H, ArH) 8,01 (д, J=8,1 Гц, 1H, ArH). MS(EI): 330.
<ПРИМЕР 14> 4b,9b-Дигидрокси-8-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (3,00 г, 16,8 ммоль) и 4-нитрофенол (2,34 г, 16,8 ммоль) добавляли к уксусной кислоте (20 мл) и нагревали в течение 5 часов при кипячении с обратным холодильником. Реакционную смесь многократно экстрагировали дихлорметаном, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан=1:3) с получением указанного в заголовке соединения. Белое вещество. 0,80 г (16%).
Точка плавления: 206-207°C.
1H-ЯМР (300 МГц, CDCl3) δ 6,94 (д, J=9,0 Гц, 1H, ArH) 7,63 (т, J=7,8 Гц, 1H, ArH) 7,80-7,90 (м, 2H, ArH) 8,03 (д, J=7,8 Гц, 1H, ArH) 8,24 (д, J=9,0 Гц, 1H, ArH) 8,42 (д, J=2,4 Гц, 1H, ArH). MS(EI): 299.
<ПРИМЕР 15> 4b,11b-Дигидрокси-4bH-индено[1,2-b]нафто[2,3-d]фуран-12(11bH)-он
Нингидрин (1,00 г, 5,61 ммоль) и 2-нафтол (0,81 г, 5,61 ммоль) растворяли в уксусной кислоте (20 мл) и нагревали в течение 6 часов при кипячении с обратным холодильником. После охлаждения, образовавшийся таким образом осадок промывали уксусной кислотой и водой в указанном порядке с получением указанного в заголовке соединения в виде белого твердого вещества. 1,31 г (77%).
Точка плавления: 220-221°C.
1H-ЯМР (300 МГц, CDCl3) δ 7,06 (д, J=8,7 Гц, 1H, ArH) 7,37 (т, J=7,5 Гц, 1H, ArH) 7,52-7,62 (м, 2H, ArH) 7,76-7,83 (м, 4H, ArH) 8,04 (д, J=7,8 Гц, 1H, ArH) 8,38 (д, J=8,4 Гц, 1H, ArH). MS(EI): 304.
<ПРИМЕР 16> 6b,11b-Дигидрокси-6bH-индено[1,2-b]нафто[2,1-d]фуран-7(11bH)-он
Нингидрин (1,00 г, 5,61 ммоль) и 1-нафтол (0,81 г, 5,61 ммоль) добавляли к уксусной кислоте (20 мл) и нагревали в течение 7 часов при кипячении с обратным холодильником. После охлаждения реакционной смеси, образовавшийся таким образом осадок промывали уксусной кислотой и водой в указанном порядке с получением указанного в заголовке соединения в виде белого твердого вещества. 0,96 г (56%).
Точка плавления: 216-218°C.
1H-ЯМР (300 МГц, CDCl3) δ 7,43-7,57 (м, 5H, ArH) 7,75-7,83 (м, 3H, ArH) 8,03-8,12 (м, 2H, ArH). MS(EI): 304.
<ПРИМЕР 17> 4b,9b-Дигидрокси-8-пропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (1,00 г, 5,61 ммоль) и п-пропилфенол (0,76 г, 5,61 ммоль) добавляли к уксусной кислоте (20 мл) и нагревали в течение 16 часов при кипячении с обратным холодильником. Реакционную смесь многократно экстрагировали дихлорметаном, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:3 до 1:1) с получением указанного в заголовке соединения. 1,10 г (66%).
Точка плавления: 126-127°C.
1H-ЯМР (300 МГц, CDCl3) δ 0,83-0,90 (т, J=7,4 Гц, 3H, CH3) 1,46-1,57 (м, 2H, CH2) 2,45 (т, J=7,8 Гц, 2H, CH2) 6,74 (д, J=8,4 Гц, 1H, ArH) 7,08 (дд, J=1,8, 8,4 Гц, 1H, ArH) 7,31 (с, 1H, ArH) 7,55 (т, J=7,8 Гц, 1H, ArH) 7,77-7,82 (м, 2H, ArH) 8,00 (д, J=7,5 Гц, 1H, ArH). MS(EI): 296.
<ПРИМЕР 18> 8-Этил-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (1,00 г, 5,61 ммоль) и п-этилфенол (0,68 г, 5,61 ммоль) растворяли в уксусной кислоте (20 мл) и нагревали в течение 15 часов при кипячении с обратным холодильником. После охлаждения реакционной смеси в течение 12 часов, образовавшийся таким образом осадок промывали уксусной кислотой и водой в указанном порядке с получением указанного в заголовке соединения в виде желтовато-белого твердого вещества. 1,10 г (69%).
Точка плавления: 157-159°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (т, J=7,4 Гц, 3H, CH3) 2,50-2,61 (кв., J=7,6 Гц, 2H, CH2) 3H, OAc) 6,74 (д, J=8,4 Гц, 1H, ArH) 7,10 (д, J=8,4 Гц, 1H, ArH) 7,33 (с, 1H, ArH) 7,54 (т, J=8,0 Гц, 1H, ArH) 7,76-7,83 (м, 2H, ArH) 8,00 (д, J=7,6 Гц, 1H, ArH). MS(EI): 282.
<ПРИМЕР 19> 8-втор-Бутил-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (1,00 г, 5,61 ммоль) и п-втор-бутилфенол (0,84 г, 5,61 ммоль) добавляли к уксусной кислоте (20 мл) и нагревали в течение 20 часов при кипячении с обратным холодильником. Реакционную смесь многократно экстрагировали дихлорметаном, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:2) с получением указанного в заголовке соединения. 0,80 г (46%).
Точка плавления: 134-136°C.
1H-ЯМР (300 МГц, CDCl3) δ 0,77 (т, J=7,2 Гц, 3H, CH3) 1,16 (д, J=6,9 Гц, 3H, CH3) 1,31-1,43 (м, 2H, CH2) 2,49-2,56 (м, 1H, CH) 6,75 (д, J=8,1 Гц, 1H, ArH) 7,09 (д, J=8,4 Гц, 1H, ArH) 7,33 (с, 1H, ArH) 7,59 (м, 1H, ArH) 7,79-7,83 (м, 2H, ArH) 8,00 (д, J=7,5 Гц, 1H, ArH). MS(EI): 310.
<ПРИМЕР 20> 8-трет-Бутил-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (1,00 г, 5,61 ммоль) и п-трет-бутилфенол (0,84 г, 5,61 ммоль) добавляли к уксусной кислоте (20 мл) и нагревали в течение 16 часов при кипячении с обратным холодильником. Реакционную смесь многократно экстрагировали дихлорметаном, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения. 0,60 г (34%).
Точка плавления: 187-188°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,22 (с, 9H, CH3) 6,78 (д, J=8,4 Гц, 1H, ArH) 7,27-7,28 (м, 1H, ArH) 7,46 (д, J=2,1 Гц, 1H, ArH) 7,57 (т, J=7,5 Гц, 1H, ArH) 7,79-7,84 (т, J=7,5 Гц, 2H, ArH) 8,00 (д, J=2,1 Гц, 1H, ArH). MS(EI): 310.
<ПРИМЕР 21> 6-трет-Бутил-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (0,60 г, 5,6 ммоль) и 2-трет-бутилфенол (0,84г, 5,6 ммоль) растворяли в уксусной кислоте (10 мл) и нагревали в течение 7 часов при кипячении с обратным холодильником. После охлаждения реакционной смеси, образовавшийся таким образом осадок промывали уксусной кислотой и водой в указанном порядке с получением указанного в заголовке соединения в виде белого твердого вещества. 1,09 г (62%).
Точка плавления: 148-152°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,35 (с, 9H, CH3) 6,93 (т, J=7,8 Гц, 1H, ArH) 7,23-7,37 (м, 2H, ArH) 7,57 (т, J=7,4 Гц, 1H, ArH) 7,80 (т, J=7,8 Гц, 2H, ArH) 8,05 (д, J=7,8 Гц, 1H, ArH). MS(EI): 310.
<ПРИМЕР 22> 4b,9b-Дигидрокси-7,8,9-триметил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (1,00 г, 5,61 ммоль) и 3,4,5-триметилфенол (0,76 г, 5,61 ммоль) растворяли в уксусной кислоте (20 мл) и нагревали в течение 16 часов при кипячении с обратным холодильником. Реакционную смесь многократно экстрагировали дихлорметаном, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:2) с получением указанного в заголовке соединения. 1,01 г (60%).
Точка плавления: 212-214°C.
1H-ЯМР (300 МГц, CDCl3) δ 2,05 (с, 3H, CH3) 2,19 (с, 3H, CH3) 2,44 (с, 3H, CH3) 6,53 (с, 1H, ArH) 7,53 (т, J=6,9 Гц, 1H, ArH) 7,74-7,80 (м, 2H, ArH) 7,96 (д, J=7,2 Гц, 1H, ArH). MS(EI): 296.
<ПРИМЕР 23> 4b,9b-Дигидрокси-8-трет-пентил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (1,00 г, 5,61 ммоль) и 4-трет-пентилфенол (0,92 г, 5,61 ммоль) растворяли в уксусной кислоте (20 мл) и нагревали в течение 32 часов при кипячении с обратным холодильником. Реакционную смесь многократно экстрагировали дихлорметаном, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 1,28 г (70%).
Точка плавления: 175-176°C.
1H-ЯМР (300 МГц, CDCl3) δ 0,63 (т, J=7,5 Гц, 3H, CH3) 1,22 (с, 6H, CH3) 1,53-1,60 (кв., J=15,0, 7,5 Гц, 2H, CH2) 6,78 (д, J=8,4 Гц, 1H, ArH) 7,28 (м, 1H, ArH 7,46 (д, J=2,1 Гц, 1H, ArH) 7,57 (т, J=7,5 Гц, 1H, ArH) 7,79-7,84 (т, J=7,5 Гц, 2H, ArH) 8,00 (д, J=6,90 Гц, 1H, ArH). MS(EI): 324.
<ПРИМЕР 24> 6,8-ди-трет-Бутил-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (1,00 г, 5,61 ммоль) и 2,4-трет-бутилфенол (1,16 г, 5,61 ммоль) растворяли в уксусной кислоте (20 мл) и нагревали в течение 16 часов при кипячении с обратным холодильником. Реакционную смесь многократно экстрагировали дихлорметаном и органический слой сушили, фильтровали и концентрировали в вакууме. Твердое вещество, образованное таким образом, промывали гексаном с получением указанного в заголовке соединения. 0,60 г (34%).
Точка плавления: 200-203°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,25 (с, 9H, CH3) 1,33 (с, 9H, CH3) 7,31 (д, J=2,1 Гц, 1H, ArH) 7,35 (д, J=2,1 Гц, 1H, ArH) 7,55 (т, J=9,0 Гц, 1H, ArH) 7,76-7,81 (м, 2H, ArH) 8,01 (д, J=7,8 Гц, 1H, ArH). MS(EI): 366.
<ПРИМЕР 25> 6,8-ди-трет-Бутил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диилдиацетат
6,8-ди-трет-Бутил-4b,9b-дигидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он (0,60 г, 0,60 ммоль) полностью растворяли в безводном тетрагидрофуране (20 мл) и проводили реакцию в течение ночи с безводной уксусной кислотой (0,33 г, 3,28 ммоль), пиридином (0,13 г, 1,64 ммоль) и 4-диметиламинопиридином (0,06 г) при комнатной температуре при перемешивании. Реакционную смесь многократно экстрагировали дихлорметаном, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан=1:3) с получением указанного в заголовке соединения. 0,61 г (61%).
Точка плавления: 242-247°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,29 (с, 18H, CH3) 2,13 (с, 3H, OAc) 2,18 (с, 3H, OAc) 7,31 (д, J=2,1 Гц, 1H, ArH) 7,43 (д, J=1,8 Гц, 1H, ArH) 7,57 (т, J=7,5 Гц, 1H, ArH) 7,73-7,84 (м, 2H, ArH) 8,19 (д, J=7,8 Гц, 1H, ArH). MS(EI): 450.
<ПРИМЕР 26> 4b,9b-Дигидрокси-8-нонил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (1,00 г, 5,61 ммоль) и нонилфенол (1,23 г, 5,61 ммоль) растворяли в уксусной кислоте (20 мл) и нагревали в течение 20 часов при кипячении с обратным холодильником. Реакционную смесь многократно экстрагировали дихлорметаном, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 1,01 г (47%).
Точка плавления: 108-110°C.
1H-ЯМР (300 МГц, CDCl3) δ 0,50-1,28 (м, 16H, CH2) 2,09 (с, 3H, CH3) 6,76 (д, J=8,4 Гц, 1H, ArH) 7,38-7,44 (м, 1H, ArH) 7,56 (т, J=7,8 Гц, 1H, ArH) 7,81 (т, J=7,5 Гц, 2H, ArH) 8,01 (т, J=7,5 Гц, 1H, ArH). MS(EI): 380.
<ПРИМЕР 27> 4b,9b-Дигидрокси-8-пентадецил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Нингидрин (1,00 г, 5,61 ммоль) и 2-пентадецилфенол (1,70 г, 5,61 ммоль) растворяли в уксусной кислоте (20 мл) и нагревали в течение 20 часов при кипячении с обратным холодильником. Реакционную смесь многократно экстрагировали дихлорметаном, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 1,01 г (37%).
Точка плавления: 105-110°C.
1H-ЯМР (300 МГц, CDCl3) δ 0,87 (т, J=6,3 Гц, 3H, CH3) 1,24 (с, 24H, CH2) 1,52-1,54 (м, 2H, CH2), 2,53 (т, J=7,6 Гц, 2H, CH2) 6,68 (с, 1H, ArH) 6,81 (д, J=7,6 Гц, 1H, ArH) 7,40 (д, J=7,8 Гц, 1H, ArH) 7,58 (т, J=7,0 Гц, 1H, ArH) 7,83 (т, J=6,80 Гц, 2H, ArH) 8,02 (д, J=8,4 Гц, 1H, ArH). MS(EI): 464.
<ПРИМЕР 28> 6,8-Бис-(1,1-диметилпропил)-4b,9b-дигидрокси-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он
Нингидрин (1,00 г, 5,6 ммоль) и 2,4-ди-трет-пентилфенол (1,31 г, 5,6 ммоль) добавляли к уксусной кислоте (20 мл) и нагревали в течение 16 часов при кипячении с обратным холодильником. Реакционную смесь многократно экстрагировали дихлорметаном, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 1,28 г (58%).
Точка плавления: 195-222°C.
1H-ЯМР (300 МГц, CD3OD) δ 0,44 (т, J=7,5 Гц, 3H, CH3) 0,62 (т, J=7,5 Гц, 3H, CH3) 1,23 (с, 9H, CH3) 1,56 (с, 3H, CH3) 1,58-1,63 (кв., J=15,0 Гц, 7,5 Гц, 2H, CH2) 1,77-1,85 (м, 2H, CH2) 7,11 (с, 1H, ArH) 7,31 (с, 1H, ArH) 7,57 (т, J=7,8 Гц, 1H, ArH) 7,74 (д, J=7,8 Гц, 1H, ArH) 7,81 (т, J=8,4 Гц, 1H, ArH) 7,96 (д, J=7,8 Гц, 1H, ArH). MS(EI): 394.
<ПРИМЕР 29> Изопропил 4b,9b-дигидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-илкарбамат
К раствору 4b,9b-дигидрокси-1-изоцианато-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (70 мг, 0,2 ммоль) в безводном тетрагидрофуране по каплям добавляли 2M аммиак (0,21 мл в изопропиловом спирте). Реакционную смесь нагревали в течение 4 часов при кипячении с обратным холодильником и концентрировали в вакууме с последующей очисткой при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 30 мг (38%).
Точка плавления: 200-202°C.
1Н-ЯМР (300 МГц, CDCl3) δ 1,16 (дд, J=6,9, 1,8 Гц, 6Н, СН3) 1,27-1,34 (м, 6Н, СН3) 2,78-2,87 (м, 1Н, СН) 3,95 (с, 1Н, ОН) 4,77 (с, 1Н, ОН) 4,96-5,05 (м, 1Н, СН) 6,71 (с, 1Н, ArH) 6,84 (д, J=8,1 Гц, 1Н, ArH) 7,42 (д, J=8,1 Гц, 1Н, ArH) 7,53 (д, J=7,2 Гц, 1Н, ArH) 7,72 (т, J=8,1 Гц, 1Н, ArH) 8,27 (д, J=8,4 Гц, 1Н, ArH) 9,29 (с, 1Н, NH). MS(EI): 397.
<ПРИМЕР 30> 5а,10а-дигидрокси-2,3,5а,10а-тетрагидродииндено[1,2-b:5′,6′-d]фуран-10(1Н)-он
К раствору нингидрина (1,00 г, 5,61 ммоль) в уксусной кислоте (20 мл) добавляли 1-(3-гидроксифенил)этанон (0,75 г, 5,61 ммоль) с последующим нагреванием в течение 3 часов при 110°C. Реакционную смесь многократно экстрагировали дихлорметаном, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения. Белое вещество. 1,56 г (94%).
Точка плавления: 214-217°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,90-2,08 (м, 2Н, СН2) 2,69-2,82 (м, 4Н, СН2) 6,68 (с, 1Н, ArH) 7,28 (д, J=12,0 Гц, 1Н, ArH) 7,54 (т, J=7,2 Гц, 1Н, ArH) 7,75-7,81 (м, 2Н, ArH) 7,99 (д, J=7,5 Гц, 1H, ArH). MS(EI): 294.
<ПРИМЕР 31> 6b,11b-Дигидрокси-1,2,3,4,6b,11b-гексагидро-12-оксабензо[4,5]пенталено[2,1-a]нафталин-7-он
К раствору нингидрина (1,00 г, 5,61 ммоль) в уксусной кислоте (20 мл) добавляли 5,6,7,8-тетрагидронафталин-1-ол (0,83 г, 5,61 ммоль) с последующим нагреванием в течение 3 часов при 110°C. После охлаждения образовавшийся таким образом осадок фильтровали с получением указанного в заголовке соединения в виде белого твердого вещества. 1,48 г (83%).
Точка плавления: 252-254°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,72-1,81 (м, 4H, CH2) 2,58-2,67 (м, 4H, CH2) 6,71 (д, J=7,8 Гц, 1H, ArH) 7,21 (д, J=7,8 Гц, 1H, ArH) 7,56 (т, J=8,4 Гц, 1H, ArH) 7,58-7,83 (м, 2H, ArH) 8,02 (д, J=7,5 Гц, 1H, ArH). MS(EI): 308.
<ПРИМЕР 32> 4b,9b-Дигидрокси-7-изопропил-2-метокси-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он.
Изопропилфенол (0,065 г, 0,48 ммоль) добавляли к раствору 5-метоксинингидрина (0,10 г, 0,48 ммоль) в уксусной кислоте (20 мл) и нагревали в течение 15 часов при 110°C. Реакционную смесь многократно экстрагировали этилацетатом, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. Белое вещество. 0,12 г (77%).
Точка плавления: 98-102°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,24 (д, J=6,9 Гц, 6H, CH3) 2,78-2,85 (с, 1H, CH) 3,98 (с, 3H, OCH3) 6,71 (с, 1H, ArH) 6,82 (д, J=7,8 Гц, 1H, ArH) 7,04-7,08 (дд, J=8,4 Гц, 3,6 Гц, 1H, ArH) 7,39-7,42 (м, 2H, ArH) 7,70 (д, J=8,4 Гц, 1H, ArH). MS(EI): 326.
<ПРИМЕР 33> 7-Изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диил-бис(2,2-диметилпропаноат)
К раствору 4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (1,00 г, 3,3 ммоль) в безводном тетрагидрофуране добавляли 2,2-диметил-пропионихлорид (0,81 г, 6,7 ммоль), триметиламин (0,40 г, 4,0 ммоль) и 4-диметиламинопиридин (0,1 г) с последующим нагреванием в течение 24 часов при кипячении с обратным холодильником. Реакционную смесь концентрировали в вакууме и промывали несколько раз дихлорметаном. Концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан=1:6) с получением указанного в заголовке соединения. 0,10 г (6%).
Точка плавления: 153-157°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,16-1,26 (м, 24H, CH3) 2,80-2,89 (м, 1H, CH) 6,73 (с, 1H, ArH) 6,93 (д, J=7,8 Гц, 1H, ArH) 7,48 (д, J=7,8 Гц, 1H, ArH) 7,56 (т, J=7,5 Гц, 1H, ArH) 7,75-7,81 (м, 2H, ArH) 8,09 (д, J=7,8 Гц, 1H, ArH). MS(EI): 464.
<ПРИМЕР 34> (2E,2′E)-7-Изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диил-бис(3-фенилакрилат)
К раствору 4b,9b-дигидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (1,00 г, 3,3 ммоль) в безводном тетрагидрофуране добавляли 3-фенилакрилоилхлорид (1,12 г, 6,7 ммоль), триметиламин (0,40 г, 4,0 ммоль) и 4-диметиламинопиридин (0,1 г) с последующим нагреванием в течение 2 суток при кипячении с обратным холодильником. Реакционную смесь концентрировали в вакууме и промывали несколько раз этилацетатом. Концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:8 до 1:4) с получением указанного в заголовке соединения. 0,08 г (9%).
Точка плавления: 111-113°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,20 (дд, J=2,7 Гц, 6,8 Гц, 6H, CH3) 2,88-2,92 (м, 1H, CH) 6,37 (д, J=16,0 Гц, 1H, CH) 6,52 (д, J=16,0 Гц, 1H, CH) 6,81 (с, 1H, ArH) 6,99 (д, J=7,3 Гц, 1H, ArH) 7,17-7,44 (м, 10H, ArH) 7,59-7,91 (м, 6H, CH, ArH) 8,25 (д, J=7,8 Гц, 1H, ArH). MS(EI): 556.
<ПРИМЕР 35> 9b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илакрилат
К раствору 4b,9b-дигидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (1,00 г, 3,37 ммоль) в безводном тетрагидрофуране добавляли акрилоилхлорид (0,61 г, 6,74 ммоль), триметиламин (0,41 г, 4,0 ммоль) и 4-диметиламинопиридин (0,1 г) с последующим нагреванием в течение 24 часов при кипячении с обратным холодильником. Реакционную смесь концентрировали в вакууме и многократно промывали этилацетатом. Концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:2 до 1:1) с получением указанного в заголовке соединения. 0,02 г (1,7%).
Точка плавления: 95-97°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,18 (д, J=2,1 Гц, 7,2 Гц, 6H, CH3) 2,81-2,87 (м, 1H, CH) 3,91 (с, 1H, OH) 5,95 (д, J=7,5 Гц, 2H, CH2) 6,19-6,28 (м, 1H, OH) 6,50 (д, J=12,0 Гц, 1H, ArH) 6,73 (с, 1H, ArH) 6,88 (д, J=8,1 Гц, 1H, ArH) 7,52 (д, J=7,8 Гц, 1H, ArH) 7,56 (т, J=7,8 Гц, 1H, ArH) 7,80-7,91 (м, 2H, ArH). MS(EI): 350.
<ПРИМЕР 36> 9b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-ил-фуран-2-карбоксилатфуран-2-карбоновой кислоты
Фуран-2-карбонилхлорид (0,88 г, 6,74 ммоль), триметиламин (0,34 г, 3,37 ммоль), 4-диметиламинопиридин (0,1 г) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]индена-10-она (1,00 г, 3,37 ммоль) в безводном тетрагидрофуране и нагревали в течение 24 часов при кипячении с обратным холодильником. Реакционную смесь концентрировали в вакууме и многократно промывали этилацетатом. Концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:2) с получением указанного в заголовке соединения. 0,07 г (5%).
Точка плавления: 116-120°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,20 (д, J=2,1 Гц, 6,9 Гц, 6H, CH3) 2,78-2,88 (м, 1H, CH) 4,77 (с, 1H, OH) 6,46-6,48 (с, 1H, CH) 6,71 (с, 1H, ArH) 6,90 (д, J=7,2 Гц, 1H, ArH) 7,24 (с, 1H, ArH) 7,50-7,56 (м, 3H, CH, ArH) 7,73-7,82 (м, 2H, ArH) 7,93 (д, J=7,8 Гц, 1H, ArH). MS(EI): 390.
<ПРИМЕР 37> Диэтил-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диилдикарбонат
Этоксикарбонилхлорид (0,81 г, 6,74 ммоль), триметиламин (0,34 г, 3,37 ммоль) и 4-диметиламинопиридин (0,1 г) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (1,00 г, 3,37 ммоль) в безводном тетрагидрофуране и нагревали в течение 24 часов при кипячении с обратным холодильником. Реакционную смесь концентрировали в вакууме и многократно промывали этилацетатом, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:2) с получением указанного в заголовке соединения. 0,03 г (2%).
Точка плавления: 150-153°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (дд, J=6,8, 2,8 Гц, 6H, CH3) 1,20-1,28 (м, 6H, CH3) 2,78-2,85 (м, 1H, CH) 4,14-4,30 (м, 4H, OCH2) 6,77 (с, 1H, ArH) 6,94 (д, J=7,9 Гц, 1H, ArH) 7,53-7,62 (м, 2H, ArH) 7,76-7,87 (м, 2H, ArH) 8,18 (д, J=7,8 Гц, 1H, ArH). MS(EI): 440.
<ПРИМЕР 38> Этил-9b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илкарбонат
Этоксикарбонилхлорид (0,81 г, 6,74 ммоль), триметиламин (0,34 г, 3,37 ммоль) и 4-диметиламинопиридин (0,1 г) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (1,00 г, 3,37 ммоль) в безводном тетрагидрофуране и нагревали в течение 24 часов при кипячении с обратным холодильником. Реакционную смесь концентрировали в вакууме и многократно промывали этилацетатом, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1: 2) с получением указанного в заголовке соединения. 0,07 г (5%).
Точка плавления: 144-147°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (д, J=6,9 Гц, 6H, CH3) 1,25 (т, J=7,1 Гц, 3H, CH3) 2,78-2,85 (м, 1H, CH) 4,12-4,19 (кв., J=14,3, 7,1 Гц, 2H, OCH2) 4,60 (с, 1H, OH) 6,69 (с, 1H, ArH) 6,88 (д, J=7,8 Гц, 1H, ArH) 7,47-7,58 (м, 2H, ArH) 7,75-7,83 (м, 2H, ArH) 7,97 (д, J=7,6 Гц, 1H, ArH). MS(EI): 368.
<ПРИМЕР 39> Метил-4b,9b-дигидрокси-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-8-карбоксилат
Метил-3-гидроксибензоат (0,42 г, 2,8 ммоль) добавляли к раствору нингидрина (0,50 г, 2,8 ммоль) в ледяной уксусной кислоте (10 мл) и нагревали в течение 27 часов при кипячении с обратным холодильником. Реакционную смесь разбавляли в этилацетате, многократно промывали водой, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = 1:4) с получением указанного в заголовке соединения. 0,14 г (16%).
Точка плавления: 220-223°C.
1H-ЯМР (300 МГц, CDCl3) δ 3,87 (с, 3H, OCH3) 4,05 (с, 1H, OH) 4,79 (с, 1H, OH) 6,87 (д, J=8,4 Гц, 1H, ArH) 7,59 (т, J=7,8 Гц, 1H, ArH) 7,80-7,86 (м, 2H, ArH) 7,98-8,02 (м, 2H, ArH) 8,20 (с, 1H, ArH). MS(EI): 312.
<ПРИМЕР 40> 9b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илдиэтилкарбамат
Триэтиламин (0,4 г, 4,0 ммоль), диэтилкарбамоилхлорид (0,91 г, 6,7 ммоль) и 4-диметиламинопиридин (0,1 г) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (1,00 г, 3,3 ммоль) в безводном тетрагидрофуране и нагревали при кипячении с обратным холодильником. Реакционную смесь концентрировали в вакууме, разбавляли в дихлорметане и многократно промывали водой. Концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:2) с получением указанного в заголовке соединения. 0,63 г (47%).
Точка плавления: 127-130°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,08-1,29 (м, 12H, CH3) 2,81-2,86 (м, 1H, CH) 3,22-3,45 (м, 4H, NCH2) 4,73 (с, 1H, OH) 6,70 (с, 1H, ArH) 6,91 (д, J=7,9 Гц, 1H, ArH) 7,53-7,61 (м, 2H, ArH) 7,78-7,91 (м, 3H, ArH). MS(EI): 395.
<ПРИМЕР 41> 4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-илдиэтилкарбамат
Триэтиламин (0,4 г, 4,0 ммоль), диэтилкарбамоилхлорид (0,91 г, 6,7 ммоль) и 4-диметиламинопиридин (0,1 г) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (1,00 г, 3,3 ммоль) в безводном тетрагидрофуране и нагревали при кипячении с обратным холодильником. Реакционную смесь концентрировали в вакууме, разбавляли в дихлорметане и многократно промывали водой. Концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:2) с получением указанного в заголовке соединения. 0,02 г (1,5%).
Точка плавления: 101-104°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,06-1,30 (м, 12H, CH3) 2,79-2,88 (м, 1H, CH) 3,21-3,28 (м, 2H, NCH2) 3,36-3,47 (м, 2H, NCH2) 5,60 (с, 1H, OH) 6,73 (с, 1H, ArH) 6,85 (д, J=7,2 Гц, 1H, ArH) 7,39 (д, J=7,8 Гц, 1H, ArH) 7,54 (т, J=6,3 Гц, 1H, ArH) 7,78-7,88 (м, 2H, ArH) 8,00 (д, J=7,5 Гц, 1H, ArH). MS(EI): 395.
<ПРИМЕР 42> 2,3-Дифтор-4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
м-Изопропилфенол (0,21 г, 1,5 ммоль) добавляли к раствору 5,6-дифтор-2,2-дигидрокси-1H-инден-1,3(2H)-диона (0,33 г, 1,54 ммоль) в ледяной уксусной кислоте (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь разбавляли в этилацетате и многократно промывали водой. Концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:2) с получением указанного в заголовке соединения. 0,32 г (63%).
Точка плавления: 134-136°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,18 (д, J=5,1 Гц, 6H, CH3) 1,19 (с, 3H, CH3) 2,79-2,88 (м, 1H, CH) 3,71 (с, 1H, OH) 4,65 (с, 1H, OH) 6,72 (с, 1H, ArH) 6,87 (д, J=7,8 Гц, 1H, ArH) 7,37 (д, J=8,1 Гц, 1H, ArH) 7,56 (т, J=8,1 Гц, 1H, ArH) 7,77 (т, J=6,7 Гц, 1H, ArH). MS(EI): 332.
<ПРИМЕР 43> 1,4b,9b-Тригидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
м-Изопропилфенол (0,35 г, 2,5 ммоль) добавляли к раствору 2,2,4-тригидрокси-1H-инден-1,3(2H)-диона (0,50 г, 2,5 ммоль) в ледяной уксусной кислоте (10 мл) и нагревали в течение 4 часов при кипячении с обратным холодильником. Реакционную смесь разбавляли в этилацетате и многократно промывали водой. Концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения. 0,33 г (41%).Точка плавления: 205-207°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,19 (дд, J=1,8 Гц, 6,9 Гц, 6H, CH3) 2,80-2,89 (м, 1H, CH) 3,59 (с, 1H, OH) 4,60 (с, 1H, OH) 6,73 (с, 1H, ArH) 6,88 (дд, J=1,5 Гц, 7,8 Гц, 1H, ArH) 6,95 (д, J=8,1 Гц, 1H, ArH) 7,45 (д, J=7,2 Гц, 2H, ArH) 7,69 (т, J=7,8 Гц, 1H, ArH) 8,40 (с, 1H, OH). MS(EI): 312.
<ПРИМЕР 44> 4b,9b-Дигидрокси-7-изопропил-1H-циклопента[b]нафталино[1,2-b]фуран-10(9bH)-он
м-Изопропилфенол (0,03 г, 0,2 ммоль) добавляли к раствору 2,2-дигидрокси-1H-циклопента[b]нафталин-1,3(2H)-диона (50 мг, 0,2 ммоль) в ледяной уксусной кислоте (5 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь концентрировали в вакууме, и концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:3) с получением указанного в заголовке соединения. 0,07 г (92%).
Точка плавления: 186-189°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,09 (д, J=6,9 Гц, 6H, CH3) 2,70-2,80 (м, 1H, CH) 6,67 (с, 1H, ArH) 6,76 (д, J=7,8 Гц, 1H, ArH) 7,41 (д, J=7,8 Гц, 1H, ArH) 7,48-7,61 (м, 2H, ArH) 7,92 (м, 2H, ArH) 8,26 (с, 1H, ArH) 8,43 (с, 1H, ArH). MS(EI): 346.
<ПРИМЕР 45> 9b-Гидрокси-7-изопропил-4b-метокси-1-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Железо (0,09 г, 1,6 ммоль), конц. HCl (0,05 мл) и воду (0,5 мл) добавляли в указанном порядке к раствору 4b,9b-дигидрокси-7-изопропил-1-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (80 мг, 0,2 ммоль) в абсолютном этаноле (5 мл). Реакционную смесь нагревали в течение 2 часов при кипячении с обратным холодильником. После фильтрования при высокой температуре для удаления железа, фильтрат концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:1) с получением указанного в заголовке соединения. 80 мг (80%).
Точка плавления: 181-183°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,19 (дд, J=2,7 Гц, 6,9 Гц, 6H, CH3) 2,80-2,89 (м, 1H, CH) 3,73 (с, 3H, OCH3) 5,56 (с, 1H, OH) 6,59 (д, J=8,1 Гц, 1H, ArH) 6,73 (с, 1H, ArH) 6,86 (дд, J=1,5 Гц, 7,8 Гц, 1H, ArH) 7,08 (д, J=7,2 Гц, 1H, ArH) 7,46 (м, 2H, ArH). MS(EI): 326.
<ПРИМЕР 46> 1-Амино-4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Железо (0,48 г, 8,5 ммоль), конц. HCl (0,1 мл) и воду (1 мл) добавляли в указанном порядке к раствору 4b,9b-дигидрокси-7-изопропил-1-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (0,40 г, 1,1 ммоль) в абсолютном этаноле (10 мл). Реакционную смесь нагревали в течение 2 часов при кипячении с обратным холодильником. После удаления железа высокотемпературным фильтрованием, остаток концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 0,17 г (47%).
Точка плавления: 180-182°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,19 (дд, J=1,8 Гц, 6,9 Гц, 6H, CH3) 2,79-2,89 (м, 1H, CH) 3,57 (с, 1H, OH) 4,57 (с, 1H, OH) 5,55 (с, 2H, NH2) 6,61 (д, J=8,1 Гц, 1H, ArH) 6,77 (с, 1H, ArH) 6,85 (дд, J=1,5 Гц, 7,8 Гц, 1H, ArH) 7,17 (д, J=7,5 Гц, 1H, ArH) 7,42-7,52 (м, 2H, ArH). MS(EI): 311.
<ПРИМЕР 47> 1-Амино-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диилдиацетат
Железо (0,22 г, 3,8 ммоль), конц. HCl (0,05 мл) и воду (1 мл) добавляли в указанном порядке к раствору 7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диилдиацетата (0,23 г, 0,5 ммоль) в абсолютном этаноле (10 мл). Реакционную смесь нагревали в течение 2 часов при кипячении с обратным холодильником. После удаления железа высокотемпературным фильтрованием, фильтрат концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 0,15 г (71%).
Точка плавления: 220-223°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,18 (дд, J=6,9 Гц, 2,1 Гц, 6H, CH3) 2,15 (с, 6H, OAc) 2,81-2,90 (м, 1H, CH) 5,57 (с, 2H, NH2) 6,64 (д, J=8,1 Гц, 1H, ArH) 6,75 (с, 1H, ArH) 6,92 (дд, J=7,8 Гц, 1,2 Гц, 1H, ArH) 7,29 (д, J=7,8 Гц, 1H, ArH) 7,43-7,51 (м, 2H, ArH). 13C-ЯМР (300 МГц, CDCl3) δ 20,22, 21,40, 23,77, 23,82, 34,37, 87,36, 108,54, 110,02, 113,847, 116,11, 117,79, 118,03, 121,31, 124,89, 137,49, 145,40, 147,37, 154,38, 157,54, 167,18, 169,51, 194,17. MS(EI): 395.
<ПРИМЕР 48> N-(4b,9b-Дигидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-ил)ацетамид
1-Ацетамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диилдиацетат (30 мг, 0,06 ммоль) в абсолютном метаноле (2 мл) реагировал с карбонатом калия (0,05 г, 0,3 ммоль) при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали в вакууме, разбавляли в этилацетате и многократно промывали водой. Концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:2) с получением указанного в заголовке соединения. 7 мг (35%).
Точка плавления: 152-154°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,18 (дд, J=1,9 Гц, 6,7 Гц, 6H, CH3) 2,16 (с, 3H, NHAc) 2,72-2,81 (м, 1H, CH) 3,76 (с, 1H, OH) 4,60 (с, 1H, OH) 6,65 (с, 1H, ArH) 6,79 (д, J=8,1 Гц, 1H, ArH) 7,35 (д, J=7,8 Гц, 1H, ArH) 7,53 (д, J=7,5 Гц, 1H, ArH) 7,66 (т, J=8,1 Гц, 1H, ArH) 8,44 (д, J=8,1 Гц, 1H, ArH) 9,88 (с, 1H, NH). MS(EI): 353.
<ПРИМЕР 49> Метил-4b,9b-дигидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-илкарбамат
Раствор 4b,9b-дигидрокси-1-изоцианато-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (50 мг, 0,14 ммоль) в абсолютном метаноле (5 мл) нагревали в течение 40 мин при кипячении с обратным холодильником, концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 12 мг (22%).
Точка плавления: 96-99°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (дд, J=6,9, 1,8 Гц, 6H, CH3) 2,77-2,87 (м, 1H, CH) 3,80 (с, 3H, OCH3) 6,70 (с, 1H, ArH) 6,84 (д, J=8,1 Гц, 1H, ArH) 7,41 (д, J=7,8 Гц, 1H, ArH) 7,54 (д, J=7,8 Гц, 1H, ArH) 7,71 (т, J=8,1 Гц, 1H, ArH) 8,23 (д, J=8,4 Гц, 1H, ArH) 9,37 (с, 1H, NH). MS(EI): 369.
<ПРИМЕР 50> 1-Амино-7-этил-4b,9b-дигидрокси-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он
Железо (0,31 г, 5,57 ммоль) и конц. HCl (0,05 мл) добавляли к раствору 7-этил-4b,9b-дигидрокси-1-нитро-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,25 г, 0,76 ммоль) в этаноле (5 мл) и воде (0,5 мл). После 2 часов реакции, реакционную смесь промывали метанолом, фильтрат концентрировали и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения. 0,05 г (22%).
Точка плавления: 200-203°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (т, J=7,5 Гц, 3H, CH3) 2,57 (кв., J=7,5 Гц, 2H, CH2) 5,47 (с, 2H, NH2) 6,61 (д, J=8,1 Гц, 1H, ArH) 6,66 (с, 1H, ArH) 6,80 (д, J=7,8 Гц, 1H, ArH) 7,14 (д, J=7,5 Гц, 1H, ArH) 7,29-7,39 (м, 2H, ArH). MS(EI): 297.
<ПРИМЕР 51> 7-Этил-4b,9b-дигидрокси-1-нитро-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он
Триэтиламин (0,09 г, 0,96 ммоль) и метиловый эфир хлормуравьиной кислоты (0,09 г, 0,96 ммоль) добавляли к раствору 1-амино-4b,9b-дигидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,10 г, 0,32 ммоль) в безводном тетрагидрофуране (15 мл) и нагревали в течение 14 часов при кипячении с обратным холодильником. Органический слой концентрировали и очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:2) с получением указанного в заголовке соединения. 80 мг (58%).
Точка плавления: 110-120°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,19 (д, J=6,9 Гц, 6H, CH3) 2,84-2,89 (м, 1H, CH) 3,71 (с, 3H, OCH3) 3,76 (с, 3H, OCH3) 5,67 (с, 2H, NH2) 6,88-6,93 (м, 2H, ArH) 7,19 (д, J=8,4 Гц, 1H, ArH) 7,25 (д, J=7,5 Гц, 1H, ArH) 7,56 (т, J=7,8 Гц, 1H, ArH) 7,66 (д, J=8,4 Гц, 1H, ArH). MS(EI): 427.
<ПРИМЕР 52> 7-Этил-2,4b,9b-тригидрокси-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он
м-Этилфенол (0,60 г, 4,97 ммоль) добавляли к раствору 2,2,5-тригидрокси-2H-инден-1,3-диона (0,99 г, 4,97 ммоль) в уксусной кислоте (10 мл) и нагревали в течение 10 часов при кипячении с обратным холодильником. Фильтрат концентрировали и подвергали хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 1,02 г (69%).
Точка плавления: 208-213°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,17 (т, J=7,5 Гц, 3H, CH3) 2,57 (кв., J=15,0 Гц, 7,5 Гц, 2H, CH2) 6,64 (с, 3H, ArH) 6,79 (д, J=7,8 Гц, 1H, ArH) 6,97 (дд, J=8,5 Гц, 1,9 Гц 1H, ArH) 7,28 (с, 1H, ArH) 7,42 (д, J=7,8 Гц, 1H, ArH) 7,65 (д, J=8,5 Гц, 1H, ArH). MS(EI): 298,29.
<ПРИМЕР 53> 4b-Ацетокси-1-амино-7-изопропил-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-a]инден-9b-иловый эфир уксусной кислоты
Триэтиламин (0,11 г, 1,16 ммоль) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-1-нитро-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,20 г, 0,58 ммоль) в безводном хлороформе (10 мл) при комнатной температуре. К этой реакционной смеси медленно добавляли разбавленный 10% ацетилхлорид (1 мл) в хлороформе при 0°C и инкубировали при той же температуре в течение 1 часа. Реакционную смесь разбавляли в дихлорметане и многократно промывали водой. Концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:2) с получением указанного в заголовке соединения. 30 мг (12%).
Точка плавления: 201-203°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,21 (дд, J=8,4 Гц, 2,0 Гц, 6H, CH3) 2,16 (с, 6H, OAc) 2,85-2,90 (м, 1H, CH) 6,75 (с, 1H, ArH) 6,96 (д, J=7,9 Гц, 1H, ArH) 7,49 (д, J=7,9 Гц, 1H, ArH) 7,88-7,91 (м, 2H, ArH) 8,39 (дд, J=6,7 Гц, 2,0 Гц, 1H, ArH). MS(EI): 425.
<ПРИМЕР 54> 4b-Ацетокси-7-изопропил-1-метансульфониламино-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-a]инден-9b-иловый эфир уксусной кислоты
Триэтиламин (0,05 г, 0,50 ммоль) добавляли к раствору 4b-ацетокси-1-амино-7-изопропил-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-a]инден-9b-илового эфира уксусной кислоты (0,10 г, 0,25 ммоль) в безводном хлороформе (10 мл) при комнатной температуре. К этому раствору медленно добавляли метансульфонилхлорид (0,05 г, 0,50 ммоль) при 0°C и проводили реакцию при комнатной температуре в течение 12 часов. Реакционную смесь разбавляли в дихлорметане и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой посредством хроматографии на колонке (этилацетат:гексан = от 1:2 до 1:1) с получением указанного в заголовке соединения. 10 мг (8%).
Точка плавления: 96-100°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,19 (д, J=6,9 Гц, 6H, CH3) 2,07 (с, 3H, OAc) 2,20 (с, 3H, OAc) 2,83-2,88 (м, 1H, CH) 3,16 (с, 3H, CH3) 6,83 (с, 1H, ArH) 7,14 (д, J=8,1 Гц, 1H, ArH) 7,59 (кв., J=8,1 Гц, 1H, ArH) 7,67 (д, J=7,5 Гц, 1H, ArH) 7,86 (т, J=7,5 Гц, 1H, ArH) 7,98 (д, J=8,1 Гц, 1H, ArH) 9,23 (с, 1H, NH). MS(EI): 473.
<ПРИМЕР 55> 1-(4b,9b-Дигидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-ил)-3-изопропилмочевина
Изопропиламин (0,012 мл) по каплям добавляли к раствору 4b,9b-дигидрокси-1-изоцианато-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (40 мг, 0,11 ммоль) в безводном тетрагидрофуране. Реакционную смесь нагревали в течение 12 часов при кипячении с обратным холодильником, концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 10 мг (21%).
Точка плавления: 81-85°C.
1H-ЯМР (300 МГц, CDCl3) δ 0,98 (т, J=7,4 Гц, 6H, CH3) 1,15-1,32 (м, 6H, CH3) 2,81-2,85 (м, 1H, CH) 3,78 (с, 1H, OH) 4,14 (т, J=6,6 Гц, 2H, NH, CH) 4,67 (с, 1H, OH) 6,72 (с, 1H, ArH) 6,86 (д, J=7,8 Гц, 1H, ArH) 7,42 (д, J=7,8 Гц, 1H, ArH) 7,53 (д, J=7,8 Гц, 1H, ArH) 7,71 (т, J=8,0 Гц, 1H, ArH) 8,27 (д, J=8,3 Гц, 1H, ArH) 9,36 (с, 1H, NH). MS(EI): 396.
<ПРИМЕР 56> N-(9b-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-ил)ацетамид
К раствору N-(4b-хлор-9b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-ил)ацетамида (0,53 г, 1,4 ммоль) в безводном тетрагидрофуране (10 мл) добавляли 2M аммиак (1,42 мл в изопропиловом спирте) при 5°C и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. После концентрирования в вакууме, реакционную смесь разбавляли в дихлорметане и промывали водным раствором бикарбоната натрия. Концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 40 мг (8%).
Точка плавления: 152-156°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,17 (дд, J=1,8, 6,9 Гц, 6H, CH3) 2,23 (с, 3H, CH3) 2,78-2,87 (м, 1H, CH) 6,70 (с, 1H, ArH) 6,84 (д, J=7,8 Гц, 1H, ArH) 7,34 (д, J=7,8 Гц, 1H, ArH) 7,63 (д, J=7,2 Гц, 1H, ArH) 7,75 (т, J=8,1 Гц, 1H, ArH) 8,54 (д, J=8,1 Гц, 1H, ArH) 9,99 (с, 1H, NH). MS(EI): 352.
<ПРИМЕР 57> N,N′-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1,9b-диил)диацетамид
N-(9b-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-ил)ацетамид (400 мг, 0,11 ммоль) растворяли в безводной уксусной кислоте (3 мл) и подвергали реакции с безводной уксусной кислотой (0,01 г, 0,11 ммоль) в течение 2 часов при 80°C. Реакционную смесь концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 12 мг (27%).
Точка плавления: 189-191°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (дд, J=2,1, 6,9 Гц, 6H, CH3) 2,03 (с, 3H, CH3) 2,20 (с, 3H, CH3) 2,77-2,86 (м, 1H, CH) 5,40 (с, 1H, OH) 6,52 (с, 1H, NH) 6,70 (с, 1H, ArH) 6,84 (дд, J=1,2, 8,1 Гц, 1H, ArH) 7,29 (д, J=8,1 Гц, 1H, ArH) 7,57 (д, J=7,5 Гц, 1H, ArH) 7,72 (т, J=8,1 Гц, 1H, ArH) 8,54 (д, J=8,1 Гц, 1H, ArH) 10,00 (с, 1H, NH). MS(EI): 394.
<ПРИМЕР 58> N-(7-Амино-2-гидрокси-2-(4-изопропил-2-гидроксифенил)-1,3-диоксо-2,3-дигидро-1H-инден-4-ил)ацетамид
Воду (1,5 мл), железо (0,71 г) и конц. HCl (0,05 мл) добавляли в указанном порядке к раствору 1-амино-4b,9b-дигидрокси-7-изопропил-4-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (0,70 г, 1,75 ммоль) в этаноле (15 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали метанолом, концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:1) с получением указанного в заголовке соединения. 0,33 г (51%).
Точка плавления: 278-280°C.
1H-ЯМР (300 МГц, ацетон-d6) δ 1,18 (дд, J=6,3 Гц, 6H, CH3) 2,17 (с, 3H, CH3) 2,78-2,86 (м, 1H, CH) 6,38 (м, 2H, NH, ArH) 6,65 (с, 2H, ArH) 6,83 (д, J=8,1 Гц, 2H, ArH). MS(EI): 368.
<ПРИМЕР 59> N-(2-Амино-4b,9b-дигидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-ил)ацетамид
Воду (0,3 мл), железо (0,10 г) и конц. HCl (0,05 мл) добавляли в указанном порядке к раствору N-(4b,9b-дигидрокси-7-изопропил-2-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1-ил)ацетамида (0,10 г, 0,25 ммоль) в этаноле (3 мл) и нагревали в течение 90 мин при кипячении с обратным холодильником. Реакционную смесь промывали метанолом, концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=2:1) с получением указанного в заголовке соединения. 22 мг (24%).
Точка плавления: 177-181°C.
1H-ЯМР (300 МГц, ацетон-d6) δ 1,16 (д, J=3,0, 6,9 Гц, 6H, CH3) 2,30 (с, 3H, CH3) 2,77-2,86 (м, 1H, CH) 5,93 (с, 2H, NH2) 6,62 (с, 1H, ArH) 6,79 (д, J=7,8 Гц, 1H, ArH) 6,99 (с, 1H, ArH) 7,29-7,40 (м, 2H, ArH) 8,86 (с, 1H, NH).
<ПРИМЕР 60> 1-Амино-4b,9b-дигидрокси-7-изопропил-2-нитро-4bH-индено[1,2-b]бензофуран-10(9bH)-он
N-(2,2-Дигидрокси-7-нитро-1,3-диоксо-2,3-дигидро-1H-инден-4-ил)ацетамид (0,10 мг, 0,25 ммоль) растворяли в 6 M HCl (1,4 мл) и метаноле (1 мл) и нагревали в течение 90 мин при 90°C. Этот раствор добавляли к карбонату натрия и 2 н. NaOH и экстрагировали метиленхлоридом. Органический слой концентрировали с получением указанного в заголовке соединения. 87 мг (97%).
Точка плавления: 12-116°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,19 (д, J=6,9 Гц, 6H, CH3) 2,83-2,88 (м, 1H, CH) 4,60 (с, 1H, OH) 6,75 (с, 1H, ArH) 6,90 (д, J=6,9 Гц, 1H, ArH) 7,19 (д, J=8,4 Гц, 1H, ArH) 7,43 (д, J=8,1 Гц, 1H, ArH) 7,96 (с, 2H, NH2) 8,56 (д, J=9,0 Гц, 1H, ArH). MS(EI): 356.
<ПРИМЕР 61> 1,4-Диамино-4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Воду (1,5 мл), железо (0,68 г) и конц. HCl (0,05 мл) добавляли в указанном порядке к раствору 1-амино-4b,9b-дигидрокси-7-изопропил-4-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (0,60 г, 1,68 ммоль) в этаноле (15 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали метанолом, концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения. 0,22 г (36%).
Точка плавления: 223-231°C.
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,9 Гц, 6H, CH3) 2,78-2,82 (м, 1H, CH) 6,56 (с, 1H, ArH) 6,77 (д, J=8,1 Гц, 1H, ArH) 6,99 (с, 2H, ArH) 7,43 (д, J=8,1 Гц, 1H, ArH). MS(EI): 326.
<ПРИМЕР 62> 1,2-Диамино-4b,9b-дигидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-он
Воду (0,3 мл), железо (0,08 г) и конц. HCl (0,03 мл) добавляли в указанном порядке к раствору 1-амино-4b,9b-дигидрокси-7-изопропил-2-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (75 мг, 0,21 ммоль) в этаноле (3 мл) и нагревали в течение 90 мин при кипячении с обратным холодильником. Реакционную смесь промывали метанолом, концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:1) с получением указанного в заголовке соединения. 12 мг (17%).
Точка плавления: 163-166°C.
1H-ЯМР (300 МГц, ацетон-d6) δ 1,03 (д, J=6,9 Гц, 6H, CH3) 2,61-2,70 (м, 1H, CH) 5,46 (с, 1H, ArH) 6,01 (с, 1H, ArH) 6,51-6,58 (м, 2H, ArH) 6,98 (д, J=9,0 Гц, 1H, ArH). MS(EI): 326.
<ПРИМЕР 63> 2-(2-Гидрокси-4-изопропилфенил)-1,3-диоксо-2,3-дигидро-1H-инден-2-илдиметилкарбамат
Диметилкарбамоилхлорид (0,72 г, 6,7 ммоль) и триметиламин (0,41 г, 4,0 ммоль) добавляли к раствору 4-диметиламинопиридина (0,1 г) 4b,9b-дигидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (1,00 г, 3,3 ммоль) в безводном тетрагидрофуране (10 мл) и нагревали в течение 24 часов при кипячении с обратным холодильником. Продукт реакции концентрировали и экстрагировали этилацетатом. Концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:2) с получением указанного в заголовке соединения. 0,19 г (15%).
Точка плавления: 114-118°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,19 (д, J=6,8 Гц, 6H, CH3) 2,78-2,91 (м, 4H, CH, NCH3) 3,06 (с, 3H, NCH3) 5,57 (с, 1H, OH) 6,72 (с, 1H, ArH) 6,88 (д, J=7,8 Гц, 1H, ArH) 7,51 (д, J=8,1 Гц, 1H, ArH) 7,56-7,78 (м, 3H, ArH) 7,99 (д, J=7,8 Гц, 1H, ArH). MS(EI): 367.
<ПРИМЕР 64> 4b,9b-Дигидрокси-6,8-диизопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он
К раствору нингидрина (0,30 г, 1,68 ммоль) в уксусной кислоте (10 мл) добавляли 2,4-диизопропилфенол (0,27 г, 1,51 ммоль), затем раствор нагревали в течение 12 часов при кипячении с обратным холодильником. После концентрирования в вакууме, перекристаллизация из метиленхлорида дала указанное в заголовке соединение (0,40 г, 70%).
Точка плавления: 205-206°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,14-1,24 (м, 12H), 2,81 (кв., J=7,2 Гц, 1H), 3,07 (кв., J=7,2 Гц, 1H), 3,65 (с, 1H), 4,55 (с, 1H), 7,00 (д, J=1,7 Гц, 1H), 7,17 (с, 1H), 7,54 (д, J=8,4 Гц, 1H), 7,76-7,81 (м, 2H), 8,00 (д, J=7,6 Гц, 1H).
<ПРИМЕР 65> 9b-Амино-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он
Оксалилхлорид (0,69 мл, 8,15 ммоль) и две капли диметилформамида добавляли к раствору 4b,9b-дигидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (2,00 г, 6,79 ммоль) в метиленхлориде (20 мл) и перемешивали при комнатной температуре в течение 3 часов. Концентрирование в вакууме давало 9b-хлор-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он (2,33 г, 109%).
9b-Хлор-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он (1,00 г, 3,18 ммоль) растворяли в тетрагидрофуране (10 мл), охлаждали до 5°C и смешивали с 2,0 M аммиаком в изопропиловом спирте (3,18 мл, 6,36 ммоль) при комнатной температуре в течение 4 часов при перемешивании. После концентрирования в вакууме, очистка посредством хроматографии на колонке (этилацетат:гексан=1:4) давала указанное в заголовке соединение (0,75 г, 80%).
Точка плавления: 151-152°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (дд, J=1,9 Гц, 7,0 Гц, 6H), 2,81 (кв., J=7,2 Гц, 1H), 6,68 (с, 1H), 6,81 (д, J=7,8 Гц, 1H), 7,33 (д, J=7,8 Гц, 1H), 7,51 (т, J=8,3 Гц, 1H), 7,73-7,80 (м, 2H), 8,01 (д, J=7,8 Гц, 1H).
<ПРИМЕР 66> N-(4b-Гидрокси-7-изопропил-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-a]инден-9b-ил)ацетамид
Безводную уксусную кислоту (0,08 мл, 0,88 ммоль) добавляли к раствору 9b-амино-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,26 г, 0,88 ммоль) в уксусной кислоте (5 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Концентрирование в вакууме и перекристаллизация в метиленхлориде давали указанное в заголовке соединение (0,25 г, 84%).
Точка плавления: 183-184°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,15 (д, J=3,0 Гц, 3H), 1,17 (д, J=3,0 Гц, 3H), 2,06 (с, 3H), 2,81 (кв., J=7,1 Гц, 1H), 5,73 (с, 1H), 6,70 (д, J=1,1 Гц, 1H), 6,81 (дд, J=1,4 Гц, 7,9 Гц, 1H), 7,25 (д, J=7,2 Гц, 1H), 7,54 (т, J=8,2 Гц, 1H), 7,76-7,82 (м, 2H), 7,99 (д, J=7,7 Гц, 1H).
<ПРИМЕР 67> 9b-Гексиламино-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он
К раствору 4b,9b-дигидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]индена-10-она (1,00 г, 3,39 ммоль) в метиленхлориде (10 мл) добавляли оксалилхлорид (0,35 мл, 4,08 ммоль) и две капли диметилформамида с последующим перемешиванием при комнатной температуре в течение 3 часов. Концентрирование в вакууме давало 9b-хлор-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он (1,33 г, 109%).
9b-Хлор-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он (1,00 г, 3,18 ммоль) растворяли в тетрагидрофуране (10 мл), охлаждали до 5°C и подвергали реакции с гексиламином (0,84 мл, 6,36 ммоль) при комнатной температуре в течение 3 часов при перемешивании. Концентрирование в вакууме и очистка посредством хроматографии на колонке (этилацетат:гексан=1:4) давали указанное в заголовке соединение (0,58 г, 48%).
1H-ЯМР (300 МГц, CDCl3) δ 0,84 (т, J=7,8 Гц, 3H), 1,15 (д, J=2,5 Гц, 3H), 1,17 (д, J=2,7 Гц, 3H), 1,20-1,33 (м, 6H), 1,42-1,52 (м, 2H), 2,45 (т, J=8,3 Гц, 2H), 2,81 (кв., J=7,7 Гц, 1H), 6,69 (с, 1H), 6,81 (дд, J=1,0 Гц, 7,9 Гц, 1H), 7,30 (д, J=7,6 Гц, 1H), 7,49 (т, J=8,6 Гц, 1H), 7,73-7,78 (м, 2H), 8,00 (д, J=7,6 Гц, 1H).
<ПРИМЕР 68> 9b-Амино-4b-гидрокси-6,8-диизопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он
К раствору 4b,9b-дигидрокси-6,8-диизопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,30 г, 0,88 ммоль) в метиленхлориде (10 мл) добавляли оксалилхлорид (0,35 мл, 4,08 ммоль) и две капли диметилформамида с последующей реакцией при комнатной температуре в течение 3 часов при перемешивании. Концентрирование в вакууме давало 9b-хлор-4b-гидрокси-6,8-диизопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он (0,35 г, 111%).
9b-Хлор-4b-гидрокси-6,8-диизопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он (0,35 г, 0,98 ммоль) растворяли в тетрагидрофуране (10 мл), охлаждали до 5°C и подвергали реакции с 2,0 M аммиаком в изопропиловом спирте (0,98 мл, 1,96 ммоль) при комнатной температуре в течение 4 часов. Концентрирование в вакууме и очистка посредством хроматографии на колонке (этилацетат:гексан=1:2) давали указанное в заголовке соединение (0,10 г, 30%).
Точка плавления: 199-200°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,15-1,23 (м, 12H), 2,80 (кв., J=7,3 Гц, 1H), 3,06 (кв., J=7,3 Гц, 1H), 4,43 (с, 2H), 7,00 (д, J=1,4 Гц, 1H), 7,21 (д, J=1,6 Гц, 1H), 7,51 (т, J=9,0 Гц, 1H), 7,73-7,80 (м, 2H), 8,00 (д, J=6,8 Гц, 1H).
<ПРИМЕР 69> 4b-Гидрокси-9b-изоцианато-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он
К раствору 9b-амино-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,50 г, 1,69 ммоль) в толуоле (10 мл) добавляли триэтиламин (0,26 мл, 1,86 ммоль) и трифосген (0,55 г, 1,86 ммоль) с последующим нагреванием в течение 3 часов при кипячении с обратным холодильником. После концентрирования в вакууме, концентрат очищали при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения (0,40 г, 73%).
Точка плавления: 150-152°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (д, J=3,1 Гц, 3Н), 1,18 (д, J=3,1 Гц, 3Н), 2,85 (кв., J=7,4 Гц, 1Н), 6,82 (с, 1Н), 6,90 (дд, J=1,0 Гц, 7,9 Гц, 1Н), 7,51 (д, J=8,0 Гц, 1Н), 7,65 (т, J=8,6 Гц, 1Н), 7,77 (с, 1Н), 7,85-7,89 (м, 2Н), 8,01 (д, J=8,0 Гц, 1Н).
<ПРИМЕР 70> Метил-((4b,9b)-4b-гидрокси-7-изопропил-10-оксо-4b,10-дигидро-9bH-индено[1,2-b]бензофуран-9b-ил)карбамат
К раствору 9b-амино-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-а]инден-10-она (0,30 г, 1,01 ммоль) в тетрагидрофуране (10 мл) добавляли триэтиламин (0,17 мл, 1,21 ммоль) и метилхлорформиат (0,07 мл, 1,01 ммоль) с последующей реакцией при комнатной температуре в течение 3 часов при перемешивании.
После вакуумного концентрирования, концентрат экстрагировали водой и метиленхлоридом и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения (30 мг, 8%).
Точка плавления: 150-152°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,15 (д, J=3,0 Гц, 3Н), 1,17 (д, J=3,1 Гц, 3Н), 2,82 (кв., J=7,8 Гц, 1Н), 3,66 (с, 3Н), 5,54 (с, 1Н), 5,94 (с, 1Н), 6,70 (с, 1Н), 6,83 (д, J=7,5 Гц, 1Н), 7,28 (д, J=7,9 Гц, 1H), 7,55 (т, J=8,7 Гц, 1H), 7,78-7,84 (м, 2H), 8,01 (д, J=7,9 Гц, 1H).
<ПРИМЕР 71> (9b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-ил)амид пентановой кислоты
К раствору 9b-амино-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,30 г, 1,01 ммоль) в тетрагидрофуране (10 мл) добавляли триэтиламин (0,17 мл, 1,21 ммоль) и валероилхлорид (0,12 мл, 1,01 ммоль) с последующей реакцией при комнатной температуре в течение 1 часа при перемешивании.
После вакуумного концентрирования, концентрат экстрагировали водой и метиленхлоридом и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения (0,21 г, 55%).
Точка плавления: 110-112°C.
1H-ЯМР (300 МГц, CDCl3) δ 0,89 (т, J=8,0 Гц, 3H), 1,15 (д, J=3,3 Гц, 3H), 1,17 (д, J=3,1 Гц, 3H), 1,28-1,38 (м, 2H), 1,54-1,64 (м, 2H), 2,30 (т, J=9,1 Гц, 2H), 2,82 (кв., J=7,8 Гц, 1H), 5,73 (с, 1H), 6,63 (с, 1H), 6,71 (д, J=1,3 Гц, 1H), 6,81 (дд, J=1,1 Гц, 7,9 Гц, 1H), 7,24 (д, J=7,5 Гц, 1H), 7,55 (т, J=8,0 Гц, 1H), 7,77-7,84 (м, 2H), 8,01 (д, J=7,7 Гц, 1H).
<ПРИМЕР 72> N-(9b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-ил)изобутиламид
К раствору 9b-амино-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,30 г, 1,01 ммоль) в тетрагидрофуране (10 мл) добавляли триэтиламин (0,17 мл, 1,21 ммоль) и изобутирилхлорид (0,10 мл, 1,01 ммоль) с последующей реакцией при комнатной температуре в течение 1 часа при перемешивании.
После вакуумного концентрирования, концентрат экстрагировали водой и метиленхлоридом и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения (0,21 г, 54%).
Точка плавления: 109-111°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,17 (д, J=6,7 Гц, 12H), 2,51 (кв., J=7,2 Гц, 1H), 2,82 (кв., J=7,7 Гц, 1H), 5,73 (с, 1H), 6,63 (с, 1H), 6,71 (с, 1H), 6,81 (д, J=7,7 Гц, 1H), 7,24 (д, J=8,3 Гц, 1H), 7,55 (т, J=8,1 Гц, 1H), 7,76-7,86 (м, 2H), 8,00 (д, J=7,6 Гц, 1H).
<ПРИМЕР 73> N-(1-Амино-9b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-ил)ацетамид
К раствору N-(9b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-ил)ацетамида (0,30 г, 0,78 ммоль) в этаноле/воде (9 мл/0,9 мл) добавляли железо (0,30 г, 5,46 ммоль) и одну каплю конц. HCl с последующим нагреванием в течение 1 часа при кипячении с обратным холодильником. После нейтрализации раствором бикарбоната натрия, реакционную смесь концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:1) с получением указанного в заголовке соединения (0,20 г, 72%).
Точка плавления: 278-280°C.
1H-ЯМР (300 МГц, CD3OD) δ 1,15 (д, J=7,0 Гц, 6H), 2,00 (с, 3H), 2,80 (кв., J=7,0 Гц, 1H), 6,61-6,68 (м, 2H), 6,83 (д, J=7,5 Гц, 1H), 6,97 (д, J=7,2 Гц, 1H), 7,35 (д, J=7,8 Гц, 1H), 7,41 (т, J=9,6 Гц, 1H).
<ПРИМЕР 74> N-(9b-Гидрокси-6,8-диизопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-ил)ацетамид
Безводную уксусную кислоту (0,02 мл, 0,20 ммоль) добавляли к раствору 9b-амино-4b-гидрокси-6,8-диизопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (70 мг, 0,20 ммоль) в уксусной кислоте (5 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. После нейтрализации бикарбонатом натрия реакционную смесь концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:1) с получением указанного в заголовке соединения (50 мг, 66%).
Точка плавления: 217-219°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,15 (д, J=7,0 Гц, 3H), 1,19 (д, J=3,6 Гц, 3H), 1,21 (д, J=2,4 Гц, 3H), 1,23 (д, J=5,7 Гц, 3H), 2,20 (с, 3H), 2,85 (кв., J=6,7 Гц, 1H), 3,06 (кв., J=7,6 Гц, 1H), 7,05 (д, J=1,7 Гц, 1H), 7,25 (д, J=1,7 Гц, 1H), 7,56 (т, J=8,3 Гц, 1H), 7,74-7,82 (м, 2H), 7,96 (д, J=7,6 Гц, 1H).
<ПРИМЕР 75> N-(9b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-ил)-N-метилацетамид
Безводную уксусную кислоту (0,03 мл, 0,32 ммоль) добавляли к раствору 4b-гидрокси-7-изопропил-9b-метиламино-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,10 г, 0,32 ммоль) в уксусной кислоте (5 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. После нейтрализации бикарбонатом натрия реакционную смесь концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:1) с получением указанного в заголовке соединения (70 мг, 62%).
Точка плавления: 216-217°C.
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,7 Гц, 6H), 2,13 (с, 3H), 2,75-2,90 (м, 3H), 6,69 (с, 1H), 6,84 (д, J=7,6 Гц, 1H), 7,34 (д, J=8,0 Гц, 1H), 7,44 (т, J=8,4 Гц, 1H), 7,64 (т, J=8,3 Гц, 1H), 7,71 (д, J=7,6 Гц, 1H), 7,80 (д, J=7,6 Гц, 1H).
<ПРИМЕР 76> 1-(4b-Гидрокси-7-изопропил-1-нитро-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-a]инден-9b-ил)-3-изопропилмочевина
Трифосген (0,28 г, 0,97 ммоль) добавляли к раствору 9b-амино-4b-гидрокси-7-изопропил-1-нитро-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,30 г, 0,88 ммоль) в тетрагидрофуране (10 мл) и перемешивали при комнатной температуре в течение 2 часов. Концентрирование в вакууме и очистка посредством хроматографии на колонке (этилацетат:гексан=1:2) давали 4b-гидрокси-9b-изоцианато-7-изопропил-1-нитро-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он (0,20 г, 62%).
4b-Гидрокси-9b-изоцианато-7-изопропил-1-нитро-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он (0,20 г, 0,54 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли к триэтиламину (0,18 мл, 1,30 ммоль) и изопропиламину (0,05 мл, 0,65 ммоль) и нагревали в течение 48 часов при кипячении с обратным холодильником.
После вакуумного концентрирования, концентрат экстрагировали водой и метиленхлоридом и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:1) с получением указанного в заголовке соединения (40 мг, 17%).
Точка плавления: 228-229°C.
1H-ЯМР (300 МГц, (CD3)2CO-d6) δ 1,00 (д, J=6,8 Гц, 3H), 1,14 (д, J=4,5 Гц, 3H), 1,17 (д, J=4,5 Гц, 3H), 1,50 (д, J=6,6 Гц, 3H), 2,78-2,88 (м, 1H), 3,87 (кв., J=7,2 Гц, 1H), 5,84 (с, 1H), 6,34 (с, 1H), 6,61 (с, 1H), 6,66 (с, 1H), 6,84 (д, J=7,9 Гц, 1H), 7,46 (д, J=7,9 Гц, 1H), 7,77 (т, J=8,5 Гц, 1H), 8,08 (д, J=7,2 Гц, 1H), 8,19 (д, J=7,9 Гц, 1H).
<ПРИМЕР 77> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-a]инден-9b-ил)изобутиламид
Железо (0,09 г, 1,70 ммоль) и одну каплю конц. HCl добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-a]инден-9b-ил)изобутиламида (100 мг, 0,24 ммоль) в этаноле/воде (3 мл/0,3 мл) и нагревали в течение 1 часа при кипячении с обратным холодильником. После нейтрализации бикарбонатом натрия, реакционную смесь концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:1) с получением указанного в заголовке соединения (60 мг, 66%).
Точка плавления: 141-143°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,17 (д, J=6,7 Гц, 12H), 2,51 (кв., J=7,2 Гц, 1H), 2,83 (кв., J=7,7 Гц, 1H), 5,60 (с, 2H), 6,67-6,72 (м, 1H), 6,78-6,82 (м, 1H), 6,86-6,91 (м, 1H), 7,16 (т, J=7,7 Гц, 1H), 7,22 (д, J=6,7 Гц, 1H), 7,46 (т, J=8,8 Гц, 1H).
<ПРИМЕР 78> (1-Амино-4b-гидрокси-7-изопропил-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-a]инден-9b-ил)амид пентановой кислоты
К раствору (4b-гидрокси-7-изопропил-1-нитро-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-a]инден-9b-ил)амида пентановой кислоты (100 мг, 0,23 ммоль) в этаноле/воде (3 мл:0,3 мл) добавляли железо (0,09 г, 1,64 ммоль). После добавления одной капли конц. HCl раствор нагревали в течение 1 часа при кипячении с обратным холодильником. После нейтрализации бикарбонатом натрия, реакционную смесь концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:1) с получением указанного в заголовке соединения (70 мг, 77%).
Точка плавления: 165-168°C.
1H-ЯМР (300 МГц, CD3OD) δ 0,93 (т, J=8,1 Гц, 3H), 1,17 (д, J=1,0 Гц, 3H), 1,20 (д, J=1,0 Гц, 3H), 1,35-1,44 (м, 2H), 1,52-1,63 (м, 2H), 2,28 (т, J=8,6 Гц, 2H), 2,84 (кв., J=7,1 Гц, 1H), 6,65-6,72 (м, 2H), 6,86 (дд, J=1,1 Гц, 7,9 Гц, 1H), 6,99 (д, J=7,4 Гц, 1H), 7,37 (д, J=7,7 Гц, 1H), 7,43 (т, J=8,6 Гц, 1H).
<ПРИМЕР 79> 9b-Гидрокси-4b-(2-гидроксиэтокси)-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Йод (1,71 г, 6,74 ммоль) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (1 г, 3,37 ммоль) в этиленгликоле (20 мл) и перемешивали при комнатной температуре в течение 3 часов. После того, как раствор выливали в воду (100 мл), раствор экстрагировали этилацетатом и реакционную смесь очищали при помощи хроматографии на колонке с силикагелем (40% этилацетат в гексане) с получением указанного в заголовке соединения. 0,40 г (39%).
Точка плавления: 100-105°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,12-1,25 (м, 6H, CH3), 2,51 (с, 1H, OH, обменивается с D2O) 2,82-2,86 (септ., 1H, CH), 3,83 (т, 2H, CH2) 4,04-4,15 (м, 3H, CH2 и OH, обменивается с D2O) 6,72 (с, 1H, ArH) 6,87 (д, J=7,8 Гц, 1H, ArH) 7,42 (д, J=7,8 Гц, 1H, ArH) 7,57 (т, J=7,5 Гц, 1H, ArH) 7,92 (т, J=7,5 Гц, 2H, ArH) 7,94 (д, J=7,8 Гц, 2H, ArH). MS(EI): 340.
<ПРИМЕР 80> 4b,9b-Дигидрокси-7-изопропил-1-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Раствор 4-нитро-2,3-дигидро-1H-инден-1-она (1,50 г, 8,4 ммоль) в 1,4-диоксане (15 мл) и ледяной уксусной кислоте (3,5 мл) добавляли к диоксиду цезия (1,87 г, 16,9 ммоль) и кипятили с обратным холодильником при 110°C в течение 2 часов. После фильтрации, фильтрат концентрировали, смешивали с водой и экстрагировали этилацетатом. Реакционную смесь концентрировали с получением 2,2-дигидрокси-4-нитро-2H-инден-1,3-диона (600 мг).
В ледяной уксусной кислоте (5 мл) 2,2-дигидрокси-4-нитро-2H-инден-1,3-дион (0,50 г, 2,24 ммоль) и 3-изопропилфенол (0,37 мл, 2,7 ммоль) кипятили с обратным холодильником в течение 2 часов. Реакционную смесь концентрировали и очищали при помощи хроматографии на колонке с силикагелем (20% этилацетат в гексане) с получением указанного в заголовке соединения в виде белого твердого вещества. 0,30 г (39%).
Точка плавления: 186-188°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,15-1,18 (м, 6H, CH3) 2,81-2,86 (септ., 1H, CH) 3,53 (с, 1H, OH) 6,24 (с, 1H, OH) 6,71 (с, 1H, ArH) 6,92 (д, J=7,9 Гц, 1H, ArH) 7,48 (д, J=7,9 Гц, 1H, ArH) 7,79 (т, J=8,6 Гц, 1H, ArH) 8,19 (д, J=7,7 Гц, 1H, ArH) 8,50 (д, J=7,1 Гц, 1H, ArH). MS(EI): 341.
<ПРИМЕР 81> 4b,9b-Дигидрокси-7-изопропил-2,3-диметокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
К раствору 5,6-диметокси-2,3-дигидро-1H-инден-1-она (1,00 г, 5,2 ммоль) в 1,4-диоксане (20 мл) и ледяной уксусной кислоте (2 мл) добавляли диоксид цезия (1,16 г, 10,4 ммоль) с последующей реакцией при 110°C в течение 2 часов при перемешивании. Реакционную смесь концентрировали, разбавляли в воде и экстрагировали этилацетатом с получением 0,80 г 2,2-дигидрокси-5,6-диметокси-2H-инден-1,3-диона.
2,2-Дигидрокси-5,6-диметокси-2H-инден-1,3-дион (0,55 г, 2,30 ммоль) в ледяной уксусной кислоте (6 мл) и 3-изопропилфеноле (1,10 мл, 2,76 ммоль) кипятили с обратным холодильником в течение 2 часов. Концентрированную реакционную смесь очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат в гексане) с получением указанного в заголовке соединения. Белое вещество 0,22 г (57%).
Точка плавления: 127-129°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,81-2,86 (септ., 1H, CH) 3,71 (с, 1H, OH) 3,9 (с, 3H, CH3) 4,1 (с, 3H, CH3) 4,6 (с, 1H, OH) 6,72 (с, 1H, ArH) 6,86 (д, J=7,8 Гц, 1H, ArH) 7,14 (с, 1H, ArH) 7,37-7,43 (м, 2H, ArH). MS(EI): 356.
<ПРИМЕР 82> 4b,9b-Дигидрокси-7-изопропил-2,3-диметил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
К раствору 5,6-диметил-2,3-дигидро-1H-инден-1-она (0,50 г, 3,12 ммоль) в 1,4-диоксане (10 мл) и ледяной уксусной кислоте (1 мл) добавляли диоксид цезия (0,69 г, 6,24 ммоль) с последующей реакцией при 110°C в течение 2 часов при перемешивании. Реакционную смесь фильтровали через слой целита, и полученный органический раствор концентрировали и очищали при помощи хроматографии на колонке с силикагелем (40% этилацетат в гексане) с получением 2,2-дигидрокси-5,6-диметил-2H-инден-1,3-диона. 0,40 г (63%).
2,2-Дигидрокси-5,6-диметил-2H-инден-1,3-дион (0,35 г, 1,7 ммоль) и 3-изопропилфенол (0,28 мл, 2,03 ммоль) растворяли в ледяной уксусной кислоте (4 мл) и кипятили с обратным холодильником в течение 4 часов. Концентрированную реакционную смесь очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат в гексане) с получением указанного в заголовке соединения. Белое вещество 0,39 г (71%).
Точка плавления: 138-140°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (д, J=6,9 Гц, 6H, CH3) 2,30 (с, 3H, CH3) 2,40 (с, 3H, CH3) 2,77-2,86 (септ., 1H, CH) 3,99 (с, 1H, OH) 4,73 (с, 1H, OH) 6,70 (с, 1H, ArH) 6,81 (д, J=7,9 Гц, 1H, ArH) 7,39 (д, J=7,9 Гц, 1H, ArH) 7,53 (с, 1H, ArH) 7,8 (с, 1H, ArH). MS(EI): 324.
<ПРИМЕР 83> Смесь 6:4 (4bS,9bS)-2-бром-4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она и (4bS,9bS)-3-бром-4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она
К раствору 5-бром-2,3-дигидро-1Н-инден-1-она (0,81 г, 3,83 ммоль) в 1,4-диоксане (15 мл) и ледяной уксусной кислоте (1,5 мл) добавляли диоксид цезия (0,94 г, 8,44 ммоль) с последующей реакцией при 110°C в течение 2,5 часов при перемешивании. Реакционную смесь фильтровали через слой из целита, фильтрат концентрировали и очищали при помощи хроматографии на колонке с силикагелем (этилацетат:гексан=1:1) с получением 5-бром-2,2-дигидрокси-2Н-инден-1,3-диона 0,80 г.
5-Бром-2,2-дигидрокси-2Н-инден-1,3-дион (0,70 г, 2,7 ммоль) и 3-изопропилфенол (0,45 мл, 3,3 ммоль) растворяли в ледяной уксусной кислоте (8 мл) и кипятили с обратным холодильником в течение 4 часов. Концентрированную реакционную смесь очищали при помощи хроматографии на колонке с силикагелем (этилацетат:гексан=1:2) с получением указанного в заголовке соединения в виде смеси 6:4. Белое вещество 760 мг (75%).
Точка плавления: 160-162°C.
1Н-ЯМР (300 МГц, CDCl3) δ 1,12 (м, 6Н, СН3) 2,72-2,81 (септ., 1Н, СН) 5,12 (с, 1Н, ОН) 5,60 (с, 1Н, ОН) 6,63 (д, J=5,7 Гц, 1Н, ArH) 6,75 (д, J=7,8 Гц, 1Н, ArH) 7,32 (д, J=7,8 Гц, 1Н, ArH) 7,49-7,59 (м, 1,3Н, ArH) 7,76-7,81 (м, 1Н, ArH) 8,11 (с, 0,6Н, ArH). MS(EI): 341.
<ПРИМЕР 84> Индено[2,1-а]инден-4b,9b(5Н,10Н)-диол
Раствор 2,3-дигидро-2-(4-изопропил-2-метоксифенил)-1,3-диоксо-1Н-инден-2-илкарбамата (120 мг, 0,32 ммоль) в дихлорметане (5 мл) добавляли при -78°C в течение 5 мин к раствору трибромида бора (1,0 M, 0,71 мл, 0,71 ммоль) в дихлорметане (3 мл) и перемешивали при -10°C в течение 3 часов. Реакционную смесь выливали в воду, экстрагировали дихлорметаном и очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат в гексане) с получением указанного в заголовке соединения. 90 мг (78%).
Точка плавления: 161-163°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,15-1,18 (м, 6H, CH3) 2,82 (септ., J=6,9 Гц, 1H, CH) 3,64 (с, 3H, OCH3) 5,49 (с, 1H, OH) 5,93 (с, 1H, NH) 6,70 (с, 1H, ArH) 6,82-6,85 (м, 1H, ArH) 7,25-7,29 (м, 1H, ArH) 7,53-7,59 (м, 1H, ArH) 7,79-7,84 (м, 2H, ArH) 8,00-8,03 (м, 1H, ArH). MS(EI): 353.
<ПРИМЕР 85> Изопропил-(4bS,9bS)-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-илкарбамат
Трибромид бора (1,0 M в дихлорметане, 0,55 мл, 0,55 ммоль) растворяли в дихлорметане (3 мл) и охлаждали до -78°C. К этому раствору в течение 5 мин по каплям добавляли изопропил-2-(4-изопропил-2-метоксифенил)-1,3-диоксо-2,3-дигидро-1H-инден-2-илкарбамат (100 мг, 0,25 ммоль) в дихлорметане (5 мл) и перемешивали при 0°C в течение 4 часов. Реакционную смесь выливали в воду, экстрагировали дихлорметаном и очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат в гексане) с получением указанного в заголовке соединения. 45 мг (47%).
Точка плавления: 114-116°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,15-1,18 (м, 12H, CH3) 2,82 (септ., J=6,9 Гц, 1H, CH) 4,83 (септ., J=6,3 Гц, 1H, CH) 5,83 (с, 1H, NH) 6,69 (д, J=1,5 Гц, 1H, ArH) 6,83 (дд, J=1,5 Гц, J=7,8 Гц, 1H, ArH) 7,29 (д, J=7,8 Гц, 1H, ArH) 7,52-7,58 (м, 1H, ArH) 7,78-7,84 (м, 2H, ArH) 8,01 (д, J=7,5 Гц, 1H, ArH). MS(EI): 395.
<ПРИМЕР 86> Этил-(4bS,9bS)-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-илкарбамат
Трибромид бора (1,0 M в дихлорметане, 4,3 мл, 4,3 ммоль) растворяли в дихлорметане (15 мл) и охлаждали до -78°C. К этому раствору по каплям в течение 10 мин добавляли этил-2-(4-изопропил-2-метоксифенил)-1,3-диоксо-2,3-дигидро-1H-инден-2-илкарбамат (750 мг, 1,96 ммоль) в дихлорметане (20 мл) и перемешивали при 0°C в течение 4 часов. Реакционную смесь выливали в воду, экстрагировали дихлорметаном и очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат в гексане) с получением указанного в заголовке соединения. 500 мг (70%).
Точка плавления: 115-118°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,14-1,17 (м, 9H, CH3) 2,81 (септ., J=6,9 Гц, 1H, CH) 4,03-4,09 (м, 2H, OCH2) 5,67 (уш., 1H, OH) 5,92 (уш., 1H, NH) 6,68 (с, 1H, ArH) 6,83 (дд, J=1,5 Гц, J=8,1 Гц, 1H, ArH) 7,29 (д, J=8,1 Гц, 1H, ArH) 7,51-7,56 (м, 1H, ArH) 7,76-7,81 (м, 2H, ArH) 8,00 (д, J=7,5 Гц, 1H, ArH). MS(EI): 367.
<ПРИМЕР 87> N,N′-((4bS,9bS)-4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-1,9b-диил)диацетамид
Трибромид бора (1,0 M в дихлорметане, 1,32 мл, 1,32 ммоль) растворяли в дихлорметане (5 мл) и охлаждали до -78°C. К этому раствору по каплям в течение 10 мин добавляли N,N′-(2-(4-изопропил-2-метоксифенил)-1,3-диоксо-2,3-дигидро-1H-инден-2,4-диил)диацетамид (200 мг, 0,49 ммоль) в дихлорметане (10 мл) и перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь выливали в воду, экстрагировали дихлорметаном и очищали при помощи хроматографии на колонке с силикагелем (этилацетат:гексан=2:1) с получением указанного в заголовке соединения. 130 мг (67%).
Точка плавления: 205-207°C.
1H-ЯМР (300 МГц, CDCl3) δ 1,15 (д, J=6,9 Гц, 6H, CH3) 1,98 (с, 3H, NAc) 2,19 (с, 3H, NAc) 2,8 (септ., J=6,9 Гц, 1H, CH) 5,61 (с, 1H, OH) 6,61 (с, 1H, NH) 6,68 (д, J=1,2 Гц, 1H, ArH) 6,82 (дд, J=1,2 Гц, J=7,8 Гц, 1H, ArH) 7,28 (д, J=7,8 Гц, 1H, ArH) 7,55 (дд, J=0,6 Гц, J=7,8 Гц, 1H, ArH) 7,66-7,72 (м, 1H, ArH) 8,50 (д, J=8,4 Гц, 1H, ArH) 10,03 (с, 1H, NH). MS(EI): 394.
Стадия 2: 4b,5,9b,10-тетрагидроиндено[2,1-a]инден-4b-ол
Хлорид хрома (2,50 г, 16,00 ммоль) и хлорид никеля (130 мг, 1 ммоль) растворяли в диметилформамиде (25 мл) и перемешивали при комнатной температуре в течение 10 мин. Полученный раствор подвергали реакции с раствором 1-(2-бромбензил)-1H-инден-2(3H)-она (2,50 г, 0,83 ммоль) в диметилформамиде (25 мл) при 120-125°C в течение 18 часов. Реакционную смесь выливали в воду, экстрагировали диэтиловым эфиром и очищали при помощи хроматографии на колонке с силикагелем (этилацетат:гексан=1:10) с получением указанного в заголовке соединения. 0,30 г (16%).
1H-ЯМР (300 МГц, CDCl3) δ 2,05 (с, 1H, OH) 3,05 (дд, J=1,5 Гц, J=16,2 Гц, 1H) 3,56 (д, J=2,4 Гц, 2H) 3,59-3,67 (м, 1H, CH) 3,87 (д, J=7,8 Гц, 1H) 7,11-7,26 (м, 7H, ArH) 7,51-7,53 (м, 1H, ArH).
Стадия 3: 5,10-Дигидроиндено[2,1-a]инден
4b,5,9b,10-Тетрагидроиндено[2,1-a]инден-4b-ол (0,10 г, 0,82 ммоль) растворяли в бензоле (5 мл) и добавляли небольшое количество паратолуол сульфониловой кислоты при комнатной температуре. Реакционную смесь кипятили с обратным холодильником при 85°C в течение 12 часов до полного выпаривания бензола, и остаток разделяли, используя колоночную хроматографию на силикагеле (2% этилацетат в гексане), с получением указанного в заголовке соединения в виде твердого вещества. 45 мг (50%).
1H-ЯМР (300 МГц, CDCl3) δ 3,63 (с, 4H, CH2) 7,16-7,34 (м, 4H, ArH) 7,42-7,53 (м, 4H, ArH).
Стадия 4: (4b,9b)-4b,5,9b,10-Тетрагидроиндено[2,1-a]инден-4b,9b-диол
Тетраоксид осмия (0,02 мл, 0,002 ммоль, 2,5% в трет-бутаноле), ферроцианид калия (193 мг, 0,6 ммоль), карбонат калия (81 мг, 0,6 ммоль) и хинолидин (2,2 мг, 0,02 ммоль) смешивали в смеси трет-бутанола и воды (1:1, 3 мл), к которой затем добавляли раствор метансульфонамида (19 мг, 0,2 ммоль) и 5,10-дигидроиндено[2,1-a]индена (40 мг, 0,2 ммоль) в 1 мл смеси трет-бутанола и воды (1:1).
Полученную смесь перемешивали в течение 4,5 часов при комнатной температуре, а затем добавляли сульфит натрия (0,2 г) и перемешивали в течение дополнительных 15 мин. Реакционную смесь выливали в воду, экстрагировали диэтиловым эфиром, концентрировали и очищали при помощи хроматографии на колонке с силикагелем (этилацетат:гексан=1:2) с получением указанного в заголовке соединения. Белое вещество 25 мг (54%).
Точка плавления: 157-159°C.
1H-ЯМР (300 МГц, CDCl3) δ 2,89 (с, 2H, OH) 3,40 (кв., J=16,8 Гц, J=8,4 Гц, 4H, CH2) 7,13-7,28 (м, 6H, ArH) 7,50-7,53 (м, 2H, ArH). MS(EI): 238.
<ПРИМЕР 88> O-Метилоксим 4b,9b-дигидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-она
К раствору 4b,9b-дигидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-она (1,00 г, 3,37 ммоль) в безводном пиридине (1 мл) добавляли гидрохлорид O-метил гидроксиламина (564 мг, 6,75 ммоль) с последующей реакцией при комнатной температуре в течение 3 часов при перемешивании. После удаления растворителя пиридина, проводили экстракцию DCM и водой, и концентрированный органический слой разделяли и очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат, смешанный с 30% гексаном) с получением указанного в заголовке соединения. 70 мг (30%).
1H-ЯМР (300 МГц, ДМСО) δ 1,17 (д, J=6,9 Гц, 6H, CH3) 2,79 (септ., J=6,9 Гц, 1H, CH) 3,9 (с, 3H, N-OCH3) 6,44 (с, 1H, ArH/OH) 6,64 (с, 1H, ArH) 6,75 (д, J=7,8 Гц, 1H, ArH) 7,54 (д, J=7,8 Гц, 1H, ArH) 7,71-7,76 (м, 1H, ArH) 7,84-7,88 (м, 2H, ArH) 8,40 (д, J=8,1 Гц, 1H, ArH) 9,25 (с, 1H, OH/NH).
<ПРИМЕР 89> 9b-Бутириламино-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-иловый эфир масляной кислоты
К раствору 9b-амино-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,20 г, 0,67 ммоль) в безводном метиленхлориде (10 мл) добавляли триэтиламин (0,20 г, 2,01 ммоль) и бутирилхлорид (0,18 г, 1,69 ммоль) при комнатной температуре с последующей реакцией в течение 3 часов при перемешивании. Продукт реакции концентрировали и экстрагировали этилацетатом, после чего концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:2) с получением указанного в заголовке соединения. 50 мг (17%).
1H-ЯМР (300 МГц, CDCl3) δ 0,90-1,00 (м, 6H, CH3) 1,18 (дд, J=2,7, 6,9 Гц, 6H, CH3) 1,50-1,72 (м, 4H, CH2) 2,02-2,30 (м, 2H, CH2) 2,33-2,54 (м, 2H, CH2) 2,79-2,88 (м, 1H, CH) 6,00 (с, 1H, NH) 6,67 (с, 1H, ArH) 6,90 (д, J=8,1 Гц, 1H, ArH) 7,44 (д, J=7,8 Гц, 1H, ArH) 7,56 (т, J=7,5 Гц, 1H, ArH) 7,76 (т, J=7,5 Гц, 1H, ArH) 7,85 (д, J=7,8 Гц, 1H, ArH) 7,93 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 90> [2-(2-Гидрокси-4-изопропилфенил)-1,3-диоксо-индан-2-ил]амид октановой кислоты
К раствору 9b-амино-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,20 г, 0,67 ммоль) в безводном метиленхлориде (10 мл) добавляли триэтиламин (0,20 г, 2,01 ммоль) и октаноилхлорид (0,27 г, 1,67 ммоль) с последующей реакцией при комнатной температуре в течение 28 часов при перемешивании. Продукт реакции концентрировали и экстрагировали этилацетатом, после чего концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:6 до 1:4) с получением указанного в заголовке соединения в виде сиропа. 0,13 г (45%).
1H-ЯМР (300 МГц, CDCl3) δ 0,84-0,88 (м, 3H, CH3) 1,17 (дд, J=3,0, 6,9 Гц, 6H, CH3) 1,26-1,29 (м, 12H, CH2) 1,58-1,65 (м, 4H, CH2) 2,31 (т, J=7,2 Гц, 2H, CH2) 2,77-2,86 (м, 1H, CH) 5,71 (с, 1H, OH) 6,62 (с, 1H, NH) 6,71 (с, 1H, ArH) 6,81 (д, J=7,8 Гц, 1H, ArH) 7,24 (д, J=7,8 Гц, 1H, ArH) 7,55 (т, J=7,8 Гц, 1H, ArH) 7,78-7,84 (м, 2H, ArH) 8,00 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 91> 9b-Гексаноиламино-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-иловый эфир гексановой кислоты
К раствору 9b-амино-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,20 г, 0,67 ммоль) в безводном метиленхлориде (10 мл) добавляли триэтиламин (0,20 г, 2,01 ммоль) и гексаноилхлорид (0,22 г, 1,69 ммоль) с последующей реакцией в течение 5 часов при комнатной температуре при перемешивании. Продукт реакции концентрировали и экстрагировали этилацетатом, после чего концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:6 до 1:4) с получением указанного в заголовке соединения. 15 мг (4%).
1H-ЯМР (300 МГц, CDCl3) δ 0,79-0,89 (м, 6H, CH3) 1,17 (дд, J=2,7, 6,9 Гц, 6H, CH3) 1,22-1,33 (м, 8H, CH2) 1,40-1,65 (м, 4H, CH2) 2,04-2,55 (м, 4H, CH2) 2,82-2,91 (м, 1H, CH) 6,00 (с, 1H, NH) 6,67 (с, 1H, ArH) 6,91 (д, J=8,1 Гц, 1H, ArH) 7,44 (д, J=8,1 Гц, 1H, ArH) 7,56 (т, J=7,5 Гц, 1H, ArH) 7,74-7,89 (м, 2H, ArH) 7,93 (д, J=7,5 Гц, 1H, ArH).
<ПРИМЕР 92> 9b-Гептаноиламино-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-иловый эфир гептановой кислоты
Триэтиламин (0,20 г, 2,01 ммоль) и гептаноилхлорид (0,25 г, 1,69 ммоль) добавляли при комнатной температуре к раствору 9b-амино-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,20 г, 0,67 ммоль) в безводном метиленхлориде (10 мл) и перемешивали в течение 3 часов. Продукт реакции концентрировали и экстрагировали этилацетатом, после чего концентрированный органический слой очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:6 до 1:4) с получением указанного в заголовке соединения. 0,14 г (40%).
1H-ЯМР (300 МГц, CDCl3) δ 0,84-0,88 (м, 6H, CH3) 1,17 (дд, J=2,4, 6,9 Гц, 6H, CH3) 1,25-1,44 (м, 14H, CH2) 1,59-1,64 (м, 2H, CH2) 2,06-2,52 (м, 4H, CH2) 2,79-2,86 (м, 1H, CH) 5,98 (с, 1H, NH) 6,74 (с, 1H, ArH) 6,91 (д, J=7,8 Гц, 1H, ArH) 7,44 (д, J=8,1 Гц, 1H, ArH) 7,56 (т, J=7,5 Гц, 1H, ArH) 7,76 (т, J=7,5 Гц, 1H, ArH) 7,85 (д, J=7,8 Гц, 1H, ArH) 7,92 (д, J=7,5 Гц, 1H, ArH).
<ПРИМЕР 93> N-((4bS,9bS)-1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)октанамид
N-(4b-Гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)октанамид (130 мг, 0,28 ммоль) растворяли в этаноле:воде (9:1, 13 мл), добавляли порошок железа (118 мг, 2,12 ммоль) и конц. HCl (3 капли) и нагревали в течение 3 часов при кипячении с обратным холодильником. Затем реакционную смесь фильтровали, фильтрат концентрировали в вакууме, отделяли и очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат, 1% триэтиламин в гексане) с получением указанного в заголовке соединения. 115 мг (96%).
1H-ЯМР (300 МГц, CDCl3) δ 0,86 (т, J=6,6 Гц, 3H, CH3) 1,17 (д, J=6,9 Гц, 6H, CH3) 1,25 (м, 8H, CH2) 1,59 (т, J=6,9 Гц, 2H, CH2) 2,51 (т, J=6,9 Гц, 2H, CH2) 2,81 (септ., J=6,9 Гц, 1H, CH) 5,66 (уш., 2H, NH2) 6,62 (м, 2H, ArH) 6,73-6,79 (м, 2H, ArH) 7,13-7,16 (м, 1H, ArH) 7,39-7,45 (т, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 94> (4bR,9bS)-1-Амино-7-изопропил-10-оксо-9b-пропионамидо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b-илпропионат
(4bR,9bS)-7-Изопропил-1-нитро-10-оксо-9b-пропионамидо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илпропионат (130 мг, 0,29 ммоль) растворяли в этаноле:воде (9:1, 10 мл), добавляли порошок железа (122 мг, 2,18 ммоль) и конц. HCl (3 капли) и нагревали в течение 1 часа при кипячении с обратным холодильником. Затем реакционную смесь фильтровали, фильтрат концентрировали в вакууме, отделяли и очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат, 1% триэтиламин в гексане) с получением указанного в заголовке соединения. 60 мг (50%).
1H-ЯМР (300 МГц, CDCl3) δ 1,05-1,20 (м, 12H, CH3) 2,10-2,51 (м, 4H, CH2) 2,85 (септ., J=6,9 Гц, 1H, CH) 4,41 (уш., 2H, NH2) 5,99 (уш., 1H, NH) 6,73 (с, 1H, ArH) 6,89-6,96 (м, 2H, ArH) 7,22-7,34 (м, 2H, ArH) 7,43 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 95> (4bR,9bS)-1-Амино-9b-бутирамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b-илбутират
(4bR,9bS)-9b-Бутирамидо-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илбутират (220 мг, 0,46 ммоль) растворяли в этаноле:воде (9:1, 10 мл), добавляли порошок железа (195 мг, 3,48 ммоль) и конц. HCl (5 капель), нагревали в течение 1 часа при кипячении с обратным холодильником. Затем реакционную смесь фильтровали, фильтрат концентрировали в вакууме, отделяли и очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат, 1% триэтиламин в гексане) с получением указанного в заголовке соединения. 100 мг (49%).
1H-ЯМР (300 МГц, CDCl3) δ 0,90-0,99 (м, 6H, CH3) 1,16-1,19 (м, 6H, CH3) 1,50-1,77 (м, 4H, CH2) 2,04-2,50 (м, 4H, CH2) 2,85 (септ., J=6,9 Гц, 1H, CH) 4,40 (уш., 2H, NH2) 5,97 (уш., 1H, NH) 6,71 (с, 1H, ArH) 6,71-6,97 (м, 2H, ArH) 7,22-7,35 (м, 2H, ArH) 7,41 (д, J=8,1 Гц, 1H, ArH).
<ПРИМЕР 96> 1-Амино-7-изопропил-10-оксо-9b-пентанамидо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илпентаноат
К раствору 7-изопропил-1-нитро-10-оксо-9b-пентанамидо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илпентаноата (0,287 г, 0,55 ммоль) в этаноле (10 мл) добавляли 1 мл воды, порошок железа (0,22 г, 4,01 ммоль) и конц. HCl (0,05 мл) с последующим нагреванием в течение 1,5 часов при кипячении с обратным холодильником. Затем реакционную смесь фильтровали, фильтрат концентрировали в вакууме, отделяли и очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:2) с получением указанного в заголовке соединения. 0,12 г (46%).
1H-ЯМР (300 МГц, CDCl3) δ 0,89 (м, 6H, CH3) 1,17 (дд, J=2,4, 6,9 Гц, 6H, CH3) 1,23-1,48 (м, 4H, CH2) 1,50-1,65 (м, 4H, CH2) 2,04-2,37 (м, 2H, CH2) 2,40-2,54 (м, 2H, CH2) 2,80-2,89 (м, 1H, CH) 4,39 (с, 2H, NH2) 5,91 (с, 1H, NH) 6,71 (с, 1H, ArH) 6,88-6,96 (м, 2H, ArH) 7,22-7,34 (м, 2H, ArH) 7,46 (д, J=8,1 Гц, 1H, ArH).
<ПРИМЕР 97> 1-Амино-9b-гексанамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илгексаноат
9b-Гексанамидо-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илгексаноат (0,17 г, 0,32 ммоль) растворяли в этаноле (15 мл), добавляли 1,5 мл воды, порошок железа (0,13 г, 2,3 ммоль) и конц. HCl (0,05 мл) и нагревали в течение 1 часа при кипячении с обратным холодильником. Затем реакционную смесь фильтровали, фильтрат концентрировали в вакууме, отделяли и очищали при помощи хроматографии на колонке (этилацетат:гексан = 1:6 до 1:4) с получением указанного в заголовке соединения. 0,15 г (90%).
1H-ЯМР (300 МГц, CDCl3) δ 0,77-0,93 (м, 6H, CH3) 1,20 (дд, J=3,6, 6,9 Гц, 6H, CH3) 1,23-1,39 (м, 8H, CH2) 1,50-1,62 (м, 4H, CH2) 2,04-2,51 (м, 4H, CH2) 2,80-2,86 (м, 1H, CH) 4,40 (с, 2H, NH2) 5,97 (с, 1H, NH) 6,72 (с, 1H, ArH) 6,88-7,06 (м, 2H, ArH) 7,22-7,34 (м, 2H, ArH) 7,43 (д, J=7,6 Гц, 1H, ArH).
<ПРИМЕР 98> (4bS,9bS)-4b-Гидрокси-7-изопропил-9b-метокси-4bH-индено[1,2-b]бензофуран-10(9bH)-он
Безводный метанол (0,1 мл) медленно добавляли при 0°C в течение 5 минут к раствору (4bS,9bS)-9b-хлор-4b-гидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (0,30 г, 0,95 ммоль) в безводном ТГФ (10 мл). После реакции в течение 3 часов, реакционную смесь концентрировали, отделяли и очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат в 20% гексане) с получением указанного в заголовке соединения. 50 мг (17%).
1H-ЯМР (300 МГц, CDCl3) δ 1,18 (дд, J=2,4 Гц, J=6,9 Гц, 6H, CH3) 2,84 (септ., J=6,9 Гц, 1H, CH) 3,70 (с, 3H, OCH3) 4,51 (с, 1H, OH) 6,72 (с, 1H, ArH) 6,85 (дд, J=1,2 Гц, J=7,8 Гц, 1H, ArH) 7,49 (д, J=7,8 Гц, 1H, ArH) 7,52-7,58 (м, 1H, ArH) 7,77-7,82 (м, 2H, ArH) 7,98 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 99> 1-Амино-9b-гептанамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илгептаноат
9b-Гептанамидо-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илгептаноат (0,28 г, 0,50 ммоль) растворяли в этаноле (10 мл), добавляли 1 мл воды, порошок железа (0,20 г, 3,7 ммоль) и конц. HCl (0,05 мл) и нагревали в течение 1 часа при кипячении с обратным холодильником. Затем реакционную смесь фильтровали, фильтрат концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан = от 1:6 до 1:4) с получением указанного в заголовке соединения. 0,15 г (90%).
1H-ЯМР (300 МГц, CDCl3) δ 0,79-0,97 (м, 6H, CH3) 1,19 (дд, J=3,7, 6,9 Гц, 6H, CH3) 1,25-1,39 (м, 12H, CH2) 1,59-1,68 (м, 2H, CH2) 2,08-2,30 (м, 4H, CH2) 2,36-2,54 (м, 2H, CH2) 2,84-2,89 (м, 1H, CH) 4,42 (с, 2H, NH2) 5,98 (с, 1H, NH) 6,74 (с, 1H, ArH) 6,91-6,98 (м, 2H, ArH) 7,24-7,37 (м, 2H, ArH) 7,43 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 100> 1-((4bS,9bS)-7-Изопропил-4b-метокси-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)мочевина
Концентрированную HCl (1 мл) добавляли к раствору (4bS,9bR)-7-изопропил-10H-4b,9b-(эпиминометаноимино)индено[1,2-b]бензофуран-10,12-диона (0,20 г, 0,625 ммоль) в метаноле (10 мл) и перемешивали при комнатной температуре. После реакции в течение 2,5 часов реакционную смесь концентрировали, экстрагировали этилацетатом и водой, а затем досуха концентрировали в вакууме. Очищали посредством хроматографии на колонке с силикагелем (5% MeOH в ДХМ, 1% TEA) с получением указанного в заголовке соединения. (80 мг, 38%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,9 Гц, 6H, CH3) 2,75 (септ., J=6,9 Гц, 1H, CH) 3,68 (с, 3H, CH3) 6,50 (дд, J=1,2 Гц, J=7,8 Гц, 1H, ArH) 6,68 (с, 1H, ArH) 6,76 (д, J=7,8 Гц, 1H, ArH) 7,35-7,53 (м, 3H, ArH) 7,83 (д, J=7,5 Гц, 1H, ArH).
<ПРИМЕР 101> 1-((4bS,9bS)-4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-метилмочевина
К раствору (4bS,9bS)-9b-Амино-4b-гидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (0,10 г, 0,34 ммоль) в безводном ТГФ (2 мл) добавляли метилизоцианат (32 мкл, 0,51 ммоль). После реакции в течение 1 часа, реакционную смесь концентрировали и очищали при помощи хроматографии на колонке с силикагелем (5% MeOH в ДХМ, 1% TEA) с получением указанного в заголовке соединения. 50 мг (42%).
1H-ЯМР (300 МГц, CDCl3) δ 1,20 (д, J=6,9 Гц, 6H, CH3) 2,78-2,89 (м, 4H, NMe, CH) 6,63 (с, 1H, ArH) 6,86 (дд, J=1,2 Гц, J=7,8 Гц, 1H, ArH) 7,43 (д, J=7,8 Гц, 1H, ArH) 7,56 (уш., 2H, ArH) 7,81 (уш., 2H, ArH).
<ПРИМЕР 102> 1-Этил-3-((4bS,9bS)-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)мочевина
К раствору (4bS,9bS)-9b-амино-4b-гидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (0,10 г, 0,34 ммоль) в безводном ТГФ (5 мл) добавляли этилизоцианат (45 мкл, 0,85 ммоль). После реакции в течение 1 часа, реакционную смесь концентрировали и очищали при помощи хроматографии на колонке с силикагелем (5% MeOH в ДХМ, 1% TEA) с получением указанного в заголовке соединения. 60 мг (19%).
1H-ЯМР (300 МГц, CDCl3) δ 1,04 (т, J=7,2 Гц, 3H, CH3) 1,20 (дд, J=2,4 Гц, J=6,9 Гц, 6H, CH3) 2,84 (септ., J=6,9 Гц, 1H, CH) 3,36-3,51 (м, 2H, CH2) 6,62 (д, J=1,2 Гц, 1H, ArH) 6,85 (дд, J=1,2 Гц, J=8,1 Гц, 1H, ArH) 7,46 (д, J=8,1 Гц, 1H, ArH) 7,52-7,62 (м, 2H, ArH) 7,68-7,70 (м, 1H, ArH), 7,77-7,98 (м, 1H, ArH).
<ПРИМЕР 103> 1-((4bS,9bS)-4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-метоксимочевина
Трибромид бора (1,0 M раствор в ДХМ, 1,72 мл, 1,72 ммоль) растворяли в безводном ДХМ (10 мл) и охлаждали до -80°C. К этому раствору медленно добавляли раствор 1-(2-(4-изопропил-2-метоксифенил)-1,3-диоксо-2,3-дигидро-1H-инден-2-ил)-3-метоксимочевины (300 мг, 0,78 ммоль) в безводном ДХМ (15 мл). Реакционную смесь оставляли на 10 мин при -80°C и перемешивали в течение 3 часов при 0°C. Затем реакционную смесь экстрагировали ДХМ и водой, сушили и концентрировали в вакууме. Очищали посредством хроматографии на колонке с силикагелем (5% MeOH в ДХМ, 1% TEA) и получали в виде указанного в заголовке соединения. 110 мг (38%).
1H-ЯМР (300 МГц, CDCl3) δ 1,20 (д, J=6,9 Гц, 6H, CH3) 2,83 (септ., J=6,9 Гц, 1H, CH) 3,88 (с, 3H, OCH3) 6,64 (д, J=1,2 Гц, 1H, ArH) 6,85 (дд, J=1,2 Гц, J=7,8 Гц, 1H, ArH) 7,37 (д, J=7,8 Гц, 1H, ArH) 7,55-7,60 (м, 1H, ArH) 7,66-7,71 (м, 1H, ArH) 7,78-7,84 (м, 2H, ArH).
<ПРИМЕР 104> 5-Ацетил-4b,9b-дигидрокси-7,8-диметил-4b,5-дигидроиндено[1,2-b]индол-10(9bH)-он
N-(3,4-Диметилфенил)ацетамид (300 мг, 1,84 ммоль) и нингидрин (328 мг, 1,84 ммоль) растворяли в разбавленной серной кислоте (6 мл) и перемешивали при комнатной температуре в течение 5,5 часов. Реакцию останавливали медленным выливанием раствора в 150 г льда и перемешиванием. Реакционную смесь дважды промывали этилацетатом (70 мл) и органический слой повторно промывали водой и солевым раствором. Раствор сушили над сульфатом натрия, концентрировали в вакууме и очищали посредством хроматографии на колонке (этилацетат:гексан=1:1) с последующей перекристаллизацией из этилацетата/гексана с получением указанного в заголовке соединения. 60 мг (10%).
1H-ЯМР (300 МГц, ДМСО) δ 2,13 (с, 6H, CH3) 2,74 (с, 3H, NAc) 6,84 (с, 1H, ArH) 7,16 (с, 1H, ArH) 7,49 (уш., 1H, ArH) 7,56-7,61 (м, 1H, ArH) 7,63-7,71 (м, 1H, ArH) 7,80-7,89 (м, 2H, ArH) 8,01-8,05 (м, 1H, ArH).
<ПРИМЕР 105> 4b,9b-Дигидрокси-7,8-диметил-5-пропиноил-4b,5-дигидроиндено[1,2-b]индол-10(9bH)-он
Десять капель концентрированной HCl добавляли к раствору N-(2-(2-гидрокси-1,3-диоксо-2,3-дигидро-1H-инден-2-ил)-4,5-диметилфенил)пропионамида (0,20 г) в безводном ТГФ (10 мл) и перемешивали. После реакции в течение 5 часов, реакционную смесь выливали в ледяную воду, чтобы остановить реакцию. Перед концентрированием в вакууме проводили экстракцию этилацетатом и водой. Концентрат очищали при помощи хроматографии на колонке (30% этилацетат, смешанный с 50% гексаном) с получением указанного в заголовке соединения. 40 мг (20%).
1H-ЯМР (300 МГц, ДМСО) δ 1,26 (т, J=7,5 Гц, 3H, CH3) 2,14 (с, 6H, CH3) 3,06-3,58 (м, 2H, CH2) 6,84 (с, 1H, ArH/OH) 7,16 (с, 1H, ArH/OH) 7,48 (с, 1H, ArH/OH) 7,56-7,61 (м, 1H, ArH) 7,70 (д, J=7,8 Гц, 1H, ArH) 7,80-7,86 (м, 2H, ArH) 7,95-8,01 (м, 1H, ArH).
<ПРИМЕР 106> 4b,9b-Дигидрокси-7,8-диметил-4b,5-дигидроиндено[1,2-b]индол-10(9bH)-он
Концентрированную HCl (1 мл) добавляли к раствору N-(2-(2-гидрокси-1,3-диоксо-2,3-дигидро-1H-инден-2-ил)-4,5-диметилфенил)ацетамида (0,10 г) в метаноле (10 мл) и перемешивали в течение ночи для концентрирования. Концентрат промывали насыщ. NaHCO3, экстрагировали этилацетатом и водой и концентрировали в вакууме с получением указанного в заголовке соединения (50 мг, 58%).
1H-ЯМР (300 МГц, ДМСО) δ 2,33 (с, 3H, CH3) 2,36 (с, 3H, CH3) 7,30 (с, 1H, ArH) 7,49 (с, 1H, ArH) 7,55 (т, J=7,8 Гц, 1H, ArH) 7,94 (т, J=7,8 Гц, 1H, ArH) 8,03 (д, J=7,8 Гц, 1H, ArH) 8,25 (д, J=7,8 Гц, 1H, ArH) 11,70 (уш., 1H, NH).
<ПРИМЕР 107> 5-Ацетил-7,8-диметил-10-оксо-4b,5,9b,10-тетрагидроиндено[1,2-b]индол-4b,9b-диилдиацетат
Ацетилхлорид (0,33 мл, 4,64 ммоль) и триэтиламин (0,65 мл, 4,64 ммоль) медленно добавляли при комнатной температуре к раствору 5-ацетил-4b,9b-дигидрокси-7,8-диметил-4b,5-дигидроиндено[1,2-b]индол-10(9bH)-она (300 мг, 0,93 ммоль) в безводном ТГФ (20 мл). После перемешивания при комнатной температуре в течение 24 часов, твердое вещество, образованное таким образом, промывали ТГФ и фильтровали. После удаления ТГФ, очистка посредством хроматографии на колонке (30% этилацетата перемешивали с 30% гексана) давала указанное в заголовке соединение в виде желтоватого твердого вещества. 150 мг (40%).
1H-ЯМР (300 МГц, ДМСО) δ 2,06 (с, 3H, OAc) 2,10 (с, 3H, OAc) 2,22-2,23 (с, 6H, CH3) 2,47 (с, 3H, NAc) 7,23 (с, 1H, ArH) 7,37 (с, 1H, ArH) 7,64-7,69 (т, 1H, ArH) 7,75 (д, J=7,2 Гц, 1H, ArH) 7,87-7,92 (м, 1H, ArH) 8,33 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 108> 5-Ацетил-9b-амино-4b-гидрокси-5,9b-дигидро-4bH-индено[1,2-b]индол-10-он
AIBN (0,1 г) и SO2Cl2 (0,72 г, 5,3 ммоль) добавляли к раствору N-[2-(1,3-диоксо-индан-2-ил)фенил]ацетамида (1,00 г, 3,5 ммоль) в CCl4 (20 мл) и нагревали с обратным холодильником в течение 3 часов. Раствор концентрировали в вакууме, экстрагировали CH2Cl2, сушили, фильтровали и концентрировали в вакууме. Очистка посредством хроматографии на колонке (этилацетат:гексан = от 1:4 до 1:2) давала указанное в заголовке соединение. 0,60 г (53%).
1H-ЯМР (300 МГц, CDCl3) δ 2,64 (с, 3H, CH3) 7,19 (т, J=1,5, 8,4 Гц, 1H, ArH) 7,37 (т, J=1,5, 8,4 Гц, 1H, ArH) 7,55 (т, J=7,2 Гц, 1H, ArH) 7,73-7,83 (м, 3H, ArH) 8,20 (д, J=8,1 Гц, 1H, ArH).
<ПРИМЕР 109> N-(9b-Амино-4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-5-оксаиндено[2,1-a]инден-1-ил)ацетамид
К раствору N-(9b-хлор-4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-5-оксаиндено[2,1-a]инден-1-ил)ацетамида (3,90 г, 9,3 ммоль) в безводном ТГФ (40 мл) добавляли 2M NH3 в IPA (9,36 мл) при 5°C с последующим перемешиванием в течение ночи при комнатной температуре. После удаления растворителя путем концентрирования в вакууме, остаток разбавляли в метиленхлориде и промывали водным раствором бикарбоната натрия, доводя pH до 8,0. Органический слой сушили, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения. 3,98 г (107%).
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (дд, J=6,9, 2,7 Гц, 6H, CH3) 2,29 (с, 3H, CH3) 2,78-2,87 (септ., 1H, CH) 6,71 (с, 1H, ArH) 6,88 (дд, J=8,1, 2,1 Гц, 1H, ArH) 7,37 (д, J=7,8 Гц, 1H, ArH) 8,48 (д, J=9,3 Гц, 1H, ArH) 8,75 (д, J=9,3 Гц, 1H, ArH) 10,67 (с, 1H, NH).
<ПРИМЕР 110> 1,9b-бис-Ацетиламино-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-иловый эфир уксусной кислоты
К раствору N-(9b-амино-4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-5-оксаиндено[2,1-a]инден-1-ил)ацетамида (0,55 г, 1,38 ммоль) в безводном метиленхлориде (20 мл) добавляли триэтиламин (0,21 г, 2,76 ммоль) и AcCl (0,20 г, 2,07 ммоль) при 0°C, с последующим перемешиванием в течение ночи при комнатной температуре. Реакционную смесь концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 0,17 г (26%).
1H-ЯМР (300 МГц, CDCl3) δ 1,19 (дд, J=3,6, 6,9 Гц, 6H, CH3) 2,00 (с, 3H, CH3) 2,17 (с, 3H, CH3) 2,25 (с, 3H, CH3) 2,83-2,92 (м, 1H, CH) 6,15 (с, 1H, NH) 6,71 (с, 1H, ArH) 6,98 (д, J=7,8 Гц, 1H, ArH) 7,43 (д, J=7,8 Гц, 1H, ArH) 8,50 (д, J=9,0 Гц, 1H, ArH) 8,83 (д, J=9,3 Гц, 1H, ArH) 10,72 (с, 1H, NH).
<ПРИМЕР 111> 9b-Ацетамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b-илметилкарбонат
К N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)ацетамиду (0,50 г, 1,48 ммоль) добавляли 10 мл ТГФ, Et3N (0,24 мл, 1,77 ммоль) и метилхлорформиат (0,11 мл, 1,48 ммоль) в указанном порядке, затем этот раствор перемешивали при комнатной температуре в течение 12 часов.
Реакционную смесь концентрировали, экстрагировали H2O и CH2Cl2 и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения. 20 мг (3%).
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (д, J=2,6 Гц, 3H), 1,18 (д, J=2,6 Гц, 3H), 2,17 (с, 3H), 2,84 (кв., J=7,8 Гц, 1H), 3,62 (с, 3H), 5,40 (с, 1H), 6,68 (с, 1H), 6,91 (д, J=7,7 Гц, 1H), 7,44 (д, J=8,1 Гц, 1H), 7,58 (т, J=8,5 Гц, 1H), 7,78 (т, J=8,1 Гц, 1H), 7,87 (д, J=7,7 Гц, 1H), 7,98 (д, J=8,1 Гц, 1H).
<ПРИМЕР 112> 9b-Ацетамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b-илпентаноат
К N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)ацетамиду (0,50 г, 1,48 ммоль) добавляли 10 мл ТГФ, Et3N (0,24 мл, 1,77 ммоль) и валероилхлорид (0,18 мл, 1,48 ммоль) в указанном порядке с последующим перемешиванием раствора при комнатной температуре в течение 12 часов. После концентрирования, концентрат экстрагировали H2O и CH2Cl2 и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения. (30 мг, 5%).
1H-ЯМР (300 МГц, CDCl3) δ 0,91 (т, J=7,4 Гц, 3H), 1,16 (д, J=2,6 Гц, 3H), 1,18 (д, J=2,6 Гц, 3H), 1,33-1,40 (м, 2H), 1,56-1,64 (м, 2H), 1,95 (с, 3H), 2,35-2,55 (м, 2H), 2,84 (кв., J=7,6 Гц, 1H), 6,10 (с, 1H), 6,68 (д, J=0,9 Гц, 1H), 6,91 (дд, J=1,3 Гц, 7,8 Гц, 1H), 7,44 (д, J=8,0 Гц, 1H), 7,57 (т, J=8,0 Гц, 1H), 7,77 (т, J=8,2 Гц, 1H), 7,84 (д, J=7,5 Гц, 1H), 7,93 (д, J=7,8 Гц, 1H).
<ПРИМЕР 113> 9b-Ацетамидо-1-амино-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b-илметилкарбонат
К 9b-ацетамидо-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илметилкарбонату (50 мг, 0,11 ммоль) добавляли EtOH:H2O=2 мл:0,2 мл, Fe (40 мг, 0,79 ммоль) и одну каплю конц. HCl с последующим кипячением с обратным холодильником в течение 1 часа.
После нейтрализации NaHCO3, реакционную смесь очищали при помощи хроматографии на колонке (этилацетат:гексан=1:1) с получением указанного в заголовке соединения. (25 мг, 55%).
1H-ЯМР (300 МГц, CDCl3) δ 1,17 (д, J=2,6 Гц, 3H), 1,19 (д, J=2,6 Гц, 3H), 2,18 (с, 3H), 2,85 (кв., J=7,7 Гц, 1H), 3,63 (с, 3H), 4,44 (с, 2H), 6,72 (с, 2H), 6,90 (д, J=7,8 Гц, 1H), 6,97 (д, J=7,7 Гц, 1H), 7,23-7,25 (м, 1H), 7,34 (д, J=7,9 Гц, 1H), 7,41 (д, J=7,9 Гц, 1H).
<ПРИМЕР 114> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)пиваламид
Порошок железа (0,04 г, 0,85 ммоль), конц. HCl (0,05 мл) и воду (0,5 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)пиваламида (50 мг, 0,11 ммоль) в абсолютном этаноле (5 мл). Реакционную смесь нагревали в течение 2 часов при кипячении с обратным холодильником. Затем порошок железа отфильтровывали, фильтрат концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения. (40 мг, 86%).
1H-ЯМР (300 МГц, CDCl3) δ 1,16-1,19 (м, 15H, CH3) 2,71-2,92 (м, 1H, CH) 6,66 (с, 1H, ArH) 6,81 (д, J=7,2 Гц, 1H, ArH) 6,93-7,01 (м, 2H, ArH) 7,11-7,25 (м, 1H, ArH) 7,38-7,47 (м, 1H, ArH).
<ПРИМЕР 115> 9b-Ацетамидо-1-амино-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илбутилкарбонат
Порошок железа (0,09 г, 1,66 ммоль), конц. HCl (0,05 мл) и воду (0,5 мл) добавляли в указанном порядке к раствору 9b-ацетамидо-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-ил-бутил-карбоната (0,11 г, 0,22 ммоль) в абсолютном этаноле (5 мл). Реакционную смесь нагревали в течение 1,5 часов при кипячении с обратным холодильником. Затем порошок железа отфильтровывали, фильтрат концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения (50 мг, 50%).
1H-ЯМР (300 МГц, CDCl3) δ 0,89 (т, J=7,5 Гц, 3H, CH3) 1,18 (дд, J=2,4 Гц, 6,9 Гц, 3H, CH3) 1,28-1,43 (м, 2H, CH2) 1,56-1,68 (м, 2H, CH2) 1,96 (с, 3H, CH3) 2,81-2,90 (м, 1H, CH) 4,07-4,20 (м, 2H, OCH2) 6,11 (с, 1H, NH) 6,76 (с, 1H, ArH) 6,94 (т, J=7,8 Гц, 2H, ArH) 7,22-7,35 (м, 2H, ArH) 7,46 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 116> 9b-Ацетамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илэтилкарбонат
Этилхлорформиат (0,32 г, 3,11 ммоль) и триметиламин (0,25 г, 2,48 ммоль) добавляли к раствору 9b-хлор-4b-гидрокси-7-изопропил-1-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (0,70 г, 2,07 ммоль) в безводном ТГФ (15 мл) и перемешивали в течение 4 часов. После удаления ТГФ путем концентрирования в вакууме, концентрат разбавляли в метиленхлориде и многократно промывали водой. Органический слой сушили, фильтровали и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 14 мг (1,6%).
1H-ЯМР (300 МГц, CDCl3) δ 1,16-1,18 (м, 9H, CH3) 2,17 (с, 3H, CH3) 2,82-2,86 (м, 1H, CH) 4,05-4,13 (м, 2H, OCH2) 5,34 (с, 1H, NH) 6,68 (с, 1H, ArH) 6,91 (д, J=7,5 Гц, 1H, ArH) 7,44 (д, J=6,9 Гц, 1H, ArH) 7,58 (т, J=6,9 Гц, 1H, ArH) 7,79-7,86 (м, 2H, ArH) 7,98 (д, J=7,5 Гц, 1H, ArH).
<ПРИМЕР 117> 9b-Ацетамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илпивалат
Пивалоилхлорид (0,26 г, 2,22 ммоль) и триметиламин (0,18 г, 1,77 ммоль) добавляли к раствору 9b-хлор-4b-гидрокси-7-изопропил-1-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (0,50 г, 1,48 ммоль) в безводном ТГФ (15 мл) и нагревали в течение 18 часов при кипячении с обратным холодильником. После удаления ТГФ посредством концентрирования в вакууме, остаток разбавляли в метиленхлориде и многократно промывали водой. Органический слой сушили, фильтровали и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 0,13 г (20%).
1H-ЯМР (300 МГц, CDCl3) δ 1,16-1,19 (м, 15H, CH3) 2,17 (с, 3H, CH3) 2,80-2,89 (м, 1H, CH) 6,11 (с, 1H, NH) 6,68 (с, 1H, ArH) 6,92 (д, J=7,8 Гц, 1H, ArH) 7,45 (д, J=7,8 Гц, 1H, ArH) 7,56 (т, J=7,5 Гц, 1H, ArH) 7,76 (т, J=7,5 Гц, 1H, ArH) 7,86 (д, J=7,8 Гц, 1H, ArH) 7,94 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 118> 9b-Ацетамидо-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илметилкарбамат
Метилизоцианат (0,12 г, 2,22 ммоль) и триметиламин (0,18 г, 1,77 ммоль) добавляли к раствору 9b-хлор-4b-гидрокси-7-изопропил-1-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (0,50 г, 1,48 ммоль) в безводном ТГФ (15 мл) и нагревали в течение 5 часов при кипячении с обратным холодильником. После удаления ТГФ путем концентрирования в вакууме, остаток разбавляли в метиленхлориде и многократно промывали водой. Органический слой сушили, фильтровали и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения. 0,10 г (17%).
1H-ЯМР (300 МГц, CDCl3) δ 1,17 (дд, J=2,4, 6,9 Гц, 6H, CH3) 1,96 (с, 3H, CH3) 2,77-2,88 (м, 4H, CH, CH3) 5,14 (с, 1H, NH) 6,26 (с, 1H, NH) 6,70 (с, 1H, ArH) 6,90 (д, J=7,8 Гц, 1H, ArH) 7,45 (д, J=7,8 Гц, 1H, ArH) 7,56 (т, J=6,9 Гц, 1H, ArH) 7,75 (т, J=6,9 Гц, 1H, ArH) 7,83-7,90 (м, 2H, ArH).
<ПРИМЕР 119> N,N′-(7-Изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b,9b-диил)диацетамид
4b,9b-Диазидо-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он (2,50 г, 7,2 ммоль) растворяли в 50 мл EtOH и перемешивали в течение ночи в присутствии 10% Pd/C (0,38 г) в атмосфере водорода.
Реакционную смесь фильтровали через слой целита и концентрировали в вакууме с получением 4b,9b-диамино-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (1,60 г, 5,4 ммоль). Это соединение растворяли в 50 мл ТГФ и Et3N (3,02 мл, 21,7 ммоль) и ацетилхлорид (1,16 мл, 16,3 ммоль) добавляли к раствору и перемешивали в течение ночи при комнатной температуре. После концентрирования в вакууме, остаток очищали колоночной хроматографией (этилацетат:гексан=2:1) с получением указанного в заголовке соединения. 0,28 г (10%).
1H-ЯМР (300 МГц, CDCl3) δ 1,14 (д, J=3,1 Гц, 3H), 1,16 (д, J=3,1 Гц, 3H), 1,83 (с, 3H), 1,87 (с, 3H), 2,80 (кв., J=7,6 Гц, 1H), 6,62-6,68 (м, 2H), 6,83 (д, J=7,8 Гц, 1H), 7,05 (с, 1H), 7,36 (д, J=7,8 Гц, 1H), 7,54 (т, J=8,7 Гц, 1H), 7,72 (т, J=8,7 Гц, 1H), 7,82 (т, J=9,5 Гц, 1H).
<ПРИМЕР 120> 4b-(Бензилокси)-9b-гидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-он
п-Толуол серную кислоту (65 мг, 0,33 ммоль) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (0,50 г, 1,68 ммоль) в бензиловом спирте (5 мл) и перемешивали при 60°C в течение 3 суток. Реакционную смесь концентрировали и очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат, смешанный с 10% гексаном) с получением указанного в заголовке соединения. 20 мг (3%).
1H-ЯМР (300 МГц, CDCl3) δ 1,20 (дд, J=3 Гц, J=6,9 Гц, 6H, CH3) 2,86 (септ., J=6,9 Гц, 1H, CH) 3,42 (уш., 1H, OH) 5,03 (д, J=11,4 Гц, 1H, CH2) 5,12 (д, J=11,4 Гц, 1H, CH2) 6,76 (с, 1H, ArH) 6,90 (д, J=7,8 Гц, 1H, ArH) 7,29-7,37 (м, 3H, ArH) 7,42-7,47 (м, 3H, ArH) 7,54-7,59 (м, 1H, ArH) 7,77-7,82 (м, 2H, ArH) 7,98 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 121> 9b-Ацетиламино-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-иловый эфир фенилового эфира угольной кислоты
Фенилхлорформиат (0,35 г, 2,22 ммоль) и триметиламин (0,18 г, 1,77 ммоль) добавляли к раствору N-(4b-гидрокси-7-изопропил-10-оксо-4b,10-дигидро-5-оксаиндено[2,1-a]инден-9b-ил)ацетамида (0,50 г, 1,48 ммоль) в безводном ТГФ и нагревали в течение 24 часов при кипячении с обратным холодильником. После удаления ТГФ путем концентрирования в вакууме, остаток разбавляли в этилацетате и промывали несколько раз водным раствором бикарбоната натрия. Органический слой сушили, фильтровали и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:1) с получением указанного в заголовке соединения.10 мг (1,5%).
1H-ЯМР (300 МГц, CDCl3) δ 1,17 (дд, J=3,9, 6,9 Гц, 6H, CH3) 2,04 (с, 3H, CH3) 2,78-2,87 (м, 1H, CH) 6,13 (с, 1H, NH) 6,71 (с, 1H, ArH) 6,90 (д, J=7,8 Гц, 1H, ArH) 7,16 (д, J=7,8 Гц, 2H, ArH) 7,36-7,46 (м, 4H, ArH) 7,61 (т, J=7,8 Гц, 1H, ArH) 7,81 (т, J=7,5 Гц, 1H, ArH) 7,88 (д, J=7,5 Гц, 1H, ArH) 8,07 (д, J=9,0 Гц, 1H, ArH).
<ПРИМЕР 122> O-(9b-Азидо-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-ил) эфир фенилтиокарбаминовой кислоты
Фенилизотиоцианат (0,62 г, 4,66 ммоль) и триметиламин (0,37 г, 3,73 ммоль) добавляли к раствору 9b-азидо-4b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (1,00 г, 3,11 ммоль) в безводном ТГФ и нагревали в течение 24 часов при кипячении с обратным холодильником. После удаления ТГФ путем вакуумной концентрации, остаток разбавляли в этилацетате и многократно промывали водным раствором бикарбоната натрия. Органический слой сушили, фильтровали и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения. 0,15 г (10%).
1H-ЯМР (300 МГц, CDCl3) δ 1,23 (д, J=6,9 Гц, 6H, CH3) 2,86-2,95 (септ., 1H, CH) 6,84 (с, 1H, NH) 6,95-7,05 (м, 3H, ArH) 7,29 (д, J=7,5 Гц, 1H, ArH) 7,36 (д, J=8,1 Гц, 2H, ArH) 7,46-7,61 (м, 3H, ArH) 7,71 (т, J=7,5 Гц, 1H, ArH) 7,91 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 123> Этил-9b-ацетамидо-1-амино-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илкарбонат
Порошок железа (0,45 г, 8,0 ммоль) и конц. HCl (0,03 мл) добавляли к раствору этил-9b-ацетамидо-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b-илкарбоната (0,50 г, 1,1 ммоль) в этаноле (10 мл) и воде (1 мл) и нагревали в течение 1 часа при кипячении с обратным холодильником. Реакционную смесь промывали MeOH, фильтровали и концентрировали в вакууме. Очищали через колоночную хроматографию (этилацетат:гексан=1:2) с получением указанного в заголовке соединения. 0,32 г (69%).
1H-ЯМР (300 МГц, CDCl3) δ 1,16-1,19 (м, 9H, CH3) 2,17 (с, 3H, CH3) 2,80-2,89 (м, 1H, CH) 4,05-4,15 (м, 2H, OCH2) 4,44 (с, 3H, NCH2) 5,33 (с, 1H, NH) 6,72 (с, 1H, ArH) 6,90 (д, J=7,8 Гц, 1H, ArH) 6,96 (д, J=7,8 Гц, 1H, ArH) 7,23-7,25 (м, 1H, ArH) 7,32 (т, J=7,8 Гц, 1H, ArH) 7,41 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 124> N,N′-(7-Изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b,9b-диил)дипропионамид
К 4b,9b-диамино-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-ону (0,50 г, 1,70 ммоль) добавляли 10 мл ТГФ. Этот раствор перемешивали при комнатной температуре в течение ночи вместе с Et3N (0,94 мл, 6,79 ммоль) и пропинолхлоридом (0,44 мл, 5,09 ммоль). После концентрирования в вакууме, очистка при помощи хроматографии на колонке (этилацетат:гексан=2:1) давала указанное в заголовке соединение (0,27 г, 39%).
1H-ЯМР (300 МГц, CDCl3) δ 1,05-1,17 (м, 12H), 2,08-2,39 (м, 4H), 2,82 (кв., J=7,6 Гц, 1H), 6,27 (с, 1H), 6,51 (с, 1H), 6,67 (с, 1H), 6,85 (д, J=7,8 Гц, 1H), 7,39 (д, J=8,4 Гц, 1H), 7,56 (т, J=8,4 Гц, 1H), 7,75 (т, J=8,4 Гц, 1H), 7,85 (д, J=7,8 Гц, 2H).
<ПРИМЕР 125> N,N′-(7-Изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b,9b-диил)бис(2-метилпропанамид)
К 4b,9b-диамино-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-ону (0,50 г, 1,70 ммоль) добавляли 10 мл ТГФ. Этот раствор перемешивали в течение ночи вместе с Et3N (0,94 мл, 6,79 ммоль) и изобутирилхлоридом (0,53 мл, 5,09 ммоль) при комнатной температуре. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (этилацетат:гексан=1:1) давала указанное в заголовке соединение. 0,27 г (39%).
1H-ЯМР (300 МГц, CDCl3) δ 1,05-1,20 (м, 18H), 2,35-2,46 (м, 2H), 2,80 (кв., J=6,9 Гц, 1H), 6,43 (с, 1H), 6,65 (с, 1H), 6,78 (с, 1H), 6,83 (д, J=7,5 Гц, 1H), 7,36 (д, J=8,0 Гц, 1H), 7,52 (т, J=8,0 Гц, 1H), 7,71 (т, J=8,5 Гц, 1H), 7,82 (т, J=8,5 Гц, 2H).
<ПРИМЕР 126> 4b,9b-Дигидрокси-7-изопропил-4bH-бензофуро[2′,3′:3,4]циклопента[1,2-b]пиридин-10(9bH)-он
К 5H-циклопента[b]пиридин-7(6H)-ону (1,50 г, 11,26 ммоль) добавляли 10 мл диоксана и 1 мл AcOH. Раствор перемешивали в течение ночи вместе с SeO2 (3,75 г, 33,79 ммоль) в приборе с обратным холодильником. За нейтрализацией раствором NaHCO3 последовала экстракция этилацетатом. Экстракт концентрировали в вакууме с получением 6,6-дигидрокси-5H-циклопента[b]пиридин-5,7(6H)-диона (1,50 г, 8,37 ммоль). Концентрат растворяли в 10 мл AcOH и перемешивали в течение ночи вместе с изопропилфенолом (1,14 г, 8,37 ммоль) в приборе с обратным холодильником. Концентрирование в вакууме и очистка при помощи хроматографии на колонке (этилацетат:гексан=2:1) давала указанное в заголовке соединение (0,70 г, 21%).
1H-ЯМР (300 МГц, CDCl3) δ 1,17 (д, J=4,1 Гц, 3H), 1,19 (д, J=4,1 Гц, 3H), 2,85 (кв., J=7,2 Гц, 1H), 3,77 (с, 1H), 6,74 (с, 1H), 6,94 (д, J=7,5 Гц, 1H), 7,27 (д, J=5,2 Гц, 1H), 7,58 (д, J=7,5 Гц, 1H), 7,65 (с, 1H), 8,07 (д, J=7,9 Гц, 1H).
<ПРИМЕР 127> 10-Гидрокси-7-изопропил-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b,9b-диилдиацетат
Раствор 7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b,9b-диилдиацетата (0,10 г, 0,26 ммоль) в абсолютном MeOH (5 мл) перемешивали вместе с боргидридом натрия (20 мг, 0,53 ммоль) при комнатной температуре в течение 7 часов. Добавляли ацетон (5 мл) и реакционную смесь перемешивали в течение 10 мин до остановки реакции. Затем растворитель удаляли. Реакционную смесь экстрагировали ДХМ и водой, сушили, концентрировали в вакууме и очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат, смешанный с 20% гексаном) с получением указанного в заголовке соединения. 30 мг (30%).
1H-ЯМР (300 МГц, CDCl3) δ 1,15 (дд, J=3,6 Гц, J=6,9 Гц, 6H, CH3) 2,10 (с, 3H, OAc) 2,16 (с, 3H, OAc) 2,81 (септ., J=6,9 Гц, 1H, CH) 4,38 (д, J=3 Гц, 1H, OH) 5,93 (д, J=3 Гц, 1H, CH) 6,72 (с, 1H, ArH) 6,81 (д, J=8,1 Гц, 1H, ArH) 7,36-7,50 (м, 3H, ArH) 7,57 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 128> O-Метилоксим 9b-гидрокси-7-изопропил-4b-(метоксиамино)-4bH-индено[1,2-b]бензофуран-10(9bH)-она
Гидрохлорид O-метилгидроксиламина (564 мг, 6,75 ммоль) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-она (1,00 г, 3,37 ммоль) в водном пиридине (10 мл) и перемешивали при комнатной температуре. Через 3 часа растворитель удаляли и реакционную смесь промывали ДХМ и 1н. HCl. Органический слой повторно промывали водой и солевым раствором, концентрировали в вакууме и разделяли при помощи хроматографии на колонке с силикагелем (30% этилацетат, смешанный с 10% гексаном) с получением указанного в заголовке соединения. 100 мг (9%).
1H-ЯМР (300 МГц, CDCl3) δ 1,20 (д, J=6,9 Гц, 6H, CH3) 2,81 (септ., J=6,9 Гц 1H, CH) 3,98 (с, 3H, N-OCH3) 4,09 (с, 3H, N-OCH3), 4,46 (с, 1H, OH) 6,57 (дд, J=1,8 Гц, J=8,1 Гц, 1H, ArH) 6,82 (д, J=8,1 Гц, 1H, ArH) 6,88 (д, J=1,5 Гц, 1H, ArH) 7,44-7,55 (м, 2H, ArH) 7,87 (дд, J=1,2 Гц, 6,9 Гц, 1H, ArH) 8,20 (дд, J=1,2 Гц, J=6,9 Гц, 1H, ArH) 8,73 (с, 1H, NH).
<ПРИМЕР 129> 7-Изопропил-4b-метокси-10-метилен-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ол
Раствор 1 M третичного бутоксида калия (1,25 мл, 1,25 ммоль) в ТГФ медленно добавляли при 0°C к раствору бромида метилтрифенилфосфония (415 мг, 1,16 ммоль) в безводном ТГФ (5 мл) и перемешивали при 0°C в течение 30 мин, а затем при комнатной температуре в течение 3 часов. К этой смеси медленно добавляли раствор 9b-гидрокси-7-изопропил-4b-метокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (0,30 г, 0,97 ммоль) в безводном ТГФ (5 мл) при 0°C и нагревали в течение 24 часов при кипячении с обратным холодильником. Реакционную смесь концентрировали в вакууме и промывали водой (50 мл) и ДХМ (50 мл×2). Органический слой вновь промывали водой (30 мл) и солевым раствором (30 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (30% этилацетат, смешанный с 10% гексаном) давала указанное в заголовке соединение. 30 мг (10%).
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (дд, J=3 Гц, J=6,9 Гц, 6H, CH3) 2,81 (септ., J=6,9 Гц, 1H, CH) 2,97 (уш., 1H, OH) 3,67 (с, 3H, OMe) 5,71 (д, J=9,9 Гц, 2H, олефиновые CH2) 6,69 (с, 1H, ArH) 6,80 (дд, J=1,2 Гц, J=7,8 Гц, 1H, ArH) 7,35-7,40 (м, 3H, ArH) 7,46-7,51 (м, 1H, ArH) 7,66-7,68 (м, 1H, ArH).
<ПРИМЕР 130> O-Метилоксим 9b-гидрокси-7-изопропил-4b-метокси-4bH-индено[1,2-b]бензофуран-10(9bH)-она
Гидрохлорид O-метил гидроксиламина (269 мг, 3,20 ммоль) добавляли к раствору 9b-гидрокси-7-изопропил-4b-метокси-4bH-индено[1,2-b]бензофуран-10(9bH)-она (0,50 г, 1,61 ммоль) в безводном пиридине (10 мл) и перемешивали в течение ночи при комнатной температуре. После удаления растворителя, остаток промывали ДХМ и 1 н. HCl. Органический слой вновь промывали водой и солевым раствором, концентрировали в вакууме и очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат, смешанный с 20% гексана) с получением указанного в заголовке соединения. 60 мг (11%).
1H-ЯМР (300 МГц, CDCl3) δ 1,20 (дд, J=2,4 Гц, J=6,9 Гц, 6H, CH3) 1,40 (с, 3H, CH3), 1,46 (с, 3H, CH3), 2,87 (септ., 1H, CH) 6,76 (д, J=0,9 Гц, 1H, ArH) 6,92 (дд, J=1,2 Гц, J=7,8 Гц, 1H, ArH) 7,55-7,60 (м, 2H, ArH) 7,77-7,82 (м, 2H, ArH) 7,90 (м, 1H, ArH).
<ПРИМЕР 131> Смесь 1-бром и 4-бром-4b,9b-дигидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-она
К раствору 4-бром-1-инданона (10,0 г, 47,4 ммоль) в AcOH (4,0 мл) и диоксане (40 мл) добавляли SeO2 (11,5 г, 104 ммоль) с последующим нагреванием в течение 4 часов при кипячении с обратным холодильником. Реакционную смесь фильтровали и концентрировали с получением темно-коричневого масла. м-Изопропилфенол (6,81 г, 50,0 ммоль) и AcOH (10 мл) добавляли к темно-коричневому маслу и перемешивали в течение ночи. Реакционную смесь очищали при помощи хроматографии на колонке (элюировали EtOAc/гексан=1/4-1/2) с получением указанного в заголовке соединения в виде коричневого твердого вещества. 9,28 г (52%).
1H-ЯМР (300 МГц, CDCl3) δ 1,17 (д, J=6,9 Гц, 6H), 2,84 (гепт., J=6,9 Гц, 1H), 4,07 (с, уш., 1H), 4,81 (с, уш., 1H), 6,71 (с, 0,34H), 6,79 (д, J=1,2 Гц, 0,66H), 6,85 (дд, J=7,9, 1,2 Гц, 1H), 7,37-7,42 (м, 1,64H), 7,57-7,62 (м, 0,36H), 7,67-7,75 (м, 1H), 7,91-7,97 (м, 1H).
<ПРИМЕР 132> 1-(Бензиламино)-4b,9b-дигидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-он
Бензальдегид (0,30 г, 2,88 ммоль) и NaCNBH3 (0,12 г, 1,92 ммоль) добавляли при 0°C к раствору 1-амино-4b,9b-дигидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,30 г, 0,96 ммоль) в абсолютном MeOH (3 мл) с последующей реакцией в течение ночи при комнатной температуре. Растворитель удаляли путем концентрирования в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 80 мг (15%).
1H-ЯМР (300 МГц, CDCl3) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,79-2,88 (м, 1H, CH) 4,50 (д, J=6,0 Гц, 2H, CH2) 6,57 (д, J=8,1 Гц, 1H, ArH) 6,73 (с, 1H, ArH) 6,83 (д, J=7,8 Гц, 1H, ArH) 7,11 (д, J=7,2 Гц, 1H, ArH) 7,31-7,39 (м, 5H, ArH) 7,47-7,53 (м, 2H, ArH).
<ПРИМЕР 133> 1-(Этиламино)-4b,9b-дигидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-он
Ацетальдегид (0,08 г, 1,92 ммоль) и NaCNBH3 (0,08 г, 1,28 ммоль) добавляли при 0°C к раствору 1-амино-4b,9b-дигидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (0,20 г, 0,64 ммоль) в абсолютном MeOH (3 мл) и реакцию проводили при комнатной температуре в течение 2 суток. После удаления растворителя путем концентрирования в вакууме, проводили колоночную хроматографию (этилацетат:гексан=1:2) с получением указанного в заголовке соединения. 40 мг (18%).
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (д, J=6,6 Гц, 6H, CH3) 1,26 (т, J=6,9 Гц, 3H, CH3) 2,77-2,88 (м, 1H, CH) 3,16-3,25 (м, 2H, CH2) 6,57 (д, J=8,1 Гц, 1H, ArH) 6,65 (с, 1H, NH) 6,80 (д, J=7,5 Гц, 1H, ArH) 6,94 (с, 1H, ArH) 7,07 (д, J=7,2 Гц, 1H, ArH) 7,39 (д, J=7,2 Гц, 1H, ArH) 7,54 (т, J=8,1 Гц, 1H, ArH).
<ПРИМЕР 134> 9b-Гидрокси-7-изопропил-4b-метил-4bH-индено[1,2-b]бензофуран-10(9bH)-он
7-Изопропил-4b-метокси-10-метилен-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ол (50 мг, 0,16 ммоль) растворяли в ТГФ:конц. HCl (1:1, 1 мл) и нагревали с обратным холодильником в течение 30 минут. После удаления растворителя, остаток промывали ДХМ (50 мл) и водой (20 мл). Органический слой вновь промывали водой и солевым раствором, концентрировали в вакууме. Концентрат очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат, смешанный с 15% гексаном) с получением указанного в заголовке соединения. 20 мг (40%).
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (дд, J=2,7 Гц, J=6,9 Гц, 6H, CH3) 1,79 (с, 3H, CH3) 2,82 (септ., J=6,9 Гц, 1H, CH) 3,29 (с, 1H, OH) 6,67 (д, J=1 Гц, 1H, ArH) 6,80 (дд, J=1 Гц, J=7,8 Гц, 1H, ArH) 7,35 (д, J=7,8 Гц, 1H, ArH) 7,50 (т, J=7,8 Гц, 1H, ArH) 7,72-7,78 (м, 2H, ArH) 7,83 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 135> 4b,9b-Дигидрокси-5-изобутирил-7,8-диметил-4b,5-дигидроиндено[1,2-b]индол-10(9bH)-он
Конц. HCl (5 мл) добавляли к раствору N-(2-(2-гидрокси-1,3-диоксо-2,3-дигидро-1H-инден-2-ил)-4,5-диметилфенил)изобутирамида (200 мг, 0,57 ммоль) в ТГФ (5 мл) и перемешивали в течение 8 часов. Для прекращения реакции добавляли избыток воды (50 мл), а затем проводили экстракцию этилацетатом и водой. Органический слой промывали солевым раствором, концентрировали и очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат, смешанный с 20% гексаном) с получением указанного в заголовке соединения. 120 мг (6%).
1H-ЯМР (300 МГц, CDCl3) δ 1,20 (д, J=6,9 Гц, 3H, CH3) 1,25 (д, J=6,9 Гц, 3H, CH3) 2,16 (с, 3H, CH3) 2,17 (с, 3H, CH3) 2,74 (септ., J=6,9 Гц, 1H, CH) 3,91 (с, 1H, OH) 4,90 (с, 1H, OH) 6,48 (с, 1H, ArH) 7,30 (с, 1H, ArH) 7,46-7,54 (м, 1H, ArH) 7,72-7,83 (м, 3H, ArH).
<ПРИМЕР 136> 7-Изопропил-10-метил-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b,9b-диол
7-Изопропил-10-метилен-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b,9b-диол (50 мг, 0,20 ммоль) растворяли в абсолютном MeOH (5 мл) и перемешивали в течение 24 часов в присутствии Pd/C (10%, 10 мг) в атмосфере водорода. Реакционную смесь промывали ДХМ, фильтровали через фильтр с целитом и концентрировали. Очистка при помощи хроматографии на колонке с силикагелем (30% этилацетат, смешанный с 20% гексаном) давала указанное в заголовке соединение. 30 мг (60%).
1H-ЯМР (300 МГц, CDCl3) δ 1,13-1,19 (м, 6H+3H, CH3) 2,73-2,83 (септ., J=6,9 Гц, 1H, CH) 3,66-3,74 (м, 1H, CH) 3,82 (с, 1H, OH) 6,34 (д, J=8,1 Гц, 0,8H, ArH) 6,52 (дд, J=1,5 Гц, J=8,1 Гц, 0,8H, ArH) 6,78 (д, J=1,5 Гц, 0,8H, ArH) 7,46-7,51 (м, 1,6H, ArH) 7,70-7,75 (м, 0,8H, ArH) 8,50 (с, 1H, ArH).
<ПРИМЕР 137> N-(1-Бром-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)ацетамид
Оксалилхлорид (0,60 мл, 6,88 ммоль) и ДМФ (3 капли) добавляли к раствору 1-бром-4b,9b-дигидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-она (1,98 г, 5,28 ммоль) в ДХМ (20 мл) и перемешивали при комнатной температуре в течение 3 часов. Реакцию прекращали, добавляя воду с последующей экстракцией ДХМ и водой. Органический слой сушили и концентрировали в вакууме с получением 1-бром-9b-хлор-4b-гидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-она в виде твердого вещества. 1,81 г.
К раствору 1-бром-9b-хлор-4b-гидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-она (1,81 г) в ТГФ (15 мл) добавляли 2,0 M NH3 в i-PrOH (8,0 мл, 16 ммоль) при 0°C. Через 30 мин температуру повышали до комнатной температуры, и раствор перемешивали в течение 1 часа. Реакцию прекращали, добавляя воду с последующей экстракцией этилацетатом и водой. Органический слой сушили и концентрировали в вакууме с получением 1,57 г 9b-амино-1-бром-4b-гидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-она в виде темно-коричневого твердого вещества.
Это соединение (1,55 г) растворяли в уксусной кислоте (5 мл) и нагревали в течение 30 мин при кипячении с обратным холодильником в присутствии Ac2O (390 мг, 3,82 ммоль). Реакционную смесь экстрагировали этилацетатом и водой, и органический слой концентрировали в вакууме и очищали при помощи хроматографии на колонке (элюировали EtOAc/гексан=1/1-1/1) с получением указанного в заголовке соединения в виде желтого твердого вещества. 510 мг (23%).
1H-ЯМР (500 МГц, CDCl3) (мажорный:минорный=58:42 региоизомерная смесь) δ 1,16-1,18 (м, 6H), 2,06 (с, 1,7H мажорный), 2,08 (с, 1,3H минорный), 2,81-2,85 (м, 1H), 6,44 (с, уш., 0,58H), 6,70 (д, уш., J=1,4 Гц, 0,84H), 6,78 (д, J=1,4 Гц, 0,58H), 6,83-6,86 (м, 1H), 7,25 (д, J=8,1 Гц, 0,42H), 7,29 (д, J=7,9 Гц, 0,58H), 7,40 (т, J=7,7 Гц, 0,58H), 7,61 (т, J=7,7 Гц, 0,42H), 7,69 (дд, J=7,8, 0,9 Гц, 0,42H), 7,75 (дд, J=7,6, 0,8 Гц, 0,58H), 7,91 (дд, J=7,8, 1,0 Гц, 0,58H), 7,95 (дд, J=7,7, 0,9 Гц, 0,48H).
<ПРИМЕР 138> 4b,9b-Дигидрокси-5-изобутирил-7,8-диметокси-5,9b-дигидро-4bH-индено[1,2-b]индол-10-он
Конц. HCl (5 мл) добавляли к раствору N-[2-(2-гидрокси-1,3-диоксо-индан-2-ил)-4,5-диметоксифенил]изобутирамида (500 мг, 1,30 ммоль) в безводном ТГФ (5 мл) и перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь многократно промывали этилацетатом и водой, и органический слой сушили, фильтровали и концентрировали в вакууме с последующей колоночной хроматографией (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 100 мг (20%).
1H-ЯМР (300 МГц, CDCl3) δ 1,19-1,37 (м, 6H, CH3) 2,70-2,80 (м, 1H, CH), 3,10 (с, 1H, CH) 3,78 (с, 3H, OMe) 3,84 (с, 3H, OMe) 4,87 (с, 1H, OH) 6,25 (с, 1H, ArH), 6,97 (с, 1H, ArH) 7,51 (т, J=7,2 Гц, 1H, ArH) 7,73-7,82 (м, 3H, ArH).
<ПРИМЕР 139> 4b,9b-Дигидрокси-7-изопропил-2-пиперидинил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Пиперидин (136 мг, 1,60 ммоль) и триэтиламин (200 мг, 1,98 ммоль) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-2-фтор-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (250 мг, 0,80 ммоль) в N,N-диметилформамиде (2 мл) и проводили реакцию при 110°C в течение 10 мин при помощи микроволнового излучения. Продукт очищали хроматографией на колонке с получением указанного в заголовке соединения в виде желтого твердого вещества (50 мг, 8%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H), 1,68 (с, 8H), 2,82 (септ., J=6,9H, 1H), 3,49 (с, 4H), 6,66 (с, 1H), 6,81 (д, J=7,6 Гц, 1H), 7,07 (д, J=9 Гц, 1H), 7,22 (д, J=1,2 Гц, 1H), 7,41 (д, J=7,7 Гц, 1H), 7,55 (д, J=8,6 Гц, 1H).
<ПРИМЕР 140> 4b,9b-Дигидрокси-7-изопропил-2-морфолинил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Морфолин (140 мг, 1,60 ммоль) и триэтиламин (200 мг, 1,98 ммоль) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-2-фтор-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (250 мг, 0,80 ммоль) в N,N-диметилформамиде (2 мл) и проводили реакцию при 110°C в течение 10 мин при помощи микроволнового излучения. Продукт очищали хроматографией на колонке с получением указанного в заголовке соединения в виде желтого твердого вещества (60 мг, 10%).
1H-ЯМР (500 МГц, CD3OD) δ 1,15 (т, J=5,8 Гц, 6H), 2,80 (септ., J=6,9H, 1H), 3,32 (т, J=1,5 Гц, 4H), 3,76 (т, J=4,5 Гц, 4H), 6,68 (с, 1H), 6,81 (д, J=7,6 Гц, 1H), 7,06 (д, J=8,3 Гц, 1H), 7,24 (с, 1H), 7,41 (д, J=7,8 Гц, 1H), 7,57 (д, J=8,8 Гц, 1H).
<ПРИМЕР 141> 4b,9b-Дигидрокси-7-изопропил-1-пиперидинил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Пиперидин (140 мг, 1,60 ммоль) и триэтиламин (200 мг, 1,98 ммоль) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-1-фтор-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (250 мг, 0,80 ммоль) в N,N-диметилформамиде (1 мл) и проводили реакцию при 110°C в течение 10 мин при помощи микроволнового излучения. Продукт очищали хроматографией на колонке с получением указанного в заголовке соединения в виде флуоресцентного желтого твердого вещества (110 мг, 18%).
1H-ЯМР (500 МГц, CD3OD) δ 1,16 (дд, J=6,9 Гц, 4,9 Гц, 6H), 1,59 (квинт, J=5,8 Гц, 2H), 1,74 (м, 4H), 2,81 (септ., J=6,9H, 1H), 3,02 (м, 2H), 3,09 (м, 2H), 6,64 (с, 1H), 6,81 (д, J=7,8 Гц, 1H), 6,93 (д, J=8,2 Гц, 1H), 7,35 (д, J=7,5 Гц, 1H), 7,38 (д, J=7,8 Гц, 1H), 7,61 (т, J=7,8 Гц, 1H).
<ПРИМЕР 142> 4b,9b-Дигидрокси-7-изопропил-1-морфолинил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Морфолин (140 мг, 1,60 ммоль) и триэтиламин (200 мг, 1,98 ммоль) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-1-фтор-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (250 мг, 0,80 ммоль) в N,N-диметилформамиде (1 мл) и проводили реакцию при 110°C в течение 10 мин при помощи микроволнового излучения. Продукт очищали хроматографией на колонке с получением указанного в заголовке соединения в виде флуоресцентного желтого твердого вещества (80 мг, 13%).
1H-ЯМР (500 МГц, CD3OD) δ 1,14 (т, J=6,25 Гц, 6H), 2,79 (септ., J=6,8 Гц, 1H), 3,00 (м, 2H), 3,11 (м, 2H), 3,83 (с, 4H), 6,67 (с, 1H), 6,81 (д, J=8,0 Гц, 1H), 6,84 (д, J=8,2 Гц, 1H), 7,40 (д, J=7,8 Гц, 1H), 7,44 (д, J=7,5 Гц, 1H), 7,61 (т, J=7,8 Гц, 1H).
<ПРИМЕР 143> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пропионамид
Триметилуксусный ангидрид (0,27 г, 1,46 ммоль) добавляли к раствору 9b-хлор-4b-гидрокси-5,9b-дигидро-4bH-индено[1,2-b]индол-10-она (0,50 г, 1,46 ммоль) в пиваловой кислоте (5 мл) и нагревали при 100°C в течение 30 мин. Реакционную смесь разбавляли в этилацетате и многократно промывали водн. NaHCO3. Органический слой сушили, фильтровали, концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 50 мг (14%).
1H-ЯМР (300 МГц, CDCl3) δ 1,07 (т, J=7,5 Гц, 3H, CH3) 1,16 (д, J=6,9 Гц, 6H, CH3) 2,24-2,32 (м, 2H, CH2) 2,77-2,86 (м, 1H, CH) 6,64-6,65 (м, 2H, ArH) 6,82 (д, J=6,6 Гц, 1H, ArH) 6,98 (д, J=7,2 Гц, 1H, ArH) 7,33 (м, 1H, ArH) 7,38-7,43 (м, 1H, ArH).
<ПРИМЕР 144> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)бутирамид
H2O (0,5 мл), Fe (0,28 г, 5,14 ммоль) и конц. HCl (0,03 ммоль) добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)бутирамида (0,30 г, 0,70 ммоль) в EtOH (5 мл) и нагревали в течение 1 часа при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали. Затем фильтрат концентрировали и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 0,20 г (75%).
1H-ЯМР (300 МГц, CD3OD) δ 0,95 (т, J=7,5 Гц, 3H, CH3) 1,16 (д, J=6,9 Гц, 6H, CH3) 1,56-1,63 (м, 1H, CH2) 2,23 (т, J=7,5 Гц, 2H, CH2) 2,79-2,83 (м, 1H, CH) 6,64 (с, 2H, ArH) 6,82 (д, J=7,8 Гц, 1H, ArH) 6,98 (д, J=6,6 Гц, 1H, ArH) 7,33 (с, 1H, ArH) 7,40 (т, J=6,6 Гц, 1H, ArH).
<ПРИМЕР 145> 4b,9b-Дигидрокси-5-изобутирил-7-изопропил-5,9b-дигидро-4bH-индено[1,2-b]индол-10-он
Конц. HCl (2 мл) добавляли к раствору N-[2-(2-гидрокси-1,3-диоксоиндан-2-ил)-5-изопропилфенил]изобутирамида (80 мг, 0,21 ммоль) в безводном ТГФ (2 мл) и перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь многократно промывали этилацетатом и водой, органический слой сушили, фильтровали и концентрировали в вакууме с последующей очисткой посредством хроматографии на колонке (этилацетат:гексан=1:4) с получением указанного в заголовке соединения. 33 мг (41%).
1H-ЯМР (300 МГц, CDCl3) δ 1,15-1,25 (м, 12H, CH3) 2,68-2,84 (м, 2H, CH) 3,08 (с, 1H, OH) 5,02 (с, 1H, OH) 6,51 (с, 1H, ArH) 6,76 (д, J=8,1 Гц, 1H, ArH) 7,44 (д, J=8,1 Гц, 1H, ArH) 7,51 (т, J=7,5 Гц, 1H, ArH) 7,73-7,84 (м, 3H, ArH).
<ПРИМЕР 146> 4b,9b-Дигидрокси-7-изопропил-2-(гидроксипиперидинил)-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Гидроксипиперидин (162 мг, 1,60 ммоль) и триэтиламин (200 мг, 1,98 ммоль) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-2-фтор-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (250 мг, 0,80 ммоль) в N,N-диметилформамиде (1 мл) и проводили реакцию при 110°C в течение 5 мин при помощи микроволнового излучения. Продукт очищали хроматографией на колонке с получением указанного в заголовке соединения в виде желтого твердого вещества (65 мг, 10%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16 (дд, J=6,9 Гц, 1,4 Гц, 6H), 1,57 (м, 2H), 1,95 (м, 2H), 2,80 (септ., J=6,9 Гц, 1H), 3,24 (м, 2H), 3,92 (м, 3H), 6,63 (с, 1H), 6,80 (д, J=7,7 Гц, 1H), 7,12 (д, J=7,7 Гц, 1H), 7,25 (с, 1H), 7,39 (д, J=7,6 Гц, 1H), 7,56 (д, J=8,0 Гц, 1H).
<ПРИМЕР 147> 4b,9b-Дигидрокси-1-(4-гидроксипиперидин-1-ил)-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Гидроксипиперидин (162 мг, 1,60 ммоль) и триэтиламин (200 мг, 1,98 ммоль) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-1-фтор-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (250 мг, 0,80 ммоль) в N,N-диметилформамиде (1 мл) и проводили реакцию при 110°C в течение 5 мин при помощи микроволнового излучения. Продукт очищали хроматографией на колонке с получением указанного в заголовке соединения в виде флуоресцентного желтого твердого вещества (60 мг, 10%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16 (д, J=6,6 Гц, 6H), 1,74 (м, 2H), 1,94 (с, 2H), 2,79 (м, 3H), 3,44 (с, 1H), 3,76 (м, 1H), 6,63 (с, 1H), 6,81 (д, J=7,9 Гц, 1H), 6,98 (д, J=7,9 Гц, 1H), 7,36 (д, J=7,5 Гц, 2H), 7,63 (т, J=7,4 Гц, 1H).
<ПРИМЕР 148> 4b,9b-Дигидрокси-7-изопропил-2-(4-(4-метоксибензил)пиперазин-1-ил)-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
1-(4-Метоксибензил)пиперазин (136 мг, 1,60 ммоль) и триэтиламин (200 мг, 1,98 ммоль) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-2-фтор-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (250 мг, 0,80 ммоль) в N,N-диметилформамиде (1 мл) и проводили реакцию при 110°C в течение 5 мин при помощи микроволнового излучения. Продукт очищали хроматографией на колонке с получением указанного в заголовке соединения в виде желтого твердого вещества (70 мг, 9%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, 6,8 Гц), 2,60 (с, 4H), 2,80 (септ., J=6,8 Гц, 1H), 3,47 (с, 4H), 3,55 (с, 2H), 3,80 (с, 3H), 6,74 (с, 1H), 6,78 (уш., 1H), 6,87 (д, J=7,8 Гц, 2H), 6,93 (с, 1H), 7,23 (м, 3H), 7,40 (уш., 1H), 7,60 (уш., 1H).
<ПРИМЕР 149> 4b,9b-Дигидрокси-7-изопропил-1-(4-(4-метоксибензил)пиперазин-1-ил)-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
1-(4-Метоксибензил)пиперазин (140 мг, 1,60 ммоль) и триэтиламин (200 мг, 1,98 ммоль) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-1-фтор-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (250 мг, 0,80 ммоль) в N,N-диметилформамиде (1 мл) и проводили реакцию при 110°C в течение 5 мин при помощи микроволнового излучения. Продукт очищали хроматографией на колонке с получением указанного в заголовке соединения в виде флуоресцентного желтого твердого вещества (84 мг, 11%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16 (д, J=6,9 Гц, 6H), 2,65 (м, 4H), 2,81 (септ., J=6,9 Гц, 1H), 3,18 (т, J=4,6 Гц, 4H), 3,53 (д, 2,6 Гц, 2H), 3,80 (с, 3H), 6,70 (с, 1H), 6,79 (д, J=7,8 Гц, 1H), 6,89 (м, 3H), 7,43 (д, J=7,4 Гц, 1H), 7,62 (т, J=7,8 Гц).
<ПРИМЕР 150> 2-(Диметиламино)-4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Гидрохлорид диметиламина (136 мг, 1,60 ммоль) и триэтиламин (400 мг, 3,96 ммоль) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-2-фтор-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (250 мг, 0,80 ммоль) в N,N-диметилформамиде (1 мл) и проводили реакцию при 110°C в течение 5 мин при помощи микроволнового излучения. Продукт очищали хроматографией на колонке с получением указанного в заголовке соединения в виде желтого твердого вещества (73 мг, 10%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16 (д, J=6,9 Гц, 6H), 2,82 (септ., J=6,9 Гц, 1H), 3,14 (с, 6H), 6,71 (с, 1H), 6,80 (т, J=7,5 Гц, 2H), 7,05 (д, J=7,8 Гц, 1H), 7,43 (д, J=7,8 Гц, 1H), 7,62 (д, J=8,8 Гц, 1H).
<ПРИМЕР 151> 1-(Диметиламино)-4b,9b-дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
Гидрохлорид диметиламина (140 мг, 1,60 ммоль) и триэтиламин (400 мг, 3,96 ммоль) добавляли к раствору 4b,9b-дигидрокси-7-изопропил-1-фтор-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (250 мг, 0,80 ммоль) в N, N-диметилформамиде (1 мл) и проводили реакцию при 110°C в течение 10 мин при помощи микроволнового излучения. Продукт очищали хроматографией на колонке с получением указанного в заголовке соединения в виде желтого твердого вещества (168 мг, 31%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (дд, J=6,9, 2,8 Гц, 6H), 2,82 (септ., J=6,9 Гц, 1H), 2,95 (с, 6H), 6,71 (д, J=1,25 Гц, 1H), 6,80 (м, 2H), 7,30 (т, J=7,9 Гц, 2H), 7,57 (т, J=7,4 Гц, 1H).
<ПРИМЕР 152> 10-Гидразоно-7-изопропил-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-4b,9b-диол
4b,9b-Дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он (500 мг, 1,69 ммоль) и моногидрат гидразина (125 мг, 2,50 ммоль) растворяли в толуоле (5 мл) в реакторе и перемешивали в течение ночи при комнатной температуре. Продукт очищали хроматографией на колонке с получением указанного в заголовке соединения в виде белого твердого вещества. 7 мг, (1%).
1H-ЯМР (300 МГц, ДМСО) δ 1,15 (д, J=6,9 Гц, 6H), 2,80 (септ., J=6,8 Гц, 1H), 5,83 (уш., 1H), 6,72~6,76 (м, 2H), 7,48 (т, J=7,8 Гц, 1H), 7,64~7,70 (м, 2H), 7,75 (д, J=7,9 Гц, 1H), 7,83 (д, J=7,7 Гц, 1H), 11,24 (с, 1H).
<ПРИМЕР 153> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)бензамид
Порошок железа (38 мг, 0,68 ммоль) добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)бензамида (0,10 г, 0,23 ммоль) в этаноле:воде (10:1, 10 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь фильтровали, фильтрат концентрировали в вакууме и очищали при помощи хроматографии на колонке с силикагелем (50% этилацетат в гексане) с получением указанного в заголовке соединения. 80 мг (86%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,84 (септ., J=6,9 Гц, 1H, CH) 6,67 (уш., 2H, ArH) 6,87-6,89 (м, 1H, ArH) 7,01-7,03 (м, 1H, ArH) 7,40-7,54 (м, 5H, ArH) 7,83-7,86 (м, 2H, ArH).
<ПРИМЕР 154> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-метоксибензамид
N-(4b-Гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-метоксибензамид (0,10 г, 0,21 ммоль) растворяли в этаноле:воде (10:1, 10 мл) и нагревали в течение 3 часов в присутствии порошка железа (36 мг, 0,63 ммоль) при кипячении с обратным холодильником. Реакционную смесь фильтровали, фильтрат концентрировали в вакууме и очищали хроматографией на колонке с силикагелем (50% этилацетат в гексане) с получением указанного в заголовке соединения. 85 мг (90%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,9 Гц, 6H, CH3) 2,84 (септ., J=6,9 Гц, 1H, CH) 3,82 (с, 3H, OCH3) 6,67-6,72 (м, 2H, ArH) 6,89 (д, J=6,3 Гц, 1H, ArH) 7,03-7,09 (м, 2H, ArH) 7,31-7,36 (м, 1H, ArH) 7,43-7,49 (м, 4H, ArH).
<ПРИМЕР 155> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-хлорбензамид
4-Хлор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)бензамид (0,08 г, 0,17 ммоль) растворяли в этаноле:воде (10:1, 10 мл) и нагревали в течение 3 часов в присутствии порошка железа (28 мг, 0,50 ммоль) при кипячении с обратным холодильником. Реакционную смесь фильтровали, фильтрат концентрировали в вакууме и очищали при помощи хроматографии на колонке с силикагелем (50% этилацетат в гексане) с получением указанного в заголовке соединения. 60 мг (80%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,84 (септ., J=6,9 Гц, 1H, CH) 6,66-6,75 (м, 2H, ArH) 6,88 (д, J=7,8 Гц, 1H, ArH) 7,01 (д, J=7,5 Гц, 1H, ArH) 7,41-7,46 (м, 4H, ArH) 8,83 (д, J=8,4 Гц, 2H, ArH).
<ПРИМЕР 156> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-нитробензамид
N-(4b-Гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-нитробензамид (0,075 г, 0,15 ммоль) растворяли в этаноле:воде (10:1, 10 мл) и нагревали в течение 6 часов в присутствии порошка железа (52 мг, 0,92 ммоль) при кипячении с обратным холодильником. Реакционную смесь фильтровали, фильтрат концентрировали в вакууме и очищали при помощи хроматографии на колонке с силикагелем (50% этилацетат в гексане) с получением указанного в заголовке соединения. 50 мг (76%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,83 (септ., J=6,9 Гц, 1H, CH) 6,60-6,69 (м, 4H, ArH) 6,86-6,88 (м, 1H, ArH) 6,99-7,01 (м, 1H, ArH) 7,40-7,46 (м, 2H, ArH) 7,60-7,63 (м, 2H, ArH).
<ПРИМЕР 157> 1-Амино-4b,9b-дигидрокси-6,8-диизопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он
4b,9b-Дигидрокси-6,8-диизопропил-1-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он (300 мг, 0,78 ммоль) растворяли в этаноле:воде (10 мл:1 мл). К этому раствору добавляли Fe (319 мг, 5,7 ммоль) и одну каплю конц. HCl с последующим нагреванием в течение 1 часа при кипячении с обратным холодильником. После нейтрализации раствором NaHCO3, концентрирование в вакууме и очистка при помощи хроматографии на колонке (20% метанол в метиленхлориде) давали указанное в заголовке соединение (90 мг, 33%).
1H-ЯМР (300 МГц, ДМСО) δ 1,09~1,17 (м, 12H), 2,81 (септ., J=6,8 Гц, 1H), 2,93 (септ., J=6,8 Гц, 1H), 6,36 (с, 1H), 6,64-6,68 (м, 2H), 6,97 (с, 1H), 7,08 (д, J=1,2 Гц, 1H), 7,43 (т, J=7,7 Гц, 1H), 7,50 (с, 1H).
<ПРИМЕР 158> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)циклопропанкарбоксамид
Раствор N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)циклопропанкарбоксамида (0,20 г, 0,49 ммоль) в этаноле:воде (10:1, 20 мл) нагревали в течение 3 часов в присутствии порошка железа (82 мг, 1,47 ммоль) при кипячении с обратным холодильником. Реакционную смесь фильтровали, фильтрат концентрировали в вакууме и очищали при помощи хроматографии на колонке с силикагелем (50% этилацетат в гексане) с получением указанного в заголовке соединения. 150 мг (81%).
1H-ЯМР (300 МГц, CD3OD) δ 0,74-0,76 (м, 4H, CH2) 1,17 (д, J=6,9 Гц, 6H, CH3) 1,72-1,75 (м, 1H, CH) 2,82 (септ., J=6,9 Гц, 1H, CH) 6,64 (м, 2H, ArH) 6,84-6,86 (м, 1H, ArH) 6,97-6,99 (м, 1H, ArH) 7,42 (м, 2H, ArH).
<ПРИМЕР 159> 1-(4b-Гидрокси-6,8-диизопропил-1-амино-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-(4-метоксифенил)тиомочевина
1-(4b-Гидрокси-6,8-диизопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-(4-метоксифенил)тиомочевину (100 мг, 0,78 ммоль) растворяли в этаноле:воде (10 мл:1 мл). К этому раствору добавляли Fe (319 мг, 5,7 ммоль) и одну каплю конц. HCl и нагревали в течение 1 часа при кипячении с обратным холодильником. Концентрирование в вакууме и очистка при помощи хроматографии на колонке (20% метанол в метиленхлориде) давали указанное в заголовке соединение. 60 мг, (64%).
1H-ЯМР (300 МГц, CD3OD) δ 1,22 (д, J=6,9 Гц, 6H, CH3), 2,84 (септ., J=6,9 Гц, 1H, CH), 3,80 (с, 3H, OCH3), 5,88 (д, J=7,3 Гц, 1H, ArH), 6,64~6,67 (м, 2H, ArH), 6,85~6,89 (м, 3H, ArH), 6,98~7,01 (м, 2H, ArH), 7,16 (т, J=7,8 Гц, 1H, ArH), 7,43 (д, J=8,0 Гц, 1H, ArH).
<ПРИМЕР 160> 1-(4b-Гидрокси-6,8-диизопропил-1-амино-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-(фенил)тиомочевина
1-(4b-Гидрокси-6,8-диизопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-(фенил)тиомочевину (100 мг, 0,78 ммоль) растворяли в этаноле:воде (10 мл:1 мл). К этому раствору добавляли Fe (319 мг, 5,7 ммоль) и одну каплю конц. HCl и нагревали с обратным холодильником в течение 1 часа. Концентрирование в вакууме и очистка при помощи хроматографии на колонке (20% метанол в метиленхлориде) давали указанное в заголовке соединение. 40 мг, (43%).
1H-ЯМР (300 МГц, ацетон-d6) δ 1,21 (дд, J=6,9 Гц, 1,0 Гц, 6H, CH3), 2,84 (септ., J=6,9 Гц, 1H, CH), 5,79 (с, 1H, OH), 5,86 (д, J=7,3 Гц, 1H, ArH), 6,43 (с, 2H, NH2), 6,71 (д, J=8,0 Гц, 1H, ArH), 6,74 (д, J=1,4 Гц, 1H, ArH), 6,85 (дд, J=8,0 Гц, 1,4 Гц, 1H, ArH), 7,12~7,22 (м, 3H, ArH), 7,32~7,35 (м, 3H, ArH), 7,45 (д, J=8,0 Гц, 1H, ArH), 8,73 (с, 1H, NH), 8,78 (с, 1H, NH).
<ПРИМЕР 161> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)тиофен-2-карбоксамид
Тиофенкарбоновую кислоту (0,13 г, 1,01 ммоль) растворяли в безводном метиленхлориде (10 мл) и перемешивали в течение ночи при 0°C в присутствии EDCI (0,19 г, 1,01 ммоль) и HOBt (0,13 г, 1,01 ммоль). Поскольку реакция не завершилась, несмотря на столь длительный период времени, дополнительно добавляли EDCI (0,19 г, 1,01 ммоль) и HOBt (0,13 г, 1,01 ммоль). Однако завершение реакции не обнаружилось. Реакционную смесь разбавляли метиленхлоридом и промывали водой. Органический слой сушили и фильтровали. Очистка при помощи хроматографии на колонке (этилацетат:гексан=1:4) давала указанное в заголовке соединение. 0,12 г (29%).
1H-ЯМР (300 МГц, CDCl3) δ 1,13-1,15 (м, 6H, CH3) 2,76-2,85 (м, 1H, CH) 6,71 (с, 1H, NH) 6,80 (д, J=7,8 Гц, 1H, ArH) 7,05 (с, 1H, ArH) 7,20 (с, 1H, ArH) 7,33 (д, J=7,8 Гц, 1H, ArH) 7,50-7,55 (м, 2H, ArH) 7,61 (д, J=2,4 Гц, 1H, ArH) 7,76-7,87 (м, 2H, ArH) 8,01 (д, J=7,5 Гц, 1H, ArH).
<ПРИМЕР 162> 1-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-(4-метоксифенил)мочевина
1-(4b-Гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-(4-метоксифенил)мочевину (93 мг, 0,19 ммоль) добавляли к 5 мл EtOH:H2O (10:1) с образованием бледно-желтоватого мутного раствора, к которому затем добавляли порошок Fe (39 мг, 0,70 ммоль) и две капли конц. HCl при комнатной температуре с последующим перемешиванием в течение 1,5 часов при кипячении с обратным холодильником. Наблюдали новое пятно чуть ниже исходного вещества по показаниям ТСХ. Реакционную смесь фильтровали, концентрировали и очищали при помощи хроматографии на колонке с силикагелем с использованием EtOAc/Hx (1/2-1/1) с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (65 мг, 0,14 ммоль, 74%).
1H-ЯМР (300 МГц, CDCl3+2 капли CD3OD) δ 1,18 (д, J=6,9 Гц, 6H), 2,38 (с, уш., 5H), 2,82 (гепт., J=6,9 Гц, 1H), 3,78 (с, 3H), 6,07 (д, J=7,4 Гц, 1H), 6,58 (д, J=8,2 Гц, 1H), 6,68 (д, J=1,5 Гц, 1H), 6,81-6,87 (м, 1H), 6,84 (д, J=9,0 Гц, 2H), 7,08 (д, J=9,0 Гц, 2H), 7,17 (т, J=7,8 Гц, 1H), 7,34 (д, J=8,0 Гц, 1H).
<ПРИМЕР 163> 1-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-бутилмочевина
1-Бутил-3-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)мочевину (100 мг, 0,228 ммоль) добавляли к 5 мл EtOH:H2O (10:1) с образованием бледно-желтоватого мутного раствора, к которому затем добавляли порошок Fe (38 мг, 0,680 ммоль) и две капли конц. HCl при комнатной температуре с последующим перемешиванием в течение 2,5 часов при кипячении с обратным холодильником. Наблюдали новое пятно чуть ниже исходного вещества по показаниям ТСХ. Реакционную смесь фильтровали, концентрировали и очищали при помощи хроматографии на колонке с силикагелем с использованием EtOAc/Hx (1/2-1/1), с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (66 мг, 0,16 ммоль, 71%).
1H-ЯМР (300 МГц, CDCl3+капля CD3OD) δ 0,87 (т, J=7,2 Гц, 3H), 1,16 (дд, J=6,9, 0,8 Гц, 6H), 1,27 (секст., J=7,4 Гц, 2H), 1,36-1,65 (м, 2H), 2,10 (с, уш., 3H), 2,79 (гепт., J=6,9 Гц, 1H), 3,16-3,28 (м, 1H), 3,32-3,44 (м, 1H), 6,63 (д, J=8,2 Гц, 1H), 6,69 (д, J=1,5 Гц, 1H), 7,76 (дд, J=8,1, 1,6 Гц, 1H), 6,93 (д, J=7,3 Гц, 1H), 7,15 (д, J=8,0 Гц, 1H), 7,42 (дд, J=8,1, 7,4 Гц, 1H).
<ПРИМЕР 164> 1-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-(4-фторфенил)мочевина
1-(4-Фторфенил)-3-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)мочевину (187 мг, 0,392 ммоль) добавляли к 5 мл EtOH:H2O (10:1) с образованием бледно-желтоватого мутного раствора, к которому затем добавляли порошок Fe (66 мг, 1,18 ммоль) и одну каплю конц. HCl при комнатной температуре с последующим перемешиванием в течение 1 часа при кипячении с обратным холодильником. Наблюдали новое пятно чуть ниже исходного вещества по показаниям ТСХ. Реакционную смесь фильтровали, концентрировали и очищали при помощи хроматографии на колонке с силикагелем, используя EtOAc/Hx (1/2-1/1), с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (107 мг, 0,239 ммоль, 61%).
1H-ЯМР (300 МГц, CD3OD) δ 1,23 (д, J=6,9 Гц, 6H), 2,85 (гепт., J=6,9 Гц, 1H), 5,87 (д, J=7,3 Гц, 1H), 6,64-6,67 (м, 2H), 6,87 (дд, J=8,0, 1,6 Гц, 1H), 7,05-7,20 (м, 5H), 7,48 (д, J=6,5 Гц, 1H).
<ПРИМЕР 165> 1-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-(трет-бутил)мочевина
1-(трет-Бутил)-3-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)мочевину (99 мг, 0,23 ммоль) добавляли к 5 мл EtOH:H2O (10:1) с образованием бледно-желтоватого мутного раствора, к которому затем добавляли порошок Fe (38 мг, 0,688 ммоль) и две капли конц. HCl при комнатной температуре с последующим перемешиванием в течение 1,5 часа при кипячении с обратным холодильником. Наблюдали (PK344) новое пятно чуть ниже исходного вещества по показаниям ТСХ. Реакционную смесь фильтровали, концентрировали и очищали при помощи хроматографии на колонке с силикагелем, используя EtOAc/Hx (1/2-1/1), с получением указанного в заголовке соединения в виде желтого твердого вещества (84 мг, 0,21 ммоль, 91%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (дд, J=6,9, 1,9 Гц, 6H), 1,23 (с, 9H), 2,73-2,88 (м, 1H), 6,58-6,72 (м, 2H), 6,81 (д, уш., J=7,3 Гц, 1H), 6,99 (д, уш., J=6,9 Гц, 1H), 7,31 (д, уш., J=7,2 Гц, 1H), 7,38-7,52 (м, 1H).
<ПРИМЕР 166> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)формамид
N-(4b-Гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)ацетамид (123 мг, 0,334 ммоль) добавляли к 5 мл EtOH:H2O (10:1) с образованием бледно-желтоватого мутного раствора, к которому затем добавляли порошок Fe (46 мг, 0,83 ммоль) и одну каплю конц. HCl при комнатной температуре с последующим перемешиванием в течение 2 часов при кипячении с обратным холодильником. Наблюдали новое пятно чуть ниже исходного вещества по показаниям ТСХ. Реакционную смесь фильтровали, концентрировали и очищали при помощи хроматографии на колонке с силикагелем, используя EtOAc/Hx (1/2-1/1), с получением указанного в заголовке соединения в виде желтого твердого вещества (72 мг, 0,21 ммоль, 64%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (дд, J=6,9, 1,4 Гц, 6H), 2,83 (гепт., J=6,9 Гц, 1H), 6,66 (с, 1H), 6,68-6,76 (м, 1H), 6,84 (д, J=7,9 Гц, 1H), 7,00 (д, J=7,1 Гц, 1H), 7,33 (д, J=7,9 Гц, 1H), 7,41-7,50 (м, 1H), 8,10 (с, 1H).
<ПРИМЕР 167> N-(1-Формамидо-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)ацетамид
Смесь муравьиной кислоты (5 мл) и уксусного ангидрида (10 мл) перемешивали при 80°C в течение 30 минут, а затем охлаждали до комнатной температуры. К этой смеси добавляли раствор N-(1-амино-9b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-5-оксаиндено[2,1-a]инден-4b-ил)ацетамида (200 мг, 0,57 ммоль) в метиленхлориде с последующим перемешиванием при комнатной температуре. После удаления растворителя и добавления небольшого количества метиленхлорида, формировался белый осадок. Его фильтровали с получением указанного в заголовке соединения (170 мг, 79%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16 (дд, J=6,9 Гц, 1,6 Гц, 6H, CH3), 1,99 (с, 3H, CH3), 2,82 (септ., J=6,9 Гц, 1H, CH), 6,65 (с, 1H, CH3), 6,88 (дд, J=7,9 Гц, 1,0 Гц, 1H, ArH), 7,38 (д, J=7,9 Гц, 1H, ArH), 7,59 (д, J=7,6 Гц, 1H, ArH), 7,75 (т, J=8,0 Гц, 1H, ArH), 8,46 (с, 1H), 8,50 (д, J=8,1 Гц, 1H, ArH).
<ПРИМЕР 168> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)метансульфонамид
К N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)метансульфонамиду (150 мг, 0,36 ммоль) добавляли смесь этанол:вода (10 мл:1 мл), Fe (80 мг, 1,43 ммоль) и две капли конц. HCl в указанном порядке. После нагревания в течение 2 часов при кипячении с обратным холодильником, реакционную смесь концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:н-гексан=1:2) с получением указанного в заголовке соединения (60 мг, 43%).
1H-ЯМР (300 МГц, CD3OD) δ 1,34 (д, J=6,9 Гц, 6H, CH3), 3,09 (септ., J=6,9 Гц, 1H, CH), 3,34 (с, 3H, SCH3), 7,11 (д, J=7,7 Гц, 1H, ArH), 7,28-7,35 (м, 2H, ArH), 7,56 (с, 1H, ArH), 7,73 (д, J=7,9 Гц, 1H, ArH), 7,81 (д, J=8,1 Гц, 1H, ArH).
<ПРИМЕР 169> Диэтил-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)фосфоамидат
Диэтил-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)фосфоамидат (0,050 г, 0,11 ммоль) растворяли в смеси этанол:вода (10:1, 10 мл). К этому раствору добавляли порошок железа (20 мг, 0,36 ммоль) и 2-3 капли конц. HCl перед нагреванием в течение 2,5 часов при кипячении с обратным холодильником. После завершения реакции, реакционную смесь промывали этилацетатом, фильтровали для удаления порошка железа и экстрагировали этилацетатом и водой. Органический слой промывали солевым раствором, сушили и концентрировали с последующим разделением и очисткой при помощи хроматографии на колонке (30% этилацетат, смешанный с 50% гексаном) с получением указанного в заголовке соединения. 6 мг (13%).
1H-ЯМР (300 МГц, CD3OD) δ 1,13 (т, J=6,9 Гц, 6H, CH3) 1,26 (д, J=6,9 Гц, 6H, CH3) 2,88 (септ., J=6,9 Гц, 1H, CH) 3,65-3,89 (м, 4H, CH2) 6,69 (д, J=7,8 Гц, 1H, ArH) 6,83-6,86 (м, 2H, ArH) 7,03 (д, J=7,8 Гц, 1H, ArH) 7,30 (д, J=8,1 Гц, 1H, ArH) 7,40 (т, J=8,1 Гц, 1H, ArH).
<ПРИМЕР 170> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-цианобензамид
Порошок железа (30 мг, 0,38 ммоль) и 3 капли конц. HCl добавляли к раствору 4-циано-N-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)бензамида (0,06 г, 0,13 ммоль) в этаноле:воде (10:1, 20 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После завершения реакции, реакционную смесь промывали этилацетатом, фильтровали для удаления порошка железа и экстрагировали этилацетатом и водой. Органический слой промывали солевым раствором, сушили и концентрировали с последующим разделением и очисткой при помощи хроматографии на колонке (30% этилацетат, смешанный с 30% гексаном) с получением указанного в заголовке соединения. 50 мг (89%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,9 Гц, 6H, CH3) 2,83 (септ., J=6,9 Гц, 1H, CH) 6,67 (уш., 2H, ArH) 6,86-6,88 (м, 1H, ArH) 7,00-7,02 (м, 1H, ArH) 7,43-7,45 (м, 2H, ArH) 7,77-7,80 (м, 2H, ArH) 7,96-7,99 (м, 2H, ArH).
<ПРИМЕР 171> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-нафтамид
Порошок железа (35 мг, 0,60 ммоль) и 3 капли конц. HCl добавляли к раствору N-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-нафтамида (0,10 г, 0,20 ммоль) в этаноле:воде (10:1, 10 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После завершения реакции, реакционную смесь промывали этилацетатом, фильтровали для удаления порошка железа и экстрагировали этилацетатом и водой. Органический слой промывали солевым раствором, сушили и концентрировали с последующим разделением и очисткой при помощи хроматографии на колонке (30% этилацетат, смешанный с 40% гексаном) с получением указанного в заголовке соединения. 85 мг (90%).
1H-ЯМР (300 МГц, CD3OD) δ 1,20 (д, J=6,9 Гц, 6H, CH3) 2,86 (септ., J=6,9 Гц, 1H, CH) 6,68-6,72 (м, 2H, ArH) 6,90 (д, J=7,5 Гц, 1H, ArH) 7,03 (д, J=7,5 Гц, 1H, ArH) 7,44-7,59 (м, 4H, ArH) 7,89-7,97 (м, 4H, ArH) 8,45 (с, 1H, ArH).
<ПРИМЕР 172> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-[1,1′-бифенил]-4-карбоксамид
Порошок железа (33 мг, 0,58 ммоль) и 3 капли конц. HCl добавляли к раствору N-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-[1,1′-бифенил]-4-карбоксамида (0,10 г, 0,19 ммоль) в этаноле:воде (10:1, 10 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После завершения реакции, реакционную смесь промывали этилацетатом, фильтровали для удаления порошка железа и экстрагировали этилацетатом и водой. Органический слой промывали солевым раствором, сушили и концентрировали с последующим разделением и очисткой при помощи хроматографии на колонке (30% этилацетат, смешанный с 30% гексаном) с получением указанного в заголовке соединения. 85 мг (90%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,9 Гц, 6H, CH3) 2,85 (септ., J=6,9 Гц, 1H, CH) 6,68-6,76 (м, 2H, ArH) 6,89 (д, J=8,1 Гц, 1H, ArH) 7,02 (д, J=7,2 Гц, 1H, ArH) 7,34=7,45 (м, 5H, ArH) 7,53-7,59 (м, 4H, ArH) 7,92-7,94 (м, 2H, ArH).
<ПРИМЕР 173> 1-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-этилмочевина
Fe (61 мг, 1,09 ммоль) и 2 капли конц. HCl добавляли к раствору 1-(1-нитро-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-этилмочевины (150 мг, 0,36 ммоль) в смеси этанол:вода (10 мл:1 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После концентрирования в вакууме, очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:1) давала указанное в заголовке соединение в виде белого твердого вещества (50 мг, 36%).
1H-ЯМР (300 МГц, CD3OD) δ 1,08 (т, J=7,1 Гц, 3H, CH3), 1,19 (д, J=6,9 Гц, 6H, CH3), 2,80 (септ., J=6,9 Гц, 1H, CH), 3,32~3,43 (м, 2H, CH2), 6,60 (д, J=1,3 Гц, 1H, ArH), 6,70 (д, J=8,2 Гц, 1H, ArH), 6,79 (дд, J=8,0 Гц, 1,3 Гц, 1H, ArH), 6,91 (д, J=7,3 Гц, 1H, ArH), 7,36~7,44 (м, 2H, ArH).
<ПРИМЕР 174> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)тетрагидрофуран-2-карбоксамид
Fe (38 мг, 0,68 ммоль) и 2 капли конц. HCl добавляли к раствору 2N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)тетрагидрофуран-2-карбоксамида (100 мг, 0,23 ммоль) в смеси этанол:вода (10 мл:1 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После концентрирования в вакууме, очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:1) давала указанное в заголовке соединение в виде белого твердого вещества (70 мг, 75%).
1H-ЯМР (300 МГц, CD3OD) δ 1,14 (д, J=6,9 Гц, 6H, CH3), 1,78~2,08 (м, 3H, CH2), 2,11~2,23 (м, 1H, CH2), 2,80 (септ., J=6,9 Гц, 1H, CH), 3,75~3,87 (м, 1H, OCH2), 3,91~4,04 (м, 1H, OCH2), 4,30~4,34 (м, 1H, OCH), 6,63~6,67 (м, 2H, ArH), 6,83 (д, J=7,9 Гц, 1H, ArH), 6,98 (д, J=7,3 Гц, 1H, ArH), 7,32~7,43 (м, 2H, ArH).
<ПРИМЕР 175> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2,2,2-трифторацетамид
Порошок железа (0,10 г, 1,8 ммоль), конц. HCl (0,03 мл) и воду (0,8 мл) добавляли в указанном порядке к раствору 2,2,2-трифтор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)ацетамида (0,11 г, 0,25 ммоль) в абсолютном этаноле (8 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа. Фильтрат концентрировали в вакууме и подвергали в течение 30 мин хроматографии на колонке (этилацетат:гексан=1:4), наполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 90 мг (90%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,9 Гц, 6H, CH3) 2,80-2,85 (м, 1H, CH) 6,66-6,72 (м, 2H, ArH) 6,86 (д, J=7,8 Гц, 1H, ArH) 6,98 (д, J=7,2 Гц, 1H, ArH) 7,33-7,36 (м, 1H, ArH) 7,45 (т, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 176> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1,1,1-трифторметансульфонамид
Fe (60 мг, 1,08 ммоль) и 2 капли конц. HCl добавляли к раствору 1,1,1-трифтор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)метансульфонамида (170 мг, 0,36 ммоль) в этаноле:воде (10 мл:1 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После концентрирования в вакууме, очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:1) давала указанное в заголовке соединение в виде белого твердого вещества (140 мг, 88%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16 (дд, J=6,9 Гц, 1,6 Гц, 6H, CH3), 2,82 (септ., J=6,9 Гц, 1H, CH), 6,64 (с, 1H, ArH), 6,67 (д, J=8,2 Гц, 1H, ArH), 6,85 (д, J=7,7 Гц, 1H, ArH), 7,00 (д, J=7,4 Гц, 1H, ArH), 7,35 (д, J=8,0 Гц, 1H, ArH), 7,45 (т, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 177> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)формамид
Смесь муравьиной кислоты (2,5 мл) и уксусного ангидрида (5,0 мл) перемешивали при 80°C в течение 30 мин, а затем охлаждали до комнатной температуры перед добавлением раствора 9b-амино-4b-гидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (400 мг, 1,35 ммоль) в ДХМ. Полученную реакционную смесь перемешивали при комнатной температуре в течение 1 часа, концентрировали, экстрагировали этилацетатом и водой и повторно концентрировали в вакууме. Концентрат очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат перемешивали с 30% гексаном) с получением указанного в заголовке соединения. 140 мг (32%).
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (дд, J=6,9 Гц, J=2,4, 6H, CH3) 2,82 (гепт., J=6,9 Гц, 1H, CH) 6,65 (с, 1H, ArH/NH/OH) 6,87 (д, J=7,8 1H, ArH) 7,35 (д, J=7,8, 1H, ArH.) 7,65-7,80 (м, 2H, ArH) 7,81-7,9 (м, 2H, ArH) 8,10 (с, 1H, NH/CHO).
<ПРИМЕР 178> 1,1,1-Трифтор-N-(4b-гидрокси-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)метансульфонамид
Метансульфоновый ангидрид (229 мг, 0,81 ммоль) и триэтиламин (123 мг, 1,22 ммоль) добавляли к раствору 4b-амино-9b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (200 мг, 0,68 ммоль) в метиленхлориде (10 мл) и перемешивали при комнатной температуре в течение 4 часов. После концентрирования в вакууме, очистка при помощи хроматографии на колонке (этилацетат:гексан=1:2) давала указанное в заголовке соединение в виде красного твердого вещества (220 мг, 32%).
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (д, J=6,9 Гц, 6H, CH3), 2,81 (септ., J=6,9 Гц, 1H, CH), 6,68 (с, 1H, ArH), 6,81 (д, J=7,6 Гц, 1H, ArH), 7,54 (д, J=7,9 Гц, 1H, ArH), 7,51 (т, J=7,5 Гц, 1H, ArH), 7,75~7,82 (м, 2H, ArH), 8,01 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 179> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-фенилацетамид
Порошок железа (61 мг, 1,09 ммоль) и 3 капли конц. HCl добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-фенилацетамида (0,10 г, 0,22 ммоль) в этаноле:воде (10:1, 10 мл) и нагревали в течение 12 часов при кипячении с обратным холодильником. Реакционную смесь фильтровали для удаления порошка железа и экстрагировали этилацетатом и водой. Органический слой промывали солевым раствором, концентрировали в вакууме и очищали при помощи хроматографии на колонке с силикагелем (50% этилацетат в гексане) с получением указанного в заголовке соединения. 75 мг (81%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,9 Гц, 6H, CH3) 2,82 (септ., J=6,9 Гц, 1H, CH) 3,59 (с, 2H, CH2) 6,64 (уш., 2H, ArH) 6,83 (уш., 1H, ArH) 6,96-6,98 (уш., 1H, ArH) 7,19-7,41 (м, 6H, ArH).
<ПРИМЕР 180> (E)-N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-(3,4-дихлорфенил)акриламид
Порошок железа (42 мг, 0,74 ммоль) и 3 капли конц. HCl добавляли к раствору (E)-3-(3,4-дихлорфенил)-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)акриламида (0,08 г, 0,15 ммоль) в этаноле:воде (10:1, 10 мл) и нагревали в течение 12 часов при кипячении с обратным холодильником. Реакционную смесь фильтровали для удаления порошка железа и экстрагировали этилацетатом и водой. Органический слой промывали солевым раствором и концентрировали в вакууме. Небольшое количество метанола добавляли к концентрату для образования осадка, который затем фильтровали с получением указанного в заголовке соединения. 30 мг (80%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,84 (септ., J=6,9 Гц, 1H, CH) 6,66-6,79 (м, 3H, ArH) 6,86-6,88 (м, 1H, ArH) 6,99-7,01 (м, 1H, ArH) 7,34-7,54 (м, 5H, ArH) 7,74 (с, 1H, ArH).
<ПРИМЕР 181> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-(бензилокси)бензамид
Порошок железа (26 мг, 0,47 ммоль) и 2 капли конц. HCl добавляли к раствору 4-бензил-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)бензамида (0,05 г, 0,094 ммоль) в этаноле:воде (10:1, 10 мл) и нагревали в течение 6 часов при кипячении с обратным холодильником. После удаления порошка железа фильтрованием, реакционную смесь экстрагировали этилацетатом и водой. Органический слой промывали солевым раствором и концентрировали в вакууме. Небольшое количество метанола добавляли к концентрату для образования осадка, который затем фильтровали с получением указанного в заголовке соединения. 15 мг (32%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,83 (септ., J=6,9 Гц, 1H, CH) 5,12 (с, 2H, CH2) 6,67 (с, 2H, ArH) 6,85 (с, 1H, ArH) 7,00-7,03 (с, 3H, ArH) 7,18-7,43 (м, 7H, ArH) 7,80-7,83 (м, 2H, ArH).
<ПРИМЕР 182> 2-([1,1′-Бифенил]-4-ил)-N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)ацетамид
Порошок железа (31,3 мг, 0,56 ммоль) и 3 капли конц. HCl добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)бифенил-4-карбоксамида (0,1 г, 0,18 ммоль) в этаноле:воде (10:1, 10 мл) и нагревали в течение 4 часов при кипячении с обратным холодильником. После удаления порошка железа фильтрованием, реакционную смесь экстрагировали этилацетатом и водой. Органический слой промывали солевым раствором и концентрировали в вакууме. Небольшое количество метанола добавляли к концентрату для образования осадка, который затем фильтровали с получением указанного в заголовке соединения. 50 мг (54%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,9 Гц, 6H, CH3) 2,83 (септ., J=6,9 Гц, 1H, CH) 3,64 (с, 2H, CH2) 6,65 (с, 2H, ArH) 6,83-6,86 (уш., 1H, ArH) 6,98 (уш., 1H, ArH) 7,27-7,43 (м, 7H, ArH) 7,53-7,60 (м, 4H, ArH).
<ПРИМЕР 183> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-метоксибензамид
Порошок железа (0,13 г, 2,46 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-метоксибензамида (0,16 г, 0,33 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа. Фильтрат очищали в течение 30 минут при помощи хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения (80 мг, 54%).
1H-ЯМР (300 МГц, CD3OD) δ 1,22-1,23 (м, 6H, CH3) 2,81-2,90 (септ., 1H, CH) 4,00 (с, 3H, OCH3) 6,71 (с, 1H, ArH) 6,86 (с, 1H, ArH) 7,04-7,07 (м, 2H, ArH) 7,12-7,15 (м, 2H, ArH) 7,50-7,55 (м, 3H, ArH) 7,94 (с, 1H, ArH).
<ПРИМЕР 184> трет-Бутил(2R)-1-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-иламино)-1-оксопропан-2-илкарбамат
EDCI (233 мг, 1,22 ммоль) и HOBt (165 мг, 1,22 ммоль) добавляли к раствору Boc-L-аланина (231 мг, 1,22 ммоль) в метиленхлориде (20 мл). Через 20 мин к раствору добавляли 4b-амино-9b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он (300 мг, 1,02 ммоль) и перемешивали в течение ночи при комнатной температуре. После завершения реакции, реакционную смесь экстрагировали метиленхлоридом и водой, и органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:2) давала указанное в заголовке соединение (368 мг, 77%).
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (д, J=6,9 Гц, 6H, CH3), 1,33~1,47 (м, 9H, CH3), 1,59 (с, 3H, CH3), 2,81 (септ., J=6,9 Гц, 1H, CH), 4,19 (м, 1H), 4,88 (м, 1H), 5,56 (с, 1H), 6,69 (с, 1H, ArH), 6,79-6,83 (м, 1H, ArH), 7,28 (м, 1H, ArH), 7,54 (т, J=7,4 Гц, 1H, ArH), 7,76-7,81 (м, 2H, ArH), 7,99 (д, J=7,6 Гц, 1H, ArH).
<ПРИМЕР 185> трет-Бутил(2R)-1-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-иламино)-1-оксо-3-фенилпропан-2-илкарбамат
EDCI (233 мг, 1,22 ммоль) и HOBt (165 мг, 1,22 ммоль) добавляли к раствору Boc-L-фенилаланина (324 мг, 1,22 ммоль) в метиленхлориде (20 мл). Через 20 мин к раствору добавляли 4b-амино-9b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-он (300 мг, 1,02 ммоль) и перемешивали в течение ночи при комнатной температуре. После завершения реакции, реакционную смесь экстрагировали метиленхлоридом и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очищали при помощи хроматографии на колонке (этилацетат:н-гексан=1:2) с получением указанного в заголовке соединения (480 мг, 87%).
1H-ЯМР (300 МГц, CDCl3) δ 1,13 (9 м, 6H, CH3), 1,40 (м, 1H, CH), 2,99-3,12 (м, 2H, CH2), 4,29-4,42 (м, 1H, CH), 4,90-5,01 (м, 1H, CH), 6,68 (с, 1H, ArH), 6,76-6,84 (м, 1H, ArH), 7,10-7,21 (м, 3H, ArH), 7,27-7,34 (м, 3H, ArH), 7,48-7,55 (м, 1H, ArH), 7,75-7,80 (м, 2H, ArH), 7,96-8,01 (м, 1H, ArH).
<ПРИМЕР 186> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-метилбензамид
Fe (66 мг, 1,18 ммоль) и 2 капли конц. HCl добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-метилбензамида (180 мг, 0,39 ммоль) в этаноле:H2O (20 мл:2 мл) и нагревали в течение 2,5 часов при кипячении с обратным холодильником. После концентрирования в вакууме, реакционную смесь очищали при помощи хроматографии на колонке (этилацетат:н-гексан=1:3) с получением указанного в заголовке соединения в виде желтого твердого вещества (134 мг, 80%).
1H-ЯМР (500 МГц, CD3OD) δ 1,16 (д, J=6,8 Гц, 6H, CH3), 2,45 (с, 3H, ArH), 2,82 (септ., J=6,8 Гц, 1H, CH), 6,64 (с, 1H, ArH), 6,68 (д, J=8,3 Гц, 1H, ArH), 6,85 (д, J=7,3 Гц, 1H, ArH), 7,03 (д, J=7,3 Гц, 1H, ArH), 7,18-7,22 (м, 2H, ArH), 7,30 (т, J=7,4 Гц, 1H, ArH), 7,41-7,46 (м, 2H, ArH), 7,51 (д, J=7,3 Гц, 1H, ArH).
<ПРИМЕР 187> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-метилбензамид
Fe (66 мг, 1,18 ммоль) и 2 капли конц. HCl добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-метилбензамида (1800 мг, 0,39 ммоль) в этаноле:H2O (10 мл:1 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После концентрирования в вакууме, реакционную смесь очищали при помощи хроматографии на колонке (этилацетат:н-гексан=1:3) с получением указанного в заголовке соединения в виде желтого твердого вещества (88 мг, 52%).
1H-ЯМР (500 МГц, CD3OD) δ 1,18 (дд, J=6,9 Гц, 1,4 Гц, 6H, CH3), 2,36 (с, 3H, ArH), 2,84 (септ., J=6,8 Гц, 1H, CH), 6,67-6,70 (м, 2H, ArH), 6,87-6,88 (м, 1H, ArH), 7,02-7,03 (м, 1H, ArH), 7,28-7,35 (м, 2H, ArH), 7,45 (м, 1H, ArH), 7,63 (д, J=7,6 Гц, 1H, ArH), 7,67 (с, 1H, ArH).
<ПРИМЕР 188> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-метилбензамид
Fe (59 мг, 1,05 ммоль) и 2 капли конц. HCl добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-метилбензамида (160 мг, 0,35 ммоль) в этаноле:H2O (20 мл:2 мл) и нагревали в течение 4 часов при кипячении с обратным холодильником. После концентрирования в вакууме, реакционную смесь очищали при помощи хроматографии на колонке (этилацетат:н-гексан=1:3) с получением указанного в заголовке соединения в виде желтого твердого вещества (106 мг, 71%).
1H-ЯМР (500 МГц, CD3OD) δ 1,16 (д, J=6,8 Гц, 6H, CH3), 2,35 (с, 3H, ArH), 2,81 (септ., J=6,8 Гц, 1H, CH), 6,65-6,69 (м, 2H, ArH), 6,86 (д, J=7,4 Гц, 1H, ArH), 7,00 (д, J=7,4 Гц, 1H, ArH), 7,22 (д, J=7,5 Гц, 1H, ArH), 7,41-7,46 (м, 2H, ArH), 7,74 (д, J=7,5 Гц, 1H, ArH).
<ПРИМЕР 189> Метил-4-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-илкарбамоил)бензоат
Fe (93 мг, 1,67 ммоль) и 2 капли конц. HCl добавляли к раствору метил-4-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-илкарбамоил)бензоата (280 мг, 0,56 ммоль) в этаноле:H2O (20 мл:2 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После концентрирования в вакууме, реакционную смесь очищали при помощи хроматографии на колонке (этилацетат:н-гексан=1:3) с получением указанного в заголовке соединения в виде желтого твердого вещества (186 мг, 71%).
1H-ЯМР (500 МГц, CD3OD) δ 1,16 (д, J=6,5 Гц, 6H, CH3), 2,81 (септ., J=6,5 Гц, 1H, CH), 3,89 (с, 3H, OCH3), 6,65~6,68 (м, 2H, ArH), 6,86 (д, J=7,4 Гц, 1H, ArH), 7,02 (д, J=6,9 Гц, 1H, ArH), 7,41~7,46 (м, 2H, ArH), 7,93 (д, J=8,1 Гц, 2H, ArH), 8,04 (д, J=8,0 Гц, 2H, ArH).
<ПРИМЕР 190> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-хлорбензамид
Порошок железа (0,17 г, 3,04 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору 3-хлор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)бензамида (0,20 г, 0,41 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа. Фильтрат подщелачивали NaHCO3, многократно промывали водой, и органический слой сушили, фильтровали и подвергали в течение 30 мин хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 90 мг (93%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (дд, J=6,9, 2,1 Гц, 6H, CH3) 2,85-2,87 (септ., 1H, CH) 6,68-6,78 (м, 2H, ArH) 6,82-6,86 (м, 1H, ArH) 6,95-7,03 (м, 1H, ArH) 7,38-7,60 (м, 4H, ArH) 7,77-7,79 (м, 1H, ArH) 7,87-7,90 (м, 1H, ArH).
<ПРИМЕР 191> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3,5-диметилбензамид
Порошок железа (0,04 г, 0,77 ммоль), конц. HCl (0,01 мл) и воду (0,5 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3,5-диметилбензамида (50 мг, 0,10 ммоль) в абсолютном этаноле (5 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа. Фильтрат подщелачивали NaHCO3 и многократно промывали водой, органический слой сушили, фильтровали и подвергали в течение 30 мин хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 30 мг (68%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18-1,20 (м, 6H, CH3) 2,33 (с, 6H, CH3) 2,81-2,87 (септ., 1H, CH) 6,67-6,70 (м, 2H, ArH) 6,84-6,86 (м, 1H, ArH) 7,03-7,05 (м, 1H, ArH) 7,18 (с, 1H, ArH) 7,46 (с, 4H, ArH).
<ПРИМЕР 192> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2,4,6-трихлорбензамид
Порошок железа (37 мг, 0,66 ммоль) и 2 капли конц. HCl добавляли к раствору 2,4,6-трихлор-N-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)бензамида (0,12 г, 0,22 ммоль) в этаноле:воде (10:1, 10 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После завершения реакции, реакционную смесь промывали этилацетатом, фильтровали для удаления порошка железа и экстрагировали этилацетатом и водой. Органический слой промывали солевым раствором, сушили, концентрировали и очищали при помощи хроматографии на колонке (30% этилацетат, смешанный с 20% гексаном) с получением указанного в заголовке соединения. 85 мг (75%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,9 Гц, 6H, CH3) 2,83 (септ., J=6,9 Гц, 1H, CH) 6,62-6,75 (м, 2H, ArH) 6,83 (м, 1H, ArH) 7,05 (м, 1H, ArH) 7,36-7,54 (м, 3H, ArH) 7,89 (с, 1H, ArH).
<ПРИМЕР 193> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-фторацетамид
Fe (63 мг, 1,12 ммоль) и 3 капли конц. HCl добавляли к раствору 2-фтор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)ацетамида (150 мг, 0,37 ммоль) в этаноле:H2O (20 мл:2 мл) и нагревали в течение 2,5 часов при кипячении с обратным холодильником. После концентрирования в вакууме, реакционную смесь очищали при помощи хроматографии на колонке (EtOAc:гексан=1:1) с получением указанного в заголовке соединения в виде желтого твердого вещества (63 мг, 46%).
1H-ЯМР (300 МГц, CD3OD) δ 1,15 (д, J=6,3 Гц, 6H, CH3), 2,82 (септ., J=6,3 Гц, 1H, CH), 4,84 (д, J=45 Гц, 2H, CH2F), 6,65-6,68 (м, 2H, ArH), 6,84-6,87 (м, 1H, ArH), 6,97-6,99 (м, 1H, ArH), 7,35-7,45 (м, 2H, ArH).
<ПРИМЕР 194> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-хлорацетамид
Fe (45 мг, 0,79 ммоль) и 3 капли конц. HCl добавляли к раствору 2-хлор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)ацетамида (110 мг, 0,26 ммоль) в этаноле:H2O (10 мл:1 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После концентрирования в вакууме, реакционную смесь очищали при помощи хроматографии на колонке (EtOAc:гексан=1:1) с получением указанного в заголовке соединения в виде желтого твердого вещества (98 мг, 97%).
1H-ЯМР (300 МГц, CD3OD) δ 1,15 (д, J=6,9 Гц, 6H, CH3), 2,81 (септ., J=6,9 Гц, 1H, CH), 4,10 (д, J=4,0 Гц, 2H, CH2Cl), 6,64-6,67 (м, 2H, ArH), 6,83-6,87 (м, 1H, ArH), 6,98 (д, J=7,3 Гц, 1H, ArH), 7,35-7,42 (м, 2H, ArH).
<ПРИМЕР 195> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2,2-дихлорацетамид
Fe (36 мг, 0,65 ммоль) и 2 капли конц. HCl добавляли к раствору 2,2-дихлор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)ацетамида (90 мг, 0,22 ммоль) в этаноле:H2O (10 мл:1 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После концентрирования в вакууме, реакционную смесь очищали при помощи хроматографии на колонке (EtOAc:гексан=1:2) с получением указанного в заголовке соединения в виде желтого твердого вещества (62 мг, 74%).
1H-ЯМР (300 МГц, CD3OD) δ 1,15 (д, J=6,6 Гц, 6H, CH3), 2,81 (септ., J=6,6 Гц, 1H, CH), 6,06 (т, J=5,4 Гц, 1H, CHF2), 6,65-6,68 (м, 2H, ArH), 6,84-6,87 (м, 1H, ArH), 6,97-6,99 (м, 1H, ArH), 7,35-7,45 (м, 2H, ArH).
<ПРИМЕР 196> 1-Амино-9b-(4-бутил-1H-1,2,3-триазол-1-ил)-4b-гидрокси-7-изопропил-4bH-индено[1,2-b]бензофуран-10(9bH)-он
Раствор 9b-(4-бутил-1H-1,2,3-триазол-1-ил)-4b-гидрокси-7-изопропил-1-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (0,080 г, 0,18 ммоль) в этаноле:воде (10:1, 10 мл) нагревали в течение 23 часов при кипячении с обратным холодильником в присутствии порошка железа (38 мг, 0,68 ммоль). Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа с последующей экстракцией этилацетатом и водой. Разделение и очистка при помощи хроматографии на колонке с силикагелем (30% этилацетат, смешанный с 50% гексаном) давали указанное в заголовке соединение. 50 мг (67%).
1H-ЯМР (300 МГц, CD3OD): δ 0,93 (т, J=7,2 Гц, 3H, CH3) 1,23 (д, J=6,9 Гц, 6H, CH3) 1,33-1,41 (м, 2H, CH2) 1,58-1,68 (м, 2H, CH2) 2,69 (т, J=7,2 Гц, 2H, CH2) 2,90 (септ., J=6,9 Гц, 1H, CH) 6,79 (уш., 2H, ArH) 6,98-7,03 (м, 2H, ArH) 7,22-7,41 (м, 2H, ArH) 7,50-7,55 (м, 1H, ArH).
<ПРИМЕР 197> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиколинамид
Порошок железа (0,18 г, 3,2 ммоль), конц. HCl (0,03 мл) и воду (0,8 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)пиколинамида (0,20 г, 0,44 ммоль) в абсолютном этаноле (8 мл) и нагревали в течение 4 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа. Фильтрат концентрировали в вакууме и очищали в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:2 к метиленхлориду:MeOH=20:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 80 мг (43%).
1H-ЯМР (300 МГц, CD3OD) δ 1,20 (д, J=6,9 Гц, 6H, CH3) 2,83-2,87 (м, 1H, CH) 6,70 (с, 2H, ArH) 6,89 (д, J=7,2 Гц, 1H, ArH) 7,02 (д, J=7,2 Гц, 1H, ArH) 7,45-7,48 (м, 2H, ArH) 7,55 (т, J=6,0 Гц, 1H, ArH) 7,90-7,97 (м, 2H, ArH) 8,62 (д, J=3,6 Гц, 1H, ArH).
<ПРИМЕР 198> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)никотинамид
Порошок железа (0,18 г, 3,2 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)никотинамида (0,20 г, 0,44 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа. Фильтрат концентрировали в вакууме и очищали в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:2 к метиленхлориду:MeOH=20:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 140 мг (75%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,79-2,88 (м, 1H, CH) 6,67-6,70 (м, 2H, ArH) 6,88 (д, J=7,8 Гц, 1H, ArH) 7,01 (д, J=7,2 Гц, 1H, ArH) 7,43-7,51 (м, 3H, ArH) 8,25 (д, J=8,1 Гц, 1H, ArH) 8,65 (д, J=3,9 Гц, 1H, ArH) 9,00 (с, 1H, ArH).
<ПРИМЕР 199> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)изоникотинамид
Порошок железа (0,09 г, 16,3 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)изоникотинамида (0,10 г, 0,22 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа. Фильтрат концентрировали в вакууме и очищали в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 62 мг (68%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,6 Гц, 6H, CH3) 2,82-2,86 (м, 1H, CH) 6,67-6,71 (с, 2H, ArH) 6,89 (д, J=7,5 Гц, 1H, ArH) 7,01 (д, J=7,2 Гц, 1H, ArH) 7,43-7,48 (м, 2H, ArH) 7,79-7,80 (м, 2H, ArH) 8,64-8,66 (м, 2H, ArH).
<ПРИМЕР 200> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиразин-2-карбоксамид
Порошок железа (0,09 г, 1,63 ммоль), конц. HCl (0,03 мл) и воду (0,8 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)пиразин-2-карбоксамида (0,10 г, 0,22 ммоль) в абсолютном этаноле (8 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа. Фильтрат концентрировали в вакууме и очищали в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 90 мг (98%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,6 Гц, 6H, CH3) 2,80-2,89 (м, 1H, CH) 6,69-6,72 (м, 2H, ArH) 6,89 (д, J=8,1 Гц, 1H, ArH) 7,02 (д, J=7,2 Гц, 1H, ArH) 7,43-7,49 (м, 2H, ArH) 8,66 (с, 1H, ArH) 8,78 (с, 1H, ArH) 9,14 (с, 1H, ArH).
<ПРИМЕР 201> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)фуран-2-карбоксамид
Порошок железа (0,09 г, 1,68 ммоль), конц. HCl (0,03 мл) и воду (0,8 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)фуран-2-карбоксамида (0,10 г, 0,23 ммоль) в абсолютном этаноле (8 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа. Фильтрат концентрировали в вакууме и очищали в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:2), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 52 мг (56%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,79-2,85 (м, 1H, CH) 6,56 (д, J=1,5 Гц, 1H, ArH) 6,67 (с, 2H, ArH) 6,87 (д, J=6,0 Гц, 1H, ArH) 7,00 (д, J=6,0 Гц, 1H, ArH) 7,12 (д, J=3,3 Гц, 1H, ArH) 7,43-7,51 (м, 2H, ArH) 7,64 (с, 1H, ArH).
<ПРИМЕР 202> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-8-карбоксамид
Порошок Fe (35 мг, 0,60 ммоль) и 3 капли конц. HCl добавляли к раствору N-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-8-карбоксамида (0,10 г, 0,20 ммоль) в этаноле:воде (10:1, 10 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа. Фильтрат концентрировали в вакууме и очищали при помощи хроматографии на колонке (30% этилацетат перемешивали с 40% гексаном) с получением указанного в заголовке соединения. 80 мг (85%).
1H-ЯМР (300 МГц, CD3OD): δ 1,23 (дд, J=1,5 Гц, J=6,9 Гц, 6H, CH3) 2,84 (септ., J=6,9 Гц, 1H, CH) 6,69 (с, 2H, ArH) 6,89 (с, 1H, ArH) 7,01 (с, 1H, ArH) 7,45-7,67 (м, 3H, ArH) 7,72 (с, 1H, ArH) 8,14-8,17 (м, 1H, ArH) 8,46-8,58 (м, 2H, ArH) 8,86 (с, 1H, ArH).
<ПРИМЕР 203> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-6-карбоксамид
Порошок Fe (68 мг, 1,21 ммоль) и 3 капли конц. HCl добавляли к раствору N-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-6-карбоксамида (0,20 г, 0,40 ммоль) в этаноле:воде (10:1, 20 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа. Фильтрат концентрировали в вакууме и перекристаллизовывали из 30% этилацетата, смешанного с 30% гексаном, с получением указанного в заголовке соединения. 130 мг.
1H-ЯМР (300 МГц, CD3OD): δ 1,19 (д, J=6,9 Гц, 6H, CH3) 2,85 (септ., J=6,9 Гц, 1H, CH) 6,70 (уш., 2H, ArH) 6,88-6,90 (м, 1H, ArH) 7,03-7,06 (м, 1H, ArH) 7,48 (уш., 2H, ArH) 7,58-7,62 (м, 1H, ArH) 8,05-8,08 (м, 1H, ArH) 8,10-8,19 (м, 1H, ArH) 8,43-8,51 (м, 2H, ArH) 8,91-8,93 (м, 1H, ArH).
<ПРИМЕР 204> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)бензофуран-2-карбоксамид
Fe (69 мг, 1,24 ммоль) и 2 капли конц. HCl добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)бензофуран-2-карбоксамида (200 мг, 0,41 ммоль) в этаноле:воде (10 мл:1 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После концентрирования в вакууме, реакционную смесь очищали при помощи хроматографии на колонке (этилацетат:н-гексан=1:1) с получением указанного в заголовке соединения в виде белого твердого вещества (118 мг, 63%).
1H-ЯМР (300 МГц, CD3OD) δ 1,12 (д, J=6,7 Гц, 6H, CH3), 2,77 (септ., J=6,7 Гц, 1H, CH), 6,65~6,67 (м, 2H, ArH), 6,85 (д, J=7,8 Гц, 1H, ArH), 7,03 (д, J=7,3 Гц, 1H, ArH), 7,24 (т, J=7,4 Гц, 1H, ArH), 7,35-7,43 (м, 2H, ArH), 7,46-7,53 (м, 3H, ArH), 7,63 (д, J=7,7 Гц, 1H, ArH).
<ПРИМЕР 205> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-метилбензофуран-2-карбоксамид
Fe (67 мг, 1,2 ммоль) и 2 капли конц. HCl добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-метилбензофуран-2-карбоксамида (200 мг, 0,40 ммоль) в растворителе этанол:вода (10 мл:1 мл) и нагревали в течение 23 часов при кипячении с обратным холодильником. После вакуумного концентрирования, реакционную смесь очищали при помощи хроматографии на колонке (этилацетат:н-гексан=1:1) с получением указанного в заголовке соединения в виде белого твердого вещества (162 мг, 86%).
1H-ЯМР (300 МГц, CDCl3) δ 1,20 (д, J=6,9 Гц, 6H, CH3), 2,49 (с, 3H, CH3), 2,85 (септ., J=6,9 Гц, 1H, CH), 6,70 (м, 2H, ArH), 6,89 (м, 1H, ArH), 7,03 (м, 1H, ArH), 7,31 (т, J=7,1 Гц, 1H, ArH), 7,42-7,55 (м, 4H, ArH), 7,66 (д, J=7,7 Гц, 1H, ArH).
<ПРИМЕР 206> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-метилтиазол-5-карбоксамид
N-(4b-Гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-метилтиазол-5-карбоксамид (81 мг, 0,17 ммоль) добавляли к 5 мл EtOH:H2O (10:1) с получением бледно-желтого мутного раствора, к которому затем добавляли порошок Fe (29 мг, 0,51 ммоль) и одну каплю конц. HCl при комнатной температуре с последующим перемешиванием в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь фильтровали, концентрировали и очищали при помощи препаративной ТСХ на силикагеле с использованием EtOAc/Hx (1/1) с получением указанного в заголовке соединения в виде желтого твердого вещества (54 мг, 0,12 ммоль, 73%).
1H-ЯМР (300 МГц, CDCl3) (по-видимому, смесь из 2 изомеров) δ 1,17-1,21 (м, 6H), 2,71 (с, 1H), 2,77 (2H), 2,78-2,89 (м, 1H), 5,56 (с, уш., 1H), 5,58 (с, 0,6H), 5,75 (с, уш., 0,8H), 6,63 (дд, J=8,2, 0,5 Гц, 0,6H), 6,71-6,85 (м, 2H), 6,91-6,96 (м, 2H), 7,19 (дд, J=7,4, 0,5 Гц, 0,6H), 7,28-7,32 (м, 1H), 7,48-7,60 (м, 1H), 8,72 (с, 0,4H), 8,75 (д, J=3,9 Гц, 1H).
<ПРИМЕР 207> (4R)-N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-оксотиазолидин-4-карбоксамид
(4R)-N-(4b-Гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-оксотиазолидин-4-карбоксамид (100 мг, 0,213 ммоль) добавляли к 5 мл EtOH:H2O (10:1) с получением бледно-желтого мутного раствора, к которому затем добавляли порошок Fe (36 мг, 0,64 ммоль) и две капли конц. HCl при комнатной температуре с последующим перемешиванием в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь фильтровали, концентрировали и очищали при помощи препаративной ТСХ на силикагеле с использованием EtOAc/Hx (1/1) с получением указанного в заголовке соединения в виде желтого твердого вещества (47 мг, 0,11 ммоль, 50%).
1H-ЯМР (300 МГц, CD3OD) δ 1,170 (д, J=6,9 Гц, 3H), 1,173 (д, J=6,9 Гц, 3H), 2,83 (гепт., J=6,9 Гц, 1H), 3,49-3,78 (м, 2H), 4,46-4,53 (м, 1H), 6,66 (с, 1H), 6,70 (с, уш., 1H), 6,85 (д, уш., J=7,3 Гц, 1H), 7,00 (д, J=7,1 Гц, 1H), 7,35 (с, уш., 1H), 7,39-7,51 (м, 1H).
<ПРИМЕР 208> N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-индол-2-карбоксамид
Раствор индол-2-карбоновой кислоты (130 мг, 0,806 ммоль) в безводном ДХМ перемешивали вместе с оксалилхлоридом (0,08 мл, 0,967 ммоль) и катализатором при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали с получением индол-2-ацилхлорида. 9b-Амино-4b-гидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он (190 мг, 0,643 ммоль), индол-2-ацилхлорид (130 мг, 0,707 ммоль) и триэтиламин (0,13 мл, 0,964 ммоль) растворяли в безводном ДХМ (2 мл) и перемешивали при комнатной температуре в течение 2 часов. После экстракции ДХМ и водой, органический слой промывали солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме. Разделение и очистка при помощи хроматографии на колонке с силикагелем (30% этилацетат, смешанный с 20% гексаном) давали указанное в заголовке соединение. 50 мг (38%).
1H-ЯМР (300 МГц, CDCl3) δ 1,18 (дд, J=7,2 Гц, 2,4 Гц, 6H, CH3) 2,85 (гепт., J=6,9 Гц, 1H, CH) 6,68 (с, 1H, ArH/NH/OH) 6,92 (д, J=8,1, 1H, ArH) 7,01-7,06 (м, 1H, ArH) 7,19 (д, J=7,8 Гц, 1H, ArH) 7,22 (с, 1H, ArH) 7,38 (д, J=8,1 Гц, 1H, ArH) 7,47 (д, J=8,1 Гц, 1H, ArH) 7,59 (д, J=7,8 Гц, 1H, ArH) 7,74-7,88 (м, 3H, ArH).
<ПРИМЕР 209> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-индол-3-карбоксамид
Триэтиламин (0,35 мл, 2,53 ммоль) и индол-3-ацилхлорид (330 мг, 0,186 ммоль) добавляли к раствору 9b-амино-4b-гидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-она (500 мг, 1,69 ммоль) в безводном ДХМ (5 мл) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь экстрагировали ДХМ и водой, и органический слой промывали солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме. Разделение и очистка при помощи хроматографии на колонке с силикагелем (30% этилацетат, смешанный с 30% гексаном) давали указанное в заголовке соединение. 60 мг (9%).
1H-ЯМР (300 МГц, CDCl3) δ 1,15 (дд, J=6,8 Гц, J=2,4 Гц, 6H, CH3) 2,78 (гепт., J=6,8 Гц, 1H, CH) 6,80 (д, J=8,1 Гц, 1H, ArH) 7,21 (с, 1H, ArH) 7,37-7,58 (м, 2H, ArH) 7,55-7,58 (м, 1H, ArH) 7,75 (д, J=2,7 Гц, 1H, ArH) 7,813-7,850 (м, 2H, ArH) 7,99-8,07 (м, 2H, ArH) 8,95 (с, 1H, NH/ArH).
<ПРИМЕР 210> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)формамид
9b-Амино-4b-гидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он (300 мг, 1,01 ммоль) вместе с 5-нитро-3-пиразолкарбоновой кислотой (175 мг, 1,11 ммоль) растворяли в безводном ДХМ (3 мл), к которым затем добавляли EDCI.HCl (290 мг, 1,52 ммоль) и HOBt (205 мг, 1,52 ммоль) с последующим перемешиванием в течение ночи при комнатной температуре. Затем экстрагировали ДХМ и водой, органический слой промывали солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме. Разделение и очистка при помощи хроматографии на колонке с силикагелем (30% этилацетат, смешанный с 40% гексаном) давали указанное в заголовке соединение. 150 мг (34%).
1H-ЯМР (300 МГц, CDCl3) δ 1,17 (дд, J=6,9 Гц, J=2,4 Гц, 6H, CH3) 2,84 (гепт., J=6,9 Гц, 1H, CH) 6,91 (д, J=8,1 Гц, 1H, ArH) 6,68 (с, 1H, ArH/NH/OH) 7,42 (д, J=8,1 Гц, 1H, ArH) 7,60 (с, 2H, ArH.) 7,71-7,9 (м, 2H, ArH) 7,9-7,93 (м, H, ArH) 7,93 (с, уш., 1H, ArH).
<ПРИМЕР 211> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-фенил-5-(трифторметил)-1H-пиразол-4-карбоксамид
9b-Амино-4b-гидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он (200 мг, 0,677 ммоль) и 1-H-фенил-5-(трифторметил)-1H-пиразол-4-карбоновую кислоту (190 мг, 0,744 ммоль) растворяли в безводном ДХМ (2 мл), к которым затем добавляли EDCI.HCl (190 мг, 1,015 ммоль) и HOBt (137 мг, 1,015 ммоль) с последующим перемешиванием в течение ночи при комнатной температуре. После экстракции ДХМ и водой, органический слой промывали солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме. Разделение и очистка темно-коричневой смеси при помощи хроматографии на колонке с силикагелем (30% этилацетат, смешанный с 40% гексаном) давали указанное в заголовке соединение. 50 мг (14%).
1H-ЯМР (300 МГц, CDCl3) δ 1,17 (дд, J=6,9 Гц, J=2,4 Гц, 6H, CH3) 2,84 (гепт., 1H, CH) 6,68 (с, 1H, ArH/NH/OH) 6,90 (д, J=8,1 Гц, 1H, ArH) 7,42-7,46 (м, 3H, ArH) 7,54-7,62 (м, 4H, ArH) 7,75-7,90 (м, 2H, ArH) 7,90-8,10 (м, 1H, ArH) 8,10 (с, 1H, ArH/NH).
<ПРИМЕР 212> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-индазол-3-карбоксамид
N-(4b-Гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-индазол-3-карбоксамид (190 мг, 0,39 ммоль) растворяли в растворителе этанол:вода (10 мл:1 мл) и добавляли Fe (66 мг, 1,17 ммоль), а затем две капли конц. HCl. Реакционную смесь нагревали в течение 3 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:2) давала указанное в заголовке соединение в виде желтого твердого вещества (92 мг, 52%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3), 2,83 (септ., J=6,9 Гц, 1H, CH), 6,67~6,72 (м, 2H, ArH), 6,88 (дд, J=7,9 Гц, 1,0 Гц, 1H, ArH), 7,03 (д, J=7,3 Гц, 1H, ArH), 7,19 (т, J=7,6 Гц, 1H, ArH), 7,38 (т, J=7,5 Гц, 1H, ArH), 7,43~7,57 (м, 3H, ArH), 8,09 (д, J=8,2 Гц, 1H, ArH).
<ПРИМЕР 213> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-(1H-тетразол-1-ил)ацетамид
N-(4b-Гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-(1H-тетразол-1-ил)ацетамид (200 мг, 0,44 ммоль) растворяли в растворителе этанол:вода (10 мл:1 мл) и добавляли Fe (74 мг, 1,32 ммоль), а затем две капли конц. HCl. Реакционную смесь нагревали в течение 3 часов при кипячении с обратным холодильником. После концентрирования в вакууме, очистка при помощи хроматографии на колонке (этилацетат:н-гексан=2:1) давала указанное в заголовке соединение в виде желтого твердого вещества (104 мг, 56%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (дд, J=6,9 Гц, 1,2 Гц, 6H, CH3), 2,83 (септ., J=6,9 Гц, 1H, CH), 5,36 (м, 2H, CH2), 6,62~6,66 (м, 2H, ArH), 6,87 (дд, J=7,9 Гц, 1,1 Гц, 1H, ArH), 6,96 (д, J=7,3 Гц, 1H, ArH), 7,38~7,43 (м, 2H, ArH), 9,11 (с, 1H, ArH).
<ПРИМЕР 214> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-3-карбоксамид
Порошок железа (0,11 г, 1,9 ммоль), конц. HCl (0,03 мл) и воду (0,8 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)хинолин-3-карбоксамида (0,13 г, 0,27 ммоль) в абсолютном этаноле (8 мл) и нагревали в течение 1 часа при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа. Фильтрат концентрировали в вакууме и очищали в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 82 мг (65%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,9 Гц, 6H, CH3) 2,80-2,90 (септ., 1H, CH) 6,70-6,74 (м, 2H, ArH) 6,89 (д, J=7,8 Гц, 1H, ArH) 7,04 (д, J=7,2 Гц, 1H, ArH) 7,48 (т, J=7,2 Гц, 2H, ArH) 7,68 (т, J=7,2 Гц, 1H, ArH) 7,87 (т, J=7,8 Гц, 1H, ArH) 8,02-8,08 (м, 2H, ArH) 8,86 (с, 1H, ArH) 9,23 (с, 1H, ArH).
<ПРИМЕР 215> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-4-карбоксамид
Порошок железа (0,12 г, 2,20 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)хинолин-4-карбоксамида (0,15 г, 0,30 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 1 часа при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа. Фильтрат концентрировали в вакууме и очищали в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:2), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 0,12 г (92%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,9 Гц, 6H, CH3) 2,77-2,86 (септ., 1H, CH) 6,66 (с, 1H, NH) 6,74-6,87 (м, 2H, ArH) 7,08 (д, J=7,4 Гц, 1H, ArH) 7,40-7,54 (м, 2H, ArH) 7,65-7,72 (м, 2H, ArH) 7,81 (т, J=7,8 Гц, 1H, ArH) 8,06 (д, J=8,7 Гц, 1H, ArH) 8,40 (д, J=8,4 Гц, 1H, ArH) 8,90 (д, J=4,1 Гц, 1H, ArH).
<ПРИМЕР 216> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5-метилтиофен-2-карбоксамид
Порошок железа (0,06 г, 1,24 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-5-метилтиофен-2-карбоксамида (0,08 г, 0,17 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 1 часа при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка железа. Фильтрат концентрировали в вакууме и очищали в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 67 мг (90%).
1H-ЯМР (500 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,53 (с, 3H, Me) 2,75-2,84 (септ., 1H, CH) 6,57 (д, J=8,1 Гц, 1H, ArH) 6,64-6,71 (м, 2H, ArH) 6,76 (с, 1H, ArH) 6,87 (д, J=3,0 Гц, 1H, ArH) 7,24 (д, J=8,1 Гц, 1H, ArH) 7,32 (т, J=8,1 Гц, 1H, ArH) 7,68 (д, J=3,6 Гц, 1H, ArH).
<ПРИМЕР 217> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-метокситиофен-3-карбоксамид
Порошок Fe (0,06 г, 1,24 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-метокситиофен-3-карбоксамида (0,28 г, 0,58 ммоль) и нагревали в течение 1 часа при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат концентрировали в вакууме и очищали в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, а затем перекристаллизовывали из метиленхлорида с получением указанного в заголовке соединения. 77 мг (29%).
1H-ЯМР (500 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,75-2,84 (септ., 1H, CH) 3,89 (с, 3H, OMe) 6,62-6,69 (м, 3H, ArH) 6,82-6,90 (м, 1H, ArH) 6,96-7,05 (м, 1H, ArH) 7,38-7,47 (м, 2H, ArH) 7,95 (с, 1H, ArH).
<ПРИМЕР 218> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиколинамид
Раствор пиколиновой кислоты (0,26 г, 2,1 ммоль) в безводном MeCN (30 мл) перемешивали вместе с EDCI (0,45 г, 2,3 ммоль) и HOBt (0,25 г, 1,8 ммоль) при комнатной температуре в течение 10 мин, а затем вместе с 9b-амино-4b-гидрокси-7-изопропил-1-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-оном (0,52 г, 1,76 ммоль) при комнатной температуре в течение 3 часов. Реакционную смесь разбавляли в метиленхлориде и многократно промывали водой, органический слой сушили и фильтровали. Очистка при помощи хроматографии на колонке (этилацетат:гексан=1:4) давала указанное в заголовке соединение. 0,53 г (76%).
1H-ЯМР (300 МГц, CDCl3) δ 1,16 (д, J=6,9 Гц, 6H, CH3) 2,83 (септ., J=6,9 Гц, 1H, CH) 5,69 (с, 1H) 6,75 (с, 1H) 6,83 (д, J=7,8 Гц, 1H, ArH) 7,36 (д, J=7,8 Гц, 1H, ArH) 7,44-7,48 (м, 1H, ArH) 7,55-7,60 (м, 1H, ArH) 7,80-7,86 (м, 3H, ArH) 8,02-8,09 (м, 2H, ArH) 8,60-8,61 (м, 1H, ArH) 9,17 (с, 1H).
<ПРИМЕР 219> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиримидин-4-карбоксамид
Раствор изоникотиновой кислоты (0,26 г, 2,1 ммоль) в безводном метиленхлориде (20 мл) и диметилформамиде (10 мл) перемешивали вместе с EDCI (0,45 г, 2,3 ммоль) и HOBt (0,25 г, 1,8 ммоль) в течение 10 мин при комнатной температуре, а затем вместе с 9b-амино-4b-гидрокси-7-изопропил-1-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-оном (0,46 г, 1,56 ммоль) в течение 24 часов при комнатной температуре. Реакционную смесь разбавляли в метиленхлориде и многократно промывали водой, органический слой сушили и фильтровали. Очистка при помощи хроматографии на колонке (этилацетат:гексан=1:4) давала указанное в заголовке соединение. 0,20 г (32%).
1H-ЯМР (300 МГц, CD3OD) δ 1,20 (д, J=6,9 Гц, 6H, CH3) 2,81-2,90 (м, 1H, CH) 6,70 (уш. с, 1H, ArH) 6,91-6,93 (м, 1H, ArH) 7,42-7,47 (м, 1H, ArH) 7,72-7,82 (м, 6H) 8,66-8,68 (м, 2H, ArH).
<ПРИМЕР 220> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-(1H-тетразол-5-ил)ацетамид
Раствор 1H-тетразол-5-уксусной кислоты (131 мг, 1,02 ммоль) в метиленхлориде (20 мл) и ДМФ (5 мл) перемешивали вместе с EDCI (196 мг, 1,02 ммоль) и HOBt (138 мг, 1,02 ммоль) в течение 20 мин, а затем вместе с 4b-амино-9b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-оном (300 мг, 1,02 ммоль) в течение ночи при комнатной температуре. После экстракции метиленхлоридом и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (20% метанол в метиленхлориде) давала указанное в заголовке соединение в виде белого твердого вещества (136 мг, 33%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16 (д, J=6,9 Гц, 6H, CH3), 2,83 (септ., J=6,9 Гц, 1H, CH), 3,97 (с, 2H, ArH), 6,66 (с, 1H, ArH), 6,88 (дд, J=8,0 Гц, 1,1 Гц, 1H, ArH), 7,36 (д, J=7,9 Гц, 1H, ArH), 7,68~7,79 (м, 3H, ArH).
<ПРИМЕР 221> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-бензо[d][1,2,3]триазол-5-карбоксамид
Раствор бензотриазол-5-карбоновой кислоты (166 мг, 1,02 ммоль) в метиленхлориде (20 мл) и ДМФ (5 мл) подвергали реакции с EDCI (196 мг, 1,02 ммоль) и HOBt (138 мг, 1,02 ммоль) в течение 20 мин, а затем перемешивали вместе с 4b-амино-9b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-оном (300 мг, 1,02 ммоль) в течение ночи при комнатной температуре. После экстракции метиленхлоридом и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (этилацетат:н-гексан=2:1) давала N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-бензо[d][1,2,3]триазол-5-карбоксамид в виде белого твердого вещества (210 мг, 47%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3), 2,85 (септ., J=6,9 Гц, 1H, CH), 6,69 (д, J=1,2 Гц, 1H, ArH), 6,91 (дд, J=7,9 Гц, 1,2 Гц, 1H, ArH), 7,48 (д, J=7,9 Гц, 1H, ArH), 7,62 (м, 1H, ArH), 7,79~7,97 (м, 5H, ArH), 8,49 (с, 1H, ArH).
<ПРИМЕР 222> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-1,2,4-триазол-3-карбоксамид
1,2,4-Триазол-3-карбоновую кислоту (116 мг, 1,02 ммоль) растворяли в метиленхлориде (20 мл) и ДМФ (5 мл) и проводили реакцию с EDCI (196 мг, 1,02 ммоль) и HOBt (138 мг, 1,02 ммоль) в течение 20 мин, а затем перемешивали вместе с 4b-амино-9b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-оном (300 мг, 1,02 ммоль) в течение ночи при комнатной температуре. После экстракции метиленхлоридом и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (10% метанол в метиленхлориде) давала указанное в заголовке соединение в виде белого твердого вещества. (141 мг, 35%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,9 Гц, 6H, CH3), 2,85 (септ., J=6,9 Гц, 1H, CH), 6,68 (с, 1H, ArH), 6,90 (д, J=8,0 Гц, 1H, ArH), 7,45 (д, J=7,9 Гц, 1H, ArH), 7,60~7,97 (м, 4H, ArH), 8,40 (с, 1H, ArH).
<ПРИМЕР 223> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-5-нитротиофен-2-карбоксамид
5-Нитротиофен-2-карбоновую кислоту (212 мг, 1,22 ммоль) растворяли в метиленхлориде (20 мл) и ДМФ (5 мл) и проводили реакцию с EDCI (234 мг, 1,22 ммоль) и HOBt (165 мг, 1,22 ммоль) в течение 20 мин, а затем перемешивали вместе с 4b-амино-9b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-оном (300 мг, 1,22 ммоль) в течение ночи при комнатной температуре. После экстракции метиленхлоридом и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:1) давала N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-5-нитротиофен-2-карбоксамид в виде желтого твердого вещества (80 мг, 17%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,9 Гц, 6H, CH3), 2,83 (септ., J=6,9 Гц, 1H, CH), 6,67 (с, 1H, ArH), 6,90 (д, J=7,9 Гц, 1H, ArH), 7,43 (д, J=7,9 Гц, 1H, ArH), 7,71~7,73 (м, 2H, ArH), 7,73~7,93 (м, 4H, ArH).
<ПРИМЕР 224> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2,6-диоксо-1,2,3,6-тетрагидропиримидин-4-карбоксамид
Оротовую кислоту (190 мг, 1,22 ммоль) растворяли в метиленхлориде (20 мл) и ДМФ (5 мл), проводили реакцию с EDCI (233 мг, 1,22 ммоль) и HOBt (165 мг, 1,22 ммоль) в течение 20 минут, а затем перемешивали вместе с 4b-амино-9b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-оном (300 мг, 1,02 ммоль) в течение ночи при комнатной температуре. После экстракции метиленхлоридом и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (10% метанол в метиленхлориде) давала N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2,6-диоксо-1,2,3,6-тетрагидропиримидин-4-карбоксамид в виде белого твердого вещества (91 мг, 21%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16 (д, J=6,9 Гц, 6H, CH3), 2,83 (септ., J=6,9 Гц, 1H, CH), 6,30 (с, 1H, ArH), 6,67 (с, 1H, ArH), 6,90 (д, J=8,0 Гц, 1H, ArH), 7,39 (д, J=7,8 Гц, 1H, ArH), 7,60~7,93 (м, 4H, ArH).
<ПРИМЕР 225> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-оксо-2H-хромен-3-карбоксамид
Кумарин-3-карбоновую кислоту (232 мг, 1,22 ммоль) растворяли в метиленхлориде (20 мл) и ДМФ (5 мл), проводили реакцию с EDCI (234 мг, 1,22 ммоль) и HOBt (165 мг, 1,22 ммоль) в течение 20 мин, а затем перемешивали вместе с 4b-амино-9b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-оном (300 мг, 1,02 ммоль) в течение ночи при комнатной температуре. После экстракции метиленхлоридом и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:2) давала указанное в заголовке соединение в виде белого твердого вещества (377 мг, 79%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,9 Гц, 6H, CH3), 2,86 (септ., J=6,9 Гц, 1H, CH), 6,70 (с, 1H, ArH), 6,92 (д, J=7,9 Гц, 1H, ArH), 7,41~7,45 (м, 3H, ArH), 7,72~7,81 (м, 4H, ArH), 7,88~7,89 (м, 2H, ArH), 8,74 (с, 1H, ArH).
<ПРИМЕР 226> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-оксо-2H-пиран-5-карбоксамид
Кумаровую кислоту (171 мг, 1,22 ммоль) растворяли в метиленхлориде (20 мл) и ДМФ (5 мл), проводили реакцию с EDCI (234 мг, 1,22 ммоль) и HOBt (165 мг, 1,22 ммоль) в течение 20 мин, а затем перемешивали вместе с 4b-амино-9b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-оном (300 мг, 1,02 ммоль) в течение ночи при комнатной температуре. После экстракции метиленхлоридом и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:1) давала указанное в заголовке соединение в виде желтого твердого вещества (60 мг, 14%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16 (дд, J=6,9 Гц, 2,8 Гц, 6H, CH3), 2,84 (септ., J=6,9 Гц, 1H, CH), 5,61 (д, J=9,3 Гц, 1H, ArH), 6,78 (с, 1H, ArH), 6,93 (дд, J=7,9 Гц, 1,0 Гц, 1H, ArH), 7,44 (д, J=7,9 Гц, 1H, ArH), 7,49 (д, J=9,3 Гц, 1H, ArH), 7,63 (т, J=7,4 Гц, 1H, ArH), 7,81 (д, J=7,7 Гц, 1H, ArH), 7,87~7,92 (м, 2H, ArH), 8,01 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 227> N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-бензо[d]имидазол-2-карбоксамид
1H-Бензимидазол-2-карбоновую кислоту (183 мг, 1,02 ммоль) растворяли в метиленхлориде (20 мл) и ДМФ (5 мл), проводили реакцию в течение 20 мин с EDCI (195 мг, 1,02 ммоль) и HOBt (138 мг, 1,02 ммоль) и перемешивали при комнатной температуре в течение ночи вместе с 4b-амино-9b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-оном (250 мг, 0,85 ммоль). После экстракции метиленхлоридом и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:1) давала N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-бензо[d]имидазол-2-карбоксамид в виде белого твердого вещества (210 мг, 56%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,9 Гц, 6H, CH3), 2,86 (септ., J=6,9 Гц, 1H, CH), 6,69 (с, 1H, ArH), 6,93 (дд, J=7,9 Гц, 1,2 Гц, 1H, ArH), 7,32~7,35 (м, 2H, ArH), 7,49 (д, J=7,9 Гц, 1H, ArH), 7,63~7,64 (м, 4H, ArH), 7,89~7,91 (м, 2H, ArH).
<ПРИМЕР 228> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-карбоксамид
5-(2-Хлор-6-фторфенил)-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-метилциклопента-1,4-диенкарбоксамид (100 мг, 0,173 ммоль) добавляли к 5 мл EtOH:H2O (10:1) с получением бледно-желтого мутного раствора, к которому затем добавляли порошок Fe (41 мг, 0,73 ммоль) и три капли конц. HCl при комнатной температуре, с последующим перемешиванием в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь фильтровали, концентрировали и очищали при помощи препаративной ТСХ на силикагеле, используя EtOAc/Hx (1/1), с получением указанного в заголовке соединения в виде желтого твердого вещества (26,7 мг, 0,487 ммоль, 28%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16 (д, J=6,9 Гц, 3H), 1,17 (д, J=6,8 Гц, 3H), 2,72 (с, 3H), 2,73-2,88 (м, 1H), 6,62 (с, 1H), 6,63-6,82 (м, 2H), 6,93-7,17 (м, 2H), 7,19-7,25 (м, 1H), 7,39-7,52 (м, 3H).
<ПРИМЕР 229> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-фенил-1H-пиразол-5-карбоксамид
3-Фенил-1H-пиразол-5-карбоновую кислоту (116 мг, 0,616 ммоль) вместе с HOBt (316 мг, 2,34 ммоль) и EDCI.HCl (441 мг, 2,30 ммоль) растворяли в CH2Cl2 (10 мл), к которым затем добавляли раствор 9b-амино-4b-гидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он (500 мг, 1,69 ммоль) в CH2Cl2 (5 мл), с последующим перемешиванием при комнатной температуре в течение 2 часов. Полученную желтую реакционную смесь смешивали с водой и затем дважды экстрагировали CH2Cl2. Органический слой обезвоживали над безводным сульфатом магния и концентрировали. Концентрат очищали при помощи хроматографии на колонке с силикагелем, используя EtOAc/Hx (1/3-1/2), с получением указанного в заголовке соединения в виде белого твердого вещества (144,7 мг, 0,311 ммоль, 50%).
1H-ЯМР (300 МГц, CD3OD) δ 1,13-1,23 (м, 6H), 2,77-2,92 (м, 1H), 6,68 (с, 1H), 6,90 (д, J=7,9 Гц, 1H), 6,93-7,09 (м, 2H), 7,31-7,52 (м, 4H), 7,52-8,07 (м, 6H).
<ПРИМЕР 230> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)никотинамид
EDCI (0,48 г, 2,53 ммоль), 9b-амино-4b-гидрокси-7-изопропил-1-нитро-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он (0,50 г, 1,46 ммоль) и HOBt (0,34 г, 2,53 ммоль) добавляли при 0°C в указанном порядке к раствору никотиновой кислоты (0,31 г, 2,53 ммоль) в безводном ТГФ (10 мл) и ДМФ (3 мл), с последующим перемешиванием при комнатной температуре в течение 2 суток. На протяжении реакции твердые вещества промывали ТГФ и водой, фильтровали и сушили с получением указанного в заголовке соединения. 0,33 г (49%).
1H-ЯМР (300 МГц, CDCl3) δ 1,14 (д, J=6,3 Гц, 6H, CH3) 2,71-2,82 (септ., 1H, CH) 6,67 (с, 1H, NH) 6,80 (д, J=7,5 Гц, 1H, ArH) 7,30 (т, J=6,0 Гц, 1H, ArH) 7,38 (д, J=7,8 Гц, 1H, ArH) 7,53 (т, J=7,2 Гц, 1H, ArH) 7,63 (с, 1H, ArH) 7,73-7,82 (м, 2H, ArH) 7,91 (с, 1H, OH) 7,97 (д, J=7,8 Гц, 1H, ArH) 8,10 (д, J=7,2 Гц, 1H, ArH) 8,56 (д, J=3,9 Гц, 1H, ArH) 8,96 (с, 1H, ArH).
<ПРИМЕР 231> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-оксо-2-(тиофен-2-ил)ацетамид
Порошок Fe (0,30 г, 5,47 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)тиофен-2-карбоксамида (0,36 г, 0,75 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат концентрировали в вакууме и очищали в течение 30 минут при помощи хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 0,28 г (83%).
1H-ЯМР (500 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,81-2,86 (септ., 1H, CH) 6,61-6,72 (м, 2H, ArH) 6,88 (д, J=7,5 Гц, 1H, ArH) 7,01 (д, J=7,2 Гц, 1H, ArH) 7,20 (т, J=5,1 Гц, 1H, ArH) 7,40 (д, J=7,5 Гц, 1H, ArH) 7,46 (т, J=7,8 Гц, 1H, ArH) 7,96 (д, J=4,5 Гц, 1H, ArH) 8,25 (д, J=2,7 Гц, 1H, ArH).
<ПРИМЕР 232> 5-Амино-N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)фуран-2-карбоксамид
Порошок Fe (0,32 г, 5,78 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору 5-амино-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)фуран-2-карбоксамида (0,38 г, 0,79 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат концентрировали в вакууме и очищали при помощи хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 61 мг (48%).
1H-ЯМР (300 МГц, CD3OD) δ 1,25 (д, J=6,6 Гц, 6H, CH3) 2,84-2,86 (септ., 1H, CH) 6,75 (с, 1H, ArH) 6,88-6,94 (м, 2H, ArH) 7,08-7,11 (м, 1H, ArH) 7,25 (т, J=7,5 Гц, 1H, ArH) 7,34-7,38 (м, 1H, ArH) 7,38-7,50 (м, 2H, ArH).
<ПРИМЕР 233> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-пиррол-2-карбоксамид
Порошок Fe(0,09 г, 1,6 ммоль), конц. HCl (0,03 мл) и воду (0,8 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-пиррол-2-карбоксамида (0,10 г, 0,23 ммоль) в этаноле (8 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат концентрировали в вакууме и очищали в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:2), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 90 мг (96%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,6 Гц, 6H, CH3) 2,82-2,86 (септ., 1H, CH) 6,16 (д, J=2,7 Гц, 1H, ArH) 6,88 (с, 1H, ArH) 6,70-6,74 (м, 1H, ArH) 6,85-6,90 (м, 3H, ArH) 7,03 (д, J=5,1 Гц, 1H, ArH) 7,30-7,46 (м, 2H, ArH).
<ПРИМЕР 234> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-метоксиизоникотинамид
Порошок Fe (0,12 г, 2,30 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-метоксиизоникотинамида (0,15 г, 0,31 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат концентрировали в вакууме и очищали в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 0,10 г (71%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,9 Гц, 6H, CH3) 2,78-2,87 (септ., 1H, CH) 3,91 (с, 3H, OMe) 6,67 (с, 1H, ArH) 6,74 (м, 1H, ArH) 6,85 (д, J=8,1 Гц, 1H, ArH) 7,02 (д, J=7,2 Гц, 1H, ArH) 7,19 (с, 1H, ArH) 7,29 (д, J=5,4 Гц, 1H, ArH) 7,39-7,48 (м, 2H, ArH) 8,20 (д, J=4,8 Гц, 1H, ArH).
<ПРИМЕР 235> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)бензо[b]тиофен-2-карбоксамид
Fe (50 мг, 0,90 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)бензо[b]тиофен-2-карбоксамида (150 мг, 0,30 ммоль) в растворителе этанол:H2O (10 мл:1 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:3) давала указанное в заголовке соединение в виде желтого твердого вещества (76 мг, 54%).
1H-ЯМР (500 МГц, CD3OD) δ 1,19 (дд, J=6,9 Гц, 1,2 Гц, 6H, CH3), 2,85 (септ., J=6,9 Гц, 1H, CH), 6,67~6,70 (м, 2H, ArH), 6,90 (д, J=7,8 Гц, 1H, ArH), 7,01 (д, J=7,3 Гц, 1H, ArH), 7,39~7,48 (м, 4H, ArH), 7,87 (д, J=7,5 Гц, 1H, ArH), 8,10 (с, 1H, ArH).
<ПРИМЕР 236> 3-(2,6-Дихлорфенил)-N-(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-5-метилизоксазол-4-карбоксамид
Раствор 4b-амино-9b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-она (300 мг, 1,02 ммоль) в метиленхлориде (20 мл) перемешивали в течение ночи вместе с 3-(2,6-дихлорфенил)-5-метил-4-изоксазолкарбонилхлоридом (355 мг, 1,22 ммоль) и триэтиламином (0,3 мл, 1,83 ммоль) при комнатной температуре. После завершения реакции, концентрирование в вакууме и очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:3) давали указанное в заголовке соединение (109 мг, 19%).
1H-ЯМР (300 МГц, CDCl3) δ 1,14 (дд, J=6,8 Гц, 6H, CH3), 2,75 (с, 3H, CH3), 2,78 (септ., J=6,8 Гц, 1H, CH), 6,02 (с, 1H), 6,56 (с, 1H), 6,680 (с, 1H, ArH), 6,75 (д, J=7,8 Гц, 1H, ArH), 6,88 (д, J=7,8 Гц, 1H, ArH), 7,48 (т, J=7,5 Гц, 1H, ArH), 7,51~7,68 (м, 4H, ArH), 7,76 (т, J=7,5 Гц, 1H, ArH), 7,98 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 237> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-9H-ксантен-9-карбоксамид
Fe (37 мг, 0,66 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-9H-ксантен-9-карбоксамида (120 мг, 0,22 ммоль) в растворителе этанол:вода (10 мл:1 мл) и нагревали в течение 1,5 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:2) давала указанное в заголовке соединение в виде желтого твердого вещества (65 мг, 57%).
1H-ЯМР (500 МГц, CD3OD) δ 1,18 (дд, J=6,9 Гц, 2,3 Гц, 6H, CH3), 2,84 (септ., J=6,9 Гц, 1H, CH), 5,09 (с, 1H, CH), 6,59 (с, 1H, ArH), 6,66 (с, 1H, ArH), 6,88-6,94 (м, 2H, ArH), 7,01-7,06 (м, 3H, ArH), 7,15 (м, 1H, ArH), 7,22 (м, 1H, ArH), 7,28 (т, J=7,3 Гц, 1H, ArH), 7,36 (м, 1H, ArH), 7,42-7,45 (м, 2H, ArH), 7,54 (м, 1H, ArH).
<ПРИМЕР 238> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)циннолин-4-карбоксамид
Fe (85 мг, 1,51 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)циннолин-4-карбоксамида (250 мг, 0,50 ммоль) в растворителе этанол:вода (20 мл:2 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:1) давала указанное в заголовке соединение в виде желтого твердого вещества (230 мг, 99%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16 (д, J=6,9 Гц, 6H, CH3), 2,82 (септ., J=6,9 Гц, 1H, CH), 6,68 (с, 1H, ArH), 6,72 (д, J=8,1 Гц, 1H, ArH), 6,86 (д, J=8,1 Гц, 1H, ArH), 7,07 (д, J=7,1 Гц, 1H, ArH), 7,44-7,51 (м, 2H, ArH), 7,90~8,01 (м, 2H, ArH), 8,44-8,51 (м, 2H, ArH), 9,46 (с, 1H, ArH).
<ПРИМЕР 239> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)циннолин-4-карбоксамид
Раствор циннолин-4-карбоновой кислоты (183 мг, 1,02 ммоль) в метиленхлориде (20 мл) подвергали реакции с EDCI (195 мг, 1,02 ммоль) и HOBt (138 мг, 1,02 ммоль) в течение 20 мин, а затем перемешивали в течение ночи вместе с 4b-амино-9b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-оном (250 мг, 0,85 ммоль) при комнатной температуре. После экстракции метиленхлоридом и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:1) давала указанное в заголовке соединение в виде белого твердого вещества (290 мг, 63%).
1H-ЯМР (300 МГц, CD3OD) δ 1,15 (д, J=6,8 Гц, 6H, CH3), 2,82 (септ., J=6,8 Гц, 1H, CH), 6,69 (с, 1H, ArH), 6,89 (д, J=7,8 Гц, 1H, ArH), 7,45 (д, J=7,9 Гц, 1H, ArH), 7,65 (м, 1H, ArH), 7,85-8,03 (м, 5H, ArH), 8,42 (д, J=8,0 Гц, 1H, ArH), 8,51 (д, J=8,4 Гц, 1H, ArH), 9,45 (с, 1H, ArH).
<ПРИМЕР 240> N-(4b-Гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-бензо[d]имидазол-5-карбоксамид
5-Бензимидазолкарбоновую кислоту (198 мг, 1,22 ммоль) растворяли в метиленхлориде (20 мл) и ДМФ (3 мл), проводили реакцию с EDCI (233 мг, 1,22 ммоль) и HOBt (165 мг, 1,22 ммоль) в течение 20 мин, а затем перемешивали вместе с 4b-амино-9b-гидрокси-7-изопропил-4b,9b-дигидро-5-оксаиндено[2,1-a]инден-10-оном (300 мг, 1,02 ммоль) в течение ночи при комнатной температуре. После экстракции метиленхлоридом и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (MC в MeOH 10%) давала указанное в заголовке соединение в виде белого твердого вещества (207 мг, 46%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,8 Гц, 6H, CH3), 2,85 (септ., J=6,8 Гц, 1H, CH), 6,68 (с, 1H, ArH), 6,92 (д, J=7,8 Гц, 1H, ArH), 7,49 (д, J=8,1 Гц, 1H, ArH), 7,61~7,64 (м, 2H, ArH), 7,78~7,83 (м, 3H, ArH), 7,96 (д, J=7,5 Гц, 1H, ArH), 8,19 (с, 1H, ArH), 8,26 (с, 1H, ArH).
<ПРИМЕР 241> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)акридин-9-карбоксамид
Fe (46 мг, 0,82 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)акридин-9-карбоксамида (150 мг, 0,27 ммоль) в растворителе этанол:вода (20 мл:2 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:1) давала указанное в заголовке соединение в виде желтого твердого вещества (90 мг, 65%).
1H-ЯМР (500 МГц, CD3OD) δ 1,14 (д, J=6,9 Гц, 6H, CH3), 2,80 (септ., J=6,9 Гц, 1H, CH), 6,67 (с, 1H, ArH), 6,74 (д, J=7,4 Гц, 1H, ArH), 6,81 (д, J=7,5 Гц, 1H, ArH), 7,13 (д, J=6,8 Гц, 1H, ArH), 7,42 (д, J=7,0 Гц, 1H, ArH), 7,51 (т, J=7,5 Гц, 1H, ArH), 7,62 (т, J=7,1 Гц, 1H, ArH), 7,80 (т, J=7,0 Гц, 1H, ArH), 7,84 (т, J=6,8 Гц, 1H, ArH), 8,13-8,18 (м, 2H, ArH), 8,56 (д, J=7,5 Гц, 1H, ArH), 8,72 (д, J=7,5 Гц, 1H, ArH).
<ПРИМЕР 242> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-нитро-1H-пиразол-3-карбоксамид
Fe (76 мг, 1,36 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-нитро-1H-пиразол-3-карбоксамида (217 мг, 0,45 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (метанол в метиленхлориде 5%) давала указанное в заголовке соединение в виде желтого твердого вещества (134 мг, 71%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,8 Гц, 6H, CH3), 2,84 (септ., J=6,8 Гц, 1H, CH), 6,66-6,68 (м, 2H, ArH), 6,87-6,89 (м, 1H, ArH), 7,01-7,03 (м, 1H, ArH), 7,44-7,48 (м, 2H, ArH), 8,48 (с, 1H, ArH).
<ПРИМЕР 243> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-метилпиколинамид
Fe (109 мг, 1,96 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-метилпиколинамида (300 мг, 0,65 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:3) давала указанное в заголовке соединение в виде желтого твердого вещества (113 мг, 40%).
1H-ЯМР (300 МГц, CD3OD) δ 1,14 (д, J=6,7 Гц, 6H, CH3), 2,35 (с, 3H, CH3), 2,79 (септ., J=6,7 Гц, 1H, CH), 6,65~6,66 (м, 2H, ArH), 6,83 (д, J=5,9 Гц, 1H, ArH), 7,03 (д, J=6,2 Гц, 1H, ArH), 7,30 (д, J=4,1 Гц, 1H, ArH), 7,42~7,45 (м, 2H, ArH), 7,78 (д, 1H, ArH), 8,40 (д, J=4,6 Гц, 1H, ArH).
<ПРИМЕР 244> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-(трифторметил)пиколинамид
Fe (104 мг, 1,87 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-(трифторметил)пиколинамида (320 мг, 0,62 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 4 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:2) давала указанное в заголовке соединение в виде желтого твердого вещества (127 мг, 42%).
1H-ЯМР (300 МГц, CD3OD) δ 1,15 (д, J=6,8 Гц, 6H, CH3), 2,79 (септ., J=6,8 Гц, 1H, CH), 6,65~6,75 (м, 2H, ArH), 6,85 (д, J=6,7 Гц, 1H, ArH), 7,03 (д, J=6,7 Гц, 1H, ArH), 7,43~7,51 (м, 2H, ArH), 7,81 (д, J=4,6 Гц, 1H, ArH), 8,20 (с, 1H, ArH), 8,82 (д, J=4,6 Гц, 1H, ArH).
<ПРИМЕР 245> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-5-цианопиколинамид
Fe (107 мг, 1,91 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору 5-циано-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)пиколинамида (300 мг, 0,64 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 4 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:2) давала указанное в заголовке соединение в виде желтого твердого вещества (40 мг, 14%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,8 Гц, 6H, CH3), 2,83 (септ., J=6,8 Гц, 1H, CH), 6,68~6,73 (м, 2H, ArH), 6,86 (д, J=7,3 Гц, 1H, ArH), 7,02 (д, J=6,8 Гц, 1H, ArH), 8,11 (д, J=8,1 Гц, 1H, ArH), 8,31 (д, J=8,1 Гц, 1H, ArH), 8,92 (с, 1H, ArH).
<ПРИМЕР 246> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-хлорпиколинамид
Fe (157 мг, 2,81 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору 3-хлор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)пиколинамида (450 мг, 0,94 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 2,5 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:2) давала указанное в заголовке соединение в виде желтого твердого вещества (168 мг, 40%).
1H-ЯМР (500 МГц, CD3OD) δ 1,18 (дд, J=6,9 Гц, 2,2 Гц, 6H, CH3), 2,83 (септ., J=6,9 Гц, 1H, CH), 6,67 (м, 2H, ArH), 6,85~6,86 (м, 1H, ArH), 7,02~7,03 (м, 1H, ArH), 7,44~7,51 (м, 3H, ArH), 7,93 (дд, J=8,1 Гц, 1,1 Гц, 1H, ArH), 8,51 (д, J=4,1 Гц, 1H, ArH).
<ПРИМЕР 247> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-метоксихинолин-2-карбоксамид
Fe (140 мг, 2,51 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-метоксихинолин-2-карбоксамида (440 мг, 0,84 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (этилацетат:н-гексан=1:3) давала указанное в заголовке соединение в виде желтого твердого вещества (52 мг, 12%).
1H-ЯМР (300 МГц, CD3OD) δ 1,22 (д, J=6,9 Гц, 6H, CH3), 2,87 (септ., J=6,9 Гц, 1H, CH), 4,11 (с, 3H, OCH3), 6,72~6,74 (м, 2H, ArH), 6,90~6,93 (м, 1H, ArH), 7,03~7,06 (м, 1H, ArH), 7,45~7,55 (м, 3H, ArH), 7,61 (т, J=7,8 Гц, 1H, ArH), 7,77 (т, J=7,8 Гц, 1H, ArH), 8,05 (д, J=8,1 Гц, 1H, ArH), 8,24 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 248> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)изохинолин-3-карбоксамид
Порошок Fe (0,16 г, 2,92 ммоль), конц. HCl (0,04 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)изохинолин-3-карбоксамида (0,20 г, 0,40 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали. Этот фильтрат очищали в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 90 мг (50%).
1H-ЯМР (300 МГц, CD3OD) δ 1,20 (д, J=6,9 Гц, 6H, CH3) 2,81-2,88 (септ., 1H, CH) 6,70-6,80 (м, 2H, ArH) 6,85-6,90 (м, 1H, ArH) 7,07-7,10 (м, 1H, ArH) 7,45-7,52 (м, 2H, ArH) 7,77-7,87 (м, 2H, ArH) 8,05 (д, J=7,5 Гц, 1H, ArH) 8,17 (д, J=8,1 Гц, 1H, ArH) 8,43 (с, 1H, ArH) 9,27 (с, 1H, ArH).
<ПРИМЕР 249> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-2-метилизоникотинамид
Порошок Fe (0,17 г, 3,17 ммоль), конц. HCl (0,04 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2-метилизоникотинамида (0,20 г, 0,43 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали. Фильтрат очищали в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:2), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 0,13 г (72%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,9 Гц, 6H, CH3) 2,56 (с, 3H, CH3) 6,67-6,70 (м, 2H, ArH) 6,87 (д, J=6,9 Гц, 1H, ArH) 7,01 (д, J=6,3 Гц, 1H, ArH) 7,42-7,44 (м, 2H, ArH) 7,58 (д, J=5,1 Гц, 1H, ArH) 7,67 (с, 1H, ArH) 8,49 (д, J=5,1 Гц, 1H, ArH).
<ПРИМЕР 250> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-фторизоникотинамид
Порошок Fe (0,26 г, 4,72 ммоль), конц. HCl (0,04 мл) и воду (1 мл) добавляли в указанном порядке к раствору 3-фтор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)изоникотинамида (0,30 г, 0,64 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 минут при помощи хроматографии на колонке (этилацетат:гексан=1:2), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 0,16 г (84%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16 (д, J=6,9 Гц, 6H, CH3) 2,80-2,84 (м, 1H, CH) 6,67-6,72 (м, 2H, ArH) 6,86 (д, J=5,7 Гц, 1H, ArH) 7,02 (д, J=6,3 Гц, 1H, ArH) 7,43-7,46 (м, 2H, ArH) 7,66 (т, J=5,1 Гц, 1H, ArH) 8,46 (д, J=4,5 Гц, 1H, ArH) 8,56 (с, 1H, ArH).
<ПРИМЕР 251> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-хлоризоникотинамид
Порошок Fe (0,16 г, 3,04 ммоль), конц. HCl (0,04 мл) и воду (1 мл) добавляли в указанном порядке к раствору 3-хлор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)изоникотинамида (0,20 г, 0,41 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:2), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 0,15 г (83%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16 (д, J=6,6 Гц, 6H, CH3) 2,77-2,86 (м, 1H, CH) 6,66-6,71 (м, 2H, NH, ArH) 6,84 (д, J=7,5 Гц, 1H, ArH) 7,03 (д, J=6,9 Гц, 1H, ArH) 7,41-7,49 (м, 2H, ArH) 7,57 (д, J=4,8 Гц, 1H, ArH) 8,52 (д, J=4,8 Гц, 1H, ArH) 8,62 (с, 1H, ArH).
<ПРИМЕР 252> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-метил-1H-имидазол-2-карбоксамид
Порошок Fe (0,10 г, 1,95 ммоль), конц. HCl (0,04 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1-метил-1H-имидазол-2-карбоксамида (0,12 г, 0,26 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:2), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 20 мг (18%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,79-2,87 (м, 1H, CH) 3,89 (м, 3H, CH3) 6,67 (с, 1H, ArH) 6,73 (д, J=6,3 Гц, 1H, ArH) 6,86 (д, J=7,1 Гц, 1H, ArH) 7,00-7,02 (м, 2H, ArH) 7,20 (с, 1H, ArH) 7,39-7,48 (м, 2H, ArH).
<ПРИМЕР 253> 2-((1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)карбамоил)пиридин 1-оксид
Fe (109 мг, 1,95 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору 2-((4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)карбамоил)пиридин 1-оксида (300 мг, 0,65 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. После концентрирования в вакууме, очистка при помощи хроматографии на колонке (EtOAc:гексан=2:1) давала указанное в заголовке соединение в виде желтого твердого вещества (110 мг, 39%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,9 Гц, 6H, CH3), 2,84 (септ., J=6,9 Гц, 1H, CH), 6,68-6,76 (м, 2H, ArH), 6,87 (д, J=7,4 Гц, 1H, ArH), 7,02 (д, J=7,2 Гц, 1H, ArH), 7,39-7,50 (м, 2H, ArH), 7,62-7,64 (м, 2H, ArH), 8,20-8,23 (м, 1H, ArH), 8,39-8,40 (м, 1H, ArH).
<ПРИМЕР 254> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-хлорникотинамид
Fe (24 мг, 0,44 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору 4-хлор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)никотинамида (70 мг, 0,15 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (10% MeOH в CH2Cl2) давала указанное в заголовке соединение в виде желтого твердого вещества (50 мг, 74%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,8 Гц, 6H, CH3), 2,83 (септ., J=6,8 Гц, 1H, CH), 6,56 (д, J=7,2 Гц, 1H, ArH), 6,66-6,68 (м, 2H, ArH), 6,86 (д, J=7,7 Гц, 1H, ArH), 7,00 (д, J=7,1 Гц, 1H, ArH), 7,40~7,46 (м, 2H, ArH), 7,77 (д, J=7,1 Гц, 1H, ArH), 8,40 (с, 1H, ArH).
<ПРИМЕР 255> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5-фторникотинамид
Fe (72 мг, 1,29 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору 5-фтор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)никотинамида (200 мг, 0,43 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 4 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (EtOAc:гексан=2:1) давала указанное в заголовке соединение в виде желтого твердого вещества (50 мг, 27%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,8 Гц, 6H, CH3), 2,84 (септ., J=6,8 Гц, 1H, CH), 6,67-6,71 (м, 2H, ArH), 6,88 (д, J=7,9 Гц, 1H, ArH), 7,01 (д, J=7,3 Гц, 1H, ArH), 7,42~7,45 (м, 2H, ArH), 8,03 (д, J=8,7 Гц, 1H, ArH), 8,60 (с, 1H, ArH), 8,86 (с, 1H, ArH).
<ПРИМЕР 256> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5-гидроксиникотинамид
Раствор 5-гидрокси-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)никотинамида (50 мг, 0,11 ммоль) в метаноле (5 мл) смешивали с 20% масс. сульфида аммония (0,2 мл) и нагревали в течение 3,5 часов при кипячении с обратным холодильником. После удаления растворителя, реакционную смесь экстрагировали CH2Cl2, обезвоживали Na2SO4, фильтровали и концентрировали. Очистка при помощи хроматографии на колонке (3% MeOH в CH2Cl2) давала указанное в заголовке соединение в виде желтого твердого вещества (168 мг, 40%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,8 Гц, 6H, CH3), 2,84 (септ., J=6,8 Гц, 1H, CH), 6,66-6,71 (м, 2H, ArH), 6,88 (д, J=7,9 Гц, 1H, ArH), 7,00 (д, J=7,5 Гц, 1H, ArH), 8,05 (уш., 1H, ArH), 8,24 (уш., 1H, ArH).
<ПРИМЕР 257> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-гидроксипиколинамид
Раствор 3-гидрокси-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиколинамида (190 мг, 0,41 ммоль) в метаноле (5 мл) смешивали с 20% масс. сульфида аммония (0,2 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. После удаления растворителя, реакционную смесь экстрагировали CH2Cl2, обезвоживали Na2SO4, фильтровали и концентрировали. Очистка при помощи хроматографии на колонке (EtOAc:гексан=1:1) давала указанное в заголовке соединение в виде желтого твердого вещества (47 мг, 27%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16 (д, J=6,9 Гц, 6H, CH3), 2,79 (септ., J=6,9 Гц, 1H, CH), 6,50~6,74 (м, 2H, ArH), 6,80 (д, J=7,8 Гц, 1H, ArH), 7,00-7,02 (м, 1H, ArH), 7,33-7,55 (м, 2H, ArH).
<ПРИМЕР 258> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-метилникотинамид
Порошок Fe (0,17 г, 3,17 ммоль), конц. HCl (0,01 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-4-метилникотинамида (0,20 г, 0,43 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 0,11 г (53%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,9 Гц, 6H, CH3) 2,49 (с, 3H, CH3) 2,77-2,87 (септ., 1H, CH) 6,66-6,80 (м, 2H, ArH) 6,85 (д, J=7,5 Гц, 1H, ArH) 7,04 (д, J=6,9 Гц, 1H, ArH) 7,32 (д, J=5,1 Гц, 1H, ArH) 7,44-7,49 (м, 2H, ArH) 8,41 (д, J=5,4 Гц, 1H, ArH) 8,63 (с, 1H, ArH).
<ПРИМЕР 259> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5-метилникотинамид
Порошок Fe (0,23 г, 4,28 ммоль), конц. HCl (0,04 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5-метилникотинамида (0,27 г, 0,58 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 0,13 г (52%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,9 Гц, 6H, CH3) 2,37 (с, 3H, CH3) 2,78-2,87 (септ., 1H, CH) 6,67-6,74 (м, 2H, ArH) 6,86 (д, J=7,8 Гц, 1H, ArH) 7,03 (д, J=7,2 Гц, 1H, ArH) 7,40-7,48 (м, 2H, ArH) 8,07 (с, 1H, ArH) 8,49 (с, 1H, ArH) 8,79 (с, 1H, ArH).
<ПРИМЕР 260> N-(1-Амино-4b-гидрокси-7,8-диметил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)никотинамид
Порошок Fe (0,15 г, 2,70 ммоль), конц. HCl (0,04 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7,8-диметил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)никотинамида (0,15 г, 0,34 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником.
Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=2:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 70 мг (50%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,9 Гц, 6H, CH3) 2,56 (с, 3H, CH3) 6,67-6,70 (м, 2H, ArH) 6,87 (д, J=6,9 Гц, 1H, ArH) 7,01 (д, J=6,3 Гц, 1H, ArH) 7,42-7,44 (м, 2H, ArH) 7,58 (д, J=5,1 Гц, 1H, ArH) 7,67 (с, 1H, ArH) 8,49 (д, J=5,1 Гц, 1H, ArH).
<ПРИМЕР 261> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5-метоксиникотинамид
Порошок Fe (0,12 г, 2,30 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5-метоксиникотинамида (0,15 г, 0,31 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 80 мг (57%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,6 Гц, 6H, CH3) 2,81-2,86 (септ., 1H, CH) 3,89 (с, 3H, OMe) 6,67-6,70 (м, 2H, ArH) 6,88 (д, J=7,2 Гц, 1H, ArH) 7,01 (д, J=6,6 Гц, 1H, ArH) 7,43-7,45 (м, 2H, ArH) 7,82 (с, 1H, ArH) 8,34 (с, 1H, ArH) 8,58 (с, 1H, ArH).
<ПРИМЕР 262> N-(1-Амино-4b-гидрокси-7,8-диметил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-6-карбоксамид
Порошок Fe (0,16 г, 3,03 ммоль), конц. HCl (0,04 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7,8-диметил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-6-карбоксамида (0,20 г, 0,41 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=2:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 0,16 г (86%).
1H-ЯМР (300 МГц, CD3OD) δ 2,22 (д, J=8,4 Гц, 6H, CH3) 6,61 (с, 1H, ArH) 6,70 (д, J=8,1 Гц, 1H, ArH) 7,01 (д, J=6,6 Гц, 1H, ArH) 7,34 (с, 1H, ArH) 7,46-7,48 (м, 1H, ArH) 7,78-7,79 (м, 1H, ArH) 8,10-8,14 (м, 1H, ArH) 8,20-8,28 (м, 1H, ArH) 8,62 (с, 1H, ArH) 8,74 (д, J=6,9 Гц, 1H, ArH).
<ПРИМЕР 263> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)хинолин-2-карбоксамид
Fe (135 мг, 2,42 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)хинолин-2-карбоксамида (400 мг, 0,81 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 1,5 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (EtOAc:гексан=1:2) давала указанное в заголовке соединение в виде желтого твердого вещества (132 мг, 35%).
1H-ЯМР (300 МГц, CD3OD) δ 1,21 (д, J=6,8 Гц, 6H, CH3), 2,87 (септ., J=6,8 Гц, 1H, CH), 6,70-6,73 (м, 2H, ArH), 6,92 (д, J=7,9 Гц, 1H, ArH), 7,03 (д, J=7,3 Гц, 1H, ArH), 7,44-7,51 (м, 2H, ArH), 7,66 (т, J=7,6 Гц, 1H, ArH), 7,80 (т, J=7,3 Гц, 1H, ArH), 7,97 (д, J=8,1 Гц, 1H, ArH), 8,07-8,13 (м, 2H, ArH), 8,44 (д, J=8,4 Гц, 1H, ArH).
<ПРИМЕР 264> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-бромбензо[b]тиофен-2-карбоксамид
Fe (87 мг, 1,56 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору 3-бром-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)бензо[b]тиофен-2-карбоксамида (250 мг, 0,52 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (EtOAc:гексан=1:4) давала указанное в заголовке соединение в виде желтого твердого вещества (130 мг, 46%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,9 Гц, 6H, CH3), 2,85 (септ., J=6,9 Гц, 1H, CH), 6,66-6,80 (м, 2H, ArH), 6,89-6,92 (м, 1H, ArH), 7,01-7,05 (м, 1H, ArH), 7,46-7,55 (м, 4H, ArH), 7,88-7,93 (м, 2H, ArH).
<ПРИМЕР 265> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-индол-2-карбоксамид
Fe (35 мг, 0,62 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-индол-2-карбоксамида (100 мг, 0,21 ммоль) в растворителе этанол:H2O (15 мл:1 мл) и нагревали в течение 4 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (EtOAc:гексан=1:3) давала указанное в заголовке соединение в виде желтого твердого вещества (80 мг, 84%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,8 Гц, 6H, CH3), 2,84 (септ., J=6,8 Гц, 1H, CH), 6,69-6,80 (м, 2H, ArH), 6,88 (д, J=8,1 Гц, 1H, ArH), 7,02-7,07 (м, 2H, ArH), 7,18-7,23 (м, 2H, ArH), 7,37-7,50 (м, 3H, ArH), 7,59 (д, J=8,0 Гц, 1H, ArH).
<ПРИМЕР 266> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)изохинолин-1-карбоксамид
Fe (68 мг, 1,21 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)изохинолин-1-карбоксамида (200 мг, 0,40 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 3,5 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (EtOAc:гексан=1:4) давала указанное в заголовке соединение в виде желтого твердого вещества (155 мг, 81%).
1H-ЯМР (300 МГц, CD3OD) δ 1,14 (дд, J=6,9 Гц, 1,5 Гц, 6H, CH3), 2,80 (септ., J=6,9 Гц, 1H, CH), 6,67 (с, 1H, ArH), 6,70 (д, J=8,3 Гц, 1H, ArH), 6,85 (дд, J=8,0 Гц, 1,0 Гц, 1H, ArH), 7,05 (д, J=7,1 Гц, 1H, ArH), 7,43-7,50 (м, 2H, ArH), 7,64 (т, J=7,5 Гц, 1H, ArH), 7,73 (т, J=8,0 Гц, 1H, ArH), 7,87-7,92 (м, 2H, ArH), 8,44 (д, J=5,6 Гц, 1H, ArH), 8,94 (д, J=8,4 Гц, 1H, ArH).
<ПРИМЕР 267> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-6-фтор-4-метоксихинолин-3-карбоксамид
Порошок Fe (46,2 мг, 0,82 ммоль) и 5 капель конц. HCl последовательно добавляли к раствору 6-фтор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-4-метоксихинолин-3-карбоксамида (0,15 г, 0,28 ммоль) в растворителе этанол:вода (10:1, 10 мл:1 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат экстрагировали этилацетатом и водой с последующим разделением и очисткой при помощи хроматографии на колонке с получением указанного в заголовке соединения. 15 мг (11%).
1H-ЯМР (300 МГц, CD3OD): δ 1,21 (д, J=6,9 Гц, 6H, CH3) 2,87 (септ., J=6,9 Гц, 1H, CH) 3,85 (с, 3H, OCH3) 6,69 (с, 2H, ArH) 6,82 (д, J=7,2 Гц, 1H, ArH) 6,90 (д, J=7,8 Гц, 1H, ArH) 7,44-7,46 (м, 2H, ArH) 7,56 (уш., 1H, ArH) 7,66 (уш., 1H, ArH) 8,0 (м, 1H, ArH) 8,67 (с, 1H, ArH).
<ПРИМЕР 268> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-метил-1H-индол-2-карбоксамид
Порошок Fe (0,12 г, 2,20 ммоль), конц.HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1-метил-1H-индол-2-карбоксамида (0,15 г, 0,31 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:2), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 50 мг (35%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,82-2,86 (септ., 1H, CH) 3,89 (с, 3H, CH3) 6,68 (с, 1H, ArH) 6,87-6,88 (м, 1H, ArH) 7,03-7,13 (м, 2H, ArH) 7,18 (с, 1H, ArH) 7,24-7,29 (м, 2H, ArH) 7,39-7,47 (м, 3H, ArH) 7,60 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 269> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-хлор-6-фторбензо[b]тиофен-2-карбоксамид
Порошок Fe (0,05 г, 1,05 ммоль), конц.HCl (0,02 мл) и воду (0,5 мл) добавляли в указанном порядке к раствору 3-хлор-6-фтор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)бензо[b]тиофен-2-карбоксамида (80 мг, 0,14 ммоль) в абсолютном этаноле (5 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 50 мг (68%).
1H-ЯМР (300 МГц, CD3OD) δ 1,15 (д, J=6,6 Гц, 6H, CH3) 2,76-2,85 (септ., 1H, CH) 6,69 (с, 1H, ArH) 6,75 (д, J=6,6 Гц, 1H, ArH) 6,84 (д, J=7,5 Гц, 1H, ArH) 7,03 (д, J=7,2 Гц, 1H, ArH) 7,28 (т, J=7,2 Гц, 1H, ArH) 7,43-7,48 (м, 2H, ArH) 7,66 (д, J=8,7 Гц, 1H, ArH) 7,83-7,88 (м, 1H, ArH).
<ПРИМЕР 270> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-хлор-6-метилбензо[b]тиофен-2-карбоксамид
Порошок Fe (0,11 г, 1,97 ммоль), конц. HCl (0,05 мл) и воду (1 мл) добавляли в указанном порядке к раствору 3-хлор-N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-6-метилбензо[b]тиофен-2-карбоксамида (0,15 г, 0,27 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 21 мг (15%).
1H-ЯМР (300 МГц, CD3OD) δ 1,16-1,18 (м, 6H, CH3) 2,45 (с, 3H, CH3) 2,80-2,86 (септ., 1H, CH) 6,70 (с, 1H, ArH) 6,72-6,80 (м, 1H, ArH) 6,84-6,95 (м, 1H, ArH) 7,00-7,05 (м, 1H, ArH) 7,33 (д, J=8,1 Гц, 1H, ArH) 7,37-7,52 (м, 2H, ArH) 7,66 (с, 1H, ArH) 7,75 (д, J=8,1 Гц, 1H, ArH).
<ПРИМЕР 271> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1,3-диметил-1H-пиразоло[3,4-b]пиридин-5-карбоксамид
Порошок Fe (137 мг, 2,45 ммоль), конц. HCl (0,02 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1,3-диметил-1H-пиразоло[3,4-b]пиридин-5-карбоксамида (180 мг, 0,35 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой при помощи хроматографии на колонке (этилацетат:гексан=1:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения (25 мг, 16%).
1H-ЯМР (300 МГц, CD3OD) δ 1,15 (д, J=6,9 Гц, 6H), 2,54 (с, 3H), 2,80-2,89 (м, 1H), 4,03 (с, 3H), 6,68-6,71 (м, 2H), 6,88 (д, J=7,6 Гц, 1H), 7,02 (д, J=7,3 Гц, 1H), 7,42-7,50 (м, 2H), 8,71 (с, 1H), 8,94 (с, 1H).
<ПРИМЕР 272> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)имидазо[1,2-a]пиридин-6-карбоксамид
Fe (80 мг, 1,42 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)имидазо[1,2-a]пиридин-6-карбоксамида (230 мг, 0,47 ммоль) в растворителе этанол:H2O (10 мл:1 мл) и нагревали в течение 4,5 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (5% метанол в метиленхлориде) давала указанное в заголовке соединение в виде коричневого твердого вещества (50 мг, 23%).
1H-ЯМР (300 МГц, CD3OD) δ 1,03-1,42 (м, 6H), 3,05-3,30 (м, 1H), 6,61-6,75 (м, 2H), 6,81-6,92 (м, 1H), 6,96-7,05 (м, 1H), 7,31-8,32 (м, 6H), 9,05-9,30 (м, 1H).
<ПРИМЕР 273> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиразоло[1,5-a]пиримидин-2-карбоксамид
Fe (97 мг, 1,73 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиразоло[1,5-a]пиримидин-2-карбоксамида (280 мг, 0,58 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 3,5 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (EtOAc:гексан=2:1) давала указанное в заголовке соединение в виде желтого твердого вещества (80 мг, 30%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,8 Гц, 6H, CH3), 2,81 (септ., J=6,8 Гц, 1H, CH), 6,63~6,72 (м, 2H, ArH), 6,83~6,87 (м, 1H, ArH), 7,00~7,12 (м, 3H, ArH), 7,43~7,51 (м, 2H, ArH), 8,55~8,57 (м, 1H, ArH), 8,96 (д, J=7,3 Гц, 1H, ArH).
<ПРИМЕР 274> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-метилбензо[b]тиофен-2-карбоксамид
Порошок Fe (0,04 г, 0,85 ммоль), конц. HCl (0,03 мл) и воду (0,5 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-метилбензо[b]тиофен-2-карбоксамида (60 мг, 0,11 ммоль) в абсолютном этаноле (5 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:4), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 30 мг (53%).
1H-ЯМР (300 МГц, CD3OD) δ 1,00-1,27 (м, 6H), 2,53-2,64 (м, 3H), 2,70-2,84 (м, 1H), 6,54-6,87 (м, 3H), 6,96-7,10 (м, 1H), 7,25-7,52 (м, 4H), 7,69-7,86 (м, 2H).
<ПРИМЕР 275> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хиноксалин-2-карбоксамид
Порошок Fe (0,16 г, 2,92 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хиноксалин-2-карбоксамида (0,20 г, 0,40 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:2), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 68 мг (37%).
1H-ЯМР (300 МГц, CD3OD) δ 1,21 (д, J=6,9 Гц, 6H, CH3) 2,82-2,91 (септ., 1H, CH) 6,71 (с, 1H, ArH) 6,91 (д, J=7,5 Гц, 1H, ArH) 7,04 (д, J=7,2 Гц, 1H, ArH) 7,47-7,49 (м, 2H, ArH) 7,90-7,98 (м, 3H, ArH) 8,15-8,28 (м, 2H, ArH) 9,40 (с, 1H, ArH).
<ПРИМЕР 276> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиридазин-4-карбоксамид
Порошок Fe (0,03 г, 0,55 ммоль), конц. HCl (0,01 мл) и воду (0,5 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)пиридазин-4-карбоксамида (50 мг, 0,11 ммоль) в абсолютном этаноле (5 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:2), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 26 мг (56%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,7 Гц, 6H, CH3) 2,78-2,87 (септ., 1H, CH) 6,68-6,74 (м, 2H, ArH) 6,87 (д, J=7,5 Гц, 1H, ArH) 7,02 (д, J=7,2 Гц, 1H, ArH) 7,40-7,48 (м, 2H, ArH) 8,04 (с, 2H, ArH) 9,32 (д, J=5,0 Гц, 1H, ArH) 9,51 (с, 1H, ArH).
<ПРИМЕР 277> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хиноксалин-6-карбоксамид
Порошок Fe (0,028 г, 0,50 ммоль), конц. HCl (0,01 мл) и воду (0,5 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хиноксалин-6-карбоксамида (50 мг, 0,11 ммоль) в абсолютном этаноле (5 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат 100%), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 38 мг (81%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,8 Гц, 6H, CH3) 2,83-2,89 (септ., 1H, CH) 6,75 (с, 1H, ArH) 6,96 (д, J=7,8 Гц, 1H, ArH) 7,47-7,54 (м, 3H, ArH) 8,08-8,24 (м, 3H, ArH) 8,63 (с, 1H, ArH) 8,93 (с, 1H, ArH).
<ПРИМЕР 278> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)тетразоло[1,5-a]пиридин-6-карбоксамид
Fe (121 мг, 2,16 ммоль) и 4 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)тетразоло[1,5-a]пиридин-6-карбоксамида (350 мг, 0,72 ммоль) в растворителе этанол:H2O (15 мл:1,5 мл) и нагревали в течение 2,5 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (EtOAc:гексан=2:1) давала указанное в заголовке соединение в виде желтого твердого вещества (269 мг, 80%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3), 2,85 (септ., J=6,9 Гц, 1H, CH), 6,69-6,71 (м, 2H, ArH), 6,90 (д, J=7,7 Гц, 1H, ArH), 7,02 (д, J=7,2 Гц, 1H, ArH), 7,43-7,46 (м, 2H, ArH), 8,07-8,18 (м, 2H, ArH), 9,65 (с, 1H, ArH).
<ПРИМЕР 279> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)тетразоло[1,5-a]пиридин-8-карбоксамид
Fe (55 мг, 0,99 ммоль) и 3 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)тетразоло[1,5-a]пиридин-8-карбоксамида (160 мг, 0,33 ммоль) в этаноле:H2O (15 мл:1,5 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (EtOAc:гексан=2:1) давала указанное в заголовке соединение в виде желтого твердого вещества (117 мг, 76%).
1H-ЯМР (300 МГц, CD3OD) δ 1,23 (д, J=6,9 Гц, 6H, CH3), 2,89 (септ., J=6,9 Гц, CH), 6,70-6,74 (м, 2H, ArH), 6,95 (д, J=7,8 Гц, 1H, ArH), 7,02 (д, J=8,0 Гц, 1H, ArH), 7,44-7,55 (м, 3H, ArH), 8,41 (д, J=7,3 Гц, 1H, ArH), 9,29 (д, J=7,3 Гц, 1H, ArH).
<ПРИМЕР 280> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-7-метилимидазо[1,2-a]пиридин-2-карбоксамид
Порошок Fe (0,27 г, 4,91 ммоль), конц. HCl (0,04 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хиноксалин-6-карбоксамида (0,49 г, 0,98 ммоль) в абсолютном этаноле (10 мл). Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 80 мг (17%).
1H-ЯМР (300 МГц, CDCl3) δ 0,62-1,84 (м, 6H), 2,90-3,00 (м, 1H), 6,43-6,84 (м, 8H), 6,98-7,58 (м, 3H), 7,72-8,17 (м, 3H).
<ПРИМЕР 281> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-7-метил[1,2,4]триазоло[1,5-a]пиримидин-2-карбоксамид
Порошок Fe (0,23 г, 4,22 ммоль), конц. HCl (0,04 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-7-метил[1,2,4]триазоло[1,5-a]пиримидин-2-карбоксамида (0,29 г, 0,57 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат 100%), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 0,17 г (62%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,9 Гц, 6H, CH3) 2,82-2,85 (м, 4H, CH, CH3) 6,67-6,74 (м, 2H, ArH) 6,87-6,94 (м, 1H, ArH) 7,00-7,04 (м, 1H, ArH) 7,30 (д, J=4,7 Гц, 1H, ArH) 7,44-7,51 (м, 2H, ArH) 8,81 (д, J=4,6 Гц, 1H, ArH).
<ПРИМЕР 282> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид
Порошок Fe (0,06 г, 1,16 ммоль), конц. HCl (0,04 мл) и воду (0,5 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамида (0,12 г, 0,23 ммоль) в абсолютном этаноле (5 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат 100%), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 60 мг (54%).
1H-ЯМР (300 МГц, CD3OD) δ 1,20 (дд, J=6,9, 2,3 Гц, 6H, CH3) 2,53 (с, 3H, CH3) 2,76 (с, 3H, CH3) 2,84-2,88 (м, 1H, CH) 6,71-6,80 (м, 2H, ArH) 6,90 (д, J=7,8 Гц, 1H, ArH) 6,99 (с, 1H, ArH) 7,04 (д, J=7,4 Гц, 1H, ArH) 7,42-7,51 (м, 2H, ArH) 8,39 (с, 1H, ArH).
<ПРИМЕР 283> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)индолизин-2-карбоксамид
Порошок Fe (76 мг, 1,37 ммоль), конц. HCl (0,02 мл) и воду (1,5 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)индолизин-2-карбоксамида (220 мг, 0,46 ммоль) в абсолютном этаноле (15 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат: гексан=1:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения в виде желтого твердого вещества (43 мг, 21%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,8 Гц, 6H), 2,84 (септ., J=6,8 Гц, 1H), 6,50-6,56 (м, 2H), 6,65-6,72 (м, 3H), 6,79 (с, 1H), 6,88 (д, J=7,8 Гц, 1H), 7,01 (д, J=7,4 Гц, 1H), 7,33 (д, J=9,2 Гц, 1H), 7,44-7,48 (м, 1H), 7,87 (с, 1H), 8,02 (д, J=7,0 Гц, 1H).
<ПРИМЕР 284> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1,6-диизопропил-1H-пиразоло[3,4-b]пиридин-4-карбоксамид
Порошок Fe (78 мг, 1,39 ммоль), конц. HCl (0,02 мл) и воду (1,5 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1,6-диизопропил-1H-пиразоло[3,4-b]пиридин-4-карбоксамида (264 мг, 0,46 ммоль) в абсолютном этаноле (15 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой при помощи хроматографии на колонке (этилацетат:гексан=1:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения в виде белого твердого вещества (79,5 мг, 32%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,6 Гц, 6H), 1,37 (д, J=6,8 Гц, 6H), 1,54 (д, J=4,4 Гц, 6H), 2,75-2,90 (м, 1H), 3,17-3,30 (м, 1H), 5,23-5,35 (м, 1H), 6,60-6,75 (м, 2H), 6,85-6,93 (м, 1H), 6,97-7,10 (м, 1H), 7,40-7,53 (м, 1H), 7,57 (с, 1H), 8,23 (с, 1H).
<ПРИМЕР 285> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)имидазо[1,2-a]пиримидин-2-карбоксамид
Порошок Fe (137 мг, 2,45 ммоль), конц. HCl (0,02 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)имидазо[1,2-a]пиримидин-2-карбоксамида (110 мг, 0,23 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой при помощи хроматографии на колонке (ДХМ:MeO=10:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения в виде желтого твердого вещества (31 мг, 30%).
1H-ЯМР (300 МГц, CDCl3) δ 1,03-1,10 (м, 6H), 2,67-2,76 (м, 1H), 5,57-5,62 (м, 1H), 6,40 (с, 1H), 6,63 (д, J=8,7 Гц, 1H), 6,74 (д, J=7,7 Гц, 1H), 6,91-6,67 (м, 2H), 7,20 (д, J=7,5 Гц, 1H), 7,46-7,52 (м, 1H), 7,56-7,64 (м, 1H), 7,95 (с, 1H), 8,34-8,39 (м, 1H), 8,63 (с, 1H).
<ПРИМЕР 286> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-оксо-1,2-дигидроизохинолин-3-карбоксамид
Порошок Fe (47 мг, 0,83 ммоль), конц. HCl (0,02 мл) и воду (0,9 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-оксо-1,2-дигидроизохинолин-3-карбоксамида (142 мг, 0,28 ммоль) в абсолютном этаноле (9 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (EtOAc:гексан=2:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения в виде желтого твердого вещества (58 мг, 43%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,9 Гц, 6H), 2,84 (септ., J=6,9 Гц, 1H), 6,69-6,74 (м, 2H), 6,89 (д, J=7,4 Гц, 1H), 7,02 (д, J=7,5 Гц, 1H), 7,44-7,49 (м, 2H), 7,54 (с, 1H), 7,61-7,66 (м, 1H), 7,74-7,81 (м, 2H), 8,31 (д, J=7,9 Гц, 1H).
<ПРИМЕР 287> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-метилимидазо[1,5-a]пиридин-1-карбоксамид
Fe (77 мг, 1,38 ммоль) и 4 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-метилимидазо[1,5-a]пиридин-1-карбоксамида (230 мг, 0,46 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (EtOAc:гексан=2:1) получали N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-метилимидазо[1,5-a]пиридин-1-карбоксамид в виде желтого твердого вещества (90 мг, 42%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,8 Гц, 6H, CH3), 2,63 (с, 3H, CH3), 2,85 (септ., J=6,8 Гц, 1H, CH), 6,67-6,74 (м, 2H, ArH), 6,81-6,89 (м, 2H, ArH), 7,00~7,09 (м, 2H, ArH), 7,42-7,49 (м, 2H, ArH), 7,93-7,96 (м, 1H, ArH), 8,09 (д, J=7,4 Гц, 1H, ArH).
<ПРИМЕР 288> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2H-индазол-3-карбоксамид
Fe (35 мг, 0,62 ммоль) и 3 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2H-индазол-3-карбоксамида (100 мг, 0,21 ммоль) в растворителе этанол:H2O (10 мл:1 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (EtOAc:гексан=1:1) давала указанное в заголовке соединение N-(1-амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-2H-индазол-3-карбоксамид в виде желтого твердого вещества (63 мг, 66%).
1H-ЯМР (300 МГц, CD3OD) δ 1,15 (д, J=6,9 Гц, 6H, CH3), 2,80 (септ., J=6,9 Гц, 1H, CH), 6,66-6,72 (м, 2H, ArH), 6,86 (д, J=7,9 Гц, 1H, ArH), 7,04 (д, J=7,3 Гц, 1H, ArH), 7,16-7,21 (м, 1H, ArH), 7,34-7,56 (м, 4H, ArH), 8,09 (д, J=8,1 Гц, 1H, ArH).
<ПРИМЕР 289> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-7-метилпиразоло[1,5-a]пиримидин-6-карбоксамид
Порошок Fe (62 мг, 1,12 ммоль), конц. HCl (0,02 мл) и воду (1,2 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-7-метилпиразоло[1,5-a]пиримидин-6-карбоксамида (186 мг, 0,37 ммоль) в абсолютном этаноле (12 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой при помощи хроматографии на колонке (EA:гексан=1:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения в виде желтого твердого вещества (125 мг, 72%).
1H-ЯМР (300 МГц, CD3OD) δ 1,17 (д, J=6,9 Гц, 6H), 2,83 (септ., J=7,1 Гц, 1H), 2,97 (с, 3H), 6,68 (с, 1H), 6,70 (с, 1H), 6,71 (с, 1H), 6,87 (д, J=7,7 Гц, 1H), 7,06 (д, J=7,2 Гц, 1H), 7,34-7,51 (м, 2H), 8,25-8,26 (м, 1H), 8,63 (с, 1H).
<ПРИМЕР 290> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-бензо[d]имидазол-2-карбоксамид
Порошок Fe (54 мг, 0,96 ммоль), конц. HCl (0,02 мл) и воду (1,0 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-бензо[d]имидазол-2-карбоксамида (155 мг, 0,32 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой при помощи хроматографии на колонке (EA:гексан=1:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения в виде желтого твердого вещества (67 мг, 46%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,9 Гц, 6H), 2,84 (септ., J=6,7 Гц, 1H), 6,68 (с, 1H), 6,72 (с, 1H), 6,89 (д, J=7,4 Гц, 1H), 7,03 (д, J=7,3 Гц, 1H), 7,32 (с, 1H), 7,34 (с, 1H), 7,44-7,50 (м, 2H), 7,55 (с, 1H), 7,69 (с, 1H).
<ПРИМЕР 291> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-5-фтор-1H-бензо[d]имидазол-2-карбоксамид
Порошок Fe (76 мг, 1,36 ммоль), конц. HCl (0,02 мл) и воду (1,5 мл) добавляли в указанном порядке к раствору 5-фтор-N-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-бензо[d]имидазол-2-карбоксамида (227 мг, 0,45 ммоль) в абсолютном этаноле (15 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой при помощи хроматографии на колонке (EA:гексан=1:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения в виде желтого твердого вещества (144 мг, 68%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,9 Гц, 6H), 2,85 (септ., J=6,6 Гц, 1H), 6,67 (с, 1H), 6,69 (д, J=7,4 Гц, 1H), 6,90 (д, J=7,3 Гц, 1H), 7,02 (д, J=7,4 Гц, 1H), 7,12 (с, 1H), 7,25 (с, 1H), 7,45-7,51 (м, 2H), 7,73 (с, 1H).
<ПРИМЕР 292> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)тетразоло[1,5-a]пиридин-5-карбоксамид
Порошок Fe (0,17 г, 3,08 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)тетразоло[1,5-a]пиридин-5-карбоксамида (0,30 г, 0,61 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:1), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 0,11 г (40%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18-1,23 (м, 6H, CH3) 2,83-2,92 (септ., 1H, CH) 6,74 (м, 1H, ArH) 6,93 (д, J=7,5 Гц, 1H, ArH) 7,05 (д, J=6,9 Гц, 1H, ArH) 7,47-7,56 (м, 2H, ArH) 7,89 (с, 1H, ArH) 7,99 (т, J=7,2 Гц, 1H, ArH) 8,08 (д, J=7,2 Гц, 1H, ArH) 8,36 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 293> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-метил-1H-индазол-3-карбоксамид
Порошок Fe (0,16 г, 2,92 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-метил-3a,7a-дигидро-1H-индазол-3-карбоксамида (0,27 г, 0,54 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:2), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 0,13 г (52%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,9 Гц, 6H, CH3) 2,80-2,88 (септ., 1H, CH) 4,12 (с, 1H, CH3) 6,69-6,80 (м, 2H, ArH) 6,88 (д, J=6,9 Гц, 1H, ArH) 7,04 (д, J=6,6 Гц, 1H, ArH) 7,20-7,25 (м, 1H, ArH) 7,40-7,48 (м, 3H, ArH) 7,59 (д, J=8,7 Гц, 1H, ArH) 8,07 (д, J=8,4 Гц, 1H, ArH).
<ПРИМЕР 294> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-индол-5-карбоксамид
Порошок Fe (0,04 г, 0,82 ммоль), конц. HCl (0,03 мл) и воду (0,5 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-индол-5-карбоксамида (80 мг, 0,16 ммоль) в абсолютном этаноле (5 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат:гексан=1:2), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 35 мг (47%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=7,2 Гц, 6H, CH3) 2,80-2,88 (септ., 1H, CH) 6,50-6,53 (м, 1H, ArH) 6,69-6,72 (м, 2H, ArH) 6,80-6,85 (м, 1H, ArH) 7,03-7,12 (м, 2H, ArH) 7,29-7,31 (м, 1H, ArH) 7,37-7,47 (м, 2H, ArH) 7,60-7,63 (м, 1H, ArH) 8,16 (с, 1H, ArH).
<ПРИМЕР 295> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-метил-3a,7a-дигидро-1H-индазол-3-карбоксамид
Порошок Fe (0,08 г, 1,46 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-метил-[1,2,4]триазоло[4,3-a]пиридин-8-карбоксамида (0,13 г, 0,20 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 23 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат 100%), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 44 мг (46%).
1H-ЯМР (300 МГц, CD3OD) δ 1,21 (д, J=6,9 Гц, 6H, CH3) 2,77 (с, 3H, CH3) 2,84-3,30 (септ., 1H, CH) 6,71-6,79 (м, 2H, ArH) 6,90 (д, J=8,7 Гц, 1H, ArH) 7,03 (д, J=5,7 Гц, 1H, ArH) 7,13 (т, J=7,2 Гц, 1H, ArH) 7,46-7,48 (м, 2H, ArH) 8,04 (д, J=6,3 Гц, 1H, ArH) 8,48 (д, J=7,2 Гц, 1H, ArH).
<ПРИМЕР 296> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-метил-1H-имидазол-4-карбоксамид
Порошок Fe (0,09 г, 1,62 ммоль), конц. HCl (0,03 мл) и воду (1 мл) добавляли в указанном порядке к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1-метил-1H-имидазол-4-карбоксамида (0,10 г, 0,22 ммоль) в абсолютном этаноле (10 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали для удаления порошка Fe. Фильтрат подщелачивали NaHCO3 и многократно промывали водой. Органический слой сушили и фильтровали с последующей очисткой в течение 30 мин при помощи хроматографии на колонке (этилацетат 100%), заполненной силикагелем, обработанным Et3N, с получением указанного в заголовке соединения. 29 мг (31%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,80-2,86 (септ., 1H, CH) 6,66-6,69 (м, 2H, ArH) 6,87 (д, J=7,2 Гц, 1H, ArH) 6,99 (д, J=7,2 Гц, 1H, ArH) 7,41-7,45 (м, 2H, ArH) 7,57-7,61 (м, 2H, ArH).
<ПРИМЕР 297> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-пиррол-3-карбоксамид
Порошок Fe (31 мг, 0,55 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-4-нитро-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-пиррол-3-карбоксамида (0,08 г, 0,18 ммоль) в растворителе этанол:вода (10:1, 10 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. Реакционную смесь промывали этилацетатом и фильтровали в горячем состоянии для удаления порошка Fe. Фильтрат концентрировали в вакууме и очищали при помощи хроматографии на колонке с силикагелем (30% этилацетат, смешанный с 60% гексаном) с получением указанного в заголовке соединения. 35 мг (47%).
1H-ЯМР (300 МГц, CD3OD): δ 1,18 (д, J=6,9 Гц, 6H, CH3) 2,84 (септ., 1H, CH) 6,53-6,58 (м, 1H, ArH) 6,64-6,76 (м, 3H, ArH) 6,86-6,90 (м, 1H, ArH) 6,98-7,01 (м, 1H, ArH) 7,36-7,46 (м, 3H, ArH).
<ПРИМЕР 298> трет-Бутил(трет-бутоксикарбониламино)(4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-иламино)метиленкарбамат
4b,9b-Дигидрокси-7-изопропил-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он (0,30 г, 1,02 ммоль) растворяли в 5 мл ТГФ и перемешивали вместе с DEAD (0,24 мл, 1,56 ммоль) и PPh3 (0,41 г, 1,56 ммоль) в течение 5 мин, а затем вместе с Boc-гуанидином (0,40 г, 1,56 ммоль) в течение 3 часов при комнатной температуре. После этого осуществляли вакуумную концентрацию с последующей очисткой при помощи хроматографии на колонке (этилацетат:гексан=1:2) с получением указанного в заголовке соединения. 40 мг (7%).
1H-ЯМР (300 МГц, CDCl3) δ 1,15 (д, J=6,8 Гц, 6H), 1,30 (с, 9H), 1,50 (с, 9H), 2,81 (кв., J=7,3 Гц, 1H), 6,69 (с, 1H), 6,81 (д, J=7,5 Гц, 1H), 7,30 (д, J=7,9 Гц, 1H), 7,51 (т, J=8,7 Гц, 1H), 7,67 (с, 1H), 7,73-7,82 (м, 2H), 8,00 (д, J=7,9 Гц, 1H), 9,36 (с, 1H), 11,17 (с, 1H).
<ПРИМЕР 299> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-индазол-5-карбоксамид
Порошок Fe (104 мг, 1,86 ммоль) и 4 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-1H-индазол-5-карбоксамида (300 мг, 0,62 ммоль) в растворителе этанол:H2O (20 мл:2 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (EtOAc:гексан=2:1) давала указанное в заголовке соединение в виде желтого твердого вещества. 90 мг (32%).
1H-ЯМР (300 МГц, CD3OD) δ 1,19 (д, J=6,8 Гц, 6H, CH3), 2,85 (м, 1H, CH), 6,67-6,74 (м, 2H, ArH), 6,89 (д, J=8,0 Гц, 1H, ArH), 7,02 (д, J=7,4 Гц, 1H, ArH), 7,43-7,56 (м, 3H, ArH), 7,85-7,88 (м, 1H, ArH), 8,13 (с, 1H, ArH), 8,38 (с, 1H, ArH).
<ПРИМЕР 300> N-(1-Амино-4b-гидрокси-7-изопропил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-3-метил-1H-пиразол-5-карбоксамид
Порошок Fe (36 мг, 0,65 ммоль) и 2 капли конц. HCl последовательно добавляли к раствору N-(4b-гидрокси-7-изопропил-1-нитро-10-оксо-9b,10-дигидро-4bH-бензо[d]индено[1,2-b]фуран-9b-ил)-3-метил-1H-пиразол-5-карбоксамида (90 мг, 0,22 ммоль) в растворителе этанол:H2O (10 мл:1 мл) и нагревали в течение 3 часов при кипячении с обратным холодильником. После вакуумного концентрирования, очистка при помощи хроматографии на колонке (EtOAc:гексан=1:2) давала указанное в заголовке соединение в виде желтого твердого вещества. 62 мг (74%).
1H-ЯМР (300 МГц, CD3OD) δ 1,18 (д, J=6,9 Гц, 1H, CH3), 2,29 (с, 3H, CH3), 2,84 (септ., J=6,9 Гц, 1H, CH), 6,42 (с, 1H, ArH), 6,66-6,70 (м, 2H, ArH), 6,87 (д, J=8,0 Гц, 1H, ArH), 6,99 (д, J=7,4 Гц, 1H, ArH), 7,41-7,47 (м, 2H, ArH).
<ПРИМЕР 301> 1-Амино-9b-(фуран-2-карбоксамидо)-7-метокси-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-4b-илфуран-2-карбоксилат
HATU (0,35 г, 3,52 ммоль) добавляли при 0°C к раствору фуран-2-карбоновой кислоты (0,20 г, 1,85 ммоль) в безводном диметилформамиде (3 мл) и смесь затем перемешивали вместе с Et3N (0,70 г, 1,85 ммоль) и 9b-амино-4b-гидрокси-7-метокси-4bH-индено[1,2-b]бензофуран-10(9bH)-оном (0,50 г, 1,76 ммоль) при комнатной температуре в течение 24 час. Реакционную смесь разбавляли в этилацетате и многократно промывали водным раствором K2CO3 и солевым раствором, органический слой сушили и фильтровали. Очистка при помощи хроматографии на колонке (этилацетат:гексан=1:1) давала указанное в заголовке соединение. 13 мг (1,5%).
1H-ЯМР (300 МГц, CDCl3) δ 3,76 (м, 3H, OMe), 6,39-6,50 (м, 2H, ArH), 6,65 (м, 1H, ArH), 6,93-6,95 (м, 2H, ArH), 7,12 (д, J=3,9 Гц, 1H, ArH). 7,38 (с, 1H, ArH), 7,47 (с, 1H, ArH), 7,51-7,54 (м, 1H, ArH), 7,63 (т, J=7,5 Гц, 1H, ArH), 7,84 (т, J=7,2 Гц, 1H, ArH), 7,93 (д, J=7,5 Гц, 1H, ArH), 8,09 (т, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 302> N-(4b-гидрокси-7,8-диметил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)никотинамид
Раствор никотиновой кислоты (409 мг, 2,14 ммоль) в ДХМ охлаждали до 0°C. Смесь перемешивали вместе с EDCI (332 мг, 2,14 ммоль) в течение 10 мин, затем вместе с ДМФ (3 мл) в течение дополнительных 10 мин и, наконец, вместе с HOBt (289 мг, 2,14 ммоль) и 9b-амино-4b-гидрокси-7,8-диметил-4bH-индено[1,2-b]бензофуран-10(9bH)-оном (500 мг, 1,78 ммоль) в течение 15 часов при комнатной температуре. Впоследствии реакционную смесь смешивали с ДХМ, промывали водой и обезвоживали Na2SO4. После фильтрования и концентрирования, очистка при помощи хроматографии на колонке давала указанное в заголовке соединение в виде твердого вещества. 178 мг (26%).
1H-ЯМР (300 МГц, CD3OD) δ 2,19 (с, 3H), 2,22 (с, 3H), 6,60 (с, 1H), 7,29 (с, 1H), 7,49-7,52 (м, 1H), 7,66-7,88 (м, 4H), 8,25 (д, J=2,1 Гц, 1H), 8,66 (д, J=3,4 Гц, 1H), 8,99 (с, 1H).
<ПРИМЕР 303> N-(4b-гидрокси-7,8-диметил-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-пиррол-2-карбоксамид
9b-Амино-4b-гидрокси-7,8-диметил-4bH-индено[1,2-b]бензофуран-10(9bH)-он (500 мг, 1,78 ммоль) и 1H-пиррол-2-карбоновую кислоту (238 мг, 2,14 ммоль) растворяли в ДХМ (17,8 мл, 0,1 M), смешивали с DCC (442 мг, 2,14 ммоль) при комнатной температуре при перемешивании. Реакционную смесь промывали водой, обезвоживали с помощью Na2SO4, фильтровали и концентрировали с последующей очисткой при помощи колоночной хроматографии с получением указанного в заголовке соединения в виде твердого вещества. 40 мг (6%).
1H-ЯМР (300 МГц, CD3OD) δ 2,17 (с, 3H), 2,19 (с, 3H), 6,3-6,15 (м, 1H), 6,58 (с, 1H), 6,88 (с, 1H), 6,92 (д, J=3,7 Гц, 1H), 7,28 (с, 1H), 7,54-7,59 (м, 1H), 7,75-7,82 (м, 1H), 7,91-7,93 (м, 1H).
<ПРИМЕР 304> N-(6-Этил-4b-гидрокси-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)-1H-пиррол-2-карбоксамид
Пиррол-2-карбоновую кислоту (133 мг, 1,96 ммоль) и 9b-амино-6-этил-4b-гидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-он (500 г, 1,78 ммоль) вместе растворяли в метиленхлориде (10 мл) и смешивали с DCC (367 мг, 1,78 ммоль) при комнатной температуре в течение 20 часов при перемешивании. После экстракции CH2Cl2 и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (EA:Hex=1:1) давала указанное в заголовке соединение в виде желтого твердого вещества. 151 мг (23%).
1H-ЯМР (300 МГц, CDCl3) δ 1,17 (т, J=7,5 Гц, 3H, CH3), 2,64 (кв., J=7,5 Гц, 2H, CH2), 5,93 (с, 1H, OH), 6,26 (с, 1H, ArH), 6,79 (с, 1H, ArH), 6,85-6,98 (м, 3H, ArH), 7,21-7,26 (м, 1H, ArH), 7,56 (т, J=7,6 Гц, 1H, ArH), 7,80-7,85 (м, 2H, ArH), 8,04 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 305> N-(6-Этил-4b-гидрокси-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)фуран-2-карбоксамид
Фуран-2-карбоновую кислоту (239 мг, 2,13 ммоль) растворяли в метиленхлориде (10 мл) и смешивали с EDCI (406 мг, 2,13 ммоль) и HOBt (288 мг, 2,13 ммоль) в течение 10 мин, а затем с 9b-амино-6-этил-4b-гидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-оном (500 мг, 1,78 ммоль) в течение ночи при комнатной температуре при перемешивании. После экстракции CH2Cl2 и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (EA:Hex=1:2) давала указанное в заголовке соединение в виде желтого твердого вещества. 180 мг (27%).
1H-ЯМР (300 МГц, CDCl3) δ 1,17 (т, J=7,5 Гц, 3H, CH3), 2,63 (кв., J=7,5 Гц, 2H, CH2), 5,63 (уш., 1H, OH), 6,51 (кв., 1,7 Гц, 1H, ArH), 6,89 (т, J=7,6 Гц, 1H, ArH), 7,09-7,14 (м, 2H, ArH), 7,23-7,26 (м, 1H, ArH), 7,46 (с, 1H, NH), 7,52 (с, 1H, ArH), 7,56 (т, J=7,5 Гц, 1H, ArH), 7,79-7,85 (м, 2H, ArH), 8,04 (д, J=7,8 Гц, 1H, ArH).
<ПРИМЕР 306> N-(8-Хлор-4b-гидрокси-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)хинолин-4-карбоксамид
Хинолин-4-карбоновую кислоту (361 мг, 1,74 ммоль) растворяли в метиленхлориде (10 мл) и смешивали с EDCI (397 мг, 2,08 ммоль) и HOBt (281 мг, 2,08 ммоль) в течение 10 мин, а затем с 9b-амино-6-этил-4b-гидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-оном (500 мг, 1,74 ммоль) в течение ночи при комнатной температуре при перемешивании. После экстракции CH2Cl2 и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (EA:Hex=1:1) давала указанное в заголовке соединение в виде белого твердого вещества. 112 мг (15%).
1H-ЯМР (500 МГц, CDCl3) δ 6,86 (д, J=8,6 Гц, 1H, ArH), 7,19 (с, 1H, NH), 7,27~7,29 (м, 1H, ArH), 7,43 (д, J=2,1 Гц, 1H, ArH), 7,53 (д, J=4,2 Гц, 1H, ArH), 7,60-7,65 (м, 2H, ArH), 7,78 (т, J=7,9 Гц, 1H, ArH), 7,87-7,91 (м, 2H, ArH), 8,06-8,11 (м, 2H, ArH), 8,16 (д, J=8,1 Гц, 1H, ArH), 8,98 (д, J=4,2 Гц, 1H, ArH).
<ПРИМЕР 307> N-(8-Хлор-4b-гидрокси-10-оксо-9b,10-дигидро-4bH-индено[1,2-b]бензофуран-9b-ил)тетрагидрофуран-2-карбоксамид
Тетрагидрофуран-2-карбоновую кислоту (242 мг, 2,08 ммоль) растворяли в метиленхлориде (10 мл) и смешивали с EDCI (397 мг, 2,08 ммоль) и HOBt (281 мг, 2,08 ммоль) в течение 10 мин, а затем с 9b-амино-6-этил-4b-гидрокси-4bH-бензо[d]индено[1,2-b]фуран-10(9bH)-оном (500 мг, 1,74 ммоль) в течение ночи при комнатной температуре при перемешивании. После экстракции CH2Cl2 и водой, органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка при помощи хроматографии на колонке (EA:Hex=1:1) давала указанное в заголовке соединение в виде желтого твердого вещества. 183 мг (27%).
1H-ЯМР (300 МГц, CDCl3) δ 1,88-1,95 (м, 3H, CH2), 2,17-2,30 (м, 1H, CH2), 3,88-3,95 (м, 1H, OCH2), 3,98-4,09 (м, 1H, OCH2), 4,29-4,40 (м, 1H, OCH), 6,75-6,77 (м, 1H, ArH), 7,19-7,21 (м, 1H, ArH), 7,30-7,34 (м, 1H, ArH), 7,57 (т, J=7,3 Гц, 1H, ArH), 7,79-7,84 (м, 2H, ArH), 7,97-7,99 (м, 1H, ArH).
В таблице 1 показаны химические формулы соединений примеров 1-307.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 1> Анализ ингибирования цитопатического действия (CPE) для противовирусной активности в отношении пикорнавирусов
В анализе использовали клетки HeLa (клетки рака шейки матки человека), MRC-5 (эмбриональные фибробласты легкого человека) и RD (клетки, полученные из рабдомиосаркомы человека). Для сравнения в качестве контроля использовали рибавирин (Riv), плеконарил (pleco) и BTA-798 (BTA). Реагенты растворяли до концентрации 10-40 мг/мл в 100% диметилсульфоксиде (ДМСО). Водорастворимые реагенты растворяли в растворе PBS (-) и хранили при -20°C. В день эксперимента их использовали в концентрации 3x-5x так, чтобы концентрация диметилсульфоксида в каждой лунке составляла от 0,5% до 1%.
Фармацевтические эффекты определяли, используя анализ ингибирования вирус-индуцированного цитопатического действия (CPE). Для этого клетки, подходящие для вирусов, выращивали в 96-луночных планшетах, в каждую лунку планшета инокулировали разбавленные в DME с добавлением 2% FBS (DME/2% FBS) или MEM с добавлением 2% FBS (MEM/2% FBS) вирусы в количестве 100 мкл с концентрацией, соответствующей 100 CCID50 (50% инфицирующая доза для клеточной культуры) и инкубировали в течение 30 мин - 1 час при 33°C или 37°C, обеспечивая проникновение вирусов в клетки. Среду для культивирования удаляли перед добавлением в каждую лунку аликвот лекарственного средства, разведенного в различных концентрациях, в количестве 100 мкл. Тогда как HRV выращивали при 33°C, другие вирусы инкубировали при 37°C в CO2 инкубаторе в течение 2-3 суток. Альтернативно, клетки культивировали в течение 2-3 суток без удаления среды, а затем к ним добавляли 50 мкл каждого лекарственного средства с 2-кратным увеличением разведения, а затем 50 мкл разведенного вируса.
Условия проведения испытания для каждого вируса суммированы в таблице 2 ниже.
|
|
Для клеток HeLa лекарственные средства измеряли на EC50 (50% максимальной эффективной концентрации), которая представляет собой концентрацию лекарственного средства, вызывающую ответ, равный середине между исходным уровнем и максимумом, используя анализ MTT. Для клеток RD и MRC-5 CPE определяли, используя FDA (диацетат флуоресцеина). Для оценки результатов силы активности лекарственного средства для отражения токсического эффекта лекарственного средства, mock-инфицированные клетки, которые получали путем добавления безвирусной среды к культуре клеток, обрабатывали аналогичным образом. То есть, среду удаляли, затем один час инкубировали и добавляли разведенные лекарственные средства в среду еще раз. После инкубации в течение 2-3 суток клетки наблюдали под микроскопом и определяли CC50 лекарственных средств (50% цитотоксической концентрации), используя анализ MTT, в котором подсчитывали жизнеспособные клетки в mock-инфицированных лунках, содержащих лекарственное средство, сравнивали с количеством жизнеспособных клеток в контрольных лунках, не содержащих лекарственные средства. В анализе гидролиза FDA, в каждую лунку добавляли FDA, затем удаляли среду и инкубировали в течение 20-30 мин, а затем измеряли интенсивность флуоресценции, используя спектрофлуориметр для определения CPE, аналогично способу в MTT.
Коэффициент выживаемости (% выживаемости) mock-инфицированных клеток рассчитывали, используя следующую математическую формулу 1:
[Математическая формула 1]

Тогда как 100% клеточная выживаемость означает отсутствие цитотоксичности лекарственного средства, то максимальная цитотоксичность соответствует 0% клеточной выживаемости. 50% цитотоксическую концентрацию (CC50) определяли как концентрацию, требуемую для снижения числа клеток на 50% по сравнению с необработанными контролями. Наивысшие значения CC50 обозначают меньшую цитотоксичность.
Кроме того, противовирусные эффекты могут быть рассчитаны, используя следующую математическую формулу 2:
[Математическая формула 2]

Коэффициент выживаемости, равный 100%, означает превосходное противовирусное действие (100%), тогда как лекарственные средства считаются лишенными противовирусной активности при коэффициенте выживаемости, равном 0%. Регистрировали вирусный цитопатический эффект (СРЕ) и 50% эффективную концентрацию (EC50) определяли как концентрацию соединения, требующуюся для снижения вирусного СРЕ на 50% по сравнению с необработанным контролем. Более низкие значения EC50 означают более высокую противовирусную активность.
Значения CC50 и EC50 соединений, для которых считали цитотоксичность и противовирусную активность в отношении пикорнавирусов, соответственно, приведены в таблицах 3 и 4.


|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Как понятно из данных из таблиц 3 и 4, большинство производных инданона по настоящему изобретению показывают низкую цитотоксичность, так как они имеют высокие значения CC50. Кроме того, было обнаружено, что большинство производных инданона по настоящему изобретению достаточно хорошо ингибируют вирусы коксаки, полио-, риновирусы, так как их значения EC50 составили 0,01 мкг/мл или менее.
Соответственно, производные инданона, представленные химической формулой 1, по настоящему изобретению показывают низкую цитотоксичность и высокую ингибиторную активность в отношении широкого спектра пикорнавирусов и, таким образом, могут использоваться в фармацевтической композиции для профилактики или лечения заболеваний, вызванных пикорнавирусом.
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 2> Определение противовирусной активности в отношении пикорнавирусов по снижению мультициклического цитопатического эффекта (CPE)
Испытываемые соединения оценивали на активность против пикорнавирусов с помощью анализа снижения мультициклического цитопатического эффекта (СРЕ). Противовирусную активность сначала определяли с помощью анализа снижения CPE, основанном на MTS [3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2H-тетразолий].
Для этого клетки, выращенные до конфлюентности в 96-луночных планшетах, инфицировали 100 50% дозами инфицирования культуры клеток (CCID50) вирусом. После адсорбции, 2 часа при 37°С, вирус удаляли и добавляли серийные разведения соединений Культуры дополнительно инкубировали при 37°C в течение 3 суток до того, пока в зараженном и необработанном вирусом контроле (VC) не наблюдали полное CPE. После удаления среды в каждую лунку добавляли 90 мкл культуральной среды и 10 мкл MTS-феназинметосульфата (Promega, Лейден, Нидерланды). После инкубирования в течение 2 часов при 37°С регистрировали оптическую плотность (OD) в каждой лунке при 498 нм в ридере для микропланшетов.
Значения CPE для оценки противовирусной активности рассчитывали, используя следующую математическую формулу 3:
[Математическая формула 3]
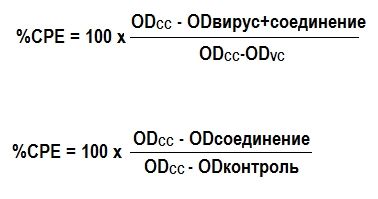
Значения CPE для оценки цитотоксичности рассчитывали с помощью следующей математической формулы 4:
[Математическая формула 4]

В формулах 3 и 4
ODCC соответствует OD неинфицированных и необработанных исходных культур клеток,
ODVC обозначает OD инфицированных и необработанных контрольных культур клеток,
ODвирус+соединение обозначает OD культур клеток, инфицированных вирусом, обработанных заданной концентрацией соединения, и
ODконтроль обозначает OD лунки с добавлением только среды для культивирования клеток.
50% Эффективную концентрацию (ЕС50) и 50% цитотоксическую концентрацию (CC50) определяли как концентрации соединения, которые обеспечивают 50% защиту против вирус-индуцированного CPE и которые уничтожают 50% клеток, соответственно, и рассчитывали с помощью логарифмической интерполяции.
CC50 и ЕС50 некоторых соединений в отношении различных вирусов приведены в таблице 5 ниже.
|
|
В таблице 5 верхний индекс c обозначает инкубирование при 37°C в клетках Vero, верхний индекс d обозначает инкубирование при 37°C в клетках MRC-5, верхний индекс e обозначает инкубирование при 37°C в клетках RD, верхний индекс f обозначает инкубирование при 37°C в клетках BGM, верхний индекс g обозначает инкубирование при 37°C в клетках HeLa и верхний индекс i обозначает 100% ингибирование вирусной репликации с соединениями 0,078 мкМ или больше.
Как видно из таблицы 5, производные инданона по настоящему изобретению имеют низкую цитотоксичность, так как их CC50 был измерен при 100 мкМ или выше. Кроме того, было обнаружено, что производные инданона имеют значение ЕС50, равное 1,1 мкМ или менее, в отношении вирусов коксаки В3, А16, А9 и А21. В частности, высокая противовирусная активность была обнаружена для соединения примера 46 с низким значением ЕС50, равным 0,0017 мкМ.
Что касается энтеровируса 71, то производные инданона по настоящему изобретению показали ЕС50, равное 0,025 мкМ или менее. В частности, высокая противовирусная активность была обнаружена у соединения Примера 46 с низким значением ЕС50, равным 0,0031 мкМ.
Производные инданона по изобретению показали значение ЕС50 0,025 мкМ или менее против эховируса 9 и эховируса 11, в то время как максимальная противовирусная активность была обнаружена для соединения Примера 46, как показывает значение ЕС50, равное 0,0035 мкМ.
В случае полиовирусов 1, 2 и 3, значения ЕС50 производных инданона по настоящему изобретению измеряли как 1,0 мкМ или менее. В частности, высокая противовирусная активность была обнаружена для соединения Примера 46 с низким значением ЕС50, всего лишь 0,068 мкМ.
Кроме того, производные инданона по изобретению довольно хорошо ингибируют риновирусы. Например, соединение Примера 46 имеет значение ЕС50, равное 0,078 мкМ или менее, в отношении риновирусов 45 и 70.
Таким образом, производные инданона по настоящему изобретению обладают низкой цитотоксичностью и демонстрируют превосходную противовирусную активность в отношении пикорнавирусов, включая вирусы коксаки, энтеро-, эхо-, полио- и риновирусы, поэтому они могут использоваться для профилактики или лечения респираторных, сердечно-сосудистых и заболеваний нервной системы, вызываемых пикорнавирусами, включая полиомиелит, паралич, острый геморрагический конъюнктивит, вирусный менингит, вирусную пузырчатку полости рта и конечностей, пузырчатку, гепатит А, миозит, миокардит, панкреатит, диабет, эпидемическую миалгию, энцефалит, грипп, везикулярный фарингит, ящур, астму, хроническое обструктивное заболевание легких, пневмонию, синусит и отит среднего уха.
<ПРИМЕР СОСТАВА 1> Получение фармацевтических составов
<1-1> Получение порошка
Производное инданона с химической формулой 1: 2 г
Лактоза: 1 г
Вышеуказанные ингредиенты смешивали и помещали в герметичный мешок для получения порошкообразного агента.
<1-2> Получение таблетки
Производное инданона с химической формулой 1: 100 мг
Кукурузный крахмал: 100 мг
Лактоза: 100 мг
Стеарат магния: 2 мг
Эти ингредиенты смешивали и таблетировали, используя обычный способ таблетирования.
<1-3> Получение капсулы
Производное инданона с химической формулой 1: 100 мг
Кукурузный крахмал: 100 мг
Лактоза: 100 мг
Стеарат магния: 2 мг
Эти ингредиенты смешивали и помещали в желатиновые капсулы с помощью обычных способов получения капсул.
<1-4> Получение инъекций
Производное инданона с химической формулой 1: 10 мкг/мл
Разбавленная хлористоводородная кислота BP: до рН 3,5
Хлорид натрия BP для инъекций: максимум 1 мл
Производное инданона по настоящему изобретению растворяли в подходящем объеме хлорида натрия BP для инъекций. Значение pH полученного раствора доводили до pH 3,5 с помощью разб. HCl BP, а затем объем регулировали с помощью хлорида натрия BP для инъекций и раствор полностью смешивали. Раствором затем наполняли 5-мл ампулу типа 1, сделанную из прозрачного стекла. Запаивали пространство в верхней части при помощи плавления стекла. Раствор, содержащийся в ампуле, автоклавировали при 120°C в течение 15 мин или более для стерилизации и, таким образом, получая инъекцию.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Обладая отличной ингибирующей активностью в отношении пикорнавирусов, включая вирусы коксаки, энтеро-, эхо-, полио- и риновирусы, а также обладая низкой цитотоксичностью, как описано выше, производное инданона химической формулы 1 может быть полезно в качестве активного ингредиента фармацевтической композиции для профилактики или лечения вирусного заболевания, в том числе полиомиелита, паралича, острого геморрагического конъюнктивита, вирусного менингита, вирусной пузырчатки полости рта и конечностей, пузырчатки, гепатита А, миозита, миокардита, панкреатита, диабета, эпидемической миалгии, энцефалита, гриппа, везикулярного фарингита и ящура.