Результат интеллектуальной деятельности: КОМПОЗИЦИИ И СПОСОБЫ ХАРАКТЕРИЗАЦИИ МИОПАТИИ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Данная заявка притязает на приоритет следующих предварительных заявок на патенты США (№№): 61/324857, поданной 16 апреля 2010 г., и 61/371798, поданной 9 августа 2010 г.; содержание каждой из которых полностью включено сюда посредством ссылки.
ЗАЯВЛЕНИЕ О ПРАВАХ НА ИЗОБРЕТЕНИЯ, СДЕЛАННЫЕ ПРИ ИССЛЕДОВАНИЯХ, ФИНАНСИРУЕМЫХ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА
Данное изобретение было поддержано следующими грантами Национальными институтами здравоохранения, (National Institutes of Health) (№№): AR44684, R37DE12354, K23-AR-053197 и K08-AR-054783. Правительство имеет определенные права на данное изобретение.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
У взрослых со слабостью проксимальных мышц, повышенными уровнями креатинкиназы (СК), признаками миопатии при электромиографии (EMG) и признаками отека мышц при магнитно-резонансной томографии (MRI) проводят обширный дифференциальный диагноз, включающий аутоиммунные миопатии, токсические миопатии, паранеопластические миопатии и мышечные дистрофии. Миопатия является частым нежелательным побочным эффектом, возникающим у субъектов, которым вводят статины для снижения у них уровня холестерина. Тяжесть возникающей у этих пациентов мышечной боли иногда приводит к необходимости прекращения терапии статинами. Разграничение иммуноопосредованных миопатии и миопатии другой этиологии очень важно, поскольку обычно только аутоиммунные заболевания мышц чувствительны к иммуносупрессивной терапии.
Во многих случаях определенные клинические признаки и/или биопсия мышц позволяют поставить окончательный диагноз. Например, перифасцикулярная атрофия патогномонична для дерматомиозита (DM), даже при отсутствии высыпаний; вакуольная миопатия у пациента, получающего лечение колхицином, является убедительным признаком токсической миопатии; и слабое окрашивание мышцы на дистрофии у молодого человека с гипертрофией икроножных мышц является диагностическим признаком дистрофинопатии.
Тем не менее, в значительном числе случаев в образцах биопсии мышц присутствуют дегенеративные и некротические мышечные волокна без признаков, специфичных для каких-либо конкретных заболеваний. В этих случаях присутствие аутоантител, специфичных для миозита (MSA), может указывать на принадлежность расстройства к семейству аутоиммунных миопатий. Например, у пациентов с антителами, направленными против частицы, распознающей сигнал (SRP), обычно имеет место тяжелая некротизирующая миопатия, чувствительная только к очень агрессивной иммуносупрессии. К сожалению, клиническая оценка и доступные в настоящее время диагностические тесты не всегда позволяют поставить окончательный диагноз, и не всегда возможно определить, является ли некротизирующая миопатия иммуноопосредованной. Эта неясность может приводить к недостаточному лечению аутоиммунных миопатий или не уместной иммуносупрессии у пациентов без иммуноопосредованного заболевания. В целом, современные клинические способы не обеспечивают адекватной диагностики специфических заболеваний мышц у пациентов, страдающих от миопатий, и существует неотложная потребность в усовершенствованных способах.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Как описано ниже, в настоящем изобретении описаны композиции, способы и наборы для лечения, диагностики, мониторинга и иной характеризации миопатий (например иммуноопосредованной некротизирующей миопатий) у субъекта.
В одном аспекте согласно изобретению предложен способ выявления аутоиммунного ответа у субъекта, включающий выявление аутоантитела, распознающего белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR), в биологическом образце, полученном от субъекта.
В другом аспекте согласно изобретению предложен способ характеризации миопатий у субъекта, включающий выявление аутоантитела, распознающего белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR), в биологическом образце, полученном от субъекта.
В другом аспекте согласно изобретению предложен способ характеризации миопатии у субъекта, включающий выявление белка массой 100 кДа и/или белка массой 200 кДа, связывающегося с HMGCR антителом, в биологическом образце, полученном от субъекта.
В другом аспекте согласно изобретению предложен способ определения целесообразности продолжения терапии статинами у субъекта, включающий анализ присутствия аутоантитела, распознающего белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR),>в биологическом образце, полученном от субъекта, где выявление аутоантитела указывает на необходимость прекращения терапии статинами. В одном воплощении отсутствие аутоантитела у субъекта, у которого установлено наличие мышечной боли, указывает на то, что терапия статинами может быть продолжена с проведением у субъекта периодического мониторинга на предмет появления аутоантитела. В другом воплощении выявление аутоантитела у субъекта с мышечной болью и слабостью указывает на необходимость прекращения терапии статинами и необходимость начала иммуносупрессивной терапии.
В другом аспекте согласно изобретению предложен способ мониторинга при терапии статинами у субъекта, включающий периодическое тестирование биологического образца, полученного от субъекта, на предмет аутоантитела, распознающего белок 3-гидрокси-3-метилгпутарил-коэнзим А-редуктазу (HMGCR), в биологическом образце, полученном от субъекта. В одном воплощении периодическое тестирование проводят на 3, 6, 9, 12, 24 и/или 36 месяцы после начала терапии статинами. В другом воплощении способ дополнительно включает установление наличия у субъекта мышечной боли или слабости после начала терапии статинами.
В другом аспекте согласно изобретению предложен способ выбора схемы лечения субъекта, у которого установлено наличие миопатии, включающий выявление аутоантитела, распознающего белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR), в биологическом образце, полученном от субъекта, где выявление аутоантитела указывает на необходимость выбора иммуносупрессивной терапии. В одном воплощении способ дополнительно включает установление наличия у субъекта мышечной боли и слабости. В другом воплощении биологический образец представляет собой жидкий биологический образец или образец ткани. В другом воплощении жидкий биологический образец представляет собой кровь, сыворотку или плазму. В другом воплощении аутоантитело выявляют иммунологическим анализом (например, твердофазным иммуноферментным анализом (ELISA), иммунопреципитацией, твердофазным иммунофлуоресцентным анализом, твердофазным иммунохимическим анализом, радиоиммунным анализом, иммуноблоттингом, количественным иммунологическим анализом, проточной цитометрией, вестерн-блоттингом или иммуногистохимией).
В другом аспекте согласно изобретению предложен способ характеризации миопатии у субъекта, включающий приведение белка 3-гидрокси-3-метилглутарил-коэнзим А-редуктазы (HMGCR) или его фрагмента в контакт с сывороткой, кровью или плазмой субъекта и выявление специфического связывания аутоантитела против HMGCR или ее фрагмента, осуществляя посредством этого характеризацию миопатии у субъекта. В одном воплощении белок HMGCR или его фрагмент фиксирован на субстрате. В другом воплощении субстрат представляет собой мембрану, гранулу или микрочип. В другом воплощении связывание выявляют колориметрическим или радиоактивным анализом.
В другом аспекте согласно изобретению предложен набор для характеризации миопатии у субъекта, содержащий белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR) или его фрагмент, фиксированный на субстрате. В одном воплощении набор дополнительно включает инструкции по применению набора в способе по любому предыдущему аспекту. В одном воплощении субстрат представляет собой мембрану, шарик или микрочип. В другом воплощении связывание выявляют колориметрическим анализом. В другом воплощении фрагмент HMGCR редуктазы содержит С-концевой фрагмент, содержащий аминокислоты 340-888.
В различных воплощениях любых описанных выше аспектов или любого другого аспекта изобретения, описанного здесь, способ дополнительно включает выявление в биологическом образце, полученном от субъекта, белка массой 100 кДа и/или белка массой 200 кДа, связывающегося с HMGCR антителом. В определенных воплощениях описанных выше аспектов белок выявляют иммунопреципитацией. В других воплощениях описанных выше аспектов HMGCR антитело, связывающееся с белком массой 100 кДа и/или 200 кДа, выявляют колориметрическим или радиоактивным анализом. В других воплощениях миопатия представляет собой аутоиммунную миопатию или некротизирующую миопатию, ассоциированную с терапией статинами. В других воплощениях способ дополнительно включает определение силы проксимальных мышц, отека мышц при двусторонней магнитно-резонансной томографии (MRI) бедер, уровней креатинкиназы и/или признаков миопатии при электромиографии. В других воплощениях способ включает выявление маркера, выбранного из группы, состоящей из антисинтетазных аутоантител, аутоантител против частицы, распознающей сигнал (SRP), повышенных уровней креатинкиназы (СК), выраженных воспалительных клеточных инфильтратов при биопсии мышц, вакуолей с ободком, перифасцикулярной атрофии, положительного результата анализа на молекулы главного комплекса гистосовместимости (МНС) I класса, отложения мембраноатакующего комплекса в малых кровеносных сосудах перимизия и окрашивания регенерирующих мышечных волокон антителом против нейрональной молекулы клеточной адгезии (NCAM). В других воплощениях выявление включает сравнение уровня аутоантител в образце, полученном от субъекта, с контрольным уровнем (например средним уровнем в группе нормальных контролей). В определенных воплощениях описанных выше аспектов выявление повышения уровня аутоантитела, распознающего белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR), приблизительно на 2-5 стандартных отклонений относительно контроля указывает на аутоиммунную миопатию, ассоциированную со статинами. В других воплощениях выявление повышения уровня аутоантитела приблизительно на 3 стандартных отклонения указывает на аутоиммунную миопатию, ассоциированную со статинами. В других воплощениях описанных выше аспектов способ дополнительно включает установление наличия у субъекта мышечной боли и слабости. В других воплощениях биологический образец представляет собой жидкий биологический образец или образец ткани. В, других воплощениях жидкий биологический образец представляет собой кровь, сыворотку или плазму. В других воплощениях аутоантитело выявляют иммунологическим анализом (например ELISA, иммунопреципитацией, твердофазным иммунофлуоресцентным анализом, твердофазным иммунохимическим анализом, радиоиммунным анализом, иммуноблоттингом, количественным иммунологическим анализом, проточной цитометрией, вестерн-блоттингом или иммуногистохимией). В определенных воплощениях описанных выше аспектов фрагмент HMGCR содержит С-концевой фрагмент, содержащий аминокислоты 340-888.
Согласно изобретению предложены способы характеризации миопатии, в частности, миопатии, ассоциированных с терапией статинами. Композиции и продукты, предложенные согласно изобретению, были выделены или изготовлены иным образом в связи с примерами, представленными ниже. Другие признаки и преимущества изобретения будут очевидны из подробного описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
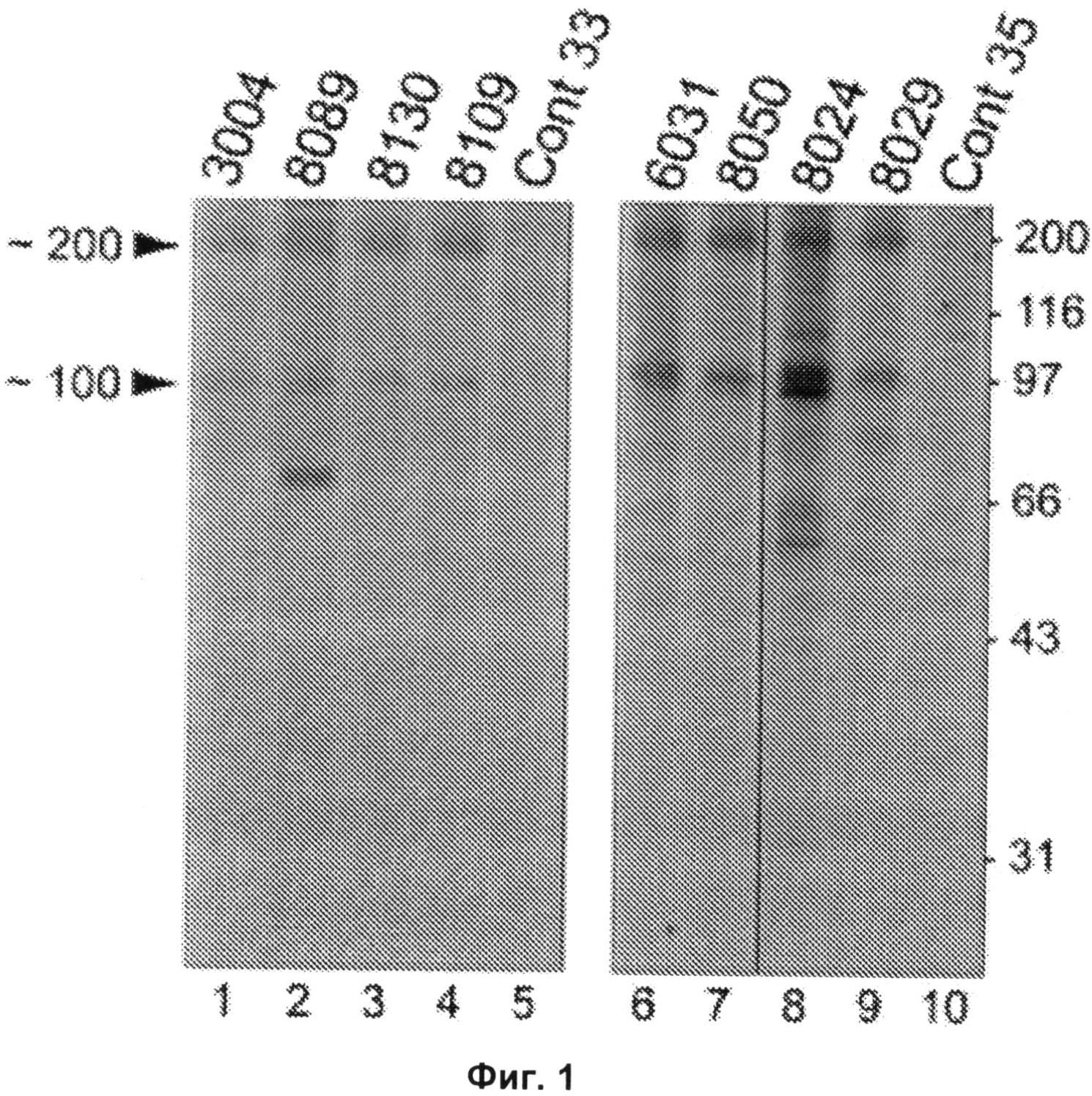
Фиг.1 включает авторадиограмму, на которой показаны белки, осажденные иммунопреципитацией из экстрактов клеток HeLa сыворотками, полученными от пациентов с некротизирующей миопатией. Иммунопреципитация белков массой приблизительно 200 кДа и приблизительно 100 кДа сыворотками, полученными от пациентов с некротизирующей миопатией. Сыворотки пациентов использовали для иммунопреципитации радиоактивно меченых белков из экстрактов клеток HeLa, инкубированных с 35S-метионином. Осажденные иммунопреципитацией белки разделяли электрофорезом в 10%-ных полиакриламидных гелях с додецилсульфатом натрия. На левой и правой панелях показаны авторадиограммы от двух раздельных экспериментов; результаты, показанные на правой панели, получены из одной авторадиограммы, разрезанной между дорожками 7 и 8 для исключения иммунопреципитации, не имеющей отношения к настоящему исследованию. Номера над дорожками 1-4 и 6-9 представляют собой номера пациентов. Для иммунопреципитации, показанной на дорожках 5 и 10, использовали сыворотки, полученные от двух здоровых контролей (Cont 33 и Cont 35). Стрелками слева показаны полосы белков массой приблизительно 200 кДа (-200) и приблизительно 100 кДа (~100). Значениями справа показаны положения стандартов маркера молекулярной массы.
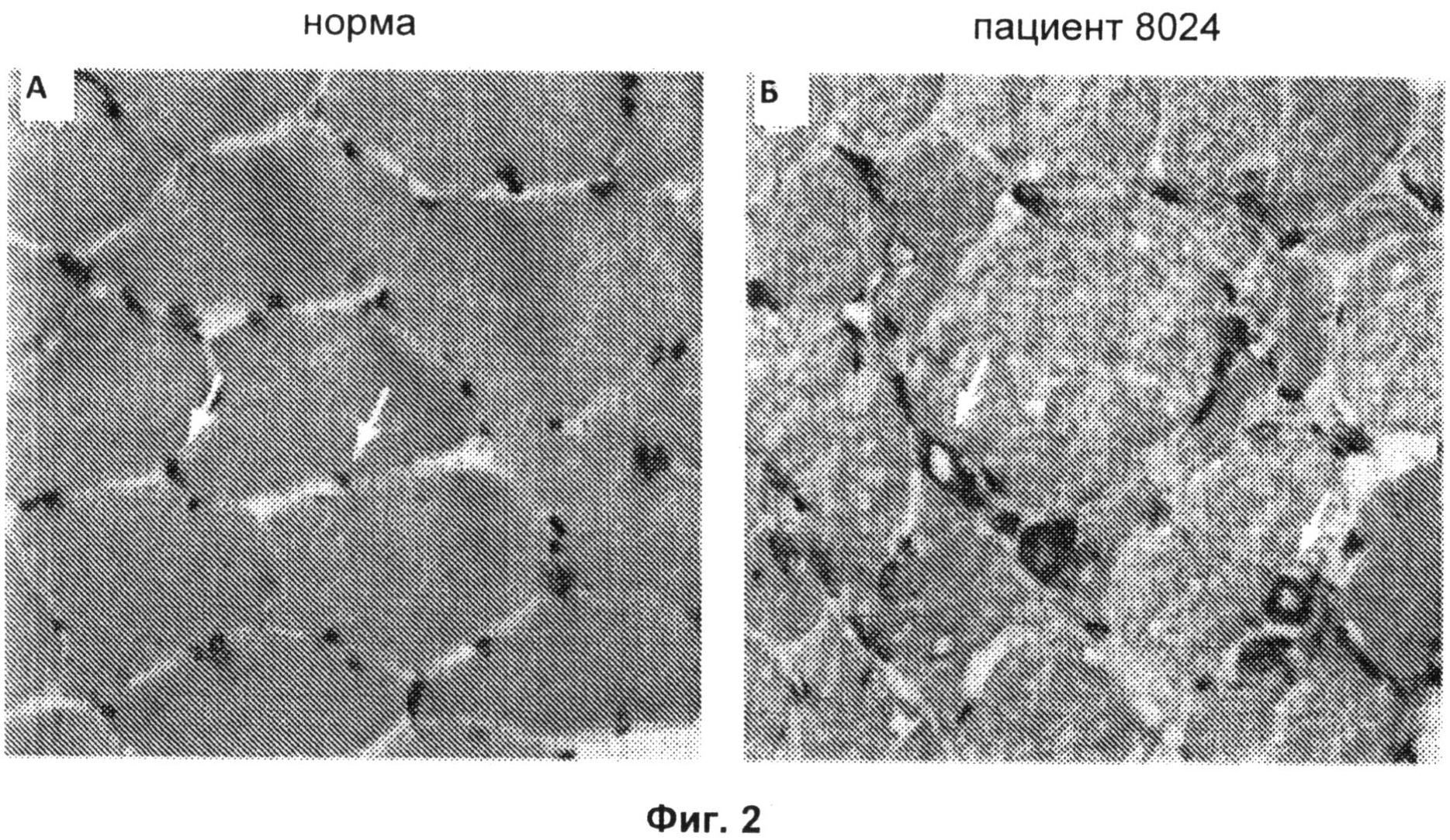
Фиг.2А и 2Б включают микрофотографии, на которых показана морфология капилляров в образцах биопсии мышц, полученных от здорового донора (Фиг.2А) и пациента (пациента 8024) с анти-200/100-кДа аутоантителами (Фиг.2Б). Образцы окашивали антителом против CD31, маркера эндотелиальных клеток. Стрелками показаны капилляры эндомизия с нормальными морфологическими признаками в контрольном образце (Фиг.2А) и капилляры с утолщенными стенками и расширенным просветом у пациента с анти-200/100-кДа аутоантителами (Фиг.2Б). Данные биопсийные образцы обрабатывали одновременно в одинаковых условиях (исходное увеличение Х 40).
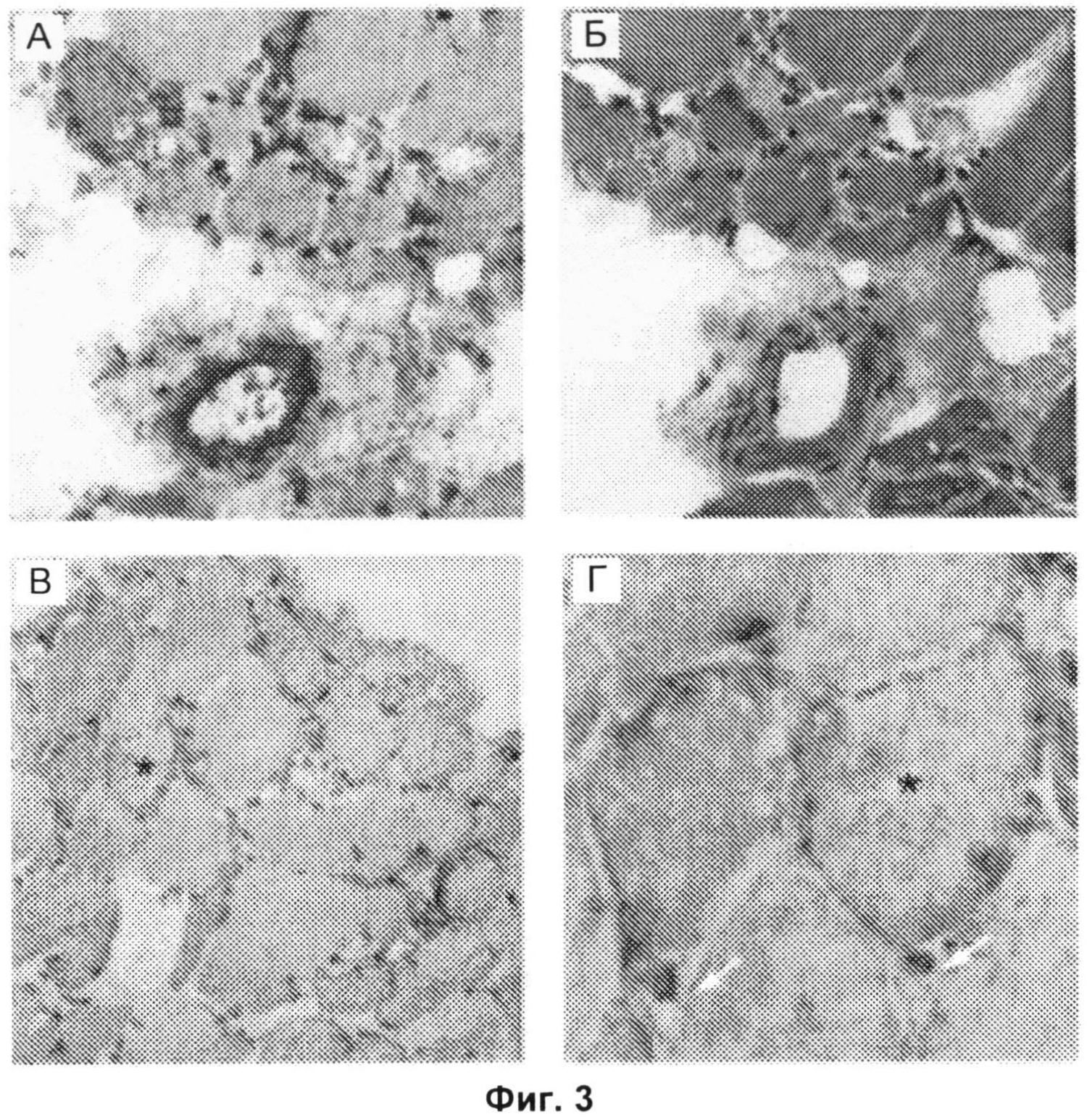
Фиг.3А-3Г включают микрофотографии, на которых показано отложение мембраноатакующего комплекса в малых кровеносных сосудах и ненекротических мышечных волокнах. Серийные срезы биопсийного образца мышцы, полученного от пациента, позитивного в отношении анти-200/100-кДа антител, с некротизирующей миопатией (пациента 8076). Окрашивание антителом против мембраноатакующего комплекса (Фиг.3А) или гематоксилином и эозином (Фиг.3Б) продемонстрировало значительное отложение комплемента в кровеносном сосуде перимизия. На Фиг.3В представлен биопсийный образец мышцы, полученный от позитивного в отношении анти-200/100-кДа антител пациента (пациента 8076), демонстрирующий отложение мембраноатакующего комплекса в разрозненных не-некротических волокнах. На Фиг.3Г показан вид поля зрения, показанного на Фиг.3В, при большем увеличении. На Фиг.3Г стрелками показано отсутствие окрашивания мембраноатакующего комплекса в капиллярах эндомизия. Звездочками на Фиг.3В и 3Г показано одно и то же мышечное волокно. (Исходное увеличение Х 40 на Фиг.3А, 3Б и 3Г; Х 20 на Фиг.3В. Звездочками на Фиг.3В и 3Г показано одно и то же мышечное волокно.)
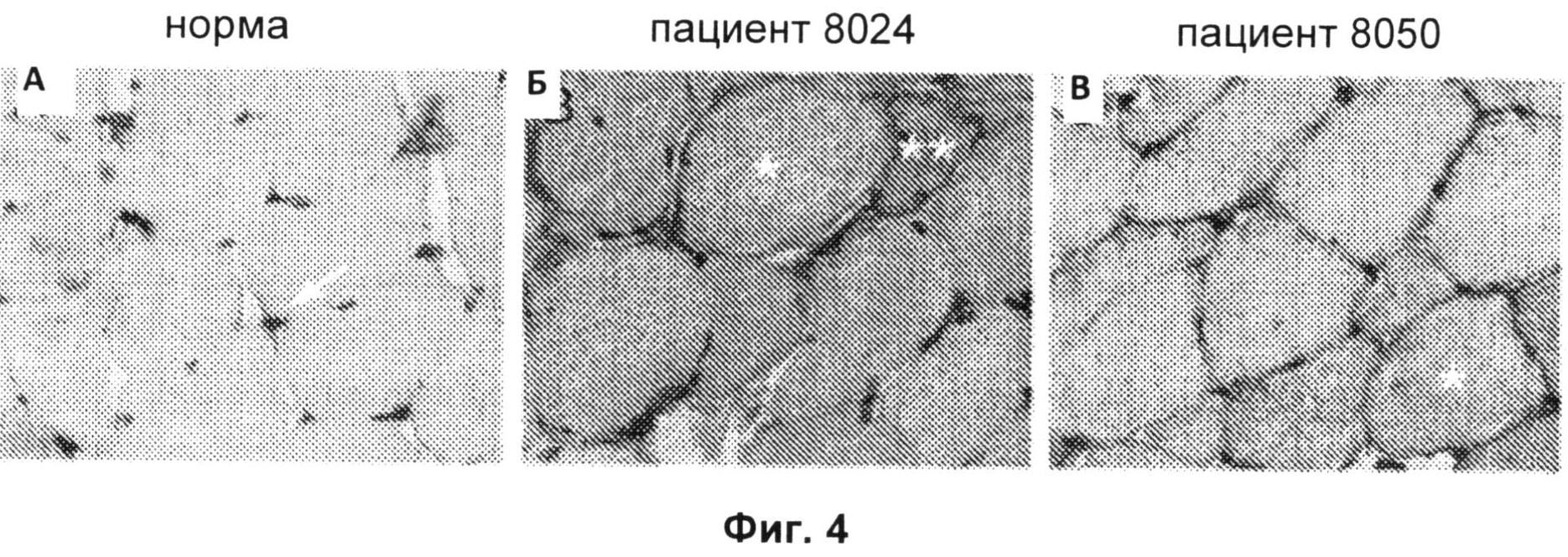
Фиг.4А-4 В включают микрофотографии, на которых показано отложение молекул МНС I класса в не-некротических волокнах биопсийных образцов, полученных от позитивных в отношении анти-200/100-кДа антител пациентов. На Фиг.4А показано окрашивание капилляров эндомизия (показано стрелкой), но не сарколеммы, антителами против молекул МНС I класса в нормальной человеческой мышце. На Фиг.4Б и 4В показано окрашивание сарколеммы разрозненных мышечных волокон антителами против молекул МНС 1 класса у 2 пациентов с анти-200/100-кДа аутоантителами (одиночные звездочки). Антитела против молекул МНС I класса также окрашивали цитоплазму волокна, положительного в отношении анти-200/100-кДа антител (двойные звездочки);
вероятно, это волокно является регенерирующим волокном. Данные биопсийные образцы обрабатывали одновременно в одинаковых условиях. (Исходное увеличение Х 40.)
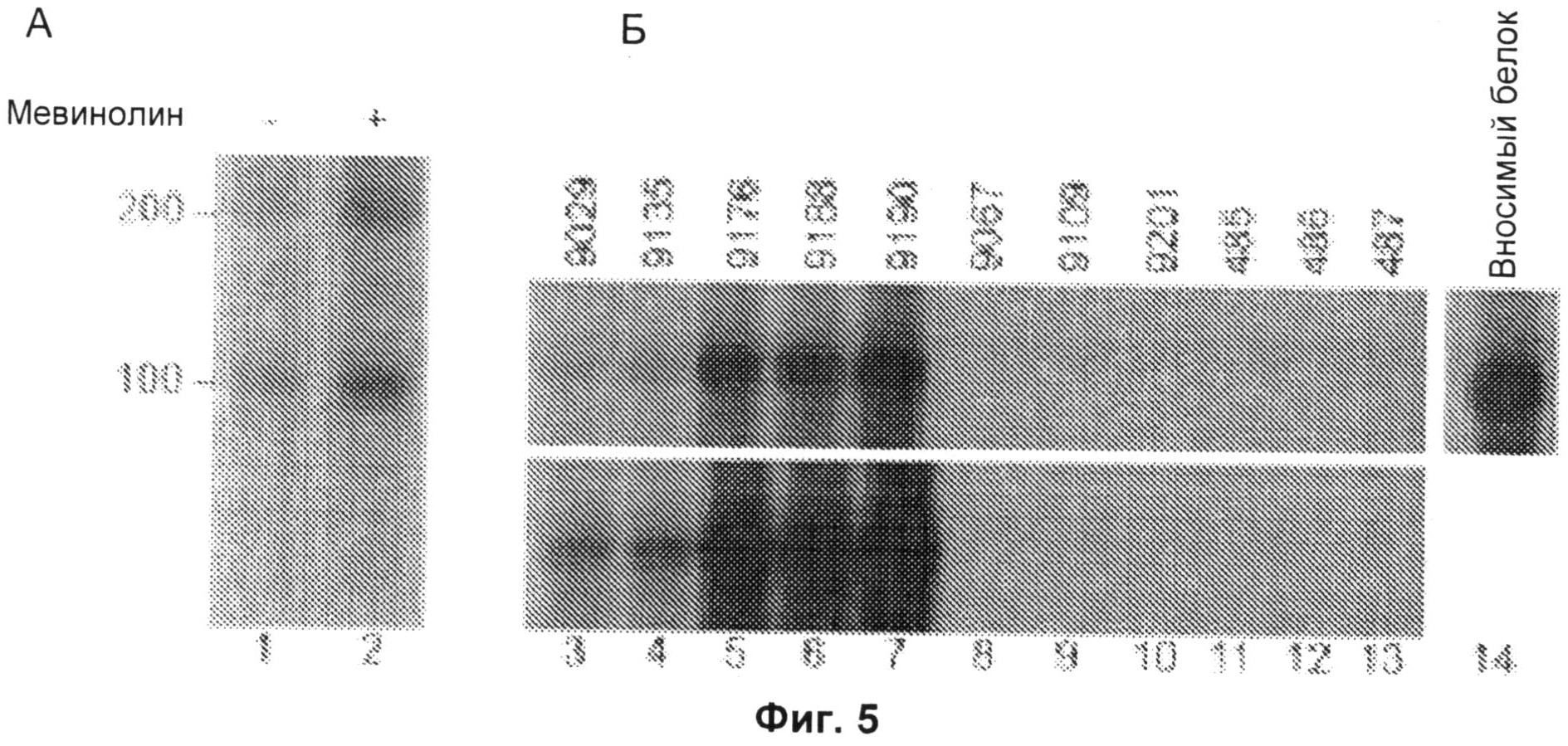
Фиг.5А и 5Б включают авторадиограммы, на которых показана активированная экспрессия 200-кДа и 100-кДа аутоантигенов статинами (Фиг.5А) и идентификация 100-кДа аутоантигена как 3-гидрокси-3-метилглутарил-коэнзим А-редуктазы (ГМГ-КоА-редуктазы). Проводили иммунопреципитацию радиоактивно меченых лизатов, полученных из клеток HeLa, обработанных в течение двадцати четырех часов в отсутствие (дорожка 1) или в присутствии (дорожка 2) 10 мкМ мевинолина, с сывороткой пациента 9190, как описано ниже. На Фиг.5Б полноразмерный in vitro транскрибированный/транслированный (IVTT). белок ГМГ-КоА-редуктазу, меченный 35S-метионином, подвергали иммунопреципитации с использованием сывороток, полученных от анти-200/100-кДа-позитивных пациентов (дорожки 3-7; показаны типичные результаты, полученные с использованием 16 протестированных анти-200/100-кДа-позитивных образцов сыворотки), от анти-200/100-кДа-негативных пациентов с дерматомиозитом (дорожки 8-10) или от здоровых контрольных пациентов (дорожки 11-13). Вносимый IVTT-продукт показан на дорожке 14. Результаты, показанные на Фиг.5А и 5Б, типичны для по меньшей мере 3 отдельных экспериментов. Маркеры молекулярной массы показаны слева.
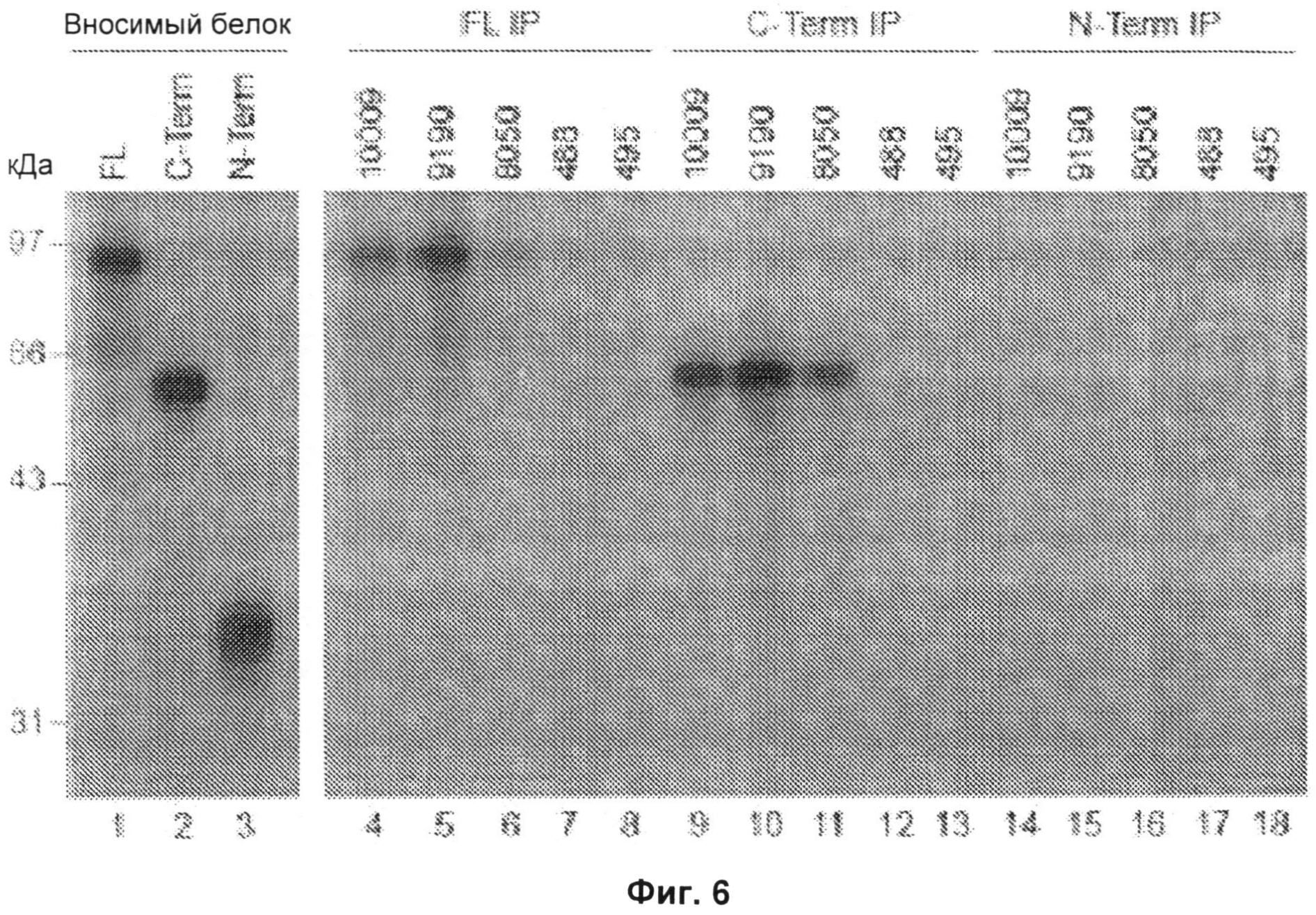
На Фиг.6 представлена авторадиограмма, на которой показаны результаты иммунопреципитации (IP) полноразмерной 3-гидрокси-3-метилглутарил-коэнзим А-редуктазы (HMGCR) и фрагмента, соответствующего ее С-концу (аминокислоты 340-888), человеческими антителами против ГМГ-КоА-редуктазы. Реакции иммунопреципитации проводили с использованием 3 разных меченных 35S-метионином HMGCR продуктов: полноразмерного белка (FL; дорожки 4-8), С-конца (C-term, дорожки 9-13) и N-конца (N-term, дорожки 14-18). Образцы сыворотки 10009, 9190 и 8050 получены от анти-200/100-кДа-позитивных пациентов, образцы 488 и 495 получены от здоровых контрольных субъектов. Вносимые in vitro транскрибированные/транслированные (IVTT) продукты показаны на дорожках 1-3; в каждом случае использовали количество, составляющее 0,4 количества, использованного для иммунопреципитации. Результаты типичны для 2-8 отдельных экспериментов. Маркеры молекулярной массы показаны слева. FL - полноразмерный белок, C-term - С-конец, N-term - N-конец, FL IP - иммунопреципитация полноразмерного белка, C-term IP-иммунопреципитация С-конца, N-term IP - иммунопреципитация N-конца.
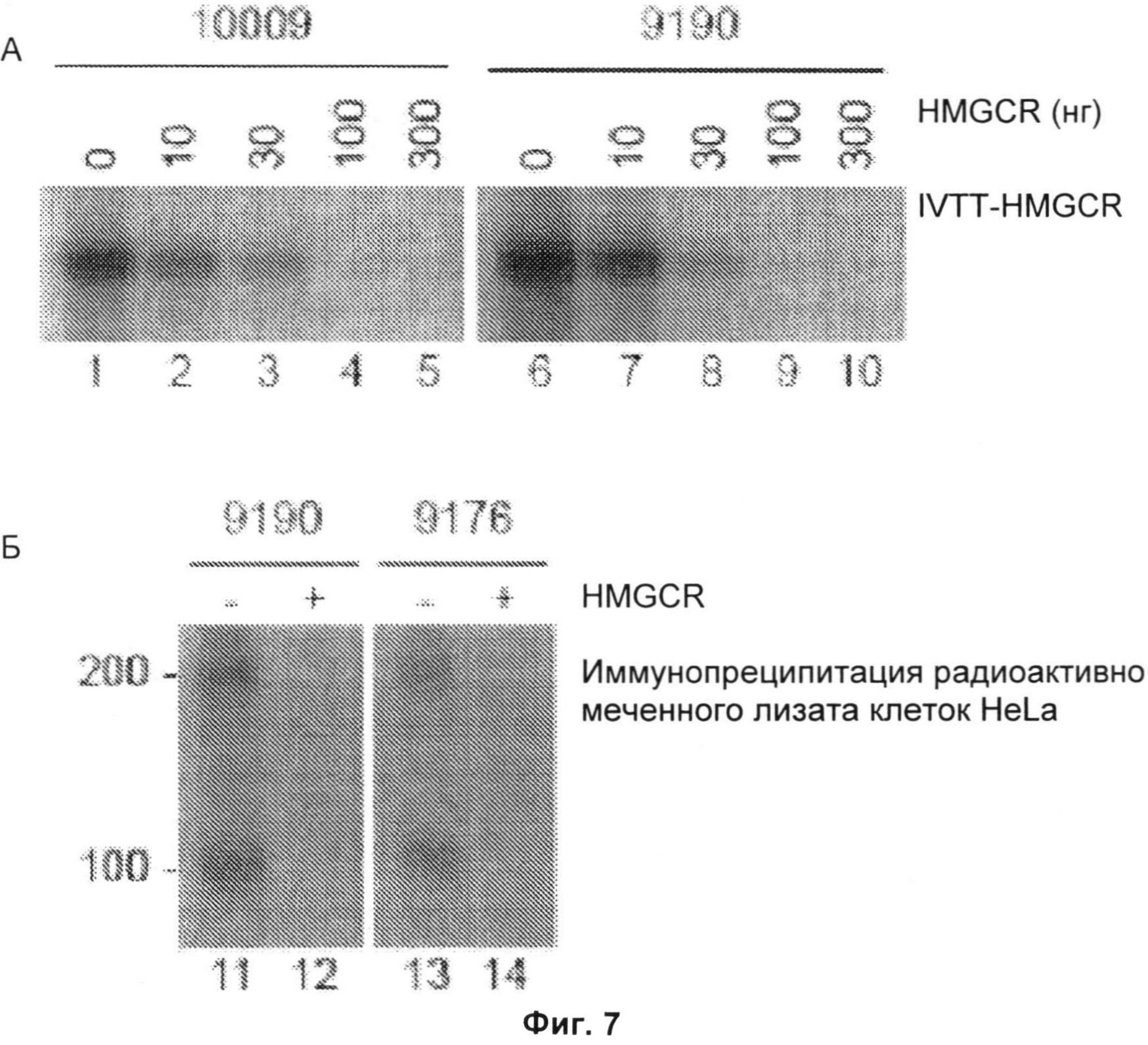
Фиг.7А и 7Б включают три авторадиограммы. На Фиг.7А показаны результаты экспериментов конкурентной иммунопреципитации (IP), подтверждающие, что человеческие антитела против 3-гидрокси-3-метилглутарил-коэнзим А-редуктазы (анти-HMGCR) распознают ее С-конец, и что белок массой 200 кДа не распознается индивидуальным антителом. Образцы сыворотки 10009 и 9190 предварительно инкубировали с указанными количествами немеченой С-концевой HMGCR и затем использовали для иммунопреципитации полноразмерной меченной 35S-метионином HMGCR. На Фиг.7Б образцы сыворотки от пациентов 9190 и 9176 предварительно инкубировали в отсутствие или в присутствии 300 нг немеченой С-концевой HMGCR и затем добавляли к радиоактивно меченым лизатам, полученным из клеток HeLa, обработанных 10 мкМ мевинолином в течение двадцати четырех часов. Полученные иммунопреципитаты обрабатывали, как описано ниже. В двух отдельных экспериментах с использованием сывороток от четырех (Фиг.7А) или шести (Фиг.7Б) разных пациентов были получены идентичные данные. Маркеры молекулярной массы показаны слева.
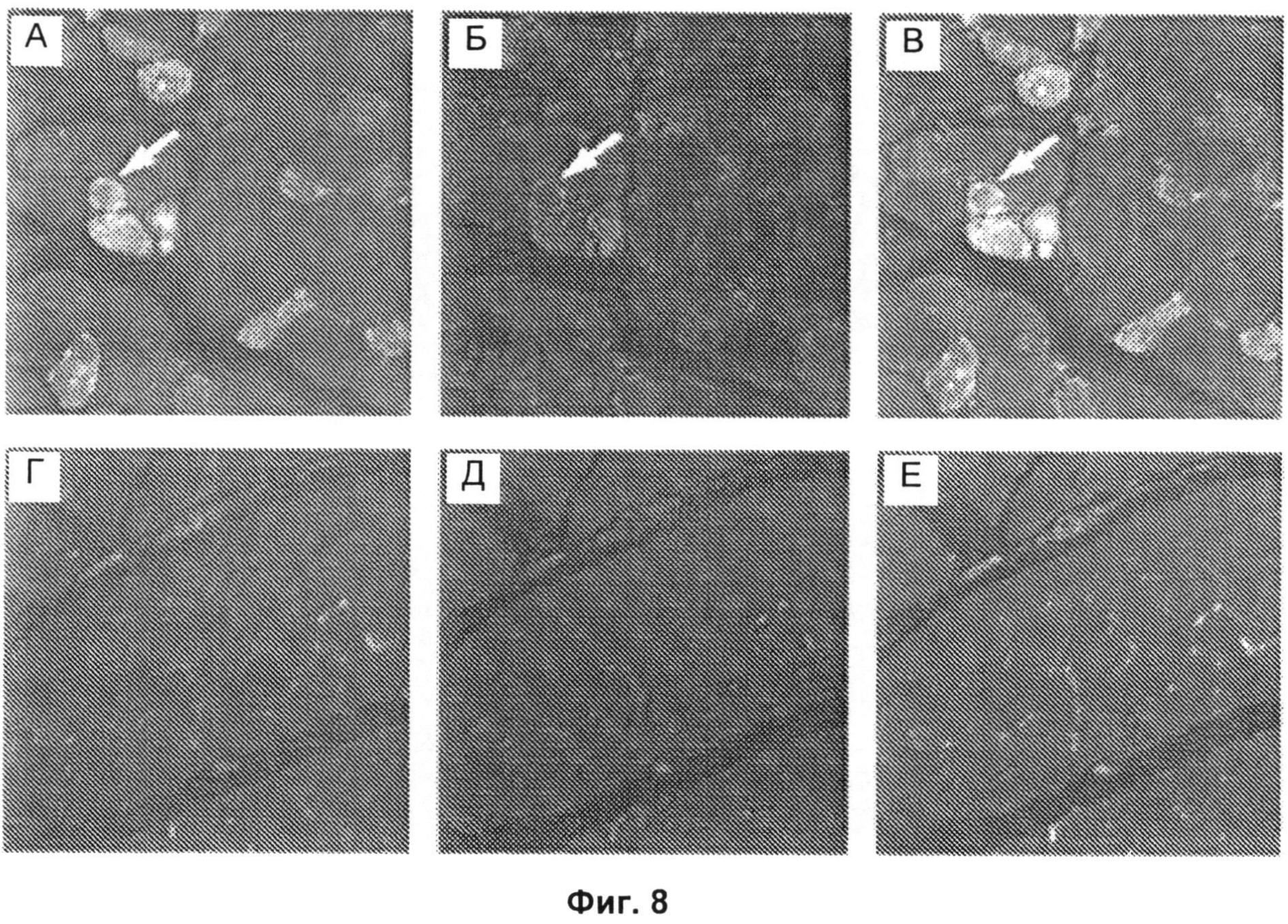
Фиг.8А-8Е включают микрофотографии, на которых показана активация экспрессии ГМГ-КоА-редуктазы в регенерирующих мышечных волокнах, экспрессирующих нейрональную молекулу клеточной адгезии (NCAM). Образцы биопсии мышц от анти-HMGCR-позитивных пациентов (Фиг.8А-В) и контрольных субъектов (Фиг.8Г-Е) одновременно окрашивали антителами против NCAM (зеленый) (Фиг.8А и 8Г), анти-HMGCR антителами (красный) (Фиг.8Б и 8Д) и DAPI (4,6-диамидино-2-фенилиндол) (синий) для окрашивания ядер. Изображения, полученные наложением (Фиг.8В и 8Е), демонстрируют, что в анти-HMGCR-позитивных тканях, полученных биопсией мышц, HMGCR и NCAM часто экспрессированы совместно на высоких уровнях в одних и тех же мышечных волокнах (стрелки), чего не наблюдали в контрольных тканях, полученных биопсией мышц. Для обеспечения сопоставимости данных Фиг.8А-8В и 8Г-8Е получали с использованием одинаковых параметров экспозиции для каждого канала. Результаты типичны для окрашивания, наблюдаемого в шести анти-HMGCR-позитивных биопсийных образцах мышц и трех биопсийных образцах нормальных мышц. Исходное увеличение Х 20.
ОПРЕДЕЛЕНИЯ
Под «белком 3-гидрокси-3-метилглутарил-коэнзим А-редуктазой (HMGCR)» понимают полипептид или его фрагмент, аминокислотная последовательность которого по меньшей мере на 85% идентична последовательности с идентификационным номером в Национальном центре биотехнологической информации (NCBI) NP_000850.1, или его фрагмент, обладающий связывающей активностью в отношении антител, присущей HMGCR. Одним предпочтительным фрагментом является С-концевой фрагмент, включающий внутриклеточную часть молекулы (аминокислоты 340-888), показанную ниже жирным/подчеркнутым шрифтом.
Типичная последовательность белка HMGCR показана ниже:
>gi|4557643|ref|NP_000850.1| 3-гидрокси-3-метилглутарил-коэнзим А-редуктаза, изоформа 1 [Homo sapiens]

Под «аутоантителом» понимают антитело, направленное против аутоантигена. Типичным аутоантителом является аутоантитело, направленное против HMGCR.
Под «HMGCR антителом» понимают антитело, специфично связывающееся с белком HMGCR.
Под «миопатией» понимают состояние мышц, ассоциированное с мышечной слабостью или болью. Другие маркеры миопатии включают, без ограничения ими, присутствие антисинтетазных аутоантител, аутоантител против частицы, распознающей сигнал (SRP), повышенных уровней креатинкиназы (СК), выраженных воспалительных клеточных инфильтратов при биопсии мышц, вакуолей с ободком, перифасцикулярной атрофии, положительный результат анализа на молекулы МНС I класса, отложение мембраноатакующего комплекса в малых кровеносных сосудах перимизия и окрашивание регенерирующих мышечных волокон антителом против NCAM. Другие маркеры включают слабость проксимальных мышц, признаки миопатии при электромиографии (EMG), выраженные воспалительные клеточные инфильтраты при биопсии мышц, вакуоли с ободком, перифасцикулярную атрофию и отек мышц при двусторонней MRI бедер.
Под «иммуноанализами» понимают тест, позволяющий измерить присутствие или уровень вещества на основании его специфичного связывания с антителами.
Под «иммуносупрессией» понимают снижение по меньшей мере одной нежелательной функции иммунной системы.
Под «иммуносупрессором» понимают агент, снижающий функцию иммунной системы. Примеры иммуносупрессоров включают глюкокортикоиды (например преднизон), цитостатики (например азатиоприн и метотрексат), лекарственные средства, действующие на иммунофилины (например циклоспорин и такролимус), и другие лекарственные средства (например гидроксихлорохин, иммуноглобулины для внутривенного введения, мофетил микофенолата и ритуксимаб).
Под «субстратом» понимают любую твердую подложку. Типичные твердые подложки включают титрационный микропланшет, предметное стекло, полистирольный шарик, пробирку, устройство для иммунохроматографии, тест-полоску или индикаторную полоску.
Под «статинами» понимают класс лекарственных средств, используемых для снижения уровней холестерина посредством Lipitor® и торваст (torvast)), флувастатин (лескол), ловастатин (Mevacor®, алтокор, мевинолин и Altoprev®), питавастатин (Livalo®, питава (pitava)), правастатин (правахол, селектин (selektine) и липостат), розувастатин (Crestor®) и симвастатин (Zocor® и Lipex™).
Под «агентом» подразумевают любое химическое соединение, представляющее собой малую молекулу, антитело, молекулу нуклеиновой кислоты, полипептид или их фрагменты.
Под «изменением» понимают изменение (повышение или снижение) уровней экспрессии или активности гена или полипептида, как выявлено стандартными известными способами, такими как способы, описанные здесь. При использовании здесь «изменение» включает изменение уровней экспрессии на 10%, предпочтительно изменение уровней экспрессии на 25%, более предпочтительно изменение уровней экспрессии на 40% и наиболее предпочтительно изменение уровней экспрессии на 50% или более.
Под «улучшением/уменьшением интенсивности» понимают уменьшение, подавление, ослабление, снижение, остановку или стабилизацию развития или прогрессирования заболевания.
Под «аналогом» понимают молекулу, не являющуюся идентичной, но имеющую аналогичные функциональные или структурные свойства. Например, аналог полипептида сохраняет биологическую активность соответствующего встречающегося в природе полипептида и в то же время имеет определенные биохимические модификации, усиливающие функцию аналога по сравнению с встречающимся в природе полипептидом. Такие биохимические модификации могут повышать устойчивость аналога к протеазам, его способность проникать через мембраны, увеличивать его период полувыведения, не изменяя, например, связывание с лигандом. Аналог может содержать не встречающуюся в природе аминокислоту.
Под «биологическим образцом» понимают любую ткань, клетку, жидкость или другой материал, имеющий происхождение от организма.
В данном описании «включает», «включающий», «содержащий», «имеющий» и тому подобное могут иметь значение, определенное для них в патентном законодательстве США, и могут означать «включает», «включающий» и тому подобное; сходным образом, «состоящий по существу из» или «состоит по существу из» имеют значение, определенное в патентном законодательстве США, и эти термины являются открытыми, допуская присутствие неуказанных элементов, при условии, что присутствие неуказанных элементов не изменяет основные или новые свойства указанных элементов, но исключают воплощения из предшествующего уровня техники.
Под «контролем» понимают стандарт, с которым проводят сравнение. Например, уровень аутоантитела в образце, полученном от субъекта, у которого подозревают наличие иммуноопосредованной некротизирующей миопатии, можно сравнивать с уровнем аутоантитела, присутствующего в соответствующем образце, полученном от здорового субъекта, то есть субъекта без миопатии.
«Выявление» относится к определению присутствия, отсутствия или количества анализируемого вещества, подлежащего выявлению.
Под «выявляемой меткой» понимают композицию, которая будучи связанной с интересующей молекулой позволяет выявлять ее спектроскопическим, фотохимическим, биохимическим, иммунохимическим или химическим способом. Например, полезные метки включают радиоактивные изотопы, магнитные шарики, металлические шарики, коллоидные частицы, флуоресцентные красители, электроноплотные реагенты, ферменты (например, обычно используемые в ELISA), биотин, дигоксигенин или гаптены.
Под «диагностикой» понимают любой способ, позволяющий определить наличие патологического состояния или охарктеризовать природу патологического состояния (например, миопатии). Диагностические способы отличаются по их чувствительности и специфичности. Когда определенный диагностический способ не может обеспечить окончательную диагностику состояния, достаточно того, что этот способ обеспечивает положительный результат, способствующий постановке диагноза.
Под «заболеванием» понимают любое состояние или расстройство, нарушающее или препятствующее нормальному функционированию клетки, ткани или органа. Примеры заболеваний включают аутоиммунные заболевания, миопатию и аутоиммунную миопатию, ассоциированную со статинами.
Под «эффективным количеством» понимают количество, необходимое для уменьшения интенсивности симптомов заболевания по сравнению с пациентом, не получающим лечение. Эффективное количество активного соединения (соединений), используемое при практическом применении настоящего изобретения для терапевтического лечения заболевания, варьирует в зависимости от способа введения, возраста, массы тела и общего состояния здоровья субъекта. В конечном счете, подходящее количество и схему введения будет определять практикующий врач или ветеринар. Такое количество называют «эффективным» количеством.
Под «фрагментом» понимают часть полипептида или молекулы нуклеиновой кислоты. Предпочтительно, эта часть содержит по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% всей длины исходного полипептида или молекулы нуклеиновой кислоты. Фрагмент может содержать 10, 20, 30, 40, 50, 60, 70, 80,90 или 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 нуклеотидов или аминокислот.
Под «выделенным полипептидом» понимают полипептид по изобретению, отделенный от компонентов, с которыми он обычно встречается в природе. Обычно полипептид является выделенным, когда он по меньшей мере на 60% по массе свободен от белков и встречающихся в природе органических молекул, с которыми он связан в природе. Предпочтительно, полипептид по изобретению составляет по меньшей мере 75%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 99% препарата по массе. Выделенный полипептид по изобретению может быть получен, например, экстракцией из природного источника, экспрессией рекомбинантной нуклеиновой кислоты, кодирующей такой полипептид, или химическим синтезом белка. Чистота может быть оценена любым подходящим способом, например колоночной хроматографией, электрофорезом в полиакриламидном геле или анализом высокоэффективной жидкостной хроматографией (HPLC).
Под «маркером» понимают любое изменение белка, полинуклеотида или клинического признака, ассоциированного с заболеванием или расстройством.
При использовании здесь «получение», как во фразе «получение агента», включает синтез, приобретение или иное получение агента.
Под «периодическим» понимают происходящий через равные промежутки времени. Периодический мониторинг у пациента включает, например, серию исследований, проводимых один раз в неделю, один раз месяц, два раза в год или один раз в год.
Под «снижением/уменьшением» или «повышением/увеличением» понимают отрицательное или положительное изменение, соответственно, на по меньшей мере приблизительно 10%, 25%, 50%, 75% или 100% относительно исходной величины.
Под «контролем/эталоном» понимают стандартное или контрольное условие.
«Эталонная последовательность» представляет собой определенную последовательность, используемую в качестве основной для сравнения последовательностей. Эталонная последовательность может представлять собой часть указанной последовательности или полноразмерную последовательность, например сегмент последовательности полноразмерной кДНК или гена или полную последовательность кДНК или гена. Для полипептидов длина эталонной полипептидной последовательности будет обычно составлять по меньшей мере приблизительно 16 аминокислот, предпочтительно по меньшей мере приблизительно 20 аминокислот, более предпочтительно по меньшей мере приблизительно 25 аминокислот, и еще более приблизительно 35 аминокислот, приблизительно 50 аминокислот или приблизительно 100 аминокислот. Для нуклеиновых кислот длина эталонной последовательности нуклеиновой кислоты будет обычно составлять по меньшей мере приблизительно 50 нуклеотидов, предпочтительно по меньшей мере приблизительно 60 нуклеотидов, более предпочтительно по меньшей мере приблизительно 75 нуклеотидов и еще более предпочтительно приблизительно 100 нуклеотидов, или приблизительно 300 нуклеотидов, или любое близкое или промежуточное целое число.
Под «специфичным связыванием» понимают, что соединение или антитело распознает полипептид по изобретению и связывается с ним, но по существу не распознает и не связывается с другими молекулами образца, например биологического образца, естественным образом содержащего полипептид по изобретению.
Идентичность последовательностей обычно оценивают с использованием программного обеспечения для анализа последовательностей (например программ Sequence Analysis Software Package of the Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 University Avenue, Madison, Wis. 53705, BLAST, BESTFIT, GAP или PILEUP/PRETTYBOX). Такие программы отмечают идентичные или сходные последовательности, присваивая степени гомологии различным заменам, делециям и/или другим модификациям. Консервативные замены обычно включают замены в пределах следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин. В типичном способе определения степени идентичности может быть использована программа BLAST с показателем вероятности от е-3 до е-100, что является признаком близкородственных последовательностей.
Под «субъектом» понимают млекопитающего, включая, без ограничения, человека или млекопитающих, не являющихся людьми, таких представители семейств бычьих, лошадиных, собачьих, овец или кошачьих.
Под «по существу идентичными» понимают молекулу полипептида или нуклеиновой кислоты, имеющие по меньшей мере 50%-ную идентичность с эталонной аминокислотной последовательностью (например с любой из аминокислотных последовательностей, описанных здесь) или с последовательностью нуклеиновой кислоты (например с любой из последовательностей нуклеиновых кислот, описанных здесь). Предпочтительно такая последовательности является на по меньшей мере 60%, более предпочтительно 80% или 85% и более предпочтительно 90%, 95% или даже 99% идентичной на аминокислотном или нуклеотидном уровне последовательности, используемой для сравнения,
Согласно изобретению предложены несколько мишеней, полезных для разработки высокоспецифичных лекарственных средств для лечения расстройства, характеризуемого способами, описанными здесь. Кроме того, способы по изобретению обеспечивают простое средство определения терапий, безопасных для применения у субъектов. Кроме того, способы по изобретению обеспечивают путь для анализа практически любого числа соединений на предмет их эффектов на описанное здесь заболевание с высокой пропускной способностью, высокой чувствительностью и низкой сложностью.
Подразумевают, что диапазоны, приведенные здесь, являются условным обозначением для всех значений, входящих в диапазон. Например, подразумевают, что диапазон от 1 до 50 включает любое число, комбинацию чисел или поддиапазон из группы, состоящей из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50.
При использовании здесь термины «лечить», «лечение» и тому подобное относятся к ослаблению или уменьшению интенсивности расстройства и/или ассоциированных с ним симптомов. Следует понимать, что лечение расстройства или состояния не обязательно приводит к полному устранению расстройства, состояния или связанных с ними симптомов, несмотря на возможность их полного устранения.
Если не указано специально или не очевидно из контекста, подразумевают, что при использовании здесь термин «или» является включающе-отличающим. Если не указано специально или не очевидно из контекста, подразумевают, что при использовании здесь формы единственного числа включают формы множественного числа, и наоборот.
Если не указано специально или не очевидно из контекста, подразумевают, что при использовании здесь термин «приблизительно» означает «в пределах диапазона, принятого в данной области техники», например, в пределах 2 стандартных отклонений среднего. «Приблизительно» следует понимать как «в пределах 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,1%, 0,05% или 0,01%» указанного значения. Если из контеста не ясно иное, все числовые значения, приведенные здесь, модифицированы термином «приблизительно».
Указание перечня химических групп в любом определении переменной, приведенном здесь, включает определения этой переменной в форме любой одной группы или комбинации перечисленных групп. Указание воплощения переменной или аспекта, приведенного здесь, включает это воплощение в форме любого воплощения самого по себе или в комбинации с любыми другими воплощениями или их частями.
Любые композиции и способы, предложенные здесь, можно комбинировать с одной/одним или несколькими из любых других композиций и способов, предложенных здесь.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном изобретении описаны композиции и способы, полезные в качестве композиций, способов и наборов для лечения, диагностики, мониторинга и иной характеризации миопатии (например иммуноопосредованной некротизирующей миопатии) у субъекта.
Изобретение основано, по меньшей мере частично, на обнаружении того, что у некоторых пациентов применение статинов ассоциировано с аутоиммунной некротизирующей миопатией с аутоантителами, распознающими белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR).
Как подробно описано ниже, новые аутоантитела у пациентов с некротизирующей миопатией были обнаружены при характеризации пациентов с некрозом мышечных волокон без выраженного воспаления, что является неспецифическим признаком у пациентов с дистрофиями и токсическими или иммуноопосредованными миопатиями. Поскольку этиология некротизирующей миопатии часто неясна, вопрос о том, как лечить этих пациентов, то есть, принесет ли им пользу иммуносупрессия, оставался без ответа. Для разработки способа диагностики и лечения таких пациентов с некротизирующей миопатией были проанализированы биопсийные образцы мышц и образцы сыворотки, полученные от 225 пациентов с миопатией. Специфичность антител определяли, проводя реакции иммунопреципитации из лизатов клеток HeLa, меченных 35S-метионином. В отобранных биопсийных образцах окрашивали мембраноатакующий комплекс, молекулы главного комплекса гистосовместимости (МНС) I класса и маркер эндотелиальных клеток CD31. Биопсийные образцы мышц, полученные от тридцати восьми из 225 пациентов, продемонстрировали преимущественно некроз мышечных волокон. У двенадцати из этих пациентов миопатия была ассоциирована с известными аутоантителами или имела другую известную этиологию. Сыворотки шестнадцати пациентов из оставшихся двадцати шести подвергали иммунопреципитации белков массой 200 кДа и 100 кДа; такую специфичность наблюдали только у одного из 187 пациентов без некротизирующей миопатии. Пациенты с аутоантителами против белков массой 100/200 кДа, 10333 МЕ/л и раздражительной миопатией при электромиографии (88%). Шестьдесят три процента этих пациентов принимали статины до появления слабости. Все пациенты были чувствительны к иммуносупрессивной терапии, и при постепенном уменьшении дозы иммуносупрессоров у многих пациентов происходил рецидив слабости мышц. Иммуногистохимические исследования продемонстрировали наличие мембраноатакующего комплекса в малых кровеносных сосудах у шести из восьми пациентов и на поверхности ненекротических мышечных волокон - у четырех из восьми пациентов. У пяти из восьми пациентов была изменена морфология капилляров, и у четырех из восьми пациентов была экспрессия молекул МНС I класса на поверхности ненекротических мышечных волокон. На основании этих данных очевидно, что специфичность анти-100/200-кДа аутоантитела определяет подгруппу пациентов с некротизирующей миопатией, которых ранее рассматривали как аутоантитело-негативных. После начального обнаружения новых аутоантител у пациентов с некротизирующей миопатией были проведены дополнительные эксперименты, как подробно описано ниже, для идентификации 200-кДа и 100-кДа аутоантигенов, являющихся мишенями для указанных аутоантител, для прояснения механизма развития иммуноопосредованной некротизирующей миопатии (IMNM) и облегчения ее диагностики. Помимо индукции самокупирующейся миопатии применение статинов связано с иммуноопосредованной некротизирующей миопатией (IMNM) с аутоантителами, распознающими 200-кДа и 100-кДа аутоантигены. Для идентификации этих молекул эффекты обработки статином на экспрессию аутоантигенов изучали иммунопреципитацией с использованием сывороток, полученных от пациентов. Идентичность приблизительно 100-кДа аутоантигена была подтверждена иммунопреципитацией in vitro транскрибированного/ транслированного (1VTT) белка 3-гидрокси-3-метилглутарил-коэнзим А-редуктазы (ГМГ-КоА-редуктазы или HMGCR). Экспрессию ГМГ-КоА-редуктазы в мышцах анализировали иммунофлуоресценцией. Проводили скрининг группы пациентов с миопатией на предмет аутоантител против ГМГ-КоА-редуктазы твердофазным иммуноферментным анализом (ELISA) и их генотипирование по аллелю rs4149056 С, являющемуся прогностическим фактором самокупирующейся миопатии, связанной со статинами. Обработка статинами индуцировала экспрессию приблизительно 200-кДа/приблизительно 100-кДа аутоантигенов в культивируемых клетках. ГМГ-КоА-редуктаза была идентифицирована как 100-кДа аутоантиген. Конкурентные эксперименты продемонстрировали отсутствие отдельных аутоантител, распознающих белок массой приблизительно 200 кДа. В тканях, полученных биопсией мышц от пациентов, позитивных в отношении аутоантител против ГМГ-КоА-редуктазы, экспрессия ГМГ-КоА-редуктазы была повышена в клетках, экспрессирующих нейрональную молекулу клеточной адгезии (NCAM), маркер регенерации мышц. Аутоантитела против ГМГ-КоА-редуктазы были обнаружены у сорока пяти из 750 пациентов, обратившихся в Центр миозитов Джона Хопкинса (Johns Hopkins Myositis Center) (6%). Среди пациентов в возрасте пятьдесят лет и старше 92,3% принимали статины. Распространенность аллеля rs4149056 С не была повышена у пациентов, позитивных в отношении аутоантител против ГМГ-КоА-редуктазы. Статины повышали экспрессию HMCGR, основной мишени аутоантител при ассоциированной со статинами IMNM. Регенерирующие мышечные клетки экспрессируют высокие уровни HMCGR, что может поддерживать иммунный ответ даже после прекращения приема статинов. Эти исследования демонстрируют механизм, связывающий средовой провоцирующий фактор с развитием устойчивого аутоиммунитета.
Эти данные показывают, что применение статинов запускает аутоиммунный ответ против ГМГ-КоА-редуктазы, активируя экспрессию данного аутоантигена. Даже после прекращения применения статинов присутствие высоких уровней ГМГ-КоА-редуктазы в регенерирующих мышечных волокнах поддерживает иммунный ответ, и у субъектов, принимающих статины, необходимо проводить мониторинг присутствия антител. При выявлении аутоантител у субъекта, принимающего статин, необходимо прекратить прием статина и начать иммуносупрессивную терапию для предотвращения или уменьшения тяжести иммуноопосредованных миопатических симптомов. Как очевидно из приведенных ниже примеров и других частей настоящей заявки, выявление аутоантител против ГМГ-КоА-редуктазы облегчает диагностику и способствует лечению иммуноопосредованной некротизирующей миопатии.
Статины
Статины снижают уровень холестерина, специфически ингибируя 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (ГМГ-КоА-редуктазу или HMGCR), ключевой фермент в метаболическом пути биосинтеза холестерина. Эти лекарственные средства оказывают значимый положительный эффект относительно сердечно-сосудистых конечных точек и являются одними из наиболее часто назначаемых лекарственных средств, при этом в 2005 г. в США статины были назначены почти 30 миллионам человек (Stagnitti MN. Rockdale (MD): Agency for Healthcare Research and Quality; 2008 May. Statistical brief 205). Примеры статинов включают аторвастатин (Lipitor® и торваст (Torvast)), флувастатин (лескол), ловастатин (Mevacor®, алтокор, мевинолин и Altoprev®), питавастатин (Livalo®, питава (pitava)), правастатин (правахол, селектин (selektine) и липостат), розувастатин (Crestor®) и симвастатин (Zocor® и Lipex™).
Симптомы со стороны опорно-двигательной системы являются хорошо известным осложнением применения статинов и варьируют от миалгий и судорог, возникающих у 9-20% принимающих статины (De Sauvage Nolting et al., Am J Cardiol 2002;90:181-4; Bruckert et al., Cardiovasc Drugs Ther 2005; 19:403-14; and Franc et al., Cardiovasc Drugs Ther 2003; 17:459-65.), до жизнеугрожающего рабдомиолиза, редкого явления, частота которого составляет 0,4 на 10000 пациентов в год (Graham et al., JAMA 2004; 292: 2585-90.).
В большинстве случаев индуцированные статинами миопатические явления купируются самостоятельно с полным выздоровлением в течение нескольких недель после прекращения приема статинов (Soininen et al., Basic Clin Pharmacol Toxicol 2006; 98:51-4). Тем не менее, в двух проведенных недавно исследованиях были описаны тридцать три пациента с аутоиммунной миопатией после приема статинов, не проходившей после прекращения приема статинов (Needham et al., Neuromuscul Disord 2007; 17: 194-200 и Grable-Esposito etal., Muscle Nerve 2010:41:185-90.).
Диагностика
В настоящем изобретении описаны диагностические анализы для выявления аутоантител, распознающих белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR) в биологическом образце, полученном от субъекта. В одном воплощении в образце, полученном от субъекта, определяют уровни таких аутоантител и используют их для характеризации аутоиммунного заболевания, миопатии, ассоциированной с аутоиммунным ответом, ассоциированным с терапией статинами, и некротизирующей миопатии, или склонности к развитию такого состояния. Для определения уровней аутоантитела в образце, полученном от субъекта, могут быть применены стандартные способы. Биологические образцы включают образцы тканей (например образцы клеток, биопсийные образцы) и биологические жидкости, включая, без ограничения, кровь, сыворотку крови и плазму. Способы измерения уровней полипептида включают иммунологический анализ, ELISA, вестерн-блоттинг и радиоиммунный анализ или любой другой способ, известный в данной области техники. Повышенные уровни аутоантител, сами по себе или в комбинации с одним или несколькими дополнительными маркерами, рассматривают как положительный индикатор аутоиммунного заболевания. Уровень аутоантител может быть повышен на по меньшей мере приблизительно 10%, 25%, 50%, 75% или более. В одном воплощении любое повышение уровня маркера по изобретению указывает на аутоиммунное заболевание, миопатию или некротизирующую миопатию.
Для выявления аутоантител и других маркеров, описанных здесь, полезных при определении этиологии миопатии, может быть применен любой подходящий способ. В частности, могут быть использованы аутоантитела, распознающие белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR), сами по себе или в комбинации с антисинтетазными аутоантителами (против Jo-1, против PL-12, против PL-7), аутоантителами против частицы, распознающей сигнал (SRP). Также возможна оценка других клинических индикаторов миопатии, включая, без ограничения, слабость проксимальных мышц, повышенные уровни креатинкиназы (СК), признаки миопатии при электромиографии (ЭМГ), выраженные воспалительные клеточные инфильтраты при биопсии мышц, перифасцикулярную атрофию, отек мышц при двусторонней МРТ бедер, положительный результат анализа на молекулы МНС I класса, отложение мембраноатакующего комплекса в малых кровеносных сосудах перимизия и окрашивание антителом против NCAM для выявления регенерирующих мышечных тканей.
Успешное практическое использование изобретения возможно с применением одного способа или комбинации способов, позволяющих выявлять и, предпочтительно, количественно оценивать такие маркеры. Эти способы включают, без ограничения, способы, основанные на гибридизации, включая способы, применяемые в биочиповых матрицах, масс-спектрометрию (например масс-спектрометрию с лазерной десорбцией/ионизацией), флуоресценцию (например иммунологический сэндвич-анализ), поверхностный плазменный резонанс, эллипсометрию и атомно-силовую микроскопию. Уровни экспрессии маркеров (например полинуклеотидов или полипептидов) сравнивают способами, хорошо известными в данной области техники, такими как полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР), нозерн-блоттинг, вестерн-блоттинг, проточная цитометрия, иммуногистохимия, связывание с магнитными и/или покрытыми антителами шариками, гибридизация in situ, флуоресцентная гибридизация in situ (FISH), анализ адгезии в проточной камере, ELISA, микрочиповые анализы или колориметрические анализы. Способы могут дополнительно включать одно или более из масс-спектрометрии с ионизацией электрораспылением (ESI-MS), тандемной масс-спектрометрии с ионизацией электрораспылением (ESI-MS/MS, ESI-MS/(MS)n), времяпролетной масс-спектрометрии с матричной лазерной десорбцией и ионизацией (MALDI-TOF-MS), времяпролетной масс-спектрометрии с поверхностной лазерной десорбцией и ионизацией (SELDI-TOF-MS), десорбции/ионизации на кремнии (DIOS), вторично-ионной масс-спектрометрии (SIMS), квадрупольной времяпролетной масс-спектрометрии (Q-TOF), масс-спектрометрии с химической ионизацией при атмосферном давлении (APCI-MS), тандемной масс-спектрометрии с химической ионизацией при атмосферном давлении (APCI-MS/MS, APCI-MS)n), масс-спектрометрии с фотоионизацией при атмосферном давлении (APPI-MS), тандемной масс-спектрометрии с фотоионизацией при атмосферном давлении (APPI-MS/MS и APPI-(MS)n), квадрупольной масс-спектрометрии, масс-спектрометрии с преобразованием Фурье (FTMS) и масс-спектрометрии с ионной ловушкой, где п представляет собой целое число, превышающее ноль.
Способы выявления могут включать применение биочиповой матрицы. Полезные в изобретении биочиповые матрицы включают белковые и полинуклеотидные матрицы. Один или более маркеров фиксируют на биочиповом массиве и подвергают анализу для определения уровня маркеров в образце.
Антитела могут быть проведена с использованием фиксирующих реагентов, таких как белки 3-гидрокси-3-метилглутарил-коэнзим А-редуктазы (HMGCR) или их фрагменты, иммобилизованные на твердой подложке, такой как биочип, многолуночный титрационный микропланшет, смола или нитроцеллюлозная мембрана, которую затем анализируют на предмет присутствия или уровня маркера. В одном воплощении фрагмент представляет собой С-концевой фрагмент, включающий внутриклеточную часть молекулы (аминокислоты 340-888). Фиксация может быть проведена на хроматографической поверхности или биоспецифической поверхности. Например, для приведения в контакт с активной поверхностью биочипа в течение времени, достаточного для связывания, может быть использован образец, содержащий аутоантитела, такой как сыворотка. Несвязанные молекулы отмывают от поверхности с использованием подходящего элюента, такого как забуференный фосфатом физиологический раствор. В целом, чем сильнее элюент, тем прочнее должны быть связаны белки для их сохранения после отмывки.
После фиксации на биочипе аутоантитела могут быть выявлены множеством способов выявления, выбранных, например, из способа газофазной ионной масс-спектрометрии, оптического способа, электрохимического способа, атомно-силовой микроскопии и радиочастотного способа. В одном воплощении применяют масс-спектрометрию и, в частности, SELDI. Оптические способы включают, например, определение флуоресценции, люминесценции, хемилюминесценции, абсорбции, отражательной способности, пропускания, двойного лучепреломления или коэффициента преломления (например, поверхностный плазменный резонанс, эллипсометрию, способ резонансного зеркала, способ волновода-решеточного светоделителя или интерферометрию). Оптические способы включают микроскопию (конфокальную и неконфокальную), способы с визуализацией и без визуализации. Распространенными способами выявления аналитов, фиксированных на твердой фазе, являются иммунологические анализы разных форматов (например ELISA). Электрохимические способы включают способы вольтаметрии и амперометрии. Радиочастотные способы включают мультиполярную резонансную спектроскопию.
В одном воплощении уровень аутоантител измеряют по меньшей мере два раза в разное время и изменение этих уровней с течением времени по сравнению с нормальными контрольными уровнями используют в качестве индикатора наличия или прогрессирования аутоиммунного заболевания, миопатии, некротизирующей миопатии. Уровень маркера в биологических жидкостях (например, крови, сыворотке крови, плазме) субъекта с аутоиммунным заболеванием, миопатией или некротизирующей миопатией может быть изменен относительно уровня такого маркера в нормальном контроле на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более. В целом, уровни аутоантител, распознающих белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR), у здорового субъекта (то есть субъекта без миопатии или субъекта, у которого не произойдет развития миопатии) являются низкими или невыявляемыми. В одном воплощении образец биологической жидкости (например крови, сыворотки крови, плазмы) получают от субъекта до появления симптомов миопатии, но после начала терапии статинами.
Диагностические способы, описанные здесь, могут быть применены по отдельности или в комбинации с любым другим диагностическим способом, описанным здесь, для более точной диагностики наличия или тяжести миопатии.
Диагностические способы, описанные здесь, могут также быть применены для мониторинга и оказания помощи при миопатии или для надежного разграничения некротизирующей миопатии и других миопатии.
Как указано выше, согласно изобретению предложены способы содействия диагностике миопатии у человека с использованием одного или нескольких маркеров, описанных здесь. Аутоантитело, распознающее белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR), может быть использовано само по себе, в комбинации с другими аутоантителами, ассоциированными с аутоиммунной миопатией, или с другими клиническими индикаторами, полезными для содействия диагностике миопатии у человека. Присутствие указанных антител различно в образцах, полученных от пациента-человека с некротизирующей миопатией и от нормального субъекта, у которого миопатии является необнаружимой. По этой причине выявление аутоантител у индивида будет обеспечивать полезную информацию о вероятности наличия у индивида некротизирующей миопатии или о его склонности к развитию данного заболевания.
Выявление аутоантител, распознающих белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR), коррелирует с аутоиммунным заболеванием, миопатией, ассоциированной с аутоиммунным ответом, ассоциированным с терапией статинами, и некротизирующей миопатией. В некоторых воплощениях полезно выявление лишь присутствия аутоантител, распознающих белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR), без определения их количества, и оно может быть скоррелировано с вероятным диагнозом миопатии. Оценка аутоантител может также включать определение количества аутоантител для коррелирования выявления маркеров с вероятным диагнозом аутоиммунного заболевания, миопатии, ассоциированной с аутоиммунным ответом, ассоциированным с терапией статинами, и некротизирующей миопатии. Таким образом, если количество маркеров, выявленных у исследуемого субъекта, отличается от контрольного количества (то есть превышает контрольное количество), то вероятность наличия у исследуемого субъекта аутоиммунного заболевания, миопатии, ассоциированной с аутоиммунным ответом, ассоциированным с терапией статинами, и некротизирующей миопатии повышена.
При установлении корреляции можно учитывать количество аутоантител в образце по сравнению с контрольным количеством маркера или маркеров (например у нормальных субъектов, у которых миопатия является необнаружимой). Контрольное количество может представлять собой, например, среднее или медианное количества аутоантител, присутствующих в сравниваемых образцах, полученных от нормальных субъектов. Контрольное значение определяют в таких же или по существу сходных экспериментальных условиях, что и при определении исследуемого количества. В результате, контроль можно использовать в качестве эталонного стандарта с установленным нормальным фенотипом (без миопатии), и каждый результат можно сравнивать с этим стандартом вместо повторного определения контрольного количества.
В определенных воплощениях способов диагностики аутоиммунного заболевания, миопатии, ассоциированной с аутоиммунным ответом, ассоциированным с терапией статинами, и некротизирующей миопатии эти способы дополнительно включают управление лечением субъекта на основании его состояния. Согласно изобретению также предложены такие способы, где маркеры (или определенную комбинацию маркеров) оценивают повторно после лечения субъекта. В этих случаях способы применяют для мониторинга статуса миопатии, например, ответа на лечение миопатии, ремиссии заболевания или прогрессирования заболевания.
Диагностика по настоящему изобретению, включающая иммунологические анализы, применяемые для выявления присутствия или измерения уровня аутоантител в биологическом образце, полученном от субъекта, имеет несколько других применений. Например, они могут быть применены для мониторинга ответов на определенное лечение аутоиммунного заболевания, миопатии, ассоциированной с аутоиммунным ответом, асоциированным с терапией статинами, и некротизирующей миопатии. В еще одном примере маркеры могут быть использованы в исследованиях наследственности. Например, определенные маркеры могут быть генетически связанными. Генетически связанные маркеры могут быть использованы в качестве способа определения генетической предрасположенности субъекта к аутоиммунной миопатии. Например, присутствие определенного полиморфизма в гене SLC01B1 (то есть аллеле rs4149056 С) в сильной степени ассоциировано с развитием связанной со статинами миопатии.
Любой отдельный маркер может быть' применен для облегчения выявления аутоиммунного заболевания, миопатии, ассоциированной с аутоиммунным ответом, ассоциированным с терапией статинами, и некротизирующей миопатии. Сначала, в образце, полученном от субъекта, выявляют аутоантитела, распознающие белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR), с применением- способов, описанных здесь. Затем полученный результат сравнивают с контролем, позволяющим отличить состояние аутоиммунной миопатии от контроля. Специалистам в данной области техники ясно, что применяемые методики могут быть изменены для повышения чувствительности или специфичности диагностического анализа по усмотрению специалиста, проводящего диагностику.
Несмотря на то, что маркеры сами по себе являются полезными диагностическими маркерами, в некоторых случаях комбинация маркеров имеет большее прогностическое значение, чем отдельные маркеры сами по себе. Выявление множества маркеров (или, в некоторых случаях, их отсутствия) в образце может повышать процент истинно положительных и истинно отрицательных диагнозов и снижать процент ложноположительных и ложноотрицательных диагнозов. По этой причине предпочтительные способы по настоящему изобретению включают оценку более чем одного маркера.
Диагностические анализы
Согласно настоящему изобретению предложены несколько диагностических анализов, полезных для идентификации или характеризации аутоиммунного заболевания, миопатии, ассоциированной с аутоиммунным ответом, ассоциированным с терапией статинами, и некротизирующей миопатии, или склонности к развитию такого состояния. В одном воплощении миопатию характеризуют посредством выявления присутствия аутоантител, распознающих белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR), самих по себе или в комбинации с одним или более другими маркерами, используемыми для характеризации миопатии (например антисинтетазными аутоантителами, аутоантителами против частицы, распознающей сигнал (SRP), повышенными уровнями креатинкиназы (СК), выраженными воспалительными клеточными инфильтратами при биопсии мышц, перифасцикулярной атрофией, положительным результатом анализа на молекулы МНС 1 класса, отложением мембраноатакующего комплекса в малых кровеносных сосудах перимизия и окрашиванием регенерирующих мышечных волокон антителом против NCAM). Несмотря на то, что в примерах, представленных ниже, описаны конкретные способы определения уровней этих маркеров, специалисту в данной области техники будет ясно, что изобретение не ограничено такими способами. Уровни антител могут быть количественно определены любым стандартным способом, ' включая, без ограничения,
иммунологические анализы, выявляющие связывание антител (например ELISA, вестерн-блоттинг, иммунопреципитация, иммунофлуоресценция). Такие анализы могут быть проведены на мембранах, тест-полосках, биочипах или любой другой платформе, известной в данной области техники.
Диагностические наборы
Согласно изобретению предложены наборы для диагностики или мониторинга аутоиммунного заболевания, миопатии, ассоциированной с аутоиммунным ответом, ассоциированным с терапией статинами, и некротизирующей миопатии или для выбора лечения для этих состояний или любого другого состояния, ассоциированного с наличием аутоантител, распознающих белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR). В одном воплощении набор используют для определения целесообразности продолжения терапии статинами у субъекта. При этом врач может принимать во внимание наличие или отсутствие у субъекта аутоантител, распознающих белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR). Появление таких антител возможно через несколько недель, месяцев или даже лет после начала терапии статинами. Если желательно, субъекта, получающего терапию статинами, обследуют на предмет таких аутоантител независимо от наличия или отсутствия у него симптомов миопатии.
В одном воплощении набор включает композицию, содержащую по меньшей мере один агент, связывающийся с аутоантителом, которое специфически связывается с белком 3-гидроксй-3-метилглутарил-коэнзим А-редуктазой (HMGCR). В определенных воплощениях агент, связывающийся с указанным аутоантителом, представляет собой фрагмент белка HMGCR, например, С-концевой фрагмент. В некоторых воплощениях набор включает стерильный контейнер, содержащий связывающий агент; такие контейнеры могут представлять собой коробки, ампулы, бутылки, флаконы, пробирки, пакеты, мешки, блистерные упаковки или другие подходящие формы контейнеров, известные в данной области техники. Такие контейнеры могут быть изготовлены из пластика, стекла, ламинированной бумаги, металлической фольги или других материалов, подходящих для изготовления упаковки для лекарственных средств.
Если желательно, набор представлен вместе с инструкциями по применению набора для диагностики аутоиммунного заболевания, миопатии, ассоциироваанной с аутоиммунным ответом, ассоциированным с терапией статинами, и/или некротизирующей миопатии. Инструкции будут обычно включать информацию о применении композиции для диагностики субъекта как имеющего миопатию или имеющего некротизирующую миопатию. В других воплощениях инструкции включают по меньшей мере одно из следующего:
описание связывающего агента, предупреждения, показания, противопоказания, данные исследований на животных, данные клинических исследований и/или список литературы. Инструкции могут быть напечатаны непосредственно на контейнере (если он присутствует) или в форме этикетки, прикрепленной к контейнеру, или в форме отдельного листа, брошюры, карты или папки, поставляемых в контейнере или вместе с ним. Типы биологических образцов
Уровень аутоантител, распознающих белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR), определяют в биологических образцах различных типов. В одном воплощении уровень аутоантитела определяют в биологических образцах различных типов. В другом воплощении уровень аутоантитела определяют в биологических образцах различных типов. В одном воплощении биологический образец представляет собой образец ткани, содержащий мышечные клетки (например мышечные клетки, полученные биопсией мышц). В другом воплощении биологический образец представляет собой образец биологической жидкости. Образцы биологических жидкостей включают кровь, сыворотку крови, плазму, слюну или любую другую биологическую жидкость, применимую в способах по изобретению. Выбор способа лечения и мониторинга у субъекта
После того, как субъект идентифицирован как имеющий аутоиммунное заболевание, миопатию, ассоциированную с аутоиммунным ответом, ассоциированным с терапией статинами, и некротизирующую миопатию, выбирают способ лечения. Доступно несколько стандартных схем лечения. Уровень или наличие аутоантител, распознающих белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR), является одним из факторов, используемых при выборе способа лечения. В одном воплощении наличие аутоантител, распознающих белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR), указывает на целесообразность проведения иммуносупрессивной терапии. Другими важными факторами, которые могут быть использованы в сочетании с наличием таких аутоантител, являются другие маркеры и клинические индикаторы, полезные при определении миопатии (например антисинтетазные аутоантитела, аутоантитела против частицы, распознающей сигнал (SRP), повышенные уровни креатинкиназы (СК), выраженные воспалительные клеточные инфильтраты в биопсии мышц, вакуоли с ободком, перифасцикулярная атрофия, положительный результат анализа на молекулы МНС I класса, отложение мембраноатакующего комплекса в малых кровеносных сосудах перимизия и окрашивание регенерирующих мышечных волокон антителом против NCAM).
Мониторинг болезненного состояния или лечения у субъекта с аутоиммунным заболеванием, миопатией, ассоциированной с аутоиммунным ответом, ассоциированным с терапией статинами, и некротизирующей миопатией, или склонностью к развитию такого состояния можно проводить с применением способов и композиций по изобретению. В одном воплощении проводят мониторинг экспрессии маркеров, присутствующих в биологической жидкости, такой как кровь, сыворотка крови и плазма. Такой мониторинг может быть полезен, например, при оценке эффективности определенного лекарственного средства (например иммуносупрессивного лекарственного средства) у субъекта с симптомами миопатии. Желательно, чтобы лечение иммуносупрессивным лекарственным средством снижало уровни аутоантител, распознающих белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR). Если такое лечение не снижает уровни аутоантител, показана другая иммуносупрессивная терапия. Например, при отсутствии снижения уровней аутоантител в ответ на преднизон, показана комбинированная иммуносупрессивная терапия. Такая терапия может включать любые два или более из следующих лекарственных средств: преднизон, ритуксимаб, иммуноглобулин для внутривенного введения, азатиоприн, и/или метотрексат, и другие иммуномодулирующие агенты. Лекарственные средства, снижающие экспрессию маркера по изобретению (то есть аутоантител, распознающих белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR)), являются особенно полезными в данном изобретении.
Наборы
Согласно изобретению предложены наборы для диагностики аутоиммунного заболевания, миопатии, ассоциированной с аутоиммунным ответом, ассоциированным с терапией статинами, и некротизирующей миопатии, в частности, аутоиммунным ответом, ассоциированным с наличием аутоантител, распознающих белок 3-гидрокси-3-метилглутарил-коэнзим А-редуктазу (HMGCR). В одном воплощении набор включает агент, связывающийся с аутоантителами, специфично связывающимися с белком 3-гидрокси-3-метилглутарил-коэнзим А-редуктазой (HMGCR). В одном воплощении этот агент фиксирован на субстрате.
Субстрат представляет собой твердую подложку, которая может иметь форму бумажной полоски, индикаторной полоски, мембраны (например нейлоновой мембраны или целлюлозного фильтра), планшета (например титрационного микропланшета, 96-луночного планшета) или твердых частиц (например латексных или магнитных шариков). Твердая подложка может быть изготовлена из любого подходящего материала, включая, без ограничения, пластик (например полиэтилен, полипропилен, полистирол, латекс, поливинилхлорид, полиуретан, полиакриламид, поливиниловый спирт, нейлон, поливинилацетат или их любые подходящие сополимеры), целлюлозу (например различные типы бумаги, такие как нитроцеллюлозная бумага и тому подобное), кремниевый полимер (например силоксан), полисахарид (например агарозу или декстран) или ионообменную смолу (например обычные анионо- или катионообменные смолы).
В других воплощениях набор содержит агент, фиксированный на субстрате, и другие реагенты, используемые в ELISA. В некоторых воплощениях набор содержит стерильный контейнер, содержащий терапевтическую или профилактическую клеточную композицию; такие контейнеры могут представлять собой коробки; ампулы, бутылки, флаконы, пробирки, пакеты, мешки, блистерные упаковки или другие подходящие формы контейнеров, известные в данной области техники. Такие контейнеры могут быть изготовлены из пластика, стекла, ламинированной бумаги, металлической фольги или других материалов, подходящих для изготовления упаковки для лекарственных средств.
Если желательно, набор включает инструкции по применению набора для выявления аутоантитела, связывающегося с белком 3-гидрокси-3-метилглутарил-коэнзим А-редуктазой (HMGCR) или его фрагментом. Инструкции будут обычно включать информацию о применении композиции для диагностики аутоиммунного заболевания, миопатии, ассоциированной с аутоиммунным ответом, ассоциированным с терапией статинами, и/или некротизирующей миопатии. В других воплощениях инструкции включают по меньшей мере одно из следующего: описание агента, связывающегося с HMGCR, меры предосторожности, предупреждения, показания, противопоказания, информацию о передозировке, побочные реакции, фармакологические данные, полученные на животных, клинические исследования и/или список литературы. Инструкции могут быть напечатаны непосредственно на контейнере (если он присутствует) или в форме этикетки, прикрепленной к контейнеру, или в форме отдельного листа, брошюры, карты или папки, поставляемых в контейнере или вместе с ним.
Если не указано иное, практическое использование настоящего изобретения включает применение обычных методик молекулярной биологии (включая рекомбинантные методики), микробиологии, клеточной биологии, биохимии и иммунологии, известных специалисту в данной области техники. Такие методики подробно описаны в литературе, такой как "Molecular Cloning: A Laboratory Manual", second edition (Sambrook, 1989); "Oligonucleotide Synthesis" (Gait, 1984); "Animal Cell Culture" (Freshney, 1987); "Methods in Enzymology" "Handbook of Experimental Immunology" (Weir, 1996); "Gene Transfer Vectors for Mammalian Cells" (Miller and Calos, 1987); "Current Protocols in Molecular Biology" (Ausubel, 1987); "PCR: The Polymerase Chain Reaction", (Mullis, 1994); "Current Protocols in Immunology" (Coligan, 1991). Эти методики применимы для получения полинуклеотидов и полипептидов по изобретению и, как таковые, могут быть применены в данном изобретении и при его практическом использовании. Методики, особенно полезные для конкретных воплощений, будут описаны в последующих разделах.
Следующие примеры приведены для предоставления специалистам в данной области техники полного описания проведения и применения анализа, скрининга и терапевтических способов по изобретению, и подразумевают, что приведенные примеры не ограничивают предполагаемый авторами изобретения объем изобретения.
ПРИМЕРЫ
Пример 1: Наличие нового анти-200/100-кДа аутоантитела против в сыворотке пациентов с некротизирующей миопатией
Проводили исследование биопсийных образцов мышц, полученных от 225 пациентов со слабостью проксимальных мышц, повышенными уровнями креатинкиназы (СК), признаками миопатии при электромиографии (EMG) и/или другими признаками заболевания мышц для выявления пациентов с преимущественно некротизирующей миопатией. Пациентов, у которых по результатам биопсии были отмечены выраженные воспалительные клеточные инфильтраты, вакуоли с ободком (характерные для миозита с включениями телец), перифасцикулярная атрофия (патогномоничная для дерматомиозита (ДМ)) или другие признаки, характерные для определенного диагноза, не рассматривали как пациентов с преимущественно некротизирующей миопатией.
В целом, при биопсии мышц преимущественно некротизирующая миопатия была выявлена у тридцати восьми пациентов (17% общего числа). У двенадцати из этих пациентов с применением существующих способов исследования был поставлен окончательный диагноз специфического заболевания мышц. У десяти пациентов была аутоиммунная миопатия, как установлено по наличию антисинтетазных аутоантител (один пациент с аутоантителами против Jo-1, два пациента с аутоантителами против PL-12 и один пациент с аутоантителами против PL-7) или по наличию аутоантител против частицы, распознающей сигнал (SRP) (шесть пациентов); у каждого из этих пациентов также был отчетливый положительный ответ на иммуносупрессивную терапию. Кроме того, у одного пациента была некротизирующая миопатия, ассоциированная с выраженным гипотиреозом, и у еще одного была тазово-плечевая мышечная дистрофия типа 2 В (то есть дисферлинопатия), что было подтверждено позднее генетическим исследованием. У оставшихся двадцати шести пациентов (приблизительно 10% исходной группы) была преимущественно некротизирующая миопатия неясной этиологии.
Проводили скрининг сывороток, полученных от двадцати шести пациентов, описанных выше, на предмет присутствия новых аутоантител. Следует отметить, что сыворотки, полученные от шестнадцати из этих пациентов (62%) приводили к иммунопреципитации из радиоактивно меченных экстрактов клеток HeLa двух белков размером приблизительно 200 кДа и 100 кДа, соответственно (Фиг.1). Осаждение этих белков, молекулярные массы которых не соответствуют молекулярным массам известных специфичных для миозитов аутоантигенов, при иммунопреципитации всегда происходило совместно. Несмотря на воспроизводимость иммунопреципитации с анти-200/100-кДа аутоантителами, ни одна сыворотка не позволяла выявить белки массой 200/100 кДа при иммуноблоттинге экстрактов клеток HeLa.
С целью оценки специфичности этих аутоанатител для некротизирующего фенотипа исследовали иммунореактивность анти-200/100-кДа аутоантител в остальной группе. Из 187 пациентов без преимущественно некротизирующей миопатии сыворотка только 1 пациента (0,5%) приводила к иммунопреципитации белков массой 200 кДа и 100 кДа, демонстрируя высокую специфичность данного наблюдения для пациентов с некротизирующей миопатией (Р<10-15 при использовании точного критерия Фишера). Ни одна из сывороток, полученных от 12 пациентов с некротизирующими миопатиями, ассоциированными с известными ранее состояниями, включая 6 пациентов с антителами против SRP, не приводила к иммунопреципитации белков с молекулярной массой 200 кДа или 100 кДа.
Несколько сывороток с анти-200/100 кДа аутоантителами давали иммунопреципитацию с дополнительными белками. Например, сыворотка, полученная от пациента 8089, приводила к иммунопреципитации, наряду с белками массой 200 кДа и 100 кДа, белка массой приблизительно 70 кДа (Фиг.1, дорожка 2). Следует отметить, что каждый из дополнительных белков распознавался не более чем 1 из 16 сывороток, полученных от пациентов с анти-200/100 кДа аутоантителами. Кроме того, ни одна из сывороток, позитивных в отношении анти-200/100-кДа аутоантител не распознавала каких-либо дополнительных полос, размер которых соответствовал бы обнаруженным ранее аутоантигенами, специфичным для миозита, включая белки с молекулярными массами 72 кДа, 54 кДа и/или 21 кДа, наблюдаемые у пациентов при миопатии с антителами против частицы, распознающей сигнал.
Пример 2: Применение статинов статистически коррелирует с позитивностью в отношении анти-200/100-кДа аутоантител
Проводили анализ демографических данных, лабораторных данных, характера слабости, магнитно-резонансной томографии (МРТ) бедер и других клинических данных шестнадцати пациентов, позитивных в отношении анти-200/100-кДа аутоантител, с некротизирующей миопатией (Таблица 1). Один пациент с аутоантителами, специфичными в отношении белков массой 200/100 кДа, и преимущественно некротизирующей миопатией не был исключен из этого анализа (Таблица 1).
|
Число мужчин и женщин было приблизительно равным, и средний возраст в начале заболевания составил 54 года. Все шестнадцать пациентов сообщали о нормальной силе мышц до начала заболевания с острым или подострым появлением слабости мышц во взрослом возрасте. На момент первичного обследования у всех пациентов была слабость проксимальных мышц, признаки отека при двусторонней MRI бедер и значительно повышенные уровни креатинкиназы, среднее значение 10333 МЕ/литр (диапазон 3052-24714). В каждой из шестнадцати электромиограмм (EMG), доступных для исследования, были признаки миопатии. У четырнадцати из шестнадцати пациентов (88%) была раздражительная миопатия, в то время как у остальных двух миопатия была нераздражительной.
Другие важные клинические данные включали миалгии у 12 (75%) из 16 пациентов, артралгии у 8 (50%) из 16 пациентов и дисфагию у 10 (63%) из 16 пациентов. Только у 2 (13%) из 16 пациентов был феномен Рейно. Несмотря на то, что 7 (44%) из 16 пациентов сообщали о неспецифической сыпи, ни у одного пациента не было кожных проявлений, указывавших на DM, при осмотре или в анамнезе. Ни у одного из этих пациентов клинические лаборатории не выявили антител против выделяемых ядерных антигенов (включая антитела против Ro, против La, против RNP и против Scl-70), и ни один из пациентов не соответствовал критериям другого заболевания соединительной ткани. У двух пациентов были предшествующие злокачественные новообразования: у 1 был безрецидивный рак яичника, лечение которого было проведено за 5 лет до начала заболевания мышц, и у другого был рак предстательной железы в состоянии клинической ремиссии после лечения.
Ни у одного из пациентов/ позитивных в отношении с анти-200/100 кДа аутоантител, в наследственном анамнезе не было заболевания мышц. Кроме того, ни у одного из этих пациентов не было крыловидных лопаток, слабости мышц лица, асимметричной слабости или других отличительных признаков, которые указывали бы на наследственное заболевание мышц.
Следует отметить, что 10 (63%) из 16 пациентов получали терапию статинами до появления слабости. Среднее ± стандартное отклонение (SD) продолжительность лечения статинами до появления мышечных симптомов составила 31,3±27,4 месяца (диапазон 0-84 месяца). В каждом случае прекращение приема статинов не привело к отчетливому клиническому улучшению, и среднее ± SD продолжительность периода от прекращения приема статинов до биопсии мышц составляло 5,2±4,6 месяца (диапазон 1-14 месяцев). Изучение анамнеза пациентов не выявило воздействия других потенциальных миотоксинов.
Для определения того, была ли связь с применением статинов случайной, анализировали частоту применения статинов в других группах пациентов с миозитом (Таблица 2).
|
5 (15,2%) из 33 пациентов с DM, 7 (18,4%) из 38 пациентов с РМ и 11 (35,5%) из 31 пациента с IBM получали статины перед биопсией мышц; частота применения статинов в группе, позитивной в отношении анти-200/100-кДа аутоантител, была значимо (Р<0,05) выше, чем в группах пациентов с DM и РМ. Тем не менее, в данном анализе не было значимых различий применения статинов в группе пациентов, позитивной в отношении анти-200/100-кДа антител, и в группе с IBM (Р=0,08), Поскольку вероятность лечения статинами выше у пациентов более старшего возраста, оценивали возраст пациентов с разными формами миозита. По сравнению со всеми пациентами, позитивными в отношении анти-200/100-кДа аутоантител, средний ± SD возраст которых составил 57,8±14,8 года, общая группа пациентов с IBM была значительно старше со средним ± SD возрастом 67,7±9,9 года. При включении в анализ только пациентов в возрасте 50 лет или старше предшествующий прием статинов имел место у 10 (83,3%) из 12 пациентов, позитивных в отношении анти-200/100-кДа аутоантител, 4 (25%) из 16 пациентов с DM, 7 (36,8%) из 19 пациентов с РМ и 10 (33,3%) из 30 пациентов с IBM (Таблица 2). При таком повозрастном сравнении частота лечения статинами в популяции, позитивной в отношении анти-200/100-кДа аутоантител, была значимо выше, чем в популяциях с DM (Р=0,002), РМ (Р=0,011) и IBM (P=0,003).
Клинические проявления сильно различались, варьируя от пациента с постоянной интубацией и квадриплегией до нескольких пациентов с лишь незначительной слабостью. Уникальным признаком у большинства пациентов было относительное сохранение силы мышц, несмотря на значительно повышенные уровни мышечных ферментов. Тем не менее, по медицинской документации нескольких пациентов был выявлен вероятный пороговый уровень мышечных ферментов (обычно от 3000 до 7000 МЕ/литр) при превышении которого наступала слабость.
Пример 3: Чувствительность миопатий пациентов, позитивных в отношении анти-200/100-кДа аутоантител, к иммуносупрессивной терапии
Схемы лечения и ответы на лечение (на основании объективного улучшения силы мышц) варьировали. Представлены клинические данные 16 пациентов, положительных в отношении анти-200/100-кДа аутоантител. Из 14 пациентов, включенных в продольное наблюдение, у 9 (64%) был полный или почти полный ответ на иммуносупрессию, и у 5 (36%) был частичный ответ на иммуносупрессию. Эти 5 пациентов включали 1 пациента, у которого было остановлено прогрессирование мышечной слабости, однако уменьшить ее иммуносупрессией не удалось. У шести (43%) из 14 пациентов при постепенном уменьшении дозы или отмене иммуносупрессивных лекарственных средств произошел рецидив. На момент исследования у семи (60%) из 14 пациентов проводили постепенное уменьшение дозы принимаемых ими иммуносупрессивных лекарственных средств без развития рецидива. Завершить постепенное уменьшение дозы иммуносупрессивных лекарственных средств без развития рецидива слабости мышц удалость только у 1 пациента.
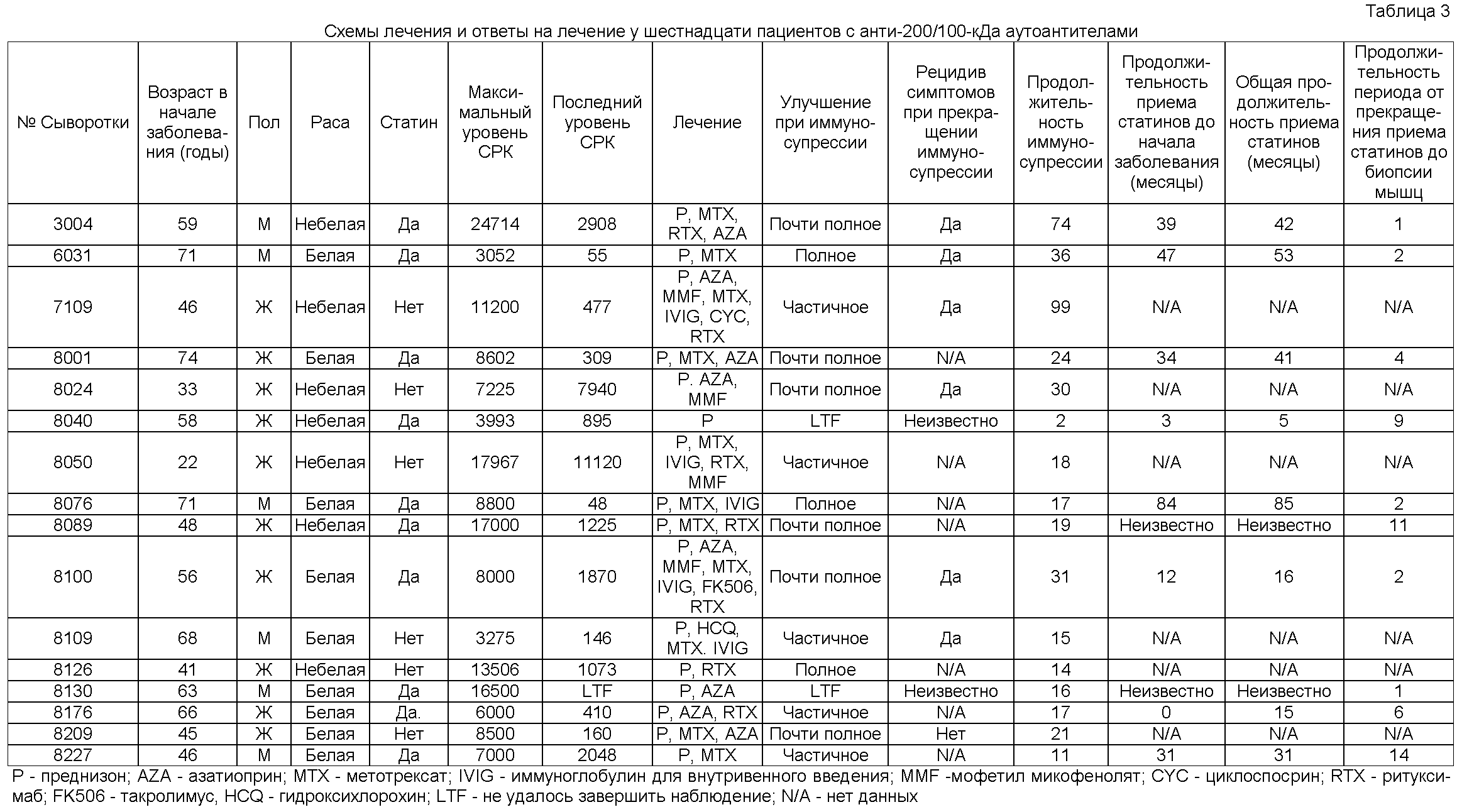
У большинства пациентов начальный ответ на преднизон был очень незначительным, и была необходима комбинированная иммуносупрессивная терапия. Ритуксимаб и иммуноглобулин для внутривенного введения были эффективными дополнительными лекарственными средствами при их использовании в комбинации с преднизоном, азатиоприном или метотрексатом. Большинству пациентов была необходима некоторая доза преднизона для поддерживающей терапии, и они сообщали о слабости при постепенном уменьшении дозы стероидов, даже если их начальный ответ на преднизон был лишь незначительным.
Пример 4: Некротизирующая миопатия, ассоциированная с позитивностью в отношении анти-200/100-кДа аутоантител, имеет признаки характерные для иммуноопосредованных миопатий
В биопсийных образцах мышц, полученных от шестнадцати (94%) из 17 пациентов с анти-200/100-кДа аутоантителами, был выраженный некроз мышечных волокон; в биопсийном образце, полученном от оставшегося пациента, были обширные воспалительные инфильтраты, и результаты этой биопсии не были включены в последующий анализ. Несмотря на то, что подробное исследование выявило скопления воспалительных клеток в эндомизии и/или вблизи сосудов в 5 (31%) из 16 биопсийных образцов мышц, степень воспаления была меньше наблюдаемой в типичных биопсийных образцах мышц, полученных от пациентов с РМ или DM. Ни в одном из биопсийных образцов, полученных от пациентов, позитивных в отношении анти-200/100-кДа аутоантител, не было признаков более чем легкой денервации, и ни в одном из биопсийных образцов не было аномального накопления гликогена или отложения амилоида.
Из 16 пациентов с некротизирующими миопатиями, которые были положительными в отношении анти-200/100-кДа аутоантител, для дальнейшего анализа были доступны замороженные образцы мышечной ткани, полученные от 8 пациентов. Для оценки морфологии кровеносных сосудов срезы окрашивали антителами против CD31. Аномально расширенные капилляры эндомизия с утолщенными стенками наблюдали в 5 (63%) из 8 биопсийных образцов (стрелки на Фиг.2Б). Однако, ни в одном из биопсийных образцов мышц не было существенного снижения плотности капилляров в мышечной ткани.
Отложение комплемента оценивали, посредством окрашивания доступных позитивных в отношении анти-200/100-кДа аутоантител образцов биопсии мышц антителами, распознающими мембраноатакующий комплекс. Несмотря на отсутствие четкого распознавания антителом капилляров эндомизия (Фиг.3Г), в 6 (75%) из 8 биопсийных образцов мышц было окрашивание малых сосудов перимизия (Фиг.3А и 3Б). В отличие от этого, антитела против мембраноатакующего комплекса не приводили к интенсивному окрашиванию кровеносных сосудов контрольных биопсийных образцов мышц. Как и следовало ожидать, отложение мембраноатакующего комплекса также происходило в некротических и дегенеративных мышечных волокнах; это рассматривали как неспецифическое явление. Тем не менее, в 4 (50%) из 8 биопсийных образцов мышц, позитивных в отношении анти-200/100-кДа аутоантител, было положительное окрашивание поверхностей сарколеммы разрозненных не подверженных некрозу мышечных волокон на мембраноатакующий комплекс (Фиг.3В и Г); как показано, некоторые из этих мышечных клеток были относительно небольшими, позволяя предположить, что они могли представлять собой регенерирующие волокна.
Окрашивание биопсийных образцов мышц, позитивных в отношении анти-200/100-кДа аутоантител, антителами, распознающими молекулы МНС I класса, ясно продемонстрировало, что сарколемма 4 (50%) из 8 образцов была позитивна в отношении молекул МНС I класса в (Фиг.4). В нескольких других образцах было пограничное окрашивание на молекулы МНС I класса, но оно было значительно менее интенсивным, чем наблюдаемое в биопсийных образцах мышц, полученных от Jo-1-положительных пациентов с РМ, включенных в тот же эксперимент в качестве положительных контролей.
Аутоиммунные миопатии (называемые общим термином миозит) представляют собой группу состояний, характерными клиническими признаками которых являются симметричная слабость проксимальных мышц, повышенные уровни креатинкиназы в сыворотке и признаки миопатии при электромиографии (Dalakas MC, et al., Lancet 2003; 362:971-82 и Mammen AL. Ann N Y Acad Sci 2010:1184:134-53). Несмотря на то, что другие состояния мышц могут приводить к сходным клиническими синдромам, диагностика аутоиммунных расстройств имеет большое терапевтическое и прогностическое значение, поскольку только эти расстройства обычно чувствительны к иммуносупрессивной терапии.
Как и при других системных аутоиммунных заболеваниях, у пациентов с аутоиммунной миопатией различные клинические фенотипы сильно зависят от аутоантител. Например, самыми частыми специфичными для миозита аутоантителами (MSA) являются аутоантитела, направленные против синтетаз аминоацил-транспортных РНК (аминоацил-тРНК-синтетаз), и их наблюдают у приблизительно 20% пациентов с миозитом (Targoff IN, et al,. Rheum Dis Clin North Am 2002:28:859-90, viii). Эти аутоантитела и аутоантитела, распознающие другие тРНК-синтетазы, ассоциированы с определенным сочетанием клинических признаков, включая интерстициальное заболевание легких, феномен Рейно, артрит и характерное кожное проявление, известное как «рука механика» (Yoshida S, et al., Arthritis Rheum 1983; 26:604-11; Marguerie С, et al., Q J Med 1990; 77:1019-38). Несмотря на то, что скрининг аутоантител может играть важную роль в диагностике иммуноопосредованного заболевания мышц, такие антитела наблюдают не всегда.
Наличие воспалительных инфильтратов в биопсийных образцах мышц является еще одним общепринятым признаком аутоиммунных миопатий (Dalakas MC, et al., 2003). Тем не менее, в биопсийных образцах мышц некоторых пациентов с аутоиммунными миопатиями воспалительных клеточных инфильтратов мало или нет совсем. Например, в биопсийных образцах пациентов со специфичными для миозита аутоантителами (MSA), направленными против компонентов SRP, присутствуют дегенеративные, некротические и регенерирующие мышечные клетки без обширных воспалительных клеточных инфильтратов (Miller Т, et al., J Neurol Neurosurg Psychiatry 2002:73:420-8; Као АН, et al.. Arthritis Rheum 2004; 50:209-15; Hengstman GJ, et al., Ann Rheum Dis 2006; 65:1635-8; и Dimitri D, et al., Muscle Nerve 2007; 35:389-95). Поэтому весьма вероятно, что у пациентов с некротизирующим миопатиями, не диагностируемыми другими способами, также возможно наличие уникальных антител, которые могут быть использованы для диагностики.
Из группы 225 пациентов с миопатиями преимущественно некротизирующие миопатии были выявлены в биопсийных образцах мышц, полученных от тридцати восьми пациентов. После всестороннего лабораторного обследования у двенадцати из этих пациентов удалось диагностировать специфическое состояние; в большинстве случаев у этих пациентов был миозит с антителами против частицы, распознающей сигнал (SRP), или антисинтетазными антителами. Проводили скрининг сывороток оставшихся двадцати шести пациентов на предмет присутствия новых аутоантител и наблюдали, что шестнадцать из, этих сывороток приводили к иммунопреципитации двух белков с молекулярной массой приблизительно 200 «Да и 100 кДа, соответственно. Кроме того, у одного из других 187 пациентов, в биопсийном образце которого были распространенные воспалительные клеточные инфильтраты, была такая же иммунологическая специфичность. У пациентов с анти-200/100-кД аутоантителами не было других известных аутоантител, включая антитела против SRP. Таким образом, анти-200/100-кД аутоантитела характеризуют уникальную подгруппу пациентов с миопатиями, в которую входят шестнадцать из двадцати шести пациентов (62%) с идиопатическими некротизирующими миопатиями.
Во многих отношениях клинические данные пациентов с иммунологической специфичностью в виде анти-200/100-кДа аутоантител сходны с клиническими данными пациентов с другими формами иммуноопосредованной миопатии; для обеих групп типично подострое появление слабости проксимальных мышц с повышенными уровнями креатинкиназы, признаки раздражительной миопатии при электромиографии, признаки отека при МРТ и, в большинстве случаев, отчетливый ответ на иммуносупрессивную терапию. Тем не менее, у пациентов, положительных в отношении 200/100-кДа аутоантител, было несколько уникальных признаков. Во-первых, у нескольких пациентов были очень высокие уровни креатинкиназы (в диапазоне 3000-8000 МЕ/литр), но лишь минимальная мышечная слабость. Это указывает либо на необычную способность мышц этих пациентов к регенерации, достаточно эффективной для компенсации распространенной деструкции мышц, либо на аномалию мембран мышечных клеток у этих пациентов, допускающую выход креатинкиназы без появления слабости; такая аномалия может соответствовать обнаружению отложения мембраноатакующего комплекса на сарколемме не подверженных некрозу мышечных волокон. Во-вторых, более 60% этих пациентов принимали статины до развития мышечных симптомов, сохранявшихся длительное время после прекращения воздействия миотоксина. Важно, что эта ассоциация была сильнее у пациентов более старшего возраста; более 80% пациентов, положительных в отношении анти-200/100-кДа аутоантител, в возрасте 50 лет или старше получали статины до развития мышечных симптомов. Этот показатель был значительно выше частоты лечения статинами в группах пациентов того же возраста с полимиозитом, дерматомиозитом или миозитом включения телец.
Несмотря на сходство определенных признаков у пациентов, положительных в отношении анти-200/100-кДа аутоантител, и хорошо описанных популяций пациентов с антителами против SRP, эти группы отличаются по двум ключевым признакам. Во-первых, сыворотки, полученные от пациентов с анти-200/100-кДа аутоантителами, не распознают субъединицы частицы, распознающей сигнал, и сыворотки, полученные от пациентов с антителами против SRP, не распознают белки с молекулярной массой приблизительно 200 кДа или приблизительно 100 кДа. Эти наблюдения демонстрируют, что пациенты со специфичностью в виде анти-200/100-кДа аутоантител, иммунологически отличаются от популяции пациентов с антителами против SRP. Во-вторых, у нескольких пациентов, положительных в отношении анти-200/100-кДа аутоантител, с очень высокими уровнями СК была лишь незначительная слабость. Это было необычно, поскольку слабость у большинства пациентов с антителами против SRP и высокими уровнями СК обычно очень выражена.
Для дальнейшей характеризации заболевания мышц у пациентов с анти-200/100-кДа аутоантителами биопсийные образцы мышц окрашивали антителами против мембраноатакующего комплекса, маркеров эндотелиальных клеток и молекул МНС I класса. Отложение мембраноатакующего комплекса представляет собой последнюю стадию активации каскада комплемента и может указывать на то, что ткань является мишенью для деструкции иммунной системой. Отложение мембраноатакующего комплекса на капиллярах эндомизия было продемонстрировано у пациентов с дерматомиозитом (Kissel JT et al., N EngI J Med 1986; 314:329-34 и Emslie-Smith AM et al., Ann Neurol 1990; 27:343-56) и в трех из четырех анализов биопсийных образцов, полученных от пациентов, позитивных в отношении анти-SRP антител (Miller Т, et al., 2002; Као АН, et al., 2004; Hengstman GJ. et al., 2006; и Dimitri D, et al., 2007); этого не происходит при мышечных дистрофиях (Spuler S et al., Neurology 1998; 50:41-6.). Несмотря на отсутствие отложения мембраноатакующего комплекса на капиллярах эндомизия в биопсийных образцах, полученных от пациентов с анти-200/100-кДа аутоантителами, в пяти из восьми образцов капилляры эндомизия были аномально утолщены и расширены. Сходные морфологические изменения были описаны у пациентов с анти-SRP антителами и в группе пациентов с «некротизирующей миопатией с узкими капиллярами». Несмотря на то, у последней группы есть определенные общие патологические признаки с пациентами с анти-200/100-кДа аутоантителами и анти-SRP антителами, пациенты этой группы отличаются наличием у них другого заболевания соединительной ткани или активного рака (Emslie-Smith AM and Engel AG, Neurology 1991; 41:936-9).
Несмотря на его отсутствие в капиллярах, отложение мембраноатакующего комплекса в малых кровеносных сосудах перимизия было очевидно в шести (75%) из восьми биопсийных образцов, полученных от пациентов с анти-200/100-кДа аутоантителами. Безотносительно теории, логично предположить, что в этих случаях отложение комплемента может свидетельствовать о новой сосудистой мишени в этой популяции пациентов. Кроме того, локализация мембраноатакующего комплекса на поверхности ненекротических волокон была отмечена в 4 (50%) из 8 проанализированных биопсийных образцов, полученных от пациентов с анти-200/100-кДа аутоантителами. Несмотря на предшествующие сообщения о присутствии мембраноатакующего комплекса на не-некротических волокнах при иммуноопосредованных миопатиях (Oxenhandler R, et al., Hum Pathol 1982; 13:745-57), это не является общим признаком таких расстройств; в нескольких исследованиях миопатии с анти-SRP антителами мембраноатакующий комплекс наблюдали на не-некротических волокнах только в одном из семи (Miller Т, et al., J Neurol Neurosurg Psychiatry 2002:73:420-8), ни в одном из шести (Hengstman GJ, et al., 2006) и одном из трех (Dimitri D, et al., Muscle Nerve 2007;35:389-95) биопсийных образцов мышц. Следует также отметить сообщения об отложении мембраноатакующего комплекса на не-некротических мышечных волокон при некоторых дистрофиях (Spuler S, et al., Neurology 1998;50:41-6), и что отложение мембраноатакующего комплекса на кровеносных сосудах и мышечных волоках может быть следствием повреждения мембран, а не первичным патологическим явлением.
В завершение, четыре из восьми доступных биопсийных образцов включали мышечные волокна с окрашиванием сарколеммы на молекулы МНС I класса. Это характерный признак иммуноопосредованных миопатий, редко встречающийся или отсутствующий в биопсийных образцах, полученных от пациентов с мышечными дистрофиями и другими мышечными и нервными расстройствами (Van der Pas J, et al., J Neurol Neurosurg Psychiatry 2004; 75:136-9 и Sundaram С, et al., Neurol India 2008; 56:363-7). По сравнению с этим, результаты исследований по оценке окрашивания на молекулы МНС I класса у пациентов с антителами против SRP были смешанными; в одном исследовании волокна, позитивные в отношении молекул МНС I класса, были отмечены у двух из трех пациентов (Dimitri D, et al., 2007), во втором исследовании такие волокна были продемонстрированы у трех из шести пациентов (Miller Т, et al., J Neurol Neurosurg Psychiatry 2002;73:420-8), и в третьем исследовании данные волокна не были продемонстрированы ни у 'одного из шести пациентов (Hengstman etal, 2006).
Интересно, что в двух недавних сообщениях описаны пациенты с развитием некротизирующей миопатий во время лечения статинами, которая прогрессировала, несмотря на прекращение приема миотоксичных лекарственных средств (Needham, et al., Neuromuscul Disord 2007; 17: 194-200 и Grable-Esposito et al., Muscle Nerve 2010; 41:185-90). В наиболее полном из этих двух сообщений Grable-Esposito et al. описали двадцать пять пациентов с развитием вероятно иммуноопосредованной ассоциированной со статинами некротизирующей миопатий, многие клинические проявления которой сходны с клиническими проявлениями, наблюдаемыми. в исследованной авторами изобретения группе пациентов, позитивных в отношении анти-200/100-кДа аутоантител. Например, у пациентов в описанной Grable-Esposito et al. группе была слабость проксимальных мышц, число мужчин и женщин в этой группе было почти одинаковым, средний уровень креатинкиназы составлял 8203 МЕ/литр, для увеличения силы мышц этим пациентам были необходимы несколько иммуносупрессивных лекарственных средств, и при постепенном уменьшении дозы иммуносупрессивных лекарственных средств у них происходил рецидив. Needham, et al. подробно анализировали биопсийные образцы мышц, полученные от восьми сходных пациентов (Needham, et al., 2007). В то время как экспрессия молекул МНС I - класса на поверхности ненекротических мышечных волокон была повышена во всех биопсийных образцах мышц, описанных Needham, et al., только четыре из восьми пациентов, позитивных в отношении анти-200/100-кДа аутоантител, описанных здесь, были позитивными в отношении окрашивания на молекулы МНС I класса.
В завершение, изложенные выше результаты позволяют выделить группу пациентов с некротизирующей миопатией и новой анти-200/100 аутоантительной специфичностью. Интересно, что появление данного фенотипа ассоциировано с приемом статинов. Помимо присутствия аутоантител все эти пациенты отвечали на иммуносупрессию, и у многих из них происходил рецидив слабости при постепенном уменьшении дозы используемых лекарственных средств. По-видимому, эти данные указывают на наличие у этих пациентов иммуноопосредованной миопатии. Присутствие молекул МНС I класса на поверхности не-некротических волокон также свидетельствует о том, что данный процесс является иммуноопосредованным. Действительно, пациенты с некротизирующими миопатиями и анти-200/100 кДа аутоантителами, вероятно, страдают от аутоиммунного заболевания, которое следует лечить иммуносупрессивными лекарственными средствами.
Пример 5: Позитивная регуляция экспрессии 200 кДа и 100 кДа аутоантигенов статинами
Как указано выше, сыворотки, полученные от группы пациентов с IMNM, образуют иммунопреципитат с 200-кДа и 100-кДа белками из радиоактивно меченных экстрактов HeLa.
С учетом выраженной связи применения статинов с появлением этих анти-200/100-кДа аутоантител, проводили мечение клеток HeLa 35S-метионином/цистеином после их предварительной обработки либо 10 пМ мевинолином, либо одним носителем (диметилсульфоксидом (DMSO)) в течение 24 часов. Для подтверждения эквивалентности белков в этих лизатах проводили реакции иммунопреципитации с использованием антител против Mi-2 или PM-Scl. Как и следовало ожидать, в лизате каждого типа были выявлены равные количества Mi-2 и 5 белковых компонентов комплекса PM-Scl. В противоположность этому, трехкратно увеличенные уровни белков массой как 200 кДа, так и 100 кДа были иммунопреципитированы из клеток, обработанных мевинолином, демонстрируя тот факт, что уровни этих аутоантигенов позитивно регулируются статинами (Фиг.5А).
То, что обработка статинами позитивно регулирует экспрессию 3-гидрокси-3-метилглутарил-коэнзим А-редуктазы (сокращенно, ГМГ-КоА-редуктазы или HMGCR), было изначально показано Goldstein и Brown (Goldstein JL and, Brown MS. Nature 1990; 343:425-30). Morikawa et al. (Morikawa S et al., J Atheroscler Thromb 2005; 12:121-31) показали применимость этих данных к мышечным клеткам. Они применяли анализ на основе ДНК-микромассива для демонстрации того, что статины индуцируют экспрессию девятнадцати генов в линии клеток скелетных мышц человека, большинство из которых связаны с биосинтезом холестерина. Из них ГМГ-КоА-редуктаза была выбрана как кандидат для 100-кДа аутоантигена ввиду ее молекулярной массы, составляющей 97 кДа.
Получали ГМГ-КоА-редуктазу, меченную 35S-метионином (IVTT), и использовали ее в анализе иммунопреципитации с сыворотками, полученными от 16 пациентов с анти-200/100-кДа аутоантителами, а также с сывороткой от субъектов, используемых в качестве отрицательных контролей, включавших 3 пациентов с DM и 3 нормальных индивидов, не принимавших статины. Образцы сыворотки, полученные от анти-200/100-кДа-позитивных пациентов, образовывали иммунопреципитаты с HMGCR, тогда как образцы сыворотки, полученные от контрольных групп, их не образовывали (Фиг.5Б).
Пример 6: Анти-200/100-кДа-аутоантитела распознают С-концевой фрагмент ГМГ-КоА-редуктазы
ГМГ-КоА-редуктаза представляет собой мембранный белок с небольшим внеклеточным доменом, семью трансмембранными доменами и внутриклеточным каталитическим доменом. Для определения области (областей) данного белка, распознаваемых сыворотками, полученными от пациентов с антителами против ГМГ-КоА-редуктазы, синтезировали меченные 35S-метионином полноразмерный белок HMGCR, N-концевой фрагмент, включающий внеклеточные и трансмембранные домены (аминокислоты 1-377), и С-концевой фрагмент, включающий внутриклеточную часть молекулы (аминокислоты 340-888). Сыворотка, полученная от анти-HMGCR-позитивных пациентов, единообразно образовывала иммунопреципитаты с полноразмерной HMGCR и С-концевым фрагментом, но не N-концевым фрагментом (Фиг.6). Когда анти-HMGCR-позитивные сыворотки предварительно инкубировали с возрастающими концентрациями немеченого С-концевого фрагмента HMGCR перед иммунопреципитацией меченного 35S-метионином полноразмерного белка HMGCR, иммунопреципитации не происходило (Фиг.7А). При их совместном рассмотрении эти данные демонстрируют, что анти-HMGCR аутоантитела распознавали внутриклеточную С-концевую часть этого фермента.
Пример 7: Отсутствие распознавания белка массой 200 кДа уникальным антителом
Для определения того, содержит ли сыворотка, полученная от анти-HMGCR-позитивных пациентов, отдельные аутоантитела, распознающие белок массой 200 кДа, проводили реакции иммунопреципитации из меченных 35S-метионином экстрактов клеток HeLa, обработанных мевинолином, снова с предварительной инкубацией с очищенным С-концевым HMGCR белком (Фиг.7Б). Эта процедура ингибировала иммунопреципитацию как HMGCR, так и белка массой 200 кДа, позволяя предположить, либо что иммунопреципитация белка массой 200 кДа происходит совместно с HMGCR, либо что этот белок является димером HMGCR.
Пример 8: Оценка нового ELISA для выявления анти-HMGCR аутоантител в сыворотках пациентов
Был разработан ELISA для быстрого скрининга пациентов на предмет наличия анти-HMGCR аутоантител. Образец сыворотки определяли как являющийся позитивным в отношении анти-HMGCR, если величина относительного поглощения была на 3 стандартных отклонения или более выше, чем среднее значение у 20 здоровых контрольных субъектов, никогда не принимавших статины. С применением этого способа все 16 анти-200/100-кДа-позитивных образцов, ранее идентифицированных посредством иммунопреципитации из экстрактов клеток HeLa были определены как являющиеся анти-HMGCR позитивными. В отличие от этого, ни один из 33 пациентов с DM (включая 5 пациентов, принимавших ранее статины) и ни один из 31 пациента с IBM (включая 11 пациентов, принимавших ранее статины) не был анти-HMGCR позитивным.
Затем данный HMGCR ELISA применяли для скрининга образцов сыворотки, полученных от всех 750 пациентов, включенных в продольное исследование пациентов в Центре миозитов Джона Хопкинса с мая 2002 г. по апрель 2010 г. 45 (6%) из этих пациентов посредством ELISA были определены как анти-HMGCR позитивные (Таблица 4).
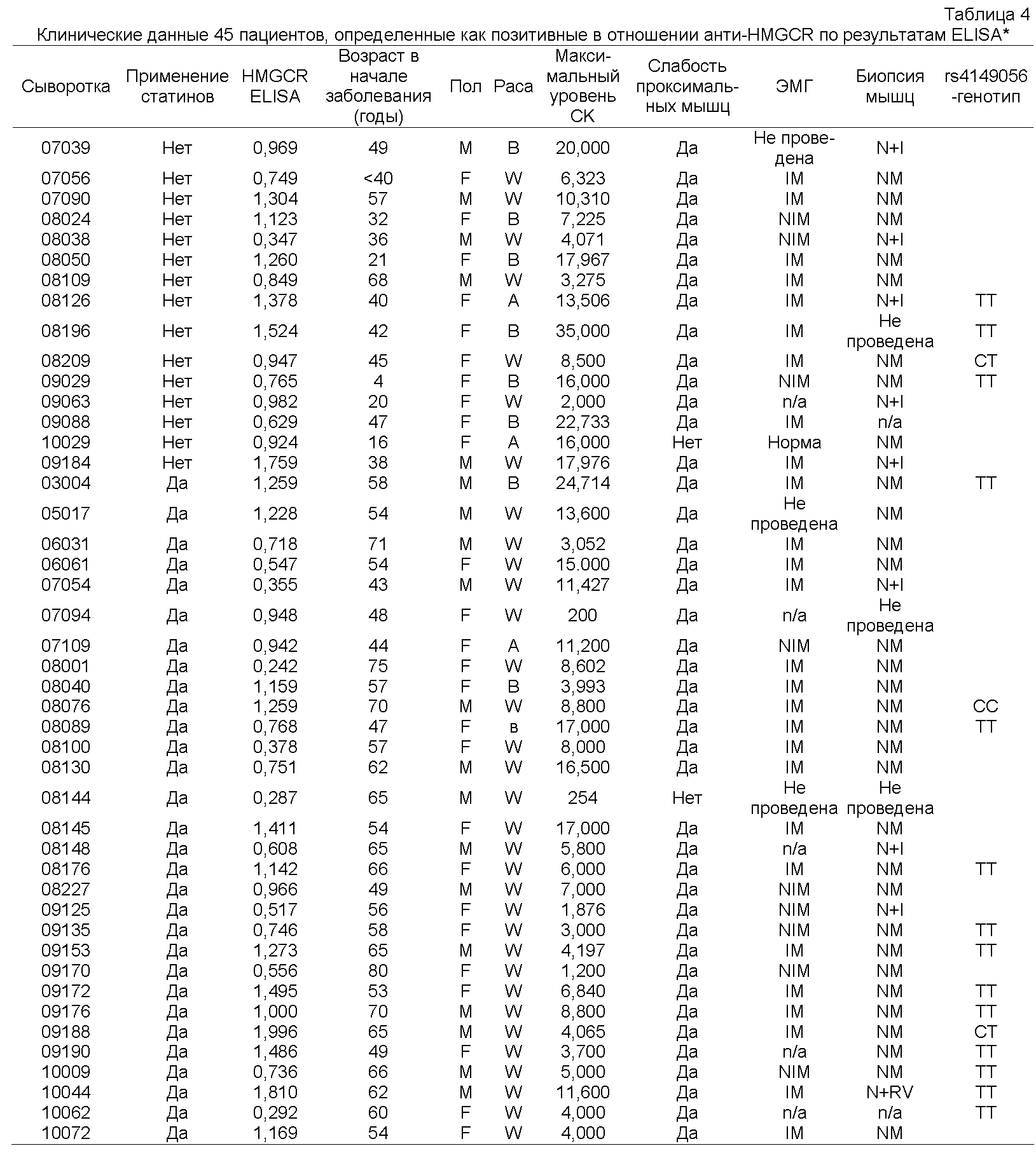
* Значения поглощения, приведенные в столбце «HMGCR ELISA», указаны в единицах относительно поглощения произвольного позитивного контрольного образца (образца 9176). Пороговое значение для позитивного результата твердофазного иммуноферментного анализа (ELISA) на антитела против ГМГ-КоА-редуктазы (HMGCR) составляло 0,215 единиц поглощения; это значение на три стандартных отклонения превышало среднее значение у двадцати здоровых субъектов, никогда не принимавших статины. Применение статинов относится к периоду, предшествующему исследованию сыворотки. Уровни креатинкиназы (СК) представлены в МЕ/литр. Электромиографические (EMG) признаки классифицировали как норму, раздражительную миопатию (IM) или нераздражительную миопатию (NIM). Результаты биопсии мышц классифицировали как некроз с воспалением (N+I), некротизирующую миопатию (NM) или некроз с вакуолями с ободком (N+RV). Генотипирование по rs4149046 проводили у семнадцати пациентов, позитивных в отношении анти-ГМГ-КоА-редуктаза-антитела, от которых были получены образцы ДНК. n/а - нет данных. W - белая, В - черная, А - азиатская.
Для оценки ELISA проводили сравнение данных ELISA и IVTT-иммунопреципитации, полученных с использованием подгруппы сывороток из этой группы, которые были получены от 307 последовательных уникальных пациентов с января 2009 г.по апрель 2010 г.О боими способами в этой подгруппе были выявлены 17 анти-HMGCR-позитивных пациентов. При ELISA была выявлена 1 дополнительная анти-HMGCR-позитивная сыворотка, которая была отрицательной по результатам иммунопреципитации (сыворотка 10029). Ввиду наличия у этого пациента некротизирующей миопатии с повышенными уровнями СК, эта сыворотка была расценена не как ложноположительная, а как истинно анти-HMGCR-позитивная сыворотка. Эти результаты демонстрируют очень сильную корреляцию этих двух способов и подтверждают, что ELISA-исследование является надежным и эффективным способом скрининга для выявления анти-HMGCR аутоантител.
Пример 9: Клинические данные анти-HMGCR-позитивных пациентов
Из 45 анти-HMGCR-позитивных пациентов 30 (66,7%) ранее принимали статины (Таблица 1). Из 26 пациентов, обратившихся в клинику авторов изобретения в возрасте 50 лет или старше, 24 принимали статины (92,3%). Таким образом, частота случаев применения статинов у пациентов с анти-HMGCR аутоантителами значительно выше частоты случаев применения статинов, о которой сообщали авторы изобретения и другие авторы, у пациентов того же возраста (приблизительно 50 лет) с другими миопатиями, включая DM (25%), РМ (36,8%) и IBM (33,3%) (Grable-Esposito et al., 2010 и Christopher-Stine et al., 2010).
Для анти-HMGCR-позитивных пациентов были характерны слабость проксимальных мышц (95,6%), повышенные уровни СК (среднее±SD 9,718±7,383 МЕ/литр) и признаки миопатии при EMG (97,3%) (Таблица 2). Во всех 40 доступных биопсийных образцах мышц (100%) было много дегенеративных, регенерирующих и/или некротических волокон. Значительные воспалительные инфильтраты были отмечены в 8 из 40 биопсийных образцов мышц (20%), и вакуоли с ободком наблюдали в 1 из 40 биопсийных образцов (2,5%); у этого пациента была слабость преимущественно проксимальных мышц, и не было клинических признаков, типичных для IBM. Клинические данные пациентов, не принимавших статины, были неотличимы от клинических данных пациентов, принимавших статины, за исключением более молодого возраста пациентов, не принимавших статины (среднее ± SD 37±17 лет против 59±9 лет), их более высоких уровней СК (13,392±8,839 против 7,881±5,875 МЕ/литр) и расовой принадлежности (46,7% против 86,7% пациентов белой расы) (Таблица 5).
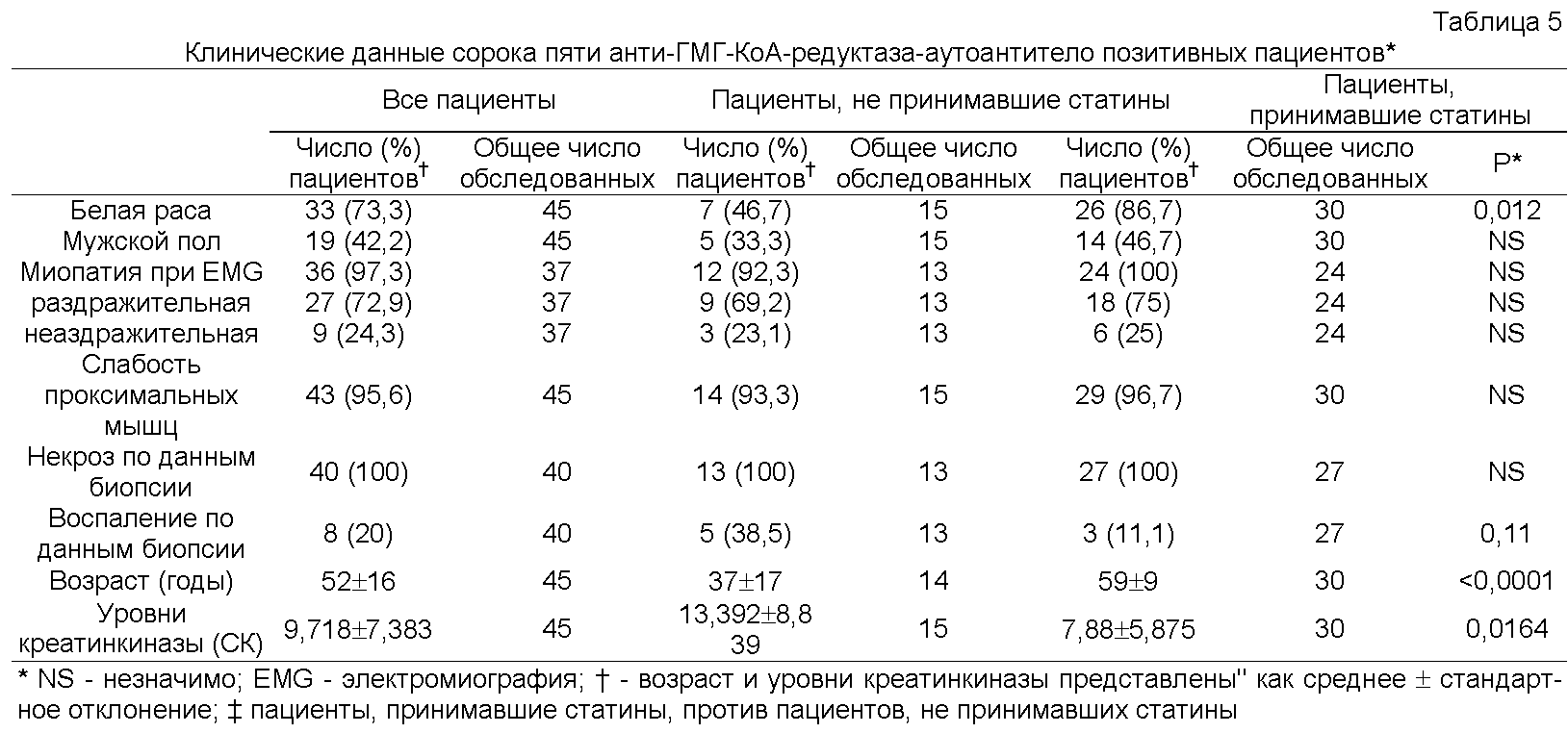
В то время как у 43 из 45 анти-HMGCR-позитивных пациентов не было другого системного аутоиммунного заболевания (95,6%), у пациента 8196 были антитела против Jo-1 и интерстициальное заболевание легких. У другого пациента (пациента 8038) была склеродермия, антитела против РМ-Scl и интерстициальное заболевание легких. Ни один из этих пациентов не принимал статины до появления мышечных симптомов.
У подавляющего большинства анти-HMGCR-позитивных пациентов были клинические признаки, соответствовавшие иммуноопосредованной миопатии. Тем не менее, у одного пациента (пациента 8144) были лишь персистирующие миалгии после применения статинов, нормальная субъективная и объективная сила мышц, нормальные результаты MRI обоих бедер, нормальные результаты EMG и уровень СК только 254 МЕ/литр. Результат ELISA в отношении HMGCR у данного пациента превышал среднее значение. 2000 нормальных контролей меньше чем на 3 стандартных отклонения. Таким образом, у данного пациента необходимо проводить мониторинг на предмет признаков слабости мышц и/или появления HMGCR аутоантител.
Пример 10: Отсутствие повышенной частоты однонуклеотидного полиморфизма, ассоциированного со статиновой миопатией, у анти-HMGCR-позитивных пациентов
В недавнем исследовании, опубликованном Коллективом Исследования эффективности дополнительного снижения уровней холестерина и гомоцистеина (Study of the Effectiveness of Additional Reductions in Cholesterol and Homocysteine (SEARCH)) (N EngI J Med 2008; 359: 789-99), продемонстрирована сильная корреляция наличия определенного полиморфизма в гене SLC01B1 (то есть аллеля rs 4149056 С) с развитием статиновой миопатии. Этот ген кодирует полипептид-переносчик органических анионов ОАТР-1 В1, регулирующий захват статинов в печени. В то время как распространенность аллеля С в исследованной указанными авторами популяции, включавшей приблизительно 12000 участников (преимущественно европейского происхождения), составляла 0,15, его распространенность у пациентов с развитием статиновой миопатии в течение 1 года после начала приема симвастатина в дозе 80 мг/сутки составила 0,54.
Образцы ДНК были получены от 17 анти-HMGCR-позитивных пациентов, и распространенность аллеля rs4149056 С в этой популяции составила 0,12. При исключении из анализа 6 пациентов, не принимавших статины, и/или неевропейского происхождения распространенность аллеля С у оставшихся 11 пациентов составила 0,14. Несмотря на небольшое число генотипированных субъектов, распространенность аллеля rs4149056 С у этих анти-HMGCR-позитивных пациентов соответствовала диапазону 0,14-0,22, описанному ранее для пациентов европейского происхождения (Совместная группа SEARCH, N EngI J Med 2008; 359:789-99).
Пример 11: Экспрессия ГМГ-КоА-редуктазы позитивно регулируется в регенерирующих мышечных волокнах у пациентов, позитивных в
отношении аутоантител против ГМГ-КоА-редуктазы Для непосредственного изучения экспрессии ГМГ-КоА-редуктазы in vivo биопсийные срезы мышц окрашивали имеющимся в продаже поликлональным антителом против ГМГ-КоА-редуктазы (Millipore, Billerica, MA). Поскольку экспрессия других аутоантигенов, связанных с миозитом, в мышечных клетках с признаками регенерации повышена (Casciola-Rosen et al., J Exp Med 2005; 201:591-601 и Mammen et al. Arthritis Rheum 2009; 60:3784-93), биопсийные срезы мышц также окрашивали антителом против NCAM (Santa Cruz Biotechnology, Santa Cruz, CA). Установлено, что NCAM (нейрональная молекула клеточной адгезии) является маркером регенерации мышц. В нормальных биопсийных образцах мышц экспрессия HMGCR (Фиг.8Д) и NCAM (Фиг.8Г) была относительно низкой (см. также Фиг.8Е). В отличие от этого, в биопсийных образцах мышц, полученных от пациентов, позитивных в отношении аутоантител против ГМГ-КоА-редуктазы (не принимавших статины в течение месяцев или лет), было много NCAM-положительных волокон (Фиг.8А). Интересно, что экспрессия ГМГ-КоА-редуктазы в большинстве этих NCAM-положительных волокон также была повышена (Фиг.8Б-В). Эти данные обеспечивают in vivo подтверждение того, что регенерирующие мышечные волокна анти-HMGCR-позитивных пациентов экспрессируют высокие уровни HMGCR.
Статины представляют собой класс часто назначаемых лекарственных средств с известными побочными, обычно нетяжелыми, эффектами на мышцы. Новые аутоантитела, распознающие белки массой 200 кДа и 100 кДа, ассоциированные с аутоиммунной миопатией и применением статинов, были описаны выше. Результаты, описанные здесь, демонстрируют возможную связь между воздействием статинов и данной конкретной формой IMNM посредством идентификации аутоантигена как HMGCR. Анализы иммунопреципитации продемонстрировали специфичность указанных аутоантител в отношении карбокси-конца данного фермента, в то время как конкурентные эксперименты подтвердили, что анти-HMGCR-аутоантитела образуют иммунопреципитат как с HMGCR, так и с белком массой 200 кДа. Этот более крупный белок может представлять собой ассоциированный белок или мультимер HMGCR. Последний вариант подтверждают другие исследования, показывающие возможность иммунопреципитации HMGCR в форме мономера массой 97 кДа и в форме димера массой 200 кДа (Parker et al., J Biol Chem 1989; 264:4877-87).
После идентификации рассматриваемого аутоантигена как HMGCR был разработан ELISA для быстрого скрининга сывороток пациентов. С применением этого ELISA было обнаружено, что распространенность анти-HMGCR аутоантител у пациентов с подозрением на миопатию, обратившихся в Центр миозитов Джона Хопкинса, составляла 6%. Анти-HMGCR аутоантитела были идентифицированы преимущественно у пациентов с некротизирующей миопатией по данным биопсии мышц и не были обнаружены у пациентов с IBM, DM или нормальных контролей. Таким образом, анти-HMGCR аутоантитела являются одними из наиболее распространенных аутоантител в данной группе, уступая по распространенности только аутоантителам против Jo-1. Поскольку некротизирующая миопатия не всегда является иммуноопосредованной, выявление анти-HMGCR посредством ELISA, вероятно, будет способствовать диагностике и выявлению пациентов с данной формой IMNM, большинство из которых отвечают на иммуносупрессивную терапию.
Из 45 анти-HMGCR-позитивных пациентов у одного был Jo-1-позитивный антисинтетазный синдром (2,2%), и у еще одного была склеродермия с аутоантителами против РМ-Scl (2,2%). Таким образом, как и при других формах аутоиммунного заболевания мышц, в редких случаях у пациентов с анти-HMGCR аутоантителами может быть перекрестный синдром с другим заболеванием соединительной ткани.
Важно, что экспрессия ГМГ-КоА-редуктазы в мышцах повышена при приеме статинов, а также в регенерирующих мышечных клетках, экспрессирующих NCAM. Это указывает на то, что иммуноопосредованное повреждение мышц, инициированное в присутствии статинов и ассоциированное с аутоантителами против ГМГ-КоА-редуктазы, может поддерживаться даже после прекращения приема статинов посредством перманентно повышенной экспрессии ГМГ-КоА-редуктазы, ассоциированной с регенерацией мышц.
Поскольку у большинства пациентов, принимающих статины, не происходит развития иммуноопосредованной миопатии, другие факторы, включая генетическую предрасположенность, также должны играть определеннуюроль. Наиболее распространенным генетическим фактором, предрасполагающим пациентов к самокупирующейся статиновой миопатии, является наличие аллеля rs4149056 С, с которым связано до 60% статиновых миопатии у пациентов, принимающих 80 мг симвастатина ежедневно (Совместная группа SEARCH, 2008 г.). Вероятно, этот полиморфизм повышает риск миопатии, снижая захват статинов переносчиком ОАТР-1В1 в печени. Тем не менее, распространенность этого генетического изменения не является повышенной у пациентов, позитивных в отношении аутоантител против ГМГ-КоА-редуктазы, позволяя предположить, что для развития аутоиммунного ответа необходимы другие виды генетической предрасположенности или сопутствующих средовых факторов.
Интересно, что тридцать три процента пациентов, позитивных в отношении аутоантител против ГМГ-КоА-редуктазы, ранее не принимали статины. Несмотря на то, что эти пациенты были моложе на момент начала заболевания и имели более высокие уровни креатинкиназы, у них также была, вероятно, иммуноопосредованная миопатия, и по другим признакам их нельзя было отличить от пациентов, принимавших статины. Вероятно, высокие уровни экспрессии ГМГ-КоА-редуктазы у этих пациентов могут быть обусловлены другими генетическими и/или средовыми факторами.
Поскольку у пациентов, нуждавшихся в лечении в стационаре и описанных здесь, была слабость и другие выраженные признаки миопатии, в данном исследовании не проводили оценки распространенности аутоантител против ГМГ-КоА-редуктазы у пациентов, принимавших статины, с менее тяжелыми симптомами. Тем не менее, был идентифицирован не один анти-HMGCR-позитивный пациент с персистирующими индуцированными статинами миалгиями, у которых не было других убедительных клинических признаков миопатии. Это показывает, что у некоторых пациентов аутоиммунный ответ может быть ассоциирован с менее тяжелыми симптомами миопатии.
Результаты, представленные выше в Примерах 1-4, были получены с применением следующих материалов и методов.
Пациенты
Двести двадцать пять пациентов с доступными образцами консервированной сыворотки, биопсийными образцами мышц и миопатией, определенной по слабости проксимальных мышц, повышенным уровням креатинкиназы (СК), признакам миопатии при электромиографии (EMG), отеку мышц по данным магнитно-резонансной томографии (MRI) и/или признаками миопатии по данным биопсии мышц были включены в продольное исследование, утвержденное Экспертным советом Центра миозитов Джона Хопкинса (Johns Hopkins Institutional Review Board), с марта 2007 г.до декабря 2008 г. Помимо сбора анамнеза и проведения физикального осмотра в Центре миозитов Джона Хопкинса, проводили всестороннее обследование этих пациентов, включавшее часть или все из следующего: (1) электромиографию и исследование нервной проводимости; (2) неконтрастную двустороннюю MRI бедер; (3) функциональное исследование легких; (4) скрининг на предмет злокачественных новообразований, включавший компьютерную томографию грудной клетки, живота и малого таза; (5) стандартное лабораторное исследование, проводимое несколькими различными коммерческими лабораториями, включавшее определение уровней креатинкиназы (СК), скрининг на предмет противоядерных антител (ANA), определение скорости оседания эритроцитов (ESR), уровней С-реактивного белка (CRP), скрининг на предмет антител против Ro/La и скрининг на предмет специфичных для миозита антител (MSA); и (6), при соответствующем подозрении на основании клинических данных или результатов биопсии, исследование на предмет наследственного заболевания мышц, включая тазово-плечевые мышечные дистрофии (с использованием панели Limb Girdle Muscular Dystrophy Evaluation panel: Athena Diagnostics, Worcester, MA), дефицит кислой мальтазы (с использованием Glycogen Storage Myopathy 'A' Profile, Athena Diagnostics, или теста сухой капли крови на α-глюкозидазную активность, Genzyme, Cambridge, МА) и/или плече-лопаточно-лицевую дистрофию (с использованием ДНК-теста на плече-лопаточно-лицевую дистрофию (FSHD DNA Test), Athena Diagnostics).
Для определения возможного более частого применения статинов у пациентов с анти-200/100-кДа аутоантителами определяли частоту применения статинов у пациентов из группы с подтвержденным или вероятным полимиозитом (РМ) или дерматомиозитом (DM) (Bohan and Peter, N EngI J Med 1975; 292:344-7 and 292:403-7), а также у пациентов с возможным миозитом телец включения (IBM) (Griggs RC, et a!., Ann Neurol 1995; 38:705-13). Возраст пациентов сравнивали с применением двусторонних t-критериев Стьюдента. Для сравнения частоты применения статинов в разных группах применяли критерий хи-квадрат.
Анализ биопсии мышц
Биопсийные образцы мышц получали из дельтовидной, двуглавой или четырехглавой мышц. В каждом случае выбранная мышца была ослаблена по определению врача, проводившего осмотр. Срезы биопсийных образцов мышц обследовали в Лаборатории нейромышечной патологии Джона Хопкинса (Johns Hopkins Neuromuscular Pathology Laboratory). Эти исследования включали окрашивание тканей гематоксилином и эозином, а также некоторые или все следующие окраски: модифицированную трехцветную окраску по Гомори, окраски на аденозинтрифосфатазу при рН 4,3, рН 4,6 и рН 9,4, НАД-тетразолий редуктазу, кислую фосфатазу, сукцинатдегидрогеназу, цитохромоксидазу, эстеразу, щелочную фосфатазу, окраску реактивом Шиффа (РАЗ), окраску PAS с контрольной обработкой диастазой и окраску Конго-красным. Проводили обычный скрининг как замороженных, так и заключенных в парафин образцов на присутствие дегенеративных, регенерирующих и/или некротических волокон, первичного воспаления эндомизия, периваскулярного воспаления, вакуолей с ободком, перифасцикулярной атрофии и фиброза. Авторы изобретения определяли «некротизирующую миопатию» в биопсийных образцах по присутствию некротических мышечных волокон в качестве основного патогистологического признака; за исключением миофагоцитоза некротических мышечных волокон, воспалительных клеток было мало или не было совсем. Биопсийные образцы мышц, полученные от пациентов с аутоантителами, специфичными в отношении белков массой 200/100 кДа, окрашивали антителами, распознающими CD31 (маркер эндотелиальных клеток), C5b-9 (то есть мембраноатакующий комплекс) и молекулы главного комплекса гистосовместимости (МНС) I класса.
Кратко, замороженные биопсийные срезы мышц толщиной 7 мкм фиксировали в охлажденном на льду ацетоне. Через десять минут обработки реагентом, блокирующим пероксидазу (Dako, Carpinteria, CA), при комнатной температуре срезы инкубировали с 5% бычьим сывороточным альбумином в забуференном фосфатом физиологическом растворе (BSA/PBS) в течение одного часа при 37°С. Приготавливали первичные антитела в 1% BSA/PBS в следующих разведениях: 1:50 для молекул МНС I класса (Santa Cruz Biotechnology, Santa Cruz, CA), 1:20 для CD31 (Dako), 1:50 для Cb5-9 (Santa Cruz Biotechnology); первичные инкубации проводили в течение ночи при 4°С. После отмывок в PBS срезы инкубировали с меченным пероксидазой хрена козьим противомышиным вторичным антителом (Dako) в 1% BSA/PBS в разведении 1:500 в течение одного часа при комнатной температуре. Для визуализации каждого антитела использовали соединение - хромаген 3,3'-диаминобензидин (Dako) и все срезы контрастировали гематоксилином. В качестве отрицательных контролей использовали образцы нормальной мышечной ткани и в качестве положительного контроля окрашивания на молекулы МНС I класса использовали мышечную ткань, полученную от Jo-1-позитивного пациента с миозитом. Для каждого первичного антитела все срезы мышц обрабатывали одновременно в одинаковых условиях.
Иммунопреципитация
Образцы сыворотки, полученные от каждого пациента, хранили при -80°С. Проводили радиоактивное мечение клеток HeLa, культивированных с применением стандартных методик, в течение двух часов с использованием 100 мкКи/мл 35S-метионина и цистеина (МР Biomedicals, Solon, ОН) в среде, свободной от метионина и цистеина. Затем клетки лизировали в буфере А (50 мМ Трис (трис-гидроксиметиламинометан), рН 7,4, 150 мМ NaCl, 5 мМ EDTA (этилендиаминтетрауксусная кислота), 0,5% Nohidet P40, 0,5% дезоксихолат натрия, 0,1% додецилсульфат натрия (SDS) и смесь ингибиторов протеаз). Каждую 10 см чашку лизировали 1 мл буфера А и использовали для 10 реакций иммунопреципитации. Реакции иммунопреципитации проводили, добавляя 1 мкл сыворотки пациента к 100 мкл радиоактивно меченного лизата и доводя объем до 1 мл буфером В (1% Nonidet P40, 20 мМ Трис, рН 7,4, 150 мМ NaCl, 1 мМ EDTA и смесь ингибиторов протеаз) с вращением смеси в течение одного часа при 4°С. Для преципитации комплексов антитело-антиген использовали агарозные шарики с белком A (Pierce, Rockford, IL) с последующим электрофорезом в 10%-ных полиакриламидных гелях с SDS. Радиоактивно меченные иммунопреципитаты визуализировали флуорографией.
Результаты, описанные выше в Примерах 5-11, были получены с применением следующих материалов и методов.
Пациенты и генотипирование
С мая 2002 г. по апрель 2010 г. 750 пациентов с подозрением на миопатию на основании слабости проксимальных мышц, повышенных уровней креатинкиназы (СК), признаков миопатии при электромиографии (EMG), отека мышц по данным магнитно-резонансной томографии (MRI) и/или признаков миопатии по данным биопсии мышц были включены в продольное исследование. У пациентов определяли полимиозит (РМ) или дерматомиозит (DM) при наличии у них вероятного или подтвержденного заболевания согласно критериям Bohan и Peter (Bohan and Peter, N EngI J Med 1975:292:344-7 and 403-7) и миозит с тельцами включения (IBM), если они соответствовали критериям возможного заболевания Griggs et al. (Griggs et al., Ann Neurol 1995;38:705-13). От каждого субъекта была получена сыворотка, и от 260 субъектов была получена ДНК. Образцы сыворотки также получали от двадцати здоровых контрольных субъектов, не принимавших ранее статины. Все субъекты были включены в протоколы, утвержденные Экспертным советом Центра миозитов Джона Хопкинса. У всех семнадцати пациентов, позитивных в отношении анти-ГМГ-КоА-редуктазы, от которых были получены образцы ДНК, проводили генотипирование по аллелю rs4149056 С с применением подходящего проверенного анализа TaqMan® Drug Metabolism Genotyping Assay (Applied Biosystems, Carlsbad, CA) (см. подробные клинические данные в Таблице 4).
Иммунопреципитация из радиоактивно меченных клеточных лизатов Клетки HeLa культивировали в отсутствие или в присутствии 10 мкМ мевинолина (Sigma, St. Louis, МО) в течение 22 Часов и затем их радиоактивно метили с использованием 100 мкКи/мл 35S-метионина и цистеина (МР Biomedicals, Solon, ОН), лизировали и проводили реакции иммунопреципитации с сыворотками пациентов (см. Примеры 1-4 выше). Иммунопреципитаты восстанавливали, кипятили, проводили их электрофорез в 10%-ных полиакриламидных гелях с додецилсульфатом натрия и визуализировали флуорографией.
Иммунопреципитация с использованием меченных 35S-метионином транскрибированных/транслированных in vitro (IVTT) белков
ДНК, кодирующую полноразмерную человеческую ГМГ-КоА-редуктазу, приобретали у Invitrogen (Carlsbad, СА). ДНК, кодирующую N-концевой фрагмент (аминокислоты 1-377) получали мутацией R377 в стоп-кодон. ДНК, кодирующую С-конец ГМГ-КоА-редуктазы (аминокислоты 340-888) получали полимеразной цепной реакцией (ПЦР) с использованием полноразмерной ДНК в качестве матрицы. Верифицировали последовательность конструкций и использовали их в IVTT-реакциях (Promega, Madison, WI) с получением белков, меченных 35S-метионином. С полученными продуктами проводили реакции иммунопреципитации, выявляя иммунопреципитаты, как описано выше. Конкурентные эксперименты
Один микролитр сыворотки каждого пациента предварительно инкубировали (30 минут при 4°С в 50 мкл) с каталитическим доменом человеческой ГМГ-КоА-редуктазы (аминокислоты 426-888), экспрессированным в форме слитого белка с глутатион-8-трансферазой (называемым здесь «С-концевым фрагментом ГМГ-КоА-редуктазы», Sigma). Предварительно инкубированные антитела затем использовали для реакций иммунопреципитации с полноразмерной IVTT ГМГ-КоА-редуктазой или радиоактивно меченными лизатами, полученными из обработанных мевинолином клеток HeLa.
Анти-HMGCR ELISA
Планшеты для ELISA (96-луночные) покрывали 100 нг С-концевого фрагмента ГМГ-КоА-редуктазы (Sigma), разведенного в забуференном фосфатом физиологическом растворе (PBS), в течение ночи при 4°С. Дублирующие лунки инкубировали с одним PBS. После отмывки планшетов в лунки добавляли образцы человеческой сыворотки, разведенные 1:400 в PBS с 0,05% Tween-20, на один час при 37°С. После отмывки в каждую лунку добавляли меченное пероксидазой хрена козье антитело против человека (1:10000; Pierce, Rockford, IL) на 30 минут 37°С. Цветовое проявление проводили с использованием пероксидазного реагента SureBlue™ (KPL, Gaithersburg, MD) и определяли поглощение при 450 нм. Для каждого образца из показателя поглощения в каждой соответствующей лунке, покрытой С-концевым фрагментом ГМГ-КоА-редуктазы, вычитали фоновое поглощение лунок с PBS. Поглощение исследуемого образца выражали как долю поглощения произвольного положительного контрольного образца (образца 9176), контрольной сыворотки, включенной в каждый ELISA.
Иммуногистохимия
Получение и использование человеческих биопсийных образцов было утверждено Экспертным советом Центра миозитов Джона Хопкинса. Исследовали биопсийные образцы мышц, полученные от 6 пациентов с анти-HMGCR антителами и 3 нормальных контрольных субъектов. Все биопсийные образцы были получены от пациентов, не принимавших статины в течение более чем трех месяцев. Окрашивание парафиновых срезов проводили, как описано ранее (9). Инкубации с антителами включали смеси первичных кроличьих анти-HMGCR (Millipore) антител и мышиных антител против нейрональной молекулы клеточной адгезии (NCAM; Santa Cruz Biotechnology), затем ослиного противокроличьего IgG Alexa Fluor 594 (для выявления HMGCR) и ослиного противомышиного IgG Alexa Fluor 488 (для выявления NCAM) вторичных антител (Invitrogen).
ДРУГИЕ ВОПЛОЩЕНИЯ
Из предшествующего описания будет очевидно, что изобретение, описанное здесь, может быть изменено и модифицировано для его адаптации к различным применениям и условиям. Такие воплощения также входят в объем последующей формулы изобретения.
Указание перечня элементов в любом определении переменной, приведенном здесь, включает определения этой переменной как любого отдельного элемента или комбинации (или субкомбинации) перечисленных элементов. Указание воплощения, приведенное здесь, включает это воплощение в форме любого одного воплощения или в комбинации с любыми другими воплощениями или их частями.
Все патенты и публикации, упомянутые в данном описании, включены сюда посредством ссылки в такой же степени, как если бы было специально и по отдельности указано, что каждый отельный патент или публикация включена посредством ссылки.