МЕДИЦИНСКОЕ УСТРОЙСТВО, ДОСТАВЛЯЮЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0001] Данное изобретение в целом относится к медицинскому устройству для введения лекарственного средства в место назначения в просвете части организма. Более конкретно, данное изобретение относится к доставляющему лекарственное средство надувному баллону, покрытому наноносителями одного или нескольких лекарственных средств, для эффективной доставки одного или нескольких лекарственных средств к месту назначения в кровеносном сосуде.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ДАННОГО ИЗОБРЕТЕНИЯ
[0002] Вводимые медицинские устройства, доставляющие лекарственное средство, применяются для локализованной доставки лекарственного средства к месту назначения в кровеносном сосуде. Баллон, элюирующий лекарственное средство (DEB), является одним таким вводимым медицинским устройством, доставляющим лекарственное средство. Несмотря на широкое применение, DEB связаны с применением полимеров для загрузки лекарственного средства на поверхность DEB. Применяемые полимеры могут вызвать воспаление в месте назначения. Чтобы избежать воспаления, вызванного полимерами, лекарственное средство может быть загружено на поверхность DEB без применения полимеров. Однако такие бесполимерные подходы, известные в данной области техники, основаны на модификации поверхности DEB.
[0003] Кроме того, DEB вступает в контакт с местом назначения в кровеносном сосуде в течение очень короткого периода, как правило, в пределах от 30 секунд до 90 секунд. Необходимое количество лекарственного средства, загруженного на DEB, не может высвобождаться с поверхности DEB за столь короткий период. Поэтому на DEB должно быть загружено большее количество лекарственного средства по сравнению с количеством лекарственного средства, которое необходимо фактически доставить. Поскольку на DEB загружено большее количество лекарственного средства, то значительное количество лекарственного средства может оставаться на поверхности DEB после изъятия DEB из места назначения. Оставшееся количество лекарственного средства, присутствующее на DEB, может быть вымыто в кровоток, пока DEB изымается через кровеносный сосуд, таким образом создавая нежелательные побочные эффекты.
[0004] Кроме того, на используемые в настоящее время DEB наносят покрытие микрочастиц лекарственного средства. Микрочастицы лекарственного средства не могут эффективно проникать в ткани в месте назначения. Следовательно, используемые в настоящее время DEB не могут проявлять эффективную внутритканевую диффузию лекарственного средства.
[0005] Поэтому в данной области техники существует необходимость в DEB, который может эффективно доставлять лекарственное средство к месту назначения в кровеносном сосуде в течение короткого периода, за который DEB вступает в контакт с местом назначения. Кроме того, в данной области техники существует необходимость в DEB, который может эффективно доставлять лекарственное средство к максимальной площади поражения и обеспечивать повышенную биодоступность с оптимальным количеством лекарственного средства, загруженного на баллон, доставляющий лекарственное средство.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0006] Прилагаемые фигуры, где подобные номера позиций относятся к идентичным или подобным в функциональном плане элементам в отдельных видах и которые вместе с подробным описанием ниже включены ниже в и являются частью описания изобретения, служат для дополнительной иллюстрации различных вариантов осуществления и объяснения различных принципов и преимуществ в соответствии с данным изобретением.
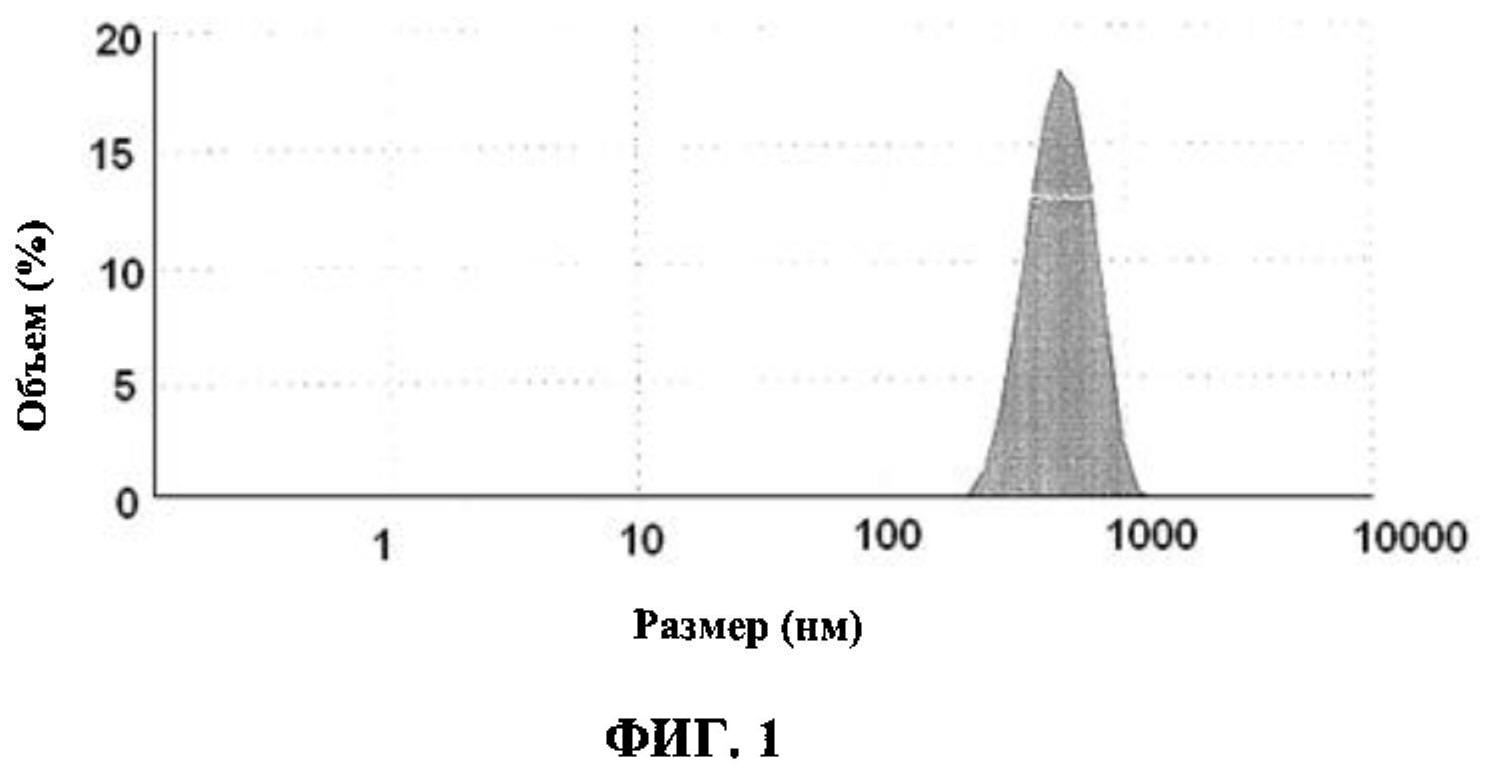
[0007] ФИГ.1 иллюстрирует распределение по размерам наночастиц фосфолипида сои при определении с помощью Malvern ZS90 в соответствии с Примером 1.
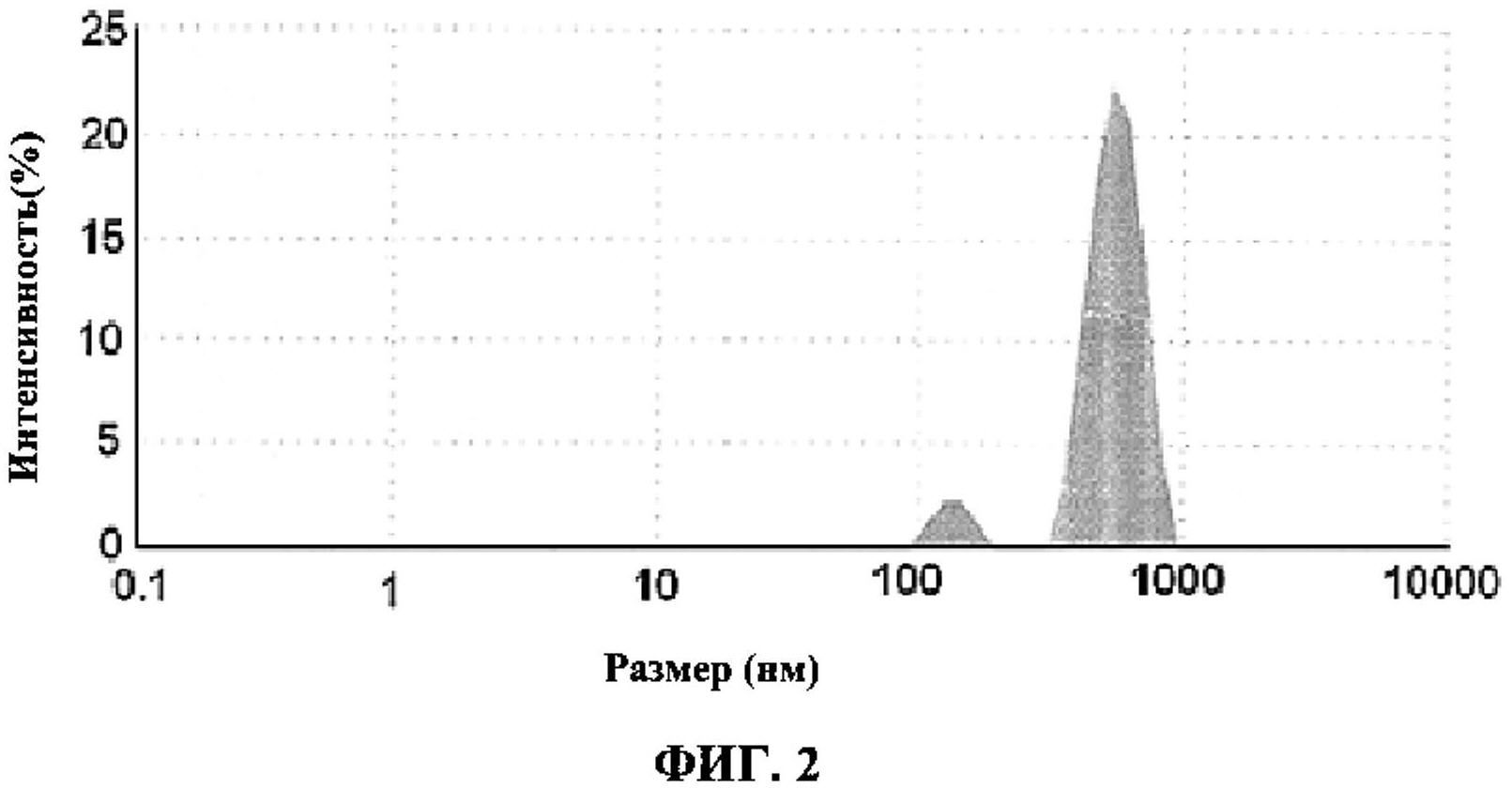
[0008] ФИГ.2 иллюстрирует распределение по размерам наноносителей при определении с помощью Malvem ZS90 в соответствии с Примером 1.
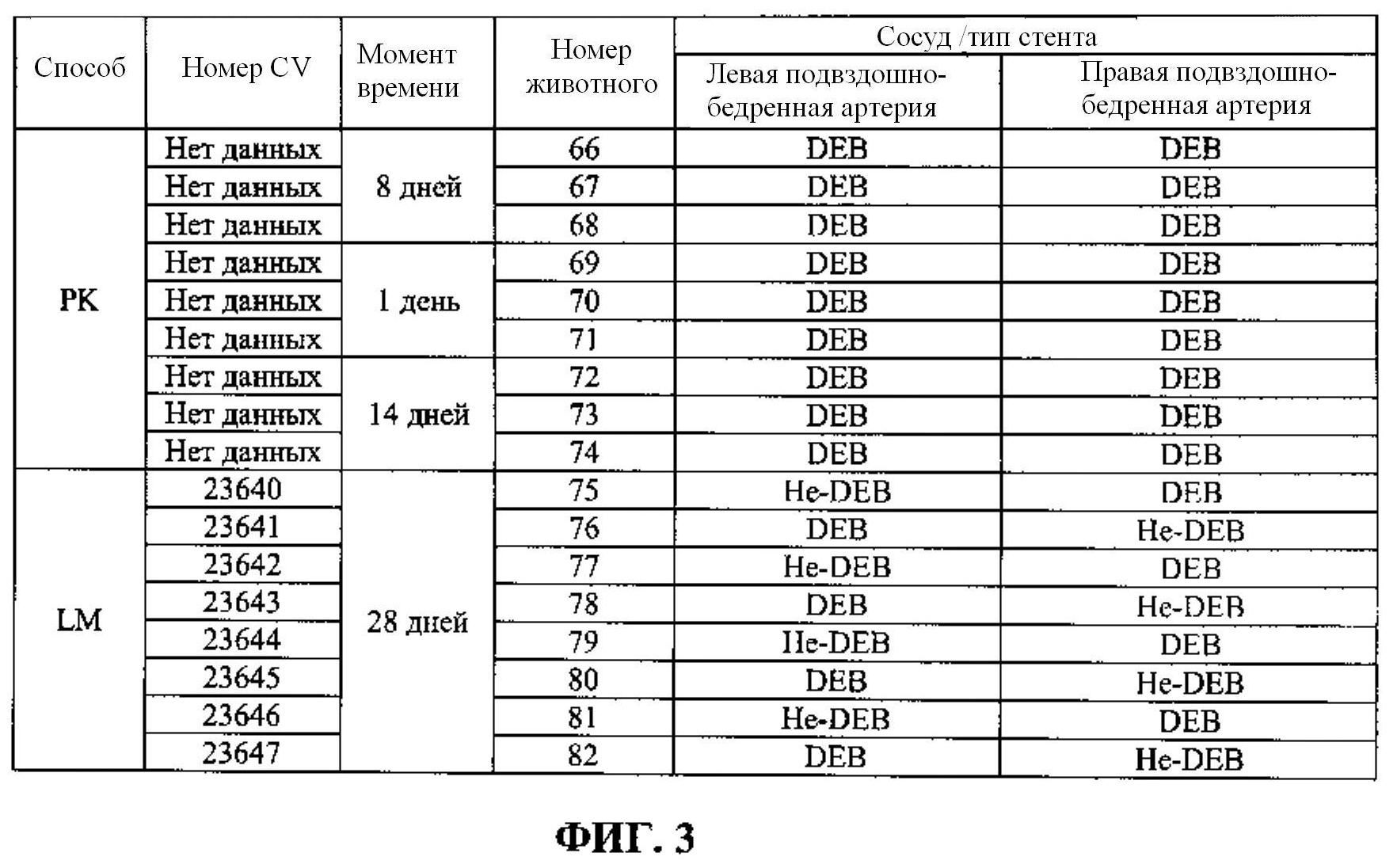
[0009] ФИГ.3 представляет собой таблицу, иллюстрирующую номера, присвоенные 17 животным, тип стента и расположение стента у каждого животного и тип исследования (PK/LM), проведенного на животных в соответствии с Примером 2.
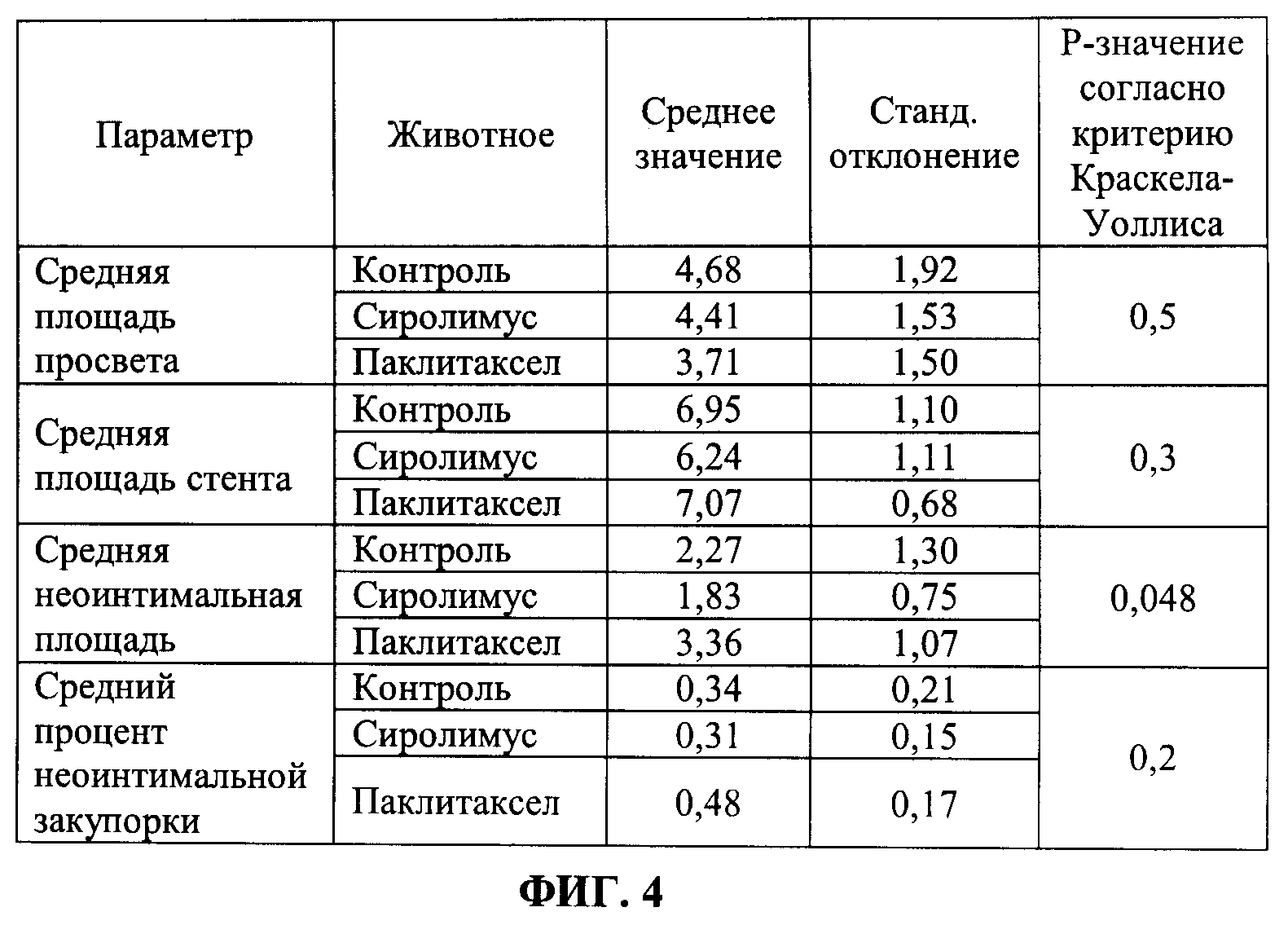
[0010] ФИГ.4 иллюстрирует таблицу значений средних и стандартных отклонений результатов средних площадей просветов, средних площадей стентов, средних неоинтимальных площадей и среднего процента неоинтимальной закупорки для каждой группы, т.е. контроля, сиролимуса и паклитаксела, в соответствии с Примером 3.
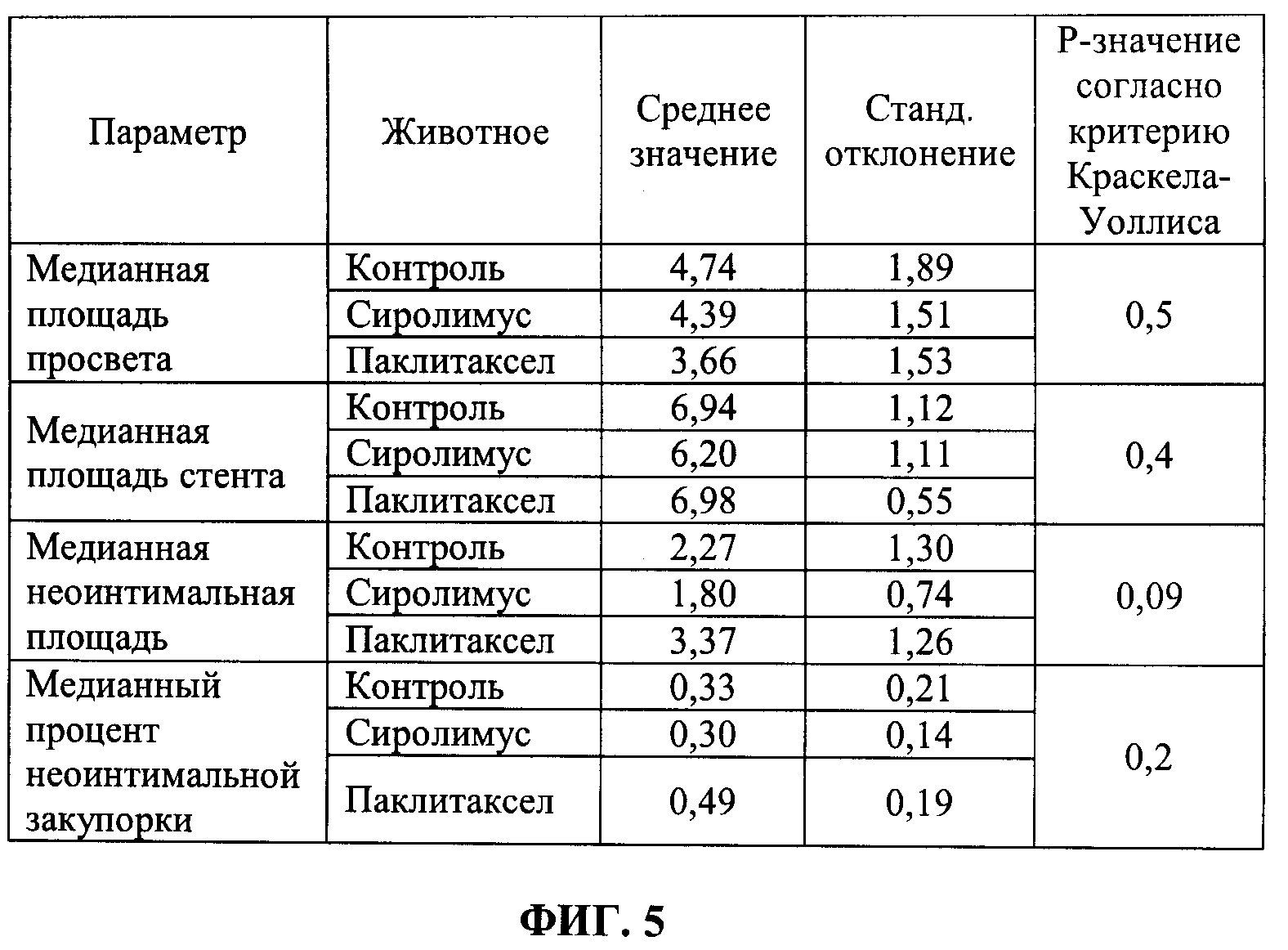
[0011] ФИГ.5 иллюстрирует таблицу значений средних и стандартных отклонений результатов медианных площадей просветов, медианных площадей стентов, медианных неоинтимальных площадей и медианного процента неоинтимальной закупорки для каждой группы в соответствии с Примером 3.
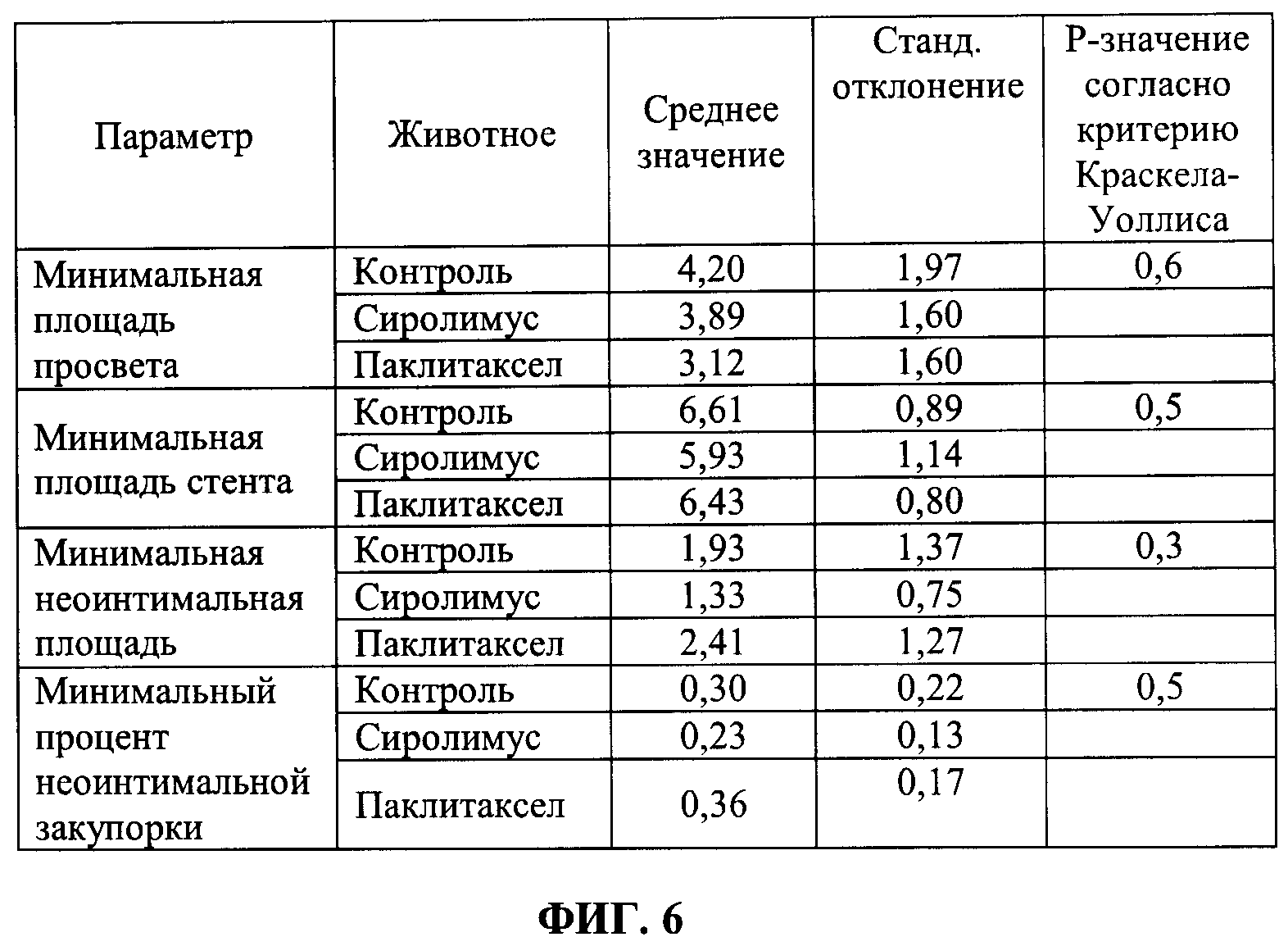
[0012] ФИГ.6 иллюстрирует таблицу значений средних и стандартных отклонений результатов минимальных площадей просветов, минимальных площадей стентов, минимальных неоинтимальных площадей и результатов минимального процента неоинтимальной закупорки для каждой группы в соответствии с Примером 3.
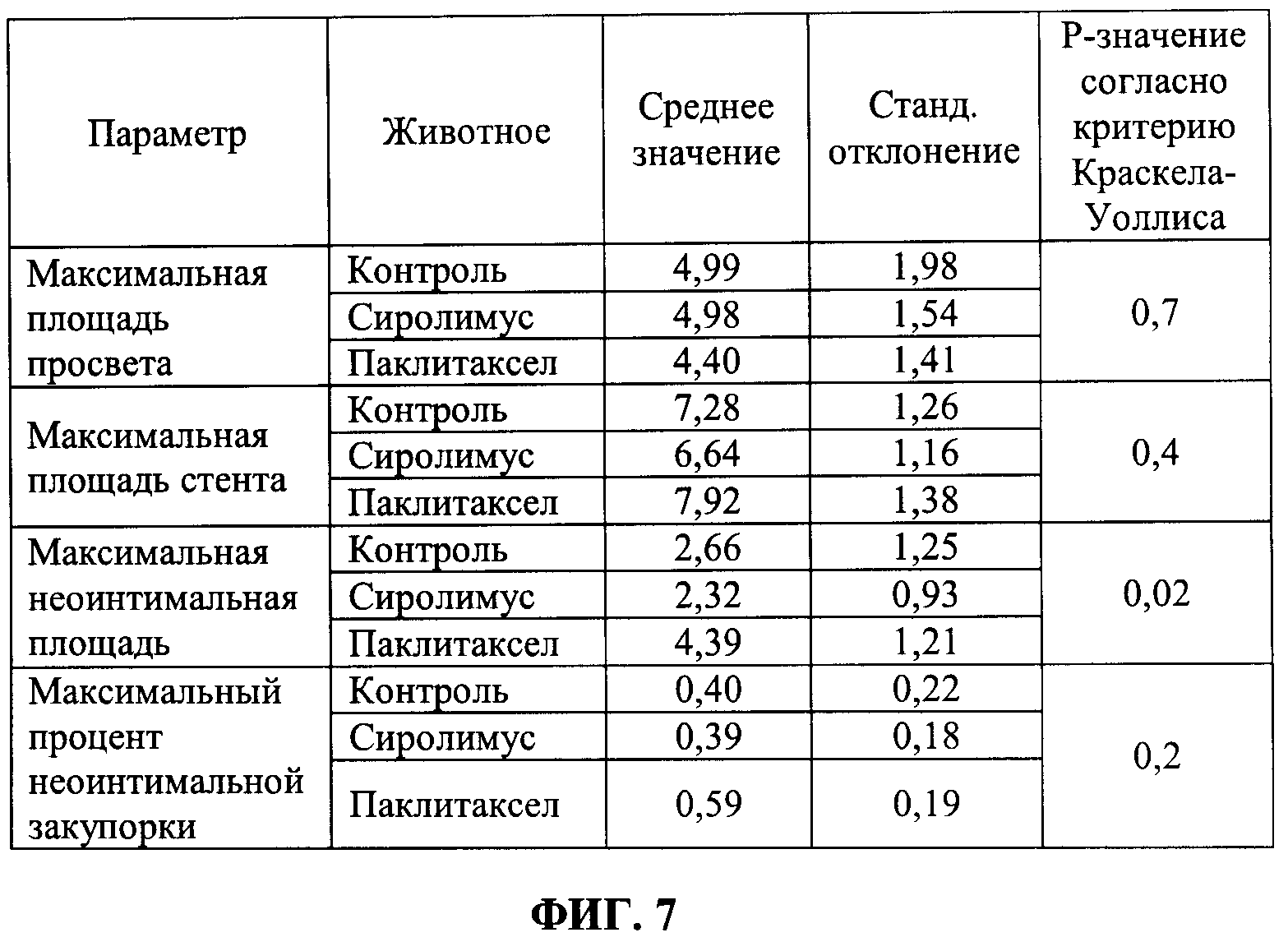
[0013] ФИГ.7 иллюстрирует таблицу значений средних и стандартных отклонений результатов максимальных площадей просветов, максимальных площадей стентов, максимальных неоинтимальных площадей и максимального процента неоинтимальной закупорки для каждой группы в соответствии с Примером 3.
ПОДРОБНОЕ ОПИСАНИЕ ДАННОГО ИЗОБРЕТЕНИЯ
[0014] Прежде чем подробно описать варианты осуществления, которые находятся в соответствии с данным изобретением, следует отметить, что варианты осуществления заключаются, в основном, в комбинациях компонентов вводимого медицинского устройства, доставляющего лекарственное средство, для локализованной доставки лекарственного средства к месту назначения в кровеносном сосуде. Соответственно, компоненты были описаны с включением только тех конкретных деталей, которые имеют отношение к пониманию вариантов осуществления данного изобретения с тем, чтобы не затруднять понимание раскрытия деталями, которые будут очевидны специалистам в данной области, извлекающим пользу из приведенного в данном документе описания.
[0015] В этом документе термины "включает", "включающий" или любая другая их вариация подразумеваются как охватывающие неисключительное включение, такое как процесс, способ, изделие или устройство, которые включают перечень элементов, не включают только такие элементы, но могут включать другие элементы, не перечисленные конкретно или присущие такому процессу, способу, изделию или аппарату. Элемент, предшествующий "включает…" не исключает, без дальнейших ограничений, существование дополнительных идентичных элементов в процессе, способе, изделии или аппарате, которые включают элемент.
[0016] Кроме того, прежде чем подробно описать варианты осуществления, которые находятся в соответствии с данным изобретением, следует отметить, что все научные и технические термины, используемые в данном документе для описания данного изобретения, имеют те же значения, которые будут пониматься специалистом в данной области.
[0017] Вообще говоря, согласно разным вариантам осуществления данное изобретение раскрывает медицинское устройство, доставляющее лекарственное средство, для доставки лекарственного средства к месту назначения в просвете части организма. Просвет части организма может быть просветом кровеносного сосуда, мочеиспускательного канала, пищевода, мочеточника и желчного протока. Медицинское устройство, доставляющее лекарственное средство, применяют для лечения медицинского состояния, связанного с просветом части организма. Медицинским состоянием может быть, например, атеросклероз, заблокированная артерия, рестеноз, накопление бляшек в кровеносном сосуде и образование тромбов в кровеносном сосуде.
[0018] Медицинское устройство, доставляющее лекарственное средство, включает катетер-баллон и надувной баллон, расположенный на катетер-баллоне. Надувной баллон имеет гидрофильную поверхность. Одна или несколько частей гидрофильной поверхности покрыты двумя или несколькими наноносителями. Наноноситель из двух или нескольких наноносителей включает лекарственное средство, окруженное инкапсулирующей средой. Инкапсулирующей средой может быть одно или несколько из биологического средства, наполнителя на основе крови и фосфолипида. Поскольку лекарственное средство окружено инкапсулирующей средой, то поверхность наноносителя лишена лекарственного средства. При накачивании надувного баллона после подхода близко к месту назначения в просвете части организма примерно от 30% до 80% двух или более наноносителей высвобождаются с гидрофильной поверхности в течение от 15 до 90 секунд.
[0019] Медицинское устройство, доставляющее лекарственное средство, может являться комплектом катетер-баллона, который в основном применяют для чрескожной транслюминальной ангиопластики (ЧТА). В варианте осуществления медицинское устройство, доставляющее лекарственное средство, является комплектом катетер-баллона, который в основном применяют для чрескожной транслюминальной коронарной ангиопластики (ЧТКА). Комплект катетер-баллона в основном включает катетер-баллон и надувной баллон, установленный на катетере-баллоне. Кроме того, комплект катетер-баллона может включать одну или несколько катетерных трубок, один или несколько проволочных направителей, запас жидкости для накачивания надувного баллона и любой другой компонент, который может быть необходимым для функционирования комплекта катетер-баллона для доставки двух или более наноносителей к месту назначения. Поскольку данное изобретение главным образом заключается в надувном баллоне, покрытом двумя или более наноносителями, функционирование и компоненты комплекта катетер-баллона, отличного от надувного баллона, подробно не раскрыты.
[0020] Надувным баллоном может быть любой баллон, который обычно применяют в одной из ЧТА и ЧТКА и который также можно применять для доставки двух или более наноносителей к месту назначения в просвете части организма. Например, надувным баллоном может быть ангиопластический баллон.
[0021] Надувной баллон имеет гидрофильную поверхность. Гидрофильная поверхность может представлять собой слой одного или нескольких гидрофильных веществ, нанесенных на поверхность надувного баллона, как правило, для уменьшения трения надувного баллона со стенками просвета части организма при перемещении надувного баллона в просвете части организма. В соответствии с различными вариантами осуществления одно или несколько гидрофильных веществ могут быть выбраны из гидрофильных веществ, известных в данной области техники, не выходя за объем данного изобретения. Например, одно или несколько гидрофильных веществ могут быть выбраны из одного или нескольких, но без ограничений, из полиалкиленгликолей, алкоксиполиалкиленгликолей, сополимеров метилвинилового эфира и малеиновой кислоты, поли(винилпирролидона), поли(N-алкилакриламида), поли(акриловой кислоты), поли(винилового спирта), поли(этиленимина), метилцеллюлозы, карбоксиметилцеллюлозы, поливиниловой сульфокислоты, гепарина, декстрана, модифицированного декстрана и хондроитинсульфата и по крайней мере одного антиадгезива.
[0022] Одна или несколько частей гидрофильной поверхности покрыты двумя или более наноносителями. Два или более наноносителей, нанесенных на одну или несколько частей гидрофильной поверхности, высвобождаются быстрее по сравнению с высвобождением наноносителей с поверхности баллона без гидрофильного покрытия. Следовательно, «взрывное» высвобождение двух или более наноносителей с гидрофильной поверхности может быть достигнуто за короткий период, в течение которого надувной баллон вступает в контакт с местом назначения в просвете части организма. В иллюстративном варианте осуществления приблизительно от 70% до 80% двух или более наноносителей высвобождаются с гидрофильной поверхности в течение приблизительно 60 секунд при накачивании надувного баллона после подхода близко к месту назначения.
[0023] Согласно различным вариантам осуществления у гидрофильной поверхности дополнительно может быть одна или несколько внешних гидрофильных поверхностей. Одна или несколько внешних гидрофильных поверхностей могут быть созданы на одной или нескольких желаемых частях надувного баллона без нанесения покрытия двух или более наноносителей на одну или несколько желаемых частей. Другими словами, два или более наноносителя нанесены на всю гидрофильную поверхность за исключением одной или нескольких внешних гидрофильных поверхностей. В варианте осуществления одна или несколько внешних гидрофильных поверхностей созданы на одной или нескольких из одной или нескольких частей дистального конца гидрофильной поверхности и на одной или нескольких частях проксимального конца гидрофильной поверхности. Одна или несколько внешних гидрофильных поверхностей способствуют растворению одного или нескольких гидрофильных веществ, присутствующих у одной или нескольких внешних гидрофильных поверхностей, вступая в контакт с кровью в месте назначения. В ответ на растворение одного или нескольких гидрофильных веществ, присутствующих у одной или нескольких внешних гидрофильных поверхностей, одно или несколько гидрофильных веществ, присутствующих в гидрофильной поверхности, также могут раствориться в крови, приведя к высвобождению двух или более наноносителей с гидрофильной поверхности. Таким образом, одна или несколько внешних гидрофильных поверхностей способствуют высвобождению двух или более наноносителей с надувного баллона.
[0024] У надувного баллона дополнительно есть два или более наноносителей, нанесенных на одну или несколько частей гидрофильной поверхности. Наноноситель из двух или более наноносителей включает лекарственное средство, окруженное инкапсулирующей средой. Лекарственное средство может включать нанокристаллы лекарственного средства. Нанокристаллы лекарственного средства могут иметь средний диаметр, варьирующий в диапазоне от 1 нм до 1500 нм. Кроме того, нанокристаллы лекарственного средства могут иметь два или более различных средних диаметров. В качестве альтернативы лекарственное средство может включать одно или несколько из частиц наноразмеров, наносфер, липосом, нанокапсул, дендримеров и любых других подобных формы лекарственного средства, которые имеют наноразмеры.
[0025] Лекарственное средство может быть одним или несколькими из, но без ограничений, антипролиферативного средства, противовоспалительного средства, противоопухолевого средства, противосвертывающего средства, антифибринного средства, антитромботического средства, антимитотического средства, антибиотического средства, противоаллергического средства и антиоксиданта, антипролиферативного средства, эстрогенов, ингибитора протеазы, антител, иммунодепрессантного средства, цитостатического средства, цитотоксического средства, блокатора кальциевых каналов, ингибитора фосфодиэстеразы, ингибитора простагландина, пищевой добавки, витаминов, средства против агрегации тромбоцитов и генетически сконструированных эпителиальных клеток.
[0026] Лекарственное средство может являться, например, но без ограничений, одним или несколькими из сиролимуса, такролимуса, паклитаксела, клобетазола, дексаметазона, генистеина, гепарина, 17 бета-эстрадиола, рапамицина, эверолимуса, этилрапамицина, зотаролимуса, АВТ-578, биолимуса А9, доцетаксела, метотрексата, азатиоприна, винкристина, винбластина, фторурацила, доксорубицина гидрохлорида, митомицина, гепарина натрия, низкомолекулярного гепарина, гепариноида, гирудина, аргатробана, форсколина, вапипроста, простациклина, аналога простациклина, декстрана, D-Phe-Pro-Arg-хлорметилкетона, дипиридамола, гликопротеина IIb/IIIa, рекомбинантного гирудина, бивалирудина, нифедипина, колхицина, ловастатина, нитропруссида, сурамина, блокатора серотонина, стероида, ингибитора тиопротеазы, триазолопиримидина, оксида азота или донора оксида азота, супероксиддисмутазы, миметика супероксиддисмутазы, эстрадиола, аспирина, ангиопептина, каптоприла, цилазаприла, лизиноприла, пермироласта калия, альфа-интерферона, биологически активных RGD и любых их солей или аналогов.
[0027] В соответствии с различными вариантами осуществления лекарственное средство полностью окружено инкапсулирующей средой и, следовательно, поверхность наноносителя лишена какого-либо свободного лекарственного средства. Следовательно, избегается прямой контакт лекарственного средства с поверхностью надувного баллона. Кроме того, лекарственное средство вступает в контакт с тканями места назначения только при проникновении наноносителя в ткани места назначения и растворении инкапсулирующей среды. Таким образом предотвращается прямое воздействие лекарственного средства на ткани места назначения и поверхность надувного из-за наличия инкапсулирующей среды.
[0028] Инкапсулирующая среда может представлять собой одно или несколько из биологического средства, наполнителя на основе крови и фосфолипида. В качестве альтернативы инкапсулирующая среда может представлять собой одно или несколько из, но без ограничений, одного или нескольких биологических средств, одного или нескольких наполнителей на основе крови, одного или нескольких фосфолипидов и одного или нескольких наполнителей.
[0029] В иллюстративном варианте осуществления инкапсулирующая среда может быть биологическим средством. Биологическое средство может включать наночастицы биологического средства. Наночастицы биологического средства могут иметь средний диаметр, варьирующий в диапазоне от 1 нм до 1500 нм. Кроме того, наночастицы биологического средства могут иметь два или более различных средних диаметров. В качестве альтернативы биологическое средство может включать одно или несколько из частиц наноразмеров, наносфер, липосом, нанокапсул, дендримеров и любой другой подобной формы биологического средства, которая имеет наноразмеры.
[0030] Биологическое средство может быть одним или несколькими из, но без ограничений, носителей лекарственного средства, наполнителей, компонентов крови, наполнителей, полученных из крови, естественных фосфолипидов, твердых липидных наночастиц, фосфолипидов, полученных из живых животных, фосфолипидов, полученных синтетическим путем, липоидов, витаминов и молекул сахара. Биологическое средство может включать, например, стероиды, витамины, эстрадиол, этерифицированные жирные кислоты, неэтерифицированные жирные кислоты, глюкозу, инозит, L-лактат, липопротеины, углеводы, трикальцийфосфат, осажденный фосфат кальция, трехосновный фосфат кальция, вещества, полученные по меньшей мере из одного из человека, яйца и сои, фосфолипон 80Н, фосфолипон 90Н, липоиды S75, липоиды Е80, интралипид 20, липоид ЕРС, липоиды Е75, липиды, полученные из яйца, липиды, полученные из сои, фосфатидилхолин, фосфатидилглицерин, фосфатидилинозитол, фосфатидилсерин, фосфатидную кислоту, кардиолипин и фосфатидилэтаноламин.
[0031] В другом иллюстративном варианте осуществления инкапсулирующая среда может быть фосфолипидом. Фосфолипид может включать наночастицы фосфолипида. Наночастицы фосфолипида могут иметь средний диаметр, варьирующий в диапазоне от 1 нм до 1500 нм. Кроме того, наночастицы фосфолипида могут иметь два или более различных средних диаметров. В качестве альтернативы фосфолипид может включать одно или несколько из частиц наноразмеров, наносфер, липосом, нанокапсул, дендримеров и любой другой подобной формы фосфолипида, которая имеет наноразмеры. Фосфолипид может быть одним или несколькими из, но без ограничений, липидов, полученных из яйца, липидов, полученных из сои, фосфатидилхолина, фосфатидилглицерина, фосфатидилинозитола, фосфатидилсерина, фосфатидной кислоты, кардиолипина и фосфатидилэтаноламина.
[0032] В еще одном иллюстративном варианте осуществления инкапсулирующая среда может быть наполнителем на основе крови. Наполнитель на основе крови может включать наночастицы наполнителя на основе крови. Наночастицы наполнителя на основе крови могут иметь средний диаметр, варьирующий в диапазоне от 1 нм до 1500 нм. Кроме того, наночастицы наполнителя на основе крови могут иметь два или более различных средних диаметров. В качестве альтернативы, наполнитель на основе крови может быть одним или несколькими из частиц наноразмеров, наносфер, липосом, нанокапсул, дендримеров и любой другой подобной формы наполнителя на основе крови, которая имеет наноразмеры. Наполнитель на основе крови может быть одним или несколькими обнаруживаемыми в крови наполнителями, которые могут быть изготовлены искусственно. Наполнитель на основе крови может быть одним или несколькими из, но без ограничений, стероидов, витаминов, эстрадиола, этерифицированных жирных кислот, неэтерифицированных жирных кислот, глюкозы, инозита, L-лактата, липидов, липопротеинов, фосфолипидов, углеводов, трикальцийфосфата, осажденного фосфата кальция и трехосновного фосфата кальция.
[0033] Наполнитель на основе крови и биологическое средство растворимы при рН ниже 7,4. Следовательно, если два или более наноносителей вступают в контакт с тканями места назначения, то биологическое средство и наполнитель на основе крови растворяются в крови. Растворение биологического средства и наполнителя на основе крови приводит к высвобождению в месте назначения лекарственного средства из двух или более наноносителей. Таким образом достигается рН-зависимое высвобождение лекарственного средства из двух или более наноносителей.
[0034] Кроме того, поскольку инкапсулирующая среда представляет собой одно или несколько из биологического средства, наполнителя на основе крови и фосфолипида, то два или более наноносителей проявляют сродство к тканям места назначения. Такое сродство способствует эффективному переносу двух или более наноносителей с гидрофильной поверхности надувного баллона к цели. Кроме того, одно или несколько из биологического средства и фосфолипида проявляют свойство стабилизации лекарственного средства, присутствующего в наноносителе из двух или более наноносителей.
[0035] Два или более наноносителей могут иметь средний диаметр, варьирующий в диапазоне от 10 нм до 1500 нм. В качестве альтернативы два или более наноносителей могут иметь два или более средних диаметров. Два или более средних диаметров могут варьировать в диапазоне от 1 нм до 1500 нм.
[0036] В соответствии с различными вариантами осуществления два или более наноносителей можно получить с помощью способов, известных в данной области техники. Например, одно или несколько из нанокристаллов лекарственного средства, наночастиц биологического средства, наночастиц фосфолипида и наночастиц наполнителя на основе крови можно получить с помощью одного или нескольких из, но без ограничений, гомогенизации при высоком давлении, распылительной сушки, высокоскоростной гомогенизации, шаровой мельницы, пульверизации, золь-гель-методов, гидротермальных методов, методов спрей-пиролиза и тому подобного.
[0037] Для получения двух или более наноносителей нанокристаллы лекарственного средства дополнительно инкапсулируют наночастицами одного или нескольких из биологического средства, фосфолипида и наполнителя на основе крови с помощью способов, известных в данной области техники. Средний диаметр двух или более наноносителей, полученных таким образом, может варьировать в диапазоне от 1 нм до 1500 нм. Затем, после получения двух или более наноносителей два или более наноносителей могут быть нанесены на гидрофильную поверхность вводимого медицинского устройства, доставляющего лекарственное средство с помощью способов и приемов, известных в данной области техники.
[0038] В иллюстративном варианте осуществления с целью получения нанокристаллов лекарственного средства заданное количество лекарственного средства можно добавить в растворитель с последующим добавлением поверхностно-активного вещества. Например, с целью получения нанокристаллов сиролимуса заданное количество сиролимуса можно добавить в воду с последующим добавлением Твина 80. Полученный таким образом раствор лекарственного средств можно затем подвергнуть высокоскоростной гомогенизации при заданных оборотах в минуту в течение заданного времени. Заданные обороты в минуту и заданное время могут быть выбраны на основе желаемого среднего диаметра нанокристаллов лекарственного средства. В результате воздействия на раствор лекарственного средства высокоскоростной гомогенизацией при заданных оборотах в минуту и в течение заданного времени получают раствор нанокристаллов лекарственного средства.
[0039] Подобным образом заданное количество биологического средства, например фосфолипида сои, можно добавить в растворитель с последующим добавлением поверхностно-активного вещества. Полученный таким образом раствор биологического средства затем можно подвергнуть высокоскоростной гомогенизации с заданными оборотами в минуту в течение заданного времени. Заданные обороты в минуту и заданное время могут быть выбраны на основе желаемого среднего диаметра наночастиц биологического средства. В результате воздействия на раствор биологического средства высокоскоростной гомогенизацией при заданных оборотах в минуту и в течение заданного времени получают раствор наночастиц биологического средства.
[0040] Затем для образования смеси раствор нанокристаллов лекарственного средства добавляют в раствор наночастиц биологического средства. Затем смесь подвергают высокоскоростной гомогенизации при заданных оборотах в минуту в течение заданного времени. В результате воздействия на смесь высокоскоростной гомогенизацией при заданных оборотах в минуту и в течение заданного времени нанокристаллы лекарственного средства инкапсулируются наночастицами биологического средства с образованием двух или более наноносителей. Таким образом можно получить раствор двух или более наноносителей.
[0041] После этого раствор двух или более наноносителей можно экстрагировать одним или несколькими органическими растворителями (например, метанолом, дихлорметаном и тому подобными), чтобы удалить любую свободную форму одного или нескольких из биологического средства и лекарственного средства. Раствор, полученный в результате экстракции одним или несколькими органическими растворителями, можно использовать для нанесения двух или более наноносителей на гидрофильную поверхность надувного баллона. Два или более наноносителей можно нанести на гидрофильную поверхность надувного баллона с помощью способов и оборудования, известных в данной области техники. Например, два или более наноносителей можно нанести на гидрофильную поверхность надувного баллона с применением одной или нескольких из, но без ограничений, техники покрытия напылением и техники распыления. Кроме того, два или более наноносителей можно нанести на гидрофильную поверхность надувного баллона, когда баллон находится в свернутой форме и расправленной форме.
[0042] В варианте осуществления гидрофильная поверхность надувного баллона покрыта двумя или более наноносителями со средним диаметром 800 нм. Гидрофильная поверхность дополнительно имеет одну или несколько внешних гидрофильных поверхностей на проксимальном конце и дистальном конце гидрофильной поверхности. Другими словами, части на проксимальном конце и дистальном конце не покрыты двумя или более наноносителями. Наноноситель из двух или более наноносителей включает нанокристаллы сиролимуса, окруженные одним или несколькими из трикальцийфосфата и фосфолипида сои. При накачивании надувного баллона после подхода близко к месту назначения в кровеносном сосуде приблизительно от 70% до 80% двух или более наноносителей высвобождаются с гидрофильной поверхности надувного баллона. Затем два или более наноносителей абсорбируются тканями в месте назначения.
[0043] В иллюстративном варианте осуществления надувной баллон применяют для лечения медицинского состояния, связанного с кровеносным сосудом. Кровеносный сосуд может являться одним из, например, коронарной артерии, периферической артерии, сонной артерии, почечной артерии, подвздошной артерии, подколенных артерий и вены. Кровеносный сосуд включает два или более слоев тканей. Два или более слоев ткани могут представлять собой слой интимы, средний слой и адвентициальный слой. Слой интимы является наиболее глубоким слоем тканей кровеносного сосуда, который находится в непосредственном контакте с кровотоком в кровеносном сосуде. Средний слой представляет собой слой тканей кровеносного сосуда, который находится под слоем интимы. Между тем адвентициальный слой представляет собой слой тканей кровеносного сосуда, который находится под средним слоем.
[0044] При высвобождении с гидрофильной поверхности надувного баллона наноноситель из двух или более наноносителей может проникнуть в слой интимы непосредственно через внутритканевые поры, присутствующие в слое интимы. Между тем наноноситель из двух или более наноносителей может проникнуть в средний слой, проходя через внутритканевые поры, присутствующие в слое интимы и сосудах сосудов, сопряженных со средним слоем. Подобным образом наноноситель из двух или более наноносителей может проникнуть в адвентициальный слой, проходя через внутритканевые поры, присутствующие в слое интимы, сосуды сосудов, сопряженные со средним слоем, и сосуды сосудов, сопряженные с адвентициальным слоем. Внутритканевые поры, присутствующие в слое интимы, сосуды сосудов, сопряженные со средним слоем, и сосуды сосудов, сопряженные с адвентициальным слоем, имеют различные внутренние диаметры. Поэтому проникновение наноносителя из двух или более наноносителей в один или несколько из слоя интимы, среднего слоя и адвентициального слоя зависит от среднего диаметра, сопряженного с двумя или более наноносителями.
[0045] В другом варианте осуществления два или более наноносителей включают первую группу наноносителей, вторую группу наноносителей и третью группу наноносителей. Первая группа наноносителей имеет первый средний диаметр, подходящий для проникновения в слой интимы через внутритканевые поры, присутствующие в слое интимы. Вторая группа наноносителей имеет второй средний диаметр, подходящий для проникновения в средний слой через сосуды сосудов, сопряженные со средним слоем, и внутритканевые поры, присутствующие в слое интимы. Третья группа наноносителей имеет третий диаметр, подходящий для проникновения в адвентициальный слой через внутритканевые поры, присутствующие в слое интимы, сосуды сосудов, сопряженные со средним слоем, и сосуды сосудов, сопряженные с адвентициальным слоем.
[0046] Первый средний диаметр может варьировать в диапазоне от 800 нм до 1500 нм, второй средний диаметр может варьировать в диапазоне от 300 нм до 800 нм, и третий средний диаметр может варьировать в диапазоне от 10 нм до 300 нм. В варианте осуществления первый средний диаметр составляет 1000 нм, второй средний диаметр составляет 700 нм, и третий средний диаметр составляет 200 нм. Первый средний диаметр, второй средний диаметр и третий средний диаметр можно изменять в соответствии с конкретной терапевтической потребностью, не выходя за пределы объема данного изобретения.
[0047] Первая группа наноносителей с первым средним диаметром может включать приблизительно от 10% до 60% двух или более наноносителей, в то время как вторая группа наноносителей со вторым средним диаметром может включать приблизительно от 20% до 70% двух или более наноносителей, а третья группа наноносителей с третьим средним диаметром может включать приблизительно от 30% до 80% двух или более наноносителей. В качестве альтернативы первая группа наноносителей, вторая группа наноносителей и третья группа наноносителей могут включать приблизительно от 15% до 90%, от 10% до 85% и от 5% до 85% двух или более наноносителей соответственно.
[0048] При высвобождении двух или более наноносителей с гидрофильной поверхности надувного баллона первая группа наноносителей проникает в средний слой через внутритканевые поры, присутствующие в слое интимы. Вторая группа наноносителей проникает в средний слой через сосуды сосудов, сопряженные со средним слоем, и внутритканевые поры, присутствующие в слое интимы. А третья группа наноносителей проникает в адвентициальный слой через сосуды сосудов, сопряженные с адвентициальным слоем, сосуды сосудов, сопряженные со средним слоем, и внутритканевые поры, присутствующие в слое интимы. Таким образом достигается зависящее от размеров проникновение двух или более наноносителей.
[0049] В еще одном варианте осуществления лекарственное средство, присутствующее в третьей группе наноносителей, может отличаться от лекарственного средства, присутствующего во второй группе наноносителей, и лекарственное средство, присутствующее во второй группе наноносителей, может отличаться от лекарственного средства, присутствующего в первой группе наноносителей. Иными словами, лекарственные средства, присутствующие в каждой из первой группы наноносителей, второй группы наноносителей и третьей группы наноносителей, могут отличаться. Например, лекарственное средство, присутствующее в третьей группе наноносителей, может быть одним или несколькими из противовоспалительных средств и антитромбогенных средств. Вторая группа наноносителей может включать антипролиферативное средство. А первая группа наноносителей может включать, например, средство, способствующее заживлению. Кроме того, лекарственное средство, присутствующее в одной или нескольких из первой группы наноносителей, второй группы наноносителей и третьей группы наноносителей, может быть выбрано из одного или нескольких из, но без ограничений, противоопухолевого средства, противосвертывающего средства, антифибринного средства, антитромботического средства, антимитотического средства, антибиотического средства, противоаллергического средства и антиоксиданта, эстрогенов, ингибитора протеазы, антител, иммунодепрессантных средств, цитостатического средства, цитотоксического средства, блокатора кальциевых каналов, ингибитора фосфодиэстеразы, ингибитора простагландина, пищевой добавки, витаминов, средства против агрегации тромбоцитов и генетически сконструированных эпителиальных клеток, не выходя за пределы объема данного изобретения.
[0050] Третья группа наноносителей имеет наименьший средний диаметр среди первой группы наноносителей, второй группы наноносителей и третьей группы наноносителей. Поэтому время, необходимое для высвобождения третьей группы наноносителей с гидрофильной поверхности после подхода близко к месту назначения, меньше времени, необходимого для высвобождения второй группы наноносителей и первой группы наноносителей с наружной поверхности. Таким образом, третья группа наноносителей проявляет быструю скорость высвобождения с гидрофильной поверхности. А вторая группа наноносителей и третья группа наноносителей проявляют более медленные скорости высвобождения с гидрофильной поверхности по сравнению со скоростью высвобождения третьей группы наноносителей.
[0051] Кроме того, из-за наличия одного или нескольких из биологического средства, фосфолипида и наполнителя на основе крови в двух или более наноносителях два или более наноносителей проявляют сродство к тканям места назначения. Кроме того, благодаря способности двух или более наноносителей проникать через один или несколько слоев кровеносного сосуда наноносители с наименьшим средним диаметром проникают до адвентициального слоя. Наноносители, которые проникают в адвентицию, могут оставаться в адвентициальном слое в течение продолжительного времени. Другими словами, адвентициальный слой может выступать в качестве хранилища лекарственного средства, откуда лекарственное средство медленно высвобождается с течением продолжительного времени.
[0052] Лекарственное средство, присутствующее в наноносителе из двух или более наноносителей, высвобождается только после того, как наноносители проникнут в один или несколько из слоя интимы, среднего слоя и адвентицального слоя, и после растворения инкапсулирующей среды. Таким образом достигается внутритканевое высвобождение лекарственного средства в месте назначения. Высвобождаемое таким образом лекарственное средство может диффундировать через один или несколько из адвентициального слоя, среднего слоя и слоя интимы в течение продолжительного времени. В таком случае лекарственное средство, которое диффундирует через один или несколько из адвентициального слоя, среднего слоя и слоя интимы, может обеспечивать внутритканевую диффузию лекарственного средства в течение продолжительного времени. Следовательно, в результате внутритканевого высвобождения лекарственного средства и внутритканевой диффузии лекарственного средства лекарственное средство может быть доставлено к максимальной части повреждения в месте назначения.
[0053] В еще одном варианте осуществления надувной баллон применяют для доставки лекарственного средства к месту назначения, где в кровеносном сосуде расправлен стент. В таком случае вследствие внутритканевого высвобождения и внутритканевого проникновения лекарственного средства в течение продолжительного времени минимизированы случаи замедленного заживления повреждений в месте назначения и ненадлежащего заживления повреждений в месте назначения. Таким образом можно минимизировать антитромбоцитарную терапию, которую необходимо назначать пациентам с замедленным заживлением или ненадлежащим заживлением повреждений.
[0054] В соответствии с различными вариантами осуществления два или более наноносителей могут быть нанесены на гидрофильную поверхность надувного баллона любым способом с тем, чтобы достигнуть определенной терапевтической цели, не выходя за пределы объема данного изобретения. Способы, с помощью которых можно нанести два или более наноносителей на гидрофильную поверхность, включают одно или несколько из, но без ограничений, нанесение двух или более наноносителей в виде единственного слоя на гидрофильную поверхность, нанесение двух или более наноносителей в виде двух или более слоев на гидрофильную поверхность и нанесение двух или более наноносителей с применением одного или нескольких полимеров. Кроме того, два или более наноносителей могут быть нанесены на гидрофильную поверхность надувного баллона с применением одной или нескольких техник, например, но без ограничений, напыления, покрытия погружением, покрытия ультразвуковым распылением, тонкослойного покрытия, электростатического покрытия и любого другого способа, известного в данной области техники.
[0055] Вообще говоря, в соответствии с различными вариантами осуществления данное изобретение также раскрывает способ доставки лекарственного средства к месту назначения в просвете части организма для лечения медицинского состояния, связанного с просветом части организма. Способ включает установку надувного баллона в месте назначения просвета части организма. Надувной баллон может быть установлен в месте назначения с применением комплекта катетер-баллона и способов, известных в данной области техники. После установки надувного баллона в месте назначения надувной баллон накачивают с помощью подходящего механизма для накачивания, связанного с комплектом катетер-баллона. В результате накачивания надувной баллон вступает в контакт с местом назначения и приблизительно от 30% до 80% двух или более наноносителей высвобождаются с надувного баллона в течение от 15 до 90 секунд после контакта с местом назначения. В соответствии с различными вариантами осуществления надувной баллон может быть приведен в контакт с местом назначения один или несколько раз для доставки лекарственного средства к месту назначения.
[0056] Пример 1:
[0057] Фосфолипид сои был получен от Lioid GMBH, партия №: 776114-1/906. Сиролимус был получен от Fujan Chemicals, Китай, с чистотой более 99,5%. Вода, другие используемые растворители и реактивы были степени чистоты для ВЭЖХ. Система полиамидного катетера с сополиамидным ангиопластическим баллоном COPAN (далее "баллонная система"), покрытым гидрофильным покрытием Hydraflow® (далее «гидрофильная поверхность»), была получена от Minvasys, Париж, Франция.
[0058] Фосфолипид сои (20 мг в весовом соотношении) добавили в воду степени чистоты для ВЭЖХ (20 мл) с последующим добавлением Твин 80 (5 мг) с получением водного раствора фосфолипида сои. Водный раствор фосфолипида сои (20 мл) подвергли высокоскоростной гомогенизации при 15000-20000 оборотах в минуту в течение от 20 до 25 минут в ледяной водной ванне с получением раствора А1. Полученный таким способом раствор А1 содержал наночастицы фосфолипида сои. Раствор А1 затем проанализировали на определение размера частицы с помощью прибора для определения размера Malvem ZS90 (Malvem, Великобритания). ФИГ.1 иллюстрирует распределение наночастиц фосфолипида сои по размерам при определении с помощью Malvern ZS90. Средний диаметр наночастиц фосфолипида сои, как было обнаружено, составлял 431 нм с наибольшим диаметром до 1000 нм.
[0059] Сиролимус (20 мг в весовом соотношении) добавили в 10 мл деионизированной воды с получением водного раствора сиролимуса. Водный раствор сиролимуса (10 мл) подвергли высокоскоростной гомогенизации при 15000-20000 оборотах в минуту в течение от 150 до 200 минут в ледяной водяной бане с получением раствора А2. Полученный таким способом раствор А2 содержал нанокристаллы сиролимуса.
[0060] Раствор А1 незамедлительно медленно покапельно добавили к раствору А2 в процессе высокоскоростной гомогенизации. Полученную смесь подвергли высокоскоростной гомогенизации при 15000-20000 оборотах в минуту в течение еще 20 минут после завершения добавления с получением раствора A3. Затем раствор A3 перемешивали магнитной мешалкой (нагревательная плитка, совмещенная с мешалкой, 2MLH, Accumax, Индия) в течение 20 минут. Полученный таким способом раствор A3 содержал наноносители (нанокристаллы сиролимуса, окруженные наночастицами фосфолипида сои). Раствор A3 затем проанализировали на определение размеров частицы с помощью прибора для определения размера Malvem ZS90 (Malvem, Великобритания). ФИГ.2 иллюстрирует распределение наноносителей по размерам при определении с помощью Malvem ZS90. Средние диаметры наноносителей, как было обнаружено, составляли 133,6 нм (пик 1) и 554,9 нм (пик 2) с максимальным диаметром, составляющим до 1000 нм.
[0061] Раствор A3 (водный раствор наноносителей) дополнительно подвергли экстракции дихлорметаном. Раствор A3 (20 мл) перенесли в 100 мл делительную воронку. В 100 мл делительную воронку добавили 50 мл дихлорметана. Полученную смесь встряхивали в течение 15 мин, а затем дали отстояться. После этого в 100 мл делительной воронке наблюдали два слоя, т.е. водный слой и слой дихлорметана. Слой дихлорметана отделили от водного слоя. Слой дихлорметана, т.е. раствор наноносителей, хранили в небольшой мерной колбе янтарного цвета с номером партии. Затем раствор наноносителей использовали для покрытия баллонной системы.
[0062] Раствор наноносителей (5 мл) подавали в резервуар аппарата для нанесения покрытия. Баллонную систему установили на вращающейся оправке аппарата для нанесения покрытия. Баллон баллонной системы был обращен к распылительному наконечнику аппарата для нанесения покрытия. Баллонную систему вращали со скоростью от 5 до 40 оборотов в минуту благодаря вращению оправки и одновременно на баллон распыляли раствор наноносителей при давлении инертного газа 0,5-4,0 фунтов на квадратный дюйм и 2 покачиваниях. Таким образом был получен баллон, покрытый наноносителями (далее "покрытый баллон"). Покрытую баллонную систему сняли и проверили под микроскопом с высокой разрешающей способностью на гладкость покрывающей поверхности и любые посторонние частицы. Покрытую баллонную систему затем подвергли дальнейшему анализу, как описано в примере 2 ниже.
[0063] Пример 2:
[0064] Покрытый баллон дополнительно оценивали in vivo у 17 новозеландских кроликов мужского пола в возрасте от 5 до 6 месяцев и весом от 3 до 4 кг (далее «животные») по фармакокинетическому (РК) исследованию и гистологической оценке или световой микроскопии (LM). ФИГ. 3 представляет собой таблицу, иллюстрирующую номера, присвоенные 17 животным, тип стента и местоположение стента у каждого животного и тип исследования (PK/LM), проводимого на животных. Из 17 животных 9 (животные с 66 по 74) использовали для РК исследования и 8 (животные с 75 по 82) использовали для гистологической оценки.
[0065] Покрытые баллоны вводили в обе подвздошно-бедренные артерии животных, используемых для РК исследования. Покрытые баллоны накачивали дважды в подвздошно-бедренных артериях. Покрытые баллоны сначала накачали на 70 секунд при 7 атмосферах, а затем спустили. Снова покрытые баллоны накачали во второй раз на 60 секунд при 7 атмосферах, а затем спустили и извлекли.
[0066] Предварительно установленный стент (3,0 мм × 12-14 мм), т.е. стент, установленный на покрытом баллоне, имплантировали в правую и левую подвздошные артерии животных при номинальном давлении посредством 30 секундного накачивания баллона. Соотношение баллона к стенту для всех предварительно сжатых стентов составляло примерно 1,4:1. После раскрытия стентов провели ангиографию для проверки проходимости стентов.
[0067] Цельную кровь отбирали из центра ушной раковины животных для анализа сыворотки в четырех временных точках, а именно 0,5 часа, 1 час, 3 часа и 24 часа после раскрытия стента. После эвтаназии в соответствующей временной точке ткань вокруг стента иссекали, взвешивали и замораживали мгновенной заморозкой в жидком азоте для последующего измерения. Университет Колорадо, Денвер, провел анализ лекарственного средства по цельной крови и ткани, окружающей стент. Концентрация сиролимуса в четырех временных точках, т.е. 0,5 часа, 1 час, 3 часа и 24 часа, как было установлено, составляла 9,32 нг/мл, 7,08 нг/мл, 4,09 нг/мл и 0,81 нг/мл соответственно.
[0068] Пришли к заключению, что в 1-й день, 8-й день и 14-й день фармакокинетического исследования максимальные концентрации сиролимуса в крови были замечены через 30 минут после катетеризации (9,3 нг/мл), в то время как циркулирующие уровни заметно снизились к 24 часам (0,81 нг/мл). Для уровней лекарственного средства в тканях максимальные концентрации были достигнуты в 1-й день (140,4 нг/мг), которые показали существенное снижение до 15,5 нг/мг к 8-му дню и 5,5 нг/мг к 14-му дню. Однако отдельные концентрации лекарственного средства в каждой временной точке показывают разброс среди артерий, где значения в 1-й день варьировали в диапазоне от 35,0 до 275,0 нг/мг, значения на 8-й день варьировали в диапазоне от 0,7 нг/мг до 33,2 нг/мг и значения на 14-й день варьировали в диапазоне от 14,8 нг/мг до уровней ниже пределов количественного определения [BLQ] у двух животных (животное номер 72 и 74). Для сравнения опубликованы данные, что у кролика с сиролимус-элюирующим стентом в подобные временные точки достигнуты тканевые концентрации 4,52 нг/мг и 1,56 нг/мг в 1-й день и 8-й день соответственно (FinnAV, Kolodgie FD Circulation 2005; 112:270).
[0069] Дальнейшие измерения включали гистологическое исследование микроскопических препаратов тканей вокруг стентов. Микроскопические препараты анализировали с помощью системы для микроскопии, откалиброванной в Национальном институте стандартов и технологий (IP Lab Software, Мэриленд). Измеряли площади поперечного сечения каждого микроскопического препарата, т.е. внешнюю упругую пластинку (EEL), внутреннюю упругую пластинку (IEL) и площадь просвета. Неоинтимальную толщину измеряли как расстояние между внутренней поверхностью распорки стента и границей просвета стента. Площади слоя сосуда рассчитывали, используя следующие формулы:
[0070] Площадь средней оболочки стенки кровеносного сосуда = EEL-IEL,
[0071] Площадь неоинтимы = IEL - Площадь просвета и [0072] Процент стеноза = [1-(Площадь просвета/IEL)]*100.
[0073] Все стенты, как оказалось, широко расправлялись и хорошо примыкали к стенкам сосуда. Все животные пережили прижизненную фазу исследования.
[0074] Реэндотелиализация, как оказалось, была полной для выборки и контрольной группы. Процент стеноза, как определили, составил 11,48 (±1,30%) в выборке и 11,49 (±1,49%) в контрольной группе. Неоинтимальная толщина, как обнаружили, составляла 0,030 мм (±0,0076 мм) в выборке и 0,032 (±0,0098 мм) в контрольной группе.
[0075] Внутритканевую концентрацию сиролимуса также оценивали в 1-й день, 8-й день и 14-й день. Определили, что внутритканевая концентрация сиролимуса в 1-й день, 8-й день и 14-й день составляла 140,4 нг/мг, 15,5 нг/мг и 5,5 нг/мг соответственно. Пришли к заключению, что сравнительно более высокие внутритканевые концентрации могут быть достигнуты при помощи покрытого баллона и с единственным накачиванием по сравнению с опубликованными данными об исследовании на кроликах, относящихся к сиролимус-элюирующему стенту с подобными временными точками (FinnA V, Kolodgie FD Circulation 2005; 112: 270).
[0076] Пример 3:
[0077] Для исследования были отобраны 6 бразильских свиней (далее "животные") весом приблизительно от 25 до 30 кг. Использовали металлический стент без покрытия (Cronus ®, приобретенный у Scitech, Бразилия) с размерами стента, варьирующими в пределах от 2,5*13 мм до 3,0*13 мм, и баллоны с покрытием с размерами приблизительно 3,0*15 мм. Стенты разместили в трех сосудах, т.е. LAD (левом внутреннем нисходящем), LCX (левом огибающем) и RCA (правой коронарной артерии каждого животного с помощью: а) баллона с покрытием (сиролимус), b) баллона с покрытием (паклитаксел) и с) баллона без покрытия. Баллон, покрытый паклитакселом, получили путем замены сиролимуса в примере 1 на паклитаксел, а остальной процесс остался таким же. Соотношение баллона к артерии каждого баллона с покрытием составляло примерно от 1,1:1,0 до 1,2:1,0. Как баллон с покрытием, так и баллон без покрытия накачали на 60 секунд. Животных с баллоном, покрытым сиролимусом, пометили как "сиролимус", животных с баллоном, покрытым паклитакселом, пометили как "паклитаксел" и животных с баллоном без покрытия пометили как "контроль".
[0078] Каждую группу, т.е. сиролимус, паклитаксел и контроль, исследовали в отношении качественного ОСТ анализа. Качественные параметры, которые были изучены, включали: а) пролиферацию тканей на краях стента, b) внутриполостное тромбообразование и с) распорки стента без покрытия. Было установлено, что пролиферацию тканей на краях стента обнаружили в одном контроле и двух паклитакселах, в то время как в группе сиролимуса не наблюдали случаев пролиферации тканей на краях стента. Кроме того, было обнаружено, что внутриполостное тромбообразование обнаружено в одном контроле и двух паклитакселах. В то время как в группе сиролимуса не наблюдали случаев внутриполостного тромбообразования.
[0079] Пришли к заключению, что сиролимус функционирует лучше, чем паклитаксел и баллон без покрытия в отношении сокращения неоинтимального роста и эндотелиализации. Покрытие распорки стента тканью было практически полным для всех групп. Токсическое действие обнаружили в группе паклитаксела. Токсическое действие обнаружили в группе паклитаксела из-за значительной внутритканевой концентрации паклитаксела. Однако использованная доза паклитаксела была ниже по сравнению с коммерчески доступными продуктами. Таким образом, баллоны с покрытием показали резкий перенос паклитаксела или сиролимуса при применении бесполимерного подхода.
[0080] Количественные ОСТ анализы провели на шести равноудаленных срезах внутристентовой ткани для каждого стента. Таким образом было проанализировано, в общей сложности, 108 [т.е. 6 (животных)*3 (артерии каждого)*6 (срезов ткани)] срезов внутристентовой ткани (поперечных сечений). Параметры для количественного анализа включали: а) площадь просвета, b) площадь стента, с) неоинтимальная площадь и d) процент неоинтимальной закупорки. ФИГ.4 иллюстрирует таблицу значений средних и стандартных отклонений результатов средних площадей просветов, средних площадей стентов, средних неоинтимальных площадей и средних процентов неоинтимальной закупорки для каждой группы, т.е. контроля, сиролимуса и паклитаксела. ФИГ.5 иллюстрирует таблицу значений средних и стандартных отклонений результатов медианных площадей просветов, медианных площадей стентов, медианных неоинтимальных площадей и медианного процента неоинтимальной закупорки для каждой группы. ФИГ.6 иллюстрирует таблицу значений средних и стандартных отклонений результатов минимальных площадей просветов, минимальных площадей стентов, минимальных неоинтимальных площадей и результатов минимального процента неоинтимальной закупорки для каждой группы. ФИГ.7 иллюстрирует таблицу значений средних и стандартных отклонений результатов максимальных площадей просветов, максимальных площадей стентов, максимальных неоинтимальных площадей и максимального процента неоинтимальной закупорки для каждой группы. Сделали вывод, что из набора данных 927 распорок стента только одна распорка (паклитаксел), как установлено, однозначно не была покрыта тканями. Основываясь на наблюдениях за тромбами, сделали вывод, что доза лекарственного средства паклитаксела могла быть выше, чем требовалось. Более высокая доза и в отношении тромбозного эффекта паклитаксела может быть признаком более высокого внутритканевого проникновения лекарственного средства паклитаксела. Таким образом, количество сиролимуса или паклитаксела, которое нужно нанести на баллоны с покрытием, меньше, чем количество сиролимуса или паклитаксела, загруженного на используемые в настоящее время DEB.
[0081] Различные варианты осуществления данного изобретения обеспечивают баллон, доставляющий лекарственное средство, который может эффективно доставлять лекарственное средство к месту назначения в кровеносном сосуде за короткий период, в течение которого баллон, доставляющий лекарственное средство, вступает в контакт с местом назначения. Кроме того, данное изобретение обеспечивает баллон, доставляющий лекарственное средство, который может эффективно доставлять лекарственное средство к максимальной площади поражения и обеспечивать повышенную биодоступность с оптимальным количеством лекарственного средства, загруженного на баллон, доставляющий лекарственное средство.
[0082] Специалисты данной области техники поймут, что вышепризнанные преимущества и другие преимущества, описанные в данном документе, являются лишь иллюстративными и не предназначены для полного изображения всех преимуществ различных вариантов осуществления данного изобретения.
[0083] В вышеприведенном описании изобретения были описаны определенные варианты осуществления данного изобретения. Однако рядовой специалист в данной области техники понимает, что можно сделать различные модификации и изменения, не выходя за пределы объема данного изобретения, который изложен ниже в формуле изобретения. Соответственно, описание изобретения и фигуры следует рассматривать в иллюстративном, а не ограничивающем смысле, и все подобные модификации подразумеваются как включенные в объем данного изобретения. Выгоды, преимущества, решения проблем и любой(любые) элемент(элементы), которые могут обуславливать возникновение какой-либо выгоды, преимущества или решения или делать их более явными, не должны толковаться как определяющие, необходимые или существенные признаки или элементы какого-либо или всех пунктов формулы изобретения. Данное изобретение определено исключительно приложенной формулой изобретения, включая любые поправки, внесенные во время рассмотрения этой заявки, и все эквиваленты этой формулы изобретения, которые опубликованы.