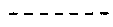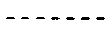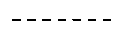Результат интеллектуальной деятельности: ПРОТИВОРАКОВЫЕ СТЕРОИДНЫЕЛАКТОНЫ, НЕНАСЫЩЕННЫЕ В ПОЛОЖЕНИИ 7(8)
Вид РИД
Изобретение
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым противораковым соединениям, содержащим их фармацевтическим композициям и их применению в качестве противораковых средств.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям с некоторым структурным сходством с буфадиенолидными соединениями, описанными в предшествующем уровне техники. Обзор буфадиенолидов см. у Huimin Gao et al. в Nat. Prod. Rep., 2011, 28, 953.
Буфадиенолидные соединения, о которых сообщалось в предшествующем уровне техники, представляют собой природные стероиды, первоначально выделенные из неземных природных источников, таких как растения семейств Crassulaceae, Hyacinthaceae, Iridaceae, Melianthaceae, Ranunculaceae и Santalaceaethe, и животных рода Bufo (жабы), Photinus (светлячки) и Rhabdophis (змеи) (Steyn et al. Nat. Prod. Rep. 1998, 15, 397-413; Krenn et al. Phytochemistry, 1998, 48(1), 1-29).
Среди этих буфадиенолидных соединений сциллирозид и другие соединения сциллы были выделены из красного морского лука, Urginea maritima, и описаны как высокотоксичные, в особенности сциллирозид, который действует на сердечно-сосудистую и центральную нервную систему, вызывая судороги и смерть (Verbiscar et al. J. Agric. Food Chem. 1986, 34, 973-979; Kopp et al. Phytochemistry, 1996, 42(2), 513-522). Majinda et al. также выделили буфадиенолидные соединения из Urginea sanguinea, которые делают это растение небезопасным для использования в качестве лекарственного растения (Planta Med. 1997, 63, 188-190).
Противовирусную активность в отношении ряда риновирусов и антигерпетическую активность некоторых буфадиенолидных соединений исследовали Kamano et al. (Chem. Pharm. Bull. 1988, 36(1), 326-332) и Takechi et al. (Phytochemistry, 1996, 41(1), 125-127), соответственно, и они обнаружили, что большинство этих соединений демонстрировало некоторую ингибирующую активность.
Кроме того, цитотоксическую активность некоторых буфадиенолидных соединений исследовало несколько авторов. В частности, Jing et al. сообщали о том, что буфалин обладает мощным ингибирующим рост раковых клеток действием при лейкозе человека (клеточные линии HL-60, ML1, U937 и K562), эпителиоидной карциноме (клеточная линия HeLa), гепатоме (клеточная линия PLC/PRF/5) и эпидермоидной карциноме (клеточная линия A431), но является менее эффективным в отношении клеточных линий лейкоза мышей M1, меланомы B16 и лимфоидной неоплазмы P388 и клеточных линий гепатомы крысы AH66 и хромаффинных клеток PC12. Они также обнаружили, что буфалин индуцирует типичный апоптоз в клеточной линии HL-60 лейкоза человека, но не в лейкоцитах человека (Jpn. J. Cancer Res. 1994, 85(6), 645-651).
Kupchan et al. описали буфадиенолидные соединения, выделенные из Bersama abyssinica, которые показали ингибирующую активность в отношении клеточной линии карциномы носоглотки человека (Bioorg. Chem. 1971, 1, 13-31; J. Org. Chem. 1971, 36(18), 2611-2616).
Kamano et al. исследовали цитотоксическую активность 80 буфадиенолидных и карденолидных соединений, выделенных из китайского лекарственного средства Ch'an Su (полученного из кожных желез жаб, таких как Bufo gargarizans), в отношении клеточной линии первичной карциномы печени PLC/PRF/5 и резистентной к колхицину PLC/PRF/5. Было показано, что 16 из них обладают мощным цитотоксическим действием (IC50<10-3 мкг/мл) в отношении клеточной линии PLC/PRF/5 (Bioorg. Med. Chem. 1998, 6, 1103-1115; J. Med. Chem. 2002, 45, 5440-5447). Дополнительные буфадиенолидные соединения были выделены Nogawa et al. из того же источника, которые были тестированы в отношении клеточных линий карциномы носоглотки человека (KB), лейкоза человека (HL-60), лейкоза мышей (MH60), аденокарциномы поджелудочной железы (BXPC3), аденокарциномы груди (MCF7), глиобластомы ЦНС (SF268), немелкоклеточного рака легких (NCIH460), карциномы толстой кишки (KM20L2) и рака предстательной железы (DU145) (J. Nat. Prod. 2001, 64, 1148-1152).
Ye et al. получили новые буфадиенолидные соединения из буфалина путем микробиологического гидроксилирования. Эти соединения были протестированы в отношении клеточных линий Bel-7402 гепатомы человека, BGC-823 рака желудка человека, HeLa карциномы шейки матки человека и HL-60 лейкоза человека, демонстрируя, что некоторые из их мощных цитотоксических эффектов сравнимы с таковыми буфалина (J. Steroid. Biochem. Mol. Biol. 2004, 91, 87-98; J. Nat. Prod. 2005, 68, 626-628).
Поскольку раковые заболевания являются ведущей причиной смерти у животных и людей, предпринимались и предпринимается ряд попыток для получения противоракового лекарственного средства, активного и безопасного для введения пациентам, страдающим раковых заболеванием. Проблемой, решаемой настоящим изобретением, является получение соединений, которые применимы при лечении раковых заболеваний.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
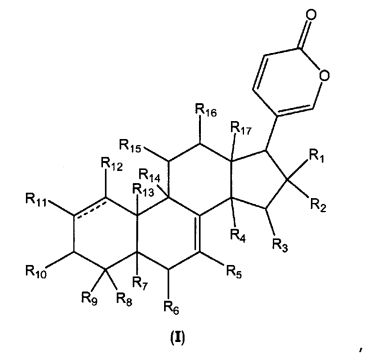
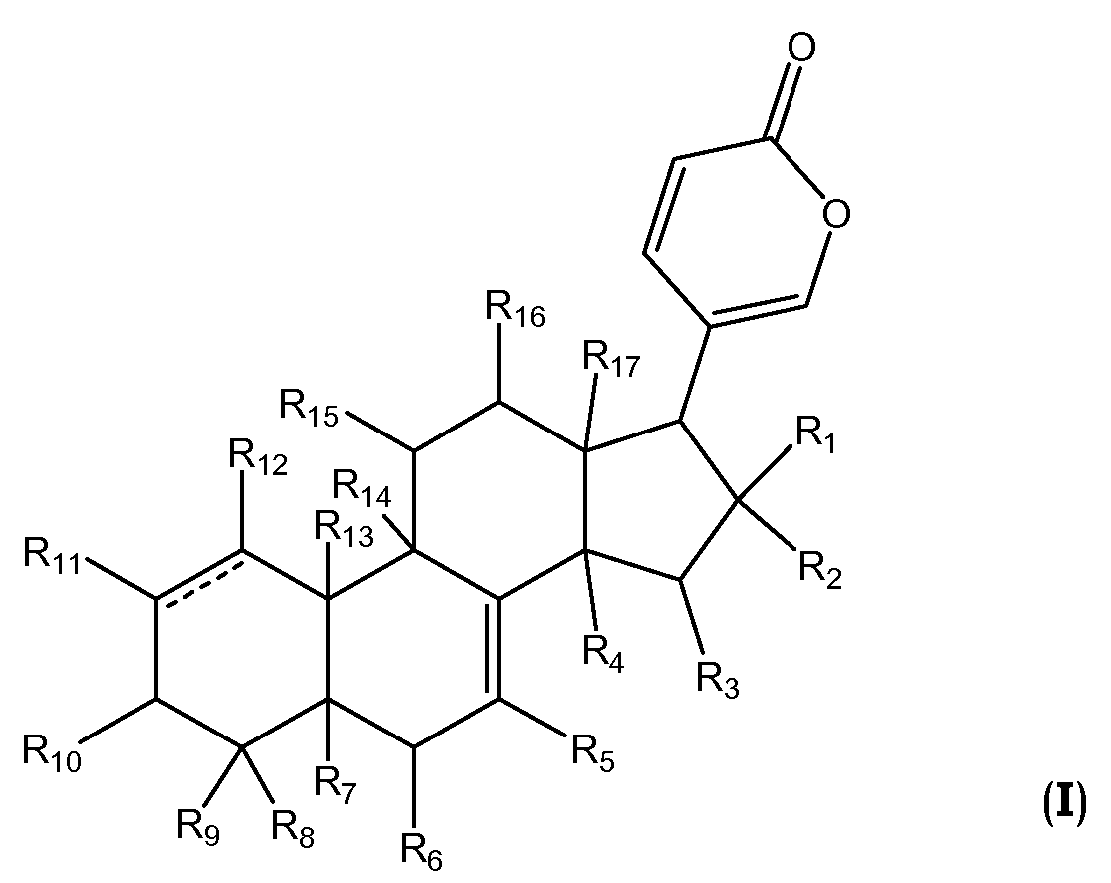
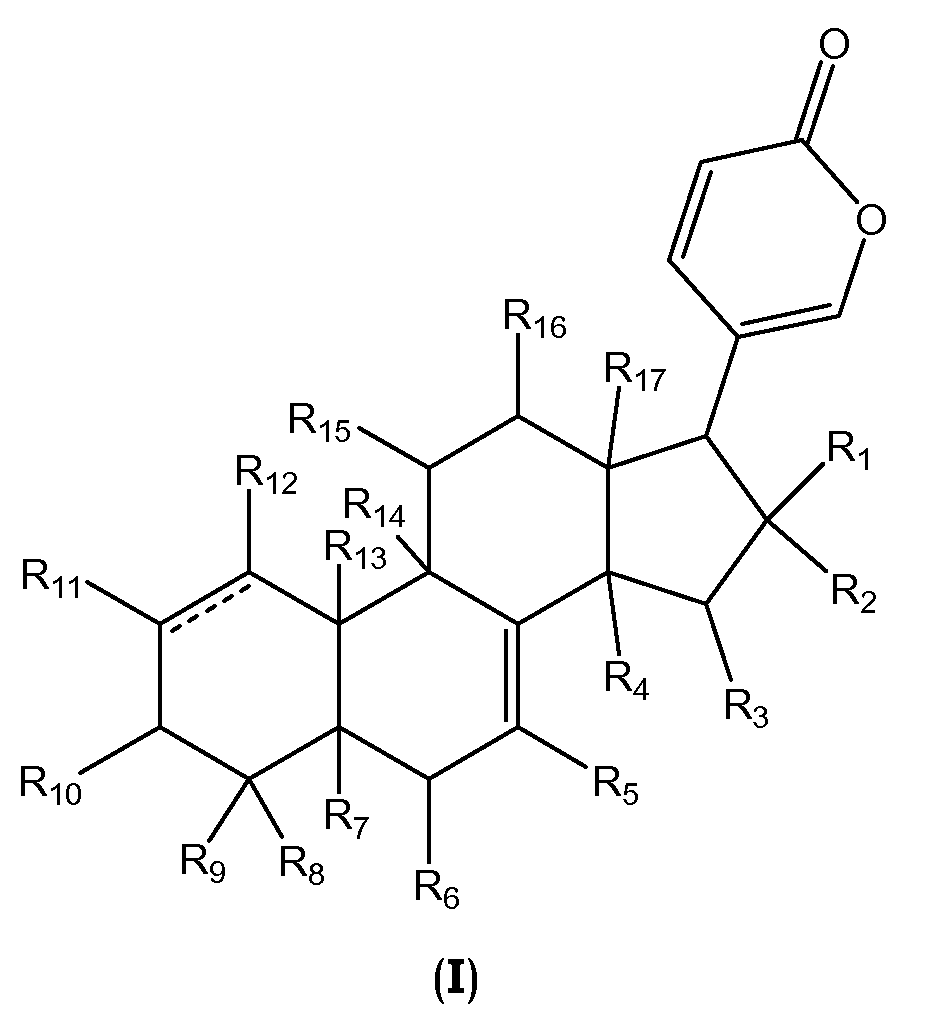
В одном аспекте настоящее изобретение относится к соединениям общей формулы I или их фармацевтически приемлемым солям, пролекарствам или стереоизомерам
 ,
,
где
каждый R1 и R2 независимо выбран из водорода, галогена, ORa, OCORa и OCOORa, или R1 и R2 вместе представляют собой =O;
каждый R3, R15 и R16 независимо выбран из водорода, ORa, OCORa, OCOORa и =O, при условии, что когда существует =O группа, водород у атома углерода, к которому присоединен =O, отсутствует;
каждый R4, R5, R6, R7, R11, R12 и R14 независимо выбран из водорода, ORa, OCORa и OCOORa;
каждый R8, R9 и R17 независимо выбран из водорода, ORa, OCORa, OCOORa, замещенного или незамещенного C1-C12 алкила, замещенного или незамещенного C2-C12 алкенила, и замещенного или незамещенного C2-C12 алкинила;
R10 выбран из водорода, ORb, OCORa, OCOORa и =O, при условии, что когда существует группа =O, водород у атома углерода, к которому присоединен =O, отсутствует;
R13 выбран из водорода, CORa, замещенного или незамещенного C1-C12 алкила, замещенного или незамещенного C2-C12 алкенила, и замещенного или незамещенного C2-C12 алкинила;
каждый Ra независимо выбран из водорода, замещенного или незамещенного C1-C12 алкила, замещенного или незамещенного C2-C12 алкенила, замещенного или незамещенного C2-C12 алкинила, замещенного или незамещенного арила, и замещенной или незамещенной гетероциклической группы;
каждый Rb независимо выбран из водорода, замещенного или незамещенного C1-C12 алкила, замещенного или незамещенного C2-C12 алкенила, замещенного или незамещенного C2-C12 алкинила, замещенного или незамещенного арила, замещенной или незамещенной гетероциклической группы, и замещенного или незамещенного сахара; и
линия ------- представляет дополнительную связь, эпокси группу или отсутствует.
В другом аспекте, настоящее изобретение относится к соединению формулы I, или его фармацевтически приемлемой соли, пролекарству или стереоизомеру, для применения в качестве лекарственного средства, в частности, в качестве лекарственного средства для лечения раковых заболеваний.
Еще в одном аспекте, настоящее изобретение также относится к применению соединения формулы I, или его фармацевтически приемлемой соли, пролекарства или стереоизомера, при лечении раковых заболеваний или при получении лекарственного средства предпочтительно для лечения раковых заболеваний. Другими аспектами настоящего изобретения являются способы лечения и соединения для использования в этих способах. Таким образом, настоящее изобретение дополнительно относится к способу лечения любого млекопитающего, в частности, человека, страдающего раковым заболеванием, включающему введение указанному больному индивидууму терапевтически эффективного количества соединения, как определено выше.
Еще в одном аспекте настоящее изобретение также относится к соединению формулы I, или его фармацевтически приемлемой соли, пролекарству или стереоизомеру, для применения в качестве противоракового средства.
В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим соединение формулы I, или его фармацевтически приемлемой соли, пролекарству или стереоизомеру, вместе с фармацевтически приемлемым носителем или разбавителем.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям общей формулы I, определенной выше.
В этих соединениях группы могут быть выбраны в соответствии со следующими рекомендациями:
Алкильные группы могут быть разветвленными или неразветвленными, и предпочтительно имеют от 1 примерно до 12 атомов углерода. Один более предпочтительный класс алкильных групп имеет от 1 примерно до 6 атомов углерода. Еще более предпочтительными являются алкильные группы, имеющие 1, 2, 3 или 4 атомов углерода. Метил, этил, н-пропил, изопропил и бутил, в том числе, н-бутил, трет-бутил, втор-бутил и изобутил представляют собой особенно предпочтительные алкильные группы в соединениях по настоящему изобретению. В контексте настоящего изобретения термин «алкил», если не указано иное, относится как к циклическим, так и к нециклическим группам, хотя циклические группы будут содержать по меньшей мере три углеродных члена в кольце.
Предпочтительные алкенильные и алкинильные группы в соединениях по настоящему изобретению могут быть разветвленными или неразветвленными, иметь одну или несколько ненасыщенных связей и от 2 примерно до 12 атомов углерода. Один более предпочтительный класс алкенильных и алкинильных групп имеет от 2 примерно до 6 атомов углерода. Еще более предпочтительными являются алкенильные и алкинильные группы, имеющие 2, 3 или 4 атома углерода. Термины «алкенил» и «алкинил» в контексте настоящего изобретения относятся как циклическим, так и к нециклическим группам, хотя циклические группы будут содержать по меньшей мере три углеродных члена в кольце.
Подходящие арильные группы в соединениях по настоящему изобретению включают соединения с одним или множеством колец, в том числе соединения со множеством колец, которые содержат отдельные и/или конденсированные арильные группы. Характерные арильные группы содержат от 1 до 3 отдельных или конденсированных колец и от 6 примерно до 18 атомов углерода в кольце. Предпочтительно арильные группы содержат от 6 примерно до 10 атомов углерода в кольце. Особенно предпочтительные арильные группы включают замещенный или незамещенный фенил, замещенный или незамещенный нафтил, замещенный или незамещенный бифенил, замещенный или незамещенный фенантрил, и замещенный или незамещенный антрил.
Подходящие гетероциклические группы включают гетероароматические и гетероалициклические группы, содержащие от 1 до 3 отдельных и/или конденсированных колец и от 5 примерно до 18 атомов кольца. Предпочтительно гетероароматические и гетероалициклические группы содержат от 5 примерно до 10 атомов кольца. Подходящие гетероароматические группы в соединениях по настоящему изобретению содержат один, два или три гетероатома, выбранных из атомов N, O или S, и включают, например, кумаринил, в том числе, 8-кумаринил, хинолил, в том числе, 8-хинолил, изохинолил, пиридил, пиразинил, пиразолил, пиримидинил, фурил, пирролил, тиенил, тиазолил, изотиазолил, триазолил, тетразолил, изоксазолил, оксазолил, имидазолил, индолил, изоиндолил, индазолил, индолизинил, фталазинил, птеридинил, пуринил, оксадиазолил, тиадиазолил, фуразанил, пиридазинил, триазинил, циннолинил, бензимидазолил, бензофуранил, бензофуразанил, бензотиенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридил. Подходящие гетероалициклические группы в соединениях по настоящему изобретению содержат один, два или три гетероатома, выбранных из атомов N, O или S, и включают, например, пирролидинил, тетрагидрофурил, дигидрофурил, тетрагидротиенил, тетрагидротиопиранил, пиперидил, морфолинил, тиоморфолинил, тиоксанил, пиперазинил, азетидинил, оксетанил, тиэтанил, гомопиперидил, оксепарил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6-тетрагидропиридил, 2-пирролинил, 3-пирролинил, индолинил, 2H-пиранил, 4H-пиранил, диоксоланил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, пиразолидинил, имидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексил, 3-азабицикло[4.1.0]гептил, 3H-индолил и хинолизинил.
Термин «сахар» включает моносахариды, дисахариды, трисахариды, полисахариды, олигосахариды и производные сахаридов. Предпочтительно, сахарид выбран из рамнозы, глюкозы, дигитоксозы, дигиталозы, диггинозы, сарментозы, валларозы и фруктозы. Их производные, в том числе гликозиды сахаров, N-гликозиламины, O-ацильные производные, O-метильные производные, сахарные спирты, сахарные кислоты, дезоксисахара и родственные им группы, также являются предпочтительными сахарными группами.
Подходящие галогеновые группы в соединениях по настоящему изобретению включают F, Cl, Br и I.
Группы, указанные выше, могут быть замещены в одном или нескольких доступных положениях одной или несколькими подходящими группами, такими как OR', =O, SR', SOR', SO2R', NO2, NHR', N(R')2, =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCON(R')2, CONHR', CON(R')2, замещенный или незамещенный C1-C12 алкил, замещенный или незамещенный C2-C12 алкенил, замещенный или незамещенный C2-C12 алкинил, замещенный или незамещенный арил, и замещенная или незамещенная гетероциклическая группа, где каждая из R' групп независимо выбрана из группы, состоящей из водорода, OH, NO2, NH2, SH, CN, галогена, COH, СОалкила, COOH, замещенного или незамещенного C1-C12 алкила, замещенного или незамещенного C2-C12 алкенила, замещенного или незамещенного C2-C12 алкинила, замещенного или незамещенного арила, и замещенной или незамещенной гетероциклической группы. В тех случаях, когда эти группы сами являются замещенными, заместители могут быть выбраны из указанного выше списка.
Термин «фармацевтически приемлемые соли и пролекарства» относится к любой фармацевтически приемлемой соли, сложному эфиру, сольвату, гидрату или любому другому соединению, которое при введении пациенту способно обеспечивать (прямо или опосредованно) описанное здесь соединение. Однако будет понятно, что нефармацевтически приемлемые соли также входят в объем настоящего изобретения, поскольку могут быть применимы при получении фармацевтически приемлемых солей. Получение солей и пролекарств может осуществляться способами, известными из уровня техники.
Например, фармацевтически приемлемые соли соединений, представленных в настоящей заявке, синтезируют из исходного соединения, которое содержит основную или кислотную часть молекулы, с помощью общепринятых химических способов. В основном такие соли получают, например, реакцией этих соединений в форме свободной кислоты или основания со стехиометрическим количеством соответствующего основания или кислоты в воде или органическом растворителе или в смеси того и другого. В основном, предпочтительными являются неводные среды, такие как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил. Примеры кислотно-аддитивных солей включают минеральные кислотно-аддитивные соли, например, такие как, гидрохлорид, гидробромид, гидройодид, сульфат, нитрат, фосфат и органические кислотно-аддитивные соли, например, такие как ацетат, трифторацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, соль миндальной кислоты, метансульфонат и п-толуолсульфонат. Примеры щелочных аддитивных солей включают неорганические соли, например, такие как соли натрия, калия, кальция и аммония, и органические щелочные соли, например, такие как этилендиамин, этаноламин, N,N-диалкиленэтаноламин, триэтаноламин и соли основных аминокислот.
Соединения по настоящему изобретению могут находиться в кристаллической форме либо в виде свободных соединений, либо в виде сольватов (например, гидратов) и надо понимать, что обе формы входят в объем настоящего изобретения. Способы сольватации в основном известны из уровня техники.
Любое соединение, которое является пролекарством соединения формулы I, входит в объем настоящего изобретения. Термин «пролекарство» используется в самом широком смысле и охватывает те производные, которые превращаются in vivo в соединения по изобретению. Примеры пролекарств включают, но не ограничиваются, производные и метаболиты соединений формулы I или II, которые включают биогидролизуемые функциональные группы, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые аналоги фосфатов. Предпочтительно, пролекарства соединений с карбоксильными функциональными группами представляют собой сложные эфиры низших алкилов карбоновой кислоты. Сложные эфиры карбоксилатов обычно образуются посредством этерификации любой из групп карбоновых кислот, присутствующих в молекуле. Пролекарства обычно могут быть получены с использованием хорошо известных способов, таких, которые описаны Burger “Medicinal Chemistry and Drug Discovery 6th ed. (Donald J. Abraham ed., 2001, Wiley) и “Design and Applications of Prodrugs” (H. Bundgaard ed., 1985, Harwood Academic Publishers).
Любое соединение, на которое дается ссылка в настоящей заявке, предназначено представлять такое конкретное соединение, а также некоторые варианты или формы. В частности, соединения, на которые имеется ссылка в настоящей заявке, могут иметь асимметричные центры и, следовательно, существовать в различных энантиомерных или диастереоизомерных формах. Таким образом, любое указанное соединение, на которое дается ссылка в настоящей заявке, предназначено представлять любой из рацематов, одну или более энантиомерных форм, одну или более диастереомерных форм и их смеси. Подобным образом, также возможна пространственная изомерия или геометрическая изомерия вокруг двойной связи, следовательно, в некоторых случаях, молекула могла существовать в виде (E)-изомера или (Z)-изомера (транс и цис изомеры). Если молекула содержит несколько двойных связей, каждая двойная связь будет иметь свою собственную пространственную изомерию, которая могла бы быть такой же как пространственная изомерия других двойных связей в молекуле, или отличной от нее. Кроме того, соединения, на которые дается ссылка в настоящей заявке, могут существовать в виде атропоизомеров. Все стереоизомеры, включая энантиомеры, диастереоизомеры, геометрические изомеры и атропоизомеры соединений, на которые дается ссылка в настоящей заявке, и их смеси, рассматриваются в объеме настоящего изобретения.
Кроме того, любое соединение, на которое дается ссылка в настоящей заявке, может существовать в меченных изотопами формах, т.е. в форме соединений, которые отличаются наличием одного или нескольких изотопно-обогащенных атомов. Например, соединения, имеющие представленные структуры, за исключением замены по меньшей мере одного атома водорода дейтерием или тритием, или замены по меньшей мере одного атома углерода 13C- или 14C-обогащенным углеродом, или замену по меньшей мере одного атома азота 15N-обогащенным азотом, входят в объем настоящего изобретения.
Для предоставления более точного описания, некоторые из количественных выражений, данных в настоящей заявке, не определяются термином «примерно». Понятно, что используется ли термин «примерно» явным образом, или нет, подразумевается, что каждое количество, приведенное в настоящей заявке, относится к фактической заданной величине, и также подразумевается, что оно относится к приближению к такой заданной величине, которую было бы разумно получить на основании сведений из уровня техники, включая эквиваленты и аппроксимации вследствие экспериментальных условий и/или условий измерения для такой заданной величины.
В соединениях общей формулы I, каждый R1 и R2 предпочтительно и независимо выбран из водорода, галогена, ORa, и OCORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе, н-бутил, трет-бутил, втор-бутил и изобутил. Более предпочтительно, R1 и R2 каждый независимо выбран из водорода и галогена, наиболее предпочтительным галогеном является Cl.
Особенно предпочтительные R3, R5, R6, R14 и R15 каждый независимо выбран из водорода, ORa, и OCORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе н-бутил, трет-бутил, втор-бутил и изобутил. Более предпочтительно, R3, R5, R6, R14 и R15 представляют собой галоген.
R4 предпочтительно выбран из водорода и ORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе н-бутил, трет-бутил, втор-бутил и изобутил. Более предпочтительно, R4 представляет собой ORa и Ra представляет собой водород.
R7 предпочтительно выбран из водорода, ORa, и OCORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе, н-бутил, трет-бутил, втор-бутил и изобутил. Более предпочтительно, R7 представляет собой водород.
Особенно предпочтительные R8 и R9 каждый независимо выбран из водорода, замещенного или незамещенного C1-C12 алкила, ORa, и OCORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе, н-бутил, трет-бутил, втор-бутил и изобутил. Более предпочтительно, R8 и R9 каждый представляет собой замещенный или незамещенный C1-C6 алкил; и еще более предпочтительными являются метил, этил, н-пропил, изопропил и бутил, в том числе, н-бутил, трет-бутил, втор-бутил и изобутил; наиболее предпочтительным является метил.
R10 предпочтительно выбран из ORb, OCORa и =O, при условии, что когда R10 представляет собой =O, водород у С атома, к которому R10 присоединен, отсутствует, и где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила и Rb выбран из водорода, замещенного или незамещенного C1-C12 алкила, и замещенного или незамещенного сахара. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе, н-бутил, трет-бутил, втор-бутил и изобутил. Особенно предпочтительным Rb является водород, замещенный или незамещенный C1-C6 алкил, моносахарид, дисахарид и трисахарид; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, втор-бутил, изобутил, рамноза, глюкоза, дигитоксоза, дигиталоза, дигиноза, сарментоза, валлароза и фруктоза. Более предпочтительно, R10 представляет собой =O или ORb, где Rb представляет собой метил.
В одном предпочтительном классе соединений по настоящему изобретению, в которых отсутствует линия ------, особенно предпочтительные R11 и R12 каждый независимо выбран из водорода, ORa и OCORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе н-бутил, трет-бутил, втор-бутил и изобутил.
В другом предпочтительном классе соединений по настоящему изобретению, в которых присутствует либо дополнительная связь, либо эпокси группа в месте, указанном линией -------, особенно предпочтительные R11 и R12 представляют собой водород.
R13 предпочтительно выбран из водорода, замещенного или незамещенного C1-C12 алкила, и CORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе н-бутил, трет-бутил, втор-бутил и изобутил. Более предпочтительно, R13 представляет собой замещенный или незамещенный C1-C6 алкил и CORa, где Ra представляет собой водород и замещенный или незамещенный C1-C6 алкил. Еще более предпочтительным R13 является замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный пропил, и CORa, где Ra представляет собой водород. Предпочтительными заместителями метила, этила и пропила являются OR', где R' представляет собой водород или СОалкил, наиболее предпочтительным R' является водород.
R16 предпочтительно выбран из водорода, ORa, и OCORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе н-бутил, трет-бутил, втор-бутил и изобутил. Более предпочтительно, R16 представляет собой водород или ORa, где Ra представляет собой водород.
Особенно предпочтительным R17 является замещенный или незамещенный C1-C12 алкил. Более предпочтительно, замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является метил, этил, н-пропил, изопропил и бутил, в том числе, н-бутил, трет-бутил, втор-бутил и изобутил. Наиболее предпочтительным R17 является метил.
Особенно предпочтительным является присутствие дополнительной связи или эпокси группы в месте, указанном линией -------.
Более конкретно, настоящее изобретение относится к соединениям общей формулы II или их фармацевтически приемлемым солям, пролекарствам или стереоизомерам
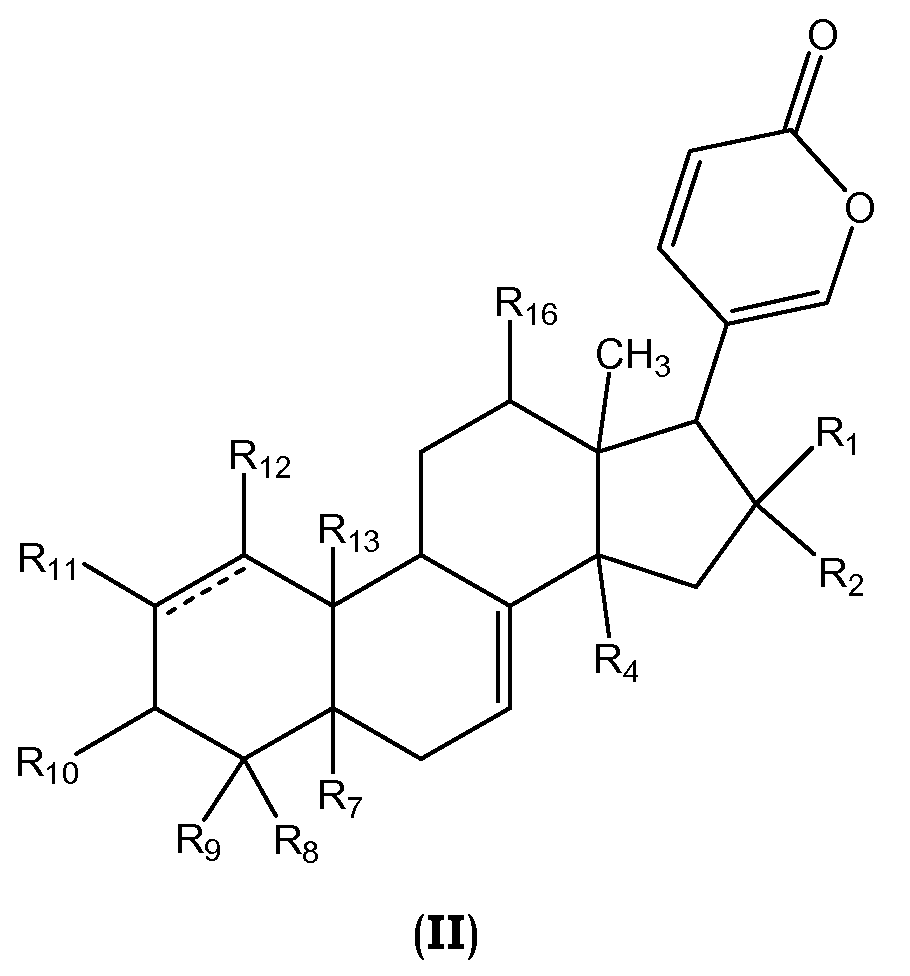 ,
,
где R1, R2, R4, R7, R8-R13, R16 и линия ------- имеют те же значения, которые даны выше.
Особенно предпочтительной стереохимией указанных соединений общей формулы II является следующая:
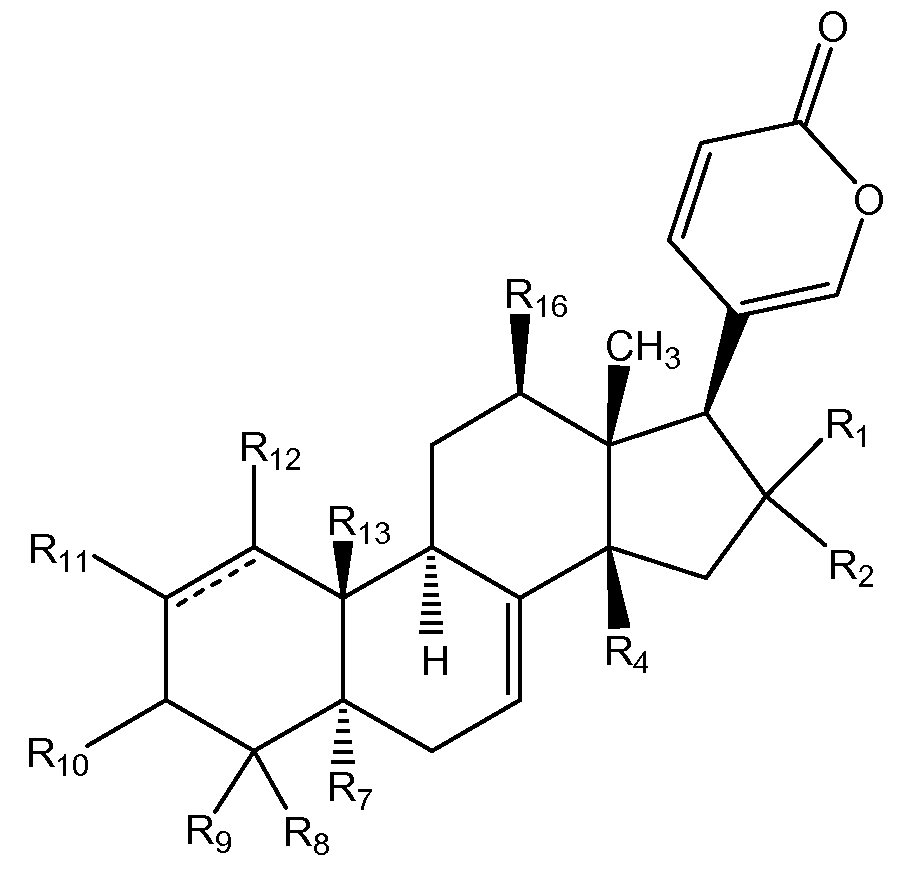
В соединениях общей формулы II каждый R1 и R2 предпочтительно и независимо выбран из водорода, галогена, ORa, и OCORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе, н-бутил, трет-бутил, втор-бутил и изобутил. Более предпочтительно, R1 и R2 каждый независимо выбран из водорода и галогена, наиболее предпочтительным галогеном является Cl.
R4 предпочтительно выбран из водорода и ORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе, н-бутил, трет-бутил, втор-бутил и изобутил. Более предпочтительно, R4 представляет собой ORa и Ra представляет собой водород.
R7 предпочтительно выбран из водорода, ORa и OCORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе н-бутил, трет-бутил, втор-бутил и изобутил. Более предпочтительно, R7 представляет собой водород.
Особенно предпочтительные R8 и R9 каждый независимо выбран из водорода, замещенного или незамещенного C1-C12 алкила, ORa и OCORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе н-бутил, трет-бутил, втор-бутил и изобутил. Более предпочтительно, R8 и R9 каждый представляют собой замещенный или незамещенный C1-C6 алкил; и еще более предпочтительными являются метил, этил, н-пропил, изопропил и бутил, в том числе н-бутил, трет-бутил, втор-бутил и изобутил; наиболее предпочтительным является метил.
R10 предпочтительно выбран из ORb, и OCORa и =O, при условии, что когда R10 представляет собой =O, водород у С атома, к которому R10 присоединен, отсутствует, и где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила и Rb выбран из водорода, замещенного или незамещенного C1-C12 алкила, и замещенного или незамещенного сахара. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе н-бутил, трет-бутил, втор-бутил и изобутил. Особенно предпочтительным Rb является водород, замещенный или незамещенный C1-C6 алкил, моносахарид, дисахарид, и трисахарид; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, втор-бутил, изобутил, рамноза, глюкоза, дигитоксоза, дигиталоза, дигиноза, сарментоза, валароза и фруктоза. Более предпочтительно, R10 представляет собой =O или ORb, где Rb представляет собой метил.
В одном предпочтительном классе соединений по настоящему изобретению, где линия ------- отсутствует, особенно предпочтительные R11 и R12 каждый независимо выбран из водорода, ORa и OCORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе, н-бутил, трет-бутил, втор-бутил и изобутил.
В другом предпочтительном классе соединений по настоящему изобретению, в которых либо дополнительная связь, либо эпокси группа присутствует на месте, указанном линией -------, особенно предпочтительные R11 и R12 представляют собой водород.
R13 предпочтительно выбран из водорода, замещенного или незамещенного C1-C12 алкила, и CORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе н-бутил, трет-бутил, втор-бутил и изобутил. Более предпочтительно, R13 представляет собой замещенный или незамещенный C1-C6 алкил и CORa, где Ra представляет собой водород и замещенный или незамещенный C1-C6 алкил. Еще более предпочтительным R13 является замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный пропил, и CORa, где Ra представляет собой водород. Предпочтительными заместителями метила, этила и пропила являются OR', где R' является водород, или СОалкил, наиболее предпочтительным R' является водород.
R16 предпочтительно выбран из водорода, ORa и OCORa, где Ra выбран из водорода и замещенного или незамещенного C1-C12 алкила. Особенно предпочтительным Ra является водород и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительным является водород, метил, этил, н-пропил, изопропил и бутил, в том числе н-бутил, трет-бутил, втор-бутил и изобутил. Более предпочтительно, R16 представляет собой водород или ORa, где Ra представляет собой водород.
Особенно предпочтительным является наличие дополнительной связи или эпокси группы на месте, указанном линией -------.
В настоящем описании и определениях, в тех случаях, когда несколько заместителей Ra присутствует в соединениях по настоящему изобретению, и если это не указано однозначно, должно быть понятно, что они могут быть, каждый независимо, различными в пределах данного определения, т.е. Ra не представляет обязательно одну и ту же группу одновременно в данном соединении по настоящему изобретению.
В предыдущих абзацах определены предпочтительные варианты для групп заместителей с R1 по R17 и пунктирной линии. Также должно быть понятно, что различные сочетания этих предпочтительных вариантов также являются предпочтительными в пределах соединений по настоящему изобретению.
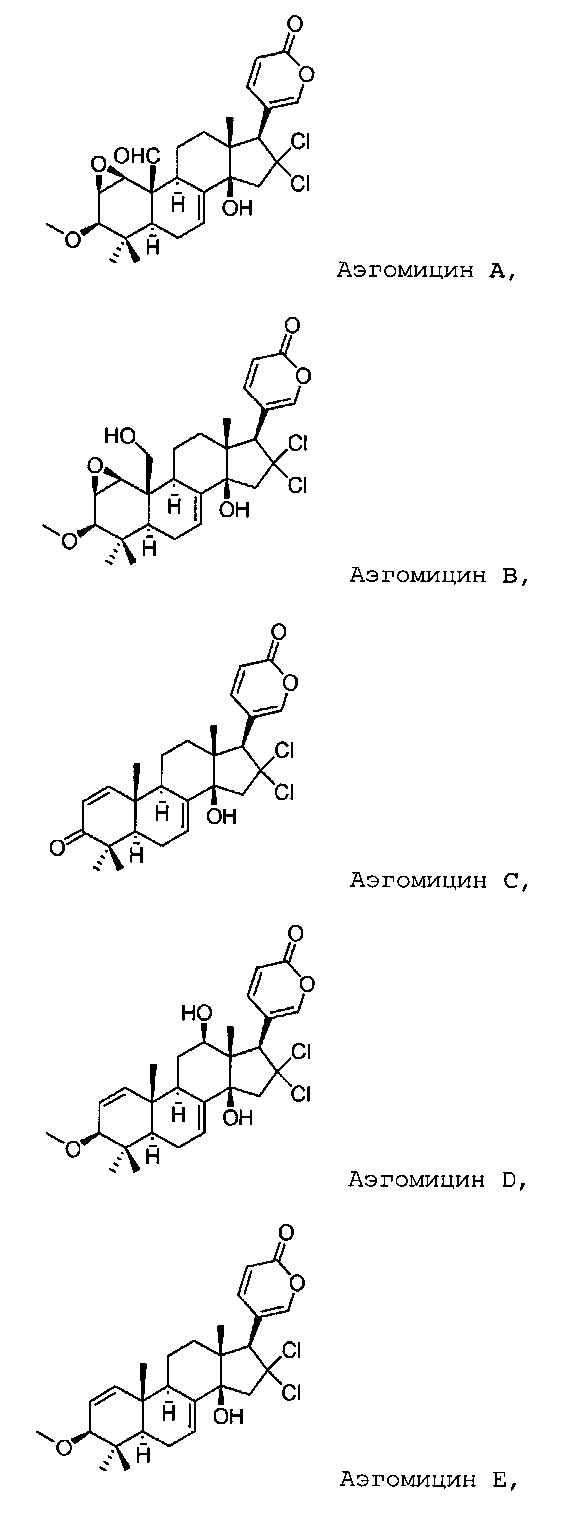
Особенно предпочтительными соединениями по настоящему изобретению являются следующие:
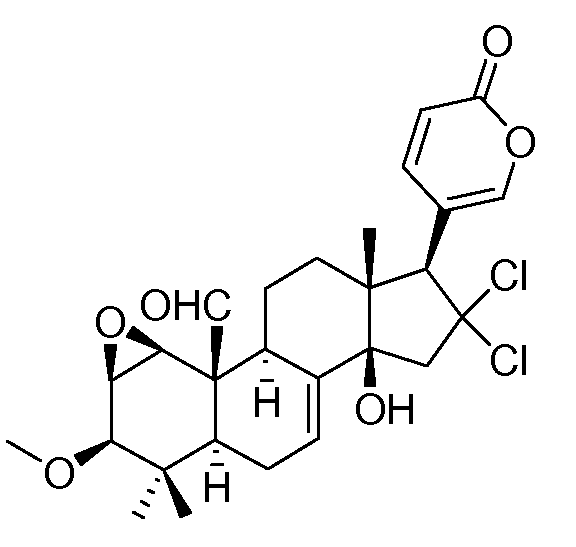 Аэгомицин A
Аэгомицин A
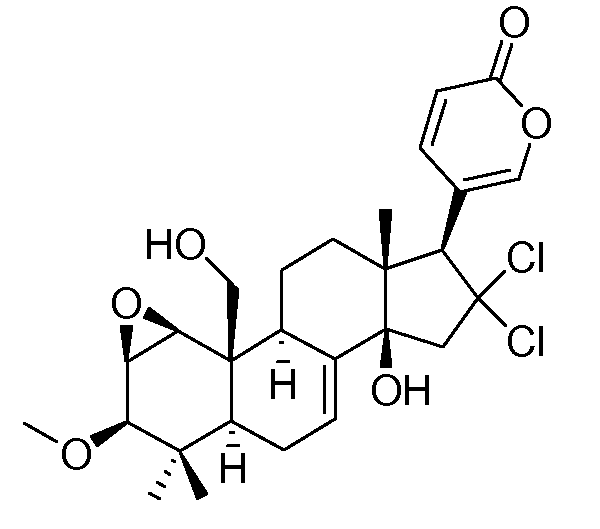 Аэгомицин B
Аэгомицин B
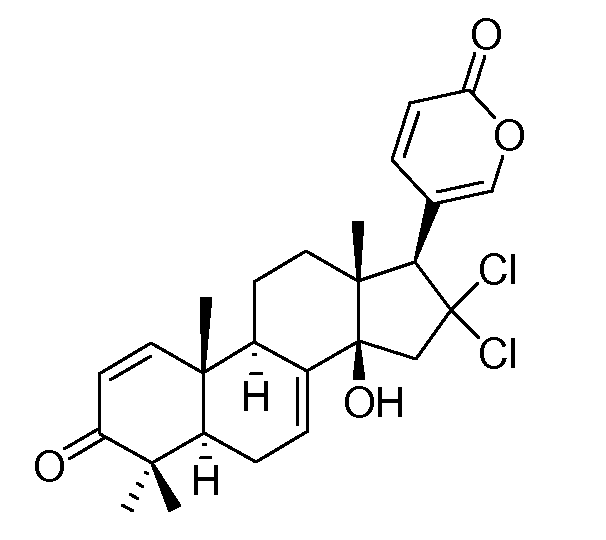 Аэгомицин C
Аэгомицин C
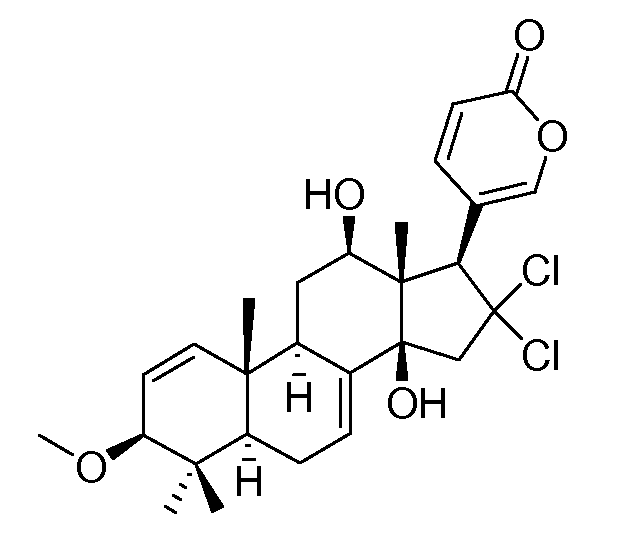 Аэгомицин D
Аэгомицин D
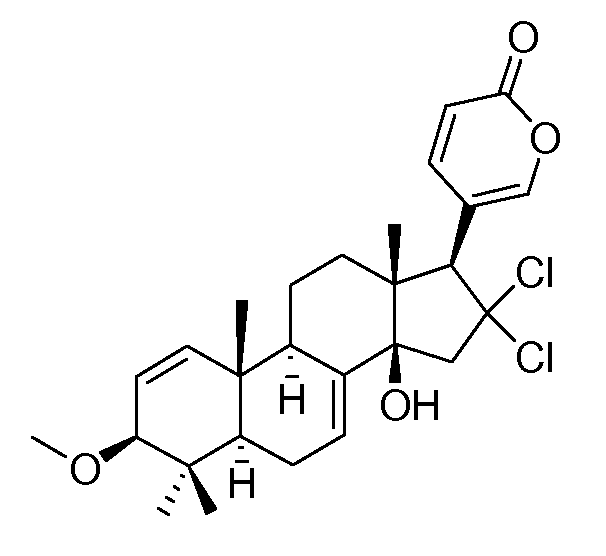 Аэгомицин E
Аэгомицин E
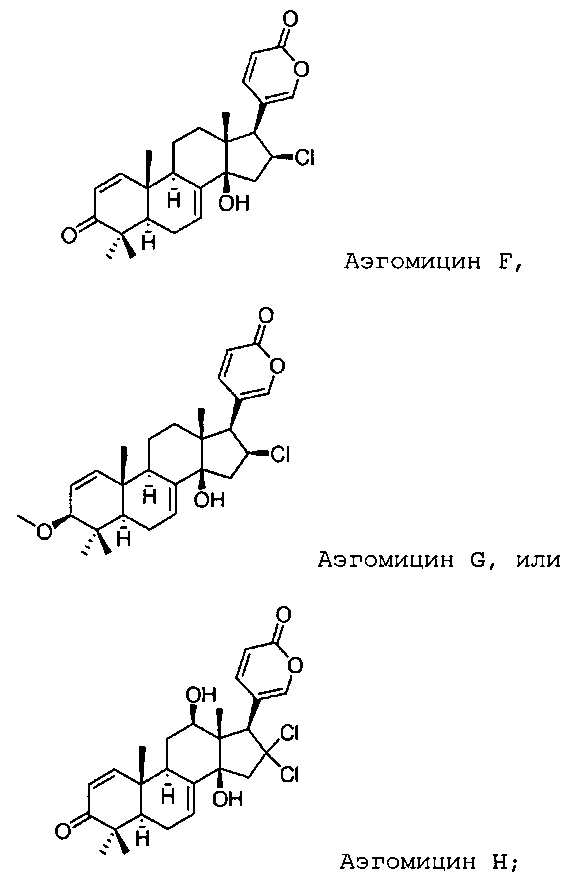
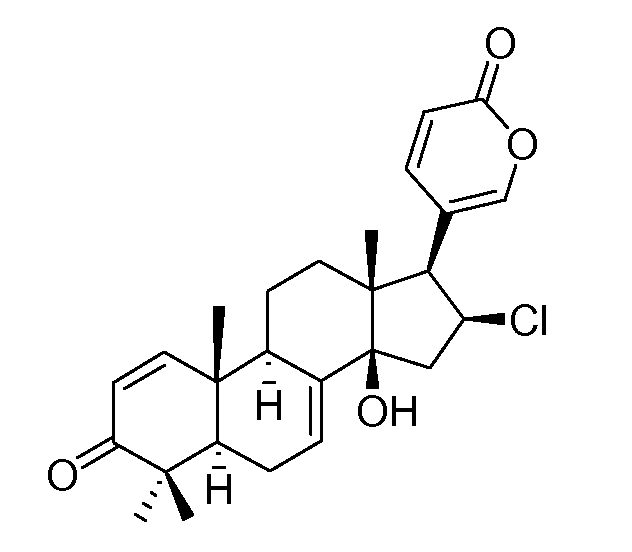 Аэгомицин F
Аэгомицин F
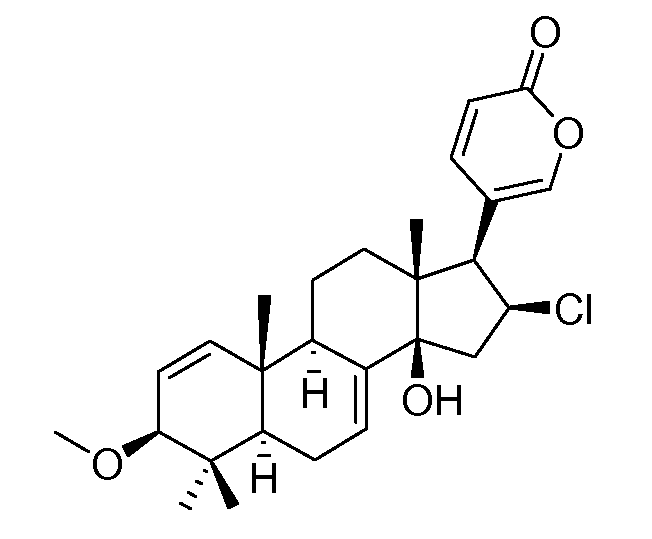 Аэгомицин G
Аэгомицин G
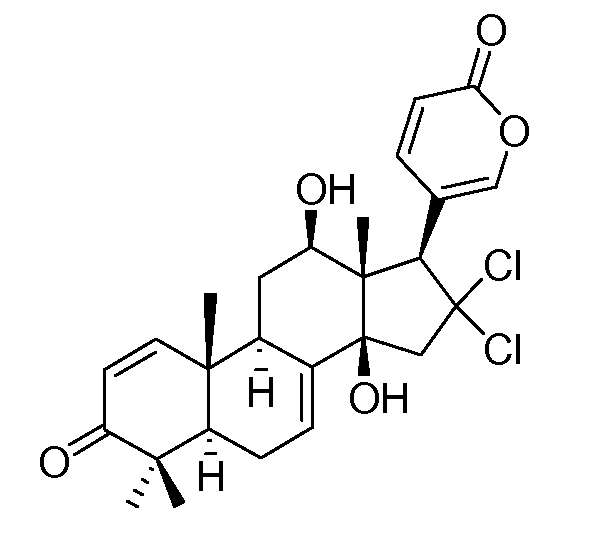 Аэгомицин H
Аэгомицин H
или их фармацевтически приемлемые соли, пролекарства или стереоизомеры.
Стереохимия, указанная здесь для Аэгомицинов A-H, является соответствующей.
Аэгомицины A-H были выделены из губок семейства Mycalidae, рода Mycale, подрода Aegogropila, видов Mycale (Aegogropila) crassissima (Dendy, 1905). Образец Mycale (Aegogropila) crassissima (Dendy, 1905) был депонирован в Институте морских наук и лимнологии Universidad Nacional Autónoma of Mexico, с кодом доступа MFIA-399. Эту губку собирали руками посредством подводного плавания с аквалангом на острове Мафия (07° 39.558' S/39° 55.043' E) на глубине между 5 и 31,4 м.
Описание губки представляет собой следующее: рассмотренные образцы были тонко корковыми, растущими на скалах. Цвет живых образцов был коричневым, хотя они также были описаны как оранжевые или цвета охры. В дополнение, описание спикулы: мегасклеры были прямыми субтилостилями, часто с едва уловимой омозолелостью, и обычно слегка согнуты в середине. Их средняя длина была около 270 мкм, ширина стержня - около 4,6 мкм и ширина омозолелости - около 4,8 мкм. Включенные микросклеры пальчатые анизохелы (три класса по размерам: анизохела 1 - в среднем примерно 36 мкм, анизохела 2 - в среднем, примерно 27 мкм и анизохела 3 - в среднем примерно 11 мкм), сигмы (один класс: прочная сигма около 57 мкм в среднем), и рафиды (очень редко встречающиеся). Скелетные расположения: пучки субтилостилей подняты кнаружи от базальной пластинки и заканчиваются на поверхности в небольшие пучки или кисти. Эктосома имела хорошо развитое сетчатое строение пучков микалостилей и микросклер, разбросанных случайным образом и в хоаносоме и в эктосоме. Анизохелы не образуют розетки. Mycale crassissima широко распространена в месте сбора образцов на острове Мафия и была также найдена в Момбасе, Занзибаре, Мадагаскаре, Цейлоне, и Арафурском море, на скалах и коралловых рифах на глубине от 1 до 60 м.
Дополнительно, соединения по настоящему изобретению могут быть получены путем синтеза, следуя обычным методикам в синтетической органической химии, и уже известным специалистам в данной области. Например, соединения по настоящему изобретению могут быть получены, применяя методики, описанные в литературе, например, у Steyn et al. Nat. Prod. Rep. 1998, 15, 397-413; Huimin Gao et al в Nat. Prod. Rep., 2011, 28, 953; WO 01/79256; WO 2006/120472; и CA 2.418.458. Пути синтеза могут использовать комбинацию стадий, взятых более чем из одной из этих ссылок.
Подобным образом, природные, синтетические или уже модифицированные соединения по настоящему изобретению могут быть дополнительно модифицированы посредством целого ряда химических реакций для получения дополнительных соединений по настоящему изобретению. Таким образом, гидроксильные группы могут быть ацилированы посредством стандартных методик соединения или ацилирования, например, используя уксусную кислоту или уксусный ангидрид в пиридине, или подобное. Формиатные группы могут быть получены путем нагревания гидроксильных предшественников в муравьиной кислоте. Гидрокси группы также могут быть окислены до оксо (=O), например, путем использования диоксида марганца или хрома, или превращены в амино-низший алкокси, например, с использованием защищенного 2-бромэтиламина. Карбокси группы могут быть алкилированы, например, метилированы путем обработки диазометаном. Гликозидные функциональные группы могут быть введены посредством стандартных реакций соединения сахаров.
Важной особенностью описанных выше соединений формулы I и II является их биологическая активность и, в частности, их цитотоксическая активность.
Настоящее изобретение представляет новые фармацевтические композиции соединений общей формулы I и II, которые обладают цитотоксической активностью, и их применение в качестве противораковых средств. Таким образом, настоящее изобретение дополнительно относится к фармацевтическим композициям, содержащим соединение по настоящему изобретению или его фармацевтически приемлемую соль, пролекарство или стереоизомер с фармацевтически приемлемым носителем.
Примеры фармацевтических композиций включают любые твердые (таблетки, пилюли, капсулы, гранулы и т.д.) или жидкие (растворы, суспензии или эмульсии) композиции для перорального, местного или паренетерального применения.
Введение соединений или композиций по настоящему изобретению может осуществляться любым подходящим способом, таким как внутривенная инфузия, пероральными препаратами и внутрибрюшинным и внутривенным введением. Предпочтительно используемое время инфузии составляет до 24 часов, более предпочтительно, 1-12 часов, наиболее предпочтительно, 1-6 часов. Особенно желательным является короткое время инфузии, которое позволяет проводить лечение без пребывания в стационаре в течение ночи. Однако инфузия может быть от 12 до 24 часов, или даже дольше, если требуется. Инфузию можно проводить с подходящими интервалами приблизительно от 1 до 4 недель. Фармацевтические композиции, содержащие соединения по настоящему изобретению, можно доставлять посредством липосом или инкапсуляции в наносферы, в составы замедленного высвобождения или другими стандартными средствами доставки лекарственных средств.
Точная доза соединений будет варьировать в соответствии с конкретным составом, способом применения и конкретным местом, организмом-хозяином и опухолью, подвергаемых лечению. Также во внимание будут приняты другие факторы, такие как возраст, масса тела, пол, рацион питания, время введения, скорость экскреции, состояние организма-хозяина, лекарственные взаимодействия, реакции чувствительности и тяжесть заболевания. Введение можно проводить непрерывно или периодически в максимально переносимой дозе.
В контексте настоящего изобретения термины «лечить», «лечение» и «лечебное воздействие» включают уничтожение, устранение, модификацию или контроль за опухолью или первичными, региональными или метастазирующими раковыми клетками или тканью и сведение к минимуму или задержку распространения раковой опухоли.
Соединения по настоящему изобретению обладают противораковой активностью, в том числе, но не только, в отношении рака легких, рака толстой кишки и рака груди.
Примеры
ПРИМЕР 1: ОПИСАНИЕ МОРСКОГО ОРГАНИЗМА И МЕСТО СБОРА
Mycale (Aegogropila) crassissima (Dendy, 1905) собирали руками посредством подводного плавания с аквалангом на острове Мафия (07º 39.558' S/39º 55.043' E) на глубине между 5 и 31,4 м. Животный материал был идентифицирован Dr. José Luis Carballo (Universidad Nacional Autónoma of Mexico). Образец этого вида был депонирован в Институте морских наук и лимнологии Universidad Nacional Autónoma of Mexico, с кодом доступа MFIA-399.
ПРИМЕР 2: ВЫДЕЛЕНИЕ АЭГОМИЦИНОВ A И B
Замороженный образец, полученный в Примере 1 (67 г) растирали и экстрагировали H2O и смесью MeOH:CH2Cl2 (50:50) при 23ºC. Органический экстракт упаривали под пониженным давлением с выходом 500 мг сырого продукта. Этот продукт подвергали хроматографии (VLC) на Lichroprep RP-18 со ступенчатым градиентом от H2O до MeOH и CH2Cl2. Две фракции, полученные в результате проведения хроматографии, дополнительно очищали, как описано ниже. Фракцию, элюированную с использованием H2O:MeOH 1:3 (23 мг), подвергали полупрепаративной ВЭЖХ с обращенной фазой (Symmetry Prep C18, 7,8×150 мм, градиент H2O:MeCN от 60 до 75% MeCN за 10 мин, затем от 75 до 100% MeCN за 10 мин, УФ детекция, поток 2,3 мл/мин) с получением на выходе Аэгомицина A (0,6 мг). Эту фракцию, элюированную MeOH (83 мг), подвергали полупрепаративной ВЭЖХ с обращенной фазой (Symmetry Prep C18, 7,8×150 мм, градиент H2O:MeCN от 50 до 75% MeCN за 30 мин, УФ детекция, поток 2,3 мл/мин) с получением на выходе Аэгомицина A (1,8 мг) и Аэгомицина B (0,8 мг).
Аэгомицин A: аморфное белое твердое вещество. (+)HRMALDIMS m/z 523,1622 [M+H]+ (рассчитано для C27H33 35Cl2O6 523,1649); 1H (500 МГц) и 13C ЯМР (75 МГц) в CDCl3 см. Таблицу 1.
Аэгомицин B: аморфное белое твердое вещество. (+)HRMALDIMS m/z 525,1788 [M+H]+ (Рассчитано для C27H35 35Cl2O6 525,1805); 1H (500 МГц) и 13C ЯМР (75 МГц) в CD3OD см. Таблицу 2.
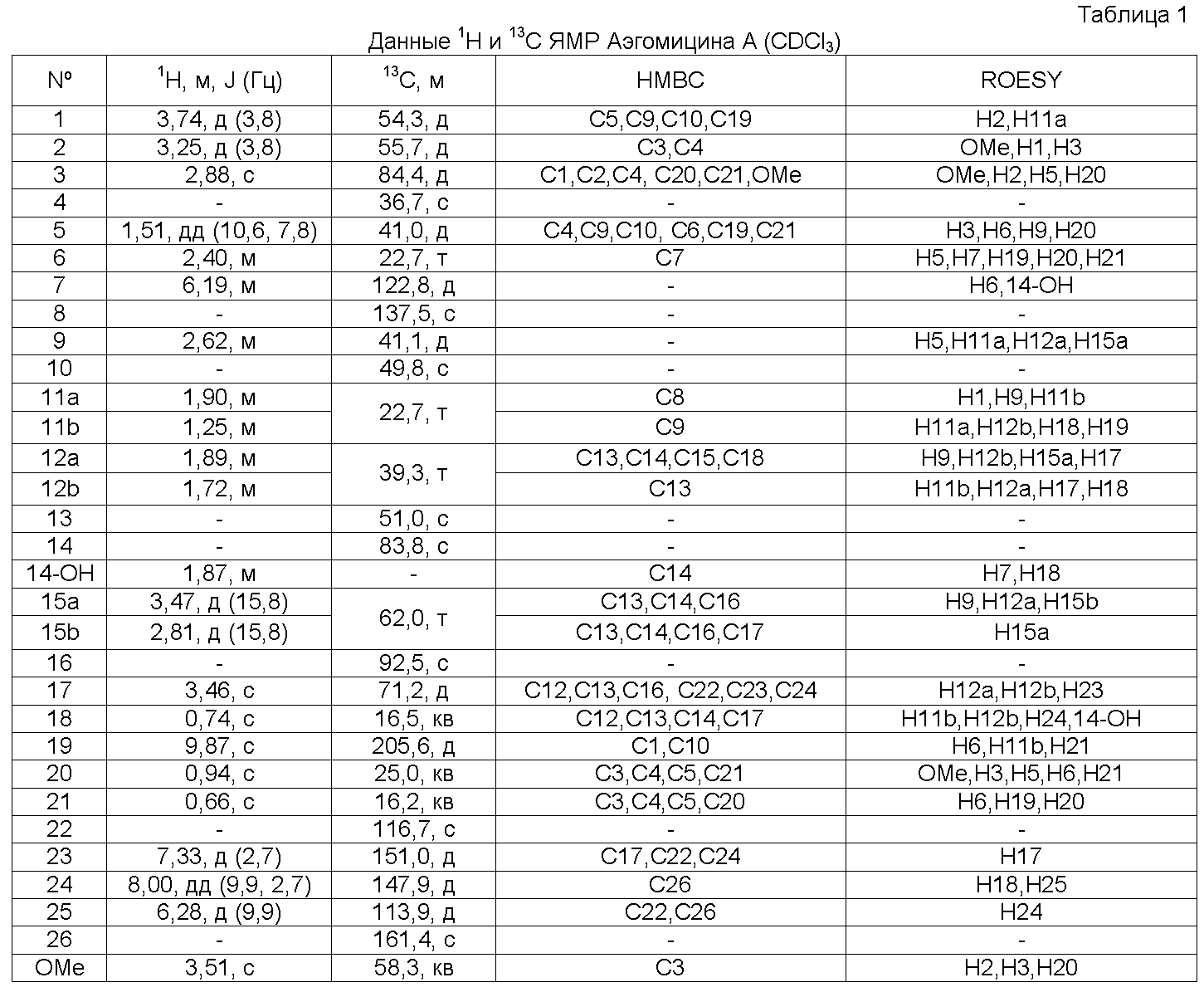
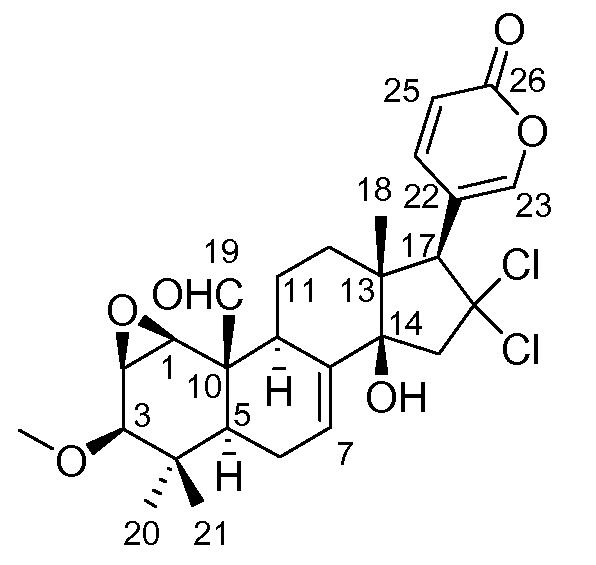
Аэгомицин A
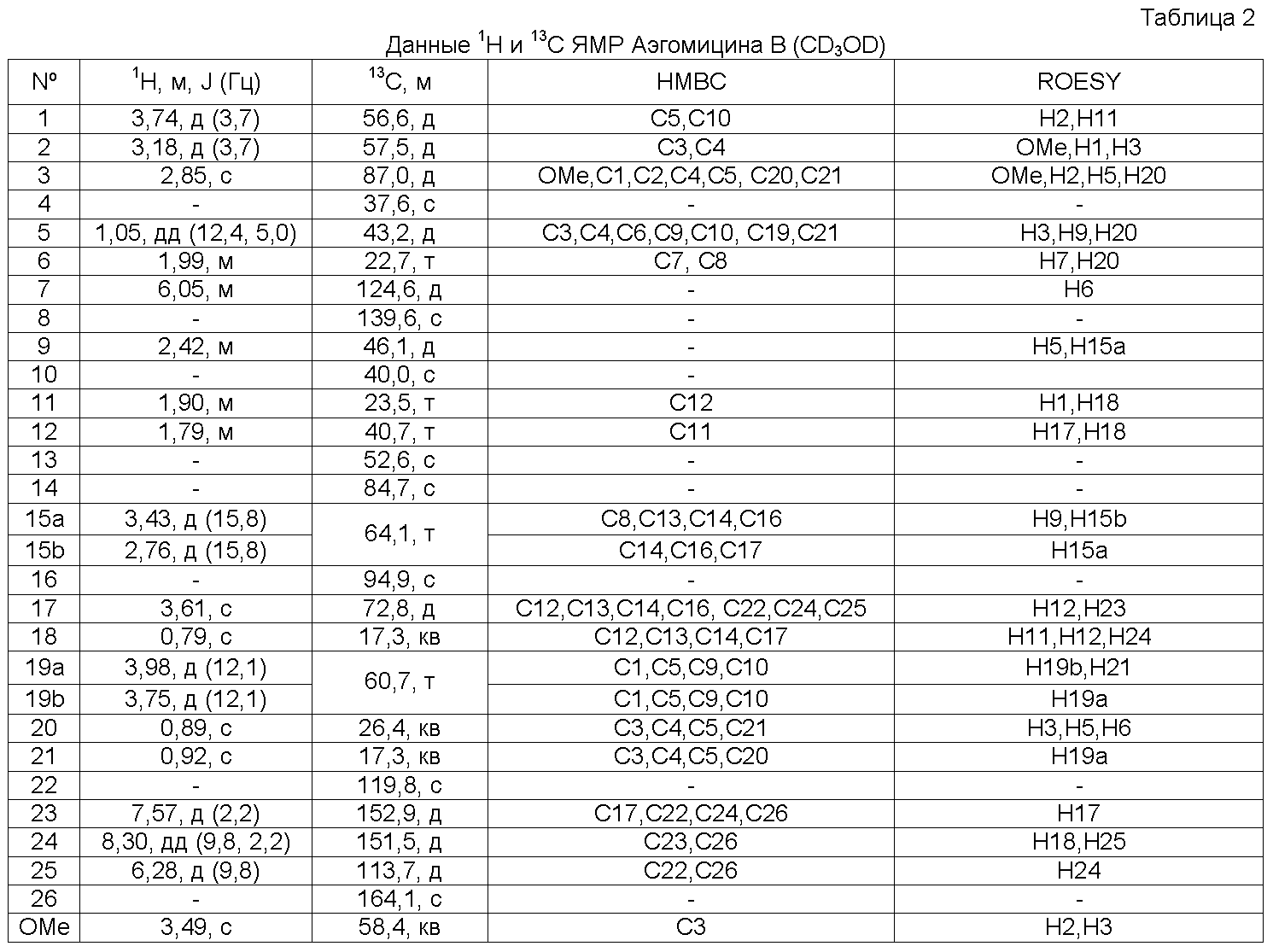
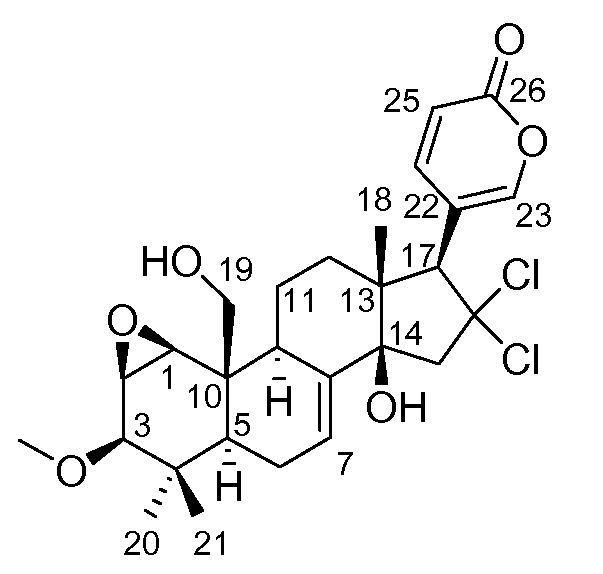
Аэгомицин B
ПРИМЕР 3: ВЫДЕЛЕНИЕ АЭГОМИЦИНОВ C, D, E, F И G
Вторую группу образцов препарата из Примера 1 (160 г) растирали и экстрагировали H2O и смесью MeOH:CH2Cl2 (50:50) при 23ºC. Органический экстракт упаривали под пониженным давлением с получением на выходе 3,12 г сырого продукта. Этот продукт подвергали хроматографии (VLC) на Lichroprep RP-18 со ступенчатым градиентом от H2O до MeOH и CH2Cl2. Две фракции, полученные в результате хроматографии, дополнительно очищали, как описано ниже. Эту фракцию, элюированную с использованием H2O:MeOH 1:3 (122 мг) подвергали полупрепаративной ВЭЖХ с обращенной фазой (Symmetry Prep C18, 7,8×150 мм, градиент H2O:MeCN от 45 до 65% MeCN за 30 мин, УФ детекция, поток 2,3 мл/мин) с получением на выходе Аэгомицина F (2,6 мг) и смесь других соединений Аэгомицина (5,1 мг). Эту смесь дополнительно очищали с помощью полупрепаративной ВЭЖХ (X Terra Phenyl, 10×150 мм, градиент H2O:MeCN от 45 до 60% MeCN за 30 мин, УФ детекция, поток 2,3 мл/мин) с получением на выходе Аэгомицина C (0,5 мг) и D (2,8 мг). Эту фракцию, элюированную с использованием MeOH (230 мг) подвергали флэш-хроматографии на силикагеле, элюируя градиентом гексан:EtOAc с получением на выходе 11 фракций (S1-S11). Фракции S6 (гексан:EtOAc 70:30) и S7 (гексан:EtOAc 60:40) подвергали полупрепаративной ВЭЖХ с обращенной фазой (X Terra Phenyl, 10×150 мм, градиент H2O:MeCN от 50 до 55% MeCN за 30 мин, УФ детекция, поток 3,0 мл/мин) с получением на выходе Аэгомицина E (1,3 мг) из S6 и Аэгомицина G (0,3 мг) из S7.
Аэгомицин C: аморфное белое твердое вещество. (+)HRMALDIMS m/z 477,1581 [M+H]+ (Рассчитано для C26H31 35Cl2O4 477,1594); 1H (500 МГц) и 13C ЯМР (75 МГц) в CD3OD см. Таблицу 3.
Аэгомицин D: аморфное белое твердое вещество. (+)HRMALDIMS m/z 509,1834 [M+H]+ (Рассчитано для C27H35 35Cl2O5 509,1856); 1H (500 МГц) и 13C ЯМР (125 МГц) в CD3OD см. Таблицу 4.
Аэгомицин E: аморфное белое твердое вещество. (+)HRMALDIMS m/z 493,1898 [M+H]+ (Рассчитано для C27H35 35Cl2O4 493,1907); 1H (500 МГц) и 13C ЯМР (75 МГц) в CD3OD см. Таблицу 5.
Аэгомицин F: аморфное белое твердое вещество. (+)HRMALDIMS m/z 443.1997 [M+H]+ (Рассчитано для C26H32 35ClO4 443,1984); 1H (500 МГц) и 13C ЯМР (75 МГц) в CD3OD см. Таблицу 6.
Аэгомицин G: аморфное белое твердое вещество. (+)HRMALDIMS m/z 459,2306 [M+H]+ (Рассчитано для C27H36 35ClO4 459,2297); 1H (500 МГц) и 13C ЯМР (75 МГц) в CD3OD см. Таблицу 7.
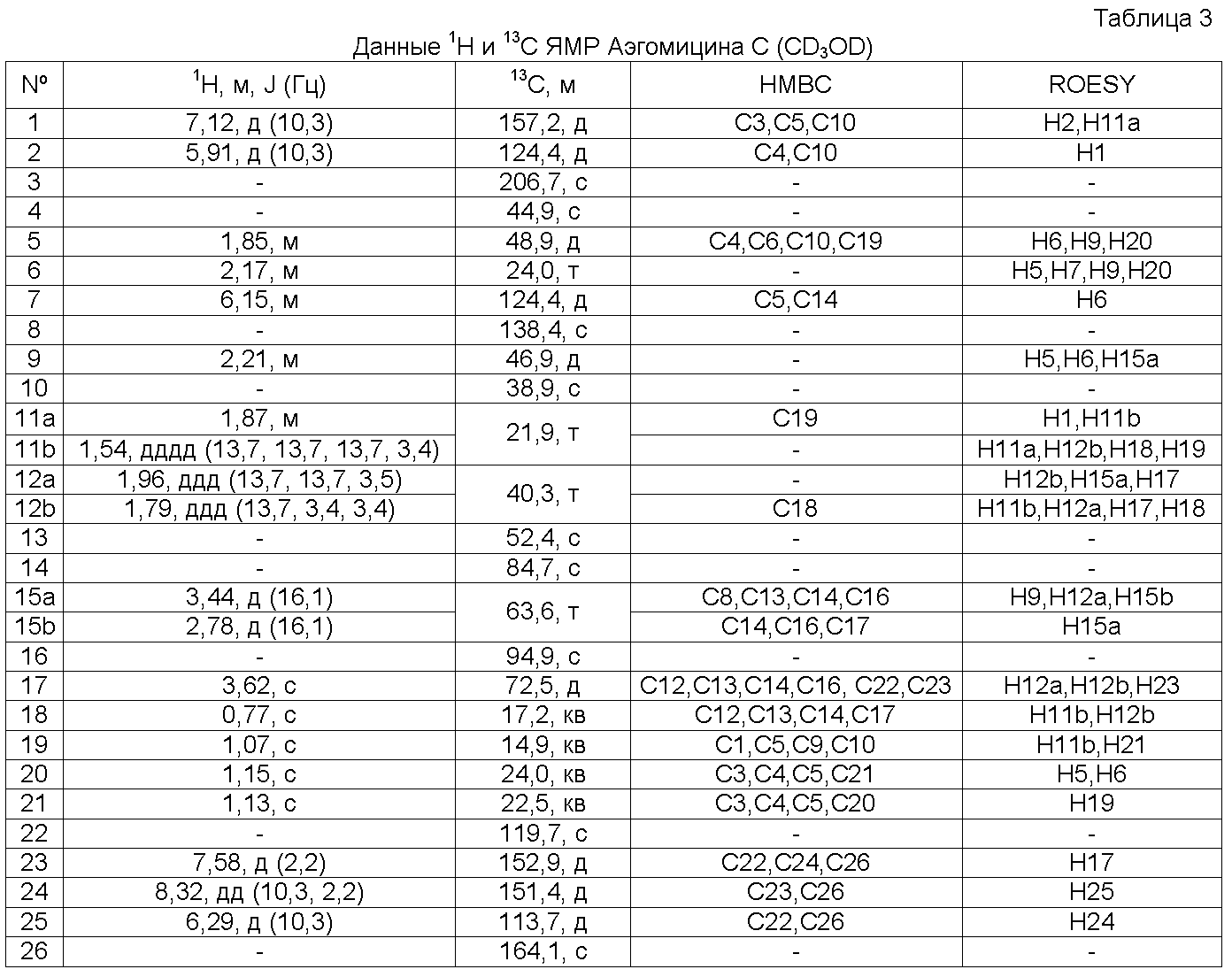
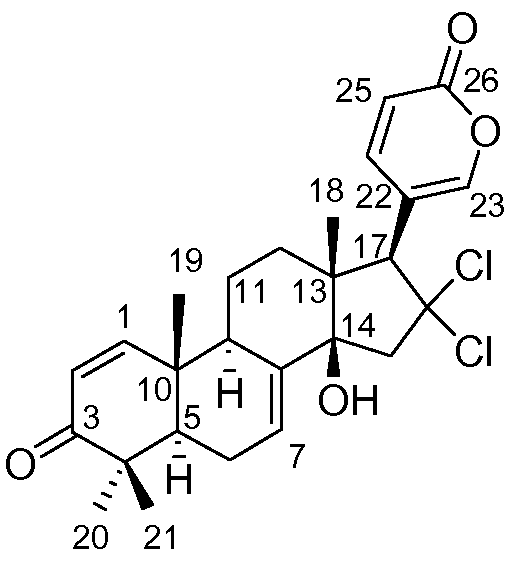
Аэгомицин C
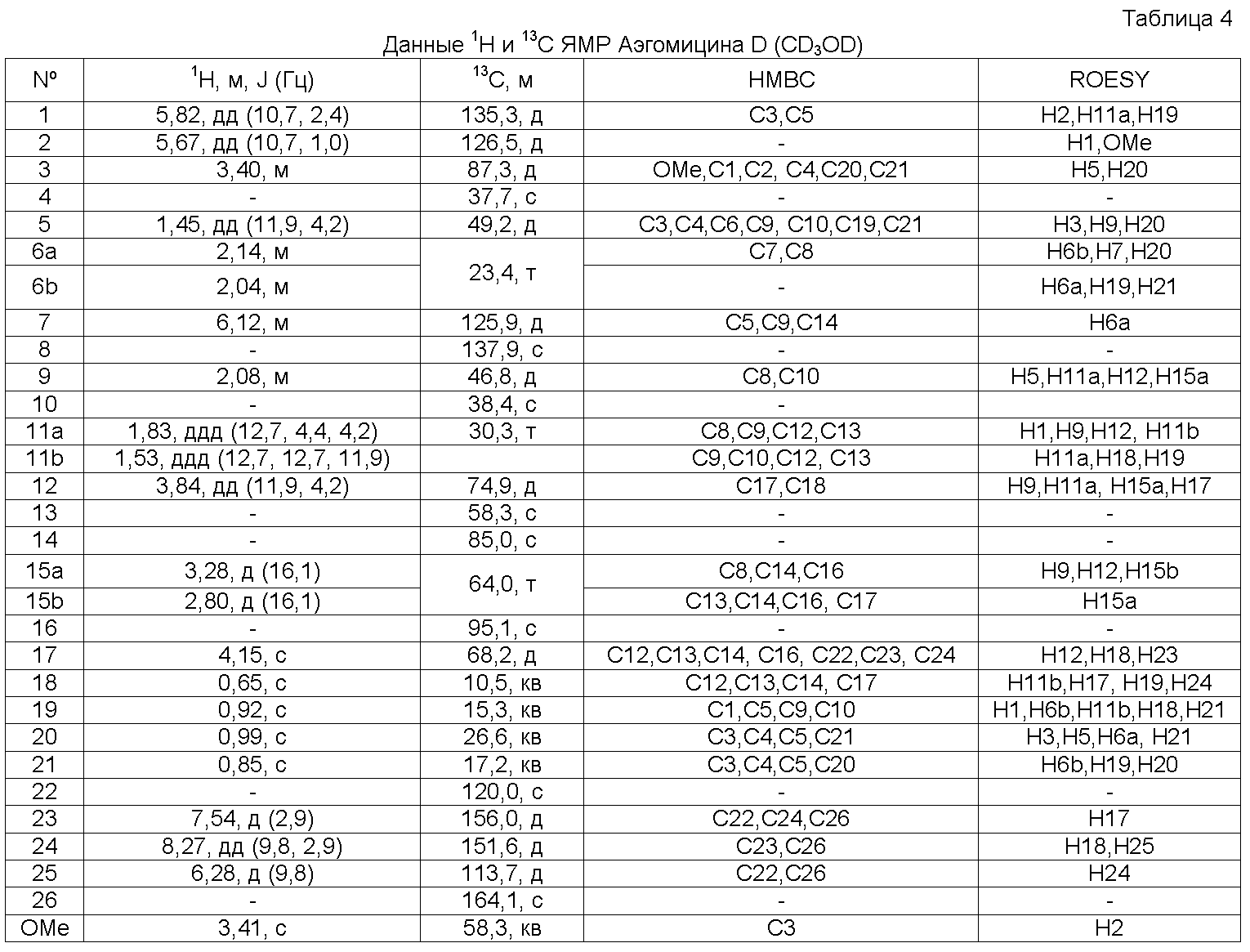
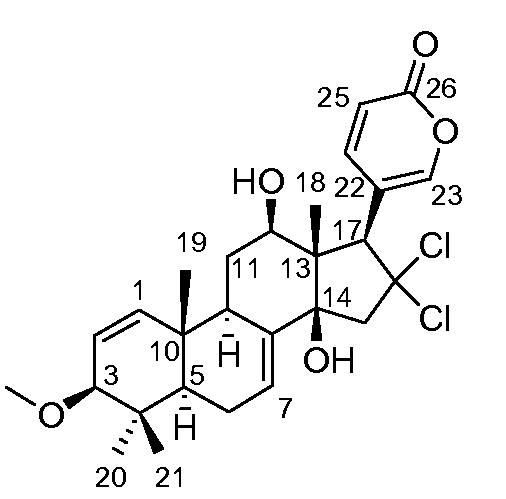
Аэгомицин D
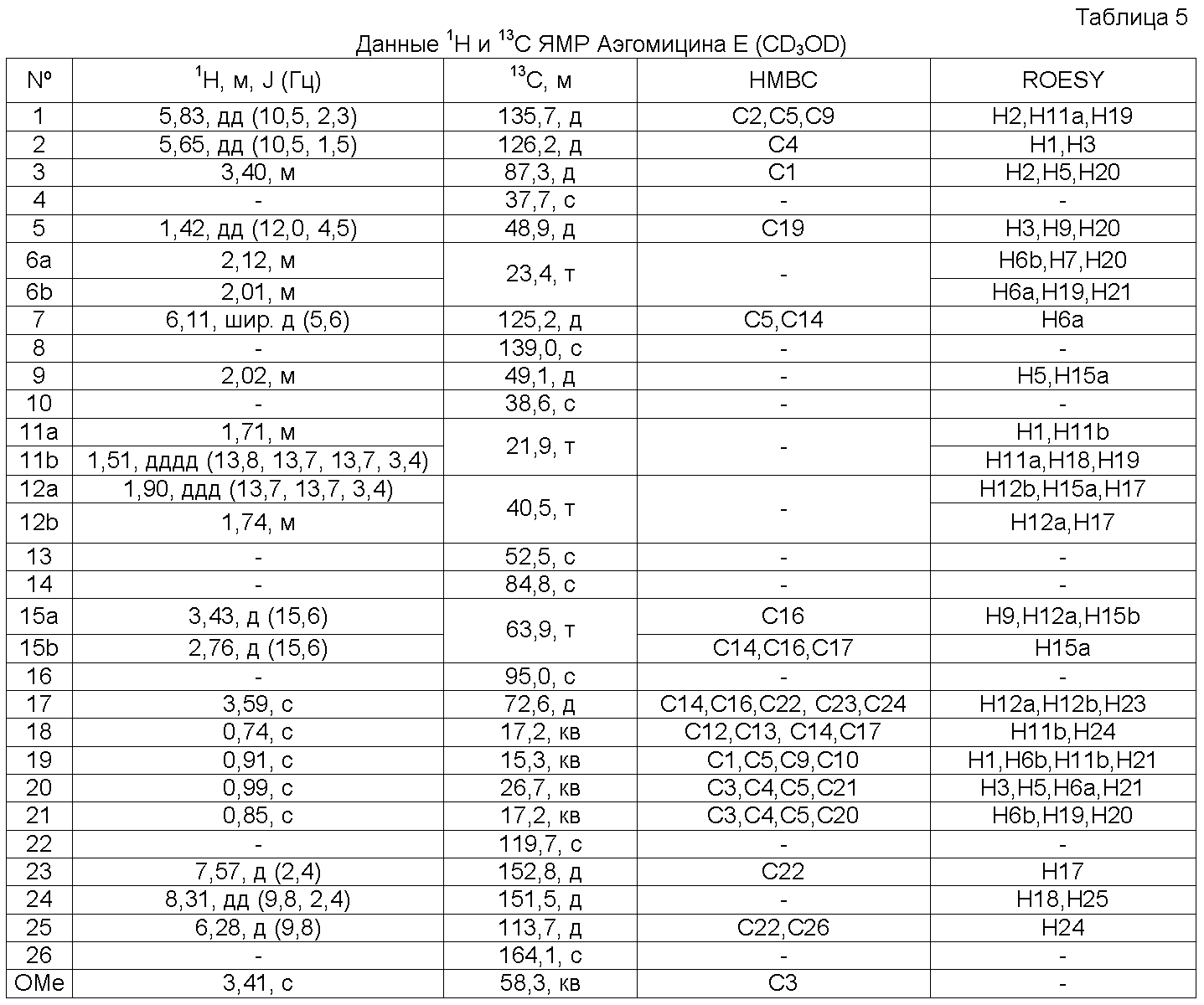
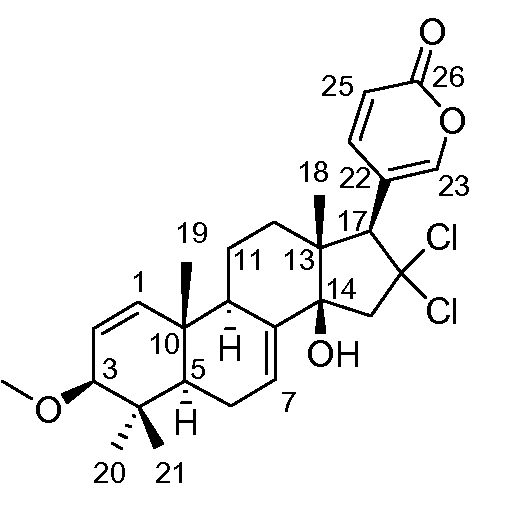
Аэгомицин E
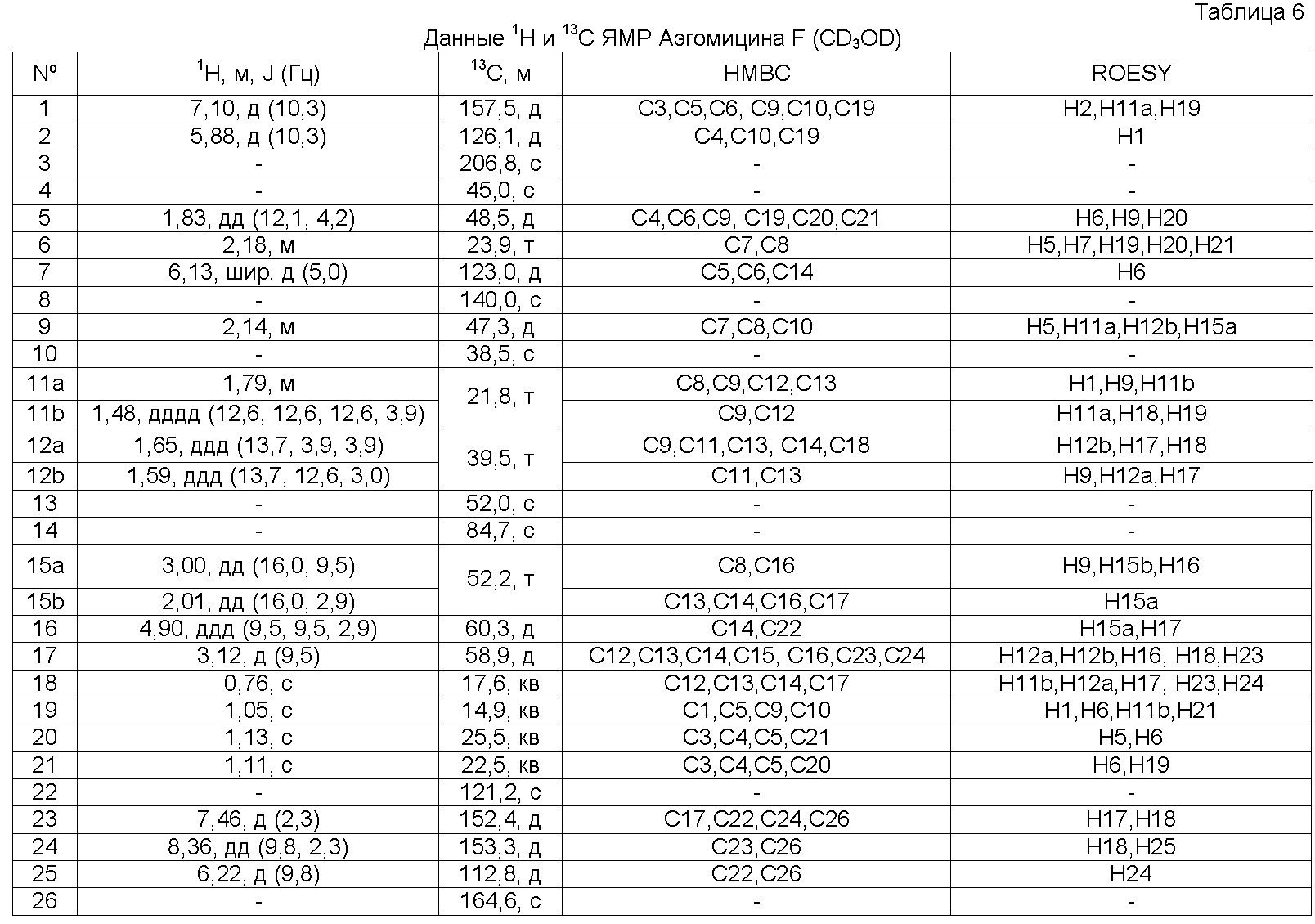
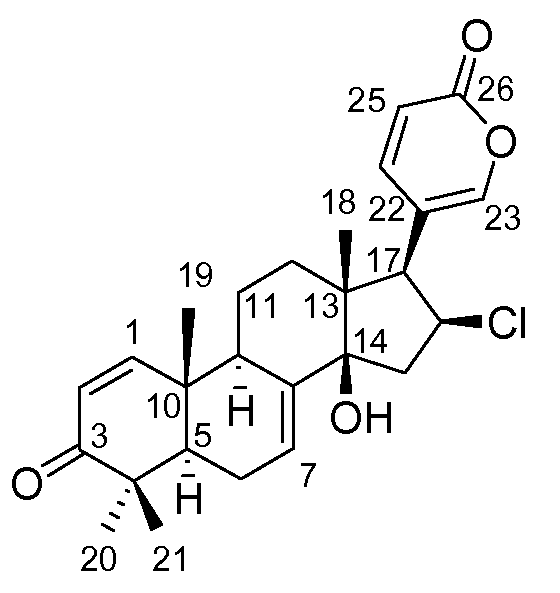
Аэгомицин F
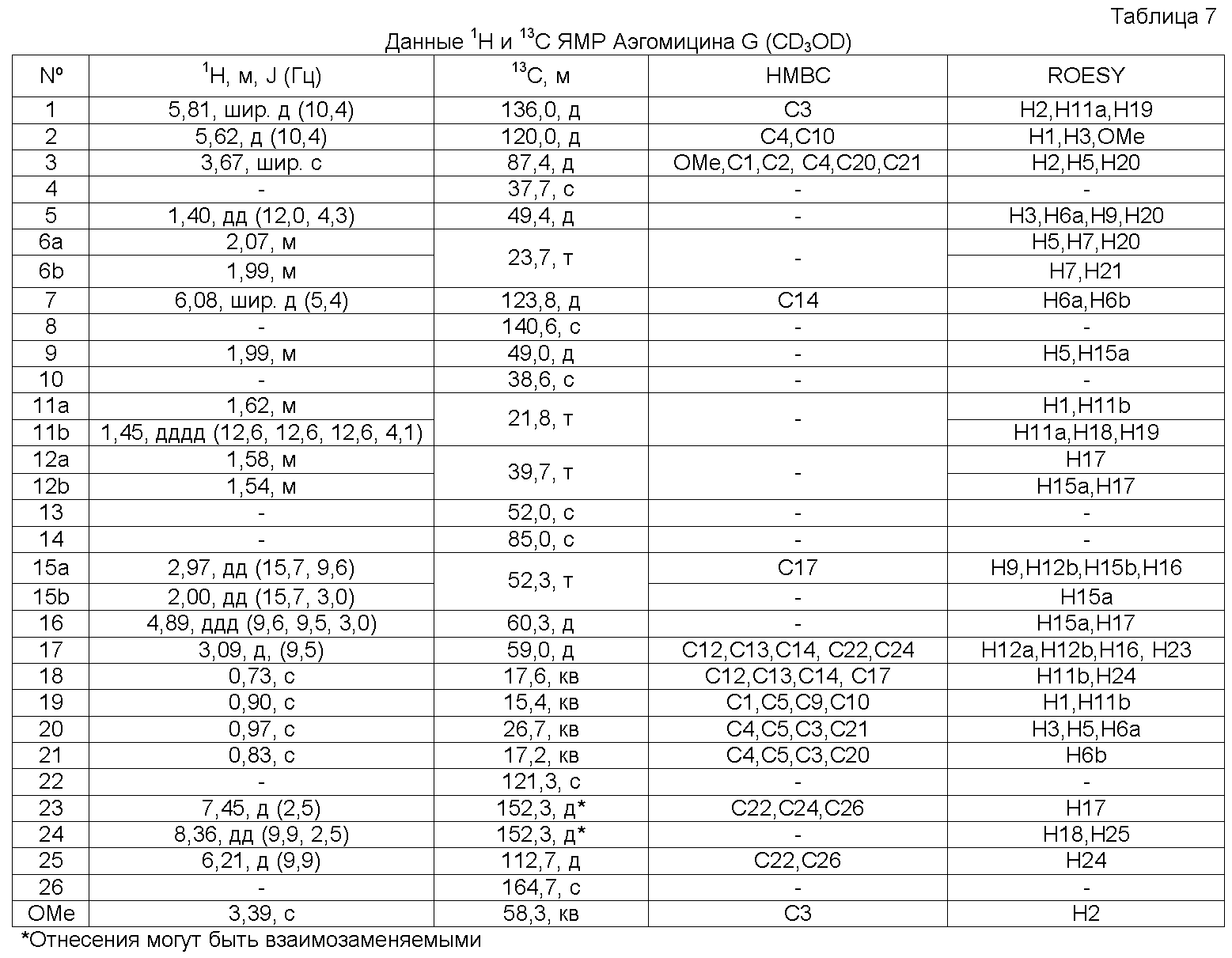
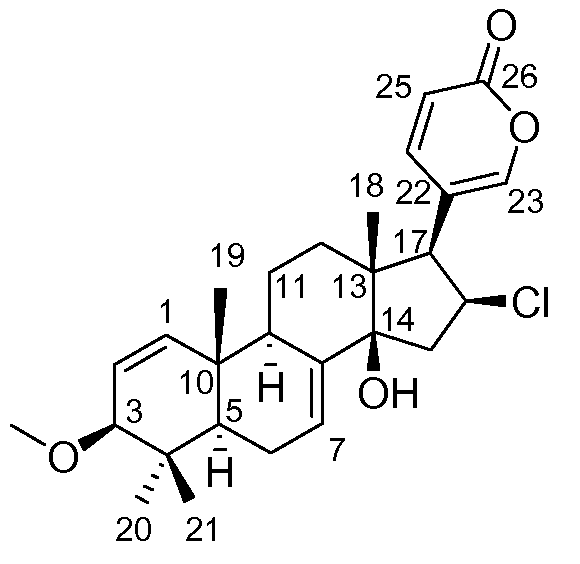
Аэгомицин G
ПРИМЕР 4: ВЫДЕЛЕНИЕ АЭГОМИЦИНА D, F И H
Третью группу образцов препарата Примера 1 (700 г) растирали и экстрагировали H2O и смесью MeOH:CH2Cl2 (50:50) при 23ºC. Органический экстракт упаривали под пониженным давлением с получением на выходе 33 г сырого продукта. Сырой продукт растворяли в MeOH:H2O (1:9, 500 мл) и экстрагировали гексаном (3×500 мл), EtOAc (3×500 мл) и nBuOH (2×500 мл).
Гексановую фракцию (4 г) подвергали хроматографии (VLC) на Lichroprep RP-18 со ступенчатым градиентом от H2O:MeOH (3:1) до MeOH, а затем до CH2Cl2. Эту фракцию элюировали с использованием H2O:MeOH 1:3 (430 мг) подвергали препаративной ВЭЖХ с обращенной фазой (Symmetry Prep C18, 19×150 мм, градиент H2O:MeCN от 45 до 65% MeCN за 30 мин, УФ детекция, поток 14,6 мл/мин) с получением на выходе 7 фракций (H1-H7). Фракцию H4 подвергали полупрепаративной ВЭЖХ с обращенной фазой (X Terra Phenyl, 10×150 мм, градиент H2O:MeCN от 30 до 50% MeCN за 30 мин, УФ детекция, поток 3,8 мл/мин) с получением на выходе Аэгомицина F (8,3 мг). Фракцию H5 подвергали полупрепаративной ВЭЖХ с обращенной фазой (X Terra Phenyl, 10×150 мм, градиент H2O:MeCN от 45 до 60% MeCN за 30 мин, УФ детекция, поток 3,8 мл/мин) с получением на выходе Аэгомицина D (20,4 мг).
EtOAc фракцию (1,2 г) подвергали хроматографии (VLC) на Lichroprep RP-18 со ступенчатым градиентом от H2O:MeOH (3:1) до MeOH, а затем до CH2Cl2. Эту фракцию, элюированную с использованием H2O:MeOH 1:3 (162 мг), подвергали препаративной ВЭЖХ с обращенной фазой (Symmetry Prep C18, 19×150 мм, градиент H2O:MeCN от 45 до 65% MeCN за 30 мин, УФ детекция, поток 14,6 мл/мин) с получением на выходе 7 фракций (H1-H7). Фракцию H2 подвергали полупрепаративной ВЭЖХ с обращенной фазой (X Terra Phenyl, 10×150 мм, градиент H2O:MeCN от 30 до 55% MeCN за 30 мин, УФ детекция, поток 3,8 мл/мин) с получением на выходе Аэгомицина H (1,4 мг). Фракцию H4 подвергали полупрепаративной ВЭЖХ с обращенной фазой (X Terra Phenyl, 10×150 мм, градиент H2O:MeCN от 30 до 50% MeCN за 20 мин, УФ детекция, поток 3,8 мл/мин) с получением на выходе Аэгомицина F (12,2 мг). Фракцию H5 подвергали полупрепаративной ВЭЖХ с обращенной фазой (X Terra Phenyl, 10×150 мм, градиент H2O:MeCN от 45 до 60% MeCN за 30 мин, УФ детекция, поток 3,8 мл/мин) с получением на выходе Аэгомицина D (21,7 мг).
Аэгомицин H: аморфное белое твердое вещество. (+)ESIMS m/z 493 [M+H]+, 1H (500 МГц) и 13C ЯМР (75 МГц) в CD3OD см. Таблицу 8.
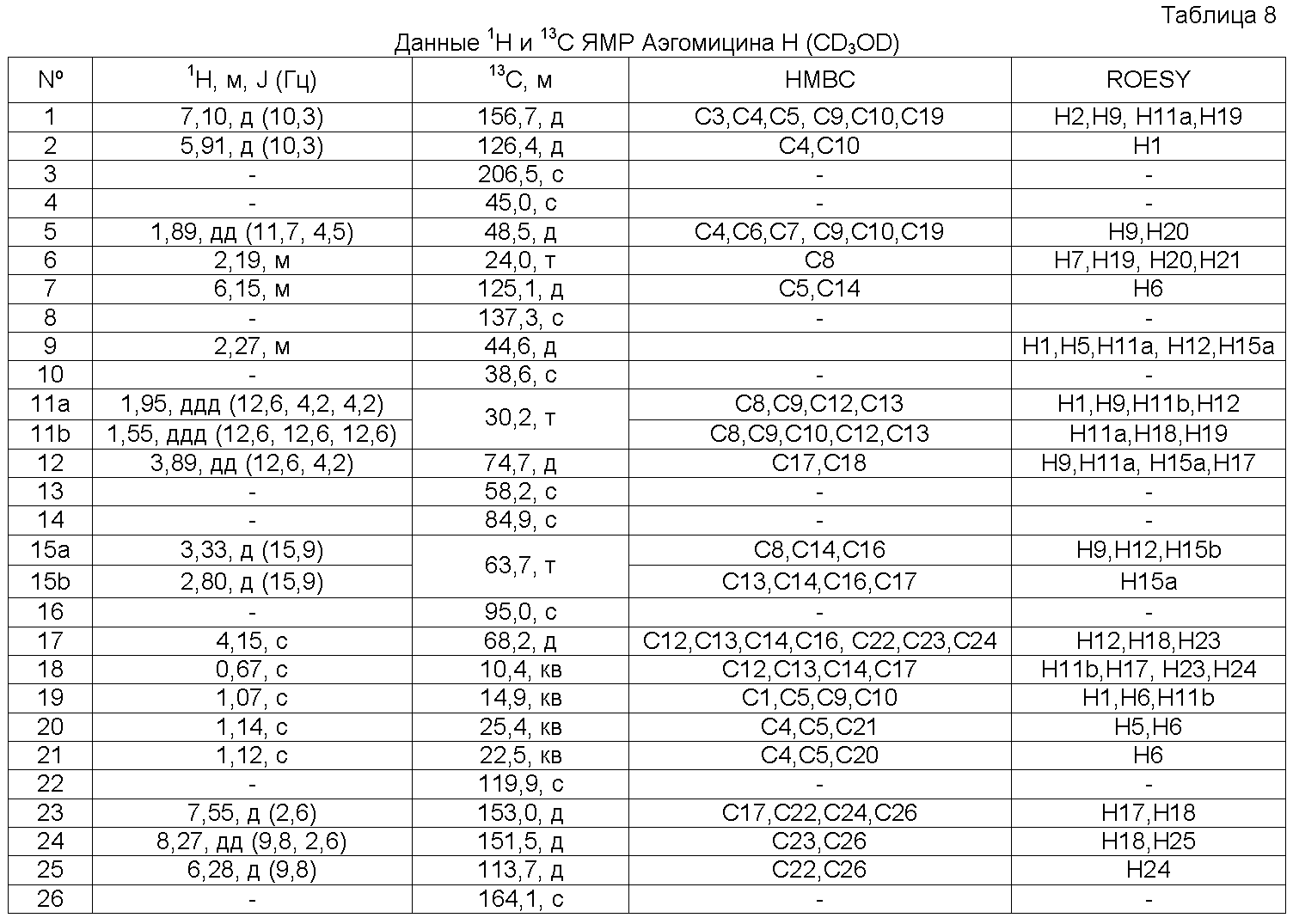
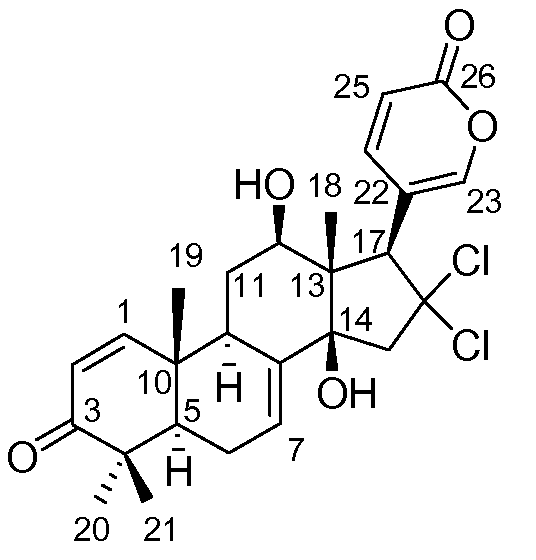
Аэгомицин H
ПРИМЕР 5: БИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ ДЛЯ ОПРЕДЕЛЕНИЯ ПРОТИВОРАКОВОЙ АКТИВНОСТИ
Целью настоящего исследования является оценка in vitro цитостатической (способности отсрочить или задержать рост раковых клеток) или цитотоксической (способности уничтожать раковые клетки) активности тестируемых образцов.
|
|
ОЦЕНКА ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТИ С ИСПОЛЬЗОВАНИЕМ КОЛОРИМЕТРИЧЕСКОГО АНАЛИЗА SBR
Колориметрический анализ с использованием реакции с сульфородамином B (SRB) был адаптирован для осуществления количественного измерения клеточного роста и жизнеспособности (по методике, описанной Skehan et al. J. Natl. Cancer Inst. 1990, 82, 1107-1112).
В этой форме анализа используют SBS-стандартные 96-луночные клеточные культуральные микропланшеты (Faircloth et al. Methods in Cell Science, 1988, 11(4), 201-205; Mosmann et al, Journal of Immunological Methods, 1983, 65(1-2), 55-63). Все клеточные линии, используемые в этом исследовании, были получены из американской коллекции типовых культур (ATCC) и происходили из различных типов раковых опухолей человека.
Клетки подращивали в модифицированной по Дульбекко среде Игла (DMEM), дополненной 10% эмбриональной сывороткой теленка (FBS), 2 мМ L-глутамина, 100 Ед/мл пенициллина и 100 Ед/мл стрептомицина при 37ºC, 5% CO2 и 98% влажности. Для этих экспериментов клетки собирали из конфлюэнтных культур с помощью трипсинизации, и суспендировали в свежей среде до подсчета и высевания.
Клетки высевали в 96-луночные микротитровальные планшеты, с плотностью 5×103 клеток на лунку в аликвотах 150 мкл, и оставляли прикрепляться к поверхности планшета в течение 18 часов (в течение ночи) в среде без лекарственного средства. После этого, один контрольный (необработанный) планшет каждой клеточной линии фиксировали (как описано ниже) и использовали для эталонной величины нулевого момента времени. Культуральные планшеты затем обрабатывали тестируемыми соединениями (50 мкл аликвоты 4X маточных растворов в полной культуральной среде плюс 4% DMSO) с использованием десяти серийных разведений (концентрации в интервале от 10 до 0,00262 мкг/мл) и тройных культур (1% конечная концентрация DMSO). После обработки в течение 72, измеряли противораковое действие, путем использования методики SRB: вкратце, клетки промывали дважды с использованием PBS, фиксировали в течение 15 мин в 1% растворе глутарового альдегида при комнатной температуре, дважды промывали в PBS, и окрашивали в 0,4% растворе SRB в течение 30 мин при комнатной температуре. Затем клетки промывали несколько раз 1% раствором уксусной кислоты и сушили на воздухе при комнатной температуре. SRB затем экстрагировали в 10 мМ растворе трис-основания и измеряли поглощение в автоматическом спектрофотометрическом планшетном ридере при 490 нм. Действие на клеточный рост и выживанием оценивали, применяя алгоритм NCI (Boyd MR and Paull KD. Drug Dev. Res. 1995, 34, 91-104).
Используя среднее +SD культур в трех повторах, автоматически получали кривую доза-ответ, с использованием анализа нелинейной регрессии. Три эталонных параметра вычисляли (алгоритм NCI) путем автоматической интерполяции: GI50 = концентрация соединения, которая дает 50% ингибирование клеточного роста, по сравнению с контрольными культурами; TGI = суммарное ингибирование клеточного роста (цитостатическое действие), по сравнению с контрольными культурами, и LC50 = концентрация соединения, которая дает 50% конечное уничтожение клеток (цитотоксическое действие).
Таблицы 9 и 10 иллюстрируют данные о биологической активности соединений по настоящему изобретению.
|
|