Результат интеллектуальной деятельности: ДОБАВКА К ПИТАТЕЛЬНОЙ СРЕДЕ ДЛЯ ФОРМИРОВАНИЯ БАКТЕРИАЛЬНЫХ БИОПЛЕНОК (ВАРИАНТЫ)
Вид РИД
Изобретение
Изобретение относится к микробиологии и биотехнологии, а именно к процессам культивирования микроорганизмов в искусственных условиях с использованием питательных сред для формирования бактериальных биопленок. Изобретение может быть использовано в диагностических целях в клинической и общей микробиологии, а также в биотехнологическом производстве для накопления микробной биомассы.
Искусственные питательные среды являются субстанциями, на которых производится рост и размножение микроорганизмов в микробиологии и биотехнологических процессах. В настоящее время существует большое количество разнообразных питательных сред, которые классифицируются по исходным компонентам: натуральные и искусственные; консистенции: жидкие, плотные и полужидкие; по составу: простые и сложные; по назначению: основные и специальные: элективные, дифференциально-диагностические и консервирующие [Поляк М.С., Сухаревич В.И., Сухаревич М.Э. Питательные среды для медицинской микробиологии. - Санкт-Петербург: НИЦФ. 2002, 80 с.].
Специальные питательные среды предназначаются для получения культур определенных микроорганизмов с проявлением нужных фенотипических свойств, например, бактериальных биопленок. Биопленки являются формой микробных сообществ, фиксированных на поверхностях и состоящих из двух обязательных элементов: микробных клеток и ассоциированного с ними внеклеточного матрикса [Costerton J.W., Stewart P.S., Greenberg Е.Р. Bacterial biofilms: a common cause of persistent infections // Science. - 1999. - Vol. 284. - P. 1318-1322]. Важной задачей современной микробиологии является воспроизведение микробных биопленок в искусственных условиях (in vitro). Моделирование биопленок необходимо для диагностики и исследования биопленочных инфекций, для реализации биотехнологических процессов и технологий.
Для воспроизведения микробных (бактериальных и грибковых) биопленок in vitro применяются различные питательные среды:
1. Среды без каких-либо модификаций, которые рекомендуются для моделирования биопленок конкретным видом микроорганизмов. Они выбраны для конкретного вида микроорганизма путем экспериментального перебора, в результате которого рекомендована среда, на которой для многих штаммов конкретного вида наблюдается наиболее интенсивное биопленкообразование.
Известная питательная среда Луриа-Бертани (Lysogeny broth или LB-medium) применялась для моделирования биопленок синегнойной палочки (Pseudomonas aeruginosa) [Martinez-Granero F, Navazo A, Barahona E, Redondo-Nieto M, Gonzalez de Heredia E, Baena I, Martin-Martin I, Rivilla R, Martin M. Identification of flgZ as a flagellar gene encoding a PilZ domain protein that regulates swimming motility and biofilm formation in Pseudomonas. PLoS One. 2014; 9(2): e87608]. LB-среда содержала стандартизованные по концентрации азота продукты естественного происхождения (триптон, дрожжевой экстракт), а также натрий хлористый.
2. Среды, содержащие специальные добавки (глюкозу, галактозу и др.), которые усиливают биопленкообразование [Møretrø Τ, Hermansen L, Holck AL, Sidhu MS, Rudi K, Langsrud S. Biofilm formation and the presence of the intercellular adhesion locus ica among staphylococci from food and food processing environments. Appl Environ Microbiol. 2003; 69(9): 5648-55]. Эти добавки усиливают синтез микроорганизмами обязательного атрибута биопленок - внеклеточного матрикса, скрепляющего микробные клетки в единую систему биопленки.
Известна питательная среда «Сердечно-мозговой бульон» (Heart Infusion Broth) с добавлением глюкозы до конечной концентрации 1% применялась для моделирования биопленок ацинетобактериями (Acinetobacter baumannii) и синегнойной палочкой (Pseudomonas aeruginosa) [Gurung J, Khyriem AB, Banik A, Lyngdoh WV, Choudhury B, Bhattacharyya P. Association of biofilm production with multidrug resistance among clinical isolates of Acinetobacter baumannii and Pseudomonas aeruginosa from intensive care unit. Indian J Crit Care Med. 2013; 17(4): 214-8].
Известна питательная среда «Основная дрожжевая азотистая» (Yeast nitrogen base medium или YNB medium) с добавлением 500 мМ галактозы или 50 мМ глюкозы применялась для моделирования биопленок микроскопических дрожжеподобных грибов Candida albicans [Hawser SP, Douglas LJ. Biofilm formation by Candida species on the surface of catheter materials in vitro. Infect Immun. 1994; 62(3): 915-21.].
Недостатком перечисленных питательных сред является то, что не все штаммы каждого вида микроорганизмов могут формировать биопленки даже на средах, которые рекомендуются для моделирования биопленок микробами конкретного вида. Этот недостаток не позволяет воспроизводить в условиях in vitro биопленки на основе любого штамма, клетки которого необходимо получить в составе биопленки, что бывает необходимо, потому что в составе биопленок клетки микробов приобретают качественно новые свойства, отличающие их от небиопленочных планктонных клеток.
Известна питательная среда для усиления роста бифидобактерий на основе гидролизата молока, содержащая добавку, отличающаяся тем, что в качестве добавки она содержит аскорбиновую кислоту при следующем содержании компонентов, г/л: аскорбиновая кислота -0,01-0,1, гидролизат молока - остальное (патент РФ №2104014).
Широко применяется питательная среда на основе триптоно-соевого бульона (Tryptone Soya Broth), которая была модифицирована с целью усиления биопленкообразования путем добавления в нее глюкозы до концентрации 2,0%,. Питательная среда была использована для моделирования in vitro биопленок на основе разных видов рода Staphylococcus - S. epidermidis, S. aureus, S. saprophyticus, S. capitis, S. cohnii, S. intermedius, S. lentus и S. sciuri. [Møretrø T, Hermansen L, Holck AL, Sidhu MS, Rudi K, Langsrud S. Biofilm formation and the presence of the intercellular adhesion locus ica among staphylococci from food and food processing environments. Appl Environ Microbiol. 2003; 69(9): 5648-55].
Состав триптоно-соевого бульона: пептон из казеина - 1,7%, пептон из сои - 0,3%, глюкоза - 2,0%, натрия хлорид - 0,5%, гидрофосфат калия (K2HPO4·3H2O) - 0,25%.
Задачей предлагаемого изобретения является создание новой эффективной добавки к питательным средам для формирования бактериальных биопленок в условиях in vitro.
Технический результат изобретения заключается в достижении эффекта биопленкообразования на средах с предлагаемой добавкой для штаммов бактерий, которые не способны формировать биопленки на питательных средах без предлагаемой добавки.
Задача решается тремя вариантами составов композиций добавок для формирования бактериальных биопленок.
1. Нерастворимый в водной среде биополимер фибрин в количестве от 0,05 г до 10 г на 1 кг питательной среды и ингибитор протеиназ в количестве от 0,002 г до 0,5 г на 1 кг питательной среды.
2. Фибриноген, как предшественник нерастворимого в водной среде биополимера фибрина, в количестве от 0,05 г до 10 г на 1 кг питательной среды, плазмокоагулаза в соотношении к фибриногену от 1:128 до 1:10000 (масса:масса), обеспечивающая трансформацию фибриногена в нерастворимый в водной среде биополимер фибрин, и ингибитор протеиназ в количестве от 0,002 г до 0,5 г на 1 кг питательной среды.
3. Фибриноген, как предшественник нерастворимого в водной среде биополимера, в концентрации от 0,01 г/л до 10 г/л, (2) комплекс «тромбинионы Са2+, содержащий тромбин в соотношении к фибриногену 1:10-1:500 и ионы Са2+ в количестве от 0,08 г до 0,2 г на 1 кг питательной среды, который обеспечивает трансформацию фибриногена в нерастворимый в водной среде биополимер фибрин, и ингибитор протеиназ в количестве от 0,002 г до 0,5 г на 1 кг питательной среды.
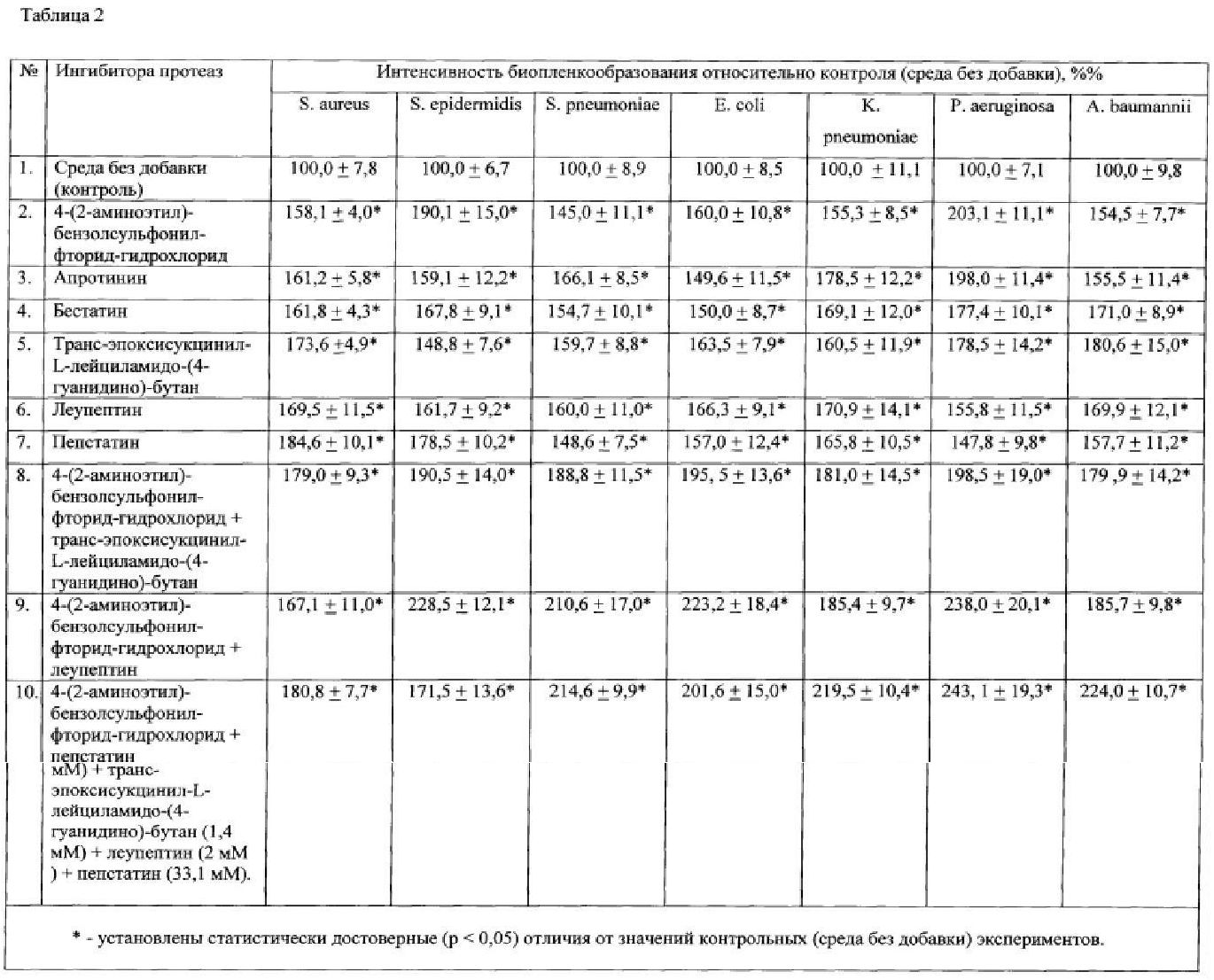
В качестве ингибитора протеиназ использовали следующие вещества, как по отдельности, так и в виде различных комбинаций смеси компонентов:
- 4-(2-аминоэтил)-бензолсульфонил-фторид-гидрохлорид (104 мМ),
- апротинин (80 мкМ),
- бестатин (4 мМ), транс-эпоксисукцинил-L-лейциламидо-(4-гуанидино)-бутан (0,56 мМ),
- транс-эпоксисукцинил-L-лейциламидо-(4-гуанидино)-бутан (1,4 мМ),
- леупептин (2 мМ),
- пепстатин (1,5 мМ),
- 4-(2-аминоэтил)-бензолсульфонил-фторид-гидрохлорид (104 мМ) + транс-эпоксисукцинил-L-лейциламидо-(4-гуанидино)-бутан (1,4 мМ),
- 4-(2-аминоэтил)-бензолсульфонил-фторид-гидрохлорид (104 мМ) + леупептин (2 мМ),
- 4-(2-аминоэтил)-бензолсульфонил-фторид-гидрохлорид (104 мМ) + пепстатин (1,5 мМ),
- 4-(2-аминоэтил)-бензолсульфонил-фторид-гидрохлорид (104 мМ) + апротинин (80 мкМ),
- 4-(2-аминоэтил)-бензолсульфонил-фторид-гидрохлорид (104 мМ) + бестатин (4 мМ)
- 4-(2-аминоэтил)-бензолсульфонил-фторид-гидрохлорид (104 мМ)+апротинин (80 мкМ)+бестатин (4 мМ),
- транс-эпоксисукцинил-L-лейциламидо-(4-гуанидино)-бутан (1,4 мМ)+леупептин (2 мМ)+пепстатин (1,5 мМ),
- 4-(2-аминоэтил)-бензолсульфонил-фторид-гидрохлорид (104 мМ) + апротинин (80 мкМ) + бестатин (4 мМ) + транс-эпоксисукцинил-L-лейциламидо-(4-гуанидино)-бутан (1,4 мМ) + леупептин (2 мМ) + пепстатин (1,5 мМ),
- 4-(2-аминоэтил)-бензолсульфонил-фторид-гидрохлорид (104 мМ) + апротинин (80 мкМ) + бестатин (4 мМ) + транс-эпоксисукцинил-L-лейциламидо-(4-гуанидино)-бутан (1,4 мМ) + леупептин (2 мМ) + пепстатин (33,1 мМ).
Выбор ингибитора протеаз либо комбинации ингибиторов протеаз обусловлен тем, что перечисленные варианты ингибиторов протеиназ являются типовыми ингибиторами, способными подавлять активность подавляющего большинства протеиназ эукариотов, включая серинпротеиназы, цистеинпротеиназы, аспартатпротеиназы, металлопротеиназы и аминопептидазы [Berg J.М., Tymoczko J.L., Stryer L. Biochemistry New York // NY: WH Freeman. - 2002]. По одному из перечисленных вариантов добавки (в количестве 1 мл) было внесено в 99 г триптоно-соевого бульона, содержащего 2% глюкозы.
Все три варианта добавки используются для внесения в питательную среду в соотношении: добавка (масса):питательная среда (масса)=1:99.
В итоге бульоны содержали концентрацию ингибитора протеаз в диапазоне от 0,002 до 0,5 г на 1 кг.
Модифицированные таким образом варианты триптозо-соевого бульона использовались для получения биопленок, сформированных основными представителями различных групп микроорганизмов, включая грампозитивные кокки, энтеробактерии, неферментирующие грамнегативные палочки, а именно: золотистыми стафилококками (Staphylococcus aureus), эпидермальным стрептококком (Staphylococcus epidermidis), пневмококками (Streptococcus pneumoniae), кишечной палочкой (Escherichia coli), клебсиеллами (Klebsiella pneumoniae), синегнойной палочкой (Pseudomonas aeruginosa), ацинетобактериями (Acinetobacter baumannii).
Спектр бактерий был выбран исходя из того, что они являются типовыми видами, которые отражают общие свойства физиологии бактерий из разных таксономических групп [Ленгелер Й., Древе Г., Шлегель Г. Современная микробиология. Прокариоты. - М.: Мир, 2005. - Т. 1. - 667 с.]. Поэтому их свойства и особенности метаболизма, включая биопленкообразование, можно экстраполировать на представителей других видов бактерий.
В лунки 96-луночного планшета вносили по 0,35 мл приготовленной среды и 0,01 мл взвеси одной из перечисленных выше бактерий в изотоническом растворе хлорида натрия, стандартизованной до 0,5 ед. оптической мутности по МакФарланду. В качестве среды сравнения использовали триптоно-соевый бульон, содержащий 2% глюкозы, без внесения добавки. Пробы инкубировали 48 часов при 37°C. Рост биопленок, сформированных каждым штаммом, исследовали в трех повторениях (лунках). После инкубации лунки с бактериями при помощи пипетки дважды ополаскивали изотоническим раствором хлорида натрия (по 0,4 мл), в течение 4 минут фиксировали 4%-ным раствором формальдегида, окрашивали 1%-ным раствором красителя кристаллического фиолетового (по 0,4 мл в лунку) в течение 5 мин. При помощи пипетки удаляли краситель, ополаскивали 96-луночный планшет в дистиллированной воде до исчезновения синих струек красителя. Высушивали при комнатной температуре. Высушивали при комнатной температуре. Оценивали интенсивность биопленкообразования по количеству остаточного красителя в лунках с бактериями при помощи известного метода, который включал смывание (элюирование) красителя из лунок этанолом (дважды по 0,4 мл, элюаты объединяли) с последующей оценкой интенсивности окраски элюата при помощи оценки светопоглощения (при длине волны 610 нм) с помощью плашечного фотометра Infinite 200М Tecan при длине волны
610 нм [Чеботарь И.В., Погорелов А.Г., Яшин В.А., Гурьев Е.Л., Ломинадзе Г.Г. Современные технологии исследования бактериальных биопленок. Современные технологии в медицине. - 2013. - Т. 5, №1. - с. 14-20].
Результаты, представленные в Таблице 2, демонстрируют интенсивность биопленкообразования и значительное увеличение объема биопленок при культивировании на среде, содержащей заявляемые добавки. Каждая из заявленных добавок способствует формированию биопленок любых бактерий.
Эффективность от использования предлагаемой добавки подтверждена следующими примерами.
Пример 1. Добавка, состоящая из: 0,5 г фибрина и 1 мл изотонического раствора хлорида натрия, содержащего ингибитор протеаз, представляющий собой композицию 4-(2-аминоэтил)-бензолсульфонил-фторид-гидрохлорида (104 мМ), апротинина (80 мкМ), бестатина (4 мМ), транс-эпоксисукцинил-L-лейциламидо-(4-гуанидино)-бутана (1,4 мМ), леупептина (2 мМ), пепстатина (1,5 мМ), была внесена в 99 г бульона Луриа-Бертани (Lysogeny broth или LB-medium) бульона, содержащего 1% глюкозы.
Модифицированный таким образом бульон Луриа-Бертани использовался для получения биопленок, сформированных синегнойной палочкой (Pseudomonas aeruginosa, штамм АТСС 27853): в лунки 96-луночного планшета вносили по 0,35 мл приготовленной среды и 0,01 мл взвеси синегнойной палочки в изотоническом растворе хлорида натрия, стандартизованной до 0,5 ед. оптической мутности по МакФарланду. В качестве среды сравнения использовали бульон Луриа-Бертани, содержащий 1% глюкозы, без внесения добавки. Пробы инкубировали 24 часа при 37°C. Рост биопленок исследовали в трех повторениях (лунках). После инкубации лунки с бактериями при помощи пипетки дважды ополаскивали изотоническим раствором хлорида натрия (по 0,4 мл), в течение 4 минут фиксировали 4%-ным раствором формальдегида, окрашивали 1%-ным раствором красителя кристаллического фиолетового (по 0,4 мл в лунку) в течение 5 мин. При помощи пипетки удаляли краситель, ополаскивали 96-луночный планшет в дистиллированной воде до исчезновения синих струек красителя. Высушивали при комнатной температуре. Оценивали интенсивность биопленкообразования по количеству остаточного красителя в лунках с бактериями при помощи известного метода, который включал смывание (элюирование) красителя из лунок этанолом (дважды по 0,4 мл, элюаты объединяли) с последующей оценкой интенсивности окраски элюата при помощи колориметрии (светопоглощение при длине волны 610 нм) на плашечном фотометре Infinite 200М Tecan [Чеботарь И.В., Погорелов А.Г., Яшин В.А., Гурьев Е.Л., Ломинадзе Г.Г. Современные технологии исследования бактериальных биопленок. Современные технологии в медицине. - 2013. - Т. 5, № 1. - с. 14-20]. Результаты выражали в процентах относительно показателей, полученных на среде сравнения (бульон Луриа-Бертани, содержащий 1% глюкозы, предлагаемой без добавки) и обрабатывали, используя стандартные статистические методы.
Увеличение объема биопленок синегнойной палочки (Pseudomonas aeruginosa) при культивировании на среде, содержащей предлагаемую добавку, представлено в таблице 1.

В пробах сравнения, где использовалась питательная сред без добавки, интенсивность окраски элюатов составляла 100,0±5,2%. При использовании добавки интенсивность окраски элюатов составляла 158,1±8,3%, что в 1,5 раза превышало результаты, полученные на известной среде без добавки. Это говорит о том, что на питательной среде, содержащей заявляемую добавку, биопленки исследуемого штамма синегнойной палочки характеризовалась статистически достоверным увеличением биомассы по сравнению с биопленками, образованными тем же штаммом на известной питательной среде без добавки (p<0,001).
Пример 2. Добавка, состоящая из: 0,4 г фибриногена, 0,004 г плазмокоагулазы и 1 мл изотонического раствора хлорида натрия, содержащего ингибитор протеаз, представляющий собой композицию 4-(2-аминоэтил)-бензолсульфонил-фторид-гидрохлорида (104 мМ), апротинина (80 мкМ), бестатина (4 мМ), транс-эпоксисукцинил-L-лейциламидо-(4-гуанидино)-бутана (1,4 мМ), леупептина (2 мМ), пепстатина (1,5 мМ), была внесена в 99 г сердечно-мозгового бульона, содержащего 1% глюкозы.
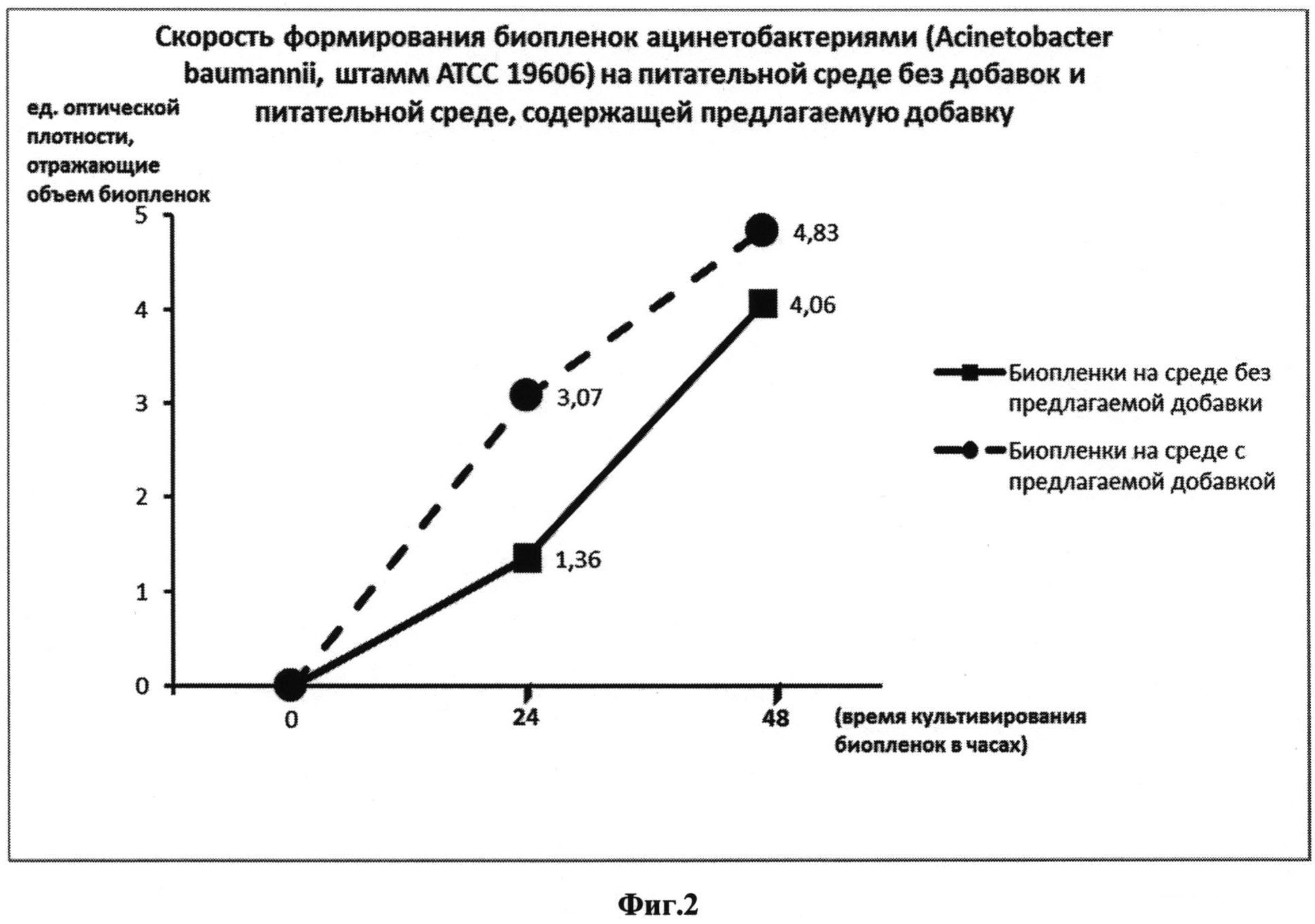
Модифицированный таким образом сердечно-мозговой бульон использовался для получения биопленок, сформированных ацинетобактериями (Acinetobacter baumannii, штамм АТСС 19606): в лунки 96-луночного планшета вносили по 0,35 мл приготовленной среды и 0,01 мл взвеси ацинетобактерий в изотоническом растворе хлорида натрия, стандартизованной до 0,5 ед. оптической мутности по МакФарланду. В качестве среды сравнения использовали сердечно-мозговой бульон, содержащий 1% глюкозы, без внесения добавки. Пробы инкубировали при 37°C. Рост биопленок исследовали на сроках 24 часа и 48 часов. Все эксперименты проводили в трех повторениях. На этих сроках инкубации лунки с бактериями при помощи пипетки дважды ополаскивали изотоническим раствором хлорида натрия (по 0,4 мл), в течение 4 минут фиксировали 4%-ным раствором формальдегида, окрашивали 1%-ным раствором красителя кристаллического фиолетового (по 0,4 мл в лунку) в течение 5 мин. При помощи пипетки удаляли краситель, ополаскивали 96-луночный планшет в дистиллированной воде до исчезновения синих струек красителя. Высушивали при комнатной температуре. Оценивали интенсивность биопленкообразования по количеству остаточного красителя в лунках с ацинетобактериями при помощи известного метода, который включал смывание (элюирование) красителя из лунок этанолом (дважды по 0,4 мл, элюаты объединяли) с последующей оценкой интенсивности окраски элюата при помощи оценки светопоглощения (при длине волны 610 нм) на плашечном фотометре Infinite 200М Tecan [Чеботарь И.В., Погорелов А.Г., Яшин В.А., Гурьев Е.Л., Ломинадзе Г.Г. Современные технологии исследования бактериальных биопленок. Современные технологии в медицине. - 2013. - Т. 5, №1, - с. 14-20]. Результаты выражали в единицах оптической плотности элюатов, рассчитанных плашечным ридером Infinite 200М Tecan на основе встроенного программного обеспечения и прямо коррелирующих с объемом биопленок. Результаты обрабатывали, используя стандартные статистические методы. Результаты представлены на Фиг. 1 графиком зависимости «Скорость формирования биопленок ацинетобактериями (Acinetobacter baumannii, штамм АТСС 19606) на среде без добавок и среде, содержащей предлагаемую добавку». В пробах сравнения, где использовалась питательная сред без добавки, интенсивность окраски элюатов составляла 1,36±0,30 через 24 часа инкубации и 3,07±0,41 через 48 часов инкубации. При использовании добавки интенсивность окраски элюатов составляла 4,06±0,35 через 24 часа инкубации и 4,83±0,31 через 48 часов инкубации. Таким образом, на сроках культивирования 24 часа и 48 часов наблюдалась статистически значимые различия между показателями биопленкообразования на среде с предлагаемой добавкой и среде без добавки (в обоих случаях p<0,05). Эти данные говорят об ускорении процесса формирования бактериальных биопленок на питательных средах, содержащих предлагаемую добавку по сравнению с известными средами без добавки.
Для экспериментов использовалась добавка, которая включала в свой состав 0,3 г фибриногена, 0,003 г тромбина, 0,03 г кальция хлорида (CaCl2) и 1 мл изотонического раствора хлорида натрия, содержащего ингибитор протеаз.
Пример 3. Добавка, состоящая из: 0,3 г фибриногена, 0,003 г тромбина, 0,03 г кальция хлорида (CaCl2) - в 1 литре среды содержится 0,107 г ионов Са2+ и 0,190 г ионов хлора, что вместе составляет 0,297 г - и 1 мл изотонического раствора хлорида натрия, содержащего ингибитор протеаз, представляющий собой композицию 4-(2-аминоэтил)-бензолсульфонил-фторид-гидрохлорида (104 мМ), апротинина (80 мкМ), бестатина (4 мМ), транс-эпоксисукцинил-L-лейциламидо-(4-гуанидино)-бутана (1,4 мМ), леупептина (2 мМ), пепстатина (1,5 мМ), была внесена в 99 г триптоно-соевого бульона, содержащего 2% глюкозы.
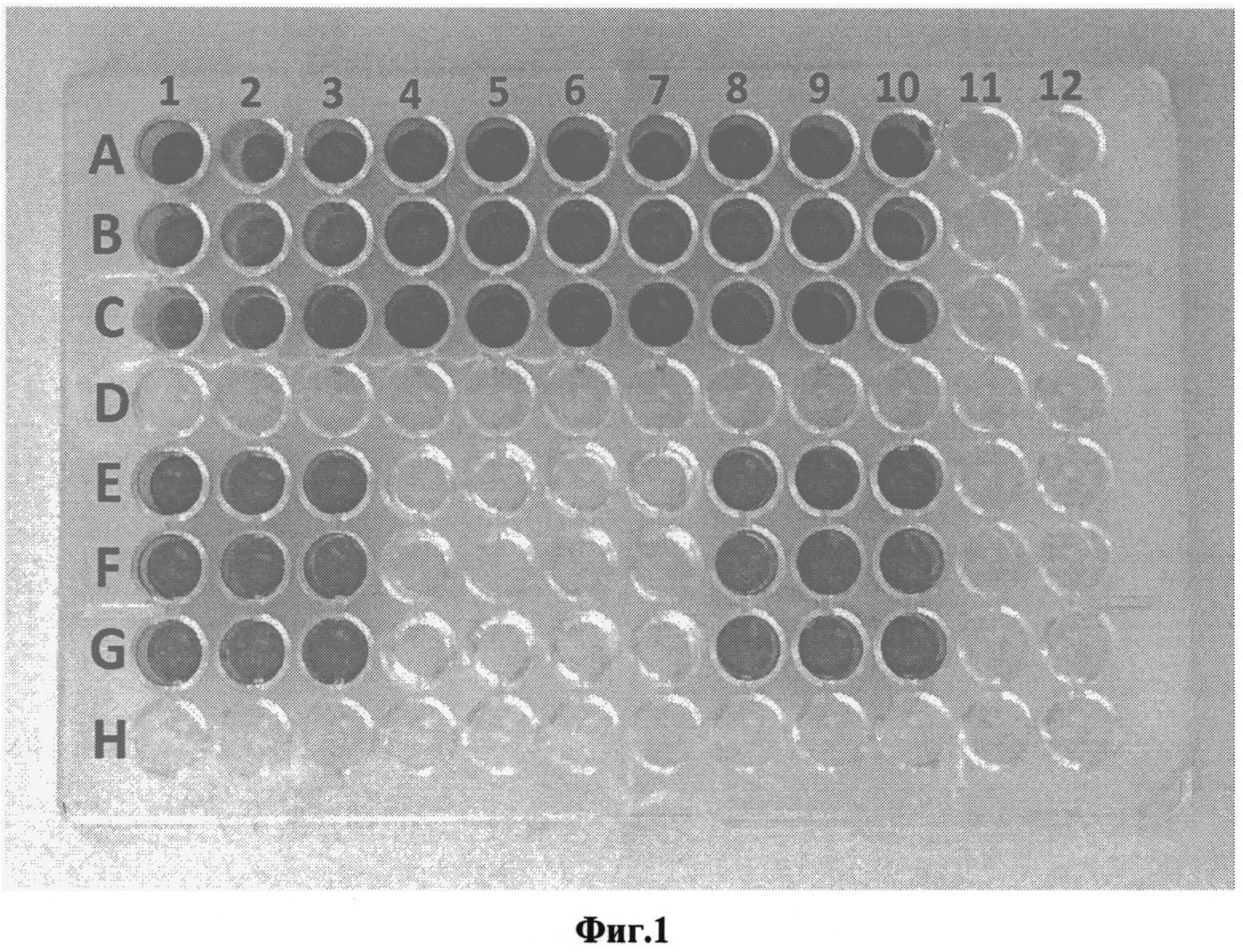
Модифицированный таким образом триптозо-соевый бульон использовался для получения биопленок, сформированных золотистым стафилококком (Staphylococcus aureus): в лунки 96-луночного планшета вносили по 0,35 мл приготовленной среды и 0,01 мл взвеси золотистого стафилококка в изотоническом растворе хлорида натрия, стандартизованной до 0,5 ед. оптической мутности по МакФарланду. В качестве среды сравнения использовали триптоно-соевый бульон, содержащего 2% глюкозы, без внесения добавки. Пробы инкубировали 48 часов при 37°C. В эксперименте были использованы 10 штаммов золотистого стафилококка, в том числе 2 штамма известных музейных культур (АТСС 29213 и V2A) и 8 штаммов, изолированных из клинических источников (штаммы 5983, 41-1764, 42-1610, 43-833, 45-380, 47-165, 49-182, 49-466). Рост биопленок, сформированных каждым штаммом, исследовали в трех повторениях (лунках). После инкубации лунки со стафилококками при помощи пипетки дважды ополаскивали изотоническим раствором хлорида натрия (по 0,4 мл), в течение 4 минут фиксировали 4%-ным раствором формальдегида, окрашивали 1%-ным раствором красителя кристаллического фиолетового (по 0,4 мл в лунку) в течение 5 мин. При помощи пипетки удаляли краситель, ополаскивали 96-луночный планшет в дистиллированной воде до исчезновения синих струек красителя. Высушивали при комнатной температуре. Биопленкообразование оценивали визуально по интенсивности окраски бактериального слоя стафилококков в лунках планшета.
Результаты в виде фотографии окрашенных биопленок показаны на Фиг. 2. Лунки, находящиеся по горизонтали в рядах А, В, С и по вертикали под номерами 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 содержат питательную среду - триптоно-соевый бульон, содержащий 2% глюкозы и предлагаемую добавку, включающую в свой состав 0,3 г фибриногена, 0,003 г тромбина, 0,03 г кальция хлорида (CaCl2) и ингибитор протеаз. Лунки, находящиеся по горизонтали в рядах Е, F, G и по вертикали под номерами 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, содержат питательную среду - триптоно-соевый бульон, содержащий 2% глюкозы без предлагаемой добавки. В лунках под номером 1 культивировался золотистый стафилококк (Staphylococcus aureus), штамм АТСС 29213. В лунках под номером 2 культивировался золотистый стафилококк (Staphylococcus aureus), штамм V2A. В лунках под номером 3 культивировался золотистый стафилококк (Staphylococcus aureus), штамм 5983. В лунках под номером 4 культивировался золотистый стафилококк (Staphylococcus aureus), штамм 41-1764. В лунках под номером 5 культивировался золотистый стафилококк (Staphylococcus aureus), штамм 42-1610. В лунках под номером 6 культивировался золотистый стафилококк (Staphylococcus aureus), штамм 43-833. В лунках под номером 7 культивировался золотистый стафилококк (Staphylococcus aureus), штамм 45-380. В лунках под номером 8 культивировался золотистый стафилококк (Staphylococcus aureus), штамм 47-165. В лунках под номером 9 культивировался золотистый стафилококк (Staphylococcus aureus), штамм 49-182. В лунках под номером 10 культивировался золотистый стафилококк (Staphylococcus aureus), штамм 49-466. При использовании добавки интенсивная окраска, которая свидетельствует о наличии биопленки, была выявлена для всех штаммов золотистого стафилококка: АТСС 29213, V2A, 5983, 41-1764, 42-1610, 43-833, 45-380, 47-165, 49-182, 49-466. Все перечисленные штаммы золотистого стафилококка формировали биопленки на питательной среде, содержащей заявляемую добавку. В пробах сравнения, где использовалась питательная среда без добавки, интенсивная окраска, которая свидетельствует о наличии биопленки, была выявлена для 6 штаммов золотистого стафилококка: АТСС 29213, V2A, 5983, 47-165, 49-182, 49-466. Лунки, в которых культивировались штаммы 41-1764, 42-1610, 43-833, 45-380 не были окрашены. Это говорит о том, что лишь 60% штаммов формировали биопленку на известной питательной среде без предлагаемой добавки.
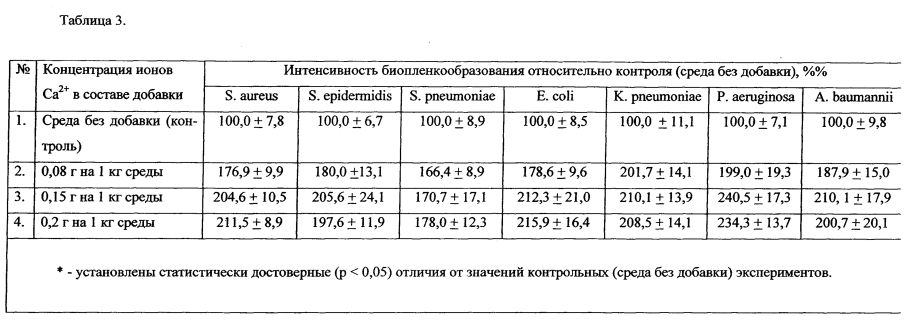
В качестве добавки к питательной среде по п. 3. формулы изобретения использовали следующие концентрации кальция хлорида в 1 кг питательной среды:
- 0,22 г на 1 кг питательной среды (соответствует количеству ионов Са2+, равному 0,08 г на 1 кг питательной среды);
- 0,42 г на 1 кг питательной среды (соответствует количеству ионов Са2+, равному 0,15 г на 1 кг питательной среды);
- 0,55 г на 1 кг питательной среды (соответствует количеству ионов Са2+, равному 0,2 г на 1 кг питательной среды).
Интервал концентрации ионов Са2+ составлял от 0,08 до 0,2 г на 1 кг питательной среды. Результаты, представленные в Таблице 3, продемонстрировали значительное увеличение объема биопленок при культивировании на среде, содержащей предлагаемую добавку с разными концентрациями ионов кальция.
Таким образом, при использовании добавки достигнут качественно иной эффект, который заключался в том, что в присутствии предлагаемой добавки наблюдалось биопленкообразование штаммами стафилококка, которые не были способны формировать биопленки на питательных средах без предлагаемой добавки.
Предлагаемые добавки универсальны, их можно вводить в состав разных питательных сред, предназначенных для культивирования различных видов бактерий с целью моделирования биопленок. Использование предлагаемой добавки позволяет получить биопленки на основе штаммов бактерий, которые не способны формировать биопленки на известных питательных средах без предлагаемой добавки.
Предлагаемые добавки ускоряют процесс формирования бактериальных биопленок на питательных средах по сравнению с известными средами без добавки.
Приготовление добавки технически достижимо при массовом производстве.
Среды, содержащие ее в своем составе, могут быть стерилизованы общепринятыми методами, например фильтрацией, имеют достаточный срок хранения без потери полезных свойств и не требуют особых условий утилизации после использования.