Результат интеллектуальной деятельности: АНТИТРОМБОТИЧЕСКОЕ СРЕДСТВО ИЗ ЦЕЛЛЮЛОЗЫ ПИХТЫ СИБИРСКОЙ
Вид РИД
Изобретение
Изобретение относится к области химико-фармацевтической промышленности и медицины и может быть использовано для создания эффективного средства для профилактики и лечения тромботических состояний у людей (инфаркты, инсульты различной локализации).
В современной медицинской практике для профилактики и лечения тромбозов используют, в том числе, и антитромботические (АТБ) препараты сульфатированного полисахарида (гликозаминогликана) - антикоагулянта прямого действия гепарина. Подобные гепарину полимеры и сульфатированные полисахариды находят как в тканях морских беспозвоночных, так и в водорослях.
Из морского беспозвоночного асцидии Styela plicata Santos J. и др. [1] выделили гепарин и определили структурные единицы: ΔUA (2SO4)-1→4-β-D-GlcN(SO4) (47.5%), ΔUA(2SO4)-1→4-β-D-GlcN(SO4)(6SO4) (38.3%), ΔUA(2SO4)-1→4-β-D-GlcN(SO4)(3SO4) (6SO4) (2.8%), ΔUA(2SO4)-1→4-β-D-GlcN(SO4)(3SO4) (8.0%). Антитромбиновая (aIIa) активность гепарина беспозвоночных, измеренная в тесте активированного частичного тромбопластинового времени (АЧТВ), составила 18 ЕД/мг, активность против фактора Ха (аХа активность) не превышала 2 ЕД/мг. Поэтому на модели венозного тромбоза у крыс гепарин из S.plicata на 80% ингибировал увеличение размеров тромба в 10 раз большей дозой, чем требовалось для 100% ингибирования при введении нефракционированного гепарина (НФГ).
В 2012 году Chen S. и др. [2] показали, что полисахарид фукан, выделенный из морского огурца Isostichopus badionotus с повторяющимся тетрасахаридным звеном в структуре [→3Fuc(2c, 4S)α1→3Fuc(2 S)α1→3Fuc(2S)α1→3Fuc α1→]n S) α1→3Fuc (2S) α1→3Fuc α1→]n, обладает высокими антикоагулянтной (AK, при потенцировании активности антитромбина) и антитромботической (АТБ) активностями. Удлинение времени свертывания плазмы в тестах АЧТВ, тромбинового времени (ТВ) и степень ингибирования активности тромбина зависят от степени сульфатирования (СС) 2,4-O-сульфатированных ветвей фукозы, входящих в состав фукозилированных сульфатов хондроитина Е, выделенных из морских огурцов Isostichopus badionotus и Pearsonothuria graeffei; тогда как ингибиторный эффект фуканов на активацию факторов X, XII и на появление тромба авторы связывают с полной структурой полисахаридов.
В лечебной практике на основе гепарина существует несколько препаратов: нативный НФГ, средняя молекулярная масса - ММ ~15000), низкомолекулярный гепарин (полусинтетический НМГ, ММ ~6000) и ультра низкомолекулярный гепарин (синтетический, ММ<2000). Антикоагулянтная активность гепаринов обусловлена наличием в молекулах полисахаридов антитромбин-связывающей пентасахаридной последовательности {GlcNAc (6SO4)-GlcA-GlcNS (3SO4)-IdoA (2SO4)-GlcNS (6SO4)} [3]; эта последовательность активирует антитромбин (плазменный ингибитор сериновых протеаз - серпин), после чего скорость ингибирования антитромбином активности тромбина, факторов IXa и Ха увеличивается на 2-3 порядка. Однако НФГ в одинаковой степени антитромбин-зависимо ингибирует активность тромбина и фактора Ха (отношение активностей aXa/aIIa=0,9-1,2), НМГ - в большей степени активность фактора Ха (aXa/aIIa=1,5-2,5), а пентасахарид - только активность фактора Ха (активности против тромбина нет). Как правило, с увеличением АК активности гепаринов возрастает их АТБ активность. Аптечные препараты гепаринов получают из тканей млекопитающих (слизистой оболочки кишечника свиней или легких крупного рогатого скота).
Однако поскольку нефракционированный гепарин получают и из тканей жвачных млекопитающих, то данный антикоагулянт может содержать прионы или сульфат хондроитина [4], а также провоцирует тромбоцитопении, кровотечения, остеопорозы.
Наиболее близким по сущности и назначению к предлагаемому изобретению является антитромботическое средство - сульфат целлюлозы, выделенный из древесины пихты с молекулярной массой 3600, полученный сульфатированием хлорсульфоновой кислотой в 1,4-диоксане по методике, описанной в патенте №2404994 [5].
Недостатками данного изобретения является недостаточная антитромботическая активность. Кроме того, в процессе сульфатирования происходит деполимеризация как исходного, так и сульфатированного полисахаридов, что может привести к значительной деструктуризации сульфатированной целлюлозы по сравнению с исходной целлюлозой и к снижению антитромботической и антикоагулянтной активности сульфатированной целлюлозы.
Известно, что с увеличением молекулярной массы сульфатов полисахаридов из растительного сырья антикоагулянтная активность иногда увеличивается.
Задача изобретения - получение соединения на основе растительного полисахарида с большей антитромботической активностью.
Технический результат изобретения - получено эффективное средство профилактики и лечения тромботических состояний на основе химически модифицированной целлюлозы, выделенной из растительного сырья.
Технический результат достигается тем, что получено антитромботическое средство на основе сульфатированного целлюлозного материала, отличающееся тем, что оно представляет собой сульфат целлюлозы, полученный из частично гидролизованной древесины пихты путем сульфатирования комплексом пиридина с хлорсульфоновой кислотой.
Целлюлоза - это полисахарид, макромолекула которого построена из повторяющихся звеньев - остатков β-D-глюкопиранозы с общей формулой (C6H10O5)n, и являющийся самым распространенным органическим соединением, которое выделяют из травянистых и древовидных растений.
Получение антитромботического средства осуществляли следующим образом.
Исходную микрокристаллическую целлюлозу (МКЦ) получали по способу, описанному в патенте [6]. Сульфатирование МКЦ пихты проводили предварительно полученным комплексом из пиридина и хлорсульфоновой кислоты (C5H5N·SO3) по методике, описанной в патенте [7]. Степень замещения в образцах находили по уравнению: C3s=162·ωs/3200-ωs·103, где ωs - содержание серы, % [8]. Содержание серы в сульфате МКЦ (СЦ) определяли по модифицированной методике сжиганием в токе кислорода с последующим поглощением продуктов сжигания пероксидом водорода и титрованием щелочью в присутствии индикатора метилового красного [9]. Элементный состав МКЦ и СЦ определяли на элементном анализаторе Flash ЕА-1112 (Thermo Quest Italia). Среднюю молекулярную массу СЦ определяли вискозиметрическим методом в соответствии с рекомендациями [10]. ИК-спектры сняты на ИК-Фурье спектрометре Tensor-27 (Bruker, Германия) в области длин волн 400-4000 см-1. Обработка спектральной информации проведена по программе OPUS (версия 5.0). Твердые образцы для анализа готовили в виде таблеток в матрице KBr (2 мг образца/1000 мг KBr). Структурные параметры СЦ составили: степень сульфатирования 1.65, количество серы 15,8%, динамическая вязкость 1.65 сПа, ММ 80 kDa.
Специфические антикоагулянтные (АК) активности полученной субстанции СЦ оценивали по времени свертывания плазмы крови человека в коагулологических тестах активированного частичного тромбопластинового времени (АЧТВ) и с использованием теста РеаКлот-Гепарин (НПО "Ренам", Москва). Лиофильно высушенную плазму человека приобретали в НПО «Ренам». Для расчета антитромбиновой (aIIa) и анти-фактор Ха (аХа) активностей использовали калибровочные кривые НФГ (ОАО "Белмедпрепарат"; ММ 15 кДа, aIIa активность 160 ЕД/мг, аХа активность 145 ЕД/мг).
Величина антитромбиновой активности СЦ (aIIa>70 ЕД/мг) в экспериментах in vitro позволила провести оценку ex vivo АТБ и геморрагической активностей. Эти исследования проводили с использованием лабораторных животных (крыс), которых получали из питомника РАМН "Столбовая". Все опыты осуществляли с соблюдением "Правил для проведения работ с использованием экспериментальных животных" (Приказ Минздрава СССР от 12.08.1977 №755 "О мерах по дальнейшему совершенствованию огранизационных форм работы с использованием экспериментальных животных) и "Правил лабораторной практики" (приложение к Приказу Минздравсоцразвития России от 23 августа 2010 г. № 708н). В качестве препарата сравнения использовали НФГ (ОАО "Белмедпрепарат"; ММ 15 кДа, aIIa активность 160 ЕД/мг, аХа активность 145 ЕД/мг, аХа/aIIa=0,91). Для оценки АТБ активности использовали модель венозного тромбоза у крыс, основанную на оценке формирования тромба, индуцированного двумя факторами - активацией свертывания и стазом [11]. В результате венозный тромб состоит из фибрина и эритроцитов. Нами показано, что с увеличением дозы СЦ и НФГ (ОАО "Белмедпрепарат"; ММ 15 кД, aIIa активность 160 ЕД/мг, аХа активность 145 ЕД/мг) увеличивалась АТБ активность при моделированном венозном тромбозе у крыс. Для достижения 50% ингибирования роста тромба СЦ требовалось в 2 раза больше, чем НФГ. Ранее Wu В. и Xu J. показали, что для снижения размеров тромбов на 42,5%, при моделировании артерио-венозного шунта у крыс, необходимо введение НФГ в дозе 0,6 мг/кг. Min S. и др. на модели артериального тромбоза у мышей наблюдали 100% АТБ эффект при введении НФГ в дозе 0,8 мг/кг [12].
Кровотечение - основное осложнение при АК терапии, даже при достижении терапевтических диапазонов антикоагулянтной активности плазмы. Поэтому мы оценивали геморрагическую активность СЦ при внутривенном введении крысам. Геморрагическую активность СЦ [13] по подкожным кровоизлияниям определяли при введении в одинаковых с препаратом сравнения НФГ дозах (по aIIa активности). С увеличением дозы СЦ и НФГ (ОАО "Белмедпрепарат"; ММ 15 кДа, aIIa активность 160 ЕД/мг, аХа активность 145 ЕД/мг) геморрагическая активность возрастала. Однако в сравнении с контролем, в зависимости от дозы, концентрации гемоглобина в гемолизатах крови крыс после введения СЦ и НФГ были в 10-200 и 40-800 раз больше, соответственно. Меньший в 4 раза геморрагический эффект СЦ можно объяснить в 2 и 10 раз меньшими, чем у гепарина, ингибиторными активностями по отношению к тромбину и фактору Ха, соответственно.
Возможность осуществления заявляемого изобретения показана следующими примерами:
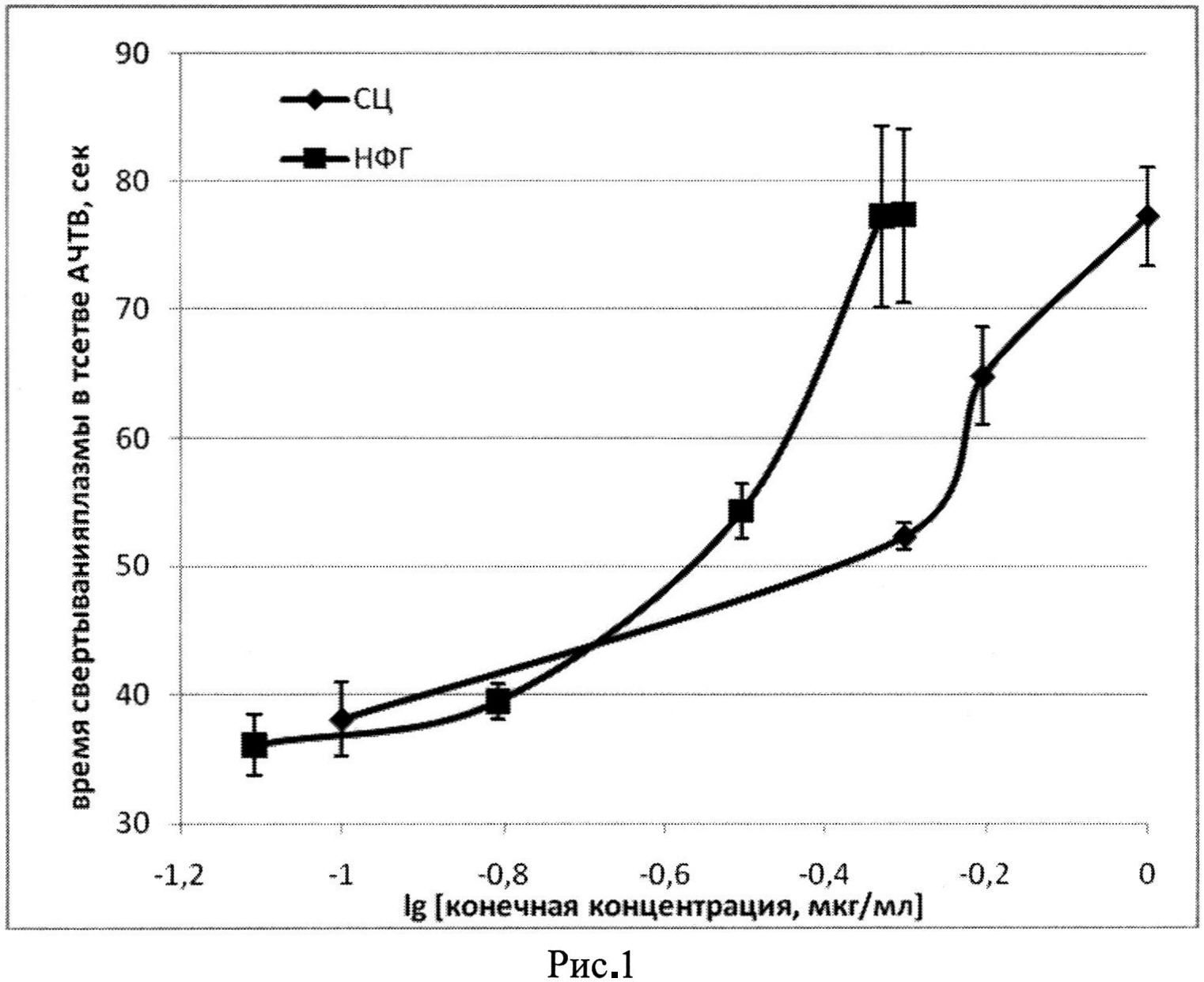
Пример 1. Определение антитромбиновой активности субстанции СЦ: К смеси 0,06 мл плазмы и 0,06 мл АЧТВ-реагента (НПО "Ренам") добавляем 0,02 мл раствора СЦ или НФГ (ОАО "Белмедпрепарат"; aIIa=160 ЕД/мг) в конечных концентрациях 0,08-1,0 мкг/мл. Через 3 мин инкубирования при 37°C добавляем 0,06 мл 0,025 М раствора CaCl2 и на коагулометре «Минилаб 701-М», фиксируем время (сек) появления фибринового сгустка. На фиг. 1 показано влияние разных концентраций СЦ и НФГ на время свертывания плазмы человека в тесте АЧТВ (время свертывания плазмы без антикоагулянтов 33,9±1,1 сек). Сравнивая показания кривых СЦ концентрация-время свертывания плазмы в 4-независимых определениях с калибровочными кривыми НФГ (ОАО "Белмедпрепарат"), определяем антитромбиновую (aIIa) активность СЦ [14]; aIIa активность СЦ составила 83,4±0,7 ЕД/мг.
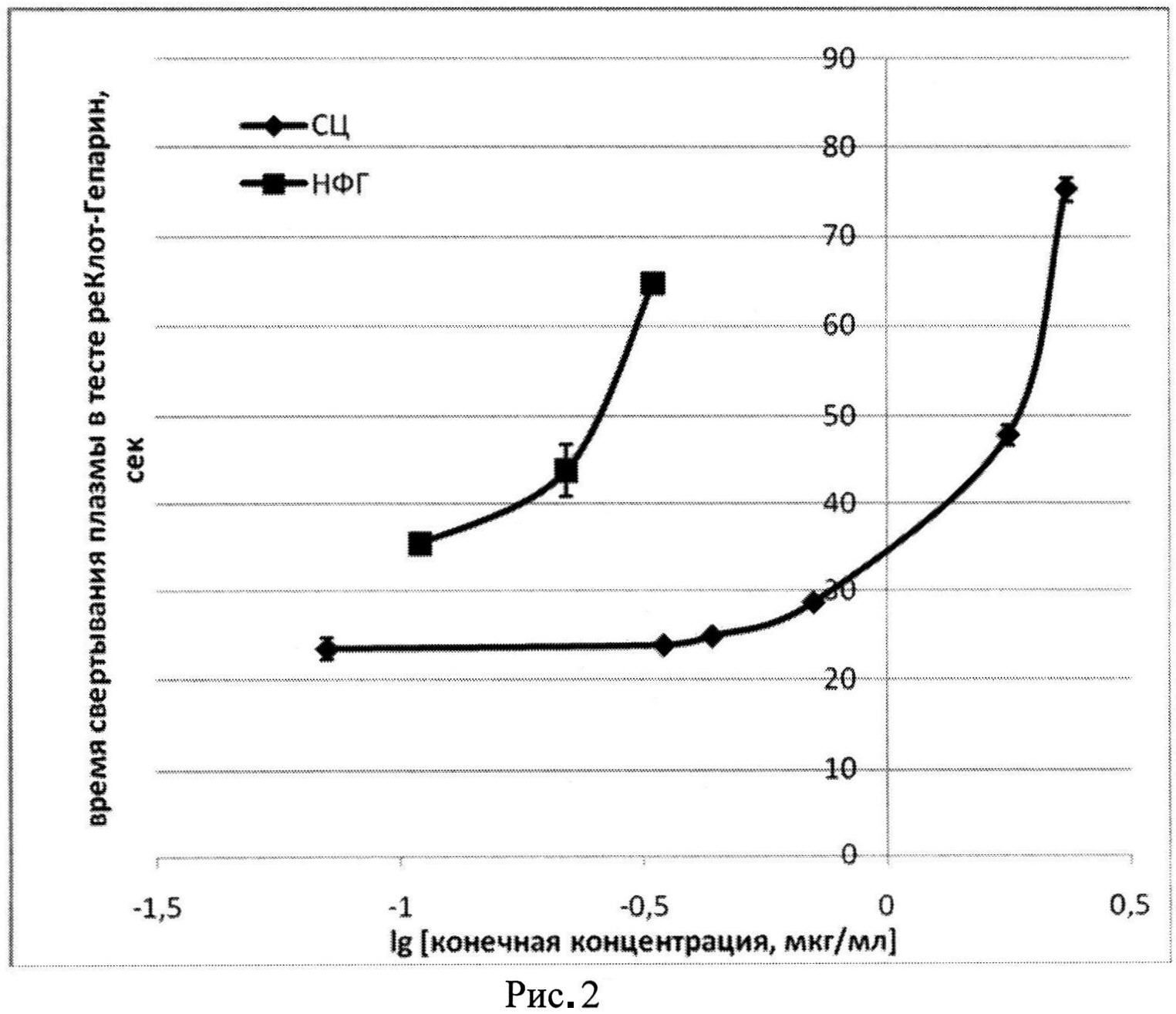
Пример 2. Определение анти-фактор Ха активности субстанции СЦ: К смеси 0,069 мл плазмы и 0,035 мл раствора фактора Ха (тест РеаКлот-Гепарин, НПО "Ренам") добавляем 0,01 мл раствора СЦ или НФГ (ОАО "Белмедпрепарат"; аХа=145 ЕД/мг) в конечных концентрациях 0,07-2,36 мкг/мл. Через 2 мин инкубирования при 37°C добавляем 0,06 мл 0,035 М раствора CaCl2 и на коагулометре «Минилаб 701-М» фиксируем время (сек) появления фибринового сгустка. На фиг. 2 показано влияние СЦ и НФГ на время свертывания плазмы человека в тесте РеаКлот-Гепарин (время свертывания плазмы без антикоагулянтов 30,6±2,6 сек). Сравнивая показания кривых СЦ концентрация-время свертывания плазмы в 4-независимых определениях с калибровочными кривыми НФГ (ОАО "Белмедпрепарат"), определяем анти-фактор Ха (аХа) активность СЦ [14]; аХа активность СЦ составила 18,3±0,2 ЕД/мг.
Пример 3. Антитромботическую активность (АТБ) СЦ оцениваем, моделируя венозный тромбоз по Wessler S. и др. [11] у 41 крысы самцов Wistar массой 250-350 г. Для наркоза крысам внутрибрюшинно вводим нембутал в дозе 60 мг/кг. Растворы СЦ в дозах 1, 3, 4 и 5 мг/кг вводим в левую яремную вену (препарат сравнения НФГ ОАО "Белмедпрепарат" вводим дозах 1 и 2 мг/кг), а через 15 мин - активированную стеклом сыворотку человека. Затем перевязываем нитью участок противоположной вены, не использованной для введения АК, и через 15 мин вырезаем перевязанный участок вены и извлекаем содержимое в малую чашку Петри. Эффективность АТБ активности оцениваем: 1) в баллах от 0 (тромба нет) до 4 (один большой тромб) по форме тромба, извлеченного из перевязанного участка вены; 2) по концентрации белка в гомогенате тромба, измеренной по Лоури; содержание белка в испытуемой пробе устанавливаем по калибровочной кривой, построенной с раствором фибриногена (Behring, Германия) в концентрациях от 10 до 400 мкг/мл; 3) по размеру изображения тромба в электронном формате JPG в пикселах. С увеличением дозы СЦ снижаются: форма тромбов с 3,33 до 0 баллов, размер тромбов с 727 до 0 пкс и концентрация белка в гомогенатах тромбов с 1,28 до 0 мг/мл (табл. 1). При введении СЦ в дозе 5 мг/кг и НФГ в дозе 2 мг/кг тромбов не наблюдаем. Отмечаем достоверные различия формы тромбов между показаниями при введении физиологического раствора и СЦ, начиная с дозы 3 мг/кг, а различия размеров тромбов и концентрации белка в гомогенатах тромбов - начиная с дозы 1 мг/кг.
Пример 4. Геморрагическую активность определяем на 68 крысах самцах Wistar массой 200-250 г [13]. Антикоагулянты (СЦ и НФГ ОАО "Белмедпрепарат") в дозах 50, 100 и 200 aIIa ЕД/кг вводим в яремную вену и через 30 с надрезаем кожу со стороны спины. Под кожу на глубину 10 см вводим острые концы ножниц, раздвигаем бранши на 4 см и в таком положении извлекаем ножницы, достигая отсепарирования кожи от подлежащих тканей. Под кожу помещаем марлевую салфетку размером 14×14 см. Через 30 мин извлекаем салфетку и проводим гемолиз эритроцитов, добавляя 10 мл дистиллированной воды. Через 2 ч после полного гемолиза эритроцитов измеряем оптическую плотность проб на спектрофотометре при длине волны 540 нм. Содержание гемоглобина в пробах оцениваем по калибровочной кривой на гемоглобин кролика (Sigma). По концентрации гемоглобина в гемолизатах крови крыс, с увеличением дозы от 50 до 200 aIIa ЕД/кг для СЦ (0,0022±0,0011-0,0420±0,0060 г/л) и НФГ (0,0075±0,0026-0,1634±0,0109 г/л) наблюдаем достоверные различия (р=0,0018-0,012; р=0,0018, соответственно) с показаниями в контроле (доза 0 мг/кг - 0,00020±0,00003 г/л) (табл. 2). Достоверные различия в показаниях между СЦ и НФГ наблюдаем при введении в дозах 100 и 200 aIIa ЕД/кг (р=0,012).
Преимуществом заявляемого средства, в сравнении с прототипом является большая в 1,5 раза антитромботическая активность, величина которой позволяет оценить противотромботический эффект на модели экспериментального тромбоза.
Список литературы
1. Santos J.C., Mesquita J.M., Belmiro C.L., da Silveira С.В., Viscov С., Mourier P.A., Pavao M.S. Isolation and characterization of a heparin with low antithrombin activity from the body of Styela plicata (Chordata-Tunicata). Distinct effects in venous and arterial models of thrombosis. // Thromb Res. - 2007. - V. 121, №2. - p. 213-223.
2. Chen S., Hu Y., Ye X., Li G., Yu G., Xue C., Chai W. Sequence determination and anticoagulant and antithrombotic activities of a novel sulfated fucan isolated from the sea cucumber Isostichopus badionotus // Biohcim. Biophys. Acta. - 2012. - V. 1820. - № 7. - p. 989-1000.
3. Bjork I., Lindahl U. Mechanism of the anticoagulant action of heparin // Molec. Cellur. Bioch. - 1982. - V 48. - № 3. - p. 161-182.
4. Bannach O., Reinartz E., Henke F., Dressen F., Oelschlegel A., Kaatz M., Groschup M., Willbold D., reisner D., Birkmann E. Analysis of prion protein aggregates in blood and brain from pre-clinical and clinical BSE cases // Vet. Microbiol. - 2013. - V. 166. - №. 1-2. - p. 102-108.
5. Автореферат диссертации «Антикоагулянтная активность сульфатированной целлюлозы и аптамера RA36». Савчик Е.Ю. 2012.
6. Патент RU №2203995, опубл. 10.05.2003.
7. Патент RU №2426746, опубл. 20.08.2011.
8. Торлопов М.А. Получение порошковых материалов деструкцией целлюлозы кислотами Льюиса и их модификация. Сульфатирование порошковых материалов, полученных деструкцией целлюлозы кислотами Льюиса / М.А. Торлопов, С.В. Фролова // Химия растительного сырья. - 2008. - №3. - С. 63-67.
9. Черонис Н.Д., Ma Т.С. Микро- и полумикрометоды органического функционального анализа. М.: Химия, 1973. 576 с.
10. Петропавловский, Г.И. Гидрофильные частично замещенные эфиры целлюлозы и их модификации путем химического сшивания / Г.И. Петропавловский. - Л.: Химия, 1988. - 288 с.; Геллер А.А. Практическое руководство по физико-химии волокно - образующих полимеров / А.А. Геллер, Б.Э. Геллер. - Л.: Химия, 1972. - 200 с.
11. Wessler S., Reimer S., Sheps M. Biologic assay of a thrombosis-inducing activity in human serum // J. Appl Physiol. - 1959. - №14. - p. 943-946.
12. Wu B., Xu J. Antithrombotic effect of a novel protein from Fusarium sp. CPCC 480097 in a rat model of artery-vein bypass thrombosis // Pharm Biol. - 2012. - V. 50. - № 7. - p. 866-870.
13. Hobbelen P., Vogel G., Meuleman D Time courses of the antithrombotic effects, bleeding enhancing effects and interactions with factors Xa and thrombin after administration of low molecular weight heparinoid Org 10172 or heparin to rats., Thromb Res. - 1987. - V. 48. - № 5. - p. 549-558.
14. Barrowcliffe T.W., Johnson E.A., Eggleton C.A., Kemball-Cook G., Thomas D.P. Anticoagulant activities of high and low molecular weight heparin fraction // Br. J. Haematol. - 1979. - V. 41. - №4. - p. 573-583.
Антитромботическое средство на основе сульфатированного целлюлозного материала, отличающееся тем, что оно представляет собой сульфат целлюлозы с молекулярной массой 80000 Да, полученный из частично гидролизованной древесины пихты сульфатированием комплексом пиридина и хлорсульфоновой кислоты.