БАКТЕРИАЛЬНЫЕ КОМПОЗИЦИИ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНОГО ЗАБОЛЕВАНИЯ
Вид РИД
Изобретение
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет находящейся одновременно на рассмотрении Предварительной заявки США No. 61/174740, поданной 1 мая 2009 г., полное содержание которой включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее описание относится к улучшенной пероральной композиции бактерий с высокой активностью bsh, их изоляту или супернатанту и к способам получения улучшенной композиции. Настоящее описание относится также к способам и применениям улучшенной пероральной композиции для снижения уровня холестерина в сыворотке, уровня липидов в сыворотке, количества жировой ткани или индекса атерогенности, и для профилактики и лечения атеросклероза, сердечно-сосудистых или цереброваскулярных заболеваний.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Гиперхолестеринемия и болезнь коронарных артерий
Болезнь коронарных артерий (CAD) является лидирующей причиной смерти, наиболее распространенной формой заболевания сердца и наиболее распространенной причиной внезапной смерти в западном мире. Клинические и эпидемиологические свидетельства установили явную связь между повышенным уровнем холестерина в сыворотке и CAD. Внутри практически здоровых популяций существует экспоненциальная зависимость между уровнем холестерина в сыворотке и риском болезни коронарных артерий. В среднем возрасте риск CAD увеличивается на 2-3% на каждый 1% увеличения уровней холестерина.
По оценкам 107 миллионов взрослых американцев имеют общий уровень холестерина в сыворотке 5,18 ммоль/л (200 мг/дл) и выше. Из них, приблизительно 37 миллионов имеют уровни 6,22 ммоль/л (240 мг/дл) или выше. У взрослых общие уровни холестерина 6,22 ммоль/л или выше рассматривают как высокий риск связанных с сердечно-сосудистой системой патологий, в то время как уровни между 5,18 и 6,22 ммоль/л рассматривают как находящиеся на грани высокого риска. Согласно рекомендациям Национальной образовательной программы по холестерину (NCEP), первоочередной целью любой терапии является снижение уровней холестерина ЛНП (Third Report of the NCEP Expert Panel 2002). Новые руководства в настоящее время рассматривают другие факторы риска, такие как возраст, семейная история, курение, гипертензия, низкий уровень ЛВП и сахарный диабет, при определении пороговых уровней холестерина, требующих вмешательства. Таким образом, целевые ЛНП при первичной профилактике зависят от абсолютного риска связанных с CAD событий у пациента в течение короткого времени или длительного времени. В настоящее время, согласно недавно пересмотренным рекомендациям NCEP, дополнительно 36 миллионов граждан США следует лечить из-за высокого уровня холестерина. В настоящее время менее половины пациентов с основаниями для модифицирующей липиды терапии получают ее, и только треть пациентов после лечения достигают своего целевого холестерина ЛНП.
Патогенез атеросклероза
Вовлечение повышенных уровней холестерина ЛНП в атеросклероз и CAD хорошо документировано. Атеросклероз начинается с удержания содержащих аполипопротеин B липопротеинов (например, холестерина ЛНП) в артериальной стенке. С течением времени липопротеины, удержанные в артериальной стенке, становятся модифицированными (например, подвергаются агрегации и окислению) и вызывают каскад биологических ответов, развивающийся в недостаточно адаптируемый воспалительный ответ (Tabas et al 2007) В частности, моноциты входят в субэндотелий, дифференцируются в макрофаги и поглощают остаточные модифицированные липопротеины, становясь нагруженными холестерином пенистыми клетками. С течением времени воспалительные клетки входят в очаги и способствуют вкладу в вышеупомянутый недостаточно адаптируемый воспалительный ответ, этот процесс усиливается умножением удержания липопротеинов в развившихся очагах. Процесс, опосредованный цитокинами и факторами роста, заставляет гладкомышечные клетки мигрировать и формировать коллагеновое фиброзное утолщение (зрелая атеросклеротическая бляшка), наиболее вероятно, в качестве подобного шраму ответа, чтобы отгородить очаг (Tabas et al 2007). Однако, при прогрессировании очага, макрофаги погибают, образуя области некроза, содержащие внеклеточный дебрис, кристаллы холестерина, протеазы и тромботический материал. В этой точке фиброзное утолщение утончается, может произойти разрыв или эрозия бляшки, потенциально приводящие к острым тромботическим сосудистым событиям, таким как инфаркт миокарда и удар.
Липопротеины высокой плотности играют ключевую роль в «обратном транспорте холестерина», пути, посредством которого избыточный холестерин выводится из внепеченочных клеток и возвращается в печень для выведения из организма. Считают, что в периферических тканях ЛВП удаляют клеточный холестерин посредством множества механизмов, включая взаимодействие аполипопротеинов ЛВП с участками связывания или рецепторами на поверхности клеток (Tall, 1998). Действие лецитин-холестерин-ацилтрансферазы (LCAT) превращает абсорбированный холестерин в эфиры холестерина и в свою очередь, может увеличивать всасываемость ЛВП. При возвращении в печень холестерин может подвергаться метаболизму до солей желчных кислот и выведению из организма. Холестерин ЛНП и ЛВП являются главными факторами в поддержании баланса холестерина в организме, и высокое отношение ЛВП к ЛНП коррелирует с более низкой заболеваемостью CAD у человека
Высокие уровни триглицеридов в сыворотке сходным образом являются факторами риска для атеросклероза и CAD. Конкретные причины этого включают увеличенную продукцию атерогенных хиломикрон и остатков ЛПОНП, обратную зависимость, существующую между сывороточным уровнем триглицеридов и ЛПВП, возможное суммарное увеличение ЛПНП, обусловленное снижаемыми остатками уровнями рецепторов ЛПНП, а также формированием более плотных и, таким образом, более атерогенных, ЛПНП и взаимодействием между сывороточными триглицеридами и системой фибринолиза/свертывания. Из-за множества связей между повышенными уровнями триглицеридов и риском атеросклеротического сердечно-сосудистого заболевания, скрининг по гипертриглицеридемии является важным при определении риска у пациента риска атеросклеротического сердечно-сосудистого заболевания.
Иммунные ответы при атеросклерозе
Считают, что патогенез атеросклероза включает в себя дислипидемию, дисфункцию эндотелия сосудов и хронический воспалительный процесс. Показано, что несколько медиаторов вовлечены во внутриклеточную передачу сигналов при атеросклерозе, включая малые молекулы, такие как оксид азота, липидные медиаторы, такие как эйкозаноиды и стерины, и цитокины. Воспаление опосредовано цитокинами, гликопролтеинами, вовлеченными в передачу сигнала от клетки к клетке, продуцируемыми макрофагами и дендритными клетками в эпителии в ответ на стимуляцию антигеном или чужеродным телом. Иммунный ответ вовлечен в формирование ранних жировых прожилок, когда эндотелий активируется и экспрессирует хемокины и молекулы адгезии, что приводит к рекрутированию моноцитов/лимфоцитов и инфильтрации в субэндотелий. Он также действует в начале неблагоприятных клинических сосудистых событий, когда активированные клетки внутри плашки секретируют матриксные протеазы, вызывающие деградацию белков внеклеточного матрикса и ослабление фиброзного утолщения, приводя к разрыву и образованию тромба. Недавно показали связь toll-подобных рецепторов (TLR) на поверхности эпителия желудка и кишечника с индукцией воспалительного ответа, помогающей вызывать сигнал запуска продукции провоспалительных цитокинов (Tobias and Curtiss, 2007).
Особое значение придают вкладу про- и антивоспалительных цитокинов в патогенный (врожденный и приобретенный) и регуляторный иммунитет в контексте атеросклероза. Цитокины можно разделить на цитокины в основном с провоспалительным образом действия, включая фактор некроза опухоли (TNF-альфа), интерлейкин-12, IL-18 и интерферон гамма, и цитокины с противовоспалительнм образом действия, включая IL-4, IL-10, IL-13 и эндогенный антагонист рецепторов IL-1 IL-1ra. В ответ на местное окружение цитокинов, CD4+ клетки подвергаются дифференцировке в линию Th1 (провоспалительных) или Th2 (противовоспалительных). Среди принципиальных индукторов Th1 и Th2 клеток присутствуют IL-12 и IL-10, соответственно. Цитокины, вовлеченные в процесс Th1, включают в себя IL-2, IFN-гамма и TNF, в то время как цитокины, вовлеченные в процесс Th2, включают в себя IL-3, IL-4, IL-5, IL-6, IL-10 и IL-13. Идентифицировано более 30 главных членов семейства интерлейкина, большинство из которых играют роль в атерогенезе. Конкретно, им приписывают первичные антиатерогенные (IL-1ra, IL-9, IL-10, IL-11) и проатерогенные (IL-1, IL-2, IL-6, IL-18) свойства. Модуляция этих интерлейкинов представляет собой способ иммунотерапии при атеросклерозе, наиболее ожидаемый для применения. Считают, что бактерии кишечника инициируют воспалительный ответ, когда TLR эпителия узнают мотивы не относящихся к симбионитам микроорганизмов, и этот цитокиновый сигнал может передаваться с увеличением риска атеросклероза. Последствием этого ответа является то, что необходима симбиотическая микрофлора для поддержания гомеостаза кишечника посредством узнавания ее невоспалительных мотивов посредством TLR. Недавние исследования показали, что количество провоспалительных цитокинов, продуцируемых в кишечнике, можно сильно уменьшать введением симбиотических бактерий (Lactobacillus acidophilus), вводимых в свободном состоянии в солевом растворе или в кисломолочных продуктах (Urbanska et al 2009). Эти исследования показали, что L. acidophilus уменьшали уровни IL-6, IL-12, TNF-альфа и IFN-гамма при пероральном введении в солевом растворе и в кисломолочных продуктах (опубликованы только данные для IL-6) (Prakash and Urbanska 2007).
В дополнение к про- и противовоспалительным цитокинам, высокая чувствительность C-реактивного белка, возможно, является наиболее важным маркером воспаления в сыворотке для риска коронарного заболевания. Недавние исследования позволяют предполагать, что пациенты с увеличенными исходными уровнями CRP подвержены повышенному риску сердечно-сосудистых заболеваний, так же как диабета и гипертензии. Клиническое исследование. Клиническое исследование, проведенное для 700 медсестер, показало, что субъекты в наивысшей квартили потребления трансжира имеют уровни C-реактивного белка в крови, на 73% выше уровней в наименьшей квартили (Lopez-Garcia, 2005). Другие исследователи показали, что CRP может обострять ишемический некроз зависимым от комплемента образом, и что ингибирование CRP может представлять собой безопасную и эффективную терапию для инфарктов миокарда и головного мозга (Pepys et al 2006).
Метаболический синдром
Дислипидемия, атеросклероз и хроническое воспаление связаны с другими дегенеративными заболеваниями через метаболический синдром. Метаболический синдром характеризуется группой метаболических факторов риска у одного индивидуума и увеличивает риск развития у индивидуума атеросклероза, сердечно-сосудистого заболевания, цереброваскулярного заболевания и диабета. Эта совокупность признаков и симптомов поражает одного из пяти человек, и распространенность увеличивается с увеличением возраста. В некоторых исследованиях оценивают распространенность в США как вплоть до 25% популяции (Ford et al, 2002). Симптомы и признаки включают в себя: гипергликемию при голодании - сахарный диабет типа 2 или нарушение количества глюкозы при голодании, нарушение толерантности к глюкозе или устойчивость к инсулину, высокое кровяное давление, Центральное ожирение (известное также как висцеральное ожирение, ожирение мужского типа или ожирение в форме яблока), избыточная масса тела с жировыми отложениями преимущественно вокруг талии.
Заболевание неалкогольной жировой инфильтрации печени (NAFLD)
Заболевание неалкогольной жировой инфильтрации печени (NAFLD) рассматривают как печеночное проявление метаболического синдрома. NAFLD определяют как воспаление печени на фоне жирового перерождения, которое не вызвано избыточным потреблением алкоголя. NAFLD сильно ассоциировано с ожирением, дислипидемией, устойчивостью к инсулину (IR) и сахарным диабетом II типа (инсулиннезависимым). NAFLD покрывает полный спектр метаболических нарушений с жировой инфильтрацией печени, в частности, с неопределенной гистологией. NAFLD может проявляться как простой стеатоз (жировая инфильтрация печени) в случае наименьшего клинического проявления, или может прогрессировать до стеатоза с воспалением или фиброзом, в этом случае его называют NASH. Однако даже стабильные формы NAFLD могут приводить к еще неидентифицированной смертности, поскольку печень при жировой инфильтрации, как правило, функционирует менее эффективно, чем печень без жировой инфильтрации. NASH, по-видимому, представляет собой промежуточную стадию, характеризующуюся стеатозом с лобулярным воспалением. Известно, что NAFLD поражает 10-39% из общемировой популяции со средней заболеваемостью 20% (Angulo 2002).
Существует несколько факторов риска, ассоциированных с NAFLD. Эти факторы включают в себя общие условия жизни и такие заболевания, как ожирение, гипергликемия, сахарный диабет 2 типа и гипертриглицеридемия. Помимо этого, NAFLD сильно ассоциирован с центральным ожирением и висцеральным ожирением. Генетические и расовые факторы также ассоциированы с NAFLD/NASH. Это нарушение, таким образом, вносит значительный вклад в нагрузку хронического заболевания печени в последующие десятилетия.
Лечение и предотвращение гиперхолестеринемии и дислипидемии
Способы снижения уровней холестерина у человека включают в себя управление диетой, изменение поведения, и лечебную физкультуру и терапию лекарственными средствами. Одно воздействие на диету является недостаточным для большинства индивидуумов. Исследования показали, что полное исключение холестерина в диете и уменьшение содержания жира до менее десяти процентов суточного потребления калорий приводит только к четырем процентам регрессии атеросклеротических бляшек через пять лет при сочетании с управлением стрессовыми ситуациями и аэробными упражнениями (Ornish et al. 1990).
Предложены дополнительные возможности диеты для снижения уровня холестерина ЛНП, включая растворимые волокна, растительные стеролы и станолы, и соевый белок. В недавних публикациях указано, что растворимые формы пищевых волокон в количестве 5-10 г в сутки могут уменьшать холестерин ЛНП приблизительно на 5% (Third Report of the NCEP Expert Panel 2002). Опубликованы небольшие эффекты, отсутствие эффектов или противоречивые эффекты по отношению к холестерину ЛВП; однако, по-видимому, модуляция путей метаболизма холестерина и компонентов желчи может являться необходимой по многочисленным данным исследований, что попытки снижения потребления холестерина с пищей или увеличения катаболизма холестерина приводят к уменьшению уровня ЛВП, если не используются в сочетании с понижающими уровень холестерина лекарственными средствами, влияющими на ферменты печени. Более того, не показано, что нерастворимые волокна значительно влияют на уровни циркулирующего холестерина. Исследования на животных и человеке показали, что растительные станолы и стеролы уменьшают уровни в плазме общего холестерина и холестерина липопротеинов низкой плотности (ЛНП). Данные показали, что полученные из растений сложные эфиры стеролов и станолов в дозах 2-3 г/сутки уменьшают уровни холестерина ЛНП на 6-15% без значительных изменений уровней триглицеридов или холестерина ЛВП (Hallikainen and Uusitupa, 1999). И снова, часто исследования, показывающие отсутствие уменьшения уровней ЛВП или статистически не значимое уменьшение уровней ЛВП, включают пациентов, принимающих понижающие уровень холестерина лекарственные средства, изменяющие пути ферментов печени, такие как статины. Показано, что белок сои, включенный в диету с низким содержанием насыщенных жирных кислот и холестерина, снижает уровень холестерина ЛНП приблизительно на 5%, однако, требования к дозированию хорошо не изучены (Jenkins et al. 2000).
Статины могут значительно уменьшать эндогенный синтез холестерина посредством ингибирования HMG-CoA-редуктазы и осуществлять повышающую регуляцию рецепторов липопротеинов низкой плотности в печени, приводя к уменьшению уровней ЛНП-Х на 20-30%. Эффективность статинов тщательно изучена во множестве клинических исследований (Pedersen et al. 1994). Однако показано, что статины оказывают редкие, но потенциально тяжелые побочные эффекты. Наиболее распространенными из них являются миопатия, которая может развиваться в опасный для жизни рабдомиолиз, и полиневропатия (Gaist et al 2001, Gaist et al 2002, Omar and Wilson 2002, Staffa et al 2002).
Показано также, что терапия фибратами предоставляет долговременные преимущества для пациентов, подверженных высокому риску, с дислипидемией с низким уровнем холестерина ЛВП - высоким уровнем триглицеридов (Goldenberg et al 2008). Однако фибраты ассоциированы также с множеством неблагоприятных эффектов, включая увеличенный риск желчных камней, миопатию и расстройство желудка (Sgro and Escousse, 1991).
Ниацин к настоящему времени использовался в течение достаточно долгого времени, в дозах 1-2 грамма в сутки, для снижения уровней триглицеридов и снижения уровней ЛНП-Х. Интересно, что показано, что витамин B3 также увеличивает уровень ЛВП-Х на этих уровнях, и его прописывали пациентам с низким уровнем ЛВП-Х, подверженным риску страдать от кардиологических событий. К сожалению, некомфортабельные и тяжелые побочные эффекты, включая покраснение лица и всего тела, наблюдают при регулярном использовании.
Секвестранты желчных кислот (BAS) использовали в клинике с 1960 гг. для снижения уровней холестерина ЛНП. Секвестранты желчных кислот обладают низким соблюдением пациентами условий лечения, вызванным, частично, желудочно-кишечными побочными эффектами (Probstfiled and Rifkind, 1991).
Пробиотики
Опубликовано, что пробиотики ассоциированы с рядом клинически важных преимуществ для здоровья. Различные штаммы молочнокислых бактерий особенно хорошо изучены у человека и животных. Клинические исследования с контролем плацебо показали, что L. reuteri, L rhamnosus GG, L casei и S boulardii являются эффективными для уменьшения продолжительности острой диареи (Huang et al 2002). L rhamnosus GG при введении грудным детям уменьшает риск нозокомиальной диареи и ротавирусного гастроэнтерита (Szajewska et al 2001). Исследования Aso et al. выявили, что L casei Shirota увеличивает процент клеток T-хелперов и клеток NK у взрослых пациентов с колоректальным раком и оказывает защитный эффект по отношению к рецидиву поверхностного рака мочевого пузыря (Aso et al, 1995). Кроме того, показано, что избранные штаммы лактобацилл значительно супрессируют вызванные химическими мутагенами опухоли желудка и кишечника (Mclntosh et al 1999). Молочнокислые бактерии вводили для предотвращения сепсиса у пациентов с тяжелым острым панкреатитом. Рандомизированное исследование Rayes et al, включающее пациентов с трансплантатами печени, выявило значительное уменьшение послеоперационных инфекций при принятии с пищей живых клеток L plantarum по сравнению со стандартным лечением антибиотиками (Rayes et al 2002). В качестве средства для предотвращения аллергии, в рандомизированном котролируемом исследовании Lodinova-Zadnikova et al. исследовали эффект колонизации при рождении непатогенными Escherichia coli Nissle 1917 (Lodinova-Zadnikova and Sonnenborn 1997). Для субъектов после инокуляции штаммом E coli показали значительно уменьшенную колонизацию бактериальными патогенами, так же как значительно меньшую заболеваемость аллергией через 10 и 20 лет по сравнению с контрольными субъектами. Пробиотики использовали также в качестве вариантов лечения для управления течением воспалительных заболеваний кишечника (IBD), таких как Болезнь Крона, язвенный колит и поучит.
L. reuteri хорошо изучен как один из наиболее распространенных членов встречающихся в природе бактерий кишечника. Документировано, что специфические для хозяев штаммы L. reuteri обеспечивают широкий спектр защиты от ряда ассоциированных с микроорганизмами и химическими веществами заболеваний у человека и животных (Dobrogosz, 2005). Однако традиционная терапия пробиотиками включает в себя введение бактерий в надежде, что некоторые бактерии переживут жесткие условия желудка и колонизируют ободочную кишку, где бактерии могут размножаться и жить неопределенно долго. Гораздо меньше бактерий выживает в двенадцатиперстной кишке, тонкой кишке или подвздошной кишке из-за таких факторов, как кислотность, иммунный ответ и концентрация желчи. Бактерии должны присутствовать в двенадцатиперстной кишке или тонкой кишке тонкого кишечника для снижения уровня холестерина и особенно желчной кислоты.
КРАТКОЕ ИЗЛОЖЕНИЕ
Авторы настоящего изобретения определили, что бактерии с высокой активностью гидролазы солей желчных кислот (bsh) обеспечивают улучшенное средство для снижения уровня холестерина в сыворотке, липидов в сыворотке, жировой ткани и индекса атерогенности, и для профилактики и лечения атеросклероза, сердечно-сосудистых и цереброваскулярных заболеваний.
Соответственно, в одном аспекте настоящее описание относится к пероральной композиции, содержащей бактерии с высокой активностью bsh, их изолят или супернатант; где бактерии с высокой активностью bsh деградируют >50 мкмоль гликодезоксихолевой кислоты (GDCA)/грамм/час и >2 мкмоль тауродезоксихолевой кислоты (TDCA)/грамм/час при измерении через 1 час и 5 часов, соответственно; или деградируют >65 мкмоль GDCA/г/час и >7 мкмоль TDCA/г/час при измерении через 30 минут. В одном варианте осуществления бактерии с высокой активностью bsh деградируют >300 мкмоль GDCA/г/час и >40 мкмоль TDCA/г/час при измерении через 30 минут. В другом варианте осуществления бактерии с высокой активностью bsh деградируют >2000 мкмоль GDCA/г/час и >500 мкмоль TDCA/г/час при измерении через 30 минут. В другом варианте осуществления бактерии с высокой активностью bsh деградируют >15000 мкмоль GDCA/г/час и >2000 мкмоль TDCA/г/час при измерении через 30 минут.
В одном варианте осуществления бактерии представляют собой Lactobacillus, Bifidobacteria, Pediococcus, Streptococcus, Enterococcus или Leuconostoc. В другом варианте осуществления Lactobacillus представляет собой Lactobacillus reuteri, необязательно, Lactobacillus reuteri (NCIMB 701359), Lactobacillus reuteri (NCIMB 701089), Lactobacillus reuteri (ATCC 55148), Lactobacillus reuteri (ATCC 23272), Lactobacillus reuteri (NCIMB 702655), Lactobacillus reuteri (LMG 18238), Lactobacillus reuteri (CCUG 32271), Lactobacillus reuteri (CCUG 32305), Lactobacillus reuteri (CCUG 37470), Lactobacillus reuteri (CCUG 44001) или Lactobacillus reuteri (CCUG 44144). В другом варианте осуществления композиция дополнительно содержит носитель.
В другом варианте осуществления концентрация бактерий составляет 106 - 1012 колониеобразующих единиц (КОЕ)/грамм.
Бактерии по настоящему описанию, необязательно, заключены в полимер или микрокапсулу, или нанокапсулу.
В другом варианте осуществления пероральную композицию, описанную в настоящем документе, выращивают в условиях ферментации, включающих в себя источник углерода, источник азота, pH 4-7, необязательно, 5, и время сбора 12-24 часов, необязательно, 12-16 часов. В одном варианте осуществления источник углерода содержит мальтозу, сахарозу, декстрин, комбинацию сорбита и глюкозы или комбинацию инулина и глюкозы. В другом варианте осуществления источник азота содержит (i) дрожжевой экстракт и солодовый экстракт, дрожжевой экстракт и говяжий экстракт, или гидролизат казеина и солодовый экстракт, и (ii) пептон или триптон.
В другом варианте осуществления пероральная композиция, описанная в настоящем документе, является лиофилизированной с лиопротекторами. В одном варианте осуществления лиопротекторы содержат конечную концентрацию 0,2-10% мальтодекстрина и 0,05-0,33% дрожжевого экстракта или 0,05-2,5% инулина и 0,05-0,1% дрожжевого экстракта. В одном варианте осуществления лиопротекторы содержат конечную концентрацию 2-4% мальтодекстрина и 0,1% дрожжевого экстракта, 0,3% инулина и 0,1% дрожжевого экстракта, или 0,3% инулина.
В следующем варианте осуществления пероральную композицию, описанную в настоящем документе, сохраняют в жидкости, где условия хранения в жидкости включают в себя конечный раствор консерванта, содержащий 2,5-10% культуральной среды, 50-99,99% йогурта или других кисломолочных продуктов, 50-99,99% культурального супернатанта или 5% MRS.
В следующем варианте осуществления пероральная композиция, описанная в настоящем документе, является сверхбыстрозамороженной в конечном растворе криопротектора, такого как 0,2-10% мальтодекстрина, необязательно 1-3%, мальтодекстрина и 0,05-0,33% дрожжевого экстракта, необязательно, 0,1-0,2% дрожжевого экстракта, 0,05-2,5% инулина, необязательно, по меньшей мере 0,2% инулина, 0,5 М трегалоза, 0,5 М фруктоза, 0,5 М лактоза, 0,5 М мальтоза или 50-99,99%, необязательно, 50%, среды после культивирования.
В другом аспекте пероральная композиция по настоящему описанию дополнительно содержит снижающее уровень триглицеридов средство, средство для увеличения уровня ЛВП или ограничения снижения уровня ЛВП, снижающее уровень холестерина средство, средство для сохранения активности bsh, средство для модуляции адипокинов или гормонов ожирения, гипогликемическое средство, или лекарственное средство для уменьшения уровней провоспалительных цитокинов IL-1α/β, IL-2, IL-15, IL-3, IL-6, IL-8, IL-12, IL-17, IFN-гамма, TNF-альфа, или для увеличения уровня противовоспалительных цитокинов IL-1ra, IL-9, IL-10, IL-11.
В другом аспекте по настоящему описанию авторы настоящего изобретения предоставляют способы и применения пероральных композиций для снижения уровня холестерина в сыворотке, липидов в сыворотке, жировой ткани или индекса атерогенности и для профилактики и лечения атеросклероза, сердечно-сосудистых или цереброваскулярных заболеваний у животного, необязательно, млекопитающего, такого как человек.
В настоящем документе представлены также способы получения бактерий с высокой активностью bsh, включающие в себя выращивание бактерий в условиях ферментации, лиофилизацию бактерий с лиопротектором, хранение бактерий в условиях хранения жидкостей и сверхбыстрого замораживания бактерий с криопротекторами.
Другие признаки и преимущества по настоящему описанию очевидны из следующего подробного описания. Следует понимать, однако, что подробное описание и конкретные примеры, в то время как указывают на предпочтительные варианты осуществления описания, приведены только с целью иллюстрации, поскольку различные изменения и модификации в пределах сущности и объема описания очевидны специалистам в данной области из этого подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Варианты осуществления описания в настоящее время описаны в отношении рисунков, на которых:
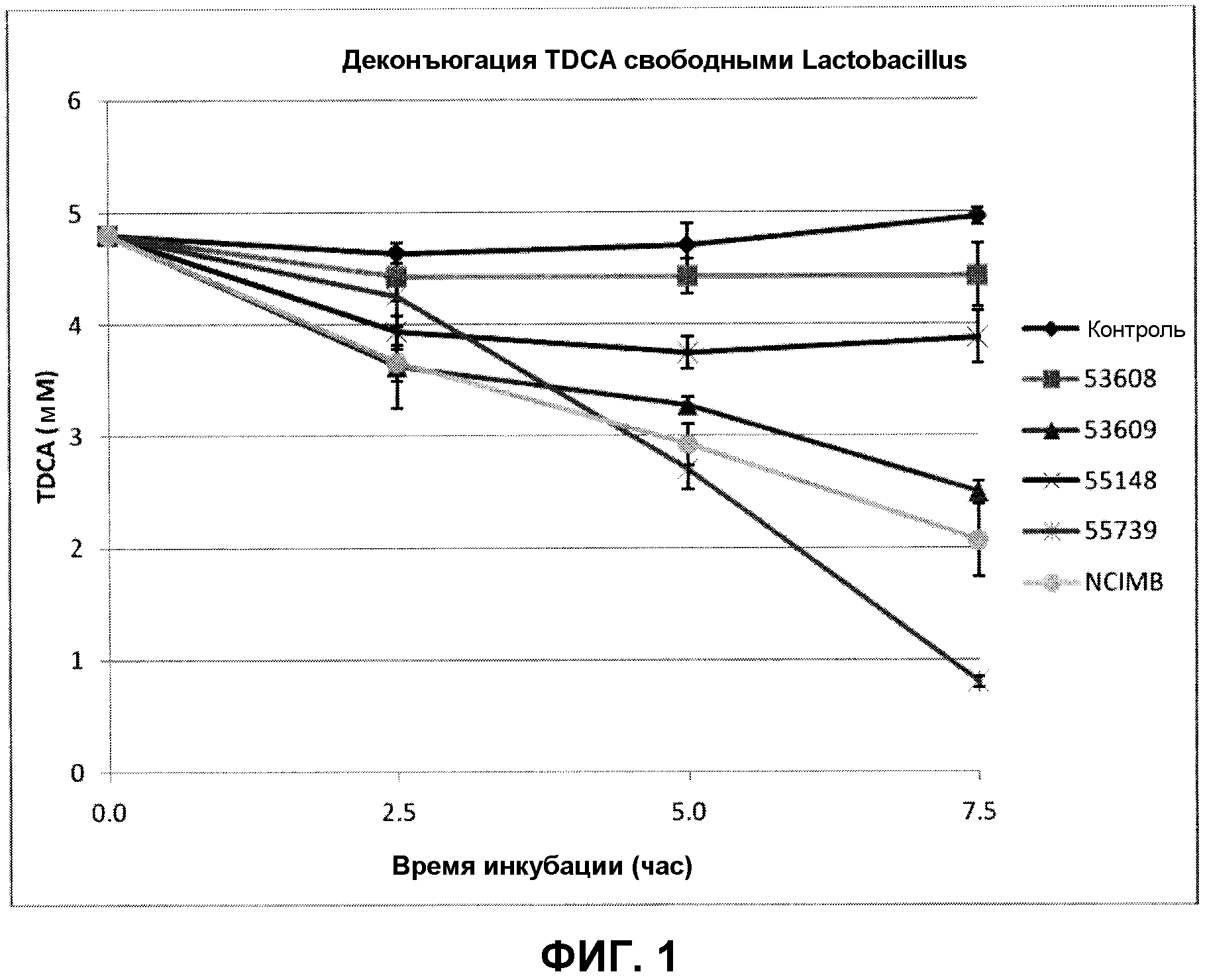
На фиг. 1 показана деконъюгация TDCA свободными штаммами Lactobacillus reuteri (ATCC 53608, ATCC 53609, ATCC 55148, ATCC 55739 и NCIMB 701359) с течением времени. Эксперимент проводили в трех повторах, и планки погрешностей представляют одно стандартное отклонение от среднего.
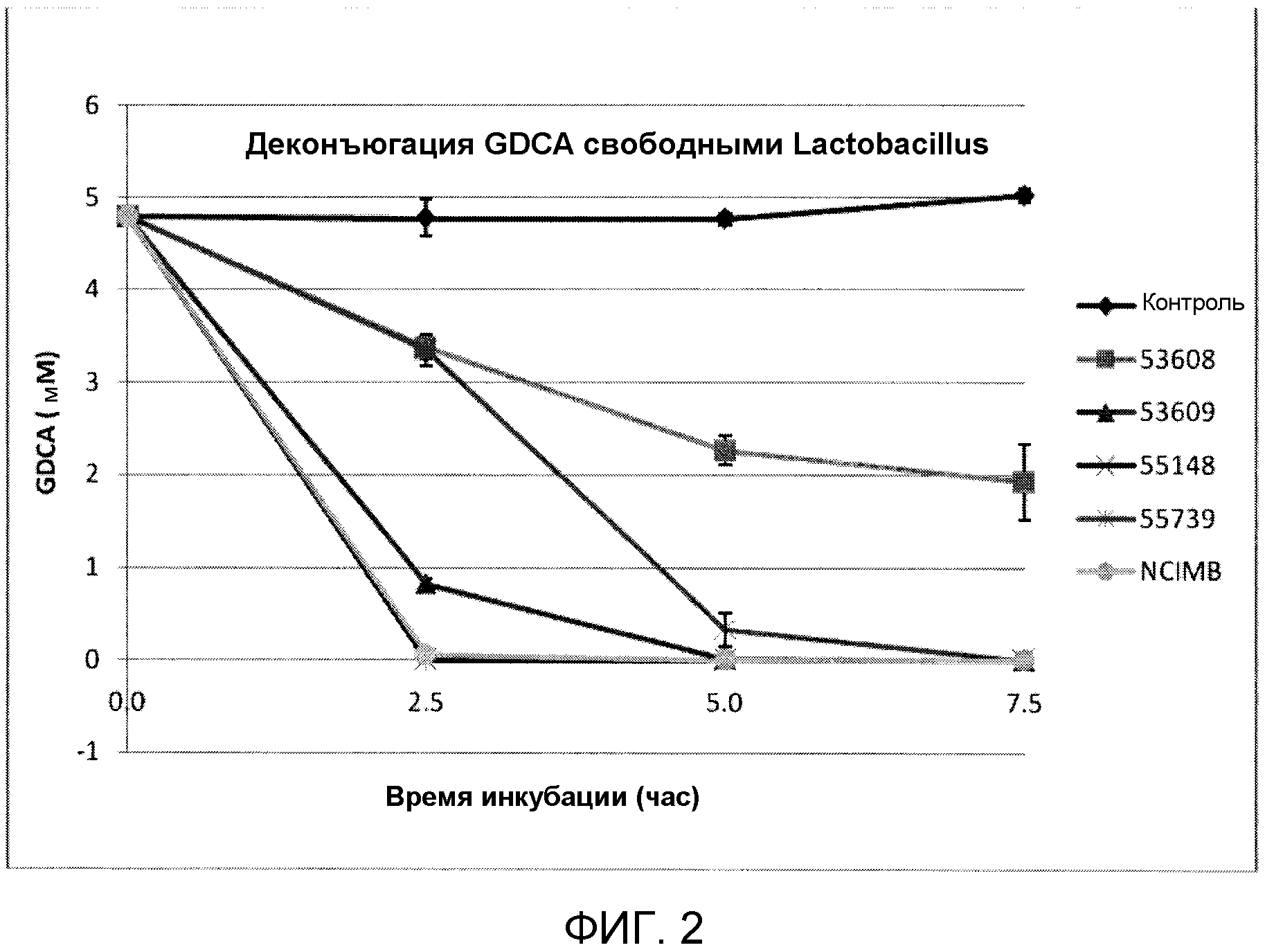
На фиг. 2 показана деконъюгация GDCA свободными штаммами Lactobacillus reuteri (ATCC 53608, ATCC 53609, ATCC 55148, ATCC 55739 и NCIMB 701359) с течением времени. Эксперимент проводили в трех повторах, и планки погрешностей представляют одно стандартное отклонение от среднего.
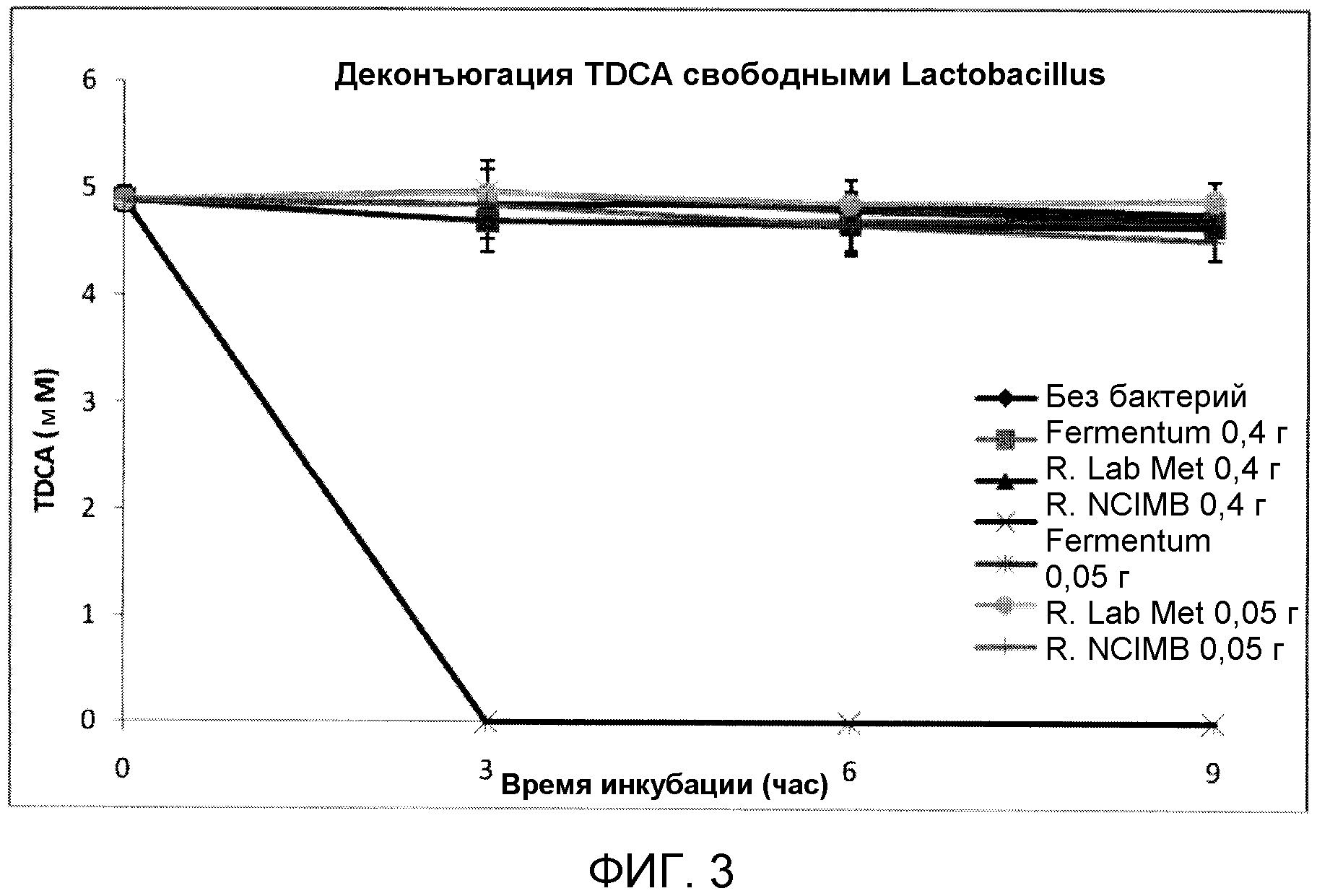
На фиг. 3 показана деконъюгация TDCA свободными штаммами Lactobacillus reuteri и Lactobacillus fermentum с течением времени. Эксперимент проводили в трех повторах, и планки погрешностей представляют одно стандартное отклонение от среднего.
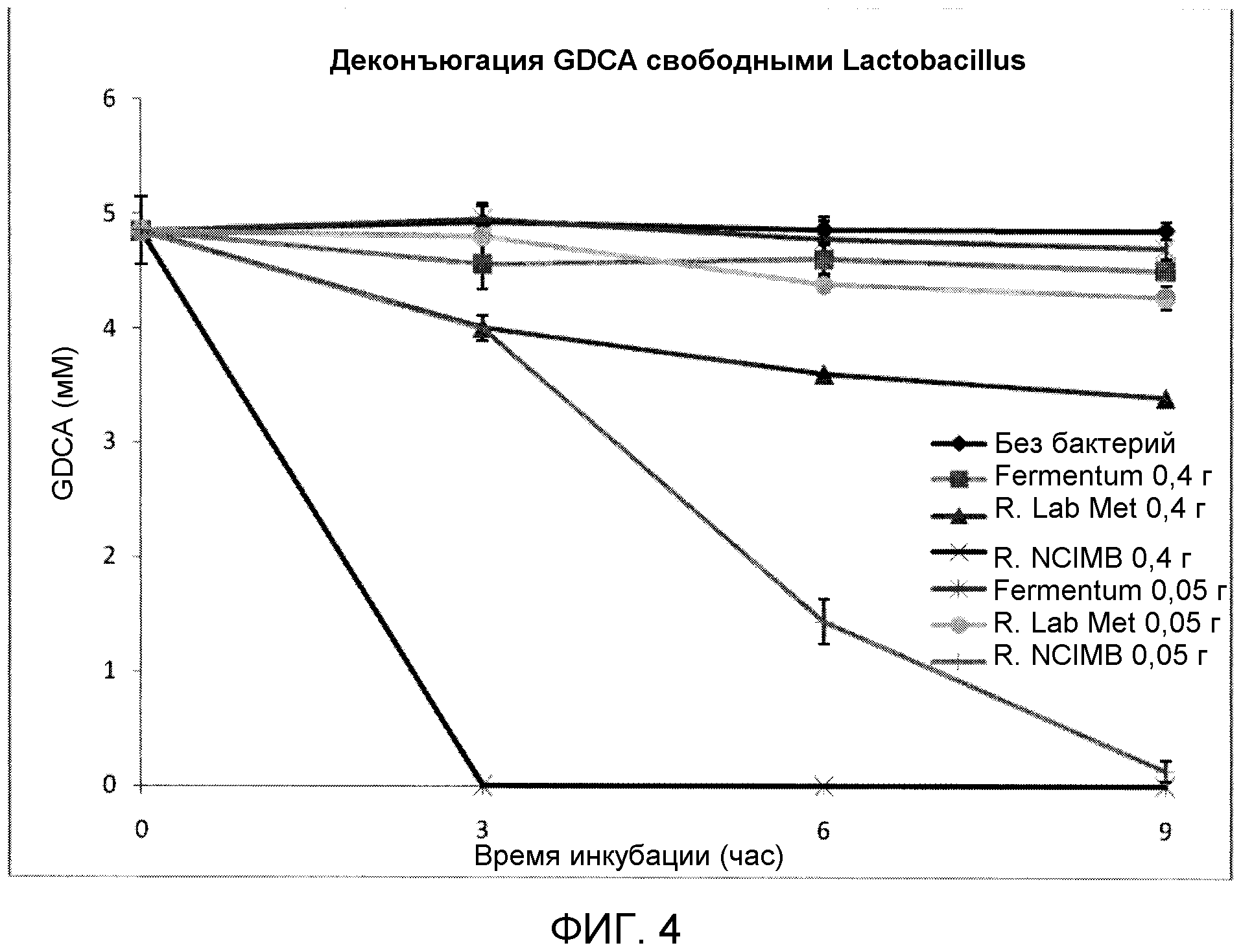
На фиг. 4 показана деконъюгация GDCA свободными штаммами Lactobacillus reuteri (LabMet, NCIMB 701359) и Lactobacillus fermentum (ATCC 11976) с течением времени. Эксперимент проводили в трех повторах, и планки погрешностей представляют одно стандартное отклонение от среднего.
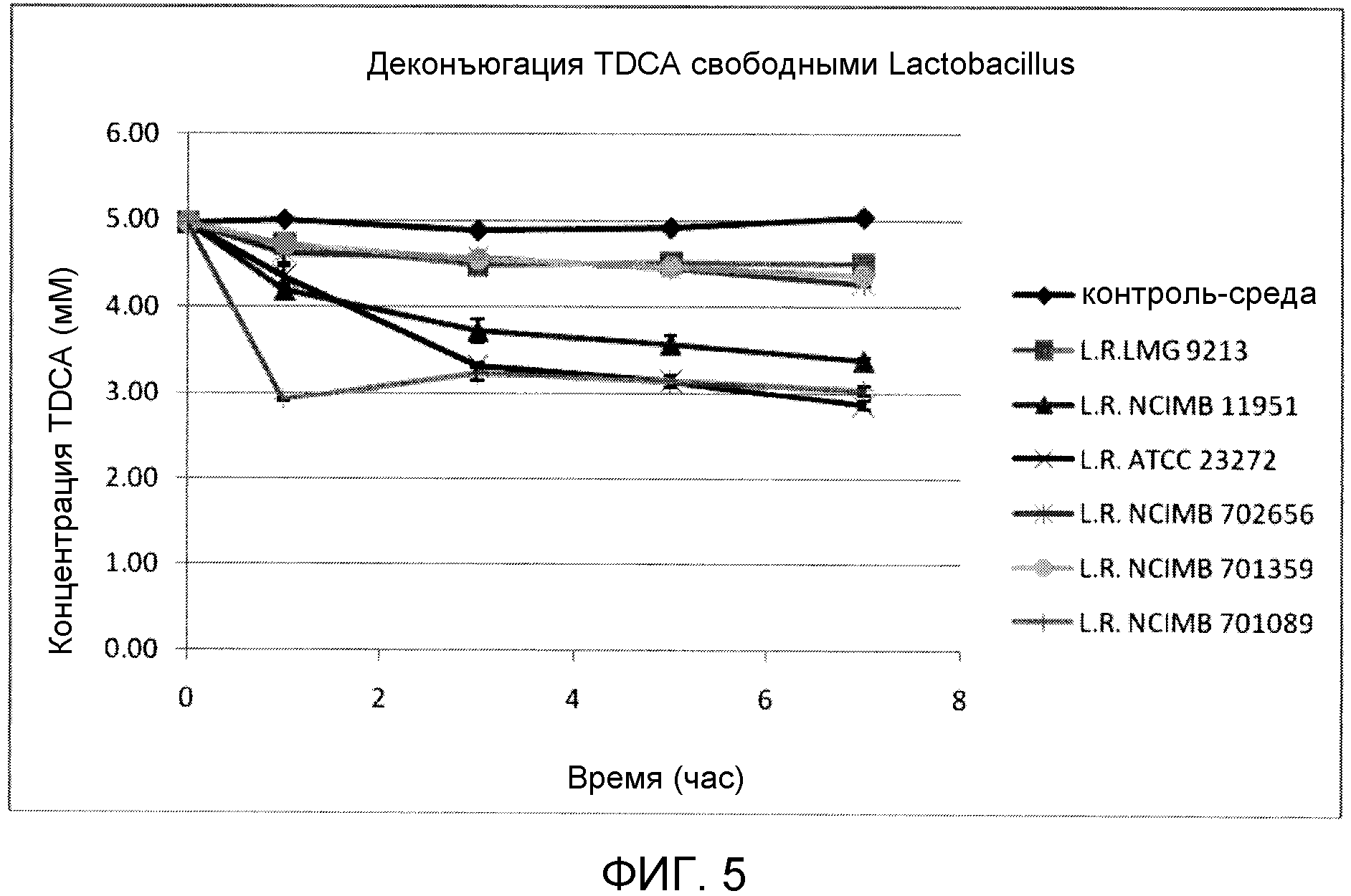
На фиг. 5 показана деконъюгация TDCA свободными штаммами Lactobacillus reuteri (LMG 9213, NCIMB 11951, ATCC 23272, NCIMB 702656, NCIMB 701359 и NCIMB 701089) с течением времени. Эксперимент проводили в трех повторах, и планки погрешностей представляют одно стандартное отклонение от среднего.
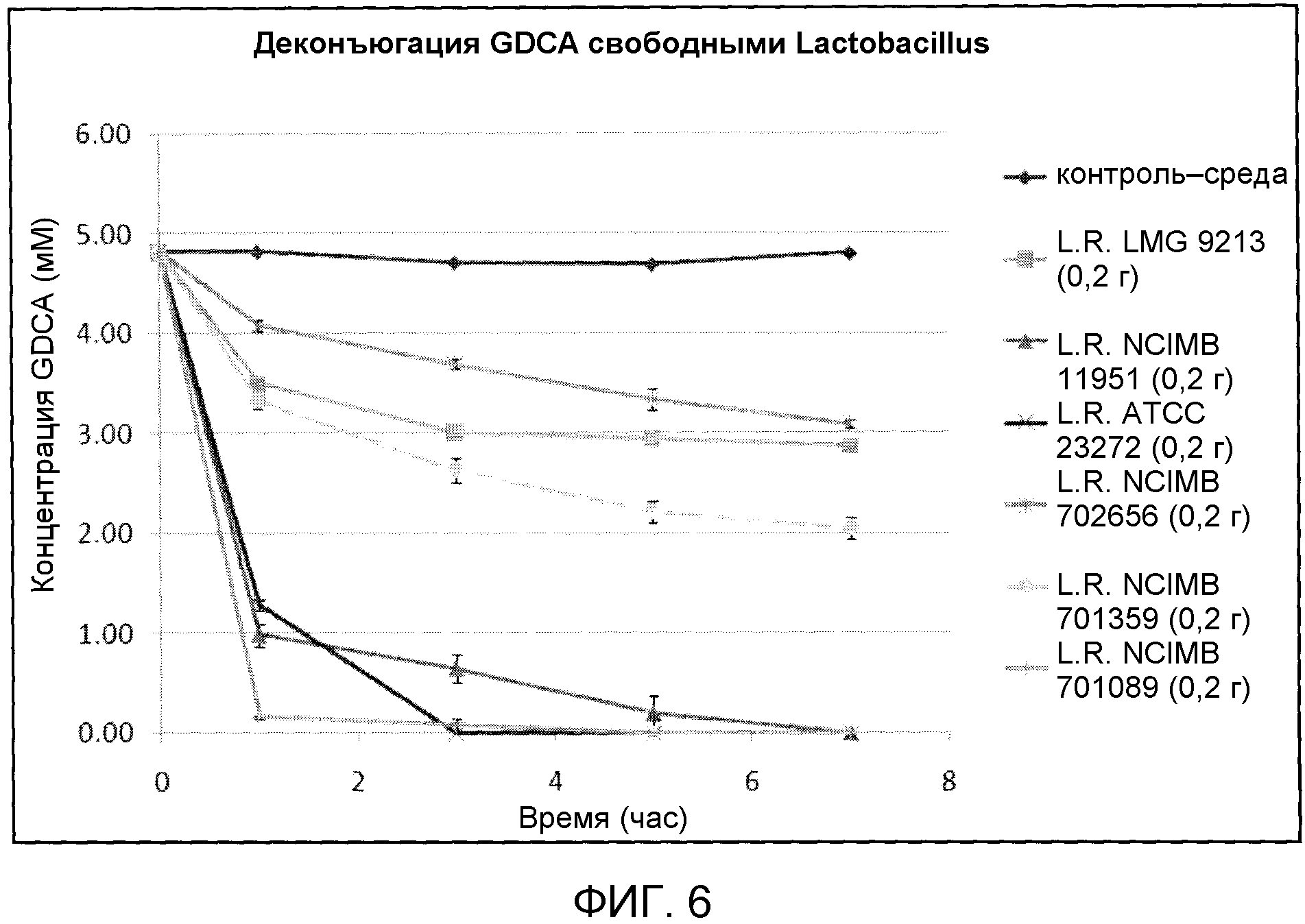
На фиг. 6 показана деконъюгация GDCA свободными штаммами Lactobacillus reuteri (LMG 9213, NCIMB 11951, ATCC 23272, NCIMB 702656, NCIMB 701359 и NCIMB 701089) с течением времени. Эксперимент проводили в трех повторах, и планки погрешностей представляют одно стандартное отклонение от среднего.
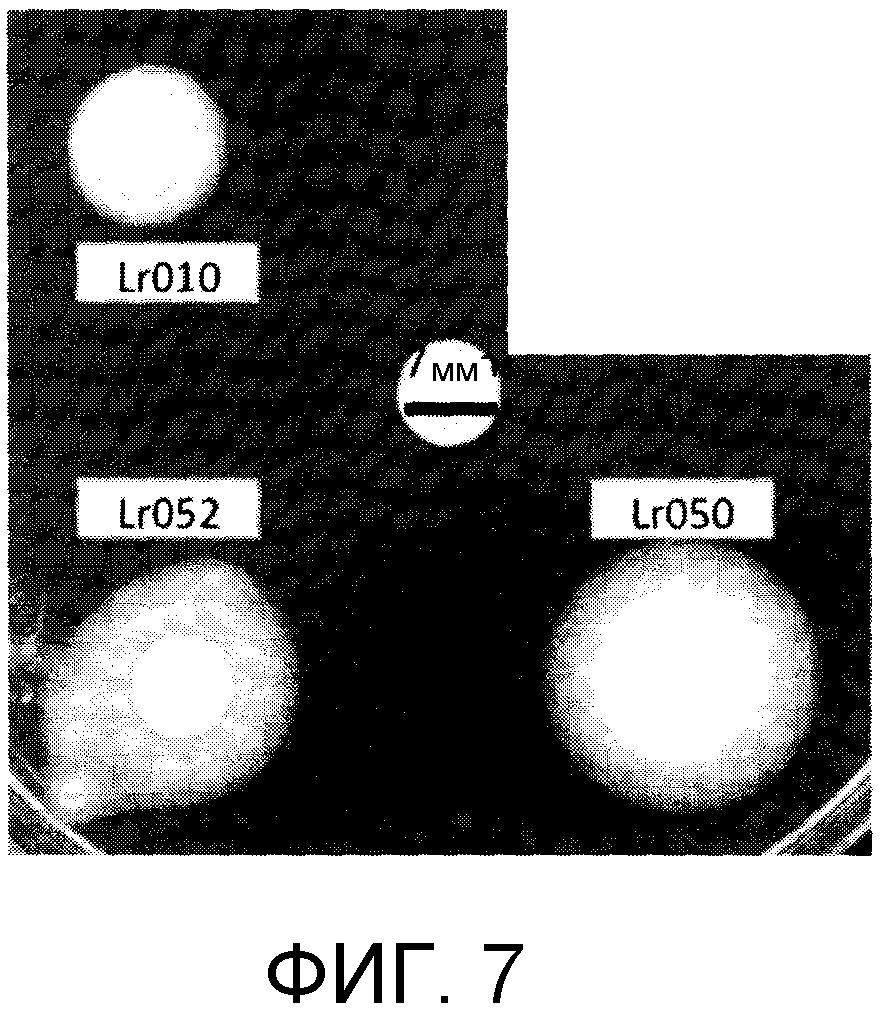
На фиг. 7 показан размер зоны преципитации 3 Lactobacillus reuteri с активностью bsh: Lr010: Lactobacillus reuteri (LabMet), Lr052: Lactobacillus reuteri (NCIMB 701089) и Lr050: Lactobacillus reuteri (NCIMB 701359).
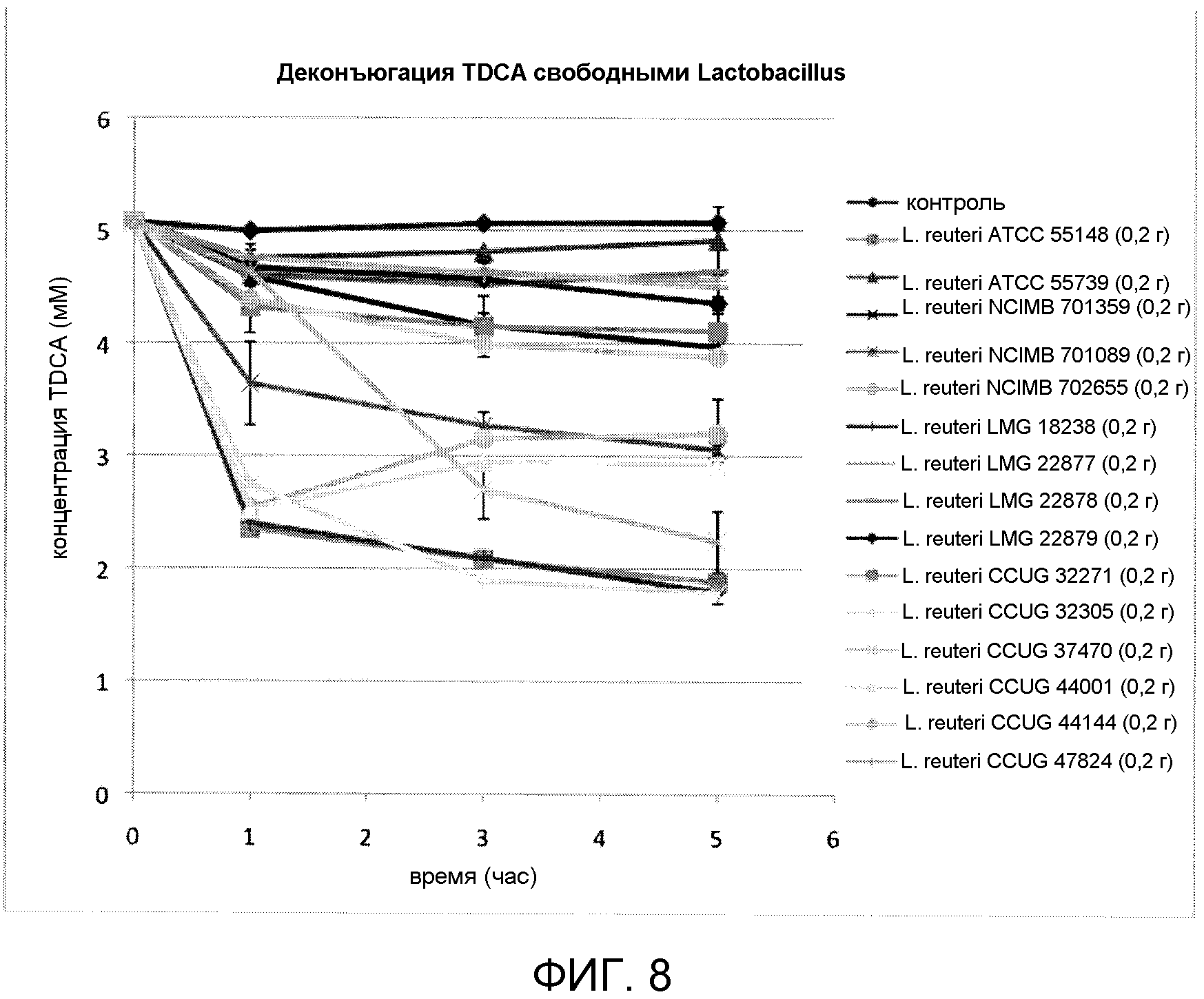
На фиг. 8 показана деконъюгация TDCA свободными штаммами Lactobacillus reuteri (ATCC 55148, ATCC 55739, NCIMB 701359, NCIMB 701089, NCIMB 702655, LMG 18238, LMG 22877, LMG 22878, LMG 22879, CCUG 32305, CCUG 37470, CCUG 44001, CCUG 44144, CCUG 47824) с течением времени. Эксперимент проводили в трех повторах, и планки погрешностей представляют одно стандартное отклонение от среднего.
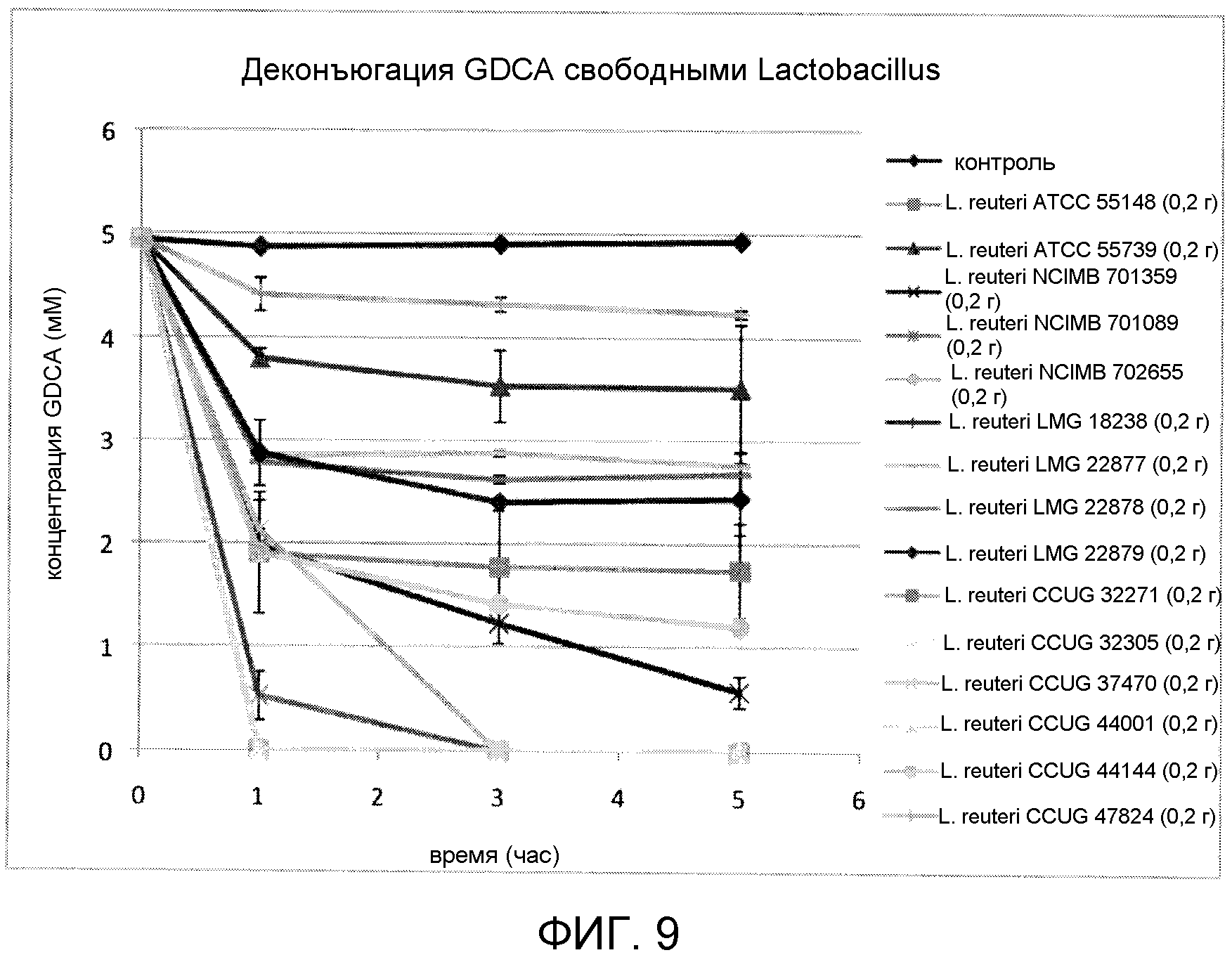
На фиг. 9 показана деконъюгация GDCA свободными штаммами Lactobacillus reuteri (ATCC 55148, ATCC 55739, NCIMB 701359, NCIMB 701089, NCIMB 702655, LMG 18238, LMG 22877, LMG 22878, LMG 22879, CCUG 32305, CCUG 37470, CCUG 44001, CCUG 44144, CCUG 47824) с течением времени. Эксперимент проводили в трех повторах, и планки погрешностей представляют одно стандартное отклонение от среднего.
На фиг. 10 показан репрезентативный набор микрофотографий морфологии микрокапсул с использованием различных условий для лиопротектора при 7:3 микрокапсул к лиопротектора для солевого раствора, 1 M трегалозы, и 10% обезжиренного молока, используемых для лиофилизации и регидратации микрокапсулированных Lactobacillus.
ПОДРОБНОЕ ОПИСАНИЕ
Авторы настоящего изобретения показали, что бактерии с высокой активностью bsh обеспечивают улучшенную пероральную композицию для снижения уровня холестерина в сыворотке, липидов в сыворотке, жировой ткани и индекса атерогенности, и для профилактики и лечения атеросклероза, сердечно-сосудистых и цереброваскулярных заболеваний.
Композиции
Соответственно, представлена пероральная композиция для снижения уровня холестерина в сыворотке, липидов в сыворотке, жировой ткани или индекса атерогенности, или для профилактики и лечения атеросклероза, сердечно-сосудистых и цереброваскулярных заболеваний, где композиция содержит бактерии с высокой активностью bsh, их изолят или супернатант; где бактерии с высокой активностью bsh деградируют >50 мкмоль гликодезоксихолевой кислоты (GDCA)/грамм/час и >2 мкмоль тауродезоксихолевой кислоты (TDCA)/грамм/час при измерении через 1 час и 5 часов, соответственно; или деградируют >65 мкмоль GDCA/г/час и >7 мкмоль TDCA/г/час при измерении через 30 минут. В одном варианте осуществления бактерии с высокой активностью bsh деградируют >300 мкмоль GDCA/г/час и >40 мкмоль TDCA/г/час при измерении через 30 минут. В другом варианте осуществления бактерии с высокой активностью bsh деградируют >2000 мкмоль GDCA/г/час и >500 мкмоль TDCA/г/час при измерении через 30 минут. В другом варианте осуществления бактерии с высокой активностью bsh деградируют >15000 мкмоль GDCA/г/час и >2000 мкмоль TDCA/г/час при измерении через 30 минут.
В одном варианте осуществления композиция дополнительно содержит носитель.
Бактерии с высокой активностью bsh, как применяют в настоящем документе, относится к бактериям, которые деградируют >50 мкмоль GDCA/грамм/час и >2 мкмоль TDCA/грамм/час при измерении через 1 час и 5 часов, соответственно, или деградируют >65 мкмоль GDCA/г/час и >7 мкмоль TDCA/г/час при измерении через 30 минут, необязательно, >300 мкмоль GDCA/г/час и >40 мкмоль TDCA/г/час при измерении через 30 минут, или >2000 мкмоль GDCA/г/час и >500 мкмоль TDCA/г/час при измерении через 30 минут или >15000 мкмоль GDCA/г/час и >2000 мкмоль TDCA/г/час при измерении через 30 минут, и их легко идентифицируют специалисты в данной области на основании способов, описанных в примерах. В одном варианте осуществления деградацию GDCA и TDCA измеряют посредством HPLC. Определение солей желчных кислот посредством HPLC, как описано в Scalia 1988 and Jones et al 2003.
Термин «изолят», как применяют в настоящем документе, относится к отделенной, выделенной или фракционированной части культуры клеток или продукта ферментации, которая может являться более чистой или более активной, чем неочищенный образец. Термин «супернатант», как применяют в настоящем документе, относится к жидкости, расположенной выше материала, собранного осаждением, преципитацией или центрифугированием.
В одном варианте осуществления бактерии с высокой активностью bsh представляют собой живые бактерии. Термин «живые бактерии», как применяют в настоящем документе, относится к биомассе осуществляющих метаболизм питательных веществ и утилизирующих отработанные вещества бактерий. В одном варианте осуществления живые бактерии представляют собой пробиотические бактерии. Термин «пробиотические бактерии», как применяют в настоящем документе, относится к живым микроорганизмам, которые при введении в адекватных количествах обеспечивают преимущества для здоровья хозяина.
Бактерии с высокой активностью bsh, необязательно, представляют собой Lactobacillus, Bifidobacteria, Pediococcus, Streptococcus, Enterococcus или Leuconostoc. В одном варианте осуществления Lactobacillus представляет собой Lactobacillus reuteri, необязательно, Lactobacillus reuteri (NCIMB 701359), Lactobacillus reuteri (NCIMB 701089), Lactobacillus reuteri (ATCC 55148), Lactobacillus reuteri (ATCC 23272), Lactobacillus reuteri (NCIMB 702655), Lactobacillus reuteri (LMG 18238), Lactobacillus reuteri (CCUG 32271), Lactobacillus reuteri (CCUG 32305), Lactobacillus reuteri (CCUG 37470), Lactobacillus reuteri (CCUG 44001) или Lactobacillus reuteri (CCUG 44144).
В другом варианте осуществления Lactobacillus reuteri проявляет адгезию к эпителиальным клеткам желудка и кишечника, конкурирует за адгезию с другими бактериями или ингибирует связывание других бактерий благодаря белкам поверхности клеток.
В одном из вариантов осуществления концентрация бактерий в пероральных композициях, описанных в настоящем документе, составляет 106-1012 колониеобразующих единиц (КОЕ)/грамм, необязательно, 108-1012 КОЕ/грамм. В другом варианте осуществления композиция, представленная в настоящем документе, содержит 106-1014 КОЕ, необязательно, 108-1013 КОЕ.
Термин «bsh» или «гидролаза солей желчных кислот», как применяют в настоящем документе, относится к ферменту, способному гидролизовать соли желчных кислот, продуцируемому бактериями.
Бактерии с высокой активностью bsh можно выращивать в условиях ферментации, улучшающих продукцию биомассы и активность bsh. В одном варианте осуществления условия ферментации включают в себя инокуляцию в среду, содержащую источники углерода и азота, и обладающую pH 4-7, и время сбора 12-24 часа. В конкретном варианте осуществления pH в условиях ферментации составляет 5. В другом варианте осуществления время сбора составляет 12-16 часов.
В одном варианте осуществления источник углерода содержит мальтозу, сахарозу, декстрин, комбинацию сорбита и глюкозы или комбинацию инулина и глюкозы. В конкретном варианте осуществления источник углерода представляет собой мальтозу. В одном варианте осуществления источники углерода добавляют до конечной концентрации 2%, например, при использовании инулина и глюкозы, добавляют 1% каждого до конечной концентрации 2%.
В другом варианте осуществления источник азота содержит (i) дрожжевой экстракт и солодовый экстракт, дрожжевой экстракт и говяжий экстракт, или гидролизат казеина и солодовый экстракт, и (ii) пептон или триптон. В одном из вариантов осуществления источник азота дополнительно содержит цистеин. Пептон может представлять собой любой пептон, включая, без ограничения, пептон no. 3, рыбный пептон, соевый пептон, протеозный пептон и казеиновый пептон. В конкретном варианте осуществления пептон представляет собой пептон no. 3. В одном варианте осуществления добавляют источник азота в сумме до 2,5%, например, при использовании в качестве источников пептона, дрожжевого и солодового экстракта, добавляют 1% пептона, 0,5% дрожжевого экстракта и 1% солодового экстракта до конечной концентрации 2,5%. В другом варианте осуществления говяжий экстракт используют вместо солодового экстракта, и казеин используют вместо пептона или дрожжевого экстракта. В другом варианте осуществления добавляют 0,01-0,05% цистеина, необязательно 0,01%.
В одном варианте осуществления бактерии с высокой активностью bsh представляют собой свободные бактерии. Термин «свободные бактерии», как применяют в настоящем документе, относится к бактериям, которые не являются иммобилизованными в полимере или инкапсулированными посредством микроинкапсуляции искусственных клеток.
В другом варианте осуществления бактерии с высокой активностью bsh содержатся или являются иммобилизованными в полимере, необязательно, в природном полимере. Природные полимеры включают в себя, без ограничения, альгинат, хитозан, агарозу, пектин, агаропектин, генипин и целлюлозу. В одном из вариантов осуществления бактерии с высокой активностью bsh являются иммобилизованными на пленке.
В другом варианте осуществления бактерии с высокой активностью bsh являются инкапсулированными. Инкапсуляция представляет собой термин, используемый, чтобы включать в себя способы макроинкапсуляции, микроинкапсуляции и наноинкапсуляции. Термины микроинкапсуляция и наноинкапсуляция относятся к подклассу инкапсуляции, где получают малые капсулы, капсулы с микро- или наноинкапсуляцией. Способы инкапсуляции и микроинкапсуляции известны в данной области. Микрокапсулы представляют собой небольшие сферические контейнеры или покрытые ткани в диапазоне 1-999 мкм, и нанокапсулы лежат в диапазоне 1-999 нм, где макрокапсулы представляют собой более крупные сосуды с мембранами из плоских листов или полых волокон. Макро-, микро- и нанокапсулы должны содержать клеточное окружение, способное поддерживать метаболизм и пролиферацию клеток, поскольку клетки, которые они содержат, обеспечивают функциональность капсул.
Микроинкапсуляция или наноинкапсуляция искусственных клеток представляет собой способ, используемый для инкапсуляции биологически активных материалов в специализированных ультратонких полупроницаемых полимерных мембранах (см., например, Chang and Prakash, 1997, Chang, 1964). Способы получения искусственных клеток хорошо документированы в данной области техники. Мембраны искусственных клеток специалист в данной области, необязательно, выбирает или разрабатывает для каждого конкретного терапевтического устройства, поскольку можно сконструировать несколько различных мембран для препаратов искусственных клеток со свойствами мембраны, необходимыми для желательного применения. Использование различных мембран позволяет изменять проницаемость, перенос массы, механическую стабильность, буферную емкость, биосовместимость и другие характеристики. Необходимо поддерживать равновесие между физическими свойствами мембран капсул, чтобы поддерживать выживаемость заключенных клеток.
Микрокапсулы для бактерий по изобретению можно получать с использованием таких способов, как в Публикации США No 2007-0116671 Prakash and Jones, содержание которой приведено в настоящем документе в качестве ссылки.
Свойства переноса массы мембраны являются критическими, поскольку скорость притока молекул, необходимых для выживания клеток, и скорость истечения конечных продуктов обмена веществ в конечном счете определяет жизнеспособность заключенных клеток. Любые барьеры потенциально можно использовать для связанных с ферментами применений. Обычно желательную проницаемость капсул определяют по отсекаемой молекулярной массе (MWCO), и она зависит от применения. MWCO представляет собой максимальную молекулярную массу молекулы, которой позволяют проходить через поры мембраны капсулы (Uludag et al (2000) Adv Drug Deliv Rev 42: 29-64). Для трансплантации MWCO должна быть достаточно высокой, чтобы позволять прохождение питательных веществ, но достаточно низкой, чтобы отсекать антитела и другие молекулы иммунной системы. Диапазон MWCO, необязательно, составляет 3000 Да - 950000 Да (Chang and Prakash, 1998). MWCO вводимых перорально микрокапсул должна позволять прохождение нежелательных метаболитов из плазмы в микрокапсулу, и затем должна либо способствовать последующему удалению измененной молекулы, либо обеспечивать ее хранение (Uludag et al, 2000). Для клеток по настоящему описанию, предназначенных для перорального введения, необязательно, используют удерживающее средство, которое позволяет прохождение питательных веществ, но блокирует антитела и другие иммунные молекулы, например, полупроницаемая мембрана с MWCO 3000 Да - 950000 Да (Chang and Prakash, 1998) Альтернативно, нижний конец диапазона может составлять приблизительно 2000 Да, 4000 Да, 5000 Да или 10000 Да, и верхний конец диапазона может составлять приблизительно 900000 Да, 750000 Да или 500000 Да.
Наиболее распространенным типом мембраны, используемой для клеточной терапии, является полимерная мембрана на основе одного альгината, однако, можно использовать несколько других веществ, таких как различные белки, полигемоглобин и липиды (Uludag et al, 2000, Prakash and Jones, 2002). Еще одним способом составления мембраны является использование биоразлагаемого синтетического полимера, такого как полилактид, полигликолевая кислота, и полиангидрид. Общепринятые мембраны включают в себя мембраны из полого волокна, альгинат-полилизин-альгинатную (APA) мембрану, нитрат целлюлозы, полиамид, полимер в комплексе с липидами и липидные везикулы. Хорошо разработанные и многообещающие полимеры для инкапсуляции живых клеток и инкапсуляции ферментов включают в себя альгинат-полилизин-альгинат (APA), альгинат-сополимер метилена с гуанидином-альгинат (A-PMCG-A), гидроксиметилакрилат-метилметакрилат (HEMA-MMA), многослойный HEMA-MMA-MAA, полиакрилонитрилвинилхлорид (PAN-PVC), акрилонитрил/металлилсульфонат натрия (AN-69), полиэтиленгликоль/полипентаметилциклопентасилоксан/олидиметилсилоксан (PEG/PD5/PDMS), поли-N,N-диметилакриламид (PDMAAm), кремнийсодержащие инкапсуляты и сульфат целлюлозы/альгинат натрия/сополимер метилена и гуанидина (CS/A/PMCG). Другие материалы, которые являются полезными, включают в себя, без ограничения, ацетат фталат целлюлозы, альгинат кальция и гранулы из k-каррагинана - геля камеди бобов рожкового дерева, геллан-ксантановые гранулы, сополимеры лактида и гликолида, каррагинан, полиангидриды крахмала, полиметакрилаты крахмала, полиаминокислоты, образующие энтеросолюбильное покрытие полимеры.
При разработке мембраны, предназначенной для использования для терапии с пероральным введением живых клеток, необходимо принимать во внимание несколько первостепенных факторов, чтобы минимизировать гибель микроорганизмов и максимизировать терапевтическую эффективность. Для обеспечения их эффективности, искусственно инкапсулированные клетки, предназначенные для перорального введения, необходимо разрабатывать для защиты их живого груза как против кислой среды желудка, так и против иммуноглобулина, высвобождаемого при иммунном ответе кишечника.
Полезной композицией является инкапсуляция гранул альгината кальция с поли-L-лизином (PLL) с получением альгинат-поли-L-лизин-альгинатных (APA) микрокапсул. В микрокапсулах с APA мембраной, альгинат образует сердцевину и матрикс для клетки, и PLL связывается с альгинатной сердцевиной. Связывание PLL с альгинатом происходит из-за многочисленных алкиламиногрупп с длинной цепью внутри PLL, которые распространяются от полиамидного остова во множестве направлений и взаимодействуют с различными молекулами альгината через электростатические взаимодействия. Полученное сшивание образует стабильную комплексную мембрану, которая уменьшает пористость альгинатной мембраны и образует иммунозащитный барьер.
Альтернативно, мембраны из альгината/поли-l-лизина/пектина/поли-l-лизина/альгината (APPPA), альгината/поли-l-лизина/пектина/поли-l-лизина/пектина (APPPP) и альгината/поли-L-лизина/хитозана/поли-l-лизина/альгината (APCPA) используют для инкапсуляции. Эти многослойные мембранные композиции хорошо действуют в тестах стабильности в GI, обеспечивая увеличенную устойчивость к полному растворению в воде, к растворенным кислотам и основаниям, так же как к присутствию хелаторов ионов, в то же время позволяя более точный контроль проницаемости мембраны.
Существуют различные способы, доступные для получения искусственных клеток, содержащих живые клетки, для терапии. Например, для получения классической альгинат-полилизин-альгинатной (APA) мембраны, живые клетки, такие как бактериальные клетки, суспендируют в матриксе из природного полимера альгината (1,5%). Вязкую суспензию полимера и бактерий пропускают через иглу 23 калибра с использованием поршневого насоса. Затем стерильный сжатый воздух, пропущенный через иглу 16 калибра с совпадающей осью, используют для отрезания мелких капель, выходящих из наконечника иглы 23 калибра. Мелким каплям позволяют образовывать гель в течение 15 минут в осторожно перемешиваемом ледяном растворе отверждающих химических веществ, таких как CaCl2 (1,4%). После гелеобразования в CaCl2, гранулы затем промывают с помощью HEPES (0,05% в HEPES, pH 7,20), покрывают полилизином (0,1% в течение 10 мин) и снова промывают в HEPES (0,05% в HEPES, pH 7,20). Затем полученные капсулы покрывают посредством реакции с альгинатом (0,1% в течение 10 мин) и промывают подходящими химическими веществами для растворения содержимого их внутренней сердцевины. Для этой стадии часто используют баню с 3,00% цитратом (3,00% в 1:1 HEPES-буфер солевой раствор, pH 7,20). Затем сформированные микрокапсулы можно сохранять при 4°C в минимальном растворе (10% питательных веществ для клеток и 90% воды).
Соответственно, в одном варианте осуществления, бактерии с высокой активностью bsh являются инкапсулированными в полимерные полупроницаемые микрокапсулы (1-999 мкм) или нанокапсулы (1-999 нм). В одном варианте осуществления полимерные полупроницаемые микрокапсулы или нанокапсулы содержат мембраны из альгината/поли-l-лизина/альгината (APA), альгината/хитозана/альгината (ACA) или альгината/генипина/альгината (AGA). В другом варианте осуществления, микрокапсула или нанокапсула содержит мембраны из альгината/поли-l-лизина/пектина/поли-l-лизина/альгината (APPPA), альгината/поли-l-лизина/пектина/поли-l-лизина/пектина (APPPP), альгината/поли-L-лизина/хитозана/поли-l-лизина/альгината (APCPA), альгината - сополимера метилена с гуанидином - альгината (A-PMCG-A), гидроксиметилакрилата-метилметакрилата (HEMA-MMA), многослойного HEMA-MMA-MAA, полиакрилонитрилвинилхлорида (PAN-PVC), акрилонитрила/металлилсульфоната натрия (AN-69), полиэтиленгликоля/полипентаметилциклопентасилоксана/полидиметилсилоксана (PEG/PD5/PDMS) или поли-N,N-диметилакриламида (PDMAAm). В другом варианте осуществления микрокапсула или нанокапсула содержит полое волокно, нитрат целлюлозы, полиамид, полимер в комплексе с липидом, липидную везикулу с кремнийсодержащим инкапсулятом, сульфат целлюлозы/альгинат натрия/сополимер метилена и гуанидина (CS/A/PMCG), ацетат фталат целлюлозы, альгинат кальция, гранулы из k-каррагинана - геля камеди бобов рожкового дерева, геллан-ксантановые гранулы, сополимеры лактида и гликолида, каррагинан, полиангидриды крахмала, полиметакрилаты крахмала, полиаминокислоты или образующие энтеросолюбильное покрытие полимеры.
В следующем варианте осуществления, полимерные микрокапсулы или нанокапсулы являются устойчивыми к условиям желудочно-кишечного тракта, таким как pH 1-8 и/или желчь [1-30 ммоль]).
Оральные композиции, описанные в настоящем документе, необязательно, являются лиофилизированными, высушенными нагреванием, высушенными распылением или высушенными замораживанием. Альтернативно, пероральные композиции, необязательно, получают влажными.
В одном из вариантов осуществления пероральные композиции, описанные в настоящем документе, являются лиофилизированной с лиопротекторами для обеспечения жизнеспособности и улучшенной активности bsh с течением времени. Типичные лиопротекторы включают в себя, без ограничения, конечную концентрацию 0,2% - 10% мальтодекстрина и 0,05-0,33% дрожжевого экстракта или 0,05-2,5% инулина и 0,05-0,1 % дрожжевого экстракта. В одном варианте осуществления лиопротекторы содержат конечную концентрацию 2-4% мальтодекстрина и 0,1 % дрожжевого экстракта, 0,3% инулина и 0,1% дрожжевого экстракта или 0,3% инулина.
В другом варианте осуществления пероральные композиции, описанные в настоящем документе, сохраняют в жидкости для обеспечения жизнеспособности и улучшенной активности bsh. Типичные условия хранения в жидкости включают в себя, без ограничения, конечную концентрацию раствора консерванта, содержащего 2,5-10% культуральной среды (как описано в настоящем описании) 50-99,99% йогурта или других кисломолочных продуктов, 50-99,99% культурального супернатанта или 5% MRS.
В другом варианте осуществления пероральные композиции, описанные в настоящем документе, являются сверхбыстрозамороженными для обеспечения жизнеспособности и улучшенной активности bsh. Типичные условия сверхбыстрого замораживания включают в себя, без ограничения, конечную концентрацию раствора криопротектора, содержащего 0,2-10% мальтодекстрина, необязательно, 1-3% мальтодекстрина и 0,05-0,33% дрожжевого экстракта, необязательно, 0,1-0,2% дрожжевого экстракта, 0,05-2,5% инулина, необязательно, по меньшей мере 0,2% инулина, 0,5 М трегалозу, 0,5 М фруктозу, 0,5 М лактозу, 0,5 М мальтозу или 50-99,99%, необязательно, 50% среды после культивирования.
Термин «носитель», как применяют в настоящем документе, относится к приемлемому носителю, облегчающему введение субъекту. Например, приемлемый носитель, облегчающий пероральное введение, включает в себя, без ограничения, добавку, пищевой продукт, напиток, функциональный пищевой продукт или нутрицевтик или наполнитель. «Нутрицевтик» обозначает продукт, выделенный или очищенный из пищевых продуктов (или источников, используемых для получения пищевых продуктов, таких как растения, животные или другие организмы), который, как считают, обладает преимуществами для здоровья, например, оказывает медицинский, физиологический или профилактический эффект. «Функциональный пищевой продукт» обозначает пищевой продукт, употребляемый как часть диеты и обладающий преимуществами для здоровья, такими как медицинские, физиологические или профилактические преимущества, помимо основной относящийся к питанию функции предоставления питательных веществ.
В другом варианте осуществления носитель содержит капсулу, пилюлю, желатиновую капсулу, жидкость или растворимую пленку.
Оральные композиции, описанные в настоящем документе для снижения уровня холестерина в сыворотке, липидов в сыворотке, жировой ткани или индекса атерогенности, или для профилактики или лечения атеросклероза, сердечно-сосудистых или цереброваскулярных заболеваний, необязательно, дополнительно содержат другие средства или лекарственные средства для таких показаний. Соответственно, в одном варианте осуществления пероральная композиция дополнительно содержит средство, понижающее уровень триглицеридов, необязательно, ингибиторы скваленсинтазы, ингибиторы микросомального белка-переносчика триглицеридов, статины, секвестранты желчных кислот, ингибиторы абсорбции холестерина, фибраты и другие агонисты PPAR альфа, двойные агонисты PPAR, ингибиторы липазы, ингибиторы протеинтирозинфосфатазы 1B, панкреатический пептид YY3-36, рекомбинантные и другие антагонисты рецептора каннабиноидов или агонисты 5-HT2c, такие как лоркасерин. В другом варианте осуществления композиция дополнительно содержит средство для увеличения уровня ЛВП или для ограничения снижения уровня ЛВП, необязательно, статины, секвестранты желчных кислот, ингибиторы абсорбции холестерина, фибраты и другие агонисты PPAR альфа, двойные агонисты PPAR, ингибиторы липазы, ингибиторы протеинтирозинфосфатазы 1 B, панкреатический пептид YY3-36, рекомбинантные и другие антагонисты рецептора каннабиноидов или агонисты 5-HT2c, такие как лоркасерин. В другом варианте осуществления пероральная композиция дополнительно содержит средство, снижающее уровень холестерина, необязательно, секвестранты желчных кислот (BAS), статин, эзетимиб, альфа-линолевую кислоту, омега-3,6,9, эйкозапентаеновую кислоту (EPA), докозагексаеновую кислоту (DHA), фибраты, растворимые волокна, полифенол, метаболит гесперетина гамма-ориназол, фитохимическое соединение, другой пробиотик, псилиум, фитостерол, фитостанол, витамин, антиоксидант или антибиотик. Статин может являться выбранным из группы, состоящей из ловастатина, правастатина, зокора, флувастатина, мевастатина, питавастатина, церивастатина, симвастатина, розувастатина и аторвастатина. BAS может представлять собой колестирамин, колестипол или колесевилам. Фибрат может представлять собой клофибрат, безафибрат, гемфиброзил или фенофибрат. В следующем варианте осуществления пероральная композиция дополнительно содержит средство для сохранения активности bsh, необязательно, инулин, трегалозу, мальтодекстран, дрожжевой экстракт, полиэтиленгликоль, глицерин, липид, эмульгированный жир, молочный продукт, глюкозу, фруктозу, сахарозу, полисахар, ангидробиотический микроорганизм, поликозанол, полиэтиленгликоль (PEG), растительный стерол, растительный станол или омега-жирную кислоту. Поликозанол может представлять собой октакозанол, триаконтанол, бегениловый спирт, лигноцериловый спирт, цериловый спирт, 1-гептакозанол, 1-нонакозанол, 1-дотриаконтанол или гедиловый спирт. В следующем варианте осуществления пероральная композиция дополнительно содержит средство для модуляции адипокинов или гормонов ожирения, необязательно, лептин, грелин, резистин, адипонектин, хемерин, Il-6, висфатин, ретинол-связывающий белок 4 или ингибитор активатора плазминогена-1. В другом дополнительном варианте осуществления пероральная композиция дополнительно содержит гипогликемическое средство, необязательно, метформин, розиглитазон, пиоглитазон, глибурид, гликлазид, глимепирид, Glipizidebile, Glibenclamide, акарбозу, миглитол, воглибозу, ситаглиптин, натеглинид, репаглинид, митиглинид, алоглиптин, саксаглиптин, вилдаглиптин и дапаглифлозин. В даже более предпочтительном варианте осуществления пероральная композиция дополнительно содержит лекарственное средство для уменьшения уровня провоспалительных цитокинов IL-1α/β, IL-2, IL-15, IL-3, IL-6, IL-8, IL-12, IL-17, IFN-гамма, TNF-альфа или для увеличения уровня противовоспалительных цитокинов IL-1ra, IL-9, IL-10, IL-11.
В другом варианте осуществления пероральная композиция дополнительно содержит витамин B12. В следующем варианте осуществления пероральная композиция дополнительно содержит конъюгированную линолевую кислоту (CLA). В следующем варианте осуществления пероральная композиция дополнительно содержит реутерин и/или рейтерициклин.
Способы и применения
Описание включает в себя способы и применения для пероральных композиций, описанных в настоящем документе. В одном варианте осуществления представлен способ терапии, включающий в себя введение пероральной композиции, описанной в настоящем документе, нуждающемуся в этом животному. Представлено также применение пероральной композиции, описанной в настоящем документе, для лечения животного. Кроме того, представлено применение пероральной композиции, описанной в настоящем документе, в изготовлении лекарственного средства для терапии. Представлена также пероральная композиция, описанная в настоящем документе, для применения в терапии.
Композиции, описанные в настоящем документе, являются полезными для снижения уровня холестерина в сыворотке нуждающегося в этом животного. Соответственно, в одном аспекте настоящее описание относится к способу снижения уровня холестерина в сыворотке нуждающегося в этом животного, включающему в себя введение уменьшающего уровень желчной кислоты количества пероральной композиции, описанной в настоящем документе. Представлено также применение пероральной композиции, описанной в настоящем документе, для снижения уровня холестерина в сыворотке нуждающегося в этом животного. Представлено также применение пероральной композиции, описанной в настоящем документе, в изготовлении лекарственного средства для снижения уровня холестерина в сыворотке нуждающегося в этом животного. Кроме того, представлена пероральная композиция, описанная в настоящем документе, для применения для снижения уровня холестерина в сыворотке нуждающегося в этом животного.
В одном варианте осуществления нуждающееся в этом животное страдает заболеванием или нарушением, характеризующимся увеличенным накоплением холестерина в сыворотке и/или ткани, вызывающим патологию, или имеет избыточный уровень холестерина в качестве фактора риска. Нарушения уровня холестерина включают в себя гиперхолестеринемию или наследственное нарушение уровня холестерина (ICD), дефекты продуктов генов метаболизма холестерина, например, 7-альфа-гидроксилазы, и различные формы ксантом. Увеличенные уровни холестерина в сыворотке могут указывать на атеросклероз, билиарный цирроз печени, семейные гиперлипидемии, диету с высоким содержанием холестерина, гипотиреоз, инфаркт миокарда, нефритический синдром и неконтролируемый диабет. «Избыточный уровень холестерина» обозначает уровень вне типичного (нормального) диапазона уровня холестерина. Типичный уровень холестерина составляет менее 200 мг/дл. Граница высокого уровня составляет 200-239 мг/дл, и любое значение выше 240 мг/дл является высоким. Отчет Национальной образовательной программы по холестерину NCEP III относительно холестерина включает в себя «Полный отчет» и раздел «Терапия лекарственными средствами». В нем представлен обзор примеров управления уровнем холестерина посредством статинов, секвестрантов желчных кислот, диеты и т.д., и он относится к уровням холестерина и факторам риска (см., например, Таблицы IV.1-1 VI.1-1; VI.1-2, VI.1-3). Композиции, описанные в настоящем документе, являются сходными с секвестрантами желчных кислот в том, что они уменьшают уровни желчи. Отчет NCEP предоставляет руководство для использования фармацевтической терапии в зависимости от присутствия других факторов риска. Существует два типа холестерина, холестерин ЛВП (иногда называемый хорошим холестерином) и холестерин ЛНП (иногда называемый плохим холестерином). «Избыточный уровень холестерина» можно также определять по отношению к ЛНП. Например, терапию лекарственными средствами, необязательно, предусматривают для индивидуумов со многими факторами риска (2 или более), когда холестерин ЛНП составляет >100 мг/дл (например, с целью снижения уровня холестерина ЛНП до <100 мг/дл), по меньшей мере 130 мг/дл (например, с целью снижения уровня холестерина ЛНП до менее 130 мг/дл), по меньшей мере, 160 мг/дл (например, с целью снижения уровня холестерина ЛНП до менее 130 мг/дл). Более того, терапию лекарственными средствами также необязательно предусматривают для индивидуумов с 0-1 факторами риска, когда холестерин ЛНП составляет по меньшей мере 190 мг/дл (например, с целью снижения уровня холестерина ЛНП до менее 160 мг/дл). Нормальные значения проявляют тенденцию увеличиваться с возрастом, и женщины в пременопаузе имеют несколько более низкие уровни, чем мужчины такого же возраста.
В другом варианте осуществления способы и применения для снижения уровня холестерина в сыворотке также увеличивают уровень липопротеинов высокой плотности (ЛВП-Х) в сыворотке животного или ограничивают уменьшение уровня липопротеинов высокой плотности в сыворотке животного. В следующем варианте осуществления способы и применения для снижения уровня холестерина в сыворотке также уменьшают уровень триглицеридов в сыворотке животного. В следующем варианте осуществления способы и применения для снижения уровня холестерина в сыворотке также уменьшают факторы риска атеросклероза у животного. Факторы риска атеросклероза включают в себя, без ограничения, гомоцистин, фибриноген, C-реактивный белок, липопротеин(a), мочевую кислоту, матриксную металлопептидазу 9 (MMP-9), ингибитор активатора плазминогена 1 (PAI-1) или его антиген, тканевой активатор плазминогена (tPA), TNF альфа, IL-6, P-селектин, моноцитарный хемотаксический белок-1 (MCP-1), растворимый лиганд CD40 (sCD40L), молекулу межклеточной адгезии 1 (ICAM-1), миелопероксидазу (MPO), адипонектин, лептин, липопротеин- ассоциированную фосфолипазу A и инсулин в сыворотке.
В другом варианте осуществления способы и применения для снижения уровня холестерина в сыворотке обеспечивают также и доставку витамина B12 животному. В следующем варианте осуществления способы и применения для снижения уровня холестерина в сыворотке обеспечивают также и доставку конъюгированной линолевой кислоты (CLA) животному. В следующем варианте осуществления способы и применения для снижения уровня холестерина в сыворотке обеспечивают также и доставку реутерина и рейтерициклина животному.
Оральные композиции, описанные в настоящем документе, являются также полезными для снижения уровня триглицеридов в сыворотке нуждающегося в этом животного Соответственно, в одном аспекте настоящее описание относится к способу снижения уровня триглицеридов в сыворотке нуждающегося в этом животного, включающему в себя введение уменьшающего уровень желчной кислоты количества пероральной композиции, описанной в настоящем документе. Представлено также применение пероральной композиции, описанной в настоящем документе, для снижения уровня триглицеридов в сыворотке нуждающегося в этом животного. Представлено также применение пероральной композиции, описанной в настоящем документе, в изготовлении лекарственного средства для снижения уровня триглицеридов в сыворотке нуждающегося в этом животного. Кроме того, представлена пероральная композиция, описанная в настоящем документе, для применения для снижения уровня триглицеридов в сыворотке нуждающегося в этом животного.
В другом аспекте настоящее описание относится к способу уменьшения индекса атерогенности животного, включающему в себя введение животному уменьшающего уровень желчной кислоты количества пероральной композиции по описанию. Представлено также применение уменьшающего уровень желчной кислоты количества пероральной композиции по описанию для уменьшения индекса атерогенности животного. Представлено также применение уменьшающего уровень желчной кислоты количества пероральной композиции по описанию в изготовлении лекарственного средства для уменьшения индекса атерогенности животного. Кроме того, представлено уменьшающее уровень желчной кислоты количество пероральной композиции по описанию для применения для уменьшения индекса атерогенности животного. Индекс атерогенности рассчитывают с использованием по меньшей мере одного из уравнений, показанных в таблице 1.
В другом аспекте описание относится к способу профилактики или лечения атеросклероза или дегенеративного нарушения, вызванного атеросклерозом, у животного, включающему в себя введение животному уменьшающего уровень желчной кислоты количества пероральной композиции по описанию. Представлено также применение уменьшающего уровень желчной кислоты количества пероральной композиции по описанию для профилактики или лечения атеросклероза или дегенеративного нарушения, вызванного атеросклерозом. Представлено также применение уменьшающего уровень желчной кислоты количества пероральной композиции по описанию в изготовлении лекарственного средства для профилактики или лечения атеросклероза или дегенеративного нарушения, вызванного атеросклерозом. Кроме того, представлено уменьшающее уровень желчной кислоты количество пероральной композиции по описанию для применения для профилактики или лечения атеросклероза или дегенеративного нарушения, вызванного атеросклерозом. Дегенеративные нарушения включают в себя, без ограничения, цереброваскулярное заболевание, удар, сосудистое заболевание, болезнь коронарных артерий, инфаркт миокарда, тромбоз, стенокардию, нестабильную стенокардию, перемежающуюся хромоту, транзиторную ишемическую атаку или почечную недостаточность.
Термин «профилактика или лечение» относится к уменьшению вероятности состояния или к улучшению состояния.
В следующем аспекте описание относится к способу уменьшения общего количества жировой ткани или лечения ожирения или предожирения у животного, включающему в себя введение животному уменьшающего уровень желчной кислоты количества пероральной композиции по описанию. Представлено также применение уменьшающего уровень желчной кислоты количества пероральной композиции по описанию для уменьшения общего количества жировой ткани или лечения ожирения или предожирения у животного. Представлено также применение уменьшающего уровень желчной кислоты количества пероральной композиции по описанию для изготовления лекарственного средства для уменьшения общего количества жировой ткани или лечения ожирения или предожирения у животного. Кроме того, представлено уменьшающее уровень желчной кислоты количество пероральной композиции по описанию для применения для уменьшения общего количества жировой ткани или лечения ожирения или предожирения у животного. Термин «ожирение», как применяют в настоящем документе, относится к заболеванию, медицинскому состоянию или нарушению, и его определяют как индекс массы тела (BMI)>30. BMI 25-30 относится к предожирению.
В следующем аспекте описание относится к способу профилактики или лечения метаболического заболевания или нарушения у животного, включающему в себя введение животному уменьшающего уровень желчной кислоты количества пероральной композиции по описанию. Представлено также применение уменьшающего уровень желчной кислоты количества пероральной композиции по описанию для профилактики или лечения метаболического заболевания или нарушения у животного. Представлено также применение уменьшающего уровень желчной кислоты количества пероральной композиции по описанию для изготовления лекарственного средства для профилактики или лечения метаболического заболевания или нарушения у животного. Кроме того, представлено уменьшающее уровень желчной кислоты количество пероральной композиции по описанию для применения в профилактике или лечении метаболического заболевания или нарушения у животного. Метаболические заболевания и нарушения включают в себя, без ограничения, гиперлипидемию, гипергликемию, гиперлипопротеинемию, нарушение толерантности к глюкозе (IGT), устойчивость к инсулину, преддиабет, диабет I типа, диабет II типа и метаболический синдром.
В другом аспекте описание относится к способу профилактики или лечения заболевания или нарушения печени, ассоциированного с высокими концентрациями липидов и триглицеридов в сыворотке или печени, воспаления печени, заболевания неалкогольной жировой инфильтрации печени (NAFLD), заболевания алкогольной жировой инфильтрации печени (AFLD), неалкогольного стеатогепатита (NASH), цирроза печени, стеатоза печени, фиброза печени, аномально высоких уровней в сыворотке ALT, AST GGT или Alk-P, вируса Эпштейна-Барр, гепатита, аутоиммунного гепатита, заболевания гранулематоза печени, холангита, гепатоцеллюлярного рака, холангиокарциномы, метаболического заболевания печени у животного, включающему в себя введение животному уменьшающего уровень желчной кислоты количества пероральной композиции по описанию. Представлено также применение уменьшающего уровень желчной кислоты количества пероральной композиции по описанию для профилактики или лечения заболевания или нарушения печени, ассоциированного с высокими концентрациями липидов и триглицеридов в сыворотке или печени, воспаления печени, заболевания неалкогольной жировой инфильтрации печени (NAFLD), заболевания алкогольной жировой инфильтрации печени (AFLD), неалкогольного стеатогепатита (NASH), цирроза печени, стеатоза печени, фиброза печени, аномально высоких уровней в сыворотке ALT, AST, GGT или Alk-P, вируса Эпштейна-Барр, гепатита, аутоиммунного гепатита, заболевания гранулематоза печени, холангита, гепатоцеллюлярного рака, холангиокарциномы, метаболического заболевания печени у животного. Представлено также применение уменьшающего уровень желчной кислоты количества пероральной композиции по описанию для изготовления лекарственного средства для профилактики или лечения заболевания или нарушения печени, ассоциированного с высокими концентрациями липидов и триглицеридов в сыворотке или печени, воспаления печени, заболевания неалкогольной жировой инфильтрации печени (NAFLD), заболевания алкогольной жировой инфильтрации печени (AFLD), неалкогольного стеатогепатита (NASH), цирроза печени, стеатоза печени, фиброза печени, аномально высоких уровней в сыворотке ALT, AST, GGT или Alk-P, вируса Эпштейна-Барр, гепатита, аутоиммунного гепатита, заболевания гранулематоза печени, холангита, гепатоцеллюлярного рака, холангиокарциномы, метаболического заболевания печени у животного. Представлено также применение уменьшающего уровень желчной кислоты количества пероральной композиции по описанию для применения в профилактике или лечении заболевания или нарушения печени, ассоциированного с высокими концентрациями липидов и триглицеридов в сыворотке или печени, воспаления печени, заболевания неалкогольной жировой инфильтрации печени (NAFLD), заболевания алкогольной жировой инфильтрации печени (AFLD), неалкогольного стеатогепатита (NASH), цирроза печени, стеатоза печени, фиброза печени, аномально высоких уровней в сыворотке ALT, AST, GGT или Alk-P, вируса Эпштейна-Барр, гепатита, аутоиммунного гепатита, заболевания гранулематоза печени, холангита, гепатоцеллюлярного рака, холангиокарциномы, метаболического заболевания печени у животного.
Другие средства или лекарственные средства можно вводить совместно или использовать в сочетании с пероральными композициями, описанными в настоящем документе. Соответственно, в одном варианте осуществления, способы и применения, описанные в настоящем документе, дополнительно включают в себя введение уменьшающего уровень триглицеридов средства, необязательно, ингибиторов скваленсинтазы, ингибиторов микросомального белка-переносчика триглицеридов, статинов, секвестрантов желчных кислот, ингибиторов абсорбции холестерина, фибратов и других агонистов PPAR альфа, двойных агонистов PPAR, ингибиторов липазы, ингибиторов протеинтирозинфосфатазы 1B, панкреатического пептида YY3-36, рекомбинантных и других антагонистов рецептора каннабиноидов или агонистов 5-HT2c, таких как лоркасерин. В другом варианте осуществления способы и применения, описанные в настоящем документе, дополнительно включают в себя введение средства для увеличения уровня ЛВП или для ограничения уменьшения уровня ЛВП, необязательно, статинов, секвестрантов желчных кислот, ингибиторов абсорбции холестерина, фибратов и других агонистов PPAR альфа, двойных агонистов PPAR, ингибиторов липазы, ингибиторов протеинтирозинфосфатазы 1B, панкреатического пептида YY3-36, рекомбинантных и других антагонистов рецептора каннабиноидов, или агонистов 5-HT2c, таких как лоркасерин. В другом варианте осуществления способы и применения, описанные в настоящем документе, дополнительно включают в себя введение уменьшающего уровень холестерина средства, необязательно, секвестрантов желчных кислот (BAS), статина, эзетимиба, альфа-линолевой кислоты, омега-3,6,9, эйкозапентаеновой кислоты (EPA) докозагексаеновой кислоты (DHA), фибратов, растворимых волокон, полифенола, метаболита гесперетина гамма-ориназола, фитохимического соединения, другого пробиотика, псилиума, фитостерола, фитостанола, витамина, антиоксиданта или антибиотика. Статины включают в себя, без ограничения, ловастатин, правастатин, зокор, флувастатин, мевастатин, питавастатин, церивастатин, симвастатин, розувастатин и аторвастатин. BAS включают в себя, без ограничения, колестирамин, колестипол и колесевилам. Фибраты включают в себя, без ограничения, клофибрат, безафибрат, гемфиброзил и фенофибрат. В другом варианте осуществления способы и применения, описанные в настоящем документе, дополнительно включают в себя введение средства для сохранения активности bsh, необязательно, инулина, трегалозы, мальтодекстрана, дрожжевого экстракта, полиэтиленгликоля, глицерина, липида, эмульгированного жира, молочного продукта, глюкозы, фруктозы, сахарозы, полисахара, ангидробиотического микроорганизма, a поликозанола, полиэтиленгликоля (PEG), растительного стерола, растительного станола или омега-жирной кислоты. Поликозанол включает в себя, без ограничения, октакозанол, триаконтанол, бегениловый спирт, лигноцериловый спирт, цериловый спирт, 1-гептакозанол, 1-нонакозанол, 1-дотриаконтанол и гедиловый спирт. В следующем варианте осуществления способы и применения, описанные в настоящем документе, дополнительно включают в себя введение средства для модуляции адипокинов или гормонов ожирения, необязательно, лептина, грелина, резистина, адипонектина, хемерина, Il-6, висфатина, ретинол-связывающего белка 4 или ингибитора активатора плазминогена-1. В следующем варианте осуществления способы и применения, описанные в настоящем документе, дополнительно включают в себя введение гипогликемического средства, необязательно, метформина, розиглитазона, пиоглитазона, глибурида, гликлазида, глимепирида, Glipizidebile, Glibenclamide, акарбозы, миглитола, воглибозы, ситаглиптина, натеглинида, репаглинида, митиглинида, алоглиптина, саксаглиптина, вилдаглиптина и дапаглифлозина. В другом варианте осуществления способы и применения, описанные в настоящем документе, дополнительно включают в себя введение лекарственного средства для уменьшения уровня провоспалительных цитокинов IL-1α/β, IL-2, IL-15, IL-3, IL-6, IL-8, IL-12, IL-17, IFN-гамма, TNF-альфа или для увеличения уровня противовоспалительных цитокинов IL-1ra, IL-9, IL-10, IL-11.
Термин «животное», как применяют в настоящем документе, относится к любому члену царства животных, необязательно, млекопитающему, такому как человек.
Введение «эффективного количества» или «уменьшающего уровень желчной кислоты количества» средств, описанных в настоящем документе, определяют как количество, эффективное в дозах и в течение периодов времени, необходимых для достижения желаемого результата. Эффективное количество бактериальной композиции с высокой активностью bsh, необязательно, регулируют в соответствии с такими факторами, как стадия заболевания, возраст, пол и масса животного. Режимы дозирования легко регулировать для обеспечения оптимального терапевтического ответа. Например, можно вводить несколько дробных доз ежесуточно, или дозу можно пропорционально уменьшать, как требуют обстоятельства терапевтической ситуации. В одном варианте осуществления композиции можно вводить или использовать 1-4 раза в сутки.
Композиции можно получать известными способами для получения фармацевтически приемлемых композиций, которые можно вводить пациентам, и так, что эффективное количество клеток объединяют в смеси с фармацевтически приемлемым носителем. Подходящие носители описаны, например, в Remington's Pharmaceutical Sciences (Remington's Pharmaceutical Sciences, Mack Publishing Company Easton Pa, USA 2003 - 20th Edition) и в The United States Pharmacopeia The National Formulary (USP 24 NF19) published in 1999).
Способы выращивания и получения бактерий
В настоящем документе представлены также способы получения бактерий с высокой активностью bsh, включающие в себя выращивание продуцирующих bsh бактерий в условиях ферментации, поддерживающих развитие высокой активности bsh. Подходящие условия ферментации описаны в разделе композиции выше. Например, условия ферментации, необязательно, включают в себя источник углерода, источник азота, pH 4-7 и время сбора 12-24 часа. В одном варианте осуществления источник углерода представляет собой сахар, который, необязательно, содержит мальтозу, сахарозу, декстрин, комбинацию сорбита и глюкозы или комбинацию инулина и глюкозы. В конкретном варианте осуществления источник углерода представляет собой мальтозу. В другом варианте осуществления источник азота содержит (i) дрожжевой экстракт и солодовый экстракт, дрожжевой экстракт и говяжий экстракт, или гидролизат казеина и солодовый экстракт, и (ii) пептон или триптон. В другом варианте осуществления источник азота дополнительно содержит цистеин. В конкретном варианте осуществления пептон представляет собой пептон no. 3. Типичные концентрации источников углерода и азота являются такими, как описано в разделе композиции выше.
В следующем варианте осуществления способ дополнительно включает в себя лиофилизацию свободных или микроинкапсулированных бактериальных композиций с лиопротекторами, как описано в настоящем описании. В одном варианте осуществления лиопротекторы содержат конечную концентрацию 0,2-10% мальтодекстрина и 0,05-0,33% дрожжевого экстракта или 0,05-2,5% инулина и 0,05-0,1% дрожжевого экстракта. В одном варианте осуществления лиопротекторы содержат конечную концентрацию 2-4% мальтодекстрина и 0,1% дрожжевого экстракта, 0,3% инулина и 0,1% дрожжевого экстракта или 0,3% инулина.
В альтернативном варианте осуществления способ дополнительно включает в себя хранение свободной или микроинкапсулированной бактериальной композиции с высокой активностью bsh в условиях хранения в жидкости. В одном варианте осуществления условия хранения в жидкости включают в себя конечный раствор консерванта, содержащий 2,5-10% культуральной среды, 50-99,99% йогурта или других кисломолочных продуктов, 50-99,99% культурального супернатанта или 5% MRS.
В другом варианте осуществления способ дополнительно включает в себя сверхбыстрое замораживание свободной или микроинкапсулированной композиции в растворе криопротектора, как описано в настоящем описании. В одном варианте осуществления раствор криопротектора содержит конечную концентрацию 0,2-10% мальтодекстрина, необязательно, 1-3% мальтодекстрина и 0,05-0,33% дрожжевого экстракта, необязательно, 0,1-0,2% дрожжевого экстракта, 0,05-2,5% инулина, необязательно, по меньшей мере 0,2% инулина, 0,5 М трегалозу, 0,5 М фруктозу, 0,5 М лактозу, 0,5 М мальтозу или 50-99,99%, необязательно, 50% среды после культивирования. Сверхбыстрое замораживание, как применяют в настоящем документе, относится к подверганию композиции воздействию температур ниже -80 градусов Цельсия, например, посредством подвергания свободной или микроинкапсулированной композиции воздействию жидкого азота, например, при температуре -196 градусов Цельсия или замораживания композиции при сверхнизких температурах, таких как -130 градусов Цельсия, или с использованием сухого льда.
Приведенное выше описание описывает настоящее описание в общем смысле. Более полное понимание можно получить со ссылкой на следующие конкретные примеры. Эти примеры описаны единственно с целью иллюстрации и не предназначены для ограничения объема описания. Предусматривают изменения формы и замену эквивалентов, как могут предполагать обстоятельства или как представляется целесообразным.
Следующие неограничивающие примеры являются иллюстративными для настоящего описания.
ПРИМЕРЫ
Деконъюгация TDCA и GDCA свободными штаммами Lactobacillus reuteri (Фиг. 1 и 2)
Результаты
На фиг. 1 и 2 показана деконъюгация тауродезоксихолевой кислоты и гликодезоксихолевой кислоты, как измерено посредством HPLC, в анализе in-vitro с использованием 0,4 грамм свободных Lactobacillus reuteri (ATCC 53608, ATCC 53609, ATCC 55148, ATCC 55739, и NCIMB 701359), с течением времени. Штаммы Lactobacillus reuteri NCIMB 701359 и ATCC 55739 обладают наивысшей активностью bsh, как измерено посредством HPLC. Следует принимать во внимание ограничения «разрешающей способности» анализа (с использованием 0,4 грамм и отбора проб через 2,5 часа), однако, все еще показано, что эти штаммы обладают значительно более высокой активностью bsh, чем другие, тестированные в этом эксперименте, и поскольку уровень GDCA не поддается измерению через 2,5 часа, существует даже более сильная разница в активности bsh, поскольку субстрат становится лимитирующим.
Материалы и методы
Бактерии и условия культивирования
Четыре штамма Lactobacillus reuteri, полученные из ATCC (53609, 53608, 55148 и 55739) и NCIMB 701359, культивировали в стерильной среде Ман, Рогоза, Шарп (MRS) при 37°C в течение 20 часов. Выросшие культуры выделяли центрифугированием, и собранные клетки бактерий использовали в следующем анализе BSH.
Измерение активности BSH
Для измерения активности BSH собранные бактерии добавляли в 100% MRS, дополненную комбинацией гликодезоксихолата натрия и тауродезоксихолата натрия, оба при 5 мМ (0,4 г клеток бактерий/20 мл MRS, дополненной GDCA и TDCA). Затем бактерии инкубировали в реакционной смеси анаэробно при 37°C с минимальным встряхиванием (100 об./мин), образцы супернатанта отбирали с интервалами 2,5 часов и обрабатывали для определения концентраций конъюгированных солей желчных кислот. Кратко, образцы по 500 мкл подкисляли с помощью 5 мкл 6Н HCl после удаления клеток бактерий центрифугированием при 10000 g в течение 3 мин. Затем супернатанты дополняли 500 мкл метанола, содержащего 4 мМ GCA (гликохолевую кислоту) в качестве внутреннего стандарта. Образцы встряхивали в течение 10 мин и центрифугировали при 1000 g в течение 15 мин. Образцы фильтровали через фильтр 0,22 мкм перед анализом посредством HPLC. Для анализа HPLC солей желчных кислот следовали способу, описанному Jones et al 2003.
Анализ HPLC солей желчных кислот
Для анализа HPLC солей желчных кислот следовали способу, описанному Jones et al. 2003. Анализ проводили на обращеннофазовой колонке C-18: LiChrosorb RP-18, 5 мкм, 250 x 4,6 мм. Система HPLC содержала два модуля доставки растворителя ProStar 210, детектор ProStar 320 UV-VIS, автодозатор ProStar 410 и систему сбора и обработки данных хроматографии Galaxie (версия 1.9.3.2). Смесь метанола и буфера 50 мМ ацетата натрия, доведенную до pH 4,3 с помощью o-фосфорной кислоты (70:30, об./об.), наносили в качестве подвижной фазы со скоростью потока 1,0 мл/мин. Детектор устанавливали на 210 нм, и все измерения проводили при комнатной температуре.
Деконъюгация TDCA и GDCA свободными Lactobacillus reuteri и Lactobacillus fermentum (Фиг. 3 и 4)
Результаты
На фиг. 3 и 4 показана деконъюгация тауродезоксихолевой кислоты и гликодезоксихолевой кислоты, как измерено посредством HPLC, в анализе in-vitro для свободных Lactobacillus reuteri (Lab Met, NCIMB 701359) и Lactobacillus fermentum (ATCC 11976) с течением времени. Lactobacillus reuteri (NCIMB 701359) обладает намного большей активностью bsh, чем Lactobacillus reuteri (LabMet) или Lactobacillus fermentum (ATCC 11976), и даже часть (1/8) количества клеток Lactobacillus reuteri (NCIMB 701359) превосходит по производительности Lactobacillus reuteri (LabMet) in-vitro.
Материалы и методы
Бактерии и условия культивирования
Бактериальные штаммы, используемые в этом исследовании, представляют собой L. reuteri (LabMet, NCIMB 701359) и L. fermentum (ATCC 11976). Бактерии культивировали в стерильной среде Ман, Рогоза, Шарп (MRS) при 37°C в течение 20 часов. Выросшие культуры выделяли центрифугированием, и собранные клетки бактерий использовали в следующем анализе BSH.
Измерение активности BSH
Для измерения активности BSH собранные бактерии добавляли в 100% MRS, дополненную комбинацией гликохолата натрия и таурохолата натрия при 5 мМ (0,4 г или 0,05 г бактерий /20 мл MRS, дополненной GDCA и TDCA). Затем бактерии инкубировали анаэробно при 37°C, образцы супернатанта отбирали с интервалами 3 часа и обрабатывали для определения концентраций конъюгированных солей желчных кислот в реакционных пробирках. Кратко, образцы по 500 мкл подкисляли с помощью 5 мкл 6 Н HCl после удаления клеток бактерий центрифугированием при 10000 g в течение 3 мин. Затем супернатанты дополняли 500 мкл метанола, содержащего 4 мМ GCA (гликохолевую кислоту) в качестве внутреннего стандарта. Образцы встряхивали в течение 10 мин и центрифугировали при 1000 g в течение 15 мин. Образцы фильтровали через фильтр 0,22 мкм перед анализом посредством HPLC. Для анализа HPLC солей желчных кислот следовали способу, описанному Jones et al.
Анализ HPLC солей желчных кислот
Для анализа HPLC солей желчных кислот следовали способу, описанному Jones et al 2003. Анализ проводили на обращеннофазовой колонке C-18 LiChrosorb RP-18, 5 мкм, 250x4,6 мм. Система HPLC содержала два модуля доставки растворителя ProStar 210, детектор ProStar 320 UV-VIS, автодозатор ProStar 410 и систему сбора и обработки данных хроматографии Galaxie (версия 1.9.3.2). Смесь метанола и буфера 50 мМ ацетата натрия, доведенную до pH 4,3 с помощью o-фосфорной кислоты (70:30, об./об.), наносили в качестве подвижной фазы со скоростью потока 1,0 мл/мин. Детектор устанавливали на 210 нм, и все измерения проводили при комнатной температуре.
Деконъюгация TDCA и GDCA свободными штаммами Lactobacillus reuteri (Фиг. 5 и 6)
Результаты
На фиг. 5 и 6 показана деконъюгация тауродезоксихолевой кислоты и гликодезоксихолевой кислоты, как измерено посредством HPLC в анализе in-vitro с использованием 0,2 грамм свободных Lactobacillus reuteri (NCIMB 701359, NCIMB 701089, NCIMB 702656, NCIMB 11951, ATCC 23272 и LMG 9213) с течением времени. Штаммы NCIMB 701359, NCIMB 701089 и ATCC 23272 обладают наивысшей степенью активности bsh, как измерено посредством HPLC, снова с ограничением разрешающей способностью исследования.
Материалы и методы
Бактерии и условия культивирования
Бактериальные штаммы, используемые в этом исследовании, представляют собой L. reuteri NCIMB 701359, L. reuteri NCIMB 701089, L. reuteri NCIMB 702656, L. reuteri NCIMB 11951, L. reuteri ATCC 23272 и L. reuteri LMG 9213. Бактерии инокулировали из отдельной колонии и дважды пассировали с использованием 1% инокулятов. Бактерии культивировали в стерильной среде Ман, Рогоза, Шарп (MRS, Difco) при 37°C в течение 20 часов каждый раз. Выросшие культуры выделяли центрифугированием, и собранные клетки бактерий использовали в следующем анализе BSH.
Измерение активности BSH
Для измерения активности BSH 0,2 г собранных бактерий добавляли в 100% MRS, дополненную комбинацией гликохолата натрия и таурохолата натрия при 5 мМ (0,2 г бактерий /20 мл MRS, дополненной 5 мМ GDCA и 5 мМ TDCA). Затем бактерии инкубировали анаэробно при 37°C, и образцы супернатанта отбирали через 1, 3, 5 и 7 часов для определения концентраций конъюгированных солей желчных кислот в реакционных пробирках. Кратко, образцы по 500 мкл подкисляли с помощью 5 мкл 6 Н HCl после удаления клеток бактерий центрифугированием при 10000 g в течение 3 мин. Затем супернатанты дополняли 500 мкл метанола, содержащего 4 мМ GCA (гликохолевую кислоту) в качестве внутреннего стандарта. Образцы встряхивали в течение 10 мин и центрифугировали при 1000 g в течение 15 мин. Образцы фильтровали через фильтр 0,45 мкм перед анализом посредством HPLC. Для анализа HPLC солей желчных кислот следовали способу, описанному Jones et al.
L. reuteri с высокой активностью bsh и уменьшение уровня холестерина
Материалы и методы
Активность bsh штаммов Lactobacilli рассчитывали посредством стандартного анализа TDCA и GDCA посредством HPLC, описанного в разделах материалы и методы выше. Скорость удаления xDCA рассчитывали взятием концентрации GDCA или TDCA, удаленных из содержимого стимулированного кишечника в конечной точке и вычитанием исходного значения. Количество продуцированной DCA или удаленной xDCA делили на массу использованных микрокапсул и умножали на объем использованного содержимого стимулированного кишечника, и делили на истекшее время, в часах, от исходной до конечной точки. Это осуществляли посредством уравнения: уменьшенное количество xDCA = мкмоль продуцированной DCA или уменьшенного количества xDCA /г микрокапсул/час.
Результаты
В таблице 2 показана активность bsh штаммов Lactobacillus reuteri при доклиническом или клиническом исследовании и выраженная как скорость (мкмоль DCA/г/час), измеренная через 5 часов и через 30 минут. Хотя показано, что Lactobacillus reuteri (LabMet) уменьшали уровень холестерина в доклиническом исследовании, необходимы были высокие дозы L. reuteri и высокая частота дозирования. Подтверждено, что Lactobacillus reuteri с более высокой активностью bsh (NCIMB 701359), уменьшавший уровень холестерина в доклинических исследованиях, значительно уменьшал уровень холестерина в клинических исследованиях на людях. Полагали, что более высокая степень активности bsh была ответственной за эту активность, и существует большое число свидетельств, поддерживающее утверждение, что пороговый уровень активности bsh необходим для свободных клеток, вводимых в высоких ежесуточных дозах. По-видимому, организмов, деградирующих >50 мкмоль GDCA/грамм/час и >2мкмоль TDCA/грамм/час, по измерениям через 1 час и 5 часов, соответственно, и вводимых в количестве 106-1012 организмов, достаточно для снижения уровня холестерина. По этой причине, предсказывают, что Lactobacillus reuteri (NCIMB 701089), обладающий даже большей активностью bsh, может уменьшать уровень холестерина и хорошо действовать в доклинических и клинических исследованиях. Кроме того, активность bsh измеряли с помощью такого же анализа посредством HPLC для и GDCA; однако, среднюю скорость рассчитывали в течение 30-минутного периода. Это обеспечивает точное определение истинной скорости ферментативной реакции, поскольку кривая деконъюгации xDCA является более линейной между 0 и 30 минутами, и реакция не является ограниченной низкой доступностью субстрата, наблюдаемой в более поздних временных точках.
Материалы и методы являются такими же, как для раздела анализ HPLC, описанного выше.
Эффективность и безопасность микроинкапсулированных Lactobacillus reuteri (NCIMB 701359) с высокой активностью bsh для сирийских золотистых хомяков F1B (Таблица 3)
Результаты
В таблице 3 показано изменение процентного содержания липидов в конечной точке по сравнению с контрольными значениями для хомяков F1B, у которых индуцировали гиперхолестеринемию и которых затем лечили кормлением через желудочный зонд микроинкапсулированными или свободными Lactobacillus reuteri (NCIMB 701359). В то время как присутствует сходное уменьшение общего холестерина между группами, присутствует более значительное уменьшение ЛНП-Х, менее значительное уменьшение ЛВП-Х, и улучшенное выведение триглицеридов для свободного организма в этой модели. Это приводит к значительным различиям в общем индексе атерогенности (AI) и показывает, что в то время как существуют преимущества микроинкапсуляции в отношении улучшенной доставки и выживаемости, существуют также преимущества доставки свободного организма с высокой активностью bsh в том отношении, что можно получать улучшенный липидный профиль.
Материалы и методы
Всего 38 сирийских золотистых хомячков Bio F1B, в возрасте 7-8 недель закупали из Biobreeders, USA. После доставки животным давали неделю акклиматизации. Животных содержали по одному на клетку в помещении с контролируемыми температурой и влажностью с двенадцатичасовым обращенным циклом света-темноты с пищей и водой, доступными по желанию. После акклиматизации животных взвешивали и собирали кровь для оценки исходного уровня липидов, как описано ниже.
Гиперхолестеринемию индуцировали посредством пяти недель кормления с использованием тестовой диеты, содержащей 0,05% холестерина. Потребление пищи и увеличение массы мониторировали еженедельно. Кровь собирали через четыре и пять недель индукции, и анализировали по уровню липидов. Кроме того, маркеры безопасности оценивали до начала обработки (пяти недель индукции). Образцы фекалий собирали в последние сутки периода индукции и оценивали по содержанию желчной кислоты.
Всех животных, у которых не обнаружили гиперхолестеринемию после пяти недель кормления с использованием индуцирующей гиперхолестеринемию диеты, исключали (5 животных). Оставшихся животных затем приписывали к одной из трех групп обработки посредством блочной рандомизации на основании уровней ЛНП в сыворотке с коррекцией, чтобы уравнять среднюю массу в каждой группе (n=11 для каждой группы). После рандомизации животным проводили лечение посредством кормления через желудочный зонд в течение шести недель.
На протяжении периода обработки кормление с использованием индуцирующей гиперхолестеринемию тестовой диеты продолжали. Потребление пищи и массу мониторировали на еженедельной основе, и уровни липидов в крови измеряли на двухнедельной основе. Через шесть недель обработки собирали образцы фекалий в конечной точке, и животных умерщвляли диоксидом углерода. Кровь собирали посредством пункции сердца для анализа в конечной точке липидов, маркеров безопасности и гематологии. Во время вскрытия печень репрезентативных животных из каждой группы собирали для гистологического анализа.
Эффективность и безопасность йогурта, содержащего микроинкапсулированные Lactobacillus reuteri (LabMet) с меньшей активностью bsh, для снижения уровня липидов (Таблица 4)
Результаты
В таблице 4 показано изменение процентного содержания липидов при голодании у субъектов с умеренной гиперхолестеринемией в ответ на потребление микроинкапсулированных Lactobacillus reuteri (LabMet) в течение 6-недельного периода лечения. Результат показывает некоторое изменение уровня холестерина в сыворотке по сравнению с контролем с уменьшением уровней триглицеридов в сыворотке.
Материалы и методы
В этом исследовании оценивали эффективность композиций пробиотического йогурта, содержащего микроинкапсулированные Lactobacillus reuteri (LabMet) с меньшей активностью bsh, по отношению к параметрам состояния здоровья, связанным с дегенеративным заболеванием у человека.
Предполагали, что потребление пробиотического продукта может индуцировать благоприятные сдвиги маркеров риска для некоторых истощающих заболеваний, связанных с увеличением возраста, и что потребление пробиотиков может преимущественным образом изменять уровень липидов по сравнению с общепринятыми способами лечения индивидуумов с гиперлипидемией.
Дизайн исследования представлял собой многофазное/двойное слепое контролируемое исследование с фазами выведения препарата из организма, в котором субъекты получали контрольные йогурты или тестовые йогурты в течение периода 6 недель с последующим выведением из организма в течение 6 недель перед следующими фазами.
Всего рандомизировали 30 здоровых мужчин и женщин в возрасте 18-60 лет, с уровнями ЛНП-Х в плазме 130-260 мг/дл, уровнями TG ниже 400 мг/дл, и индексом массы тела (BMI) 22-32 кг/м2.
Диеты для контроля метаболизма с точно известным составом предоставляли субъектам под строгим контролем отдела клинических исследований. Диеты являлись адекватными в отношении питательных веществ и обеспечивали 100% энергетических потребностей. Кроме того, субъекты получали один тестовый йогурт в сутки в течение периода лечения.
Образцы крови после двенадцатичасового голодания собирали в начале и конце каждой из фаз исследования. Образцы крови, полученные на сутки 1 и 2, использовали для измерения исходных значений для различных измерений в исследовании, в то время как образцы крови, полученные в последние несколько суток, использовали для измерения конечных значений для уровней липидов в сыворотке.
Эффективность и безопасность йогурта, содержащего микроинкапсулированные Lactobacillus reuteri (NCIMB 701359) с высокой активностью bsh, для снижения уровня липидов (Таблицы 5 и 6)
Результаты
В таблицах 5 и 6 показано изменение процентного содержания липидов при голодании у субъектов с гиперхолестеринемией в ответ на потребление Lactobacillus reuteri (NCIMB 701359) с более высокой активностью bsh в течение 6-недельного периода лечения. Результат показывает значительное уменьшение общего холестерина и холестерина ЛНП, так же как ApoB, как можно предсказать из значений активности bsh (26,4 мкмоль GDCA/грамм/час и 182,6 мкмоль TDCA/грамм/час). Это рандомизированное, двойное слепое исследование с параллельными группами являлось достаточно мощным и хорошо контролируемым, таким образом, любое снижение уровня холестерина было обусловлено пробиотическим ингредиентом.
Материалы и методы
В этом исследовании оценивали эффективность составов пробиотического йогурта, содержащего микроинкапсулированные Lactobacillus reuteri (NCIMB 701359) с высокой активностью bsh, по отношению к параметрам состояния здоровья, связанным с дегенеративным заболеванием у человека.
Целью являлась оценка эффектов потребления состава йогурта, содержащего микроинкапсулированные в альгинате поли-L-лизине альгинате (APA) Lactobacillus reuteri (NCIMB 701359) с высокой активностью гидролазы солей желчных кислот (bsh) на уровни липидов в плазме взрослых с гиперхолестеринемией и оценка относительных изменений концентрации ЛНП-холестерина в плазме взрослых с гиперхолестеринемией через 6 недель потребления продукта, по сравнению с контрольным продуктом.
Эксперимент включал в себя многоцентровое (5 центров) двойное слепое плацебо-контролируемое исследование с параллельными группами. Субъектов инструктировали для следования рекомендациям Министерства здравоохранения Канады относительно диеты, предназначенным, чтобы способствовать снижению риска ожирения и заболеваний сердца. Продолжительность исследования составляла 10 недель, включая 2-недельный период выведения из организма, 2-недельный подготовительный период и 6-недельный период лечения. Во время периода выведения из организма субъекты только следовали инструкциям по питанию. Во время подготовительного периода принимали плацебо. Лекарственный продукт или продукт плацебо принимали на протяжении всего периода лечения.
Всего рандомизировали 120 здоровых мужчин и женщин в возрасте между 18-74, с уровнями ЛНП-Холестерина >3,4 ммоль/л и уровнями TG <4,0 ммоль/л, и BMI в диапазоне 22-32 кг/м2, и 109 субъектов оценивали согласно протоколу.
Образцы крови после двенадцатичасового голодания собирали в начале и конце периода лечения. Образцы крови, полученные на сутки 1 и 2, использовали для измерения исходных значений для различных измерений в исследовании, в то время как образцы крови, полученные в последние несколько суток, использовали для измерения конечных значений для уровней липидов в сыворотке.
Идентификация бактерий с высокой активностью bsh (Фиг. 7 и Таблица 7)
Результаты
Анализ скрининга по зоне преципитации на MRS-TDCA-чашке показал, что в качестве способа определения активности bsh, рассев на TDCA чашки является грубым и может не являться достаточным для идентификации пробиотиков с высокой активностью bsh как кандидатов на снижение уровня холестерина. Как можно видеть, культуры с большей активностью bsh обладают более обширными зонами преципитации, однако, в случаях, когда DCA преципитат является более плотно сконцентрированным, скрининг только с помощью чашек TDCA не идентифицирует организмы с наиболее высокой активностью bsh в качестве потенциальных кандидатов. По этой причине может являться необходимым анализ с большей разрешающей способностью, такой как анализ HPLC, дающий количественное определение активности bsh для глико- и тауро-конъюгатов.
На фиг. 7 показаны три образца Lactobacillus reuteri с активностью bsh, выращиваемые анаэробно на чашке MRS-TDCA в течение 24 часов. Размер зоны преципитации и плотность преципитации явно отличаются для каждого организма.
В таблице 7 показан диаметр (мм) преципитата дезоксихолевой кислоты (DCA), как измерено на чашках MRS-TDCA после 24 часов анаэробного роста с помощью дисков из фильтровальной бумаги, пропитанных культурой. Значения представляют собой средние для измерений в трех повторах на 3 MRS-TDCA чашках с агаром. Сравнение результатов из таблицы 7 с результатами из таблицы 2 показывает, что анализ зоны преципитации не всегда позволяет различать бактерии с высокой активностью bsh, поскольку LR050 явно обладает большей зоной преципитации, чем LR052, но HPLC показывает, что фактически LR052 обладает более высокой активностью bsh.
Материалы и методы
Культуры Lactobacillus выращивали в течение ночи в среде MRS при 37°C. По 500 мкл каждой культуры центрифугировали в предварительно взвешенной пробирке Eppendorf. Супернатант удаляли и осадки взвешивали. Осадки ресуспендировали с помощью MRS для получения одинакового соотношения 1:10 масс./об., и 10 мкл каждой культуры наносили на дисках из фильтровальной бумаги в двух повторах на различные MRS-TDCA чашки с агаром. Чашки инкубировали в анаэробных условиях при 37°C и проводили измерения.
Деконъюгация TDCA и GDCA свободными штаммами Lactobacillus reuteri (Фиг. 8 и 9)
Результаты
На фиг. 8 и 9 показана деконъюгация тауродезоксихолевой кислоты и гликодезоксихолевой кислоты, как измерено посредством HPLC в анализе in-vitro с использованием 0,2 грамм свободных Lactobacillus reuteri (ATCC 55148, ATCC 55739, NCIMB 701359, NCIMB 701089, NCIMB 702655, LMG 18238, LMG 22877, LMG 22878, LMG 22879, CCUG 32271, CCUG 32305, CCUG 37470, CCUG 44001, CCUG 44144, CCUG 47824) с течением времени. Результаты показывают, что штаммы ATCC 55148, NCIMB 701359, NCIMB 701089, NCIMB 702655, LMG 18238, CCUG 32271, CCUG 32305, CCUG 37470, CCUG 44001 и CCUG 44144 обладают особенно высокой активностью bsh, как измерено посредством HPLC.
Материалы и методы
Бактерии и условия культивирования
Штаммы Lactobacillus reuteri культивировали в стерильной среде Ман, Рогоза, Шарп (MRS) при 37°C в течение 20 часов. Выросшие культуры выделяли центрифугированием, и собранные клетки бактерий использовали в следующем анализе BSH.
Измерение активности BSH
Для измерения активности BSH собранные бактерии добавляли в 100% MRS, дополненную комбинацией гликодезоксихолата натрия и тауродезоксихолата натрия, оба при 5 мМ (0,2 г клеток бактерий /20 мл MRS, дополненной GDCA и TDCA). Затем бактерии инкубировали в реакционной смеси анаэробно при 37°C с минимальным покачиванием (100 об./мин), и образцы супернатанта отбирали с интервалами 2,5 часа и обрабатывали для определения концентраций конъюгированных солей желчных кислот. Кратко, образцы по 500 мкл подкисляли с помощью 5 мкл 6 Н HCl после удаления клеток бактерий центрифугированием при 10000 g в течение 3 мин. Затем супернатанты дополняли 500 мкл метанола, содержащего 4 мМ GCA (гликохолевую кислоту) в качестве внутреннего стандарта. Образцы встряхивали в течение 10 мин и центрифугировали при 1000 g в течение 15 мин. Образцы фильтровали через фильтр 0,22 мкм перед анализом посредством HPLC. Для анализа HPLC солей желчных кислот следовали способу, описанному Jones et al 2003.
Анализ HPLC солей желчных кислот
Для анализа HPLC солей желчных кислот следовали способу, описанному Jones et al 2003. Анализ проводили на обращеннофазовой колонке C-18 LiChrosorb RP-18, 5 мкм, 250x4,6 мм. Система HPLC содержала два модуля доставки растворителя ProStar 210, детектор ProStar 320 UV-VIS, автодозатор ProStar 410 и систему сбора и обработки данных хроматографии Galaxie (версия 1.9.3.2). Смесь метанола и буфера 50 мМ ацетата натрия, доведенную до pH 4,3 с помощью o-фосфорной кислоты (70:30, об./об.), наносили в качестве подвижной фазы со скоростью потока 1,0 мл/мин. Детектор устанавливали на 210 нм, и все измерения проводили при комнатной температуре.
Пример 2 - Высокая активность BSH
Общие материалы и методы
Рассев и выращивание бактерий: поверхности хранящихся замороженными в глицерине бактериальных культур соскребали стерильной деревянной палочкой для рассева штрихом на MRS чашки с агаром. После инкубации в течение ночи при 37°C в анаэробных условиях отдельную колонию L. reuteri NCIMB 701359 отбирали с помощью металлической петли в стерильных условиях и переносили в пробирку, содержащую 10 мл MRS. Культуры инкубировали в течение ночи при 37°C для использования в эксперименте.
Микроинкапсуляция L. reuteri NCIMB 701359: получали микрокапсулы с 8% загрузкой клеток и концентрацией альгината 1,75% с использованием сопла размером 200 мкм. Способ покрытия являлся следующим: во-первых, альгинатные гранулы высушивали с помощью CaCl2, во-вторых, альгинатные гранулы промывали в 0,85% (масс./об.) NaCl в течение 10 минут, в-третьих, альгинатные гранулы покрывали 0,1% (масс./об.) ε-PLL в течение 20 минут, в-четвертых, альгинатные-PLL микрокапсулы промывали с помощью 0,85% (масс./об.) NaCl в течение 10 минут, в-пятых, альгинатные-PLL микрокапсулы покрывали 0,1% (масс./об.) альгинатом в течение 20 минут, и наконец, альгинат-PLL-альгинатные микрокапсулы промывали с помощью 0,85% (масс./об.) NaCl в течение 10 минут.
Анализ BSH для замороженных и лиофилизированных свободных клеток: замороженные свободные клетки размораживали, центрифугировали и промывали, и добавляли (0,05 г) в 20 мл MRS, содержащей 5 мМ TDCA и 5 мМ GDCA. Лиофилизированные свободные клетки добавляли (0,15 г) в 20 мл MRS, содержащей 5 мМ TDCA и 5 мМ GDCA. Образцы отбирали через 30 мин и анализировали с помощью HPLC. Контролем служили только среда и свежеполученные микрокапсулы после выращивания в MRS.
Анализ BSH для микрокапсул: размороженные и промытые микрокапсулы (образец между 0,3 г и 2,5 г, в зависимости от относительной активности) добавляли к 20 мл MRS, содержащей 5 мМ TDCA и 5 мМ GDCA. Образцы отбирали через 30 мин и анализировали с помощью HPLC. Контролем служили только среда и свежеполученные микрокапсулы после выращивания в MRS. 0,3 г микрокапсул содержали 0,03 г осадка свободных клеток.
Анализ HPLC активности BSH: анализы проводили на обращеннофазовой колонке C-18 (LiChrosorb RP-18 250 мм x 4,6 мм, 5 мкм) при скорости потока 1,0 мл/мин. Подвижная фаза представляла собой смесь метанола и буфера 50 мМ ацетата натрия (pH 4,3, доведенный с помощью o-фосфорной кислоты) в соотношении 70:30 и детекцию проводили при 210 нм. Активность bsh оценивали по количеству деконъюгированных GDCA и TDCA в образцах в час на грамм микрокапсул.
A. Улучшенная активность bsh во время ферментации (Таблицы 8-10)
Материалы и методы
Увеличение активности bsh, основанное на источниках углерода и азота: клетки Lactobacillus reuteri NCIMB 701359 выращивали общим способом, описанным выше. 1% L. reuteri NCIMB 701359 инокулировали в модифицированную среду MRS с различными источниками углерода и азота. Инокулированные культуры инкубировали при 37°C в течение 24 час. После времени инкубации 0,05 г или 0,1 г осадка клеток добавляли к 20 мл MRS, содержащей 5 мМ TDCA и 5 мМ GDCA. Образцы отбирали через 0,5 час и 1,5 час, и анализировали с помощью HPLC. MRS использовали в качестве контрольной среды для выращивания. Анализы проводили посредством HPLC, как описано в общих способах выше.
Увеличение активности bsh, основанное на pH и времени сбора: клетки Lactobacillus reuteri NCIMB 701359 выращивали общим способом, описанным выше. 1% L. reuteri NCIMB 701359 инокулировали в среду для выращивания с источниками углерода и азота, и pH, доведенным до pH 5,6 и 6,8 добавлением NaOH или HCl. Инокулированные культуры в различных условиях pH инкубировали при 37°C до времени сбора от 12 час до 48 час. После времени инкубации 0,05 г или 0,1 г осадка клеток добавляли к 20 мл MRS, содержащей 5 мМ TDCA и 5 мМ GDCA. Образцы отбирали через 0,5 час и 1,5 час, и анализировали с помощью HPLC, как описано в общих способах выше. Контрольные образцы выращивали в немодифицированной среде MRS.
Результаты
Из источников углерода наиболее благоприятные результаты для Lactobacillus reuteri NCIMB 701359 при ферментации в модифицированной MRS, увеличивающей активность bsh и выход, получены для мальтозы. GDCA и TDCA являлись деконъюгированными со скоростью 2,253 (мкмоль/г/час) и 173 (мкмоль/г/час), соответственно, и сохранялся выход 0,015 г/мл (Таблица 8). Из источников азота наиболее благоприятные результаты для Lactobacillus reuteri NCIMB 701359 при ферментации с этим источником углерода (мальтозой) и выборе увеличенных деконъюгации GDCA (мкмоль/г/час), деконъюгации TDCA (мкмоль/г/час) (HPLC) и выхода (г/мл), получены для комбинации пептона No. 3, дрожжевого экстракта, солодового экстракта и цистеина. GDCA и TDCA являлись деконъюгированными со скоростью 21,185 (мкмоль/г/час) и 2,323 (мкмоль/г/час), соответственно, и сохранялся выход 0,013 г/мл (Таблица 9). Из времени сбора и исходного pH наиболее благоприятные результаты для Lactobacillus reuteri NCIMB 701359 при ферментации либо в вышеупомянутой среде (мальтоза + пептон No. 3 + дрожжевой экстракт + солодовый экстракт + цистеин), либо в MRS, при выборе увеличенных деконъюгации GDCA (мкмоль/г/час), деконъюгации TDCA (мкмоль/г/час) (HPLC) и выхода (г/мл), получены для pH 5 при времени сбора 12-20 часов (Таблица 10).
Эти результаты показывают, что при этих условиях, включая источники углерода и азота, pH и время сбора, достигают высокой активности bsh и выхода клеток для Lactobacillus reuteri NCIMB 701359; в этих условиях получают высоко активный продукт, сохраняющий высокие уровни bsh на протяжении срока хранения в формате пищевой добавки или функционального пищевого продукта, и являющийся экономически эффективным для коммерческого производства. Эти данные показывают, что пробиотические клетки с аппаратом продукции bsh можно легко подвергать ферментации в определенных среде и условиях для достижения терапевтических уровней ферментативной активности и рентабельных уровней биомассы. Этот способ является полезным для получения пробиотиков с активностью bsh, рентабельных для снижения уровней липидов и других применений.
B. Улучшение активности bsh посредством лиофилизации (Таблица 11 и Фиг. 10)
Материалы и методы
Условия хранения с лиофилизацией для высокой активности BSH: Микрокапсулы, содержащие Lactobacillus reuteri NCIMB 701359, получали общим способом, описанным выше. Микрокапсулы сохраняли в соотношении 7:3 микрокапсул к следующему раствору лиопротектора: 1 M трегалоза, 10% мальтодекстрин, 1% инулин, 10% мальтодекстрин и 0,33% дрожжевой экстракт, 1M трегалоза и 0,33% дрожжевой экстракт, 1% инулин и 0,33% дрожжевой экстракт, 10% мальтодекстрин и 1% гидролизат казеина, и 10% обезжиренное молоко. Взвеси, содержащие микрокапсулы и раствор лиопротектора, лиофилизировали и хранили при 4°C в течение 0, 1, 2, 3, 4, 5 и 6 недель в отдельных аликвотах. В каждой временной точке образцы лиофилизированных микрокапсул, содержащих каждый лиопротектор, в двух повторах, регидратировали с помощью солевого раствора. Анализ bsh для микрокапсул, описанный выше, использовали для получения образцов для анализа HPLC по вышеописанному общему способу.
Свободные Lactobacillus reuteri NCIMB 701359 получали общим способом, описанным выше. Лиопротекторы добавляли к взвеси свободных клеток в конечной концентрации 10% мальтодекстрина и 0,33% дрожжевого экстракта. Взвеси лиофилизировали и хранили при 4°C или RT в течение 0, 1, 2 и 3 месяцев в отдельных аликвотах. В каждой временной точке образцы лиофилизированных клеток, содержащих каждый лиопротектор, в двух повторах, регидратировали с помощью солевого раствора. Анализ bsh для лиофилизированного материала, описанный выше, использовали для получения образцов для анализа HPLC по вышеописанному общему способу.
Результаты
Из лиопротекторов для Lactobacillus reuteri NCIMB 701359, увеличивающих активность bsh, наиболее благоприятные результаты получены для 10% мальтодекстрина и 0,33% дрожжевого экстракта, 1% инулина и 0,33% дрожжевого экстракта, и 1% инулина (Таблица 11).
Эти результаты показывают, что лиопротекторы поддерживают высокую активность bsh для Lactobacillus reuteri NCIMB 701359; лиопротектор поддерживает морфологию микрокасул при регидратации (Фигура 10), поддерживает высокие уровни bsh на протяжении срока хранения в формате пищевой добавки или функционального пищевого продукта и является экономически эффективным для коммерческого производства. Эти данные показывают, что свободные или микроинкапсулированные пробиотические клетки с аппаратом продукции bsh можно легко подвергать лиофилизации с лиопротекторами для сохранения терапевтических уровней ферментативной активности. Этот способ является полезным для получения лиофилизированных пробиотиков с активностью bsh, рентабельных для снижения уровней липидов и других применений.
C. Улучшение активности bsh посредством хранения в жидкости (Таблица 12)
Материалы и методы
Условия хранения в жидкости для активности BSH: Микрокапсулы, содержащие Lactobacillus reuteri NCIMB 701359, получали общим способом, описанным выше. Микрокапсулы сохраняли при соотношении 1:1 микрокапсулы к следующим растворам консервантов: 5% культуральная среда, 10% культуральная среда, 20% культуральная среда, 10% среда MRS, йогурт, культуральный супернатант, 1% мальтоза, 0,85% солевой раствор, 1% солодовый экстракт, 1% инулин, 10% сорбит, 0,33% дрожжевой экстракт, 1% инулин и 0,33% дрожжевой экстракт, и 1 M фруктоза. Полученные микрокапсулы сохраняли в растворах консервантов при 4 градусах для кратковременного хранения в течение 4 суток в отдельных аликвотах. Образцы микрокапсул, содержащие жидкий раствор каждого консерванта, в двух повторах, удаляли из среды для хранения и промывали солевым раствором. Анализ bsh для микрокапсул, описанный выше, использовали для получения образцов для анализа HPLC по вышеописанному общему способу.
Результаты
Из условий хранения в жидкости Lactobacillus reuteri NCIMB 701359, учитывая активность bsh после 4 суток хранения в жидкости, наиболее благоприятные результаты получены для йогурта (1:1), 5% культуральной среды (1:1), 10% культуральной среды, 20% культуральной среды (1:1), культурального супернатанта (1:1) и 10% MRS (1:1) (Таблица 12).
Эти результаты показывают, что условия хранения в жидкости поддерживают высокую активность bsh Lactobacillus reuteri NCIMB 701359; эти условия приводят к получению высоко активного продукта, который сохраняет высокие уровни bsh на протяжении временного хранения в жидкости и который является экономически эффективным для коммерческого производства. Эти данные показывают, что конкретные условия хранения являются преимущественными для хранения в жидкой среде для достижения терапевтических уровней ферментативной активности. Этот способ является полезным для поддержания активности bsh на протяжении кратковременного хранения и делает способ продукции рентабельным получения пробиотиков с активностью bsh для снижения уровней липидов и терапевтических применений для других метаболических заболеваний.
D. Улучшение активности bsh посредством сверхбыстрого замораживания (Таблица 13)
Материалы и методы
Условия хранения со сверхбыстрым замораживанием для активности bsh: Микрокапсулы, содержащие Lactobacillus reuteri NCIMB 701359, получали общим способом, описанным выше. Микрокапсулы сохраняли в соотношении 1:1 микрокапсулы к следующему раствору лиопротектора: 1 M трегалоза, 1 M фруктоза, 1% инулин, 1 M мальтоза, 1 M лактоза, 1 M сахароза, 10% PEG 8000, 0,85% солевой раствор, 10% обезжиренное молоко, 10% крахмал или 10% фруктоолигосахариды. Взвеси, содержащие микрокапсулы и раствор лиопротектора, медленно пропускали через стерильный шприц для формирования сферических мелких капель, которые суспендировали в жидком азоте. Полученные сверхбыстрозамороженные осадки отделяли от жидкого азота и хранили при -80°C в отдельных аликвотах. Сразу и через 3 недели хранения образцы осажденных микрокапсул, содержащие каждый раствор криопротектора, в двух повторах, выделяли из среды для хранения и промывали солевым раствором. Анализ bsh для микрокапсул, описанный выше, использовали для получения образцов для анализа HPLC, описанного в общих способах выше.
Свободные Lactobacillus reuteri NCIMB 701359 получали общим способом, описанным выше. Осадок свободных клеток ресуспендировали в среде после культивирования в соотношении 1:1 клетки к среде после культивирования. Полученную взвесь клеток медленно пропускали через стерильный шприц для формирования сферических мелких капель, которые суспендировали в жидком азоте. Полученные сверхбыстрозамороженные осадки отделяли от жидкого азота и хранили при -80°C. Образцы осажденных клеток, содержащие раствор криопротектора со средой после культивирования, в двух повторах, выделяли из среды для хранения. Анализ bsh для свободных клеток, описанный выше, использовали для получения образцов для анализа HPLC, описанного в общих способах выше.
Результаты
Из сред для криоконсервации Lactobacillus reuteri NCIMB 701359, сверхбыстрозамороженных в жидком азоте, наиболее благоприятные результаты с учетом морфологии капсул и/или % оставшейся активности bsh немедленно после сверхбыстрого замораживания и через 3 недели, получены для 1:1 свободных или микроинкапсулированных бактерий к раствору криоконсерванта с мальтодекстрином и дрожжевым экстрактом, инулином, трегалозой, фруктозой, сахарозой, лактозой, мальтозой и средой после культивирования в указанных концентрациях (Таблица 13).
Эти результаты показывают, что в условиях криоконсервации со сверхбыстрым замораживанием в жидком азоте для хранения в замороженном состоянии достигали высокой активности bsh и хорошей морфологии микрокапсул с инкапсулированными Lactobacillus reuteri NCIMB 701359, позволяющих получения продукта с высокими уровнями bsh на протяжении длительного срока хранения в формате пищевой добавки или функционального пищевого продукта, экономически эффективного для коммерческого производства. Эти данные показывают, что свободные или микроинкапсулированные пробиотические клетки с высокой активностью bsh легко получать в некоторых условиях с криоконсервантами и сверхбыстро замораживать в жидком азоте, достигая терапевтических уровней ферментативной активности и отличной морфологии микрокапсул. Этот способ является полезным для получения пробиотиков с активностью bsh, рентабельных для снижения уровней липидов и других применений.
В то время как настоящее описание описано в отношении того, что в настоящее время считают предпочтительными примерами, следует понимать, что описание не ограничено описанными примерами. Напротив, описание предназначено, чтобы охватывать различные модификации и эквивалентные комбинации, включенные в сущность и объем прилагаемой формулы изобретения.
Полное содержание всех публикаций, патентов и патентных заявок приведено в настоящем документе в качестве ссылки в такой же степени, как если бы было конкретно и отдельно указано, что полное содержание каждой отдельной публикации, патента или патентной заявки приведено в качестве ссылки.
|
|
|
|
|
|
|
|
|
|
|
|
|
СПИСОК ЛИТЕРАТУРЫ
Angulo, P. "Nonalcoholic fatty liver disease." N. Engl. J. Med. 346, 1221 (2002).
Aso, Y. et al., "Preventive Effect of A Lactobacillus-Casei Preparation on the Recurrence of Superficial Bladder-Cancer in A Double-Blind Trial," European Urology 27(2), 104 (1995).
Chang, T.M.S. Semipermeable microcapsules. Science 146, 524-525 (1964).
Chang, T.M. & Prakash, S. Artificial cells for bioencapsulation of cells and genetically engineered E. coli. For cell therapy, gene therapy, and removal of urea and ammonia. Methods Mol. Biol. 63, 343-358 (1997)
Chang,T.M. & Prakash,S. Therapeutic uses of microencapsulated genetically engineered cells. Mol. Med. Today 4, 221-227 (1998).
Dobrogosz, W.J. "Enhancement of human health with Lactobacillus reuteri: A probiotic, immunobiotic and immunoprobiotic," NUTRAfoods 4, 15 (2005).
Ford, E.S. et al. Pevalence of metabolic syndrome among US adults: findings from the third National Health and Nutrition Examination Survey. JAMA 287(3):356 (2002).
Gaist, D. et al., "Lipid-lowering drugs and risk of myopathy: A population based follow-up study," 12(5), 565 (2001).
Gaist, D. et al., "Statins and risk of polyneuropathy - A case-control study," 58(9), 1333 (2002).
Goldenberg, I., M. Benderly, and U. Goldbourt, "Update on the use of fibrates: focus on bezafibrate," 4(1), 131 (2008).
Hallikainen, M. A. and М. I. J. Uusitupa, "Effects of 2 low-fat stanol ester- containing margarines on serum cholesterol concentrations as part of a low-fat diet in hypercholesterolemic subjects," 69(3), 403 (1999).
Huang, J.S. et al., "Efficacy of probiotic use in acute diarrhea in children: a meta-analysis," Dig. Dis. Sci. 47(11), 2625 (2002).
Jenkins, D. J. A. et al., "The effect on serum lipids and oxidized low-density lipoprotein of supplementing self-selected low-fat diets with soluble-fiber, soy, and vegetable protein foods," 49(1), 67 (2000).
Jones et al. “Method for Bile Acid Determination by High Performance Liquid Chromatography”. J Med Sci 2003;23(5):277-280.
Lodinova-Zadnikova, R. and U. Sonnenborn, "Effect of preventive administration of a nonpathogenic Escherichia coli strain on the colonization of the intestine with microbial pathogens in newborn infants," Biol. Neonate 71(4), 224(1997).
Lopez-Garcia, E. "Consumption of Trans Fatty Acids Is Related to Plasma Biomarkers of Inflammation and Endothelial Dysfunction". The Journal of Nutrition 135 (3): 562 (2005).
McIntosh, G.H., P.J. Royle, and M.J. Playne, "A probiotic strain of L. acidophilus reduces DMH-induced large intestinal tumors in male Sprague-Dawley rats," Nutr. Cancer 35(2), 153 (1999).
Omar, M. A. and J. P. Wilson, "FDA adverse event reports on statin-associated rhabdomyolysis," 36(2), 288 (2002).
Ornish, D. et al., "Can Life-Style Changes Reverse Coronary Heart-Disease," 336(8708), 129 (1990).
Pedersen, T. R. et al., "Randomized Trial of Cholesterol-Lowering in 4444 Patients with Coronary-Heart-Disease - the Scandinavian Simvastatin Survival Study (4S)," 344(8934), 1383 (1994).
Pepys, M.B. et al.,"Targeting C-reactive protein for the treatment of cardiovascular disease". Nature 440: 1217 (2006).
Prakash, S. and Jones M.L. Engineering Artificial Cells for Therapy. 7-22-2002. Sarawak, Malaysia, 2nd World Engineering Congress. Ref Type: Conference Proceeding
Prakash, S. and. Urbanska A.M. (2007). Fermented milk product and uses thereof. WO 2007/140613.
Probstfield, J. L. and В. M. Rifkind, "The Lipid Research Clinics Coronary Primary Prevention Trial: design, results, and implications," 40 Suppl 1, S69-S75 (1991).
Rayes, N. et al., "Early enteral supply of lactobacillus and fiber versus selective bowel decontamination: a controlled trial in liver transplant recipients," Transplantation 74(1), 123 (2002).
Scalia. “Simultaneous determination of free and conjugated bile acids in human gastric juice by HPLC”. J of Chrom, 431 (1988) 259-269.
Sgro, C. and A. Escousse, "Side-Effects of Hypolipidemic Drugs," 46(5), 351 (1991).
Staffa, J. A., J. Chang, and L. Green, "Cerivastatin and reports of fatal rhabdomyolysis," 346(7), 539 (2002).
Szajewska, H. et al., "Efficacy of Lactobacillus GG in prevention of nosocomial diarrhea in infants," J. Pediatr. 138(3), 361 (2001).
Tabas, K. J. Williams, and J. Boren, "Subendothelial lipoprotein retention as the initiating process in atherosclerosis - Update and therapeutic implications," 116 (16), 1832 (2007).
Tall, A. R. "An overview of reverse cholesterol transport", 19 Suppl A, A31-A35 (1998).
"Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report," 106(25), 3143 (2002).
Tobias, P.S., L.K. Curtiss, "Toll-like receptors in atherosclerosis," Biochem Soc Trans. 35(6) 1453 (2007).
Uludag, H., De Vos, P., & Tresco, P.A. Technology of mammalian cell encapsulation. Adv. Drug Deliv. Rev. 42, 29-64 (2000).
Urbanska A.M., Bhathena J., Martoni C., Prakash S. “Estimation of the Potential Antitumor Activity of Microencapsulated Lactobacillus acidophilus Yogurt Formulation in the Attenuation of Tumorigenesis in Apc(Min/+) Mice”. Dig. Dis. Sci. (2009) 54:264-273.