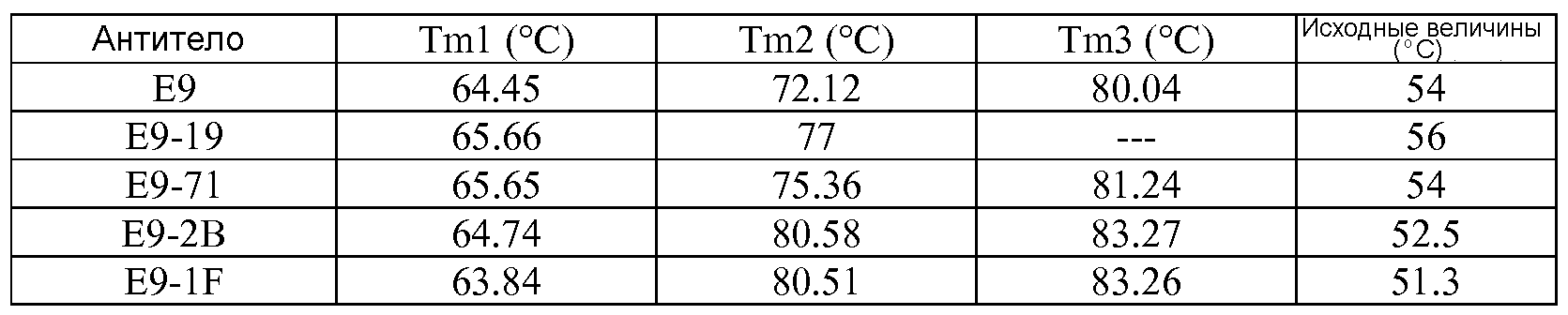
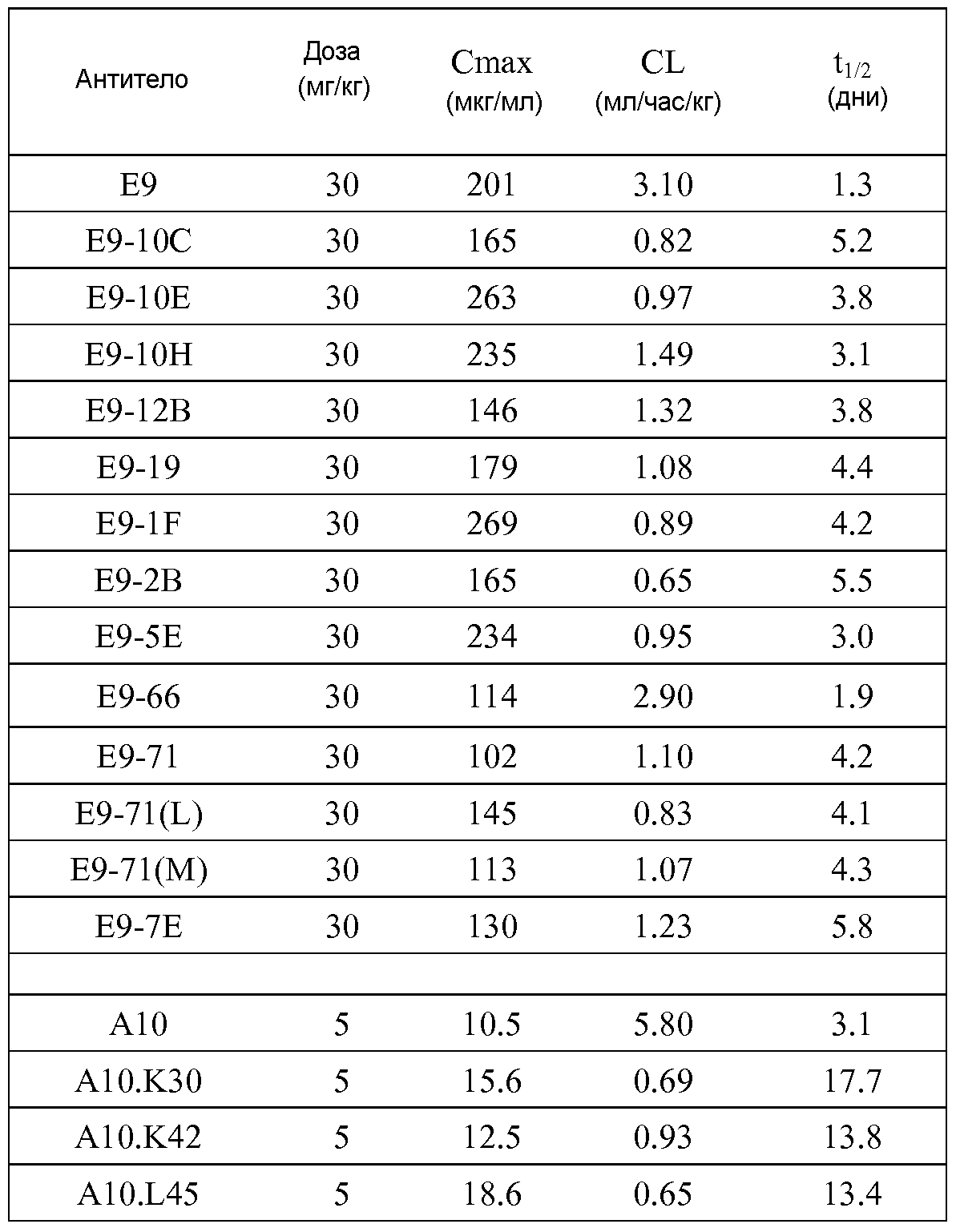
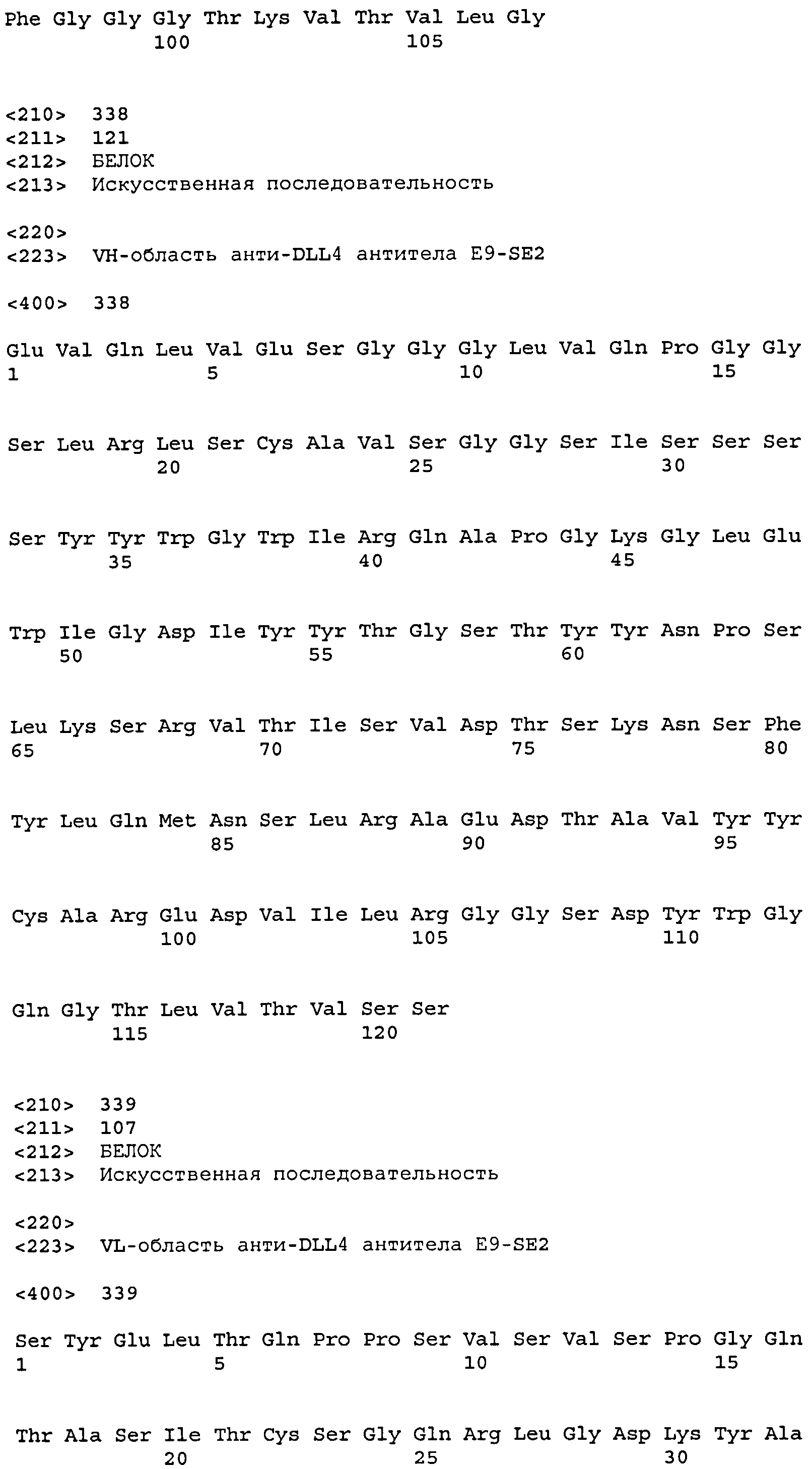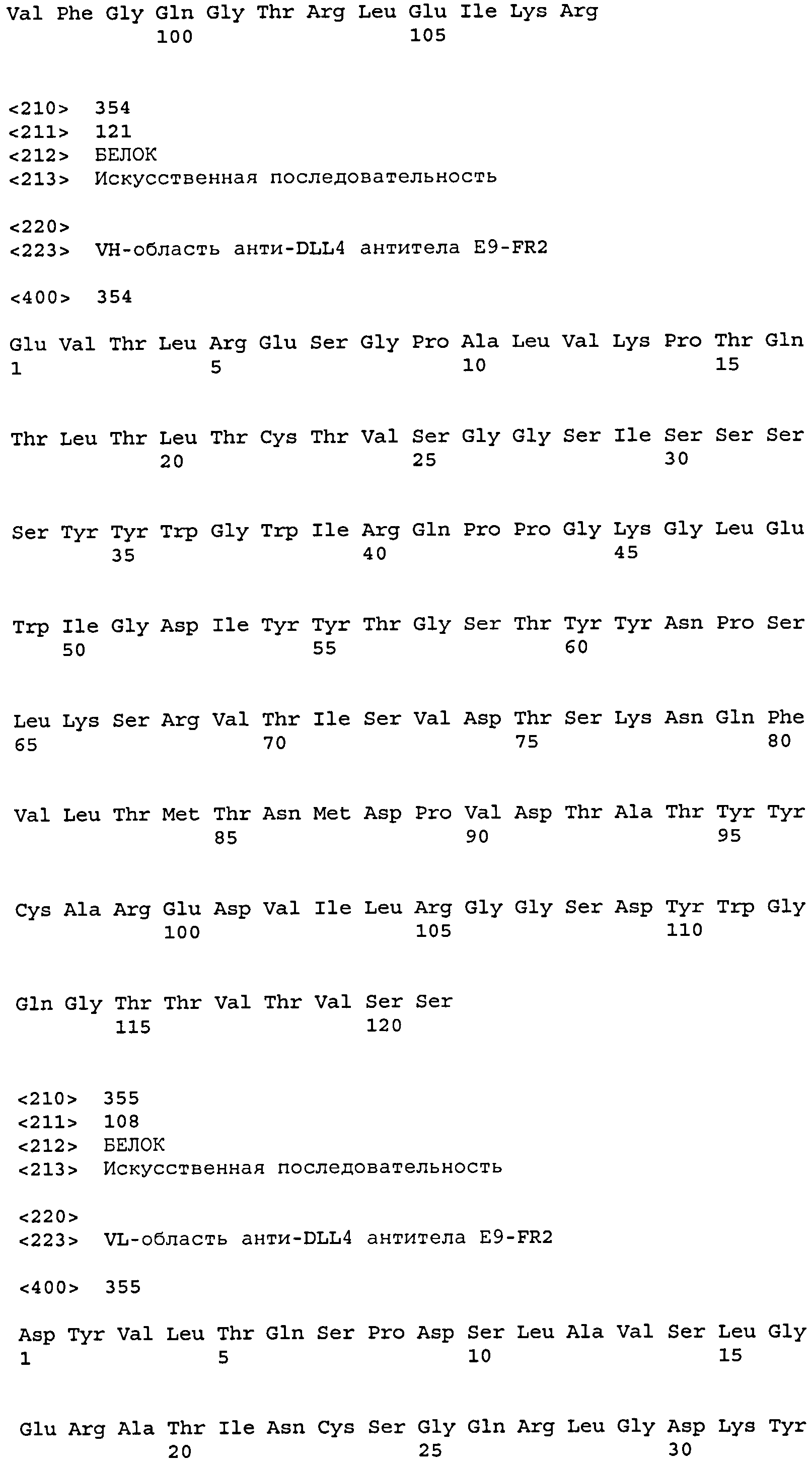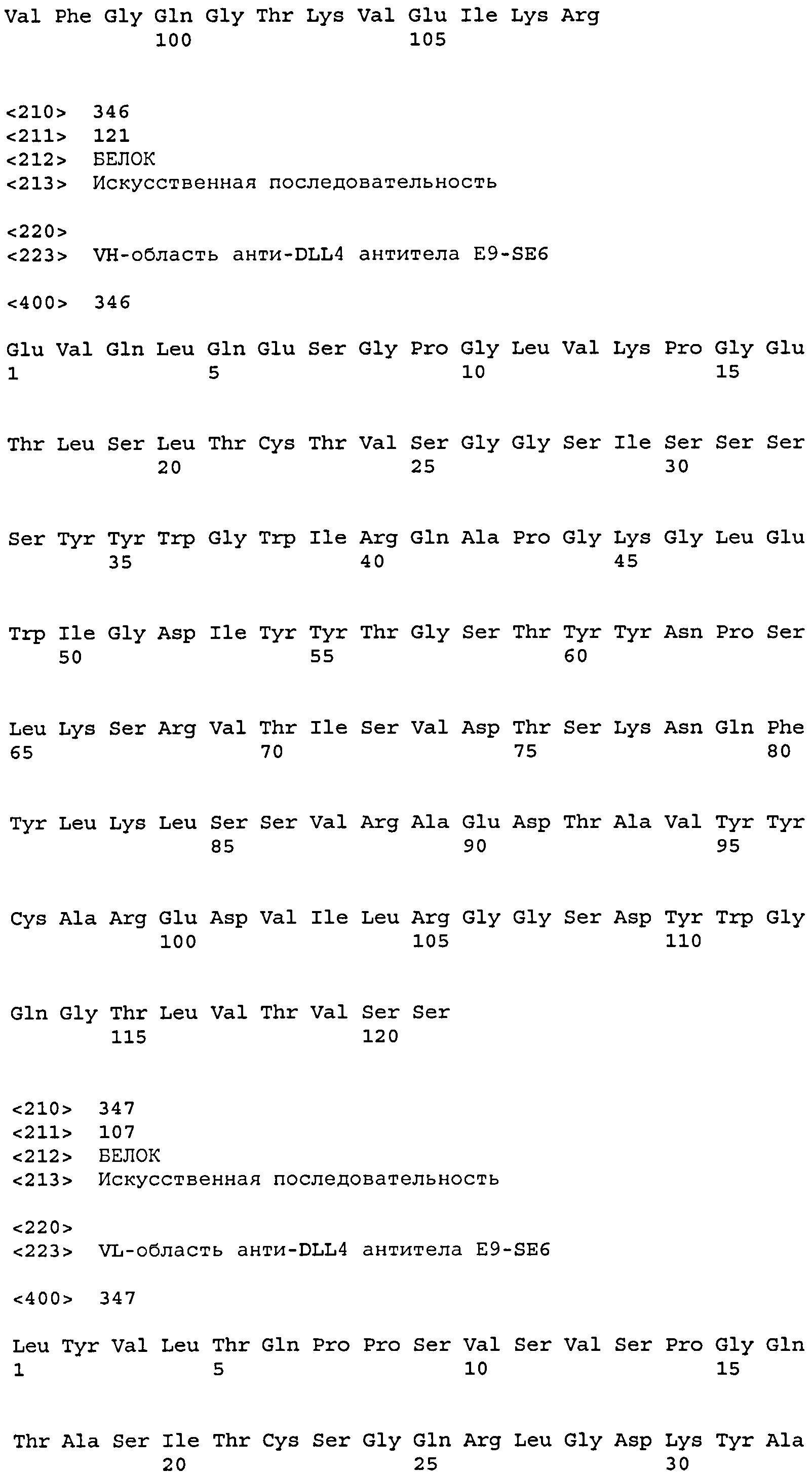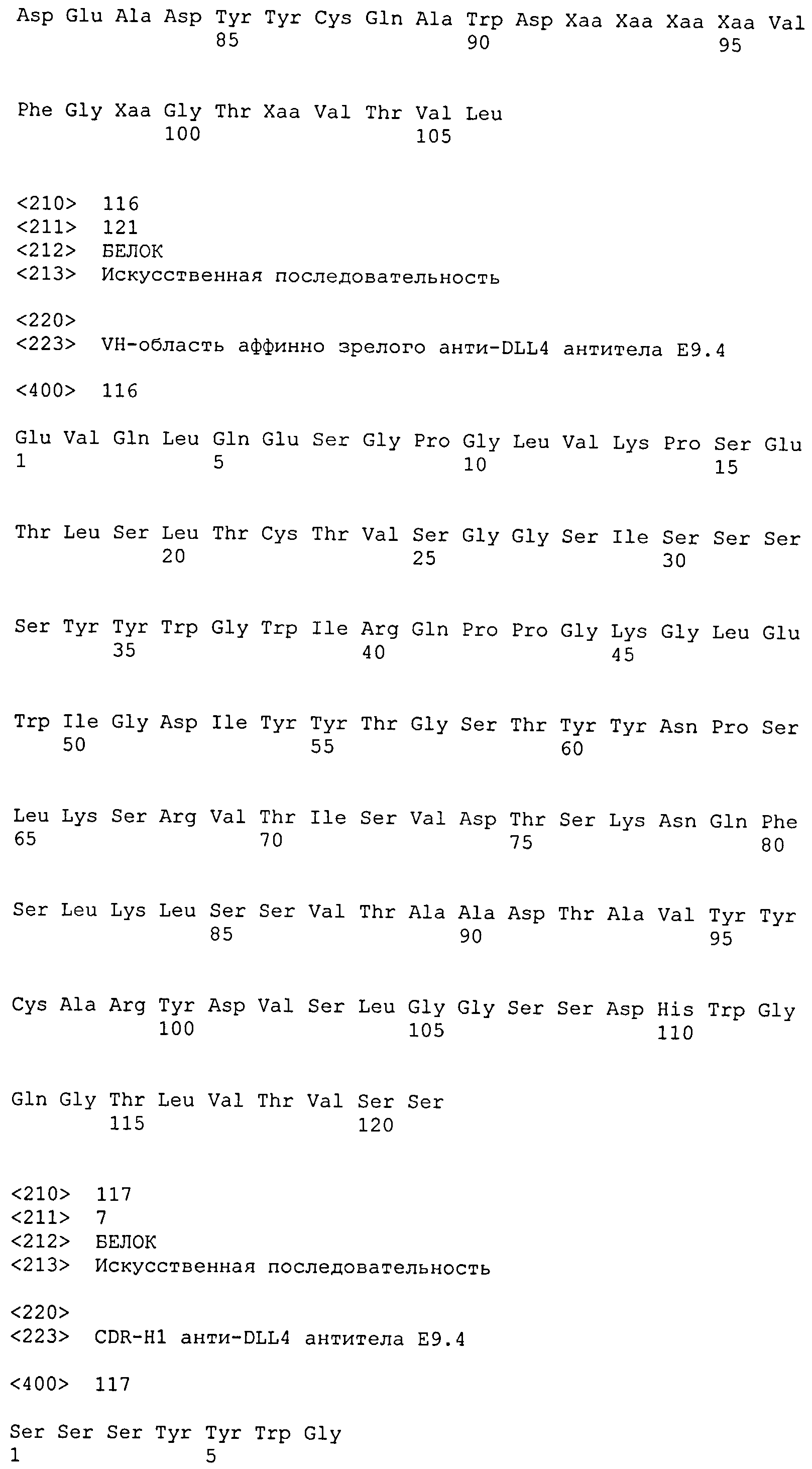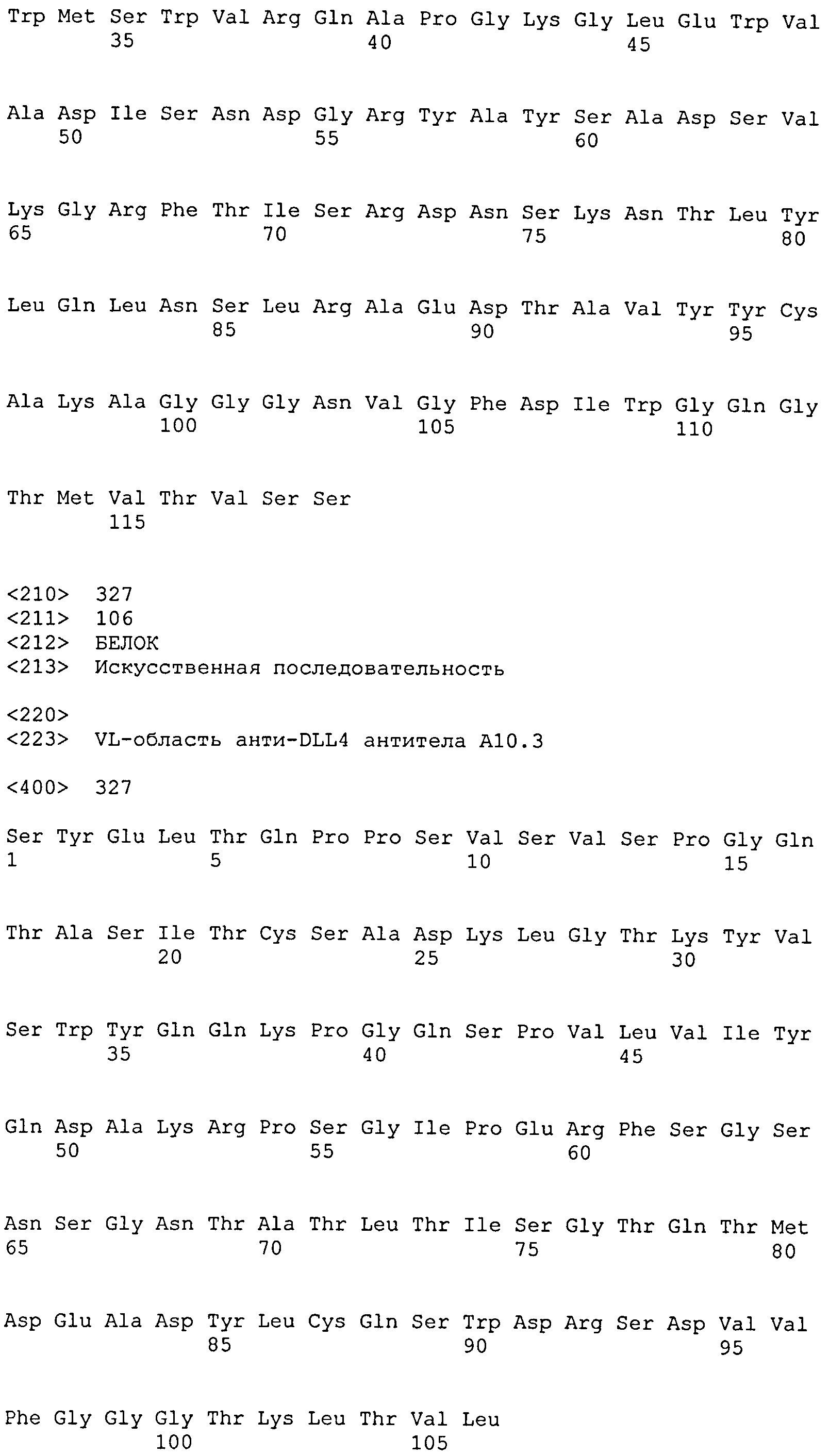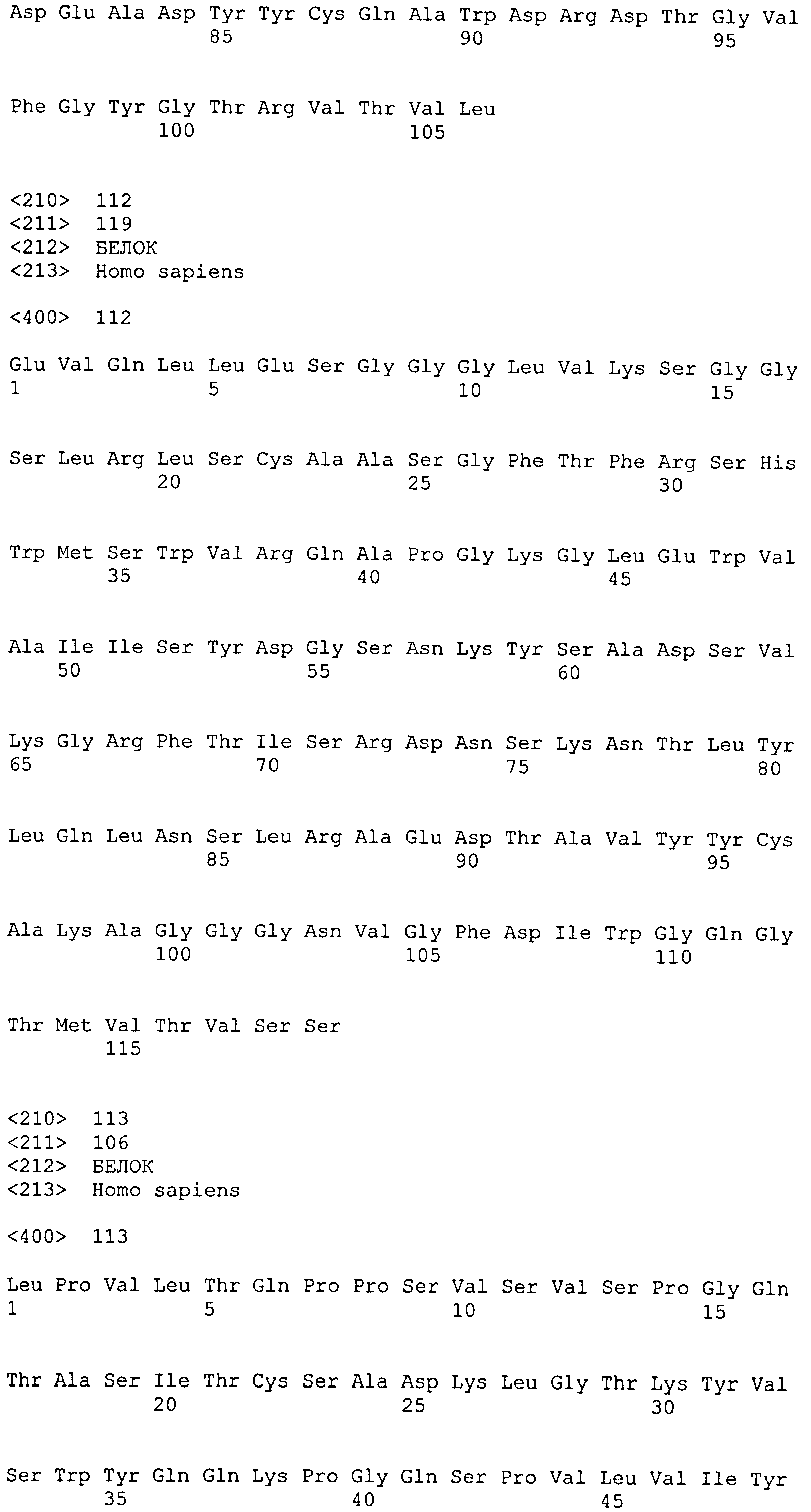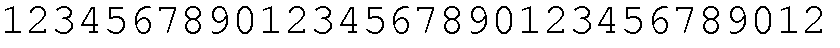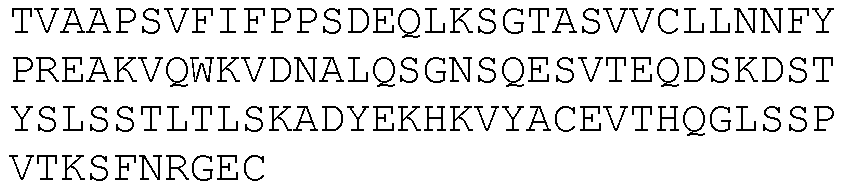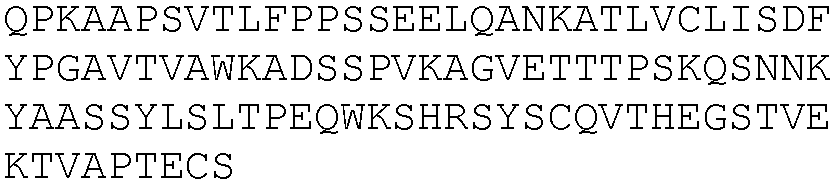Результат интеллектуальной деятельности: ТЕРАПЕВТИЧЕСКИЕ DLL4-СВЯЗЫВАЮЩИЕ БЕЛКИ
Вид РИД
Изобретение
Ссылка на родственные заявки
В настоящей заявке испрашивается приоритет предварительной заявки на патент США № 61/238152, поданной 29 августа 2009 г., и предварительной заявки на патент США № 61/261728, поданной 16 ноября 2009 г.
Область, к которой относится изобретение
Настоящее изобретение относится к получению и применению DLL4-связывающих белков с улучшенными свойствами, и к их использованию для подавления, предупреждения и/или лечения раковых заболеваний, опухолей и/или других ассоциированных с ангиогенезом заболеваний, таких как глазная неоваскуляризация, или заболеваний, не ассоциированных с ангиогенезом и характеризующихся нарушением экспрессии или активности DLL4, таких как аутоиммунные расстройства.
Предшествующий уровень техники
Межклеточные взаимодействия необходимы для осуществления множества биологических процессов, таких как дифференцировка, пролиферация и гомеостаз. Одной из систем, используемых эукариотами широкого ряда, является путь передачи сигнала Notch. Этот путь, а в частности, рецептор Notch, также играет важную роль в функциональном ангиогенезе опухоли. Таким образом, ингибирование функции рецептора Notch, блокирование рецептора Notch и/или блокирование пути передачи Notch-сигнала является стратегией, которая может быть применена для получения противораковых композиций и разработки методов лечения рака. Было установлено, что небольшие молекулы-ингибиторы рецептора Notch являются токсичными, поскольку они подавляют экспрессию рецептора Notch в тканях дикого типа (нормальных тканях) во всем организме. Таким образом, различные члены пути передачи сигнала Notch должны рассматриваться как потенциальные мишени для терапии.
Лигандом сосудистой сети для рецептора Notch является дельта 4 или дельта-подобный лиганд 4 (DLL4). DLL4, который экспрессируется, главным образом, в сосудистой сети, играет важную роль в развитии сосудов (Yan et al., Clin. Cancer Res., 13(24): 7243-7246 (2007); Shutter et al., Genes Dev., 14(11): 1313-1318 (2000); Gale et al., Proc. Natl. Acad. Sci. USA, 101(45): 15949-15954 (2004); Krebs et al., Genes Dev., 14(11): 1343-1352 (2000)). Мыши, гетерозиготные по DLL4, погибают на стадии эмбрионального развития, что обусловлено значительными нарушениями развития сосудов (Gale et al., Proc. Natl. Acad. Sci. USA, 101(45): 15949-15954 (2004); Duarte et al., Genes Dev., 18(20): 2474-2478 (2004); Krebs et al., Genes Dev., 18(20): 2469-2473 (2004)). Экспрессия DLL4 может быть индуцирована VEGF (Liu et al., Mol. Cell Biol, 23(1): 14-25 (2003); Lobov et al., Proc. Natl. Acad. Sci. USA, 104(9): 3219-3224 (2007)). В свою очередь, DLL4 может снижать передачу сигнала VEGF, частично посредством ингибирования VEGFR2 и индуцирования VEGRl (Harrington et al., Microvasc. Res., 75(2): 144-154 (2008); Suchting et al., Proc. Natl. Acad. Sci USA, 104(9): 3225-3230 (2007)). Тонкая координация между DLL4 и VEGF играет важную роль в функциональном ангиогенезе.
Помимо своей физиологической роли DLL4 также активируется в кровеносных сосудах опухолей (Gale et al., Proc. Natl. Acad. Sci. USA, 101(45): 15949-15954 (2004); Mailhos et al., Differentiation, 69(2-3): 135-144 (2001); Patel et al., Cancer Res., 65(19): 8690-8697 (2005); Patel et al., Clin. Cancer Res., 12(16): 4836-4844 (2006); Noguera-Troise et al., Nature, 444(7122): 1032-1037 (2006)). Блокирование DLL4 приводит к сильному ингибированию роста первичной опухоли во многих моделях (Noguera-Troise et al., Nature, 444(7122): 1032-1037 (2006); Ridgway et al., Nature, 444(7122): 1083-1087 (2006); Scehnet et al., Blood, 109(11): 4753-4760 (2007)). Такое ингибирование DLL4 является эффективным даже по отношению к опухолям, резистентным к терапии анти-VEGF антителами. Комбинированное ингибирование DLL4 и VEGF приводит к повышению противоопухолевой активности. Интересно отметить, что в отличие от ингибирования VEGF, которое снижает образование опухолевых сосудов, блокирование DLL4 приводит к повышению плотности сосудистой сети опухоли, где указанные сосуды являются аномальными, не могут обеспечивать эффективное прохождение кровотока и являются функционально неэффективными. Таким образом, DLL4 является потенциальной мишенью для лечения рака.
Поэтому необходимо получить такие терапевтические средства, которые могут быть нацелены на путь DLL4-Notch и тем самым ингибировать этот путь или даже предотвращать ангиогенез и рост опухоли.
Описание сущности изобретения
Настоящее изобретение относится к белкам, которые связываются с DLL4, включая антитела, CDR-привитые антитела и их связывающие фрагменты, обладающие способностью связываться с DLL4. Описанный здесь связывающий белок, предпочтительно, связывается с DLL4 с высокой аффинностью. Более предпочтительно, связывающий белок согласно изобретению обладает способностью нейтрализовать DLL4. Настоящее изобретение также относится к способам получения и применения DLL4-связывающих белков, включая человеческие DLL4-связывающие белки. Преимущество настоящего изобретения заключается в том, что оно не требует получения гуманизированных DLL4-связывающих белков, что позволяет избежать проблем, возникающих при использовании гуманизированных DLL4-связывающих белков.
В одном из своих аспектов настоящее изобретение относится к связывающему белку, содержащему антигенсвязывающий домен, способный связываться с человеческим DLL4, где указанный антигенсвязывающий домен включает по меньшей мере одну или несколько CDR, выбранных из группы, состоящей из:
CDR-H1: X1-X2-X3-X4-X5-X6-X7 (SEQ ID NO: 99), где:
X1 представляет собой S или N;
X2 представляет собой S, G или N;
X3 представляет собой S, N, T, G или R;
X4 представляет собой Y;
X5 представляет собой Y или H;
X6 представляет собой W; и
X7 представляет собой G;
CDR-H2: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16 (SEQ ID NO: 100), где:
X1 представляет собой D;
X2 представляет собой I;
X3 представляет собой Y, N или S;
X4 представляет собой Y;
X5 представляет собой T, N, A, I, S или R;
X6 представляет собой G;
X7 представляет собой S, N, T или G;
X8 представляет собой T;
X9 представляет собой Y;
X10 представляет собой Y;
X11 представляет собой N;
X12 представляет собой P;
X13 представляет собой S;
X14 представляет собой L;
X15 представляет собой K; и
X16 представляет собой S, N, D или G;
CDR-H3: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11 (SEQ ID NO: 101), где:
X1 представляет собой E, Y, F, Q, W, L или A;
X2 представляет собой D, A, S, G, V, E или N;
X3 представляет собой V, M, L, P или A;
X4 представляет собой I, A, P, R, S, K, Q, V, G, M или E;
X5 представляет собой L, Y, F или M;
X6 представляет собой R, G, S, Q или A;
X7 представляет собой G;
X8 представляет собой G, A или S;
X9 представляет собой S, A, L, V, R или G;
X10 представляет собой D; и
X11 представляет собой Y, D, S, N, H, E, R, L, P, C, I, M, T, Q или K;
CDR-L1: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11 (SEQ ID NO: 102), где:
X1 представляет собой S;
X2 представляет собой G;
X3 представляет собой Q, E или D;
X4 представляет собой R, S, G, M, K, L или T;
X5 представляет собой L;
X6 представляет собой G;
X7 представляет собой D или E;
X8 представляет собой K;
X9 представляет собой Y;
X10 представляет собой A или V; и
X11 представляет собой S;
CDR-L2: X1-X2-X3-X4-X5-X6-X7 (SEQ ID NO: 103), где:
X1 представляет собой E или Q;
X2 представляет собой D;
X3 представляет собой S, L, T, A, E или F;
X4 представляет собой K, T, Е, N, Q, S или M;
X5 представляет собой R;
X6 представляет собой P; и
X7 представляет собой S;
и
CDR-L3: X1-X2-X3-X4-X5-X6-X7-X8-X9 (SEQ ID NO: 104), где:
X1 представляет собой Q;
X2 представляет собой A;
X3 представляет собой W;
X4 представляет собой D;
X5 представляет собой R, S, M, E, N, G или K;
X6 представляет собой D или E;
X7 представляет собой T, V, A, S или M;
X8 представляет собой G, A или C; и
X9 представляет собой V.
Предпочтительно, антигенсвязывающий домен DLL4-связывающего белка согласно изобретению содержит по меньшей мере одну CDR, содержащую аминокислотную последовательность, выбранную из группы, состоящей из:
остатков 31-37 SEQ ID NO: 1 (CDR-H1); остатков 52-67 SEQ ID NO: 1 (CDR-H2); остатков 100-110 SEQ ID NO: 1 (CDR-H3);
остатков 23-33 SEQ ID NO: 111 (CDR-L1); остатков 49-55 SEQ ID NO: 111 (CDR-L2); остатков 88-96 SEQ ID NO: 111 (CDR-L3);
SEQ ID NO: 117 (CDR-H1); SEQ ID NO: 118 (CDR-H2); SEQ ID NO: 119 (CDR-H3); SEQ ID NO: 121 (CDR-H1); SEQ ID NO: 122 (CDR-H2); SEQ ID NO: 123 (CDR-H3); SEQ ID NO: 125 (CDR-H1); SEQ ID NO: 126 (CDR-H2); SEQ ID NO: 127 (CDR-H3); SEQ ID NO: 129 (CDR-H1); SEQ ID NO: 130 (CDR-H2); SEQ ID NO: 131 (CDR-H3); SEQ ID NO: 133 (CDR-H1); SEQ ID NO: 134 (CDR-H2); SEQ ID NO: 135 (CDR-H3); SEQ ID NO: 137 (CDR-H1); SEQ ID NO: 138 (CDR-H2); SEQ ID NO: 139 (CDR-H3); SEQ ID NO: 141 (CDR-H1); SEQ ID NO: 142 (CDR-H2); SEQ ID NO: 143 (CDR-H3); SEQ ID NO: 145 (CDR-H1); SEQ ID NO: 146 (CDR-H2); SEQ ID NO: 147 (CDR-H3); SEQ ID NO: 149 (CDR-H1); SEQ ID NO: 150 (CDR-H2); SEQ ID NO: 151 (CDR-H3); SEQ ID NO: 153 (CDR-H1); SEQ ID NO: 154 (CDR-H2); SEQ ID NO: 155 (CDR-H3); SEQ ID NO: 157 (CDR-HI); SEQ ID NO: 158 (CDR-H2); SEQ ID NO: 159 (CDR-H3); SEQ ID NO: 161 (CDR-H1); SEQ ID NO: 162 (CDR-H2); SEQ ID NO: 163 (CDR-H3); SEQ ID NO: 165 (CDR-H1); SEQ ID NO: 166 (CDR-H2); SEQ ID NO: 167 (CDR-H3); SEQ ID NO: 169 (CDR-H1); SEQ ID NO: 170 (CDR-H2); SEQ ID NO: 171 (CDR-H3); SEQ ID NO: 173 (CDR-H1); SEQ ID NO: 174 (CDR-H2); SEQ ID NO: 175 (CDR-H3); SEQ ID NO: 177 (CDR-H1); SEQ ID NO: 178 (CDR-H2); SEQ ID NO: 179 (CDR-H3); SEQ ID NO: 181 (CDR-H1); SEQ ID NO: 182 (CDR-H2); SEQ ID NO: 183 (CDR-H3); SEQ ID NO: 185 (CDR-H1); SEQ ID NO: 186 (CDR-H2); SEQ ID NO: 187 (CDR-H3); SEQ ID NO: 189 (CDR-H1); SEQ ID NO: 190 (CDR-H2); SEQ ID NO: 191 (CDR-H3); SEQ ID NO: 193 (CDR-H1); SEQ ID NO: 194 (CDR-H2); SEQ ID NO: 195 (CDR-H3); SEQ ID NO: 197 (CDR-H1); SEQ ID NO: 198 (CDR-H2); SEQ ID NO: 199 (CDR-H3); SEQ ID NO: 201 (CDR-H1); SEQ ID NO: 202 (CDR-H2); SEQ ID NO: 203 (CDR-H3); SEQ ID NO: 205 (CDR-H1); SEQ ID NO: 206 (CDR-H2); SEQ ID NO: 207 (CDR-H3); SEQ ID NO: 209 (CDR-H1); SEQ ID NO: 210 (CDR-H2); SEQ ID NO: 211 (CDR-H3); SEQ ID NO: 213 (CDR-H1); SEQ ID NO: 214 (CDR-H2); SEQ ID NO: 215 (CDR-H3); SEQ ID NO: 217 (CDR-L1); SEQ ID NO: 218 (CDR-L2); SEQ ID NO: 219 (CDR-L3); SEQ ID NO: 221 (CDR-L1); SEQ ID NO: 222 (CDR-L2); SEQ ID NO: 223 (CDR-L3); SEQ ID NO: 225 (CDR-L1); SEQ ID NO: 226 (CDR-L2); SEQ ID NO: 227 (CDR-L3); SEQ ID NO: 229 (CDR-L1); SEQ ID NO: 230 (CDR-L2); SEQ ID NO: 231 (CDR-L3); SEQ ID NO: 233 (CDR-L1); SEQ ID NO: 234 (CDR-L2); SEQ ID NO: 235 (CDR-L3); SEQ ID NO: 237 (CDR-L1); SEQ ID NO: 238 (CDR-L2); SEQ ID NO: 239 (CDR-L3); SEQ ID NO: 241 (CDR-L1); SEQ ID NO: 242 (CDR-L2); SEQ ID NO: 243 (CDR-L3); SEQ ID NO: 245 (CDR-L1); SEQ ID NO: 246 (CDR-L2); SEQ ID NO: 247 (CDR-L3); SEQ ID NO: 249 (CDR-L1); SEQ ID NO: 250 (CDR-L2); SEQ ID NO: 251 (CDR-L3); SEQ ID NO: 253 (CDR-L1); SEQ ID NO: 254 (CDR-L2); SEQ ID NO: 255 (CDR-L3); SEQ ID NO: 257 (CDR-L1); SEQ ID NO: 258 (CDR-L2); SEQ ID NO: 259 (CDR-L3); SEQ ID NO: 261 (CDR-L1); SEQ ID NO: 262 (CDR-L2); SEQ ID NO: 263 (CDR-L3); SEQ ID NO: 265 (CDR-L1); SEQ ID NO: 266 (CDR-L2); SEQ ID NO: 267 (CDR-L3); SEQ ID NO: 269 (CDR-L1); SEQ ID NO: 270 (CDR-L2); SEQ ID NO: 271 (CDR-L3); SEQ ID NO: 273 (CDR-L1); SEQ ID NO: 274 (CDR-L2); SEQ ID NO: 275 (CDR-L3); SEQ ID NO: 277 (CDR-L1); SEQ ID NO: 278 (CDR-L2); SEQ ID NO: 279 (CDR-L3); SEQ ID NO: 281 (CDR-L1); SEQ ID NO: 282 (CDR-L2); SEQ ID NO: 283 (CDR-L3); SEQ ID NO: 285 (CDR-L1); SEQ ID NO: 286 (CDR-L2); SEQ ID NO: 287 (CDR-L3); SEQ ID NO: 289 (CDR-L1); SEQ ID NO: 290 (CDR-L2); SEQ ID NO: 291 (CDR-L3); SEQ ID NO: 293 (CDR-L1); SEQ ID NO: 294 (CDR-L2); SEQ ID NO: 295 (CDR-L3); SEQ ID NO: 297 (CDR-L1); SEQ ID NO: 298 (CDR-L2); SEQ ID NO: 299 (CDR-L3); SEQ ID NO: 301 (CDR-L1); SEQ ID NO: 302 (CDR-L2); SEQ ID NO: 303 (CDR-L3); SEQ ID NO: 305 (CDR-L1); SEQ ID NO: 306 (CDR-L2); SEQ ID NO: 307 (CDR-L3); SEQ ID NO: 309 (CDR-L1); SEQ ID NO: 310 (CDR-L2); SEQ ID NO: 311 (CDR-L3); SEQ ID NO: 313 (CDR-L1); SEQ ID NO: 314 (CDR-L2); SEQ ID NO: 315 (CDR-L3);
остатков 31-37 SEQ ID NO: 334 (CDR-H1); остатков 52-67 SEQ ID NO: 334 (CDR-H2); остатков 100-110 SEQ ID NO: 334 (CDR-H3);
остатков 23-33 SEQ ID NO: 335 (CDR-L1); остатков 49-55 SEQ ID NO: 335 (CDR-L2); остатков 88-96 SEQ ID NO: 335 (CDR-L3);
остатков 31-37 SEQ ID NO: 336 (CDR-H1); остатков 52-67 SEQ ID NO: 336 (CDR-H2); остатков 100-110 SEQ ID NO: 336 (CDR-H3);
остатков 23-33 SEQ ID NO: 337 (CDR-L1); остатков 49-55 SEQ ID NO: 337 (CDR-L2); остатков 88-96 SEQ ID NO: 337 (CDR-L3);
остатков 31-37 SEQ ID NO: 338 (CDR-H1); остатков 52-67 SEQ ID NO: 338 (CDR-H2); остатков 100-110 SEQ ID NO: 338 (CDR-H3);
остатков 23-33 SEQ ID NO: 339 (CDR-L1); остатков 49-55 SEQ ID NO: 339 (CDR-L2); остатков 88-96 SEQ ID NO: 339 (CDR-L3);
остатков 31-37 SEQ ID NO: 340 (CDR-H1); остатков 52-67 SEQ ID NO: 340 (CDR-H2); остатков 100-110 SEQ ID NO: 340 (CDR-H3);
остатков 23-33 SEQ ID NO: 341 (CDR-L1); остатков 49-55 SEQ ID NO: 341 (CDR-L2); остатков 88-96 SEQ ID NO: 341 (CDR-L3);
остатков 31-37 SEQ ID NO: 342 (CDR-H1); остатков 52-67 SEQ ID NO: 342 (CDR-H2); остатков 100-110 SEQ ID NO: 342 (CDR-H3);
остатков 23-33 SEQ ID NO: 343 (CDR-L1); остатков 49-55 SEQ ID NO: 343 (CDR-L2); остатков 88-96 SEQ ID NO: 343 (CDR-L3);
остатков 31-37 SEQ ID NO: 344 (CDR-H1); остатков 52-67 SEQ ID NO: 344 (CDR-H2); остатков 100-110 SEQ ID NO: 344 (CDR-H3);
остатков 24-34 SEQ ID NO: 345 (CDR-L1); остатков 50-56 SEQ ID NO: 345 (CDR-L2); остатков 89-97 SEQ ID NO: 345 (CDR-L3);
остатков 31-37 SEQ ID NO: 346 (CDR-H1); остатков 52-67 SEQ ID NO: 346 (CDR-H2); остатков 100-110 SEQ ID NO: 346 (CDR-H3);
остатков 23-33 SEQ ID NO: 347 (CDR-L1); остатков 49-55 SEQ ID NO: 347 (CDR-L2); остатков 88-96 SEQ ID NO: 347 (CDR-L3);
остатков 31-37 SEQ ID NO: 348 (CDR-H1); остатков 52-67 SEQ ID NO: 348 (CDR-H2); остатков 100-110 SEQ ID NO: 348 (CDR-H3);
остатков 24-34 SEQ ID NO: 349 (CDR-L1); остатков 50-56 SEQ ID NO: 349 (CDR-L2); остатков 89-97 SEQ ID NO: 349 (CDR-L3);
остатков 31-37 SEQ ID NO: 350 (CDR-H1); остатков 52-67 SEQ ID NO: 350 (CDR-H2); остатков 100-110 SEQ ID NO: 350 (CDR-H3);
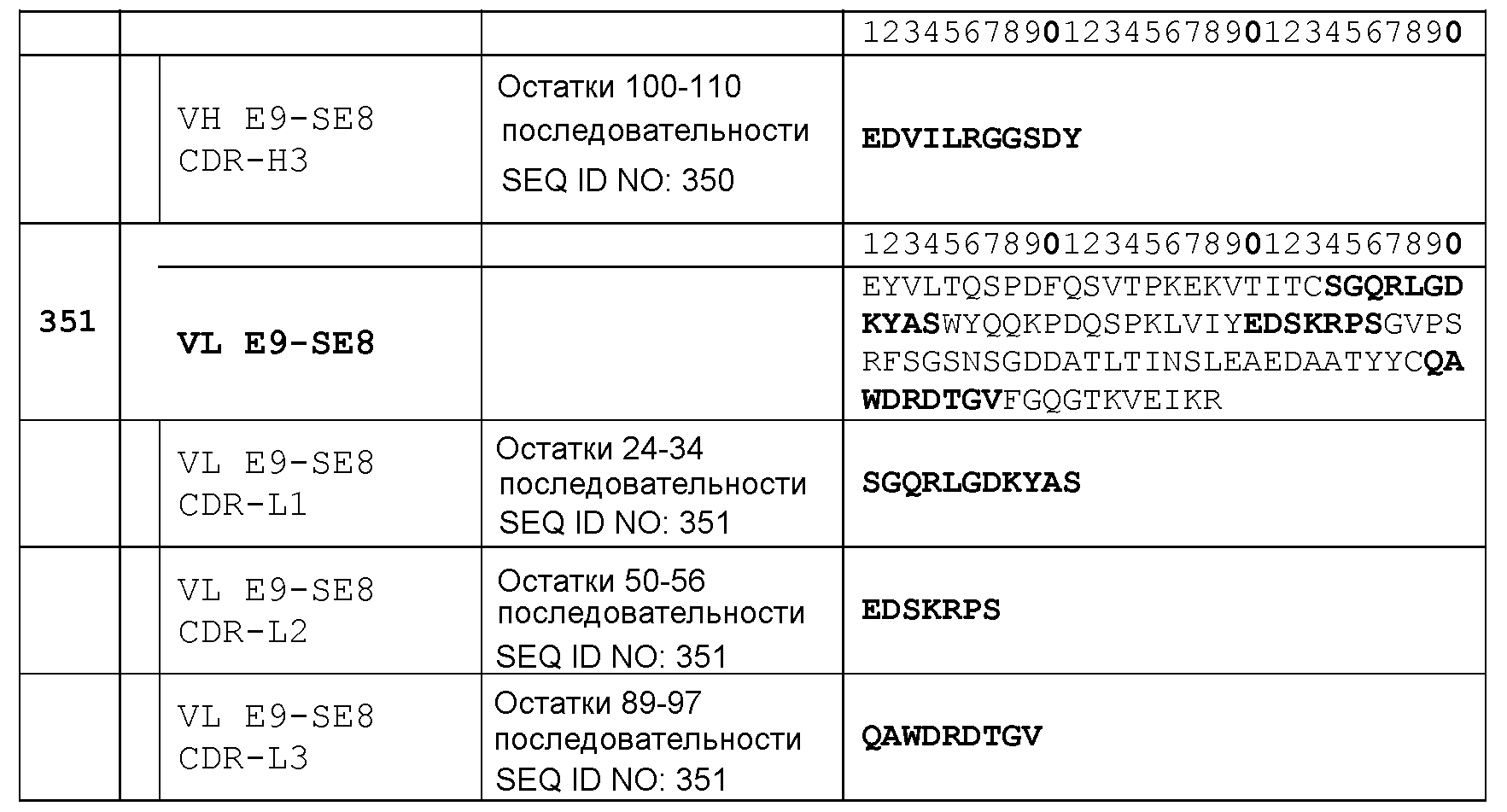
остатков 24-34 SEQ ID NO: 351 (CDR-L1); остатков 50-56 SEQ ID NO: 351 (CDR-L2); остатков 89-97 SEQ ID NO: 351 (CDR-L3);
остатков 31-37 SEQ ID NO: 352 (CDR-H1); остатков 52-67 SEQ ID NO: 352 (CDR-H2); остатков 100-110 SEQ ID NO: 352 (CDR-H3);
остатков 24-34 SEQ ID NO: 353 (CDR-L1); остатков 50-56 SEQ ID NO: 353 (CDR-L2); остатков 89-97 SEQ ID NO: 353 (CDR-L3);
остатков 31-37 SEQ ID NO: 354 (CDR-H1); остатков 52-67 SEQ ID NO: 354 (CDR-H2); остатков 100-110 SEQ ID NO: 354 (CDR-H3);
остатков 24-34 SEQ ID NO: 355 (CDR-L1); остатков 50-56 SEQ ID NO: 355 (CDR-L2); остатков 89-97 SEQ ID NO: 355 (CDR-L3);
остатков 31-37 SEQ ID NO: 356 (CDR-H1); остатков 52-67 SEQ ID NO: 356 (CDR-H2); остатков 100-110 SEQ ID NO: 356 (CDR-H3);
остатков 23-33 SEQ ID NO: 357 (CDR-L1); остатков 49-55 SEQ ID NO: 357 (CDR-L2); остатков 88-96 SEQ ID NO: 357 (CDR-L3);
остатков 31-37 SEQ ID NO: 358 (CDR-H1); остатков 52-67 SEQ ID NO: 358 (CDR-H2); остатков 100-110 SEQ ID NO: 358 (CDR-H3);
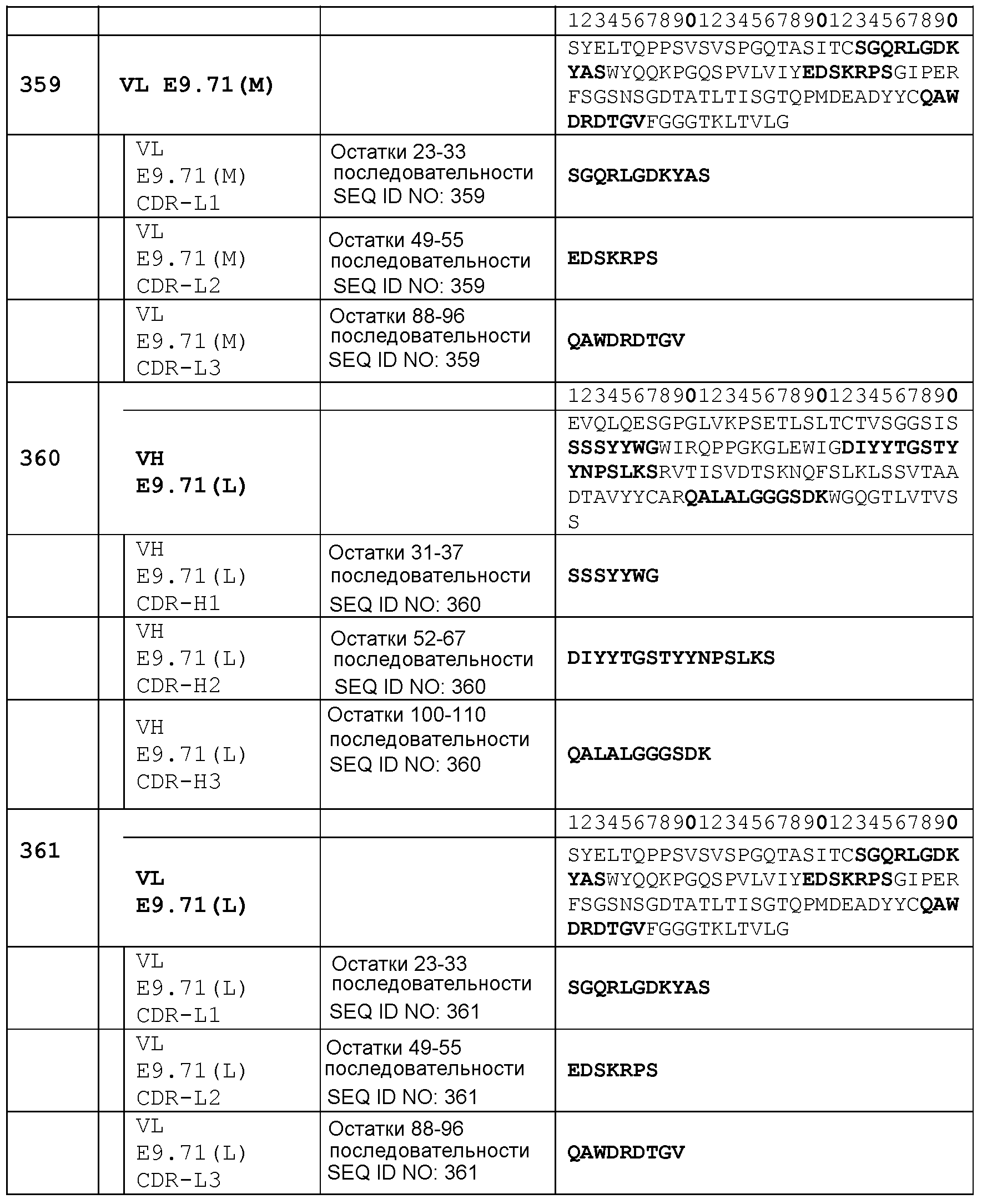
остатков 23-33 SEQ ID NO: 359 (CDR-L1); остатков 49-55 SEQ ID NO: 359 (CDR-L2); остатков 88-96 SEQ ID NO: 359 (CDR-L3);
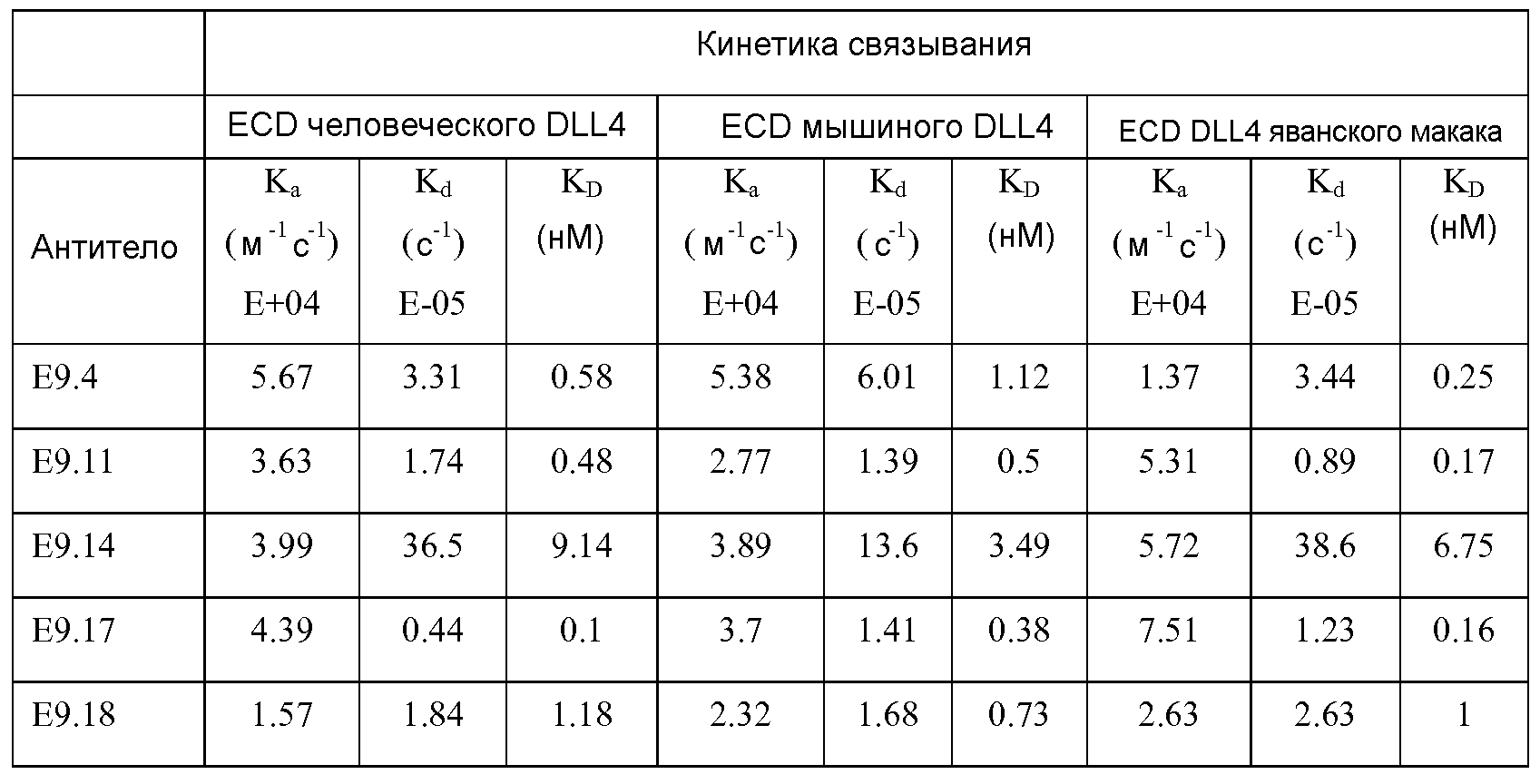
остатков 31-37 SEQ ID NO: 360 (CDR-H1); остатков 52-67 SEQ ID NO: 360 (CDR-H2); остатков 100-110 SEQ ID NO: 360 (CDR-H3);
остатков 23-33 SEQ ID NO: 361 (CDR-L1); остатков 49-55 SEQ ID NO: 361 (CDR-L2); остатков 88-96 SEQ ID NO: 361 (CDR-L3).
В другом варианте изобретения связывающий белок содержит по меньшей мере 3 CDR, описанные выше.
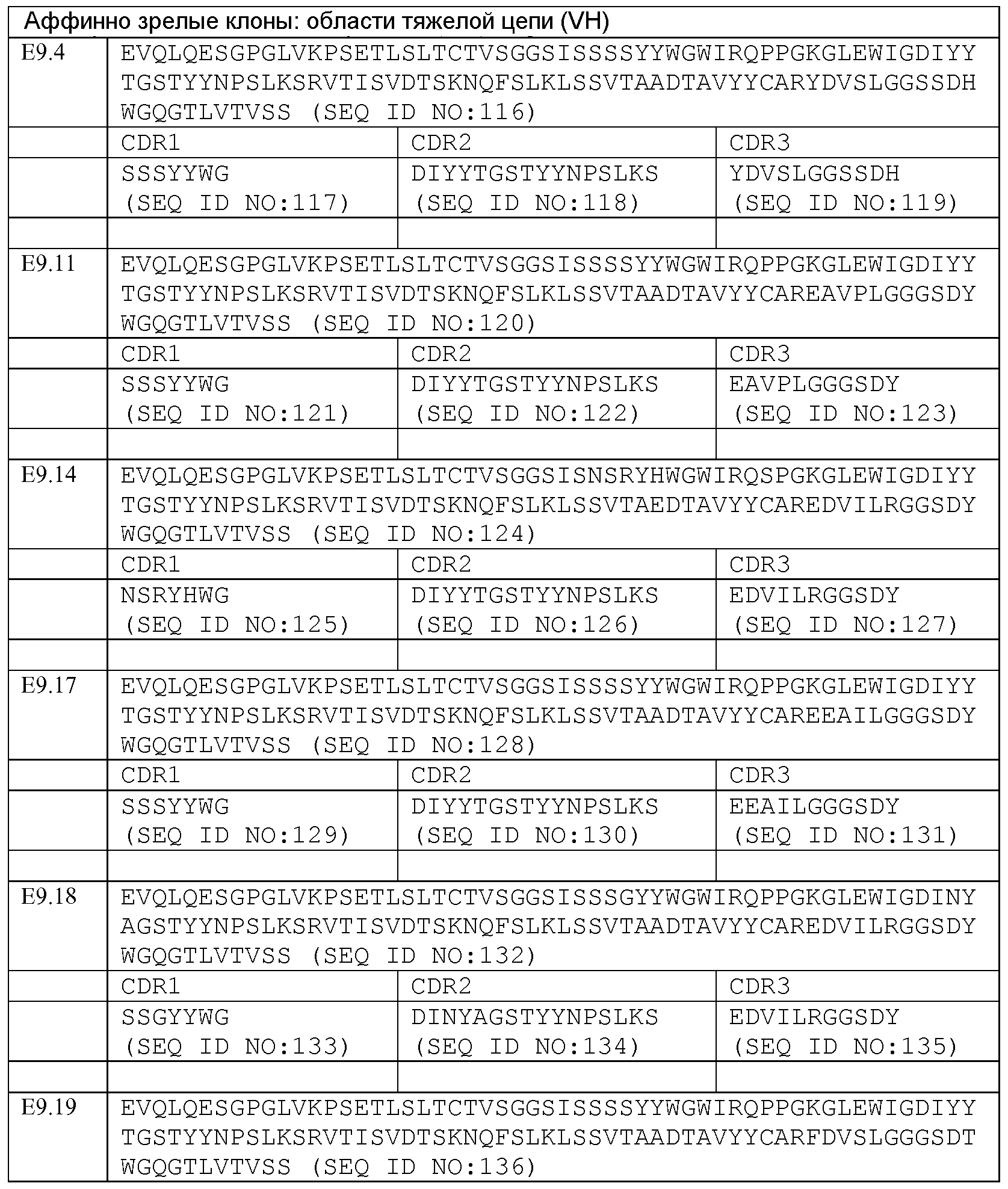
Предпочтительно, DLL4-связывающий белок согласно изобретению содержит одну или несколько описанных выше CDR. Более предпочтительно, указанный связывающий белок содержит три или более CDR, описанных выше. Наиболее предпочтительно, DLL4-связывающий белок согласно изобретению содержит шесть CDR, описанных выше, то есть CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 и CDR-L3, описанные выше.
В предпочтительном варианте изобретения связывающий белок содержит по меньшей мере 3 CDR, выбранных из группы, состоящей из описанных выше последовательностей.
Более предпочтительно, связывающий белок содержит 3 CDR, выбранных из набора CDR вариабельного домена, выбранного из нижеследующей группы:
Набор VH E9 CDR
CDR-H1: остатки 31-37 SEQ ID NO: 1
CDR-H2: остатки 52-67 SEQ ID NO: 1
CDR-H3: остатки 100-110 SEQ ID NO: 1
Набор VL E9 CDR
CDR-L1: остатки 23-33 SEQ ID NO: 111
CDR-L2: остатки 49-55 SEQ ID NO: 111
CDR-L3: остатки 88-96 SEQ ID NO: 111
Набор VH E9.4 CDR
CDR-H1: SEQ ID NO: 117
CDR-H2: SEQ ID NO: 118
CDR-H3: SEQ ID NO: 119
Набор VL E9.4 CDR
CDR-L1: SEQ ID NO: 229
CDR-L2: SEQ ID NO: 230
CDR-L3: SEQ ID NO: 231
Набор VH E9.11 CDR
CDR-H1: SEQ ID NO: 121
CDR-H2: SEQ ID NO: 122
CDR-H3: SEQ ID NO: 123
Набор VL E9.11 CDR
CDR-L1: SEQ ID NO: 233
CDR-L2: SEQ ID NO: 234
CDR-L3: SEQ ID NO: 235
Набор VH E9.14 CDR
CDR-H1: SEQ ID NO: 125
CDR-H2: SEQ ID NO: 126
CDR-H3: SEQ ID NO: 127
Набор VL E9.14 CDR
CDR-L1: SEQ ID NO: 237
CDR-L2: SEQ ID NO: 238
CDR-L3: SEQ ID NO: 239
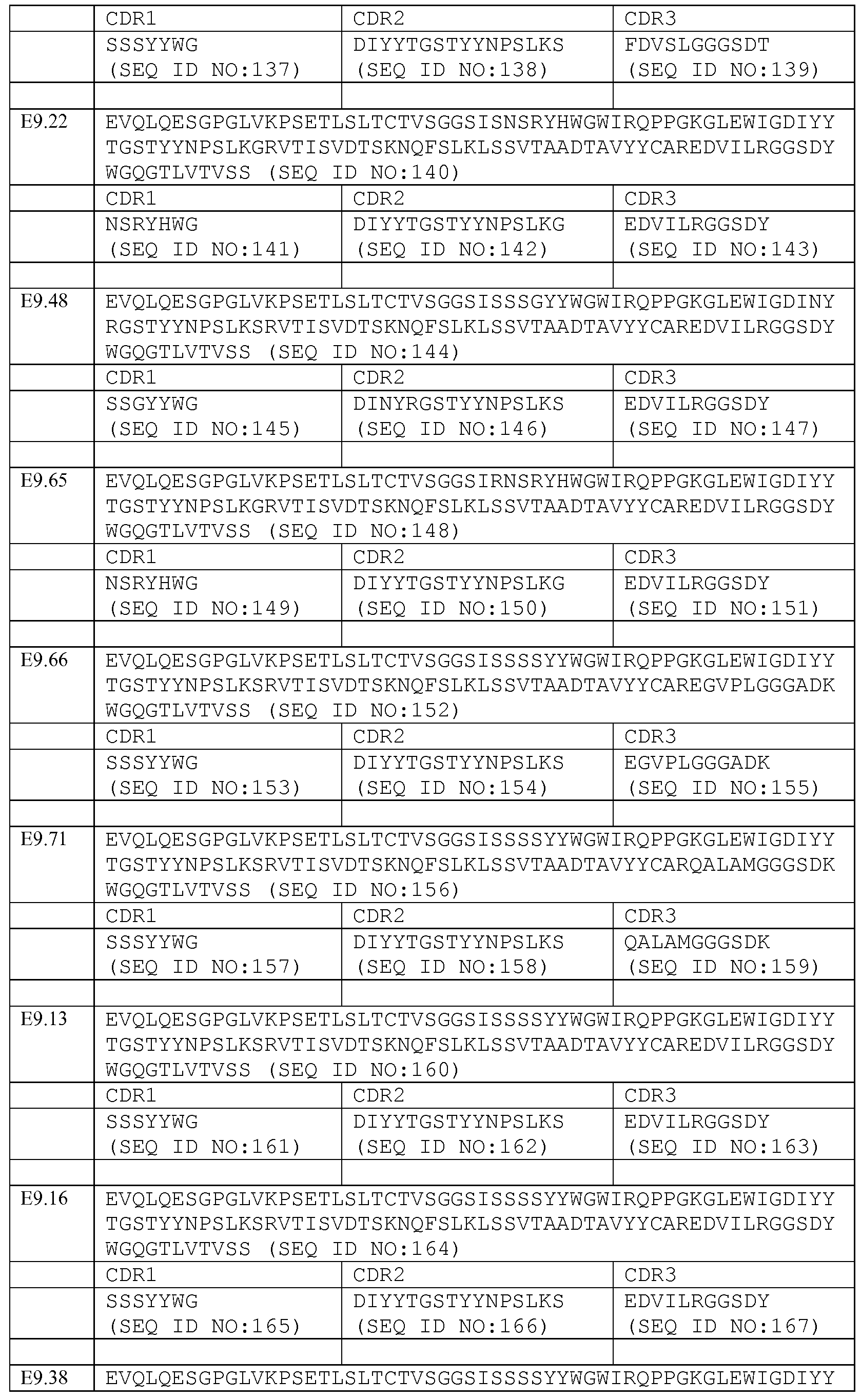
Набор VH E9.17 CDR
CDR-H1: SEQ ID NO: 129
CDR-H2: SEQ ID NO: 130
CDR-H3: SEQ ID NO: 131
Набор VL E9.17 CDR
CDR-L1: SEQ ID NO: 241
CDR-L2: SEQ ID NO: 242
CDR-L3: SEQ ID NO: 243
Набор VH E9.18 CDR
CDR-H1: SEQ ID NO: 133
CDR-H2: SEQ ID NO: 134
CDR-H3: SEQ ID NO: 135
Набор VL E9.18 CDR
CDR-L1: SEQ ID NO: 245
CDR-L2: SEQ ID NO: 246
CDR-L3: SEQ ID NO: 247
Набор VH E9.19 CDR
CDR-H1: SEQ ID NO: 137
CDR-H2: SEQ ID NO: 138
CDR-H3: SEQ ID NO: 139
Набор VL E9.19 CDR
CDR-L1: SEQ ID NO: 249
CDR-L2: SEQ ID NO: 250
CDR-L3: SEQ ID NO: 251
Набор VH E9.22 CDR
CDR-H1: SEQ ID NO: 141
CDR-H2: SEQ ID NO: 142
CDR-H3: SEQ ID NO: 143
Набор VL E9.22 CDR
CDR-L1: SEQ ID NO: 253
CDR-L2: SEQ ID NO: 254
CDR-L3: SEQ ID NO: 255
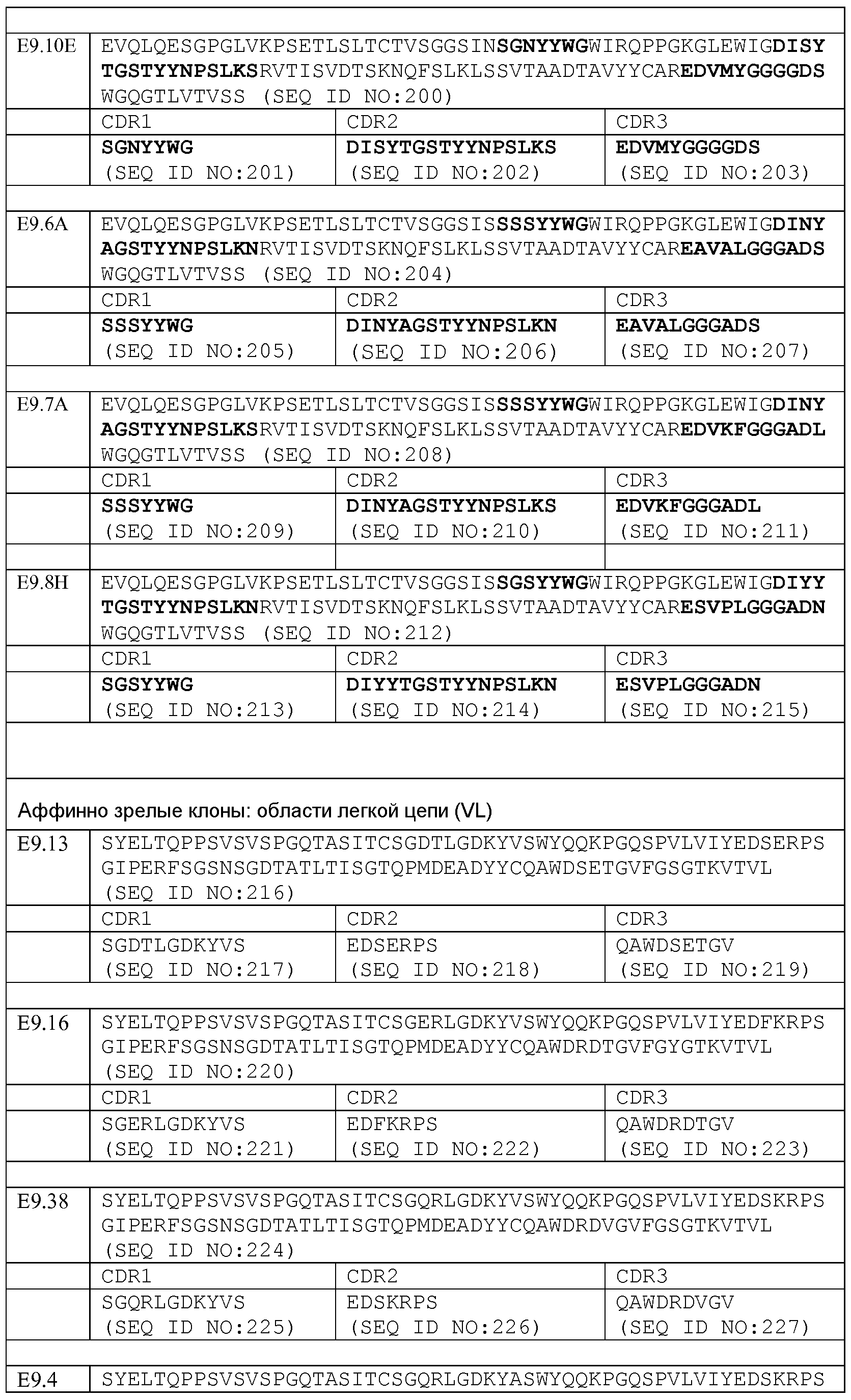
Набор VH E9.48 CDR
CDR-H1: SEQ ID NO: 145
CDR-H2: SEQ ID NO: 146
CDR-H3: SEQ ID NO: 147
Набор VL E9.48 CDR
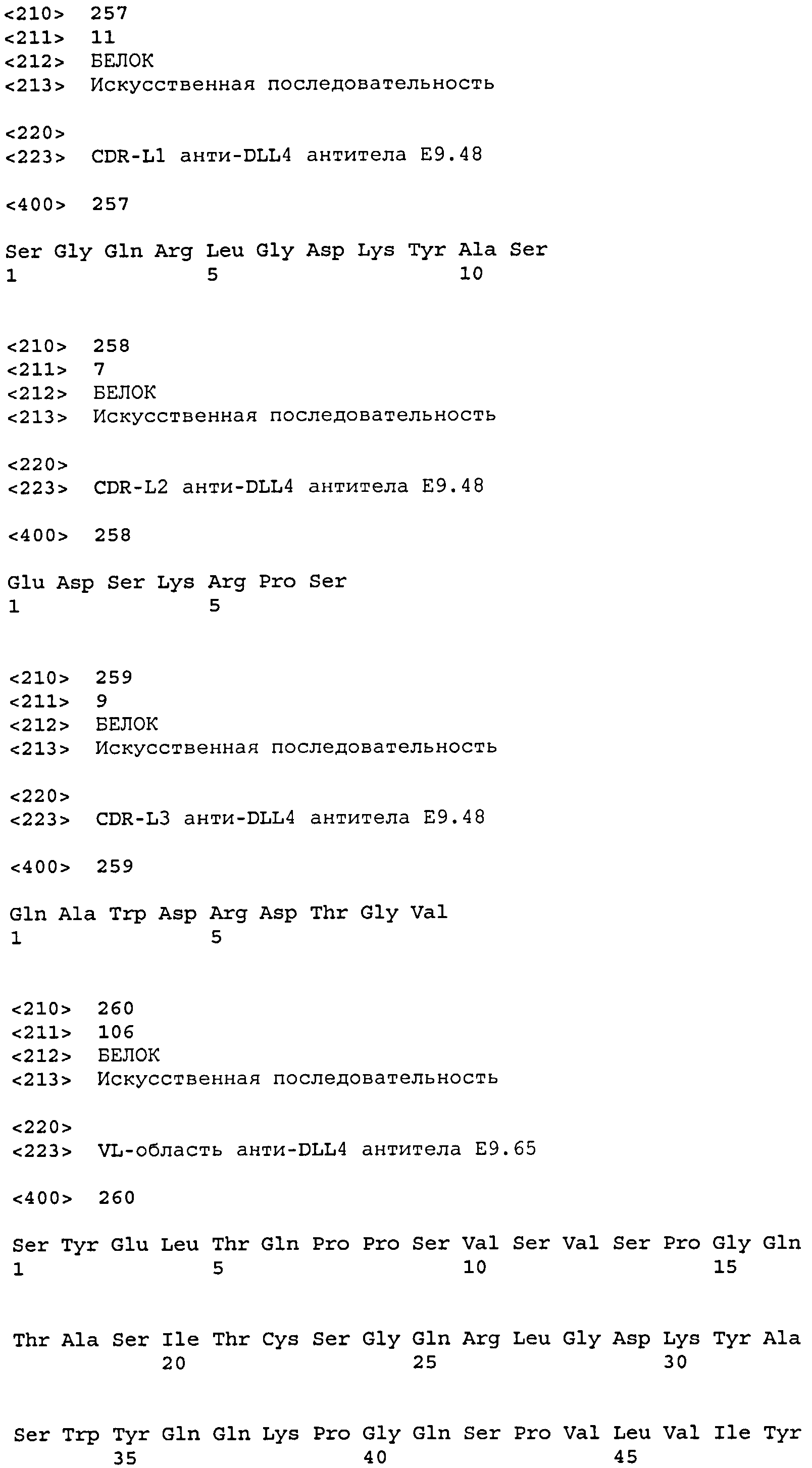
CDR-L1: SEQ ID NO: 257
CDR-L2: SEQ ID NO: 258
CDR-L3: SEQ ID NO: 259
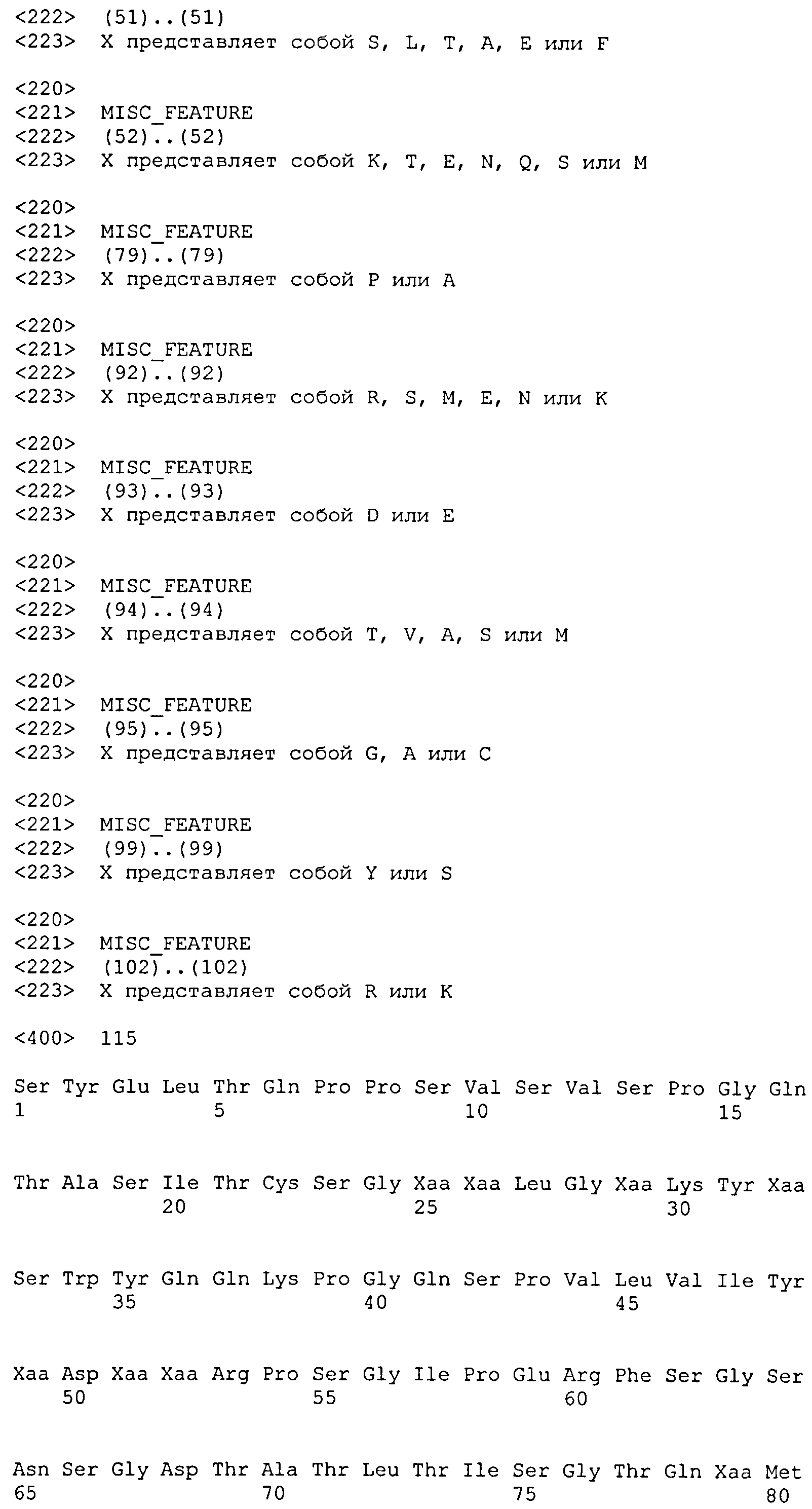
Набор VH E9.65 CDR
CDR-H1: SEQ ID NO: 149
CDR-H2: SEQ ID NO: 150
CDR-H3: SEQ ID NO: 151
Набор VL E9.65 CDR
CDR-L1: SEQ ID NO: 261
CDR-L2: SEQ ID NO: 262
CDR-L3: SEQ ID NO: 263
Набор VH E9.66 CDR
CDR-H1: SEQ ID NO: 153
CDR-H2: SEQ ID NO: 154
CDR-H3: SEQ ID NO: 155
Набор VL E9.66 CDR
CDR-L1: SEQ ID NO: 265
CDR-L2: SEQ ID NO: 266
CDR-L3: SEQ ID NO: 267
Набор VH E9.71 CDR
CDR-H1: SEQ ID NO: 157
CDR-H2: SEQ ID NO: 158
CDR-H3: SEQ ID NO: 159
Набор VL E9.71 CDR
CDR-L1: SEQ ID NO: 269
CDR-L2: SEQ ID NO: 270
CDR-L3: SEQ ID NO: 271
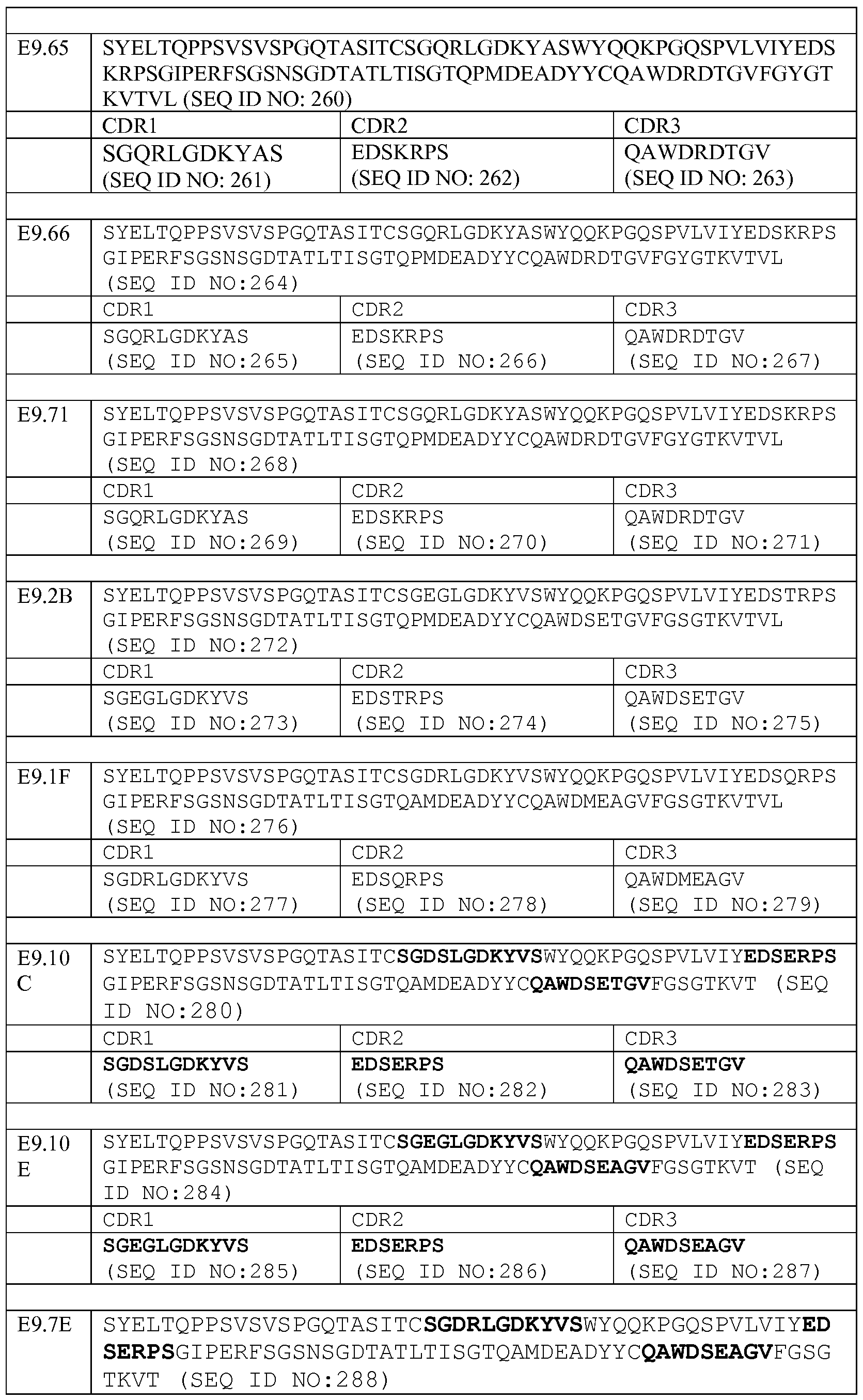
Набор VH E9.13 CDR
CDR-H1: SEQ ID NO: 161
CDR-H2: SEQ ID NO: 162
CDR-H3: SEQ ID NO: 163
Набор VL E9.13 CDR
CDR-L1: SEQ ID NO: 217
CDR-L2: SEQ ID NO: 218
CDR-L3: SEQ ID NO: 219
Набор VH E9.16 CDR
CDR-H1: SEQ ID NO: 165
CDR-H2: SEQ ID NO: 166
CDR-H3: SEQ ID NO: 167
Набор VL E9.16 CDR
CDR-L1: SEQ ID NO: 221
CDR-L2: SEQ ID NO: 222
CDR-L3: SEQ ID NO: 223
Набор VH E9.38 CDR
CDR-H1: SEQ ID NO: 169
CDR-H2: SEQ ID NO: 170
CDR-H3: SEQ ID NO: 171
Набор VL E9.38 CDR
CDR-L1: SEQ ID NO: 225
CDR-L2: SEQ ID NO: 226
CDR-L3: SEQ ID NO: 227
Набор VH E9.2В CDR
CDR-H1: SEQ ID NO: 173
CDR-H2: SEQ ID NO: 174
CDR-H3: SEQ ID NO: 175
Набор VL E9.2В CDR
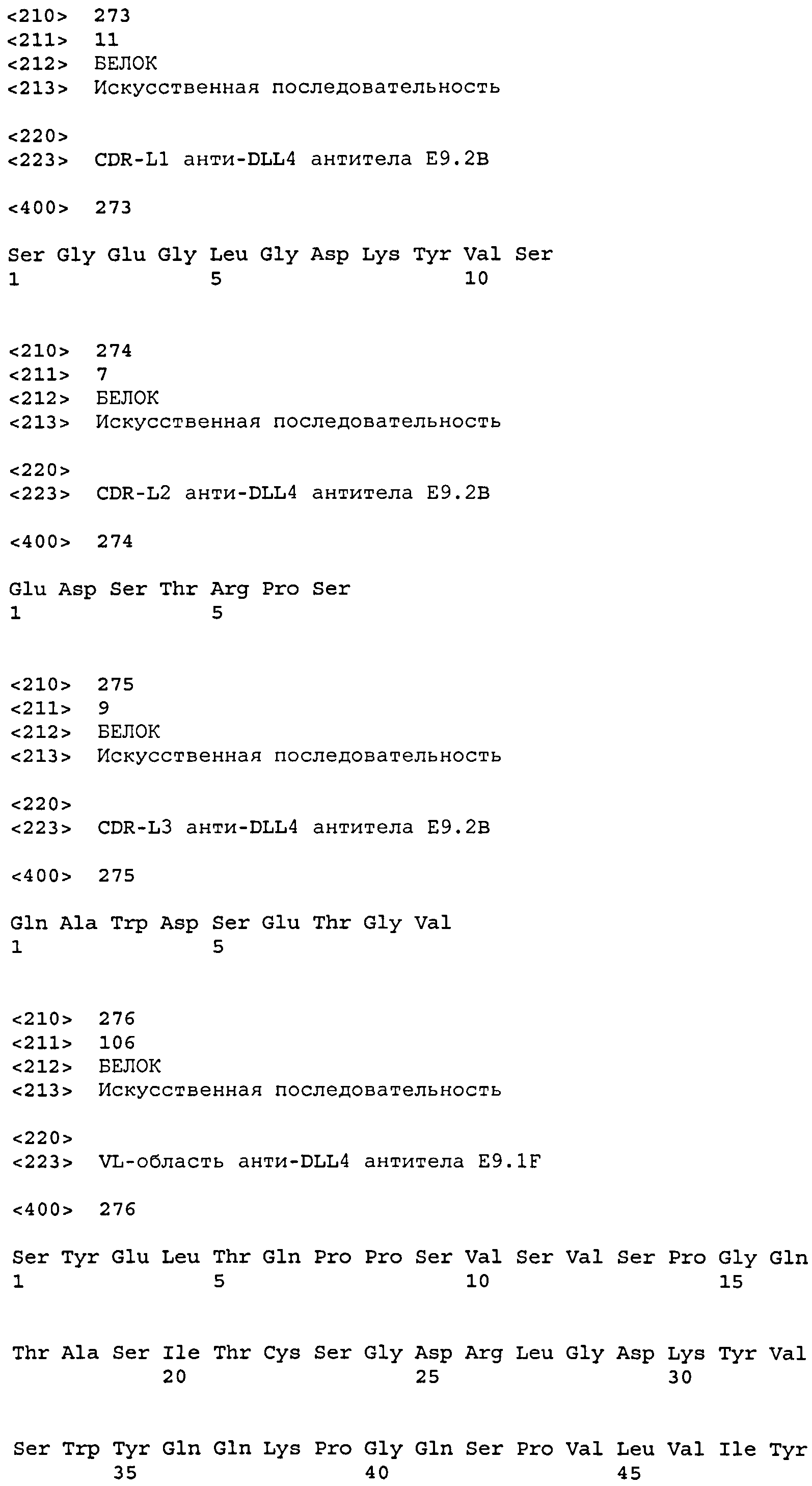
CDR-L1: SEQ ID NO: 273
CDR-L2: SEQ ID NO: 274
CDR-L3: SEQ ID NO: 275
Набор VH E9.1F CDR
CDR-H1: SEQ ID NO: 177
CDR-H2: SEQ ID NO: 178
CDR-H3: SEQ ID NO: 179
Набор VL E9.1F CDR
CDR-L1: SEQ ID NO: 277
CDR-L2: SEQ ID NO: 278
CDR-L3: SEQ ID NO: 279
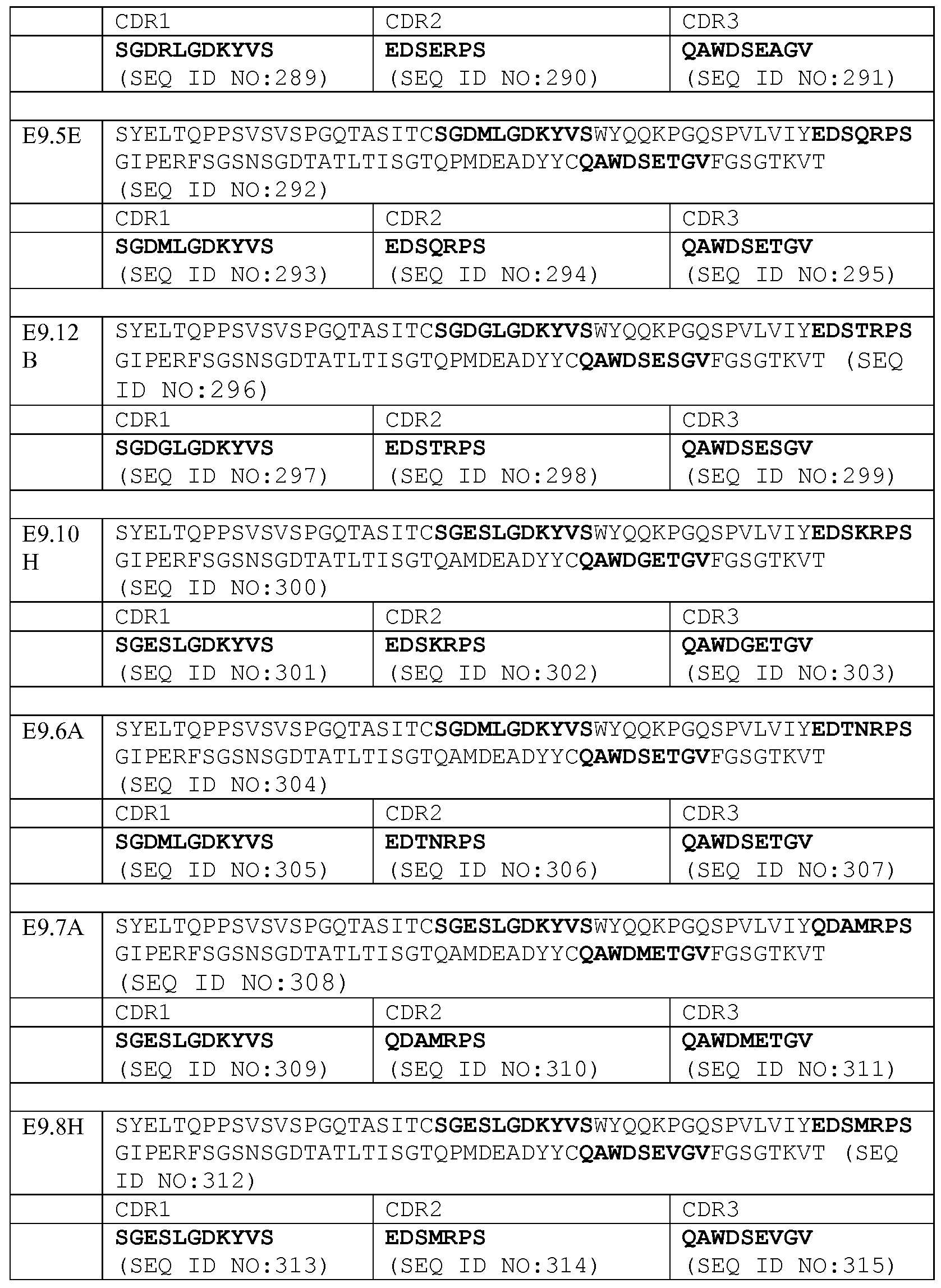
Набор VH E9.10H CDR
CDR-H1: SEQ ID NO: 181
CDR-H2: SEQ ID NO: 182
CDR-H3: SEQ ID NO: 183
Набор VL E9.10H CDR
CDR-L1: SEQ ID NO: 301
CDR-L2: SEQ ID NO: 302
CDR-L3: SEQ ID NO: 303
Набор VH E9.5E CDR
CDR-H1: SEQ ID NO: 185
CDR-H2: SEQ ID NO: 186
CDR-H3: SEQ ID NO: 187
Набор VL E9.5E CDR
CDR-L1: SEQ ID NO: 293
CDR-L2: SEQ ID NO: 294
CDR-L3: SEQ ID NO: 295
Набор VH E9.10C CDR
CDR-H1: SEQ ID NO: 189
CDR-H2: SEQ ID NO: 190
CDR-H3: SEQ ID NO: 191
Набор VL E9.10C CDR
CDR-L1: SEQ ID NO: 281
CDR-L2: SEQ ID NO: 282
CDR-L3: SEQ ID NO: 283
Набор VH E9.7E CDR
CDR-H1: SEQ ID NO: 193
CDR-H2: SEQ ID NO: 194
CDR-H3: SEQ ID NO: 195
Набор VL E9.7E CDR
CDR-L1: SEQ ID NO: 289
CDR-L2: SEQ ID NO: 290
CDR-L3: SEQ ID NO: 291
Набор VH E9.12B CDR
CDR-H1: SEQ ID NO: 197
CDR-H2: SEQ ID NO: 198
CDR-H3: SEQ ID NO: 199
Набор VL E9.12B CDR
CDR-L1: SEQ ID NO: 297
CDR-L2: SEQ ID NO: 298
CDR-L3: SEQ ID NO: 299
Набор VH E9.10E CDR
CDR-H1: SEQ ID NO: 201
CDR-H2: SEQ ID NO: 202
CDR-H3: SEQ ID NO: 203
Набор VL E9.10E CDR
CDR-L1: SEQ ID NO: 285
CDR-L2: SEQ ID NO: 286
CDR-L3: SEQ ID NO: 287
Набор VH E9.6A CDR
CDR-H1: SEQ ID NO: 205
CDR-H2: SEQ ID NO: 206
CDR-H3: SEQ ID NO: 207
Набор VL E9.6A CDR
CDR-L1: SEQ ID NO: 305
CDR-L2: SEQ ID NO: 306
CDR-L3: SEQ ID NO: 307
Набор VH E9.7A CDR
CDR-H1: SEQ ID NO: 209
CDR-H2: SEQ ID NO: 210
CDR-H3: SEQ ID NO: 211
Набор VL E9.7A CDR
CDR-L1: SEQ ID NO: 309
CDR-L2: SEQ ID NO: 310
CDR-L3: SEQ ID NO: 311
Набор VH E9.8H CDR
CDR-H1: SEQ ID NO: 213
CDR-H2: SEQ ID NO: 214
CDR-H3: SEQ ID NO: 215
Набор VL E9.8H CDR
CDR-L1: SEQ ID NO: 313
CDR-L2: SEQ ID NO: 314
CDR-L3: SEQ ID NO: 315
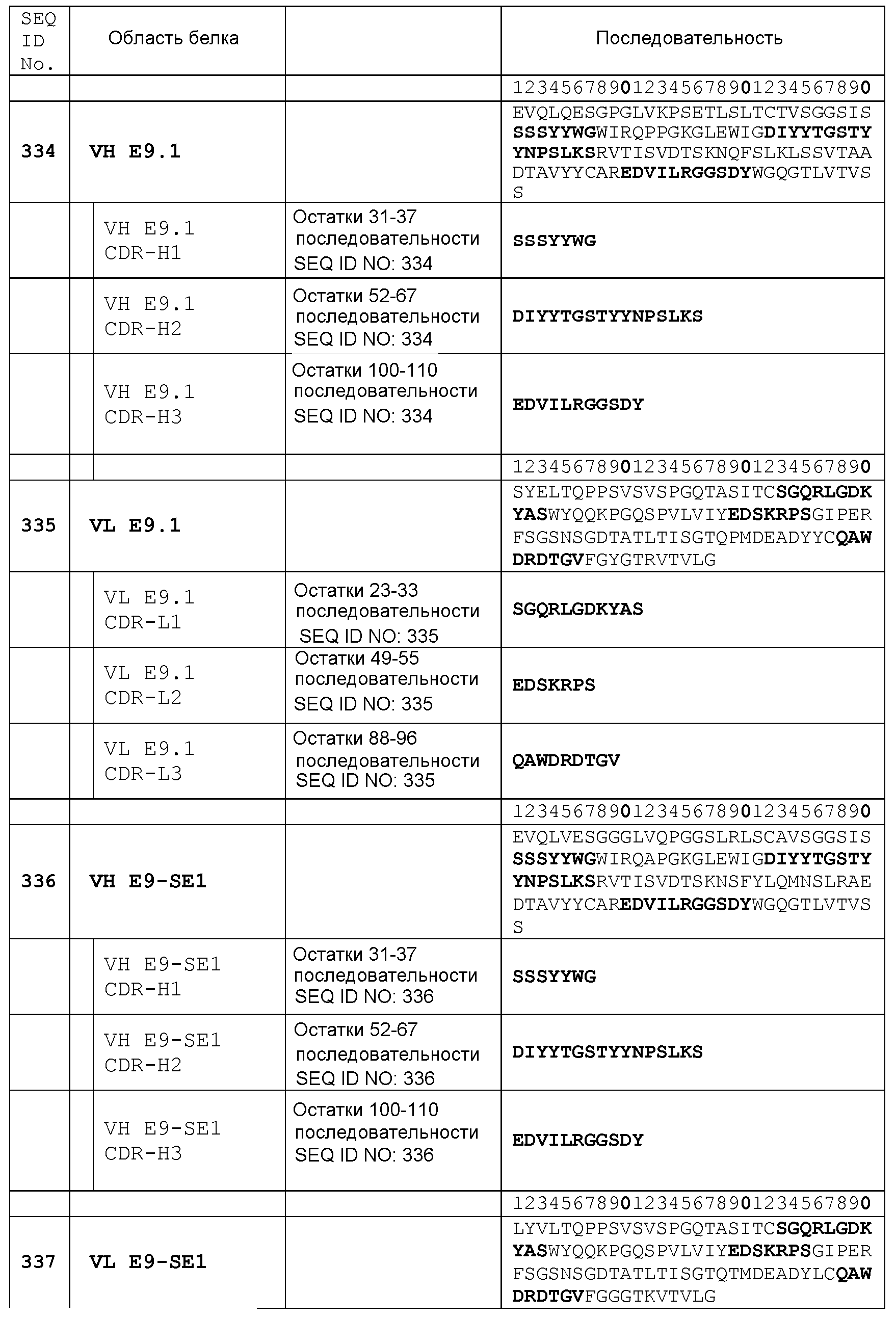
Набор VH E9.1 CDR
CDR-H1: остатки 31-37 SEQ ID NO: 334
CDR-H2: остатки 52-67 SEQ ID NO: 334
CDR-H3: остатки 100-110 SEQ ID NO: 334
Набор VL E9.1 CDR
CDR-L1: остатки 23-33 SEQ ID NO: 335
CDR-L2: остатки 49-55 SEQ ID NO: 335
CDR-L3: остатки 88-96 SEQ ID NO: 335
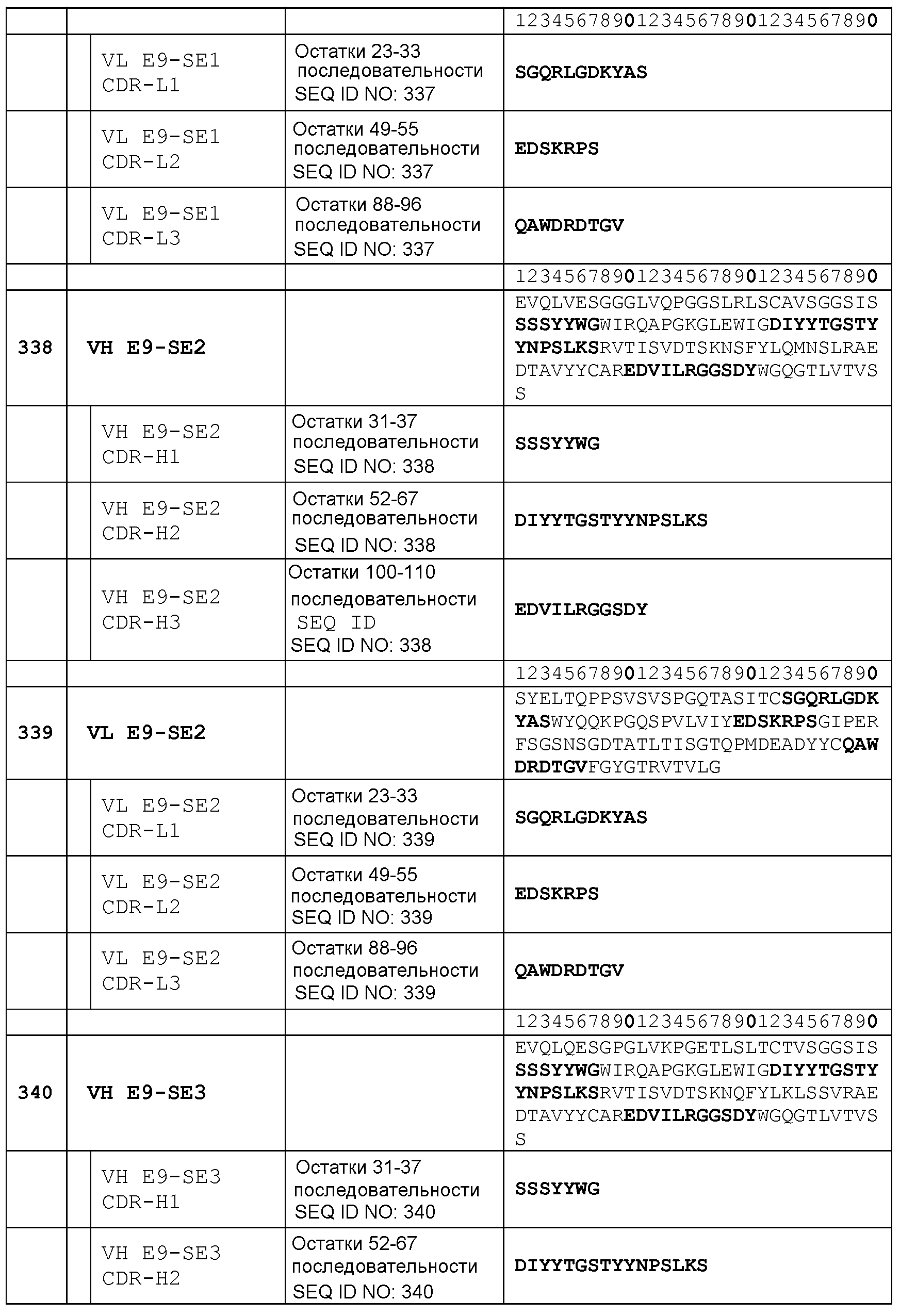
Набор VH E9-SE1 CDR
CDR-H1: остатки 31-37 SEQ ID NO: 336
CDR-H2: остатки 52-67 SEQ ID NO: 336
CDR-H3: остатки 100-110 SEQ ID NO: 336
Набор VL E9-SE1 CDR
CDR-L1: остатки 23-33 SEQ ID NO: 337
CDR-L2: остатки 49-55 SEQ ID NO: 337
CDR-L3: остатки 88-96 SEQ ID NO: 337
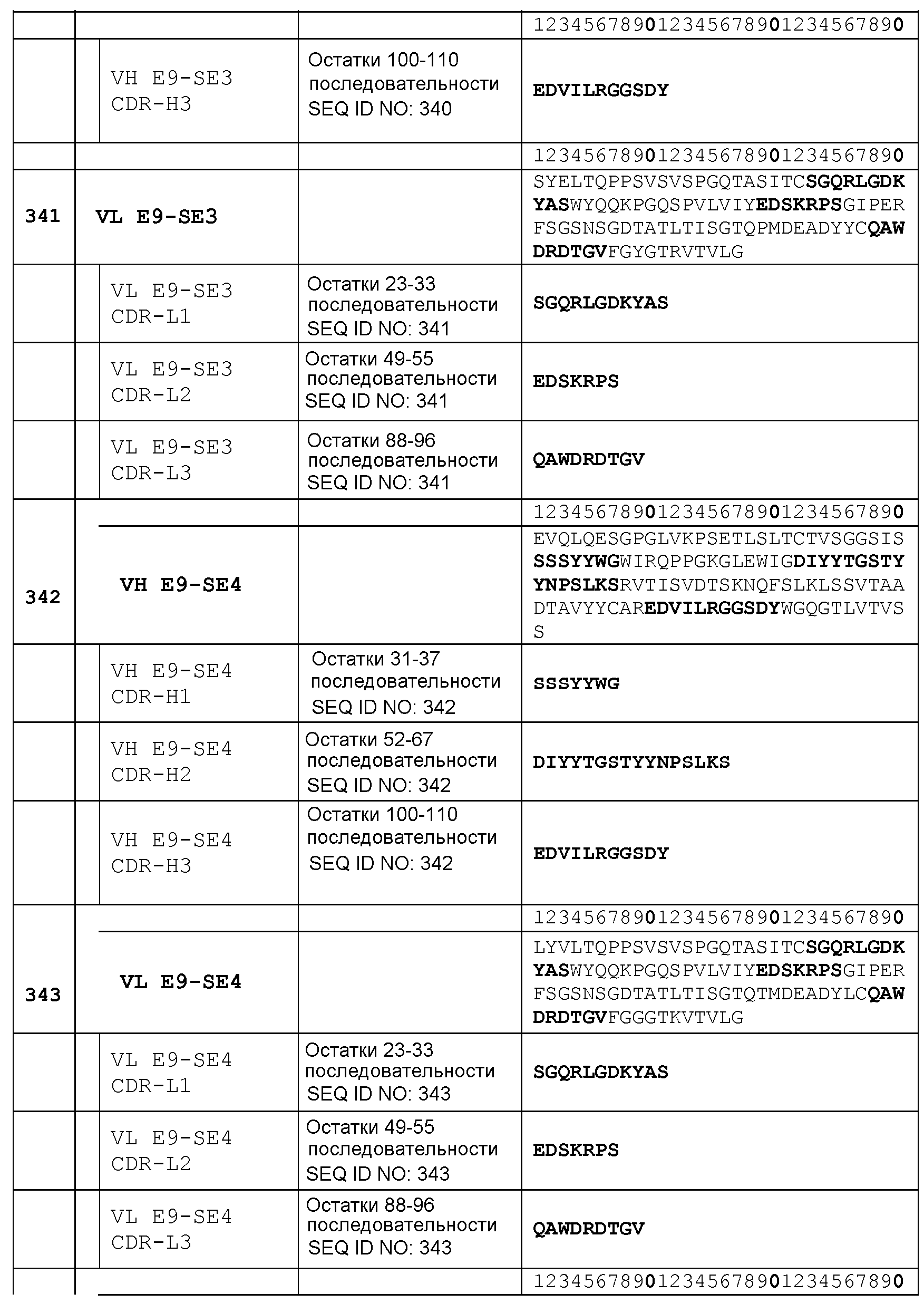
Набор VH E9-SE2 CDR
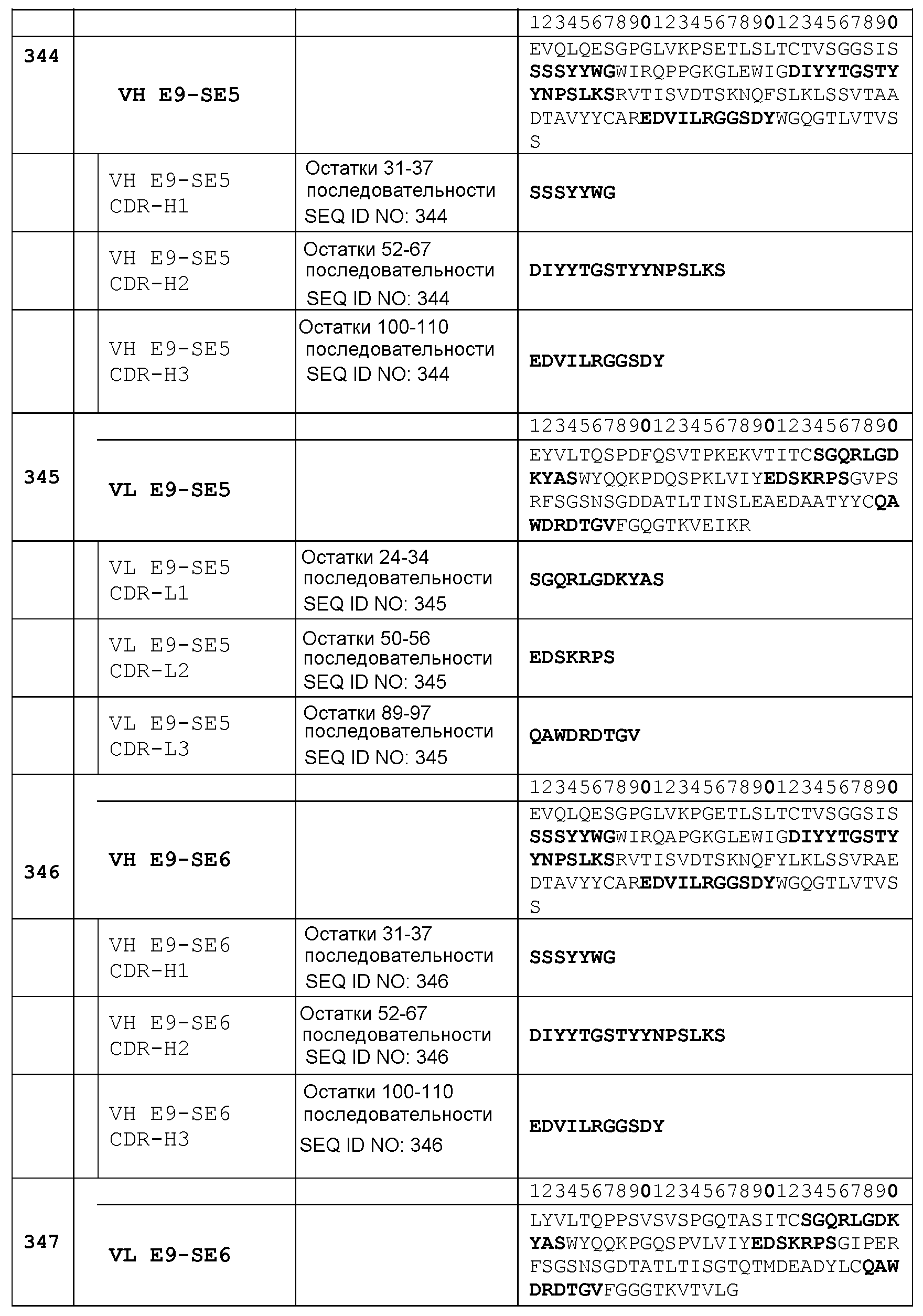
CDR-H1: остатки 31-37 SEQ ID NO: 338
CDR-H2: остатки 52-67 SEQ ID NO: 338
CDR-H3: остатки 100-110 SEQ ID NO: 338
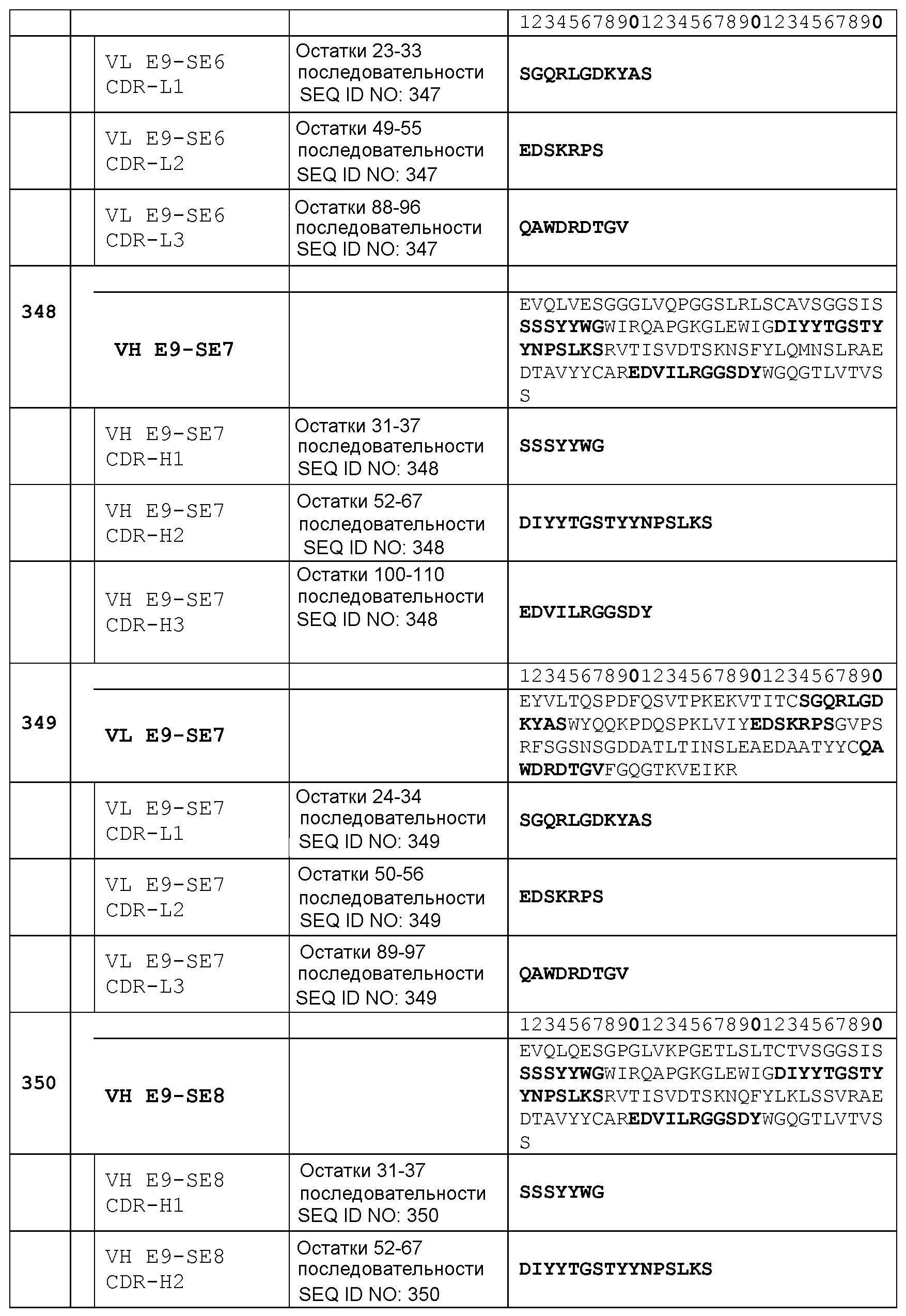
Набор VL E9-SE2 CDR
CDR-L1: остатки 23-33 SEQ ID NO: 339
CDR-L2: остатки 49-55 SEQ ID NO: 339
CDR-L3: остатки 88-96 SEQ ID NO: 339
Набор VH E9-SE3 CDR
CDR-H1: остатки 31-37 SEQ ID NO: 340
CDR-H2: остатки 52-67 SEQ ID NO: 340
CDR-H3: остатки 100-110 SEQ ID NO: 340
Набор VL E9-SE3 CDR
CDR-L1: остатки 23-33 SEQ ID NO: 341
CDR-L2: остатки 49-55 SEQ ID NO: 341
CDR-L3: остатки 88-96 SEQ ID NO: 341
Набор VH E9-SE4 CDR
CDR-H1: остатки 31-37 SEQ ID NO: 342
CDR-H2: остатки 52-67 SEQ ID NO: 342
CDR-H3: остатки 100-110 SEQ ID NO: 342
Набор VL E9-SE4 CDR
CDR-L1: остатки 23-33 SEQ ID NO: 343
CDR-L2: остатки 49-55 SEQ ID NO: 343
CDR-L3: остатки 88-96 SEQ ID NO: 343
Набор VH E9-SE5 CDR
CDR-H1: остатки 31-37 SEQ ID NO: 344
CDR-H2: остатки 52-67 SEQ ID NO: 344
CDR-H3: остатки 100-110 SEQ ID NO: 344
Набор VL E9-SE5 CDR
CDR-L1: остатки 24-34 SEQ ID NO: 345
CDR-L2: остатки 50-56 SEQ ID NO: 345
CDR-L3: остатки 89-97 SEQ ID NO: 345
Набор VH E9-SE6 CDR
CDR-H1: остатки 31-37 SEQ ID NO: 346
CDR-H2: остатки 52-67 SEQ ID NO: 346
CDR-H3: остатки 100-110 SEQ ID NO: 346
Набор VL E9-SE6 CDR
CDR-L1: остатки 23-33 SEQ ID NO: 347
CDR-L2: остатки 49-55 SEQ ID NO: 347
CDR-L3: остатки 88-96 SEQ ID NO: 347
Набор VH E9-SE7 CDR
CDR-H1: остатки 31-37 SEQ ID NO: 348
CDR-H2: остатки 52-67 SEQ ID NO: 348
CDR-H3: остатки 100-110 SEQ ID NO: 348
Набор VL E9-SE7 CDR
CDR-L1: остатки 24-34 SEQ ID NO: 349
CDR-L2: остатки 50-56 SEQ ID NO: 349
CDR-L3: остатки 89-97 SEQ ID NO: 349
Набор VH E9-SE8 CDR
CDR-H1: остатки 31-37 SEQ ID NO: 350
CDR-H2: остатки 52-67 SEQ ID NO: 350
CDR-H3: остатки 100-110 SEQ ID NO: 350
Набор VL E9-SE8 CDR
CDR-L1: остатки 24-34 SEQ ID NO: 351
CDR-L2: остатки 50-56 SEQ ID NO: 351
CDR-L3: остатки 89-97 SEQ ID NO: 351
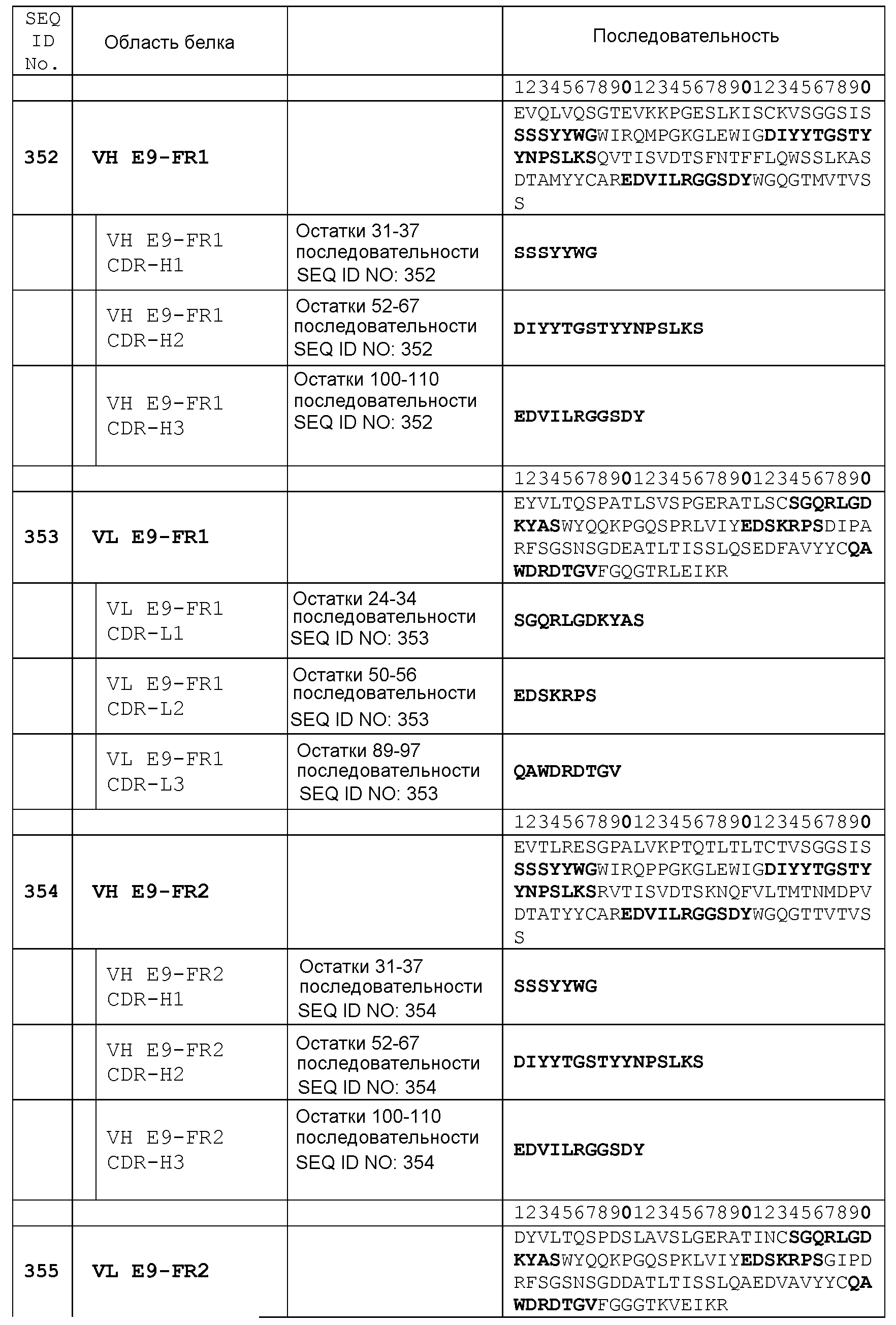
Набор VH E9-FR1 CDR
CDR-H1: остатки 31-37 SEQ ID NO: 352
CDR-H2: остатки 52-67 SEQ ID NO: 352
CDR-H3: остатки 100-110 SEQ ID NO: 352
Набор VL E9-FR1 CDR
CDR-L1: остатки 24-34 SEQ ID NO: 353
CDR-L2: остатки 50-56 SEQ ID NO: 353
CDR-L3: остатки 89-97 SEQ ID NO: 353
Набор VH E9-FR2 CDR
CDR-H1: остатки 31-37 SEQ ID NO: 354
CDR-H2: остатки 52-67 SEQ ID NO: 354
CDR-H3: остатки 100-110 SEQ ID NO: 354
Набор VL E9-FR2 CDR
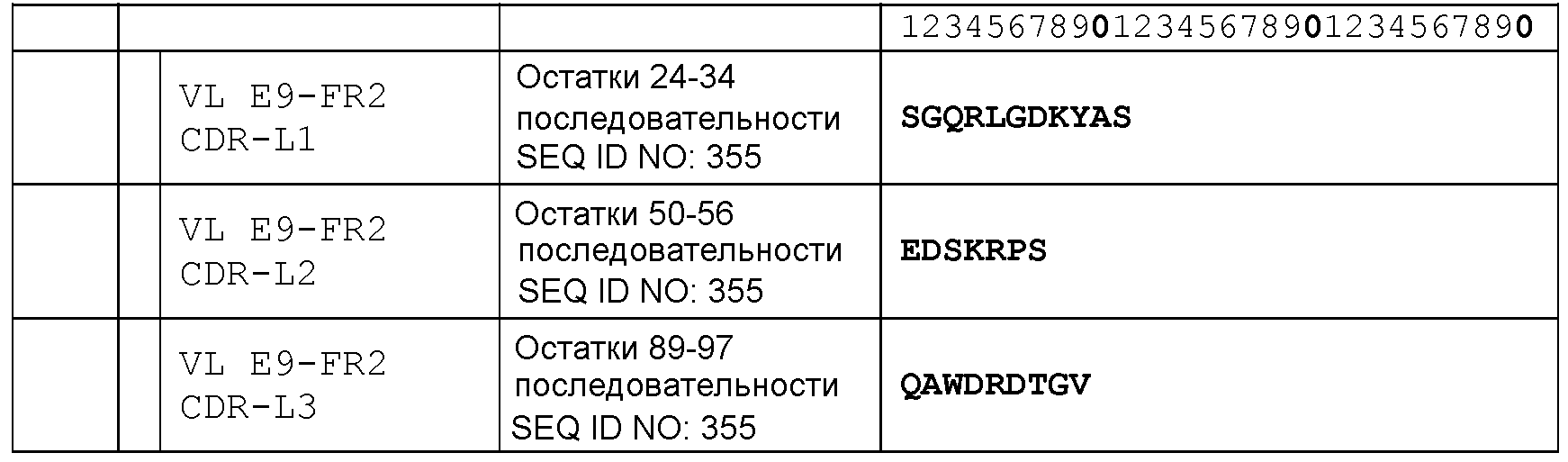
CDR-L1: остатки 24-34 SEQ ID NO: 355
CDR-L2: остатки 50-56 SEQ ID NO: 355
CDR-L3: остатки 89-97 SEQ ID NO: 355
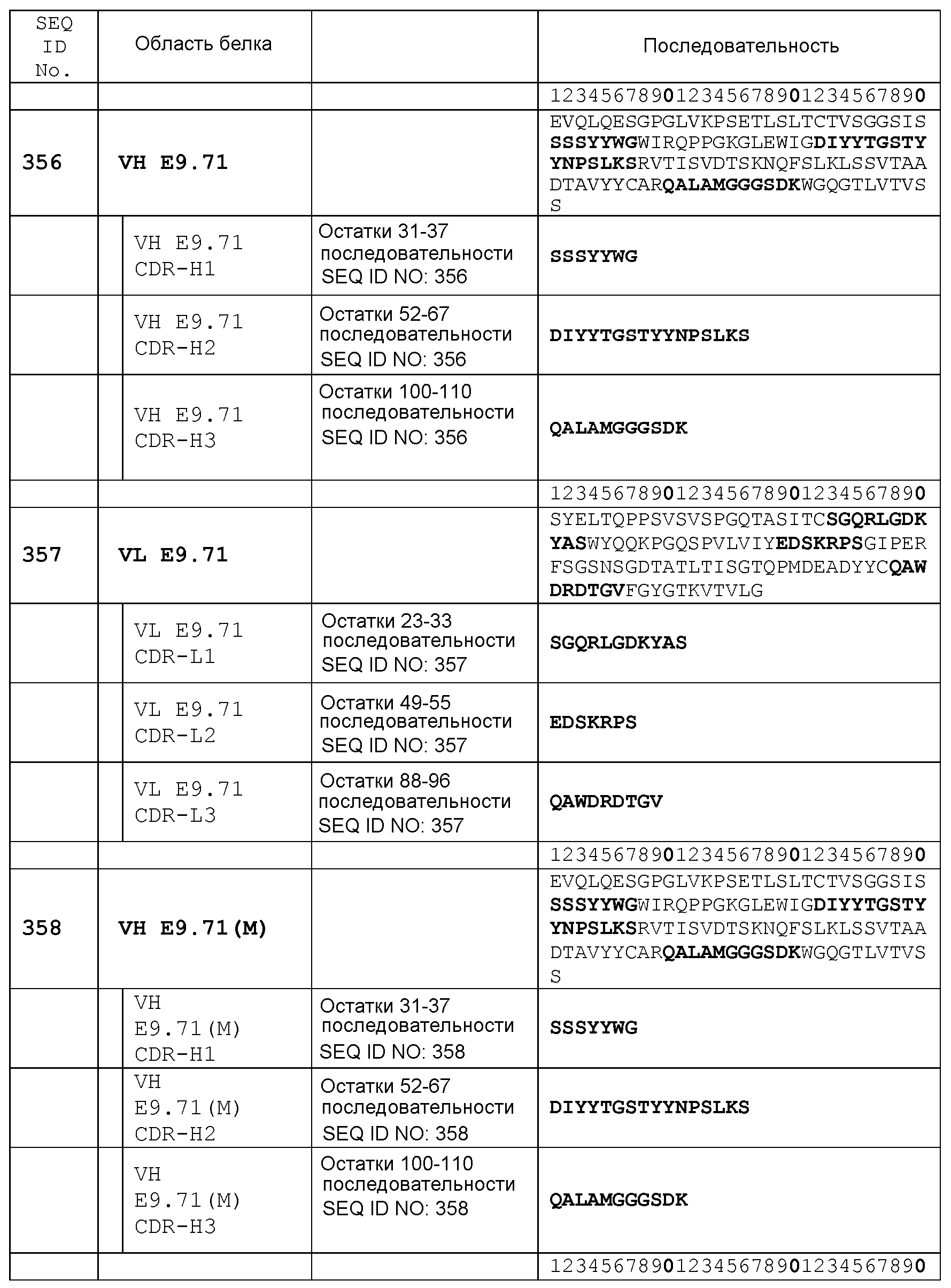
Набор VH E9.71 CDR
CDR-H1: остатки 31-37 SEQ ID NO: 356
CDR-H2: остатки 52-67 SEQ ID NO: 356
CDR-H3: остатки 100-110 SEQ ID NO: 356
Набор VL E9.71 CDR
CDR-L1: остатки 23-33 SEQ ID NO: 357
CDR-L2: остатки 49-55 SEQ ID NO: 357
CDR-L3: остатки 88-96 SEQ ID NO: 357
Набор VH E9.71(M) CDR
CDR-H1: остатки 31-37 SEQ ID NO: 358
CDR-H2: остатки 52-67 SEQ ID NO: 358
CDR-H3: остатки 100-110 SEQ ID NO: 358
Набор VL E9.71(M) CDR
CDR-L1: остатки 23-33 SEQ ID NO: 359
CDR-L2: остатки 49-55 SEQ ID NO: 359
CDR-L3: остатки 88-96 SEQ ID NO: 359
Набор VH E9.71(L) CDR
CDR-H1: остатки 31-37 SEQ ID NO: 360
CDR-H2: остатки 52-67 SEQ ID NO: 360
CDR-H3: остатки 100-110 SEQ ID NO: 360
Набор VL E9.71(L) CDR
CDR-L1: остатки 23-33 SEQ ID NO: 361
CDR-L2: остатки 49-55 SEQ ID NO: 361
CDR-L3: остатки 88-96 SEQ ID NO: 361.
В другом варианте изобретения связывающий белок содержит набор из 3 CDR вариабельных тяжелых цепей (VH), выбранных из любого набора из 3 CDR VH в вышеуказанной группе, и набор из 3 CDR вариабельных легких цепей (VL), выбранных из любого набора из 3 CDR VL в вышеуказанной группе.
В другом варианте изобретения связывающий белок содержит набор из 3 CDR цепей, обозначенных VH, и набор из 3 CDR цепей, соответственно обозначенных VL, в вышеуказанной группе. Предпочтительно, связывающий белок согласно изобретению содержит по меньшей мере два набора CDR вариабельных доменов, выбранные из группы наборов CDR вариабельных доменов, состоящей из:
набора VH E9 CDR и набора VL E9 CDR,
набора VH E9.4 CDR и набора VL E9.4 CDR,
набора VH E9.11 CDR и набора VL E9.11 CDR,
набора VH E9.14 CDR и набора VL E9.14 CDR,
набора VH E9.17 CDR и набора VL E9.17 CDR,
набора VH E9.18 CDR и набора VL E9.18 CDR,
набора VH E9.19 CDR и набора VL E9.19 CDR,
набора VH E9.22 CDR и набора VL E9.22 CDR,
набора VH E9.48 CDR и набора VL E9.48 CDR,
набора VH E9.65 CDR и набора VL E9.65 CDR,
набора VH E9.66 CDR и набора VL E9.66 CDR,
набора VH E9.71 CDR и набора VL E9.71 CDR,
набора VH E9.13 CDR и набора VL E9.13 CDR,
набора VH E9.16 CDR и набора VL E9.16 CDR,
набора VH E9.38 CDR и набора VL E9.38 CDR,
набора VH E9.2B CDR и набора VL E9.2B CDR,
набора VH E9.1F CDR и набора VL E9.1F CDR,
набора VH E9.10H CDR и набора VL E9.10H CDR,
набора VH E9.5E CDR и набора VL E9.5E CDR,
набора VH E9.10C CDR и набора VL E9.10C CDR,
набора VH E9.7E CDR и набора VL E9.7E CDR,
набора VH E9.12B CDR и набора VL E9.12B CDR,
набора VH E9.10E CDR и набора VL E9.10E CDR,
набора VH E9.6A CDR и набора VL E9.6A CDR,
набора VH E9.7A CDR и набора VL E9.7A CDR,
набора VH E9.8H CDR и набора VL E9.8H CDR,
набора VH E9-SE1 CDR и набора VL E9-SE1 CDR,
набора VH E9-SE2 CDR и набора VL E9-SE2 CDR,
набора VH E9-SE3 CDR и набора VL E9-SE3 CDR,
набора VH E9-SE4 CDR и набора VL E9-SE4 CDR,
набора VH E9-SE5 CDR и набора VL E9-SE5 CDR,
набора VH E9-SE6 CDR и набора VL E9-SE6 CDR,
набора VH E9-SE7 CDR и набора VL E9-SE7 CDR,
набора VH E9-SE8 CDR и набора VL E9-SE8 CDR,
набора VH E9-FR1 CDR и набора VL E9-FR1 CDR,
набора VH E9-FR2 CDR и набора VL E9-FR2 CDR,
набора VH E9.71 CDR и набора VL E9.71 CDR,
набора VH E9.71(M) CDR и набора VL E9.71(M) CDR, и
набора VH E9.71(L) CDR и набора VL E9.71(L) CDR.
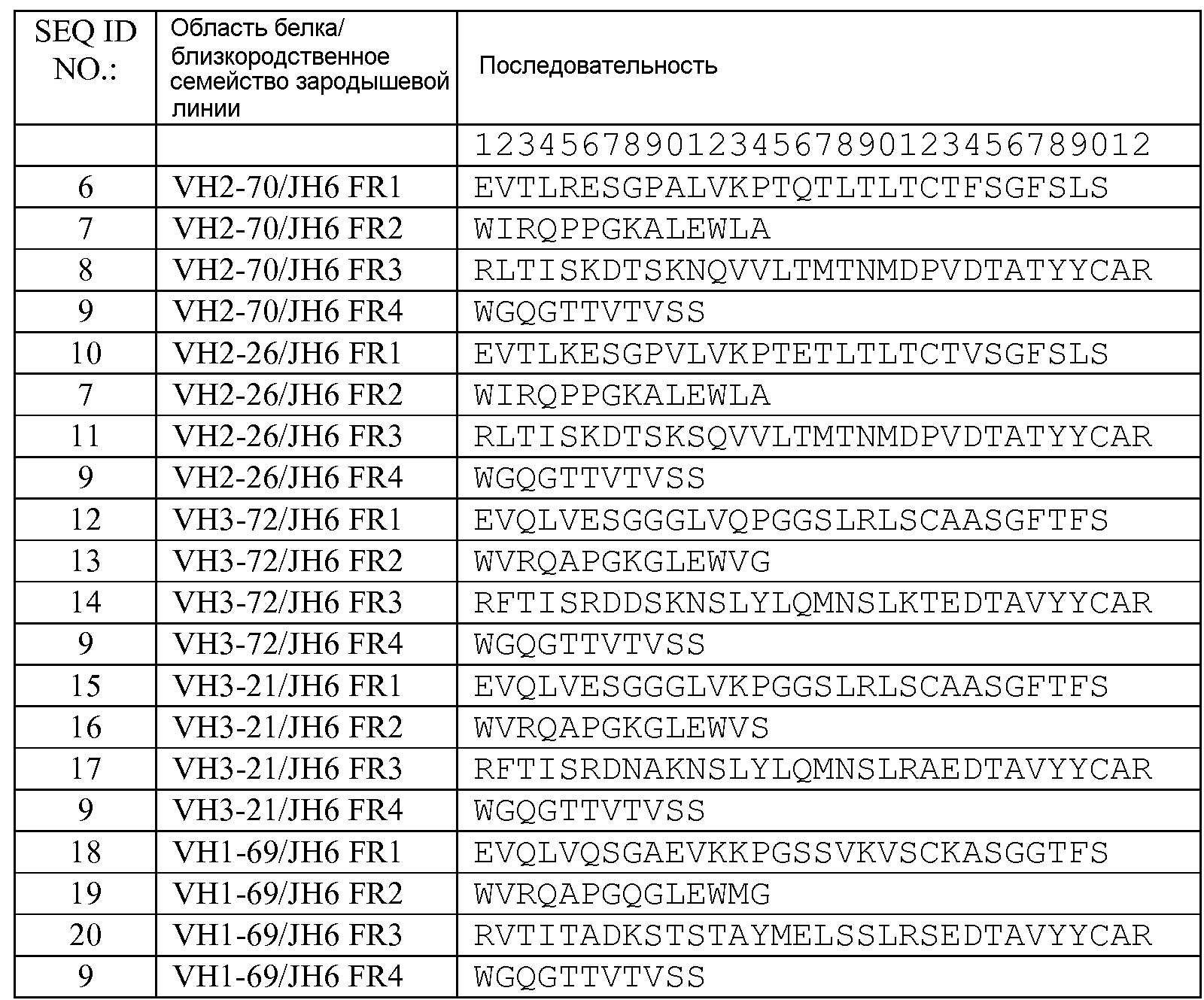
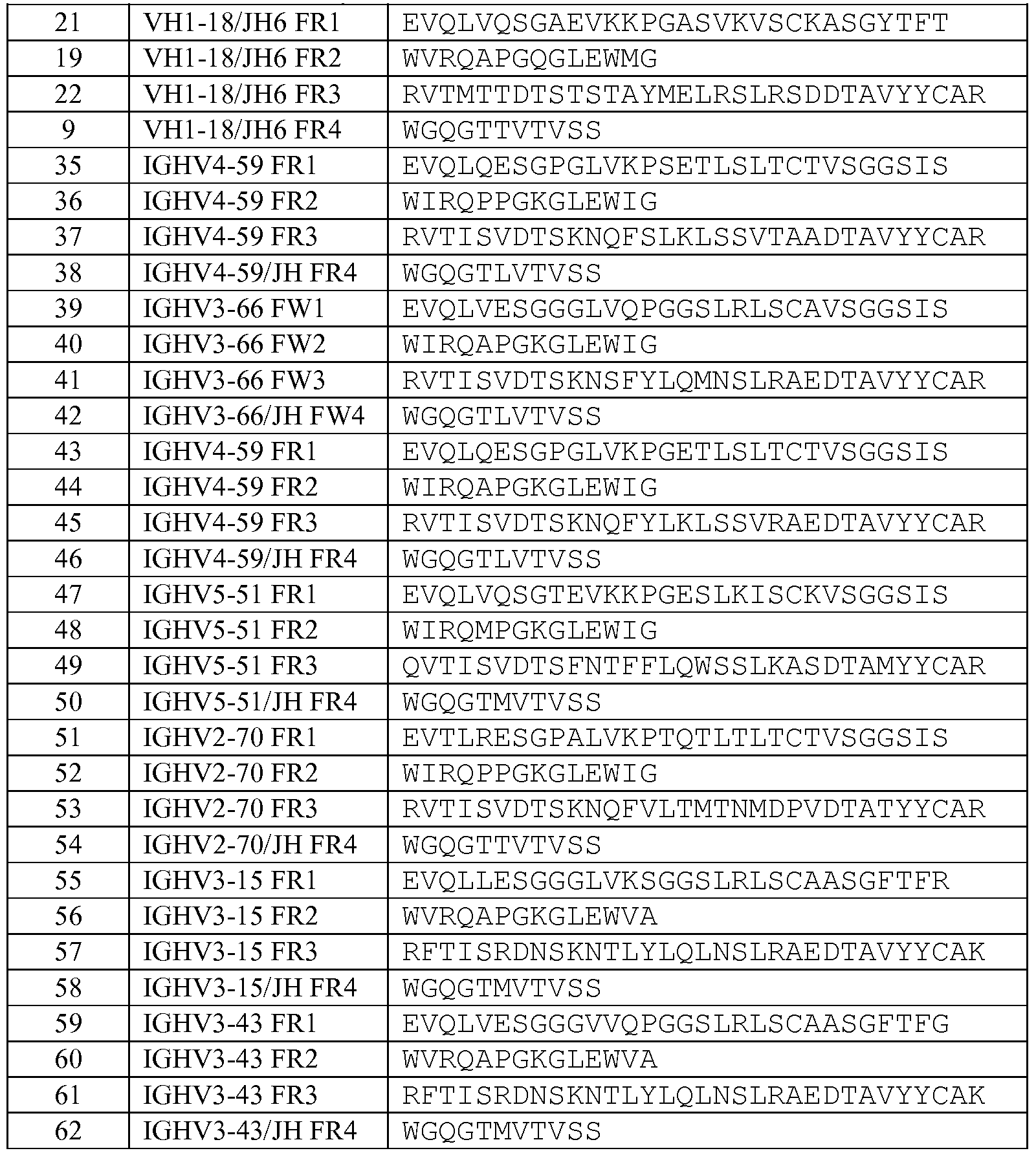
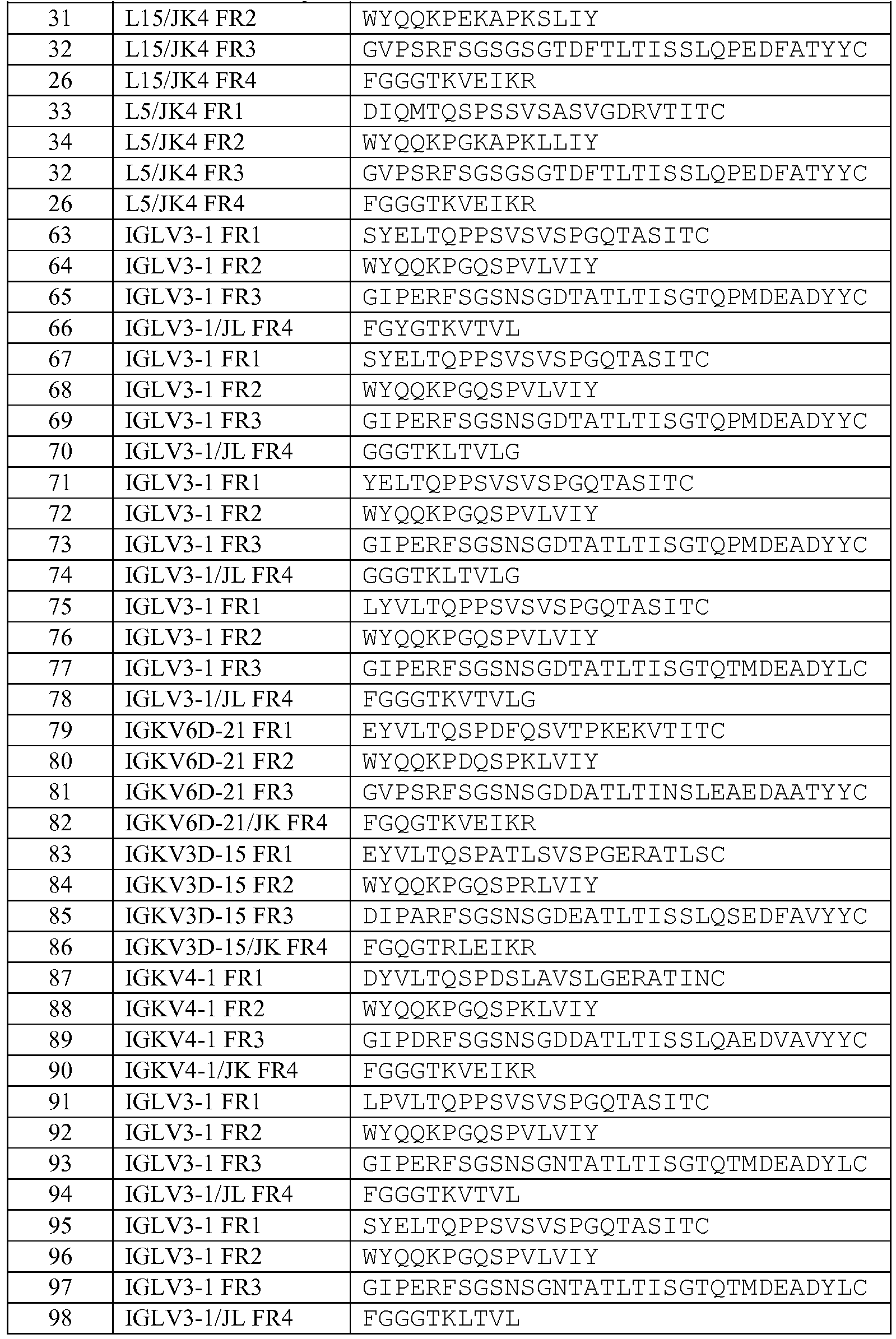
В другом варианте изобретения описанный выше связывающий белок также содержит человеческую акцепторную каркасную область. Предпочтительно, человеческая акцепторная каркасная область содержит аминокислотную последовательность, выбранную из группы, состоящей из:
последовательностей акцепторной каркасной области тяжелой цепи SEQ ID NO: 6-22,
акцепторных последовательностей тяжелой цепи SEQ ID NO: 35-62,
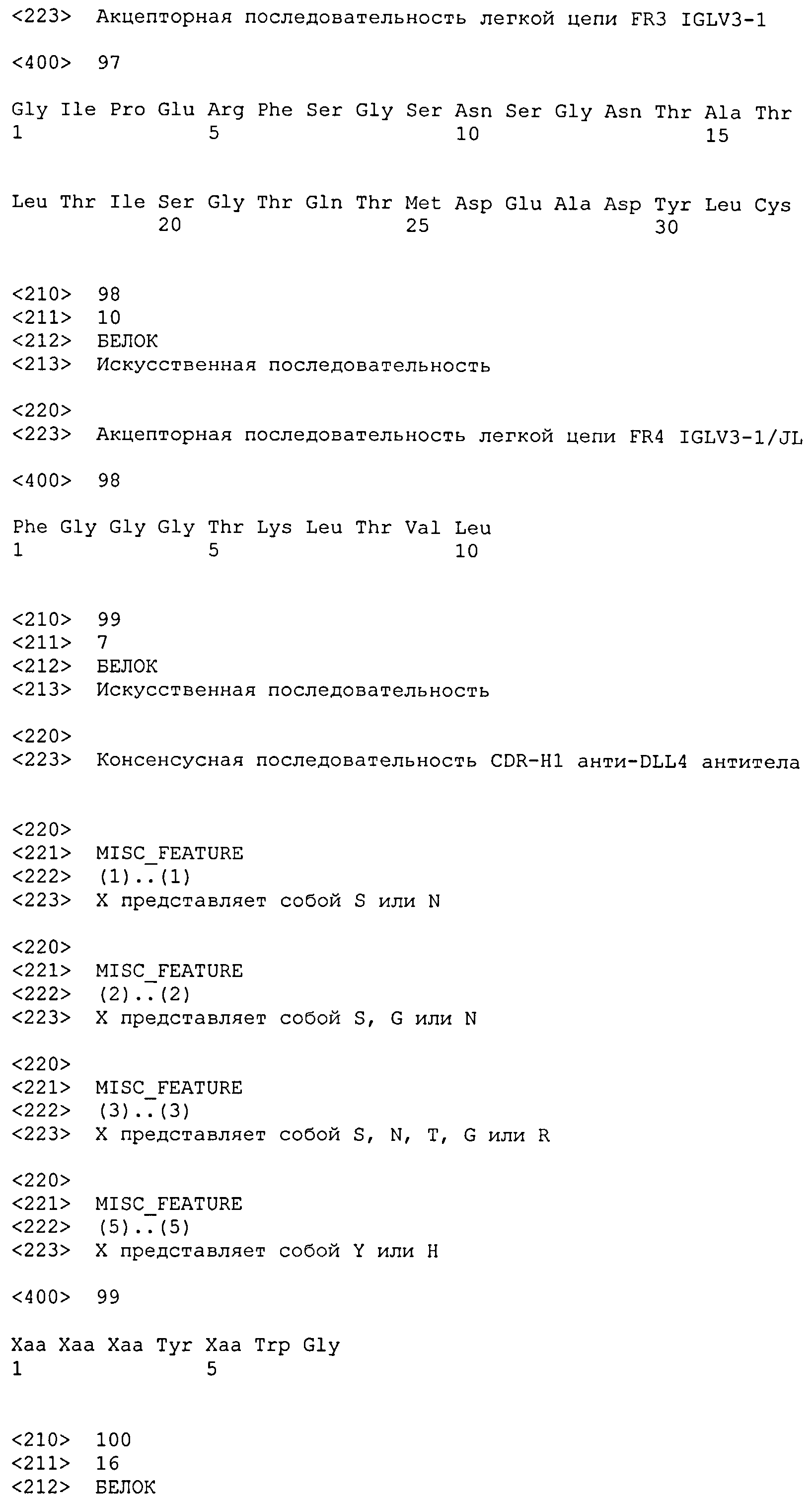
акцепторных последовательностей легкой цепи SEQ ID NO: 23-34, и
акцепторных последовательностей легкой цепи SEQ ID NO: 63-98.
В другом варианте изобретения вышеописанный связывающий белок содержит человеческую акцепторную каркасную область, которая включает по меньшей мере одну аминокислотную замену в каркасной области, где указанная аминокислотная последовательность каркасной области по меньшей мере на 65% идентична последовательности указанной человеческой акцепторной каркасной области и содержит по меньшей мере 70 аминокислотных остатков, идентичных остаткам указанной человеческой акцепторной каркасной области.
В другом варианте изобретения описанный здесь связывающий белок содержит человеческую акцепторную каркасную область, включающую по меньшей мере одну аминокислотную замену в каркасной области в положении ключевого остатка, где указанный ключевой остаток выбран из группы, состоящей из:
остатка, смежного с CDR;
остатка сайта гликозилирования;
редкого остатка;
остатка, способного взаимодействовать с человеческим DLL4;
канонического остатка;
остатка зоны контактирования вариабельной области тяжелой цепи с вариабельной областью легкой цепи;
остатка в зоне Верньера; и
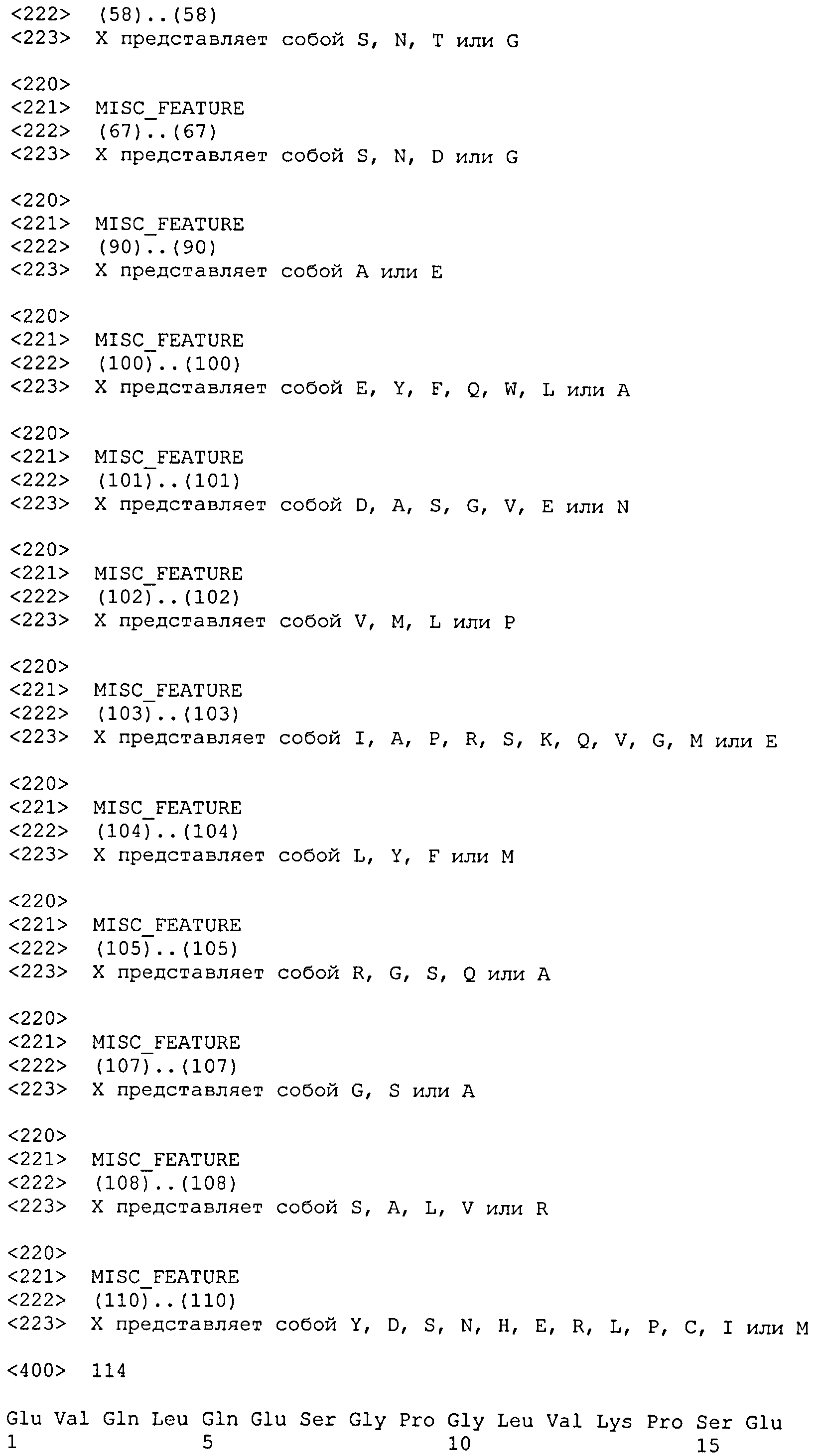
остатка в области, которая перекрывается с областью CDR1 вариабельной тяжелой цепи, определенной по Чотиа, и с первой каркасной областью тяжелой цепи, определенной по Кэбату. Предпочтительно, ключевой остаток выбран из группы, состоящей из: 2H, 4H, 24H, 26H, 27H, 29H, 34H, 35H, 37H, 39H, 44H, 45H, 47H, 48H, 49H, 50H, 51H, 58H, 59H, 60H, 63H, 67H, 69H, 71H, 73H, 76H, 78H, 91H, 93H, 94H, 2L, 4L, 25L, 29L, 27bL, 33L, 34L, 36L, 38L, 43L, 44L, 46L, 47L, 48L, 49L, 55L, 58L, 62L, 64L, 71L, 87L, 89L, 90L, 91L, 94L, 95L.
В другом варианте изобретения описанный здесь связывающий белок содержит консенсусный человеческий вариабельный домен.
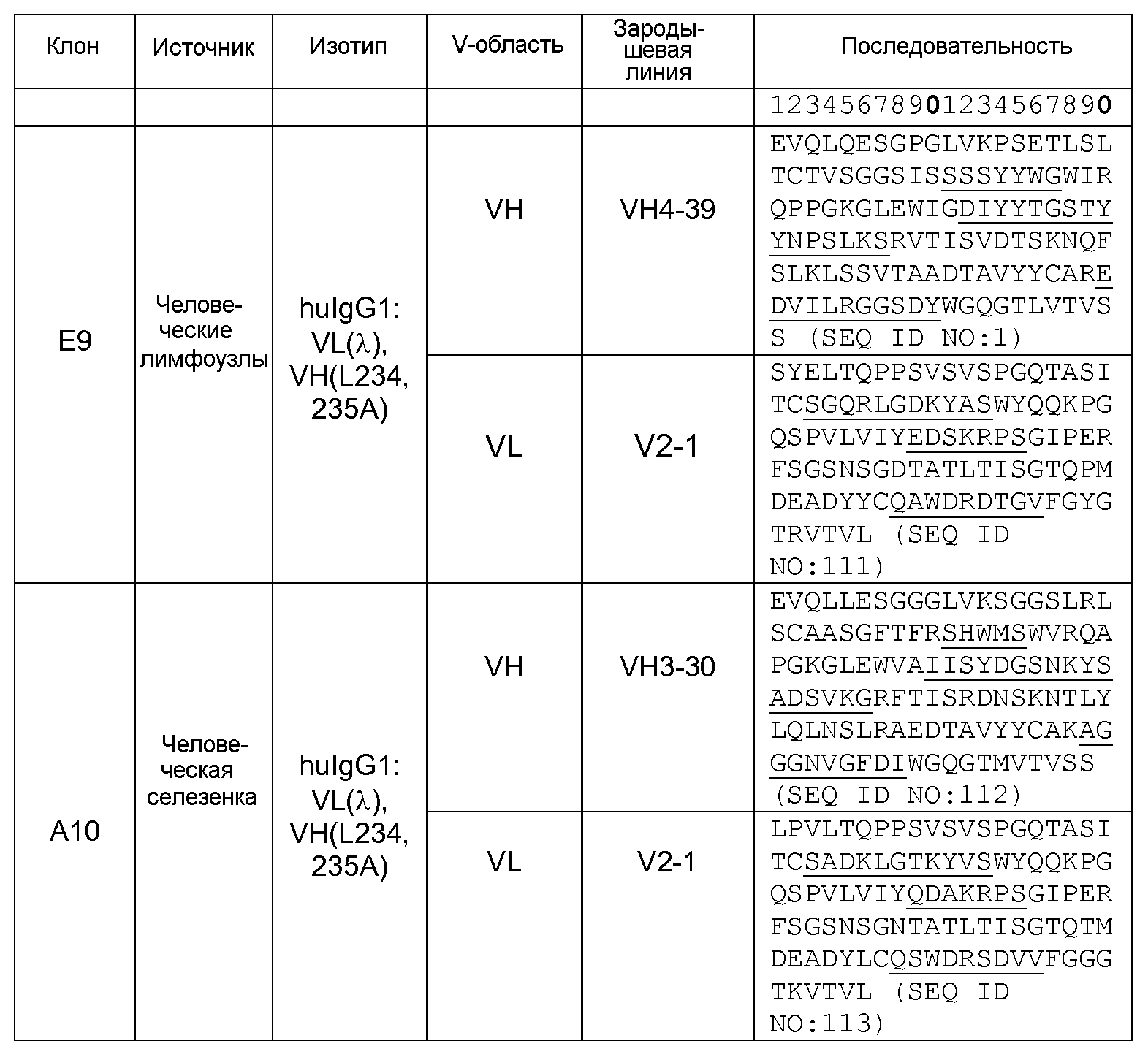
В предпочтительном варианте изобретения вышеописанный связывающий белок содержит по меньшей мере один вариабельный домен, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 1, 111, 116, 228, 120, 232, 124, 236, 128, 240, 132, 244, 136, 248, 140, 252, 144, 256, 148, 260, 152, 264, 156, 268, 160, 216, 164, 220, 168, 224, 172, 272, 176, 276, 180, 300, 184, 292, 188, 280, 192, 288, 196, 296, 200, 284, 204, 304, 208, 308, 212, 312, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360 и 361.
В другом варианте изобретения связывающий белок согласно изобретению содержит два вариабельных домена, где указанные два вариабельных домена имеют аминокислотные последовательности, выбранные из группы, состоящей из: SEQ ID NO: 1 и 111, SEQ ID NO: 116 и 228, SEQ ID NO: 120 и 232, SEQ ID NO: 124 и 236, SEQ ID NO: 128 и 240, SEQ ID NO: 132 и 244, SEQ ID NO: 136 и 248, SEQ ID NO: 140 и 252, SEQ ID NO: 144 и 256, SEQ ID NO: 148 и 260, SEQ ID NO: 152 и 264, SEQ ID NO: 156 и 268, SEQ ID NO: 160 и 216, SEQ ID NO: 164 и 220, SEQ ID NO: 168 и 224, SEQ ID NO: 172 и 272, SEQ ID NO: 176 и 276, SEQ ID NO: 180 и 300, SEQ ID NO: 184 и 292, SEQ ID NO: 188 и 280, SEQ ID NO: 192 и 288, SEQ ID NO: 196 и 296, SEQ ID NO: 200 и 284, SEQ ID NO: 204 и 304, SEQ ID NO: 208 и 308, SEQ ID NO: 212 и 312, SEQ ID NO: 334 и 335, SEQ ID NO: 336 и 337, SEQ ID NO: 338 и 339, SEQ ID NO: 340 и 341, SEQ ID NO: 342 и 343, SEQ ID NO: 344 и 345, SEQ ID NO: 346 и 347, SEQ ID NO: 348 и 349, SEQ ID NO: 350 и 351, SEQ ID NO: 352 и 353, SEQ ID NO: 354 и 355, SEQ ID NO: 356 и 357, SEQ ID NO: 358 и 359, SEQ ID NO: 360 и 361.
В одном из вариантов изобретения связывающий белок согласно изобретению содержит вариабельный домен тяжелой цепи (VH), где, предпочтительно, VH включает аминокислотную последовательность, выбранную из группы, состоящей из:
SEQ ID NO: 1, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 334, 336, 338, 340, 342, 344, 346, 348, 350, 352, 354, 356, 358 и 360.
В другом варианте изобретения связывающий белок согласно изобретению содержит вариабельный домен легкой цепи (VL), где, предпочтительно, VL включает аминокислотную последовательность, выбранную из группы, состоящей из:
SEQ ID NO: 111, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 216, 220, 224, 272, 276, 300, 292, 280, 288, 296, 284, 304, 308, 312, 335, 337, 339, 341, 343, 345, 347, 349, 351, 353, 355, 357, 359 и 361.
В предпочтительном варианте изобретения связывающий белок согласно изобретению содержит VH и VL, где, предпочтительно, VH и VL представляют собой любую из описанных выше последовательностей.
В другом варианте настоящее изобретение относится к связывающему белку, обладающему способностью связываться с человеческим DLL-4, где указанный связывающий белок содержит:
константную область тяжелой цепи Ig, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2 и SEQ ID NO: 3;
константную область легкой цепи Ig, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 4 и SEQ ID NO: 5;
вариабельную область тяжелой цепи Ig, имеющую аминокислотную последовательность, выбранную из группы, состоящей из:
SEQ ID NO: 1, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 334, 336, 338, 340, 342, 344, 346, 348, 350, 352, 354, 356, 358 и 360; и
вариабельную область легкой цепи Ig, имеющую аминокислотную последовательность, выбранную из группы, состоящей из:
SEQ ID NO: 111, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 216, 220, 224, 272, 276, 300, 292, 280, 288, 296, 284, 304, 308, 312, 335, 337, 339, 341, 343, 345, 347, 349, 351, 353, 355, 357, 359 и 361.
В другом аспекте настоящее изобретение относится к связывающему белку, содержащему антигенсвязывающий домен, обладающий способностью связываться с человеческим DLL4, где указанный антигенсвязывающий домен содержит по меньшей мере одну или несколько CDR, выбранных из группы, состоящей из:
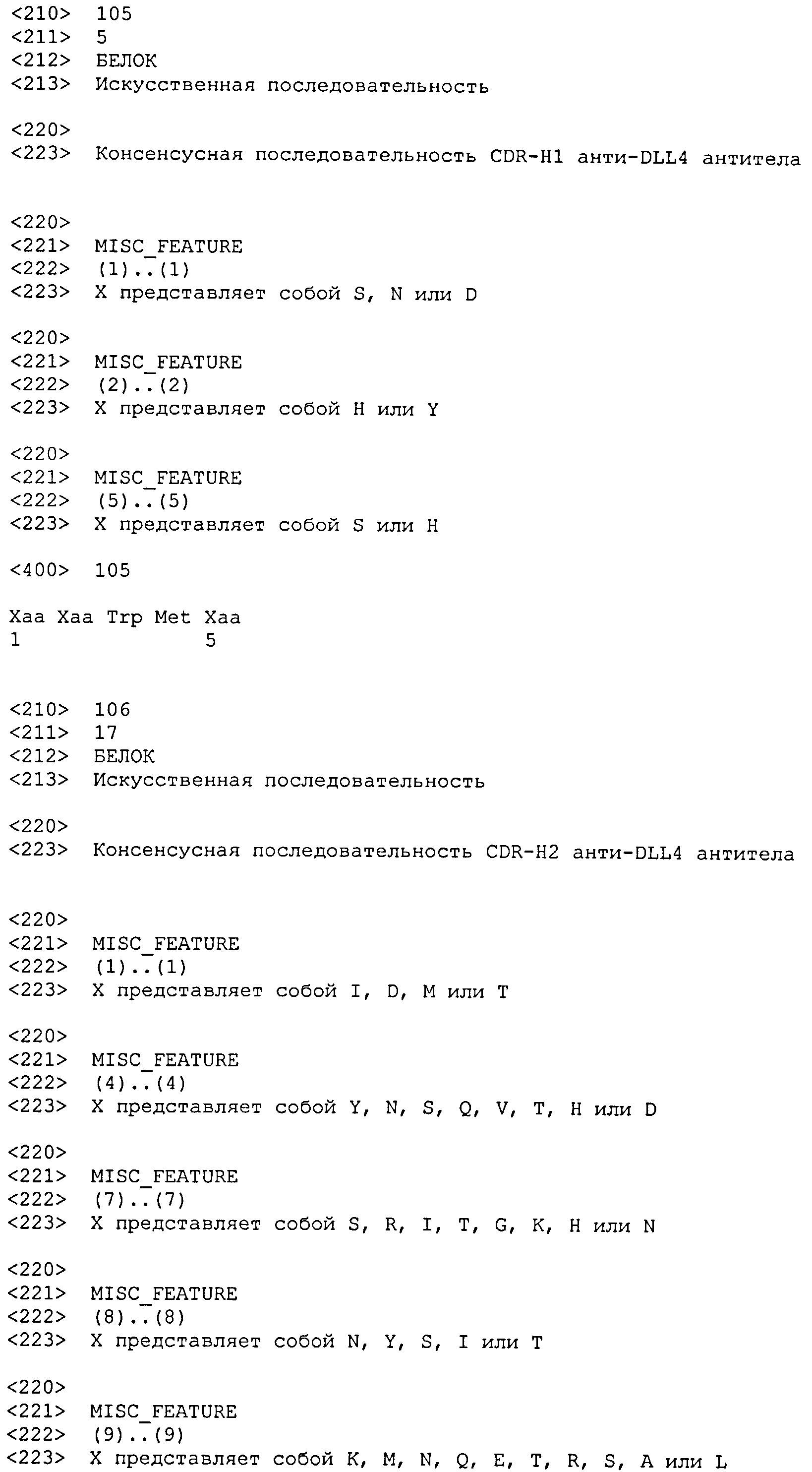
CDR-H1: X1-X2-X3-X4-Х5 (SEQ ID NO: 105), где
X1 представляет собой S, N или D;
X2 представляет собой H или Y;
X3 представляет собой W;
X4 представляет собой M;
X5 представляет собой S или H;
CDR-H2: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-Х17 (SEQ ID NO: 106), где:
X1 представляет собой I, D, M или Т;
X2 представляет собой I;
X3 представляет собой S;
X4 представляет собой Y, N, S, Q, V, T, H или D;
X5 представляет собой D;
X6 представляет собой G;
X7 представляет собой S, R, I, T, G, K, H или N;
X8 представляет собой N, Y, S, I или T;
X9 представляет собой K, M, N, Q, E, T, R, S, A или L;
X10 представляет собой Y, D или E;
X11 представляет собой S или Y;
X12 представляет собой А;
X13 представляет собой D;
X14 представляет собой S;
X15 представляет собой V;
X16 представляет собой К; и
X17 представляет собой G;
CDR-H3: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10 (SEQ ID NO: 107), где:
X1 представляет собой A;
X2 представляет собой G, А или R;
X3 представляет собой G;
X4 представляет собой G, S или А;
X5 представляет собой N;
X6 представляет собой V или М;
X7 представляет собой G;
X8 представляет собой F, L, Y или M;
X9 представляет собой D; и
X10 представляет собой I, S или L;
CDR-L1: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11 (SEQ ID NO: 108), где:
X1 представляет собой S;
X2 представляет собой А или G;
X3 представляет собой D;
X4 представляет собой K, N, L, Q, M, E, S, T, G или D;
X5 представляет собой L;
X6 представляет собой G;
X7 представляет собой T, S, N, A, G или E;
X8 представляет собой K, Q, N или R;
X9 представляет собой Y;
X10 представляет собой V или I; и
X11 представляет собой S;
CDR-L2: X1-X2-X3-X4-X5-X6-X7 (SEQ ID NO: 109), где:
X1 представляет собой Q;
X2 представляет собой D;
X3 представляет собой A, G, W, S или D;
X4 представляет собой K, M, Q, N, L, T, I или E;
X5 представляет собой R;
X6 представляет собой P; и
X7 представляет собой S; и
CDR-L3: X1-X2-X3-X4-X5-X6-X7-X8-X9 (SEQ ID NO: 110), где:
X1 представляет собой Q;
X2 представляет собой S или A;
X3 представляет собой W;
X4 представляет собой D;
X5 представляет собой R, S, Q, P, A, V, W или M;
X6 представляет собой S, G, I, N, R или T;
X7 представляет собой D или G;
X8 представляет собой V, A, P или E; и
X9 представляет собой V.
Предпочтительно, антигенсвязывающий домен DLL4-связывающего белка согласно изобретению содержит по меньшей мере одну CDR, содержащую аминокислотную последовательность, выбранную из группы, состоящей из:
остатков 31-35 SEQ ID NO: 112 (CDR-H1); остатков 50-66 SEQ ID NO: 112 (CDR-H2); остатков 99-108 SEQ ID NO: 112 (CDR-H3);
остатков 23-33 SEQ ID NO: 113 (CDR-L1); остатков 49-55 SEQ ID NO: 113 (CDR-L2); остатков 88-96 SEQ ID NO: 113 (CDR-L3);
остатков 31-35 SEQ ID NO: 316 (CDR-H1); остатков 50-66 SEQ ID NO: 316 (CDR-H2); остатков 99-108 SEQ ID NO: 316 (CDR-H3);
остатков 31-35 SEQ ID NO: 317 (CDR-H1); остатков 50-66 SEQ ID NO: 317 (CDR-H2); остатков 99-108 SEQ ID NO: 317 (CDR-H3);
остатков 31-35 SEQ ID NO: 318 (CDR-H1); остатков 50-66 SEQ ID NO: 318 (CDR-H2); остатков 99-108 SEQ ID NO: 318 (CDR-H3);
остатков 31-35 SEQ ID NO: 319 (CDR-H1); остатков 50-66 SEQ ID NO: 319 (CDR-H2); остатков 99-108 SEQ ID NO: 319 (CDR-H3);
остатков 31-35 SEQ ID NO: 320 (CDR-H1); остатков 50-66 SEQ ID NO: 320 (CDR-H2); остатков 99-108 SEQ ID NO: 320 (CDR-H3);
остатков 31-35 SEQ ID NO: 321 (CDR-H1); остатков 50-66 SEQ ID NO: 321 (CDR-H2); остатков 99-108 SEQ ID NO: 321 (CDR-H3);
остатков 31-35 SEQ ID NO: 322 (CDR-H1); остатков 50-66 SEQ ID NO: 322 (CDR-H2); остатков 99-108 SEQ ID NO: 322 (CDR-H3);
остатков 31-35 SEQ ID NO: 323 (CDR-H1); остатков 50-66 SEQ ID NO: 323 (CDR-H2); остатков 99-108 SEQ ID NO: 323 (CDR-H3);
остатков 31-35 SEQ ID NO: 324 (CDR-H1); остатков 50-66 SEQ ID NO: 324 (CDR-H2); остатков 99-108 SEQ ID NO: 324 (CDR-H3);
остатков 31-35 SEQ ID NO: 325 (CDR-H1); остатков 50-66 SEQ ID NO: 325 (CDR-H2); остатков 99-108 SEQ ID NO: 325 (CDR-H3);
остатков 31-35 SEQ ID NO: 326 (CDR-H1); остатков 50-66 SEQ ID NO: 326 (CDR-H2); остатков 99-108 SEQ ID NO: 326 (CDR-H3);
остатков 23-33 SEQ ID NO: 327 (CDR-L1); остатков 49-55 SEQ ID NO: 327 (CDR-L2); остатков 88-96 SEQ ID NO: 327 (CDR-L3);
остатков 23-33 SEQ ID NO: 328 (CDR-L1); остатков 49-55 SEQ ID NO: 328 (CDR-L2); остатков 88-96 SEQ ID NO: 328 (CDR-L3);
остатков 23-33 SEQ ID NO: 329 (CDR-L1); остатков 49-55 SEQ ID NO: 329 (CDR-L2); остатков 88-96 SEQ ID NO: 329 (CDR-L3);
остатков 23-33 SEQ ID NO: 330 (CDR-L1); остатков 49-55 SEQ ID NO: 330 (CDR-L2); остатков 88-96 SEQ ID NO: 330 (CDR-L3);
остатков 23-33 SEQ ID NO: 331 (CDR-L1); остатков 49-55 SEQ ID NO: 331 (CDR-L2); остатков 88-96 SEQ ID NO: 331 (CDR-L3);
остатков 23-33 SEQ ID NO: 332 (CDR-L1); остатков 49-55 SEQ ID NO: 332 (CDR-L2); остатков 88-96 SEQ ID NO: 332 (CDR-L3);
остатков 23-33 SEQ ID NO: 333 (CDR-L1); остатков 49-55 SEQ ID NO: 333 (CDR-L2); остатков 88-96 SEQ ID NO: 333 (CDR-L3).
В другом варианте изобретения связывающий белок содержит по меньшей мере 3 CDR, описанных выше.
Предпочтительно, DLL4-связывающий белок согласно изобретению содержит одну или несколько описанных выше CDR. Более предпочтительно, указанный связывающий белок содержит три или более CDR, описанных выше. Наиболее предпочтительно, DLL4-связывающий белок согласно изобретению содержит шесть CDR, описанных выше, то есть CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 и CDR-L3, описанные выше.
В предпочтительном варианте изобретения связывающий белок содержит по меньшей мере 3 CDR, выбранных из группы, состоящей из описанных выше последовательностей.
В другом предпочтительном варианте изобретения, связывающий белок содержит 3 CDR, выбранных из набора CDR вариабельного домена, выбранного из нижеследующей группы:
набор VH A10 CDR
CDR-H1: остатки 31-35 SEQ ID NO: 112
CDR-H2: остатки 50-66 SEQ ID NO: 112
CDR-H3: остатки 99-108 SEQ ID NO: 112
набор VL A10 CDR
CDR-L1: остатки 23-33 SEQ ID NO: 113
CDR-L2: остатки 49-55 SEQ ID NO: 113
CDR-L3: остатки 88-96 SEQ ID NO: 113
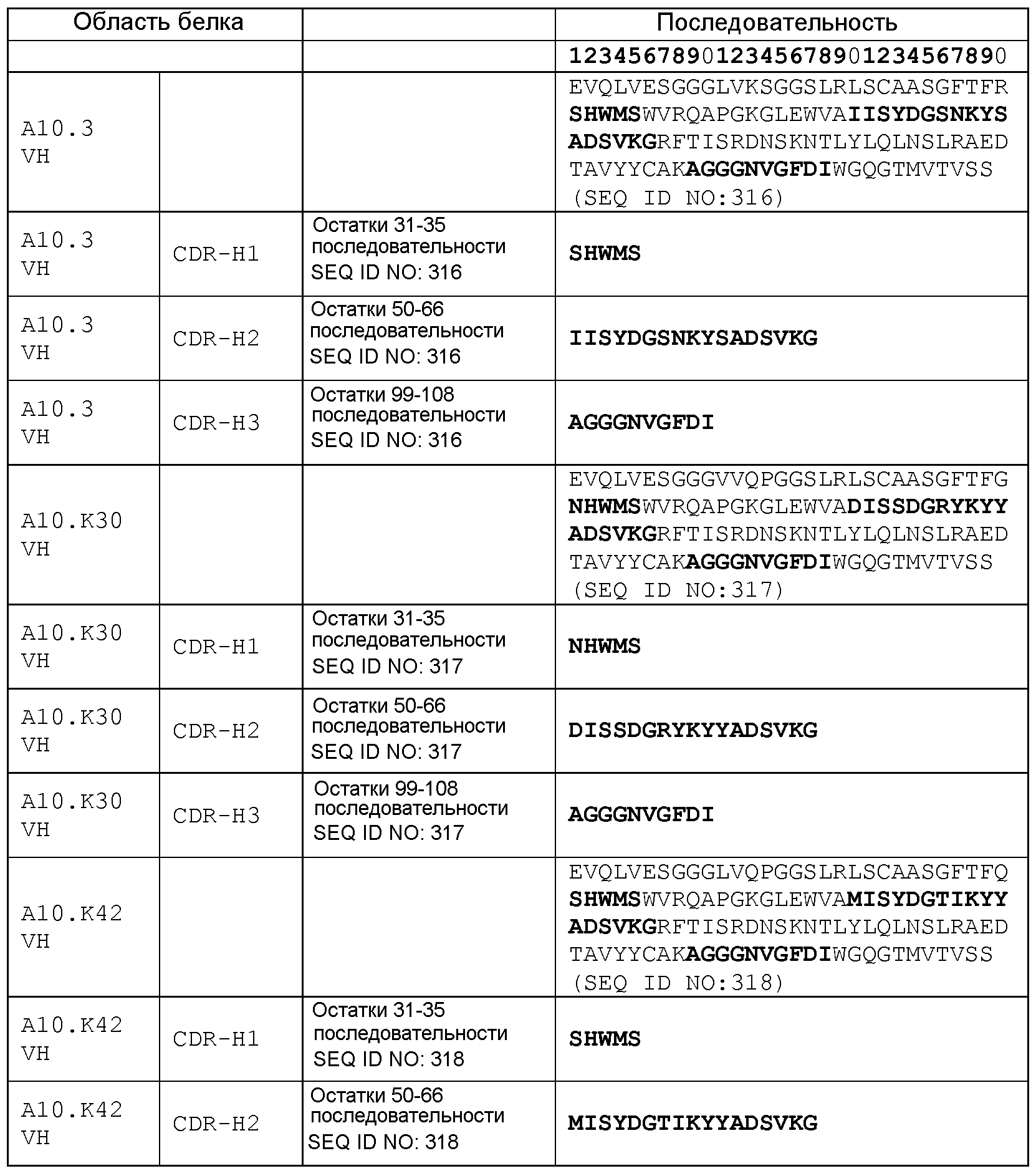
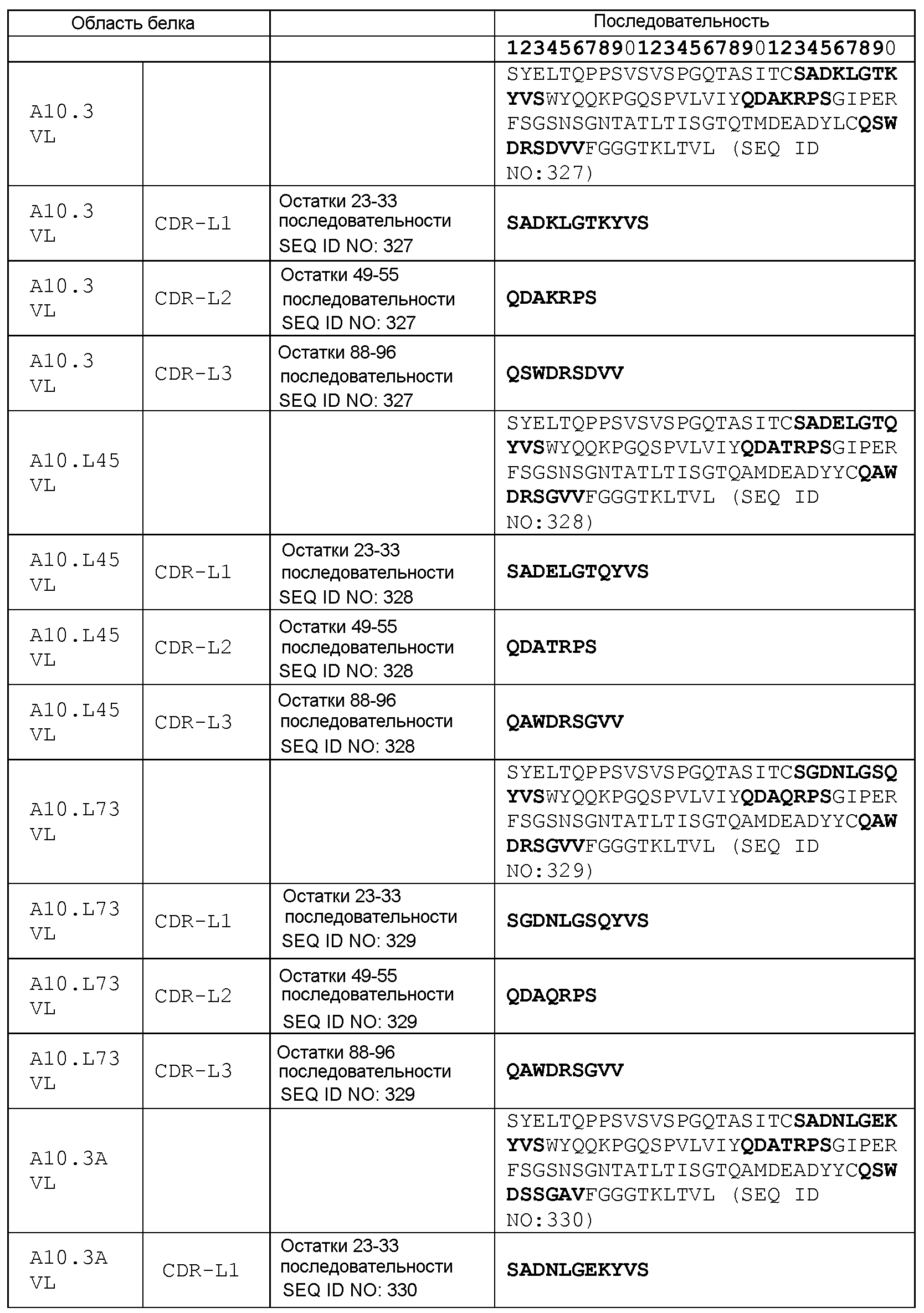
набор VH A10.3 CDR
CDR-H1: остатки 31-35 SEQ ID NO: 316
CDR-H2: остатки 50-66 SEQ ID NO: 316
CDR-H3: остатки 99-108 SEQ ID NO: 316
набор VL A10.3 CDR
CDR-L1: остатки 23-33 SEQ ID NO: 327
CDR-L2: остатки 49-55 SEQ ID NO: 327
CDR-L3: остатки 88-96 SEQ ID NO: 327
набор VH A10.К30 CDR
CDR-H1: остатки 31-35 SEQ ID NO: 317
CDR-H2: остатки 50-66 SEQ ID NO: 317
CDR-H3: остатки 99-108 SEQ ID NO: 317
набор VH A10.К42 CDR
CDR-H1: остатки 31-35 SEQ ID NO: 318
CDR-H2: остатки 50-66 SEQ ID NO: 318
CDR-H3: остатки 99-108 SEQ ID NO: 318
набор VH A10.9А CDR
CDR-H1: остатки 31-35 SEQ ID NO: 319
CDR-H2: остатки 50-66 SEQ ID NO: 319
CDR-H3: остатки 99-108 SEQ ID NO: 319
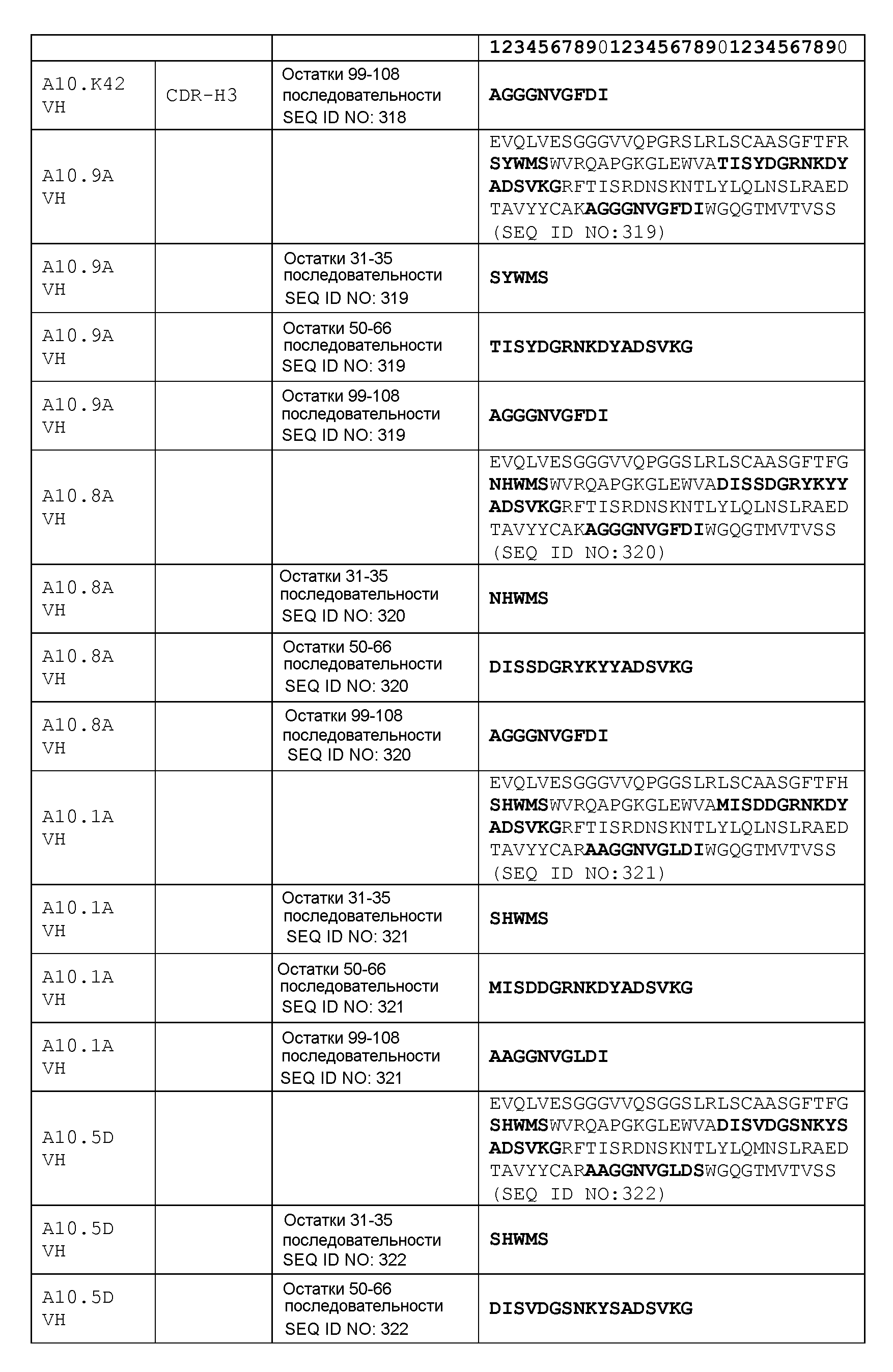
набор VH A10.8А CDR
CDR-H1: остатки 31-35 SEQ ID NO: 320
CDR-H2: остатки 50-66 SEQ ID NO: 320
CDR-H3: остатки 99-108 SEQ ID NO: 320
набор VH A10.1А CDR
CDR-H1: остатки 31-35 SEQ ID NO: 321
CDR-H2: остатки 50-66 SEQ ID NO: 321
CDR-H3: остатки 99-108 SEQ ID NO: 321
набор VH A10.5D CDR
CDR-H1: остатки 31-35 SEQ ID NO: 322
CDR-H2: остатки 50-66 SEQ ID NO: 322
CDR-H3: остатки 99-108 SEQ ID NO: 322
набор VH A10.3А CDR
CDR-H1: остатки 31-35 SEQ ID NO: 323
CDR-H2: остатки 50-66 SEQ ID NO: 323
CDR-H3: остатки 99-108 SEQ ID NO: 323
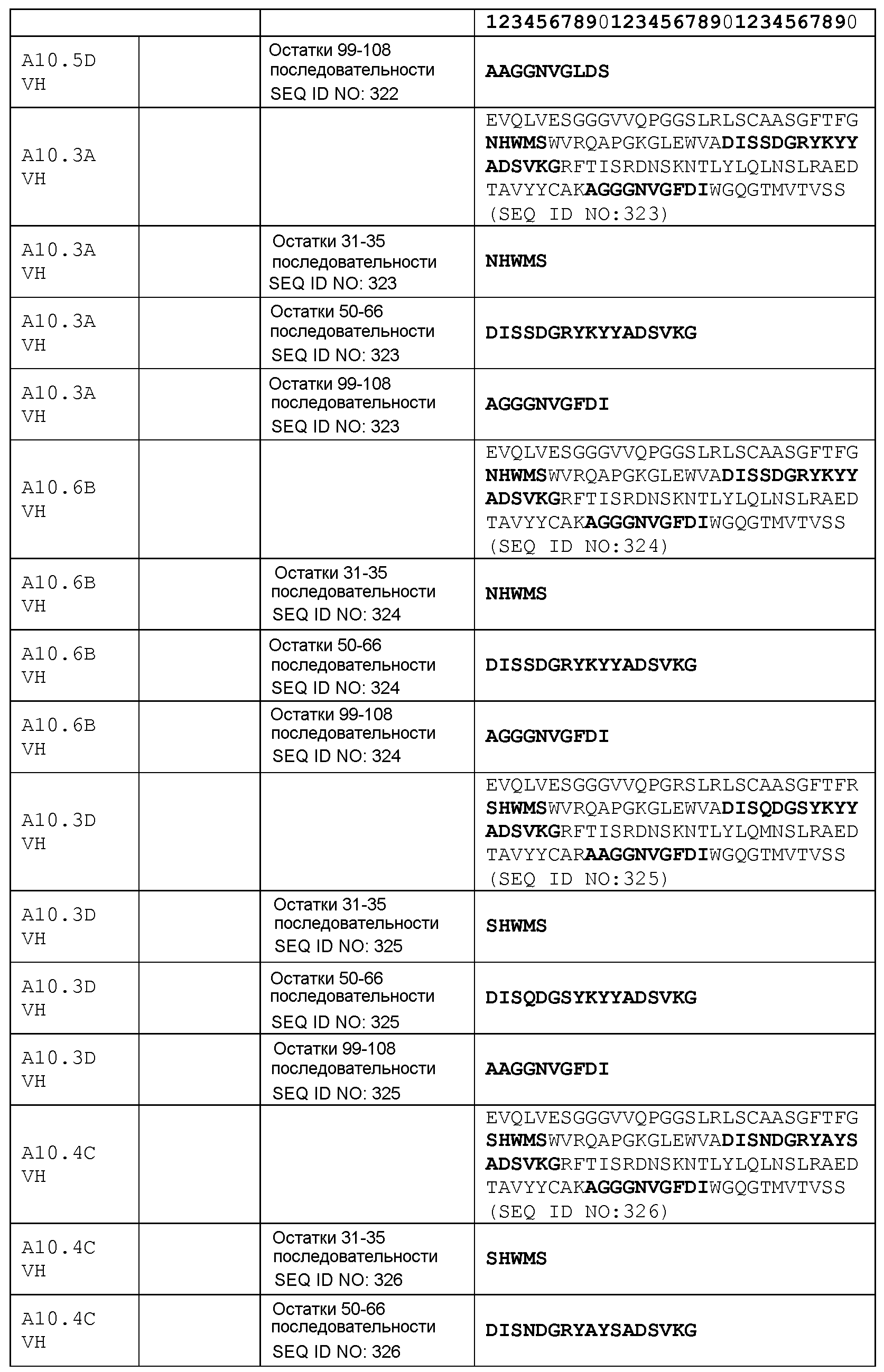
набор VL A10.3А CDR
CDR-L1: остатки 23-33 SEQ ID NO: 330
CDR-L2: остатки 49-55 SEQ ID NO: 330
CDR-L3: остатки 88-96 SEQ ID NO: 330
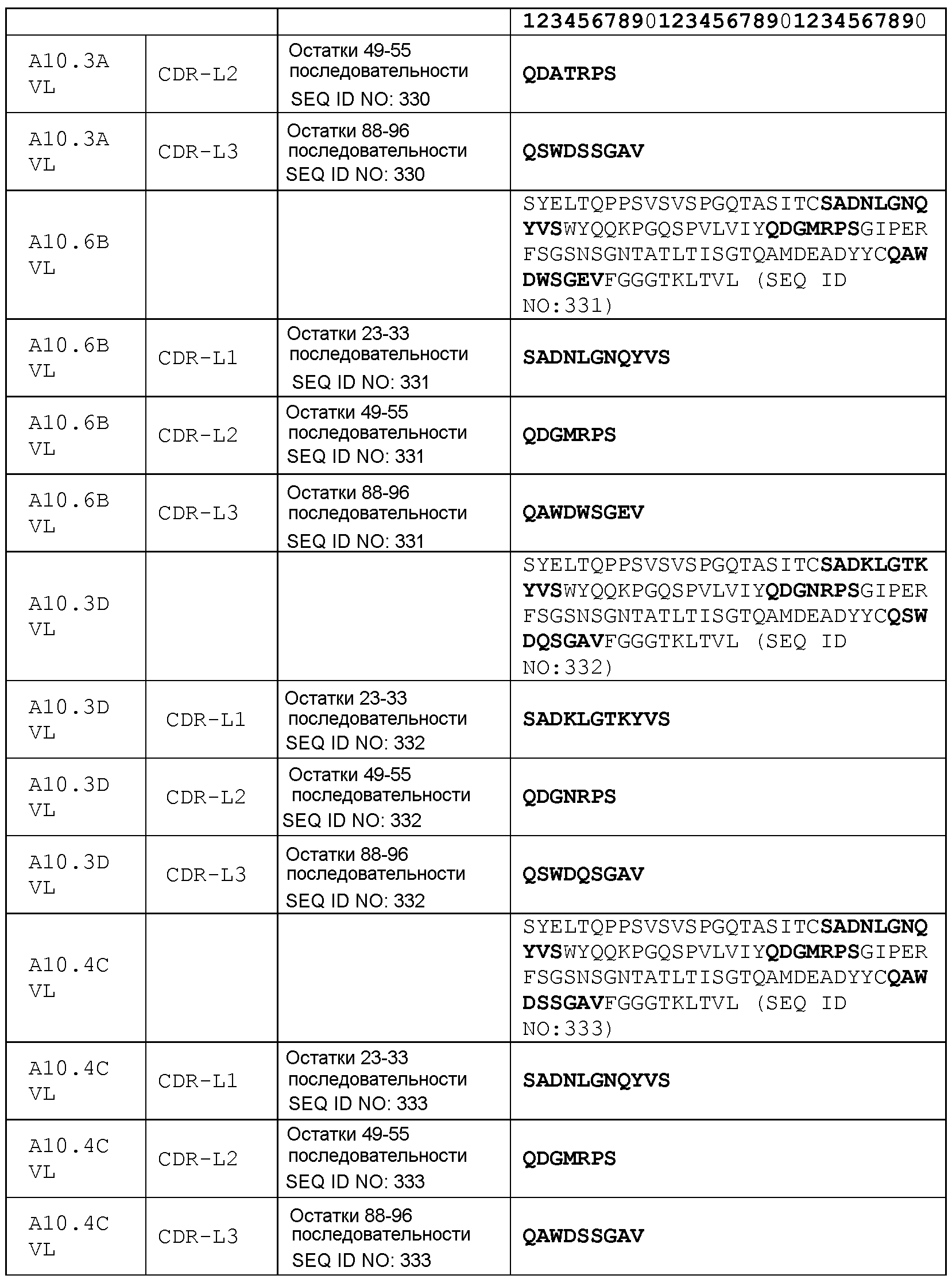
набор VH A10.6В CDR
CDR-H1: остатки 31-35 SEQ ID NO: 324
CDR-H2: остатки 50-66 SEQ ID NO: 324
CDR-H3: остатки 99-108 SEQ ID NO: 324
набор VL A10.6В CDR
CDR-L1: остатки 23-33 SEQ ID NO: 331
CDR-L2: остатки 49-55 SEQ ID NO: 331
CDR-L3: остатки 88-96 SEQ ID NO: 331
набор VH A10.3D CDR
CDR-H1: остатки 31-35 SEQ ID NO: 325
CDR-H2: остатки 50-66 SEQ ID NO: 325
CDR-H3: остатки 99-108 SEQ ID NO: 325
набор VL A10.3D CDR
CDR-L1: остатки 23-33 SEQ ID NO: 332
CDR-L2: остатки 49-55 SEQ ID NO: 332
CDR-L3: остатки 88-96 SEQ ID NO: 332
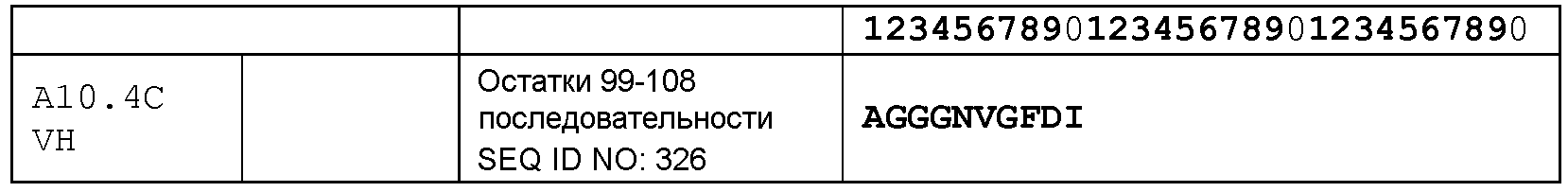
набор VH A10.4С CDR
CDR-H1: остатки 31-35 SEQ ID NO: 326
CDR-H2: остатки 50-66 SEQ ID NO: 326
CDR-H3: остатки 99-108 SEQ ID NO: 326
набор VL A10.4С CDR
CDR-L1: остатки 23-33 SEQ ID NO: 333
CDR-L2: остатки 49-55 SEQ ID NO: 333
CDR-L3: остатки 88-96 SEQ ID NO: 333
набор VL A10.L45 CDR
CDR-L1: остатки 23-33 SEQ ID NO: 328
CDR-L2: остатки 49-55 SEQ ID NO: 328
CDR-L3: остатки 88-96 SEQ ID NO: 328
набор VL A10.L73 CDR
CDR-L1: остатки 23-33 SEQ ID NO: 329
CDR-L2: остатки 49-55 SEQ ID NO: 329
CDR-L3: остатки 88-96 SEQ ID NO: 329.
В другом варианте изобретения связывающий белок содержит набор из 3 CDR вариабельных тяжелых цепей (VH), выбранных из любого набора из 3 CDR VH в вышеуказанной группе, и набор из 3 CDR вариабельных легких цепей (VL), выбранных из любого набора из 3 CDR VL в вышеуказанной группе.
В другом варианте изобретения связывающий белок содержит набор из 3 CDR цепей, обозначенных VH, и набор из 3 CDR цепей, соответственно обозначенных VL в вышеуказанной группе. Предпочтительно, связывающий белок согласно изобретению содержит по меньшей мере два набора CDR вариабельных доменов, выбранные из группы наборов CDR вариабельных доменов, состоящей из:
набора VH A10 CDR и набора VL A10 CDR;
набора VH A10.3 CDR и набора VL A10.3 CDR:
набора VH A10.3A CDR и набора VL A10.3A;
набора VH A10.6B CDR и набора VL A10.6B;
набора VH A10.3D CDR и набора VL A10.3D CDR;
набора VH A10.4C CDR и набора VL A10.4C CDR;
набора VH A10.K30 CDR и набора VL A10.3 CDR;
набора VH A10.K42 CDR и набора VL A10.3 CDR;
набора VH A10.3 CDR и набора VL A10.L45 CDR;
набора VH A10.3 CDR и набора VL A10.L73 CDR;
набора VH A10.9A CDR и набора VL A10.3 CDR;
набора VH A10.8A CDR и набора VL A10.3 CDR;
набора VH A10.1A CDR и набора VL A10.3 CDR; и
набора VH A10.5D CDR и набора VL A10.3 CDR.
В другом варианте изобретения описанный выше связывающий белок также содержит человеческую акцепторную каркасную область. Предпочтительно, человеческая акцепторная каркасная область содержит аминокислотную последовательность, выбранную из группы, состоящей из:
последовательностей акцепторной каркасной области тяжелой цепи SEQ ID NO: 6-22,
акцепторных последовательностей тяжелой цепи SEQ ID NO: 35-62,
акцепторных последовательностей легкой цепи SEQ ID NO: 23-34 и
акцепторных последовательностей легкой цепи SEQ ID NO: 63-98.
В другом варианте изобретения вышеописанный связывающий белок содержит человеческую акцепторную каркасную область, которая включает по меньшей мере одну аминокислотную замену в каркасной области, где указанная аминокислотная последовательность каркасной области по меньшей мере на 65% идентична последовательности указанной человеческой акцепторной каркасной области и содержит по меньшей мере 70 аминокислотных остатков, идентичных остаткам указанной человеческой акцепторной каркасной области.
В другом варианте изобретения описанный здесь связывающий белок содержит человеческую акцепторную каркасную область, включающую по меньшей мере одну аминокислотную замену в каркасной области в положении ключевого остатка, где указанный ключевой остаток выбран из группы, состоящей из:
остатка, смежного с CDR;
остатка сайта гликозилирования;
редкого остатка;
остатка, способного взаимодействовать с человеческим DLL4;
канонического остатка;
остатка зоны контактирования вариабельной области тяжелой цепи с вариабельной областью легкой цепи;
остатка в зоне Верньера; и
остатка в области, которая перекрывается с областью CDR1 вариабельной тяжелой цепи, определенной по Чотиа, и с первой каркасной областью тяжелой цепи, определенной по Кэбату. Предпочтительно, ключевой остаток выбран из группы, состоящей из: 2H, 4H, 24H, 26H, 27H, 29H, 34H, 35H, 37H, 39H, 44H, 45H, 47H, 48H, 49H, 50H, 51H, 58H, 59H, 60H, 63H, 67H, 69H, 71H, 73H, 76H, 78H, 91H, 93H, 94H, 2L, 4L, 25L, 29L, 27bL, 33L, 34L, 36L, 38L, 43L, 44L, 46L, 47L, 48L, 49L, 55L, 58L, 62L, 64L, 71L, 87L, 89L, 90L, 91L, 94L, 95L.
В другом варианте изобретения описанный здесь связывающий белок содержит консенсусный человеческий вариабельный домен.
В предпочтительном варианте изобретения вышеописанный связывающий белок содержит по меньшей мере один вариабельный домен, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 112, 113, 316, 327, 317, 318, 319, 320, 321, 322, 323, 330, 324, 331, 325, 332, 326, 333, 328 и 329.
В другом варианте изобретения вышеописанный связывающий белок содержит два вариабельных домена, где указанные два вариабельных домена имеют аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 112 и 113, SEQ ID NO: 316 и 327, SEQ ID NO: 323 и 330, SEQ ID NO: 324 и 331, SEQ ID NO: 325 и 332 и SEQ ID NO: 326 и 333.
В одном из вариантов изобретения связывающий белок согласно изобретению содержит вариабельный домен тяжелой цепи (VH), где, предпочтительно, VH включает аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 112, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325 и 326.
В другом варианте изобретения связывающий белок согласно изобретению содержит вариабельный домен легкой цепи (VL), где, предпочтительно, VL включает аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 113, 327, 328, 329, 330, 331, 332 и 333.
В другом варианте настоящее изобретение относится к связывающемуся белку, обладающему способностью связываться с человеческим DLL-4, где указанный связывающий белок содержит:
константную область тяжелой цепи Ig, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2 и SEQ ID NO: 3;
константную область легкой цепи Ig, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 4 и SEQ ID NO: 5;
вариабельную область тяжелой цепи Ig, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 112, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325 и 326; и
вариабельную область легкой цепи Ig, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 113, 327, 328, 329, 330, 331, 332 и 333.
В соответствии с настоящим изобретением вариабельные домены тяжелой цепи (VH) и вариабельные домены легкой цепи (VL) DLL4-связывающих белков, описанных в настоящей заявке, могут быть также подвергнуты процедуре перестановки цепей рекомбинантными методами, известными специалистам, в целях получения и отбора дополнительных DLL4-связывающих белков, содержащих различные комбинации описанных здесь доменов VH и VL.
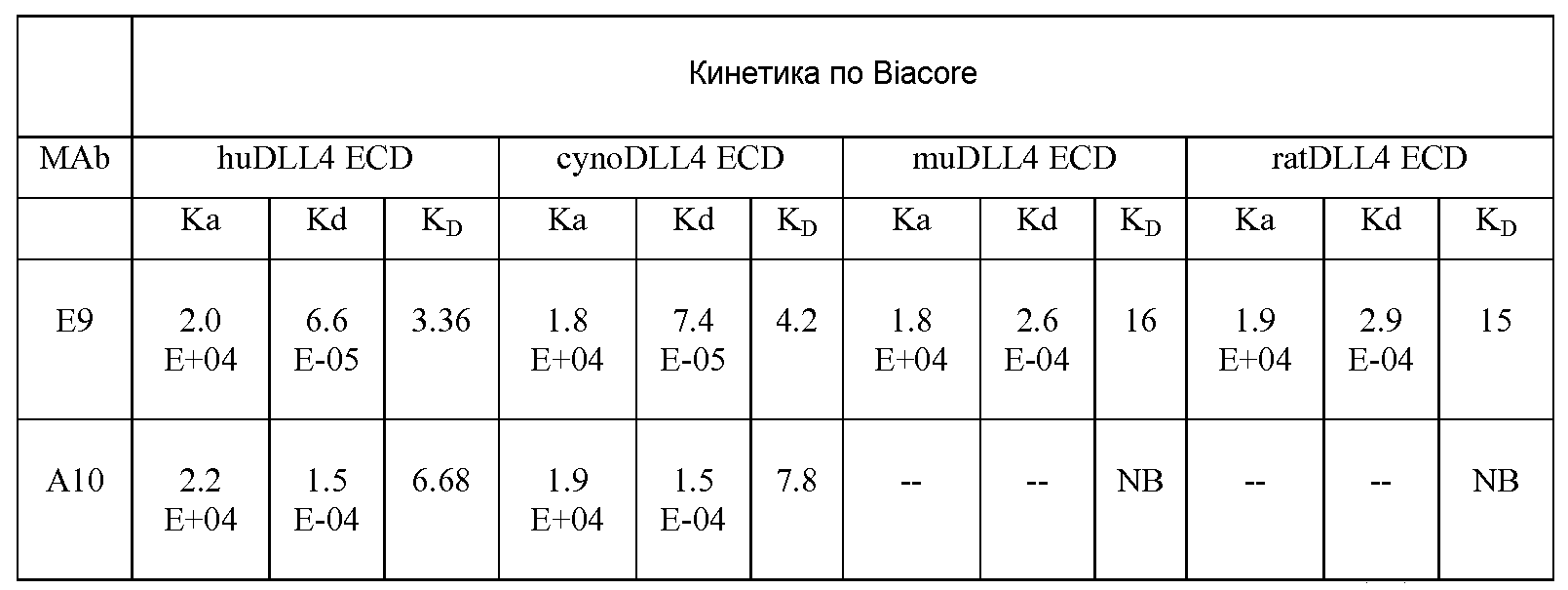
В предпочтительном варианте изобретения DLL4-связывающий белок согласно изобретению связывается с человеческим DLL4 (huDLL4) и по меньшей мере с одним DLL4 другого вида. Более предпочтительно, описанный здесь DLL4-связывающий белок связывается с человеческим DLL4 и DLL4, выбранным из группы, состоящей из мышиного DLL4 (muDLL4), DLL4 яванского макака (DLL4 яванского макака, cyno DLL4), крысиного DLL4 и их комбинаций.
В другом варианте изобретения DLL4-связывающим белком является полностью человеческое антитело или его антигенсвязывающая часть.
В другом варианте изобретения DLL4-связывающим белком является CDR-привитое антитело. Более предпочтительно, DLL4-связывающий белок представляет собой CDR-привитое антитело или его антигенсвязывающую часть, содержащие одну или несколько описанных выше CDR.
Еще более предпочтительно, CDR-привитое антитело или его антигенсвязывающая часть содержат описанный выше вариабельный домен. Более предпочтительно, CDR-привитое антитело или его антигенсвязывающая часть содержат два вышеописанных вариабельных домена. Предпочтительно, CDR-привитое антитело или его антигенсвязывающая часть содержат человеческую акцепторную каркасную область. Более предпочтительно, указанной человеческой акцепторной каркасной областью является любая из вышеописанных человеческих акцепторных каркасных областей.
Более предпочтительно, связывающий белок обладает способностью нейтрализовать активность DLL4, выбранного из группы, состоящей из человеческого DLL4, мышиного DLL4, DLL4 яванского макака, крысиного DLL4 и их комбинаций. Оценка нейтрализации активности DLL4 может быть проведена с помощью нескольких in vitro и in vivo анализов, известных специалистам. Репрезентативными параметрами для оценки нейтрализации активности DLL4 являются, но не ограничиваются ими, антитела, которые ингибируют взаимодействие DLL4 с рецептором Notch и/или путь передачи Notch-сигнала при величинах IC50, составляющих примерно по меньшей мере 10-6 М; по меньшей мере 10-7 М; или по меньшей мере 10-8 М.
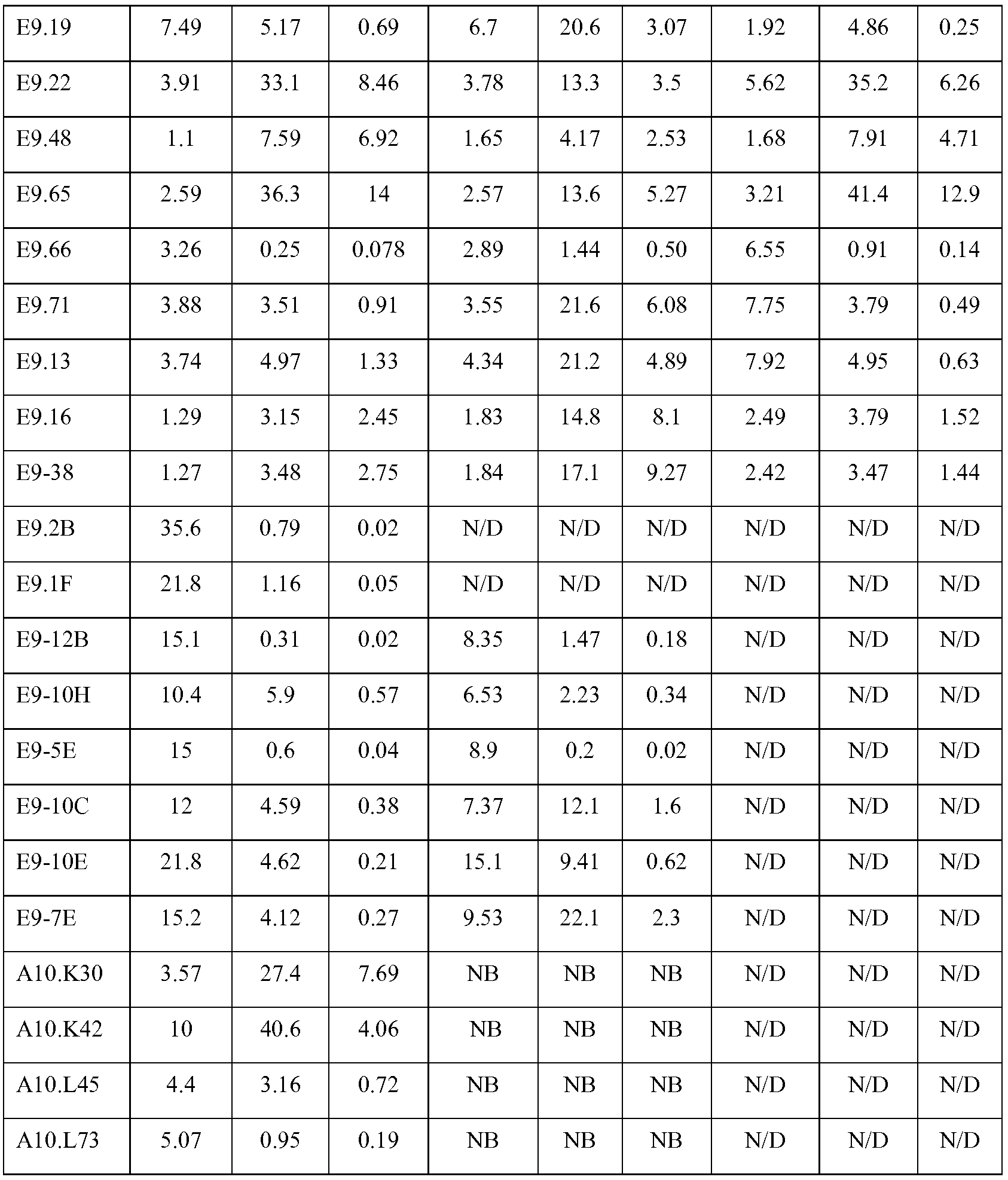
В одном из вариантов изобретения связывающий белок согласно изобретению имеет константу скорости ассоциации (Kon) по отношению к DLL4, составляющую по меньшей мере примерно 102 M-1c-1; по меньшей мере примерно 103 M-1c-1; по меньшей мере примерно 104 M-1c-1; по меньшей мере примерно 105 M-1c-1; или по меньшей мере примерно 106 M-1c-1, как было измерено методом поверхностного плазмонного резонанса. Предпочтительно, связывающий белок согласно изобретению имеет константу скорости ассоциации (Kon) по отношению к DLL4, составляющую в пределах 102 M-1c-1 - 103 M-1c-1; 103 M-1c-1 - 104 M-1c-1; 104 M-1c-1 - 105 M-1c-1; или 105 M-1c-1 - 106 M-1c-1, как было измерено методом поверхностного плазмонного резонанса.
В другом варианте изобретения, связывающий белок согласно изобретению имеет константу скорости диссоциации (Koff) по отношению к DLL4, составляющую примерно максимум 10-3 c-1; примерно максимум 10-4 c-1; примерно максимум 10-5 c-1 или примерно максимум 10-6 c-1, как было измерено методом поверхностного плазмонного резонанса. Предпочтительно, связывающий белок согласно изобретению имеет константу скорости диссоциации (Koff) по отношению к DLL4, составляющую в пределах 10-3 c-1 - 10-4 c-1; 10-4 c-1 - 10-5 c-1; или 10-5 c-1 - 10-6 c-1, как было измерено методом поверхностного плазмонного резонанса.
В другом варианте изобретения, связывающий белок согласно изобретению имеет константу диссоциации (KD) по отношению к DLL4, составляющую примерно максимум 10-7 M; примерно максимум 10-8 M; примерно максимум 10-9 M; примерно максимум 10-10 M; примерно максимум 10-11 M; примерно максимум 10-12 M; и максимум 10-13 M. Предпочтительно, связывающий белок согласно изобретению имеет константу диссоциации (KD) по отношению к DLL4, составляющую 10-7 M - 10-8 M; 10-8 M - 10-9 M; 10-9 M - 10-10 M; 10-10 - 10-11 M; 10-11 M - 10-12 M или 10-12M - 10-13 M.
В одном из вариантов настоящее изобретение относится к конструкции антитела, включающей любой из вышеописанных DLL4-связывающих белков и полипептидный линкер или константный домен иммуноглобулина. В предпочтительном варианте изобретения конструкцию антитела согласно изобретению выбирают из группы, состоящей из молекулы иммуноглобулина, моноклонального антитела, химерного антитела, CDR-привитого антитела, гуманизированного антитела, Fab, Fab', F(ab')2, Fv, Fv, связанного дисульфидной связью, scFv, однодоменного антитела, диантитела, мультиспецифического антитела, антитела с двойной специфичностью и биспецифического антитела.
В предпочтительном варианте изобретения конструкция антитела согласно изобретению содержит константный домен тяжелой цепи иммуноглобулина, выбранный из группы, состоящей из константного домена человеческого IgM, константного домена человеческого IgGl, константного домена человеческого IgG2, константного домена человеческого IgG3, константного домена человеческого IgG4, константного домена человеческого IgE и константного домена человеческого IgA, и мутантов Ig вышеуказанных подтипов, которые могут модифицировать связывание с рецептором Fc-гамма, связывание с FcRn и связывание с C1q и могут изменять фармакокинетические свойства и/или эффекторные функции Fc.
В другом варианте изобретения конструкция антитела является гликозилированной. Предпочтительно, указанный профиль гликозилирования является характерным для человека.
В другом варианте изобретения описанный здесь DLL4-связывающий белок конъюгирован с агентом. Конъюгатами связывающего белка согласно изобретению являются конъюгаты антител, в которых описанная здесь конструкция антитела конъюгирована с агентом. Указанный агент предпочтительно выбирают из группы, состоящей из молекулы иммуноадгезина, визуализирующего агента, терапевтического средства и цитотоксического агента. В предпочтительном варианте изобретения визуализирующий агент выбран из группы, состоящей из радиоактивной метки, фермента, флуоресцентной метки, люминесцентной метки, биолюминесцентной метки, магнитной метки и биотина. Более предпочтительно, указанным визуализирующим агентом является радиоактивная метка, выбранная из группы, состоящей из: 3H, 14C, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho и 153Sm. В предпочтительном варианте изобретения терапевтическое или цитотоксическое средство выбрано из группы, состоящей из антиметаболита, алкилирующего агента, антибиотика, фактора роста, цитокина, антиангиогенного агента, антимитотического средства, антрациклина, токсина и апоптотического агента.
В другом варианте изобретения описанные выше DLL4-связывающий белок, конструкция антитела или конъюгат связывающего белка (включая конъюгаты антитела) присутствуют в виде кристаллов. Предпочтительным кристаллом является не содержащий носителя фармацевтический кристалл с контролируемым высвобождением. В предпочтительном варианте изобретения указанные кристаллизованный связывающий белок, кристаллизованная конструкция антитела или кристаллизованный конъюгат антитела имеют более продолжительное время полужизни in vivo, чем их растворимый аналог. В другом предпочтительном варианте изобретения указанные кристаллизованный связывающий белок, кристаллизованная конструкция антитела или кристаллизованный конъюгат связывающего белка (включая конъюгат антитела) сохраняют биологическую активность после кристаллизации.
В одном из своих аспектов, настоящее изобретение относится к изолированной нуклеиновой кислоте, кодирующей DLL4-связывающий белок, конструкцию антитела, конъюгат DLL4-связывающего антитела или его DLL4-связывающую часть. Особенно предпочтительной является изолированная нуклеиновая кислота, которая кодирует полипептид, выбранный из группы, состоящей из: полипептида, содержащего вариабельный домен тяжелой цепи, где указанный вариабельный домен тяжелой цепи включает CDR-H1, CDR-H2 или CDR-H3, описанные выше; полипептида, содержащего вариабельный домен легкой цепи, где указанный вариабельный домен легкой цепи включает CDR-L1, CDR-L2 или CDR-L3, описанные выше, или комбинации обоих полипептидов.
В другом варианте настоящее изобретение относится к вектору, содержащему описанную выше изолированную нуклеиновую кислоту. В предпочтительном варианте изобретения указанный вектор выбран из группы, состоящей из: pcDNA, pTT (Durocher et al., Nucl. Acids Res., 30(2e9): 1-9 (2002)), pTT3 (pTT с дополнительными сайтами множественного клонирования), pEFBOS (Mizushima et al., Nucl. Acids. Res., 18 (17): 5322 (1990)), pHybE, pBV, pJV и pBJ, и любых других экспрессионных векторов, подходящих для их использования в прокариотических или эукариотических клетках.
В другом аспекте настоящее изобретение относится к клетке-хозяину, трансформированной вышеописанным вектором. Указанной клеткой-хозяином может быть прокариотическая или эукариотическая клетка. Предпочтительной прокариотической клеткой-хозяином является Escherichia coli. Предпочтительно, эукариотическая клетка выбрана из группы, состоящей из клетки протиста, клетки животного, клетки растения и клетки грибов. Более предпочтительно, клеткой-хозяином является клетка млекопитающего, включая, но не ограничиваясь ими, клетки CHO и COS. Предпочтительными клетками грибов являются, но не ограничиваются ими, клетки Saccharomyces cerevisiae. Предпочтительной клеткой насекомого является клетка Sf9.
В другом аспекте настоящее изобретение относится к способу продуцирования связывающего белка, который связывается с человеческим DLL4, где указанный способ включает стадию культивирования любой из вышеописанных клеток-хозяев в культуральной среде в условиях, подходящих для продуцирования связывающего белка, который связывается с человеческим DLL4. В другом варианте настоящее изобретение относится к связывающемуся белку, полученному способом, описанным выше.
В одном из вариантов настоящее изобретение относится к композиции для высвобождения DLL4-связывающего белка согласно изобретению, где указанная композиция содержит состав, который, в свою очередь, содержит кристаллизованный DLL4-связывающий белок, кристаллизованную конструкцию антитела или кристаллизованный конъюгат связывающего белка (включая конъюгаты антитела), описанные выше; и ингредиент, а также по меньшей мере один полимерный носитель. Предпочтительным полимерным носителем является полимер, выбранный из одной или нескольких групп, состоящих из полиакриловой кислоты, полицианоакрилатов, полиаминокислот, полиангидридов, полидепсипептидов, полиэфиров, полимолочной кислоты, сополимера молочной и гликолевой кислоты или PLGA, поли-β-гидроксибутирата, поликапролактона, полидиоксанона, полиэтиленгликоля, полигидроксипропилметакриламида, полиорганофосфазена, полиортоэфиров, поливинилового спирта, поливинилпирролидона, сополимеров малеинового ангидрида-алкилвинилового эфира, полиолов плюроников, альбумина, альгината, целлюлозы и производных целлюлозы, коллагена, фибрина, желатина, гиалуроновой кислоты, олигосахаридов, гликаминогликанов, сульфатированных полисахаридов и их смесей и сополимеров. Предпочтительно, указанный ингредиент выбран из группы, состоящей из альбумина, сахарозы, трегалозы, лактита, желатина, гидроксипропил-β-циклодекстрина, метоксиполиэтигенгликоля и полиэтиленгликоля.
В другом варианте настоящее изобретение относится к способу лечения млекопитающего, включающему стадию введения указанному млекопитающему эффективного количества композиции, содержащей кристаллизованный DLL4-связывающий белок, кристаллизованную конструкцию антитела или кристаллизованный конъюгат белка (включая конъюгаты антитела), описанные выше.
Настоящее изобретение также относится к фармацевтической композиции, содержащей DLL4-связывающий белок, конструкцию антитела или конъюгат белка (включая конъюгаты антитела), описанные выше, и фармацевтически приемлемый носитель. В другом варианте изобретения фармацевтическая композиция содержит по меньшей мере один дополнительный агент. Указанным дополнительным агентом может быть терапевтическое средство, используемое для лечения расстройства, ассоциированного с негативным воздействием DLL4. Предпочтительно, фармацевтическая композиция содержит дополнительный агент, выбранный из группы, состоящей из терапевтического средства, визуализирующего агента, противоопухолевого средства; химиотерапевтического средства (такого как ДНК-алкилирующий агент, цисплатин, карбоплатин, антитубулиновый агент, паклитаксел, доцетаксел, доксорубицин, гемцитабин, гемзар, антрациклин, адриамицин, ингибитор топоизомеразы I, ингибитор топоизомеразы II, 5-фторурацил (5-FU), лейковорин, иринотекан) и ингибиторов тирозинкиназных рецепторов (например, эрлотиниба, гефитиниба), ингибитора COX-2 (например, целекоксиба), ингибитора киназы и ингибитора ангиогенеза (включая, но не ограничиваясь ими, анти-VEGF антитело или VEGF-ловушка); блокатора костимулирующей молекулы (включая, но не ограничиваясь ими, анти-B7.1 антитело, анти-B7.2 антитело, CTLA4-Ig, анти-CD20 антитело); блокатора адгезивной молекулы (включая, но не ограничиваясь ими, анти-LFA-1 антитело, антитело против E/L-селектина и ингибитор небольшой молекулы); антитела против цитокинов или его функционального фрагмента (включая, но не ограничиваясь ими, анти-IL-18 антитело, анти-TNF антитело и анти-IL-6 антитело/антитело против рецептора цитокина), метотрексата, циклоспорина, рапамицина, FK506, детектируемой метки или репортера, антагониста TNF, противоревматического средства, мышечного релаксанта, наркотического средства, нестероидного противовоспалительного средства (НСПВС), аналгетика, анестетика, седативного средства, местного анестетика, нейромышечного блокатора, противомикробного средства, средства против псориаза, кортикостероида, анаболического стероида, эритропоэтина, иммунизирующего средства, иммуноглобулина, иммунодепрессанта, гормона роста, лекарственного средства для гормон-заместительной терапии, радиофармацевтического средства, антидепрессанта, антипсихотического средства, стимулятора, противоастматического лекарственного средства, бета-агониста, стероида, вводимого путем ингаляции, эпинефрина или его аналога, цитокина и антагониста цитокина.
В другом аспекте настоящее изобретение относится к способу ингибирования активности человеческого DLL4, включающему контактирование человеческого DLL4 с описанным выше связывающим белком в целях ингибирования или нейтрализации человеческого DLL4. В своем родственном аспекте, настоящее изобретение относится к способу ингибирования активности DLL4 у человека, страдающего расстройством, ассоциированным с негативным воздействием DLL4, где указанный способ включает введение указанному человеку вышеописанного связывающего белка в целях ингибирования человеческого DLL4 у человека и лечения указанного пациента, страдающего данным расстройством. Указанное расстройство предпочтительно выбрано из группы, включающей первичный и метастатический рак, включая карциномы молочной железы, толстой кишки, прямой кишки, легких, ротоглотки, гортани, пищевода, желудка, поджелудочной железы, печени, желчного пузыря и желчных протоков, тонкой кишки, мочевых путей (включая почки, мочевой пузырь и уротелий), женских половых органов (включая шейку матки, матку и яичники, а также хориокарциномы и трофобластоз у беременных), мужских половых органов (включая предстательную железу, семенные пузырьки, яички и эмбрионально-клеточные опухоли), эндокринных желез (включая щитовидную железу, кору надпочечника и гипофиз) и кожи, а также гемангиомы, меланомы, саркомы (включая саркомы костей и мягких тканей, а также саркому Капоши), опухоли головного мозга, нервных тканей, глаз и мозговой оболочки (включая астроцитомы, глиомы, глиобластомы, ретинобластомы, невромы, нейробластомы, шванномы и менингиомы), солидные опухоли, происходящие от гемопоэтических злокачественных опухолей, такие как лейкоз и лимфомы (ходжкинская и неходжкинская лимфомы), метастазы опухоли, глазную неоваскуляризацию (включая слепоту при диабете, ретинопатию, возрастную дегенерацию желтого пятна и покраснение), отеки, ревматоидный артрит, рассеянный склероз, атеросклеротические бляшки, болезнь Крона, воспалительное заболевание кишечника, асцит, трудно поддающийся лечению, псориаз, саркоидоз, артериосклероз, сепсис, пептические язвы, ожоги, панкреатит, поликистоз яичника (ПКЯ), эндометриоз, фиброму матки, злокачественную гипертрофию предстательной железы и другие ассоциированные и неассоциированные с ангиогенезом заболевания, характеризующиеся абберантной активностью DLL4.
В другом аспекте настоящее изобретение относится к способу лечения пациента, страдающего расстройством, ассоциированным с негативным воздействием человеческого DLL4, где указанный способ включает стадию введения любого из описанных выше связывающих белков до, во время или после введения второго агента, описанного выше. В предпочтительном варианте изобретения указанный второй агент выбран из группы, состоящей из: средства для лучевой терапии; противоопухолевого средства; химиотерапевтического средства (такого как ДНК-алкилирующий агент, цисплатин, карбоплатин, антитубулиновый агент, паклитаксел, доцетаксел, таксол, доксорубицин, гемцитабин, гемзар, антрациклин, адриамицин, ингибитор топоизомеразы I, ингибитор топоизомеразы II, 5-фторурацил (5-FU), лейковорин, иринотекан) и ингибиторов тирозинкиназных рецепторов (например, эрлотиниба, гефитиниба), ингибитора COX-2 (например, целекоксиба), ингибитора киназы и ингибитора ангиогенеза (включая, но не ограничиваясь ими, анти-VEGF антитело или VEGF-ловушка); блокатора костимулирующей молекулы (включая, но не ограничиваясь ими, анти-B7.1 антитело, анти-B7.2 антитело, CTLA4-Ig, анти-CD20 антитело), блокатора адгезивной молекулы (включая, но не ограничиваясь ими, анти-LFA-1 антитело, антитело против E/L-селектина и ингибитор небольшой молекулы); антитела против цитокинов или его функционального фрагмента (включая, но не ограничиваясь ими, анти-IL-18 антитело, анти-TNF антитело и анти-IL-6 антитело/антитело против рецептора цитокина), метотрексата, циклоспорина, рапамицина, FK506, детектируемой метки или репортера, антагониста TNF, противоревматического средства, мышечного релаксанта, наркотического средства, нестероидного противовоспалительного средства (НСПВС), аналгетика, анестетика, седативного средства, местного анестетика, нейромышечного блокатора, противомикробного средства, средства против псориаза, кортикостероида, анаболического стероида, эритропоэтина, иммунизирующего средства, иммуноглобулина, иммунодепрессанта, гормона роста, лекарственного средства для гормон-заместительной терапии, радиофармацевтического средства, антидепрессанта, антипсихотического средства, стимулятора, противоастматического лекарственного средства, бета-агониста, стероида, вводимого путем ингаляции, эпинефрина или его аналога, цитокина и антагониста цитокина.
В предпочтительном варианте изобретения вышеописанные здесь фармацевтические композиции вводят индивидууму по меньшей мере одним способом, выбранным из группы, состоящей из парентерального введения, подкожного введения, внутримышечного введения, внутривенного введения, внутрисуставного введения, внутрибронхиального введения, внутрибрюшинного введения, интракапсулярного введения, внутрихрящевого введения, внутриполостного введения, внутричревного введения, внутримозжечкового введения, интрацеребровентрикулярного введения, введения в толстую кишку, интрацервикального введения, внутрижелудочного введения, введения в печень, введения в миокард, внутрикостного введения, внутритазового введения, введения в перикард, интраперитониального введения, интраплеврального введения, введения в предстательную железу, интрапульмонарного введения, интраректального введения, внутрипочечного введения, введения в сетчатку глаза, интраспинального введения, введения в синовиальную жидкость, введения в грудную клетку, внутриматочного введения, интравезикулярного введения, введения в виде болюса, вагинального введения, ректального введения, трансбуккального введения, подъязычного введения, интраназального введения и чрескожного введения.
В другом аспекте настоящее изобретение относится по меньшей мере к одному антиидиотипическому анти-DLL4 антителу против по меньшей мере одного DLL4-связывающего белка согласно изобретению. Таким антиидиотипическим антителом является любая белок- или пептид-содержащая молекула, включающая по меньшей мере часть молекулы иммуноглобулина, такую как, но не ограничивающуюся ими, по меньшей мере одна гипервариабельная область (комплементарность-определяющая область (CDR)) тяжелой или легкой цепи или ее лиганд-связывающая часть, вариабельная область тяжелой цепи или легкой цепи, константная область тяжелой цепи или легкой цепи, каркасная область или любая их часть, которые могут быть включены в связывающий белок согласно изобретению.
Любой из ряда форматов иммунодетектирующих анализов может быть адаптирован для использования DLL4-связывающего белка согласно изобретению в целях детектирования DLL4 в смеси, в растворе или в биологическом образце. Такими форматами иммунодетектирующих анализов являются, но не ограничиваются ими, радиоиммуноанализ (РИА), иммунопреципитация, твердофазный иммуноферментный анализ (ELISA), иммуноблот-анализ (например, вестерн-блот-анализ), имммунологические полоски (например, индикаторные тест-полоски), содержащие DLL4-связывающий белок согласно изобретению, адсорбированный или иммобилизованный на субстрате, FACS и т.п. Детектирование DLL4 с использованием DLL4-связывающего белка согласно изобретению может быть проведено in vitro в смеси, в растворе или в биологическом образце. Биологическими образцами, которые могут быть подвергнуты контактированию со связывающим белком согласно изобретению для детектирования DLL4 или для измерения его уровня в образце, являются, но не ограничиваются ими, моча, слюна, мазок из ротовой полости (щечный мазок, мазок с языка или из зева), кожный мазок, соскоб с кожи, мазок из прямой кишки, влагалищный мазок, проба цельной крови, проба плазмы, проба сыворотки, биоптат ткани и любой другой образец, взятый у индивидуума в соответствии с процедурой, известной специалистам. В другом варианте изобретения DLL4-связывающий белок может быть использован для детектирования DLL4 in vivo различными методами томографии и сканирования, включая, но не ограничиваясь ими, рентгеновскую компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ) и позитронно-эмиссионную томографию (ПЭТ).
Подробное описание изобретения
Настоящее изобретение относится к DLL4-связывающим белкам, а в частности, к анти-DLL4 антителам или к их антигенсвязывающим частям, которые связываются с DLL4. В различных аспектах настоящее изобретение относится к антителам и фрагментам антител и фармацевтическим композициям, содержащим такие антитела и фрагменты, а также к нуклеиновым кислотам, рекомбинантным экспрессионным векторам и к клеткам-хозяевам, используемым для получения таких антител и фрагментов. В объем настоящего изобретения входят также способы применения антител согласно изобретению для детектирования человеческого DLL4 или мышиного DLL4, способы ингибирования активности человеческого или мышиного DLL4 и/или человеческого или мышиного VEGFR2 или VEGRl, in vitro или in vivo, и способы регуляции экспрессии генов.
Если это не оговорено особо, то все технические и научные термины, используемые в настоящей заявке, имеют значения, в основном, понятные среднему специалисту в области, к которой относится изобретение. Значения и объем терминов должны быть понятны специалистам в данной области, однако, в случае возникновения каких-либо скрытых разночтений, следует отдать предпочтение определениям, данным в настоящей заявке, а не тем определениям, которые приводятся в словарях или в других источниках. Кроме того, если это не противоречит контексту настоящего описания, то существительные, употребляемые в единственном числе, могут означать и существительные во множественном числе, и наоборот. В настоящей заявке, употребление слова «или» означает «и/или», если это не оговорено особо. Кроме того, термин «включающий», а также другие его формы, такие как «включать» или «включенный», являются неограничивающими. Такие термины, как «элемент» или «компонент» охватывают как элементы, так и компоненты, включающие одну единицу и элементы и компоненты, которые включают более чем одну субъединицу, если это не оговорено особо.
В общих чертах, номенклатура и способы, относящиеся к клеткам, к тканевым культурам, к молекулярной биологии, иммунологии, микробиологии, генетике, химии белков и нуклеиновых кислот и к гибридизации описанных здесь белков и нуклеиновых кислот, хорошо известны специалистам и широко применяются в данной области. Настоящее изобретение обычно осуществляют стандартными методами и способами, хорошо известными специалистам и описанными в различных общих руководствах и в специальной научной литературе, которые цитируются и обсуждаются в настоящем описании, если это не указано особо. Ферментативные реакции и способы очистки осуществляют в соответствии с инструкциями производителей, обычно рекомендуемыми специалистам или предложенными в настоящей заявке. Используемая номенклатура и лабораторные процедуры, а также методы аналитической химии, химии органического синтеза и медицинской фармацевтической химии, описанные в настоящей заявке, хорошо известны и широко применяются специалистами. Для химических синтезов, химических анализов, фармацевтических составов, составов доставки и для лечения пациентов применяются стандартные методы.
Для лучшего понимания настоящего изобретения ниже приводится определение отдельных терминов.
Используемый здесь термин «полипептид» означает любую полимерную цепь из аминокислот. Термины «пептид» и «белок» являются синонимами термина «полипептид», а также означают полимерную цепь из аминокислот. Термин «полипептид» охватывает нативные или искусственные белки, фрагменты белков и полипептидные аналоги последовательности белка. Полипептид может быть мономерным или полимерным. При употреблении термина «полипептид» подразумевается, что он включает полипептид и его фрагменты и варианты (включая фрагменты вариантов), если это не противоречит контексту изобретения. Что касается антигенного полипептида, то фрагмент полипептида содержит, но необязательно, по меньшей мере один эпитоп с непрерывной цепью или нелинейный эпитоп полипептида. Точные границы по меньшей мере одного фрагмента эпитопа могут быть определены средним специалистом в данной области. Этот фрагмент содержит по меньшей мере примерно 5 смежных аминокислот, например, по меньшей мере примерно 10 смежных аминокислот, по меньшей мере примерно 15 смежных аминокислот или по меньшей мере примерно 20 смежных аминокислот. Варианты полипептида описаны в настоящей заявке.
Термины «изолированный белок» или «изолированный полипептид» означают белок или полипептид, которые, по своему происхождению или в своем источнике, не ассоциируются с природными компонентами, вместе с которыми они обычно присутствуют в своем природном состоянии; по существу, не содержат других белков, происходящих от одного и того же вида; экспрессируются клеткой другого вида, или не существуют в природе. Таким образом, полипептид, который синтезируется химическими методами или синтезируется в клеточной системе, отличающейся от его природной клеточной системы, будет рассматриваться как полипептид, «изолированный» из его природного окружения. Белок может также, по существу, не содержать природных компонентов в результате его выделения методами очистки белка, хорошо известными специалистам.
Используемый здесь термин «выделение» означает способ получения химических молекул, таких как полипептид, который, по существу, не содержит природных компонентов в результате его выделения, например, методами очистки белка, хорошо известными специалистам.
Используемый здесь термин «человеческий DLL4» (сокращенно обозначаемый здесь «hDLL4» или «huDLL4») включает несколько EGF-подобных доменов и домен DSL, необходимые для связывания с рецептором. Этот термин включает белок размером примерно 74-75 кДа. Структура и выведенные последовательности ДНК и последовательности белка человеческого DLL4 более подробно описаны, например, Shutter et al., Genes & Dev., 4: 1313-1318 (2000). Используемый здесь термин «человеческий DLL4» также включает рекомбинантный человеческий DLL4 (rhDLL4), который может быть получен стандартными рекомбинантными методами экспрессии.
Используемый здесь термин «биологическая активность», если он относится к DLL4, означает все биологические свойства, присущие DLL4. Биологическими свойствами DLL4 являются, но не ограничиваются ими, связывание с рецептором Notch, активация рецептора Notch, ингибирование передачи сигнала VEGF, подавление VEGFR2 и индуцирование VEGFR1.
Используемые здесь термины «специфическое связывание» или «специфически связывающий», если они относятся к взаимодействию антитела, белка или пептида со второй химической молекулой, означают, что такое взаимодействие зависит от присутствия конкретной структуры (например, антигенной детерминанты или эпитопа) на химической молекуле, так, например, антитело распознает специфическую белковую структуру, а не белки в целом, и связывается с этой структурой. Если антитело является специфичным к эпитопу «A», то присутствие молекулы, содержащей эпитоп A (или свободный немеченый A), в реакционной смеси, включающей меченый «A» и антитело, будет приводить к снижению количества меченого A, связанного с антителом.
Используемый здесь термин «антитело», в своем широком смысле, означает любую молекулу иммуноглобулина (Ig), состоящую из четырех полипептидных цепей, двух тяжелых цепей (Н) и двух легких цепей (L), или любые их функциональные фрагменты, мутанты, варианты или производные, сохраняющие основные эпитоп-связывающие свойства молекулы Ig. Такие типы мутантных, модифицированных или дериватизированных антител известны специалистам. Неограничивающие варианты таких антител обсуждаются ниже.
В полноразмерном антителе каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (обозначаемой здесь HCVR или VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (обозначаемой здесь LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Области VH и VL могут быть также подразделены на гипервариабельные области, называемые комплементарность- определяющими областями (CDR), которые чередуются с областями, являющимися более консервативными и называющимися каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных в направлении от амино-конца до карбокси-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Молекулами иммуноглобулина могут быть молекулы любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса.
Термин «Fc-область» используется для определения С-концевой области тяжелой цепи иммуноглобулина, которая может быть получена путем гидролиза интактного антитела папаином. Fc-областью может быть Fc-область нативной последовательности или Fc-область ее варианта. Fc-область иммуноглобулина обычно содержит два константных домена, домен CH2 и домен CH3, и включает, но необязательно, домен CH4. Замены аминокислотных остатков в Fc-части, вводимые для изменения эффекторной функции антитела, известны специалистам (патенты США №№ 5648260 и 5624821). Fc-часть антитела опосредует несколько важных эффекторных функций, например, индуцирование цитокинов, ADCC, фагоцитоз, комплемент-зависимую цитотоксичность (CDC), время полужизни/скорость клиренса антитела и образование комплексов антиген-антитело. В некоторых случаях желательно, чтобы терапевтическое антитело обладало этими эффекторными функциями, но в других случаях, в зависимости от терапевтического применения, такие функции могут необязательными или даже нежелательными. Некоторые изотипы человеческих IgG, а в частности, IgG1 и IgG3, опосредуют ADCC и CDC посредством связывания с FcγR и с комплементом C1q, соответственно. Fc-рецепторы у новорожденных (FcRn) представляют собой важные компоненты, определяющие время полужизни антител в кровотоке. В другом варианте изобретения по меньшей мере один аминокислотный остаток в константной области антитела, например, в Fc-области антитела, заменяют так, чтобы это приводило к изменению эффекторных функций антитела. Димеризация двух идентичных тяжелых цепей иммуноглобулина опосредуется димеризацией доменов CH3 и стабилизируется дисульфидными связями в шарнирной области (Huber et al. Nature; 264: 415-420 (1976); Thies et al., J. Mol. Biol; 293: 67-79 (1999)). Мутация цистеиновых остатков в шарнирных областях, проводимая в целях предотвращения образования дисульфидных связей между тяжелыми цепями, будет дестабилизировать димеризацию доменов СН3. Были идентифицированы остатки, ответственные за димеризацию СН3 (Dall'Acqua Biochem. 37: 9266-9273 (1998)). Поэтому это дает возможность получить одновалентную половину Ig. Интересно отметить, что такие одновалентные молекулы, составляющие половину Ig, были обнаружены в природе для иммуноглобулинов подклассов IgG и IgA (Seligman, Ann. Immunol. 129: 855-70 (1978); Biewenga et al. Clin Exp Immunol 51:395-400 (1983)). Стехиометрия Fc-области FcRn:Ig, как было определено, составляет 2:1 (West et al. Biochem. 39: 9698-9708 (2000)), и половина Fc является достаточной для опосредования связывания с FcRn (Kim et al. Eur. J. Immunol.; 24: 542-548 (1994)). Мутации, вводимые для нарушения димеризации домена CH3, больше не смогут негативно влиять на связывание с FcRn, поскольку остатки, играющие важную роль в димеризации CH3, расположены на внутренней поверхности β-складчатой структуры CH3, а область, ответственная за связывание с FcRn, расположена за пределами границы доменов CH2-CH3. Однако половина молекул Ig может иметь определенное преимущество с точки зрения проникновения в ткань, что обусловлено ее меньшим размером по сравнению с обычным антителом. В одном из вариантов изобретения по меньшей мере один аминокислотный остаток в константной области связывающего белка согласно изобретению, например, в Fc-области, заменяют так, чтобы это приводило к изменению димеризации тяжелых цепей и к образованию половинных молекул Ig. Противовоспалительная активность IgG полностью зависит от сиалилирования N-связанного гликана Fc-фрагмента IgG. Было определено, что присутствие гликана является обязательным условием для сообщения противовоспалительной активности, поскольку его присутствие позволяет создать соответствующий Fc-фрагмент IgG1 и, тем самым, получить полностью рекомбинантный сиалилированный Fc-фрагмент IgGl со значительно более высокой активностью (Anthony, et al. Science 320: 373-376 (2008)).
Используемый здесь термин «антигенсвязывающая часть» антитела (или просто «часть антитела») означает один или несколько фрагментов антитела, которые сохраняют способность специфически связываться с антигеном (то есть, с конкретным эпитопом антигена, таким как эпитоп DLL4). Было показано, что антигенсвязывающая функция антитела может быть реализована благодаря фрагментам полноразмерного антитела. Такие варианты антител могут быть также биспецифическими, иметь «двойную» специфичность или быть мультиспецифическими, то есть специфически связываться с двумя или более различными антигенами (или с двумя или более различными эпитопами на одном и том же антигене). Примерами связывающихся фрагментов, входящих в объем термина «антигенсвязывающая часть» антитела, являются (i) Fab-фрагмент, одновалентный фрагмент, состоящий из доменов VL, VH, CL и CHl; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, включающий два Fab-фрагмента, связанные дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CHl; (iv) Fv-фрагмент, состоящий из доменов VL и VH одной плеча антитела; (v) dAb-фрагмент (Ward et al., Nature 341: 544-546 (1989); публикация PCT WO 90/05144Al), который содержит один вариабельный домен; и (vi) изолированная гипервариабельная область (CDR). Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, однако, они могут быть присоединены друг к другу рекомбинантными методами посредством синтетического линкера, который позволяет создать одну белковую цепь, где области VL и VH спариваются, образуя одновалентные молекулы (известные как одноцепочечный Fv (scFv); см. например, Bird et al. Science 242: 423-426 (1988); и Huston et al. Proc. Natl. Acad. Sci USA 85: 5879-5883 (1988)). Такие одноцепочечные антитела также входят в объем термина «антигенсвязывающая часть» антитела. В объем этого термина также входят и другие формы одноцепочечных антител, таких как диантитела. Диантитела представляют собой двухвалентные биспецифические антитела, в которых домены VH и VL экспрессируются на одной полипептидной цепи, но соединены посредством линкера, который является слишком коротким для образования пары между двумя доменами на одной и той же цепи, а поэтому домены вынуждены спариваться с комплементарными доменами другой цепи и образовывать два антигенсвязывающих сайта (см., например, Holliger et al. Proc. Natl. Acad. Sci USA 90: 6444-6448 (1993); Poljak, R.J., Structure 2:1121-1123 (1994)). Такие антигенсвязывающие части антитела известны специалистам (Kontermann & Dubel eds., Antibody Engineering (Springer-Verlag. New York, 2001) p. 790 (ISBN 3-540-41354-5). Кроме того, одноцепочечными антителами также являются «линейные антитела», содержащие пару тандемных Fv-сегментов (VH-CH1-VH-CH1), которые, вместе с комплементарными полипептидами легкой цепи, образуют пару антигенсвязывающих областей (Zapata et al. Protein Eng. 8(10): 1057-1062 (1995); и патент США № 5641870).
Используемый здесь термин «конструкция антитела» (или «конструкция анти-DLL4 антитела») означает полипептид, содержащий одну или несколько антигенсвязывающих частей согласно изобретению, связанных с линкерным полипептидом или с константным доменом иммуноглобулина. Линкерные полипептиды содержат два или более аминокислотных остатков, связанных пептидными связями, и используются для связывания с одной или несколькими антигенсвязывающими частями. Такие линкерные полипептиды хорошо известны специалистам (см., например, Holliger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993); Poljak, RJ., Structure, 2: 1121-1123 (1994)). Термин «константный домен иммуноглобулина» означает константный домен тяжелой или легкой цепи. Аминокислотные последовательности константного домена тяжелой и легкой цепей человеческого IgG известны специалистам и представлены в таблице 1.
|
Кроме того, антитело или его антигенсвязывающая часть могут быть частью более крупных иммуноадгезивных молекул, образованных посредством ковалентного или нековалентного связывания данного антитела или его антигенсвязывающей части с одним или несколькими другими белками или пептидами. Примерами таких иммуноадгезивных молекул являются коровая область стрептавидина, используемая для получения тетрамерной молекулы scFv (Kipriyanov et al., Human Antibodies and Hybridomas, 6: 93-101 (1995)), цистеиновый остаток, маркерный пептид и C-концевая полипептидная метка, используемые для получения двухвалентных и биотинилированных молекул scFv (Kipriyanov et al., Mol. Immunol, 31: 1047-1058 (1994)). Части антител, такие как Fab- и F(ab')2-фрагменты, могут быть получены из целых антител стандартными методами, такими как гидролиз целых антител папаином или пепсином, соответственно. Кроме того, антитела, части антител и иммуноадгезивные молекулы могут быть получены стандартными методами рекомбинантных ДНК, описанными в настоящей заявке и известными в данной области техники.
Используемый здесь термин «изолированное антитело» означает антитело, которое, по существу, не содержит другие антитела, обладающие различными специфичностями к антигену (например, изолированное антитело, которое специфически связывается с hDLL4, в основном, изолировано от антител, которые специфически связываются с антигенами, не являющимися hDLL4). Однако изолированное антитело, которое специфически связывается с hDLL4, может перекрестно реагировать с другими антигенами, такими как молекулы DLL4, происходящие от других видов (например, muDLL4). Кроме того, изолированное антитело может быть, в основном, отделено от другого клеточного материала и/или других химических веществ.
Используемый здесь термин «моноклональное антитело» или сокращенно «Mab» и «mAb» означает антитело, полученное от популяции, в основном, гомогенных антител, то есть отдельных антител, составляющих данную популяцию, которые являются идентичными за исключением антител с возможными природными мутациями, которые могут присутствовать в небольших количествах. Моноклональные антитела являются в высокой степени специфичными и направлены против одного антигена. Кроме того, в отличие от составов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое mAb направлено против одной детерминанты на антигене. Определение «моноклональный» не означает, что данное антитело должно быть продуцировано каким-либо конкретным методом.
Используемый здесь термин «человеческое антитело» включает антитела, имеющие вариабельные и константные области, происходящие от последовательностей иммуноглобулина человеческой зародышевой линии. Человеческие антитела согласно изобретению могут включать аминокислотные остатки, не принадлежащие последовательностям иммуноглобулина человеческой зародышевой линии (например, в них могут быть введены мутации посредством неспецифического или сайт-специфического мутагенеза in vitro или посредством соматической мутации in vivo), например, такие остатки могут присутствовать в CDR, а в частности, в CDR3. Однако используемый здесь термин «человеческое антитело» не включает антитела, в которых последовательности CDR, происходящие от зародышевой линии млекопитающих других видов, таких как мышь, были присоединены к человеческим каркасным последовательностям.
Используемый здесь термин «рекомбинантное человеческое антитело» включает все человеческие антитела, которые были получены, экспрессированы, сконструированы или выделены рекомбинантными методами, например, антитела, экспрессируемые с использованием рекомбинантного экспрессионного вектора, трансфицированного в клетку-хозяина, антитела, выделенные из библиотеки рекомбинантных комбинаторных человеческих антител (Hoogenboom, Trends Biotechnol. 15: 62-70(1997); Azzazy & Highsmith Clin. Biochem. 35: 425-445(2002); Gavilondo & Larrick BioTechniques 29: 128-145 (2002); Hoogenboom & Chames, Immunol. Today 21: 371-378 (2000)), антитела, выделенные у животных (например, мышей), которые являются трансгенными по отношению к генам человеческого иммуноглобулина (см., Taylor et al. Nucl. Acids Res. 20: 6287-6295 (1992); Kellermann & Green, Curr. Opin. Biotechnol. 13: 593-597 (2002); Little et al. Immunol. Today 21: 364-370 (2000)), или антитела, которые были получены, экспрессированы, сконструированы или выделены другими методами, включающими сплайсинг последовательностей генов человеческого иммуноглобулина с образованием других последовательностей ДНК. Такие рекомбинантные человеческие антитела имеют вариабельные и константные области, происходящие от последовательностей иммуноглобулина человеческой зародышевой линии. Однако, в некоторых вариантах изобретения, такие рекомбинантные человеческие антитела подвергают мутагенезу in vitro (или, если используется животное, которое является трансгенным по отношению к последовательностя человеческого Ig, его подвергают соматическому мутагенезу in vivo), и таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител представляют собой последовательности, которые, если они происходят от последовательностей VH и VL человеческой зародышевой линии и являются родственными этим последовательностям, обычно не входят в репертуар человеческих антител зародышевой линии in vivo.
Термин «химерное антитело» означает антитела, которые содержат последовательности вариабельной области тяжелой и легкой цепей, происходящие от одного вида, и последовательности константной области, происходящие от других видов, такие как антитела, имеющие мышиные вариабельные области тяжелой и легкой цепей, присоединенные к человеческим константным областям.
Используемый здесь термин «CDR» означает гипервариабельную область в вариабельных последовательностях антитела. В каждой из вариабельных областей тяжелой цепи и легкой цепи присутствуют три CDR, которые, для каждой вариабельной области, обозначаются CDR1, CDR2 и CDR3. Используемый здесь термин «набор CDR» означает группу из трех CDR, которые присутствуют в одной вариабельной области, обладающей способностью связываться с антигеном. Точные границы этих CDR были определены различным образом в зависимости от различных систем. Система, описанная Кэбатом (Kabat et al., Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987) и (1991)), имеет не только однозначную систему нумерации остатков, применяемую к любой вариабельной области антитела, но также и точные границы остатков, определяющие три CDR. Эти CDR могут называться «CDR по Кэбату». Чотия и сотрудники (Chothia & Lesk, J. Mol. Biol. 196: 901-917 (1987) и Chothia et al., Nature 342: 877-883 (1989)) обнаружили, что некоторые субположения в CDR по Кэбату приобретают почти идентичную конформацию пептидного остова, несмотря на то, что они имеют значительные различия на уровне аминокислотной последовательности. Такие подобласти были обозначены «L1», «L2» и «L3» или «Hl», «H2» и «H3», где «L» и «H» означают области легкой и тяжелой цепи, соответственно. Такие области, которые имеют границы, перекрывающиеся с CDR по Кэбату, могут называться «CDR по Чотиа». Другие границы, определяющие перекрывание CDR с CDR по Кэбату, были описаны в публикации Padlan, FASEB J. 9: 133-139 (1995) и MacCallum, J. Mol. Biol. 262(5): 732-45 (1996). Другие определения границ CDR могут, но не строго, соответствовать одной из описанных здесь систем, но тем не менее эти границы перекрываются с CDR по Кэбату, хотя эти области могут быть короче или длиннее, чем это было предсказано или получено из экспериментальных данных, которые указывают на то, что конкретные остатки или группы остатков или даже полноразмерные CDR не оказывают значительного влияния на связывание с антигеном. В описанных здесь способах могут использоваться CDR, определенные в соответствии с любой из этих систем, хотя в некоторых вариантах используются CDR, определенные по Кэбату или Чотия.
Используемые здесь термины «нумерация по Кэбату», «определение по Кэбату» и «мечение по Кэбату» являются синонимами. Эти термины, известные специалистам, означают систему нумерации аминокислотных остатков, которые являются более вариабельными (то есть, гипервариабельными), чем другие аминокислотные остатки в вариабельных областях тяжелой и легкой цепейе антитела или его антигенсвязывающей части. (Kabat et al., Ann. NY Acad. Sci., 190: 382-391 (1971) and Kabat et al., Sequences of Proteins of Immunological Interest. Fifth Edition. U.S. Department of Health and Human Services, NIH Publication No. 91-3242 (1991)). Для вариабельной области тяжелой цепи (VH) гипервариабельная область простирается в пределах от аминокислотного положения 31 до аминокислотного положения 35 для CDR1, от аминокислотного положения 50 до аминокислотного положения 65 для CDR2, и от аминокислотного положения 95 до аминокислотного положения 102 для CDR3. Для вариабельной области легкой цепи (VL) гипервариабельная область простирается в пределах от аминокислотного положения 24 до аминокислотного положения 34 для CDR1, от аминокислотного положения 50 до аминокислотного положения 56 для CDR2, и от аминокислотного положения 89 до аминокислотного положения 97 для CDR3.
За последние 20 лет наблюдается увеличение общедоступных баз данных и данных анализа имеющихся в них аминокислотных последовательностей вариабельных областей тяжелых и легких цепей, что позволяет специалистам определить типичные пограничные области между каркасными областями (FR) и последовательностями CDR, присутствующими в последовательностях вариабельных областей, и точно идентифицировать CDR в соответствии с нумерацией по Кэбату, нумерацией по Чотиа или в соответствии с другими системами нумерации. См., например, Martin, «Protein Sequence and Structure Analysis of Antibody Variable Domains», Kontermann and Dϋbel, eds., Antibody Engineering (Springer-Verlag, Berlin, 2001), глава 31, страницы 432-433. Ниже приводится подходящий метод определения аминокислотных последовательностей CDR по Кэбату, присутствующих в аминокислотных последовательностях вариабельных областей тяжелой цепи (VH) и легкой цепи (VL):
Идентификация аминокислотной последовательности CDR-L1:
Приблизительно первые 24 аминокислотных остатка от амино-конца области VL;
Остатком перед последовательностью CDR-L1 всегда является цистеин (C);
Остатком после последовательности CDR-L1 всегда является триптофан (W), обычно Trp-Tyr-Gln (W-Y-Q), но также и Trp-Leu-Gln (W-L-Q), Trp-Phe-Gln (W-F-Q) и Trp-Tyr-Leu (W-Y-L);
Длина обычно составляет от 10 до 17 аминокислотных остатков.
Идентификация аминокислотной последовательности CDR-L2:
Всегда первые 16 остатков после CDR-L1;
Остатками перед последовательностью CDR-L2 обычно являются Ile-Tyr (I-Y), но также и Val-Tyr (V-Y), Ile-Lys (I-K) и Ile-Phe (I-F);
Длина всегда составляет 7 аминокислотных остатков.
Идентификация аминокислотной последовательности CDR-L3:
Всегда первые 33 аминокислоты после CDR-L2;
Остатком перед аминокислотной последовательностью CDR-L3 всегда является цистеин (C);
Остатками после последовательностями всегда являются Phe-Gly-X-Gly (F-G-X-G) (SEQ ID NO: 374), где X представляет собой любую аминокислоту;
Длина обычно составляет от 7 до 11 аминокислотных остатков.
Идентификация аминокислотной последовательности CDR-H1:
Приблизительно первые 33 аминокислотных остатка от амино-конца области VH и всегда 9 остатков после цистеина (C);
Остатками перед последовательностью всегда являются Cys-X-X-X-X-X-X-X-X (SEQ ID NO: 375), где X представляет собой любую аминокислоту;
Остатком после последовательности всегда является Trp (W), обычно Trp-Val (W-V), но также и Trp-Ile (W-I) и Trp-Ala (W-A);
Длина обычно составляет от 5 до 7 аминокислотных остатков.
Идентификация аминокислотной последовательности CDR-H2:
Всегда первые 15 аминокислотных остатков после CDR-H1;
Остатками перед последовательностью обычно являются Leu-Glu-Trp-Ile-Gly (L-E-W-I-G) (SEQ ID NO: 376), но возможны также и другие варианты;
Остатками после последовательности являются Lys/Arg-Leu/Ile/Val/Phe/Thr/Ala-Thr/Ser/Ile/Ala (K/R-L/I/V/F/T/A-T/S/I/A);
Длина обычно составляет от 16 до 19 аминокислотных остатков.
Идентификация аминокислотной последовательности CDR-H3:
Всегда первые 33 аминокислотных остатка после CDR-H2 и всегда 3 остатка после цистеина (C);
Остатками перед последовательностью всегда являются Cys-X-X(C-X-X), где X представляет собой любую аминокислоту, а обычно Cys-Ala-Arg (C-A-R);
Остатками после последовательности всегда являются Trp-Gly-X-Gly (W-G-X-G) (SEQ ID NO: 377), где X представляет собой любую аминокислоту;
Длина обычно составляет от 3 до 25 аминокислотных остатков.
Термин «CDR-привитое антитело» означает антитела, которые содержат последовательности вариабельной области тяжелой и легкой цепей, которые происходят от одного вида, но в которых последовательности одной или нескольких CDR-областей VH и/или VL заменены последовательностями CDR других видов, например, такие антитела имеют мышиные вариабельные области тяжелой и легкой цепей, в которых одна или несколько мышиных CDR (например, CDR3) были заменены человеческими последовательностями CDR.
Термин «гуманизированное антитело» означает антитела, которые содержат последовательности вариабельной области тяжелой и легкой цепей, происходящие от млекопитающих, не являющихся человеком (например, мыши), но в которых по меньшей мере часть последовательности VH и/или VL была модифицирована для сообщения ей большего сходства с последовательностью человеческого антитела, то есть большего сходства с вариабельными последовательностями человеческой зародышевой линии. «Гуманизированное антитело» представляет собой антитело или его вариант, производное, аналог или фрагмент, которые иммуноспецифически связываются с представляющим интерес антигеном и содержат каркасную область (FR), имеющую, в основном, аминокислотную последовательность человеческого антитела и гипервариабельную область (CDR), имеющую, в основном, аминокислотную последовательность нечеловеческого антитела. Используемый здесь термин «в основном», относящийся к CDR, означает, что CDR имеет аминокислотную последовательность, которая по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99% идентична аминокислотной последовательности CDR нечеловеческого антитела. Гуманизированное антитело включает в основном все или по меньшей мере один, а обычно два вариабельных домена (Fab, Fab', F(ab')2, FabC, Fv), в которых все или в основном все области CDR соответствуют нечеловеческому иммуноглобулину (то есть, донорному антителу), а все или в основном все каркасные области представляют собой области, имеющие консенсусную последовательность человеческого иммуноглобулина. В одном из вариантов изобретения гуманизированное антитело также содержит по меньшей мере часть константной области иммуноглобулина (Fc), а обычно человеческого иммуноглобулина. В некоторых вариантах изобретения гуманизированное антитело содержит легкую цепь, а также по меньшей мере вариабельный домен тяжелой цепи. Такое антитело также может включать области CHl, шарнирную область и области CH2, CH3 и CH4 тяжелой цепи. В некоторых вариантах изобретения гуманизированное антитело содержит только гуманизированную легкую цепь. В некоторых вариантах изобретения гуманизированное антитело содержит только гуманизированную тяжелую цепь. В конкретных вариантах изобретения гуманизированное антитело содержит только гуманизированный вариабельный домен легкой цепи и/или гумунизированную тяжелую цепь.
Гуманизированное антитело может быть выбрано из иммуноглобулинов любого класса, включая IgM, IgG, IgD, IgA и IgE, и любого изотипа, включая, но не ограничиваясь ими, IgGl, IgG2, IgG3 и IgG4. Гуманизированное антитело может содержать последовательности, происходящие от антител более чем одного класса или изотипа, а конкретные константные домены могут быть выбраны для оптимизации нужных эффекторных функций методами, хорошо известными специалистам.
Каркасные области и CDR гуманизированного антитела необязательно должны точно соответствовать родительским последовательностям, так, например, CDR донорного антитела или консенсусная каркасная область могут быть подвергнуты мутагенезу путем замены, инсерции и/или делеции по меньшей мере одного аминокислотного остатка так, чтобы CDR или каркасный остаток в этом сайте не соответствовал остатку донорного антитела или консенсусной каркасной области. Однако, в предпочтительном варианте изобретения, такие мутации не должны быть избыточными. Обычно остатки гуманизированного антитела по меньшей мере на 80%, предпочтительно, по меньшей мере на 85%, более предпочтительно, по меньшей мере на 90%, а наиболее предпочтительно, по меньшей мере на 95% соответствуют остаткам последовательностей родительских FR и CDR. Используемый здесь термин «консенсусная каркасная область» означает каркасную область в консенсусной последовательности иммуноглобулина. Используемый здесь термин «консенсусная последовательность иммуноглобулина» означает последовательность, происходящую от наиболее часто встречающихся аминокислот (или нуклеотидов) в семействе родственных последовательностей иммуноглобулина (см., например, Winnaker, From Genes to Clones (Verlagsgesellschaft, Weinheim, 1987)). «Консенсусная последовательность иммуноглобулина» может также содержать «консенсусную(ые) каркасную(ые) область(и)» и/или «консенсусную(ые) CDR». В семействе иммуноглобулинов каждое положение в консенсусной последовательности занято аминокислотой, наиболее часто встречающейся в этом положении указанного семейства. Если две аминокислоты встречаются с одинаковой частотой, то в консенсусной последовательности может присутствовать любая из этих аминокислот.
«Аффинно зрелым» антителом является антитело, имеющее одну или несколько модификаций в одной или нескольких CDR, которые приводят к повышению аффинности антитела к антигену-мишени, в отличие от родительского антитела, не имеющего такой(их) модификации(й). Репрезентативные аффинно зрелые антитела обладают наномолярной или даже пикомолярной аффинностью по отношению к антигену-мишени. Аффинно зрелые антитела получают различными методами, известными специалистам. В публикации Marks et al., BioTechnology, 10: 779-783 (1992) описано аффинное созревание, достигаемое посредством перестановки доменов VH и VL. Неспецифический мутагенез CDR и/или каркасных остатков описан в публикациях: Barbas et al., Proc. Nat. Acad. Sci. USA, 91: 3809-3813 (1994); Schier et al., Gene, 169: 147-155 (1995); Yelton et al., J. Immunol, 155: 1994-2004 (1995); Jackson et al., J. Immunol, 154(7): 3310-3319 (1995); Hawkins et al, J. Mol. Biol, 226: 889-896 (1992). Селективная мутация в селективных положениях мутагенеза и контактирование или гипермутация с заменой аминокислотным остатком, повышающим активность, описана в патенте США US6914128B1.
Термин «поливалентный связывающий белок» означает связывающий белок, содержащий два или более антигенсвязывающих сайтов (также называемых здесь «антигенсвязывающими доменами»). Поливалентный связывающий белок предпочтительно конструируют так, чтобы он содержал три или более антигенсвязывающих сайта и, по существу, не являлся природным антителом. Термин «мультиспецифический связывающий белок» означает связывающий белок, который способен связываться с двумя или более родственными или неродственными мишенями, включая связывающий белок, который способен связываться с двумя или более различными эпитопами одной и той же молекулы-мишени.
Используемый здесь термин «биспецифическое антитело» означает полноразмерные антитела, которые получают с применением квадромной технологии (см. Milstein et al., Nature, 305(5934): 537-540 (1983)), химического конъюгирования двух различных моноклональных антител (см., Staerz et al., Nature, 314(6012): 628-631 (1985)) или с применением технологии «узлы в дырках» или аналогичных технологий, которые позволяют вводить мутации в Fc-область (см. Holliger et al., Proc. Natl. Acad. Sci. USA, 90(14): 6444-6448 (1993)), что приводит к получению множества различных молекул иммуноглобулина, из которых только одна молекула является функциональным биспецифическим антителом. Благодаря своей молекулярной функции, биспецифическое антитело связывается с одним антигеном (или эпитопом) на одной из двух связывающихся ветвей (одна пара HC/LC), и с другим антигеном (или эпитопом) на второй ветви (другая пара HC/LC). Согласно такому определению, биспецифическое антитело имеет две отдельных антигенсвязывающих ветви (отличающихся по специфичности и по последовательностям CDR) и является одновалентным для каждого антигена, с которым оно связывается.
Используемый здесь термин «антитело с двойной специфичностью» означает полноразмерные антитела, которые могут связываться с двумя различными антигенами (или эпитопами) в каждой из своих двух связывающихся ветвей (пара HC/LC) (см. публикацию заявки РСТ WO 02/02773). В соответствии с этим, связывающий белок с двойной специфичностью имеет две идентичных антигенсвязывающихся ветви с идентичными специфичностями и идентичными последовательностями CDR и является двухвалентным для каждого антигена, с которым он связывается.
Связывающиеся белки «с двумя вариабельными доменами» («DVD») согласно изобретению содержат два или более антигенсвязывающих сайта и могут представлять собой двухвалентные связывающиеся белки (с двумя антигенсвязывающими сайтами), четырехвалентные связывающиеся белки (с четырьмя антигенсвязывающими сайтами) или поливалентные связывающиеся белки. DVD могут быть моноспецифическими, то есть они могут связываться с одним антигеном (или с одним специфическим эпитопом), или мультиспецифическими, то есть они могут связываться с двумя или более антигенами (то есть, с двумя или более эпитопами одной и той же молекулы антигена-мишени или с двумя или более эпитопами различных антигенов-мишеней). Предпочтительный связывающий DVD-белок содержит два DVD-полипептида тяжелой цепи и два DVD-полипептида легкой цепи и называется «DVD-иммуноглобулином» или «DVD-Ig». Поэтому такой связывающий белок DVD-Ig является тетрамерным и напоминает молекулу IgG, но имеет большее количество антигенсвязывающих сайтов, чем молекула IgG. Таким образом, каждая половина тетрамерной молекулы DVD-Ig напоминает одну половину молекулы IgG и включает DVD-полипептид тяжелой цепи и DVD-полипептид легкой цепи, но в отличие от пары тяжелой и легкой цепей молекулы IgG, которая имеет один антигенсвязывающий домен, пара тяжелой и легкой цепей молекулы DVD-Ig имеет два или более антигенсвязывающих сайтов.
Каждый антигенсвязывающий сайт связывающего белка DVD-Ig происходит от донорного («родительского») моноклонального антитела, а поэтому содержит вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), где общее число CDR, участвующих в связывании с антигеном, в каждом антигенсвязывающем сайте равно шести. В соответствии с этим, связывающий белок DVD-Ig, который связывается с двумя различными эпитопами (то есть, с двумя различными эпитопами двух различных молекул антигенов или с двумя различными эпитопами одной и той же молекулы антигена), содержит антигенсвязывающий сайт, происходящий от первого родительского моноклонального антитела, и антигенсвязывающий сайт, происходящий от второго родительского моноклонального антитела.
Описание конструирования и экспрессии, а также характеризация связывающихся молекул DVD-Ig приводится в публикации заявки PCT № WO 2007/024715, в патенте США № 7612181 и в публикации Wu et al., Nature Biotech., 25: 1290-1297 (2007). Предпочтительным примером таких молекул DVD-Ig являются молекулы, которые содержат тяжелую цепь, имеющую структурную формулу VD1-(X1)n-VD2-C-(X2)n, где VD1 представляет собой первый вариабельный домен тяжелой цепи, VD2 представляет собой второй вариабельный домен тяжелой цепи, C представляет собой константный домен тяжелой цепи, X1 представляет собой линкер, при условии, что он не является CHl, X2 представляет собой Fc-область, а n равно 0 или 1, а предпочтительно 1; и легкую цепь, имеющую структурную формулу VD1-(X1)n-VD2-C-(X2)n, где VD1 представляет собой первый вариабельный домен легкой цепи, VD2 представляет собой второй вариабельный домен легкой цепи, C представляет собой константный домен легкой цепи, X1 представляет собой линкер, при условии, что он не является CHl, а X2 не содержит Fc-области, n равно 0 или 1, а предпочтительно 1. Такой DVD-Ig может содержать две указанных тяжелых цепи и две указанных легких цепи, где каждая из этих цепей содержит вариабельные домены, тандемно присоединенные друг к другу без промежуточной константной области, обычно присутствующей между вариабельными областями, где тяжелая цепь и легкая цепь связаны друг с другом и образуют тандемные функциональные антигенсвязывающие сайты, а пара тяжелой и легкой цепей может быть связана с другой парой тяжелой и легкой цепей с образованием тетрамерного связывающего белка, имеющего четыре функциональных антигенсвязывающих сайта. В другом примере молекула DVD-Ig может содержать тяжелую и легкую цепи, каждая из которых включает три вариабельных домена (VD1, VD2, VD3), тандемно присоединенных друг к другу без промежуточной константной области, обычно присутствующей между вариабельными областями, где тяжелая и легкая цепи могут быть связаны друг с другом и образуют три антигенсвязывающих сайта, а пара тяжелой и легкой цепей может быть связана с другой парой тяжелой и легкой цепей с образованием тетрамерного связывающего белка, имеющего шесть антигенсвязывающих сайтов.
В предпочтительном варианте изобретения связывающий белок DVD-Ig согласно изобретению не только способен связываться с одними и теми же молекулами-мишенями, связанными с родительскими моноклональными антителами, но также обладают одним или несколькими нужными свойствами, которыми обладают одно или несколько родительских моноклональных антител. Предпочтительно, таким дополнительным свойством является свойство антитела, присущее одному или нескольким родительским моноклональным антителам. Свойствами антител, которые могут быть сообщены связывающемуся белку DVD-Ig одним или несколькими родительскими моноклональными антителами, являются, но не ограничиваются ими, специфичность к антигену, аффинность к антигену, активность, биологическая функция, распознавание эпитопа, стабильность белка, растворимость белка, эффективность продуцирования, иммуногенность, фармакокинетические свойства, биологическая доступность, способность перекрестно реагировать с тканями и способность к связыванию с ортологичным антигеном.
Связывающий белок DVD-Ig согласно изобретению связывается по меньшей мере с одним эпитопом человеческого белка DLL4. Неограничивающими примерами связывающего белка DVD-Ig согласно изобретению являются связывающий белок DVD-Ig, который связывается с одним или несколькими эпитопами человеческого DLL4; связывающий белок DVD-Ig, который связывается с эпитопом человеческого DLL4 и с эпитопом DLL4 других видов (например, мыши); и связывающий белок DVD-Ig, который связывается с эпитопом человеческого DLL4 и с эпитопом другой молекулы-мишени (например, VEGFR2 или VEGFR1).
«Функциональный антигенсвязывающий сайт» связывающего белка представляет собой сайт, способный связываться с антигеном-мишенью. Аффинность связывания антигенсвязывающего сайта с антигеном необязательно должна быть такой же высокой, как и аффинность родительского антитела, от которого происходит антигенсвязывающий сайт, однако способность связываться с антигеном должна быть детектируемой любым из различных методов, обычно применяемых для оценки связывания антитела с антигеном. Кроме того, аффинности связывания каждого антигенсвязывающего сайта поливалентного антитела с антигеном необязательно должны быть количественно равноценными.
Используемые здесь термины «акцептор» и «акцепторное антитело» означают антитело или последовательность нуклеиновой кислоты, содержащие или кодирующие, соответственно, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или 100% от всех аминокислотных последовательностей одной или нескольких каркасных областей (FR). В некоторых вариантах изобретения термин «акцептор» означает аминокислотную последовательность или нуклеотидную последовательность антитела, которая включает или кодирует, соответственно, константную(ые) область(и). В другом варианте изобретения термин «акцептор» означает аминокислотную последовательность или нуклеотидную последовательность антитела, которая содержит или кодирует, соответственно, одну или несколько каркасных областей и константных областей. В конкретном варианте изобретения термин «акцептор» означает аминокислотную последовательность или нуклеотидную последовательность человеческого антитела, которое содержит или кодирует, соответственно, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или 100% от всех аминокислотных последовательностей одной или нескольких каркасных областей. В соответствии с этим вариантом, акцептор может содержать по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5 или по меньшей мере 10 аминокислотных остатков, которые не присутствуют в одном или нескольких конкретных положениях человеческого антитела. Акцепторная каркасная область и/или акцепторная(ые) константная(ые) область(и) могут, например, происходить или могут быть получены из гена антитела зародышевой линии, гена зрелого антитела и функционального антитела (например, антител, хорошо известных специалистам, антител, находящихся на стадии конструирования, или коммерчески доступных антител).
Используемый здесь термин «канонический» остаток означает остаток в CDR или каркасной области, который определяет конкретную каноническую структуру CDR, определенную Чотиа и др. (см. публикации Chothia et al. J. Mol. Biol, 196: 901-917 (1987); Chothia et al., J. Mol. Biol, 227: 799-817 (1992), которые вводятся в настоящее описание посредством ссылки). В соответствии с описанием Чотия и др., играющие важную роль положения CDR многих антител имеют почти идентичную конформацию пептидного остова, несмотря на значительную вариабельность на уровне аминокислотных последовательностей. Каждая каноническая структура определяет, главным образом, серию углов закручивания пептидного остова для непрерывного сегмента из аминокислотных остатков, образующих петлю.
Используемые здесь термины «донор» и «донорное антитело» означают антитело, содержащее одну или несколько CDR. В предпочтительном варианте изобретения донорным антителом является антитело, происходящее от видов, отличающихся от тех видов, от которых были получены или от которых происходят каркасные области антитела. Термин «донорное антитело», если он относится к гуманизированному антителу, означает нечеловеческое антитело, имеющее одну или несколько CDR.
Используемые здесь термины «каркасная область» или «каркасная последовательность» означают остальные последовательности вариабельной области минус CDR. Поскольку точное определение последовательности CDR может быть дано исходя из других систем (например, см. выше), то термин «каркасная последовательность» может иметь, соответственно, другую интерпретацию. Шесть CDR (CDR-L1, -L2 и -L3 легкой цепи и CDR-H1, -H2 и -H3 тяжелой цепи) также разделяют каркасные области в легкой цепи и в тяжелой цепи на четыре подобласти (FR1, FR2, FR3 и FR4) на каждой цепи, где CDR1 расположена между FR1 и FR2, CDR2 расположена между FR2 и FR3, и CDR3 расположена между FR3 и FR4. Не претендуя на точное определение конкретных подобластей, таких как FR1, FR2, FR3 или FR4, можно также сказать, что каркасная область представляет собой объединенные FR в вариабельной области в одной природной цепи иммуноглобулина. Используемый здесь термин «область FR» означает одну из четырех подобластей, а термин «области FR» означает две или несколько из четырех подобластей, составляющих каркасную область.
Последовательности акцепторных человеческих тяжелых и легких цепей известны специалистам. В одном из вариантов изобретения последовательности акцепторных человеческих тяжелых и легких цепей выбраны из последовательностей, представленных в таблицах 2 и 3.
|
|
Таблица 3
Акцепторные последовательности легкой цепи
|
|
Используемые здесь термины «ген антитела зародышевой линии» или «генный фрагмент» означают последовательность иммуноглобулина, кодируемую нелимфоидными клетками, которые не подвергались процессу созревания, приводящему к генетической реаранжировке и мутации, для экспрессии конкретного иммуноглобулина. (См., например, Shapiro et al., Crit. Rev. Immunol. 22(3): 183-200 (2002); Marchalonis et al., Adv. Exp. Med. Biol. 484: 13-30 (2001)). Одно из преимуществ различных вариантов настоящего изобретения заключается в том, что гены антитела зародышевой линии с большей вероятностью, чем гены зрелого антитела, будут сохранять основные структуры аминокислотной последовательности, характерные для индивидуумов данного вида, а следовательно, менее вероятно, что они будут распознаваться как последовательности, происходящие из чужеродного источника, при их терапевтическом применении в данных видах.
Используемый здесь термин «ключевой остаток» означает определенные остатки вариабельной области, которые оказывают значительное влияние на специфичность связывания антитела и/или аффинность антитела, а в частности, гуманизированного антитела. Ключевыми остатками являются, но не ограничиваются ими, один или несколько из нижеследующих остатков: остаток, который является смежным с CDR; потенциальный сайт гликозилирования (N- или O-гликозилирования); редкий остаток; остаток, обладающий способностью взаимодействовать с антигеном; остаток, обладающий способностью взаимодействовать с CDR; канонический остаток; остаток в зоне контактирования вариабельной области тяжелой цепи с вариабельной областью легкой цепи; остаток в зоне Верньера; и остаток в области, которая перекрывается с CDR1 вариабельной тяжелой цепи, как определено по Чотиа, и с первой каркасной областью тяжелой цепи, как определено по Кэбату.
Используемый здесь термин «зона Верньера» означает субнабор из каркасных остатков, которые могут осуществлять корректировку структуры CDR и тонкую корректировку для адаптации этих остатков к данному антигену, как описано Foote и Winter (J. Mol. Biol, 224: 487-499 (1992)). Остатки зоны Верньера образуют слой, лежащий в основе CDR, и могут влиять на структуру CDR и аффинность данного антитела.
Используемый здесь термин «нейтрализация» относится к предотвращению биологической активности антигена при его специфическом связывании с антигеном. В одном из вариантов изобретения нейтрализующий связывающий белок связывается с антигеном и снижает его биологическую активность по меньшей мере примерно на 20%, 40%, 60%, 80%, 85% или более.
Термин «активность» включает такую активность, как специфичность/аффинность связывания антитела с антигеном, например, анти-hDLL4 антитела, которое связывается с антигеном DLL4, и/или нейтрализующую активность антитела или анти-hDLL4 антитела, которое связывается с hDLL4 и тем самым ингибирует биологическую активность hDLL4, например, ингибирует связывание рецептора в анализе на связывание «лиганд-рецептор», или ингибирует активацию рецептора в анализе, проводимом с использованием репортера человеческого рецептора Notch, или стимулирует пролиферацию в анализе на разрастание эндотелиальных клеток.
Термин «эпитоп» включает любую полипептидную детерминанту, способную специфически связываться с иммуноглобулином или Т-клеточным рецептором. В некоторых вариантах изобретения антигенные детерминанты или эпитопы включают химически активные поверхностные группы молекул, таких как аминокислоты, сахарные боковые цепи, фосфорил или сульфонил, а в некоторых вариантах изобретения они могут обладать специфическими трехмерными структурными свойствами и/или могут иметь конкретный заряд. Эпитоп представляет собой область антигена, связывающуюся с антителом. Так, например, эпитоп состоит из аминокислотных остатков области антигена (или его фрагмента), который, как известно, связывается с комплементарным сайтом на специфическом партнере по связыванию. Антиген или его фрагмент могут содержать более чем один эпитоп. Так, например, для специалиста в данной области очевидно, что каждый «антигенсвязывающий сайт» молекулы антитела связывается с эпитопом молекулы антигена, а каждая молекула антигена может иметь один, два, несколько или множество эпитопов. Кроме того, для специалистов в данной области очевидно, что два независимо выделенных антитела против молекулы антигена могут связываться с одним и тем же эпитопом или с двумя различными эпитопами на молекуле антигена.
В некоторых вариантах изобретения считается, что антитело специфически связывается с антигеном, если оно распознает антиген-мишень в сложной смеси белков и/или макромолекул. Говорят, что антитела «связываются с одним и тем же эпитопом», если они перекрестно конкурируют с другими антителами (то есть, одно из них предотвращает связывающее или модулирующее действие другого). Кроме того, структурные определения эпитопов (перекрывающиеся, аналогичные, идентичные) являются информативными, а функциональные определения часто являются более релевантными, поскольку они включают структурные параметры (связывание) и функциональные параметры (модуляцию, конкурирование).
Используемый здесь термин «поверхностный плазмонный резонанс» означает оптическое явление, позволяющее проанализировать биоспецифические взаимодействия в реальном времени посредством детектирования изменений концентраций белка в биосенсорной матрице, например, с использованием системы BIAcore® (BIAcore International AB, a GE Healthcare company, Uppsala, Sweden и Piscataway, NJ). Более подробное описание можно найти в публикациях Jönsson, U., et al. Ann. Biol. Clin. 51: 19-26 (1993); Jönsson, U., et al. BioTechniques 11: 620-627 (1991); Johnsson, B., et al. (1995) J. Mol. Recognit. 8: 125-131; и Johnnson, B., et al. Anal. Biochem. 198: 268-277 (1991).
Используемый здесь термин «Kon» означает константу ассоциации связывающего белка (например, антитела) с антигеном с образованием, например, комплекса «антитело/антиген», известного специалистам. «Kon» также называется «константой скорости ассоциации» или «ka», и эти термины являются синонимами. Данная величина означает скорость связывания антитела с его антигеном-мишенью или скорость образования комплекса антитела и антигена, и может быть также представлена нижеследующим уравнением:
Антитело («Ab») + Антиген («Ag»)→Ab-Ag.
Используемый здесь термин «Koff» означает константу диссоциации или «константу скорости диссоциации» связывающего белка (например, антитела), например, из комплекса «антитело/антиген», известного специалистам. Данная величина означает скорость диссоциации антитела из его антигена-мишени или разделения комплекса Ab-Ag в течение определенного периода времени с образованием свободного антитела и антигена, и представлена нижеследующим уравнением:
Ab+Ag←Ab-Ag.
Используемые здесь термины «константа равновесной диссоциации» или «KD» являются синонимами и означают величину, полученную путем измерения титров при равновесии или путем деления константы скорости диссоциации (koff) на константу скорости ассоциации (kon). Константа скорости ассоциации, константа скорости диссоциации и константа равновесной диссоциации используются для определения аффинности связывания антитела с антигеном. Методы определения констант скорости ассоциации и диссоциации хорошо известны специалистам. Применение флуоресцентных методов позволяет с высокой степенью чувствительности проанализировать образцы в физиологических буферах при равновесии. Могут быть применены и другие экспериментальные подходы, такие как анализ BIAcore® (анализ на биомолекулярное взаимодействие) и экспериментальное оборудование (например, оборудование, поставляемое компанией BIAcore International AB, a GE Healthcare company, Uppsala, Sweden). Кроме того, может быть также использован анализ KinExA® (кинетический эксклюзионный анализ), разработанный компанией Sapidyne Instruments (Boise, Idaho).
Термины «метка» и «детектируемая метка» означают молекулу, присоединяемую к специфически связывающемуся партнеру, такому как антитело или аналит, например, для обеспечения реакции между членами пары специфического связывания, такими как антитело и аналит, где указанная метка является детектируемой, а указанный партнер по специфическому связыванию, например, меченые таким образом антитело или аналит, также является «детектируемо меченым». Таким образом, используемый здесь термин «меченый связывающий белок» означает белок с меткой, включенной в него в целях идентификации указанного связывающего белка. В одном из вариантов изобретения, меткой является детектируемый маркер, который может продуцировать сигнал, детектируемый визуально или с помощью приборов, например, посредством включения радиоактивно меченой аминокислоты или присоединения к полипептиду биотинильных групп, которые могут быть детектированы помеченным авидином (например, стрептавидином, содержащим флуоресцентный маркер или обладающим ферментативной активностью, которая может быть детектирована оптическими или колориметрическими методами). Примерами меток для полипептидов являются, но не ограничиваются ими, радиоизотопы или радионуклиды (например, 3H, 14C, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho и 153Sm); хромогены, флуоресцентные метки (например, ФИТЦ, родамин, флуоресцирующие вещества лантанидной группы), ферментативные метки (например, пероксидаза хрена, люцифераза, щелочная фосфатаза); хемилюминесцентные маркеры; биотинильные группы; предварительно определенные полипептидные эпитопы, распознаваемые вторичным репортером (например, последовательностями пары «лейциновая молния», сайтами связывания со «вторыми» антителами, металл-связывающими доменами, эпитопными метками); и магнитные агенты, такие как хелатные комплексы гадолиния. Репрезентативными примерами меток, наиболее часто используемых в иммунноанализах, являются молекулы, которые излучают свет, например, соединения акридиния, и молекулы, обладающие флуоресцентным действием, например, флуоресцеин. В настоящей заявке описаны и другие метки. В этой связи следует отметить, что сама такая молекула не может быть детектируемо меченой, но может стать детектируемой после ее реакции с другой молекулой. Использование «детектируемо меченой» молекулы включает детектируемое мечение последнего типа.
Термин «конъюгат антитела» означает связывающий белок, такой как антитело, химически связанное со второй химической молекулой, такой как терапевтическое или цитотоксическое средство. Используемый здесь термин «агент» означает химическое соединение, смесь химических соединений, биологическую макромолекулу или экстракт, полученный из биологических материалов. Предпочтительно, терапевтическими или цитотоксическими средствами являются, но не ограничиваются ими, коклюшный токсин, таксол, цитохалазин B, грамицидин D, этидийбромид, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин и его аналоги или гомологи.
Используемые здесь термины «кристалл» и «кристаллизованный» относится к связывающемуся белку (например, к антителу) или к его антигенсвязывающей части, которые присутствуют в форме кристалла. Кристаллы представляют собой одну из форм твердого состояния вещества, которая отличается от других форм, таких как аморфное твердое состояние или жидкое кристаллическое состояние. Кристаллы состоят из регулярных, повторяющихся трехмерных кристаллических решеток атомов, ионов, молекул (например, белков, таких как антитела) или молекулярных агрегатов (включая комплексы Fab/антиген). Эти трехмерные кристаллические решетки являются упорядоченными в соответствии с их математическими соотношениями, которые хорошо известны специалистам в данной области. Фундаментальная единица или структурный блок, повторяющиеся в кристаллах, называются асимметрической ячейкой. Повторение асимметрической ячейки в данной структуре, которая соответствуют хорошо определенной кристаллографической симметрии, позволяет называть ее «элементарной ячейкой» кристалла. Повторение этой элементарной ячейки посредством регулярной трансляции во всех трех измерениях образует кристалл. См. Giege et al., Crystallization of Nucleic Acids и Proteins, a Practical Approach, 2nd ed., (Ducruix and Giege, eds.) (Oxford University Press, New York, 1999), глава 1, стр. 1-16.
Термин «полинуклеотид» означает полимерную форму, состоящую из двух или более нуклеотидов, а именно рибонуклеотидов или дезоксирибонуклеотидов, или модифицированную форму, состоящую из нуклеотидов любого типа. Этот термин включает одноцепочечную и двухцепочечную формы ДНК.
Термин «изолированный полинуклеотид» означает полинуклеотид (например, геномную ДНК, кДНК, синтетическую ДНК или их комбинацию), который, по своему происхождению, не связан с полноразмернм полинуклеотидом или с его частью, вместе с которыми данный «изолированный полинуклеотид» обнаруживается в природе; или полинуклеотид, который функционально присоединен к полинуклеотиду, с которым он не связан в природе; или полинуклеотид, который не существует в природе как часть более крупной последовательности.
Термин «вектор» означает молекулу нуклеиновой кислоты, способную осуществлять транспорт другой нуклеиновой кислоты, с которой он был связан. Одним из типов вектора является «плазмида», представляющая собой кольцевую двухцепочечную ДНК-петлю, в которую могут быть лигированы дополнительные ДНК-сегменты. Другим типом вектора является вирусный вектор, в вирусный геном которого могут быть лигированы дополнительные ДНК-сегменты. Некоторые векторы обладают способностью автономно реплицироваться в клетке-хозяине, в которую они были встроены (например, бактериальные векторы, имеющие бактериальный ориджин репликации и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина после их введения в эту клетку-хозяина, а затем реплицироваться вместе с геномом хозяина. Кроме того, некоторые векторы способны направлять экспрессию генов, к которым они функционально присоединены. Такие векторы называются здесь «рекомбинантными экспрессионными векторами» (или просто «экспрессионными векторами»). В общих чертах, экспрессионные векторы, применяемые в методах рекомбинантных ДНК, часто присутствуют в форме плазмид. В настоящем описании термины «плазмида» и «вектор» могут быть синонимами, поскольку плазмида наиболее часто используется в качестве вектора. Однако настоящее изобретение включает и другие формы экспрессионных векторов, таких как вирусные векторы (например, дефектные по репликации ретровирусы, аденовирусы и аденоассоциированные вирусы), которые имеют эквивалентные функции. В настоящем изобретении могут быть также использованы РНК-варианты векторов (включая вирусные РНК-векторы).
Термин «функционально присоединенный» относится к положениям в области стыка (юкста-положениям), где описанные компоненты находятся в такой взаимосвязи, которая соответствующим образом обеспечивает их функционирование. Регуляторная последовательность, «функционально присоединенная» к кодирующей последовательности, лигирована так, чтобы экспрессия кодирующей последовательности достигалась в условиях, совместимых с условиями действия регуляторных последовательностей. «Функционально присоединенными» последовательностями являются последовательности регуляции экспрессии, которые являются смежными с представляющим интерес геном, и последовательности регуляции экспрессии, которые осуществляют регуляцию представляющего интерес гена in trans, то есть расположены не на молекуле представляющего интерес гена, а на молекуле другой нуклеиновой кислоты, а также последовательности регуляции экспрессии, которые расположены на той же самой молекуле нуклеиновой кислоты, но на некотором расстоянии от представляющего интерес гена. Используемый здесь термин «последовательность регуляции экспрессии» означает полинуклеотидные последовательности, которые необходимы для экспрессии и процессинга кодирующих последовательностей, с которыми они лигированы. Последовательностями регуляции экспрессии являются соответствующие последовательности инициации транскрипции, последовательности терминации транскрипции, промоторы и энхансерные последовательности; сигналы для эффективного РНК-процессинга, такие как сигналы сплайсинга и полиаденилирования; последовательности, стабилизирующие цитоплазматическую мРНК; последовательности, повышающие эффективность трансляции (то есть, консенсусная последовательность Козака); последовательности, повышающие стабильность белка, и, если это необходимо, последовательности, повышающие уровень секреции белка. Природа таких регуляторных последовательностей варьируется в зависимости от типа организма-хозяина, например, в прокариотах такими регуляторными последовательностями обычно являются промотор, сайт связывания с рибосомой и последовательность терминации транскрипции, а в эукариотах такими регуляторными последовательностями обычно являются промоторы и последовательность терминации транскрипции. Термин «регуляторные последовательности» включает компоненты, присутствие которых играет важную роль в экспрессии и процессинге, и эти последовательности могут также включать дополнительные компоненты, присутствие которых является предпочтительным, например, лидерные последовательности и последовательности партнеров по слиянию.
Термин «трансформация» означает любой способ, с помощью которого экзогенная нуклеиновая кислота (например, молекула ДНК) может быть введена в клетку-хозяина. Трансформация может быть осуществлена в природных условиях или в условиях, искусственно созданных различными методами, хорошо известными специалистам. Трансформация может быть осуществлена любым методом, подходящим для встраивания чужеродных последовательностей нуклеиновой кислоты в прокариотические или эукариотические клетки-хозяева. Этот метод выбирают исходя из трансформируемой клетки-хозяина, и таким методом может быть, но не ограничивается ими, получение плазмиды, проникающей через клеточную мембрану, инфицирование вирусом, электропорация, липофекция и бомбардировка частицами. Указанными «трансформированными» клетками являются стабильно трансформированные клетки, в которых встроенная ДНК обладает способностью реплицироваться либо как автономно реплицирующаяся плазмида, либо как часть хромосомы хозяина. Такими клетками также являются клетки, которые временно экспрессируют встроенную ДНК или РНК в течение ограниченного периода времени.
Термин «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин») означает клетку, в которую была встроена экзогенная ДНК. В одном из вариантов изобретения клетка-хозяин включает две или более (например, множество) нуклеиновых кислот, кодирующих антитела, например, клетки-хозяева, описанные, например, в патенте США № 7262028. Эти термины относятся не только к конкретно рассматриваемой клетке, но также и к потомству такой клетки. Поскольку в последующих генерациях могут присутствовать некоторые модификации, обусловленные либо мутацией, либо влиянием окружающей среды, то такое потомство, фактически, не может быть идентичным родительской клетке, но оно также входит в объем используемого здесь термина «клетка-хозяин». В одном из вариантов изобретения клетками-хозяевами являются прокариотические и эукариотические клетки, выбранные из царства живых организмов. В другом варианте изобретения эукариотическими клетками являются клетки простейших, грибов, растений и животных. В другом варианте изобретения клетками-хозяевами являются, но не ограничиваются ими, прокариотическая клеточная линия E.coli; клеточные линии млекопитающих CHO, HEK 293, COS, NS0, SP2 и PER.C6; клеточная линия насекомых Sf9; и клеточная линия грибов, таких как Saccharomyces cerevisiae.
Для получения рекомбинантных ДНК, а также для олигонуклеотидного синтеза, культивирования и трансформации тканей могут быть применены стандартные методы (например, электропорация, липофекция). Методы с применением ферментативных реакций и методы очистки могут быть осуществлены в соответствии с инструкциями производителей или в соответствии со стандартными процедурами, известными специалистам, либо в соответствии с описанием в настоящей заявке. Вышеупомянутые методы и процедуры могут быть осуществлены стандартными методами, хорошо известными специалистам, и описанными в различных общих и специальных руководствах, цитируемых и обсуждаемых в настоящей заявке. См., например, Sambrook et al. Molecular Cloning: A Laboratory Manual, second ed. (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 1989).
Термин «трансгенный организм», известный специалистам, означает организм, имеющий клетки, содержащие трансген, где указанный трансген, введенный в организм (или «предок» такого организма), экспрессирует полипептид, который в природе не экспрессируется в данном организме. «Трансген» представляет собой ДНК-конструкцию, которая стабильно и функционально интегрируется в геном клетки, от которой происходит такой трансгенный организм, и направляет экспрессию кодируемого генного продукта в клетки или ткани трансгенного организма одного или нескольких типов.
Используемые здесь термины «регуляция» и «модуляция» являются синонимами и означают изменения или модификации активности представляющей интерес молекулы (например, биологической активности hDLL4). Модуляция может приводить к увеличению или снижению величины определенной активности или функции представляющей интерес молекулы. Репрезентативными активностями или функциями молекулы являются, но не ограничиваются ими, связывающие свойства, ферментативная активность, активация клеточного рецептора и передача сигнала.
В соответствии с этим, термин «модулятор» означает соединение, способное изменять или модифицировать активность или функцию представляющей интерес молекулы (например, биологической активности hDLL4). Так, например, модулятор может способствовать увеличению или снижению величины определенной активности или функции представляющей интерес молекулы, по сравнению с величиной активности или функции, наблюдаемой в отсутствие данного модулятора. В некоторых вариантах изобретения модулятором является ингибитор, который способствует снижению величины по меньшей мере одной активности или функции молекулы. Репрезентативными ингибиторами являются, но не ограничиваются ими, белки, пептиды, антитела, пептидные антитела, углеводы и небольшие органические молекулы. Пептидные антитела описаны, например, в публикации РСТ № WO01/83525.
Термин «агонист» означает модулятор, который, при его контактировании с представляющей интерес молекулой, вызывает увеличение величины определенной активности или функции данной молекулы, по сравнению с величиной активности или функции, наблюдаемой в отсутствие данного агониста. Конкретными представляющими интерес агонистами являются, но не ограничиваются ими, члены пути передачи сигнала Notch, полипептиды и нуклеиновые кислоты DLL4, углеводы или любые другие молекулы, которые связываются с DLL4.
Используемые здесь термины «антагонист» или «ингибитор» означают модулятор, который, при его контактировании с представляющей интерес молекулой, вызывает снижение величины определенной активности или функции данной молекулы, по сравнению с величиной активности или функции, наблюдаемой в отсутствие данного антагониста. Конкретными представляющими интерес антагонистами являются антагонисты, которые блокируют или модулируют биологическую или иммунологическую активность DLL4, а в частности, человеческого DLL4 (hDLL4). Антагонистами и ингибиторами hDLL4 могут быть, но не ограничиваются ими, белки, нуклеиновые кислоты, углеводы или любые другие молекулы, которые связываются с hDLL4 и/или с DLL4 грызунов.
Используемый здесь термин «эффективное количество» означает количество терапевтического средства, которое является достаточным для ослабления тяжести расстройства или одного или нескольких его симптомов и/или для снижения их продолжительности, и для предупреждения прогрессирования расстройства, а также для достижения ремиссии данного расстройства, для предотвращения или предупреждения возникновения рецидивов, развития, начала или прогрессирования одного или нескольких симптомов, ассоциированных с данным расстройством, для обнаружения данного расстройства, либо для усиления или улучшения профилактического(их) или терапевтического(их) эффекта(ов) другого терапевтического средства (например, профилактического или терапевтического средства).
Термины «пациент» и «индивидуум» могут быть использованы здесь как синонимы и означают животное, такое как млекопитающее, включая приматов (например, человека, обезьян и шимпанзе), млекопитающих, не являющихся приматами (например, коров, свиней, верблюдов, лам, лошадей, коз, кроликов, овец, хомячков, морских свинок, кошек, собак, крыс, мышей и китов), птиц (например, уток или гусей) и акул. При этом предпочтительным пациентом или индивидуумом является человек, например, человек, который проходит лечение или обследование по поводу какого-либо заболевания, расстройства или состояния; человек с риском развития у него данного заболевания, расстройства или состояния; человек, страдающий данным заболеванием, расстройством или состоянием; и/или человек, подвергающийся лечению данного заболевания, расстройства или состояния. При этом более предпочтительно, если данный пациент или индивидуум подвергается лечению по поводу рака или другого заболевания или обследованию на наличие рака или другого заболевания, при котором имеющееся нарушение экспрессии DLL4 подтверждает наличие рака или другого заболевания, а ингибирование или подавление активности DLL4 являются желательными для лечения рака или другого заболевания.
Используемый здесь термин «образец» употребляется в самом широком смысле. Используемый здесь термин «биологический образец» включает, но не ограничивается ими, любое количество вещества, взятое у живого существа или у ранее живого существа. Такими живыми существами являются, но не ограничиваются ими, человек, мыши, крысы, обезьяны, собаки, кролики и другие животные. Указанными веществами являются, но не ограничиваются ими, кровь (например, цельная кровь), плазма, сыворотка, моча, амниотическая жидкость, синовиальная жидкость, эндотелиальные клетки, лейкоциты, моноциты, другие клетки, органы, ткани, костный мозг, лимфоузлы и селезенка.
Термины «компонент», «компоненты» и «по меньшей мере один компонент» означают иммобилизованное антитело, детектирующее или конъюгированное антитело, контроль, калибровочный маркер, серию калибровочных маркеров, набор тест-соединений для определения чувствительности, контейнер, буфер, разбавитель, соль, фермент, кофактор для фермента, детектирующий реагент, реагент/раствор для предварительной обработки, субстрат (например, в виде раствора), блокирующий раствор и т.п., которые могут быть включены в набор для анализа тест-образца, такого как проба мочи, сыворотки или плазмы пациента, проводимого в соответствии с описанными здесь методами и другими методами, известными специалистам. Таким образом, в контексте настоящего изобретения термины «по меньшей мере один компонент», «компонент» и «компоненты» могут включать полипептид или другие аналиты, описанные выше, такие как композиция, содержащая аналит, такой как полипептид, необязательно иммобилизованный на твердом носителе, например, посредством связывания с антителом против аналита (например, против полипептида). Некоторые компоненты могут присутствовать в растворе или в лиофилизованной форме, которую затем разводят для использования в анализе.
Термин «риск» означает возможность или вероятность осуществления конкретного события либо в настоящее время, либо в какой-либо момент в будущем. «Стратификация риска» означает набор известных клинических факторов риска, который позволяет врачу классифицировать пациентов как пациентов с низким, умеренным, высоким или очень высоким риском развития конкретного заболевания, расстройства или состояния.
Термин «специфический» и «специфичность», употребляемый в связи с взаимодействием между членами специфически связывающейся пары, например, антигена или его фрагмента и антитела или его антигенсвязывающего фрагмента, относится к селективной реактивности данного взаимодействия. Термин «специфически связывается с …» и аналогичные термины относятся к способности антител (или их антигенсвязывающих фрагментов) специфически связываться с аналитом (или с его фрагментом), но не с другими молекулами.
«Партнер по специфическому связыванию» представляет собой член специфически связывающейся пары. Специфически связывающаяся пара содержит две различных молекулы, каждая из которых специфически связывается друг с другом по химическому или физическому механизму. Поэтому помимо специфически связывающейся пары, такой как антиген-антитело, могут быть использованы и другие специфически связывающиеся пары, которые могут включать биотин и авидин (или стрептавидин), углеводы и лектины, комплементарные нуклеотидные последовательности, молекулы эффекторов и рецепторов, кофакторы и ферменты, ингибиторы ферментов и ферменты и т.п. Кроме того, специфически связывающиеся пары могут включать члены, которые являются аналогами исходных специфически связывающихся членов, таких как, например, аналит-аналог. Иммунореактивными специфически связывающимися членами являются антигены, фрагмент антигена и антитела, включая моноклональные и поликлональные антитела, а также комплексы, фрагменты и варианты (включая фрагменты вариантов), независимо от того, являются ли они выделенными или рекомбинантно продуцированными.
Используемый здесь термин «вариант» означает полипептид, который, по своей аминокислотной последовательности, отличается от данного полипептида (например, полипептида DLL4 или анти-DLL4 антитела), что обусловлено добавлением (например, инсерцией), делецией или консервативной заменой аминокислот, но при этом сохраняет биологическую активность данного полипептида (например, вариант DLL4 может конкурировать с DLL4 дикого типа за связывание с анти-DLL4 антителом, если вариант DLL4 сохраняет исходный антигенсвязывающий сайт (эпитоп) DLL4 дикого типа). Консервативная аминокислотная замена, то есть замена одной аминокислоты на другую аминокислоту с аналогичными свойствами (например, гидрофильностью и степенью распределения заряженных областей), может быть легко осуществлена специалистом, поскольку обычно такая замена является весьма несущественной. Такие незначительные замены могут быть, отчасти, идентифицированы путем определения гидропатического индекса аминокислот, известного специалистам (см., например, Kyte et al., J. Mol. Biol. 157: 105-132 (1982)). Гидропатический индекс аминокислот определяют исходя из их гидрофобности и заряда. Специалистам в данной области известно, что при замене аминокислот на аминокислоты с аналогичными гидропатическими индексами функции белка могут быть сохранены. В одном из аспектов изобретения, аминокислоты, имеющие гидропатические индексы ±2, являются замененными. Гидрофильность аминокислот может быть также использована для выявления замен, которые должны приводить к получению белков, сохраняющих свою биологическую функцию. Определение гидрофильности аминокислот в данном пептиде позволяет вычислить наибольшую локальную среднюю гидрофильность этого пептида, которая, как сообщалось, является ценным параметром, хорошо коррелирующим с антигенностью и иммуногенностью (см., например, патент США № 4554101). Замена аминокислот, имеющих аналогичные значения гидрофильности, может приводить к получению пептидов, сохраняющих биологическую активность, например, иммуногенность, как известно специалистам. В одном из аспектов изобретения каждую аминокислоту заменяют аминокислотой, имеющей величину гидрофильности в пределах ±2. На индекс гидрофобности и на величину гидрофильности аминокислот влияет конкретная боковая цепь этой аминокислоты. Согласно этому наблюдению, выбор аминокислотных замен, совместимых с биологической функцией, зависит от относительного сходства аминокислот, а в частности, от сходства боковых цепей этих аминокислот, что может быть выявлено по гидрофобности, гидрофильности, заряду, размеру и другим свойствам аминокислот. Термин «вариант» может быть также использован для описания полипептида или его фрагмента, который был подвергнут альтернативному процессингу, такому как протеолиз, фосфорилирование или другая посттрансляционная модификация, и который сохраняет свою биологическую активность или реактивность по отношению к антигену, например, способность связываться с DLL4. Используемый здесь термин «вариант» включает фрагменты варианта, если это не противоречит контексту описания изобретения.
Используемый здесь термин «образец» употребляется в самом широком смысле. Используемый здесь термин «биологический образец» включает, но не ограничивается ими, любое количество вещества, взятое у живого существа или у ранее живого существа. Такими живыми существами являются, но не ограничиваются ими, человек, мыши, крысы, обезьяны, собаки, кролики и другие животные. Указанными веществами являются, но не ограничиваются ими, кровь, сыворотка, моча, синовиальная жидкость, клетки, органы, ткани, костный мозг, лимфоузлы и селезенка.
I. Антитела, которые связываются с человеческим DLL4
В одном из аспектов настоящее изобретение относится к изолированным человеческим моноклональным антителам или к их антигенсвязывающим частям, которые связываются с DLL4 с высокой аффинностью, низкой скоростью диссоциации и/или с высокой нейтрализующей активностью. Такие человеческие антитела или их антигенсвязывающие части, которые связываются с DLL4, преимущественно могут быть использованы в медицине в качестве терапевтических средств, которые могут быть введены человеку и дают минимальный иммунный ответ или вообще не продуцируют иммунного ответа у человека на вводимый терапевтический DLL4-связывающий белок. В соответствии с этим, у пациента может наблюдаться благоприятный эффект от введения таких полностью человеческих DLL4-связывающих белков в процессе всего курса повторных введений. В других аспектах настоящее изобретение относится к химерным антителам, которые связываются с DLL4, и к CDR-привитым антителам или к их антигенсвязывающим частям, которые связываются с DLL4. Предпочтительными антителами или их частями являются изолированные антитела. Предпочтительными антителами согласно изобретению являются нейтрализующие человеческие анти-DLL4 антитела.
A. Способ получения анти-DLL4 антител
Антитела согласно изобретению могут быть получены любым из ряда известных методов. Предпочтительным методом является технология представления мРНК PROfusion, описанная в примере 2 настоящей заявки. Другим методом является иммунизация трансгенных грызунов (например, трансгенных мышей), которые несут функциональный комплемент человеческого гена иммуноглобулина, человеческим DLL4 или его антигенсвязывающей частью, с последующим проведением стандартной гибридомной технологии для получения гибридом, экспрессирующих полностью человеческие моноклональные антитела, которые связываются с человеческим DLL4. Рекомбинантные человеческие антитела, полученные таким методом, имеют вариабельные и константные области, происходящие от последовательностей иммуноглобулина человеческой зародышевой линии. Такие методы позволяют получить полностью человеческие DLL4-связывающие белки и не требуют какого-либо дополнительного проведения одного или нескольких раундов гуманизации в целях снижения уровня антигенности, источником которой являются нечеловеческие молекулы моноклонального анти-DLL4 антитела. В соответствии с этим, методы, проводимые с использованием материала, происходящего от множества видов, являются менее предпочтительными, но, тем не менее, они могут быть применены.
Следует также отметить, что используемый здесь термин «моноклональное антитело» не ограничивается антителами, полученными с применением гибридомной технологии. Термин «моноклональное антитело» означает антитело, происходящее от одного клона, включая любые эукариотические, прокариотические или фаговые клоны, независимо от метода, которым оно было получено.
Дополнительные аспекты различных методов, которые могут быть применены для получения молекул моноклональных анти-DLL4 антител согласно изобретению, описаны ниже.
1. Получение анти-DLL4 моноклональных антител с помощью гибридомной технологии
Моноклональные антитела могут быть получены с применением методов широкого ряда, известных специалистам, включая применение гибридомных технологий, рекомбинантных методов и методов фагового представления или их комбинаций. Так, например, моноклональные антитела могут быть продуцированы гибридомными методами, включая методы, известные специалистам и описанные, например, в публикации Harlow et al., Antibodies: A Laboratory Manual, second edition, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 1988); Hammerling, et al., Monoclonal Antibodies and T-Cell Hybridomas, pages 563-681 (Elsevier, New York, 1981) (указанные публикации во всей своей полноте вводятся в настоящее описание посредством ссылки). Методы продуцирования и скрининга специфических антител с применением гибридомной технологии являются рутинными и хорошо известны специалистам. В одном из вариантов настоящее изобретение относится к способам получения моноклональных антител, а также к антителам, полученным способом, включающим культивирование гибридомных клеток, секретирующих антитело согласно изобретению, где предпочтительно указанную гибридому получают путем слияния спленоцитов, выделенных у мышей, иммунизированных антигеном согласно изобретению, с миеломными клетками, а затем скрининга гибридом, полученных посредством такого слияния, на гибридомные клоны, секретирующие антитело, способное связываться с полипептидом согласно изобретению. Вкратце, мышь может быть иммунизирована антигеном DLL4. В предпочтительном варианте изобретения антиген DLL4 вводят вместе с адъювантом для стимуляции иммунного ответа. Такими адъювантами являются полный или неполный адъювант Фрейнда, RIBI (мурамил-дипептиды) или ISCOM (иммуностимулирующие комплексы). Такие адъюванты могут защищать полипептид от быстрого диспергирования путем его помещения в местный депозитарий, либо они могут содержать вещества, стимулирующие секрецию факторов хозяина, которые индуцируют хемотаксис макрофагов и других компонентов иммунной системы. Если вводится полипептид, то схема иммунизации будет предпочтительно включать два или более введений полипептида в течение нескольких недель, однако, данный полипептид может быть также введен и один раз.
После иммунизации животного антигеном DLL4, у этого животного могут быть продуцированы антитела, и/или от этого животного могут быть получены антитело-продуцирующие клетки. Сыворотку, содержащую анти-DLL4 антитело, получают путем забора крови у животного или его умерщвления. Сыворотка может быть использована в том виде, в каком она была получена от животного, и из этой сыворотки может быть выделена иммуноглобулиновая фракция, либо из этой сыворотки могут выделены анти-DLL4 антитела. Полученные таким образом сыворотка или иммуноглобулины являются поликлональными и имеют неоднородный набор свойств.
После детектирования иммунного ответа, антитела, специфичные к антигену DLL4, например, детектируют в мышиной сыворотке, а затем у мышей извлекают селезенку и выделяют спленоциты. Затем спленоциты подвергают слиянию хорошо известными методами с любыми подходящими миеломными клетками, например, с клетками, происходящими от клеточной линии SP20, имеющейся в Американской коллекции типовых культур (ATCC, Manassas, Virginia, US). Гибридомы отбирают и клонируют путем лимитирующего разведения. После этого гибридомные клоны анализируют методами, известными специалистам, на клетки, секретирующие антитела, способные связываться с DLL4. Асцитная жидкость, которая обычно содержит высокие уровни антител, может быть получена путем иммунизации мышей позитивными гибридомными клонами.
В другом варианте изобретения антитело-продуцирующие иммортализованные гибридомы могут быть получены от иммунизированного животного. После иммунизации животных умерщвляют, и В-клетки селезенки подвергают слиянию с иммортализованными миеломными клетками методом, хорошо известным специалистам. См., например, Harlow and Lane, см. выше. В предпочтительном варианте изобретения миеломные клетки не секретируют иммуноглобулиновые полипептиды (несекреторная клеточная линия). После слияния и отбора на резистентность к антибиотикам, гибридомы скринируют с использованием DLL4 или его части, либо клеток, экспрессирующих DLL4. В предпочтительном варианте изобретения предварительный скриниг осуществляют с помощью твердофазного иммуноферментного анализа (ELISA) или радиоиммуноанализа (РИА), и предпочтительно ELISA. Пример ELISA-скрининга приводится в публикации заявки PCT № WO 00/37504, которая вводится в настоящее описание посредством ссылки.
Гибридомы, продуцирующие анти-DLL4 антитела, отбирают, клонируют, а затем скринируют на нужные свойства, включая стабильный рост гибридом, высокий уровень продуцирования антител, и желательные свойства антител, как обсуждается ниже. Гибридомы могут быть культивированы и размножены in vivo у сингенных животных, у животных, у которых отсутствует иммунная система, например, у «голых» мышей, либо in vitro в клеточной культуре. Методы отбора, клонирования и размножения гибридом хорошо известны среднему специалисту в данной области.
В предпочтительном варианте изобретения гибридомами являются мышиные гибридомы, описанные выше. В другом варианте изобретения гибридомы продуцируют у животных, не являющихся человеком или мышами, например, у таких животных, как крысы, овцы, свиньи, козы, крупный рогатый скот или лошади. В еще одном предпочтительном варианте изобретения, гибридомами являются человеческие гибридомы, в которых человеческая несекреторная миелома гибридизирована с человеческими клетками, экспрессирующими анти-DLL4 антитело.
Фрагменты антител, распознающие специфические эпитопы, могут быть получены известными методами. Так, например, Fab- и F(ab')2-фрагменты согласно изобретению могут быть получены путем протеолитического расщепления молекул иммуноглобулина с использованием ферментов, таких как папаин (для получения Fab-фрагментов) или пепсин (для получения F(ab')2-фрагментов). F(ab')2-фрагменты содержат вариабельную область, константную область легкой цепи и домен CH1 тяжелой цепи.
2. Получение анти-DLL4 моноклональных антител с использованием SLAM
В другом аспекте изобретения рекомбинантные антитела получают из одиночных выделенных лимфоцитов в соответствии с процедурой, называемой специалистами методом отбора антитело-продуцирующих лимфоцитов (SLAM), описанным в патенте США № 5627052, в публикации заявки PCT WO 92/02551 и в публикации Babcock, J.S. et al. Proc. Natl. Acad. Sci. USA 93: 7843-7848 (1996). В этом методе одиночные клетки, секретирующие представляющие интерес антитела, например, лимфоциты, происходящие от любого иммунизированного животного, описанного в разделе I.А.1 (см. выше), скринируют с помощью анализа методом ангигенспецифических гемолитических бляшек, где антиген DLL4, субъединицу DLL4 или ее фрагмент подвергают взаимодействию с бараньими эритроцитами с помощью линкера, такого как биотин, и используют для идентификации одиночных клеток, секретирующих антитела, специфичные к DLL4. После идентификации представляющих интерес антитело-секретирующих клеток, кДНК вариабельной области тяжелой и легкой цепей извлекают из клеток посредством ПЦР с обратной транскриптазой (ОТ-ПЦР), после чего такие вариабельные области могут быть экспрессированы в окружении соответствующих константных областей иммуноглобулинов (например, человеческих константных областей) в клетках-хозяевах млекопитающих, таких как клетки COS или CHO. Эти клетки-хозяева, трансфицированные амплифицированными последовательностями иммуноглобулина, происходящими от in vivo отобранных лимфоцитов, могут быть подвергнуты дополнительному анализу и отбору in vitro, например, путем пэннинга трансфицированных клеток в целях выделения клеток, экспрессирующих антитела против DLL4. Затем амплифицированные последовательности иммуноглобулина могут быть модифицированы in vitro, например, методами аффинного созревания in vitro. См., например, публикацию заявки PCT WO 97/29131 и публикацию заявки PCT WO 00/56772.
3. Получение анти-DLL4 моноклональных антител с использованием трансгенных животных
В другом варианте изобретения антитела продуцируют путем иммунизации животного, не являющегося человеком и содержащего некоторые или все локусы человеческих иммуноглобулинов, антигеном DLL4. В предпочтительном варианте изобретения животное, не являющееся человеком, представляет собой трансгенную мышь XENOMOUSE®, то есть искусственно сконструированный штамм мыши, который содержит крупные фрагменты локусов человеческого иммуноглобулина и является дефицитным по продуцированию мышиного антитела. См., например, Green et al. Nature Genetics 7:1 3-21 (1994) и патенты США №№ 5916771, 5939598, 5985615, 5998209, 6075181, 6091001, 6114598 и 6130364. См. также публикации заявок РСТ WO 91/10741, WO 94/02602, WO 96/34096, WO 96/33735, WO 98/16654, WO 98/24893, WO 98/50433, WO 99/45031, WO 99/53049, WO 00/09560 и WO 00/037504. Трансгенная мышь XENOMOUSE® продуцирует репертуар полностью человеческих антител, подобных антителам взрослого человека, и генерирует антигенспецифические человеческие моноклональные антитела. Трансгенная мышь XENOMOUSE® содержит приблизительно 80% репертуара человеческих антител, что обусловлено введением фрагментов локусов человеческой тяжелой цепи и х локусов человеческой легкой цепи, имеющих размер мегаоснований и конфигурацию зародышевых линий YAC. См. публикации Mendez et al., Nature Genetics 15: 146-156 (1997), Green & Jakobovits J. Exp. Med. 188: 483-495 (1998), описание которых вводится в настоящее описание посредством ссылки.
4. Получение анти-DLL4 моноклональных антител с использованием библиотек рекомбинантных антител
Методы in vitro могут быть также применены для получения антител согласно изобретению, где указанную библиотеку антител скринируют для идентификации антитела, обладающего нужной специфичностью связывания с DLL4. Методы такого скрининга библиотек рекомбинантных антител хорошо известны специалистам и включают методы, описанные, например, в патенте США № 5223409 (Ladner et al.); в публикации заявки PCT № WO 92/18619 (Kang et al.); в публикации заявки PCT № WO 91/17271 (Dower et al.); в публикации заявки PCT № WO 92/20791 (Winter et al.); в публикации заявки PCT № WO 92/15679 (Markland et al.); в публикации заявки PCT № WO 93/01288 (Breitling et al.); в публикации заявки PCT № WO 92/01047 (McCafferty et al.); в публикации заявки PCT № WO 92/09690 (Garrard et al.); Fuchs et al., Bio/Technology, 9: 1369-1372 (1991); Hay et al., Hum. Antibod. Hybridomas, 3: 81-85 (1992); Huse et al., Science, 246: 1275-1281 (1989); McCafferty et al., Nature, 348: 552-554 (1990); Griffiths et al., EMBO J., 12: 725-734 (1993); Hawkins et al., J. Mol. Biol, 226: 889-896 (1992); Clackson et al., Nature, 352: 624-628 (1991); Gram et al., Proc. Natl. Acad. Sci. USA, 89: 3576-3580 (1992); Garrard et al., Bio/Technology, 9: 1373-1377 (1991); Hoogenboom et al., Nucl Acids Res., 19: 4133-4137 (1991); Barbas et al., Proc. Natl. Acad. Sci. USA, 88: 7978-7982 (1991); в публикации заявки на патент США № 2003/0186374; и в публикации заявки PCT № WO 97/29131, которые вводятся в настоящее описание посредством ссылки.
Библиотека рекомбинантных антител может быть получена у индивидуума, иммунизированного DLL4 или частью DLL4. Альтернативно, библиотека рекомбинантных антител может быть получена у индивидуума, ранее не участвующего в экспериментах, то есть у индивидуума, который не был иммунизирован DLL4, например, может быть получена библиотека человеческих антител, происходящая от человека, который не был иммунизирован человеческим DLL4. Антитела согласно изобретению отбирают путем скрининга библиотеки рекомбинантных антител с использованием пептида, содержащего человеческий DLL4, в целях получения антител, распознающих DLL4. Методы проведения такого скрининга и отбора хорошо известны специалистам и описаны в публикациях, указанных в предыдущем параграфе. Для отбора антител согласно изобретению, обладающих конкретной аффинностью связывания с DLL4, таких как антитела, которые диссоциируют из человеческого DLL4 с конкретной константой скорости диссоциации Koff, может быть применен хорошо известный метод поверхностного плазмонного резонанса, который позволяет проводить отбор антител, имеющих нужную константу скорости диссоциации Koff. Для отбора антител согласно изобретению, обладающих конкретной активностью нейтрализации hDLL4, таких как антитела с конкретным значением IC50, могут быть применены стандартные методы, известные специалистам в области анализа на ингибирование активности DLL4.
В одном из аспектов настоящее изобретение относится к выделенному антителу или к его антигенсвязывающей части, которые связываются с человеческим DLL4. Предпочтительным антителом является нейтрализующее антитело. В различных вариантах изобретения указанным антителом является рекомбинантное антитело или моноклональное антитело. Так, например, антитела согласно изобретению могут быть также получены различными методами фагового представления, известными специалистам. В методах фагового представления функциональные домены антител представлены на поверхности фаговых частиц, которые несут полинуклеотидные последовательности, кодирующие эти домены. Такой фаг может быть использован для представления антигенсвязывающих доменов, экспрессированных из репертуара или комбинаторной библиотеки антител (например, человеческих или мышиных антител). Фаг, экспрессирующий антигенсвязывающий домен, который связывается с представляющим интерес антигеном, может быть отобран или идентифицирован с использованием антигена, например, меченого антигена или антигена, связанного с твердой поверхностью или сферой или иммобилизированного на этой поверхности или сфере. Фагом, используемым в этих методах, обычно является нитчатый фаг, включающий связывающие домены фагов fd и M13, экспрессируемые из фага, имеющего домены Fab-фрагмента, Fv-фрагмента или стабилизированного дисульфидом Fv-фрагмента антител, рекомбинантно присоединенные к белку фагового гена III или VIII. Репрезентативными методами фагового представления, которые могут быть применены для получения антител согласно изобретению, являются методы, описанные Brinkmann et al., J. Immunol. Methods 182: 41-50 (1995); Ames et al., J. Immunol. Methods 184: 177-186 (1995); Kettleborough et al., Eur. J. Immunol. 24: 952-958 (1994); Persic et al., Gene 187:9-18 (1997); Burton et al., Advances in Immunology 57: 191-280 (1994); в заявке PCT № PCT/GB91/01134; в публикациях заявок PCT WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401; и в патентах США №№ 5698426; 5223409; 5403484; 5580717; 5427908; 5750753; 5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743 и 5969108, которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
Как описано в цитируемых выше работах, после отбора фага, антитело-кодирующие области фага могут быть выделены и использованы для получения полноразмерных антител, включая человеческие антитела или любой другой нужный антигенсвязывающий фрагмент, и экспрессированы в любом нужном хозяине, включая клетки млекопитающих, клетки насекомых, клетки растений, дрожжи и бактерии, например, подробно описанные ниже. Так, например, способы рекомбинантного продуцирования Fab-, Fab'- и F(ab')2-фрагментов могут быть также осуществлены с применением методов, известных специалистам, таких как методы, описанные в публикации заявки РСТ WO 92/22324; и в публикациях Mullinax et al., BioTechniques 12(6): 864-869 (1992); и Sawai et al., Am. J. Reprod. Immunol. 34: 26-34 (1995); и Better et al., Science 240: 1041-1043 (1988) (указанные публикации во всей своей полноте вводятся в настоящее описание посредством ссылки). Примерами методов, которые могут быть применены для продуцирования одноцепочечных Fv-фрагментов и антител, являются методы, описанные в патентах США 4946778 и 5258498; и в публикациях Huston et al., Methods in Enzymology 203: 46-88 (1991); Shu et al., Proc. Natl. Acad. Sci. USA 90: 7995-7999 (1993); и Skerra et al., Science 240: 1038-1041 (1988).
В качестве альтернативы скринингу библиотек рекомбинантных антител методом фагового представления, используемому для идентификации антител согласно изобретению, могут быть применены и другие методы, известные специалистам в области скрининга крупных комбинаторных библиотек. Одним из типов альтернативной экспрессионной системы является система, в которой библиотеку рекомбинантных антител экспрессируют в виде гибрида «РНК-белок», как описано в публикации заявки PCT WO 98/31700 (Szostak и Roberts), и в публикации Roberts & Szostak, Proc. Natl. Acad. Sci. USA 94: 12297-12302 (1997). В этой системе ковалентное связывание осуществляется между мРНК и пептидом или белком, которые она кодирует, посредством in vitro трансляции синтетических мРНК, несущих у своего 3'-конца пуромицин, то есть антибиотик-акцептор пептидила. Таким образом, специфическая мРНК может быть обогащена из комплексной смеси мРНК (например, комбинаторной библиотеки) исходя из свойств кодируемого пептида или белка, например, антитела или его части, таких как связывание антитела или его части с антигеном с двойной специфичностью. Последовательности нуклеиновых кислот, кодирующие антитела или их части, выявленные путем скрининга указанных библиотек, могут быть экспрессированы описанными здесь рекомбинантными методами (например, в клетках-хозяевах млекопитающих), и кроме того, они могут быть подвергнуты последующему аффинному созреванию путем проведения либо дополнительных раундов скрининга гибридов «мРНК-пептид», где в их первоначально отобранную(ые) последовательность(и) были введены мутации, либо другими методами аффинного созревания рекомбинантных антител in vitro, описанными выше. Предпочтительным примером такой методики является технология представления PROfusion, используемая в Примерах (см. ниже).
В другом подходе, антитела согласно изобретению могут быть также получены методами дрожжевого представления, известными специалистам. В методах дрожжевого представления, для связывания доменов антител со стенками дрожжевых клеток и их представления на поверхности дрожжей применяются генетические методы. В частности, такие дрожжи могут быть использованы для представления антигенсвязывающих доменов, экспрессируемых из репертуара или комбинаторной библиотеки антител (например, человеческих или мышиных антител). Примерами методов дрожжевого представления, которые могут быть применены для получения антител согласно изобретению, являются методы, описанные в патенте США № 6699658 (Wittrup et al.), который вводится в настоящее описание посредством ссылки.
B. Продуцирование рекомбинантных анти-DLL4 антител
Антитела согласно изобретению могут быть продуцированы любыми методами, известными специалистам. Так, например, экспрессию в клетках-хозяевах, где экспрессионный(е) вектор(ы), кодирующий(ие) тяжелую и легкую цепи, был(и) перенесен(ы) в указанную клетку-хозяина, осуществляют стандартными методами. Различные формы термина «трансфекция» охватывают широкий ряд методов, обычно применяемых для введения экзогенной ДНК в прокариотические или эукариотические клетки-хозяева, например, электропорацию, осаждение фосфатом кальция, трансфекцию, опосредуемую DEAE-декстраном, и т.п. Хотя антитела согласно изобретению могут экспрессироваться в прокариотических или эукариотических клетках-хозаевах, однако, предпочтительной является экспрессия антител в эукариотических клетках, а наиболее предпочтительно, в клетках-хозяевах млекопитающих, поскольку такие эукариотические клетки (а в частности, клетки млекопитающих) с большей вероятностью, чем прокариотические клетки, будут подвергаться слиянию и секретировать «правильно» уложенное и иммунологически активное антитело.
Предпочтительными клетками-хозяевами млекопитающих, используемыми для экспрессии рекомбинантных антител согласно изобретению, являются клетки яичника китайского хомячка (клетки CHO) (включая клетки dhfr-CHO, описанные Urlaub и Chasin, Proc. Natl. Acad. Sci. USA 77: 4216-4220 (1980)), используемые вместе с DHFR-селективным маркером, например, как описано Kaufman и Sharp J. Mol. Biol. 159: 601-621 (1982), клетки миеломы NSO, клетки COS и клетки SP2. После введения рекомбинантных экспрессионных векторов, содержащих гены антител, в клетки-хозяева млекопитающих, антитела получают путем культивирования клеток-хозяев в течение периода времени, достаточного для экспрессии антитела в клетках-хозяевах или, более предпочтительно, секреции антитела в культуральную среду, в которой выращивают клетки-хозяева. Антитела могут быть выделены из культуральной среды стандартными методами очистки белков.
Клетки-хозяева могут быть также использованы для продуцирования функциональных фрагментов антитела, таких как Fab-фрагменты или молекулы scFv. Совершенно очевидно, что в объем настоящего изобретения входят варианты вышеописанных процедур. Так, например, может оказаться желательной трансфекция клеток-хозяев ДНК, кодирующей функциональные фрагменты легкой цепи и/или тяжелой цепи антитела согласно изобретению. Техника рекомбинантных ДНК может быть также применена для удаления некоторых или всех ДНК, кодирующих легкую или тяжелую цепи или обе этих цепи, которые не являются необходимыми для связывания с представляющими интерес антигенами. В объем термина «антитела согласно изобретению» также входят молекулы, экспрессируемые такими усеченными молекулами ДНК. Кроме того, могут быть продуцированы бифункциональные антитела, в которых одна тяжелая цепь и одна легкая цепь представляют собой антитело согласно изобретению, а другие тяжелая и легкая цепи являются специфичными к антигену, не представляющему интерес с точки зрения настоящего изобретения, где указанный способ продуцирования осуществляют путем перекрестного сшивания антитела согласно изобретению со вторым антителом стандартными химическими методами перекрестного сшивания.
В предпочтительной системе рекомбинантной экспрессии антитела или его антигенсвязывающей части согласно изобретению, рекомбинантный экспрессионный вектор, кодирующий тяжелую цепь и легкую цепь антитела, встраивают в клетки dhfr-CHO методом трансфекции, опосредуемой фосфатом кальция. В рекомбинантном экспрессионном векторе гены тяжелой и легкой цепей антитела функционально присоединены к регуляторным элементам «энхансер CMV/промотор AdMLP», что приводит к запуску транскрипции генов на высоком уровне. Рекомбинантный экспрессионный вектор также несет ген DHFR, что позволяет проводить отбор клеток CHO, трансфицированных вектором, путем их культивирования в присутствии метотрексата/амплификации. Отобранные трансформированные клетки-хозяева культивируют для экспрессии тяжелой и легкой цепей антитела, и из культуральной среды выделяют интактное антитело. Для получения рекомбинантного экспрессионного вектора и для трансфекции клеток-хозяев, отбора трансформантов, культивирования клеток-хозяев и выделения антитела из культуральной среды применяют стандартные методы молекулярной биологии. Настоящее изобретение также относится к способу синтеза рекомбинантного антитела согласно изобретению путем культивирования клеток-хозяев согласно изобретению в подходящей культуральной среде с получением рекомбинантного антитела согласно изобретению. Этот способ может также включать выделение рекомбинантного антитела из культуральной среды.
1. Анти-DLL4 антитела
Аминокислотные последовательности VH- и VL-областей выделенных полностью человеческих антител, которые связываются с человеческим DLL4, представлены для клонов E9 и A10 в таблице 4 (см. ниже в разделе «Примеры»). Было установлено, что изолированные последовательности CDR анти-DLL4 антител E9 и A10 принадлежат к двум новым семействам DLL4-связывающих белков, выделенных в соответствии с настоящим изобретением, и содержат полипептиды, которые включают последовательности CDR, происходящие от E9 и его аффинно зрелых клонов, и последовательности CDR, происходящие от A10 и его аффинно зрелых клонов. Вариабельные области и CDR моноклонального антитела E9 и его аффинно зрелых производных указаны в таблицах 4, 8, 14, 18 и 19. Вариабельные области и CDR моноклонального антитела A10 и его аффинно зрелых производных указаны в таблицах 4, 9 и 10. Для продуцирования и для отбора CDR в целях получения связывающихся белков согласно изобретению, обладающих предпочтительной активностью связывания с DLL4 и/или нейтрализации DLL4, а именно человеческого DLL4, могут быть применены известные стандартные методы получения связывающихся белков согласно изобретению и оценки способности этих связывающихся белков связываться с DLL4 и/или нейтрализовать их активность, включая, но не ограничиваясь ими, методы, конкретно описанные в настоящей заявке.
Исходя из результатов сопоставления аминокислотных последовательностей CDR вариабельных областей тяжелой цепи (VH) и вариабельных областей легкой цепи (VL) клонов анти-DLL4 антитела E9, описанных в настоящей заявке, был получен DLL4-связывающий белок согласно изобретению, содержащий антигенсвязывающий домен, способный связываться с человеческим DLL4, где указанный антигенсвязывающий домен содержит по меньшей мере одну или несколько CDR, выбранных из группы, состоящей из:
CDR-H1: X1-X2-X3-X4-X5-X6-X7 (SEQ ID NO: 99), где:
X1 представляет собой S или N;
X2 представляет собой S, G или N;
X3 представляет собой S, N, T, G или R;
X4 представляет собой Y;
X5 представляет собой Y или H;
X6 представляет собой W; и
X7 представляет собой G;
CDR-H2: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16 (SEQ ID NO: 100), где:
X1 представляет собой D;
X2 представляет собой I;
X3 представляет собой Y, N или S;
X4 представляет собой Y;
X5 представляет собой T, N, A, I, S или R;
X6 представляет собой G;
X7 представляет собой S, N, T или G;
X8 представляет собой T;
X9 представляет собой Y;
X10 представляет собой Y;
X11 представляет собой N;
X12 представляет собой P;
X13 представляет собой S;
X14 представляет собой L;
X15 представляет собой K; и
X16 представляет собой S, N, D или G;
CDR-H3: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11 (SEQ ID NO: 101), где:
X1 представляет собой E, Y, F, Q, W, L или A;
X2 представляет собой D, A, S, G, V, E или N;
X3 представляет собой V, M, L, P или A;
X4 представляет собой I, A, P, R, S, K, Q, V, G, M или E;
X5 представляет собой L, Y, F или M;
X6 представляет собой R, G, S, Q или A;
X7 представляет собой G;
X8 представляет собой G, A или S;
X9 представляет собой S, A, L, V, R или G;
X10 представляет собой D; и
X11 представляет собой Y, D, S, N, H, E, R, L, P, C, I, M, T, Q или K;
CDR-L1: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11 (SEQ ID NO: 102), где:
X1 представляет собой S;
X2 представляет собой G;
X3 представляет собой Q, E или D;
X4 представляет собой R, S, G, M, K, L или T;
X5 представляет собой L;
X6 представляет собой G;
X7 представляет собой D или E;
X8 представляет собой K;
X9 представляет собой Y;
X10 представляет собой A или V; и
X11 представляет собой S;
CDR-L2: X1-X2-X3-X4-X5-X6-X7 (SEQ ID NO: 103), где:
X1 представляет собой E или Q;
X2 представляет собой D;
X3 представляет собой S, L, T, A, E или F;
X4 представляет собой K, T, Е, N, Q, S или M;
X5 представляет собой R;
X6 представляет собой P; и
X7 представляет собой S;
и
CDR-L3: X1-X2-X3-X4-X5-X6-X7-X8-X9 (SEQ ID NO: 104), где:
X1 представляет собой Q;
X2 представляет собой A;
X3 представляет собой W;
X4 представляет собой D;
X5 представляет собой R, S, M, E, N, G или K;
X6 представляет собой D или E;
X7 представляет собой T, V, A, S или M;
X8 представляет собой G, A или C; и
X9 представляет собой V.
Предпочтительно, DLL4-связывающий белок, содержащий одну или несколько вышеописанных CDR, связывается с человеческим («hu», «h») DLL4, а также с одним или несколькими белками DLL4, выбранными из группы, состоящей из мышиного («mu») DLL4, DLL4 яванского макака («cyno») и крысиного DLL4.
Исходя из результатов сопоставления аминокислотных последовательностей CDR вариабельных областей тяжелой цепи (VH) и вариабельных областей легкой цепи (VL) клонов анти-DLL4 антитела А10, описанных в настоящей заявке, был получен DLL4-связывающий белок согласно изобретению, содержащий антигенсвязывающий домен, способный связываться с человеческим DLL4, где указанный антигенсвязывающий домен содержит по меньшей мере одну или несколько CDR, выбранных из группы, состоящей из:
CDR-H1: X1-X2-X3-X4-Х5 (SEQ ID NO: 105), где:
X1 представляет собой S, N или D;
X2 представляет собой H или Y;
X3 представляет собой W;
X4 представляет собой M; и
X5 представляет собой S или H;
CDR-H2: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-Х17 (SEQ ID NO: 106), где:
X1 представляет собой I, D, M или Т;
X2 представляет собой I;
X3 представляет собой S;
X4 представляет собой Y, N, S, Q, V, T, H или D;
X5 представляет собой D;
X6 представляет собой G;
X7 представляет собой S, R, I, T, G, K, H или N;
X8 представляет собой N, Y, S, I или T;
X9 представляет собой K, M, N, Q, E, T, R, S, A или L;
X10 представляет собой Y, D или E;
X11 представляет собой S или Y;
X12 представляет собой А;
X13 представляет собой D;
X14 представляет собой S;
X15 представляет собой V;
X16 представляет собой К; и
X17 представляет собой G;
CDR-H3: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10 (SEQ ID NO: 107), где:
X1 представляет собой A;
X2 представляет собой G, А или R;
X3 представляет собой G;
X4 представляет собой G, S или А;
X5 представляет собой N;
X6 представляет собой V или М;
X7 представляет собой G;
X8 представляет собой F, L, Y или M;
X9 представляет собой D; и
X10 представляет собой I, S или L;
CDR-L1: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11 (SEQ ID NO: 108), где:
X1 представляет собой S;
X2 представляет собой А или G;
X3 представляет собой D;
X4 представляет собой K, N, L, Q, M, E, S, T, G или D;
X5 представляет собой L;
X6 представляет собой G;
X7 представляет собой T, S, N, A, G или E;
X8 представляет собой K, Q, N или R;
X9 представляет собой Y;
X10 представляет собой V или I; и
X11 представляет собой S;
CDR-L2: X1-X2-X3-X4-X5-X6-X7 (SEQ ID NO: 109), где:
X1 представляет собой Q;
X2 представляет собой D;
X3 представляет собой A, G, W, S или D;
X4 представляет собой K, M, Q, N, L, T, I или E;
X5 представляет собой R;
X6 представляет собой P;
X7 представляет собой S; и
CDR-L3: X1-X2-X3-X4-X5-X6-X7-X8-X9 (SEQ ID NO: 110), где:
X1 представляет собой Q;
X2 представляет собой S или A;
X3 представляет собой W;
X4 представляет собой D;
X5 представляет собой R, S, Q, P, A, V, W или M;
X6 представляет собой S, G, I, N, R или T;
X7 представляет собой D или G;
X8 представляет собой V, A, P или E; и
X9 представляет собой V.
Предпочтительно, DLL4-связывающий белок, содержащий одну или несколько вышеописанных CDR, связывается с человеческим («hu») DLL4, а также с DLL4 яванского макака («cyno»).
2. Химерные анти-DLL4 антитела
Химерное антитело представляет собой молекулу, в которой различные части антитела происходят от животных различных видов, и такое антитело имеет вариабельную область, происходящую от мышиного моноклонального антитела, и константную область человеческого иммуноглобулина. См., например, Morrison, Science, 229: 1202-1207 (1985); Oi et al., BioTechniques, 4: 214 (1986); Gillies et al., J. Immunol. Methods, 125: 191-202 (1989); патенты США №№ 5807715, 4816567 и 4816397, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. Кроме того, могут быть применены методы продуцирования «химерных антител» путем сплайсинга генов молекулы мышиного антитела, обладающей соответствующей специфичностью к антигену, вместе с генами молекулы человеческого антитела, обладающей соответствующей биологической активностью. См., например, публикации Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984); Neuberger et al., Nature, 312: 604-608 (1984); Takeda et al., Nature, 314: 452-454 (1985), которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
3. CDR-привитые анти-DLL4 антитела
Изолированные последовательности CDR анти-DLL4 антитела согласно изобретению могут быть использованы для получения CDR-привитых антител в целях модуляции свойств исходного антитела. Такими свойствами являются, но не ограничиваются ими, кинетика связывания, аффинность, биологическая активность, видовая перекрестная реактивность, молекулярная видовая перекрестная реактивность, эпитоп, физико-химические свойства, фармакокинетические свойства, фармакодинамические свойства или фармакологические свойства. CDR-привитые антитела содержат последовательности вариабельной области тяжелой и легкой цепей, происходящие от человеческого антитела или антитела приматов, не являющихся человеком, где одна или несколько областей CDR цепи VH и/или VL заменены CDR-последовательностями исходного анти-DLL4 антитела. Каркасная последовательность, происходящая от любого человеческого антитела или антитела приматов, не являющихся человеком, может служить в качестве матрицы для присоединения CDR. Однако замена прямой цепи на такую каркасную последовательность часто приводит к некоторой потери аффинности связывания с антигеном. Чем больше гомология человеческого антитела или антитела животного другого вида с исходным человеческим антителом, тем меньше вероятность того, что объединение CDR с новой человеческой каркасной областью или каркасной областью приматов, не являющихся человеком, будет вносить изменения в CDR, приводящие к снижению аффинности или к ухудшению других свойств. Поэтому, предпочтительно, чтобы вариабельная каркасная область, выбранная для замены человеческой вариабельной каркасной области, не включая CDR, была по меньшей мере на 30% идентична каркасной вариабельной области человеческого антитела. Более предпочтительно, чтобы вариабельная каркасная область, выбранная для замены человеческой вариабельной каркасной области, не включая CDR, была по меньшей мере на 40% идентична каркасной вариабельной области человеческого антитела. Более предпочтительно, чтобы вариабельная каркасная область, выбранная для замены человеческой вариабельной каркасной области, не включая CDR, была по меньшей мере на 50% идентична каркасной вариабельной области человеческого антитела. Более предпочтительно, чтобы вариабельная каркасная область, выбранная для замены человеческой вариабельной каркасной области, не включая CDR, была по меньшей мере на 60% идентична каркасной вариабельной области человеческого антитела. Более предпочтительно, чтобы новая каркасная область вариабельной области человека или приматов, не являющихся человеком, и исходная человеческая вариабельная каркасная область, не включая CDR, имели последовательности, идентичные по меньшей мере на 70%. Более предпочтительно, чтобы новая каркасная область вариабельной области человека или приматов, не являющихся человеком, и исходная человеческая вариабельная каркасная область, не включая CDR, имели последовательности, идентичные по меньшей мере на 75%. И наиболее предпочтительно, чтобы новая каркасная область вариабельной области человека или приматов, не являющихся человеком, и исходная человеческая вариабельная каркасная область, не включая CDR, имели последовательности, идентичные по меньшей мере на 80%. Даже при использовании в высокой степени гомологичных каркасных человеческих последовательностей и последовательностей приматов, не являющихся человеком, для присоединения к CDR исходного человеческого анти-DLL4 антитела, полученное привитое антитело может до некоторой степени терять аффинность связывания с антигеном. В этом случае, для восстановления аффинности необходимо включить по меньшей мере одну или несколько замен ключевых каркасных остатков исходного антитела в соответствующее положение полученного привитого антитела. Такой ключевой остаток может быть выбран из группы, состоящей из:
остатка, смежного с CDR;
остатка сайта гликозилирования;
редкого остатка;
остатка, способного взаимодействовать с человеческим DLL4;
канонического остатка;
остатка, расположенного в зоне контактирования вариабельной области тяжелой цепи с вариабельной областью легкой цепи;
остатка в зоне Верньера; и
остатка в области, которая перекрывается с областью CDR1 вариабельной тяжелой цепи, определенной по Чотиа, и с первой каркасной областью тяжелой цепи, определенной по Кэбату.
4. Гуманизированные анти-DLL4 антитела
Хотя для композиций согласно изобретению не требуется получения гуманизированных антител, однако, такие гуманизированные анти-DLL4 антитела могут быть получены с использованием композиций согласно изобретению. Гуманизированные антитела представляют собой молекулы антител, происходящие от антител нечеловеческих видов, которые связываются с нужным антигеном, и имеют одну или несколько гипервариабельных областей (CDR), происходящих от нечеловеческих видов, и каркасные области молекулы человеческого иммуноглобулина. Известные последовательности человеческих Ig описаны, например, в интернете на web-сайтах (www.), например, ncbi.nlm.nih.gov/entrez/query.fcgi;
atcc.org/phage/hdb.html;
sciquest.com/;
abcam.com/;
antibodyresource.com/onlinecomp.html;
public.iastate.edu/.about.pedro/research_tools.html;
mgen.uniheidelberg.de/SD/IT/IT.html;
whfreeman.com/immunology/CH05/kuby05.htm;
library.thinkquest.org/12429/Immune/Antibody.html;
hhmi.org/grants/lectures/1996/vlab/;
path.-cam.ac.Uk/.about.mrc7/mikeimages.html;
antibodyresource.com/;
mcb.harvard.edu/BioLinks/Immunology.html;
immunologylink.com/;
pathbox.wustl.edu/.about.hcenter/index.html;
biotech.ufl.edu/.about.hcl/;
pebio.com/pa/340913-/340913.html;
nal.usda.gov/awic/pubs/antibody/;
m.ehimeu.acjp/.about.yasuhito/Elisa.html;
biodesign.com/table.asp;
icnet.uk/axp/facs/davies/lin-ks.html;
biotech.ufl.edu-/.about.fccl/protocol.html;
isac-net.org/sites_geo.html;
aximtl.imt.uni-marburg.de/.about.rek/AEP-Start.html;
baserv.uci.kun.nl/.about.jraats/linksl.html;
recab.uni-hd.de/immuno.bme.nwu.edu/;
mrc-cpe.cam.ac.uk/imt-doc/public/INTRO.html;
ibt.unam.mx/vir/V_mice.html;
imgt.cnusc.fr:8104/;
biochem.ucl.ac.uk/.about.martin/abs/index.html;
antibody.bath.ac.uk/;
abgen.cvm.tamu.edu/lab/wwwabgen.html;
unizh.ch/.about.honegger/AHO-seminar/Slide01.html;
cryst.bbk.ac.uk/.about.ubcg07s/;
nimr.mrc.ac.uk/CC/ccaewg/ccaewg.htm;
path.cam.ac.uk/.about.mrc7/humanisation/TAHHP.html;
ibt.unam.mx/vir/structure/stat_aim.html;
biosci.missouri.edu/smithgp/index.html;
cryst.bioc.cam.ac.uk/.about.fmolina/Webpages/Pept/spot-tech.html;
jerini.de/frroducts.htm;
patents.ibm.com/ibm.html, Kabat et al., Sequences of Proteins of Immunological Interest, U.S. Dept. Health (1983), которые во всей своей полноте вводятся в настоящее описание посредством ссылки. Такие «импортные» последовательности могут быть использованы для снижения иммуногенности или для снижения, усиления или модификации связывания, аффинности, скорости ассоциации, скорости диссоциации, авидности, специфичности, времени полужизни или любых других подходящих свойств, известных специалистам.
Каркасные остатки в человеческих каркасных областях могут быть заменены соответствующим остатком донорного антитела с CDR в целях изменения, например, улучшения связывания с антигеном. Такие каркасные замены идентифицируют методами, хорошо известными специалистам, например, путем моделирования взаимодействий CDR и каркасных остатков в целях идентификации каркасных остатков, играющих важную роль в связывании с антигеном, и сравнения последовательностей в целях идентификации редко встречающихся каркасных остатков в конкретных положениях. (См., например, патент США № 5585089 (Queen et al.); и публикацию Riechmann et al., Nature 332: 323-327 (1988), которые во всей своей полноте вводятся в настоящее описание посредством ссылки). Трехмерные модели иммуноглобулинов являются общедоступными и известны специалистам в данной области. Существуют компьютерные программы, которые иллюстрируют и представляют вероятные трехмерные конформационные структуры выбранных последовательностей-кандидатов иммуноглобулина. Анализ таких представлений позволяет определить вероятную роль этих остатков в функционировании последовательности-кандидата иммуноглобулина, то есть выявить остатки, влияющие на способность иммуноглобулина-кандидата связываться с антигеном. Таким образом, остатки FR могут быть выбраны из консенсусных последовательностей и «импортных» последовательностей и объединены так, чтобы получить антитело с желаемыми свойствами, такими как повышенная аффинность по отношению к антигену(ам)-мишени(ям). В общих чертах, остатки CDR непосредственно и в самой высокой степени влияют на связывание с антигеном. Антитела могут быть гуманизированы различными методами, известными специалистам, такими как, но не ограничивающимися ими, методы, описанные в публикациях Jones et al., Nature 321: 522-525 (1986); Verhoeyen et al., Science 239: 1534-1536 (1988)), Sims et al., J. Immunol. 151: 2296-2308 (1993); Chothia and Lesk, J. Mol. Biol. 196: 901-907 (1987), Carter et al., Proc. Natl. Acad. Sci. U.S.A. 89: 4285-4289 (1992); Presta et al., J. Immunol. 151: 2623-2632 (1993), Padlan, Molecular Immunology 28(4/5): 489-498 (1991); Studnicka et al., Protein Engineering 7(6): 805-814 (1994); Roguska Е.А. et al., Proc. Natl. Acad. Sci. U.S.A. 91: 969-973 (1994); в публикации РСТ №№ WO 91/09967, WO 99/06834 (PCT/US98/16280), WO 97/20032 (PCT/US96/18978), WO 92/11272 (PCT/US91/09630), WO 92/03461 (PCT/US91/05939), WO 94/18219 (PCT/US94/01234), WO 92/01047 (PCT/GB91/01134), WO 93/06213 (PCT/GB92/01755), WO90/14443, WO90/14424 и WO90/14430; в публикациях Европейских патентных заявок №№ EP059106, EP0519596 и EP0239400; в патентах США №№ 5565332, 5723323, 5976862, 5824514, 5817483, 5814476, 5763192, 5723323, 5766886, 5714352, 6204023, 6180370, 5693762, 5530101, 5585089, 5225539 и 4816567, которые во всей своей полноте вводятся в настоящее описание посредством ссылки, включая цитируемые там работы.
C. Получение антител и антитело-продуцирующих клеточных линий
Анти-DLL4 антитела согласно изобретению предпочтительно обладают высокой способностью снижать или нейтрализовать активность опухолей в отношении ангиогенеза, оцениваемую, например, с помощью любого из нескольких существующих анализов in vitro и in vivo, известных специалистам. Оценка нейтрализации активности DLL4 может быть проведена с помощью нескольких in vitro и in vivo анализов, известных специалистам. Репрезентативными параметрами для оценки нейтрализации активности DLL4 являются, но не ограничиваются ими, антитела, которые ингибируют взаимодействие DLL4 с рецептором Notch и/или путь передачи сигнала Notch при величинах IC50, составляющих примерно по меньшей мере 10-6 М, по меньшей мере 10-7 М или по меньшей мере 10-8 М.
Предпочтительно, анти-DLL4 антитела согласно изобретению также обладают высокой способностью снижать или нейтрализовать активность DLL4.
В предпочтительных вариантах изобретения изолированное антитело или его антигенсвязывающая часть связывается с человеческим DLL4, где указанное антитело или его антигенсвязывающая часть диссоциируется из человеческого DLL4 с константой скорости диссоциации Koff примерно 0,1 c-1 или менее, как было определено методом поверхностного плазмонного резонанса, или ингибирует DLL4 и/или активность человеческого DLL4 с IC50 примерно 1×10-6 М или менее. Альтернативно, указанное антитело или его антигенсвязывающая часть могут диссоциироваться из человеческого DLL4 с константой скорости диссоциации Koff примерно 1×10-2 c-1 или менее, как было определено методом поверхностного плазмонного резонанса, или могут ингибировать человеческий DLL4 и/или активность человеческого DLL4 с IC50 примерно 1×10-7 М или менее. Альтернативно, указанное антитело или его антигенсвязывающая часть могут диссоциироваться из человеческого DLL4 с константой скорости диссоциации Koff примерно 1×10-3 c-1 или менее, как было определено методом поверхностного плазмонного резонанса, или могут ингибировать человеческий DLL4 с IC50 примерно 1×10-8 М или менее. Альтернативно, указанное антитело или его антигенсвязывающая часть могут диссоциироваться из человеческого DLL4 с константой скорости диссоциации Koff примерно 1×10-4 c-1 или менее, как было определено методом поверхностного плазмонного резонанса, или могут ингибировать активность человеческого DLL4 с IC50 примерно 1×10-9 М или менее. Альтернативно, указанное антитело или его антигенсвязывающая часть могут диссоциироваться из человеческого DLL4 с константой диссоциации Koff примерно 1×10-5 c-1 или менее, как было определено методом поверхностного плазмонного резонанса, или могут ингибировать DLL4 и/или активность человеческого DLL4 с IC50 примерно 1×10-10 М или менее. Альтернативно, указанное антитело или его антигенсвязывающая часть могут диссоциироваться из человеческого DLL4 с константой скорости диссоциации Koff примерно 1×10-5 c-1 или менее, как было определено методом поверхностного плазмонного резонанса, или могут ингибировать DLL4 и/или активность человеческого DLL4 с IC50 примерно 1×10-11 М или менее.
В некоторых вариантах изобретения антитело содержит константную область тяжелой цепи, такую как константная область IgGl, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD. Предпочтительно, константная область тяжелой цепи представляет собой константную область тяжелой цепи IgGl или константную область тяжелой цепи IgG4. Кроме того, указанное антитело может содержать константную область легкой цепи, то есть либо константную область легкой цепи каппа, либо константную область легкой цепи лямбда. Предпочтительно, указанное антитело содержит константную область легкой цепи каппа. Альтернативно, часть антитела может представлять собой, например, Fab-фрагмент или одноцепочечный Fv-фрагмент.
Замены аминокислотных остатков в Fc-части, вводимые для изменения эффекторной функции антитела, известны специалистам (см. патенты США №№ 5648260 и 5624821 (Winter, et al.). Fc-часть антитела опосредует несколько важных эффекторных функций, например, индуцирование цитокинов, ADCC, фагоцитоз, комплемент-зависимую цитотоксичность (CDC), время полужизни/скорость клиренса антитела и образование комплексов антиген-антитело. В некоторых случаях желательно, чтобы терапевтическое антитело обладало этими эффекторными функциями, но в других случаях, в зависимости от терапевтического применения, такие функции могут быть необязательными или даже нежелательными. Некоторые изотипы человеческих IgG, а в частности, IgG1 и IgG3, опосредуют ADCC и CDC посредством связывания с FcγR и с комплементом C1q, соответственно. Fc-рецепторы у новорожденных (FcRn) представляют собой важные компоненты, определяющие время полужизни антител в кровотоке. В другом варианте изобретения по меньшей мере один аминокислотный остаток в константной области антитела, например, в Fc-области антитела, заменяют так, чтобы это приводило к изменению эффекторных функций антитела.
В одном из вариантов настоящее изобретение относится к меченому связывающему белку, где указанные антитело или часть антитела согласно изобретению дериватизированы другой функциональной молекулой (например, другим пептидом или белком), или связаны с такой молекулой. Так, например, меченый связывающий белок согласно изобретению может быть дериватизирован путем функционального присоединения антитела или части антитела согласно изобретению (путем химического взаимодействия, генетического слияния, нековалентного связывания или т.п.) к одной или нескольким другим молекулам, таким как другое антитело (например, биспецифическое антитело или диантитело), детектируемый агент, цитотоксическое средство, фармацевтическое средство и/или белок или пептид, которые могут опосредовать связывание антитела или его части с другой молекулой (такой как коровая область стрептавидина или полигистидиновая метка).
Подходящими детектируемыми агентами, которыми может быть деритиватизировано антитело или часть антитела согласно изобретению, являются флуоресцентные соединения. Репрезентативными детектируемыми флуоресцентными соединениями являются флуоресцеин, флуоресцеин-изотиоцианат, родамин, 5-диметиламин-1-нафталинсульфонилхлорид, фикоэритрин и т.п. Антитело может быть также дериватизировано детектируемыми ферментами, такими как щелочная фосфатаза, пероксидаза хрена, глюкоза-оксидаза и т.п. Если антитело дериватизировано детектируемым ферментом, то он может быть детектирован путем добавления вспомогательных реагентов, которые используются ферментом для продуцирования детектируемого реакционного продукта. Так, например, если таким детектируемым агентом является пероксидаза хрена, то добавление пероксида водорода и диаминобензидина приводит к образованию окрашенного реакционного продукта, который является детектируемым. Антитело может быть также дериватизировано биотином и детектировано путем непрямого измерения уровня связывания с авидином или стрептавидином.
В другом варианте настоящее изобретение относится к кристаллизованному DLL4-связывающему белку. В предпочтительном варианте настоящее изобретение относится к кристаллам описанных здесь DLL4-связывающих белков, включая полноразмерные анти-DLL4 антитела, их фрагменты, а также конструкции антител и конъюгаты связывающих белков (включая конъюгаты антител), описанные в настоящей заявке, и к составам и композициям, содержащим такие кристаллы. В одном из вариантов изобретения кристаллизованный связывающий белок имеет более длительное время полужизни in vivo, чем его растворимый аналог. В другом варианте изобретения связывающий белок сохраняет биологическую активность после кристаллизации. Кристаллизованные связывающие белки согласно изобретению могут быть получены методами, известными специалистам и описанными в публикации заявки РСТ WO 02/72636, которая вводится в настоящее описание посредством ссылки.
В другом варианте настоящее изобретение относится к гликозилированному связывающему белку, где антитело или его антигенсвязывающая часть содержат один или несколько углеводных остатков. Растущая цепь белка при его продуцировании in vivo может затем подвергаться процессингу, известному как посттрансляционная модификация. В частности, сахарные (гликозильные) остатки могут быть присоединены ферментативно, способом, известным как гликозилирование. Полученные белки, несущие ковалентно связанные олигосахаридные боковые цепи, известны как гликозилированные белки или гликопротеины. Гликозилирование белка зависит от представляющей интерес аминокислотной последовательности белка, а также от типа клетки-хозяина, в которой экспрессируется такой белок. Различные организмы могут продуцировать различные гликозилирующие ферменты (например, гликозилтрансферазы и гликозидазы) и имеют различные доступные субстраты (нуклеотидные сахара). Благодаря таким факторам характер гликозилирования белка и состав гликозильных остатков могут варьировать в зависимости от системы хозяина, в которой экспрессируется конкретный белок. Гликозильными остатками, используемыми в настоящем изобретении, являются, но не ограничиваются ими, остатки глюкозы, галактозы, маннозы, фукозы, N-ацетилглюкозамина и сиаловой кислоты. Предпочтительно, гликозилированный связывающий белок содержит гликозильные остатки, имеющие характер гликозилирования, наблюдаемый у человека.
Специалисту в данной области известно, что изменение характера гликозилирования белка может приводить к изменению свойств белка. Так, например, эффективность терапевтического белка, продуцированного в микроорганизме-хозяине, таком как дрожжи, и гликозилированного по эндогенному дрожжевому пути, может быть ниже, чем эффективность того же самого белка, экспрессируемого в клетках млекопитающих, таких как клеточная линия СНО. Такие гликопротеины могут быть также иммуногенными для человека и имеют уменьшенное время полужизни in vivo после введения. Специфические рецепторы у человека и других животных могут распознавать специфические гликозильные остатки и стимулировать быстрое выведение белка из кровотока. Другими побочными эффектами могут быть изменение укладки белка, его растворимости, чувствительности к протеазам, переноса, транспорта, компартментализации, секреции, распознавания другими белками или факторами, а также антигенности или аллергенности. В соответствии с этим, практический врач может выбрать терапевтический белок, имеющий конкретный состав и характер гликозилирования, например, белок, в котором состав и характер гликозилирования идентичны или по меньшей мере аналогичны составу или характеру гликозилирования белка, продуцированного в человеческих клетках или в видоспецифических клетках рассматриваемого животного.
Экспрессия гликозилированных белков, отличающихся от белков клеток-хозяев, может быть достигнута путем генетической модификации клеток-хозяев, осуществляемой так, чтобы эти клетки-хозяева экспрессировали гетерологичные гликозилирующие ферменты. С применением известной техники специалист-практик может самостоятельно получить антитела или их антигенсвязывающие части, имеющие характер гликозилирования, присущий человеческому белку. Так, например, дрожжевые штаммы были генетически модифицированы в целях экспрессии неприродных гликозилирующих ферментов, так, чтобы гликозилированные белки (гликопротеины), продуцируемые в этих дрожжевых штаммах, имели характер гликозилирования белка, идентичный характеру гликозилирования, присущему клеткам животных, а в частности, человеческим клеткам (см. публикации заявок на патент США №№ 2004/0018590 и 2002/0137134).
Кроме того, для специалиста в данной области очевидно, что представляющий интерес белок может быть экспрессирован с использованием библиотеки клеток-хозяев, генетически сконструированных в целях осуществления экспрессии различных гликозилирующих ферментов, для того чтобы члены библиотеки клеток-хозяев продуцировали представляющий интерес белок, имеющий измененный характер гликозилирования. Специалист-практик может затем самостоятельно выбрать и выделить представляющий интерес белок, имеющий конкретный новый характер гликозилирования. При этом предпочтительно, чтобы белок, имеющий конкретно выбранный новый характер гликозилирования, обладал улучшенными или измененными биологическими свойствами.
D. Применение DLL4-связывающих белков
Учитывая способность связываться с человеческим DLL4 и с мышиным DLL4, следует отметить, что описанные здесь DLL4-связывающие белки, включая антитела и их части, могут быть использованы для детектирования или измерения уровня DLL4 в образце (например, в смеси, в растворе или в биологическом образце, таком как кровь, сыворотка или плазма) с помощью любого из стандартных иммуноанализов, известных специалистам, таких как твердофазные иммуноферментные анализы (ELISA), радиоиммуноанализ (РИА) или иммуногистохимический анализ ткани. Настоящее изобретение относится к способу детектирования человеческого DLL4 и/или мышиного DLL4 в образце, где указанный способ включает контактирование образца с DLL4-связывающим белком и детектирование DLL4-связывающего белка, связанного с человеческим DLL4 и/или мышиным DLL4, или несвязанного связывающего белка в целях определения уровня человеческого DLL4 и/или мышиного DLL4 в образце. Описанный здесь DLL4-связывающий белок может быть прямо или опосредованно помечен детектируемым веществом для облегчения детектирования связанного или несвязанного DLL4-связывающего белка. Подходящими детектируемыми веществами являются различные ферменты, простетические группы, флуоресцентные вещества, люминесцентные вещества и радиоактивные вещества. Примерами подходящих ферментов являются пероксидаза хрена, щелочная фосфатаза, β-галактозидаза или ацетилхолинэстераза; примерами подходящих комплексов с простетическими группами являются стрептавидин/биотин и авидин/биотин; примерами подходящих флуоресцентных веществ являются умбеллиферон, флуоресцеин, флуоресцеин-изотиоцианат, родамин, дихлортриазиниламин-флуоресцеин, дансилхлорид или фикоэритрин; примером люминесцентного вещества является люминол, а примерами подходящих радиоактивных веществ являются 3H, 14C, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho или 153Sm.
Биологическими образцами, которые могут быть оценены на DLL4, являются моча, фекалии, кровь, сыворотка, плазма, пот, слюна, мазок из ротовой полости (щечный мазок, мазок с языка или из зева), влагалищный мазок, мазок из прямой кишки, кожный мазок, соскоб с кожи, биоптат ткани, а также любой другой образец ткани, который может быть получен методами, известными специалистам.
Альтернативно мечению связывающего белка, человеческий DLL4 может быть проанализирован в биологических жидкостях с помощью конкуретного иммуноанализа, проводимого с использованием стандартных рекомбинантных человеческих (rh) DLL4, меченных детектируемым веществом, и описанного здесь немеченого DLL4-связывающего белка. В этом анализе, биологический образец, меченые rhDLL4-стандарты и DLL4-связывающий белок объединяют и определяют количество меченого rhDLL4-стандарта, связанного с немеченым связыващим белком. Количество человеческого DLL4 в биологическом образце обратно пропорционально количеству меченного rhDLL4-стандарта, связанного с DLL4-связывающим белком. Аналогичным образом, человеческий DLL4 может быть также проанализирован в биологических жидкостях с помощью конкурентного иммуноанализа, проводимого с использованием rhDLL4-стандартов, меченных детектируемым веществом, и описанного здесь немеченого DLL4-связывающего белка.
Предпочтительно, DLL4-связывающие белки согласно изобретению обладают способностью нейтрализовать активность DLL4, а в частности, активность hDLL4, in vitro и in vivo. В соответствии с этим, такие связывающие белки согласно изобретению могут быть использованы для ингибирования активности DLL4, например, в клеточной культуре, содержащей DLL4, у человека или у других млекопитающих, у которых экспрессируются DLL4, перекрестно реагирующий со связывающим белком согласно изобретению. В одном из вариантов настоящее изобретение относится к способу ингибирования активности DLL4, где указанный способ включает контактирование DLL4 с анти-DLL4 антителом или его частью согласно изобретению с последующим ингибированием активности DLL4. Так, например, в клеточной культуре, содержащей или предположительно содержащей DLL4, антитело или его часть согласно изобретению могут быть добавлены в клеточную среду в целях ингибирования активности DLL4 в культуре.
В другом варианте настоящее изобретение относится к способу снижения активности DLL4 у индивидуума, и преимущественно у индивидуума, страдающего заболеванием или расстройством, ассоциированным с негативным воздействием DLL4 или активности DLL4. Настоящее изобретение относится к способам снижения уровня DLL4 или активности DLL4 у индивидуума, страдающего указанным заболеванием или расстройством, где указанный способ включает введение индивидууму DLL4-связывающего белка согласно изобретению в целях снижения уровня DLL4 или активности DLL4 у индивидуума. Предпочтительно, DLL4 представляет собой человеческий DLL4, а указанным индивидуумом является человек. Альтернативно, таким индивидуумом может быть млекопитающее, экспрессирующее DLL4, с которым может связываться DLL4-связывающий белок согласно изобретению. Кроме того, таким индивидуумом может быть млекопитающее, которому был введен DLL4 (например, путем прямого введения DLL4 или посредством экспрессии DLL4-трансгена). Антитело или другой DLL4-связывающий белок согласно изобретению может быть введен человеку в терапевтических целях. Кроме того, DLL4-связывающий белок согласно изобретению может быть введен млекопитающему, не являющемуся человеком и экспрессирующему DLL4, с которым может связываться указанный связывающий белок, где указанный белок вводят для лечения указанного животного, или используют для создания животного с моделью человеческого заболевания. В последнем случае такие животные-модели могут быть использованы для оценки терапевтической эффективности антител и других DLL4-связывающих белков согласно изобретению (например, для тестирования доз и проведения курсов лечения путем введения указанного белка).
Используемый здесь термин «расстройство, ассоциированное с негативным воздействием DLL4 и/или с активностью передачи Notch-сигнала» включает такие заболевания, как рак и другие расстройства, при которых у индивидуумов, страдающих указанным расстройством, наблюдается присутствие DLL4 и/или активность передачи Notch-сигнала, которые, как было установлено или как подозревается, ответственны за патофизиологию указанного расстройства или являются фактором, повышающим тяжесть данного расстройства. В соответствии с этим, расстройством, ассоциированным с негативным воздействием DLL4 и/или с активностью передачи Notch-сигнала, является расстройство, при котором изменение уровня DLL4 и/или активности передачи Notch-сигнала, как предполагается, способствует ослаблению симптомов и/или прогрессирования указанного расстройства (например, роста опухоли). Такие расстройства могут проявляться такими признаками, как усиление ангиогенеза у индивидуума, страдающего указанным расстройством (например, увеличение концентрации различных белков, известных специалистам, в сыворотке, в плазме, в синовиальной жидкости и т.п. у индивидуума в процессе роста и образования опухоли), где указанное усиление ангиогенеза может быть установлено, например, с использованием анти-DLL4 антитела, описанного выше. Неограничивающими примерами расстройств, которые могут быть подвергнуты лечению с использованием антител согласно изобретению, являются расстройства, обсуждаемые в нижеследующем разделе, относящемся к фармацевтическим композициям антител согласно изобретению.
II. Фармацевтические композиции
Настоящее изобретение также относится к фармацевтическим композициям, содержащим DLL4-связывающий белок согласно изобретению и фармацевтически приемлемый носитель. Фармацевтические композиции, содержащие DLL4-связывающие белки согласно изобретению, применяются в целях, но не ограничиваются ими, диагностики, детектирования или мониторинга расстройства, а также для предупреждения, лечения, устранения или снижения тяжести расстройства или одного или нескольких его симптомов, и/или в исследованиях. В конкретном варианте изобретения композиция содержит один или несколько DLL4-связывающих белков согласно изобретению. В другом варианте изобретения фармацевтическая композиция содержит один или несколько связывающих белков согласно изобретению и один или несколько профилактических или терапевтических средств, не являющихся связывающими белками согласно изобретению и использующихся для лечения расстройства, ассоциированного с негативным воздействием DLL4 и/или активности DLL4. Предпочтительно, профилактические или терапевтические средства, как известно, могут быть использованы, уже были использованы или используются в настоящее время для предупреждения, лечения, устранения или снижения тяжести расстройства, например, рака или опухоли, или одного или нескольких их симптомов. В соответствии с этими вариантами указанная композиция может также содержать носитель, разбавитель или наполнитель.
Связывающие белки согласно изобретению могут быть включены в фармацевтические композиции, подходящие для введения индивидууму. Обычно фармацевтическая композиция содержит DLL4-связывающий белок (или его DLL4-связывающую часть) согласно изобретению и фармацевтически приемлемый носитель. Используемый здесь термин «фармацевтически приемлемый носитель» включает любые и все растворители, дисперсионные среды, материал для покрытий, антибактериальные и противогрибковые средства, изотонические агенты и агенты, замедляющие абсорбцию и т.п., которые являются физиологически совместимыми. Примерами фармацевтически приемлемых носителей являются один или несколько компонентов, таких как вода, физиологический раствор, забуференный фосфатом физиологический раствор, декстроза, глицерин, этанол и т.п., а также их комбинации. Во многих случаях в указанную композицию могут быть включены изотонические агенты, например, сахара, многоатомные спирты, такие как маннит и сорбит, или хлорид натрия. Фармацевтически приемлемые носители могут также содержать небольшие количества вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, консерванты или буферы, которые позволяют увеличивать срок хранения или эффективность антитела или его части.
Различные системы доставки известны специалистам и могут быть использованы для введения одного или нескольких DLL4-связывающих белков согласно изобретению или комбинаций одного или нескольких DLL4-связывающих белков согласно изобретению и профилактического или терапевтического средства, подходящего для предупреждения, лечения, устранения или снижения тяжести расстройства или одного или нескольких его симптомов, например, для подавления ангиогенеза опухоли, где указанное введение осуществляют путем инкапсулирования в липосомы, в микрочастицы, в микрокапсулы, в рекомбинантные клетки, способные экспрессировать DLL4-связывающий белок; путем рецептор-опосредуемого эндоцитоза (см., например, Wu & Wu, J. Biol. Chem. 262: 4429-4432 (1987)) и путем конструирования нуклеиновой кислоты как части ретровирусного или другого вектора, и т.п. Методы введения профилактического или терапевтического средства согласно изобретению включают, но не ограничиваются ими, парентеральное введение (например, интрадермальное, внутримышечное, внутрибрюшинное, внутривенное и подкожное), эпидуральное введение, введение в опухоль и введение в слизистую (например, интраназальное и пероральное введение). Кроме того, введение в легкие может быть осуществлено, например, с использованием ингалятора или аэрозольного распылителя и состава, содержащего аэрозоль-образующий агент. См., например, патенты США №№ 6019968, 5985320, 5985309, 5934272, 5874064, 5855913, 5290540 и 4880078; и публикации заявок PCT WO 92/19244, WO 97/32572, WO 97/44013, WO 98/31346 и WO 99/66903, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. В одном из вариантов изобретения DLL4-связывающий белок согласно изобретению, средства для комбинированной терапии или композицию согласно изобретению вводят с применением технологии доставки лекарственного средства в легкие Alkermes AIR® (Alkermes, Inc., Cambridge, Massachusetts, US). В конкретном варианте изобретения профилактические или терапевтические средства согласно изобретению вводят внутримышечно, внутривенно, вовнутрь опухоли, перорально, интраназально, в легкие или подкожно. Профилактические или терапевтические средства могут быть введены любым стандартным способом, например, путем вливания или инъекции ударной дозы, путем абсорбции через эпителиальную или кожно-слизистую выстилку (например, через слизистую ротовой полости, слизистую прямой кишки и тонкой кишки и т.п.), и могут быть также введены в комбинации с другими биологически активными средствами. Введение может быть системным или местным.
В конкретном варианте изобретения может оказаться желательным местное введение профилактических или терапевтических средств согласно изобретению в область, на которую направлено лечение; и это может быть достигнуто, например, такими способами, но не ограничивающимися ими, как местная инфузия, инъекция или введение имплантата, где указанный имплантат состоит из пористого или непористого материала, включая мембраны и матрицы, такие как сиаластические мембраны, полимеры, волокнистый матрикс (например, Tissuel®), или коллагеновый матрикс. В одном из вариантов изобретения эффективное количество одного или нескольких DLL4-связывающих белков-антагонистов согласно изобретению вводят пациенту местно в пораженную область для предупреждения, лечения, устранения и/или снижения тяжести расстройства или его симптомов. В другом варианте изобретения эффективное количество одного или нескольких DLL4-связывающих белков согласно изобретению вводят местно в пораженную область в комбинации с эффективным количеством одного или нескольких терапевтических средств (например, одного или нескольких профилактических или терапевтических средств), не являющихся связывающим белком согласно изобретению и используемых для предупреждения, лечения, устранения и/или снижения тяжести расстройства или одного или нескольких его симптомов.
В другом варианте изобретения профилактическое или терапевтическое средство может быть доставлено в виде системы контролируемого высвобождения или системы замедленного высвобождения. В одном из вариантов изобретения для достижения контролируемого или замедленного высвобождения может быть использован насос (см. Langer (Science, 249: 1527-1533 (1990)); Sefton, CRC Crit. Ref. Biomed. Eng., 14: 201-240 (1987); Buchwald et al., Surgery, 88: 507-516 (1980); Saudek et al., N. Engl. J. Med., 321: 574-579 (1989)). В другом варианте изобретения для обеспечения контролируемого или замедленного высвобождения терапевтических средств согласно изобретению могут быть использованы полимерные материалы (см. например, Goodson, J. M., In Medical Applications of Controlled Release. Vol. II. Applications and Evaluations. (Langer and Wise, eds.), (CRC Press Inc., Boca Raton, 1984), chapter 6, pages 115-138; Controlled Drug Bioavailability. Drug Product Design and Performance. Smolen and Ball (eds.) (Wiley, New York, 1984); Langer and Peppas, J. Macromol. Sci. Rev. Macromol. Chem. Phys., C23: 61-126 (1983); см. также Levy et al., Science, 228: 190-192 (1985); During et al., Ann. Neurol, 25: 351-356 (1989); Howard et al., J. Neurosurg., 71: 105-112 (1989); патенты США №№ 5679377, 5916597, 5912015, 5989463 и 5128326; и публикации заявок PCT №№ WO 99/15154 и WO 99/20253. Примерами полимеров, используемых в составах замедленного высвобождения, являются, но не ограничиваются ими, поли(2-гидроксиэтилметакрилат), полиметилметакрилат, полиакриловая кислота, сополимер этилена и винилацетата, полиметакриловая кислота, полигликолиды (ПЛГ), полиангидриды, поли-N-винилпирролидон, поливиниловый спирт, полиакриламид, полиэтиленгликоль, полилактиды (PLA), сополимеры лактида и гликолида (PLGA) и полиортоэфиры. В одном из вариантов изобретения полимер, используемый в составе замедленного высвобождения, является инертным, не содержит выщелачиваемых примесей, является стабильным при хранении, стерильным и биологически разлагаемым. В другом варианте изобретения система контролируемого или замедленного высвобождения может быть введена поблизости от профилактической или терапевтической мишени, для чего потребуется лишь часть системной дозы (см., например, Goodson, Medical Applications of Controlled Release (1984), pages 115-138).
Системы контролируемого высвобождения обсуждаются в работе Langer (1990, Science 249: 1527-1533). Для получения составов замедленного высвобождения, содержащих одно или несколько терапевтических средств согласно изобретению, может быть применен любой метод, известный специалистам в данной области. См., например, патент США № 4526938, публикации заявок РСТ WO 91/05548 и WO 96/20698, Ning et al., «Intratumoral Radioimmunotherapy of a Human Colon Cancer Xenograft Using a Sustained-Release Gel» Radiother. Oncol, 39: 179-189 (1996); Song et al., «Antibody Mediated Lung Targeting of Long-Circulating Emulsions» PDA J. Pharm. Sci.Tech., 50: 372-377 (1996); Cleek et al., «Biodegradable Polymeric Carriers for a bFGF Antibody for Cardiovascular Application» Proceed. Intl. Symp. Control Rel. Bioact. Mater., 24: 853-854 (1997), и Lam et al., «Microencapsulation of Recombinant Humanized Monoclonal Antibody for Local Delivery» Proceed. Intl. Symp. Control Rel. Bioact. Mater.: 24: 759-760 (1997), которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
В конкретном варианте изобретения, если композицией согласно изобретению является нуклеиновая кислота, кодирующая профилактическое или терапевтическое средство, то такая нуклеиновая кислота может быть введена in vivo для стимуляции экспрессии кодируемых ею профилактических или терапевтических средств, где указанную нуклеиновую кислоту конструируют как часть соответствующего вектора, экспрессирующего нуклеиновую кислоту, и вводят таким образом, чтобы она проникала вовнутрь клетки, например, посредством ретровирусного вектора (см. патент США № 4980286), посредством прямой инъекции или посредством бомбардировки микрочастицами (например, с использованием «дробовика» для выстреливания генов; Biolistic, Dupont), либо путем покрытия липидами, рецепторами клеточной поверхности или трансфицирующими агентами; либо путем ее включения в форме, связанной с гомеобокс-подобным пептидом, который, как известно, встраивается в ядро (см., например, Joliot et al., Proc. Natl. Acad. Sci. USA 88: 1864-1868 (1991)). Альтернативно, нуклеиновая кислота может быть введена вовнутрь клетки и встроена в ДНК клетки-хозяина для экспрессии посредством гомологичной рекомбинации.
Фармацевтическую композицию согласно изобретению получают в форме, совместимой с предполагаемым способом введения. Примерами способов введения являются, но не ограничиваются ими, парентеральное введение (например, внутривенное введение), интрадермальное введение, подкожное введение, пероральное введение, интраназальное введение (например, путем ингаляции), трансдермальное введение (например, местное введение), введение через слизистую и ректальное введение. В конкретном варианте изобретения указанную композицию приготавливают рутинными методами в виде фармацевтической композиции, адаптированной для внутривенного, подкожного, внутримышечного, перорального, интраназального или местного введения человеку. Обычно композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. При необходимости, такая композиция может также включать солюбилизирующий агент и местный анестетик, такой как лигнокаин для облегчения боли на участке инъекции.
Если композиции согласно изобретению вводят местно, то они могут быть приготовлены в виде мази, крема, чрескожного пластыря, лосьона, геля, шампуня, спрея, аэрозоля, раствора, эмульсии или другой формы, хорошо известной специалистам. См., например, Remington's Pharmaceutical Sciences and Introduction to Pharmaceutical Dosage Forms. 19th ed. (Mack Publishing Co., Easton, Pennsylavania, 1995). В этих целях обычно используются лекарственные формы для местного введения, не являющиеся спреем, а также вязкие или полутвердые или твердые формы, содержащие носитель или один или несколько наполнителей, совместимых с местным введением и имеющих динамическую вязкость, превышающую динамическую вязкость воды. Подходящими составами являются, но не ограничиваются ими, растворы, суспензии, эмульсии, кремы, жидкие мази, порошки, пастообразные мази, твердые мази и т.п., которые при необходимости могут быть стерилизованы или смешаны с вспомогательными агентами (например, с консервантами, стабилизаторами, смачивающими агентами, буферами или солями) для изменения различных свойств, таких как, например, осмотическое давление. Другими подходящими лекарственными формами для местного введения являются распыляемые аэрозольные составы, в которых активный ингредиент, присутствующий в комбинации с твердым или жидким инертным носителем, упакован в виде смеси с летучими веществами под давлением (например, с газообразным пропеллентом, таким как FREON®) или помещен в бутыль под давлением. В фармацевтические композиции и в лекарственные формы могут быть добавлены, если это необходимо, увлажнители или смачивающие средства. Примеры таких дополнительных ингредиентов хорошо известны специалистам.
Если способ согласно изобретению включает интраназальное введение композиции, то такая композиция может быть приготовлена в форме аэрозоля, спрея, паров, создающих туман, или в форме капель. В частности, профилактические или терапевтические средства, используемые в настоящем изобретении, могут быть легко доставлены в форме аэрозольного спрея из упаковок под давлением или аэрозольного ингалятора с использованием подходящего пропеллента (например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа). В случае использования аэрозоля под давлением, унифицированная доза лекарственной формы может быть определена с помощью дозирующего клапана. Могут быть приготовлены капсулы и картриджи (состоящие, например, из желатина) для их использования в ингаляторе или в инсуффляторе, где указанные капсулы и картриджи содержат порошкообразную смесь соединения и подходящей порошкообразной основы, такой как лактоза или крахмал.
Если способ согласно изобретению включает пероральное введение, то композиции для такого перорального введения могут быть приготовлены в форме таблеток, капсул, саше, гелевых капсул, растворов, суспензий и т.п. Таблетки или капсулы могут быть получены стандартными методами с использованием фармацевтически приемлемых наполнителей, таких как связывающие агенты (например, кукурузный крахмал в предварительной стадии желатинизации, поливинилпирролидон, или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или бифосфат кальция); замасливатели (например, стеарат магния, тальк или двуокись кремния); дезинтеграторы (например, кукурузный крахмал или натрийсодержащий гликолят крахмала); или смачивающие агенты (например, лаурилсульфат натрия). На таблетки могут быть нанесены покрытия хорошо известными методами. Жидкие составы для перорального введения могут быть приготовлены в таких формах, но не ограничивающихся ими, как растворы, сиропы или суспензии, либо они могут быть получены в виде сухого продукта, который, перед его применением, может быть разведен водой или другим подходящим носителем. Такие жидкие составы могут быть получены стандартными методами с использованием фармацевтически приемлемых добавок, таких как суспендирующие агенты (например, сорбитоловый сироп, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгирующие агенты (например, лецитин или аравийская камедь); безводные носители (например, миндальное масло, эфиры масел, этиловый спирт или фракционированные растительные масла); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Эти составы могут также содержать забуферивающие соли, ароматизаторы, красители и подсластители, если это необходимо. Составы для перорального введения могут быть соответствующим образом приготовлены для достижения замедленного высвобождения, контролируемого высвобождения или замедленного высвобождения профилактического(их) или терапевтического(их) средства (средств).
Способ согласно изобретению может включать введение композиции, приготовленной в комбинации с аэрозоль-образующим агентом, в легкие, например, с использованием ингалятора или аэрозольного распылителя. См., например, патенты США №№ 6019968, 5985320, 5985309, 5934272, 5874064, 5855913, 5290540 и 4880078; и публикации заявок PCT №№ WO 92/19244, WO 97/32572, WO 97/44013, WO 98/31346 и WO 99/66903, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. В конкретном варианте изобретения, антитело согласно изобретению, средство для комбинированной терапии и/или композицию согласно изобретению вводят с применением технологии доставки лекарственного средства в легкие Alkermes AIR® (Alkermes, Inc., Cambridge, Massachusetts, US).
Способ согласно изобретению может включать введение композиции, приготовленной для парентерального введения путем инъекции (например, путем инъекции ударной дозы или непрерывного вливания). Композиции для инъекции могут быть приготовлены в унифицированной лекарственной форме (например, в ампулах или в контейнерах для многократного введения доз) с добавлением консерванта. Композиции могут быть получены в таких формах, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать агенты для приготовления композиций, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть приготовлен в порошкообразной форме, которая, перед ее применением, может быть разведена подходящим носителем (например, стерильной апирогенной водой).
Способ согласно изобретению может также включать введение композиций, приготовленных в виде депо-составов. Такие составы замедленного действия могут быть введены путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Так, например, композиции могут быть приготовлены с использованием подходящих полимерных или гидрофобных материалов (например, в виде эмульсии в подходящем масле) или ионообменных смол, или в виде слаборастворимых производных (например, в виде слаборастворимой соли).
Способы согласно изобретению включают введение композиций, приготовленных в виде нейтральной или солевой формы. Фармацевтически приемлемыми солями являются соли, образованные анионами, такими как анионы хлористоводородной, фосфорной, уксусной, щавелевой, винной кислот и т.п., и соли, образованные катионами, такими как катионы натрия, калия, аммония, кальция, гидроксидов железа(3), изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.п.
Обычно ингредиенты композиций поставляются либо отдельно, либо в смеси в унифицированной лекарственной форме, например, в виде сухого лиофилизированного порошка или безводного концентрата в герметически запаянном контейнере, таком как ампула или саше с указанным количеством активного агента. Если способом введения является вливание, то композиция может быть расфасована по бутылям для вливания раствора, содержащим стерильную воду фармацевтического качества или физиологический раствор. Если способом введения является инъекция, то ампулу со стерильной водой для инъекций или с физиологическим раствором приготавливают так, чтобы ингредиенты могли быть смешаны перед введением.
В частности, настоящее изобретение также относится к одному или нескольким профилактическим или терапевтическим средствам или к фармацевтическим композициям согласно изобретению, упакованным в герметически запаянный контейнер, такой как ампула или саше с указанным количеством активного агента. В одном из вариантов изобретения один или несколько профилактических или терапевтических средств или фармацевтические композиции согласно изобретению поставляются в виде сухого лиофилизованного порошка или безводного концентрата в герметически запаянном контейнере, и могут быть разведены (например, водой или физиологическим раствором) до соответствующей концентрации, необходимой для введения индивидууму. Предпочтительно, одно или несколько профилактических или терапевтических средств или фармацевтических композиций согласно изобретению поставляются в виде сухого стерильного лиофилизованного порошка в герметически запаянном контейнере в унифицированной дозе, составляющей по меньшей мере 5 мг, а более предпочтительно, по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 25 мг, по меньшей мере 35 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 75 мг или по меньшей мере 100 мг. Лиофилизованные профилактические или терапевтические средства или фармацевтические композиции согласно изобретению должны храниться при 2°C-8°C в контейнере, в котором они были получены, и эти профилактические или терапевтические средства или фармацевтические композиции согласно изобретению должны быть введены через 1 неделю, а предпочтительно, через 5 дней, через 72 часа, через 48 часов, через 24 часа, через 12 часов, через 6 часов, через 5 часов, через 3 часа или через 1 час после разведения. В альтернативном варианте изобретения один или несколько профилактических или терапевтических средств или фармацевтические композиции согласно изобретению поставляются в жидкой форме в герметически запаянном контейнере с указанным количеством и концентрацией агента. Предпочтительно, композиция, вводимая в жидкой форме, поставляется в герметично запаянном контейнере в количестве, составляющем по меньшей мере 0,25 мг/мл, а более предпочтительно, по меньшей мере 0,5 мг/мл, по меньшей мере 1 мг/мл, по меньшей мере 2,5 мг/мл, по меньшей мере 5 мг/мл, по меньшей мере 8 мг/мл, по меньшей мере 10 мг/мл, по меньшей мере 15 мг/кг, по меньшей мере 25 мг/мл, по меньшей мере 50 мг/мл, по меньшей мере 75 мг/мл или по меньшей мере 100 мг/мл. Такая жидкая форма должна храниться при 2°C-8°C в контейнере, в котором она была получена.
Связывающие белки согласно изобретению могут быть включены в фармацевтическую композицию, подходящую для парентерального введения. Предпочтительно, связывающий белок получают в виде раствора для инъекций, содержащего 0,1-250 мг/мл антитела. Раствор для инъекций может состоять из жидкой или лиофилизированной лекарственной формы и находиться в сосуде из кремния или янтарной смолы, в ампуле или в предварительно заполненном шприце. Буфер может представлять собой L-гистидин (1-50 мМ), оптимально 5-10 мМ, при pH 5,0-7,0 (оптимальный pH 6,0). Другими подходящими буферами являются, но не ограничиваются ими, сукцинат натрия, цитрат натрия, фосфат натрия или фосфат калия. Хлорид натрия может быть использован для снижения токсичности раствора при концентрации 0-300 мМ (для жидкой лекарственной формы оптимальной является концентрация 150 мМ). В лиофилизированную лекарственную форму могут быть включены криозащитные агенты, главным образом, 0-10% сахароза (оптимально, 0,5-1,0%). Другими подходящими криозащитными агентами являются трегалоза и лактоза. В лиофилизованную лекарственную форму могут быть включены агенты, придающие объем, главным образом, 1-10% маннит (оптимально, 2-4%). В жидких и лиофилизированных лекарственных формах могут использоваться стабилизаторы, главным образом, 1-50 мМ L-метионина (оптимально, 5-10 мМ). Другими подходящими агентами, придающими объем, являются глицин и аргинин, которые могут быть включены в виде 0-0,05% полисорбата-80 (оптимально, 0,005-0,01%). Дополнительными поверхностно-активными веществами являются, но не ограничиваются ими, полисорбат 20 и поверхностно-активные вещества BRIJ.
Композиции согласно изобретению могут иметь различные формы. Такими формами являются, например, жидкие, полутвердые и твердые лекарственные формы, такие как жидкие растворы (например, растворы для инъекций и инфузий), дисперсии или суспензии, таблетки, драже, порошки, липосомы и суппозитории. Выбор таких форм зависит от предполагаемого способа введения и терапевтического применения. Типичными композициями являются композиции в форме растворов для инъекций или инфузий, такие как композиции, аналогичные композициям, используемым для пассивной иммунизации человека другими антителами. Выбранным способом введения является парентеральное введение (например, внутривенное, подкожное, внутрибрюшинное, внутримышечное введение). В предпочтительном варианте изобретения описанный здесь DLL4-связывающий белок вводят путем внутривенного вливания или внутривенной инъекции. В другом предпочтительном варианте изобретения DLL4-связывающий белок вводят путем внутримышечной или подкожной инъекции.
Терапевтические композиции обычно должны быть стерильными и стабильными в условиях их получения и хранения. Такая композиция может быть приготовлена в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для введения лекарственного средства в высокой концентрации. Стерильные растворы для инъекций могут быть получены путем введения активного соединения (то есть, антитела или его части) в нужном количестве в соответствующем растворителе вместе с одним из перечисленных здесь ингредиентов или с их комбинациями, если это необходимо, с последующей стерилизацией путем фильтрации. Вообще говоря, дисперсии получают путем введения активного соединения в стерильный носитель, содержащий основную дисперсионную среду и другие необходимые ингредиенты из числа ингредиентов, перечисленных в настоящей заявке. В случае использования стерильных лиофилизованных порошков для получения стерильных растворов для инъекций, такие порошки предпочтительно приготавливают из предварительно стерильно отфильтрованного раствора путем его вакуумной сушки и сушки распылением с получением порошка, содержащего активный ингредиент плюс любой дополнительный нужный ингредиент. Соответствующая текучесть раствора может поддерживаться, например, с использованием покрытия, такого как лецитин, путем сохранения требуемого размера частиц в случае дисперсии, и с использованием поверхностно-активных веществ. Замедленная абсорбция композиций для инъекций может достигаться путем включения в данную композицию агента, замедляющего абсорбцию, например, моностеаратных солей и желатина.
DLL4-связывающие белки согласно изобретению могут быть введены различными методами, известными специалистам, хотя, в одном из вариантов изобретения, для многих терапевтических применений, предпочтительным путем/способом введения является подкожная инъекция, внутривенная инъекция или инфузия. Следует отметить, что путь и/или способ введения варьируют в зависимости от желаемых результатов. В некоторых вариантах изобретения активное соединение может быть получено с использованием носителя, который будет защищать данное соединение от быстрого высвобождения, например, в виде состава с контролируемым высвобождением, включая имплантаты, чрескожные пластыри и микроинкапсулированные системы доставки. Могут быть использованы биологически разлагаемые, биологически совместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Многие методы получения таких составов запатентованы или, как правило, известны специалистам в данной области техники. См., например, Sustained and Controlled Release Drug Delivery Systems, J. R. Robinson, ed. (Marcel Dekker, Inc., New York, 1978).
В некоторых вариантах изобретения связывающий белок согласно изобретению может быть введен перорально, например, вместе с инертным разбавителем или с легко усваиваемым пищевым носителем. Соединение (и другие ингредиенты, если это необходимо) может быть заключено в жесткие или мягкие желатиновые капсулы, спрессовано в таблетки или включено непосредственно в пищу индивидуума. Для перорального терапевтического введения соединения могут быть введены вместе с наполнителями и использованы в форме таблеток для проглатывания, подщечных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и т.п. Для введения соединения согласно изобретению непарентеральными методами может оказаться необходимым нанесение на соединение покрытия из материала, предупреждающего его инактивацию, или совместное введение соединения с этим материалом.
В композиции могут быть также включены вспомогательные активные соединения. В некоторых вариантах изобретения связывающий белок согласно изобретению приготавливают и/или вводят вместе с одним или несколькими другими терапевтическими средствами, которые могут быть использованы для лечения расстройств, ассоциированных с негативным воздействием активности DLL4. Так, например, анти-huDLL4 антитело или его часть согласно изобретению могут быть приготовлены и/или введены вместе с одним или несколькими дополнительными антителами, которые связываются с другими мишенями (например, с антителами, которые связываются с другими цитокинами или с молекулами клеточной поверхности). Кроме того, один или несколько связывающих белков согласно изобретению могут быть использованы в комбинации с двумя или более вышеупомянутыми терапевтическими средствами. В такой комбинированной терапии могут применяться преимущественно более низкие дозы вводимых терапевтических средств, что позволяет избежать возможной токсичности или осложнений, ассоциированных с различными монотерапиями.
В некоторых вариантах изобретения DLL4-связывающий белок согласно изобретению присоединяют к известному носителю, увеличивающему время полужизни этого белка. Такими носителями являются, но не ограничиваются ими, Fc-домен, полиэтиленгликоль и декстран. Такие носители описаны, например, в патенте США № 6660843 Bl и в опубликованной заявке PCT WO 99/25044, которые вводятся в настоящее описание посредством ссылки.
В конкретном варианте изобретения методами генотерапии, проводимой в целях лечения, предупреждения, устранения или снижения тяжести расстройства или одного или нескольких его симптомов, являются введение нуклеотидных последовательностей нуклеиновой кислоты, кодирующих связывающий белок согласно изобретению или другое профилактическое или терапевтическое средство согласно изобретению. Генотерапия означает терапию, осуществляемую путем введения индивидууму экспрессированной или экспрессируемой нуклеиновой кислоты. В этом варианте изобретения нуклеиновые кислоты продуцируют кодируемые ими связывающий белок или профилактическое или терапевтическое средство согласно изобретению, которые опосредуют профилактический или терапевтический эффект.
В настоящем изобретении может быть применен любой из методов генотерапии, известных специалистам. Общий обзор этих методов генотерапии можно найти в публикациях Goldspiel et al., Clin. Pharmacy, 12: 488-505 (1993); Wu and Wu, Biotherapy, 3: 87-95 (1991); Tolstoshev, Ann. Rev. Pharmacol. Toxicol, 32: 573-596 (1993); Mulligan, Science, 260: 926-932 (1993); и Morgan and Anderson, Ann. Rev. Biochem., 62: 191-217 (1993); Robinson, C, Trends Biotechnol, 11(5): 155 (1993). Методы, хорошо известные специалистам в области техники рекомбинантных ДНК, можно найти в руководстве Ausubel et al. (eds.), Current Protocols in Molecular Biology (John Wiley & Sons, New York, 1993); and Kriegler, Gene Transfer and Expression. A Laboratory Manual, (Stockton Press, New York, 1990). Подробное описание различных методов генотерапии приводится в публикации заявки на патент США № 20050042664 Al, которая вводится в настоящее описание посредством ссылки.
В другом аспекте настоящее изобретение относится к способу терапии (например, лечения, ингибирования, ослабления симптомов, замедления или предотвращения развития или повторного появления или рецидива) или предупреждения развития DLL4-ассоциированной опухоли у индивидуума. Указанный способ включает введение индивидууму DLL4-связывающего белка, например, анти-DLL4 антитела или его фрагмента, описанных в настоящей заявке, в количестве, достаточном для лечения или предупреждения развития DLL4-ассоциированной опухоли или DLL4-ассоциированного ракового заболевания. Антагонист DLL4, то есть анти-DLL4 антитело или его фрагмент, может быть введен индивидууму отдельно или в комбинации с другими терапевтическими средствами, описанными в настоящей заявке.
DLL4 играет важную роль в развитии патологии, ассоциированной с рядом заболеваний, включая иммунные и воспалительные компоненты, а в частности, ангиогенез при раковом заболевании и опухоли. Примерами DLL4-ассоциированных расстройств являются, но не ограничиваются ими, расстройства, которые негативно влияют на нижеследующие биологические процессы: на функцию и развитие нервной системы; на стабилизацию артериальных эндотелиальных процессов и ангиогенез; на регуляцию основных клеточных взаимодействий между эндокардом и миокардом во время зарождения клапана и развития и дифференциации желудочков; на гомеостаз сердечного клапана, а также на процессы, вызывающие другие расстройства у человека, включая расстройства сердечно-сосудистой системы; временную дифференцировку клеточных линий эндокринного или экзокринного отдела поджелудочной железы; на выбор клеткой одного из двух путей линии дифференцировки, а именно выбор между секреторной и абсорбционной линиями дифференцировки в кишечнике; на увеличение компартмента гемопоэтических стволовых клеток в процессе развития кости и участие в коммитировании клеток в остеобластную линию дифференцировки, например, в процессе развития остеопороза; на регуляцию выбора клеткой пути дифференцировки в молочных железах на некоторых отдельных стадиях развития; и на определенные неядерные механизмы, такие как регуляция уровня актина в цитоскелете посредством тирозинкиназы Ab1. Более конкретно, DLL4-ассоциированными расстройствами являются, но не ограничиваются ими, рак, T-ОЛЛ (T-клеточный острый лимфобластный лейкоз), CADASIL (церебральная аутосомно-доминантная артериопатия, ассоциированная с инфарктами в подкорковом слое и лейкоэнцефалопатией), РС (рассеянный склероз), тетралогия Фалло и синдром Алажилля. Антитела и их антигенсвязывающие части, описанные в настоящей заявке, предпочтительно использовать для лечения рака и опухолей.
Связывающие белки согласно изобретению могут быть использованы отдельно или в комбинации друг с другом, то есть более чем один описанный здесь DLL4-связывающий белок может быть использован для лечения рака, опухоли или другого расстройства, при которых, на здоровье индивидуума, наиболее благоприятный эффект оказывают связывание с DLL4, ингибирование DLL4 и/или нейтрализация DLL4, либо такой эффект может быть достигнут другими способами.
Следует отметить, что DLL4-связывающие белки согласно изобретению могут быть использованы отдельно или в комбинации с дополнительным агентом, например, с терапевтическим средством, где указанный дополнительный агент может быть выбран самим специалистом в зависимости от цели введения. Так, например, дополнительным агентом может быть терапевтическое средство, которое, как известно, может быть использовано для лечения рака, опухоли или заболевания или состояния, при котором связывание с DLL4 или ингибирование DLL4 рассматривается как желательный или преимущественный фактор для лечения рака, опухоли или другого заболевания или состояния. Дополнительным агентом может быть также агент, который сообщает терапевтической композиции дополнительную эффективность, например, агент, который улучшает вязкость композиции.
Следует также отметить, что комбинации согласно изобретению представляют собой комбинации, которые могут быть использованы в целях настоящего изобретения. Средства, описанные ниже, приводятся лишь для иллюстрации и не ограничивают объема изобретения. Комбинациями, которые являются частью настоящего изобретения, могут быть антитела согласно изобретению, вводимые в сочетании по меньшей мере с одним дополнительным агентом, выбранным из нижеприведенного списка. Комбинация может также включать более чем один дополнительный агент, например, два или три дополнительных агента, если такой комбинацией является полученная композиция, которая может осуществлять нужные функции.
Предпочтительными комбинациями являются нестероидные противовоспалительные средства, также называемые НСПВС, которые включают лекарственные средства, подобные ибупрофену. Другими предпочтительными комбинациями являются кортикостероиды, включая преднизолон; при этом хорошо известные побочные эффекты используемых стероидов могут быть снижены или даже устранены путем уменьшения дозы стероидов, используемых для лечения пациентов в комбинации с анти-DLL4 антителами согласно изобретению. Неограничивающими примерами терапевтических средств для лечения ревматоидного артрита, с которыми могут быть объединены антитело или его часть согласно изобретению, являются цитокин-ингибирующие противовоспалительные средства (ЦИПС); антитела или антагонисты против других человеческих цитокинов или факторов роста, например, TNF, LT, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, IL-21, интерферонов, EMAP-II, GM-CSF, FGF и PDGF. Антитела согласно изобретению или их антигенсвязывающие части могут быть объединены с антителами против молекул клеточной поверхности, таких как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80 (B7.1), CD86 (B7.2), CD90, CTLA или их лиганды включая CD154 (gp39 или CD40L).
Предпочтительные комбинации терапевтических средств могут влиять на различные участки путей передачи проонкогенного или проангиогенного сигнала. Предпочтительными примерами терапевтических средств, которые могут быть использованы в способах и композициях согласно изобретению, являются противоопухолевые средства, средства для лучевой терапии и химиотерапевтические средства, такие как ДНК-алкилирующие агенты, цисплатин, карбоплатин, антитубулиновые агенты, паклитаксел, доцетаксел, таксол, доксорубицин, гемцитабин, гемзар, антрациклины, адриамицин, ингибиторы топоизомеразы I, ингибиторы топоизомеразы II, 5-фторурацил (5-FU), лейковорин, иринотекан, ингибиторы тирозинкиназных рецепторов (например, эрлотиниб, гефитиниб), ингибиторы COX-2 (например, целекоксиб) и ингибиторы киназы.
DLL4-связывающие белки согласно изобретению могут быть также объединены с такими агентами, как метотрексат, 6-MP, азатиоприн, сульфасалазин, месалазин, олсалазин, хлорохинин/гидроксихлорохин, пеницилламин, ауротиомалат (вводимый внутримышечно и перорально), азатиоприн, колхицин, кортикостероиды (инъецируемые перорально, путем ингаляции и местно), агонисты адренорецептора бета-2 (сальбутамол, тербуталин, сальметерал), ксантины (теофиллин, аминофиллин), кромогликат, недокромил, кетотифен, ипратропий и окситропий, циклоспорин, FK506, рапамицин, микофенолят-мофетил, лефлуномид, НСПВС, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические средства, ингибиторы комплемента, адренергические средства, агенты, блокирующие передачу сигнала провоспалительными цитокинами, такими как IL-1 (например, ингибиторы киназ IRAK, NIK, IKK, p38 или MAP), ингибиторы IL-1β- и TNFα-конвертирующих ферментов (TACE), ингибиторы Т-клеточных конвертирующих ферментов, ингибиторы передачи TNFα-сигнала, такие как ингибиторы киназы, ингибиторы металлопротеиназы, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензин-конвертирующего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые рецепторы TNF p55 или p75 и производные p75TNFRIgG (Enbrel™ и p55TNFRIgG (Ленерцепт)), sIL-lRI, sIL-lRII, sIL-6R), противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFβ), целекоксиб, фолиевая кислота, сульфат гидроксихлорохина, рофекоксиб, этанерцепт, инфликсимаб, напроксен, вальдекоксиб, сульфасалазин, метилпреднизолон, мелоксикам, ацетат метилпреднизолона, тиомалат золота-натрия, аспирин, ацетонид триамцинолона, напсилат пропоксифена/АРАР, фолат, набуметон, диклофенак, пироксикам, этодолак, диклофенак-натрий, оксапрозин, оксикодон-HCl, битартрат гидрокодона/АРАР, диклофенак натрий/мизопростол, фентанил, анакинра, человеческий рекомбинантный трамадол-HCl, салсалат, сулиндак, цианокобаламин/fa/пиридоксин, ацетаминофен, алендронат натрий, преднизолон, сульфат морфина, гидрохлорид лидокаина, индометацин, сульфат глюкозамина/хондроитин, амитриптилин-HCl, сульфадиазин, оксикодон-HCl/ацетаминофен, олопатадин-HCl, мизопростол, напроксен натрий, омепразол, циклофосфамид, ритуксимаб, IL-1, TRAP, MRA, CTLA4-IG, IL-18 BP, анти-IL-18 антитело, анти-IL15 антитело, BIRB-796, SCIO-469, VX-702, AMG-548, VX-740, рофлумеласт, IC-485, CDC-801 и мезопрам. Предпочтительные комбинации включают метотрексат или лефлуномид, а в случае умеренного или тяжелого ревматоидного артрита, циклоспорин.
Неограничивающими примерами терапевтических средств для лечения рака, с которыми может быть объединен DLL4-связывающий белок согласно изобретению, являются нижеследующие средства: будезонид; эпидермальный фактор роста; кортикостероиды; циклоспорин, сульфасалазин; аминосалицилаты; 6-меркаптопурин; азатиоприн; метронидазол; ингибиторы липоксигеназы; месаламин; олсалазин; балсалазид; антиоксиданты; ингибиторы тромбоксана; антагонисты рецептора IL-1; моноклональные анти-IL-1β антитела; моноклональные анти-IL-6 антитела; факторы роста; ингибиторы эластазы; соединения пиридинил-имидазола; антитела или антагонисты, направленные против других человеческих цитокинов или факторов роста, например, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-17, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Антитела согласно изобретению или их антигенсвязывающие части могут быть объединены с антителами против молекул клеточной поверхности, таких как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90 или их лигандов. Антитела согласно изобретению или их антигенсвязывающие части могут быть объединены с такими средствами, как метотрексат, циклоспорин, FK506, рапамицин, микофенолят-мофетил, лефлуномид, НСПВС, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические средства, ингибиторы комплемента, адренергические средства, средства, блокирующие передачу сигнала провоспалительными цитокинами, такими как IL-1 (например, IRAK, пути передачи NIK-сигнала провоспалительными цитокинами, такими как TNFα, IKK, p38 или ингибиторы киназы MAP), ингибиторы IL-1β-конвертирующего фермента, ингибиторы TNFα-конвертирующего фермента, ингибиторы передачи Т-клеточного сигнала, такие как ингибиторы киназы, ингибиторы металлопротеиназы, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензин-конвертирующего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые рецепторы TNF p55 или p75, sIL-1RI, sIL-1RII, sIL-6R) и противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFβ).
Другими примерами терапевтических средств, с которыми может быть объединен DLL4-связывающий белок, являются следующие средства: антагонисты TNF, например, анти-TNF антитела, D2E7 (публикация заявки PCT № WO 97/29131; HUMIRA®), CA2 (REMICADE®), CDP 571, конструкции TNFR-Ig, (p75TNFRIgG (ENBREL®) и p55TNFRIgG (LENERCEPT)) и ингибиторы PDE4. Связывающие белки согласно изобретению могут быть объединены с кортикостероидами, например, с будезонидом и дексаметазоном. Связывающие белки согласно изобретению могут быть также объединены с такими средствами, как сульфасалазин, 5-аминосалициловая кислота и олсалазин, и со средствами, блокирующими синтез или действие провоспалительных цитокинов, таких как IL-1, например, ингибиторы IL-1β-конвертирующего фермента и IL-1ra. DLL4-связывающие белки согласно изобретению могут быть также использованы вместе с ингибиторами передачи Т-клеточных сигналов, например, с ингибиторами тирозинкиназы, 6-меркаптопуринами. DLL4-связывающие белки согласно изобретению могут быть объединены с IL-11. Связывающие белки согласно изобретению могут быть объединены с мезаламином, преднизоном, азатиоприном, меркаптопурином, инфликсимабом, натрий-сукцинатом метилпреднизолона, дифеноксилатом/сульфатом атропина, гидрохлоридом лоперамида, метотрексатом, омепразолом, фолатом, ципрофлоксацином/декстрозой-водой, битартратом гидрокодона/АРАР, гидрохлоридом тетрациклина, флуоцинонидом, метронидазолом, тимерозалом/борной кислотой, холестирамином/сахарозой, гидрохлоридом ципрофлоксацина, сульфатом гиосциамина, гидрохлоридом меперидина, гидрохлоридом мидазолама, оксикодоном-HCl/ацетаминофеном, гидрохлоридом прометазина, фосфатом натрия, сульфаметоксазолом/триметопримом, целекоксибом, поликарбофилом, напсилатом пропоксифена, гидрокортизоном, поливитаминами, балсалазид-динатрием, фосфатом кодеина/АРАР, колесевеламом-HCl, цианокобаламином, фолиевой кислотой, левофлоксацином, метилпреднизолоном, натализумабом и интерфероном-гамма.
Неограничивающими примерами терапевтических средств, с которыми может быть объединен связывающий белок согласно изобретению, являются: аспирин, нитроглицерин, мононитрат изосорбида, сукцинат метопролола, атенолол, тартрат метопролола, безилат амлодипина, гидрохлорид дилтиазема, динитрат изосорбида, бисульфат клопидогреля, нифедипин, аторвастатин кальций, хлорид калия, фуросемид, симвастатин, верапамил-HCl, дигоксин, гидрохлорид пропранолола, карведилол, лизиноприл, спиронолактон, гидрохлортиазид, малеат эналаприла, надолол, рамиприл, эноксапарин натрий, натрийсодержащий гепарин, валсартан, гидрохлорид соталола, фенофибрат, эзетимиб, буметанид, лозартан калий, лизиноприл/гидрохлортиазид, фелодипин, каптоприл и фумарат бизопролола.
Фармацевтические композиции согласно изобретению могут включать «терапевтически эффективное количество» или «профилактически эффективное количество» связывающего белка согласно изобретению. Термин «терапевтически эффективное количество» означает количество, которое, в соответствующих дозах и в течение необходимого периода времени, является эффективным для достижения желаемого терапевтического эффекта. Терапевтически эффективное количество связывающего белка может быть определено самим специалистом, и такое количество может варьироваться в зависимости от таких факторов, как тип патологического расстройства, возраст, пол и масса индивидуума, а также от способности связывающего белка вырабатывать желаемый ответ у индивидуума. Терапевтически эффективное количество также означает количество, при котором терапевтически благоприятные эффекты превышают любые токсические или негативные эффекты указанного связывающего белка. Термин «профилактически эффективное количество» означает количество, которое, в соответствующих дозах и в течение необходимого периода времени, является эффективным для достижения желаемого профилактического эффекта. Обычно, поскольку профилактическая доза вводится индивидуумам до начала развития заболевания или на ранней стадии его развития, профилактически эффективное количество должно быть меньше терапевтически эффективного количества.
Схемы введения доз могут быть скорректированы для получения оптимального желаемого ответа (например, терапевтического или профилактического ответа). Так, например, в течение определенного периода времени может быть введена одна ударная доза, или может быть введено несколько дробных доз, либо эта доза может быть пропорционально снижена или увеличена в зависимости от терапевтической ситуации. Для облегчения введения и для достижения однородности дозы, особенно предпочтительно, если композиции для парентерального введения будут получены в унифицированной лекарственной форме. Используемый здесь термин «унифицированная лекарственная форма» означает физически дискретные единицы, используемые в качестве унитарных доз для лечения млекопитающих; причем каждую дозу такой единицы, содержащей предварительно определенное количество активного соединения, вычисляют так, чтобы достигался желаемый терапевтический эффект в комбинации с требуемым фармацевтическим носителем. Определение спецификации дозы такой унифицированной лекарственной формы согласно изобретению непосредственно зависит от (a) уникальных свойств активного соединения и от конкретно достигаемого терапевтического или профилактического эффекта, и (b) ограничений, известных специалистам и связанных с приготовлением такого активного соединения, с точки зрения восприимчивости индивидуума к такому лечению.
Репрезентативное и неограничивающее терапевтически или профилактически эффективное количество DLL4-связывающего белка согласно изобретению составляет в пределах 0,1-20 мг/кг, а более предпочтительно, 1-10 мг/кг. При этом следует отметить, что уровни доз могут варьироваться в зависимости от типа и тяжести состояния, подвергаемого лечению. Кроме того, очевидно, что для любого конкретного индивидуума конкретная схема введения доз должна быть скорректирована в зависимости от времени, требующегося для лечения индивидуума, и от назначения врача, осуществляющего введение или наблюдение за введением таких композиций, причем приведенные здесь интервалы доз являются лишь иллюстративными и не ограничивают объем или практическое применение заявленной композиции.
Для специалиста в данной области совершенно очевидно, что в описанные здесь способы могут быть внесены и другие подходящие модификации и изменения, которые могут быть осуществлены с использованием подходящих эквивалентов, не выходящих за рамки объема настоящего изобретения или его вариантов, описанных в настоящей заявке. Хотя настоящее изобретение достаточно подробно описано в настоящей заявке, однако, для лучшего его понимания, в настоящем описании приводятся ссылки на нижеследующие примеры, которые представлены лишь в целях иллюстрации и не ограничивают объема изобретения.
Примеры
Пример 1: In vitro анализы для определения функциональной активности анти-DLL4 антител.
Пример 1.1: Определение аффинности с применением технологии поверхностного плазмонного резонанса BIACORE®.
Анализ с применением технологии поверхностного плазмонного резонанса BIACORE® (Biacore, Inc, Piscataway, New Jersey, US) позволяет определить аффинность антител или DVD-Ig путем кинетических измерений констант скорости ассоциации и диссоциации. Связывание анти-DLL4 антител с очищенным рекомбинантным внеклеточным доменом DLL4 определяли методом поверхностного плазмонного резонанса на оборудовании Biacore® (Biacore 2000, Biacore 3000 или Biacore T100; GE Healthcare, Piscataway, New Jersey, US) с использованием рабочего буфера HBS-EPB (10 мМ HEPES [pH 7,4], 150 мМ NaCl, 3 мМ EDTA, 0,1 мг/мл BSA и 0,005% поверхностно-активного вещества P20) при 25°C. Так, например, приблизительно 9000 резонансных единиц козьего поликлонального антитела против человеческого Fc (Thermo Fisher Scientific Inc., Rockford, Illinois, US), разведенного в 10 мМ ацетата натрия (pH 4,5), непосредственно иммобилизовали на биосенсорном чипе CM5 экспериментального качества с помощью стандартного набора для связывания с амином в соответствии с инструкциями производителей, и эти процедуры осуществляли при 25 мкг/мл. Непрореагировавшие молекулы на поверхности биосенсора блокировали этаноламином. Для кинетических анализов уравнения скорости ассоциации и диссоциации, выведенные исходя из лангмюровской модели связывания 1:1, аппроксимировали одновремено для множества инъекций антигена (путем проведения общего эмпирического анализа) с использованием компьютерной программы Scrubber 2 (BioLogic Software), Biacore Biaevaluation 4.0.1 software или оценочной компьютерной программы Biacore T100. Очищенные антитела разводили в рабочем буфере для захвата козьего антитела против человеческого Fc, специфичного к реакционной поверхности. Антитела, которые были захвачены в качестве лиганда (1 мкг/мл), инъецировали на реакционные матрицы, при скорости потока 10 мкл/мин. В процессе анализа, в качестве контроля, все измерения были проведены для «пустой» поверхности для захвата (то есть, в отсутствие иммобилизованного анти-DLL4 антитела). Константы скорости ассоциации и диссоциации, Kon (M-1с-1) и Koff (с-1) определяли при постоянной скорости потока 80 мкл/мин. Константы скорости ассоциации и диссоциации вычисляли путем измерения кинетики связывания при различных концентрациях антигена в пределах 1,23-900 нМ, полученных в результате серийного 3-кратного разведения, и были включены инъекции только буфера (используемого в качестве двойного контроля). Затем константу равновесной диссоциации KD (M) в реакции между антителами и антигеном-мишенью вычисляли исходя из констант скорости кинетической реакции по следующей формуле: KD=Koff/Kon. Затем регистрировали связывание в зависимости от времени и вычисляли константы скорости кинетической реакции. В этом анализе могут быть измерены скорости ассоциации с верхним пределом 106 M-1с-1 и скорости диссоциации с нижним пределом 10-6 с-1.
Пример 1.2: Связывание анти-DLL4 антител с растворимым внеклеточным доменом DLL4, которое было определено с помощью ELISA
Метод 1 (ELISA с захватом)
96-луночные планшеты Nunc-Immuno (#439454) покрывали 5 мкг/мл антитела против человеческого IgG (специфичного к Fcγ-фрагменту, Jackson ImmunoResearch, #109-005-098, 100 мкл/лунку) в D-PBS (Gibco #14190) и инкубировали в течение ночи при 4°C. ELISA-планшеты 3 раза промывали промывочным буфером (PBS, 0,05% Твин-20), а затем блокировали 200 мл/лунку блокирующего буфера (D-PBS, 1% BSA, 1 мМ CaCl2, 0,05% Твин-20) в течение 1 часа при 25°C. Планшеты 3 раза промывали и инкубировали со 100 мкл/лунку анти-DLL4 антител (0,0001-100 нМ, 10-кратное серийное разведение в блокирующем буфере) в течение 1 часа при 25°C, а затем снова 3 раза промывали. Планшеты, содержащие захваченное анти-DLL4 антитело, инкубировали с внеклеточным доменом человеческого DLL4, меченным биотином (10 нМ в блокирующем буфере, 100 мкл/лунку) в течение 1 часа при 25°C, 3 раза промывали и инкубировали со стрептавидином, конъюгированным с ПХ (KPL #474-3000, разведение 1:10000 в блокирующем буфере, 100 мкл/лунку) в течение 1 часа при 25°C. После последней промывки планшеты инкубировали со 100 мкл/лунку субстрата для ELISA (1-Step Ultra TMB-ELISA, Pierce #340280). Реакцию прекращали через 2 минуты при 25°C добавлением 100 мкл/лунку 2н H2SO4 и считывали оптическую плотность на 450 нм. Данные анализировали с помощью компьютерной программы Graphpad Prism и регистрировали величины EC50.
Метод 2 (планшет, покрытый медью)
Перед использованием 96-луночные планшеты, покрытые медью (Thermo Scientific #15143), 3 раза промывали промывочным буфером (PBS, 0,05% Твин-20), а затем инкубировали со 100 мл/лунку человеческого DLL4-his или мышиного DLL4-his или DLL4-his яванского макака при 1 мкг/мл в PBS, в течение 1 часа при 25°C со встряхиванием. Затем планшеты 3 раза промывали. После этого в планшет добавляли 100 мкл/лунку рекомбинантных крысиных/человеческих химерных или рекомбинантных человеческих анти-DLL4 антител (0,00164-27 нМ, 4-кратное серийное разведение в ELISA-буфере = PBST, 10% Superblock (Pierce #37515)) в течение 1 часа при 25°C со встряхиванием, а затем снова 3 раза промывали. Планшеты инкубировали с ПХ-конъюгированным козьим античеловеческим антителом (Pierce #31412) (разведение 1:40000 в ELISA-буфере, 100 мкл/лунку) в течение 1 часа при 25°C со встряхиванием, а затем 3 раза промывали. После последней промывки, планшеты инкубировали с 100 мкл/лунку субстрата для ELISA (Sigma #T8665). Реакцию прекращали через 8 минут при 25°C добавлением 100 мкл/лунку 1н HCl, и считывали оптическую плотность на 450 нм. Данные анализировали с помощью компьютерной программы Graphpad Prism и регистрировали величины EC50.
Пример 1.3: Связывание моноклональных анти-DLL4 антител с поверхностью человеческих опухолевых клеточных линий, оцениваемое с помощью проточной цитометрии (FACS)
Стабильные клеточные линии, сверхэкспрессирующие DLL4 клеточной поверхности, собирали из колб с клеточной культурой, четыре раза промывали и ресуспендировали в забуференном фосфатом физиологическом растворе (PBS), содержащем 1% альбумина бычьей сыворотки и 1 мМ CaCl2 (FACS-буфер). 1,5×105 клеток инкубировали с антителами в различных концентрациях в FACS-буфере в течение 60 минут на льду. Клетки два раза промывали, а затем добавляли 50 мкл конъюгированного с R-фикоэритрином F(ab')2-фрагмента антитела против крысиных IgG (разведение 1:200 в FACS-буфере) (Jackson ImmunoResearch, West Grove, Pennsylvania, US, Cat.#l 12-116-072). После инкубирования на льду (4°C, 60 минут) клетки три раза промывали и ресуспендировали в FACS-буфере. Флуоресценцию измеряли на проточном цитометре Becton Dickinson FACSCalibur-HTS (Becton Dickinson, San Jose, California, US). Данные анализировали с использованием компьютерной программы Graphpad Prism, и величины EC50 регистрировали как концентрацию антитела, при которой уровень связывания достигает 50% от максимального уровня связывания анти-DLL4 антител с DLL4-экспрессирующими клетками.
Пример 1.4: Ингибирование взаимодействия Notch-1 с растворимым внеклеточным доменом DLL4 под действием анти-DLL4 антител (ELISA на конкурентное связывание)
96-луночные планшеты Nunc-Immuno (#439454 для ELISA huDLL4) и 96-луночные планшеты Costar (#9018 для ELISA muDLL4) покрывали 16 нМ человеческого Notch-1 (R&D Systems #3647-TK, 100 мкл/лунку в D-PBS) и инкубировали в течение ночи при 4°C. Затем планшеты 3 раза промывали промывочным буфером (PBS, 0,05% Твин-20), а затем блокировали 200 мкл/лунку блокирующего буфера (D-PBS, 1% BSA, 1 мМ CaCl2, 0,05% Твин-20) в течение 1 часа при 25°C. При блокировании меченный биотином человеческий внеклеточный домен DLL4 (14 нМ) смешивали с антителом (30 пМ-66 нМ, 3-кратное серийное разведение в блокирующем буфере) в течение 1 часа при 25°C со встряхиванием. После блокирования аналитические планшеты промывали и инкубировали со смесями DLL4/антител (100 мкл/лунку, 1 час при 25°C со встряхиванием). Затем планшеты снова промывали и добавляли 100 мкл/лунку стрептавидина, конъюгированного с ПХ (Fitzgerald #65R-S104PHRPx, разведенного 1:5000 в блокирующем буфере), и оставляли на 1 час при 25°C со встряхиванием. После последней промывки планшеты проявляли с использованием 100 мкл/лунку субстрата (TMB Sigma #T8665), реакцию прекращали после 8-минутного инкубирования при 25°C (для ELISA muDLL4), а затем инкубировали 20 минут при 25°C (для ELISA huDLL4) с использованием 100 мкл/лунку 1н HCl, и оптическую плотность считывали на 450 нм. Данные анализировали с помощью компьютерной программы Graphpad Prism, и величины IC50 регистрировали как концентрацию антитела, при которой достигается 50%-ое снижение уровня связывания DLL4 с Notch 1.
Пример 1.5: Блокирование связывания растворимого Notch с DLL4-сверхэкспрессирующими клетками 293G под действием моноклональных анти-DLL4 антител, оцениваемое с помощью проточной цитометрии (FACS на конкурентное связывание)
Анализ на блокирование Notch. Вкратце, стабильные клеточные линии, сверхэкспрессирующие DLL4 клеточной поверхности, собирали из колб для культивирования ткани и ресуспендировали в забуференном фосфатом физиологическом растворе (PBS), содержащем 1% альбумин бычьей сыворотки и 1 мМ CaCl2 (FACS-буфер). HEK293-hDLL4- или HEK293-mDLL4-клетки распределяли по 96-луночному планшету (с V-образным дном) при плотности 1,5×105 клеток/лунку в FACS-буфере. После центрифугирования клеток и отбрасывания супернатанта, в каждую лунку добавляли 50 мкл очищенного IgG с соответствующим разведением и инкубировали на льду при 4°C в течение 60 минут, а затем добавляли 50 мкл/лунку Notch1-биотина при 0,2 мкг/мл для hDLL4-293G или 2,0 мкг/мл для mDLL4-293G (1,0 или 0,1 мкг/мл конечного раствора) и дополнительно инкубировали еще 1 час на льду при 4°C. После двукратной промывки клеток FACS-буфером добавляли 50 мкл стрептавидина, конъюгированного с R-фикоэритрином (разведение 1:150 в FACS-буфере) (Jackson ImmunoResearch, West Grove, Pennsylvania, US, catalog no. 016-110-084). После инкубирования на льду (4°C, 60 минут) клетки три раза промывали и ресуспендировали в FACS-буфере. Флуоресценцию измеряли на проточном цитометре Becton Dickinson FACSCalibur-HTS (Becton Dickinson, San Jose, California, US). Данные анализировали с использованием компьютерной программы Graphpad Prism, и величины EC50 регистрировали как концентрацию, при которой достигается 50%-ое снижение уровня связывания Notch1 с DLL4-экспрессирующими клетками.
Пример 1.6: Ингибирование DLL4-зависимого увеличения уровня sVEGFR1 (sFLTl) в клетках EA.hy926 под действием анти-DLL4 антител
96-луночные планшеты с тканевой культурой покрывали 100 мкл/лунку человеческого внеклеточного домера DLL4 при 1,67 мг/мл в D-PBS (Gibco #14190) и инкубировали в течение ночи при 4°C. Затем планшеты один раз промывали D-PBS, и клетки EA.hy926 высевали при плотности 4000 клеток/лунку в отсутствие или в присутствии антител. Пролиферацию клеток измеряли через четыре дня с использованием набора для анализа на пролиферацию клеток CyQUANT (Invitrogen, #C35007). Экспрессию sVEGFR1 в кондиционированной среде детектировали с помощью набора для ELISA в соответствии с инструкциями производителей (R&D Systems #DVR100B). Уровни sVEGFR1 нормализовали по RFU, определенным с помощью анализа CyQUANT, с учетом различий в пролиферации клеток.
Пример 1.7: Ингибирование DLL4-зависимой активации Notch в клетках EA.hy926 под действием анти-DLL4 антител с помощью анализа на Notch-репортер
В 96-луночные черные планшеты с прозрачным дном для культивирования тканей высевали 7000 сконструированных клеток EA.hy926/лунку, экспрессирующих люциферазу, индуцируемую Notch-чувствительным промотором. Антитела серийно разводили исходя из концентрации 200 нМ и смешивали в течение 15 минут с равным объемом 5000 клеток HEK293G/лунку, экспрессирующих полноразмерный DLL4. Клетки 293G/DLL4 культивировали вместе с Notch-репортер-содержащими клетками EA.hy926 в течение 24 часов в присутствии тестируемых антител. Люциферазную активность анализировали с использованием субстрата Promega (Promega # E2940).
Пример 1.8: Методы анализа и методика определения идентичности молекул и их физико-химических свойств
Метод ПЭГ-преципитации
Использование ПЭГ для индуцирования фазового фракционирования твердого белка в соответствии с принципом вытеснения объема представляет собой подходящий способ оценки растворимости белка. Использование ПЭГ, по сравнению с другими осаждающими веществами, имеет несколько преимуществ, включая минимальную денатурацию белков при температурах окружающей среды (что не влияет на третичную структуру белка) и отсутствие необходимости в регуляции температуры в пределах от 4°C до 30°C, то есть исследования по преципитации могут быть проведены при температуре окружающей среды в лабораторных условиях.
Обычно преципитацию белков с помощью ПЭГ можно объяснить эффектом вытеснения объема. В соответствии с этой теорией, белки стерически вытесняются из областей растворителя, которые заняты линейными цепями ПЭГ. В результате белки концентрируются и, в конечном счете, осаждаются, если они имеют избыточную растворимость. С точки зрения термодинамики, стерическое вытеснение приводит к увеличению химического потенциала белка до тех пор, пока он не превысит химический потенциал белка, находящегося в абсолютно твердом состоянии, что будет приводить к преципитации белка. Это происходит, главным образом, из-за нежелательной высокой свободной энергии взаимодействия между ПЭГ и белками, и приводит к снижению желательной гидратации белка, что обусловлено эффектами стерического вытеснения. В водных растворах такая предпочтительная гидратация способствует сохранению нативной структуры белков. Было показано, что вытеснение объема становится более эффективным при увеличении молекулярной массы ПЭГ, то есть с возрастанием молекулярной массы ПЭГ требуется меньшее количество ПЭГ для преципитации белков.
Молекулярная масса ПЭГ 3000 была выбрана для оценки растворимости антител, которые входят в объем настоящего изобретения. 50%-ый раствор ПЭГ получали путем растворения ПЭГ в деионизированной воде в отношении один грамм ПЭГ на 1 мл воды. Затем раствор ПЭГ добавляли к раствору антитела, исходная концентрация которого составляла 0,5 мг/мл или менее, а объем составлял 0,5 мл. После этого постоянно добавляли раствор ПЭГ и смешивали до первого появления устойчивой мутности. Процент ПЭГ 3000, необходимый для достижения такой преципитации, вычисляли как 50 x (объем добавленного раствора ПЭГ 3000/исходный объем раствора антитела перед добавлением ПЭГ).
Процент ПЭГ 3000, необходимый для достижения такой преципитации белка, сравнивали с процентом, необходимым для преципитации белка с известной водорастворимостью. Так, например, водорастворимость адалимумаба превышает 200 мг/мл. Следовательно, если процент, необходимый для преципитации представляющего интерес белка, аналогичен проценту, необходимому для преципитации адалимумаба, то предполагаемая растворимость этого белка аналогична растворимости адалимумаба.
Метод определения истинной растворимости
Истинную растворимость определяли с использованием центрифужных фильтров Amicon для концентрирования белка в растворе до тех пор, пока не наблюдалось осаждение белка из раствора, или до тех пор, пока не был достигнут минимальный объем, при котором белок может концентрироваться в фильтрующем устройстве. В последнем случае 15-миллилитровые центрифужные фильтры Amicon имеют минимальный объем приблизительно 50 мкл, а 4-миллилитровые центрифужные фильтры Amicon имеют минимальный объем приблизительно 15 мкл.
Сначала белок диализовали с получением соответствующего(их) состава(ов). В этих исследованиях количество антитела составляло 10 мг или гораздо меньше. Затем раствор белка помещали в камеру центрифужного фильтра Amicon для ретентата. Эту камеру подсоединяли к нитроцеллюлозной мембране с порами, которые позволяют молекулам, имеющим менее чем 10-30 килодальтон, проходить под действием центробежной силы. Антитела, размер которых обычно составляет 140 килодальтон, удерживались, а вода, буферные молекулы, небольшие наполнители и соли проходили через поры. Затем фильтр центрифуги вращали в соответствии с инструкциями производителя до тех пор, пока не наблюдалось осаждение белка из раствора, или до тех пор, пока не был достигнут минимальный объем, при котором белок может концентрироваться в фильтрующем устройстве.
После центрифугирования раствор белка удаляли из камер для ретентата и измеряли концентрацию по поглощению ультрафиолета. Затем раствор оставляли на 1-2 дня при 25°C и 5°C и проводили мониторинг на признаки осаждения.
Методы спектроскопии кругового дихроизма (КД) в ближнем УФ-диапазоне
КД-спектроскопия в области ближнего УФ дает важную информацию о третичной структуре белков и является одним из самых широко применяемых методов в этих целях. КД означает дифференциальное поглощение составляющих плоско-поляризованного излучения с левой и правой круговой поляризацией. Для белков хромофорами, имеющими спектр КД в области ближнего УФ (250-320 нм), являются ароматические аминокислоты, то есть триптофан, тирозин и фенилаланин и дисульфидные связи, а КД-эффект наблюдается в том случае, если хромофоры имеют асимметрическую (скрытую) конформацию. Сигналы в области от 250 до 270 нм соответствуют фенилаланиновым остаткам, сигналы в области от 270 до 290 нм соответствуют тирозину, сигналы в области от 280 до 300 нм соответствуют триптофану. Дисульфидные связи дают широкие слабые сигналы по всему спектру ближнего УФ. КД-спектр в ближнем УФ может быть чувстительным к небольшим изменениям третичной структуры, например, к изменениям, вызываемым взаимодействиями белок-белок, и/или изменениям условий получения состава.
Существует также ряд других факторов, которые могут влиять на КД-спектры ароматических аминокислот. Такими факторами, среди прочих, являются: (1) жесткость молекулы белка, (2) природа водородных связей и (3) взаимодействия между различными ароматическими аминокислотами. Кроме того, белки с большим количеством аминокислот могут иметь более мелкие КД-полосы, что обусловлено гашением положительных и отрицательных полос.
Вкратце, белок диализовали с получением нужного(ных) состава(ов) при 1 мг/мл и сканировали на длине волны 250-320 нм или 240-320 нм на КД-спектрометре Jasco 800. Также сканировали соответствующий состав без белка, и зарегистрированные данные вычитали из данных, полученных в результате сканирования раствора белка. КД-спектр в ближнем УФ представляет собой график зависимости молярной эллиптичности от длины волны в области от 250 или 240 до 320 нм.
В целом, для антител КД-спектр в ближнем УФ с полусигмоидным профилем указывает на хорошую укладку третичной структуры, а более плоский и менее четко выраженный профиль указывает на значительную тенденцию к разворачиванию белка. Компактная укладка ассоциируется с хорошей стабильностью, тогда как плохая укладка указывает на внутреннюю часть, которая может вызывать гидрофобные взаимодействия между молекулами белка и приводить к образованию нежелательных агрегатов.
ДСК-технология
Термостабильность антител оценивали на ДСК-оборудовании. Используемое ДСК-оборудование представляет собой автоматизированное VP-ДСК-оборудование, снабженное капиллярными ячейками (Microcal, GE Healthcare Ltd./Microcal, Buckinghamshire, UK). Исследования по разворачиванию молекул оценивали путем сканирования при скорости 1°C/минуту при температуре 25°C-95°C для 1 мг/мл образца. Дополнительными параметрами измерений являются период аппроксимации 16 секунд и время ожидания перед сканированием, составляющее 10 минут, где указанные измерения проводили в режиме отсутствия обратной связи. Для каждого конкретного измерения 420 мкл образца/контроля помещали в держатель для образцов измерительного ДСК-устройства в соответствии со схемой заполнения планшетов, описанной ниже. Полученные термограммы были построены для двух нестационарных моделей в целях получения средних температур и энтальпии различных переходов.
Дополнительным требованием, предъявляемым к кандидату на успешное его использование в биологических исследованиях, является сохранение нативного состояния и конформации белка. Белок в водном растворе находится в равновесии между его нативной (уложенной) конформацией и денатурированной (развернутой) конформацией. Стабильность белка в нативном состоянии определяется величиной свободной энергии Гиббса (DG) данной системы и термодинамической взаимосвязью между изменениями энтальпии (DH) и энтропии (DS). Положительная DG указывает на то, что нативное состояние является более стабильным, чем денатурированное состояние, то есть, чем выше положительная DG, тем выше стабильность. Для разворачивания белка стабилизирующие силы должны быть устранены. Конформационная энтропия преодолевает стабилизирующие силы, что приводит к разворачиванию белка при температурах, при которых энтропия становится доминантной. ДСК позволяет измерять DH разворачивания белка вследствие тепловой денатурации. Согласно общему закону термодинамики можно утверждать, что чем выше средняя температура перехода (Tm), тем более стабильным является белок при более низких температурах. При проведении той самой экспериментальной ДСК можно также измерять изменение теплоемкости (DCp) для денатурации белка. Изменения теплоемкости, ассоциированные с разворачиванием белка, обусловлены, главным образом, изменениями характера гидратации боковых цепей, которые скрыты в нативном состоянии, но становятся более доступными для растворителя в денатурированном состоянии. Было показано, что ДСК является ценным прогностическим фактором стабильности белков и других биологических макромолекул в жидких составах (Remmele and Gombotz, BioPharm., 13: 36-46 (2000), и Remmele et al., Pharm. Res., 15: 200-208 (1998)).
ЭХ-технология
Эксклюзионная хроматография применяется для разделения белков по размеру. Белки, содержащиеся в водной подвижной фазе, пропускают через пористую смолу, упакованную в качестве стационарной фазы на колонке. Время удерживания в колонке зависит от гидродинамического размера белка и размера пор слоя упакованной смолы. Более мелкие молекулы могут проникать в меньшие поры в смоле и удерживаются дольше, чем более крупные молекулы. После элюирования с колонки белки детектировали по УФ-поглощению. В ЭХ-методе использовали защитный гель TSK (TOSOH Biosciences, Montgomeryville, Pennsylvania, US, cat. no. 08543) и гель TSK G3000SWxL (TOSOH Biosciences, Montgomeryville, Pennsylvania, US, cat. no. 08541). В качестве подвижной фазы использовали 100 мМ Na2HPO4, 200 мМ Na2SO4, pH 6,8. Скорость потока составляла 0,25 мл/минуту. Объем впрыска составлял 20 мкл от 1 мг/мл образца. Колонка имела комнатную температуру. Температура автоматического устройства для взятия образцов составляла 2-8°C. Общее время проведения процедуры составляло 55 минут. Детектирование проводили по УФ-поглощению на длине волны 214 нм, где ширина полосы составляла 8 нм, причем в качестве стандарта использовали поглощение на длине волны 360 нм с шириной полосы 100 нм.
Метод замораживания-оттаивания
Растворы антител в нужном составе в концентрации 1 мг/мл замораживали при -80°C в течение по меньшей мере 4 часов, а затем оттаивали при 30°C на водяной бане. Затем раствор снова замораживали при -80°C. Таким образом, проводили 5 циклов замораживания-оттаивания. После проведения определенных циклов замораживания-оттаивания, например, второго и четвертого цикла, часть раствора может быть взята для ЭХ-анализа с последующим повторным замораживанием. Анализ стабильности в условиях замораживания-оттаивания проводили при низких концентрациях белка для получения «худшего сценария», обусловленного более высокой вероятностью денатурации молекул белка на границе раздела «лед-вода». При более высоких концентрациях вероятность соударения белка с поверхностью раздела «лед-вода» прямо пропорционально снижается, а вместо этого, он сталкивается с другими молекулами белка.
Ускоренный метод определения стабильности
Растворы антител в нужном составе в концентрации 1 мг/мл пропускали через ПВДФ-фильтры с размером пор 0,22 мкм в стерильных условиях и инкубировали при 40°C и/или 50°C в течение по меньшей мере 21 дня. На 7 и 21 дни брали аликвоты в стерильных условиях и подвергали ЭХ-анализу. Затем растворы снова инкубировали.
Пример 2: Продуцирование и выделение человеческих моноклональных анти-DLL4 антител E9 и A10 с применением технологии представления мРНК PROfusion
С применением технологии представления мРНК PROfusion (см. Chung-Ming Hsieh et al., публикацию заявки на патент США № 2010/0099103), за семь раундов отбирали объединенные библиотеки антител против антигенов DLL4 селезенки и лимфоузлов: 100 нМ меченного биотином внеклеточного домена человеческого DLL4 (раунды 1 и 2), смеси 50 нМ меченного биотином внеклеточного домена человеческого DLL4 и 50 нМ меченного биотином внеклеточного домена мышиного DLL4 (раунд 3), 100 нМ меченного биотином внеклеточного домена человеческого DLL4 (раунды 4 и 5), клеток 293G, стабильно экспрессирующих человеческий DLL4, и 100 нМ меченного биотином внеклеточного домена человеческого DLL4 (раунд 6), и клеток BAF3, стабильно экспрессирующих человеческий и мышиный DLL4 (раунд 7). А10 и E9 идентифицировали после отбора библиотек антител в раунде 7 (таблица 4). При конструировании человеческого IgGl дикого типа эти конструкции обозначали A10.1 и E9.1, соответственно.
|
Пример 3: Характеризация in vitro антител Е9 и А10 PROfusion
Аффинность связывания с антигеном DLL4 для антител E9 и A10 определяли с применением BIACORE-технологии, как описано в примере 1.1. Как показано ниже в таблице 5, E9 и A10 имеют аналогичные величины констант равновесной диссоциации по отношению к человеческому DLL4 (KD=3,36 и 6,68 нМ, соответственно) и к DLL4 яванского макака (KD=4,2 и 7,8 нМ, соответственно). E9 также перекрестно реагирует с мышиным и крысиным DLL4 (KD 16 и 15 нМ, соответственно).
|
Активность связывания антитела с антигеном также оценивали с помощью ELISA- и FACS-анализов (как описано в примере 1.2, 1.3, где величины EC50 представлены в таблице 3). Антитела Е9 и А10, помимо их связывания с рекомбинантным внеклеточным доменом DLL4 (ECD), могут также связываться с DLL4, экспрессируемым на клеточной поверхности (таблица 6).
Способность антител блокировать взаимодействие DLL4 с рецептором Notch1 оценивали с помощью ELISA- и FACS-анализов на конкурентное связывание, описанных в примерах 1.4 и 1.5. Как показано в таблице 6, E9 и A10 эффективно блокируют взаимодействие Notchl с DLL4 (в форме внеклеточного домена (ECD) и в клеточно-ассоциированной форме). Кроме того, клеточные функциональные анализы были также разработаны для определения способности антител нейтрализовать DLL4-опосредованную клеточную активность in vitro (как описано в примерах 1.6 и 1.7). Антитела E9 и A10 ингибировали DLL4-индуцированиную активацию Notch и экспрессию sVEGFR1 в клетках EA.hy926 (таблица 6).
|
Пример 4: Аффинное созревание антител E9 и А10 PROfusion.
Аффинное созревание анти-DLL4 антитела E9
Выравнивание последовательностей показало, что анти-DLL4 антитело E9 имеет наиболее высокую идентичность с VH4-39/JH4 и V2-1/JL6 человеческих зародышевых линий. Для повышения аффинности E9 к DLL4, остатки гипермутированной CDR идентифицировали исходя из других последовательностей человеческих антител, имеющихся в базе данных IgBLAST, которые также обнаруживают высокую идентичность с VH4-39 и V2-1 зародышевой линии. Затем соответствующие остатки CDR E9 подвергали ограниченному мутагенезу посредством ПЦР с использованием праймеров, имеющих низкую вырожденность кодов в этих положениях, в целях создания библиотек антител в формате scFv, подходящем для их применения в процедуре созревания аффинности. Первая библиотека содержала мутации в положениях остатков 30, 31, 32, 33, 50, 54, 56 и 65 в CDR1 и CDR2 VH (нумерация по Кэбату); вторая библиотека содержала мутации в положениях остатков 95-100, 100a, 100b, 100c и 102 в CDR3 VH; а третья библиотека содержала мутации в положениях остатков 27, 30, 31, 33, 52, 53, 93-96 в трех CDR VL. Для дальнейшего повышения идентичности E9 с последовательностями каркасной области человеческой зародышевой линии, остаток Arg в положении VL 103 заменяли остатком Lys, а в третью библиотеку также вносили двойную вырожденность в положениях 80 (A/P) и 100 (S/Y) VL (таблица 7).
|
Эти библиотеки E9 переносили в клетки и представляли на клеточной поверхности для отбора на внеклеточный домен биотинилированного DLL4 с низкой концентрацией методом магнитной визуализации, а затем методом клеточного сортинга с активацией флуоресценции (FACS). Затем проводили отбор на более высокие величины констант ассоциации, диссоциации или тех и других, после чего последовательности белков-антител клонов E9 с модулированной аффинностью (таблица 8) регенерировали для обратного превращения в формат IgG для последующей характеризации.
|
|
|
|
|
|
|
Аффинное созревание анти-DLL4 антитела А10
Аналогично созреванию аффинности Е9, описанному выше, выравнивание последовательностей показало, что анти-DLL4 антитело А10 имеет наиболее высокую идентичность с VH3-30 и V2-1 человеческих зародышевых линий. Человеческие последовательности VH и Vλ, происходящие от VH3-30 и V2-1, соответственно, брали из базы данных NCBI IgBlast для создания логоса последовательности. Эти логосы использовали для того, чтобы решить, какие именно последовательности должны быть введены для генерирования аффинно зрелых библиотек.
Библиотеки А10 переносили в клетки и представляли на клеточной поверхности для отбора на внеклеточный домен биотинилированного DLL4 с низкой концентрацией методом магнитной визуализации, а затем методом клеточного сортинга с активацией флуоресценции. Затем проводили отбор на более высокие величины констант ассоциации, диссоциации или тех и других, после чего последовательности белков-антител клонов А10 с модулированной аффинностью регенерировали для обратного превращения в формат IgG для последующей характеризации. Области тяжелой цепи (VH) аффинно зрелых клонов представлены ниже в таблице 9, а области легкой цепи (VL) аффинно зрелых клонов представлены ниже в таблице 10.
|
|
|
|
|
Пример 5: Конструирование CDR-привитых антител E9
CDR VH E9 присоединяли к консенсусной каркасной области VH3 (привитые VH=E9vh3g2), а CDR VL E9 присоединяли к каркасной области VL2-1 анти-DLL4 антитела А10 (привитые VL=E9a10vlg2) и к каркасной области VK А10 зародышевой линии (наиболее близкой по своей гомологии к VL E9) (привитые VL=E9AVK). Альтернативно, репарацию каркасной области (FW) также проводили с использованием VH Е9; и эта FW была сохранена, но аминокислоты, которые могут вызывать нестабильность антитела, были заменены (репарированная VH=E9VH4r2). Обратные мутации каркасной области вводили в CDR-привитую и в FW-репарированную области для сохранения структуры и функции антитела (таблица 11 и таблица 14).
CDR E9 также присоединяли к каркасным областям анти-IL-18 и анти-IL-12 антител. В частности, CDR VH Е9 присоединяли к каркасной области VH5-51 анти-IL-18 антитела (привитые VH=E9VH325) и к каркасной области VH2-70 анти-IL-12 антитела (привитые VH=E9VH1D4.1). CDR VL Е9 присоединяли к каркасной области VK L2/L16 анти-IL-12 (привитые VL=E9VL325) и к каркасной области VK B3 анти-IL-12 антитела (привитые VL=E9VL1D4.1). Обратные мутации каркасной области вводили в CDR-привитую область для сохранения структуры и функции антитела (таблица 15 и таблица 18).
In silico сконструированные CDR-привитые антитела, описанные выше, синтезировали непосредственно в выбранную плазмиду с применением биотехнологического метода Blue Heron. Вариабельную область тяжелой цепи встраивали, с сохранением рамки считывания, в кДНК-фрагмент, кодирующий константную область человеческого IgGl дикого типа, и в кДНК-фрагмент, кодирующий константную область человеческого IgGl, содержащую две аминокислотные мутации в шарнирной области. Эти мутации были получены в результате замены лейцина аланином в положении 234 (в соответствии с Европейской системой нумерации) и замены лейцина аланином 235 (Lund et al., J. Immunol., 147: 2657 (1991)). Вариабельную область легкой цепи встраивали, с сохранением рамки считывания, в человеческую константную область лямбда и в человеческую константную область каппа. После получения синтезированных конструкций методом Blue Heron, ДНК масштабировали и подтверждали ее последовательность. «Правильно» CDR-привитые тяжелые и легкие цепи, соответствующие каждому антителу (таблицы 11 и 14) (таблицы 15 и 18), совместно переносили в клетки HEK-293-6E для кратковременного продуцирования полноразмерных CDR-привитых анти-DLL4 антител. В таблице 11 систематизированы все созданные варианты антител E9 и данные экспрессии HEK-293-6e. Клеточные супернатанты, содержащие рекомбинантное человеческое антитело, были очищены с помощью хроматографии на белке А-сефарозе, и связанное тело элюировалось при добавлении кислотного буфера. Антитела диализовали в PBS.
Способность очищенных CDR-привитых антител связываться с DLL4 или ингибировать активность DLL4 определяли с помощью анализов различных типов, таких как ELISA (Пример 1.2, метод 2), Biacore (Пример 1.2) и проточная цитометрия (FACS) (Пример 1.3). В таблице 12 и в таблице 16 представлены величины EC50, полученные в анализах ELISA и FACS, и аффинности CDR-привитых антител, определенные методом Biacore и описанные, соответственно, в таблице 11 и в таблице 15 для человеческого DLL4, мышиного DLL4 и DLL4 яванского макака. В таблице 13 и в таблице 17 представлены величины IC50, полученные с помощью ELISA-анализа на блокирование (Пример 1.4) и анализа FACS на блокирование (Пример 1.5) человеческого DLL4 и мышиного DLL4 CDR-привитыми антителами, описанными, соответственно, в таблице 11 и в таблице 15.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пример 6: Дальнейшее конструирование аффинно зрелого антитела E9-71
E9-71(M) и E9-71(L)
Было проведено дальнейшее конструирование тяжелой и легкой цепей аффинно зрелого анти-DLL4 антитела E9-71. Метионин (M) в CDR-H3 тяжелой цепи E9-71 заменяли лейцином (L) путем конструирования прямых и обратных перекрывающихся праймеров, содержащих мутированные нуклеотиды. Затем проводили последовательную двухстадийную полимеразную цепную реакцию (ПЦР) для амплификации полноразмерного гена вариабельной области с использованием двух праймеров, несущих мутированные нуклеотиды, и двух самых крайних праймеров, содержащих выступающие последовательности, комплементарные полученному вектору.
Сигнальный пептид, используемый для легкой цепи E9-71 (M) и E9-71 (L), называется сигнальным пептидом лямбда 1а. Каркасную область 4 (FW4) hJL-1 легкой цепи E9-71 заменяли областью hJL2 для сообщения ей большей совместимости с константной областью huCL2 антитела. Затем конструировали прямые и обратные праймеры, содержащие мутированные нуклеотиды. Затем проводили последовательную двухстадийную полимеразную цепную реакцию (ПЦР) для амплификации полноразмерного гена вариабельной области с использованием двух праймеров, несущих мутированные нуклеотиды, и двух самых крайних праймеров, содержащих выступающие последовательности, комплементарные полученному вектору.
ПЦР-продукты, полученные после проведения каждой сборки кДНК, разделяли на агарозном геле, и полосу, соответствующую предсказанной кДНК вариабельной области, вырезали по размеру и очищали. Вариабельную область тяжелой цепи встраивали, с сохранением рамки считывания, в кДНК-фрагмент, кодирующий константную область человеческого IgGl, содержащую две аминокислотные мутации в шарнирной области, путем гомологичной рекомбинации в бактериях. Такими мутациями являются замена лейцина аланином в положении 234 (в соответствии с Европейской системой нумерации) и замена лейцина аланином в положении 235 (Lund et al., J. Immunol, 147: 2657 (1991)). Вариабельную область легкой цепи встраивали, с сохранением рамки считывания, между человеческим сигнальными пептидом лямбда 1a и человеческой константной областью лямбда посредством гомологичной рекомбинации. Бактериальные колонии выделяли, плазмидную ДНК экстрагировали и кДНК-вставку секвенировали кДНК по всей длине. «Правильные» тяжелые и легкие цепи, соответствующие каждому антителу (таблица 19), совместно переносили в клетки HEK-293-6E для кратковременного продуцирования полноразмерных антител против человеческого DLL4, E9-71(M) или E9-71(L). Оба эти антитела E9.71(M) и E9.71(L) имели одну и ту же легкую цепь. Клеточные супернатанты, содержащие рекомбинантное человеческое антитело, были очищены с помощью хроматографии на белке А-сефарозе и связанное тело элюировалось при добавлении кислотного буфера. Антитела нейтрализовали и диализовали в PBS.
|
|
Пример 7: Конструирование сигнального пептида E9-71(M)
Для генерирования анти-DLL4 антитела E9-71(M) использовали сигнальный пептид лямбда 1а. Были также исследованы альтернативные сигнальные пептиды. Предположительные данные относительно процента «правильного» расщепления антитела в процессе экспрессии in silico сконструированных аминокислотных последовательностей N-концевой вариабельной области E9-71(M) с различными сигнальными пептидами, происходящими от семейства сигнальных пептидов лямбда и каппа, могут быть найдены в Интернете с помощью сервера Signal IP 3.0 (например, на web-сайте cbs.dtu.dk/services/SignalP/) или с использованием других эквивалентных компьютерных программ. Были выбраны сигнальные пептиды, предположительно, с наиболее высоким процентом «правильного» отщепления, по одному от каждого семейства: пептид лямбда 3р, принадлежащий к семейству лямбда, и пептид L23, принадлежащий к семейству каппа. Был также выбран мутированный вариант, происходящий от исходного сигнального пептида лямбда 1a, с двумя аминокислотными заменами (глицина на аргинин и серина на валин). Для конструирования легкой цепи, содержащей сигнальный пептид лямбда 1а, осуществляли одностадийную полимеразную цепную реакцию (ПЦР) для амплификации полноразмерного гена вариабельной области с использованием двух самых крайних праймеров, содержащих выступающие последовательности, комплементарные «принимающему» вектору, где один из них содержит мутированную нуклеотидную последовательность. Для получения легкой цепи, содержащей сигнальный пептид лямбда 3p и сигнальный пептид каппа L23, были созданы два перекрывающихся праймера в целях конструирования области сигнального пептида, а затем была проведена полимеразная цепная реакция (ПЦР) для амплификации полноразмерного гена вариабельной области с использованием двух самых крайних праймеров, содержащих выступающие последовательности, комплементарные «принимающему» вектору. С использованием сигнальных пептидов лямбда 3р и каппа L23 были получены два варианта вариабельных областей E9-71, где один из них имел полноразмерную вариабельную область, а другой - вариабельную область, в которой отсутствовал первый серин (S) у N-конца. Сигнальный пептид лямбда 1а присутствовал только в сконструированной полноразмерной вариабельной области. ПЦР-продукты, полученные после каждой сборки кДНК, разделяли на агарозном геле, и полосу, размер которой соответствовал предсказанной кДНК вариабельной области, вырезали и очищали. Вариабельную область тяжелой цепи встраивали с сохранением рамки считывания в кДНК-фрагмент, кодирующий константную область человеческого IgGl, содержащую две аминокислотных мутации в шарнирной области, путем гомологичной рекомбинации в бактериях. Такими мутациями являются замена лейцина аланином в положении 234 (в соответствии с Европейской системой нумерации) и замена лейцина аланином в положении 235 (Lund et al., J. Immunol, 147: 2657 (1991)). Вариабельную область легкой цепи с человеческой константной областью лямбда встраивали, с сохранением рамки считывания, посредством гомологичной рекомбинации. Бактериальные колонии выделяли, плазмидную ДНК экстрагировали, и кДНК-вставку секвенировали по всей ее длине. «Правильные» тяжелые и легкие цепи, соответствующие каждому антителу (таблица 19), совместно переносили в клетки HEK-293-6E для кратковременного продуцирования полноразмерных антител против человеческого DLL4, E9-71(M). Клеточные супернатанты, содержащие рекомбинантное человеческое антитело, очищали с помощью хроматографии на белке А-сефарозе и связанное антитело элюировалось при добавлении кислотного буфера. Антитела диализовали в PBS. Очищенное антитело E9.71(M) анализировали с помощью масс-спектрометрии (МС) для подтверждения последовательности интактного антитела. В таблице 20, приведенной ниже, представлены аминокислотные последовательности различных сигнальных пептидов, используемых для получения антитела E9.71(M). В таблице 21, приведенной ниже, представлены сайты расщепления антитела E9.71(M), проанализированные с помощью масс-спектрометрии.
|
|
Пример 8. Характеризация in vitro сконструированных антител PROfusion
Аффинность связывания сконструированных антител PROfusion с антигеном определяли с применением BIACORE-технологии, как описано в примере 1.1., и эти данные представлены ниже в таблице 22. In vitro активность репрезентативных антител также оценивали другими методами, описанными в примере 1, и результаты такой оценки представлены в таблице 23.
|
|
|
|
Пример 8: Физико-химические свойства выбранных антител PROfusion
Идентичность моноклональных антител, специфичных к DLL4, определяли с помощью масс-спектрометрии, описанной ниже.
Масс-спектрометрический анализ E9-71
Анализ молекулярной массы легкой цепи и тяжелой цепи: Образец E9-71 разводили до 1 мг/мл путем добавления воды Milli-Q. К 20 мкл разведенного образца добавляли 1 мкл 1М DTT. Образец инкубировали при 37°C в течение 30 минут. 1 мкл восстановленных образцов впрыскивали в ЖХ/МС-систему Agilent 6510 Q-TOF, снабженную упакованной дифенилом колонкой Varian Diphenyl. Буфер A представляет собой 0,02% трифторуксусную кислоту (TFA), 0,08% муравьиную кислоту (FA) в воде. Буфер B представляет собой 0,02% TFA, 0,08% FA в ацетонитриле. Исходный градиент составлял 5% B, а затем его увеличивали до 35% B за 5 минут и до 38% B за 15 минут. После этого градиент увеличивали до 95% B за 1 минуту и удерживали при 95% B в течение 4 минут, а затем снижали до 5% B за 1 минуту. Скорость потока составляла 50 мкл/мин. Масс-спектрометр работал при напряжении распыления 5 кВ, а интервалы сканирования составляли 600:3200 (отношение масса:заряд). Молекулярная масса легкой цепи 22649 дальтон четко соответствует теоретической величине для легкой цепи, где у N-конца присутствует аминокислота Y. Три небольших пика наблюдались при молекулярных массах 22014 дальтон, 22737 дальтон и 22937 дальтон. Пик при 22014 дальтон соответствовал N-концевому фрагменту, состоящему из 6 аминокислот. Этот пик, по всей вероятности, возник в результате фрагментации полноразмерной легкой цепи в ионном источнике, поскольку снижение «величины фрагмента» в масс-спектрометре приводило к исчезновению этого пика. 22737 дальтон соответствовал теоретической величине для легкой цепи с аминокислотой S, присутствующей у N-конца. 22937 дальтон соответствовал легкой цепи с сигнальным пептидом, удлиненным на аминокислоты «LS» на N-конце. Молекулярные массы тяжелой цепи хорошо соответствовали теоретическим величинам. Наблюдаемые молекулярные массы составляли 50263 дальтон, 50426 дальтон и 50588 дальтон, где разница в 162 дальтон является результатом различия в гликозилировании.
Масс-спектрометрический анализ E9-71(M)
Метод, описанный в разделе «Масс-спектрометрический анализ E9-71», был использован для анализа образца E9-71(M). Молекулярная масса легкой цепи, равная 22645 дальтон, хорошо соответствовала теоретической величине, полученной для легкой цепи с аминокислотой S, присутствующей у N-конца. Небольшой пик, наблюдаемый для молекулярной массы 22989 дальтон, соответствовал легкой цепи с сигнальным пептидом, удлиненным на аминокислоты «SWA» у N-конца. Наблюдался также очень небольшой пик с молекулярной массой 21923 дальтон, хотя, по всей вероятности, он возник в результате фрагментации полноразмерной легкой цепи в ионном источнике, поскольку снижение «величины фрагмента» в масс-спектрометре приводило к исчезновению этого пика. Молекулярные массы тяжелой цепи хорошо соответствовали теоретическим величинам. Наблюдаемые молекулярные массы составляли 50263 дальтон, 50426 дальтон и 50588 дальтон, где разница в 162 дальтон является результатом различия в гликозилировании.
Масс-спектрометрический анализ E9-71(L)
Метод, описанный в разделе «Масс-спектрометрический анализ E9-71», был использован для анализа образца E9-71(L). Молекулярная масса легкой цепи, равная 22645 дальтон, хорошо соответствовала теоретической величине, полученной для легкой цепи с аминокислотой S, присутствующей у N-конца. Небольшой пик, наблюдаемый для молекулярной массы 22989 дальтон, соответствовал легкой цепи с сигнальным пептидом, удлиненным на аминокислоты «SWA» у N-конца. Наблюдался также очень небольшой пик с молекулярной массой 21923 дальтон, хотя, по всей вероятности, он возник в результате фрагментации полноразмерной легкой цепи в ионном источнике, поскольку снижение «величины фрагмента» в масс-спектрометре приводило к исчезновению этого пика. Молекулярные массы тяжелой цепи хорошо соответствовали теоретическим величинам. Наблюдаемые молекулярные массы составляли 50245 дальтон, 50407 дальтон и 50569 дальтон, где разница в 162 дальтон является результатом различия в гликозилировании.
Масс-спектрометрический анализ E9-71(М)-3
Метод, описанный в разделе «Масс-спектрометрический анализ E9-71», был использован для анализа образца E9-71(М)-3. Молекулярная масса легкой цепи, равная 22558 дальтон, хорошо соответствовала теоретической величине. Наблюдался также очень небольшой пик с молекулярной массой 21923 дальтон, хотя, по всей вероятности, он возник в результате фрагментации полноразмерной легкой цепи в ионном источнике, поскольку снижение «величины фрагмента» в масс-спектрометре приводило к исчезновению этого пика. Молекулярные массы тяжелой цепи хорошо соответствовали теоретическим величинам. Наблюдаемые молекулярные массы составляли 50263 дальтон, 50426 дальтон и 50588 дальтон, где разница в 162 дальтон является результатом различия в гликозилировании.
Растворимость антител оценивали путем преципитации полиэтиленгликолем (ПЭГ) 3000. Такая растворимость, то есть истинная растворимость, была определена прямым методом путем концентрирования антител в специальном растворе и/или буфере с помощью центрифужных фильтров Amicon с последующим мониторингом какой-либо преципитации при 25°C и 5°C. Стабильность оценивали методом спектроскопии в ближнем ультрафиолете - круговой поляризации (УФ-КД) и методом дифференциальной сканирующей калориметрии (ДСК). Стабильность при замораживании и оттаивании и при повышенных температурах (ускоренный тест на стабильность) оценивали с помощью эксклюзионной хроматографии (ЭХ). Эти методы подробно описаны в примере 1.8, а результаты описаны ниже, в разделе: Оценка растворимости по результатам ПЭГ-преципитации.
В таблицах 24 и 26 указан процент ПЭГ 3000, необходимый для индуцирования преципитации серии клонов E9. Эти клоны и эталонный адалимумаб приготавливали в концентрации 0,2 мг/мл. В соответствии с этими результатами было установлено, что клоны, такие как E9-4, E9-14, E9-22 и E9-19, имели растворимость, аналогичную растворимости адалимумаба (приблизительно 200 мг/мл), а такие клоны, как E9-11 и E9-17, оценивали как клоны, обладающие гораздо меньшей растворимостью.
В таблице 25 указан процент ПЭГ 3000, необходимый для индуцирования преципитации серии стабильных сконструированных клонов E9. Эти клоны и эталонный адалимумаб приготавливали в концентрации 0,2 мг/мл. В соответствии с этими результатами было установлено, что клоны E9-SE1 в данной серии имели самую высокую растворимость, но при этом не предполагалось, что их растворимость будет аналогична растворимости адалимумаба (приблизительно 200 мг/мл), и такие клоны, как E9-SE5, имели гораздо меньшую растворимость.
|
|
|
Результаты скрининга на истинную растворимость: E9, E9-19, E9-71, E9-2B, E9-1F.
Были получены растворы, содержащие 12 мг E9, E9-71, E9-1F и E9-19 и 5,5 мг E9-2B. E9 представляет собой IgGl мутантного изотипа. Объемы всех растворов снижали до величины ниже 1 мл путем ультрацентрифугирования 15-миллилитровых пробирок на центрифуге Amicon 30K.
После проведения этой стадии получали следующие антитела: E9-2B и E9-19, которые были прозрачными, и E9, E9-71 и E9-1F, которые были слегка мутноватыми.
В каждую пробирку добавляли 10 мл 15 мМ гистидинового буфера при pH 5,03, и растворы снова концентрировали до 1 мл. Затем эти растворы переносили в 4-миллилитровые пробирки Amicon 30K и концентрировали до самого низкого объема, насколько это возможно.
После проведения этой стадии при комнатной температуре получали следующие антитела:
E9: 163 мг/мл; объем=0,05 мл; pH=5,12;
E9-19: 132 мг/мл; объем=0,05 мл; pH=5,06;
E9-71: 193 мг/мл; объем=0,05 мл; pH=5,32;
E9-2B: 64 мг/мл; объем=0,1 мл; pH=5,29;
E9-1F: 100 мг/мл; объем=0,1 мл; pH=5,31.
Для концентрирования антител E9-2B и E9-1F потребовалось гораздо большее количество времени, чем для трех остальных. Это позволяет предположить, что их вязкость является высокой в условиях приготовления составов.
Затем растворы оставляли на два дня при 5°C для оценки растворимости при этой температуре. Были получены следующие антитела:
E9: оставалось прозрачным при 5°C и при доведении до комнатной температуры,
E9-71: оставалось прозрачным при 5°C и при доведении до комнатной температуры,
E9-1F: обнаруживало очень незначительную мутность при 5°C и становилось прозрачным после доведения до комнатной температуры через 20 минут,
E9-2B: обнаруживало незначительную мутность при 5°C и становилось прозрачным после доведения до комнатной температуры через 20 минут,
E9-19: обнаруживало явную мутность при 5°C и становилось прозрачным после доведения до комнатной температуры через 20 минут.
Результаты скрининга на истинную растворимость E9-71
4 мг E9-71 в растворе концентрировали с использованием центрифужных фильтров Amicon до 60 мг/мл. Какого-либо осаждения или помутнения не наблюдалось ни при 25°C, ни после хранения в течение 1 дня при 5°C.
Характеризация третичной структуры по результатам спектроскопии кругового дихроизма в ближнем диапазоне УФ-излучения.
Спектроскопию кругового дихроизма в ближнем УФ-диапазоне осуществляли для образцов E9, E9-19, E9-71, E9-2B и E9-1F при 1 мг/мл. Спектры обнаруживали сигмоидальные профили, обычно наблюдаемые для «правильно» уложенных антител. Этим методом не было обнаружено какой-либо неправильной укладки антител.
Характеризация внутренней стабильности методом дифференциальной сканирующей калориметрии (ДСК).
ДСК осуществляли на образцах E9, E9-19, E9-71, E9-2B и E9-1F в концентрации 1 мг/мл. Результаты представлены в таблице 27. Сначала определяли температуру, при которой начинается разворачивание. Кроме того, антитело IgG обычно проходит три фазы разворачивания (Tm): разворачивание интактного антитела, которое ассоциируется с плавлением домена CH2 в Fc-фрагменте; плавление домена CH3 в Fc-фрагменте; и плавление Fab-фрагмента. Предварительные величины позволили предположить, что наиболее стабильными являются антитела E9, E9-19 и E9-71. Обычно клоны, имеющие более высокие величины Tm, являются более предпочтительными, чем клоны с более низкими величинами.
|
Оценка устойчивости к стрессу в условиях замораживания-оттаивания
Устойчивость к стрессу в условиях замораживания-оттаивания оценивали для образцов E9, E9-19, E9-71, E9-2B и E9-1F в концентрации 1 мг/мл. В таблице 28 представлены результаты ЭХ-анализа образцов после проведения пяти циклов замораживания-оттаивания. Все протестированные антитела оказались устойчивыми к стрессу в условиях замораживания-оттаивания. Какой-либо явной потери мономеров не наблюдалось даже после проведения 5 циклов замораживания-оттаивания.
|
Оценка стабильности при повышенных температурах (ускоренная оценка стабильности)
Стабильность при повышенных температурах оценивали для образцов E9, E9-19, E9-71, E9-2B и E9-1F при концентрации 1 мг/мл. В таблице 29 представлены результаты ЭХ-анализа образцов на время 0, и через 7 дней и 21 день при 40°C и 50°C. Кинетика расщепления для всех антител показала приблизительно 8%-ое снижение процента мономеров через 21 день при 50°C.
|
|
|
Пример 9: Оценка фармакокинетических свойств анти-DLL4 антител у грызунов
Для оценки фармакокинетических свойств анти-DLL4 антител, мышам SCID с врожденным отсутствием природных клеток-киллеров (n=3 на антитело) внутрибрюшинно (i.р.) вводили одну дозу антитела в концентрации 5 или 30 мг/кг, в зависимости от перекрестной реактивности антитела с мышиным DLL4. У каждого животного в течение 21 дня непрерывно брали пробы сыворотки (5 мкл цельной крови, разведенной 1:50 в HBS-EP+-буфере в определенный момент времени). Концентрации в сыворотке определяли с применением DLL4-специфического метода Biacore. Вкратце, человеческий DLL4 иммобилизовали на сенсорном чипе, и образцы впрыскивали через проточную кювету при скорости 5 мкл в минуту в течение 5 минут, а затем измеряли уровни связывания и величины сравнивали со стандартами. Для оценки фармакокинетических параметров: Cmax (максимальная концентрация в сыворотке), CL (клиренс) и t½ (время полужизни антитела), использовали кривые зависимости концентрации в сыворотке от времени, и полученные данные систематизировали в таблице 30. Что касается антител E9 и А10 PROfusion, то их фармакокинетические свойства были улучшены благодаря конструированию CDR в процессе созревания аффинности.
|
Пример 10: Обработка анти-DLL4 антителом приводила к увеличению разрастания эндотелиальных клеток in vitro
Анализ на разрастание клеток, присутствующих на сферах фибринового геля, проводили для оценки in vitro активности клеток HUVEC (пассаж 2-3, Lonza) в отношении ангиогенеза, как описано в литературе (Nakatsu et al., Microvasc. Res., 66: 102-112 (2003)). Вкратце, раствор фибриногена разводили апротинином (4 ед/мл) и тромбином (50 ед/мл). На 3 сферы из цитодекса (Amersham Pharmacia Biotech) наносили 350-400 клеток HUVEC на сферу и оставляли на ночь. Примерно 20 сфер, покрытых HUVEC, заключали в фибриновый сгусток на лунку в 96-луночные планшеты для культивирования тканей. Поверх геля наносили кондиционированную среду, происходящую от нормальных человеческих фибробластов (NHLF, Lonza) при конфлюэнтности 80%. После этого в лунку добавляли анти-DLL4 антитело и контрольное антитело KLH при 15 мкг/мл. На 10 и 12 дни изображения наблюдали с помощью инвертированного микроскопа и ПЗС-камеры Nikon. Ингибирование DLL4 антителами E9 и А10 приводило к усилению разрастания эндотелиальных клеток in vitro (данные не приводятся).
Пример 11: Обработка анти-DLL4 антителом приводила к ингибированию роста опухоли in vivo
Влияние анти-DLL4 антител на рост опухоли оценивали на мышах SCID с врожденным отсутствием природных клеток-киллеров, которым подкожно имплантировали опухолевые ксенотрансплантаты Calu-6. Вкратце, 2×106 клеток подкожно инокулировали в правый задний бок самок мышей SCID с врожденным отсутствием природных клеток-киллеров. Мышей оставляли на 14-18 дней для роста опухолей, после чего измеряли объем опухоли в данный момент времени электронным штангенциркулем. Размер опухоли вычисляли по формуле: L×W2/2. Мышей распределяли по экспериментальным группам (n=10 на группу) так, чтобы каждая группа животных, перед началом проведения терапии, имела эквивалентный средний объем опухоли (обычно в пределах от 180 до 250 мм3). Затем животным внутрибрюшинно вводили дозу анти-DLL4 антител два раза в неделю в течение двух недель (всего 4 дозы). Во время проведения эксперимента объем опухоли измеряли в среднем два раза в неделю до тех пор, пока средний объем опухоли у мышей в каждой группе не достигал ≥2000 мм3. Результаты представлены в таблице 31. Антитела PROfusion серии E9, обладающие улучшенными фармакокинетическими свойствами (как показано в примере 9), обнаруживали тенденцию к усилению противоопухолевой активности in vivo.
|
Содержание всех цитируемых документов (включая литературные источники, патенты, патентные заявки и web-сайты), которые могут упоминаться в настоящей заявке, во всей своей полноте и во всех целях вводятся в настоящее описание посредством ссылки.
Эквиваленты
Настоящее изобретение может быть осуществлено и в других конкретных формах, не выходящих за рамки его существа или основных отличительных признаков. Поэтому все вышеуказанные варианты во всех своих аспектах носят иллюстративный характер и не ограничивают настоящее изобретение. Таким образом, объем настоящего изобретения определен в прилагаемой формуле изобретения, а не в вышеприведенном описании, а поэтому все внесенные изменения не должны выходить за рамки значений и серии эквивалентов, определенных в формуле изобретения.