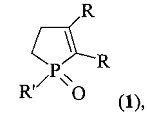
Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-1-ФЕНИЛ(АЛКИЛ)ЗАМЕЩЕННЫХ ФОСФОЛ-2-ЕН-1-ОКСИДОВ
Вид РИД
Изобретение
Изобретение относится к органической химии, в частности способу получения 2,3-диалкил-1-фенил(алкил)фосфол-2-ен-1-оксидов формулы (1):
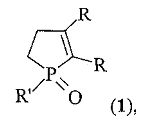
где R=Et, Pr, Bu; R′=Me, Bu, Ph.
Указанные соединения могут найти применение в качестве эффективных интермедиатов и лигандов в металлоорганической химии и катализе [Kollar L., Keglevich G. P-Heterocycles as Ligands in Homogeneous Catalytic Reactions, Chem. Rev., 2010, 4257-4302], в качестве прекурсоров при производстве фосфосахаров [Reddy V.K., Haritha В., Oshikawa Т., Yamashita М. A novel conversion of eritro phospholane epoxides to one-carbon atom homologated allylic alcohols, 2004, 45, 2851-2854; Reddy V.K., Rao L.N., Oshikawa Т., Takahashi M., Yamashita M. Synthesis of novel 1-(substiyuytd phenyl)-2-phospholene 1-oxide derivatives, Phosphorus, Sulfur and Silicon, 2002, 177, 1801-1806] и биологически активных соединений [Yamada М., Yamashita M., Suyama Т., Yamashita J., Asai K., Niimi Т., Ozaki N., Fujie M., Maddali K., Nakamura S. Preparation and characterization of novel 4-bromo-2,4-dimethyl-1-phenyl-2-phospholene 1-oxide and the analogous phosphorus heterocycles or phospha sugars, Bioorg. Med. Chem. Lett., 2010, 20, 5943-5946].
Известен способ (У.М. Джемилев, А.Г. Ибрагимов, Г.А. Толстиков, А.П. Золотарев. Способ получения 1-фенил-3-алкилфосфоланов. Авторское свидетельство №1747452 от 15.03.1992) получения 3-алкилфосфоланов (2) взаимодействием α-олефина с Et3Al в алифатическом растворителе под действием катализатора Cp2ZrCl2 при температуре 25°C в течение 8 ч, с последующей обработкой образующейся реакционной смеси фенилдихлорфосфином в среде эфира при 0°C и перемешиванием реакционной смеси при комнатной температуре в течение 6-8 часов. Реакция протекает по схеме:
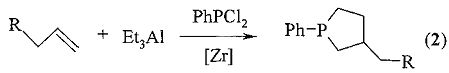
Известным способом не могут быть получены 2,3-диалкил-1-фенил(алкил)фосфол-2-ен-1-оксиды формулы (1).
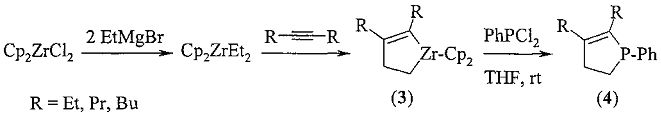
Известен способ (Y. Zhou, X. Yan, С. Xi. Preparation of 2-phospholene derivatives from zirconacyclopentenes. Tetrahedron Lett., 2010, 51, 6136-6138) получения 2,3-диалкил-1-фенилфосфоленов (4) взаимодействием фенилдихлорфосфина с цирконациклопентеном (3), полученным из ZrCp2Et2 и дизамещенных ацетиленов, по схеме:
Предлагается новый способ получения 2,3-диалкил-1-фенил(алкил)фосфол-2-ен-1-оксидов (1).
Сущность способа заключается во взаимодействии дизамещенных ацетиленов общей формулы R-≡-R (5), где R=Et, Pr, Bu, с триэтилалюминием (Et3Al) в присутствии катализатора цирконацендихлорида (Cp2ZrCl2), взятых в мольном соотношении ацетилен: Et3Al:Cp2ZrCl2=10:(10÷30):(0.1÷1.0), предпочтительно 10:10:0.5, в толуоле в атмосфере аргона при температуре 20-40°C в течение 4-12 ч, с последующим добавлением при (-5)-(-10)°C фенилдихлорфосфина или алкилдихлорфосфина общей формулы R′PCl2, где R′=Me, Bu, Ph, взятого в эквимольном по отношению к Et3Al количестве, и перемешиванием при комнатной температуре в течение 10-30 мин. Последующее взаимодействие полученных фосфоланов с 30%-ной перекисью водорода, взятой в эквимольном по отношению к фосфину количестве, в хлороформе в течение 1 часа приводит к 2,3-диалкил-1-фенил(алкил)фосфол-2-ен-1-оксидам (1) с выходами 33-91%. Реакция протекает по схеме:
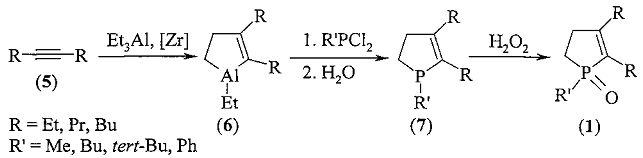
2,3-Диалкил-1-фенил(алкил)фосфол-2-ен-1-оксиды формулы (1) образуются только лишь с участием Et3Al, симметричных ацетиленов, циркониевого катализатора Cp2ZrCl2, и дигалогенидов фосфора. В присутствии других соединений алюминия (например, 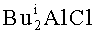 ,
, 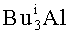 ,
, 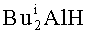 , EtAlCl2, Et2AlCl), других непредельных соединений (α-олефины, диены, аллены), других катализаторов (например, Zr(acac)4, ZrCl4, Cp2TiCl2, Pd(acac)2, Ni(acac)2, NiCl2, Fe(acac)2) или других соединений фосфора (например, Ph2PCl, PCl3, PCl5, POCl3) целевой продукт (1) не образуется.
, EtAlCl2, Et2AlCl), других непредельных соединений (α-олефины, диены, аллены), других катализаторов (например, Zr(acac)4, ZrCl4, Cp2TiCl2, Pd(acac)2, Ni(acac)2, NiCl2, Fe(acac)2) или других соединений фосфора (например, Ph2PCl, PCl3, PCl5, POCl3) целевой продукт (1) не образуется.
Проведение указанной реакции в присутствии катализатора Cp2ZrCl2 больше 10 мол.% по отношению к симметричным ацетиленам не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора Cp2ZrCl2 менее 1 мол.% снижает выход 2,3-диалкил-1-фенил(алкил)фосфоленов (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе.
Изменение соотношения исходных реагентов в сторону увеличения их содержания по отношению к исходным ацетиленам не приводит к существенному повышению выхода целевого продукта (1).
Существенные отличия предлагаемого способа:
В известном способе 1-фенил-3-алкилфосфолан (3) получают взаимодействием α-олефинов с Et3Al под действием катализатора Cp2ZrCl2 последующей обработкой образующейся реакционной смеси фенилдихлорфосфином в среде эфира при 0°C и перемешиванием реакционной смеси при комнатной температуре 6-8 часов.
В известном четырехступенчатом способе 2,3-диалкил-1-фенилфосфол-2-ен (1) получают исходя из фенилдихлорфосфина и 2,3-дизамещенного цирконациклопент-2-ена, получаемого из стехиометрических количеств дорогостоящего Cp2ZrCl2, который при -78°C обрабатывается в течение 1 ч EtMgBr и затем образующийся Cp2ZrEt2 вовлекается в реакцию с дизамещенным алкином.
В предлагаемом трехступенчатом способе 2,3-диалкил-1-фенил(алкил)фосфолен-1-оксиды (1) получают из дизамещенных ацетиленов и Et3Al с участием в качестве катализатора Cp2ZrCl2 при температуре 40°C с дальнейшей обработкой реакционной массы с помощью фенилдихлорфосфина или алкилдихлорфосфина в течение 10-30 мин. Последующее взаимодействие 2,3-диалкил-1-фенилфосфол-2-ена (3) с 30%-ной перекисью водорода в хлороформе в течение 1 часа приводит к образованию целевого 2,3-диалкил-1-фенилфосфол-2-ен-1-оксида (1).
Предлагаемый способ обладает следующими преимуществами.
1. Способ позволяет получать с высоким выходом 2,3-диалкил-1-фенил(алкил)фосфол-2-ен-1-оксиды общей формулы (1).
2. Нет необходимости применения низких температур - (-78)°C, реакция проходит при 20-40°C.
3. Дорогостоящий Cp2ZrCl2 используется в каталитических количествах - 1-5 мол.% на исходный алкин.
Способ поясняется следующими примерами.
ПРИМЕР 1. В стеклянный реактор объемом 50 мл, установленный на магнитной мешалке, в атмосфере сухого аргона при 0°C и перемешивании последовательно помещают 20 мл толуола, 1,1 мл (10 ммолей) гекс-3-ина, 0,149 г (0,5 ммолей) Cp2ZrCl2, и 1,5 мл (10 ммолей) Et3Al. Температуру реакционной массы доводят до 40°C и перемешивают 4 ч. Затем реакционную смесь охлаждают до (-5)-(-10)°C, прикапывают 4,1 мл (30 ммоль) фенилдихлорфосфина и перемешивают при комнатной температуре еще 30 мин. Реакционную массу обрабатывают насыщенным водным раствором NH4Cl, продукты реакции экстрагируют диэтиловым эфиром, сушат над MgSO4, растворитель упаривают, целевой фосфолен выделяют вакуумной разгонкой с выходом 83%. К раствору 1,17 г (5 ммоль) синтезированного фосфолена в 10 мл хлороформа при интенсивном перемешивании медленно прикапывают 0,6 мл (5 ммоль) 30%-ной перекиси водорода и перемешивают 1 ч. Затем реакционную смесь промывают водой 3×5 мл, органический слой сушат над MgSO4. Растворитель упаривают.
Другие примеры, подтверждающие способ, приведены в табл. 1.
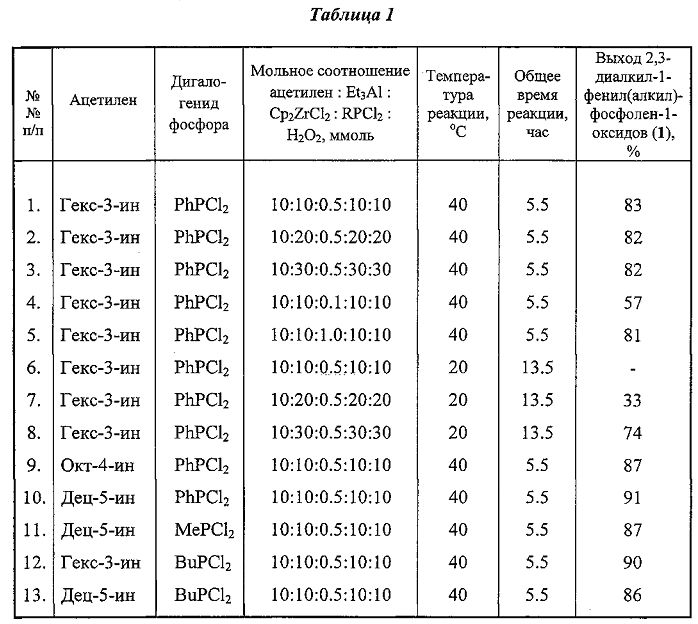
Спектральные характеристики (1)*:

2,3-Диэтил-1-фенилфосфол-2-ен-1-оксид.
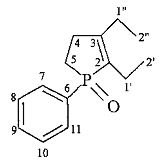 Найдено (%): C, 71.9; H, 8.3. С14Н19РО. Вычислено (%): C, 71.77; H, 8.17.
Найдено (%): C, 71.9; H, 8.3. С14Н19РО. Вычислено (%): C, 71.77; H, 8.17.  =1.5274. Спектр ЯМР 1Н (δ, м.д., J/Гц): 0.85 (т, 3Н, C(2″)Н3, 3J=7.6); 1.07 (т, 3Н, С(2′)Н3, 3J=7.6); 2.02-2.18 (м, 3Н, С(1″)На, С(5)На, С(5)Нб); 2.19-2.38 (м, 3Н, С(1″)Нб, С(1′)Н2); 2.50-2.63 (м, 1Н, С(4)На); 2.68-2.82 (м, 1H, С(4)Нб); 7.33-7.49, 7.55-7.75 (м, 5Н, Ph). Спектр ЯМР 13С (δ, м.д., J/Гц): 12.31 (С(2′)); 14.04 (С(2″)); 18.64 (C(1″), 3JPC=11.1); 24.13 (C(1′), 2JPC=15.1); 25.40 (С(5), 1JPC=69.4); 30.56 (С(4), 2JPC=9.1); 128.42 (С(8), С(10), 3JPC=11.1); 130.40 (С(7), C(11), 2JPC=10.1); 131.37 (С(9), JPC=3.0); 131.97 (С(2), 1JPC=95.6); 134.19 (С(6), 1JPC=92.5); 159.21 (С(3), 2JPC=31.2). Спектр ЯМР 31Р (δ, м.д.): 63.74. Масс-спектр (MALDI TOF/TOF), найдено: m/z 235.401 [М+Н]+. С14Н19РОН. Вычислено: М=234.274.
=1.5274. Спектр ЯМР 1Н (δ, м.д., J/Гц): 0.85 (т, 3Н, C(2″)Н3, 3J=7.6); 1.07 (т, 3Н, С(2′)Н3, 3J=7.6); 2.02-2.18 (м, 3Н, С(1″)На, С(5)На, С(5)Нб); 2.19-2.38 (м, 3Н, С(1″)Нб, С(1′)Н2); 2.50-2.63 (м, 1Н, С(4)На); 2.68-2.82 (м, 1H, С(4)Нб); 7.33-7.49, 7.55-7.75 (м, 5Н, Ph). Спектр ЯМР 13С (δ, м.д., J/Гц): 12.31 (С(2′)); 14.04 (С(2″)); 18.64 (C(1″), 3JPC=11.1); 24.13 (C(1′), 2JPC=15.1); 25.40 (С(5), 1JPC=69.4); 30.56 (С(4), 2JPC=9.1); 128.42 (С(8), С(10), 3JPC=11.1); 130.40 (С(7), C(11), 2JPC=10.1); 131.37 (С(9), JPC=3.0); 131.97 (С(2), 1JPC=95.6); 134.19 (С(6), 1JPC=92.5); 159.21 (С(3), 2JPC=31.2). Спектр ЯМР 31Р (δ, м.д.): 63.74. Масс-спектр (MALDI TOF/TOF), найдено: m/z 235.401 [М+Н]+. С14Н19РОН. Вычислено: М=234.274.
2,3-Дипропил-1-фенилфосфол-2-ен-1-оксид.
 Найдено (%): С, 73.3; Н, 8.9. C16H23OP. Вычислено (%): С, 73.26; Н, 8.84.
Найдено (%): С, 73.3; Н, 8.9. C16H23OP. Вычислено (%): С, 73.26; Н, 8.84. 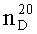 =1.5200. Спектр ЯМР 1Н (δ, м.д, J/Гц): 0.77 (т, 3Н, С(3″)Н3, 3J=7.2); 0.96 (т, 3Н, С(3′)Н3, 3J=7.2); 1.19-1.35 (м, 2Н, С(2″)Н2); 1.46-1.59 (м, 2Н, С(2′)Н2); 1.93-2.17 (м, 3Н, С(1″)На, С(5)На, С(5)Нб); 2.17-2.34 (м, 3Н, С(1″)Нб, С(1′)Н2); 2.52-2.65 (м, 1H, С(4)На); 2.67-2.83 (м, 1Н, С(4)Нб); 7.35-7.50, 7.55-7.65 (м, 5Н, Ph). Спектр ЯМР 13С (δ, м.д., J/Гц): 14.16 (С(3′)); 14.24 (С(3″)); 20.95 (С(2′)); 22.50 (С(2″)); 25.45 (С(5), lJPC =69.4); 27.90 (C(1″), 3JPC=11.1); 31.06 (С(4), 2JPC=9.0); 33.21 (C(1′), 2JPC=14.1); 128.46 (C(7), C(11), 2JPC=12.1); 130.38 (C(8), C(10), 3JPC=10.1); 131.42 (C(9), JPC=3.0); 131.44 (C(2), 1JPC=94.5); 134.10 (C(6), 1JPC=92.5); 158.20 (C(3), 2JPC=31.2). Спектр ЯМР 31P (δ, м.д.): 63.99. Масс-спектр (MALDI TOF/TOF), найдено: m/z 263.408 [M+H]+. C16H23OPH. Вычислено: M=262.327.
=1.5200. Спектр ЯМР 1Н (δ, м.д, J/Гц): 0.77 (т, 3Н, С(3″)Н3, 3J=7.2); 0.96 (т, 3Н, С(3′)Н3, 3J=7.2); 1.19-1.35 (м, 2Н, С(2″)Н2); 1.46-1.59 (м, 2Н, С(2′)Н2); 1.93-2.17 (м, 3Н, С(1″)На, С(5)На, С(5)Нб); 2.17-2.34 (м, 3Н, С(1″)Нб, С(1′)Н2); 2.52-2.65 (м, 1H, С(4)На); 2.67-2.83 (м, 1Н, С(4)Нб); 7.35-7.50, 7.55-7.65 (м, 5Н, Ph). Спектр ЯМР 13С (δ, м.д., J/Гц): 14.16 (С(3′)); 14.24 (С(3″)); 20.95 (С(2′)); 22.50 (С(2″)); 25.45 (С(5), lJPC =69.4); 27.90 (C(1″), 3JPC=11.1); 31.06 (С(4), 2JPC=9.0); 33.21 (C(1′), 2JPC=14.1); 128.46 (C(7), C(11), 2JPC=12.1); 130.38 (C(8), C(10), 3JPC=10.1); 131.42 (C(9), JPC=3.0); 131.44 (C(2), 1JPC=94.5); 134.10 (C(6), 1JPC=92.5); 158.20 (C(3), 2JPC=31.2). Спектр ЯМР 31P (δ, м.д.): 63.99. Масс-спектр (MALDI TOF/TOF), найдено: m/z 263.408 [M+H]+. C16H23OPH. Вычислено: M=262.327.
2,3-Дибутил-1-фенилфосфол-2-ен-1-оксид.
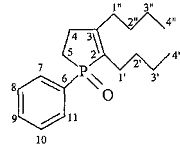 Найдено (%): С, 74.6; H, 9.5. C18H27PO. Вычислено (%): С, 74.45; Н, 9.37.
Найдено (%): С, 74.6; H, 9.5. C18H27PO. Вычислено (%): С, 74.45; Н, 9.37. 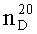 =1,5225. Спектр ЯМР 1Н (δ, м.д., J/Гц): 0.67 (т, 3Н, С(4″)Н3, 3J=7.2); 0.88 (т, 3Н, С(4′)Н3, 3J=7.2); 1.04-1.47 (м, 8Н, С(2′)Н2, С(2″)Н2, С(3′)Н2, С(3″)Н2); 1.95-2.10 (м, 3Н, С(1″)На, С(5)На, С(5)Нб); 2.17-2.28 (м, 3Н, С(1″)Нб, С(1′)Н2); 2.48-2.58 (м, 1H, С(4)На); 2.65-2.77 (м, 1Н, С(4)Нб); 7.24-7.43, 7.48-7.62 (м, 5Н, Ph). Спектр ЯМР 13С (δ, м.д., J/Гц): 13.53 (С(4″)); 13.81 (С(4′)); 22.68 (С(3″)); 22.73 (С(3′)); 25.30 (С(5), 1JPC=69.4); 25.38 (С(1″), 3JPC=11.1); 29.77 (С(2′)); 30.89 (С(1′), 2JPC=14.1); 31.05 (С(4), 2JPC=9.1); 31.18 (С(2″)); 128.40 (С(8), С(10), 3JPC=12.1); 130.32 (С(7), С(11), 2JPC=10.1); 131.18 (С(2), 1JPC=94.5); 131.36 (С(9), JPC=3.0); 133.98 (С(6), 1JPC=93.5); 158.30 (С(3), 2JPC=31.2). Спектр ЯМР 31Р (δ, м.д.): 64.04. Масс-спектр (MALDI TOF/TOF), найдено: m/z 291.100 [М+Н]+. С18Н27РОН. Вычислено: М=290.380.
=1,5225. Спектр ЯМР 1Н (δ, м.д., J/Гц): 0.67 (т, 3Н, С(4″)Н3, 3J=7.2); 0.88 (т, 3Н, С(4′)Н3, 3J=7.2); 1.04-1.47 (м, 8Н, С(2′)Н2, С(2″)Н2, С(3′)Н2, С(3″)Н2); 1.95-2.10 (м, 3Н, С(1″)На, С(5)На, С(5)Нб); 2.17-2.28 (м, 3Н, С(1″)Нб, С(1′)Н2); 2.48-2.58 (м, 1H, С(4)На); 2.65-2.77 (м, 1Н, С(4)Нб); 7.24-7.43, 7.48-7.62 (м, 5Н, Ph). Спектр ЯМР 13С (δ, м.д., J/Гц): 13.53 (С(4″)); 13.81 (С(4′)); 22.68 (С(3″)); 22.73 (С(3′)); 25.30 (С(5), 1JPC=69.4); 25.38 (С(1″), 3JPC=11.1); 29.77 (С(2′)); 30.89 (С(1′), 2JPC=14.1); 31.05 (С(4), 2JPC=9.1); 31.18 (С(2″)); 128.40 (С(8), С(10), 3JPC=12.1); 130.32 (С(7), С(11), 2JPC=10.1); 131.18 (С(2), 1JPC=94.5); 131.36 (С(9), JPC=3.0); 133.98 (С(6), 1JPC=93.5); 158.30 (С(3), 2JPC=31.2). Спектр ЯМР 31Р (δ, м.д.): 64.04. Масс-спектр (MALDI TOF/TOF), найдено: m/z 291.100 [М+Н]+. С18Н27РОН. Вычислено: М=290.380.
2,3-Дибутил-1-метилфосфол-2-ен 1-оксид.
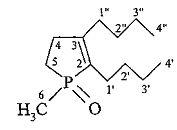 Найдено (%): С, 68.5; Н, 11.2. С13Н25РО. Вычислено (%): С, 68.39; Н, 11.04.
Найдено (%): С, 68.5; Н, 11.2. С13Н25РО. Вычислено (%): С, 68.39; Н, 11.04. 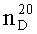 =1,4934. Спектр ЯМР 1Н (δ, м.д, J/Гц): 0.84-0.93 (м, 6Н, С(4′)Н3, С(4″)Н3); 1.24-1.42 (м, 6Н, С(2′)Н2, С(3′)Н2, С(3″)Н2); 1.42-1.51 (м, 2Н, С(2″)Н2); 1.51-1.60 (м, 3Н, С(6)Н3); 1.86-1.98 (м, 2Н, С(5)На, С(5)Нб); 2.10-2.46 (м, 5Н, С(1′)Н2, С(1″)На, С(1″)Нб, С(4)На); 2.54-2.70 (м, 1H, С(4)Нб). Спектр ЯМР 13С (δ, м.д., J/Гц): 13.78 (С(4″)); 13.83 (С(4′)); 16.83 (С(6), 1JPC=64.4); 22.66 (С(3″)); 22.95 (С(3′)); 24.59 (С(5), 1JPC=69.4); 25.32 (С(1″), 3JPC=11.1); 29.60 (С(2″)); 30.21 (С(4), 2JPC=9.0); 30.77 (C(1′), 2JPC=14.1); 31.77 (С(2′)); 131.76 (С(2), 1JPC=99.6); 155.37 (С(3), 2JPC=29.2). Спектр ЯМР 31P (δ, м.д.): 68.87. Масс-спектр (MALDI TOF/TOF), найдено: m/z 229.413 [М+Н]+. C13H25POH. Вычислено: М=228.311.
=1,4934. Спектр ЯМР 1Н (δ, м.д, J/Гц): 0.84-0.93 (м, 6Н, С(4′)Н3, С(4″)Н3); 1.24-1.42 (м, 6Н, С(2′)Н2, С(3′)Н2, С(3″)Н2); 1.42-1.51 (м, 2Н, С(2″)Н2); 1.51-1.60 (м, 3Н, С(6)Н3); 1.86-1.98 (м, 2Н, С(5)На, С(5)Нб); 2.10-2.46 (м, 5Н, С(1′)Н2, С(1″)На, С(1″)Нб, С(4)На); 2.54-2.70 (м, 1H, С(4)Нб). Спектр ЯМР 13С (δ, м.д., J/Гц): 13.78 (С(4″)); 13.83 (С(4′)); 16.83 (С(6), 1JPC=64.4); 22.66 (С(3″)); 22.95 (С(3′)); 24.59 (С(5), 1JPC=69.4); 25.32 (С(1″), 3JPC=11.1); 29.60 (С(2″)); 30.21 (С(4), 2JPC=9.0); 30.77 (C(1′), 2JPC=14.1); 31.77 (С(2′)); 131.76 (С(2), 1JPC=99.6); 155.37 (С(3), 2JPC=29.2). Спектр ЯМР 31P (δ, м.д.): 68.87. Масс-спектр (MALDI TOF/TOF), найдено: m/z 229.413 [М+Н]+. C13H25POH. Вычислено: М=228.311.
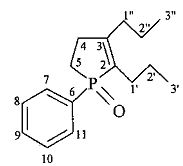
2,3-Диэтил-1-бутил-1-фосфол-2-ен-1-оксид.
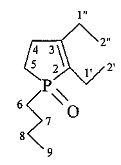 Найдено (%): C, 67.4; H, 10.9. C12H23OP. Вычислено (%): C, 67.26; H, 10.82.
Найдено (%): C, 67.4; H, 10.9. C12H23OP. Вычислено (%): C, 67.26; H, 10.82. 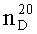 =1,4852. Спектр ЯМР 1Н (δ, м.д., J/Гц): 0.91 (т, 3Н, С(9)Н3, 3J=7.2); 1.04 (т, 3Н, С(2′)Н3, 3J=7.6); 1.12 (т, 3Н, С(2″)Н3, 3J=7.6); 1.33-1.56 (м, 4Н, С(8)Н2, С(7)Н2); 1.64-1.79 (м, 1Н, С(6)На); 1.80-2.05 (м, 3Н, С(5)На, С(5)Нб, С(6)Нб); 2.16-2.47 (м, 5Н, С(1′)Н2, С(1″)На, С(1″)Нб, С(4)На); 2.59-2.72 (м, 1H, С(4)Нб). Спектр ЯМР 13С (δ, м.д., J/Гц): 13.27 С(2′)); 14.62 (С(9)); 15.44 (С(2″)); 19.66 (C(1″), 3JPC=12.1); 23.27 (С(5), 1JPC=65.4); 24.92 (C(1′), 2JPC=15.1); 25.09 (С(7), 2JPC=15.1); 25.38 (С(8), 3JPC=3.0); 31.15 (С(6), 1JPC=64.4); 31.25 (С(4), 2JPC=8.1); 132.24 (С(2), 1JPC=91.5); 158.80 (С(3), 2JPC=29.2). Спектр ЯМР 31Р (δ, м.д.): 75.14. Масс-спектр (MALDI TOF/TOF), найдено: m/z 215.423 [M+H]+. C12H23OPH. Вычислено: M=214.284.
=1,4852. Спектр ЯМР 1Н (δ, м.д., J/Гц): 0.91 (т, 3Н, С(9)Н3, 3J=7.2); 1.04 (т, 3Н, С(2′)Н3, 3J=7.6); 1.12 (т, 3Н, С(2″)Н3, 3J=7.6); 1.33-1.56 (м, 4Н, С(8)Н2, С(7)Н2); 1.64-1.79 (м, 1Н, С(6)На); 1.80-2.05 (м, 3Н, С(5)На, С(5)Нб, С(6)Нб); 2.16-2.47 (м, 5Н, С(1′)Н2, С(1″)На, С(1″)Нб, С(4)На); 2.59-2.72 (м, 1H, С(4)Нб). Спектр ЯМР 13С (δ, м.д., J/Гц): 13.27 С(2′)); 14.62 (С(9)); 15.44 (С(2″)); 19.66 (C(1″), 3JPC=12.1); 23.27 (С(5), 1JPC=65.4); 24.92 (C(1′), 2JPC=15.1); 25.09 (С(7), 2JPC=15.1); 25.38 (С(8), 3JPC=3.0); 31.15 (С(6), 1JPC=64.4); 31.25 (С(4), 2JPC=8.1); 132.24 (С(2), 1JPC=91.5); 158.80 (С(3), 2JPC=29.2). Спектр ЯМР 31Р (δ, м.д.): 75.14. Масс-спектр (MALDI TOF/TOF), найдено: m/z 215.423 [M+H]+. C12H23OPH. Вычислено: M=214.284.
1,2,3-Трибутил-1-фосфол-2-ен-1-оксид.
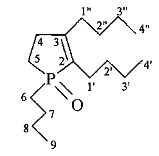 Найдено (%): C, 71.2; H, 11.7. С16Н31ОР. Вычислено (%): С, 71.07; Н, 11.56.
Найдено (%): C, 71.2; H, 11.7. С16Н31ОР. Вычислено (%): С, 71.07; Н, 11.56. 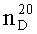 =1,4852. Спектр ЯМР 1Н (δ, м.д., J/Гц): 0.81-0.95 (м, 9Н, С(4′)Н3, С(4″)Н3, С(9)Н3); 1.22-1.54 (м, 12Н, С(2′)Н2, С(2″)Н2, С(3′)Н2, С(3″)Н2, С(7)Н2, С(8)Н2); 1.64-1.74 (м, 1H, С(6)На); 1.76-2.01 (м, 3Н, С(5)На, С(5)Нб, С(6)Нб); 2.11-2.23 (м, 3Н, С(1′)Н2, С(1″)На); 2.27-2.42 (м, 2Н, С(1″)Нб, С(4)На); 2.55-2.68 (м, 1Н, С(4)Нб). Спектр ЯМР 13С (δ, м.д., J/Гц): 14.60 (С(9)); 14.80 (С(4″)); 14.86 (С(4′)); 23.38 (С(5), 1JPC=68.4); 23.72 (С(3″)); 24.06 (С(3′)); 25.09 (С(7), 2JPC=15.1); 25.41 (С(8), 3JPC=3.0); 26.59 (C(1″), 3JPC=11-1); 30.72 (С(2′)); 31.11 (С(6), 1JPC=64.4); 31.68 (С(4), 2JPC=9.1); 31.70 (C(1′), 2JPC=14.1); 32.85 (С(2″)); 131.69 (С(2), 1JPC=90.5); 157.46 (С(3), 2JPC=29.2). Спектр ЯМР 31Р (δ, м.д.): 74.48. Масс-спектр (MALDI TOF/TOF), найдено: m/z 271.342 [М+H]+. С12Н23ОРН. Вычислено: М=270.391.
=1,4852. Спектр ЯМР 1Н (δ, м.д., J/Гц): 0.81-0.95 (м, 9Н, С(4′)Н3, С(4″)Н3, С(9)Н3); 1.22-1.54 (м, 12Н, С(2′)Н2, С(2″)Н2, С(3′)Н2, С(3″)Н2, С(7)Н2, С(8)Н2); 1.64-1.74 (м, 1H, С(6)На); 1.76-2.01 (м, 3Н, С(5)На, С(5)Нб, С(6)Нб); 2.11-2.23 (м, 3Н, С(1′)Н2, С(1″)На); 2.27-2.42 (м, 2Н, С(1″)Нб, С(4)На); 2.55-2.68 (м, 1Н, С(4)Нб). Спектр ЯМР 13С (δ, м.д., J/Гц): 14.60 (С(9)); 14.80 (С(4″)); 14.86 (С(4′)); 23.38 (С(5), 1JPC=68.4); 23.72 (С(3″)); 24.06 (С(3′)); 25.09 (С(7), 2JPC=15.1); 25.41 (С(8), 3JPC=3.0); 26.59 (C(1″), 3JPC=11-1); 30.72 (С(2′)); 31.11 (С(6), 1JPC=64.4); 31.68 (С(4), 2JPC=9.1); 31.70 (C(1′), 2JPC=14.1); 32.85 (С(2″)); 131.69 (С(2), 1JPC=90.5); 157.46 (С(3), 2JPC=29.2). Спектр ЯМР 31Р (δ, м.д.): 74.48. Масс-спектр (MALDI TOF/TOF), найдено: m/z 271.342 [М+H]+. С12Н23ОРН. Вычислено: М=270.391.