Результат интеллектуальной деятельности: ЛЕЧЕНИЕ И ПРЕДУПРЕЖДЕНИЕ ВИЧ-ИНФЕКЦИИ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Данное изобретение относится к области долговременного лечения ВИЧ-инфекции путем периодического введения парентерального состава, содержащего бреканавир, в течение относительно длительных интервалов времени. Данное изобретение дополнительно относится к фармацевтическим композициям для парентерального введения, содержащим микро- или наночастицы бреканавира, суспендированные в водном фармацевтически приемлемом носителе, для лечения и профилактики ВИЧ-инфекции.
Предпосылки создания изобретения
Лечение инфекции, вызываемой вирусом иммунодефицита человека (ВИЧ), известного как причина синдрома приобретенного иммунодефицита (СПИД), остается глобальной медицинской проблемой. ВИЧ способен уклонятся от иммунологического давления, способен адаптироваться к различным типам клеток и условиям роста и способен вырабатывать резистентность к существующим на сегодняшний день лекарственным средствам. Последние включают нуклеозидные ингибиторы обратной транскриптазы (NRTI), ненуклеозидные ингибиторы обратной транскриптазы (NNRTI), нуклеотидные ингибиторы обратной транскриптазы (NtRTI), ингибиторы ВИЧ-протеазы (PI) и более современные ингибиторы слияния (также известные как ингибиторы проникновения).
Несмотря на то что каждое из этих лекарственных средств эффективно подавляет ВИЧ, их действие при индивидуальном применении препятствует возникновению резистентных мутантов. Это привело к введению комбинированной терапии несколькими анти-ВИЧ агентами, обычно имеющими различные профили действия. В частности, введение «HAART» (высокоактивная противовирусная терапия) привело к значительному улучшению анти-ВИЧ лечения, сильно снизившейся ВИЧ-ассоциированной заболеваемости и смертности. В существующих руководствах по противовирусной терапии такая схема тройной комбинированной терапии рекомендуется даже для начальной терапии. Однако ни одна из существующих на сегодняшний день лекарственных терапий не способна полностью устранить ВИЧ. Даже в случае HAART возможно возникновение резистентности, часто вследствие несоблюдения и непостоянного выполнения схемы противовирусной терапии. В этих случаях, эффективность HAART можно восстановить заменой одного из ее компонентов другим компонентом, относящимся к другому классу. При правильном применении лечение комбинациями HAART может подавлять вирус в течение многих лет (до десятилетий) до уровня, на котором он не может вызывать появление СПИД.
Одним классом анти-ВИЧ лекарственных средств, используемых в HAART, являются PI, ряд которых доступен в продаже на сегодняшний день, а несколько других находятся на различных стадиях разработки. Одним из PI, находящихся в разработке, является соединение [(3R,3aS,6aR)-2,3,3a,4,5,6a-гексагидрофуро[5,4-b]фуран-3-ил]-N-[(2S,3R)-4-(1,3-бензодиоксол-5-илсульфонил(2-метилпропил)амино)-3-гидрокси-1-[4-[(2-метил-1,3-тиазол-4-ил)метокси]фенил]бутан-2-ил]карбамат, также называемый N-(3R,3aS,6aR)-гексагидрофуро[2,3-b]фуран-3-илоксикарбонил-(4S,5R)-4-[4-(2-метилтиазоло-4-метилокси)бензил]-5-изобутил[(3,4-метилендиоксифенил)сульфонил]аминометил-2,2-диметилоксазолидином (CAS 313682-08-5), обычно называемый бреканавиром. Хотя данное соединение проявляло выраженную активность против ВИЧ дикого типа, а также против мутированных вариантов, его разработка была прекращена вследствие непреодолимых проблем, связанных с фармацевтическим составом.
Вследствие их фармакокинетических свойств и необходимости поддерживать концентрацию в плазме выше минимального уровня, для большинства анти-ВИЧ лекарственных средств требуется частое введение в относительно высоких дозах. Число и/или объем дозированных форм, которые необходимо вводить, обычно называют «лекарственной нагрузкой». Высокая лекарственная нагрузка нежелательна по многим причинам, например, из-за частоты введения, часто в сочетании с необходимостью проглатывать дозированные формы крупного размера, а также необходимостью хранить и транспортировать большое число или объем лекарственных препаратов. Высокая лекарственная нагрузка повышает риск того, что пациенты не принимают полную дозу препарата, таким образом, не выполняя предписанную схему дозирования. Кроме снижения эффективности лечения это также приводит к возникновению вирусной резистентности. Проблемы, ассоциированные с высокой лекарственной нагрузкой, умножаются, когда пациент должен принимать комбинацию различных анти-ВИЧ агентов.
Поэтому желательна ВИЧ-ингибирующая терапия, снижающая лекарственную нагрузку благодаря тому, что терапия включает введение дозированных форм относительно небольшого размера и, кроме того, не требует их частого введения. Представляет интерес анти-ВИЧ терапия, включающая введение дозированных форм с большими интервалами, например, с двухнедельными интервалами или более длительными интервалами, или даже с интервалами в один месяц или более длительными интервалами.
Согласно данным, полученным in vitro, пероральное введение бреканавира без агента, положительно влияющего на метаболизм и/или фармакокинетику лекарственного средства, улучшая биодоступность, как, например, ритонавира, давало концентрацию бреканавира, теоретически недостаточную для ингибирования PI-резистентного вируса. Однако совместное введение бреканавира с ритонавиром значительно увеличивало для бреканавира площадь под кривой зависимости концентрации от времени и максимальную концентрацию, позволяя достичь концентраций бреканавира, теоретически способных ингибировать PI-резистентный ВИЧ (Antimicrob. Agents Chemother. 50: 2201-2206). Соединение бреканавира, его фармакологическое действие, а также ряд методик его получения были описаны в WO 2000/076961. Совместное введение с ритонавиром не только увеличивает лекарственную нагрузку, но ритонавир сам по себе влияет также на эффективность множества других лекарственных препаратов, затрудняя их совместное введение. Кроме того, он сам по себе может вызывать большое число побочных эффектов.
Поэтому обеспечение терапии на основе бреканавира без необходимости в совместном введении ритонавира должно быть желаемой задачей в отношении упрощения схемы лечения и устранения побочных эффектов при введении ритонавира.
ВИЧ никогда нельзя полностью устранить, поэтому индивидуум, инфицированный ВИЧ, подвергает постоянному риску заражения других людей. После первоначального заражения проходит длительное время перед возникновением первых симптомов СПИД. Люди могут жить годами с инфекцией, не испытывая каких-либо ее признаков, тем самым не беспокоясь о риске дальнейшей передачи вируса другим людям. Поэтому критичным является предупреждение передачи ВИЧ. Профилактика в настоящий момент сфокусирована на предупреждении передачи в результате половых контактов, в частности, на использовании презервативов в популяциях, имеющих риск инфицирования, на тщательной проверке образцов крови на присутствие ВИЧ и на устранении контактов с кровью, потенциально зараженной ВИЧ.
Несмотря на все эти меры, всегда существует неизбежный риск заражения для индивидуумов, находящихся в контакте с ВИЧ-инфицированными людьми. Это особенно актуально для медицинского персонала, обеспечивающего уход за инфицированными пациентами или пациентами с риском заражения, например, для терапевтов, медсестер или дантистов. В другую группу риска входят дети на грудном вскармливании, чьи матери являются инфицированными или имеют риск инфицирования, особенно в развивающихся странах, где альтернатив грудному вскармливанию существует гораздо меньше.
Поэтому существует необходимость в дополнительных средствах, предупреждающих передачу ВИЧ. Особенно необходимы эффективные средства предупреждения, легкие в применении. Такие профилактические средства являются еще одной задачей настоящего изобретения.
Было обнаружено, что периодическое введение парентеральных составов бреканавира с интервалами в две недели или с более длительными интервалами, например до одного года, приводило к его содержанию в плазме, достаточному для эффективного предупреждения ВИЧ-инфекции или для эффективного подавления ВИЧ-инфекции. Это позволяет снизить число введений, снижая, таким образом, лекарственную нагрузку, и способствует соблюдению пациентом схемы приема лекарственного средства. Дополнительным преимуществом является отсутствие необходимости в совместном введении дополнительного агента, имеющего положительный эффект на метаболизм и/или фармакокинетику лекарственного средства в отношении улучшения биодоступности, например, ритонавира, в результате чего дополнительно снижается лекарственная нагрузка, а также исключаются побочные эффекты, ассоциированные с введением ритонавира.
Сущность изобретения
В одном аспекте настоящее изобретение относится к применению парентерального состава, содержащего эффективное в отношении вируса количество бреканавира или его фармацевтически приемлемой аддитивной соли кислоты и носитель, для изготовления лекарственного препарата для предупреждения передачи ВИЧ-инфекции или для лечения субъекта, инфицированного ВИЧ, где состав вводят или должны вводить периодически с помощью подкожной или внутримышечной инъекции с временными интервалами в диапазоне от двух недель до одного года.
Другой аспект изобретения относится к способу предупреждения передачи ВИЧ-инфекции или лечения субъекта, инфицированного ВИЧ, включающему введение парентерального состава, содержащего эффективное в отношении вируса количество бреканавира или его фармацевтически приемлемой аддитивной соли кислоты и носитель, где состав вводят периодически с помощью подкожной или внутримышечной инъекции с временными интервалами в диапазоне от двух недель до одного года.
В одном варианте осуществления изобретение относится к применению или способу, как определено в данном описании, где парентеральный состав вводят или должны вводить с временными интервалами, которые составляют интервал от двух недель до одного месяца, или интервал от одного месяца до трех месяцев, или интервал от трех месяцев до шести месяцев, или интервал от шести месяцев до двенадцати месяцев.
В другом варианте осуществления изобретение относится к применению или способу, как определено в данном описании, где парентеральный состав вводят или должны вводить один раз в две недели, или один раз в месяц, или один раз в три месяца.
Один аспект настоящего изобретения касается того факта, что парентеральные составы могут быть введены без агента, положительно влияющего на метаболизм и/или фармакокинетику лекарственного средства в отношении улучшения биодоступности, например, ритонавира.
В дополнительном варианте осуществления настоящее изобретение относится к фармацевтической композиции для введения с помощью внутримышечной или подкожной инъекции, содержащей терапевтически эффективное количество бреканавира или его соли в форме суспензии микро- или наночастиц, содержащей:
(а) бреканавир или его соль в форме микро- или наночастиц, имеющих адсорбированный на своей поверхности модификатор поверхности; и
(b) фармацевтически приемлемый водный носитель, в котором суспендирован активный ингредиент бреканавира.
Изобретение дополнительно относится к способу лечения субъекта, инфицированного ВИЧ, включающему введение с помощью внутримышечной или подкожной инъекции эффективного в отношении ВИЧ количества фармацевтической композиции, как определено в данном описании выше или ниже. Или, альтернативно, изобретение относится к применению фармацевтической композиции, как определено в данном описании выше или ниже, для изготовления лекарственного препарата для лечения ВИЧ-инфекции. В одном варианте осуществления композиция предназначена для долговременного лечения ВИЧ-инфекции.
Другой аспект изобретения обеспечивает способ долговременного лечения субъекта, инфицированного ВИЧ, включающий введение эффективного количества фармацевтической композиции, как определено в данном описании выше или ниже, с помощью внутримышечной или подкожной инъекции; где композицию вводят или должны вводить периодически с временными интервалами, которые составляют интервал от двух недель до одного года или от двух недель до двух лет. Или, альтернативно, изобретение относится к применению фармацевтической композиции, как определено в данном описании выше или ниже, для изготовления лекарственного препарата для долговременного лечения субъекта, инфицированного ВИЧ, для введения с помощью внутримышечной или подкожной инъекции, где композицию вводят или должны вводить периодически с временными интервалами, которые составляют интервал от двух недель до одного года или от двух недель до двух лет.
Изобретение дополнительно относится к способу предупреждения ВИЧ-инфекции у субъекта с риском инфицирования ВИЧ, включающему введение эффективного для предупреждения ВИЧ-инфекции количества фармацевтической композиции, как определено в данном описании выше или дополнительно ниже, указанному субъекту. Или, альтернативно, изобретение относится к применению фармацевтической композиции, как определено в данном описании выше или дополнительно ниже, для изготовления лекарственного препарата для предупреждения ВИЧ-инфекции у субъекта с риском инфицирования ВИЧ.
В другом аспекте изобретение относится к способу долговременного предупреждения ВИЧ-инфекции у субъекта с риском инфицирования ВИЧ, включающему введение указанному субъекту эффективного количества фармацевтической композиции, как определено в данном описании выше или дополнительно ниже, где композицию вводят или должны вводить периодически с временными интервалами, которые составляют интервал от двух недель до одного года или от двух недель до двух лет.
Настоящее изобретение, кроме того, относится к применению фармацевтической композиции, как определено в данном описании выше или дополнительно ниже, для изготовления лекарственного препарата для долговременного предупреждения ВИЧ-инфекции у субъекта с риском инфицирования ВИЧ, где композицию вводят или должны вводить периодически с временными интервалами, которые составляют интервал от двух недель до одного года или от двух недель до двух лет.
В одном варианте осуществления изобретение относится к применению или способу, как определено в данном описании, где фармацевтическую композицию вводят или должны вводить с временными интервалами, которые составляют интервал от двух недель до одного месяца, или интервал от одного месяца до трех месяцев, или интервал от трех месяцев до шести месяцев, или интервал от шести месяцев до двенадцати месяцев.
В другом варианте осуществления изобретение относится к применению или способу, как определено в данном описании, где фармацевтическую композицию вводят или должны вводить один раз в две недели, или один раз в месяц, или один раз в два месяца, или один раз в три месяца.
Дополнительные фармацевтические композиции, способы лечения или предупреждения, а также применение для изобретения лекарственных препаратов на основе указанных композиций будут описаны в настоящем описании ниже, и подразумевается, что они являются частью настоящего изобретения.
Описание фигур
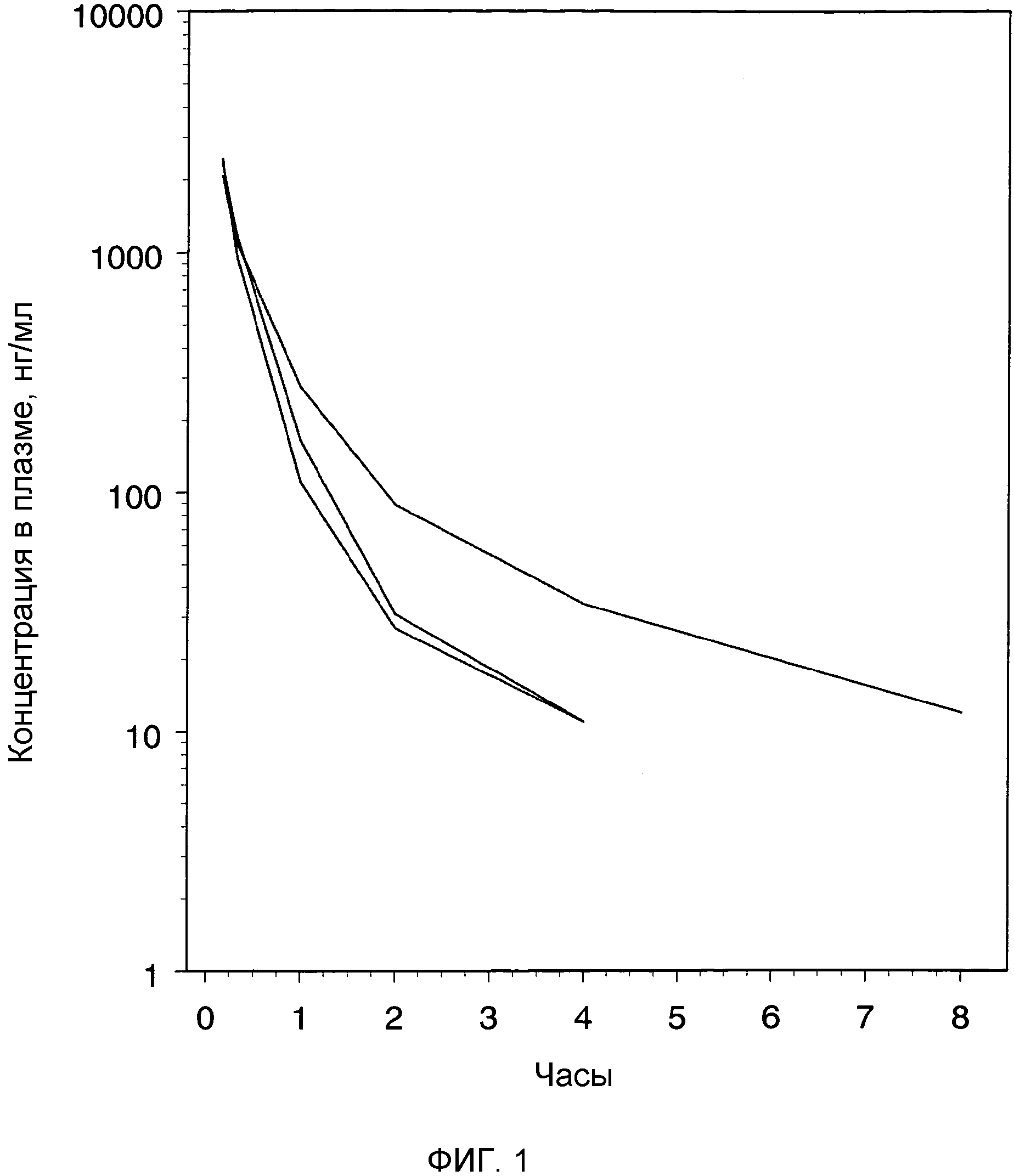
Фиг.1: индивидуальные профили плазматических концентраций (нг/мл) относительно времени после внутривенного введения крысам раствора бреканавира в количестве 2 мг/кг.
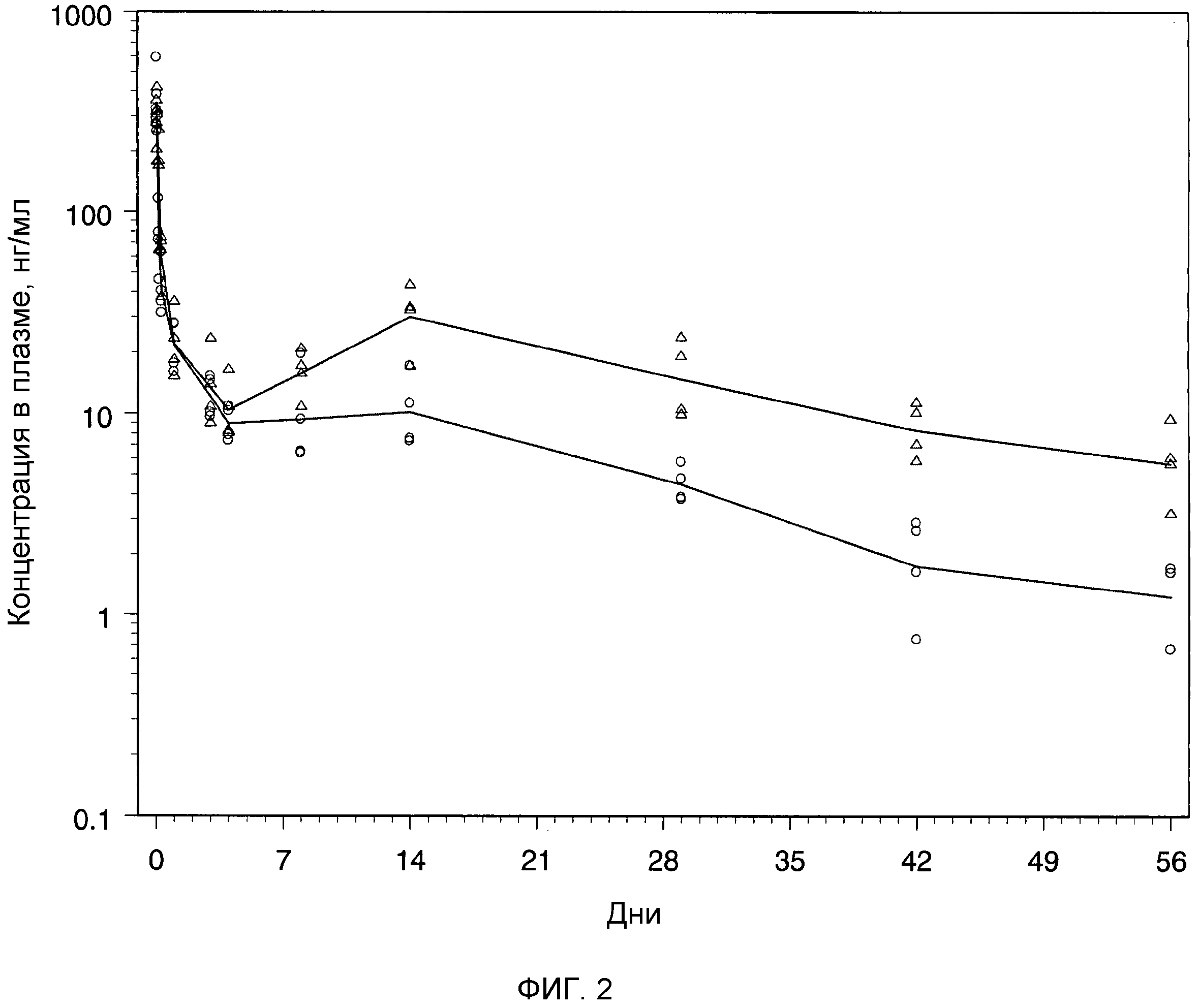
Фиг.2: индивидуальные и средние концентрации бреканавира в плазме после однократной подкожной инъекции крысам раствора бреканавира в количестве 16 (Δ) и 56 мг/кг (o).
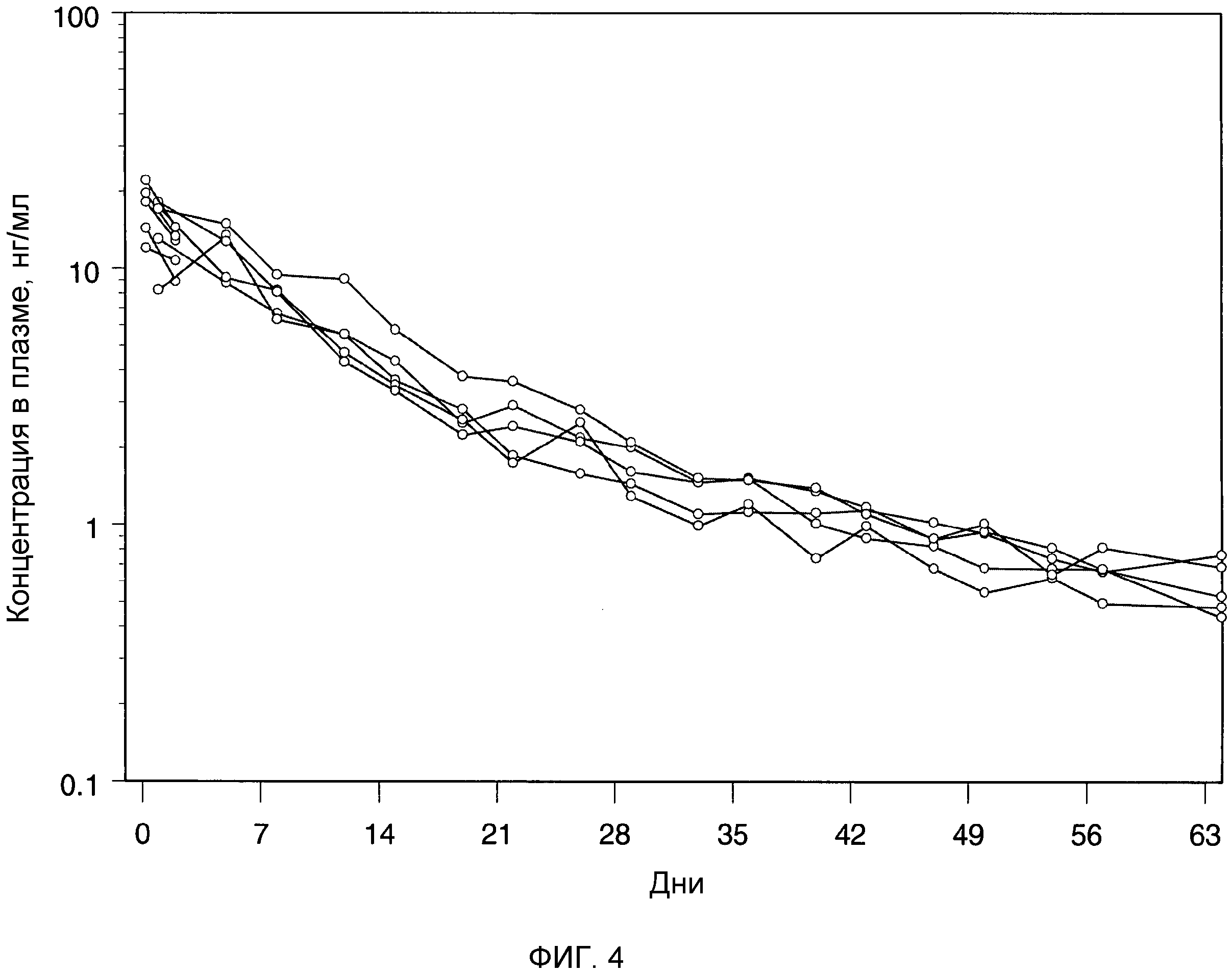
Фиг.3: индивидуальные профили плазматических концентраций бреканавира (нг/мл) относительно времени после однократной внутримышечной (o) и подкожной (Δ) инъекции крысам:
А. микросуспензии бреканавир-Tween 20 (62,5 мг/мл) в количестве 50 мг/кг;
B. наносуспензии бреканавир-Tween 20 (100 мг/мл) в количестве 50 мг/кг;
С. наносуспензии бреканавир-F108 (100 мг/мл) в количестве 50 мг/кг;
D. наносуспензии бреканавир-Tween 20 (200 мг/мл) в количестве 50 мг/кг;
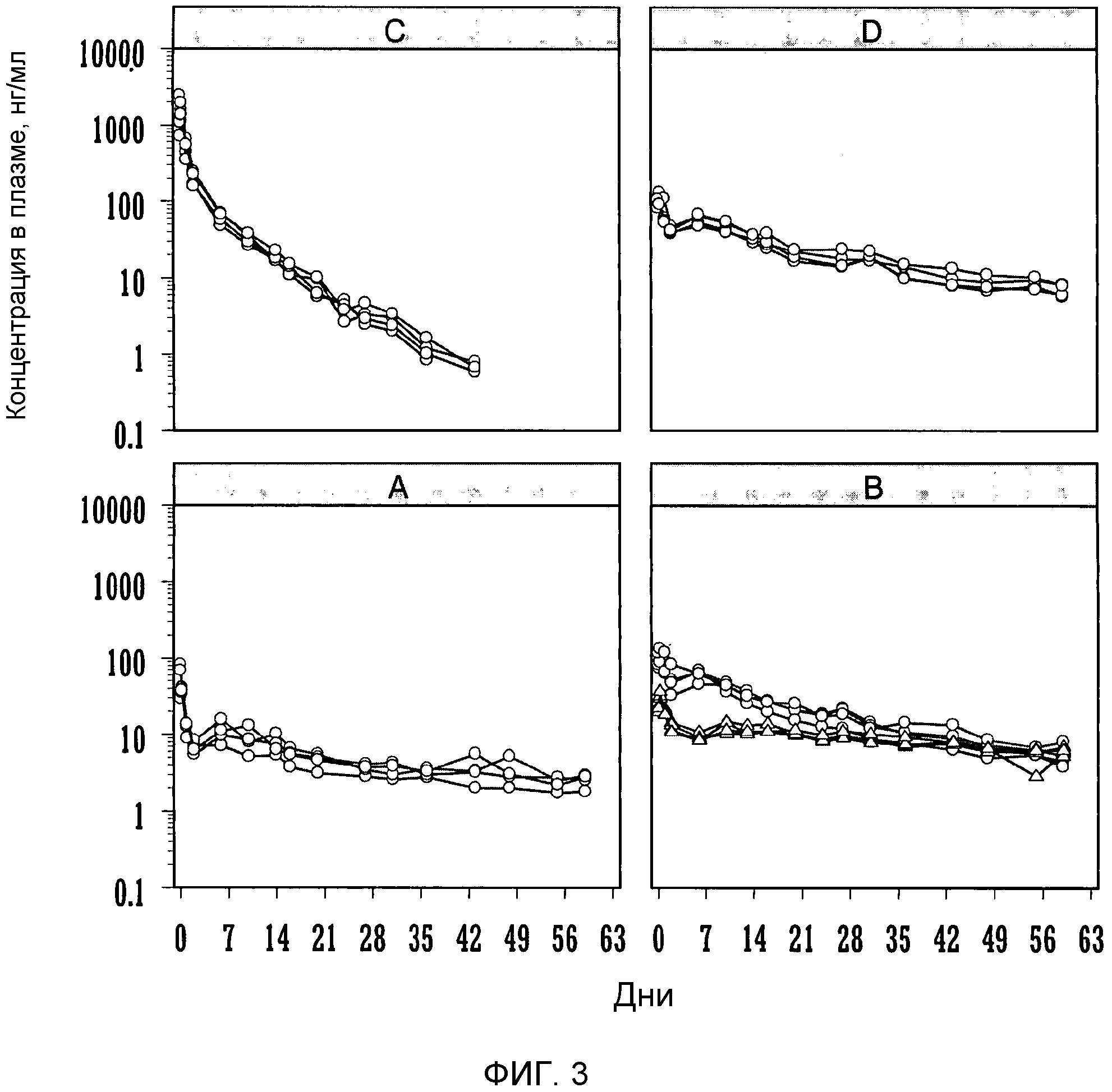
Фиг.4: индивидуальные профили плазматических концентраций бреканавира (нг/мл) относительно времени после однократной внутримышечной дозы (50 мг/животное) наносуспензии в Tween 20 (100 мг/мл).
Подробное описание изобретения
Бреканавир можно использовать в основной форме или в виде фармацевтически приемлемой соли, например, в виде аддитивной соли кислоты. Фраза «фармацевтически приемлемые аддитивные соли кислот» означает, что они содержат терапевтически активные нетоксичные соли. Везде в настоящем описании термин «бреканавир» относится как к свободной форме, так и к любой его фармацевтически приемлемой соли.
Термин «профилактика ВИЧ-инфекции» относится к предупреждению или предотвращению заражения субъекта ВИЧ. Источник инфекции может быть различным: материал, содержащий ВИЧ, в частности, жидкость тела, содержащая ВИЧ, например, кровь или сперма, или другой субъект, инфицированный ВИЧ. Предупреждение ВИЧ-инфекции относится к предупреждению передачи вируса из материала, содержащего ВИЧ, или от ВИЧ-инфицированного индивидуума к неинфицированному человеку, или оно связано с предупреждением проникновения вируса в организм неинфицированного человека. Передачей ВИЧ может являться любой известный случай ВИЧ-передачи, например, в результате передачи половым путем или в результате контакта с кровью инфицированного субъекта, например, медицинского персонала, обеспечивающего уход за инфицированными субъектами. Передача ВИЧ может произойти в результате контакта с ВИЧ-зараженной кровью, например, при работе с образцами крови или при переливании крови. Она также может произойти в результате контакта с инфицированными клетками, например, при проведении лабораторных экспериментов с ВИЧ-инфицированными клетками.
Термины «лечение ВИЧ-инфекции», «анти-ВИЧ терапия», а также аналогичные термины относятся к лечению, в результате которого снижается вирусная нагрузка ВИЧ (представляемая в виде числа копий вирусной РНК в определенном объеме сыворотки). Чем более эффективно лечение, тем меньше вирусная нагрузка. Предпочтительно снижать вирусную нагрузку до минимально возможного уровня, например, ниже примерно 200 копий/мл, в частности, ниже примерно 100 копий/мл, более предпочтительно, ниже 50 копий/мл, при возможности - ниже предела обнаружения вируса. Снижение вирусной нагрузки на один, два или даже три порядка (например, снижение примерно в 10-100 раз или в большей степени, например, снижение примерно в 1000 раз) указывает на эффективность лечения. Другим параметром эффективности анти-ВИЧ лечения является число CD4-положительных клеток, которое у здоровых взрослых людей находится в интервале примерно от 500 до примерно 1500 клеток на мкл. Снижение числа CD4-положительных клеток указывает на ВИЧ-инфекцию, и при его падении ниже примерно 200 клеток на мкл может развиться СПИД. Увеличение числа CD4-положительных клеток, например, примерно на 50, 100, 200 или больше клеток на мкл, также указывает на эффективность анти-ВИЧ лечения. Число CD4-положительных клеток, в частности, должно увеличиваться до уровня выше примерно 200 клеток на мкл или выше примерно 350 клеток на мкл. Вирусную нагрузку или количество CD4-положительных клеток (или оба эти параметра) можно использовать для диагностики степени выраженности ВИЧ-инфекции.
Термины «эффективное лечение ВИЧ» и аналогичные термины относятся к такому лечению, которое снижает вирусную нагрузку или повышает число CD4-положительных клеток (или оказывает оба эти действия), как описано выше.
Термин «лечение ВИЧ-инфекции» также относится к лечению заболеваний, ассоциированных с ВИЧ-инфекцией, например, СПИД, или других состояний, ассоциированных с ВИЧ-инфекцией, включая тромбоцитопению, саркому Капоши и инфекцию центральной нервной системы, отличающуюся прогрессирующей демиелинизацией, приводящую к деменции и симптомам, таким как прогрессирующая дизартрия, атаксия и дезориентация, и другие состояния, с которыми также ассоциирована ВИЧ-инфекция, например, периферическая невропатия, прогрессирующая генерализованная лимфоаденопатия (PGL) и СПИД-связанный комплекс (ARC).
Термин «эффективное предупреждение ВИЧ» и аналогичные термины относятся к ситуации, при которой наблюдается снижение относительного числа ново инфицированных субъектов в популяции, контактирующей с источником ВИЧ-инфекции, например, материалом, содержащим ВИЧ, или ВИЧ-инфицированным субъектом. Эффективность предупреждения можно измерить, например, изучая в смешанной популяции ВИЧ-инфицированных и неинфицированных индивидуумов, наблюдается ли снижение относительного числа новоинфицированных индивидуумов при сравнении неинфицированных индивидуумов, получавших лечение фармацевтической композицией по изобретению, и неинфицированных индивидуумов, не получавших лечение. Это снижение можно измерить, используя статистический анализ числа инфицированных и неинфицированных индивидуумов в данной популяции в динамике.
Термин «эффективное количество» относится к такому количеству бреканавира, которое при введении обеспечивает эффективное лечение ВИЧ. Термин «эффективный уровень в плазме» относится к такому уровню бреканавира в плазме, который приводит к снижению вирусной нагрузки, в частности, ниже числа копий, указанных выше. Термин «эффективное количество» аналогично относится к количеству бреканавира, которое при введении эффективно предупреждает ВИЧ.
Термины «терапевтически эффективное количество», «количество, эффективное для предупреждения ВИЧ-инфекции», и аналогичные термины относятся к количеству активного ингредиента бреканавира, которое обеспечивает действующий уровень в плазме крови. Под «действующим уровнем в плазме крови» понимается такой уровень ВИЧ-ингибитора бреканавира в плазме крови, который обеспечивает эффективное лечение или эффективное предупреждение ВИЧ-инфекции.
Термин «субъект», в частности, относится к человеку.
Применение или способы применения парентеральных композиций бреканавира по настоящему изобретению могут предназначаться для лечения ВИЧ-инфекции или для предупреждения передачи ВИЧ-инфекции в течение длительного периода времени. В случае предупреждения ВИЧ-инфекции, композиции следует применять, пока существует риск инфицирования. Или когда риск инфицирования присутствует в течение ограниченного периода времени, композиции следует применять в тот период, когда существует риск инфицирования, например, от двух до трех недель, или от трех до четырех недель, или от одного до двух месяцев, или от двух до трех месяцев, или от трех до шести месяцев, или от шести месяцев до 12 месяцев, или от 12 месяцев до 24 месяцев. Для лечения ВИЧ-инфекции парентеральные композиции бреканавира следует применять в течение длительного периода времени, например, в течение одного года или нескольких лет.
Под выражением «эффективно в течение по меньшей мере двух недель или более длительного периода» понимается, что минимальное значение концентрации активного ингредиента бреканавира в плазме в конце интервала дозирования или между двумя интервалами дозирования должно быть выше порогового значения. В случае терапевтического применения, указанное пороговое значение представляет собой минимальный уровень в плазме, при котором бреканавир обеспечивает эффективное лечение ВИЧ-инфекции. В случае применения для предупреждения ВИЧ-инфекции, указанное пороговое значение представляет собой минимальный уровень в плазме, при котором бреканавир эффективно предупреждает передачу ВИЧ-инфекции.
Фармацевтические композиции по настоящему изобретению можно вводить с различными временными интервалами. При использовании для предупреждения ВИЧ-инфекции фармацевтические композиции по настоящему изобретению можно вводить однократно или ограниченное число раз, например, дважды, три, четыре, пять или шесть раз, или большее число раз. Этот вариант можно рекомендовать, когда предупреждение необходимо на ограниченный период времени, например, период, в течение которого существует риск инфицирования.
Фармацевтические композиции по настоящему изобретению можно вводить с временными интервалами, указанными выше, такими как временные интервалы, которые составляют интервал от двух недель до одного месяца или интервал от одного месяца до трех месяцев, или интервал от трех месяцев до шести месяцев, или интервал от шести месяцев до двенадцати месяцев. В одном варианте осуществления изобретения фармацевтическую композицию можно вводить каждые две недели, или один раз в месяц, или один раз в три месяца. В другом варианте осуществления изобретения временной интервал составляет интервал от одной до двух недель, или от двух до трех недель, или от трех до четырех недель, или временной интервал составляет от одного до двух месяцев, или от двух до трех месяцев, или от трех до четырех месяцев, или от трех до шести месяцев, или от шести месяцев до двенадцати месяцев, или от двенадцати месяцев до двадцати четырех месяцев. Временной интервал может составлять по меньшей мере две недели, но также может составлять несколько недель, например, две, три, четыре, пять или шесть недель, или временной интервал может составлять один месяц или несколько месяцев, например, два, три, четыре, пять или шесть месяцев, или даже более длительный период времени, например, семь, восемь, девять или двенадцать месяцев. В одном варианте осуществления изобретения фармацевтическую композицию по настоящему изобретению вводят с временным интервалом один, два или три месяца. Эти более длительные периоды между каждым введением фармацевтических композиций по изобретению обеспечивают дополнительные преимущества в отношении лекарственной нагрузки и соблюдения пациентом схемы лечения. Для дополнительного улучшения соблюдения пациентом схемы лечения пациента можно проинструктировать принимать свой лекарственный препарат в определенный день недели, если композицию вводят еженедельно, или в определенный день месяца, если препарат вводят ежемесячно.
Длительность временных интервалов между каждым введением композиции по настоящему изобретению может меняться. Например, указанные временные интервалы могут быть выбраны в зависимости от уровня соединения в плазме. Интервалы могут быть сокращены, если уровень бреканавира в плазме крови считается слишком низким, например, когда он приближается к минимальному уровню в плазме крови, указанному в настоящем описании ниже. Интервалы могут быть увеличены, если уровень бреканавира в плазме крови считается слишком высоким. В одном варианте осуществления композиции по изобретению вводят с одинаковыми временными интервалами. Предпочтительно вводить композиции без любых промежуточных дополнительных введений, или другими словами, композиции можно вводить в определенные моменты времени, отделенные друг от друга варьирующим или одинаковым интервалом, например, составляющим по меньшей мере две недели, или любой другой период времени, указанный в настоящем описании, в течение которого не вводят дополнительное количество бреканавира. Временные интервалы одинаковой продолжительности обладают преимуществом простоты схемы введения, то есть введение происходит в один и тот же день недели или один и тот же день месяца. Поэтому такая схема введения включает ограниченную лекарственную нагрузку, тем самым положительно влияя на соблюдение пациентом предписанной схемы дозирования.
Дозу (или количество) вводимого бреканавира, которая представляет собой количество бреканавира в парентеральном составе для использования в изобретении, выбирают таким образом, чтобы концентрация бреканавира в плазме крови поддерживалась при лечении продолжительного периода времени выше минимального уровня в плазме крови. Термин «минимальный уровень в плазме крови» (Cmin) в контексте лечения ВИЧ относится к наименьшему действующему уровню в плазме крови, причем последний представляет собой такой уровень бреканавира в плазме крови, который обеспечивает эффективное лечение ВИЧ, или другими словами, такой уровень бреканавира в плазме крови, который эффективно подавляет ВИЧ. Уровень бреканавира в плазме следует поддерживать выше этого порогового уровня, поскольку низкое содержание лекарственного средства не будет эффективным, тем самым увеличивая риск возникновения мутаций. В случае предупреждения ВИЧ термин «минимальный уровень в плазме крови (или Cmin) относится к наименьшему уровню бреканавира в плазме крови, который обеспечивает эффективное предупреждение передачи ВИЧ-инфекции, то есть представляет собой наименьший уровень в плазме крови, который эффективно ингибирует указанную передачу.
Доза вводимого бреканавира также зависит от временного интервала, в котором его вводят. При менее частом введении доза будет более высокой.
Доза вводимого бреканавира зависит от количества бреканавира в фармацевтических композициях по изобретению или от количества данной композиции, которую вводят. Если желателен более высокий уровень в плазме, то можно ввести любую из двух или обе композиции с более высокой концентрацией бреканавира, или большее количество данной композиции. Если желателен более низкий уровень бреканавира в плазме, то действуют наоборот. Кроме того, можно подобрать комбинацию различных временных интервалов и различных дозировок для того, чтобы получить определенный желаемый уровень в плазме крови.
Доза (или количество) вводимого бреканавира зависит также от частоты введения (то есть временного интервала между каждым введением). Обычно доза будет выше при менее частом введении. Все эти параметры можно использовать для получения желаемого значения уровня в плазме крови.
Схема дозирования также зависит от того, предполагается ли лечение или предупреждение ВИЧ-инфекции. В случае лечения, дозу вводимого бреканавира или частоту введения (или оба параметра) выбирают таким образом, чтобы поддерживать концентрацию бреканавира в плазме крови выше минимального уровня в плазме крови. В частности, уровень бреканавира в плазме крови поддерживают выше минимального уровня в плазме крови примерно 24 нг/мл или выше примерно 40 нг/мл, или выше примерно 50 нг/мл, или выше примерно 75 нг/мл. Уровень бреканавира в плазме крови можно поддерживать выше минимального уровня в плазме крови, то есть выше, например, примерно 100 нг/мл или выше примерно 150 нг/мл, или выше примерно 200 нг/мл. Минимальный уровень в плазме крови можно определить, умножая значение ЕС50 на фактор, выражающий связывание белка и резерв безопасности, который можно установить примерно как 10. Значение ЕС50 можно получить в тесте с использованием ВИЧ дикого типа. О нем также можно узнать из Antimicrobial Agents and Chemotherapy, Apr. 2007, pp. 1202-1208.
В одном варианте осуществления изобретения уровень бреканавира в плазме крови поддерживается в определенном диапазоне, в частности, в диапазоне от минимального уровня в плазме крови, выбранного из указанных выше, и до более высокого уровня в плазме крови, такого как примерно 100 нг/мл, или примерно 200 нг/мл, или примерно 500 нг/мл, или примерно 1000 нг/мл. В одном варианте осуществления уровень бреканавира в плазме крови поддерживают в диапазоне примерно от 5 до примерно 500 нг/мл, или примерно от 10 нг/мл до примерно 200 нг/мл, или примерно от 10 нг/мл до примерно 100 нг/мл, или примерно от 10 нг/мл до примерно 50 нг/мл.
Уровень бреканавира в плазме следует поддерживать выше указанного выше минимального уровня в плазме крови, поскольку более низкая концентрация не будет достаточно подавлять вирус, так что он сможет размножаться с дополнительным риском возникновения мутаций.
В частности, в случае предупреждения ВИЧ, уровень бреканавира в плазме крови можно поддерживать выше минимального уровня в плазме крови, указанного выше для терапевтического применения. Однако при предупреждении ВИЧ концентрацию бреканавира в плазме крови можно поддерживать на более низком уровне, например, на уровне выше примерно 1 нг/мл или примерно 5 нг/мл, или примерно 10 нг/мл. Предпочтительно следует поддерживать уровень бреканавира в плазме крови выше этих указанных минимальных значений уровня в плазме крови, поскольку более низкое содержание лекарственного средства может оказаться неэффективными, тем самым, увеличивая риск передачи ВИЧ. Концентрацию бреканавира в плазме можно поддерживать на несколько большем уровне для создания резерва безопасности. Такие более высокие уровни начинаются примерно с 24 нг/мл или выше. Концентрацию бреканавира в плазме можно поддерживать на уровне, находящемся в диапазоне, указанном выше для терапевтического применения, но в котором нижняя граница включает уровни в плазме крови примерно 4 нг/мл или примерно 5 нг/мл, или примерно 8 нг/мл.
В некоторых обстоятельствах может быть желательно поддерживать концентрацию бреканавира в плазме на относительно низком уровне, например, как можно ближе к минимальным уровням в плазме крови, указанным в настоящем описании. Это позволит снизить частоту введений и/или количество бреканавира, вводимого каждый раз. Это также позволит избежать нежелательных побочных эффектов, что тоже повлияет на одобрение дозированных форм в большинстве групп целевой популяции, которые состоят из здоровых людей с риском инфицирования и, поэтому, менее склонных переносить побочные эффекты. Концентрацию бреканавира в плазме можно поддерживать на относительно низком уровне в случае предупреждения ВИЧ. В других случаях, может быть желательно поддерживать концентрацию бреканавира в плазме на относительно более высоком уровне, например, когда существует высокий риск инфицирования, и более частое введение и/или более высокие дозы не представляют проблему. В этих случаях, минимальный уровень в плазме крови может равняться наименьшему уровню бреканавира в плазме крови, обеспечивающему эффективное лечение ВИЧ, например, такому как конкретные уровни, указанные в настоящем описании.
В случае предупреждения ВИЧ, вводимую парентерально дозу следует вычислять исходя из дозировки примерно от 0,2 мг/день до примерно 50 мг/день или от 0,5 мг/день до примерно 50 мг/день, или примерно от 1 мг/день до примерно 10 мг/день, или примерно от 2 мг/день до примерно 5 мг/день, например, исходя примерно из 3 мг/день. Это соответствует недельной дозе примерно от 1,5 мг до примерно 350 мг, в частности, примерно от 3,5 мг до примерно 350 мг, в частности, примерно от 7 мг до примерно 70 мг, или примерно от 14 мг до примерно 35 мг, например, примерно 35 мг, или это соответствует месячной дозе от 6 мг до примерно 3000 мг, в частности, примерно от 15 мг до примерно 1500 мг, более конкретно, примерно от 30 мг до примерно 300 мг, или примерно от 60 мг до примерно 150 мг, например, примерно 150 мг. Дозировки для других схем лечения можно легко вычислить, умножая дневную дозу на число дней между каждым введением.
В случае лечения, доза, вводимая парентерально, должна быть несколько выше, и ее следует вычислять, исходя из количества примерно от 1 мг/день до примерно 150 мг/день или примерно от 2 мг/день до примерно 100 мг/день, или примерно от 5 мг/день до примерно 50 мг/день, или примерно от 10 мг/день до примерно 25 мг/день, например, примерно 15 мг/день. Соответствующие недельные или месячные дозировки можно вычислить, как указано выше. Для предупреждения ВИЧ дозировки могут быть ниже, хотя можно использовать такие же дозировки, как для лечения.
Было обнаружено, что после введения уровень бреканавира в плазме крови остается более или менее стабильным, то есть меняется в ограниченных пределах. Было обнаружено, что уровень в плазме крови остается более или менее стабильным, или скорость выведения приблизительно остается нулевой в течение продолжительного периода времени. Под «стабильным» понимается состояние, в котором количество лекарственного средства, присутствующего в плазме крови субъекта, остается более или менее на том же уровне в течение продолжительного периода времени. Уровень бреканавира в плазме не падает ниже минимального уровня, при котором лекарственное средство является эффективным. Термин «остается более или менее на одном уровне» не исключает небольших отклонений концентрации в плазме в допустимых пределах, например, отклонений в диапазоне примерно ±30% или примерно ±20%, или примерно ±10%, или примерно ±5%.
Парентеральные составы бреканавира вводят периодически с интервалами по меньшей мере в две недели или, в частности, с временными интервалами, указанным в настоящем описании, то есть парентеральный состав вводят без каких-либо промежуточных дополнительных введений бреканавира. Другими словами, бреканавир вводят в определенные моменты времени, отделенные друг от друга по меньшей мере двухнедельным интервалом или, в частности, интервалом, указанным в настоящем описании, в течение которого не вводят бреканавир. Таким образом, введение является простым и более редким и, в результате, значительно снижает проблему «лекарственной нагрузки», встречающуюся в случае стандартных препаратов против ВИЧ. Это, в свою очередь, будет улучшать соблюдение пациентом схемы лечения назначенным препаратом.
Парентеральные составы бреканавира можно вводить с временными интервалами, указанными выше. В одном варианте осуществления диапазон временных интервалов составляет от двух до трех недель или от трех до четырех недель. В другом варианте осуществления диапазон временных интервалов составляет от одного до двух месяцев или от двух до трех месяцев, или от трех до четырех месяцев. Временной интервал может составлять по меньшей мере две недели, но может также составлять несколько недель, например, две, три, четыре, пять или шесть недель, или временной интервал может составлять один месяц или несколько месяцев, например, два, три, четыре, пять или шесть месяцев, или даже может быть больше, например, может составлять семь, восемь, девять или двенадцать месяцев. В одном варианте осуществления парентеральный состав вводят с временным интервалом один, два или три месяца.
Эти более длительные периоды времени между введениями парентерального состава приводят к дополнительному снижению «лекарственной нагрузки» и дополнительно улучшают соблюдение пациентом схемы лечения. Для дополнительного улучшения соблюдения пациентами схемы лечения, пациентов можно проинструктировать принимать лекарственный препарат в определенный день недели, если состав вводят еженедельно, или в определенный день месяца при ежемесячном введении препарата. Временные интервалы между каждым введением парентерального состава бреканавира могут меняться. Например, интервалы можно сокращать, если уровень бреканавира в плазме крови считается слишком низким, например, когда он приближается к минимальному уровню в плазме крови, указанному в настоящем описании ниже. Интервалы могут быть увеличены, если уровень бреканавира в плазме крови считается слишком высоким. В одном варианте осуществления парентеральные составы бреканавира вводят с одинаковыми временными интервалами, например, каждые две недели, каждый месяц или с временными интервалами, указанными в настоящем описании. Временные интервалы одинаковой продолжительности обладают преимуществом в том, что введение происходит, например, в один и тот же день недели, или один и тот же день месяца, тем самым, внося положительный вклад в соблюдение пациентом схемы лечения.
Предпочтительно вводить парентеральный состав в одно введение, например, одной инъекцией после по меньшей мере двухнедельного интервала, например, путем одной инъекции каждые две недели или каждый месяц, или каждые три месяца.
Концентрации бреканавира в плазме могут достичь относительно высоких уровней, не вызывая существенных побочных эффектов, но не должны превышать максимального уровня в плазме (или Cmax), который представляет собой уровень в плазме крови, при котором бреканавир вызывает значительные побочные эффекты. Используемый в настоящем описании термин «значительные побочные эффекты» означает, что побочные эффекты возникают у значительной популяции пациентов в такой степени, что они влияют на нормальную жизнедеятельность пациентов. Cmax для бреканавира можно определить, экстраполируя экспериментальные данные, полученные клеточными методами анализа, или оценивая результаты клинических исследований, и предпочтительно, она не должна превышать примерно 1000 нг/мл.
Парентеральные составы бреканавира можно вводить подкожно или внутримышечно.
Носители
Настоящее изобретение основано на применении парентеральных составов активного ингредиента бреканавира, и, поэтому, природу носителя следует выбирать таким образом, чтобы она подходила для парентерального введения. Носитель должен быть жидким и может быть на масляной основе, но в большинстве случаев будет водным. В последнем случае, носитель включает стерильную воду, хотя могут быть включены другие ингредиенты. Носитель может включать сорастворитель, например спирт, такой как этанол, пропанол, этиленгликоль, пропиленгликоль, или полимер, действующий как сорастворитель, такой как полиэтиленгликоль (ПЭГ) или полиэтоксилированное касторовое масло (кремофор®).
Для усиления растворимости активного соединения в парентеральные составы бреканавира могут быть добавлены дополнительные ингредиенты, которые усиливают растворимость, такие как солюбилизаторы и поверхностно-активные вещества, или ингредиенты, которые являются как поверхностно-активным веществом, так и солюбилизатором. Примерами таких дополнительных ингредиентов являются циклодекстрины или производные циклодекстринов. Подходящими циклодекстринами являются α-, β-, γ-циклодекстрины или их простые эфиры и смешанные простые эфиры, в которых одна или несколько гидроксильных групп ангидроглюкозных звеньев циклодекстрина замещены С1-6алкилом, в частности, метилом, этилом или изопропилом, например, случайным образом метилированные β-CD; гидроксиС1-6алкилом, в частности, гидроксиэтилом, гидроксипропилом или гидроксибутилом; карбоксиС1-6алкилом, в частности, карбоксиметилом или карбоксиэтилом; С1-6алкилкарбонилом, в частности, ацетилом. Особенно следует отметить в качестве комплексообразователей и/или солюбилизаторов β-CD, случайным образом метилированный β-CD, 2,6-диметил-β-CD, 2-гидроксиэтил-β-CD, 2-гидроксипропил-β-CD и (2-карбоксиметокси)пропил-β-CD и, в частности, 2-гидроксипропил-β-CD (2-HP-β-CD).
Другими подобными ингредиентами, обладающими поверхностно-активными свойствами, являются полоксамеры, которые представляют собой полиоксиэтилен-полиоксипропиленовые блок-сополимеры, в общем соответствующие формуле HO-[CH2CH2O]x-[CH(CH3)CH2O]y-[CH2H2O]z-H, где x, y и z имеют различные значения, которые доступны под торговой маркой плюроник®, например, плюроник® F108, соответствующий полоксамеру 338, в котором средние значения x, y и z составляют 128, 54 и 128, соответственно. Еще такими ингредиентами являются α-токоферилполиэтиленгликольсукцинаты, в частности, витамин Е-TGPS; сложные эфиры полиоксиэтиленсорбитана и жирных кислот (также называемые полисорбатами), доступные под торговым наименованием Tween®, например Tween® 80; полиэтиленгликоли (ПЭГ), такие как ПЭГ 400.
Парентеральные составы бреканавира могут дополнительно содержать суспендирующие агенты и буферы и/или агенты, для доведения рН, и, необязательно, консерванты и агенты, обеспечивающие изотоничность. Отдельные ингредиенты могут функционировать в качестве двух или нескольких из этих агентов одновременно, например, действовать как консервант и буферный агент, или действовать как буферный агент и агент, обеспечивающий изотоничность.
Буферирующие агенты и агенты для доведения рН можно использовать в количестве, достаточном для доведения рН дисперсии до нейтральных или несколько основных значений (до рН 8,5), предпочтительно в диапазоне рН от 7 до 7,5. Предпочтительными буферами являются соли слабых кислот. Буферирующие агенты и агенты для доведения рН, которые могут быть добавлены, могут быть выбраны из винной кислоты, малеиновой кислоты, глицина, лактата натрия/молочной кислоты, аскорбиновой кислоты, цитратов натрия/лимонной кислоты, ацетата натрия/уксусной кислоты, бикарбоната натрия/угольной кислоты, сукцината натрия/янтарной кислоты, бензоата натрия/бензойной кислоты, фосфатов натрия, трис(гидроксиметил)аминометана, бикарбоната натрия/карбоната натрия, гидроксида аммония, бензолсульфоновой кислоты, бензоата натрия/кислоты, диэтаноламина, глюконо-дельта-лактона, хлористоводородной кислоты, бромистого водорода, лизина, метансульфоновой кислоты, моноэтаноламина, гидроксида натрия, трометамина, глюконовой кислоты, глицериновой кислоты, глутаровой кислоты, глутаминовой кислоты, этилендиаминтетрауксусной кислоты (EDTA), триэтаноламина, включая их смеси.
Консерванты включают противомикробные соединения и антиоксиданты, которые могут быть выбраны из группы, состоящей из бензойной кислоты, бензилового спирта, бутилированного гидроксианизола (ВНА), бутилированного гидрокситолуола (ВНТ), хлорбутола, галлата, гидроксибензоата, EDTA, фенола, хлоркрезола, метакрезола, бензетонийхлорида, миристил-γ-пиколинийхлорида, ацетата фенилртути и тимеросала. Акцепторы радикалов включают ВНА, ВНТ, витамин Е и аскорбилпальмитат, а также их смеси. Акцепторы кислорода включают аскорбат натрия, сульфит натрия, L-цистеин, ацетилцистеин, метионин, тиоглицерин, ацетон-бисульфит натрия, изоаскорбиновую кислоту, гидроксипропилциклодекстрин. Хелатирующие агенты включают цитрат натрия, натриевую соль EDTA и яблочную кислоту.
Агентами, обеспечивающими изотоничность, являются, например, хлористый натрий, декстроза, сахароза, фруктоза, трегалоза, маннит, глицерин, сорбит, ксилит, лактоза, сульфат натрия. Суспензии обычно содержат от 0 до 10% (масса/объем), конкретно, 0-6% агента, обеспечивающего изотоничность. Предпочтительны обычные неионные агенты, обеспечивающие изотоничность, более конкретно, глицерин, поскольку электролиты могут повлиять на коллоидную стабильность.
В одном варианте осуществления парентеральные составы бреканавира для применения по настоящему изобретению имеют форму раствора, содержащего эффективное количество бреканавира и водный носитель. Предпочтительно, чтобы к раствору был добавлен солюбилизатор или поверхностно-активное вещество, в частности, любой из солюбилизаторов или поверхностно-активных веществ, указанных выше.
Кроме того, было обнаружено, что физико-химические свойства бреканавира позволяют изготовление его в виде суспензии микро- или наночастиц, которую можно использовать для длительного лечения ВИЧ-инфекции, а также для долговременного предупреждения ВИЧ-инфекции.
Термин «микро- или наночастицы» относится к частицам в микрометровом или нанометровом диапазоне. Размер частиц должен быть ниже максимального размера, выше которого нарушается или становится невозможным введение с помощью подкожных или внутримышечных инъекций. Указанный максимальный размер зависит, например, от ограничений, налагаемых диаметром иглы или негативной реакцией организма на частицы большого размера, или двумя этими факторами. В одном варианте осуществления фармацевтические композиции по изобретению содержат бреканавир в виде наночастиц.
Эффективный средний размер микро- или наночастиц по настоящему изобретению может быть ниже примерно 50 мкм или ниже примерно 20 мкл, или ниже примерно 10 мкм, или ниже примерно 1000 нм, или ниже примерно 500 нм, или ниже примерно 400 нм, или ниже примерно 300 нм, или ниже примерно 200 нм. Нижняя граница эффективного среднего размера частиц может быть низкой, например, примерно до 100 нм или примерно до 50 нм. В одном варианте осуществления эффективный средний размер частиц находится в диапазоне примерно от 50 нм до примерно 50 мкм, или примерно от 50 нм до примерно 20 мкм, или примерно от 50 нм до примерно 10 мкм, или примерно от 50 нм до примерно 1000 нм, примерно от 50 нм до примерно 500 нм, или примерно от 50 нм до примерно 400 нм, или примерно от 50 нм до примерно 300 нм, или примерно от 50 нм до примерно 250 нм, или примерно от 100 нм до примерно 250 нм, или примерно от 150 нм до примерно 220 нм, или от 100 до 200 нм, или примерно от 150 нм до примерно 200 нм, например, составляет примерно 130 нм или примерно 150 нм.
Используемый в настоящем описании термин эффективный средний размер частиц имеет свое стандартное значение, известное специалисту в данной области, и его можно измерить методами измерения размера частиц, известными в данной области, такими как, например, седиментационное проточное фракционирование в поперечном поле, фотон-корреляционная спектроскопия, лазерная дифракция и дисковое центрифугирование. Указанный в настоящем описании средний размер частиц может относиться к объемному распределению частиц. В этом случае, под «эффективным средним размером частиц меньше примерно 50 мкм» понимается, что по меньшей мере 50% объема частиц имеют размер частицы меньше эффективного среднего размера 50 мкм, и такое же правило применимо к другим указанным эффективным размерам частиц. Аналогичным образом, эффективные средние размеры частиц могут относиться к массовому распределению частиц, но обычно это дает такое же или по существу такое же значение для эффективного среднего размера частиц.
Композиции микро- и наночастиц по настоящему изобретению обеспечивают высвобождение активного ингредиента бреканавира в течение длительного периода времени. После введения, эти композиции остаются в организме и постоянно высвобождают бреканавир, сохраняя уровень активного ингредиента в кровотоке пациента в течение длительного периода времени, таким образом, обеспечивая в течение указанного периода лечение ВИЧ или предупреждение передачи ВИЧ-инфекции.
Композиции микро- и наночастиц по изобретению хорошо переносятся при местном введении и легко вводятся. Хорошая местная переносимость относится к минимальному раздражению и воспалению в месте инъекции; легкость введения относится к размеру иглы и продолжительности интервала, необходимого для введения дозы конкретного состава лекарственного средства. Кроме того, они имеют хорошую стабильность и приемлемый срок годности.
Микро- или наночастицы по настоящему изобретению имеют адсорбированный на своей поверхности модификатор поверхности. Модификатор поверхности действует в качестве увлажняющего агента, а также в качестве стабилизатора коллоидной суспензии.
В одном варианте осуществления микро- или наночастицы в композициях по изобретению в основном содержат кристаллический бреканавир или его соль, а также модификатор поверхности, общее количество которых может по меньшей мере составлять примерно 50%, или по меньшей мере примерно 80%, или по меньшей мере примерно 90%, или по меньшей мере примерно 95%, или по меньшей мере примерно 99% от микро- или наночастиц.
В дополнительном аспекте настоящее изобретение относится к фармацевтической композиции для введения с помощью внутримышечной или подкожной инъекции, содержащей терапевтически эффективное количество бреканавира или его стереоизомера, или смеси стереоизомеров, в форме суспензии частиц, состоящих по существу из:
(1) бреканавира или его стереоизомера, или смеси стереоизомеров в виде микро- или наночастиц, имеющих адсорбированный на своей поверхности модификатор поверхности; и
(2) фармацевтически приемлемого водного носителя, в котором суспендирован активный ингредиент.
Подходящие модификаторы поверхности могут быть выбраны из известных органических и неорганических фармацевтических эксципиентов, включая различные полимеры, низкомолекулярные олигомеры, природные соединения и поверхностно-активные вещества. Конкретные модификаторы поверхности включают неионные и анионные поверхностно-активные вещества. Представительные примеры модификаторов поверхности включают желатин, казеин, лецитин, соли отрицательно заряженных фосфолипидов или их кислотные формы (такие как фосфатидилглицерин, фосфатидилинозит, фосфатидилсерин, фосфатидовая кислота и их соли, такие как соли щелочных металлов, например, натриевые соли, например, яичный фосфатидилглицерин натрия, такой как продукт, доступный под торговым наименованием Lipoid™ EPG), гуммиарабик, стеариновую кислоту, бензалконийхлорид, полиоксиэтиленалкиловые эфиры, например, эфиры макрогола, такие как цетомакрогол 1000, полиоксиэтиленовые производные касторового масла, полиоксиэтиленстеараты, коллоидный диоксид кремния, додецилсульфат натрия, натрийкарбоксиметилцеллюлозу, соли желчных кислот, такие как таурохолат натрия, дезокситаурохолат натрия, дезоксихолат натрия, метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, алюмосиликат магния, поливиниловый спирт (PVA), полоксамеры, такие как Pluronic™ F68, F108 и F127, которые представляют собой блок-сополимеры этиленоксида и пропиленоксида, тилоксапол, витамин Е-TGPS (α-токоферилполиэтиленгликольсукцинат, в частности, α-токоферилполиэтиленгликоль 1000 сукцинат), полоксамины, такие как Tetronic™ 908 (T908), являющийся тетрафункциональным блок-сополимером, полученным в результате последовательного присоединения этиленоксида и пропиленоксида к этилендиамину, декстран, лецитин, натриевую соль диоктилового эфира сульфоянтарной кислоты, такую как продукты, продаваемые под торговым названием Aerosol ОТ™ (AOT), лаурилсульфат натрия (Duponol™ P), алкиларилполиэфирсульфонат, доступный под торговым названием Triton™ X-200; сложные эфиры полиоксиэтиленсорбитана и жирных кислот (Tween™ 20, 40, 60 и 80), сложные эфиры сорбитана и жирных кислот (Span™ 20, 40, 60 и 80 или Arlacel™ 20, 40, 60 и 80), полиэтиленгликоли (такие как продаваемые под торговым названием Carbovax™ 3550 и 934), смеси стеарата и дистеарата сахарозы, такие как продукты, доступные под торговым названием Crodesta™ F110 или Crodesta™ SL-40, гексилдецилтриметиламмонийхлорид (CTAC), поливинилпирролидон (PVP). При желании можно использовать комбинацию двух или нескольких модификаторов поверхности.
Конкретные модификаторы поверхности выбраны из полоксамеров, α-токоферилполиэтиленгликольсукцинатов, сложных эфиров полиоксиэтиленсорбитана и жирных кислот, и солей отрицательно заряженных фосфолипидов или их кислотных форм. Более конкретно, модификаторы поверхности выбраны из Pluronic™ F108, витамина E-TGPS, Tween™ 80, Tween™ 20 и Lipoid™ EPG. Можно использовать один или несколько из указанных модификаторов поверхности. Pluronic™ F108 соответствует полоксамеру 338 и представляет собой блок-сополимер полиоксиэтилена и полиоксипропилена, в общем соответствующий формуле HO-[CH2CH2O]x-[CH(CH3)CH2O]y-[CH2H2O]z-H, где средние значения x, y и z составляют 128, 54 и 128, соответственно. Другими торговыми названиями полоксамера 338 являются Hodag Nonionic™ 1108-F и Synperonic™ PE/F108. В одном варианте осуществления модификатор поверхности включает комбинацию сложного эфира полиоксиэтиленсорбитана и жирной кислоты и соль фосфатидилглицерина (в частности, яичный фосфатидилглицерин натрия).
Оптимальное соотношение количества бреканавира и модификатора поверхности зависит от выбранного модификатора поверхности, конкретной площади поверхности суспензии бреканавира, которую можно определить по среднему эффективному размеру частиц и концентрации бреканавира, критической концентрации мицеллообразования модификатора поверхности, если он образует мицеллы, и т.п. Относительное количество (по массе) бреканавира к модификатору поверхности предпочтительно составляет интервал от 1:2 до примерно 20:1, в частности, интервал от 1:1 до примерно 10:1, например, составляет примерно 4:1.
Частицы по настоящему изобретению могут быть получены путем микронизации/уменьшения размера частиц/нанонизации механическим путем и контролируемым осаждением из перенасыщенного раствора, или используя сверхкритические жидкости, такие как в GAS-методике («газового антирастворителя»), либо с помощью любой комбинации таких методик. В одном варианте осуществления используют способ, включающий стадии диспергирования бреканавира в жидкой дисперсионной среде и использования механических средств в присутствии абразивной среды для уменьшения размера частиц бреканавира до эффективного среднего размера частиц меньше примерно 50 мкм, и частности, меньше примерно 1000 нм. Размер частиц можно уменьшать в присутствии модификатора поверхности.
Общая методика получения частиц по настоящему изобретению включает:
(а) получение бреканавира в форме микрочастиц или, при желании, получение микрочастиц бреканавира в микронизированной форме;
(b) добавление бреканавира к жидкой среде с образованием премикса/предисперсии; и
(с) обработку премикса/предисперсии механическими средствами в присутствии абразивной среды для уменьшения эффективного среднего размера частиц.
Исходный бреканавир необходимо привести в микродисперсную форму, означающую, что эффективный средний размер частиц находится в микрометровом диапазоне. Предпочтительно, чтобы определяемый ситовым анализом эффективный средний размер частиц активного вещества бреканавира для получения предисперсии был меньше примерно 100 мкм. Если эффективный средний размер частиц микронизированного бреканавира превышает примерно 100 мкм, то предпочтительно снизить размер частиц бреканавира до значений меньше 100 мкм с помощью микронизации, используя методики, известные в данной области.
Затем бреканавир может быть добавлен к жидкой среде (в которой он по существу не растворим), с получением предисперсии. Концентрация бреканавира в жидкой среде (по массе) может варьировать в широких пределах и зависит от выбранного модификатора поверхности и других факторов. Подходящие концентрации бреканавира в композициях варьируют примерно от 0,1% до примерно 60% или примерно от 1% до примерно 60%, или примерно от 10% до примерно 50%, или примерно от 10% до примерно 30%, или составляют, например, 10%, 20% или 30% (все % в данном абзаце относятся к соотношению масса/объем).
Премикс можно использовать напрямую, обрабатывая его механическими средствами для снижения эффективного среднего размера частиц в дисперсии до значений меньше 2000 нм. Премикс может быть использован напрямую, когда для измельчения используют шаровую мельницу. Альтернативно, бреканавир и необязательно модификатор поверхности могут быть диспергированы в жидкой среде, используя перемешивание, например, вальцовую мельницу, до получения гомогенной дисперсии.
Механическое средство, используемое для уменьшения эффективного среднего размера частиц бреканавира, обычно представляет собой дисперсионную мельницу. Подходящие дисперсионные мельницы включают шаровую мельницу, аттритор/дисковую мельницу, вибрационную мельницу, планетарную мельницу, мельницы для размола в среде, такие как песочная мельница и бисерная мельница. Мельница для размола в среде является предпочтительной благодаря относительно короткому времени измельчения, требуемому для достижения желаемого уменьшения размера частиц.
Измельчающая среда для стадии уменьшения размера частиц может быть выбрана из твердой среды, предпочтительно, сферической формы или в форме частиц, имеющих средний размер меньше 3 мм и, более предпочтительно, меньше 1 мм (размер шариков может составлять до 200 мкм). Желательно, чтобы такая среда обеспечивала более короткое время получения частиц по изобретению и обеспечивала меньший износ измельчающего оборудования. Примерами измельчающей среды являются ZrO2, например, 95%-й ZrO2, стабилизированный оксидом магния или иттрием, силикат циркония, стеклянные шарики, полимерные шарики, стальные шарики, титановые шарики, алюминиевые шарики и т.п. Предпочтительная измельчающая среда имеет плотность выше 2,5 г/см3 и включает 95%-й ZrO2, стабилизированный оксидом магния, и полимерные шарики. Предпочтительной измельчающей средой являются шарики ZrO2.
Уменьшение размеров частиц следует проводить при температуре, при которой не происходит значительного разрушения соединения бреканавира. Обычно предпочтительна температура обработки меньше 30-40°C, в частности, комнатная температура.
Фармацевтические композиции по настоящему изобретению содержат водный носитель, который, предпочтительно, является фармацевтически приемлемым. Указанный водный носитель содержит стерильную воду необязательно в смеси с другими фармацевтически приемлемыми ингредиентами. Последние включают любые ингредиенты для применения в составах для инъекций. Эти ингредиенты могут быть выбраны из одного или нескольких из суспендирующего агента, буфера, агента для доведения рН, консерванта, агента, обеспечивающего изотоничность, и подобных ингредиентов. В одном варианте осуществления указанные ингредиенты выбраны из одного или нескольких из суспендирующего агента, буфера, агента для доведения рН и необязательно консерванта, агента, обеспечивающего изотоничность. Отдельные ингредиенты могут функционировать в качестве двух или нескольких таких агентов одновременно, например, действовать как консервант и буфер, или действовать как буфер и агент, обеспечивающий изотоничность.
Соответствующие буферирующие агенты и агенты для доведения рН следует использовать в количестве, достаточном для доведения рН дисперсии до нейтральных или немного основных значений (до рН 8,5), предпочтительно в диапазоне рН от 7 до 7,5. Предпочтительными буферами являются соли слабых кислот. Буферирующие агенты и агенты для доведения рН, которые могут быть добавлены, могут быть выбраны из винной кислоты, малеиновой кислоты, глицина, лактата натрия/молочной кислоты, аскорбиновой кислоты, цитратов натрия/лимонной кислоты, ацетата натрия/уксусной кислоты, бикарбоната натрия/угольной кислоты, сукцината натрия/янтарной кислоты, бензоата натрия/бензойной кислоты, фосфатов натрия, трис(гидроксиметил)аминометана, бикарбоната натрия/карбоната натрия, гидроксида аммония, бензолсульфоновой кислоты, бензоата натрия/кислоты, диэтаноламина, глюконо-дельта-лактона, хлористоводородной кислоты, бромистого водорода, лизина, метансульфоновой кислоты, моноэтаноламина, гидроксида натрия, трометамина, глюконовой кислоты, глицериновой кислоты, глутаровой кислоты, глутаминовой кислоты, этилендиаминтетрауксусной кислоты (EDTA), триэтаноламина, включая их смеси.
Консерванты включают противомикробные соединения и антиоксиданты, которые могут быть выбраны из группы, состоящей из бензойной кислоты, бензилового спирта, бутилированного гидроксианизола (ВНА), бутилированного гидрокситолуола (ВНТ), хлорбутола, галлата, гидроксибензоата, EDTA, фенола, хлоркрезола, метакрезола, бензетонийхлорида, миристил-γ-пиколинийхлорида, ацетата фенилртути и тимеросала. Акцепторы радикалов включают ВНА, ВНТ, витамин Е и аскорбилпальмитат, а также их смеси. Акцепторы кислорода включают аскорбат натрия, сульфит натрия, L-цистеин, ацетилцистеин, метионин, тиоглицерин, ацетон-бисульфит натрия, изоаскорбиновую кислоту, гидроксипропилциклодекстрин. Хелатирующие агенты включают цитрат натрия, натриевую соль EDTA и яблочную кислоту.
Для обеспечения изотоничности фармацевтической композиции по настоящему изобретению может присутствовать агент, обеспечивающий изотоничность, или изотонизирующий агент, включающий сахара, такие как глюкоза, декстроза, сахароза, фруктоза, трегалоза, лактоза, многоатомные сахарные спирты, предпочтительно, трехатомные или спирты с большим числом гидроксильных групп, такие как глицерин, эритрит, арабит, ксилит, сорбит и маннит. Альтернативно, для придания растворам изотоничности можно использовать хлорид натрия, сульфат натрия или другие подходящие неорганические соли. Эти изотонизирующие агенты можно использовать по отдельности или в комбинации. Суспензии обычно содержат от 0 до 10% (масса/объем), в частности, 0-6% агента, обеспечивающего изотоничность. Предпочтительны неионные изотонизирующие агенты, например, глюкоза, поскольку электролиты могут повлиять на коллоидную стабильность.
Желательным признаком фармацевтической композиции по изобретению является легкость введения. Вязкость фармацевтических композиций по изобретению должна быть достаточно низкой для введения с помощью инъекции. В частности, они должны быть подобраны таким образом, чтобы их легко можно было набирать в шприц (например, из ампулы), и их введение с помощью инъекции через тонкую иглу (например, иглу калибра 20 (G) 1½, калибра 21 (G) 1½, калибра 22 (G) 2 или 22 (G) 1¼) не занимало слишком много времени. В одном варианте осуществления вязкость композиций по изобретению составляет меньше 75 мПа*с или ниже 60 мПа*с. Водные суспензии с такой вязкостью или с меньшей вязкостью обычно соответствуют вышеуказанным критериям.
В оптимальном варианте, водные суспензии по настоящему изобретению будут содержать максимально переносимое количество бреканавира для снижения инъецируемого объема до минимума, в частности, они будут содержать от 3 до 40% (масса/объем) или от 3 до 30% (масса/объем), или от 3 до 20% (масса/объем), или от 10 до 30% (масса/объем) бреканавира. В одном варианте осуществления водные суспензии по изобретению содержат примерно 10% (масса/объем) бреканавира или примерно 20% (масса/объем) бреканавира, или примерно 30% (масса/объем) бреканавира.
В одном варианте осуществления изобретения водные суспензии могут содержать по массе от общего объема композиции:
(a) от 3% до 50% (масса/объем) или от 10% до 40% (масса/объем), или от 10% до 30% (масса/объем) бреканавира;
(b) от 0,5% до 10% или от 0,5% до 2% (масса/объем) смачивающего агента;
(c) от 0% до 10% или от 0% до 5%, или от 0% до 2%, или от 0% до 1% одного или нескольких буферирующих агентов;
(d) от 0% до 10% или от 0% до 6% (масса/объем) агента, обеспечивающего изотоничность;
(e) от 0% до 2% (масса/объем) консервантов; и
(f) воды для инъекций в количестве до 100%.
Необязательно к суспензиям может быть добавлено некоторое количество кислоты или основания для доведения рН суспензии примерно до 7. Подходящими кислотами или основаниями являются любые физиологически приемлемые кислоты или основания, например, HCl, HBr, серная кислота, гидроксиды щелочных металлов, такие как NaOH.
Введение бреканавира по настоящему изобретению может быть достаточным для лечения ВИЧ-инфекции, хотя в ряде случаев может быть рекомендовано совместное введение с другими ВИЧ-ингибиторами. Последние, предпочтительно, включают ВИЧ-ингибиторы других классов, в частности, выбранных из NRTI, NNRTI и ингибиторов слияния. В одном варианте осуществления другим ВИЧ-ингибитором, вводимым совместно, является NNRTI. Предпочтительными ВИЧ-ингибиторами, которые можно вводить совместно, являются используемые в HAART-кобинациях, содержащих PI. Например, можно вводить совместно два дополнительных NRTI или NRTI и NNRTI. Такое совместное введение может осуществляться перорально или парентерально.
Настоящее изобретение также относится к фармацевтической композиции, описанной в настоящем описании выше, для применения в качестве лекарственного средства при лечении или профилактике ВИЧ-инфекции.
Кроме того, настоящее изобретение относится к применению фармацевтической композиции, описанной в настоящем описании, для получения лекарственного средства для профилактики или лечения ВИЧ-инфекции.
Настоящее изобретение дополнительно относится к способу лечения субъекта, инфицированного ВИЧ, включающему введение терапевтически эффективного количества фармацевтической композиции, описанной в настоящем описании.
Используемое в настоящем описании выражение «по существу» не исключает «полностью», например, композиция, которая «по существу свободна» от Y может быть полностью свободна от Y. При необходимости выражение «по существу» можно исключить из описания изобретения. Подразумевается, что термин «примерно» в связи с числовой величиной имеет свое обычное значение в контексте числовой величины. При необходимости, слово «примерно» можно заменить числовой величиной ±10% или ±5%, или ±2%, или ±1%. Все цитируемые в настоящем описании ссылки полностью включены в данное описание посредством ссылки.
Следующие примеры предназначены для иллюстрации настоящего изобретения и не должны истолковываться как ограничивающие изобретение.
Пример
В данном примере приведено исследование, целью которого являлась демонстрация того, что введение парентерального состава бреканавира приводит к стабильному уровню в плазме крови в течение длительного периода времени. Более высокие уровни бреканавира в плазме крови можно получить, увеличивая дозу бреканавира парентерального состава.
Фармакокинетические исследования на крысах проводили, используя парентеральное (внутривенное, внутримышечное и подкожное) введение бреканавира в виде раствора и бреканавира в виде водной нано- или микросуспензии для исследования кинетики бреканавира в плазме при различных дозировках.
Внутривенные инъекции раствора бреканавира
Бреканавир вводили с помощью внутривенных инъекций в виде раствора 1 мг/мл (ПЭГ 400/физиологический раствор, 70:30) крысам (n=3) для определения кинетики бреканавира в плазме у этих животных. Образцы плазмы забирали от каждой крысы в указанные моменты времени после введения; концентрацию бреканавира в образцах определяли с помощью ЖХ/МС. (См. фиг.1).
После внутривенного введения бреканавира, данное соединение показало высокие концентрации и, следовательно, объем распределения от среднего до низкого. Соединение эффективно выводилось из плазмы со средним плазменным клиренсом.
|
Подкожные инъекции раствора бреканавира
Крысам Sprague-Dawley (Crl:CD®(SD)IGS) массой 200-300 г однократно вводили водный раствор бреканавира с помощью подкожных инъекций в количестве 16 мг/кг (n=4) и 56 мг/кг (n=4). Раствор готовили за один день перед введением дозы препарата; бреканавир вводили в состав 30%-ного водного раствора (масса/объем) DMA/50%-ного (масса/объем) ПЭГ 400 в концентрации 35 мг/мл. Ингредиентами раствора были: бреканавир, DMA 30% (масса/объем), ПЭГ 400 50% (масса/объем) и апирогенная вода. Содержание бреканавира в составе проверяли, используя ЖХ-УФ. Концентрация бреканавира в составе составляла 35 мг/мл.
Образцы крови (по 0,3 мл в EDTA) отбирали из хвостовой вены крыс через 1, 2, 4, 7 и 24 ч и дополнительно через 3, 4, 8, 14, 29, 42 и 56 дней после введения соединения. Содержание бреканавира в образцах плазмы анализировали сертифицированным методом исследования на ЖХ/МС/МС. Концентрации в плазме откладывали на графике как функцию от времени после введения соединения (фиг.2). Фармакокинетические параметры вычисляли, используя программное обеспечение WinNonlin. Введение крысам водного раствора бреканавира с помощью подкожной инъекции давало фармакокинетический профиль пролонгированного действия с длительностью по меньшей мере 8 недель (фиг.2). Из профиля зависимости концентрации от времени для плазмы и сравнения времени полужизни между внутривенным и подкожным введением ясно следует, что бреканавир после подкожной инъекции высококонцентрированного раствора очень медленно всасывается в системный кровоток. Средняя абсолютная биодоступность соединения при дозе 16 мг/кг была практически полной (F=0,91), но немного ниже для более высокой дозы, 56 мг/кг (F=0,66).
|
|
Внутримышечные и подкожные инъекции нано- и микросуспензий бреканавира
Бреканавир получали в виде водной наносуспензии, содержащей 25 мг/мл полисорбата 20 для парентерального введения и 100 мг/мл бреканавира. В ингредиенты наносуспензии входили: бреканавир, полисобрат 20 для парентерального введения 2,5% (масса/объем), декстроза 5% (масса/объем) и апирогенная вода. Содержание бреканавира в составе проверяли, используя ЖХ-УФ. Концентрация бреканавира в составе составляла 100 мг/мл. Распределение частиц по размерам измеряли на Malvern Mastersizer™ с использованием лазерной дифракции. Величина d50 составляла 125 нм.
Крысам Sprague-Dawley (Crl:CD®(SD)IGS) массой 200-300 г однократно вводили водную наносуспензию бреканавира в количестве 50 мг/кг с помощью инъекции внутримышечно (n=4) или подкожно (n=4). Образцы крови отбирали из хвостовой вены крыс через 1, 7 и 24 ч и дополнительно через 2, 6, 10, 13, 16, 20, 24, 27, 31, 36, 43, 48, 55 и 59 дней после введения соединения. Из образцов выделяли плазму, и анализ содержания бреканавира проводили сертифицированным методом исследования на ЖХ/МС/МС. Концентрации в плазме откладывали на графике как функцию от времени после введения соединения (фиг.3). Фармакокинетические параметры вычисляли, используя программное обеспечение WinNonlin™.
Внутримышечная инъекция водной наносуспензии бреканавира давала профиль концентрации в плазме пролонгированного высвобождения в течение 56 дней. Концентрации в плазме после внутримышечной инъекции были выше концентраций после подкожной инъекции. Было определено, что количество, высвобождаемое в системный кровоток за этот период, было полным (F~1) после внутримышечной инъекции и составляло приблизительно половину (F~0,5) после подкожной инъекции. По сравнению с подкожной инъекцией раствора было очевидно, что подкожная инъекция наносуспензии дает намного меньшую пиковую концентрацию в плазме после инъекции. Кроме того, после подкожной инъекции наносуспензии концентрация в плазме оставалась очень стабильной в течение продолжительного периода времени около 10 нг/мл, в отличие от раствора, когда концентрация в плазме продолжала медленно снижаться после начальных 2 недель.
Бреканавир получали в форме микросуспензии, содержащей 25 мг/мл полисорбата 20 для парентерального введения и 100 мг/мл бреканавира. В ингредиенты наносуспензии входили: бреканавир, полисобрат 20 для парентерального введения 2,5% (масса/объем), декстроза 5% (масса/объем) и апирогенная вода. Содержание бреканавира в составе проверяли, используя ЖХ-УФ. Концентрация бреканавира в составе составляла 62,5 мг/мл. Распределение частиц по размерам измеряли на Malvern Mastersizer™ с использованием лазерной дифракции. Величина d50 составляла 1,613 мкм.
Крысам Sprague-Dawley (Crl:CD®(SD)IGS) массой 200-300 г (n=4) однократно вводили водную наносуспензию бреканавира в количестве 50 мг/кг с помощью внутримышечной инъекции. Образцы крови отбирали из хвостовой вены крыс через 1, 7 и 24 ч и дополнительно через 2, 6, 10, 14, 16, 20, 24, 27, 31, 36, 43, 48, 55 и 59 дней после введения соединения. Отделяли плазму и анализировали на содержание бреканавира сертифицированным методом исследования на ЖХ/МС/МС. Концентрации в плазме откладывали на графике как функцию зависимости от времени после введения соединения (фиг.3). Фармакокинетические параметры вычисляли, используя программное обеспечение WinNonlin™.
|
Внутримышечные инъекции суспензии бреканавира кроликам
Бреканавир получали в виде водной наносуспензии, содержащей 25 мг/мл полисорбата 20 для парентерального введения и 100 мг/мл бреканавира. В ингредиенты наносуспензии входили: бреканавир, полисобрат 20 для парентерального введения 2,5% (масса/объем), декстроза 5% (масса/объем) и апирогенная вода. Содержание бреканавира в составе проверяли, используя ЖХ-УФ. Концентрация бреканавира в составе составляла 100 мг/мл. Распределение частиц по размерам измеряли на Malvern Mastersizer™ с использованием лазерной дифракции. Величина d50 составляла 125 нм.
Новозеландским белым кроликам массой приблизительно 2,5 кг однократно вводили внутримышечно (n=5) водную наносуспензию бреканавира в количестве 50 мг на кролика. Образцы крови собирали из хвостовой вены через 6 и 24 часа, и дополнительно через 2, 5, 8, 12, 15, 19, 22, 26, 29, 33, 36, 40, 43, 47, 50, 54, 57, 64 и 71 день после введения соединения.
Отделяли плазму и анализировали на содержание бреканавира сертифицированным методом исследования, используя ЖХ/МС/МС. Концентрации в плазме откладывали на графике как функцию зависимости от времени после введения соединения (фиг.4). Фармакокинетические параметры вычисляли, используя программное обеспечение WinNonlin™.
|