Результат интеллектуальной деятельности: НИОБАТ-ТИТАНАТ ГИДРАЗИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ
Вид РИД
Изобретение
Изобретение относится к области химических технологий, в частности к очистке промышленных жидких отходов и сточных вод от токсичных и радиоактивных элементов, и может быть использовано для удаления из промышленных жидких отходов и сточных вод ряда радиоизотопов, таких как технеций-99, палладий-107, и токсичных экологических загрязнителей, включая свинец и шестивалентный хром.
Известно, что оксидные материалы, имеющие каркасную кристаллическую структуру типа пирохлора А0-2В2О6-7, обладают ионообменными свойствами и могут быть использованы для очистки жидких сред от токсичных и радиоактивных элементов. На Фиг. 1 представлена основа кристаллической структуры соединений типа пирохлора - металлокислородные октаэдры, соединенные в каркас общими углами.
Известны оксидные ионообменные материалы [1], где на основе ниобатов со структурой пирохлора, которые используются как ионообменные адсорбенты, используемые для очистки жидких сред от цезия и стронция. Однако известные оксидные ионообменные материалы из WO 2002/096559, относятся: достаточно дорогим, поскольку высока стоимость исходных материалов, используемых в синтезе (оксидов и алкоксидов ниобия).
К недостаткам используемых ниобатов со структурой пирохлора следует отнести:
1. Сравнительно высокую стоимость исходных материалов, в качестве которых при синтезе ниобатов и титанатов гидразина использовались пентафторониобиевая H2NbOF5 и гексафторотитановая H2TiF6 кислоты. Обе кислоты являются промежуточными продуктами в технологических процессах переработки ниобо-титановых концентратов [2].
2. Сравнительная сложность и продолжительность самого синтеза, проводимого в гидротермальных условиях при температуре 200°С в течение не менее недели;
3. Ограниченная адсорбционная функциональность: при адсорбции задействуется только механизм ионного обмена.
Заявляемое изобретение свободно от указанных недостатков.
Техническим результатом заявленного изобретения является существенное снижение стоимости синтеза ниобат-титаната гидразина, а также упрощение процесса синтеза.
Указанный технический результат достигается тем, что в заявляемом изобретении ниобат-титанат гидразина с кристаллической структурой пирохлора имеют химический состав, который выражается общей формулой:
(N2H5)Nb1.2Ti0.8O3.2(OH)2.8·1.2H2O,
где гидразин представлен в виде иона гидразиния (N2H5).+ Кроме этого, указанный технический результат достигается тем, что заявленный способ получения ниобат-титанат гидразина, охарактеризованным этой химической формулой, заключается в смешивании водных растворов пентаоксофторониобиевой и гексафторотитановой кислоты, взятых в концентрации 0.25 моль/л, и 20% водного раствора гидразин гидразина, нагревании полученной реакционной смеси до температуры кипения, отделении твердой фазы, промывки в дистиллированной воде и сушки при оптимальной температуре 60°С.
Помимо этого, указанный технический результат достигается тем, что заявленный ниобат-титанат гидразина с кристаллической структурой пирохлора, охарактеризованный указанной выше химической формулой и полученный указанным выше способом, может быть использован в качестве ионообменных или восстановительных адсорбентов для очистки загрязненной воды или водных растворов от токсичных и радиоактивных загрязнителей путем их добавления к загрязненной воде или водным растворам, подвергаемым очистке, или фильтрации загрязненной воды или водных растворов через фильтры, содержащие ниобат-титанат гидразина.
В заявленном изобретении синтез ниобатов и титанатов гидразина не требует использования дорогостоящих оксидных и алкоксидных соединений. Производство заявляемого ниобат-титанат гидразина в качестве адсорбентов может быть легко интегрировано в существующие технологические процессы переработки ниобо-титановых концентратов [3]. К важным преимуществам заявляемого ниобат-титаната гидразина является простота синтеза, достигаемого простым кипячением реакционной смеси в течение короткого времени - 10-30 мин, не требующего гидротермальных условий и высоких температур, а также эффективное их использование в качестве адсорбентов.
В заявляемом изобретении для получения ниобат-титанат гидразина смешивают растворы следующего состава:
Раствор А: раствор, содержащий ниобий, титан или смесь ниобия и титана в любой растворимой форме, преимущественно в виде пентафторооксониобиевой кислоты H2NbOF5 и гексафторотитановой кислоты H2TiF6.
Раствор Б: раствор, содержащий гидразин N2H4 или соли гидразиния (N2H5)+, (N2H6)2+ в любой растворимой форме, преимущественно в виде гидрата гидразина.
Прототипом способа получения ниобат-титаната гидразина со структурой пирохлора является WO 2011/116788 [4].
Наряду с механизмом ионного обмена в заявляемых адсорбентах используется механизм восстановительной адсорбции. Это придает адсорбентам новую функциональность, позволяющую адсорбировать такие загрязнители, как радиоактивный палладий-107, технеций-99, шестивалентный хром.
В изобретении заявлена новая группа оксидных соединений - ниобат-титанат, имеющих кристаллическую структуру пирохлора и при этом содержащих в своем составе гидразин (или ион гидразиния) в качестве активного химического компонента. Технические области применения гидразина, H2N-NH2 чрезвычайно широки и связаны преимущественно с его сильными восстановительными свойствами [4]. Заявляемый ниобат-титанат одновременно сочетают в себе ионообменные свойства, присущие соединениям со структурой пирохлора, и восстановительные свойства, присущие гидразину, и, таким образом, могут быть использованы как химические адсорбенты двойного действия (ионный обмен и восстановленная адсорбция).
Такая комбинация свойств позволяет удалять из водных растворов широкий круг элементов-загрязнителей, не поглощаемых в процессах катионного обмена. Известно, например, что существенными компонентами жидких радиоактивных отходов ядерного топливного цикла являются радиоактивные палладий-107 (Pd-107) и технеций-99 (Тс-99). Оба эти элемента не сорбируются классическими ионообменными материалами. В то же время и палладий, и технеций легко извлекаются из водных растворов путем восстановительной адсорбции на заявляемых новых материалах благодаря восстановительной адсорбции, согласно следующим схемам реакций:
2Pd(NO3)2+N2H4→2Pd↓+N2↑+4HNO3
4KTcO4+3N2H4→4TcO2↓+3N2↑+4КОН+4H2O
В то же время заявляемый ниобат-титанат гидразина может быть использован и в качестве хороших адсорбентов, работающих по механизму ионного обмена.
Заявленное изобретение было апробировано в лабораторных условиях на базе Санкт-Петербургского государственного университета.
Результаты многочисленных исследований приведены ниже в виде конкретных примеров.
В таблице 1 приведены коэффициенты распределения (Kd) для Pd(II), Tc(VII), Pb(II) и Cr(VI), полученные в эксперименте по адсорбции этих элементов на гидразин-ниобиевом пирохлоре, имеющем формулу (N2H5)(Nb,Ti)2(O,OH,F)6. При проведении эксперимента использовалась навески гидразинового пирохлора массой 50 мг, взаимодействовавшие с растворами солей палладия (Pd(NO3)2), технеция (KTcO4), свинца (Pb(NO3)2) и хрома (CrO3) при объемах очищаемого раствора 20 мл.
Эксперименты по адсорбции проводились в течение 10 часов путем периодического встряхивания суспензии адсорбента в растворе. По окончании эксперимента исследуемый раствор отфильтровывался, а содержание исследуемого элемента в исходном и обедненном растворах определялось методом индуктивно-связанной плазмы (ICP).
Коэффициенты распределения (Kd, мл/г) вычислялись по стандартной формуле:
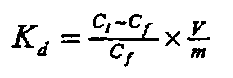
где
Ci - концентрация элемента в исходном растворе (г/мл);
Cf - концентрация элемента в обедненном растворе (г/мл);
V - объем исходного раствора (мл);
m - масса сорбента (г)
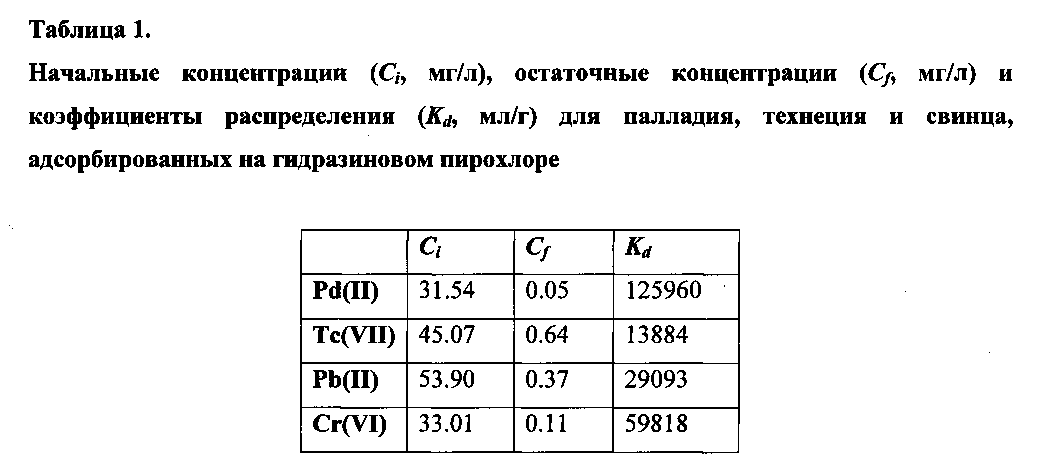
Как видно из таблицы 1, гидразин-содержащий пирохлор может использоваться как для восстановительной адсорбции (в случае палладия, технеция и хрома), так и для классической ионообменной адсорбции (в случае свинца).
Полученное вещество имеет каркасную кристаллическую структуру пирохлорового типа, что подтверждается дифрактограммой порошка, содержащщего рефлексы, характерные для структуры пирохлора (Таблица 2).

Пример. Получение гидразин-ниобий-титанового пирохлора
Раствор А - 100 мл водного раствора с концентрацией 0.25М по гексафторотитановой кислоте H2TiF6 и 0.25М по пентаохофторониобиевой кислоте H2NbOF5.
Раствор Б - 100 мл 20% водного раствора гидрата гидразина N2H4·H2O.
Раствор Б добавляется к раствору А при перемешивании при комнатной температуре и атмосферном давлении. Полученная реакционная смесь нагревается до кипения и кипятится в течение 5-120 минут. Образовавшийся белый порошкообразный продукт отфильтровывается, промывается дистиллированной водой и сушится 8 часов при 60°С. Рентгенограмма порошка полученного продукта приведена в Таблице 2. Химический состав вещества соответствует формуле: (N2H5)Nb1.2Ti0.8O3.2(OH)2.8·1.2H2O.
Таким образом, как показывают результаты испытаний и апробация в разных регионах в режиме реального времени, заявленное изобретение имеет существенно более низкую стоимость синтеза ниобат-титаната гидразина, а также значительное упрощение всего процесса синтеза, а его использование в качестве адсорбента позволяет проводить очистку от таких опасных загрязнителей, как радиоактивный палладий-107, технеций-99, шестивалентный хром.
Список используемой литературы
1. WO 2002/096559 A1. Inorganic ion exchangers for removing contaminant metal ions from liquid streams (прототип).
2. Agulyansky, A. The Chemistry of Tantalum and Niobium Fluoride Compounds. Elsevier, Amsterdam, 2004.
3. Gupta, С.K.; Suri, A.K. Extractive Metallurgy of Niobium. CRC Press, Boca Raton, FL, 1994.
4. WO 2011/116788 A1. Layered titanates.


