Результат интеллектуальной деятельности: СПОСОБЫ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ УСТАЛОСТИ
Вид РИД
Изобретение
Область техники изобретения, к которой относится изобретение
Настоящее изобретение относится к использованию соединений по изобретению для лечения и/или профилактики усталости, в том числе усталости, вызванной заболеваниями или лечением.
Уровень техники
Усталость - это вялость или отсутствие энергии, которые обычно не проходят после отдыха или сна. Усталость обычно бывает побочным эффектом многих заболеваний и болезненных состояний, включая депрессию, рак, рассеянный склероз, болезнь Паркинсона, болезнь Альцгеймера, синдром хронической усталости, фибромиалгию, хронические боли, черепно-мозговые травмы, СПИД и остеоартрит. Усталость может быть также следствием приема некоторых медикаментов или терапии, такой как химиотерапия, радиационная терапия, трансплантация костного мозга и лечение антидепрессантами. Известны несколько последних обзоров по эффективному лечению усталости.
Настоящее изобретение предлагает усовершенствованные способы лечения или профилактики усталости, например усталости, вызванной заболеваниями или лечением.
Раскрытие изобретения
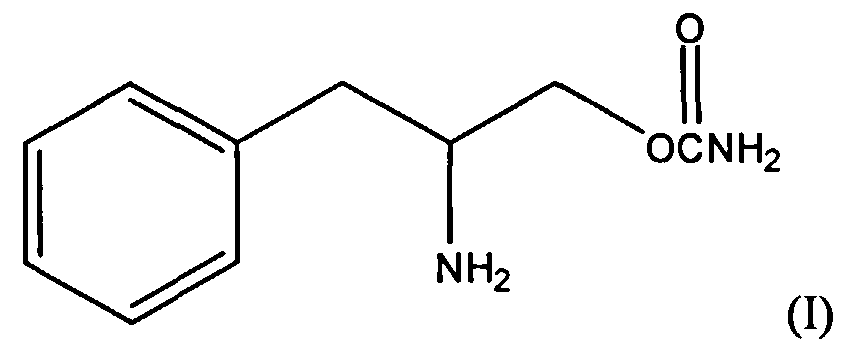
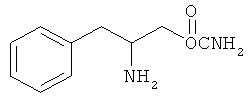
Настоящее изобретение предлагает способы лечения и/или профилактики усталости, например усталости, связанной с болезнью и/или лечением пациента, включающие введение нуждающемуся в лечении пациенту эффективного для лечения или профилактики количества соединения формулы I:
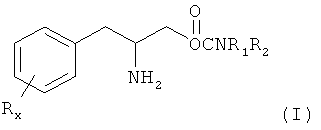
или его фармацевтически приемлемой соли или сложного эфира, в котором
Rx представляет собой группу, которую выбирают из водорода, низшего алкила с 1-8 атомами углерода, галогена, выбранного из F, Cl, Br и I, алкоксила с 1-3 атомами углерода, нитрогруппы, гидроксила, трифторметила и тиоалколксила с 1-3 атомами углерода;
х является целым числом при условии, что при х, равном 2 или 3, группы R могут быть одинаковыми или разными;
R1 и R2 могут быть одинаковыми или разными и их выбирают независимо из группы, состоящей из водорода, низшего алкила с 1-8 атомами углерода, арила, алкиларила и циклоалкила с 3-7 атомами углерода;
или R1 и R2 могут объединяться с образованием 5-7-членного гетероцикла, замещенного группой, который выбирают из водорода, алкильных и арильных групп, причем циклическое соединение может содержать 1-2 атома азота и 0-1 атом кислорода и атомы азота не связаны непосредственно друг с другом или с атомом кислорода.
В одном варианте изобретения усталость связана с конкретным заболеванием или болезненным состоянием, включая без ограничений депрессию, рак, рассеянный склероз, болезнь Паркинсона, болезнь Альцгеймера, синдром хронической усталости, фибромиалгию, хроническую боль, черепно-мозговую травму, СПИД и остеоартрит. В другом варианте усталость обусловлена конкретным лечением или терапией, применяемой для лечения заболевания, расстройства или болезненного состояния, включая без ограничения химиотерапию, радиационную терапию, трансплантацию костного мозга и лечение антидепрессантами.
В другом варианте изобретения соединение формулы I вводят одновременно с дополнительным препаратом или лечением, например, с препаратом или лечением либо профилактикой заболевания, расстройства или болезненного состояния.
Настоящее изобретение разъяснено более подробно на рисунках и в приведенном ниже описании.
Краткое описание рисунков
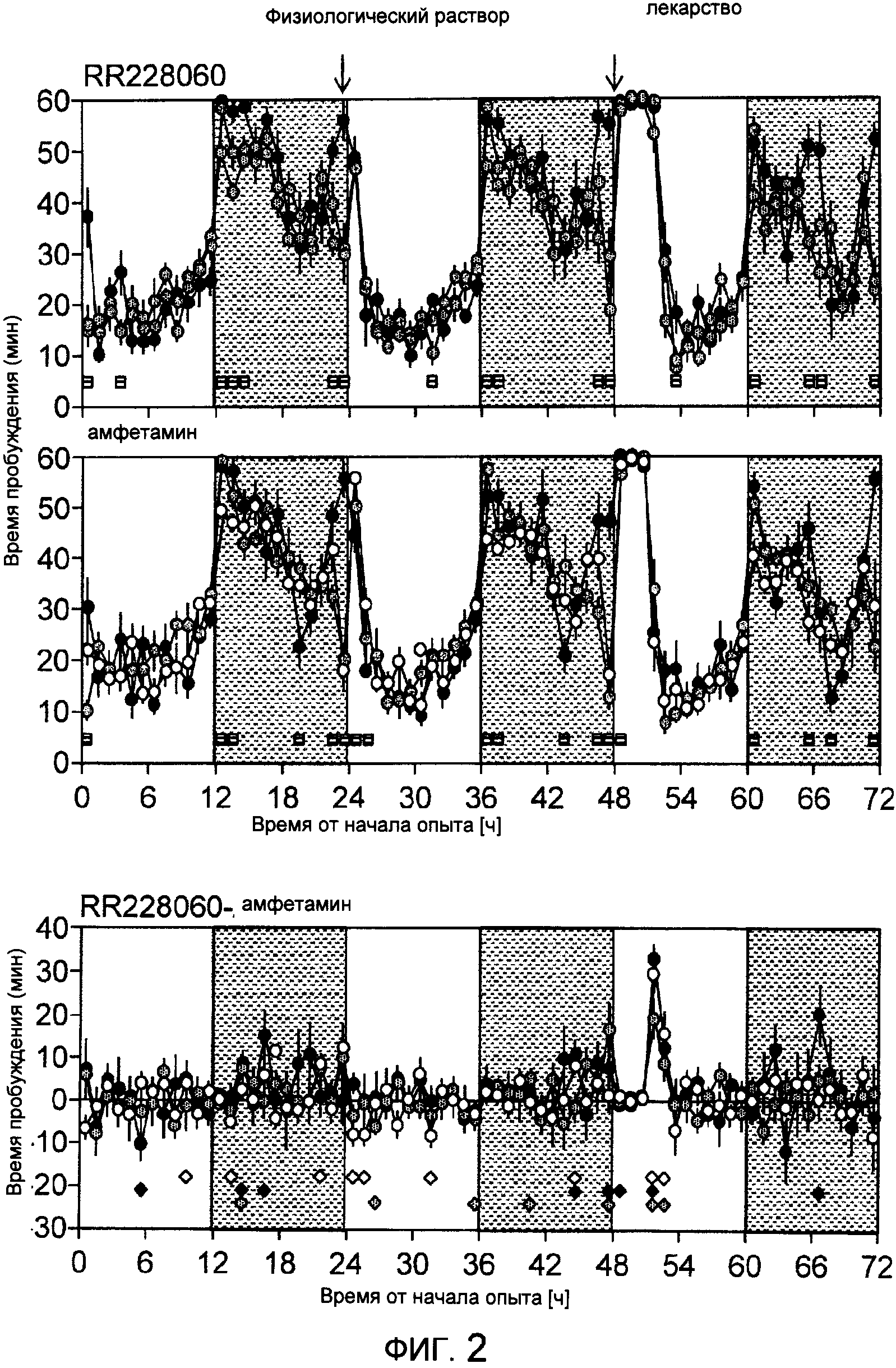
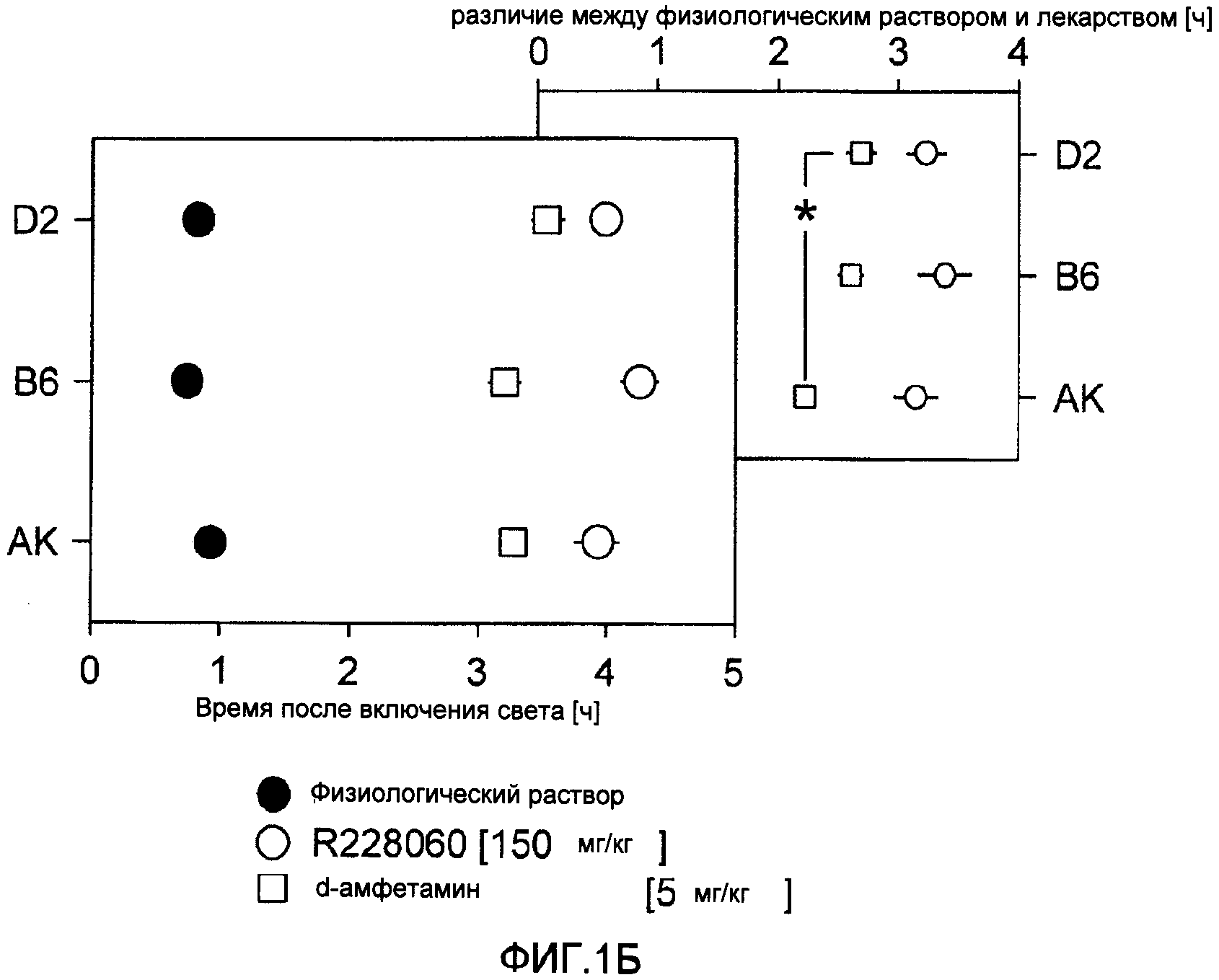
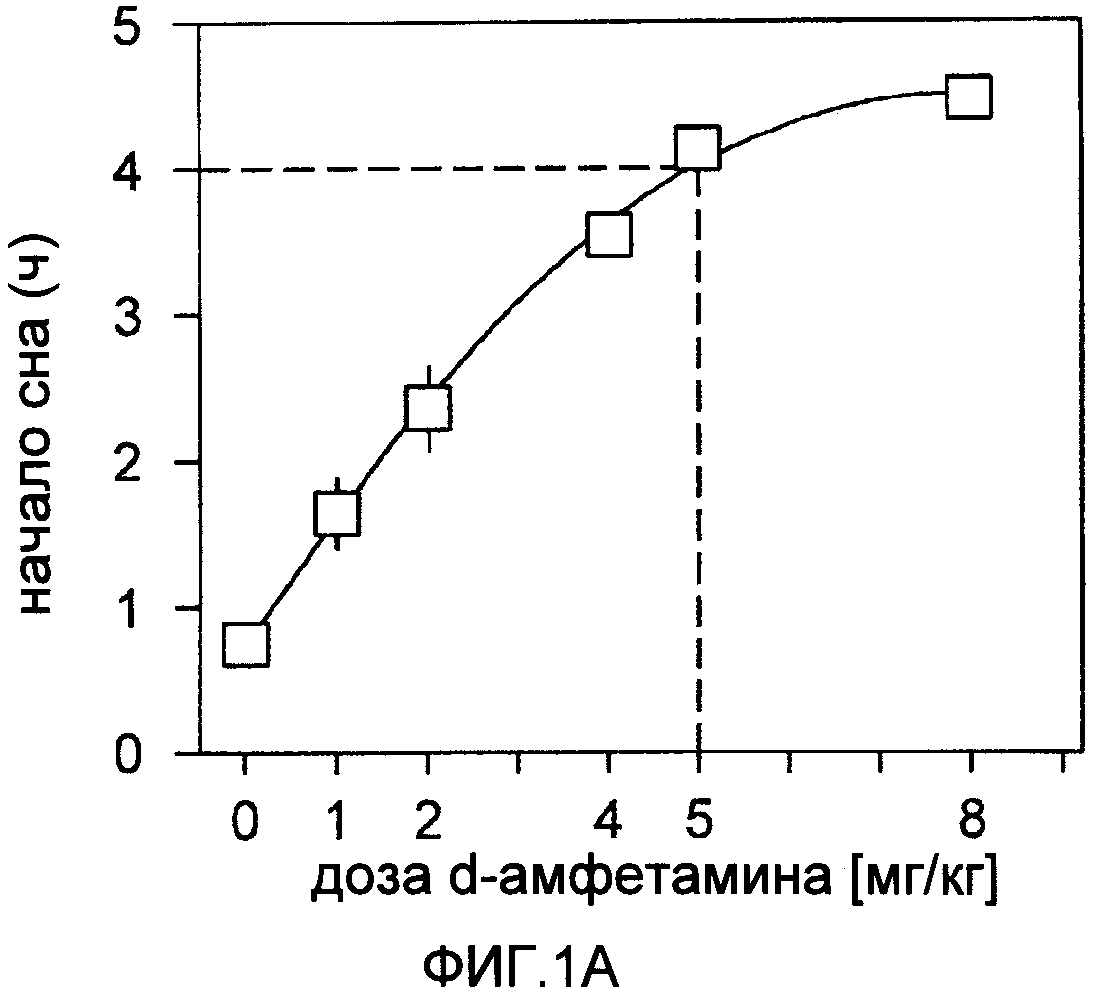
На фиг.1А показано время засыпания мышей C57BL/6J после повторных внутрибрюшинных (IP) инъекций d-амфетамина (А) при включении освещения (9:00 утра). На фиг.1В показано время засыпания трех инбредных линий мышей (D2=DBA/2J, В6=C57BL/6J, АК=AKR/J, n=7/инбредную линию) после одной IP инъекции 150 мг/кг тестируемого соединения (R228060) или 5 мг/кг d-амфетамина. Разница в действии инъекций физиологического раствора на засыпание мышей D2 и АК после d-амфетамина показана на врезке звездочкой (Р<0.05; апостериорный критерий Тьюки). Для сравнения показано время засыпания при невозбужденных базовых условиях (черные символы). Усами показана величина ±1, стандартное отклонение среды.
На фиг.2 показаны средние за 1 час времена бодрствования для 3 инбредных линий мышей (В6 черные; D2 серые и АК белые символы). Вертикальными отрезками показана величина ±1 (стандартное отклонение среды); (n=7/генотип). Затемненные участки означают темновые периоды. На нижнем графике показаны дифференциальные эффекты тестируемого соединения (R228060) по сравнению с d-амфетамином. Темно-серыми квадратами на верхнем и среднем графиках показаны межгенотипические различия (1-факторная ANOVA; Р<0.05). Ромбами на нижнем графике показаны значимые различия в спаренных t-тестах между тестируемым соединением и d-амфетамином; (Р<0.05; обозначение цветом то же, что на верхнем графике).
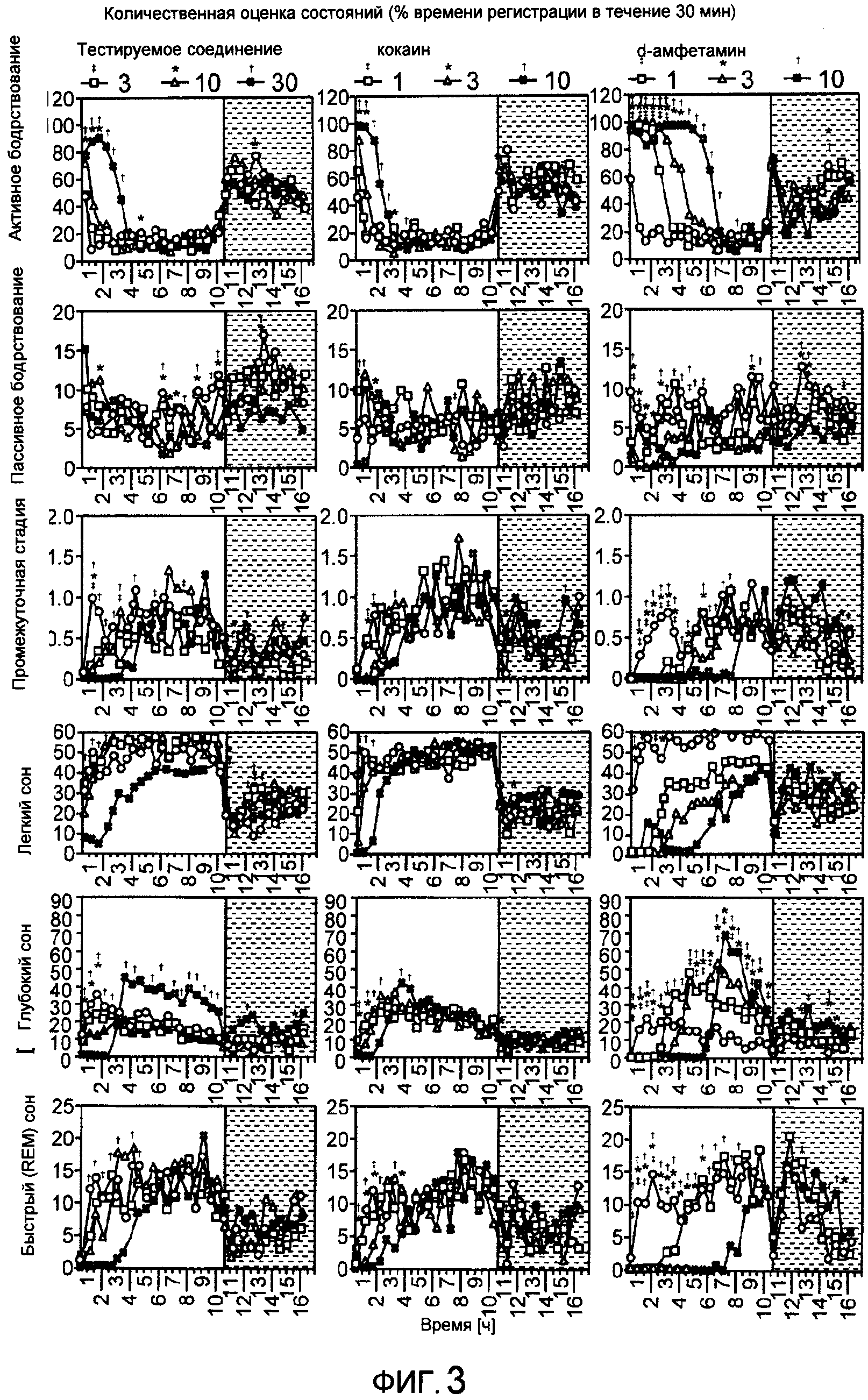
На фиг.3 показано действие тестируемого соединения (3, 10, 30 мг/кг внутрибрюшинно), кокаина (1, 3, 10 мг/кг внутрибрюшинно), амфетамина (1, 3, 10 мг/кг внутрибрюшинно) и носителя (черные кружки) на состояния сон-бодрствование в течение шестнадцати часов после введения препарата.
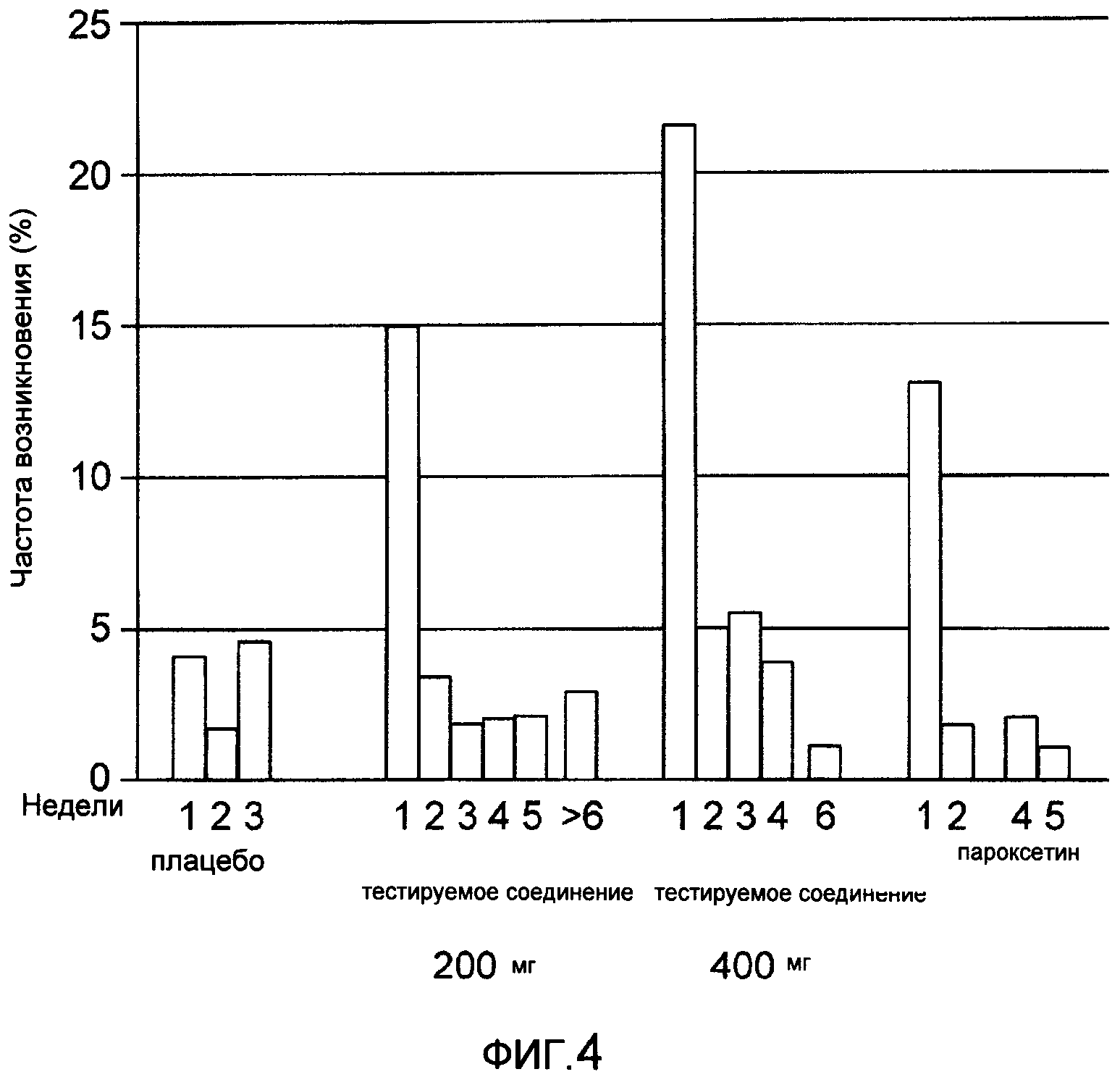
На фиг.4 показана частота случаев бессонницы по группам и неделям.
Осуществление изобретения
Настоящее изобретение может быть реализовано в различных вариантах и не ограничивается приведенными здесь вариантами. Кроме того, эти варианты представлены в подробном и полном виде и для специалистов в данной области полностью описывают объем изобретения. Например, особенности, указанные для одного варианта, можно использовать и в других вариантах, а особенности какого-либо конкретного варианта можно исключить из этого варианта. Кроме того, в свете данного описания специалистам будут очевидны многочисленные вариации и добавления к представленным вариантам, которые не противоречат данному изобретению.
Если не указано особо, все использованные технические и научные термины имеют смысл, понятный специалисту в той области, к которой относится изобретение. Использованная в описании изобретения терминология имеет целью описание только конкретных вариантов и не ограничивает данное изобретение.
Все приведенные публикации, патентные заявки и другие ссылки включены здесь ссылками во всей полноте.
Определения
Используемое здесь выражение «и/или» включает любые и все возможные комбинации одного или нескольких связанных предметов, а также отсутствие альтернативных («или») комбинаций.
Кроме того, термин «примерно», используемый для обозначения измеряемой величины типа количества соединения или препарата по данному изобретению, дозы, времени, температуры и т.п., включает отклонения ±20%, ±10%, ±5%, ±1%, ±0.5% или даже ±0.1% от указанной величины.
Термин «по существу состоит из» (или грамматические варианты) в отношении композиций по данному изобретению означает композицию, которая может содержать дополнительные компоненты в той степени, в какой дополнительные компоненты существенно не изменяют композицию. Термин «существенно изменяют» в отношении композиции относится к увеличению или уменьшению терапевтической эффективности композиции по меньшей мере примерно на 20% или более по сравнению с эффективностью композиции, состоящей из цитированных компонентов.
Используемый термин «эффективное для лечения количество» относится к количеству композиции по данному изобретению и включает модулирующий эффект, который может быть полезным эффектом для пациента, страдающего заболеванием, расстройством или болезненным состоянием, в том числе включает улучшение состояния пациента (например, по одному или нескольким симптомам), задержку или замедление прогрессирования болезненного состояния и/или изменение клинических параметров заболевания или болезненного состояния и т.п., как хорошо известно в данной области. Например, эффективное для лечения количество может относиться к количеству композиции, соединения или препарата, которые улучшают состояние пациента по меньшей мере на 5%, например, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100%.
Используемый термин «эффективное для профилактики количество» относится к количеству композиции по данному изобретению, которое препятствует или задерживает начало расстройства, болезни или болезненного состояния (например, по одному или нескольким симптомам) или уменьшает тяжесть расстройства, болезни или болезненного состояния (например, по одному или нескольким симптомам) после их начала, как хорошо известно в данной области. Например, эффективное для профилактики количество может относиться к количеству композиции, соединения или препарата, которое задерживает начало болезненного состояния у пациента по меньшей мере на 5%, например, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100% относительно отсутствия введения композиции.
«Лечение» относится к любому типу воздействия с модулирующим эффектом, который может быть полезным эффектом для пациента, страдающего расстройством, болезнью или болезненным состоянием (например, усталостью), и включает улучшение состояния пациента (например, по одному или несколькими симптомам), задерживает или замедляет прогрессирование болезненного состояния и/или изменяет клинические параметры, заболевание или болезненность и т.п., как хорошо известно специалистам.
«Профилактика» относится к предотвращению начала болезни или задержке начала расстройства, болезни или болезненного состояния (например, усталости) и/или к понижению степени усталости пациента относительно степени усталости, которая была бы в отсутствие способов по данному изобретению. Профилактика может быть полной, например, приводить к полному отсутствию усталости у пациента. Профилактика может быть частичной, т.е. пациент устает меньше, чем без применения настоящего изобретения.
Способы оценки усталости известны в данной области и включают психометрические шкалы, такие как Fatigue Severity Scale, the HIV-Related Fatigue Scale, the Situational Fatigue Scale, the Fatigue Assessment Instrument и the Functional Assessment of Chronic Illness Therapy-Fatigue.
Термин «усталость» обычно понимают и трактуют как болезненное состояние, характеризующееся пониженной работоспособностью и пониженной эффективностью деятельности, которое обычно сопровождается чувством слабости и недомогания, а также потерей ментальной четкости, внимания и концентрации. Усталость может быть острой или хронической. Усталость отличается от сонливости и заболеваний, связанных с сонливостью (таких как повышенная сонливость в дневное время и нарколепсия). Усталость также отличают от утомления вследствие недосыпания.
Используемый здесь термин «фармацевтически приемлемый» означает вещество, которое не является биологически или иначе нежелательным, т.е. веществом, которое можно вводить пациенту вместе с композициями по данному изобретению и которое не вызывает существенно отрицательных биологических эффектов и не взаимодействует отрицательно с любым из компонентов композиции, в которой он содержится. Естественно выбирать это вещество таким образом, чтобы минимизировать любое разложение активного ингредиента и любые побочные эффекты у пациента, которые хорошо известны специалистам в данной области (см., например, Remington's Pharmaceutical Science; 21st ed. 2005). Примеры фармацевтически приемлемых носителей для композиций по данному изобретению включают, но не ограничиваются этим, стерильную очищенную воду для инъекций и стерильный очищенный физиологический раствор для инъекций.
Используемый здесь термин «фармацевтически приемлемые соли или сложные эфиры» означает нетоксичные соли или сложные эфиры соединений, применяемых в данном изобретении, которые обычно получают по реакции свободной кислоты с подходящим органическим или неорганическим основанием или свободного основания с подходящей органической или неорганической кислотой. Примеры таких солей включают, но не ограничиваются ими: ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, кальций, этилендиаминтетраацетат кальция, камсилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, этилендиаминтетраацетат, эдисилат, эстолат, эсилат, фумарат, глюцептат, глюконат, глютамат, гликоллиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, иодид, изотионат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, муцинат, напсилат, нитрат, олеат, оксалат, памоат, пальмитат, пантотенат, фосфат-дифосфат, полигалактуронат, калий, салицилат, натрий, стеарат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиодид и валерат.
Используемый здесь термин «пациент, нуждающийся в лечении» относится к любому пациенту или субъекту, у которого в настоящее время развивается любой из указанных синдромов или расстройств, включая любое болезненное состояние или расстройство, приводящее к усталости, или любое другое расстройство, при котором клиническое состояние или прогноз для пациента может улучшиться в результате введения одного или нескольких соединений формулы I отдельно или в комбинации с другими терапевтическими средствами, включая, но не ограничиваясь этим, лечение другими лекарствами.
Используемые здесь термины «усталость, связанная с болезнями или лечением» и «связанная с усталостью» (и близкие термины) относятся к любой болезни, расстройству, болезненному состоянию, лечению или медикаментозному лечению, при которых проявляется усталость как один из симптомов или побочных эффектов.
«Одновременно» означает достаточно близкий по времени объединенный эффект (т.е. это могут быть два или несколько событий, протекающих за короткий период времени одно за другим). В некоторых вариантах введение двух или нескольких соединений «одновременно» означает, что два соединения вводят достаточно близко по времени и присутствие одного изменяет биологический эффект от другого. Два соединения можно ввести в одинаковых или разных лекарственных формах одновременно или последовательно. Одновременное введение можно осуществить путем смешения соединений до введения или путем введения соединений в двух разных лекарственных формах, например, в одно время, но в разных анатомических точках или используя разные способы введения.
Термин «алкил» означает прямую или разветвленную углеводородную цепь, содержащую от 1 до 24 атомов углерода, например 1-12 атомов углерода. Алкильная группа может содержать одну или несколько двойных или тройных связей. Примеры алкильных групп включают метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил и т.п.
Термин «циклоалкил» относится к фрагментам неароматических циклических углеводородов, содержащих 3-24 атома углерода. Циклоалкильная группа может содержать одну или несколько двойных связей. Примеры включают циклопропил, циклобутил, циклопентил и циклогексил.
«Замещенный алкил» означает алкил, в котором один атом алкила замещен, например, атомом углерода, азота, серы, кислорода, кремния или галогена либо альтернативно атомом азота, серы, кислорода или галогена. Термин включает заместители в алкильных, алкенильных, алкинильных и циклоалкильных группах.
Примеры заместителей, которые могут присоединяться к любому атому алкильной группы в «замещенном алкиле», включают циклические группы, гетероциклические группы, арильные группы, гетероарильные группы, аминогруппы, амидогруппы, нитрогруппы, цианогруппы, азидные группы, гидроксильные группы, алкоксильные группы, тиоалкоксильные группы, ацилтиоалкоксильные группы, галогены, сульфонатные группы, сульфонамидные группы, сложноэфирные группы, карбоновые кислоты, кислород (например, карбонильную группу) и серу (например, тиокарбонильную группу). Заместители также включают любую химическую функциональную группу, которая обеспечивает повышенную растворимость молекулы в воде (например, карбоновую кислоту, сложный эфир карбоновой кислоты, карбоксамид-, морфолино-, пиперазинил-, имидазолил-, тиоморфолино- или тетразолильные группы как незамещенные, так и замещенные).
Термин «алкоксил» означает алкил, указанный выше, связанный с кислородом.
Термин «тиоалкоксил» означает алкил, указанный выше, соединенный с серой.
Термины «гало» и «галоген» относятся к любым радикалам фтора, хлора, брома или иода.
Термины «цикл» и «циклическая система» относятся к циклу, представляющему собой замкнутую атомную систему, причем указанные атомы являются атомами углерода или, если указано, гетероатомами типа азота, кислорода или серы. Сам цикл, а также любые заместители в нем, могут быть присоединены к любому атому с образованием устойчивого соединения.
Термин «арил» относится к ароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической системе, в которой 0, 1, 2 или 3 атома в каждом кольце могут быть замещены заместителем. Примеры арильных групп включают фенил, нафтил и т.п.
Термин «гетероарил» относится к ароматичесекой 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической системе, содержащей 1-3 гетероатома в случае моноциклической системы, 1-6 гетероатомов в случае бициклической системы или 1-9 гетероатомов в случае трициклической системы, причем гетероатомы выбирают из О, N или S и 0, 1, 2 или 3 атома каждого кольца могут быть замещены заместителем. Примеры гетероарильных групп включают пиридил, фурил или фуранил, имидазолил, бензимидазолил, пиримидинил, тиофенил или тиснил, хинолинил, индолил, тиазолил и т.п.
Термин «арилалкил» относится к определенному выше алкилу, замещенному арилом, как указано выше.
Термин «гетероцикл» относится к неароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической системе, содержащей 1-3 гетероатома в случае моноциклической системы, 1-6 гетероатома в случае бициклической системы 1-9 гетероатома в случае трициклической системы, причем указанные гетероатомы выбирают из О, N или S, где 0, 1, 2 или 3 атома в каждом кольце могут быть замещены заместителем. Примеры гетероциклических радикалов включают пиперизинил, пирролидинил, диоксанил, морфолинил, тетрагидрофуранил и т.п.
Подходящими заместителями для арильной, гетероарильной и гетероциклической групп являются те же заместители, что и для алкильных групп.
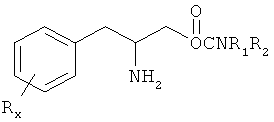
Настоящее изобретение предлагает способы лечения и/или профилактики усталости у пациента, включающие введение пациенту, нуждающемуся в лечении, эффективного для лечения и/или профилактики количества соединения формулы I:

или его фармацевтически приемлемой соли или сложного эфира, в которых
Rx представляет собой член, который выбирают из группы, состоящей из водорода, низшего алкила с 1-8 атомами углерода, галогена, выбранного из F, Cl, Br и I, алкоксила с 1-3 атомами углерода, нитрогруппы, гидроксила, трифторметила и тиоалколксила с 1-3 атомами углерода;
х является целым числом при условии, что при х, равном 2 или 3, группы R могут быть одинаковыми или разными;
R1 и R2 могут быть одинаковыми или разными и их независимо выбирают из группы, состоящей из водорода, низшего алкила с 1-8 атомами углерода, арила, алкиларила и циклоалкила с 3-7 атомами углерода;
или R1 и R2 могут соединяться с образованием 5-7-членного гетероцикла, замещенного группой, которую выбирают из водорода, алкильной, арильной или гетероарильной групп, причем циклическое соединение может содержать 1-2 атома азота и 0-1 атомов кислорода и атомы азота не связаны непосредственно друг с другом или с атомом кислорода.
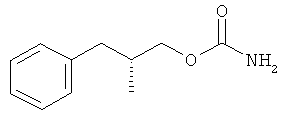
В одном варианте R является водородом и х=1. В другом варианте все группы R, R1 и R2 являются водородом и х=1. В следующем варианте соединение имеет структуру:
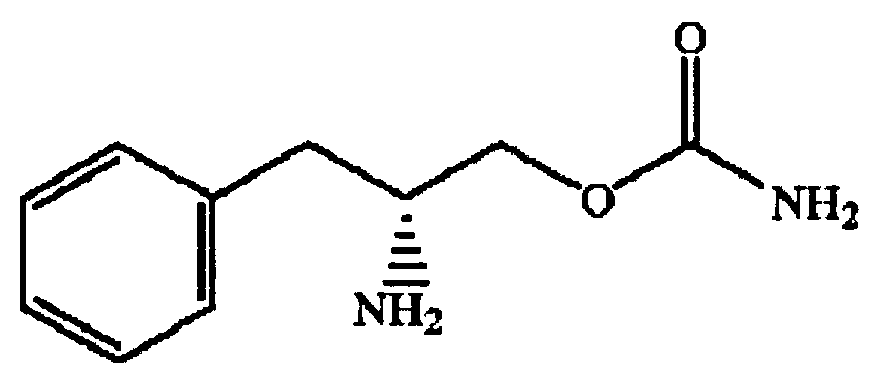
Соединения формулы I могут существовать в виде энантиомеров, например R- или S-энантиомеров. Таким образом, в одном варианте соединение формулы I является энантиомером, практически не содержащим других энантиомеров, или энантиомерной смесью, в которой преобладает один энантиомер соединения (избыток энантиомера). В другом варианте один энантиомер преобладает по меньшей мере примерно на 60%, например, по меньшей мере примерно на 70%, 80%, 90%, 95%, 96%, 97%, 98% или 99%. В одном варианте энантиомер представляет собой (R)-(бета-аминобензолпропил)карбамат или (О-карбамоил-(D)-фенилаланинол) или энантиомерную смесь, в которой преобладает энантиомер (R)-(бета-аминобензолпропил)карбамат или (О-карбамоил-(D)-фенилаланинол).
Выделенный энантиомер - это такой энантиомер, который практически не содержит другого соответствующего энантиомера. Таким образом, выделенный энантиомер относится к соединению, которое выделено методами разделения или синтезировано в форме, не содержащей другого соответствующего энантиомера. Использованный здесь термин «практически не содержит» означает, что соединение синтезировано со значительным превышением содержания одного энантиомера, например, по меньшей мере примерно на 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99%. Предпочтительные энантиомеры можно выделить из рацемических смесей любым способом, известным специалистам в данной области, в том числе путем высокоэффективной жидкостной хроматографии (ВЭЖХ) и способом получения и кристаллизации хиральных солей, либо энантиомеры можно синтезировать способами, описанными здесь.
Одно соединение формулы I состоит из энантиомера (D) со структурой, приведенной ниже, где Rx=R1=R2=водород; в приведенной ниже структуре аминогруппа направлена вниз от плоскости бумаги. Судя по структуре, это соединение является энантиомером (R), т.е. (R)-(бета-аминобензолпропил)карбаматом. Это соединение является правовращающим энантиомером и поэтому его можно назвать O-карбамоил-(D)-фенилаланинолом. В данном описании оба химических названия можно использовать взаимозаменяемо. В одном варианте соединение присутствует в виде фармацевтически приемлемой соли, например гидрохлорида.
В одном варианте изобретения усталость обусловлена расстройством, заболеванием или болезненным состоянием, включая, например, депрессию, рак, рассеянный склероз, болезнь Паркинсона, болезнь Альцгеймера, синдром хронической усталости, фибромиалгию, хроническую боль, черепно-мозговую травму, СПИД и остеоартрит. В другом варианте усталость связана с особенностями лечения или терапии, применяемой для лечения и/или профилактики расстройства, заболевания или болезненного состояния, в том числе без ограничения химиотерапии, радиационной терапии, трансплантации костного мозга или лечения антидепрессантами.
Соединения формулы I можно синтезировать способами, известными специалистам. Соли и сложные эфиры соединений формулы I можно получить обработкой данного соединения подходящей минеральной или органической кислотой (НХ) в подходящем растворителе или другими способами, хорошо известными специалистам.
Подробности указанных схем реакций синтеза соединений формулы I, а также репрезентативные примеры получения конкретных соединений были описаны в патентах США №№5705640, 5756817, 5955499 и 6140532, которые включены здесь ссылками во всей полноте.
Из формулы I очевидно, что некоторые соединения по данному изобретению содержат по меньшей мере один и, возможно, несколько асимметрических атомов углерода. Предполагается, что настоящее изобретение включает стереохимически чистые изомерные формы соединений, а также их рацематы. Стереохимически чистые изомерные формы можно получить, применяя известные принципы. Диастереомеры можно разделить способами физического разделения, такими как фракционная кристаллизация и хроматографические способы, а энантиомеры можно отделить друг от друга с помощью селективной кристаллизации диастереомерных солей с оптически активными кислотами или основаниями или хиральной хроматографии. Чистые стереомеры можно также синтезировать из соответствующих стереохимически чистых исходных веществ или используя стереоселективные реакции.
Аналогично соединения по данному изобретению, содержащие двойную связь, могут существовать в виде геометрических изомеров, которые можно легко разделить и выделить традиционными способами. Такие изомерные формы включены в объем данного изобретения.
В ходе любого синтеза соединений по настоящему изобретению необходимо и/или желательно защитить чувствительные или реакционноспособные группы реагирующих молекул. Этого можно достичь с помощью традиционных защитных групп, таких как описанные в Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press 1973; и T.W.Greene & P.G.M. Wuts, Protective Groups in Organic Synthesis, Third Edition, John Wiley & Sons, 1999. Защитные группы можно удалить на удобной последующей стадии известными способами.
Другие варианты изобретения включают использование для приготовления лекарства от усталости одного из соединений или энантиомеров или энантиомерных смесей, описанных выше, или их фармацевтически приемлемых солей или сложных эфиров.
Соединения по данному изобретению включают все их фармацевтически приемлемые соли. Примеры таких солей включают соли, полученные из фармацевтически приемлемых неорганических и органических кислот и оснований. Примеры подходящих солей кислот включают без ограничений ацетат, адипинат, альгинат, аспартат, бензоат, бутират, цитрат, фумарат, глюколат, кислый сульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, малонат, метансульфонат, никотинат, нитрат, оксалат, пальмоат, пектинат, персульфат, гидроксинафтоат, пивалат, пропионат, салицилат, сукцинат, сульфат, тартрат, тиоцианат, тозилат и ундеканоат. Для приготовления солей, используемых в качестве интермедиатов при получении соединений по данному изобретению и их фармацевтически приемлемых солей с кислотами, можно использовать и другие кислоты, такие как щавелевая, хотя эта кислота сама по себе является неприемлемой.
Соли, полученные из соответствующих оснований, включают без ограничений соли щелочных металлов (например, натрия, калия), щелочноземельных металлов (например, магния и кальция), аммония и N-(алкил)4 +.
Соединения формулы I включают соединения, полученные кватернизацией любой содержащейся в нем основной азотсодержащей группы.
Кроме того, соединения по данному изобретению включают пролекарства соединений формулы I, которые превращаются in vivo в активные соединения. Например, соединение можно модифицировать для увеличения клеточной проницаемости (например, путем этерификации полярных групп) и затем превратить в активное соединение с помощью клеточных ферментов. Способы маскировки заряженных или реакционноспособных фрагментов в качестве пролекарств известны специалистам (см., например, Р.Korgsgaard-Larsen and H.Bundgaard, A Textbook of Drug Design and Development, Reading U.K., Harwood Academic Publishers, 1991).
Термин «пролекарство» относится к соединениям, которые быстро превращаются in vivo с образованием исходного соединения приведенной выше формулы, например, в результате гидролиза в крови, см. например, в работе Т.Higuchi and V.Stella, Prodrugs as Novel delivery Systems, Vol.14 of the A.C.S. Symposium Series и Edward B. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987, которые включены здесь ссылками. См. также патент США №6680299. Примеры пролекарств включают такие пролекарства, которые в результате метаболизма in vivo в организме пациента превращаются в активное лекарство, обладающее активностью описанных выше соединений, причем пролекарство является сложным эфиром спирта или карбоксильной группы, если такая группа присутствует в соединении; амидом аминогруппы или карбоксильной группы, если такие группы присутствуют в соединении; уретаном аминогруппы, если такая группа присутствует в соединении; ацеталью или кеталью спиртовой группы, если такая группа присутствует в соединении; N-основанием Манниха или имином аминогруппы, если такая группа присутствует в соединении; или основанием Шиффа, оксимом, ацеталью, сложным эфиром енола, оксазолидином или тиазолидином карбоксильной группы, если такая группа присутствует в соединении, как это описано, например, в патентах США №№6680324 и 6680322.
Использованный здесь термин «фармацевтически приемлемое пролекарство» (и подобные термины) относится к таким пролекарствам соединений по настоящему изобретению, которые, в рамках обоснованного медицинского суждения, пригодны для применения путем контакта с тканями человека и/или других животных без нежелательной токсичности, воспаления, аллергического отклика и т.п., характеризуются разумным соотношением риск/польза и эффективны для планируемого применения, а также, относится, когда это возможно, к цвиттер-ионным формам соединений по данному изобретению.
В одном варианте соединения по данному изобретению вводят пациенту, нуждающемуся в лечении и/или профилактике усталости. Соединение можно вводить непрерывно или с перерывами. В одном варианте соединение вводят пациенту несколько раз в сутки, например, 2, 3, 4 или более раз в сутки. В другом варианте соединение вводят пациенту не чаще одного раза в сутки, например, один раз каждые 2, 3, 4, 5 или 6 суток, один раз в неделю, например, не чаще одного раза каждые две недели, один раз в месяц, один раз каждые два месяца, один раз каждые три месяца, один раз каждые четыре месяца, один раз каждые пять месяцев, один раз каждые шесть месяцев или еще реже. Соединение можно вводить за 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 12 часов, 1 сутки, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 1 неделю, 2 недели, 3 недели, 4 недели или раньше до начала усталости (например, до события, которое по-видимому вызовет усталость). В других вариантах соединение можно вводить в любом периодическом режиме. Введение можно продолжать в течение одной, двух, трех или четырех недель или одного, двух или трех месяцев или дольше. После отдыха соединение необязательно можно вводить по той же или другой схеме. Перерыв может продолжаться одну, две, три или четыре недели или дольше в зависимости от фармакодинамических эффектов от соединения в организме пациента.
Соединения по данному изобретению можно вводить пациенту любым подходящим способом, например, перорально, ректально, в рот (например, под язык), вагинально, парентерально (например, подкожно, внутримышечно, внутрикожно или внутривенно), местно (т.е. через кожу и слизистые оболочки, включая дыхательные пути) и чрескожно. Соединение доставляют пациенту в такой дозе, которая эффективна для лечения и/или профилактики усталости. Эффективная доза зависит от многих факторов, включая пол, возраст, масса и общее физическое состояние пациента, тяжесть усталости, конкретное вводимое соединение или композицию, длительность лечения, природу любого сопутствующего лечения и используемый носитель и другие факторы, известные специалистам. Как обычно, эффективное для лечения количество в любом конкретном случае специалисты определяют из соответствующей литературы и/или с помощью рутинных экспериментов (см., например. Remington, The Science and Practice of Pharmacy (21st ed. 2005)). В одном варианте соединение вводят в дозе примерно от 0.01 мг/кг/дозу до примерно 300 мг/кг/дозу, например, примерно от 0.1 мг/кг/дозу до 200 мг/кг/дозу, примерно от 0.5 мг/кг/дозу до примерно 100 мг/кг/дозу или примерно 0.01, 0.05, 0.1, 0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 50, 75, 100, 125, 150, 175, 200, 225, 250, 275 или 300 мг/кг/дозу. В некоторых случаях доза может быть даже меньше, например, всего 0.005 или 0.001 мг/м2 или меньше. В других случаях доза может быть даже выше, например, до 500 или 1000 мг/кг/дозу или больше. Настоящее изобретение включает каждый из перечисленных интервалов.
В одном варианте данного изобретения пациентом является тот, у кого развивается усталость, и после этого пациенту вводят соединение. В другом варианте пациентом является тот, кто не чувствует усталости, и соединение вводят пациенту для профилактики усталости. Еще в одном варианте пациентом является тот, кто переживает событие, которое, возможно, приведет к возникновению усталости. Соединение может быть введено пациенту до наступления события и/или после того, как событие произошло, но до развития усталости. События, которые могут привести к развитию усталости, хорошо известны и включают без ограничений заболевания, расстройства или болезненные состояния, такие как депрессия, рак, рассеянный склероз, болезнь Паркинсона, болезнь Альцгеймера, синдром хронической усталости, фибромиалгия, хроническая боль, травмы мозга, СПИД и остеоартрит, и лечение или терапию, такую как химиотерапия, радиационная терапия, трансплантация костного мозга и лечение антидепрессантами. В одном варианте пациент страдает депрессией. В другом варианте пациент не переживает депрессии.
В одном варианте соединение по данному изобретению вводят пациенту одновременно с дополнительным препаратом или лечением. Дополнительный препарат можно включить в композицию соединения или в отдельную композицию. Дополнительный препарат или лечение можно предоставить пациенту по другой схеме или другим способом по сравнению с данным соединением. Дополнительный препарат или лечение могут включать любой препарат или лечение, которые приносят пользу пациенту, например, лечение и/или профилактика болезни, расстройства или болезненного состояния, связанных с усталостью. Дополнительное лечение включает без ограничений хирургию, радиационную терапию и трансплантацию костного мозга. Дополнительные препараты включают без ограничений препараты для химиотерапии, противорвотные препараты, анальгетики (например, опиоиды и/или общие местные анестетики), противовоспалительные препараты, противовирусные препараты, антидепрессанты и иммунодепрессанты.
Примеры химиотерапевтических препаратов включают без ограничений ацивицин, акларубицин, акодазол гидрохлорид, акронин, адозелесин, альдеслейкин, альтретамин, амбомицин, аметантрон ацетат, аминоглютетимид, амсакрин, анастрозол, антрамицин, аспарагиназа, асперлин, азацитидин, азетепа, азотомицин, батимастат, бензодепа, бикалютамид, бисантрен гидрохлорид, биснафид димезилат, бизелесин, блеомицин сульфат, брекинар натрий, бропиримин, бисульфан, кактиномицин, калюстерон, карацемид, карбетимер, карбоплатин, кармустин, карубицин гидрохлорид, карзелесин, цедефингол, хлорамбуцил, циролемицин, цисплатин, кладрибин, криснатол мезилат, циклофосфамид, цитарабин, дакарбазин, дактиномицин, даунорубицин гидрохлорид, децитабин, дексормаплатин, дезагуанин мезилат, диазикуон, доцетаксел, доксорубицин, доксорубицин гидрохлорид, дролоксифен, дролоксифен цитрат, дромостанолон пропионат, дуазомицин, эдатрексат, эфлорнитин гидрохлорид, эльсамитруцин, энлоплатин, энпромат, эпипропидин, эпирубицин гидрохлорид, эрбулозол, эзорубицин гидрохлорид, эстрамустин, эстрамустин фосфат натрий, этанидазол, этопосид, этопосид фосфат, этоприн, фадрозол гидрохлорид, фазарабин, фенретинид, флоксуридин, флударабин фосфат, фторурацил, флуроцитабин, фоскидон, фостриецин натрий, гемцитабин, гемцитабин гидрохлорид, гидроксимочевина, идарубицин гидрохлорид, ифосфарнид, ильмофосин, интерлейкин II (включая рекомбинантный интерлейкин II или rIL2), интерферон альфа-2а, интерферон альфа-2b, интерферон альфа-n1, интерферон альфа-n3, интерферон бета-Ia, интерферон гамма-Ib, ипроплатин, иринотекан гидрохлорид, ланреотид ацетат, летрозол, лейпролид ацетат, лиарозол гидрохлорид, лометрексол натрий, ломустин, лозоксантрон гидрохлорид, мазопрокол, майтансин, меклоретамин гидрохлорид, мегестрол ацетат, меленгестрол ацетат, мелфалан, меногарил, меркаптопурин, метотрексат, метотрексат натрий, метоприн, метуредепа, митиндомид, митокарцин, митокромин, митогиллин, митомалцин, митомицин, митоспер, митотан, митоксантрон гидрохлорид, микофеноловая кислота, нокодазол, ногаламицин, ормаплатин, оксисуран, паклитаксел, пегаспаргаза, пелиомицин, пентамустин, пепломицин сульфат, перфосфамид, пипоброман, пипосульфан, пироксантрон гидрохлорид, пликамицин, пломестан, порфимер натрий, порфиромицин, преднимустин, прокарбазин гидрохлорид, пуромицин, пуромицин гидрохлорид, пуразофурин, рибоприн, роглетимид, спафингол, сафингол гидрохлорид, семустин, симтразин, спарфосат натрий, спарсомицин, спирогерманий гидрохлорид, спиромустин, спироплатин, стрептонигрин, стрептозотоцин, сулофенур, тализомицин, текогалан натрий, тегафур, телоксантрон гидрохлорид, темопорфин, тенипозид, тероксирон, тестолактон, тиамиприн, тиогуанин, тиотепа, тиазофурин, тирапазамин, торемифен цитрат, трестолон ацетат, трицирибин фосфат, триметрексат, триметрексат глюкуронат, трипторелин, тубулозол гидрохлорид, производные урацила на основе азотного иприта, уредепа, вапреотид, вертепорфин, винбластин сульфат, винкристин сульфат, виндесин, виндесин сульфат, винепидин сульфат, винглицинат сульфат, винлейросин сульфат, винорелбин тартрат, винросидин сульфат, винзолидин сульфат, ворозол, зениплатин, зиностатин и зорубицин гидрохлорид.
Примеры других препаратов для химиотерапии включают, но не ограничиваются ими: 20-эпи-1,25-дигидроксивитамин D3; 5-этинилурацил; абиратерон; акларубицин; ацилфульвен; адецифенол; адозелесин; альдеслекин; антагонисты ALL-TK; альтретамин; амбамустин; амидокс; амифостин; аминолевулиновая кислота; амрубицин; амсакрин; анагрелид; анастрозол; андрографолид; ингибиторы ангиогенеза; антагонист D; антагонист G; антареликс; анти-дорсализирующий морфогенетический протеин-1; антиандроген карциномы простаты; антиэстроген; антинеопластон; антисмысловые олигонуклеотиды; афидиколин глюцинат; генные модуляторы апоптоза; регуляторы апоптоза; апуриновая кислота; apa-CDP-DL-PTBA; аргининдеаминаза; асулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азасетрон; азатоксин; азатирозин; производные баккатина III; баланол; батимастат; антагонисты BCR/ABL; бензохлорины; бензоилстауроспорин; производные бета лактама; бета алетин; бетакламицин В; бетулиновая кислота; ингибитор bFGF; бикалутамид; бисантрен; бисазиридинилспермин; биснафид; бистратен А; бизелесин; брефлат; бропиримин; бидотитан; бутионин сульфоксимин; кальципотриол; калфостин С; производные камптотецина; канарипокс IL-2; капецитабин; карбоксамид-амино-триазол; карбоксиамидотриазол; CaRest M3; CARN 700; ингибитор, выделенный из хряща; карзелесин; ингибиторы казеинкиназы (ICOS); кастаноспермин; цекропин В; цетрореликс; хлорины; хлорхиноксалин сульфонамид; цикапрост; цис-порфирин; кладрибин; аналоги кломифена; клотримазол; коллисмицин А; коллисмицин В; комбретастатин А4; аналог комбрестатина; конагенин 816; криснатол; криптофицин 8; производные криптофицина А; курацин А; циклопентантрахиноны; циклоплатам; ципемицин; цитарабин осфосфат; цитолитический фактор; цитостатин; дакликсимаб; децитабин; дегидродидемнин В; деслорелин; дексаметазон; дексифосфамид; дексразоксан; дексверапамил; диазикон; дидемнин В; дидокс; диэтилнорспермин; дигидро-5-азацитидин; дигидротаксол 9-; диоксамицин, дифенилспиромустин; доцетаксел; докосанол; доласетрон; доксифлуридин; дролоксифен; дронабинол; дуокармицин SA; эвселен; экомустин; эдельфосин; эдреколомаб; эфорнитин; элемин; эмитефур; эпирубицин; эприрубицин; эпристерид; аналог эстрамустина; агонисты эстрогена; антагонисты эстрогена; этанидазол; этопозид фосфат; экземестан; фадрозол; фазарабин; фенретинид; филграстим; финастерид; флавопиридол; флезеластин; флуастерон; флударабин; флуородауноруницин гидрохлорид; форфенимекс; форместан; фострецин; фотемустин; гадолиний тексафирин; нитрат галлия; галоцитабин; ганиреликс; ингибиторы желатиназы; гемцитабин; ингибиторы глютатиона; гепсульфам; герегулин; гексаметилен бисацетамид; гиперицин; ибандроновая кислота; идарубицин; идоксифен; идрамантон; ильмофосин; иломастат; имидазоакридоны; имихимод; педки иммуностимуляторы; ингибитор рецептора инсулиноподобного фактора роста-1; агонисты интерферона; интерфероны; интерлейкины; иобенгуан; иододоксорубицин; 4-ипомеанол; ироплакт; ирсогладин; изобенгазол; изогомогаликондрин В; итасетрон; джасплакинолид; кагалалид F; ламелларин-N триацетат; ланреотид; лейнамицин; ленограстим; лентинан сульфат; лептолстатин; летрозол; фактор ингибирования лейкемии; лейкоцитарный альфа интерферон; лейпролид+эстроген+прогестерон; лейпрорелин; левамизол; лиарозол; линейный аналог полиамина; липофильный дисахарид пептид; липофильные соединения платины; лиссоклинамид 7; лобаплатин; ломбрицин; лометрексол; лонидамин; лозоксантрон; ловастатин; локсорибин; луртотекан; лутеций тексафирин; лизофиллин; литические пептиды; майтансин; манностатин А; маримастат; масопрокол; маспин; ингибиторы матрилизина; ингибиторы матричной металлопротеиназы; меногарил; мербарон, метерелин; метиониназа; метоклопрамид; ингибитор MIF; мифепристон; милтефосин; миримостим; рассогласованная двухцепочечная РНК; митогуазон; митолактол; аналоги митомицина; митонафид; сапорин - фактор роста фибробластного митотоксина; митоксантрон; мофаротен; молграмостим; моноклональные антитела; человеческий хорионический гонадотропин; монофосфорильный липид А+ стенки миобактериальной клетки sk; мопидамол; ингибитор генов устойчивости к многим лекарствам; терапия на основе супрессора множественных опухолей-1; противораковый препарат горчицы; микапероксид В; экстракт стенки микобактериальной клетки; мириапорон; N-ацетилдиналин; N-замещенные бензамиды; нафарелин; нагрестип; наксолон+пентазоцин; напавин; нафтерпин; нартограстим; недаплатин; неморубицин, неридроновая кислота, нейтральная эндопептидаза; нилутамид; низамицин; модуляторы - оксиды азота; нитроксидный антиоксидант; нитруллин; O6-бензилгуанин; октреотид; окиценон; олигонуклеотиды; онапристон; оданстерон; орацин; оральный цитокиновый индуктор; ормаплатин; осатерон; оксалиплатин; оксауномицин; паклитаксел; аналоги паклитаксела; производные паклитаксела; лауамин; пальмитоилризоксин; памидроновая кислота; панакситриол; паномифен; парабактин; пазеллиптин; пегаспаргаза; пельдезин; пентосан полисульфат натрий; пентостатин; пентозол; перфлуброн; перфосфамид; периллиловый спирт; феназиномицин; фенилацетат; ингибиторы фосфатазы; писибанил; пилокарпин гидрохлорид; пирарубицин; пиритрексим; плацетин А; плацетин В; ингибитор активатора плазминогена; комплекс платины; соединения платины; комплекс платины триаминного типа; порфимер натрий; порфиромицин; преднизон; пропил-бис-акридон; простагландин J2; ингибиторы протеазома; иммуномодулятор на основе белка-А; ингибитор протеинкиназы С; ингибиторы протеинкиназы С; микроалгал; ингибиторы протеинтирозинфосфатазы; ингибиторы пуриннуклеозидфосфорилазы; пурпурины; пиразолоакридин; конъюгат полиоксиэтилен-пиридоксилированный гемоглобин; RAF-антагонисты; ральтитрексед; рамосетрон; ингибиторы Ras фарнесилпротеинтрансферазы; ингибиторы Ras; ингибитор Ras-GAP; деметилированный ретеллиптин; этидронат рения Re 186; ризоксин; рибозимы; ретинамид RII; роглетимид; рогитукин; ромуртид; рокинимекс; рубигинон В1; рубоксил; сафингол; саинтопин; SarCNU; сакрофитол А; сарграмостим; миметики Sdi 1; семустин; ингибитор физиологического старения 1; смысловые олигонуклеотиды; ингибиторы сигнальной трансдукции; модуляторы сигнальной трансдукции; белок связывания одноцепочечного антигена; сизофиран; собузоксан; борокаптат натрия; фенилацетат натрия; солверол; белок связывания соматомедина; сонермин; спарфосовая ксилота; спикамицин D; спиромустин; спленопентин; спонжистатин 1; скваламин; ингибитор стволовых клеток; ингибиторы деления стволовых клеток; стипиамид; ингибиторы стромелисина; сульфиносин; антагонист сверхактивного вазоактивного кишечного белка; сурадист; сурамин; сваинсонин; синтетические глюкозамингликаны; таллимустин; тамоксифен метиодид; тауромустин; тазаротен; текогалан натрий; тегафур; теллурапириллин; ингибиторы теломеразы; темопорфин; темозоломид; тенипозид; тетрахлордекаоксид; тетразомин; талибластин; тиокоралин; тромбопоэтин; тромбопоэтин миметик; тималфасин; агонист рецептора тимопоэтина; тимотринан; стимулирующий тироид гормон; этилэтиопурпурин олова; тирапазамин; титаноцен дихлорид; топсентин; торемифен; фактор тотипотентных стволовых клеток; ингибитор трансляции; третиноин; триацетилуридин; трицирибин; триметрексат; трипторелин; трописетрон; туростерид; ингибиторы тирозинкиназы; тирфостины; ингибиторы UBC; убенимекс; фактор ингибирования роста в урогенитальной полости; антагонисты рецептора урокиназы; вапреотид; вариолин В; векторная система, терапия геном эритроцита; веларесол; верамин; вердинс; вертепорфин; винорелбин; винксалтин; витаксин; ворозол; занотерон; зениплатин; зиласкорб и зиностатин стималамер.
Примеры противорвотных препаратов включают без ограничений метоклопромид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, оданстерон, гранисетрон, гидроксизин, ацетиллейцин моноэтаноламин, ализаприд, азасетрон, бензхинамид, биэтанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлатал, метопимазин, набилон, оксипемдил, пирамазин, скополамин, сульпирид, тетрагидроканнабинол, тиэтилперазин, тиопроперазин, трописетрон и их смеси.
Примеры анальгетических препаратов включают без ограничения опиоиды аллилпродин, альфапродин, анилэридин, бензилморфин, бензитрамид, бупренорфин, буторфанол, клонитразен, кодеин, дезоморфин, декстроморамид, дезоцин, диампромид, диаморфон, дигидрокодеин, дигидроморфин, дименоксадол, димефептанол, диметилтиамбутен, диоксафетил бутират, дипипанон, эптазоцин, этогептазин, этилметилтиамбутен, этилморфин, этонитазен, фентанил, героин, гидрокодон, гидроморфон, гидроксипетидин, изометадон, кетобемидон, леворфанол, левофенацилморфан, лофентанил, меперидин, мептазинол, метазоцин, метадон, метопон, морфин, мирофин, налбуфин, нарцеин, никоморфин, норлевофанол, норметадон, налорфин, норморфин, норпипанон, опиум, оксикодон, оксиморфон, папаверетум, пентазоцин, фенаксодон, феноморфан, феназоцин, феноперидин, пиминодин, пиритрамид, прогептазин, промедол, проперидин, пропирам, пропоксифен, суфентанил, тилидин и трамадол.
Примеры противовоспалительных препаратов включают без ограничения аспирин, ибупрофен, напроксен, беноксапрофен, флурбипрофен, фенопрофен, флубуфен, кетопрофен, индопрофен, пиропрофен, карпрофен, оксапрозин, прамопрофен, муропрофен, триоксапрофен, супрофен, аминопрофен, тиапрофеновуюя кислоту, флупрофен, буклоксовую кислоту, индометацин, сулиндак, толметин, зомепирак, тиопинак, зидометацин, ацеметацин, фентиазак, клиданак, оксипинак, мефенамовую кислотуа, меклофенамовую кислоту, флуфенамовую кислоту, нифлумовую кислоту, толфенамовую кислоту, дифлуризал, флуфенизал, пироксикам, судоксикам, изоксикам, целекоксиб, рофекоксиб и кортикостероиды (такие как преднизон, метилпреднизолон, дексаметазон).
Примеры антивирусных средств включают без ограничений гидроксимочевину, рибавирин, IL-2, IL-12, пентафусид, 1,-D-рибофуранозил-1,2,4-триазол-3 карбоксамид, 9-(2-гидроксиэтокси)метилгуанин, адамантанамин, 5-иодо-2'-деоксиуридин, трифторотимидин, интерферон, аденинарабинозид, ингибиторы протеазы, ингибиторы тимидинкиназы, ингибиторы синтеза сахара или гликопротеина, ингибиторы синтеза структурного белка, ингибиторы присоединения и адсорбции и аналоги нуклеозидов, такие как ацикловир, пенцикловир, валацикловир и ганцикловир.
Примеры антидепрессантов включают без ограничений нефазодон, сертралин, тразодон, нортриптин, амитриптин, имипрамин, пароксетин, флувоксамин, милнаципран, миртазапин, миансерин, бупропион, литий, нефазодон, тразодон, вилоксазин, амитриптилин, кломипрамин и флуоксетин.
Примеры иммунодепрессантов включают без ограничений такролимус, сиролимус, циклоспорин, метотрексат, циклофосфамид, азатиоприн, меркаптопурин и микофенолят.
Настоящее изобретение применяют также в ветеринарии. Подходящими пациентами обычно являются млекопитающие. Используемый здесь термин «млекопитающее» включает, но не ограничивается этим, людей, приматов (кроме человека), крупный рогатый скот, овец, быков, свиней, лошадей, кошек, собак, кроликов, грызунов (например, крыс или мышей) и т.п. Термин «люди» включает новорожденных, детей, подростков, взрослых и стариков.
В конкретных вариантах пациентом является человек, который испытывает и/или предчувствует усталость. В других вариантах предметом данного изобретения является моделирование усталости у животного.
Описанные выше соединения по данному изобретению можно приготовить для введения в фармацевтическом носителе по известным методикам. См., например, Remington, The Science And Practice of Pharmacy (21st ed. 2005). В производстве фармацевтической лекарственной формы по изобретению соединение обычно смешивают inter alia с приемлемым носителем. Разумеется, носитель должен быть приемлемым с точки зрения совместимости с другими ингредиентами в лекарственной форме и не должен представлять опасности для пациента. Носитель может быть твердым или жидким либо и тем, и другим и должен содержать такое количество соединения, сколько содержится в единичной дозе лекарственной формы, например, в таблетке с содержанием от 0.01% или 0.5% до 95% или 99% по массе соединения. В лекарственные формы по данному изобретению можно вводить одно или несколько соединений по любой из хорошо известных методик фармации, включающих смешение компонентов необязательно с применением одного или нескольких сопутствующих ингредиентов.
Лекарственные формы по данному изобретению включают формы, пригодные для перорального, ректального, местного, ротового (например, сублингвального), вагинального, парентерального (например, подкожного, внутримышечного, внутрикожного или внутривенного), местного (т.е. через кожу и слизистые оболочки, включая дыхательные пути) и чрескожного введения, хотя наиболее подходящий способ в любом данном случае будет зависеть от природы и тяжести болезненного состояния пациента, нуждающегося в лечении, и от природы конкретного применяемого активного соединения.
Лекарственные формы для перорального введения могут находиться в виде отдельных изделий, таких как капсулы, облатки, лепешки или таблетки, каждая из которых содержит предварительно определенное количество активного соединения; в виде порошков или гранул; раствора или суспензии в водной или неводной жидкости или в виде эмульсии масло-в-воде или вода-в-масле. Такие лекарственные формы можно приготовить любым подходящим способом фармации, который включает стадию объединения соединения и подходящего носителя (который может содержать один или несколько сопутствующих ингредиентов, как описано выше). В целом лекарственную форму по данному изобретению готовят путем равномерного и тщательного смешения соединения с жидкостью или мелкораздробленным твердым носителем либо с тем и другим и затем при необходимости формования полученной смеси. Например, таблетку можно изготовить прессованием или формованием порошка либо гранул, содержащих соединение с сопутствующими ингредиентами. Прессованные таблетки можно изготовить прессованием в подходящем аппарате, в котором соединение свободно движется в виде порошка или гранул, необязательно смешанных со связующим, смазкой, инертным разбавителем и/или поверхностно-активным/диспергирующим компонентом. Формованные таблетки можно изготовить в подходящем аппарате формованием порошка соединения, увлажненного инертным жидким связующим.
Лекарственные формы для буккального (сублингвального) введения включают лепешки, содержащие соединение в душистой основе, обычно сахарозе и гуммиарабике или трагаканте, и пастилки, содержащие соединение в инертной основе типа желатина и глицерина либо сахарозы и гуммиарабика.
Лекарственные формы по настоящему изобретению для парентерального введения включают стерильные водные и неводные растворы соединения для инъекций, которые предпочтительно изотоничны плазме крови будущего реципиента. Эти препараты могут содержать антиоксиданты, буферные растворы, бактериостаты и растворенные вещества, которые создают изотоничность плазме крови будущего реципиента. Водные и неводные стерильные суспензии могут включать суспендирующие препараты и загустители. Лекарственные формы могут присутствовать в единичной дозе (например, в шприце или другом устройстве для инъекции) или в многодозовых контейнерах, например в запаянных ампулах и пробирках, и их можно хранить в сублимированном (лиофилизованном) виде, так что непосредственно перед использованием потребуется только добавить жидкий стерильный носитель, например физиологический раствор или воду для инъекций. Растворы и суспензии для экстренной инъекции можно приготовить из описанных выше стерильных порошков, гранул и таблеток. Например, в одном варианте настоящего изобретения предлагается устойчивая стерильная композиция для инъекций, содержащая одно или несколько соединений в единичной дозе в запаянном контейнере. Соединение предлагается в форме лиофилизата, способного восстановить структуру с помощью подходящего фармацевтически приемлемого носителя с образованием жидкой композиции, пригодной для инъекции пациенту. Единичная доза обычно содержит примерно от 1 мкг до примерно 10 г соединения. Если соединение практически не растворимо в воде (например, на жировой основе), для эмульгирования соединения в водном носителе можно применить достаточное количество физиологически приемлемого эмульгатора. Одним из таких используемых эмульгаторов является фосфатидилхолин.
Лекарственные формы, пригодные для ректального введения, предпочтительно использовать в виде суппозиториев со стандартной дозой. Их можно приготовить путем смешения соединения с одним или несколькими традиционными твердыми носителями, например, какао маслом, и затем формования полученной смеси.
Лекарственные формы для местного применения на кожу предпочтительно имеют форму мази, крема, лосьона, пасты, геля, спрея, аэрозоля или масла. Используемые носители включают вазелин, ланолин, полиэтиленгликоли, спирты, вещества, способствующие проникновению через кожу, и комбинации двух или нескольких веществ.
Лекарственные формы для чрескожного введения могут представлять собой пластыри, которые могут оставаться в тесном контакте с эпидермисом реципиента в течение длительного периода времени. Лекарственные формы для чрескожного введения можно доставить ионофорезом (см., например, Pharm. Res. 3:318 (1986)), и тогда они обычно имеют вид необязательно буферного водного раствора соединения. Подходящие лекарственные формы содержат цитрат или бис/трис буфер (рН 6) или смесь этанол/вода и содержат от 0.1 до 0.2 М активного ингредиента.
Из описанных здесь соединений можно приготовить другие фармацевтические композиции, такие как эмульсии на водной основе. В таких случаях композиция будет содержать достаточное количество фармацевтически приемлемого эмульгатора для эмульгирования нужного количества соединения. Особенно удачные эмульгаторы включают фосфатидилхолины и лецитин.
Помимо описанного соединения фармацевтические композиции могут содержать другие добавки, такие как рН-регулирующие добавки. В частности, рН-регулирующие вещества включают кислоты, такие как соляная кислота, основания или буферные реагенты, такие как лактат натрия, ацетат натрия, фосфат натрия, цитрат натрия, борат натрия или глюконат натрия. Кроме того, композиции могут содержать противомикробные консерванты. Противомикробные консерванты включают метилпарабен, пропилпарабен и бензиловый спирт. Противомикробный консервант обычно добавляют, когда лекарственную форму помещают в пробирку для многодозового использования. Другие хорошо известные добавки включают, например, средства для снижения вязкости, противопенные препараты, антиоксиданты (например, аскорбилпальмитат, бутилгидроксианизол (ВНА), бутилгидрокситолуол (ВНТ) и токоферолы, например, α-токоферол (витамин Е)), консерванты, хелатирующие реагенты (например, ЭДТК), регуляторы вязкости, наполнители (например, сахар типа сахарозы, лактозы или маннита), ароматизаторы, красители, отдушки, замутнители, суспендирующие препараты, связующие, уплотнители, пластификаторы, смазки и их смеси. Количество таких добавок специалисты могут легко определить в зависимости от необходимых конкретных свойств.
Добавки могут также включать загуститель. Можно использовать загустители, известные и применяемые в данной области, в том числе, например, фармацевтически приемлемые полимеры и неорганические загустители. Примеры загустителей для фармацевтических композиций включают полиакрилатные смолы и полиакрилат-сополимерные смолы, например смолы на основе полиакриловой/метакриловой кислот; целлюлозы и производные целлюлозы, включая: алкилцеллюлозы, например, метил-, этил- и пропилцеллюлозы; гидроксиалкилцеллюлозы, например гидрокспропилцеллюлозы и гидроксипропилалкилцеллюлозы, такие как гидроксипропилметилцеллюлозы; ацилированные целлюлозы, например ацетаты целлюлозы, ацетат-терефталаты целлюлозы, ацетат-сукцинаты и фталаты гидроксипропилметилцеллюлозы; и их соли, такие как натрий-карбоксиметилцеллюлоза; поливинилпирролидоны, например поли-N-винилпирролидоны и винилпирролидоны и сополимеры винилпирролидона, такие как винилпирролидон-винилацетатные сополимеры; поливиниловые смолы, например поливинилацетаты и спирты, а также другие полимерные вещества, включая трагакантовую камедь, гуммиарабик, альгинаты, например альгиновую кислоту и ее соли, например альгинаты натрия; и неорганические загустители, такие как атапульгит, бентонит и силикаты, в том числе гидрофильные формы диоксида кремния, например алкилированные (например, метилированные) силикагели, в частности коллоидный диоксид кремния. Описанные выше загустители можно включать, например, в препараты для пролонгированного действия. Однако при пероральном введении применение загустителей обычно не требуется и менее предпочтительно. С другой стороны, применение загустителей показано, например, при местном введении.
Настоящее изобретение более конкретно описано в следующих примерах, которые являются только иллюстративными, поскольку специалистам в данной области будут очевидны многие модификации и вариации.
ПРИМЕР 1
Действие (R)-(бета-аминобензолпропил)карбамата (также известного как R228060 и обозначенного здесь и далее как тестируемое соединение) на различные параметры сна при введении дозы per os 50-150 мг/кг определяли на 8 трансгенных нарколептических мышах, подвергнутых клеточной абляции гипокретином (препорорексин/атаксин-3), и их однопометных мышей дикого типа, и наблюдаемые эффекты сравнивали с действием модафинила в качестве пробуждающего препарата сравнения. Тестируемое соединение продемонстрировало значительное увеличение эпизодов бодрствования как у мышей дикого типа, так и у нарколептических мышей и нормализовало картину сна у нарколептических мышей.
Методы
Сигнал полиграфа (электроэнцефалограмма - EEG и электромиограмма - EMG) регистрировали на приборе SleepSign (Kissei Comtech), и стадии сна наблюдали визуально с 10-секундными интервалами для периодов бодрствования, медленного (non-REM) и быстрого (КЕМ) сна. Критерии оценки были следующие: бодрствование характеризуется десинхронизированным сигналом EEG различной частоты (>4 Гц) с малой амплитудой и высокой EMG активностью. Может также появляться волна альфа-ритма (8-9 Гц) (с высокой EMG активностью). Медленный сон характеризуется синхронизированной низкочастотной (0.25-4 Гц) активностью с высокой амплитудой и пониженной EMG активностью (по сравнению с бодрствованием). EEG активность в период быстрого сна аналогична активности при бодрствовании с десинхронизированными волнами различной частоты и малой амплитудой. Может также появляться волна альфа-ритма (8-9 Гц) с пониженной EMG активностью. EEG активность во время быстрого сна еще более снижена и во многих случаях полностью отсутствует. Во время быстрого сна на электромиограмме может наблюдаться некоторое подергивание мускулов.
Три дозы тестируемого соединения (50, 100 и 150 мг/кг per os) вместе с носителем вводили перорально в момент ZT 2 (через 2 часа после включения света) или ZT14 (через 2 часа после выключения света) и регистрировали их влияние на сон в течение 6 часов после введения препарата (данные о сне собирали в течение 30 часов после введения препарата, и они доступны для анализа). Дозы модафинила составляли 50 и 200 мг/кг per os (плюс носитель), и модафинил вводили также в моменты времени ZT 2 и ZT14.
В случае когда сигналы полиграфа для некоторых мышей были недостаточны для регистрации с необходимой точностью (в частности, при нечеткой электромиограмме), данные для этих животных отбрасывали и для анализа использовали данные минимум для 5 животных (за исключением наивысшей дозы тестируемого соединения для мышей дикого типа в период темноты, n=4) и число животных указывали на фигурах.
Действие тестируемого соединения и модафинила на количество эпизодов пробуждения, медленного и быстрого сна (суммарное число секунд), число эпизодов для каждой стадии сна в течение 6 часов и среднюю продолжительность периодов бодрствования/сна (в секундах) анализировали для каждого животного и рассчитывали среднее значение каждого параметра для каждого генотипа. Данные о действии соединений на количество эпизодов пробуждения и сна полезны для оценки их способности вызывать пробуждение, и число эпизодов каждой стадии сна и средняя продолжительность периодов бодрствования/сна являются важными параметрами для оценки фрагментации сна. Амфетамин и модафинил представляют собой основные применяемые в настоящее время препараты для лечения избыточной дневной сонливости (EDS) различной этиологии (нарколепсия, идиопатическая гиперсомния и вторичная EDS), которые облегчают пробуждение и увеличивают время бодрствования при обычных и EDS условиях.
На основании анализа полученных данных оценили терапевтическое действие тестируемого соединения на пробуждение при нарколепсии и сравнили эти эффекты с действием модафинила. Сравнение эффектов в случае мышей с дефицитом гипокретина и диких мышей очень полезно при решении вопроса, зависит ли пробуждающее действие тестируемого соединения от присутствия гипокретина и можно ли изменить чувствительность механизмов усвоения тестируемого соединения у нарколептических мышей с помощью дефицита лиганда гипокретина.
Результаты
Влияние на сон во время отдыха: наблюдали очень сильное пробуждающее действие тестируемого соединения как на мышей дикого типа, так и нарколептических мышей с дефицитом гипокретина. Эффект зависит от дозы, и введение 50, 100 и 150 мг/кг РО тестируемого соединения вызвало постоянное бодрствование у большинства мышей дикого типа и нарколептических мышей в течение периодов до 3, 4 и 5 ч соответственно. Во время этого периода полностью подавлялся медленный (non-REM) и быстрый (REM) сон. После введения тестируемого соединения не наблюдали ненормальных EEG, и по данным полиграфа сон, наступавший после продолжительного бодрствования, был нормальным.
Напротив, пробуждающие эффекты от модафинила были средними, и пробуждающий эффект от 200 мг/кг модафинила приблизительно соответствовал эффекту от 50 мг/кг тестируемого соединения. Однако модафинил не оказал заметного влияния на быстрый (REM) сон после введения 50 мг/кг тестируемого соединения. Более того, тестируемое соединение значительно уменьшило время быстрого (REM) сна, что составило его отличие от действия модафинила.
Влияние на сон в активный период: Такой эксперимент повторили с введением соединений во время активного периода. Во время активного периода нарколептические мыши спят дольше, чем мыши дикого типа. Животные дикого типа обычно остаются бодрствующими в течение почти трех часов после введения носителя. Аналогично эффектам, наблюдаемым во время светлого периода, тестируемое соединение в зависимости от дозы удлиняет время бодрствования как у мышей дикого типа, так и у нарколептических мышей. Однако у диких мышей пробуждающие эффекты во время темного периода были выражены слабо из-за большого количества эпизодов пробуждения на общем фоне и наблюдались только слабые эффекты. Напротив, у нарколептических мышей наблюдали более выраженные пробуждающие эффекты, и количество эпизодов пробуждения у этих мышей после введения 100 и 150 мг/кг тестируемого соединения достигло уровня мышей дикого типа, что предполагает нормализацию количества эпизодов сна/пробуждения у нарколептических мышей под действием тестируемого соединения. Аналогично время медленного (non-REM) сна и быстрого (REM) сна у нарколептических мышей уменьшилось под действием тестируемого соединения и достигло уровня диких мышей. Аналогичные, но значительно более слабые эффекты наблюдали после введения этим мышам модафинила. Хотя модафинил в зависимости от дозы усиливал пробуждение нарколептических мышей, высокая доза модафинила (200 мг/кг) не способствовала достижению того же количества эпизодов пробуждения на общем фоне, как у диких мышей.
ПРИМЕР 2
Влияние тестируемого соединения и d-амфетамина на состояние бессонницы изучали на трех линиях мышей, включая C57BL/6J, AKR/J и DBA/2J. Тестируемое соединение продемонстрировало независимо от генотипа увеличение бодрствования и более длительные периоды бодрствования по сравнению с d-амфетамином.
Методы
По меньшей мере 7 взрослых самцов мышей инбредных линий C57BL/6J, AKR/J и DBA/2J были протестированы в 2 сериях непрерывных экспериментов по 72 часа. Первые 24 часа каждой серии рассматривали как базовый уровень следующего дня после инъекции физиологического раствора и следующего дня день после введения 150 мг/кг тестируемого соединения в первой серии и 5 мг/кг d-амфетамина во второй серии. Две серии экспериментов были разделены 7 днями «отмывочный» период, и все инъекции были внутрибрюшинными (IP) и их проводили при включении света (в 9 ч утра) в количестве 5 мл/кг.
Результаты
Действие дозы d-амфетамина на засыпание: мышам C57BL/6J вводили ежедневно по 1, 2, 4, 5 и 8 мг/кг d-амфетамина и рассчитывали длительность сна (фиг.1А). d-Амфетамин вызывал бодрствование в зависимости от дозы в интервале 1-5 мг/кг, но при увеличении дозы до 8 мг/кг увеличение числа периодов бодрствования по сравнению с дозой 5 мг/кг не наблюдали. На основании этих данных для сравнительного эксперимента выбрали дозу 5 мг/кг. На фиг.1В показана продолжительность сна после введения 5 мг/кг d-амфетамина по сравнению с 150 мг/кг тестируемого соединения. Тестируемое соединение в дозе 150 мг/кг вызывало непрерывное бодрствование в течение времени до 4.5 часов, и время бодрствования не зависело от генотипа при сравнении с продолжительностью сна после инъекции физиологического раствора (фиг.1В, врезка). Однако в отличие от результатов отклика на дозу (фиг.1А) доза 5 мг/кг d-амфетамина не вызвала такое же количество эпизодов бодрствования, как доза 150 мг/кг тестируемого соединения. Интересно, что d-амфетамин вызывал меньшее бодрствование у мышей АК (долго спящие), чем у мышей D2 (мало спящие), что предполагает зависимость влияния d-амфетамина от генотипа (фиг.1В, врезка).
Влияние на состояние бессонницы: Количество часов бодрствования в течение 72-часового исследования приведено на фиг.2. Хотя было отмечено несколько значительных различий между линиями мышей, тестируемое соединение (верхний график) и d-амфетамин (средний график) продемонстрировали весьма близкие эффекты за исключением того, что тестируемое соединение вызывало значительно более продолжительные периоды бодрствования, чем амфетамин (нижний график).
ПРИМЕР 3
Изучили протекание эпизодов сна-пробуждения у крыс после острого введения тестируемого соединения. Лечение тестируемым соединением при дозе 30 мг/кг резко увеличило активное бодрствование за счет времени легкого сна, глубокого сна и быстрого (REM) сна в течение 3-4 ч после введения. Таким образом, тестируемое соединение продемонстрировало немедленное влияние на центральную нервную систему после инъекции, которое выразилось в изменении архитектуры сна-пробуждения у крыс при функциональном пике эффекта примерно через 2 часа после внутрибрюшинного (IP) введения.
Методы
Эксперименты проводили на взрослых самцах крыс Sprague Dawley от Harlan (Borchen, Germany) с массой 240-260 г в момент хирургической операции. Животных содержали в прозрачных плексигласовых клетках (25×33×18 см) в IVC-системе (индивидуально вентилируемые клетки), помещенных в звукоизолированной камере. Крыс снабдили микрочипами для идентификации особей и выдерживали в регулируемой среде в ходе экспериментов: средняя температура 22±2ºС, относительная влажность 60%, цикл свет-темнота 12:12 (свет от 12:00 ч до 00:00 ч; интенсивность освещения ~100 люкс), свободный доступ к стандартной лабораторной пище и водопроводной воде.
Крыс помещали в стереотаксический аппарат при анестезии изофлюраном. Удаляли овальную область черепа и открытый участок черепа зачищали от надкостницы. В кости черепа высверливали три маленькие отверстия, не нарушая твердой мозговой оболочки, для того чтобы закрепить 3 винта из нержавеющей стали (диаметром 1 мм) для регистрации на полиграфе электроэнцефалограмм (EEG) фронтальной и теменной областей. С каждой стороны сагиттального шва черепа закрепляли стереотаксически два электрода (АР+2 мм, L-2 мм; и АР-6 мм, L 3 мм от теменной кости), а третий (реперный) электрод ввинчивали над мозжечком. Резьба стержня находилась на 5 мм ниже центра каждого стержня. Для регистрации электроокулограммы (EOG) и электромиограммы (EMG) около глазницы и в затылочный мускул соответственно вводили проволочки из нержавеющей стали. Электроды из нержавеющей стальной проволоки (7N51465T5TLT, 51/46 Teflon Bilaney, Германия) соединяли со спицей (Future Electronics: 0672-2-15-15-30-27-10-0) с помощью маленькой втулки (трековые спицы Dataflex: TRP-1558-0000) и присоединяли к 8-штырьковому разъему. Наконец, электроды закрепляли на черепе с помощью зубного цемента. Животных размещали по отдельности и выдерживали для реабилитации в течение по меньшей мере одной недели. Через десять суток после хирургического вмешательства животным давали привыкнуть к процедуре регистрации в своих клетках в течение двух недель. Через определенные интервалы времени крыс подсоединяли через кабель к поворотному шарниру, обеспечивающему свободное движение животного во время регистрации EEG, EOG и EMG активности.
Для тестирования отбирали только тех крыс, которые удовлетворяли необходимым требованиям, а именно: вес животных в пределах 300-700 г; хорошее качество сигнала на полиграфе; по меньшей мере 14 суток отдыха после предыдущего тестирования при повторном исследовании и отсутствие сбоев при двух последовательных исследованиях. Для каждого соединения проводили две EEG записи на 32 оперированных животных, которые распределяли произвольно по 4 условиям обработки (n=8 крыс на каждое условие обработки). Первую запись начинали в 14:00 ч и вели в течение 16 ч после введения физиологического раствора (n=32 крысы). Вторую запись проводили в течение того же времени после введения физиологического раствора и различных доз тест-препарата (1, 3 и 10 мг/кг), кокаина (3, 10 и 30 мг/кг IP) или амфетамина (3, 10, 30 мг/кг IP). Все соединения растворяли в физиологическом растворе и вводили в количестве 10 мл/кг массы организма. В контрольных пробах вводили эквивалентный объем физиологического раствора.
Результаты
Введение тестируемого соединения вызвало значительные изменения в распределении состояний сон-бодрствование (см. фиг.3, левые панели). В течение 16 ч периода записи после введения самой малой дозы тестируемого соединения (3 мг/кг IP) наблюдали небольшое модифицирование архитектуры сна-бодрствования. Наблюдали увеличение общего легкого сна (+26%, р<0.05) и повышенный драйв к пробуждению от легкого сна, а также глубокого сна (+46%, р<0.001; +15%, р<0.05; соответственно), что указывает на некоторые варианты фрагментации сна после введения этой дозы тестируемого соединения (р<0.05) (см. таблицу 1).
|
При дозе 10 мг/кг IP тестируемое соединение вызвало изменения в протекании сна-бодрствования, связанные с увеличением общей продолжительности легкого сна (+24%, р<0.05) и значительным увеличением сдвигов от быстрого (REM) сна к активному бодрствованию (+16%, р<0.05) (см. таблицы 2 и 3). Во время первых 90 минут периода записи наблюдали заметное уменьшение продолжительности глубокого сна за счет увеличения времени активного бодрствования (см. фиг.3, левые участки графиков) (р<0.05).
|
|
При наибольшей дозе (30 мг/кг IP) тестируемое соединение вызвало выраженные изменения в распределении циклов сна-бодрствования (см. фиг.3). Изменения включали заметное увеличение общего времени активного бодрствования (AW) (+19%, р<0.05), уменьшение общего времени пассивного бодрствования (PW)(-29%, p<0.05), легкого сна (-20%, р<0.05), а также быстрого (КЕМ) сна (-25%, р<0.05) в течение 16 ч периода регистрации после введения препарата (см. таблицу 2). Кроме того, при сравнении с общим временем сна тестируемое соединение вызвало увеличение времени глубокого сна и уменьшение времени быстрого (КЕМ) сна (р<0.05) (см. таблицу 3).
Значительное увеличение времени активного бодрствования наблюдали в течение первых 3 часов после введения тестируемого соединения (р<0.01). Одновременно наблюдали значительное уменьшение времени сна, например легкого сна (р<0.01), глубокого сна (р<0.01) и быстрого (REM) сна (р<0.01) с последующим синдромом отмены, особенно увеличение времени глубокого сна через 3 часа после введения тестируемого соединения. Последний эффект продолжался в течение примерно 7 ч во время светлого периода записи (см. фиг.1). Следует отметить, что тестируемое соединение начинало действовать очень быстро, в течение первых примерно 30 мин после введения.
Значительное увеличение общего времени активного бодрствования и уменьшение времени пассивного бодрствования, легкого сна и быстрого (REM) сна было обусловлено увеличением (+19%, р<0.05) и уменьшением (-30%, р<0.05; -23%, р<0.05; -24%, р<0.01) числа эпизодов стадий сна-пробуждения соответственно. Однако средняя продолжительность этих стадий сна-пробуждения не изменилась.
Как показано в Таблице 3, тестируемое соединение в дозе 30 мг/кг вызвало увеличение числа сдвигов от легкого сна и быстрого (REM) сна в сторону бодрствования (р<0.05), что указывает на фрагментацию сна. Анализ продолжительности сна показал значительные изменения, наступающие после введения тестируемого соединения (см. таблицу 1). Тестируемое соединение в дозе 10 и 30 мг/кг вызвало заметное увеличение продолжительности быстрого (REM) сна.
Полученные результаты показывают, что тестируемое соединение почти сразу после внутрибрюшинной инъекции влияет на центральную нервную систему в течение по меньшей мере 4 ч с пиком эффекта примерно через 2 часа после введения. При наименьшей дозе 3 мг/кг наблюдали только слабое влияние на архитектуру сна-пробуждения. Изменения параметров сна наблюдали при средней (10 мг/кг) и особенно повышенной дозе 30 мг/кг. Модифицирование распределения сна-пробуждения, которое наиболее заметно во время первых 3 ч периода регистрации, характеризуется значительным увеличением времени активного бодрствования, в то время как время пассивного бодрствования, легкого сна, глубокого сна и быстрого (REM) сна уменьшается. Интересно, что тестируемое соединение вызвало синдром отмены при наблюдении глубокого сна, выразившийся в заметном увеличении продолжительности этого состояния до 7 ч.
Эффекты, обнаруженные в сравнительных экспериментах, ясно показывают, что тестируемое соединение в дозе 30 мг/кг обладает психостимулирующими свойствами при введении и повышает последующую сонливость, что следует из увеличения эпизодов глубокого сна и потенциального непрямого влияния на стабильность сна. В целом по характеру действия, величине и длительности эффекта тестируемое соединение в дозе 30 мг/кг заметно напоминает амфетамин, введенный в наименьшей дозе 1 мг/кг.
ПРИМЕР 4
Первой целью данного исследования было выяснение эффективности 2 целевых доз тестируемого соединения (200 и 400 мг/сутки) по сравнению с плацебо в течение 6 недель лечения взрослых людей с глубокой депрессией средней и тяжелой тяжести без психотических особенностей. Для выявления отрицательного результата и неудачного результата использовали активный препарат сравнения (пароксетин). Кроме того, брали интервью на выходе для сбора информации о неожиданных результатах от тестируемого соединения для разработки клинической программы. Одна из доз тестируемого соединения продемонстрировала статистически значительно более высокую эффективность по сравнению с плацебо по широкому ряду параметров вторичной эффективности в отношении настроения и самочувствия, что указывает на антидепрессивную активность тестируемого соединения. Кроме того, заметно положительное влияние тестируемого соединения на оценку физической энергии/физической формы, психической энергии или мотивации и уменьшение уныния или депрессии.
Методы
Исследование проводили в США (в 23 центрах) и Канаде (в 4 центрах) многоцентровым двойным слепым методом со случайной выборкой, параллельными группами и плацебо-контролем. Исследование проводили в 2 фазы: фаза предварительной обработки (скрининг/"отмывка" и возвращение к исходному уровню) и 6-недельная фаза исследования двойным слепым методом. В качестве положительного контроля для оценки чувствительности анализа использовали пароксетин. После "отмывки" (в случае необходимости) нежелательных веществ пациенты были распределены случайным образом (1:1:1:1) для введения тестируемых соединений, дозированных по 200 мг/сутки или 400 мг/сутки, включая плацебо, или фиксированной дозы (20 мг/сутки) пароксетина. Тестируемое соединение давали дважды в сутки в течение 6 недель. Один раз в неделю анализировали эффективность и безопасность во время фазы слепого метода. По окончании исследования у пациентов брали интервью на выходе («Ваше здоровье и самочувствие») и они заполняли ABCD анкету ("Оценка эффекта клинического лекарственного лечения") (только в США).
Результаты
Бессонница была наиболее распространенным отрицательным последствием лечения группой тестируемых соединений (200 мг: 24%; 400 мг: 35%) по сравнению с 10% в группе плацебо и 17% в случае пароксетина, но это не приводило к прекращению лечения или применению средств экстренной помощи. На фиг.4 показано преобладание бессонницы по группам лечения и по неделям. В группе тестируемых соединений, а также в группе пароксетина бессонница преобладала на первой неделе. Длительность бессонницы была в основном одинаковой по всем группам лечения.
Результаты центров в США по опросам на выходе и данные слепой ABCD анкеты по самооценке результатов лечения в проведенном исследовании составили основу для интерпретации результатов TC-MDD-201 с точки зрения перспектив пациентов. Данные опросов на выходе показали, что позитивный опыт наиболее часто включал улучшение настроения и самочувствия во всех 4 группах лечения. Это было подтверждено данными ABCD анкеты, в которых более всего улучшился такой аспект здоровья в ходе исследования, как «уменьшение грусти и депрессии». Вообще говоря, настроение было первым симптомом улучшения, отмечаемым чаще всего в первые три недели получения медикаментозного лечения (по данным опросов на выходе).
В целом между 4 группами лечения было отмечено несколько различий по 51 пункту ABCD анкеты. Очевидны сразу резкие различия между плацебо и активными лекарствами (т.е. «физическая энергия/физическая форма», «уменьшение грусти и депрессии» и «психическая энергия или мотивация»), а не между самими активными лекарствами. Во вторичных анализах статистически значительное превосходство над плацебо наблюдали при дозе тестируемого соединения 200 мг, тестируемого соединения 400 мг и пароксетина по 14, 8 и 14 пунктам анкеты соответственно. Однако такие статистически значимые различия отсутствовали между дозами тестируемого соединения 200 мг и 400 мг или между пароксетином и дозами тестируемого соединения 400 мг и 200 мг или между пароксетином и тестируемым соединением (объединенные показатели для обеих доз) по любым из 51 пунктов ABCD анкеты.
Все сказанное выше является иллюстративным для настоящего изобретения и не ограничивает его. Изобретение определено пунктами приведенной ниже формулы с включенными в нее эквивалентными пунктами. Все публикации, патентные заявки, патенты, патентные публикации и любые другие ссылки включены здесь ссылками во всей полноте в тех местах и при тех положениях, которые относятся к предложениям и/или параграфам, в которых стоит ссылка.