Результат интеллектуальной деятельности: СПОСОБ МОДЕЛИРОВАНИЯ ОТГРАНИЧЕННОГО ПЕРИТОНИТА У ЛАБОРАТОРНЫХ НЕЛИНЕЙНЫХ МЫШЕЙ
Вид РИД
Изобретение
Изобретение относится к области ветеринарии и медицины, в частности экспериментальной патологии, и предназначено для экспериментального изучения патогенеза перитонита, тестирования новых средств профилактики и лечения этого заболевания.
Известен способ моделирования острого перитонита (RU 2338265, G09B 23/28, 10.11.2008), который заключается в инъекционном введении в брюшную полость предварительно наркотизированных крыс каловой взвеси, приготовленной из содержимого слепой кишки.
Недостатком данного способа является то, что используют относительно крупных и дорогостоящих животных. При выполнении различных манипуляций в эксперименте над крысами требуются дополнительные усилия, время на фиксацию и предварительную наркотизацию животных. Еще одним недостатком является инъекционный способ введения, при котором каловую взвесь вводят в брюшную полость через одну точку вкола путем перемещения иглы в правое и левое подреберья и в правую и левую подвздошные области. При таком способе возрастает риск травмирования органов брюшной полости. Это в значительной степени изменяет течение перитонита и приводит к преждевременной гибели животных.
Наиболее близким к заявленному решению является способ воспроизведения перитонита у мышей, который заключается в том, что животным в брюшную полость вводят 15% каловую взвесь, приготовленную из фекалий морских свинок (Устойчивость к внутрибрюшинному перитониту. Неадекватность экспериментального перитонита // URL: http://medicalplanet.Su/xirurgia/1120.html (дата обращения 02.02.2014)).
Существенным недостатком данного способа является гибель животных к концу первых суток после инъекции. Это ограничивает возможности проведения длительных исследований на таких животных.
Задачей заявленного способа является расширение арсенала доступных и технически простых способов для создания экспериментальной модели перитонита, близкой в патогенетическом отношении к соответствующему заболеванию и позволяющей длительно наблюдать за животными в эксперименте.
Сущность изобретения заключается в том, что в способе моделирования отграниченного перитонита у лабораторных нелинейных мышей, включающем однократное внутрибрюшинное введение каловой взвеси, согласно изобретению мышей массой 20-22 г инфицируют 10% каловой взвесью из свежих крысиных фекалий, приготовленной на изотоническом растворе хлорида натрия и однократно профильтрованной через двойной слой марли, через одну точку вкола по средней линии в пупочной области живота на глубину 2 мм в дозах 0,3-0,4 мл для использования модели более 13 дней и 0,5 мл для использования модели не более 13 дней.
Изобретение поясняется чертежами.
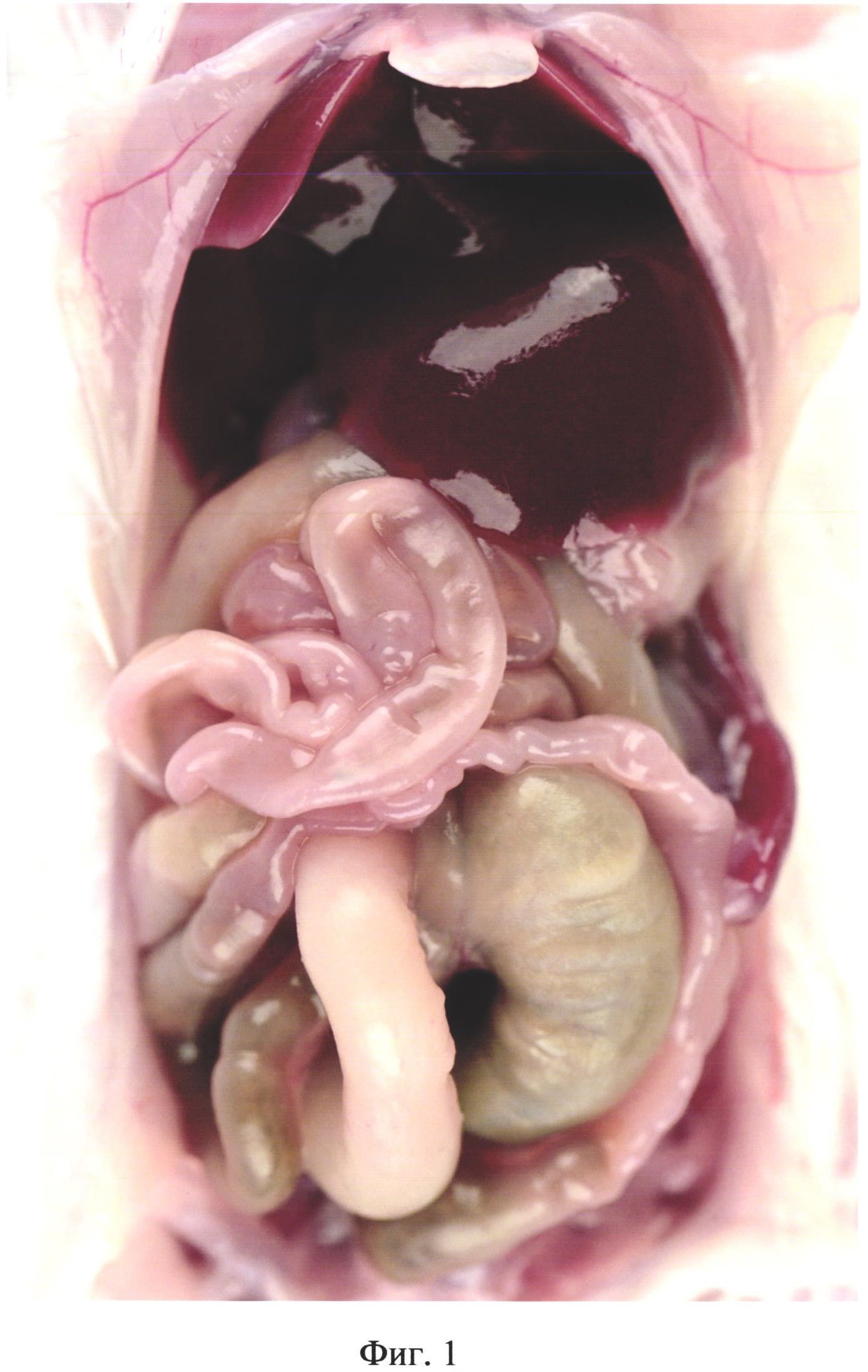
На фиг. 1 изображены внутренние органы брюшной полости животного контрольной группы №1 (в/б 0,3 мл стерильного физ. раствора).
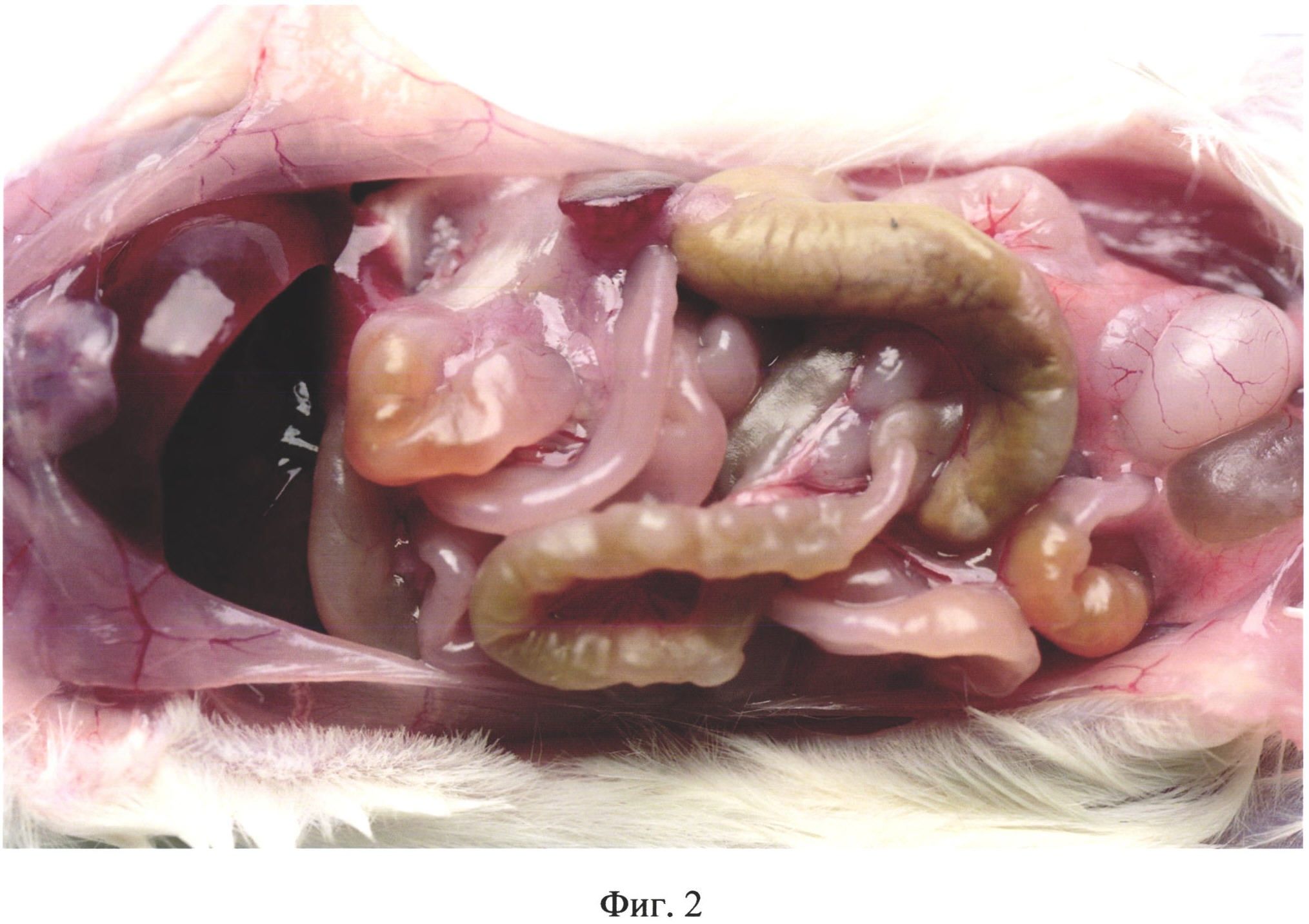
На фиг. 2 изображено ярко выраженное полнокровие сосудов сальника, брюшины, брыжейки и семенников у животного из группы №2 (в/б 0,3 мл 10% каловой взвеси из свежих крысиных фекалий) на 3 день после инъекции.
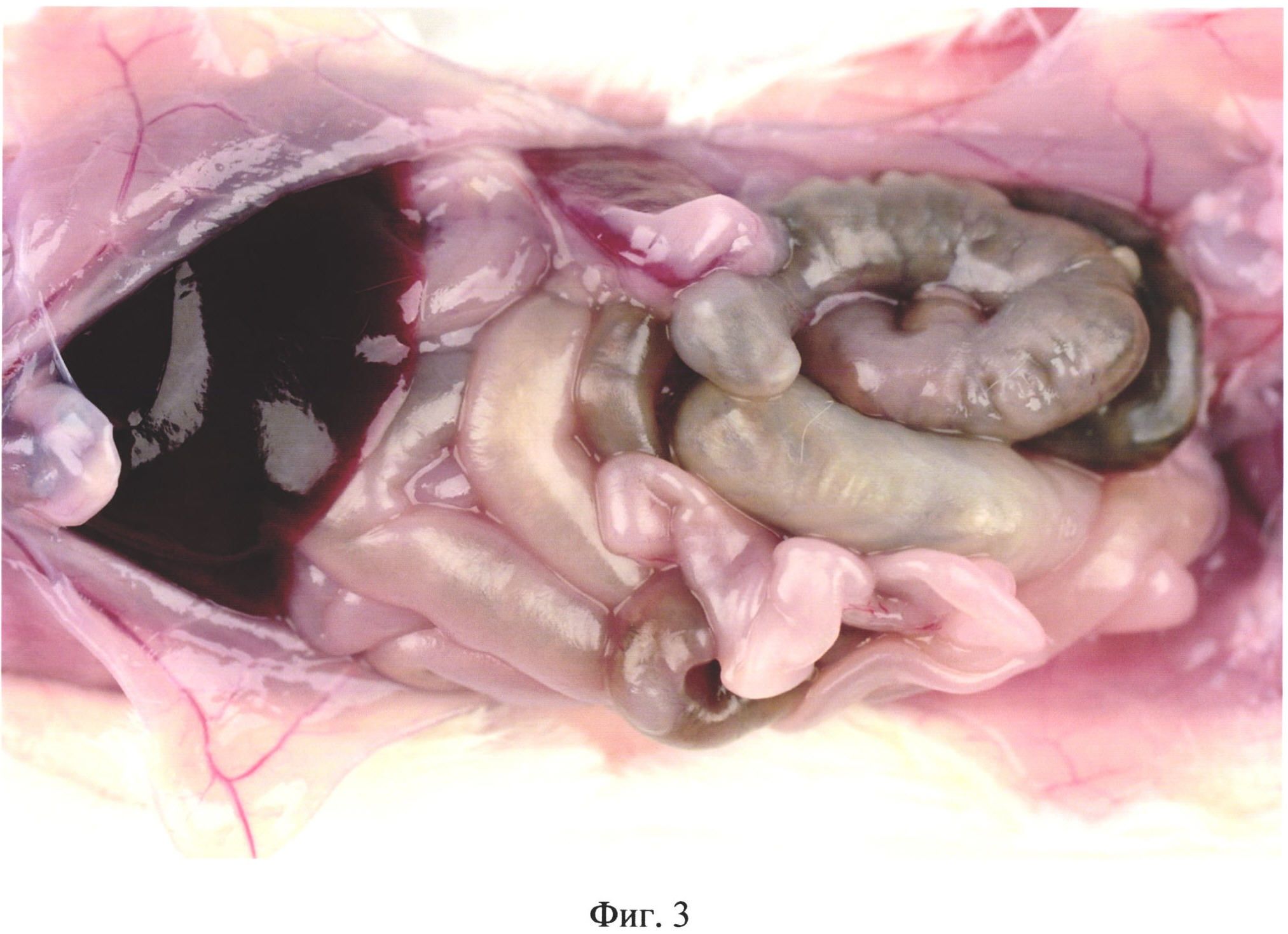
На фиг. 3 изображена гиперемия и отек кишечника у животного из группы №3 (в/б 0,4 мл 10%-й каловой взвеси из свежих крысиных фекалий) на 3 день после инъекции.
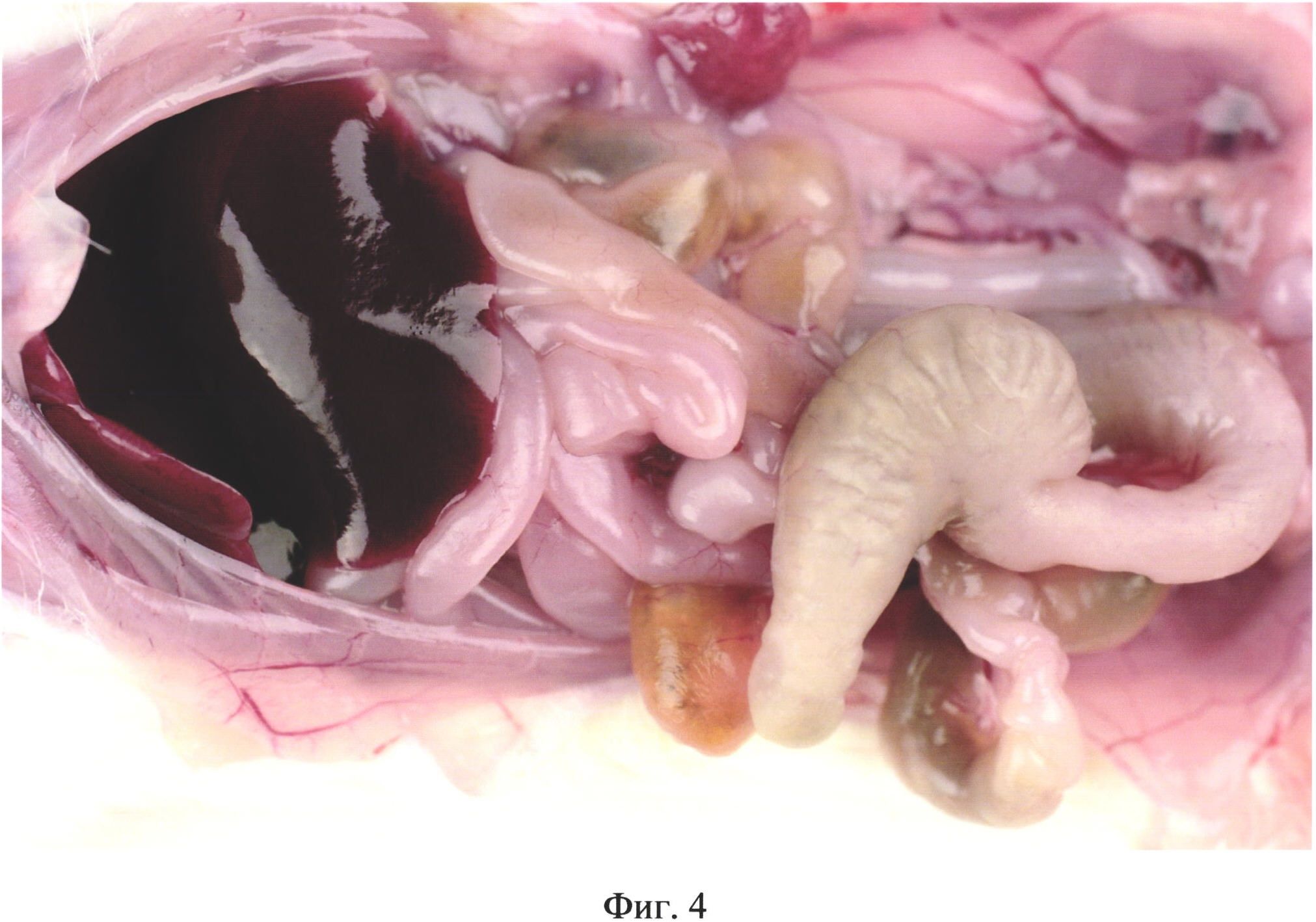
На фиг. 4 изображена гиперемия и отек кишечника у животного из группы №4 (в/б 0,5 мл 10% каловой взвеси из свежих крысиных фекалий) на 3 день после инъекции.
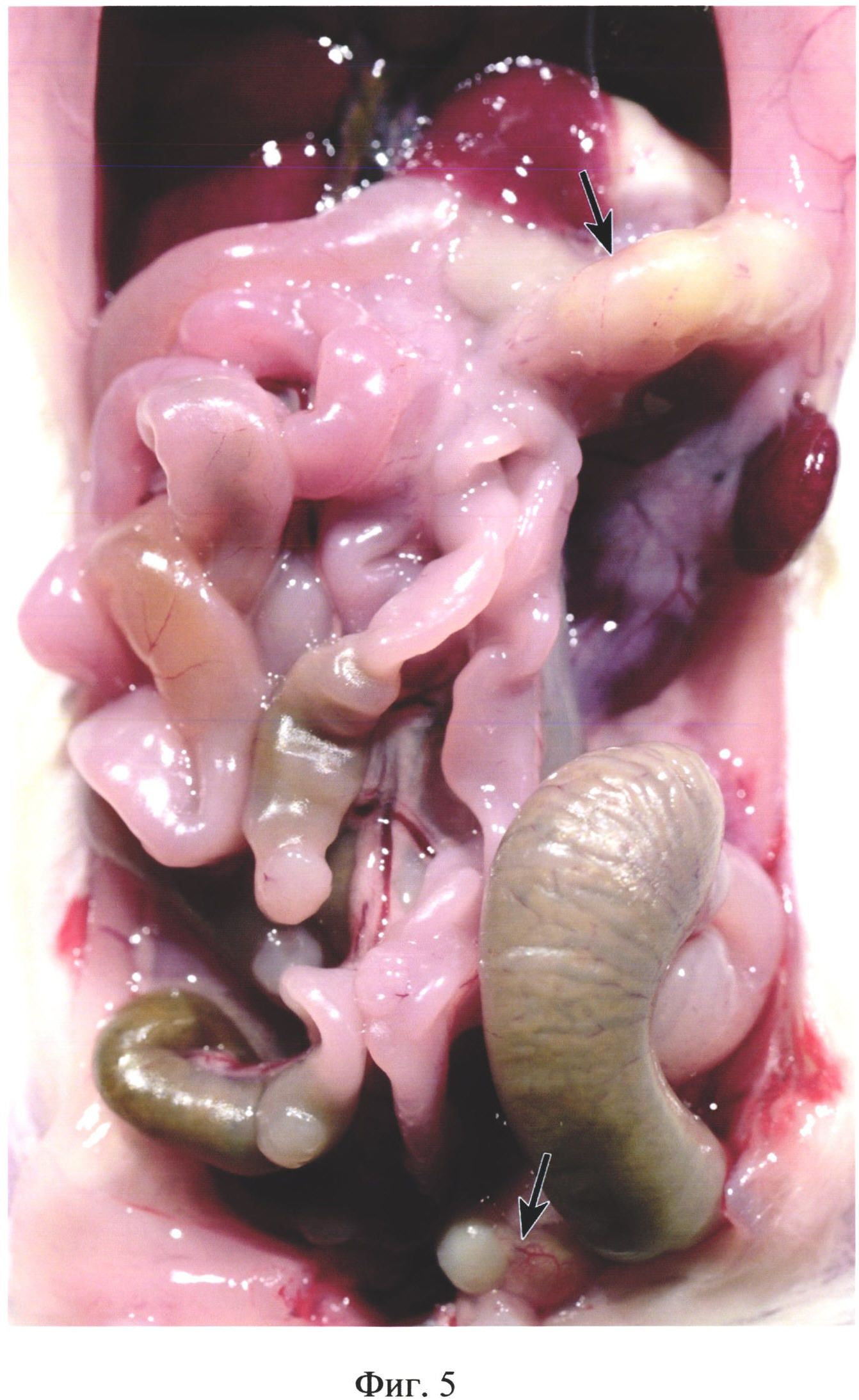
На фиг. 5 изображены абсцессы в брюшной полости у животного из группы №2 (в/б 0,3 мл 10% каловой взвеси из свежих крысиных фекалий) на 15 день после инъекции. Верхняя стрелка указывает на абсцесс, расположенный в левой краниальной области брюшной полости. Нижняя стрелка указывает на абсцесс в левой каудальной области брюшной полости.
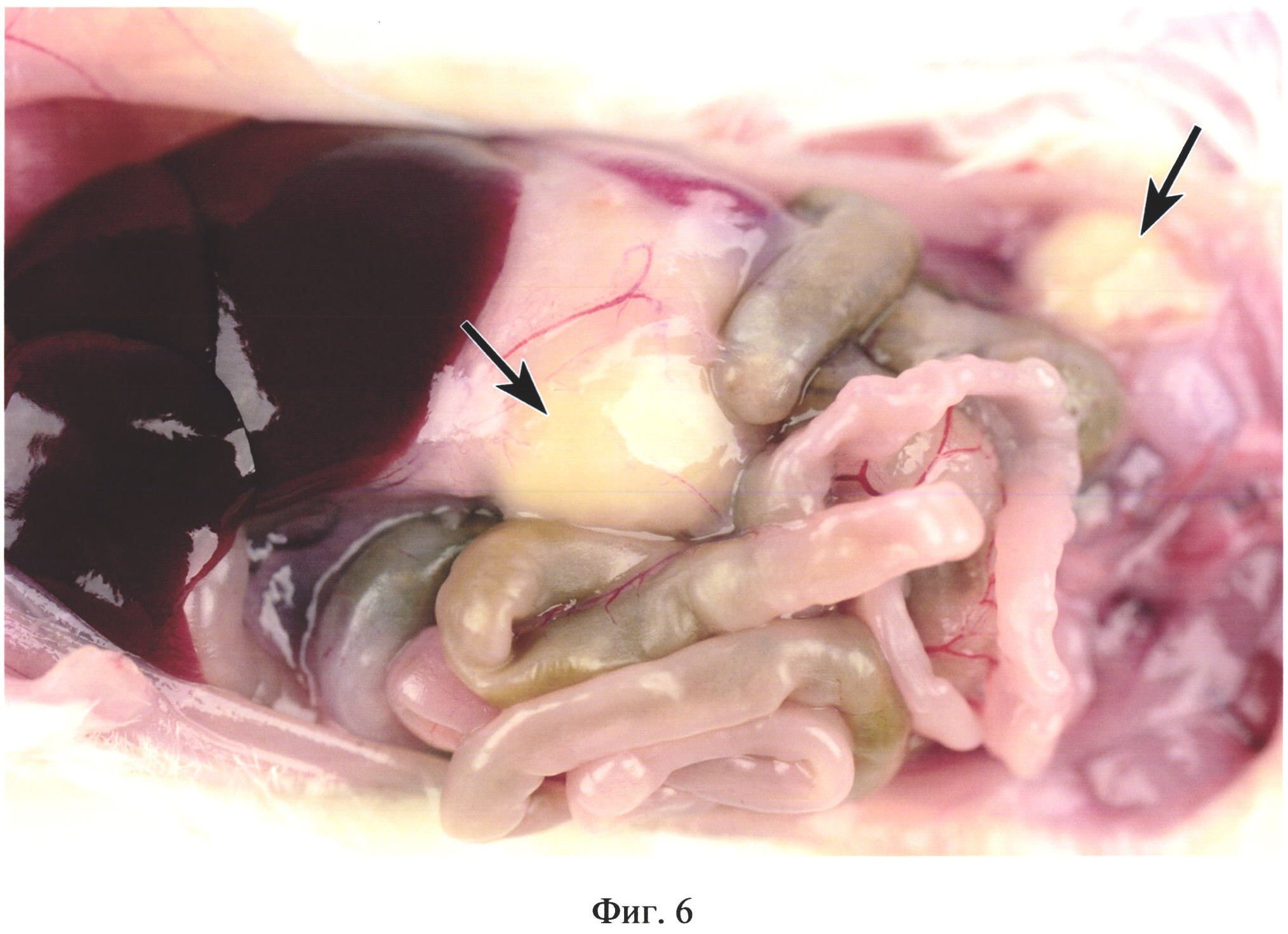
На фиг. 6 изображены абсцессы в брюшной полости у животного из группы №3 (в/б 0,4 мл 10% каловой взвеси из свежих крысиных фекалий) на 15 день после инъекции. Левая стрелка указывает на крупный абсцесс, расположенный на границе между правой и левой краниальными областями брюшной полости. Правая стрелка указывает на абсцесс в левой каудальной области.
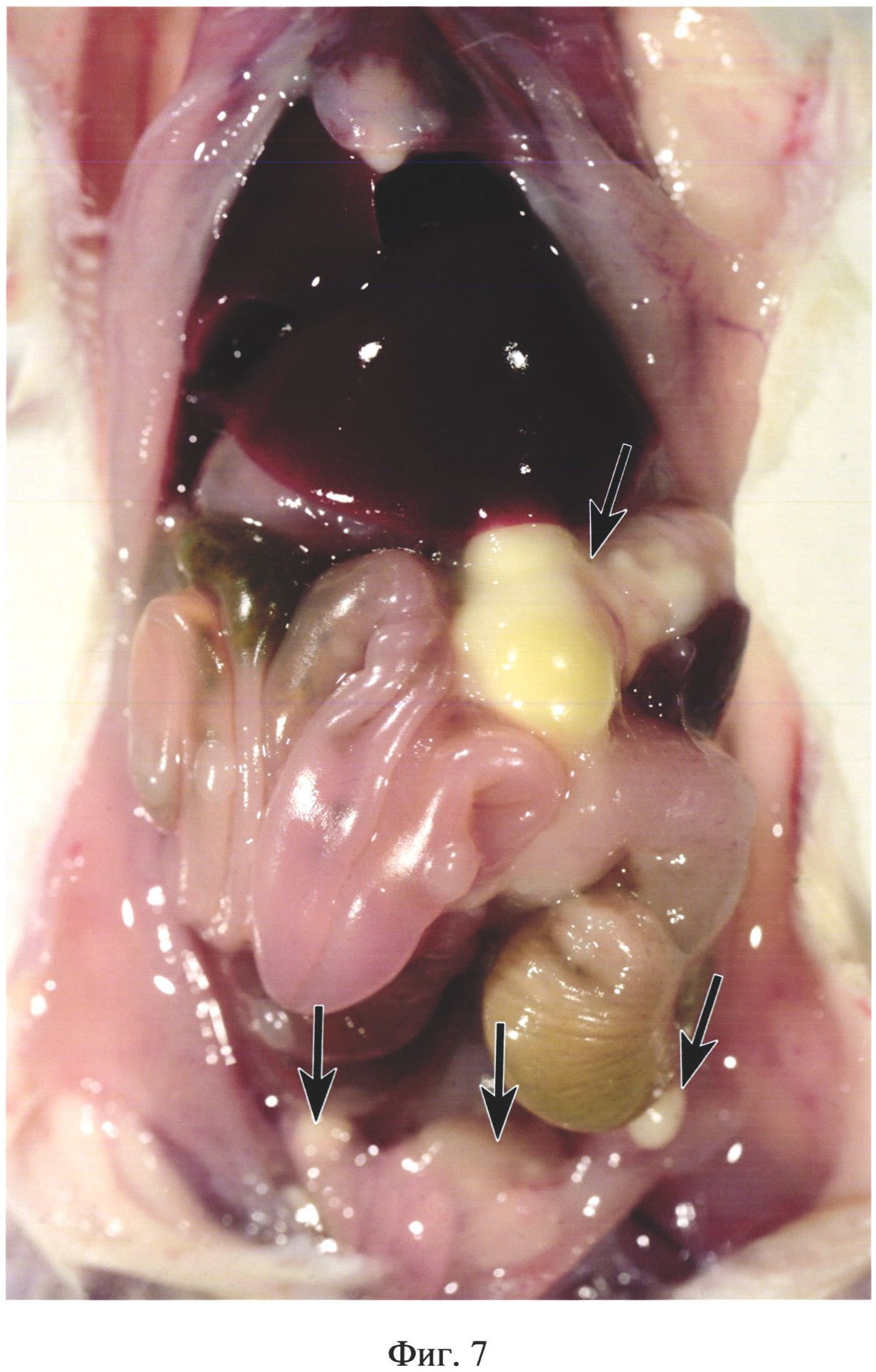
На фиг. 7 изображены абсцессы в брюшной полости у животного из группы №4 (в/б 0,5 мл 10% каловой взвеси из свежих крысиных фекалий) на 11 день после инъекции. Верхняя стрелка указывает на крупный абсцесс, расположенный в левой краниальной области брюшной полости. Нижние стрелки указывают на абсцессы в правой и левой каудальных областях брюшной полости.
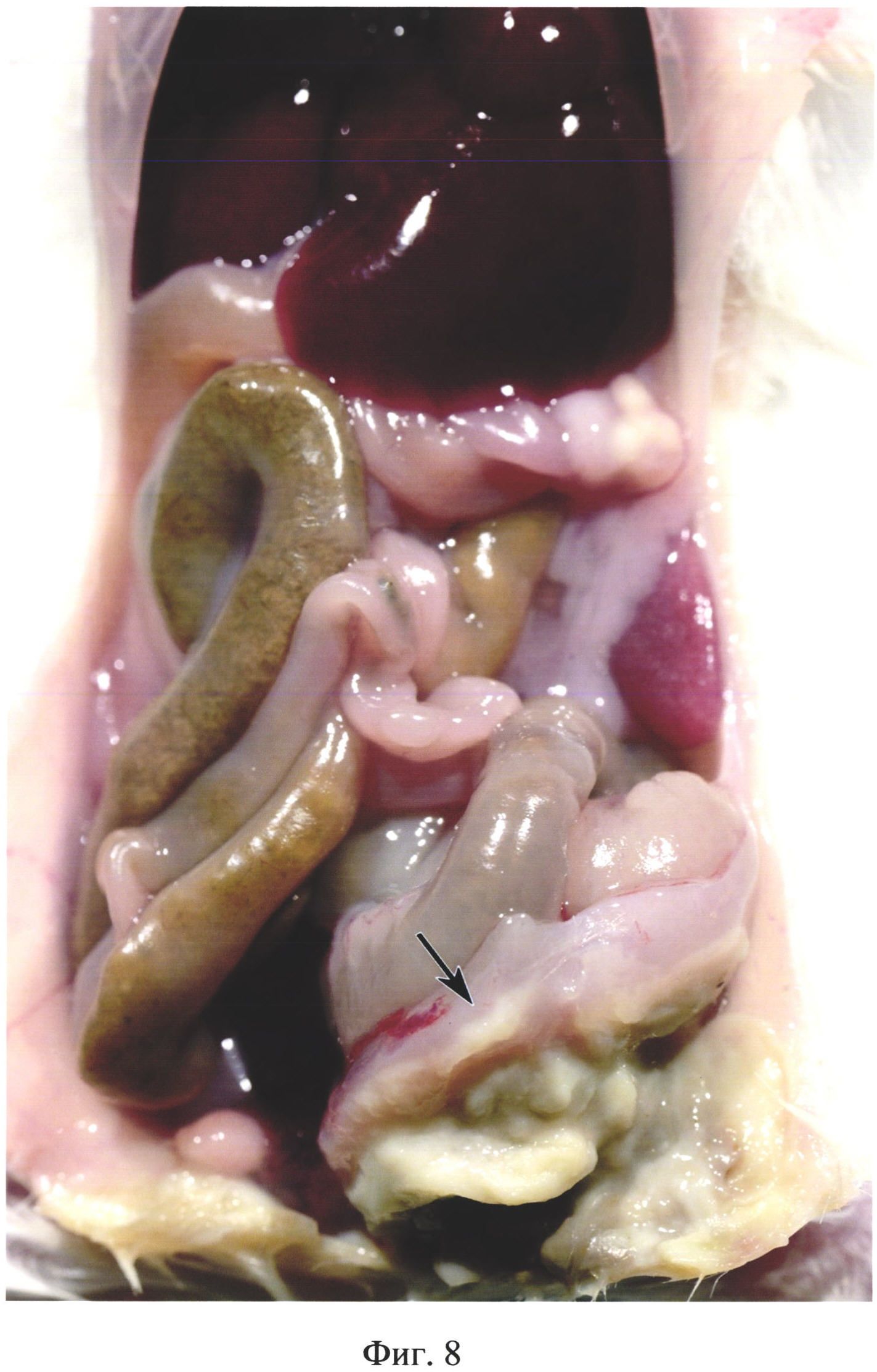
На фиг. 8 изображена флегмона брюшной стенки у животного из группы №4 (в/б 0,5 мл 10% каловой взвеси из свежих крысиных фекалий) на 13 день после инъекции.
Способ осуществляют следующим образом.
Подбирают животных весом 20-22 г возрастом 45-55 дней без признаков заболеваний. Мышей содержат в условиях специализированного вивария в клетках со сплошным полом, которые получают полноценный по своему составу гранулированный корм и воду в свободном доступе.
Из свежих крысиных фекалий готовят 10% взвесь в изотоническом растворе хлорида натрия и однократно фильтруют через двойной слой марли.
Внутрибрюшинную инъекцию мышам проводят однократно иглой 26 G×1/2 (для внутрикожных инъекций) через одну точку вкола по средней линии в пупочной области живота на глубину 2 мм. Предварительно место инъекции обрабатывают 70%-м этиловым спиртом.
После внутрибрюшинной инъекции мышам 10% каловой взвеси из свежих крысиных фекалий в дозах 0,3-0,4 мл период наблюдения за животными составит более 13 дней, после инъекции в дозе 0,5 мл - не более 13 дней.
Параметры способа были определены следующим образом.
В предлагаемом способе в качестве инфицирующей смеси выбрали каловую взвесь из свежих крысиных фекалий. Лабораторные крысы одни из самых распространенных лабораторных животных. По сравнению с крысиными фекалии мышей значительно меньше и быстро высыхают, что неприемлемо, т.к. в них резко снижается количество бактерий. Поэтому предпочтение отдали более крупным фекалиям крыс.
Определение оптимальной массы и возраста мышей для инфицирования брюшной полости крысиной каловой взвесью.
Определение оптимальной массы и возраста мышей проводили на трех группах лабораторных нелинейных мышей, которым внутрибрюшинно вводили 10% каловую взвесь из свежих крысиных фекалий в количестве 0,6 мл. Критерием оценки служил падеж животных. В первую группу входили мыши весом 15-18 г возрастом 30-40 дней, во вторую группу входили животные весом 20-22 г возрастом 45-55 дней, в третью группу входили мыши весом 30-35 г возрастом 75-85 дней. Падеж животных представлен в таблице 1.
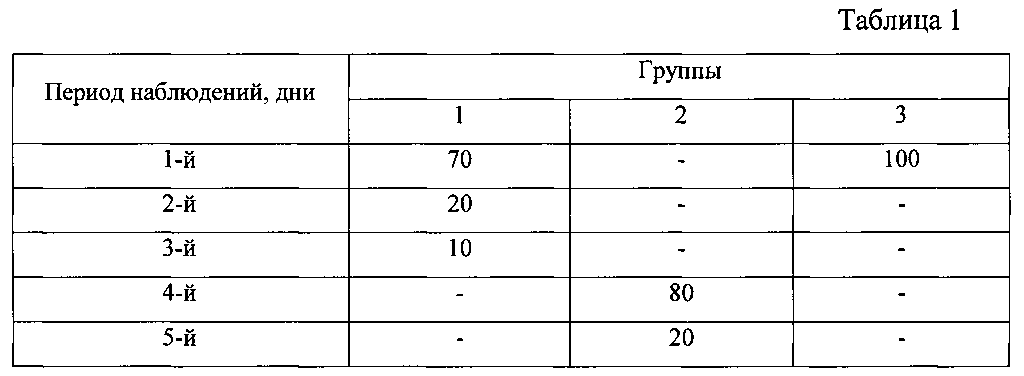
Из таблицы 1 видно, что летальность мышей в группах №1 и 3 в первый день после инъекции составила 70 и 100% соответственно. В группе №2 падеж животных начался на 4 день после инъекции. Следовательно, более устойчивыми к инфицированию брюшной полости 10% каловой взвесью из свежих крысиных фекалий являются мыши весом 20-22 г возрастом 45-55 дней. Поэтому использование лабораторных нелинейных мышей весом 20-22 г возрастом 45-55 дней при моделировании перитонита позволит проводить более длительные исследования.
Обоснование способа введения
Параметры внутрибрюшинного способа введения каловой взвеси были отработаны на двух группах лабораторных нелинейных мышей. Для того чтобы оценить характер распределения жидкости в брюшной полости после инъекционного введения через одну точку вкола по средней линии в пупочной области живота на глубину 2 мм, животным вместо каловой взвеси вводили 0,1 мл красителя (черную тушь). В первой группе диагностирование проводили сразу же после введения. На вскрытии определили, что у всех мышей черная тушь распределилась равномерно и обнаруживалась во всех анатомических областях брюшной полости.
Во второй группе диагностирование проводили на 5 день после внутрибрюшинной инъекции красителя. На вскрытии отмечали диффузное пропитывание красителем брюшной стенки в месте инъекции. Также определили, что в наибольшем количестве краситель накапливался в сальнике. Небольшие свободно лежащие в брюшной полости овальные фрагменты туши размером до 2×2,5 мм встречались в подпеченочном пространстве, в правом и левом латеральных каналах, между петлями кишечника и в полости таза. При таком способе введения признаки нарушения целостности внутренних органов в брюшной полости не были выявлены ни у одного животного. Следовательно, погружение иглы на глубину не более 2 мм позволяет избежать повреждения внутренних органов, а также обеспечивает диффузное распределение инъекционного материала в брюшной полости.
Определение оптимальной концентрации и дозы каловой взвеси из свежих крысиных фекалий
Определяя влияние различных доз и концентраций каловой взвеси из свежих крысиных фекалий на возникновение перитонита у лабораторных нелинейных мышей, животных разделили на 4 группы, в каждой по 6 подгрупп. В контрольной группе №1 мышам вводили в брюшную полость по описанной выше методике стерильный физиологический раствор в количествах от 0,1 до 0,6 мл. Животным групп №2, 3 и 4 в брюшную полость вводили тем же способом 5%, 10% и 20% профильтрованную взвесь из свежих крысиных фекалий в количествах от 0,1 до 0,6 мл соответственно.
Период наблюдения составил 15 дней. Критерием оценки служили падеж животных (таблица 2) и патологоанатомические изменения на вскрытии (таблица 3).
Наличие видимых на вскрытии изменений в брюшной полости значительно облегчает диагностику и определение тяжести заболевания. Поэтому оптимальными концентрациями и дозами каловой взвеси, вызывающими перитонит, считали те, при введении которых в брюшной полости мышей обнаруживали макроскопические патологоанатомические изменения, характерные для перитонита и при введении которых период наблюдения за животными в эксперименте был бы более продолжительным.
Для того чтобы описать локализацию абдоминальных изменений, брюшную полость мышей делили на топографические области по Н.В. Садовскому (1953 г). При этом выделяли четыре анатомические области: правая и левая краниальные (передние) области живота, правая и левая каудальные (задние) области живота.
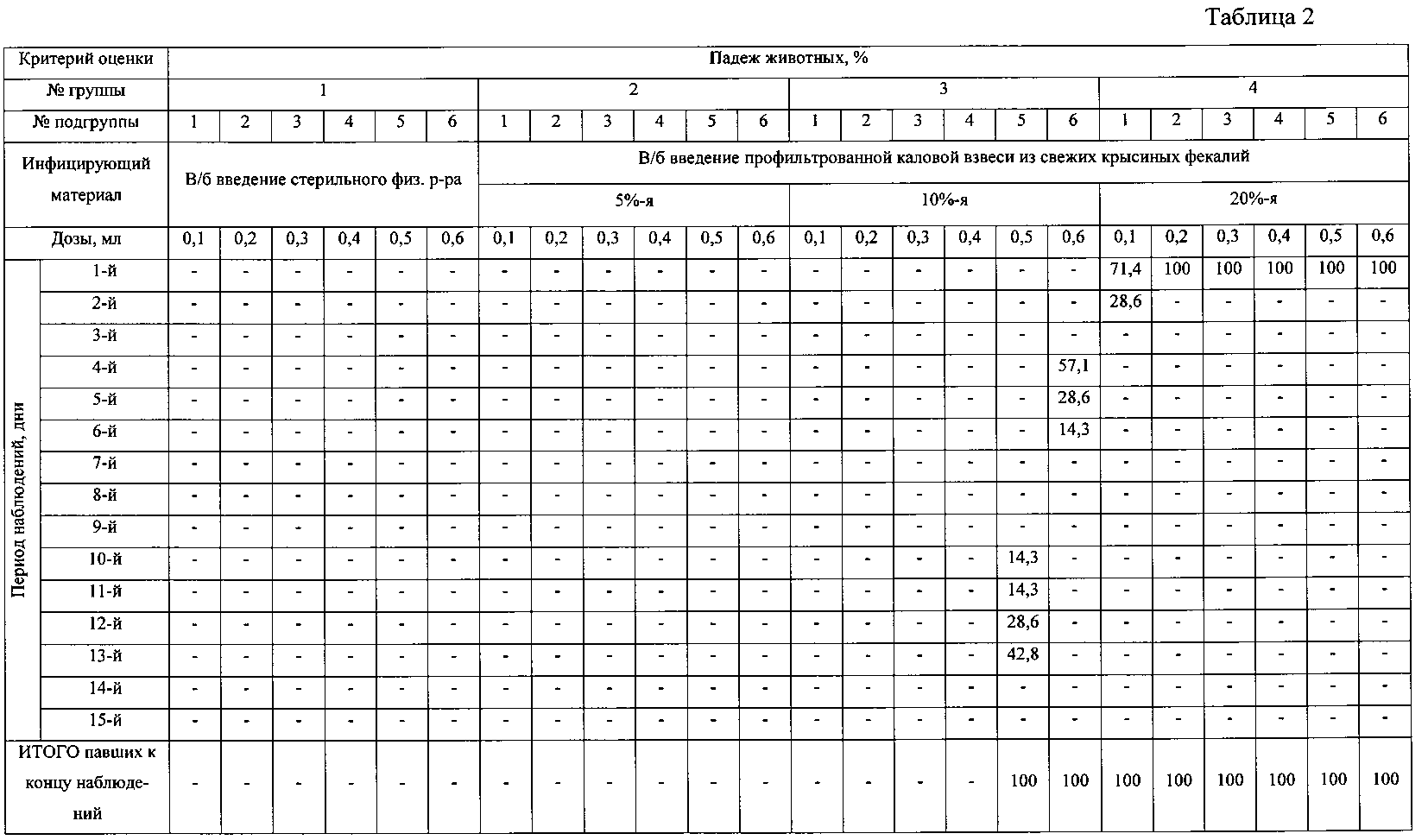


Из данных, приведенных в таблицах 2 и 3, видно, что для моделирования перитонита с характерными патологоанатомическими изменениями и с длительным периодом наблюдения за животными оптимальным является инфицирование брюшной полости 10% каловой взвесью в количестве 0,3-0,5 мл (подгруппы 3-5 группы №3). В результате чего у 100% животных развивается перитонит, склонный к отграничению воспалительного процесса. Продолжительность жизни животных после введения 0,3 и 0,4 мл каловой взвеси составляет более 13 дней. Продолжительность жизни животных после введения 0,5 мл каловой взвеси составляет не более 13 дней.
У животных контрольной группы №1, подгрупп 1-2 группы №2 (0,1-0,2 мл 5% каловой взвеси) и подгруппы 1 группы №3 (0,1 мл 10% каловой взвеси) на вскрытии каких-либо изменений в брюшной полости не выявляется.
У животных подгрупп 3-6 группы №2 (0,3-0,6 мл 5% каловой взвеси), подгруппы 2 группы №3 (0,2 мл 10%-й каловой взвеси) внутрибрюшинное введение каловой взвеси у большего количества животных приводит к образованию небольших абсцессов (до 7 мм в диаметре) только в одной анатомической области брюшной полости.
Следовательно, 5%-я концентрация каловой взвеси в количестве 0,1-0,6 мл (подгруппы 1-6 группы №2) и 10% концентрация каловой взвеси в дозах 0,1 и 0,2 мл (подгруппы 1 и 2 группы №3) являются недостаточными, поскольку либо не способствуют формированию четко выраженных патолого-анатомических изменений, либо способствуют формированию отграниченных абсцессов преимущественно в одной анатомической области.
Избыточными являются 10% концентрация каловой взвеси в количестве 0,6 мл (подгруппа 6 группы №3) и 20% концентрация в дозах 0,1-0,6 мл (подгруппы 3-6 группы №4), поскольку не позволяют длительно наблюдать за животными в эксперименте.
Апробацию способа моделирования отграниченного перитонита провели на 4 группах лабораторных нелинейных мышей (по 9 животных в каждой группе). В контрольной группе №1 мышам в брюшную полость вводили через одну точку вкола по средней линии в пупочной области живота на глубину 2 мм 0,3 мл стерильного физиологического раствора, предварительно место инъекции обрабатывали 70% этиловым спиртом. Животным опытных групп №2, 3 и 4 тем же способом вводили 10% каловую взвесь из свежих крысиных фекалий в количестве 0,3, 0,4 и 0,5 мл соответственно.
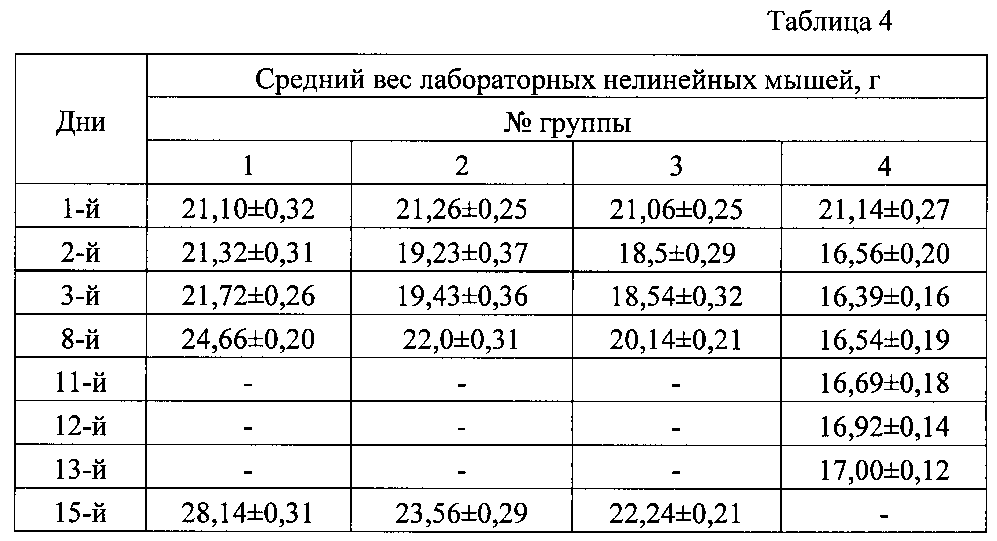
Период наблюдения составил 15 дней. На 3 день после инъекции каловой взвеси проводили диагностическое вскрытие 2 животных из каждой группы. Определяли вес мышей на 1, 2, 3, 8 и 15 дни после инъекции каловой взвеси, павших животных взвешивали в день падежа. В течение 15 дней оценивали общее состояние животных при внешнем осмотре. По окончанию срока наблюдения мышей убивали передозировкой наркоза и оценивали патологоанатомические изменения на вскрытии. Патолого-анатомическое исследование павших животных проводили в день падежа.
В первый день после инъекции у животных опытных групп №2, 3 и 4 определяли ригидность брюшной стенки. Мыши преимущественно лежали на животе, при этом периодически вытягивали задние лапы назад. Животные группировались в углу клетки, отказывались от корма и воды. Мыши контрольной группы после инъекции выглядели здоровыми.
На второй день активность животных опытных групп восстановилась, мыши принимали корм и воду. Ригидность брюшной стенки не определялась.
Во второй половине эксперимента у животных 2 и 3 групп отмечали периодическое угнетение, мыши неохотно потребляли корм, шесть стала тусклой и взъерошенной, отмечали увеличение размеров живота. В течение 15 дней в группах №2 и 3 падежа животных не было.
При внешнем осмотре мышей группы №4 отмечали более выраженное угнетение. Животные неохотно потребляли корм, были менее подвижными по сравнению с животными групп №1-3. Шерсть стала тусклой и взъерошенной. У животных отмечали выраженное истощение, запавшие в подвздошной области бока при этом размеры живота были увеличены. Гибель мышей наступила на 11-13 сутки после внутрибрюшинной инъекции каловой взвеси.
Животные контрольной группы остались здоровыми.
Группы животных и результаты определения показателей их массы тела (M±m) отражены в таблице 4. Из данных, приведенных в таблице 4, видно, что на второй день наблюдений с увеличением дозы каловой взвеси происходит значительное снижение массы тела мышей в опытных группах (максимального значения этот показатель достигает в 4-й группе) относительно контроля (группа №1). С увеличением срока наблюдений увеличивается масса животных в контрольной группе, что связанно с ростом молодых мышей. Данный показатель ниже во 2 и 3 группах относительно контроля, а в 4 группе не возрастает.
На вскрытии у животных контрольной группы патолого-анатомических изменений, характерных для перитонита не было выявлено (фиг. 1).
На третий день у животных опытных групп в брюшной полости отмечали ярко выраженное полнокровие сосудов сальника, брюшины, брыжейки и семенников (фиг. 2), гиперемию и отек кишечника (фиг. 3, фиг. 4). Выпот в брюшной полости отсутствовал.
У животных опытных групп на 11-15 дни в брюшной полости отмечали резкое полнокровие сосудов брюшины, сальника и брыжейки, гиперемию и отек кишечной стенки, газообразование в кишечнике и его парез.
В группе №2 у 100% животных обнаруживали абсцессы, расположенные преимущественно в левой краниальной и в левой каудальной областях брюшной полости (фиг. 5) диаметром до 11 мм. В месте расположения абсцессов обнаруживали висцеро-висцеральные и висцеро-париетальные спаечные сращения.
В группе №3 у 100% животных в брюшной полости отмечали наличие абсцессов в краниальных и каудальных областях брюшной полости (фиг. 6) диаметром до 12 мм. У 51,7% животных обнаруживали межкишечные абсцессы диаметром 4-8 мм в количестве до 3 шт. В месте расположения абсцессов обнаруживали висцеро-висцеральные и висцеропариетальные спаечные сращения. У 42,8% животных обнаруживали абсцессы на поверхности печени диаметром 2-3 мм в количестве до 3 шт. Отмечали отсутствие выпота.
В группе №4 у 100% животных обнаруживали абсцессы диаметром до 13 мм, расположенные в краниальных и каудальных областях брюшной полости (фиг. 7). У 71,4% мышей обнаруживали межкишечные абсцессы, диаметром 3-7 мм в количестве до 5 шт. В брюшной полости обнаруживали висцеро-висцеральные и висцеропариетальные спаечные сращения и мутный серозно-фибринозный экссудат в количестве 0,1-0,15 мл. У 51,7% животных обнаруживали абсцессы на поверхности печени диаметром 2-3 мм в количестве до 4 шт. У двух животных диагностировали флегмону брюшной стенки (фиг. 8).
Таким образом, технический результат предлагаемого нами способа заключается в развитии у нелинейных мышей отграниченного перитонита продолжительностью не менее 10 дней с формированием абсцессов в брюшной полости. Технический результат достигается за счет инфицирования нелинейных мышей массой 20-22 г через одну точку вкола по средней линии в пупочной области живота на глубину не более 2 мм 10% каловой взвесью из свежих крысиных фекалий в дозах 0,3-0,5 мл.
Способ моделирования отграниченного перитонита у нелинейных лабораторных мышей, включающий однократное внутрибрюшинное введение каловой взвеси, отличающийся тем, что мышей массой 20-22 г инфицируют 10% каловой взвесью из свежих крысиных фекалий, приготовленной на изотоническом растворе хлорида натрия и однократно профильтрованной через двойной слой марли, через одну точку вкола по средней линии в пупочной области живота на глубину 2 мм, в дозах 0,3-0,4 мл - для использования модели более 13 дней и 0,5 мл - для использования модели не более 13 дней.