Результат интеллектуальной деятельности: КРИСТАЛЛИЧЕСКАЯ ε-МОДИФИКАЦИЯ N-[2-(ДИЭТИЛАМИНО)ЭТИЛ]-5-[(Z)-(5-ФТОР-1,2-ДИГИДРО-2-ОКСО-3Н-ИНДОЛ-3-ИЛИДЕН)МЕТИЛ]-2,4-ДИМЕТИЛ-1Н-ПИРРОЛ-3-КАРБОКСАМИД МАЛАТА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЕ ОСНОВЕ
Вид РИД
Изобретение
Изобретение относится к органической химии и касается новой кристаллической модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамид (сунитиниб - международное непатентованное название) малата, названной нами ε-модификацией, способа ее получения и фармацевтической композиции на ее основе, которая может быть использована в фармацевтической промышленности и медицине в качестве противоопухолевого средства, ингибитора тирозинкиназ для лечения онкологических заболеваний.
Известны пиррол замещенные 2-индолинон соединения и их фармацевтические приемлемые соли в качестве ингибиторов протеинтирозинкиназ, способы их получения и содержащие их композиции для лечения иммунологических расстройств и опухолевых заболеваний (EA 005996 B2 от 25.08.2005 г.; RU 2007/142007 А от 20.05.2009 г.; RU 2299209 C2 от 20.05.2007 г.; US 6573293 B2 от 3.06.2003 г.; WO 2001/060814 A2 от 23.02.2001 г.; EP 1255752 B1 от 8.08.2007 г.; WO 2010/001167 A2 от 7.01.2010 г.; US 7119209 B2 от 10.10.2006 г.).
Однако в данных патентах не описаны конкретные соли или гидраты солей или их сольваты. Кроме того, синтезируемые вещества не охарактеризованы на предмет их принадлежности к той или иной полиморфной модификации и не определены параметры получаемых порошков. Эти свойства, в конечном итоге, определяют биологическую активность получаемых субстанций.
Известны кристаллические модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамид основания, а также соли сунитиниба основания с различными кислотами, в том числе: малеиновой, цикломиновой, бромистоводородной, хлористоводородной, миндальной, уксусной, щавелевой, муравьиной, аскорбиновой, фосфорной, лимонной, п-толуолсульфонной, винной, молочной, яблочной, содержащей на молекулу сунитиниба основания 0,5 молекулы яблочной кислоты, и другими (WO 2009/074862 A1 от 18.06.2009 г.; WO 2010/023471 A2 от 4.03.2010 г.; WO 2009/128083 A1 от 22.10.2009 г.; WO 2010/011834 A2 от 28.01.2010 г.; WO 2010/023474 A1 от 4.03.2010 г.; WO 2001/060814 A2 от 23.08.2001 г.; WO 2003/016305 A1 от 27.02.2003 г.; WO 2010/049449 A2 от 6.05.2010 г.; WO 2009/067686 A2 от 28.05.2009 г.; WO 2010/011834 A2 от 28.01.2010 г.).
Однако все эти формы отличаются от заявляемой кристаллической ε - модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамид малата наличием в химических формулах анионов других кислот или соотношением молекул сунитиниба основания и аниона яблочной кислоты как 1:0,5.
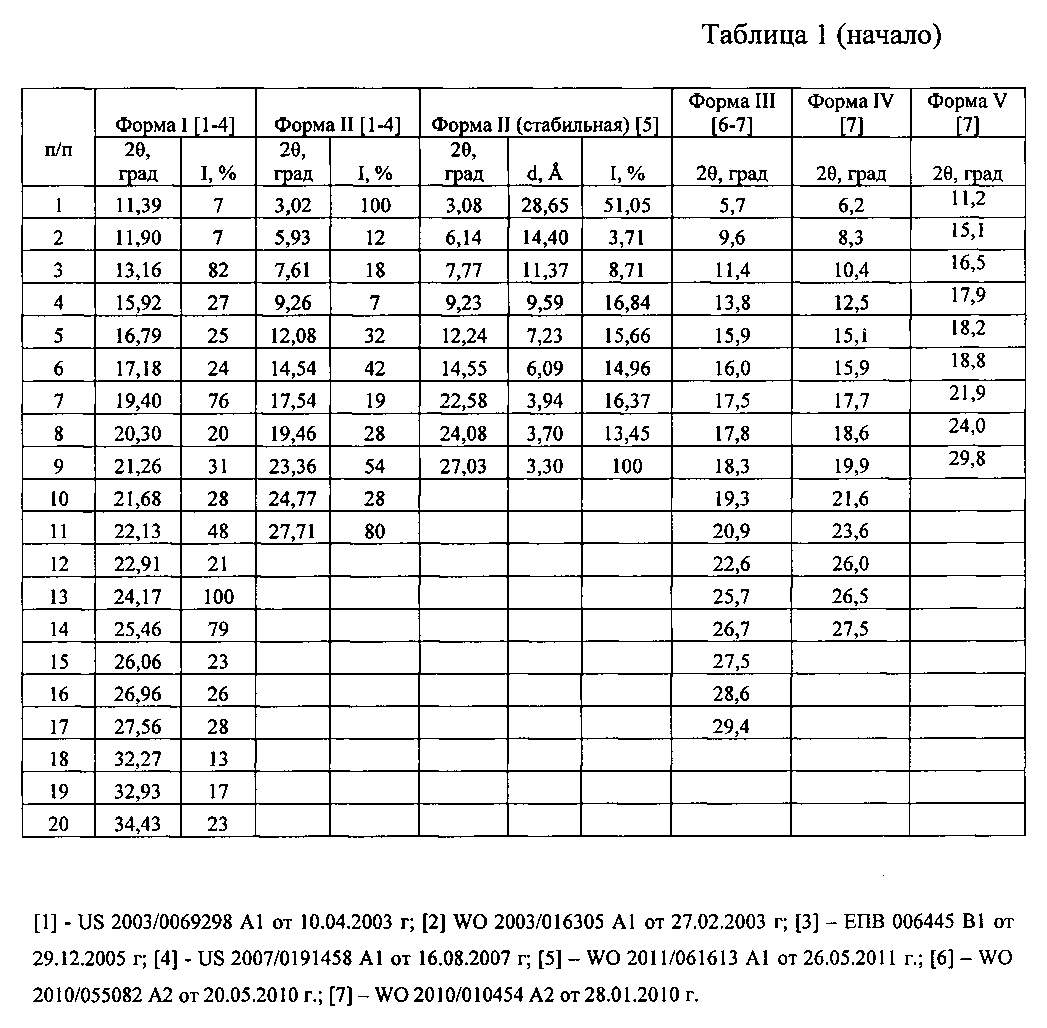
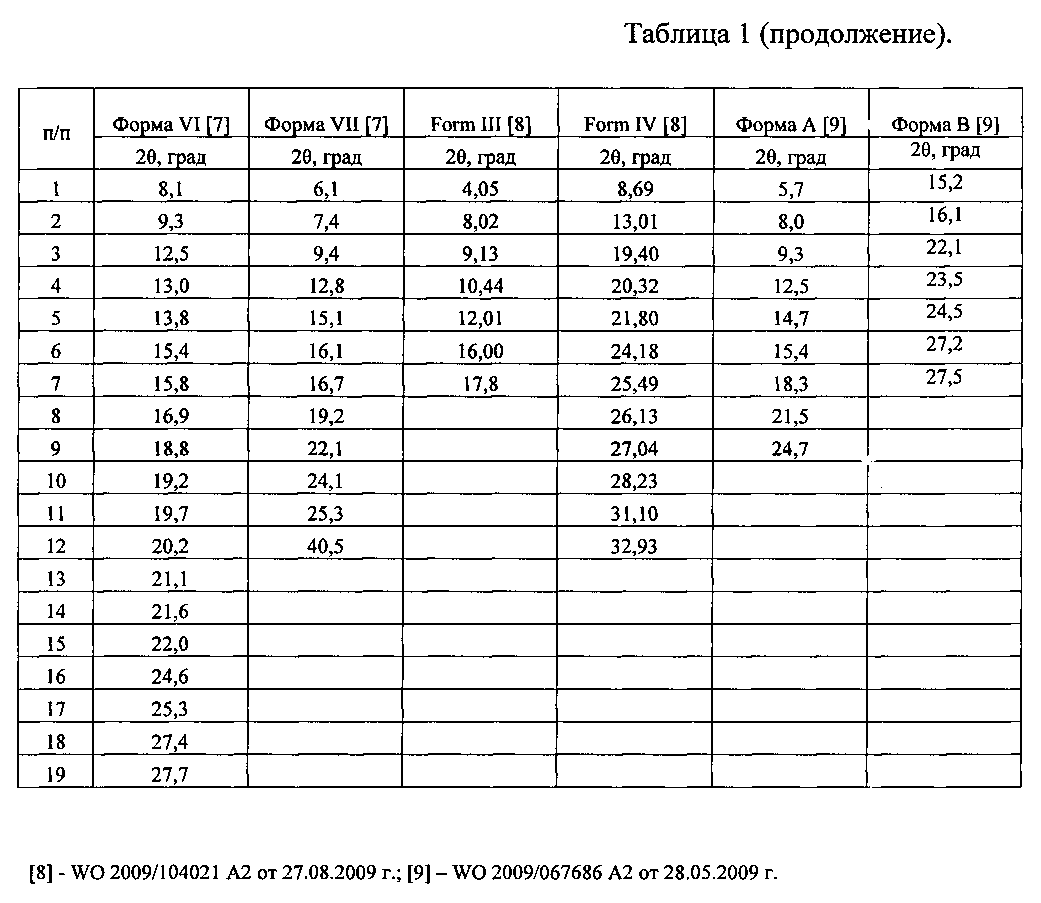
Наиболее близкими к заявляемой новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамид малата являются кристаллические и аморфная формы сунитиниба малата (форма I; форма II; форма II стабильная; форма III; форма IV; форма V; форма VI; форма VII; форма A, форма B, форма III, форма IV и аморфная форма) (US 2003/0069298 A1 от 10.04.2003 г.; WO 2003/016305 A1 от 27.02.2003 г.; EA 006445 B1 от 29.12.2005 г.; WO 2009/067686 A2 от 28.05.2009 г.; US 2007/0191458 A1 от 16.08.2007 г.; WO 2010/010454 A2 от 28.01.2010 г.; WO 2010/055082 A2 от 20.05.2010 г.; WO 2009/156837 A2 от 30.12.2009 г.; WO 2009/104021 A2 от 27.08.2009 г.; WO 2011/061613 A1 от 26.05.2011 г.).
Известные кристаллические и аморфная модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамид малата представляют собой порошки от оранжевого до желтого цвета, без запаха, малорастворимые в воде и в этаноле, растворимые в диметилсульфоксиде.
Известные кристаллические модификации сунитиниба малата характеризуются физико-химическими методами анализа такими, как: ядерным магнитным резонансом (ЯМР), методом рентгенофазового анализа (РФА) - наборами углов 2θ, град, иногда, - межплоскостных расстояний (d, Å) и их интенсивностью (Iот, = Ii/Imax×100, %) или непосредственно рентгенограммами (получение дифрактограмм авторы вышеприведенных патентов проводили на Cu Kα-излучении); ИК-спектрометрическими методами анализа, термоаналитическими исследованиями и другими.
Рассмотренные выше модификации сунитиниба получают из исходных компонентов или одну из другой в растворах, варьируя тип растворителей, условия приготовления растворов, а также условий выделения из органических растворителей или их смесей различными методами, такими как кристаллизацией из растворов (как правило, методом замены растворителей или охлаждением) с последующим фильтрованием, промыванием и, далее, сушкой на воздухе, вакуумной сушкой или сушкой в роторном испарителе, а также распылительной сушкой и сублимационной сушкой.
Наиболее близким по технической сущности является способ получения кристаллических модификаций N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамид малата, заключающийся в приготовлении раствора сунитиниба малата при нагревании до 100°C, замораживании его (скорость замораживания авторы не представили), сублимационной сушке при остаточном давлении 1 mBar, температуре 25°C и дальнейшем отжиге при 38°C в течение 1 часа (WO 2009/067686 A2 от 28.05.2009 г.).
Сходство заявляемой кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамид малата с известными кристаллическими модификациями сунитиниба малата заключается в идентичности их химических составов.
Отличие заявляемой кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамид малата, от известных кристаллических модификаций сунитиниба малата заключается в различии их дифрактограмм рентгенофазового анализа (РФА): совокупности определенного набора углов 2θ (град) - межплоскостных расстояний (d, Å) и их интенсивностью (Iотн., = Ii/Imax×100, %).
Отличие способа получения заявляемой кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамид малата от способа получения известных кристаллических форм сунитиниба малата состоит в том, что приготовленный при 25-100°C водный раствор сунитиниба малата замораживают при скорости охлаждения не ниже 60 град/мин и после сублимационной сушки полученный порошок отжигают при температурах от 70 до 150°C в течение 20-40 часов.
Отличие заявляемой фармацевтической композиции в качестве противоопухолевого средства, ингибитора тирозинкиназ для лечения онкологических заболеваний на основе N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата от известной композиции (ЕПВ 005996 B1 от 25.08.2005 г.; Регистр Лекарственных Средств России - Инструкция применения препарата Сутент/Sutent® - разработан фирмой «Pfizer», зарегистрирован в РФ в 2007 г.) состоит в том, что в качестве действующего вещества используют терапевтически эффективное количество новой, не известной ранее, кристаллической ε-модификации сунитиниба малата.
Целью изобретения является получение новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата, разработка способа ее получения и применение ее в фармацевтической композиции в качестве противоопухолевого средства, ингибитора тирозинкиназ для лечения онкологических заболеваний.
Поставленная цель достигнута настоящим изобретением, а именно получением новой, не известной ранее, кристаллической ε-модификации Ν-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата, характеризующейся следующей совокупностью межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iот, = Ii/Imax×100, %): 15,055 - 40,9%; 14,655 - 45,8%; 11,343 - 68,7%; 10,608 - 41,7%; 9,616 - 58,1%; 9,412 - 45,2%; 7,886 - 32,0%; 7,386 - 40,2%; 7,206 - 76,3%; 7,069 - 47,1%; 6,387 - 50,4%; 6,123 - 86,5%; 5,299 - 46,5%; 5,158 - 45,8%; 5,064 - 42,1%; 4,876 - 45,4%; 4,702 - 50,4%; 4,600 - 49,8%; 4,375 - 46,7%; 4,337 - 47,7%; 4,263 - 43,2%; 4,122 - 43,1%; 4,051 - 47,3%; 3,910 - 59,7%; 3,782 - 71,2%; 3,677 - 57,5%; 3,592 - 57,3%; 3,522 - 51,7%; 3,434 - 48,8%; 3,335 - 73,7%; 3,268 - 100,0%; 3,224 - 92,9%; 3,170 - 63,3%; 3,043 - 35,3%; 2,964 - 30,9%; 2,825 - 32,0%; 2,545 - 26,6%; 2,459 - 24,9%; 2,245 - 19,7%; 2,041 - 19,5%; 1,924 - 19,5%; 1,646 - 18,5%.
Поставленная цель достигнута также разработкой способа получения новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата, который состоит в том, что приготовленный при 25-100°C водный раствор сунитиниба малата замораживают при скорости охлаждения не ниже 60 град/мин, подвергают сублимационной сушке и полученный порошок отжигают при температурах от 70 до 150°C в течение 20-40 часов.
Кроме того, поставленная цель достигнута применением новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата для приготовления фармацевтической композиции в качестве противоопухолевого средства, ингибитора тирозинкиназ для лечения онкологических заболеваний, содержащей терапевтически эффективное количество кристаллической ε-модификации сунитиниба малата и, по крайней мере, один фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество или наполнитель.
Из патентной и научно-технической литературы не известна кристаллическая ε-модификация N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата, способ ее получения и применение ее в качестве противоопухолевого средства, ингибитора тирозинкиназ для лечения онкологических заболеваний.
Нами обнаружена новая, не известная ранее, кристаллическая ε-модификация N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата, характеризующаяся определенным набором дифракционных максимумов (d, Å) и их интенсивностью (Iотн., %), предложены способ ее получения и применение ее для приготовления фармацевтической композиции в качестве противоопухолевого средства, ингибитора тирозинкиназ для лечения онкологических заболеваний.
Заявляемая новая, не известная ранее, кристаллическая ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата представляет собой легкий пушистый порошок от оранжевого до желтого цвета, без запаха, малорастворимый в воде и этаноле, растворимый в диметилсульфоксиде.
Для пояснения сущности заявляемого технического решения к описанию приложены следующие таблицы и рисунки:
Таблица 1. Углы 2θ, межплоскостные расстояния (d, Å) и их интенсивности Iотн., %) известных кристаллических модификаций сунитиниба малата (форма I; форма II; форма II стабильная; форма III; форма IV; форма V; форма VI; форма VII; форма A, форма B, form III, form IV).
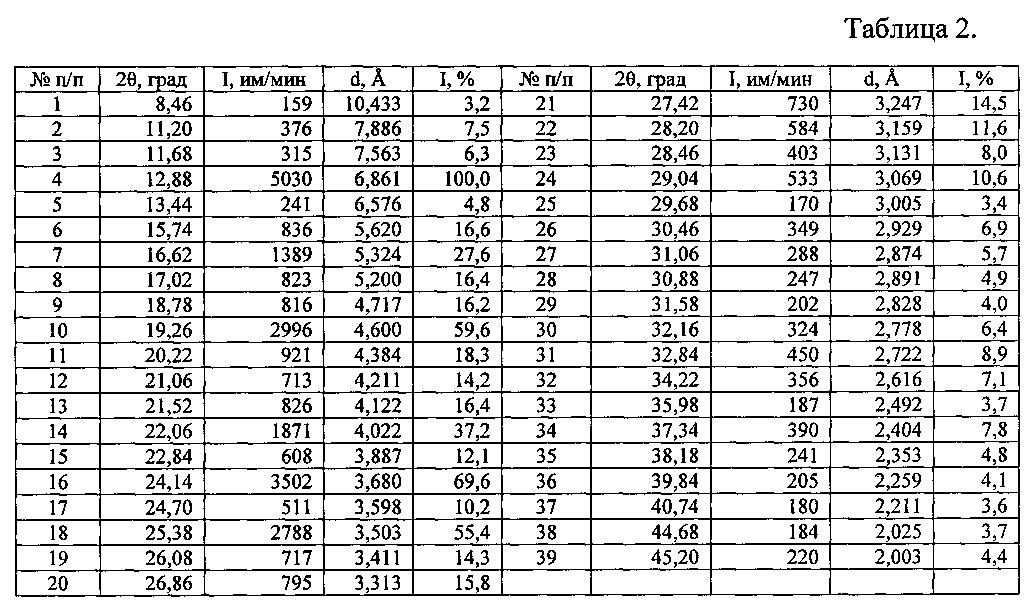
Таблица 2. Углы 2θ, межплоскостные расстояния (d, Å) и их интенсивности (I, имп./мин; Iотн., %) известной кристаллической безводной модификации сунитиниба малата (форма I) - исходной субстанции (производства «AFINE CHEMICALS LTD» Китай).
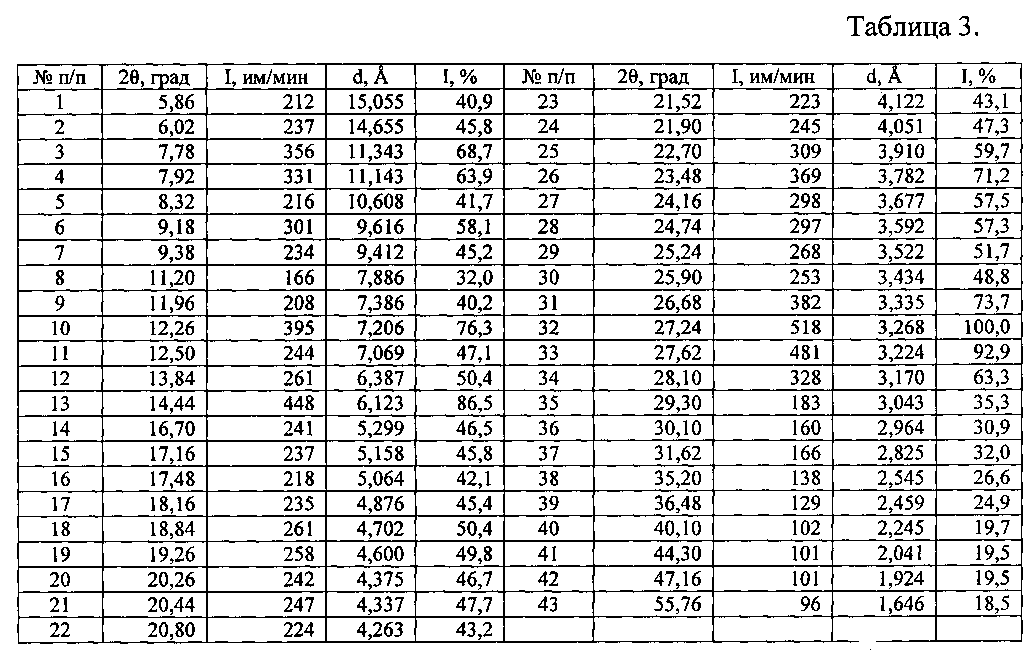
Таблица 3. Углы 2θ, межплоскостные расстояния (d, Å) и их интенсивности (I, имп./мин.; Ιотн., %) новой, не известной ранее, кристаллической ε-модификации Ν-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата.
Рис. 1 - ЯМР 1H - спектр известной кристаллической модификации сунитиниба малата (форма I) - исходной субстанции (производства «AFINE CHEMICALS LTD» Китай).
Рис. 2 - ЯМР 1H - спектр новой, не известной ранее, кристаллической ε-модификации N[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата.
Рис. 3 - Термограмма известной кристаллической модификации сунитиниба малата (форма I) - исходной субстанции (производства «AFINE CHEMICALS LTD» Китай).
Рис. 4 - Типичная термограмма новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата.
Рис. 5 - Дифрактограмма известной кристаллической модификации сунитиниба малата (форма I) - исходной субстанции (производства «AFINE CHEMICALS LTD» Китай).
Рис. 6 - Типичная дифрактограмма новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата.
Для идентификации полученного вещества был проведен комплекс физико-химических методов анализа.
Первоначально, методами ядерного магнитного резонанса (ЯМР 1H), высокоэффективной жидкостной хроматографии (ВЭЖХ) и термоаналитическими исследованиями была установлена идентичность химических формул известной кристаллической модификации сунитиниба малата (форма I) - исходной субстанции (производства «AFINE CHEMICALS LTD» Китай), аттестованной производителем, и новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата.
Определение химических сдвигов исходного сунитиниба малата и полученного из него вещества было проведено в его насыщенном растворе в дейтерированном диметилсульфоксиде (ДМСО-D6) на ЯМР-спектрометре высокого разрешения VXR-400 фирмы "VARIAN" (США). Полученные данные приведены на рис. 1 и 2, соответственно. Сравнение результатов, представленных на рис. 1 [известная кристаллическая модификация сунитиниба малата (форма I) - исходная субстанция (производства «AFINE CHEMICALS LTD» Китай)], с данными, приведенными на рис. 2 (новая, не известная ранее, кристаллическая ε-модификация N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата), показывает, что ЯМР - 1H - спектры исходного и полученного нами вещества практически идентичны, т.е. полученное вещество является N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамид малатом.
Хроматографическую подвижность известной кристаллической модификации сунитиниба малата (форма I) - исходной субстанции (производства «AFINE CHEMICALS LTD» Китай) и полученной из нее, новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата определяли методом ВЭЖХ на хроматографе Shimadzu LC-20A с детектором SPD-M20A и с колонкой длиной 150 мм, диаметром 4,6 мм, сорбентом Grace Apollo C18 "Agilent" (США) с детектированием при длине волны 247 нм. В качестве элюента использовали смесь (1:1) ацетонитрил:раствор ацетата аммония (6,00 г NH4CH3COO + 600,00 г Н2О) при 42°C и скорости 1 мл/мин. Объем испытуемой пробы составил 5 мкл с концентрацией 1,0 мг/мл. Оказалось, что хроматограммы известной кристаллической модификации сунитиниба малата (форма I) - исходной субстанции (производства «AFINE CHEMICALS LTD» Китай) и новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата содержат по одному пику основного компонента с характерными временами удерживания 6,927 мин и 7,037 мин, соответственно. Эти величины времен удерживания, в пределах ошибки определения - 0,7%, одинаковы.
Таким образом, проведенные методом ВЭЖХ эксперименты свидетельствуют о том, что при получении новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата распада вещества не происходит.
Термоаналитические исследования проводили на термоанализаторе STA 449 C Jupiter (NETZSCH) в токе аргона при повышении температуры 10 град/мин. В качестве держателей образцов использовали алюминиевые кюветы. Навески проб составляли 2,2-4,5 мг. Полученные данные приведены на рис. 3 и рис. 4. Видно, что кривые ДСК известной кристаллической модификации сунитиниба малата (форма I) - исходной субстанции (производства «AFINE CHEMICALS LTD» Китай) (рис. 3) и полученной из него новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата (рис. 4) различаются. До температуры ~200°C (для исходной субстанции сунитиниба малата) и ~180°C (для новой, не известной ранее, кристаллической ε-модификации сунитиниба малата) - начало процесса плавления на термогравиметрических кривых и кривых дифференциальной сканирующей калориметрии эффектов, связанных с удалением воды, органических растворителей, или других процессов не наблюдаются. Кроме того, температуры плавления известной кристаллической модификации сунитиниба малата (форма I) - исходной субстанции (производства «AFINE CHEMICALS LTD» Китай) (рис. 3) и полученной из нее новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата (рис. 4) равны 200,5°C и 181,1°C, соответственно.
Таким образом, проведенные эксперименты свидетельствуют о том, что при получении новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата распада вещества не происходит. Не происходит также образования кристаллогидратов или кристаллосольватов.
Экспериментальные результаты ядерного магнитного резонанса (ЯМР - 1H), высокоэффективной жидкостной хроматографии (ВЭЖХ) и термоаналитических исследований однозначно свидетельствуют о том, что полученное вещество является N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамид малатом.
Для подтверждения того, что полученное вещество является новой, не известной ранее, кристаллической ε-модификацией N-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамид малатом, был проведен рентгенофазовый анализ (РФА).
Рентгенофазовый анализ (РФА) известной кристаллической модификации сунитиниба малата (форма I) - исходной субстанции (производства «AFINE CHEMICALS LTD» Китай) и полученного из нее вещества проводили на дифрактометре Rigaku D/MAX-2500 (Rigaku, Япония) на CuKα излучении (λ=1,54056 Å). Полученные результаты для известной кристаллической модификации сунитиниба малата (форма I) - исходной субстанции (производства «AFINE CHEMICALS LTD» (Китай) приведены в табл. 2 и на рис. 5, а для полученного из него вещества - в табл. 3 и на рис. 6. В табл. 1 представлены литературные данные РФА модификаций сунитиниба малата. Сравнение полученных данных, представленных в табл. 1, 2 и табл. 3, а также на рис. 5 и на рис. 6, свидетельствует о том, что полученный порошок сунитиниба малата является новой, не известной ранее, кристаллической ε-модификацией N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамид малатом.
Таким образом, экспериментальные результаты рентгенофазового анализа однозначно свидетельствуют о том, что полученное вещество является новой, не известной ранее, кристаллической ε-модификацией N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамид малатом. Она характеризуется, отличными от других кристаллических модификаций сунитиниба малата, совокупностью межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iотн., %): 15,055 - 40,9%; 14,655 - 45,8%; 11,343 - 68,7%; 10,608 - 41,7%; 9,616 - 58,1%; 9,412 - 45,2%; 7,886 - 32,0%; 7,386 - 40,2%; 7,206 - 76,3%; 7,069 - 47,1%; 6,387 - 50,4%; 6,123 - 86,5%; 5,299 - 46,5%; 5,158 - 45,8%; 5,064 - 42,1%; 4,876 - 45,4%; 4,702 - 50,4%; 4,600 - 49,8%; 4,375 - 46,7%; 4,337 - 47,7%; 4,263 - 43,2%; 4,122 - 43,1%; 4,051 - 47,3%; 3,910 - 59,7%; 3,782 - 71,2%; 3,677 - 57,5%; 3,592 - 57,3%; 3,522 - 51,7%; 3,434 - 48,8%; 3,335 - 73,7%; 3,268 - 100,0%; 3,224 - 92,9%; 3,170 - 63,3%; 3,043 - 35,3%; 2,964 - 30,9%; 2,825 - 32,0%; 2,545 - 26,6%; 2,459 - 24,9%; 2,245 - 19,7%; 2,041 - 19,5%; 1,924 - 19,5%; 1,646 - 18,5%.
Способ получения новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата заключается в том, что приготовленный при 25-100°C водный раствор сунитиниба малата замораживают при скорости охлаждения не ниже 60 град/мин и после сублимационной сушки полученный порошок отжигают при температурах от 70 до 150°C в течение 20-40 часов.
Отличие способа получения заявляемой новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата от способа получения известных кристаллических форм сунитиниба малата состоит в том, что приготовленный при 25-100°C водный раствор сунитиниба малата замораживают при скорости охлаждения не ниже 60 град/мин и после сублимационной сушки полученный порошок отжигают при температурах от 70 до 150°C в течение 20-40 часов.
Предложенная нами совокупность, а именно: замораживание приготовленного при 25-100°C водного раствора сунитиниба малата при скорости охлаждения не ниже 60 град/мин, сублимационной сушки и отжига полученного порошка при температурах от 70 до 150°C в течение 20-40 часов приводит к получению новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата.
Уменьшение температуры приготовления водного раствора сунитиниба малата ниже комнатной температуры ~25°C нецелесообразно, поскольку требует дополнительных затрат энергии на охлаждение системы, и приводит к получению достаточно концентрированных растворов.
Увеличение температуры приготовления водного раствора сунитиниба малата выше 100°C также нецелесообразно из-за необходимости применения специального оборудования.
При уменьшении скорости замораживания раствора сунитиниба малата ниже 60 град/мин скорость криокристаллизации раствора N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата уменьшается и приближается к равновесному процессу. Это приводит к получению уже известных модификаций. Новую кристаллическую ε-модификацию N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамид малата в чистом виде получить не удается.
Сублимационная сушка замороженного раствора сунитиниба малата необходима для выделения соединения из раствора и получения неагрегированного порошка, состоящего из отдельных кристаллитов. Предпочтительным режимом сублимационной сушки является сушка, которую проводят при температурах: на конденсаторе -48…-56°C; на продукте -196…+30°C и остаточном давлении в камере (9-5)×100-2 Торр в течение 22-26 ч.
Отжиг порошка сунитиниба малата после сублимационной сушки необходим для получения новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата.
При температурах отжига меньше 70°C получить новую, не известную ранее, кристаллическую ε-модификацию N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата в чистом виде не удается.
Увеличение температуры отжига порошка сунитиниба малата выше 150°C нецелесообразно, так как может привести к частичной перекристаллизации системы. Это не позволяет получить новую, не известную ранее, кристаллическую ε-модификацию N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата в чистом виде.
При времени термической обработки кристаллитов сунитиниба малата меньше 20 часов при температурах от 70 до 150°C получить новую, не известную ранее, кристаллическую ε-модификацию N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата в чистом виде не удается.
Увеличение времени термической обработки кристаллитов сунитиниба малата более 40 часов при температурах от 70 до 150°C нецелесообразно, так как не приводит к увеличению выхода целевого продукта - новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата и лишь удорожает процесс.
Возможность осуществления предлагаемого изобретения иллюстрируется следующими примерами, но не ограничивается ими.
Пример 1. 100 мл 1 мас. % водного раствора сунитиниба малата, приготовленного из исходной субстанции N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата и воды при 40°C, наливают в поддон из нержавеющей стали и замораживают его со скоростью 60 град/мин погружением дна поддона в смесь ацетон-сухой лед (T=-78°C), а затем после криокристаллизации - в жидкий азот (Ткип=-196°C). Полученный замороженный продукт на поддоне переносят в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе -50…-56°C; на продукте -196…+30°C и остаточном давлении в камере (8-5)·10-2 Торр в течение 22 ч. Продукт сублимационной сушки - легкий, пушистый порошок оранжевого цвета помещают в химический термостойкий стакан вместимостью 400 мл, вносят его в предварительно разогретый до 70°C сушильный шкаф и выдерживают при этой температуре в течение 20 часов. Выход продукта составил 0,96 г (96 мас. %). По данным РФА, полученное вещество характеризуется типичной дифрактограммой, представленной на рис. 6, и набором межплоскостных расстояний и их интенсивностями, совпадающими с соответствующими значениями для новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата, представленными в табл. 3. По данным ВЭЖХ, проведенного согласно описанной выше методики, хроматограмма полученного порошка содержит один пик основного компонента с характерным временем удерживания 7,032 мин, что в пределах ошибки определения, соответствует времени удерживания новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата. По данным термического анализа, полученное вещество характеризуется типичными термограммами, представленными на рис. 4 и совпадающими с соответствующими значениями для новой, не известной ранее, кристаллической ε-модификации Ν-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индсл-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата. Температура плавления полученного продукта равна (179,7±0,5)°C. Кроме того, на термогравиметрической кривой и кривой дифференциальной сканирующей калориметрии (ДСК) полученного вещества вплоть до температуры плавления тепловых эффектов и потери массы не наблюдается, т.е. полученное вещество не содержит дополнительных молекул «сольватных» или «гидратных», а также молекул фармацевтически приемлемых солей.
Пример 2. 200 мл 0,5 мас. % водного раствора сунитиниба малата, приготовленного из исходной субстанции N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата и воды при 25°C, замораживают со скоростью 3×102 град/мин вливанием раствора в предварительно охлажденный и наполненный жидким азотом (Ткип=-196°C) поддон из нержавеющей стали. Полученный замороженный продукт на поддоне переносят в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе -48…-56°C; на продукте -196…+30°C и остаточном давлении в камере (8-6)·10-2 Торр в течение 24 ч. Полученный продукт сублимационной сушки - легкий пушистый порошок оранжевого цвета, помещают в химический термостойкий стакан вместимостью 400 мл, вносят его в предварительно разогретый до 150°C сушильный шкаф и выдерживают при этой температуре в течение 40 часов. Выход продукта составил 0,94 г (94 мас. %). По данным РФА, полученное вещество характеризуется типичной дифрактограммой, представленной на рис. 6, и набором межплоскостных расстояний и их интенсивностями, совпадающими с соответствующими значениями для новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата, представленными в табл. 3. По данным ВЭЖХ, проведенного согласно описанной выше методики, хроматограмма полученного порошка содержит один пик основного компонента с характерным временем удерживания 7,029 мин, что в пределах ошибки определения, соответствует времени удерживания новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата. По данным термического анализа, полученное вещество характеризуется типичными термограммами, представленными на рис. 4 и совпадающими с соответствующими значениями для новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата. Температура плавления полученного продукта равна (181,4±0,5)°C. Кроме того, на термогравиметрической кривой и кривой дифференциальной сканирующей калориметрии (ДСК) полученного вещества вплоть до температуры плавления тепловых эффектов и потери массы не наблюдается, т.е. полученное вещество не содержит дополнительных молекул «сольватных» или «гидратных», а также молекул фармацевтически приемлемых солей.
Пример 3. 250 мл 1,5 мас. % водного раствора сунитиниба малата, приготовленного из исходной субстанции N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата и воды при 70°C, замораживают со скоростью примерно 105 град/мин резким выливанием тонкого слоя раствора в предварительно охлажденный до температуры -196°C поддон из нержавеющей стали. Полученный замороженный продукт на поддоне переносят в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе -48…-56°C; на продукте -196…+30°C и остаточном давлении в камере (9-7)·10-2 Торр в течение 24 ч. Полученный продукт сублимационной сушки - легкий пушистый порошок оранжевого цвета, помещают в химический термостойкий стакан вместимостью 400 мл, вносят его в предварительно разогретый до 150°C сушильный шкаф и выдерживают при этой температуре в течение 20 часов. Выход продукта составил 3,65 г (97,3 мас. %). По данным РФА, полученное вещество характеризуется типичной дифрактограммой, представленной на рис. 6, и набором межплоскостных расстояний и их интенсивностями, совпадающими с соответствующими значениями для новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата, представленными в табл. 3. По данным ВЭЖХ, проведенного согласно описанной выше методики, хроматограмма полученного порошка содержит один пик основного компонента с характерным временем удерживания 7,037 мин, что в пределах ошибки определения, соответствует времени удерживания новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата. По данным термического анализа, полученное вещество характеризуется типичными термограммами, представленными на рис. 4 и совпадающими с соответствующими значениями для новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата. Температура плавления полученного продукта равна (181,3±0,5)°C. Кроме того, на термогравиметрической кривой и кривой дифференциальной сканирующей калориметрии (ДСК) полученного вещества вплоть до температуры плавления тепловых эффектов и потери массы не наблюдается, т.е. полученное вещество не содержит дополнительных молекул «сольватных» или «гидратных», а также молекул фармацевтически приемлемых солей.
Пример 4. 200 мл 2 мас. % водного раствора сунитиниба малата, приготовленного из исходной субстанции N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата и воды при 100°C, замораживают со скоростью примерно 103 град/мин распылением раствора пневматической форсункой при избыточном давлении 0,7 кг/см2 в реактор, наполненный жидким азотом (Tкип=-196°C). Полученные криогранулы замороженного раствора переносят в поддон из нержавеющей стали и подвергают сублимационной сушке при температурах: на конденсаторе -48…-56°C; на продукте -196…+30°C и остаточном давлении в камере (9-7)·10-2 Торр в течение 26 ч. Полученный продукт сублимационной сушки - легкий пушистый порошок оранжевого цвета, помещают в химический термостойкий стакан вместимостью 400 мл, вносят его в предварительно разогретый до 70°C сушильный шкаф и выдерживают при этой температуре в течение 40 часов. Выход продукта составил 3,8 г (95 мас. %). По данным РФА, полученное вещество характеризуется типичной дифрактограммой, представленной на рис. 6, и набором межплоскостных расстояний и их интенсивностями, совпадающими с соответствующими значениями для новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата, представленными в табл. 3. По данным ВЭЖХ, проведенного согласно описанной выше методики, хроматограмма полученного порошка содержит один пик основного компонента с характерным временем удерживания 7,041 мин, что в пределах ошибки определения, соответствует времени удерживания новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата. По данным термического анализа, полученное вещество характеризуется типичными термограммами, представленными на рис. 4 и совпадающими с соответствующими значениями для новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата. Температура плавления полученного продукта равна (181,1±0,5)°C. Кроме того, на термогравиметрической кривой и кривой дифференциальной сканирующей калориметрии (ДСК) полученного вещества вплоть до температуры плавления тепловых эффектов и потери массы не наблюдается, т.е. полученное вещество не содержит дополнительных молекул «сольватных» или «гидратных», а также молекул фармацевтически приемлемых солей.
Пример 5. Фармацевтическая композиция. Для приготовления 10,00 г известной композиции, включающей в качестве действующего вещества кристаллическую модификацию сунитиниба малата и вспомогательные вещества в соотношении (мас. %):
|
8,68 г порошка новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата (6,50 г в пересчете на сунитиниб основание) смешивают в течение 10 минут в керамической ступке с вспомогательными веществами: 2,35 г маннита (по фармакопее США и Европейской фармакопее), 0,60 г кроскармеллозы натрия (по фармакопее США и Европейской фармакопее), 0,50 г повидона (К29-32) (по фармакопее США и Европейской фармакопее) и 0,05 г магния стеарата (по ТУ 6-09-16-1533-90). Полученную смесь подвергали физико-химическим и биологическим методам анализа. По данным РФА, в полученной смеси присутствует вещество, которое характеризуется набором межплоскостных расстояний и их интенсивностями, совпадающими с соответствующими значениями для новой, не известной ранее, кристаллической ε-модификации N-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата, представленными в табл. 3.
Аналогичным способом и идентичным по составу была приготовлена композиция на основе известной, исходной субстанции сунитиниба малата (форма I) (производства «AFINE CHEMICALS LTD» Китай). По данным РФА, в полученной смеси присутствует вещество, которое характеризуется набором межплоскостных расстояний и их интенсивностями, совпадающими с соответствующими значениями для известной N-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата (форма I) - исходной субстанции производства «AFINE CHEMICALS LTD» (Китай), представленными в табл. 2.
Биологические эксперименты проводили на кроликах-самцах массой 2,0-2,5 кг. Для получения надежных результатов в параллельных сериях опытов использовали не менее 5ти кроликов. Определение времени появления сунитиниба основания в крови проводили методом in vivo при пероральном введении композиции с последующим забором плазмы из ушной раковины. Во всех случаях количество вводимого в животное действующего вещества составляло 5,0 мг смеси (4,34 мг сунитиниба малата или 3,25 мг сунитиниба основания). Оказалось, что для композиции, содержащей новую, не известную ранее, кристаллическую ε-модификацию N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамид малата, время появления сунитиниба малата в крови кроликов равно 12±3 мин, а для известной композиции, содержащей в качестве действующего вещества известную кристаллическую модификацию сунитиниба малата (форма I) - исходную субстанцию производства «AFINE CHEMICALS LTD» (Китай) - 24±3 мин.
Таким образом, нами обнаружена новая, не известная ранее, кристаллическая ε-модификация N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата, предложены способ ее получения и применение ее для приготовления фармацевтической композиции в качестве противоопухолевого средства, ингибитора тирозинкиназ для лечения онкологических заболеваний.
Полученная новая, не известная ранее, кристаллическая ε-модификация N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата характеризуется отличным от известных кристаллических модификаций сунитиниба малата: формы I (исходной субстанции производства «AFINE CHEMICALS LTD»), формы II, формы II стабильной; формы III, формы IV, формы V, формы VI, формы VII, формы A, формы B, формы III, формы IV и аморфной формы набором межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iотн., %): 15,055 - 40,9%; 14,655 - 45,8%; 11,343 - 68,7%; 10,608 - 41,7%; 9,616 - 58,1%; 9,412 - 45,2%; 7,886 - 32,0%; 7,386 - 40,2%; 7,206 - 76,3%; 7,069 - 47,1%; 6,387 - 50,4%; 6,123 - 86,5%; 5,299 - 46,5%; 5,158 - 45,8%; 5,064 - 42,1%; 4,876 - 45,4%; 4,702 - 50,4%; 4,600 - 49,8%; 4,375 - 46,7%; 4,337 - 47,7%; 4,263 - 43,2%; 4,122 - 43,1%; 4,051 - 47,3%; 3,910 - 59,7%; 3,782 - 71,2%; 3,677 - 57,5%; 3,592 - 57,3%; 3,522 - 51,7%; 3,434 - 48,8%; 3,335 - 73,7%; 3,268 - 100,0%; 3,224 - 92,9%; 3,170 - 63,3%; 3,043 - 35,3%; 2,964 - 30,9%; 2,825 - 32,0%; 2,545 - 26,6%; 2,459 - 24,9%; 2,245 - 19,7%; 2,041 - 19,5%; 1,924 - 19,5%; 1,646 - 18,5%.
Кроме того, новая, не известная ранее, кристаллическая ε-модификация Ν-[2-(диэтиламино)этил]-5-[(Ζ)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1Н-пиррол-3-карбоксамида малата отличается повышенной биологической активностью в составе фармацевтической композиции по сравнению с действием известной кристаллической модификации сунитиниба малата (форма I) - исходной субстанции производства «AFINE CHEMICALS LTD» (Китай).
Из вышеизложенного можно сделать вывод о том, что заявляемая новая, не известная ранее, кристаллическая ε-модификация N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида малата, способ ее получения и применение ее для приготовления фармацевтической композиции в качестве противоопухолевого средства, ингибитора тирозинкиназ для лечения онкологических заболеваний являются новыми и удовлетворяют критериям «изобретательский уровень» и «промышленная применимость».
![КРИСТАЛЛИЧЕСКАЯ ε-МОДИФИКАЦИЯ N-[2-(ДИЭТИЛАМИНО)ЭТИЛ]-5-[(Z)-(5-ФТОР-1,2-ДИГИДРО-2-ОКСО-3Н-ИНДОЛ-3-ИЛИДЕН)МЕТИЛ]-2,4-ДИМЕТИЛ-1Н-ПИРРОЛ-3-КАРБОКСАМИД МАЛАТА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЕ ОСНОВЕ](https://fips.edrid.ru/images/rid/23/e3/d1/16845044a314a5d6c4b4dafc4ad5e312.png)
![КРИСТАЛЛИЧЕСКАЯ ε-МОДИФИКАЦИЯ N-[2-(ДИЭТИЛАМИНО)ЭТИЛ]-5-[(Z)-(5-ФТОР-1,2-ДИГИДРО-2-ОКСО-3Н-ИНДОЛ-3-ИЛИДЕН)МЕТИЛ]-2,4-ДИМЕТИЛ-1Н-ПИРРОЛ-3-КАРБОКСАМИД МАЛАТА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЕ ОСНОВЕ](https://fips.edrid.ru/images/rid/23/e3/d1/6420d2a3d04355dfb70fbdc4bac160de.png)
![КРИСТАЛЛИЧЕСКАЯ ε-МОДИФИКАЦИЯ N-[2-(ДИЭТИЛАМИНО)ЭТИЛ]-5-[(Z)-(5-ФТОР-1,2-ДИГИДРО-2-ОКСО-3Н-ИНДОЛ-3-ИЛИДЕН)МЕТИЛ]-2,4-ДИМЕТИЛ-1Н-ПИРРОЛ-3-КАРБОКСАМИД МАЛАТА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЕ ОСНОВЕ](https://fips.edrid.ru/images/rid/23/e3/d1/dce6a6286066d5a40dc85dd97483487d.png)
![КРИСТАЛЛИЧЕСКАЯ ε-МОДИФИКАЦИЯ N-[2-(ДИЭТИЛАМИНО)ЭТИЛ]-5-[(Z)-(5-ФТОР-1,2-ДИГИДРО-2-ОКСО-3Н-ИНДОЛ-3-ИЛИДЕН)МЕТИЛ]-2,4-ДИМЕТИЛ-1Н-ПИРРОЛ-3-КАРБОКСАМИД МАЛАТА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЕ ОСНОВЕ](https://fips.edrid.ru/images/rid/23/e3/d1/06f12c377b29306e153c7b842b068284.png)
![КРИСТАЛЛИЧЕСКАЯ ε-МОДИФИКАЦИЯ N-[2-(ДИЭТИЛАМИНО)ЭТИЛ]-5-[(Z)-(5-ФТОР-1,2-ДИГИДРО-2-ОКСО-3Н-ИНДОЛ-3-ИЛИДЕН)МЕТИЛ]-2,4-ДИМЕТИЛ-1Н-ПИРРОЛ-3-КАРБОКСАМИД МАЛАТА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЕ ОСНОВЕ](https://fips.edrid.ru/images/rid/23/e3/d1/9809deb21420a145f620fafe128967a2.png)
![КРИСТАЛЛИЧЕСКАЯ ε-МОДИФИКАЦИЯ N-[2-(ДИЭТИЛАМИНО)ЭТИЛ]-5-[(Z)-(5-ФТОР-1,2-ДИГИДРО-2-ОКСО-3Н-ИНДОЛ-3-ИЛИДЕН)МЕТИЛ]-2,4-ДИМЕТИЛ-1Н-ПИРРОЛ-3-КАРБОКСАМИД МАЛАТА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЕ ОСНОВЕ](https://fips.edrid.ru/images/rid/23/e3/d1/cbab18a7fc6e2cb980499cae54dfc544.png)

