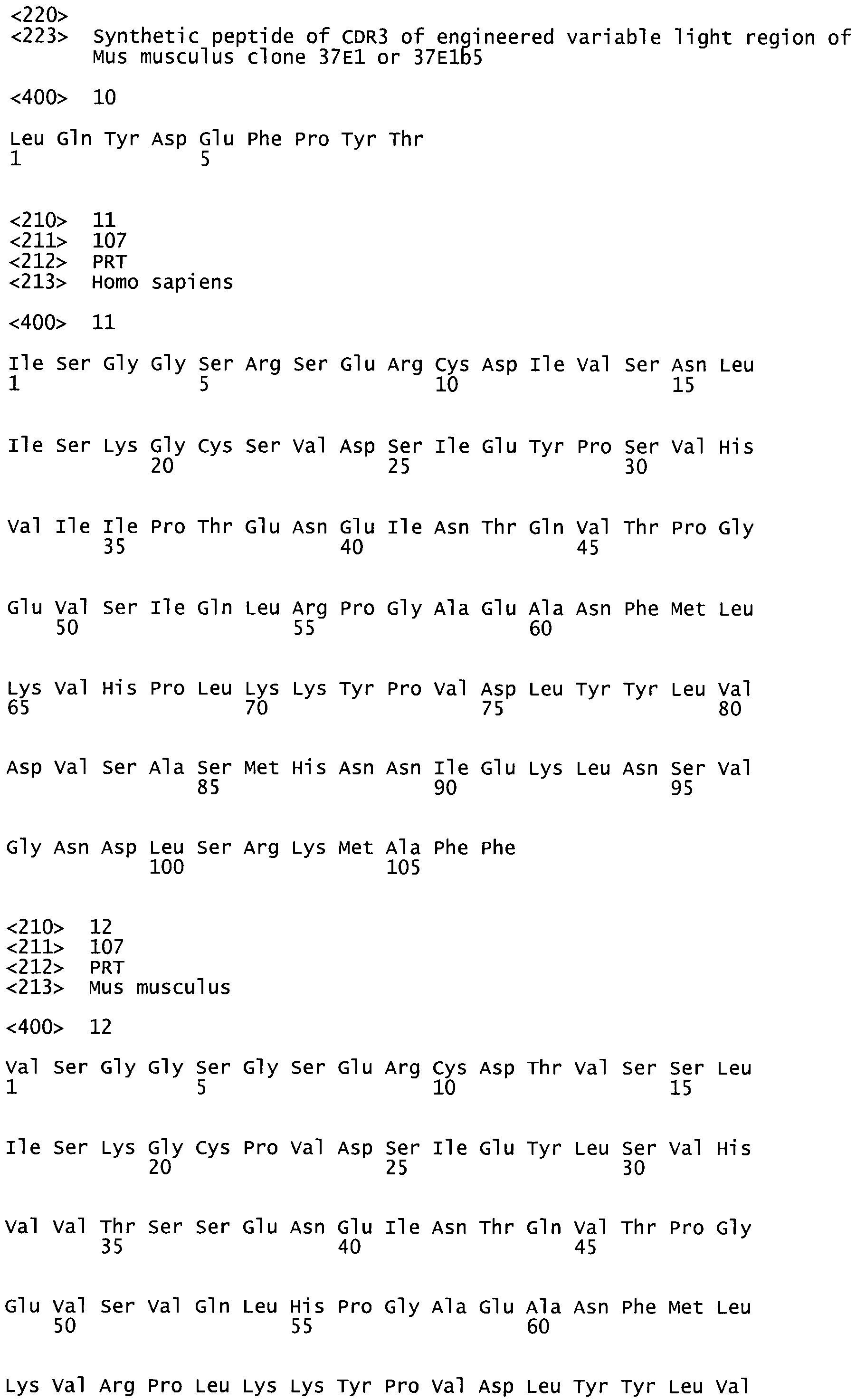Результат интеллектуальной деятельности: АНТИТЕЛА, НЕЙТРАЛИЗУЮЩИЕ ИНТЕГРИН ανβ8
Вид РИД
Изобретение
Перекрестные ссылки на родственные заявки
В настоящей заявке испрашивается приоритет по предварительной заявке США №61/305,749, поданной 18 февраля 2010 г., и приоритет по предварительной заявке США №61/428,814, поданной 30 декабря 2010 г., раскрытие которых включено в данный документ в полном объеме в виде ссылки.
Заявление относительно прав на изобретения, сделанные в соответствии с финансируемыми федеральным правительством исследованиями и разработками
Настоящее изобретение было сделано при поддержке Правительства США по грантам №HL63993, NS-44155, U01 AI075443, выданным Национальным Институтом Здравоохранения. Правительство США имеет прямые права на настоящее изобретение.
Уровень техники
Трансформирующий фактор роста-β (TGF-β) - многофункциональный цитокин, играющий важные роли в биологии иммунных, эндотелиальных, эпителиальных и мезенхимальных клеток при развитии и во взрослой жизни у беспозвоночных и позвоночных видов. У млекопитающих эти функции опосредованы тремя изоформами TGF-β1, 2, и 3, каждая из которых широко представлена. Все три изоформы взаимодействуют с одними и теми же рецепторами клеточной поверхности (TGFBR2 и ALK5) и передают сигнал через одни и те же внутриклеточные сигнальные пути, которые включают в себя либо канонические (т.е. SMADS) или неканонические (т.е., МАРК, JUN, PI3K, РР2А, Rho, Par6) сигнальные эффекторы. Наиболее интенсивно изучались канонические сигнальные пути TGF-β, в которых сигнализация TGF-β передается от рецепторного аппарата TGF-β посредством фосфорилирования цитоплазматических SMAD-2/3, образования комплекса с SMAD-4, ядерной транслокации комплекса SMAD-2/3/4, и связывания с элементами ответа SMAD, которые расположенным в промоторных регионах многих генов, вовлеченных в фиброгенный ответ.
Однако, несмотря на наличие сходных партнеров передачи сигналов, каждая изоформа служит для индивидуальной биологической функции, возможно, из-за различий в аффинности связывания с рецепторами TGF-β, в механизме активации, в интенсивности или продолжительности передачи сигнала, или в пространственном и/или временном распределении.
Модели нокаута и модели условного удаления изоформ TGF-β, рецепторов, и сигнальных медиаторов, а также направленные на все изоформы TGF-β реагенты, блокирующие их функции, выявили существенную роль TGF-β в Т-клетках и в клетках сердца, легких, сосудов, и развития неба. Например, мыши, дефицитные по TGF-β1 либо умирают внутриутробно вследствие дефектов васкулогенеза в желточном мешке или рождаются и выживают до взрослого состояния, но у них развивается тяжелые полиорганные аутоиммунные заболевания. Генетическое удаление сигнальных медиаторов TGF-R показало существенную роль SMAD2 в раннем формировании и образовании мезодермы, и мыши, лишенные SMAD3, оказываются жизнеспособными и фертильными, но демонстрируют наличие пороков развития конечностей, нарушение иммунной регуляции, колиты, рак толстой кишки, и расширение альвеол. В тканях взрослого организма путь TGF-β, как полагают, регулирует динамическое взаимодействие между иммунными, мезенхимальными и эпителиальными клетками для поддержания гомеостаза в ответ на экологический стресс.
Нормальные гомеостатические пути опосредованные TGF-β, нарушаются в ответ на хронические повторяющиеся повреждения. В случаях повреждения, TGF-β становится основным профиброгенным цитокином, задерживая эпителиальное заживление раны путем ингибирования пролиферации эпителия и миграции и стимуляции апоптоза и расширения мезенхимного компартмента, индуцируя рекрутинг фибробластов, сократительную способность фибробластов, и отложение внеклеточного матрикса. Действительно, интратрахеальное введение рекомбинантного TGF-β1 в составе аденовируса в легкие грызунов резко увеличивает накопление фибробластов и экспрессию коллагена I типа и III типа вокруг дыхательных путей и в легочном интерстиции, а нейтрализующие анти-TGF-β антитела могут блокировать экспериментально вызванный блеомицином или радиацией фиброз легких.
Возросшая активность пути TGF-β также вовлечена в фиброзные заболевания легких, гломерулосклероз, и рестеноз сосудов сердца. Большинство патологических изменений опосредованных TGFβ, как представляется, связаны с изоформой TGF-β1. Сложность функционирования TGF-β1 в организме человека объясняется наличием наследственных заболеваний с генерализованным или клеточно-специфичным повышением или недостатком непосредственно TGF-β1 или его сигнальных эффекторов. Мутации, повышающие активность путей TGF-β, приводят к дефектам костного метаболизма (напр. болезни Камурати-Энгельмана) и соединительной ткани (т.е. синдром Марфана), и к аневризме аорты (т.е. синдроме Лойе-Дитца), в то время как мутации, которые приводят к снижению активности пути TGF-β коррелируют с возникновением рака и его прогнозом. Роль TGF-β, как подавителя раковой опухоли не является однозначной, поскольку TGF-β может также увеличить рост опухоли и вызвать метастазирование, возможно, посредством его участия в подавлении иммунитета, клеточной инвазии, эпителиально-мезенхимального перехода, или ангиогенеза.
Несмотря на многочисленные важные функции TGF-β, одноразовое введение или краткосрочное назначение нейтрализующих антител пан-TGF-β, как сообщается, хорошо переносится в дозах, которые препятствуют фиброзу органа или экспериментальному росту раковых клеток и метастазов, без возникновения побочных эффектов у взрослых мышей и крыс. Данное лечение показало терапевтическую эффективность в подавлении экспериментального фиброза. Ввиду этих многообещающих результатов, проводятся клинические испытания I и II фазы разовых доз нейтрализующих пан-TGF-β антител для метастатической почечно-клеточной карциномы, меланомы, фокального сегментарного гломерулосклероза, и идиопатического легочного фиброза (Genzyme Corporation, genzymeclinicalresearch.com, последнее обращение 27 августа 2009 г.). Для минимизации системных эффектов весьма желательной целью является направленное воздействие на путь TGF-β.
Краткое описание сущности изобретения
Настоящее изобретение относится к способу уменьшения активации TGF-β, у индивида, например, человека или не человека, путем введения антагониста интегрина ανβ8 нуждающемуся в нем индивиду, тем самым, снижая активацию TGF-β у индивида. В некоторых вариантах осуществления антагонист уменьшает активацию TGF-β (например, рекрутинг протеазы, расщепляющей латентный TGF-β, тем самым освобождая зрелые, активные пептиды TGF-β), но практически не ингибируют адгезию ανβ8 к TGF-β (например, адгезию ανβ8, который экспрессируется на клеточной поверхности, к латентному TGF-β, который связан с клеточным матриксом).
В некоторых вариантах осуществления антагонист представляет собой антитело. Таким образом, изобретение предоставляет изолированные антитела, которые ингибируют высвобождение активного, зрелого пептида TGFβ (активацию TGF-β), но практически не ингибируют адгезию TGFβ к ανβ8 на ανβ8-экспрессирующей клетке. В некоторых вариантах осуществления антитело специфически связывается с ανβ8, например, специфично с β8. В некоторых вариантах осуществления антитело связывается с эпитопом на β8, в пределах SEQ ID NO:11. В некоторых вариантах осуществления эпитоп содержит, по меньшей мере, одну аминокислоту, выбранную из аминокислот I125, R128, R175, F179 и F180 человеческого β8. В некоторых вариантах осуществления антитело связывается, по меньшей мере, с одной аминокислотой, выбранной из аминокислот, R79, I85, S95, Р100, I108, Р109, R128, Н140 и F179 человеческого β8. В некоторых вариантах осуществления антитело связывает, по меньшей мере, одну аминокислоту, выбранную из аминокислот I74, N88, I107, T110, I125, R175 и F180 человеческого β8. В некоторых вариантах осуществления антитело связывает человеческий β8, но не связывает мышиный β8. В некоторых вариантах осуществления антитело уменьшает активацию TGFβ, но практически не ингибирует ανβ8 - опосредованную адгезию клеток к TGFβ.
В некоторых вариантах осуществления антитело конкурирует за связывание с ανβ8 с антителом, имеющим вариабельную область тяжелой цепи, содержащую три CDR легкой цепи с SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, и вариабельную область легкой цепи, содержащую три CDR тяжелой цепи с SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10. В некоторых вариантах осуществления антитело имеет вариабельную область тяжелой цепи, содержащую три CDR тяжелой цепи с SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, и вариабельную область легкой цепи, содержащую три CDR легкой цепи с SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10. Например, в некоторых вариантах осуществления антитело имеет вариабельную область легкой цепи с последовательностью SEQ ID NO: 3 или 4 и вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 1 или 2. Конкретные примеры антител по настоящему изобретению включают в себя антитело, имеющее вариабельную область легкой цепи с SEQ ID NO: 3 и вариабельную область тяжелой цепи с SEQ ID NO: 1, и антитело, имеющее вариабельную область легкой цепи с SEQ ID NO: 4 и вариабельную область тяжелой цепи с SEQ ID NO: 2.
Антитела могут быть различных изотипов, например, IgG1, IgG2, IgG2a, IgG или IgG4. Могут быть использованы как моноклональные, так и поликлональные антитела. В некоторых вариантах осуществления это антитела человека, гуманизированные или химерные антитела.
Настоящее изобретение также дополнительно представляет выделенную нуклеиновую кислоту, вектор или векторы, и клетки-хозяева, подходящие для экспрессии антитела по настоящему изобретению.
В настоящее изобретение также дополнительно предлагается фармацевтическая композиция, содержащая антитела по настоящему изобретению и фармацевтически приемлемый наполнитель. В некоторых вариантах фармацевтическая композиция представляет собой диагностическую композицию, например, содержащую меченые антитела. В некоторых вариантах фармацевтическая композиция является терапевтической.
В некоторых вариантах осуществления антитело используется для обнаружения, например, для определения наличия β8 in vivo или т vitro. В таких вариантах осуществления антитело прямо или опосредованно помечено обнаруживаемым фрагментом. Таким образом, в некоторых вариантах осуществления настоящее изобретение предоставляет способы определения присутствия интегрина β8 в биологическом образце (in vitro или in vivo), включающий в себя контакт биологического образца с мечеными антителами в соответствии с настоящим изобретением и обнаружение присутствия меченого антитела, тем самым определяя присутствие интегрина β8. В некоторых вариантах осуществления, метод используется для диагностики состояния, выбранного из группы, состоящей из артрита, хронической обструктивной болезни легких (ХОБЛ), астмы, фиброзного расстройства, аутоиммунного воспалительного заболевания мозга, рассеянного склероза, демиелинизирующего заболевания (например, поперечного миелита, болезни Девика, синдрома Гийена-Барре), нейровоспаления, заболевания почек, аденокарциномы, плоскоклеточного рака, глиомы, рака молочной железы, и роста рака и метастазов.
Настоящее изобретение также относится к трансгенной мыши, которая экспрессирует человеческий интегрин β8. В некоторых вариантах, трансгенные мыши по изобретению не экспрессируют интегрин мыши β8.
Композиции и способы по настоящему изобретению могут быть использованы для уменьшения активации TGF-β у индивидов, имеющих одно или несколько состояний, выбранных из группы, состоящей из артрита, хронической обструктивной болезни легких (ХОБЛ), астмы, фиброзных расстройств, аутоиммунных заболеваний, воспалительных заболеваний мозга, рассеянного склероза, демиелинизирующих заболеваний (например, поперечного миелита, болезни Девика, синдрома Гийена-Барре), нейровоспалений, заболеваний почек, аденокарциномы, плоскоклеточного рака, глиомы, рака молочной железы, и роста рака и метастазов, и в которых уменьшение содержания TGF-β улучшает состояние больных. В некоторых вариантах осуществления фиброзные расстройства дыхательных путей представляют собой фиброз, идиопатический легочный фиброз, неспецифическую интерстициальную пневмонию, постинфекционный фиброз легких, диффузное альвеолярное повреждение, связанный с фиброзом легких коллагеноз, индуцированный лекарствами фиброз легких, силикоз, связанный с асбестом фиброз легких, дыхательный бронхиолит, дыхательный бронхиолит ассоциированный с интерстициальным заболеванием легких, десквамативный интерстициальный фиброз, криптогенную пневмонию, хроническую аллергическую пневмонию, медикаментозный фиброз легких, фиброз почек или печени.
Подробное описание изобретения
Введение
Настоящее изобретение основано, частично, на открытии того, что определенные анти-ανβ8 антагонисты, анти-ανβ8 антитела или иммуноконъюгаты избирательно нарушают опосредованную ανβ8 активацию TGF-β, но не адгезию ανβ8 - экспрессирующей клетки к иммобилизованному TGF-β.Соответственно, настоящее изобретение предоставляет способы уменьшения активации TGF-β у индивида посредством введения антагониста ανβ8 (например, малых молекул, антител анти-ανβ8 или иммуноконъюгатов) индивиду, который в этом нуждается, тем самым снижая активацию TGF-β в его организме. Настоящее изобретение также предусматривает новые антитела, имеющие вариабельную область тяжелой цепи, содержащую три CDR тяжелой цепи: SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, и вариабельную область легкой цепи, содержащую три CDR легкой цепи: SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10.
Определения
Термин "интегрин β8" используется взаимозаменяемо с itgb8, ITGB8, β8, и им подобными терминами. ITGB8, как правило, используют для обозначения последовательности человека, в то время itgb8 относится к последовательности мыши. Последовательности человеческого белка можно найти в базе Uniprot, код доступа Р26012, а последовательности белков мышей имеются в базе Uniprot под кодом доступа Q0VBD0.
Термин "антагонист", по настоящему изобретению, относится к агенту, который ингибирует экспрессию полипептида или полинуклеотида изобретения или связывается с ним, частично или полностью блокируя стимуляцию, снижая, предотвращая, задерживая активацию, инактивируя, уменьшая чувствительность, или понижая активность полипептида или полинуклеотида по настоящему изобретению. Антагонист может нейтрализовать активность (например, предотвратить связывание и активацию природным лигандом) или принудительно уменьшить активность.
Термины "идентичные" или процент "идентичности" в контексте двух или более нуклеиновых кислот или полипептидных последовательностей, относятся к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми или имеют определенный процент аминокислотных остатков или нуклеотидов, которые являются такими же (т.е. около 60% идентичности, предпочтительно 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичности в пределах определенного региона, при сравнении и выравнивании для максимального соответствия в окне сравнения или в определенной области), и измеряется с помощью алгоритмов сравнения последовательностей BLAST или BLAST 2.0 с параметрами по умолчанию описанными ниже, или с помощью ручного выравнивания и визуального осмотра (см., например, веб-сайт NCBI http://ncbi.nlm.nih.gov/BLAST/ или подобный). Такие последовательности, далее называют, "по существу идентичными". Настоящее изобретение предоставляет, например, антитела, имеющие полинуклеотидные или полипептидные последовательности, которые имеют, по меньшей мере, 80% идентичности, предпочтительно 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% идентичности, по отношению к эталонной последовательности, например, SEQ ID NO:1-10. Данное определение относится, или может быть применено в качестве дополнения к тестовой последовательности. Данное определение также включает в себя последовательности, которые имеют делеции и/или вставки, а также те, которые имеют замены. Как описано ниже, предпочтительные алгоритмы могут учитывать пробелы и т.п. Предпочтительно, идентичность существует в области, которая состоит, по меньшей мере, примерно из 25 аминокислот или нуклеотидов в длину, или более предпочтительно, в области, составляющей 50-100 аминокислот или нуклеотидов в длину.
Для сравнения последовательности, как правило, одна последовательность выступает в качестве эталонной последовательности, с которой сравниваются тестовые последовательности. При использовании алгоритма сравнения исследуемая последовательность и эталонная последовательность вводятся в компьютер, если необходимо назначаются координаты подпоследовательности, и устанавливаются параметры алгоритма программы. Предпочтительно, могут быть использованы параметры по умолчанию, или могут быть установлены альтернативные параметры. Алгоритм сравнения последовательностей затем вычисляет основанный на параметрах программы процент идентичностей последовательности для тестовой последовательности по отношению к эталонной последовательности.
Термин "окно сравнения", как он использован в данном документе, включает в себя ссылку на сегмент, состоящий из некоторого количества смежных позиций, примерно из от 20 до 600, как правило, от около 50 до около 200, более обычно от около 100 до 150, последовательность которых может быть сравнена с эталонной последовательностью того же числа смежных позиций, после того как две последовательности оптимально выровняют. Методы выравнивания последовательностей для сравнения хорошо известны в данной области техники. Оптимальное выравнивание последовательностей для сравнения можно проводить, например, с помощью алгоритма локальной гомологии Smith & Waterman, Adv. Appl. Math. 2:482 (1981), с помощью алгоритма гомологии выравнивания Needleman и Wunsch, J. Mol. Biol. 48:443 (1970), способом поиска сходства Pearson & Lipman, Proc. Natl. Acad. Sci. USA 85:2444 (1988), по компьютеризированной реализации этих алгоритмов (GAP, BESTFIT, FASTA, и TFASTA на программном обеспечении Wisconsin Genetics, Genetics Computer Group, 575 Science Dr., Madison, WI), или ручным выравниванием и визуальной инспекцией (см., например. Current Protocols in Molecular Biology (Ausubel и др., ред. 1995 года, дополнение)).
Алгоритмы, которые подходят для определения процента идентичности и подобия последовательностей представляют собой алгоритмы BLAST и BLAST 2.0, которые описаны в Altschul и др., Nuc. Acids Res. 25:3389-3402 (1977) и Altschul и др., J. Mol. Biol. 215:403-410 (1990), соответственно. BLAST и BLAST 2.0, используются, с параметрами, описанными здесь, чтобы определить процент идентичности последовательности нуклеиновых кислот и белков по изобретению. Программное обеспечение для проведения анализа BLAST является общедоступным через Национальный центр по биотехнологической информации (http://www.ncbi.nlm.nih.gov/). Этот алгоритм включает первичную идентификацию пар последовательностей с максимальным сходством (HSP) посредством идентификации коротких слов с длиной W в представляющей интерес последовательности, которые либо совпадают, либо удовлетворяют некоторому оцениваемому положительно порогу значения Т при выравнивании со словом такой же длины в последовательности из базы данных. Т определяется как порог значений для соседних слов (Altschul (1990) выше). Эти изначальные совпадения соседних слов выступают в роли затравок для начала поиска при обнаружении более длинных HSP, содержащих их. Поиск совпадений слов распространяется в обоих направлениях вдоль каждой последовательности до тех пор, пока суммарное значение для выравнивания может повышаться. Суммарные значения вычисляются с использованием для нуклеотидных последовательностей параметров М (значение компенсации за пару совпавших остатков; всегда >0) и N (штрафной балл за несоответствие остатков, всегда <0). Для аминокислотных последовательностей для вычисления суммарного значения используется оценочная матрица. Продолжение поиска совпадений слов в каждом направлении останавливают, если суммарное значение для выравнивания снижается по величине Х ниже максимально достижимого значения; суммарное значение снижается до нуля или ниже при накоплении одного или нескольких выровненных остатков с отрицательным значением или если достигнут конец любой последовательности. Параметры алгоритма BLAST W, Т и Х определяют чувствительность и скорость выравнивания. Программа BLASTN (для нуклеотидных последовательностей) использует в качестве параметров по умолчанию длину слова (W) 11, ожидаемое значение (Е) 10, М=5, N=-4 и сравнение обеих цепей. Для аминокислотных последовательностей программа BLASTP использует в качестве параметров по умолчанию длину слова 3 и ожидаемые значения (Е) 10 и оценочную матрицу BLOSUM62 (см. Henikoff& Henikoff (1989) Proc. Natl. Acad. Sci., USA, 89:10915), фрагменты для выравнивания (В) 50, ожидаемое значение (Е) 10, М=5, N=-4 и сравнение обеих цепей.
Термин нуклеиновые "кислоты" относится к дезоксирибонуклеотидам или рибонуклеотидам и их полимерам в одно-или двуцепочечной форме, и к их наборам. Этот термин охватывает нуклеиновые кислоты, содержащие известные нуклеотидные аналоги или модифицированные остатки остова или связи, которые являются синтетическими, природными, и не встречающимися в природе, которые имеют аналогичные связывающие свойства, что и эталонная нуклеиновая кислота, и которые метаболизируются способом, сходным с эталонными нуклеотидами. Примеры таких аналогов включают, без ограничения фосфоротиоаты, фосфорамидаты, метилфосфонаты, хиральные-метилфосфонаты, 2-O-метилрибонуклеотиды, пептид-нуклеиновые кислоты (PNA).
Если не указано иное, последовательности нуклеиновых кислот помимо непосредственно приведенной последовательности также включают в себя консервативно модифицированные варианты (например, вырожденные замены кодонов) и комплементарные последовательности. В частности, вырожденные замены кодонов могут быть получены путем создания последовательности, в которых третье положение одного или нескольких (или всех) выбранных кодонов заменяется любым из канонических нуклеотидов или и/или дезоксинозиновыми остатками (Batzer et al. Nucleic Acids Res. 19:5081 (1991); Ohtsuka и др., J. Biol Chem 260:2605-2608 (1985);. Rossolini и др., Moll. Cell. Probes 8:91-98 (1994)). Термин "нуклеиновые кислоты" используется наравне с геном, ДНК РНК, олигонуклеотидом, и полинуклеотидом.
Последовательности нуклеиновых кислот также безусловно включает в себя "сплайс-варианты". Аналогично, белок, кодируемый нуклеиновой кислотой, безусловно, включает в себя любой белок, кодируемый сплайс-вариантом данной нуклеиновой кислоты. "Сплайс-варианты", как следует из названия, являются продуктами альтернативного сплайсинга гена. После транскрипции, исходный транскрипт нуклеиновой кислоты может быть спайсирован так, что различные (альтернативные) нуклеиновые кислоты - продукты сплайсинга будут кодировать различные полипептиды. Механизмы получения сплайс-вариантов различаются, но включают в себя альтернативный сплайсинг экзонов. Альтернативные полипептиды, полученные из одной и той же нуклеиновой кислоты сквозной транскрипцией, также охватываются этим определением. Любые продукты реакции сплайсинга, в том числе рекомбинантные формы продуктов сплайсинга, включены в данное определение. Например, сплайс варианты калиевого канала обсуждаются в Leicher et al., J. Biol. Chem. 273(52):35095-35101 (1998).
Термин "полипептид", "пептид" и "белок" используют в данном документе взаимозаменяемо для обозначения полимера аминокислотных остатков. Данные термины распространяются и на полимеры аминокислот, в которых один или несколько аминокислотных остатков являются искусственным химическим миметиком, соответствующим природным аминокислотам, а также встречающиеся в природе аминокислотные полимеры и не встречающиеся в природе аминокислотные полимеры.
Термин "аминокислота" относится к природным и синтетическим аминокислотам, а также аналогам аминокислот и миметикам аминокислот, которые функционируют способом, сходным с встречающимися в природе аминокислотами. Встречающиеся в природе аминокислоты это аминокислоты кодируемые генетическим кодом, а также аминокислоты, которые впоследствии были модифицированы, например, гидроксипролин, гамма-карбоксиглутамат, и O-фосфосерин. Аналоги аминокислот относится к соединениям, которые имеют ту же основную химическую структуру, что и природная аминокислота, т.е. α-углерод, который связан с водородом, карбоксильные группы, аминогруппы, и R-группу, например, гомосерин, норлейцин, метионинсульфоксид, метионинметилсульфоний. Такие аналоги содержат измененные R группы (например, норлейцин) или модифицированные пептидные остовы, но сохраняют такую же основную химическую структуру, что и природные аминокислоты. Миметики аминокислот относятся к химическим соединениям, которые имеют структуру, отличную от общей химической структуры аминокислот, но функционально похожи на природные аминокислоты.
Аминокислоты могут быть представлены в настоящем документе общеизвестными трехбуквенными или однобуквенными символами рекомендованными Комиссией Биохимической Номенклатуры IUPAC-IUB. Нуклеотиды представлены их общепринятыми однобуквенными обозначениями.
Термин "консервативно модифицированные варианты" относится как аминокислотным, так и к нуклеотидным последовательностям. Что касается конкретных последовательностей нуклеиновых кислот, консервативно модифицированные варианты относятся к тем нуклеиновым кислотам, которые кодируют идентичные или по существу идентичные аминокислотные последовательности, или в случае, когда нуклеиновая кислота не кодирует аминокислотную последовательность, то по существу идентичную последовательность. Из-за вырожденности генетического кода, большое число функционально идентичных нуклеиновых кислот кодируют один белок. Например, все кодоны GCA, GCC, GCG и GCU кодируют аминокислоту аланин. Таким образом, в каждом месте, где аланин задается кодоном, кодон может быть изменен на любой из описанных соответствующих кодонов без изменения кодируемого полипептида. Такие вариации нуклеиновых кислот являются "молчащими вариациями", которые являются одним из видов консервативно модифицированых вариантов. Каждая описанная в настоящем документе последовательность нуклеиновых кислот, которая кодирует полипептид, также включает все возможные "молчащие вариации" нуклеиновых кислот. Специалистам в данной области должны быть понятно, что каждый кодон в нуклеиновой кислоте (за исключением AUG, который обычно является только кодоном метионина, и TGG, который обычно является только кодоном триптофана) может быть модифицирован для получения функционально идентичных молекул. Соответственно, каждая "молчащая вариация" нуклеиновой кислоты, которая кодирует полипептид, включается в каждую описанную последовательность в отношении продукта экспрессии, но не в отношении последовательностей зондов.
Что касается аминокислотных последовательностей, специалистами в данной области должно быть понятно, что отдельные замены, делеции или вставки в нуклеиновую кислоту, пептид, полипептидную или белковую последовательность, которые изменяют, добавляют или удаляют одну аминокислоту или небольшой процент аминокислот в закодированной последовательности являются "консервативно-модифицированными вариантами", если изменение приводит к замене аминокислоты на химически подобную аминокислоту. Таблицы консервативных замен, в которых представлены функционально аналогичные аминокислоты, хорошо известны в данной области. Такие консервативно модифицированные варианты, дополнительно не исключают полиморфных вариантов, межвидовых гомологов, и аллелей по настоящему изобретению.
Каждая из следующих восьми групп содержит аминокислоты, которые являются консервативными заменами друг для друга: 1) аланин (А), глицин (G), 2) аспарагиновая кислоты (D), глутаминовая кислота (Е), 3) аспарагин (N), глютамин (Q), 4) аргинин (R), лизин (K), 5) изолейцин (I), лейцин (L), метионин (М), валин (V); 6) фенилаланин (F), тирозин (Y), триптофан (W); 7) серии (S), треонин (Т) и 8) цистеин (С), метионин (М) (см., например, Creighton, Proteins (1984)).
"Метка" или "обнаруживаемая часть" представляет собой соединение, обнаруживаемое спектроскопическими, фотохимическими, биохимическими, иммунохимическими, химическими или другими физическими средствами. Например, полезные метки включают в себя 32Р, флуоресцентные красители, электронно-плотные реагенты, ферменты (например, используемые в ELISA), биотин, дигоксигенин, или гаптены и белки, которые могут быть обнаружены, например, путем введения радиоактивной метки в пептид или использоваться для обнаружения антител, специфически связывающихся с пептидом.
Термин "рекомбинантный", при использовании по отношению, например, к клетке, или нуклеиновой кислоте, белку, или вектору, указывает, что клетка, нуклеиновая кислота, белок, или вектор были изменены путем введения гетерологичной нуклеиновой кислоты или белка или путем изменения нативной нуклеиновой кислоты или белка. Также данный термин применим к клетке, которая была получена от модифицированной указанным способом клетки. Так, например, рекомбинантные клетки экспрессируют гены, которых нет в нативных (нерекомбинантных) формах клеток или экспрессируют нативные гены, которые в противном случае экспрессируют аномально, недостаточно или не экспрессируют вообще.
Термин "гетерологичный" при использовании по отношению к участку нуклеиновой кислоты указывает, что нуклеиновая кислота содержит две или более подпоследовательности, которые не встречаются в таком же соотношении друг с другом в природе. Например, такие нуклеиновые кислоты, как правило, получают рекомбинацией и они, как правило, содержат две или более последовательности от неродственных генов соединенные, так, чтобы образовывать новую функциональную нуклеиновую кислоту, например, промотор из одного источника и кодирующую область из другого источника. Также, «гетерологичный белок» указывает на то, что данный белок состоит из двух или более последовательностей, которые не находятся в таком же соотношении друг с другом в природе (например, гибридный белок).
Термин "антитело" относится к полипептиду, который содержит область каркаса, кодируемую генами иммуноглобулинов, или к его фрагменту, который специфически связывает и распознает антиген. Распознанные гены иммуноглобулинов включают гены константной области каппа, лямбда, альфа, гамма, дельта, эпсилон и мю, а также множество генов иммуноглобулинов вариабельной области. Легкие цепи классифицируются как каппа или лямбда. Тяжелые цепи классифицируются как гамма, мю, альфа, дельта, или эпсилон, которые, в свою очередь, определяют класс иммуноглобулина IgG, IgM, IgA, IgD и IgE, соответственно. Как правило, антигенсвязывающий участок антитела, будет наиболее важным для специфичности и аффинности связывания.
Антитело связывается с эпитопом антигена. Эпитоп является сайтом антигена специфическим связывающим антитело, и может включать в себя несколько аминокислот или несколько областей, состоящих из нескольких аминокислот, например, 5 или 6, или более, например, 20 или более аминокислот, или участки этих аминокислот. В некоторых случаях, эпитоп включает в себя небелковые компоненты, например, углеводы, нуклеиновые кислоты или липиды. В некоторых случаях, эпитоп представляет собой трехмерный фрагмент. Так, например, где мишенью является белок, эпитоп может содержать последовательно соединенные аминокислоты, или аминокислоты из разных частей белка, перенесенных в непосредственную близость вследствие фолдинга белка (например, эпитоп прерывистого типа). То же самое верно и для других типов молекул-мишеней, которые образуют трехмерные структуры.
Структурная единица примерного иммуноглобулинов (антитела) включает в себя тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, каждая пара имеет одну "легкую" (около 25 кДа) и одну "тяжелую" цепь (около 50-70 кДа). N-конец каждой цепи определяет вариабельную область примерно из 100-110 или более аминокислот, в первую очередь ответственных за распознавание антигена. Термины вариабельная легкая цепь (VL) и вариабельная тяжелая цепь (VH) относятся к данным легким и тяжелым цепям соответственно.
Антитела существуют, например, в виде интактных иммуноглобулинов или в виде ряда широко известных фрагментов, полученных путем гидролиза различными пептидазами. Так, например, пепсин расщепляет антитела ниже дисульфидных связей в шарнирной области для получения F(ab)'2 - димера Fab, который сам по себе является легкой цепью, соединенной с VH-CH1 дисульфидной связью. F(ab)'2 может быть восстановлен в мягких условиях с разрывом дисульфидных связей в шарнирной области, тем самым димер F(ab)'2 превращается в мономер Fab'. Мономер Fab' это по существу Fab с частью шарнирной области (см. Fundamental Immunology (Paul изд., 3-е изд., 1993). Хотя различные фрагменты антитела определяют в терминах расщепления интактного антитела, специалистам в данной области должно быть понятно, что такие фрагменты могут быть синтезированы de novo либо химически, либо с помощью методов рекомбинантной ДНК. Таким образом, термин "антитело", как он используется в данном документе, также включает в себя фрагменты антител, полученные либо путем модификации целых антител, или синтезированные de novo с использованием методологии рекомбинантных ДНК (например, единая цепь Fv), или те, которые были получены с использованием библиотек фагового дисплея (см., например, McCafferty и др., Nature 348:552-554 (1990)).
Для приготовления подходящих антител по настоящему изобретению, например, рекомбинантных, моноклональных, или поликлональных антител, и для их применения в соответствии с настоящим изобретением, в данной области может быть использовано много известных способов (см., например, Coler Milstein, Nature 256:495-497 (1975); Kozbor и др., Immunology Today 4: 72 (1983); Cole и др., стр.77 - 96, Monoclonal antibodies in cancer therapy Alan P. Liss, Inc (1985); Coligan, Current Protocols in immunology (1991); Harlow & Lane, (1988), Antibodies, A Laboratory Manual, а также Goding, Monoclonal Antibodies: Principles and Practice (2d ed. 1986)). Гены, кодирующие тяжелые и легкие цепи представляющего интерес антитела могут быть клонированы из клеток, например, гены, кодирующие моноклональные антитела, могут быть клонированы из гибридомы и используются для производства рекомбинантных моноклональных антител. Генетические библиотеки, кодирующие тяжелые и легкие цепи моноклональных антител, также могут быть получены из гибридомы или из плазматических клеток. Случайное сочетание тяжелой и легкой цепи генных продуктов генерирует большой пул антител с различной антигенной специфичностью (см., например, Kuby, Immunology (3-е изд. 1997)). Способы для производства антител одной цепи или рекомбинантных антител (патент США 4946778, патент США №4816567) могут быть адаптированы для производства антител к полипептидам по настоящему изобретению. Кроме того, трансгенные мыши или другие организмы, такие как прочие млекопитающие, могут быть использованы для экспрессии гуманизированных или человеческих антител (см., например. Патенты США №5545807, 5545806, 5569825, 5625, 126, 5633425, 5661, 016, Marks и др., Bio/Technology 10:779-783 (1992); Lonberg и др., Nature 368:856-859 (1994), Morrison, природа 368:812-13 (1994); Fishwild и др., Nature Biotechnology 14:845-51 (1996); Neuberger, Nature Biotechnology 14:826 (1996) и Lonberg и Huszar, Inter. Rev. Immunol. 13:65-93 (1995)). Кроме того, технология фагового дисплея может быть использована для выявления антител и гетеромерных фрагментов Fab, которые специфически связываются с выбранным антигеном (см., например, McCafferty и др., Nature 348:552-554 (1990); Marks и др., Bio/Technology 10:779-783 (1992)). Антитела также могут быть сделаны биспецифическими, т.е. способными распознавать два различных антигена (см., например, WO 93/08829, Traunecker и др., EMBO J. 10:3655-3659 (1991) и Suresh и др., Methods in Enzimology 121: 210 (1986)). Антитела могут быть также гетероконъюгатами, например, двумя ковалентно связанными антителами или иммунотоксинами (см., например, патент США №4676980, WO 91/00360, WO 92/200373 и ЕР 03089).
Методы гуманизации или приматизации не человеческих антител хорошо известны в данной области. Как правило, гуманизированное антитело имеет один или несколько аминокислотных остатков, введенных в него из источника, который не является человеком. Эти «не являющиеся человеческими» аминокислотные остатки часто упоминаются как импортные остатки, которые обычно берутся из импортированного вариабельного домена. Гуманизация может главным образом выполняться в соответствии со способом Winter and co-workers (см., например, Jones и др., Nature 321:522-525 (1986); Riechmann и др., Nature 332:323-327 (1988); Verhoeyen и др., Science 239: … 1534-1536 (1988) и Presta, Curr Op Struct Biol 2:593-596 (1992)), путем замены CDR грызунов или CDR последовательностей на соответствующие последовательности человеческого антитела. Соответственно, такие гуманизированные антитела представляют собой химерные антитела (патент США №4816567), в которых существенно меньше, чем интактный человеческий вариабельный домен был заменен на соответствующую последовательностью из нечеловеческих видов. На практике гуманизированные антитела, как правило, представляют собой человеческие антитела, в которых некоторые остатки CDR и, возможно, некоторые остатки FR заменены остатками из аналогичных участков антител грызунов.
"Химерное антитело" является молекулой антитела, в котором (а) константная область или ее часть изменены, перемещены или заменены так, что сайт связывания антигена (вариабельная область) связана с константной областью других антител, или антител другого класса, антител с другой эффекторной функцией и/или антител другого вида, или с совершенно другой молекулой, которая придает новые свойства химерным антителам, например, ферментом, токсином, гормоном, фактором роста, медикаментом и т.д., или (b) вариабельная область или ее участок, изменена, перемещена или заменена на вариабельную область, имеющую отличную или измененную антигенную специфичность. Предпочтительные антитела, по настоящему изобретению, и для использования согласно настоящему изобретению, включают гуманизированные и/или химерные моноклональные антитела.
В одном варианте осуществления антитело конъюгировано с "эффекторной" частью. Эффекторной частью может быть любое количество молекул, в том числе метящие фрагменты, такие как радиоактивные метки или флуоресцентные метки, или может быть терапевтической группой. В одном аспекте антитело модулирует активность белка. Такие эффекторные фрагменты включают, но этим не ограничены, противоопухолевое лекарство, токсин, радиоактивный агент, цитокин, второе антитело или фермент. Кроме того, настоящее изобретение предоставляет вариант осуществления, в котором антитело по настоящему изобретению связано с ферментом, который превращает пролекарство в цитотоксический агент.
Иммуноконъюгат может быть использован для нацеливания эффекторных групп на ανβ8 положительные клетки, в частности, клетки, которые экспрессируют ανβ8. Такие различия могут быть очевидны при просмотре гелевых полосок с одинаковой загрузкой тестовых и контрольных образцов. Примеры цитотоксических агентов включают, но этим не ограничены: рицин, доксорубицин, даунорубицин, таксол, бромистый этидий, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, дигидрокси антрацин дион, актиномицин D, токсин дифтерии, экзотоксин Pseudomonas (РЕ), РЕ40, абрин, глюкокортикоидное и иное химиотерапевтическое средство, а также радиоизотоп. Подходящие обнаруживаемые маркеры включают, но не этим не ограничены, радиоизотопы, флуоресцентные соединения, биолюминесцентные соединения, хемилюминесцентные соединения, хелаты металлов или ферменты.
В некоторых вариантах осуществления, настоящее изобретение предоставляет антитела к ανβ8. Анти-ανβ8 антитела могут быть использованы для системного уменьшения активации TGFβ у индивида самостоятельно или при конъюгации с обнаруживаемой меткой или эффекторной частью. Анти-ανβ8 антитела, конъюгированные с токсичными веществами, такими как рицин, а также неконъюгированные антитела могут быть полезны в качестве терапевтических агентов.
Кроме того, рекомбинантный белок по настоящему изобретению, содержащий антигенсвязывающую область из любого моноклонального антитела настоящего изобретения могут быть использованы для обнаружения и лечения рака. В такой ситуации, антигенсвязывающая область рекомбинантного белка присоединяется, по меньшей мере, к функционально активному участку второго белка, обладающего терапевтической активностью. Второй белок может включать, но этим не ограничен, фермент, лимфокин, онкостатин или токсин. Подходящие токсины включают доксорубицин, даунорубицин, таксол, бромистый этидий, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, дигидроксиантрацин дион, актиномицин D, токсин дифтерии, экзотоксин Pseudomonas (РЕ), РЕ40, рицин, абрин, глюкокортикоид и радиоизотоп.
"Метка" или "обнаруживаемый фрагмент" является диагностическим агентом или компонентом, обнаруживаемым спектроскопическими, радиологическими, фотохимическими, биохимическими, иммунохимическими, химическими или другими физическими средствами. Примерны меток включают в себя радиоактивные метки (например, 111In, 99mTc, 131I, 67Ga) и другие утвержденные FDA (управление по контролю за продуктами и лекарствами) визуализирующие средства. Дополнительные метки включают в себя 32P, флуоресцентные красители, электронно-плотные реагенты, ферменты, биотин, дигоксигенин, или гаптены и белки или другие вещества, которые могут быть обнаружены, например, путем включения радиоактивной метки в целевой агент. Для конъюгации нуклеиновой кислоты или наноносителя с меткой может быть использован любой способ, известный в данной области, например, способы, описанные в Hermanson, Bioconjugate Technologies 1996 г., Academic Press, Inc, Сан-Диего.
"Меченым" или "помеченным" антителом или агентом является связанный с меткой, ковалентно, через линкер или через химическую связь, или нековалентно, через ионные связи, связи Ван-дер-Ваальса, электростатические связи или водородные связи, так что присутствие антител или агента может быть обнаружено путем обнаружения присутствия метки, связанной с антителом или агентом.
Методы конъюгации обнаруживаемых и терапевтических агентов с антителами хорошо известны (см., например, Amon и др., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", in Monoclonal Antibodies And Cancer Therapy, Reisfeld et al. (Ред.), стр.243-56 (Alan R. Liss, Inc 1985); Hellstrom и др., "Antibodies For Drug Delivery" in Controlled Drug Delivery (2-е изд), Robinson и др. (ред.), стр.623 - 53 (Marcel Dekker, Inc 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review" in Monoclonal Antibodies '84: Biological And Clinical Applications, Pinchera и др. (ред.), стр.475-506. (1985), а также Thorpe и др., "The Preparation And Cytotoxic Properties Of Antibody-Toxin Conjugates", Immunol. Rev.. 62:. 1. 19-58 (1982)).
Фраза "специфично (или селективно) связывается" с антителом или "специфично (или селективно) иммунореактивен с", когда речь идет о белке или пептиде, относится к реакции связывания, определяющей присутствие белка, часто в гетерогенной популяции белков и других биопрепаратов. Таким образом, при указанных условиях иммуноанализа, специфичные антитела связываются с конкретным белком, по меньшей мере, в два раза и что более типично, более чем в 10-100 раз сильнее, чем фон. Специфическое связывание с антителом в таких условиях требует антитела, которые выбирают по его специфичности к конкретному белку. Например, можно провести отбор среди поликлональных антител для получения только тех поликлональных антител, которые специфически иммунореактивны с выбранным антигеном, но не с другим белком. Этот отбор может быть осуществлен путем изымания из пула тех антител, которые перекрестие реагируют с другими молекулами. Могут быть использованы различные форматы иммуноанализа для отбора антител, специфически иммунореактивных с определенным белком. Например, для отбора антител, специфически иммунореактивных с белком, обычно используются твердофазный иммуноферментный анализ ELISA (см., например, Harlow & Lane, Using Antibodies, A Laboratory Manual (1998) для описания иммунологического форматов и условий, которые могут быть использованы для определения специфической иммунореактивности).
Под "терапевтически эффективной дозой или количеством" подразумевают дозу, которая производит эффекты, для которых она вводится. Точная доза и технология приготовления данного лекарственного средства будет зависеть от целей лечения, и может быть установлена специалистом в данной области с использованием известных способов (см., например, Lieberman, Pharmaceutical Dosage Forms (т.1-3, 1992); Lloyd, The Art, Science and Technology of Pharmaceutical Compounding (1999); Remington: The Science and Practice of Pharmacy, 20th Edition, Gennaro, Editor (2003), and Pickar, Dosage Calculations (1999)).
Термин "фармацевтически приемлемые соли" или "фармацевтически приемлемый носитель" означает включение солей активных соединений, которые приготовлены из относительно нетоксичных кислот или оснований, в зависимости от конкретных заместителей, найденных в соединениях, описанных в данном документе. Когда соединения по настоящему изобретению содержат относительно кислые функциональные группы, соли присоединения оснований можно получить при контактировании нейтральной формы таких соединений с достаточным количеством желаемого основания, либо в чистом виде или в подходящем инертном растворителе. Примерами фармацевтически приемлемых солей присоединения основания включают натриевую, калиевую, кальциевую, аммониевую, органическую амино или магниевую соли, или сходные соли. Когда соединения по настоящему изобретению содержат относительно основные функциональные группы, соли присоединения кислот можно получить при контактировании нейтральной формы таких соединений с достаточным количеством желаемой кислоты либо в чистом виде или в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения кислоты включают в себя соли, полученные из неорганических кислот, таких как соляная, бромистоводородная, азотная, карбоновая, моногидрокарбоновая, фосфорная, моногидрофосфорная, дигидрофосфорная, серная, моногидросерная, йодистоводородная, или фосфористая кислота и т.п., а также соли, полученные из относительно нетоксичных органических кислот, таких как уксусная, пропионовая, изомасляная, малеиновая, малоновая, бензойная, янтарная, субериновая, фумаровая, молочная, миндальная, фталевая, бензолсульфоновая, п-толилсульфоновая, лимонная, винная, метансульфоновая, и тому подобное. Также включены соли аминокислот, такие как аргинат и т.п., а также соли органических кислот, таких как глюкуроновой или галактуроновой кислоты и т.п. (см., например, Berge et al., Журнал Pharmaceutical Science 66: 1-19 (1977)). Определенные специфические соединения по настоящему изобретению содержат как основные, так и кислые функциональные группы, которые позволяют данным соединениям быть преобразованными в соли присоединения оснований или кислот. Другие фармацевтически приемлемые носители, известные специалистам в данной области также являются подходящими для настоящего изобретения.
Нейтральные формы соединений могут быть восстановлены контактированием соли с основанием или кислотой и выделения исходного соединения обычным способом. Исходная форма соединения отличается от различных форм его солей по определенным физическим свойствам, таким, как растворимость в полярных растворителях, но в противном случае соли эквивалентны исходной форме соединения в контексте настоящего изобретения.
В дополнение к солевым формам, настоящее изобретение предоставляет соединения, которые находятся в пролекарственной форме. Пролекарственными соединениями, описанные в настоящем документе, являются те соединения, которые легко вступают в химические изменения в физиологических условиях для обеспечения соединений по настоящему изобретению. Кроме того, пролекарства могут быть преобразованы в соединения по настоящему изобретению с помощью химических или биохимических методов в среде ex vivo. Например, пролекарства могут медленно превращаться в соединения по настоящему изобретению, когда их помещают в резервуар трансдермального пластыря с подходящим ферментом или химическим реагентом.
Некоторые соединения настоящего изобретения могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. В целом, сольватированные формы эквивалентны несольватированным формы и охватываются объемом настоящего изобретения. Некоторые соединения настоящего изобретения могут существовать в нескольких кристаллических или аморфных формах. В целом, все физические формы эквивалентны для применений, предусмотренных настоящим изобретением, и охватываются объемом настоящего изобретения.
Некоторые соединения по настоящему изобретению имеют асимметричные атомы углерода (оптические центры) или двойные связи; рацематы, диастереомеры, геометрические изомеры и индивидуальные изомеры охватываются объемом настоящего изобретения.
Термин "уменьшение", "снижение" или "сокращение", когда он используется в контексте оуβ8-опосредованной активации TGFR относится к любому обнаруживаемому отрицательному изменению или уменьшению количества параметра, который отражает активацию TGFβ, no сравнению со стандартным значением, полученным в тех же условиях, но в отсутствие агента, описанного выше (например, анти-ανβ8 антагониста, анти-аνβ8 антитела и иммуноконъюгата). Уровень данного снижения после воздействия агента, как описано в настоящем документе (например, анти- аνβ8 антагониста, анти-ανβ8 антитела и иммуноконъюгата) составляет, в некоторых вариантах, по меньшей мере, 10% или 20%, а более предпочтительно, по меньшей мере, 30%, 40%, 50%, 60%, 70%, 80% или 90%, и наиболее предпочтительно 100%.
Термин "конкурировать", как он используется в данном документе в связи с антителами, означает, что первое антитело или его антигенсвязывающая часть, конкурирует за связывание со вторым антителом или его антигенсвязывающей частью, где связывание первого антитела с распознаваемым им эпитопом детектируемо снижается в присутствии второго антитела по сравнению со связыванием первого антитела в отсутствие второго антитела. В качестве необязательной альтернативы, где связывание второго антитела с его эпитопом также детектируемо снижается в присутствии первого антитела. То есть, в некоторых случаях первое антитело может ингибировать связывание второго антитела с его эпитопом без ингибирования связывания вторым антителом первого антитела с соответствующим эпитопом. Однако, в других случаях каждое антитело детектируемо ингибирует связывание другого антитела с распознаваемым им эпитопом или лигандом, в той же, большей, или меньшей степени, в этих случаях антитела называются "перекрестно-конкурирующими" друг с другом за связывание соответствующего эпитопа(ов). Конкурирующие и перекрестно-конкурирующие антитела охватываются настоящим изобретением. Независимо от механизма, посредством которого происходит подобная конкуренция или перекрестная конкуренция (например, стерических препятствий, конформационных изменений, или связывания с общим эпитопом, или его частью, и т.п.), специалистам в данной области должно быть понятно, на основании сведений из данного документа, что подобные конкурирующие и/или перекрестно конкурирующие антитела включены в объем настоящего изобретения и могут применяться в способах, раскрытых в данном документе.
Известны многочисленные типы анализа конкурентного связывания, например: твердофазный прямой или непрямой радиоиммуноанализ (RIA), твердофазазный прямой или непрямой иммуноферментный анализ (EIA), анализ конкуренции типа сэндвич (см. Stahli и др., (Methods in Enzymology 9:242-253 (1983)); твердофазный прямой EIA биотин-авидин (см. Kirkland и др., J. Immunol 137:3614-3619 (1986 год.)); твердофазный анализ прямого мечения, твердофазный сэндвич-анализ прямого мечения (см. Harlow и Lane, Harlow and Lane, Antibodies, A Laboratory Manual, Cold Spring Harbor Press (1988)); твердофазный RIA прямого меченого с использованием 1-125 меток (see Morel et al, Molec. Immunol. 25(1):7- 1 5 (1988)); твердофазный Е1А с прямым мечением биотин-авидин (Cheung и др., Virology 176:546-552 (1990)); RIA с прямым мечением (Moldenhauer и др., Scand. J. Immunol. 32:77-82 (1990)). Как правило, такой анализ предполагает использование очищенных антигенов, связанных с твердой поверхностью или клеткой, несущей один из непомеченных тестовых иммуноглобулинов или помеченный эталонный иммуноглобулин. Конкурентное ингибирование измеряется путем определения количества меток, связанных с твердой поверхностью или с клетками в присутствии тестового иммуноглобулина. Обычно тестовый иммуноглобулин присутствует в избытке. Антитела, определенные конкурентным анализом (конкурирующие антитела) включают в себя антитела, связывающиеся с тем же эпитопом, что и эталонные антитела, и антитела, связывающиеся с соседними эпитопами достаточно близко к эпитопу с которым связывается эталонное антитело для осуществления стерического препятствия. Обычно, когда конкурирующие антитела присутствуют в избытке, они будут препятствовать специфическому связыванию эталонного антитела с общим антигеном, не менее чем на 50 или 75%.
Активация TGFβ
Трансформирующий фактор роста β (TGFβ) первоначально был охарактеризован как белок (секретировавшийся из линии опухолевых клеток), который был способен индуцировать трансформированный фенотип в неопухолевых клетках в культуре. Этот эффект был обратимым, как показало возвращение клеток к нормальному фенотипу при последующем удалении TGFβ. На сегодня идентифицированы TGFβ1-TGFβ5. Эти белки имеют сходные аминокислотные участки.
TGFβ оказывают пролиферативные эффекты на многие мезенхимальные и эпителиальные типы клеток. При определенных условиях TGFβ демонстрирует анти-пролиферативное воздействие на эпителиальные клетки, эндотелиальные клетки, макрофаги и Т- и В- лимфоциты. Такие эффекты включают снижение секреции иммуноглобулина и подавление кроветворения, миогенеза, адипогенеза и адреналового стероидогенеза. Несколько членов семейства TGFβ являются мощными индукторами мезодермальной дифференциации в ранних эмбрионах, в частности, TGF-β и активина А.
TGFβ, в частности, TGFβ1, 2, и 3, являются мультипотентными цитокинами, которые являются важными модуляторами роста клеток, воспаления, синтеза матрикса, иммунной системы, ангиогенеза и апоптоза (Taipale et al.). Дефекты в функции TGFβ связаны с рядом патологических состояний, в том числе иммуносупрессии, ростом опухолевых клеток, фиброзом и аутоиммунными заболевания (Blobe et al.). TGFβ являются прототипами надсемейства TGFβ, которое состоит более чем из 40 членов, которые контролируют ключевые события раннего развития, структурировании, восстановления тканей и ран. TGFβ высвобождается как часть латентного комплекса, в котором цитокин не может взаимодействовать с его рецептором.
Чтобы TGFβ получил возможность передавать сигнал он должен быть освобожден от своих неактивного комплекса процессом, называемым активацией TGFβ. Латентный комплекс TGF включает в себя 3 составляющие: активный (зрелый) димер TGFβ, LAP (латентно-ассоциированный пептид) и LTBP (латентный TGFβ, связывающий белок). LAP является димером с дисульфидной связью, который представлен N-концевой частью белка-предшественника TGFβ. Зрелый белок TGFβ представляет С-концевую часть (около 25 кДа) предшественника. Связь между TGFβ и LAP протеолитически расщепляется в комплексе Гольджи, но пропептид TGFβ остается связанным с TGFβ нековалентными взаимодействиями. Комплекс TGFβ и LAP называется малым латентным комплексом (SLC). Эта ассоциация LAP и TGF придает латентность. Связывание LAP - TGFβ является обратимым и изолированные очищенные компоненты могут комбинироваться с образованием неактивного SLC. SLC и более большой комплекс называются в данном документе латентным TGFβ, так как оба являются неактивными.
Необычность свойств TGFR состоит в том, что его активность ограничивается путем превращения латентного TGFβ в активный TGFR (этот процесс называется активацией латентного TGFβ). Ткани содержат значительные количества латентных TGFβ и активация лишь небольшой части данных латентных TGFβ генерирует максимальные клеточные реакции (Annes et al. (2003) J. Cell Sci. 116:217). Латентность обеспечивается путем нековалентного взаимодействия пропептида TGFβ, которая также называют латентно ассоциированным белком (LAP). Активация происходит при расщеплении связи между зрелыми TGFβ и LAP. Латентный TGFβ, является, таким образом, белком-предшественником зрелого, активного TGFβ.После активации TGFβ связывает и сближает свои высокоаффинные рецепторы серин/треонин киназы типа I и типа II и инициирует каскад передачи сигнала.
Имеется различие между терминами "активация TGFβ" и "процессинг TGFβ". Для TGF-β, термин "процессинг TGFβ" относится к протеолитическому расщеплению связи между TGF-β и LAP. Без расщепления при любых условиях активность TGF-R не может быть обнаружена в предшественнике TGF-β. Расщепление является необходимым условием для активности TGFβ. Термин "активация TGFβ" относится к освобождению димера TGF-β от его взаимодействия с LAP. Таким образом, "процессированный" предшественник TGF-β имеет потенциал, чтобы быть активированым, то есть высвободить TGF-β, в то время как непроцессированный TGF-β не может быть активирован без первоначального расщепления (процесинга) пропептидной связи.
Некоторые молекулы были описаны как активаторы латентного TGFβ. Первый это осуществляемый за счет протеаз клеточный процесс активации, в нем несколько типов клеток преобразуют LLC, который конститутивно производится большинством клеток, в активный TGFβ протеазозависимой реакцией. Для активации латентного TGFβ требуется: а) протеаза - урокиназный активатор плазминогена (uPA), b) активация субстрата uPA - плазминогена (зимогена из протеазы плазмина), с) связывание LAP с манноза-6 (М6Р) фосфат/IGF-Il рецепторами клеточной поверхности, d) LTBP (белок, связывающий латентный TGFR), и д) трансглутаминазы, так как антитела и/или ингибиторы каждого из этих реагентов блокируют активацию латентного TGFβ. Ряд других протеаз, в том числе ММР-2, ММР-9, плазмин, кальпаин, химаза, и эластаза впоследствии были описаны как активаторы латентного TGFβ (Koli, и др. (2001)).
Второй механизм для активации латентного TGF включает в себя взаимодействие белка клеточного матрикса тромбоспондина (TSP-1) с латентным TGFβ в мульти-молекулярном комплексе, содержащем рецепторы TSP-1, а также CD36, и, в некоторых случаях, плазмин. Активация латентного TGFβ включает в себя прямое взаимодействие между TSP-1 и LAP, и включает в себя трипептид последовательности RFK, найденный в повторах TSP-1 типа 1. Этот пептид, как полагают, взаимодействуют с консервативным тетра-пептидом LSKL на амино-конце LAP, разрушая нековалентные связи между LAP и TGF-β. Тетра-пептид KRFK будет активировать латентные TGF-β m vitro и in vivo, в то время как добавление пептида LAP (LSKL) в избытке блокирует активацию латентного TGF-β. Мыши TSP-1 -/- проявляют частично перекрывающийся фенотип с мышами TGF-β -/- в отношении усиленного воспаления. Назначение пептида блокирующего LSKL мышам дикого типа вызывает патологию поджелудочной железы и легких, аналогичные наблюдаемым у животных TGF-β -/-, в то время как добавление активирующего пептида KRTK к мышам TSP-1 -/- возвращает фенотип к норме. Тем не менее, фенотип мыши TSP-1 -/- не полностью повторяет фенотип мыши TGF-β1 -/-, также фенотип TSP-1 -/- не проявляет сходство с фенотипом мышей TGFβ2 -/- или TGF-β3 -/-. Эти расхождения позволяют снова предположить, что возможны множественные и изоформ-специфичные механизмы активации латентного TGF-β.
Латентный TGF-β может быть активирован слабой кислотой (рН 4,5), которая, вероятно, дестабилизирует взаимодействия между LAP и TGF-β. Однако, за исключением особых ситуаций, например таких, когда внеклеточный компартмент образован остеокластами в процессе костной резорбции, такой рН, вероятно, редко достигается во внеклеточной среде in vivo. Таким образом, рН вряд ли будет общим механизмом для активации TGF-β.
Пропептиды TGF-β1 и β3, но не пропептид TGF-β2, содержат последовательность узнавания интегрина RGD. TGF-β1 и TGFβ3 LAP взаимодействуют с клетками, экспрессирующими интегрины ανβ4 и ανβ5. Хотя связывание латентного TGF-β с этими интегринами не приводит к активации, связывание латентного TGF-β с ανβ6 приводит к активации (Munger et al. (1999) Cell 96:319). Активация латентного TGF-β1 или β3 посредством ανβ6 требует последовательность RGD, так как мутантные формы TGF-β1 или β3, содержащие RGE, не могут быть активированы.
Интегрин ανβ8, в сочетании с МТ1-ММР, активизирует латентный TGFβ (Mu et al. (2002) J. Cell Biol. 159:493). Интегрин ανβ8 экспрессируется прежде всего в нормальном эпителии (например, в эпителии дыхательных путей), мезенхимальных клетках и нейронах тканей. Взаимодействие экспрессированного на поверхности клеток ανβ8 с латентным TGFβ в клеточном матриксе, что вызывает рекрутинг МТ1-ММР в комплекс, где протеаза расщепляет латентный TGFβ и высвобождает активный, зрелый TGFβ пептид, считается уникальным механизмом.
Биоанализ TGFβ
Для определения активации TGFβ в анализе сокультивирования, тестируемые клетки, экспрессирующие νβ8, совместно культивируют с TMLC клетками, которые являются эпителиальными клетками легкого норки, стабильно трансфицированные геном люциферазы под контролем промотора ингибитора активатора плазминогенна-1, чувствительного к TGF-β (Abe et al. (1994) Annal Biochem 216:276). TMLC клетки сильно реагируют на TGF-β и дают очень низкий фон. TMLC клетки, таким образом, могут быть использованы для сокультивирования с другими клеточными линиями или в бесклеточной фракции, для проверки на присутствие активных TGF-β с использованием люминесценции для считывания данных. Анализы проводят в присутствии или отсутствие анти-TGF-β-блокирующих антител (10 мкг/мл, 1D11, R & D Systems), анти-β8 (20 мкг/мл, 37E 1 В5) или анти-β8 (150 мкг/мл, 10D5), как описано (Abe (1994); Munger (1999).
Для измерения активного TGF-β в опухолевой ткани, равную массу опухолевой ткани измельчают и инкубируют в стерильном DME в течение 30 мин при 4°С. Супернатанты, содержащие активные TGF-β, собирают после центрифугирования (20 g) при 4°С. Осадки затем инкубируют в бессывороточной DME течение 20 мин при 80°С, чтобы активировать SLC, после чего отбирают супернатант. Супернатанты, содержащие активный или тепло-активированный (латентный) TGF-β, затем добавляют к предварительно посеянным клеткам TMLC с или без 1D11. Для анализа ингибитора протеазы, ингибиторы добавляются при начале сокультивирования. Максимальная доза каждого ингибитора определяется как наибольшая концентрация, которых не подавляет способность TMLC клеток реагировать на рекомбинантные активные TGF-β. Для измерения активности растворимых TGF-β в культивируемых клеток, клетки инкубируют в 100 мкл полной среды с или без 37Е1 или 10D5 в течение 1 ч при температуре 37°С при легким вращении. Бесклеточные супернатанты отбирают путем центрифугирования (20 g) в течение 5 мин при 4°С и затем добавляют к предварительно посеянным клеткам TMLC в присутствии или отсутствии 1D11. Для анализа растворимого рецептора, используют кондиционированную среду полученную из суточных культур клеток. Относительные единицы люциферазы определяют как активность минус фоновая активность репортерных клеток TMLC.
Антитела по настоящему изобретению
Настоящее изобретение предоставляет антитела, которые специфически связываются с интегрином ανβ8, но практически не связываются с другими интегринами (например, ανβ6, ανβ3 и т.д.). Антитела по изобретению могут связываться с конкретным эпитопом или в области эпитопа в пределах ανβ8. Эпитоп может быть конформационным (нелинейным) или неконформационным эпитопом. Такие антитела могут связываться только с β8, т.е. эпитоп находится внутри β8. Связывание антитела по изобретению может потребовать область эпитопа вне β8, например, конформационный эпитоп, или зависящий от элементов как внутри αν, так и внутри β8.
В некоторых вариантах осуществления антитело связывается с β8 и ингибирует активацию TGFR, например, по сравнению с активацией TGFβ в отсутствие антител. В некоторых вариантах осуществления антитело не уменьшает адгезию клеток, экспрессирующих ανβ8, к TGFβ, то есть антитела не уменьшают опосредованную ανβ8 адгезию клеток к TGFβ. В некоторых вариантах осуществления антитело может уменьшить связывание растворимого ανβ8 с TGFβ, по сравнению со связыванием ανβ8 при отсутствии антител. В некоторых вариантах осуществления антитела могут связываться с эпитопом на β8, находящимся в пределах SEQ ID NO:11. В некоторых вариантах осуществления эпитоп содержит, по меньшей мере, одну аминокислоту, выбранную из аминокислот, R79, I85, S95, Р100, I108, Р109, R128, Н140 и F179 человеческого β8. В некоторых вариантах осуществления эпитоп содержит, по меньшей мере, одну аминокислоту, выбранную из аминокислот 174, N88, I107, T110, I125, R175 или F180 человеческого β8. В некоторых вариантах эпитоп содержит, по меньшей мере, одну аминокислоту, выбранную из аминокислот, 1125, R128, R175, F179 и F180 человеческого β8. В некоторых вариантах осуществления антитело связывается с человеческим β8, но не с β8 мышей.
Сайт связывания, т.е. эпитоп, антитела, направленного против данного антигена можно определить с помощью способов, известных в данной области. Например, конкурентный анализ (например, конкурентный ELISA) может быть осуществлен с использованием антитела к известному эпитопу. Если тестовые антитела конкурируют за связывание антигена, то, вероятно они делят, по меньшей мере, часть одинакового эпитопа. Эпитоп также может быть локализован с использованием перетасовки доменов или селективного мутагенеза антигена. То есть, любая область, или любая аминокислота данного антигена могут быть перетасованы, или замещены аминокислотами или компонентами, которые, как известно, не взаимодействуют с тестовыми антителами. Если замена данной области или аминокислоты уменьшает связывание тестовых антител с замещенным антигеном по сравнению с незамещенным антигеном, то данная область или аминокислота, вероятно, содержаться в эпитопе.
Настоящее изобретение относится к антителам, которые селективно нарушают ανβ8-опосредованную активацию TGF-β (например, выход зрелых, активных TGFβ из латентного TGFβ на поверхность клетки), но, в некоторых вариантах осуществления, антитело значительно не воздействует на адгезию ανβ8 (например, на ανβ8-экспрессирующих клетках) к латентному TGFR. Некоторые антитела характеризуются высокой степенью селективности в нарушении только интегрин ανβ8-опосредованной активации TGF-β, а не свойств клеточной адгезии, что может быть нежелательно ингибировать. Некоторые антитела блокируют TGFβ активацию локально, где экспрессирует интегрин ανβ8.
Примерные антитела по изобретению имеет вариабельную область легкой цепи, содержащую три CDR легкой цепи: SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, и вариабельную область тяжелой цепи, содержащую три CDR тяжелой цепи: SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10. Антитела по настоящему изобретению также включают в себя антитела, конкурирующие за связывание с ανβ8 с антителом, имеющим вариабельную область легкой цепи, содержащую три CDR легкой цепи: SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, и вариабельную область тяжелой цепи, содержащую три CDR тяжелой цепи: SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10. Первый остаток SEQ ID NO:9 может быть либо R или Y. Предполагается, что другие консервативные замены R или Y также будет работать. Изотип антитела может быть IgG1, IgG2, IgG2a, IgG3 или IgG4.
Соответственно, антителами по настоящему изобретению может быть антитело, имеющее вариабельный участок легкой цепи либо с SEQ ID NO:3 либо с SEQ ID NO:4 и вариабельный участок тяжелой цепи либо с SEQ ID NO:1 либо с SEQ ID NO:2. В некоторых вариантах осуществления антитела настоящего изобретения имеют вариабельный участок легкой цепи из SEQ ID NO:3 и вариабельный участок тяжелой цепи SEQ ID NO:1. В некоторых вариантах осуществления антитела по настоящему изобретению имеют вариабельный участок легкой цепи SEQ ID NO:4 и вариабельный участок тяжелой цепи из SEQ ID NO:2. Двумя образцами антител являются 37Е1 и 37Е1В5.
Антитела по настоящему изобретению могут быть поликлональными или моноклональными. Поликлональные сыворотки, как правило, содержат смешанные популяции антител, специфически связывающиеся с несколькими эпитопами по всей длине ανβ8. Тем не менее, поликлональная сыворотка может быть специфичной для определенного сегмента ανβ8. Примерные антитела представляют собой химерные, гуманизированные (см. Queen и др., Proc. Natl. Acad. Sci. USA 86: 10029-10033 (1989) и WO 90/07861, US 5,693,762, US 5,693,761, US 5,585,089, US 5,530, 101 and Winter, US 5,225,539), или человеческие (Lonberg и др., WO 93/12227 (1993); US 5,877,397, US 5,874,299, US 5,814,318, US 5,789,650, US 5,770,429, US 5,661,016, US 5,633,425, US 5,625,126, US 5,569,825, US 5,545,806, Nature 148, 1547-1553 (1994), Nature Biotechnology 14, 826 (1996), Kucherlapati, WO 91/10741 (1991)) EP 1481008, Bleck, Bioprocessing Journal 1 (Sept/Oct. 2005), US 2004132066, US 2005008625, WO 2004072266, WO 2005065348, WO 2005069970, and W02006055778. В некоторых вариантах осуществления антитела, являются гуманизированными или химерными формами 37Е1, или 37Е1В5. Человеческий изотип IgGI, IgG2, IgG3 или IgG4 может быть в гуманизированных или химерных антителах. Некоторые антитела специфически связываются с ανβ8 с аффинностью связывания большей или равной приблизительно 107, 108, 109, 1010, 10 или 10-12 М-1.
Антагонисты интегрина ανβ8
Кроме того, предполагается, что могут быть использованы различные антагонисты интегрина ανβ8, природные или синтетические. Такие антагонисты включают, например, пептиды или малые молекулы. Антагонисты могут включать, в себя, например, фармацевтические препараты, терапевтические средства, экологические, сельскохозяйственные, промышленные агенты, загрязняющие вещества, космецевтики, медикаменты, органические соединения, липиды, глюкокортикоиды, антибиотики, пептиды, белки, сахара, углеводы и химерные молекулы. В некоторых вариантах осуществления антагонист интегрина ανβ8 является пептидом, например, TGFβ1-специфичным пептидом например, TGFβ3-специфичным пептидом. Примеры TGFβ-специфичных пептидов включают, но этим не ограничены, пептиды, содержащие GRRGDLATIH (Mu et al. (2002) Journal of Cell Biology 157:493-507), и пептид, содержащий HGRGDLGRLK. В некоторых вариантах осуществления антагонист снижает активацию TGFR, но практически не ингибируют аура-опосредованную адгезию клеток к TGFβ.
Показания
Предполагается, что анти-ανβ8 антагонисты, анти-ανβ8 антитела или иммуноконъюгаты, композиции и способы по настоящему изобретению могут быть использованы для выявления, лечения или профилактики хронической обструктивной болезни легких (ХОБЛ) и астмы.
Кроме того, предполагается, что анти-ανβ8 антагонисты, анти-ανβ8 антитела или иммуноконъюгаты, композиции и способы по настоящему изобретению могут быть использованы для выявления, лечения или предотвращения воспалительных аутоиммунных заболеваний мозга, рассеянного склероза, демиелинизирующих заболеваний (например, поперечного миелита, болезни Девика, синдрома Гийена-Барре), нейровоспаления, болезни почек, или глиомы.
Кроме того, предполагается, что анти-ανβ8 антагонисты, анти- ανβ8 антитела или иммуноконъюгаты, композиции и способы по настоящему изобретению могут быть использованы для выявления, лечения или предотвращения артрита.
Кроме того, предполагается, что анти-ανβ8 антагонисты, анти- ανβ8 антитела или иммуноконъюгаты, композиции и способы по настоящему изобретению могут быть использованы для выявления, лечения или предотвращения различных фиброзных расстройств, таких как фиброз дыхательных путей, идиопатический легочный фиброз, неспецифическая интерстициальная пневмония, постинфекционный фиброз легких, диффузное альвеолярное повреждения, связанный с фиброзом легких коллагеноз, индуцированный лекарствами фиброз легких, силикоз, фиброз легких, связанный с асбестом, дыхательный бронхиолит, дыхательный бронхиолит ассоциированный с интерстициальным заболеванием легких, десквамативный интерстициальный фиброз, криптогенная пневмония, хроническая аллергическая пневмония, медикаментозный фиброз легких, фиброз почек, фиброз печени.
Кроме того, предполагается, что анти-ανβ8 антагонисты, анти- ανβ8 антитела или иммуноконъюгаты, композиции и способы по настоящему изобретению могут быть использованы для выявления, лечения или предотвращения аденокарциномы, плоскоклеточного рака, рака молочной железы и роста раковой опухоли и метастазов.
Диагностические композиции
Обнаруживаемая группа может быть связана с антителом по настоящему изобретению, либо непосредственно, либо косвенно, например, через хелатор или линкер. Меченые антитела могут быть введены индивиду для определения применимости намеченной терапии. Например, меченые антитела могут быть использованы для обнаружения плотности интегрина β8 внутри пораженной области, где плотность, как правило, высока по сравнению с непораженной тканью. Меченые антитела могут также указывать, на доступность пораженной области для терапии. Таким образом, на основании результатов визуализации пациентам может быть назначена терапия. Анатомические характеристики, такие, как определение точных границ раковой опухоли, может быть осуществлено с использованием стандартных методов визуализации (например, СТ (компьютерной томографии (КТ)), MRI (магнитно-резонансной томографии (МРТ)), PET (позитронно-эмиссионной томографии ПЭТ) и др.
Диагностическое средство, содержащее антитела по настоящему изобретению, может включать в себя любое диагностическое средство известное в данной области, как это предусмотрено, например, в следующих источниках: Armstrong и др., Diagnostic Imaging, 5th Ed., Blackwell Publishing (2004); Torchilin, V.P., Ed., Targeted Delivery of Imaging Agents, CRC Press (1995); Vallabhajosula, S., Molecular Imaging: Radiopharmaceuticals for PET and SPECT, Springer (2009). Диагностическое средство может быть обнаружено с помощью различных способов, в том числе с помощью средства, обеспечивающего и/или усиливающего обнаруживаемый сигнал. Обнаруживаемые сигналы включают, но не этим не ограничены, гамма-излучающие, радиоактивные, эхогенные, оптические, люминесцентные, абсорбирующие, магнитные или томографические сигналы. Способы визуализации диагностического средства могут включать, но не этим не ограничены, SPECT (однофотонную эмиссионную компьютерную томографию), магнитно-резонансное исследование MRI, оптическую визуализацию, позитронно-эмисионную томографию PET, компьютерной томографию (КТ), визуализацию в рентгеновских лучах, визуализацию в гамма-лучах, и тому подобное. Термины "обнаруживаемый агент", "обнаруживаемый фрагмент", "метка", "визуализирующий агент" и подобные термины настоящем документе использованы в качестве синонимов.
Радиоизотопы могут быть включены в диагностические средства, описанные в настоящем документе, и могут включать в себя радионуклиды, испускающие гамма-лучи, позитроны, бета- и альфа- частицы и рентгеновское излучение. Подходящие радионуклиды включают в себя, но этим не ограничены: 225Ас, 72As, 211At, 11В, 128Ва, 212Bi, 75Br, 77Br, 14C, 109Cd, 62Cu, 64Cu, 67Cu, 18F, 67Ga, 68Ga, 3H, 166Ho, 123I, 124I, 125I, 130I, 131I, 111In, 177Lu, 13N, 150, 32P, 33P, 212Pb, 103Pd, 186Re, 188Re, 47Sc, 153Sm, 89Sr, 99mTc, 88Y and 90Y. В некоторых вариантах осуществления радиоактивные вещества могут включать в себя 111In-DTPA, 99mTc(СО)3-ОТРА, 99mTc(CO)3-ENPy2, 62/64/67Cu-ТЕТА, 99mTc(CO)3-IDA, и 99mTc(CO)3-триамины (циклические или линейные). В других вариантах осуществления агенты могут включать DOTA (1,4,7,10-тетрааза-циклододекан-тетрауксусную кислоту) и его различные аналоги с 11In, 177Lu, 153Sm, 88/90Y, 62/64/67Cu, или 67/68Gu. В некоторых вариантах осуществления, наночастицы могут быть помечены включением липидов прикрепленных к хелатам, таким как ВТРА(диэтилентриаминпентаацетат)-липиды, как это предусмотрено в следующих источниках: Phillipsn др., Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology, 1 (I): 69-83 (2008); Torchilin, V.P. & Weissig, V., Eds. Liposomes 2nd Ed.: Oxford Univ. Press (2003); Elbayoumi, T.A. & Torchilin, V.P., Eur. J. Nucl. Med. Mol. Imaging 33: 1196-1205 (2006); Mougin-Degraef M. и др., Int'l. J. Pharmaceutics 344: 110-117(2007).
В некоторых вариантах осуществления диагностический агент может включать в себя, хелаторы, связывающиеся, например, с ионами металла, используемые для различных диагностических методов визуализации. Примеры хелаторов включают в себя, но этим не ограничены: этилендиаминтетрауксусную кислоту (EDTA), 4-(1,4,8,11-тетраазациклотетрадек-1-ил-метил бензойную кислоту (СРТА), циклогександиаминтетрауксусную кислоту (CDTA), этиленгликольтетрауксусную кислоту (EGTA), диэтилентриаминпентауксусную кислота (DTPA), лимонную кислоту, этилендиамингидроксиэтилтриацетат (HEDTA), иминодиуксусную кислоту (IDA), триэтиленгликольтетраамингексаацетат (ТТНА), 1,4,7, 10-тетраазациклодо декан-1,4,7,10-тетра(метиленфосфорную кислоту) (DOTP), 1,4,8,1,1-тетраазациклотетрадекан-1,4,8,11-тетраацетат (ТЕТА), 1,4,7,10-тетраазациклодо декан-1, 4,7,10-тетраацетат (DOTA), N1,N1-бис-(пиридин-2-ил-метил)этан-1,2-диамин (ENPy2) и их производные.
В некоторых вариантах диагностический агент может быть связан с вторичным связывающим лигандом или ферментом (ферментной меткой), которые будут генерировать окрашенный продукт при контакте с хромогенным субстратом. Примеры подходящих ферментов включают уреазу, щелочную фосфатазу, пероксидазу хрена и оксидазы глюкозы. Вторичные связывающие лиганды включают в себя, например, биотин и авидин или стрептавидин или соединения, известные в данной области.
В некоторых вариантах осуществления, диагностические средства могут включать в себя оптические агенты, такие как флуоресцентные агенты, фосфоресцирующие агенты, хемилюминесцентные агенты, и тому подобное. Многочисленные агенты (например, красители, датчики, метки, или индикаторы) известны в данной области и могут быть использованы в настоящем изобретении. (См., например, Invitrogen, The Handbook - A Guide to Fluorescent Probes and Labeling Technologies, Tenth Edition (2005)). Флуоресцентные агенты могут включать в себя различные органические и/или неорганические малые молекулы или различные флуоресцентные белки и их производные. Например, флуоресцентные агенты могут включать, но этим не ограничены, цианины, фталоцианины, порфирины, индоцианины, родамины, феноксазины, фенилксантены, фенотиазины, феноселеназины, флуоресцеины, бензопорфирины, сквараины, дипирролопиримидоны, тетрацены, хинолины, пиразины, коррины, соли крокониевой кислоты, акридоны, фенантридины, родамины, акридины, антрахиноны, аналоги халькогенпирилиевых солей, хлорины, нафталоцианины, метиновых красители, индолиновые красители, азосоединения, азулены, азаазулены, трифенилметановые красители, индолы, бензоиндолы, индокарбоцианины, бензоиндокарбоцианины, и производные BODIPY™ (флуоресцентные красители класса бор дипиррометен).
Способы введения и технология приготовления
Анти-ανβ8 антагонисты, анти-ανβ8 антител или иммуноконъюгаты вводят пациенту в соответствии с известными способами, такими как внутривенное введение, например, в виде болюса или непрерывной инфузии в течение некоторого периода времени, внутримышечно, внутрибрюшинно, интрацереброспинально, подкожно, внутрисуставно, интрасиновиально, интратекального, перорального, местно (например, трансдермально), или ингаляторно. Внутривенное или подкожное введение антител является предпочтительным. Введение может быть местным или системным.
Композиции для введения будут, как правило, содержать агент, как описано выше (например, анти-ανβ8 антагонист, анти-ανβ8 антитело и иммуноконъюгат), растворенный в фармацевтически приемлемом носителе, предпочтительно в водном носителе. Могут быть использованы различные водные носители, например, буферный солевой раствор и т.п. Эти растворы являются стерильными и в целом свободны от нежелательных веществ. Данные композиции могут быть стерилизованы обычными, хорошо известными методами стерилизации. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, необходимые для приближения к физиологическим условиям, такие как корректирующие рН и буферные агенты, агенты коррекции токсичности такие как, например, ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и т.п. Концентрация активного вещества в этих препаратах может широко варьироваться, и будет выбрана в первую очередь на основе объемов жидкости, вязкости, веса тела и т.п., в соответствии с конкретным выбранным способом введения и потребностей пациента.
Таким образом, типичная фармацевтическая композиция для внутривенного введения будет варьировать в зависимости от вводимого агента. Методы получения парентеральных композиций будут известны или очевидны специалистам в данной области техники и описаны более подробно в таких изданиях, Remington's Pharmaceutical Science, 15th ed., Mack Publishing Company.
Фармацевтические композиции могут быть введены в различных стандартных лекарственных формах в зависимости от способа введения. Например, стандартные лекарственные формы для перорального введения включают, но не этим не ограничены, порошки, таблетки, пилюли, капсулы и таблетки. Следует признать, что антитела при пероральном введении, должны быть защищены от переваривания. Это обычно достигается либо путем комплексообразования молекул с составом, чтобы сделать их устойчивыми к кислотному и ферментативному гидролизу, или упаковкой молекул в надлежащий устойчивый носитель, такой как липосомы или защитный барьер. Средства защиты агентов от переваривания хорошо известны в данной области.
Фармацевтические препараты, в частности, антитела, иммуноконъюгаты и ингибиторы для использования по настоящему изобретению могут быть получены путем смешивания антитела, имеющего требуемую степень чистоты, с возможными фармацевтически приемлемыми носителями, наполнителями или стабилизаторами. Такие препараты могут быть лиофилизированными препаратами или водными растворами. Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях. Приемлемыми носителями, наполнителями или стабилизаторами могут быть ацетаты, фосфаты, цитраты и другие органические кислоты; антиоксиданты (например, аскорбиновая кислота), сохраняющие полипептиды с низкой молекулярной массой; белки, такие как сывороточный альбумин или желатин, или гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразователи, а также ионные и неионные поверхностно-активные вещества (например, полисорбат); солеобразующие противоионы, такие как натрий; комплексы металлов (например, цинк-белковые комплексы), и/или неионные поверхностно-активные вещества. Антитела могут быть приготовлены в концентрации от 0,5-200 мг/мл, или между 10-50 мг/мл.
Препарат может также содержать дополнительные активные соединения, в том числе, химиотерапевтические препараты, цитостатики, цитокины, ингибирующие рост агентов, и антигормональный агент. Активные ингредиенты могут также быть приготовлены из препаратов с замедленным высвобождением (например, полупроницаемой матрицы из твердых гидрофобных полимеров (например, из сложных полиэфиров, гидрогеля (например, поли-2-гидроксиэтилметакрилат), или поливинилового спирта), полилактиды. Антитела и иммуноконъюгаты также может быть помещены в микрокапсулы, полученные, например, путем коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозы или желатиновые микрокапсулы и полиметилметацилатные микрокапсулы, соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии.
Композиции могут быть введены для терапевтических или профилактических процедур. При терапевтическом применении композиции вводят пациенту, страдающему от заболевания (например, рак, фиброз, ХОБЛ, артрит и др.) в "терапевтически эффективной дозе". Количества, эффективные для данной цели будут зависеть от тяжести заболевания и общего состояния здоровья пациента. Один или несколько введений композиции могут быть назначены в зависимости от дозировки и частоты по мере необходимости и переносимости пациентом. "Пациент" или "объект" в контексте настоящего изобретения включает в себя как человека, так и животных, в частности млекопитающих. Таким образом, данные способы применимы как к терапии человека и ветеринарному применению. В предпочтительном варианте осуществления пациент является млекопитающим, предпочтительно приматом, а в наиболее предпочтительном варианте больным человеком. Другие известные способы лечения рака могут быть использованы в сочетании со способами по настоящему изобретению. Например, композиции для использования в соответствии с изобретением могут также быть использованы для нацеливания на клетку или для повышения чувствительности клетки к другим противораковым терапевтическим агентам, таким как 5-FU (фторурацил), винбластин, актиномицин D, цисплатин, метотрексат, и т.п.
Комбинированное назначение предполагает одновременное, с использованием отдельных композиций или одной фармацевтической композиции, или последовательное введение в любом порядке, в котором предпочтительно есть период времени, когда оба (или все) активные вещества одновременно оказывают свое биологическое действие.
Идентифицированные молекулы и соединения способны прямо или косвенно модулировать экспрессию и/или функции ανβ8, что может быть полезно в уменьшении активации TGFβ у человека. Анти-ανβ8 антагонисты, анти-ανβ8 антитела или иммуноконъюгаты могут быть введены самостоятельно или совместно в сочетании с традиционной химиотерапией, лучевой терапией или иммунотерапией, так же как и принятыми на данный момент терапевтическими способами.
Композиции, пригодные для перорального введения могут состоять из (а) жидких растворов, например, представлять собой упаковку с эффективным количеством нуклеиновой кислоты, суспендированной в разбавителе, таком как вода, физиологический раствор или PEG-400 (полиэтиленгликоль), (b) капсул, саше или таблеток, каждая из которых содержит заданное количество активного ингредиента в виде жидкости, твердого вещества, гранул или желе; (с) суспензии в соответствующей жидкости, и (g) подходящие эмульсии. Таблетированные формы могут включать в себя один или несколько ингредиентов, выбранных из лактозы, сахарозы, маннита, сорбита, фосфата кальция, кукурузного крахмала, картофельного крахмала, микрокристаллической целлюлозы, желатина, коллоидного диоксида кремния, талька, стеарата магния, стеариновой кислоты и других эксципиентов, красителя, наполнителя, связующего вещества, разбавителя, буферного агента, увлажняющего агента, консерванта, ароматизатора, красителя, разрыхлителя, и фармацевтически совместимого носителя. Формы пастилок могут содержать активный ингредиент в ароматизаторе, например, в сахарозе, а также пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин или сахароза и гуммиарабик эмульсии, гели и т.п., содержащих в дополнение к активному ингредиенту, носители, известные в данной области.
Выбранные соединения, отдельно или в комбинации с другими подходящими компонентами, могут быть сделаны в виде аэрозольных препаратов (то есть, они могут "распыляться") для введения путем ингаляции. Аэрозольные препараты могут быть помещены в находящийся под давлением приемлемый пропеллент, такой как дихлордифторметан, пропан, азот, и т.п.
Подходящие композиции для ректального введения включают, например, суппозитории, которые состоят из нуклеиновой кислоты, упакованной в основание суппозитория. Подходящие основы для суппозиториев, включают природные или синтетические триглицериды или парафиновые углеводороды. Кроме того, также можно использовать желатиновые ректальные капсулы, которые состоят из комбинации выбранного соединения и основы, включающей, например, жидкие триглицериды, полиэтиленгликоли, и предельные углеводороды.
Композиции, пригодные для парентерального введения, такие как, например, внутрисуставные (в сустав), внутривенные, внутримышечные, внутриопухолевые, внутрикожные, внутрибрюшинные, и подкожные, включают водные и безводные, изотонические стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические, и растворенные вещества, которые делают препарат изотоническим по отношению к крови предполагаемого реципиента, и водные и безводные стерильные суспензии, которые могут включать в себя суспендирующие агенты, растворители, загустители, стабилизаторы и консерванты. В практике настоящего изобретения, композиции могут быть введены, например, путем внутривенной инфузии, перорально, местно, внутрибрюшинно, интравезикально или интратекально. Парентеральное введение, пероральное введение, и внутривенное введение являются предпочтительными методами введения. Композиции соединений могут быть представлены в однодозовой форме или в герметичных контейнерах для нескольких доз, таких как ампулы и флаконы.
Растворы для инъекций и суспензий могут быть получены из стерильных порошков, гранул и таблеток того типа, как было описано ранее. Клетки, траснформированные нуклеиновыми кислотами для терапии ex vivo также можно вводить внутривенно или парентерально, как описано выше.
Фармацевтический препарат предпочтительно находится в форме разовой дозы. В такой форме препарат разделен на стандартные дозы, содержащие соответствующие количества активного компонента. Лекарственная форма может представлять собой упакованный препарат, пакет, содержащий дискретные количества препарата, такие как упакованные таблетки, капсулы и порошки во флаконах или ампулах. Кроме того, однодозовая форма может представлять собой капсулу, таблетку, саше или пастилку, или это может быть соответствующее число любого из них в упакованном виде. Композиция может, при желании, также содержать и другие совместимые терапевтические агенты.
Предпочтительные фармацевтические препараты доставляют один или более анти-ανβ8 антагонистов, анти-ανβ8 антител или иммуноконъюгатов, возможно в сочетании с одним или несколькими химиотерапевтическими агентами или иммунотерапевтическими агентами, с замедленным высвобождением препарата.
При терапевтическом применении для лечения рака, анти-ανβ8 антагонисты, анти-ανβ8 антитела или иммуноконъюгаты, используемые в фармацевтическом способе по настоящему изобретению, вводят в начальной дозе около 0,001 мг/кг до примерно 1000 мг/кг в сутки. В дневном диапазоне доз могут быть использованы около 0,01 мг/кг до 500 мг/кг, или примерно 0,1 мг/кг до 200 мг/кг, или примерно 1 мг/кг до 100 мг/кг, или примерно 10 мг/кг около 50 мг/кг. Дозировка, однако, может варьироваться в зависимости от потребностей пациента, тяжести состояния, которое лечат, и используемого соединения. Например, дозировки могут быть определены эмпирически с учетом типа и стадии рака, диагностированного у конкретного пациента. Доза, вводимая пациенту в контексте настоящего изобретения, должна быть достаточной для осуществления благотворного терапевтического ответа у пациентов с течением времени. Размер дозы также будет определяться наличием, характером и степенью любых неблагоприятных побочных эффектов, сопутствующих назначению отдельного вектора, или типа трансдуцированных клеток, у отдельного пациента. Определение правильной дозировки для конкретной ситуации находится в компетенции практикующего врача. Как правило, лечение начинают с меньших доз, которые меньше, чем оптимальная доза данного соединения. После этого доза увеличивается малыми приращениями до достижения оптимального эффекта при данных обстоятельствах. Для удобства, общая суточная доза может быть разделена и вводится порциями в течение дня, если это необходимо.
Фармацевтические препараты (например, анти-ανβ8 антагонисты, анти-ανβ8 антитела или иммуноконъюгаты) для использования согласно настоящему изобретению, как правило, вводят млекопитающим, включая людей и других млекопитающих. Другие млекопитающие, которых можно лечить заявленными способами, включают в себя домашних животных (например, собак, кошек, зайцеобразных, мышей и других грызунов,) и сельскохозяйственных животных (крупный рогатый скот, лошадей, овец, свиней).
ПРИМЕРЫ
Следующие примеры представлены только для целей иллюстрации, но не для ограничения заявленного изобретения.
Пример 1. Исследование роли интегрина ανβ8 в ремоделировании дыхательных путей
Трансформирующий фактор роста В (TGF-β), является цитокином, участвующим в воспалительном и фиброзном ответе. Ранее нами было показано, что IL-1β повышает экспрессию β8, и что экспрессия β8 увеличивается в дыхательных путях пациентов с ХОБЛ. Тем не менее взаимодействие β8, TGF-β и IL-1β недостаточно изучено in vivo, что привело нас к разработке мышиной модели β8-опосредованного ремоделирования дыхательных путей. Здесь мы показываем, что индуцированная IL-1-β, β8-опосредованная активация TGF-β играет решающую роль в ремоделировании дыхательных путей.
Роль β8 в качестве посредника ремоделирования дыхательных путей оценивали путем делеции β8 с помощью Cre/LoxP системы, используя интратрахеальное введение аденовирусного IL-1β в качестве модели для воспаления. Были использованы 6- и 9-недельные мыши с одной аллелью интегрина β8 фланкированного loxP сайтами и одним нокаутированным аллелем (Floxed/-) на генетическом фоне С57В1/6. Либо аденовирус с человеческим IL-1β (Ad-hiL-1β), или контрольный аденовирус вводили внутритрахеально с или без Ad-Cre. Кроме того, мыши, экспрессирующие гибридную рекомбиназу Cre-ER(T) под контролем промотора Коллагена Iα2 использовались, чтобы показать, что фибробласты играют важную роль в ανβ8-опосредованной активации TGF-β в индуцированном блеомицином фиброзе легких, индуцированном овальбумином ремоделировании дыхательных путей, и Ad-IL1β-индуцированном ремоделировании дыхательных путей. Изменения в морфометрии дыхательных путей оценивали гистологически, а анализ экспрессии генов ряда воспалительных цитокинов в различные моменты времени после введения Ad-IL1β, обнаружил последовательную индукцию генов, которые определяют воспалительный ответ.
У модели с условным нокаутом β8, β8 необходим для индуцированного человеческим IL-1β временного воспаления дыхательных путей и фиброза. Добавление человеческого IL-Iβ приводит к β8-опосредованной активации TGF-β, индукции мышиных генов сс12 и сс120, рекрутингу дендритных клеток, и инициированию и поддержанию адаптивного иммунного ответа.
Эти данные показывают, что условное исключение интегрина β8 привело к снижению воспаления и фиброзного ответа как на Ad-hiL-Iβ, так и на овальбумин, что привело к защите дыхательных путей от ремоделирования. Мы определили ключевую роль IL-1β - индуцированной или овальбумин-индуцированной, β8-опосредованной активации TGF-β и в ремоделировании дыхательных путей, и для блеомицин-индуцированного острого повреждения легких.
Пример 2. Антитело 37Е1
Мы создали мышиное моноклональное антитело (название клона 37Е1, изотип IgG2a), который избирательно блокирует взаимодействие человеческого интегрина βνβ8 с его лигандом, трансформирующим фактором роста β (TGF-β). TGF-β повсеместно экспрессируется у млекопитающих в трех изоформах (TGF-β1-3), но сохраняется в неактивной форме из-за нековалентного взаимодействия со своим пропептидом - связанным с латентностью доменом TGF-β (LA). Интегрин ανβ8 связывается с LAP из TGF-β и опосредует активацию TGF-β1 и 3. Исследования условных генетических делеций или генетических делеций в зародышевой линии показали, что интегрин ανβ8-опосредованная активация TGF-β имеет важное значение для активации TGF-β in vivo, и, следовательно, ανβ8 является "посредником" функции TGF-β. В частности, интегрин ανβ8-опосредованная активация TGF-β, вероятно, участвуют в патогенезе хронической обструктивной болезни легких, фиброза легких, фиброза почек, воспалительных аутоиммунных заболеваний мозга (рассеянного склероза и димиелинизирующих заболеваний), нейровоспаления, болезни почек, и роста раковой опухоли и метастазов. В целом, интегрины являются молекулами адгезии, которые опосредуют прикрепление клеток к белкам внеклеточного матрикса. Клон 37Е1 отличается тем, что он избирательно нарушает ανβ8-опосредованную активацию TGF-β, но не связывание ανβ8 с иммобилизованным или секретированным TGF-β. Это дает высокую степень избирательности в нарушении только интегрин ανβ8-опосредованной активации TGF-β, а не свойств клеточной адгезии, которые весьма нежелательно ингибировать. Кроме того, глобальная инактивации TGF-β может иметь нежелательные побочные эффекты, так как TGF-β является одним из важнейших эпителиальных эффекторов гомеостаза и иммунным эффектором.
Пример 3. Антитело 37Е1В5
Мы сконструировали вариабельные области тяжелых и легких цепей клона 37Е1, и использовали случайный мутагенез и рекомбинирование цепей в системе дрожжевого дисплея, чтобы повысить аффинность антител. Мы определили конкретные аминокислотные замены, которые придают большую аффинность к тем же антигенам, и мы классифицировали эти мутации в соответствии с функцией. Один из данных мутантов был назван 37Е1В5. Он проявляет повышенную аффинность in vitro и более высокую эффективность в подавлении интегрин-ανβ8-опосредованной активации TGF-β в культивируемых клетках. Эффективная терапевтическая доза антител 37Е1 В5 in vitro находится в пикомолярном диапазоне. Для лучшего диагностического и терапевтического применения, мы создали три версии 37Е1В5: мышиный IgG1, мышиный IgG2a, и частично гуманизированный IgG1. Все были произведены в трансформированных клетках СНО.
Пример 4. Создание трансгенных мышей ITGB8 ВАС
Мы создали трансгенных мышей с гуманизированным ВАС, которые экспрессируют человеческий β8 и скрестили их с мышами β8 ko, чтобы избавиться от летальных эффектов удаления мышиного интегрина ανβ8. Эта гуманизированная мышь будет использоваться для проверки токсичности и эффективности высокоаффинных клонов в моделях заболеваний легких, мозга, печени и почек.
Клон RP 11-431K20, который содержит 72315 5' и 30,683 3' соответствующих 5' и 3' фланкирующих областей гена ITGB8 был получен в виде бактериальной культуры (научно-исследовательский институт детской больницы Окленда научно-исследовательский институт, Окленд, Калифорния). На чашки (LB с хлорамфениколом, 12,5 мкг/мл) штрихом нанесли культуру и отобрали колонии с помощью PCR колоний с использованием сконструированных праймеров, направленных на 5' и 3' концы ВАС. Последовательность была подтверждена на 5' и 3' концах, и в областях 5' UTR - первый интрон, 9-й экзон - 9-й интрон и 10-й экзон/интрон. Отдельные колонии выросли и были выделена плазмидная ДНК ВАС (система NucleoBond). Плазмиды были линеаризованы Pi-See (NEB), очищены на колонке NAP5 и подвергнуты электрофорезу в пульсирующем поле, чтобы подтвердить концентрацию и целостность ДНК. ДНК вводили в эмбрионы FVB/N в UCSF (Калифорнийский Университет, Сан-Франциско) Раковый Центр Трансгенных Услуг. Из более чем двухсот инъецированных эмбрионов, были получены 24 мыши, из которых 4 были идентифицированы как основатели с помощью анализа ДНК, путем tail-PCR с праймерами к 5' и 3' концам ВАС.
Три из этих линий (В, С и D), наследуют материал зародышевой линии. Линии В, С, D и были скрещены с мышами itgb8 C57B/6, чтобы иметь один itgb8 с нокаутом аллели. F2 поколение было скрещено для получения ITGB8 ВАС tg мышей на itgb8 -/- фоне.
Эти мыши (линия В, С, и D) не проявляли фенотипические аномалии на 3-м или 6-м месяцах жизни. Эти результаты показывают, что все необходимые регуляторные элементы содержаться выше или ниже элемента, содержащегося в ВАС RP11-431K20 чтобы обеспечить соответствующую экспрессию в ткани, чтобы избежать летального фенотипа itgb8 -/- мышей. Эти мыши также обеспечивают экспериментальную систему для определения биомаркеров, дальнейшего изучения механизмов болезни in vivo, моделирования заболеваний человека, и тестирования эффектов терапии направленной против ανβ8-опосредованной TGF-β активации.
Пример 5. Нейтрализация анти-интегрина β8 снижает Col 1
Увеличение продуцирования внеклеточного матрикса (ЕСМ) и повышение сократительной способности фибробластов являются отличительными чертами фиброзных ответов, что наблюдается как утолщение стенок дыхательных путей, возрастание коллагена типа 1 (Col 1) и повышение SA (αSMA), которые являются ключевыми биохимических маркерами данного ответа. Для оценки вклада аутокринной ανβ8-опосредованной активации TGF-β в фенотип профибротических фибробластов, мы использовали нейтрализующие анти-β8. Аутокринная ανβ8-опосредованная активация TGF-β влияет на фенотип миофибробластов, поскольку обработка фибробластов дыхательных путей β8 блокирующими антителами ингибировала αSMA экспрессию и секрецию Col 1. Совместное культивирование фибробластов дыхательных путей с плоскоклеточными метапластическими бронхиальными эпителиальными клетками человека привела к увеличению транскрипции Col 1 и синтезу белка фибробластами дыхательных путей. Возросший синтез коллагена был зависим от IL-1β и от фибробластов β8. Увеличение экспрессии Col 1, индуцированное совместным культивированием с плоскоклеточными метапластическими бронхиальными эпителиальными клетками человека может быть почти полностью подавлено лечением путем совместного культивирования с IL-1 RA, или трансфекцей фибробластов дыхательных путей с миРНК β8.
Пример 6. Характеристика эпитопа 37Е1В5
Конструкции химерного интегрина β8, в которых поменяли мышиные последовательности на человеческий ITGB8, были использованы для локализации эпитопа, связывающего 37Е1В5. Эпитоп был локализован путем связывания антитела, окрашивания клеточной поверхности, и детекции с помощью проточной цитометрии. Эпитоп 37Е1 В5 заключен внутри аминокислот 74-180 человеческого интегрина β8. 37Е1В5 связывается с человеческим, а не с мышиным β8. Таким образом, по меньшей мере, одна из 9 неконсервативных аминокислотных различий или из 7 незначительных аминокислотных различий (обозначаемые как + в средней линии последовательности) входят в связывающий эпитоп. Эти области отражают часть того, что известно в данной области, как Psi, гибридная и альфа-1-спираль Бета-1 домена субъединицы интегрина β8, находящаяся на поверхности молекулы.

В SEQ ID NO:11 представлена часть человеческого интегрина β8, которая включает в себя эпитоп 37Е1В5 (аминокислоты 74-180). В SEQ ID NO:12 представлена гомологичная мышиную последовательность, которая не связывается с антителом 37Е1В5. R в положении 140 мышиной последовательностей является полиморфной, и также может быть Н.
В дальнейшем мы выполнили исследование по замене домена внутри данной области, заменив мышиные последовательности на человеческие, чтобы определить, какая аминокислота(ы) включены в эпитоп 37Е1В5. Мы обнаружили, что замена мышиных аминокислот 125-180 интегрина β8 значительно уменьшает связывание 37Е1В5. Таким образом, эпитоп включает в себя, по меньшей мере, одну аминокислоту, выбранную из 1125, R128, R175, F179 и F180 человеческого интегрина β8.
Пример 7. Экспрессия интегрина β8 в фибробластах ХОБЛ
Мы обнаружили, что экспрессия интегрина β8 возрастает в фибробластах легких человека у пациентов с ХОБЛ, как показали окрашивания тканей в первичной культуре. Кроме того, экспрессия интегрина β8 значительно возрастает в фибробластах, выделенных у больных с идиопатическим легочным фиброзом по сравнению с фибробластами обычных пациентов. Мы также обнаружили, что ХОБЛ фибробласты имеют повышенную IL-1β-зависимую экспрессию белка интегрина ανβ8 по сравнению с фибробластами нормальных легких. Эти данные показывают, что ανβ8 является одновременно нижестоящей мишенью, и медиатором патологических IL-1β эффектов.
Антитела 37Е1В5 могут быть использованы в терапевтических и диагностических целях при заболеваниях, где экспрессируется интегрин β8, и IL-1β и/или TGF-β играют патологическую роль.
Пример 8. Антитело, нейтрализующее интегрин β8, уменьшает индуцированное воспаление дыхательных путей
Мы создали три линии трансгенных мышей ВАС с использованием человеческого клона ВАС RP11-431К20. Эти мыши были выведены с одной функционирующей аллелью мыши itgb8 для получения поколения мышей F1 с человеческим ITGB8 и одной функциональной копией мышиной itgb8. Эти мыши были скрещены для получения поколения F2, в котором были получены жизнеспособные ВАС ITGB8, то есть мыши itgb8-/- с человеческой копией гена, демонстрирующие избавление от летальности itgb8-/-.
Эти мыши были использованы, чтобы вызвать ремоделирование дыхательных путей с использованием интратрахеальной модели доставки аденовирусной-IL-lp. В этой модели индуцированного аденовирусной-IL-1β воспаления стенки дыхательных путей, устойчивое ремоделирование дыхательных путей с иммунологическим профилем сходно с человеческой хроническая обструктивной болезнью легких и является воспроизводимо индуцированным.
Мы обнаружили, что антитела 37Е1В5, в дозе 7 мг/кг, что значительно блокируют воспаление дыхательных путей, при значительном снижении числа нейтрофилов в бронхоальвеолярной жидкости. Гистологически воспаление и фиброз стенки дыхательных путей значительно снижается посредством 37Е1В5. Эти данные дополняют другие данные, показывающие, что фибробласт-специфичные делеции itgb8 могут существенно ингибировать индуцированное аденовирусом-IL-1β ремоделирование дыхательных путей.
Кроме того, мы обнаружили, что аллергическое ремоделирование дыхательных путей (овальбумин-индуцированное воспаление дыхательных путей, фиброзная и мукозная метаплазии), значительно уменьшается у мышей с фибробласт-специфичной делецией itgb8. Аллергическая модель также зависит и от IL-1β и от TGF-β. Эти данные свидетельствуют о ведущей роли itgb8 в усилении патологического врожденного и адаптивного иммунного ответа, где участвуют IL-1β и TGF-β. IL-1β приводит к увеличению интегрина β8 в разных типах клеток, включая фибробласты из дыхательных путей и легких, и астроцитах. Эта индуцированная IL-1β экспрессия интегрина β8 наблюдается и у мышей и у человека.
Пример 9. Человеческие суставные хондроциты экспрессируют интегрин ανβ8
Взрослый суставной хрящ был взят из суставного пространства колена у пациента, проходящего элективное лечение колена при хроническом остеоартрите. Первичные хондроциты были выращены до 70% конфюэнтности затем определялась экспрессия рецепторов интегрина путем окрашивания клеток и проточной цитометрией. Были использованы антитела anti-β8 (37Е1В5), и анти-β6 (Е7Р6). Стойкое окрашивание было обнаружено с 37Е1В5, а с Е7Р6 окрашивания не было. Первичные хондроциты были совместно культивированы с TMLC - репортерными клетками для TGF-β (Annes и др. (2004) J. Cell Biol. 165:723) в TGF-β биоанализе в присутствии или отсутствии анти-β8 (37Е1 В5) или нейтрализующих анти-β6. Anti-p8 надежно блокировали активацию TGF-β, в то время как анти-β6 не дали такого эффекта.
Результаты показывают не только, что ανβ8 о экспрессируется в хондроцитах, но и что эта экспрессия приводит к активации TGFβ. Таким образом, ингибирование ανβ8 может быть использовано для лечения нарушений хряща, связанных с активацией TGFR, таких как артрит и синовиальной фиброз (см., например, Bakker и др. (2001) Osteoarthritis and Cartilage 9: 128).
Следует понимать, что примеры и варианты осуществления, описаны здесь только для иллюстративных целей, и что различные модификации или изменения, которые могут быть предложены специалистом в данной области, должны быть включены в объем настоящего изобретения и входят в рамки настоящей заявки и в объем прилагаемой формулы изобретения. Все публикации, патенты и патентные заявки, цитируемые в данном документе, включены сюда путем ссылки в полном объеме для любых целей.