Результат интеллектуальной деятельности: СПОСОБ АНАЛИЗА ГЕНЕТИЧЕСКОГО ПОЛИМОРФИЗМА ДЛЯ ОПРЕДЕЛЕНИЯ ПРЕДРАСПОЛОЖЕННОСТИ К ШИЗОФРЕНИИ И АЛКОГОЛИЗМУ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области генетики, молекулярной биологии и медицины и касается способа определения генетической предрасположенности к шизофрении и алкоголизму посредством анализа полиморфизма в генах HTR2A, BDNF, DISCI, ZNF804A, RELN, СОМТ, SLC18A, PLXNA2, ADH1B, ADH1C, ALDH2, DRD2, СОМТ, NPY, AUTS2 и NK1R с помощью технологии гидрогелевых ДНК-микрочипов (биочипов).
Уровень техники
Известно большое количество способов определения генетического полиморфизма, в которых используются различные инструменты для анализа уникальной нуклеотидной последовательности ДНК человека. Условно среди них можно выделить шесть групп:
1) Методы, основанные на применении ферментов:
полиморфизм длин амплифицированных фрагментов (AFLP);
полиморфизм длин рестрикционных фрагментов (RFLP);
расщепление клевазой (CFLP);
расщепление резольвазой (EMD);
анализ, основанный на лигазной реакции (LDR, LCR);
инвазивное расщепление олигонуклеотидов;
случайная амплификация полиморфной ДНК (RAPD, AP-PCR);
ПЦР с прямой терминацией синтеза (DT-PCR);
аллель-специфическая ПЦР (AS-PCR, PCR-SSP).
2) Химические методы:
химическое расщепление гетеродуплексов;
химическое лигирование.
3) Методы, основанные на различной электрофоретической подвижности полиморфных участков ДНК:
анализ конформации одноцепочечных фрагментов (SSCP);
гетеродуплексный анализ (НА);
секвенирование.
4) Детекция на твердой фазе:
гибридизация на олигонуклеотидных матрицах;
оптико-волоконный ДНК-гибридизационный анализ;
элонгация иммобилизованных праймеров (минисеквенирование);
пиросеквенирование.
5) Хроматографические методы:
высокоэффективная жидкостная хроматография (HPLC).
6) Физические методы:
масс-спектрометрия;
резонансное тушение флуоресценции (FRET);
люминесценция, зависящая от локального окружения.
Наиболее распространенными из представленных методов являются:
1. Анализ полиморфизма длин рестрикционных фрагментов ДНК (RFLP-анализ)
Определение полиморфного сайта рестрикции методом RFLP заключается в амплификации определяемого ПЦР фрагмента и его последующем расщеплении соответствующим ферментом рестрикции. Далее проводится визуализация результатов рестрикции для оценки распределения фрагментов по длине различными методами, в том числе с помощью блот-гибридизации. Преимуществами метода являются простота и надежность, недостатками - длительность проведения анализа, трудоемкость, а также возможность детекции только известных полиморфных замен, при этом одновременно можно выявлять не более двух SNPs.
[Pawel К., Hauser J., Skibinska Μ., Szczepankiewicz Α., Dmitrzak-Weglarz Μ., Gorzkowska К., Pawlak J., Czerski P.M. Family based association study of DRD1, DRD2, DRD3, DRD4, DAT, COMT gene polymorphism in schizophrenia - Psychiatr Pol. - 2010. - V.44(3). - P. 405-413]
[Yao C.T., Cheng С.A., Wang H.K., Chiu S.W., Chen Y.C., Wang M.F., Yin S.J., Peng G.S. The role of ALDH2 and ADH1B polymorphism in alcohol consumption and stroke in Han Chinese - Hum Genomics. - 2011. - V.5(6). - P. 569-576]
2. Секвенирование амплифицированных фрагментов ДНК
Секвенирование является самым точным методом анализа генетических вариаций. Преимуществами метода являются высокая точность и чувствительность, недостатками - высокая стоимость оборудования, что исключает широкое внедрение метода в клиническую практику. Методы «секвенирования нового поколения» (next-generation sequencing) позволяют с высокой эффективностью определять как известные мутации, так и мутации de novo одновременно в большом числе генов-кандидатов, однако, их рутинное использование в клинической практике в ближайшие годы будет крайне ограниченно из-за высокой стоимости оборудования, расходных материалов и сложностей в интерпретации данных.
[Rees Ε., Kirov G., О′Donovan Μ.С., Owen M.J. De Novo Mutation in Schizophrenia - Schizophr Bull. 2012]
[Choi I.G., Son H.G., Yang B.H., Kim S.H., Lee J.S., Chai Y.G., Son B.K., Kee B.S., Park B.L., Kim L.H., Choi Y.H., Shin H.D. Scanning of genetic effects of alcohol metabolism gene (ADH1B and ADH1C) polymorphisms on the risk of alcoholism - Hum Mutat. - 2005. - V.26(3). - P. 224-234]
3. Аллель-специфичная ПЦР (AS-PCR)
Для проведения ПЦР с высокой эффективностью 3′-концевой нуклеотид праймера должен быть комплементарен соответствующему нуклеотиду матричной ДНК. В противном случае эффективность удлинения праймера во время ПЦР резко снижается и при определенных сочетаниях ошибочно спаренных нуклеотидов может отсутствовать вообще. Именно эта особенность ПЦР и лежит в основе метода обнаружения мутаций и однонуклеотидного полиморфизма с помощью аллель-специфичной ПЦР, иначе называемой аллель-специфической элонгацией праймера. Преимуществом метода является высокая скорость, так как при правильно подобранных условиях анализ SNPs занимает всего 3-4 часа. К недостаткам метода можно отнести точность (большое количество ложно-положительных результатов), трудоемкость (для каждого нового SNP необходимо корректировать условия реакции и тщательно подбирать последовательности праймеров), а также невозможность одновременной детекции большого числа SNP в одном анализе.
[Tan Е.С., Chong S.A., Wang H., Chew-Ping Lim Ε., Тео Υ.Υ. Gender-specific association of insertion/deletion polymorphisms in the nogo gene and chronicschizophrenia. - Brain Res Mol Brain Res. - 2005. - V.139(2). - P. 212-216]
[Sasabe Т., Furukawa Α., Matsusita S., Higuchi S., Ishiura S. Association analysis of the dopamine receptor D2 (DRD2) SNP rs1076560 in alcoholic patients. - Neurosci Lett. - 2007. - V.412(2). - P. 139-142]
4. Анализ конформации одноцепочечных фрагментов ДНК (SSCP)
SSCP-анализ включает денатурацию ПЦР-продуктов и разделение их в неденатурирующем геле. Электрофоретическая подвижность одноцепочечных фрагментов ДНК зависит от их нуклеотидной последовательности, определяющей характер вторичных и третичных структур, и меняется даже при отличии в один нуклеотид. Преимуществами метода являются простота, чувствительность, относительно невысокая стоимость, возможность использования флуоресцентной метки и капиллярного электрофореза, что позволяет легко автоматизировать процесс и анализировать одновременно большое количество локусов. К недостаткам метода можно отнести низкую воспроизводимость результатов, особенно при обнаружении de novo мутаций, и невозможность анализа ряда SNP, особенно групп полиморфных замен, расположенных на близком расстоянии друг от друга.
[Diez-Martin J., Hoenicka J., Martinez I., Aragües M., Rodriguez-Jimenez R., Jimenez-Arriero M.A., Ponce G., Rubio G., Palomo Т. COMT Va1158Met polymorphism and schizophrenia in a series of Spanish patients. - Med Clin (Barc). - 2007. - V.128(2). - P. 41-44]
[Okubo Т., Harada S., Higuchi S., Matsushita S. Investigation of quantitative trait loci in the CCKAR gene with susceptibility to alcoholism - Alcohol Clin Exp Res. - 2002. - V.26(8 Suppl). - P. 2S-5S]
5. Гетеродуплексный анализ (НА)
При использовании данного метода денатурированные контрольный и анализируемый ПЦР-продукты не разделяют в геле, а сначала позволяют им ренатурировать. Одноцепочечные фрагменты образуют дуплексы. Если последовательности двух цепей полностью комплементарны, то будут образовываться гомодуплексы, если они отличаются хотя бы на один нуклеотид - гетеродуплексы. Гомо- и гетеродуплексы имеют разную электрофоретическую подвижность и могут быть разделены в неденатурирующем геле. В лабораторных исследованиях меченые Су5 красителем ПЦР-продукты с известным нуклеотидом в исследуемой позиции SNP смешивают с анализируемыми ПЦР-продуктами, после чего проводят детекцию. Преимуществом метода является простота визуализации результатов в обычном полиакриламидном геле. Недостатками метода являются низкая чувствительность (~80%), при этом для более эффективного разделения гомо- и гетеродуплексов требуется использование дорогостоящих вариантов гелей, а также невозможность определения точной локализации SNP внутри исследуемого фрагмента.
[Hitzeroth A., Niehaus D.J., Koen L., Botes W.C., Deleuze J.F., Warnich L. Association between the MnSOD Ala-9Val polymorphism and development of schizophrenia and abnormal involuntary movements in the Xhosa population. - Prog Neuropsychopharmacol Biol Psychiatry. - 2007. - V.31(3). - P. 664-672]
[Lipsky R.H., Mazzanti С.М., Rudolph J.G., Xu K., Vyas G., Bozak D., Radel M.Q., Goldman D. DNA melting analysis for detection of single nucleotide polymorphisms. - Clin Chem. - 2001. - V.47(4). - P. 635-644]
6. Масс-спектрометрия
Метод заключается в том, что ионизированные молекулы ДНК (чаще всего специально подготовленные продукты ПЦР) отрываются от подложки методами MALDI (matrix-assisted laser desorption/ionisation) и ESI (electrospray ionisation). Они разгоняются в электрическом поле в вакуумной камере и попадают на детектор. Время движения регистрируется. Время обратно пропорционально скорости молекулы, которая, в свою очередь, прямо пропорциональна отношению массы летящей молекулы к ее заряду. Поскольку отношение массы к заряду является уникальной величиной для каждой молекулы, основными преимуществами метода являются чувствительность и специфичность, а также минимально необходимое количество образца для проведения анализа. Недостатками метода являются трудоемкость, высокая стоимость оборудования, необходимость высококвалифицированных сотрудников и сложность использования вне крупных медицинских центров мегаполисов.
[Lee K.Y., Joo Ε.J., Ji Υ.I., Kim D.H., Park J.B., Chung I.W., Lee S.I., Joo Y.H., Ahn Y.M., Song J.Y., Kim Y.S. Associations between DRDs and schizophrenia in a Korean population: multi-stage association analyses. - Exp Mol Med. - 2011. - V.43(1). - P. 44-52]
[Yan Y., Yang J.Y., Mou Y.H., Wang L.H., Zhang Η., Wu C.F. Possible metabolic pathways of ethanol responsible for oxidative DNA damage in human peripheral lymphocytes - Alcohol Clin Exp Res. - 2011. - V.35(1) - P. 1-9]
7. Анализ, основанный на лигазной реакции (LDR)
Метод основан на высокой чувствительности к субстрату лигаз из термофильных организмов: они не способны делать сшивку в случае, если фланкирующие нуклеотиды некомплементарны матрице. Как правило, 3′-концевые мисматчи лучше дискриминируются, чем 5′-концевые. В реакции лигазной детекции (LDR, Ligase detection Reaction) используются три олигонуклеотида, два из которых флуоресцентно меченые аллель-специфичные (различаются только меткой и 3′-нуклеотидом, соответствующим позиции SNP), а третий располагается с 5′-конца от SNP и непосредственно примыкает к аллель-специфичному праймеру. Полученные лигированные фрагменты детектируются с помощью электрофореза. Преимуществом метода является возможность одновременного проведения большого числа параллельных реакций и, следовательно, параллельной детекции большого количества возможных SNP. К недостаткам метода можно отнести трудоемкость ввиду необходимости синтеза индивидуальных проб для каждого анализируемого SNP.
[Wan С., Shi Y., Zhao X., Tang W., Zhang Μ., Ji В., Zhu H., Xu Υ., Li H., Feng G., He L. Positive association between ALDH1A2 and schizophrenia in the Chinese population - Prog Neuropsychopharmacol Biol Psychiatry. - 2009. - V.33(8). - P. 1491-1495]
[Kou C., Meng X., Xie В., Shi J., Yu Q., Yu Y., D′Arcy C. No association between catechol-O-methyltransferase polymorphisms and neurotic disorders among mainland Chinese university students - Psychiatry Res. 2012. (Epub ahead of print)]
8. Гибридизация на олигонуклеотидных матрицах (биочипы или микроматрицы)
Микроматрица - это твердый носитель небольшого размера (например, стекло, нейлон или металлическая пластина) с прикрепленными к нему в определенном порядке короткими олигонуклеотидами (8-80 нуклеотидов) или фрагментами ДНК (размером более 100 нуклеотидов). Прикрепление одного из компонентов реакции к подложке позволяет проводить множество реакций одновременно посредством детекции пространственно разделенных отдельных однонуклеотидных замен (SNPs). Иммобилизованной может быть как контрольная ДНК с известной последовательностью, так и анализируемая ДНК с неизвестным нуклеотидом в вариабельной позиции.
Микроматрицы могут применяться как для мутационного скрининга, так и для детекции известных аллелей. Иммобилизованная ДНК может непосредственно гибридизоваться с неизвестной последовательностью, и тогда эффективность гибридизации служит сигналом наличия/отсутствия мутации, либо присутствующая в растворе ДНК может являться матрицей для синтеза ДНК с иммобилизованного праймера для определения прилежащего к нему нуклеотида. Преимуществами метода являются простота, низкая стоимость и возможность использования флуоресцентной метки, что позволяет легко автоматизировать процесс. К недостаткам метода можно отнести невозможность анализа тандемных повторов, а также высокую стоимость оборудования в некоторых модификациях метода.
[Carrera Ν., Arrojo Μ., Sanjuan J., Ramos-Rios R., Paz E., Suarez-Rama J.J., Paramo M., Agra S., Brenlla J., Martinez S., Rivero O., Collier D.A., Palotie A., Cichon S., Nöthen M.M., Rietschel M., Rujescu D., Stefansson H., Steinberg S., Sigurdsson E., St Clair D., Tosato S., Werge Т., Stefansson K., Gonzalez J.C., Valero J., Gutierrez-Zotes Α., Labad Α., Martorell L., Vilella E., Carracedo Α., Costas J. Association study of nonsynonymous single nucleotide polymorphisms in schizophrenia - Biol Psychiatry. - 2012. - V.71(2). - P. 169-177]
[Johnson C., Drgon Т., Liu Q.R., Walther D., Edenberg H., Rice J., Foroud Т., Uhl G.R. Pooled association genome scanning for alcohol dependence using 104,268 SNPs: validation and use to identify alcoholism vulnerability loci in unrelated individuals from the collaborative study on the genetics of alcoholism - Am J Med Genet В Neuropsychiatr Genet. 2006 Dec 5;141B(8):844-53]
9. Минисеквенирование на олигонуклеотидном микрочипе
Гибридизующийся зонд используют в качестве матрицы для синтеза ДНК с иммобилизованного олигонуклеотида. Вместо dNTP можно добавлять в реакцию меченые ddNTP одновременно для терминации реакции синтеза и мечения получающегося продукта. Таким образом, можно получить информацию о следующем за праймером нуклеотиде, соответствующем позиции SNP. Существует множество вариаций этой методики и сама реакция может заключаться как в непосредственной элонгации праймера (если праймер располагается вплотную к SNP), так и в элонгации, определяемой праймером (если 3′-концевой нуклеотид праймера соответствует одному из аллельных состояний гена и эффективность элонгации праймера зависит от того, комплементарен этот нуклеотид матрице или нет). Метод позволяет с высокой точностью определять генотипы и проводить одновременный анализ более 20 SNPs, однако является достаточно дорогостоящим и не подходит для анализа повторов и некартированных делеций и дупликаций.
[Nikiforov Т.Т., Rendle R.B., Goelet P., Rogers Y.H., Kotewicz M.L., Anderson S., Trainor G.L., Knapp M.R. Genetic Bit Analysis: a solid phase method for typing single nucleotide polymorphisms. - Nucleic Acids Res. - 1994. - V.22(20). - P. 4167-4175].
[Podder M, Welch WJ, Zamar RH, Tebbutt SJ. Dynamic variable selection in SNP genotype autocalling from APEX microarray data. BMC Bioinformatics. 2006 Nov 30;7:521]
Таким образом, в настоящее время существует множество подходов для определения аллелей генов-кандидатов, ассоциированных с шизофренией и алкоголизмом. Данные подходы различаются набором маркеров (генотипируемые полиморфные локусы) и методами их определения.
В патенте US 2012040350 представлен способ определения генетического риска развития шизофрении, шизотипического расстройства и шизоаффективного расстройства путем определения однонуклеотидных замен на 4 и 22 хромосоме (в том числе, регионы SH3, SHANK3, KCNIP4, CERK и PI4K2B). В этом патенте представлены данные об ассоциации обнаруженных гаплотипов с вышеперечисленными расстройствами. Для определения гаплотипов больных и здоровых индивидов авторы предлагают использовать аллель-специфические олигонуклеотиды с последующей гибридизации ПЦР продукта исследуемого маркера (п. 3, метод аллель-специфичной ПЦР).
В патенте CN 102146479 представлен набор для определения генов, ассоциированных с риском развития шизофрении, биполярного расстройства и депрессии. Метод основан на аллель специфичной ПЦР (п. 3, метод аллель-специфичной ПЦР).
В патенте KR 20080084778 предлагается определение однонуклеотидных замен в генах креатинканазы и триозофосфат-изомеразы I с помощью микрочипов (п. 8, метод гибридизации на олигонуклеотидных матрицах). Однако количество полиморфных локусов гена, которые предлагается определять в патенте явно недостаточно, чтобы достоверно определять риск развития шизофрении.
В патенте US 2010285455 представлен метод полногеномного сканирования с установлением профиля гомозиготности, ассоциированного с риском развития шизофрении. Анализ проводился при помощи двух ДНК-микрочипов, предназначенных для генотипирования однонуклеотидных замен (фирма-изготовитель Affymetrix). Среднее расстояние между исследуемыми полиморфными локусами составляло около 5600 нуклеотидов (п. 8, метод гибридизации на олигонуклеотидных матрицах). Описанный метод очень информативный и хорошо подходит для исследовательских целей для выявления полиморфных локусов, ассоциированных с заболеванием. Однако данный метод не подходит для диагностических целей в медицинских учреждениях, т.к. является дорогостоящим и долгосрочным в исполнении, а также требует специальной квалификации персонала.
Ближайшим аналогом предлагаемого изобретения является метод, описанный в п. 8. Поскольку все имеющиеся в настоящее время методы определения полиморфизма в генах-кандидатах развития шизофрении обладают теми или иными недостатками, существует реальная потребность в создании простого, недорогого и специфичного метода для выявления функционально-значимых полиморфных локусов, ассоциированных с риском развития шизофрении, с целью дальнейшего внедрения в любую стандартную клиническую лабораторию.
Такой способ обеспечивается настоящим изобретением.
Раскрытие изобретения
Сущность изобретения заключается в создании биочипа для определения генетической предрасположенности к шизофрении и алкоголизму, в ячейках которого иммобилизованы оригинальные дифференцирующие олигонуклеотиды, а также в создании набора ПЦР-праймеров для амплификации двадцати полиморфных ДНК-локусов (десять для определения предрасположенности к шизофрении и десять - к алкоголизму).
Для определения индивидуальной предрасположенности к шизофрении проводится анализ полиморфизма генов, участвующих в функционировании нейротрансмиттерных систем (HTR2A, СОМТ), в развитии и функционировании нервной системы (BDNF, RELN, DISCI, SLC18A1), а также ряд генов, ассоциация с шизофренией которых была обнаружена по результатам полногеномного сканирования (ZNF804A и PLXNA2).
Потенциальные механизмы влияния полиморфизма генов HTR2A, BDNF, DISC1, ZNF804A, RELN, СОМТ, SLC18A и PLXNA2 на риск возникновения шизофрении, представлены в Табл. 1.
Механизмы возможного влияния полиморфизма генов ADH1B, ADH1C, ALDH2, DRD2, СОМТ, NPY, AUTS2 и NK1R на риск развития алкоголизма, представлены в Табл. 2.
Список литературы к Таблице 1
1. Walitza S., Wewetzer С., Warnke Α., Gerlach Μ., Geller F., Gerber G., Görg Т., Herpertz-Dahlmann В., Schulz E., Remschmidt H., Hebebrand J., Hinney Α. 5-HT2A promoter polymorphism - 1438G/A in children and adolescents with obsessive-compulsive disorders. - Mol Psychiatry. - 2002. - V.7. - №10. - P. 1054-7.
2. Arranz M.J., Munro J., Owen M.J., Spurlock G. et al. Evidence for association between polymorphisms in the promoter and coding regions of the 5-HT2A receptor gene and response to clozapine. - 1998. - Mol. Psychiatry. - V.3(1). - P. 61-56.
3. Peters E.J., Slager S.L., Jenkins G.D., Reinalda M.S. et. al. Resequencing of serotonin-related genes and association of tagging SNPs to citalopram response. - 2009. - Pharmacogenet Genomics. - V.19(1). - P. 1-10.
4. Koolschijn P.C., van Haren N.E., Bakker S.C., Hoogendoorn M.L. et al. Effects of brain-derived neurotrophic factor Val66Met polymorphism on hippocampal volume change in schizophrenia. - 2010. - Hippocampus. - V.20(9). - P. 1010-1017.
5. Saetre P., Agartz I., De Franciscis Α., Lundmark P., Djurovic S., Kähler Α., Andreassen O.A., Jakobsen K.D., Rasmussen H.B., Werge Т., Hall H., Terenius L., Jönsson E.G. Association between a disrupted-in-schizophrenia 1 (DISC1) single nucleotide polymorphism and schizophrenia in a combined Scandinavian case-control sample. - Schizophr Res. - 2008. - V.106(2-3). - P. 237-41.
6. Ovadia G., Shifman S. The genetic variation of RELN expression in schizophrenia and bipolar disorder. - PLoS One. - 2011. - V.6(5).
7. Sazci Α., Ozel M.D., Ergul E., Yildiz M. A Polymerase Chain Reaction-Restriction Fragment Length Polymorphism Method for Screening ZNF804A Gene Polymorphism (rs1344706) in Patients with Schizophrenia: A Significant Association - Genet Test Mol Biomarkers. - 2012. - V.16(3). - P. 157-61.
8. Takeshita M., Yamada K., Hattori E., Iwayama Y., Toyota Т., Iwata Y., Tsuchiya K.J., Sugihara G., Hashimoto K., Watanabe H., Iyo M., Kikuchi M., Okazaki Y., Yoshikawa T. Genetic examination of the PLXNA2 gene in Japanese and Chinese people with schizophrenia. - Schizophr Res. - 2008. - V.99(1-3). - P. 359-64.
9. Kang H.J., Choe B.M., Kim S.H., Son S.R., Lee K.M., Kim B.G., Hong Y.S. No Association Between Functional Polymorphisms in COMT and MTHFR and Schizophrenia Risk in Korean Population. Epidemiol Health. - 2010. - V.24.
10. Lohoff F.W. Genetic variants in the vesicular monoamine transporter 1 (VMAT1/SLC18A1) and neuropsychiatric disorders. - Methods Mol Biol. - 2010. - V.637. - P. 165-80.
Список литературы к Таблице 2
1. Ducci F., Goldman D. Genetic approaches to addiction: genes and alcohol // Addiction. 2008. V.103(9). P. 1414-1428
2. Borinskaya S., Kal′ina N., Marusin A. et al. Distribution of the alcohol dehydrogenase ADH1B*47His allele in Eurasia // Am J Hum Genet. 2009. V.84(1). P. 89-92
3. Macgregor S., Lind P.Α., Bucholz K.K. et al. Associations of ADH and ALDH2 gene variation with self report alcohol reactions, consumption and dependence: an integrated analysis // Hum Mol Genet. 2009. V.18(3). P. 580-593
4. Johann M., Putzhammer Α., Eichhammer P., Wodarz N. Association of the - 141C Del variant of the dopamine D2 receptor (DRD2) with positive family history and suicidality in German alcoholics // Am J Med Genet В Neuropsychiatr Genet. 2005. V.132B(1). P.46-49
5. Smith L., Watson M., Gates S., Ball D., Foxcroft D. Meta-analysis of the association of the Taq1A polymorphism with the risk of alcohol dependency: a HuGE gene-disease association review // Am J Epidemiol. 2008. V.167(2). P. 125-138
6. Hendershot C.S., Lindgren К.P., Liang Т., Hutchison Κ.Ε. СОМТ and ALDH2 polymorphisms moderate associations of implicit drinking motives with alcohol use // Addict Biol. 2011. doi: 10.1111/j.1369-1600.2010.00286.x
7. Lappalainen J., Kranzler H.R., Malison R. et al. A functional neuropeptide Y Leu7Pro polymorphism associated with alcohol dependence in a large population sample from the United States // Arch Gen Psychiatry. 2002. V.59(9). P. 825-831
8. Seneviratne C., Ait-Daoud N., Ma J.Z., Chen G., Johnson B.A., Li M.D. Susceptibility locus in neurokinin-1 receptor gene associated with alcohol dependence // Neuropsychopharmacology. 2009 V.34(11). P. 2442-9.
9. Schumann G., Coin L.J., Lourdusamy Α., Charoen P. et al. Genome-wide association and genetic functional studies identify autism susceptibility candidate 2 gene (AUTS2) in the regulation of alcohol consumption // Proc Natl Acad Sci USA. 2011. V.108(17). P. 7119-24.
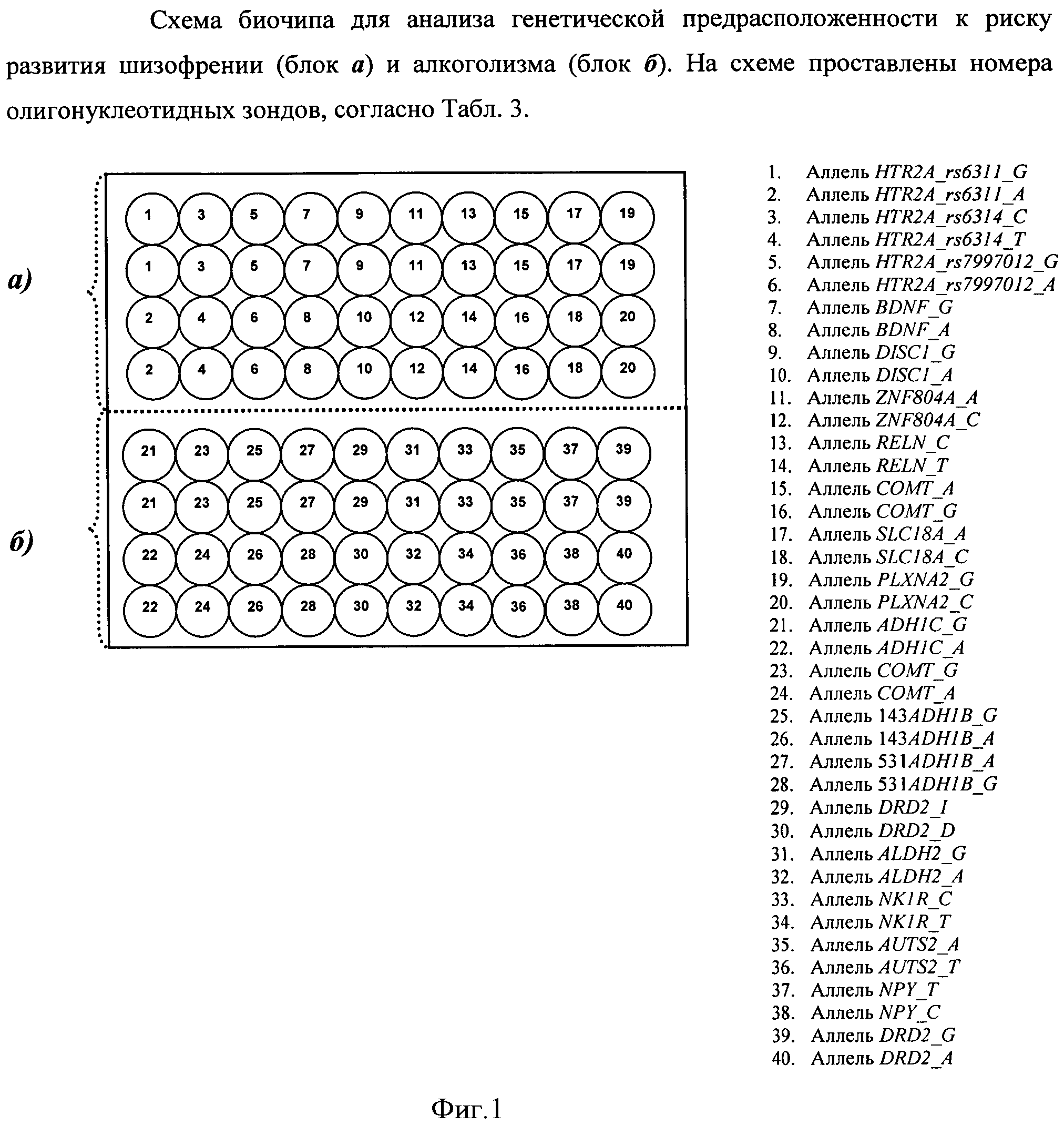
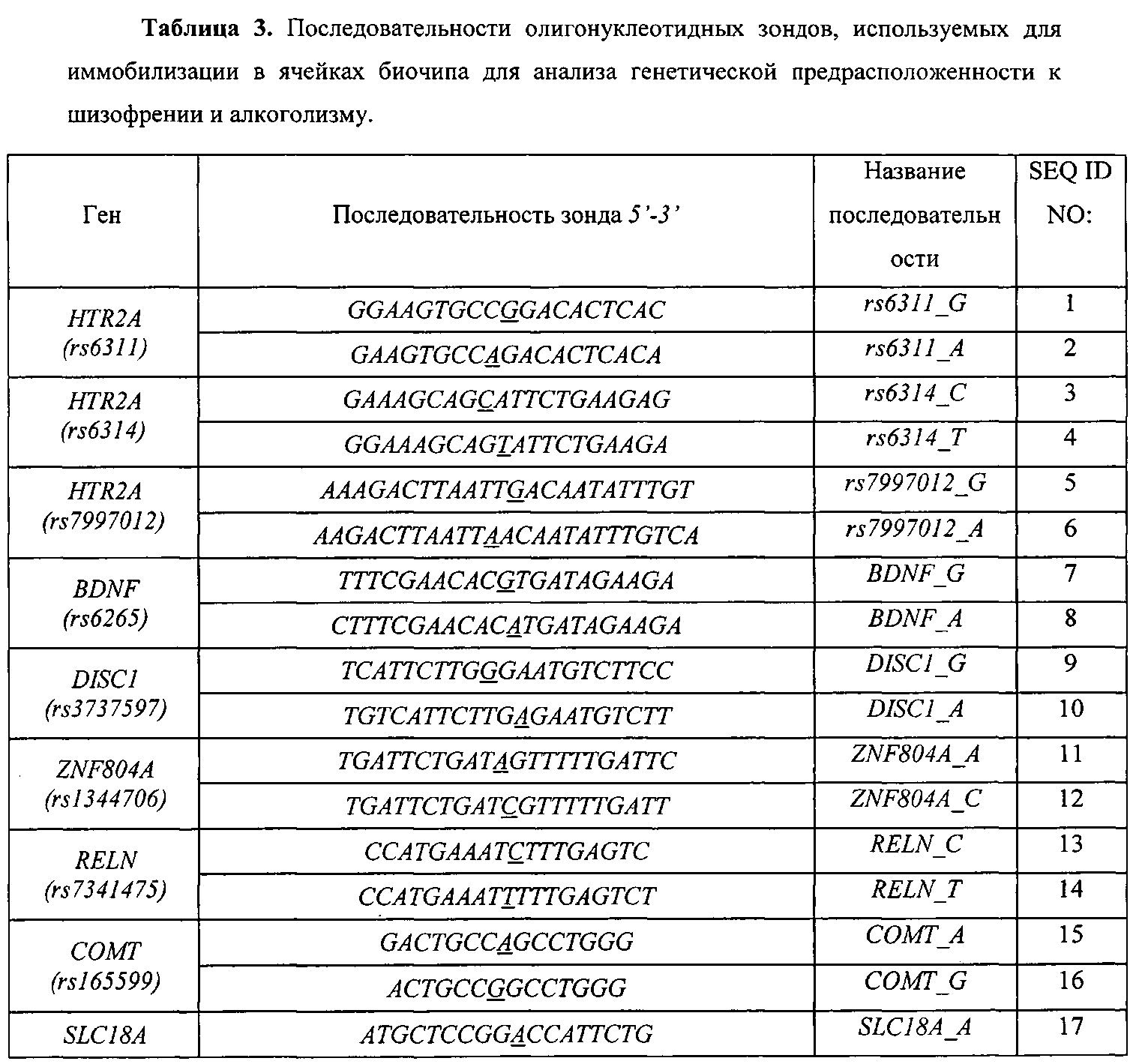
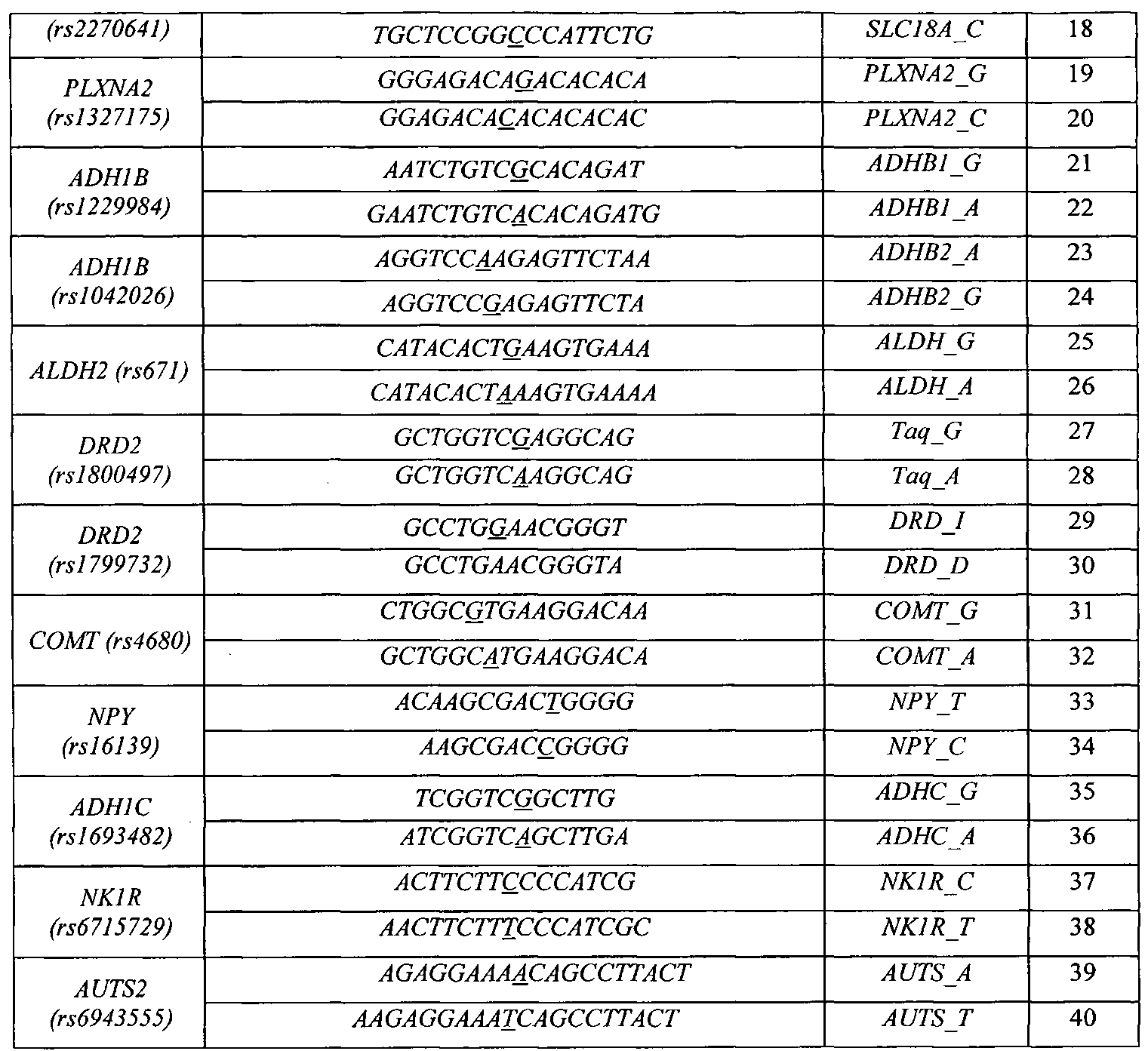
Воплощением предлагаемого изобретения является биочип, содержащий набор иммобилизованных дифференцирующих олигонуклеотидов и праймеры для амплификации полиморфных ДНК-локусов. Последовательности дифференцирующих олигонуклеотидов приведены в Табл. 3 и Перечне последовательностей (SEQ ID NO:1-40). Последовательности праймеров приведены в Табл. 4 и Перечне последовательностей (SEQ ID NO:41-120). Дифференцирующие олигонуклеотиды (SEQ ID NO:1-40) иммобилизуются в ячейках гидогелевого микрочипа в концентрации 4000 пкмоль на 1 мкл геля. [Мирзабеков А.Д., Рубина А.Ю., Паньков С.В., Перов А.Н., Чупеева В.В. (2003) Композиция для иммобилизации биологических макромолекул в гидрогелях, способ приготовления композиции, биочип, способ проведения ПЦР на биочипе. Патент RU 2206575 С2]. Схема расположения ячеек биочипа для анализа генетической предрасположенности к шизофрении и алкоголизму приведена на Фиг. 1. Проведение анализа с использованием предлагаемого изобретения выполняется аналогично способу, описанному в патенте RU 2303634 [Заседателев А.С., Наседкина Т.В., Глотов А.С. (2007) Способ анализа генетического полиморфизма, определяющего предрасположенность к онкологическим заболеваниям и индивидуальную чувствительность к фармацевтическим препаратам, с использованием олигонуклеотидного биологического микрочипа (биочипа)].
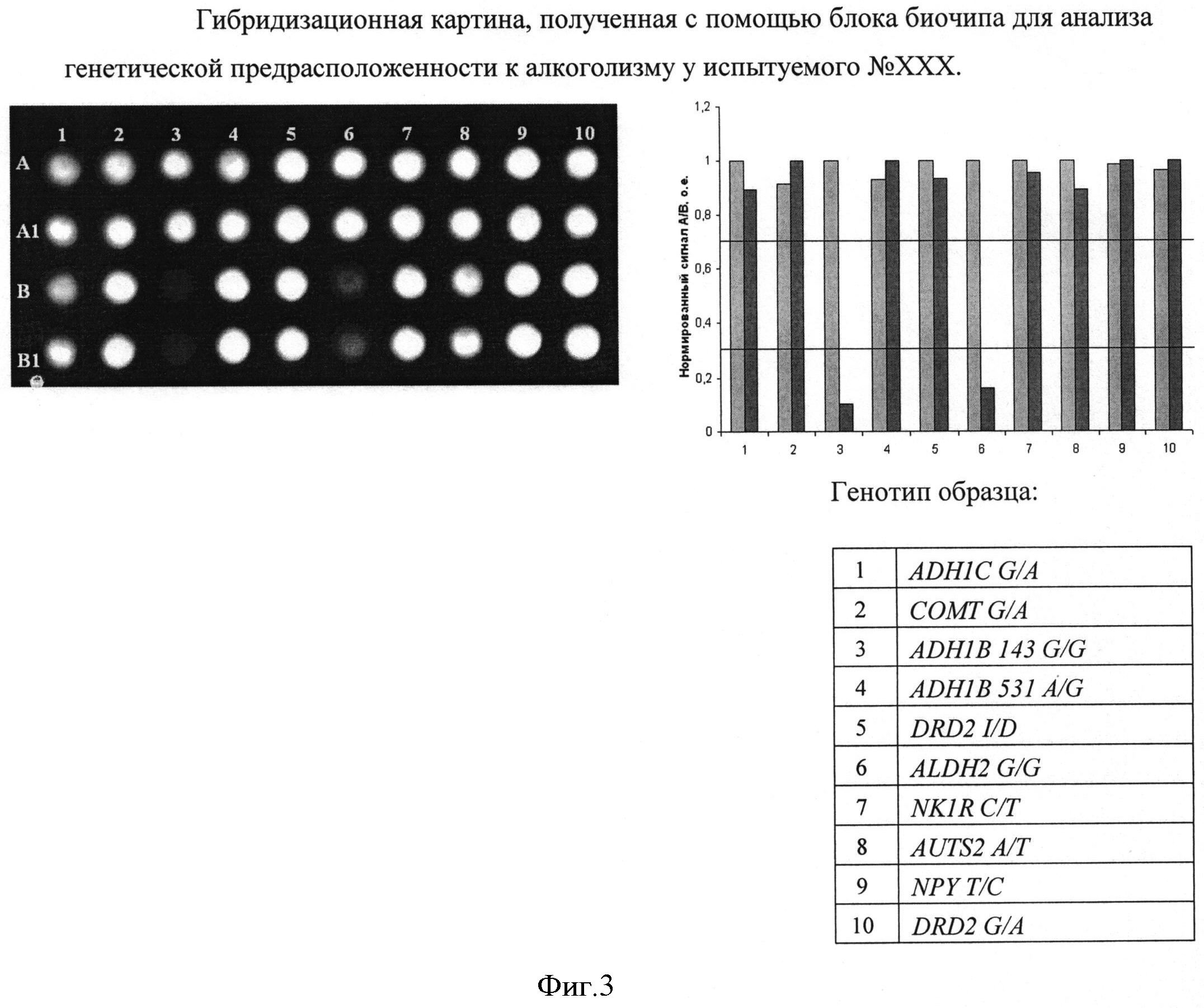
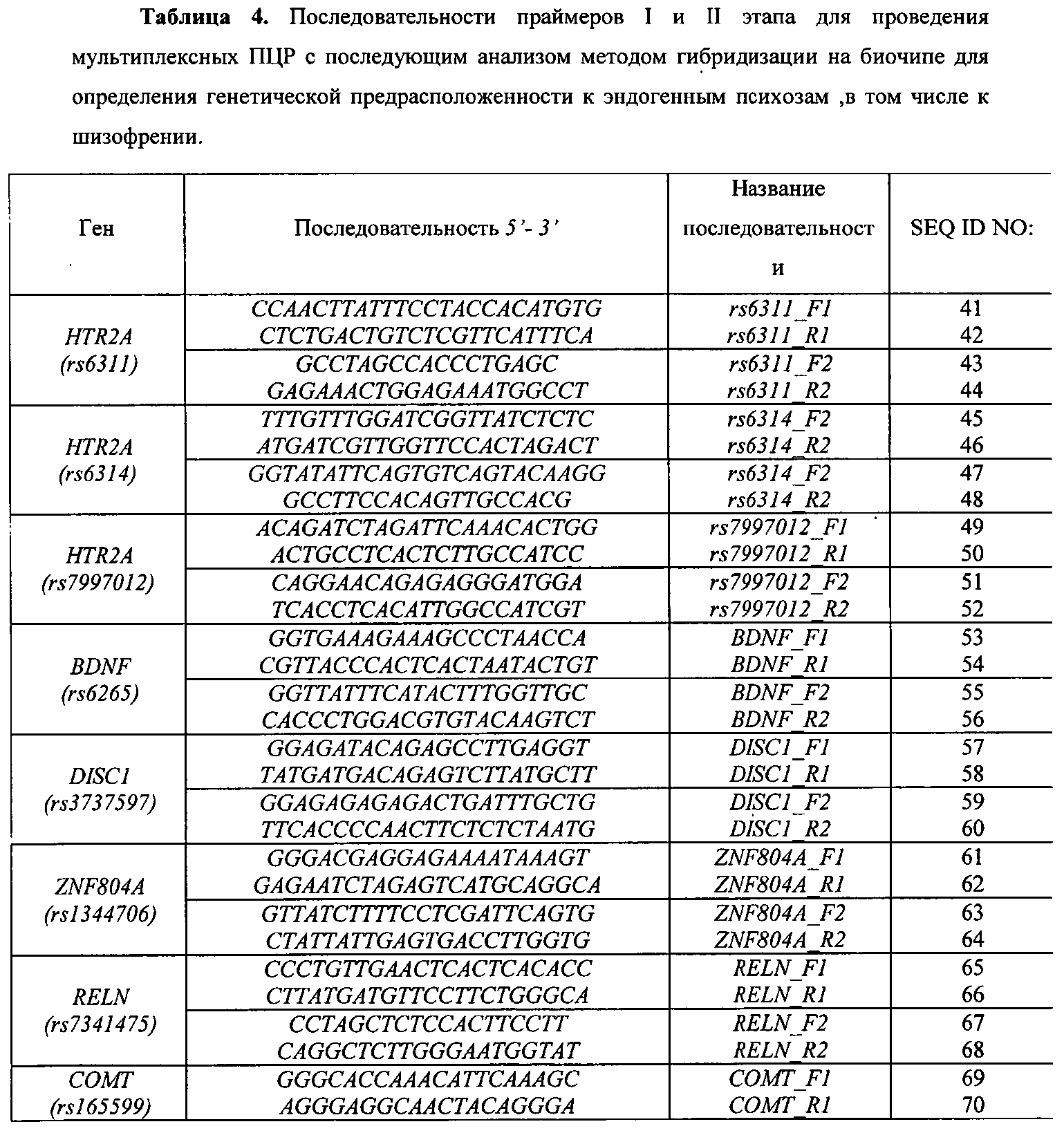
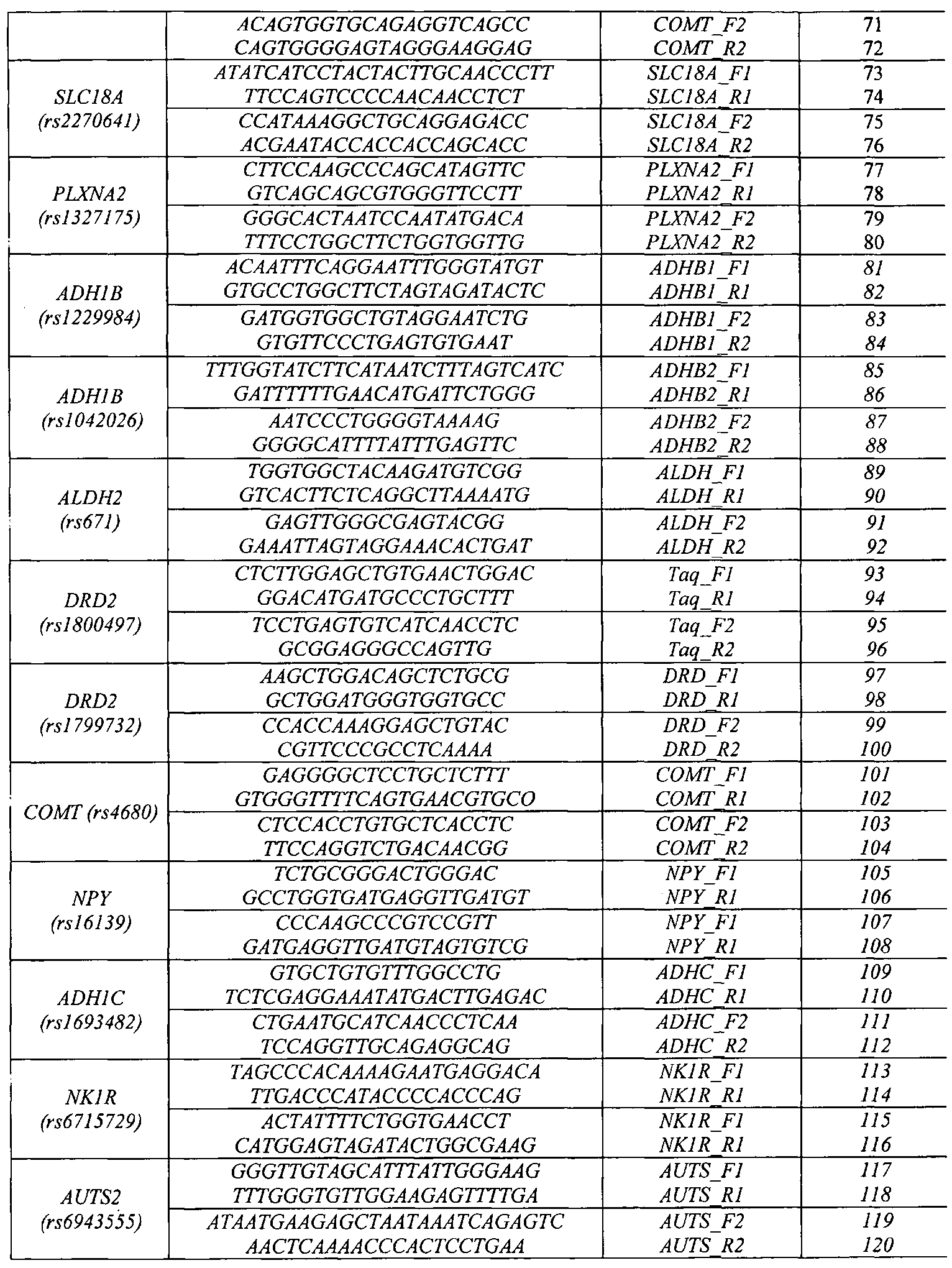
Набор праймеров используется на стадии амплификации полиморфных ДНК-локусов посредством проведения двухэтапной «гнездовой» ПЦР для подготовки ДНК-мишени к гибридизации на биочипе. На первом этапе проходит амплификация фрагмента геномной ДНК, на втором этапе с амплифицированного фрагмента нарабатывается одноцепочечная ДНК с одновременным введением флуоресцентной метки. Далее проводится гибридизация флуоресцентно меченых фрагментов ДНК, полученных после проведения второго этапа ПЦР, с иммобилизованными в ячейках геля олигонуклеотидами, расположенными на пластиковой подложке. После проведения гибридизации и отмывки биочипа проводится анализ полученной флуоресцентной картины, на основании которого делается вывод о генотипе в исследуемом образце. Примеры гибридизационных картин приведены на Фиг. 2 и Фиг. 3.
Осуществление изобретения
Задача настоящего изобретения состоит в создании биологического микрочипа (биочипа) для определения генетической предрасположенности к шизофрении и алкоголизму, позволяющего проводить генотипирование по двадцати полиморфным ДНК-локусам генов предрасположенности к шизофрении и алкоголизму посредством анализа полиморфизма в генах HTR2A (rs6311, rs6314, rs7997012), BDNF (rs6265), DISC1 (rs3737597), ZNF804A (rs1344706), RELN (rs7341475), COMT (rs165599), SLC18A (rs2270641), PLXNA2 (rs1327175), ADH1B (rs1229984, rs1042026), ALDH2 (rs671), DRD2 (rs1800497, rs1799732), COMT (rs4680), NPY (rs16139), ADH1C (rs1693482), NKR1 (rs6715729) и AUTS2 (rs6943555).
Олигонуклеотиды для иммобилизации на биочипе для определения генетической предрасположенности к шизофрении и алкоголизму подбираются таким образом, чтобы идентифицировать все выбранные для анализа вариабельные позиции в генах HTR2A, BDNF, DISC1, ZNF804A, RELN, COMT, SLC18A, PLXNA2, ADH1B, ALDH2, DRD2, NPY, ADH1C, NKR1 и AUTS2.
Олигонуклеотиды должны соответствовать следующим критериям:
1) Дискриминирующий зонд должен обладать высокой специфичностью к выбранному для анализа полиморфному локусу, который представляет собой участок гена, амплифицированный с помощью ПЦР с включенной флуоресцентной меткой.
2) Вариабельный нуклеотид должен находиться в серединной области зонда, поскольку такое положение позволяет добиться большей дискриминации между совершенными и несовершенными дуплексами.
3) Выбранные олигонуклеотиды не должны содержать высокостабильных вторичных структур, наличие которых может приводить к снижению эффективности гибридизации.
Для идентификации каждого однонуклеотидного полиморфизма используются два специфичных дискриминирующих олигонуклеотида. При гибридизации с гомозиготной пробой один из них образовывает с пробой совершенный, а другой - несовершенный дуплекс.
На биочипе для определения генетической предрасположенности к шизофрении и алкоголизму иммобилизованы 40 высокоспецифичных дифференцирующих олигонуклеотидных зондов (Табл. 3 и Перечень последовательностей (SEQ ID NO:1-40)), структура которых обеспечивает связывание только с полностью комплементарными ДНК-мишенями, что, в свою очередь, обуславливает яркий флуоресцентный сигнал в соответствующих им ячейках биочипа и дает наиболее четкие картины распределения гибридизационных сигналов. Неспецифическое связывание сведено к минимуму, что практически исключает ложноположительное «срабатывание» ячеек.
Для обеспечения оптимального состава и структуры ПЦР-праймеров, используемых в протоколе мультиплексной ПЦР, необходимы такие праймеры, которые не образуют между собой высокоэнергетических внутренних структур (шпильки и дуплексы), обеспечивают специфичную амплификацию необходимого количества продукта и при этом подобраны таким образом, чтобы их отжиг на мишени происходил при одинаковой для всех температуре (60-64°C). Для обеспечения сбалансированной эффективной амплификации исследуемых образцов оптимизированы такие параметры как концентрация MgCl2 и ПЦР-праймеров в ПЦР-смеси, соотношение прямых и обратных праймеров, количество циклов амплификации на обоих этапах, время элонгации, денатурации и отжига праймеров, температура отжига праймеров на каждом этапе. Праймеры 1 и 2 этапа позволяют осуществлять эффективную наработку фрагментов геномной ДНК, содержащих выбранные функционально значимые полиморфные локусы генов-кандидатов риска развития шизофрении (HTR2A (rs6311, rs6314, rs7997012), BDNF (rs6265), DISC1 (rs3737597), ZNF804A (rs1344706), RELN (rs7341475), COMT (rs165599), SLC18A (rs2270641) и PLXNA2 (rs1327175)) и алкоголизма (ADH1B (rs1229984, rs1042026), ALDH2 (rs671), DRD2 (rs1800497, rs1799732), COMT (rs4680), NPY (rs16139), ADH1C (rs1693482), NKR1 (rs6715729) и AUTS2 (rs6943555).
Анализ риска предрасположенности к шизофрении и алкоголизму с использованием данного изобретения состоит из нескольких этапов, которые приведены ниже. Вначале проводится наработка ПЦР-продуктов для последующей гибридизации на биочипе посредством «гнездовой» мультиплексной ПЦР в два этапа с введением флуоресцентного красителя на втором этапе, при этом в качестве матрицы для проведения реакции используют образец ДНК. Для надежной воспроизводимости результатов мультиплексную амплификацию каждого образца ДНК проводят в шести пробирках с использованием реакционных смесей с разным набором специфичных к исследуемым локусам праймеров, при этом в каждой мультиплексной смеси присутствует по 3-4 пары праймеров.
ПЦР может быть проведена с использованием любого вида термостабильной полимеразы (Taq-полимераза, Tth-полимераза, Tfl-полимераза, Pfu-полимераза, Vent-полимераза, DeepVent-полимераза и т.п. коммерчески доступные ферменты, выделенные из термофилов), работающей в соответствующем буфере. Для построения новой цепи в буфер добавляется смесь дНТФ (дАТФ, дГТФ, дЦТФ, дТТФ) в принятых концентрациях, при этом вместо дТТФ может быть использован дУТФ. Для проведения ПЦР могут быть использованы готовые коммерчески доступные наборы, содержащие все необходимые компоненты за исключением праймеров.
На первом этапе проходит амплификация полиморфных ДНК-локусов генов-кандидатов риска развития шизофрении (HTR2A, BDNF, DISC1, ZNF804A, RELN, СОМТ, SLC18A и PLXNA2) и алкоголизма (ADH1B, ADH1C, ALDH2, DRD2, СОМТ, NPY, AUTS2 и NK1R). Продукт первого этапа ПЦР используют в качестве матрицы на втором этапе, который проводят в реакционной смеси того же состава, но добавляют избыток одного из праймеров для обеспечения избытка флуоресцентно меченого одноцепочечного ПЦР-продукта. Это позволяет получать одноцепочечный ампликон, способный к гибридизации с аллель-специфичными ДНК-зондами на биочипе. Флуоресцентное мечение проводят на втором этапе ПЦР одновременно с амплификацией одноцепочечных фрагментов ДНК посредством введения флуоресцентной метки. В качестве флуоресцентной метки используется дезоксинуклеотидтрифосфат, а именно Су5-дУТФ, встраивающийся de novo в синтезируемую ДНК-цепь. В качестве флуоресцентной метки также может быть использован любой флуорохром без ограничения (например, FITC, Texas red, Су-3 и т.д.), а также биотин.
Праймеры и олигонуклеотидные зонды синтезируют с использованием различных химических подходов, таких как фосфодиэфирный метод, гидрофосфорильный метод и т.д., при этом наиболее распространенным в настоящее время является фосфоамидитный метод синтеза. Синтез праймеров осуществляют, используя автоматические ДНК/РНК синтезаторы, например производства фирмы «Applied Biosystems» (США).
При изготовлении биочипа могут быть использованы олигонуклеотиды, несущие по 5′- или 3′-концу активную группу, обеспечивающую иммобилизацию. Модификация олигонуклеотида для введения активной группы может быть осуществлена как в автоматическом режиме при синтезе с использованием широкого спектра коммерчески доступных модификаторов, так и постсинтетически в ручном режиме. Например, при синтезе олигонуклеотидных зондов с помощью 3′-Amino-Modifier С7 CPG 500 («Glen Research», США) на 3′-конец олигонуклеотидов вводится спейсер со свободной аминогруппой, используемый для последующей иммобилизации олигонуклеотида на биочипе.
В качестве праймеров для проведения мультиплексной «гнездовой» двухэтапной ПЦР используют праймеры SEQ ID NO:21-61, приведенные в Перечне последовательностей и в Табл. 3.
В мультиплексных реакциях I этапа используют праймеры:
1) в первой мультиплексной реакции - 41, 42, 45, 46, 49, 50, 53, 54;
2) во второй мультиплексной реакции - 57, 58, 61, 62, 65, 66;
3) в третьей мультиплексной реакции - 69, 70, 73, 74, 77, 78;
4) в четвертой мультиплексной реакции - 81, 82, 85, 86, 89, 90;
5) в пятой мультиплексной реакции - 93, 94, 97, 98, 101, 102, 105, 106;
6) в шестой мультиплексной реакции - 109, 110, 113, 114, 117,118;
В мультиплексных реакциях II этапа используют праймеры:
1) в первой мультиплексной реакции - 43, 44, 47, 48, 51, 52, 55, 56;
2) во второй мультиплексной реакции - 59, 60, 63, 64, 67, 68;
3) в третьей мультиплексной реакции - 71, 72, 75, 76, 79, 80;
4) в четвертой мультиплексной реакции - 83, 84, 87, 88, 91, 92;
5) в пятой мультиплексной реакции - 95, 96, 99, 100, 103, 104, 107, 108;
6) в шестой мультиплексной реакции - 111, 112, 115, 116, 119, 120;
Далее проводится гибридизация флуоресцентно меченых фрагментов ДНК, полученных после проведения второго этапа ПЦР, с иммобилизованными в ячейках геля олигонуклеотидами, которые представляют собой полиморфные участки генов и являются комплементарными как последовательности «дикого типа» (предковый аллельный вариант), так и вариабельной последовательности (производный аллель).
Перед постановкой гибридизации ампликон денатурируют путем прогрева готовой гибридизационной смеси при 95°C в течение 5 мин с последующим быстрым охлаждением на льду. Гибридизация может быть проведена в любом известном гибридизационном буфере, например в гуанидиновом или SSPE-буфере. Типичное время гибридизации составляет 12-14 ч при 37°C. Анализ генотипов и аллелей в исследуемом образце проводится с учетом расположения олигонуклеотидных зондов на биочипе, схема которого (Фиг. 1) позволяет определить, какие варианты присутствуют в том или ином образце.
Анализируемый фрагмент ДНК образует совершенные гибридизационные дуплексы только с соответствующими полностью комплементарными ему олигонуклеотидами. Если последовательность анализируемой ДНК полностью комплементарна последовательности зонда, то образуется стабильный совершенный дуплекс (детектируется сигнал флуоресценции). В случае, если искомого фрагмента нет или в нем находится некомплементарное основание, то стабильного дуплекса не образуется (сигнал флуоресценции отсутствует). Дискриминацию совершенных и несовершенных дуплексов проводят после отмывки биочипа, сравнивая интенсивности сигналов флуоресценции соответствующих ячеек биочипа. Отмывка может быть проведена в любом известном в данной области техники буфере с добавлением соли (SSC, SSPE и т.п.) или в деионизованной воде, но за более короткое время [Sambrook J.F. & D.W. Russell (2001) <<Molecular cloning: a laboratory manual)) Cold Spring Harbor Laboratory Press].
После проведения гибридизации и отмывки биочипа проводится визуализация результатов гибридизации с помощью возбуждения флуоресценции меченого ПЦР-продукта второго этапа ПЦР, на основании которой делается вывод о генотипе в исследуемом образце. Регистрация гибридизационной картины может быть произведена с помощью любой детектирующей системы, распознающей флуоресцентный сигнал (флуоресцентный микроскоп с ПЗС-камерой, лазерный сканер, портативный анализатор биочипов и т.п. коммерчески доступные флуоресцентные анализаторы, например, портативный анализатор биочипов, снабженный ПЗС-камерой и специальным программным обеспечением, производства ООО «Биочип-ИМБ» (Россия)).
Биочипы могут быть изготовлены посредством последовательного нанесения на поверхность стеклянной подложки матрицы ячеек акриламидного геля, активации ячеек и ковалентной иммобилизации в ячейках модифицированных олигонуклеотидов, несущих активные группы [Kolchinsky A, Mirzabekov A. Analysis of SNPs and other genomic variations using gel-based chips. Hum Mutat. 2002 Apr;19(4):343-60. Review]. В качестве подложки помимо стекла может быть использован другой материал, в том числе металл, гибкие мембраны и пластик [Паньков С.В., Крейндлин Э.Я., Сомова О.Г., Моисеева О.В., Барский В.Е., Заседателев А.С. (2007) Применение немодифицированных полимерных материалов для изготовления подложки биочипов, биочип на их основе и способ его изготовления, способ иммобилизации гидрогелей на немодифицированных полимерных материалах. Патент RU 2309959]. Биочипы также могут быть изготовлены любыми другими известными специалисту в данной области способами [Seliger Η, Hinz Μ, Ηapp Ε. Arrays of immobilized oligonucleotides-contributions to nucleic acids technology. Curr Pharm Biotechnol. 2003 Dec;4(6):379-95].
Для изготовления биочипа в настоящем изобретении используется набор олигонуклеотидов, приведенных в Перечне последовательностей (SEQ ID NO:1-40), а также в Табл. 3. В качестве контроля прохождения гибридизации в настоящем изобретении используют образец контрольной ДНК. Расположение конкретных олигонуклеотидных зондов на биочипе может варьироваться и определяется только удобством интерпретации результатов гибридизации.
Далее изобретение иллюстрируется примерами, которые показывают применение способа анализа однонуклеотидного и инсерционно-делеционного полиморфизма для определения генетической предрасположенности к шизофрении и алкоголизму. Следует понимать, что приводимые примеры служат исключительно для иллюстрации и не предназначены для ограничения объема притязаний, выраженных в формуле изобретения. На основании настоящего описания специалист в данной области сможет легко предложить свои варианты и модификации осуществления изобретения, не отходя от общей концепции настоящего изобретения и без привлечения собственной изобретательской деятельности, так что должно быть понятно, что такие варианты и модификации также будут входить в объем притязаний настоящего изобретения.
Пример 1. Амплификация фрагмента гена HTR2A (rs6311) методом двухэтапной «гнездовой» мультиплексной ПЦР с целью получения флуоресцентно меченого полиморфного ДНК-локуса гена в необходимом количестве.
Из слюны испытуемых была выделена ДНК набором Oragene™ DNA Self-Collection Kit («DNA Genotek», Канада). Для мультиплексной наработки всех анализируемых генов использовали ПЦР-праймеры SEQ ID NO:21-24. Первый этап ПЦР проводили на приборе MiniCycler («MJ Research, Inc.», США) в объеме 25 мкл реакционной смеси, составом: 1×ПЦР-буфер (67 мМ Трис-HCl, pH 8,6, 166 мМ (NH4)2SO4, 0,01% Тритон Х-100), 1,5 мМ MgCl2, 0,2 мМ каждого из dNTP («Силекс», Россия), по 5 рМ праймеров SEQ ID NO:21-22, 1 мкл геномной ДНК и 1,5 ед. акт. Taq-полимеразы («Силекс», Россия). ДНК денатурировали 3 мин при 94°C и проводили 35 циклов амплификации (94°C - 30 с, 64°C - 30 с, 72°C - 1 мин), затем 4 мин при 72°C. Смесь второго этапа ПЦР отличалась составом и концентрацией праймеров: прямой праймер SEQ ID NO:23 брали в концентрации 10 пкмоль/мкл, обратный праймер SEQ ID NO:24-100 пкмоль/мкл. В смесь добавляли 2 мкл продукта из первого этапа и проводили амплификацию по схеме: 3 мин 94°C, 40 циклов (94°C - 30 с, 60°C - 30 с, 72°C - 1 мин), 4 мин при 72°C. Также на втором этапе одновременно с проведением преимущественной амплификации одноцепочечного фрагмента ДНК проводили флуоресцентное мечение посредством добавления в ПЦР-смесь дезоксиуридинтрифосфата, меченого флуоресцентным красителем Су-5 (Су5-дУТФ), в количестве 0,2 нмоль на реакцию.
Пример 2. Олигонуклеотидный биочип для определения генетического полиморфизма в генах-кандидатах предрасположенности к шизофрении и алкоголизму HTR2A, BDNF, DISC1, ZNF804A, RELN, СОМТ, SLC18A, PLXNA2 ADH1B, ALDH2, DRD2, СОМТ, NPY, ADH1C, NKR1 и AUTS2.
Олигонуклеотиды для иммобилизации на микрочипе синтезируют на автоматическом синтезаторе 394 DNA/RNA Synthesizer («Applied Biosystems», США) с использованием стандартной фосфоамидитной процедуры. 5′ или 3′-конец олигонуклеотидов содержит спейсер со свободной аминогруппой, который вводят в состав олигонуклеотида при синтезе путем использования 3′-Amino-Modifier С7 CPG 500 («Glen Research», США). Присоединение флуоресцентной метки к олигонуклеотидам по свободной аминогруппе осуществляют в соответствии с рекомендациями производителя. Олигонуклеотиды, меченые цианиновым красителем Су-3, очищают методом ВЭЖХ от олигонуклеотидов, не включивших флуоресцентный краситель, на колонке «Hypersil ODS» 5 мкм, 4,6×250 мм» («Sypelco Int», США).
Биочип изготовляют методом сополимеризации олигонуклеотида в акриламидном геле, как описано ранее [Паньков С.В., Крейндлин Э.Я., Сомова О.Г., Моисеева О.В., Барский В.Е., Заседателев А.С. (2007) Применение немодифицированных полимерных материалов для изготовления подложки биочипов, биочип на их основе и способ его изготовления, способ иммобилизации гидрогелей на немодифицированных полимерных материалах. Патент RU 2309959], [Мирзабеков А.Д., Рубина А.Ю., Паньков С.В., Чернов Б.К. (2001) Способ иммобилизации олигонуклеотидов, содержащих непредельные группы, в полимерных гидрогелях при формировании микрочипа. Патент RU 2175972]. После изготовления биочипы проходят контроль качества нанесения, который включает в себя визуальный контроль физических размеров гелевых ячеек при помощи светового микроскопа в отраженном свете и контроль концентрации иммобилизованных олигонуклеотидов с помощью красителя Су-3 (ООО «Биочип-ИМБ», Россия). Биочип содержит 40 иммобилизованных олигонуклеотидньгх зондов (SEQ ID NO:1-40), список которых представлен также в Табл. 3. Ячейки наносят согласно схеме на Фиг. 1.
Реакционную смесь, полученную после проведения II этапа ПЦР, описанного в Примере 1, используют для гибридизации на биочипе в буфере следующего состава: 25% формамид («Sigma», США), 5х SSPE («Promega», США). Готовую гибридизационную смесь перед гибридизацией денатурируют при 95°C в течение 5 мин, охлаждают во льду 2 мин и наносят на биочип в гибридизационную камеру объемом 40 мкл (ООО «Биочип-ИМБ», Россия). Гибридизацию проводят в течение 12-14 ч при температуре 37°C. После завершения инкубации гибридизационную камеру удаляют вместе с непрореагирозавшей гибридизационной смесью и проводят отмывку в 1x SSPE буфере («Promega», США) при комнатной температуре в течение 10 мин.
Регистрацию гибридизационной картины производят с помощью портативного анализатора биочипов, снабженного ПЗС-камерой, производимого ООО «Биочип-ИМБ». Описание алгоритма автоматического анализа изображения с помощью программы Image Ware™ выходит за рамки настоящего изобретения.
Определим генотип по гибридизационной картине, представленной на Фиг. 2. Полиморфный участок гена HTR2A (rs6311): положительный сигнал наблюдается в двух верхних и двух нижних ячейках второго столбца, соответственно, генотип образца HTR2A rs6311 (G/A) находится в гетерозиготном состоянии.
Аналогично определяем генотипы по остальным точкам: HTR2A (rs6311, rs6314, rs7997012), BDNF (rs6265), DISC1 (rs3737597), ZNF804A (rs1344706), RELN (rs7341475), COMT (rs165599), SLC18A (rs2270641), PLXNA2 (rs1327175), ADH1B (rs1229984, rs1042026), ALDH2 (rs671), DRD2 (rs1800497, rs1799732), COMT (rs4680), NPY (rs16139), ADH1C (rs1693482), NKR1 (rs6715729) и AUTS2 (rs6943555).