Результат интеллектуальной деятельности: СРЕДСТВО ДЛЯ ПРЕДУПРЕЖДЕНИЯ И КОРРЕКЦИИ ПРОЯВЛЕНИЙ ДИАБЕТА
Вид РИД
Изобретение
Предложено применение оригинального ноотропного и нейропротективного препарата Ноопепта (этиловый эфир N-фенилацетил - L-пролилглицина) в качестве средства для предупреждения и лечения диабета. Показано, что введение крысам токсина стрептозотоцина в диабетогенных дозах 45-50 мк/кг (однократно внутрибрюшинно) ведет к развитию таких признаков диабета, как повышение содержания глюкозы в крови, ускоренная потеря массы тела, повышение болевой чувствительности, полиурия. Ноопепт, введенный в дозе 0,5 мг/кг повторно (в комбинированном профилактически-лечебном, профилактическом и лечебном, в том числе режиме отсроченного лечебного введения) ослабляет выраженность всех перечисленных метаболических проявлений диабета. В экспериментах на модели развивающегося диабета, вызванного повторным введением стрептозотоцина в субдиабетогенных дозах (30 мг/кг), продемонстрирована высокая антидиабетическая активность Ноопепта, вводимого перорально в дозе 5 мг/кг. Ноопепт превосходит другой перорально активный стандартный антидиабетический препарат Янувию (Sitagliptin) по показателям толерантности к глюкозной нагрузке. Совокупность полученных результатов в сочетании с многочисленными клиническими данными о хорошей переносимости этого ноотропного препарата (www.noopept.ru) позволяют считать целесообразным его применение по новому показанию - в качестве средства патогенетической терапии диабета, действие которого направлено на предотвращение его прогрессирования.
Область изобретения
Изобретение относится к медицине, в частности к фармакологии, и касается средства для предупреждения и лечения диабета.
Уровень техники
Сахарный диабет (СД) занимает 3-е место среди основных причин смертности населения в большинстве стран мира. По оценкам ВОЗ в настоящее время диабетом страдает более 180 млн, а по статистике, приводимой Shaw J.Е., 220 млн человек во всем мире страдают данной патологией [А.А Спасов, и соавт. // Экстр. и клин. Фамакол. 2011. 74 (11), 14-6]. Прогнозируется, что к 2030 этот показатель удвоится [J.Е.Shaw, R.A.Sicree and P.Z.Zimmet // Diabetes Research and Clinical Practice, 2011, V.87. №1, P.4-14]. Темпы нарастания распространенности этого заболевания носят угрожающий характер. Число больных диабетом в России по данным официальной статистики с показателя 8 миллионов в 1994 г. возрастет к 2020 г. до 18 млн.
В настоящее время предпочтение при лечении диабета отдается препаратам из групп производные сульфонилмочевины [P.M.Ashcroft, F.Reimann // Проблемы эндокринологии. 2001. - №6. - с. 43-47], бигуанидам [S.R.Salpeter, N.S.Buckley, J.A.Kahn and al. // Am J Med. 2008. 121: 149-157], производным тиазолидиндиона [А.С.Аметов, Е.В.Сокарева // РМЖ. 2008. №28, 1858]. Самое последнее время важное место начинают занимать препараты из группы ингибиторов дипептидилпептидазы - 4 (ДПП - 4), действие которых основано на повышении концентрации инкретинов, способствующих синтезу инсулина [R.E.Pratley, A.Salsali // Curr. Med. Res.Opin. 2007. 23, 4, 919-931; S.H.Havale, // Bioorg. Med. Chem. 2009. 17, 5, 1783-802].
Широкий спектр побочных эффектов и абсолютных противопоказаний ограничивает применение этих препаратов в клинической практике. Применение производных сульфонилмочевины лимитировано развитием вторичной резистентности к ним у 5-10% больных сахарным диабетом [А.А.Александров // Сахарный диабет: Consilium medicum. 2001. Т.1, №10. С.2-7]. Ограничение использования бигуанидов определяется возможностью развития лактоацидоза, а производных тиазолидиндиона - выявленной гепатотоксичностью [L.M.Forman, D.A.Simmons, R.H.Diamond // Ann Intern Med. 2000. 132, 2: 118-21] и повышением риска развития кардиоваскулярной патологии [A.Rohatgi, D.K.McGuire // Cardiovasc Drugs Ther. 2008. Jun; 22(3): 233-4]. Применение ингибиторов ДПП-4 нередко сопровождается развитием артралгий на фоне увеличения содержания в крови мочевой кислоты, но основным фактором риска при их применении считается повышение частоты развития панкреатита и рака поджелудочной железы [М.Elashoff, A.V.Matveyenko, В.Gier et al. // Gastroenterology. 2011. 141, 1: 150-6].
Все перечисленные факты делают очевидной необходимость создания новых высокоэффективных, безопасных противодиабетических препаратов, поскольку только расширение спектра антидиабетических средств позволит обеспечить максимальную компенсацию сахарного диабета с учетом индивидуальных особенностей каждого больного, улучшить качество жизни больных, снизить инвалидизацию, сохранить работоспособность больных диабетом, что имеет большое социальное и экономическое значение для общества.
Известно, что одним из патогенетических факторов развития СД является чрезмерная активация процессов свободнорадикального окисления [М.И.Балаболкин // Сахарный диабет. 2002. 4: 5-16; Н.И.Фадеева // Дис. на соискание степени канд мед. наук. 2000. С.217]. Этот процесс рассматривается в качестве универсального механизма, который объединяет основные биохимические пути токсичного влияния гипергликемии на организм. Такие последствия диабета, как сердечно-сосудистые заболевания, диабетическая нейропатия, нефропатия, поражение сердца и периферических сосудов, сетчатки и хрусталика, комплекс когнитивных нарушений рассматриваются, в основном, как следствие поражения соответствующих органов свободными радикалами - фрагментами молекул, имеющих благодаря атомам кислорода неспаренный электрон [Р.Ready, X.Zhu, G.Perry, el al. // J Alzheimers Dis. 2009. v.16, n. 4, 763-774; К.Maiese // Expert Rev Cardiovasc Ther. 2008. v.6, n.3, 281-284]. Одним из наиболее важных последствий усиления процессов свободно-радикального окисления является способность образующихся свободных радикалов вступать в реакцию с фосфолипидами клеточных мембран. Накопление перекисных (RO2*), алкоксильных (RO*), алкильных радикалов (R*), супероксид аниона, синглетного кислорода и цитотоксических пероксинитритов и их реакция с фосфолипидами клеточных мембран, ведет к структурным изменениям мембран, происходит повреждение протеинов, липидов и нуклеиновых кислот и фрагментация ДНК. В результате наступают структурные изменения мембран, нарушение их проницаемости и потеря эластических свойств [Р.Packer, I.G.Obrosova, J.G.Mabley et al. // Emerging New Therapeutical Strategies Curr Med Chem. 2005. 12(3): 267-275].
При сахарном диабете не только активируется образование свободных радикалов, но и снижается активность естественных факторов эндогенной антиоксидантной защиты: супероксиддисмутазы, каталазы, глютатионпероксидазы, т.е. нарушается баланс между прооксидантами и компонентами системы антиоксидантной защиты в сторону преобладания активности первых [А.Р.Rolo and С.М.Palmeira. // Toxicology and Applied Pharmacology. 2006. vol.212, n.2, pp.167-178]. Чрезмерное накопление свободных радикалов ведет к активации протеинкиназ, усилению гликирования белков, накоплению NAD(P)H, которая активизирует проинфламматорные процессы (S.Golbidi, М.Badran, and I.Laher. // Experimental Diabetes Research. 2012. Review Article, ID 941868, 1-16]. При этом известно, что начало развития диабета характеризуется лишь некоторым снижением активности антиоксидантных ферментов, а при длительном течении заболевания у больных резко ухудшаются антиокислительные свойства крови и значительно активируются процессы перекисного окисления липидов (ПОЛ). Важно подчеркнуть, что в β-клетках поджелудочной железы дефицит антиоксидантных систем и накопление свободных радикалов выражены сильнее, чем в других органах [М Т.Lortz, Th. Nachtwey, A.E.Karlsen et al. // Diabetes. 2000. Vol.49. P.1123-1130].
Данные об эффективности антиоксидантов для профилактики и комплексного лечения диабета неоднозначны. Имеются данные о наличии положительного эффекта мексидола [О.В.Занозина, Н.Н.Боровков, М.И.Балаболкин и соавт. // Бюллетень экспериментальной биологии и медицины. 2006. приложение 1; И.А. Волчегорский, Л.М. Рассохина, И.Ю. Мирошниченко // Проблемы эндокринологии. 2008. т.54, №5, с. 43-49]. Установлено, что наиболее четкий терапевтический эффект был получен при применении мексидола в дозе 200 мг (внутривенно капельно). Для известного антиоксиданта. α-липоевой кислоты, показано, что 10-дневное перфузионное введение в дозе 500 мг способствует повышению чувствительности к инсулину у больных сахарным диабетом (Н.А.Черникова, Б.Абаева, М.А.Прудникова и соавт. // Эндокринология. 2010, том 12, №12, 11-17]. Однако данные об эффективности липоевой кислоты при диабете, приводимые в зарубежных публикациях, неоднородны. Наряду с сообщениями о наличии позитивных эффектов [S.Golbidi, М.Badran and I.Laher. // Frontiers in Pharmacology 2011. V.2, Art 69, 1-15], приводятся также негативные результаты использования липоевой кислоты [Huang and Gitelman // Pediatr. Diabetes. 2008. v.9, 69-73]. Подчеркивается, что даже при курсовом применении липоевой кислоты в дозах до 1800 мг в день улучшение отмечается в основном в отношении проявлений диабетической полиневропатии [D.Ziegler, A.Ametov, A.Barinov et al. // DiabetesCare. 2006, 29, 2365-2370], но не основных метаболических проявлений диабета [A.M. de Oliveira, P.H.Rondó, Luzia el al. // Diabetes Res. Clin. Pract. 2011, 92, 253-260]. Предостерегают от завышенной оценки эффективности имеющихся антиоксидантов при диабете также и другие исследователи [J.S.Johansen, А.К.Harris, D.J Rychly el al. // Cardiovascular Diabefology. 2005, v.4. n.5, 1-11]. Нельзя не отметить, что применение липоевой кислоты сопровождается развитием неблагоприятных побочных реакций; к наиболее частым нежелательным побочным реакциям на липоевую кислоту относят ее гастротоксичность при приеме внутрь, раздражение кожи и зуд, а также головную боль при парентеральном введении [М.Reljanovic. // Free Radio Res. 1999. v.31. N 3, 171-179].
Несмотря на относительно большой спектр препаратов для подавления реакций свободнорадикального окисления возникают проблемы, связанные с использованием существующих средств, такие как токсичность некоторых фенольных антиоксидантов, вытеснение эндогенных антиоксидантов при использовании синтетических соединений [С.В.Оковитый. // Клиническая фармакология антиоксидантов // ФАРМиндекс практик. 2003. Выпуск 5. - С.85-111; М.В.Лукк, И.В.Зарубина, П.Д.Шабанов // Психофармакология и биологическая наркология. 2008. Т.8. - Выпуск 1-2, часть 1. С.2255-2263].
Таким образом, в настоящее время проблема лечения диабета препаратами с антиоксидантным компонентом действия не решена, и требуется поиск новых средств такого типа для предупреждения и лечения диабета.
Разработанный в Институте фармакологии оригинальный дипептидный препарат Ноопепт (ГВС-111; этиловый эфир N-фенилацкетил-L-пролилглицина) проявил комплекс ноотропных и нейропротективных эффектов [S.В.Seredenin, Т.A.Voronina, Т.Gudasheva el al. // US Patent. 1995. № 5,439,930; Т.А.Gudasheva, Т.A.Voronina, R.U.Oslrovskaya el al. // Eur. J. Med. Chem. 1996. 31, 151-157; R.U.Ostrovskaya, T.A.Gudacheva, S.B.Trofimov et al. In: Biological basis of individual sensitivity to Psychotropic drugs. Graffhan Press Ltd. Eds Gaviraghi G., Longo V., Seredenin S., Edinburgh, UK, 1994, 79-91]. Препарат продемонстрировал на различных экспериментальных моделях in vitro и in vivo выраженное нормализующее влияние на показатели соотношения активности про- и антиоксидантных систем. Так показано, что уже при однократном введении в малых дозах (0,1 мг/кг) он предотвращает накопление молекулярных продуктов ПОЛ-диеновых конъюгатов, малонового диальдегида и оснований Шиффа в мозговой ткани и плазме крови [А.В.Лысенко, Р.У.Островская, Е.И.Ускова и соавт. // Экспер. клинич. фармакология. 1997, 60, 15-18]. Ноопепт повышает активность ферментов эндогенной антиоксидантной системы: супероксид-дисмутазы, каталазы, церулоплазмина в субклеточных фракциях мозга и плазме крови крыс [A.M.Менджерицкий, А.В.Лысенко, С.В.Демьяненко и соавт. // Нейрохимия. 2003. т.20, 4, 281-286]. Способность препарата активировать эндогенную антиоксидантную систему подтверждена в условиях его воздействия на сыворотку крови здоровых добровольцев [Т.Н.Федорова, К.С.Ус, Р.У.Островская // Нейрохимия. 2007. т.24, №1, 69-73]. В экспериментах на культурах кортикальных нейронов человека (абортированные плоды) установлена способность Ноопепта устранять усиление оксидативных процессов, вызванное добавлением перекиси водорода к нейронам здоровых плодов или генетически предопределенной гиперактивацией перекисного окисления, характерной для плодов с пренатально диагносцированным синдромом Дауна. Показано, что Ноопепт по указанному показателю существенно эффективнее витамина Е, ловушки свободных радикалов PBN и Пирацетама [A.Pelsman, С.Hoyo-Vadillo, S.B.Seredenin el al. // Int J Dev Neurosci. 2003, 21, n. 3, 117-124]. Более высокая, чем у Пирацетама, нейропротективная активность описана также на модели Fe2+ индуцированной гибели нейронов мозжечка крыс (Н.А.Андреева, Е.В.Стимальшук, Н.К.Исаев и соавт. // Бюлл. эксп. биол. и мед. 2000. 130, № 10, 418-421]. Перечисленные данные, свидетельствующие о способности Ноопепта вызывать сдвиг в соотношении активности про- и антиоксидантных систем в сторону преобладания последних, явились основанием для исследования влияния Ноопепта на выраженность проявлений диабета. При выборе Ноопепта в качестве объекта этого исследования важную роль сыграли и другие стороны многокомпонентного механизма действия Ноопепта: его способность усиливать экспрессию нейротрофических факторов [Островская Р.У., Гудашева Т.А., Цаплина А.П. и соавт. // Бюллетень эксп. биол. мед. 2008. № 9. С 309-312], ослаблять эффекты провоспалительных цитокинов [Коваленко Л.П., Штпаева Е.В., Алексеева С.В. и др. Бюлл. Эксп. биол. мед. 2007, 144, 7, 54-57] и оказывать многокомпонентный антитромботический эффект [Островская Р.У., Ляпина Л.А., Пасторова В.Е. Эксперим. и клинич. фармакология. 2002, 65, 2, 34-37].
Известно, что в эксперименте развитие гипергликемии удается воспроизвести введением диабетогенных токсинов аллоксана и стрептозотоцина, оказывающих прямое цитотоксическое действие на β-клетки поджелудочной железы. Преимущество стрептозотоцина состоит в относительно более высокой метаболической устойчивости, большей длительности гипергликемии, менее выраженном ацидозе и летальности экспериментальных животных [Т. Szkudelski. // Minireview Physiol. Res. 50: 536-546, 2001]. Стрептозотоцин - алкилирующее соединение, производное нитрозомочевины, которое:
1) способствует генерации свободных радикалов;
2) алкилирует ДНК, активирует поли-АДФ-рибозосинтетазу, подавляет синтез ДНК и пролиферацию β-клеток;
3) угнетает активный транспорт кальция и кальмодулин-активированную протеинкиназу [D.A. Rees //Diabet Med. 2005. Apr; 22(4):359-70].
Сущность изобретения
Нашей целью явилось исследование влияния Ноопепта на выраженность эффекта диабетогенного токсина стрептозотоцина (СТЗ). Эта цель была достигнута изучением эффекта Ноопепта в эксперименте при различных способах введения (разные режимы и пути введения) на модели развитого (примеры 1-4) и развивающегося (пример 5) СТ3-диабета. Техническим результатом изобретения является сахароснижающий и улучшающий толерантность к глюкозе эффект N-фенилацетил-L-пролилглицина этилового эфира и препарата Ноопепт на модели стрептозотоцинового диабета. Опыты проведены на полученных из питомника «Столбовая» РАМН самцах белых крыс Вистар массой 210-240 г (в начале эксперимента). Животных содержали в условиях вивария ФГБУ «НИИ фармакологии имени В.В. Закусова» РАМН по 10 особей в клетке при свободном доступе к стандартизированному корму и воде (за исключением 12 часов, предшествовавших введению СТЗ на модели развитого диабета или определению толерантности к глюкозе на модели развивающегося диабета, когда корм удаляли). Исследования проводили с 1000 до 1400. Соблюдались этические правила гуманного обращения с животными, изложенные в директивах Совета Европейского сообщества 86/609/ЕЕС.
Результаты, полученные в этих экспериментах, иллюстрируются следующими примерами.
Пример 1. Эффект комбинированного (профилактического и лечебного) введения Ноопепта на модели развитого диабета.
Эксперимент выполнен на 30-ти крысах, разделенных случайным образом на 3 группы по 10 животных в каждой. 1. Животные группы пассивного контроля (ГПК1). Им ежедневно вводили физиологический раствор (ФР) в течение 29 дней. 2. Крысы группы активного контроля (ГАК1). Им в течение 14 дней вводили ФР, затем однократно Streptozotocine (Sigma) в дозе 45 мг/кг, растворенный в ФР, далее продолжалось введение ФР в течение последующих 14 дней. 3. Крысы опытной группы (ОГ1). Им профилактически ежедневно вводили Ноопепт в дозе 0,5 мг/кг, растворенный ex tempore в ФР, затем однократно был введен СТЗ. и далее в течение 14 дней продолжали введение Ноопепта. В этих экспериментах, как и в экспериментах, описанных в примерах 2-4, как СТЗ, так и Ноопепт либо ФР вводили внутрибрюшинно.
Определение уровня глюкозы в крови, взятой из хвостовой вены (глюкометр One Touch Ultra, USA), проводили через 3, 14 и через 28 дней (т.е. через 14 дней после прекращения введения Ноопепта) после введения СТЗ. Для определения болевой чувствительности использовали термическое воздействие в тесте tail-flick (TSE Analgesia System, USA), отмечали латентный период отдергивания хвоста.
При статистической обработке данных достоверность различий между группами по всем показателям определяли с помощью непараметрического критерия Манна-Уитни (после предварительной оценки по Крускалла-Уоллису).
Для выяснения сравнительной эффективности Ноопепта при разных режимах введения и его сопоставления с другими антидиабетическими препаратами рассчитывали коэффициент антигипергликемической активности (Аг) по формуле:
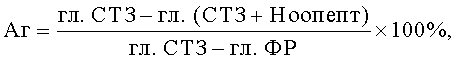
где гл. СТЗ - уровень глюкозы в крови животных ГАК1,
гл. СТЗ + Ноопепт - уровень глюкозы в крови животных ГО1,
гл. ФР - уровень глюкозы в крови животных ГПК1.
Вычислялась также Δ массы тела - среднее значение разницы массы тела между текущим и предшествующим измерениями.
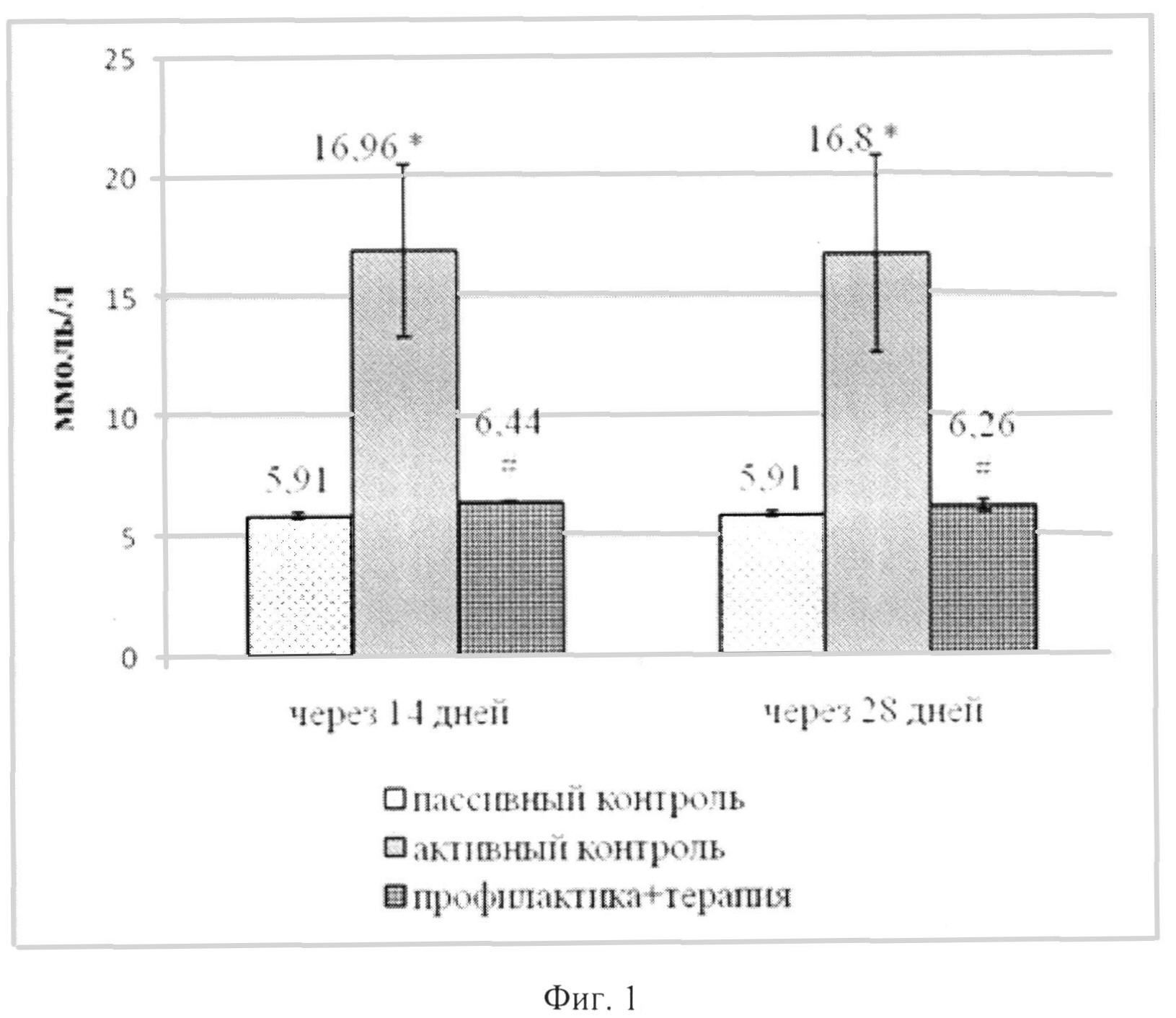
Согласно литературным данным, содержание глюкозы более 13-15 ммоль/л рассматривается как показатель диабета [A.Kuhada, M.Bishnoia, V.Tiwuria el al. // Pharmacology Biochemistry and Behavior. 2009. V.92, Iss. 2, p.251-259]. В наших экспериментах через 3 дня после введения СТЗ отмечалось повышение содержания глюкозы в венозной крови в среднем до 16,96 ммоль/л. При тестировании через 14 и 28 дней гипергликемия в группе активного контроля сохранялась (тестирование в более поздние сроки в данных экспериментах не проводилось). Ноопепт в условиях его длительного введения (профилактического и лечебного, в общей сложности 28 дней) устраняет гипергликемический эффект диабетогенного токсина (фиг.1), снижая уровень до значений, близких к показателям группы пассивного контроля. Коэффициент антигипергликемической активности Аг через 14 дней был равен 95,2%. Важно подчеркнуть, что спустя 14 дней после отмены Ноопепта его антигипергликемический эффект сохранялся - коэффициент оставался на таком же высоком уровне - 96,79%.
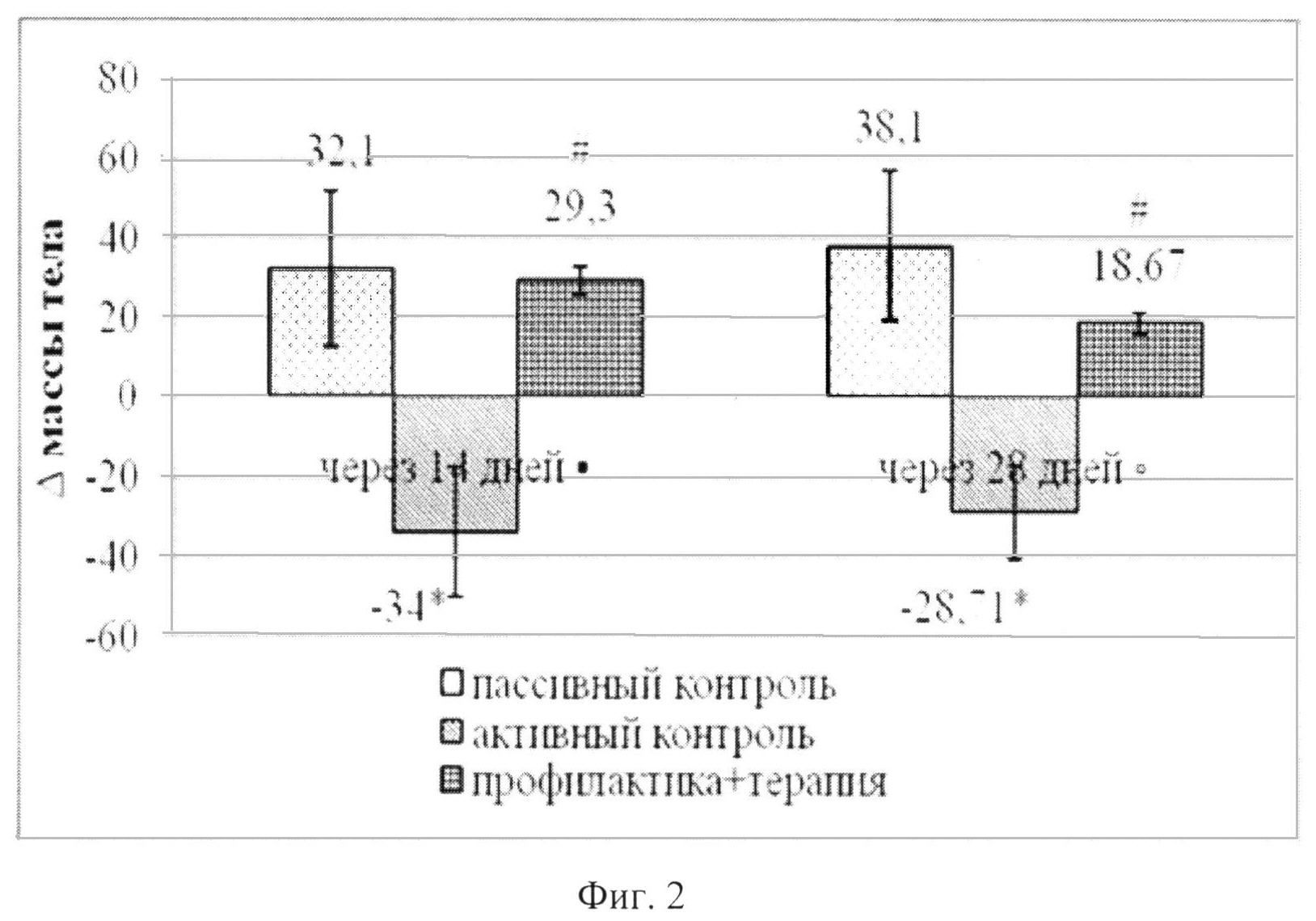
Важным показателем диабетогенного эффекта СТЗ является потеря массы тела. Ноопепт предотвращает этот эффект (фиг.2): если животные группы активного контроля теряли в массе в среднем 34±16,3 г (разница между исходной массой и массой через 14 дней после введения СТЗ), то на фоне действия Ноопепта они не только не худели, но и прибавляли в весе (в среднем 29,3±3,67 г). Этот эффект сохранялся и через 28 дней, т.е. спустя 14 дней после отмены терапии Ноопептом. Таким образом, в этих экспериментах показана высокая эффективность Ноопепта при комбинированном лечебно-профилактическом введении, и установлено, что этот эффект сохраняется после отмены терапии.
Пример 2. Эффект профилактического введения Ноопепта на модели развитого диабета.
Эксперименты выполнены на 30-ти крысах, разделенных случайным образом на 3 группы по 10 животных в каждой. 1. Животные группы пассивного контроля (ГПК2) Им ежедневно внутрибрюшинно (в/б) вводили физиологический раствор (ФР) в течение 15 дней. 2. Крысы группы активного контроля (ГАК2), которым в течение 2 недель в/б вводили ФР, затем однократно в/б был введен СТЗ в дозе 45 мг/кг, рассоренный в физиологическом растворе. 3. Животные опытной группы (ОГ2), которым профилактически ежедневно в течение 14 дней в/б вводили свежеприготовленный раствор Ноопепта (0,5 мг/кг), а затем СТЗ 45 мг/кг. Определение уровня глюкозы в крови, взятой из хвостовой вены (глюкометр One Touch Ultra, USA), в этих экспериментах, а также в экспериментах, описанных в примерах 3 и 4, проводили через 3, 14 и 28 дней после СТЗ. Взвешивание животных проводилось каждые 3 дня.
В условиях профилактического введения Ноопепт также проявляет антигипергликемический эффект (таблица 1). Аг через 3 в дня был равен 41%, при этом через 14 дней отмечалась тенденция к дальнейшему увеличению - 67,6%. На фоне профилактического введения Ноопепта потеря в массе тела была в 2 раза ниже, чем в группе активного контроля (через 3 дня после введения СТЗ), а через 14 дней животные стали даже набирать в весе (таблица 2).
|
|
В экспериментах с определением порога болевой чувствительности показано, что латентное время отдергивания хвоста в группе пассивного контроля составляло 3,01±0,34 с. У диабетических крыс он был снижен до 2,16±0,35 с, что соответствует литературным данным о способности СТЗ вызывать диабетическую нейропатию [А.I.Vinik. R.E.Maser, B.D.Mitchell el al. // Diabetes Care. 2003. 26(5): 1553-79; P.S.van Dam // Diabetes Metab Res Rev. 2002. 18(3): 17 6-84].
Установлено, что у крыс, которым профилактически вводился Ноопепт, порог болевой чувствительности был достоверно повышен (4,63±1,22 с) по сравнению с группой крыс активного контроля.
Пример 3. Эффект лечебного введения Ноопепта на модели развитого диабета.
Эксперименты выполнены на 3-х группах крыс (N=10 в каждой). 1. Группу пассивного контроля (ГПКЗ) составили крысы, которым ежедневно в течение 15 дней вводили ФР. 2. Животным группы активного контроля (ГАКЗ) однократно вводили СТЗ, а затем ежедневно в течение 14 дней вводили ФР. 3. Опытную группу (ОГЗ) составили крысы, которым сначала однократно был введен СТЗ, а затем сразу после СТЗ начинали вводить Ноопепт 0,5 мг/кг внутрибрюшинно; это лечение продолжалось в течение 14 дней.
Показано, что через 3 дня после первого введения Ноопепта уровень глюкозы ОГ существенно не отличался от показателей ГАК (Аг составляло лишь 8,4%) однако после 14-дневной терапии Аг составлял 28,9%, а в последующие 14 дней, т.е. уже после прекращения терапии, он продолжал нарастать и составил 42,35% (таблица 3). Отмечалось снижение массы тела у группы активного контроля; у крыс, которым вводили Ноопепт, потеря в массе тела была менее выраженной, а через 28 дней она прекратилась (таблица 4).
|
|
Пример 4. Эффект отсроченного введения Ноопепта на модели развитого диабета.
Эксперименты выполнены на 3-х группах крыс (N=10 в каждой). 1. Группа (ГПК4) пассивного контроля, которой ежедневно ФР в/б вводили в течение 4 недель. 2. Группа активного контроля (ГАК4), которой сначала однократно в/б ввели СТЗ, а затем, как и группе пассивного контроля, ежедневно в течение 4 недель вводили в/бр ФР. 3. Опытная группа (ОГ4), на которой исследовали возможный "отсроченный" терапевтический эффект Ноопепта. Сначала в/бр однократно был введен СТЗ, потом в течение 2-х недель в/бр вводили ФР, а затем ежедневно вводили Ноопепт в дозе 0,5 мг/кг в/бр в течение 2 недель.
В этом эксперименте, в котором начало терапевтического воздействия было отложено на 2 недели, уровень глюкозы на третий день после введения СТЗ у групп 2 и 3 был одинаково повышенным. Терапия Ноопептом, начатая через 14 дней после СТЗ, привела к ослаблению гипергликемии (Аг составлял 37,3%), а через 28 дней (на фоне уже прекратившейся терапии) коэффициент продолжал нарастать и составил 52% (таблица 5). Снижение массы тела у крыс из группы активного контроля имело место в течение всего срока наблюдения - 28 дней. У крыс группы с отсроченным введением Н через 14 и 28 дней потеря массы сменялась его увеличением.
|
Пример 5. Эффекты Ноопепта и Янувии, вводимых внутрь, на динамику развития экспериментального диабета (модель дробного введения токсина).
Метаболические нарушения в инсулярном аппарате поджелудочной железы предшествуют клинической манифестации диабета, которая возникает только после гибели 80-90% инсулино-продуцирующих клеток. Этот факт диктует целесообразность поиска средств патогенетической терапии, направленных на предотвращение прогрессирования заболевания на его ранних этапах. Очевидно, что для осуществления длительного профилактического применения препарата наиболее адекватным является применение перорального пути его введения. В отношении Ноопепта этот путь полностью приемлем, поскольку ранее установлено, что дипептиды в отличие от пептидов более сложной химической структуры сохраняют активность при пероральном введении - эффект, обусловленный наличием в энтероцитах кишечника специфической АТФ зависимой системы транспорта дипептидов [М.Sala-Rahanal, D.D.F.Loo, В.A.Hirayama et al. // J. Physiol. 2006. V.574. P.149-166]. Фармакокинетическими исследованиями подтвержден факт специфической биодоступности Ноопепта для мозга в условиях перорального введения препарата и показано, что для достижения однотипной концентрации Ноопепта в плазме крови в условиях парентенрального и перорального введения требуется 10-кратное увеличение дозы [С.С.Бойко, С.А.Коротков, Р.У.Островская и соавт. // Бюлл. Эксп. Биол. Мед. 2000. т.129, № 4, 426-429]. Этот факт полностью согласуется с результатами фармакодинамических исследований Ноопепта при парентеральном и пероральном введении Ноопепта [Т.Х.Мирзоев, Г.А.Романова, Е.В.Кравченко и соавт. // Бюлл. Эксп. Биол. Мед. 2001. т.132, №10, 404-408].
Имеются убедительные доказательства участия так называемых инкретинов - гормонов желудочно-кишечного тракта: глюкагоно-подобного пептида 1 (GLP-1) и глюкозозависимого инсулинотропного полипептида (GIP) в усилении секреции инсулина β-клетками. Поскольку оба эти пептида имеют низкую биологическую устойчивость и их невозможно использовать в качестве препаратов, для лечения диабета предложено применять пептидомиметики указанных пептидов либо ингибиторы фермента, осуществляющего их гидролиз - дипептидил пептидазы 4 (ДПП-4) [М. Lotfy,./. Singh, Н. Kalasz el al. // Open Medicinal Chemistry Journal 201 J. Vol. 5. P. 82-92]. Первым перорально активным ингибиторм ДПП-4, внедренным в медицинскую практику в США в 2007-2008 гг., явился препарат ситаглиптин (Янувия). В настоящее время он широко применяется также в Российской Федерации.
Известно, что однократное введение стрептозотоцина в дозах 45-60 мг/кг в стандартном режиме однократного введения вызывает тяжелые дегенеративные изменения в β-клетках поджелудочной железы, проявляющиеся, в частности, в длительной выраженной гипергликемии и снижении толерантности к глюкозе. Модели повторного введения малых доз стрептозотоцина в большей степени имитируют динамику развития диабета 2 типа [В.И. Новиков. О.В. Молотов, А.П. Подчеко // Сахарный диабет. 1999. №2. С. 37-39; К. Srinivasan. P. Ramarao // Indian J Med Res 2007. 125, 451-472].
Настоящий пример иллюстрирует результаты сравнительного исследования эффектов препарата Ноопепт и «золотого стандарта» лечения диабета, Янувии, на модели развивающегося диабета в условиях перорального введения обоих препаратов.
Опыты проводились на половозрелых (массой 210-240 г) самцах крыс Вистар. полученных из питомника «Столбовая» РАМН. Животных содержали в условиях вивария ФГБУ «НИИ фармакологии имени В.В. Закусова» РАМН по 10 особей в клетке при свободном доступе к стандартизированному корму и воде за исключением 12 часов, предшествовавших определению уровня фоновой (натощак) гликемии и глюкозной толерантности. Исследования проводили с 1000 до 1400. Эксперименты выполнены на 4-х группах крыс (N=12 в каждой).
1. Крысам из группы пассивного контроля физиологический раствор (ФР) вводился в/бр в течение трех последовательных дней, в тот же период и в последующие 16 дней ФР вводили крысам внутрь через желудочный зонд. 2. Крысам из группы активного контроля вводили стрептозотоцин (Sigma) - диабетогенный токсин, вызывающий избирательный окислительный стресс, алкилирование ДНК и апоптоз в β-клетках поджелудочной железы. Цитотоксин вводился в/бр в дозе 30 мг/кг в течение 3-х последовательных дней. За 5 минут до СТЗ вводили ФЗ внутрь; введение ФЗ дальнейшем продолжали в течение 16 дней. 3. Первая опытная группа, в которой стрептозотоцин (СТЗ) вводили в/бр в дозе 30 мг/кг в течение 3-х последовательных дней. За 5 минут до СТЗ крысам вводили Ноопепт внутрь в дозе 5 мг/кг; введение препарата продолжали после трехкратного введения СТЗ еще в течение 16 дней. Выбор этой дозы Ноопепта обусловлен тем, что Ноопепт в условиях внутрибрюшинного введения продемонстрировал антидиабетическую активность в дозе 0,5 мг/кг, а, согласно нашему предыдущему опыту при переходе от парентерального пути введения дипептидов к пероральному для проявления аналогичного эффекта требуется 10-кратное увеличение дозы. 4. Животным второй опытной группы СТЗ вводили в/бр в дозе 30 мг/кг в течение 3-х последовательных дней. За 5 минут до СТЗ вводили Янувию внутрь в дозе 5 мг/кг; введение препарата продолжали в дальнейшем в течение 16 дней. Выбор этой дозы Янувии был сделан на основании многочисленных литературных данных [Ferreira L.Teixeira-de-Lemos E., Filipa Pinto F. et al. // Mediators Inflamm. 2010. Art. AD 592760; Lotfy M, Singh J., Kalasz H el al. // Open Medicinal Chemistry Journal 2011. Vol.5. P.82-92].
Определение уровня глюкозы в крови, взятой из хвостовой вены (глюкометр One Touch Ultra, USA), проводили на 4-й (считая от дня первого введения СТЗ), затем на 12-й и 19-й день. Наряду с определением базального (натощак) уровня глюкозы в крови на крысах всех четырех групп проводили пробу на толерантность к глюкозе, для чего ее вводили внутрибрюшинно в дозе 1000 мг/кг; содержание глюкозы в крови определяли через 1 и 2 часа после нагрузки. Взвешивание животных проводилось каждые 3 дня.
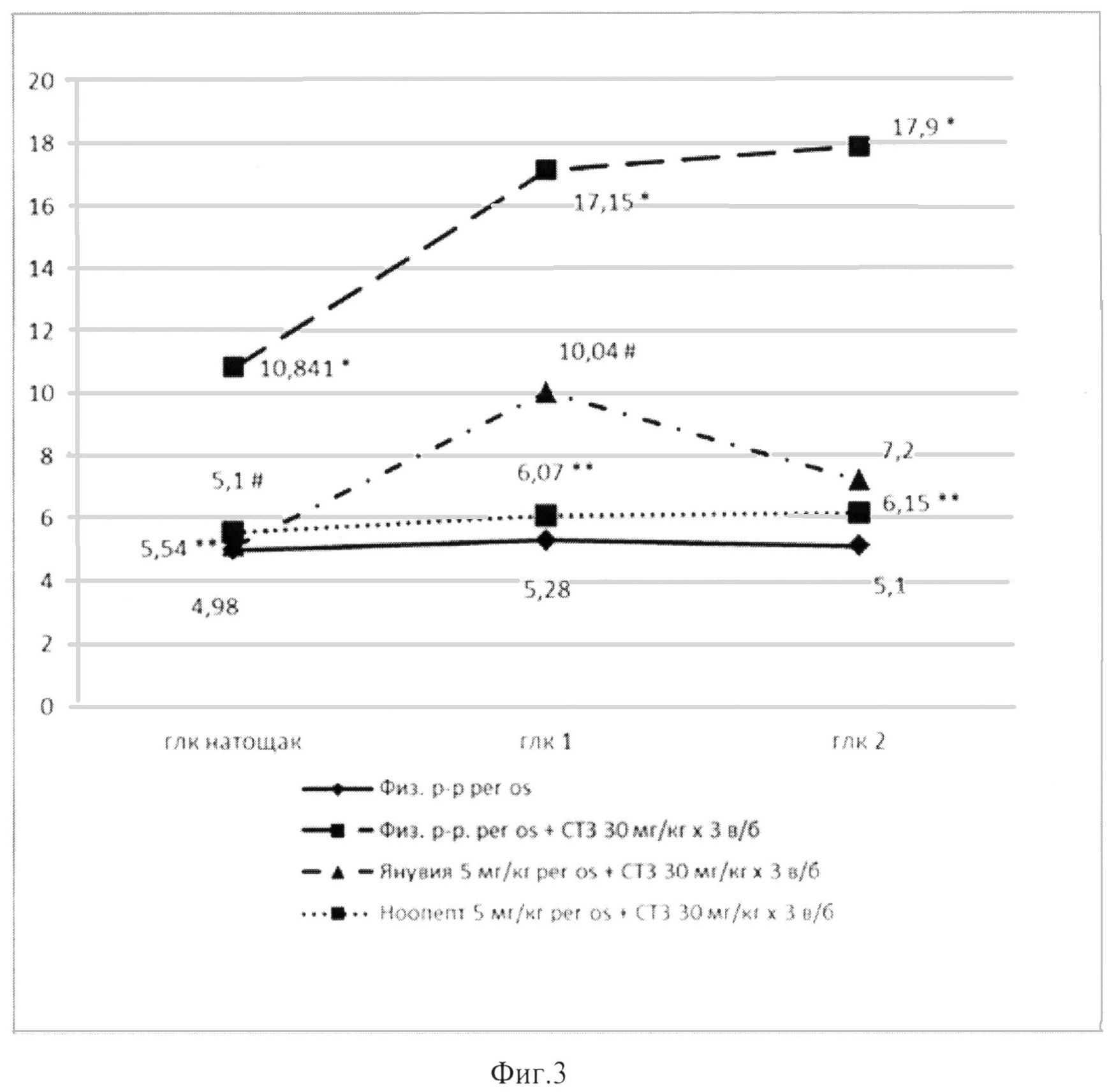
Если в группе пассивного контроля исходный уровень глюкозы составлял 4,9 ммоль/л, а при нагрузке через 1 час уже достоверно не отличался от контрольного (5,28 ммоль/л), то у животных ГАК, которым вводился СТЗ, на следующий день после третьего введения СТЗ имело место не только нарастание спонтанного уровня глюкозы (до 10,84 ммоль/л), но и снижение толерантности к глюкозе - через 1 час после нагрузки уровень глюкозы в крови составлял 17,15 ммоль/л, а через 2 часа - 17,93±2,05 ммоль/л. На 12-й день эксперимента фоновый уровень глюкозы начинал снижаться, но толерантность к глюкозе оставалась нарушенной: на 19-й день эксперимента в этой группе имела место полная нормализация фонового уровня при еще сниженной толерантности к глюкозной нагрузке (таблица 6). Масса тела крыс на всех сроках наблюдения в этой и опытных группах оставалась неизмененной.
Анализируя использованные модели диабета, следует подчеркнуть, что в экспериментах, в которых СТЗ вводился однократно в дозах 45-50 мг/кг, уровень базовой гипергликемии, в полном соответствии с литературными данными, даже через 28 дней после введения токсина составлял не менее 16 ммоль/л, то на модели дробного введения он в период максимальной выраженности (4-й день опыта) не превышал 10,8 ммоль/л, а уже через 9 дней после введения токсина приближался к 6 ммоль/л. Важно подчеркнуть, что на использованной модели дробного введения СТЗ при наличии близкого к норме базового уровня глюкозы толерантность к глюкозной нагрузке оставалась нарушенной. Поскольку известно, что сниженная глюкозорезисентность при нормальном фоновом уровне глюкозы характерна для начальной фазы развития диабета [Дедов И.И., Шестакова М.В. // Сахарный диабет. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. 2011, №3], можно заключить, что применяемый режим введения СТЗ (30 мг/кг в течение 3-х последовательных дней) моделирует процесс развития диабета. В пользу этого предположения свидетельствует также отсутствие потери веса - эффекта, характерного для действия СТЗ, введенного однократно в более высокой дозе [Skudelski Т. // Physiol. Res. 2001. Vol. 50, №6. P. 536-546].
В группе крыс, которым вводился препарат Ноопепт, уже на следующий день после окончания введения СТЗ отмечалось, во-первых, выраженное снижение показателя фонового уровня глюкозы (до 5,54 ммоль/л), что соответствует расчетному показателю относительной антигипергликемической активности Аг 90,4%. Кроме того, что очень важно, Ноопепт уже в начале эксперимента улучшал переносимость глюкозной нагрузки - показатель толерантности глюкозы достоверно не отличался от такового в группе пассивного контроля. Через 9 дней после окончания воздействия диабетогенного токсина (12-й день эксперимента), в группе крыс, леченых Ноопептом, все показатели не отличались от группы пассивного контроля, т.е. Ноопепт восстановил базальный уровень гликемии и нормальную толерантность глюкозы в условиях нагрузки. Это соответствовало нарастанию показателей Аг как для фоновой гликемии, так и для нагрузочной. Наконец, при тестировании через 16 дней после окончания введения СТЗ в группе активного контроля имело место восстановление спонтанного уровня гликемии при некотором улучшении толерантности к глюкозной нагрузке, а показатели в опытной группе, леченой Ноопептом, не отличались от таковых в группе пассивного контроля.
Как следует из данных, приведенных в таблице 6, у крыс, которым вводилась Янувия, на 4-й день эксперимента имело место восстановление базового уровня гликемии, что соответствовало высокому показателю Аг (97,9%). Хотя этот показатель был несколько выше, чем таковой для Ноопепта, влияние Янувии на толерантность к глюкозной нагрузке, особенно в первый час, было менее выраженным, чем у Ноопепта (Фиг. 3). На 12-й день эксперимента (9 дней после окончания введения токсина), когда в группе активного контроля началось снижение фонового уровня гликемии, но толерантность к глюкозной нагрузке была сниженной (15,67 и 9,86 ммоль/л через 1 и 2 часа после нагрузки соответственно), в группе крыс, леченых Янувией, фоновое содержание глюкозы было ниже и толерантность к глюкозе была лучше, чем в группе активного контроля. На 19-й день эксперимента (16 дней после окончания введения токсина) в группе активного контроля имело место восстановление фонового уровня гликемии, но толерантность к глюкозной нагрузке через 1 час оставалась сниженной, что нашло отражение в высоком уровне глюкозы (12 ммоль/л) через 1 час после нагрузки. В группе крыс, леченых Янувией, содержание глюкозы в крови на фоне нагрузки снижалось лишь до 8,8 ммоль/л, и показатель Аг составлял только 43,6%, т.е. был почти в два раза меньше, чем таковой в группе, леченой Ноопептом (84,2%).
|

Таким образом, препарат Ноопепт в условиях используемой модели развивающегося диабета не уступает "золотому стандарту" - перорально активному антидиабетическому препарату, Янувии. Если в первые дни после окончания введения токсина показатель антигипергликемической активности в отношении фонового уровня глюкозы для обоих препаратов был близок, то в дальнейшем в группе, леченой Янувией, он снижается более резко, чем в группе крыс, которым вводился Ноопепт. К концу эксперимента эффективность Ноопепта по показателю толерантности к глюкозе была в 2 раза выше, чем Янувии.
Совокупность полученных данных свидетельствует о способности препарата Ноопепт ослаблять выраженность метаболических эффектов диабетогенного токсина. Этот эффект выявлен как в условиях выраженной формы диабета, вызванного высокой дозой стрептозоцина, так и при мягком диабете, обусловленным повторным введением диабетогенного токсина в малых дозах. Очень важно подчеркнуть то, что выявленная в данном исследовании эффективность ноопепта сохраняется в условиях перорального введения.
Выполненные ранее экспериментальные исследования показали, что Ноопепт даже в условиях длительного введения не проявляет признаков токсического действия [Л.П. Коваленко, Н.М. Смольникова, С.В. Алексеева и соавт. Экспериментальная фармакология и токсикология. 2002, 65, № 1б, 62-64]. Клиническое применение препарата в качестве ноотропа также не выявило побочных эффектов [www. Noopept.ru].
Этиловый эфир N-фенилацкетил-L-пролилглицина и препарат Ноопепт, обладающий ноотропным и нейропротективным действием, демонстрируют свою эффективность как для предупреждения, так и для лечения диабета: выступают в качестве средства многокомпонентной патогенетической терапии, действие которого направлено на предотвращение прогрессирования диабета.
Краткое описание чертежей.
На фиг. 1 изображено влияние ноопепта при комбинированном (профилактическом и лечебном, в течение 28 дней) действии препарата, вводимого в дозе 0,5 мг/кг в/бр на содержание глюкозы в крови в условиях модели развитого диабета (введение СТЗ в дозе 45 мг/кг однократное). Данные представлены в виде М±SEM; по оси абсцисс - время, дни после введения СТЗ; по оси ординат - содержание глюкозы в крови, ммоль/л. Достоверные различия (р<0,05) согласно непараметрическому критерию Mann-Whitney представлены как: * - достоверность различий между пассивным контролем (ФР) и активным контролем (СТЗ); # - достоверность различий между активным контролем (СТЗ) и группой, которой вводился Ноопепт.
На фиг. 2 изображено влияние ноопепта при комбинированном (профилактическом и терапевтическом) введении на динамику массы тела крыс в условиях модели развитого диабета (введение СТЗ в дозе 45 мг/кг однократное). Данные представлены в виде М±SEM; по оси абсцисс - время, дни после введения СТЗ; по оси ординат - разница в массе тела крыс (показатель Δ) для разных сроков наблюдения, граммы: для 14-го дня - Δ между 14-м и 3-м днем после введения СТЗ; для 28-го дня - Δ между между 28-м и 14-м днем после введения СТЗ.
Достоверные различия (р<0,05) согласно непараметрическому критерию Mann-Whitney представлены как: * - достоверность различий между пассивным контролем (ФР) и активным контролем (СТЗ); # - достоверность различий между активным контролем (СТЗ) и Ноопептом.
На фиг. 3 представлены данные сравнения эффективности препарата Ноопепт (5 мг/кг) и Янувии (5 мг/кг), вводимых внутрь на модели развивающегося диабета, вызванного повторным введением СТЗ (30 мг/кг в/бр в течение 3-х последовательных дней). Показатели 4-го дня (1-й день после окончания последнего введения СТЗ). По оси абсцисс - временные точки: натощак, через 1 и 2 часа после глюкозной нагрузки (1000 мг/кг в/бр); по оси ординат - содержание глюкозы в крови, ммоль/л. Достоверные различия (р<0,05) согласно непараметрическому критерию Mann-Whitney представлены как: * - р<0,05 для различия между пассивным контролем (ФР) и активным контролем (ФР и СТЗ); # - р<0,05 для различия между группой активного контроля (ФР и СТЗ) и группой, леченой Янувией (Янувия и СТЗ), ** - р<0,05 для различия между активным контролем (СТЗ) и группой, леченой Ноопептом (Ноопепт и СТЗ).