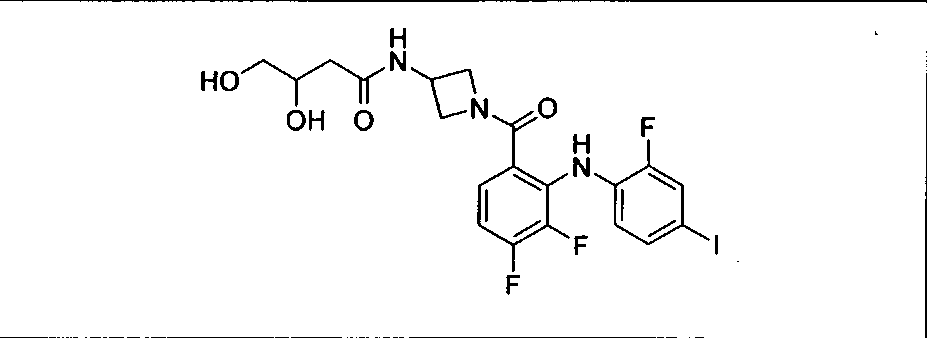
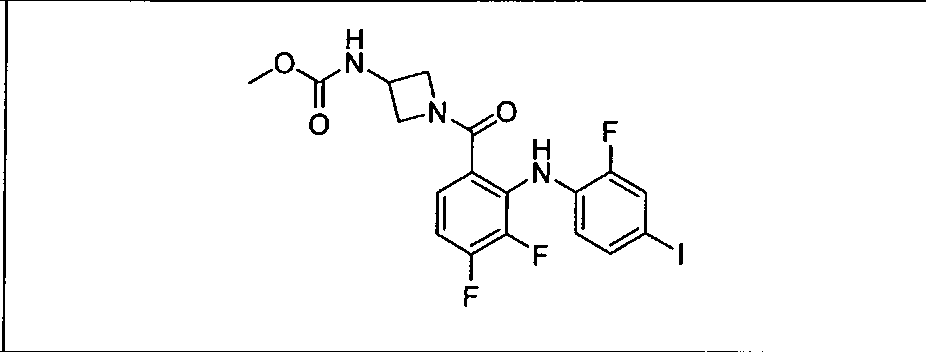
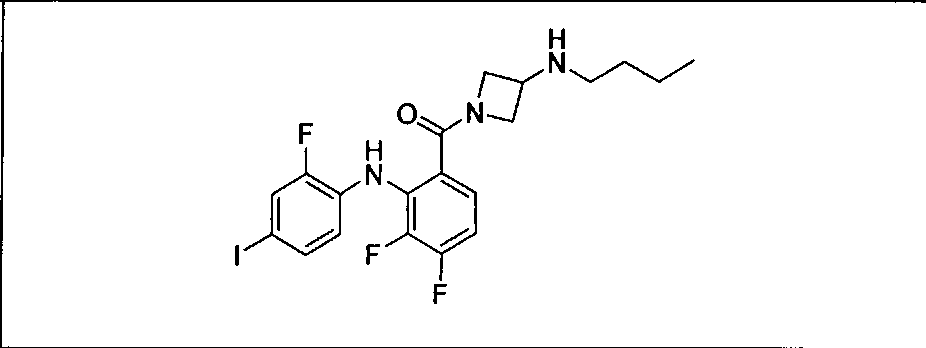
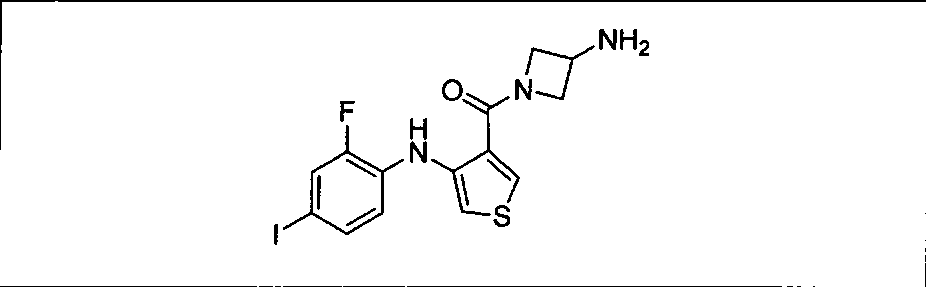
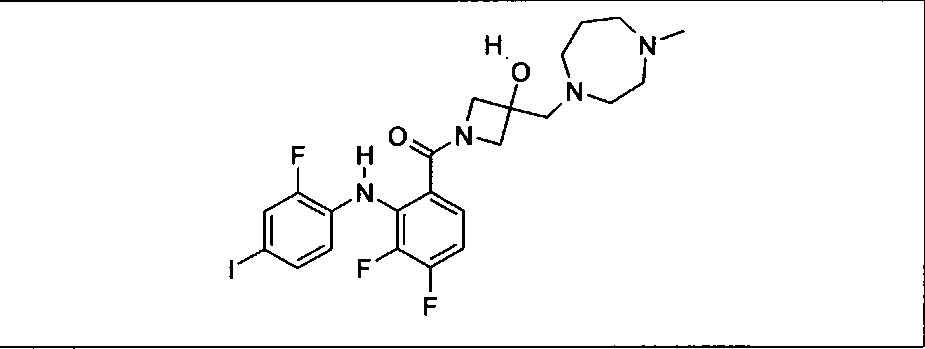
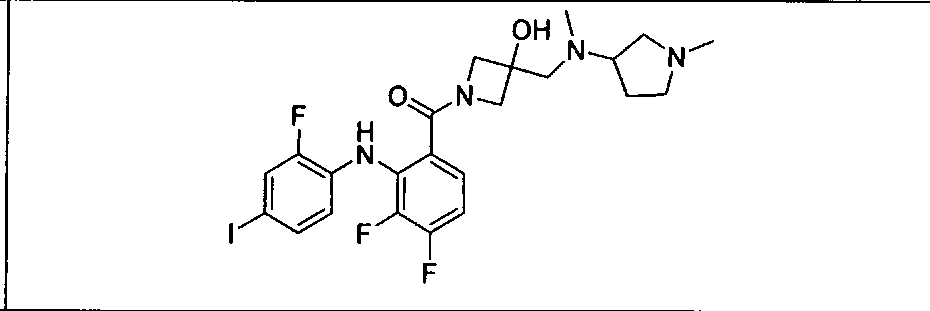
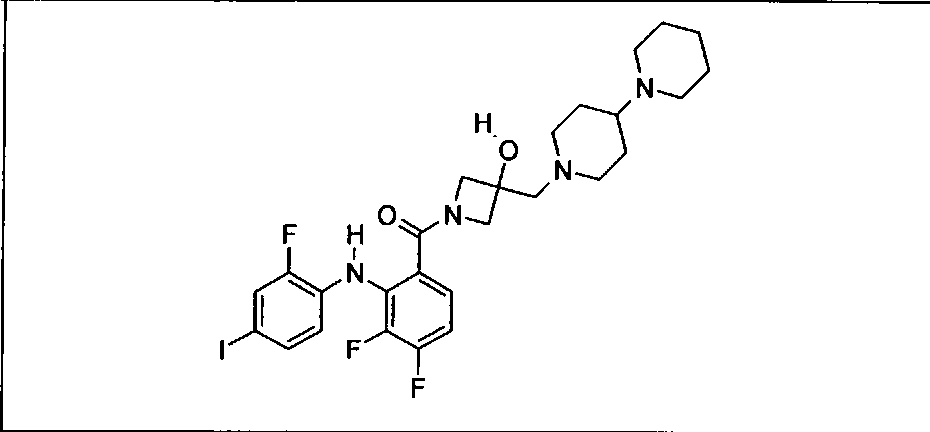
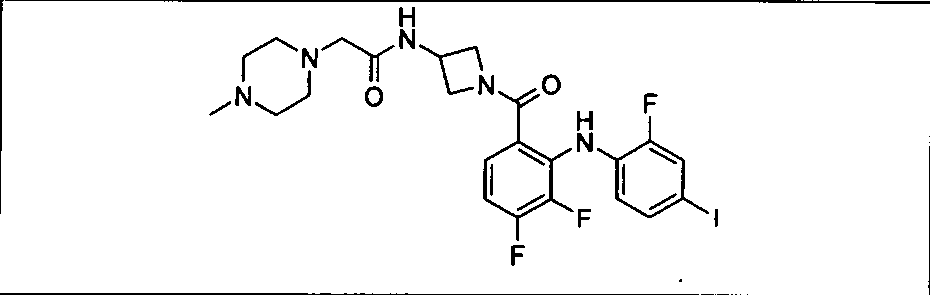
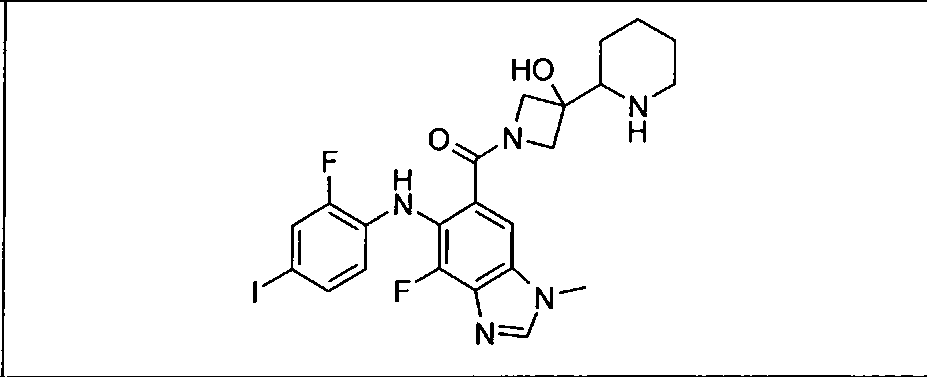
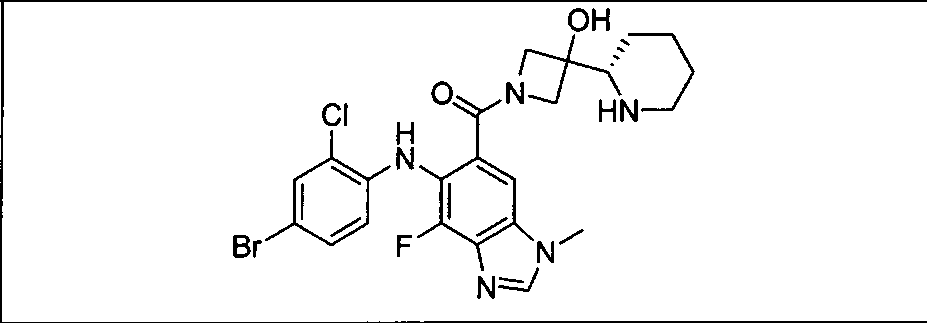
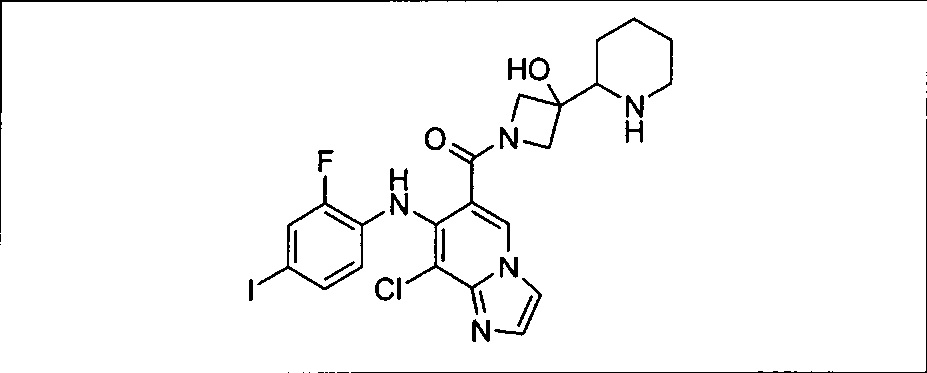
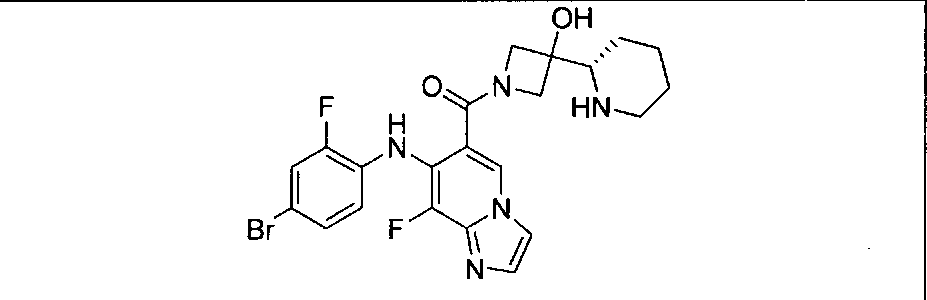
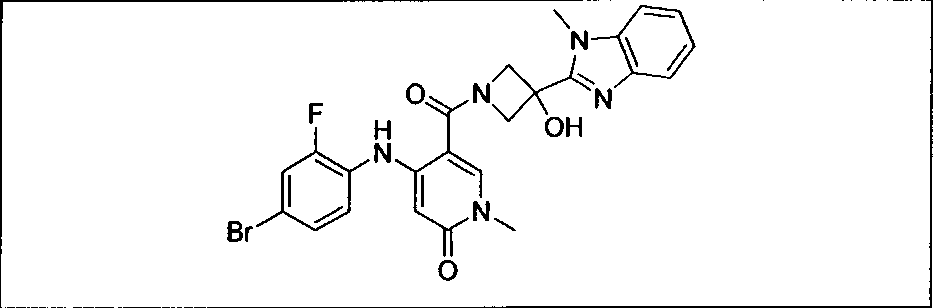
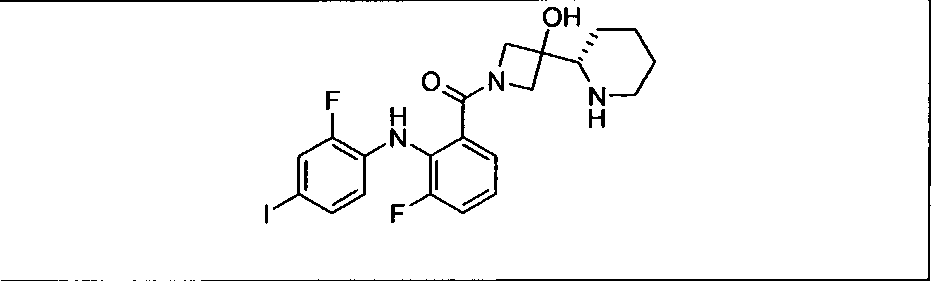
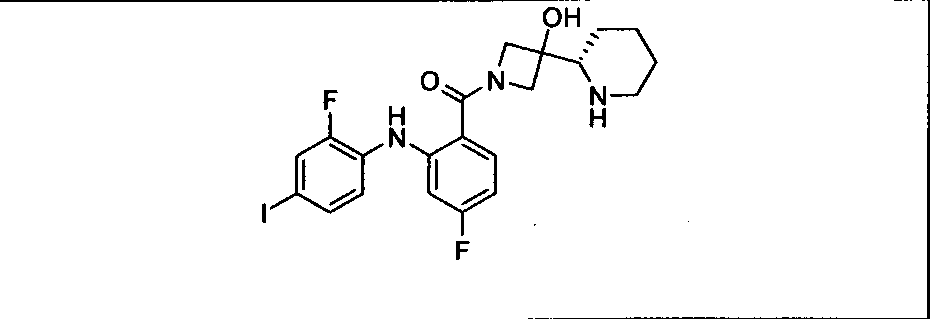
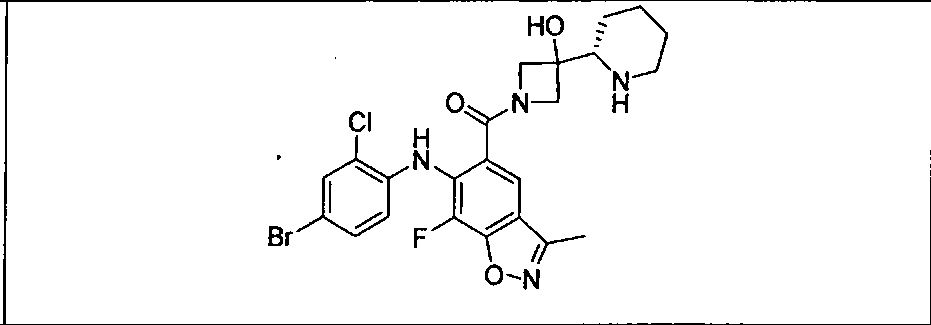
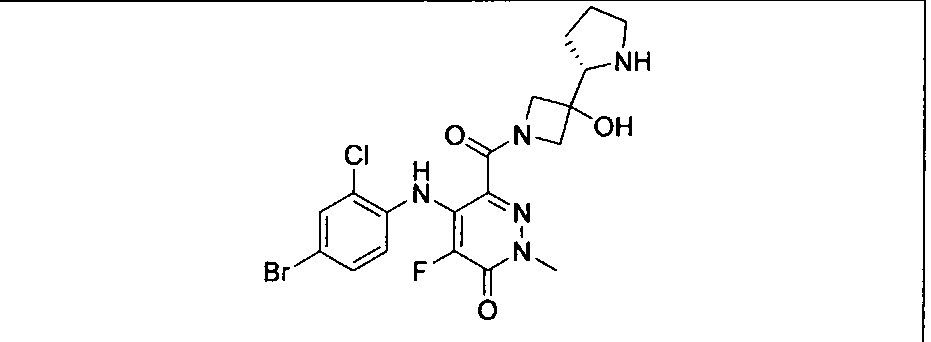
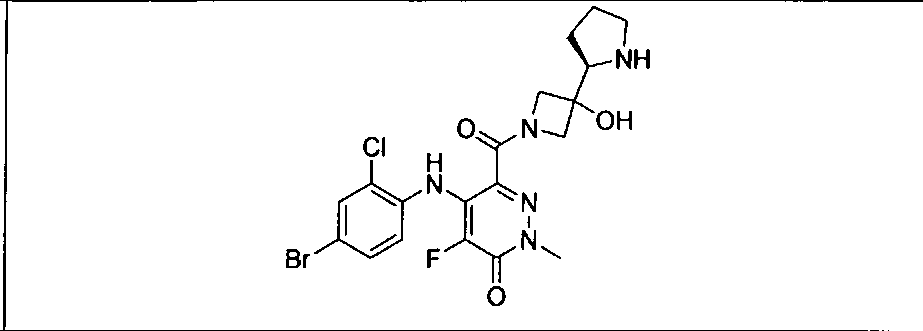
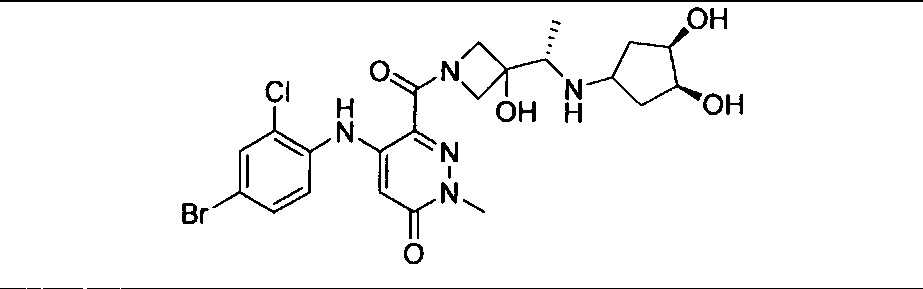
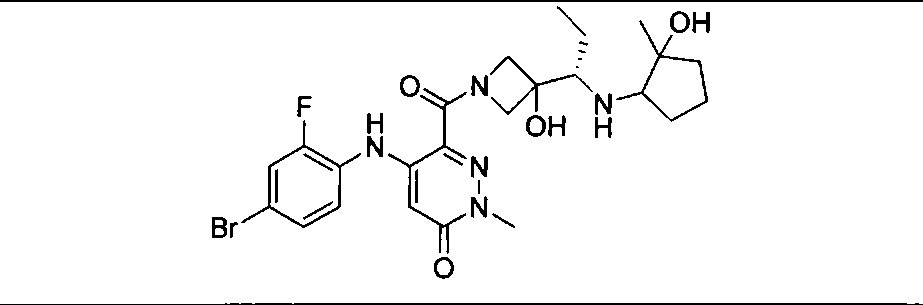
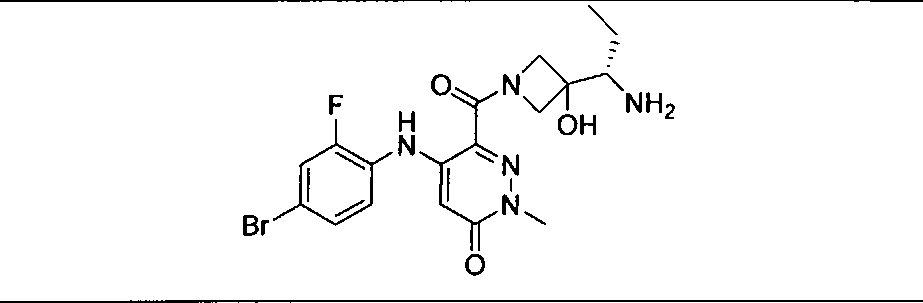
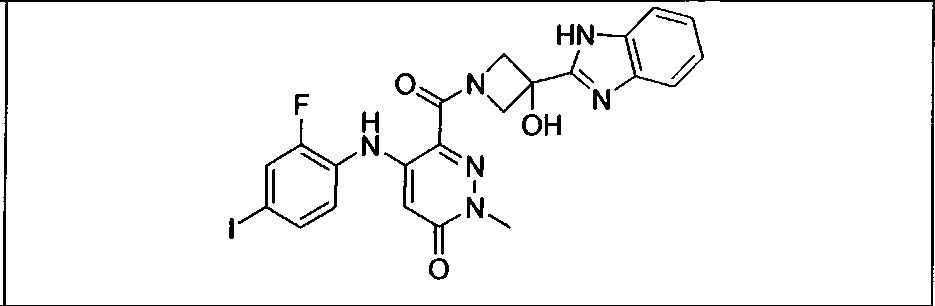
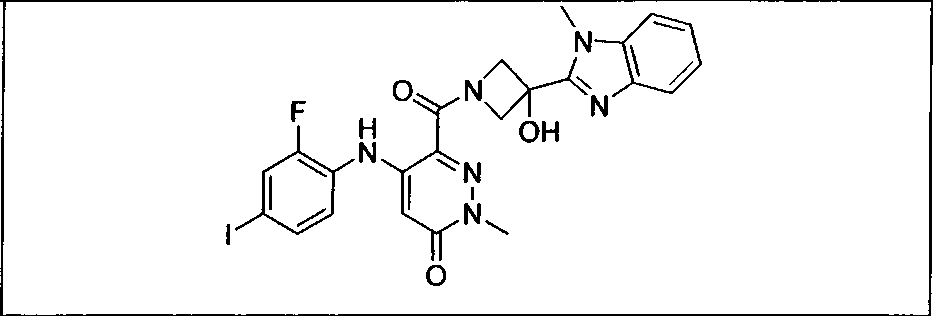
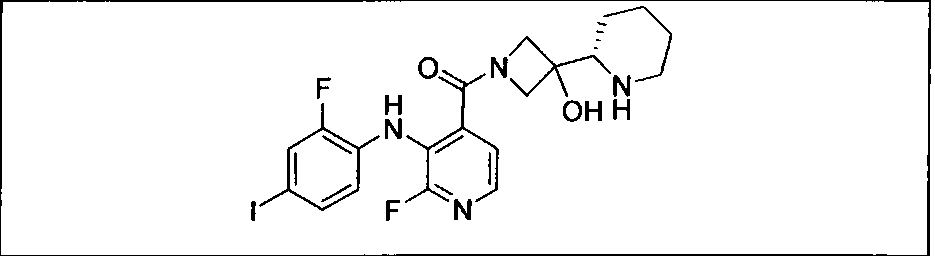
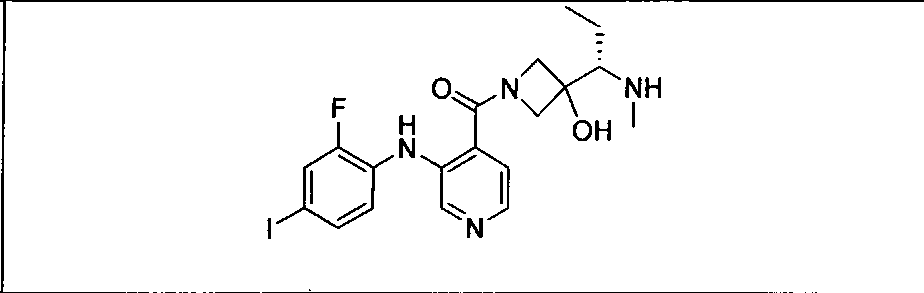
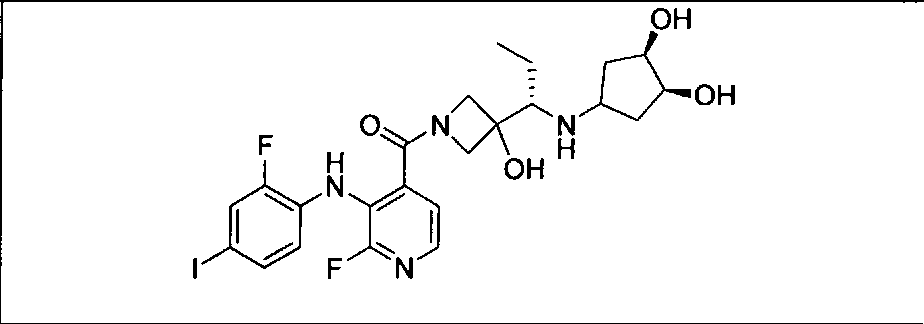
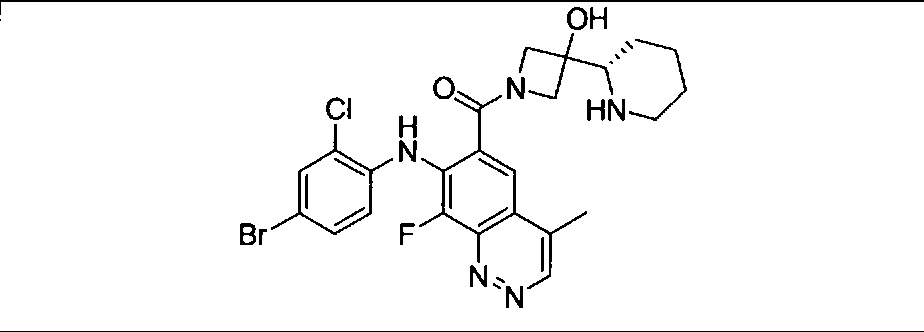
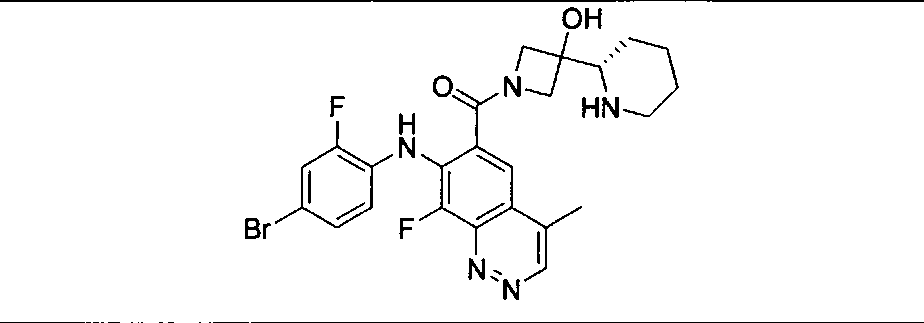
Результат интеллектуальной деятельности: КОМБИНАЦИИ ИНГИБИТОРА PI3K И ИНГИБИТОРА МЕК
Вид РИД
Изобретение
Настоящее изобретение относится к способам лечения пациента с местнораспространенными или метастазирующими плотными опухолями комбинацией ингибитора фосфатидилинозитол-3-киназы (phosphatidylinositol 3-kinase-PI 3-киназы или PI3K) и ингибитора киназы митоген-активированной протеинкиназы (mitogen activated protein kinase kinase - МЕК), описанной в настоящем изобретении.
Сигнальный каскад митоген-активированной протеинкиназы (mitogen-activated protein kinase - МАРК) преобразует множественные сигналы пролиферации и дифференциации в клетках опухоли. Выявлено четыре метаболических пути МАРК: внеклеточной сигнал-регулируемой киназы (extracellular signal-regulated kinase - ERK), c-Jun NH2-концевой киназы (c-Jun NH2-terminal kinase - JNK), p38 киназы и ERK5 (Johnson, Lapadat, Science 2002, 298(5600), cc.1911-1912). Разные внеклеточные сигналы могут стимулировать один или несколько из указанных метаболических путей.
Метаболический путь RAS/RAF/MAPK/ERK играет важную роль в опосредовании роста клеток и дифференциации в ответ на многочисленные внеклеточные сигналы. Ras-GTP активирует Raf-киназу, которая в свою очередь активирует MEK/ERK метаболический путь и вызывает клеточную пролиферацию (Downward, Nat Rev Cancer., 3(1), 2003, cc.11-22). Для регуляции клеточной пролиферации активированные киназы ERK перемещаются в ядро и регулируют генную экспрессию через активирование нескольких ключевых факторов транскрипции. Нарушенная регуляция метаболического пути RAS/RAF/MEK/ERK содействует неконтролируемой пролиферации, инвазии, метастазированию, ангиогенезу и уменьшенному апоптозу.
Можно ожидать, что ингибиторы МЕК наиболее эффективны в опухолях, которые в высокой степени зависимы от сигналов пролиферации от сигнальных метаболических путей RAS/RAF/MEK/ERK. Мутация и/или сверхэкспрессия EGFR, а также мутации онкогенов KRAS, NRAS и BRAF, активируют этот метаболический путь у многих форм рака. RAS мутирован примерно у 30% плотных опухолей (база данных Wellcome Trust Sanger Institute COSMIC). Обнаружены с высокой частотой встречаемости онкогенные мутации KRAS при аденокарциноме поджелудочной железы (90%), аденокарциноме толстой и прямой кишки (30%-50%) и немелкоклеточном раке легкого (30%) (Johnson и др., Nature, 410, 2001, сс.1111-1116). Активирование соматических мутаций в онкогене B-RAF (например, B-RAFV600E) выявлено у ряда злокачественных заболеваний с наивысшей частотой встречаемости при злокачественной меланоме (60%-80%), папиллярном раке щитовидной железы (35%-70%), раке толстой и прямой кишки (примерно 10%) и раке эндометрия (10%-20%). Раковые клетки, трансформированные B-RAFV600E, экспоненциально чувствительны к подавлению МЕК. Таким образом, ингибиторы МЕК могут иметь особое клиническое применение при меланоме и других опухолях, несущих мутацию B-RAFV600E (Solit, Nature, 441, 2006, сс.424-430).
Сигнальный метаболический путь фосфоинозитид-3-киназы (phosphoinositide 3-kinase - PI3K) является главным расположенным ниже по цепи эффектором рецепторных тирозинкиназ, которые стимулируют пролиферацию клеток, стимулируют выживание и ингибируют апоптоз, например, эпидермального фактора роста-2 человека (human epidermal growth factor-2 - HER2), рецептора эпидермального фактора роста (epidermal growth factor receptor - EGFR) и рецептора инсулин-подобного фактора роста-1. Измененная регуляция центрального сигнального метаболического пути выявлена у большого числа типов рака, действующих по разным механизмам. Метаболический путь конститутивно активируется утратой супрессора опухоли гомолога фосфатазы и тензина (phosphatase and tensin - PTEN), фосфатазой, которая препятствует киназной активности РОК у многих типов рака (Li и др., Science 1997;275, 1997, сс.1943-1947; Steck и др., Nat Genet 1997; 15, 1997, сс.356-362). АКТ, расположенная ниже по цепи мишень для РОК, сверхэкспрессируется в опухолях некоторых типов (Staal, Proc Nat Acad Sci USA, 84(14), 1987, cc.5034-5037; Cheng и др., Proc Nat Acad Sci USA, 89(19), 1992, cc.9267-9271; Bellacosa и др., Int J Cancer, 64(4), 1995, cc.280-285) и показано ее преобразование (Aoki и др., Proc Nat Acad Sci USA, 95(25), 1998, 14950-14955). Активирование мутаций POK-oc, которые принадлежат к классу IA семейства РОК, наблюдают у ряда опухолей разных типов (Bachman и др., Cancer Biol Ther, 3, 2004, сс.772-775; Samuels и др., Science, 304, 2004, с.554).
Показано, что такие активирующие мутации стимулируют рост и инвазивность раковых клеток - признаков, которые аннулируются ингибиторами РОК. Взятые вместе эти данные предоставляют разумное обоснование для разработки ингибиторов сигнального метаболического пути РОК в качестве терапевтической стратегии против рака человека.
Многие формы рака (например, меланома, рак толстой и прямой кишки, рак поджелудочной железы, рак яичника, немелкоклеточный рак легких (НМКРЛ) и рак щитовидной железы) обладают высокой и перекрывающейся частотой онкогенных мутаций, которые активируют оба метаболические пути, и RAS, и РОК. Кроме того, в раковых клетках подавление одного активированного метаболического пути может привести к активированию другого; таким образом, подавление обоих метаболических путей, и RAS, и РОК, представляет новую противораковую стратегию. Таким образом, комбинированное подавление МЕК и РОК представляет подход к лечению рака, требующий разработки.
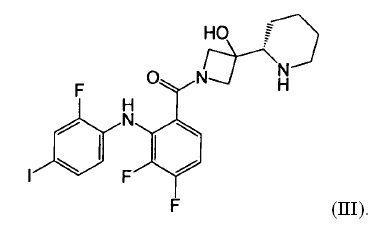
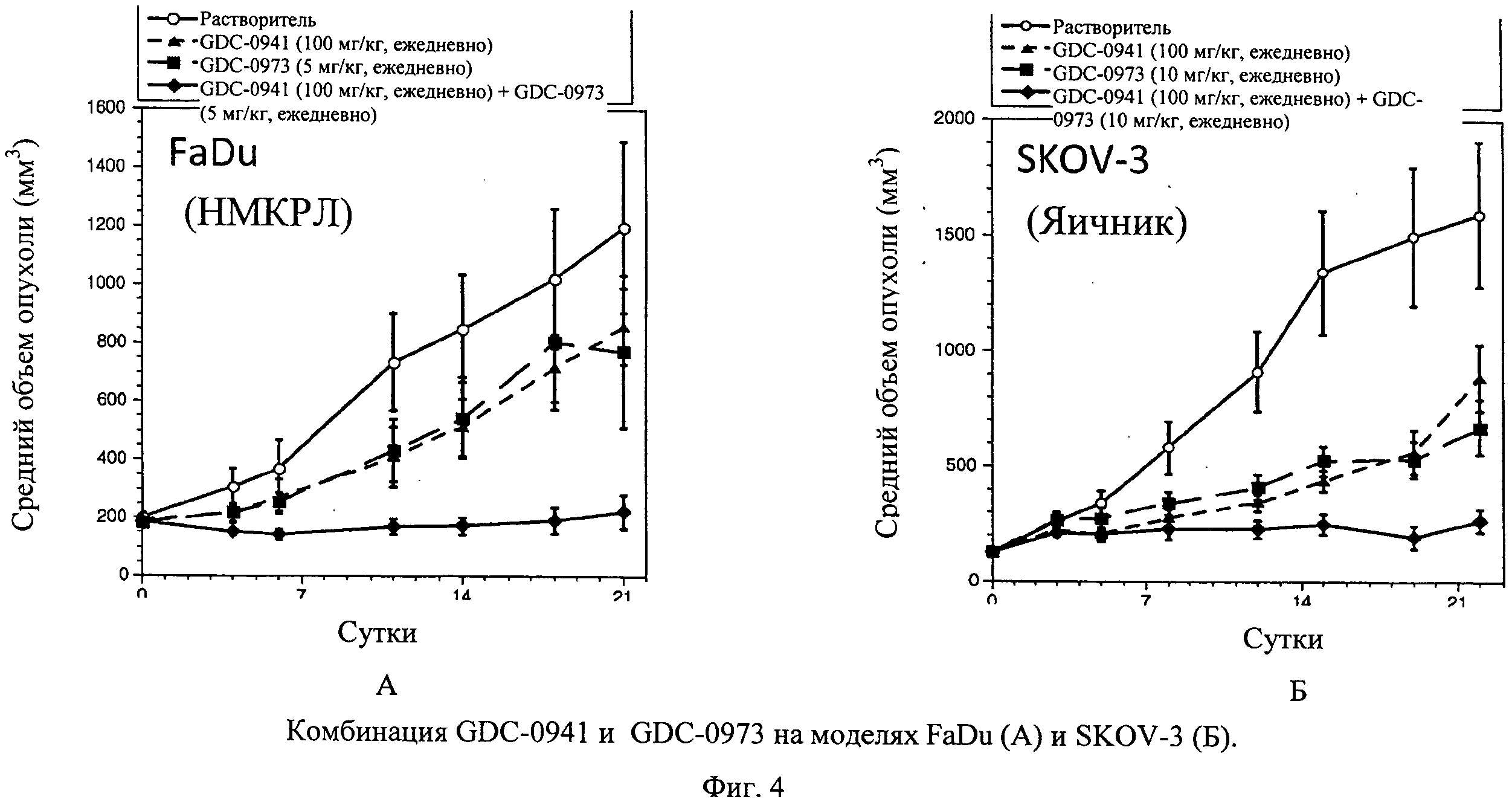
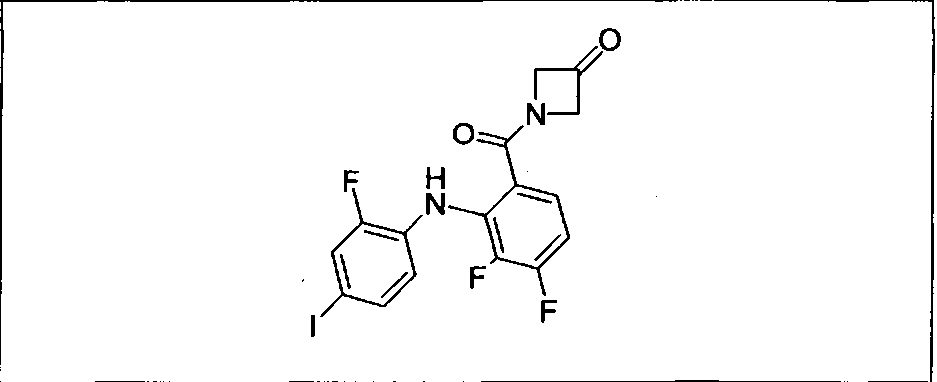
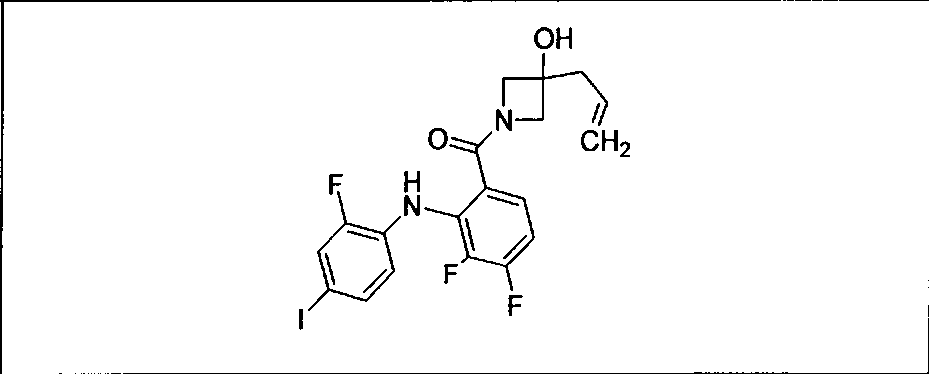
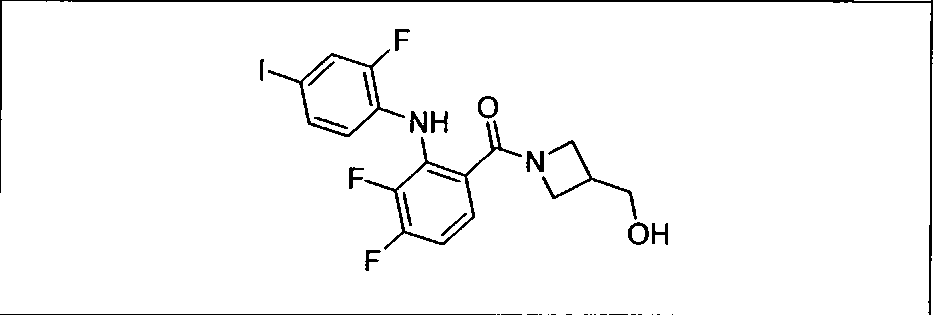
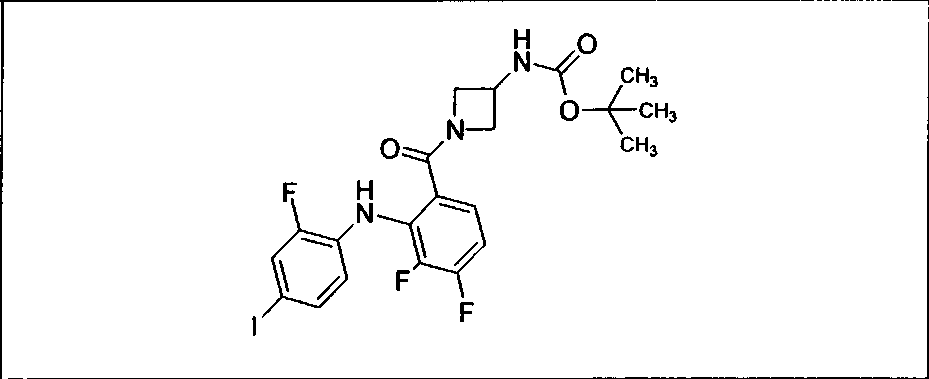
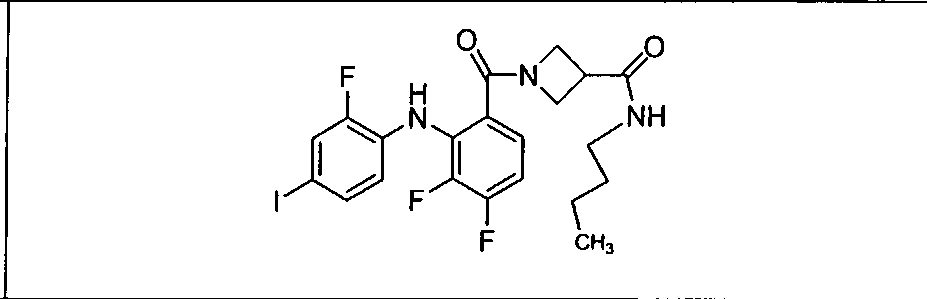
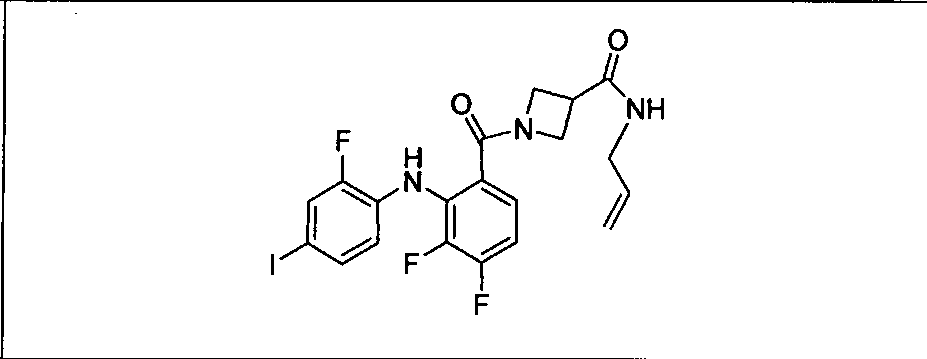
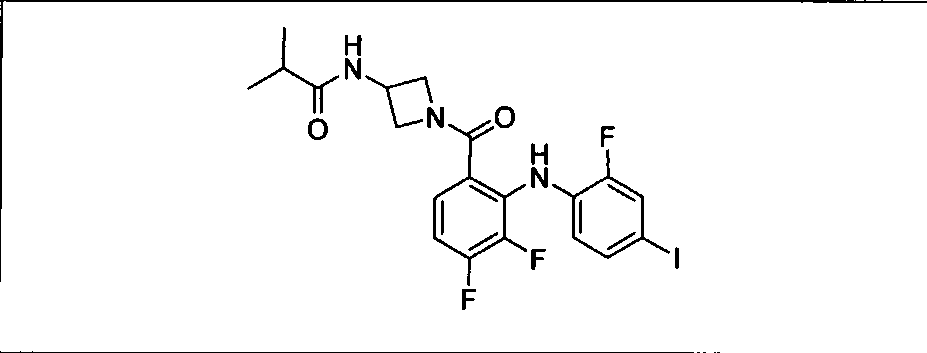
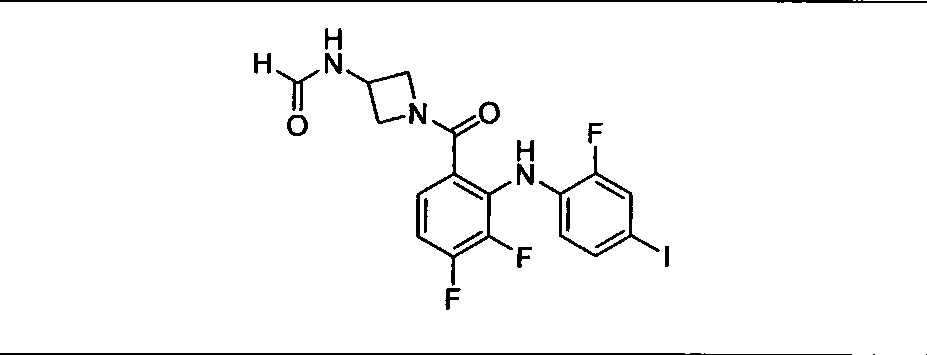
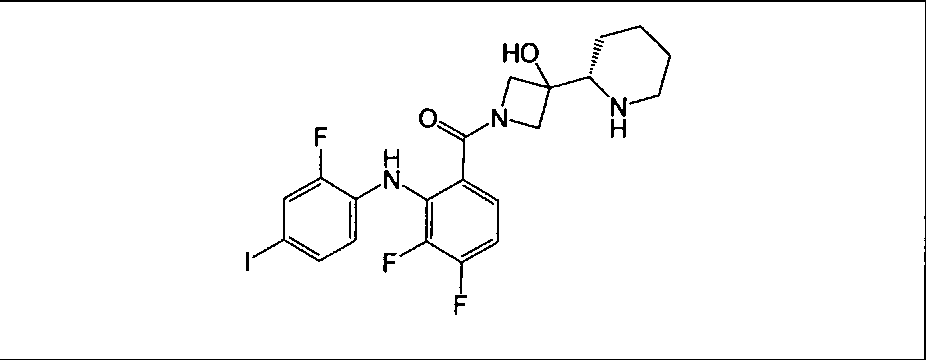
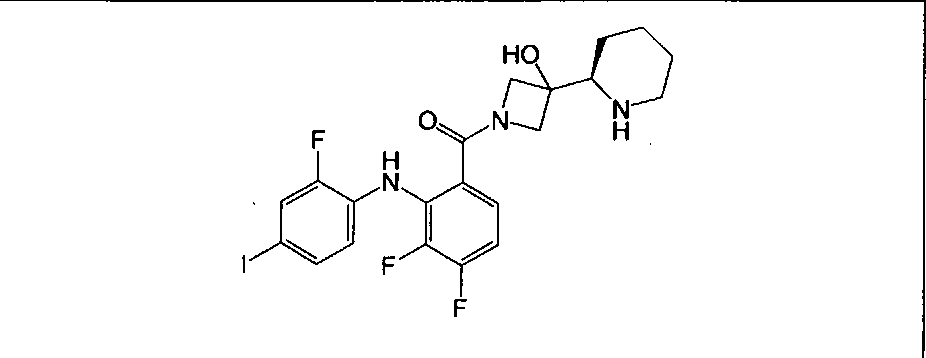
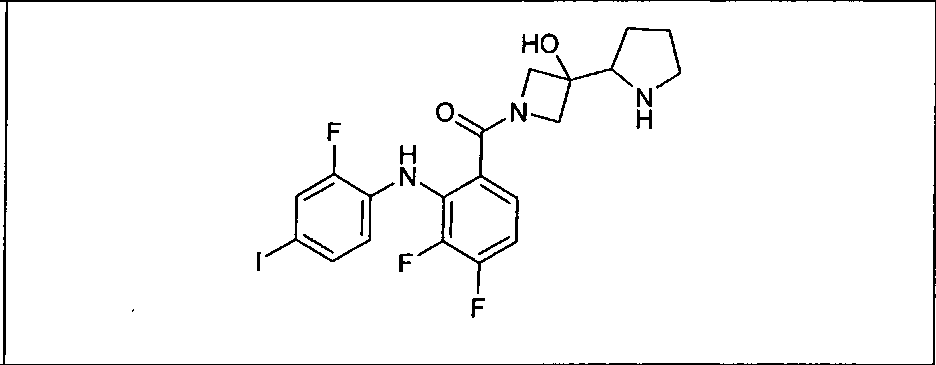
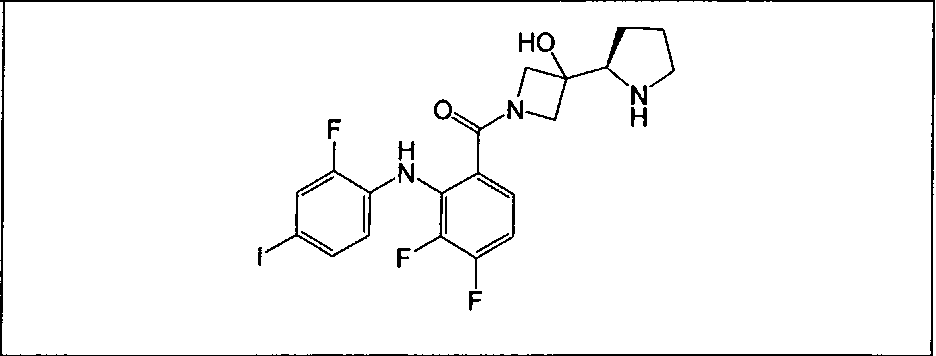
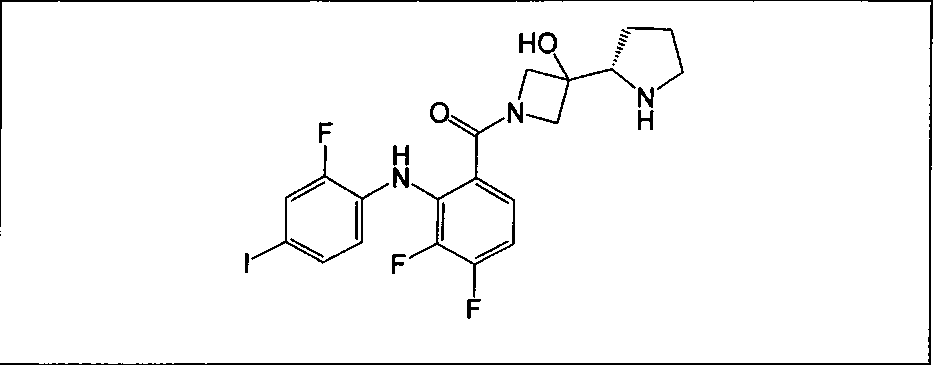
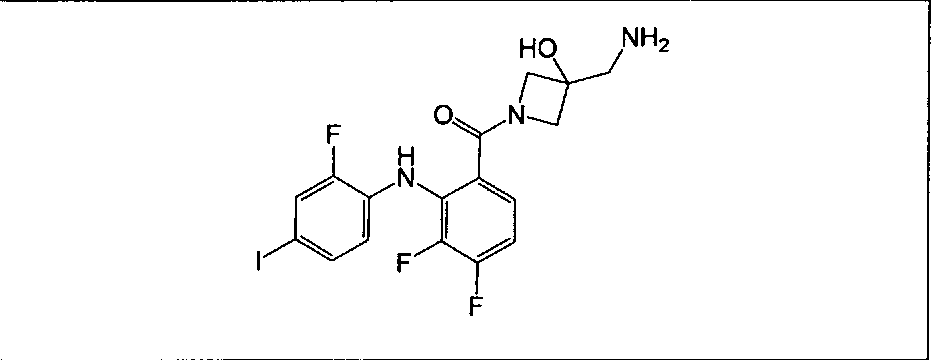
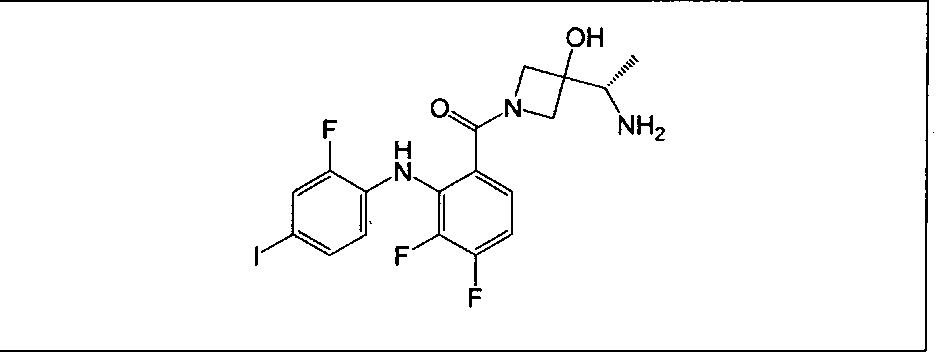
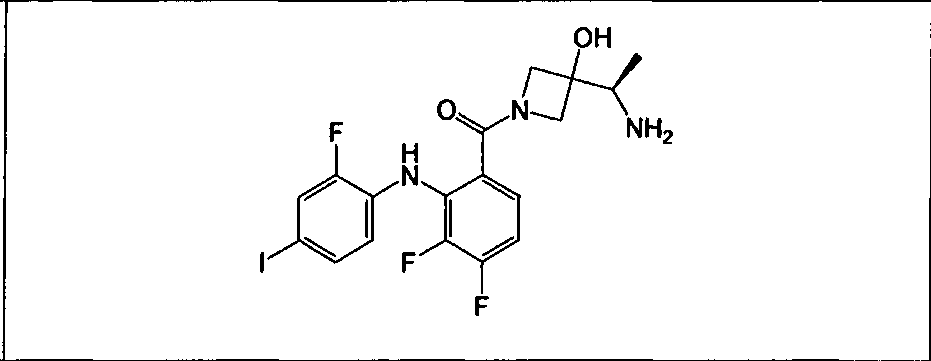
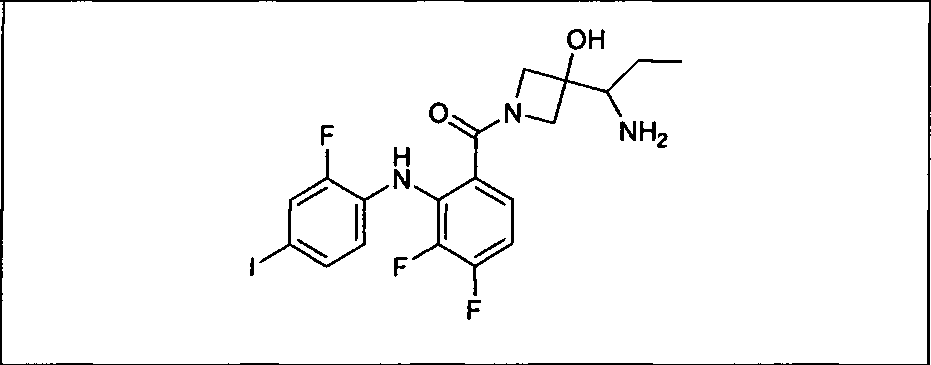
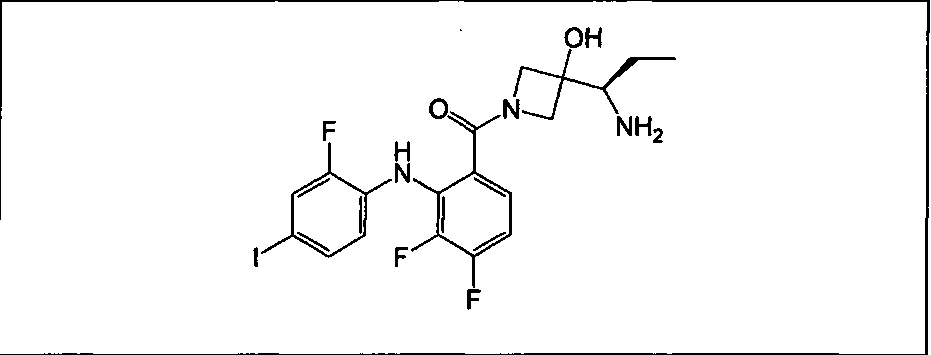
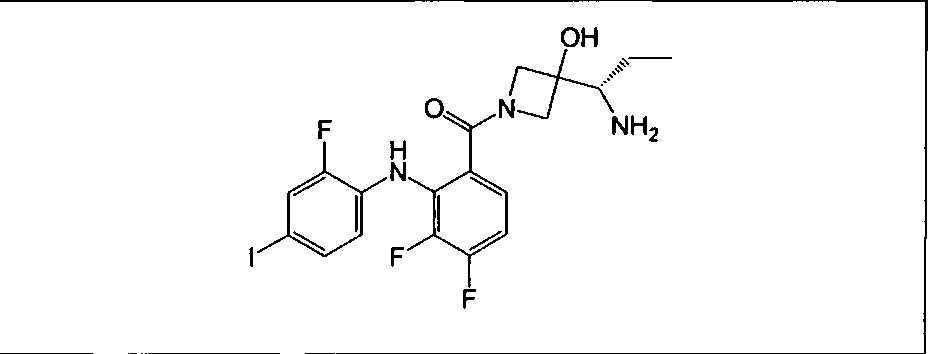
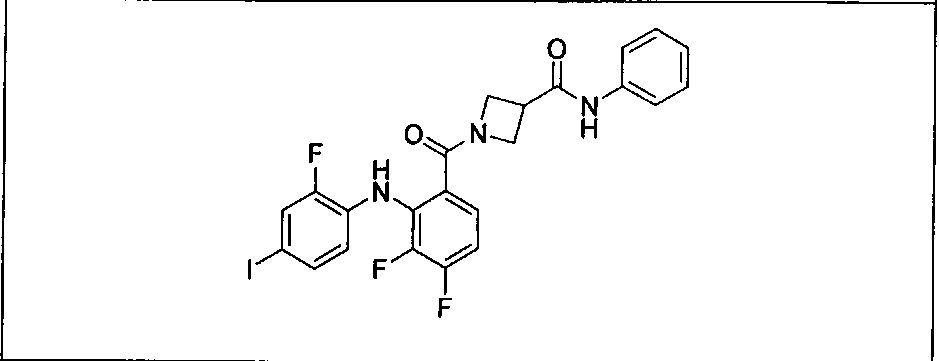
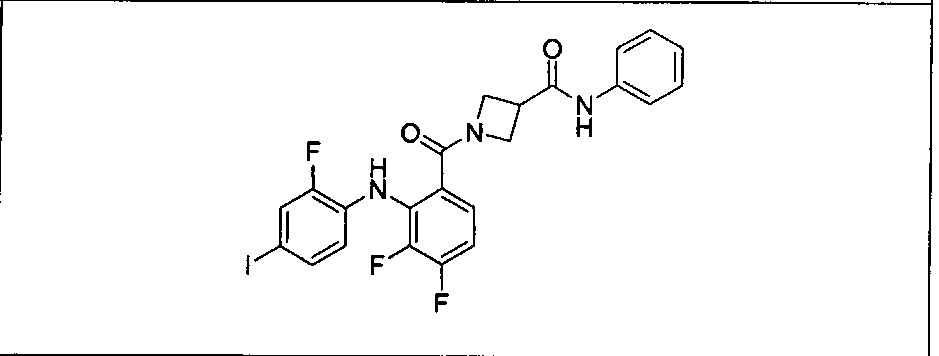
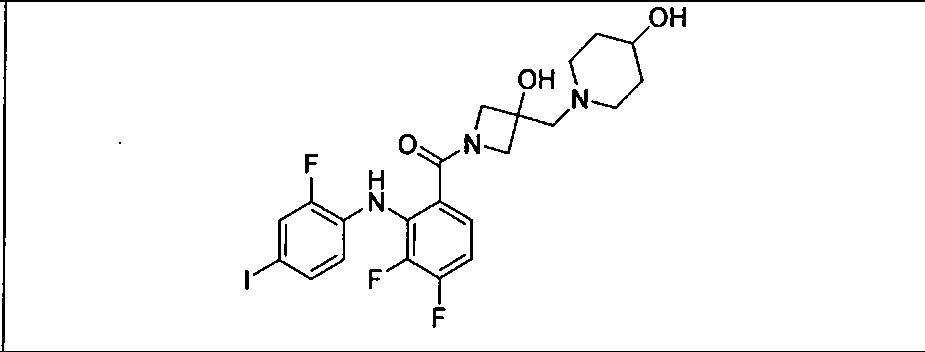
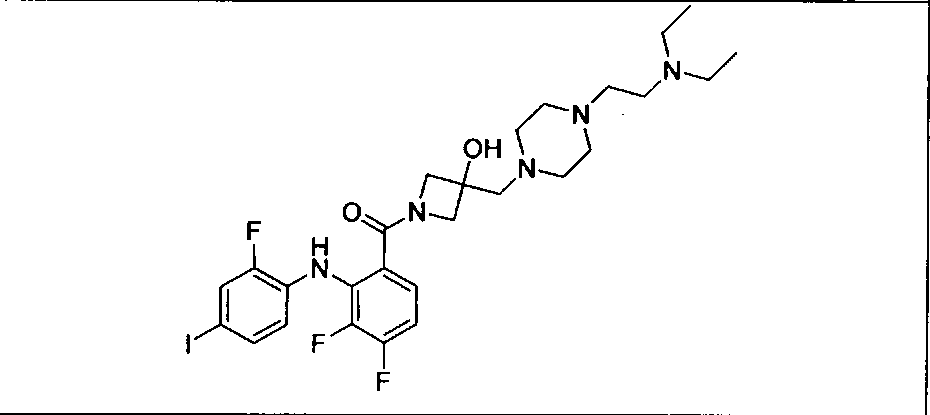
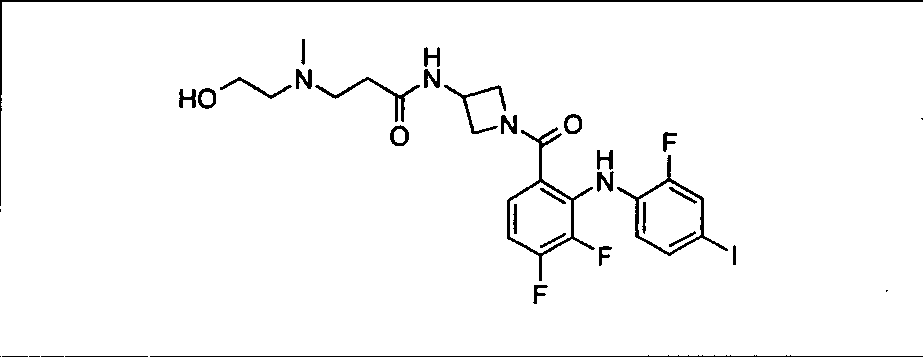
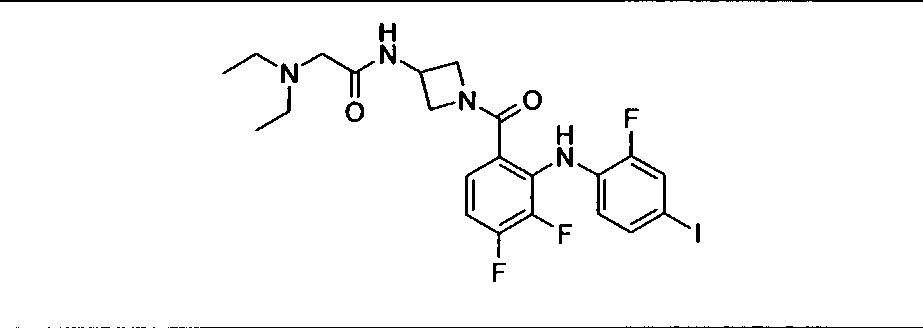
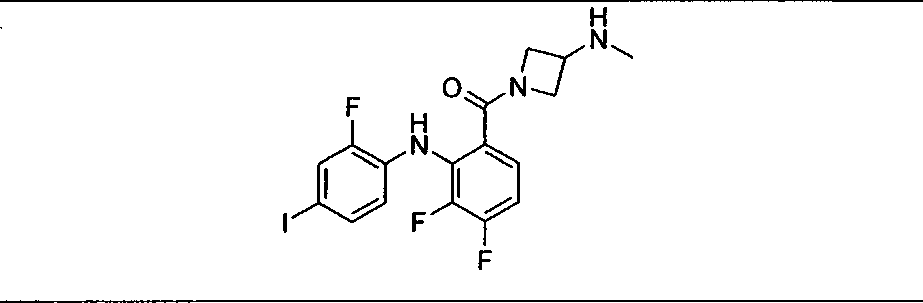
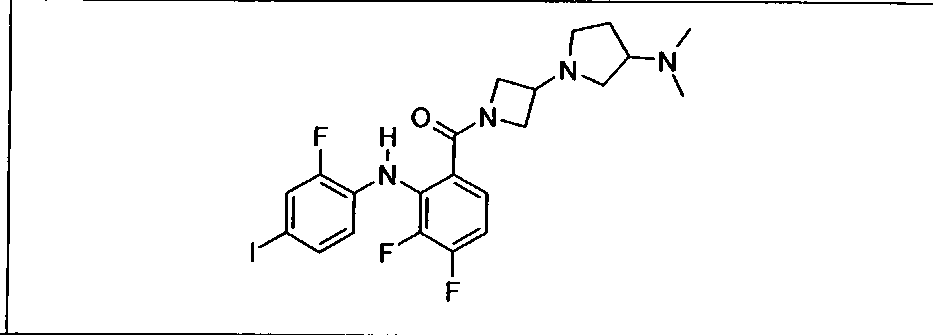
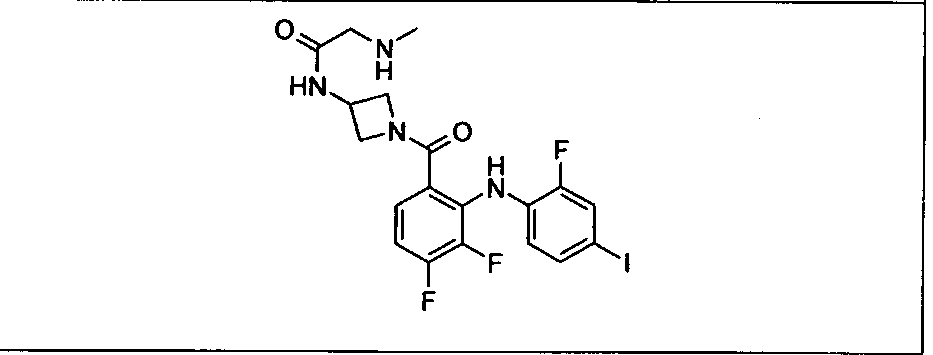
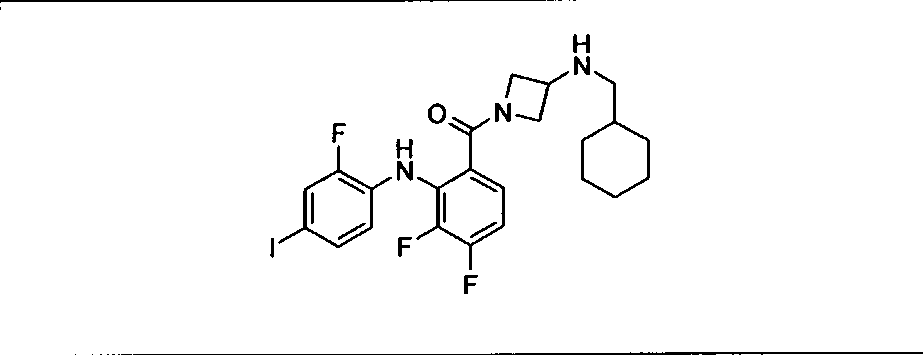
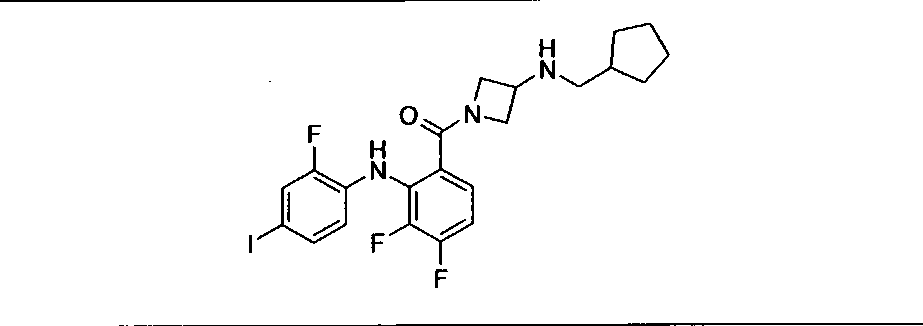
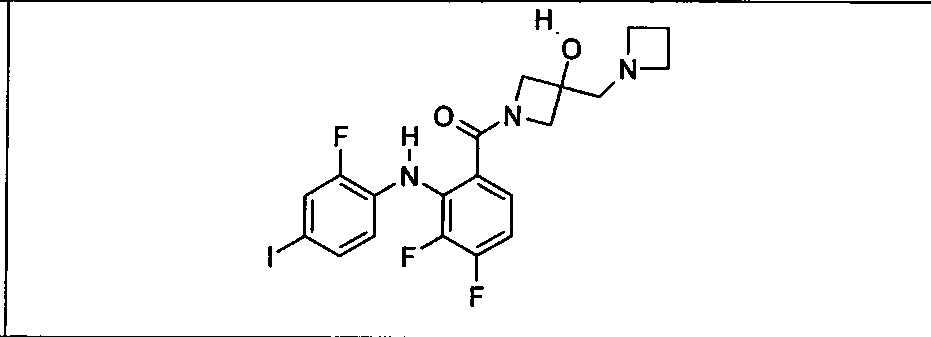
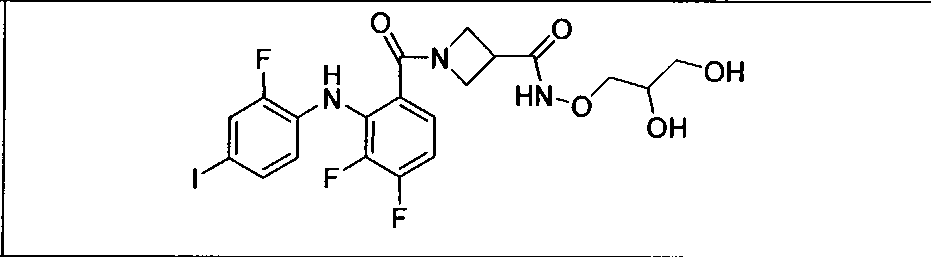
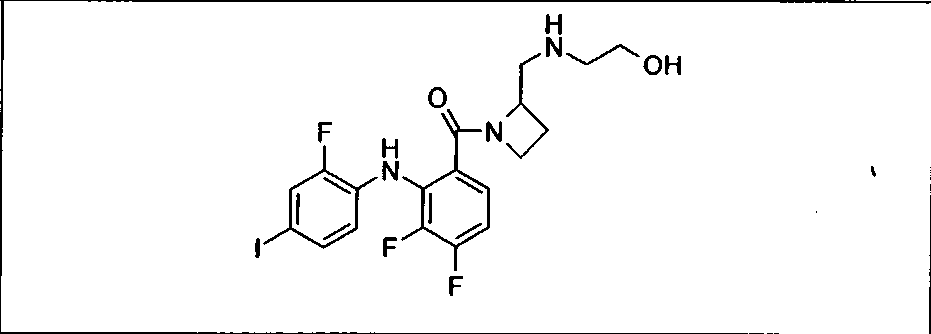
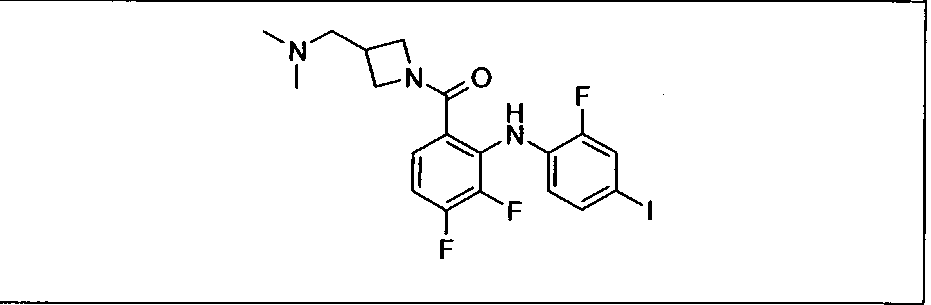
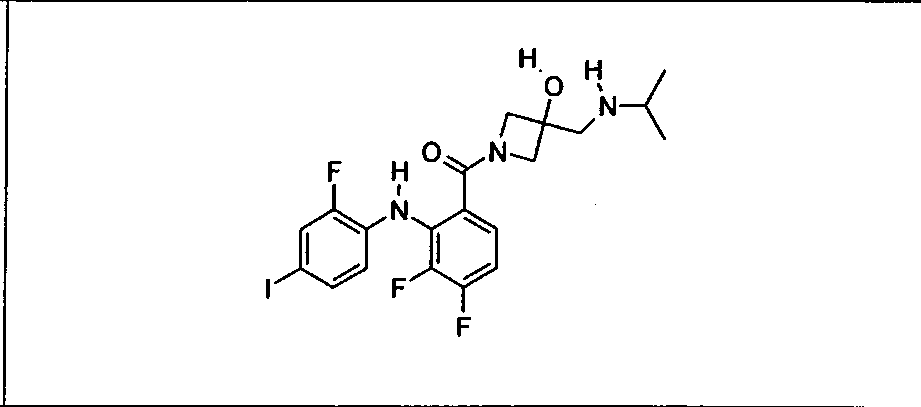
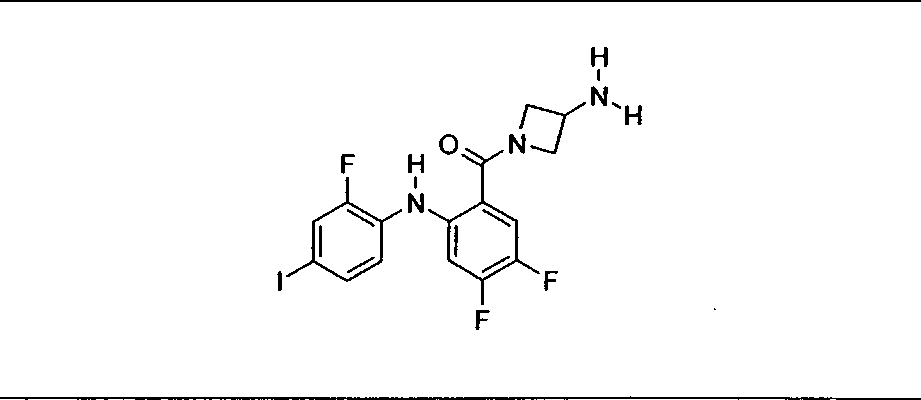
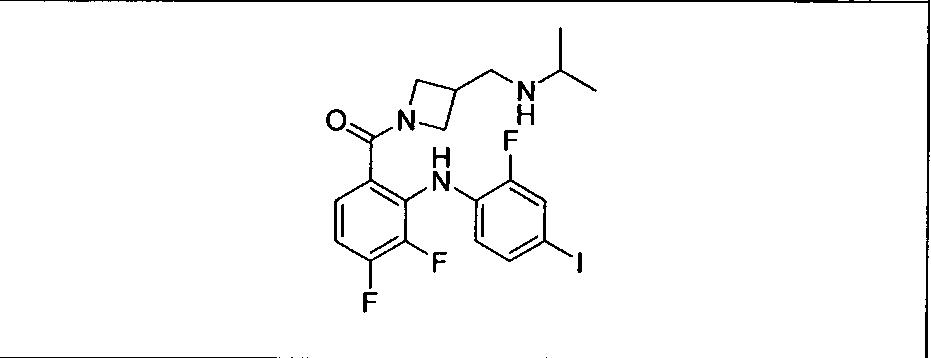
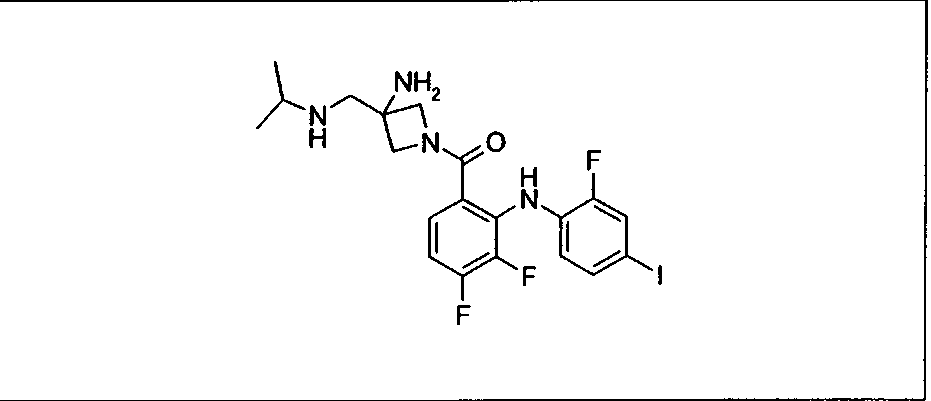
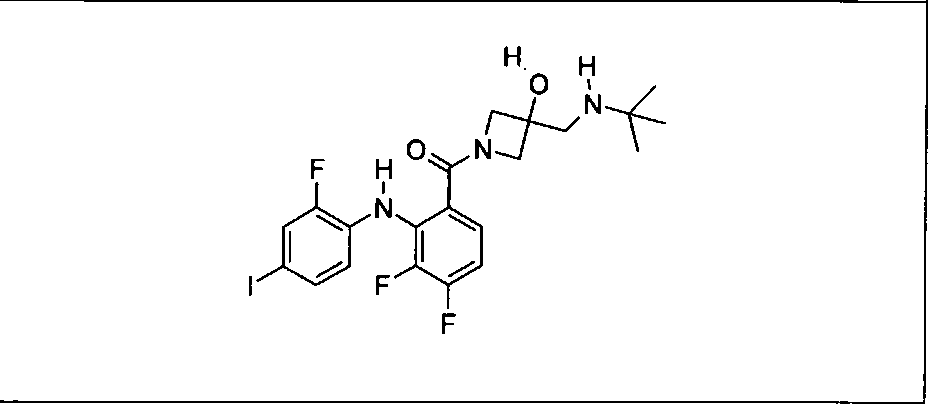
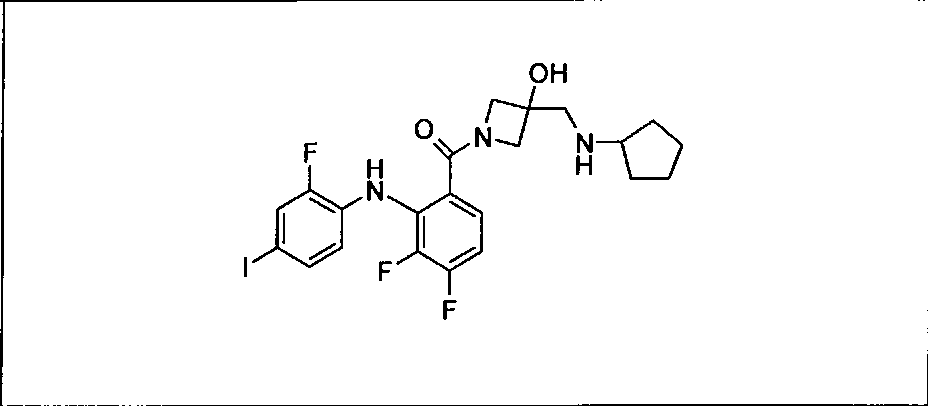
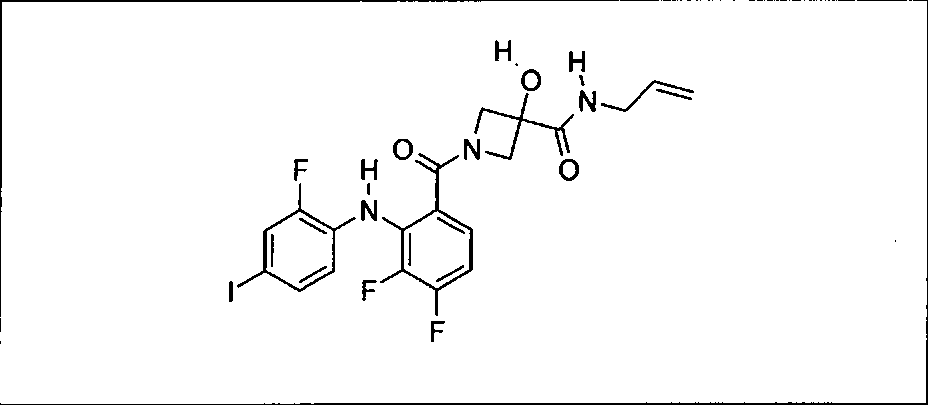
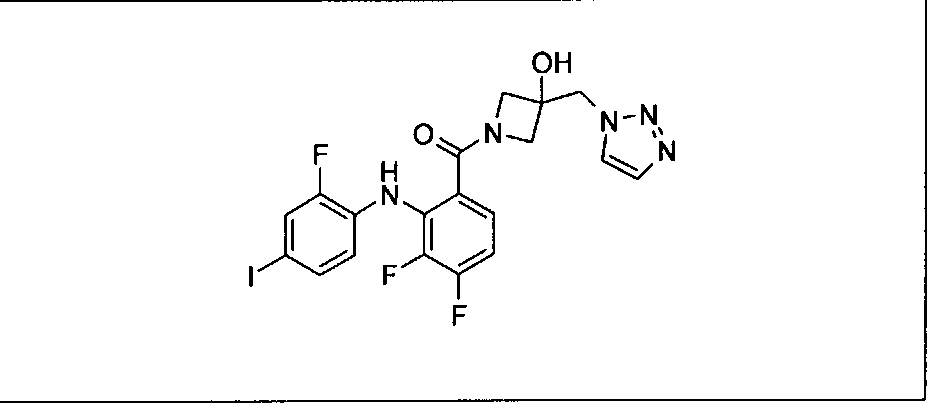
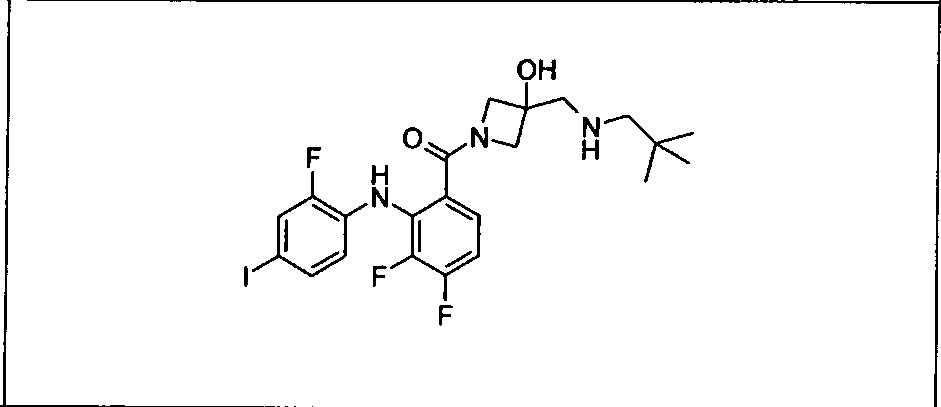
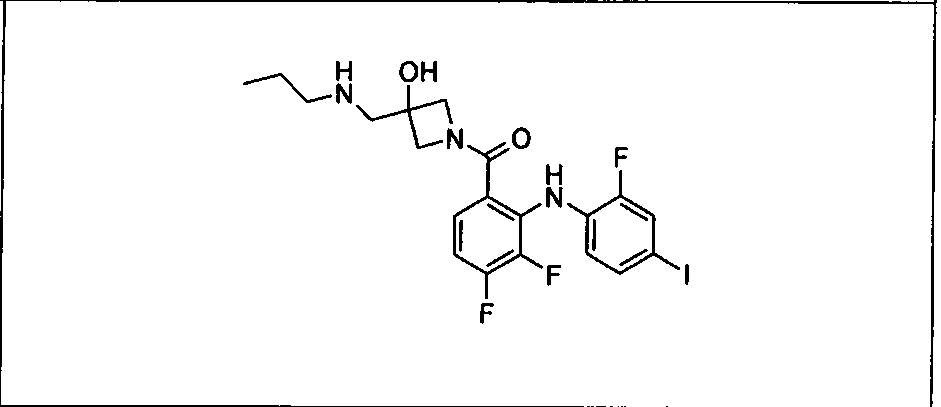
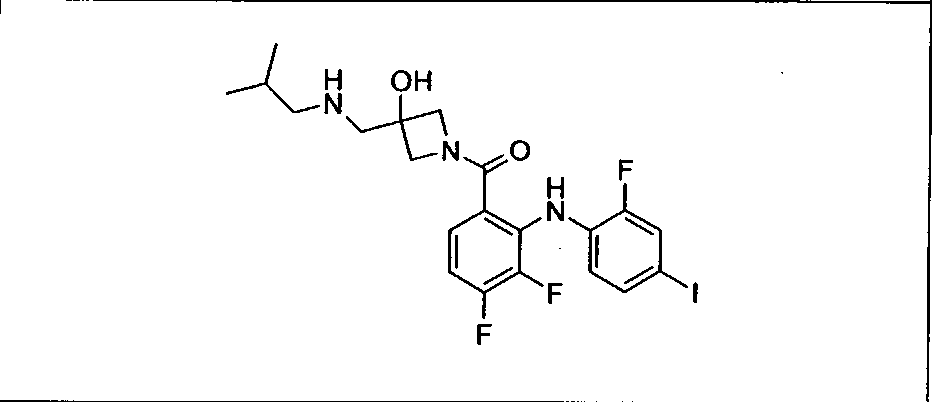
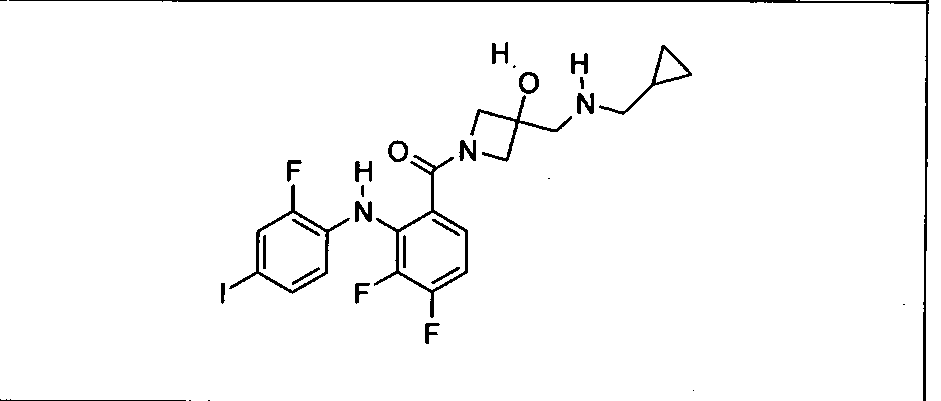
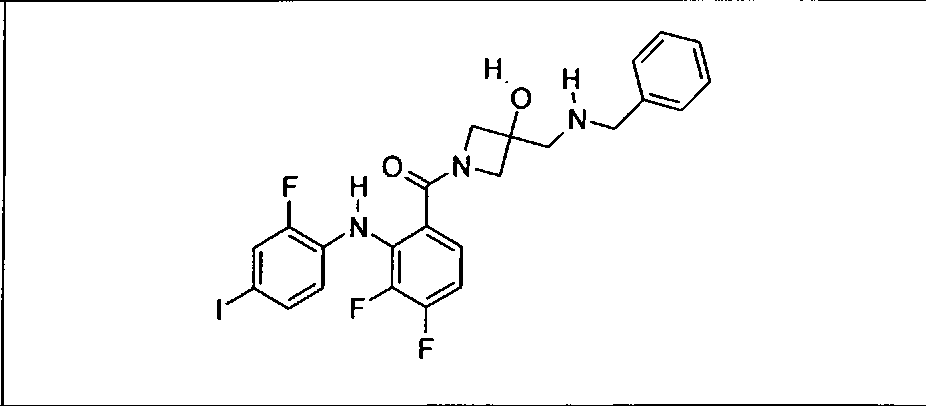
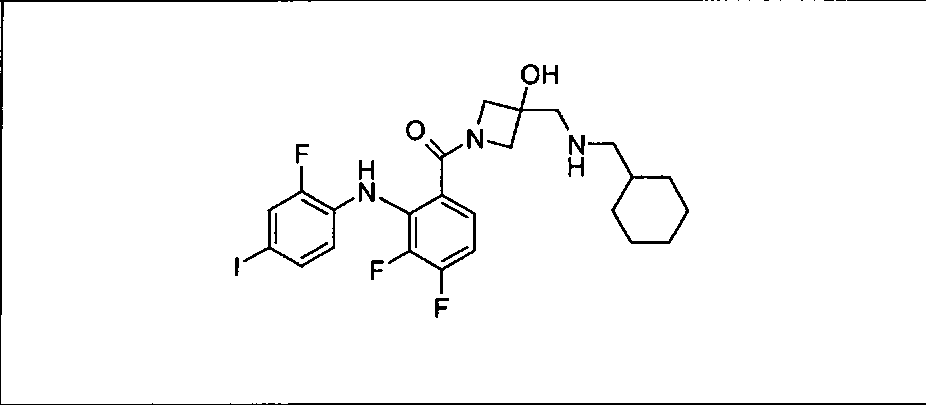
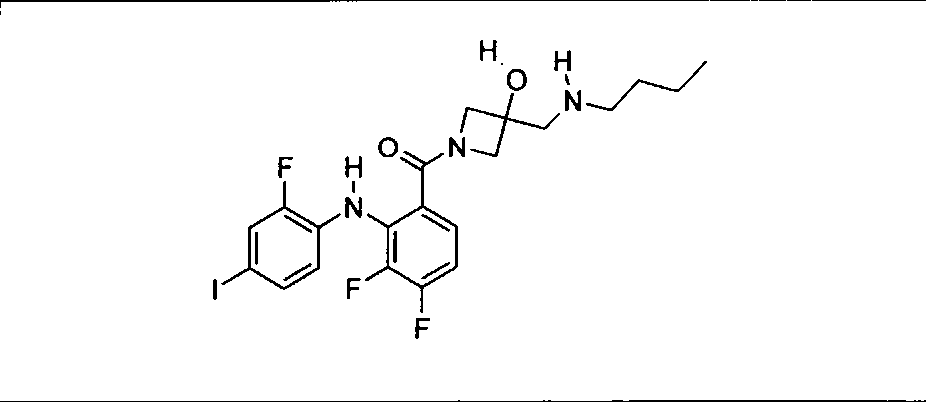
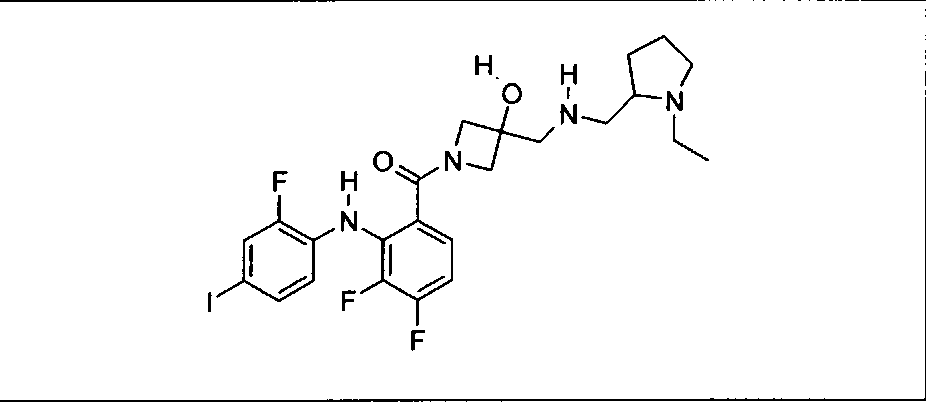
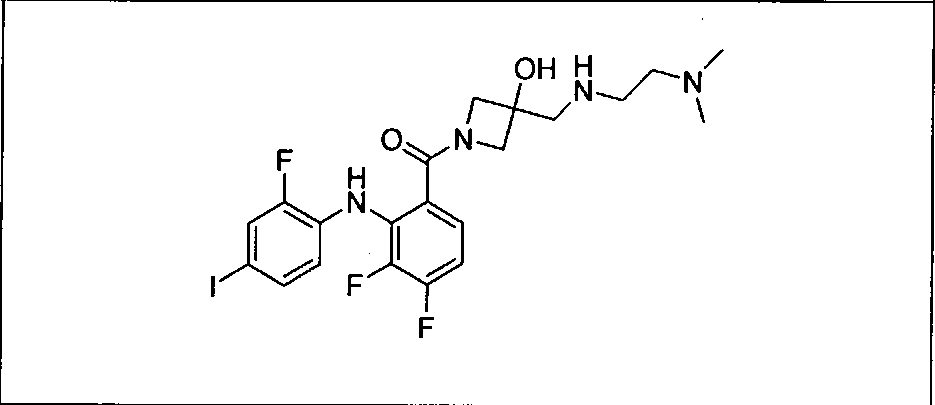
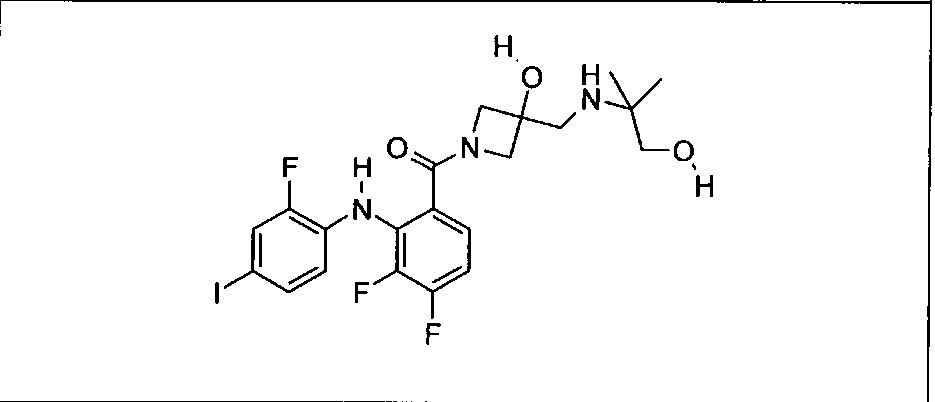
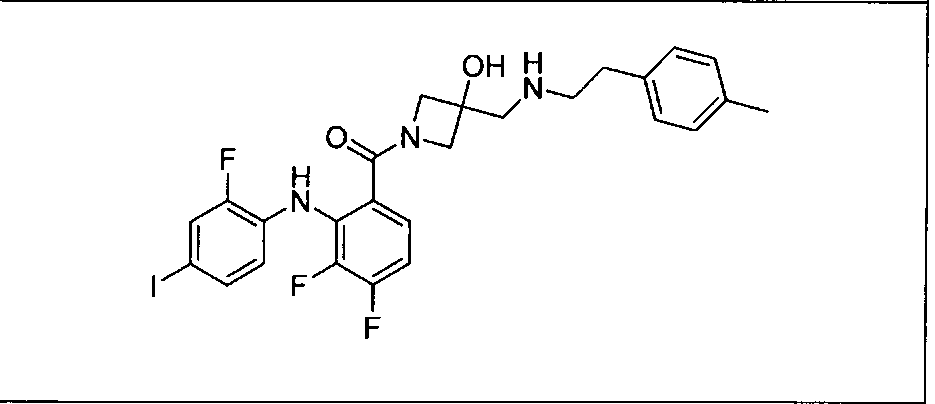
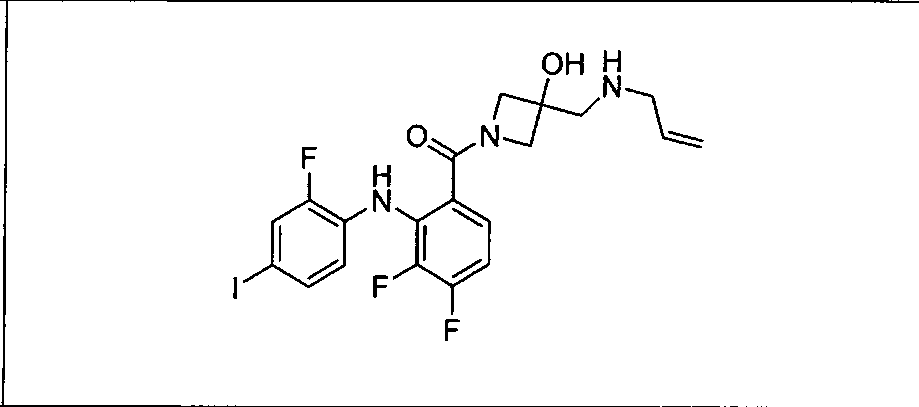
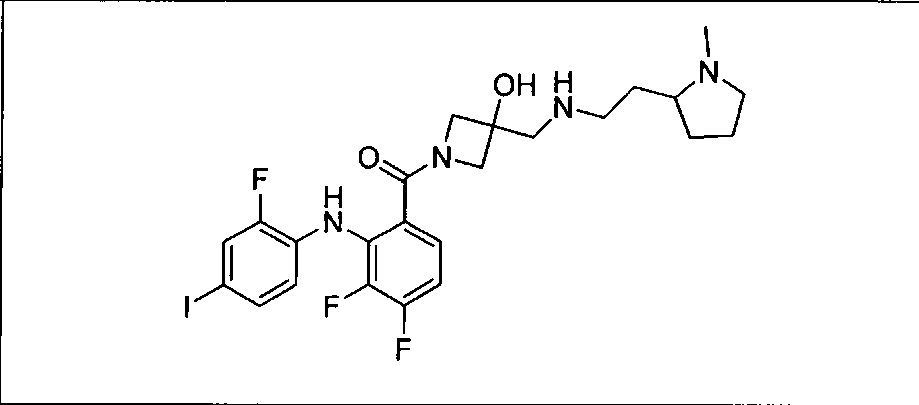
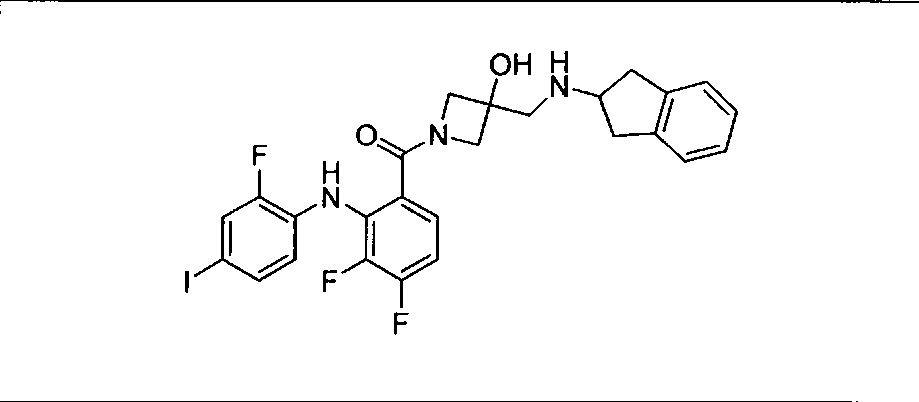
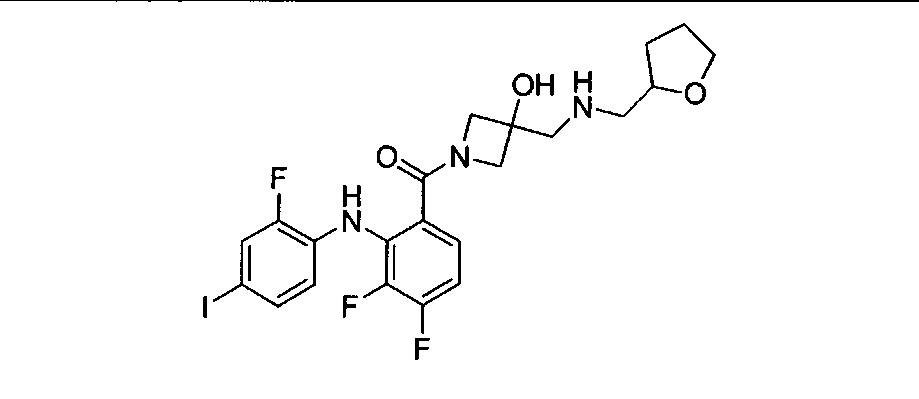
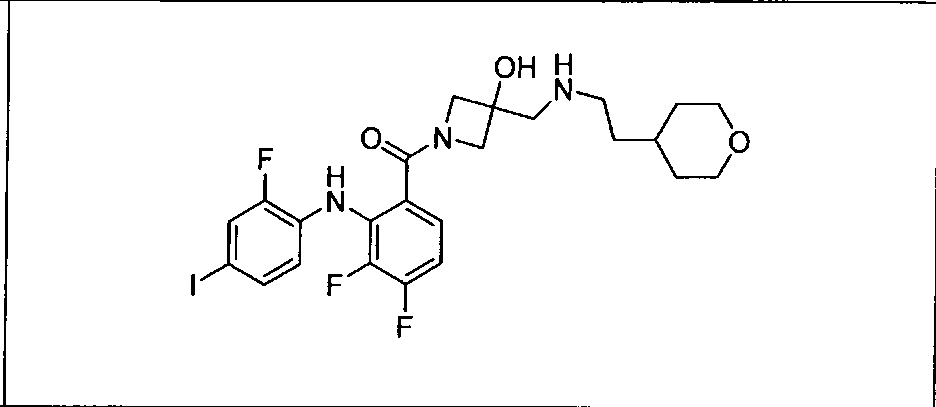
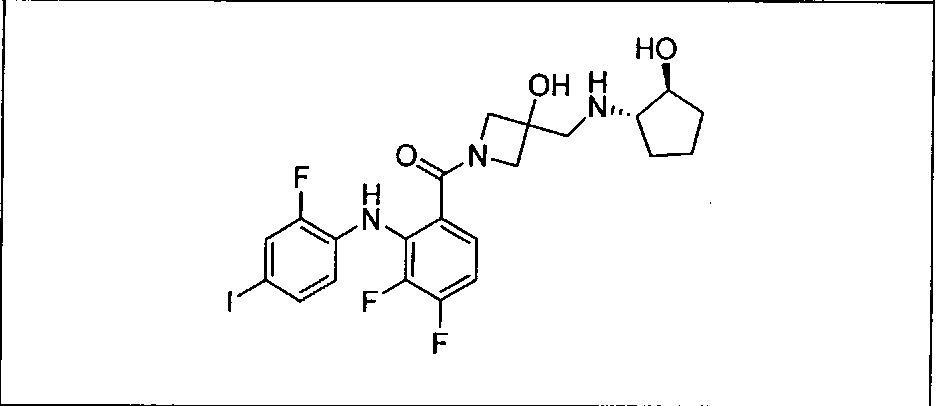
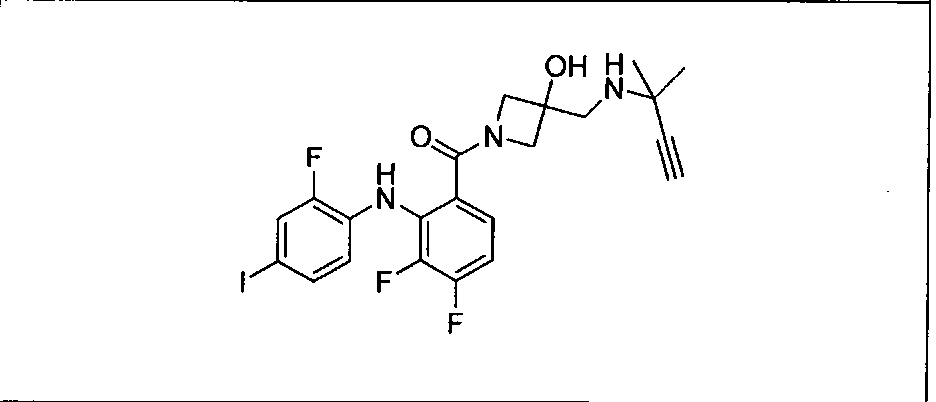
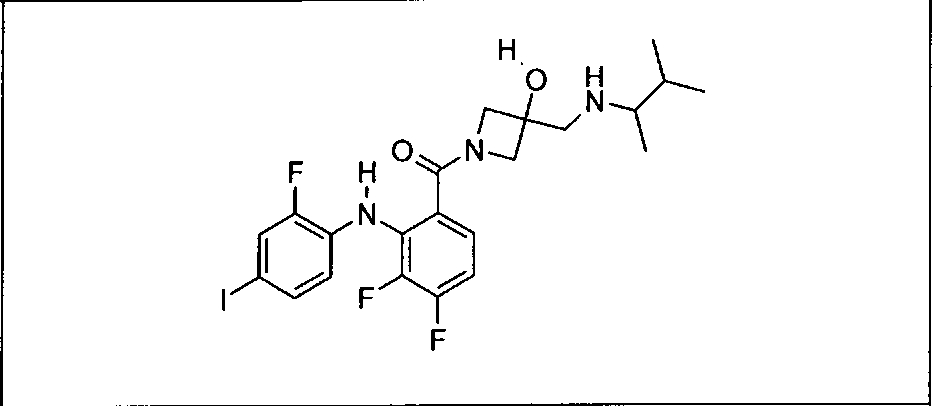
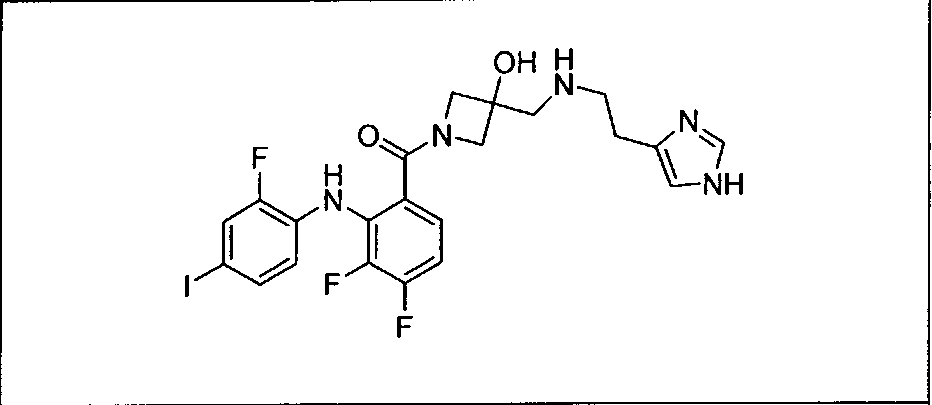
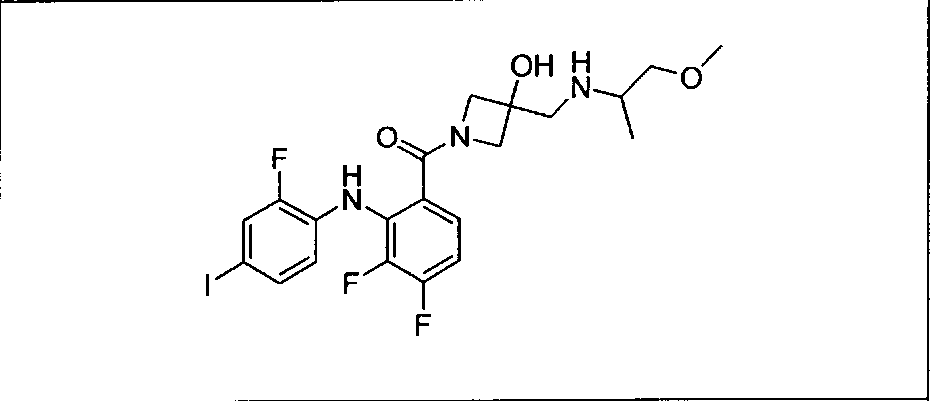
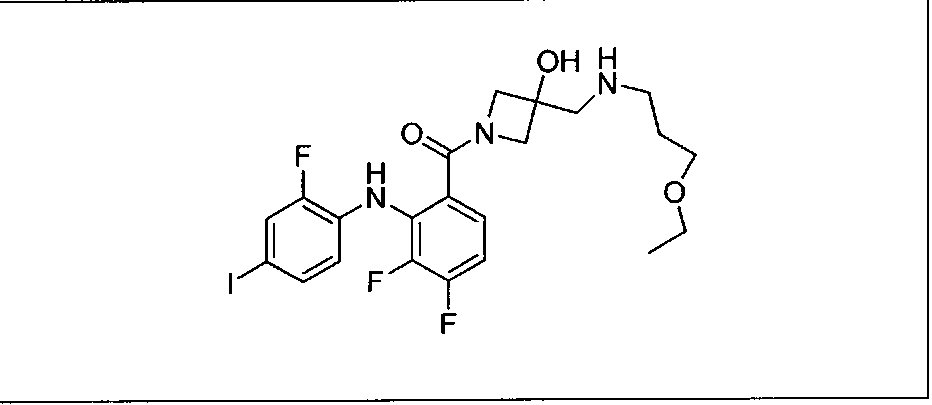
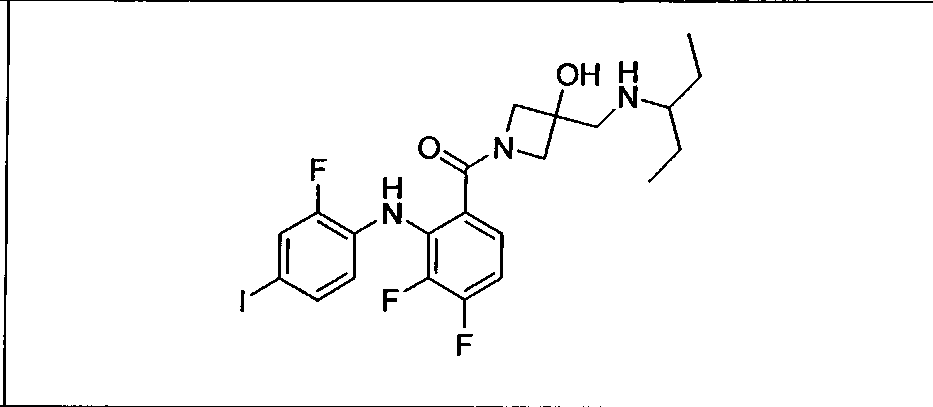
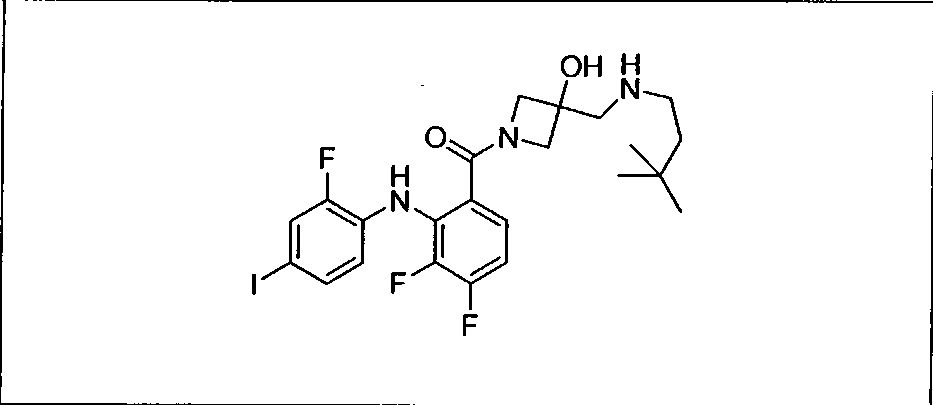
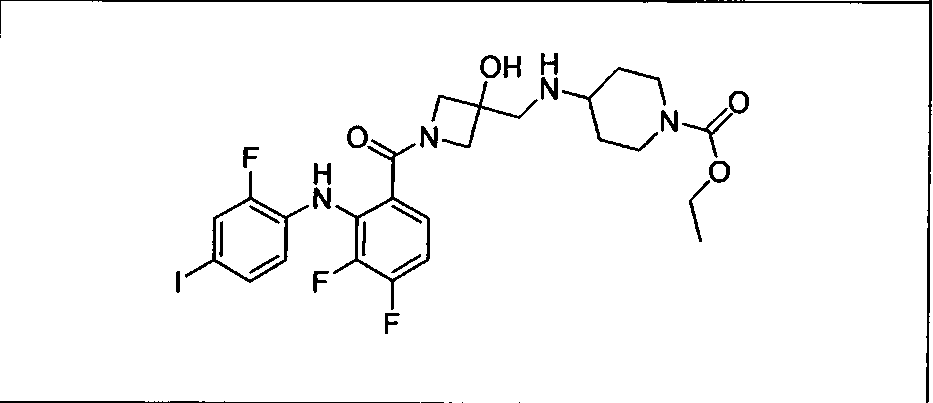
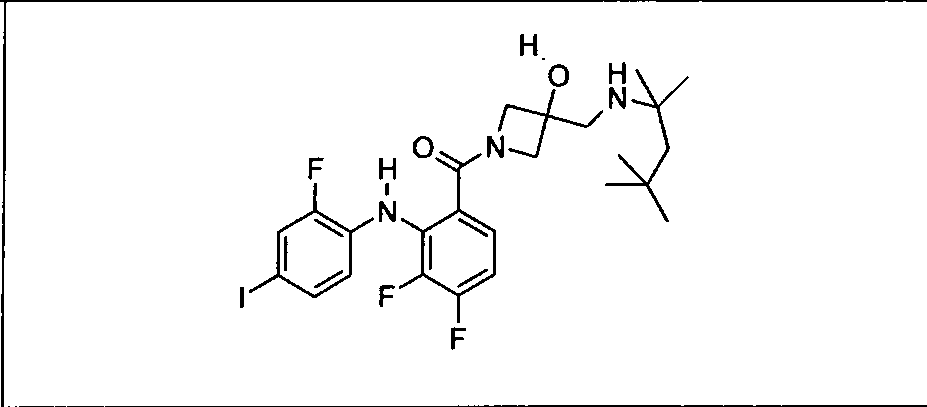
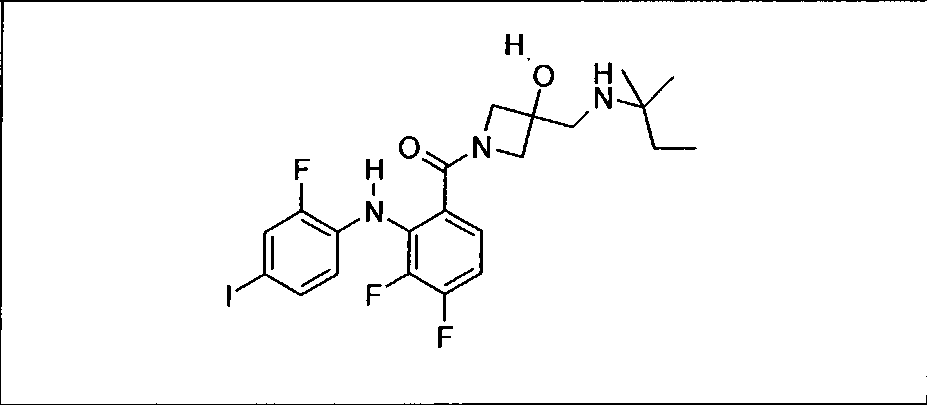
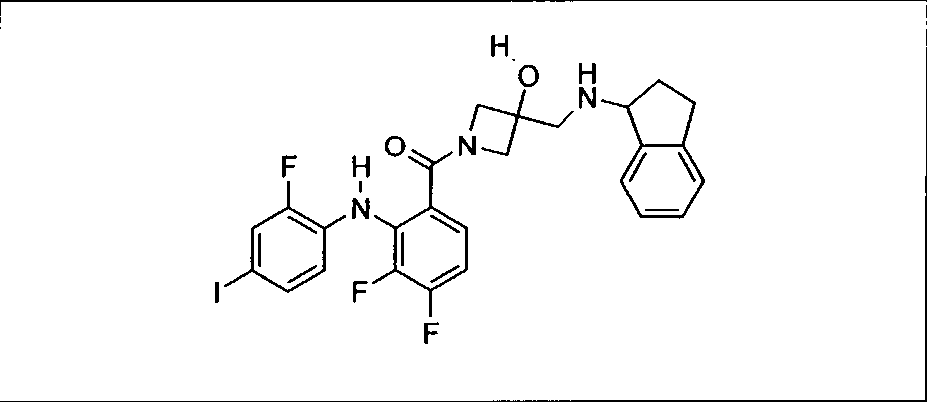
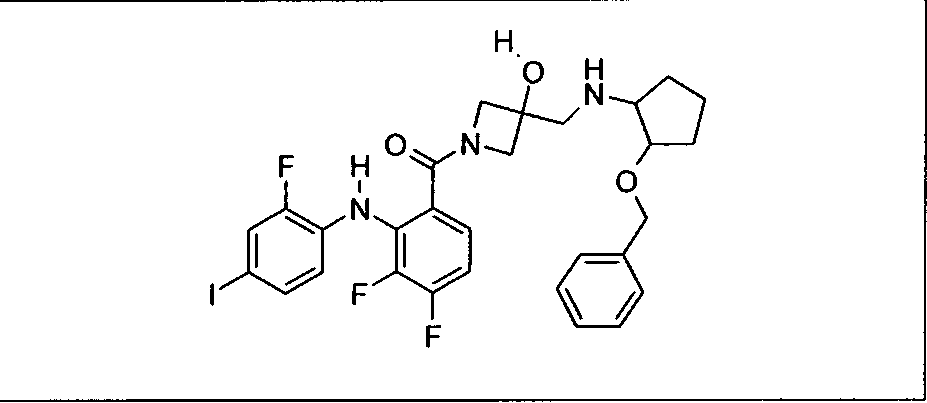
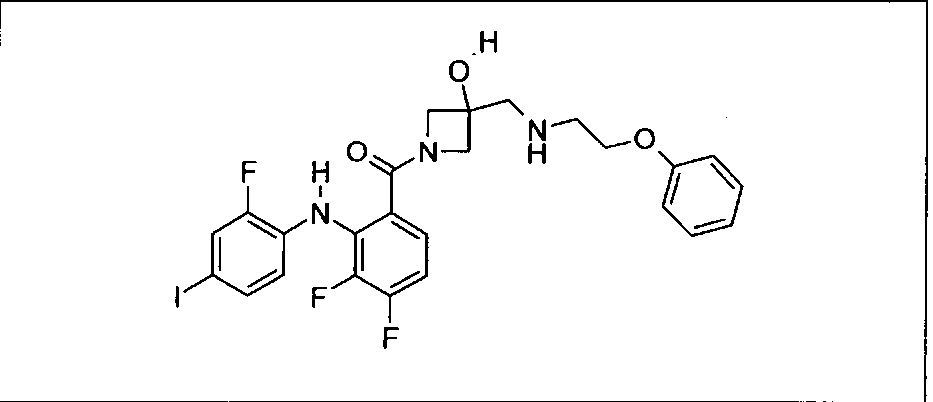
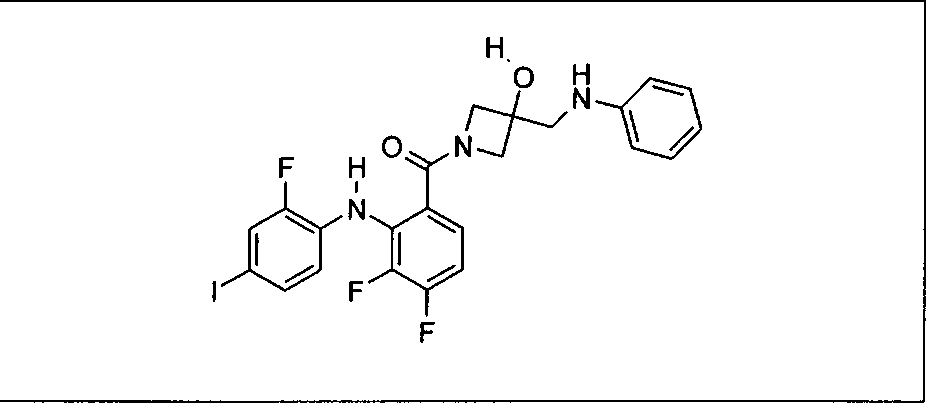
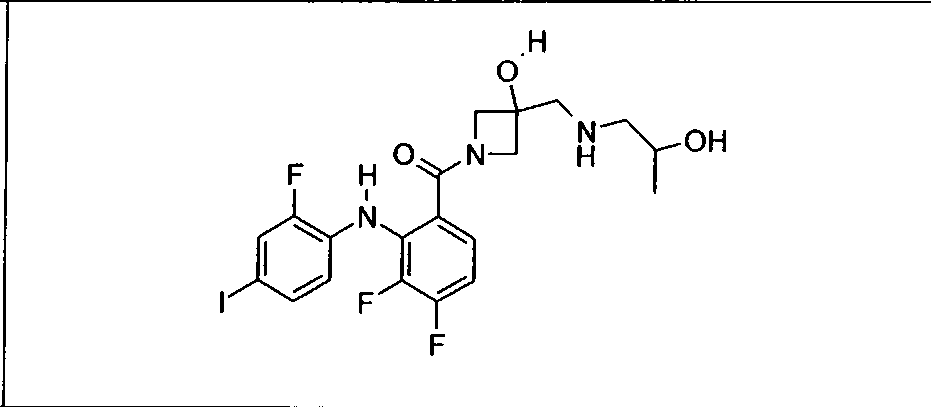
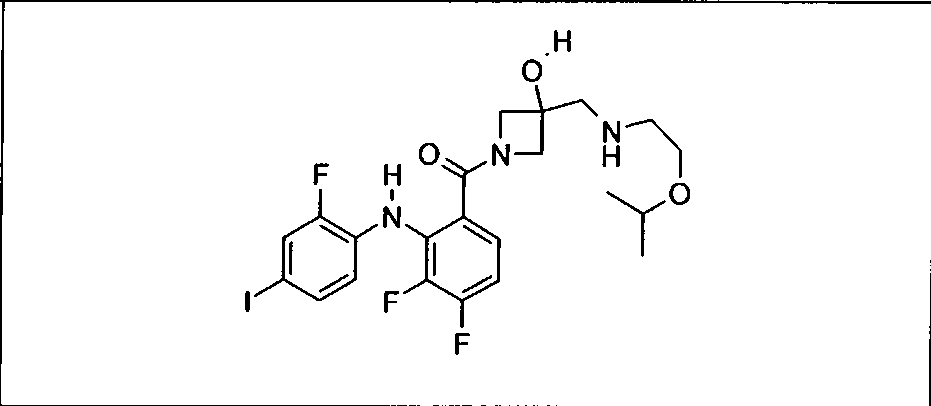
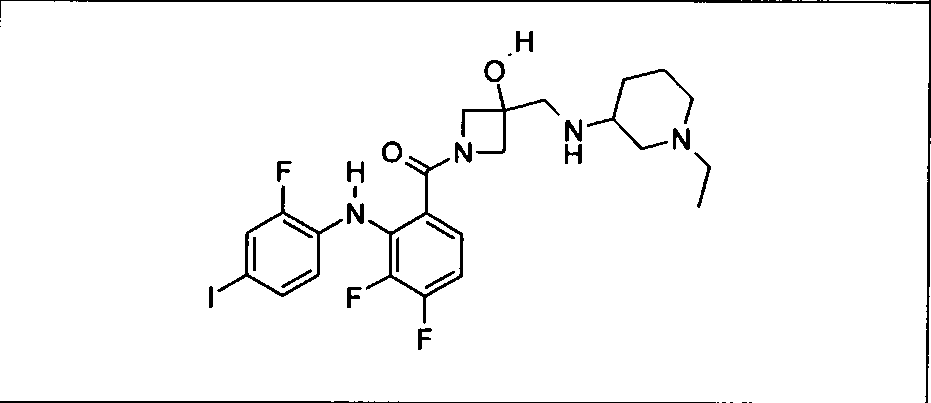
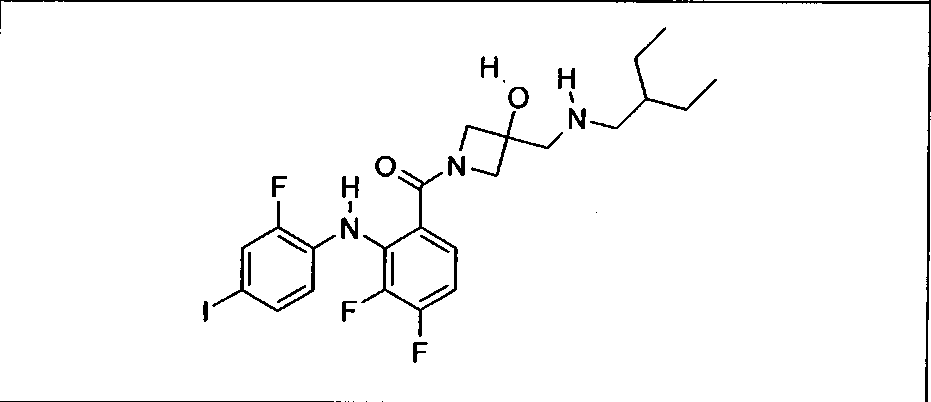
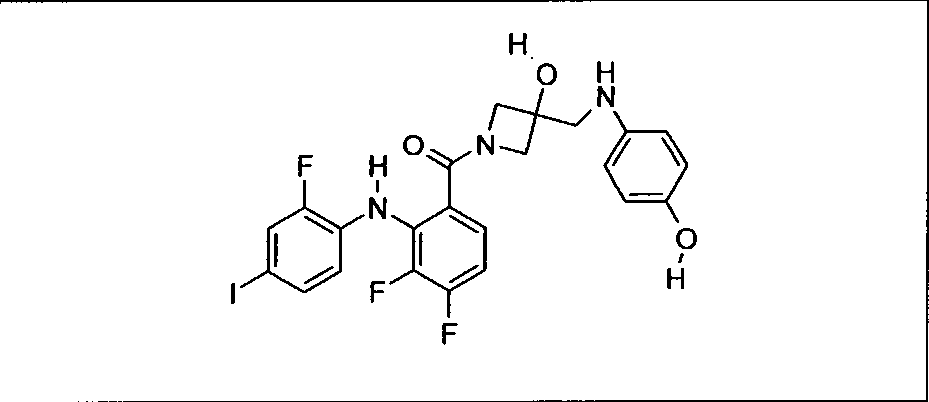
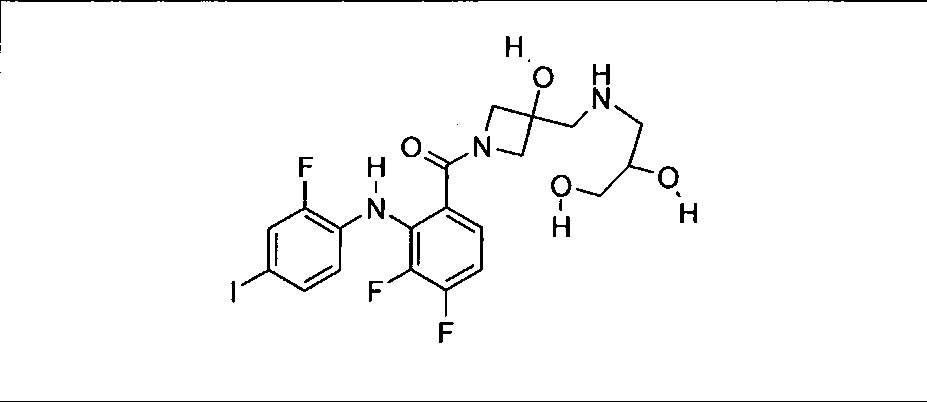
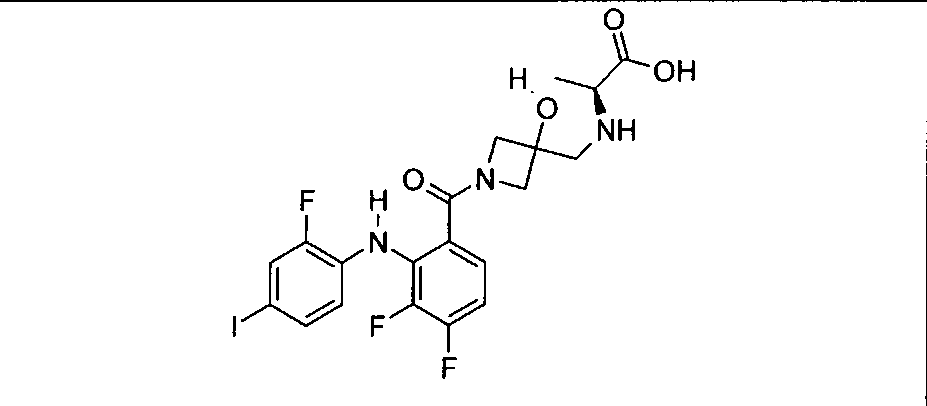
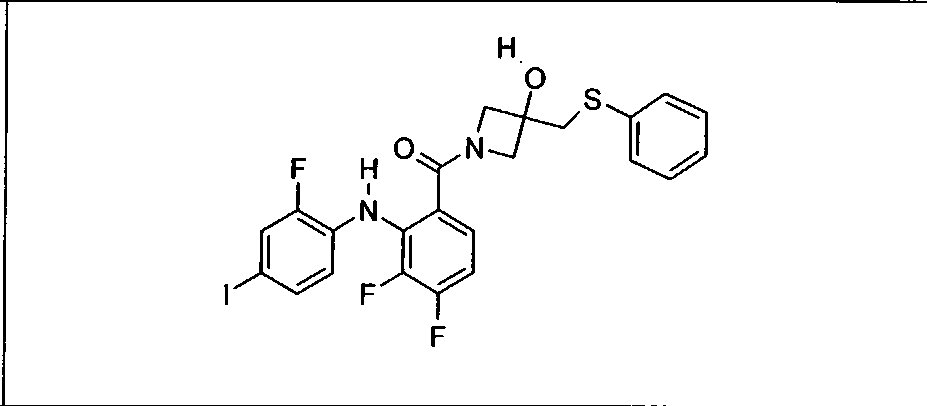
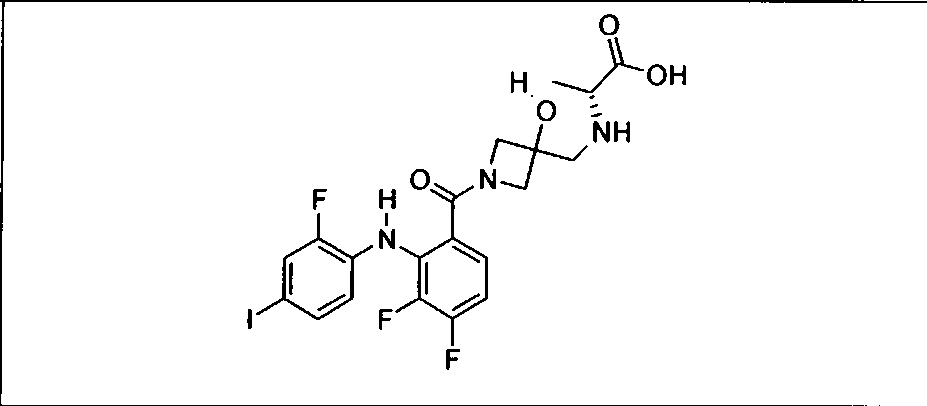
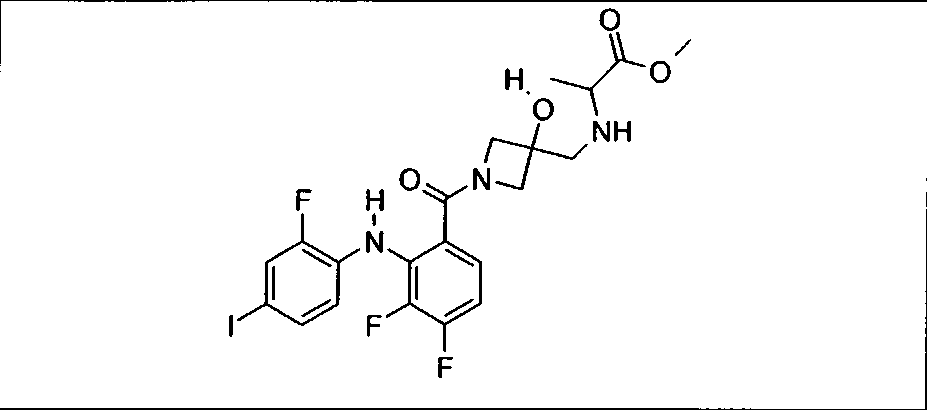
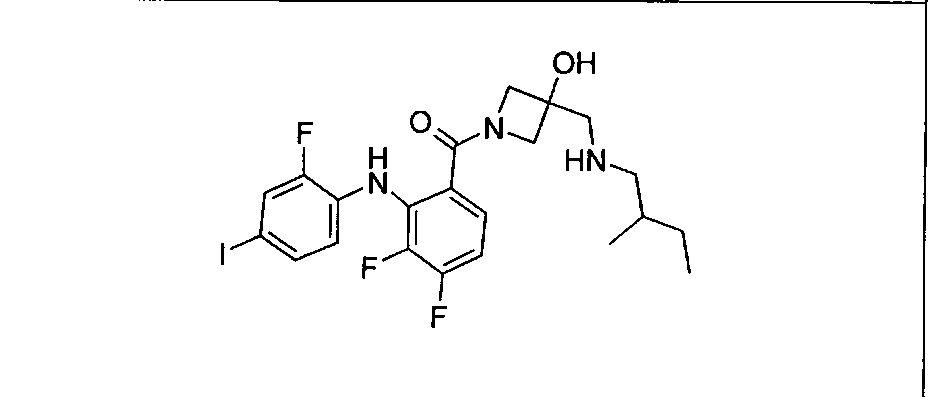
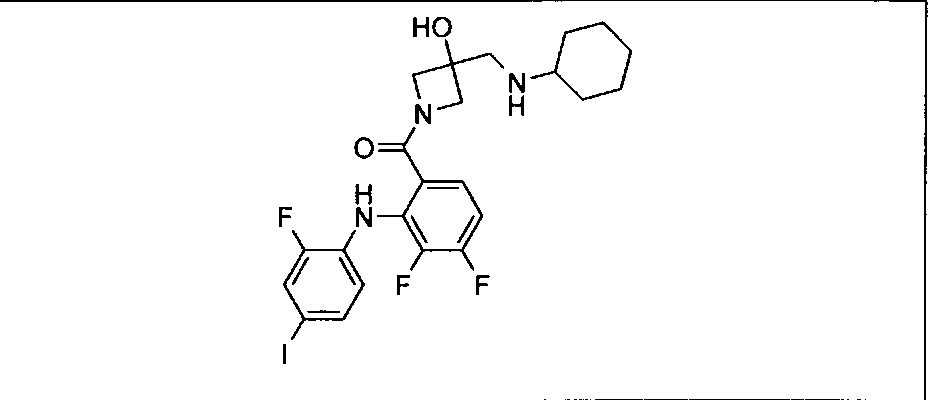
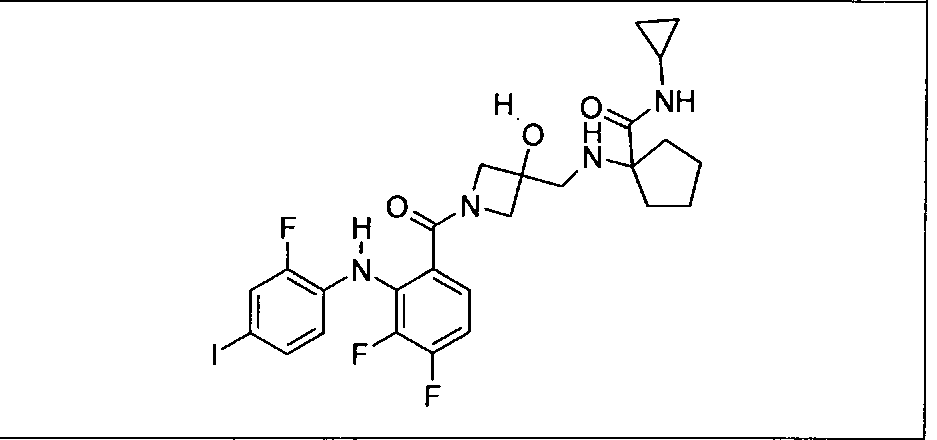
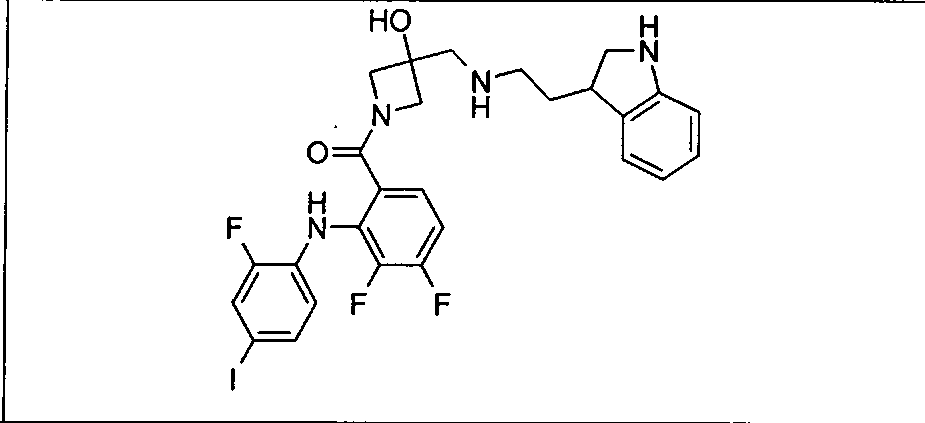
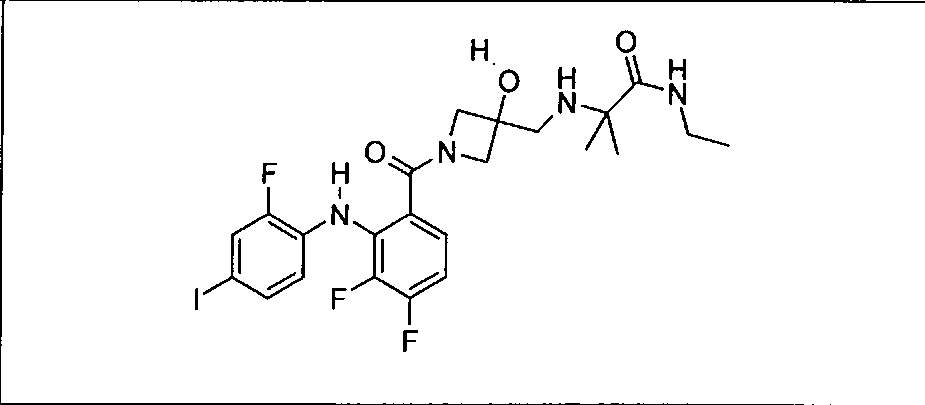
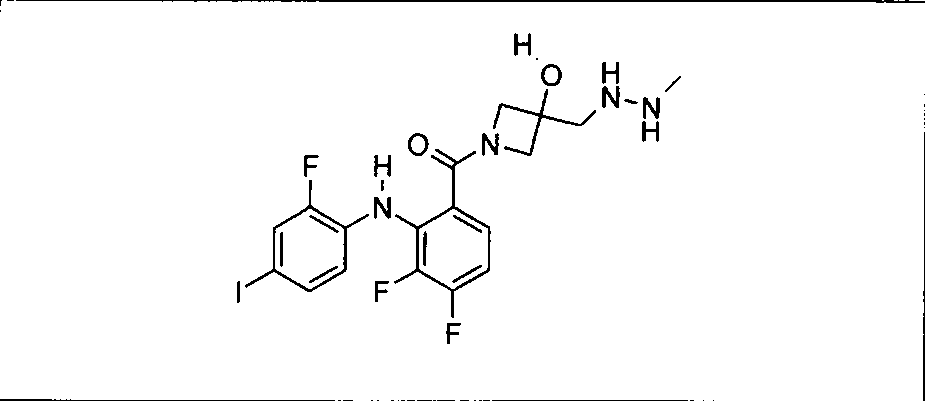
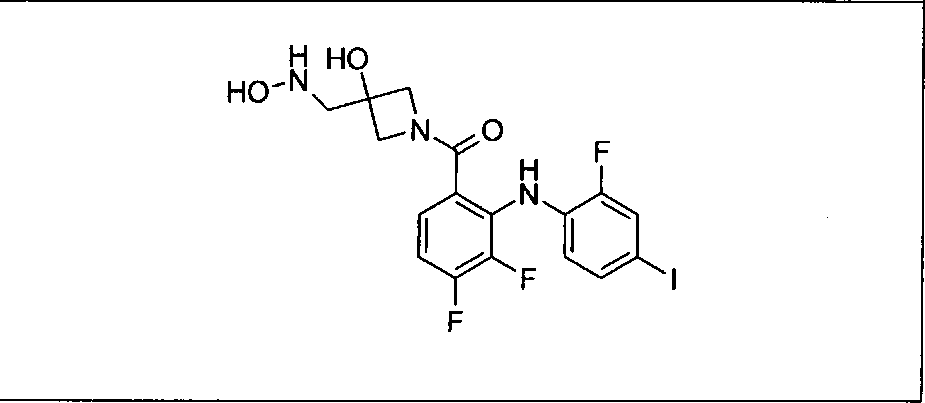
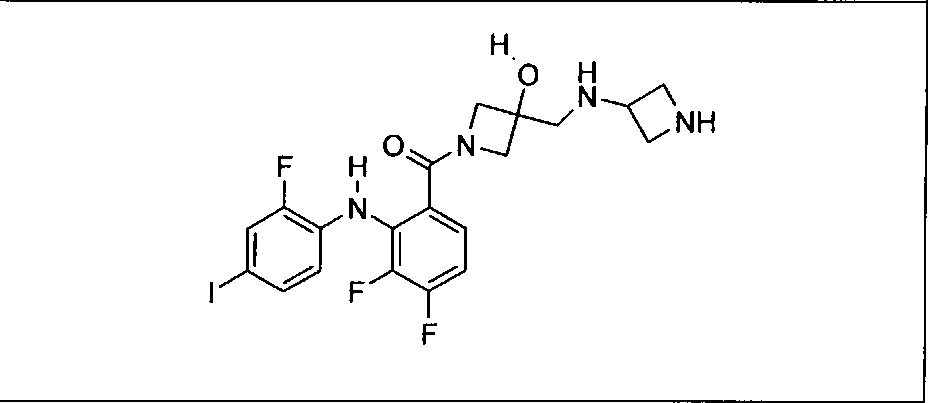
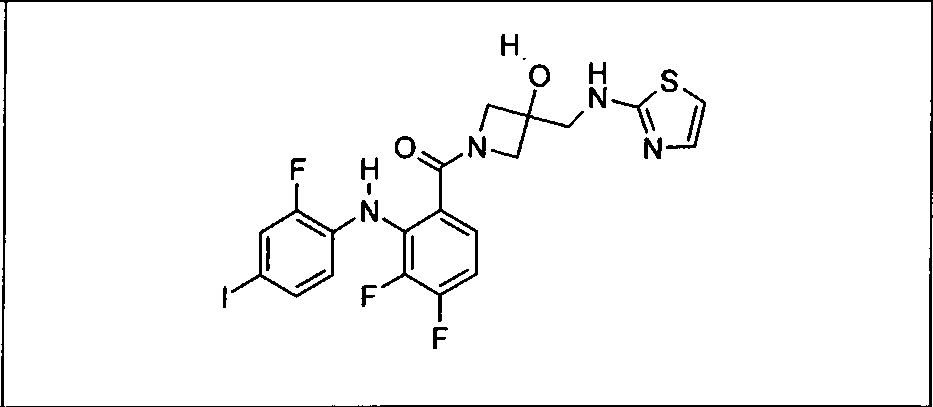
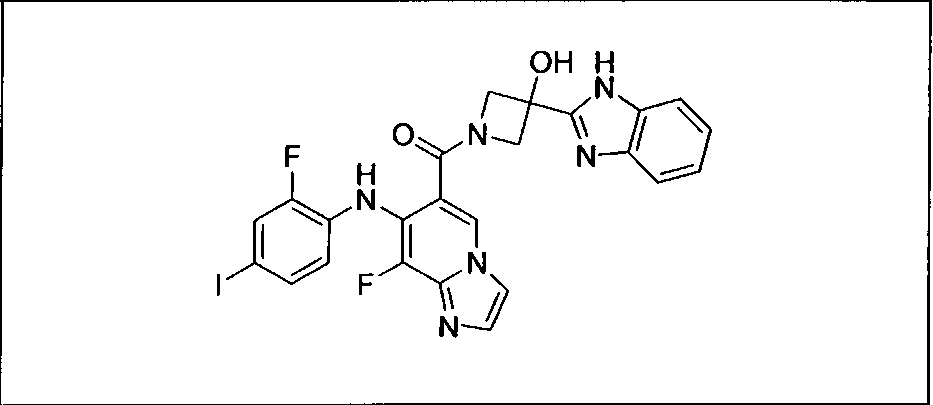
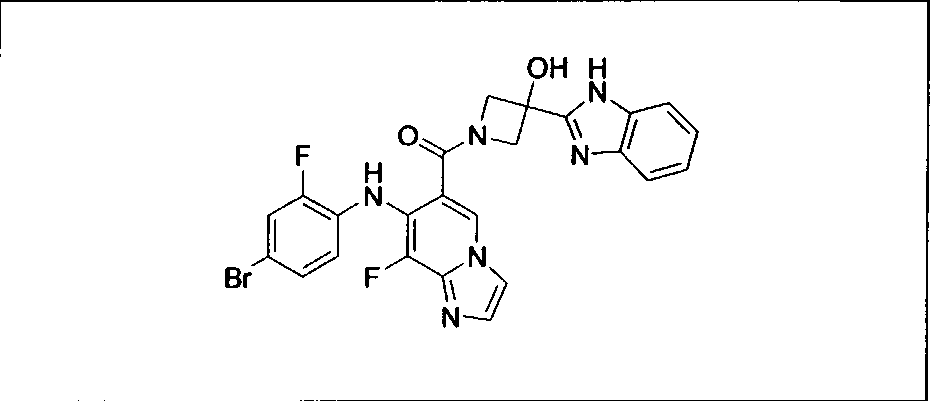
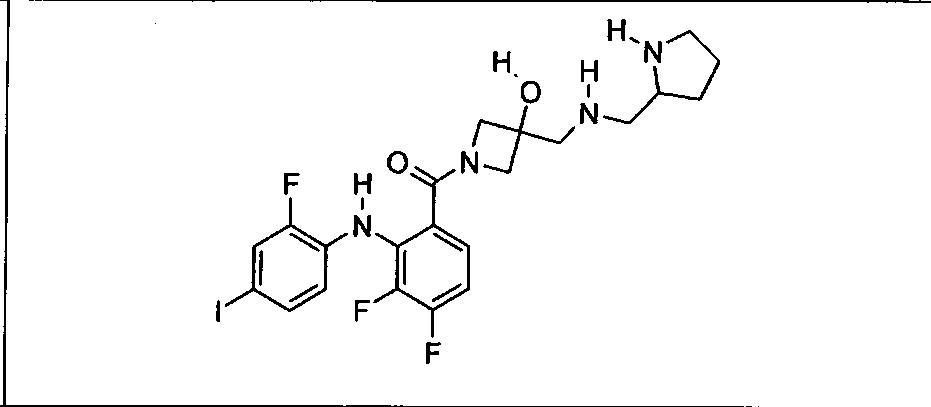
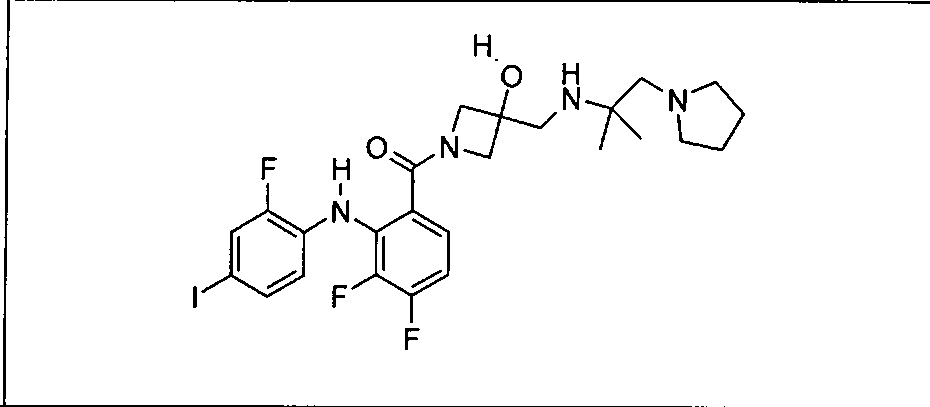
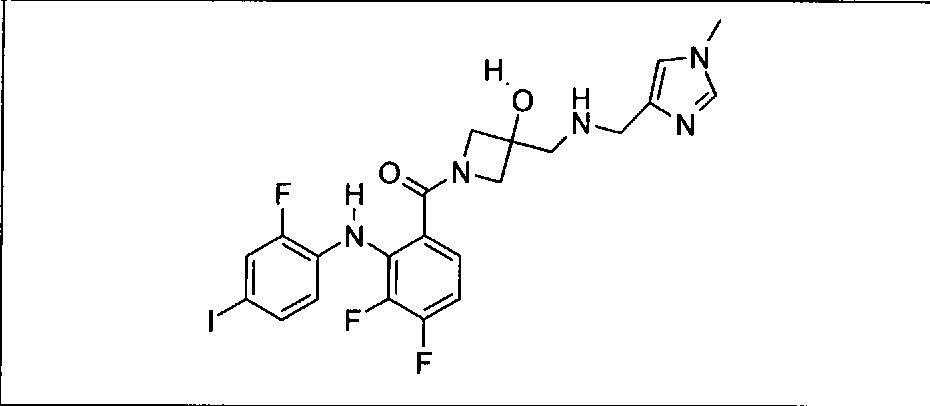
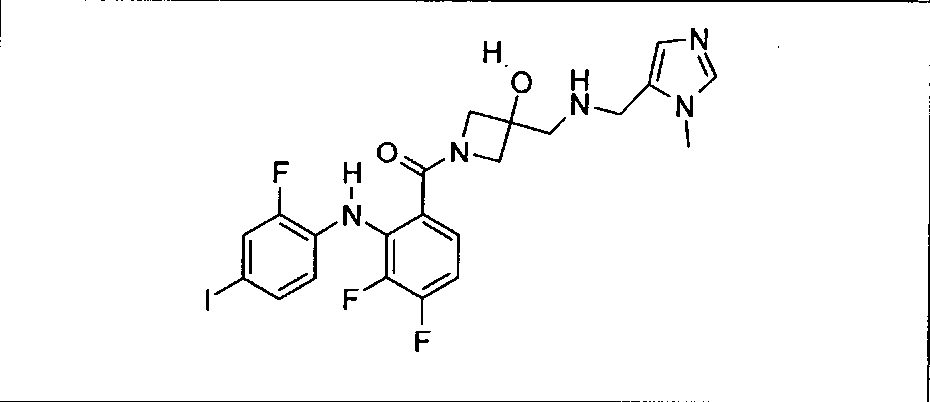
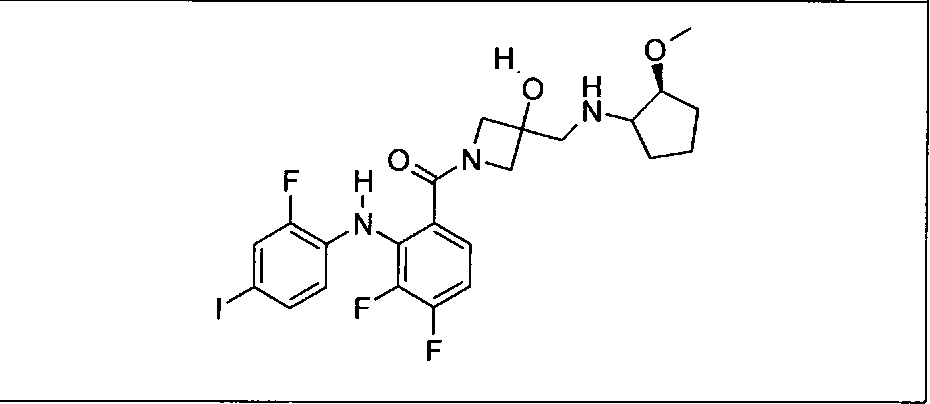
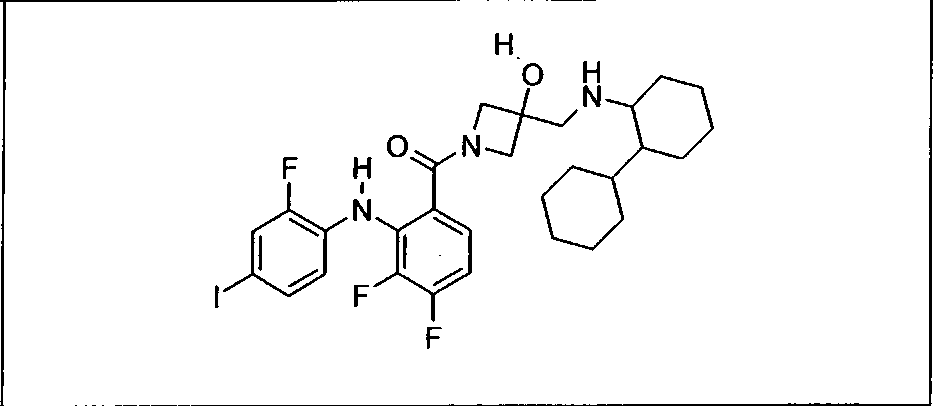
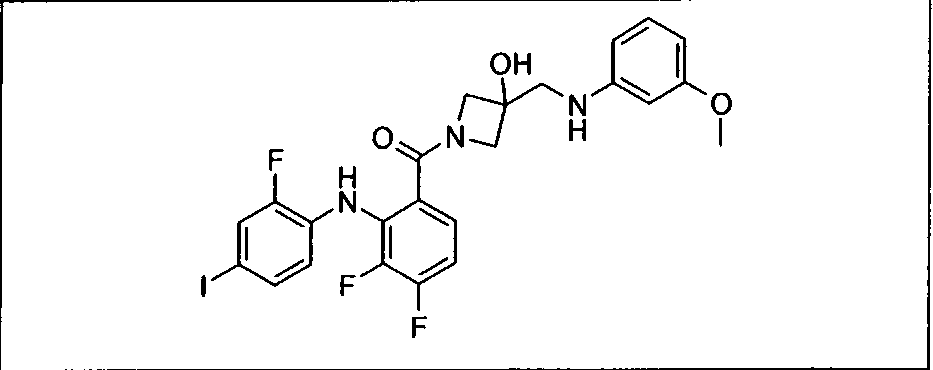
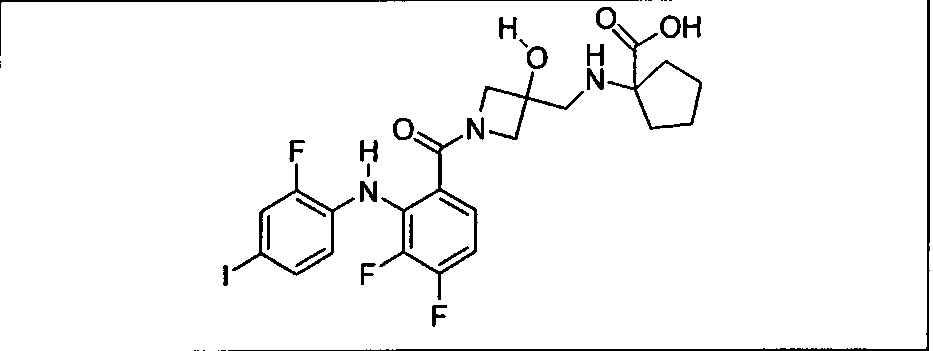
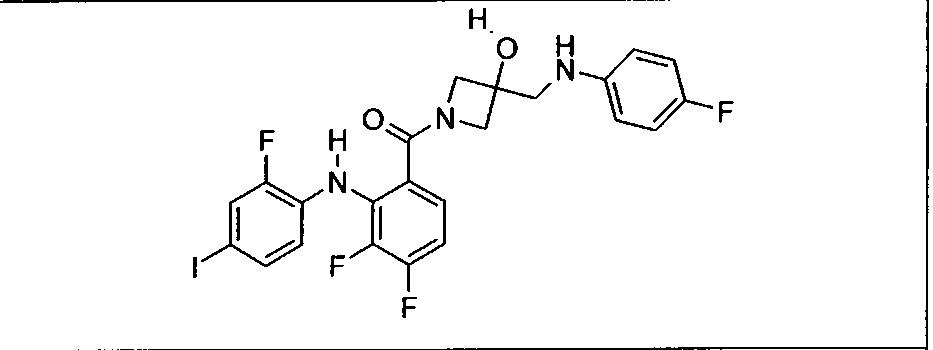
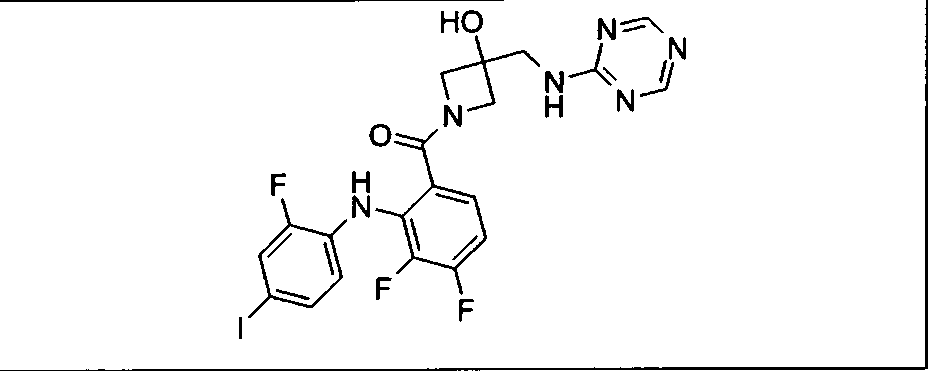
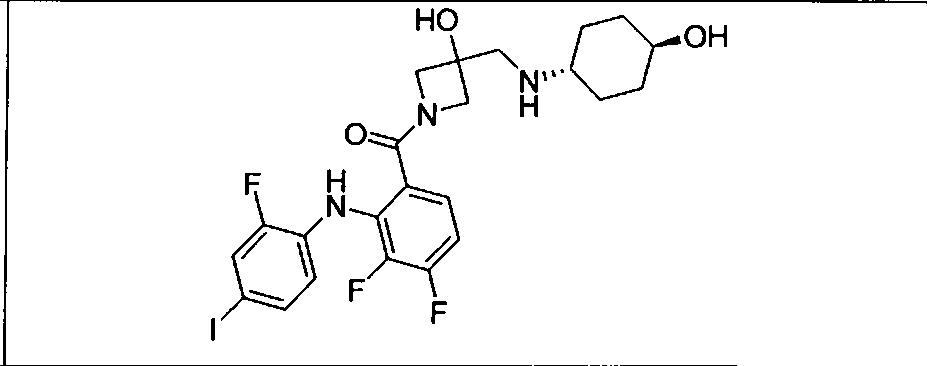
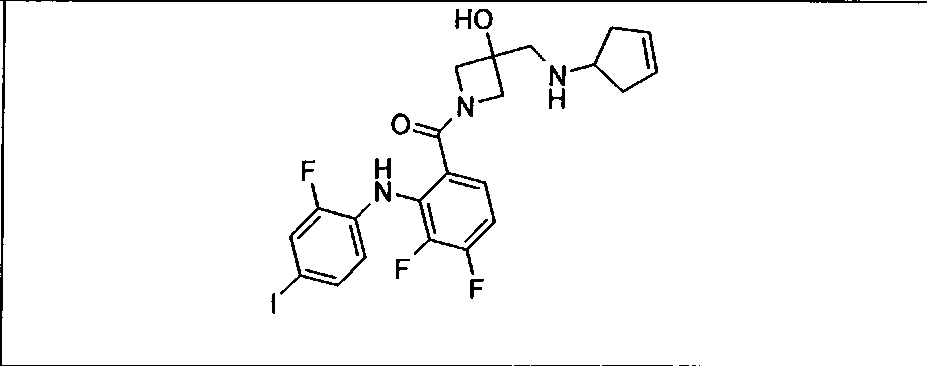
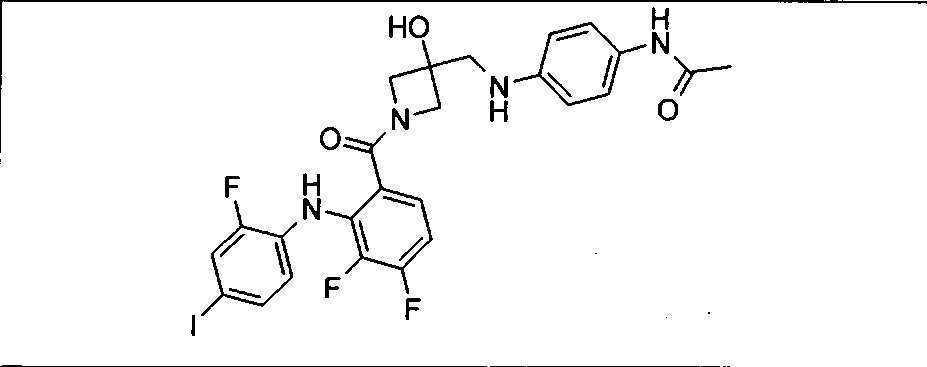
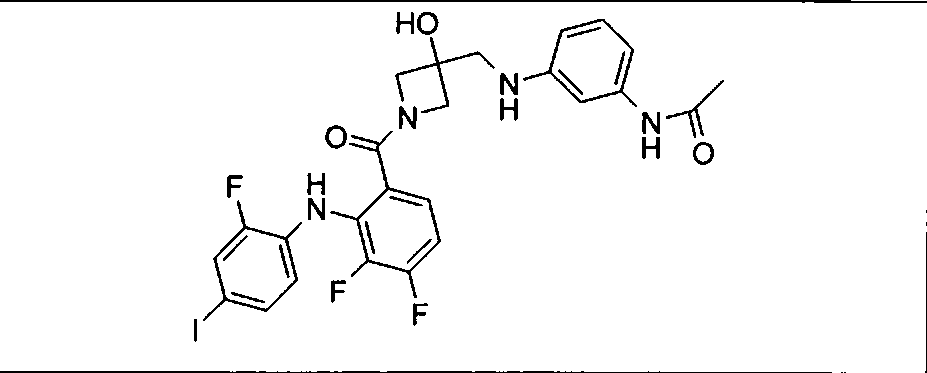
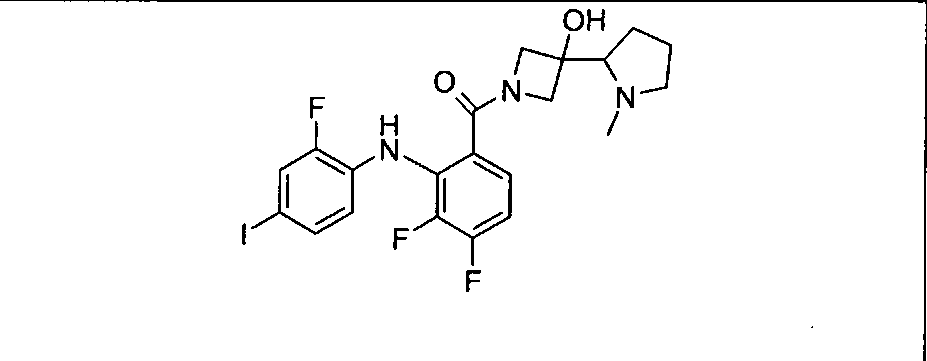
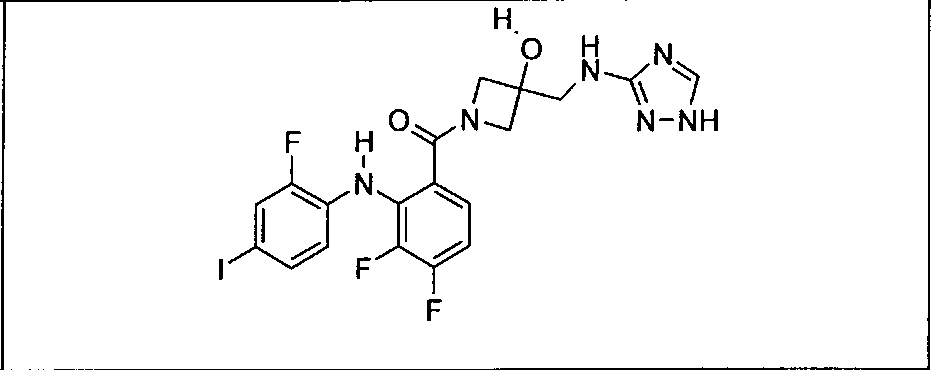
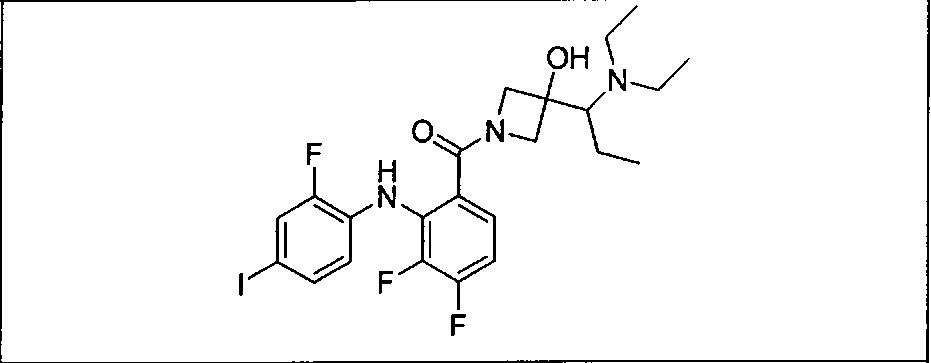
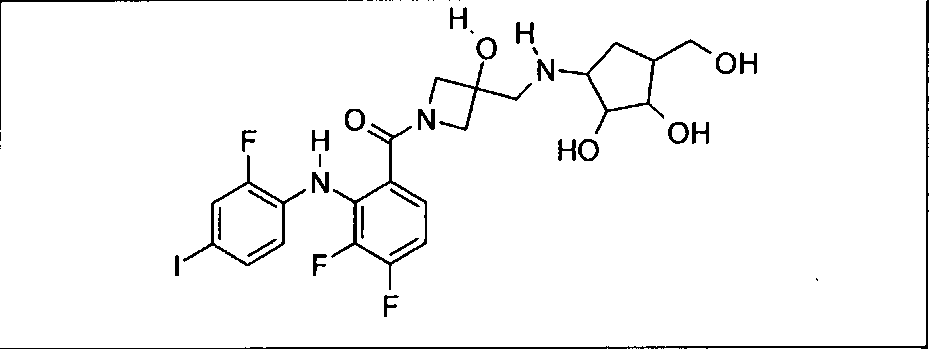
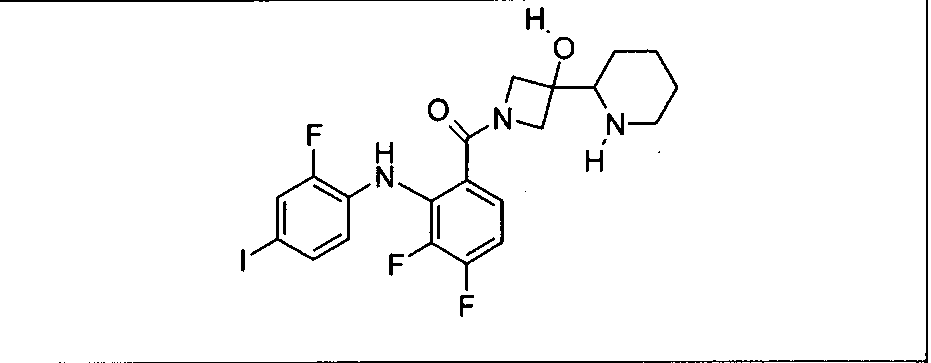
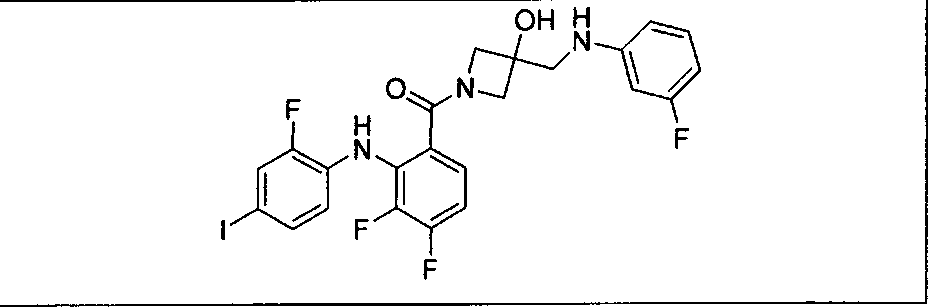
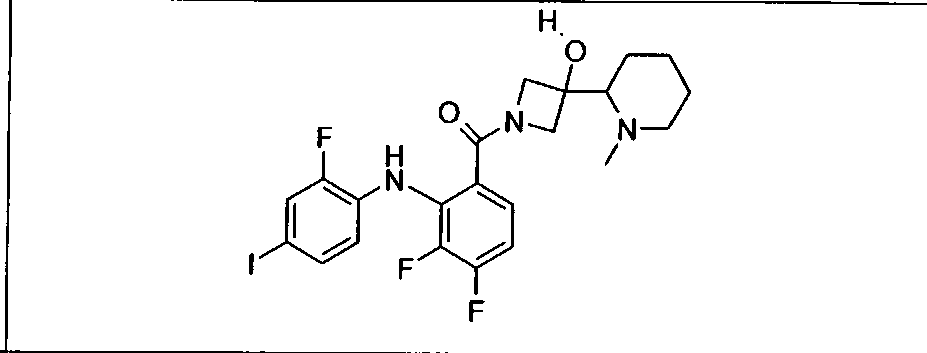
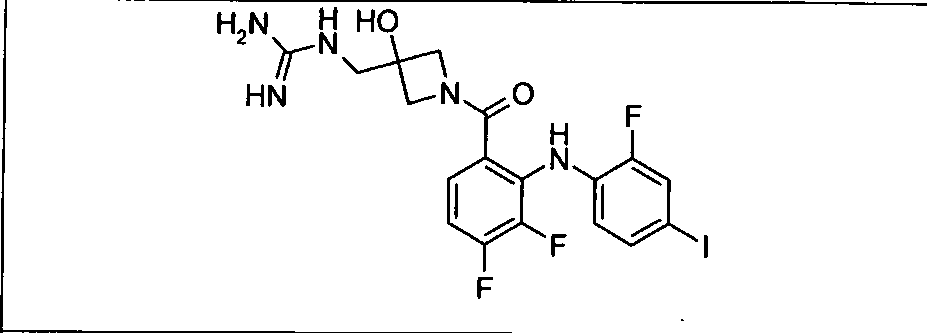
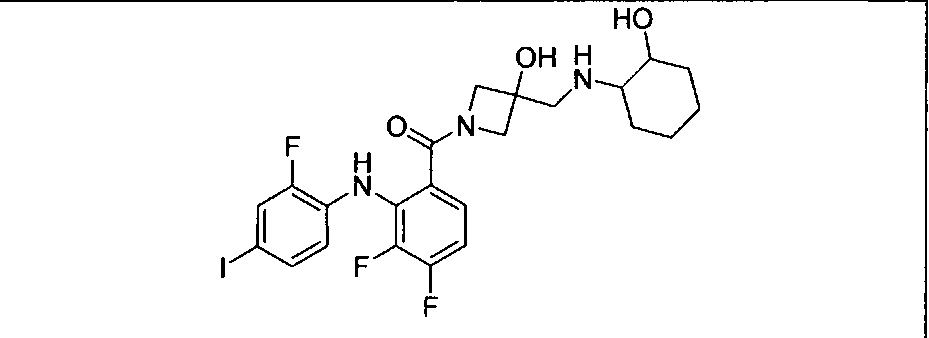
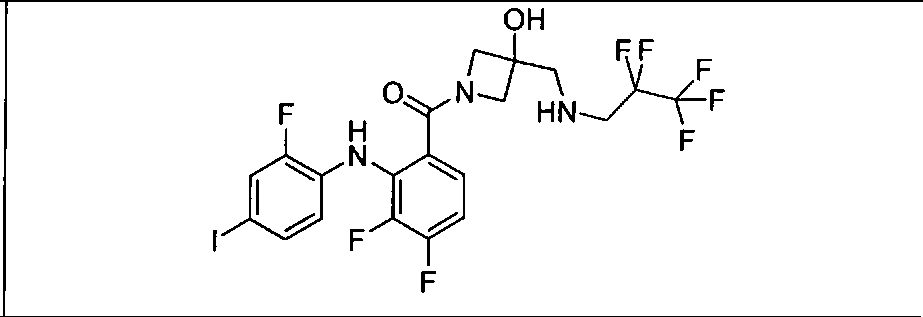
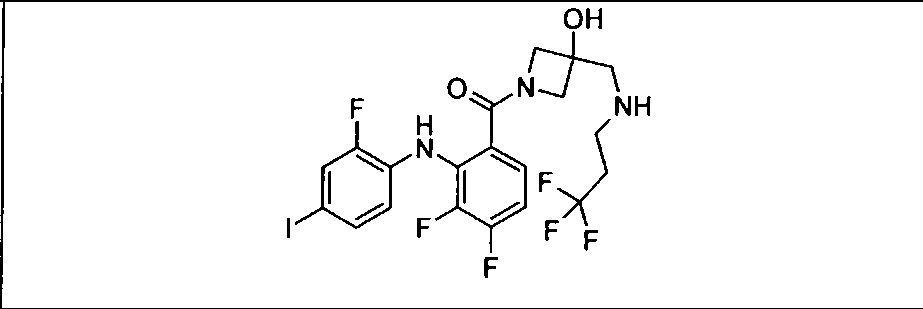
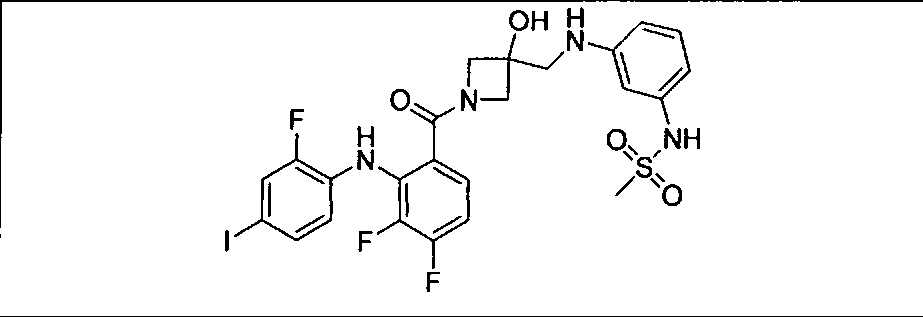
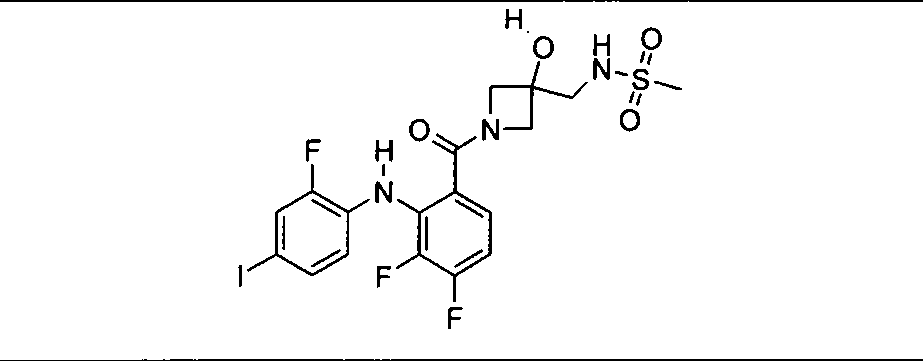
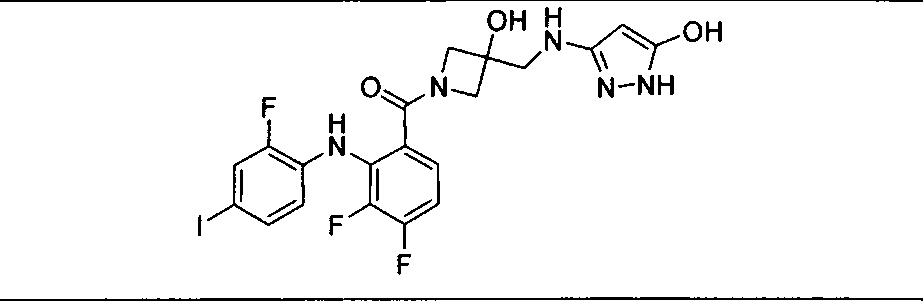
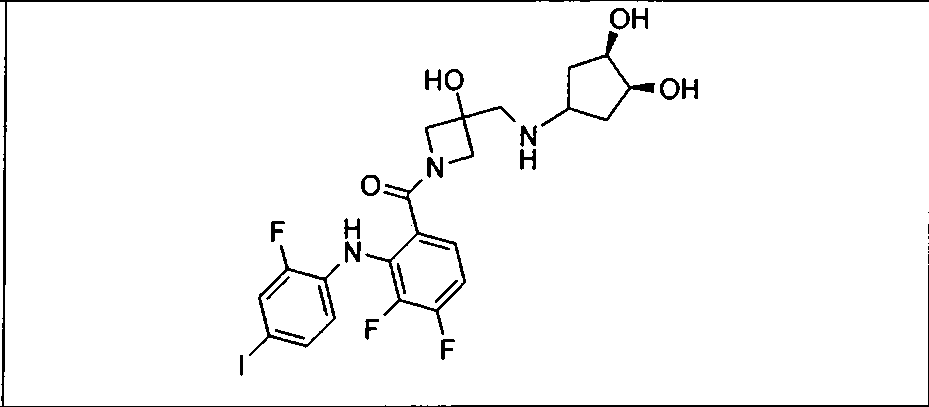
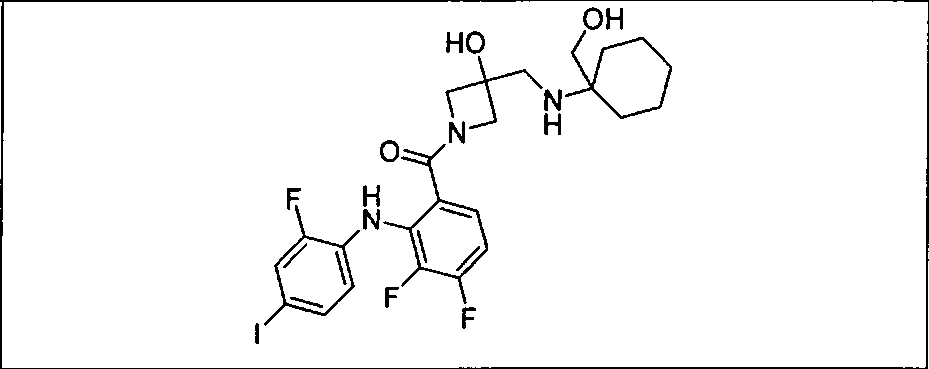
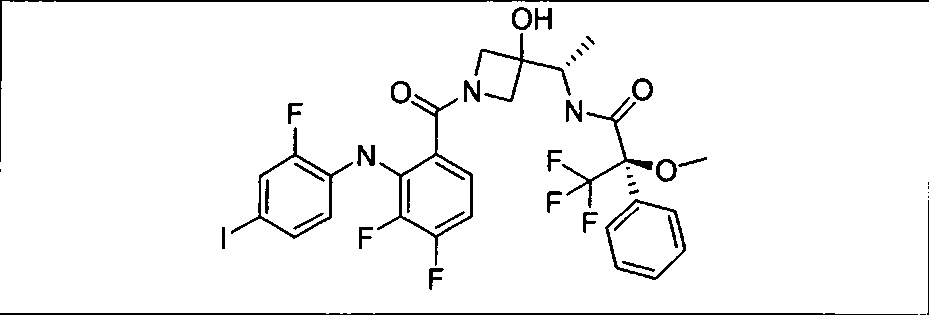
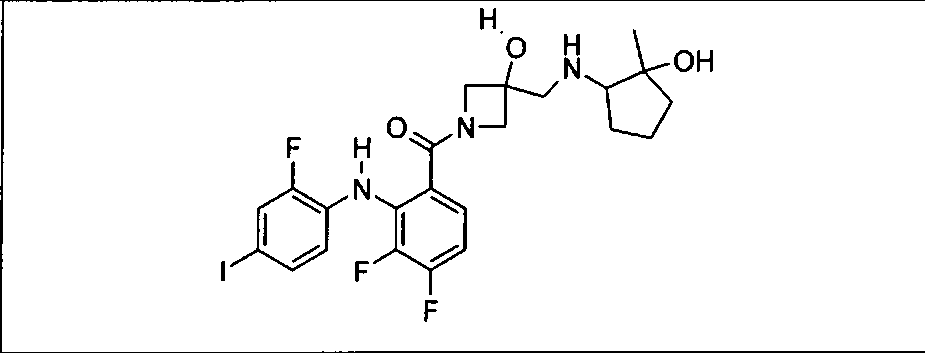
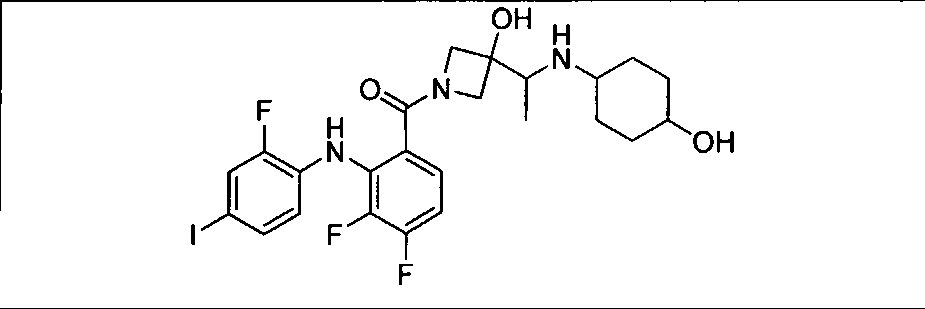
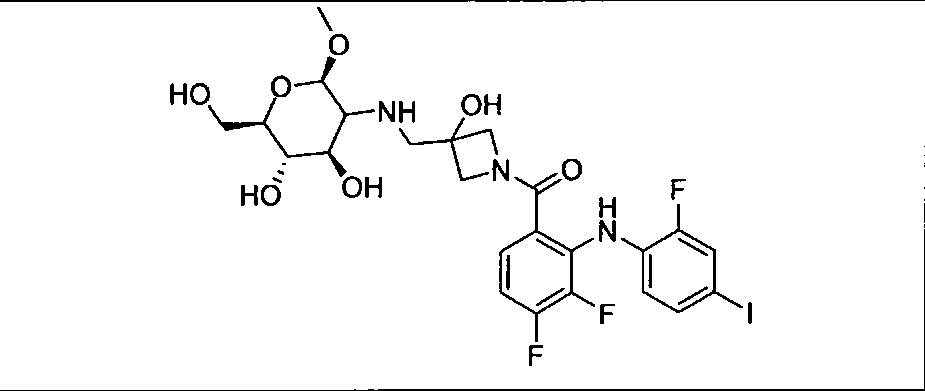
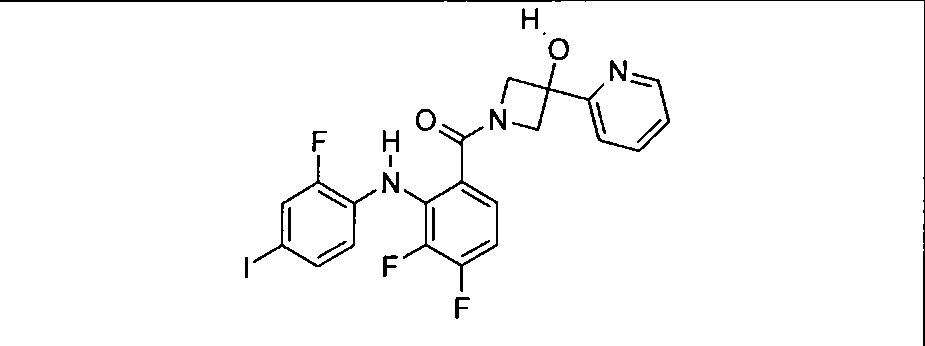
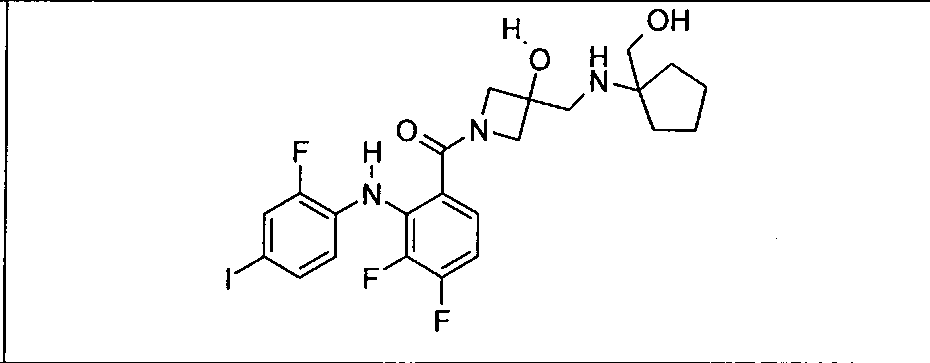
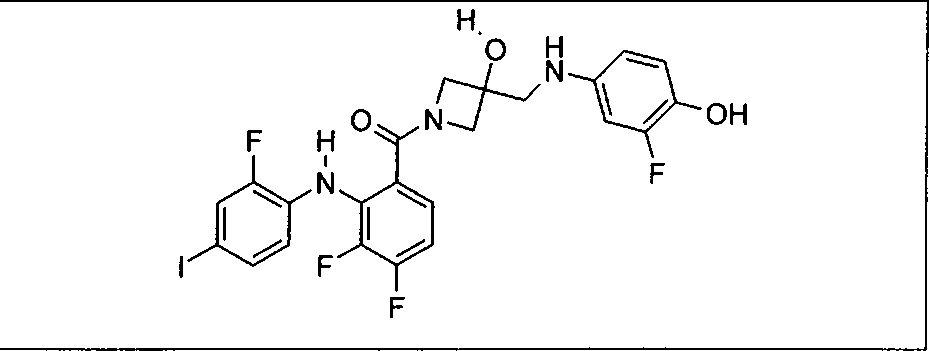
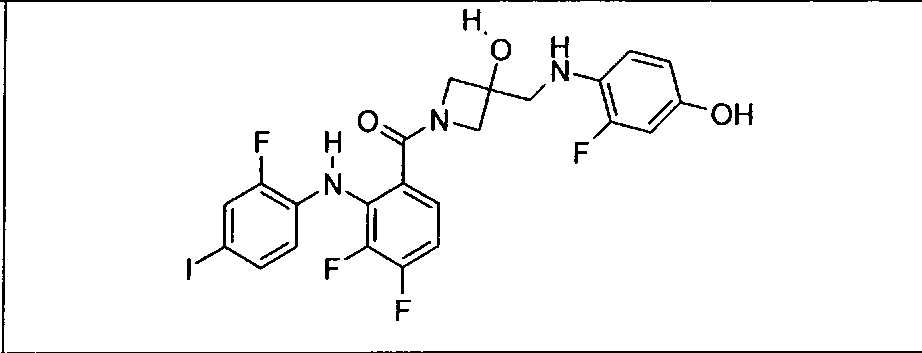
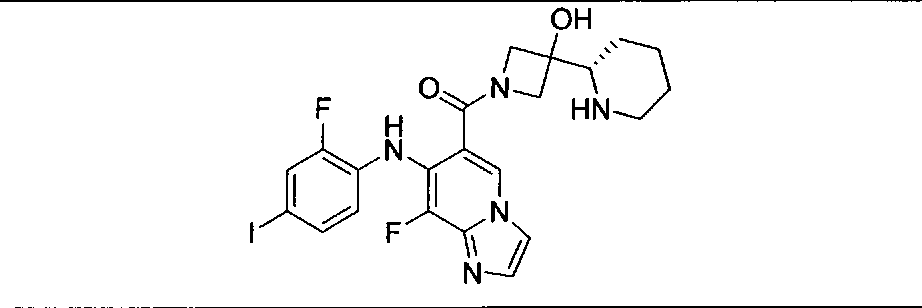
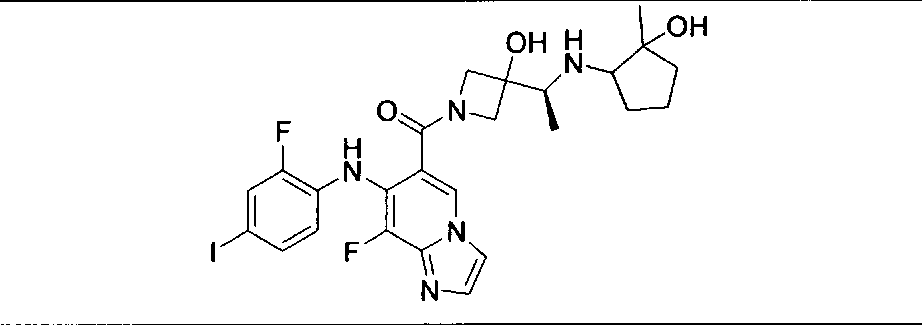
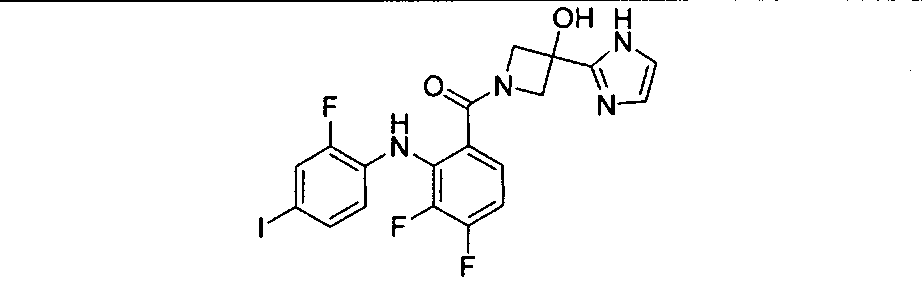
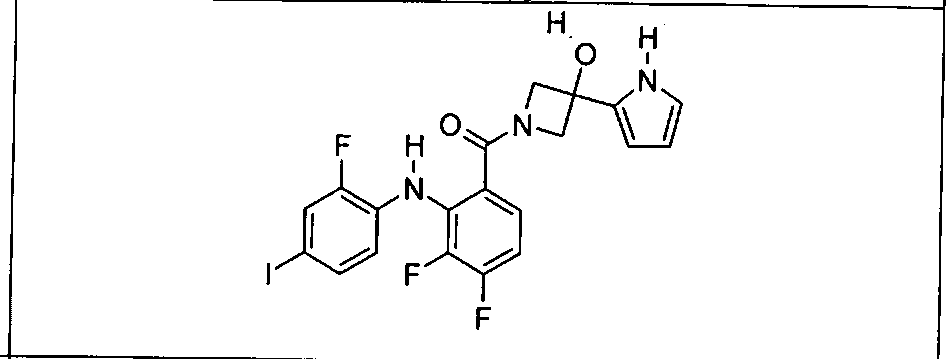
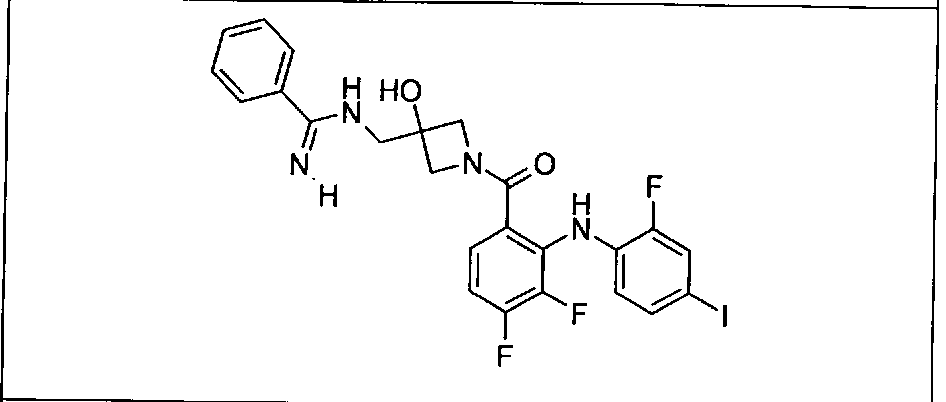
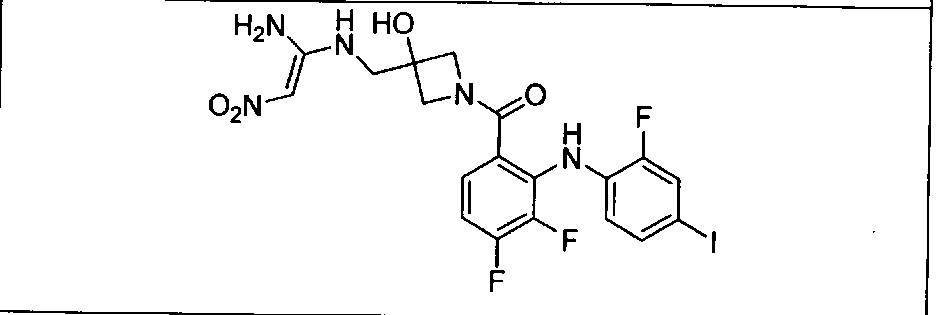
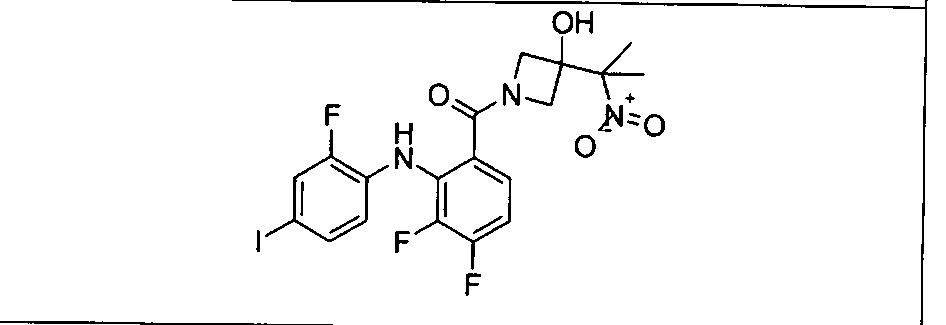
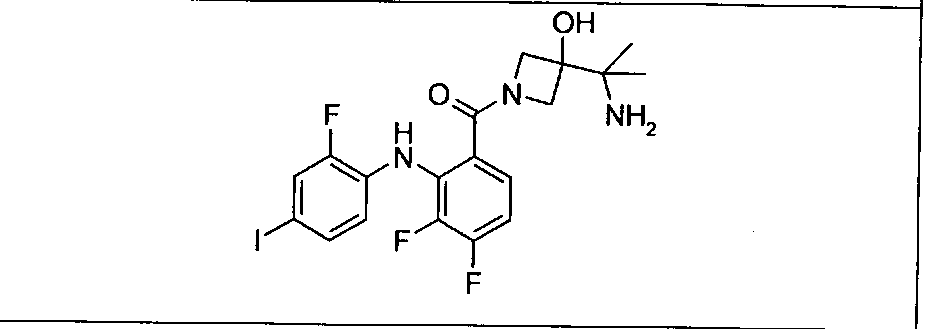
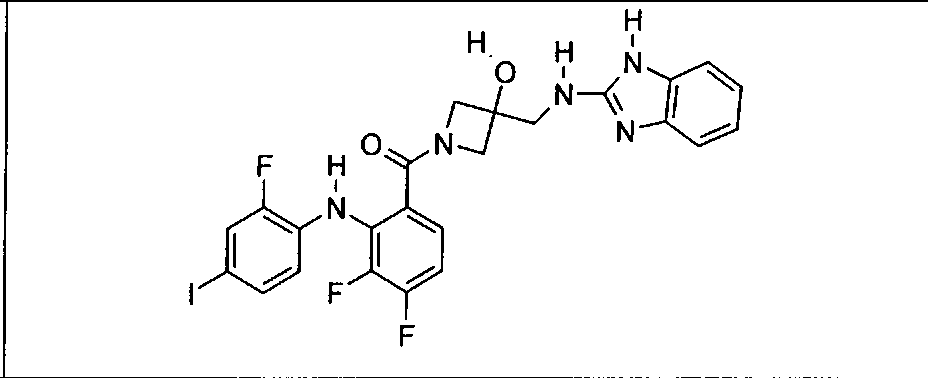
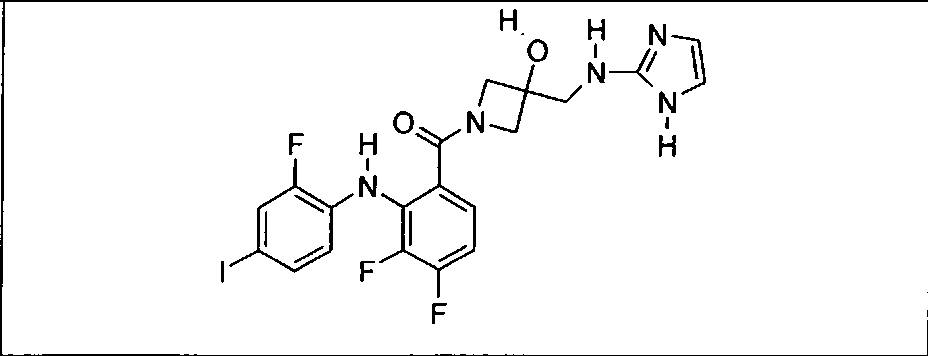
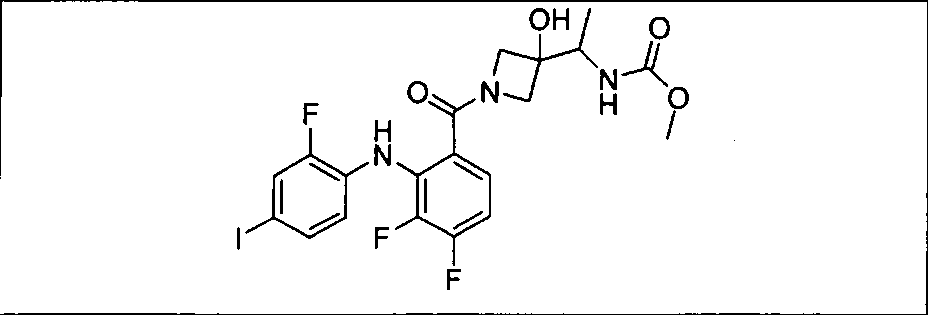
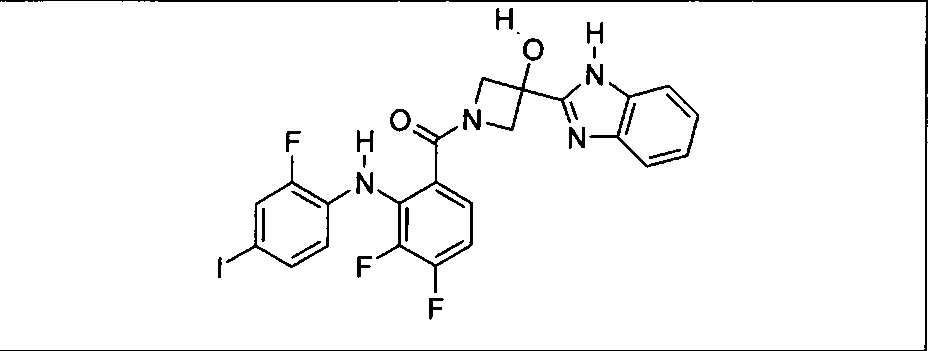
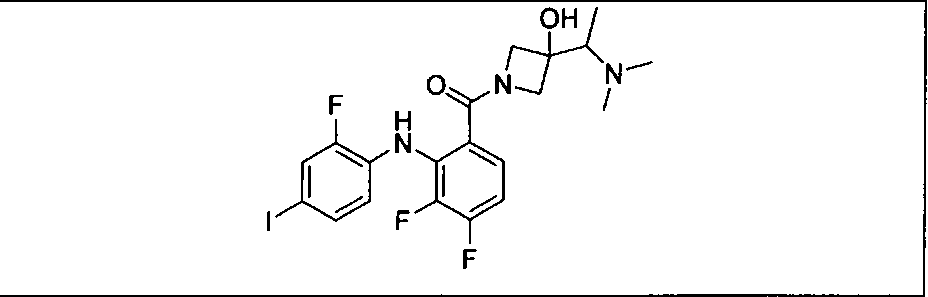
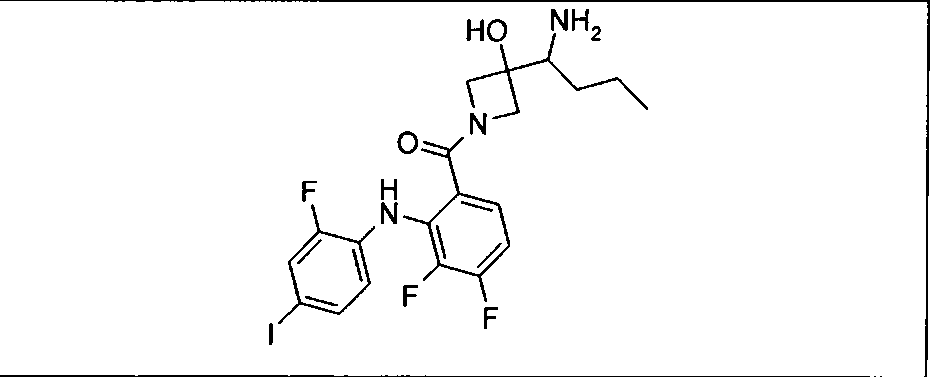
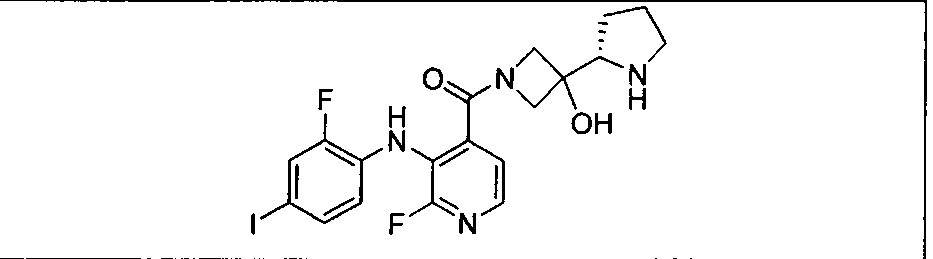
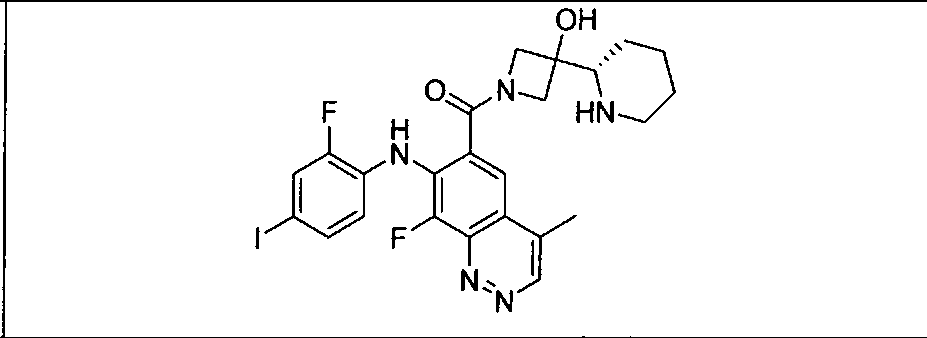
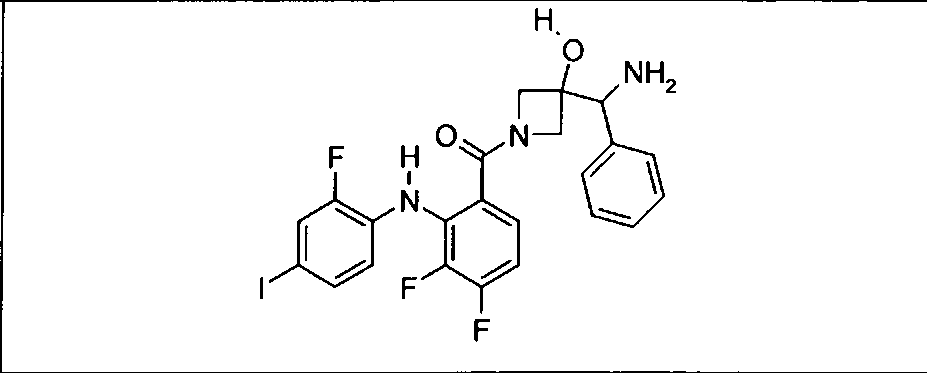
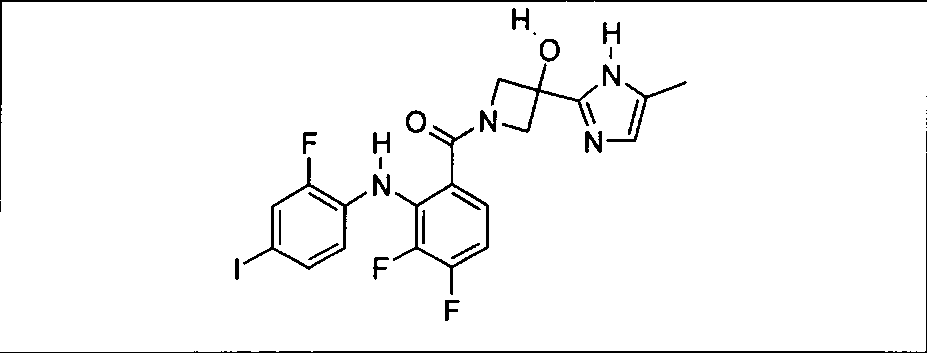
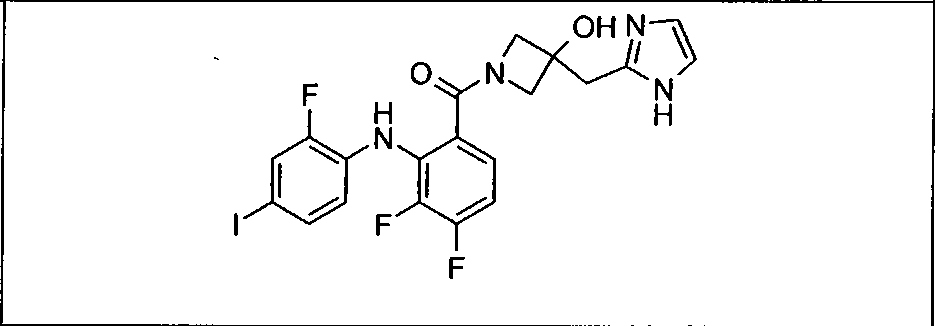
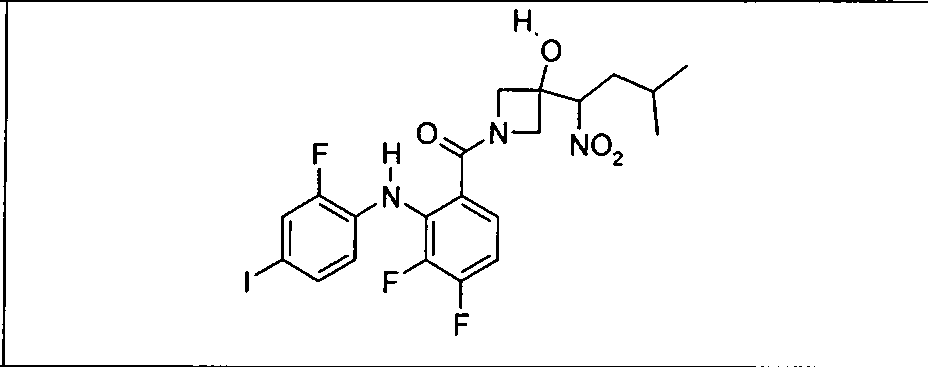
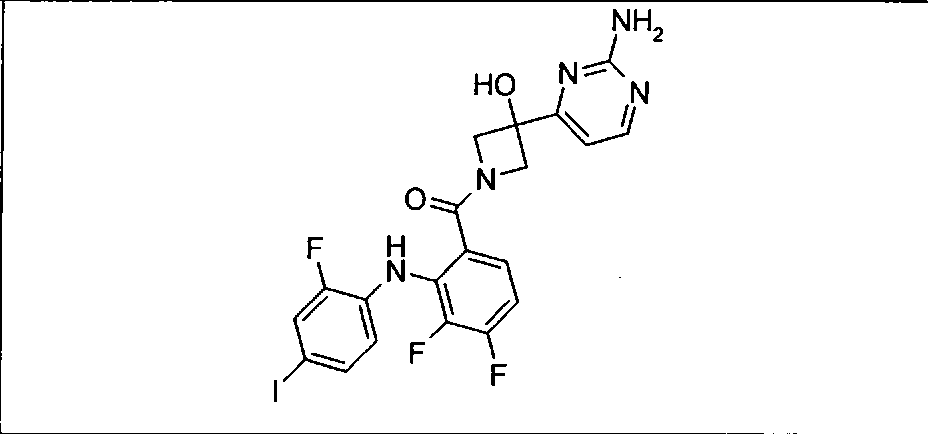
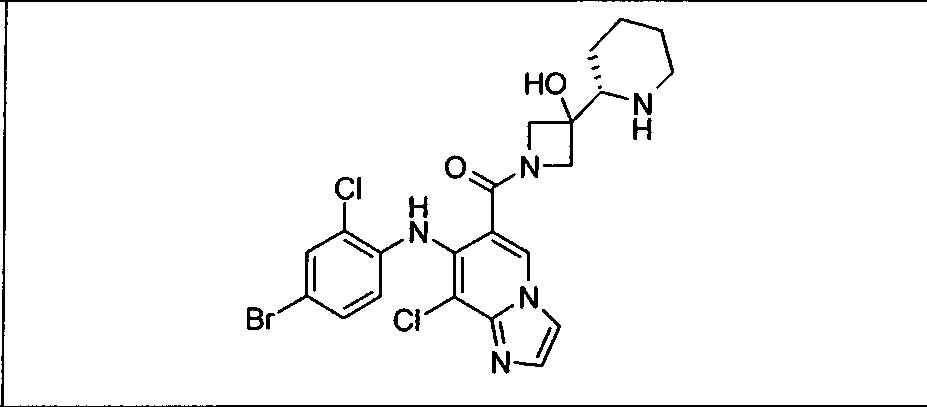
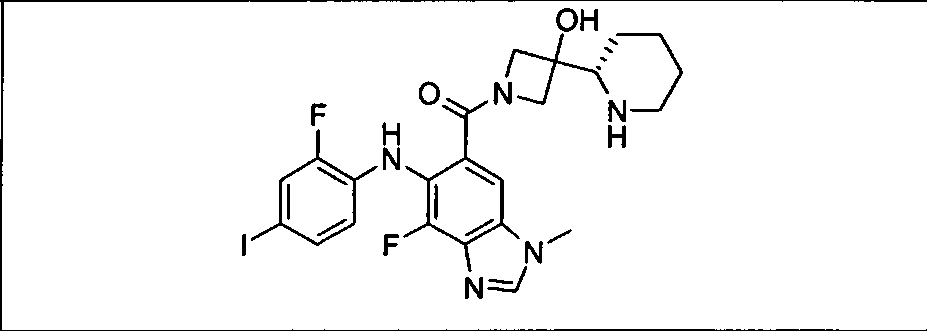
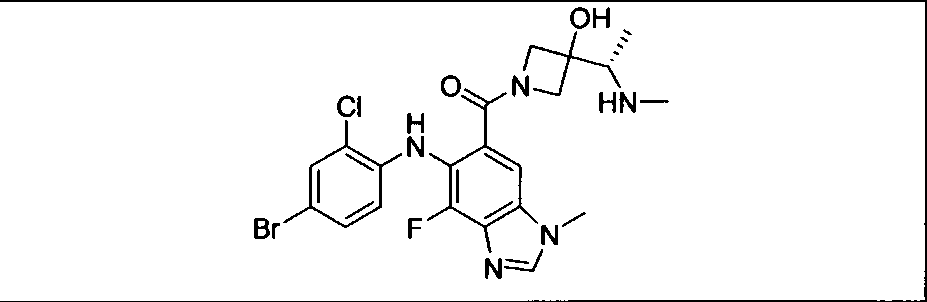
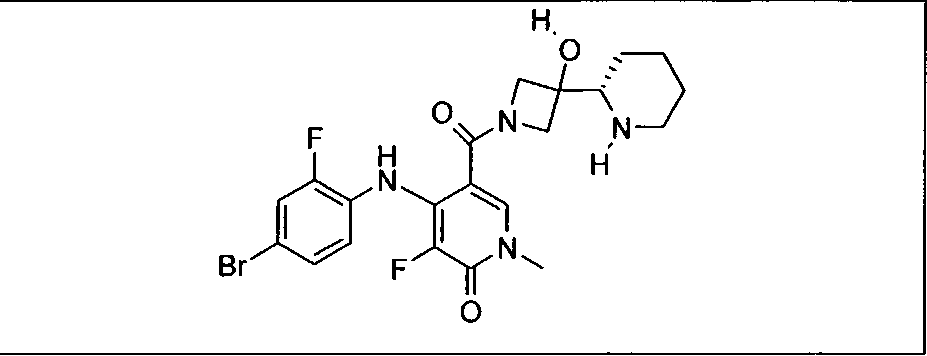
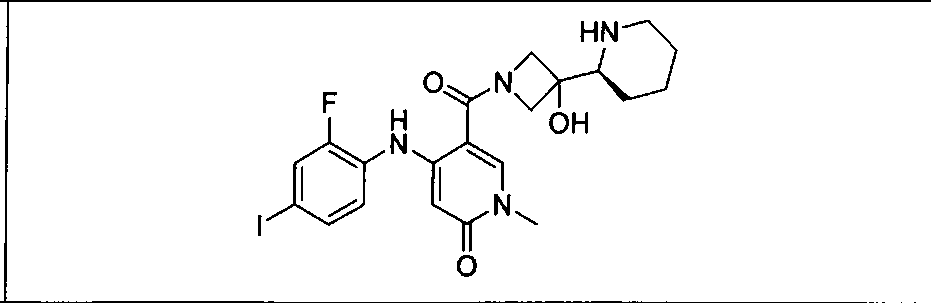
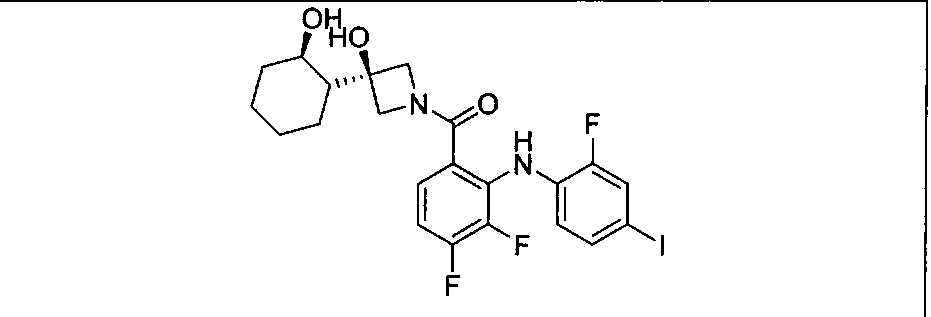
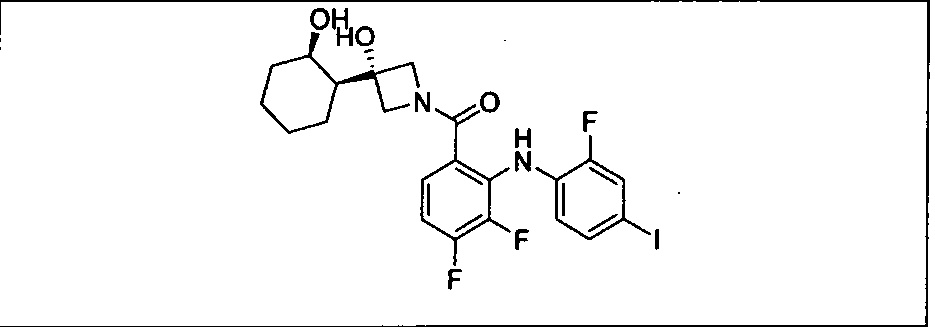
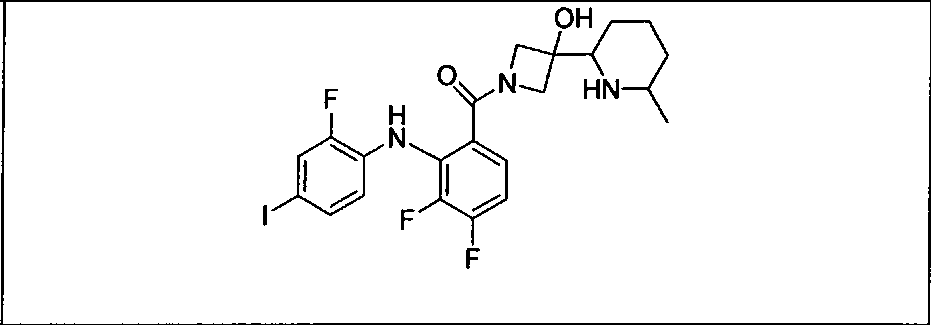
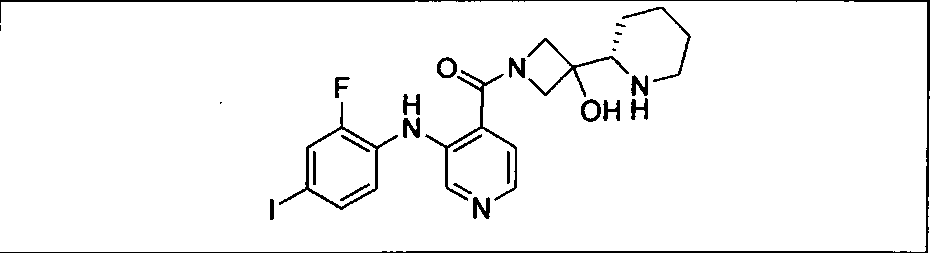
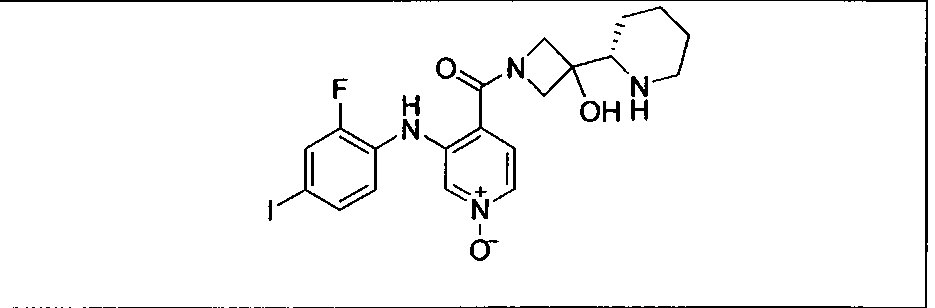
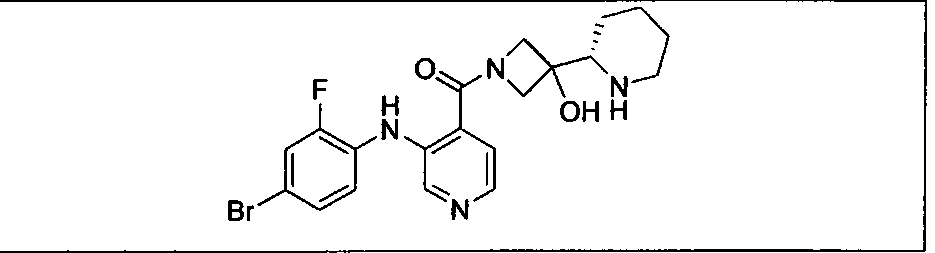
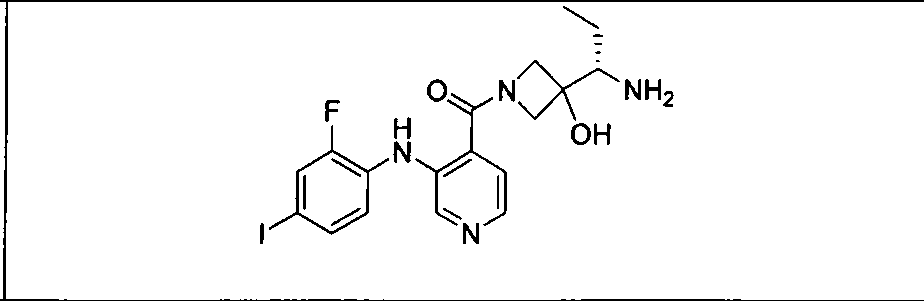
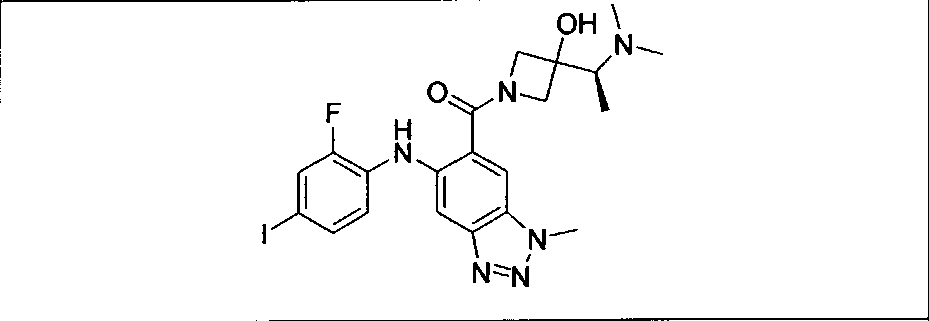
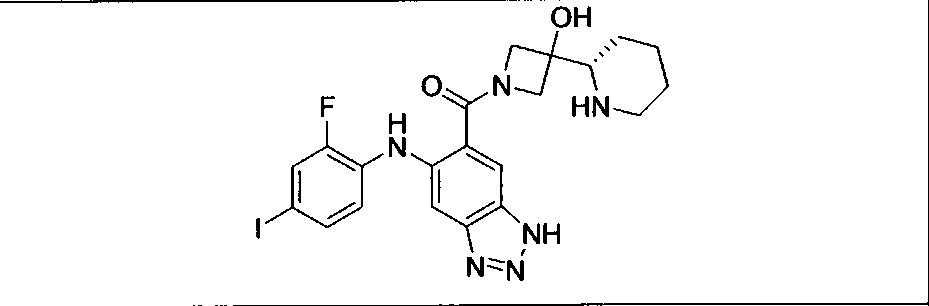
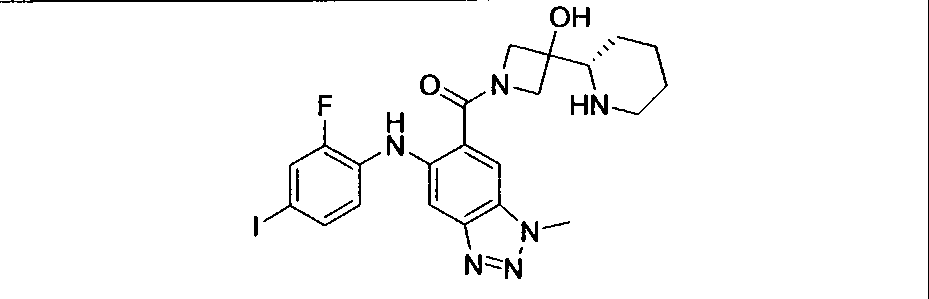
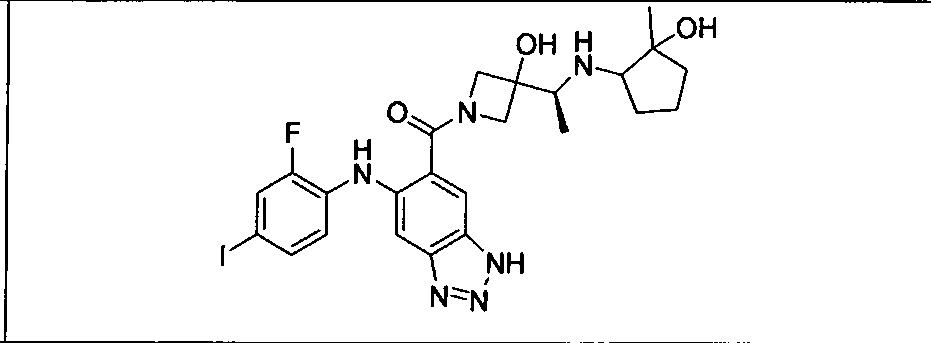
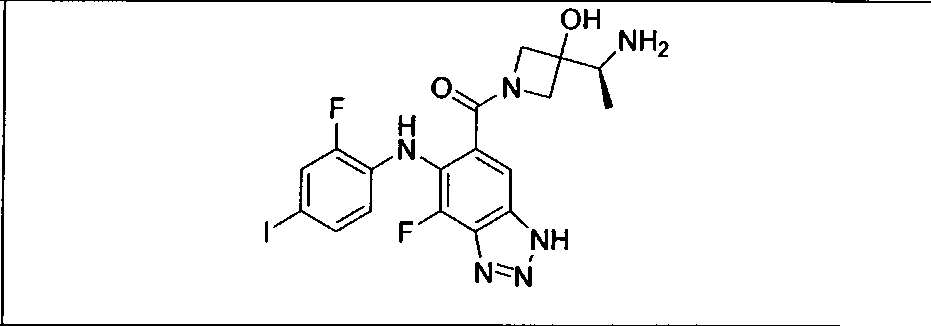
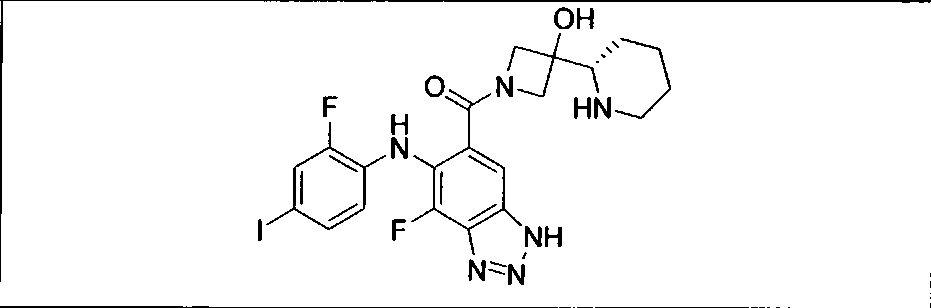
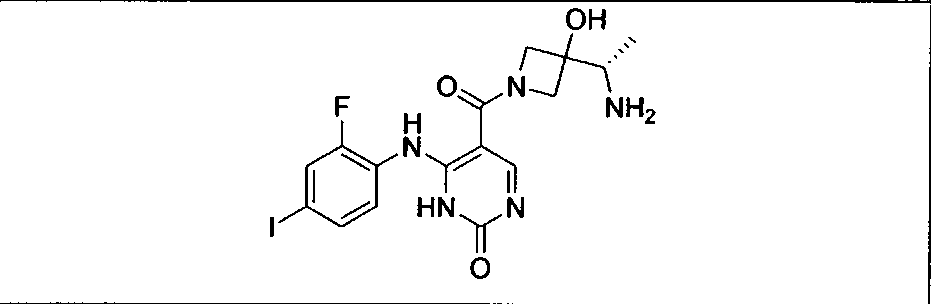
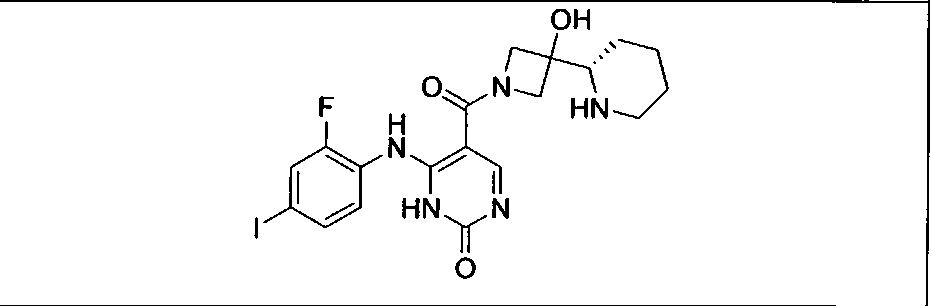
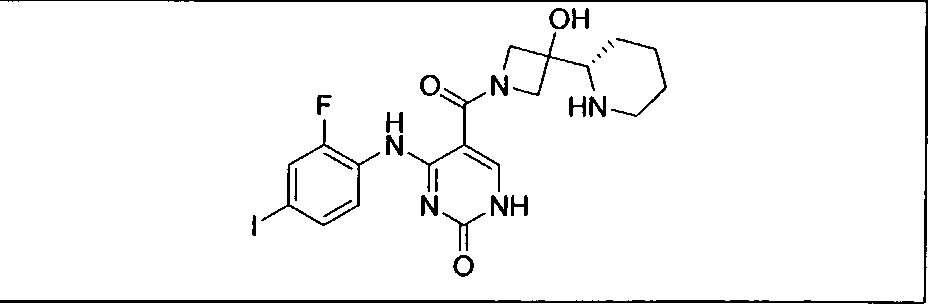
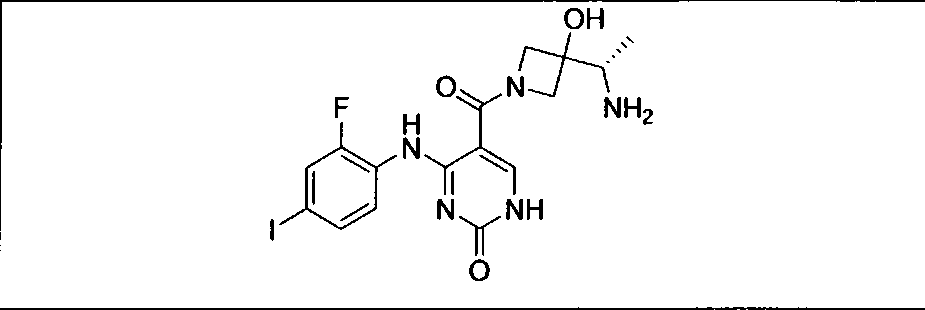
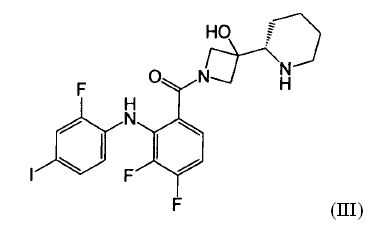
Настоящее изобретение относится к способам лечения пациента с местнораспространенными или метастазирующими плотными опухолями с помощью 4-(2-(1Н-индазол-4-ил)-6-((4-(метилсульфонил)пиперазин-1-ил)метил)тиено[3,2-d]пиримидин-4-ил)морфолина (I), также обозначаемого «GDC-0941», или (S)-1-(4-((2-(2-аминопиримидин-5-ил)-7-метил-4-морфолинотиено[3,2-d]пиримидин-6-ил)метил)пиперазин-1-ил)-2-гидроксипропан-1-она (II) (US 2008/0076768; WO 2006/046031), которые оба ингибируют PI3K, в комбинации с ингибитором МЕК, описанным в настоящем изобретении. Настоящее изобретение дополнительно относится к комбинированной терапии I или II и ингибитора МЕК, причем ингибитором является [3,4-дифтор-2-(2-фтор-4-иод-фениламино)-фенил]-((S)-3-гидрокси-3-пиперидин-2-ил-азетидин-1-ил)-метанон, также обозначаемый «GDC-0973/XL-518» (III).
Настоящее изобретение также относится к дозам соединений I или II и III, которые могут применяться в комбинированной терапии, и к режимам дозирования, применимым для практической комбинированной терапии соединениями I или II и III.
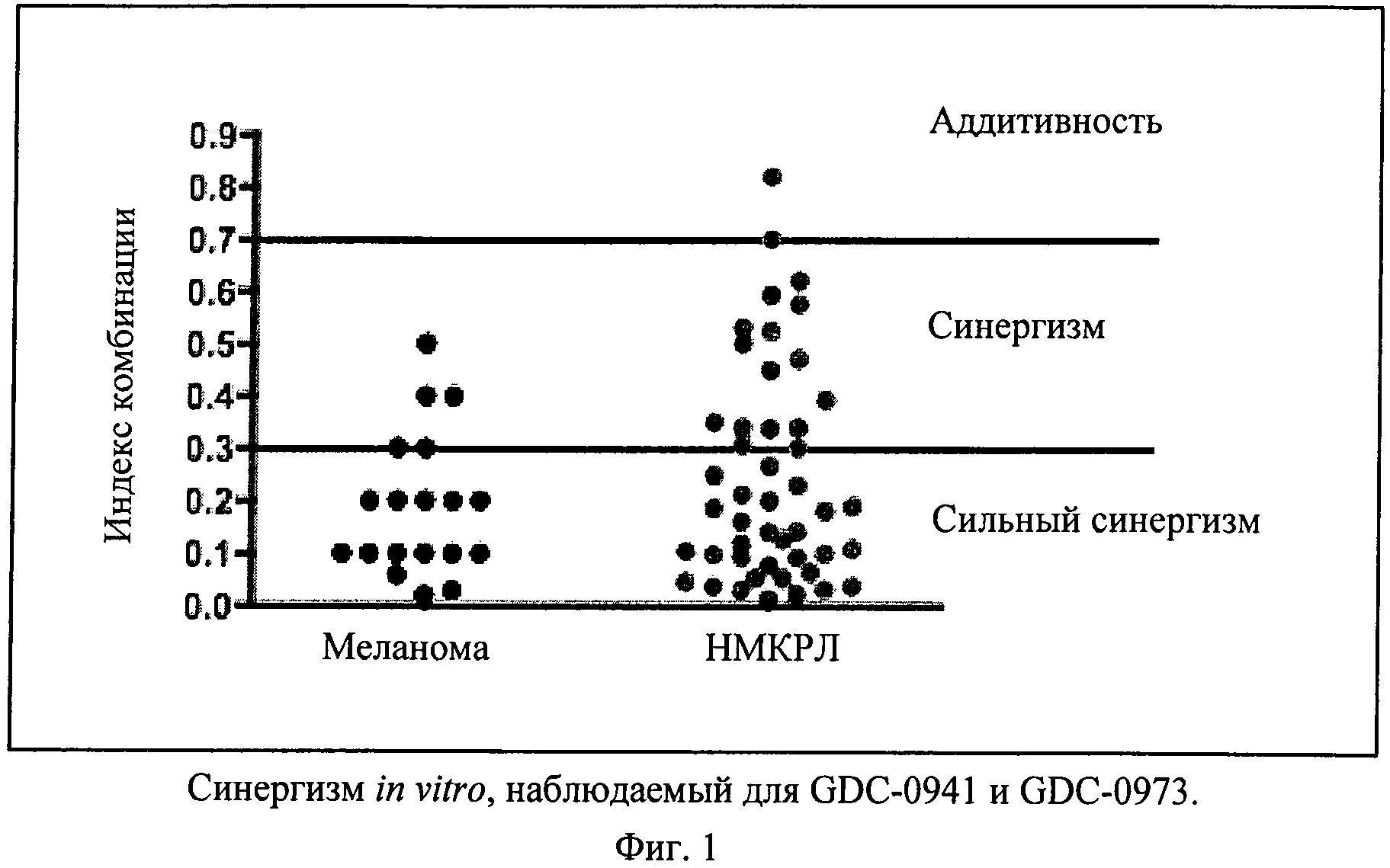
Фиг.1 показывает синергизм in vitro, наблюдаемый для GDC-0941 и GDC-0973. Индекс комбинации (ИК) GDC-0941 и GDC-0973 в панели линий клеток меланомы и НМКРЛ наносят на график. Каждая точка означает одну клеточную линию. По методу Chou и Talalay (Adv. Enz. Regul. 22, 1984, сс.27-55) индекс комбинации <0,3 означает сильный синергизм, а индекс комбинации <0,7 означает синергизм.
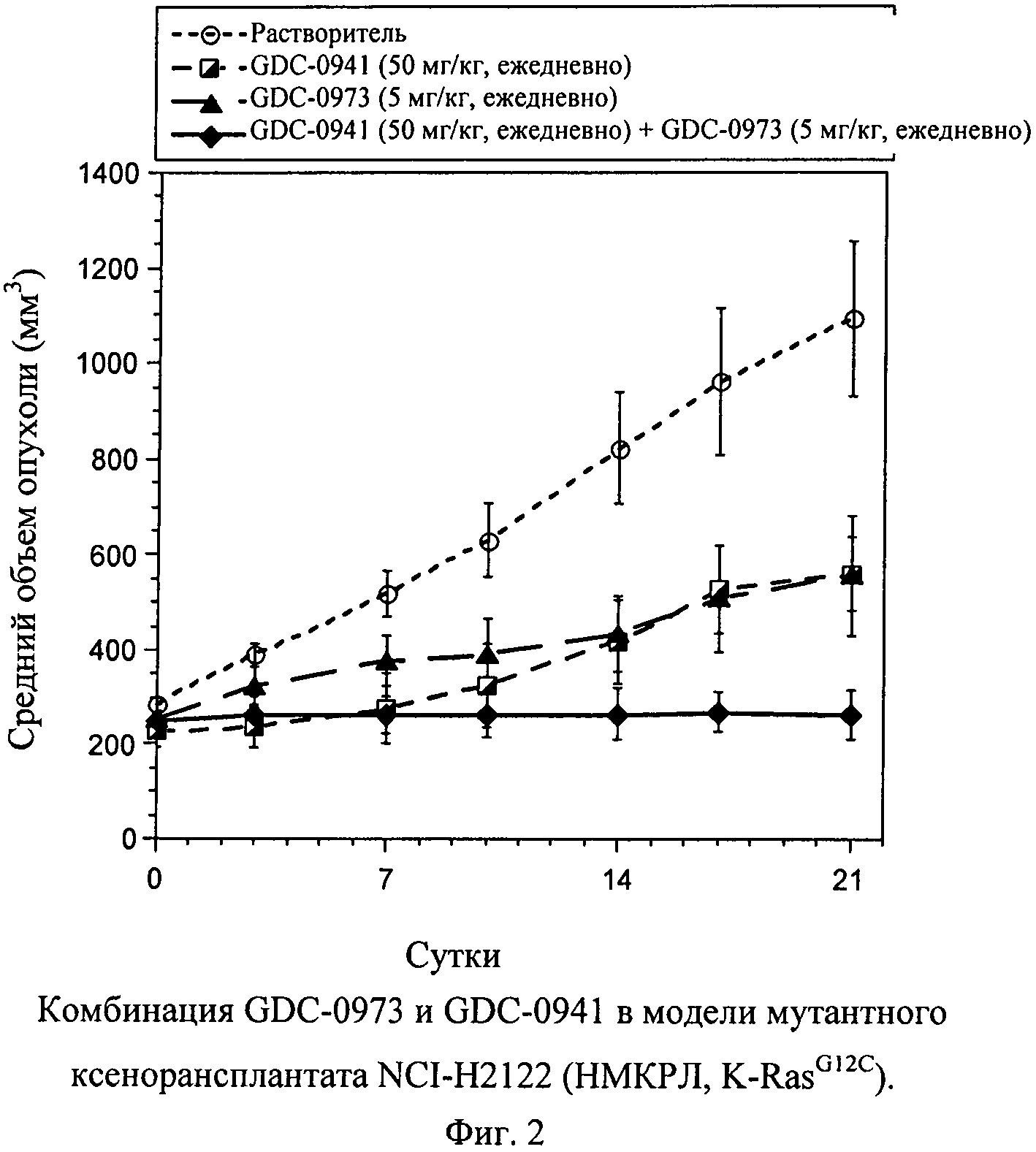
Фиг.2 показывает комбинацию GDC-0973 и GDC-0941 в модели G12С мутантного ксенорансплантата NCI-H2122 (НМКРЛ, K-RasG12C). Клетками NCI-Н2122 (10×106 в сбалансированном солевом растворе Хэнкса (Hanks Balance Salt Solution - HBSS) + Matrigel) инокулируют голых мышей (nu/nu) и допускают рост объема опухоли до среднего объема ~240 мм3. Затем начинают лечение, дозируя растворитель (незаштрихованные кружки, пунктирные линии с короткими штрихами, n=10), GDC-0941 (50 мг/кг, ежедневно, перорально; полу-заштрихованные квадраты, пунктирные линии, n=5), GDC-973 (5 мг/кг, ежедневно, перорально; заштрихованные треугольники, пунктирные линии с длинными штрихами, n=5) или комбинацию GDC-0941 и GDC-0973 (заштрихованные ромбы, сплошные линии, n=5). Измерения циркулем опухолей животных и определение массы животных проводят каждые 3-4 суток на протяжении исследования, рассчитывают объемы опухолей (TV=[L×(W2)]/2) и наносят на график +/- средняя стандартная ошибка. Процент подавления роста опухоли рассчитывают подсчетом площади под кривой (area under the curve -AUC) для каждой группы относительно контроля (растворителя). Т-критерии Стьюдента проводят на 21 сутки для определения значимости по р-величине.
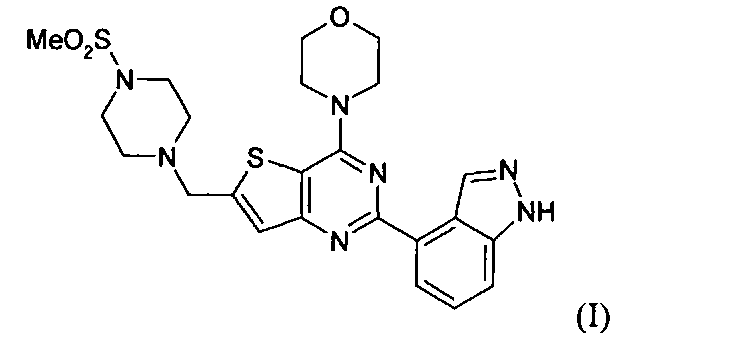
Фиг.3 показывает комбинацию GDC-0973 и GDC-0941 в модели ксенотрансплантата А2058 (меланома, B-RafV600E, PTENnull). Клетки А2058 (10×106 в сбалансированном солевом растворе Хэнкса (Hanks Balance Salt Solution -HBSS) + Matrigel)) инокулируют голым мышам (nu/nu) и допускают рост объема опухоли до среднего объема ~190 мм3. (А) Затем начинают лечение, дозируя растворитель (незаштрихованные кружки, пунктирные линии с короткими штрихами, n=7), GDC-0941 (30 мг/кг, ежедневно, перорально; полузаштрихованные квадраты, пунктирные линии, n=7), GDC-973 (6 мг/кг, ежедневно, перорально; заштрихованные треугольники, пунктирные линии с длинными штрихами, n=7) или комбинацию GDC-0941 и GDC-0973 (заштрихованные ромбы, сплошные линии, n=7). (Б) Затем начинают лечение, дозируя растворитель (незаштрихованные кружки, пунктирные линии с короткими штрихами, n=7), GDC-0941 (100 мг/кг, ежедневно, перорально; полузаштрихованные квадраты, пунктирные линии, n=7), GDC-0973 (10 мг/кг, ежедневно, перорально; заштрихованные треугольники, пунктирные линии с длинными штрихами, n=7) или комбинацию GDC-0941 и GDC-0973 (заштрихованные ромбы, сплошные линии, n=7). Измерения циркулем опухолей животных и определение массы животных проводят каждые 3-4 суток на протяжении исследования, рассчитывают объемы опухолей (TV=[L×(W2)]/2), и наносят на график +/- средняя стандартная ошибка. Процент подавления роста опухоли рассчитывают подсчетом площади под кривой (area under the curve - AUC) для каждой группы относительно контроля (растворителя). Т-критерии Стьюдента проводят на 21 сутки для определения значимости по р-величине.
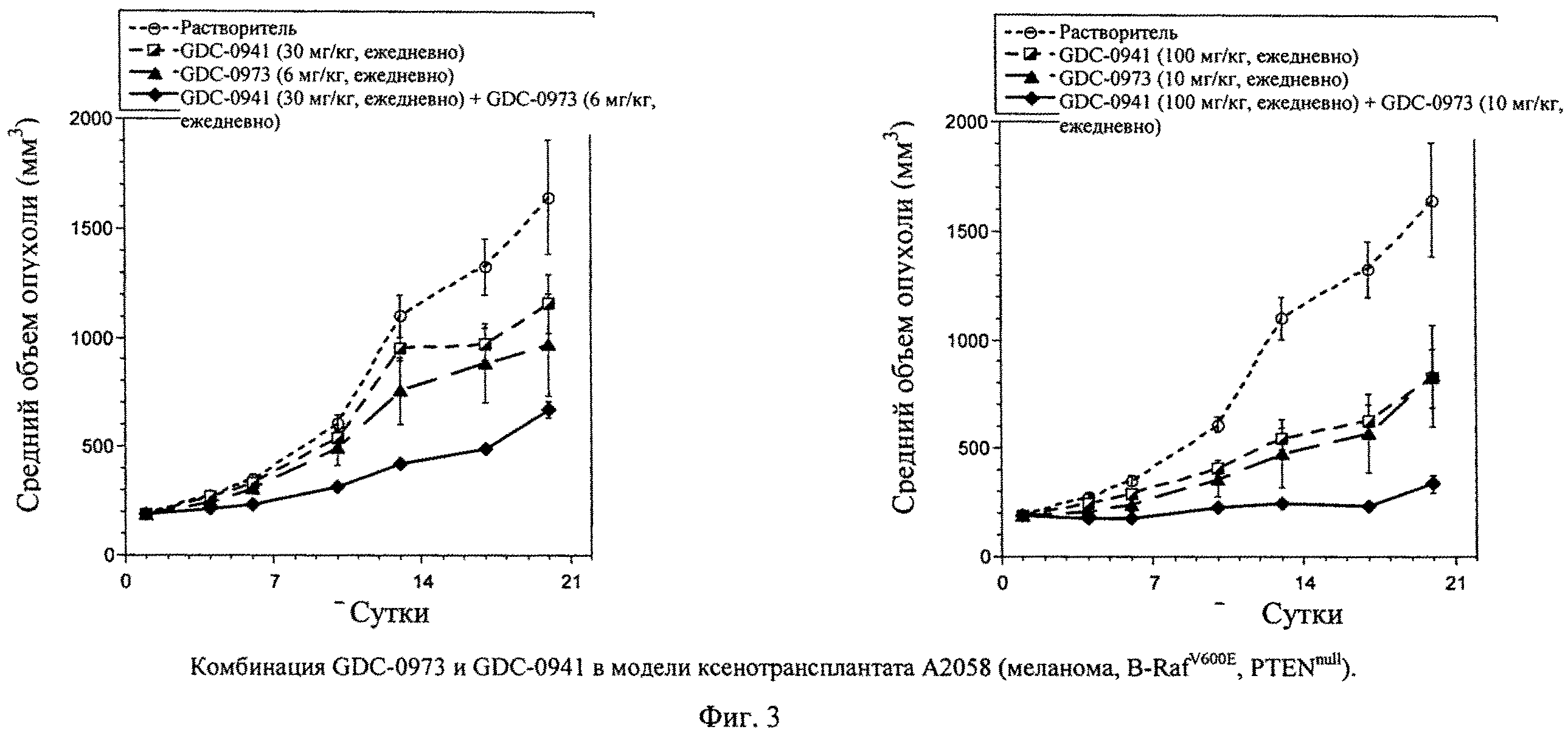
Фиг.4 показывает комбинацию GDC-0941 и GDC-0973 в модели ксенотрансплантата (A) FaDu (подглоточный плоскоклеточный рак). (А) Затем начинают лечение, дозируя растворитель (незаштрихованные кружки), GDC-0941 (100 мг/кг, ежедневно, перорально; заштрихованные треугольники), GDC-973 (5 мг/кг, ежедневно, перорально; заштрихованные квадраты) или комбинацию GDC-0941 и GDC-0973 (заштрихованные ромбы, пунктирные линии, n=7). (Б) Модель ксенотрансплантата SKOV-4 (рак яичника). Затем начинают лечение, дозируя растворитель (незаштрихованные кружки), GDC-0941 (100 мг/кг, ежедневно, перорально; заштрихованные треугольники), GDC-0973 (10 мг/кг, ежедневно, перорально; заштрихованные квадраты) или комбинацию GDC-0941 и GDC-0973 (заштрихованные ромбы). Измерения циркулем опухолей животных и определение массы животных проводят каждые 3-4 суток на протяжении исследования, рассчитывают объемы опухолей (TV=[L×(W2)]/2) и наносят на график +/- средняя стандартная ошибка. Процент подавления роста опухоли рассчитывают подсчетом площади под кривой (area under the curve - AUC) для каждой группы относительно контроля (растворителя). Т-критерии Стьюдента проводят на 21 сутки для определения значимости по р-величине.
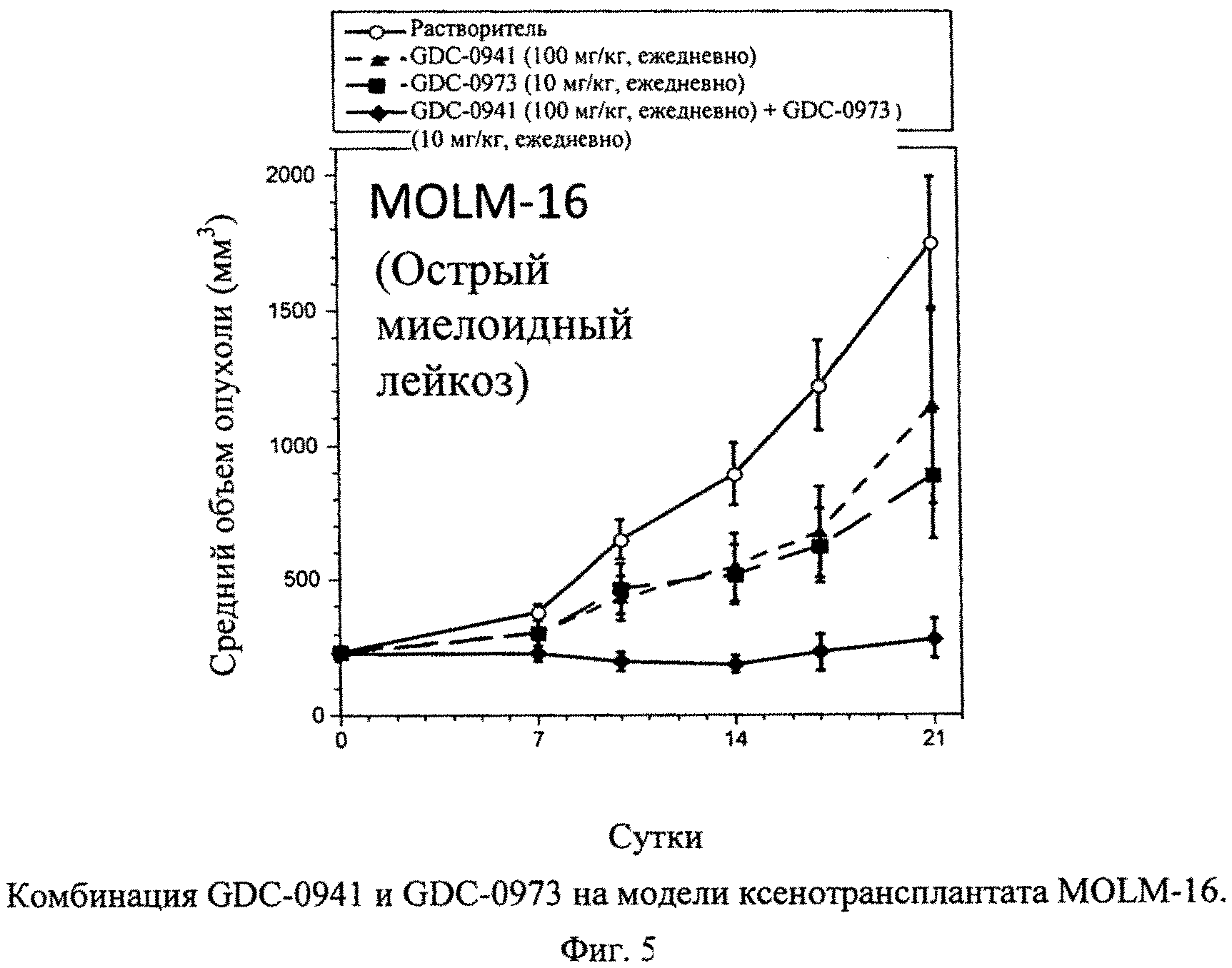
Фиг.5 показывает комбинацию GDC-0941 и GDC-0973 на модели ксентрансплантата MOLM-16 (острого миелоидного лейкоза) (А). Клетками А2058 (10×106 в сбалансированном солевом растворе Хэнкса (Hanks Balance Salt Solution - HBSS) + Matrigel)) инокулируют голых мышей (nu/nu) и допускают рост объема опухоли до среднего объема ~190 мм3. (А) Затем начинают лечение, дозируя растворитель (незаштрихованные кружки), GDC-0941 (100 мг/кг, ежедневно, перорально; заштрихованные треугольники), GDC-0973 (10 мг/кг, ежедневно, перорально; заштрихованные квадраты) или комбинацию GDC-0941 и GDC-0973 (заштрихованные ромбы, пунктирные линии, n=7). (Б) Модель ксенотрансплантата МХ-1 (трижды негативный рак молочной железы). Затем начинают лечение, дозируя растворитель (незаштрихованные кружки), GDC-0941 (100 мг/кг, ежедневно, перорально; заштрихованные треугольники), GDC-0973 (5 мг/кг, ежедневно, перорально; заштрихованные квадраты) или комбинацию GDC-0941 и GDC-0973 (заштрихованные ромбы). Измерения циркулем опухолей животных и определение массы животных проводят каждые 3-4 суток на протяжении исследования, рассчитывают объемы опухолей (TV=[L×(W2)]/2) и наносят на график +/- средняя стандартная ошибка. Процент подавления роста опухоли рассчитывают подсчетом площади под кривой (area under the curve - AUC) для каждой группы относительно контроля (растворителя). Т-критерии Стьюдента проводят на 21 сутки для определения значимости по р-величине.
Фиг.6А и 6Б показывают схему комбинации GDC-0973 и GDC-0941.
Дальнейшее описание осуществляется в виде подробного описания определенных вариантов настоящего изобретения, примеры которых сопровождаются иллюстрациями структур и формул. Хотя настоящее изобретение будет описано в соединении с перечисленными вариантами осуществления, следует учитывать, что они не предназначены ограничивать настоящее изобретение такими вариантами его осуществления. Напротив, настоящее изобретение также относится ко всем другим вариантам, модификациям и эквивалентам, которые могут быть включены в рамки охвата настоящего изобретения. Специалист в данной области может установить много методов и материалов, сходных или равноценных тем, которые описаны в настоящем изобретении, которые могли бы применяться в практике настоящего изобретения. Настоящее изобретение ни в коей мере не ограничивается методами и материалами, описанными в нем. В том случае, когда в настоящее изобретение включены литературные источники, патенты и другие подобные материалы, которые отличаются или противоположны настоящему описанию, включая определенные термины, обычные термины, описанные методики и т.д., но, не ограничиваясь ими, которые контролируются в настоящем изобретении.
Понятия «включать» и «включающий», используемые в настоящем описании и в формуле изобретения, предназначены для определения наличия определенных свойств, целых чисел, компонентов или стадий, но они не отклоняют наличия или добавления одного или нескольких других свойств, целых чисел, компонентов, стадий или их групп.
Оба понятия «лечить» и «лечащий» относятся к терапевтическому лечению и профилактическим или предохраняющим мерам, благодаря которым у объекта предупреждается или снижается (ослабевает) нежелательное физиологическое изменение или расстройство, например, рост, развитие или распространение рака. Для целей настоящего изобретения полезные или желательные клинические результаты означают, но ими перечень не ограничивается, облегчение симптомов, уменьшение степени заболевания, стабилизированное состояние заболевания (т.е. отсутствие ухудшения), отсрочку или замедление прогрессирования заболевания, улучшение или временное облегчение болезненного состояния и ремиссию (частичную или полную), выявляемые или не выявляемые. Понятия «лечить» и «лечащий» также могут означать пролонгированное выживание относительно предполагаемого выживания в случае отсутствия лечения. К тем, кто нуждается в лечении, относятся те, кто уже находится в определенном состоянии или имеет заболевание, а также те, у кого есть склонность к развитию определенного состояния или заболевания, или те, у которых определенное состояние или заболевание предупреждают.
Понятие «местнораспространенные или метастазирующие плотные опухоли» включает меланому, немелкоклеточный рак легких, рак толстой и прямой кишки, рак поджелудочной железы, рак груди и рак яичника.
Понятие «метаболит» означает продукт, вырабатываемый в результате метаболизма в организме определенного соединения или его соли. Метаболиты соединения могут быть идентифицированы, используя обычные методы, известные в данной области, и их действие определяют с помощью анализов, подобных описанным в настоящем изобретении. Такие продукты могут сформироваться из введенного соединения, например, в результате окисления, восстановления, гидролиза, амидирования, этерификации, деэтерификации, ферментативного расщепления и др. Соответственно, настоящее изобретение включает метаболиты соединений по настоящему изобретению, включая соединения, выработанные в процессе, включающем контакт соединения по настоящему изобретению с млекопитающим в течение периода, достаточного для получения продукта его метаболизма.
Понятие «фармацевтически приемлемой соли» в контексте настоящего изобретения относится к фармацевтически приемлемым органическим или неорганическим солям соединения по настоящему изобретению. К примерам солей относятся, но ими перечень не ограничивается, сульфаты, цитраты, ацетаты, оксалаты, хлориды, бромиды, иодиты, бисульфаты, фосфаты, кислые фосфаты, изоникотинаты, лактаты, салицилаты, кислые цитраты, тартраты, олеаты, таннаты, пантотенаты, битартраты, аскорбаты, сукцинаты, малеаты, гентисинаты, фумараты, глюконаты, глюкоронаты, сахараты, формиаты, бензоаты, глютаматы, метансульфонаты «мезилаты», этансульфонаты, бензолсульфонаты, p-толуолсульфонаты и памоаты (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоаты)). Фармацевтически приемлемая соль может включать присоединение другой молекулы, например, ион ацетата, ион сукцината или другой противоион. Противоион может быть какой-либо органической или неорганической частью молекулы, которая стабилизирует заряд на исходном соединении. Кроме того, фармацевтически приемлемая соль может иметь более одного заряженного атома в своей структуре. Примеры, в которых атомы со многими зарядами являются частью фармацевтически приемлемой соли, могут обладать многими противоионами. Поэтому фармацевтически приемлемая соль может содержать один или несколько заряженных атомов и/или один или несколько противоионов.
Если соединение по настоящему изобретению является основанием, требуемая фармацевтически приемлемая соль может быть получена каким-либо соответствующим способом, доступным в данной области, например, обработкой свободного основания неорганической кислотой, например, соляной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой, метансульфоновой кислотой, фосфорной кислотой и др., или органической кислотой, например, уксусной кислотой, малеиновой кислотой, янтарной кислотой, миндальной кислотой, фумаровой кислотой, малоновой кислотой, пировиноградной кислотой, щавелевой кислотой, гликолевой кислотой, салициловой кислотой, пиранозидиловой кислотой, например, глюкуроновой кислотой или галактуроновой кислотой, альфа-гидроксидной кислотой, например, лимонной кислотой или винной кислотой, аминокислотой, например, аспарагиновой кислотой или глютаминовой кислотой, ароматической кислотой, например, бензойной кислотой или коричной кислотой, сульфоновой кислотой, например, p-толуолсульфоновой кислотой или этансульфоновой кислотой и др. Кислоты, обычно рассматриваемые в качестве приемлемых для формирования фармацевтически применимых или пригодных солей из основных фармацевтических соединений, обсуждаются, например, Stahl и др. в кн.: «Handbook of Pharmaceutical Salts. Properties, Selection and Use», 2002, под ред. Camille, Цюрих, изд-во Wiley - VCH; Berge и др., Journal of Pharmaceutical Sciences, 66(1), 1977, cc.1-19; Gould, International J. of Pharmaceutics, 33, 1986, cc.201-217; Anderson и др. в кн.: «The Practice of Medicinal Chemistry», 1996, изд-во Academic Press, Нью-Йорк; «Remington's Pharmaceutical Sciences», 1995, 18e изд., изд-во Mack Publishing Co., Easton, Пенсильвания; в кн.: «The Orange Воок», изд-во Food&Drug Administration, Вашингтон, округ Колумбия, на вебсайте FDA).
Если соединение по настоящему изобретению является кислотой, требуемая фармацевтически приемлемая соль может быть получена каким-либо соответствующим методом, например, обработкой свободной кислоты неорганическим или органическим основанием, например, амином (первичным, вторичным или третичным), гидратами окисей щелочных металлов и гидратами окисей щелочноземельных металлов и др. Иллюстративными примерами соответствующих солей являются, но ими перечень не ограничивается, органические соли, производные от аминокислот, например, глицина и аргинина, аммония, первичных, вторичных и третичных аминов и циклических аминов, например, пиперидина, морфолина и пиперазина, и органические соли, производные от натрия, кальция, калия, магния, железа, меди, цинка, алюминия и лития.
Понятие «фармацевтически приемлемое» означает, что вещество или композиция должны быть химически и/или токсикологически совместимыми с другими ингредиентами, образующими состав, и/или с млекопитающим, которого лечат этим веществом или композицией.
Понятие «сольват» относится к физической ассоциации или к комплексу одной или нескольких молекул растворителя и соединения по настоящему изобретению. Соединения по настоящему изобретению могут быть в сольватированной и несольватированной форме. Примерами растворителей, формирующих сольваты, относятся, но ими перечень не ограничивается, вода, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусная кислота и этаноламин. Понятие «гидрат» относится к комплексу, в котором молекулой растворителя является вода. Физическая ассоциация включает разные степени ионного и ковалентного соединения, включая водородную связь. В некоторых случаях возможно выделение сольвата, например, если одна или несколько молекул растворителя включены в кристаллическую решетку кристаллического твердого тела. Получение сольватов в основном известно, например, Caira и др., J. Pharmaceutical Sci., 2004, 93(3), сс.601-611. Схожие получения сольватов, полусольватов, гидратов и других близких форм описаны van Tonder и др., AAPS PharmSciTech., 5(1), 2004, статья 12; Bingham и др., Chem. Commun., 7, 2001, cc.603-604. Обычный способ, который, однако, не является единственным, включает растворение обладающего признаками изобретения соединения в требуемых количествах требуемого растворителя (органического соединения, или воды, или их смесей) при температуре, превышающей температуру окружающей среды, и охлаждение раствора со скоростью, достаточной для формирования кристаллов, которые затем выделяют стандартными методами. Аналитические методы, например ИК-спектроскопия, показывают наличие растворителя (или воды) в кристаллах в виде сольвата (или гидрата).
Несмотря на последние достижения в профилировании опухолей человека и конструировании низкомолекулярных и высокомолекулярных лекарственных средств, приведшие к целевым методам лечения, которые изменили историю болезни, для которых они были первоначально разработаны, общий процент успешных целевых средств в онкологии, однако, до сих пор довольно низкий, что может быть частично объяснено неоднородностью развития многих видов рака, а также сложностью метаболических путей, в которых задействованы мишени, в которых участвуют несколько избыточных метаболических путей и перекрестных помех у многих молекулярных метаболических путей.
Один из подходов к этой проблеме заключается в лечении опухолей комбинацией целевых агентов, например, нацеливающейся на оба метаболических пути, MAPK/ERK и PI3K/AKT/mTOR. Это метаболические пути, которые независимо и вместе индуцируют пролиферацию многих форм опухолей и обычно активируются в опухолях за счет ряда геномных событий. Такой подход обладает двойной пользой: он обладает потенциалом для повышения степени исходного ответа в опухолях, индуцированных многими онкогенными событиями, а также к снижению степеней приобретенной устойчивости, наблюдающейся только с одним любым из этих агентов. Это происходит из-за подавления активирования компенсаторных метаболических путей, которые могут затем пролонгировать действие комбинации относительно действия, наблюдаемого при применении одного агента.
Активация метаболического пути PI3K-AKT вовлечена в несколько типов рака (Ward и др., Chem Biol, 10, 2003, сс.207-213; Cantley в кн.: «The Harvey Lectures», серия 100, 2004-2005. Хобокен, 2006, изд-во John Wiley and Sons Inc., сс.103-122). Активирующие и трансформирующие мутации в субъединице pi 10а PI3K обычно обнаруживают в опухолях (Bachman и др., Cancer Biol Ther, 3, 2004, сс.772-775; Samuels и др., Science, 304, 2004, с.554; Karakas и др., Br J Cancer, 94, 2006, сс.455-459). Кроме того, метаболический путь активирован при многих типах рака за счет передачи сигнала рецепторной тирозинкиназы, мутаций RAS или потери фосфатазы PTEN (Cantley, Science, 296, 2002, сс.1655-1657).
Нацеливание на любой из этих путей в отдельности может ослаблять передачу сигнала, и было показано, что они были эффективны на некоторых животных моделях (Folkes и др., J Med Chem, 51, 2008, сс.5522-5532; Hoeflich и др., Clin Cancer Res, 15(14), 2009, сс.4649-4664). Однако во многих опухолях пролиферация и выживание клеток вызываются по многим эффекторным путям, например, в опухолях с одновременной активацией метаболических путей RAS и PI3K, что часто наблюдается при меланоме, раке легких и раке толстой и прямой кишки. В этих случаях нацеливание на оба эти метаболические пути, что было показано с помощью неклинических методов, существенно более эффективно, чем нацеливание только на один метаболический путь. Например, показано, что ингибиторы МЕК и PI3K проявляют улучшенную эффективность комбинации на моделях мышей с мутацией KRAS рака легких или рака груди по сравнению с отдельными агентами (Engelman и др., Nat Med, 14, 2008, сс.1351-1356; Hoeflich и др., Clin Cancer Res, 15(14), 2009, сс.4649-4664). Неклинические данные, показывающие in vitro и in vivo эффективность комбинации ингибитора МЕК и ингибитора PI3K, описаны в настоящем изобретении и в патенте US 2009/0098135, содержание которого включено в настоящее изобретение в виде ссылки. Поскольку на неклинических моделях показано, что подавление обоих метаболических путей, PI3K и МЕК, приводит к улучшению эффективности, особенно у мутантов с генотипом RAF и RAS. Поэтому комбинация ингибиторов МЕК (например, GDC-0973) и PI3K (например, GDC-0941) особенно полезна для пациентов с мутацией RAS/RAF с местнораспространенными или метастазирующими плотными опухолями.
Настоящее изобретение относится к способам лечения пациента с местнораспространенными или метастазирующими плотными опухолями с помощью 4-(2-(1Н-индазол-4-ил)-6-((4-(метилсульфонил)пиперазин-1-ил)метил)тиено[3,2-d]пиримидин-4-ил)морфолина (I), также обозначаемого GDC-0941, или (S)-1-(4-((2-(2-аминоопиримидин-5-ил)-7-метил-4-морфолинтиен [3,2-(1]пиримидин-6-ил)метил)пиперазин-1-ил)-2-гидроксипропан-1-она (II) (US 2008/0076768; WO 2006/046031), которые оба ингибируют PI3K, в комбинации с ингибитором МЕК, описанным в патенте US 2009/0156576, содержание которого включено в виде ссылки на его сущность.
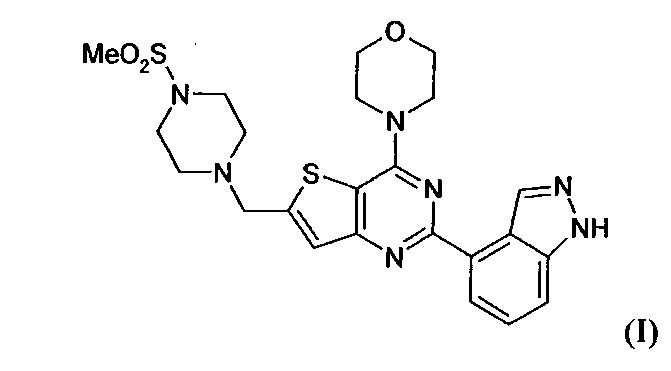
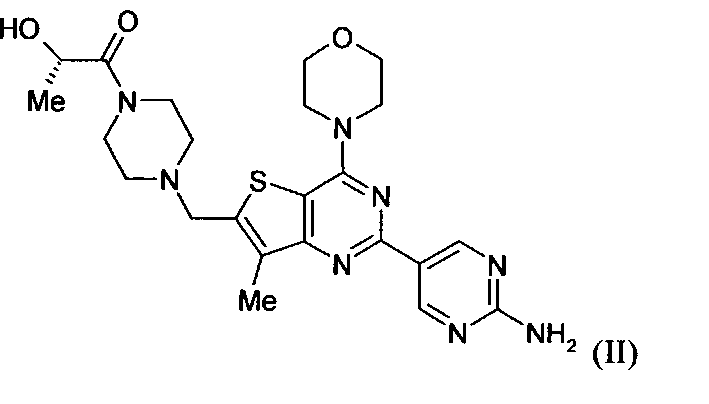
GDC-0941 или II может быть получен с помощью методов, описанных в US 2008/0076768, US 2008/0207609, US 2008/0207611 и US 2009/0131429 (содержание которых включено в настоящее изобретение в виде ссылки во всей их полноте).
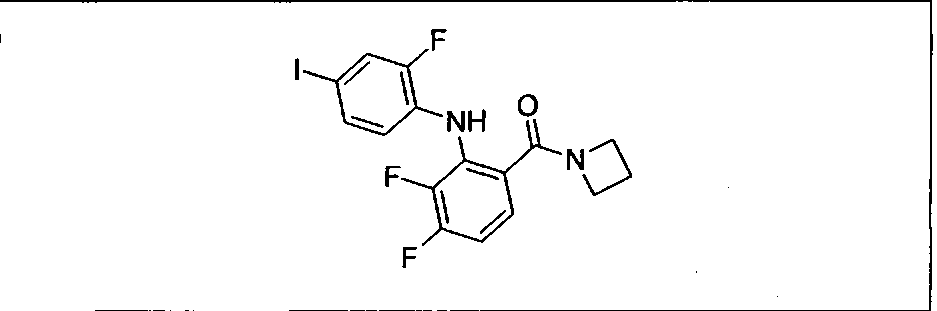
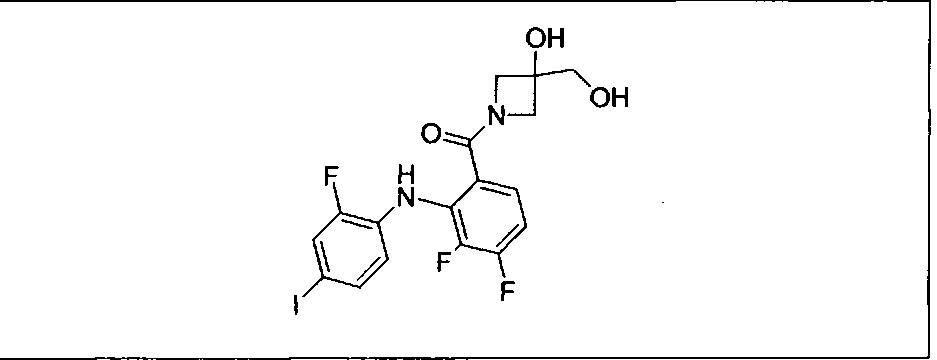
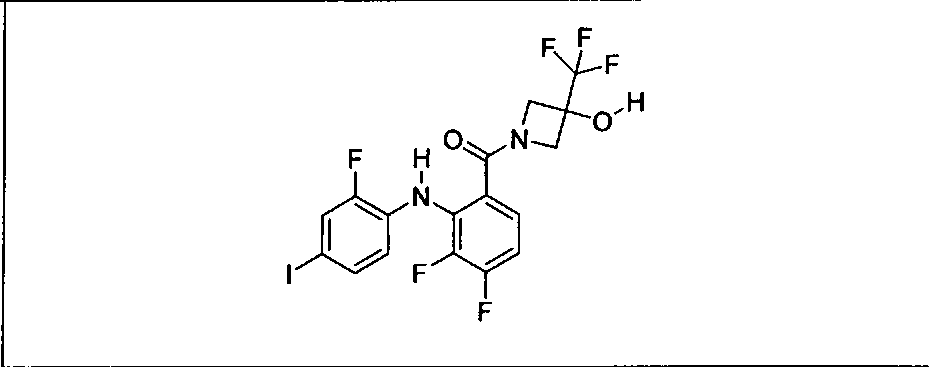
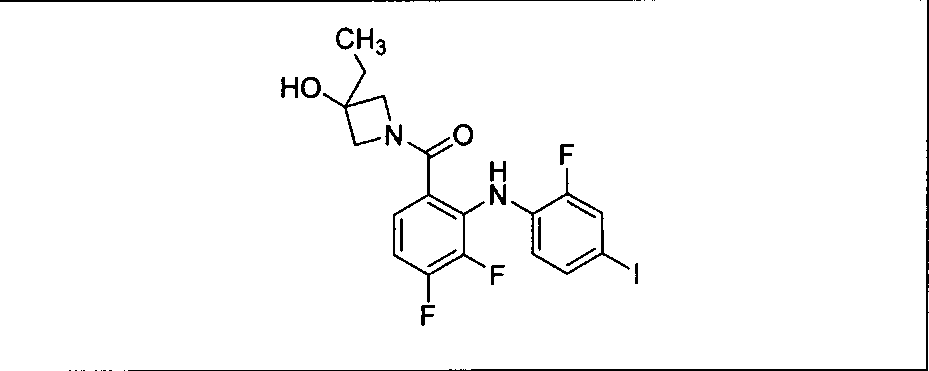
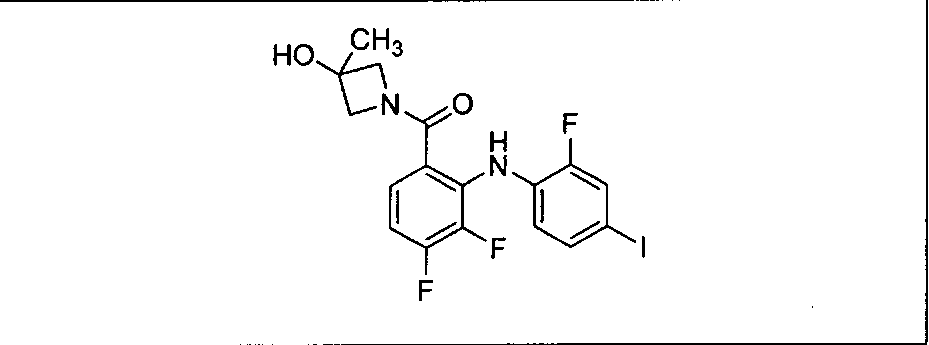
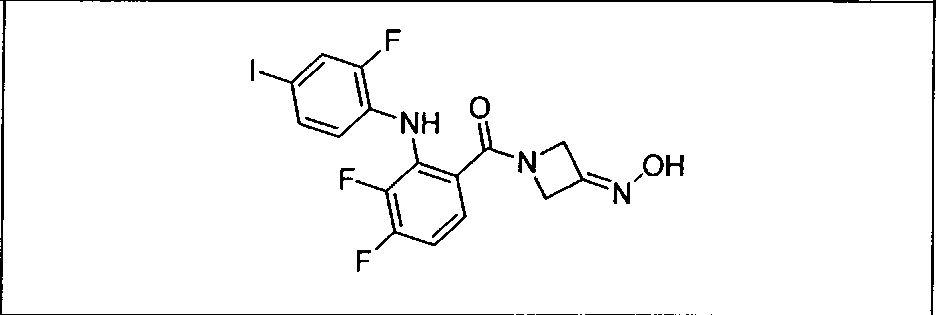
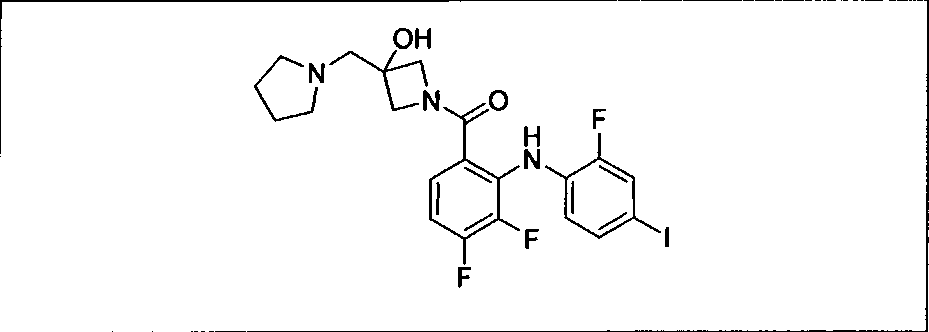
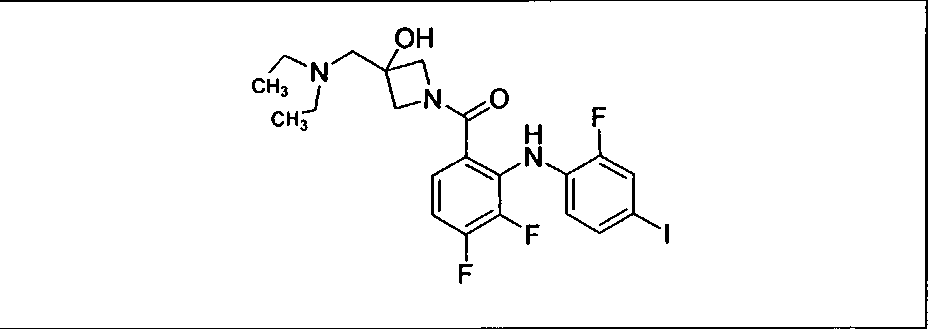
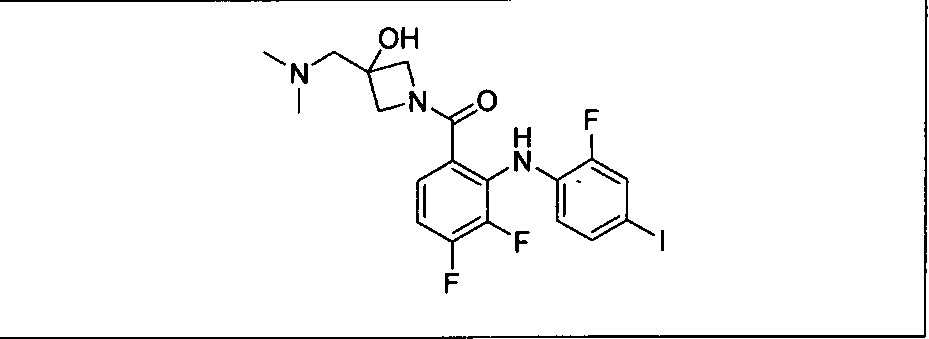
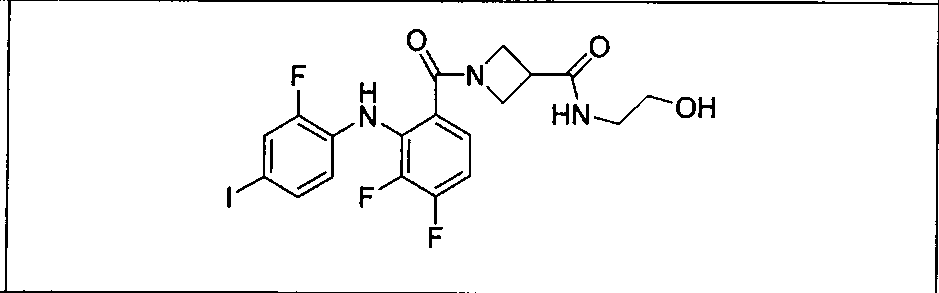
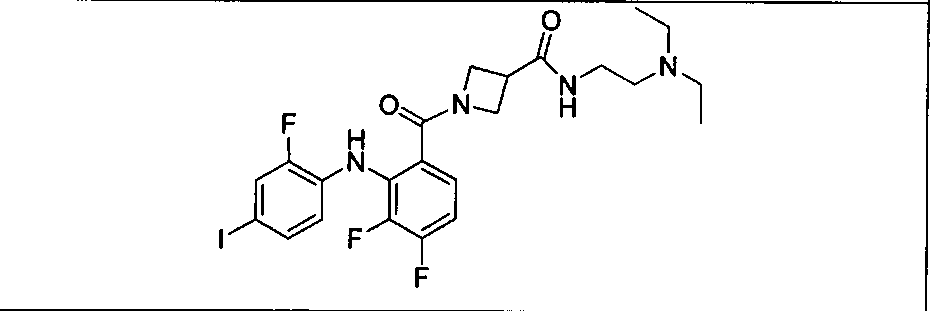
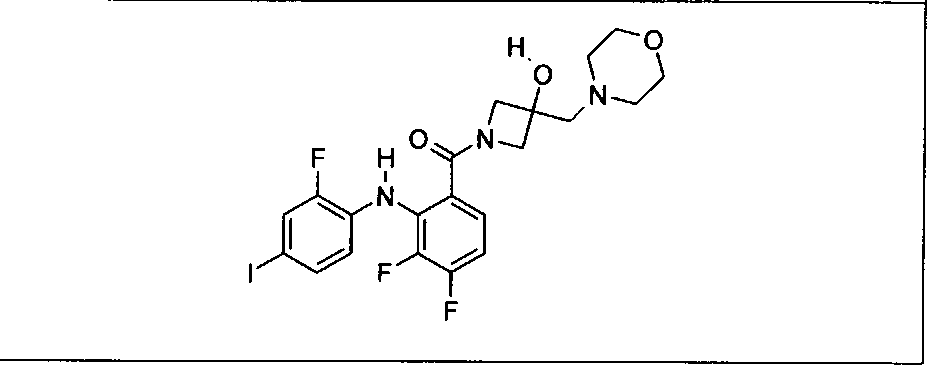
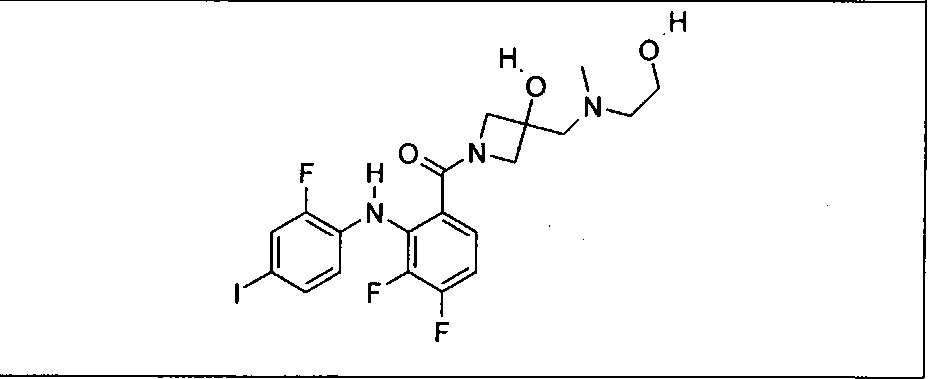
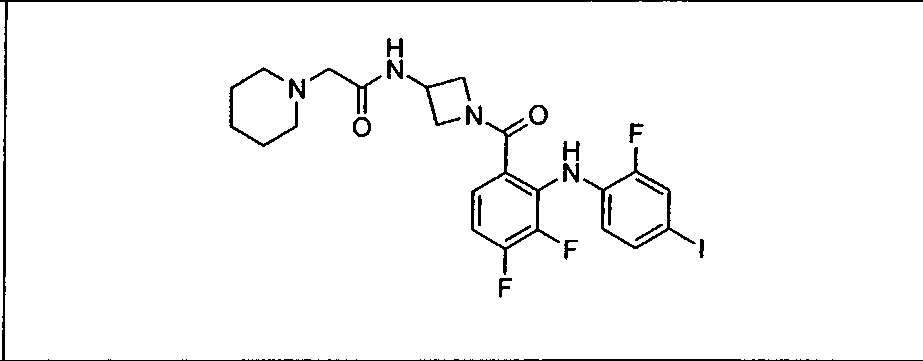
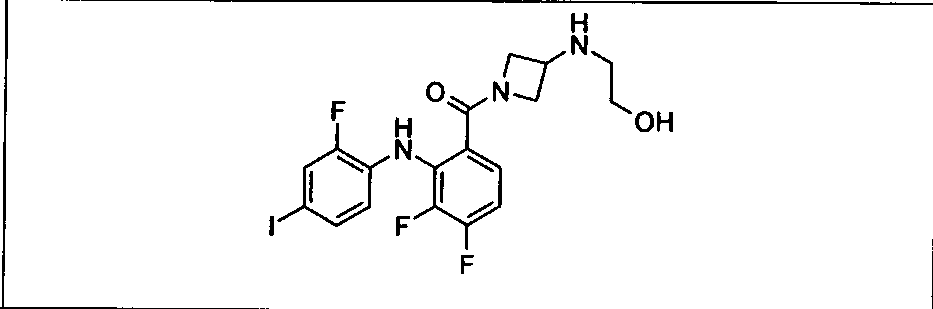
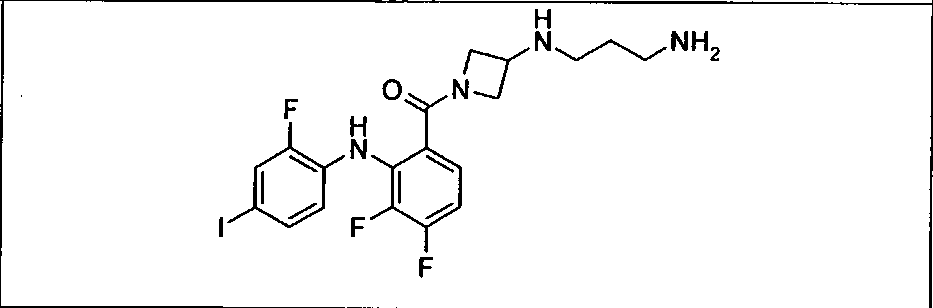
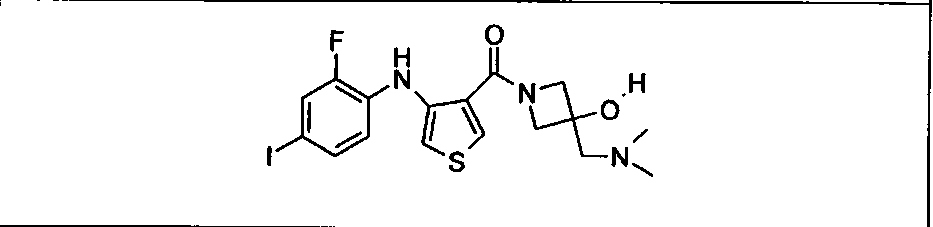
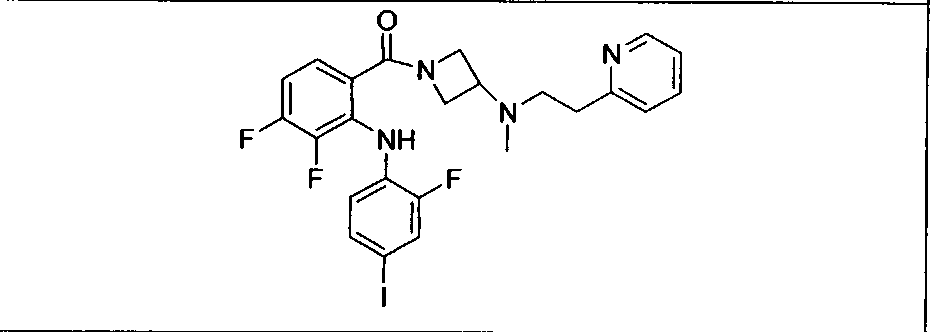
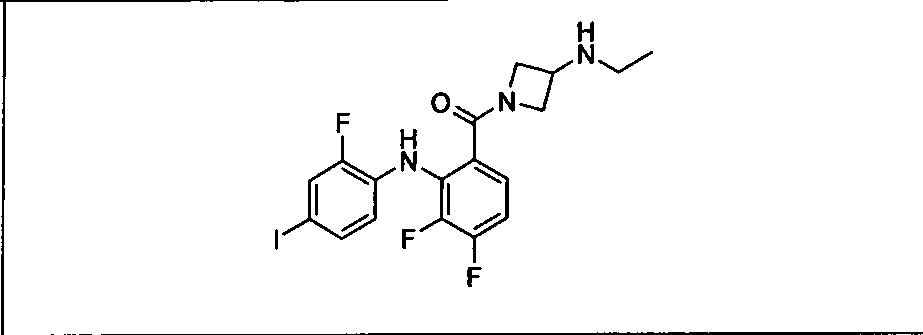
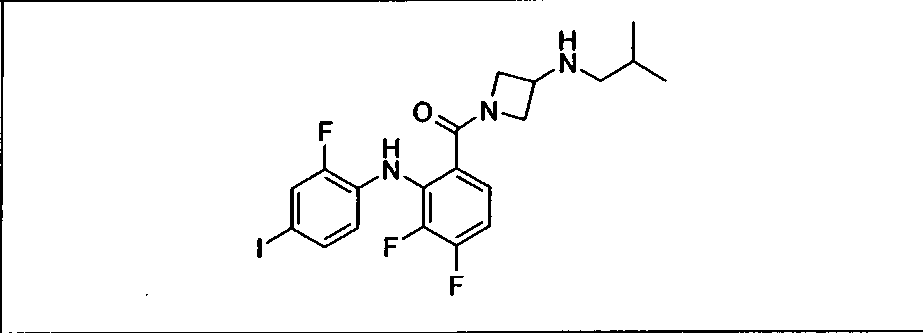
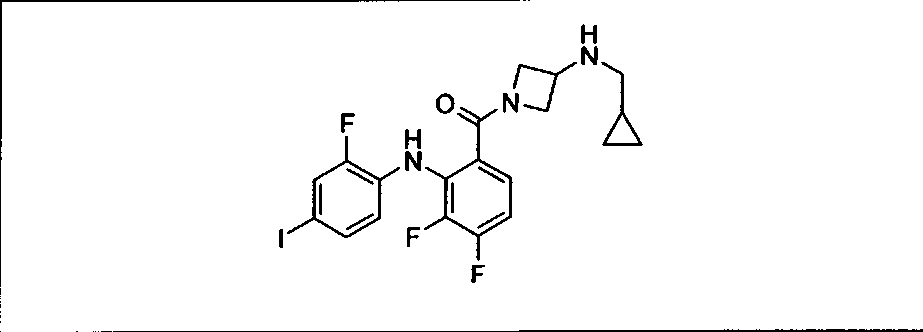
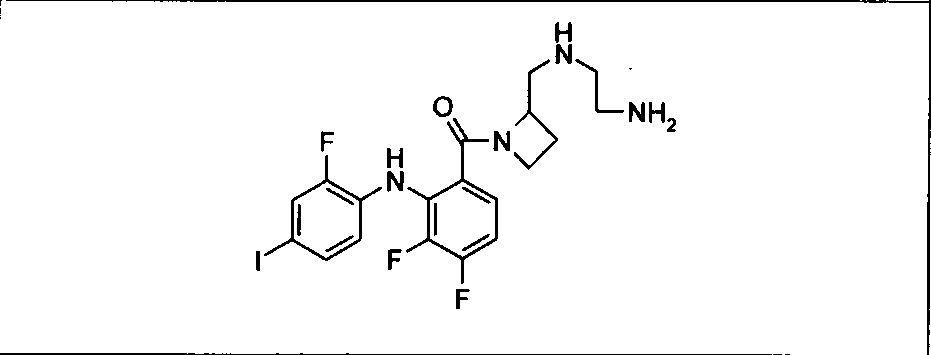
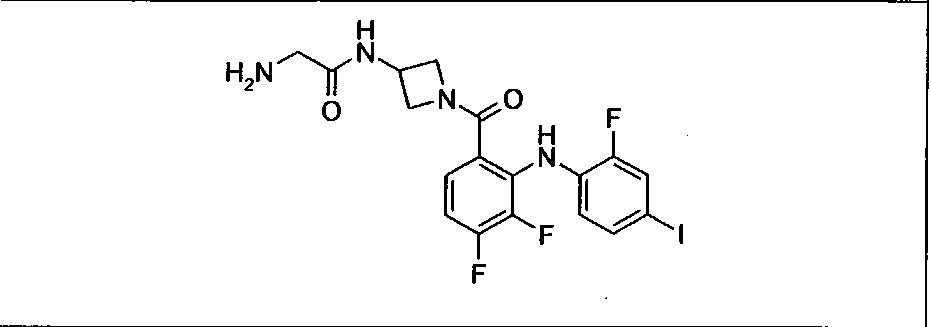
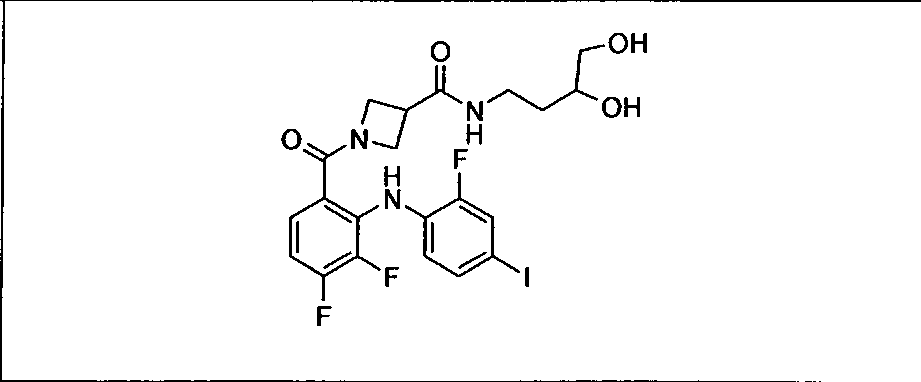
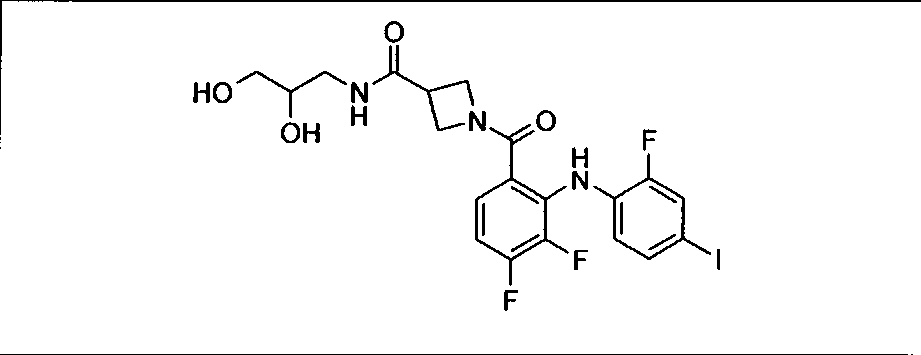
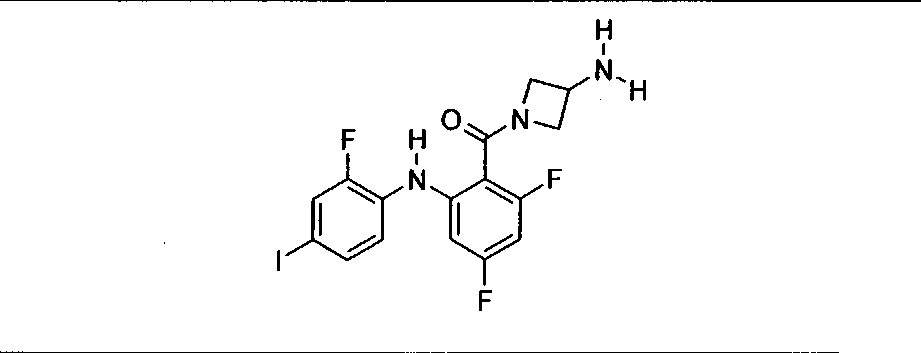
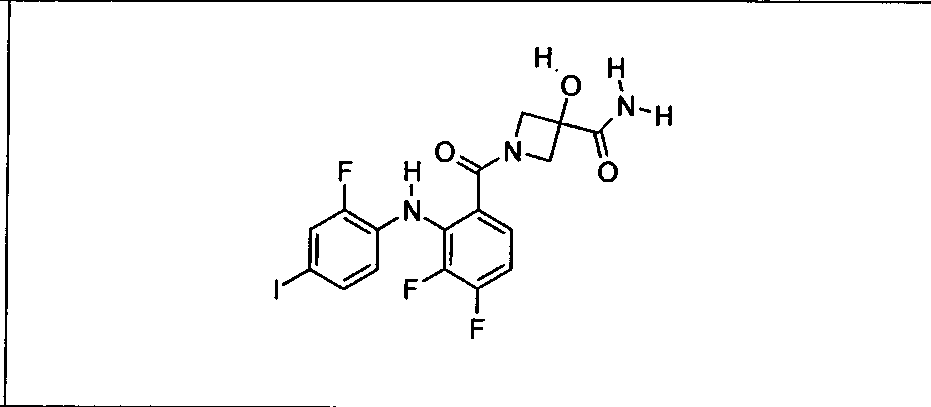
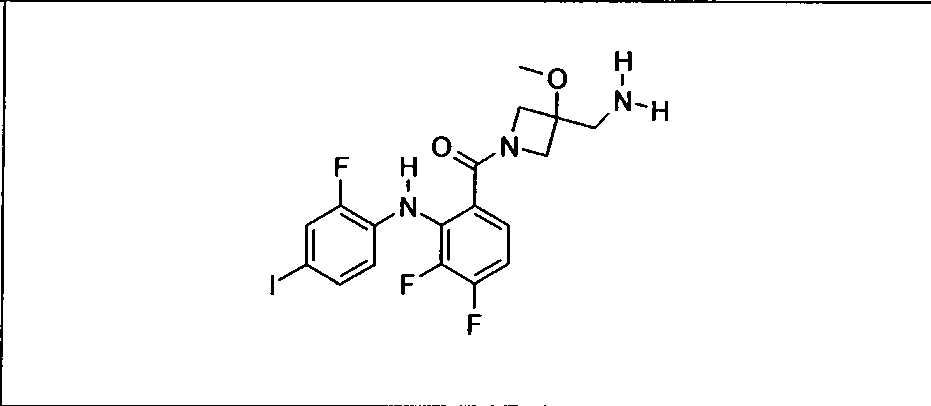
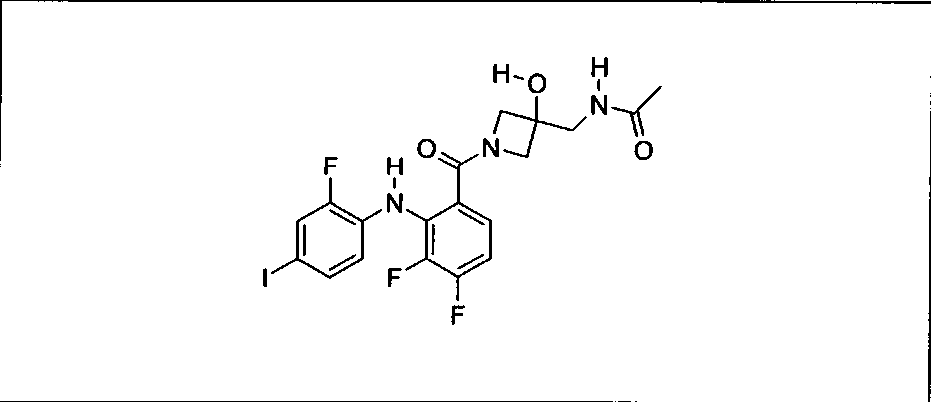
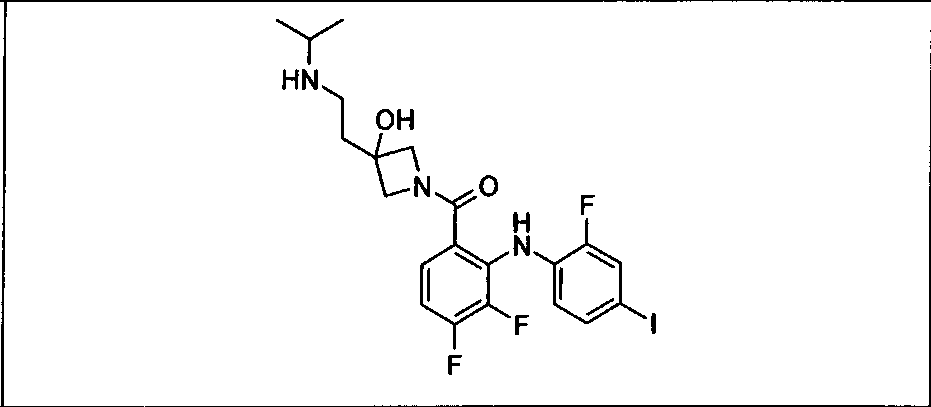
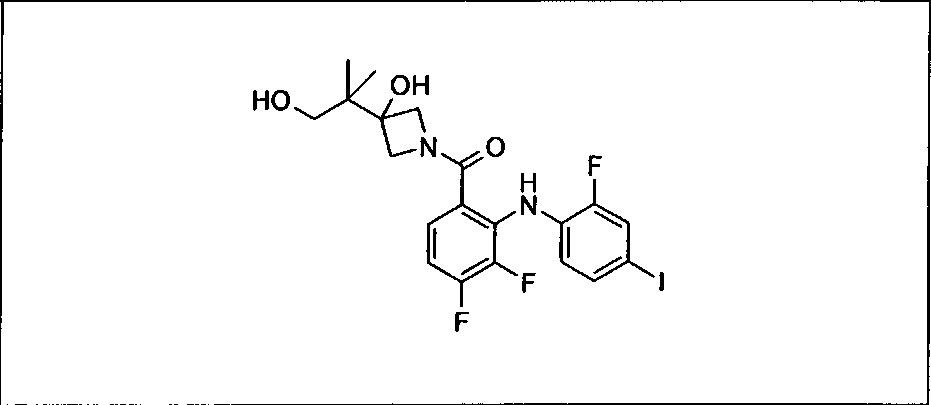
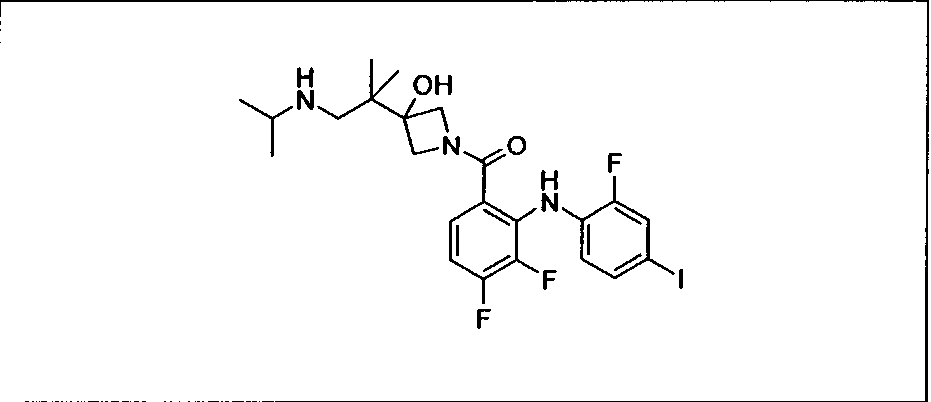
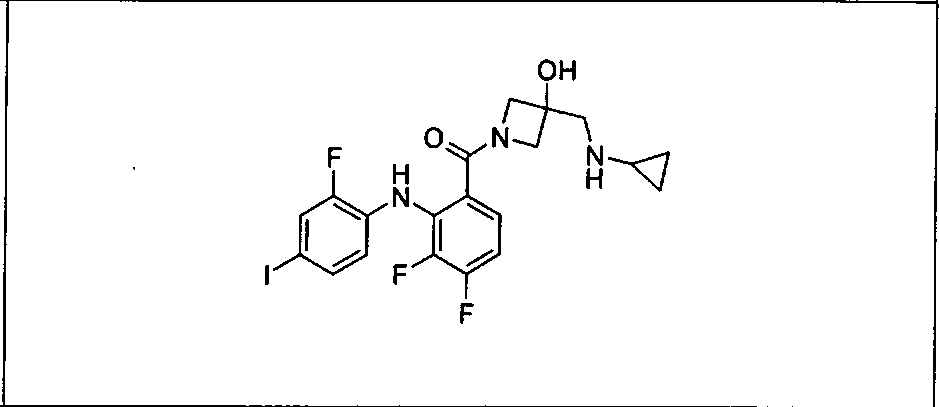
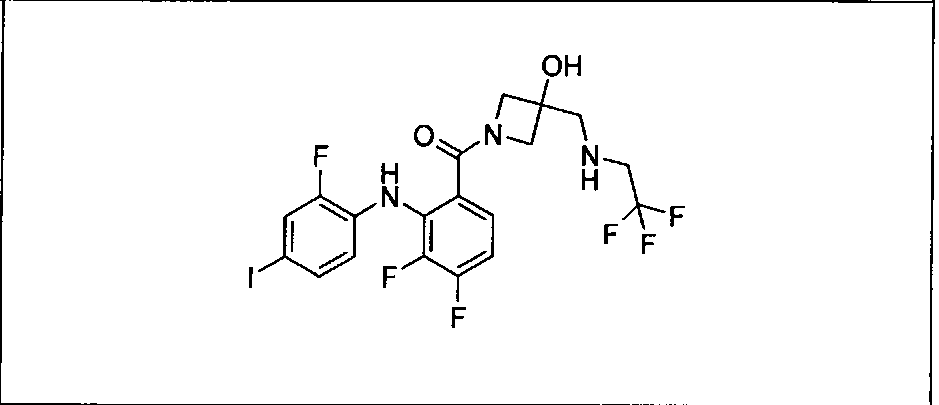
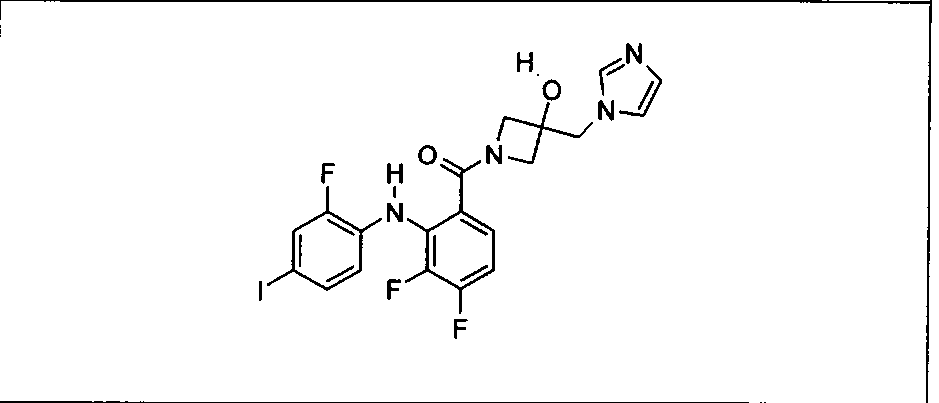
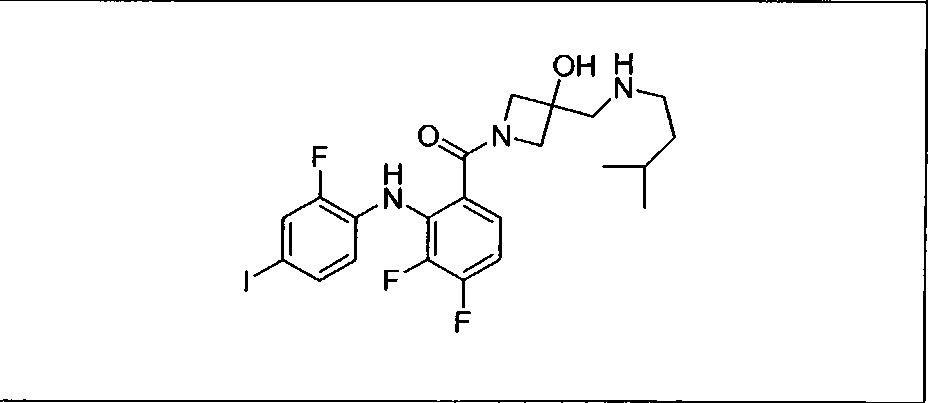
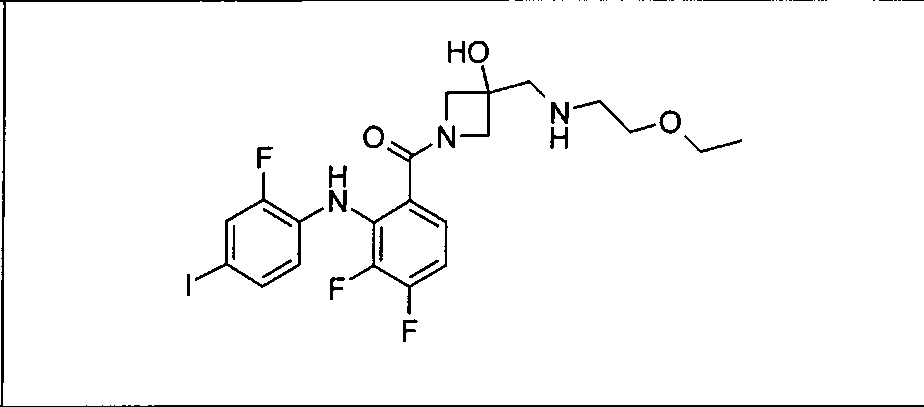
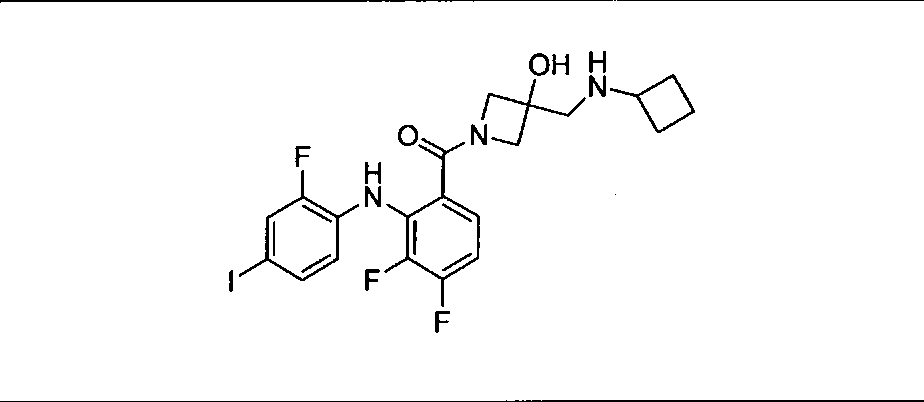
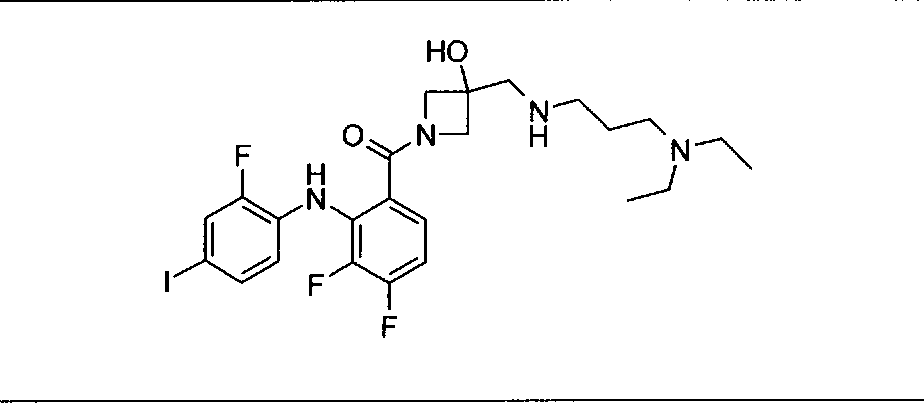
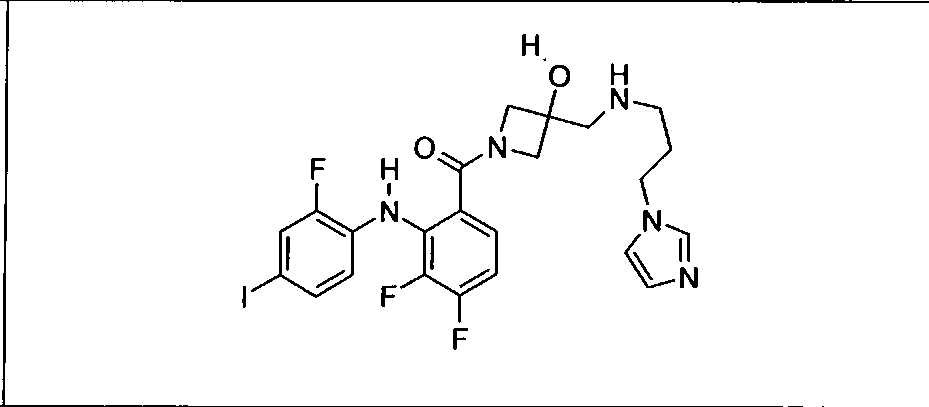
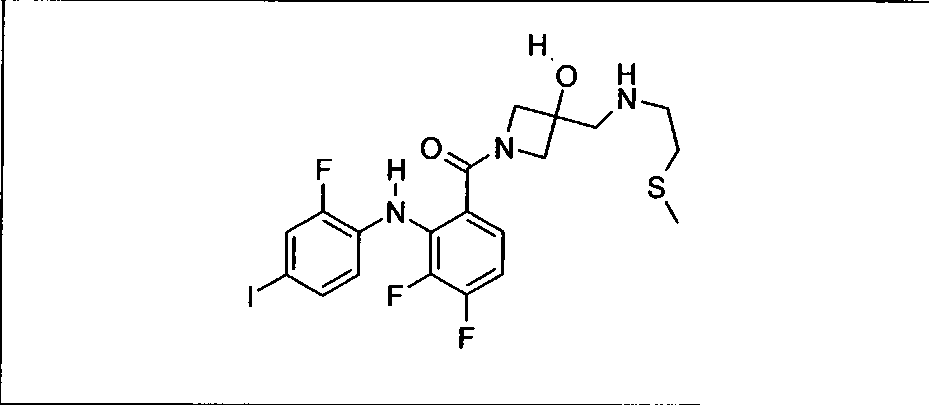
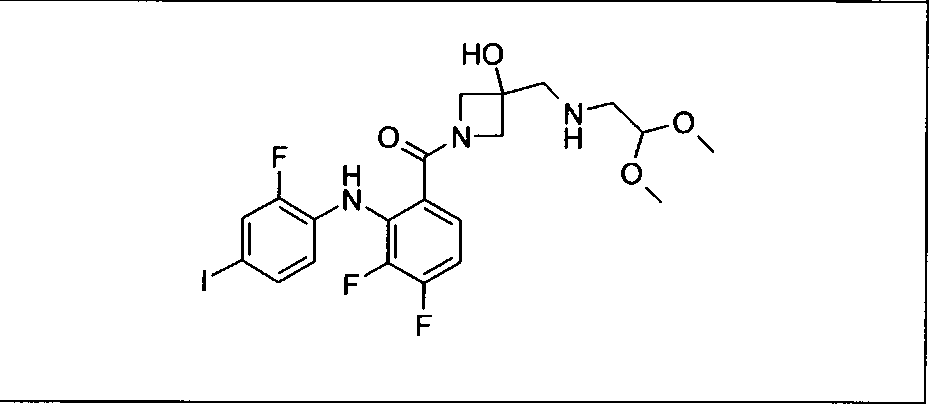
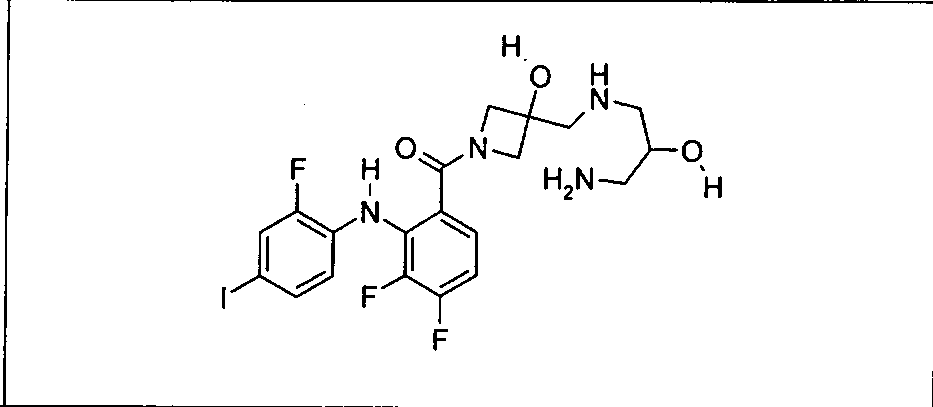
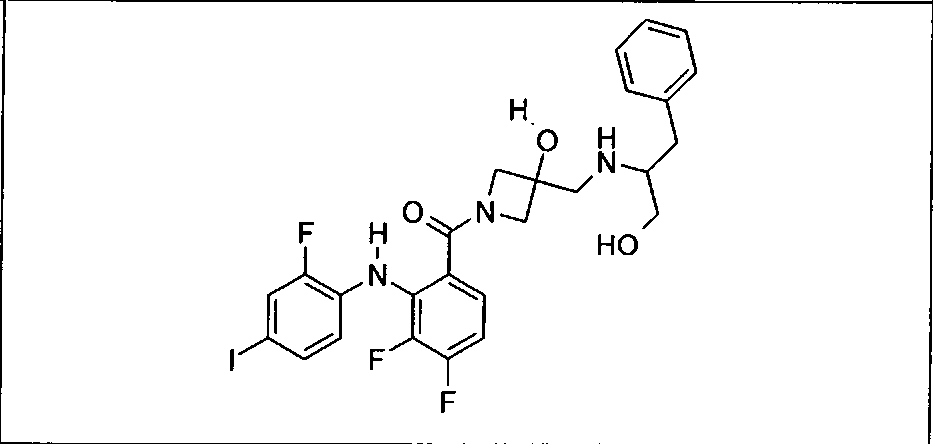
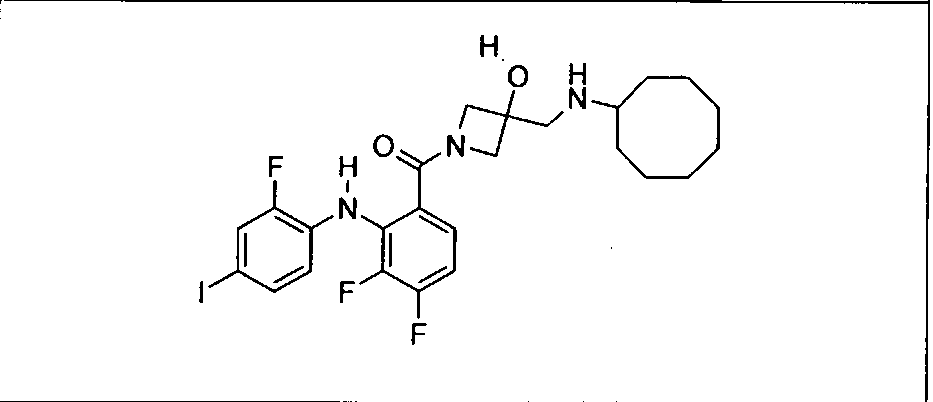
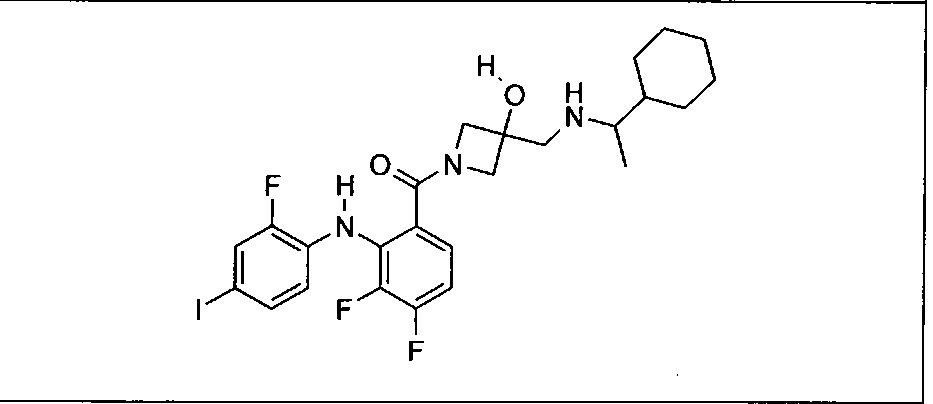
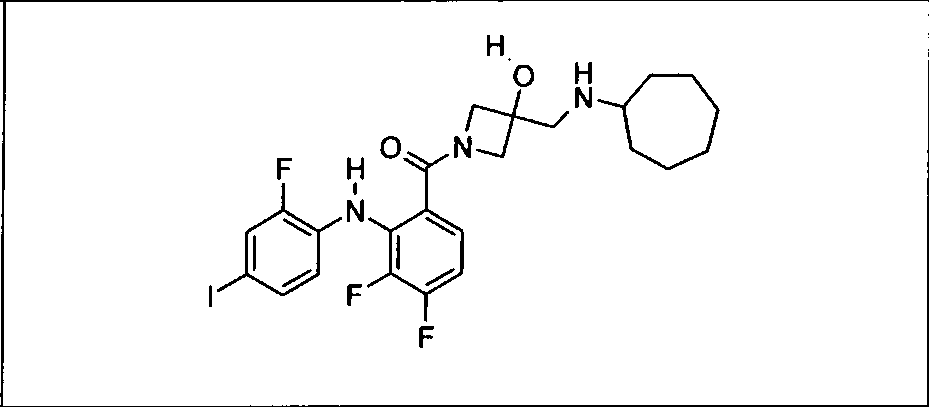
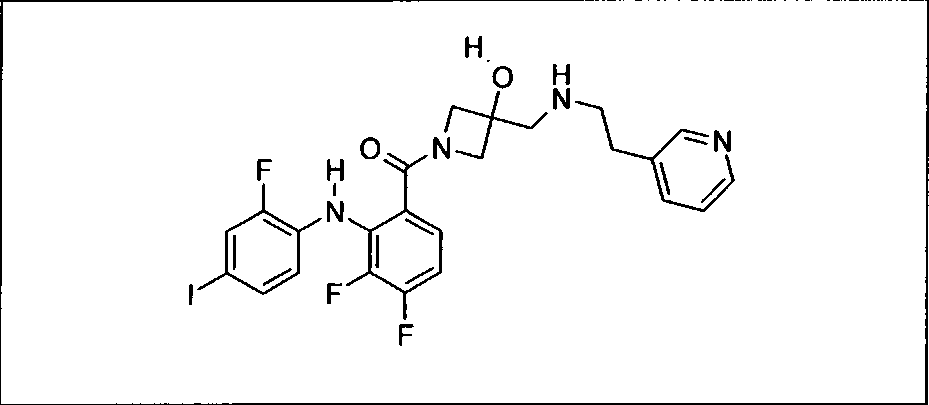
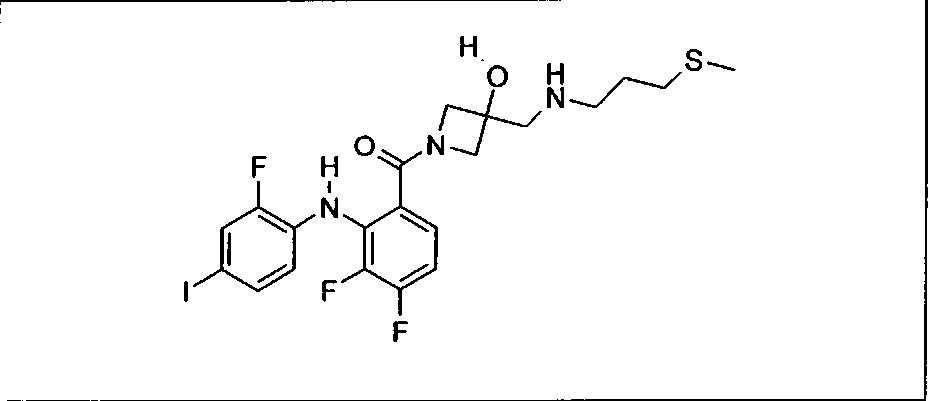
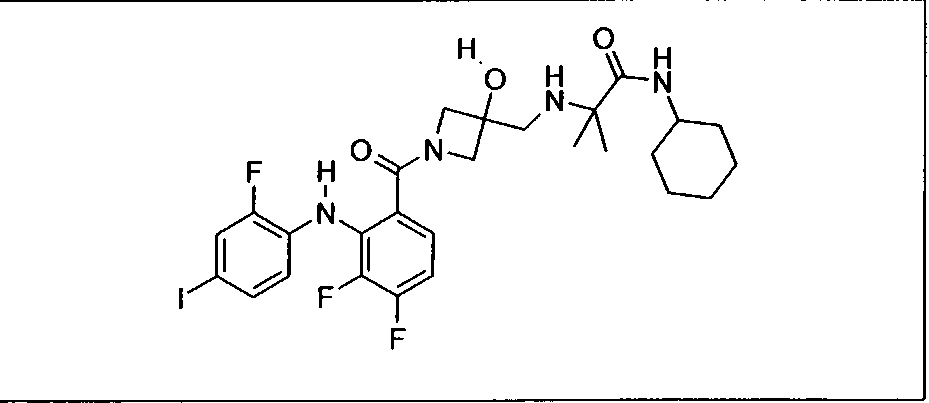
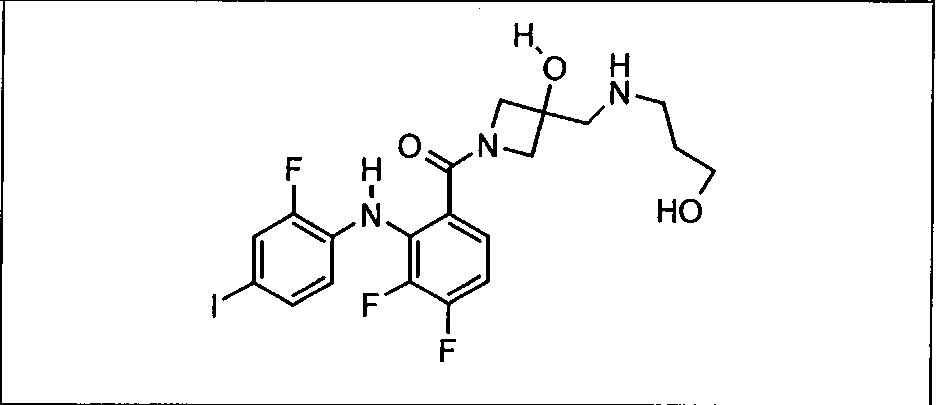
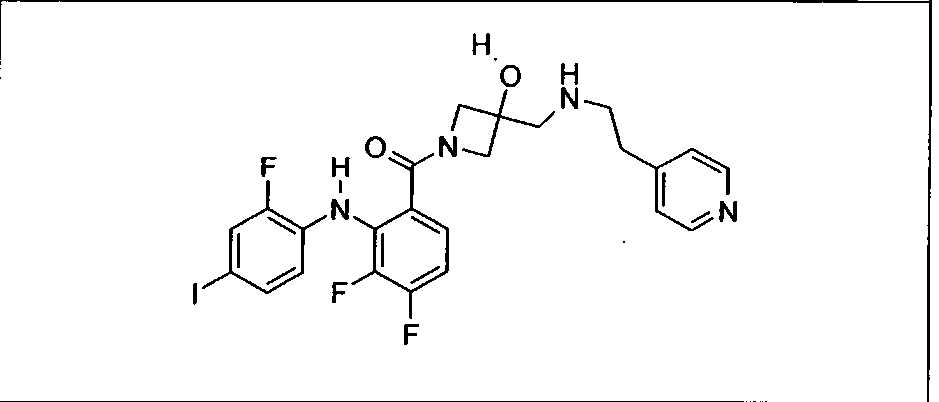
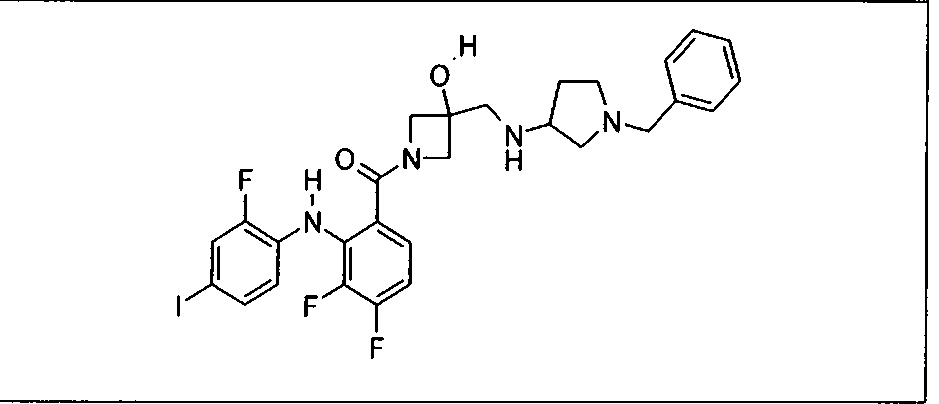
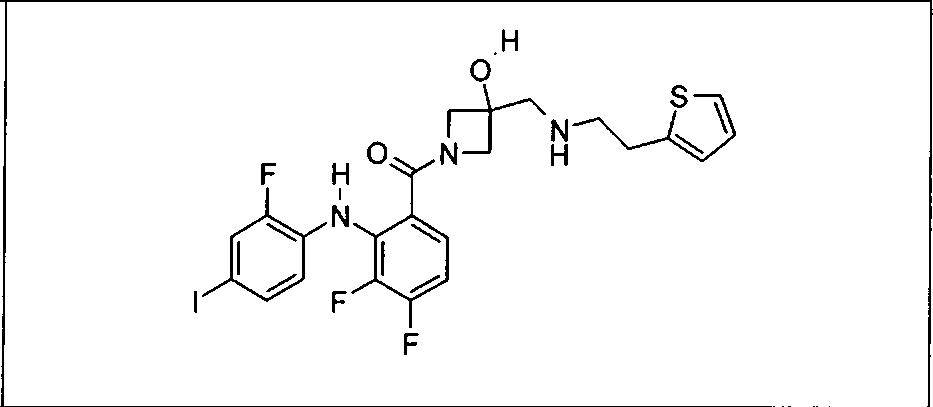
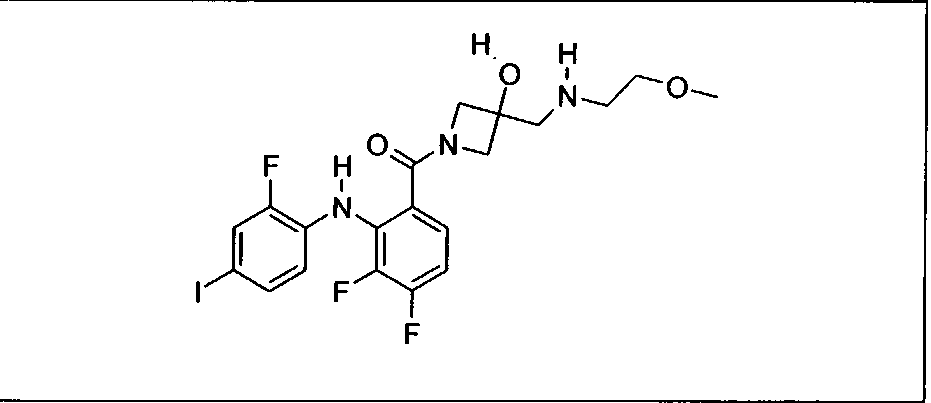
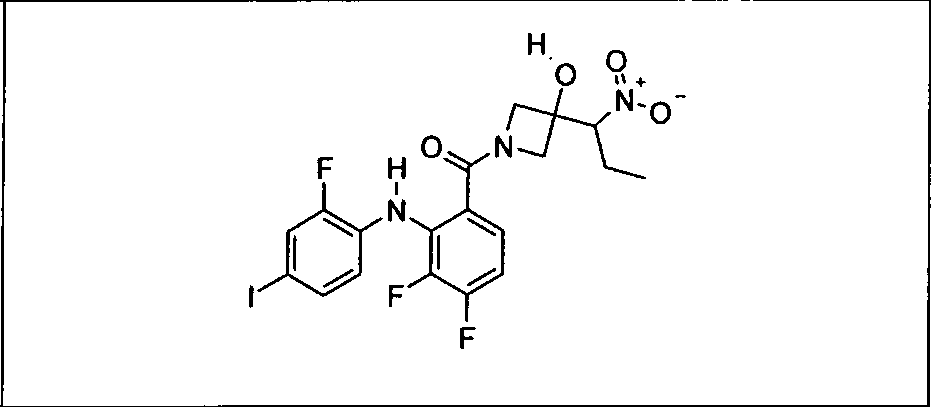
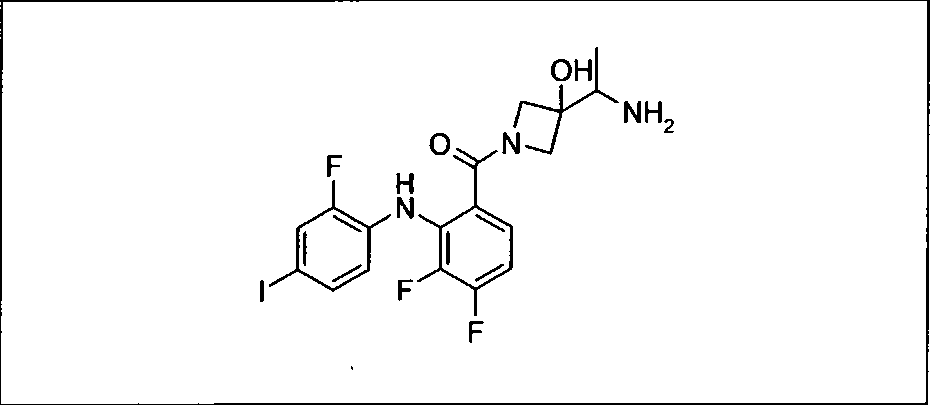
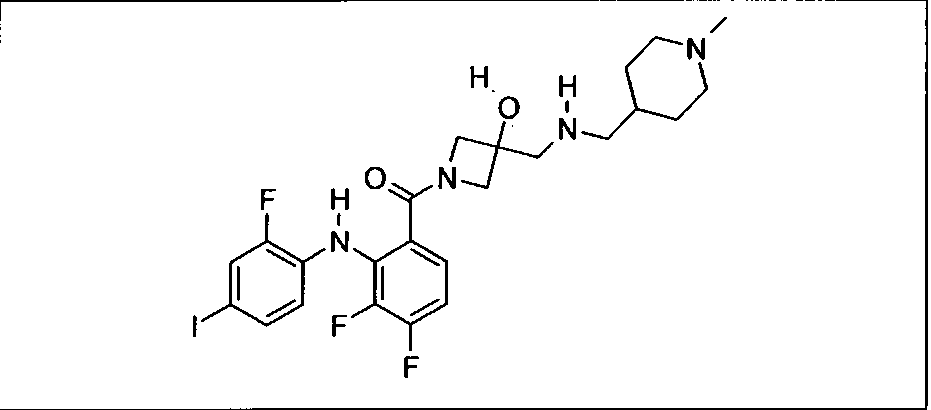
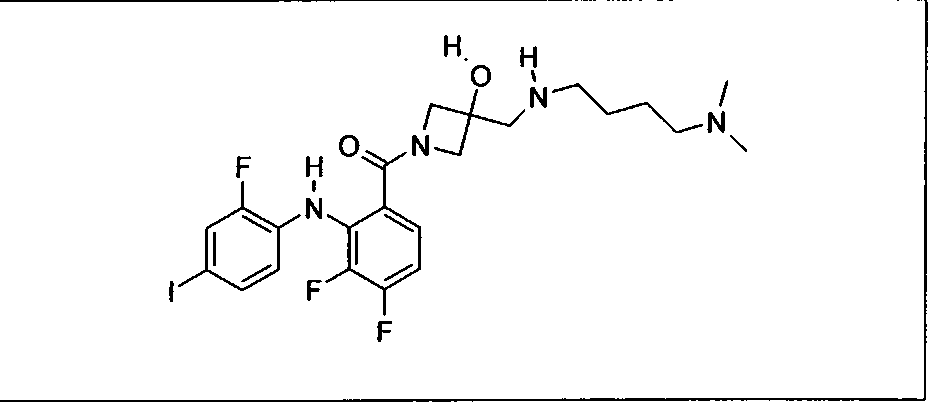
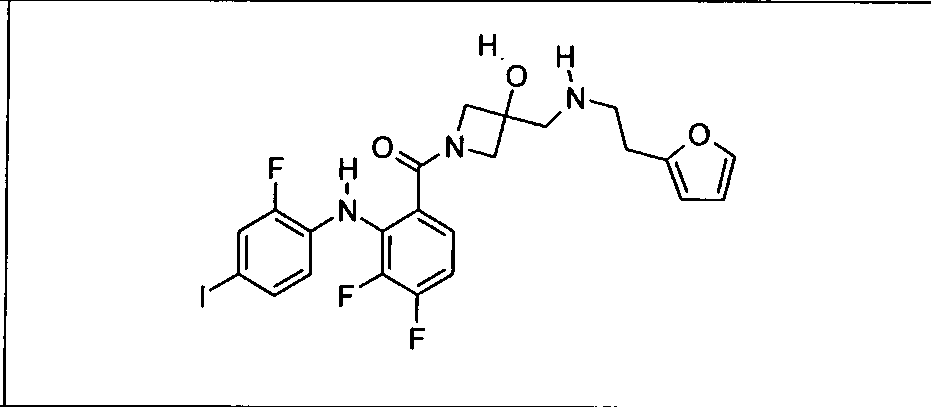
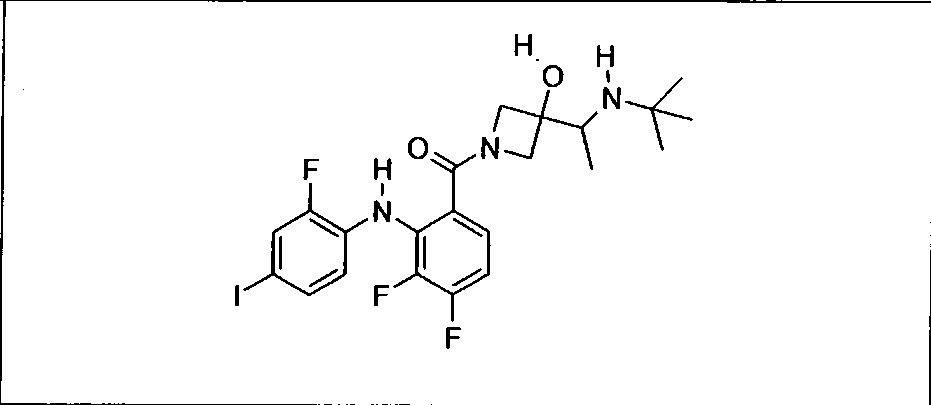
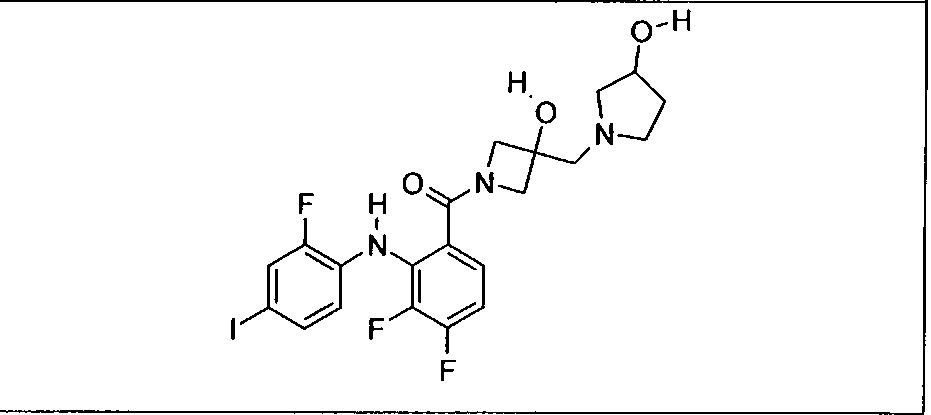
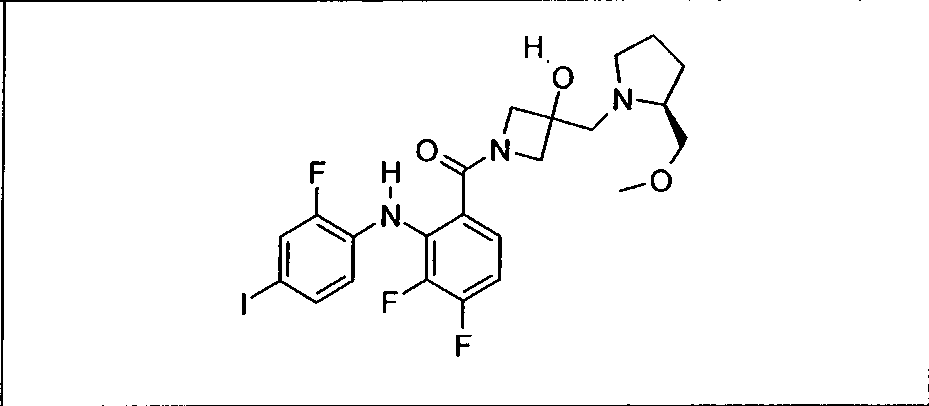
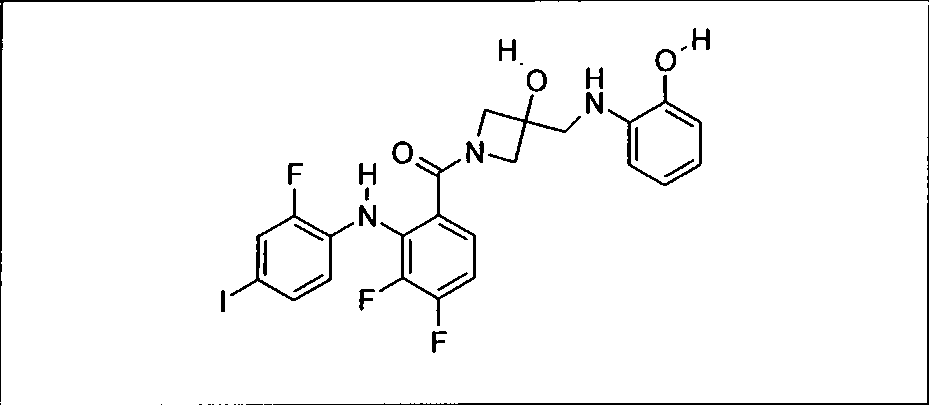
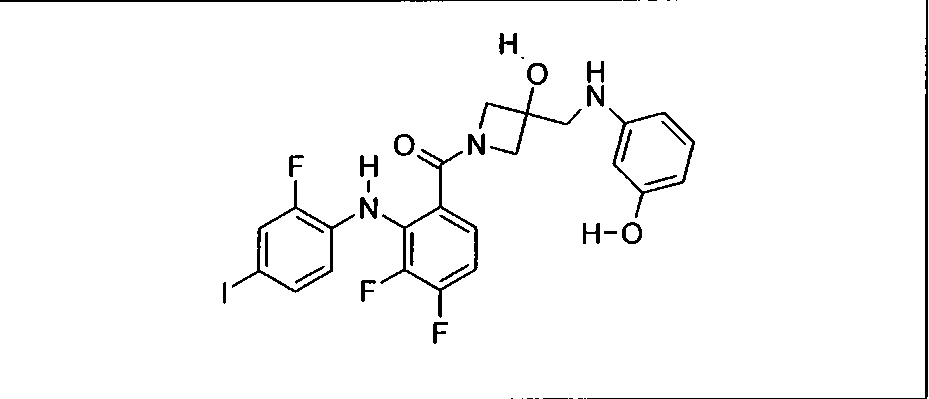
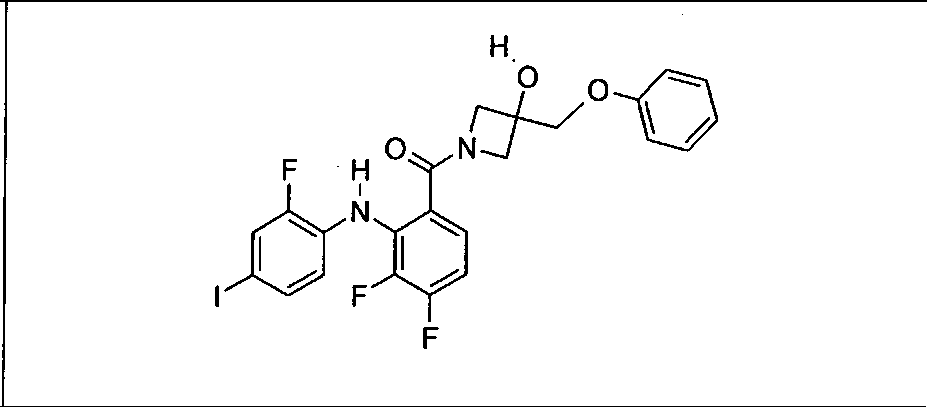
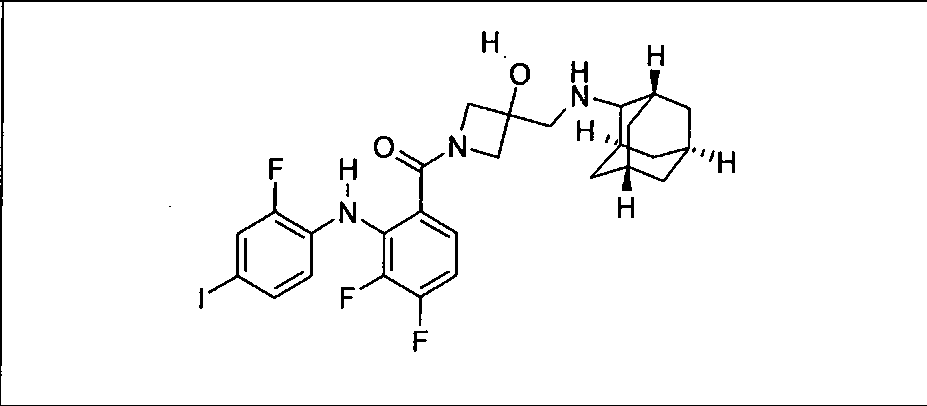
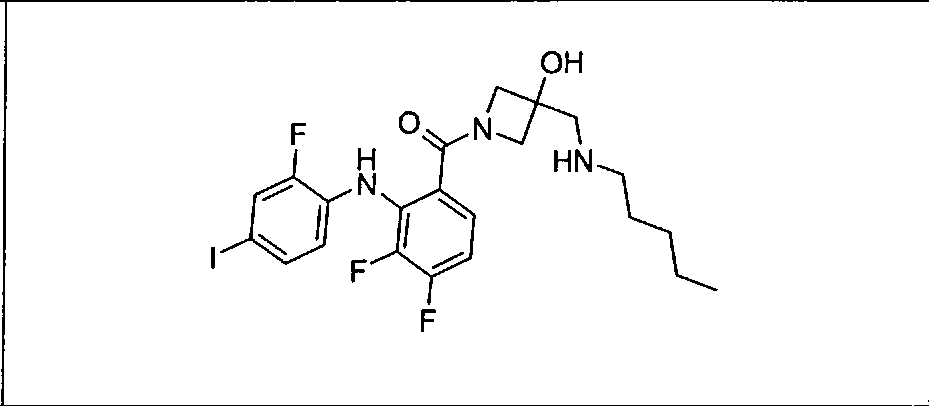
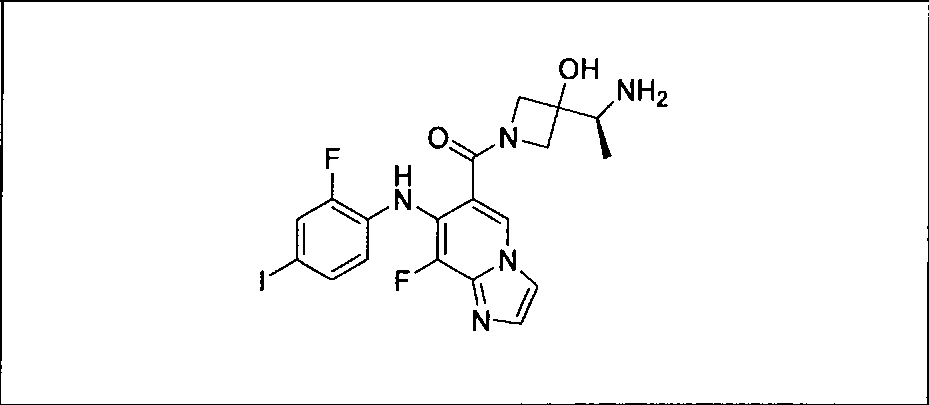
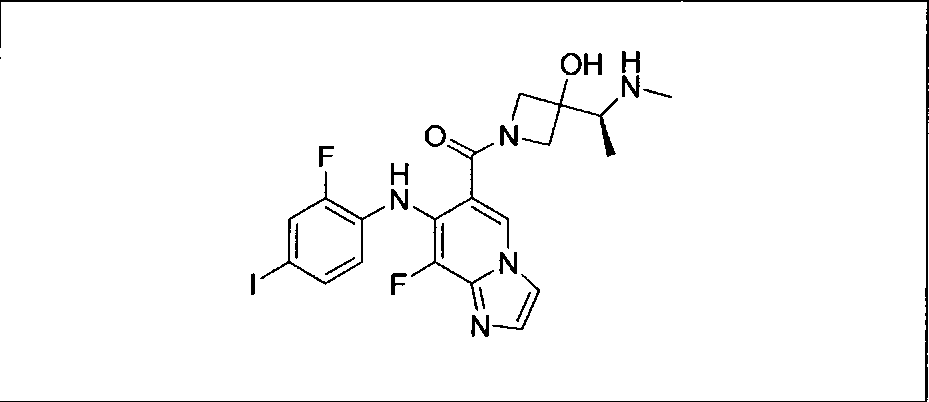
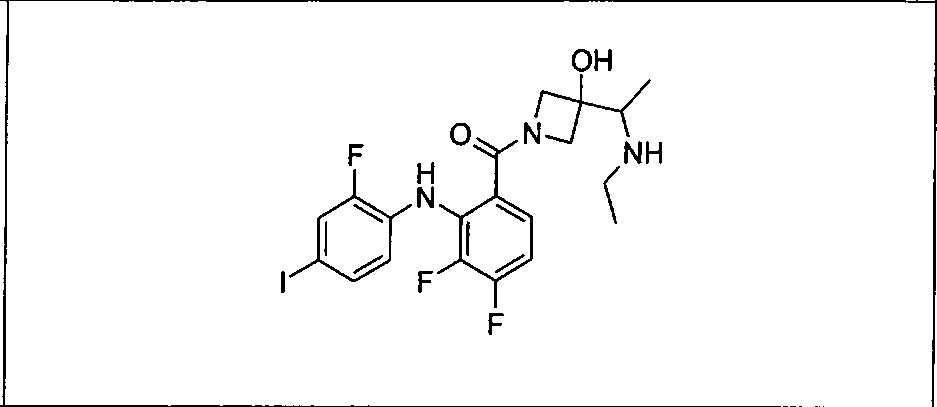
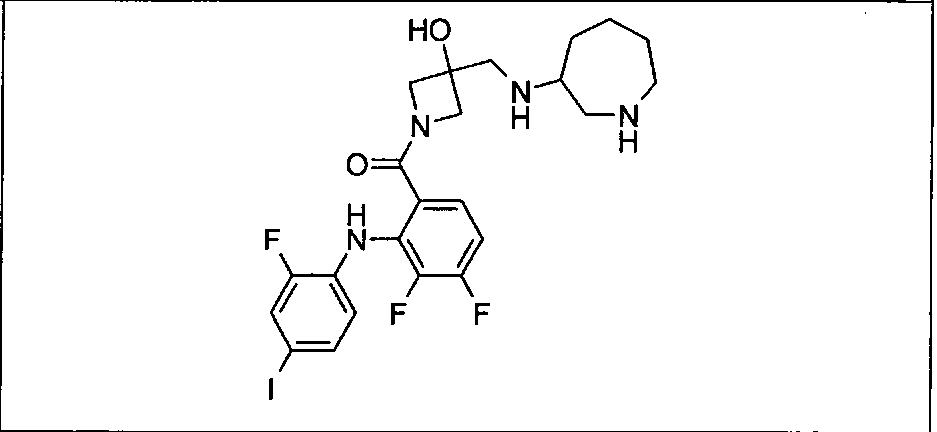
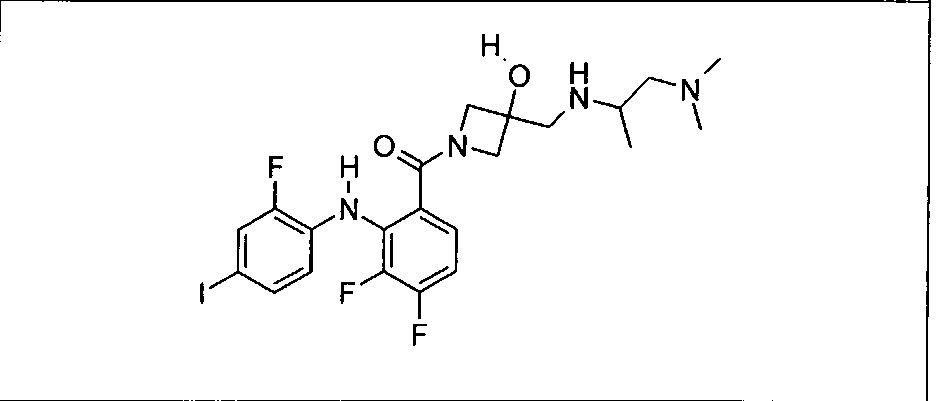
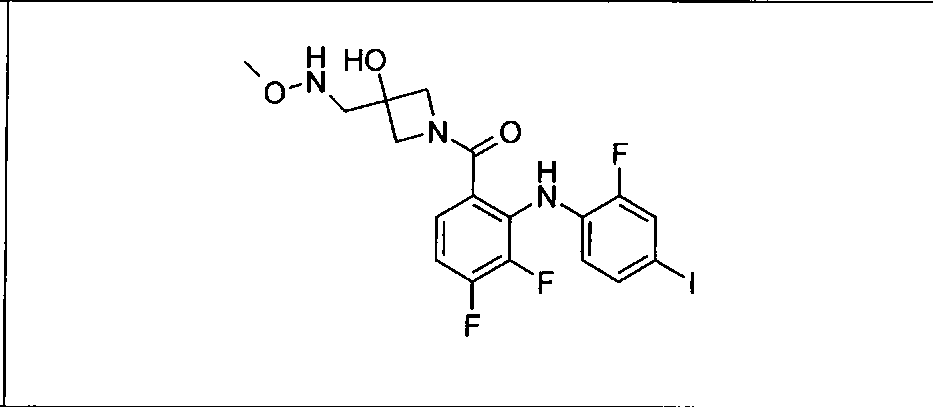
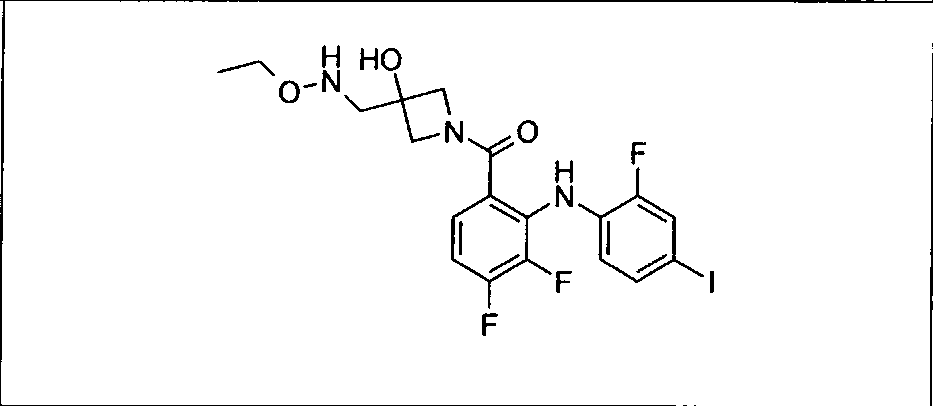
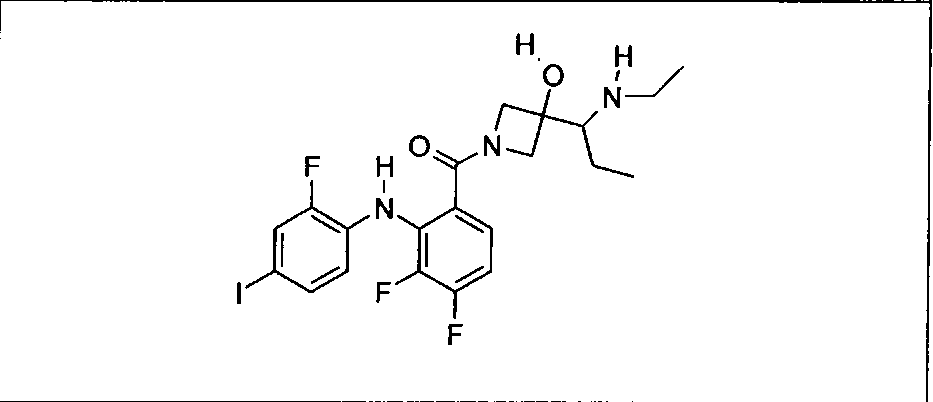
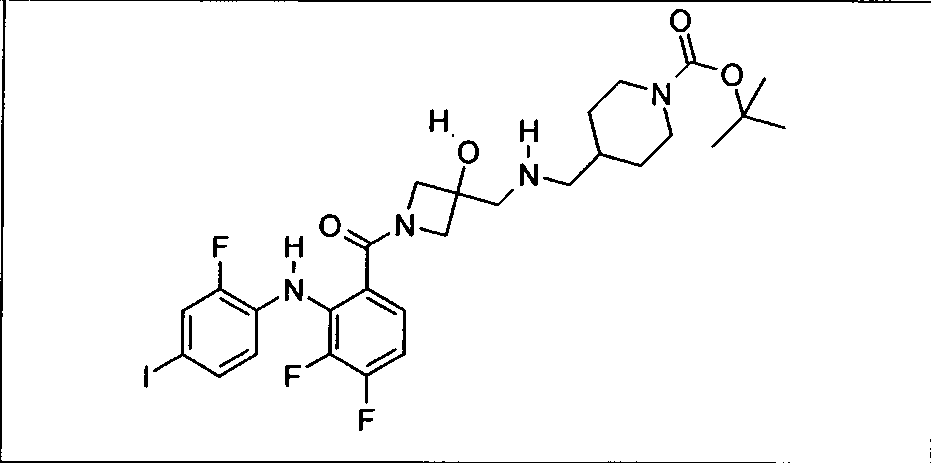
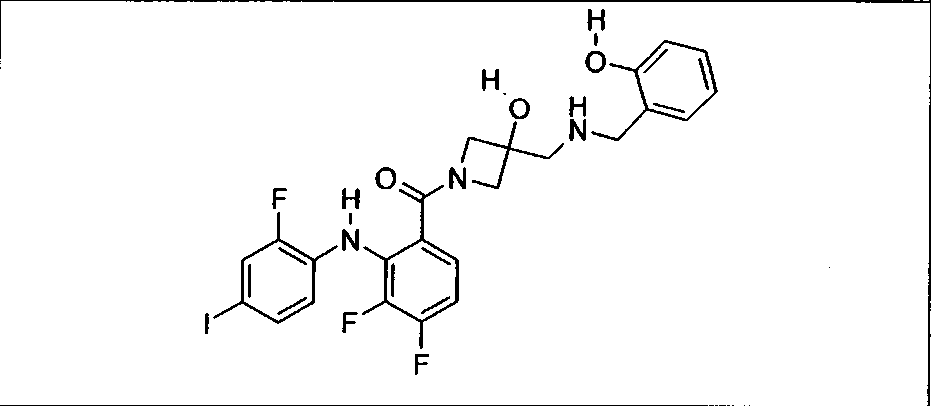
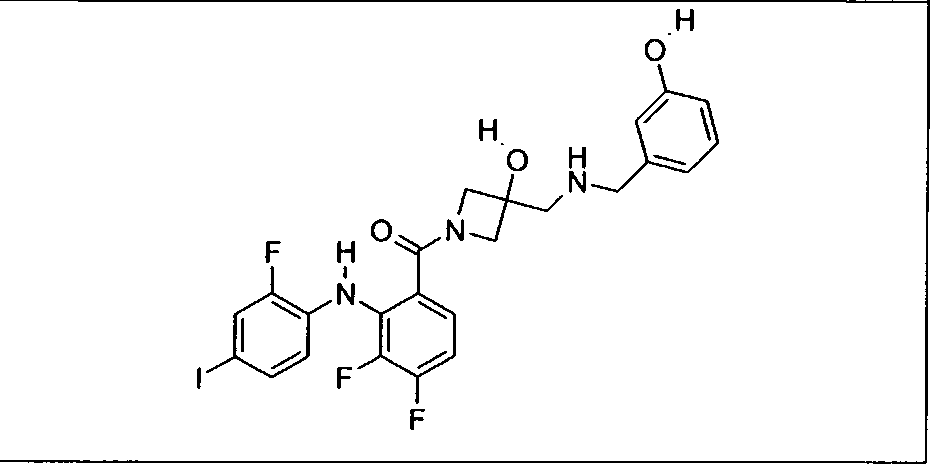
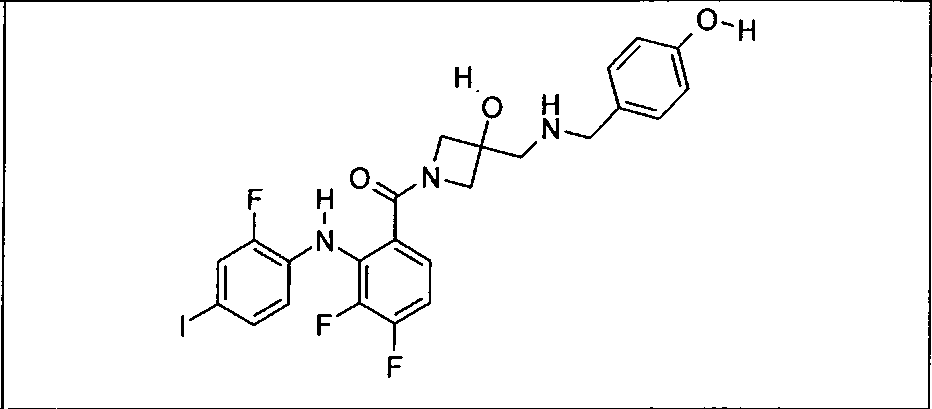
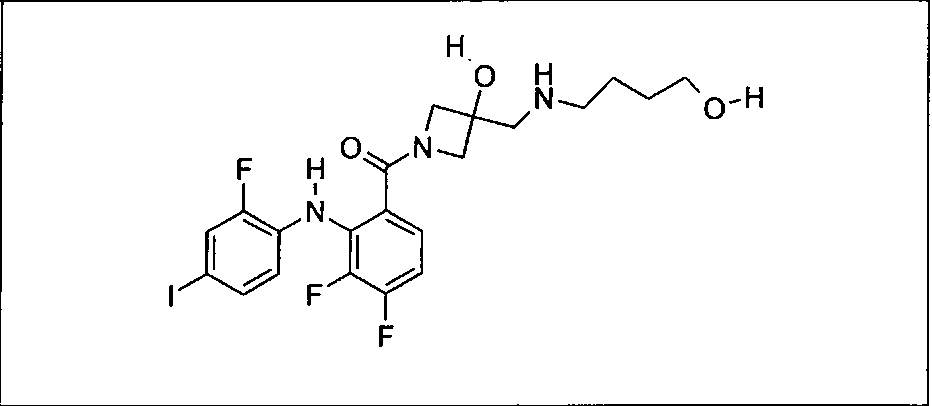
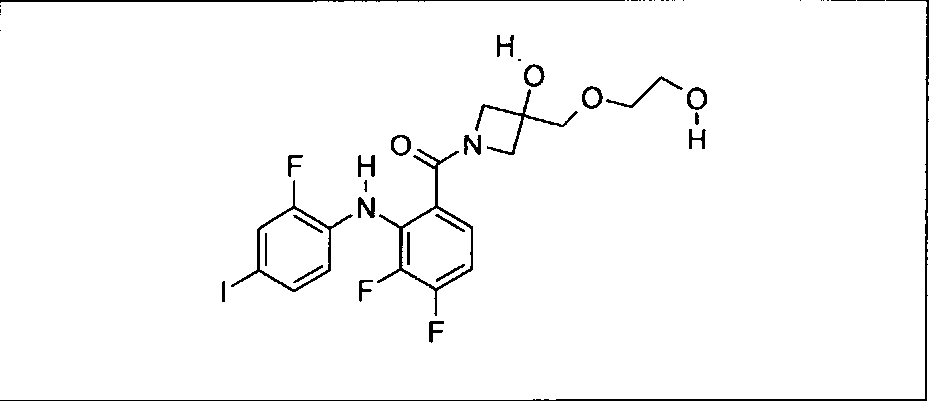
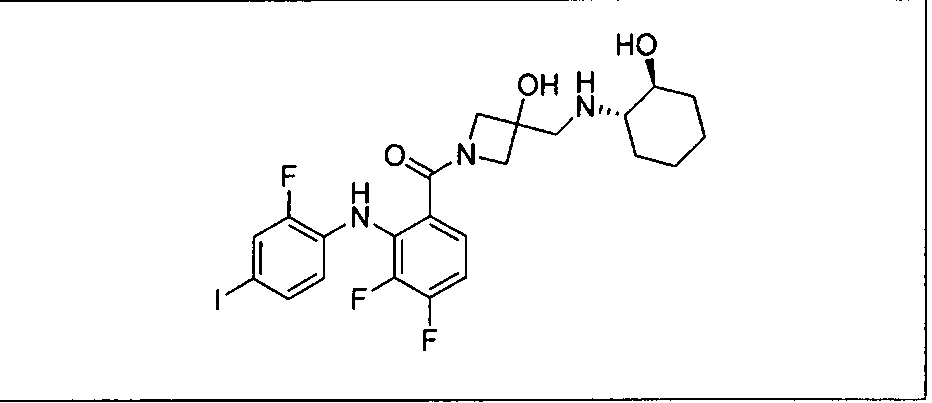
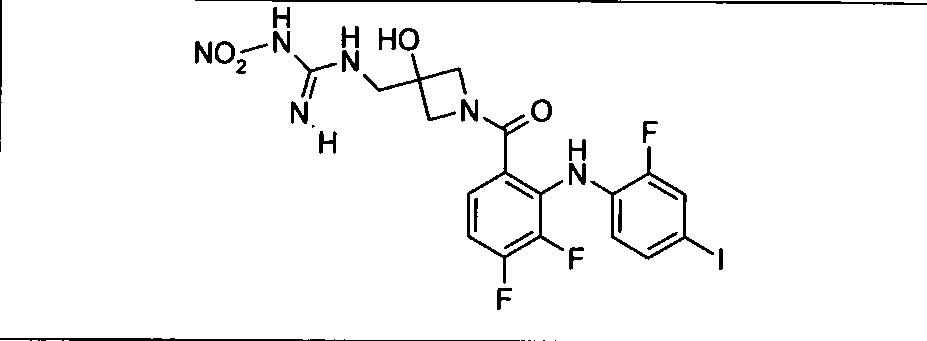
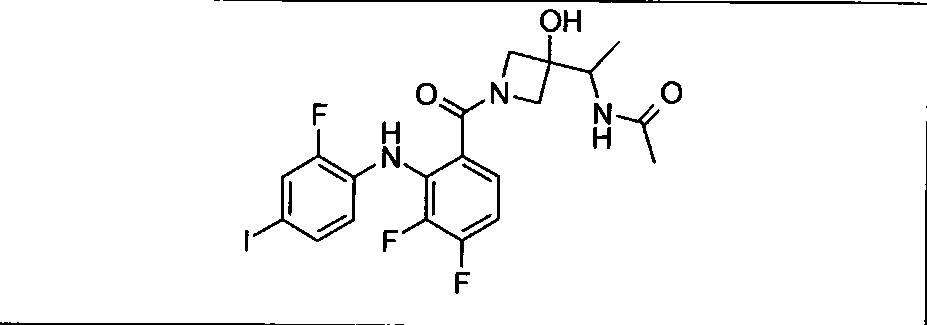
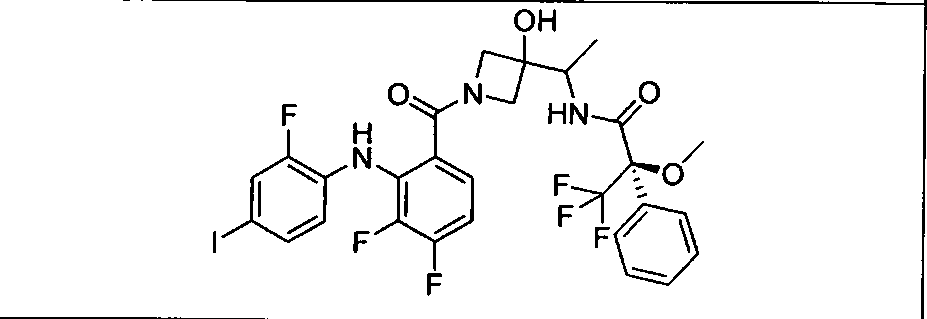
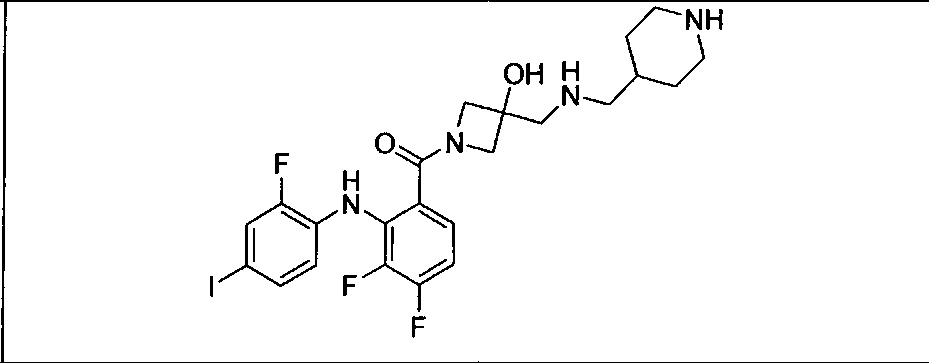
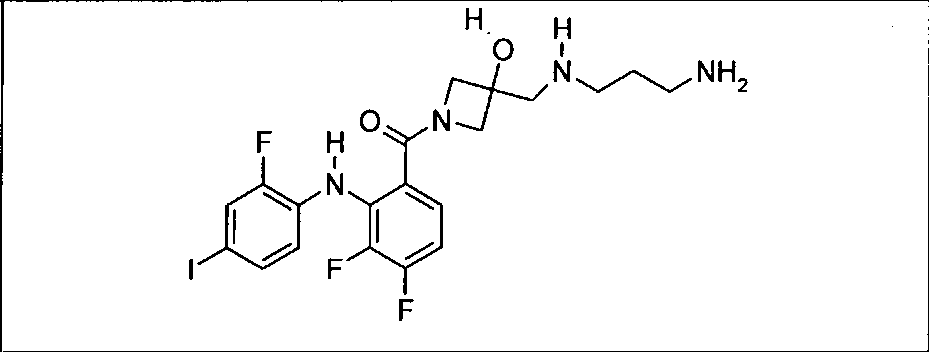
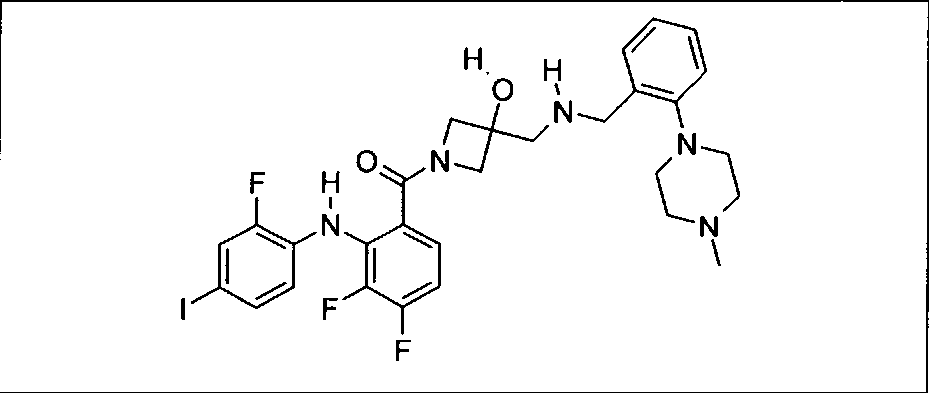
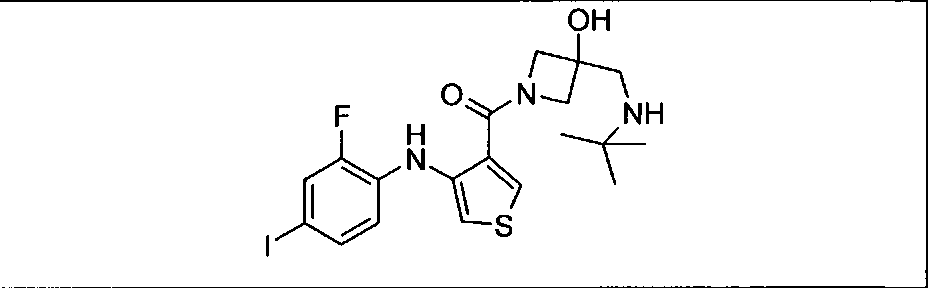
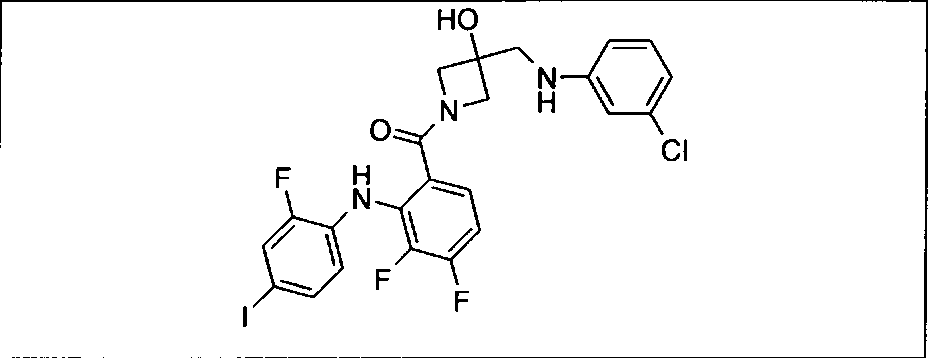
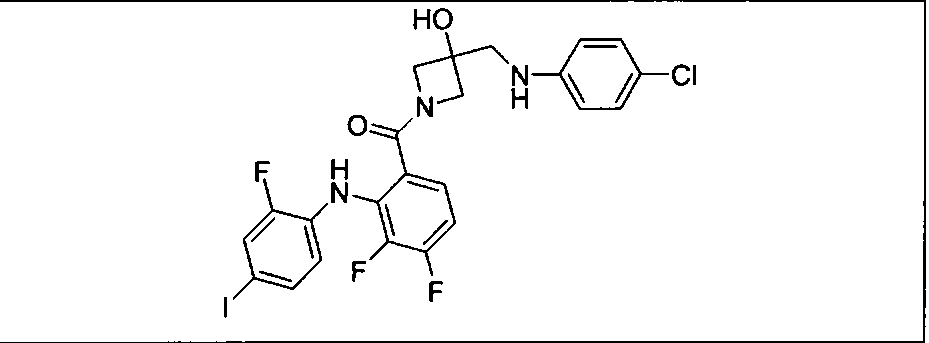
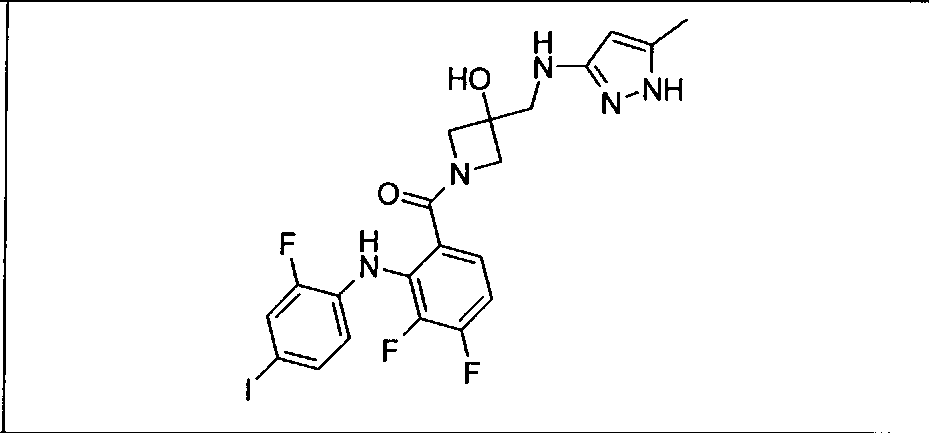
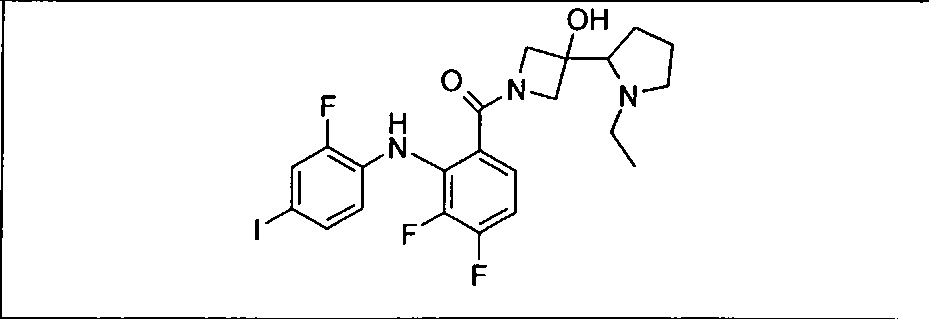
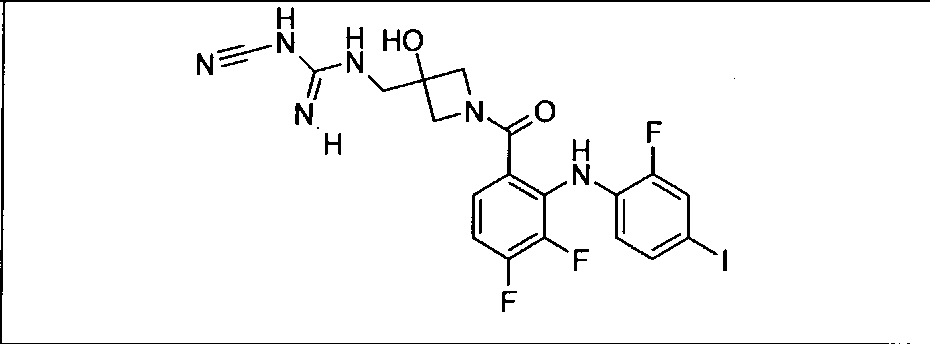
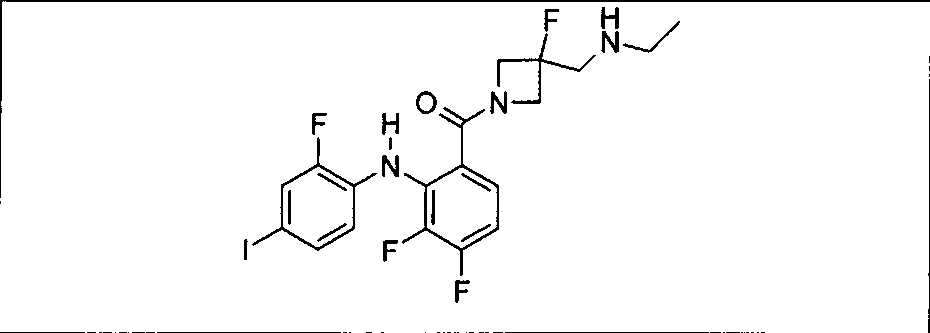
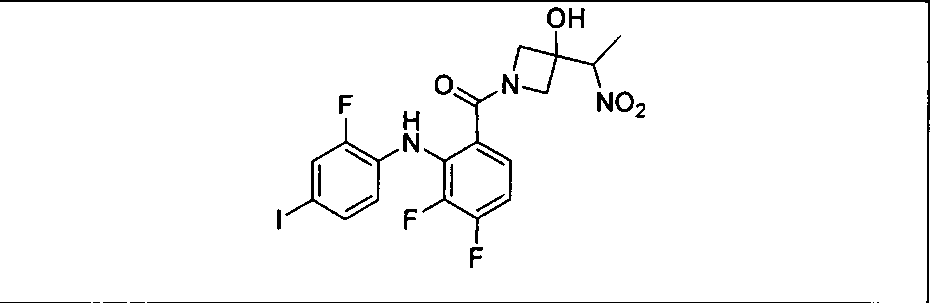
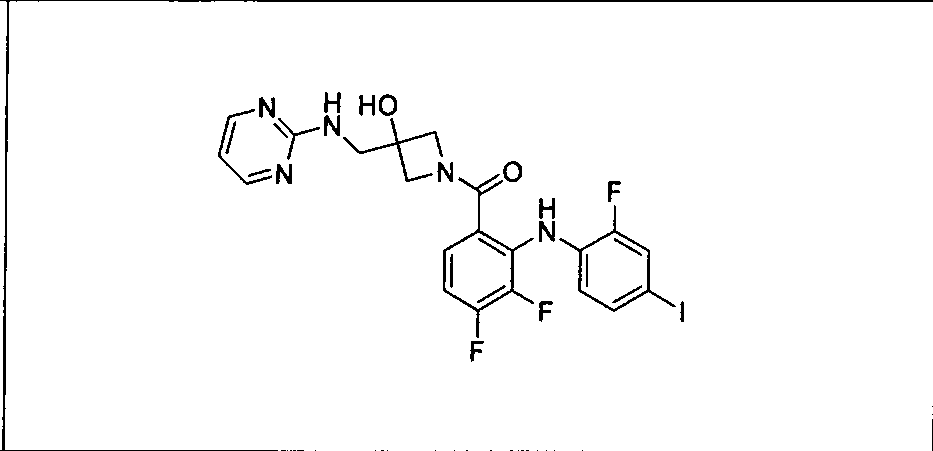
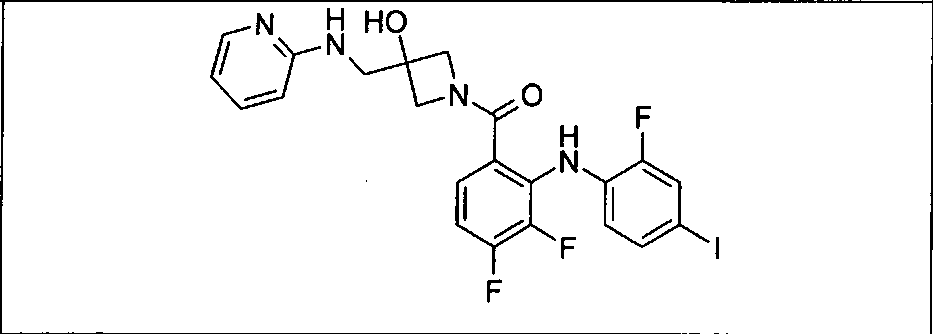
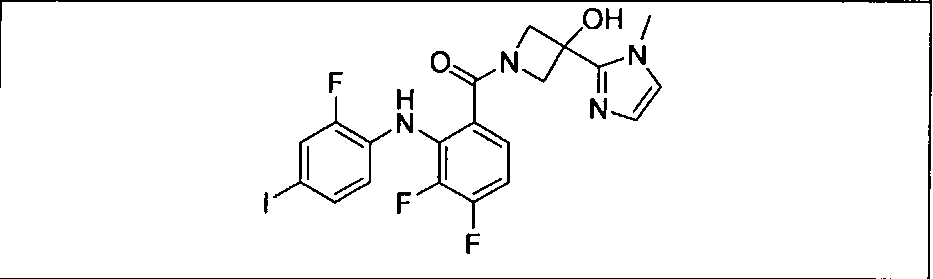
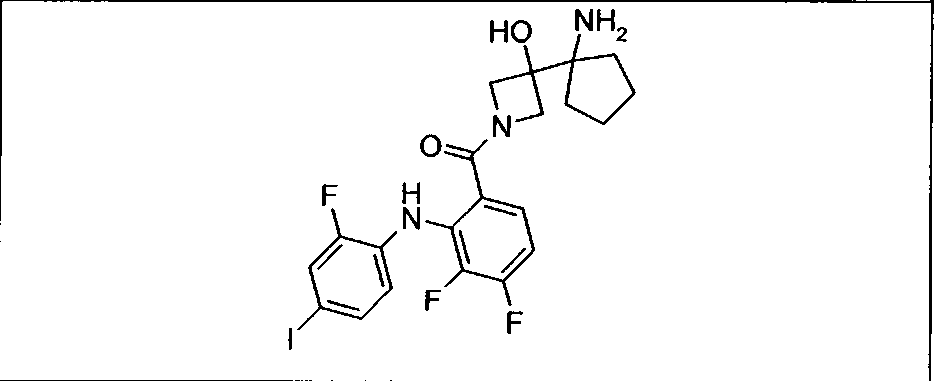
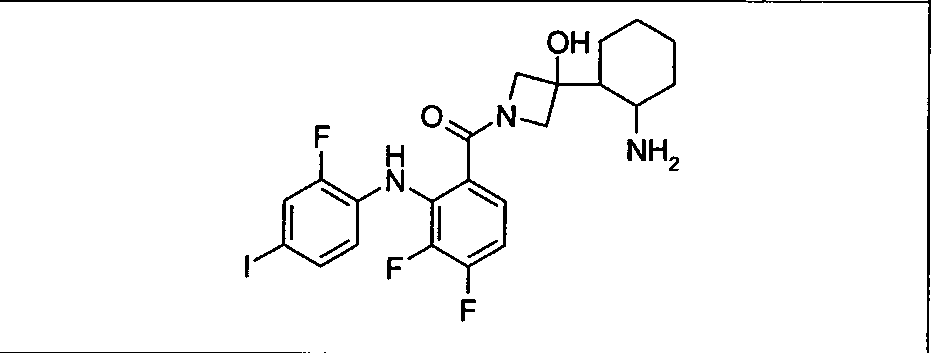
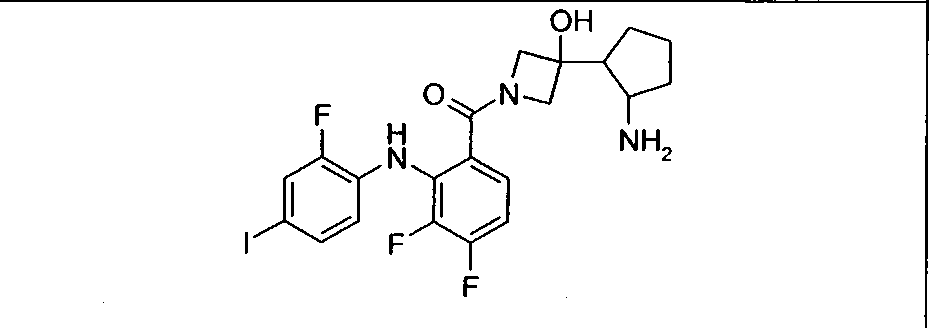
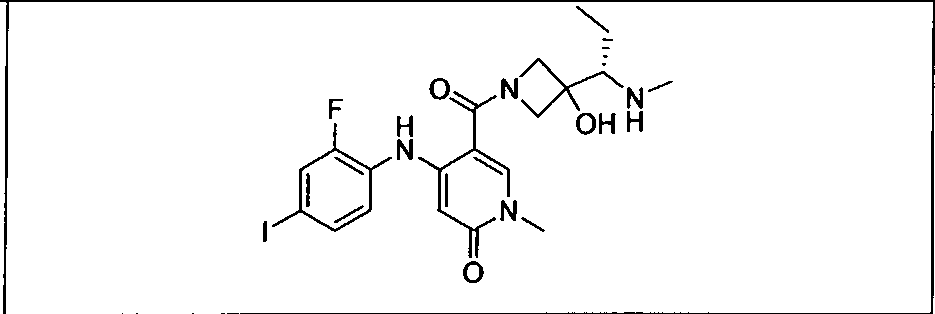
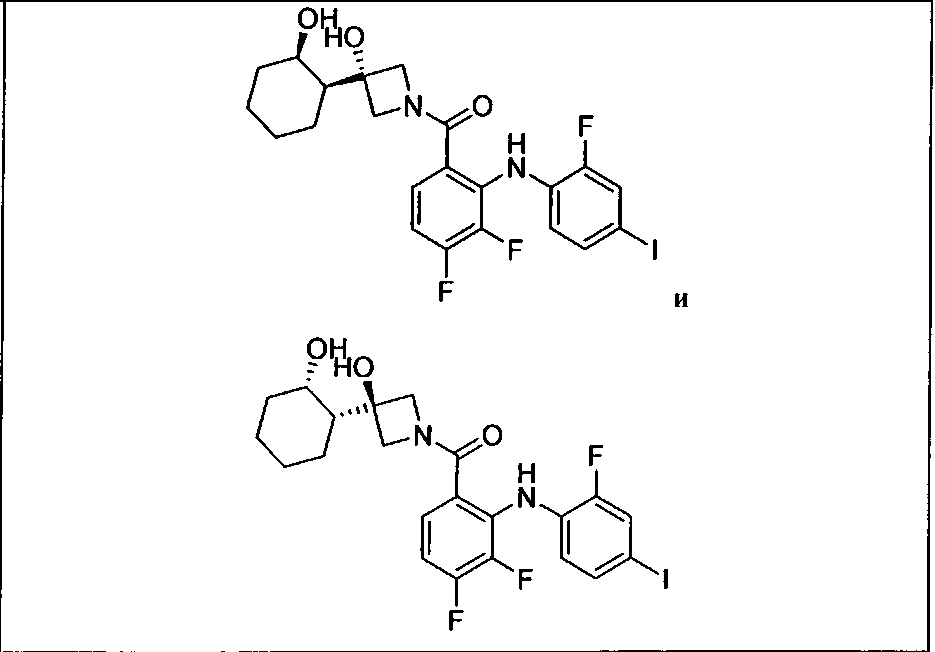
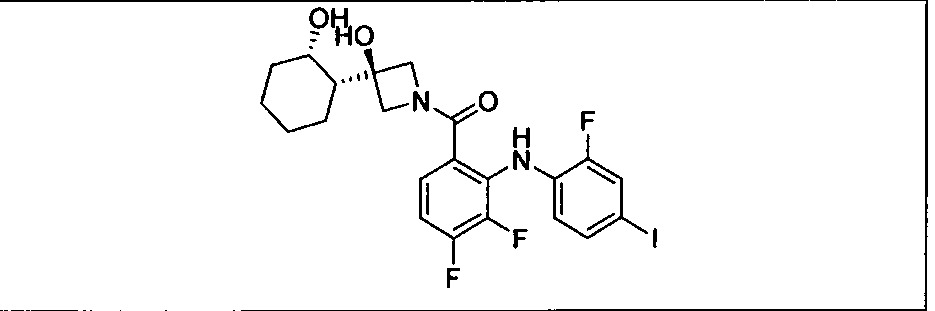
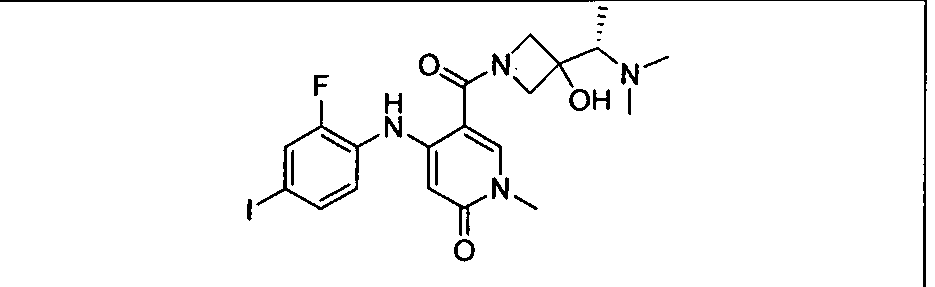
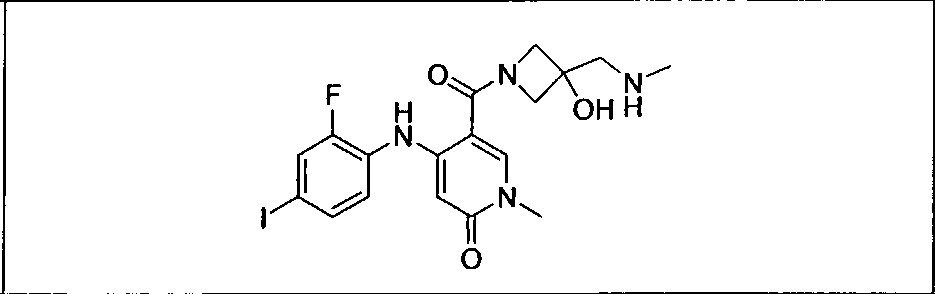
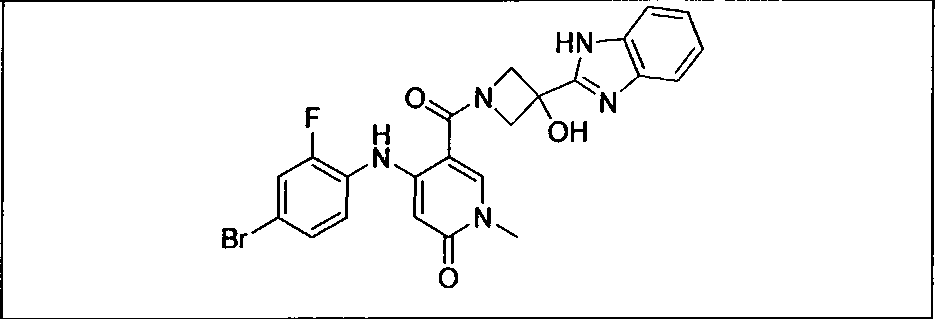
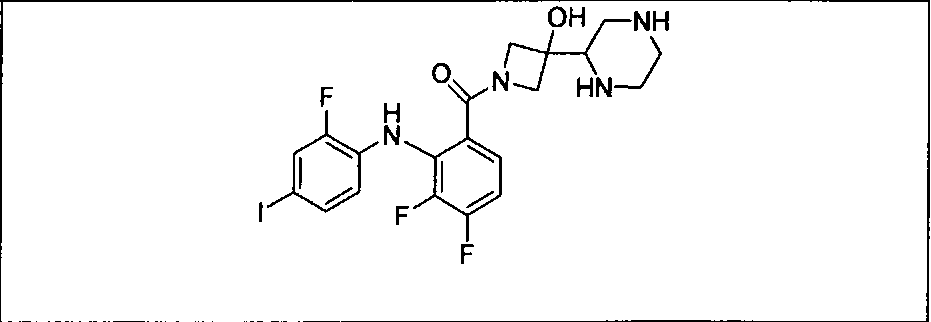
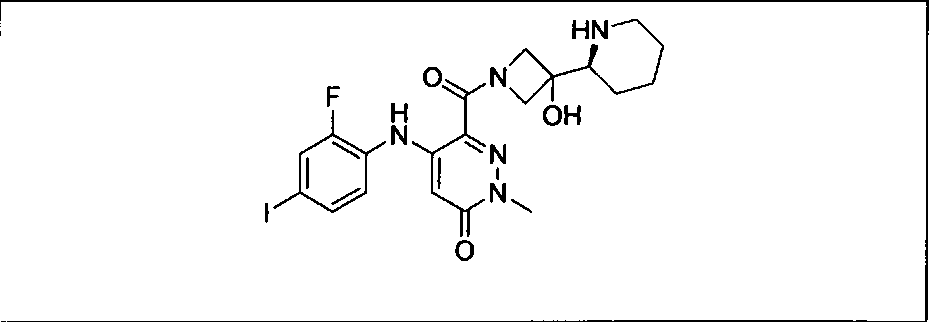
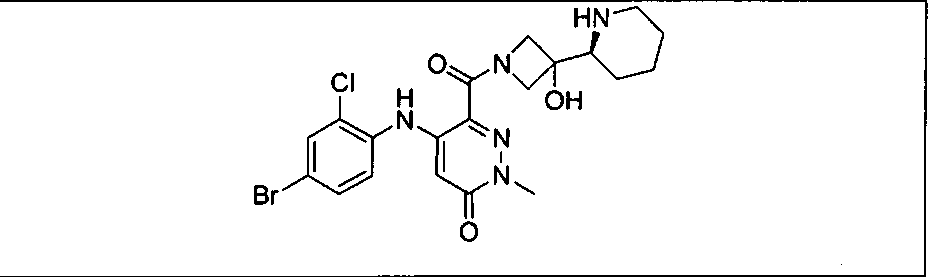
Ингибитор МЕК, применимый в комбинации с GDC-0941, ингибитором PI3K, для лечения пациентов с местнораспространенными или метастазирующими плотными опухолями, согласно описанному в настоящем изобретении в методах, включающий GDC-0973/XL-518 (III), приведен ниже в табл. 1. Ингибиторы МЕК по табл. 1, включая GDC-0973/XL-518, могут быть получены методами, описанными в патенте US 2009/0156576.
В одном из вариантов осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями с помощью 4-(2-(1Н-индазол-4-ил)-6-((4-(метилсульфонил)пиперазин-1-ил)метил)тиено[3,2-d]пиримидин-4-ил)морфолина, также обозначаемого GDC-0941, ингибитором РОК, в комбинации с ингибитором МЕК, описанным в настоящем изобретении.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно GDC-0941 в комбинации с ингибитором МЕК, выбранным из табл.1, включая GDC-0973/XL-518.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями с помощью (S)-1-(4-((2-(2-аминопиримидин-5-ил)-7-метил-4-морфолинотиен [3,2-d]пиримидин-6-ил)метил)пиперазин-1-ил)-2-гидроксипропан-1-оном (II), ингибитором PI3K, в комбинации с ингибитором МЕК, описанным в настоящее изобретении.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно II в комбинации с ингибитором МЕК, выбранной из табл.1, включая GDC-0973/XL-518.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно GDC-0941 (I) и GDC-0973/XL-518 (III).
В другом варианте осуществления настоящее изобретение относится к способу лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающему введение указанному пациенту одновременно II и GDC-0973/XL-518 (III).
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно GDC-0941 (I) в комбинации с ингибитором МЕК, выбранной из табл.1, включая GDC-0973/XL-518 (III), причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и GDC-0941, и ингибитор МЕК, выбранные из табл.1, включая GDC-0973/XL-518, в течение 21 суток подряд, и без GDC-0941 или ингибитора МЕК, выбранных из табл.1, включая GDC-0973/XL-518 в течение последующих 7 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно GDC-0941 в комбинации с ингибитором МЕК, выбранной из табл.1, включая GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и GDC-0941, и ингибитор МЕК, выбранные из табл.1, включая GDC-0973/XL-518 в течение 14 суток подряд, но не вводят GDC-0941 или ингибитор МЕК, выбранный из табл.1, включая GDC-0973/XL-518 в течение последующих 14 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно GDC-0941 в комбинации с ингибитором МЕК, выбранной из табл.1, включая GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и GDC-0941, и ингибитор МЕК, выбранные из табл.1, включая GDC-0973/XL-518 в течение 21 суток подряд, но не вводят GDC-0941 или ингибитор МЕК, выбранный из табл.1, включая GDC-0973/XL-518, в течение следующих 7 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно GDC-0941 и GDC-0973/XL-518, в котором указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и GDC-0941, и GDC-0973/XL-518 в течение 14 суток подряд, и не вводят GDC-0941 или GDC-0973/XL-518 в течение последующих 14 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно II и GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и II и GDC-0973/XL-518 в течение 14 суток подряд, и не вводят II или GDC-0973/XL-518 в течение последующих 14 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно 80 мг, 100 мг, 130 мг или 180 мг GDC-0941 или II в комбинации с 20 мг, 40 мг или 60 мг ингибитора МЕК, выбранной из табл.1, включая GDC-0973/XL-518.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно 80 мг, 100 мг, 130 мг или 180 мг GDC-0941 или II и 20 мг, 40 мг или 60 мг GDC-0973/XL-518.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно 80 мг, 100 мг, 130 мг или 180 мг GDC-0941 или II в комбинации с 20 мг, 40 мг или 60 мг ингибитора МЕК, выбранной из табл.1, включая GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и GDC-0941 или II, и ингибитор МЕК, выбранные из табл.1, включая GDC-0973/XL-518, в течение 21 суток подряд, и не вводят GDC-0941 или II или ингибитор МЕК, выбранный из табл.1, включая GDC-0973/XL-518, в течение последующих 7 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно 80 мг, 100 мг, 130 мг или 180 мг GDC-0941 или II в комбинации с 20 мг, 40 мг или 60 мг ингибитора МЕК, выбранной из табл.1, включая GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и GDC-0941 или II и ингибитор МЕК, выбранные из табл.1, включая GDC-0973/XL-518 в течение 14 суток подряд, и не вводят GDC-0941 или II или ингибитор МЕК, выбранный из табл.1, включая GDC-0973/XL-518 в течение последующих 14 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно 80 мг, 100 мг, 130 мг или 180 мг GDC-0941 или II и 20 мг, 40 мг или 60 мг GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и GDC-0941 или II и GDC-0973/XL-518 на протяжении 21 суток подряд, и не вводят GDC-0941 или II или GDC-0973/XL-518 в течение последующих 7 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно 80 мг, 100 мг, 130 мг или 180 мг GDC-0941 или II и 20 мг, 40 мг или 60 мг GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и GDC-0941 или II и GDC-0973/XL-518 на протяжении 14 суток подряд, и не вводят GDC-0941 или II или GDC-0973/XL-518 в течение последующих 14 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрены способы лечения пациента с мутантными RAS/RAF местнораспространенными или метастазирующими плотными опухолями с помощью 4-(2-(1Н-индазол-4-ил)-6-((4-(метилсульфонил)пиперазин-1-ил)метил)тиено[3,2-d]пиримидин-4-ил)морфолина, также обозначаемого GDC-0941, ингибитора PI3K, в комбинации с ингибитором МЕК, описанным в настоящем изобретении.
В другом варианте осуществления настоящего изобретения предусмотрены способы лечения пациента с мутантными RAS/RAF местнораспространенными или метастазирующими плотными опухолями с помощью (S)-1-(4-((2-(2-аминопиримидин-5-ил)-7-метил-4-морфолинтиен[3,2-d]пиримидин-6-ил)метил)пиперазин-1-ил)-2-гидроксипропан-1-она (II), ингибитора PI3K, в комбинации с ингибитором МЕК, описанным в настоящем изобретении.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с мутантными RAS/RAF местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту GDC-0941 или II в комбинации с ингибитором МЕК, выбранным из табл.1, включая GDC-0973/XL-518.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с мутантными RAS/RAF местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно GDC-0941 или II и GDC-0973/XL-518.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение терапевтической комбинации, в качестве комбинированного состава или путем чередования компонентов, млекопитающему, причем терапевтическая комбинация включает терапевтически эффективное количество соединения формулы I или II, или фармацевтически приемлемой соли соединения I или II, и терапевтически эффективное количество соединения формулы III, или фармацевтически приемлемой соли соединения III, причем указанные местнораспространенные или метастазирующие плотные опухоли являются субъектом нарушенной регуляции метаболического пути RAS/RAF/MEK/ERK.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение терапевтической комбинации, в качестве комбинированного состава или путем чередования компонентов, млекопитающему, причем терапевтическая комбинация включает терапевтически эффективное количество соединения формулы I или II, или фармацевтически приемлемую соль I или II, и терапевтически эффективное количество соединения формулы III, или фармацевтически приемлемую соль III, причем указанные местнораспространенные или метастазирующие плотные опухоли экспрессируют мутации генов RAS или RAF.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение терапевтической комбинации, в качестве комбинированного состава или путем чередования компонентов, млекопитающему, причем терапевтическая комбинация включает а терапевтически эффективное количество соединения формулы I или II, или фармацевтически применимой соли I или II, и терапевтически эффективное количество соединения формулы III, или фармацевтически применимой соли III, причем указанные местнораспространенные или метастазирующие плотные опухоли являются субъектом для измененной регуляции метаболического пути передачи сигнала PI3K.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение терапевтической комбинации, в качестве комбинированного состава или путем чередования компонентов, млекопитающему, причем терапевтическая комбинация включает терапевтически эффективное количество соединения формулы I или II или фармацевтически приемлемой соли I или II, и терапевтически эффективное количество соединения формулы III или фармацевтически приемлемой соли III, причем указанные местнораспространенные или метастазирующие плотные опухоли сверхэкспрессируют PI3K или Акт, например, если указанные местнораспространенные или метастазирующие плотные опухоли экспрессируют мутации гена PI3K или если указанные местнораспространенные или метастазирующие плотные опухоли проявляют потерю супрессора опухоли гомолога фосфатазы и тензина (PTEN).
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями, включающий введение терапевтической комбинации, в качестве комбинированного состава или путем чередования компонентов, млекопитающему, причем терапевтическая комбинация включает терапевтически эффективное количество соединения формулы I или II, или фарацевтически приемлемой соли I или II, и терапевтически эффективное количество соединения формулы III или фармацевтически приемлемой соли III, причем указанные местнораспространенные или метастазирующие плотные опухоли выбраны из группы, состоящей из аденокарциномы поджелудочной железы, аденокарциномы толстой и прямой кишки, немелкоклеточного рака легкого, злокачественной меланомы, папиллярного рака щитовидной железы, рака груди, рака яичника и рака эндометрия.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с мутантными RAS/RAF местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно GDC-0941 или II в комбинации с ингибитором МЕК, выбранным из табл.1, включая GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и GDC-0941 или II, и ингибитор МЕК, выбранный из табл.1, включая GDC-0973/XL-518 в течение 21 суток подряд, но не вводят GDC-0941 или II или ингибитор МЕК, выбранный из табл. 1, включая GDC-0973/XL-518 в течение последующих 7 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с мутантными RAS/RAF местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно GDC-0941 или II в комбинации с ингибитором МЕК, выбранной из табл.1, включая GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и GDC-0941 или II, и ингибитор МЕК, выбранной из табл.1, включая GDC-0973/XL-518 в течение 14 суток подряд, но не вводят GDC-0941 или II или ингибитор МЕК, выбранный из табл.1, GDC-0973/XL-518 в течение последующих 14 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с мутантными RAS/RAF местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно GDC-0941 или II в комбинации с ингибитором МЕК, выбранной из табл.1, включая GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и GDC-0941 или II, и ингибитор МЕК, выбранные из табл.1, включая GDC-0973/XL-518, в течение 21 суток подряд, но не вводят GDC-0941 или II, или ингибитор МЕК, выбранные из табл.1, включая GDC-0973/XL-518, в течение последующих 7 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с мутантными RAS/RAF местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно GDC-0941 или II и GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и GDC-0941 или II, и GDC-0973/XL-518, в течение 14 суток подряд, но не вводят GDC-0941 или II или GDC-0973/XL-518 в течение последующих 14 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с мутантными RAS/RAF местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно 80 мг, 100 мг, 130 мг или 180 мг GDC-0941 или II в комбинации с 20 мг, 40 мг или 60 мг ингибитора МЕК, выбранных из табл.1, включая GDC-0973/XL-518.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с мутантными RAS/RAF местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно 80 мг, 100 мг, 130 мг или 180 мг GDC-0941 или II и 20 мг, 40 мг или 60 мг GDC-0973/XL-518.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с мутантными RAS/RAF местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно 80 мг, 100 мг, 130 мг или 180 мг GDC-0941 или II в комбинации с 20 мг, 40 мг или 60 мг ингибитора МЕК, выбранных из табл. 1, включая GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят GDC-0941 или II и ингибитор МЕК, выбранные из табл.1, включая GDC-0973/XL-518, в течение 21 суток подряд, но не вводят GDC-0941 или II или ингибитор МЕК, выбранные из табл.1, включая GDC-0973/XL-518 в течение последующих 7 суток подряд.
Другой объект настоящего изобретения относится к способу лечения пациента с мутантными RAS/RAF местнораспространенными или метастазирующими плотными опухолями, включающему введение указанному пациенту одновременно 80 мг, 100 мг, 130 мг или 180 мг GDC-0941 или II в комбинации с 20 мг, 40 мг или 60 мг ингибитора МЕК, выбранных из табл.1, включая GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят GDC-0941 или II и ингибитор МЕК, выбранные из табл.1, включая GDC-0973/XL-518, в течение 14 суток подряд, но не вводят GDC-0941 или II или ингибитор МЕК, выбранные из табл.1, включая GDC-0973/XL-518, в течение последующих 14 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с мутантными RAS/RAF местнораспространенными или метастазирующими плотными опухолями, включающий введение указанному пациенту одновременно 80 мг, 100 мг, 130 мг или 180 мг GDC-0941 или II и 20 мг, 40 мг или 60 мг GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и GDC-0941 или II, и GDC-0973/XL-518, на протяжении 21 суток подряд, но не вводят GDC-0941 или II, или GDC-0973/XL-518, в течение последующих 7 суток подряд.
В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с местнораспространенными или метастазирующими плотными опухолями с мутацией RAS/RAF, включающий введение указанному пациенту комбинации одновременно 80 мг, 100 мг, 130 мг или 180 мг GDC-0941 или II и 20 мг, 40 мг или 60 мг GDC-0973/XL-518, причем указанный пациент подвергается 28-суточному циклу лечения, на протяжении которого указанному пациенту вводят и GDC-0941 или II, и GDC-0973/XL-518 на протяжении 14 суток подряд, но не вводят GDC-0941 или II или GDC-0973/XL-518 в течение последующих 14 суток подряд.
В другом объекте к способам лечения по настоящему изобретению относятся те, которые включают введение GDC-0941 или II и ингибитора МЕК, выбранных из табл.1, включая GDC-0973/XL-518, в форме различных фармацевтически приемлемых солей и/или фармацевтических композиций.
PI3K ингибитор GDC-0941 (I), II и ингибиторы МЕК, описанные в настоящем изобретении, например, в табл. 1, включая GDC-0973/XL-518 (II), содержат все стереоизомеры, геометрические изомеры, таутомеры, метаболиты и их фармацевтически приемлемые соли.
Фармацевтические композиции по настоящему изобретению могут дополнительно включать фармацевтически приемлемые носители, разбавители или эксципиенты.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Мутантный статус RAS/RAF у пациентов с местнораспространенными или метастазирующими плотными опухолями может быть определен по образцам ткани от пациентов, используя методы, известные в данной области, например, для выяснения наличия или отсутствия BRaf (например, BRafV600E) мутаций NRas или KRas, описанных выше.
РI3K ингибитор GDC-0941 и ингибиторы МЕК, включая GDC-0973/XL518 по настоящему изобретению, могут быть в несольватированной и сольватированной форме с фармацевтически приемлемыми растворителями, например, водой, этанолом и др., и настоящее изобретение охватывает и сольватированные, и несольватированные формы.
РОК ингибитор GDC-0941 и ингибиторы МЕК, включая GDC-0973/XL518 по настоящему изобретению, также могут быть в разных таутомерных формах, и все такие формы находятся в рамках охвата настоящего изобретения. Понятие «таутомер» или «таутомерная форма» относится к структурным изомерам разных энергий, которые взаимопревращаемы через низкий энергетический барьер. Например, протонные таутомеры (также обозначаемые прототропными таутомерами) включают внутренние конверсии через миграцию протона, например, кето-енольную и имин-энаминную изомеризацию. Валентные таутомеры включают внутренние конверсии путем реорганизации некоторых из присоединенных электронов.
РОК ингибитор GDC-0941 и ингибиторы МЕК, включая GDC-0973/XL518 по настоящему изобретению, также могут быть изотопически-меченым, т.е. один или несколько атомов замещены атомом с атомной массой или массовым числом, отличающимся от атомной массы или массового числа, обычно присутствующего в природе. Все указанные изотипы какого-либо определенного атома и их применения находятся в рамках охвата соединений по настоящему изобретению. К примерам изотопов, которые могут быть включены в PI3K ингибитор GDC-0941 и ингибиторы МЕК, включая GDC-0973/XL518, относятся изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора и йода, например 2H, 3H, 11C, 13C, 14C, 13N 15N, 15O, 17O, 18O, 32P, 33P, 35S, 18F, 36Cl, 123I и 125I. Определенные меченые изотопами соединения по настоящему изобретению (например, меченые 3Н и 14С) применимы в исследованиях по распределению в соединении и/или субстрате. Изотопы тритий (3Н) и углерод-14 (14С) применимы благодаря легкости их получения и возможности их обнаружения. Кроме того, замещение на более тяжелые изотопы, например, дейтерий (2Н), может обеспечить определенные терапевтические преимущества, являющиеся результатом большей метаболической стабильности таких изотопов (например, повышенный in vivo период полураспада или потребность в пониженной дозе) и поэтому может быть предпочтительным при некоторых обстоятельствах. Изотопы с позитронной эмиссией, например, 15O, 13N, 11С и 18F, применимы для исследования методом позитрон-эмиссионной томографии (ПЭТ) для оценки занятости субстратного рецептора. Меченые изотопами соединения по настоящему изобретению большей частью могут быть получены замещением меченого изотопом реагента на немеченый изотопом реагент.
PI3K ингибитор GDC-0941 и ингибиторы МЕК, включая GDC-0973/XL518 по настоящему изобретению, могут быть введены в форме фармацевтической композиции, включающей GDC-0941, и фармацевтической композиции, включающей ингибитор МЕК, в том числе GDC-0973/XL518, причем указанные фармацевтические композиции содержат один или несколько фармацевтически приемлемых носителей, агентов скольжения, разбавителей или эксципиентов.
Соответствующие носители, разбавители и эксципиенты известны специалистам в данной области и включают материалы, например, углеводы, воска, водорастворимые и/или набухающие полимеры, гидрофильные и гидрофобные материалы, желатин, масла, растворители, воду и др. Применяемые определенные носители, разбавители или эксципиенты могут зависеть от средств и цели, для которых применяют настоящее изобретение. Растворители обычно выбирают, основываясь на растворителях, оцениваемых специалистами в данной области в качестве безопасных (GRAS) для введения млекопитающему. В целом, безопасными растворителями являются нетоксичные водные растворители, например, вода и другие нетоксичные растворители, которые растворяются или смешиваются в воде. К соответствующим водным растворителям относится вода, этанол, пропиленгликоль, полиэтиленгликоли (например, ПЭГ 400, ПЭГ 300) и др., а также их смеси. Композиции также могут включать один или несколько буферов, стабилизирующих агентов, поверхностно-активных веществ, увлажняющих агентов, эмульгаторов, суспендирующих агентов, консервантов, антиоксидантов, агентов матовости, агентов скольжения, вспомогательных агентов для переработки, красителей, подсластителей, ароматизаторов, вкусовых агентов и других известных добавок для обеспечения прекрасной формы лекарственного средства (т.е. соединения по настоящему изобретению или его фармацевтической композиции) или способствования получению фармацевтического продукта (т.е. лекарственного средства).
Композиции могут быть получены, используя обычное растворение и перемешивание. Например, объемное лекарственное вещество (т.е. соединение по настоящему изобретению) или стабилизированную форму соединения (например, комплекса с производным циклодекстрина или другого известного агента комплексообразования) растворяют в соответствующем растворителе в присутствии одного или нескольких описанных выше эксципиентов.
К фармацевтическим композициям относятся те, которые применимы для способов введения, подробно описанных в настоящем изобретении. Композиции могут быть легко представлены в разовой дозированной форме и могут быть получены каким-либо из методов, известных в области фармацевтики. Методы и составы обычно можно почерпнуть из кн.: «Remington's Pharmaceutical Sciences)), 1995, 18е изд., изд-во Mack Publishing Co., Easton, Пенсильвания. К таким методам относится стадия приведения к ассоциации действующего ингредиента с носителем, которым является один или несколько вспомогательных ингредиентов. В целом составы получают единообразно, проводя в тесную ассоциацию действующий ингредиент с жидкими носителями, или мелко измельченными плотными носителями, или с обоими, и затем при необходимости придают форму продукту.
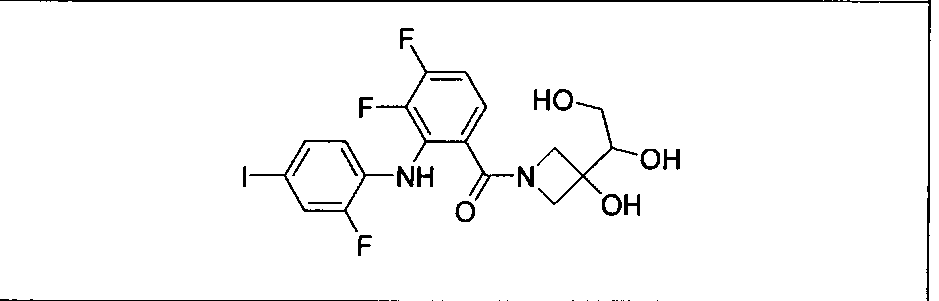
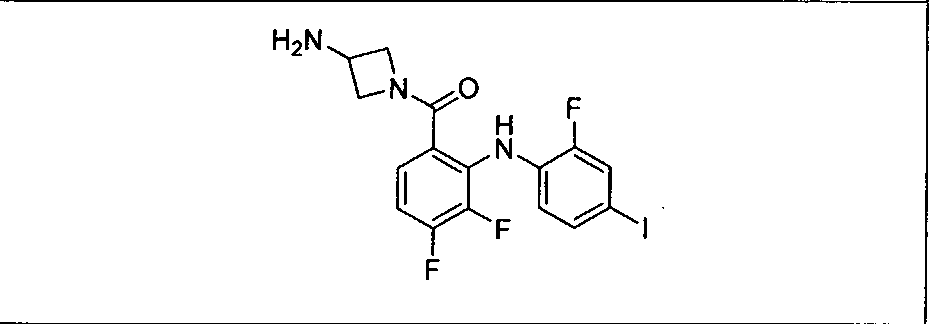
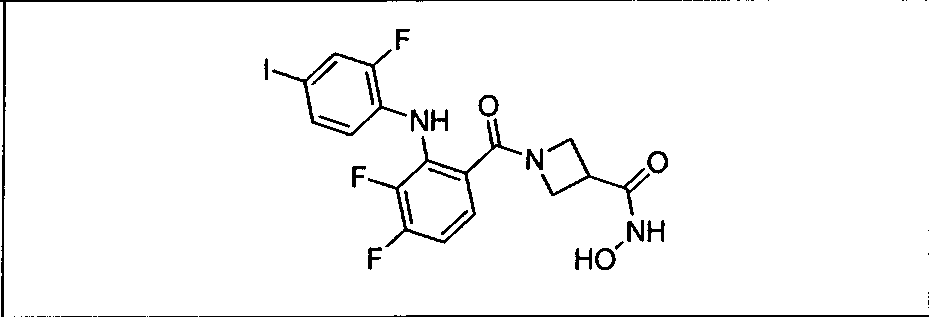
В рамках охвата настоящего изобретения находятся способы лечения пациента с местнораспространенными или метастазирующими плотными опухолями комбинацией метаболических продуктов in vivo ингибиторов GDC-0941 и МЕК, описанных в настоящем изобретении, включая GDC-0973/XL-518, в соответствии с описанными выше режимами. Такие продукты могут быть получены, например, в результате окисления, восстановления, гидролиза, амидирования, деамидирования, этерификации, деэтерификации, ферментативного расщепления и др. изменения введенного соединения.
Примеры
Для иллюстрации настоящего изобретения ниже приводятся примеры. Однако следует учитывать, что эти примеры не ограничивают настоящее изобретение и только поясняют практику применения настоящего изобретения.
Пример 1. Эффективность in vitro комбинации GDC-0941 и GDC-0973 в линиях клеток меланомы и НМКРЛ при использовании 4-суточного анализа жизнеспособности CellTiterGlo
Применяют программу Calcusyn, использующую метод Chou и Talalay (1984) по количественной оценке синергизма, для расчета индекса комбинации и, таким образом, определения уровня синергизма (фиг.1). Сильный синергизм, определенный по величинам индекса комбинации ≤0,3, наблюдают у большинства линий клеток меланомы, примерно 60% которых несут онкогенные мутации в BRAF. Синергизм, определенный по величинам индекса комбинации ≤0,7, или сильный синергизм наблюдают во всех линиях клеток НМКРЛ, кроме одной, из которых примерно половина несет онкогенные мутации в KRAS.
Пример 2. GDC-0973 и GDC-0941 в качестве терапевтических агентов в моделях ксенотрансплантатов NCI-H2122 (НМКРЛ, KRASG12C, PI3K/PTEN WT) и А2058 (меланомы, BRAFV600E, PTENnull)
Обе указанные модели показывают умеренную чувствительность к GDC-0973 или GDC-0941 в качестве единственных агентов; однако они не проявляют выраженной чувствительности ни к одному из лекарственных средств в отдельности, приводя к задержке роста опухоли, но не к стазу или регрессии. Следовательно, действие метаболического пути в отношении и МЕК, и PI3K, в каждой модели не вызывает сомнения, что делает их значимыми моделями для анализа комбинаций ингибиторов МЕК и PI3K. Животных с опухолью NCI-Н2122 лечат GDC-0973 (5 мг/кг, ежедневно), GDC-0941 (50 мг/кг, ежедневно) или комбинацией. Опухоли NCI-H2122 проявляют чувствительность к единственному агенту GDC-0973 с подавлением роста опухоли (величина ПРО, относительно растворителя, применяемого в качестве контроля) 57% в группе ежедневного применения, получающей 5 мг/кг (фиг.2). Подобным образом опухоли NCI-H2122 также чувствительны к единственному агенту GDC-0941 с величиной ПРО 73% в группе, получающей 30 мг/кг (фиг.2). Комбинация GDC-0973 и GDC-0941 приводит к выраженному улучшению эффективности относительно каждого отдельного агента при обоих уровнях дозирования, приводя к 98% ПРО или к стазу опухоли (фиг.2). С помощью критериев Стьюдента, в которых сравнивают умеренные дозы GDC-0973 или GDC-0941 с комбинацией двух агентов, показывают, что противоопухолевый эффект статистически значимый (критерий Стьюдента р=0,032, р=0,046, соответственно, на 21 сутки; (фиг.2). GDC-0973 и GDC-0941 хорошо переносимы при введении отдельно и в комбинации, даже при повышенных дозах GDC-0973 при 10 мг/кг, ежедневно с GDC-0941 в количестве 100 мг/кг, (данные не представлены). Эти данные показывают, что GDC-0973 и GDC-0941 обладают существенным воздействием на рост опухоли в модели ксенотрансплантата немелкоклеточного рака легких (НМКРЛ) NCI-H2122 при применении в комбинации.
Пример 3. Умеренные и высокие дозы GDC-0973 (6 и 10 мг/кг, ежедневно) и GDC-0941 (30 и 100 мг/кг, ежедневно), а также комбинации повышенных и пониженных доз у животных с опухолью А2058
Подобно опухолям NCI-H2122, опухоли А2058 также показывают умеренную чувствительность к единственному агенту GDC-0973 с величинами ПРО 41% при 6 мг/кг и 62% при 10 мг/кг (фиг.3А и Б, соответственно). Сходным образом опухоли А2058 также умеренно чувствительны к единственному агенту GDC-0941 с величинами ПРО, составляющими 18% при концентрации 30 мг/кг и 56% при концентрации 100 мг/кг (фиг.3А и 3Б, соответственно). Комбинация GDC-0973 и GDC-0941 приводит к выраженному улучшению эффективности относительно единственного агента, в результате получая улучшение до 69% ПРО при пониженных дозах и до 90% ПРО при повышенных дозах, приближая стаз опухоли (фиг.3А и 3Б, соответственно). С помощью критериев Стьюдента, в которых сравнивают умеренные дозы GDC-0973 или GDC-0941 с комбинацией двух агентов, показывают, что противоопухолевое действие статистически значимо (р=0,048, р=0,008, соответственно, на 17 сутки). Сходным образом, сравнение высоких доз GDC-0973 или GDC-0941 с комбинацией выявил существенное различие (критерий Стьюдента р=0,001, р=0,004, соответственно, на 17 сутки). Комбинация GDC-0973 и GDC-0941 не приводит к каким-либо очевидным побочным эффектам у мышей.
Пример 4. Лечение животных с опухолью FaDu (подглоточный плоскоклеточный рак) или единственным агентом, GDC-0973 или GDC-0941, или комбинацией двух агентов
Опухоли FaDu показывают умеренную чувствительность к одному агенту GDC-0973 в количестве 5 мг/кг, ежедневное применение, с процентом подавления роста опухоли (ПРО) 41% (фиг.4А). Сходным образом опухоли FaDu показывают умеренный ответ на GDC-0941 в количестве 100 мг/кг при величине ПРО 33% (фиг.4А). Комбинация GDC-0973 и GDC-0941 в тех же дозах приводит к выраженному улучшению эффективности относительно эффективности каждого отдельного агента, вызывая улучшение ПРО до 96% (фиг.4А). Улучшенная эффективность комбинации статистически значима относительно эффективности одного агента GDC-0973 и одного агента GDC-0941 (р=0,0281 и р=0,0034, соответственно, на 18 сутки).
Пример 5. Лечение животных с опухолью SKOV-3 (яичника) или единственным агентом, GDC-0973 (10 мг/кг, ежедневно) или GDC-0941 (100 мг/кг, ежедневно), или комбинацией двух агентов
Опухоли SKOV-3 показывают умеренный ответ на GDC-0941 в количестве 100 мг/кг с величиной ПРО 51% (фиг.4Б). Комбинация GDC-0973 и GDC-0941 в тех же дозах приводит к выраженному улучшению эффективности относительно эффективности каждого отдельного агента, вызывая улучшение ПРО до 91% (фиг.4Б). Улучшенная эффективность комбинации статистически значима относительно эффективности одного агента GDC-0973 и одного агента GDC-0941 (р=0,0017 и р=0,0283, соответственно, на 22 сутки).
Пример 6. Лечение животных с опухолью MOLM-16 (острого миелоидного лейкоза) или единственным агентом, GDC-0973 или GDC-0941, или комбинацией двух агентов
Опухоли MOLM-16 показывают чувствительность к одному агенту GDC-0973 в количестве 10 мг/кг, ежедневное применение, с процентом подавления роста опухоли (ПРО) 57% (фиг.5). Сходным образом опухоли MOLM-16 показывают умеренный ответ на GDC-0941 в количестве 100 мг/кг при величине ПРО 40% (фиг.5). Комбинация GDC-0973 и GDC-0941 в тех же дозах приводит к выраженному улучшению эффективности относительно эффективности каждого отдельного агента, вызывая улучшение ПРО до 96% (фиг.5). Улучшенная эффективность комбинации статистически значима относительно эффективности одного агента GDC-0973 и одного агента GDC-0973 и GDC-0941 (р=0,0381 и р=0,0158, соответственно, на 11 сутки).
Пример 7. Исследование безопасности и предельно допустимой дозы GDC-0973 и GDC-0941 при введении в комбинации у пациентов с местнораспространенными или метастазирующими плотными опухолями В этом исследовании ежедневно пероральное дозирование GDC-0973 (капсулы 5 мг или 25 мг) и GDC-0941 (капсулы 15 мг или 50 мг), введенных в комбинации, ежедневно в течение 21 суток с последующими 7 сутками без исследуемого лекарственного средства, пациентам с местнораспространенными или метастазирующими плотными опухолями, которые относятся к дикому типу RAS/RAF, мутантным или неустановленным. Архивные образцы опухолей могут быть получены от всех пациентов для подтверждения или определения мутантного статуса BRAF, NRAS или KRAS и PI3K мутации/Р13К амплификации/PTEN белкового статуса. У всех пациентов имеются данные по периодической визуализации методом FDG-ПЭТ в качестве фармакодинамического биомаркера и возможного раннего снятия показаний противоопухолевого действия. Лечение может продолжаться до 1 года или до прогрессирования заболевания, недопустимой токсичности или какого-либо другого возникшего показателя, требующего прерывания лечения. Одновременное введение GDC-0973 и GDC-0941 может проводиться ежедневно в течение 21 суток подряд на протяжении 28-суточного цикла по одной из приводимых ниже схем дозирования, представленных на фиг.6А и 6Б. Другие режимы и схемы дозирования могут заключаться в применении на протяжении 14 суток и GDC-0973, и GDC-0941, затем на протяжении 14 суток не применяют ни GDC-0973, ни GDC-0941, или прерывистые схемы дозирования (например, каждые 2 суток и каждый 4 суток). Таблицы 1А и 1Б показывают другие схемы лечения для одновременного перорального введения GDC-0973 и GDC-0941.
Дополнительные пациенты с мутантными RAS/RAF местнораспространенными или метастазирующими плотными опухолями, которые в прошлом прошли не более четырех системных терапевтических лечений (местнораспространенных или метастазирующих форм рака), могут быть включены в дополнительный сбор данных по фармакокинетике и фармакодинамике по одной из схем лечения в табл.1А и 1Б и схеме дозирования по фиг.6А и 6Б. Биопсийные образцы до лечения и после лечения для анализа биомаркеров PD получают от всех пациентов. Для всех пациентов будет получена серийная визуализация FDG-ПЭТ в качестве возможного раннего снятия показаний противоопухолевого действия. Мутантный статус может быть определен ретроспективно из обязательно собираемой коллекции архивных образцов опухолевой ткани.
|
Оценка статуса заболевания может быть произведена, используя критерии оценки ответа солидных опухолей (Response Evaluation Criteria in Solid Tumors-RECIST) (Therasse и др., J Natl Cancer Inst, 92, 2000, cc.205-216). Статус опухоли может быть категоризирован в качестве полного ответа, частичного ответа, стабильного заболевания или прогрессирующего заболевания по RECIST. Непредвзятый ответ может быть подтвержден повторным медицинским осмотром или основан на визуальной оценке после ≥4 недель после первоначальной документации по RECIST.
Приведенное выше описание рассматривается только в качестве иллюстрации основных положений настоящего изобретения. Кроме того, поскольку многочисленные модификации и изменения могут быть легко понятны специалисту в данной области, нет необходимости ограничивать настоящее изобретение точными конструкциями и процессами, подобными показанным выше. Таким образом, все соответствующие модификации и эквиваленты настоящего изобретения могут быть оценены в качестве входящих в область охвата настоящего изобретения.