Результат интеллектуальной деятельности: ГЕМОСТАТИЧЕСКАЯ ГУБКА
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение имеет отношение к гемостатическим губкам, способу изготовления указанных губок и различным вариантам их использования.
Уровень техники
Биологические клеи на основе факторов свертывания крови человеческого или животного происхождения уже давно известны. Способы изготовления тканевых клеев (клеев для склеивания тканей организма) на основе фибриногена и фактора XIII описаны в патентах US 4,362,567, US 4,298,598 и US 4,377,572. Тканевые клеи обычно употребляются вместе с отдельным компонентом, содержащим тромбин, который ферментативным путем действует на фибриноген с образованием фибрина и на фактор XIII с образованием активного фактора ХIIIа, сшивающего фибрин, в результате чего образуется твердый сгусток фибрина.
В течение многих лет для улучшения заживления ран или остановки кровотечения используются коллагеновые прокладки. Механизм их действия при остановке кровотечения основывается на активации и агрегации тромбоцитов, образовании тромбина на поверхности активированных тромбоцитов и формировании гемостатических сгустков фибрина при каталитическом действии тромбина на фибриноген. Для улучшения гемостатического действия коллагеновых прокладок или салфеток было предложено включать в такие прокладки факторы свертывания крови.
В US 4,600,574 описывается тканевой клей на основе коллагена в сочетании с фибриногеном и фактором XIII. Этот материал предоставляется в лиофилизированной форме, готовой к употреблению. Фибриноген и фактор XIII объединяют с коллагеном путем пропитывания коллагенового (имеющего плоскую форму) материала раствором, содержащим фибриноген и фактор XIII, и лиофилизации указанного материала.
WO 97/37694 раскрывает гемостатическую губку на основе коллагена и равномерно распределенного в нем активатора или проактиватора свертывания крови. Эта губка предоставляется в сухой форме, которую можно получить высушиванием на воздухе или лиофилизацией. Тем не менее, содержание воды в ней составляет, по меньшей мере, 2%.
US 5,614,587 раскрывает биоадгезивные композиции, содержащие сшитый коллаген и использующие полифункциональный активированный синтетический гидрофильный полимер, а также способы применения таких композиций с целью осуществления адгезии между первой поверхностью и второй поверхностью, при этом, по меньшей мере, одна из поверхностей (первая или вторая) может быть нативной поверхностью ткани.
WO 2004028404 описывает тканевой герметик, состоящий из синтетического коллагена или желатина и электрофильного сшивающего агента, которые предоставляются в сухом состоянии. После смачивания этой композиции при соответствующем значении pH происходит реакция между 2 компонентами и образуется гель с герметизирующими свойствами. Такой герметик работает, в сущности, по аналогии с другими известными двухкомпонентными герметиками (состоящими из реагента с множеством электрофильных групп и реагента с множеством нуклеофильных групп), которые известны в существующем уровне техники или которые доступны на рынке, например, Coseal™. В отдельном варианте осуществления изобретения два компонента герметика (электрофильный «сшиватель» и синтетический коллаген/желатин) наносятся на биоматериал.
Композиции, содержащие коллаген, который был механически разрушен с целью изменения его физических свойств, описаны в US 5,428,024, US 5,352,715 и US 5,204,382. В основном, эти патенты имеют отношение к фибриллярным и нерастворимым коллагенам. В US 4,803,075 описана инъецируемая коллагеновая композиция. Инъецируемая композиция кость/хрящ описывается в US 5,516,532. Матрица для доставки на основе коллагена, содержащая сухие частицы размером в пределах от 5 мкм до 850 мкм, которая может быть суспендирована в воде и имеет определенную поверхностную плотность заряда, описана в WO 96/39159. Препарат коллагена, имеющего размер частиц от 1 мкм до 50 мкм, используемый как спрэй-аэрозоль для образования повязки на рану, описывается в US 5,196,185. Другие примеры, описывающие коллагеновые композиции, включают US 5,672,336 и US 5,356,614.
Раскрытие изобретения
Объектом изобретения является гемостатическая пористая композитная губка, содержащая
i) матрицу из биоматериала и
ii) один гидрофильный полимерный компонент, содержащий реакционно-способные группы,
при этом i) и ii) связываются друг с другом так, что реакционная способность полимерного компонента сохраняется, причем «связанный» означает, что
- указанный полимерный компонент наносится на поверхность указанной матрицы из биоматериала, или
- указанная матрица пропитывается указанным полимерным материалом, или
- и то и другое.
Было обнаружено, что существовавшие ранее прокладки из волокнистых биоматериалов, в частности коллагеновые прокладки для заживления ран, не вызывают остановку кровотечения в условиях нарушенного свертывания крови (например, после гепаринизации). Губка согласно настоящему изобретению улучшает свертывание крови. Более того, губка согласно настоящему изобретению демонстрирует сильное прилипание (адгезию) к ткани при наложении на рану. Губка настоящего изобретения дополнительно демонстрирует улучшенные свойства набухания, т.е. низкое набухание после применения на ране.
Дополнительный аспект имеет отношение к способу лечения повреждения, включающему применение гемостатической пористой композитной губки на месте повреждения.
Кроме того, предоставляется набор для приготовления покрытия на рану, содержащий губку, как раскрывается в описании, и буферный раствор. В частности, набор и его компоненты служат для изготовления медицинской губки для лечения повреждения.
Специалистам в данной области техники ясно, что все предпочтительные варианты осуществления, раскрытые в следующих примерах подробного описания, представляют собой примеры конкретных вариантов осуществления, но не ограничивают общую идею изобретения. Кроме того, все конкретные варианты осуществления можно понимать во всех изобретательских аспектах и вариантах осуществления в любой комбинации, если они не являются взаимоисключающими. Настоящее изобретение включает все эквиваленты или очевидные изменения или модификации, признанные специалистами в данной области техники.
Осуществление изобретения
Объектом изобретения является гемостатическая пористая композитная губка, содержащая
i) матрицу из биоматериала и
ii) один гидрофильный полимерный компонент, содержащий реакционно-способные группы,
при этом i) и ii) связываются друг с другом так, что реакционная способность полимерного компонента сохраняется, причем «соединенный» означает, что
- указанный полимерный компонент наносится на поверхность указанной матрицы из биоматериала, или
- указанная матрица пропитывается указанным полимерным материалом, или
- и то и другое.
Термин «пропитанный (импрегнированный)» в этом описании включает термин «впитывание (абсорбцию)» полимерного материала в матрицу биоматериала.
Термины «губка», «прокладка» и «матрица» в описании настоящего изобретения используются взаимозаменяемым образом.
Предпочтительно биоматериал является коллагеном, белком, биополимером или полисахаридом. Особенно предпочтительным является биоматериал, выбранный из группы, состоящей из коллагена, желатина (в частности, сшитого желатина), фибрина, полисахарида (в частности, хитозана, окисленной целлюлозы, активированных альдегидом декстранов, полиальдегидов на основе крахмала (полученных окислением периодатом)), синтетического биодеградируемого биоматериала (в частности, полимолочной кислоты или полигликолиевой кислоты) и их производных, более предпочтительным является коллаген.
Согласно настоящему изобретению предоставляется пористый композитный материал, содержащий нерастворимую в воде матрицу из биоматериала с гемостатическими свойствами и совместно с этим гидрофильный полимерный сшивающий агент.
После контакта с кровоточащей тканью в результате реакции сшивания гидрофильного полимерного сшивающего агента с белками крови образуется гель с герметизирующими и гемостатическими свойствами. Кроме того, сшивание происходит в белках на поверхности ткани и в зависимости от природы водонерастворимого биоматериала матрицы также может происходить в биоматериале матрицы. Последняя реакция способствует улучшенной адгезии композитного материала на поверхности раненой ткани.
Более того, для гемостатической эффективности композита согласно настоящему изобретению важно, что матрица из биоматериала обладает всасывающей способностью, т.е. она способна впитывать/абсорбировать такие жидкости, как кровь, сыворотка, плазма. Всасывающая способность, в частности, зависит от гидрофильной природы полимера, из которого изготовлена матрица, и трехмерной структуры открытых сообщающихся пор или трехмерной сетчатой структуры гидрофильных волокон. Для всасывающей способности также важны размер пор и эластичность матрицы. Эластичность означает, что матрица может сжиматься в водном растворе и может возвращаться к своему первоначальному объему после уменьшения силы, вызывающей сжатие.
Губка представляет собой пористую сеть из биоматериала, способного абсорбировать жидкости организма в случае применения в месте повреждения. Это позволяет крови из раны (включая компоненты крови, такие как клетки крови или белки свертывания) войти в губку. Пористая губка согласно настоящему изобретению имеет, следовательно, внутренний объем, доступный для внешних жидкостей, таких как кровь, при применении у пациента. Например, пористая коллагеновая губка может быть получена путем лиофилизации коллагенового геля, суспензии или раствора с помощью сублимационной сушки (тогда как обычное высушивание на воздухе дает коллагеновую пленку). Из этого следует, что в случае использования коллагена полученная пористая губка согласно настоящему изобретению, как правило, содержит от 5 до 100 мг коллагена/см3, тогда как коллагеновая пленка содержит от 650 до 800 мг коллагена/см3. Если внешние жидкости, такие как кровь, входят в контакт с губкой согласно настоящему изобретению, гидрофильный полимерный компонент, содержащий реакционно-способные группы, может взаимодействовать с компонентами крови и/или с поверхностью матрицы из биоматериала, для того чтобы сшивать компоненты, которые связываются (по меньшей мере два) с реакционно-способными группами. Более того, губка обычно является гибкой и подходит для применения на разных тканях и участках с разными очертаниями.
Коллаген, используемый для настоящего изобретения, может происходить из любого коллагенового материала, включая жидкие, пастообразные, волокнистые или порошкообразные материалы, из которых можно получить пористый материал, в частности пористую и волокнистую матрицу. Приготовление коллагенового геля для получения губки описывается, например, в EP 0891193 (включенном в описание путем отсылки) и может включать подкисление до тех пор, пока не произойдет образование геля, и последующую нейтрализацию pH. Для улучшения гелеобразующей способности или растворимости коллаген может быть (частично) гидролизован или модифицирован, при условии, что свойство образовывать устойчивую губку при высушивании не уменьшается.
Коллаген или желатин матрицы губки предпочтительно имеет животное происхождение, предпочтительно является бычьим или конским. Однако в случае сверхчувствительности пациента к чужеродным белкам также может использоваться человеческий коллаген. Также можно использовать синтетический или рекомбинантный коллаген. Дополнительные компоненты губки предпочтительно имеют человеческое происхождение, что делает губку особенно пригодной для применения на человеке.
В предпочтительном варианте осуществления пористая коллагеновая губка содержит примерно от 5 до 50, например примерно от 10 до 30, предпочтительно около 25 мг коллагена/см3 сухой губки.
Биоматериал может не быть сшитым или может быть сшитым, предпочтительно биоматериал сшивается.
Гидрофильный полимерный компонент губки согласно настоящему изобретению представляет собой гидрофильный сшивающий агент, способный вступать в реакцию с реакционно-способными группами, как только губка прикладывается к пациенту (например, к ране пациента или другому месту, где гемостатическая активность необходима для пациента). Следовательно, для настоящего изобретения важно, что реакционно-способные группы полимерного компонента являются реакционно-способными при применении на пациенте. Поэтому необходимо изготавливать губки согласно настоящему изобретению так, чтобы реакционно-способные группы полимерного компонента, которые должны вступать в реакцию, как только они прикладываются к ране, сохранялись во время процесса изготовления.
Это можно сделать разными способами. Например, обычные гидрофильные полимерные компоненты имеют реакционно-способные группы, чувствительные к гидролизу после контакта с водой. Соответственно, следует не допускать предшествующего контакта с водой или водными жидкостями до применения губки у пациента, в частности во время изготовления. Однако обработка гидрофильного полимерного компонента во время изготовления также может происходить в водной среде при условиях, когда взаимодействие реакционно-способных групп ингибируется (например, при низком значении рН). Если гидрофильные полимерные компоненты можно расплавить, расплавленные гидрофильные полимерные компоненты можно нанести на матрицу из биополимера с помощью распыления или печатания (набивки). Также можно обсыпать матрицу сухой формой (например, порошкообразной) гидрофильного полимерного компонента. При необходимости, после этого можно использовать увеличение температуры, чтобы расплавить нанесенные на матрицу гидрофильные полимерные компоненты с целью достичь устойчивого покрытия губки. Альтернативно, эти гидрофильные полимерные компоненты можно поместить в инертные органические растворители (инертные по сравнению с реакционно-способными группами гидрофильных полимерных компонентов) и ввести в матрицу из биоматериала. Примерами таких органических растворителей являются обезвоженный этанол, обезвоженный ацетон или сухой дихлорметан (которые, например, являются инертными относительно гидрофильных полимерных компонентов, таких как PEG с NHS-сложноэфирными группами).
В предпочтительном варианте осуществления гидрофильный полимерный компонент является единственным гидрофильным полимерным компонентом и является полиалкиленоксидным полимером, особенно предпочтительно PEG-содержащим полимером, в дальнейшем называемым "материал". Реакционно-способные группы указанного материала предпочтительно являются электрофильными группами.
Материал может быть мультиэлектрофильным полиалкиленоксидным полимером, например мультиэлектрофильным PEG. Материал может включать две или более электрофильных групп, таких как -CON(COCH2)2, -CHO, -N=C=O и/или -N(COCH2)2, например компонент, раскрытый в WO2008/016983 (полностью включенном в описание путем отсылки), и один из компонентов коммерчески доступных материалов под торговой маркой CoSeal®.
Предпочтительно электрофильные группы гидрофильных полимерных сшивающих агентов согласно настоящему изобретению являются реакционно-способными группами по отношению к аминогруппам, карбоксигруппам, тиоловым и гидроксильным группам белков или их смесей.
Предпочтительными характерными реакционно-способными аминогруппами являются NHS-сложно-эфирные группы, имидоэфирные группы, альдегидные группы, карбоксигруппы в присутствии карбодиимидов, изоцианатов или ТНРР (бета-[трис(гидроксиметил)фосфино] пропионовой кислота, особенно предпочтительным является простой эфир пентаэритритол поли(этиленгликоль) тетрасукцинимидил глутарат (=пентаэритритол тетракис[1-1'-оксо-5'-сукцинимидилпентаноат-2-поли-оксоэтиленгликоль]эфир (=NHS-PEG с MB 10,000).
Предпочтительными характерными реакционно-способными карбоксильными группами являются аминогруппы в присутствии карбодиимидов.
Предпочтительными характерными реакционно-способными тиоловыми группами являются малеимидные или галоацетильные группы.
Предпочтительной характерной реакционно-способной гидроксильной группой является изоцианатная группа.
Эти реакционно-способные группы на гидрофильном сшивающем агенте могут быть одинаковыми (нефункциональный) или разными (гетерофункциональный). Гидрофильный полимерный компонент может иметь две реакционно-способные группы (гомобифункциональный или гетеробифункциональный) или более (гомо/гетеротрифункциональный или более).
В отдельных вариантах осуществления материал представляет собой синтетический полимер, предпочтительно содержащий PEG. Данный полимер может быть производным PEG, содержащим активные боковые группы, подходящие для сшивания и адгезии с тканью.
За счет реакционно-способных групп гидрофильный полимер обладает способностью сшивать белки крови и также белки поверхностных тканей. Также возможно сшивание с биоматериалом. Мультиэлектрофильный полиалкиленоксид может содержать две или более сукцинимидильные группы. Мультиэлектрофильный полиалкиленоксид может содержать две или более малеимидные группы.
Предпочтительно мультиэлектрофильный полиалкиленоксид является полиэтиленгликолем или его производным.
В наиболее предпочтительном варианте осуществления полимерный компонент представляет собой простой эфир пентаэритритолполи(этиленгликоль) тетрасукцинимидил глутарат (=COH102, также простой эфир пентаэритритол-тетракис[1-1'-оксо-5'-сукцинимидилпентаноат-2-поли-оксоэтиленгликоль]).
В одном предпочтительном варианте осуществления губка настоящего изобретения содержит коллаген в качестве биоматериала и полимерный компонент, например СОН102, нанесенный на поверхность коллагена (=покрытая форма).
Особенно предпочтительным покрытием является прерывистое (не сплошное) покрытие, например, как показано на фиг.6.
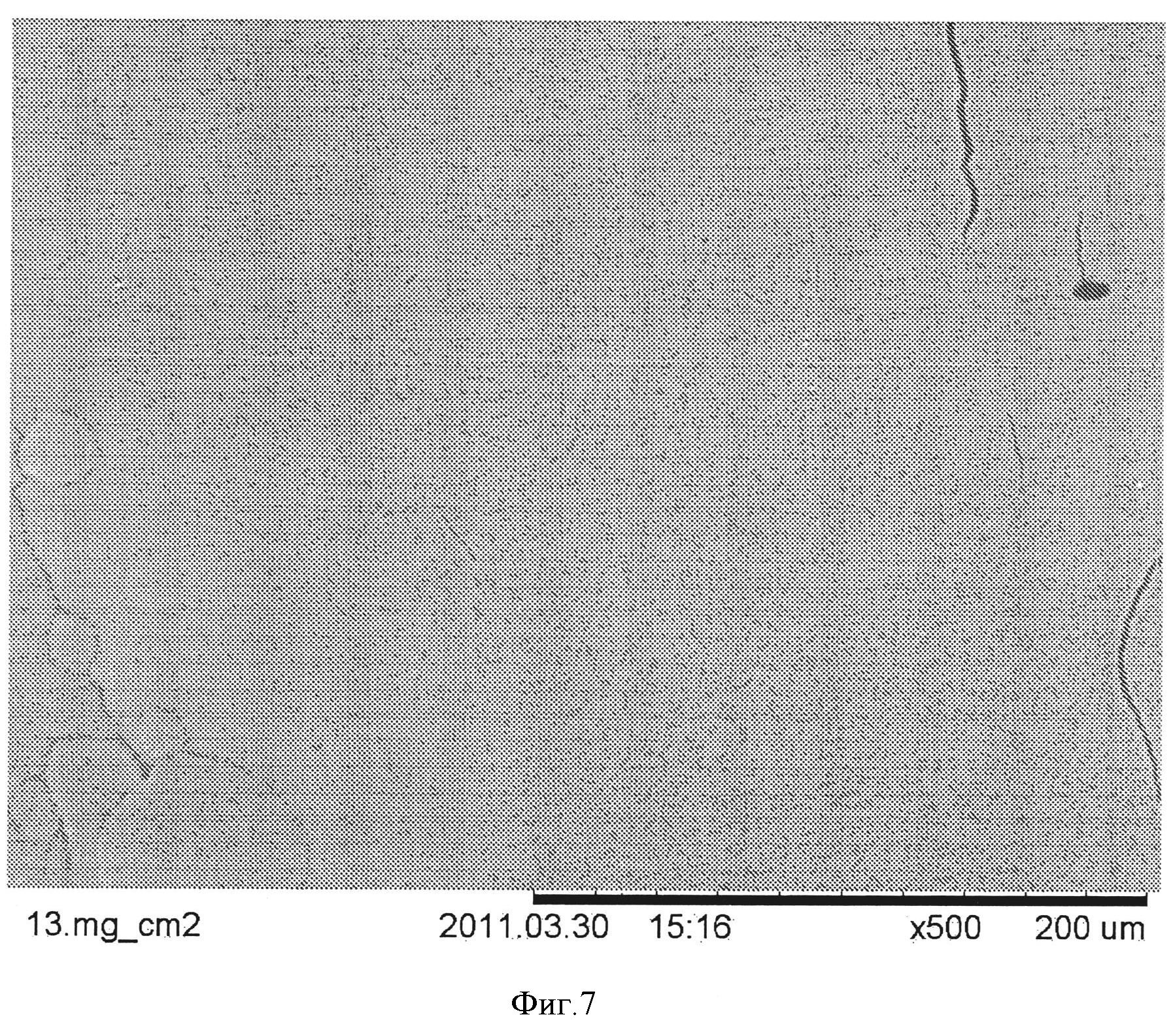
В другом предпочтительном варианте осуществления покрытие представляет собой тонкое сплошное покрытие, например, полученное путем распыления полимерного компонента из расплава на матрицу из биоматериала. Такое покрытие сопоставимо с пленкоподобной или стеклообразной структурой, например, как показано на фиг.7.
В другом предпочтительном варианте осуществления губка настоящего изобретения содержит коллаген в качестве биоматериала и полимерный компонент, например СОН102, импрегнированный в коллаген (=импрегнированная форма).
Молекулярный вес полимерного компонента предпочтительно находится в пределах от 500 до 50000, наиболее предпочтительно составляет около 10000.
Количество покрытия из полимерного компонента на губке из указанного биоматериала составляет предпочтительно примерно от 1 мг/см2 до 20 мг/см2, более предпочтительно примерно от 2 мг/см2 до 14 мг/см2 для покрытой губки. Для импрегнированной губки концентрация полимерного компонента предпочтительно составляет примерно от 5 мг/см3 до 100 мг/см3, более предпочтительно примерно от 10 мг/см3 до 70 мг/см3.
В другом предпочтительном варианте осуществления губка настоящего изобретения содержит комбинацию импрегнированной и покрытой форм. Кроме того, губка согласно настоящему изобретению сохраняет реакционную способность активных групп гидрофильного полимерного компонента, содержащего такие реакционно-способные группы, будучи высушенной, например, имея общее содержание воды ниже 10%, в частности ниже 2% и главным образом ниже 1%, в том случае, когда полимерный компонент содержит гидролизующиеся реакционно-способные группы, например NHS-PEG. Более высокое содержание воды (например, выше чем 10%) будет давать в результате функциональную губку, однако устойчивость при хранении будет ухудшена. Соответственно, содержание воды ниже 2% (вес./вес.) является предпочтительным; ниже 1% является даже более предпочтительным; ниже 0,5% является особенно предпочтительным.
В другом предпочтительном варианте осуществления присутствует добавочный слой дополнительного биоматериала. Дополнительный слой может быть из того же самого биоматериала, как матрица, или он может быть другим биоматериалом, например матрица из биоматериала является коллагеном, а дополнительный слой является окисленной целлюлозой. Могут включаться все комбинации биоматериалов, упомянутых в описании.
Будучи подходящей для биологического разложения in vivo, губка может быть полностью биодеградируемой или биорассасываемой, т.е. способной рассасываться in vivo, например, посредством разложения присутствующими in vivo протеазами и при помощи групп, способных подвергаться гидролизу in vivo. Полная резорбция (рассасывание) означает, что существенных внеклеточных фрагментов не остается. Биодеградируемый материал отличается от небиодеградируемого материала тем, что биодеградируемый материал может биологически разлагаться на части, которые или могут быть удалены из биологической системы и/или химически включены в биологическую систему. В предпочтительном варианте осуществления конкретный материал, материал матрицы или губки целиком может быть разрушен субъектом, в частности человеком, менее чем за 6 месяцев, менее чем за 3 месяца, менее чем за 1 месяц, менее чем за 2 недели.
Губка может дополнительно содержать активатор или проактиватор коагуляции (свертывания) крови, включая фибриноген, тромбин или предшественник тромбина, например, как описано в патенте US 5,714,370, включенном в описание путем отсылки. Под тромбином или предшественником тромбина подразумевается белок, обладающий активностью тромбина и вызывающий активность тромбина при контактировании с кровью или после применения пациентом соответственно. Его активность выражается как активность тромбина (NIH-единица) или как эквивалентная тромбину активность, соответствующая определенной NIH-единице. Активность в губке может составлять 100-10000, предпочтительно 500-5000. В дальнейшем активность тромбина подразумевает, что включаются и то и другое, активность тромбина или любая эквивалентная активность. Белок, обладающий активностью тромбина, может быть выбран из группы, состоящей из альфа-тромбина, меизотромбин, производного тромбина или рекомбинантного тромбина. Подходящего предшественника выбирают из группы, состоящей из протромбина, фактора Ха необязательно вместе с фосфолипидами, фактора IХа, активированного протромбинового комплекса, FEIBA, любого активатора или проактиватора внутреннего или внешнего свертывания или их смесей.
Гемостатическая губка согласно изобретению может использоваться вместе с дополнительными физиологическими веществами. Например, предпочтительно губка дополнительно содержит фармакологически активные вещества, в том числе антифибринолитические средства, такие как ингибитор активатора плазминогена, или ингибитор плазмина, или инактиватор фибринолитиков. Предпочтительным антифибринолитическим средством является средство, выбранное из группы, состоящей из апротинина или производного апротинина, альфа2-макроглобулина, ингибитора или активатора протеина С или активированного протеина С, субстрата, имитирующего связывание с плазмином, который действует конкурентно с природными субстратами, и антитела, ингибирующего фибринолитическую активность.
В качестве дополнительного фармакологически активного вещества совместно с губкой согласно изобретению может использоваться антибиотик, такой как антибактериальное или противогрибковое средство, предпочтительно в виде компонента, равномерно распределенного в губке. В изобретенной губке также могут присутствовать дополнительные биоактивные вещества, такие как факторы роста и/или болеутоляющие средства. Такую губку можно использовать, например, при лечении раны.
Предпочтительными являются дополнительные комбинации со специфическими ферментами или ингибиторами ферментов, которые могут регулировать, т.е. ускорять или ингибировать, рассасывание губки. К их числу относятся коллагеназа, средства, усиливающие ее действие, или ее ингибиторы. Кроме того, подходящие консерванты могут использоваться вместе с губкой или могут содержаться в губке.
Хотя предпочтительный вариант осуществления имеет отношение к применению гемостатической губки, содержащей активатор или проактиватор свертывания крови, в качестве единственного активного компонента, могут включаться дополнительные вещества, которые влияют на скорость свертывания крови, гемостаз и качество герметичности, что включает такие показатели, как предел прочности на разрыв, внутренняя (адгезивная) сила и продолжительность срока службы (долговечность).
Могут быть использованы прокоагулянты, усиливающие или улучшающие внутреннюю или внешнюю свертываемость, такие как факторы или кофакторы свертывания крови, фактор XIII, тканевой фактор, протромбиновый комплекс, активированный протромбиновый комплекс или части данных комплексов, комплекс протромбиназы, фосфолипиды и ионы кальция, протамин. В случае хирургической процедуры, при которой необходима тщательная герметизация, может оказаться предпочтительным продлить период работы после того, как гемостатическая губка накладывается пациенту, до образования сгустка. Увеличение срока образования сгустка будет обеспечено, если губка согласно изобретению дополнительно содержит ингибиторы свертывания крови в соответствующих количествах. Предпочтительными являются такие ингибиторы, как антитромбин III необязательно вместе с гепарином, или любой другой ингибитор сериновой протеазы.
Кроме того, для предотвращения локальной неустойчивости или гиперкоагуляции материала предпочтительным является равномерное распределение в материале такого рода добавок, в частности тромбина или предшественника тромбина. Даже при наличии некоторого содержания воды активность тромбина является неожиданно постоянной, возможно вследствие непосредственного контакта тромбина и коллагена в гомогенной смеси. Тем не менее, в соответствии с изобретением могут использоваться стабилизаторы тромбина, предпочтительно выбранные из группы, состоящей из многоатомного спирта, полисахарида, полиалкиленгликоля, аминокислот или их смесей. Предпочтительным типичным примером является использование сорбита, глицерина, полиэтиленгликоля, полипропиленгликоля, моно- или дисахаридов, таких как глюкоза, или сахароза, или любой сахар, или сульфированной аминокислоты, способной стабилизировать активность тромбина.
Другие примеры дополнительных веществ, которые могут использоваться в соответствии с настоящим изобретением, включают такие средства, как сосудосуживающие препараты, антибиотики или фукоиданы.
Губка настоящего изобретения дополнительно может содержать краситель, например рибофлавин, или другой краситель, известный из предшествующего уровня техники как биосовместимый. Краситель может быть включен, например, в виде дополнительного слоя (покрытия) и, в частности, может помочь хирургу установить, какая одна из поверхностей покрытой губки настоящего изобретения является активной или неактивной поверхностью соответственно.
Губка настоящего изобретения предпочтительно имеет общую толщину менее чем 3 см, предпочтительно примерно от 1 мм до 3 см, более предпочтительно примерно от 1 мм до 2 см, наиболее предпочтительно примерно от 1 мм до 2 мм.
В губке настоящего изобретения толщина покрытия составляет предпочтительно примерно от 0,01 мм до 1 мм.
Губка настоящего изобретения предпочтительно используется при минимально инвазивных операциях, например при лапароскопических операциях.
Губка может быть высушена, причем после высушивания губка может иметь содержание воды, по меньшей мере, 0,5 (проценты даются в весовом соотношении вес./вес.). В некоторых вариантах осуществления губка может быть высушена сублимацией или высушена на воздухе.
Кроме того, настоящее изобретение предоставляет покрытие на рану, содержащее губку согласно изобретению. Губка и все дополнительные слои могут быть предоставлены в готовом к использованию покрытии на рану с подходящими размерами. Губка и/или покрытие может представлять собой прокладку или салфетку, предпочтительно имеющую толщину, по меньшей мере, 1 мм или, по меньшей мере, 2 мм или, по меньшей мере, 5 мм и/или до 20 мм в зависимости от назначения. В случае наложения на рану относительно тонкой гибкой губки важно, чтобы кровь и фибриноген могли абсорбироваться губкой до образования фибрина, который может служить препятствием для абсорбции дополнительных выделений из раны.
Другой аспект изобретения имеет отношение к способу изготовления гемостатической губки (=процесс I), включающему
a) предоставление губки, содержащей матрицу из биоматериала в высушенном виде,
b) предоставление одного реакционно-способного полимерного материала в виде сухого порошка,
c) контактирование а) и b) таким образом, что материал из b) присутствует, по меньшей мере, на одной поверхности указанной губки, и
d) фиксирование материала из b) на губке из а).
Фиксирование может достигаться путем плавления полимерного компонента на губке в предварительно нагретом сушильном шкафу, например, при температурах между 30°C и 80°C, предпочтительно между 60°C и 65°C, в течение периода времени, достаточного для фиксирования, например, между 1 минутой и 10 минутами, предпочтительно около 4 минут.
Альтернативно фиксирование может достигаться с помощью инфракрасного нагревателя или любого другого источника тепла. Расстояние между прокладкой и нагревательным прибором, интенсивность нагревателя и время воздействия инфракрасными лучами регулируются так, чтобы добиться плавления покрытия при минимальном воздействии тепла.
Другой аспект изобретения имеет отношение к способу изготовления гемостатической губки (=процесс II), включающему
a) предоставление губки, содержащей матрицу из биоматериала в высушенном виде,
b) предоставление одного реакционно-способного полимерного материала в виде раствора, например водного раствора со значением рН ниже чем 5, предпочтительно около 3, или безводного раствора на основе органического растворителя, например на основе этанола, ацетона, метиленхлорида и тому подобного,
c) контактирование а) и b) таким образом, что материал из а) импрегнируется (пропитывается) b), и
d) высушивание материала, полученного на стадии с).
Контактирование с целью достижения пропитывания можно выполнить, расположив губку сверху полимерного раствора и позволив раствору впитываться в губку в течение периода времени, достаточного для указанной абсорбции, например примерно от 2 минут до 2 часов, предпочтительно 30 минут.
Высушивание может включать сушку сублимацией или сушку воздухом и включает удаление летучих компонентов жидкости.
В другом аспекте настоящее изобретение предоставляет гемостатическую губку, полученную методом изготовления в соответствии с процессом (I) или (II).
Другой аспект изобретения имеет отношение к применению губки настоящего изобретения для лечения повреждения, выбранного из группы, состоящей из раны, кровотечения, поврежденной ткани и/или кровоточащей ткани. Предпочтительно губка настоящего изобретения используется для герметизации тканей, например легкого, поджелудочной железы, печени; и для остановки кровотечения.
Композит настоящего изобретения также может использоваться как готовый к применению тканевой герметик повсюду, где концентрация белков в жидкостях организма является достаточно высокой, чтобы сделать возможным образование герметизирующего геля, как описано выше.
Губка настоящего изобретения особенно показана при открытых и эндоскопических/лапароскопических/торакоскопических/минимально инвазивных (MIS) хирургических процедурах в качестве вспомогательного средства для остановки кровотечения, подходящего для применения при хирургическом кровотечении, от просачивающегося до активного, когда контроль кровотечения с помощью перевязки сосуда или общепринятых методов является неэффективным или неосуществимым.
В предпочтительном варианте осуществления губка настоящего изобретения применяется вместе с буферным раствором, например щелочным буферным раствором, таким как 8,4% бикарбонатный раствор, или pH 8,3, например, марлей, пропитанной ими.
Было обнаружено, что скорость реакции увеличивается после применения марли, пропитанной 8,4% раствором NaHCO3, по сравнению с использованием марли, пропитанной физраствором. В случае применения NaHCO3 через 2 минуты наблюдается более сильная адгезия губки к ткани.
Кроме того, настоящее изобретение предоставляет набор, содержащий губку по любому из пунктов 1-5 формулы изобретения и буферный раствор, например щелочной буферный раствор, такой как бикарбонатный или карбонатный, вместе с инструкциями, касающимися его применения. Щелочной буферный раствор предпочтительно имеет значение pH около 8, например 8,3.
Другой аспект настоящего изобретения имеет отношение к гемостатическому композиту, содержащему водонерастворимый гемостатический материал (матрицу) и гидрофильный полимерный сшивающий агент (сшиватель) с реакционно-способными группами, указанный композит имеет поры, позволяющие внешним жидкостям, в частности крови человека, получать доступ в указанный композит. Гемостатический материал может быть любым материалом, упоминавшимся выше как "матрица из биоматериала", который сам по себе уже обладает свойством останавливать кровь. В общем, такие материалы известны в данной области техники так же, как и их гемостатические свойства. Композитный материал согласно настоящему изобретению имеет поры, позволяющие внешним жидкостям иметь доступ во внутреннюю часть композита для того, чтобы, например, при наложении на рану кровь из этой раны могла войти в композит. Композит может пропитываться благодаря этим порам. Практически значимые примеры включают нетканый или тканый материал из гемостатического волокна или пористую гемостатическую губку. Предпочтительно, этот гемостатический материал является коллагеновой губкой, тканью из окисленной регенерированной целлюлозы, фибриновой губкой или желатиновой губкой. Особенно предпочтительно, что коллагеновая губка представляет собой нативный коллаген (т.е. нативная структура коллагенового волокна в значительной степени сохраняется или восстанавливается путем образования фибрилл в ходе обработки).
Реакционная способность гидрофильного полимерного сшивателя в композите согласно настоящему изобретению сохраняется. Это означает, что реакционно-способные группы сшивателя еще не вступают в реакцию с (поверхностью) гемостатического материала и не гидролизуются под воздействием воды. Это может быть достигнуто посредством объединения гемостатического материала со сшивателем так, что это не приводит к взаимодействию реакционно-способных групп сшивателя с гемостатическим материалом или с водой, например, как описано здесь, посредством плавления, распыления, пропитывания в инертных условиях и т.д. Как правило, это включает исключение водных условий (или увлажнения), в частности увлажнения без наличия кислых условий (если сшиватели не вступают в реакцию в кислых условиях). Это дает возможность предоставления реакционно-способных гемостатических материалов. Предпочтительно гемостатический композит согласно настоящему изобретению содержит полиэтиленгликоль (PEG) в качестве гидрофильного полимерного сшивающего агента с реакционно-способными группами, в частности PEG, содержащий две или более, предпочтительно 4, реакционно-способные группы, выбранные из сукцинимидилэфиров (-CON(COCH2)2), альдегидов (-CHO) и изоцианатов (-N=C=O), особенно предпочтительно сукцинимидилэфиров, например компонент СОН102, как описано ниже, Coseal.
В предпочтительном варианте осуществления материал матрицы, образующий пористую сеть губки составляет примерно 1-50%, 1-10% или около 3% сухой пористой губки (вес./вес.%).
Матрица из биоматериала, в частности коллагена, согласно настоящему изобретению в большинстве случаев является нерастворимой, в частности нерастворимой в воде. Однако так как губка является пористой и/или гигроскопичной, это позволяет ей разбухать при объединении с водными жидкостями, в частности кровью, сывороткой, плазмой и т.д. или другими жидкостями, присутствующими в ранах, и впитывать эти жидкости.
Гемостатическая губка согласно настоящему изобретению абсорбирует жидкость. "Абсорбцию жидкости" следует рассматривать как физический процесс захвата жидкостей при контакте, который может вызывать или не вызывать разбухание губки. Предпочтительно губка может удерживать количество жидкости, в частности крови, по меньшей мере, составляющее 1, по меньшей мере 2, по меньшей мере 4 или по меньшей мере 10-кратный сухой вес губки и/или до 100, до 20 или до 10-кратного сухого веса губки. Материал губки согласно настоящему изобретению может поглощать жидкости даже под давлением.
Пористый материал губки согласно настоящему изобретению предпочтительно имеет размер пор от 5 до 500 мкм, предпочтительно от 10 до 200 мкм. Этот размер пор может быть соответствующим образом отрегулирован во время изготовления биоматериала губки, в частности путем управления процессом сушки в ходе изготовления.
Губка согласно настоящему изобретению предпочтительно предоставляется в готовой к использованию форме, так чтобы непосредственно применяться на нуждающемся в этом пациенте, например, на ране этого пациента (после чего начинается сшивка). Поэтому губка согласно настоящему изобретению упакована в стерильную упаковку, защищающую губку от загрязнения (например, влагой или микроорганизмами) во время хранения. Перед применением упаковка может быть открыта (предпочтительно также в стерильных условиях), а губка может быть непосредственно использована на пациенте ("готовая к использованию").
Как уже упоминалось выше, гидрофильный полимерный компонент является гидрофильным сшивающим агентом (сшивателем). Согласно предпочтительному варианту осуществления сшивающий агент имеет более чем две реакционно-способные группы для сшивки ("ответвления"), например три, четыре, пять, шесть, семь, восемь или более ответвлений с реакционно-способными группами для сшивки. Например, NHS-PEG-NHS является эффективным гидрофильным сшивателем согласно настоящему изобретению. Однако в случае некоторых вариантов осуществления может быть более предпочтительным 4-ответвленный полимер (например, 4-ответвленный-п-NP-PEG); в зависимости от целесообразности может быть даже более предпочтительным 8-ответвленный полимер (например, 8-ответвленный-NHS-PEG) в вариантах осуществления, где является полезной многократная сшивка. Более того, гидрофильный сшиватель согласно настоящему изобретению представляет собой полимер, т.е. большую молекулу (макромолекулу), состоящую из повторяющихся структурных единиц, которые в основном соединяются ковалентными химическими связями. Полимеры согласно настоящему изобретению должны иметь молекулярный вес, по меньшей мере, 1000 Da (чтобы соответствующим образом служить в качестве сшивателей для губки согласно настоящему изобретению); предпочтительно сшитый полимер согласно настоящему изобретению имеет молекулярный вес, по меньшей мере, 5000 Da, в частности, по меньшей мере, 8000 Da.
Для некоторых гидрофильных сшивателей предпочтительным или необходимым является наличие щелочных условий реакции (например, в месте применения) для функционирования (например, для более быстрой реакции сшивания в месте применения). Например, в месте применения могут быть дополнительно предоставлены (например, в виде буферного раствора или как ткань или прокладка, пропитанная таким буфером) карбонатные или бикарбонатные ионы (например, в виде буфера со значением pH 7,6 или выше, предпочтительно 8,0 или выше, особенно 8,3 и выше), для того, чтобы обеспечить улучшенные рабочие характеристики губки согласно настоящему изобретению или предоставить возможность эффективного использования в качестве гемостатического и/или адгезивного материала для ран.
Краткое описание фигур
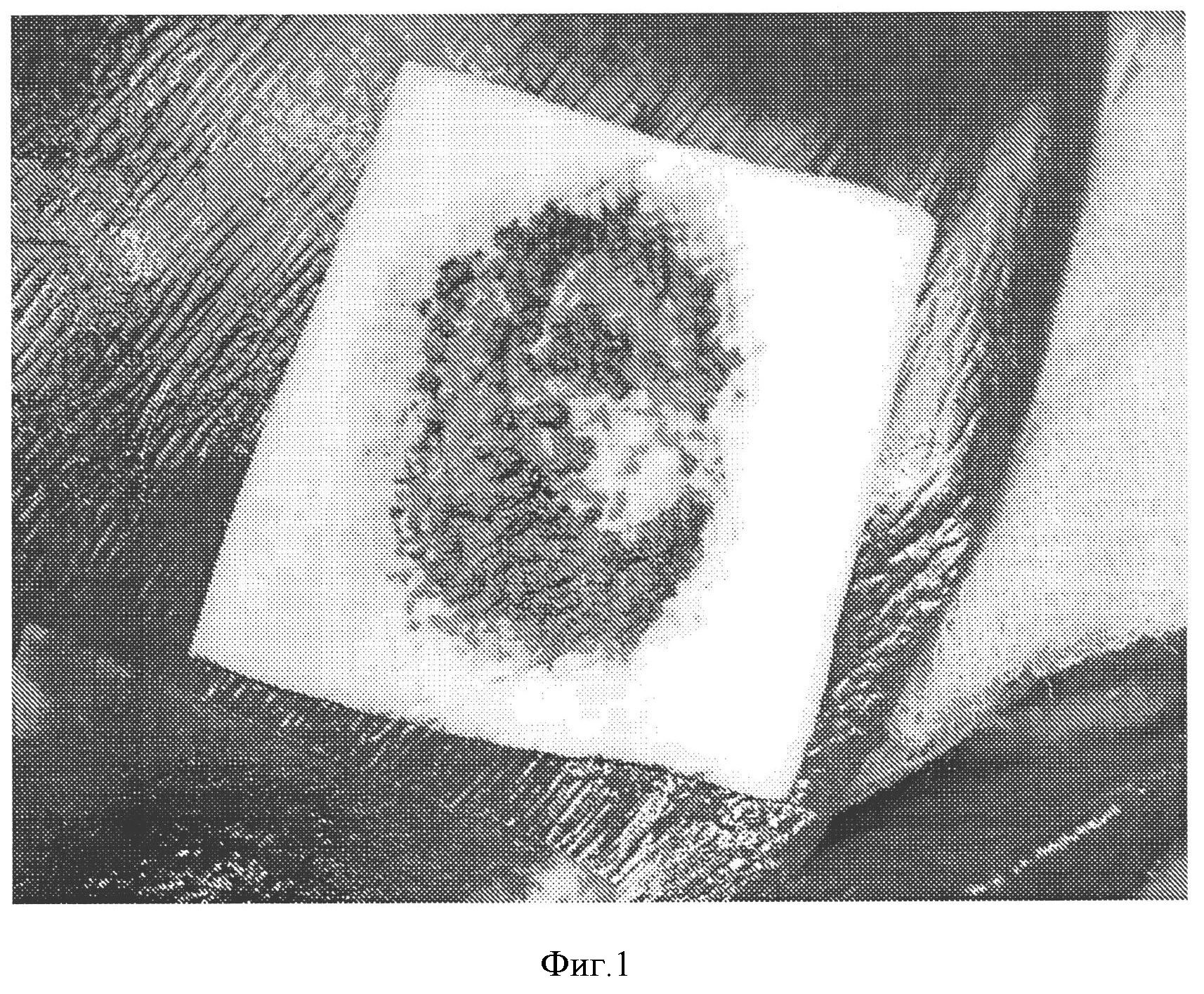
Фигура 1: Гемостатическая эффективность коллагеновой прокладки, покрытой NHS-PEG. Гемостатическая прокладка получена в соответствии с примером 2 и покрыта СОН102 14 мг/см2 (как определено ниже). Гемостатическую эффективность оценивали на животной модели, как описано ниже. Кровотечение остановилось через 2 минуты после наложения прокладки. Повторного кровотечения не наблюдалось.
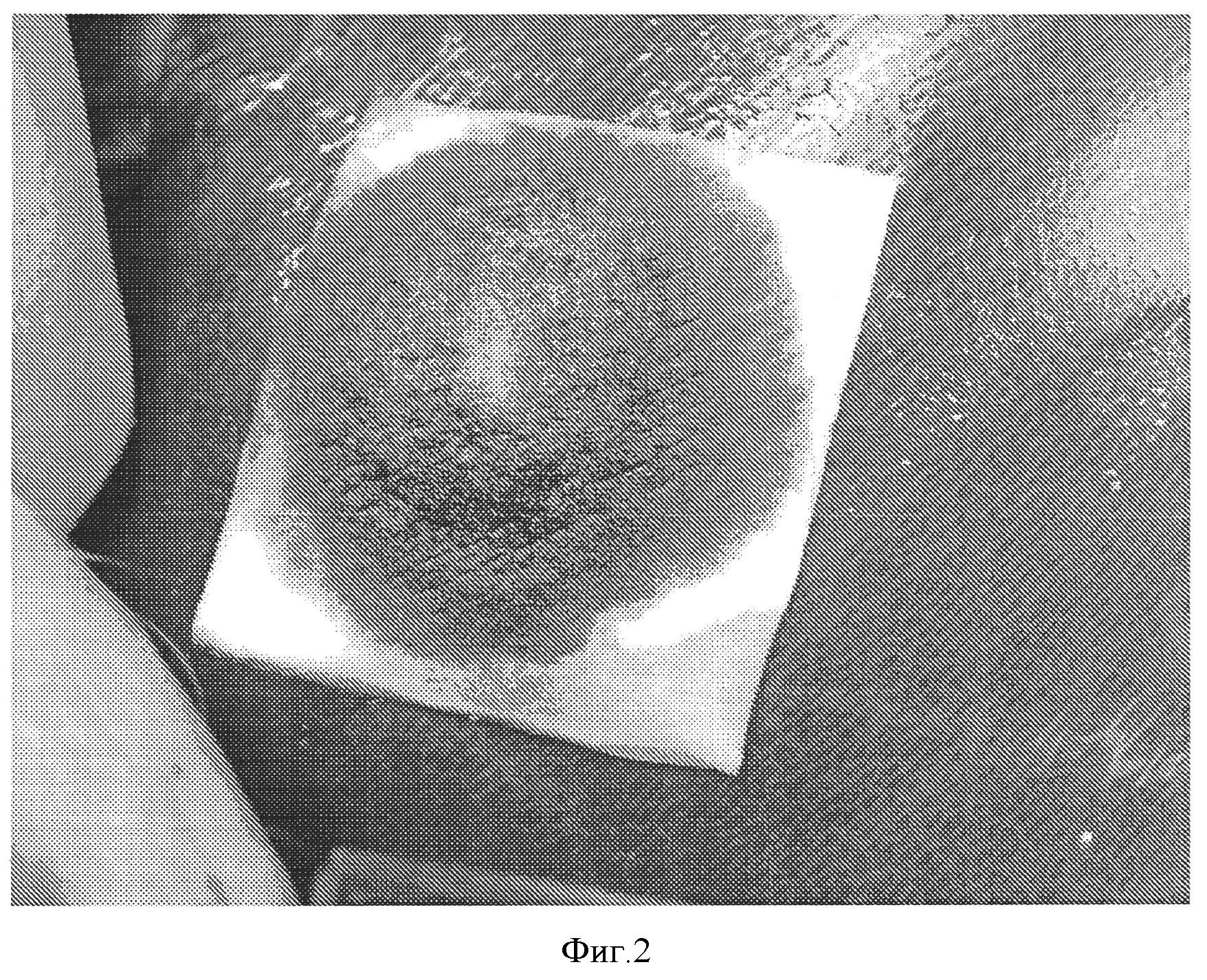
Фигура 2: Гемостатическая эффективность коллагеновой прокладки, пропитанной NHS-PEG. Гемостатическая прокладка получена в соответствии с примером 3 и пропитана СОН102 8 мг/см2. Гемостатическую эффективность оценивали на животной модели, как описано ниже. Кровотечение остановилось через 2 минуты после наложения прокладки. Повторного кровотечения не наблюдалось.
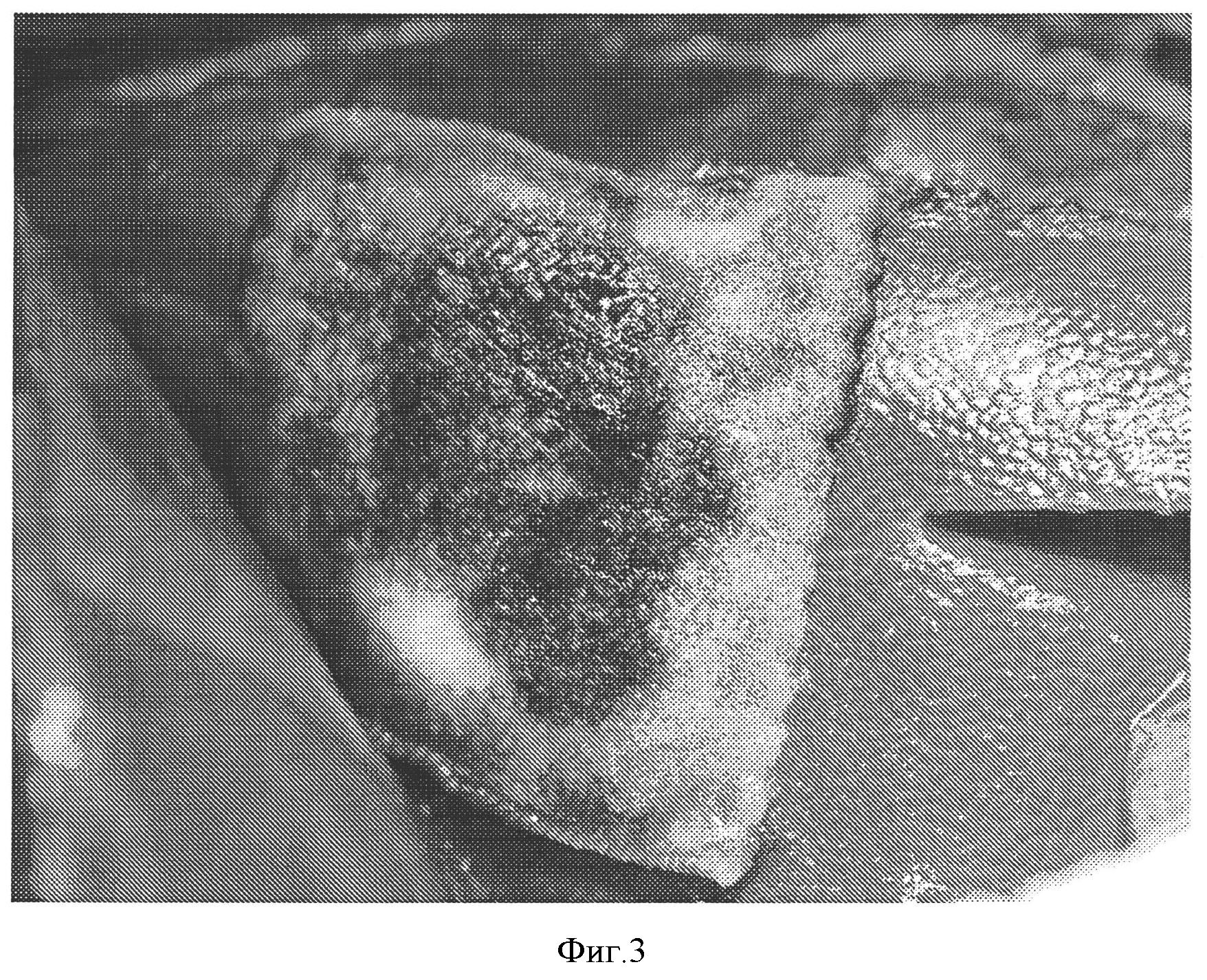
Фигура 3: Гемостатическая эффективность коллагеновой прокладки из окисленной целлюлозной ткани, покрытой NHS-PEG. Гемостатическая прокладка получена в соответствии с примером 5 и покрыта 14 мг/см2 СОН102. Гемостатическую эффективность оценивали на животной модели, как описано ниже. Кровотечение остановилось через 2 минуты после наложения прокладки. Повторного кровотечения не наблюдалось.
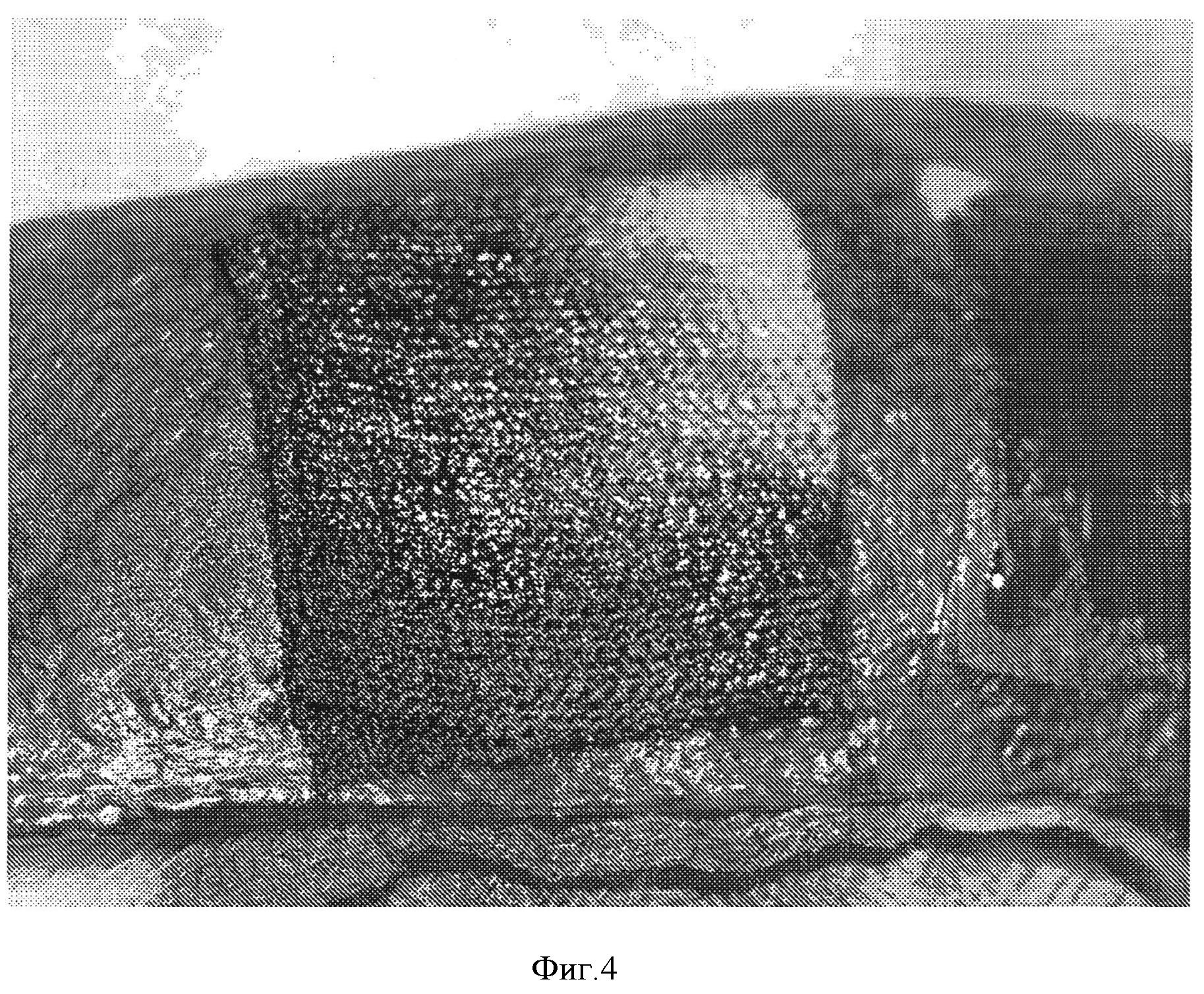
Фигура 4: Гемостатическая эффективность окисленной целлюлозной ткани, покрытой NHS-PEG. Гемостатическая прокладка получена в соответствии с примером 6 и покрыта 14 мг/см2 СОН102. Гемостатическую эффективность оценивали на животной модели, как описано ниже. Кровотечение остановилось через 2 минуты после наложения прокладки. Повторного кровотечения не наблюдалось.
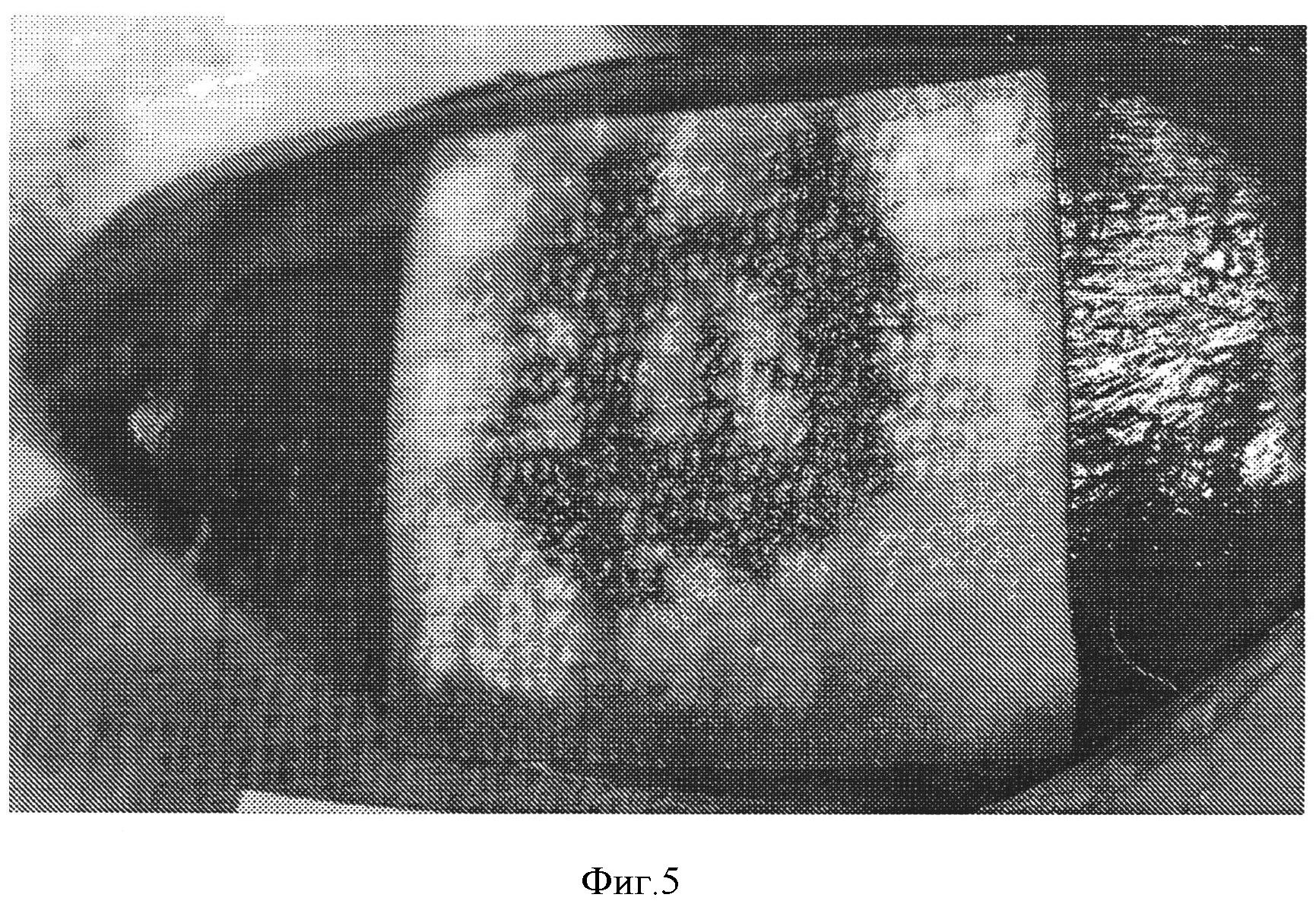
Фигура 5: Гемостатическая эффективность коллагеновой прокладки, содержащей фукоидан в качестве вещества, усиливающего свертывание крови, покрытой NHS-PEG. Гемостатическая прокладка получена в соответствии с примером 7 и покрыта 14 мг/см2 СОН102. Гемостатическую эффективность оценивали на животной модели, как описано ниже. Кровотечение остановилось через 2 минуты после наложения прокладки. Повторного кровотечения не наблюдалось.
Фигура 6: Полученное с помощью сканирующей электронной микроскопии изображение (увеличение ×500) поверхности коллагеновой губки с прерывистым покрытием.
Фигура 7: Полученное с помощью сканирующей электронной микроскопии изображение (увеличение ×500) поверхности коллагеновой губки со сплошным покрытием.
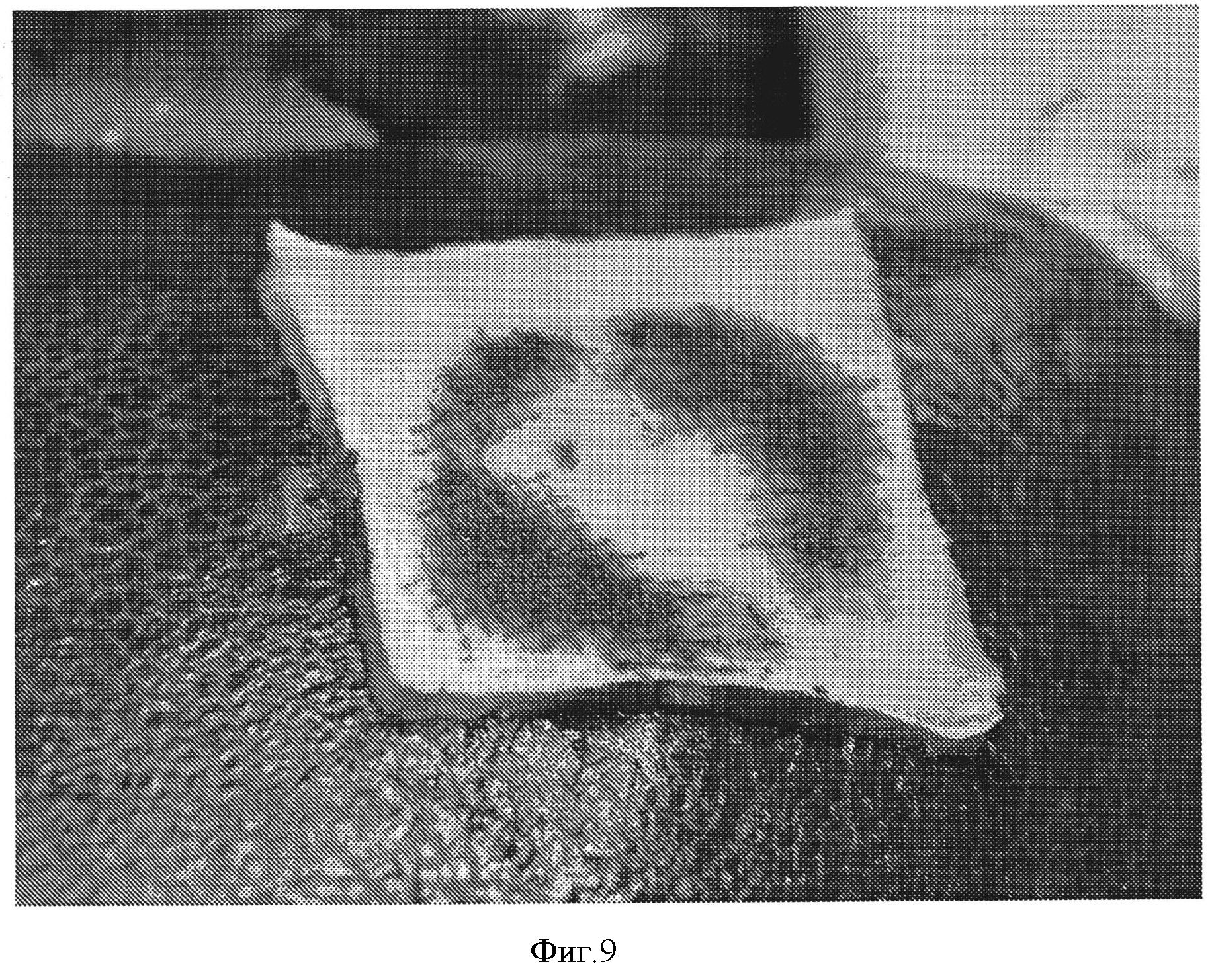
Фигура 8: Желатиновая губка Gelfoam, покрытая 14 мг/см2 СОН102, на модели абразии доли печени.
Фигура 9: Раневая повязка Chitoskin, покрытая 14 мг/см2 СОН102, на модели абразии доли печени.
Настоящее изобретение дополнительно характеризуется следующими неограничивающими примерами.
В последующих разделах используются следующие сокращения:
|
Примеры
Животная модель кровотечения для проверки эффективности гемостатических прокладок настоящего изобретения (модель абразии поверхности печени)
Эффективность гемостатических прокладок настоящего изобретения проверили на модели абразии (повреждение, при котором поверхность кожи или слизистой оболочки удаляется при помощи стирания или соскабливания) поверхности печени на гепаринизированных (2хАСТ) свиньях. Плоским, круглым, вращающимся абразионным инструментом сделали круглую кровоточащую рану (1,8 см диаметр) на поверхности печени. Прокладку настоящего изобретения (размер=3×3 см) в сухом виде накладывали на кровоточащую рану вместе с марлей, смоченной физиологическим раствором, и удерживали на месте, немного придавливая в течение 2 минут. Оценивали эффективность остановки кровотечения.
Пример 1. Приготовление суспензии бычьего коллагена
50 г нарезанного бычьего кориума (слой кожи, дерма) диспергировали в 500 мл 2 М раствора NaOH и перемешивали приблизительно 90 мин при 25°C. Кориум отсеивали и прополаскивали дистиллированной Н2O до тех пор, пока Н2O не достигала значения pH около 8,0. Промытые срезы кориума ресуспендировали в Н2О, а значение pH доводили приблизительно до 2,0 с помощью HCl. Полученную суспензию перемешивали в течение ночи приблизительно при 25°C, получая таким образом раствор коллагена. Полученный раствор охладили до 5°C, а значение pH отрегулировали до нейтрального значения с помощью NaOH. Осаждение коллагена проводили в течение ночи, оставив раствор при 18°C без перемешивания. Полученный осажденный коллаген отделили фильтрованием. Концентрацию коллагена в полученном материале определили с помощью гравиметрии. Необязательно осуществляют химическую сшивку с глютаральдегидом, т.е. приготавливают 1% водную суспензию коллагена и добавляют 5000 ч./млн глютаральдегида при 12°C. Полученную суспензию перемешивают в течение ночи. Полученный сшитый коллаген фильтруют и промывают H2O. Концентрацию коллагена в полученном материале определяют, как указано выше.
Пример 2. Коллагеновая прокладка, покрытая NHS-PEG
Порошок СОН102 равномерно распределяется на одной поверхности коммерчески доступной коллагеновой губки (Matristypt®, Dr. Suwelack Skin- and Healthcare, Германия, толщина 1 мм или 2 мм). Для покрытия используются количества СОН102 2 мг/см2, 7 мг/см2, 10 мг/см2, 14 мг/см2, 20 мг/см2. Порошок СОН102 фиксируется на поверхности губки при помощи плавления. Это осуществляют при температуре от 60°C до 65°C в течение 4 мин, поместив губку вместе с PEG-порошкообразной смесью в предварительно разогретый сушильный шкаф.
Полученную сухую губку запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек и стерилизуют γ-облучением при 25 кГр.
Пример 3. Коллагеновая прокладка, импрегнированная NHS-PEG
Приготовили водные кислые растворы (pH 3,0; АсОН) СОН102 в концентрациях 10 мг/см3, 20 мг/см3, 30 мг/см3 и 40 мг/см3 и налили их в РЕТ-кюветы 9×7 см. Коммерчески доступные губки из бычьего коллагена (Matristypt®), 9×7×0,1 или 0,2 см, такого же объема, как ранее наполненные СОН102 раствором, поместили сверху растворов для пропитывания в течение 20 мин. Раствор СОН102 абсорбируется, а полученный коллагеновый материал подвергается лиофилизации. Полученные губки могут быть дополнительно покрыты СОН102, как описано в примере 2.
После лиофилизации и/или покрытия каждую полученную высушенную губку запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек и стерилизуют γ-облучением при 25 кГр.
Пример 4. Коллагеновая прокладка, содержащая порошкообразную окисленную целлюлозу и покрытая NHS-PEG
0,5 г или 1 г порошка Traumastem® Р (Bioster, Чехия) равномерно распределили в 22 мл нейтральной водной суспензии коллагена (2,15 мг/мл; 4,3 мг/мл и 10 мг/мл), полученной согласно примеру 1. Полученную смесь налили в плоские 9×7 см РЕТ-кюветы и лиофилизировали. Полученное полотно имеет толщину примерно 3-4 мм и покрывается СОН102, как описано в примере 2.
После покрытия каждую полученную губку запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек и стерилизуют γ-облучением при 25 кГр.
Пример 5. Коллагеновая прокладка, содержащая ткань из окисленной целлюлозы и покрытая NHS-PEG
Легкое полотно 6×5 см Traumastem® TAF (Bioster, Чехия) погружают в 1% суспензию бычьего коллагена, как описано в примере 1. Ткань из окисленной целлюлозы (6×5 см) удерживает приблизительно 6 г суспензии коллагена. Полученную ткань, пропитанную суспензией коллагена, закладывают в кювету и лиофилизируют. Полученное полотно, имеющее толщину около 3-4 мм, покрывают СОН102, как описано в примере 2.
После покрытия каждую полученную губку запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек и стерилизуют γ-облучением при 25 кГр.
Пример 6. Ткань из окисленной целлюлозы, покрытая NHS-PEG
Двойной слой полотна Traumastem® Р (Bioster, Чехия) покрывают 14 мг/см2 СОН102, как описано в примере 2. Толщина полученной прокладки составляет около 1-2 мм.
Пример 7. Коллагеновая прокладка, содержащая фукоидан в качестве вещества, усиливающего свертывание крови, и покрытая NHS-PEG
Губку из бычьего коллагена Matristypt® (9×7×0,2 см) пропитывают тем же самым объемом раствора фукоидана A. nodosum (10 мкМ и 200 мкМ в 40 мМ Са2+-раствора) и лиофилизируют. Полученную губку покрывают СОН102, как описано в примере 2.
Пример 8. Коллагеновая прокладка, содержащая тромбин в качестве вещества, усиливающего свертывание крови, и покрытая NHS-PEG
Губку из бычьего коллагена Matristypt® (9×7×0,2 см) пропитывают тем же самым объемом раствора тромбина (500 IU/мл) и лиофилизируют. Полученную губку покрывают СОН102, как описано в примере 2.
Пример 9. Эффективность герметизации при использовании коллагеновой прокладки, покрытой NHS-PEG
Гемостатическую губку, покрытую 14 мг/см2 СОН102, изготавливают в соответствии с примером 2. С помощью скальпеля наносят повреждение от 1,5 до 2 см в диаметре на легкое свиньи. Образец 3×3 см указанной прокладки накладывают на рану и удерживают на месте, немного надавливая, с использованием марли в течение 2 мин. Марля предварительно насыщается или физиологическим раствором или щелочным раствором бикарбоната (pH 8,3). После наложения губка крепко прилипает к поверхности легкого (см. фигуру 6). Скорость прилипания увеличивается при использовании марли, смоченной бикарбонатом. Для того чтобы контролировать воздухонепроницаемость и адгезию прокладки к ткани, через 10 минут грудную клетку заполняют раствором Рингера. Утечки воздуха или отделения прокладки не наблюдалось.
Пример 10. Эффективность герметизации при использовании коллагеновой прокладки, импрегнированной NHS-PEG
Гемостатическую прокладку, пропитанную 40 мг/см3 СОН102, получают в соответствии с примером 3.
Скальпелем на легком свиньи делается повреждение примерно от 1,5 до 2 см в диаметре. Образец указанной прокладки 3×3 см накладывают на рану и удерживают на месте, немного надавливая, с использованием марли в течение 2 мин. Марлю предварительно пропитывают щелочным раствором бикарбоната (pH 8,3). После наложения губка крепко прилипает к поверхности легкого. Воздухонепроницаемость и адгезию прокладки к ткани определяют, как описано в примере 9.
Пример 11. Цветовая маркировка одной поверхности прокладки
Изготовленный из листа нержавеющей стали (толщиной 1 мм) экран с некоторым количеством отверстий помещают на одну сторону коллагеновой губки толщиной 1 или 2 мм (Matristypt®, Dr. Suwelack Skin- and Healthcare, Германия). Отверстия экрана имеют диаметр 2 мм и располагаются на расстоянии 1 см друг от друга в узлах вертикальной квадратной решетки. 0,5% водный раствор Erioglaucine (Fluka, Швейцария) распыляют с помощью стандартного распыляющего устройства через отверстия в экране.
Экран убирают, а коллагеновый лист с полученным синим точечным шаблоном высушивают при температуре окружающей среды, в вакуумной печи или в сушильном шкафу. Точечный шаблон на одной стороне предназначается для различения активной и неактивной поверхности покрытой прокладки. Покрытие можно наносить или на сторону с точками, или на сторону без точек.
Пример 12. Изготовление фибриновой ткани
Смешивают раствор фибриногена 2,5 мг/мл, 10 мМ Трис/HCl, 150 мМ NaCl, pH 7,4 и равный объем 55 IU тромбина/мл, 10 мМ CaCl2 с помощью стационарного миксера и сразу наливают в кювету высотой 0,7 см. В кювете получается сгусток фибрина. Посредством лиофильной сушки сгустка получают фибриновую ткань.
Пример 13. Изготовление коллагеновой прокладки, покрытой NHS-PEG-NHS, и ее тестирование на животной модели
На неокрашенную сторону коллагеновой прокладки 6×6 см (изготовленной, как описано в примере 11) равномерно наносят бифункциональный NHS-PEG-NHS (MB 10000, NOF Corporation, Япония) 14 мг/см2 и 28 мг/см2 и фиксируют плавлением. Это осуществляют при температуре приблизительно 70°C в течение 4 мин, поместив губку, покрытую порошкообразным PEG, в предварительно разогретый сушильный шкаф.
Полученные губки запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек.
Гемостатические свойства указанных прокладок тестировали на модели абразии печени свиньи, как описано выше. Свертывание крови происходило через 2 минуты. Через 10 минут не наблюдалось повторного кровотечения. Адгезия прокладки с тканью является достаточной.
Пример 14. Изготовление коллагеновой прокладки, покрытой 8-ответвленным-NHS-PEG, и ее тестирование на животной модели
На неокрашенную сторону коллагеновой прокладки 6×6 см, изготовленной, как описано в примере 11, равномерно наносят 14 мг/см2 3-ответвленный-NHS-PEG (MB 15000, NOF Corporation, Япония) и фиксируют плавлением. Это осуществляют при температуре приблизительно 65°C в течение 4 мин, поместив губку, покрытую порошкообразным PEG, в предварительно разогретый сушильный шкаф.
Полученные губки запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек.
Гемостатические свойства указанных прокладок тестировали на модели абразии печени свиньи, как описано выше. Свертывание крови происходило через 2 минуты. Через 10 минут не наблюдалось повторного кровотечения. Адгезия прокладки с тканью является достаточной.
Пример 15а. Изготовление коллагеновой прокладки, покрытой 4-ответвленным-p-NP-PEG, и ее тестирование на животной модели
На неокрашенную сторону коллагеновой прокладки 6×6 см, изготовленной, как описано в примере 11, равномерно наносят 4-ответвленный-р-МР-РЕО (MB 10000, NOF Corporation, Япония) 14 мг/см2 и фиксируют плавлением. Это осуществляют при температуре приблизительно 65°C в течение 4 мин, поместив губку, покрытую порошкообразным PEG, в предварительно разогретый сушильный шкаф.
Полученные губки запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек.
Гемостатические свойства указанных прокладок тестировали на модели абразии печени свиньи, как описано выше. Свертывание крови происходило через 2 минуты. Через 10 минут не наблюдалось повторного кровотечения. Адгезия прокладки с тканью не является достаточной.
Пример 15b. Изготовление коллагеновой прокладки, покрытой 4-ответвленным-p-NP-PEG, и ее тестирование на животной модели
Гемостатические свойства прокладки, изготовленной, как описано в примере 15а, тестировали на модели абразии печени свиньи, как описано выше, но с небольшим изменением, т.е. губку накладывали вместе с марлей, предварительно пропитанной 8% щелочным раствором бикарбоната натрия. Свертывание крови происходило через 2 минуты. Через 10 минут не наблюдалось повторного кровотечения. Адгезия прокладки с тканью является достаточной.
Пример 16а. Изготовление коллагеновой прокладки, покрытой CHO-PEG-СНО, и ее тестирование на животной модели
На неокрашенную сторону коллагеновой прокладки 6×6 см, изготовленной, как описано в примере 11, равномерно наносят CHO-PEG-CHO (MB 3400, Interchim, Франция) 9,5 мг/см2 и фиксируют плавлением. Это осуществляют при температуре 70°C в течение 4 мин, поместив губку, покрытую порошкообразным PEG, в предварительно разогретый сушильный шкаф.
Полученные губки запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек.
Гемостатические свойства указанной прокладки тестировали на модели абразии печени свиньи, как описано выше. Свертывание крови происходило через 2 минуты. Через 10 минут не наблюдалось повторного кровотечения. Адгезия прокладки с тканью является достаточной.
Пример 16b. Изготовление коллагеновой прокладки, покрытой CHO-PEG-CHO, и ее тестирование на животной модели
Гемостатические свойства прокладки, изготовленной, как описано в примере 16а, тестировали на модели абразии печени свиньи, как описано выше, но с небольшим изменением, т.е. губку накладывали вместе с марлей, предварительно пропитанной щелочным раствором бикарбоната натрия. Свертывание крови происходило через 2 минуты. Через 10 минут не наблюдалось повторного кровотечения. Адгезия прокладки с тканью является достаточной.
Пример 17а. Изготовление коллагеновой прокладки, покрытой Epoxy-PEG-Ероху, и ее тестирование на животной модели
На неокрашенную сторону коллагеновой прокладки 6×6 см, изготовленной, как описано в примере 11, равномерно наносят Epoxy-PEG-Epoxy (MB 3400, Interchim, Франция) 9,5 мг/см2 и фиксируют плавлением. Это осуществляют при температуре 70°C в течение 4 мин, поместив губку с порошкообразным PEG в предварительно разогретый сушильный шкаф.
Полученные губки запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек.
Гемостатические свойства указанной прокладки тестировали на модели абразии печени свиньи, как описано выше. Через 2 минуты свертывания крови не наблюдается. Адгезия прокладки с тканью является недостаточной.
Пример 17b. Изготовление коллагеновой прокладки, покрытой Epoxy-PEG-Epoxy и ее тестирование на животной модели
Гемостатические свойства прокладки, изготовленной, как описано в примере 17а, тестировали на модели абразии печени свиньи, как описано выше, но с небольшим изменением, т.е. губку накладывали вместе с марлей, предварительно пропитанной щелочным раствором бикарбоната натрия. Свертывание крови происходило через 2 минуты. Через 5 минут не наблюдалось повторного кровотечения. Адгезия прокладки с тканью является достаточной.
Пример 18. Изготовление коллагеновой прокладки, покрытой 4-ответвленным-Epoxy-PEG, и ее тестирование на животной модели
На неокрашенную сторону коллагеновой прокладки 6×6 см, изготовленной, как описано в Примере 11, равномерно наносят 4-ответвленный-эпокси-РЕС (MB 10000, Interchim, Франция) 14 мг/см2 и фиксируют плавлением. Это осуществляют при температуре 70°C в течение 4 мин, поместив губку с порошкообразным PEG в предварительно разогретый сушильный шкаф.
Полученные губки запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек.
Гемостатические свойства указанной прокладки тестировали на модели абразии печени свиньи, как описано выше, но с небольшим изменением, т.е. губку накладывали вместе с марлей, предварительно пропитанной щелочным раствором бикарбоната натрия. Свертывание крови происходило через 2 минуты. Через 5 минут не наблюдалось повторного кровотечения. Адгезия прокладки с тканью является достаточной.
Пример 19. Изготовление коллагеновой прокладки, покрытой ISC-PEG-ISC, и ее тестирование на животной модели
На неокрашенную сторону коллагеновой прокладки 6×6 см, изготовленной, как описано в примере 11, равномерно наносят ISC-PEG-ISC (MB 3400, Interchim, Франция) 9,5 мг/см2 и фиксируют плавлением. Это осуществляют при температуре 70°C в течение 4 мин, поместив губку с порошкообразным PEG в предварительно разогретый сушильный шкаф.
Полученные губки запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек.
Гемостатические свойства указанной прокладки тестировали на модели абразии печени свиньи, как описано выше. Свертывание крови происходило через 2 минуты. Через 10 минут не наблюдалось повторного кровотечения. Адгезия прокладки с тканью является достаточной.
Пример 20. Изготовление коллагеновой прокладки, покрытой АА-декстраном, и ее тестирование на животной модели
На неокрашенную сторону коллагеновой прокладки 6×6 см, изготовленной, как описано в примере 11, равномерно наносят смесь 0,1 мг/см2 АА-декстрана (MB 40000, Pierce, США) 14 мг/см2 и незамещенного PEG (MB 10000, Sigma Aldrich, Германия) 13,9 мг/см2 и фиксируют плавлением. Это осуществляют при температуре 80°C в течение 4 мин, поместив губку с порошкообразным PEG в предварительно разогретый сушильный шкаф.
Полученную губку запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек.
Гемостатические свойства указанной прокладки тестировали на модели абразии доли печени свиньи, как описано выше, но с небольшим изменением, т.е. губку накладывали вместе с марлей, предварительно пропитанной щелочным раствором бикарбоната натрия. Свертывание крови происходило через 2 минуты. Через 10 минут не наблюдалось повторного кровотечения. Адгезия прокладки с тканью является достаточной.
Пример 21а. Изготовление коллагеновой прокладки, покрытой DSS, и ее тестирование на животной модели
На неокрашенную сторону коллагеновой прокладки 6×6 см, изготовленной, как описано в примере 11, равномерно наносят смесь 1:1 20 мг/см2 DSS (MB 368.35, Sigma Aldrich, Германия) и незамещенного PEG (MB 10000, Sigma Aldrich, Германия) и фиксируют плавлением. Это осуществляют при температуре 80°C в течение 4 мин, поместив губку с порошкообразным PEG в предварительно разогретый сушильный шкаф.
Полученную губку запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек.
Гемостатические свойства указанной прокладки тестировали на модели абразии доли печени свиньи, как описано выше. Через 2 минуты свертывание крови не было достигнуто. Адгезия прокладки с тканью является недостаточной.
Пример 21b. Изготовление коллагеновой прокладки, покрытой DSS, и ее тестирование на животной модели
Гемостатические свойства прокладки, изготовленной, как описано в примере 21а, тестировали на модели абразии доли печени свиньи, как описано выше, но с небольшим изменением, т.е. губку накладывали вместе с марлей, предварительно пропитанной щелочным раствором бикарбоната натрия. Свертывание крови происходило через 2 минуты. Через 10 минут не наблюдалось повторного кровотечения. Адгезия прокладки с тканью является достаточной.
Пример 22а. Изготовление коллагеновой прокладки, покрытой EGS, и ее тестирование на животной модели
На неокрашенную сторону коллагеновой прокладки 6×6 см, изготовленной, как описано в примере 11, равномерно наносят смесь 1:1 26 мг/см2 EGS (MB 456.36, Sigma Aldrich, Германия) и незамещенного PEG (MB 10000, Sigma Aldrich, Германия) и фиксируют плавлением. Это осуществляют при температуре 80°C в течение 4 мин, поместив губку с порошкообразным PEG в предварительно разогретый сушильный шкаф.
Полученную губку запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек.
Гемостатические свойства указанной прокладки тестировали на модели абразии доли печени свиньи, как описано выше. Через 2 минуты свертывание крови не было достигнуто. Адгезия прокладки с тканью является недостаточной.
Пример 22b. Изготовление коллагеновой прокладки, покрытой EGS, и ее тестирование на животной модели
Гемостатические свойства прокладки, изготовленной, как описано в примере 22а, тестировали на модели абразии доли печени свиньи, как описано выше, но с небольшим изменением, т.е. губку накладывали вместе с марлей, предварительно пропитанной щелочным раствором бикарбоната натрия. Свертывание крови происходило через 2 минуты. Через 10 минут не наблюдалось повторного кровотечения. Адгезия прокладки с тканью является достаточной.
Пример 23. Фибриновая ткань, покрытая NHS-PEG
На одну сторону фибриновой ткани, изготовленной, как описано в примере 12, равномерно наносят СОН102 14 мг/см2 и фиксируют плавлением. Это осуществляют при температуре 65°C в течение 4 мин, поместив губку с порошкообразным PEG в предварительно разогретый сушильный шкаф.
Полученную губку запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек.
Гемостатические свойства указанной прокладки тестировали на модели абразии доли печени свиньи, как описано выше. Свертывание крови происходило через 2 минуты. Через 10 минут не наблюдалось повторного кровотечения. Адгезия прокладки с тканью является достаточной.
Пример 24. Взаимосвязь между силой адгезии к ткани и сшивателем, использованным для покрытия коллагеновой прокладки
После наложения прокладки на кровоточащую ткань на модели абразии печени оценивали адгезию прокладки к ткани печени. Слабую тангенциальную силу прикладывают с использованием латеральной части пинцета. Считается, что имеется адгезия (связывание с тканью), если невозможно сместить прокладку с места наложения. Оценка адгезии в баллах: 1=нет смещения через 5 минут после наложения; 2=нет смещения через 10 минут после наложения; 3=смещение (отсутствие адгезии) через 10 мин после наложения.
|
Пример 25. Хитозановая/желатиновая губка, покрытая NHS-PEG, и ее тестирование на животной модели
На коммерчески доступную губку из хитозана/желатина (Chitoskin®, Beese Medical, Германия) равномерно наносят СОН102 14 мг/см2 и фиксируют плавлением. Это осуществляют при температуре 65°С в течение 4 мин, поместив губку с порошкообразным PEG в предварительно разогретый сушильный шкаф.
Полученную губку запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек.
Гемостатические свойства указанной прокладки тестировали на модели абразии печени свиньи, как описано выше. Свертывание крови происходило через 2 минуты. Через 10 минут не наблюдалось повторного кровотечения (фигура 9). Адгезия прокладки с тканью является достаточной.
Пример 26. Изготовление желатиновой прокладки, покрытой NHS-PEG, и ее тестирование на животной модели
На коммерчески доступную желатиновую губку (Gelfoam®, Pfizer, США) равномерно наносят СОН102 14 мг/см2 и фиксируют плавлением. Это осуществляют при температуре приблизительно 70°C в течение 4 мин, поместив губку с порошкообразным PEG в предварительно разогретый сушильный шкаф.
Полученную губку запечатывают вместе с пакетиком, содержащим поглотитель влаги, в газонепроницаемый мешочек.
Гемостатические свойства указанной прокладки тестировали на модели абразии поверхности печени свиньи, как описано выше. Через 10 минут свертывания крови не наблюдалось вследствие потери адгезии с тканью и медленного поглощения жидкости губкой.
Пример 27. Скорость поглощения воды
Кусок 2×2 см сухой коллагеновой губки (Matristypt®, Dr. Suwelack, Германия) или сухой губки из сшитого желатина (Gelfoam®, Pfizer) помещают на поверхность дистиллированной воды H2O в лабораторный стакан. Сухие губки плавают на поверхности воды и поглощают воду через площадь контакта 2×2 см. Через 6 сек Matristypt® полностью пропитывается H2O, и ее убирают с поверхности воды. Более тонкая губка Gelfoam® через 13 сек не полностью пропитывается H2O, тем не менее, ее убирают с поверхности воды через 13 секунд. Исходя из веса кусочков губок 2×2 см до и после контакта в водной поверхностью, времени контакта с водной поверхностью и площади контакта с водной поверхностью, вычисляют первоначальную скорость поглощения воды губками (в мг воды/сек) на поверхность контакта (в см2). Первоначальная скорость поглощения воды составляет 35 мг×см1сек-1 для Matristypt® и 0,8 мг×см-1сек-1 для Gelfoam®.