Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ КАМПТОТЕЦИНА, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям, предназначенным для применения в качестве противоопухолевого лекарственного средства, в частности к некоторым производным камптотецина с новой химической структурой и высокой противоопухолевой активностью, к их синтезу и применению.
Уровень техники
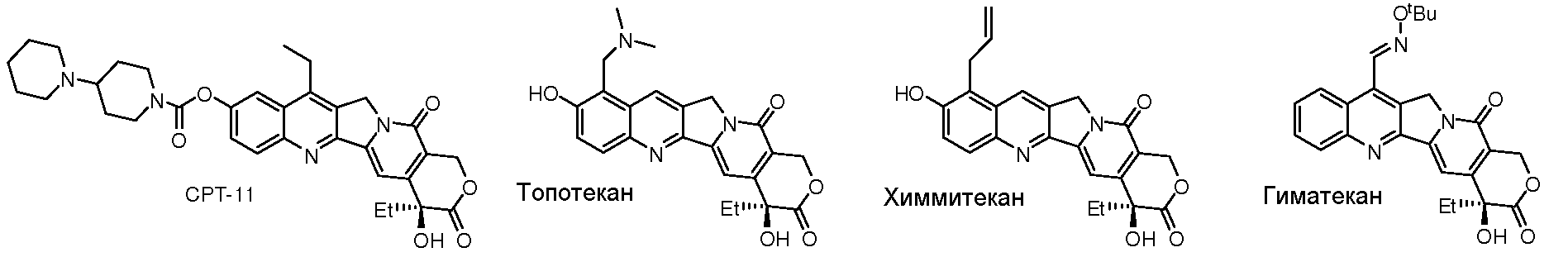
В настоящее время раковые опухоли являются одним из самых тяжелых заболеваний, которые представляют опасность для жизни и здоровья населения мира. По данным Всемирной организации здравоохранения (ВОЗ) статистические данные показывают, что ежегодно в мире наблюдается 16 миллионов случаев рака, приводящих к смерти примерно 600 миллионов человек, и рак является второй основной причиной смерти после сердечно-сосудистых заболеваний. Существуют более 70 типов противоопухолевых лекарственных средств, продающихся во всем мире, и их количество быстро растет, увеличиваясь на 1-2 новых лекарственных средства в год. Однако в Китае разработка противоопухолевых лекарственных средств еще находится на ранней стадии; по экономическим и связанным с обеспечением причинам большинство пациентов, у которых имеются опухоли, все еще не лечатся современными лекарственными средствами. Поэтому разработка новых противоопухолевых лекарственных средств с самостоятельными правами на интеллектуальную собственность очень важна для развития экономики и здравоохранения страны. Камптотецин (CPT) представляет собой тип алкалоида, выделенного из Camptotheca acuminata семейства Nyssaceae. Он действует в качестве ингибитора ДНК топоизомеразы I. Вследствие низкой специфичности камптотецин приводит к гематурии и подавлению костного мозга, что ограничивает его дальнейшее применение. Полусинтетические производные камптотецина после модификации структуры обладают повышенной специфичностью, меньшей токсичностью и повышенной эффективностью. В настоящее время лекарственные средства на основе камптотецина, имеющиеся на внутреннем и международном рынках, включают иринотекан (CPT-11), топотекан, 10-гидроксикамптотецин и белотекан (CKD-602), который появился в 2004 г. Другие лекарственные средства на основе камптотецина, которые проходят клинические исследования, включают NP-1350 (каренитецин), гиматекан, химмитекан и т.п.
Иринотекан является наиболее успешным производным камптотецина, полученным с помощью модификации структуры. Он обладает широким спектром противоопухолевых воздействий и после 5-фторурацила, появившегося 40 лет назад, является единственным лекарственным средством первой линии, использующимся для лечения метастатического колоректального рака, а также используется для лечения рака легких, рака яичников, рака молочной железы, рака желудка и рака поджелудочной железы. Топотекан является неудовлетворительным производным камптотецина, полученным путем модификации структуры. Доклинические исследования показали, что он неэффективен по отношению к большинству опухолей и в клинических условиях его можно было использовать только для лечения мелкоклеточного рака легких, который, как известно, в наибольшей степени восприимчив к химиотерапии. Несмотря на это длительность ремиссии невелика, и эффект является плохим.
Камптотецин является пентациклическим алкалоидом, который подвержен различным изменениям структуры в положениях C-7, 9-12 и 20. Высокоэффективные соединения с низкой токсичностью можно получить, если провести модификации структуры в положениях C-7 и 9. Например, этильную группу вводят в иринотекан в положении C-7; N-трет-бутилоксиметилоксимную группу вводят в гиматекан в положении C-7, причем указанная группа является липофильной и может проходить через гематоэнцефалический барьер. Для гиматекана проводят клинические исследования по лечению глиомы. Химмитекан, в котором пропенильная группа введена в положение C-9, также обладает хорошим противоопухолевым воздействием. Однако топотекан, в котором диметиламинометильная группа введена в положении C-9, не обнаруживает увеличения эффективности и уменьшенной токсичности и, в действительности, его токсичность выше, чем у 10-OH-CPT. Единственным улучшением является растворимость. Поэтому любое улучшение активности соединений при введении химических групп в положения C-7 или C-9 определяется природой введенных групп.
Сущность изобретения
Авторы настоящего изобретения провели подробное систематическое исследование противоопухолевых лекарственных средств на основе камптотецина и после выбора, сделанного на основании длительных экспериментов, установили, что соединения, полученные введением оксимной или других азотсодержащих олефиновых групп в положение C-9 одновременно с введением функциональных групп, таких как гидроксигруппа или ее производные, в положения C-10 или C-11 [структурная формула (1) в разделе Сущность изобретения] обладают превосходной противоопухолевой активностью при значительном усилении противоопухолевого воздействия in vivo. Эти соединения входят в число наиболее специфических новых производных камптотецина и являются перспективными для разработки противоопухолевых лекарственных средств на основе соединений этого типа, которые не были описаны в Китае и представляют собой новые соединения, предлагаемые в настоящем изобретении.
Подробное описание изобретения
Настоящее изобретение относится к:
1. Новым производным камптотецина, обладающим противоопухолевой активностью,
2. Соединениям, являющимся указанными производными камптотецина, и содержащим их фармацевтическим композициям, и
3. Применению указанных соединений и препаратов на основе содержащих их композиций для лечения рака.
1. Основная химическая структура новых производных камптотецина представлена следующим образом:
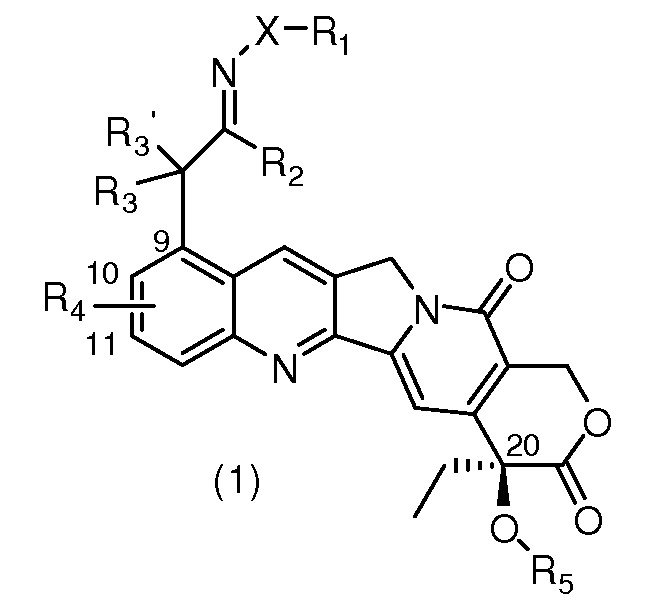
В приведенной выше структурной формуле:
R1 представляет собой H; линейную, разветвленную или циклическую C1-С10алкильную группу; линейную, разветвленную или циклическую C1-С10алкильную группу, замещенную F; линейную, разветвленную или циклическую C1-С10ацильную группу; линейную, разветвленную или циклическую C1-С10ацильную группу, замещенную F; C6-С18-углеродное ароматическое кольцо; C6-С18-углеродное ароматическое кольцо, замещенное галогеном (F, Cl, Br, I), нитрогруппой (NO2), гидроксигруппой (OH), аминогруппой (NH2), цианогруппой (CN); ароматическое кольцо, содержащее гетероатом (N, O, S);
X представляет собой O; NH; NR6; R6 представляет собой линейную, разветвленную или циклическую C1-С10алкильную группу; линейную, разветвленную или циклическую C1-С10алкильную группу, замещенную F; линейную, разветвленную или циклическую C1-С10ацильную группу; линейную, разветвленную или циклическую C1-С10ацильную группу, замещенную F;
R2 представляет собой H; линейную, разветвленную или циклическую C1-С10алкильную группу; линейную, разветвленную или циклическую C1-С10алкильную группу, замещенную F; R3 и R3' представляют собой одинаковые или различные группы, которые могут представлять собой H; F; линейную, разветвленную или циклическую C1-С10алкильную группу; линейную, разветвленную или циклическую C1-С10алкильную группу, замещенную F;
R4 представляет собой одинаковые или различные группы в положениях С10 и С11, которые могут представлять собой галоген (F, Cl, Br, I); нитрогруппу (NO2); гидроксигруппу (OH); аминогруппу (NH2); линейную, разветвленную или циклическую C1-С10алкильную группу; линейную, разветвленную или циклическую C1-С10алкильную группу, замещенную F; линейную, разветвленную или циклическую C1-С10ацильную группу; линейную, разветвленную или циклическую C1-С10ацильную группу, замещенную F; или R4 представляет собой OR7 в положении С10 или С11; где R7 представляет собой линейную, разветвленную или циклическую C1-С10карбонильную группу; линейную, разветвленную или циклическую C1-С10карбонильную группу, замещенную F; линейную, разветвленную или циклическую C1-С20карбонильную группу, содержащую атом N; карбонильную группу, содержащую природные или неприродные аминокислоты, и C-концевые пептиды, содержащие указанные аминокислоты;
R5 представляет собой H; линейную, разветвленную или циклическую C1-С10карбонильную группу; линейную, разветвленную или циклическую C1-С10карбонильную группу, замещенную F; линейную, разветвленную или циклическую C1-С20карбонильную группу, содержащую атом N; карбонильную группу, содержащую природные или неприродные аминокислоты, и C-концевые пептиды, содержащие указанные аминокислоты.
Фармацевтически приемлемые соли указанных выше соединений обычно формируются основной аминогруппой в (4'-пиперидинилпиперидинил)карбонилокси или аминогруппе в природной или неприродной аминокислоте при взаимодействии с неорганическими или органическими кислотами медицинской чистоты. Эти соли делают лекарственные средства растворимыми в воде. Например: гидрохлориды, гидробромиды, фосфаты, сульфаты, ацетаты, трифторацетаты, цитраты, малеаты, оксалаты, сукцинаты, бензоаты, тартраты, фумараты, манделаты, аскорбаты, малаты, метансульфонаты, п-толуолсульфонаты и т.п.
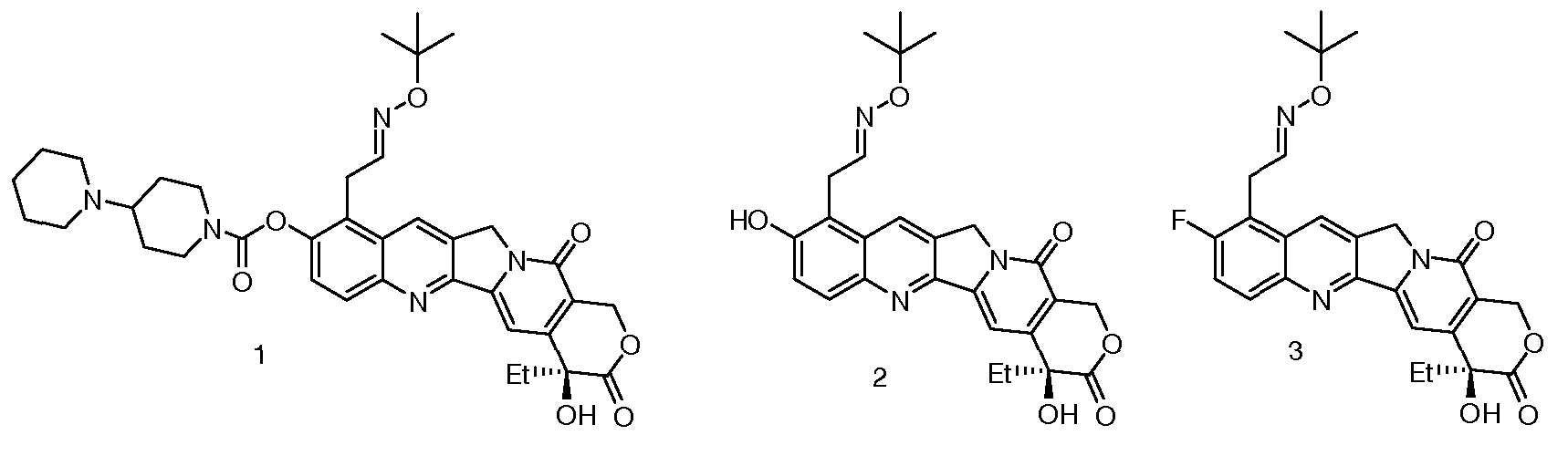
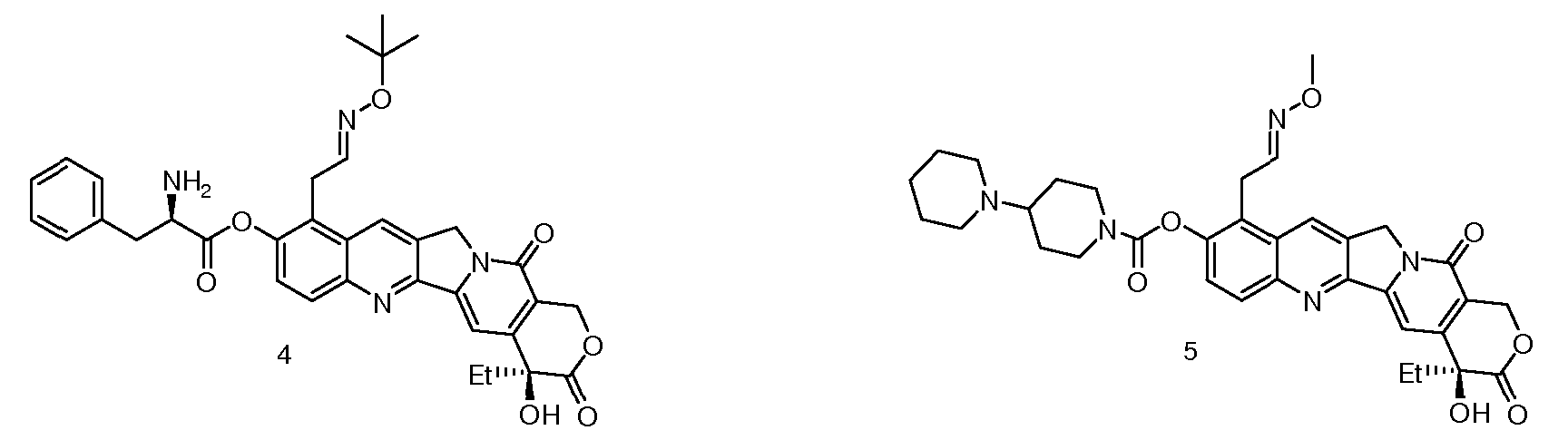
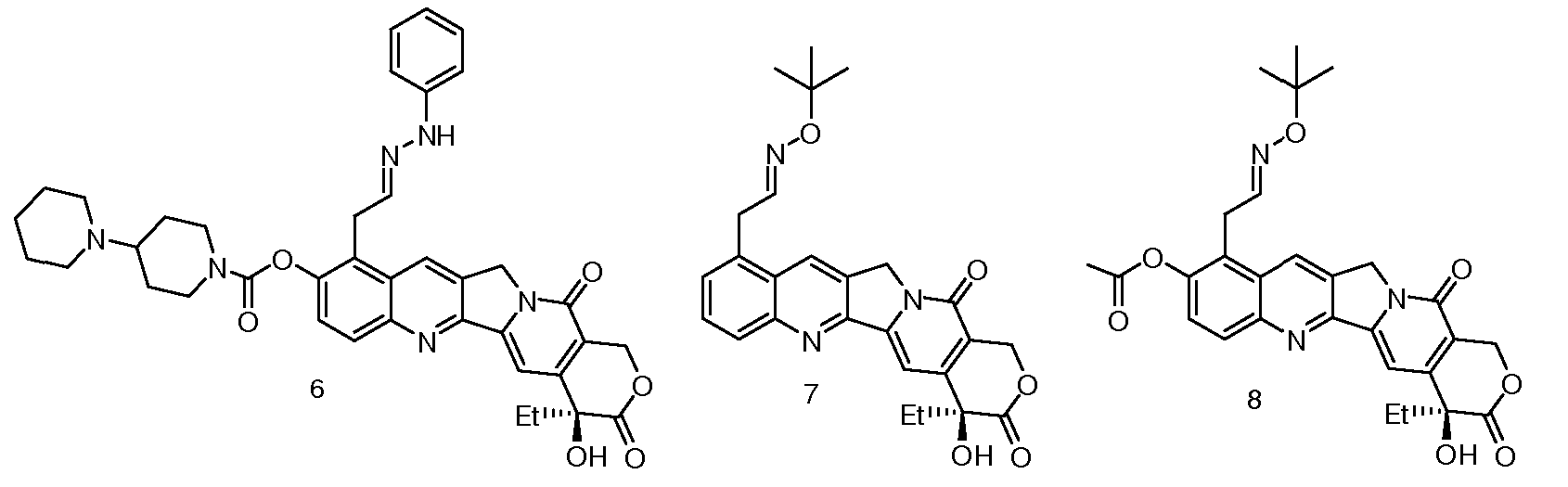
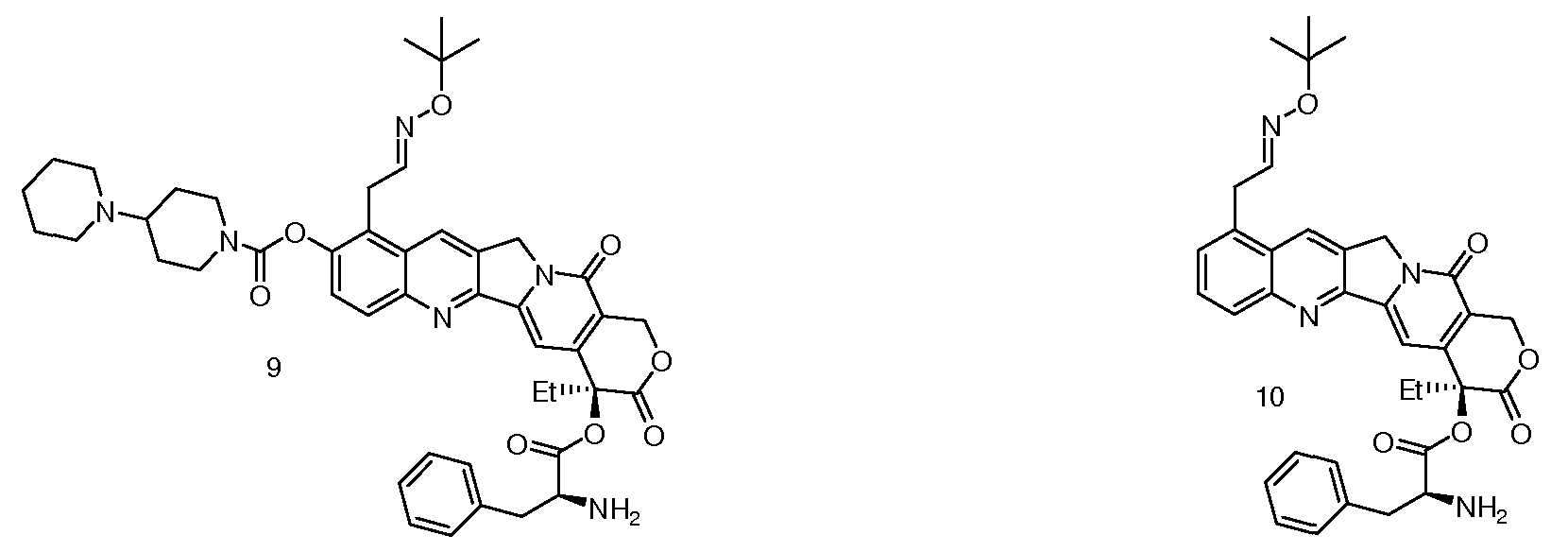
Предпочтительными вариантами осуществления настоящего изобретения являются следующие соединения (CPT1-CPT10):
CPT1: 9-трет-бутилоксиэтилоксим-10-[(4'-пиперидинилпиперидинил)карбонилокси]камптотецин;
CPT2: 9-трет-бутилоксиэтилоксим-10-гидроксикамптотецин;
CPT3: 9-трет-бутилоксиэтилоксим-10-фторкамптотецин;
CPT4: 9-трет-бутилоксиэтилоксим-10-фенилаланинкарбонилоксикамптотецин;
CPT5: 9-метоксиэтилоксим-10-[(4'-пиперидинилпиперидинил)карбонилокси]камптотецин;
CPT6: 9-фениламиноэтилгидразон-10-[(4'-пиперидинилпиперидинил)карбонилокси]камптотецин;
CPT7: 9-трет-бутилоксиэтилоксимкамптотецин;
CPT8: 9-трет-бутилоксиэтилоксим-10-ацетоксикамптотецин;
CPT9: 9-трет-бутилоксиэтилоксим-10-[(4'-пиперидинилпиперидинил)карбонилокси]-20-фенилаланинкарбонилоксикамптотецин;
CPT10: 9-трет-бутилоксиэтилоксим-20-фенилаланинкарбонилоксикамптотецин.
Настоящее изобретение также относится к способам получения представителей соединений согласно настоящему изобретению, как представлено на приведенной ниже схеме:
2. Соединения и содержащие их фармацевтические композиции
Настоящее изобретение также относится к фармацевтическим композициям, содержащим эффективное количество соединений по настоящему изобретению, где указанные фармацевтические композиции вводят перорально или путем инъекции.
Лекарственные средства для перорального введения могут находиться в форме таблеток, капсул, растворов для перорального введения, гранул, суспензий и т.п. Эксципиенты для лекарственных средств для перорального введения представляют собой обычные фармацевтические эксципиенты, включая разбавители, вкусовые агенты, солюбилизаторы, лубриканты, суспендирующие агенты, связующие, наполнители и т.п.
Препараты для инъекций могут находиться в форме жидкости, порошка, лиофилизованного порошка, липосом и т.п. Эксципиенты для препаратов для инъекций представляют собой обычные фармацевтические эксципиенты, включая растворители, разбавители, солюбилизаторы, регуляторы pH и т.п.
Эффективное количество представляет собой дозу, оказывающую положительное терапевтическое воздействие на пациента; реальная доза зависит от пути введения лекарственного средства и режима введения.
3. Применение соединений и содержащих их композиций для лечения рака
1) Исследование in vitro биологической активности новых производных камптотецина MTT (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромид) использовали для изучения in vitro ингибирующего воздействия CPT1-CPT10, активного компонента иринотекана (SN-38), гиматекана и топотекана по отношению к клеткам линий A549 (немелкоклеточный рак легких), HT-29 (колоректальный рак), OV-3 (рак яичников), U87 (глиома), BX-PC3 (рак поджелудочной железы). Результаты показали, что среди CPT1-10, пролекарства CPT1, CPT4, CPT5, CPT6, CPT9 и CPT10 не обладают значительной активностью in vitro (не приведены в таблице), тогда как CPT2, СРТ3, СРТ7 и CPT8 обладают значительной цитотоксичностью.
Воздействие CPT2, CPT3, CPT7, CPT8, гиматекана, SN-38 и топотекана на указанные линии клеток изменяется от наиболее сильного до наиболее слабого в ряду U87, BX-PC3, HT-29, OV-3 и A549. Средние концентрации (нМ) этих соединений, которые на 50% подавляют рост клеток U87, BX-PC3, HT-29, OV-3 и A549 составляли соответственно: CPT7 (3,3), CPT3 (7,1), гиматекан (2,7), CPT2 (9,1), SN-38 (10,5), CPT8 (12,9) и топотекан (197) (См. таблицу 1).
2) Терапевтическое воздействие новых производных камптотецина на ксенотрансплантаты опухолей человека
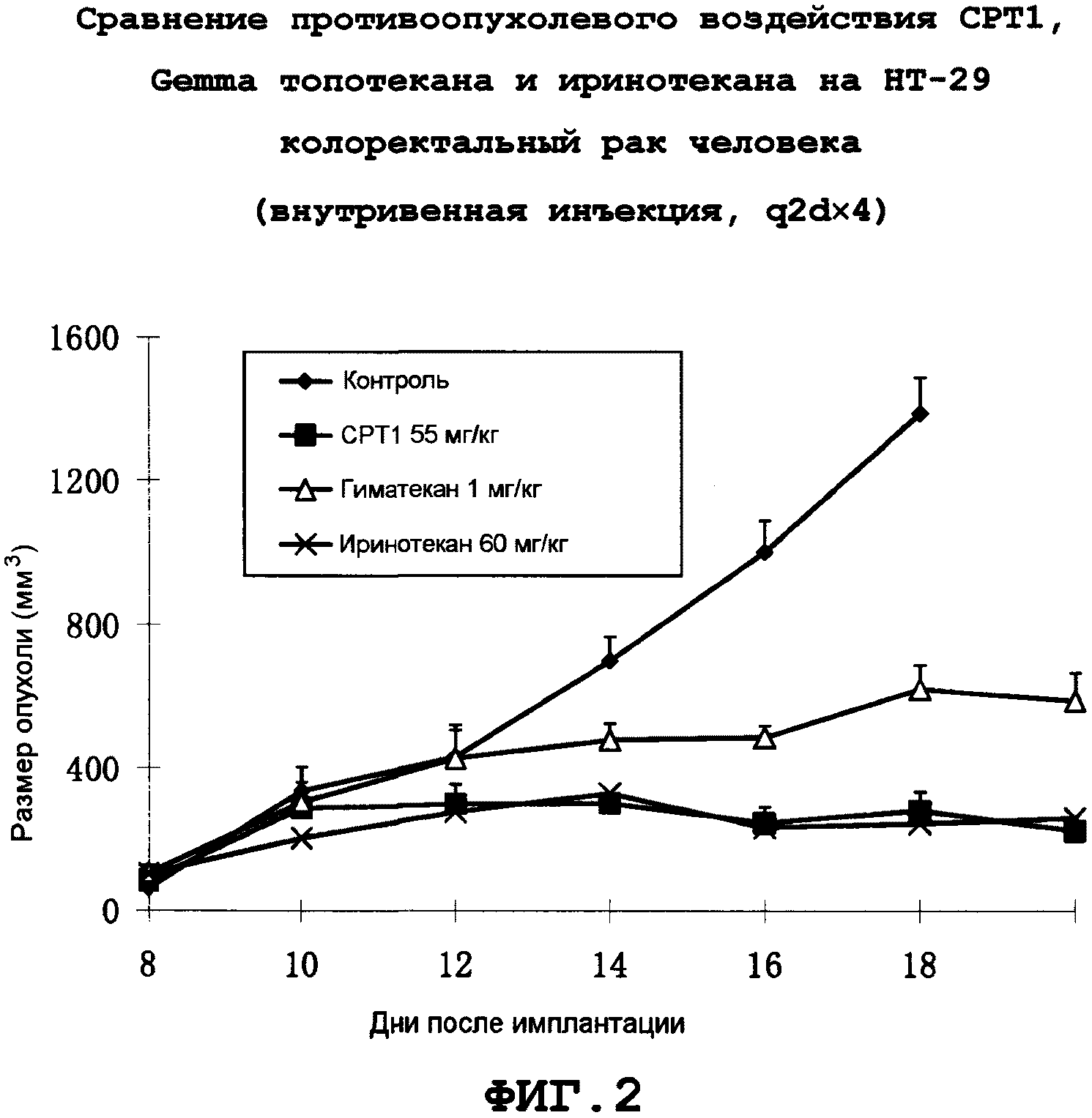
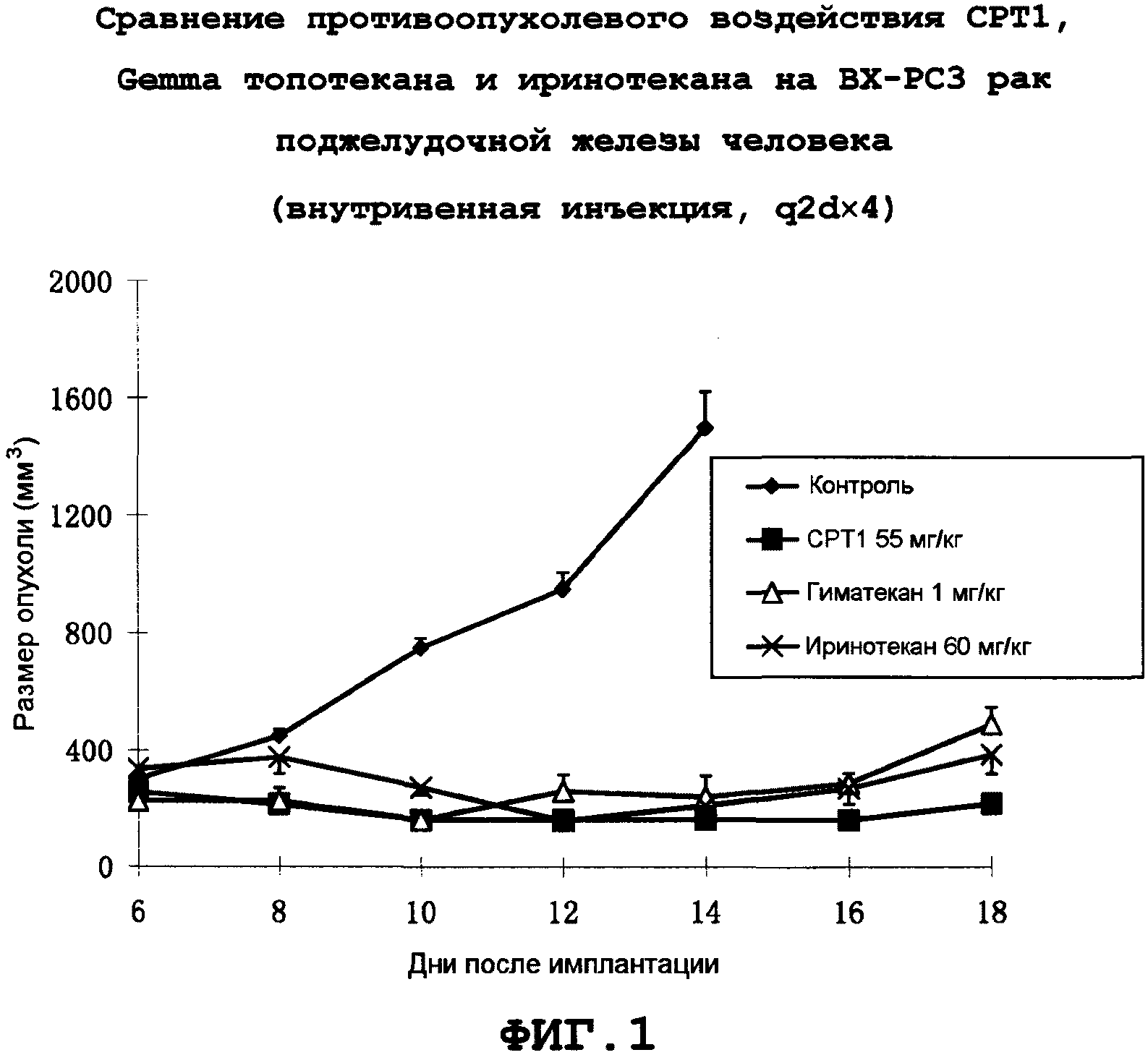
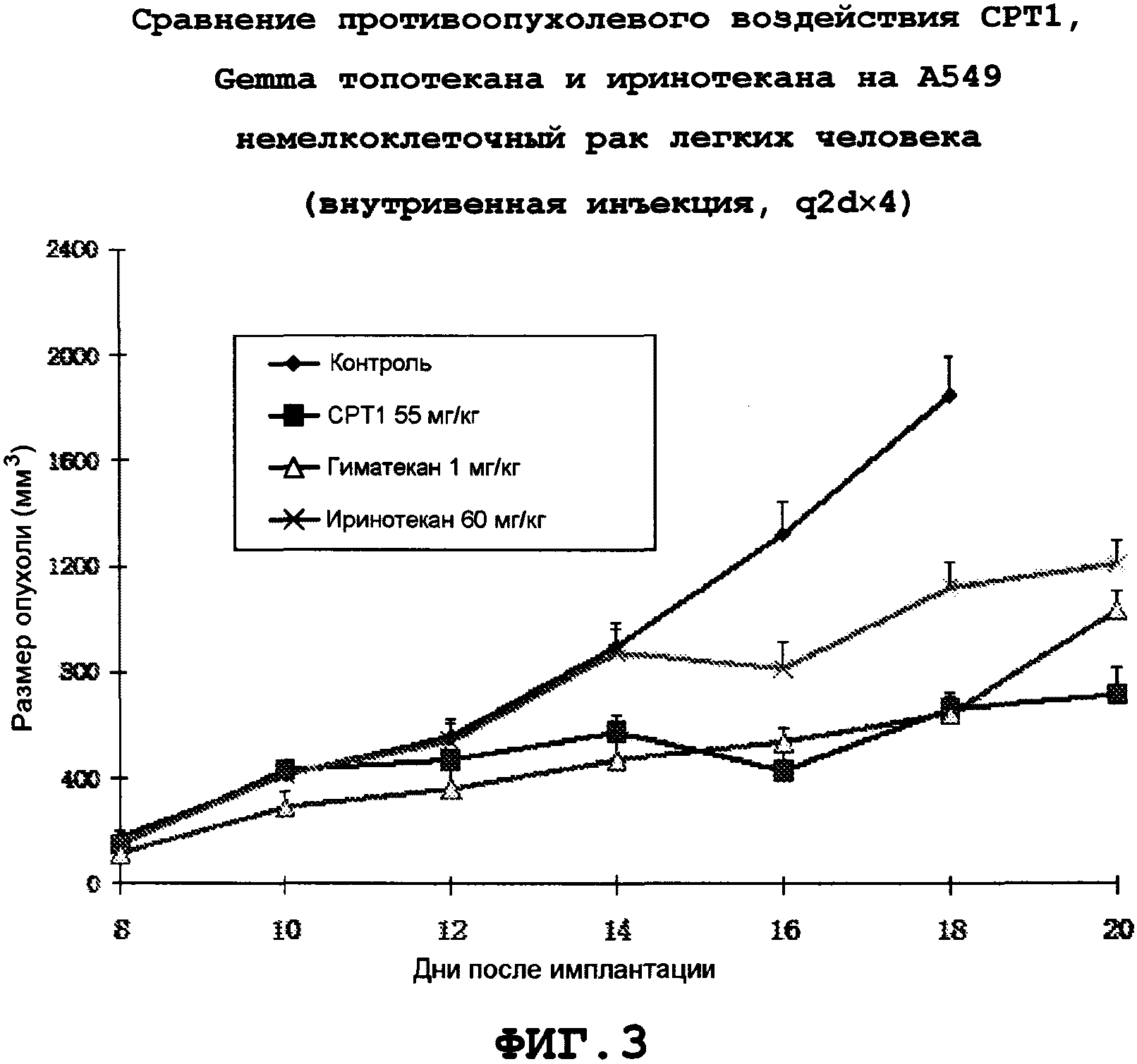
Для точной оценки противоопухолевых воздействий новых производных камптотецина in vivo проводили сопоставление противоопухолевых воздействий при одинаковой степени токсичности, и поэтому все эксперименты проводили при максимальной переносимой дозе (МПД). Экспериментально определенные дозы этих соединений с одинаковой степенью токсичности (уменьшение массы примерно на 15%) составляли: CPT1 55 мг/кг, q2d×4 (четыре дозы через день); иринотекан 55 мг/кг, q2d×4/гиматекан 1 мг/кг, q2d×4; топотекан 12 мг/кг, q2d×4. CP1 обладал лучшей растворимостью и стабильностью, чем CPT2-10. Результаты показывают, что CPT1 оказывает эффективное терапевтическое воздействие на различные трансплантированные опухоли.
Краткое описание фигур
Фиг.1: Противоопухолевое воздействие CPT1 на BX-PC-3 рака поджелудочной железы человека.
Фиг.2: Противоопухолевое воздействие CPT1 на HT-29 колоректального рака человека.
Фиг.3: Противоопухолевое воздействие CPT1 на A549 немелкоклеточного рака легких человека.
ПРИМЕРЫ
Настоящее изобретение дополнительно иллюстрируется с помощью приведенных ниже примеров, которые не ограничивают объем настоящего изобретения.
ПРИМЕР 1
Методики получения CPT1
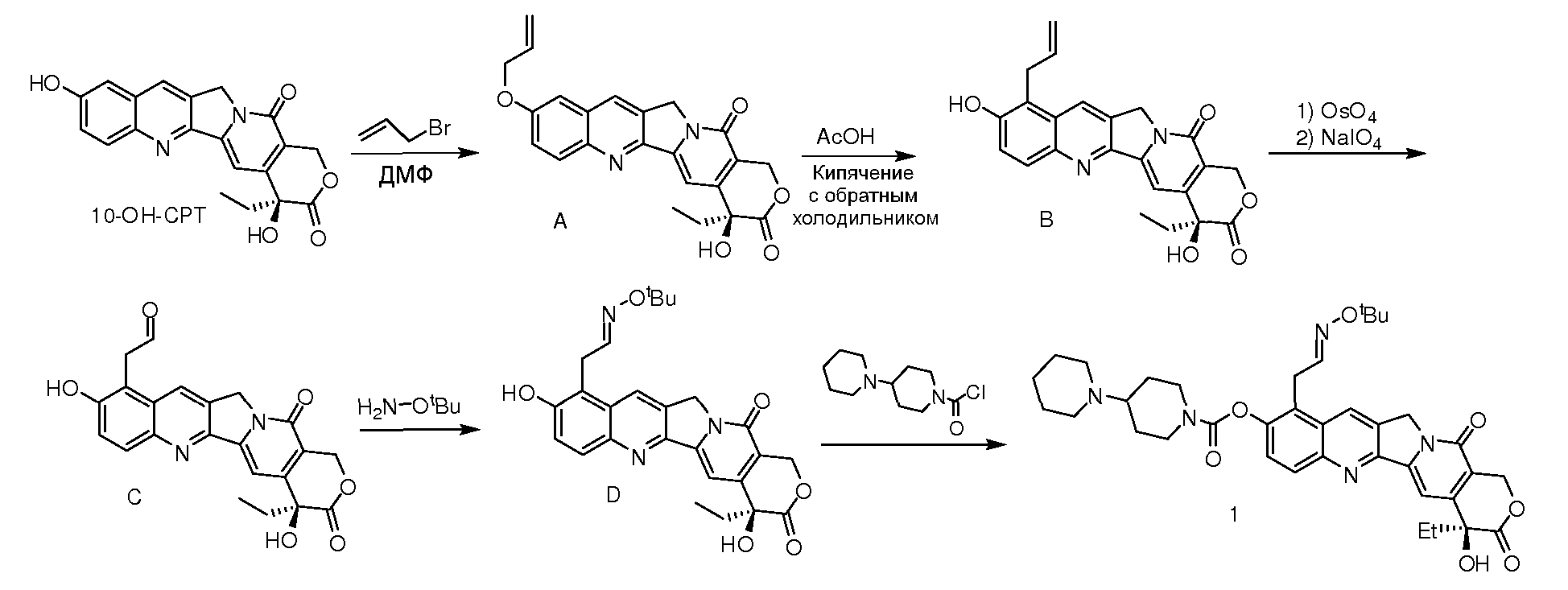
A. Синтез 10-аллилоксикамптотецина
В двугорлую колбу объемом 500 мл, снабженную баллоном с аргоном, добавляли 10,0 г (27,5 ммоль) 10-гидроксикамптотецина и 200 мл ДМФ (диметилформамид). Смесь перемешивали до полного растворения всех твердых веществ и затем последовательно добавляли 5,6 г (4,0 ммоль) карбоната калия и 2,6 мл (3 ммоль) аллилбромида, и реакции давали протекать при комнатной температуре в атмосфере аргона.
После завершения реакции продукт выливали в 250 мл воды со льдом и добавляли разбавленную хлористоводородную кислоту для доведения pH до 5. Осадившееся желтое твердое вещество отделяли фильтрованием с последующей промывкой осадка на фильтре 3×100 мл воды и 100 мл диэтилового эфира. Последующая сушка давала бледно-желтый порошок, 9,8 г (24,2 ммоль) с выходом, равным 88,2%.
1H ЯМР (CDCl3): δ 8,21 (c, 1H), 8,12 (д, 1H), 7,62 (c, 1H), 7,48 (д, 1H), 7,14 (c, 1H), 6,1 (м, 1H), 5,73 (д, 1H), 5,50 (дд, 1H), 5,47 (дд, 1H), 5,30 (м, 1H), 5,25 (c, 2H), 4,71 (д, 2H), 3,88 (c, 1H), 1,76 (м, 2H), 1,03 (т, 3H).
B. Синтез 9-аллил-10-гидроксикамптотецина
В двугорлую колбу объемом 1000 мл, снабженную баллоном с аргоном и обратным холодильником, добавляли 9,8 г (24,2 ммоль) 10-аллилоксикамптотецина и 500 мл ледяной уксусной кислоты. Смесь нагревали при кипячении с обратным холодильником в атмосфере аргона в течение 3 дней, затем выпаривали досуха при пониженном давлении. Использовали колоночную хроматографию на силикагеле со смесью дихлорметан:метанол=30:1 (об./об.) в качестве элюента, с получением 6,4 г (15,8 ммоль) коричнево-желтого порошка с выходом, равным 65,3%.
1H ЯМР (ДМСО-d6): δ 10,19 (c, 1H), 8,61 (c, 1H), 7,95 (д, 1H), 7,53 (д, 1H), 7,26 (c, 1H), 6,45 (c, 1H), 6,10 (м, 1H), 5,40 (c, 2H), 5,23 (c, 2H), 4,98 (м, 2H), 3,78 (д, 2H), 1,85 (м, 2H), 0,88 (т, 3H).
C. Синтез 2-(10-гидроксикамптотецин-9)ацетальдегида
В двугорлую колбу объемом 500 мл добавляли 6,4 г (15,8 ммоль) 9-аллил-10-гидроксикамптотецина, 250 мл диоксана и 80 мл воды. Смесь перемешивали до полного растворения всех твердых веществ и затем добавляли 0,040 г (0,158 ммоль) тетраоксида осмия. Смесь перемешивали при комнатной температуре в течение 30 мин и затем в течение 1 ч порциями добавляли 16,8 г (79,0 ммоль) периодата натрия. Реакцию останавливали через 16 ч. Добавляли 18,0 г Na2S2O3. Смесь перемешивали в течение 30 мин, затем выливали в 500 мл воды, разбавленной хлористоводородной кислотой pH доводили до 5 и экстрагировали хлороформом (500 мл ×6). Объединенный хлороформный слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Затем Na2SO4 удаляли фильтрованием, растворитель отгоняли при пониженном давлении. Использовали колоночную хроматографию на силикагеле со смесью хлороформ:ацетон=10:1 (об./об.) в качестве элюента, с получением 3,1 г (7,6 ммоль) светло-желтого порошка с выходом, равным 48,1%.
1H ЯМР (ДМСО-d6): δ 9,79 (c, 1H), 8,68 (д, 1H), 7,88 (д, 1H), 7,82 (д, 1H), 7,38 (c, 1H), 6,47 (c, 1H), 5,41 (c, 2H), 5,36 (c, 2H), 5,23 (c, 2H), 4,32 (c, 2H), 1,88 (м, 2H), 0,87 (т, 3H).
D. Синтез 2-(10-гидроксикамптотецин-9)трет-бутиламинооксима
В двугорлую колбу объемом 250 мл, снабженную баллоном с аргоном и обратным холодильником, добавляли 3,1 г (7,6 ммоль) 2-(10-гидроксикамптотецин-9)ацетальдегида, 20 мл этанола, 1,9 г (15,2 ммоль) гидрохлорида трет-бутиламина и 20 мл пиридина. Смесь перемешивали в течение 15 ч при 90°C в атмосфере аргона. После завершения реакции растворитель отгоняли при пониженном давлении, остаток разделяли колоночной хроматографией на силикагеле с использованием смеси дихлорметан:метанол=30:1 (об./об.) в качестве элюента, с получением 2,1 г (4,1 ммоль) бледно-желтого порошка с выходом, равным 53,9%.
1H ЯМР: δ 0,88 (т, H3-Е+H3-Z), 1,28 (c, t-Bu Z), 1,41 (c, t-Bu E), 1,80-1,90 (м, H2-E+H2-Z), 4,32 (c, 2H), 5,10-5,40 (м, H2-E+H2-Z), 6,53 (c, OH), 7,25-7,50 (м, H-E+H-Z), 7,70 (д, H-E), 8,05 (д, H-E+H-Z), 8,25 (c, Z), 9,0 (c, E) 10,35 (c, 1H).
1. Синтез 10-[(4'-пиперидинилпиперидинил)карбонилокси]-9-трет-бутиламинэтилоксимкамптотецина
1,5 г (6,5 ммоль) Пиперидинилпиперидинилхлоркарбониламида растворяли в 30 мл дихлорметана. 2,1 г (4,4 ммоль) 2-(10-Гидроксикамптотецин-9)трет-бутиламиноксима растворяли 30 мл безводного пиридина, который охлаждали на бане со льдом, и добавляли указанный выше раствор в дихлорметане. Смесь перемешивали в течение 16 ч при комнатной температуре, и после завершения реакции растворитель отгоняли при пониженном давлении. Затем остаток очищали колоночной хроматографией на силикагеле, с получением 2,1 г желтого твердого вещества с выходом, равным 70,1%.
1H ЯМР (CDCl3): δ 8,78 (c, E), 8,61 (c, Z), 8,13 (д, 1H), 7,66 (д, 1H), 7,58 (дд, 1H,), 7,37 (т, E), 6,68 (т, Z), 5,74 (д, 1H,), 5,29 (д, 1H), 5,26 (c, 2H), 4,43 (ушир., 1H), 4,32 (д, 1H), 4,11 (д, Z), 3,93 (д, E), 3,1 (т, 1H), 2,95 (т, 1H), 2,57 (ушир., 4H), 1,95 (ушир., 2H), 1,83 (м, 2H), 1,63 (ушир., 4H), 1,47 (ушир., 2H), 1,27 (c, E), 1,25 (c, Z), 1,03 (т, 3H).
ПРИМЕР 2
Методики получения CPT2-10
Методики получения CPT2-10 являлись такими же, как в примере 1, и отличались только исходными веществами, которые представляли собой соединения, содержащие соответствующие заместители.
ПРИМЕР 3
Получение таблеток, содержащих CPT1
|
Составляли в 1000 таблеток (50 мг/таблетка).
ПРИМЕР 4
Получение капсул, содержащих CPT1
|
Перемешивали и помещали в 1000 капсул по 50 мг/капсула.
ПРИМЕР 5
Получение таблеток и капсул, содержащих CPT2, CPT3
Получали, как в примере 3 и в примере 4.
ПРИМЕР 6
Цитотоксичность in vitro по отношению к опухолевым клеткам
Цитотоксичность in vitro исследовали с использованием MTT. Суспензию клеток готовили с использованием клеток, находящихся в хорошем состоянии, и высевали по 200 мкл/лунка в 96-луночный планшет и затем выращивали в течение 24 ч в инкубаторе с регулируемой температурой в атмосфере CO2. Исследуемое лекарственное средство добавляли по 20 мкл/лунка и выращивали в течение 48 ч. MTT добавляли в 96-луночный планшет по 20 мкл/лунка и реакции давали протекать в инкубаторе в течение 4 ч. Сепернатант удаляли и добавляли ДМСО (диметилсульфоксид) по 20 мкл/лунка. Цитотоксичность определяли по поглощению, измеренному с помощью иммуноферментного анализа при длине волны, равной 570 нм.
|
|
Средние концентрации (нМ) указанных выше соединений, подавляющих на 50% рост клеток U87, BX-PC3, HT-29, OV-3, A549 составляли, соответственно: CPT7 (3,3), CPT3 (7,1), гиматекан (2,7), CPT2 (9,1), SN-38 (10,5), CPT8 (12,9), топотекан (19,7).
ПРИМЕР 6
Противоопухолевые воздействия in vivo
Методики: для экспериментов использовали самок голых мышей. Трансплантация опухолей: Активно растущие опухолевые ткани нарезали на кусочки стерилизованными ножницами, и каждой мыши вводили 50 мг опухолевой такни. Лечение начинали в дни 6-10 после трансплантации опухоли, когда масса опухоли составляла примерно 300 мг. Голых мышей взвешивали, и раз в два дня измеряли размер опухоли. Трансплантированные опухоли: рак молочной железы человека (MX-1), немелкоклеточный рак легких человека (A549), карцинома яичников человека (SK-0V3), колоректальная карцинома человека (HT29), рак поджелудочной железы человека (BX-PC-3).
A:
B: Исчезновение опухоли: опухоль невозможно было обнаружить визуально через 60 дней после начала эксперимента.
|
Режим дозирования: через день, всего 4 раза; путь введения: внутривенная инъекция в хвостовую вену. # Через 16 дней после начала лечения. Исчезновение опухоли наблюдалось через 60 дней. Использовали такие дозы, которые определены экспериментально, как приводящие к такой же токсичности с уменьшением массы на 12-15%. РО: размер опухоли.
|
|
Режим дозирования: через день, всего 4 раза; путь введения: внутривенная инъекция в хвостовую вену. # Через 16 дней после начала лечения. Исчезновение опухоли наблюдалось через 60 дней. Использовали такие дозы, которые определены экспериментально, как приводящие к такой же токсичности с уменьшением массы на 12-15%. РО: размер опухоли.
|
Режим дозирования: через день, всего 4 раза; путь введения: внутривенная инъекция в хвостовую вену. Мыши погибали от опухоли головного мозга после введения 2×105 клеток. #: Сопоставление CPT1 с иринотеканом и гиматеканом. Продолжительность жизни статистически значимо увеличивалась, P<0,05.