БЫСТРО РАСТВОРЯЮЩИЕСЯ СИСТЕМЫ, ОСВОБОЖДАЮЩИЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к введению биоактивных агентов с помощью быстро диспергируемых/растворяющихся систем, освобождающих лекарственные препараты для лечения пациентов с критическими патологиями ротовой полости, приводящими к затруднениям в проглатывании оральных лекарственных форм и, соответственно, к затруднениям в лечении упомянутых заболеваний.
В частности, настоящее изобретение описывает введение биоактивных агентов с помощью оральных быстро диспергируемых/растворяющихся систем, освобождающих лекарственные препараты для лечения заболеваний пациентов с дисфагией, и/или одинофагией, и/или риском аспирации. Другой аспект настоящего изобретения заключается во введении биоактивных агентов с помощью быстро диспергируемых/растворяющихся систем для лечения дисфагии, и/или одинофагии, и/или риска аспирации.
Уровень техники
Некоторые пациенты сталкиваются с критическими патологиями полости рта, включая затруднения в проглатывании таблеток и капсул, что приводит к проблемам приема оральных лекарственных форм. Эти критические патологические состояния полости рта известны как «дисфагия», общий термин, означающий затруднения глотания, или, более конкретно, «одинофагия», что означает болезненное глотание или «риск аспирации», когда материал, такой как лекарство, пища, слюна или отделяемое носоглотки, попадают вместо пищеварительного тракта в дыхательные пути дыхательного тракта.
Дисфагия или затруднения глотания - это патология или симптом, которые могут быть вызваны множеством разных условий, повреждений или заболеваний. Дисфагия может вызвать шок, попадание пищи или жидкости в легкие, что может привести к пневмонии (называемой «аспирационной пневмонией») или неполному введению орального лекарства. Эти факторы могут, по меньшей мере, вызвать дискомфорт у пациента, но могут также взаимодействовать или усложнить общепризнанное лечение пациентов при лечении других параллельно существующих заболеваний. Среди многих вкладов и причин дисфагии - повреждения головы, повреждения ствола головного мозга, мозговые сосудистые катастрофы, паркинсонизм, болезнь Альцгеймера, мышечная дистрофия, церебральный паралич, рак (конкретно, опухоли мозга), диабет, побочные эффекты лекарственных средств, продвинутые HIV инфекции, желудочно-кишечные нарушения, гастро пищеводное нарушение или нарушение рефлюкса. Согласно оценке, более 10000 пациентов в год погибают от шока в результате дисфагии.
Онкологические пациенты, получающие химиотерапию или радиотерапию, или пациенты в постоперационном периоде очень часто страдают от таких побочных эффектов, как тошнота и рвота, причина которых должна быть установлена. Но в результате побочных эффектов химиотерапии или радиотерапии у этих пациентов развиваются критические патологические состояния полости рта, такие как дисфагия или затруднения глотания. Кроме того, ондансетрон, один из наиболее рекомендуемых биоактивных агентов для лечения тошноты или рвоты, известен как препарат, индуцирующий дисфагию при долговременном применении. Поэтому имеется особая необходимость идентифицировать раствор, пригодный для введения ондансетрона, и ограничить риск дисфагии.
Пациенты с заболеваниями головы/шеи или с AIDS также часто страдают от дисфагии.
Такие патологии часто проявляются у пожилых пациентов. По мере старения популяции количество людей, страдающих от дисфагии, возрастает. Многие пожилые люди могут иметь затруднения с проглатыванием пищи и развитием симптомов дисфагии. Во многих случаях дисфагия может вызывать аспирацию и попадание веществ из дыхательных путей в легкие, может вызвать бактериальную инфекцию, приводя к пневмонии.
Эти явления наблюдаются часто также у детей, которые обычно не соглашаются принимать орально твердые дозированные формы. Зачастую дисфагию индуцируют лекарства, применяемые для долговременного лечения других заболеваний. Например, это наблюдается в случае лекарств для лечения центральной нервной системы, сердечно-сосудистой системы или противовоспалительных лекарств и анальгетиков. Кроме того, дети имеют наибольший риск умереть и получить повреждения от механической закупорки дыхательных путей, что в значительной степени связано с их анатомической незрелостью (Tarrago, 2000). У них не полностью развиты жевательные зубы и отсутствуют коренные зубы. Кроме того, их дыхательные пути тонки, у них снижена жевательная способность, а скорость дыхания у них выше, чем у старших детей и подростков (Gregori, 2008). Таким образом, аспирация представляет собой реальный риск для детей.
Дисфагия часто может быть преодолена с помощью гигиенических и диетических способов или биоактивных агентов, таких как ингибиторы протонной помпы (PPI), анти-Н2 или прокинетические агенты. Однако эти виды лечения сопровождаются вторичными эффектами (ятрогенные патологии), поэтому следует избегать их долговременного применения.
Ингибиторы протонной помпы являются очень сильными ингибиторами кислотной секреции желудка. Особенно они проявляются при лечении воспаления пищевода или пептидного стеноза. Они могут также использоваться путем долговременного применения, но имея сильные ятрогенные эффекты, они ответственны также за дезориентацию пациента. Лица старше 80 лет не должны использовать их слишком долго. Эти препараты омегразол, лансопразол и пантопразол.
Анти-Н2 эффективны против 60% симптомов, и эффективность снижается со временем. Эти препараты циметидин, рантидин, фамотидин или низатидин. Они также обладают сильными ятрогенными эффектами, особенно гипосализмом, и должны применяться с осторожностью пациентами с пониженным клиренсом креатина, встречающимся все чаще с возрастом.
Прокинетические агенты так же эффективны, как анти-Н2, но имеют те же недостатки и больше побочных эффектов (диарея, тошнота, взаимодействие с другими медикаментами).
В то время как дисфагия возникает под действием препаратов, индуцирующих дисфагию при долговременном лечении, раствор предназначен для подавления таких препаратов. К сожалению, это не всегда возможно и зависит от тяжести заболевания.
Общепринятые оральные дозированные формы, такие как таблетки, пилюли, таблетки в виде капсул или капсулы, предназначены для кратковременного пребывания в полости рта. Адсорбция активного агента из этих дозированных форм происходит в желудочно-кишечном тракте только после того, как дозированная форма подвергнется дезинтеграции и последующему растворению агента в жидкостях желудка. Поэтому эти дозированные формы непригодны для пациентов с дисфагией или затруднениями проглатывания.
Для целенаправленного орального введения биоактивного начала пациенту с затруднением проглатывания была разработана жидкая дозированная форма. Действительно, жидкая форма более удобна для проглатывания, чем твердая форма. Однако манипулирование и доставка упомянутой жидкой системы всегда представляет проблему по сравнению с твердой системой. В сущности жидкая дозированная форма часто оказывается нестабильной при хранении, и более сложно точно дозировать жидкую дозированную форму биоактивного агента при введении пациентам. Таким образом, желательны дозированные формы с преимуществами жидкостей и с возможностью хранения и точностью дозировки твердой дозированной формы.
Однако жидкая форма пока неприменима для пациентов с тяжелыми затруднениями глотания.
Чтобы преодолеть этот недостаток, были разработаны такие таблетки, которые быстро диспергировались в полости рта. В этом случае биоактивный агент быстро растворяется в слюне, образуя жидкую форму, которая очень легко проглатывается. Однако время оральной дезинтеграции/дисперсии оказывается критическим параметром для преодоления недостатка техники. Действительно, время оральной дезинтеграции/дисперсии существующей дезинтегрирующейся/диспергируемой таблетки часто составляет несколько минут, что слишком долго для преодоления риска, связанного с шоком или позывами к рвоте, наблюдаемыми у лиц с ограниченным контролем глотательных рефлексов.
Иногда советуют применять внешнюю воду сразу после помещения дезинтегрирующейся/диспергируемой таблетки в рот, чтобы ускорить ее дезинтеграцию/дисперсию во рту перед проглатыванием. Но это применение внешней воды оставляет затруднение в проглатывании у пациента с критической патологией рта.
Кроме того, часто советуют, чтобы дети растворяли оральную дезинтегрирующуюся/диспергируемую таблетку в воде, прежде чем брать ее в рот. Однако этот способ также непригоден в случае затруднений с проглатыванием.
Зофрен (Zofran®) - это таблетка, которая в качестве биоактивного начала содержит ондансетрон. Зофрен - противотошнотное и противорвотное средство, предназначенное для предотвращения тошноты и рвоты, связанных с умеренно-эметогенной противоопухолевой химиотерапией и для предотвращения постоперативной тошноты и рвоты. Зофрен - высокоспецифичный и селективный антагонист серотонинового 5-НТЗ рецептора, не обладающий, как было показано, активностью по отношению к другим известным серотониновым рецепторам и обладающий низкой активностью к допаминовым рецепторам.
Был разработан продукт Зофран, Sofran ODT®, производное Зофрена (для орально дезинтегрирующихся таблеток Zofran). Будучи помещен на корень языка, он растворяется за секунды и может затем быть проглочен со слюной. В обзоре свойств продукта Zofran ODT® указано, что детям младше 6 лет в связи с риском аспирации таблетки следует рекомендовать перед проглатыванием растворить ее в воде или в сиропе. Таким образом, Zofran® и Zofran ODT® не вполне пригодны в случае дисфагии и риска аспирации.
Кроме того, несколько производителей предложили формы, которые могли бы быть использованы для освобождения биоактивных агентов. Подавляющее большинство этих форм - это «мукоадгезивные» формы, предназначенные для адгезии дозированной формы к слизистой оболочке рта и передачи лекарственного препарата из дозированной формы через слизистую оболочку в системную циркуляцию. Как описано в U.S. Patent No. 6,750, 291 Kim et al., использовали агенты, образующие пленку, для производства освобождающих препарат форм, предназначенных для подкожного или чрескожного введения, причем эти агенты должны обязательно содержать адгезивную композицию для достаточно длительного удерживания агента на своем месте, чтобы обеспечить высвобождение активного ингредиента. Биоразрушаемые пленки описаны в Tapolsky et al., U.S. Patent No. 5,800,832. Пленки имеют адгезивный слой и неадгезивную подложку и предназначены для адгезии к поверхности слизистой оболочки. Biegajski et al., U.S. Patent No. 5,700,478, описывает водорастворимую чувствительную к давлению мукоадгезивную поверхность, пригодную для использования в покрытой слизистой оболочкой полости организма. Основное преимущество этих мукоадгезивных пленок заключается в трансмукозальном пути адсорбции и связанном с ним способе обходить желудочно-кишечный тракт и барьеры в желудочно-кишечном тракте, препятствующие адсорбции лекарства, такие как пресистемный метаболизм и распад активного ингредиента в желудке. Однако такая система доставки нацелена на новый путь введения и поэтому не может применяться для биоактивных агентов, для которых их клиническая эффективность доказана при оральном введении. Действительно, особенно эффективная система доставки должна быть разработана или применена для адсорбции биоактивного агента в желудочно-кишечном тракте, который должен быть биоэквивалентен и взаимозамещаем с существующим вводимым перорально лекарственным препаратом.
Таким образом, необходима твердая, не мукоадгезивная и быстро растворяющаяся без добавления дополнительной воды система освобождения для орального введения пациенту с критической патологией ротовой полости.
Раскрытие изобретения
Настоящее изобретение относится к пленочным дозированным формам, которые разработаны или применяемы для желудочно-кишечной адсорбции биоактивного агента и которые биоэквивалентны и взаимозамещаемы с существующими вводимыми перорально лекарственными препаратами.
Эти пленочные дозированные формы не являются мукоадгезивными; они адсорбируются преимущественно через желудочно-кишечный тракт. Самое главное, эти дозированные формы составлены специально так, чтобы удовлетворить существующим требованиям биодоступности или чтобы быть биоэквивалентными существующим вводимым орально дозированным формам, и особенно подходят пациентам с дисфагией, поскольку они быстро дезинтегрируются в полости рта при взаимодействии со слюной и не требуют добавления воды для ускорения дезинтеграции.
Таким образом, в первом основном воплощении настоящее изобретение предлагает оральную быстро растворяющуюся пленку, содержащую активное начало для лечения болезней пациентов с критической патологией ротовой полости. Для облегчения растворения или проглатывания активного начала не требуется добавления воды.
В предпочтительных аспектах изобретения критические патологии ротовой полости - это дисфагия, риск аспирации, одинофагия, индуцированные химиотерапией и/или радиотерапией мукозиты, рак головы, шеи или пищевода или сниженное слюноотделение.
Другой предпочтительный объект изобретения - оральная быстро растворяющаяся пленка, содержащая активное начало для лечения таких заболеваний, как нейропатии (болезнь Альцгеймера, болезнь Паркинсона, эпилепсия) или заболевания легких. Более предпочтительный предмет изобретения - оральная быстро растворяющаяся пленка, содержащая активную основу для лечения заболеваний детского или старшего возраста. Предпочтительны также пациенты с ятрогенными патологиями.
Обычно в геронтологии часто встречаются ятрогенные патологии. Некоторые лекарственные препараты могут, например, ухудшать секрецию слюны (антидепрессанты, трициклические соединения, антихолинэргетики) и даже изменять ротоглоточные ощущения (токсины).
Оральная быстро растворяющаяся пленка по настоящему изобретению пригодна также для лечения пациента с одним или большим числом биоактивных агентов, которые могут вызвать гипосаливацию при долговременном лечении:
|


Другим объектом настоящего изобретения является разработка оральных быстрорастворимых пленок, содержащих активный агент для лечения дисфагии, риска аспирации, одинофагии, индуцированных химиотерапией и/или радиотерапией мукозитов, рака головы и шеи или пищевода или сниженного слюноотделения.
В другом предпочтительном воплощении биоактивные агенты для лечения дисфагии - это ингибиторы протонной помпы (PPI), анти-Н2 или прокинетические агенты.В следующем предпочтительном воплощении биоактивный агент пригоден для лечения заболеваний, несмотря на его неблагоприятный побочный эффект, заключающийся в индуцировании дисфагии при долговременном лечении.
В следующем предпочтительном воплощении оральная быстрорастворимая пленка по данному изобретению содержит биоактивный агент, гидрофильное связывающее вещество и водорастворимые разбавители.
В предпочтительном воплощении биоактивный агент выбирают из: гидрохлорида донепезила; ондансетрона, основного ондансетрона; деслоратадина; оланзапина; риспенидона; тартата ривастигмина; силденафила; варденафила; галантамина; диклофенака калия; бупренорфина НС1; дегидрата налоксона НС1; алпразолама; клоназепама; диазепама; лоразепама; суматриптана; элетриптана; ризатриптана; золмитриптана, наратриптана; алмотриптана; фроватриптана; гидрохлорида цетризина; лоратадина; гидрохлорида амброксола; апоморфина; аскорбиновой кислоты; бетаметазона; кафеина; декстрометорфана; глимепирида; гидрокортизона; кетотифена; лоперамида; меклозина; мелатонина; нерамексана; пироксикама; пикосульфата натрия; и гистидина цинка; или их фармацевтически приемлемых солей или их комбинации.
Особенно предпочтительный биоактивный агент по настоящему изобретению -ондансетрон и, более предпочтительно, ондансетрон основной.
Кроме того, оральная быстрорастворимая пленка по данному изобретению содержит от 0,05% до 50% от веса биоактивного агента.
Оральная быстрорастворимая пленка по данному изобретению содержит от 40% до 80% от веса одного или большего числа ингредиентов, состоящих из гидрофильных связывающих веществ и водорастворимого разбавителя. Гидрофильное связывающее вещество предпочтительно может быть поливиниловым спиртом, а водорастворимый разбавитель может предпочтительно быть рисовым крахмалом.
В предпочтительном воплощении изобретение предлагает не мукоадгезивную орально дезинтегрируемую пленку, способную распадаться при контакте со слюной в ротовой полости в течение приблизительно шестидесяти секунд, включающую ондасетрон основной в комбинации с гидрофильным связывающим веществом и водорастворимым разбавителем, и предназначена для провоцирования адсорбции упомянутого ондансетрона в желудочно-кишечном тракте, где: (а) упомянутое предназначено для провоцирования адсорбции ондансетрона в основной форме; (b) упомянутая пленка включает от приблизительно 4 до приблизительно 24 мг ондансетрона основного; (с) ондансетрон основной присутствует в количестве от приблизительно 0,05% до приблизительно 50% (в/в), по отношению к полному весу формулы, (d) упомянутая пленка имеет Tmax от приблизительно 1,5 до приблизительно 2,5 часов, и (е) упомянутый ондастерон основной имеет абсолютную биодоступность в упомянутой дозированной форме от приблизительно 45% до приблизительно 75%. Наиболее предпочтительная пленка содержит 4 или 8 мг ондансетрона основного.
Дополнительные преимущества изобретения будут частично представлены ниже в описании изобретения и частично будут очевидны из описания или могут быть изучены при практическом применении изобретения. Преимущества изобретения будут реализованы и достигнуты с помощью элементов и комбинаций, специально указанных в приложенной формуле изобретения. Нужно понимать, что оба вышеупомянутых общих описания и нижеследующее детальное описание являются только иллюстративными и описательными, но не ограничивающими заявленное изобретение.
Осуществление изобретения
Настоящее изобретение будет лучше понято с помощью ссылки на следующее подробное описание предпочтительных воплощений изобретения и примеров, включающих их.
Определения
Термин «внешняя добавленная вода», «внешняя вода» или «добавленная вода» означают, что вода не имеет своим источником слюну.
Термин «дезинтеграция» имеет привычное, обычно применяемое в фармацевтической технике значение, как описано в <701> Фармакопеи U.S. Pharmacopoeia (2005 USP/NF) для таблеток без покрытия с использованием корзиночного набора штативов, вращающегося при 30 оборотах в минуту на расстоянии 5,5 см, в дезинтегрирующей среде при 37°C. Требования к дезинтеграции преимущественно совпадают с ранее указанными условиями тестирования при pH 4,0 или 6,8. О пленке или другой дозированной форме говорят, что она «дезинтегрирована», если она дезинтегрирована, то есть находится в состоянии, в котором любой остаток препарата, остающийся на сетке тестирующей аппаратуры или во рту, - это мягкая масса, не имеющая ощутимой пленки на поверхности или фрагментов покрытия таблетки или оболочки капсулы. Таким образом, дезинтеграция не предполагает полного растворения дозированной формы или даже активного агента хотя растворенная дозированная форма обычно полностью дезинтегрирована. В настоящей заявке ссылка на Европейскую Фармакологию 2.9.1 (дезинтеграция) означает, что могут использоваться также описанные выше условия дезинтеграции при <701> USP.
Термин «растворение» также имеет привычное, обычно применяемое в фармацевтической технике значение, как описано в <711> и <724> Фармакопеи U.S. (2005 USP/NF). Таким образом, считают, что пленка «растворена», если при тестировании по методу U.S. Pharmacopoeia (2005 USP/NF), количество растворенного агента в растворяющей среде превышает заранее определенный процент. Если заданы условия растворения, следует иметь в виду, что предпочтительно выполнять растворение в 0.1N солянокислом буфере (pH 2), или при pH 1,2, pH 4,0 или 6,8, при 37°C, используя аппарат для растворения типа II, основанный на лопастном методе при 50 оборотах в минуту.
Выражение «орально растворяющаяся или орально диспергируемая таблетка» («ODT») относится к непокрытым таблеткам, предназначенным для помещения в ротовую полость, где она может быстро диспергировать, прежде чем будет проглочена, как описано в Eur. Ph. 5.0. ODT распадается за три минуты при проверке с помощью описанного здесь тестирования дезинтеграции.
Термин «не мукоадгезивный» означает, что дозированная форма не предназначена для введения активного фармацевтического агента через слизистую оболочку рта. То есть дозированная форма не предназначена для адгезии к слизистым поверхностям ротовой полости в виде интактной пленки или остатков распада пленки.
Термин «абсолютная биодоступность» относится к доступности активных лекарственных средств в системной циркуляции после не внутривенного введения (то есть, после орального, ректального, чрескожного, подкожного введения). Чтобы оценить абсолютную биодоступность лекарственного препарата, следует выполнить фармакокинетическое исследование, чтобы определить концентрацию препаратов в плазме в зависимости от времени после внутривенного (IV) и не внутривенного введения. Абсолютная биодоступность - это площадь под кривой (AUC) с поправкой на величину дозы при не внутривенном введении, разделенная на AUC при внутривенном введении.
Что касается фармакокинетических параметров, приведенных здесь (то есть Тmах, абсолютной биодоступности и т.д.), следует иметь в виду, что они могут относиться к средним, медиане или наблюдаемым индивидуально значениям фармакокинетики и что, если не утверждается обратное, заявляются средние параметры фармакокинетики.
Если не утверждается обратное, термин «масс. %» по отношению к конечному продукту (то есть к пленке в противоположность форме, использованной для ее создания) означает процент полного сухого веса, вносимый данным ингредиентом. Это теоретическое значение может отличаться от экспериментального значения, поскольку на практике пленка обычно сохраняет часть воды и/или этанола, использованных при приготовлении.
Если приведены значения дозировок лекарственного препарата и его соли, следует иметь в виду, что расчетная доза основана на молекулярном весе активного фармацевтического ингредиента, который включает катионные и анионные формы в случае соли и только основные, если активный агент присутствует не в виде соли. Кроме того, когда ссылка относится к солям лекарственного препарата и их фармацевтически приемлемым солям, следует понимать, что имеются в виду соли щелочной формы щелочного лекарственного препарата.
«Критическое патологическое состояние ротовой полости» означает, что у пациента дисфагия, одинофагия, риск аспирации, ротоглоточный кандидоз, герпес, мукозит, тяжелый афтоз и/или красный плоский лишай.
«Быстро растворяющийся или «мгновенно растворяющийся» означает растворение в течение менее 60 секунд и более предпочтительно в течение менее 30 секунд.
Настоящее изобретение предлагает физиологически приемлемую пленку, которая особенно хорошо приспособлена для быстрой дезинтеграции при помещении на язык пациента и для облегчения адсорбции фармацевтически активного агента в желудочно-кишечном тракте. Пленка и биоактивный агент не должны полностью растворяться во рту. Пленка не может полностью растворяться.
Пленку можно охарактеризовать временем, необходимым для полной дезинтеграции, и она предпочтительно распадается до образования мягкого остатка через приблизительно 10, 20, 30 или 60 секунд после приема, после чего она проглатывается. Эти времена распада предпочтительно наблюдаются в ротовой полости, когда вводят пленку, так же как при тестировании дезинтеграции с помощью метода, описанного в Европейской Фармакологии 2.9.1. Быстрая дезинтеграция и проглатывание пленки помогают обеспечить адсорбцию дозированной формы в желудочно-кишечном тракте. Пленка не является общепринятой мукоадгезивной системой, предназначенной для трансмукозальной доставки активного агента.
Пленочная лекарственная форма
Предпочтительно, пленки по настоящему изобретению содержат фармацевтически активный агент, пленкообразующий агент и по меньшей мере один из следующих дополнительных ингредиентов: воду, антимикробные агенты, водорастворимые разбавители, такие как пластифицирующие агенты, умягчители и наполнители, ароматизирующие агенты, агенты, стимулирующие слюноотделение, охлаждающие агенты, стабилизаторы, сурфактанты, стабилизирующие агенты, эмульсифицирующие агенты, утолщающие агенты, связывающие агенты, окрашивающие агенты, подсластители, отдушки, триглицериды, предохранители, полиэтилен оксиды, пропилен гликоль и т.д. В предпочтительном воплощении пленка содержит один или большее число ингредиентов, которые действуют как водорастворимые связывающие агенты и гидрофильные полимеры, такие как поливиниловый спирт, полиэтиленгликоль ("PEG"), пропиленгликоль, полиэтилен оксид и крахмалы, целлюлезы, желатины и т.д. Таким образом, когда в данной заявке утверждается, что форма содержит водорастворимый связывающий агент и гидрофильный полимер, понятно, что эти два агента могут описываться как единый ингредиент. Конечный пленочный продукт предпочтительно содержит от приблизительно 40 до приблизительно 80 масс. % от этих ингредиентов и, более предпочтительно, от приблизительно, 50 до приблизительно, 75 масс. %. Активный агент предпочтительно составляет от 5 до 20 масс. % от окончательной пленочной формы, более предпочтительно, от приблизительно 8 до приблизительно 15 масс. %. Кроме того, форма предпочтительно свободна от сурфактантов. В другом варианте форма может содержать один или большее число сурфактантов.
Предпочтительный маскирующий вкус агент, облегчающий растворение продукта и, как считается, способствующий сохранению аморфного состояния определенных активных ингредиентов, таких как донепезил, - это сополимер аминоалкил метакрилата, имеющий торговую марку Эудрагит Е РО. Сополимер аминоалкил метакрилата предпочтительно содержит остатки диэтиламиноэтила и предпочтительно содержит от приблизительно 20 до приблизительно 26 масс. % таких групп в сухом остатке вещества.
Средний молекулярный вес сополимера предпочтительно равен от приблизительно 120000 до приблизительно 180000, или от приблизительно 140000 до приблизительно 160000, наиболее предпочтительно приблизительно 150000. Предпочтительно, метакрильные мономеры включают бутил метакрилат и метил метакрилат. Этот агент предпочтительно присутствует в конечной пленке в количестве от приблизительно 5 до приблизительно 25 масс. %, предпочтительно, от приблизительно 10 до приблизительно 20 масс. %, и более предпочтительно, от приблизительно 12 до приблизительно 18 масс. %. Сополимер предпочтительно тонко измельчен до среднего размера частиц меньше чем 1000, 100 или 10 микрон.
Другой маскирующий вкус агент - циклодекстрин или его производные. Этот компонент предпочтительно присутствует в финальной пленке в количестве от приблизительно 10 до приблизительно 50 масс. %, или в альтернативном воплощении от приблизительно 10 до приблизительно 40 масс. %, или от приблизительно 20 до приблизительно 35 масс. %.
Предпочтительно, стабилизатор, особенно для пленок из донепезила, - это лимонная кислота, особенно безводная лимонная кислота, и в предпочтительном воплощении конечный продукт содержит от приблизительно 0,5 до приблизительно 2,0 масс. % лимонной кислоты или от приблизительно 0,75 до приблизительно 1,25 масс. % лимонной кислоты.
В другом варианте форма может содержать один или большее число сурфактантов.
Предпочтительный фармацевтически активный агент - это ондансетрон основной. Ондансетрон химически представляет собой (±) 1, 2, 3, 9 тетрагидро-9-метил-3-[(2-метил-1Н-имидазол-1-ил)метил]-4Н-карбазол-4-он, и его основная форма представлена следующей химической структурой:
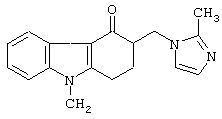
Таким образом, в другом воплощении изобретение предлагает ондансетроновую полоску пленки, где онандосетрон предпочтительно присутствует в основной форме, чтобы индуцировать адсорбцию GI ондансетрона. Изобретение предлагает также не мукоадгезивную орально дезинтегрирующуюся пленку, способную дезинтегрироваться при контакте со слюной в ротовой полости через шестьдесят секунд, содержащую (±) 1, 2, 3, 9 тетрагидро-9-метил-3-[(2-метил-1Н-имидазол-1-ил)метил]-4Н-карбазол-4-он, (ондансетрон), в комбинации с гидрофильным связывающим веществом и водорастворимым разбавителем и предназначено для активации адсорбции упомянутого ондансетрона в желудочно-кишечном тракте, причем: (а) упомянутое вещество, предназначенное для активации адсорбции в желудочно-кишечном тракте, содержит ондансетрон основной; (b) упомянутая пленка содержит от приблизительно 4 до приблизительно 24 мг ондансетрона основного; (с) ондансетрон основной присутствует в количестве от приблизительно 0,05% до приблизительно 50% (в/в), в расчете на полный вес формы, (d) упомянутая пленка имеет значение Tmax от приблизительно 1,5 до приблизительно 2,5 часов, и (е) упомянутый ондансетрон имеет абсолютную биодоступность в упомянутой дозированной форме от приблизительно 45% до приблизительно 75%. Пленка наиболее предпочтительно содержит 4 или 8 мг ондасетрона основного и предпочтительно разработана в соответствии с общей техникой создания лекарственных форм, описанной в этом документе.
Известно, что ондансетрон может существовать в нескольких полиморфных формах, в том числе формах А, В, С, D и Е. См. WO 03/093260 и WO 2005/080381. Неожиданно было обнаружено, что кристаллическая чистота ондансетрона в конечном продукте влияет на физические свойства конечной пленки и что особенно предпочтительна высокоочищенная форма В. В частности, для пленок, хранившихся при повышенных температурах (60°C).
В RapidFilm были зарегистрированы физические изменения, включающие дополнительную жесткость, деформации и складки, и эти изменения связаны с уменьшением пиковой интенсивности и снижением чистоты формы В. Таким образом, в еще одном воплощении пленка содержит полиморф формы В, который существенно свободен от других полиморфных форм, то есть их чистота больше чем 70, 80, 90, 95, 98 или даже 99%. В другом варианте или, кроме того, продукт характеризуют эндотермой плавления при 244±2°C, подвергая его дифференциальной сканирующей калориметрии.
В другом воплощении изобретение предлагает способы использования полосок ондасертоновой пленки по настоящему изобретению для лечения или предотвращения рвоты, в том числе рвоты из-за постоперативной тошноты и рвоты, вызванной химиотерапией и облучением. Таким образом, изобретение предлагает также способ лечения или предотвращения рвоты у человека, включающий нанесение на язык пациента предпочтительно от одного до трех раз в день полоски пленки ондансетрона по настоящему изобретению, который содержит от приблизительно 4 до приблизительно 24 мг ондансетрона основного, предпочтительно 4 или 8 мг ондансетрона основного. Этот способ используют предпочтительно с дополнительным этапом, индуцирующим адсорбцию упомянутого ондансетрона в желудочно-кишечном тракте, который заключается в проглатывании упомянутой пленки в течение приблизительно шестидесяти секунд после упомянутого нанесения с водой или без воды.
В международной заявке WO2008/040534 описаны другие пленочные формы по изобретению.
Примеры
Следующие примеры приведены, чтобы предоставить обычно используемые специалистами способы с полным раскрытием и описанием приготовления и исследования заявленных здесь соединений, и должны рассматриваться только в качестве примеров изобретения и не предназначены для ограничения рамок того, что авторы считают своим изобретением. Были затрачены усилия, чтобы обеспечить точность числовых значений (например, количества, температуры и т.д.), но следует принимать во внимание и некоторые ошибки. Если не указано обратное, части - это весовые части, температура дана в °C или как комнатная температура, а давление равно или приблизительно равно атмосферному.
Пример 1. Типичная форма ондансетрона
Таблица 1 представляет типичный состав пленки, содержащей 8.0 мг основной формы ондансетрона, предназначенной для стимуляции адсорбции в желудочно-кишечном тракте.
|
Пример 2. Сообщение о дисфагии как побочном эффекте Зофрана (Zofran®)
Сообщение о побочных эффектах Зофрана потребителя или профессионала в области, не относящейся к здравоохранению, из Франции #5566830-8 от 10 декабря, 2007.
Пациент мужского пола, 57 лет, наблюдавшийся по поводу рака прямой кишки, получал Зофран для предотвращения тошноты и рвоты. После приема Зофрана у пациента отмечена дисфагия в качестве побочного эффекта.
Поскольку ондансетрон может вызывать развитие дисфагии, Zofran® (таблетки) или Zofran ODT® (Ого Dispersible Tablet) не вполне пригодны для получения согласия пациента.
Пример 3. Сравнение между ондансетроном ОРТ (Zofran ODT®) и пленкой по данному изобретению, содержащей ондансетрон.
В среде, имитирующей слюну, описанной в WO2008/025926, при применении дезинтеграционного теста мы сравнивали время, необходимое для растворения Zofran ОРТ® и пленки по данному изобретению. Для растворения Zofran ODT® требуется от 2 до 3 минут, в то время как для растворения содержащей ондансетрон пленки по настоящему изобретению требуется менее 60 секунд.
Пример 4. Исследование предпочтений из трех лечебных форм ондансетрона (Zofran®, Zofran ODT® и содержащей ондансетрон пленки по настоящему изобретению) для предотвращения и/или лечения индуцированной радиотерапией или химиотерапией тошноты или рвоты для больных с затруднениями глотания.
Выбранные 18 пациентов отвечали на несколько вопросов, чтобы оценить их предпочтения по отношению к трем различным лечебным формам ондансетрона (Zofran®, Zofran ODT® и содержащей ондансетрон пленки по данному изобретению) в случае тошноты и/или рвоты, связанных или не связанных с затруднениями проглатывания. Среди опрашиваемых было 12 женщин и 6 мужчин, в возрасте от 25 до 44 лет (в среднем: 33 года).
В случае тошноты и/или рвоты без затруднений проглатывания 50% опрошенных предпочли бы Zofran ODT® и только 43,7% содержащую ондансетрон пленку по настоящему изобретению.
Неожиданно, но в случае тошноты и/или рвоты, связанных с затруднениями проглатывания, 61% опрошенных пациентов предпочли содержащую ондансетрон пленку по настоящему изобретению и только 39% Zofran ODT®.

