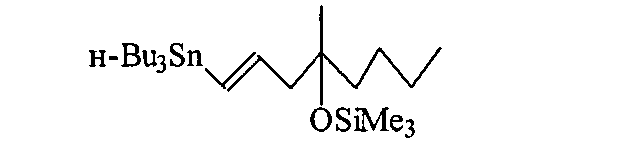
Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ (1Е)-1-ТРИ-Н-БУТИЛСТАННИЛ-4-МЕТИЛ-4-ТРИМЕТИЛСИЛОКСИОКТ-1-ЕНА
Вид РИД
Изобретение
Изобретение относится к области органической химии, конкретно к способу получения (1Е)-1-три-н-бутилстаннил-4-метил-4-триметилсилокси-окт-1-ена формулы (1),
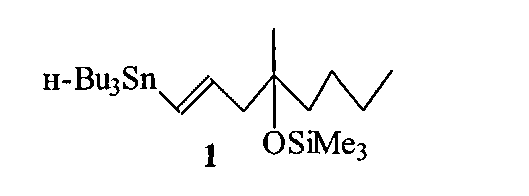
применяемого при построении нижней цепи практически важного аналога простагландина E1 мизопростола 2 ([1] Collins R.W. Misoprostol: discovery development and clinical applications. Med. Res. Rev., 1990, Vol. 10, P. 149; [2] Collins P.W., Djuric S.W. Synthesis of therapeutically useful prostaglandin and prostacyclin analogs. Chem. Rev., 1993, Vol. 93, P. 1533).
Первоначально мизопростол был введен в практику как антисекреторное средство для лечения гастропатий, вызываемых применением нестероидных противовоспалительных средств ([1] Collins P.W., Djuric S.W. Synthesis of therapeutically useful prostaglandin and prostacyclin analogs. Chem. Rev., 1993, Vol.93, P.1533; [3] Collins R.W., Dajani E.Z., Driskill D.R., Bruhn M.S., Jung C.J., Pappo R. Synthesis and gastric antisecretory properties of 15-deoxy-16-hydroxyprostaglandin E analogues. J. Med. Chem., 1977, Vol. 20, P. 1152; [4] Collins R.W., Dajani E.Z., Pappo R., Gasiecki A.F., Bianchi R.G. Woods E.M. Synthesis and gastric antisecretory properties of 4,5-unsatured derivates of 15-deoxy-16-hydroxy-16-methylprostaglandin E1. J. Med. Chem., 1983, Vol. 26, P. 786).
Впоследствии было показано, что мизопростол в комбинации со стероидом (Мифепристон) исключительно эффективен для раннего прерывания беременности и в настоящее время широко используется в акушерстве и гинекологии для прерывания беременности, родовспоможения, лечения послеродовых осложнений и др. ([5] Абрамченко В.В. Простагландины и антигестагены в акушерстве и гинекологии. Петрозаводск: ИнтелТек, 2003, 208 с.). Мизопростол внесен Всемирной организацией здравоохранения (ВОЗ) в Примерный перечень ВОЗ основных лекарственных средств ([6] Безопасный аборт: рекомендация для систем здравоохранения по вопросам политики и практики, изд. 2, Женева, ВОЗ, 2013, 125 с.).
В синтезе мизопростола 2 винилстаннан 1 является предшественником литийкупратного реагента 3, который реагирует с циклопентеноном 4 по схеме сопряженного 1,4-присоединения, давая целевой простагландин 2 [1-4].
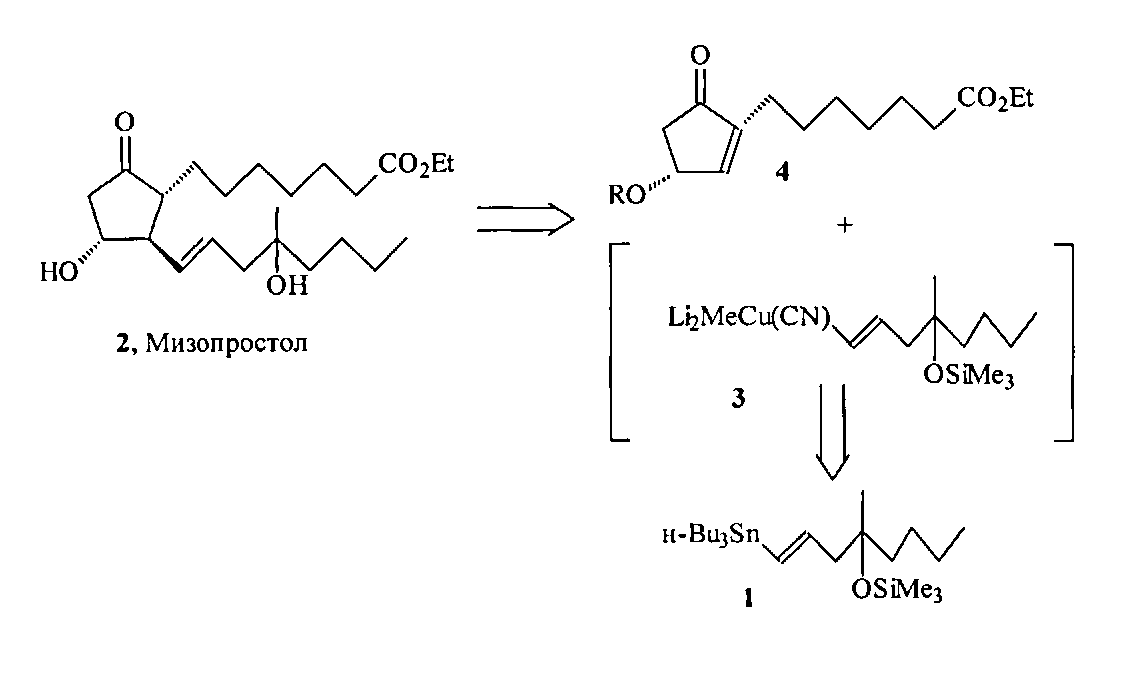
Эффективные и практичные пути синтеза циклопентенонового блока 4 описаны в ряде публикаций ([7] Novac L., Rohaly J., Kajtar M., Szantay Cs. Notes on the mechanism rearangement of 2′-hydroxycyclopentenone derivatives to the 3′-hydroxyanalogues. Sterocontrolled synthesis of prostaglandin syntons. Acta Chim. Acad. Sci. Hung., 1979, Vol. 102, P. 91; ([8] Пивницкий K.K., Фрейманис Я.Ф., Бокалдере Р.П., Лапицкая М.А., Холодников В.А., Шеймина Л.Г., Лоля Д.О., Лиепиня А.Я., Ноздрачева А.Т. Способ получения 2-(6'-карбметокси(этокси)гексил)циклопентен-2-она-1. Авт. свид. СССР №789510, 1978).
Известные к настоящему времени синтезы винилстаннана 1 немногочисленны. Так, трехстадийный подход к незащищенному винилстаннану 5, разработанный Ли и сотр. ([9] Lee A. Sh-Y., Wu Ch-W. Stannyl-oriented Regioselective Allylation and Its Application to the Synthesis of Silyl Misoprostol. Tetrahedron, 1999, Vol. 55, P. 12531), основан на алкилировании гексанона-2 в условиях сочетания Барбье при ультрозвуковом облучении и промотировании CeCl3 3-бром-1E-трибутилстаннилпропеном 6 10, полученным радикальным гидростаннилированием пропаргилового спирта Bu3SnH с последующими хроматографическим разделением изомерной смеси (E/Z=78:22) трибутилстаннильных спиртов и бромированием необходимого Е-изомера.
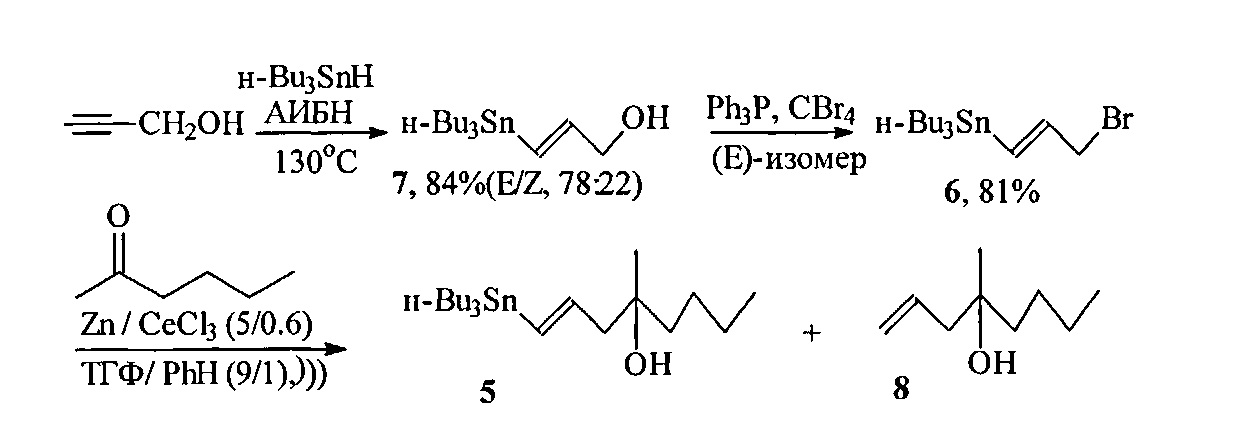
Основные недостатки этого метода состоят в труднодоступности бромвинилстаннана 7, образовании изомерного Z-винилстаннана 5 (E/Z равно 81:19) и побочного соединения 8 (11%), а также общем умеренном (55%) выходе целевого винилстаннана 5.
Известны более близкие аналоги предлагаемого способа получения винилстаннана 1, базирующиеся на радикальном гидростаннилировании ацетиленового эфира 9 Bu3SnH.
Например, при инициировании радикального процесса гидростаннилирования фотохимическим путем ([10] P.W. Collins, С.J. Jung, R. Jasieck, R. Pappo. Synthesis of antisecretory prostaglandins using vinyl tin precursors. Tetrahedron Lett., 1978, Vol. 35, P. 3187) смесь эфира 9 с 1.1 экв. Bu3SnH в отсутствии растворителя облучали лампой 275W GE Sunlamp при охлаждении. Анализ реакционной смеси свидетельствовал, что независимо от температуры и продолжительности процесса соотношение образующихся транс- и цис-винилстаннанов 1 и 10 не превышает 86:14.

К недостаткам этого способа следует отнести токсичность и дороговизну Bu3SnH, невысокую стереоселективность процесса и необходимость использования пониженных температур и специального аппаратурного оформления.
Подобная стереоселективность процесса гидростаннилирования пропаргильных эфиров отмечалась и Кори с сотр. ([11] Bansal R., Cooper G.F., Corey E.J. Stereoselective Synthesis of an Important Prostaglandin Synthetic Intermediate. J. Org. Chem. ′1991, Vol. 56, P. 1329): транс/цис-соотношение полученных винилстаннанов составляло 85:15 и не зависело ни от стерических факторов, ни от температуры.
Следует отметить, что использование для генерирования «купратов» непосредственно смеси винилстаннанов (1+10) или иодидов, полученных ее иодированием, приводит к образованию наряду с целевым простагландином 1 также и побочного стереоизомерного цис-Δ13,14-простагландина (10-15%) ([12] Collins R.W., Dajani E.Z., Driskill D.R., Bruhn M.S., Jung C.J., Pappo R. Synthesis and gastric antisecretory properties of 15-deoxy-16-hydroxyprostaglandin E analogues. J. Med. Chem., 19 Vol. 77, P. 1152).
Ближайшим прототипом предлагаемого способа может служить радикальное гидростаннилирование ацетиленового эфира 9 с использованием в качестве инициатора каталитических количеств азобисизобутиронитрила (АИБН) ([13] Chen S.-M. L., Schau, Grudzinskas C.V. Prostaglandins and Congeners. 19. Vinylstannanes: Useful Organometallic Reagents for the Synthesis of prostaglandins and prostaglandin Intermediates. J. Org. Chem., 1978, Vol. 43, P. 3450).
Так, нагреванием при 130°C в течение 2 ч смеси ацетиленового эфира 9 с эквимолярным количеством Bu3SnH без растворителя с выходом 90% после вакуумной перегонки был получен целевой (1E)-1-три-н-бутилстаннил-4-метил-4-триметилсилокси-окт-1-ен в виде (E/Z) смеси в соотношении 10/1.
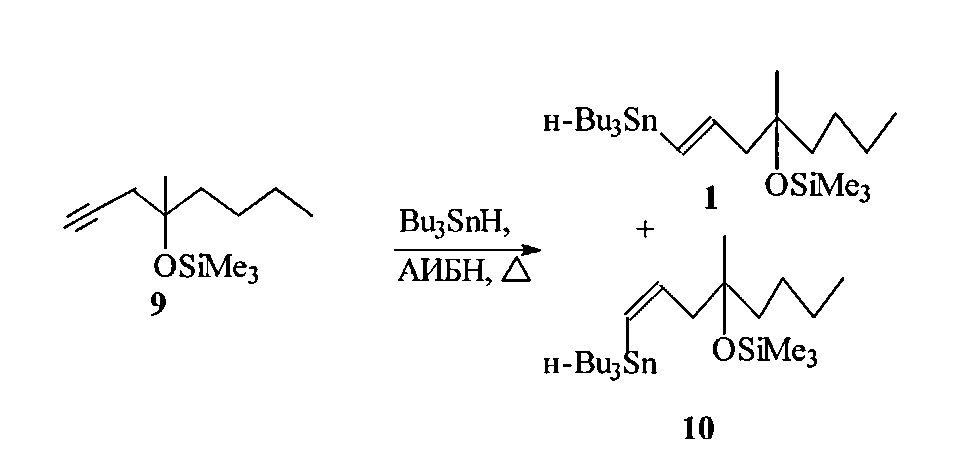
Основными недостатками способа-прототипа с использованием продажного реагента Bu3SnH являются его дороговизна и токсичность.
Задача, на решение которой направлено заявляемое техническое решение, заключается в разработке простого, экономичного и стереоселективного способа получения (1Е)-1-три-н-бутилстаннил-4-метил-4-триметилсилокси-окт-1-ена 1 из 4-триметилсилилокси-4-метил-1-октана.
По предлагаемому способу, в отличие от способа-прототипа [10], в котором гидростаннилирование ацетиленового триметилсилилового эфира 9 проводят с использованием дорогого продажного реагента Bu3SnH, в предлагаемом способе синтез осуществляют с вовлечением BU3SnH, предварительно генерируемого in situ из Bu3SnCl и NaBH4 ([14] Corey E.J., Suggs J.W. A Metod for Catalytic Dehalogenation via Trialkyltin Hydrides. J. Org. Chem., 1975, Vol. 40, P. 2554).
С этой целью при 20°C в атмосфере аргона к гидриду трибутилолова, in situ приготовленному добавлением, при перемешивании, небольшими порциями боргидрида натрия в безводном этаноле к хлориду трибутилолова в безводном этаноле, добавляют 4-метил-4-триметилсилилокси-1-октин 9, кипятят в течение 3 ч и выделяют целевой продукт вакуумной перегонкой.
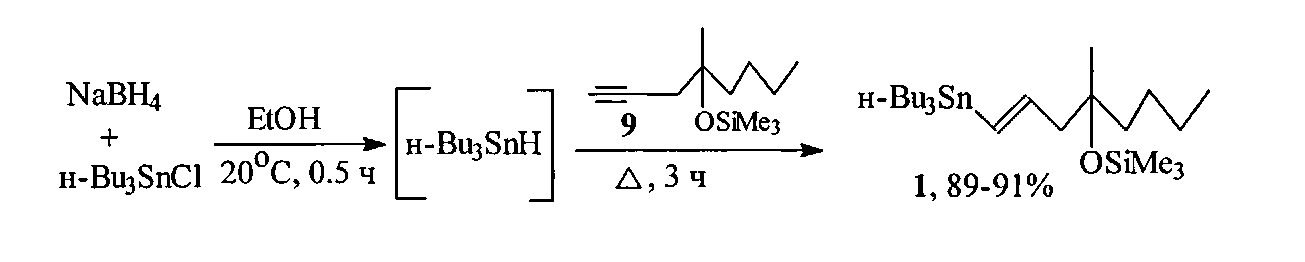
Простота условий реакции, доступные, не дорогие, относительно Bu3SnH, используемые продажные реагенты (Bu3SnCl и NaBH4), легкое выделение целевого продукта простой вакуумной перегонкой, высокий выход и стереохимическая чистота (содержание транс-винилстаннана 1 97-99%, ГЖХ) делает предлагаемый способ получения (1Е)-1-три-н-бутилстаннил-4-метил-4-триметилсилокси-окт-1-ена 1 весьма экономичным и технологичным.
Таким образом, предложенный способ получения (1Е)-1-три-н-бутилстаннил-4-метил-4-триметилсилокси-окт-1-ена, при сопоставимых со способом-прототипом высоких селективности процесса (содержание изомерного цис-винилстаннана в реакционной смеси по данным ГЖХ не превышает 1-3%) и выхода (89-91%) целевого соединения, имеет преимущества перед прототипом, заключающиеся в повышении экологичности, экономичности (вместо дорогого и токсичного продажного реагента Bu3SnH используется приготовленный in situ из доступных и дешевых Bu3SnCl и NaBH4 и технологичности процесса (one pot процесс, т.е. генерирование Bu3SnH и собственно процесс гидростаннилирования существляются в одной колбе), что создает возможность масштабирования синтеза до сотен граммов.
Сущность изобретения подтверждается следующим примером.
К 23.0 г (70.6 моль) хлорида трибутилолова в 50 мл безводного этилового спирта в атмосфере аргона при 20°C и интенсивном перемешивании добавляют небольшими порциями суспензию 2.6 г боргидрида натрия в 100 мл безводного этанола. Реакционную массу перемешивают дополнительно 30 мин, добавляют по каплям 12.0 г (56.5 ммоль) 4-триметилсилилокси-4-метил-1-октина и кипятят 3 ч. Реакционную массу охлаждают, добавляют 100 мл гексана и фильтруют через фильтр Шотта. Фильтрат концентрируют в вакууме роторного испарителя, остаток перегоняют в вакууме масляного насоса. Получают 25.8 г (90,7%) (1E)-1-три-н-бутилстаннил-4-метил-4-триметилсилоксиокт-1-ена, т. кип. 160-162°C/1 мм рт.ст. Содержание соответствующего Z-изомера (не более 3-5%) определено методом газожидкостной хроматографии (SE-30,5%). ИК спектр, v, см-1: 841, 1250 (Me3-Si), 1600 (C=С). Спектр ЯМР 1Н, δ, м.д.: 0.12 с (9Н, Me3Si), 0.91 т (3Н, Н20), 1.23 с (3Н, С4 СН3), 5.94 д (1Н, Н1, J 19 Гц), 5.99 м (1Н, Н2). Спектр ЯМР 13С, δ, м.д. (в скобках приведены минорные сигналы соотвествующего цис-изомера): 2.66 (Me3Si), 9.42 (С1′), 13.7 (С4′), 14.1 (С8), 23.26 (С7), 26.15 (С6), 27.30 (С3′), 27.49 (4-Ме), 29.16 (С2′), 42.10 (42.52) (С5), 51.10 (49.71) (С3), 75.95 (С4), 130.44 (129.76) (С1), 146.02 (145.54) (С2). Найдено, %: С 57.38; Н 10.19; Si 23.33. C24H52OSiSn. Вычислено, %: С 57.25; Н 10.41; Si 23.58.
Способ получения (1)-1-три--бутилстаннил-4-метил-4-триметилсилоксиокт-1-ена радикальным гидростаннилированием 4-триметилсилилокси-4-метил-1-октина гидридом трибутилолова в токе аргона при нагревании, перемешивании и выделении целевого продукта вакуумной перегонкой, отличающийся тем, что процесс ведут в безводном этаноле при кипячении в течение 3 ч, а используемый гидрид трибутилолова предварительно генерируют из хлорида трибутилолова и боргидрида натрия.