Результат интеллектуальной деятельности: ТРИАЗОЛПИРИДИНОВЫЕ СОЕДИНЕНИЯ, ИНГИБИРУЮЩИЕ JAK, И СПОСОБЫ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Триазолпиридиновые соединения формулы I, которые являются ингибиторами янус киназ, например JAK2 киназы, а также композиции, содержащие данные соединения, и способы применения, включая, но не ограничиваясь, in vitro, in situ и in vivo диагностику или лечение клеток млекопитающих.
УРОВЕНЬ ТЕХНИКИ
Миелопролиферативные заболевания (MPD) возникают в гематопоэтических стволовых клетках и в первую очередь проявляются в повышенном количестве преимущественно нормальных клеток миелоидного ростка. Можно сделать первичное разделение на положительную филадельфийскую хромосому (Ph+) и отрицательную филадельфийскую хромосому (Ph-). Ph+ MPD приводит в результате к хронической гранулоцитной лейкемии и контролируется bcr-abl гибридным белком, который контролирует пролиферацию гематопоэтических клеток. Ph- MPD можно дополнительно разделить на три различных заболевания по соответствующим разновидностям, а именно, истинную полицитемию (PV), эссенциальную тромбоцитемию (ET) и идиопатический миелофиброз (IMF). Dameshek, W., Blood 6(4):372-375 (1951). Пациенты с PV страдают от повышенного количества красных кровяных тел, тогда как пациенты с ET имеют повышенные концентрации циркулирующих тромбоцитов. Если не лечить данные заболевания, оба из них могут привести к опасным для жизни тромботическим осложнениям. Пациенты с IMF страдают от фиброза костного мозга с последующим перемещением гематопоэза в селезенку и печень. Это приводит в первую очередь к спленомегалии, за которой следует анемия на более поздних стадиях заболевания, поскольку гематопоэзис становится непродуктивным. Данным пациентам делают неблагоприятные прогнозы, хотя при определенных условиях их можно вылечить посредством аллогенного трансплантата костного мозга. Неизвестно случаев вылечивания Ph- MPD заболеваний.
Активирующая мутация в тирозинкиназе JAK2 связана с PV, ET, IMF и другими заболеваниями. Практически все пациенты с PV и приблизительно 50% пациентов с ET и IMF содержат данную мутацию. Morgan, KJ. и Gilliland, D. G., Ann. Rev. Med. 59:213-222 (2008). Мутация представляет собой замену валина на фенилаланин в положении 617 в зрелом человеческом JAK2 белке (V617F). Дополнительные мутации в JAK2, обычно обнаруживаемые в экзоне 12 и называемые мутации в экзоне 12, также обладают активирующим действием и могут приводить к MPD. Кроме того, T875N мутация была связана с мегакариобластной лейкемией. Наконец, JAK2 гибридные белки обнаруживают при острой лейкемии.
V617F мутация действует, активируя JAK2, что приводит к MPD. В немутированной форме JAK2 связана с цитокиновыми рецепторами (например EPO-R, TPO-R и другими) и активируется только, если сам рецептор активирован стимулом родственного цитокинового лиганда. Затем, гематопоэзис в целом регулируется за счет присутствия лигандов. Например, цитокиновый эритропоэтин (EPO) стимулирует гематопоэтические клетки-предшественники, образуя красные кровяные клетки. Мутация, которая нарушает JAK2 активацию EPO, следовательно, приводит к повышенным концентрациям красных кровяных клеток. Аналогично, тромбопоэтин (TPO) регулирует рост тромбоцитов связыванием с TPO-R, который, в свою очередь, также передает сигнал посредством JAK2. Таким образом, повышенные концентрации тромбоцитов могут также быть результатом нарушений активации JAK2.
Необходимы соединения, которые ингибируют JAK2, что оказывало бы благоприятный эффект на пациентов с миелопролиферативными нарушениями, контролируемыми JAK2, а также, с другими заболеваниями, которые являются чувствительными к ингибированию JAK2. Данные заболевания включают и заболевания, при которых JAK2 активируется мутацией или амплификацией, и заболевания, при которых активация JAK2 является частью онкогенного каскада. Многочисленные линии опухолевых клеток и образцы опухолей имеют высокие концентрации фосфо-STAT3, который является JAK2 геном-мишенью.
Первоначально JAK1 была обнаружена при поиске новых киназ (Wilks A.F.,1989, Proc. Natl. Acad. Sci. U.S.A. 86:1603-1607). Генетические и биохимические исследования показали, что JAK1 функционально и физически связана с интерфероном типа I (например, IFNальфа), интерфероном типа II (например, IFNгамма), IL-2 и IL-6 цитокиновыми рецепторными комплексами (Kisseleva et al., 2002, gene 285:1-24; Levy et al, 2005, Nat. Rev. Mol. Cell Biol. 3:651-662; O'Shea et al., 2002, Cell, 109 (suppl.): S121-S131). JAK1 нокаутные мыши умирают на перинатальной стадии из-за нарушений в LIF рецепторной сигнализации (Kisseleva et al., 2002, gene 285:1-24; O'Shea et al., 2002, Cell, 109 (suppl.): S121-S131). Исследование тканей, полученных из JAK1 нокаутных мышей, показало, что данные киназы играют решающую роль в IFN, IL-10, IL-2/IL-4 и IL-6 путях. Гуманизированное моноклональное антитело, мишенью которого является IL-6 путь (тоцилизумаб), недавно было одобрено Европейской комиссией для лечения от умеренного до тяжелого ревматоидного артрита (Scheinecker et al., 2009, Nat. Rev. Drug Discov. 8:273-274).
JAK3 связывается только с общей гамма-цепью цитокинового рецептора, которая присутствует в IL-2, IL-4, IL-7, IL-9, IL-15 и IL-21 цитокиновых рецепторных комплексах. JAK3 является важной при дифференцировке и пролиферации лимфоцитов, и мутации в JAK3 приводят в результате к тяжелому комбинированному иммунодефициту (SCID) (O'Shea et al., 2002, Cell, 109 (suppl): S121-S131). На основании их роли в регуляции лимфоцитов, JAK3 и JAK3-опосредованные пути являются мишенью в случаях, когда необходимо подавить иммунитет (например, отторжение трансплантата и ревматоидный артрит) (Baslund et al., 2005, Arthritis & Rheumatism 52:2686-2692; Changelian et al., 2003, Science 302: 875-878).
TYK2 связывается с интерфероном типа I (например, IFNальфа), IL-6, IL-10, IL-12 и IL-23 цитокиновыми рецепторными комплексами (Kisseleva et al., 2002, gene 285:1-24; Watford, W.T. & O'Shea, J.J., 2006, Immunity 25:695-697). В соответствии с этим первичные клетки, полученные у людей с дефицитом TYK2, имеют нарушения в сигнализации с интерфероном I типа, IL-6, IL-10, IL-12 и IL-23. Полностью человеческое моноклональное тело, мишенью которого является общая p40 субъединица IL-12 и IL-23 цитокинов (устекинумаб), недавно было одобрено Европейской комиссией для лечения от умеренного до тяжелого пятнистого псориаза (Krueger et al., 2007, N. Engl. J. Med. 356:580-92; Reich et al., 2009, Nat. Rev. Drug Discov. 8:355-356).
Кроме того, антитело, мишенью которого является IL-12 и IL-23 пути, подвергалось клиническим экспериментам для лечения болезни Крона (Mannon et al., 2004, N. Engl. J. Med. 351:2069-79).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
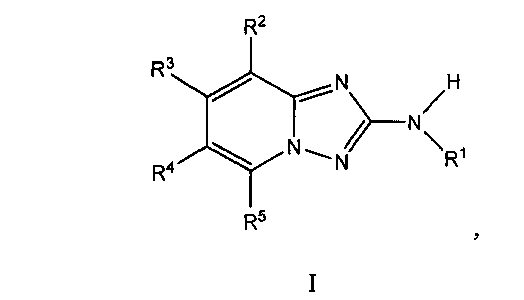
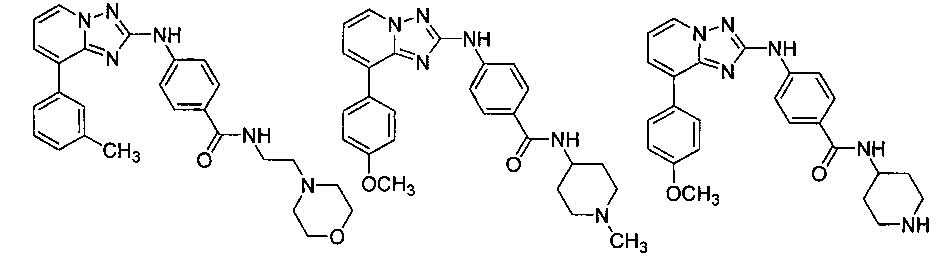
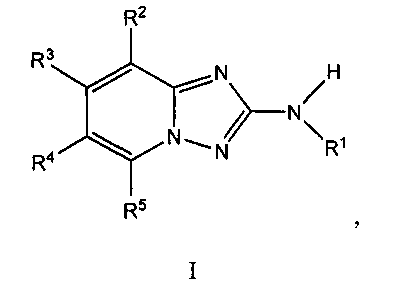
Один вариант осуществления включает соединение формулы I:

его энантиомеры, диастереомеры, таутомеры или фармацевтически приемлемые соли, в которых R1, R2, R3, R4 и R5 определяют в настоящем изобретении.
Другой вариант осуществления включает фармацевтическую композицию, которая содержит соединение формулы I и фармацевтически приемлемый носитель, вспомогательное вещество или среду.
Другой вариант осуществления включает способ лечения или снижения тяжести заболевания или состояния, чувствительного к ингибированию активностей одной или более янус киназ, выбранных из JAK1, JAK2, JAK3 и TYK2, у пациента. Способ включает введение пациенту терапевтически эффективного количества соединения формулы I.
Другой вариант осуществления включает способ лечения или снижения тяжести заболевания или состояния, чувствительного к ингибированию JAK2 киназной активности у пациента. Способ включает введение пациенту терапевтически эффективного количества соединения формулы I.
Другой вариант осуществления включает набор для лечения заболевания или расстройства, чувствительного к ингибированию JAK киназы. Набор содержит первую фармацевтическую композицию, содержащую соединение формулы I, и инструкции по применению.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В настоящее время будут делаться подробные ссылки на определенные варианты осуществления, примеры которых иллюстрируются сопровождающими их структурами и формулами. Когда настоящее изобретение будет описываться в соответствии с перечисленными вариантами осуществления, будет ясно, что предполагается, что они не ограничивают настоящее изобретение данными вариантами осуществления. И наоборот, предполагается, что настоящее изобретение включает все альтернативные варианты, модификации и эквивалентны, которые можно включить в объем настоящего изобретения, как описано в формуле изобретения. Специалистам в данной области техники известны многие способы и материалы, аналогичные или эквивалентные способам и материалам, описанным в настоящем изобретении, которые можно применять при осуществлении на практике настоящего изобретения. Настоящее изобретение никоим образом не ограничивается описанными способами и материалами. В случае если один или более из введенных в настоящее изобретение литературных источников, патентов и аналогичных материалов отличаются или противоречат данной заявке, включая, но не ограничиваясь, определенные термины, применение терминов, описанные методики или подобные, данная заявка имеет приоритет.
Термин "алкил" относится к насыщенному линейному или разветвленному моновалентному углеводородному радикалу, в котором алкильный радикал может необязательно быть замещенным независимо одним или более заместителями, описанными в настоящем изобретении. В одном примере алкильный радикал содержит от одного до восемнадцати атомов углерода (C1-C18). В других примерах алкильный радикал представляет собой C0-C6, C0-C5, C0-C3, C1-C12, C1-C1O, C1-C8, C1-C6, C1-C5, C1-C4 или C1-C3. Примеры алкильных групп включают C1-C8 углеводородные группы, такие как метил (Me, -CH3), этил (Et, -CH2CH3), 1-пропил (н-Pr, н-пропил, -CH2CH2CH3), 2-пропил (изо-Pr, изопропил, -CH(CH3)2), 1-бутил (н-Bu, н-бутил, -CH2CH2CH2CH3), 2-метил-1-пропил (изо-Bu, изобутил, -CH2CH(CH3)2), 2-бутил (втор-Bu, втор-бутил, -CH(CH3)CH2CH3), 2-метил-2-пропил (трет-Bu, трет-бутил, -C(CH3)3), 1-пентил (н-пентил, -CH2CH2CH2CH2CH3), 2-пентил (-CH(CH3)CH2CH2CH3), 3-пентил (-CH(CH2CH3)2), 2-метил-2-бутил (-C(CH3)2CH2CH3), 3-метил-2-бутил (-CH(CH3)CH(CH3)2), 3-метил-1-бутил (-CH2CH2CH(CH3)2), 2-метил-1-бутил (-CH2CH(CH3)CH2CH3), 1-гексил (-CH2CH2CH2CH2CH2CH3), 2-гексил (-CH(CH3)CH2CH2CH2CH3), 3-гексил (-CH(CH2CH3)(CH2CH2CH3)), 2-метил-2-пентил (-C(CH3)2CH2CH2CH3), 3-метил-2-пентил (-CH(CH3)CH(CH3)CH2CH3), 4-метил-2-пентил (-CH(CH3)CH2CH(CH3)2), 3-метил-3-пентил (-C(CH3)(CH2CH3)2), 2-метил-3-пентил (-CH(CH2CH3)CH(CH3)2), 2,3-диметил-2-бутил (-C(CH3)2CH(CH3)2), 3,3-диметил-2-бутил (-CH(CH3)C(CH3)3, 1-гептил и 1-октил.
Термин "алкенил" относится к линейному или с разветвленной цепью моновалентному углеводородному радикалу с, по меньшей мере, одним сайтом ненасыщенности, а именно, углерод-углеродной двойной связью, в котором алкенильный радикал можно необязательно замещать независимо одним или более заместителями, описанными в настоящем изобретении, и он включает радикалы, имеющие "цис" и "транс" ориентации, или альтернативно, "E" и "Z" ориентации. В одном примере алкенильный радикал содержит от двух до восемнадцати атомов углерода (C2-C18). В других примерах алкенильный радикал представляет собой C2-C12, C2-C10, C2-C8, C2-C6 или C2-C3. Примеры включают, но не ограничиваются, этенил или винил (-CH=CH2), проп-1-енил (-CH=CHCH3), проп-2-енил (-CH2CH=CH2), 2-метилпроп-1-енил, бут-1-енил, бут-2-енил, бут-3-енил, бута-1,3-диенил, 2-метилбута-1,3-диен, гекс-1-енил, гекс-2-енил, гекс-3-енил, гекс-4-енил, гекса-1,3-диенил.
Термин "алкинил" относится к линейному или разветвленному моновалентному углеводородному радикалу с, по меньшей мере, одним сайтом ненасыщенности, а именно, углерод-углеродной тройной связью, в котором алкинильный радикал можно необязательно замещать независимо одним или более заместителями, описанными в настоящем изобретении. В одном примере алкинильный радикал содержит от двух до восемнадцати атомов углерода (C2-C18). В других примерах алкинильный радикал представляет собой C2-C12, C2-C10, C2-C8, C2-C6 или C2-C3. Примеры включают, но не ограничиваются, этинил (-C≡CH), проп-1-инил (-C≡CCH3), проп-2-инил (пропаргил, -CH2C≡CH), бут-1-инил, бут-2-инил и бут-3-инил.
"Циклоалкил" относится к неароматической, насыщенной или частично ненасыщенной углеводородной кольцевой группе, в которой циклоалкильную группу можно необязательно замещать независимо одним или более заместителями, описанными в настоящем изобретении. В одном примере циклоалкильная группа содержит 3 - 12 атомов углерода (C3-C12). В других примерах циклоалкил представляет собой C3-C10 или C5-C10. В других примерах циклоалкильная группа, в виде моноцикла, представляет собой C3-C6 или C5-C6. В другом примере циклоалкильная группа, в виде бицикла, представляет собой C7-C12. Примеры моноциклического циклоалкила включают циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогексадиенил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил и циклододецил. Примерное соотношение атомов в бициклических циклоалкилах, содержащих 7 - 12 кольцевых атомов, включает, но не ограничиваются, [4,4], [4,5], [5,5], [5,6] или [6,6] кольцевые системы. Примерные бициклические циклоалкилы с мостиковой связью включают, но не ограничиваются, бицикло[2.2.1]гептан, бицикло[2.2.2]октан и бицикло[3.2.2]нонан.
"Арил" относится к циклической ароматической углеводородной группе, необязательно замещенной независимо одним или более заместителями, описанными в настоящем изобретении. В одном примере арильная группа содержит 6-20 атомов углерода (C6-C20). В другом примере арильная группа представляет собой C6-C9. В другом примере арильная группа представляет собой C6 арильную группу. Арильные группы могут быть представлены в структурах примеров, как "Ar". Арил включает бициклическую группу, содержащую ароматическое кольцо, конденсированное неароматическим или частично насыщенным кольцом. Примеры арильных групп включают, но не ограничиваются, фенил, нафталенил, антраценил, инденил, инданил, 1,2-дигидронафталенил, 1,2,3,4-тетрагидронафтил и подобные.
"Галоген" относится к F, Cl, Br или I.
"Гетероциклил" относится к насыщенной или частично ненасыщенной (т.е., содержащей одну или более двойных и/или тройных связей в кольце) циклической группе, в которой, по меньшей мере, один кольцевой атом представляет собой гетероатом, независимо выбранный из азота, кислорода, фосфора и серы, причем оставшиеся кольцевые атомы представляют собой атомы углерода. Гетероциклильную группу можно необязательно замещать одним или более заместителями, описанными ниже. В одном варианте осуществления гетероциклил включает моноциклы или бициклы, содержащие 1-9 углеродных кольцевых членов (C1-C9). В других примерах гетероциклил включает моноциклы или бициклы, содержащие C1-C5, C3-C5 или C4-C5. Примеры бициклических систем включают, но не ограничиваются, [3,5], [4,5], [5,5], [3,6], [4,6], [5,6] или [6,6] системы. В другом варианте осуществления гетероциклил включает кольцевые системы с мостиковой связью, содержащие [2.2.1], [2.2.2], [3.2.2] и [4.1.0] расположения атомов, и содержащие 1-3 гетероатомы, выбранные из N, O, S и P. В другом варианте осуществления гетероциклил включает спиро группы, содержащие 1-3 гетероатома, выбранные из N, O, S и P. Гетероциклильная группа может быть группой, присоединенной через атом углерода, или группой, присоединенной через гетероатом. "Гетероциклил" включает гетероциклильную группу, конденсированную с циклоалкильной группой.
Примеры гетероциклильных групп включают, но не ограничиваются, оксиранил, азиридинил, тииранил, азетидинил, оксетанил, тиентанил, 1,2-дитиетанил, 1,3-дитиетанил, пирролидинил, пиперидинил, морфолинил, тиоморфолинил, тиооксанил, пиперазинил, гомопиперазинил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, дигидротиенил, дигидропиранил, дигидрофуранил, тетрагидрофуранил, тетрагидротиенил, тетрагидропиранил, тетрагидротиопиранил, 1-пирролинил, 2-пирролинил, 3-пирролинил, индолинил, 2H-пиранил, 4H-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, пиразолидинил, дитианил, дитиоланил, пиразолидинилимидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил и азабицикло[2.2.2]гексанил. Примерами гетероциклильной группы, в которой кольцевой атом замещают оксо (=O), являются индолинонил, пиримидинонил и 1,1-диоксотиоморфолинил. Гетероциклильные группы настоящего изобретения необязательно замещают независимо одним или более заместителями, описанными в настоящем изобретении. Гетероциклилы описывают в Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry" (W. A. Benjamin, New York, 1968), в частности в главах 1, 3, 4, 6, 7 и 9; "The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, с 1950 до настоящего времени), в частности в томах 13, 14, 16, 19, и 28; и J. Am. Chem. Soc.(1960) 82:5566.
Термин "гетероарил" относится к ароматическому углеводородному радикалу, в котором, по меньшей мере, один кольцевой атом представляет собой гетероатом, независимо выбранный из азота, кислорода и серы, причем оставшиеся кольцевые атомы представляют собой атом углерода. Гетероарильные группы необязательно замещены одним или более заместителями, описанными в настоящем изобретении. В одном примере гетероарильная группа содержит 1-9 углеродных кольцевых атомов (C1-C9). В других примерах гетероарильная группа представляет собой C1-C5, C3-C5 или C5-C10. В одном варианте осуществления примерные гетероарильные группы включают моноциклические ароматические 5-, 6- и 7-членные кольца, содержащие один или более гетероатомов, независимо выбранных из азота, кислорода и серы. В другом варианте осуществления примерные гетероарильные группы включают конденсированные кольцевые системы 8-20 атомов, в которых, по меньшей мере, одно ароматическое кольцо содержит один или более гетероатомов, независимо выбранных из азота, кислорода и серы. "Гетероарил" включает гетероарильные группы, конденсированные с арильной, циклоалкильной или гетероциклильной группой. Примеры гетероарильных групп включают, но не ограничиваются, пиридинил, имидазолил, имидазопиридинил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, триазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил.
В определенных вариантах осуществления гетероциклильную или гетероарильную группу присоединяют через C атом. Посредством примера и без ограничения, присоединенные через атом углерода гетероциклилы включают расположение связи в положении 2, 3, 4, 5 или 6 пиридина, положении 3, 4, 5 или 6 пиридазина, положении 2, 4, 5 или 6 пиримидина, положении 2, 3, 5 или 6 пиразина, положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, положении 2, 4 или 5 оксазола, имидазола или тиазола, положении 3, 4 или 5 изоксазола, пиразола или изотиазола, положении 2 или 3 азиридина, положении 2, 3 или 4 азетидина, положении 2, 3, 4, 5, 6, 7 или 8 хинолина или положении 1, 3, 4, 5, 6, 7 или 8 изохинолина. (2-пиридил, 3-пиридил, 4-пиридил, 5-пиридил, 6-пиридил).
В определенных вариантах осуществления гетероциклильную или гетероарильную группу присоединяют через N атом. Посредством примера и без ограничения, присоединенная через атом азота гетероциклильная или гетероарильная группа включает расположение связи в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1H-индазола, положении 2 изоиндола или изоиндолина, положении 4 морфолина и положении 9 карбазола или β-карболина.
В одном варианте осуществления, в отношении формулы I, алкил, алкенил и алкинил необязательно замещены 1-5 заместителями, независимо выбранными из одного или более ORa, NRcRd, оксо и галогена, и арил, гетероциклил, гетероарил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, оксо, галогена, CF3, NRcRd, C1-C4 алкила и C(O)(C1-C4 алкила), в которых Ra, Rc и Rd определяют ниже для формулы I. В другом варианте осуществления, в отношении формулы I, алкил, алкенил и алкинил необязательно замещены 1-3 заместителями, независимо выбранными из одного или более ORa, NRcRd, оксо и галогена, и арил, гетероциклил, гетероарил и циклоалкил необязательно замещены 1-3 заместителями, независимо выбранными из ORa, оксо, галогена, CF3, NRcRd, C1-C4 алкила и C(O)(C1-C4 алкила), в которых Ra, Rc и Rd определяют ниже для формулы I.
В одном варианте осуществления, в отношении формулы I, алкил, алкенил и алкинил необязательно замещены 1-5 заместителями, независимо выбранными из оксо и галогена, и арил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, галогена, CF3, NRcRd и C1-C4 алкила, в которых Ra, Rc и Rd определяют ниже в отношении формулы I. В другом варианте осуществления в отношении формулы I, алкил, алкенил и алкинил необязательно замещены 1-3 заместителями, независимо выбранными из оксо и галогена, и арил необязательно замещены 1-3 заместителями, независимо выбранными из ORa, галогена, CF3, NRcRd и C1-C4 алкила, в которых Ra, Rc и Rd определяют ниже в отношении формулы I.
В одном варианте осуществления, в отношении формулы I, алкил, арил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из C1-C4 алкила, (C0-C3 алкил)ORc, оксо, галогена, NRcRd и C4-C5 гетероциклила, в которых Rc и Rd определяют ниже в отношении формулы I. В другом варианте осуществления в отношении формулы I, алкил, арил и циклоалкил необязательно замещены 1-3 заместителями, независимо выбранными из C1-C4 алкила, (C0-C3 алкил)ORc, оксо, галогена, NRcRd и C4-C5 гетероциклила, в которых Rc и Rd определяют ниже в отношении формулы I.
В одном варианте осуществления в отношении формулы I, алкил, циклоалкил и фенил необязательно замещены 1-5 заместителями, независимо выбранными из галогена, CH3 OH, NH2, C(O)O(C1-C6 алкила) и C(O)NH(C1-C6 алкила). В другом варианте осуществления в отношении формулы I, алкил, циклоалкил и фенил необязательно замещены 1-3 заместителями, независимо выбранными из галогена, CH3 OH, NH2, C(O)O(C1-C6 алкила) и C(O)NH(C1-C6 алкила).
"Лечить" и "лечение" включает и терапевтическое лечение и профилактические или превентативные меры, при которых целью является предотвращение или замедление (облегчение) нежелательного физиологического изменения или заболевания, такого как развитие или распространение рака. Для целей настоящего изобретения, полезные или желательные клинические результаты включают, но не ограничиваются, облегчение симптомов, уменьшение длительности заболевания, стабилизирование (т.е., не ухудшение) состояния заболевания, задержку или замедление развития заболевания, уменьшение интенсивности или временное облегчение течения заболевания, и ремиссию (частичную ли или полную), обнаруживаемую ли или не обнаруживаемую. "Лечение" может также обозначать увеличение продолжительности жизни по сравнению с ожидаемым сроком жизни без осуществления лечения. Пациенты, нуждающиеся в лечении, включают пациентов уже с состоянием или заболеванием, а также пациентов, склонных иметь состояние или заболевание, (например, посредством генетической мутации) или пациентов, у которых состояние или заболевание нужно предотвратить.
Фраза "терапевтически эффективное количество" относится к количеству соединения настоящего изобретения, которое (i) лечит или предотвращает конкретное заболевание, состояние или расстройство, (ii) смягчает, облегчает или устраняет один или более симптомов конкретного заболевания, состояния или расстройства, или (iii) предотвращает или задерживает возникновение одного или более симптомов конкретного заболевания, состояния или расстройства, описанного в настоящем изобретении. В случае рака терапевтически эффективное количество лекарственного средства может уменьшить число раковых клеток; уменьшить размер опухоли; замедлить (т.е., замедлить до некоторой степени и предпочтительно остановить) инфильтрацию раковых клеток в периферические органы; замедлить (т.е., замедлить до некоторой степени и предпочтительно остановить) метастаз опухоли; замедлить, до некоторой степени, рост опухоли; и/или облегчить до некоторой степени один или более симптомов, связанных с раком. В тех случаях, когда лекарственное средство может предотвратить и/или убить существующие раковые клетки, оно может быть цитостатическим и/или цитотоксическим. Для терапии рака, эффективность можно, например, измерить оценкой времени до прогрессирования заболевания (TTP) и/или определением эффективности лекарственного средства (RR).
Термин "биодоступность" относится к системной доступности (а именно, концентрации в крови/плазме) данного количества лекарственного средства, введенного пациенту. Биодоступность представляет собой независимый термин, который показывает величину и времени (скорости) и суммарного количества (значение) лекарственного средства, которая достигает общего кровообращения из введенной лекарственной формы.
Термины "рак" и "раковый" относятся к или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым клеточным ростом. "Опухоль" включает одну или более раковых клеток. Примеры рака включают, но не ограничиваются, карциному, лимфому, бластому, саркому и лейкемию или лимфонеоплазию. Более конкретные примеры данных видов рака включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легкого, включая мелкоклеточный рак лёгкого, немелкоклеточный рак лёгкого ("NSCLC"), аденокарциному легкого и плоскоклеточный рак легкого, рак брюшной полости, гепатоцеллюлярный рак, рак желудочно-кишечного тракта или желудка, включая гастроинтестинальный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, рак ободочной и прямой кишки, рак эндометрия или матки, рак слюнной железы, рак почек, рак предстательной железы, рак влагалища, рак щитовидной железы, рак печени, рак анального отверстия, рак полового члена, а также рак головы и шеи.
"Химиотерапевтический агент" представляет собой химическое соединение, пригодное для лечения рака. Примеры химиотерапевтических агентов включают эрлотиниб (TARCEVA®, Genentech, Inc./OSI Pharm.), трастузумаб (HERCEPTIN®, Genentech, Inc.); бевацизумаб (AVASTIN®, Genentech, Inc.); ритуксимаб (RITUXAN®, Genentech, Inc./Biogen Idee, Inc.), бортезомиб (VELCADE®, Millennium Pharm.), фульвестрант (FASLODEX®, AstraZeneca), сутент (SU11248, Pfizer), летрозол (FEMARA®, Novartis), мезилат иматиниба (GLEEVEC®, Novartis), PTK787/ZK 222584 (Novartis), оксалиплатин (Eloxatin®, Sanofi), 5-FU (5-фторурацил), лейковорин, рапамицин (Sirolimus, RAPAMUNE®, Wyeth), лапатиниб (GSK572016, Glaxo Smith Kline), лонафарниб (SCH 66536), сорафениб (BAY43-9006, Bayer Labs) и гефитиниб (IRESSA®, AstraZeneca), AG1478, AG1571 (SU 5271; Sugen), алкилирующие агенты, такие как тиотепа и CYTOXAN® циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфамид, триэтилентиофосфамид и триметиломеланин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; CC-1065 (включая его адозелезиновые, карзелезиновые и бизелезиновые синтетические аналоги); криптофицины (в частности криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CBl-TМл); элеутеробин; панкратистатин; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, меклоретамин, гидрохлорид меклоретаминоксида, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урамустин; нитромочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики, (например, калихимицин, особенно калихимицин гамма1I и калихимицин омегаI1 (Angew Chem. Intl. Ed. Engl. (1994) 33:183-186); динемицин, включая динемицин A; бисфосфонаты, такие как клодронат; эсперамицин; а также неокарзиностатиновый хромофор и родственные хромопротеиновые энедииновые антибиотические хромофоры), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлеуцин, ADRIAMYCIN® (доксорубицин), морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; препараты, подавляющие синтез стероидов корой надпочечников, такие как аминоглутетимид, митотан, трилостан; пополнители фолиевой кислоты, такие как фролиновая кислота; ацеглатон; альдофосфамидные гликозиды; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; ацетат эллиптиния; эпотилон; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; мэйтанзиноиды, такие как мейтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK® полисахаридный комплекс (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно T-2 токсин, верракурин A, роридин A и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); циклофосфамид; тиотепа; таксоиды, например, TAXOL® (паклитаксел; Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANE® (без кремофора), стабилизированные альбумином наночастицы паклитаксела (American Pharmaceutical Partners, Schaumberg, Illinois) и TAXOTERE® (доксетаксел; Rhône-Poulenc Rorer, Antony, France); хлорамбуцил; GEMZAR® (гемцитабин); 6-тиогуанин; меркаптопурин; метотрексат; платиновые аналоги, такие как цисплатина и карбоплатина; винбластин; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; NAVELBINE® (винорелбин); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; CPT-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин; и фармацевтически приемлемые соли, кислоты и производные любого из вышеперечисленных.
Также включенными в определение "химиотерапевтический агент" являются: (i) противогормональные агенты, которые действуют, регулируя или ингибируя действие гормонов на опухоли, такие как антиэстрогены и селективный модулятор рецепторов эстрогена (SERM), включая, например, тамоксифен (включая NOLVADEX®; цитрат тамоксифена), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и FARESTON® (торемифин цитрат); (ii) ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует синтез эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглютетимид, MEGASE® (ацетат мегестрола), AROMASIN® (экземестан; Pfizer), форместан, фадрозол, RIVISOR® (ворозол), FEMARA® (летрозол; Novartis) и ARIMIDEX® (анастрозол; AstraZeneca); (iii) агенты, подавляющие синтез стероидов корой надпочечников, такие как флутамид, нилутамид, бикалутамид, лейпроледин и гозерелин; а также троксацитабин (1,3-диоксолановый нуклеозидный цитозиновый аналог); (iv) ингибиторы протеинкиназ; (v) ингибиторы липидных киназ; (vi) антисмысловые олигонуклеотиды, в частности антисмысловые олигонуклеотиды, которые ингибируют экспрессию генов в сигнальных путях, вовлеченных в нарушенную пролиферацию клеток, такие как, например, PKC-альфа, Ralf и H-Ras; (vii) рибозимы, такие как VEGF ингибиторы (например, ANGIOZYME®) и (viii) вакцины, такие как вакцины для генной терапии, например, ALLOVECTIN®, LEUVECTIN® и VAXID®; PROLEUKIN® rIL-2ингибитор топоизомеразы 1, такой как LURTOTECAN®; ABARELIX® rmRH; (ix) антиангиогенные агенты; и (x) фармацевтически приемлемые соли, кислоты и производные любого из вышеуказанных.
Гуманизированные моноклональные антитела с терапевтической активностью в качестве агентов в комбинации с ингибиторами янус киназы настоящего изобретения включают: алемтузумаб, аполизумаб, азелизумаб, атлизумаб, бапинеузумаб, бевацизумаб, мертансин биватузумаб, мертансин кантузумаб, цеделизумаб, цертолизумаб пегол, цидфузитузумаб, цидтузумаб, даклизумаб, экулизумаб, эфализумаб, эпратузумаб, эрлизумаб, фелвизумаб, фонтолизумаб, озогамицин гемтузумаб, озогамицин инотузумаба, ипилимумаб, лабетузумаб, линтузумаб, матузумаб, меполизумаб, мотавизумаб, мотовизумаб, натализумаб, нимотузумаб, ноловизумаб, нумавизумаб, окрелизумаб, омализумаб, паливизумаб, пасколизумаб, пекфузитузумаб, пектузумаб, пертузумаб, пекселизумаб, раливизумаб, ранибизумаб, ресливизумаб, реслизумаб, резивизумаб, ровелизумаб, руплизумаб, сибротузумаб, сиплизумаб, сонтузумаб, такатузумаб тетраксетан, тадоцизумаб, тализумаб, тефибазумаб, тоцилизумаб, торализумаб, трастузумаб, тукотузумаб целмолейкин, тукузитузумаб, умавизумаб, уртоксазумаб, устекинумаб, визилизумаб, адалимумаб, этанерцепт, инфликсимаб и антиинтерлейкин-12 (ABT-874/J695, Wyeth Research и Abbott Laboratories), который представляет собой рекомбинантное исключительно с человеческой последовательностью, полнодлинновое IgG1 λ антитело, генетически модифицированное для того, чтобы узнавать интерлейкин-12 p40 белок.
Термин "пролекарство", как применяют в настоящей заявке, относится к предшественнику или производному фармацевтически активного вещества, которое действует слабее на пациента или является менее цитотоксичным для клеток опухоли по сравнению с родственным лекарственным средством и которое может ферментативно или гидролитически активироваться, или превращаться в более активную родственную форму. Смотри, например, Wilman, "Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) и Stella et al., "Prodrugs: A Chemical Approach to Targeted Drug Delivery," Directed Drug Delivery, Borchardt et al., (ed.), pp. 247-267, Humana Press (1985). Пролекарства настоящего изобретения включают, но не ограничиваются, пролекарства, содержащие фосфат, пролекарства, содержащие тиофосфат, пролекарства, содержащие сульфат, пролекарства, содержащие пептид, пролекарства, модифицированные D-аминокислотой, гликозилированные пролекарства, пролекарства, содержащие β-лактам, пролекарства, содержащие необязательно замещенный феноксиацетамид или необязательно замещенный фенилацетамид, 5-фторцитозиновые и другие 5-фторуридиновые пролекарства, которые могут превращаться в более активное цитотоксичное свободное лекарственное средство. Примеры цитотоксичных лекарственных средств, которые можно превратить в пролекарственную форму для применения в настоящем изобретении, включают, но не ограничиваются, те химиотерапевтические агенты, которые описаны выше.
"Липосома" представляет собой маленькую везикулу, состоящую из различных типов липидов, фосфолипидов и/или поверхностно-активного вещества, которая являются пригодной для доставки лекарственного средства (такого как соединение формулы I и, необязательно, химиотерапевтического агента) у млекопитающего. Компоненты липосомы обычно располагаются в виде бислоя, аналогичного расположению липидов биологических мембран.
Термин "листок-вкладыш" применяют относительно инструкций, обычно содержащихся в коммерческой упаковке терапевтических продуктов, которые содержат информацию о показаниях, применении, дозе, введении, противопоказаниях и/или предостережениях, касающихся применения данных терапевтических продуктов.
Термин "хиральная" относится к молекулам, которые обладают свойством неналожимости друг на друга зеркальных изображений, тогда как термин "ахиральная" относится к молекулам, зеркальные изображения которых накладываются друг на друга.
Термин "стереоизомеры" относится к соединениям, которые обладают идентичной химической структурой, но отличаются расположеним атомов или групп в пространстве.
"Диастереомер" относится к стереоизомеру с двумя или более центрами хиральности, и чьи морлекулы не являются зеркальными изображениями друг друга. Диастереомеры имеют различные физические свойства, например, температуру плавления, температуру кипения, спектральные свойства и реакционноспособность. Смеси диастереомеров можно разделить аналитическими методиками высокого разрешения, такими как электрофорез и хроматография.
"Энантиомеры" относятся к двум стереоизомерным соединениям, которые являются неналожимыми зеркальными изображениями друг друга.
Стереохимические определения и условные обозначения, применяемые в настоящем изобретении, обычно соответствуют S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. и Wilen, S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994. Многие органические соединения существуют в оптически активных формах, т.е., они обладают способностью вращать плоскость плоско-поляризованного света. При описании оптически активного соединения, приставки D и L, или R и S, применяют для обозначения абсолютной конфигурации молекулы относительно ее хирального центра (центров). Приставки d и l или (+) и (-) применяют для обозначения знака вращения плоско-поляризованного света соединением, причем (-) или l обозначает то, что соединение является левовращающим. Соединение с приставкой (+) или d является правовращающим. Для данной химической структуры данные стереоизомеры являются идентичными за исключением того, что они являются зеркальными отображениями друг друга. Конкретный стереоизомер можно также называть энантиомером, и смесь данных изомеров часто называют энантиомерной смесью. Смесь 50:50 энантиомеров называют рацемической смесью или рацематом, которая может образовываться, когда в химической реакции или процессе отсутствует стереоселективность или стереоспецифичность. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных молекул, которая не обладает оптической активностью.
Фраза "фармацевтически приемлемая соль", как применяют в настоящем изобретении, относится к фармацевтически приемлемым органическим или неорганическим солям соединения формулы I. Примеры солей включают, но не ограничиваются, сульфатную, цитратную, ацетатную, оксалатную, хлоридную, бромидную, йодидную, нитратную, бисульфатную, фосфатную, кислую фосфатную, изоникотинатную, лактатную, салицилатную, кислую цитратную, тартратную, олеатную, таннатную, пантотенатную, битартратную, аскорбатную, сукцинатную, малеатную, гентизинатную, фумаратную, глюконатную, глюкуронатную, сахаратную, формиатную, бензоатную, глутаматную, метансульфонатную, этансульфонатную, бензолсульфонатную, п-толуолсульфонатную и памоатную (т.е., 1,1'-метилен-бис-(2-гидрокси-3-нафтоатную)) соли. Фармацевтически приемлемая соль может содержать включение другой молекулы, такой как ион ацетата, сукцинатный ион или другой противоион. Протиовион может быть органической или неорганической молекулой, которая стабилизирует заряд исходного соединения. Кроме того, фармацевтически приемлемая соль может содержать более чем один заряженный атом в своей структуре. Примеры, когда атомы с мультизарядом являются частью фармацевтически приемлемой соли, могут содержать несколько противоионов. Следовательно, фармацевтически приемлемая соль может иметь один или более заряженных атомов и/или один или более противоионов.
"Сольват" относится к ассоциату или комплексу одной или более молекул растворителя и соединения формулы I. Примеры растворителей, которые образуют сольваты, включают, но не ограничиваются, воду, изопропанол, этанол, метанол, DMSO, этилацетат, уксусную кислоту и этаноламин. Термин "гидрат" относится к комплексу, когда молекулой растворителя является вода.
Термин "защитная группа" или "Pg" относится к заместителю, который обычно применяют для блокирования или защиты конкретной функциональной группы во время реакции других функциональных групп соединения. Например, "защитная группа аминофункции" представляет собой заместитель, присоединенный к аминогруппе, который блокирует или защищает аминофункцию соединения. Подходящие защитные группы аминофункции включают ацетил, трифторацетил, фталимидо, трет-бутоксикарбонил (BOC), бензилоксикарбонил (CBz) и 9-флуоренилметиленоксикарбонил (Fmoc). Аналогично, "защитная группа гидрокси-функции" относится к заместителю гидрокси группы, который блокирует или защищает гидрокси-функцию. Подходящие защитные группы гидрокси-функции включают ацетил, триалкилсилил, диалкилфенилсилил, бензоил, бензил, бензилоксиметил, метил, метоксиметил, триарилметил и тетрагидропиранил. "Защитная группа карбокси-функции" относится к заместителю карбокси группы, который блокирует или защищает карбокси функцию. Стандартные защитные группы карбокси группы включают - CH2CH2SO2Ph, цианоэтил, 2-(триметилсилил)этил, 2-(триметилсилил)этоксиметил, 2-(п-толуолсульфонил)этил, 2-(п-нитрофенилсульфенил)этил, 2-(дифенилфосфино)этил, нитроэтил и подобные. Об общем описании защитных групп и их применении смотри T. W. Greene и P. Wuts, Protective Groups in Organic Synthesis, Third Ed., John Wiley & Sons, New York, 1999; и P. Kocienski, protecting Groups, Third Ed., Verlag, 2003.
Термин "пациент" включает пациентов, являющихся людьми, и пациентов, являющихся животными. Термин "животное" включает домашние животные (например, собак, кошек и лошадей), животные, являющиеся источником еды, животные для зоопарков, морские животные, птиц и другие аналогичные виды животных.
Фраза "фармацевтически приемлемая" показывает то, что вещество или композиция должна быть совместима химически и/или токсилогически, с другими ингредиентами, содержащимися в рецептуре, и/или животным, которого будут лечить.
Термины "соединение настоящего изобретения" и "соединения настоящего изобретения", и "соединения формулы I", если не указано особо, включают соединения формулы I и их стереоизомеры, таутомеры, сольваты, метаболиты, соли (например, фармацевтически приемлемые соли) и пролекарства. Если не указано особо, подразумевается, что структуры, показанные в настоящем изобретении, включают соединения, которые отличаются наличием одного или более изотопно обогащенных атомов. Например, соединения формулы I, в котором один или более атомов водорода замещают дейтерием или тритием, или один или более атомов углерода замещают 13C- или 14C-обогащенным атомом углерода, включены в объем настоящего изобретения.
"Воспалительное заболевание", как применяют в настоящем изобретении, может относиться к любому заболеванию, расстройству или синдрому, при котором чрезмерная или нерегулируемая воспалительная реакция приводит к чрезмерным воспалительным симптомам, повреждению ткани хозяина, или потере тканью ее функции. "Воспалительное заболевание" также относится к патологическому состоянию, опосредованному притоком лейкоцитов и/или нейтрофильным хемотаксисом.
"Воспаление", как применяют в настоящем изобретении, относится к местной, защитной реакции, вызванной повреждением или разрушением тканей, которая служит для того, чтобы уничтожить, растворить, или изолировать и вредный агент, и поврежденную ткань. Воспаление в значительной мере связано с притоком лейкоцитов и/или нейтрофильным хемотаксисом. Воспаление может быть результатом заражения патогенными организмами и вирусами, и может возникать по неинфекционным причинам, таким как травма или реперфузия после инфаркта миокарда или инсульта, иммунной реакции на чужеродный антиген и аутоиммунной реакции. Соответственно, воспалительные заболевания, подлежащие лечению соединениями формулы I, включают заболевания, связанные с реакциями специфических защитных систем, а также с реакциями неспецифических защитных систем.
"Специфическая защитная система" относится к компоненту иммунной системы, которая реагирует на наличие конкретных антигенов. Примеры воспаления, являющегося результатом ответной реакции специфической защитной системы, включают классическую ответную реакцию на чужеродные антигены, аутоиммунные заболевания и гиперчувствительность замедленного типа, опосредованную T-клетками. Хронические воспалительные заболевания, отторжение твердой трансплантированной ткани и органов, например, трансплантатов почек и костного мозга, и реакция "трансплантат против хозяина" (GVHD), являются дополнительными примерами воспалительных ответных реакций специфической защитной системы.
Термин "неспецифическая защитная система", как применяют в настоящем изобретении, относится к воспалительным заболеваниям, которые опосредованы лейкоцитами, которые не обладают иммунологической памятью (например, гранулоциты и макрофаги). Примеры воспаления, которое является результатом, по меньшей мере, частично, реакции неспецифической защитной системы включают воспаление, связанное с состояниями, такими как синдром острой дыхательной недостаточности у взрослых (ARDS) или синдром повреждения нескольких органов; реперфузионное повреждение; острый гломерулонефрит; реактивные артриты; дерматозы с острой воспалительной компонентой; острый гнойный менингит или другие воспалительные заболевания центральной нервной системы, такие как инсульт; поражение тепловым излучением; воспалительное заболевание кишечника; синдром, связанный с трансфузией гранулоцитов; и токсичность, вызванная цитокинами.
"Аутоиммунное заболевание", как применяют в настоящем изобретении, относится к любой группе заболеваний, при которых повреждение ткани связано с гуморальным или опосредованным клетками ответом на компоненты собственного тела.
"Аллергическое заболевание", как применяют в настоящем изобретении, относится к любым симптомам, повреждению ткани или потере тканью функции в результате аллергии. " Артритическое заболевание", как применяют в настоящем изобретении, относится к любому заболеванию, которое характеризуется воспалительным повреждением суставов, связанным с различной этиологией. "Дерматит", как применяют в настоящем изобретении, относится к любому из большого семейства заболеваний кожи, которые характеризуются воспалением кожи, связанным с различной этиологией. "Отторжение трансплантата", как применяют в настоящем изобретении, относится к любой иммунной реакции, направленной против трансплантируемой ткани, такой как орган или клетки (например, костный мозг), характеризуемой потерей функции трансплантируемой и окружающих тканей, болью, опуханием, лейкоцитозом и тромбоцитопенией. Терапевтические методы настоящего изобретения включают способы лечения заболеваний, связанных с активацией клеток воспаления.
"Активация клеток воспаления" относится к индукции стимулом (включая, но не ограничиваясь, цитокины, антигены или аутоантитела) пролиферативного клеточного ответа, синтеза растворимых медиаторов (включая, но не ограничиваясь, цитокины, кислородные радикалы, ферменты, простаноиды или вазоактивные амины), или экспрессии поверхностью клеток нового или повышенного количества медиаторов (включая, но не ограничиваются, антигены главного комплекса гистосовместимости или молекулы клеточной адгезии) в воспалительных клетках (включая, но не ограничиваясь, моноциты, макрофаги, T лимфоциты, B лимфоциты, гранулоциты (т.е., полиморфно-ядерные лейкоциты, такие как нейтрофилы, базофилы и эозинофилы), тучные клетки, дендритные клетки, клетки Лангерганса и эндотелиальные клетки). Специалистам в данной области техники ясно, что активация одного или комбинации данных фенотипов в данных клетках может вносить вклад в возникновение, сохранение или обострение воспалительного заболевания.
Термин "NSAID" представляет собой сокращение "нестероидного противовоспалительного лекарственного средства" и представляет собой терапевтический агент с анальгетическим, жаропонижающим (снижающим повышенную температуру тела и облегчающим боль без влияния на сознание) и, в больших дозах, противовоспалительным действием (ослабляющим воспаление). Термин "нестероидное" применяют для того, чтобы отличить данные лекарственные средства от стероидов, которые (среди большого диапазона других эффектов) обладают аналогичным подавляющим эйкозаноиды, противовоспалительным действием. В качестве анальгезирующих средств, NSAID являются необычными потому, что не являются наркотическими. NSAID включают аспирин, ибупрофен и напроксен. NSAID обычно требуются для лечения острых или хронических состояний при наличии боли и воспаления. NSAID обычно требуются для облегчения симптомов следующих состояний: ревматоидный артрит, остеоартрит, воспалительная артропатия (например, анкилозирующий спондилоартрит, псориатический артрит, болезнь Рейтера, острая подагра, дисменорея, метастатическая боль в костях, головная боль и мигрень, боль после операции, от слабой до умеренной боли в результате воспаления и повреждения ткани, лихорадка, заворот кишок и почечные колики. Большинство NSAID действуют, как неселективные ингибиторы ферментов циклооксигеназ, ингибируя изоферменты и циклооксигеназу-1 (COX-I) и циклооксигеназу-2 (COX-2). Циклооксигеназа катализирует образование простагландинов и тромбоксанов из арахидоновой кислоты (которая сама получается из клеточного фосфолипидного бислоя при действии фосфолипазы A2). Простагландины действуют (среди других эффектов) в качестве сигнализирующих молекул в процессе воспаления. COX-2 ингибиторы включают целекоксиб, этерикоксиб, лумиракоксиб, парекоксиб, рофекоксиб и вальдекоксиб.
"JAK киназа" и "янус киназа" относятся к JAK1, JAK2, JAK3 и TYK2 белковым киназам.
ТРИАЗОЛОПИРИДИНОВЫЕ СОЕДИНЕНИЯ, ЯВЛЯЮЩИЕСЯ JAK ИНГИБИТОРАМИ
В одном варианте осуществления обеспечивают соединением формулы I, и его фармацевтическими композициями, которые являются пригодными для лечения заболеваний, состояний и/или расстройств, чувствительных к ингибированию JAK киназ.
Другой вариант осуществления включает соединения формулы I

их энантиомеры, диастереомеры, таутомеры или фармацевтически приемлемые соли, в которых:
R1 представляет собой H, C(O)ORa, фенил, C1-C9 гетероциклил или C1-C9 гетероарил, в которых упомянутый фенил и гетероарил необязательно замещены 1-5 R6;
R2 представляет собой фенил, C1-C9 гетероарил или C1-C9 гетероциклил, в которых фенил, гетероарил и гетероциклил необязательно замещены 1-5 R7;
R3, R4 и R5 независимо представляют собой H, CH3, CH2CH3, OCH3, CF3, F или Cl;
R6 независимо представляет собой H, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, (C0-C6 алкил)ORa, (C0-C6 алкил)NRaRb, галоген, CN, CF3, S(O)1-2NRaRb, C(O)Ra, NRaC(O)ORb, NRaS(O)1-2NRb, (C0-C6 алкил)C1-C5 гетероарил, (C0-C6 алкил)C1-C5 гетероциклил, (C0-C6 алкил)C3-C6 циклоалкил, (C0-C6 алкил)C6-C9 арил, (C0-C6 алкил)C(O)ORa, C(O)(C0-C5 алкил)NRaRb, C(O)(C0-C5 алкил)(C1-C5 гетероциклил), C(O)NRa(C0-C5 алкил)(C1-C5 гетероциклил), C(O)NRa(C0-C5 алкил)(C3-C6 циклоалкил), C(O)NRa(C0-C5 алкил)(С1-C5 гетероарил), C(O)NRa(C1-C5 алкил)NRaRb или C(O)NRa(C0-C5 алкил)(C6 арил), в которых упомянутый алкил, алкенил и алкинил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, NRcRd, оксо и галогена, и упомянутый арил, гетероциклил, гетероарил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, оксо, галогена, CF3, NRcRd, C1-C4 алкила, (C0-C6 алкил)C1-C5 гетероциклила и C(O)(C1-C4 алкила);
R7 независимо представляет собой H, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, (C0-C6 алкил)ORa, (C0-C6 алкил)NRaRb, (C0-C6 алкил)(C6-C9 арил), галоген, C(0)NRaRb, NRaC(O)Rb, SO2(C1-C6 алкил), SO2NRaRb, CN, CF3, CH2CF3, нитро, S(O)(C1-C6 алкил), S(O)NRaRb, NR3S(O)1-2Rb, C(O)Ra, C(O)ORa, (C0-C6 алкил)C1-C5 гетероарил, (C0-C6 алкил)C1-C5 гетероциклил или (C0-C6 алкил)C3-C6 циклоалкил, в которых упомянутый алкил, алкенил и алкинил необязательно замещены 1-5 заместителями, независимо выбранными из оксо, NRaRb, ORa и галогена, и упомянутый арил, гетероарил, гетероциклил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, галогена, CF3, NRcRd и C1-C4 алкила;
Ra и Rb независимо представляют собой H, ORC, C(O)O(C1-C6 алкил), C1-C6 алкил, C6 арил или C3-C6 циклоалкил, в которых упомянутый алкил, арил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из C1-C4 алкила, (C0-C3 алкил)ORc, оксо, галогена, NRcRd и C4-C5 гетероциклила; или
Ra и Rb, вместе с атомом, к которому они присоединены, образуют C1-C5 гетероциклил; и
Rc и Rd независимо представляют собой H, C1-C3 алкил, C3-C6 циклоалкил или фенил, в которых упомянутый алкил, циклоалкил и фенил необязательно замещены 1-5 заместителями, независимо выбранными из галогена, CH3, OH или NH2, C(O)O(C1-C6 алкила) и C(O)NH(C1-C6 алкила).
Другой вариант осуществления включает соединения формулы I:

их энантиомеры, диастереомеры, таутомеры или фармацевтически приемлемые соли, в которых:
R1 представляет собой H, C(O)ORa, фенил или C1-C9 гетероарил, в которых упомянутый фенил и гетероарил необязательно замещены 1-6 R6
R2 представляет собой фенил, C1-C9 гетероарил или C1-C9 гетероциклил, в которых фенил, гетероарил и гетероциклил необязательно замещены 1-6 R7;
R3, R4 и R5 независимо представляют собой H, CH3, CH2CH3, CF3, F или Cl;
R6 независимо представляет собой H, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, (C0-C6 алкил)ORa, (C0-C6 алкил)NRaRb, галоген, CN, C1-C5 гетероарил, C1-C5 гетероциклил, C3-C6 циклоалкил, C6-C9 арил, C(O)ORa, C(O)(C0-C5 алкил)NRaRb, C(O)(C0-C5 алкил)(C1-C5 гетероциклил), C(O)NRa(C0-C5 алкил)(C1-C5 гетероциклил), C(O)NRa(C0-C5 алкил)(C3-C6 циклоалкил), C(O)NRa(C0-C5 алкил)(C1-C5 гетероарил), C(O)NRa(C1-C5 алкил)NRaRb, C(O)NRa(C1-C5 алкил)(C6 арил), в которых упомянутый алкил, алкенил и алкинил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, NRcRd, оксо и галогена, и упомянутый арил, гетероциклил, гетероарил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, оксо, галогена, CF3, NRcRd, C1-C4 алкила и C(O)(C1-C4 алкила);
R7 независимо представляет собой H, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, (C0-C6 алкил)ORa, (C0-C6 алкил)NRaRb, (C0-C6 алкил)(C6-C9 арил), галоген, C(O)NRaRb, NRaC(O)Rb, SO2(C1-C6 алкил), SO2NRaRb, CN, нитро, в которых упомянутый алкил, алкенил и алкинил необязательно замещены 1-5 заместителями, независимо выбранными из оксо и галогена, и упомянутый арил необязательно замещен 1-5 заместителями, независимо выбранными из ORa, галогена, CF3, NRcRd и C1-C4 алкила;
Ra и Rb независимо представляют собой H, ORC, C(O)O(C1-C6 алкил), C1-C6 алкил, C6 арил или C3-C6 циклоалкил, в которых упомянутый алкил, арил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из C1-C4 алкила, (C0-C3 алкил)ORc, оксо, галогена, NRcRd и C4-C5 гетероциклила; или
Ra и Rb, вместе с атомом, к которому они присоединены, образуют C1-C5 гетероциклил; и
Rc и Rd независимо представляют собой H, C1-C3 алкил, C3-C6 циклоалкил или фенил, в которых упомянутый алкил, циклоалкил и фенил необязательно замещены 1-5 заместителями, независимо выбранными из галогена, CH3 OH, NH2, C(O)O(C1-C6 алкила) и C(O)NH(C1-C6 алкила).
В одном варианте осуществления R1 представляет собой фенил или C1-C9 гетероарил, в которых упомянутый фенил и гетероарил необязательно замещены 1-5 R6.
В одном варианте осуществления R1 представляет собой фенил, необязательно замещенный 1-5 R6.
В одном варианте осуществления, R1 представляет собой фенил, необязательно замещенный 1-3 R6.
В одном варианте осуществления R1 представляет собой фенил, необязательно замещенный 2 R6.
В одном варианте осуществления R1 представляет собой фенил, необязательно замещенный 1 R6.
В одном варианте осуществления R1 представляет собой C1-C9 гетероарил, необязательно замещенный 1-5 R6.
В одном варианте осуществления, C1-C9 гетероарил представляет собой пиридинил, имидазолил, имидазопиридинил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, триазолил, тиадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил или фуропиридинил, каждый из которых необязательно замещен 1-5 R6.
В одном варианте осуществления R1 представляет собой пиридинил, необязательно замещенный 1-4 R6.
В одном варианте осуществления R1 представляет собой пиридинил, необязательно замещенный 2 R6.
В одном варианте осуществления R1 представляет собой пиридинил, необязательно замещенный 1 R6.
В одном варианте осуществления R1 представляет собой H.
В одном варианте осуществления R1 представляет собой C(O)ORa, в котором Ra независимо представляет собой H, ORC, C(O)O(C1-C6 алкил), C1-C6 алкил, C6 арил или C3-C6 циклоалкил, в которых упомянутый алкил, арил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из C1-C4 алкила, (C0-C3 алкил)ORc, оксо, галоген, NRcRd и C4-C5 гетероциклила.
В одном варианте осуществления R1 представляет собой фенил или C1-C9 гетероарил, необязательно замещенный 1-3 R6. В одном примере R1 представляет собой фенил, пиразолил, бензимидазолил или пиридил, необязательно замещенный 1-3 R6. В одном примере R1 представляет собой фенил, пиразолил или пиридил, необязательно замещенный 1-3 R6, в которых R6 независимо представляет собой C1-C6 алкил, (C0-C6 алкил)ORa, (C0-C6 алкил)NRaRb, галоген, CF3, C(O)ORa, C(O)(C0-C5 алкил)NRaRb, C(O)(C0-C5 алкил)(C1-C5 гетероциклил), C(O)NRa(C0-C5 алкил)(C1-C5 гетероциклил), C(O)NRa(C0-C5 алкил)(C3-C6 циклоалкил), C(O)NRa(C0-C5 алкил)(С1-C5 гетероарил), C(O)NRa(C0-C5 алкил)NRaRb, C(O)NRa(C1-C5 алкил)(C6 арил), в которых упомянутый алкил необязательно замещен 1-5 заместителями, независимо выбранными из ORa, NRcRd, оксо и галогена, и упомянутый арил, гетероциклил, гетероарил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранных из ORa, оксо, галогена, CF3, NRcRd, C1-C4 алкила, (C0-C6 алкил)C1-C5 гетероциклила и C(O)(C1-C4 алкила). В одном примере R1 представляет собой фенил, пиразолил или пиридил, необязательно замещенный 1 R6, в которых R6 независимо представляет собой C(O)ORa, C(O)(C0-C5 алкил)NRaRb, C(O)(C0-C5 алкил)(C1-C5 гетероциклил), C(O)NRa(C0-C5 алкил)(C1-C5 гетероциклил), C(O)NRa(C0-C5 алкил)(C3-C6 циклоалкил), C(O)NRa(C0-C5 алкил)(C1-C5 гетероарил), C(O)NRa(C1-C5 алкил)NRaRb, C(O)NRa(C0-C5 алкил)(C6 арил), в которых упомянутый алкил необязательно замещен 1-5 заместителями, независимо выбранными из ORa, NRcRd, оксо и галогена, и упомянутый арил, гетероциклил, гетероарил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, оксо, галогена, CF3, NRcRd, C1-C4 алкила, (C0-C6 алкил)C1-C5 гетероциклила и C(O)(C1-C4 алкила).
В одном варианте осуществления R1 представляет собой фенил или пиридинил, необязательно замещенный 1-3 R6, в которых R6 независимо представляет собой C1-C3 алкил, (C0-C6 алкил)ORa, (C0-C6 алкил)NRaRb, галоген, CF3, S(O)1-2R3, S(O)1-2NRaRb, NRaS(O)1-2Rb, (C0-C5 алкил)C1-C5 гетероциклил или C(O)ORa, в которых упомянутый алкил необязательно замещен 1-5 заместителями, независимо выбранными из ORa, NRcRd, оксо, S(O)1-2Ra, S(O)1-2NRaRb и галогена, и упомянутый гетероциклил необязательно замещен 1-3 заместителями, независимо выбранными из (C0-C5 алкил)ORa, оксо, галогена, CF3, (C0-C5 алкил)NRcRd, C1-C4 алкила и C(O)Rc. В одном примере R1 выбран из следующих:


в которых волнистая линия представляет собой место присоединения к соединению формулы I.
В одном варианте осуществления R1 представляет собой фенил или пиридинил, необязательно замещенный 1 R6, в которых R6 независимо представляет собой C(O)(C0-C5 алкил)NRaRb, C(O)NRa(C0-C5 алкил)(C1-C5 гетероциклил), C(O)NRa(C0-C5 алкил)(C3-C6 циклоалкил), C(O)NRa(C0-C5 алкил)(C1-C5 гетероарил), C(О)NRa(С1-C5 алкил)NRaRb, C(O)NRa(C0-C5 алкил)(C6 арил), в которых упомянутый арил, гетероциклил, гетероарил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, оксо, галогена, CF3, NRcRd, C1-C4 алкила, (C0-C6 алкил)C1-C5 гетероциклила и C(O)(C1-C4 алкила). В одном примере R1 выбран из следующих:



в которых волнистая линия представляет собой место присоединения к соединению формулы I.
В одном варианте осуществления R1 представляет собой C1-C5 гетероарил, необязательно замещенный 1-3 R6. В одном примере R1 представляет собой пиразолил или тиазолил, необязательно замещенный 1 или 2 R6, в которых R6 представляет собой C1-C6 алкил или (C0-C6 алкил)C1-C5 гетероциклил, в которых упомянутый алкил необязательно замещен 1-5 заместителями, независимо выбранными из ORa, NRcRd, оксо и галогена, и упомянутый гетероциклил необязательно замещен 1-5 заместителями, независимо выбранными из ORa, оксо, галогена, CF3, NRcRd, C1-C4 алкила, (C0-C6 алкил)C1-C5 гетероциклила и C(O)(C1-C4 алкила). В одном примере упомянутый гетероциклил представляет собой пирролидинил, тетрагидрофуранил, тетрагидропиранил, пиперидинил, пиперазинил или морфолинил. В одном примере R1 выбран из следующих:

в которых волнистая линия представляет собой место присоединения к соединению формулы I.
В одном варианте осуществления R1 представляет собой C8-C9 бициклический гетероциклил, необязательно замещенный 1-5 R6. В одном примере R1 представляет собой индолинил или изоиндолинил, необязательно замещенный 1-3 R6. В одном примере R1 представляет собой 3,3-диметилиндолин-2-онил или 3,3-диметилизоиндолин-1-онил.
В одном варианте осуществления R1 представляет собой C1-C5 гетероциклил, необязательно замещенный 1-5 R6. В одном примере R1 представляет собой оксетанил, необязательно замещенный 1-3 R6.
В одном варианте осуществления R6 независимо представляет собой H, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, (C0-C6 алкил)ORa, (C0-C6 алкил)NRaRb, галоген, CN, CF3, S(O)1-2NRaRb, C(O)Ra, NRaC(O)ORb, NRaS(O)1-2NRb, (C0-C6 алкил)C1-C5 гетероарил, (C0-C6 алкил)C1-C5 гетероциклил, (C0-C6 алкил)C3-C6 циклоалкил, (C0-C6 алкил)C6-C9 арил, (C0-C6 алкил)C(O)ORa, C(O)(C0-C5 алкил)NRaRb, C(O)(C0-C5 алкил)(C1-C5 гетероциклил), C(O)NRa(C0-C5 алкил)(C1-C5 гетероциклил), C(O)NRa(C0-C5 алкил)(C3-C6 циклоалкил), C(O)NRa(C0-C5 алкил)(C1-C5 гетероарил), C(O)NRa(C1-C5 алкил)NRaRb или C(O)NRa(C1-C5 алкил)(C6 арил), в которых упомянутый алкил, алкенил и алкинил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, NRcRd, оксо и галоген, и упомянутый арил, гетероциклил, гетероарил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, оксо, галогена, CF3, NRcRd, C1-C4 алкила, (C0-C6 алкил)C1-C5 гетероциклила и C(O)(C1-C4 алкила).
В одном варианте осуществления R6 независимо представляет собой C1-C6 алкил, (C0-C6 алкил)ORa, (C0-C6 алкил)NRaRb, галоген, CN, C1-C5 гетероарил, C4-C5 гетероциклил, C3-C6 циклоалкил, C6 арил, C(O)ORa, C(O)(C0-C5 алкил)NRaRb, C(O)(C0-C5 алкил)(C1-C5 гетероциклил), C(O)NRa(C0-C5 алкил)(C1-C5 гетероциклил), C(O)NRa(C0-C5 алкил)(C3-C6 циклоалкил), C(O)NRa(C0-C5 алкил)(C1-C5 гетероарил), C(0)NRa(С1-C5 алкил)NRaRb, C(O)NRa(C1-C5 алкил)(C6 арил), в которых упомянутый алкил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, NRcRd, оксо и галогена, и упомянутый арил, гетероциклил, гетероарил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, оксо, галогена, CF3, NRcRd, C1-C4 алкила и C(O)(C1-C4 алкила).
В одном варианте осуществления R6 представляет собой C4-C5 гетероциклил, необязательно замещенный 1-5 заместителями, независимо выбранными из OH, оксо, галоген, CF3, NRcRd, C1-C4 алкила и C(O)(C1-C4 алкила).
В одном варианте осуществления гетероциклил представляет собой пирролидинил, тетрагидрофуранил, тетрагидротиофенил, 1,1-диоксотетрагидротиофенил, пиперидинил, пиперизинил, тетрагидропиранил, тианил, морфолинил, пиридизинил или гексагидропиримидинил.
В одном варианте осуществления гетероциклил представляет собой пиперидинил, пиперизинил или морфолинил.
В одном варианте осуществления R6 представляет собой (C0-C6 алкил)ORa или (C0-C6 алкил)NRaRb.
В одном варианте осуществления R6 представляет собой (C0-C3 алкил)ORa или (C0-C3 алкил)NRaRb.
В одном варианте осуществления R6 представляет собой галоген.
В одном варианте осуществления R6 представляет собой F или Cl.
В одном варианте осуществления R6 представляет собой S(O)1-2NRaRb.
В одном примере R6 представляет собой S(O)2NH2.
В одном варианте осуществления R6 представляет собой NRaC(O)Rb. В одном примере R6 представляет собой NHCOCH3.
В одном варианте осуществления R6 представляет собой C(O)NRa(C0-C5 алкил)(C1-C5 гетероциклил), C(O)NRa(C0-C5 алкил)(C3-C6 циклоалкил), C(O)NRa(C0-C5 алкил)(C1-C5 гетероарил), C(O)NRa(С1-C5 алкил)NRaRb, C(O)NRa(C1-C5 алкил)(C6 арил), в которых упомянутый алкил необязательно замещен 1-5 заместителями, независимо выбранными из ORa, NRcRd, оксо и галогена, и упомянутый арил, гетероциклил, гетероарил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, оксо, галогена, CF3, NRcRd, C1-C4 алкила и C(O)(C-C4 алкила).
В одном варианте осуществления R6 представляет собой C(O)ORa, C(O)(C0-C5 алкил)NRaRb или C(O)(C0-C5 алкил)(C1-C5 гетероциклил), в которых упомянутый алкил необязательно замещен 1-5 заместителями, независимо выбранными из ORa, NRcRd, оксо и галогена, и упомянутый арил, гетероциклил, гетероарил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, оксо, галогена, CF3, NRcRd, C1-C4 алкила и C(O)(C1-C4 алкила).
В одном варианте осуществления R6 независимо представляет собой C1-C6 алкил, (C0-C6 алкил)NRaRb, (C0-C6 алкил)C1-C5 гетероциклил, (C0-C6 алкил)C3-C6 циклоалкил или C(O)(C0-C5 алкил)(C1-C5 гетероциклил), в которых упомянутый алкил необязательно замещен 1-5 заместителями, независимо выбранными из ORa, NRcRd, оксо и галогена, и упомянутый гетероциклил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, оксо, галогена, CF3, NRcRd, C1-C4 алкила, (C0-C6 алкил)C1-C5 гетероциклила и C(O)(C1-C4 алкила). В одном примере R6 выбран из следующих:

в которых волнистая линия представляет собой место присоединения к соединению формулы I.
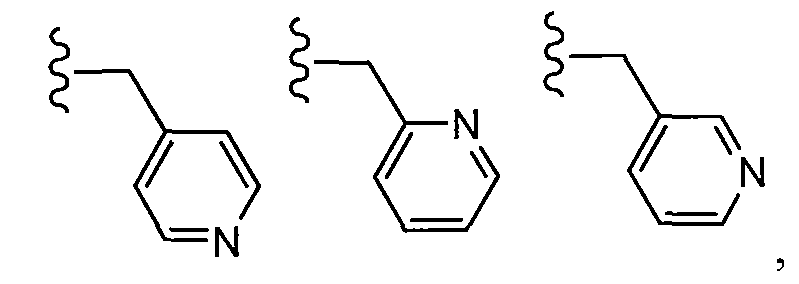
В одном варианте осуществления R6 представляет собой (C0-C6 алкил)C1-C5 гетероарил, необязательно замещенный 1-5 заместителями, независимо выбранными из ORa, галогена, CF3, NRcRd и C1-C4 алкила. В одном примере R7 представляет собой пиридинил, необязательно замещенный 1-5 заместителями, независимо выбранными из ORa, галогена, CF3, NRcRd и C1-C4 алкила.
В одном варианте осуществления R6 выбран из следующих:
в которых волнистая линия представляет собой место присоединения к соединению формулы I.
В одном варианте осуществления R3, R4 и R5 независимо представляют собой Н, CH3, CF3, или F.
В одном варианте осуществления R3, R4 и R5 независимо представляют собой H или F.
В одном варианте осуществления R3, R4 и R5 представляют собой H.
В одном варианте осуществления R3 представляет собой OCH3.
В одном варианте осуществления R2 представляет собой фенил, C1-C9 гетероарил или C3-C5 гетероциклил, в которых фенил, гетероарил и гетероциклил необязательно замещены 1-5 R7.
В одном варианте осуществления R2 представляет собой фенил, необязательно замещенный 1-5 R7.
В одном варианте осуществления R2 представляет собой фенил, необязательно замещенный 1-3 R7.
В одном варианте осуществления R2 представляет собой фенил, необязательно замещенный 2 R7.
В одном варианте осуществления R2 представляет собой фенил или пиридинил, необязательно замещенный 2 R7, где R7 независимо представляет собой C1-C6 алкил, OCF3, OCH3, NH2, NO2, CH2NH2, F, Cl, C(O)NRaRb, NRaC(O)Rb, SO2(C1-C3 алкил), SO2NRaRb, CN, CF3, OCF3, C(O)Ra, C(O)ORa, (C0-C6 алкил)С1-C5 гетероциклил, C(O)(C0-C6 алкил)C1-C5 гетероциклил или C(O)NRa(C0-C6 алкил)C1-C5 гетероциклил, где упомянутый гетероциклил необязательно замещен C1-C4 алкилом. В одном примере R2 выбран из:
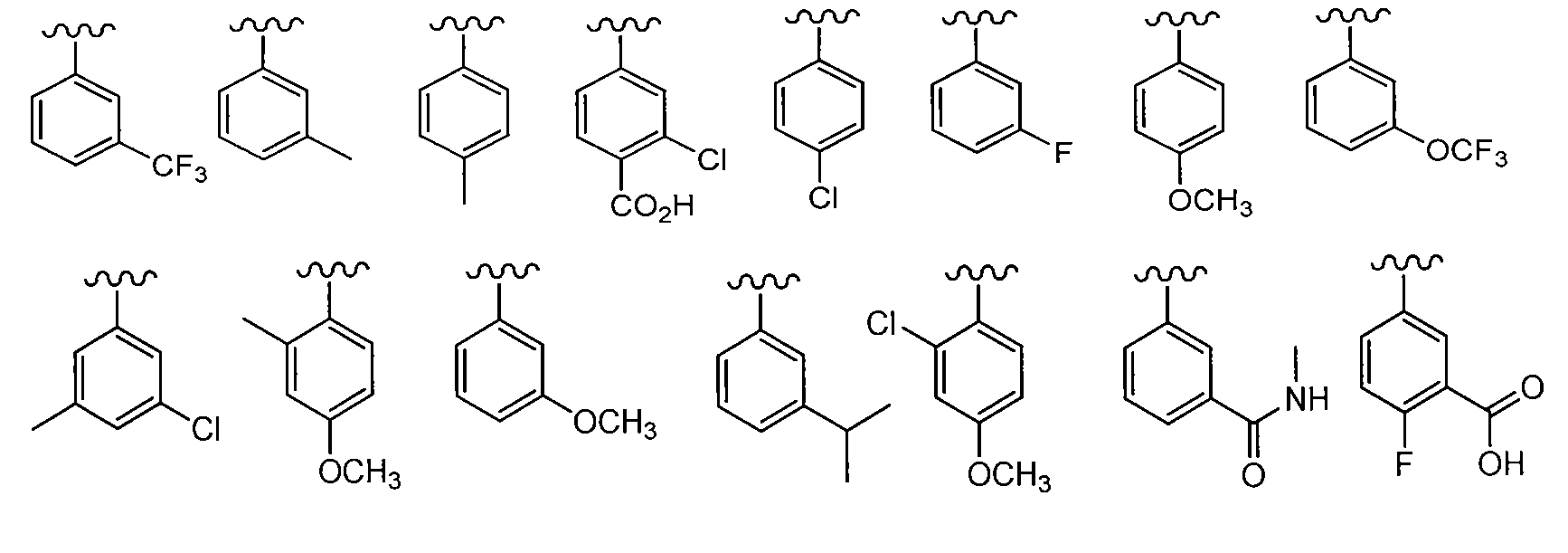


в которых волнистая линия представляет собой место присоединения к соединению формулы I.
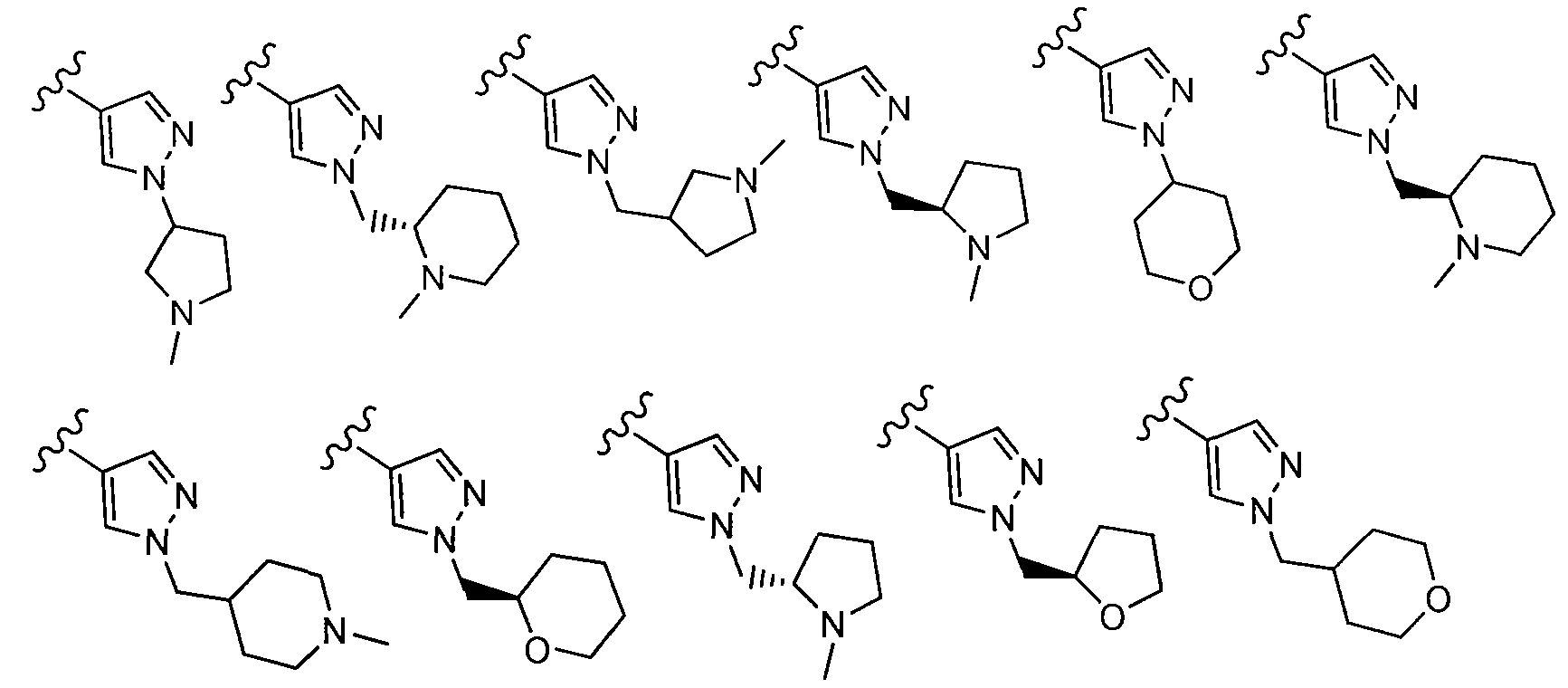
В одном варианте осуществления R2 представляет собой пиразолил, необязательно замещенный 1 или 2 R7, в которых R7 независимо представляет собой C1-C6 алкил, (C0-C6 алкил)ORa, (C0-C6 алкил)NRaRb, (C0-C6 алкил)(C6-C9 арил), галоген, (C0-C6 алкил)C1-C5 гетероарил, (C0-C6 алкил)C1-C5 гетероциклил или (C0-C6 алкил)C3-C6 циклоалкил, в которых упомянутый алкил необязательно замещен 1-5 заместителями, независимо выбранными из оксо, NRaRb, ORa и галогена, и упомянутый арил, гетероарил, гетероциклил и циклоалкил необязательно замещены 1-5 заместителями, независимо выбранными из ORa, галогена, CF3, NRcRd и C1-C4 алкила. В одном примере, R2 выбран из:

 ,
,
в которых волнистая линия представляет собой место присоединения к соединению формулы I.
В одном варианте осуществления R2 представляет собой фенил, необязательно замещенный 1 R7.
В одном варианте осуществления R7 независимо представляет собой C1-C6 алкил, (C0-C6 алкил)ORa, (C0-C6 алкил)NRaRb, (C0-C6 алкил)(C6-C9 арил), галоген, C(O)NRaRb, NRaC(O)Rb, SO2(C1-C6 алкил), SO2NRaRb, CN, нитро, в которых упомянутый алкил необязательно замещен 1-5 заместителями, независимо выбранными из оксо и галогена, и упомянутый арил необязательно замещен 1-5 заместителями, независимо выбранными из ORa, галогена, CF3, NRcRd и C1-C4 алкила.
В одном варианте осуществления R7 независимо представляет собой C1-C4 алкил, (C0-C6 алкил)ORa, (C0-C6 алкил)NRaRb, галоген, NRaC(O)Rb, SO2(C1-C6 алкил), SO2NRaRb, CN или нитро.
В одном варианте осуществления R7 независимо представляет собой C3-C6 циклоалкил.
В одном варианте осуществления R7 независимо представляет собой NH2, OCH3, CH3, CH2CH3, CH(CH3)2, NO2, OCF3, S(O)2N(CH3)2, S(O)2NH(CH(CH3)2), S(O)2NH(C(CH3)3), CN, CF3, F, Cl, NHC(O)CH3 или S(O)2CH3.
В одном варианте осуществления R7 независимо представляет собой NH2, OCH3, CH3, CH2CH3, CH(CH3)2, NO2, OCF3, S(O)2N(CH3)2, S(O)2NH(CH(CH3)2), S(O)2NH(C(CH3)3), CN, CF3, F, Cl, NHC(O)CH3, S(O)2CH3, CO2H, S(O)CH3, циклопентил, 1-гидроксиэтил, 1-аминоэтил или CH2CF3.
В одном варианте осуществления R2 представляет собой C1-C9 гетероарил, необязательно замещенный 1-5 R7.
В одном варианте осуществления C1-C9 гетероарил представляет собой пиридинил, имидазолил, имидазопиридинил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, триазолил, тиадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил или фуропиридинил, каждый из которых необязательно замещен 1-5 R7.
В одном варианте осуществления R2 представляет собой пиридинил или пиразолил, необязательно замещенный 1-5 R7.
В одном варианте осуществления R2 представляет собой пиридинил или пиразолил, необязательно замещенный 1-3 R7.
В одном варианте осуществления R2 представляет собой пиридинил или пиразолил, необязательно замещенный 1 R7.
В одном варианте осуществления R7 независимо представляет собой CH3, CH2(фенил), CH2CH(CH3)2 или CF3.
В одном варианте осуществления R2 представляет собой C3-C5 гетероциклил, необязательно замещенный 1-5 R7.
В одном варианте осуществления R2 представляет собой пиперидинил, морфолинил или пиперизинил, необязательно замещенный 1-5 R7.
В одном варианте осуществления R2 представляет собой пиперидинил, морфолинил или пиперизинил, необязательно замещенный 1-3 R7.
В одном варианте осуществления R2 представляет собой пиперидинил, морфолинил или пиперизинил, необязательно замещенный 2 R7.
В одном варианте осуществления R2 представляет собой пиперидинил, морфолинил или пиперизинил, необязательно замещенный 1 R7.
В одном варианте осуществления R7 независимо представляет собой CH3, CH2CH3, OH или OCH3.
В одном варианте осуществления R1 представляет собой фенил, необязательно замещенный 1-5 R6; и R2 представляет собой фенил, необязательно замещенный 1-5 R7.
В одном варианте осуществления R1 представляет собой фенил, необязательно замещенный 1-5 R6; и R2 представляет собой гетероциклил, необязательно замещенный 1-5 R7.
В одном варианте осуществления гетероциклил представляет собой пиперидинил, морфолинил или пиперизинил.
В одном варианте осуществления R1 представляет собой пиридил, необязательно замещенный 1-4 R6; и R2 представляет собой фенил, необязательно замещенный 1-5 R7.
В одном варианте осуществления R1 представляет собой пиридил, необязательно замещенный 1-4 R6; и R2 представляет собой гетероциклил, необязательно замещенный 1-5 R7.
В одном варианте осуществления гетероциклил представляет собой пиперидинил, морфолинил или пиперизинил.
В одном варианте осуществления R1 представляет собой фенил, необязательно замещенный 1-5 R6; и R2 представляет собой пиридил, необязательно замещенный 1-4 R7.
В одном варианте осуществления R1 представляет собой пиридил, необязательно замещенный 1-4 R6; и R2 представляет собой пиридил, необязательно замещенный 1-4 R7.
В одном варианте осуществления, R1 представляет собой фенил или пиридинил, необязательно замещенный 1-3 R6, где R6 независимо представляет собой C1-C3 алкил, галогена, CF3 или C(O)ORa; и R2 представляет собой фенил или пиридинил, необязательно замещенный 2 R7, в которых R7 независимо представляет собой C1-C6 алкил, OCF3, OCH3, NH2, CH2NH2, F, Cl, C(O)NRaRb, NRaC(O)Rb, SO2(C1-C3 алкил), SO2NRaRb, CN, CF3, OCF3, C(O)Ra, C(O)ORa.
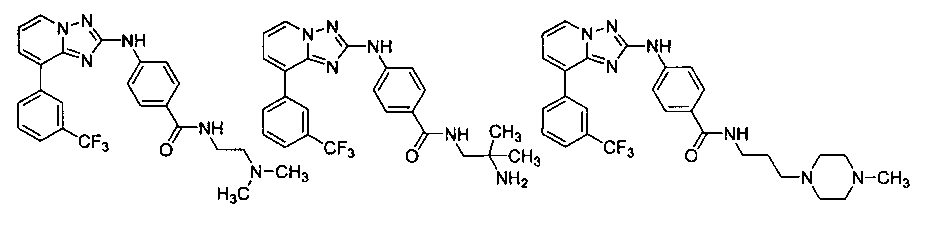
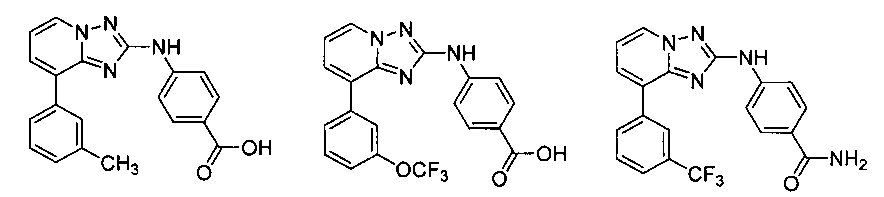
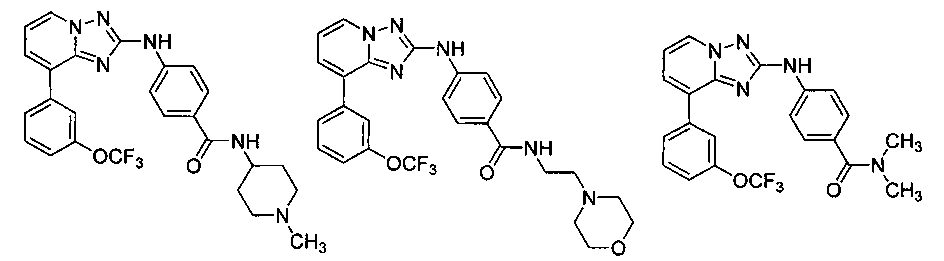
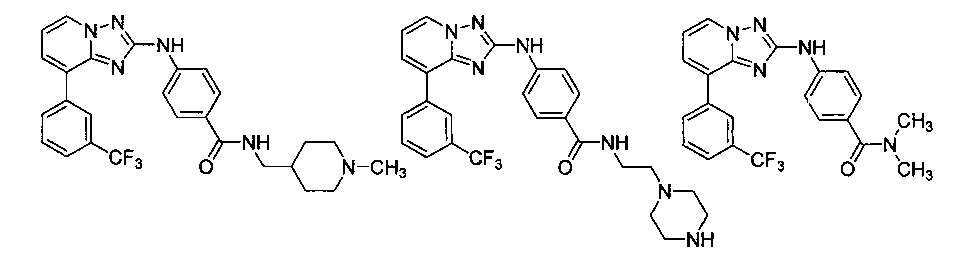
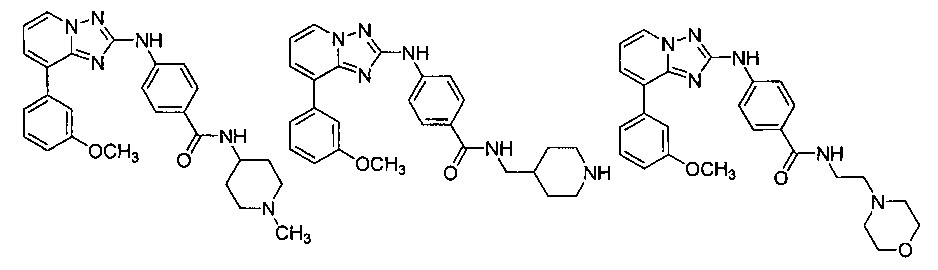
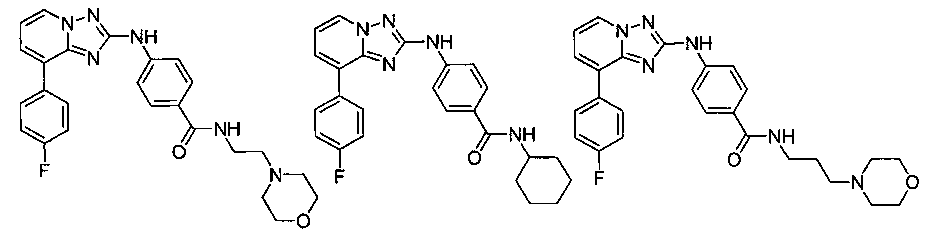
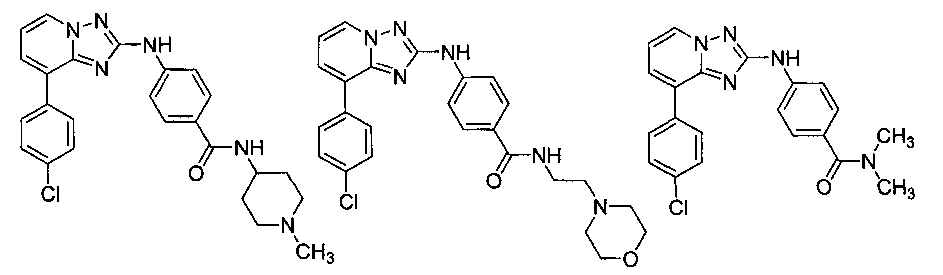
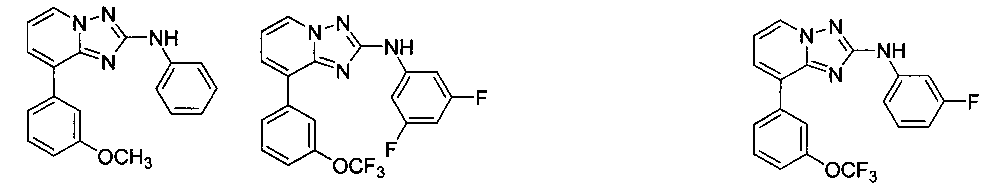
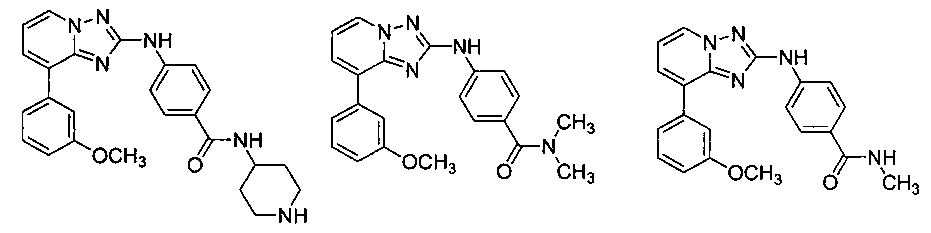
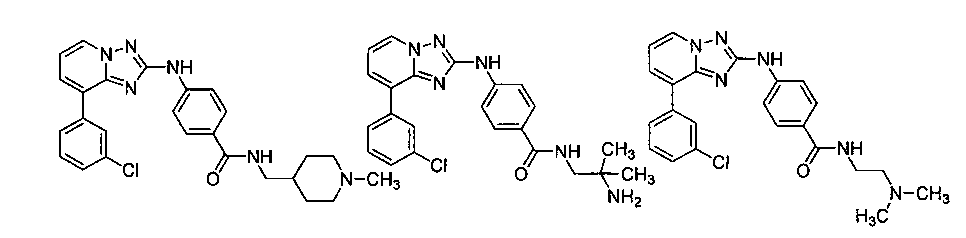
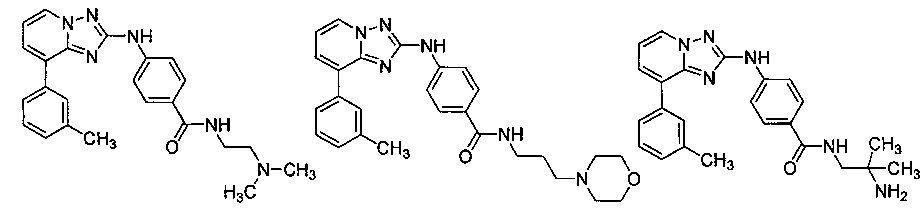
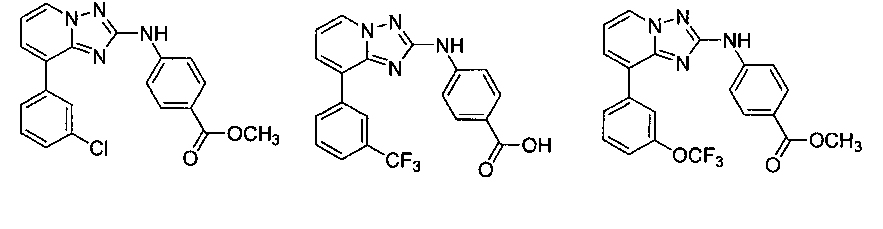
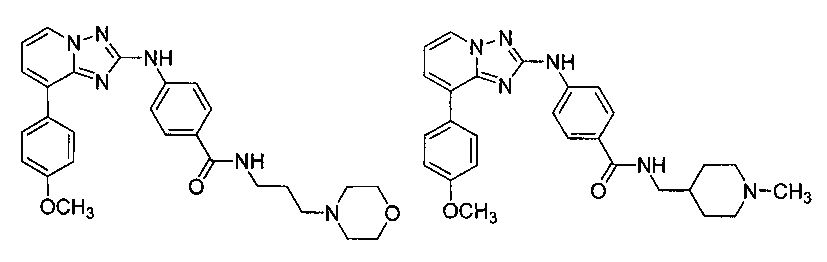
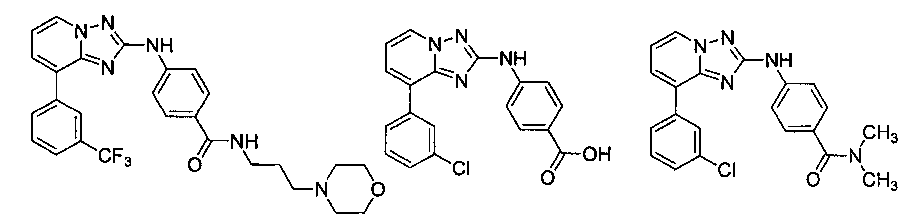
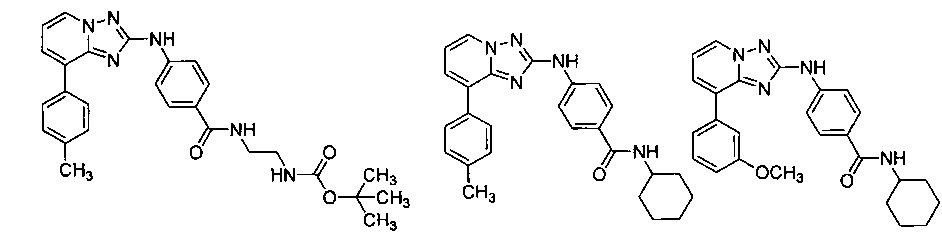
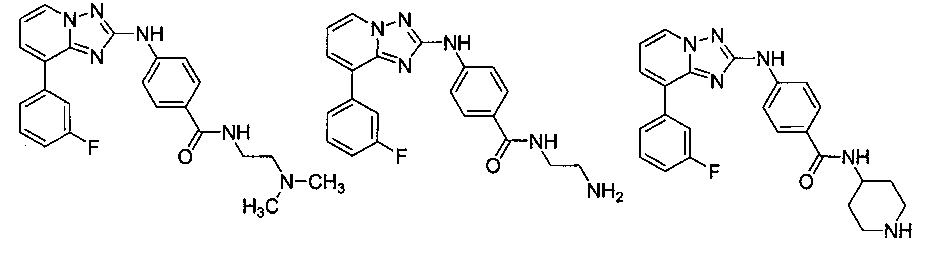
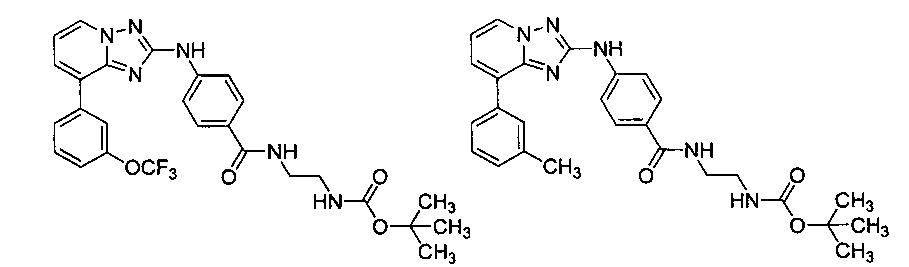
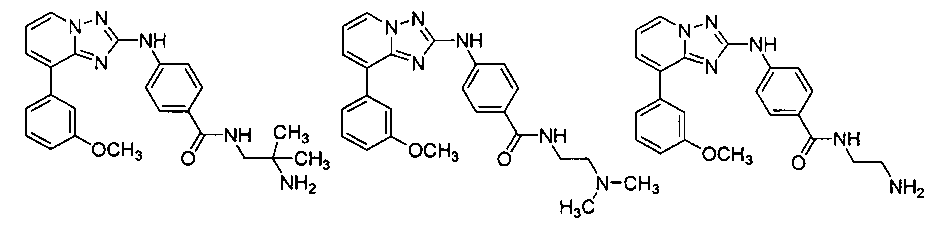
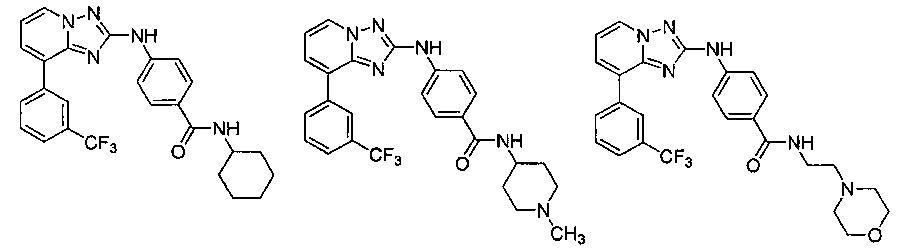
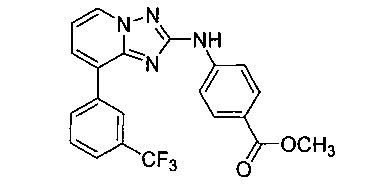
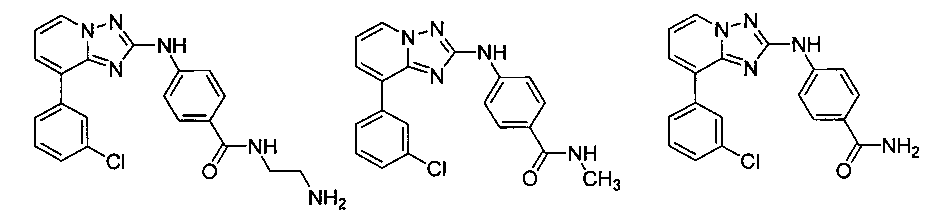
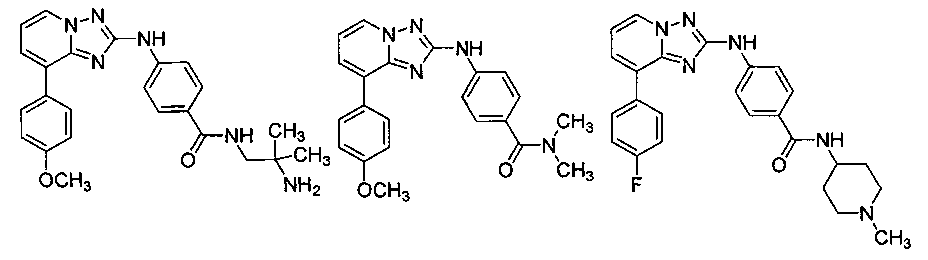
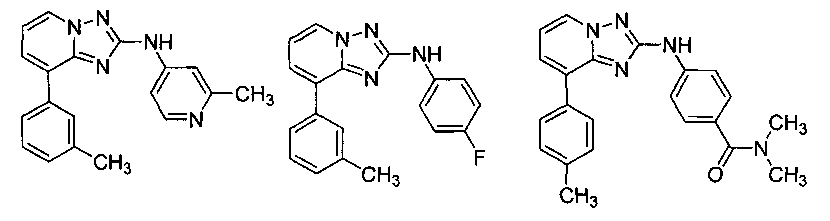
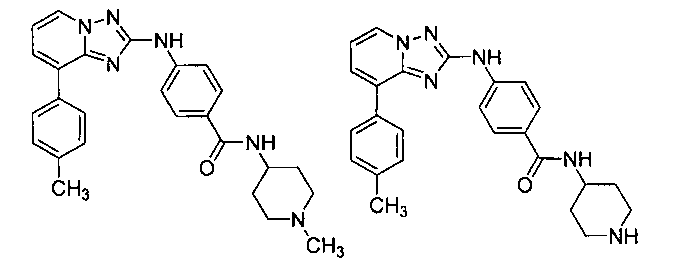
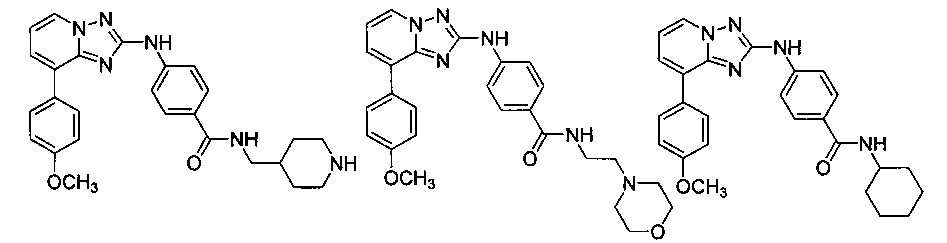
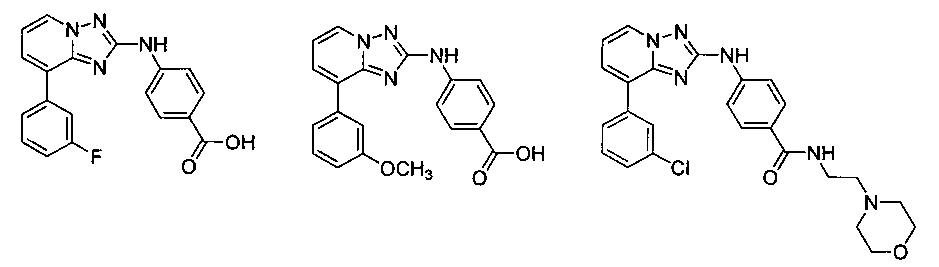
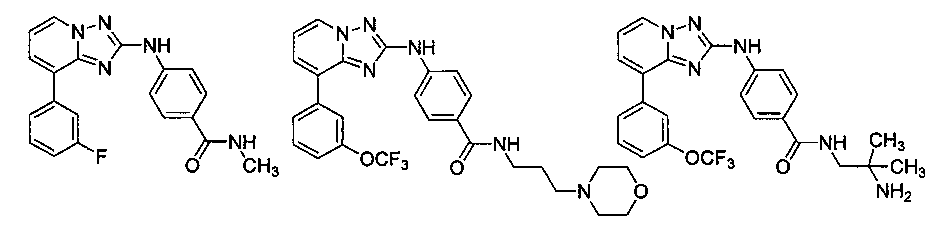
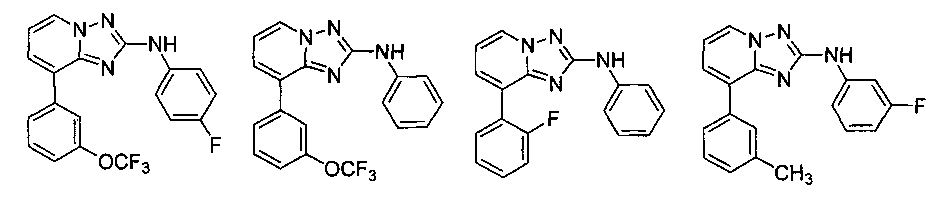
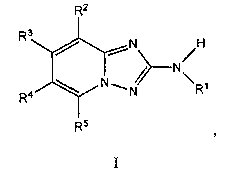
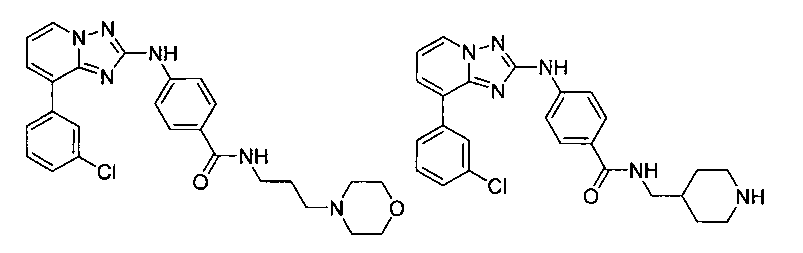
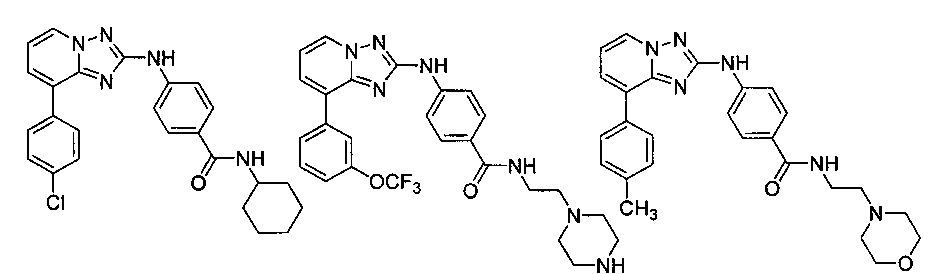
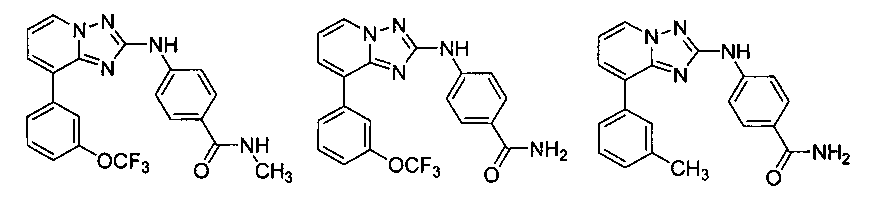
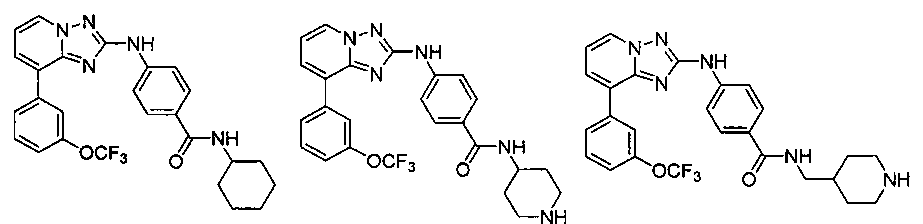
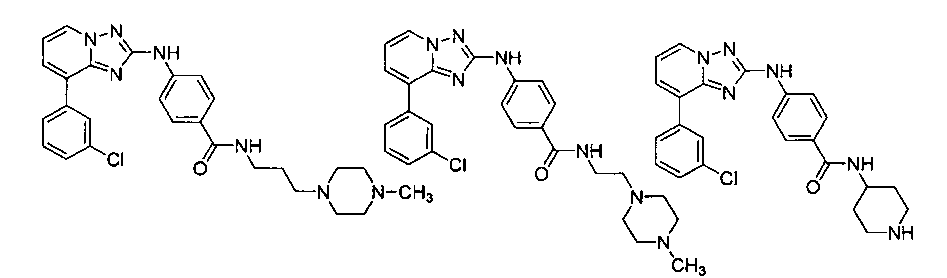
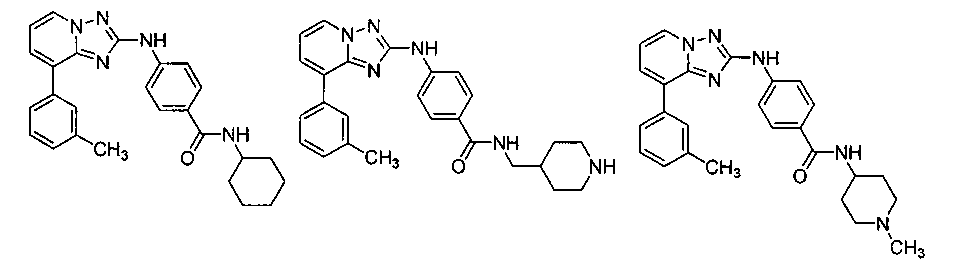
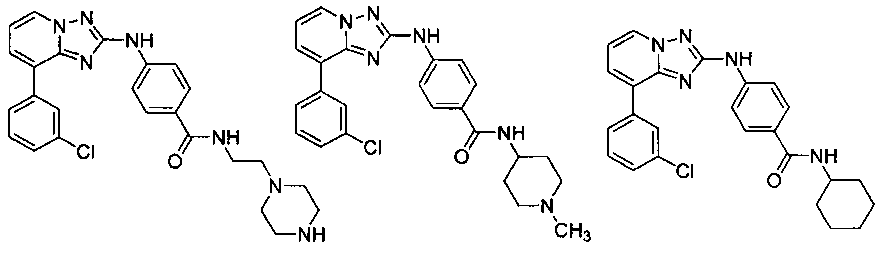
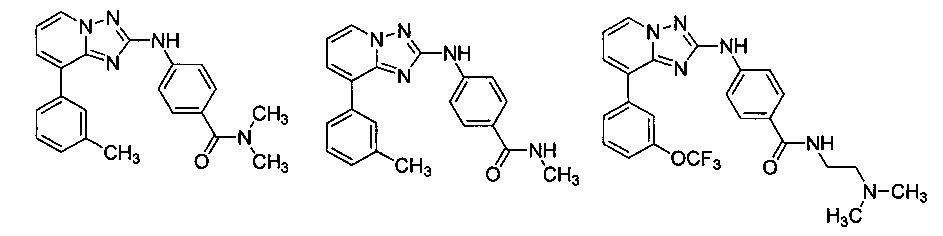
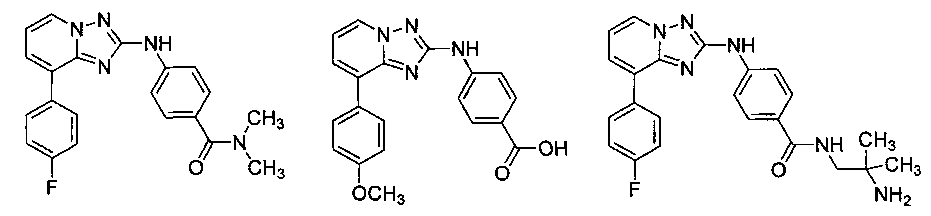
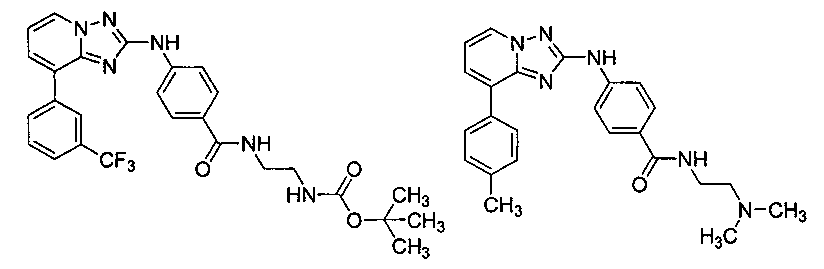
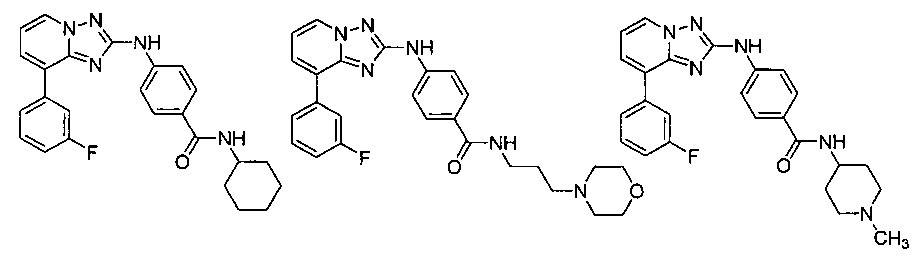
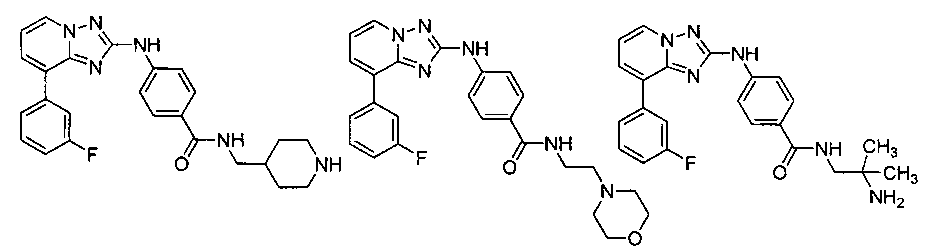
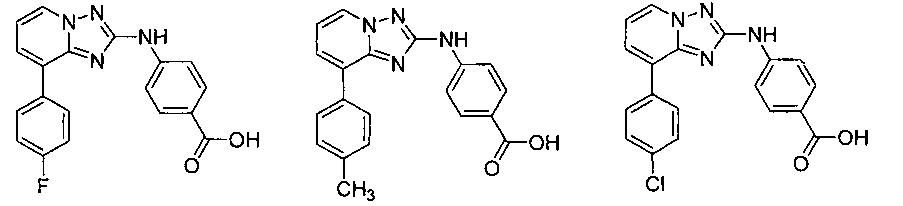
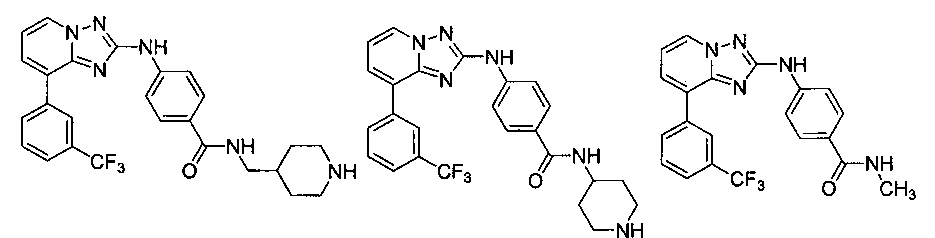
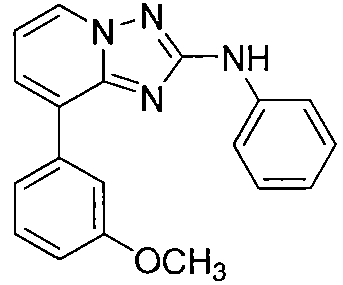
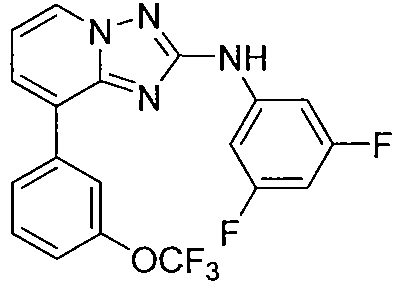
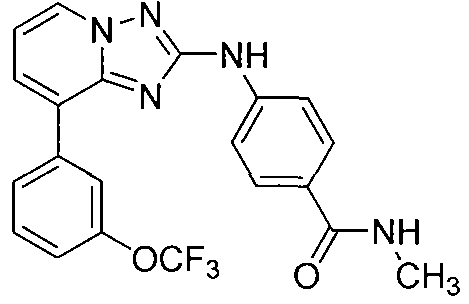
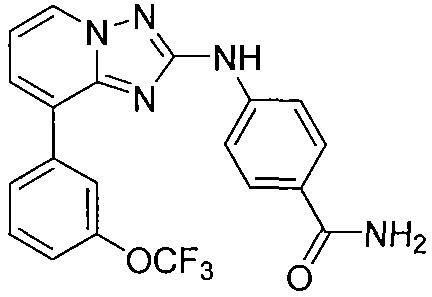
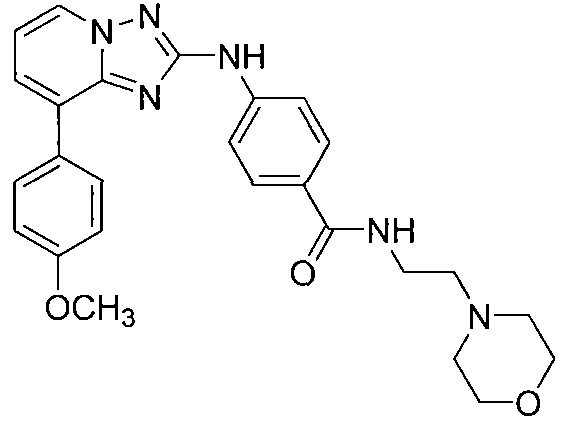
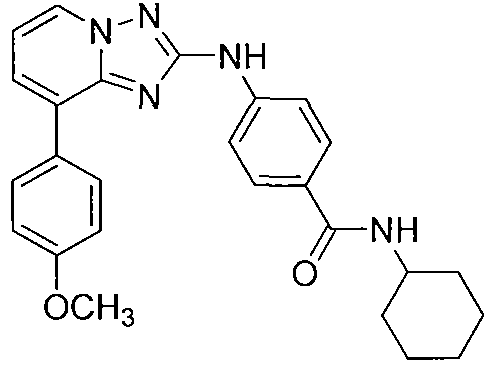
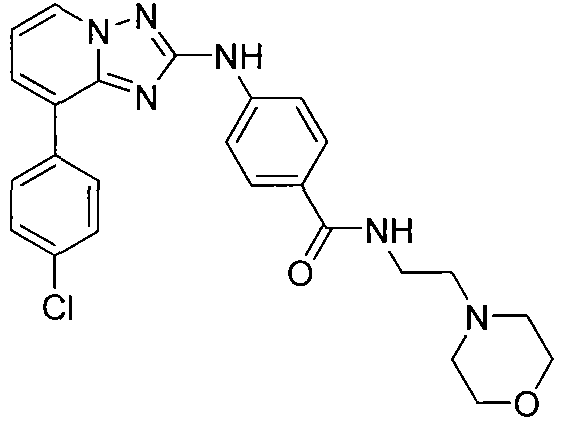
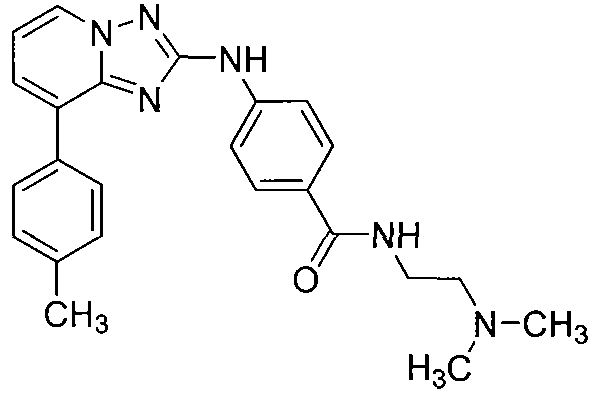
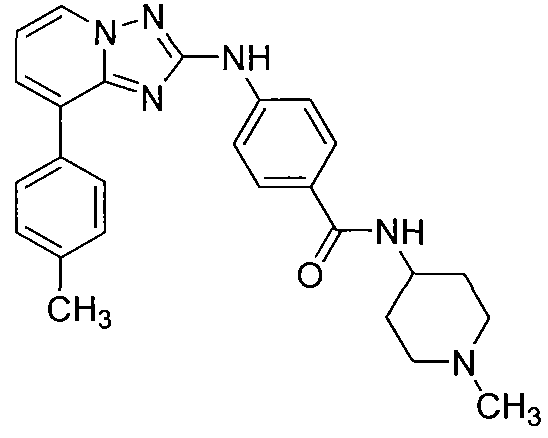
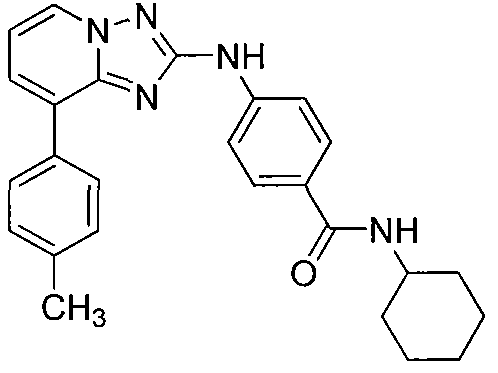
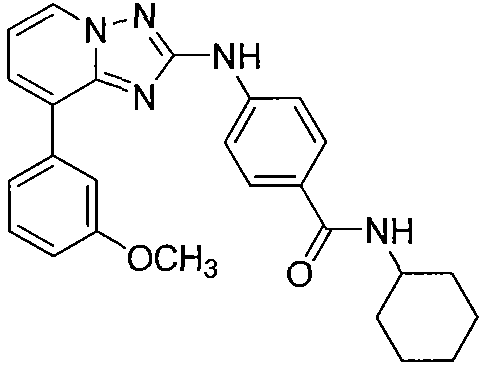
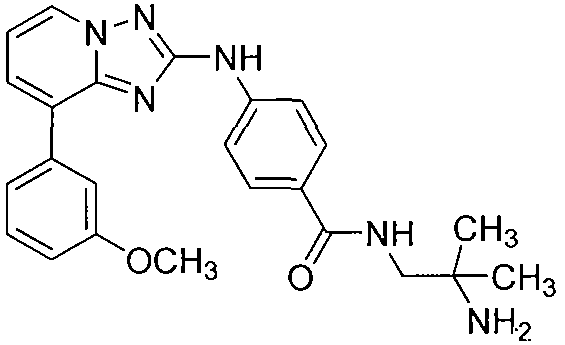
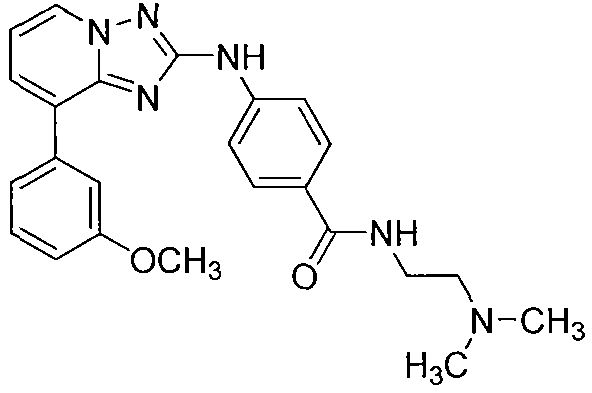
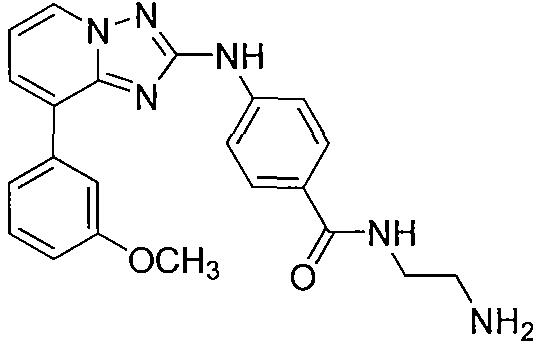
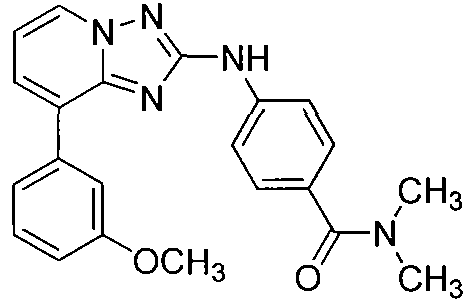
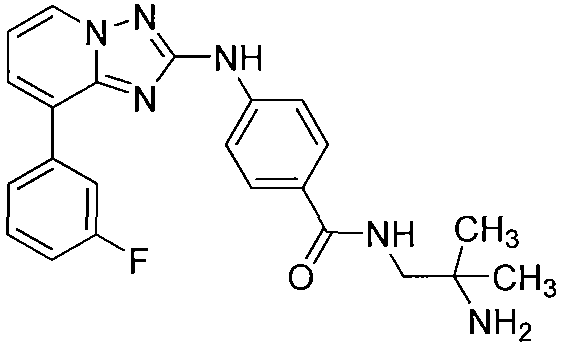
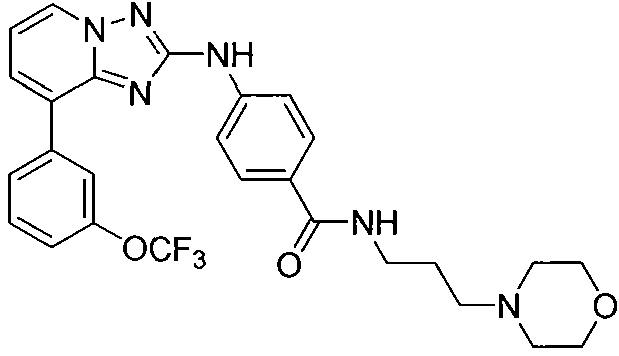
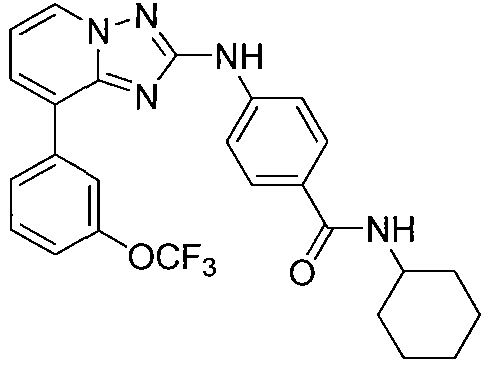
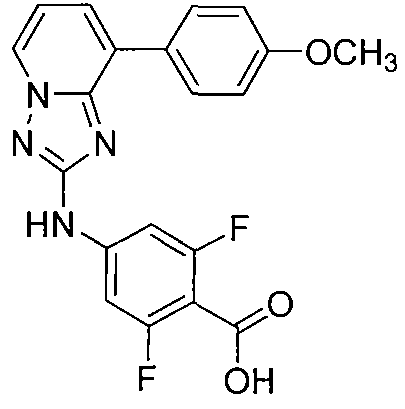
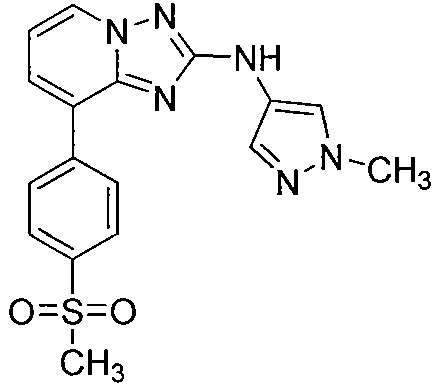
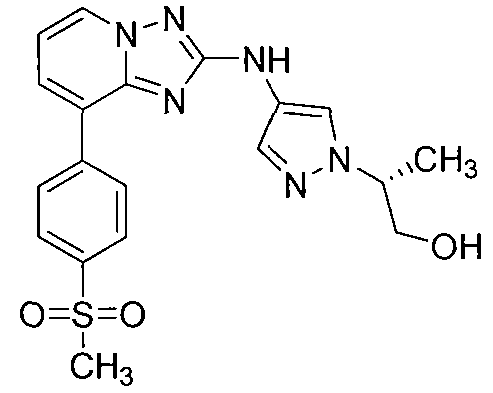
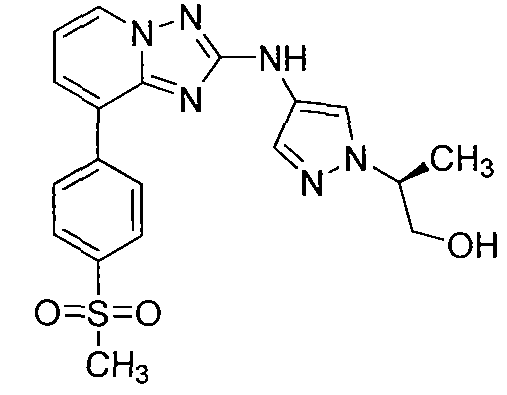
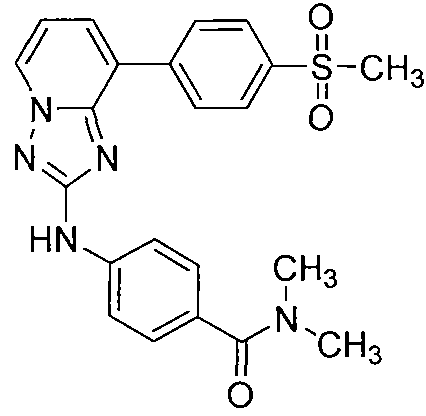
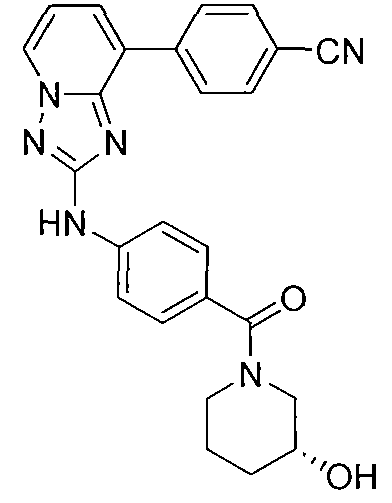
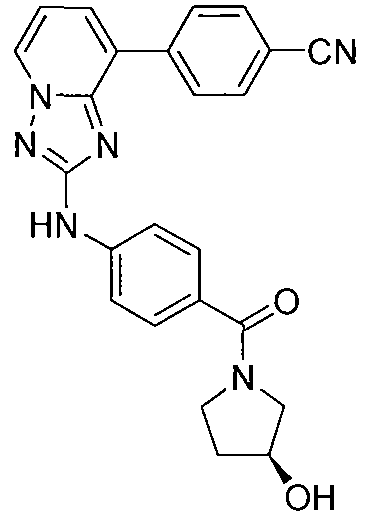
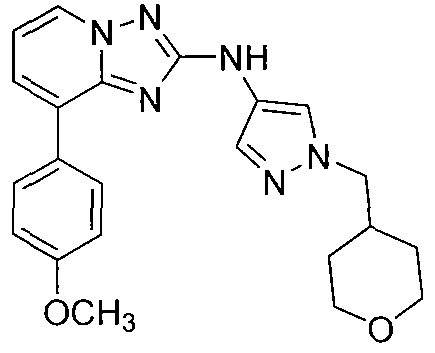
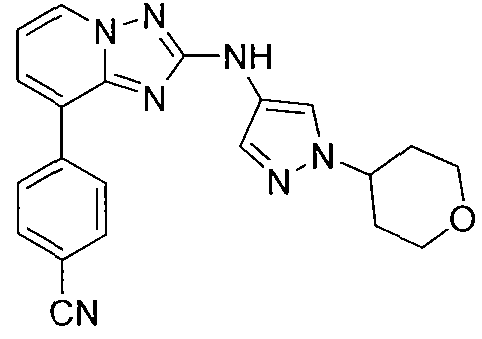
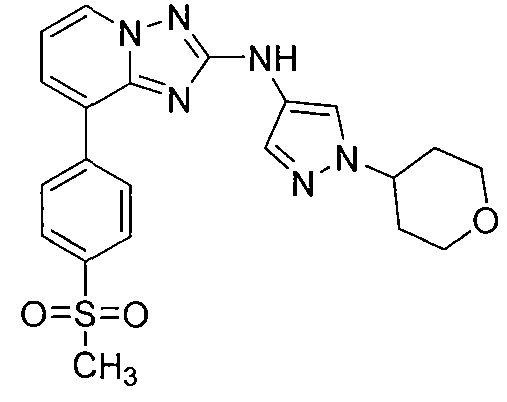
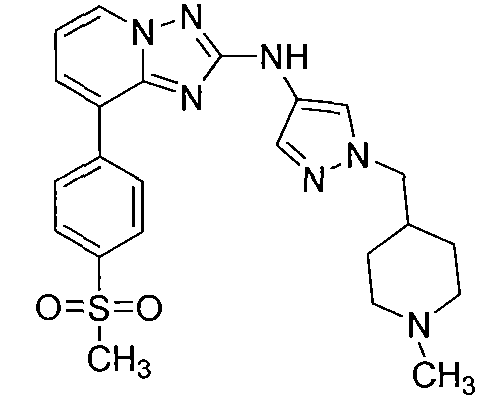
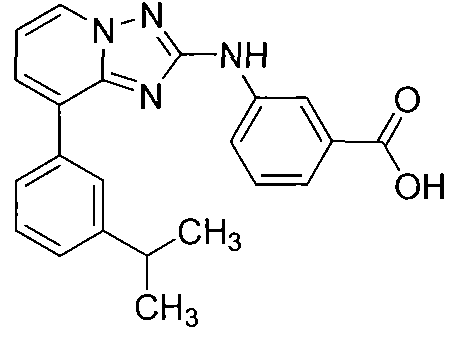
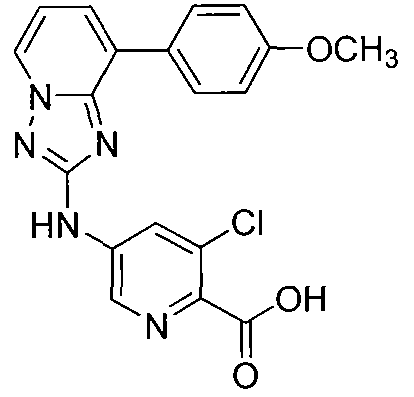
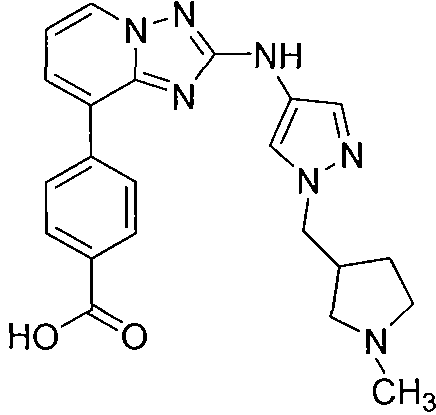
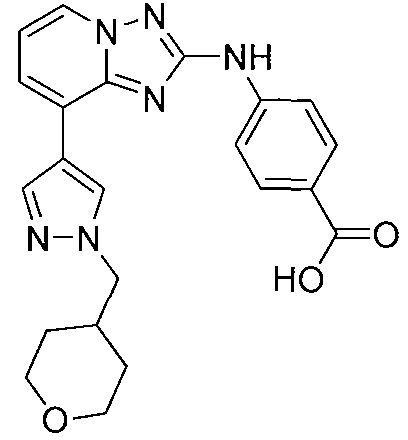
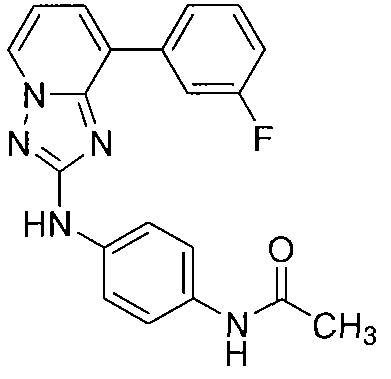
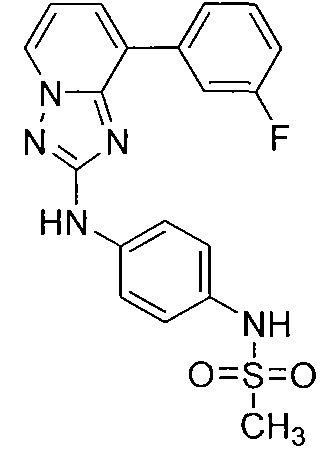
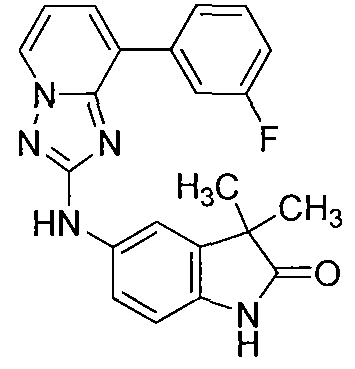
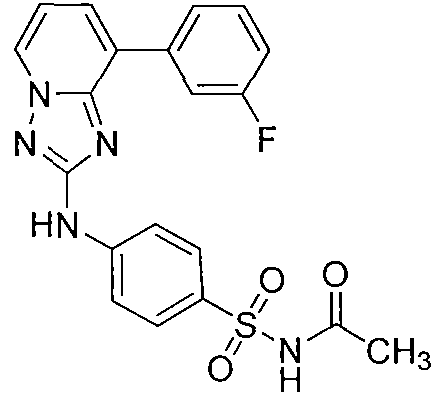
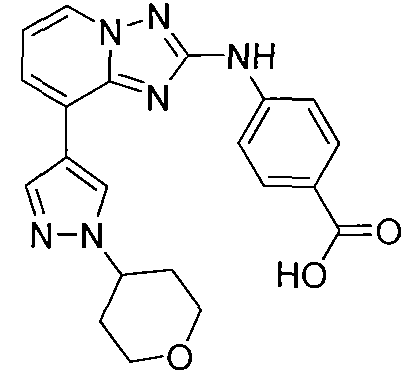
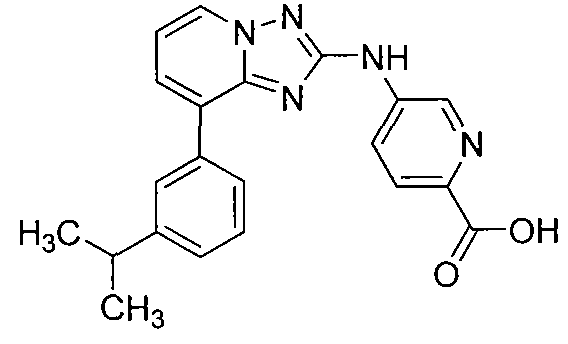
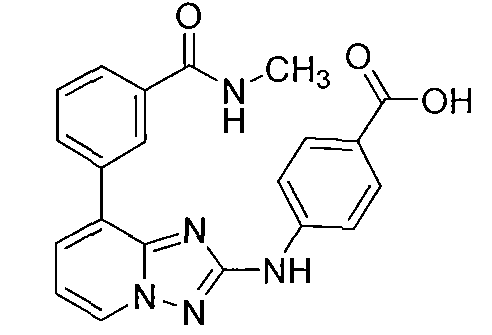
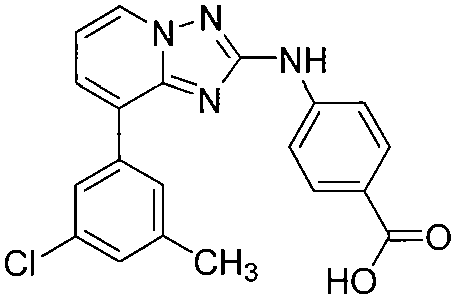
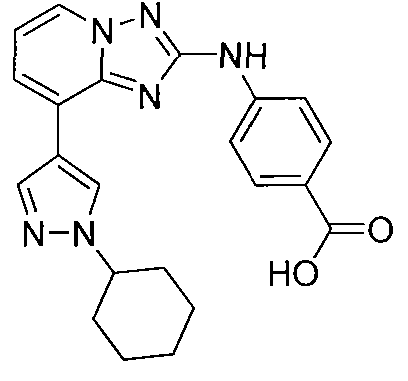
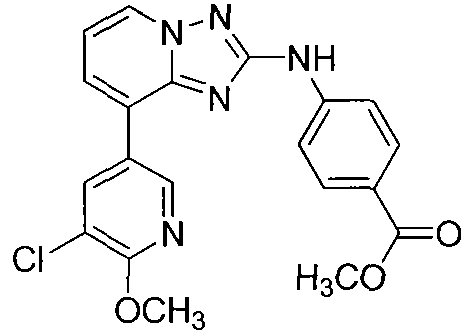
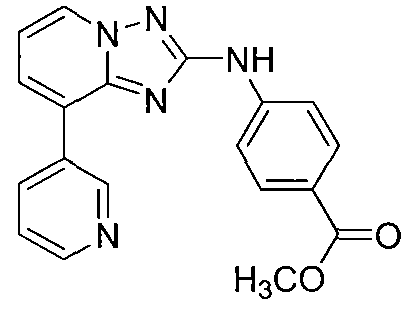
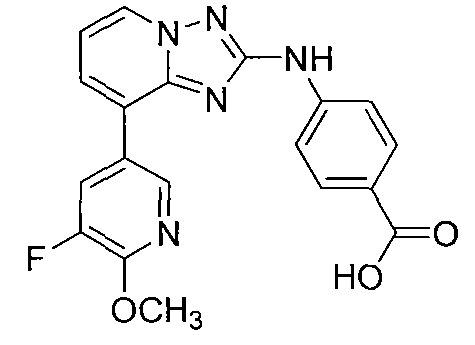
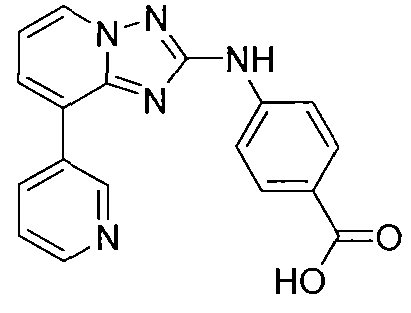
Другой вариант осуществления включает соединение, выбранное из:

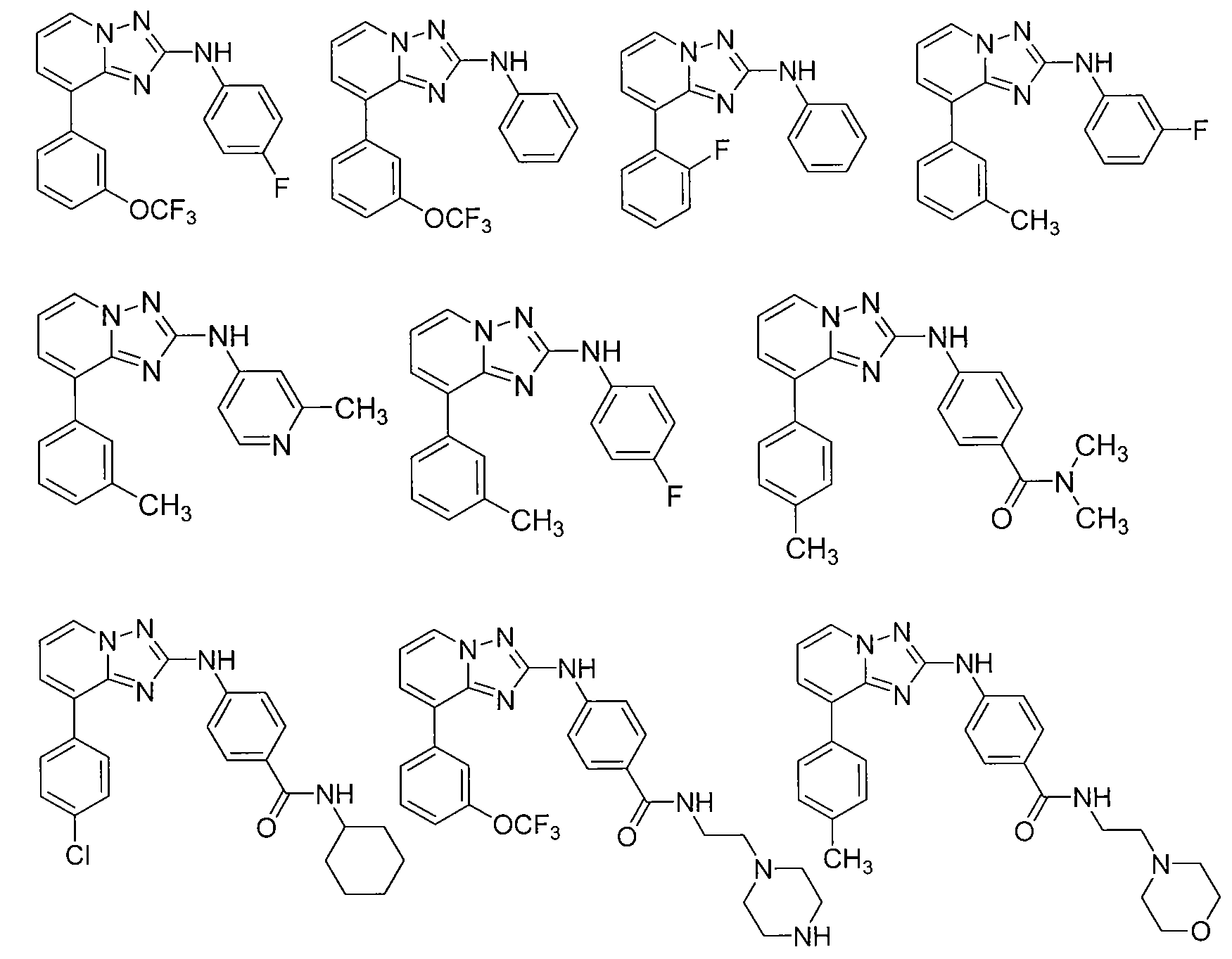

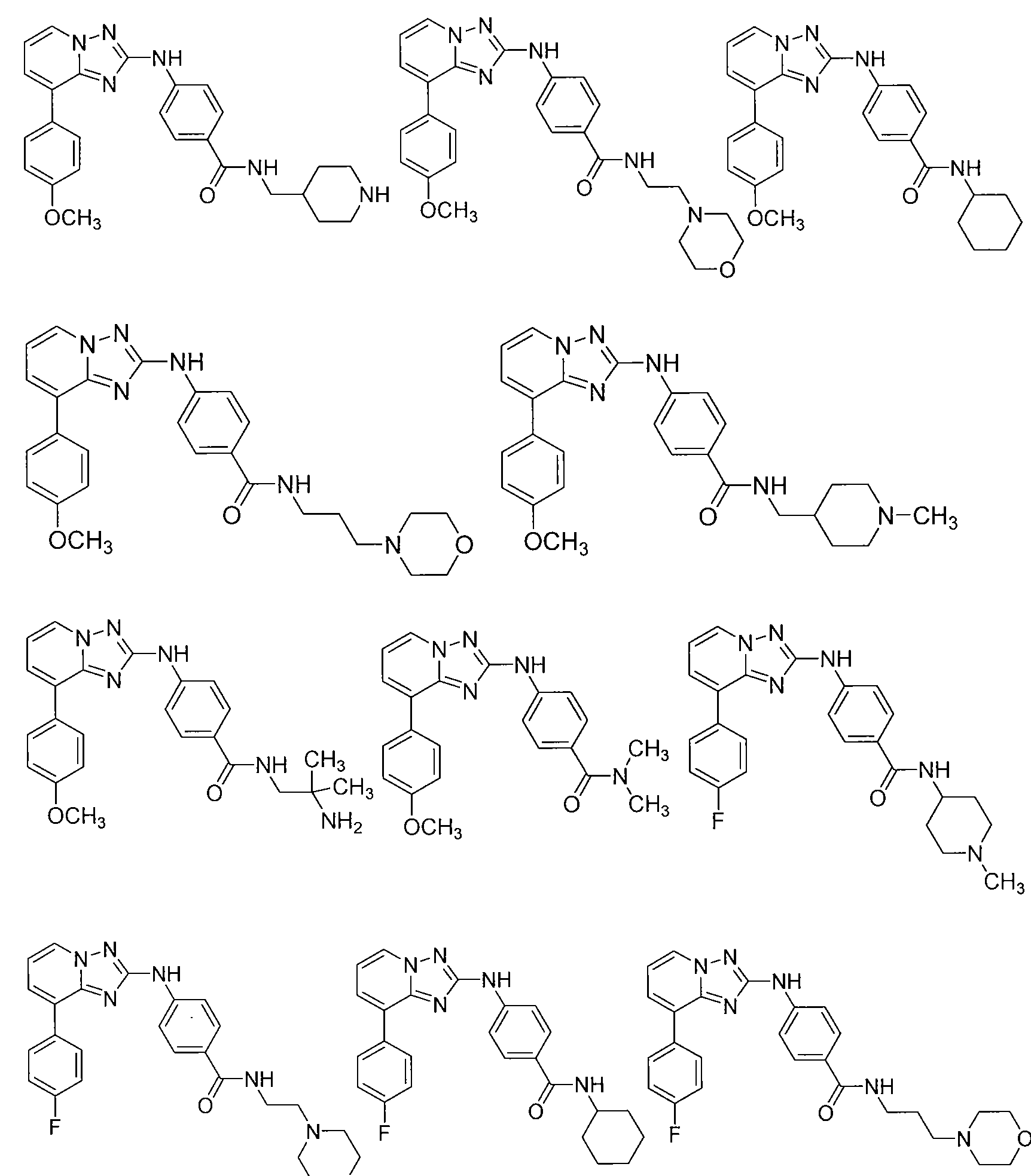




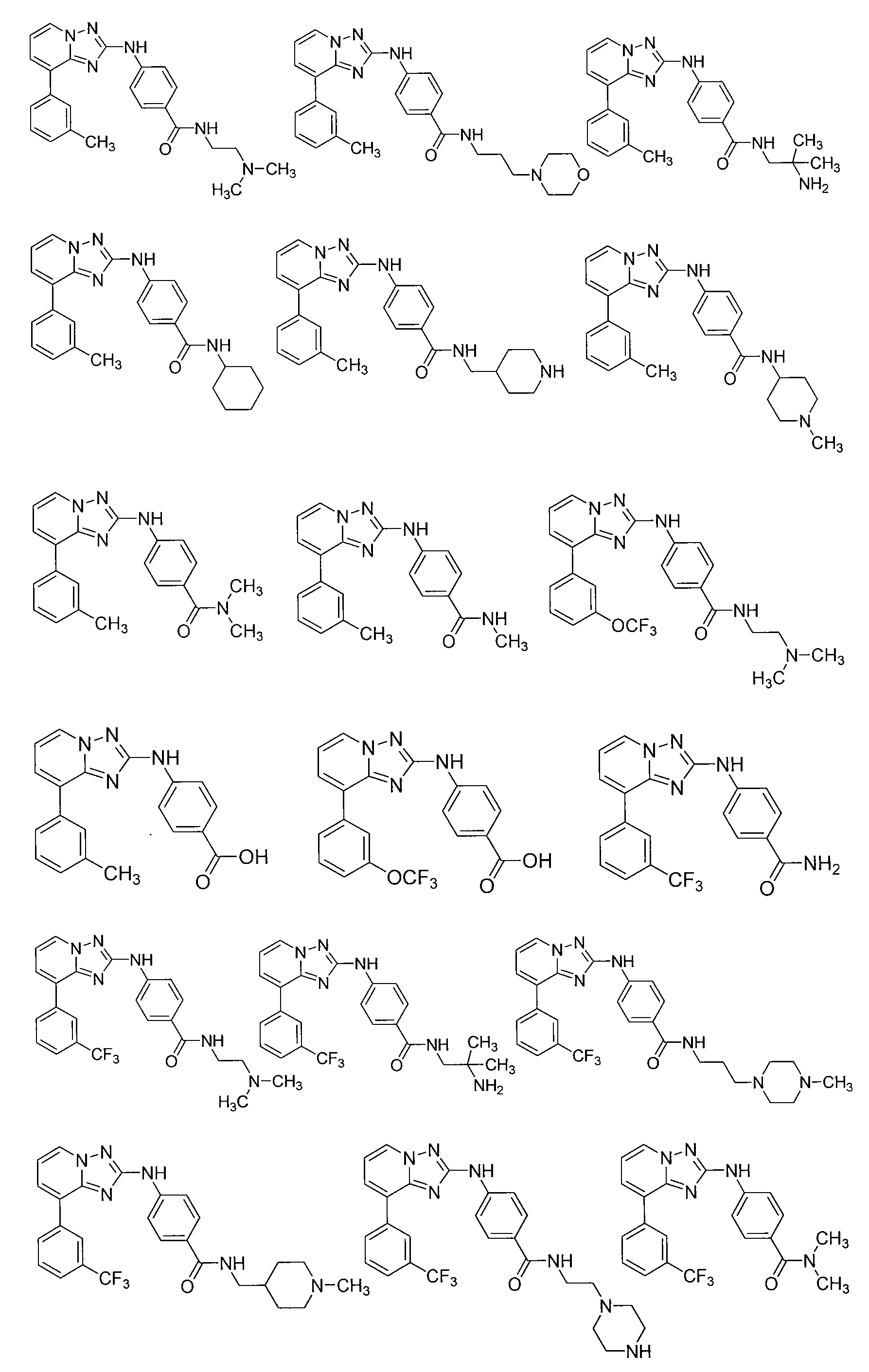


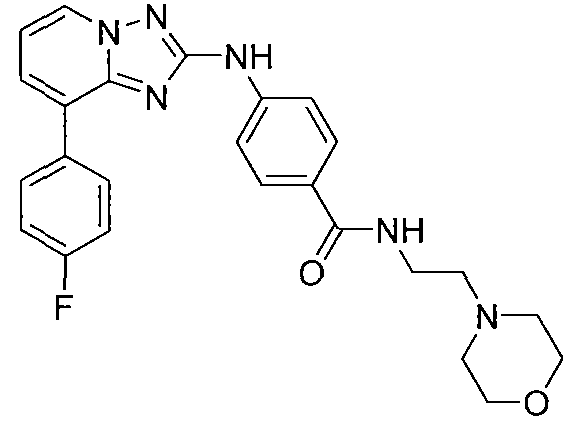
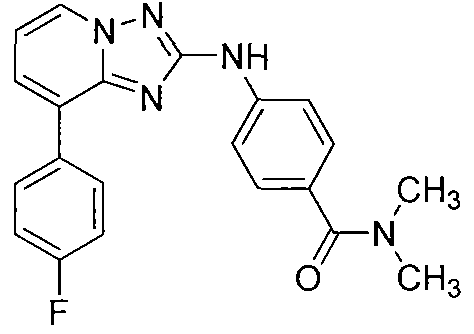
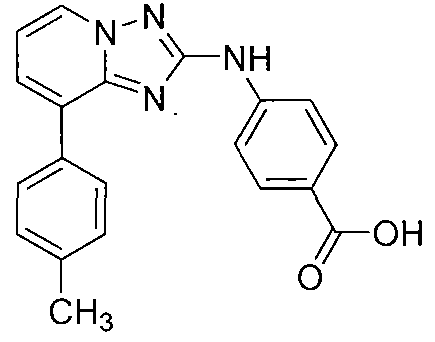
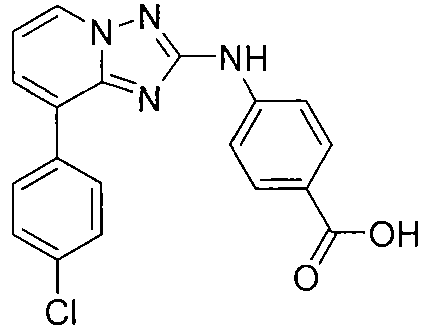
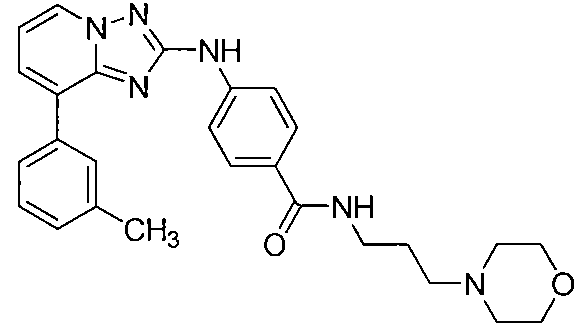
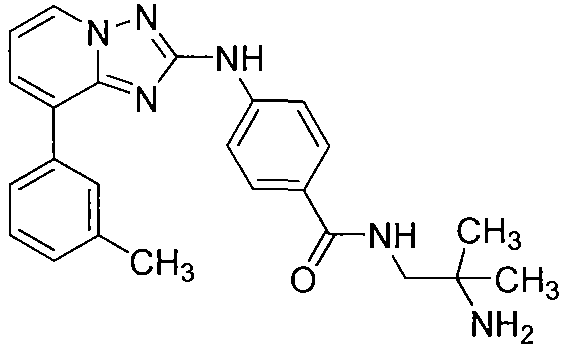
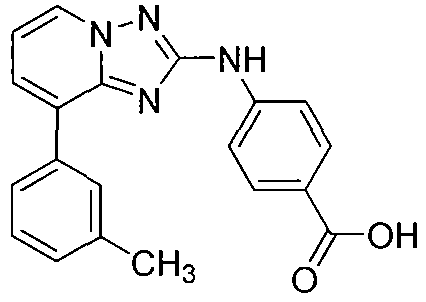
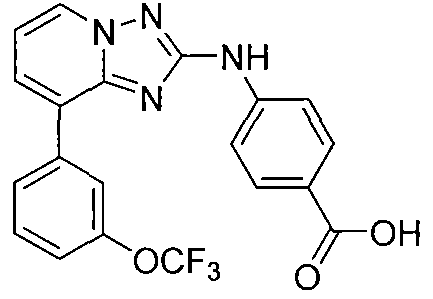
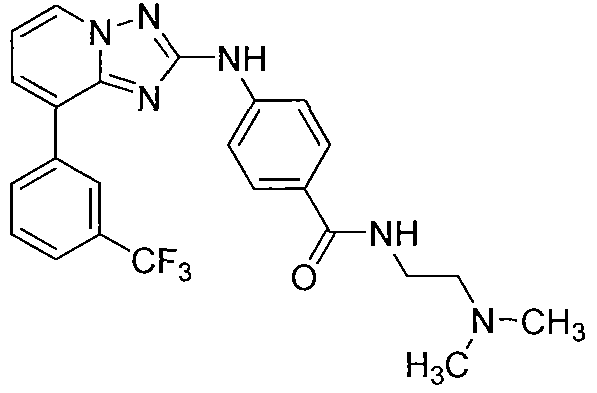
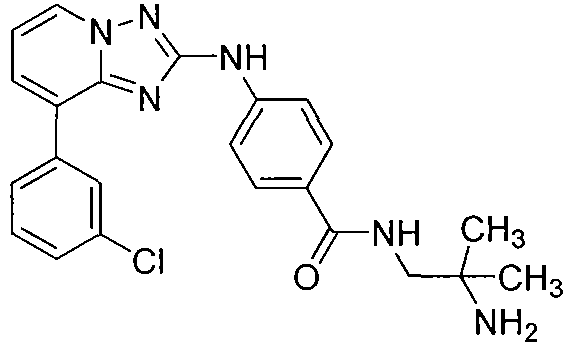
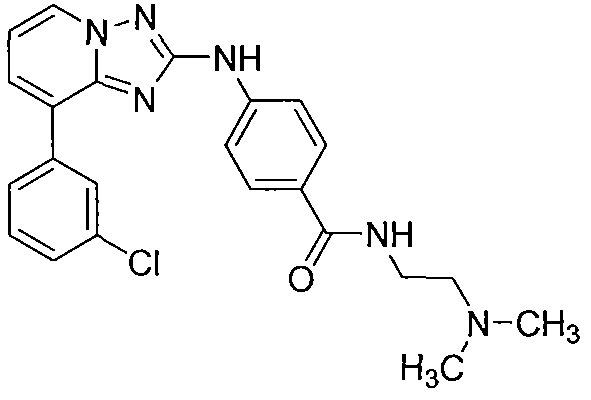
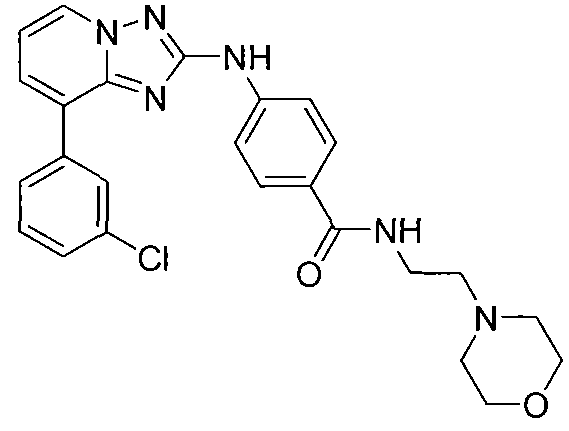
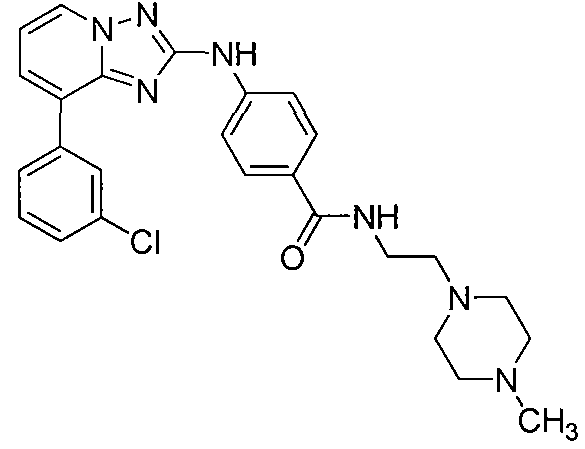
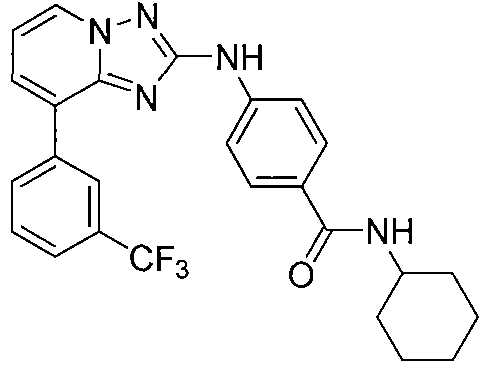
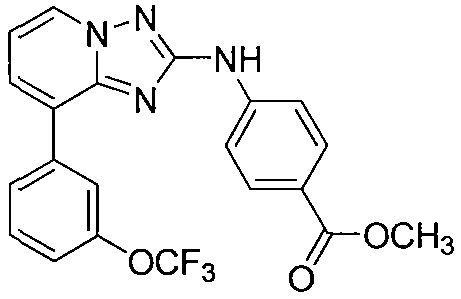
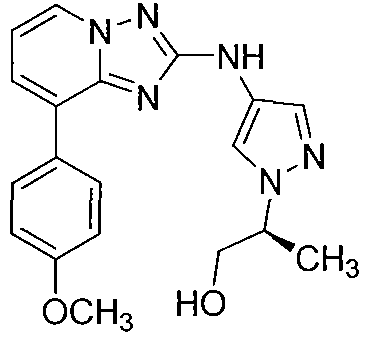
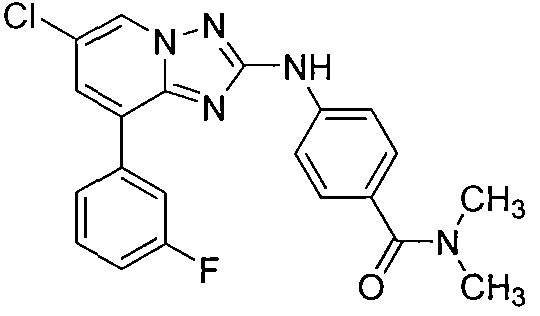
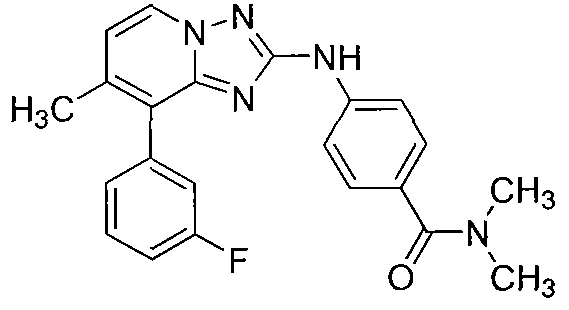
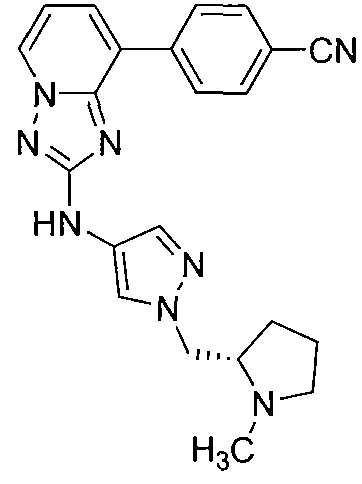
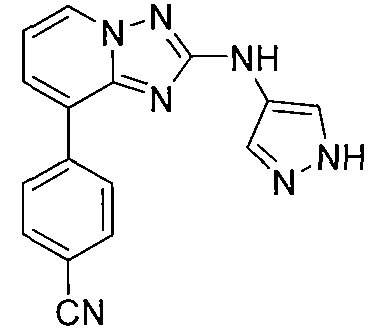
Другой вариант осуществления включает соединения формулы I, выбранные из соединений примеров 1-312.
Другой вариант осуществления включает соединение формулы I, которое имеет Ki и/или EC50, которое является, по меньшей мере, в 15 раз, альтернативно в 10 раз, или в 5 раз или более селективным при ингибировании активности янус киназы по сравнению с ингибированием активности каждой из других янус киназ.
Соединения формулы I могут содержать асимметрические или хиральные центры, и, следовательно, существовать в различных стереоизомерных формах. Предполагается, что все стереоизомерные формы соединений формулы I, включая, но не ограничиваясь: диастереомеры, энантиомеры и атропизомеры, а также их смеси, такие как рацемические смеси, образуют часть настоящего изобретения. Кроме того, настоящее изобретение включает все геометрические изомеры и изомеры положения. Например, если соединение формулы I содержит двойную связь или конденсированное кольцо, и цис- и транс-формы, а также смеси, включены в объем настоящего изобретения. И отдельные изомеры положения и смеси изомеров положения, например, в результате N-окисления пиримидинильного и пиррозолильного кольца, или E и Z формы соединений формулы I (например, оксимные группировки), также включены в объем настоящего изобретения.
В структурах, показанных в настоящем изобретении, в которых стереохимия любого конкретного хирального атома не показана, предполагаются все стереоизомеры, и они включены в виде соединений настоящего изобретения. Когда стереохимия показана цельным клином или пунктирной линией, представляющими конкретную конфигурацию, данный изомер показан и определен таким образом.
Соединения настоящего изобретения могут существовать в несольватированной, а также в сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и подобными, и предполагается, что настоящее изобретение, как определено формулой изобретения, включает и сольватированную и несольватированную формы.
В одном варианте осуществления соединения формулы I могут существовать в различных таутомерных формах, и все данные формы включены в объем настоящего изобретения, как определено формулой изобретения. Термин "таутомер" или "таутомерная форма" относится к структурным изомерам различной энергии, которые способны взаимопревращаться через барьер с низкой энергией. Например, протонные таутомеры (также известные, как прототропные таутомеры) включают взаимное превращение за счет миграции протона, такое как кето-енольная и имин-енаминовая изомеризации. Таутомеры валентности включают взаимопревращения перегруппировкой некоторых из связывающих электронов.
Настоящее изобретение также включает изотопно-меченные соединения формулы I, которые являются идентичными соединениям, перечисленными в настоящем изобретении, если не считать тот факт, что один или более атомов замещают атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа атома, обычно встречаемого в природе. Предполагается, что все изотопы любого конкретного атома или элемента, как указано, включены в объем настоящего изобретения. Примеры изотопов, которые можно вводить в соединения формулы I, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора и йода, такие как 2H, 3H, 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18O, 32P, 33P, 35S, 18F, 36Cl, 123I, и 125I, соответственно. Определенные изотопно-меченные соединения формулы I (например, соединения, меченные 3H и 14C) являются пригодными в анализах на распределение в тканях соединений и/или субстратов. Тритилированные (т.е., 3H) и углерод-14 (т.е., 14C) изотопы являются пригодными из-за легкости их получения и обнаружения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (т.е., 2H) может давать некоторые терапевтические преимущества в результате большей метаболической стабильности (например, повышенное время полувыведения in vivo или снижение требуемой дозы) и, следовательно, может быть предпочтительно в некоторых обстоятельствах. Позитронно-активные изотопы, такие как 15O, 13N, 11C и 18F являются пригодными для исследований с помощью позитрон-эмиссионной томографии (PET) для изучения заполнения рецепторов субстратом. Изотопно-меченные соединения формулы I можно обычно получить следующими методиками, аналогичными методикам, описанным на схемах и/или в примерах настоящего изобретения ниже, замещением изотопно-немеченных реагентов изотопно-меченными реагентами.
СИНТЕЗ ТРИАЗОЛОПИРИДИНОВЫХ СОЕДИНЕНИЙ, ЯВЛЯЮЩИХСЯ ИНГИБИТОРАМИ JAK
Соединения формулы I можно получить синтетическими путями, описанными в настоящем изобретении. В определенных вариантах осуществления можно применять методики, хорошо известные в данной области техники, в добавление к, или с учетом, содержащегося в настоящем изобретении описания. Исходные соединения обычно доступны из коммерческих источников, таких как Aldrich Chemicals (Milwaukee, Wis.), или их легко получить, применяя способы, хорошо известные специалистам в данной области техники (например, получить способами, описанными в общем в Louis F. Fieser и Mary Fieser, Reagents for Organic Synthesis, v. 1-19, Wiley, N. Y. (1967-1999 ed.), Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, включая приложения (также доступные через онлайн базу данных Beilstein)), или Comprehensive Heterocyclic Chemistry, Editors Katrizky и Rees, Pergamon Press, 1984. Способы получения триазолопиридинов также описываются в: WO 02/38572 и WO 2006/038116.
Соединения формулы I можно получить отдельно или в виде библиотек соединений, содержащих, по меньшей мере, 2, например, 5-1000 соединений, или 10-100 соединений формулы I. Библиотеки соединений формулы I можно получить комбинаторным подходом "разделения и смешения" или множественным параллельным синтезом, применяя или химические реакции в растворе или химические реакции на твердой фазе, методиками, хорошо известными специалистам в данной области техники. Таким образом, согласно следующему аспекту настоящего изобретения обеспечивают библиотекой соединений, содержащей, по меньшей мере, 2 соединения формулы I, их энантиомеры, диастереомеры, таутомеры или фармацевтически приемлемые соли.
С целью иллюстрации реакционные схемы 1-6, показанные ниже, предоставляют пути получения соединений настоящего изобретения, а также ключевых промежуточных соединений. Что касается более подробного описания конкретных стадий реакций, смотри часть с примерами ниже. Специалистам в данной области техники ясно, что можно применять другие способы для получения соединений настоящего изобретения.
Хотя конкретные исходные соединения и реагенты изображены на схемах и обсуждаются ниже, другие исходные соединения и реагенты можно легко применять вместо них для получения ряда производных и/или условий реакций. Кроме того, многие соединения, полученные способами, описанными ниже, можно дополнительно модифицировать с учетом данного описания, применяя стандартные реакции, хорошо известные специалистам в данной области техники.
При получении соединений настоящего изобретения, может быть необходима защита реакционноспособных группировок (например, первичного или вторичного амина) промежуточных соединений. Необходимость в данной защите будет изменяться в зависимости от природы реакционноспособной группировки и условий способа получения. Подходящие защитные группы аминофункции (NH-Pg) включают ацетил, трифторацетил, трет-бутоксикарбонил (BOC), бензилоксикарбонил (CBz) и 9-флуоренилметиленоксикарбонил (Fmoc). Необходимость в данной защите легко определяется специалистами в данной области техники. Что касается общего описания защитных групп и их применения, смотри T. W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991.
Соединения настоящего изобретения можно получить из легко доступных исходных соединений, применяя общие методики, показанные в настоящем изобретении.
Реакционная схема 1

Например, соединения формулы I можно получить, как показано на реакционной схеме 1. Общее защищенное промежуточное соединение 5, которое получено из 2-амино-3-бромпиридина (2), можно подвергнуть реакциям конденсации, катализируемым палладием, таким как реакция Сузуки с бороновыми кислотами или боронатными эфирами для того, чтобы получить соединения формулы 6 после удаления защитной группы. Катализируемое палладием аминирование арил или гетероарилгалогенидов триазолопиридинамином 6 дает соединения формулы 1a. Катализируемое палладием аминирование фенилгалогенидов, замещенных метоксикарбонилом, или гетероарилгалогенидов 7, замещенных метоксикарбонилом, триазолопиридинамином 6 дает соединения формулы 1b. Гидролиз соответствующих метиловых эфиров 1b дает карбоновые кислоты 1c, которые можно подвергать стандартным способам получения амидов для получения амидов 1d.
Ясно, что при наличии подходящих функциональных групп, соединения различных формул или любые промежуточные соединения, применяемые при их получении, можно дополнительно дериватизировать одним или более стандартными способами синтеза, применяя реакции конденсации, замещения, окисления, восстановления или расщепления. Конкретные подходы для замещения включают общепринятые методики алкилирования, арилирования, гетероарилирования, ацилирования, сульфонилирования, галогенирования, нитрования, формилирования и конденсации.
В следующем примере первичную или вторичную аминовую группы можно превратить в амидные группы (-NHCOR' или -NRCOR') ацилированием. Ацилирование можно осуществлять реакцией с подходящим хлорангидридом кислоты в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан, или реакцией с подходящей карбоновой кислотой в присутствии подходящего конденсирующего агента, такого как HATU (гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония) в подходящем растворителе, таком как дихлорметан. Аналогично, аминогруппы можно превратить в сульфонамидные группы (-NHSO2R' или -NR”SO2R') реакцией с подходящим сульфонилхлоридом в присутствии подходящего основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан. Первичную или вторичную аминогруппу можно превратить в карбамидную группу (-NHCONR'R" или -NRCONR'R") реакцией с подходящим изоцианатом в присутствии подходящего основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан.
Амин (-NH2) можно получить восстановлением нитро (-NO2) группы, например, каталитическим гидрогенированием, применяя, например, водород в присутствии металлического катализатора, например, палладия на подложке, такой как уголь, в растворителе, таком как этилацетат, или спирте, например, метаноле. Альтернативно, превращение можно проводить химическим восстановлением, применяя, например металл, например, олово или железо, в присутствии кислоты, такой как хлороводородная кислота.
В следующем примере аминогруппу (-CH2NH2) можно получить восстановлением нитрилов (-CN), например, каталитическим гидрогенированием, применяя, например, водород в присутствии металлического катализатора, например, палладия на подложке, такой как уголь, или никель Ренея, в растворителе, таком как эфир, например, циклический эфир, такой как тетрагидрофуран, при подходящей температуре, например от приблизительно -78°C до температуры кипения растворителя.
В следующем примере, аминогруппу (-NH2) можно получить из карбоксильной группы (-CO2H) превращением в соответствующий ацилазид (-CON3), перегруппировкой Карциуса и гидролизом полученного в результате изоцианата (-N=C=O).
Альдегидные группы (-CHO) можно превратить в аминогруппы (-CH2NR'R")) восстановительным аминированием, применяя амин и боргидрид, например, триацетоксиборгидрид натрия или цианоборгидрид натрия, в растворителе, таком как галогенированный углеводород, например, дихлорметан, или спирт, такой как этанол, при необходимости в присутствии кислоты, такой как уксусная кислота, при температуре окружающей среды.
В следующем примере альдегидные группы можно превратить в алкенильные группы (-CH=CHR') применяя реакцию Виттига или Вадсворта-Эммонса, применяя подходящий фосфоран или фосфонат в стандартных условиях, известных специалистам в данной области техники.
Альдегидные группы можно получить восстановлением эфирных групп (таких как -CO2Et) или нитрилов (-CN), применяя диизобутилалюмогидрид в подходящем растворителе, таком как толуол. Альтернативно, альдегидные группы можно получить окислением спиртовой группы, применяя подходящий окисляющий агент, известный специалистам в данной области техники.
Эфирные группы (-CO2R') можно превратить в соответствующие карбоксильные группы (-CO2H) гидролизом, катализируемым кислотой или основанием, в зависимости от природы R. Если R представляет собой трет-бутил, гидролиз, катализируемый кислотой, можно осуществлять, например, обработкой органической кислотой, такой как трифторуксусная кислота, в водном растворителе, или обработкой неорганической кислотой, такой как хлороводородная кислота, в водном растворителе.
Карбоксильные группы (-CO2H) можно превратить в амиды (CONHR' или -CONR'R") реакцией с подходящим амином в присутствии подходящего конденсирующего агента, такого как HATU, в подходящем растворителе, таком как дихлорметан.
В следующем примере можно получать гомологи карбоновых кислот, отличающиеся на один атом углерода (т.е. -CO2H в -CH2CO2H) превращением в соответствующий хлорангидрид кислоты (-COCl), с последующей реакцией Арндта-Айстрейта.
В следующем примере -OH группу можно получить из соответствующего эфира (например -CO2R') или альдегида (-CHO) восстановлением, применяя, например, сложный гидрид металлов, такой как алюмогидрид лития, в диэтиловом эфире или тетрагидрофуране, или боргидрид натрия в растворителе, таком как метанол. Альтернативно, спирт можно получить восстановлением соответствующей кислоты (-CO2H), применяя, например, алюмогидрид лития, в растворителе, таком как тетрагидрофуран, или применяя бор в растворителе, таком как тетрагидрофуран.
Спиртовую группу можно превратить в уходящую группу, такую как атомы галогена или сульфонилоксигруппы, такие как алкилсульфонилокси, например, трифторметилсульфонилокси или арилсульфонилокси, например п-толуолсульфонилокси группу, применяя условия, известные специалистам в данной области техники. Например, спирт может реагировать с тионилхлоридом в галогенированном углеводороде, (например, дихлорметане) для того, чтобы получить соответствующий хлорид. Можно также применять в данной реакции основание (например, триэтиламин).
В другом примере, спиртовую, фенольную или амидную группу можно алкилировать конденсацией фенола или амида со спиртом в растворителе, таком как тетрагидрофуран, в присутствии фосфина, например, трифенилфосфина и активатора, такого как диэтил-, диизопропил- или диметилазодикарбоксилат. Альтернативно, алкилирование можно осуществлять депротонированием, применяя подходящее основание, например, гидрид натрия, с последующим добавлением алкилирующего агента, такого как алкилгалогенид.
Ароматические галогеновые заместители в соединениях можно подвергать замещению галогена на металл обработкой основанием, например, основанием лития, таким как н-бутил или трет-бутил литий, необязательно при низкой температуре, например, приблизительно при -78°C, в растворителе, таком как тетрагидрофуран и, затем, гашением электрофилом для введения требуемого заместителя. Таким образом, например, формильную группу можно ввести, применяя N,N-диметилформамид в качестве электрофила. Ароматические галогеновые заместители можно альтернативно подвергать реакции, катализируемой металлом (например, палладием или медью), для введения, например, карбоксильного, эфирного, циано, амидного, арильного, гетероарильного, алкенильного, алкинильного, тио- или амино заместителя. Подходящие методики, которые можно применять, включают методики, описанные Хеком, Сузуки, Стилле, Бухвальдом или Хартвигом.
Ароматические галогеновые заместители можно также подвергать нуклеофильному замещению после реакции с подходящим нуклеофилом, таким как амин или спирт. Предпочтительно проводить данную реакцию при повышенной температуре в присутствии микроволнового излучения.
СПОСОБЫ РАЗДЕЛЕНИЯ
В каждой из примерных схем может быть предпочтительно разделять продукты реакций друг от друга и/или от исходных соединений. Целевые продукты каждой стадии или ряда стадий выделяют и/или очищают (в дальнейшем выделяют) до требуемой степени гомогенности методиками, обычными в данной области техники. Обычно данное выделение включает многофазовую экстракцию, кристаллизацию из растворителя или смеси растворителей, перегонку, сублимацию или хроматографию. Хроматография может включать любое число способов, включая, например: обращенно-фазовую хроматографию и хроматографию с нормальной фазой; эксклюзионную; ионообменную; жидкостную хроматографию низкого, среднего и высокого давления; мелкомасштабную аналитическую хроматографию; хроматографию с псевдоожиженным слоем (SMB) и препаративную тонко- или толстослойную хроматографию, а также методики мелкомасштабной тонкослойной и флеш-хроматографии.
Другой класс способов выделения включает обработку смеси реагентом, селективно связывающимся или иначе придающим способность быть выделяемым целевому продукту, непрореагировавшему исходному соединению, побочному продукту реакции или подобным. Данные реагенты включают адсорбенты или абсорбенты, такие как активированный уголь, молекулярные сита, ионообменные среды или подобные. Альтернативно, реагенты могут быть кислотами в случае основных веществ, основаниями в случае кислотных веществ, связывающими реагентами, такими как антитела, связывающими белками, селективными комплексообразователями, такими и как краун эфиры, реагентами для ионной экстракции жидкость/жидкость (LIX) или подобными.
Выбор подходящих способов выделения зависит от свойств исходных и получаемых соединений. Например, температура кипения и молекулярный вес при перегонке и сублимации, наличие или отсутствие полярных функциональных групп при хроматографии, стабильность соединений в кислой и основной среде при многофазовой экстракции и подобные. Специалисты в данной области техники будут применять методики, наиболее подходящие для достижения требуемого разделения.
Диастереомерные смеси можно разделять на индивидуальные диастереоизомеры на основе их физико-химических различий способами, хорошо известными специалистам в данной области техники, такими как хроматография и/или фракционная кристаллизация. Энантиомеры можно разделить превращением энантиомерной смеси в диастереомерную смесь реакцией с подходящим оптически активным соединением (например, хиральным вспомогательным веществом, таким как хиральный спирт или хлорангидрид кислоты Мошера), разделением диастереоизомеров и превращением (например, гидролизом) отдельных диастереоизомеров в соответствующие чистые энантиомеры. Кроме того, некоторые соединения настоящего изобретения могут представлять собой атропизомеры (например, замещенные биарилы) и они рассматриваются, как часть настоящего изобретения. Энантиомеры можно также разделить, применяя хиральные ВЭЖХ колонки.
Отдельный стереоизомер, например энантиомер, практически не содержащий своего стереоизомера, можно получить разделением рацемической смеси, применяя способ, такой как образование диастереомеров, применяя оптически активные реагенты для разделения (Eliel, E. и Wilen, S., Stereochemistry of Organic Compounds, John Wiley & Sons, Inc., New York, 1994; Lochmuller, C. H., J. Chromatogr.,113(3):283-302 (1975)). Рацемические смеси хиральных соединений настоящего изобретения можно разделить и выделить подходящим способом, включая: (1) образование ионных, диастереомерных солей хиральных соединений и разделение фракционной кристаллизацией или другими способами, (2) образование диастереомерных соединений с хиральными реагентами для получения производных, разделение диастереомеров и превращение в чистые стереоизомеры, и (3) разделение практически чистых или обогащенных стереоизомеров непосредственно в хиральных условиях. Смотри: Drug Stereochemistry, Analytical Methods and Pharmacology, Irving W. Wainer, Ed., Marcel Dekker, Inc., New York (1993).
Диастереомерные соли можно получить реакцией энантиомерно чистых хиральных оснований, таких как бруцин, хинин, эфедрин, стрихнин, α-метил-β-фенилэтиламин (амфетамин) и подобных с асимметрическими соединениями, несущими кислотные группы, такими как карбоновая кислота и сульфоновая кислота. Диастереомерные смеси можно привести к разделению фракционной кристаллизацией или ионной хроматографией. Для разделения оптических изомеров аминосоединений, добавление хиральной карбоновой или сульфоновой кислот, таких как камфорсульфоновая кислота, винная кислота, миндальная кислота или молочная кислота, может приводить в результате к образованию диастереомерных солей.
Альтернативно, субстрат, который нужно выделить, реагирует с одним энантиомером хирального соединения для того, чтобы образовать диастереомерную пару (Eliel, E. And Wilen, S., Stereochemistry of Organic Compounds, John Wiley & Sons, Inc., New York, 1994, p. 322). Диастереомерные соединения можно получить реакцией асимметрических соединений с энантиомерно чистыми хиральными реагентами для получения производных, таких как производные ментола, с последующим разделением диастереомеров и гидролизом для получения чистого или обогащенного энантиомера. Способ определения оптической чистоты включает получения хиральных эфиров, таких как эфир ментола, например, (-) ментилхлорформиат, в присутствии основания, или эфир Мошера, α-метокси-α-(трифторметил)фенилацетат (Jacob, J. Org. Chem. 47:4165 (1982)), рацемической смеси, и анализ ЯМР спектров на присутствие двух атропизомерных энантиомеров или диастереомеров. Стабильные диастереомеры атропоизомерных соединений можно разделять и выделять обращенно-фазовой хроматографией и хроматографией с нормальной фазой, следуя способам разделения атропоизомерных нафтилизохинолинов (WO 96/15111). Способом (3), рацемическую смесь двух энантиомеров можно разделить хроматографией, применяя хиральную стационарную фазу (Chiral Liquid Chromatography W. J. Lough, Ed., Chapman and Hall, New York, (1989); Okamoto, J. of Chromatogr. 513:375-378 (1990)). Обогащенные или очищенные энантиомеры можно охарактеризовать способами, применяемыми для характеризации других хиральных молекул с асимметрическими атомами углерода, такими как оптическое вращение и круговой дихроизм.
Изомеры положения, например E и Z формы, соединений формулы I, и промежуточные соединения для их получения, можно наблюдать способами характеризации, такими как ЯМР и аналитическая ВЭЖХ. Для определенных соединений, у которых энергетический барьер для взаимопревращения является достаточно высоким, E и Z изомеры можно разделить, например, препаративной ВЭЖХ.
БИОЛОГИЧЕСКИЙ АНАЛИЗ
Предыдущие исследования показали, что выделенные киназные домены человеческих JAK1, JAK2, JAK3 или TYK2 фосфорилируют пептидные субстраты в in vitro анализах киназ (Saltzman et al., Biochem. Biophys. Res. Commun. 246:627-633 (2004)). Каталитически активный киназный домен человеческой JAK1, JAK2, JAK3 или TYK2 выделяли из экстрактов SF9 клеток насекомых, инфицированных рекомбинантным экпрессирующим бакуловирусным вектором, кодирующим человеческие JAK1, JAK2, JAK3 или TYK2 киназные домены (JAK1 аминокислотные остатки N852-D1154 согласно нумерации GenBank номера доступа последовательности P23458, JAK2 аминокислотные остатки D812-G1132 согласно нумерации GenBank номера доступа последовательности NP_004963.1; JAK3 аминокислотные остатки S783-S1124 согласно нумерации GenBank номера доступа последовательности P52333 и TYK2 аминокислотные остатки N873-C1187 согласно нумерации GenBank номера доступа последовательности P29597). Активность JAK1, JAK2, JAK3 или TYK2 киназных доменов можно измерить рядом прямых и косвенных способов, включая количественное измерение фосфорилирования пептидных субстратов, полученных из человеческого JAK3 белка (Saltzman et ai, Biochem. Biophys. Res. Commun. 246:627-633 (2004)). Активность JAK1, JAK2, JAK3 или TYK2 киназных доменов можно измерить in vitro контролем фосфорилирования пептидов, полученных из JAK3, применяя Caliper LabChip технологию (смотри примеры).
Соединения настоящего изобретения исследовали на их способность ингибировать и активировать (первичные анализы) активность янус киназ, а также на их биологический эффект на растущие клетки (вторичные анализы), как описано в настоящем изобретении.
Соединения, имеющие IC50, меньшую чем 10 мкМ (предпочтительно меньшую чем 5 мкМ, более предпочтительно меньшую чем 1 мкМ, самое предпочтительное меньшую чем 0,5 мкМ) в подходящем анализе активности и активации янус киназ (смотри примеры A и B), и EC50, меньшую чем 20 мкМ (предпочтительно меньшую чем 10 мкМ, более предпочтительно меньшую чем 5 мкМ, самое предпочтительное меньшую чем 1 мкМ) в подходящих анализах клеток (смотри пример C), являются пригодными в качестве ингибиторов янус киназ.
ВВЕДЕНИЕ ТРИАЗОЛОПИРИДИНОВЫХ СОЕДИНЕНИЙ
Другой вариант осуществления включает способ лечения или снижения тяжести заболевания или состояния, чувствительного к ингибированию активности одной или более янус киназ, выбранных из JAK1, JAK2, JAK3 и TYK2, у пациента. Способ включает введение пациенту терапевтически эффективного количества соединения формулы I.
Другой вариант осуществления включает способ лечения или снижения тяжести заболевания или состояния, чувствительного к ингибированию активности JAK2 киназы, у пациента. Способ включает стадию введения пациенту терапевтически эффективного количества соединения формулы I.
В одном варианте осуществления, заболевание или состояние представляет собой рак, инсульт, диабет, гепатомегалию, сердечнососудистое заболевание, множественный склероз, болезнь Альцгеймера, кистозный фиброз, вирусное заболевание, аутоиммунные заболевания, атеросклероз, рестеноз, псориаз, аллергические заболевания, воспаление, неврологические заболевания, заболевание, связанное с гормоном, состояния, связанные с трансплантацией органов, иммунодефицитные заболевания, заболевания, приводящие к разрушению костей, пролиферативные заболевания, инфекционные заболевания, состояния, связанные с гибелью клеток, агрегацию тромбоцитов, вызванную тромбином, заболевание печени, патологические иммунные состояния, включая активацию T-клеток, заболевания ЦНС или миелопролиферативное заболевание.
В одном варианте осуществления заболевание или состояние представляет собой рак.
В одном варианте осуществления заболевание представляет собой миелопролиферативное заболевание.
В одном варианте осуществления миелопролиферативное заболевание представляет собой истинную полицитемию, эссенциальный тромбоцитоз, миелофиброз или хроническую гранулоцитную лейкемию (CML).
В одном варианте осуществления рак представляет собой рак груди, рак яичников, рак шейки матки, рак простаты, рак яичек, рак мужского полового органа, рак мочеполовой системы, семиному, рак пищевода, рак гортани, рак желудка, рак желудочно-кишечного тракта, рак кожи, кератоакантому, фолликулярную карциному, меланому, рак легкого, мелкоклеточный рак легкого, немелкоклеточный рак легкого (NSCLC), аденокарциному легкого, чешуйчатую карциному легкого, рак толстой кишки, рак поджелудочной железы, рак щитовидной железы, паппилярный рак, рак мочевого пузыря, рак печени, рак желчного протока, рак почек, рак костей, миелоидные заболевания, лимфоидные заболевания, рак «волосатных» клеток, рак полости рта и глотки, рак губ, рак языка, рак ротовой щели, рак слюнной железы, рак глотки, рак тонкой кишки, рак толстой кишки, рак анального канала, рак почек, рак простаты, рак женских наружных половых органов, рак щитовидной железы, рак толстой кишки, эндометриальный рак, рак матки, рак мозга, рак центральной нервной системы, рак брюшной полости, гепатоцеллюлярный рак, рак головы, рак шеи, болезнь Ходжкина и лейкемию.
В одном варианте осуществления сердечнососудистое заболевание представляет собой рестеноз, кардиомегалию, атеросклероз, инфаркт миокарда или застойную сердечную недостаточность.
В одном варианте осуществления нейродегенеративное заболевание представляет собой болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Хантингтона и ишемию головного мозга, и нейродегенеративное заболевание, вызванное травматическим повреждением, глутаматной нейротоксичностью или гипоксией.
В одном варианте осуществления воспалительные заболевания представляют собой ревматоидный артрит, псориаз, контактный дерматит или повышенную чувствительность.
В одном варианте осуществления воспалительное заболевание представляет собой воспалительные заболевания кишечника.
В одном варианте осуществления аутоиммунное заболевание представляет собой волчанку или множественный склероз.
Оценку подавления иммунитета, вызванного лекарственным средством, соединениями настоящего изобретения можно осуществлять, применяя in vivo функциональные испытания, такие как на моделях грызунов с индуцированным артритом, и терапевтическое или профилактическое лечение для оценки тяжести заболевания, T клеточно-зависимый гуморального иммунный ответ (TDAR) и гиперчувствительность замедленного типа (DTH). Другие in vivo системы, включая модели мышей с иммунной защитой против инфекций и опухолевой резистентностью (Burleson GR, Dean JH, and Munson AE. Methods in Immunotoxicology, Vol. 1. Wiley-Liss, New York, 1995) можно применять для прояснения природы и механизмов наблюдаемого подавления иммунитета. Системы для испытаний in vivo можно дополнять общепринятыми функциональными анализами in vitro или ex vivo для оценки состояния системы иммунитета. Данные анализы могут включать пролиферацию B- или T-клеток в ответ на митогены или специфические антитела, измерение сигнала через один или более путей янус киназ в B- или T-клетках или иммортализированных B- или T-клеточных линиях, измерение маркеров на поверхности клетки в ответ на сигнал B- или T-клеток, клеточной активности природных киллеров (NK), активности тучных клеток, дегрануляции тучных клеток, фагоцитоза или уничтожающей активности макрофагов, и оксидативного взрыва нейтрофилов и/или хемотаксиса. Каждое из этих испытаний может включать определение продуцирования цитокинов конкретными клетками-эффекторами (например, лимфоцитами, NK, моноцитами/макрофагами, нейтрофилами). Анализы in vitro и ex vivo можно применять и в преклинических и в клинических испытаниях, применяя лимфоидные ткани и/или периферическую кровь (House RV. "Theory and practice of cytokine assessment in immunotoxicology" (1999) Methods 19:17-27; Hubbard AK. "Effects of xenobiotics on macrophage function: evaluation in vitro" (1999) Methods; 19:8-16; Lebrec H, et al (2001) Toxicology 158:25-29).
Шести недельное детальное исследование с коллаген-индуцированным артритом (CIA), применяя аутоиммунный механизм для имитации человеческого артрита; модели на крысах и мышах (пример 68). Коллаген-индуцированный артрит (CIA) представляет собой одну из наиболее часто применяемых моделей человеческого ревматоидного артрита (RA). Воспаление суставов, которое развивается у животных с CIA, сильно напоминает воспаление, наблюдаемое у пациентов с RA. Блокирование фактора некроза опухолей (TNF) представляет собой эффективное лечение CIA, точно также, как оно является высокоэффективной терапией при лечении RA пациентов. CIA опосредуется и T-клетками и антителами (B-клетками). Считают, что макрофаги играют важную роль и выступают посредниками при повреждении тканей в процессе развития заболевания. CIA вызывают, иммунизируя животных коллагеном, эмульгированным в полном адъюванте Фрейнда (CFA). Он наиболее часто вызывается в линии мышей DBA/1, но заболевание может также быть вызвано у крыс Льюиса.
Существуют надежные доказательства того, что B-клетки играют ключевую роль в патогенезе аутоиммунных и/или воспалительных заболеваний. Терапевтические средства на основе белков, которые уменьшают количество B-клеток, такие как ритуксан, являются эффективными относительно воспалительных заболеваний, управляемых аутоиммунными антителами, таких как ревматоидный артрит (Rastetter et al. (2004) Annu Rev Med 55:477). CD69 представляет собой маркер ранней активации в лейкоцитах, включая T-клетки, тимоциты, B-клетки, NK-клетки, нейтрофилы и эозинофилы. Анализ на CD69 человеческой цельной крови (пример 69) определяет способность соединений ингибировать продуцирование CD69 B-лимфоцитами в человеческой цельной крови, активированными поперечным связыванием IgM с козлиным F(ab')2 античеловеческим IgM.
T-клеточно-зависимый гуморальный иммунный ответ (TDAR) представляет собой анализ, обладающий предсказательной силой, для испытания иммунной функции, когда необходимо изучить возможные иммунотоксичные эффекты соединений. Анализ с применением IgM-бляшкообразующих клеток (PFC), применяя эритроциты овец (SRBC) в качестве антигена, представляет собой в настоящее время широко распространенный и ратифицированный стандартный способ испытания. Оказалось, что TDAR представляет собой анализ с большой предсказательной силой для определения иммунотоксичности у взрослых, подвергшихся обработке, на мышах на основе базы данных национальной токсикологической программы США (NTP) (M.I. Luster et al (1992) Fundam. Appl. Toxicol. 18:200-210). Полезность данного анализа обуславливается тем фактом, что он представляет собой целостное измерение, включая несколько важных компонентов иммунного ответа. TDAR зависит от функционирования следующих клеточных компонентов: (1) антиген-представляющих клеток, таких как макрофаги или дендрические клетки; (2) T-хелперных клеток, которые являются важными участниками при генезисе ответа, а также в переключении изотипа; и (3) B-клеток, которые являются конечными клетками-эффекторами и ответственны за синтез антител. Изменения, вызванные химически в любом одном компартменте, могут вызвать значительные изменения в суммарном TDAR (M. P. Holsapple In: G.R. Burleson, J.H. Dean and A.E. Munson, Editors, Modern Methods in Immunotoxicology, Volume 1, Wiley-Liss Publishers, New York, NY (1995), pp. 71-108). Обычно, данный анализ проводят или в виде ELISA для измерения количества растворимых антител (RJ. Smialowizc et al (2001) Toxicol. Sci. 61:164-175) или в виде анализа бляшкообразующих (или антителообразующих) клеток (L. Guo et al (2002) Toxicol. Appl. Pharmacol. 181:219-227) для обнаружения клеток плазмы, секретирующих специфические к антигену антитела. Предпочтенный антиген представляет собой или целые клетки (например, эритроциты овец) или растворимые белковые антигены (T. Miller et al (1998) Toxicol. Sci. 42:129-135).
Соединение формулы I можно вводить любым путем, пригодным для заболевания или состояния, которое нужно лечить. Подходящие пути включают пероральный, парентеральный (включая подкожный, внутримышечный, внутривенный, внутриартериальный, внутрикожный, интратекальный и эпидуральный), трансдермальный, ректальный, назальный, местный (включая буккальный и сублингвальный), вагинальный, внутрибрюшинный, внутрилегочный и интраназальный путь введения. Что касается локальной иммуносупрессивной терапии, соединения можно вводить внутрь пораженных тканей, включая опрыскивание или, иначе, контакт хозяина с ингибитором перед трансплантацией. Ясно, что предпочтительный путь введения будет изменяться, например, в зависимости от состояния пациента. Когда соединение формулы I вводят перорально, его можно получать в виде пилюль, капсул, таблеток и т.д, с фармацевтически приемлемым носителем или вспомогательным веществом. Когда соединение формулы I вводят парентерально, его можно смешивать с фармацевтически приемлемой для парентерального введения основой и получать в виде стандартной инъецируемой лекарственной формы, как описано ниже.
Доза, применяемая для лечения пациентов, являющихся людьми, может изменяться в диапазоне от приблизительно 10 мг до приблизительно 1000 мг соединения формулы I. Стандартная доза может составлять от приблизительно 100 мг до приблизительно 300 мг соединения формулы I. Дозу можно вводить один раз в день (QID), дважды в день (BID), или более часто, в зависимости от фармакокинетических и фармакодинамических свойств, включающих абсорбцию, распределение, метаболизм и выведение конкретного соединения. Кроме того, показатели токсичности могут влиять на дозировку и режим введения. При введении перорально, пилюли, капсулы или таблетки можно принимать внутрь ежедневно или менее часто в течение оговоренного срока. Режим можно повторять для ряда циклов терапии.
Другой вариант осуществления настоящего изобретения относится к соединению настоящего изобретения для применения в качестве лекарственного средства при лечении заболеваний или состояний, описанных в настоящем изобретении, у млекопитающего, например, человека, страдающего от данного заболевания или состояния. Также включенным является применение соединений настоящего изобретения для получения лекарственных средств для лечения заболеваний и состояний, описанных в настоящем изобретении, у теплокровных животных, таких как млекопитающие, например, люди, страдающие от данного заболевания.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ТРИАЗОЛОПИРИДИНОВЫХ СОЕДИНЕНИЙ
Другой вариант осуществления включает фармацевтическую композицию, которая содержит соединение формулы I и фармацевтически приемлемый носитель, вспомогательное вещество или среду.
В одном варианте осуществления фармацевтическая композиция также содержит дополнительный терапевтический агент, выбранный из противопролиферативного агента, противовоспалительного агента, иммуномодулирующего агента, нейротропного фактора, агента для лечения сердечнососудистого заболевания, агента для лечения заболевания печени, противовирусного агента, агента для лечения заболеваний крови, агента для лечения диабета или агента для лечения иммунодефицитных заболеваний.
В другом варианте осуществления соединение формулы I присутствует в фармацевтический рецептуре в количестве, заметно ингибирующем активность одной или более янус киназ, выбранных из JAK1, JAK2, JAK3 и TYK2, которая также содержит фармацевтически приемлемый носитель, вспомогательное вещество или среду.
В одном варианте осуществления соединение формулы I присутствует в фармацевтический рецептуре в количестве, заметно ингибирующем активность JAK2 киназы, которая также содержит фармацевтически приемлемый носитель, вспомогательное вещество или среду.
В одном варианте осуществления соединение формулы I присутствует в фармацевтический рецептуре в количестве, заметно ингибирующем активность JAK2 киназы, и является, по меньшей мере, в 10 раз или более селективным при ингибировании активности JAK2 киназы по сравнению с ингибированием активности каждой из JAK1, JAK3 и Tyk-2.
В одном варианте осуществления соединение формулы I присутствует в фармацевтический рецептуре в количестве, заметно ингибирующем активность одной из янус киназ, и является, по меньшей мере, в 15 раз, альтернативно, в 10 раз или в 5 раз или более селективным при ингибировании активности данной янус киназы по сравнению с ингибированием активности каждой из других янус киназ.
В одном варианте осуществления соединение формулы I присутствует в фармацевтический рецептуре в количестве, заметно ингибирующем активность янус киназ, и является, по меньшей мере, в 15 раз, альтернативно, в 10 раз или в 5 раз или более селективным при ингибировании активности одной янус киназы по сравнению с ингибированием активности каждой из других JAK1, JAK2, JAK3 и/или Tyk-2.
Стандартную рецептуру получают смешением соединения настоящего изобретения и носителя, разбавителя или вспомогательного вещества. Подходящие носители, разбавители и вспомогательные вещества являются хорошо известными специалистам в данной области техники и включают вещества, такие как углеводы, воски, растворимые в воде и/или поддающиеся разбуханию полимеры, гидрофильные или гидрофобные вещества, желатин, масла, растворители, воду и подобные. Конкретный применяемый носитель, разбавитель или вспомогательное вещество будет зависить от пути и целей, для которых будет применяться соединение настоящего изобретения. Растворители обычно выбирают, исходя из растворителей, известных специалистам в данной области техники как безопасные (GRAS) для введения млекопитающему. Обычно, безопасные растворители являются нетоксичными водными растворителями, такими как вода, и другими нетоксичными растворителями, которые являются растворимыми или смешиваемыми с водой. Подходящие водные растворители включают воду, этанол, пропиленгликоль, полиэтиленгликоли (например, PEG 400, PEG 300) и т.д., и их смеси. Рецептуры также содержат один или более буферов, стабилизаторов, поверхностно-активных веществ, смачивающих агентов, смазывающих агентов, эмульгаторов, суспендирующих веществ, консервантов, антиоксидантов, агентов для нанесения прозрачного покрытия, регуляторов сыпучести, вспомогательных веществ, используемых в производственном процессе, красителей, подсластителей, ароматизирующих агентов, вкусовых добавок и других известных добавок для придания лекарственному средству привлекательного вида (т.е., соединению настоящего изобретения или его фармацевтической композиции) или облегчения получения фармацевтического продукта (т.е., лекарственного средства).
Рецептуры можно получить, применяя стандартные методики растворения и смешения. Например, нерасфасованное лекарственное вещество (т.е., соединение настоящего изобретения или стабилизированная форма соединения (например, комплекс с циклодекстриновым производным или другим известным комплексообразователем) растворяют в подходящем растворителе в присутствии одного или более вспомогательных веществ, описанных выше. Соединение настоящего изобретения обычно формулируют в фармацевтические лекарственные формы для обеспечения легко контролируемого дозирования лекарственного средства и облегчения соблюдения пациентом предписанного режима.
Фармацевтическую композицию (или рецептуру) для применения можно упаковывать различными способами, в зависимости от применяемого способа для введения лекарственного средства. Обычно, изделие для продажи включает упаковку, содержащую фармацевтическую композицию в подходящей форме. Подходящие упаковки являются хорошо известными специалистам в данной области техники и включают материалы, такие как флаконы (пластиковые и стеклянные), саше, ампулы, полиэтиленовые пакеты, металлические цилиндры и подобные. Упаковка может содержать наклейку для защиты от неумелого обращения для предотвращения несанкционированного доступа к содержимому упаковки. Кроме того, упаковка содержит внутри себя вкладыш, в котором описывается содержание упаковки. Вкладыш может также содержать подходящие меры предосторожности.
Фармацевтические композиции соединений настоящего изобретения можно получить для различных путей и типов введения. Соединение формулы I, имеющее требуемую степень чистоты, необязательно смешивают с фармацевтически приемлемыми разбавителями, носителями, вспомогательными веществами или стабилизаторами (Remington's Pharmaceutical Sciences (1980) 16th edition, Osol, A. Ed.), в форме лиофилизированной рецептуры, порошка, полученного размолом, или водного раствора. Получение рецептуры можно проводить смешением при комнатной температуре и при подходящем pH, и при требуемой степени чистоты, с физиологически приемлемыми носителями, т.е., носителями, которые являются нетоксичными для реципиентов при используемой дозе и концентрациях. Величина pH композиции зависит от конкретного применения и концентрации соединения, но может изменяться от приблизительно 3 до приблизительно 8. Композиция в ацетатном буфере при pH 5 является подходящим вариантом осуществления.
Ингибирующее соединение для применения в настоящем изобретении является предпочтительно стерильным. Соединение обычно можно хранить в виде твердой композиции, хотя лиофилизированные рецептуры или водные растворы являются приемлемыми.
Фармацевтические композиции настоящего изобретения будут получать, дозировать и вводить некоторым образом, т.е., в количестве, при концентрациях, в режиме, курсе, среде и пути введения, согласующимися с надлежащей медицинской практикой. Факторы, которые нужно учитывать в данном контексте, включают конкретное заболевание, которое нужно лечить, конкретное млекопитающее, которое нужно лечить, клиническое состояние конкретного пациента, причину заболевания, место доставки агента, способ введения, режим введения и другие факторы, известные терапевтам. "Терапевтически эффективное количество" соединения, которое будут вводить, будет определяться данными факторами, и оно представляет собой минимальное количество, необходимое для предотвращения, облегчения или лечения гиперпролиферативного заболевания. Данное количество предпочтительно является меньшим количества, которое является токсичным для хозяина.
В качестве общей нормы первоначальное фармацевтически эффективное количество ингибитора, вводимого парентерально, на дозу, будет находиться в диапазоне приблизительно 0,01-100 мг/кг, а именно приблизительно от 0,1 до 20 мг/кг веса тела пациента в день, причем стандартный первоначальный диапазон применяемого соединения составляет от 0,3 до 15 мг/кг/день.
Приемлемые разбавители, носители, вспомогательные вещества и стабилизаторы являются нетоксичными для пациентов при применяемых дозировках и концентрациях, и они включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмонийхлорид; гексаметонийхлорид; бензалконийхлорид, бензэтонийхлорид; фенол, бутиловый или бензиловый спирт; алкильные парабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (меньше чем приблизительно 10 остатков аминокислот) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глютамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, Zn-белковые комплексы); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG). Активные фармацевтические ингредиенты можно также включать в микрокапсулы, полученные, например, методиками накапливания или полимеризацией на границе фаз, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы, соответственно, в коллоидные системы доставки лекарственного средства (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Данные методики описывают в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Можно получить составы с замедленным высвобождением соединения формулы I. Подходящие примеры составов с замедленным высвобождением включают полупроницаемые матриксы твердых гидрофобных полимеров, содержащих соединение формулы I, где матриксы находятся в виде формованных изделий, например, пленок или микрокапсул. Примеры матриксов с замедленным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат), или поли(виниловый спирт)), полиактиды (патент США 3773919), сополимеры L-глютаминовой кислоты и гамма-этил-L-глутамата, неразлагающийся этиленвинилацетат, разлагающиеся сополимеры молочной и гликолевой кислот, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной и гликолевой кислот и лейпролидацетата) и поли-D-(-)-3-гидроксимасляную кислоту.
Рецептуры, которые будут применять при введении in vivo, должны быть стерильными, что легко достигается фильтрацией через стерильные фильтрующие мембраны.
Рецептуры включают рецептуры, подходящие для путей введения, подробно рассмотренных в настоящем изобретении. Удобно получать рецептуры в стандартной лекарственной форме, и их можно получить любым из способов, хорошо известных в области фармацевтики. Методики и составы обычно можно найти в Remington 's Pharmaceutical Sciences (Mack Publishing Co., Easton, PA). Данные способы включают стадию смешения активного ингредиента и носителя, который состоит из одного или более вспомогательных ингредиентов. Обычно рецептуру получают равномерным и тщательным смешением активного ингредиента с жидкими носителями или мелкоизмельченными твердыми носителями или обоими, и, затем, в случае необходимости, формованием продукта.
Рецептуры соединения формулы I, подходящие для перорального введения, можно получить в виде дискретных единичных форм, таких как пилюли, капсулы, саше или таблетки, причем каждая содержит предварительно определенное количество соединения формулы I.
Прессованные таблетки можно получить прессованием на подходящей машине активного ингредиента в сыпучей форме, такой как порошок или гранулы, необязательно смешанного со связующим, смазывающей добавкой, инертным разбавителем, консервантом, поверхностно-активным или диспергирующим агентом. Формованные таблетки можно получить формованием в подходящей машине смеси порошкообразного активного ингредиента, смоченного инертным жидким разбавителем. Таблетки можно необязательно покрывать или на них можно наносить риски и необязательно формулировать так, чтобы обеспечить медленное или контролируемое высвобождение из них активного ингредиента.
Таблетки, формованные пастилки, пастилки, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии, твердые или мягкие капсулы, например, желатиновые капсулы, сиропы или эликсиры можно получить для перорального применения. Рецептуры соединения формулы I, предназначенные для перорального применения, можно получить согласно любому способу, известному в данной области для получения фармацевтических композиций, и данные композиции могут содержать один или более агентов, включая подсластители, ароматизаторы, красители и консерванты, для того чтобы придать привлекательный вид. Таблетки, содержащие активный ингредиент в смеси с нетоксичным фармацевтически приемлемым вспомогательным веществом, которое является подходящим для получения таблеток, являются приемлемыми. Данные вспомогательные вещества могут представлять собой, например, инертные разбавители, такие как карбонат кальция или натрия, лактозу, фосфат кальция или натрия; агенты для гранулирования и разрыхлители, такие как кукурузный крахмал или альгиновая кислота; связующие, такие как крахмал, желатин или камедь; и смазывающие вещества, такие как стеарат магния, стеариновая кислота или тальк. Таблетки можно не покрывать или покрывать известными способами, включая микрокапсулирование для замедления разрушения и адсорбции в желудочно-кишечном тракте и посредством этого обеспечить замедленное действие в течение более продолжительного периода времени. Например, можно применять материал, замедляющий скорость высвобождения активного ингредиента, такой как моностеарат глицерина или дистеарат глицерина отдельно или с воском.
При заражении глаз или других внешних тканей, например, глотки и кожи, рецептуры предпочтительно применяют в виде мази для местного применения или крема, содержащего активный ингредиент (ингредиенты) в количестве, например, 0,075 - 20% в/в. При получении мази, активные ингредиенты можно применять или с парафиновой или смешиваемой с водой мазевой основой. Альтернативно, активные ингредиенты можно формулировать в виде крема с кремовой основой масло в воде.
При желании водная фаза кремовой основы может содержать многоатомный спирт, т.е., спирт, содержащий две или более гидроксильные группы, такой как пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин и полиэтиленгликоль (включая PEG 400) и их смеси. Желательно, чтобы рецептуры для местного применения содержали соединение, которое увеличивает абсорбцию или проникновение активного ингредиента через кожу или другие подвергаемые воздействию поверхности. Примеры данных агентов, усиливающих проникновение через кожу, включают диметилсульфоксид и родственные ему аналоги.
Масляная фаза эмульсий настоящего изобретения может состоять из известных ингредиентов в известном соотношении. В то время как фаза может содержать только эмульгатор (иначе известный как эмульгирующее вещество, желательно, чтобы она содержала смесь, по меньшей мере, одного эмульгатора с жиром или маслом, или и жиром и маслом. Предпочтительно добавлять гидрофильный эмульгатор вместе с липофильным эмульгатором, который действует в качестве стабилизатора. Также предпочтительно добавлять и масло и жир. Вместе, эмульгатор (эмульгаторы) с или без стабилизатора (стабилизаторов) составляют так называемый неионный эмульгированный воск, и данный воск вместе с маслом и жиром образует так называемою эмульгированную мазевую основу, которая образует масляную дисперсную фазу кремовых композиций. Эмульгаторы и стабилизаторы эмульсий, подходящие для применения в композициях настоящего изобретения, включают Tween® 60, Span® 80, цетостеариловый спирт, бензиловый спирт, миристиловый спирт, моностеарат глицерина и лаурилсульфат натрия.
Водные суспензии настоящего изобретения содержат активные вещества в смеси с вспомогательными веществами, подходящими для получения водных суспензий. Данные вспомогательные вещества включают суспендирующие агенты, такие как карбоксиметилцеллюлоза натрия, кроскармелоза, повидон, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и аравийская камедь, и диспергирующие или смачивающие агенты, такие как природные фосфатиды (например, лецитин), продукт конденсации алкиленоксида (например, этиленоксида, пропиленоксида) с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида с алифатическим спиртом с длинной углеводородной цепью (например, гептадекаэтиленоксицетанол), продукт конденсации этиленоксида с неполным эфиром, полученным из жирной кислоты и гекситолангидрида (например, моноолеат полиоксиэтиленсорбитана). Водная суспензия может также содержать один или более консервантов, таких как этил или н-пропил п-гидроксибензоат, один или более красителей, один или более ароматизаторов и один или более подсластителей, таких как сахароза или сахарин.
Фармацевтические композиции соединения формулы I могут быть в форме стерильного инъецируемого препарата, такого как стерильная инъецируемая водная или масляная суспензия. Данную суспензию можно формулировать согласно известному уровню техники, применяя подходящие диспергирующие или смачивающие агенты, и суспендирующие агенты, которые упоминались выше. Стерильный инъецируемый препарат может также представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном для парентерального введения разбавителе или растворителе, таком как раствор в 1,3-бутандиоле, или их можно получать в виде лиофилизированного порошка. К числу приемлемых носителей и растворителей, которые можно применять, относится вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные жирные масла можно обычно применять в качестве растворителя или суспендирующей среды. Для этих целей можно применять любое асептическое жирное масло, включая синтетические моно- или диглицериды. Кроме того, можно применять жирные кислоты, такие как олеиновая кислота, для получения инъецируемых препаратов.
Количество активного ингредиента, который можно смешивать с носителем для получения единичной лекарственной формы, будет изменяться в зависимости от пациента, подвергающегося лечению, и конкретного способа введения. Например, рецептура с постепенным высвобождением, предназначенная для перорального введения людям, может содержать от приблизительно 1 до 1000 мг активного вещества, смешанного с подходящим и пригодным количеством носителя, которое может изменяться от приблизительно 5 до приблизительно 95% суммарного веса композиции (вес:вес). Фармацевтическую композицию можно получить для того, чтобы обеспечить легкость измерения количества для введения. Например, водный раствор, предназначенный для внутривенного вливания, может содержать от приблизительно 3 до 500 мкг активного ингредиента на миллилитр раствора для того, чтобы наблюдалась инфузия подходящего объема при скорости приблизительно 30 мл/час.
Композиции, подходящие для парентерального введения, включают водные и неводные стерильные инъецируемые растворы, которые могут содержать антиоксиданты, буферы, бактериостаты и жидкие фазы, которые делают композицию изотоничной крови предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты и загустители.
Композиции, подходящие для местного введения на глаза, также включают глазные капли, в которых активный ингредиент растворяют или суспендируют в подходящем носителе, особенно водном растворителе для активного ингредиента. Активный ингредиент предпочтительно присутствует в данной композиции при концентрации приблизительно 0,5-20% в/в, например, приблизительно 0,5-10% в/в, например, приблизительно 1,5% в/в.
Композиции, подходящие для местного введения в полость рта, включают таблетки для рассасывания, содержащие активный ингредиент в ароматизированной основе, обычно сахарозе и камеди или трагаканте; пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин, или сахарозе и камеди; и жидкость для полоскания рта, содержащую активный ингредиент в подходящем жидком носителе.
Композиции для ректального введения могут быть представлены суппозиторием с подходящей основой, содержащей, например, масло какао или салицилат.
Композиции, подходящие для внутрилегочного или назального введения, имеют размер частиц, например, в диапазоне 0,1-500 микрон (включая размеры частиц в диапазоне от 0,1 до 500 микрон с шагом, таким как 0,5, 1, 30 микрон, 35 микрон и т.д.), которые вводят быстрой ингаляцией через носовой канал или ингаляцией через полость рта так, чтобы достичь альвеолярных мешочков. Подходящие композиции включают водные или масляные растворы активного ингредиента. Рецептуры, подходящие для введения с помощью аэрозоля или сухого порошка, можно получить согласно стандартным способам и можно доставлять с различными терапевтическими агентами, такими как соединения, ранее применяемые для лечения или профилактики ВИЧ инфекции, как описано ниже.
Композиции, подходящие для вагинального введения, могут быть представлены пессариями, тампонами, кремами, гелями, пастами, пенами или спреями, содержащими в добавление к активному ингредиенту носители, о которых известно, что они являются подходящими в данной области техники.
Композиции можно упаковывать в упаковки для одной дозы или для большего количества доз, например, запаянные ампулы и пробирки, и их можно хранить в лиофилизированном состоянии, требующем только добавления стерильного водного носителя, например, воды, для инъекции непосредственно перед применением. Растворы и суспензии, приготовленные для немедленного инъецирования, получают из стерильных порошков, гранул и таблеток описанного ранее типа. Предпочтительными рецептурами для единичного дозирования являются рецептуры, содержащие дневную дозу или единичную дневную поддозу, как перечислено выше в настоящем изобретении, или их подходящие части, активного ингредиента.
Кроме того, настоящее изобретение относится к ветеринарным композициям, содержащим, по меньшей мере, один активный ингредиент, как определено выше, вместе с пригодным для ветеринарных целей носителем. Пригодные для ветеринарных целей носители являются веществами, пригодными для целей введения композиции, и они могут быть твердыми, жидкими или газообразными веществами, которые, иначе, являются инертными или приемлемыми в области ветеринарии и являются совместимыми с активным ингредиентом. Данные ветеринарные композиции можно вводить парентерально, перорально или любым другим требуемым путем.
КОМБИНАЦИОННАЯ ТЕРАПИЯ
Соединение формулы I можно смешивать в фармацевтическую комбинированную рецептуру, или в режиме дозирования, как при комбинационной терапии, со вторым соединением, которое обладает антигиперпролиферативными или химиотерапевтическими свойствами, которое является пригодным для лечения заболевания или расстройства, чувствительного к ингибированию JAK киназы, например, гиперпролиферативного заболевания (например, рака), или которое является пригодным для лечения других заболеваний, перечисленных в настоящем изобретении. Второе соединение фармацевтической комбинированной рецептуры или режима дозирования предпочтительно обладает активностями, дополняющими активность соединения формулы I комбинации так, что они не оказывают неблагоприятное действие друг на друга. Данные молекулы соответственно присутствуют в комбинации в количестве, которое является эффективным для предполагаемых целей.
В другом варианте осуществления соединение формул I можно применять отдельно или в комбинации с другими терапевтическими агентами для лечения заболевания или расстройства, описанного в настоящем изобретении, такого как иммунологическое заболевание (например, псориаз или воспаление). В определенных вариантах осуществления соединение формулы I смешивают в фармацевтическую комбинированную рецептуру, или в режиме дозирования, как при комбинационной терапии, со вторым терапевтическим соединением, которое обладает противовоспалительной активностью или которое является пригодным для лечения воспаления, заболевания, связанного с иммунным ответом. Вторым терапевтическим агентом может быть NSAID или другой противовоспалительный агент. В одном варианте осуществления композиция настоящего изобретения содержит соединение формулы I, или его стереоизомер, геометрический изомером, таутомер, сольват, метаболит или фармацевтически приемлемую соль или пролекарство в комбинации с терапевтическим агентом, таким как NSAID.
Другой вариант осуществления, следовательно, включает способ лечения или снижения тяжести заболевания или состояния, чувствительного к ингибированию активности JAK2 киназы, у пациента, включающий введение упомянутому пациенту терапевтически эффективного количества соединения формулы I, и дополнительно включающий введение второго химиотерапевтического агента.
Комбинационную терапию можно осуществлять в режиме одновременного или последовательного введения. При последовательном введении композицию для комбинационной терапии можно вводить двумя или более введениями. Комбинированное введение включает совместное введение, применяя разные рецептуры или одну фармацевтическую рецептуру, и последовательное введение в любом порядке, при котором предпочтительно имеется период времени, когда оба (или все) активные агенты одновременно проявляют биологическую активность.
Подходящие дозы любого из вышеупомянутых совместно вводимых агентов являются дозами, применяемыми в настоящее время, и они могут быть снижены, благодаря комбинированному действию (эффекту синергии) нового обнаруженного агента и других химиотерапевтических агентов или лекарственных средств.
Комбинационная терапия может обеспечивать "эффект синергии" и оказаться "синергичной", т.е., эффект, достигаемый при применении активных ингредиентов вместе, является большим, чем сумма эффектов, которые являются результатом отдельного применения соединений. Синергический эффект можно достигнуть, когда активные ингредиенты: (1) смешивают и вводят или доставляют в одной рецептуре одновременно в смешанной, единичной, дозированной композиции; (2) доставляют чередованием или параллельно в виде отдельных рецептур; или (3) некоторыми другими режимами. При доставке в терапии с чередующимся введением, синергический эффект можно достичь, когда соединения вводят или доставляют последовательно, например, различными инъекциями в отдельных шприцах, в отдельных пилюлях или капсулах, или отдельными вливаниями. Обычно, в течение терапии с чередующимся введением, эффективную дозу каждого активного ингредиента вводят последовательно, т.е., периодически, тогда как в комбинационной терапии, эффективные дозы двух или более активных ингредиентов вводят вместе.
МЕТАБОЛИТЫ ТРИАЗОЛОПИРИДИНОВЫХ СОЕДИНЕНИЙ
Другой вариант осуществления включает продукты метаболизма in vivo введенного соединения формулы I. Данные продукты могут быть результатом, например, окисления, восстановления, гидролиза, амидирования, деамидирования, этерификации, деэтерификации ферментативного расщепления и подобных, введенного соединения.
Продукты метаболизма обычно идентифицируют получением соединения настоящего изобретения с радиомеченным (например,14C или 3H) изотопом, введением его парентерально в дозе, которую можно обнаружить (например, большей, чем приблизительно 0,5 мг/кг) животному, такому как крыса, мышь, морская свинка, обезьяна, или человеку, обеспечением достаточным временем для протекания метаболизма (обычно приблизительно от 30 секунд до 30 часов) и выделением продуктов его превращения из мочи, крови или других биологических образцов. Данные продукты легко выделить, т.к. они являются меченными (другие выделяют применением антител, способных связываться с эпитопами на поверхности метаболитов). Структуры метаболитов определяют стандартными способами, например, MS, LC/MS или ЯМР анализом. Обычно, анализ метаболитов проводят тем же способом, как стандартные исследования метаболизма лекарственных средств, хорошо известные специалистам в данной области техники. Продукты метаболизма, поскольку они не обнаруживаются иначе in vivo, являются пригодными в диагностических анализах для терапевтического дозирования соединения формулы I.
ГОТОВЫЕ ИЗДЕЛИЯ
Другой вариант осуществления включает набор для лечения заболевания или расстройства, чувствительного к ингибированию JAK киназы. Набор содержит:
(a) первую фармацевтическую композицию, содержащую соединение формулы I; и
(b) инструкцию по применению.
В другом варианте осуществления набор дополнительно содержит:
(c) вторую фармацевтическую композицию, которая содержит химиотерапевтический агент.
В одном варианте осуществления инструкция включает инструкцию для одновременного, последовательного или раздельного введения первой и второй фармацевтических композиций нуждающемуся в них пациенту.
В одном варианте осуществления первая и вторая композиции содержатся в отдельных упаковках.
В одном варианте осуществления первая и вторая композиции содержатся в одной упаковке.
Подходящие упаковки включают, например, флаконы, пробирки, шприцы, блистерную упаковку и т.д. Упаковку можно получить из различных материалов, таких как стекло или пластик. Упаковка может содержать соединение формулы I или его композицию, которая является эффективной для лечения состояния и может содержать стерильное отверстие (например, упаковка может представлять собой резервуар с раствором для внутривенного введения или флакон, имеющий пробку, проницаемую для иглы для подкожной инъекции).
Упаковка содержит композицию, содержащую, по меньшей мере, одно соединение формулы I. Этикетка или листовка-вкладыш показывают, что композиция применяется для лечения выбранного состояния, такого как рак. В одном варианте осуществления, этикетка или листовка-вкладыш показывают, что композицию, содержащую соединение формулы I, можно применять для лечения заболевания. Кроме того, этикетка или листок-вкладыш могут показывать, что пациент, которого нужно лечить, является паицентом, имеющим заболевание, характеризующееся чрезмерной или нерегулируемой киназной активностью. Этикетка или листок-вкладыш могут также показывать, что композицию можно применять для лечения других заболеваний.
Готовое изделие может содержать (a) первую упаковку с соединением формулы I, содержащемся в ней; и (b) вторую упаковку со второй фармацевтической композицией, содержащейся в ней, где вторая фармацевтическая композиция содержит химиотерапевтический агент. Готовое изделие в данном варианте осуществления настоящего изобретения может дополнительно содержать листок-вкладыш, показывающий, что первое и второе соединения можно применять для лечения пациентов с риском инсульта, тромбами или тромбозного заболевания. Альтернативно или дополнительно, готовое изделие может дополнительно содержать вторую (или третью) упаковку, содержащую фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), физиологический раствор с фосфатным буфером, раствор Рингера и раствор декстрозы. Оно также может дополнительно содержать другие вещества, желательные с коммерческой точки зрения и с точки зрения потребителя, включая другие буферы, разбавители, фильтры, иглы и шприцы.
В одном варианте осуществления соединения формулы I можно применять для контроля JAK протеинкиназ, тирозинкиназ, дополнительных серин/треонин киназ, и/или киназ с двойной специфичностью. Таким образом, они являются пригодными в качестве фармакологических стандартов для применения в разработки новых биологических тестов, анализов и в поиске новых фармакологических агентов.
Соединения формулы I можно оценить на их способность модулировать активность JAK протеинкиназ, тирозинкиназ, дополнительных серин/треонин киназ, и/или киназ с двойной специфичностью in vitro и in vivo. Испытания in vitro включают биохимические анализы и анализы на основе клеток, которые определяют ингибирование киназной активности. Альтернативные анализы in vitro определяют количественно способность соединения формулы I связывать киназы, и ее можно измерить или введением радиоактивной метки в соединение формулы I перед связыванием, выделением комплекса соединения формулы I и киназы и определением количества связанной радиоактивной метки, или проведением конкурентного эксперимента, где соединение формулы I выдерживают с известными меченными радиоактивной меткой лигандами. Данные и другие пригодные in vitro анализы являются хорошо известными специалистам в данной области техники.
Для того чтобы проиллюстрировать настоящее изобретение приведены следующие примеры. Однако должно быть ясно, что данные примеры не ограничивают настоящее изобретение и предназначены только для того, чтобы предложить способ осуществления на практике настоящего изобретения.
Специалистам в данной области техники ясно, что описанные химические реакции можно легко приспособить для получения других соединений формулы I, и альтернативные способы получения соединений формулы I включены в объем настоящего изобретения. Например, синтез отсутствующих в примерах соединений согласно настоящему изобретению можно успешно проводить модификациями, очевидными специалистам в данной области техники, например, подходящей защитой групп, препятствующих проведению реакции, применением других подходящих реагентов, известных в данной области техники, отличных от описанных реагентов, и/или осуществляя стандартные изменения условий реакций. Альтернативно, другие реакции, описанные в настоящем изобретении, или известные в данной области техники, будут допустимы в качестве пригодных для получения других соединений настоящего изобретения.
БИОЛОГИЧЕСКИЕ ПРИМЕРЫ
Соединения формулы I можно оценить на их способность модулировать активность янус протеинкиназ, тирозинкиназ, дополнительных серин/треонин киназ, и/или киназ с двойной специфичностью in vitro и in vivo. Испытания in vitro включают биохимические анализы и анализы на основе клеток, которые определяют ингибирование киназной активности. Альтернативные анализы in vitro определяют количественно способность соединения формулы I связывать киназы, и ее можно измерить или введением радиоактивной метки в соединение формулы I перед связыванием, выделением комплекса соединения формулы I и киназы и определением количества связанной радиоактивной метки, или проведением конкурентного эксперимента, где соединение формулы I выдерживают с известными меченными радиоактивной меткой лигандами. Данные и другие пригодные in vitro анализы являются хорошо известными специалистам в данной области техники.
Предварительные исследования показали, что выделенные киназные домены человеческих JAK1, JAK2, JAK3 или TYK2 фосфорилируют пептидные субстраты в in vitro анализах киназ (Saltzman et al., Biochem. Biophys. Res. Commun. 246:627-633 (2004)). Каталитически активный киназный домен человеческой JAK1, JAK2, JAK3 или TYK2 выделяли из экстрактов SF9 клеток насекомых, инфицированных рекомбинантным экпрессирующим бакуловирусным вектором, кодирующим человеческие JAK1, JAK2, JAK3 или TYK2 киназные домены (JAK1 аминокислотные остатки N852-D1154 согласно нумерации GenBank номера доступа последовательности P23458, JAK2 аминокислотные остатки D812-G1132 согласно нумерации GenBank номера доступа последовательности NP_004963.1; JAK3 аминокислотные остатки S783-S1124 согласно нумерации GenBank номера доступа последовательности P52333 и TYK2 аминокислотные остатки N873-C1187 согласно нумерации GenBank номера доступа последовательности P29597). Активность JAK1, JAK2, JAK3 или TYK2 киназных доменов можно измерить рядом прямых и косвенных способов, включая количественное измерение фосфорилирования пептидных субстратов, полученных из человеческого JAK3 белка (Saltzman et ai, Biochem. Biophys. Res. Commun. 246:627-633 (2004)). Активность JAK1, JAK2, JAK3 или TYK2 киназных доменов можно измерить in vitro мониторингом фосфорилирования пептидов, полученных из JAK3, применяя Caliper LabChip технологию (смотри примеры).
Пример A
Протокол анализа на ингибирование JAK2
Активность выделенного JAK2 киназного домена измеряли мониторингом фосфорилирования пептида, полученного из JAK3 (Val-Ala-Leu-Val-Asp-Gly-Tyr-Phe-Arg-Leu-Thr-Thr), флуоресцентно меченного на N-конце 5-карбоксифлуоресцеином, применяя Caliper LabChip технологию (Caliper Life Sciences, Hopkinton, MA). Для определения константы ингибирования (Ki) примеров 1-304, соединения разбавляли последовательно в DMSO и добавляли к 50 мкл киназных реакционных смесей, содержащих 0,2 нМ очищенного JAK2 фермента, 100 мМ Hepes pH 7,2, 0,015% Brij-35, 1,5 мкМ пептидного субстрата, 25 мкМ ATP, 10 мМ MgCl2, 4 мМ DTT при конечной концентрации в DMSO 2%. Реакционные смеси выдерживали при 22°C в 384-луночных полипропиленовых титрационных микропланшетах в течение 30 минут, и затем реакцию прекращали добавлением 25 мкл раствора, содержащего EDTA (100 мМ Hepes pH 7,2, 0,015% Brij-35, 150 мМ EDTA), что приводило в результате к конечной концентрации в EDTA, равной 50 мМ. После прекращения киназной реакции, долю фосфорилированного продукта определяли в виде фракции всего пептидного субстрата, применяя Caliper LabChip 3000 согласно инструкциям изготовителя. Затем, Ki величины определяли, применяя модель прочного связывания Моррисона. Morrison, J. F., Biochim. Biophys. Acta. 185:269-296 (1969); William, J.W. и Morrison, J.F., Meth. Enzymol, 63:437-467 (1979).
Пример B
Протокол анализа на ингибирование JAK1 и TYK2
Активность выделенных JAK1 или TYK2 киназных доменов измеряли мониторингом фосфорилирования пептида, полученного из JAK3 (Val-Ala-Leu-Val-Asp-Gly-Tyr-Phe-Arg-Leu-Thr-Thr), флуоресцентно меченного на N-конце 5-карбоксифлуоресцеином, применяя Caliper LabChip технологию (Caliper Life Sciences, Hopkinton, MA). Для определения константы ингибирования (Ki) примеров 1-312, соединения разбавляли последовательно в DMSO и добавляли к 50 мкл киназных реакционных смесей, содержащих 1,5 нМ JAK1, 0,2 нМ очищенного JAK2 или 1 нМ очищенного TYK2 фермента, 100 мМ Hepes pH 7,2, 0,015% Brij-35, 1,5 мкМ пептидного субстрата, 25 мкМ ATP, 10 мМ MgCl2, 4 мМ DTT при конечной концентрации в DMSO 2%. Реакционные смеси выдерживали при 22°C в 384-луночных полипропиленовых титрационных микропланшетах в течение 30 минут, и затем реакцию прекращали добавлением 25 мкл раствора, содержащего EDTA (100 мМ Hepes pH 7,2, 0,015% Brij-35, 150 мМ EDTA), что приводило в результате к конечной концентрации в EDTA, равной 50 мМ. После прекращения киназной реакции, долю фосфорилированного продукта определяли в виде фракции всего пептидного субстрата, применяя Caliper LabChip 3000 согласно инструкциям изготовителя. Затем, Ki величины определяли, применяя модель прочного связывания Моррисона. Morrison, J. F., Biochim. Biophys. Acta. 185:269-296 (1969); William, J.W. и Morrison, J.F., Meth. Enzymol, 63:437-467 (1979).
ПРИМЕР C
Протокол анализа на ингибирование JAK3
Активность выделенного JAK3 киназного домена измеряли мониторингом фосфорилирования пептида, полученного из JAK3 (Leu-Pro-Leu-Asp-Lys-Asp-Tyr-Tyr-Val-Val-Arg), флуоресцентно меченного на N-конце 5-карбоксифлуоресцеином, применяя Caliper LabChip технологию (Caliper Life Sciences, Hopkinton, MA). Для определения константы ингибирования (Ki) примеров 1-312, соединения разбавляли последовательно в DMSO и добавляли к 50 мкл киназных реакционных смесей, содержащих 5 нМ очищенного JAK3 фермента, 100 мМ Hepes pH 7,2, 0,015% Brij-35, 1,5 мкМ пептидного субстрата, 25 мкМ ATP, 10 мМ MgCl2, 4 мМ DTT при конечной концентрации в DMSO 2%. Реакционные смеси выдерживали при 22°C в 384-луночных полипропиленовых титрационных микропланшетах в течение 30 минут, и затем реакцию прекращали добавлением 25 мкл раствора, содержащего EDTA (100 мМ Hepes pH 7,2, 0,015% Brij-35, 150 мМ EDTA), что приводило в результате к конечной концентрации в EDTA, равной 50 мМ. После прекращения киназной реакции, долю фосфорилированного продукта определяли в виде фракции всего пептидного субстрата, применяя Caliper LabChip 3000 согласно инструкциям изготовителя. Затем, Ki величины определяли, применяя модель прочного связывания Моррисона. Morrison, J. F., Biochim. Biophys. Acta. 185:269-296 (1969); William, J.W. и Morrison, J.F., Meth. Enzymol, 63:437-467 (1979).
Пример D
Фармакологические анализы на основе клеток
Активности соединений 1-312 определяли в анализах на основе клеток, которые разработаны для измерения сигналов, зависимых от янус киназ.
Соединения последовательно разбавляли в DMSO и выдерживали с Set-2 клетками (German Collection of Microorganisms and Cell Cultures (DSMZ); Braunschweig, Germany), которые экспрессируют JAK2V617F мутантный белок, в 96-луночных титрационных микропланшетах в течение 1 часа при 37°C в RPMI среде при конечной плотности клеток, равной 105 клеток на лунку и конечной концентрации в DMSO 0,57%. Затем, эффекты, опосредованные соединениями, на STAT5 фосфорилирование измеряли в лизатах инкубированных клеток, применяя технологию Meso Scale Discovery (MSD) (Gaithersburg, Maryland) согласно протоколу изготовителя и определяли EC50 величины. Альтернативно, последовательно разбавленные соединения добавляли к NK92 клеткам (American Type Culture Collection (ATCC); Manassas, VA) в 96-луночных титрационных микропланшетах в RPMI среде при конечной плотности клеток, равной 105 клеткам на лунку и конечной концентрации в DMSO 0,57%. Затем, добавляли человеческий рекомбинантный IL-12 (R&D systems; Minneapolis, MN) при конечной концентрации 10 нг/мл к титрационным микропланшетам, содержащих NK92 клетки и соединение, и планшеты инкубировали в течение 1 часа при 37°C.
Затем, эффекты, опосредованные соединениями, на STAT4 фосфорилирование измеряли в лизатах инкубированных клеток, применяя технологию Meso Scale Discovery (MSD) (Gaithersburg, Maryland) согласно протоколу изготовителя и определяли EC50 величины.
ПРИМЕРЫ ПОЛУЧЕНИЯ
Сокращения
CD3OD дейтерированный метанол
DCM дихлорметан
DIPEA диизопропилэтиламин
DMSO диметилсульфоксид
DMF диметилформамид
EtOAc этилацетат
EtOH этанол
HCl хлороводородная кислота
HM-N Isolute® HM-N представляет собой модифицированную форму диатомита
IMS промышленный метиловый спирт
MeOH метанол
POCl3 хлорокись фосфора
NaH гидрид натрия
Na2SO4 сульфат натрия
NaHCO3 бикарбонат натрия
NaOH гидроксид натрия
Pd(PPh3)4 тетракис(трифенилфосфин)палладий(0)
NEt3 триэтиламин
Pd2dba3 трис(дибензилиденацетон)дипалладий(0)
Si-SPE расфасованный картридж с Isolute® силикагелем для флеш- хроматографии
Si-ISCO расфасованный картридж с ISCO® силикагелем для флеш- хроматографии
THF тетрагидрофуран
Общие условия экспериментов
1H ЯМР спектры регистрировали при температуре окружающей среды, применяя Varian Unity Inova (400МГц) спектрометр с 5мм датчиком тройного резонанса. Химические сдвиги выражены в м.д. относительно тетраметилсилана. Применяют следующие сокращения: br = уширенный синглет, s = синглет, d = дуплет, dd = дуплет дуплетов, t = триплет, q = квартет, m = мультиплет.
Эксперименты с жидкостной хроматографией высокого давления - масс-спектрометром (LCMS) для определения времени удержания (RT) и связанной с ним массы ионов проводили, применяя один из следующих способов.
Способ A: эксперименты проводили на Waters Micromass ZQ квадрупольном масс-спектрометре, соединенным с Hewlett Packard HP1100 LC системой с детектором на диодной матрице. Данная система применяет Higgins Clipeus 5 микронную C18 100×3,0 мм колонку и скорость потока 1 мл/минута. Первоначальной системой растворителей было 95% воды, содержащей 0,1% муравьиной кислоты (растворитель A) и 5% ацетонитрила, содержащего 0,1% муравьиной кислоты (растворитель B), в течение первой минуты, с последующим градиентом вплоть до 5% растворителя A и 95% растворителя B в течение следующих 14 минут. Конечную систему растворителей выдерживали без изменений в течение следующих 5 минут.
Способ B: эксперименты проводили на Waters Platform LC квадрупольном масс-спектрометре, соединенным с Hewlett Packard HP1100 LC системой с детектором на диодной матрице и автодозатором на 100 позиций, применяя Phenomenex Luna C18(2) 30×4,6 мм колонку и скорости потока 2 мл/минута. Первоначальной системой растворителей было 95% воды, содержащей 0,1% муравьиной кислоты (растворитель A) и 5% ацетонитрила, содержащего 0,1% муравьиной кислоты (растворитель B), в течение 0,50 минуты, с последующим градиентом вплоть до 5% растворителя A и 95% растворителя B в течение следующих 4 минут. Конечную систему растворителей выдерживали без изменений в течение следующих 0,50 минут.
Эксперименты с микроволновым излучением проводили, применяя Biotage Initiator 60™ или CEM Explorer®. Можно достигнуть температур 40-250 °C и давления вплоть до 30 бар.
В примерах, описанных ниже, если не указано особо, все температуры представлены в градусах Цельсия. Реагенты получали из коммерческих источников, таких как Aldrich Chemical Company, Lancaster, TCI или Maybridge, и применяли без дополнительной очистки, если не указано особо.
Реакции, приведенные ниже, проводили обычно при положительном давлении азота или аргона или с сушильной трубкой (если не указано особо) в безводных растворителях, и реакционные колбы обычно снабжали резиновой мембраной для введения субстратов и реагентов через шприц. Стеклянную посуду сушили в сушильном шкафу и/или сушили нагреванием.
Колоночную хроматографию проводили на Combiflash системе (Manufacturer: Teledyne Isco), содержащей колонку с силикагелем. 1H ЯМР спектры регистрировали на Varian приборе, работающем при 400 МГц. 1H ЯМР спектры получали в CDCl3, d6-DMSO или d4-MeOH растворах (приведенные в м.д.), применяя хлороформ в качестве внутреннего стандарта (7,25 м.д.). При сообщении мультиплетности пиков применяли следующие сокращения: s (синглет), d (дуплет), t (триплет), m (мультиплет), br (уширенный), dd (дуплет дуплетов), dt (дуплет триплетов). Константы связывания, когда они приводятся, представлены в герцах (Гц).
Пример 1

N-Пиперидин-4-ил-4-[8-(3-трифторметилфенил)-[1,2,4]триазоло[1,5 -a]пиридин-2-иламино]бензамид

Этил [(3-бромпиридин-2-ил)карбамотиоил]карбамат
К раствору 2-амино-3-бромпиридина (50,0 г, 289 ммоль, 1 экв) в дихлорметане (500 мл) добавляли по каплям этоксикарбонил изотиоцианат (39,0 г, 297 ммоль, 1,03 экв) при комнатной температуре. Через 2 часа дихлорметан удаляли в вакууме для того, чтобы получить неочищенный этил [(3-бромпиридин-2-ил) карбамотиоил]карбамат (88 г).

8-бром[1,2,4]триазоло[1,5-a]пиридин-2-амин
К раствору гидрохлорида гидроксиламина (0,10 кг, 1,4 моль, 5,0 экв) и N,N-диизопропилэтиламина (112 г, 0,867 моль, 3,00 экв) в смеси 1:1 метанол/этанол (1,5 л) добавляли этил [(3-бромпиридин-2-ил)карбамотиоил]карбамат (88 г, 0,29 ммоль, 1 экв) одной порцией при комнатной температуре. Через 2 часа реакционную смесь нагревали до 60°C в течение ночи. Реакционную смесь концентрировали в вакууме, и добавляли к полученному в результате остатку воду. Твердый остаток отфильтровывали и промывали последовательно смесью 4:1 метанол/диэтиловый эфир и диэтиловым эфиром для того, чтобы получить продукт в виде грязно-белого твердого остатка (25 г, 40%). LCMS (ESI) m/z: 212,8; 1H ЯМР (400 МГц, DMSO-d6) δ: 8,55 (м, 1 H), 7,70 (м, 1 H), 6,75 (м, 1 H), 6,20 (уш. с, 2 H).

Ди-трет-бутил (8-бром[1,2,4]триазоло[1,5-a]пиридин-2-имидодикарбонат
Раствор 8-бром-[1,2,4]триазоло[1,5-a]пиридин-2-амина (10,6 г, 49,7 ммоль, 1 экв), ди-трет-бутилдикарбоната (43,6 г, 0,200 моль, 4,01 экв) и 4-диметиламинопиридина (0,61 г, 5,0 ммоль, 0,10 экв) в пиридине (200 мл) грели при 50°C в течение ночи. Реакционную смесь концентрировали в вакууме. Полученный в результате остаток распределяли между водой и диэтиловым эфиром. Органический слой отделяли и промывали водой (3×). Фильтрация органического слоя через слой силикагеля (4:1 петролейный эфир/ этилацетат) давала неочищенный продукт. (14,8 г, 72%). 1H ЯМР (400 МГц), DMSO-d6) δ: 9,0 (м, 1 H), 8,1 (м, 1 H), 7,2 (м, 1 H), 1,4 (с, 18 H).

8-(3-(трифторметил)фенил)[1,2,41триазоло[1,5-a]пиридин-2-амин
Раствор ди-трет-бутил (8-бром[1,2,4]триазоло[1,5-a]пиридин-2-ил)имидодикарбоната (3,3 г, 8,0 ммоль, 1 экв), дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия (II) (0,584 г, 0,798 ммоль, 0,10 экв), карбоната цезия (3,1 г, 9,5 ммоль, 1,2 экв) и 3-трифторметилфенилбороновой кислоты (1,8 г, 9,5 ммоль, 1,2 экв) в смеси 10:1 1,2-диметоксиэтан/вода (50 мл) грели при 120°C в течение ночи. Реакционную смесь концентрировали в вакууме, и полученный в результате остаток распределяли между этилацетатом и водой. Объединенные органические фракции сушили над безводным сульфатом натрия, фильтровали и концентрировали. Очистка колоночной флеш-хроматографией (4:1 петролейный эфир/этилацетат) давала ди-трет-бутил (8-(3-трифторметилфенил[1,2,4]триазоло[1,5-a]пиридин-2-ил)имидодикарбонат (3,17 г, 83%).
Ди-трет-бутил (8-(3-трифторметилфенил[1,2,4]триазоло[1,5-a]пиридин-2-ил)имидодикарбонат (3,15 г, 6,58 ммоль, 1 экв) растворяли в растворе хлороводорода в диоксане (50 мл). Реакционную смесь выдерживали при комнатной температуре в течение ночи. Диоксан удаляли в вакууме, и полученный в результате остаток растворяли в дихлорметане (100 мл). Органический слой промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали для того, чтобы получить продукт (1,41 г, 77 %). LCMS (ESI) m/z: 279,1.
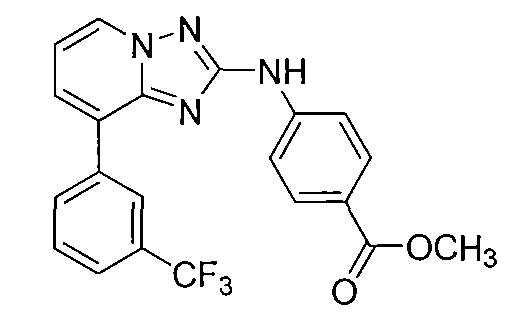
Метил 4-(8-(3-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензоат
Суспензию 8-(3-(трифторметил)фенил)[1,2,4]триазоло[1,5- a]пиридин-2-амина (1,0 г, 3,6 ммоль, 1 экв), метил 4-йодбензоата (0,95 г, 3,6 ммоль, 1,0 экв), ацетата палладия (II) (0,080 г, 0,36 ммоль, 0,10 экв), карбоната цезия (2,34 г, 7,18 ммоль, 2,0 экв) и ксантфоса (0,10 г, 0,17 ммоль, 0,047 экв) в 1,4-диоксане (20 мл) нагревали до 80 °C. Через 16 часов реакционную смесь концентрировали в вакууме, и полученный в результате остаток разбавляли метанолом и водой. Твердый остаток собирали фильтрацией и промывали последовательно водой, изопропанолом и гексаном для того, чтобы получить неочищенный метил 4-(8-(3-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензоат (1,07 г, 72%). LCMS (ESI) m/z: 413,0; 1H ЯМР (400 МГц, DMSO-J6) δ: 10,29 (с, 1 H), 8,88 (м, 1 H), 8,63 (с, 1 H), 8,40 (м, 1 H), 8,02 (м, 1 H), 7,78-7,90 (м, 6 H), 7,20 (м, 1 H), 3,80 (с, 3 H).

4-(8-(3-(трифторметил)фенил)-[1,2,4]триазоло|1,5-a]пиридин-2-иламино)бензойная кислота
Раствор метил 4-(8-(3-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензоата (1,03 г, 2,50 ммоль, 1 экв) в 2M водном гидроксиде натрия (10 мл) и 1,4-диоксане (5 мл) грели при 80-90°C. Через 3 часа раствор охлаждали до 0°C и нейтрализовали добавлением 6M HCl до pH=4-5. Полученный в результате твердый остаток собирали фильтрацией и промывали последовательно водой, изопропанолом и гексаном для того, чтобы получить неочищенную 4-(8-(3-(трифторметил)фенил)-[1,2,4] триазоло[1,5-a]пиридин-2-иламино)бензойную кислоту (1,0 г, ВЭЖХ чистота: 89%). LCMS (ESI) m/z: 398,9; 1H ЯМР (400 МГц, DMSO-d6) δ: 12,45 (уш. с, 1 H), 10,22 (с, 1 H), 8,89 (д, J=6,8 Гц, 1 H), 8,65 (с, 1 H), 8,42 (д, J=6,9 Гц, 1 H), 8,03 (м, 1 H), 7,77-7,84 (м, 6 H), 7,21 (т, J=7,0 Гц, 1 H).
N-Пиперидин-4-ил-4-[8-(3-трифторметилфенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино]бензамид
К раствору 4-(8-(3-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензойной кислоты (1,0 г, 2,5 ммоль, 1 экв), гексафторфосфата O-(7-Азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (1,14 г, 3,00 ммоль, 1,2 экв), N,N-диизопропилэтиламина (484 мг, 3,74 ммоль, 1,5 экв) в смеси 2:1 тетрагидрофуран/дихлорметан (50 мл) добавляли трет-бутил 4-амино-1-пиперидинкарбоксилат (0,60 г, 3,0 ммоль, 1,2 экв) при комнатной температуре. Через 16 часов реакционную смесь фильтровали, и фильтрат концентрировали. Полученный в результате остаток растворяли в смеси 1:1 трифторуксусная кислота/ тетрагидрофуран (50 мл) при комнатной температуре. Через 2 часа реакционную смесь концентрировали в вакууме. Очистка препаративной ВЭЖХ давала продукт (508 мг, 42%). LCMS (ESI) m/z: 481,0; 1H ЯМР (400 МГц, DMSO-d6) δ: 10,06 (с, 1 H), 8,85 (д, J=7,6 Гц, 1 H), 8,60 (с, 1 H), 8,38 (д, J=8,8 Гц, 1 H), 7,98 (д, J=8,8 Гц, 1 H), 7,84 (уш. с, 2 H), 7,72-7,79 (м, 3 H), 7,32 (д, J=7,6 Гц, 2 H), 7,15 (м, 1 H), 4,02 (м, 1 H), 3,27-3,32 (м, 2 H), 2,95-3,05 (м, 2 H), 1,87-1,94 (м, 2 H), 1,41-1,48 (м, 2 H).
Пример 2
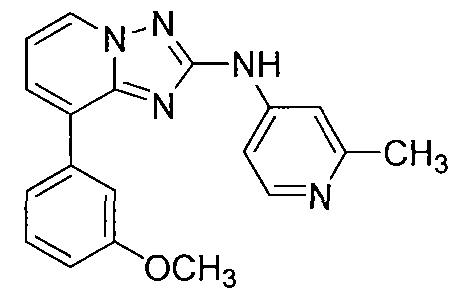
[8-(3-Метоксифенил[1,2,4]триазол[1,5-a]пиридин-2-ил]-(2-метилпиридин-4-ил)амин

8-(3-метоксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин
Следовали методике, описанной для получения 8-(3-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амина, но с 3-метоксифенилбороновой кислотой, и вводили некритические изменения.
[8-(3-Метоксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-ил]-(2-метилпиридин-4-ил)амин
Суспензию 8-(3-метоксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амина (0,150 г, 0,625 ммоль, 1 экв), 4-бром-2-метилпиридина (0,160 г, 0,935 ммоль, 1,5 экв), трис(дибензилиденацетон)дипалладия (0) (27,5 мг, 0,03 ммоль, 0,05 экв), трет-бутоксида натрия (0,90 г, 0,94 ммоль, 1,5 экв) и 2,2'-бис[ди(3,5-ксилил)фосфино]-1,1'-бинафтила (38,9 мг, 0,625 ммоль, 0,1 экв) в толуоле (2 мл) продували азотом в течение 15 минут. Реакционную смесь грели при 110°C микроволновым излучением в течение 10 минут. Реакционную смесь разбавляли этилацетатом (50 мл) и фильтровали через целит. Затем, фильтрат промывали соляным раствором (3×20 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали. Очистка препаративной ВЭЖХ давала 8-(3-метоксифенил)-N-(2-метилпиридин-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин (80 мг, 39%). LCMS (ESI) m/z: 332,1; 1H ЯМР (400 МГц, DMSO-d6) δ: 10,45 (уш. с, 1 H), 8,81 (дд, J=6,4, 0,8 Гц, 1 H), 8,23 (д, J=6,0 Гц, 1 H), 7,88 (дд, J=6,8, 0,8 Гц, 1 H), 7,74 (с, 1 H), 7,64 (д, J=8,0 Гц, 1 H), 7,57 (с, 1 H), 7,54 (дд, J=6,0, 2,0 Гц, 1 H), 7,41 (т, J=8,0 Гц, 1 H), 7,15 (т, J=6,8 Гц, 1 H), 7,00 (дд, J=8,0, 2,4 Гц, 1 H), 3,83 (с, 3 H), 2,42 (с, 3 H).
Примеры 3-126, показанные в таблице 1, получали согласно способам, описанным выше.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пример 127

4-(8-(1-циклопентил-1H-пиразол-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензойная кислота

метил 4-(8-бром-[1,2,4|триазоло[1,5-a]пиридин-2-иламино)бензоат
Суспензию 8-бром-[1,2,4]триазоло[1,5-a]пиридин-2-амина (2,8 г, 13,2 ммоль, 1 экв), метил 4-йодбензоата (3,4 г, 13 ммоль, 1,0 экв), карбоната цезия (8,4 г, 26 ммоль, 2,0 экв), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (763 мг, 1,32 ммоль, 0,10 экв) и ацетата палладия (II) (300 мг, 1,32 ммоль, 0,10 экв) в диоксане (100 мл) грели при 80°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и разбавляли дихлорметаном (100 мл). Полученный в результате твердый остаток фильтровали и последовательно промывали водой (3×50 мл) и метанолом (2×20 мл). Твердый остаток сушили в вакууме для того, чтобы получить метил 4-(8-бром-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензоат (3,1 г). 1H ЯМР (400 МГц, DMSO-d6), δ: 10,42 (с, 1 H), 8,87 (м, 1 H), 7,93 (м, 1 H), 7,92 (д, J=8,8 Гц, 2 H), 7,77 (д, J=8,8 Гц, 2 H), 7,00 (дд, J=7,4, 6,9 Гц, 1 H), 3,81 (с, 3 H).
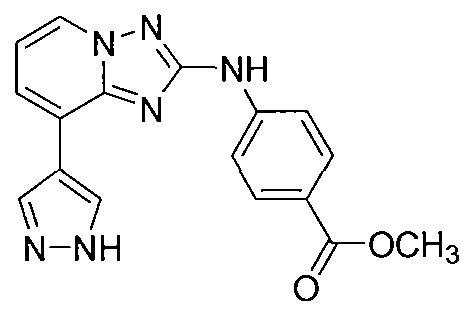
метил 4-(8-(1-циклопентил-1H-пиразол-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензоат
Суспензию метил 4-(8-бром-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензоата (0,800 г, 2,30 ммоль, 1 экв), 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола (894 мг, 4,60 ммоль, 2,00 экв), хлорида 1,1'-бис(дифенилфосфино)ферроценпалладия(II) (376 мг, 0,461 ммоль, 0,200 экв) и карбоната цезия (1,50 г, 4,61 ммоль, 2,00 экв) в смеси 5:1 1,2-диметоксиэтан/вода (6 мл) вакуумировали и наполняли азотом (3x). Реакционную смесь грели при 140°C в течение 30 минут микроволновым излучением. LCMS реакционной смеси показало -60% превращение, и добавляли дополнительное количество хлорида бис(дифенилфосфино)ферроценпалладия(II) (95 мг, 0,12 ммоль, 0,05 экв) и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола (225 мг, 1,16 ммоль, 0,500 экв). Затем, реакционную смесь грели при 140°C в течение 30 минут микроволновым излучением. Твердый остаток собирали фильтрацией и очищали колоночной флеш-хроматографией (10% метанол, 1% гидроксид аммония в дихлорметане) для того, чтобы получить серый твердый остаток (620 мг, 80% выход). LCMS (ESI) m/z: 335,0.

метил 4-(8-(1-циклопентил-1H-пиразол-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензоат
Суспензию метил 4-(8-(1H-пиразол-4-ил)-[1,2,4]триазоло[1,5- a]пиридин-2-иламино)бензоата (43 мг, 0,13 ммоль, 1 экв), циклопентилбромида (41 мкл, 0,38 ммоль, 3,0 экв) и карбоната цезия (126 мг, 0,383 ммоль, 3,0 экв) в N,N-диметилформамиде (1 мл) грели при 100°C. Через 2 часа реакционную смесь разбавляли этилацетатом, и полученный в результате раствор промывали насыщенным водным раствором хлорида натрия. Объединенные органические фракции концентрировали. Очистка полученного в результате остатка колоночной флеш-хроматографией (20% этилацетат в дихлорметане) давала белый твердый остаток (23,5 мг, 45% выход). 1H ЯМР (400 МГц, DMSO-d6) δ 10,18 (с, 1 H), 8,74-8,55 (м, 2 H), 8,32 (с, 1 H), 7,91 (дд, J=13,9, 8,1 Гц, 3 H), 7,85 (д, J=8,9 Гц, 2 H), 7,10 (т, J=7,0 Гц, 1 H), 4,81 (с, 1 H), 3,82 (с, 3 H), 2,25-2,11 (м, 2 H), 2,11-1,93 (м, 2 H), 1,85 (д, J=3,5 Гц, 2 H), 1,77-1,63 (м, 2 H).
4-(8-(1-циклопентил-1H-пиразол-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензойная кислота
Следовали методике, описанной для получения 4-(8-(3-трифторметил)фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензойной кислоты и вносили некритические изменения. 1H ЯМР (400 МГц, DMSO-d6) δ 12,43 (с, 1 H), 10,12 (с, 1 H), 8,74-8,60 (м, 2 H), 8,32 (с, 1 H), 7,90 (т, J=6,8 Гц, 3 H), 7,83 (д, J=8,8 Гц, 2 H), 7,09 (с, 1 H), 4,81 (д, J=7,0 Гц, 1 H), 2,16 (м, 2 H), 2,00 (м, 2 H), 1,94-1,79 (м, 2 H), 1,72 (дд, J=14,6, 8,1 Гц, 2 H).
Пример 128

(R)-1-(4-(8-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1H-пиразол-1-ил)пропан-2-ол

8-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин
Следовали методике, описанной для получения 8-(3-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амина с 4-метоксифенилбороновой кислотой и вносили некритические изменения.

2-йод-8-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиридин
Раствор йодида калия (5,4 г, 32 ммоль, 3,9 экв) и нитрита натрия (1,73 г, 25,1 ммоль, 3,00 экв) в воде (10 мл) добавляли в течение 5 минут к раствору 8-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амина (2,01 г, 8,36 ммоль, 1 экв) и п-толуолсульфокислоты (7,3 г, 38 ммоль, 4,6 экв) в ацетонитриле при 24°C. Через 19 часов реакционную смесь разбавляли этилацетатом (250 мл), и полученный в результате раствор промывали последовательно водой (2×120 мл) и насыщенным водным раствором хлорида натрия (120 мл). Объединенные органические фракции сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Очистка колоночной флеш-хроматографией (20→30% этилацетата в гептане) давала продукт в виде светло-желтого твердого остатка (1,92 г, 65% выход). 1H ЯМР (400 МГц, CDCl3), δ: 8,46 (дд, J=6,8, 1,0 Гц, 1 H), 7,96 (м, 2 H), 7,59 (дд, J=7,4, 1,1 Гц, 1 H), 7,01-7,06 (м, 3 H), 3,86 (с, 3 H).
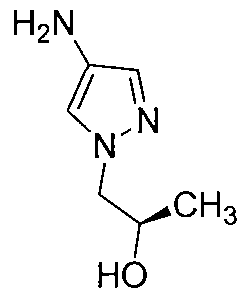
Получение (R)- 1-(4-амино-1H-пиразол-1-ил)пропан-2-ола
К раствору 4-нитропиразола (44,7 мг, 0,395 ммоль, 1 экв) в (R)-пропиленоксиде (1 мл) добавляли карбонат цезия (78 мг, 0,24 ммоль, 0,61 экв) при 24°C. Через 64 часа реакционную смесь распределяли между этилацетатом (3 мл) и на половину насыщенным водным раствором хлорида натрия (3 мл). Органический слой отделяли, и оставшуюся водную фазу экстрагировали этилацетатом (2×3 мл). Объединенные органические фракции сушили над безводным сульфатом натрия, фильтровали и концентрировали. Полученный в результате остаток растворяли в метаноле (4 мл) и пропускали через H-Cube® реактор гидрогенизации с непрерывным потоком (ThalesNano), снабженный картриджем с палладием на угле, при 30°C. Полученный в результате раствор концентрировали в вакууме для того, чтобы получить продукт в виде розового масла, который применяли без дальнейшей очистки. 1H ЯМР (500 МГц, CDCl3), δ: 7,17 (с, 1 H), 7,01 (с, 1 H), 4,13 (м, 1 H), 4,00 (дд, J=13,8, 2,7 Гц, 1 H), 3,84 (дд, J=13,8, 7,9 Гц, 1 H), 3,47 (с, 1 H), 3,15 (уш. с, 2 H), 1,18 (д, J=6,3 Гц, 3 H).
(R)-1-(4-(8-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1H-пиразол-1-ил)пропан-2-ол
Суспензию 2-йод-8-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиридина (53,6 мг, 0,153 ммоль, 1 экв), (R)-1-(4-амино-1H-пиразол-1-ил)пропан-2-ола (27 мг, 0,19 ммоль, 1,2 экв), трет-бутоксида натрия (43,1 мг, 0,448 ммоль, 2,94 экв), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (15,2 мг, 0,0263 ммоль, 0,172 экв) и трис(дибензилиденацетон)дипалладия (O) (10,5 мг, 0,0115 ммоль, 0,0751 экв) в диоксане (2 мл) грели при 170°C при микроволновом излучении в течение 15 минут. Реакционную смесь распределяли между насыщенным водным раствором хлорида натрия (5 мл) и этилацетат (5 мл). Органический слой отделяли, и водный слой экстрагировали этилацетатом (2×5 мл). Объединенные органические фракции сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Очистка колоночной флеш-хроматографией (5% метанола в дихлорметане) давала продукт в виде белого твердого остатка (42,4 мг, 73% выход). 1H ЯМР (400 МГц, DMSO-d6), δ: 9,32 (с, 1 H, NH), 8,64 (дд, J=6,6, 0,9 Гц, 1 H), 8,13 (дд, J=8,8 Гц, 2 H), 7,81 (с, 1 H), 7,74 (дд, J=7,5, 0,9 Гц, 1 H), 7,47 (с, 1 H), 7,08 (д, J=8,9 Гц, 2 H), 7,03 (т, J=7,0 Гц, 1 H), 4,92 (д, J=4.7 Гц, 1 H, OH), 3,96 (м, 3 H), 3,83 (с, 3 H), 1,04 (д, J=5,8 Гц, 3 H).
Пример 129

8-(4-Метоксифенил)-N-(1-(тетрагидро-2H-пиран-4-ил)-1H-пиразол-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин

4-нитро-1-(тетрагидро-2H-пиран-4-ил)-1H-пиразол
Методика, заимствованная из Zabierek, A. A.; Konrad, K. M.; Haidle, A. M. Tetrahedron Lett. 2008, 49, 2996.
К раствору 4-нитро-1H-пиразола (0,40 мг, 3,5 ммоль, 1 экв), 4-гидрокситетрагидропирана (0,36 г, 3,6 ммоль, 1,0 экв) и трифенилфосфина (1,1 г, 4,2 ммоль, 1,3 экв) в тетрагидрофуране (10 мл) при 20°C добавляли дибензилазодикарбоксилат (1,1 г, 4,6 ммоль, 1,3 экв) в тетрагидрофуране (2 мл) в течение 5 минут. Через 3 часа реакционную смесь концентрировали в вакууме, и полученный в результате остаток очищали колоночной флеш-хроматографией (40% этилацетат в гексане) для того, чтобы получить продукт в виде белого твердого остатка (568 мг, 81% выход). 1H ЯМР (400 МГц, CD3OD) δ 8,64 (с, 1H), 8,13 (с, 1H), 4,49 (с, 1H), 4,15-3,94 (м, 2H), 3,72-3,45 (м, 2H), 2,24-1,95 (м, 4H).
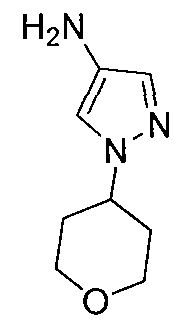
1-(тетрагидро-2H-пиран-4-ил)-1H-пиразол-4-амин
Раствор 4-нитро-1-(тетрагидро-2H-пиран-4-ил)-1H-пиразола (568 мг, 2,88 ммоль, 1 экв) в метаноле пропускали через H-Cube® реактор гидрогенизации с непрерывным потоком (ThalesNano), снабженный картриджем с палладием на угле, при 50°C. Объединенный раствор концентрировали в вакууме для того, чтобы получить продукт в виде розового твердого остатка (458 мг, 95% выход). LCMS (ESI) m/z: 168,0.
8-(4-Метоксифенил)-N-(1-(тетрагидро-2H-пиран-4-ил)-1H-пиразол-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин
Следовали методике, описанной для получения (R)-1-(4-(8-(4-метоксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1H- пиразол-1-ил)пропан-2-ола с 1-(тетрагидро-2H-пиран-4-ил)-1H-пиразол-4-амином и вносили некритические изменения. 1H ЯМР (400 МГц, DMSO-d6) δ 9,31 (с, 1H), 8,64 (дд, J=6,6, 0,9 Гц, 1 H), 8,14 (д, J=8,9 Гц, 2 H), 7,87 (с, 1 H), 7,73 (м, 1 H), 7,50 (с, 1 H), 7,08 (д, J=8,9 Гц, 3 H), 4,35 (м, 1 H), 3,98 (дд, J=13,4, 10,9 Гц, 2 H), 3,83 (с, 3 H), 3,47 (м, 2 H), 1,93 (м, 4 H).
Примеры 130-312, показанные в таблице 2, получали согласно описанным выше способам.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Хотя настоящее изобретение описано и проиллюстрировано достаточно подробно, ясно, что настоящее описание сделано только в качестве примера, и что специалисты в данной области техники могут прибегнуть к многочисленным изменениям в комбинациях и расположениях частей, не выходя за рамки сущности и объема настоящего изобретения, как определено формулой изобретения.