КОМПОЗИЦИЯ ДЛЯ УЛУЧШЕНИЯ СОСТОЯНИЯ ПРИ ГИПОАЛЬБУМИНЕМИИ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции для улучшения состояния при гипоальбуминемии, и, конкретно, относится к композиции для улучшения состояния при гипоальбуминемии, для предпочтительного применения в формах, таких как инфузионная готовая лекарственная форма, пероральная готовая лекарственная форма и пища или питье.
Предшествующий уровень техники
Обычно аминокислотные препараты, содержащие аминокислоты с разветвленной цепью, широко применяются с целью улучшения состояния при гипоальбуминемии и т.п., вызываемого болезнью печени и т.д. Требуется, чтобы такие аминокислотные препараты для улучшения состояния при гипоальбуминемии, содержащие аминокислоты с разветвленной цепью, обладали промоторным эффектом на выработку альбумина в качестве показателя эффективности действия и снижением побочных эффектов в качестве показателя безопасности. Три аминокислоты, валин, лейцин и изолейцин, представляют собой аминокислоты с разветвленной цепью. Например, Livact (зарегистрированный товарный знак) представляет собой пример аминокислотных препаратов, содержащих все из валина, лейцина и изолейцина в качестве активных ингредиентов, и широко применяется.
Такие обычно применяемые аминокислотные препараты, содержащие все из трех аминокислот с разветвленной цепью, все еще не соответствуют требованию клинической практики к эффекту улучшения состояния при гипоальбуминемии у пациента с болезнью печени. С точки зрения вышеуказанной эффективности действия, необходимой является разработка нового медицинского лекарственного средства и пищи для дополнительного улучшения состояния при гипоальбуминемии.
Кроме того, обычно применяемые аминокислотные препараты, содержащие все из трех аминокислот с разветвленной цепью, могут проявлять побочные эффекты, такие как тошнота, ощущение переполнения желудка, диарея, запор, дискомфорт в животе, боль в животе, рвота, отсутствие аппетита и изжога. Эти побочные эффекты обусловлены тяжелой белковой нагрузкой на организм. Следовательно, обычно применяемые аминокислотные препараты, содержащие большое количество белка, могут снизить степень соблюдения режима лечения. Конкретно, также с учетом вышеуказанной позиции безопасности, было решено разработать лекарственное средство и пищу для улучшения состояния при гипоальбуминемии, обладающие незначительными побочными эффектами и обеспечивающие хорошее соблюдение режима лечения.
Затем, с позиций вышеуказанных эффективности действия и безопасности, была предложена технология с учетом взаимодействий, таких как аддитивное действие, синергистическое действие и антагонистическое действие, между активными ингредиентами, такими как валин, лейцин и изолейцин в указанном выше аминокислотном препарате. Например, Патент Японии № 3712539 раскрывает композицию, содержащую только один L-валин в качестве активного ингредиента, для улучшения состояния или лечения гипоальбуминемии, ассоциированной с ухудшением функции печени. Такая композиция характеризуется как не содержащая аминокислот, за исключением L-валина в качестве активного ингредиента, и утверждают, что она имеет незначительные побочные эффекты и обладает способностью, например, улучшать состояние при болезни печени и т.д.
Однако указанные выше обычно используемые аминокислотный препарат и композиция, раскрытые в Патенте Японии № 3712539, не могут в достаточной степени проявлять эффективность действия, которой, как ожидают, должен обладать аминокислотный препарат, особенно, промоторный эффект на выработку альбумина. Другими словами, высокобезопасный аминокислотный препарат, и т.д. имеющий меньше побочных эффектов, в то же время проявляющий высокий промоторный эффект на выработку альбумина пока еще не был предоставлен.
Документ предшествующего уровня
Патентный документ
Патентный документ 1: патент Японии № 3712539
Сущность изобретения
Задача, решаемая изобретением
Настоящее изобретение было создано с учетом этих недостатков и направлено на предоставление высоко безопасной композиции для улучшения состояния при гипоальбуминемии, проявляющей высокий промоторный эффект на выработку альбумина, а также имеющей меньше побочных эффектов.
Средства для решения задачи
Авторы настоящего изобретения предположили, что валин среди аминокислот с разветвленной цепью, т.е. валина, лейцина и изолейцина, может обладать антагонистическим действием (ингибиторным действием) против промоторного эффекта на выработку альбумина лейцина и изолейцина в человеческих гепатоцитах, и, вследствие этого, обнаружили, что композиция, содержащая лейцин и/или изолейцин за исключением валина в качестве активного ингредиента имеет особенно высокий промоторный эффект на выработку альбумина на уровне человеческих гепатоцитов.
В результате, изобретение, созданное для решения указанных выше проблем, направлено на композицию для улучшения состояния при гипоальбуминемии, содержащую аминокислоту с разветвленной цепью в качестве активного ингредиента, где композиция содержит лейцин и/или изолейцин и не содержит валин в качестве активного ингредиента.
Поскольку композиция для улучшения состояния при гипоальбуминемии, по существу, не содержит валин, антагонистическое действие валина против промоторного эффекта на выработку альбумина от других активных ингредиентов, т.е. лейцина и/или изолейцина, исключается. В результате, другие активные ингредиенты за исключением валина могут эффективно проявлять высокий промоторный эффект на выработку альбумина. Кроме того, поскольку композиция для улучшения состояния при гипоальбуминемии, по существу, не содержит валин в качестве активного ингредиента, белковая нагрузка может быть снижена как раз за счет количества валина, с тем результатом, что побочный эффект может быть снижен и безопасность может быть улучшена. В особенности, композиция для улучшения состояния при гипоальбуминемии, которая не содержит валин в количестве, соответствующем количеству активного ингредиента, может значительно снижать существенную нагрузку от глюкозы на пациента с болезнью печени, который находится в состоянии нарушенной переносимости глюкозы, и является также применимой при контроле глюкозы в крови.
Композиция для улучшения состояния при гипоальбуминемии предпочтительно содержит лейцин и изолейцин в качестве аминокислоты с разветвленной цепью. Как описано, поскольку композиция для улучшения состояния при гипоальбуминемии содержит как лейцин, так и изолейцин в качестве аминокислоты с разветвленной цепью, промоторные эффекты на выработку альбумина, которые раздельно имеют лейцин и изолейцин, могут быть оказаны аддитивным образом.
Как описано, в случае, где лейцин и изолейцин содержатся в качестве аминокислот с разветвленной цепью, массовое отношение лейцина к изолейцину составляет предпочтительно от 0,1 к 10. Посредством установления, таким образом, массового отношения лейцина к изолейцину в указанном выше интервале, вышеуказанный промоторный эффект на выработку альбумина, улучшенный аддитивным образом, может эффективно проявляться.
Кроме того, композиция для улучшения состояния при гипоальбуминемии может содержать либо лейцин, либо изолейцин в качестве аминокислоты с разветвленной цепью. Посредством получения, таким образом, композиции, содержащей либо лейцин, либо изолейцин по отдельности, белковая нагрузка in vivo может быть дополнительно более снижена, и баланс между эффективностью действия и безопасностью может поддерживаться, например, в зависимости от состояния пациента с болезнью печени.
Композиция для улучшения состояния при гипоальбуминемии предпочтительно применяется в виде инфузионной готовой лекарственной формы. Посредством получения, таким образом, композиции для улучшения состояния при гипоальбуминемии в виде инфузионной готовой лекарственной формы, композиция для улучшения состояния при гипоальбуминемии может быстро и эффективно вводиться внутрисосудисто.
Композиция для улучшения состояния при гипоальбуминемии предпочтительно применяется в виде пероральной лекарственной готовой формы. Посредством получения, таким образом, композиции для улучшения состояния при гипоальбуминемии в виде пероральной готовой лекарственной формы, композиция для улучшения состояния при гипоальбуминемии может легко и просто вводиться неинвазивным образом в живой организм.
Композиция для улучшения состояния при гипоальбуминемии может применяться в виде пищи или питья. Посредством получения, таким образом, композиции для улучшения состояния при гипоальбуминемии в виде пищи или питья, композиция для улучшения состояния при гипоальбуминемии может дополнительно более легко и просто вводиться по сравнению с пероральной готовой лекарственной формой и, особенно, может способствовать улучшению КЖ (Качества Жизни).
В данном описании, термин "аминокислота с разветвленной цепью", который относится к трем незаменимым аминокислотам, лейцину, изолейцину и валину, представляет собой понятие, включающее также их соли, пептиды или производные. "Активный ингредиент" относится к компоненту, содержащемуся в количестве, достаточном, чтобы самому по себе проявлять промоторный эффект на выработку альбумина.
Эффект изобретения
Как объясняется в вышесказанном, композиция для улучшения состояния при гипоальбуминемии настоящего изобретения содержит аминокислоту с разветвленной цепью в качестве активного ингредиента. Поскольку валин не содержится, по существу, в качестве аминокислоты с разветвленной цепью, если композиция применяется в форме, например, препарата, проявляется высокий промоторный эффект на выработку альбумина; в то же время, показана высокая безопасность вследствие меньших побочных эффектов. В особенности, поскольку существенная нагрузка глюкозой на пациента с болезнью печени, который находится в состоянии нарушенной переносимости глюкозы, может быть значительно снижена, вышеуказанные традиционные проблемы могут быть решены в достаточной степени.
Конкретно, композиция для улучшения состояния при гипоальбуминемии может предотвратить или улучшить состояние гипоальбуминемии, вызванное снижением экзогенного ввода питания при несварении и недостаточном питании, условиями низкого питания после хирургических операций, снижением выработки белка при болезнях печени, таких как гепатит и цирроз; утечкой белков in vivo из организма, наблюдаемой, например, при нефротическом синдроме и гастроэнтеропатии с потерей белка и ожоге; гиперкатаболизмом белков in vivo, наблюдаемой при заболеваниях, таких как серьезная инфекция, лихорадка, гипертиреоз и злокачественные опухоли; и большим количеством плевральной эффузии и накоплением асцитной жидкости, водянкой и ожогом. Кроме того, композиция для улучшения состояния при гипоальбуминемии может предотвратить или улучшить симптомы, такие как судорога в ногах, отек легких, асцитный выпот и отек, вызываемые гипоальбуминовым состоянием, как указано выше.
Краткое описание чертежа
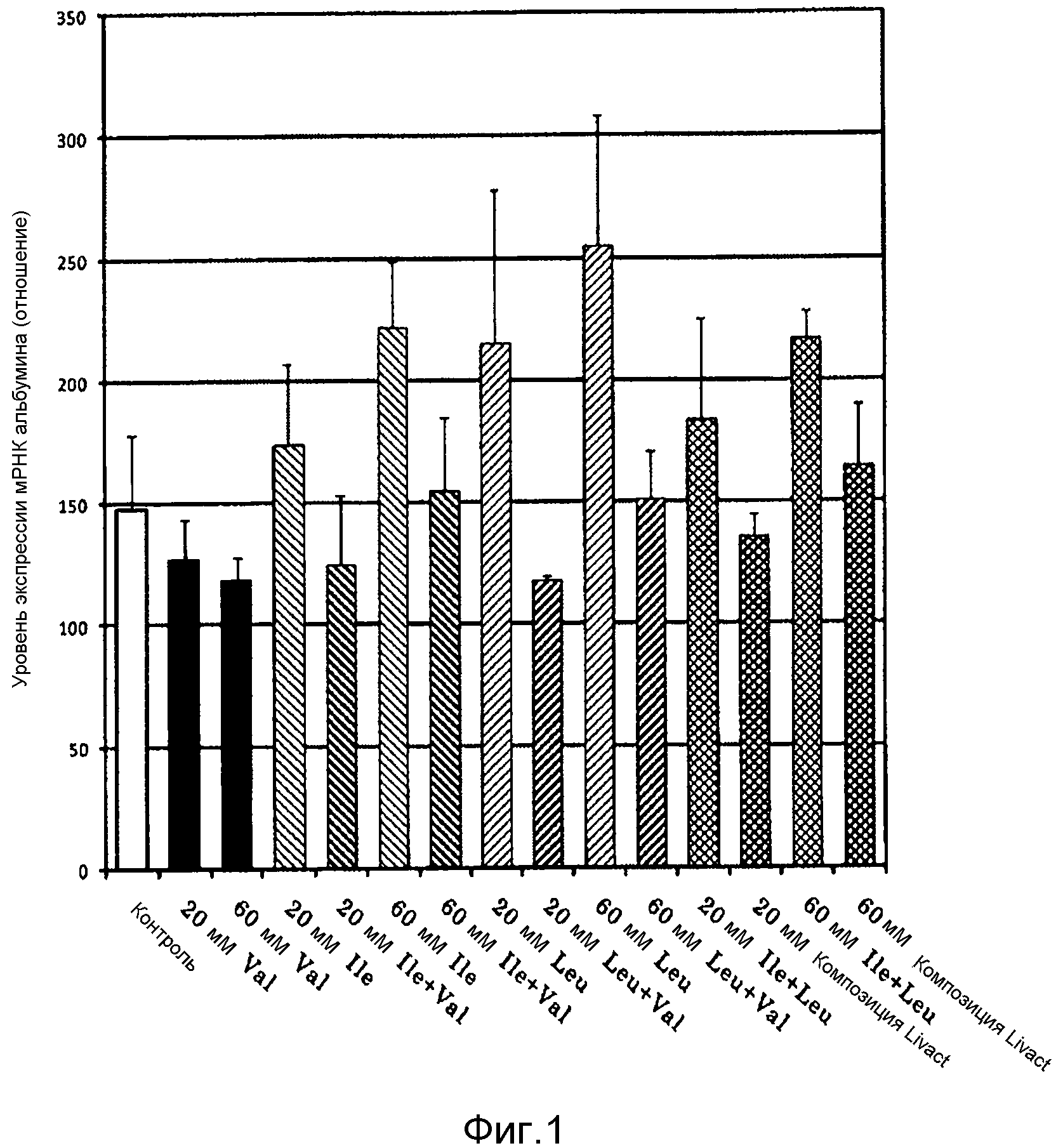
Фигура 1 представляет собой график, показывающий результаты Эксперимента 1.
Способ осуществления изобретения
Теперь, варианты осуществления изобретения будут описаны подробно ниже.
Композиция для улучшения состояния при гипоальбуминемии
Композиция для улучшения состояния при гипоальбуминемии содержит аминокислоту с разветвленной цепью в качестве активного ингредиента, где композиция содержит лейцин и/или изолейцин и не содержит валин в качестве активного ингредиента.
Как описано выше, поскольку композиция для улучшения состояния при гипоальбуминемии, по существу, не содержит валин в качестве активного ингредиента, несмотря на то, что подробности механизма являются неизвестными, считается, что композиция имеет следующие рабочие эффекты (A) и (B).
(A) Валин представляет собой ингибирующий фактор других веществ, служащих в качестве активных ингредиентов, таких как лейцин, и предполагают, что он имеет антагонистическое действие против промоторного эффекта на выработку альбумина, проявляемого активными ингредиентами, такими как лейцин, in vivo. Соответственно, композиция для улучшения состояния при гипоальбуминемии не содержит валин, по существу, в качестве активного ингредиента, посредством чего полностью устраняется антагонистическое действие валина против промоторного эффекта на выработку альбумина лейцина и/или изолейцина. В результате считают, что активный ингредиент, за исключением валина, такой как лейцин, может эффективно проявлять высокий промоторный эффект на выработку альбумина in vivo.
(B) Поскольку композиция для улучшения состояния при гипоальбуминемии не содержит валин, по существу, белковая нагрузка может быть снижена как раз за счет содержания валина, особенно когда он применяется в форме препарата. Вследствие этого, композиция для улучшения состояния при гипоальбуминемии может снижать побочные эффекты, такие как симптомы пищеварительной системы и симптомы почечной системы, которые проявляются, когда обычно применяемый аминокислотный препарат, содержащий все из трех аминокислот с разветвленной цепью, вводят in vivo, и улучшать безопасность. Конкретно, валин из трех аминокислот с разветвленной цепью представляет собой одну глюкогенную аминокислоту, увеличивающую уровень глюкозы в крови при его приеме. Когда пациент с болезнью печени принимает обычно применяемый аминокислотный препарат, содержащий такую глюкогенную аминокислоту, валин, у пациента с болезнью печени может проявиться побочный эффект дальнейшего увеличения уровня глюкозы после приема пищи. Напротив, поскольку композиция для улучшения состояния при гипоальбуминемии не содержит валин, по существу, в качестве активного ингредиента, существенная нагрузка глюкозой на пациента с болезнью печени, который находится в состоянии нарушенной переносимости глюкозы, может быть значительно снижена. Этот эффект является также применимым при контроле глюкозы в крови.
Примеры изомеров вышеуказанной аминокислоты с разветвленной цепью включают, но конкретно не ограничены ими, L-форму, D-форму и DL-форму. Из них, L-форма изомера аминокислоты с разветвленной цепью, которая имеет отношение к синтезу белка альбумина in vivo, применяется предпочтительно.
Формы аминокислот с разветвленной цепью, как указано выше, конкретно не ограничены и включают, например, свободную чистую кристаллическую аминокислоту, соль, пептид или их производное. Примеры солевой формы аминокислоты с разветвленной цепью включают фармакологически приемлемые солевые формы, такие как натриевая соль, калиевая соль, гидрохлорид и ацетат. Кроме того, примеры пептидной формы аминокислот с разветвленной цепью включают пептид из аминокислот с разветвленной цепью, такой как их дипептид и трипептид. Как описано, если указанные выше аминокислоты с разветвленной цепью преобразуются в пептиды, эти пептиды гидролизуются под действием пептидазы in vivo до свободных аминокислот, которые могут эффективно применяться. Кроме того, примеры производных аминокислот с разветвленной цепью включают N-ацетил-DL-лейцин, DL-норлейцин, N-ацетил-DL-изолейцин, 4-гидрокси-L-изолейцин и β-метилнорлейцин. Эти производные разлагаются под действием ацилазы in vivo и т.д. в свободные аминокислоты, которые могут эффективно применяться.
Композиция для улучшения состояния при гипоальбуминемии предпочтительно содержит как лейцин, так и изолейцин в качестве аминокислоты с разветвленной цепью. Как описано, поскольку как лейцин, так и изолейцин содержатся в качестве аминокислоты с разветвленной цепью, особенно, когда композиция для улучшения состояния при гипоальбуминемии применяется в форме препарата, действия лейцина и изолейцина на выработку альбумина взаимно не антагонизируются, и промоторный эффект на выработку альбумина in vivo может быть улучшен аддитивным образом.
Композиция для улучшения состояния при гипоальбуминемии может содержать либо лейцин, либо изолейцин по отдельности в качестве аминокислоты с разветвленной цепью. Посредством получения, таким образом, композиции для улучшения состояния при гипоальбуминемии, содержащей либо лейцин, либо изолейцин по отдельности, композиция, особенно, когда она применяется в форме препарата, может дополнительно снизить белковую нагрузку in vivo и эффективно уменьшить побочные эффекты.
Соответственно, композиция для улучшения состояния при гипоальбуминемии, если особенно важна ее эффективность действия, когда ее вводят, например, пациенту с болезнью печени, может предпочтительно содержать как лейцин, так и изолейцин с намерением улучшить вышеуказанный промоторный эффект на выработку альбумина аддитивным образом. Напротив, если особое внимание уделяется безопасности, когда композицию вводят, например, пациенту с болезнью печени, композиция для улучшения состояния при гипоальбуминемии может содержать только либо лейцин, либо изолейцин по отдельности с намерением эффективно снизить побочные эффекты посредством уменьшения вышеуказанной белковой нагрузки. Вкратце, композиция для улучшения состояния при гипоальбуминемии может поддерживать баланс между эффективностью действия и безопасностью в зависимости от состояния пациента с болезнью печени.
Массовое отношение лейцина к изолейцину предпочтительно составляет от 0,1 до 10, и более предпочтительно, от 0,5 до 3,0. Посредством установления таким образом массового отношения лейцина к изолейцину в указанном выше интервале, композиция для улучшения состояния при гипоальбуминемии сможет обязательно проявлять эффект улучшения вышеуказанного промоторного эффекта на выработку альбумина аддитивным образом.
Необязательные компоненты
Композиция для улучшения состояния при гипоальбуминемии может содержать добавки, отличные от вышеуказанной аминокислоты с разветвленной цепью, по необходимости, при условии, что они не наносят вред эффекту изобретения. Примеры добавок включают фармацевтически или с позиций гигиены пищи приемлемые аминокислоты, стабилизатор, консервант, солюбилизатор, регулятор pH, загуститель, антиоксидант, краситель, ароматизатор и искусственный подсластитель. Содержание этих добавок может подходящим образом устанавливаться в соответствии с содержанием вышеуказанной аминокислоты с разветвленной цепью.
Форма препарата
Композиция для улучшения состояния при гипоальбуминемии предпочтительно применяется в форме препарата. Примеры формы такого препарата включают, но конкретно не ограничены ими, инфузионную готовую лекарственную форму, пероральную готовую лекарственную форму, препарат для трансдермального всасывания, суппозиторий, адгезивный кожный пластырь, мазь, припарку и примочку.
Конкретно, композицию для улучшения состояния при гипоальбуминемии предпочтительно получают в виде инфузионной готовой лекарственной формы. Посредством получения, таким образом, композиции для улучшения состояния при гипоальбуминемии в виде инфузионной готовой лекарственной формы, композиция для улучшения состояния при гипоальбуминемии может быстро и эффективно вводится внутрисосудисто и промоторный эффект на выработку альбумина in vivo может быть оказан на наиболее высоком уровне.
Примеры типов инфузионной готовой лекарственной формы включают, например, жидкость для инъекций и внутривенного введения. Когда композицию для улучшения состояния при гипоальбуминемии получают в форме жидкости для инъекций или внутривенного введения, их предпочтительно стерилизуют и регулируют, чтобы они были изотоническими по отношению к крови. Кроме того, при получении композиции для улучшения состояния при гипоальбуминемии в форме жидкости для инъекций или внутривенного введения, в качестве разбавителя могут применяться, например, вода, этиловый спирт, полиэтиленгликоль, пропиленгликоль, этоксилированный изостеариловый спирт, полиоксиизостеариловый спирт и жирнокислотный сложный эфир полиоксиэтиленсорбитана. Кроме того, может содержаться достаточное количество соли, глюкозы или глицерина для регуляции изотоничности раствора по отношению к жидкой среде организма. Следует отметить, что вышеуказанная инфузионная готовая лекарственная форма может быть криоконсервирована или ее можно также сохранять после удаления содержания влаги посредством лиофилизации или т.п. Когда применяют такую лиофилизированную и сохраненную инфузионную готовую лекарственную форму, дистиллированную воду, стерилизованную воду или т.п. для инъекции добавляют для повторного ее растворения и затем вводят в действие.
Композиция для улучшения состояния при гипоальбуминемии может также быть получена в виде пероральной лекарственной готовой формы. Посредством получения, таким образом, композиции для улучшения состояния при гипоальбуминемии в виде пероральной лекарственной готовой формы, композиция для улучшения состояния при гипоальбуминемии может легко и просто вводиться без инвазивного воздействия на живой организм, и промоторный эффект на выработку альбумина может в достаточной степени оказываться in vivo.
Примеры типов пероральной готовой лекарственной формы включают, но конкретно не ограничены ими, таблетку, порошок, зернышко, мелкое зернышко, пилюлю, капсулу, пастилку, жевательное средство и сироп. Когда препарат применяется в форме таблетки, применяют разнообразные типы носителей, известных в области улучшения состояния при гипоальбуминемии. Примеры носителя включают эксципиенты, такие как лактоза, белый сахар, хлорид натрия, глюкоза, мочевина, крахмал, карбонат кальция, каолин, кристаллическая целлюлоза и силикат; связующие вещества, такие как вода, этанол, пропанол, простой сироп, декстроза в воде, крахмальная жидкость, раствор желатина, карбоксиметилцеллюлоза, шеллак, метилцеллюлоза, фосфат калия и поливинилпирролидон; дезинтеграторы, такие как сухой крахмал, альгинат натрия, порошкообразный агар, порошкообразный ламинаран, гидрокарбонат натрия, карбонат кальция, жирнокислотный сложный эфир полиоксиэтиленсорбитана, лаурилсульфат натрия, стеарат моноглицерида, крахмал и лактоза; подавители разрушения, такие как белый сахар, стеарин, масло какао и гидрированное масло; промоторы всасывания, такие как четвертичное аммониевое основание и лаурилсульфат натрия; увлажнители, такие как глицерин и крахмал; адсорбенты, такие как крахмал, лактоза, каолин, бентонит и коллоидный силикат; и смазывающие вещества, такие как очищенный тальк, стеарат, порошкообразная борная кислота и полиэтиленгликоль. Кроме того, эти таблетки могут быть получены, если необходимо, в форме таблеток с общим покрытием, таких как таблетка с сахарным покрытием, таблетка с желатиновым покрытием, таблетка с энтеросолюбильным покрытием, таблетка с пленочным покрытием, таблетка с двойным покрытием и таблетка с множественным покрытием.
Кроме того, когда препарат применяется в форме пилюли, применяются разнообразные типы носителей, известных в области улучшения состояния при гипоальбуминемии. Примеры носителей включают эксципиенты, такие как глюкоза, лактоза, крахмал, масло какао, гидрированное растительное масло, каолин и тальк; связующие вещества, такие как порошкообразная аравийская камедь, порошкообразный трагакант, желатин и этанол; ламинаран и агар.
Вышеуказанная пероральная готовая лекарственная форма может дополнительно содержать добавки. Примеры таких добавок включают поверхностно-активное вещество, промотор всасывания, наполнитель, разжижающее средство, увлажнитель, консервант, стабилизатор, эмульгатор, солюбилизатор и соль, регулирующая осмотическое давление. Они могут быть подходящим образом выбраны в зависимости от стандартной лекарственной формы пероральной готовой лекарственной формы и введены в действие.
Форма пищи или питья
Композиция для улучшения состояния при гипоальбуминемии предпочтительно применяется в виде пищи или питья. Посредством использования композиции для улучшения состояния при гипоальбуминемии в виде пищи или питья, композиция может дополнительно более легко и просто вводиться, чем вышеуказанная пероральная готовая лекарственная форма, и промоторный эффект на выработку альбумина in vivo может быть оказан в достаточной степени. Кроме того, посредством получения композиции для улучшения состояния при гипоальбуминемии в виде пищи или питья, композиция может особенно просто и легко приниматься в повседневной жизни, способствуя улучшению КЖ (Качества Жизни).
Примеры вышеуказанной пищи или питья включают, но конкретно не ограничены ими, добавку, пищу с заявленной питательной функцией, пищу для установленного применения для здоровья и пищу для больного. Кроме того, примеры формы вышеуказанных пищи или питья включают порошок, зерно и напитки, такие как питье, капсула, таблетка, включающая жевательное средство, и съедобная пленка. Следует отметить, что способ получения этих пищи и питья конкретно не ограничивается, поскольку он не может нанести вред Эффекту Изобретения, и может использоваться способ, используемый квалифицированными специалистами в области при каждом применении.
Из вышеуказанных пищи и питья, в случае гранулированной пищи, размер зерна составляет предпочтительно приблизительно 20 мкм или более и 2000 мкм или менее, более предпочтительно, приблизительно 100 мкм или более и 1500 мкм или менее и особенно предпочтительно, приблизительно 500 мкм или более и 1000 мкм или менее. Такая гранулированная пища может приниматься в гранулированном состоянии вместе с напитком, таким как вода, чай и сок, и также приниматься посредством растворения ее в напитке.
Следует обратить внимание, что композиция для улучшения состояния при гипоальбуминемии настоящего изобретения не ограничивается вышеуказанным вариантом осуществления. Например, если форма композиции для улучшения состояния при гипоальбуминемии настоящего изобретения представляет собой пероральную готовую лекарственную форму или пищу, или питье, при необходимости, адгезив (загуститель, желатинизирующий компонент) может быть добавлен для получения композиции в форме желатина или форме желе. Посредством получения, таким образом, композиции для улучшения состояния при гипоальбуминемии настоящего изобретения в форме желатина или форме желе, пероральное введение может просто осуществляться, и всасывание в желудочно-кишечном тракте становится удовлетворительным. Примеры типа адгезива включают, но конкретно не ограничены ими, агар, желатин, каррагинан, аравийскую камедь, гуаровую камедь, камедь бобов рожкового дерева, камедь тары, геллановую камедь, курдлан, ксантановую камедь, пуллулан, пектин, альгинат натрия, карбоксиметилцеллюлозу, и другие, такие как полисахарид, который может обычно применяться в качестве адгезива.
Эти вещества могут применяться по отдельности или в комбинации двух или более. Следует обратить внимание, что в качестве соотношения компонентов в смеси такого адгезива, отношение, равное 5 или менее массовых частей относительно композиции для улучшения состояния при гипоальбуминемии (100 массовых частей), полученной в форме желатина или форме желе.
Примеры
Теперь, настоящее изобретение будет описано более конкретно на основании Примеров; однако, настоящее изобретение не должно интерпретироваться ограничительно на основании описания этих Примеров.
Эффект на экспрессию мРНК альбумина и уровень секреции альбумина в культивированных человеческих гепатоцитах
В данном тесте, человеческие первичные культивированные гепатоциты культивировали с каждым тестовым раствором для проверки изменения экспрессионной эффективности мРНК альбумина и изменения уровня секреции альбумина. Тест проводили следующим образом.
Измерямый параметр
(1) мРНК альбумина и мРНК гипоксантинфосфорибозилтрансферазы 1 (далее здесь обозначаемой сокращенно "HPRT1")
Измеряли мРНК альбумина и мРНК HPRT1. Нуклеотидные последовательности альбумина и HPRT1 регистрируют в GenBank следующим образом, и каждая нуклеотидная последовательность соответствует регистрируемой последовательности.
Альбумин; Инвентарный номер в GenBank XM 031322.
HPRT1; Инвентарный номер в GenBank NM 000194.
Следует обратить внимание, что HPRT1, который представляет собой конститутивный ген, служащий в качестве контроля, измеряли в том же тесте. Последовательности праймеров и зондов, применяемые при измерении альбумина, сделаны общеизвестными в Nishimura M., Yoshitsugu H., Yokoi T., Tateno C., Kataoka M., Horie T., Yoshizato K. and Naito S.: Evaluation of mRNA expression of human drug-metabolizing enzymes и transporters in chimeric mouse with humanized liver. Xenobiotica, 35: 877-890 (2005). Кроме того, последовательности праймеров и зондов, применяемые при измерении HPRT1, сделаны общеизвестными в Nishimura M., Naito S. and Yokoi T.: Tissue-specific mRNA expression profiles of human nuclear receptor subfamilies. Drug Metab. Pharmacokinet., 19: 135-149 (2004).
(2) Концентрация альбумина в среде
Концентрацию альбумина в среде измеряли посредством набора Human Albumin EIA (производство Takara Bio Inc.).
Вещества, подвергаемые тестированию
Применяли следующие вещества.
Изолейцин (Ile): ММ 131,17
Лейцин (Leu): ММ 131,17
Валин (Val): ММ 117,5
Гепатоциты, подвергаемые тестированию
В качестве гепатоцитов применяли человеческие нормальные гепатоциты (Human Normal Hepatocytes, Лот.100, LMP, ONQ и VUA, производство In Vitro Technologies, Inc.).
Реагенты
Применяли следующие реагенты и инструменты.
Набор специфичной среды для нормальных гепатоцитов: Cambrex Corporation (Takara Bio Inc.)
Модифицированный сбалансированный солевой раствор Хэнкса: Sigma (компания), 500 мл
HEPES Буфер (1 M): 100 мл
Раствор пирувата натрия (100 мМ): 100 мл
Шприцевые фильтры Acrodisc: Pall Corporation, номер продукта 4187, 50 фильтров на набор
Мини-набор Rneasy (50): QIAGEN
QIAshredder (50): QIAGEN
Дрожжевая тРНК: GIBCO BRL
Набор реагентов TaqMan Master Mix для одностадийной ОТ-ПЦР: Applied Biosystems
Быстрый 96-луночный реакционный планшет (0,1 мл): Applied Biosystems
Оптические адгезивные покрытия: Applied Biosystems
24-луночный плоскодонный планшет (покрытие Коллаген типа I): AGC Techno Glass Co., Ltd.
15 мл коническая пробирка: Falcon
Трипановый синий: Flow Laboratories LTD., 0,4% раствор в 0,85% физрастворе
β-меркаптоэтанол: Sigma (компания)
Набор Human Albumin EIA: Takara Bio Inc.
Кроме того, мРНК количественно определяли посредством применения пар праймеров и зонда, представленных индивидуальными последовательностями (инициаторный кодон следует за каждой зарегистрированной нуклеотидной последовательностью), показанной в следующей Таблице 1 и в соответствии с ОТ-ПЦР (количественная с обратной транскрипцией - полимеразная реакция в реальном масштабе времени). Каждый из праймеров и зонд получали посредством автоматизированного синтезатора ДНК.

Получение раствора
(1) Препарат 50 мкг/мл раствор дрожжевой тРНК
Дрожжевую тРНК разбавляли водой, не содержащей РНКазы, до концентрации 50 мкг/мл.
(2) Получение разнообразных типов тестовых растворов, каждый из которых содержит тестируемое вещество.
(2-1) Буфер A
В качестве Буфера A, модифицированный сбалансированный солевой раствор Хэнкса, буфер HEPES (1 M) и раствор пирувата натрия (100 мМ) смешивали при соотношении 100:1:2.
(2-2) Буфер B
В качестве Буфера B, Буфер А и среду смешивали при соотношении 9:1.
(2-3) Тестовый раствор композиции Livact
В качестве тестового раствора композиции Livact, композицию Livact растворяли таким образом, чтобы концентрации Ile, Leu и Val стали равными 13,8 мМ, 27,7 мМ и 18,5 мМ соответственно, после смешивания (60 мМ в качестве концентрации тестового раствора композиции Livact). Следует обратить внимание, что в методике растворения композицию Livact растворяли в Буфере А и затем добавляли среду в количестве 1/10, таком же, как количество Буфера A.
(2-4) Раствор Ile, Leu или Val
В качестве раствора Ile, Leu или Val, Ile, Leu или Val растворяли таким образом, чтобы иметь концентрацию, равную 60 мМ. Следует обратить внимание, что в методике растворения, Ile, Leu или Val растворяли в Буфере А и затем добавляли среду в количестве 1/10 таком же, как количество Буфера A.
(2-5) Контроль
Тестовый раствор композиции Livact, полученный в Разделе (2-3) и раствор Ile, Leu или Val, полученный в Разделе (2-4) разбавляли в 3 раза Буфером B для получения раствора с концентрацией 20 мМ.
Первичная культура человеческих нормальных гепатоцитов
В соответствии со способом Nishimura et al. (Nishimura M., Yoshitsugu H., Naito S. и Hiraoka I.: Evaluation of gene induction of drug-metabolizing enzymes and transporters in primary culture of human hepatocytes using high-sensitivity real-time reverse transcription PCR. Yakugaku Zasshi, 122: 339-361 (2002)), 1×105 клеток/400 мкл распределяли в каждую лунку 24-луночного планшета и культивировали в инкубаторе с CO2. Через 3 часа осуществляли обмен среды. Дополнительно через 21 час (24 часа после инокуляции) осуществляли обмен среды. Затем, среду заменяли каждые 24 часа. Следует обратить внимание, что количество жидкой среды, подлежащей обмену, было установлено при 400 мкл/лунку. Кроме того, обмен на каждый тестовый раствор осуществляли через 48 часов, после осуществления обмена среды.
Эксперимент 1
После того как человеческие гепатоциты (1×105 жизнеспособных клеток/0,4 мл/лунку) инокулировали, осуществляли обмен среды через 3 часа и 24 часа после инокуляции. Следует обратить внимание, что жизнеспособность на время инокуляции составляла 90,4% (Лот 100). Затем, через 48 часов после инокуляции, добавляли тестируемое вещество и через 24 часа после начала добавления тестируемого вещества, экстрагировали Общую РНК (с использованием набора Rneasy Mini). Количественную оценку мРНК альбумина и HPRT1 осуществляли посредством ОТ-ПЦР в реальном масштабе времени. Следует обратить внимание, что HPRT1, который представляет собой конститутивный ген, применяли в качестве внутреннего стандарта.
Эксперимент 2
После того как человеческие гепатоциты (1×105 жизнеспособных клеток/0,4 мл/лунку) инокулировали, осуществляли обмен среды через 3 часа и 24 часа после инокуляции. Следует обратить внимание, что жизнеспособность на время инокуляции составляла, 93,6% (Лот 100), 84,2% (Лот LMP), 90,0% (Лот QNQ) и 84,3% (Лот VUA). Затем, через 48 часов после инокуляции, добавляли тестируемое вещество и через 24 часа после начала добавления тестируемого вещества среду отбирали и измеряли уровень секреции альбумина.
Получение общей РНК
После отбора среды аспирацией, общую РНК экстрагировали посредством использования шредера QIA и набора Rneasy Mini. Теперь, способ получения с использованием Набора будет описан ниже. В моменты времени, составляющие 3, 24, 48 и 72 часа после инициации культивирования, среду удаляли аспирацией из каждой лунки 24-луночного планшета. Однако при нулевой отметке, т.е. инициации культивирования, гепатоциты отбирали в коническую пробирку объемом 15 мл, так, чтобы она содержала 2×105 клеток/пробирку. После центрифугирования, среду удаляли аспирацией. Далее, β-меркаптоэтанолсодержащий раствор RLT (раствор RLT: β-меркаптоэтанол = 1:100) добавляли в количестве 400 мкл для каждого и пипетировали. Далее, общее количество переносили в колонку шредера QIA и центрифугировали при 15000 об/мин в течение 2 минут. Отбирали элюат (350 мкл) и добавляли эквивалентное количество раствора 70% этанола. После того, как перемешивание в течение 10 секунд повторяли три раза, общее количество добавляли в центрифужную пробирку Rneasy Mini и центрифугировали при 12000 об/мин в течение 30 секунд, и элюат в Пробирке для сбора образцов удаляли аспирацией. Раствор RW1 (700 мкл) добавляли и центрифугировали при 12000 об/мин в течение 30 секунд и затем пробирку для сбора образцов заменяли. Добавляли раствор RPE (500 мкл) и центрифугировали при 12000 об/мин в течение 30 секунд, и затем элюат в пробирке для сбора образцов удаляли аспирацией. Добавляли раствор RPE (500 мкл) и центрифугировали при 15000 об/мин в течение 2 минут. Затем, пробирку для сбора образцов заменяли на пробирку для сбора образцов (1,5 мл). Добавляли воду, не содержащую РНКазы (50 мкл), и центрифугировали при 10000 об/мин в течение 1 минуты для элюирования общей РНК. Элюат разбавляли раствором 50 мкг/мл дрожжевой тРНК 5-кратно для получения раствора общей РНК для измерения. Следует обратить внимание, что все операции по экстракции осуществляли при комнатной температуре. Кроме того, раствор дрожжевой тРНК с концентрацией 50 мкг/мл получали посредством разбавления дрожжевой тРНК дистиллированной водой, не содержащей РНКазы.
Измерение мРНК
Систему быстрого обнаружения последовательности Applied Biosystems 7500 (Applied Biosystems) применяли для количественной оценки мРНК конститутивного гена (HPRT1) и альбумина, следующим образом.
ОТ-ПЦР осуществляли, используя набор реагентов TaqMan One-Step RT-PCR Master Mix, содержащий 300 нМ прямого праймера, 900 нМ обратного праймера и 200 нМ зонда TaqMan, в системе из 20 мкл/пробирку. Применяли раствор общей РНК (3 мкл). Что касается условий ОТ-ПЦР, то реакционную смесь поддерживали при 48°C в течение 30 минут и затем при 95°C в течение 10 минут, и затем цикл, состоящий из реакции при 95°C в течение 15 секунд и реакции при 60°C в течение 1 минуты, повторяли 40 раз. Интенсивность флуоресценции измеряли в каждом цикле. Следует обратить внимание, что в качестве реакционного контейнера применяли 96-луночный планшет для быстрых реакций (0,1 мл) и в качестве покрытия применяли оптические адгезивные покрытия.
Количественное определение уровня секреции альбумина
Концентрацию альбумина в среде измеряли посредством набора Human Albumin EIA (Takara Bio Inc.).
Метод расчета и статистической обработки результатов
(1) Количественное определение мРНК
МРНК HPRT1 применяли в качестве эндогенного контроля. Количественные значения мРНК рассчитывали по методу ΔCt (Nishimura M., Yaguri H., Yoshitsugu H., Naito S. & Satoh, T., (2003); Yakugaku Zasshi, 123, 369-375) и тест осуществляли при трех повторах. Уровень экспрессии мРНК альбумина выражали посредством отношения, основанного на уровне экспрессии мРНК HPRT1 (считали как 1). Среднее значение (среднее арифметическое) ± среднеквадратическое отклонение (SD) показано в Таблице 2 и на Фигуре 1.
Количественное определение уровня секреции альбумина
Результаты показаны в виде значений для каждого Лота и как среднее значение (среднее арифметическое) ± среднеквадратическое отклонение (SD)
Результаты и обсуждение
Полученные результаты показаны в Таблице 2, Таблице 3 и на Фигуре 1.


При анализе каждой таблицы и графиков Фигуры 1, показывающих результаты Таблицы 2, обнаруживаются следующие факты. А именно, как показано в Таблице 2 и на Фигуре 1, с использованием человеческих гепатоцитов, эффекты однократного применения Ile, Leu и Val, независимо от того, используют ли комбинацию Ile и Leu, комбинацию Ile и Val, и комбинацию Leu и Val, взаимно продуцируют аддитивный эффект, синергистический эффект или взаимно антагонизируют, что исследовали на основании увеличения уровня экспрессии мРНК альбумина в качестве показателя. Проводили сравнение единичной аминокислоты из Ile, Leu и Val, комбинаций Ile и Leu, Leu и Val, Ile и Val и композиции Livact (Ile:Leu:Val=1:2:1,35, 20 мМ, 60 мМ). В результате, было подтверждено, что в случаях единичных аминокислот из Ile и Leu и комбинации Ile и Leu, уровень экспрессии мРНК альбумина увеличивается аддитивным образом. Было обнаружено, что комбинация Ile и Leu обладает аддитивным эффектом на уровень экспрессии мРНК альбумина. Кроме того, было подтверждено, что в случаях комбинации с Val эффект увеличения уровня экспрессии мРНК альбумина является обратимым.
Кроме того, Эксперимент 2 показывает результаты 4 Лотов человеческих гепатоцитов. Если содержался Val, уровень секреции снижался таким же образом, как в Эксперименте 1 (см. Таблицу 3).
Как описано выше, обнаружено, что эффективным является применение композиции для улучшения состояния при гипоальбуминемии для увеличения синтетической способности альбумина.
Исследование эффектов плазменной концентрации альбумина у мышей с гипоальбуминемией
В данном тесте измеряли эффекты каждого тестируемого вещества на плазменную концентрацию альбумина у мышей, у которых наступала гипоальбуминемия. Тест осуществляли следующим образом.
Эксперимент 3
У BALB/c, мышиных самок, индуцировали гипоальбуминемию посредством голодания в течение 3 дней. Каждое тестируемое вещество перорально вводили в течение 7 дней и измеряли плазменную концентрацию альбумина. Подробности Эксперимента будут показаны ниже.
Получение тестируемого вещества
Val (+):
L-лейцин (0,214 г), L-изолейцин (0,107 г) и L-валин (0,129 г) (все полученные из пептидной лаборатории) взвешивали и помещали вместе с соответствующим количеством дистиллированной воды для инъекции (Otsuka Pharmaceutical Co., Ltd.) в 15 мл онической пробирке (Japan, Beeton, Dickinson and Company) и смешивали. Они полностью растворялись в воде с получением 15 мл.
Val (-):
L-лейцин (0,214 г) и L-изолейцин (0,107 г) (все полученные из пептидной лаборатории) взвешивали и помещали вместе с соответствующим количеством дистиллированной воды для инъекции (Otsuka Pharmaceutical Co., Ltd.) в 15 мл оническую пробирку (Japan, Becton, Dickinson and Company) и смешивали. Они полностью растворялись в воде с получением 15 мл.
Используемые животные
В этом Эксперименте, использовали мышей, BALB/cCr Slc, самки, в возрасте 7 недель (масса тела по прибытии: от 18 г до 20 г) (Japan SLC, Inc.).
Способ введения
Указанных выше мышей разделяли на следующие три группы. Следующие группу валина (+) и группу Val (-) подвергали голоданию в течение 3 дней, и каждое тестируемое вещество, полученное выше, перорально вводили при дозе, равной 10 мл/кг/день, непрерывно в течение 7 дней. Следует обратить внимание, что группу Val (+) и группу Val (-) кормили во время периода введения каждого тестируемого вещества. Кроме того, контрольную группу только кормили во время всего периода тестирования.
Группа Val (+)
Группу мышей подвергали голоданию в течение 3 дней и затем перорально вводили Val (+), n=3
изолейцин: 0,071 г/кг/день,
лейцин: 0,143 г/кг/день,
валин: 0,086 г/кг/день
Группа Val (-)
Группу мышей подвергали голоданию в течение 3 дней и затем перорально вводили Val (-), n=5
изолейцин: 0,071 г/кг/день,
лейцин: 0,143 г/кг/день
Контрольная группа
Группу мышей кормили во время всего периода тестирования, n=5
Отбор образцов
На 3-ий день после начала голодания и 1-ый, 3-ий и 7-ой дни после начала введения тестируемого вещества, вышеуказанным мышам царапали глазное дно обработанной гепарином капиллярной пробиркой Terumo Hematocrit (Terumo Corporation) без анестезии для забора крови (приблизительно 20 мкл). Собранную кровь охлаждали льдом и центрифугировали при 12000 об/мин в течение 10 минут для отделения плазмы и подвергали измерению плазменного альбумина.
Метод измерения плазменного альбумина
Плазменную концентрацию альбумина измеряли посредством использования предметного стекла Fuji dry-chem ALB-P (FUJIFILM Medical, Inc.) в автоматизированном анализаторе DRI-CHEM 7000 (FUJIFILM Medical, Inc.). Плазменные концентрации альбумина для мышей на 7-ой день после введение тестируемого вещества показаны в Таблице 4.
Метод анализа
По отношению к значениям каждого измеряемого параметра получали среднее значение (среднее арифметическое) ± среднеквадратическое отклонение (S.D.) каждой группы. Кроме того, статистический анализ между группой Val (+) и группой Val (-) осуществляли посредством t-теста Стьюдента и анализа дисперсии времязависимых изменений. Следует обратить внимание, что уровень достоверности теста составлял 5% (обе стороны). Подсчет данных осуществляли посредством Microsoft Excel 2003 (Microsoft Co., Ltd.). В качестве программного обеспечения для статистического анализа применяли EXSAS 7.6 (Arm Systex Co., Ltd.).

Результаты и обсуждение
Как показано в Таблице 4, тестируемое вещество давали в течение 7 дней мышам, подвергаемым голоданию, при вышеуказанных условиях, и наблюдали, что группа Val (-) показывает тенденцию к возрастанию альбумина (р=0,0531) по сравнению с группой Val (+) на 7-ой день. Кроме того, в соответствии с анализом дисперсии дополнительно проводимых зависимых от времени изменений, между группами и периодами времени наблюдали достоверное различие. Предполагали, что Val (-) может увеличивать концентрацию альбумина в плазме со временем по сравнению с Val (+). По результатам данного теста, считали, что в результате удаления Val из BCAA (Val (-)) может ожидаться эффект на увеличение концентрации альбумина в крови, превышающий эффект от препарата BCAA (Val (+)), такого как Livact (зарегистрированный товарный знак), в настоящее время применяемого в клинической практике.
Промышленная применимость
Как упомянуто выше, композицию для улучшения состояния при гипоальбуминемии настоящего изобретения предпочтительно применяют, например, в форме препарата, такого как инфузионная готовая лекарственная форма, пероральная готовая лекарственная форма и пища или питье.