Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ РИСКА РАЗВИТИЯ РАКА ТЕЛА МАТКИ
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к медицинской диагностике, и может быть использовано для прогнозирования развития рака тела матки у женщин с гиперпластическими процессами эндометрия.
Гиперпластические процессы эндометрия (гиперплазия эндометрия, эндометриальные полипы) являются распространенной патологией слизистой оболочки тела матки. Аденокарцинома эндометрия часто развивается на фоне гиперплазии эндометрия [Ашрафян Л.А., Киселев В.И., Муйжнек Е.Л. Патогенетическая профилактика рака репродуктивных органов. - М.: Димитрейд График Групп, 2009, 176 стр.]. Для диагностики и прогноза течения гиперпролиферативных заболеваний эндометрия широко применяют морфометрические, биохимические, иммунологические, цитогенетические, молекулярно-генетические маркеры, среди которых часто используют анализ экспрессии функционально-значимых генов в исследуемых образцах опухолевой ткани.
Известен способ для диагностики субтипов рака эндометрия на основе суммарного показателя, включающего наличие амплификации и делеций в хромосомных регионах 3q26.32 и 12р12.1, а также измененный статус экспрессии 29 генов или гена STMN1 [US 2011217701, 08.09.2011]. Диагностика выполняется с помощью гибридизации РНК, выделенной из образца опухоли, содержащей более 50% опухолевых клеток, на чипах Agilent 21K и 22K. Гены PLEKHK1, АТР10 В, NMU, ММР1, ATAD2, NETO2, TNNI3, PHLDA2, OVOL1 обладают повышенной экспрессией по сравнению с нормальной тканью, в то время как другие гены (NDP, KIAA1434, MME, CFH, MOXD1, SLC47A1, RBP1, PDE8B, ASRGL1, ADAMTS19, EFHD1, ABCA5, NPAS3, SCML1, TNXB, ENTPD3, AMY1A, ENPP, RASL11B, PDZK3) имеют пониженный экспрессионный статус. Недостатками способа являются инвазивность, неоднородность материала, в котором количество опухолевых клеток в образцах варьирует от 50% до более 80%, необходимость дополнительного проведения полимеразной цепной реакции с обратной транскрипцией для подтверждения результатов анализа экспрессии на микроарреях, использование дорогостоящих приборов и расходных материалов.
В другом изобретении CA 2767914 от 27.01.2011 обнаружены иные гены, измененный уровень экспрессии которых служит маркером для выявления рака эндометрия или предрасположенности к нему. Это - ACAA1, AP1M2, CGN, DDR1, EPS8L2, FASTKD1, GMIP, IKBKE, P2RX4, Р4НВ, PHKG2, PPFIBP2, PPP1 R16A, RASSF7 RNF183, SIRT6, TJP3, EFEMP2, S0CS2, and DCN. Преимуществом данного способа по сравнению с предыдущим является то, что образцами для выделения РНК могут служить не только образцы опухолевой ткани, но и аспираты или выделения из полости матки. Недостатками способа являются следующие ограничения: 1 - при наличии предраковых заболеваний необходимо увеличить число исследуемых генов вплоть до 100; 2 - фазы менструального цикла влияют на уровень экспрессии генов; 3 - наличие воспалительных заболеваний в матке также искажает экспрессионный статус; 4 - использование дорогостоящих приборов и расходных материалов.
Известен способ оценки вероятности прогрессии гиперплазии в рак, включающий определение экспрессии двух генов (СОХ-2 и р16) и количественный показатель D-score. Последний определяется с помощью компьютерной морфометрии и рассчитывается по формуле:
D=0.6229+0.0439×(площадь стромы в очаге гиперплазии в процентах)-3.9934×Ln(вариация размеров ядер эндометриального эпителия в очаге гиперплазии)-0.1592×(периметр ветвящихся эндометриальных желез в очаге гиперплазии).
Значения D-score колеблются от -4 до +5, при D-score<1 предсказывается высокий риск развития эндометриальной интраэпителиальной неоплазии, а при значениях≥1 риск понижен. Уровни экспрессии генов определяются иммуногистохимическими методами в образце ткани гиперплазированного эндометрия. Маркером высокого риска рака эндометрия служит комбинированный показатель, включающий негативную экспрессию СОХ-2, оверэкспрессию p16 и D-score<1 (Steinbakk A, Gudlaugsson Е, Aasprong OG, Skaland I, Malpica A, Feng W, Janssen,EA, Baak JP. Molecular biomarkers in endometrial hyperplasias predict cancer progression. Am J Obstet Gynecol. 2011, 204 (4): pp. 357. e1-e12). Недостатками способа являются инвазивность, а также высокая вероятность ошибочного включения в материал биопсии ткани эндометрия, в которой нет патологических изменений. Это приводит к завышенным значениям D-score. Кроме того, иммуногистохимическое окрашивание неоднородно в рамках одного и того же препарата. Поэтому присутствует субъективный фактор, разными специалистами часто даются заключения на основе анализа неодинаковых областей анализируемых препаратов.
Известен способ повышения точности прогнозирования развития рака тела матки при патологических процессах эндометрия (RU 2466390 от 10.11.2012), в котором определяют метилирование генов MLH1, RASSF1, GSTP1, p16, RAR-b, CDX1 в биоптате эндометрия. Вероятность развития рака тела матки прогнозируют на основе коэффициента (p), который вычисляется по формуле, разработанной авторами на основе бинарной логистической регрессии
p=1/1+e-z
где p - коэффициент вероятности развития рака тела матки (от 0 до 1);
e - основание натурального логарифма,
z=-11,2754+2,32327·X1+2,713726·Х2+2,631425·X3+2,412264·Х4+2,571489·X5+2,411352·X6+2,521·X7-3,521352·X8+1,132435·X9+0,85648·X10+1,32356·X11+0,765356·X12+1,211383·X13+1.234·X14+0,921237·X15+0,516623·X16
X1 - морфотип (величина: эндометрит - 1, простая гиперплазия без атипии - 2, комплексная гиперплазия без атипии - 3, полип эндометрия - 4, комплексная гиперплазия с атипией - 5),
X2 - метилирование RASSF1 (величина: при наличии - 1, при отсутствии - 0),
X3 - метилирование MLH1 (величина: при наличии - 1, при отсутствии - 0),
X4 - метилирование p16 (величина: при наличии - 1, при отсутствии - 0),
X5 - метилирование RAR-b (величина: при наличии - 1, при отсутствии - 0),
X6 - метилирование GSTP1 (величина: при наличии - 1, при отсутствии - 0),
X7 - метилирование Cdx1 (величина: при наличии - 1, при отсутствии - 0),
X8 - индекс резистентности кровотока в аркуатных артериях (величина 0,3-0,65),
X9 - нарушение углеводного обмена (величина: при наличии - 1, при отсутствии - 0),
X10 - гипертоническая болезнь (величина: при наличии - 1, при отсутствии - 0),
X11 - рецидивирование гиперпластических процессов эндометрия (величина: при наличии - 1, при отсутствии - 0),
X12 - миома матки и/или аденомиоз (величина: при наличии - 1, при отсутствии - 0),
X13 - наследственная отягощенность по опухолевым заболеваниям (величина: при наличии - 1, при отсутствии - 0),
X14 - синдром поликистозных яичников (величина: при наличии - 1, при отсутствии - 0),
X15 - бесплодие (величина: при наличии - 1, при отсутствии - 0),
X16 - степень ожирения (величина: 1-3).
При величине p больше 0,6 прогнозируют высокую вероятность развития рака тела матки, при p, равном 0,3-0,59, - умеренную вероятность развития рака, при р ниже 0,29 - низкую вероятность развития рака.
Недостатком способа является наличие в формуле параметров для клинических показателей, характерных как при малигнизации патологических процессов эндометрия так и при ее отсутствии.
Все указанные способы имеют существенные недостатки, связанные с материалом исследования, это: 1 - инвазивность при взятии образца ткани; 2 - в опухоли часто присутствуют клетки разных клонов, которые отличаются между собой по профилю экспрессии и метилирования генов; 3 - гиперпластические процессы всего эндометрия имеют разную степень выраженности (Л.А. Ашрафян, Н.В. Харченко, и др. Современные принципы первичной и уточняющей диагностики рака эндометрия. Практическая онкология. 2004. Т. 5, №1, стр. 16-24).
Известен способ выявления повышенной предрасположенности к раку эндометрия на основе определения у пациенток полиморфных генотипов GG (идентификационный номер полиморфного варианта по базе данных dbSNP "rs" 2279744) в гене MDM2 (C.S. Walsh, C.W. Miller, B.Y. Karlan, H.P. Koeffler. Association between a functional single nucleotide polymorphism in the MDM2 gene and sporadic endometrial cancer risk. 2007 Gynecologic Oncology 104, 660-664). Генотипирование проводится с помощью полимеразной цепной реакции с последующим определением длин фрагментов рестрикции ампликонов (ПЦР/ПДРФ анализ). Среди больных раком эндометрия выявлена повышенная частота носителей гомозиготного генотипа GG гена MDM2 по сравнению со здоровыми женщинами. Шанс (OR) появления рака эндометрия увеличен в 2,76 раз (95% CI 1,06-7,20, P=0,03) у носителей гомозиготного генотипа GG по сравнению с носителями генотипов T/G и Т/Т. Чувствительность теста составляет 25%, специфичность 89%.
Недостатком способа является низкая специфичность теста, обусловленная высокой частотой встречаемости полиморфных генотипов среди здоровых женщин. Кроме того, в группе больных раком эндометрия не были учтены пациентки, у которых малигнизация развилась на фоне гиперпластических процессов эндометрия.
Прототипом предлагаемого изобретения является патент RU 2468367 от 27.11.2012 «Способ прогнозирования риска развития гиперплазии эндометрия у женщин с генитальным эндометриозом». У пациенток выделяют ДНК из периферической венозной крови, определяют генетический полиморфизм 308 G/A гена TNFα (фактора некроза опухоли α) и прогнозируют риск развития гиперплазии эндометрия при генитальном эндометриозе на основе анализа полиморфизма гена - 308G/A TNFα в зависимости от выявленного аллеля. В случае выявления аллеля - 308A, больные генитальным эндометриозом имеют высокий риск развития гиперплазии эндометрия. В реакции используют полимеразу Thermus aquaticus производства фирмы «Силекс-М», олигонуклеотидные праймеры и зонды, синтезированных фирмой «Синтол». Полиморфизм определяют методом дискриминации аллелей.
Недостатком способа является отсутствие возможности анализа риска развития к гиперпролиферативным заболеваниям в целом и в том числе к раку эндометрия. Не указан возрастной состав представленной группы больных.
Полученный нами опыт позволяет определять предрасположенность женщин к возникновению эстроген-зависимых раков на основе определения полиморфных вариантов генов метаболизма методом полимеразной цепной реакции с последующим определением длин фрагментов рестрикции ампликонов (ПЦР/ПДРФ анализ). (Kondrashova TV, Neriishi К, Ban S, Ivanova TI, Krikunova LI, Shentereva NI, Smirnova IA, Zharikova IA, Konova MV, Taira S, Tsyb AF. Frequency of hemochromatosis gene (HFE) mutations in Russian healthy women and patients with estrogendependent cancers. Biochim Biophys Acta. 2006 Jan; 1762(1):59-65; Кондрашова T.B., Иванова Т.И., Жарикова И.А. и др. Полиморфизм гена гемохроматоза (HFE) и риск рака молочной железы // Молекулярный полиморфизм человека / Под ред. С.Д. Варфоломеева. М.: РУДН, 2007. Т. 1. С. 383-396; Иванова Т.И., Крикунова Л.И, Хорохорина В.А, Вербинская Н.И., Мкртчян Л.С., Рябченко Н.И., Замулаева И.А., Цыб А.Ф. Полиморфизм гена HFE - фактор риска возникновения рака эндометрия у женщин репродуктивного возраста. Радиация и риск. 2012. т. 21. №2. стр. 54-61).
Технический результат заключается в устранении недостатков прототипа и повышении точности прогнозирования развития гиперпролиферативных заболеваний эндометрия, в том числе эндометриоидной аденокарциномы у женщин с гиперпластическими процессами эндометрия.
Сущность предлагаемого изобретения, включающего выделение ДНК из периферической венозной крови у женщин с гиперпластическими процессами эндометрия и генотипирование гена APOE, заключается в выявлении полиморфных аллелей APOE*2, APOE*3, APOE*4 и при наличии генотипов, содержащих аллель APOE*2 (идентификационный номер полиморфного варианта по базе данных dbSNP "rs" 7412, C158Arg), прогнозируют высокий риск развития рака тела матки.
В соответствии с нашими данными обнаружено, что у женщин с гиперпластическими процессами эндометрия, имеющих любой из генотипов, в которых присутствует аллель APOE*2 (E2/E3; E2/E4; E2/E2), прогнозируют высокую вероятность развития эндометриоидной аденокарциномы. Известно, что аполипопротеин E (APOE) - гликопротеин плазмы с широким спектром действия: регулирует обмен липидов, холестерина, функции макрофагов, влияет на пролиферацию Т-клеток, модулирует воспалительные и оксидативные процессы, участвует в процессах канцерогенеза, полиморфные генотипы E2/E2, E2/E4, E4/E4 повышают вероятность возникновения у лиц старше 65 лет рака толстой кишки. (OR=1,88, 95% confidence interval 1,17-3,04). (Slattery ML, Sweeney C, Murtaugh M, Ma KN, Potter JD, Levin TR, Samowitz W, Wolff R. Associations between apoE genotype and colon and rectal cancer // Carcinogenesis. 2005, Aug; 26(8):1422-9).
Поставленная задача решается с помощью способа определения генетической предрасположенности к развитию эндометриоидной аденокарциномы у женщин с гиперпластическими процессами эндометрия, включающего выделение ДНК из периферической венозной крови, определение полиморфных аллелей APOE*2, APOE*3 и APOE*4 гена аполипопротеина E (APOE), прогнозирование риска развития рака эндометрия на основе анализа полиморфизма гена аполипопротеина E (APOE) в зависимости от выявленного аллеля: в случае наличия аллеля APOE*2 (rs7412, C158Arg) пациентки с гиперпластическими процессами эндометрия имеют высокий риск заболевания раком эндометрия.
Новизна и изобретательский уровень данного изобретения заключается в том, что в уровне техники отсутствуют сведения о способах определения предрасположенности женщин к развитию гиперпролиферативных заболеваний эндометрия, в том числе к эндометриоидной аденокарциноме, на основе определения генотипов, несущих аллель APOE*2 (rs7412, C158Arg).
Перечень фигур
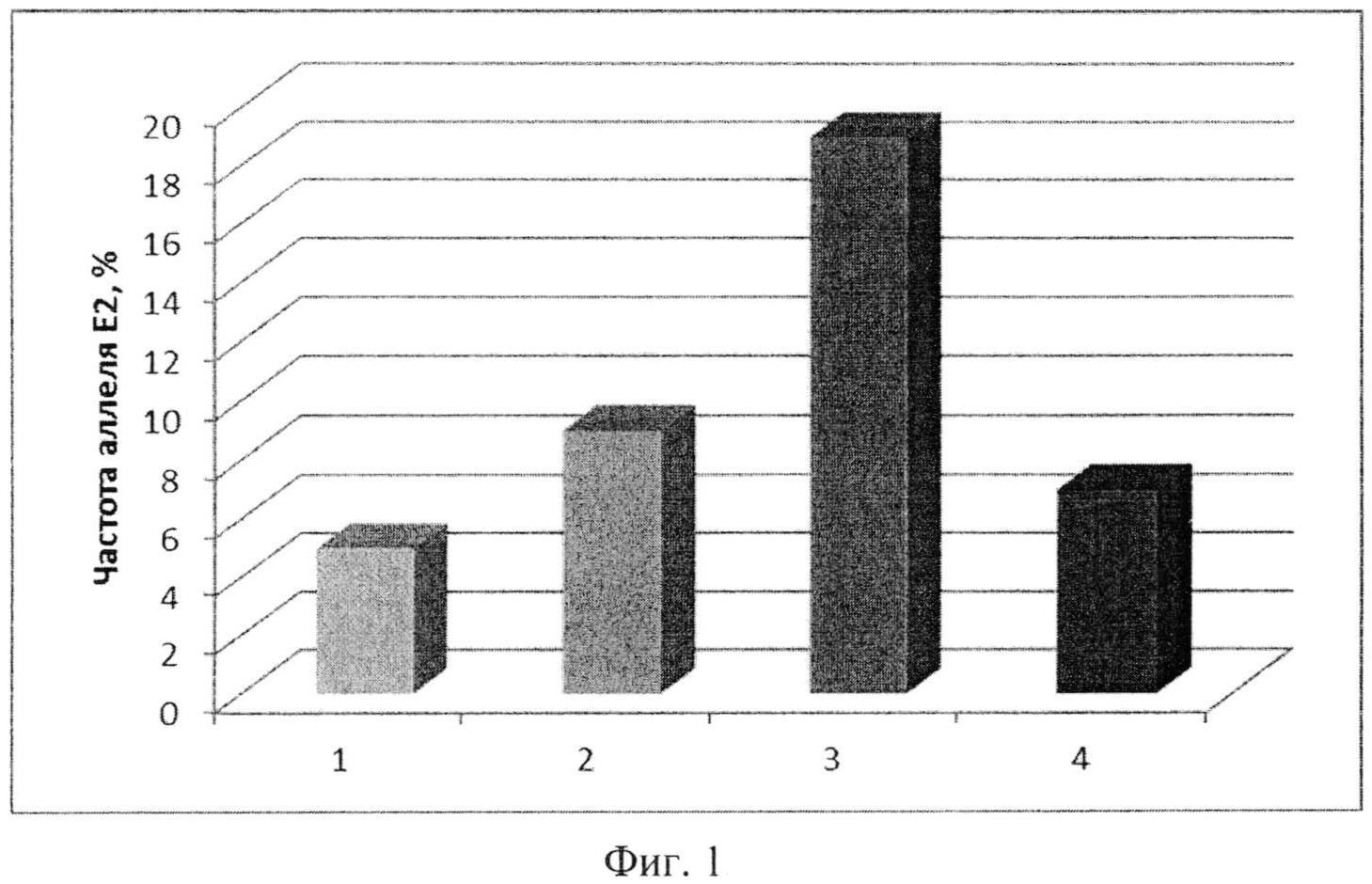
Фиг. 1. Распределение аллеля APOE*2 среди здоровых женщин и больных гиперпролиферативными заболеваниями эндометрия: 1 - здоровые женщины; 2 - гиперпластические процессы эндометрия (ГПЭ); 3 - рак эндометрия на фоне ГПЭ; 4 - рак эндометрия без гиперпластических процессов в анамнезе.
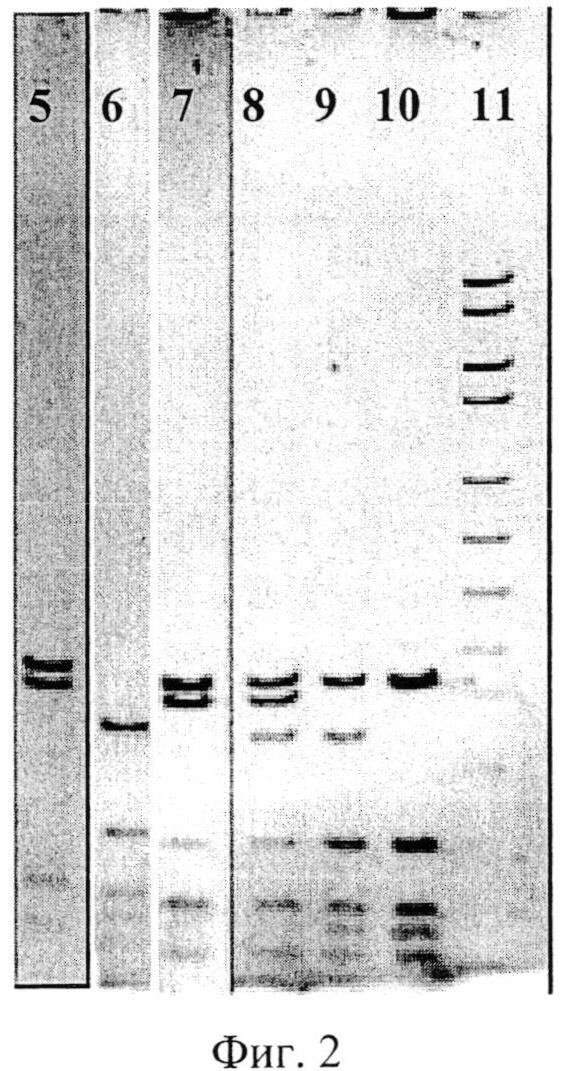
Фиг. 2. Электрофореграмма генотипов APOE: 5 - E2/E2, 6 - E4/E4, 7 - E2/E3, 8 - E2/E4, 9 - E3/E4, 10 - E3/E3, 11 - маркер молекулярного веса pUc18.
Порядок осуществления способа.
У пациенток с гиперпролиферативными заболеваниями эндометрия берется периферическая кровь. Образцы крови забираются в вакутейнеры с этилендиаминуксусной калиевой солью (К2ЭДТА) и хранятся при температуре минус 20°C. Геномную ДНК выделяют с помощью набора «Wizard Genomic DNA Purification Kit» («Promega») в соответствии с протоколом производителя. Для определения концентрации выделенной ДНК используют спектрофотометр NanoDrop1000. Критерием хорошего качества очистки выделенной ДНК служит величина A260/A280=1,8 (отношение абсорбции при длинах волн 260 и 280 нм). Далее образцы ДНК разводят до концентрации 25 нг/мкл и проводят полимеразную цепную реакцию (ПЦР) с последующей обработкой специфической рестриктазой (Cfo 1) и определением длин фрагментов рестрикции ПЦР/ПДРФ. В ПЦР реакцию брали 25 мкл реакционной смеси, состоящей из 50 нг ДНК, 0,5 мкмолей каждого праймера (прямой праймер GAGACGCGGGCACGGCTGTCC; обратный праймер GCACGCGGCCCTGTTCCACC, http://genome.cse.ucsc.edu/), 0,2 ммолей дезоксинуклеотидтрифосфатов, 0,2 Ед на реакцию ХотСтар ТагПолимеразы (Qiagen) с однократным буфером и Q-буфером(Qiagen).
Программа амплификации (термоциклер Mastercycler Nexus, Eppendorf):
95°C - 15 мин,
94°C - 30 с,
67°C - 30 с,
72°C - 1 мин,
со 2 по 4 29 циклов,
72°C - 10 мин.
Ампликоны APOE (310 пар оснований) рестрицировали Cfol(Promega). Замена Т(тимин) на С(цитозин) ведет к образованию сайта рестрикции
5′…GCG↓C…3′
3′…C↑GCG…5′
Переваривание проводили при 37°C в течение ночи в объеме 10 мкл реакционной смеси, содержащей 4 мкл ампликона, 1 мкл×10 буфера В (Promega), 1 мкг БСА, 1 ЕД фермента CfoI. Продукты рестрикции фракционировали посредством электрофореза в 8% полиакриламидном геле.
Аллель E2 на электрофореграмме имеет 4 полосы, соответствующие 91, 83, 39 и 32 парам оснований. Аллель E4 имеет 5 полос, соответствующие 72, 48, 39, 35 и 32 парам оснований. Аллель E3 характеризуется 5 полосами, соответствующими 91, 49, 39, 36 и 32 парам оснований (см. фиг. 2). Затем по сочетанию аллелей определяют генотипы у женщин с гиперпластическими процессами эндометрия, по которым судят о степени риска возникновения рака тела матки.
Для выявления связи между полиморфными аллелями и возникновением гиперпластических и онкологических заболеваний эндометрия применялось исследование «случай-контроль».
Статистический анализ проводят стандартными методами с помощью пакета программ «WinSTAT 2003.1», интегрированного в Exel и Snpstats Soft (http://bioinfo.iconcologia.net/snpstats/start.htm). При сравнении частот аллелей и генотипов применялся критерий Фишера. Для оценки прогностической и диагностической значимости аллеля APOE*2 вычисляют следующие показатели: чувствительность (доля среди больных, у которых присутствует аллель APOE*2) и специфичность теста (доля среди здоровых лиц, у которых отсутствует аллель APOE*2), отношение шансов (OR) - традиционный критерий для исследований «случай-контроль», отражающий степень сопряженности признаков при 95% доверительном интервале (CI). При OR=1 отсутствует связь между генотипом и заболеванием. OR>1 свидетельствует о риске развития заболевания. В качестве референтного аллеля используют аллель APOE*3.
Примеры реализации способа
Выявление пациенток с повышенным риском развития рака тела матки среди больных с гиперпластическими процессами эндометрия.
Риск развития рака тела матки определяют генотипы, несущие аллель APOE*2 (rs7412, C158Arg): E2/E3, или E2/E2, или E2/E4 гена APOE.
Пример 1
1. Определение прогностического и диагностического значения аллеля APOE*2 в оценке эффективности повышенного риска рака тела матки у женщин с гиперпластическими процессами эндометрия.
Возможность использования предложенного способа для определения прогноза развития эндометриоидной аденокарциномы у женщин с гиперпластическими процессами эндометрия подтверждает анализ результатов наблюдений 77 пациенток, у которых рак развился на фоне гиперпластических процессов эндометрия (РЭ+ГПЭ), в возрасте от 24 до 76 лет (средний возраст 52,9±11 лет). Для всех пациенток, больных раком эндометрия, по данным биопсии диагностирована эндометриоидная аденокарцинома. Контрольную группу составили 170 здоровых женщин, не имевших в анамнезе гинекологических заболеваний и соответствующих по возрасту исследуемому контингенту больных (51,5±10 лет, P>0,05). Распределение частот аллелей APOE*2 и APOE*3 приведено в таблице 1, а показатели прогностической и диагностической эффективности аллеля APOE*2 указаны в таблице 2.
|
|
Вывод. Среди больных раком тела матки на фоне гиперплазии эндометрия в 3,8 раза повышена частота встречаемости аллеля APOE*E2 (P<0,0001). Носительство аллеля E2 повышает шанс (риск) возникновения рака эндометрия на фоне гиперплазии в 5 раз, (OR=5,1; 95% CI 2.67-9.79) по сравнению с носителями аллеля E3 при чувствительности 22% и специфичности 95%. Частота аллеля APOE*2 представлена на Фиг 1, позиция 3.
1.а. Определение прогностического и диагностического значения генотипа E2/E3 гена APOE в оценке эффективности повышенного риска рака тела матки у женщин с гиперпластическими процессами эндометрия
Электрофореграмма генотипа E2/E3 гена APOE представлена на фиг. 2, позиция 7.
|
|
1.б. Определение прогностического и диагностического значения генотипа E2/E4 гена APOE в оценке эффективности повышенного риска рака тела матки у женщин с гиперпластическими процессами эндометрия
Электрофореграмма генотипа E2/E4 гена APOE представлена на фиг. 2, позиция 8.
|
|
Вывод. Наиболее неблагоприятным генотипом является вариант E2/E4 гена аполипопротеина, для носителей которого прогноз риска развития рака эндометрия максимален (OR=12, 95% CI 0,07-0,33, P=0,0097) при чувствительности теста 16% и специфичности 98,5%. В группе больных раком тела матки на фоне гиперпластических процессов эндометрия доля носителей E2/E4 в 9 раз превышает таковую в группе гинекологически здоровых женщин. Доля носителей генотипа E2/E3 повышена в 3,3 раза в группе больных раком тела матки на фоне гиперпластических процессов эндометрия по сравнению со здоровыми женщинами. Шанс заболеть увеличен в 3,6 раза (95% CI 1.84-7.03, P=0,0003) при чувствительности теста 35% и специфичности 87%.
Таким образом, полученные результаты выявили значимое увеличение частоты аллеля APOE*2 среди больных раком тела матки на фоне гиперпластических процессов эндометрия. Выявление у пациентки с гиперпластическими процессами эндометрия генотипа, несущего аллель APOE*2, указывает на повышенный шанс (риск) возникновения рака эндометрия у этой женщины.
Пример 2
Определение прогностического и диагностического значения аллеля APOE*2 в оценке эффективности повышенного риска гиперпластических заболеваний эндометрия.
Пациенты
Больные с гиперпластическими процессами эндометрия (гиперплазия эндометрия, полипы эндометрия, 93 человека), в возрасте от 22 до 71 года (средний возраст 50,5±10,1). Контрольную группу составили 170 здоровых женщин, не имевших в анамнезе гинекологических заболеваний и соответствующих по возрасту исследуемому контингенту больных (51,5±10). Генотипирование и анализ выполняются, как в примере 1.
|
|
Вывод. Среди пациенток с гиперпластическими процессами эндометрия доля носителей аллеля E2 {rs7412, C158Arg) гена APOE повышена в 1,8 раза по сравнению со здоровыми женщинами (P=0,0217). Шанс появления гиперпластических процессов эндометрия увеличен в 2,3 раза (95% CI 1,13-4,72) у носителей аллеля APOE*2 {rs7412, C158Arg) по сравнению с носителями аллеля E3. Чувствительность теста составляет 11%, специфичность 95%. Частота аллеля APOE*2 представлена на Фиг 1, позиция 2.
Пример 3
Распределение аллеля APOE*2 у женщин, больных гиперпролиферативными заболеваниями эндометрия, и здоровых женщин.
Проведен анализ распределения аллеля APOE*2 у здоровых и больных гиперпролиферативными заболеваниями эндометрия женщин (Табл. 9, Фиг. 1).
|
Обнаружено статистически достоверное (p-trend=0,0016) увеличение частоты встречаемости аллеля APOE*2 в ряду «здоровые, ГПЭ, ГПЭ+РЭ», что указывает на высокую значимость аллеля APOE*2 в развитии и течении гиперпролиферативных заболеваний эндометрия у женщин.
Пример 4.
Анализ ассоциации аллеля E2 гена APOE с раком эндометрия (в анамнезе не было гиперпластических заболеваний).
Пациенты
Пациентки с диагнозом рак эндометрия, у которых в анамнезе не было гиперпластических заболеваний (154 человека), в возрасте от 28 до 74 лет (средний возраст 57,4±9,7). Контрольную группу составили 99 здоровых женщин, не имевших в анамнезе гинекологических заболеваний и соответствующих по возрасту исследуемому контингенту больных (57,7±8,8, P=0,7). В таблице 10 приведены частоты аллелей APOE*2 и APOE*3.
|
Различия в распределении частоты аллеля APOE*2 между здоровыми и больными раком эндометрия, у которых в анамнезе не было гиперпластических процессов эндометрия, статистически не достоверны, P=0,2544. Аллель APOE*2 не является маркером риска развития рака эндометрия для женщин старшей возрастной категории, у которых в анамнезе не было гиперпластических процессов (гиперплазия, полипы эндометрия). Частота аллеля APOE*2 представлена на Фиг 1, позиция 4.
Подтверждение достижения технического результата
Представленный нами способ по сравнению с прототипом позволяет существенно расширить прогноз развития гиперпластических процессов эндометрия.
Полученный результат подтвержден наблюдениями 170 женщин, больных гиперпролиферативными заболеваниями эндометрия, среди которых у 93 человек диагностированы гиперпластические процессы эндометрия, а у 77 пациенток рак (эндометриоидная аденокарцинома) развился на их фоне. Контрольную группу составили 169 здоровых женщин, не имевших в анамнезе гинекологических заболеваний и соответствующих по возрасту исследуемому контингенту больных.
Сравнение результатов анализа генетических показателей риска развития гиперпролиферативных заболеваний эндометрия по предлагаемому способу и прототипу показывает большую эффективность аллеля APOE*2, т.к. позволяет выявлять не только высокий риск развития гиперпластических процессов эндометрия, в частности гиперплазию эндометрия, но и риск развития рака тела матки у женщин с гиперпластическими процессами эндометрия. В группе пациенток с раком тела матки на фоне гиперпластических заболеваний эндометрия уровень значимости превышения частоты аллеля APOE*2 по сравнению со здоровыми женщинами чрезвычайно высокий (P<0,0001), а шанс возникновения рака эндометрия у больных ГПЭ носительниц аллеля APOE*2 повышен в 5 раз, (OR=5,1; 95% CI 2.67-9.79) (Пример 1).
Анализ распределения аллеля APOE*2 у здоровых и больных гиперпролиферативными заболеваниями эндометрия женщин (Пример 3, Табл. 9, Фиг.1) обнаружил статистически достоверное (p-trend=0,0016) увеличение частоты встречаемости аллеля APOE*2 в ряду «здоровые, ГПЭ, ГПЭ+РЭ», что указывает на значимую ассоциацию аллеля APOE*2 с гиперпролиферативными заболеваниями эндометрия и его роль в их развитии.
Примеры 1, 3, 4 доказывают, что предлагаемый способ прогнозирует развитие онкологических заболеваний тела матки, которые возникли на фоне гиперпластических процессов эндометрия.
Таким образом, прогностические и диагностические показатели аллеля APOE*2 по предлагаемому способу достаточно высоки и значимы, что доказывает возможность его применения для выявления среди пациенток с гиперпластическими процессами эндометрия женщин с повышенным шансом возникновения рака тела матки. Предлагаемый способ дает возможность быстро получить неинвазивным способом высокоспецифичный критерий для оценки прогноза риска развития гиперпролиферативных заболеваний эндометрия, в том числе эндометриоидной аденокарциномы у женщин с гиперпластическими процессами эндометрия.
Способ определения риска развития рака тела матки, включающий выделение ДНК из периферической венозной крови, отличающийся тем, что проводят генотипирование гена APOE у женщин с гиперпластическими процессами эндометрия, выявляют полиморфные аллели APOE*2, APOE*3, APOE*4 и при наличии генотипов, содержащих аллели APOE*2, прогнозируют высокий риск рака эндометрия.