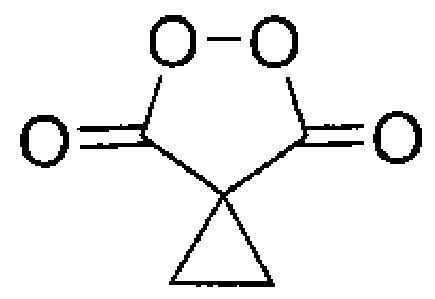
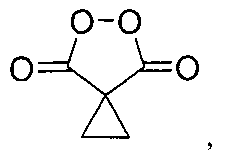
Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОПРОИЛМАЛОНИЛ ПЕРОКСИДА
Вид РИД
Изобретение
Настоящее изобретение относится к области химии органических пероксидов, конкретно к способу получения циклопропилмалонил пероксида (5,6-диоксоспиро[2.4]гептан-4,7-диона), представителю класса диацилпероксидов, который находит широкое применение в органическом синтезе как селективный окислитель.
В настоящее время возможности использования и востребованность циклопропилмалонил пероксида значительно выросли. Открыты методы стереоселективного дигидроксилирования алкенов [(a) M. Schwarz, О. Reiser. // Metal or No Metal: That Is the Question! // Angew. Chem. Int. Ed., 2011, 50, 10495-10497. (b) J.C. Griffith, К.M. Jones, S. Picon, M.J. Rawling, B.M. Kariuki, M. Campbell, N.C.O. Tomkinson \\ Alkene Syn Dihydroxylation with Malonoyl Peroxides \\ J. Am. Chem. Soc, 2010, 132, 14409-14411. (c) S. Picon, M. Rawling, M. Campbell, N.С.O. Tomkinson \\ Alkene Dihydroxylation with Malonoyl Peroxides: Catalysis Using Fluorinated Alcohols \\ Org. Lett., 2012, 14, 6250-6253. (d) К.M. Jones, N.С.O. Tomkinson \\ Metal-Free Dihydroxylation of Alkenes using Cyclobutane Malonoyl Peroxide \\ J. Org. Chem., 2012, 77, 921-928. http://dx.doi.org/10.1021/jo202084w (e) M.J. Rawling, J.H. Rowley, M. Campbell, A.R. Kennedy, J.A. Parkinson, N.С.O. Tomkinson \\ Mechanistic insights into the malonoyl peroxide syn-dihydroxylation of alkenes \\ Chem. SW., 2014, 5, 1777. (f) M.J. Rawling, N.С.O. Tomkinson \\ Metal-free syn-dioxygenation of alkenes \\ Org. Biomol. Chem., 2013, 11, 1434-1440.] и гидроксилирования аренов [С. Yuan, Y. Liang, T. Hernandez, A. Berriochoa, К.N Houk, D. Siegel \\ Metal-free oxidation of aromatic carbon-hydrogen bonds through a reverse-rebound mechanism \\ Nature, 2013, 499, 192-196. DOI: 10.1038/nature 12284].
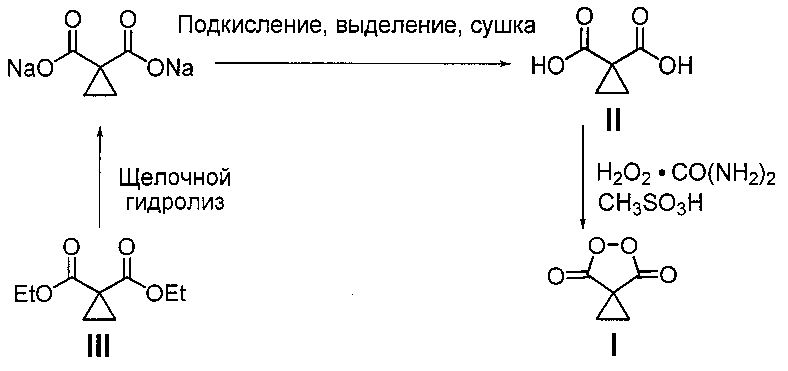
В литературе известен единственный способ получения циклопропилмалонил пероксида (5,6-диоксоспиро[2.4]гептан-4,7-диона) (I) путем взаимодействия циклопропилмалоновой кислоты (II) с клатратом пероксида водорода и карбамида в среде метансульфоновой кислоты [J.C. Griffth, К.М. Jones, S. Picon, M.J. Rawling, В.М. Kariuki, М. Cambell, N.С.О. Tomkinson \\ Alkene Syn Dihydroxylation with Malonoyl Peroxides \\ J. Am. Chem. Soc., 2010, 132, 14409-14411]. Согласно этому способу циклопропилмалоновую кислоту (35 ммоль) добавляют к смеси клатрата пероксида водорода и карбамида (104 ммоль) в метансульфоновой кислоте (30 мл, 462 смоль), через 18 часов выделяют продукт с выходом 77% в расчете на циклопропилмалоновую кислоту (II). Мольное соотношение реагентов циклопропилмалоновая кислота : пероксид водорода (в форме клатрата пероксида водорода и карбамида) : метансульфоновая кислота составляет 1:2.97:13.2 соответственно. Циклопропилмалоновую кислоту (II) предварительно получают через стадии щелочного гидролиза циклопропилмалонового эфира (III) в течение 60 часов, подкисления реакционной массы, выделения и сушки. В расчете на циклопропилмалоновый эфир (III) выход циклопропилмалонил пероксида (I) составил 66%. Недостатком этого способа является невысокий выход целевого продукта, многостадийность и длительность процесса, а также необходимость выделения и очистки промежуточных продуктов. Процесс протекает по следующей схеме:
Задачей настоящего изобретения является увеличение выхода целевого циклопропилмалонил пероксида (5,6-диоксоспиро[2.4]гептан-4,7-диона) (I) и упрощение технологии процесса его получения.
Поставленная задача достигается предлагаемым способом получения циклопропилмалонил пероксида формулы I:
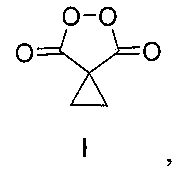
путем взаимодействия циклопропилмалонового эфира (III) с клатратом пероксида водорода и карбамида в присутствии метансульфоновой кислоты при мольном соотношении циклопропилмалоновый эфир (III) : пероксид водорода (в форме клатрата пероксида водорода и карбамида) : метансульфоновая кислота 1:5-10:20-45 соответственно. Процесс проводят при комнатной температуре (20-25°C) в течение 18-24 ч с выходом от 80 до 90% по следующей схеме:
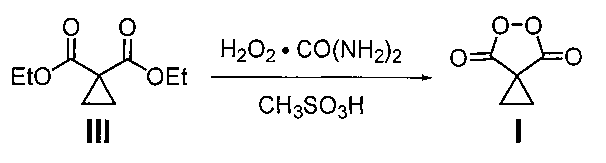
Вовлечение в реакцию непосредственно циклопропилмалонового эфира в качестве исходного соединения с клатратом пероксида водорода и карбамида в присутствии метансульфоновой кислоты и проведение процесса при мольном соотношении циклопропилмалоновый эфир (III) : пероксид водорода (в форме клатрата пероксида водорода и карбамида) : метансульфоновая кислота 1:5-10:20-45 соответственно позволило не только упростить процесс за счет сокращения стадий щелочного гидролиза циклопропилмалонового эфира (III), подкисления реакционной массы, выделения и сушки циклопропилмалоновой кислоты (II), но также значительно повысить выход целевого продукта.
Следует отметить, что использование в качестве исходного соединения непосредственно циклопропилмалонового эфира (III), а не циклопропилмалоновой кислоты (II) для получения конечного продукта было неочевидным, так как при использовании для этой реакции, например, циклопентилмалонового эфира малонилпероксид вообще не образуется (сравнительный пример 5). Таким образом, изобретение соответствует критерию «изобретательский уровень», так как заранее не возможно было предвидеть, что реакция пройдет успешно, и при этом выход целевого продукта будет достаточно высоким.
Изобретение иллюстрируется следующими примерами.
Пример 1.
К метансульфоновой кислоте (5.17 г, 3.49 мл, 53.80 ммоль, 20 моль на моль циклопропилмалонового эфира) добавляли при перемешивании клатрат пероксида водорода и карбамида (2.53 г, 26.90 ммоль, 10 моль на моль циклопропилмалонового эфира), перемешивали смесь 2 минуты. Добавляли циклопропилмалоновый эфир (0.50 г, 2.69 ммоль) и перемешивали смесь в течение 24 часов. Добавляли H2O (30 мл) и этилацетат (30 мл), органический слой отделяли, водный промывали этилацетатом (4×30 мл). Объединенные органические слои промывали водой H2O (2×10 мл), 5% водным раствором NaHCO3 (2×10 мл) и снова водой H2O (2×10 мл), сушили над MgSO4. Растворитель удаляли в вакууме водоструйного насоса. Получали белые кристаллы циклопропилмалонил пероксида с выходом 80% (0.28 г, 2.15 ммоль). Τпл.=89-91°C. 1H NMR (300.13 MHz, CDCl3, δ): 2.08 (s, 4H). 13C NMR (75.48 MHz, CDCl3, δ): 19.8, 23.6, 172.1.
Пример 2.
К метансульфоновой кислоте (11.63 г, 7.86 мл, 121.05 ммоль, 45 моль на моль циклопропилмалонового эфира) добавляли при перемешивании клатрат пероксида водорода и карбамида (2.53 г, 26.90 ммоль, 10 моль на моль циклопропилмалонового эфира), перемешивали смесь 2 минуты. Добавляли циклопропилмалоновый эфир (0.50 г., 2.69 ммоль) и перемешивали смесь в течение 24 часов. Добавляли H2O (30 мл) и этилацетат (30 мл), органический слой отделяли, водный промывали этилацетатом (4×30 мл). Объединенные органические слои промывали водой H2O (2×10 мл), 5% водным раствором NaHCO3 (2×10 мл) и снова водой H2O (2×10 мл), сушили над MgSO4. Растворитель удаляли в вакууме водоструйного насоса. Получали белые кристаллы циклопропилмалонил пероксида с выходом 88% (0.30 г, 2.37 ммоль). Τпл.=89-91°C. 1Н NMR (300.13 MHz, CDCl3, δ): 2.08 (s, 4Н). 13С NMR (75.48 MHz, CDCl3, δ): 19.8, 23.6, 172.1.
Пример 3.
К метансульфоновой кислоте (7.76 г, 5.24 мл, 80.70 ммоль, 30 моль на моль циклопропилмалонового эфира) добавляли при перемешивании клатрат пероксида водорода и карбамида (2.53 г, 26.90 ммоль, 10 моль на моль циклопропилмалонового эфира), перемешивали смесь 2 минуты. Добавляли циклопропилмалоновый эфир (0.50 г, 2.69 ммоль) и перемешивали смесь в течение 18 часов. Добавляли H2O (30 мл) и этилацетат (30 мл), органический слой отделяли, водный промывали этилацетатом (4×30 мл). Объединенные органические слои промывали водой H2O (2×10 мл), 5% водным раствором NaHCO3 (2×10 мл) и снова водой H2O (2×10 мл), сушили над MgSO4. Растворитель удаляли в вакууме водоструйного насоса. Получали белые кристаллы циклопропилмалонил пероксида с выходом 90% (0.31 г, 2.42 ммоль). Τпл.=89-91°C. 1Н NMR (300.13 MHz, CDCl3, δ): 2.08 (s, 4Н). 13С NMR (75.48 MHz, CDCl3, δ): 19.8, 23.6, 172.1.
Пример 4.
К метансульфоновой кислоте (7.76 г, 5.24 мл, 80.70 ммоль, 30 моль на моль циклопропилмалонового эфира) добавляли при перемешивании клатрат пероксида водорода и карбамида (1.27 г, 13.45 ммоль, 5 моль на моль циклопропилмалонового эфира), перемешивали смесь 2 минуты. Добавляли циклопропилмалоновый эфир (0.50 г, 2.69 ммоль) и перемешивали смесь в течение 24 часов. Добавляли H2O (30 мл) и этилацетат (30 мл), органический слой отделяли, водный промывали этилацетатом (4×30 мл). Объединенные органические слои промывали водой H2O (2×10 мл), 5% водным раствором NaHCO3 (2×10 мл) и снова водой H2O (2×10 мл), сушили над MgSO4. Растворитель удаляли в вакууме водоструйного насоса. Получали белые кристаллы циклопропилмалонил пероксида с выходом 84% (0.29 г, 2.26 ммоль). Τпл.=89-91°C. 1Н NMR (300.13 MHz, CDCl3, δ): 2.08 (s, 4Н). 13С NMR (75.48 MHz, CDCL3, δ): 19.8, 23.6, 172.1.
Пример 5. (Сравнительный)
К метансульфоновой кислоте (4.48 г, 3.02 мл, 46.60 ммоль, 20 моль на моль циклопентилмалонового эфира) добавляли при перемешивании клатрат пероксида водорода и карбамида (2.19 г, 23.30 ммоль, 10 моль на моль циклопентилмалонового эфира), перемешивали смесь 2 минуты. Добавляли циклопентилмалоновый эфир (0.50 г, 2.33 ммоль) и перемешивали смесь в течение 24 часов. Добавляли H2O (30 мл) и этилацетат (30 мл), органический слой отделяли, водный промывали этилацетатом (4×30 мл). Объединенные органические слои промывали водой H2O (2×10 мл), 5% водным раствором NaHCO3 (2×10 мл) и снова водой H2O (2×10 мл), сушили над MgSO4. Растворитель удаляли в вакууме водоструйного насоса. Получали 0.48 г прозрачного масла. Анализ с помощью спектроскопии H1 и С13 ЯМР показал, что выделенное масло является исходным циклопентилмалоновым эфиром с чистотой 90%.
Техническим результатом предлагаемого изобретения является повышение выхода целевого продукта до 90% в отличие от прототипа (77% в расчете на циклопропилмалоновую кислоту (II) и 66% в расчете на циклопропилмалоновый эфир (III)), сокращение стадий и времени, что значительно упрощает процесс и делает его недорогим и доступным для лабораторного и промышленного применения.
Способ получения циклопропилмалонил пероксида формулы: заключающийся в том, что циклопропилмалоновый эфир подвергают взаимодействию с клатратом пероксида водорода и карбамида в присутствии метансульфоновой кислоты и процесс ведут при мольном соотношении циклопропилмалоновый эфир : пероксид водорода (в форме клатрата пероксида водорода и карбамида) : метансульфоновая кислота 1:5-10:20-45 соответственно.