СПОСОБЫ МОДУЛИРОВАНИЯ АКТИВНОСТИ МС5 РЕЦЕПТОРА И ЛЕЧЕНИЕ СОСТОЯНИЙ, ОТНОСЯЩИХСЯ К ДАННОМУ РЕЦЕПТОРУ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к способам модулирования активности меланокортин-5 рецептора. В частности данное изобретение относится к применению семейства 1,4-диазепан-2-онов и их производных для модулирования активности меланокортин-5 рецептора. Данное изобретение также относится к способам и применениям соединений при лечении состояний, в которых является выгодным антагонизм меланокортин-5 рецептора.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Меланокортин-5 рецептор (MC5R) представляет собой сопряженный с G-белком рецептор (GPCR), относящийся к семейству меланокортиновых рецепторов. Существует пять меланокортиновых рецепторов, которые были выделены и клонированы к настоящему времени. MC1R, MC2R, MC3R, MC4R и MC5R. Меланокортиновые рецепторы участвуют в различных физиологических функциях, обеспечивая ряд возможностей для терапевтического вмешательства в физиологические процессы при помощи изменения (т.е. статистически значимое повышение или уменьшение) или модуляции (например, повышающая регуляция или понижающая регуляция) сигнальной активности меланокортинового рецептора.
Опубликованы обзоры о меланокортиновых рецепторах и их потенциале в качестве мишеней для терапии (Wikberg 2001; Bohm 2006). Члены семейства меланокортиновых рецепторов регулируются природными пептидными агонистами, такими как АСТН (адренокортикотропный гормон), и меланоцит-стимулирующими гормонами (α-, β-, γ-MSH), полученными из проопиомеланокортина (РОМС), и пептидными антагонистами, такими как Агути-сигнальный белок (ASP) и Агути-родственный белок (AGRP). MC1R широко экспрессируется и связан с пигментацией в меланоцитах и с воспалительными ответами во многих клетках, вовлеченных в иммунную систему. MC2R отличается от других меланокортиновых рецепторов тем, что он связывает только АСТМ, но не MSH лиганды. Он высоко экспрессируется в надпочечной железе и регулирует синтез кортикостероидов. MC3R встречается в мозге, а также в других местах в теле и, как оказывается, играет роль в регуляции энергетического гомеостаза и возможно половой дисфункции. MC4R встречается фактически только в мозге, иногда сообщается о его присутствии в других местах. Он тесно связан с контролем питания, а также связан с половым влечением. MC5R широко экспрессируется в периферических тканях, особенно в экзокринных железах, при этом некоторое количество рецептора также экспрессируется в мозге. Принимая во внимание охват активности, связанной с меланокортиновыми рецепторами, необходимо при наведении на мишень одного из этих рецепторов делать это избирательно во избежание побочных эффектов, связанных с антагонизмом или агонизмом другого рецептора в этом семействе.
MC5R клонировали и экспрессировали из множества видов, включая людей в 1993 (хотя называется МС2 в данном документе) (Chhajlani 1993), крысу в 1994 (Griffon 1994), мышей в 1994 (Gantz 1994; Labbe 1994) и в 1995 (Fathi 1995), представителя собачьих (Houseknecht 2003), макак-резус (Huang 2000), овцу (Barrett 1994), полосатую перцину (Ringholm 2002), серебряного карася (Cerdá-Reverter 2003), колючую акулу (Klovins 2004), радужную форель (Haitina 2004) и курицу (Ling 2004), с помощью MC5R гена, также идентифицированным у свиньи (Kim 2000). Были опубликованы патенты, охватывающие MC5R последовательность у людей (Wikberg 2002), мышей (Yamada 1997), макак-резус (Fong 2003) и собак (Houseknecht 2003).
Ряд исследований связывают MC5R с регулированием салоотделения, как подытожено в 2006 (Zhang 2006). Мыши, испытывающие нехватку MC5R, имеют уменьшенную выработку кожного сала, о чем свидетельствует отмеченная неспособность сбрасывать воду с их меха и уменьшенное количество кожного сала, выделенного из их шерсти. В значительной степени эти мыши в остальном в целом были здоровыми, без легко заметных нарушений (внешний вид, поведение, рост, мышечная масса, жировая масса, размножение, уровни базального и вызванного стрессом кортикостерона, глюкозы и инсулина) (Chen 1997). Дальнейшие исследования идентифицировали уменьшение феромонов, вызывающее изменения в агрессивном поведении между мышами (Caldwell 2002; Morgan 2004a; Morgan 2004b; Morgan 2006). Мыши, у которых РОМС-производные пептидные нативные лиганды MC5R «нокаутированы», проявляют сходный фенотип (Yaswen 1999). Крысы, инъецированные α-MSH, имели увеличенные на 30-37% нормы выработки кожного сала, в то время как удаление промежуточной доли гипофиза (источника MSH). вызвало понижение салоотделения на 35%, которое было восстановлено после введения α-MSH (Thody 1973). Синергетическое действие между а-MSH и тестостероном наблюдалось у крыс, при этом тестостерон увеличивает сальную железу и клеточные объемы (вероятно посредством повышенной пролиферации), α-MSH увеличивает жирообразование кожи, а сочетание увеличивает салоотделение (Thody 1975a; Thody 1975b).
Посредством обнаружения MC5R транскриптов в микрорассеченных сальных железах (Thiboutot 2000), обнаружения MC5R в человеческих лицевых сальных железах окрашиванием с использованием иммунной метки (Hatta 2001), обнаружения MC5R мРНК и MC5R в человеческих сальных железах, культивированных человеческих себоцитах и крысиных препуциальных клетках (Thiboutot 2000) и обнаружения MC5R в виде пунктатных частиц в сальных железах окрашиванием поликлональными антителами было показано, что на клеточном уровне человеческие себоциты экспрессируют MC5R, который виден в дифференцированных, но не в недифференцированных себоцитах (Zhang 2006). MC5R мРНК также обнаружена в сальных железах из кожи мышей дикого типа, но не в срезах кожи «MC5R-нокаутированных» мышей (Chen 1997). Обработка человеческих себоцитов холерным токсином (СПТ), экстрактом гипофиза быка (ВРЕ), α-MSH или NDP-MSH увеличивает формирование липидных капель, синтез сквалена и экспрессию MC5R (Zhang 2003; Zhang 2006). В то время, как и MC1R, и MC5R обнаружены в жировых клетках, обработка первичной себоцитной клеточной культуры человека NDP-MSH или ВРЕ вызвала у человека значительное увеличение экспрессии MC5R по сравнению с бессывороточными состояниями, коррелируя с дифференцировкой себоцитов. Иммортализованные линии жировых клеток (SZ-95, TSS-1 и SEB-1) также демонстрируют экспрессию MC5R (Jeong 2007; Smith 2007a; Phan 2007). Эти исследования наводят на мысль, что MC5R антагонисты могут применяться при уменьшении салоотделения у млекопитающих и, следовательно, при лечении состояний, связанных с избыточным салоотделением.
Было обнаружено, что семейство 1,2,4-тиадиазольных производных с антагонистической активностью MC5R (138-320 нМ) уменьшают салообразование как в культурах человеческих клеток себоцитов, так и при нанесении местно на человеческую кожу, пересаженную на иммунодефицитных мышей (Eisinger 2003a-d; 2006a, b).
Избыточное салоотделение, или себорея, представляет собой обычный недуг, Сальные железы встречаются на большей части тела с плотными сосредоточениями больших желез на лице, волосистой части кожи головы и верхней части торса (Simpson and Cunliffe p43.1). Салоотделение зависит частично от андрогенных гормонов, возможно 35 частично опосредуется 5α-редуктазой, которая перерабатывает тестостерон в 5α-DHT (дигидротестостерон). Кожное сало состоит из видоспецифической смеси липидов. У людей оно состоит из приблизительно 58% глицеридов, 26% сложных восковых эфиров, 12% сквалена и 4% холестерина/сложных эфиров холестерина (Simpson and Cunliffe p43.5). Присутствие сквалена является едва не исключительной особенностью человеческого кожного сала. Функция кожного сала четко не определена, но считается, что оно имеет фунгистатические свойства и играет роль в потере влаги из эпидермиса и его водоотталкивающей способности (Simpson and Cunliffe p43.6; Danby 2005; Porter 2001; Shuster 1976; Kligman 1963).
Избыточное салоотделение связано с развитием обыкновенных угрей. Обыкновенные угри является обычным заболеванием, поражающим примерно 80% населения земного шара на определенном этапе своей жизни. У человека скорее разовьется акне, чем любое другое заболевание, несмотря на то, что тяжесть значительно варьирует (Simpson and Cunliffe p43.16). Акне достигает максимума в распространенности и тяжести у подростков в возрасте 14-19 лет, с приблизительно 35-40% пораженными, но у значительного числа пациентов (7-24%) он продолжается за пределами 25-летнего возраста (Simpson and Cunliffe p43.15). Из пациентов, лечащихся от акне, одно исследование обнаружило, что 80% все еще имели симптомы в 30-40-летнем возрасте (Simpson and Cunliffe p43.16). Несмотря на то, что акне не является опасным для жизни заболеванием, оно может сильно воздействовать на качество жизни пациентов (Follador 2006), при этом одно исследование пациентов с тяжелым акне показывает подобное влияние как у более серьезных хронических медицинских состояний, таких как астма, эпилепсия, диабет, боль в спине или артрит (Mallon 1999).
Считается, что четыре основных фактора вовлечены в патогенез акне: (i) увеличенная выработка кожного сала (себорея), (ii) гиперороговение/закупирование протока, относящегося к волосу и сальной железе (угревая сыпь), (iii) инфицирование протока Р. acnes, и (iv) воспаление протока, относящегося к волосу и сальной железе (Simpson and Cunliffe p43.15; Williams 2006). Ряд исследований показал четкую связь между увеличенной выработкой кожного сала и наличием и тяжестью акне (Simpson and Cunliffe p43.17; Youn 2005; Pierard 1987; Harris 1983; Cotterill 1981; Thody 1975 с; Pochi 1964). Исследование в 2007 году установило взаимосвязь между экскрецией кожного сала и развитием акне у детей в предподростковом возрасте (Mourelatos 2007). Кожное сало является основным питательным веществом Р. acnes, таким образом, уменьшение кожного сала будет уменьшать последующую бактериальную инфекцию и воспалительный ответ.
Андрогенные половые гормоны, по-видимому, играют роль в развитии акне, с сильной взаимосвязью с выработкой кожного сала (Makrantonaki 2007). Драже двух пероральных противозачаточных средств одобрены FDA (Комиссия по контролю за лекарствами и питательными веществами) для лечения обыкновенных угрей (Harper 2005), и эти соединения, по-видимому, действуют при помощи уменьшения андроген-опосредованного салообразования. Режим питания (Cordain 2005; Smith 2007b), стресс (Zouboulis 2004) и генетические факторы (Goulden 1999, Bataille 2006) также могут играть роль в акне, опять же потенциально посредством увеличенной выработки кожного сала.
Нынешние методы лечения обыкновенных угрей сосредоточены преимущественно на лечении инфекции и воспалительных стадиях заболевания с помощью большого числа различных составов местнодействующих антибиотиков (например, бензоил пероксид, тетрациклин, эритромицин, клиндамицин) и ретиноидов (например, ретиноевая кислота, изотретиноин, адапален, тазаротен), применяемых или одиночно, или в сочетании, некоторые из них также обладают противовоспалительным действием (Simpson and Cunliffe p43.36-43.38). Многие из этих методов лечения, имеют ограниченную эффективность, особенно в тяжелых случаях акне Растущей проблемой является развитие антибиотик-резистентных штаммов Р acnes (Simpson and Cunliffe р43 37, 43 46, Williams 2006). Как местнодействующие ретиноиды, так и бензоил пероксид вызывают раздражение кожи, а ретиноиды могут вызывать светочувствительность (Williams 2006). Пероральные методы лечения включают изотретиноин, антибиотики, гормоны и стероиды. Было показано, что у женских особей антиандрогены уменьшают выработку кожного сала (приблизительно на 40-80%, хотя и без плацебо контрольной группы) и уменьшают акне (Simpson and Cunliffe р43 44; Burke 1984, Goodfellow 1984) Лазерные и основанные на УФ терапии получают распространение и, как предполагается действуют при помощи нагревания сальной железы с последующим уменьшением салообразования, с уменьшением как салообразования, так и измеренных поражений акне (Jih 2006, Bhardwaj 2005). Из многих терапий, пригодных для акне, только пероральный изотретиноин и гормональные терапии действуют путем регулирования сальной железы для уменьшения салоотделения (Clarke 2007).
Наиболее эффективное лечение акне, пероральный изотретиноин (13-цис-ретиноевая кислота, Roaccutane, Accutane), был внедрен в 1983 и все еще остается наиболее клинически эффективной терапией против акне. Это единственное известное лечение с сильной супрессивной активностью на выработку сала, уменьшающее экскрецию кожного сала до 90% после 8-12 недель терапии (60-70% через 2 недели) (Simpson and Cunliffe р43 47, Jones 1983, Goldstein 1982, King 1982). Местнодействующие ретиноиды, в отличие от этого, не оказывают влияния на выработку кожного сала. Пероральный изотретиноин является также противовоспалительным, уменьшает возникновение угревой сыпи и уменьшает инфекцию Р. acnes. Механизм действия до сих пор неясен, и, по-видимому, важную роль играют метаболиты изотретиноина. Изотретиноин индуцирует апоптоз и прекращение клеточного цикла у человеческой иммортализованной SEB-1 себоцитной клеточной культуры (Nelson 2006). К сожалению, пероральный изотретиноин имеет серьезные побочные действия; в значительной степени он является тератогеном и ему необходима программа регистрации для применения в США. FDA выдал предупреждение против онлайн покупок изотретиноина. Во время лечения также рекомендуют исследование крови на липиды, сдаваемой натощак, и функцию печени (Williams 2006). Изотретиноин связывали (хотя и не существенно) с побочными психологическими эффектами, включая суицид и депрессию (Marqueling 2005).
Другие формы акне, такие как шаровидные угри или молниеносные угри, могут также реагировать на вещество, уменьшающее кожное сало. Себорея, или избыточное продуцирование кожного жира, часто связана с тяжелым состоянием акне. Себорейный дерматит (СД) представляет собой кожное заболевание, связанное с богатыми кожным салом областями волосистой части головы, лица и торса с чешуйчатым, хлопьевидным, зудящим покраснением кожи, поражающим 3-5% населения; перхоть представляет легкую форму этого дерматита, поражающее 15-20% населения. Себорея и СД встречаются чаще у пациентов с болезнью Паркинсона или аффективными расстройствами (паралич лицевого нерва, супраорбитальное повреждение, полиомиелит, сирингомиелия, квадриплегия, одностороннее повреждение в гассеровом ганглие и таковые с ВИЧ/СПИД) (Plewig 1999). Исследования показали, что себорейный дерматит также связан с хроническим алкогольным панкреатитом, вирусом гепатита С и различными раковыми опухолями. Он также обычно встречается у пациентов с генетическими нарушениями, такими как синдром Дауна, болезнь Хейли-Хейли и кардио-фацио-кожный синдром (Gupta 2004). Для лечения этих симптомов MC5R антагонисты могут применяться.
Хотя и немногочисленно, но описаны различные опухоли, поражающие сальные железы или жировые клетки (например, Ide 1999; Mariappan 2004; Kruse 2003). Синдром Мюир-Торре включает аденомы сальной железы, связанные с внутренней аденокарциномой (обычно толстой кишки, молочной железы, яичника или простаты). Предотвращение дифференцировки жировых клеток может предоставить эффективное лечение для купирования роста опухоли. Для этой цели применяли пероральный изотретиноин (Graefe 2000). Гиперплазия сальных желез является доброкачественной гиперплазией сальных желез, образовывающей желтоватые маленькие папулы на поверхности кожи, обычно лица. Заболевание связано с избыточный пролиферацией недифференцированных себоцитов, но не с избыточным салообразованием. Эктопические сальные железы (гранулы Фордайса) представляют собой сходные желтые папулы, обнаруживаемые во рту или на теле полового члена. И те, и другие реагируют на пероральный изотреиноин. Эффективное лечение может представлять собой соединение, которое уменьшало пролиферацию себоцитов.
a-MSH демонстрирует иммуносупрессивные эффекты на людей, подавляя ряд воспалительных ответов, и MC5R вовлекался в эти иммуномодулирующие активности. Было обнаружено, что MC5R мРНК экспрессируется на высоких уровнях в человеческих CD4+ Т-хелперных (ТП) клетках и на умеренных уровнях в других человеческих лейкоцитах периферической крови (Andersen 2005). У мышей MC5R выявили в лимфоидных органах (Labbe, 1994) и MC5R обнаружили на поверхности мышиных про-В-лимфоцитных клеток, где он, как оказалось, опосредует α-MSH активацию JAK2 сигнального проводящего пути, усиливающую клеточную пролиферацию (Buggy 1998). Индуцирование CD25+ CD4+ регуляторных Т-клеток с помощью α-MSH также, как оказалось, осуществляется посредством MC5R (Taylor 2001).
Вследствие вышеописанных причин было бы желательным обеспечение MC5R антагонистов, которые можно было бы применять в ряде терапевтических областей. Терапевтическая регуляция биологической сигнальной трансдукции включает модуляцию MC5R-опосредованных клеточных событий, включая, среди прочего, ингибирование или потенцирование взаимодействий среди MC5R-связывающих и активирующих или деактивирующих молекул, или других веществ, которые регулируют MC5R активности. Увеличенная способность к такому регулированию MC5R может облегчить развитие способов модулирования салоотделения или других биологических процессов, и лечения состояний, связанных с такими путями, таких как акне, как описано выше.
Соответственно по-прежнему необходимо разработать более совершенные способы модулирования активности MC5R, которые будут облегчать лечение MC5R-связанных состояний.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
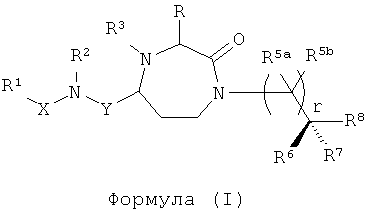
Данное изобретение предусматривает способ понижающего регулирования активности MC5R или его фрагмента, аналога или функционального эквивалента, при котором MC5R или его фрагмент или аналог или функциональный эквивалент подвергают воздействию соединения формулы (I):
 ,
,
где
Y представляет собой группу формулы -(CR9R10)n-;
Х выбран из группы, включающей -С(=O)-, -ОС(=O)-, -NHC(=O)-, -(CR11R12)s и -S(=O)2-;
R представляет собой группу аминокислотной боковой цепи;
R1 выбран из группы, включающей Н, факультативно замещенный С1-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С2-С12алкинил, факультативно замещенный С1-С12гетероалкил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный С2-С12гетероциклоалкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил;
R2 и R3 каждый независимо выбран из группы, включающей Н, факультативно замещенный С1-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С2-С12алкинил, факультативно замещенный С1-С12гетероалкил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный С2-С12гетероциклоалкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил;
каждый R5a и R5b независимо выбраны из группы, включающей Н, галоген, С1-С12алкил, С1-С12гидроксиалкил и С1-С12галоалкил, или
один или более из R5a и R5b, взятые вместе с одним или более из R6, R7 и R8, и атомами, к которым они прикреплены, образуют часть, выбранную из группы, включающей факультативно замещенный С3-С12циклоалкил, факультативно замещенный С2-С12гетероциклоалкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил;
R6, R7 и R8 каждый независимо выбран из группы, включающей Н, галоген, гидрокси, факультативно замещенный С1-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С2-С12алкинил, факультативно замещенный С1-С12гетероалкил, факультативно замещенный C1-С10гетероалкенил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный С2-С12гетероциклоалкил, факультативно замещенный С6-С18арил, факультативно замещенный С1-С18гетероарил, факультативно замещенный амино, факультативно замещенный карбокси, С1-С12алкилокси и факультативно замещенный тио, или
(a) взятые вместе с атомом углерода, к которому они прикреплены, два или более из R6, R7 и R8 образуют часть, выбранную из группы, включающей факультативно замещенный С2-С12алкенил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный С2-С12гетероциклоалкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил, или
(b) один или более из R6, R7 и R8, взятые вместе с одним или более из R5a и R5b и атомами, к которым они прикреплены, образуют часть, выбранную из группы, включающей факультативно замещенный С3-С12циклоалкил, факультативно замещенный С2-С12гетероциклоалкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил;
каждый R9 и R10 независимо выбран из группы, включающей Н, факультативно замещенный С1-С12алкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил;
каждый R11 и R12 независимо выбран из группы, включающей Н и факультативно замещенный С1-С12алкил;
n представляет собой целое число, выбранное из группы, включающей 1, 2, 3 и 4;
r представляет собой целое число, выбранное из группы, включающей 1, 2, 3 и 4;
s представляет собой целое число, выбранное из группы, включающей 1, 2, 3 и 4;
или его фармацевтически приемлемая соль или пролекарство.
В одном варианте осуществления MC5R или его фрагмент, или аналог, или функциональный эквивалент находится в клетке, и способ включает этап, на котором клетку подвергают воздействию соединения формулы (I). В одном варианте осуществления данное изобретение предусматривает способ понижающего регулирования активности MC5R или его фрагмента, или аналога, или функционального эквивалента в млекопитающем, при это млекопитающему вводят MC5R-модулирующее количество соединения данного изобретения.
В еще одном аспекте данное изобретение предусматривает применение соединения формулы (I) при понижающем регулировании активности MC5R или его фрагмента, аналога или функционального эквивалента.
В еще одном аспекте данное изобретение предусматривает применение соединения формулы (I) при приготовлении лекарственного препарата для понижающего регулирования активности MC5R или его фрагмента, или аналога, или функционального эквивалента у млекопитающего.
В еще одном аспекте данное изобретение предусматривает способ лечения, предотвращения или контролирование состояния, связанного с активностью MC5R или его фрагмента, аналога или функционального эквивалента у млекопитающего, при это способ, включает этап, на котором вводят терапевтически эффективное количество соединения формулы (I). Соединение можно вводить любым способом, известным из уровня техники, хотя в одном аспекте соединение применяют местно. В другом аспекте соединение вводят перорально. В другом аспекте соединение вводят парентерально. В одном варианте осуществления способа состояние выбирают из группы, включающей акне, себорею и себорейный дерматит. В одном варианте осуществления состояние представляет собой обыкновенные угри. В одном варианте осуществления соединение формулы (I) вводят совместно со вторым активным веществом. В одном варианте осуществления второе активное вещество выбирают из группы, включающей антибиотики, ретиноиды, анти-андрогены и стероиды.
В еще одном аспекте данное изобретение предусматривает применение соединения формулы (I) в приготовлении лекарственного препарата для лечения, предотвращения, или контролирование состояния, связанного с активностью MC5R или его фрагмента, аналога или функционального эквивалента у млекопитающего. В одном аспекте лекарственный препарат приспосабливают к применению местно. В другом аспекте лекарственный препарат приспосабливают к введению перорально. В другом аспекте соединение вводят парентерально. В одном варианте осуществления способа состояние выбирают из группы, включающей акне, себорею и себорейный дерматит. В определенном варианте осуществления данного изобретения состояние представляет собой обыкновенные угри.
В еще одном аспекте изобретение предусматривает способ уменьшения салоотделения млекопитающим, при этом способ включает этап, на котором млекопитающему вводят терапевтически эффективное количество соединения формулы (I). Соединение данного изобретения можно вводить любым образом, известным из уровня техники, хотя в одном аспекте соединение применяют местно. В другом аспекте соединение вводят перорально. В другом аспекте соединение вводят парентерально.
В еще одном аспекте изобретение предусматривает применение соединения формулы (I) при приготовлении лекарственного препарата для уменьшения салоотделения у млекопитающего. В одном варианте осуществления лекарственный препарат приспосабливают к применению местно. В другом варианте осуществления лекарственный препарат приспосабливают к введению перорально. В другом варианте осуществления соединение вводят парентерально.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном описании используется ряд выражений, хорошо известных специалисту в данной области. Тем не менее, в целях ясности будет определен ряд выражений.
Как используется здесь, выражение «незамещенный» означает, что нет заместителя или, что единственным заместителем является водород.
Выражение «факультативно замещенный», как используется во всем описании, означает, что группа может или не может дополнительно быть замещенной или слитой (так, чтобы образовать конденсированную полициклическую систему), с одной или более не водородными замещающими группами. В определенных вариантах осуществления замещающие группы представляют собой одну или более групп, независимо выбранных из группы, включающей галоген, =O, =S, -CN, -NO2, -CF3, -OCF3, алкил, алкенил, алкинил, галоалкил, галоалкенил, галоалкинил, гетероалкил, циклоалкил, циклоалкенил, гетероциклоалкил, гетероциклоалкенил, арил, гетероарил, циклоалкил ал кил, гетероциклоалкилалкил, гетероарилалкил, арилалкил, циклоалкилалкенил, гетероциклоалкилалкенил, арилалкенил, гетероарилалкенил, циклоалкилгетероалкил, гетероциклоалкилгетероалкил, арилгетероалкил, гетероарилгетероалкил, гидрокси, гидроксиалкил, алкилокси, алкилоксиалкил, алкилоксициклоалкил, алкилоксигетероциклоалкил, алкилоксиарил, алкилоксигетероарил, алкилоксикарбонил, алкиламинокарбонил, алкенилокси, алкинилокси, циклоалкилокси, циклоалкенилокси, гетероциклоалкилокси, гетероциклоалкенилокси, арилокси, фенокси, бензилокси, гетероарилокси, арилалкилокси, амино, алкиламино, ациламино, аминоалкил, ариламино, сульфониламино, сульфиниламино, сульфонил, алкилсульфонил, арилсульфонил, аминосульфонил, сульфинил, алкилсульфинил, арилсульфинил, аминосульфиниламиноалкил, -С(=O)ОН, -C(=O)Ra, -C(=O)ORa, C(=O)NRaRb, C(=NOH)Ra, C(=NRa)NRbRc, NRaRb, NRaC(=O)Rb, NRaC(=O)ORb, NRaC(=O)NRbRc, NRaC(=NRb)NRcRd, NRBSO2Rb, -SRa, SO2NRaRb, -ORa OC(=O)NRaRb, ОС(=O)Ra и ацил,
где Ra, Rb, Rc и Rd каждый независимо выбран из группы, включающей Н, С1-С12алкил, С1-С12галоалкил, С2-С12алкенил, С2-С12алкинил, C1-С10гетероалкил, С3-С12циклоалкил, С3-С12циклоалкенил, С1-С12гетероциклоалкил, С1-С12гетероциклоалкенил, С6-С18арил, С1-С18гетероарил и ацил, или любые два или более из Ra, Rb, Rc и Rd, взятые вместе с атомами, к которым они прикреплены, образуют гетероциклическую кольцевую систему с 3-12 кольцевыми атомами.
В одном варианте осуществления каждый факультативный заместитель независимо выбран из группы, включающей: галоген, =O, =S, -CN, -NO2, -CF3, -OCF3, алкил, алкенил, алкинил, галоалкил, галоалкенил, галоалкинил, гетероалкил, циклоалкил, циклоалкенил, гетероциклоалкил, гетероциклоалкенил, арил, гетероарил, гидрокси, гидроксиалкил, алкилокси, алкилоксиалкил, алкилоксиарил, алкилоксигетероарил, алкенилокси, алкинилокси, циклоалкилокси, циклоалкенилокси, гетероциклоалкилокси, гетероциклоалкенилокси, арилокси, гетероарилокси, арилалкил, гетероарилалкил, арилалкилокси, амино, алкиламино, ациламино, аминоалкил, ариламино, сульфонил, алкилсульфонил, арилсульфонил, аминосульфонил, аминоалкил, -СООН, -SH и ацил.
Примеры особенно подходящих факультативных заместителей включают F, Cl, Br, I, СН3, СН2СН3, ОН, ОСН3, CF3, OCF3, NO2, NH2 и CN.
Выражение «группа аминокислотной боковой цепи» представляет естественную или неестественную группу боковой цепи, присутствующей в белке. Выражение включает части боковой цепи, присутствующие во встречающихся в природе белках, включая встречающиеся в природе части аминокислотной боковой цепи, идентифицированные в таблице 1 ниже.
|
В добавление к встречающимся в природе группам аминокислотных боковых цепей, как идентифицировано выше, выражение также включает их производные или аналоги. Как используется здесь, выражение производное или аналог группы аминокислотной боковой цепи включает модификации и вариации встречающимся в природе группам боковой цепи. Согласно вышеприведенной таблице, большинство встречающихся в природе групп аминокислотной боковой цепи можно классифицировать как алкильные, арильные, арилалкильные или гетероалкильные части. Как таковые производные групп аминокислотной боковой цепи включают прямые или разветвленные, циклические или нециклические алкильные, арильные, гетероарильные, гетероарилалкильные, арилалкильные или гетероалкильные части.
Группы аминокислотной боковой цепи, как обсуждалось выше, также включают факультативно замещенные производные алкильных, арильных, арилалкильных, гетероарильных, гетероарилалкильных или гетероалкильных частей. Факультативные заместители можно выбрать из группы, определенной выше. Например, факультативные заместители можно выбрать, но не ограничиваясь, из ОН, Cl, Br, F, COOH, COORZ, CONH2, NH2, NHRZ, NRZRZ, SH, SRZ, SO2RZ, SO2H и SORZ, где RZ представляет собой алкильную, арильную или арилалкильную часть.
В определениях ряда заместителей ниже установлено, что «группа может представлять собой терминальную группу или мостиковую группу». Предполагается, что это означает, что использование выражения имеет целью включение ситуации, где группа представляет собой связующее звено между двумя другими участками молекулы, а также, где она представляет собой терминальную часть. Использование выражения алкил в качестве примера, в некоторых публикациях используется выражение «алкилен» для мостиковой группы, и, следовательно, в этих других публикациях существует различие между выражениями «алкил» (терминальная группа) и «алкилен» (мостиковая группа), В данной заявке не делается такого различия, и большинство групп могут представлять собой или мостиковую группу, или терминальную группу.
Несколько выражений начинаются с индексного регистра, показывающего некоторое количество атомов углерода, присутствующих в части. Например, индексный регистр «C1-С6» перед выражением «алкил» показывает, что алкильная часть имеет 1-6 атомов углерода. Кроме того, индексный регистр «C1-C18» перед выражением «гетероарил» показывает, что гетероароматическое кольцо может иметь 1-18 атомов углерода в составе общего числа атомов в кольцевой системе.
«Ацил» означает R-C(=O)-группу, в которой R группа может представлять собой алкильную, циклоалкильную, гетероциклоалкильную, арильную или гетероарильную группу, как определено здесь. Примеры ацила включают ацетил и бензоил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через карбонильный углерод.
«Ациламино» означает R-C(=O)-NH-группу, в которой R группа может представлять собой алкильную, циклоалкильную, гетероциклоалкильную, арильную или гетероарильную группу, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом азота.
«Алкенил», как группа или часть группы, означает алифатическую углеводородную группу, содержащую, по меньшей мере, одну углерод-углеродную двойную связь и которая может быть прямой или разветвленной, предпочтительно с 2-14 атомами углерода, более предпочтительно 2-12 атомов углерода, наиболее предпочтительно 2-6 атомов углерода в нормальной цепи. Группа может содержать несколько двойных связей в нормальной цепи и ориентация почти каждого является независимо Е или Z. Примерные алкенильные группы включают, но не ограничиваются, этенил, пропенил, бутенил, пентенил, гексенил, гептенил, октенил и ноненил. Группа может представлять собой терминальную группу или мостиковую группу.
«Алкенилокси» относится к алкенил-O-группе, в которой алкенил представляет собой, как определено здесь. Предпочтительные алкенилокси группы представляют собой С1-С6 алкенилокси группы. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
«Алкил» как группа или часть группы относится к прямой или разветвленной алифатической углеводородной группе, предпочтительно С1-С14 алкил, более предпочтительно C1-С10 алкил, наиболее предпочтительно C1-C6, если не указано иначе. Примеры подходящих прямых и разветвленных C1-C6 алкильных заместителей включают метил, этил, н-пропил, 2-пропил, н-бутил, втор-бутил, трет-бутил, гексил и подобное. Группа может представлять собой терминальную группу или мостиковую группу.
«Алкиламино» включает и моноалкиламино, и диалкиламино, если не уточнено. «Моноалкиламино» означает алкил-NH-группу, в которой алкил представляет собой, как определено здесь. «Диалкиламино» означает (алкил)2N-группу, в которой каждый алкил может быть одинаковым или различным, и каждый представляет собой, как определено здесь для алкила. Алкильная группа представляет собой предпочтительно C1-C6 алкильную группу». Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом азота.
«Алкиламинокарбонил» относится к группе формулы (Алкил)x(H)yNC(=O)-, в которой x равно 1 или 2, и сумма x+y=2. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком, молекулы через карбонильный углерод.
«Алкилокси» относится к алкил-O-группе, в которой алкил представляет собой, как определено здесь. Предпочтительно алкилокси представляет собой C1-С6алкилокси. Примеры включают, но не ограничиваются, метокси и этокси. Группа может представлять собой терминальную группу или мостиковую группу.
«Алкилоксиалкил» относится к алкилокси-алкил-группе, в которой алкилокси и алкильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкильную группу.
«Алкилоксиарил» относится к алкилокси-арил-группе, в которой алкилокси и арильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через арильную группу.
«Алкилоксикарбонил» относится к алкил-O-С(=O)-группе, в которой алкил представляет собой, как определено здесь. Алкильная группа представляют собой предпочтительно C1-C6 алкильную группу. Примеры включают, но не ограничиваются, метоксикарбонил и этоксикарбонил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через карбонильный углерод.
«Алкилоксициклоалкил» относится к алкилокси-циклоалкил-группе, в которой алкилокси и циклоалкильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через циклоалкильную группу.
«Алкилоксигетероарил» относится к алкилокси-гетероарил-группе, в которой алкилокси и гетероарильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через гетероарильную группу.
«Алкилоксигетероциклоалкил» относится к алкилокси-гетероциклоалкил-группе, в которой алкилокси и гетероциклоалкильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через гетероциклоалкильную группу.
«Алкилсульфинил» означает алкил-S-(=O)-группу, в которой алкил представляет собой, как определено здесь. Алкильная группа представляет собой предпочтительно C1-С6 алкильную группу. Примерные алкилсульфинильные группы включают, но не ограничиваются, метилсульфинил и этилсульфинил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом серы.
«Алкилсульфонил» относится к алкил-S(=O)2-группе, в которой алкил представляет собой, как определено выше. Алкильная группа представляет собой предпочтительно C1-С6 алкильную группу. Примеры включают, но не ограничиваются, метилсульфонил и этилсульфонил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом серы.
«Алкинил» как группа или часть группы означает алифатическую углеводородную группу, содержащую углерод-углеродную тройную связь, и которая может быть прямой или разветвленной, предпочтительно имеющую 2-14 атомов углерода, более предпочтительно 2-12 атомов углерода, более предпочтительно 2-6 атомов углерода в нормальной цепи. Примерные структуры включают, но не ограничиваются, этинил и пропинил. Группа может представлять собой терминальную группу или мостиковую группу.
«Алкинилокси» относится к алкинил-O-группе, в которой алкинил представляет собой, как определено здесь. Предпочтительные алкинилокси группы представляют собой С1-С6 алкинилокси группы. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
«Аминоалкил» означает NH2-алкил-группу, в которой алкильная группа представляет собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкильную группу.
«Аминосульфонил» означает NH2-S(=O)2-группу. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом серы.
«Арил» как группа или часть группы означает (i) факультативно замещенный моноциклический или слитый полициклический, ароматический углеродный цикл (кольцевая структура, имеющая кольцевые атомы, при этом все представляют собой углерод), предпочтительно имеющий 5-12 атомов в кольце. Примеры арильных групп включают фенил, нафтил и подобное; (ii) факультативно замещенную частично насыщенную бициклическую ароматическую карбоциклическую часть, в которой фенил и С5-7 циклоалкильная или С5-7 циклоалкенильная группа слиты вместе для образования циклической структуры, такой как тетрагидронафтил, инденил или инданил. Группа может представлять собой терминальную группу или мостиковую группу. В основном арильная группа представляет собой С6-С18 арильную группу.
«Арилалкенил» означает арил-алкенил-группу, в которой арил и алкенил представляют собой, как определено здесь. Примерные арилалкенильные группы включают фенилаллил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкенильную группу.
«Арилалкил» означает арил-алкил-группу, в которой арильная и алкильная части представляют собой, как определено здесь. Предпочтительные арилалкильные группы содержат C1-5 алкильную часть. Примерные арилалкильные группы включают бензил, фенэтил, 1-нафталинметил и 2-нафталинметил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкильную группу.
«Арилалкилокси» относится к арил-алкил-O-группе, в которой алкил и арил представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
«Ариламино» включает и моноариламино и диариламино, если не уточнено. Моноариламино означает группу формулы арилNН-, в которой арил представляет собой, как определено здесь. Диариламино означает группу формулы (арил)2N-, где каждый арил может быть одинаковым или различным, и каждый представляет собой, как определено здесь для арила. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом азота.
«Арилгетероалкил» означает арил-гетероалкил-группу, в которой арильная и гетероалкильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через гетероалкильную группу.
«Арилокси» относится к арил-O-группе, в которой арил представляет собой, как определено здесь. Предпочтительно арилокси представляет собой С6-С18арилокси, более предпочтительно С6-С10арилокси. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
«Арилсульфонил» означает арил-S(=O)2-группу, в которой арильная группа представляет собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом серы.
«Связь» представляет собой соединение между атомами в соединении или молекуле. Связь может представлять собой одинарную связь, двойную связь или тройную связь.
«Циклическая группа» относится к насыщенной, частично ненасыщенной или полностью ненасыщенной моноциклической, бициклической или полициклической кольцевой системе. Примеры циклических групп включают циклоалкил, циклоалкенил и арил.
«Циклоалкенил» означает неароматическую моноциклическую или многоциклическую-кольцевую систему, содержащую, по меньшей мере, одну углерод-углеродную двойную связь и, предпочтительно, имеющую 5-10 атомов углерода в кольце.
Примерные моноциклические циклоалкенильные кольца включают циклопентенил, циклогексенил или циклогептенил. Циклоалкенильная группа может быть замещенной одной или более группами заместителей. Группа может представлять собой терминальную группу или мостиковую группу.
«Циклоалкил» относится к насыщенному моноциклическому или слитому или спирополициклическому, углеродному циклу, предпочтительно, содержащему 3-9 углеродов в кольце, такой как циклопропил, циклобутил, циклопентил, циклогексил и подобное, если не указано иначе. Он включает моноциклические системы, такие как циклопропил и циклогексил, бициклические системы, такие как декалин, и полициклические системы, такие как адамантан. Группа может представлять собой терминальную группу или мостиковую группу.
«Циклоалкилалкил» означает циклоалкил-алкил-группу, в которой циклоалкильная и алкильная части представляют собой, как определено здесь. Примерные моноциклоалкилалкильные группы включают циклопропилметил, циклопентилметил, циклогексилметил и циклогептилметил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкильную группу.
«Циклоалкилалкенил» означает циклоалкил-алкенил-группу, в которой циклоалкильная и алкенильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкенильную группу.
«Циклоалкилгетероалкил» означает циклоалкил-гетероалкил-группу, в которой циклоалкильная и гетероалкильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через гетероалкильную группу.
«Циклоалкилокси» относится к циклоалкил-O-группе, в которой циклоалкил представляет собой, как определено здесь. Предпочтительно циклоалкилокси представляет собой C1-С6циклоалкилокси. Примеры включают, но не ограничиваются, циклопропанокси и циклобутанокси. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
«Циклоалкенилокси» относится к циклоалкенил-O-группе, в которой циклоалкенил представляет собой, как определено здесь. Предпочтительно циклоалкенилокси представляет собой C1-С6циклоалкенилокси. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
«Галоалкил» относится к алкильной группе, как определено здесь, в которой один или более водородных атомов заменены атомом галогена, выбранным из группы, включающей фтор, хлор, бром и йод. Галоалкильная группа обычно имеет формулу CnH(2n+1-m)Xm, где каждый Х независимо выбран из группы, включающей F, Cl, Br и I. В группах такого типа n обычно равно 1-10, более предпочтительно 1-6, наиболее предпочтительно 1-3. m обычно равно 1-6, более предпочтительно 1-3. Примеры галоалкила включают фторметил, дифторметил и трифторметил.
«Галоалкенил» относится к алкенильной группе, как определено здесь, в которой один или более из атомов водорода заменены атомом галогена, независимо выбранным из группы, включающей F, Cl, Br и I.
«Галоалкинил» относится к алкинильной группе, как определено здесь, в которой один или более атомов водорода заменены атомом галогена, независимо выбранным из группы, включающей F, Cl, Br и I.
«Галоген» представляет хлор, фтор, бром или йод.
«Гетероалкил» относится к алкильной группе с прямой или разветвленной цепью, предпочтительно имеющей 2-14 углеродов, более предпочтительно 2-10 углеродов в цепи, один или более из которых замещены гетероатомом, выбранным из S, О, Р и N. Примерные гетероалкилы включают алкильные эфиры, вторичные и третичные алкильные амины, амиды, алкильные сульфиды и подобное. Группа может представлять собой терминальную группу или мостиковую группу.
«Гетероарил» или отдельно, или как часть группы относится к группам, содержащим ароматическое кольцо (предпочтительно 5 или 6 членное ароматическое кольцо), имеющее один или более гетероатомов в качестве кольцевых атомов в ароматическом кольце с остатком кольцевых атомов, представляющих собой атомы углерода. Подходящие гетероатомы включают азот, кислород и серу. Примеры гетероарила включают тиофен, бензотиофен, бензофуран, бензимидазол, бензоксазол, бензотиазол, бензизотиазол, нафто[2,3-b]тиофен, фуран, изоиндолизин, ксантолен, феноксатин, пиррол, имидазол, пиразол, пиридин, пиразин, пиримидин, пиридазин, тетразол, индол, изоиндол, 1Н-индазол, пурин, хинолин, изохинолин, фталазин, нафтиридин, хиноксалин, циннолин, карбазол, фенантридин, акридин, феназин, тиазол, изотиазол, фенотиазин, оксазол, изооксазол, фуразан, феноксазин, 2-, 3- или 4-пиридил, 2-, 3-, 4-, 5- или 8-хинолил, 1-, 3-, 4- или 5-изохинолинил, 1-, 2- или 3- индолил и 2- или 3-тиенил. Группа может представлять собой терминальную группу или мостиковую группу.
«Гетероарилалкил» означает гетероарил-алкильную группу, в которой гетероарильная и алкильная части представляют собой, как определено здесь. Предпочтительные, гетероарилалкильные группы содержат низшую алкильную часть. Примерные гетероарилалкильные группы включают пиридилметил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкильную группу.
«Гетероарилалкенил» означает гетероарил-алкенил-группу, в которой гетероарильная и алкенильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкенильную группу.
«Гетероарилгетероалкил» означает гетероарил-гетероалкил-группу, в которой гетероарильная и гетероалкильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через гетероалкильную группу.
«Гетероарилокси» относится к гетероарил-O-группе, в которой гетероарил представляет собой, как определено здесь. Предпочтительно гетероарилокси представляет собой С1-С12гетероарилокси. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
«Гетероциклический» относится к насыщенной, частично ненасыщенной или полностью ненасыщенной моноциклической, бициклической или полициклической кольцевой системе, содержащей, по меньшей мере, один гетероатом, выбранный из группы, включающей азот, серу и кислород в качестве кольцевого атома. Примеры гетероциклических частей включают гетероциклоалкил, гетероциклоалкенил и гетероарил.
«Гетероциклоалкенил» относится к гетероциклоалкилу, как определено здесь, но содержащий, по меньшей мере, одну двойную связь. Группа может представлять собой терминальную группу или мостиковую группу.
«Гетероциклоалкил» относится к насыщенному моноциклическому, бициклическому или полициклическому кольцу, содержащему, по меньшей мере, один гетероатом, выбранный из азота, серы, кислорода, предпочтительно 1-3 гетероатома, по меньшей мере, в одном кольце. Каждое кольцо представляет собой предпочтительно 3-10 членное, более предпочтительно 4-7 членное. Примеры подходящих гетероциклоалкильных заместителей включают пирролидил, тетрагидрофурил, тетрагидротиофуранил, пиперидил, пиперазил, тетрагидропиранил, морфилино, 1,3-диазапан, 1,4-диазапан, 1,4-оксазепан и 1,4-оксатиапан. Группа может представлять собой терминальную группу или мостиковую группу.
«Гетероциклоалкилалкил» относится к гетероциклоалкил-алкил-группе, в которой гетероциклоалкильная и алкильная части представляют собой, как определено здесь. Примерные гетероциклоалкилалкильные группы включают (2-тетрагидрофурил)метил, (2-тетрагидротиофуранил) метил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкильную группу.
«Гетероцикпоалкилалкенил» относится к гетероциклоалкил-алкенил-группе, в которой гетероциклоалкильная и алкенильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкенильную группу.
«Гетероциклралкилгетероалкил» означает гетероциклоалкил-гетероалкил-группу, в которой гетероциклоалкильная и гетероалкильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через гетероалкильную группу.
«Гетероциклоалкилокси» относится к гетероциклоалкил-O-группе, в которой гетероциклоалкил представляет собой, как определено здесь. Предпочтительно гетероциклоалкилокси представляет собой С1-C6гетероциклоалкилокси. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
«Гетероциклоалкенилокси» относится к гетероциклоалкенил-O-группе, в которой гетероциклоалкенил представляет собой, как определено здесь. Предпочтительно гетероциклоалкенилокси представляет собой C1-C6 гетероциклоалкенилокси. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
«Гидроксиалкил» относится к алкильной группе, как определено здесь, в которой один или более из атомов водорода заменены ОН группой. Гидроксиалкильная группа типично имеет формулу CnH(2n+1-x)(ОН)x. В группах этого типа n, как правило, равно 1-10, более предпочтительно 1-6, наиболее предпочтительно 1-3. X, как правило, равно 1-6, более предпочтительно 1-3.
«Низший алкил» как группа означает, если не указано иначе, алифатическую углеводородную группу, которая может быть прямой или разветвленной с 1-6 атомами углерода в цепи, более предпочтительно 1-4 углеродами, такую как метил, этил, пропил (н-пропил или изопропил) или бутил (н-бутил, изобутил или третичный-бутил). Группа может представлять собой терминальную группу или мостиковую группу.
«Сульфинил» означает R-S(=O)-группу, в которой R группа может представлять собой ОН, алкильную, циклоалкильную, гетероциклоалкильную, арильную или гетероарильную группу, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом серы.
«Сульфиниламино» означает R-S(=O)-NH-группу, в которой R группа может представлять собой ОН, алкильную, циклоалкильную, гетероциклоалкильную, арильную или гетероарильную группу, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом азота.
«Сульфонил» означает R-S(=O)2-группу, в которой R группа может представлять собой ОН, алкильную, циклоалкильную, гетероциклоалкильную; арильную или гетероарильную группу, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом серы.
«Сульфониламино» означает R-S(=O)2-NH-группу. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом азота.
Понятно, что включенными в семейство соединений формулы (I) являются изомерные формы, включая диастереоизомеры, энантиомеры, таутомеры и геометрические изомеры в «Е» или «Z» конфигурационном изомере или смесь Е и Z изомеров. Также понятно, что некоторые изомерные формы, такие как диастереомеры, энантиомеры и геометрические изомеры можно разделить физическими и/или химическими способами и специалистами в данной области техники.
Некоторые из соединений раскрытых вариантов осуществления могут существовать в качестве отдельных стереоизомеров, рацематов и/или смесей энантиомеров и/или диастереомеров. Предполагается, что все такие отдельные стереоизомеры, рацематы и их смеси подразумеваются как находящиеся в объеме описанной и заявленной сущности данного изобретения.
Данное изобретение включает все фармацевтически приемлемые изотопно-меченые соединения формулы (I), где один или более атомов имеют такой же атомный номер как, но атомная масса или массовое число отличаются от атомной массы или массового числа, обычно встречающегося в природе.
Примеры изотопов, подходящих для включения в соединения данного изобретения, включают изотопы водорода, такие как 2H и 3Н, углерода, такие как 11С, 13С и 14С, хлора, такие как 36Cl, фтора, такие как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15О, 17O и 18О, фосфора, такой как 32P и серы, такой как 35S.
Определенные изотопно-меченые соединения формулы (I), например включающие радиоактивный изотоп, применимы при изучениях тканевого распределения лекарственного средства и/или субстрата. Радиоактивные изотопы трития, т.е. 3Н, и углерод-14, т.е. 14С, особенно применимы для этой цели в связи с простотой их включения и легких способов обнаружения.
Замена более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может обеспечить определенные терапевтические преимущества, полученные в результате большей метаболической стабильности, например, увеличенное in vivo время полужизни или уменьшенные требования дозировки, и, следовательно, могут быть предпочтительными при некоторых условиях.
Замена позитрон излучающими изотопами, такими как 11С, 18F, 15O и 13N, может быть применимой в исследованиях Позитронной Эмиссионной Томографией (PET) для проверки занятости рецептора субстратом.
Изотопно-меченые соединения формулы (I) можно обычно приготовить общепринятыми методами, известными специалисту в данной области, или процессами, аналогичными описанным в сопутствующих Примерах и Приготовлениях, применяя подходящие изотопно-меченые реактивы вместо предварительно используемого немеченого реактива.
Дополнительно, Формула (I) предназначена охватывать, где применимо, сольватированные; а также несольватированные формы соединений. Таким образом, каждая формула включает соединения, имеющие указанную структуру, включая гидратированные, а также негидратированные формы.
Выражение «фармацевтически приемлемые соли» относится к солям, которые сохраняют желаемую биологическую активность вышеустановленных соединений, и включают фармацевтически приемлемые соли присоединения кислоты и соли присоединения основания. Подходящие фармацевтически приемлемые соли присоединения кислоты соединений формулы (I) можно приготовить из неорганической кислоты или из органической кислоты. Примерами таких неорганических кислот являются соляная, серная и фосфорная кислота. Подходящие органические кислоты можно выбрать из алифатического, циклоалифатического, ароматического, гетероциклического карбоксильного и сульфонового классов органических кислот, примерами которых являются муравьиная, уксусная, пропионовая, янтарная, гликолевая, глюконовая, молочная, яблочная, винная, лимонная, фумаровая, малеиновая, алкилсульфоновая, арилсульфоновая. Дополнительную информацию по фармацевтически приемлемым солям можно найти в Remington's Pharmaceutical Sciences, 19th Edition, Mack Publishing Co., Easton, PA 1995. В случае веществ, которые представляют собой твердые вещества, специалисту в данной области понятно, что патентоспособные соединения, вещества и соли могут существовать в различных кристаллических или полиморфных формах, все из которых, как подразумевается, находятся в объеме данного изобретения и установлены формулами.
«Пролекарство» означает соединение, которое подвергается превращению в соединение формулы (I) в биологической системе, обычно метаболическими средствами (например, гидролизом, восстановлением или окислением). Например, эфирное Пролекарство соединения формулы (I), содержащее гидроксильную группу, может быть превращаемым гидролизом in vivo в исходную молекулу. Подходящие сложные эфиры соединений формулы (I), содержащие гидроксильную группу, представляют собой, например, ацетаты, цитраты, лактаты, тартраты, малонаты, оксалаты, салицилаты, пропионаты, сукцинаты, фумараты, малеат, метилен-бис-β-гидроксинафтоаты, гентизаты, изетионаты, ди-р-толуоилтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, р-толуолсульфонаты, циклогексилсульфаматы и соли хинной кислоты. В качестве другого примера сложноэфирное Пролекарство соединения формулы (I), содержащее карбоксигруппу, может быть превращено гидролизом in vivo в исходную молекулу. (Примерами сложноэфирных пролекарств являются таковые, описанные F.J.Leinweber, Drug Metab. Res., 18:379, 1987). Подобным образом, ацильное пролекарство соединения формулы (I), содержащее аминогруппу, может быть превращено гидролизом in vivo в исходную молекулу (Большинство примеров пролекарств для этих и других функциональных групп, включая амины, описаны в Prodrugs: Challenges and Rewards (Parts 1 and 2); Ed V. Stella, R. Borchardt, M. Hageman, R. Oliyai, H. Maag and J Tilley; Springer, 2007).
Выражение «терапевтически эффективное количество» или «эффективное количество» является количеством, достаточным для осуществления полезных или желаемых клинических результатов. Эффективное количество можно вводить за одно или более введений. Эффективное количество является, как правило, достаточным для того, чтобы временно облегчить, улучшить, стабилизировать, реверсировать, замедлить или задержать развитие болезненного состояния.
Выражение «функциональный эквивалент» имеет целью включение вариантов специфического рецептора, описанного здесь. Станет понятно, что рецепторы могут иметь изоформы такие, что в то время как первичная, вторичная, третичная или четвертичная структура данной изоформы рецептора отличается от прототипа рецептора; молекула поддерживает биологическую активность на уровне рецептора. Изоформы могут появляться из нормальной аллельной вариации внутри популяции и включать мутации, такие как аминокислотная замена, делеция, добавление, усечение или дупликацию. Также включенными в выражение «функциональный эквивалент» являются варианты, образованные на уровне транскрипции.
В способах и применениях данного изобретения следует отметить, что некоторые из соединений формулы (I), являются более активными, чем другие и, следовательно, желательно применять эти соединения в способах и применениях данного изобретения.
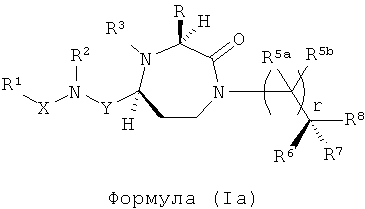
В способах и применениях данного изобретения предпочтительной стереохимией в 3 и 5 положениях кольца соединений формулы (I) является 3S, 5S диастереомер. Соответственно, в одном варианте осуществления способов и применений данного изобретения применяемое соединение формулы (I) представляет собой соединение формулы (Ia):
 ,
,
где R, R1, R2, R3, R5a, R5b R6, R7, R8, X, Y и r представляют собой, как определено в формуле 1, или фармацевтически приемлемую соль или их пролекарство.
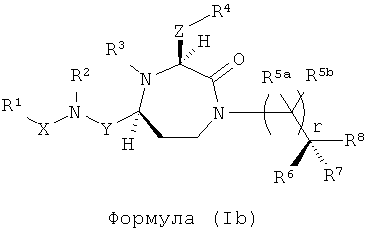
В способах и применениях данного изобретения особенно применимая субпопуляция соединений формулы (I) представляют собой соединения формулы (Ib), как показано ниже.
 ,
,
где
R1, R2, R3, R5a, R5b, R6, R7, R8, X, Y и r представляют собой, как определено выше,
Z представляет собой группу формулы -(CR13R14)q-;
R4 выбран из группы, включающей Н, С1-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С2-С12алкинил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный С6-С18арил, факультативно замещенный С1-С18гетероарил, NR4aR4b, C(=O)R15, C(=O)NR16R17, -C(=NR16)NR17R18, SR20, SC(=O)R20, SO2R20, OR20, ONR16R17, OCR17R18R20, OC(=O)R20, OC(=O)OR20, OC(=O)NR16R17 и ONR16C(NR17)NR18R19,
R4a выбран из группы, включающей Н, факультативно замещенный С1-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С2-С12алкинил, факультативно замещенный С1-С12гетероалкил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный С2-С12гетероциклоалкил, факультативно замещенный С6-С18арил, факультативно замещенный С1-С18гетероарил, С(=O)R15a, C(=O)NR15aR16a, С(=O)OR15a, SO2R15a, C(=O)H, -C(=NR15a)-NR16aR17a и OR15a,
R4b выбран из группы, включающей Н, факультативно замещенный С1-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С2-С12алкинил, факультативно замещенный С1-С12гетероалкил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный С2-С12гетероциклоалкил, факультативно замещенный С6-С18арил, факультативно замещенный С1-С18гетероарил, C(=O)R15a, C(=O)NR15aR16a, C(=O)OR15a, или
R4a и R4b, взятые вместе с атомом азота, к которому они прикреплены, образуют факультативно замещенную гетероциклическую часть, или
один из R4a и R4b, взятый вместе с любым R13 или R14 и атомами, к которым они прикреплены, образует факультативно замещенную гетероциклическую часть;
R13 и R14 каждый независимо выбран из группы, включающей Н, галоген, ОН, С1-С12алкил, С6-С18арил, С1-С12гидроксиалкил, С1-С12галоалкил, С1-С12галкилокси и С1-С12галоалкилокси, или
взятые вместе с углеродом, к которому они прикреплены, R13 и R14 образуют факультативно замещенный С3-С12циклоалкил или факультативно замещенную C1-С12гетероциклоалкильную группу, или
один из R13 и R14, взятый вместе с одним из R4a и R4b и атомы, к которым они прикреплены, образуют факультативно замещенную гетероциклическую часть, или
один из R13 и R14, взятый вместе с одним из R15, R16, R17, R18, R19 или R20, и атомы, к которым они прикреплены, образуют факультативно замещенную циклическую часть;
каждый R15, R15a, R16, R16a, R17, R17a, R18, R19 и R20 независимо выбран из группы, включающей Н, факультативно замещенный С1-С12алкил, факультативно замещенный C1-С12гетероалкил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный С2-С12гетероциклоалкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил, или
любые два из R15, R15a, R16, R16a, R17, R17a, R18, R19 и R20, взятые вместе с атомами, к которым они прикреплены, образуют факультативно замещенную циклическую группу, или
один из R15, R16, R17, R18, R19 и R20, взятый вместе с одним из R13 и R14, и атомы, к которым они прикреплены, образуют факультативно замещенную циклическую часть;
q представляет собой целое число, выбранное из группы, включающей 0, 1, 2, 3, 4 и 5;
или его фармацевтически приемлемая соль или пролекарство.
В способах и применениях данного изобретения особенно применимая подгруппа соединений формулы (I) представляют собой соединения, где Y представляет собой группу формулы -(CR9R10)n-. В одном варианте осуществления подходящих соединений n равно 1 и Y представляет собой -CR9R10-. В другом варианте осуществления подходящих соединений n равно 2 и Y представляет собой -CR9R10CR9R10-.
В одном варианте осуществления соединений, подходящих для применения в данном изобретении, каждый R9 и R10 независимо выбран из Н и СН3. В одном определенном варианте осуществления R9 и R10 оба представляют собой Н. Соответственно в одном варианте осуществления соединений, подходящих для применения в данном изобретении, Y представляет собой -СН2-. В другом варианте осуществления соединений, подходящих для применения в данном изобретении, Y представляет собой -CH2CH2-. В еще одном варианте осуществления соединений, подходящих для применения в данном изобретении, Y представляет собой -С(СН3)2-.
В одном варианте осуществления соединений, подходящих для применения в данном изобретении, R2 представляет собой Н или C1-C6 алкил. В определенном варианте осуществления R2 представляет собой Н.
В одном варианте осуществления соединений, подходящих для применения в данном изобретении, R3 представляет собой Н или C1-C6 алкил. В определенном варианте осуществления R3 представляет собой Н.
В одном варианте осуществления соединений, подходящих для применения в данном изобретении Х выбирают из группы, включающей -С(=O)- и -(CR11R12)s-. В одном определенном варианте осуществления Х представляет собой -С(=O)-. В одном варианте осуществления соединений, подходящих для применения в данном изобретении Х представляет собой -(CR11R12)s-, s равно 1. В другом варианте осуществления соединений, подходящих для применения в данном изобретении, Х представляет собой -(CR11R12)s-, s равно 2. В одной форме каждого из этих вариантов осуществления R11 и R12 каждый независимо выбран из группы, включающей Н и С1-С6 алкил. В определенном варианте осуществления оба R11 и R12 представляют собой Н, и s равно 1 так, что Х представляет собой -CH2-.
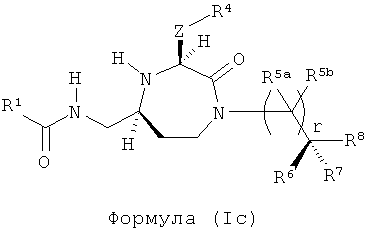
В одном варианте осуществления соединений, подходящих для применения в данном изобретении, R2=Н, R3=Н, Х=С(=O) и Y=CH2. Это обеспечивает соединения формулы (Ic).
 ,
,
где R1, R4, R5a, R5b, R6, R7, R8 и r представляют собой, как определено выше.
В одном варианте осуществления соединений, подходящих для применения в данном изобретении, и в частности соединений формулы (Ib) и (Ic), R4 выбирают из группы, включающей Н, С1-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С2-С12алкинил, С3-С12циклоалкил, факультативно замещенный С6-С18арил, факультативно замещенный С-связанный С1-С18гетероарил, C(=O)R15, C(=O)NR16R17, -C(=NR16)NR17R18, SR20, SC(=O)R20, SO2R20, OR20, ONR16R17, OCR17R18R20, OC(=O)R20, OC(=O)OR20, OC(=O)NR16R17 и ONR16C(=NR17)NR18R19.
В одном определенном варианте осуществления R4 факультативно замещен C1-С18гетероарилом. В другом варианте осуществления R4 факультативно замещен С3-С12циклоалкилом. В другом варианте осуществления R4 представляет собой С1-С12алкил.
В другом определенном варианте осуществления R4 представляет собой C(=O)NR16R17.
В другом определенном варианте осуществления R4 представляет собой C(=O)NR16R17 и R16 и R17, взятые вместе с атомом азота, к которому они прикреплены, образуют факультативно замещенную С2-С12гетероциклоалкильную группу. В определенных вариантах осуществления R15 и R16, взятые вместе с атомом азота, к которому они прикреплены, образуют факультативно замещенную гетероциклоалкильную группу, выбранную из группы, включающей пиперидин-1-ил, пирролидин-1-ил, азетидин-1-ил, морфолин-4-ил, пиперазин-1-ил, 4-метил-пиперазин-1-ил и 1-азепанил.
В одном варианте осуществления соединений, подходящих для применения в данном изобретении, R16 выбирают из группы, включающей Н, СН3, СН2СН3, СН2СН2СН3, СН(СН3)2, CH2CH2CH2CH3, СН(СН3)СН2СН3, СН2СН(СН3)2, С(СН3)3, циклопропил, циклобутил, циклопентил, циклогексил, бензил и фенил или их галогенированное производное.
В одном варианте осуществления соединений, подходящих для применения в данном изобретении, R17 выбирают из группы, включающей Н, СН3, СН2СН3, СН2СН2СН3, СН(СН3)2, CH2CH2CH2CH3, СН(СН3)СН2СН3, СН2СН(СН3)2, С(СН3)3, циклопропил, циклобутил, циклопентил, циклогексил, бензил и фенил или их галогенированное производное.
В одном варианте осуществления способов и применений данного изобретения применяемое соединение формулы (I) представляет собой то, в котором R4=NR4aR4b. Соответственно применимая подгруппа соединений для применения в способах и применениях данного изобретения представляют собой соединения формулы (Id):
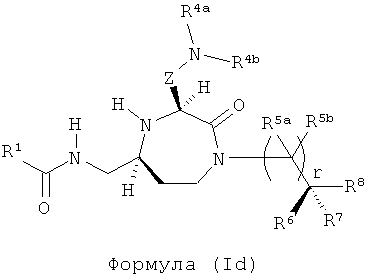 ,
,
где R1, R4a, R4b, R5a, R5b, R6, R7, R8, Z и r представляют собой, как определено для формулы (I).
В одном варианте осуществления соединений, подходящих для применения в данном изобретении, r выбирают из группы, включающей 1, 2, 3 и 4. В одном определенном варианте осуществления r равно 1. В другом определенном варианте осуществления r равно 2. В еще одном определенном варианте осуществления r равно 3. В еще одном определенном варианте осуществления r равно 4.
В одном варианте осуществления соединений, подходящих для применения в данном изобретении, R5a и R5b независимо выбраны из Н и C1-C6 алкила. В одном варианте осуществления R5a и R5b каждый независимо выбран из Н и СН3. В одном определенном варианте осуществления R5a и R5b оба представляют собой Н. В еще одном варианте осуществления, по меньшей мере, один из R5a и R5b, взятые вместе, по меньшей мере, с одним из R6, R7 и R8, и атомы, к которым они прикреплены, образуют факультативно замещенную циклоалкильную группу. В одном определенном варианте осуществления, по меньшей мере, один из R5a и R5b, взятые вместе, по меньшей мере, с одним из R6, R7 и R8 и атомами, к которым они прикреплены, образует циклогексильную группу.
В одном варианте осуществления соединений данного изобретения, Y представляет собой CH2, R2 представляет собой Н, R3 представляет собой Н, R5a и R5b представляют собой Н, и Х представляет собой -С(=O)- и r равно 1. Это обеспечивает соединения формулы (II).
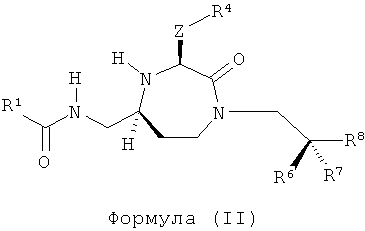 ,
,
где R1, R4, R6, R7, R8 и Z представляют собой, как определено для формулы (I).
В одном варианте осуществления соединений данного изобретения, Y представляет собой CH2, R2 представляет собой Н, R3 представляет собой Н, R5a и R5b представляют собой Н, Х представляет собой -С(=O)-, R4 представляет собой NR4aR4b, и r равно 1. Это обеспечивает соединения формулы (IIa).
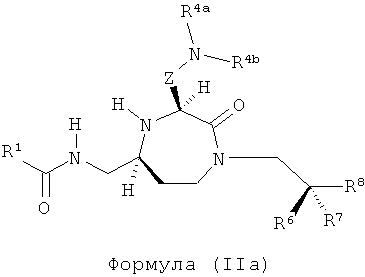 ,
,
где R1, R4a, R4b, R6, R7, R8 и Z представляют собой, как определено для формулы (I).
В соединениях данного изобретения Z представляет собой группу формулы -(CR13R14)q-. В одном варианте осуществления соединений, подходящих для применения в данном изобретении, и в частности соединения формулы (I), формулы (Ia), формулы (Ib), формулы (Ic), формулы (Id), формулы (II) и формулы (На), R13 и R14 независимо выбраны из Н и C1-С6 алкила. В одном варианте осуществления R13 и R14 каждый независимо выбран из Н и СН3. В одном определенном варианте осуществления R13 и R14 оба представляют собой Н. В еще одном варианте осуществления, по меньшей мере, один из R13 и R14, взятые вместе, по меньшей мере, с одним из R4a и R4b, и атомы, к которым они прикреплены, образуют факультативно замещенную гетероциклоалкильную группу. В одном варианте осуществления Z представляет собой -(CH2)q-.
В одном варианте осуществления соединений, подходящих для применения в данном изобретении, q представляет собой целое число, выбранное из группы, включающей 0, 1, 2, 3, 4 и 5. В одном определенном варианте осуществления q равно 1. В другом определенном варианте осуществления q равно 2, в еще одном варианте осуществления q равно 3, и в еще одном варианте осуществления q равно 4.
Соединения, в которых R7, R13 и R14 представляют собой Н, и q равно 1-4, приводят к соединениям (IIIa), (IIIb), (IIIc) и (IIId) соответственно.
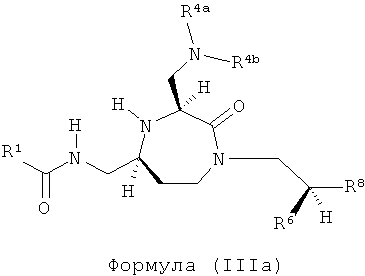 ,
,
где R1, R4a, R4b, R6 и R8 представляют собой, как определено для формулы (I).
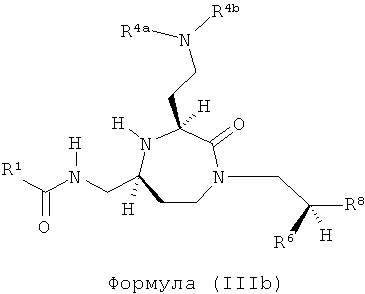 ,
,
где R1, R4a, R4b, R6 и R8 представляют собой, как определено для формулы (I).
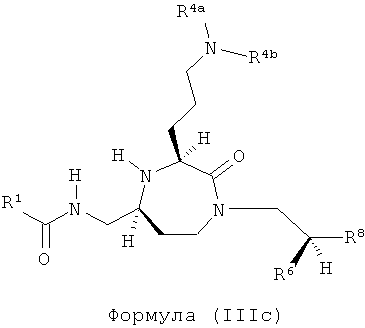 ,
,
где R1, R4a, R4b, R6 и R8 представляют собой, как определено для формулы (I).
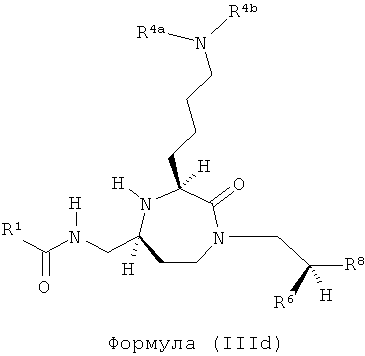 ,
,
где R1, R4a, R4b, R6 и R8 представляют собой, как определено для формулы (I).
В одной форме соединений, подходящих для применения в данном изобретении, R4a выбирают из группы, включающей H, -C(=N)NH2, -С(=N)N(СН3)2, -С(=N)NCH(СН3)2, -С(=O)СН3, -С(=O)циклогексил, СН3, СН2СН3, СН2СН2СН3, СН(СН3)2, СН2СН2СН2СН3, СН(СН3)СН2СН3, СН2СН(СН3)2, С(СН3)3, циклопропил, циклобутил, циклопентил, циклогексил, бензил и фенил или их галогенированное производное. В одной форме соединений, подходящих для применения в данном изобретении, R4b выбирают из группы, включающей Н, СН3, СН2СН3, СН2СН2СН3, СН(СН3)2, CH2CH2CH2CH3, СН(СН3)СН2СН3, СН2СН(СН3)2, С(СН3)3, циклопропил, циклобутил, циклопентил, циклогексил, бензил и фенил или их галогенированное производное.
В другой форме соединений, подходящих для применения в данном изобретении, R4a и R4b, взятые вместе с атомом азота, к которому они прикреплены, образуют факультативно замещенную C2-C12 гетероциклоалкильную группу, факультативно замещенную C2-C12 гетероциклоалкенильную группу или факультативно замещенную C1-C18 гетероарильную группу.
В определенном варианте осуществления соединений, подходящих для применения в данном изобретении, R4a и R4b, взятые вместе с атомом азота, к которому они прикреплены, образуют факультативно замещенную гетероциклоалкильную группу, выбранную из группы, включающей пиперидин-1-ил, пирролидин-1-ил, азетидин-1-ил, пиперазин-1-ил, морфолин-4-ил и азепан-1-ил.
В одном варианте осуществления способов и применений данного изобретения, соединение формулы (I) представляет собой такое, в котором один из R4a и R4b, взятый вместе с атомом азота, к которому он прикреплен, и один из R13 и R14, и атом углерода, к которому он прикреплен, образуют факультативно замещенную C2-С12 гетероциклоалкильную группу. В определенном варианте осуществления один из R4a и R4b, взятый вместе с атомом азота, к которому он прикреплен, и один из R13 и R14, и атом углерода, к которому он прикреплен, образуют факультативно замещенную гетероциклоалкильную группу, выбранную из группы, включающей пиперидинил, пирролидинил, азетидинил, морфолинил, пиперазинил и азепанил.
Определенные примеры NR4aR4b в соединениях, которые применимы в способах и применениях данного изобретения включают:
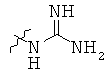
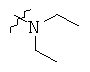
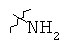
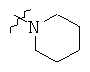
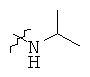
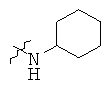
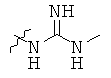
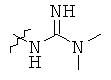
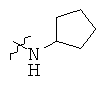
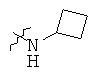
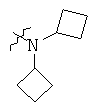
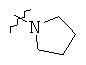
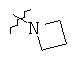
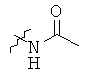
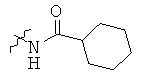
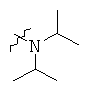
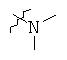
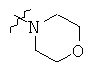
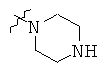
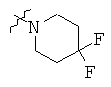
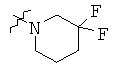
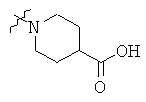
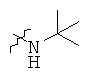
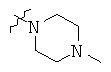
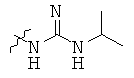
В одном варианте осуществления соединений, подходящих для применения в данном изобретении, R7 представляет собой Н.
В одном варианте осуществления соединений, подходящих для применения в данном изобретении, R6 и R8 каждый независимо выбран из группы, включающей Н, факультативно замещенный C1-C12 алкил, факультативно замещенный C2-C12 алкенил, факультативно замещенный C6-C18 арил и факультативно замещенный С1-С18гетероарил.
В одном определенном варианте осуществления соединений, подходящих для применения в данном изобретении, R6 выбирают из группы, включающей Н, метил, трифторметил, этил, 2,2,2-трифторэтил, изопропил, изопропенил, пропил, 2-этил-пропил, 3,3-диметил-пропил, бутил, 2-метилбутил, изобутил, 3,3-диметил-бутил, 2-этил-бутил, пентил, 2-метил-пентил, факультативно замещенный фенил и факультативно замещенный C1-C5 гетероарил.
В одном определенном варианте осуществления соединений, подходящих для применения в данном изобретении, R6 представляет собой факультативно замещенный фенил или факультативно замещенный С1-С18гетероарил.
В одном определенном варианте осуществления соединений, подходящих для применения в данном изобретении, R8 выбирают из группы, включающей Н, метил, трифторметил, этил, 2,2,2-трифторэтил, изопропил, изопропенил, пропил, 2-этил-пропил, 3,3-диметил-пропил, бутил, 2-метил-бутил, изобутил, 3,3-диметил-бутил, 2-этил-бутил, пентил, 2-метил-пентил, пент-4-енил, гексил, гептил, октил, факультативно замещенный фенил и факультативно замещенный C1-C5 гетероарил.
В одном определенном варианте осуществления соединений, подходящих для применения в данном изобретении, R8 представляет собой метил, этил, фенил или факультативно замещенный С1-С5 гетероарил.
В одном определенном варианте осуществления соединений, подходящих для применения в данном изобретении, R6, R7 и R8, взятые вместе с углеродом, к которому они прикреплены, образуют часть, выбранную из группы, включающей факультативно замещенный С2-С12алкенил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный С2-С12 гетероциклоалкил, факультативно замещенный С6-C18арил и факультативно замещенный С1-С18гетероарил.
В одном определенном варианте осуществления соединений, подходящих для применения в данном изобретении, R6, R7 и R8, взятые вместе с углеродом, к которому они прикреплены, образуют факультативно замещенную С6-С18арильную группу.
В одном определенном варианте осуществления соединений данного изобретения и в особенности соединений формулы (I), (II) (IIa) (IIIa), (IIIb), (IIIc) и (IIId), R6, R7 и R8, взятые вместе с атомом углерода, к которому они прикреплены, образуют двузамещенную фенильную группу.
В одном варианте осуществления двузамещенная фенильная группа представляет собой 2,4-двузамещенную фен-1-ильную группу или 3,5-двузамещенную фен-1-ильную группу. Большое число заместителей может присутствовать на двузамещенной фенильной группе, как определено выше. Примеры, в частности, подходящих заместителей включают, но не ограничиваются, F, Br, Cl, метил, трифторметил, этил, 2,2,2-трифторэтил, изопропил, пропил, 2-этил-пропил, 3,3-диметил-пропил, бутил, изобутил, 3,3-диметил-бутил, 2-этил-бутил, пентил, 2-метил-пентил, пент-4-енил, гексил, гептил, октил, фенил, NH2, циано, фенокси, гидрокси, метокси, этокси, метилендиокси, пиррол-1-ил и 3,5-диметил-пиразол-1-ил. В одном определенном варианте осуществления двузамещенная фенильная группа представляет собой 3,5-дихлорфен-1-ильную группу.
В одном определенном варианте осуществления соединений, подходящих для применения в данном изобретении, R1 выбирают из группы, включающей факультативно замещенный С2-С12алкенил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил.
В одном определенном варианте осуществления соединений, подходящих для применения в данном изобретении R1 представляет собой факультативно замещенный С6-С18арил. С6-С18арил может представлять собой моноциклическую, бициклическую или полициклическую часть. В определенных вариантах осуществления С6-С18арил представляет собой моноциклическую часть. В определенных вариантах осуществления С6-С18арил представляет собой бициклическую часть.
В одном определенном варианте осуществления R1 представляет собой факультативно замещенный С6-С18арил, выбранный из группы, включающей факультативно замещенный фенил, бифенил и факультативно замещенный нафтил. Части могут быть незамещенными или могут быть замещенными одним или более факультативными заместителями. Большое число факультативных заместителей можно применять, как определено выше. Примеры особенно подходящих факультативных заместителей включают, но не ограничиваются, F, Br, Cl, метил, трифторметил, этил, 2,2,2-трифторэтил, изопропил, пропил, 2-этил-пропил, 3,3-диметил-пропил, бутил, изобутил, 3,3-диметил-бутил, 2-этил-бутил, пентил, 2-метил-пентил, пент-4-енил, гексил, гептил, октил, фенил, MHz, циано, фенокси, гидрокси, метокси, этокси, пиррол-1-ил и 3,5-диметил-пиразол-1-ил.
Заместители могут быть расположены в любом замещаемом положении вокруг арильного кольца, доступного для замены, как будет ясно специалисту в данной области. Примеры подходящих факультативно замещенных фенильных соединений включают, но не ограничиваются, 2-метокси-фенил, 3-метокси-фенил, 4-метокси-фенил, 2-трифторметил-фенил, 3-трифторметил-фенил, 4-трифторметил-фенил, 2-хлор-фенил, 3-хлор-фенил, 4-хлор-фенил, 4-бром-фенил, 2-фтор-фенил, 3-фтор-фенил, 4-фтор-фенил, 4-гидрокси-фенил, 4-фенил-фенил, 4-метил-фенил, 2,4-дихлор-фенил, 3,4-дихлор-фенил, 2,5-дихлор-фенил, 2,6-дифтор-фенил, 2-хлор-6-фтор-фенил, 3-фтор-4-хлор-фенил, 3-метил-4-хлор-фенил, 3-хлор-4-фтор-фенил, 3-хлор-4-метил-фенил, 2-гидрокси-фенил, 3-гидрокси-фенил, 4-гидрокси-фенил, 4-этокси-фенил, 3-фенокси-фенил, 4-фенокси-фенил, 2-метил-фенил, 3-метил-фенил, 4-метил-фенил, 4-изопропил-фенил, 4-циано-фенил, 3,4-диметил-фенил, 2,4-диметил-фенил, 4-трет-бутил-фенил, 2,4-диметокси-фенил и 3,4-метилендиокси-фенил.
В случае, когда R1 представляет собой факультативно замещенный бифенил, точка крепления R1 к остатку молекулы может быть в 2-, 3- или 4- положении по отношению к точке крепления второго фенильного кольца. Как таковой бифенил может представлять собой факультативно замещенный бифен-2-ил или факультативно замещенный бифен-3-ил или факультативно замещенный бифен-4-ил. В основном факультативно замещенный бифенил представляет собой факультативно замещенный бифен-4-ил. Факультативно замещенный бифенил может быть замещенным в любом подходящем положении.
В случае, когда R1 представляет собой факультативно замещенный нафтил, точка крепления R1 к остатку молекулы может быть в 1 или 2 положении. Как таковой нафтил может представлять собой факультативно замещенный нафт-1-ил, или факультативно замещенный нафт-2-ил. В основном факультативно замещенный нафтил представляет собой факультативно замещенный нафт-2-ил. Факультативно замещенный нафтил может быть замещенным в любом подходящем положении. Примеры подходящих факультативно замещенных нафт-2-илов включают, но не ограничиваются, 6-фтор-нафт-2-ил, 6-бром-нафт-2-ил, 6-хлор-нафт-2-ил, Ч-метокси-нафт-2-ил, 3-метокси-нафт-2-ил, 6-метокси-нафт-2-ил, 1-гидрокси-нафт-2-ил и 6-амино-нафт-2-ил.
В одном определенном варианте осуществления соединений, подходящих для применения в данном изобретении, R1 представляет собой факультативно замещенный С1-С18гетероарил. С1-С18гетероарил может представлять собой моноциклическую, бициклическую или полициклическую часть. В определенных вариантах осуществления С1-С18гетероарил представляет собой моноциклическую часть. В определенных вариантах осуществления С1-С18гетероарил представляет собой бициклическую часть. Примеры подходящих гетероарильных частей включают, но не ограничиваются, индол-2-ил, индол-3-ил, хинолин-2-ил хинолин-3-ил, изохинолин-3-ил, хиноксалин-2-ил, бензо[b]фуран-2-ил, бензо[b]тиофен-2-ил, бензо[b]тиофен-5-ил, тиазол-4-ил, бензимидазол-5-ил, бензотриазол-5-ил, фуран-2-ил, бензо[d]тиазол-6-ил, пиразол-1-ил, пиразол-4-ил и тиофен-2-ил. Они также могут быть факультативно замещенными, как обсуждалось выше.
В одном определенном варианте осуществления соединений, подходящих для применения в данном изобретении, R1 представляет собой факультативно замещенный С2-С12алкенил. Факультативно замещенный алкенил может содержать одну или более двойных связей с каждой из двойных связей, будучи независимо в Е или Z конфигурации. В одном варианте осуществления данного изобретения алкенил содержит одну двойную связь, которая находится в Е конфигурации.
В одной определенной форме этого варианта осуществления R1 представляет собой факультативно замещенный С2-С12алкенил формулы:
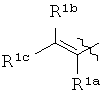 ,
,
R1a выбирают из группы, включающей Н, галоген и факультативно замещенный C1-C12 алкил;
R1b и R1c каждый независимо выбран из группы, включающей Н, галоген, факультативно замещенный С1-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С2-С12алкинил, факультативно замещенный С1-С12гетероалкил, факультативно замещенный С3-C12циклоалкил, факультативно замещенный C2-C12гетероциклоалкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил.
В одной форме этого варианта осуществления R1a представляет собой Н. В одной форме этого варианта осуществления R1b представляет собой Н. Это обеспечивает соединения, где R1 формулы:
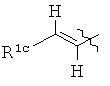 .
.
В одном варианте осуществления соединений данного изобретения R10 представляет собой факультативно замещенный С6-С18арил. С6-С18арил может представлять собой моноциклическую, бициклическую или полициклическую часть. В определенных вариантах осуществления С6-С18арил представляет собой моноциклическую часть. В определенных вариантах осуществления С6-С18арил представляет собой бициклическую часть.
В одном определенном варианте осуществления R10 представляет собой факультативно замещенный С6-С18арил, выбранный из группы, включающей факультативно замещенный фенил и факультативно замещенный нафтил. Части могут быть незамещенными или могут быть замещенными одним или более факультативными заместителями. Большое число факультативных заместителей можно применять, как определено выше. Примеры в частности подходящих факультативных заместителей включают, но не ограничиваются, F, Br, Cl, метил, трифторметил, этил, 2,2,2-трифторэтил, изопропил, пропил, 2-этил-пропил, 3,3-диметил-пропил, бутил, изобутил, 3,3-диметил-бутил, 2-этил-бутил, пентил, 2-метил-пентил, пент-4-енил, гексил, гептил, октил, фенил, NH2, циано, фенокси, гидрокси, метокси, этокси, метилендиокси, пиррол-1-ил и 3,5-диметил-пиразол-1-ил.
Заместители могут быть расположены в любом замещаемом положении вокруг арильного кольца, доступного для замены, как будет ясно специалисту в данной области. Примеры подходящих факультативно замещенных фенильных соединений включают, но не ограничиваются, 2-метокси-фенил, 3-метокси-фенил, 4-метокси-фенил, 2-трифторметил-фенил, 3-трифторметил-фенил, 4-трифторметил-фенил, 2-хлор-фенил, 3-хлор-фенил, 4-хлор-фенил, 4-бром-фенил, 2-фтор-фенил, 3-фтор-фенил, 4-фтор-фенил, 4-гидрокси-фенил, 4-фенил-фенил, 4-метил-фенил, 2,4-дихлор-фенил, 3,4-дихлор-фенил, 2,5-дихлор-фенил, 2,6-дифтор-фенил, 2-хлор-6-фтор-фенил, 3-фтор-4-хлор-фенил, 3-метил-4-хлор-фенил, 3-хлор-4-фтор-фенил, 3-хлор-4-метил-фенил, 2-гидрокси-фенил, 3-гидрокси-фенил, 4-гидрокси-фенил, 4-этокси-фенил, 3-фенокси-фенил, 4-фенокси-фенил, 2-метил-фенил, 3-метил-фенил, 4-метил-фенил, 4-изопропил-фенил, 4-циано-фенил 3,4-диметил-фенил, 2,4-диметил-фенил, 4-трет-бутил-фенил, 2,4-диметокси-фенил и 3,4-метилендиокси-фенил.
Определенные соединения, подходящие для применения в способах и применениях данного изобретения, включают следующие:
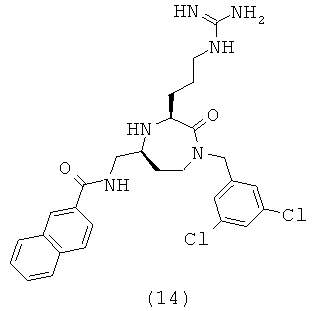
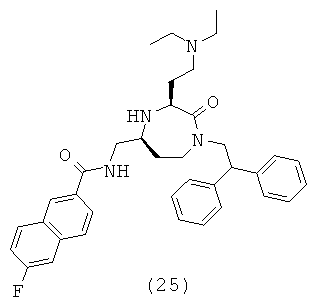
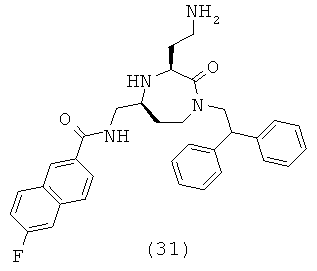
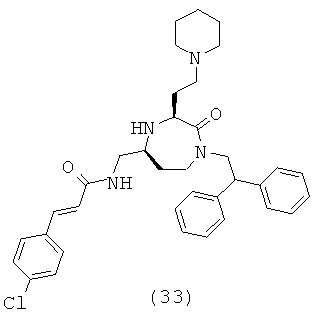
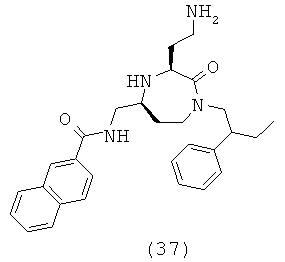
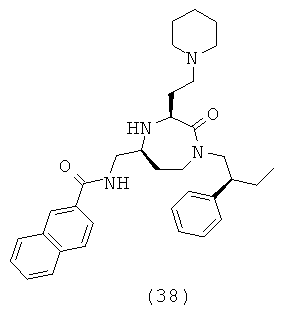
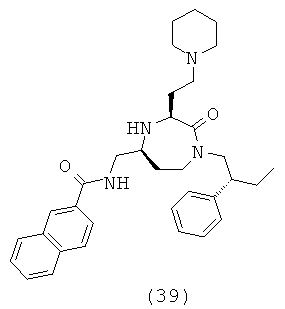
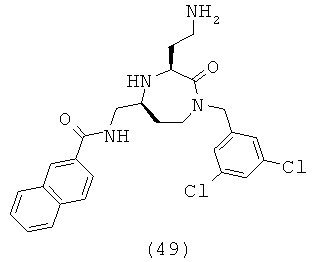
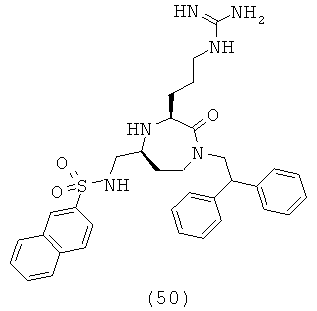
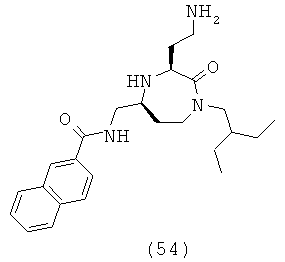
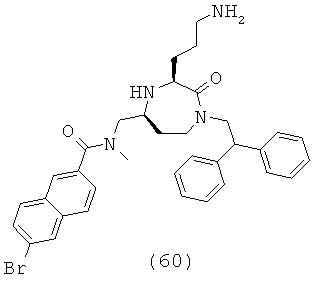
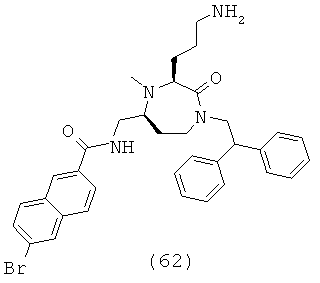
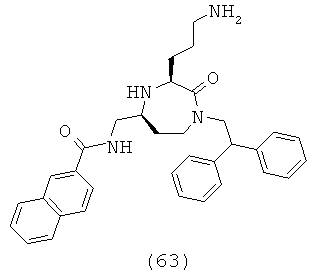
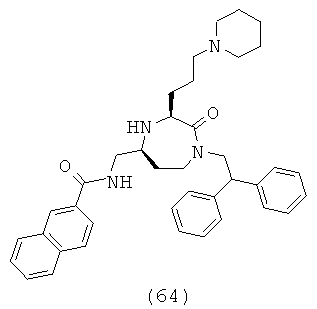
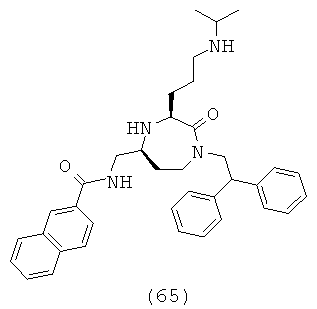
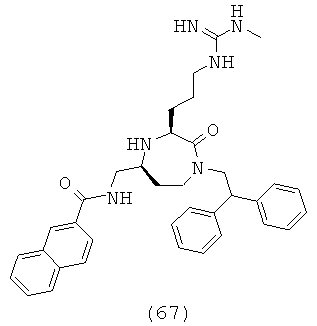
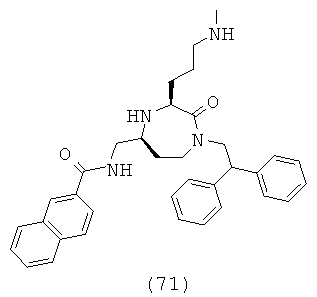
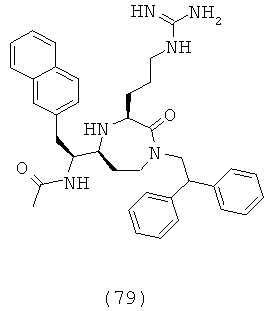
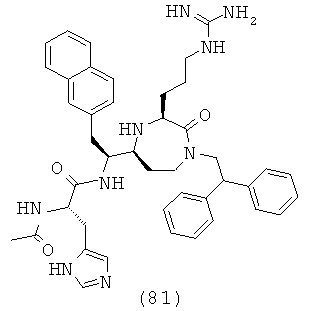
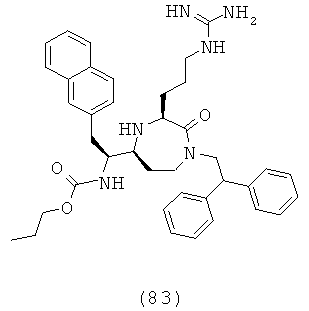
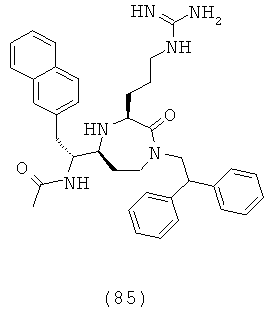
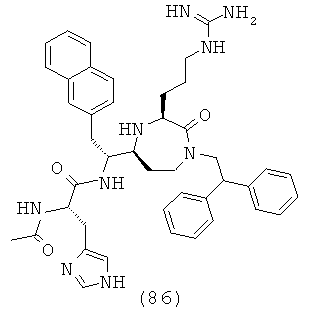
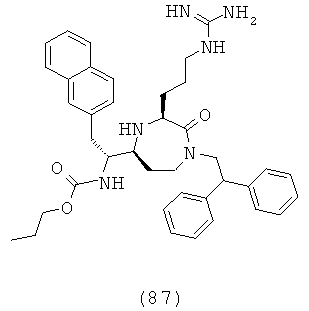
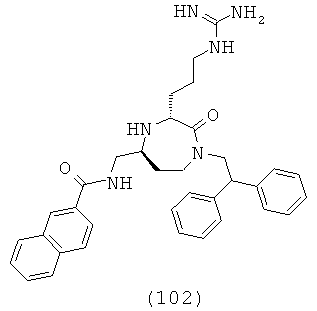
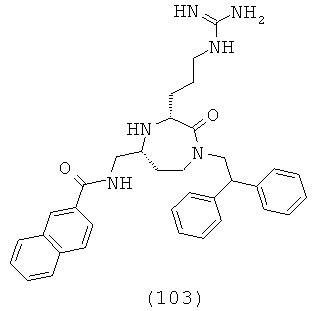
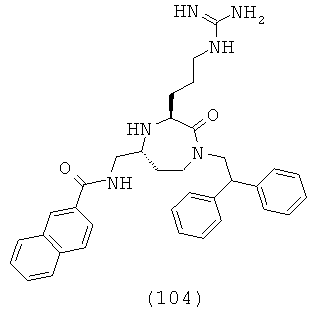
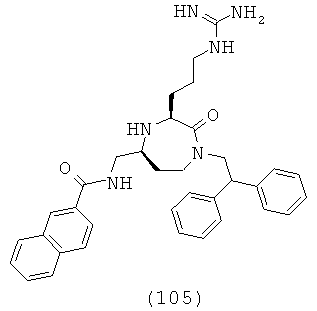
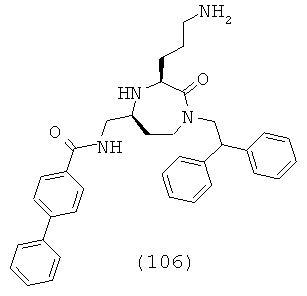
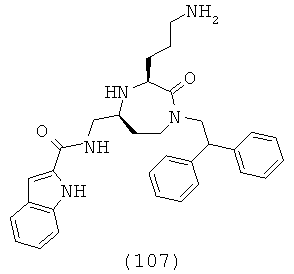
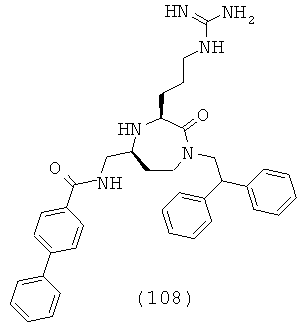
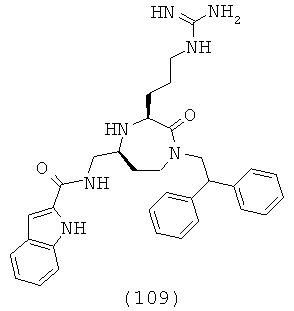
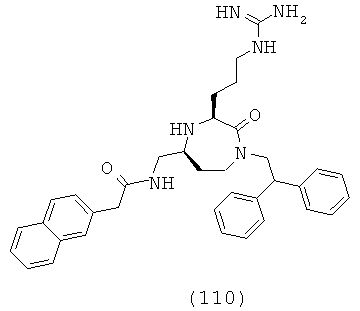
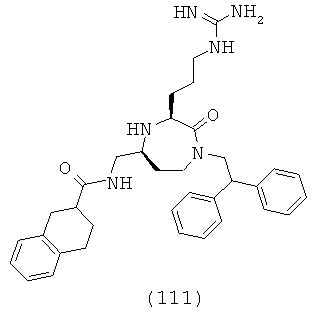
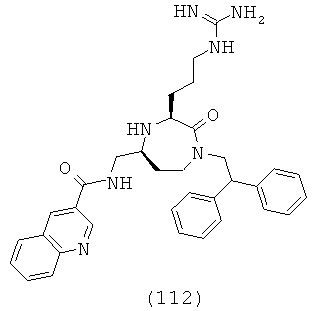
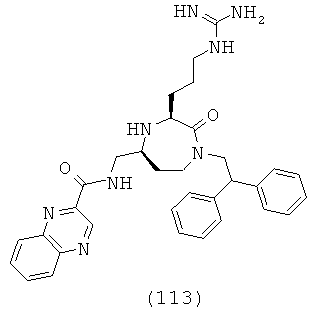
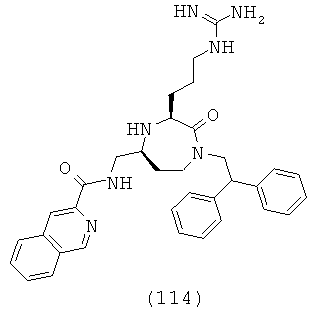
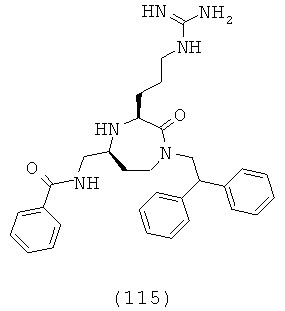
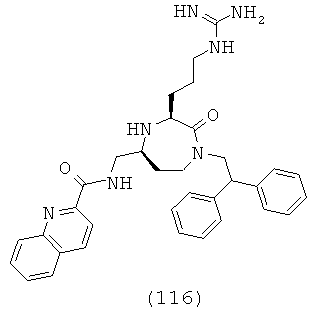
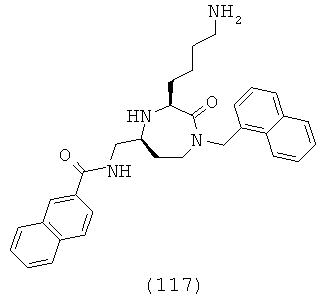
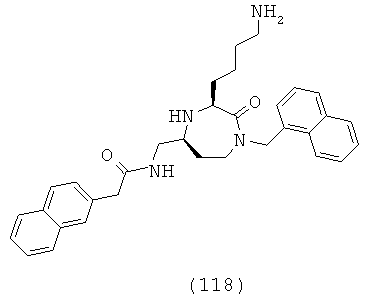
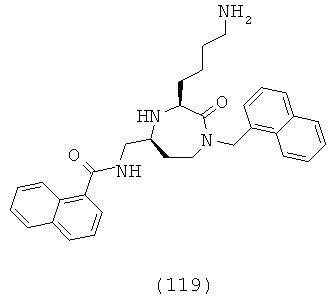
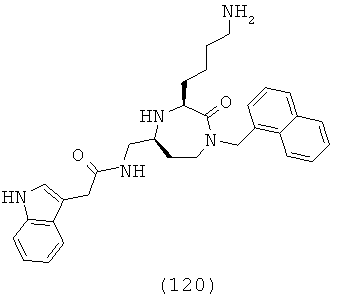
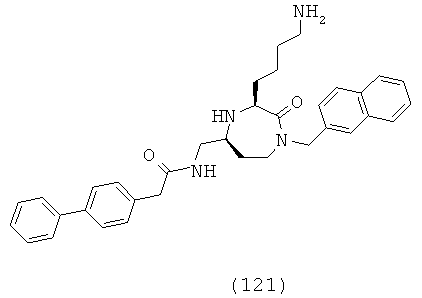
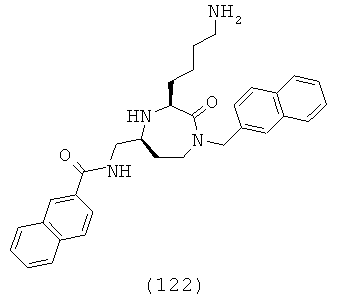
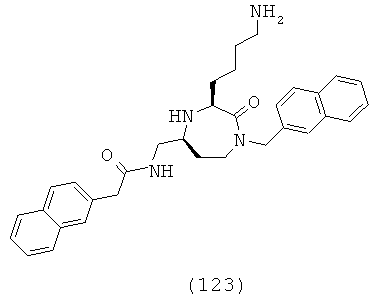
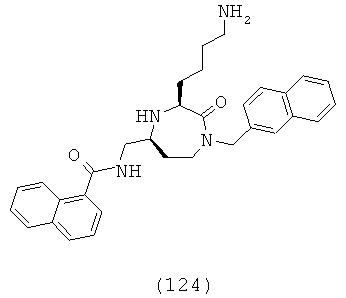
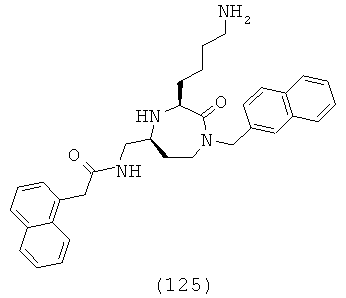
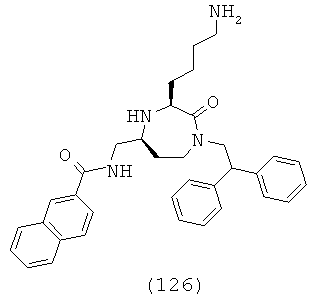
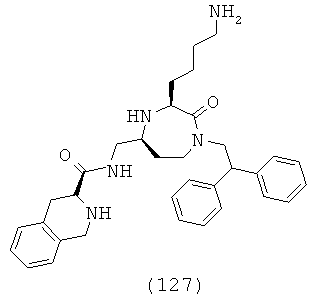
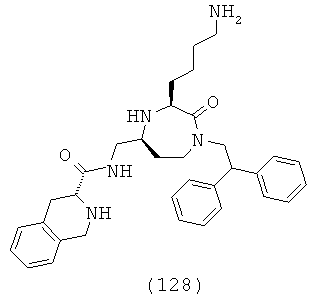
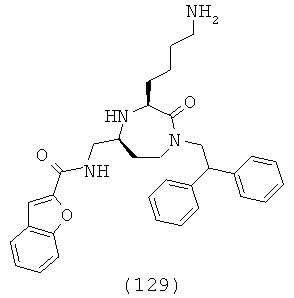
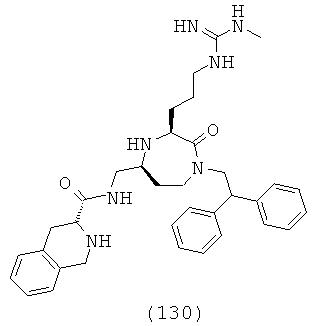
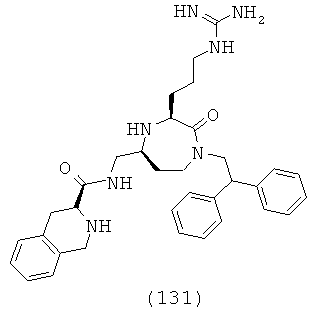
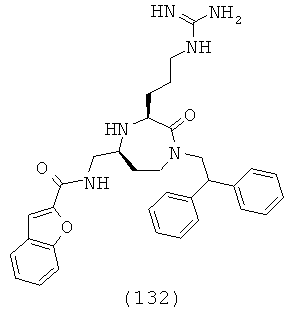
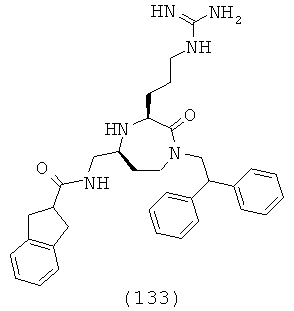
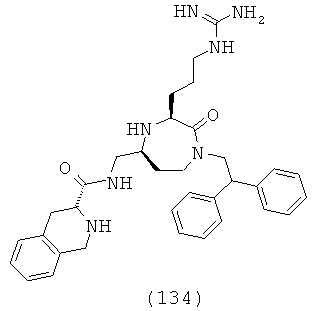
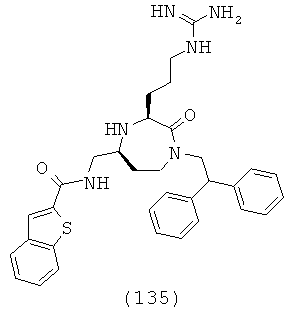
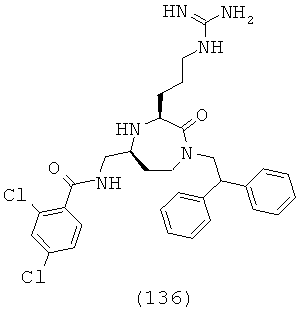
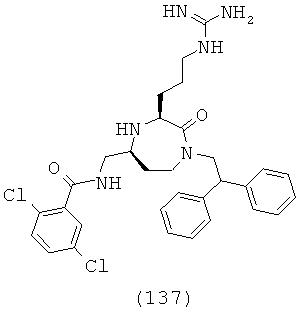
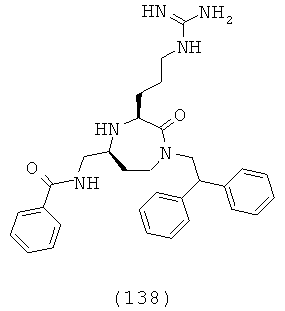
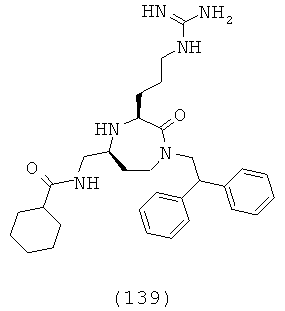
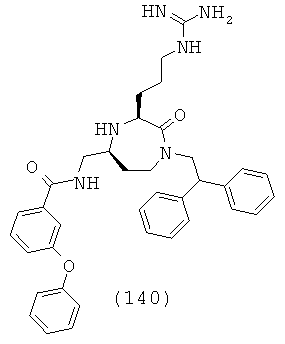
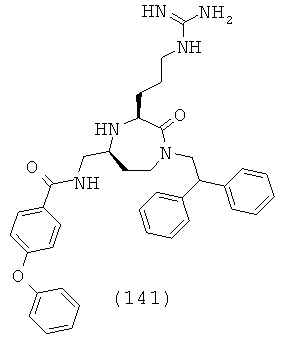
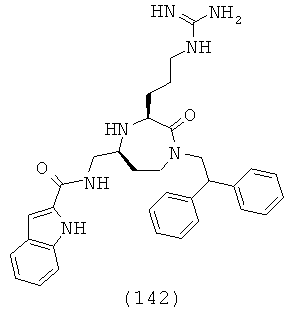
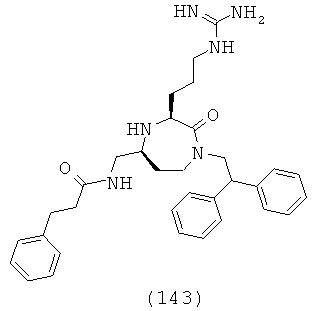
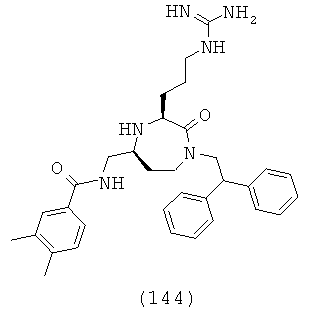
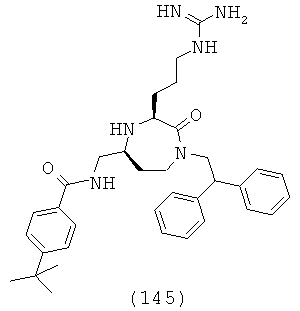
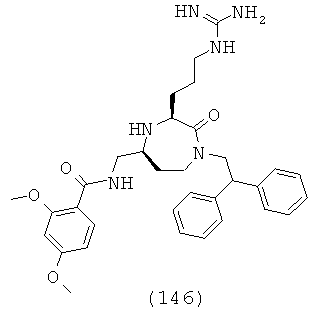
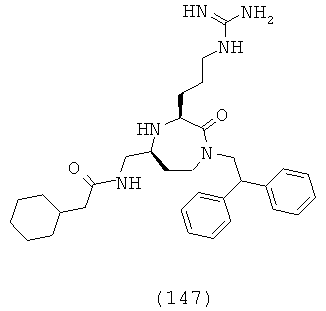
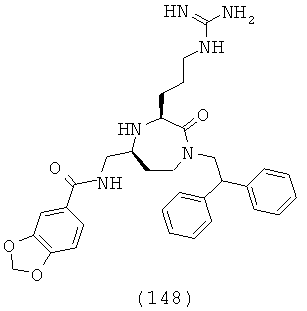
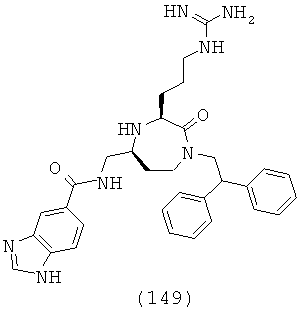
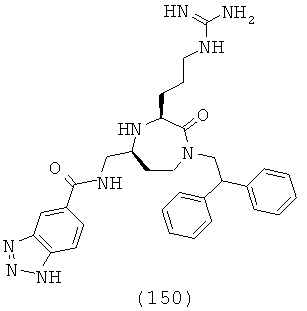
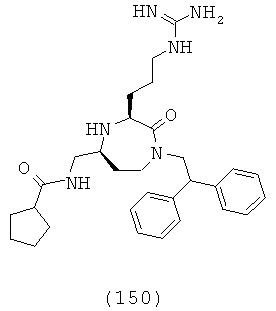
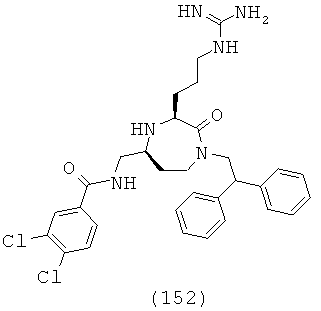
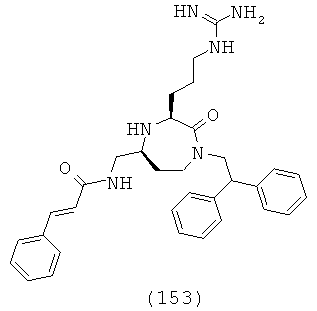
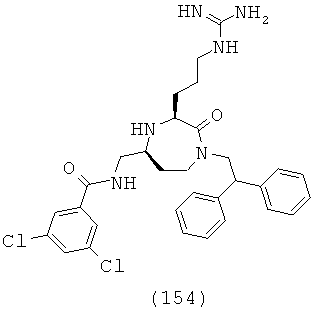
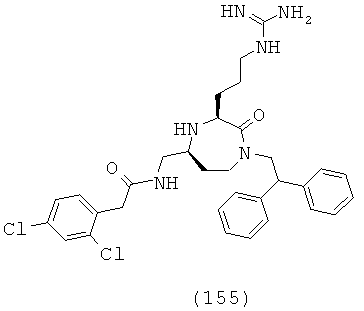
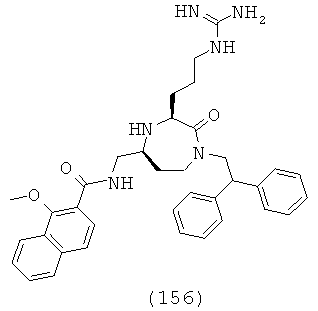
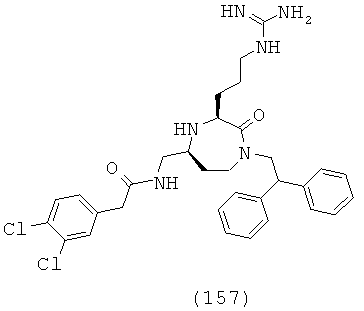
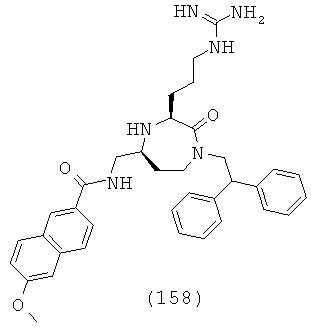
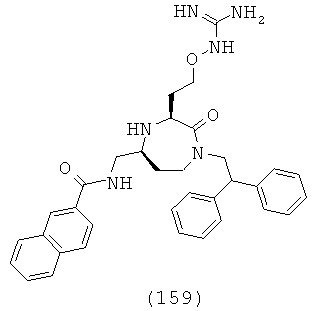
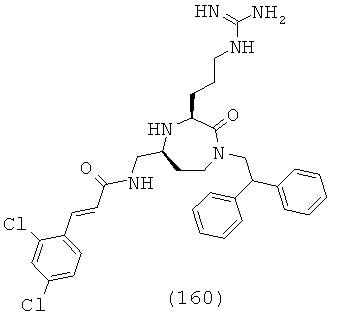
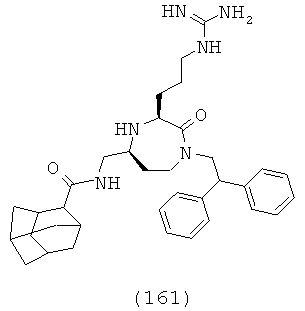
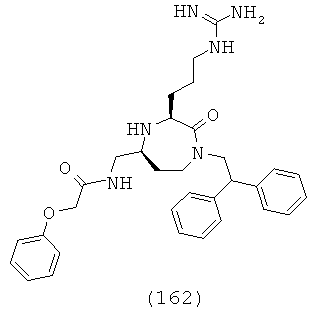
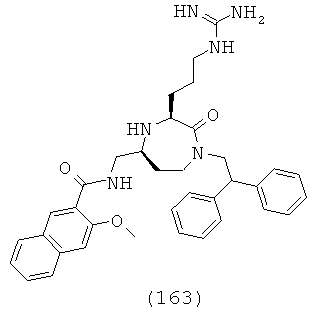
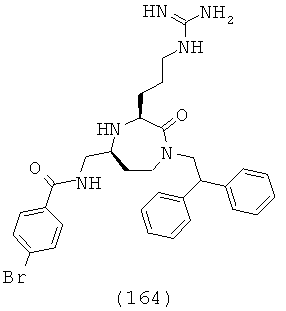
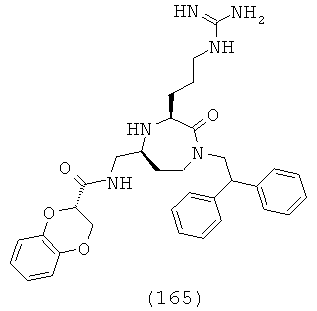
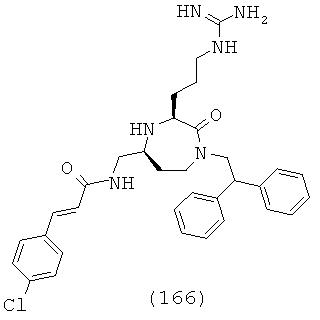
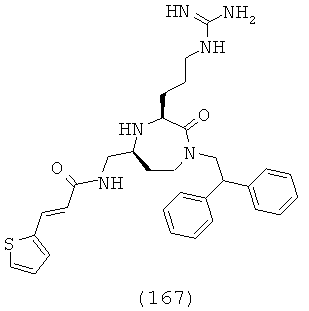
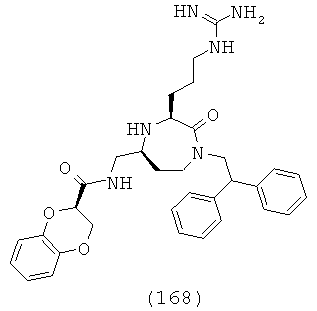
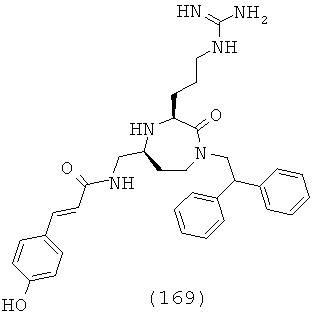
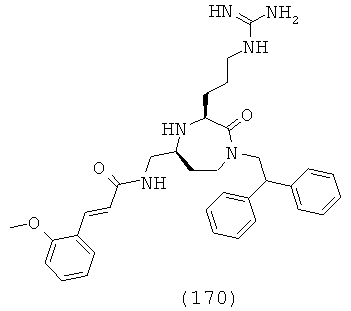
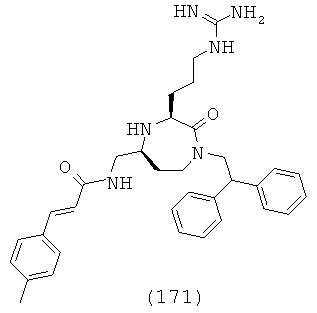
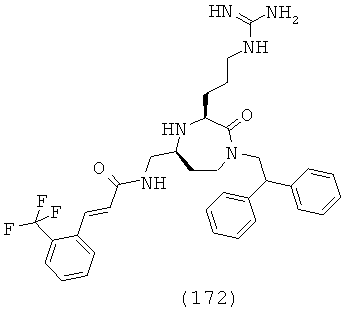
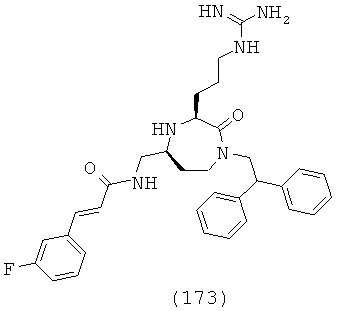
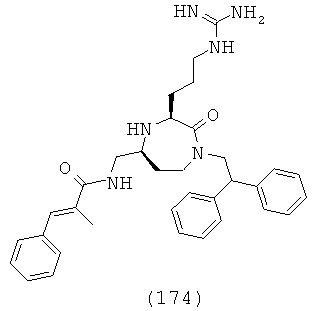
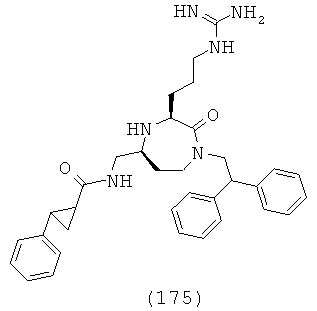
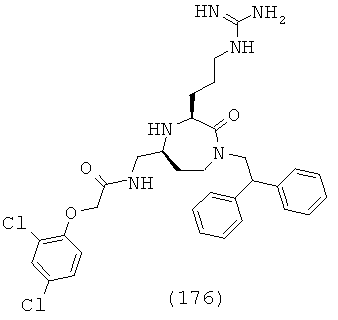
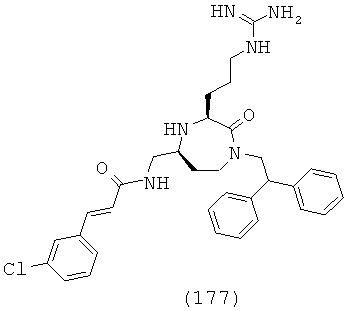
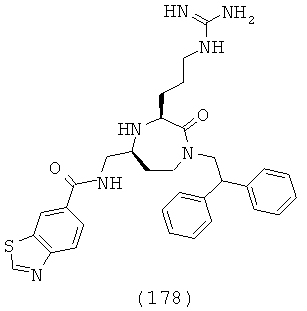
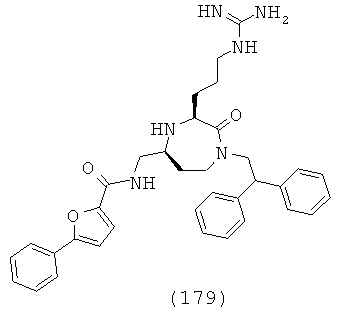
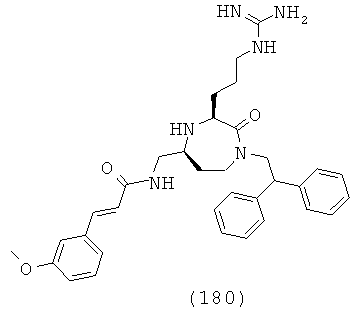
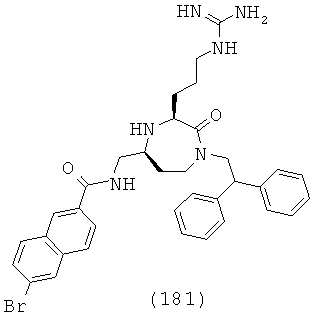
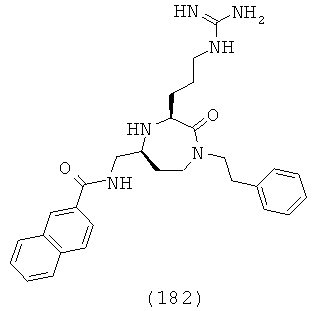
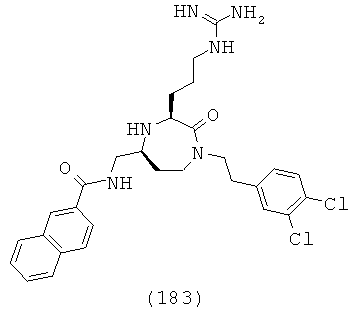
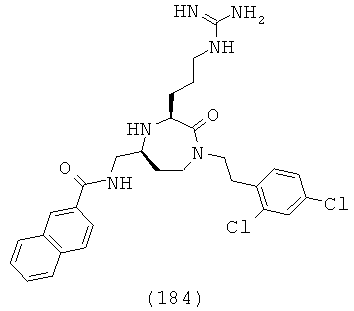
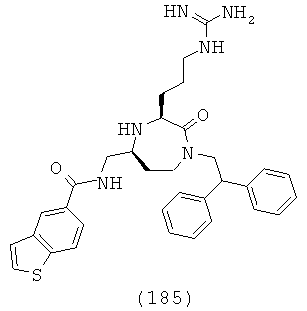
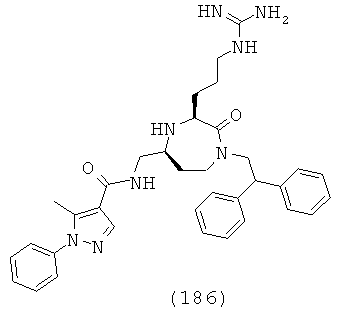
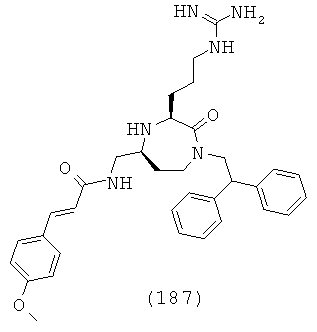
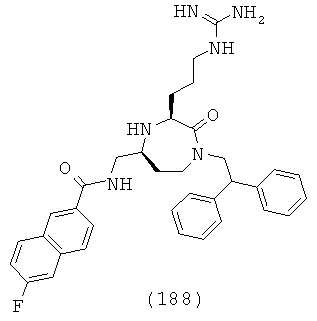
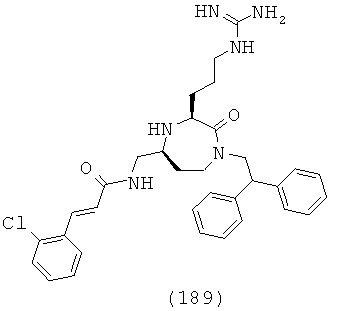
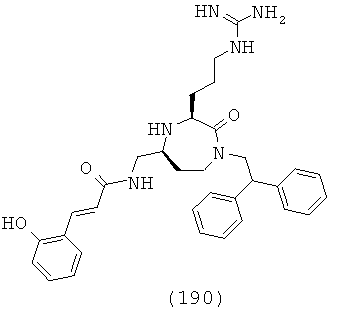
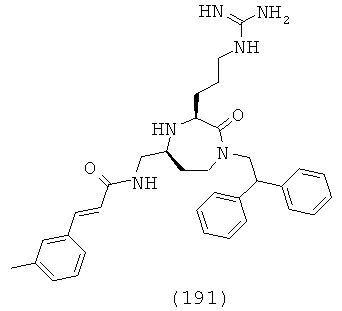
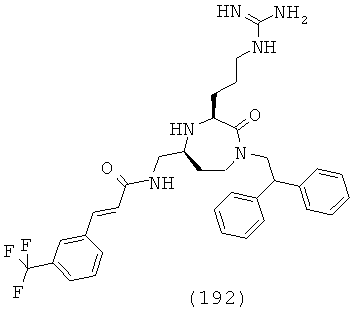
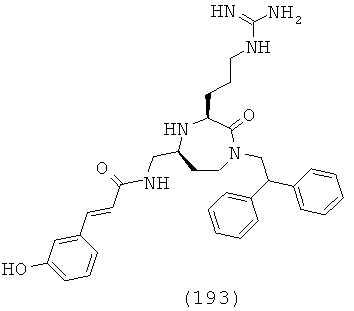
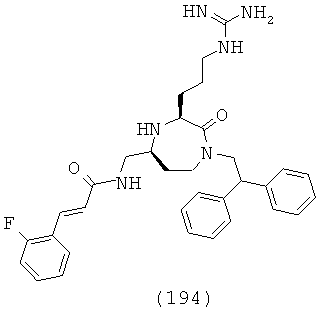
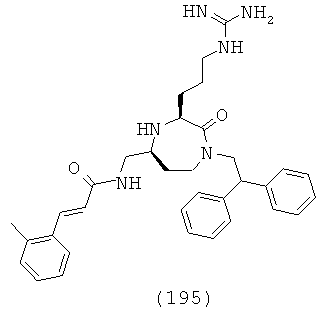
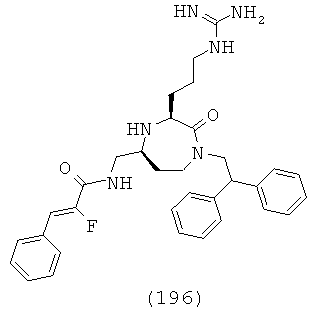
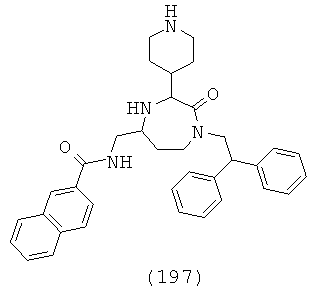
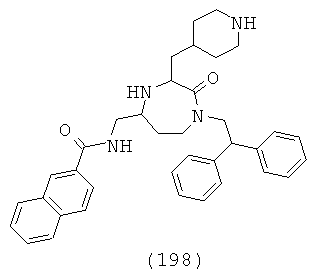
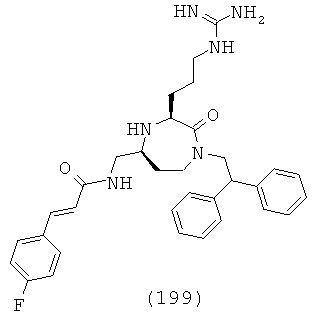
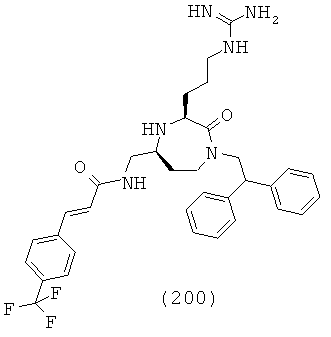
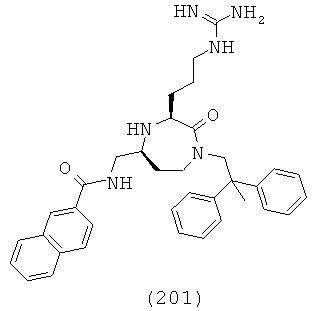
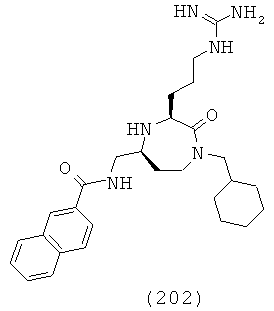
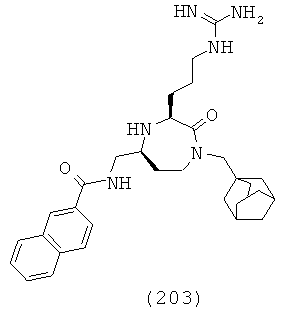
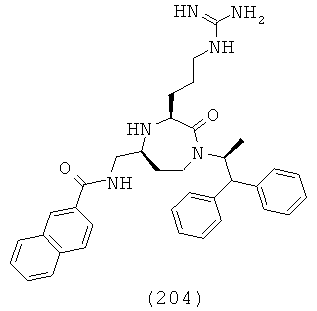
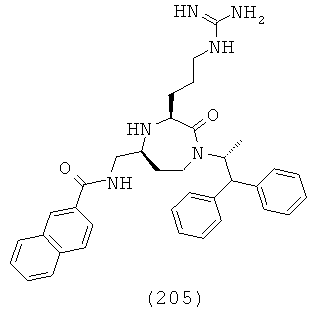
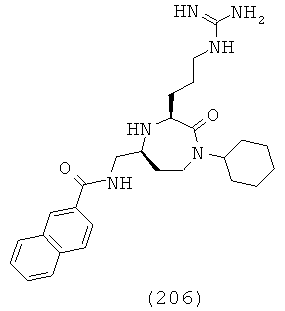
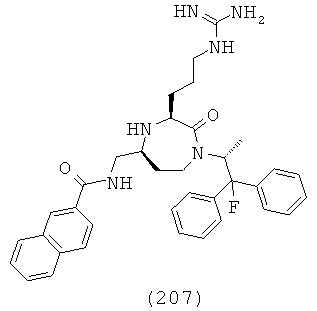
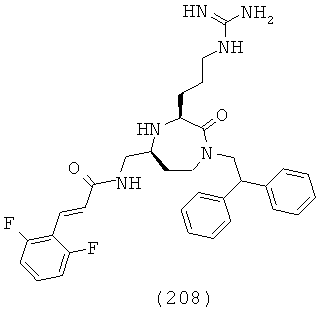
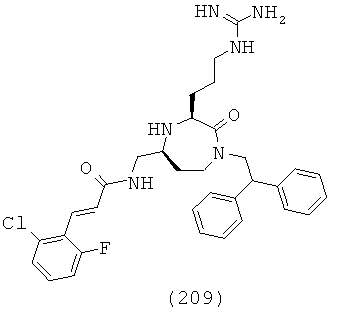
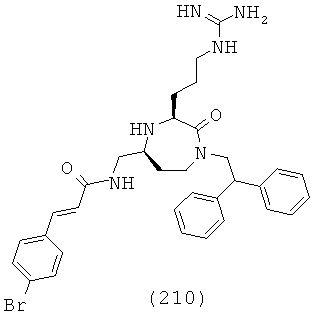
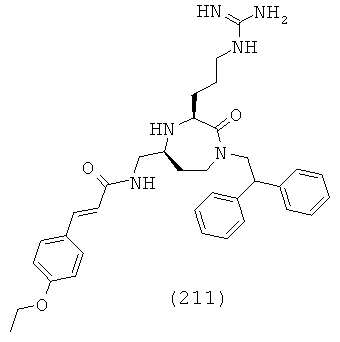
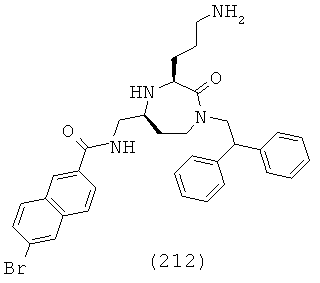
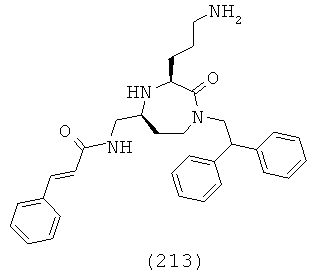
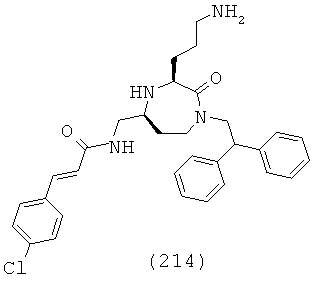
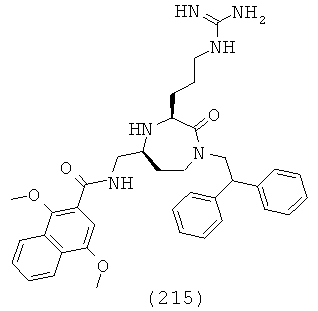
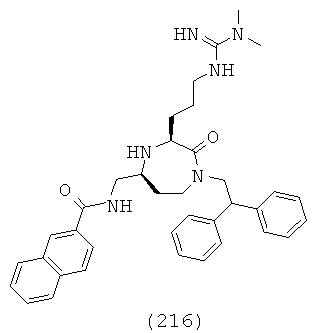
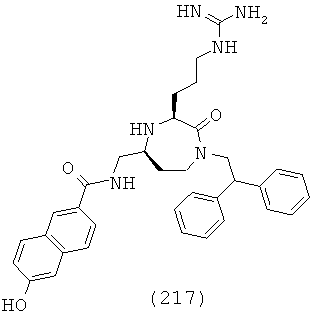
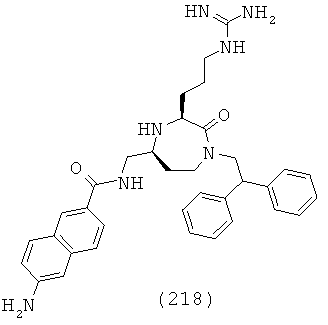
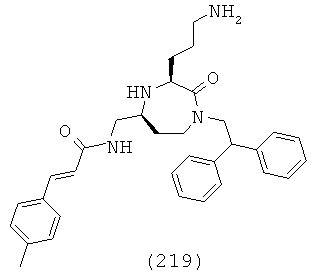
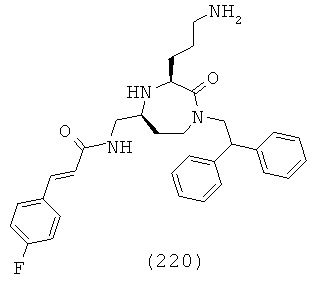
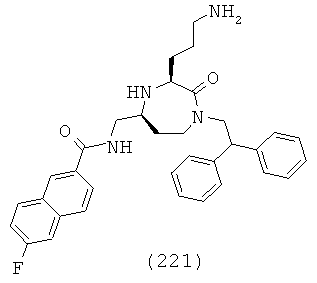
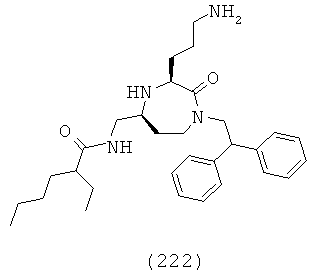
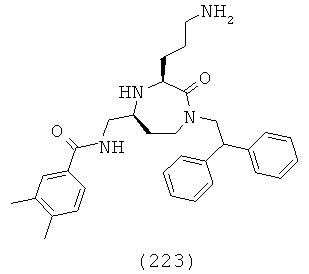
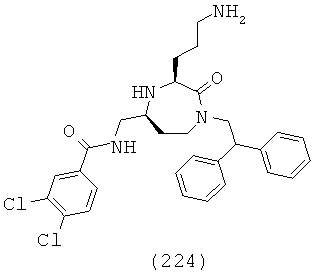
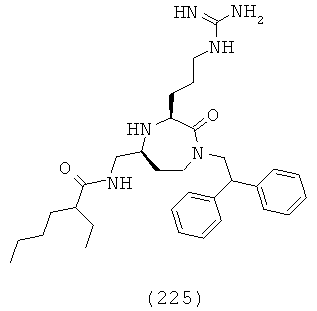
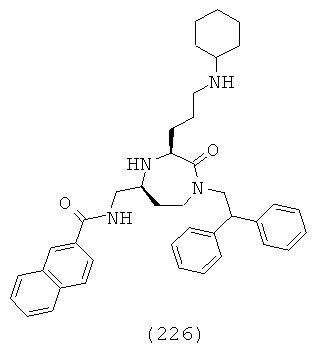
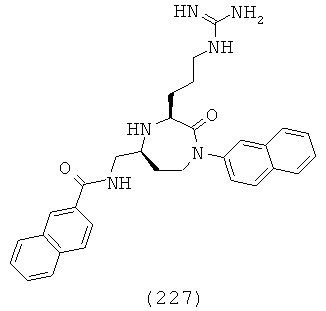
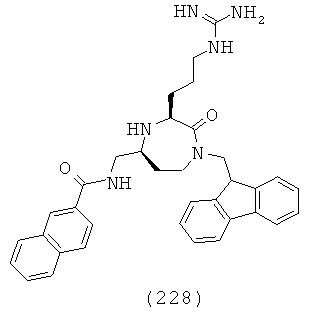
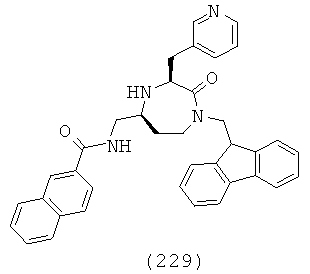
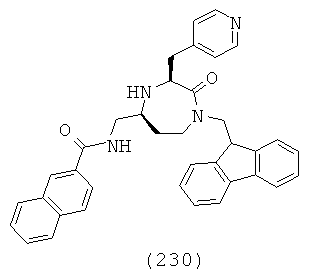
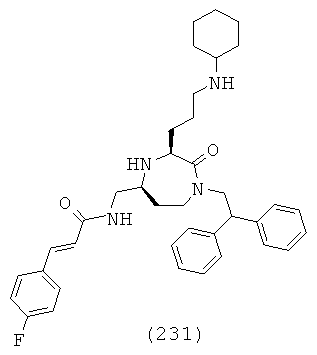
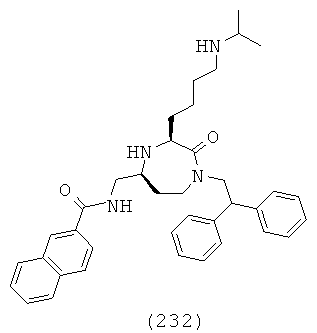
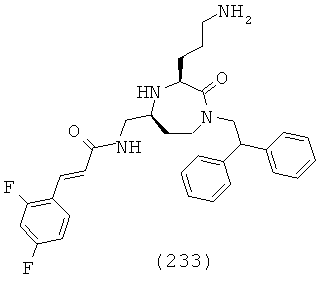
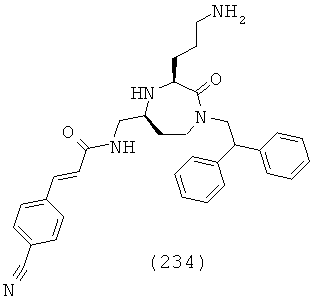
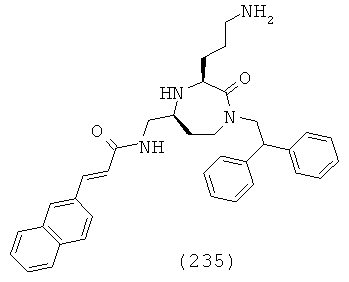
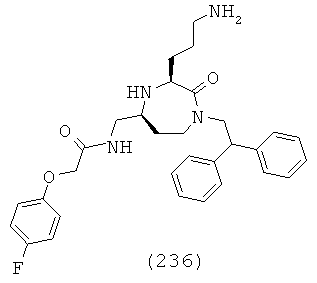
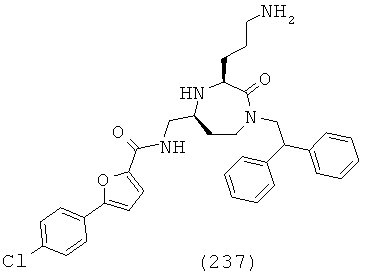
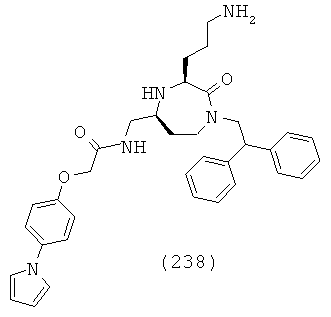
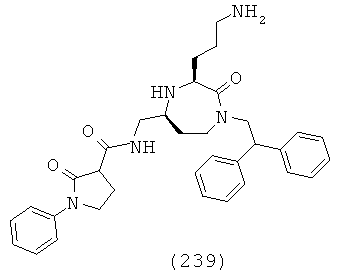
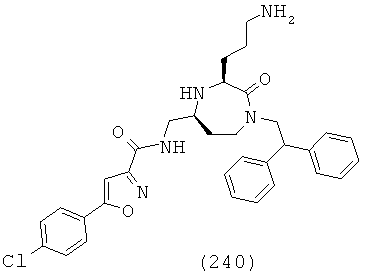
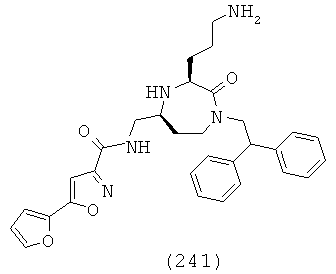
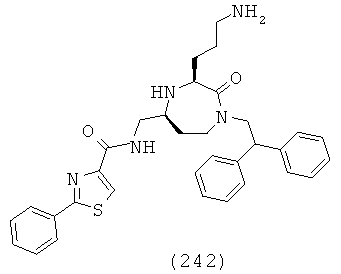
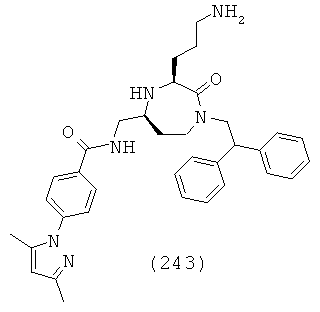
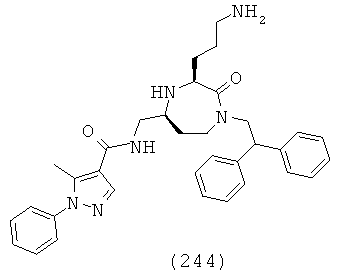
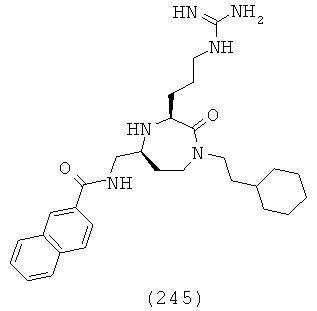
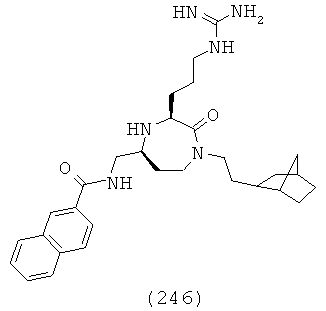
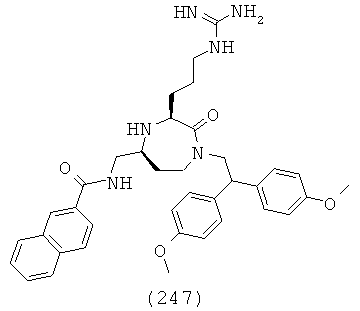
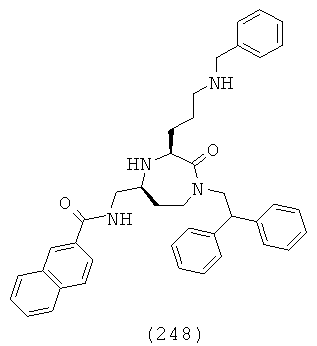
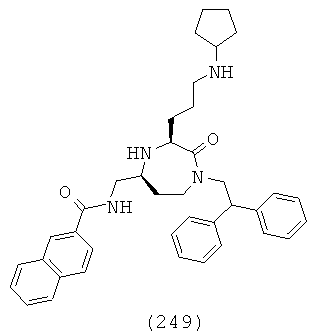
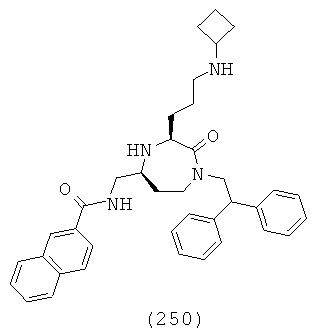
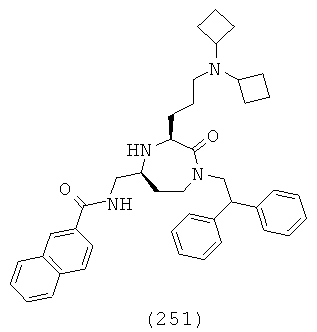
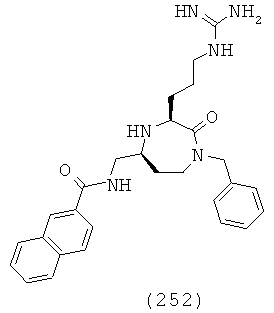
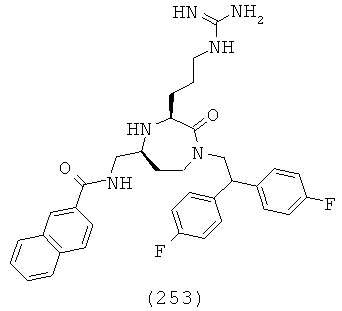
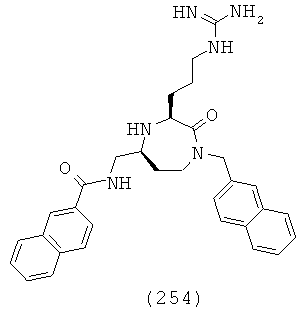
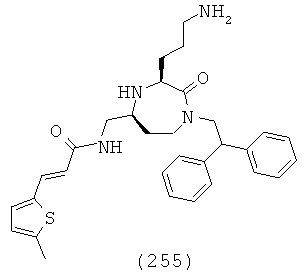
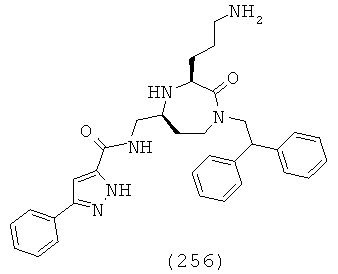
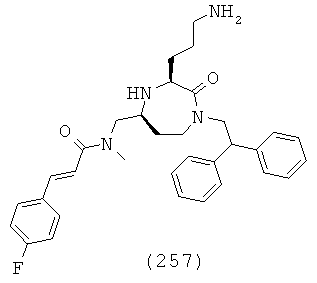
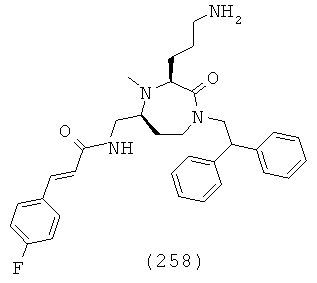
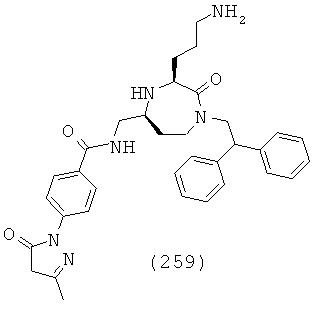
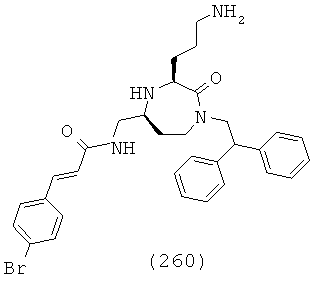
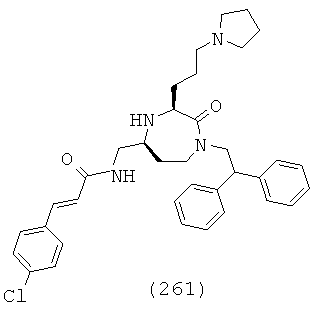
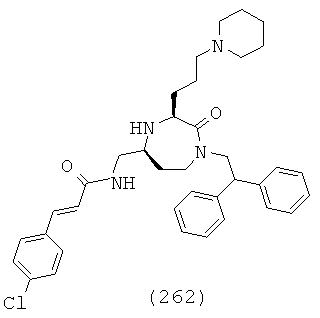
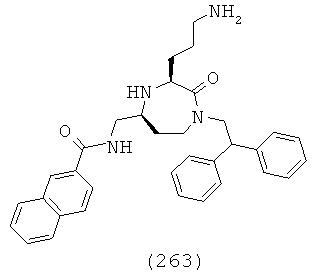
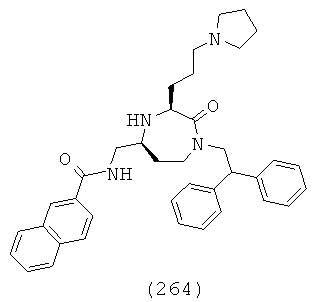
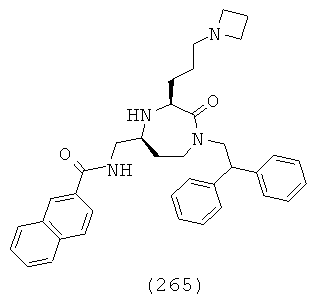
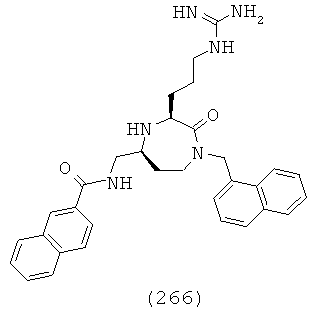
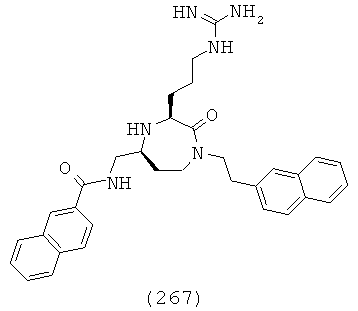
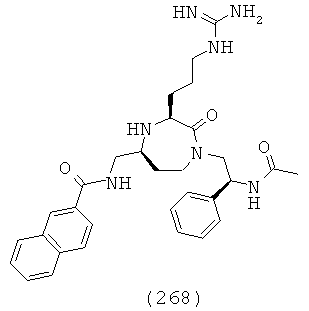
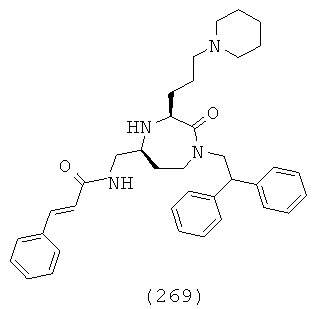
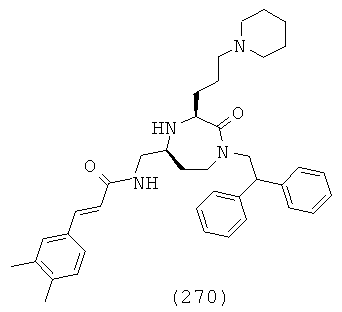
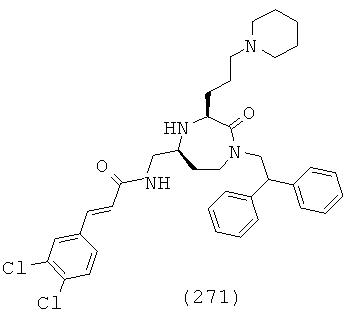
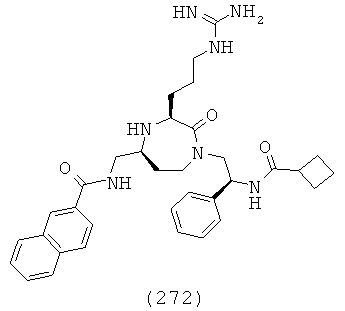
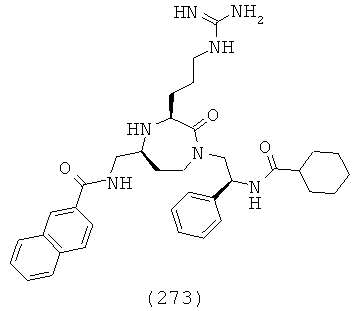
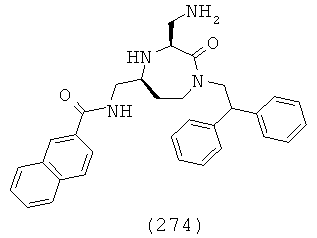
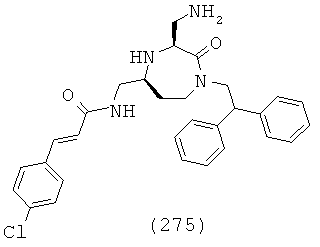
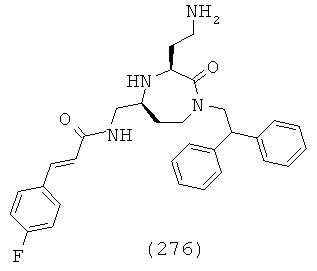
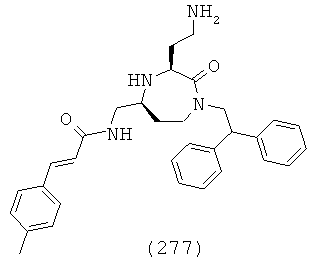
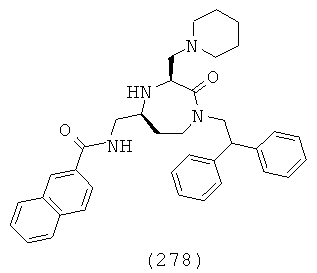
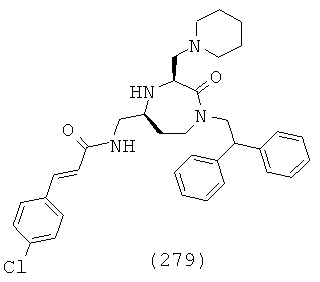
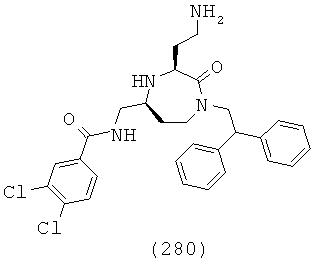
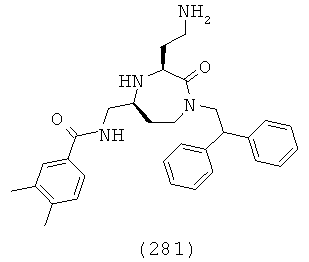
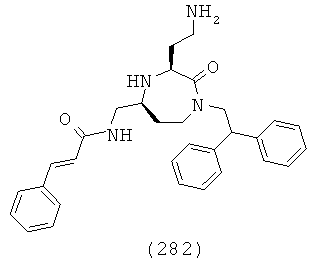
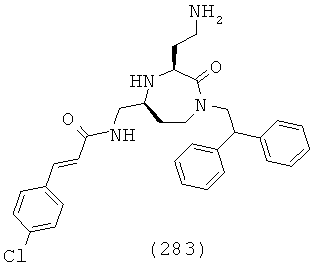
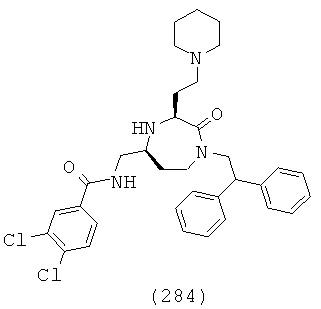
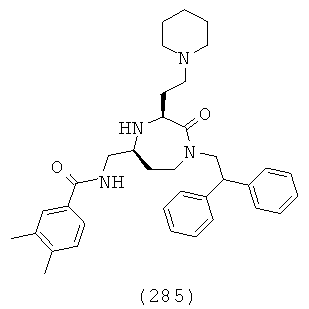
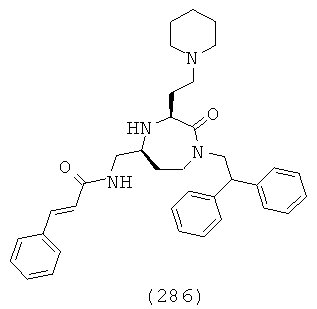
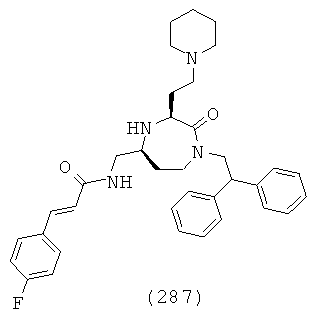
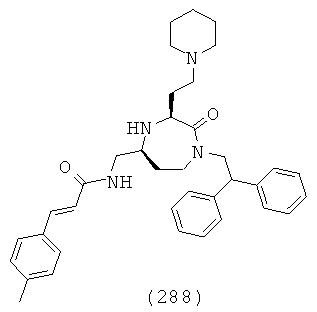
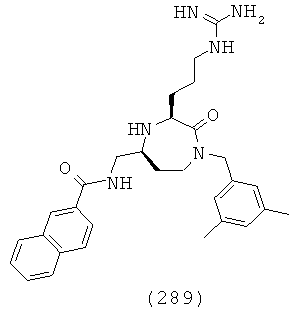
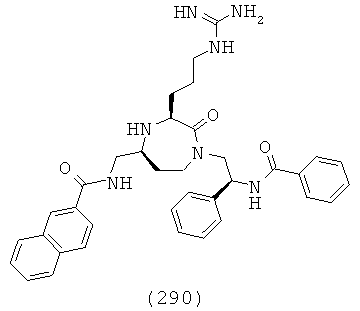
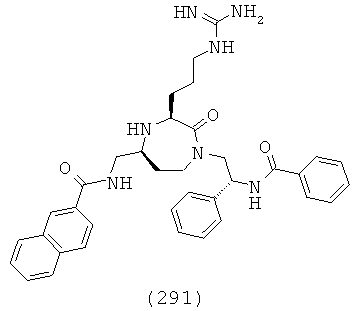
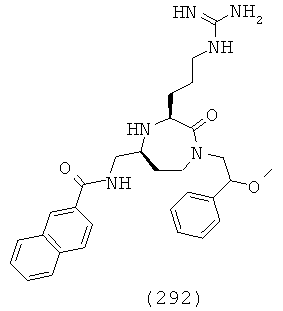
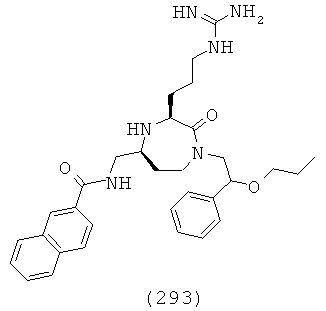
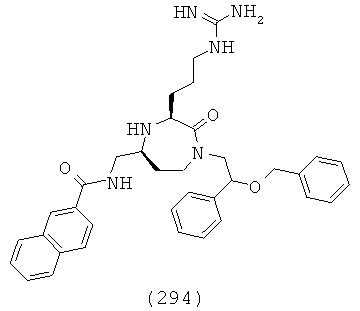
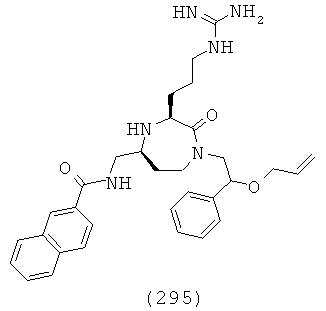
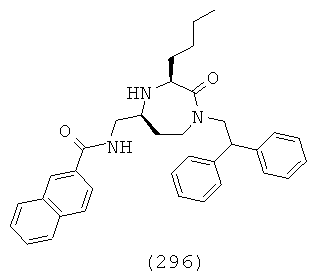
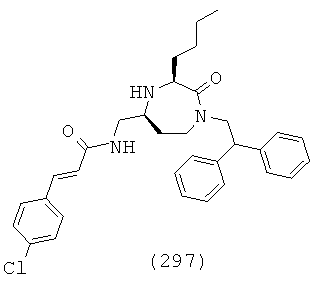
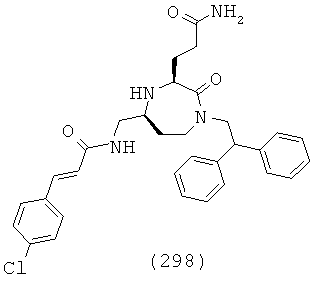
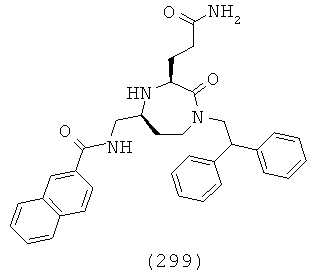
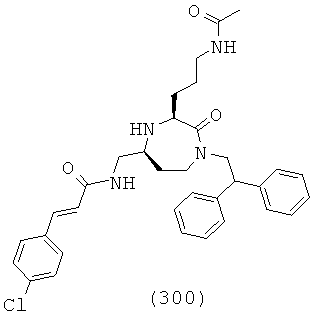
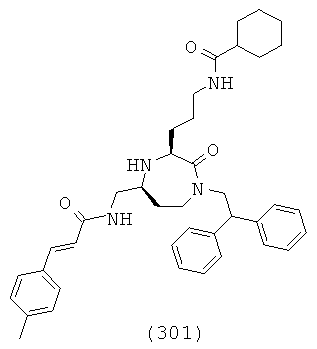
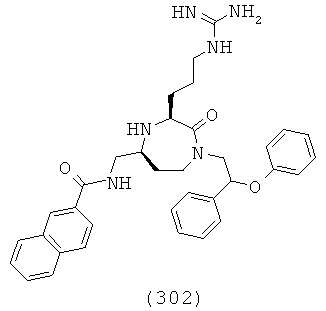
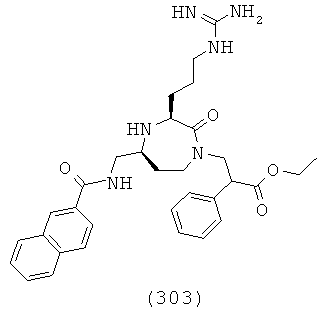
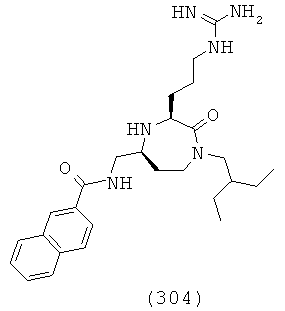
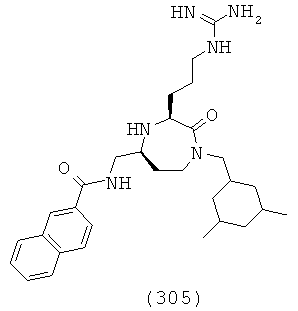
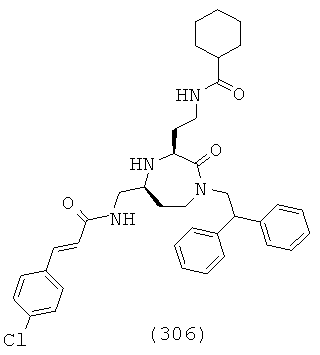
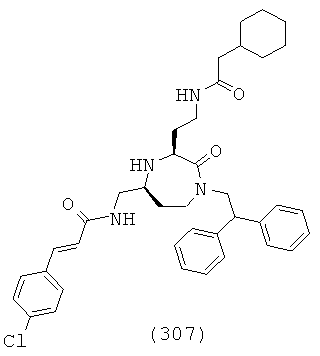
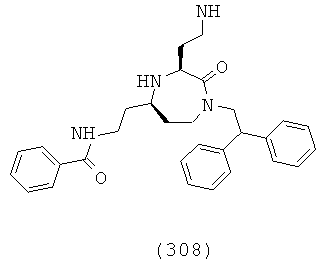
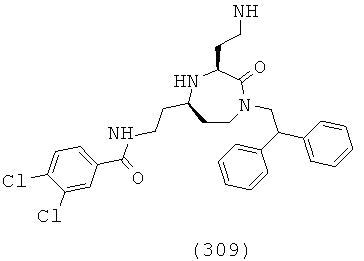
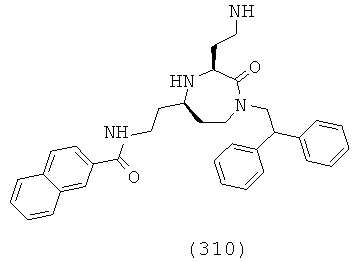
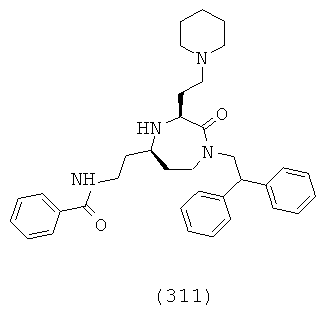
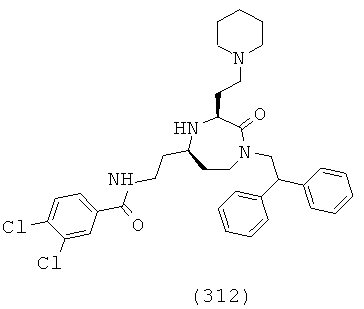
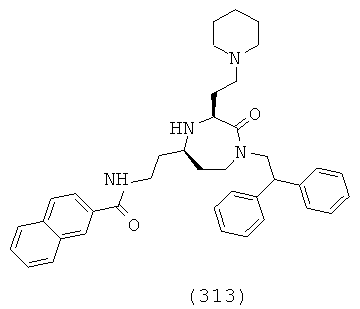
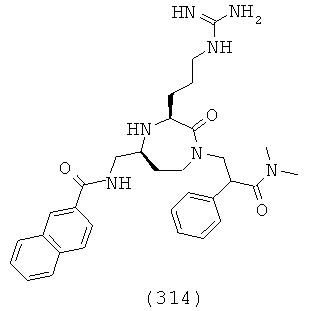
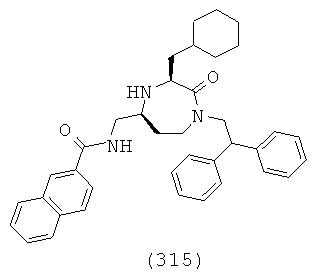
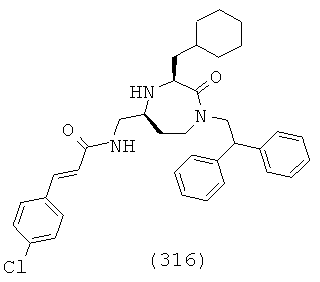
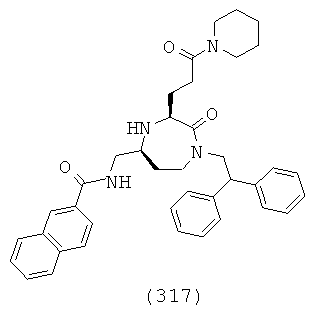
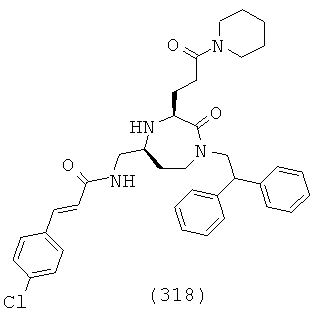
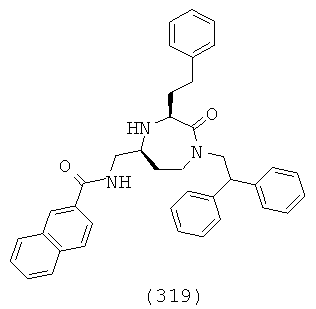
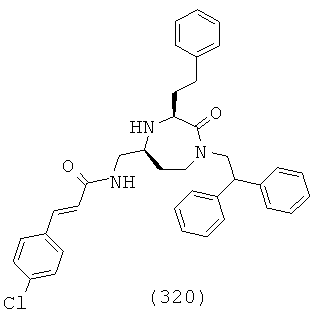
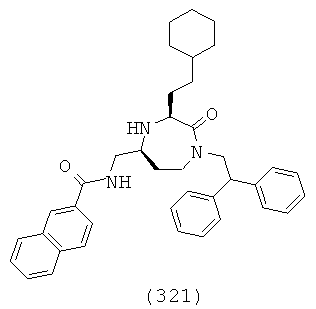
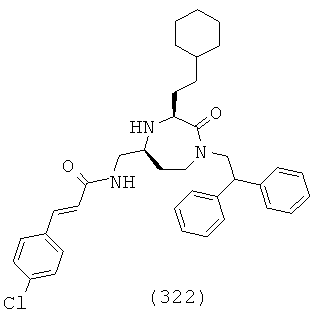
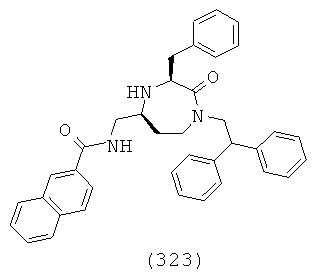
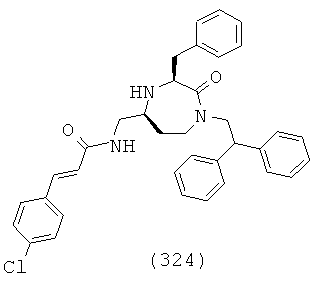
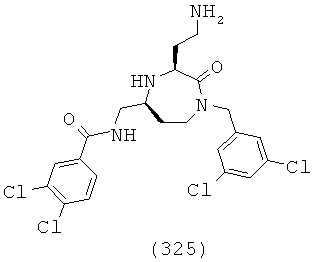
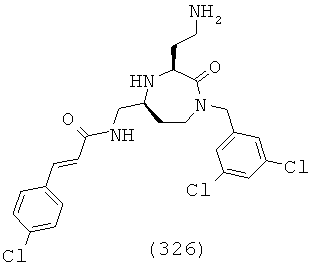
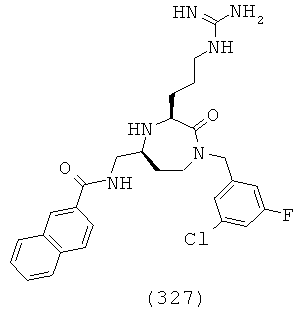
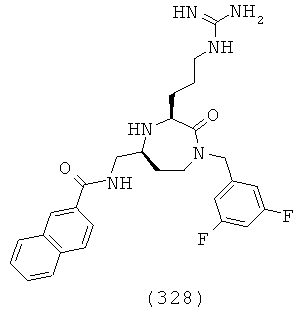
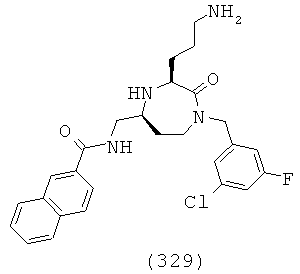
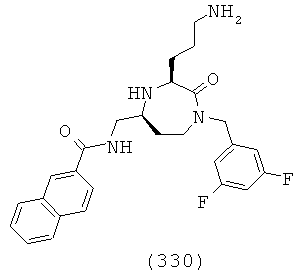
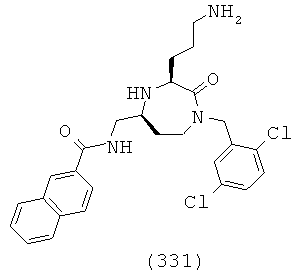
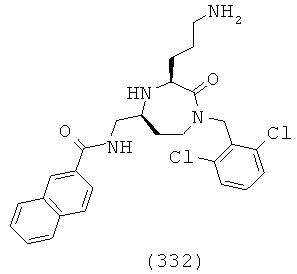
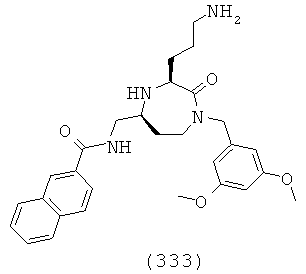
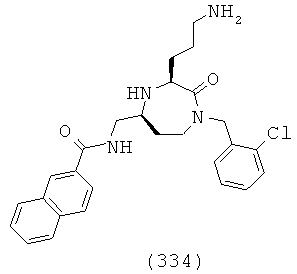
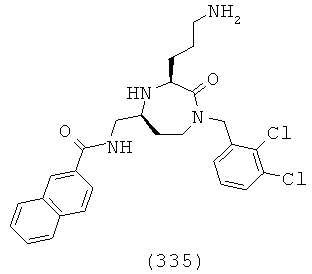
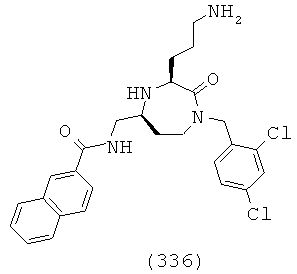
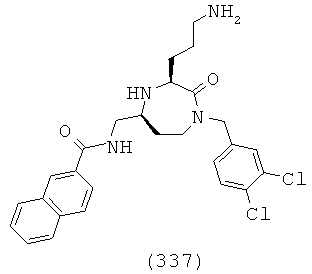
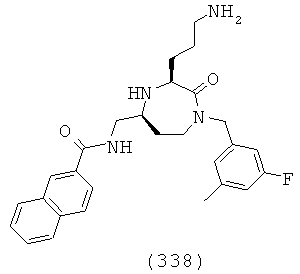
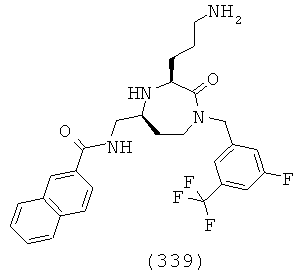
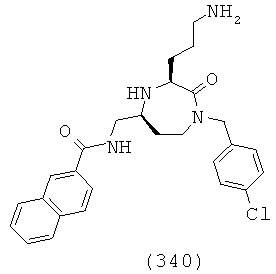
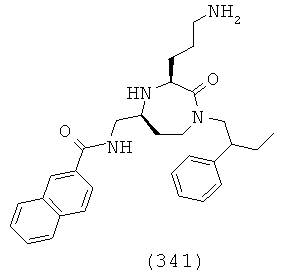
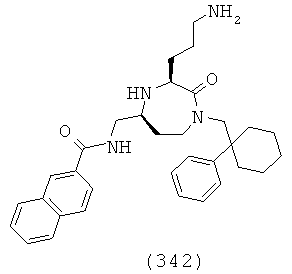
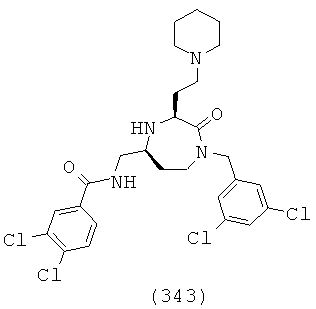
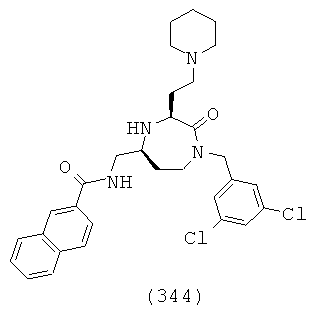
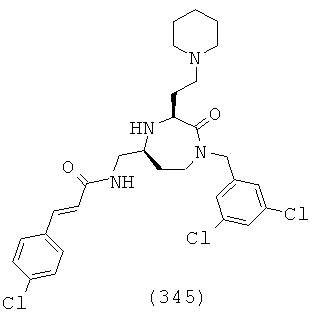
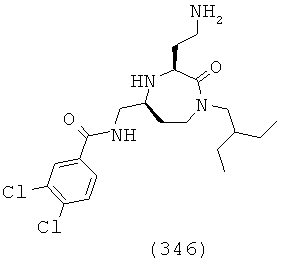
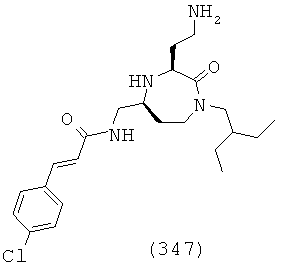
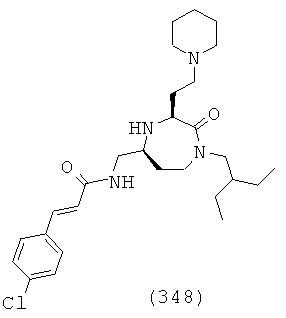
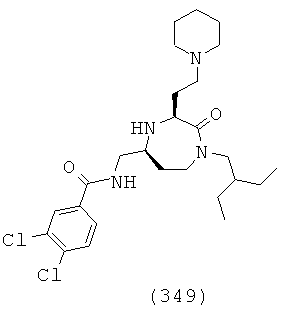
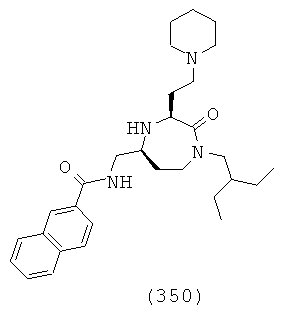
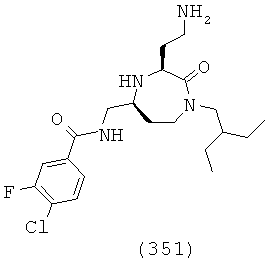
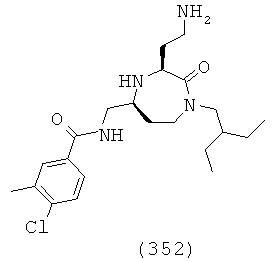
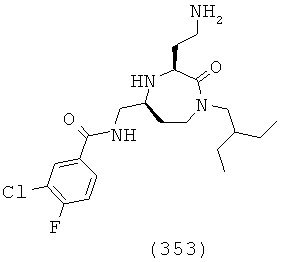
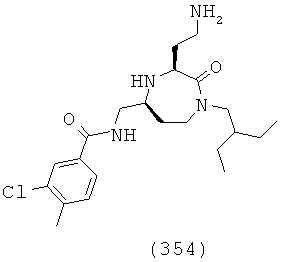
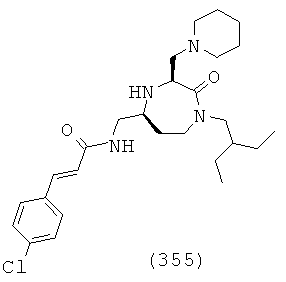
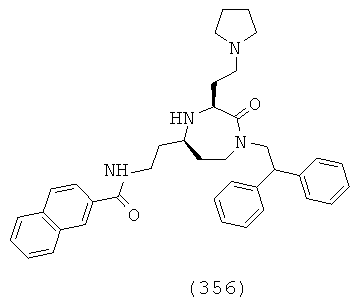
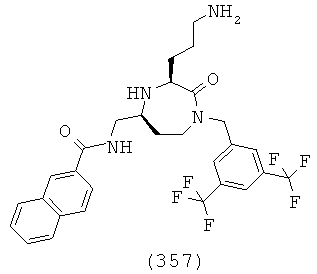
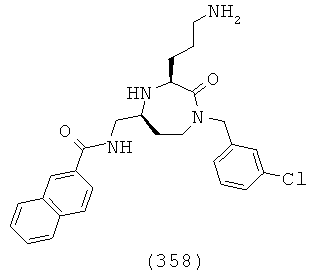
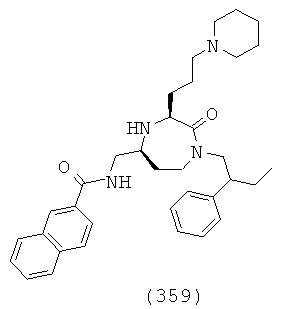
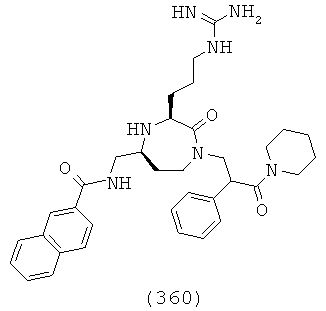
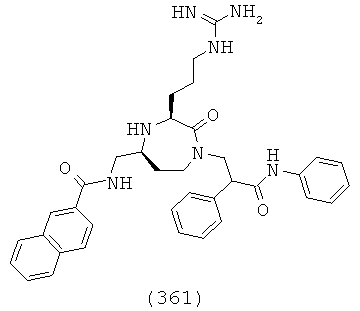
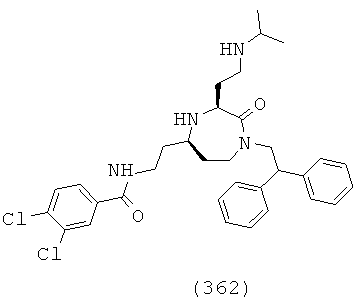
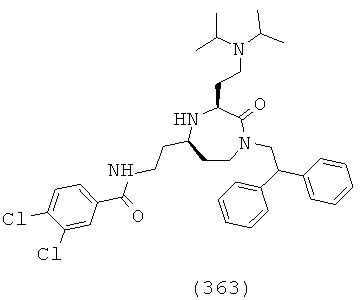
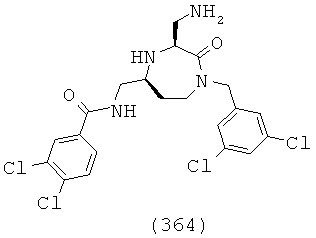
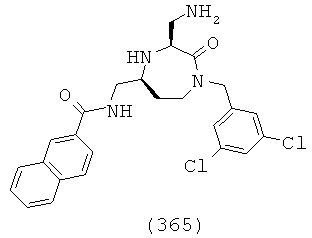
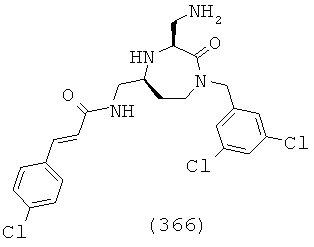
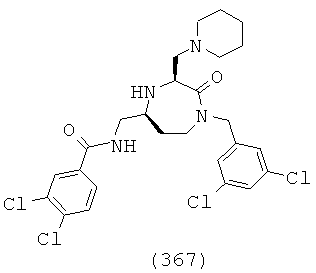
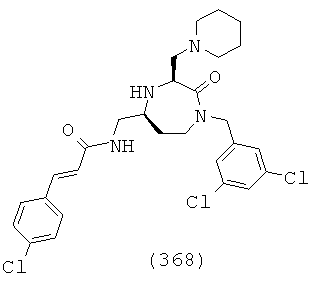
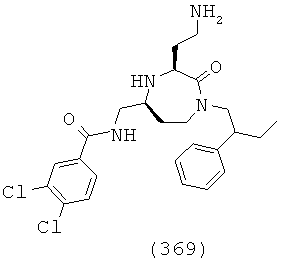
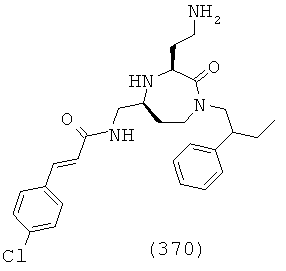
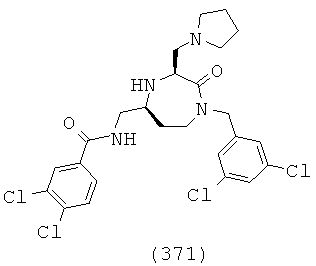
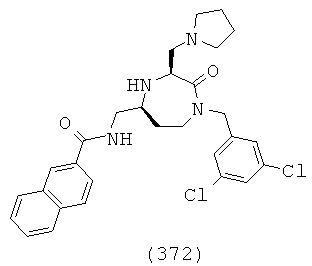
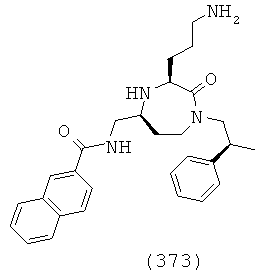
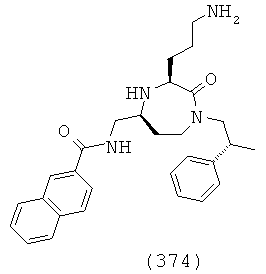
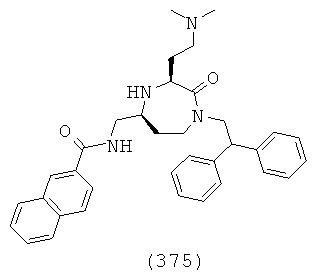
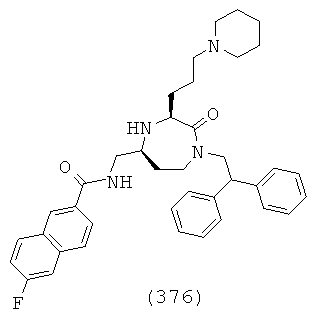
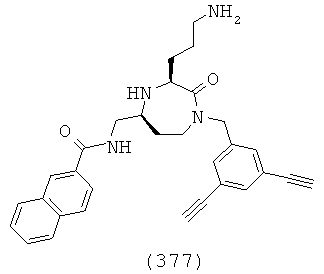
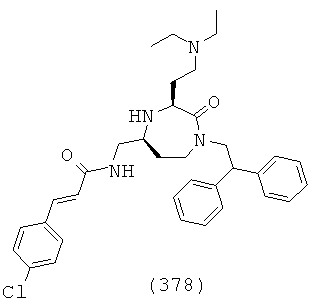
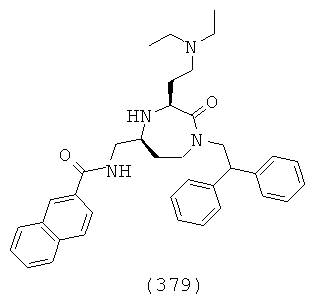
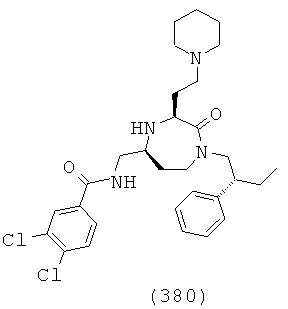
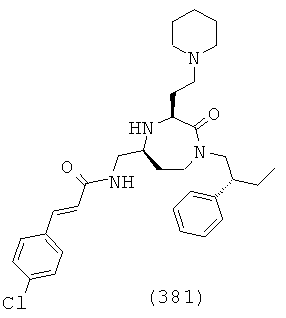
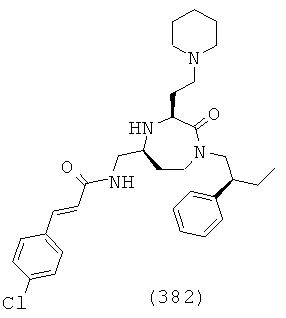
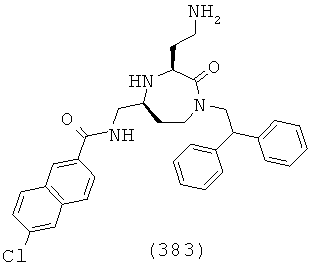
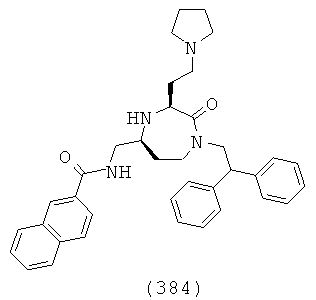
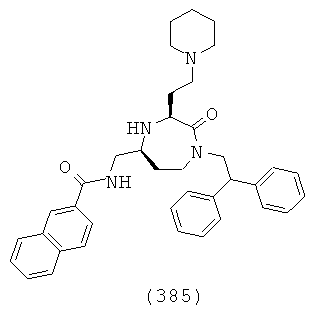
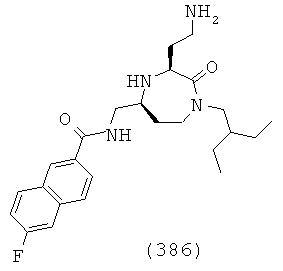
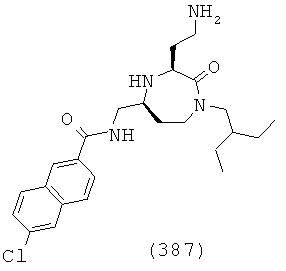
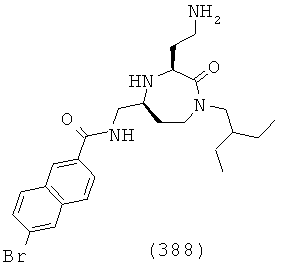
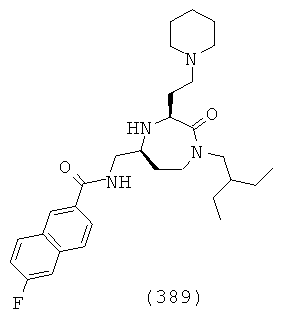
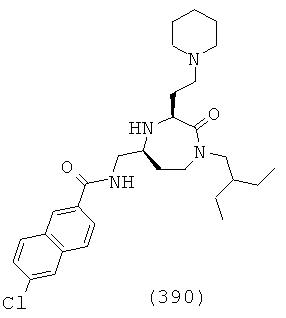
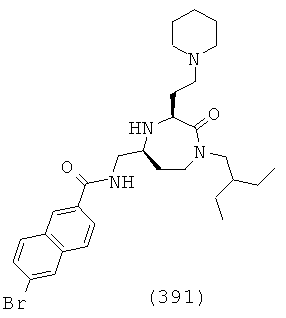
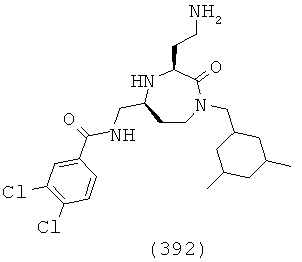
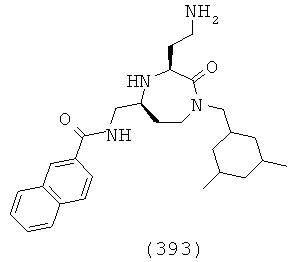
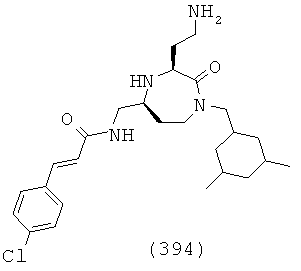
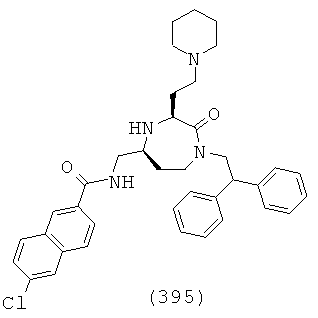
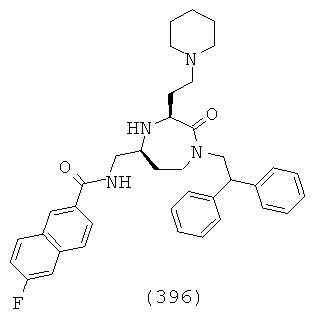
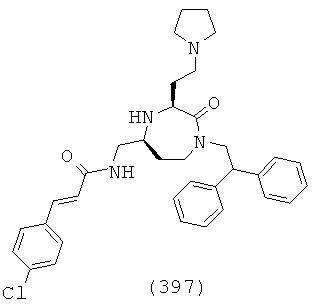
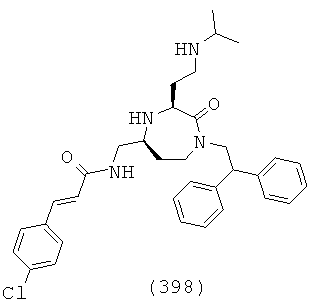
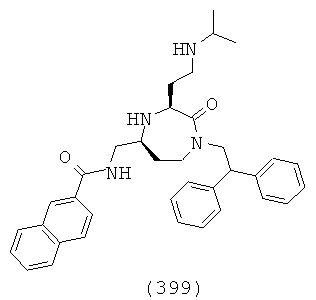
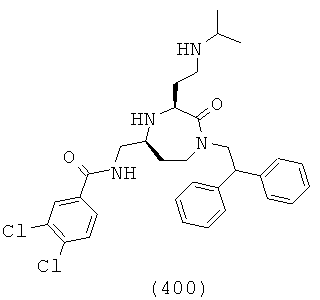
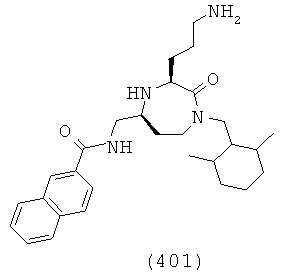
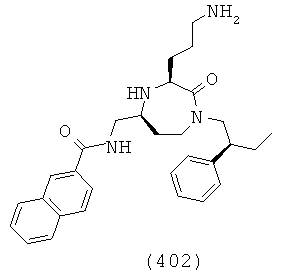
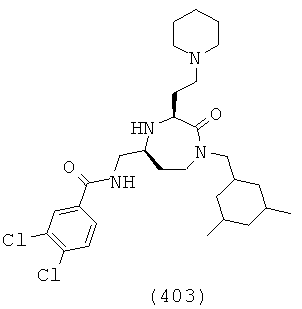
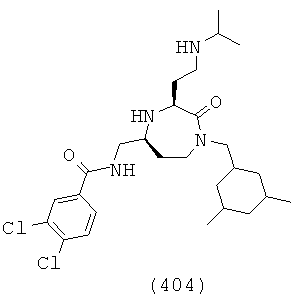
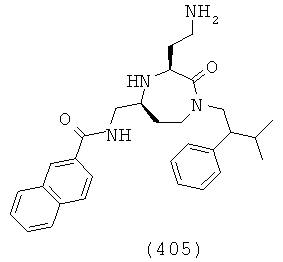
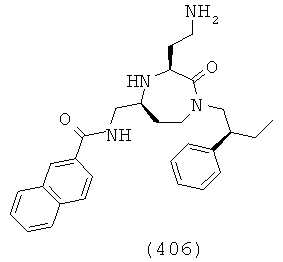
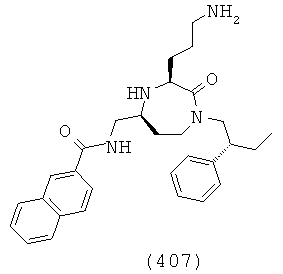
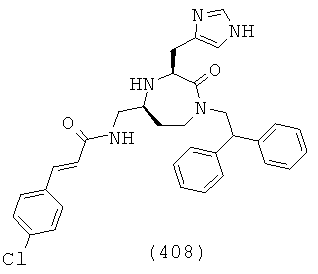
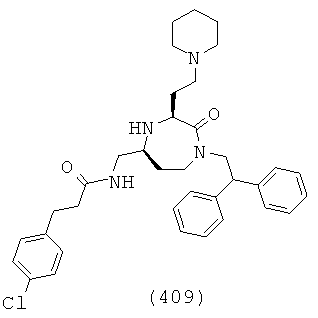
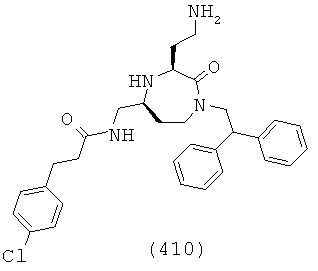
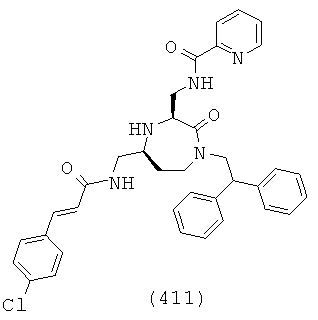
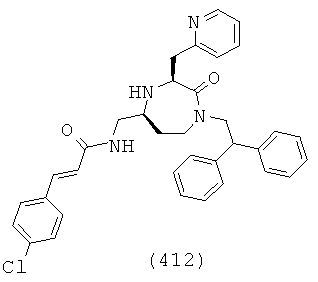
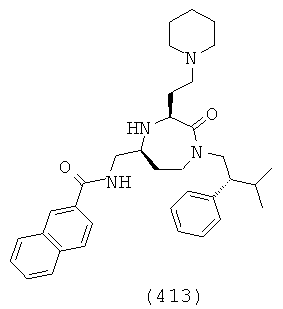
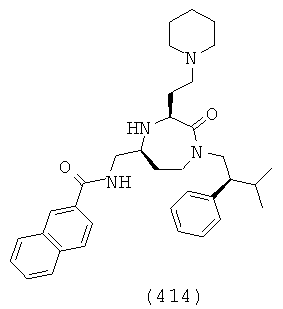
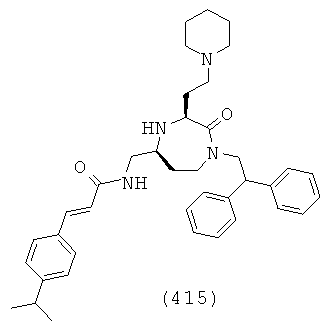
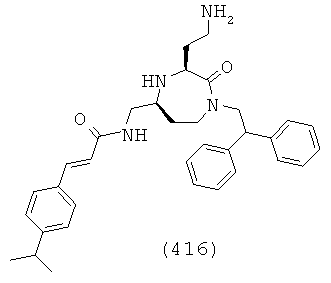
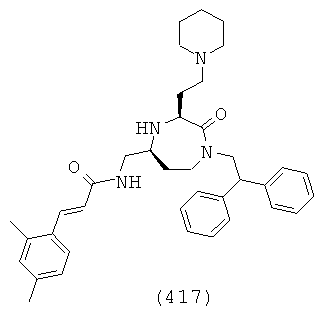
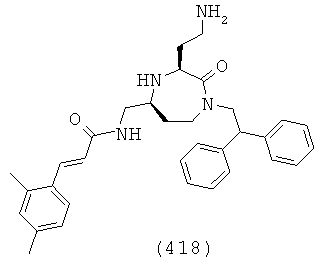
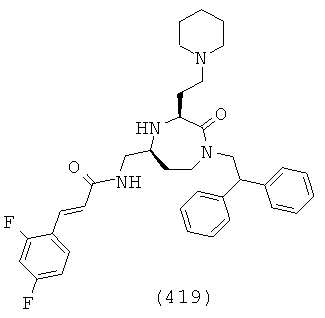
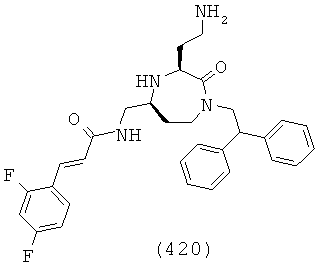
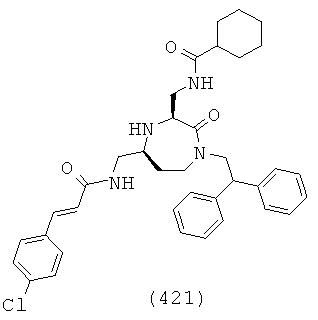
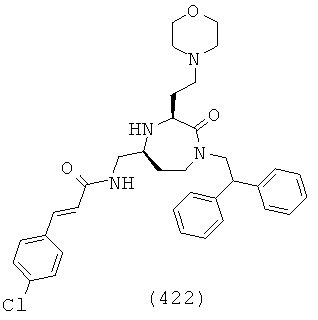
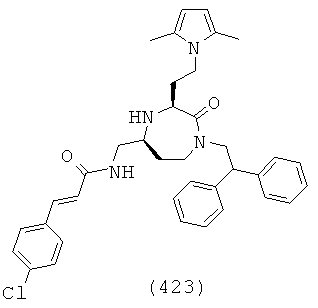
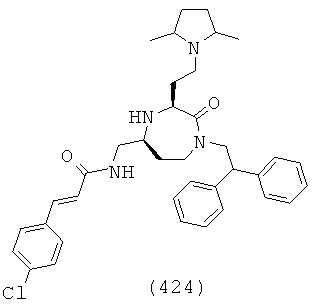
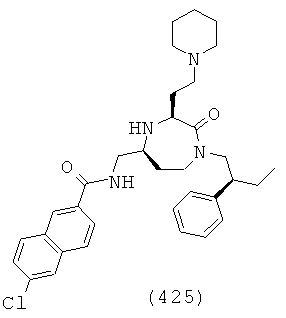
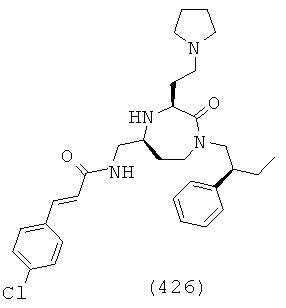
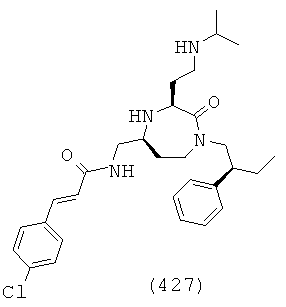
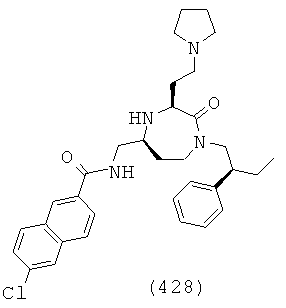
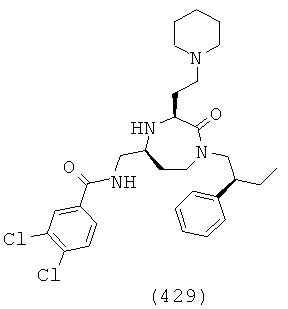
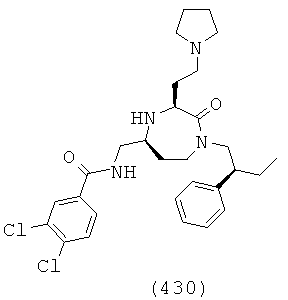
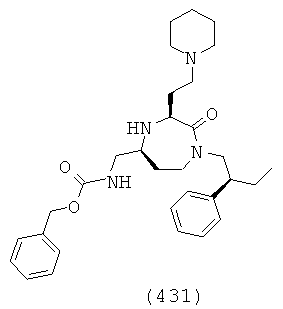
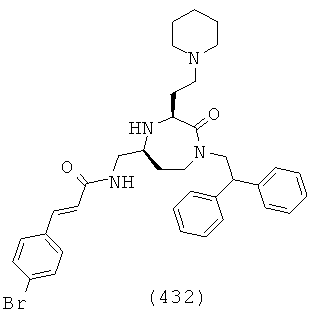
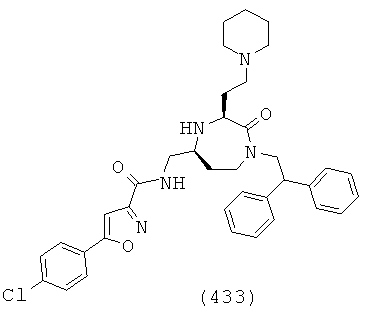
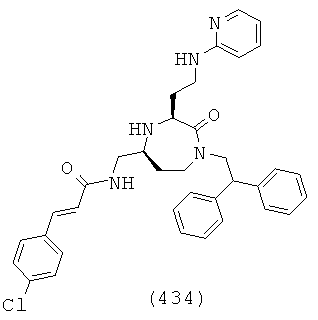
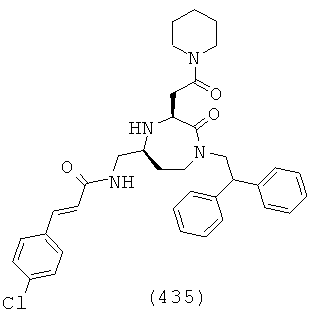
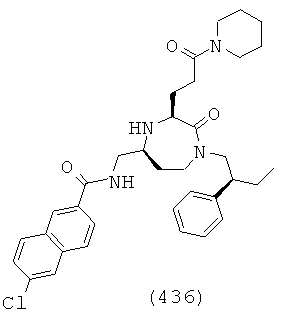
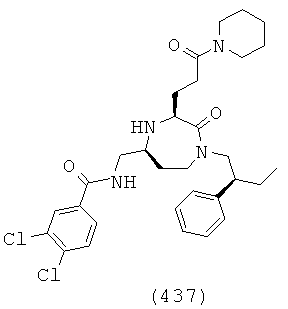
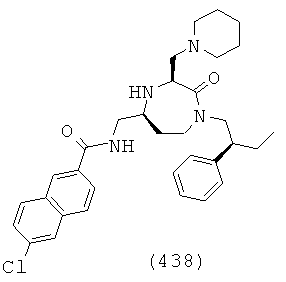
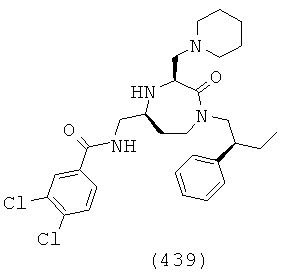
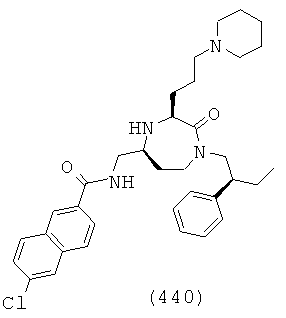
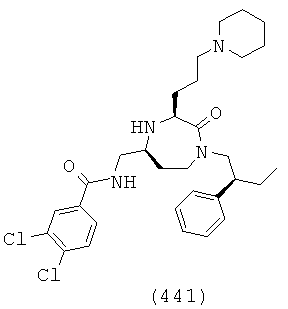
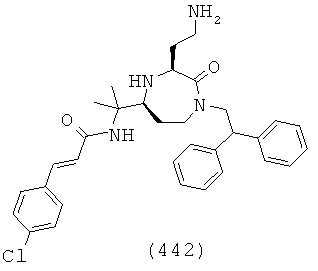
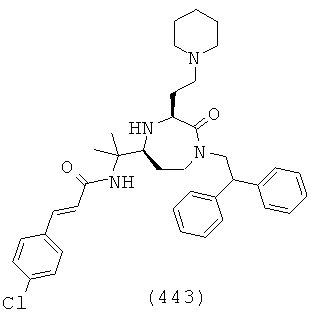
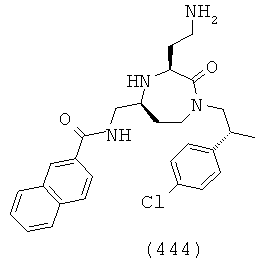
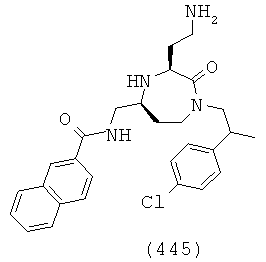
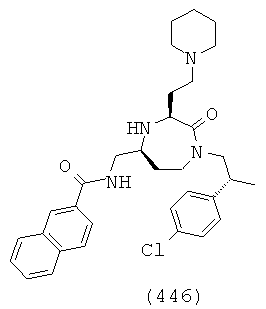
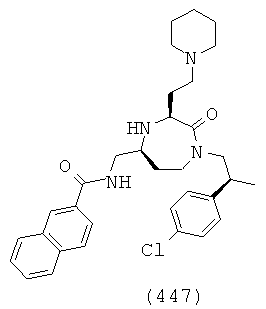
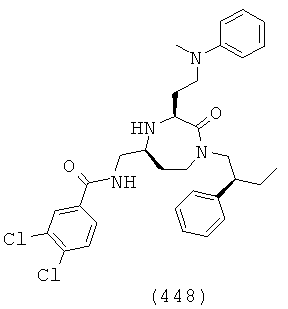
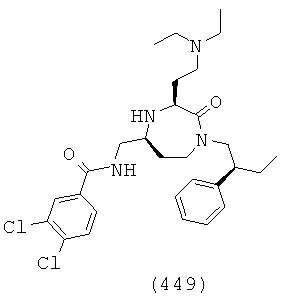
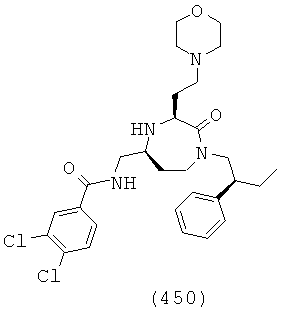
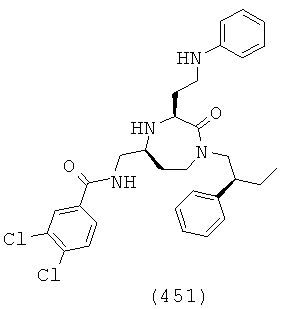
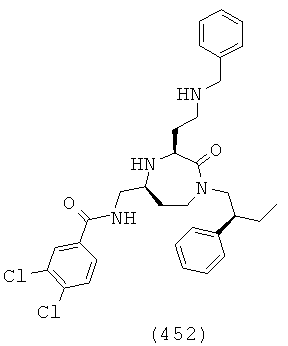
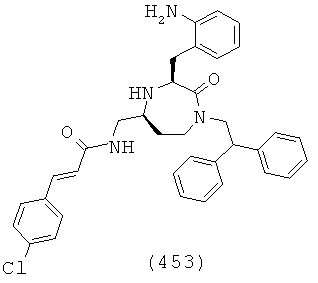
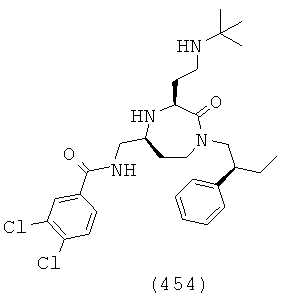
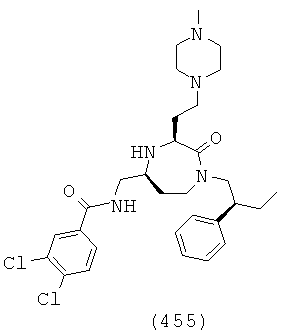
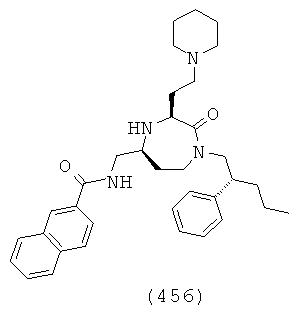
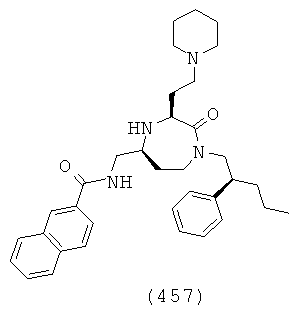
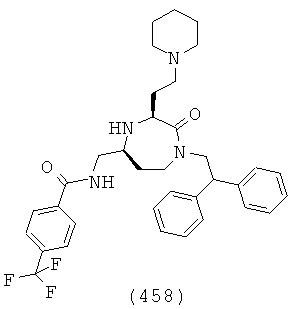
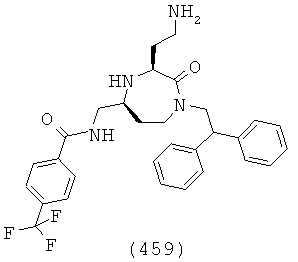
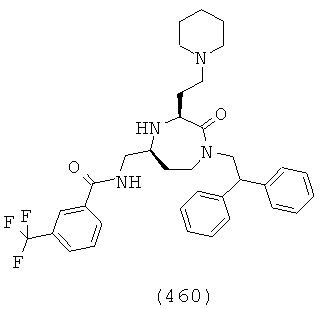
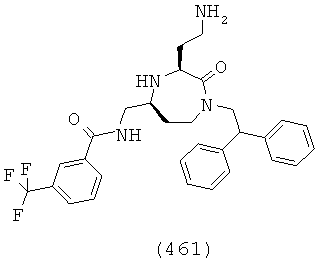
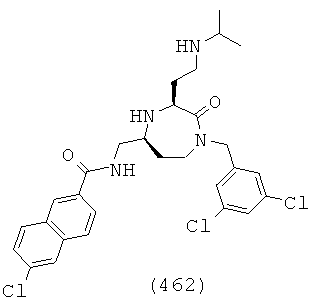
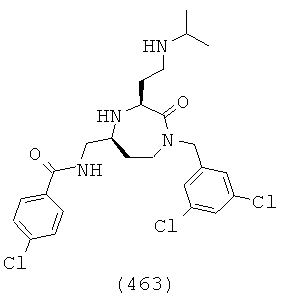
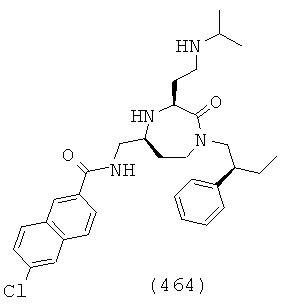
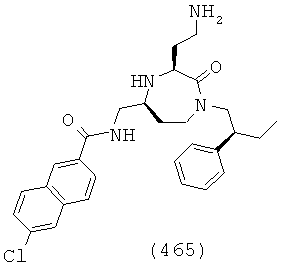
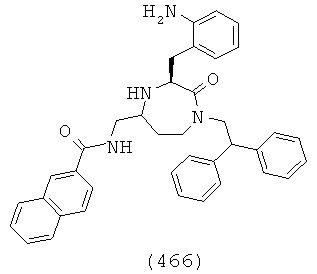
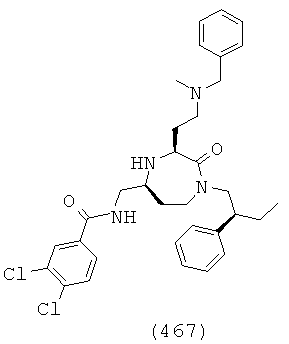
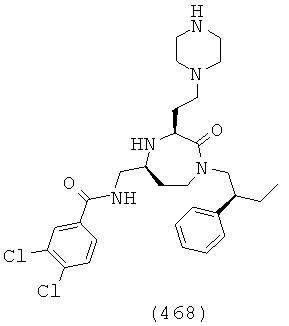
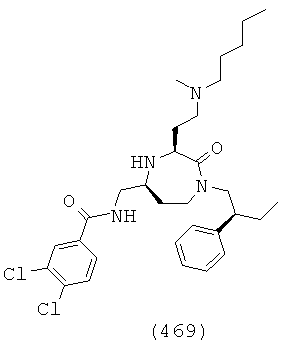
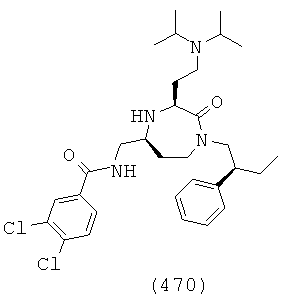
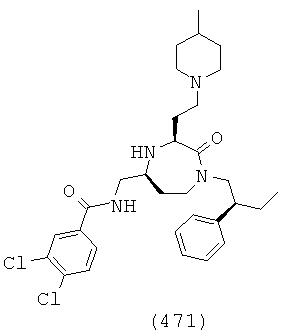
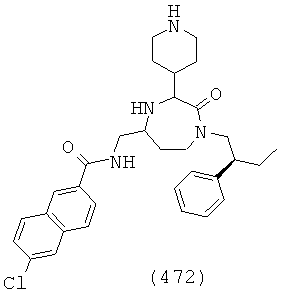
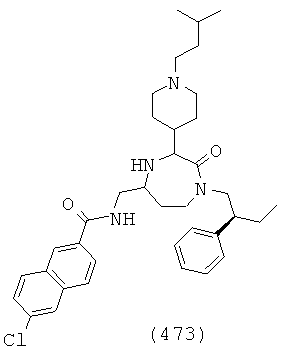
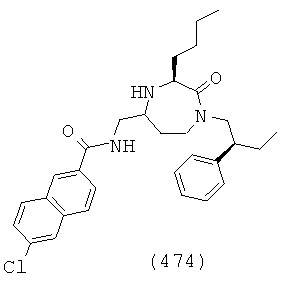
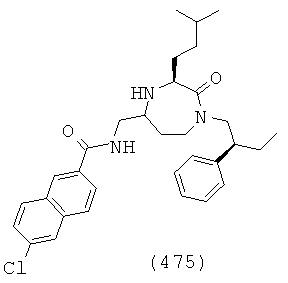
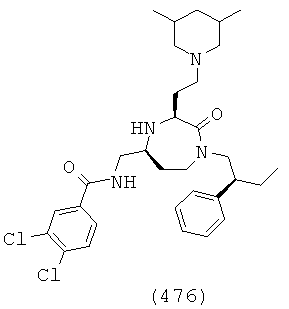
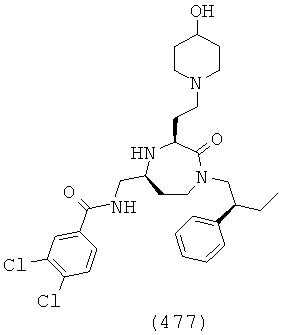
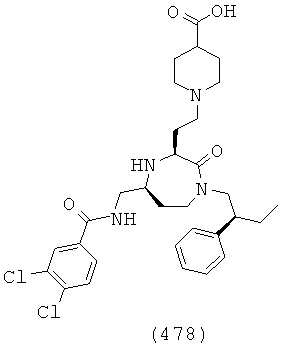
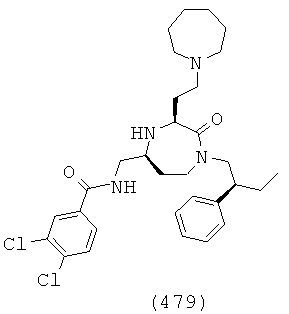
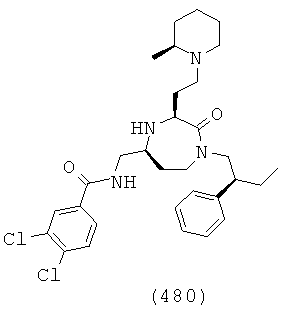
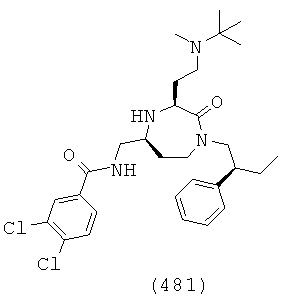
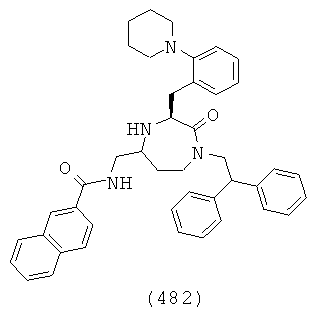
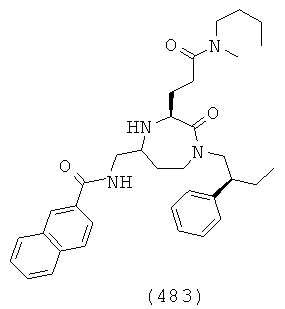
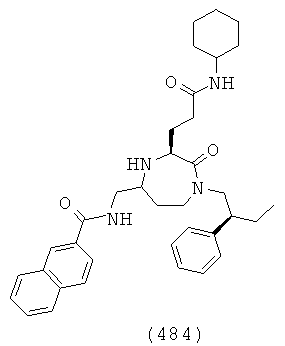
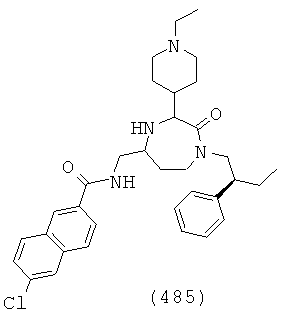
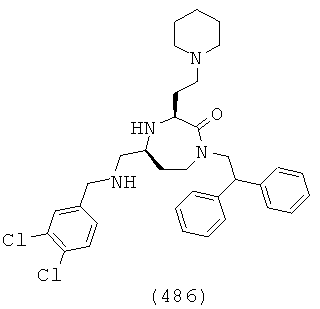
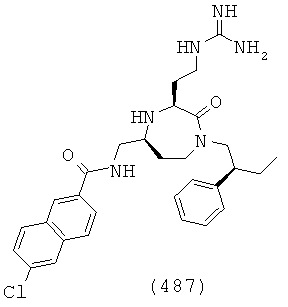
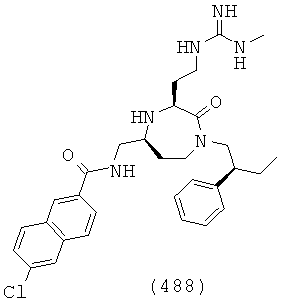
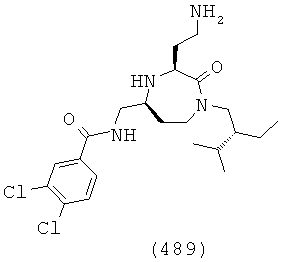
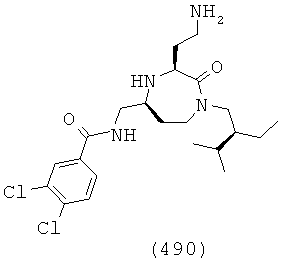
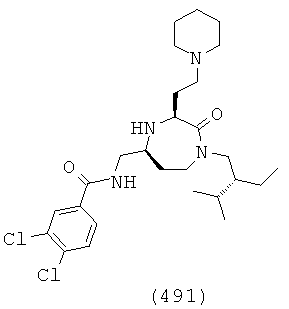
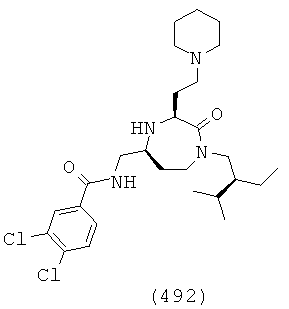
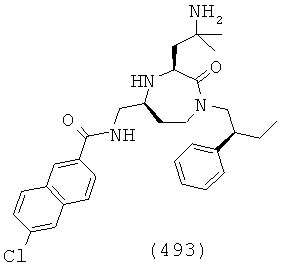
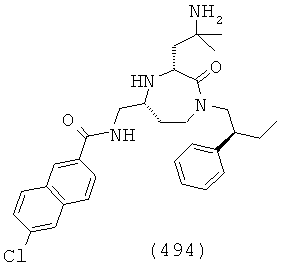
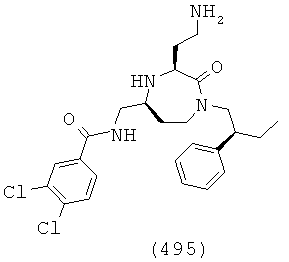
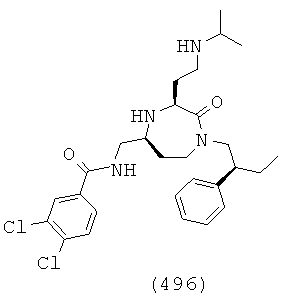
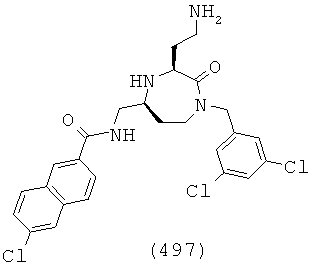
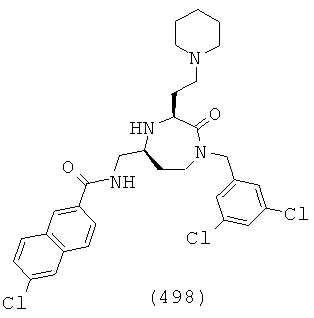
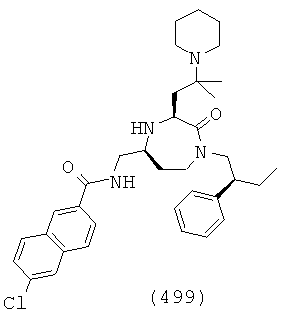
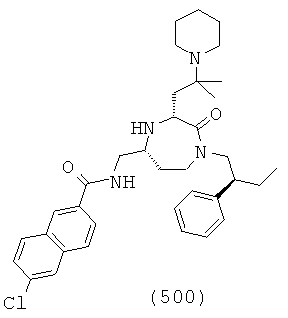
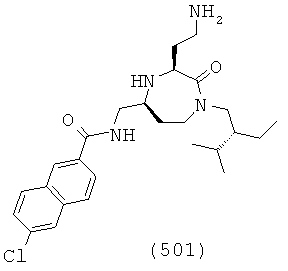
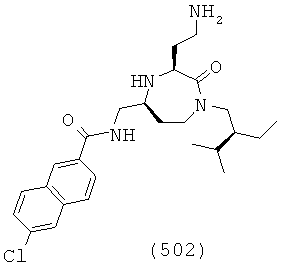
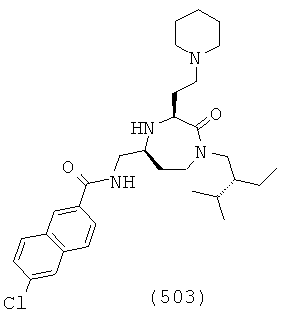
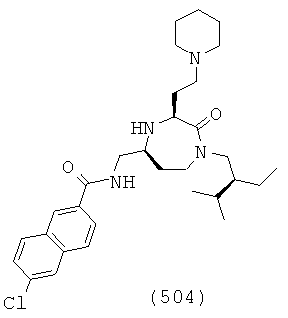
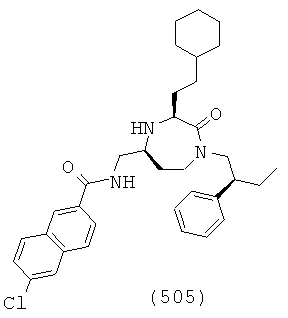
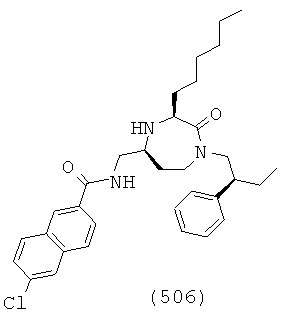
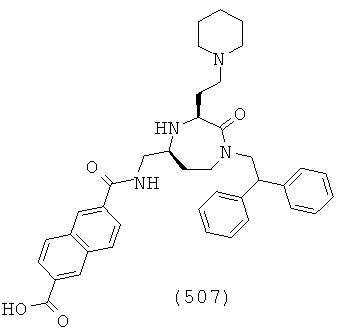
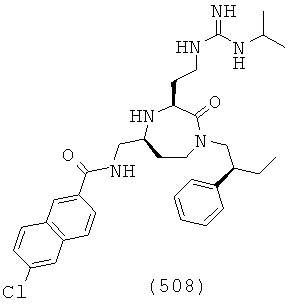
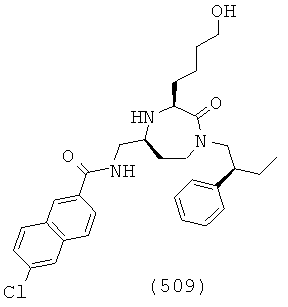
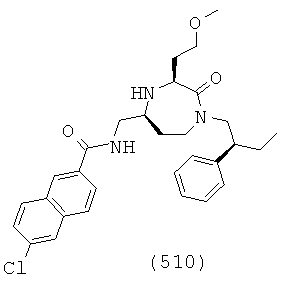
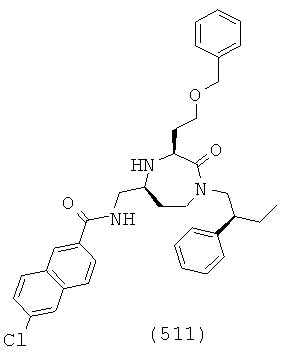
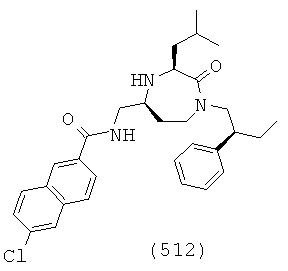
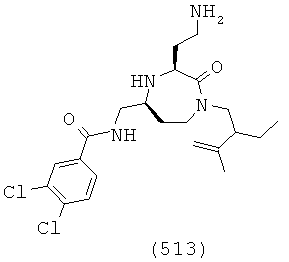
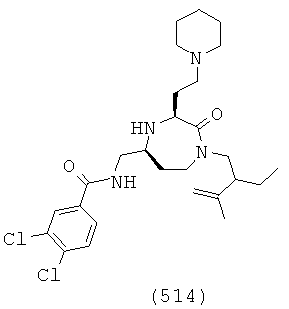
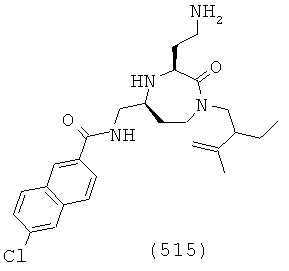
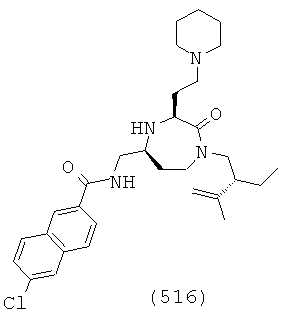
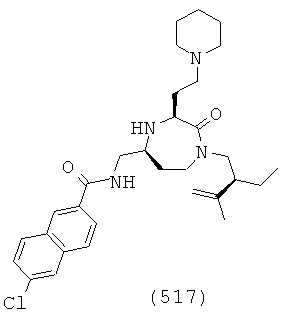
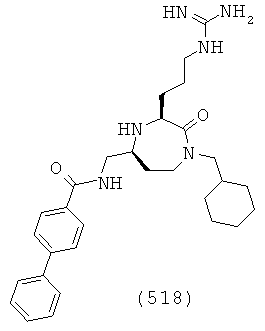
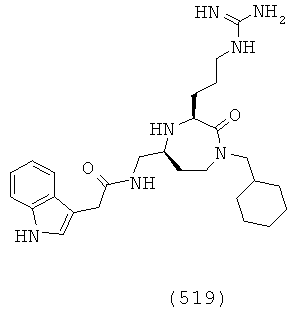
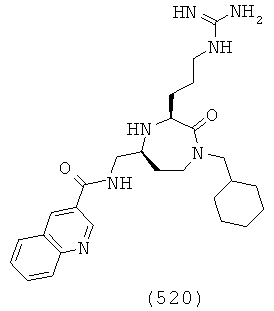
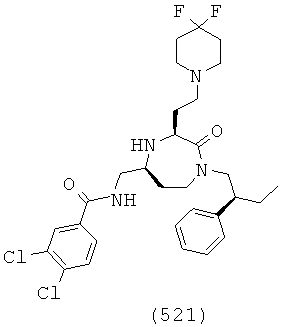
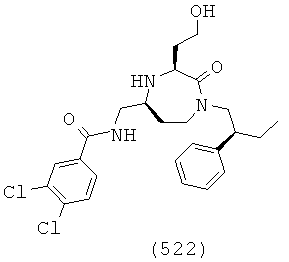
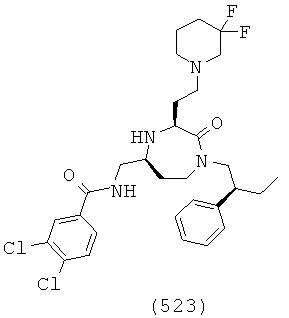
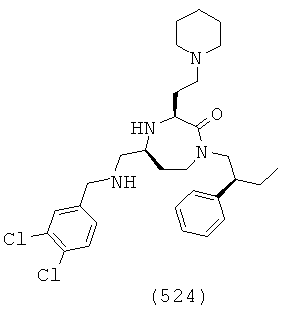
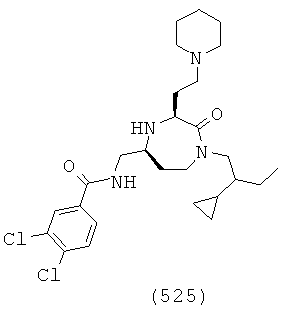
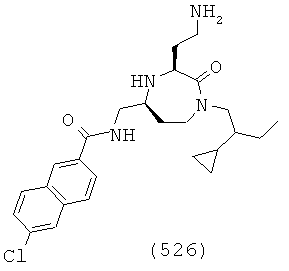
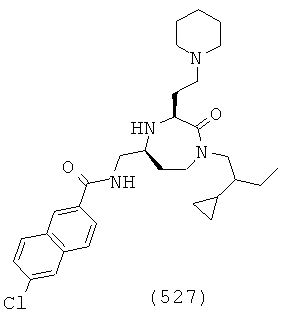
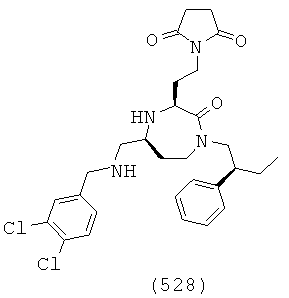
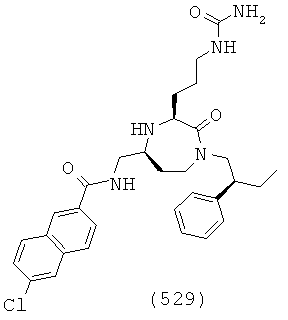
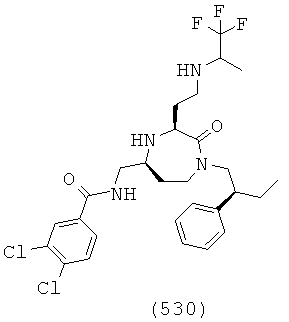
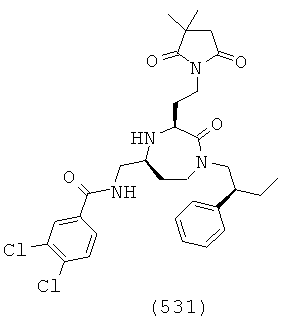
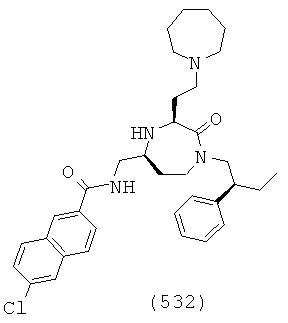
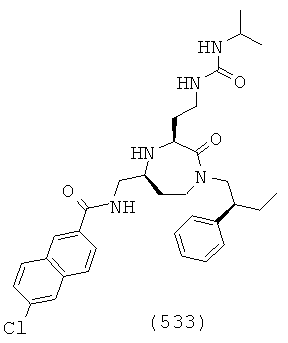
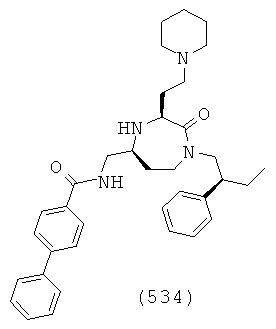
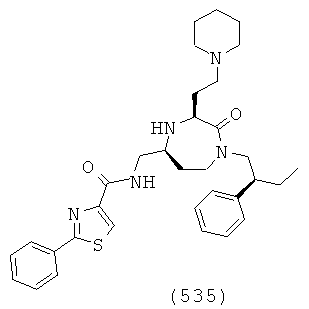
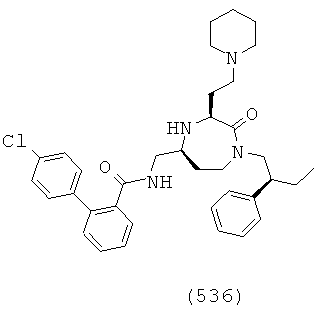
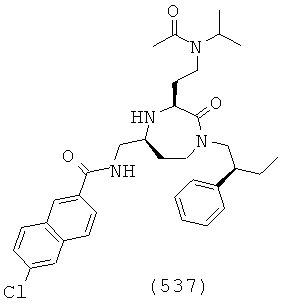
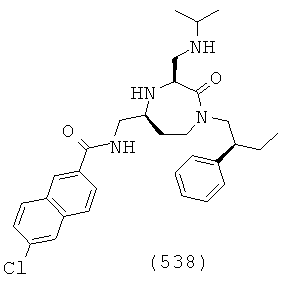
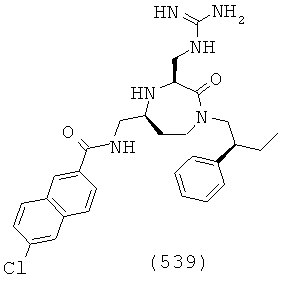
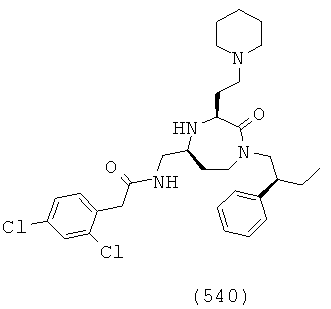
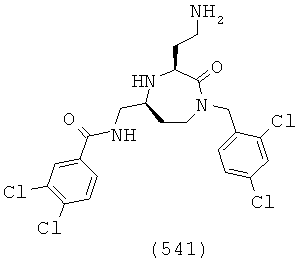
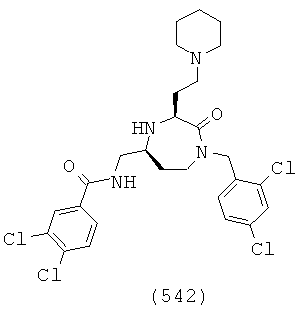
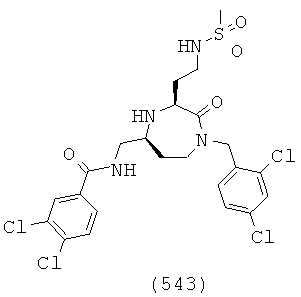
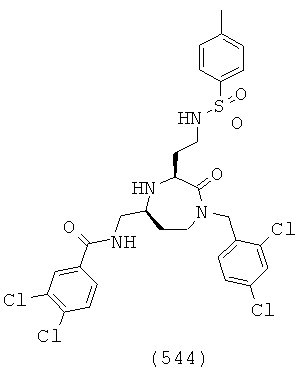
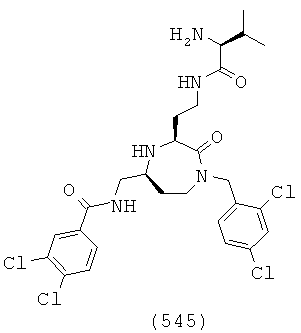
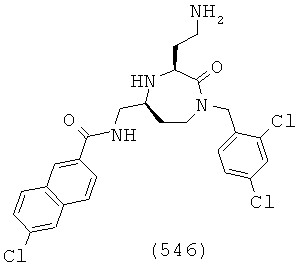
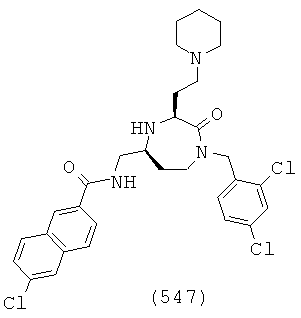
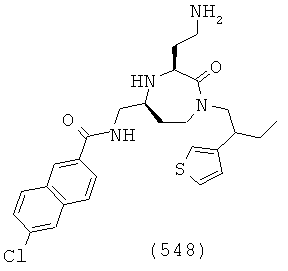
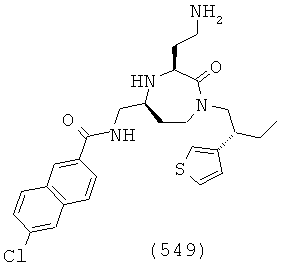
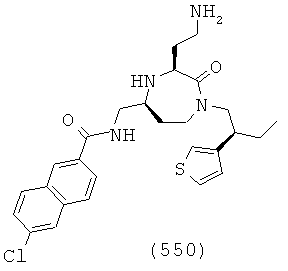
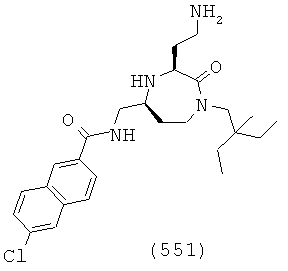
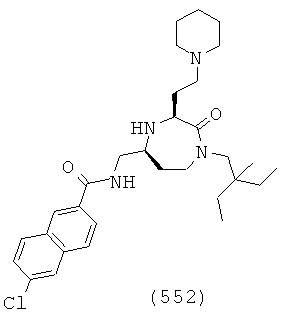
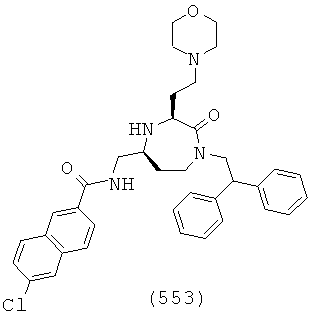
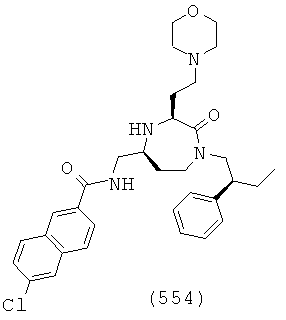
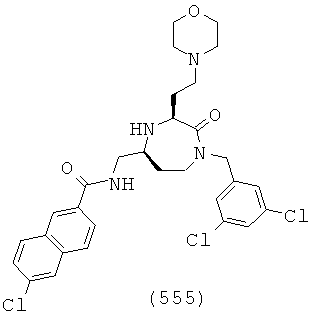
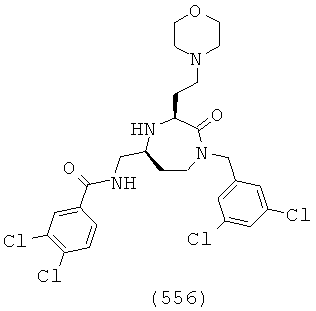
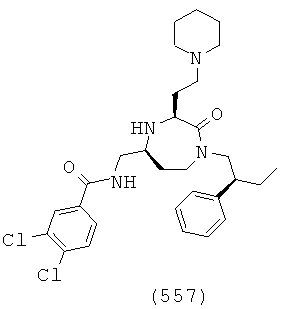
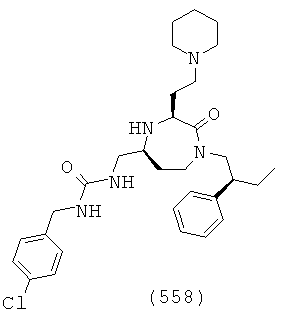
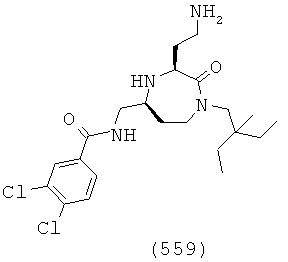
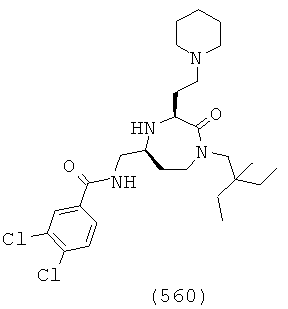
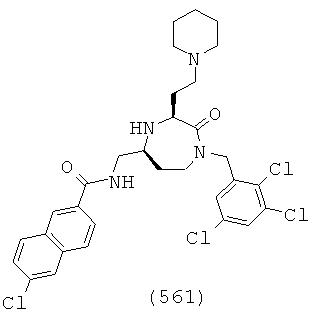
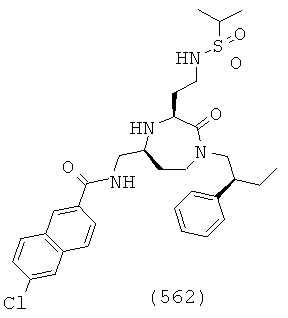
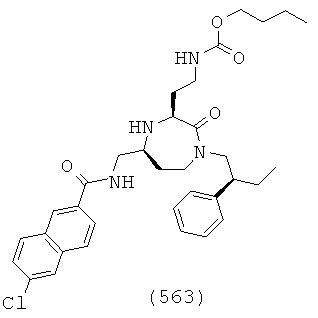
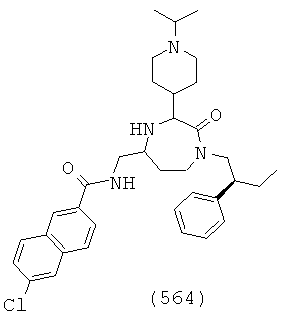
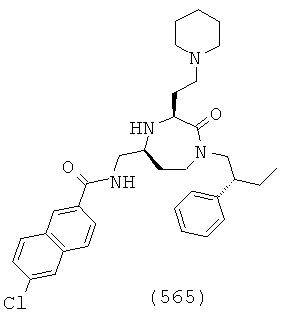
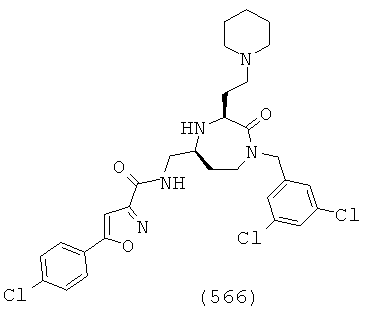
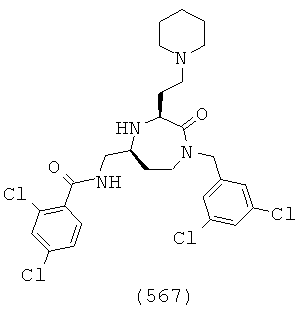
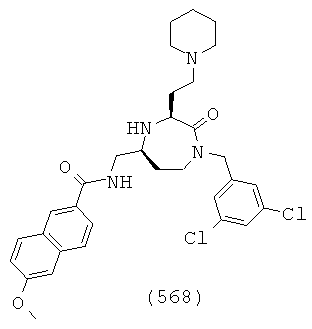
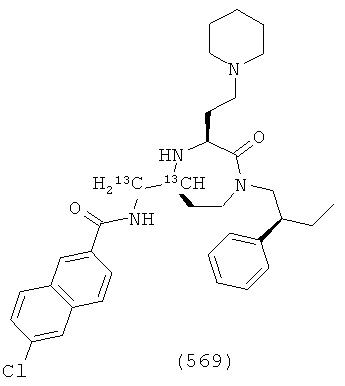
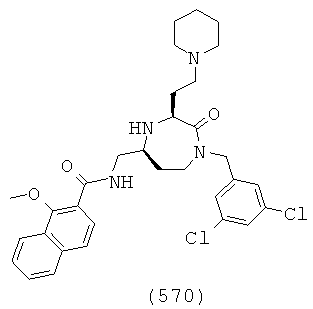
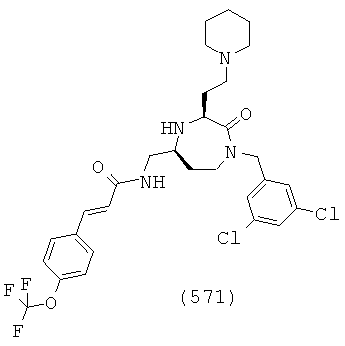
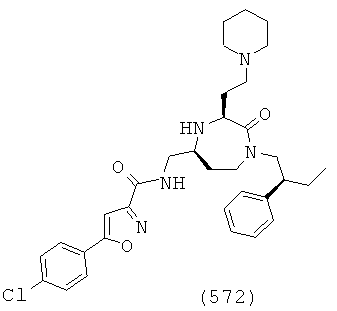
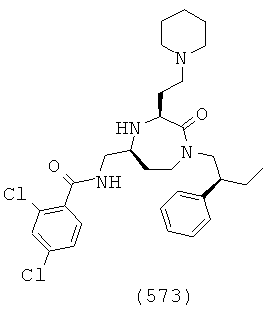
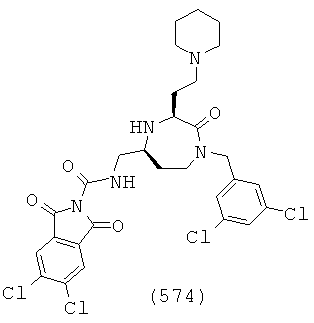
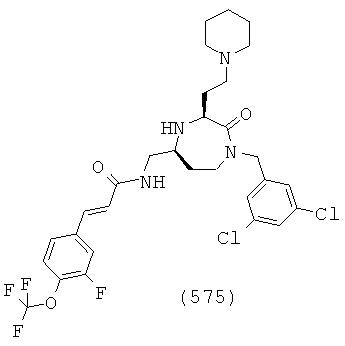
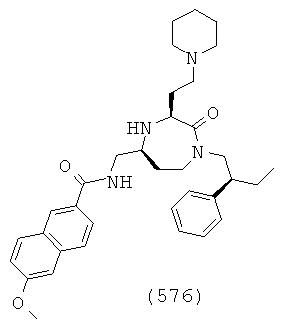
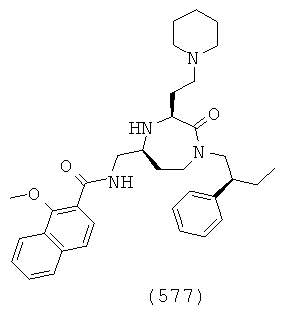
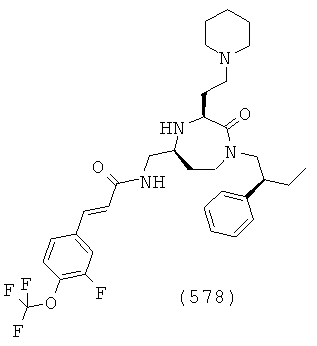
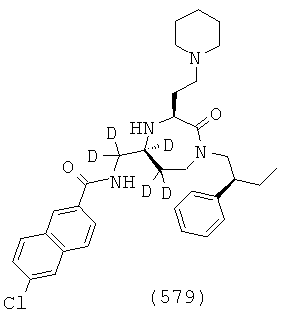
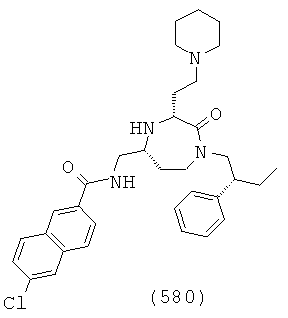
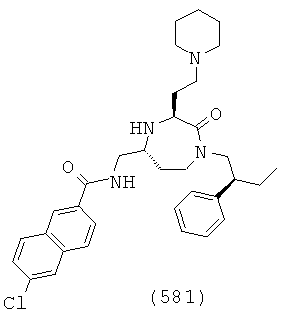
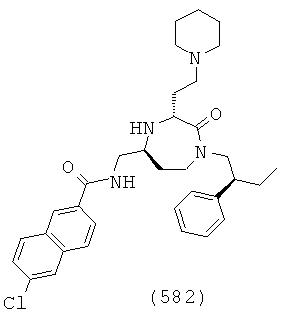
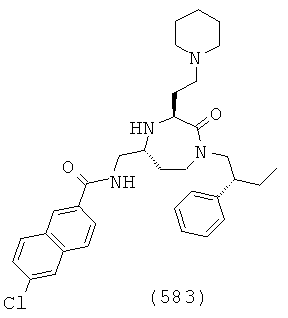
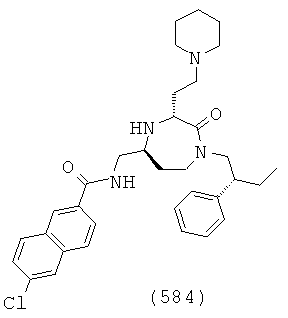
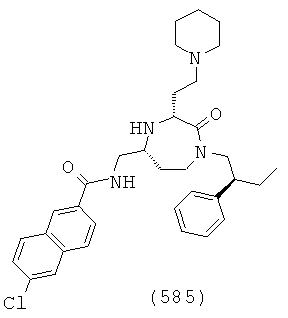
или их фармацевтически приемлемую соль или пролекарство.
С целью помочь читателю, названия соединений, подходящих для применения в 5 данном изобретении, как обсуждалось выше, указаны далее:
(14) N-(((3S,5S)-1-(3,5-дихлорбензил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(25) N-(((3S,5S)-3-(2-(диэтиламино)этил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-6-фтор-2-нафтамид
(31) N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-6-фтор-2-нафтамид
(33) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)акриламид
(37) N-(((3S,5S)-3-(2-аминоэтил)-2-оксо-1-(2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(38) N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(39) N-(((3S,5S)-2-оксо-1-((R)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(49) N-(((33,58)-3-(2-аминоэтил)-1-(3,5-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(50) N-((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)нафталин-2-сульфонамид
(54) N-(((3S,5S)-3-(2-аминоэтил)-1-(2-этилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(60) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-6-бром-N-метил-2-нафтамид
(62) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-4-метил-2-оксо-1,4-диазепан-5-ил)метил)-6-бром-2-нафтамид
(63) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(64) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(65) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-(изопропиламино)пропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(67) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-(3-метилгуанидино)пропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(71) (Е)-N-(((3S,5S)-3-бутил-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(79) N-((S)-1-((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)-2-(нафталин-2-ил)этил)ацетамид
(81) (S)-2-ацетамидо-N-((S)-1-((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)-2-(нафталин-2-ил)этил)-3-(1Н-имидазол-5-ил)пропанамид
(83) пропил (S)-1-((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)-2-(нафталин-2-ил)этилкарбамат
(85) N-((R)-1-((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)-2-(нафталин-2-ил)этил)ацетамид
(86) (S)-2-ацетамидо-N-((R)-1-((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)-2-(нафталин-2-ил)этил)-3-(1Н-имидазол-4-ил)пропанамид
(87) пропил (R)-1-((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)-2-(нафталин-2-ил)этилкарбамат
(102) N-(((3R,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(103) N-(((3R,5R)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(104) N-(((3S,5R)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(105) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(106) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)бифенил-4-карбоксамид
(107) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-1Н-индол-2-карбоксамид
(108) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бифенил-4-карбоксамид
(109) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-1Н-индол-2-карбоксамид
(110) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-(нафталин-2-ил)ацетамид
(111) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-1,2,3,4-тетрагидронафталин-2-карбоксамид
(112) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)хинолин-3-карбоксамид
(113) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)хиноксалин-2-карбоксамид
(114) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)изохинолин-3-карбоксамид
(115) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бензамид
(116) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)хинолин-2-карбоксамид
(117) N-(((3S,5S)-3-(4-аминобутил)-1-(нафталин-1-илметил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(118) N-(((3S,5S)-3-(4-аминобутил)-1-(нафталин-1-илметил)-2-оксо-1,4-диазепан-5-ил)метил)-2-(нафталин-2-ил)ацетамид
(119) N-(((3S,5S)-3-(4-аминобутил)-1-(нафталин-1-илметил)-2-оксо-1,4-диазепан-5-ил)метил)-1-нафтамид
(120) N-(((3S,5S)-3-(4-аминобутил)-1-(нафталин-1-илметил)-2-оксо-1,4-диазепан-5-ил)метил)-2-(1Н-индол-3-ил)ацетамид
(121) N-(((3S,5S)-3-(4-аминобутил)-1-(нафталин-2-илметил)-2-оксо-1,4-диазег1ан-5-ил)метил)-2-(бифенил-4-ил)ацетамид
(122) N-(((3S,5S)-3-(4-аминобутил)-1-(нафталин-2-илметил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(123) N-(((3S,5S)-3-(4-аминобутил)-1-(нафталин-2-илметил)-2-оксо-1,4-диазепан-5-ил)метил)-2-(нафталин-2-ил)ацетамид
(124) N-(((3S,5S)-3-(4-аминобутил)-1-(нафталин-2-илметил)-2-оксо-1,4-диазепан-5-ил)метил)-1-нафтамид
(125) N-(((3S,5S)-3-(4-аминобутил)-1-(нафталин-2-илметил)-2-оксо-1,4-диазепан-5-ил)метил)-2-(нафталин-1-ил)ацетамид
(126) N-(((3S,5S)-3-(4-аминобутил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(127) (S)-N-(((3S,5S)-3-(4-аминобутил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-1,2,3,4-тетрагидроизохинолин-3-карбоксамид
(128) (R)-N-(((3S,5S)-3-(4-аминобутил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-1,2,3,4-тетрагидроизохинолин-3-карбоксамид
(129) N-(((3S,5S)-3-(4-аминобутил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)бензофуран-2-карбоксамид
(130) (R)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-(3-метилгуанидино)пропил)-2-оксо-1,4-диазепан-5-ил)метил)-1,2,3,4-тетрагидроизохинолин-3-карбоксамид
(131) (S)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-1,2,3,4-тетрагидроизохинолин-3-карбоксамид
(132) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бензофуран-2-карбоксамид
(133) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2,3-дигидро-1Н-инден-2-карбоксамид
(134) (R)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3 ч7анидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-1,2,3,4-тетрагидроизохинолин-3-карбоксамид
(135) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бензо[b]тиофен-2-карбоксамид
(136) 2,4-дихлор-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бензамид
(137) 2,5-дихлор-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бензамид
(138) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бензамид
(139) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)циклогексанкарбоксамид
(140) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-феноксибензамид
(141) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-4-феноксибензамид
(142) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-1Н-индол-2-карбоксамид
(143) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-фенилпропанамид
(144) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-диметилбензамид
(145) 4-трет-бутил-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бензамид
(146) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2,4-диметоксибензамид
(147) 2-циклогексил-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)ацетамид
(148) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бензо[d][1,3]диоксол-5-карбоксамид
(149) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-1Н-бензо[d]имидазол-5-карбоксамид
(150) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-1H-бензо[d][1,2,3]триазол-5-карбоксамид
(151) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)циклопентанкарбоксамид
(152) 3,4-дихлор-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бензамид
(153) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)циннамамид
(154) 3,5-дихлор-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бензамид
(155) 2-(2,4-дихлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)ацетамид
(156) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-1-метокси-2-нафтамид
(157) 2-(3,4-дихлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)ацетамид
(158) N-((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-6-метокси-2-нафтамид
(159) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(2-(гуанидиноокси)этил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(160) (E)-3-(2,4-дихлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидино-пропил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(161) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-адамантан-1-карбоксамид
(162) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-феноксиацетамид
(163) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-метокси-2-нафтамид
(164) 4-бром-N-((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бензамид
(165) (S)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-карбоксамид
(166) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(167) (E)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(тиофен-2-ил)акриламид
(168) (R)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-карбоксамид
(169) (Е)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-гидроксифенил)акриламид
(170) (E)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(2-метоксифенил)акриламид
(171) (Е)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-р-толилакриламид
(172) (Е)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(2-(трифторметил)фенил)акриламид
(173) (Е)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(3-фторфенил)акриламид
(174) (E)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-метил-3-фенилакриламид
(175) N-(((3S,5S)-1 -(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-фенилциклопропанкарбоксамид
(176) 2-(2,4-дихлорфенокси)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)ацетамид
(177) (Е)-3-(3-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(178) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бензо[d]тиазол-6-карбоксамид
(179) N-(((33,58)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-5-фенилфуран-2-карбоксамид
(180) (E)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(3-метоксифенил)акриламид
(181) 6-бром-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(182) N-(((3S,5S)-3-(3-гуанидинопропил)-2-оксо-1-фенэтил-1,4-диазепан-5-ил)метил)-2-нафтамид
(183) N-(((3S,5S)-1-(3,4-дихлорфенэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(184) N-(((3S,5S)-1-(2,4-дихлорфенэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(185) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бензо[b]тиофен-5-карбоксамид
(186) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-5-метил-1-фенил-1Н-пиразол-4-карбоксамид
(187) (Е)-N-(((38,53)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-Диазепан-5-ил)метил)-3-(4-метоксифенил)акриламид
(188) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-6-фтор-2-нафтамид
(189) (Е)-3-(2-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(190) (Е)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(2-гидроксифенил)акриламид
(191) (Е)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-m-толилакриламид
(192) (Е)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(3-(трифторметил)фенил)акриламид
(193) (Е)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(3-гидроксифенил)акриламид
(194) (Е)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(2-фторфенил)акриламид
(195) (Е)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-о-толилакриламид
(196) (Z)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-фтор-3-фенилакриламид
(197) N-((1-(2,2-дифенилэтил)-2-оксо-3-(пиперидин-4-ил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(198) N-((1-(2,2-дифенилэтил)-2-оксо-3-(пиперидин-4-илметил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(199) (E)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-фторфенил)акриламид
(200) (E)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-(трифторметил)фенил)акриламид
(201) N-(((3S,5S)-1-(2,2-дифенилпропил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(202) N-(((3S,5S)-1-(циклогексилметил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(203) N-(((3S,5S)-1-(1-адамантилметил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(204) N-(((3S,5S)-1-((S)-1,1-дифенилпропан-2-ил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(205) N-(((3S,5S)-1-((R)-1,1-дифенилпропан-2-ил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(206) N-(((3S,5S)-1-циклогексил-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(207) N-(((3S,5S)-1-((R)-1-фтор-1,1-дифенилпропан-2-ил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(208) (Е)-3-(2,6-дифторфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(209) (Е)-3-(2-хлор-6-фторфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(210) (Е)-3-(4-бромфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(211) (Е)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-этоксифенил)акриламид
(212) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-6-бром-2-нафтамид
(213) N-(((3S,5S)-3-(3-аминопропил)-1 -(2,2-дифенилэтил)-2-оксо-1,4-диазепан-6-ил)метил)циннамамид
(214) (Е)-N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(215) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-1,4-димитокси-2-нафтамид
(216) N-(((3S,5S)-3-(3-(3,3-диметилгуанидино)пропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(217) N-(((3S,58)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-6-гидрокси-2-нафтамид
(218) 6-амино-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(219) (Е)-N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-р-толилакриламид
(220) (Е)-N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-фторфенил)акриламид
(221) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-6-фтор-2-нафтамид
(222) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-этилгексанамид
(223) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-диметилбензамид
(224) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(225) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-этилгексанамид
(226) N-(((3S,5S)-3-(3-(циклогексиламино)пропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(227) N-(((3S,5S)-3-(3-гуанидинопропил)-1 -(нафталин-2-ил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(228) N-(((3S,5S)-1-((9Н-флуорен-9-ил)метил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(229) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(пиридин-3-илметил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(230) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(пиридин-4-илметил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(231) (Е)-N-(((3S,5S)-3-(3-(циклогексиламино)пропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-фторфенил)акриламид
(232) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(4-(изопропиламино)бутил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(233) (Е)-N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(2,4-дифторфенил)акриламид
(234) (Е)-N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-цианофенил)акриламид
(235) (Е)-N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-6-ил)метил)-3-(нафталин-2-ил)акриламид
(236) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-(4-фторфенокси)ацетамид
(237) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-5-(4-хлорфенил)фуран-2-карбоксамид
(238) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-4-(1Н-пиррол-1-ил)бензамид
(239) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-оксо-1-фенилпирролидин-3-карбоксамид
(240) N-(((3S,5S)-3-(3-аминопропил)-1 -(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-5-(4-хлорфенил)изоксазол-3-карбоксамид
(241) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-5-(фуран-2-ил)изоксазол-3-карбоксамид
(242) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-6-ил)метил)-2-фенилтиазол-4-карбоксамид
(243) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-4-(3,5-диметил-1Н-пиразол-1-ил)бензамид
(244) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-5-метил-1-фенил-1Н-пиразол-4-карбоксамид
(245) N-(((3S,5S)-1-(2-циклогексилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(246) N-(((3S,5S)-1-(2-(бицикло[2.2.1]гептан-2-ил)этил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(247) N-(((3S,5S)-1-(2,2-бис(4-метоксифенил)этил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(248) N-(((3S,5S)-3-(3-(бензиламино)пропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(249) N-(((3S,5S)-3-(3-(циклопентиламино)пропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(250) N-(((3S,5S)-3-(3-(циклобутиламино)пропил)-1 -(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(251) N-(((3S,5S)-3-(3-(дициклобутиламино)пропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(252) N-(((3S,5S)-1-бензил-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(253) N-(((3S,5S)-1-(2,2-бис(4-фторфенил)этил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(254) N-(((3S,5S)-3-(3-гуанидинопропил)-1-(нафталин-2-илметил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(255) (Е)-N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(5-метилтиофен-2-ил)акриламид
(256) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-фенил-1Н-пиразол-5-карбоксамид
(257) (Е)-N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-фторфенил)-N-метилакриламид
(258) (Е)-N-(((3S,5S)-3-(3-аминопропил)-1 -(2,2-дифенилэтил)-4-метил-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-фторфенил)акриламид
(259) N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-4-(3-метил-5-оксо-4,5-дигидро-1Н-пиразол-1-ил)бензамид
(260) (Е)-N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-бромфенил)акриламид
(261) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(3-(пирролидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)акриламид
(262) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1 -(2,2-дифенилэтил)-2-оксо-3-(3-(пиперидин-1 -ил)пропил)-1,4-диазепан-5-ил)метил)акриламид
(263) N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(264) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(3-(пирролидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(265) N-(((3S,5S)-3-(3-(азетидин-1-ил)пропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(266) N-(((3S,5S)-3-(3-гуанидинопропил)-1-(нафталин-1-илметил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(267) N-(((3S,5S)-3-(3-гуанидинопропил)-1-(2-(нафталин-2-ил)этил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(268) N-(((3S,5S)-1-((S)-2-ацетамидо-2-фенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(269) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)циннамамид
(270) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)-3,4-диметилбензамид
(271) 3,4-дихлор-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)бензамид
(272) N-(((3S,5S)-1-((S)-2-(циклобутанкарбоксамид)-2-фенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(273) N-(((3S,5S)-1-((S)-2-(циклогексанкарбоксамид)-2-фенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(274) N-(((3S,5S)-3-(аминометил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(275) (Е)-N-(((3S,5S)-3-(аминометил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(276) (Е)-N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-фторфенил)акриламид
(277) (Е)-N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-р-толилакриламид
(278) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(пиперидин-1-илметил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(279) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(пиперидин-1-илметил)-1,4-диазепан-5-ил)метил)акриламид
(280) N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(281) N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-диметилбензамид
(282) N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)циннамамид
(283) (Е)-N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(284) 3,4-дихлор-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(285) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-3,4-диметилбензамид
(286) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)циннамамид
(287) (E)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-3-(4-фторфенил)акриламид
(288) (Е)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-3-р-толилакриламид
(289) N-(((3S,5S)-1-(3,5-диметилбензил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(290) N-((3S,5S)-1-((S)-2-бензамид-2-фенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(291) N-(((3S,5S)-1-((R)-2-бензамид-2-фенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(292) N-(((3S,5S)-3-(3-гуанидинопропил)-1-(2-метокси-2-фенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(293) N-(((3S,5S)-3-(3-гуанидинопропил)-2-оксо-1-(2-фенил-2-пропоксиэтил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(294) N-(((3S,5S)-1-(2-(бензилокси)-2-фенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(295) N-(((3S,5S)-1-(2-(аллилокси)-2-фенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(296) N-(((3S,5S)-3-бутил-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(297) (Е)-N-(((3S,5S)-3-бутил-1-(2,2-дифенилэтил)-2-оксо-1,4-Диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(298) (Е)-N-(((3S,5S)-3-(3-амино-3-оксопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(299) N-(((3S,5S)-3-(3-амино-3-оксопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(300) (Е)-N-(((3S,5S)-3-(3-ацетамидопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-р-толилакриламид
(301) N-(3-((2S,7S)-4-(2,2-дифенилэтил)-3-оксо-7-(((Е)-3-р-толилакриламид)метил)-1,4-диазепан-2-ил)пропил)циклогексанкарбоксамид
(302) N-(((3S,5S)-3-(3-гуанидинопропил)-2-оксо-1-(2-фенокси-2-фенилэтил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(303) этил 3-((3S,5S)-5-((2-нафтамид)метил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-1-ил)-2-фенилпропаноат
(304) N-(((3S,5S)-1-(2-этилбутил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(305) N-(((3S,5S)-1-((3,5-диметилциклогексил)метил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(306) N-(2-((2S,7S)-7-(((Е)-3-(4-хлорфенил)акриламид)метил)-4-(2,2-дифенилэтил)-3-оксо-1,4-диазепан-2-ил)этил)циклогексанкарбоксамид
(307) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-3-(2-(2-циклогексилацетамидо)этил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(308) N-(2-((3S,5R)-1-(2,2-дифенилэтил)-2-оксо-3-(2-аминоэтил)-1,4-диазепан-5-ил)этил)бензамид
(309) 3,4-дихлор-N-(2-((3S,5R)-1-(2,2-дифенилэтил)-2-оксо-3-(2-аминоэтил)-1,4-диазепан-5-ил)этил)бензамид
(310) N-(2-((3S,5R)-1-(2,2-дифенилэтил)-2-оксо-3-(2-аминоэтил)-1,4-диазепан-5-ил)этил)-2-нафтамид
(311) N-(2-((3S,5R)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)этил)бензамид
(312) 3,4-дихлор-N-(2-((38,5Р)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)этил)бензамид
(313) N-(2-((3S,5R)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)этил)-2-нафтамид
(314) N-(((3S,5S)-1-(3-(диметиламино)-3-оксо-2-фенилпропил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(315) N-(((3S,5S)-3-(циклогексилметил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(316) N-(((3S,5S)-3-(2-аминоэтил)-1-(3,5-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(317) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(3-оксо-3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(318) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(3-оксо-3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)акриламид
(319) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-фенэтил-1,4-диазепан-5-ил)метил)-2-нафтамид
(320) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-фенэтил-1,4-диазепан-5-ил)метил)акриламид
(321) N-((3S,5S)-3-(2-циклогексилэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(322) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-3-(2-циклогексилэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(323) N-(((3S,5S)-3-бензил-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(324) (Е)-N-(((3S,5S)-3-бензил-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(325) N-(((3S,5S)-3-(2-аминоэтил)-1-(3,5-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(326) (Е)-N-(((3S,5S)-3-(2-аминоэтил)-1-(3,5-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(327) N-(((3S,5S)-1-(3-хлор-5-фторбензил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(328) N-(((3S,5S)-1-(3,5-дифторбензил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(329) N-(((3S,5S)-3-(3-аминопропил)-1-(3-хлор-5-фторбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(330) N-(((3S,5S)-3-(3-аминопропил)-1-(3,5-дифторбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(331) N-(((3S,5S)-3-(3-аминопропил)-1-(2,5-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(332) N-(((3S,5S)-3-(3-аминопропил)-1-(2,6-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(333) N-(((3S,5S)-3-(3-амипропил)-1-(3,5-диметоксибензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(334) N-(((3S,5S)-3-(3-аминопропил)-1-(2-хлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(335) N-(((3S,5S)-3-(3-аминопропил)-1-(2,3-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(336) N-(((3S,5S)-3-(3-аминопропил)-1-(2,4-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(337) N-(((3S,5S)-3-(3-аминопропил)-1-(3,4-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(338) N-(((3S,5S)-3-(3-аминопропил)-1-(3-фтор-5-метилбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(339) N-(((3S,5S)-3-(3-аминопропил)-1-(3-фтор-5-(трифторметил)бензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(340) N-(((3S,5S)-3-(3-аминопропил)-1-(4-хлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(341) N-(((3S,5S)-3-(3-аминопропил)-2-оксо-1-(2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(342) N-(((3S,5S)-3-(3-аминопропил)-2-оксо-1-((1-фенилциклогексил)метил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(343) 3,4-дихлор-N-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(344) N-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(345) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)акриламид
(346) N-(((3S,5S)-3-(2-аминопропил)-1-(2-этилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(347) (Е)-N-(((3S,5S)-3-(2-аминоэтил)-1-(2-этилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(348) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2-этилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)акриламид
(349) 3,4-дихлор-N-(((3S,5S)-1-(2-этилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(350) N-(((3S,5S)-1-(2-этилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(351) N-(((3S,5S)-3-(2-аминоэтил)-1-(2-этилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-4-хлор-3-фторбензамид
(352) N-(((3S,5S)-3-(2-аминоэтил)-1-(2-этилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-4-хлор-3-метилбензамид
(353) N-(((3S,5S)-3-(2-аминоэтил)-1-(2,3-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-3-хлор-4-фторбензамид
(354) N-(((3S,5S)-3-(2-аминоэтил)-1-(2-этилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-3-хлор-4-метилбензамид
(355) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2-этилбутил)-2-оксо-3-(пиперидин-1-илметил)-1,4-диазепан-5-ил)метил)акриламид
(356) N-(2-((3S,5R)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пирролидин-1-ил)этил)-1,4-диазепан-5-ил)этил)-2-нафтамид
(357) N-(((3S,5S)-3-(3-аминопропил)-1-(3,5-бис(трифторметил)бензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(358) N-(((3S,5S)-3-(3-аминопропил)-1-(3-хлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(359) N-(((3S,5S)-2-оксо-1-(2-фенилбутил)-3-(3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(360) N-(((3S,5S)-3-(3-гуанидинопропил)-2-оксо-1-(3-оксо-2-фенил-3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(361) N-(((3S,5S)-3-(3-гуанидинопропил)-2-оксо-1-(3-оксо-2-фенил-3-(фениламино)пропил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(362) 3,4-дихлор-N-(2-((3S,5R)-1-(2,2-дифенилэтил)-3-(2-(изопропиламино)этил)-2-оксо-1,4-диазепан-5-ил)этил)бензамид
(363) 3,4-дихлор-N-(2-((3S,5R)-3-(2-(диизопропиламино)этил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)этил)бензамид
(364) N-(((3S,5S)-3-(аминометил)-1-(3,5-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(365) N-(((3S,5S)-3-(аминометил)-1-(3,5-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(366) (Е)-N-(((3S,5S)-3-(аминометил)-1-(3,5-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(367) 3,4-дихлор-N-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(пиперидин-1-илметил)-1,4-диазепан-5-ил)метил)бензамид
(368) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(пиперидин-1-илметил)-1,4-диазепан-5-ил)метил)акриламид
(369) N-(((3S,5S)-3-(2-аминоэтил)-2-оксо-1-(2-фенилбутил)-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(370) (Е)-N-(((3S,5S)-3-(2-аминоэтил)-2-оксо-1-(2-фенилбутил)-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(371) 3,4-дихлор-N-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(пирролидин-1-илметил)-1,4-диазепан-5-ил)метил)бензамид
(372) N-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(пирролидин-1-илметил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(373) N-(((3S,5S)-3-(3-аминопропил)-2-оксо-1-((S)-2-фенилпропил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(374) N-(((3S,5S)-3-(3-аминопропил)-2-оксо-1-((R)-2-фенилпропил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(375) N-(((3S,5S)-3-(2-(диметиламино)этил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(376) N-(((3S,5S)-1 -(2,2-дифенилэтил)-2-оксо-3-(3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)-6-фтор-2-нафтамид
(377) N-(((3S,5S)-3-(3-аминопропил)-1-(3,5-диэтинилбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(378) (Е)-3-(4-хлорфенил)-N^-(((3S,5S)-3-(2-(диэтиламино)этил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(379) N-(((3S,5S)-3-(2-(диэтиламино)этил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(380) 3,4-дихлор-N-(((3S,5S)-2-оксо-1-((R)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(381) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-2-оксо-1-((R)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)акриламид
(382) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)акриламид
(383) N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-б-хлор-2-нафтамид
(384) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пирролидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(385) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(386) N-(((3S,5S)-3-(2-аминоэтил)-1-(2-этилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-6-фтор-2-нафтамид
(387) N-(((3S,5S)-3-(2-аминоэтил)-1-(2-этилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(388) N-(((3S,5S)-3-(2-аминоэтил)-1-(2-этилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-6-бром-2-нафтамид
(389) N-(((3S,5S)-1-(2-этилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-6-фтор-2-нафтамид
(390) 6-хлор-N-(((3S,5S)-1-(2-этилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(391) 6-бром-N-(((3S,5S)-1-(2-этилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(392) N-(((3S,5S)-3-(2-аминоэтил)-1-((3,5-диметилциклогексил)метил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(393) N-(((3S,5S)-3-(2-аминоэтил)-1-((3,5-диметилциклогексил)метил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(394) (Е)-N-(((3S,5S)-3-(2-аминоэтил)-1-((3,5-диметилциклогексил)метил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(395) 6-хлор-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(396) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-6-фтор-2-нафтамид
(397) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пирролидин-1-ил)этил)-1,4-диазепан-5-ил)метил)акриламид
(398) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(2-(изопропиламино)этил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(399) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(2-(изопропиламино)этил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(400) 3,4-дихлор-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(2-(изопропиламино)этил)-2-оксо-1,4-диазепан-5-ил)метил)бензамид
(401) N-(((3S,5S)-3-(3-аминопропил)-1-((2,6-диметилциклогексил)метил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(402) N-(((3S,5S)-3-(3-аминопропил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(403) 3,4-дихлор-N-(((3S,5S)-1-((3,5-диметилциклогексил)метил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(404) 3,4-дихлор-N-(((3S,5S)-1-((3,5-диметилциклогексил)метил)-3-(2-(изопропиламино)этил)-2-оксо-1,4-диазепан-5-ил)метил)бензамид
(405) N-(((3S,5S)-3-(2-аминоэтил)-1-(3-метил-2-фенилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(406) N-(((3S,5S)-3-(2-аминоэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(407) N-(((3S,5S)-3-(3-аминопропил)-2-оксо-1-((К)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(408) (Е)-N-(((3S,5S)-3-((1Н-имидазол-4-ил)метил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(409) 3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)пропанамид
(410) N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)пропанамид
(411) N-(((28,78)-7-(((Е)-3-(4-хлорфенил)акриламид)метил)-4-(2,2-дифенилэтил)-3-оксо-1,4-диазепан-2-ил)метил)пиколинамид
(412) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(пиридин-2-илметил)-1,4-диазепан-5-ил)метил)акриламид
(413) N-(((3S,5S)-1-((R)-3-метил-2-фенилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(414) N-(((3S,5S)-1-((S)-3-метил-2-фенилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(415) (Е)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-3-(4-изопропилфенил)акриламид
(416) (Е)-N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-6-ил)метил)-3-(4-изопропилфенил)акриламид
(417) (Е)-3-(2,4-диметилфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазгепан-5-ил)метил)акриламид
(418) (Е)-N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-6-ил)метил)-3-(2,4-диметилфенил)акриламид
(419) (Е)-3-(2,4-дифторфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)акриламид
(420) (Е)-N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(2,4-дифторфенил)акриламид
(421) N-(((28,78)-7-(((Е)-3-(4-хлорфенил)акриламид)метил)-4-(2,2-дифенилэтил)-3-оксо-1,4-диазепан-2-ил)метил)циклогексанкарбоксамид
(422) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(2-морфолиноэтил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(423) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-3-(2-(2,5-диметил-1Н-пиррол-1-ил)этил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(424) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-3-(2-(2,5-диметилпирролидин-1-ил)этил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(425) 6-хлор-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(426) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пирролидин-1-ил)этил)-1,4-диазепан-5-ил)метил)акриламид
(427) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-3-(2-(изопропиламино)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)акриламид
(428) 6-хлор-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пирролидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(429) 3,4-дихлор-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(430) 3,4-дихлор-N-(((33,53)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пирролидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(431) бензил ((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метилкарбамат
(432) (Е)-3-(4-бромфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)акриламид
(433) 5-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)изоксазол-3-карбоксамид
(434) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-оксо-2-(пиридин-2-иламино)этил)-1,4-диазепан-5-ил)метил)акриламид
(435) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-оксо-2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)акриламид
(436) 6-хлор-N-(((3S,5S)-2-оксо-3-(3-оксо-3-(пиперидин-1-ил)пропил)-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(437) 3,4-дихлор-N-(((3S,5S)-2-оксо-3-(3-оксо-3-(пиперидин-1-ил)пропил)-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(438) 6-хлор-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(пиперидин-1-илметил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(439) 3,4-дихлор-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(пиперидин-1-илметил)-1,4-диазепан-5-ил)метил)бензамид
(440) 6-хлор-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(441) 3,4-дихлор-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)бензамид
(442) (Е)-N-(2-((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-6-ил)пропан-2-ил)-3-(4-хлорфенил)акриламид
(443) (Е)-3-(4-хлорфенил)-N-(2-((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)пропан-2-ил)акриламид
(444) N-(((3S,5S)-3-(2-аминоэтил)-1-((R)-2-(4-хлорфенил)пропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(445) N-(((3S,5S)-3-(2-аминоэтил)-1-(2-(4-хлорфенил)пропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(446) N-(((3S,5S)-1-((R)-2-(4-хлорфенил)пропил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(447) N-(((3S,5S)-1-((S)-2-(4-хлорфенил)пропил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(448) 3,4-дихлор-N-(((3S,5S)-3-(2-(метил(фенил)амино)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(449) 3,4-дихлор-N-(((3S,5S)-3-(2-(диэтиламино)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(450) 3,4-дихлор-N-(((3S,5S)-3-(2-морфолиноэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(451) 3,4-дихлор-N-(((3S,5S)-2-оксо-3-(2-(фениламино)этил)-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(452) N-(((3S,5S)-3-(2-(бензиламино)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(453) (5S,9aS)-5-(2-аминобензил)-2-((Е)-3-(4-хлорфенил)акрилоил)-7-(2,2-дифенилэтил)гексагидро-1Н-имидазо[1,5-d][1,4]диазепин-6(5Н)-он
(454) N-(((3S,5S)-3-(2-(трет-бутиламино)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(455) 3,4-дихлор-N-(((3S,5S)-3-(2-(4-метилпиперазин-1-ил)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(456) N-(((3S,5S)-2-оксо-1-((R)-2-фенилпентил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(457) N-(((3S,5S)-2-оксо-1-((S)-2-фенилпентил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(458) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-4-(трифторметил)бензамид
(459) N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-4-(трифторметил)бензамид
(460) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-3-(трифторметил)бензамид
(461) N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(трифторметил)бензамид
(462) 6-хлор-N-(((3S,5S)-1-(3,5-дихлорбензил)-3-(2-(изопропиламино)этил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(463) 3,4-дихлор-N-(((3S,5S)-1-(3,5-дихлорбензил)-3-(2-(изопропиламино)этил)-2-оксо-1,4-диазепан-5-ил)метил)бензамид
(464) 6-хлор-N-(((3S,5S)-3-(2-(изопропиламино)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(465) N-(((3S,5S)-3-(2-аминоэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(466) N-(((3S,5S)-3-(2-аминобензил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-6-ил)метил)-2-нафтамид
(467) N-(((3S,5S)-3-(2-(бензил(метил)амино)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(468) 3,4-дихлор-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперазин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(469) 3,4-дихлор-N-(((3S,5S)-3-(2-(метил(пентил)амино)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(470) 3,4-дихлор-N-(((3S,5S)-3-(2-(диизопропиламино)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(471) 3,4-дихлор-N-(((3S,5S)-3-(2-(4-метилпиперидин-1-ил)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(472) (S)-6-хлор-N-((2-оксо-1-(2-фенилбутил)-3-(пиперидин-4-ил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(473) (S)-6-хлор-N-(3-(1-изопентилпиперидин-4-ил)-2-оксо-1-(2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(474) N-(((3S,5S)-3-бутил-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(475) 6-хлор-N-(((3S,5S)-3-изопентил-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(476) 3,4-дихлор-N-(((3S,5S)-3-(2-(3,5-диметилпиперидин-1-ил)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(477) 3,4-дихлор-N-(((3S,5S)-3-(2-(4-гидроксипиперидин-1-ил)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(478) 1-(2-((2S,7S)-7-((3,4-дихлорбензамид)метил)-3-оксо-4-((S)-2-фенилбутил)-1,4-диазепан-2-ил)этил)пиперидин-4-карбоновая кислота
(479) N-(((3S,5S)-3-(2-(азепан-1-ил)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(480) 3,4-дихлор-N-(((3S,5S)-3-(2-((S)-2-метилпиперидин-1-ил)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(481) N-(((3S,5S)-3-(2-(трет-бутил(метил)амино)этил)-2-оксо-1 -((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(482) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)бензил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(483) N-(((3S,5S)-3-(3-(бутил(метил)амино)-3-оксопропил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(484) N-(((3S,5S)-3-(3-(циклогексиламино)-3-оксопропил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(485) 6-хлор-N-((3-(1-этилпиперидин-4-ил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(486) (3S,5S)-5-((3,4-дихлорбензиламино)метил)-1-(2,2-дифенилэтил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-2-он
(487) 6-хлор-N-(((3S,5S)-3-(2-гуанидиноэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(488) 6-хлор-N-(((3S,5S)-3-(2-(3-метилгуанидино)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(489) N-(((3S,5S)-3-(2-аминоэтил)-1-((R)-2-этил-3-метилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(490) N-(((3S,5S)-3-(2-аминоэтил)-1-((S)-2-этил-3-метилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(491) 3,4-дихлор-N-(((3S,5S)-1 -((R)-2-этил-3-метилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(492) 3,4-дихлор-N-(((3S,5S)-1-((S)-2-этил-3-метилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(493) N-(((3S,5S)-3-(2-амино-2-метилпропил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(494) N-(((3R,5R)-3-(2-амино-2-метилпропил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(495) N-(((3S,5S)-3-(2-аминоэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(496) 3,4-дихлор-N-(((3S,5S)-3-(2-(изопропиламино)этил)-2-оксо-1 ~((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(497) N-(((3S,5S)-3-(2-аминоэтил)-1-(3,5-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(498) 6-хлор-N-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(499) 6-хлор-N-(((3S,5S)-3-(2-метил-2-(пиперидин-1-ил)пропил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(500) 6-хлор-N-(((3R,5R)-3-(2-метил-2-(пиперидин-1-ил)пропил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(501) N-(((3S,5S)-3-(2-аминоэтил)-1-((R)-2-этил-3-метилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(502) N-(((3S,5S)-3-(2-аминоэтил)-1-((S)-2-этил-3-метилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(503) 6-хлор-N-(((3S,5S)-1-((R)-2-этил-3-метилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(504) 6-хлор-N-(((3S,5S)-1-((S)-2-этил-3-метилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(505) 6-хлор-N-(((3S,5S)-3-(2-циклогексилэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(506) 6-хлор-N-(((3S,5S)-3-гексил-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(507) 6-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метилкарбамоил)-2-нафтойная кислота
(508) 6-хлор-N-(((3S,5S)-3-(2-(3-изопропилгуанидино)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(509) 6-хлор-N-(((3S,5S)-3-(4-гидроксибутил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(510) 6-хлор-N-(((3S,5S)-3-(2-метоксиэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(511) N-(((3S,5S)-3-(2-(бензилокси)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-6-ил)метил)-6-хлор-2-нафтамид
(512) 6-хлор-N-(((3S,5S)-3-изобутил-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(513) N-(((3S,5S)-3-(2-аминоэтил)-1-(2-этил-3-метилбут-3-енил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(514) 3,4-дихлор-N-(((3S,5S)-1-(2-этил-3-метилбут-3-енил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(515) N-(((3S,5S)-3-(2-аминоэтил)-1-(2-этил-3-метилбут-3-енил)-2-оксо-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(516) 6-хлор-N-(((3S,5S)-1-((R)-2-этил-3-метилбут-3-енил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(517) 6-хлор-N-(((3S,5S)-1-((S)-2-этил-3-метилбут-3-енил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(518) N-(((3S,5S)-1-(циклогексилметил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)бифенил-4-карбоксамид
(519) N-(((3S,5S)-1-(циклогексилметил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-(1Н-индол-3-ил)ацетамид
(520) N-(((3S,5S)-1-(циклогексилметил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)хинолин-3-карбоксамид
(521) 3,4-дихлор-N-(((3S,5S)-3-(2-(4,4-дифторпиперидин-1-ил)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(522) 3,4-дихлор-N-(((3S,5S)-3-(2-гидроксиэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(523) 3,4-дихлор-N-(((3S,5S)-3-(2-(3,3-дифторпиперидин-1-ил)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(524) (3S,5S)-5-((3,4-дихлорбензиламино)метил)-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-2-он
(525) 3,4-дихлор-N-(((3S,5S)-1-(2-циклопропилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(526) N-(((3S,5S)-3-(2-аминоэтил)-1-(2-циклопропилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(527) 6-хлор-N-(((3S,5S)-1-(2-циклопропилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(528) 3,4-дихлор-N-(((3S,5S)-3-(2-(2,5-диоксопирролидин-1-ил)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-дйазепан-5-ил)метил)бензамид
(529) 6-хлорp-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(3-уреидопропил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(530) 3,4-дихлор-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(1,1,1-трифторпропан-2-иламино)этил)-1,4-диазепан-5-ил)метил)бензамид
(531) 3,4-дихлор-N-(((3S,5S)-3-(2-(3,3-диметил-2,5-диоксопирролидин-1-ил)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(532) N-(((3S,5S)-3-(2-(азепан-1-ил)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(533) 6-хлор-N-(((3S,5S)-3-(2-(3-изопропилуреидо)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(534) N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бифенил-4-карбоксамид
(535) N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-фенилтиазол-4-карбоксамид
(536) 4'-хлор-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бифенил-2-карбоксамид
(537) 6-хлор-N-(((3S,5S)-3-(2-(N-изопропилацетамидо)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(538) 6-хлор-N-(((3S,5S)-3-((изопропиламино)метил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(539) 6-хлор-N-(((3S,5S)-3-(гуанидинометил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(540) 2-(2,4-дихлорфенил)-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)ацетамид
(541) N-(((3S,5S)-3-(2-аминоэтил)-1-(2,4-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(542) 3,4-дихлор-N-(((3S,5S)-1-(2,4-дихлорбензил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(543) 3,4-дихлор-N-(((3S,5S)-1-(2,4-дихлорбензил)-3-(2-(метилсульфонамид)этил)-2-оксо-1,4-диазепан-5-ил)метил)бензамид
(544) 3,4-дихлор-N-(((3S,5S)-1-(2,4-дихлорбензил)-3-(2-(4-метилфенилсульфонамид)этил)-2-оксо-1,4-диазепан-5-ил)метил)бензамид
(545) N-(((3S,5S)-3-(2-((S)-2-амино-3-метилбутанамид)этил)-1-(2,4-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(546) N-(((3S,5S)-3-(2-аминоэтил)-1-(2,4-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(547) 6-хлор-N-(((3S,5S)-1-(2,4-дихлорбензил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(548) N-(((3S,5S)-3-(2-аминоэтил)-2-оксо-1-(2-(тиофен-3-ил)бутил)-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(549) 6-хлор-N-(((3S,5S)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1-((R)-2-(тиофен-3-ил)бутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(550) 6-хлор-N-(((3S,5S)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1-((S)-2-(тиофен-3-ил)бутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(551) N-(((3S,5S)-3-(2-аминоэтил)-1-(2-этил-2-метилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(552) 6-хлор-N-(((3S,5S)-1-(2-этил-2-метилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(553) 6-хлор-N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(2-морфолиноэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(554) 6-хлор-N-(((3S,5S)-3-(2-морфолиноэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(555) 6-хлор-N-(((3S,5S)-1-(3,5-дихлорбензил)-3-(2-морфолиноэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(556) 3,4-дихлор-N-(((3S,5S)-1-(3,5-дихлорбензил)-3-(2-морфолиноэтил)-2-оксо-1,4-диазепан-5-ил)метил)бензамид
(557) N-(3,4-дихлорбензил)-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)ацетамид
(558) 1-(4-хлорбензил)-3-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)мочевина
(559) N-(((3S,5S)-3-(2-аминоэтил)-1-(2-этил-2-метилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-3,4-дихлорбензамид
(560) 3,4-дихлор-N-(((3S,5S)-1-(2-этил-2-метилбутил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(561) 6-хлор-N-(((3S,5S)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1-(2,3,5-трихлорбензил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(562) 6-хлор-N-(((3S,5S)-3-(2-(1-метилэтилсульфонамид)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(563) бутил 2-((2S,7S)-7-((6-хлор-2-нафтамид)метил)-3-оксо-4-((S)-2-фенилбутил)-1,4-диазепан-2-ил)этилкарбамат
(564) (8)-6-хлор-N-((3-(1-изопропилпиперидин-4-ил)-2-оксо-1-(2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(565) 6-хлор-N-(((3S,5S)-2-оксо-1-((R)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(566) 5-(4-хлорфенил)-N-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)изоксазол-3-карбоксамид
(567) 2,4-дихлор-N-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(568) N-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-6-метокси-2-нафтамид
(569) 6-хлор-N-(([5-13C,4-15N](3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)[13C]метил)-2-нафтамид
(570) N-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-1-метокси-2-нафтамид
(571) (Е)-N-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-3-(4-(трифторметокси)фенил)акриламид
(572) 5-(4-хлорфенил)-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)изоксазол-3-карбоксамид
(573) 2,4-дихлор-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)бензамид
(574) 5,6-дихлор-2-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)изоиндолин-1,3-дион
(575) (Е)-N-(((3S,5S)-1-(3,5-дихлорбензил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-3-(3-фтор-4-(трифторметокси)фенил)акриламид
(576) 6-метокси-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(577) 1-метокси-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(578) (Е)-3-(3-фтор-4-(трифторметокси)фенил)-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)акриламид
(579) 6-хлор-N-(([5,6,6-2H3](3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)[2H2]метил)-2-нафтамид
(580) 6-хлор-N-(((3R,5R)-2-оксо-1-((R)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(581) 6-хлор-N-(((3S,5R)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(582) 6-хлор-N-(((3R,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(583) 6-хлор-N-(((3S,5R)-2-оксо-1-((R)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(584) 6-хлор-N-(((3R,5S)-2-оксо-1-((R)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(585) 6-хлор-N-(((3R,5R)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
Как указано ранее, соединения формулы (I) представляют собой антагонисты MC5R и, следовательно, могут применяться для модулирования активности MC5R или его фрагмента, или аналога, или функционального эквивалента путем того, что подвергают MC5R- или его фрагмент, или аналог, или функциональный эквивалент воздействию соединения данного изобретения. Это может происходить in vitro в испытаниях, где желательна понижающая регуляция активности MC5R, однако, обычно более полезно, когда используется при понижающей регуляции активности MC5R у пациента. Величина понижающей регуляции, обусловленной соединениями данного изобретения, будет изменяться от соединения к соединению и будет также зависеть от количества вводимого соединения. В одном варианте осуществления величина понижающей регуляции составляет, по меньшей мере, 10%. В другом варианте осуществления величина понижающей регуляции составляет, по меньшей мере, 20%. В еще одном варианте осуществления величина понижающей регуляции составляет, по меньшей мере, 50%.
Соответственно, способы данного изобретения можно применять при лечении любого состояния, при котором модуляция активности MC5R или его фрагмента или аналога, или функционального эквивалента приведет к благоприятному воздействию на это состояние. Как таковые соединения, пригодные для применения в данном изобретении, можно применять в способах лечения, предотвращения или контролирования состояния, связанного или непосредственно, или косвенно с активностью MC5R или его фрагмента или аналога или функционального эквивалента у млекопитающего, где модулирующее MC5R количество соединения данного изобретения вводят млекопитающему. Одно состояние, связанное с активностью MC5R, представляет собой избыточное салоотделение и состояния, связанные с ним. В одном варианте осуществления способа состояние выбирают из группы, включающей акне, себорею и себорейный дерматит. В одном варианте осуществления акне выбирают из группы, включающей обыкновенные угри, акне, шаровидные угри и молниеносные угри. В одном определенном варианте осуществления состояние представляет собой обыкновенные угри.
Например, понижающая регуляция MC5R приводит к уменьшению салоотделения и, таким образом, может применяться при лечении или профилактике ряда состояний, в которых наблюдают избыточное салоотделение, а именно акне, себореи и себорейного дерматита.
Способы данного изобретения могут быть также пригодными при лечении, предотвращении или контроле ряда состояний, которые относятся к биологическим процессам, контролируемым MC5R, такие как заболевания связанные с воспалением. Соединения формулы (I) могут быть также пригодными для лечения или предотвращения раковых опухолей, таких как синдром Мюир-Торре или другие раковые опухоли сальной железы.
Благодаря своему влиянию на салоотделение соединения формулы (1) могут также найти применение при лечениях, где является желательным уменьшенное салоотделение, а именно при косметических лечениях. Соединения могут, таким образом, применяться в способах уменьшения салоотделения млекопитающим, при этом способ, включает этап, на котором вводят эффективное количество соединения формулы (I).
Соединения формулы (I) можно применять при лечении состояний у любых видов, у которых присутствует MC5R, наиболее обычно млекопитающих. Примеры видов, у которых находят MC5R и, следовательно, видов, у которых можно применять соединения, включают людей, крыс, мышей, собак, макак-резусов, овец, полосатую перцину, серебряного карася, колючую акулу, радужную форель и куриц. В определенном варианте осуществления млекопитающее представляет собой человека.
Введение соединений формулы (I) пациенту, такому как люди, можно осуществить посредством местного применения, посредством любого из общепринятых методов для энтерального введения, такого как пероральное или ректальное, или посредством парентерального введения, такого как подкожный, внутримышечный, внутривенный и внутрикожный способы применения. Инъекция может быть в виде инъекции ударной дозы вещества или посредством постоянной или прерывистой инфузии. Активное соединение, как правило, включается в фармацевтически приемлемый носитель или разбавитель и в количестве, достаточном для доставки пациенту терапевтически эффективной дозы.
При применении соединений формулы (I) их можно вводить в любой форме или виде, который делает соединение биодоступным. Специалист в данной области по приготовлению составов может легко выбрать подходящую форму и вид введения, в зависимости от отдельных характеристик выбираемого соединения, состояния, которое следует лечить, стадии состояния, которое следует лечить, и других относящихся обстоятельств. Авторы ссылаются на Remingtons Pharmaceutical Sciences, 19th edition, Mack Publishing Co. (1995) для получения дополнительной информации.
Соединения формулы (I) можно вводить отдельно или в форме фармацевтической композиции совместно с фармацевтически приемлемым носителем, разбавителем или наполнителем. Соединения формулы (I), несмотря на то, что эффективны и сами, обычно составляются и вводятся в форме их фармацевтически приемлемых солей, поскольку эти формы обычно более стабильны, легче кристаллизуются и имеют повышенную растворимость.
Однако соединения, как правило, применяют в форме фармацевтических композиций, которые составляются в зависимости от желаемого вида введения. Композиции готовят в порядке, хорошо известном из уровня техники.
Соединение формулы (I) обычно комбинируют с носителем для получения лекарственной формы, подходящей для конкретного пациента, которого лечат, и конкретного метода введения. Например, состав, предназначенный для перорального введения людям, может содержать от приблизительно 0,5 мг до приблизительно 5 г соединения данного изобретения, составленного с подходящим и пригодным количеством материала-носителя, которое может изменяться в пределах от приблизительно 5 до приблизительно 99,95 процентов от общей композиции. Типичные лекарственные формы обычно будут содержать от приблизительно 1 мг до приблизительно 500 мг соединения данного изобретения, как правило, 25 мг, 50 мг, 100 мг, 200 мг, 300 мг, 400 мг, 500 мг, 600 мг, 800 мг или 1000 мг. Соединения данного изобретения можно также составить для местной доставки в составах, таких как растворы, мази, лосьоны, гели, крема, микроэмульсии или трансдермальные пластыри. Например, эти местные составы могут содержать 0,005 - 5% (вес/вес или вес/объем) соединения данного изобретения.
Соединения формулы (I) можно применять или вводить совместно с одним или более дополнительным лекарственным средством(ами). Соединения данного изобретения можно применять совместно с одним или более другими фармацевтически-активными соединениями, такими как другие лечения против акне. В одном варианте осуществления другое фармацевтически активное вещество выбирают из группы, включающей антибиотики, ретиноиды, антиандрогены и стероиды. Примеры других фармацевтически активных соединений, которые можно объединять с соединением формулы (I) и вводить в одновременной или последовательной их комбинации, могут включать, путем неограничивающих примеров, другие вещества против акне, такие как пероральные ретиноиды (например, изотретиноин), местные ретиноиды (например, изотретиноин, адапален, тазаротен), пероральные или местные антибиотики (например, клиндамицин, эритромицин, миноциклин, тетрациклин, бензоилпероксид) или гормональные терапии (например, дроспиренон, норгестимат - этинилэстрадиол, ципротеронацетат). Как указано, эти компоненты можно вводить в одном составе или в отдельных составах. При введении в отдельных составах соединения данного изобретения можно вводить последовательно или одновременно с другим лекарственным средством(ами).
Фармацевтические композиции, подходящие для применения в данном изобретении для парентеральной инъекции, содержат фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для преобразования непосредственно перед применением в стерильные инъецируемые растворы или дисперсии. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или сред включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и подобное) и их подходящие смеси, растительные масла (такие как оливковое масло), и инъецируемые органические сложные эфиры, такие как этилолеат. Подходящая текучесть может поддерживаться, например, посредством применения покрывающих материалов, таких как лецитин, посредством поддержания требуемого размера частиц в случае дисперсий, и посредством применения поверхностно-активных веществ.
Эти композиции могут также содержать вспомогательные средства, такие как консервант, увлажняющие вещества, эмульгирующие вещества и диспергирующие вещества. Предотвращение воздействия микроорганизмов можно обеспечить включением различных антибактериальных и противогрибковых веществ, например, парабена, хлорбутанола, фенолсорбиновой кислоты и подобное. Также может быть желаемым включение изотонических веществ, таких как сахара, хлорид натрия и подобное. Пролонгированную абсорбцию инъецируемой фармацевтической формы можно вызвать включением веществ, которые задерживают абсорбцию, таких как моностеарат алюминия и желатин.
При необходимости, и для более эффективного распределения, соединения можно включить в медленно высвобождающиеся или нацеленные системы доставки, такие как полимерные матрицы, липосомы и микросферы.
Инъецируемые составы можно стерилизовать, например, посредством фильтрации через задерживающий бактерии фильтр или посредством включения стерилизующих веществ в форме стерильных твердых композиций, которые можно растворить или диспергировать в стерильной воде или другой стерильной инъецируемой среде непосредственно перед применением.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, драже, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешивают, по меньшей мере, с одним инертным, фармацевтически приемлемым наполнителем или носителем, такими как цитрат натрия или дикальцийфосфат'и/или а) наполнителями или разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик, с) увлажнителями, таким как глицерин, d) распадающимися веществами, такими как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, e) замедлителями растворения, такими как парафин, f) ускорителями абсорбции, такими как соединения четвертичного аммония, g) увлажняющими веществами, такими как, например, цетиловый спирти глицеролмоностеарат, h) абсорбентами, такими как каолин и бентонитовая глина, и i) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смесями. В случае капсул, таблеток и драже, лекарственная форма может также содержать буферные вещества.
Твердые композиции подобного типа можно также использовать в качестве наполнителей в мягких и твердо-заполненных желатиновых капсулах, используя такие наполнители, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и подобное.
Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул можно приготовить с покрытиями и оболочками, такими как энтеросолюбильные покрытия таблеток и другие покрытия, хорошо известные в области фармацевтического составления. Они могут факультативно содержать замутняющие компоненты и также могут включать композицию, из которой они высвобождают только активный ингредиент(ы), или предпочтительно, в определенных частях кишечника, факультативно, пролонгированным способом. Примеры заливочных композиций, которые можно применять, включают полимерные вещества и воски.
При необходимости, и для более эффективного распределения, соединения можно включать в медленно высвобождающиеся или нацеленные системы доставки, такие как полимерные матрицы, липосомы и микросферы.
Активные соединения могут также быть в микроинкапсулированной форме, при необходимости, с одним или более вышеупомянутыми наполнителями.
Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие лекарственные формы могут содержать инертные разбавители, обычно применяемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие вещества и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое масло, земляного ореха, кукурузное, зародышевое, оливковое, касторовое и сезамовое масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и жирнокислотные сложные эфиры сорбитана и их смеси.
Кроме того, инертные разбавители, пероральные композиции могут также включать адъюванты, такие как увлажняющие вещества, эмульгирующие и суспендирующие вещества, подслащивающие, ароматизирующие и отдушивающие вещества.
Суспензии, дополнительно к активным соединениям, могут содержать суспендирующие вещества, как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сорбитановые сложные эфиры, микрокристаллическую целлюлозу, алюминия метагидроксид, бентонит, агар-агар и трагакант и их смеси.
Композиции для ректального или вагинального введения представляют собой предпочтительно суппозитории, которые можно приготовить смешиванием соединений данного изобретения с подходящими нераздражающими наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск суппозитория, которые являются твердыми при комнатной температуре, но жидкими при температуре тела и, следовательно, плавятся в прямой кишке или вагинальной полости, и высвобождают активное соединение.
Для местного применения активное вещество может быть в форме мази, крема, суспензии, лосьона, порошка, раствора, пасты, геля, распыляемого раствора, аэрозоля или масла. Как вариант, композиция может доставляться с помощью липосомы, наносомы, ривосомы или нутри-диффузорной среды. С другой стороны, состав может включать трансдермальный пластырь или повязку, такую как перевязку, пропитанную активным ингредиентом и факультативно одним или более носителями или разбавителями. Для введения в форме трансдермальной системы доставки, введение дозировки будет, конечно, скорее непрерывным, а не прерывистым в ходе схемы приема. Способы производства составов для местного применения известны в данной области техники.
Композиции, используемые для местного применения, обычно содержат фармацевтически приемлемый носитель, который может представлять собой любую среду, которая является токсилогически и фармацевтически приемлемой. Обычные фармацевтически приемлемые носители, которые могут применяться в композициях данного изобретения, включают воду, этанол, ацетон, изопропиловый спирт, стеариловый спирт, фреоны, поливинилпирролидон, пропиленгликоль, полиэтиленгликоль, душистые вещества, гель-продуцирующие материалы, минеральное масло, стеариновую кислоту, спермацет, сорбитан, монолеат, полисорбат, «твины», сорбит, метилцеллюлозу, пертолатум, минеральное масло (вазелиновое масло), которое может представлять собой любой продукт на нефтяной основе; модифицированные или немодифицированные растительные масла, такие как арахисовое масло, масло пшеничных зародышей, льняное масло, масло жожоба, масло из косточек абрикоса, ореховое масло, пальмовое масло, фисташковое масло, сезамовое масло, сурепное масло, можжевеловое масло, масло из зародышей кукурузы, масло персиковых косточек, маковое масло, сосновое масло, касторовое масло, масло из соевых бобов, сафлоровое масло, кокосовое масло, масло лесного ореха, масло из виноградных косточек, масло авокадо, соевое масло, масло сладкого миндаля, масло калофилла, касторовое масло, оливковое масло, подсолнечное масло или животные масла, такие как китовый жир, тюлений жир, менхэденовый жир, жир печени палтуса, жир печени трески, тресковый, тунцовый, черепаший жир, жир лошадиного копыта, овечьей лапы, норки, выдры, сурка и подобное; синтетические масла, такие как силиконовое масло, такое как диметилполисилоксан; алкильные и алкенильные сложные эфиры жирных кислот, такие как изопропильные сложные эфиры миристиновых, пальмитиновых и стеариновых кислот и жирные сложные эфиры, которые являются твердыми при комнатной температуре; воски, такие как ланолиновый воск, канделильский воск, спермацетовый, масло какао, масло карите, силиконовый воски, гидрогенизированные масла, которые являются твердыми при комнатной температуре, сахаро-глицериды, олеаты, миристаты, линолеаты, стеараты, парафин, пчелиный воск, карнаубский воск, озокеритовый, канделильский воск, микрокристаллический воск; жирные спирты, такие как лауриловый, цетиловый, миристиловый, стеариловый, пальмитиловый и олеиловый спирты; полиоксиэтилированные жирные спирты; и восковые сложные эфиры, ланолин и его производные, пергидросквален и насыщенные сложные эфиры, этилпальмитат, изопропилпальмитат, алкилмиристаты, такие как изопропилмиристат, бутилмиристат и децилмиристат, гексилстеарат, триглицеридные сложные эфиры, триглицериды октеновой и декановой кислоты, цетилрицинолеат, стеарилоктаноат (пурцеллиновое масло), жирные кислоты, многоатомные спирты, полиэфирные производные, жирнокислотные моноглицериды, полиэтиленгликоль, пропиленгликоль, алкилэтоксиэфирсульфонаты, аммонийалкилсульфаты, мыла жирных кислот и гидрогенизированный полиизобутен и смеси восков и масел.
Композиции для местного применения можно составить в различных формах. Однако композиция может часто принимать форму водного или масляного раствора, или дисперсии, или эмульсии, или геля, или крема. Эмульсия может представлять собой эмульсию типа масло-в-воде или эмульсию типа вода-в-масле.
Масляная фаза эмульсий типа вода-в-масле или масло-в-воде может содержать, например: а) углеводородные масла, такие как парафин или минеральные масла; b) воски, такие как пчелиный воск или парафиновый воск; с) натуральные масла, такие как подсолнечное масло, масло из косточек абрикоса, масло из масляного дерева или масло жожоба; d) силиконовые масла, такие как диметикон, циклометикон или цетилдиметикон; е) жирнокислотные сложные эфиры, такие как изопропилпальмитат, изопропилмиристат, диоктилмалеат, глицерилолеат и цетостеарилизононаноат; f) жирные спирты, такие как цетиловый спирт или стеариловый спирт и их смеси (например, цетиариловый спирт); g) полипропиленгликолевые или полиэтиленгликолевые эфиры, например, PPG-14 бутиловый эфир; или h) их смеси.
Применяемые эмульгаторы могут представлять собой любые эмульгаторы, известные в данной области техники для применения в эмульсиях типа вода-в-масле или масло-в-воде. Известные косметически приемлемые эмульгаторы включают: a) сесквиолеаты, такие как сорбитансесквиолеат, доступный коммерчески, например, под торговым названием Arlacel 83 (ICI), или полиглицерил-2-сесквиолеат; b) этоксилированные сложные эфиры производных натуральных масел, такие как полиэтоксилированный сложный эфир гидрогенизированного касторового масла, доступного коммерчески, например, под торговым названием Arlacel 989 (ICI); с) силиконовые эмульгаторы, такие как силиконполиолы, доступные коммерчески, например, под торговым названием ABIL WS08 (Th. Goldschmidt AG); d) анионные эмульгаторы, такие как мыла жирных кислот, например, стеарат калия и сульфаты жирных кислот, например, цетостеарилсульфат натрия, доступный коммерчески под торговым названием Dehydag (Henkel); e) этоксилированные жирные спирты, например, эмульгаторы, доступные коммерчески под торговым названием Brij (ICI); f) сложные эфиры сорбитана, например, эмульгаторы, доступные коммерчески под торговым названием Span (ICI); g) этоксилированные сложные эфиры сорбитана, например, эмульгаторы, доступные коммерчески под торговым названием Tween (ICI); h) этоксилированные жирнокислотные сложные эфиры, такие как этоксилированные стеараты, например, эмульгаторы, доступные коммерчески под торговым названием Myrj (ICI); i) этоксилированные моно-, ди- и триглицериды, например, эмульгаторы, доступные коммерчески под торговым названием Labrafil (Alfa Chem.); j) неионные самоэмульгирующиеся воски, например воск, доступный коммерчески под торговым названием Polawax (Croda); k) этоксилированные жирные кислоты, например, эмульгаторы, доступные коммерчески под торговым названием Tefose (Alfa Chem.); l) метилглюкозные сложные эфиры, такие как полиглицерин-3 метилглюкозы дистеарат, доступный коммерчески под названием Tegocare 450 (Degussa Goldschmidt); или m) их смеси.
Гели для местного применения могут быть водными или неводными. Водные гели предпочтительны. Гель будет содержать загуститель или желатинирующее вещество для придания достаточной вязкости гелю. Ряд загустителей можно применять в соответствии с природой жидкого носителя и требуемой вязкостью, и они перечислены ниже. Особенно подходящим загустителем является сополимер акрилоилдиметилтауриновой кислоты (или ее соли), предпочтительно сополимер этого мономера с другим виниловым мономером. Например, загуститель представляет собой сополимер соли акрилоилдиметилтауриновой кислоты с другим виниловым мономером. Соль может представлять собой соль щелочных металлов I группы, но более предпочтительно представляет собой аммонийную соль. Примерами подходящих сополимерных загустителей являются: i) аммонийный акрилоилдиметилтаурат I винилпирролидон сополимер, то есть сополимер аммонийного акрилоилдиметилтаурата и винилпирролидона (1-винил-2-пирролидон).
Композиция может дополнительно включать другие активные вещества ухода за кожей, которые хорошо известны из уровня техники, которые могут быть эффективными для поддержки нормального функционирования кожи. Одна группа предпочтительных композиций включает гидролизованный молочный белок для регулирования выработки кожного сала.
Композиция может дополнительно включать другие компоненты, которые будут хорошо известны специалисту в данной области техники, такие как смягчители, увлажнители, стабилизирующие эмульсию соли, консерванты, хелатирующие вещества или комплексообразующие соединения (связывающие соединения), абразивы, антиоксиданты, стабилизаторы, регулировщики рН, поверхностно-активные вещества, загустители, разбавители, отдушки и красящие вещества.
Составы для местного применения могут желательно включать соединение, которое усиливает абсорбцию или проникновение активного ингредиента через кожу или другие пораженные зоны. Примеры таких усилителей дермального проникновения включают диметилсульфоксид и родственные аналоги.
Количество вводимого соединения будет предпочтительно лечить и улучшать или облегчать состояние. Терапевтически эффективное количество может без труда определить лечащий диагност с помощью применения общепринятых методов и наблюдением результатов, полученных при аналогичных обстоятельствах. При определении терапевтически эффективного количества следует рассматривать ряд факторов, включая, но без ограничений, вид животного, его размер, возраст и общее состояние здоровья, пол, режим питания, вовлеченное специфическое состояние, тяжесть состояния, ответ пациента на лечение, конкретное вводимое соединение, вид введения, биологическая доступность вводимого препарата, выбранный режим дозирования, применение других лекарственных средств и других относящихся обстоятельств.
Предпочтительная дозировка будет находиться в области приблизительно 0,01 - 300 мг на килограмм веса тела в день. Более предпочтительная дозировка будет находиться в области 0,1 - 100 мг на килограмм веса тела в день, более предпочтительно 0,2 - 80 мг на килограмм веса тела в день, даже более предпочтительно 0,2 - 50 мг на килограмм веса тела в день. Подходящую дозу можно вводить в многочисленных субдозах в день.
СИНТЕЗ СОЕДИНЕНИЙ ДЛЯ ПРИМЕНЕНИЯ В ДАННОМ ИЗОБРЕТЕНИИ
Общий подход синтеза к соединениям для применения в данном изобретении протекает через ключевой промежуточный продукт А, производимый как изложено в схемах 1 или 2.
На схеме 1 аминокислотное производное V-N(R2)-Y-CO2H (V=R1X или защитная группа амина Р1) превращают в амид Вейнреба посредством активации карбоксильной группы и амидирования N-метилметоксиамина. Добавление винилового реактива Гриньяра продуцирует аминоалкилвинилкетон, который подвергают сопряженному присоединению с R6R7R8C(CR5aR5b)rNH2 аминовым компонентом (показанным как WNH2 для простоты). Получившийся вторичный амин ацилируют при стандартных условиях пептидного соединения с защищенной аминокислотой, P2-NHCH(U)-CO2H, где U представляет или конечную боковую цепь R, защищенную конечную боковую цепь R-P3, или предшественник, которому необходимо химическое модифицирование для образования конечной боковой цепи R. Снятие защитной группы Р2 с последующим внутримолекулярным восстановительным аминированием кетона при помощи стандартных условий восстановления, таких как H2/Pd катализатор, NaBH4, NaBH3CN или NaBH(OAc)3, с образованием ключевого промежуточного продукта А. Если Y=CH2 или CH2CH2, то А образуется как преимущественный диастереомер. Если V=R1X и U=R, то А является конечным продуктом.
Схема 1: Синтез промежуточного продукта А посредством внутримолекулярного восстановительного аминирования
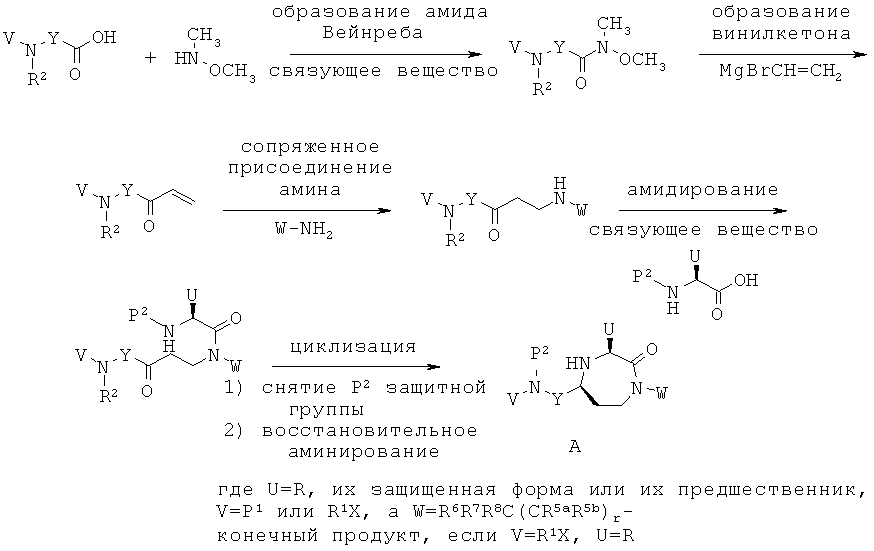
На схеме 2 альтернативный путь к требуемому промежуточному продукту А начинается с такого же образования амида Вейнреба, винилового присоединения Гриньяра и аминового сопряженного присоединения. На этом этапе вторичный амин защищен защитной группой амина Р4. Кетон затем восстановительно аминируют защищенным аминосложным эфиром, H2NCH(U)-СО2Р5, продуцируя смесь диастереомеров, которая проводится через последующие этапы реакции. Кольцевую систему получают в результате снятия защитных групп Р4 и Р5, с последующим образованием амидной связи при помощи стандартных реактивов пептидного соединения. Альтернативно, защитную группу Р4 удаляют и достигают циклизации посредством термической или основание-индуцируемой циклизации с Р5-защищенным сложным эфиром. Циклизация продуцирует смесь двух диастереомеров, А и В, из которых предпочтительные диастереомеры А можно отделить хроматографией.
Схема 2: Синтез промежуточного продукта А посредством внутримолекулярного восстановительного аминирования
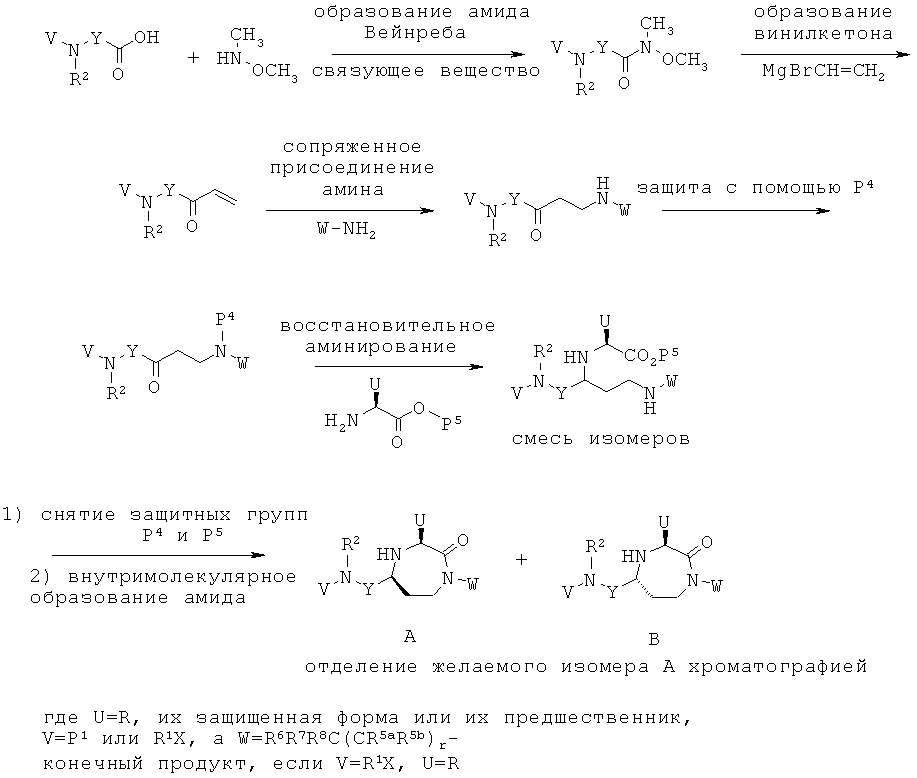
Ключевой промежуточный продукт А может представлять собой конечный продукт, если U=R и V=R1X, но в остальных случаях превращается в конечный продукт, как показано на схемах 3, 4 и 5.
На схеме 3, где V=R1X, конечный продукт получают модифицированием боковой цепи U, например, удалением защитной группы Р3 или удалением защитной группы Р3, с последующим дополнительным химическим модифицированием.
Схема 3: V=R1X
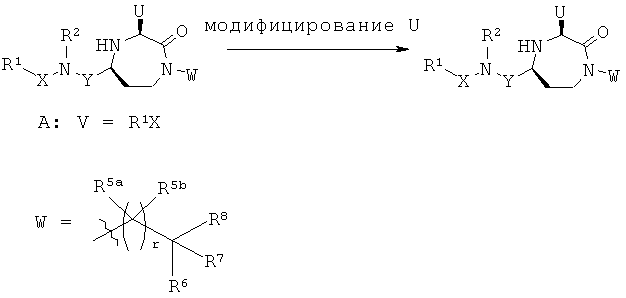
На схеме 4, где V=Р1, конечный продукт получают удалением защитной группы Р1, с последующим введением заместителя R1X. Если U=R, это продуцирует конечный продукт. Альтернативно, боковую цепь U затем модифицируют для получения конечной R группы, как на схеме 3.
Схема 4: V=P1

На схеме 5, где V=Р1, конечный продукт получают, сначала модифицируя боковую цепь U для получения конечной R группы, как на схеме 3. Это сопровождается удалением защитной группы Р1, с последующим введением заместителя R1X.
Схема 5: V=P1
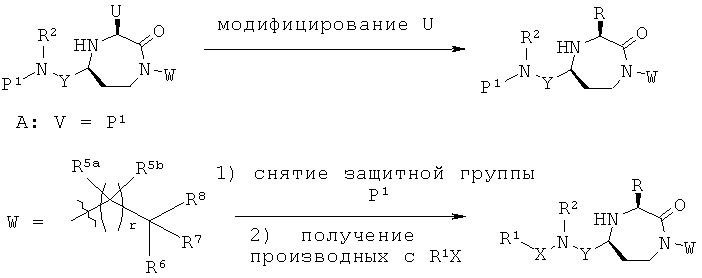
Также возможно модифицировать заместитель W, если необходимо, во время последовательностей этих реакций.
Примеры
Следующие примеры предназначены для того, чтобы показать раскрытые варианты осуществления, и не должны истолковываться, как ограничивающие их. Дополнительные соединения, помимо тех, которые описаны ниже, можно получить при помощи следующих описанных схем реакций, как отмечалось выше, или подходящих их вариаций или модификаций. Все исходные вещества, описанные в Примерах ниже, коммерчески доступны или легко синтезируются специалистами в данной области.
Оборудование
Анализ ВЭЖХ (высокоэффективная жидкостная хроматография) проводили на системе очистки Agilent серии 1100 с Phenomenex Synergi 4µ Max-RP 80A, 50×2,00 мм аналитической ВЭЖХ колонке, с обнаружением пиков посредством УФ. При стандартном анализе использовали скорость потока 1 мл/мин 0,05% трифторуксусной кислоты (TFA) в воде (растворитель А) и 0,05% TFA в 90:10 ацетонитрил:вода (растворитель В), используя градиент от 5% В (начальный) до 95% В в течение 9 минут. Массовые спектры получали на Applied Biosystems MDS Sciex API 2000 LC/MS/MS тройном квадрупольном масс-спектрометре и анализировали ионораспыляющей масс-спектрометрией (ISMS). Препаративную ВЭЖХ проводили на Waters Delta Prep 3000 ВЭЖХ системе с обнаружением пиков посредством УФ (Waters модель 486 настраиваемый абсорбционный детектор), используя Phenomenex Luna 10µ С5 100А, 250×21,20 мм (20 мг шкала), Phenomenex Luna 15u C8(2) 100А, 250×30,00 мм (50 мг шкала) или Phenomenex Luna 15µ С8(2) 100А, 250×50,00 мм (100 мг шкала) ВЭЖХ колонки. Для системы растворителя использовали различные градиенты 0,05% TFA в воде (растворитель А) и 0,05% TFA в 90:10 ацетонитрил:вода (растворитель В).
Следующие примеры 1-7 предлагают общие методики синтеза, которым можно следовать для проведения превращений, описанных на схемах 1-5. Для образования различных конечных продуктов при помощи этих методик необходимо или изменять изменяемую группу на исходном материале, или изменять изменяемую группу на одном из реактивов в зависимости от характера реакции. Специалисту в данной области будет ясно из прочтения общих методик как изменить или исходный материал, или реактивы, используемые в методике для продуцирования различных конечных продуктов. К тому же, в зависимости от исходных материалов и реактивов, может возникнуть необходимость и/или желание сделать незначительные модификации в описанных общих методиках для того, чтобы обеспечить наиболее легкий синтез необходимого конечного продукта.
Пример 1 - Общая методика - образование амида Вейнреба

ВОР (бензотриазол-1-ил-окси-трис-(диметиламино)-фосфонийгексафтор фосфат) реактив (100 ммоль) и диизопропилэтиламин (DIPEA) (100 ммоль) добавляют к перемешиваемому раствору аминокислоты (1) (100 ммоль) в дихлорметане (DCM) (100 мл). Раствор затем перемешивают при комнатной температуре в течение 10 мин, перед добавлением предварительно смешанного раствора N,O-диметилгидроксиламин гидрохлорида (100 ммоль) и DIPEA (100 ммоль) с последующим перемешиванием при комнатной температуре всю ночь. DCM затем удаляют посредством ротационного испарения и остаток поглощают в этилацетате (EtOAc) (200 мл). Органическую фазу затем промывают 1Н HCl (3×100 мл), H2O (3×100 мл), насыщенный водным раствором NaHCO3 (3×100 мл) и соляным раствором (1×10 мл). Органическую фазу затем высушивают (MgSO4) и EtOAc удаляют для получения амида Вейнреба (2) в форме белого твердого вещества или масла.
Пример 2 - Общая методика - присоединение винила Гриньяра к амиду Вейнреба для образования α,β-ненасыщенных кетонов формулы (3)
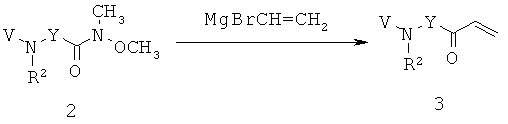
К амиду Вейнреба (2) (15 ммоль) в DCM (10 мл) при 0°С добавляют винилмагнийбромид (45 ммоль) в THF (45 мл). Реакцию перемешивают в течение 2 часов и проверяют при помощи ВЭЖХ. Реакцию затем быстро охлаждают при помощи добавления к ней смеси льда и 1М HCl (200 мл). Водную смесь экстрагируют DCM (3×100 мл) и органические слои объединяют и промывают 1М HCl (2×200 мл) и H2O (3×100 мл). Органическую фазу высушивают (MgSO4) для получения раствора α,β-ненасыщенного кетона (3). α,β-Ненасыщенный кетон (3) можно выделить ротационным испарением или его можно применять в растворе без дополнительной очистки. Если цель заключается в применении α,β-ненасыщенного кетона (3) в растворе, объем уменьшают до 100 мл при помощи ротационного испарения и хранят для дальнейшего применения.
Пример 3 Общая методика - сопряженное присоединение амина к α,β-ненасыщенным кетонам формулы (3) для получения соединений формулы (4)

К амину W-NH2 (7,4 ммоль) в DCM (10 мл) добавляют раствор α,β-ненасыщенного кетона (3) (5,7 ммоль) в DCM (50 мл). Раствор перемешивают при комнатной температуре в течение 15 минут или до тех пор, пока анализ не покажет, что все из (3) израсходованы. Раствор соединения (4) непосредственно применяют без очистки для последующей реакции.
Пример 4 Общая методика - ацилирование аминокетона (4)
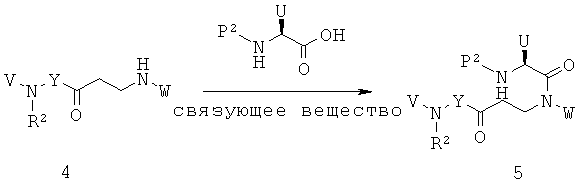
Аминокислоту P2-NHCH(U)-CO2H (15 ммоль) и DIC (15 ммоль) добавляют к раствору DCM, содержащему 10 ммоль аддукта 4 сопряженного присоединения. Реакцию перемешивают при комнатной температуре всю ночь. DCM удаляют при помощи ротационного испарения, и остаток затем подвергают колоночной хроматографии на силикагеле, с применением уайт-спирит:EtOAc для получения 5.
В качестве альтернативы DIC можно заменить на HATU (2-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат) (15 ммоль) и DIPEA (15 ммоль). Реакцию перемешивают при комнатной температуре всю ночь. DCM удаляют при помощи ротационного испарения, и остаток поглощают в EtOAc (100 мл). Органический слой промывают насыщенным раствором бикарбоната натрия (2×100 мл), насыщенным раствором хлорида аммония (2×100 мл) и соляным раствором (2×100 мл). Органическую фазу высушивают и растворитель удаляют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, используя петролейный эфир:EtOAc для получения 5.
Пример 5 Общая методика - снятие защитной группы Р2 и циклизация

Методика, выбранная для удаления защитной группы P2, будет изменяться в зависимости от конкретной природы защитной группы. Как будет оценено специалистом в данной области, можно использовать большее количество возможных защитных групп, и специалист в данной области без труда сможет определить подходящую методику для удаления любой отдельной защитной группы из методик, известных из уровня техники. Тем не менее, для того, чтобы помочь читателю, приводятся общие методики удаления наиболее известных защитных групп. Р2=Fmoc: К соединению 5 (2 ммоль) в DCM (3 мл) добавляют диэтиламин (20 ммоль). Реакцию перемешивают при комнатной температуре в течение 1 часа. DCM и диэтиламин затем удаляют при помощи ротационного испарения. DCM (5 мл) и затем добавляют триацетоксиборогидрид натрия (3 ммоль), и реакцию перемешивают всю ночь при комнатной температуре. Органическую фазу промывают насыщенным раствором бикарбоната натрия (25 мл), высушивают (MgSO4) и удаляют DCM для получения циклизованного продукта А. Его можно очистить флэш-хроматографией на силикагеле или использовать без очистки.
Р2=Boc: К соединению 5 (2 ммоль) в DCM (3 мл) добавляют TFA (3 мл) и реакцию перемешивают при комнатной температуре в течение 2 часов. DCM и TFA затем удаляют при помощи ротационного испарения. Затем добавляют DCM (5 мл) и триацетоксиборогидрид натрия (3 ммоль) и реакцию перемешивают всю ночь при комнатной температуре. Органическую фазу промывают насыщенным раствором бикарбоната натрия (25 мл), высушивают (MgSO4) и удаляют DCM, для получения циклизованного продукта А. Его можно очистить флэш-хроматографией на силикагеле или использовать без очистки.
Р2=Cbz: Смесь неочищенного 5 (1 ммоль) и 5% Pd/C (200 мг) в 2-пропаноле (15 мл) встряхивают при комнатной температуре под водородом (30 psi (фунтов на квадратный дюйм)) в течение 24 часов. Смесь затем фильтруют через прокладку из Целита и фильтрат концентрируют при пониженном давлении для получения неочищенного продукта. Для получения А можно применять очистку при помощи флэш-хроматографии на силикагеле (100% EtOAc).
Пример 6 Общая методика - снятие защитной группы Р1 и получение производных c R1X

Методика, выбранная для удаления защитной группы Р1, будет изменяться в зависимости от конкретной природы защитной группы. Как будет оценено специалистом в данной области, можно применять большое количество возможных защитных групп, и специалист в данной области без труда сможет определить подходящую методику для удаления любой отдельной защитной группы из методик, известных из уровня техники. Тем не менее, для того, чтобы помочь читателю, приводятся общие методики удаления наиболее известных защитных групп.
Снятие защитных групп, Р1=Cbz:
К циклизованному продукту А (1 ммоль) в метаноле (5 мл) добавляют каталитический Pd/C. Реакцию перемешивают в атмосфере водорода всю ночь. Реакционную смесь фильтруют через Целит, и метанол удаляют при помощи ротационного испарения, для получения свободного амина. Амин можно использовать в последующей реакции без очистки.
Снятие защитных групп, Р1=Boc:
К циклизованному продукту А (1 ммоль) в DCM (1 мл) добавляют TFA (1 мл) и реакцию перемешивают при комнатной температуре в течение 2 часов. Растворитель удаляют при помощи ротационного испарения для получения аминной TFA соли, которую можно использовать в последующей реакции без очистки.
Снятие защитных групп, Р1=Alloc:
К циклизованному продукту А (1 ммоль) в DCM (6 мл) добавляют 1,3-диметилбарбитуровую кислоту (0,2 ммоль) и палладия тетракистрифенилфосфин (10 мг). Реакцию вакуумируют и перемешивают при комнатной температуре в течение 1 часа. DCM удаляют при пониженном давлении для получения неочищенного свободного амина, который можно использовать в последующей реакции без очистки.
Получение производных с R1X, когда Х=С(=O):
К свободному амину (1 ммоль) в DCM (5 мл) добавляют DIPEA (1 ммоль), ВОР реактив (1,5 ммоль) и кислотный компонент R1CO2H (1,5 ммоль). Реакцию перемешивают при комнатной температуре в течение 2 часов. Ротационное испарение и препаративная ВЭЖХ дает очищенный аддукт.
Пример 7 Общая методика - модифицирование U посредством снятия защитной группы Р3 и диалкилирования дибромидом
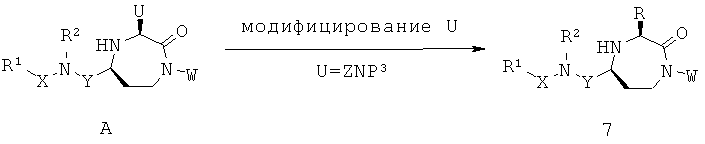
Методика, выбранная для модифицирования U посредством снятия защитной группы и получения производных, будет изменяться в зависимости от конкретной природы группы U. Как будет оценено специалистом в данной области, возможно большое количество видоизменений, и специалист в данной области без труда сможет определить подходящую методику для превращения в необходимую R группу. Тем не менее, для того, чтобы помочь читателю, приводится одна общая методика модифицирования, обычно используемая для ряда следующих примеров.
Р3=Boc:
К защищенному амину (1 ммоль) в DCM (5 мл) добавляют TFA (5 мл) и реакцию перемешивают при комнатной температуре в течение 2 часов. Добавляют DCM (20 мл) и раствор промывают насыщенным раствором бикарбоната натрия (20 мл), высушивают (MgSO4) и выпаривают для получения неочищенного амина. К неочищенному амину добавляют DMF (диметилформамид) (0,5 мл), карбонат калия (50 мг) и 1,5-дибромпентан (5 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1,5 часов, после чего добавляют DCM (20 мл), органический слой промывают насыщенным раствором бикарбоната натрия (20 мл) и Н2О (20 мл), высушивают (MgSO4) и выпаривают. Остаток можно очистить препаративной ВЭЖХ для получения пиперидинилового продукта. Очищенный продукт выделяют в виде TFA соли, но без труда превращают в свободное основание посредством нейтрализации водным NaHCO3 и экстракции в органический растворитель или дополнительно превращают в соль HCl при помощи подкисления 1Н HCl.
Пример 8 - Синтез соединения 8 N-(2-(метокси(метил)амино)-2-оксоэтил)-2-нафтамида
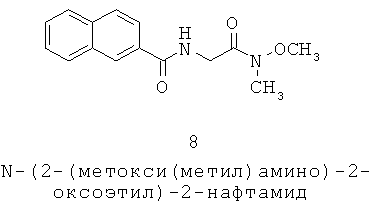
К смеси 2-нафтойной кислоты (5,8 г, 33,7 ммоль), 2-амино-N-метокси-N-метилацетамида (Gly амид Вейнреба; приготовленного из Boc-Gly амида Вейнреба 15, как в Примере 43) (3,8 г, 32,1 ммоль) и DIPEA (12,0 мл, 68,9 ммоль) в DCM (70 мл) добавляли ВОР (14,9 г, 33,7 ммоль) за одну порцию при комнатной температуре. Получившуюся смесь перемешивали в течение 1 часа, затем добавили насыщенный водный раствор NaHCO3. Органический слой промыли соляным раствором (5×60 мл) и 1 Н HCl (2×30 мл), высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта, который применяли в последующей реакции без дополнительной очистки.
Пример 9 - Синтез соединения 9 N-(2-(метокси(метил)амино)-2-оксоэтил)-2-нафтамида
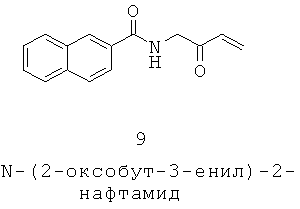
К раствору 8 (3,5 г, 12,85 ммоль) в сухом THF (10 мл) медленно добавили раствор винилмагнийбромида в THF (1 М, 31 мл) при 0°С. После добавления получившуюся смесь перемешивали при комнатной температуре в течение 1 часа, затем вылили в ледяной 20 раствор 1 Н HCl (50 мл). Водный слой экстрагировали DCM (3 х 80 мл) и объединенные органические слои высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта. MS (ESI) 240 (М+1); ВЭЖХ tR 5,46 минут.
Пример 10 - Синтез соединения 10 N-(4-(3,5-дихлорбензиламино)-2-оксобутил)-2-нафтамида
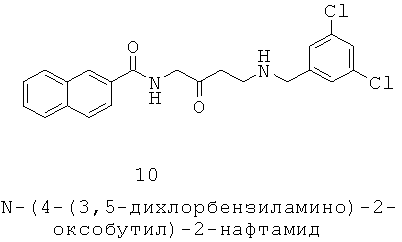
К раствору 3,5-дихлорбензиламина (12 мг, 0,068 ммоль) в DCM (0,2 мл) добавили раствор 9 (13 мг, 0,054 ммоль) в DCM (0,5 мл) при комнатной температуре. Получившуюся смесь перемешивали до тех пор, пока все из 9 не израсходовались (в течение одного часа) и затем применяли непосредственно в последующей реакции. MS (ESI) 415 (М+1); ВЭЖХ tR 6,00 минут.
Пример 11 - Синтез соединения 11 (S)-N-(4-(5-(3-Pbf-гуанидино)-2-(Fmoc-амино)-N-(3,5-дихлорбензил)пентанамидо)-2-оксобутил)-2-нафтамида
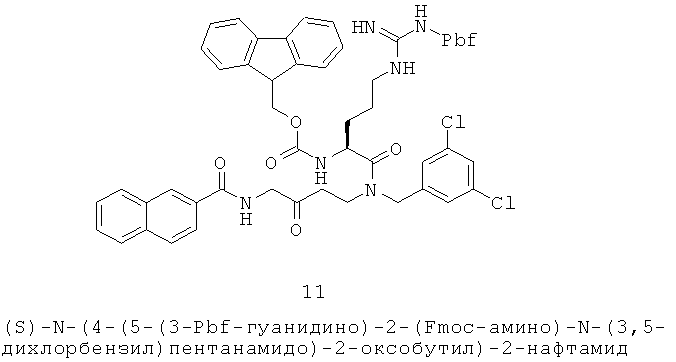
К раствору свежеприготовленного аминокетона 10 в DCM (2 мл) добавили Fmoc-L-Arg(Pbf)-OH (53 мг, 0,082 ммоль), с последующим добавлением DIC (12,5 мкл, 0,082 ммоль) при комнатной температуре. Получившуюся смесь перемешивали в течение 2 часов, затем растворитель удалили при пониженном давлении. Остаток профильтровали через короткую пробку из силикагеля, элюируя DCM с последующим EtOAc, для получения целевого продукта 11 в форме белого твердого вещества. Его применяли на следующем этапе без дополнительной очистки. MS (ESI) 1045 (М+1); ВЭЖХ tR 9,99 минут.
Пример 12 - Синтез соединения 12 (S)-N-(4-(5-(3-Pbf-гуанидино)-2-амино-N-(3,5-дихлорбензил)пентанамидо)-2-оксобутил)-2-нафтамида
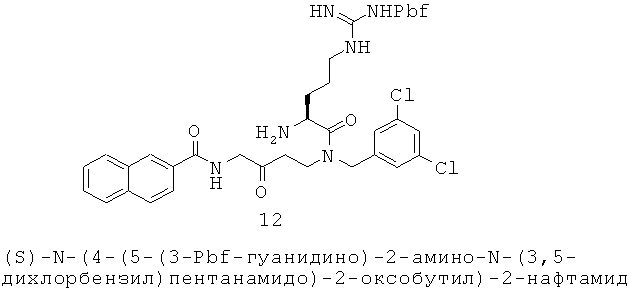
Диэтиламин (0,5 мл) добавили к Fmoc-защищенному 11 (56 мг, 0,054 ммоль) при комнатной температуре и получившуюся смесь перемешивали в течение 30 минут. Избыточное количество диэтиламина удалили при пониженном давлении для получения требуемого свободного амина 12. Его применяли на следующем этапе без дополнительной очистки. MS (ESI) 823 (М+1); ВЭЖХ tR 7,49 минут.
Пример 13 - Синтез соединения 13 N-(((3S,5S)-3-(3-(3-Pbf-гуанидино)пропил)-1-(3,5-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида
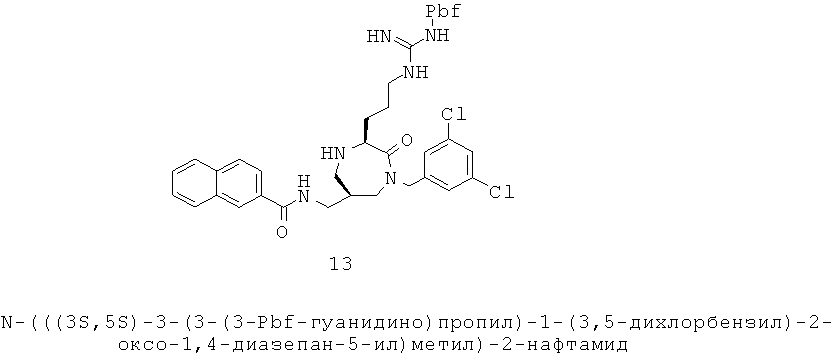
Аминокетон 12 (44 мг, 0,053 ммоль) в DCM (2 мл) циклизовали при помощи добавления NaBH(ОАс)3 (40 мг, 0,18 ммоль) за одну порцию при комнатной температуре. Получившуюся смесь перемешивали в течение 3 часов с последующим добавлением насыщенного водного раствора NaHCO3 (3 мл). Водный слой экстрагировали DCM (3×3 мл), и объединенные органические слои высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении. Остаток профильтровали через короткую пробку из силикагеля, элюируя DCM с последующим EtOAc, затем EtOAc/IPA (9:1), для получения целевого продукта 13 в форме белого твердого вещества. Его применяли на следующем этапе без дополнительной очистки. MS (ESI) 807 (М+1); ВЭЖХ tR 7,75 минут.
Пример 14 - Синтез соединения 14 N-(((3S,5S)-1-(3,5-дихлорбензил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида
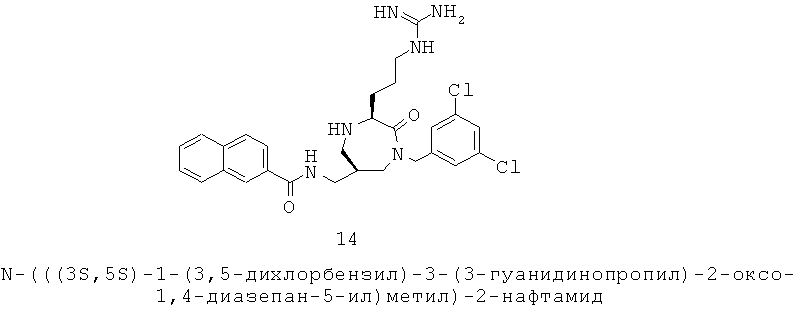
Раствор TFA/DCM (2:1) (1 мл) с 5% H2O добавили к 13 при комнатной температуре и получившуюся смесь перемешивали в течение 4 часов. Растворители удалили при пониженном давлении и остаток очистили при помощи препаративной ВЭЖХ (100% H2O к MeCN/H2O 9:1, градиент) для получения 14 (7,6 мг) в форме белого твердого вещества (TFA соль). Общий выход (из 9) составил приблизительно 18%. MS (ESI) 556,2 (М+1); ВЭЖХ tR 5,74 минут.
Пример 15 - Синтез соединения 15 трет-бутил 2-(метокси(метил)амино)-2-оксоэтилкарбамата (Boc-Gly амид Вейнреба)
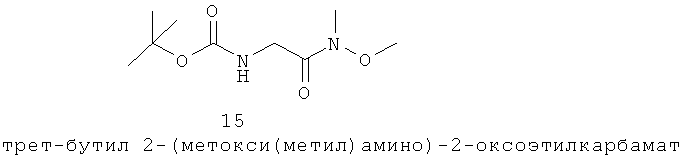
К перемешанной смеси Boc-Gly-OH (20 г, 114,1 ммоль), DIPEA (19,8 мл, 114,1 ммоль) и ВОР (50,5 г, 114,1 ммоль) в DCM (20 мл) добавили предварительно смешанный раствор N,O-диметилгидроксиламингидрохлорида (11,2 г, 114,1 ммоль) и DIPEA (19,8 мл, 114,1 ммоль) в DCM (20 мл) при комнатной температуре. Получившуюся смесь перемешивали в течение 16 часов, затем промыли 1Н HCl (3×120 мл), H2O (3×120 мл), насыщенным водным раствором NaHCO3 (3×120 мл) и соляным раствором (40 мл), высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения 15 в форме белого твердого вещества (20 г, 80%), который применяли на следующем этапе без дополнительной очистки. MS(ESI) 219 (М+1); ВЭЖХ tR 4,12 минут.
Пример 16 - Синтез соединения 16 трет-бутил 2-оксобут-3-енилкарбамата
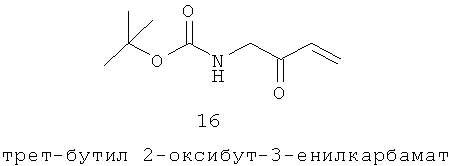
При 0°С раствор винилмагнийбромида в THF (184 мл, 1 М) добавили за одну порцию к амиду Вейнреба 15 (20 г, 91,6 ммоль) под азотом с перемешиванием. Полученной смеси позволили перемешиваться в течение 2 часов и вылили в смесь 1Н HCl/лед (400 мл). Водную смесь экстрагировали DCM (5[100 мл), объединенный DCM экстракт промыли 1Н HCl (2×100 мл), насыщенным водным раствором NaHCO3 (100 мл) и соляным раствором (100 мл), затем высушили над MgSO4. Растворитель удалили при пониженном давлении, получили кетон 16 (12,9 г, 76%) в форме бледно-желтого масла, который применяли на следующем этапе без дополнительной очистки. MS(ESI) 186 (М+1); ВЭЖХ tR 4,19 минут.
Пример 17 - Синтез соединения 17 трет-бутил 4-(2,2-дифенилэтиламино)-2-оксобутилкарбамата
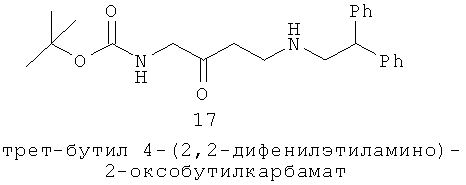
К перемешиваему раствору 2,2-дифенилэтиламина (0,33 г, 1,66 ммоль) в DCM (10 мл) добавили α,β-ненасыщенный кетон 16 (0,31 г, 1,66 ммоль) при комнатной температуре. Перемешивание продолжали в течение 2 часов; неочищенную реакционную смесь 17 применяли на следующем этапе без очистки. MS(ESI) 383 (М+1); ВЭЖХ tR 5,98 минут
Пример 18 - Синтез соединения 18 (S)-трет-бутил 3-метил-4,8-диоксо-10-фенил-2,9-диокса-3,7-диазадекан-6-карбоксилата
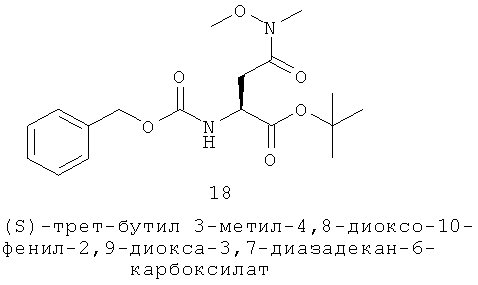
К суспензии соли Cbz-L-Asp-OtBu-DCHA (10,1 г, 20,0 ммоль), N,O-диметилгидроксиламин-HCl (5,9 г, 60,5 ммоль) и DIPEA (12,0 мл, 68,9 ммоль) в DCM (150 мл) добавили ВОР (10,6 г, 24,0 ммоль) за одну порцию при комнатной температуре. Получившуюся суспензию перемешивали в течение 3 часов, затем добавили H2O (100 мл). Органический слой промыли 1 Н HCl (2×100 мл), насыщенным водным раствором NaHCO3 (2×100 мл) и соляным раствором (3×100 мл) и затем высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта. Очистка при помощи флэш-хроматографии на силикагеле (пет. эфир/ EtOAc 1:2) дала 18 (6,4 г, 87%) в форме бесцветного масла. MS (ESI) 367 (М+1); ВЭЖХ tR 6,87 минут.
Пример 19 - Синтез соединения 19 (S)-3-метил-4,8-диоксо-10-фенил-2,9-диокса-3,7-диазадекан-6-карбоновой кислоты
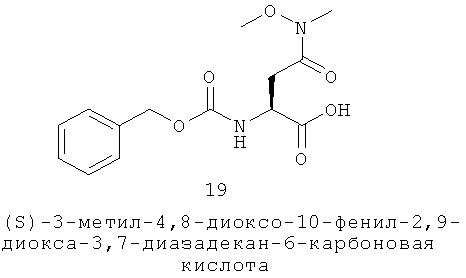
Соединение 18 (300 мг, 0,82 ммоль) растворили в TFA/DCM (1:1) растворе (2 мл) и получившуюся смесь перемешивали при комнатной температуре в течение 2 часов. Растворители удалили при пониженном давлении и остаток повторно растворили в DCM (10 мл). Этот раствор промыли 1 Н HCl (1×10 мл) и органический слой высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта 19 (235 мг, 92%), который применяли в последующей реакции без дополнительной очистки. MS (ESI) 311 (М+1); ВЭЖХ tR 4,96 минут.
Пример 20 - Синтез соединения 20 (S)-бензил 8-(2,2-дифенилэтил)-3,16,16-триметил-4,7,11,14-тетраоксо-2,15-диокса-3,8,13-триазагептадекан-6-илкарбамата
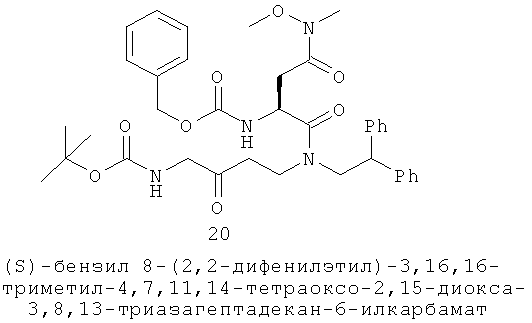
Соединение 20 получили из соединения 17 и 19, следуя методике Примера 5. MS (ESI) 675 (М+1); ВЭЖХ tR 8,31 минут.
Пример 21 - Синтез соединения 21 трет-бутил ((3S,5S)-1-(2,2-дифенилэтил)-3-(2-(метокси(метил)амино)-2-оксоэтил)-2-оксо-1,4-диазепан-5-ил)метилкарбамата
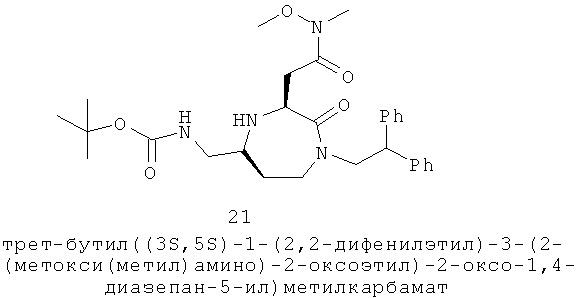
Смесь неочищенного 20 (350 мг) и 5% Pd/C (200 мг) в 2-пропаноле (15 мл) взбалтывали при комнатной температуре под водородом (30 psi) в течение 24 часов. Смесь затем профильтровали через прокладку из Целита и фильтрат сконцентрировали при пониженном давлении для получения неочищенного продукта. Очистка при помощи флэш-хроматографии на силикагеле (100% of EtOAc) дала 21 (175 мг, 65% через 3 этапа) в форме белого твердого вещества. MS (ESI) 525 (М+1); ВЭЖХ tR 6,24 минут.
Пример 22 - Синтез соединения 22 2-((2S,7S)-7-(аминометил)-4-(2,2-дифенилэтил)-3-оксо-1,4-диазепан-2-ил)-N-метокси-N-метилацетамида
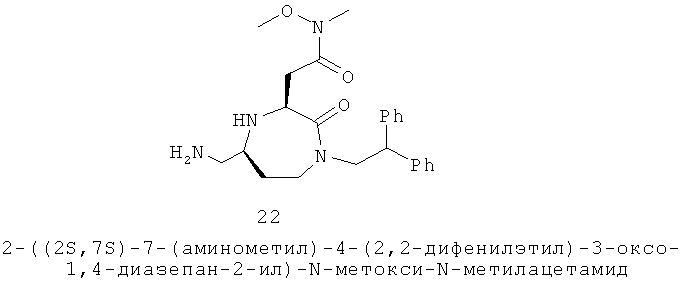
Соединение 21 (175 мг, 0,333 ммоль) растворили в TFA/DCM (1;1) растворе (1 мл) и получившуюся смесь перемешивали при комнатной температуре в течение 2 часов. Растворители удалили при пониженном давлении и остаток повторно растворили в EtOAc (20 мл). Насыщенный водный раствор NaHCO3 (10 мл) и соляной раствор (10 мл) добавили к вышеупомянутому раствору и водный слой экстрагировали EtOAc (9×20 мл). Объединенные органические слои высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта 22 (120 мг, 85%) в форме желтого твердого вещества, который применили в последующей реакции без дополнительной очистки. MS (ESI) 425 (М+1); ВЭЖХ tR 5,20 минут.
Пример 23 Синтез соединения 23 N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(2-(метокси(метил)амино)-2-оксоэтил)-2-оксо-1,4-диазепан-5-ил)метил)-6-фтор-2-нафтамида
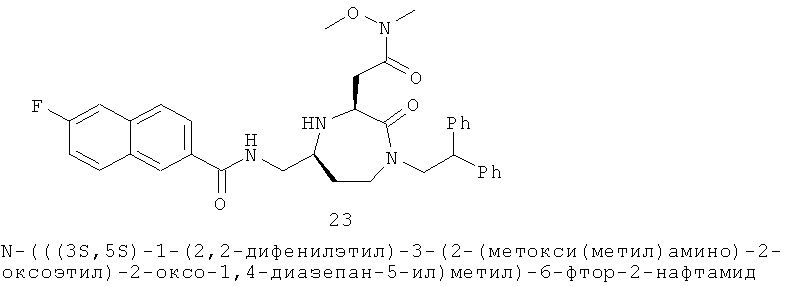
К раствору 22 (50 мг, 0,118 ммоль) и 6-фтор-2-нафтойной кислоты (27 мг, 0,142 ммоль) в DCM (4 мл) добавили DIC (22 мкл, 0,142 ммоль) при комнатной температуре. Получившуюся смесь перемешивали в течение 2 часов, затем растворитель удалили при пониженном давлении для получения неочищенного продукта. Очистка при помощи флэш-хроматографии на силикагеле (элюируя петролейным эфиром: EtOAc (1:1), затем EtOAc) дала 23 (29 мг, 41%) в форме белого твердого вещества. MS (ESI) 597 (М+1); ВЭЖХ tR 6,75 минут.
Пример 24 - Синтез соединения 24 N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-оксоэтил)-1,4-диазепан-5-ил)метил)-6-фтор-2-нафтамида
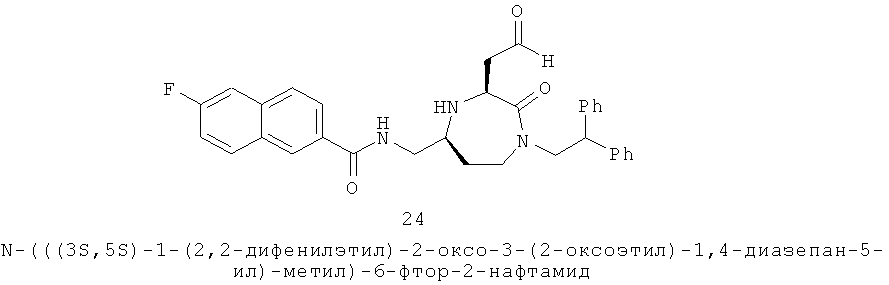
К раствору 23 (29 мг, 0,049 ммоль) в сухом THF (1 мл) добавили LiAlH(OtBu)3 (38 мг, 0,145 ммоль) за одну порцию при комнатной температуре и получившуюся суспензию перемешивали всю ночь. Эту суспензию затем медленно вылили в холодный (0°С) 0,4 М водный раствор KHSO4 (2 мл, 0,8 ммоль) и получившуюся смесь разбавили EtOAc (3 мл). Водный слой экстрагировали EtOAc (3×3 мл) и объединенные органические слои промыли 1 Н HCl (3×6 мл), насыщенным водным раствором NaHCO3 (1×6 мл) и соляным раствором (1×6 мл). Органический раствор затем высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта 24 (24 мг, 91%), который применили в последующей реакции без дополнительной очистки. MS (ESI) 538 (М+1); ВЭЖХ tR 6,41 минут.
Пример 25 - Синтез соединения 25 N-(((3S,5S)-3-(2-(диэтиламино)этил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-6-фтор-2-нафтамида
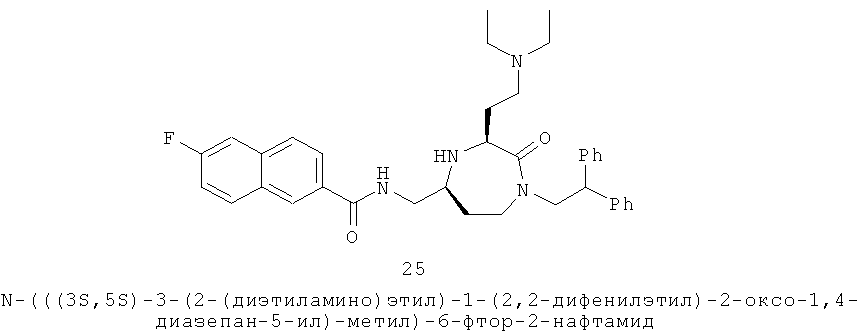
К раствору 24 (24 мг, 0,044 ммоль) в DCM (2 мл) добавили диэтиламин (55 мкл, 0,532 ммоль) при комнатной температуре. После перемешивания в течение 5 минут к вышеупомянутому раствору добавили NaBH(ОАс)3 (20 мг, 0,090 ммоль) за одну порцию и получившуюся суспензию перемешивали еще 10 минут. К суспензии добавили насыщенный водный раствор NaHCO3 (4 мл) и водный слой экстрагировали DCM (3×4 мл). Объединенные органические слои промыли соляным раствором (10 мл), высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта. Этот неочищенный продукт очистили при помощи препаративной ВЭЖХ (100% H2O к MeCN/H2O 9:1, градиент) для получения 25 в форме белого твердого вещества (соль TFA). MS (ESI) 595,3 (М+1); ВЭЖХ tR 6,22 минут.
Пример 26 - Синтез соединения 26 бензил 2-(метокси(метил)амино)-2-оксоэтилкарбамата
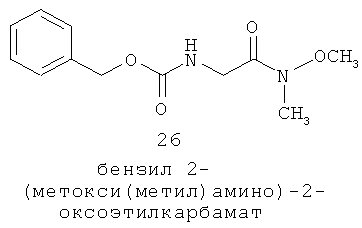
К Cbz-глицину (10 г, 47,8 ммоль, Aldrich) в DCM (100 мл) добавили ВОР реактив (21,5 г, 48,6 ммоль) и DIPEA (6,5 мл, 46,0 ммоль). После перемешивания при комнатной температуре в течение 10 минут добавили N,О-диметилгидроксиламингидрохлорид (4,9 г, 50,2 ммоль) и DIPEA (6,5 мл, 46,0 ммоль). Реакцию перемешивали при комнатной температуре всю ночь. DCM удалили при помощи ротационного испарения и остаток поглотили в EtOAc (100 мл). Органическую фазу промыли H2O (3×100 мл), насыщенным раствором бикарбоната натрия (3×100 мл), H2O (3×100 мл), 1М HCl (3×100 мл), соляным раствором (3×100 мл). Органическую фазу высушили (MgSO4) и удалили EtOAc для получения амида Вейнреба 26 в форме белого твердого вещества (7,78 г, 64%).
Пример 27 - Синтез соединения 27 бензил 2-оксобут-3-енилкарбамата
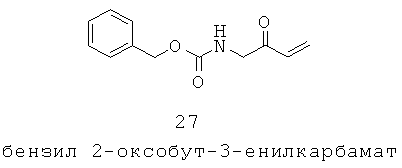
К амиду Вейнреба 26 (3,89 г, 15,42 ммоль) в DCM (10 мл) при 0°С добавили винилмагнийбромид (45 ммоль) в THF (45 мл). Реакцию перемешивали в течение 2 часов и проверяли при помощи ВЭЖХ. Реакцию добавили к смеси льда и 1М HCl (200 мл). Водную смесь экстрагировали DCM (3×100 мл) и промыли 1М HCl (2×200 мл) и H2O (3×100 мл). Органическую фазу высушили (MgSO4) и объем уменьшили до 100 мл при помощи ротационного испарения. α,β-Ненасыщенный кетон 27 хранили и применяли в растворе без очистки.
Пример 28 - Синтез соединения 28 (S)-9-флуоренилметил 10-(2,2-дифенилэтил)-2,2-диметил-18-фенил-4,9,13,16-тетраоксо-3,17-диокса-5,10,15-триазаоктадекан-8-илкарбамата
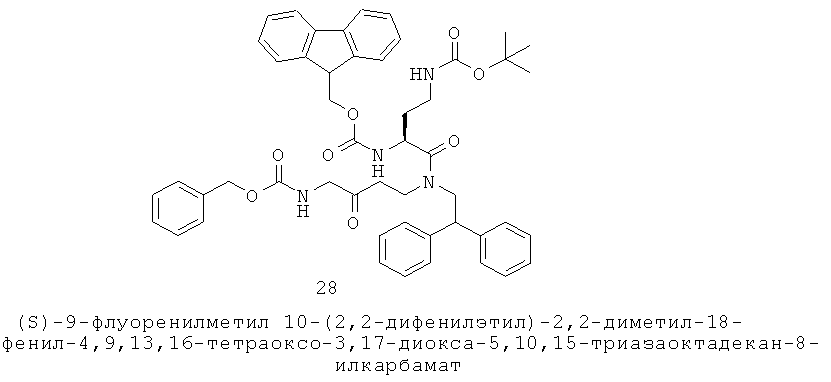
К 2,2-дифенилэтиламину (0,95 г, 7,4 ммоль) в DCM (10 мл) добавили α,β-ненасыщенный кетон 27 (5,7 ммоль) в DCM (75 мл). После перемешивания при комнатной температуре в течение 15 минут добавили Fmoc-L-2,4-диаминомасляная кислота(Вос)-ОН (2,4 г, 8,55 ммоль) и DIC (0,87 мл, 5,6 ммоль). Реакцию перемешивали при комнатной температуре всю ночь. DCM удалили при помощи ротационного испарения и остаток подвергли колоночной хроматографии на силикагеле с применением уайт-спирита:EtOAc (1:1 к 0:1) для получения 28 (1,5 г, 31%).
Альтернативно, к 2,2-дифенилэтиламину (0,97 г, 7,4 ммоль) в DCM (20 мл) добавили α,β-ненасыщенный кетон 27 (5,95 ммоль) в DCM (40 мл). После перемешивания при комнатной температуре в течение 15 минут добавили Fmoc-L-2,4-диаминомасляная кислота(Вос)-ОН (2,4 г, 8,55 ммоль), DIPEA (2,5 мл) и HATU (2,3 г, 6,0 ммоль). Реакцию перемешивали при комнатной температуре всю ночь. DCM удалили при помощи ротационного испарения и остаток поглотили в EtOAc (100 мл). Органический слой промыли насыщенным раствором бикарбоната натрия (2×100 мл), насыщенным раствором хлорида аммония (2×100 мл) и соляным раствором (2×100 мл). Органическую фазу высушили и растворитель удалили при пониженном давлении. Остаток подвергли колоночной хроматографии на силикагеле с применением уайт-спирит:EtOAc (3:1 к 1:1 к 0:1) для получения 28 (0,86 г, 17%).
Пример 29 - Синтез соединения 29 (3S,5S)-3-(2-трет-бутоксикарбониламиноэтил)-5-(бензилоксикарбониламинометил)-1-(2,2-дифенилэтил)-1,4-диазепан-2-она
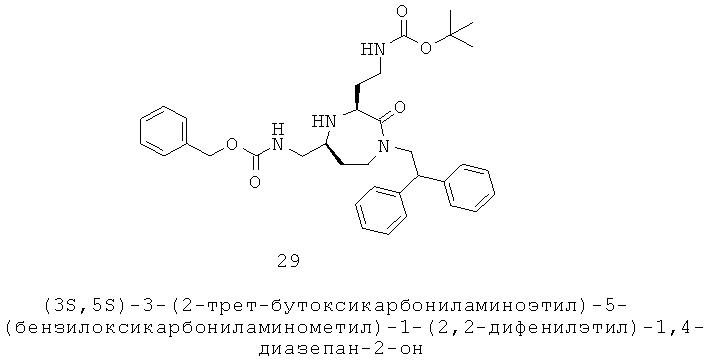
К соединению 28 (1,5 г, 1,8 ммоль) в DCM (3 мл) добавили диэтиламин (1,5 мл, 14,5 ммоль). Реакцию перемешивали при комнатной температуре в течение 1 часа. DCM и диэтиламин удалили при помощи ротационного испарения. Добавили DCM (5 мл), триацетоксиборогидрид натрия (0,4 г, 1,9 ммоль), и реакцию перемешивали всю ночь при комнатной температуре. Органическую фазу промыли насыщенным раствором бикарбоната натрия (25 мл), высушили (MgSO4) и DCM удалили для получения циклизованного продукта 29, который применяли на следующем этапе без очистки.
Пример 30 - Синтез соединения 30 (3S,5S)-3-(2-трет-бутоксикарбониламиноэтил)-5-аминометил-1 -(2,2-дифенилэтил)-1,4-диазепан-2-она
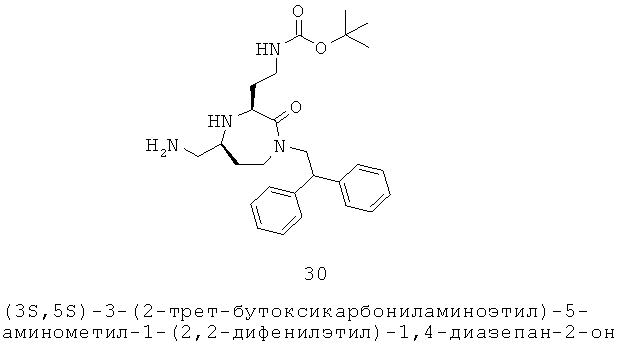
К циклизованному продукту 29 в метаноле (5 мл) добавили каталитический Pd/C. Реакцию перемешивали под атмосферой водорода всю ночь. Реакционную смесь профильтровали через Целит и метанол удалили при помощи ротационного испарения для получения амина 30 (0,7 г, 83% из 28).
Пример 31 - Синтез соединения 31 N-(((3S,5S)-3-(2-аминоэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-6-фтор-2-нафтамида
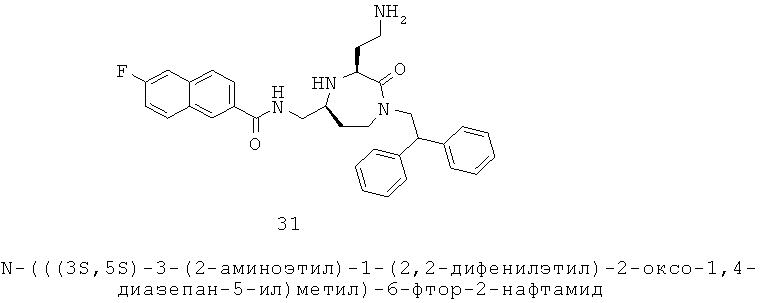
К амину 30 (0,08 г, 0,17 ммоль) в DCM (1 мл) добавили DIPEA (0,25 мл), ВОР реактив (0,08 г, 0,18 ммоль) и 6-фтор-2-нафтойную кислоту (0,06 г, 0,32 ммоль). Реакцию перемешивали при комнатной температуре в течение 2 часов. TFA (1 мл) добавили и реакцию перемешивали при комнатной температуре в течение 2 часов. Ротационным испарением и препаративной ВЭЖХ получили 31 (0,05 г, 54%). MS (ESI) 539,3 (M+1); ВЭЖХ tR мин 5,92.
Пример 32 - Синтез соединения 32 6-хлор-2-нафтойной кислоты
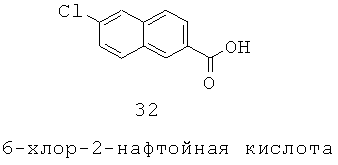
Суспензию 6-бром-2-нафтойной кислоты (3,0 г, 11,47 ммоль), CuCl (11,7 г, 114,64 ммоль) и CuI (2,19 г, 11,50 ммоль) в дегазированном DMF (45 мл) нагревали до кипения под аргоном в темноте в течение 4 часов. После охлаждения до комнатной температуры раствор декантировали в воду Н2О (200 мл) и получившуюся смесь экстрагировали EtOAc (2×500 мл). Объединенные органические слои затем промыли H2O (4×500 мл), затем соляным раствором (1×500 мл), высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении до сухого состояния. Остаток растерли в порошок с CH3CN и полученное твердое вещество затем перекристаллизовали из EtOAc для получения чистого продукта 32 (2,2 г, 93%) в форме грязно-белого твердого вещества. ВЭЖХ tR 6,47 минут.
Пример 33 - Синтез соединения 33 (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)акриламида
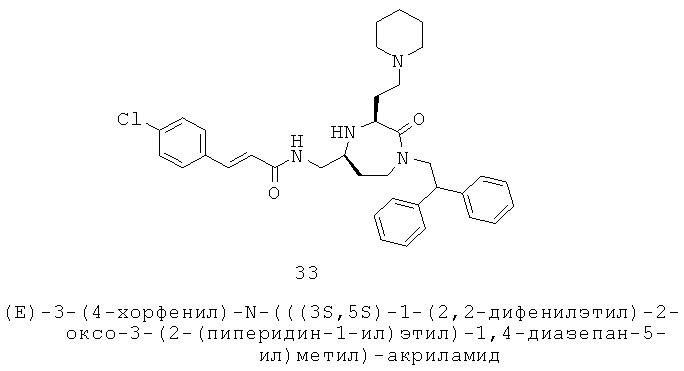
К амин(Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-аминоэтил)-1,4-диазепан-5-ил)метил)акриламиду (21 мг, 0,05 ммоль) в DMF (0,25 мл) добавили K2CO3 (5 мг) и 1,5-дибромпропан (0,066 мл, 0,5 ммоль). Реакционную смесь оставили при комнатной температуре в течение 4 часов. Растворитель удалили при высоком вакууме и остаток очистили при помощи препаративной ВЭЖХ для получения 8 мг (~30%) 33 в виде TFA соли. MS (ESI) 599,4 (М+1); ВЭЖХ tR минут 6,31.
Пример 34 - Синтез соединения 34 (S)-9-флуоренилметил 10-(2-фенилбутил)-2,2-диметил-18-фенил-4,9,13,16-тетраоксо-3,17-диокса-5,10,15-триазаоктадекан-8илкарбамата
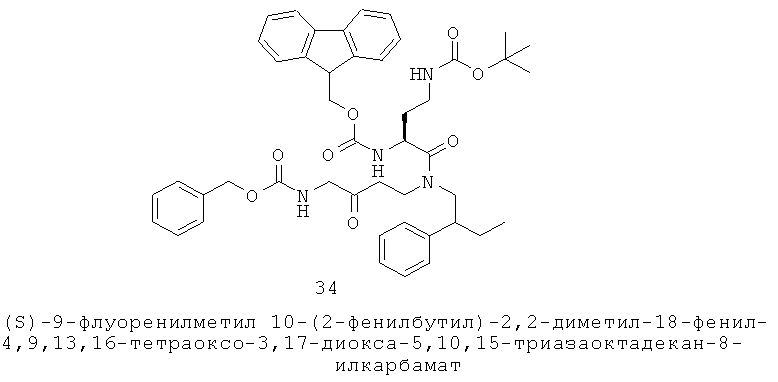
К 2-фенилбутиламингидрохлориду (0,26 г, 1,4 ммоль) в DCM (10 мл) и DIPEA (0,25 мл, 1,8 ммоль) добавили α,β-ненасыщенный кетон 27 (1,06 ммоль) в DCM (20 мл). После перемешивания при комнатной температуре в течение 15 минут добавили Fmoc-диаминомасляную кислоту(Вос)-ОН (0,7 г, 1,56 ммоль) и DIC (0,25 мл, 1,61 ммоль). Реакцию перемешивали при комнатной температуре всю ночь. DCM удалили при помощи ротационного испарения и остаток подвергли колоночной хроматографии на силикагеле с помощью уайт-спирит:EtOAc (1:1-0:1), давая соединение 34 в виде смеси диастереомеров (0,17 г, 21%).
Пример 35 - Синтез соединения 35 (3S,5S)-3-(2-трет-бутоксикарбониламиноэтил)-5-(бензилоксикарбониламинометил)-1-(2-фенилбутил)-1,4-диазепан-2-она
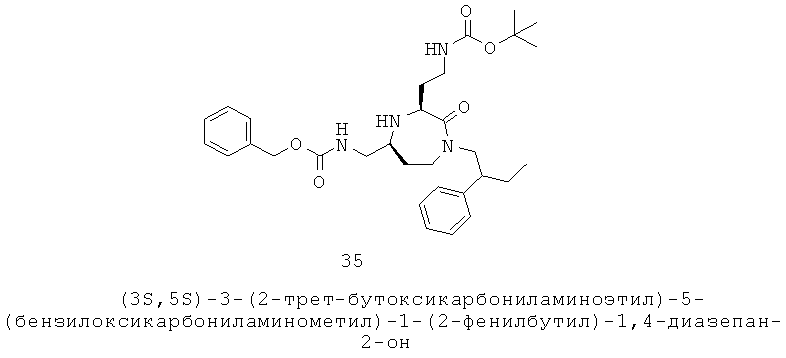
К соединению 34 (0,17 г, 0,2 ммоль) в DCM (3 мл) добавили диэтиламин (1,5 мл). Реакцию перемешивали при комнатной температуре в течение 1 часа. DCM и диэтиламин удалили при помощи ротационного испарения. DCM (5 мл) и триацетоксиборогидрид натрия (0,1 г, 0,47 ммоль) добавили и реакцию перемешивали всю ночь при комнатной температуре. Органическую фазу промыли насыщенным раствором бикарбоната натрия (25 мл), высушили (MgSO4) и удалили DCM для получения циклизованного продукта 35 в виде смеси диастереомеров (0,11 г, 100%).
Пример 36 - Синтез соединения 36 (3S,5S)-3-(2-трет-бутоксикарбониламиноэтил)-5-(аминометил)-1-(2-фенилбутил)-1,4-диазепан-2-она
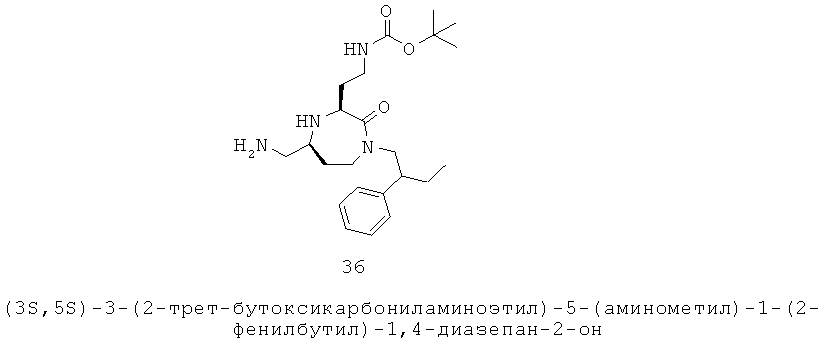
К циклизованному продукту 35 (0,11 г) в метаноле (5 мл) добавили каталитический Pd/C. Реакцию перемешивали под атмосферой водорода всю ночь. Реакционную смесь профильтровали через Целит и метанол удалили при помощи ротационного испарения для получения амина 36 в виде смеси диастереомеров (0,11 г, 100%).
Пример 37 - Синтез соединения 37 (3S,5S)-3-(2-аминоэтил)-5-(N-2-нафтамидметил)-1-(2-фенилбутил)-1,4-диазепан-2-она
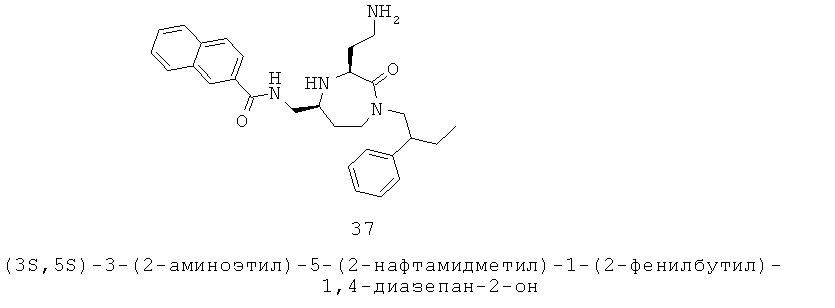
К амину 36 (0,02 мг, 0,05 ммоль) в DCM (1 мл) добавили DIPEA (0,1 мл, 0,7 ммоль), ВОР реактив (0,02 мг, 0,045 ммоль) и 2-нафтойную кислоту (0,015 мг, 0,09 ммоль). Реакцию перемешивали при комнатной температуре в течение 2 часов. Добавили TFA (1 мл) и реакцию перемешивали при комнатной температуре в течение 2 часов. Ротационным испарением и препаративной ВЭЖХ получили 37 в виде смеси диастереомеров (13,4 мг, 57%). MS (ESI) 473,4 (M+1); ВЭЖХ tR 5,59 минут.
Пример 38 - Синтез соединений 38-39 N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамида и N-(((3S,5S)-2-оксо-1-((R)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамида
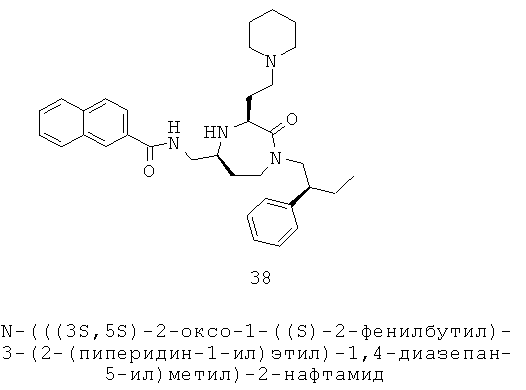
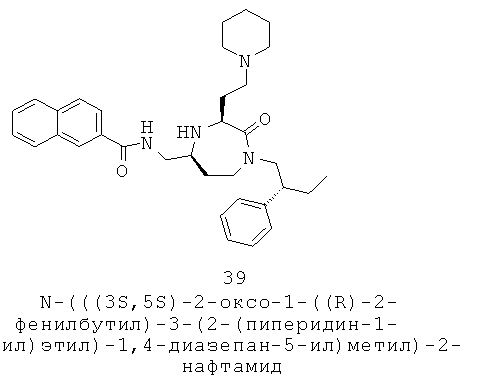
Приготовленный из соединения 37 посредством алкилирования, как в Примере 33. Препаративная ВЭЖХ очистка отделила два диастереомера. Надлежащую конфигурацию установили повторным синтезом соединений с помощью (3)-2-фенилбутиламина 43 или (S)-2-фенилбутиламина. 38: MS (ESI) 541,3 (М+1); ВЭЖХ tR 5,78 минут; 39: MS (ESI) 541,3 (M+1); ВЭЖХ tR 5,67 минут.
Пример 39 - Синтез соединения 40 (S)-2-фенилбутанола
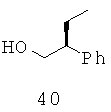
К суспензии боргидрида натрия (2,36 г, 62,4 ммоль) в THF (50 мл) медленно добавили раствор (S)-2-фенилмасляной кислоты (4,27 г, 26,0 ммоль) в THF (40 мл) при 0°С. Смесь перемешивали до тех пор, пока не прекратилось образование газа. Раствор йода (6,60 г, 26,0 ммоль) в THF (40 мл) затем медленно добавили при 0°С. После добавления получившейся смеси позволили нагреться до комнатной температуры и перемешивали в течение 1 часа. Реакцию раствора затем медленно вылили в раствор 1 Н HCl (280 мл) и получившуюся смесь разбавили EtOAc (250 мл). Водный слой экстрагировали EtOAc (150 мл × 3) и объединенные органические слои затем промыли насыщенным NaHCO3 (водн.), 0,5 М Na2S2O3 (водн.) и соляным раствором. Этот органический раствор высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта. Очисткой при помощи флэш-хроматографии на силикагеле (петролейный эфир: EtOAc 4:1) получили желаемый продукт 40 в форме бесцветного масла в количественном выходе. ВЭЖХ tR 5,24 минут.
Пример 40 - Синтез соединения 41 (S)-1-мезилокси2-фенилбутана
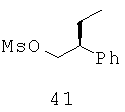
К смеси 40 (3,9 г, 26,0 ммоль) и триэтиламина (5,5 мл, 39,5 ммоль) в DCM (90 мл) медленно добавили раствор метансульфонилхлорида (4,47 г, 39,0 ммоль) в DCM (30 мл) при 0°С. После добавления получившейся смеси позволили нагреться до комнатной температуры и перемешивали в течение 2 часов. Затем к вышеупомянутой смеси добавили 1 Н HCl (70 мл), и водный слой экстрагировали DCM (1×70 мл). Объединенные органические слои промыли соляным раствором (150 мл), высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта 41 в форме бесцветного масла. Этот неочищенный продукт применяли на следующем этапе без дополнительной очистки. ВЭЖХ tR 6,48 минут.
Пример 41 - Синтез соединения 42 (S)-1-азидо-2-фенилбутана
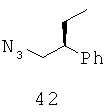
Суспензию 41 (5,93 г, 26,0 ммоль) и азид натрия (5,7 г, 78,0 ммоль) в DMF (60 мл) нагревали при 85°С в течение 3 часов. После охлаждения до комнатной температуры смесь разбавили H2O (200 мл) и экстрагировали EtOAc (250 мл). Органический слой затем промыли H2O (4×150 мл), а затем соляным раствором (150 мл), высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта. Очисткой при помощи флэш-хроматографии на силикагеле (100% петролейный эфир в качестве элюента) получили чистый продукт 42 (4,03 г, 88%) в форме бесцветного масла. ВЭЖХ tR 7,67 минут.
Пример 42 - Синтез соединения 43 (S)-2-фенилбутиламина
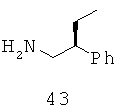
Смесь 42 (4,0 г, 22,8 ммоль) и катализатора Линдлара (1,5 г) в EtOAc (50 мл) взбалтывали при комнатной температуре под H2 (40 psi) всю ночь. Смесь затем профильтровали через прокладку из Целита и фильтрат сконцентрировали при пониженном давлении для получения неочищенного продукта 43 (3,4 г, 100%) в форме светло-желтоватого масла. Этот неочищенный продукт применяли для реакций сопряженного присоединения без дополнительной очистки. MS (ESI) 150 (М+1); ВЭЖХ tR 1,84 минут.
Пример 43 - Синтез соединения 44 аллил 2-(метокси(метил)амино)-2-оксоэтилкарбамата
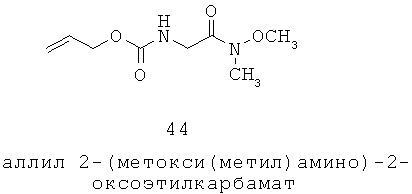
К Alloc(аллилоксикарбонил)-глицину (1,45 г, 9,1 ммоль) в DCM (20 мл) добавили ВОР реактив (3,3 г, 7,46 ммоль) и DIPEA (1,5 мл, 10,7 ммоль). После перемешивания при комнатной температуре в течение 10 минут добавили N,O-диметилгидроксиламингидрохлорид (0,8 г, 8,2 ммоль) и DIPEA (1,5 мл, 10,7 ммоль). Реакцию перемешивали при комнатной температуре всю ночь. DCM удалили при помощи ротационного испарения и остаток поглотили в EtOAc (100 мл). Органическую фазу промыли H2O (3×100 мл), насыщенным раствором бикарбоната натрия (3×50 мл), H2O (3×50 мл), 1М HCl (3×50 мл), соляным раствором (3×50 мл). Органическую фазу высушили (MgSO4) и EtOAc удалили для получения амида Вейнреба 44 в форме белого твердого вещества (0,43 г, 23%).
Альтернативно, трет-бутил 2-(метокси(метил)амино)-2-оксоэтилкарбамат 16 (Вос-Gly амид Вейнреба, 1,4 г, 6,4 ммоль) в DCM (5 мл) и TFA (3 мл) перемешивали при комнатной температуре 1 час. Растворитель удалили при пониженном давлении с последующим добавлением DCM (20 мл) и затем DIPEA до основного. Раствор охладили до 0°С и добавили аллилхлорформат (1,4 мл, 13,2 ммоль). Реакцию перемешивали при комнатной температуре всю ночь. Реакционную смесь нейтрализовали 1М HCl и экстрагировали EtOAc. EtOAc удалили при помощи ротационного испарения и остаток подвергли колоночной хроматографии на силикагеле с помощью уайт-спирит:EtOAc (1:1-0:1), обеспечивая 44 (0,86 г, 66%).
Пример 44 - Синтез соединения 45 аллил 2-оксобут-3-енилкарбамата
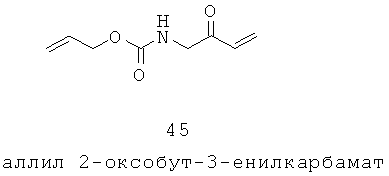
К амиду Вейнреба 44 (0,43 г, 2,1 ммоль) в DCM (5 мл) при 0°С добавили винилмагнийбромид (10 ммоль) в THF (10 мл). Реакцию перемешивали в течение 2 часов и проверяли при помощи ВЭЖХ. Реакцию добавили к смеси льда и 1М HCl (100 мл). Водную смесь экстрагировали DCM (3×50 мл) и промыли 1М HCl (2×100 мл) и H2O (3×50 мл). Органическую фазу высушили (MgSO4) и объем уменьшили до 50 мл при помощи ротационного испарения. α,β-Ненасыщенный кетон 45 хранили и применяли в растворе без дополнительной очистки.
Пример 45 - Синтез соединения 46 (S)-9-флуоренилметил 10-(3,5-дихлорбензил)-2,2-диметил-4,9,13,16-тетраоксо-3,17-диокса-5,10,15-триазаискос-19-ен-8-илкарбамата
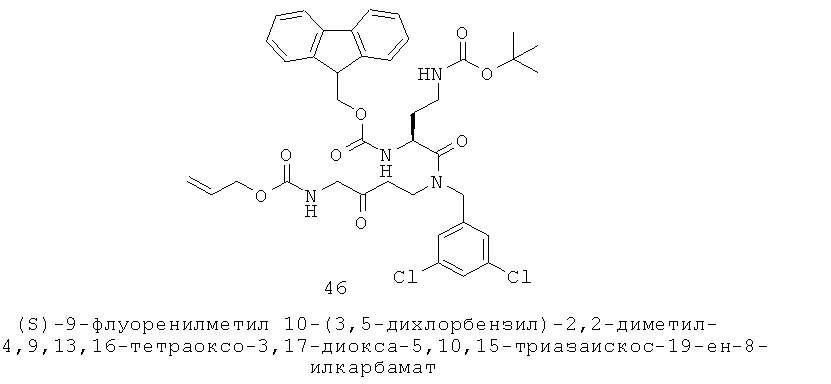
К 3,5-дихлорбензиламину (0,49 г, 2,8 ммоль) в DCM (5 мл) добавили а, (3-ненасыщенный кетон 45 (2,12 ммоль) в DCM (10 мл). После перемешивания при комнатной температуре в течение 15 минут добавили Fmoc-диаминомасляную кислоту(Вос)-ОН (1,35 г, 3,1 ммоль) и DIC (0,5 мл, 3,2 ммоль). Реакцию перемешивали при комнатной температуре всю ночь. DCM удалили при помощи ротационного испарения и остаток подвергли колоночной хроматографии на силикагеле при помощи уайт-спирит:EtOAc (1:1-0:1), обеспечивая соединение 46 (0,48 г, 22%).
Пример 46 - Синтез соединения 47 (3S,5S)-3-(2-трет-бутоксикарбониламиноэтил)-5-(аллилоксикарбониламинометил)-1-(3,5-дихлорбензил)-1,4-диазепан-2-она
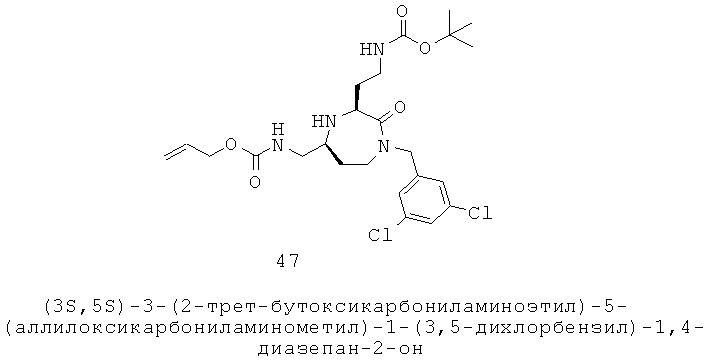
К соединению 46 (0,48 г, 0,63 ммоль) в DCM (3 мл) добавили диэтиламин (1,5 мл). Реакцию перемешивали при комнатной температуре в течение 1 часа. DCM и диэтиламин удалили при помощи ротационного испарения. Добавили DCM (5 мл), триацетоксиборогидрид натрия (0,2 г, 0,94 ммоль) и реакцию перемешивали всю ночь при комнатной температуре. Органическую фазу промыли насыщенным раствором бикарбоната натрия (25 мл), высушили (MgSO4) и DCM удалили для получения циклизованного продукта 47 (0,24 г, 72%).
Пример 47 - Синтез соединения 48 (3S,5S)-3-(2-трет-бутоксикарбониламиноэтил)-5-аминометил-1-(3,5-дихлорбензил)-1,4-диазепан-2-она
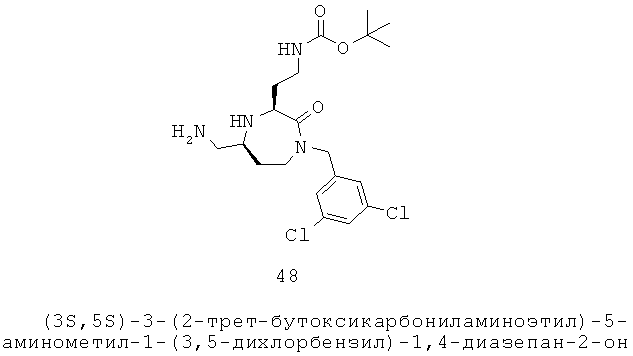
К циклизованному продукту 47 (0,24 г, 0,45 ммоль) в DCM (3 мл) добавили 1,3-диметилбарбитуровую кислоту (13 мг, 0,08 ммоль) и палладия тетракистрифенилфосфин (5 мг). Реакцию откачали и перемешивали при комнатной температуре в течение 1 часа. DCM удалили при пониженном давлении для получения неочищенного продукта 48 (0,15 г, 75%), который применили в последующей реакции без очистки.
Пример 48 - Синтез соединения 49 (3S,5S)-3-(2-аминоэтил)-5-(2-нафтоиламинометил)-1-(3,5-дихлорбензил)-1,4-диазепан-2-она
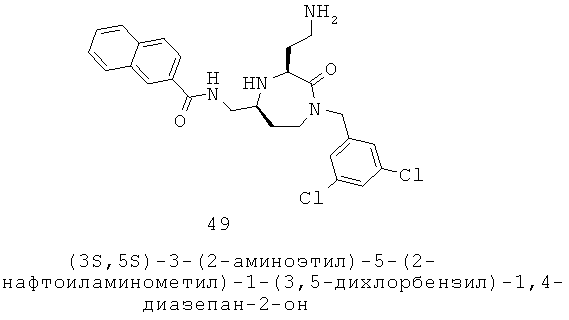
К амину 48 (0,05 мг, 0,11 ммоль) в DCM (1 мл) добавили DIPEA (0,1 мл, 0,7 ммоль), ВОР реактив (0,05 мг, 0,11 ммоль) и 2-нафтойную кислоту (0,04 мг, 0,23 ммоль). Реакцию перемешивали при комнатной температуре в течение 2 часов. TFA (1 мл) добавили и реакцию перемешивали при комнатной температуре в течение 2 часов. Ротационным испарением и препаративной ВЭЖХ получили 49 (48 мг, 90%). MS (ESI) 499,3 (M+1); ВЭЖХ tR 5,77 минут.
Пример 49 - Синтез соединения 50 N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафталин-2-сульфонамида
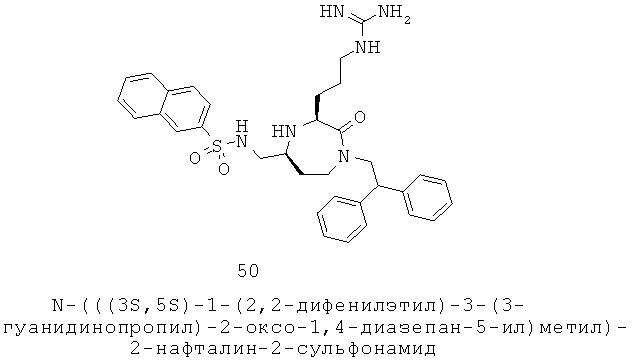
Приготовленный из аллил 2-оксобут-3-енилкарбамата 45, Boc-L-Arg(Fmoc)2-OH и 2,2-дифенилэтиламина согласно методикам Примеров 46-48 с последующим модифицированием: Вос группу удалили TFA во время метода снятия защитных групп/циклизации Примера 47, скорее, чем применение диэтиламина для Fmoc удаления. После Alloc снятия защитных групп методом Примера 48 свободный амин растворили в DCM, к которому добавили нафталин-2-сульфонилхлорид (10 мг) и DIPEA (20 мкл) и реакцию перемешивали в течение 2 часов при комнатной температуре. Диэтиламин (1 мл) добавили и перемешивали всю ночь, чтобы удалить Fmoc защиту, и реакцию выпаривали до сухого состояния. Препаративной ВЭЖХ получили названное соединение 50 (13 мг). MS (ESI) 613,5 (M+1); ВЭЖХ tR 5,89 минут.
Пример 50 - Синтез соединения 51 (S)-9-флуоренилметил 10-(2-этилбутил)-2,2-диметил-18-фенил-4,9,13,16-тетраоксо-3,17-диокса-5,10,15-триазаоктадекан-8-илкарбамата
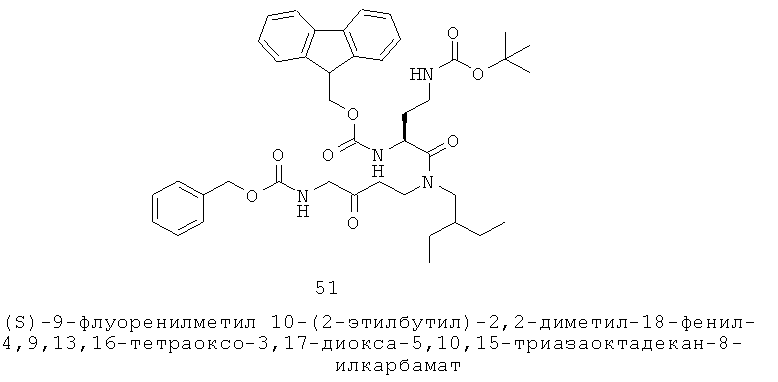
К 2-этилбутиламину (0,15 г, 1,48 ммоль) в DCM (10 мл) добавили α,β-ненасыщенный кетон 27 (1,47 ммоль) в DCM (30 мл). После перемешивания при комнатной температуре в течение 15 минут добавили Fmoc-диаминомасляную кислоту(Вос)-ОН (0,95 г, 2,16 ммоль) и DIC (0,34 мл, 2,19 ммоль). Реакцию перемешивали при комнатной температуре всю ночь. DCM удалили при помощи ротационного испарения и остаток подвергли колоночной хроматографии на силикагеле при помощи уайт-спирит:EtOAc (1:1-0:1), обеспечивая соединение 51 (0,5 г, 46%).
Пример 51 - Синтез соединения 52 (3S,5S)-3-(2-трет-бутоксикарбониламиноэтил)-5-(бензилоксикарбониламинометил)-1-(2-этилбутил)-1,4-диазепан-2-она
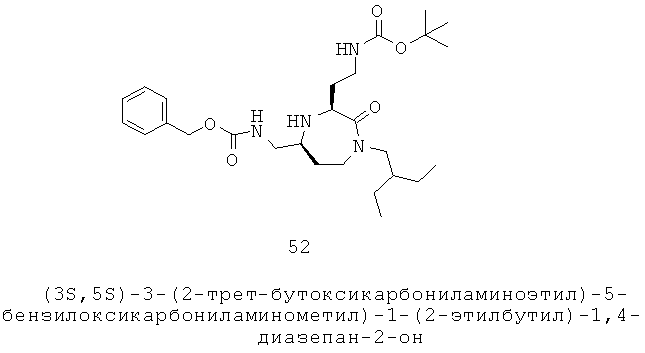
К соединению 51 (0,5 г, 0,67 ммоль) в DCM (3 мл) добавили диэтиламин (1,5 мл). Реакцию перемешивали при комнатной температуре в течение 1 часа. DCM и диэтиламин удалили при помощи ротационного испарения. DCM (5 мл) и триацетоксиборогидрид натрия (0,2 г, 0,94 ммоль) добавили, и реакцию перемешивали всю ночь при комнатной температуре. Органическую фазу промыли насыщенным раствором бикарбоната натрия (25 мл), высушили (MgSO4) и удалили DCM для получения неочищенного циклизованного продукта 52 (0,4 г).
Пример 52 - Синтез соединения 53 (3S,5S)-3-(2-трет-бутоксикарбониламиноэтил)-5-(аминометил)-1-(2-этилбутил)-1,4-диазепан-2-она
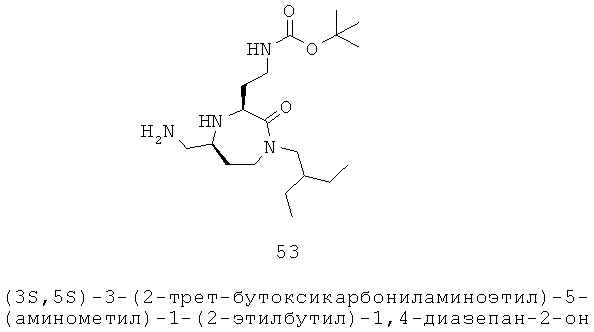
К циклизованному продукту 52 (0,4 г) в метаноле (5 мл) добавили каталитический Pd/C. Реакцию перемешивали под атмосферой водорода всю ночь. Реакционную смесь профильтровали через Целит и метанол удалили при помощи ротационного испарения для получения амина 53 (0,17 г, 68% из 51).
Пример 53 - Синтез соединения 54 N-(((3S,5S)-3-(2-аминоэтил)-1-(2-этилбутил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида
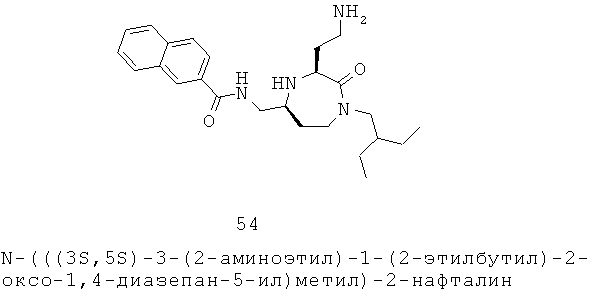
К амину 53 (0,030 г, 0,08 ммоль) в DCM (1 мл) добавили DIPEA (0,1 мл, 0,7 ммоль), ВОР реактив (0,03 г, 0,07 ммоль) и 2-нафтойную кислоту (0,025 г, 0,14 ммоль). Реакцию перемешивали при комнатной температуре в течение 2 часов. Добавили TFA (1 мл) и реакцию перемешивали при комнатной температуре в течение 2 часов. Ротационным испарением и препаративной ВЭЖХ получили соединение 54 (23 мг, 68%). MS (ESI) 425,7 (M+1); ВЭЖХ tR 5,27.
Пример 54 - Синтез соединения 55 (3S,5S)-3-[2-(пиперидин-1-ил)этил]-5-(бензилоксикар6ониламинометил)-1-(2-этилбутил)-1,4-диазепан-2-она
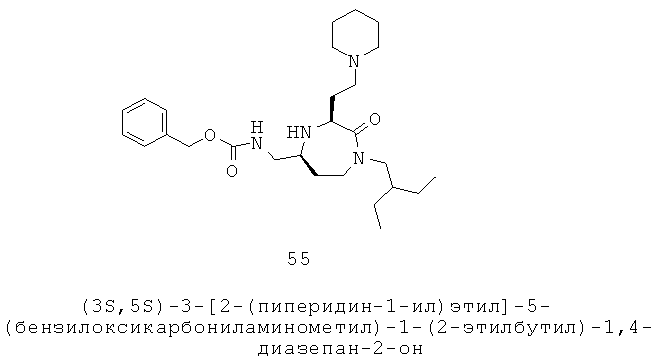
К соединению 54 (0,25 г, 0,5 ммоль) в DCM (3 мл) добавили TFA (1,5 мл), и далее раствор перемешивали при комнатной температуре в течение 1 часа. Добавили DCM (20 мл) и раствор промыли насыщенным раствором бикарбоната натрия (20 мл), высушили над MgSO4 и выпарили для получения неочищенного амина (0,16 г). К этому добавили DMF (0,25 мл), карбонат калия (10 мг) и 1,5-дибромпентан (0,35 мл, 2,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1,5 часов, после чего добавили DCM (20 мл), органический слой промыли насыщенным раствором бикарбоната натрия (20 мл) и H2O (20 мл), высушили (MgSO4) и выпарили для получения неочищенного 55, который применили в последующей реакции без очистки.
Пример 55 - Синтез соединения 56 (3S,5S)-3-[2-(пиперидин-1-ил)этил]-5-аминометил-1-(2-этилбутил)-1,4-диазепан-2-она
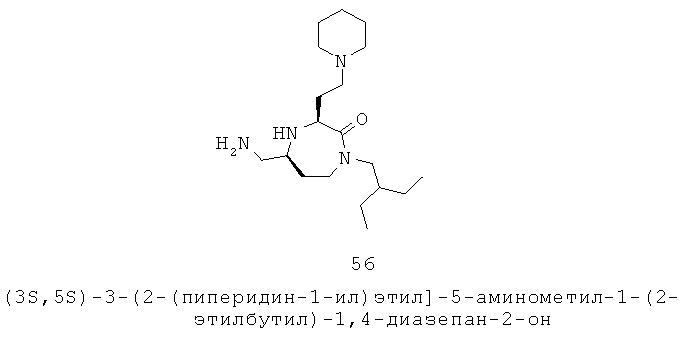
К циклизованному продукту 55 (0,4 г) в метаноле (5 мл) добавили каталитический Pd/C. Реакцию перемешивали под атмосферой водорода всю ночь. Реакционную смесь профильтровали через Целит и метанол удалили при помощи ротационного испарения для получения амина 56 (0,12 г).
Пример 56 - Синтез Вос-L-Glu(пиперидин)-ОН 57 (S)-2-(трет-бутоксикарбониламино)-5-оксо-5-(пиперидин-1-ил)пентановой кислоты
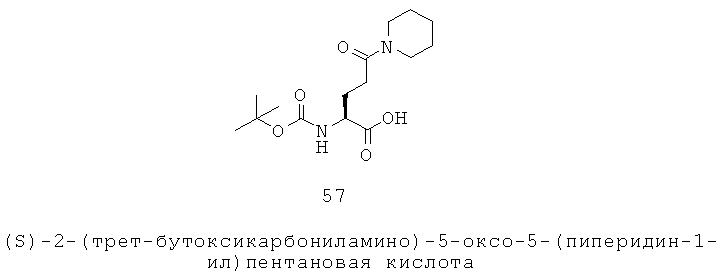
HATU (2,5 г) и DIPEA (1,5 мл) добавили к Boc-L-Glu(OH)-OBn (2,0 г) в DCM (50 мл), перемешивали в течение 10 минут, затем добавили пиперидин (0,7 мл) и реакцию перемешивали всю ночь при комнатной температуре. Реакцию промыли раствором бикарбоната натрия (2×), насыщенным NH4Cl (2×), соляным раствором (2×), высушили над MgSO4, профильтровали и выпарили для получения 2,9 г Вос-L-Glu(пиперидин)-OBn. Бензиловый сложный эфир (0,6 г) растворили в EtOH (15 мл) с каталитическим Pd/C и гидрогенизировали в течение 1 часа, профильтровали через Целит и выпарили EtOH при помощи ротационного испарения для получения 0,51 г 57.
Пример 57 - Синтез соединения 58 (3S,5S)-3-(2-трет-бутоксикарбониламинопропил)-5-[бензилоксикарбонил(метиламино)метил]-1-(2,2 дифенилэтил)-1,4-диазепан-2-она
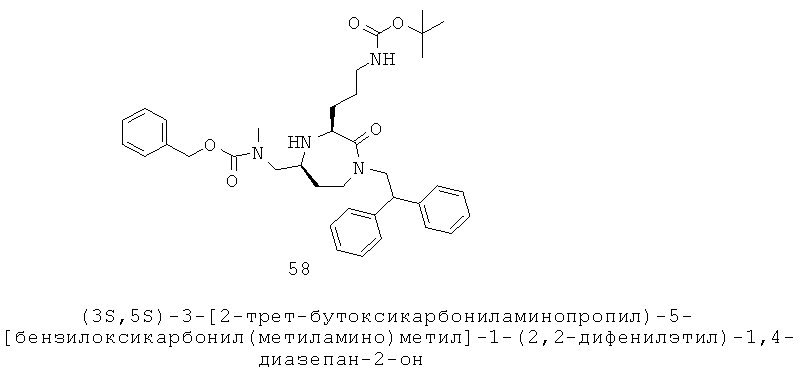
Приготовленный из Cbz-Sar, 2,2-дифенилэтиламин и Fmoc-L-Orn(Boc) согласно методикам Примеров 27-30.
Пример 58 - Синтез соединения 59 (3S,5S)-3-(2-трет-бутоксикарбониламинопропил)-5-(метиламино)метил-1-(2,2-дифенилэтил)-1,4 диазепан-2-она
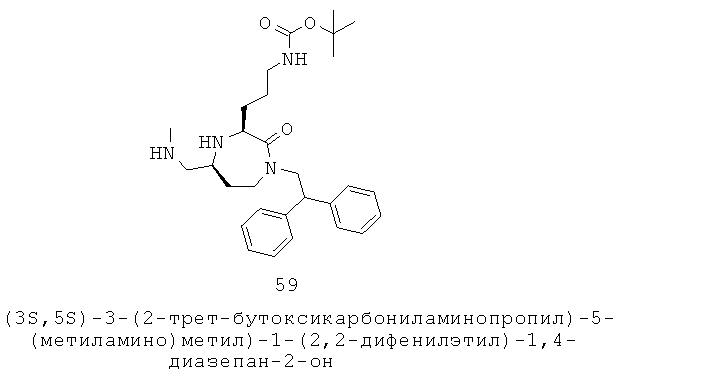
Циклизованный продукт 58 (1,9 г) растворили в метаноле (10 мл) с каталитическим Pd/C и гидрогенизировали под атмосферой водорода (40 psi) всю ночь. Реакционную смесь профильтровали через Целит и метанол удалили при помощи ротационного испарения для получения амина 59 (1,86 г, 97%).
Пример 59 - Синтез соединения 60 N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-6-бром-N-метил-2-нафтамида
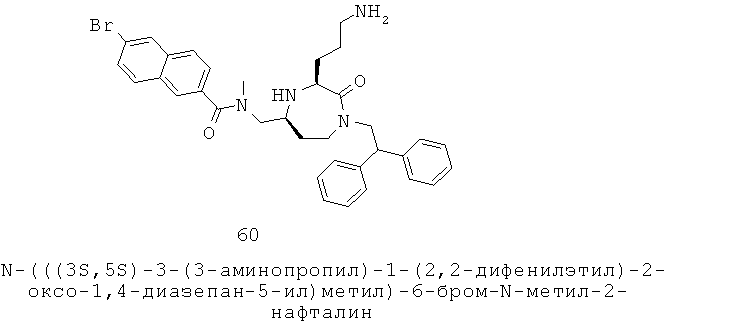
Амин 59 объединили с 6-бром-2-нафтойной кислотой, затем сняли защитные группы с помощью TFA согласно Примеру 31. Ротационное испарение и препаративная ВЭЖХ дали 60 (7,8 мг). MS (ESI) 629,4 (М+1); ВЭЖХ tR 6,27 минут.
Пример 60 - Синтез соединения 61 (3S,5S)-3-(трет-бутоксикарбониламинопропил)-5-(6-6ром-2-нафтамидметил)-1-(2,2-дифенилэтил)-1,4-диазепан-2-она
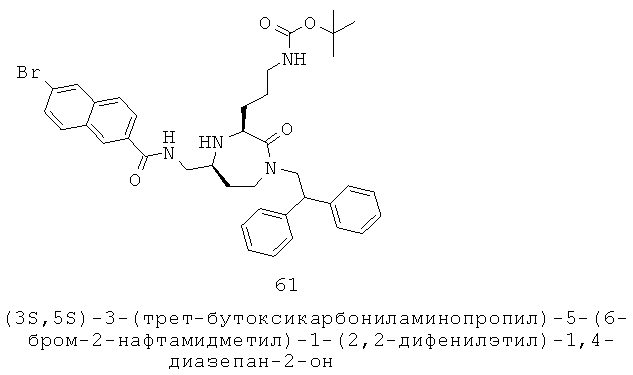
Приготовили из 2,2-дифенилэтиламина, Fmoc-L-Orn(Boc) и 6-бром-2-нафтойной кислоты согласно методикам Примеров 28-31, без этапа снятия TFA защитных групп Примера 31.
Пример 61 - Синтез соединения 62 N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-4-метил-2-оксо-1,4-диазепан-5-ил)метил)-6-бром-2-нафтамида
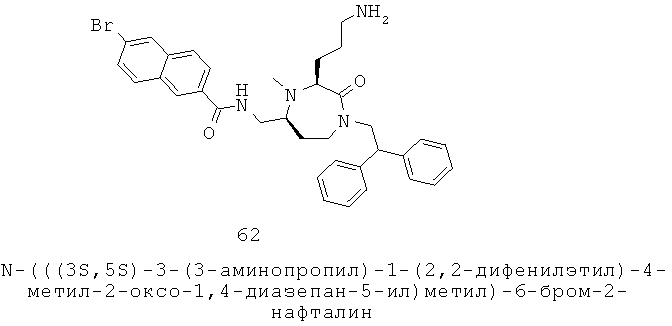
Соединение 61 (20,8 мг) растворили в DMF (1 мл) и обрабатывали метилйодидом (6 мкл) при комнатной температуре в течение 1 недели. Добавили дополнительный метилйодид (0,5 мл) и K2CO3 и реакцию оставили при комнатной температуре в течение еще 2 дней. Добавили TFA (2 мл) и реакцию перемешивали при комнатной температуре в течение 2 часов. Ротационное испарение с последующим выпариванием под высоким вакуумом затем препаративной ВЭЖХ дали 62 (8,5 мг). MS (ESI) 629,3 (М+1); ВЭЖХ tR 6,22 минут.
Пример 62 - Синтез соединения 63 N-(((3S,5S)-3-(3-аминопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида
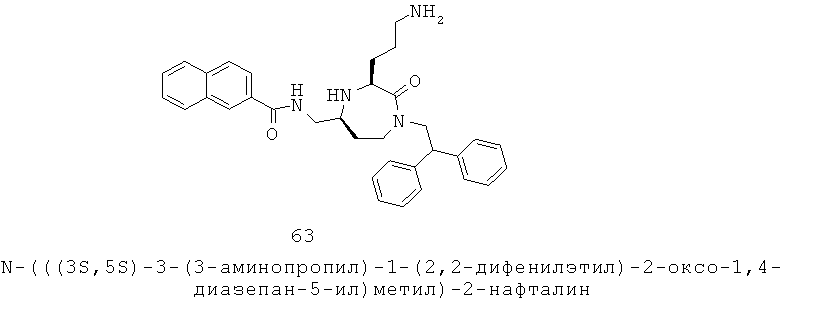
Полученный из 9 2,2-дифенилэтиламин и Fmoc-L-Orn(Boc) согласно Примерам 10-12. Boc группу удалили при стандартных условиях для получения свободного амина. MS(ESI) 535 (М+1); ВЭЖХ tR 5,78 минут.
Пример 63 - Синтез соединения 64 N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)-2-нафтамида
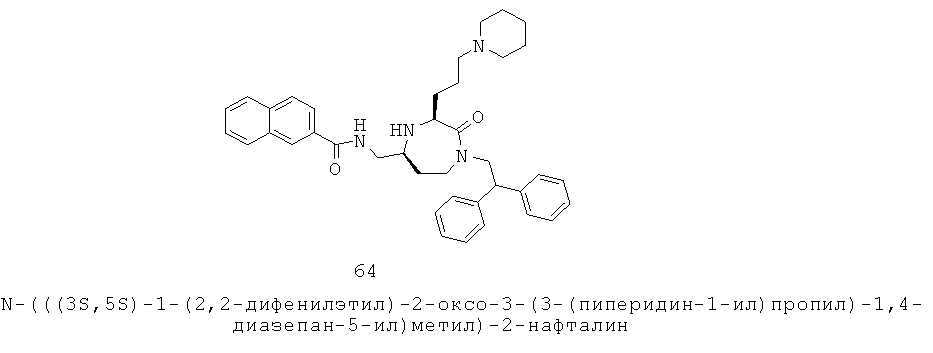
Амин 63 (0,79 г, 1,48 ммоль), 1,5-дибромпентан (0,2 мл, 1,48 ммоль) и К2СО3 (0,79 г) в DMF (11 мл) перемешивали при комнатной температуре в течение 4 часов. Получившуюся смесь разбавили этилацетатом (30 мл), промыли Н2О (5×30 мл), соляным раствором (10 мл) и высушили над MgSO4. Очисткой посредством препаративной ВЭЖХ получили 64 (0,23 г, 25%) MS(ESI) 603,3 (М+1); ВЭЖХ tR 6,04 минут.
Пример 64 - Синтез соединения 65 N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-(изопропиламино)пропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида
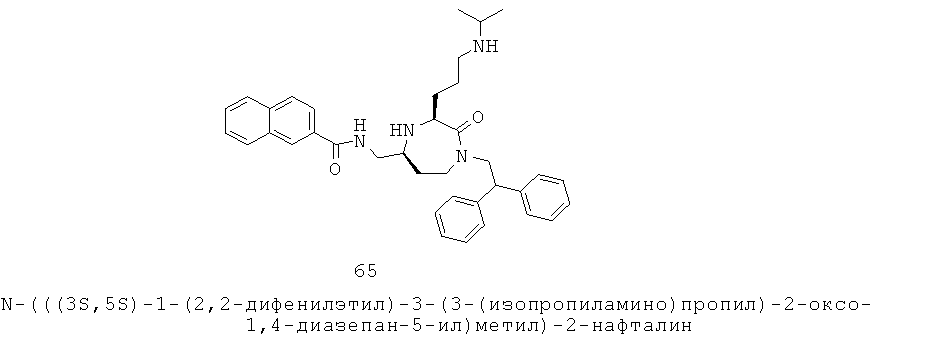
К перемешанной смеси амина 63 (11 мг, 0,02 ммоль), ацетона (2 мл) и MgSO4 (50 мг) в DCM (5 мл) добавили триацетоксиборогидрид натрия (8,5 мг, 0,04 ммоль) при комнатной температуре. Перемешивание продолжалось в течение 2 часов, смесь сконцентрировали, повторно растворили в EtOAc (5 мл), промыли насыщенным водным раствором NaHCO3 (10 мл) и соляным раствором (10 мл), высушили над MgSO4 и сконцентрировали при пониженном давлении. Очисткой посредством препаративной ВЭЖХ получили 65 (9,5 мг, 80%). MS (ESI) 577,2 (М+1); ВЭЖХ tR 5,97 минут.
Пример 65 - Синтез соединения 66 трет-бутил (метиламино)(метилтио)метиленкарбамата
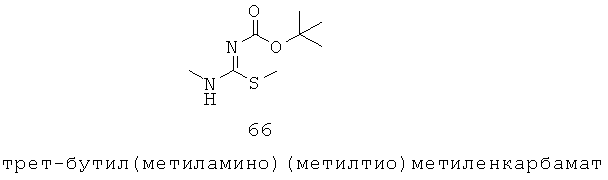
DIAD (диизопропил азодикарбоксилат) (2,7 мл, 13,8 ммоль) добавили к перемешанной смеси тиопсевдомочевины (2,0 г, 6,9 ммоль), РРпз (3,6 г, 13,8 ммоль) и МеОН (0,55 мл, 13,8 ммоль) в сухом THF (5 мл) при 0°С под азотом. Перемешивание продолжалось при 0°С в течение 3 часов, затем при комнатной температуре в течение 16 часов. Растворитель удалили при пониженном давлении и получившийся остаток повторно растворили в EtOAc, промыли насыщенным водным раствором NaHCO3 (20 мл) и соляным раствором (20 мл) и высушили над MgSO4. Очисткой посредством силикагелевой хроматографии при помощи 20% EtOAc в петролейном эфире в качестве элюента получили 66 (1,63 г, 78%) в форме бесцветного масла. MS (ESI) 305 (М+1); ВЭЖХ tR 7,97 минут.
Пример 66 - Синтез соединения 67 N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-(3-метилгуанидино)пропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида
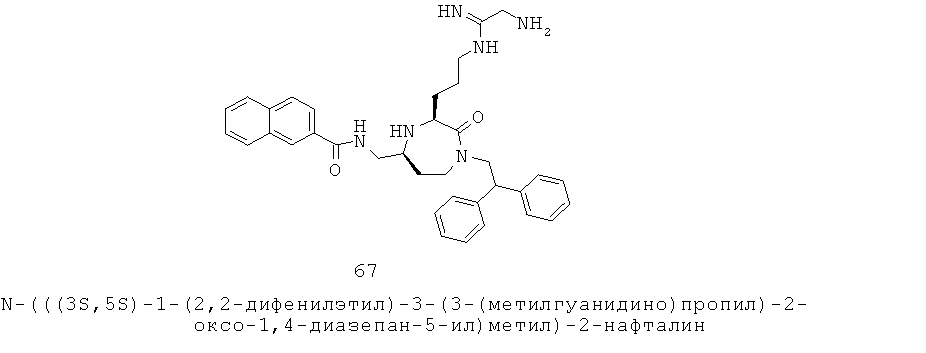
Смесь соединения 63 (10 мг, 0,019 ммоль), гуанилирующего вещества 66 (56,9 мг, 0,19 ммоль) и DIPEA (6,6 мкл, 0,038 ммоль) в DCM (5 мл) перемешивали при комнатной температуре в течение 16 часов. Добавили TFA (5 мл) и получившуюся смесь перемешивали при комнатной температуре в течение 30 минут. Растворитель удалили при пониженном давлении и неочищенный продукт очистили посредством препаративной ВЭЖХ для получения 67 (0,53 мг, 4,7%) в форме белого твердого вещества. MS (ESI) 591,3 (М+1); ВЭЖХ tR 5,94 минут.
Пример 67 - Синтез соединения 68 (S)-9-флуоренилметил 1-фенил-10-(2,2-дифенилэтил)-18,18-диметил-4,9,13,16-тетраоксо-2,17-диокса-4,10,15-триазанонадекан-8-илкарбамата
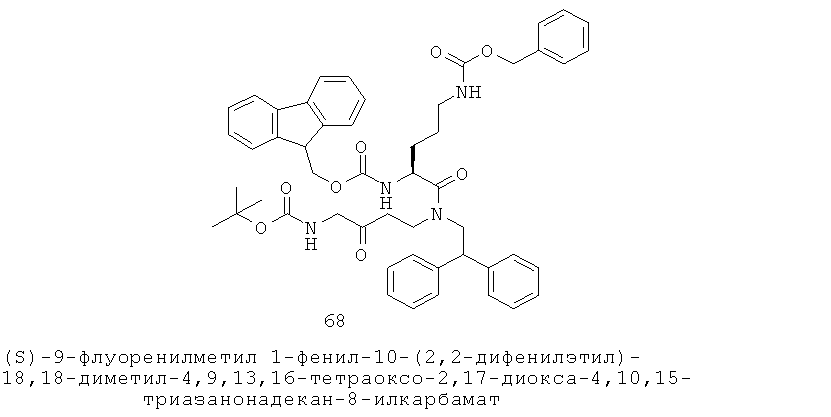
К перемешанной смеси Fmoc-L-Orn(Cbz)-OH (1,78 г, 3,65 ммоль), DIPEA (0,64 мл, 3,65 ммоль) и HATU (1,39 г, 3,65 ммоль) в DCM (10 мл) добавили раствор амина 17 при комнатной температуре. Перемешивание продолжалось в течение 3 часов, реакционную смесь промыли насыщенным водным раствором NaHCO3 (20 мл) и соляным раствором (20 мл) и высушили над MgSO4. Растворитель удалили при пониженном давлении, после этого неочищенный 68 применяли на последующем этапе без дополнительной очистки. MS (ESI) 853 (М+1); ВЭЖХ tR 9,90 минут.
Пример 68 - Синтез соединения 69 (S)-(9Н-флуорен-9-ил)метил 7-((4-(трет-бутоксикарбониламино)-3-оксобутил)(2,2-дифенилэтил)карбамоил)-3-метил-1,3-диазепан-1-карбоксилата
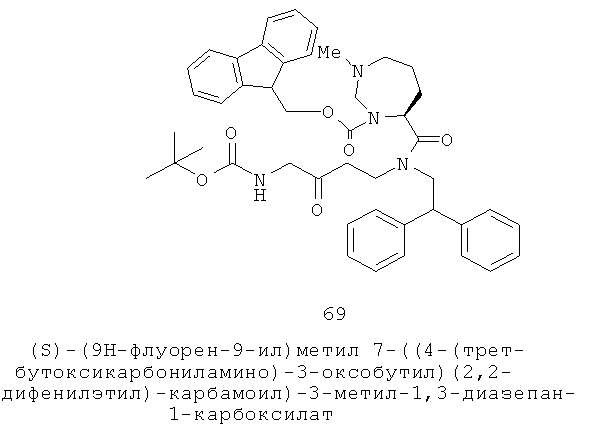
Смесь 68 (136 мг, 0,159 ммоль) и Pd/C (20 мг) в этаноле (5 мл) взбалтывали под Н2 при 30 psi в течение 16 часов, затем профильтровали, сконцентрировали при пониженном давлении для получения неочищенного амина (90 мг, 78%). Амин (90 мг, 0,125 ммоль) обработали избытком раствора формальдегида в H2O (37 ммоль) в МеОН (5 мл) с последующим триацетоксиборогидридом натрия (23,5 мг, 0,375 ммоль). После 1 часа реакционную смесь промыли насыщенным водным раствором NaHCO3 (10 мл) и соляным раствором (10 мл), высушили над MgSO4, профильтровали и сконцентрировали. Неочищенный материал применяли на следующем этапе без дополнительной очистки. MS (ESI) 745 (М+1); ВЭЖХ; ВЭЖХ tR 7,83 минут.
Пример 69 - Синтез соединения 70 (S)-(9Н-флуорен-9-ил)метил 7-((4-(2-нафтамид)-3-оксобутил)(2,2-дифенилэтил)-карбамоил)-3-метил-1,3-диазепан-1-карбоксилата
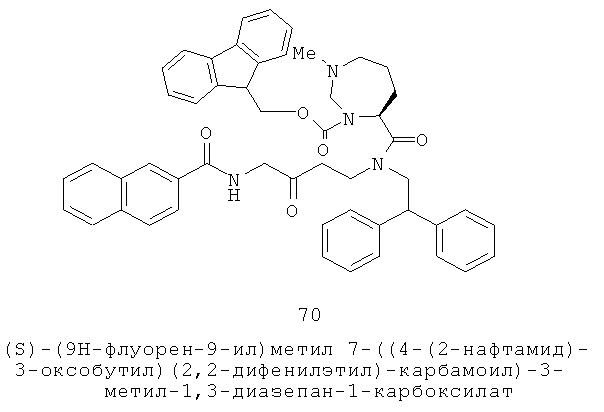
Соединение 69 (8 мг, 0,011 ммоль) обработали смесью 1:1 объем/объем трифторуксусной кислоты/DCM (2 мл) в течение 30 минут при комнатной температуре. Смесь сконцентрировали при пониженном давлении, повторно растворили в DCM (5 мл), промыли насыщенным водным раствором NaHCO3 (5 мл) и соляным раствором (5 мл), высушили над MgSO4 и профильтровали. Фильтрат затем обработали смесью 2-нафтойной кислоты (1,8 мг, 0,011 ммоль), DIPEA (5,7 мкл, 0,033 ммоль) и ВОР (4,8 мг, 0,011 ммоль) в DCM (1 мл) с перемешиванием при комнатной температуре. После 3 часов реакционную смесь промыли насыщенным водным раствором NaHCO3 (10 мл) и соляным раствором (10 мл), высушили над MgSO4, профильтровали и сконцентрировали. Неочищенный материал применяли на следующем этапе без дополнительной очистки. MS (ESI) 799 (М+1); ВЭЖХ tR 7,90 минут.
Пример 70 - Синтез соединения 71 N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(3-(метиламино)пропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида
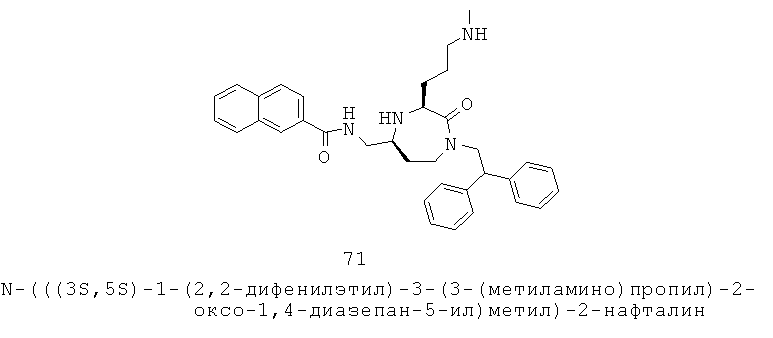
К перемешанному раствору 70 (0,011 ммоль) в DCM (5 мл) добавили диэтиламин (5 мл) при комнатной температуре. Реакцию перемешивали в течение 1 часа, затем сконцентрировали при пониженном давлении. Остаток повторно растворили в DCM (5 мл), затем добавили триацетоксиборогидрид натрия (5 мг, 0,08 ммоль) при комнатной температуре. Перемешивание продолжали в течение 1 часа, после этого полученную смесь промыли насыщенным водным раствором NaHCO3 (10 мл) и соляным раствором (10 мл), высушили над MgSO4, профильтровали и сконцентрировали. Очисткой посредством препаративной ВЭЖХ получили 71 (0,21 мг) в форме белого твердого вещества. MS (ESI) 549,3 (М+1); ВЭЖХ tR 5,93 минут.
Пример 71 - Синтез соединения 72 (S)-2-(аллилоксикарбониламино)-3-(нафталин-2-ил)пропановой кислоты
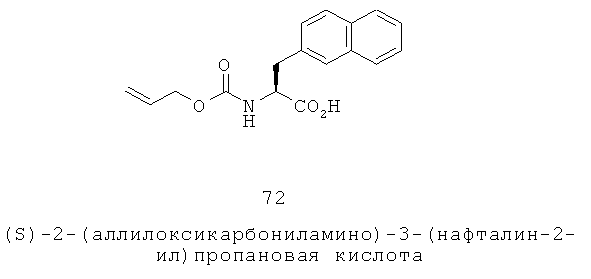
К перемешанной смеси L-3-(2-нафтил)аланингидрохлорида (5,0 г, 19,8 ммоль), Na2CO3 (7,3 г, 69,3 ммоль) и 1,4-диоксана (30 мл) в H2O (50 мл) добавили аллилхлорформат, (2,1 мл, 19,8 ммоль) при 0°С. Получившуюся смесь перемешивали в течение 16 часов, затем сконцентрировали при пониженном давлении. Остаток разбавили этилацетатом (50 мл) и при 0°С подкислили до рН 2. Водную фазу экстрагировали этилацетатом (3×20 мл), объединенную органическую фазу промыли H2O (50 мл) и соляным раствором (20 мл), высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения 72 в форме бесцветного масла (5,8 г, 97%), которое применяли на следующем этапе без дополнительной очистки. ВЭЖХ (к 6,60 минут.
Пример 72 - Синтез соединения 73 (S)-аллил 1-(метокси(метил)амино)-3-(нафталин-2-ил)-1-оксопропан-2-илкарбамата
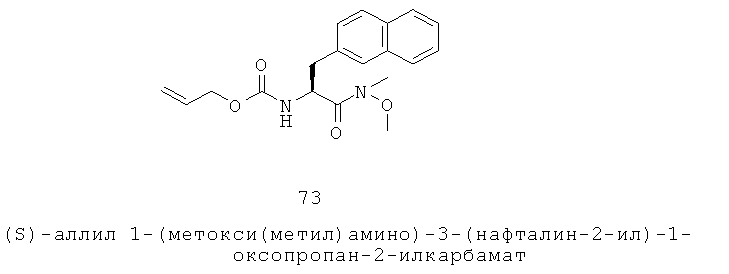
К перемешанной смеси кислоты 72 (5,84 г, 19,5 ммоль), DIPEA (3,7 мл, 2,09 ммоль) и ВОР (8,63 г, 19,5 ммоль) в DCM (10 мл) добавили предварительно смешанный раствор N,О-диметилгидроксиламингидрохлорида (1,9 г, 19,5 ммоль) и DIPEA (7,3 мл, 41,6 ммоль) в DCM (10 мл) при комнатной температуре. Перемешивание продолжалось в течение 16 часов, реакционную смесь промыли 1Н HCl (3×60 мл), H2O (3×60 мл), насыщенным водным раствором NaHCO3 (3×60 мл) и соляным раствором (60 мл), высушили над MgSO4. Очисткой посредством силикагелевой хроматографии с помощью 20% этилацетата в петролейном эфире в качестве элюента получили 73 (4,83 г, 71%) в форме бесцветного масла. MS (ESI) 343 (М+1); ВЭЖХ tR 7,07 минут.
Пример 73 - Синтез соединения 74 (S)-аллил 1-(нафталин-2-ил)-3-оксопент-4-ен-2-илкарбамата
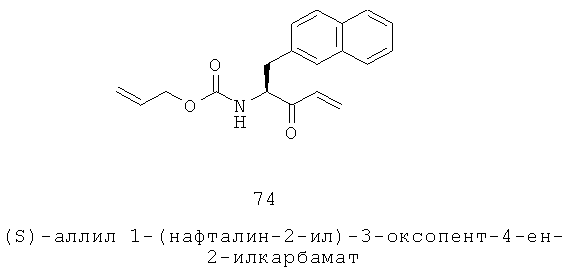
При 0°С раствор винилмагнийбромида в THF (11,5 мл, 1 М) добавили за одну порцию к амиду Вейнреба 73 (1,58 г, 4,62 ммоль) под азотом с перемешиванием. Получившейся смеси позволили перемешиваться в течение 2 часов и вылили в смесь 1Н HCl/лед (50 мл). Водную смесь экстрагировали DCM (3×20 мл), объединенный DCM экстракт промыли-1Н HCl (50 мл), насыщенным водным раствором NaHCO3 (50 мл) и соляным раствором (20 мл), высушили над MgSO4. Растворитель удалили при пониженном давлении, получая продукт 74 (1,14 г, 80%), который применяли на следующем этапе без дополнительной очистки. MS (ESI) 310 (М+1); ВЭЖХ tR 7,51 минут.
Пример 74 - Синтез соединения 75 (S)-аллил 5-(2,2-дифенилэтиламино)-1-(нафталин-2-ил)-3-оксопентан-2-илкарбамата
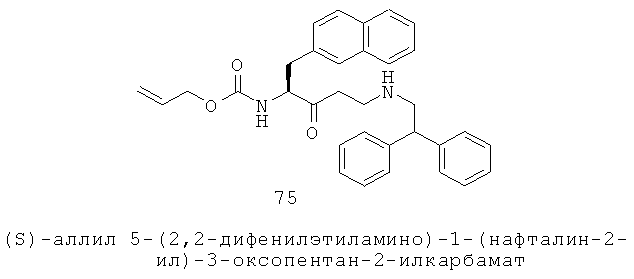
К перемешанному раствору 2,2-дифенилэтиламина (0,45 г, 2,3 ммоль) в DCM (55 мл) добавили винилкетон 74 (0,71 г, 2,3 ммоль) за одну порцию. Перемешивание продолжалось в течение 2 часов, после этого реакционную смесь, применяли на последующем этапе без очистки. MS (ESI) 507 (М+1); ВЭЖХ tR 7,22 минут.
Пример 75 - Синтез соединения 76 (S)-аллил 5-(N-(Вос-1-Arg(Cbz)2) 2,2-дифенилэтиламино)-1-(нафталин-2-ил)-3-оксопентан-2-илкарбамата
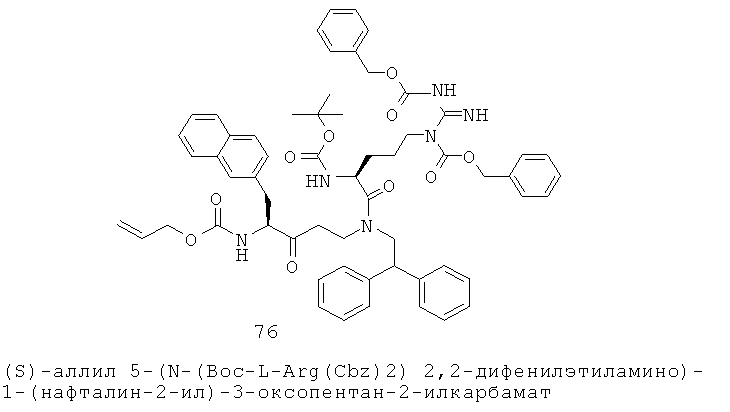
К перемешанному раствору аддукта амина 75 (2,3 ммоль) добавили смесь Вос-Arg(Cbz)2-OH (1,25 г, 2,3 ммоль), DIPEA (0,8 мл, 4,6 ммоль) и HATU (0,87 г, 2,3 ммоль) в DCM (15 мл) при комнатной температуре. Перемешивание продолжалось в течение 16 часов, после чего реакционную смесь промыли насыщенным водным раствором NaHCO3 (3×20 мл) и соляным раствором (10 мл), затем высушили над MgSO4. Очисткой посредством силикагелевой хроматографии с помощью 20% этилацетата в петролейном эфире в качестве элюента получили 76 в форме бесцветного масла (708 мг, 30% за 3 этапа). MS (ESI) 1031 (М+1); ВЭЖХ tR 10,80 минут.
Пример 76 - Синтез соединения 77 аллил (S)-1-((3S,5RS)-1-(2,2-дифенилэтил)-3-(бис Cbz 3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)-2-(нафталин-2-ил)этилкарбамата
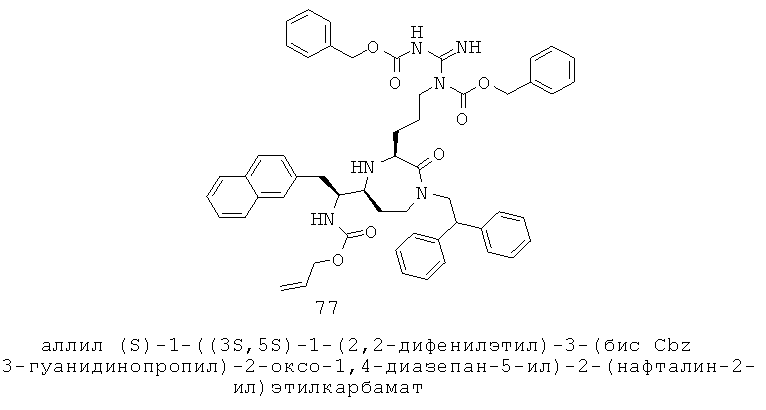
К перемешанному раствору ациклического промежуточного продукта 76 (0,48 г, 0,47 ммоль) в DCM (5 мл) добавили TFA (5 мл) при комнатной температуре. Перемешивание продолжалось в течение 30 мин, после чего смесь разбавили DCM (20 мл), затем промыли насыщенным водным раствором NaHCO3 (3×20 мл) и соляным раствором (10 мл) и высушили над MgSO4. К получившемуся раствору добавили триацетоксиборогидрид натрия (0,2 г, 0,94 ммоль) с перемешиванием при комнатной температуре, через 30 мин смесь промыли насыщенным водным раствором NaHCO3 (3×20 мл) и соляным раствором (10 мл), затем высушили над MgSO4. Неочищенный 77, смесь диастереомеров в диазепан-2-оне С5, применяли на следующем этапе без дополнительной очистки. MS (ESI) 915 (М+1)
Пример 77 - Синтез соединения 78 бис (Cbz) 1-(3-((2S,7RS)-7-((S)-1-амино-2-(нафталин-2-ил)этил)-4-(2,2-дифенилэтил)-3-оксо-1,4-диазепан-2-ил)пропил)гуанидина
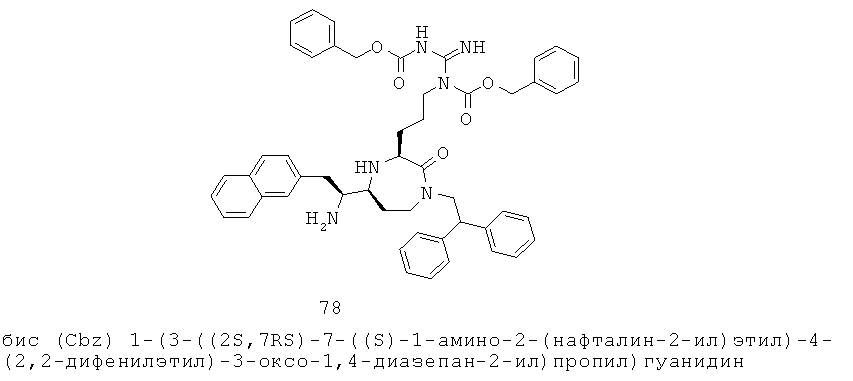
Смесь соединения 77 (36 мг, 0,039 ммоль), 1,3-диметилбарбитуровой кислоты (7,4 мг, 0,047 ммоль) и Pd(PPh3)4 в DCM (5 мл) перемешивали при комнатной температуре под вакуумом в течение 4 часов. Получившуюся смесь применяли на следующем этапе без дополнительной очистки. MS (ESI) 832 (М+1)
Пример 78 - Синтез соединений 79 и 80 N-((S)-1-((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)-2-(нафталин-2-ил)этил)ацетамида и N-((S)-1-((3S,5R)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)-2-(нафталин»2-ил)этил)ацетамида
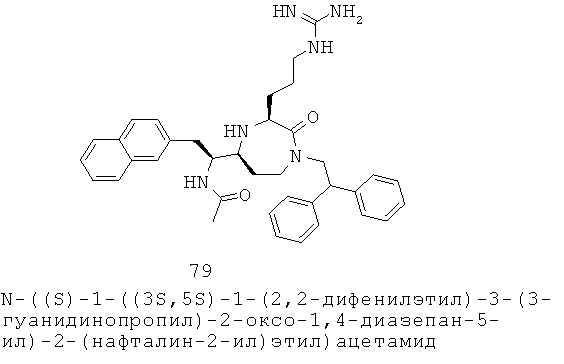
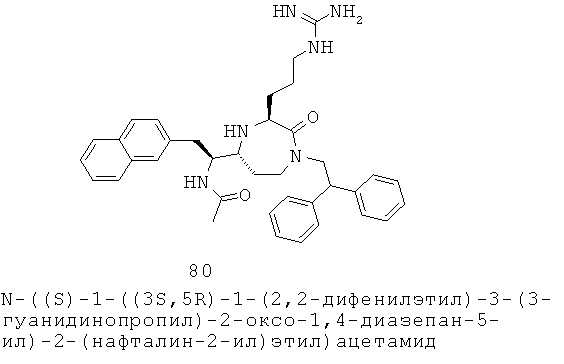
Раствор амина 78 (0,09 ммоль) в DCM (5 мл) обработали уксусным ангидридом (8,6 мкл, 0,09 ммоль) с перемешиванием при комнатной температуре. Через 3 часа смесь сконцентрировали,- повторно растворили в EtOAc, промыли насыщенным водным раствором NaHCO3 (10 мл) и соляным раствором (10 мл), высушили над MgSO4, затем сконцентрировали при пониженном давлении. Остаток растворили в МеОН (10 мл), добавили Pd/C (5 мг) и раствор взбалтывали под Н2 при 20 psi в течение 16 часов. Реакцию профильтровали, сконцентрировали и очистили посредством препаративной ВЭЖХ для получения предпочтительного диастереомера 79 (3 мг) и менее предпочтительного диастереомера 80 (6 мг) в форме белых твердых веществ. 79: MS (ESI) 606,4 (М+1); ВЭЖХ tR 6,033 минут 80: MS (ESI) 606,3 (М+1); ВЭЖХ tR 6,046 минут
Пример 79 - Синтез соединений 81 и 82 (S)-2-ацетамидо-N-((S)-1-((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)-2-(нафталин-2-ил)этил)-3-(1Н-имидазол-5-ил)пропанамида и (S)-2-ацетамидо-N-((S)-1-((3S,5R)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)-2-(нафталин-2-ил)этил)-3-(1Н-имидазол-5-ил)пропанамида
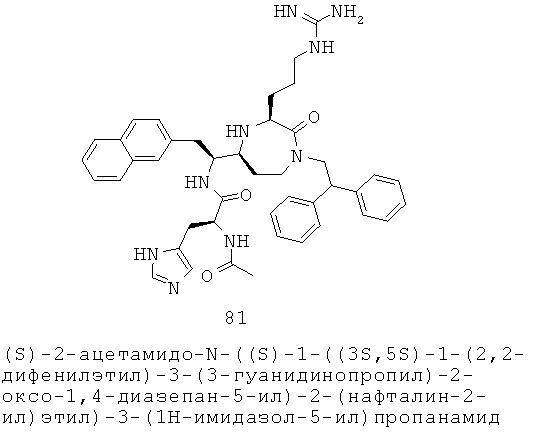
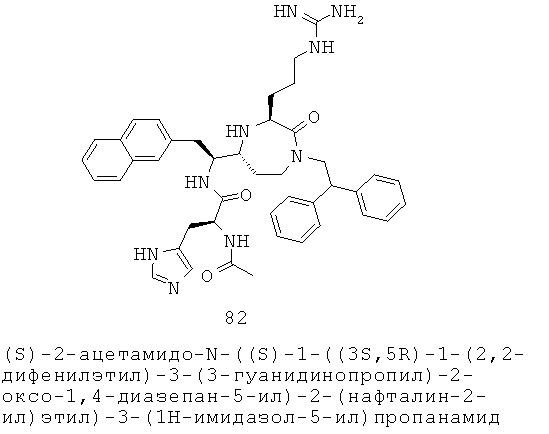
К перемешанной смеси Ac-L-His-OH (33,6 мг, 0,156 ммоль), DIPEA (112,5 мкл, 0,312 ммоль) и ВОР (68,8 мг, 0,156 ммоль) в DMF (1 мл) добавили амин 78 (0,039 ммоль) при комнатной температуре. Перемешивание продолжали в течение 16 часов, затем реакционную смесь разбавили смесью DCM/H2O (10 мл, 1:1 объем/объем) и водную фазу экстрагировали DCM (3×5 мл). Объединенные DCM экстракты промыли насыщенным водным раствором NaHCO3 (3×20 мл) и соляным раствором (10 мл), высушили над MgSO4, и сконцентрировали при пониженном давлении. Остаток повторно растворили в МеОН (5 мл) и добавили Pd/C (20 мг). Получившуюся смесь взбалтывали под H2 при 30 psi в течение 16 часов, затем профильтровали, сконцентрировали и очистили посредством препаративной ВЭЖХ для получения предпочтительного диастереомера 81 (1,9 мг) и менее предпочтительного диастереомера 82 (0,9 мг) в форме белых твердых веществ.
81: MS (ESI) 743,4 (М+1); ВЭЖХ tR 5,489 минут
82: MS (ESI) 743,4 (М+1); ВЭЖХ tR 5,555 минут
Пример 80 - Синтез соединений 83 и 84 пропил (S)-1-((3S,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)-2-(нафталин-2-ил)этилкарбамата и пропил (S)-1-((3S,5R)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)-2-(нафталин-2-ил)этилкарбамата
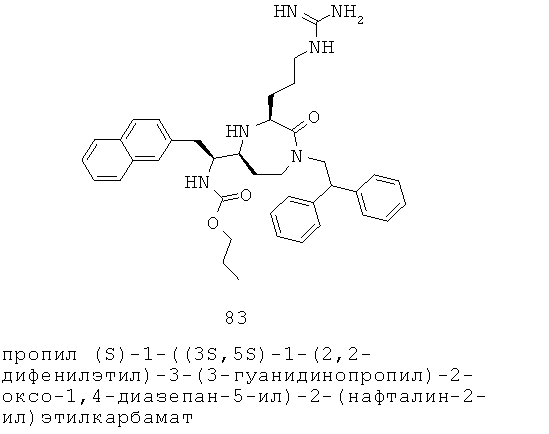
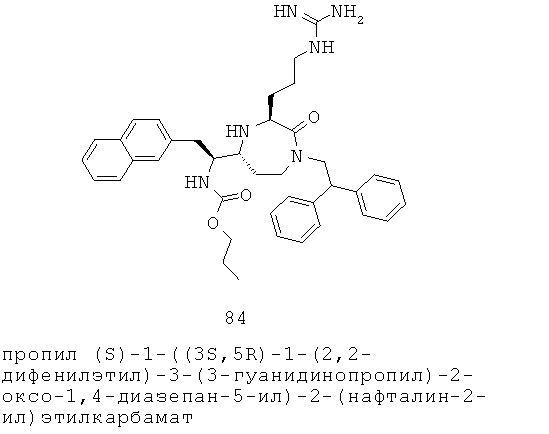
Смесь 77 (36 мг, 0,039 ммоль) и Pd/C (5 мг) в МеОН (5 мл) взбалтывали под Н2 при 20 psi в течение 16 часов, затем профильтровали, сконцентрировали и очистили посредством препаративной ВЭЖХ для получения предпочтительного диастереомера 83 (0,07 мг) и менее предпочтительного диастереомера 84 (2,7 мг) в форме белых твердых веществ.
83: MS (ESI) 650,3 (М+1); ВЭЖХ tR 6,52 минут
84: MS (ESI) 650,2 (М+1); ВЭЖХ tR 6,64 минут
Пример 81 - Синтез соединений 85-87 1-(3-((2S,7S)-7-(N-R1 (R)-1-амино-2-(нафталин-2-ил)этил)-4-(2,2-дифенилэтил)-3-оксо-1,4-диазепан-2-ил)пропил)гуанидина
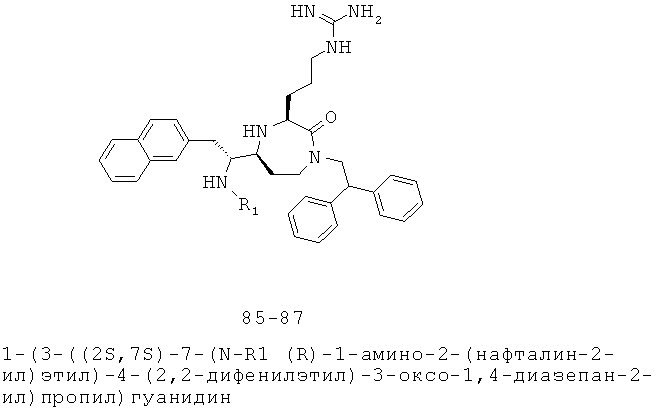
Соединения 85-87 были приготовлены таким же образом, как и предпочтительные диастереомеры соединений 79, 81 и 83 при помощи методик, описанных в Примерах 72-81 с D-(2-нафтил)аланингидрохлоридом в качестве исходного материала.
|
Примеры 82-90: Синтезы посредством схемы 2: Приготовление всех четырех диастереомеров N-((1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида 88
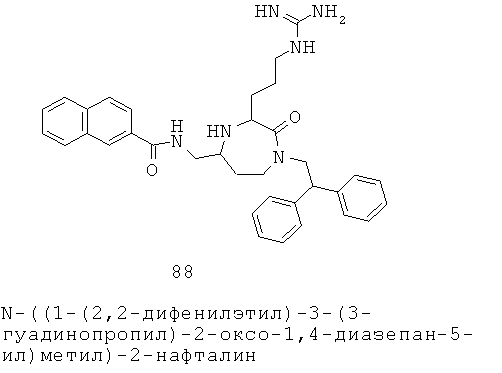
Пример 82 - Синтез соединения 89 2,2-диметил-10-(2,2-дифенилэтил)-4,7,11-триоксо-3,12-диокса-5,10-диазапентадек-14-ена
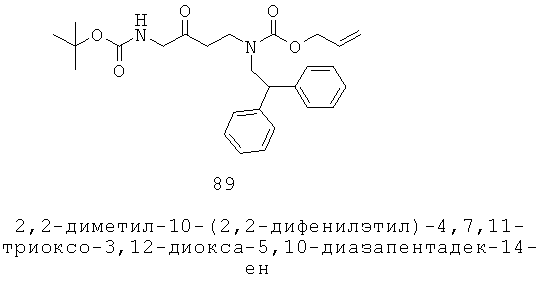
2,2-дифенилэтиламин (3 г) добавили к Вос-винилкетону 16 (2,8 г), как в Примере 17. К неочищенному аддукту 17 добавили Alloc-Cl (1,6 мл) и реакцию перемешивали до тех пор, пока ТСХ (тонкослойная хроматография) не показала потребление вторичного амина. Растворитель выпарили и остаток очистили колоночной хроматографией (SiO2 гель, пет. эфир/EtOAc) для получения 3,2 г (57%) 89.
Пример 83 - Синтез соединения 90 (S)-аллил 2-амино-5-(бензилоксикарбониламино)пентаноат L-Н-Orn(Cbz)-Оаллила
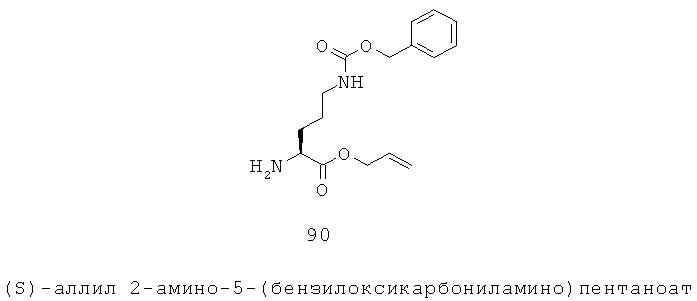
H-L-Orn(Cbz)-OH (6,66 г, 25 ммоль), аллильный спирт (17,56 мл, 25 ммоль) и р-TsOH (5,7 г, 30 ммоль) растворили в бензоле (200 мл) и кипятили с обратным холодильником при условиях Дина-Старка в течение 5 часов. Большую часть растворителя затем отогнали, остальную часть удалили под вакуумом. Получившееся твердое вещество перекристаллизовали из DCM, профильтровали и высушили для получения 11,19 г (94%) соли тозилата. Для получения свободного амина твердое вещество растворили в DCM, промыли насыщ. NaHCO3, водный слой промыли DCM (3×) и органические слои высушили над MgSO4 и выпарили досуха.
Пример 84 - Синтез соединения 91 (R)-аллил 2-амино-5-(бензилоксикарбониламино)пентаноат D-Н-Orn(Cbz)-Оаллила
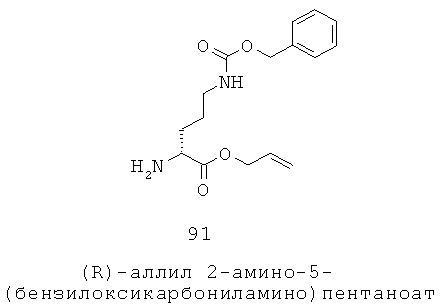
H-D-Orn(Cbz)-OH (6,66 г, 25 ммоль) превратили в 10,93 г (91%) соли тозилата 91, как в Примере 83, затем превратили в свободный амин.
Пример 85 - Синтез соединения 92 (2R)-аллил 5-(бензилоксикарбониламино)-2-(10-(2,2-дифенилэтил)-2,2-диметил-4,11-диоксо-3,12-диокса-5,10-диазапентадек-14-ен-7-иламино)пентаноата
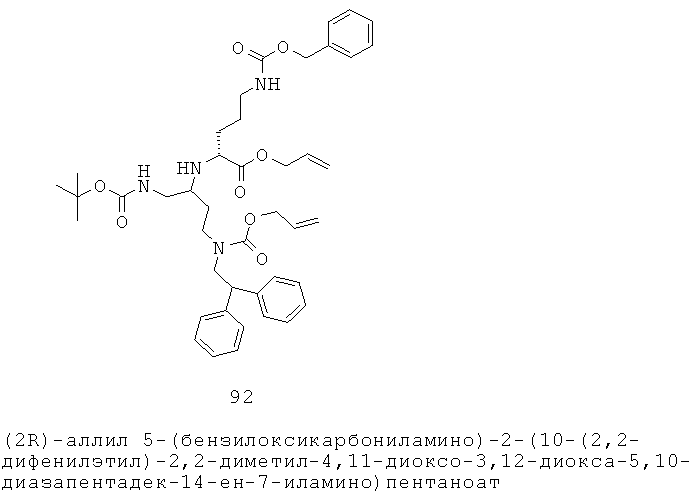
Защищенный аминокетон 89 (746 мг, 1,6 ммоль), D-Orn(Cbz)-Oaллил 91 (538 мг, 1,76 ммоль) и NaBH(ОАс)3 (678 мг, 3,2 ммоль) в минимальном количестве объема DCM перемешивали в течение 24 часов. Добавили каплю АсОН непосредственно перед отработкой, на этом уровне добавили насыщенный NaHCO3, экстрагировали с помощью DCM (3×), и органические экстракты объединили и промыли насыщенным NaHCO3 и Н2О, высушили над MgSO4, и выпарили досуха. Продукт очистили колоночной хроматографией (SiO2 гель, пет. эфир/EtOAc) для получения 890 мг (74%) 92 в качестве смеси диастереоизомеров.
Пример 86 - Синтез соединения 93 (28)-аллил 5-(бензилоксикарбониламино)-2-(10-(2,2-дифенилэтил)-2,2-диметил-4,11-диоксо-3,12-диокса-5,10-диазапентадек-14-ен-7-иламино)пентаноата
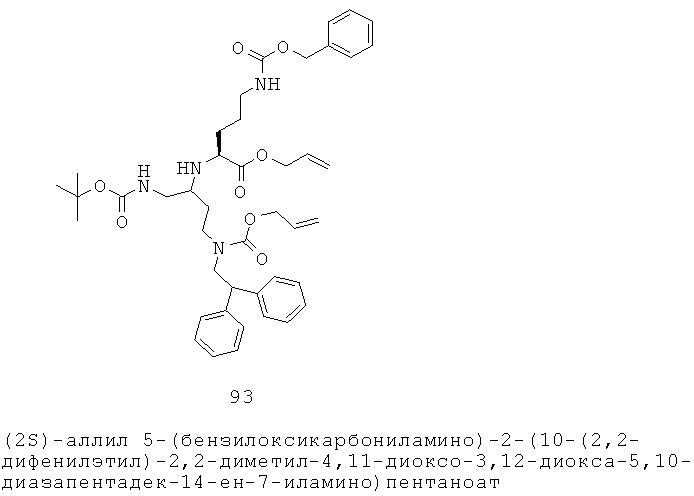
L-Orn(Cbz)-Оаллил 90 (592 мг, 1,93 ммоль) превратили в смесь многих диастереомеров 93 (925 мг, 76%), следуя методикам Примера 86.
Пример 87 - Синтез соединений 94 и 95 (3R,5S)-5-(N-Boc аминометил)-3-(N-Cbz 3-аминопропил)-1-(2,2-дифенилэтил)-1,4-диазепан-2-она и (3R,5R)-5-(N-Boc аминометил)-3-(N-Cbz 3-аминопропил)-1-(2,2-дифенилэтил)-1,4-диазепан-2-она
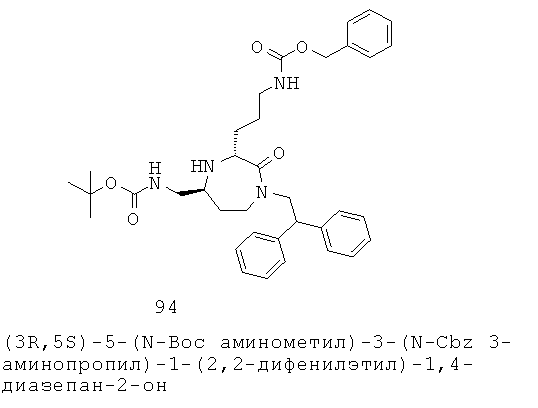
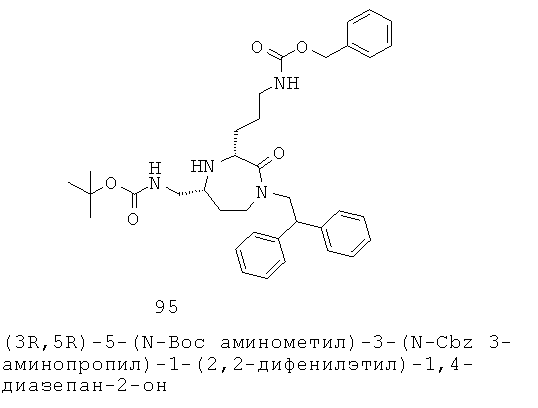
Alloc/аллил защищенное производное 92 (840 мг, 1,11 ммоль) растворили в минимальном количестве DCM. Добавили 1,3-диметилбарбитуровую кислоту (346 мг, 2,22 ммоль) и каталитический Ра(РРh3)4 и реакцию дегазировали под вакуумом, герметизировали и перемешивали всю ночь. Реакцию разбавили до 50 мл DCM, добавили DIPEA (430 мг, 3,33 ммоль) и ВОР (540 мг, 1,22 ммоль) и реакцию перемешивали в течение 30 минут. DCM удалили под вакуумом и остаток поглотили в EtOAc, промыли (насыщенный NaHCO3, H2O, насыщенный NaCl), высушили (MgSO4) и выпарили досуха (ТСХ: EtOAc, 2 пятна, Rf 0,33 и 0,57). Два диастереомерных продукта отделили колоночной хроматографией (SiO2 гель, пет. эфир/EtOAc) для получения 362 мг ранее элюированного (3R,5S) изомера 94, и 342 мг позднее элюированного (3R,5R) изомера 95.
Пример 88 - Синтез соединений 96 и 97 (3S,5R)-5-(N-Boc аминометил)-3-(N-Cbz 3-аминопропил)-1-(2,2-дифенилэтил)-1,4-диазепан-2-она и (3S,5S)-5-(N-Boc аминометил)-3-(N-Cbz 3-аминопропил)-1-(2,2-дифенилэтил)-1,4-диазепан-2-она
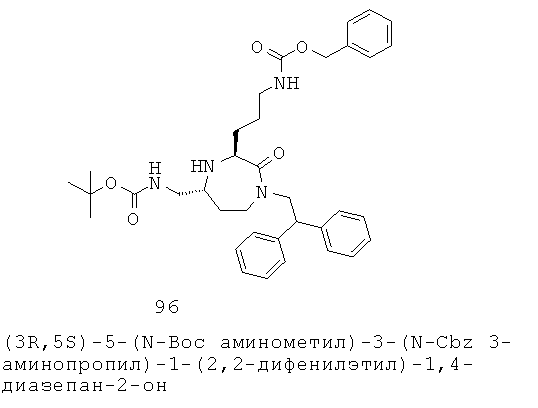
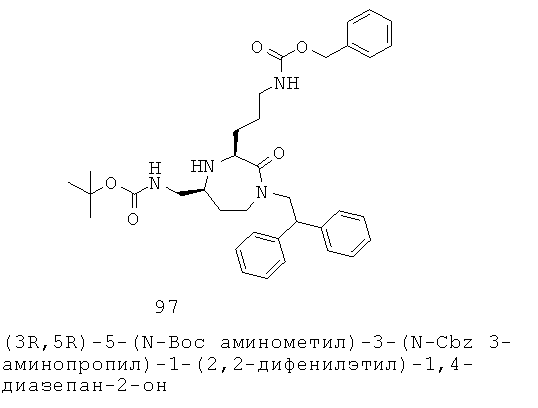
(3S,5R) (312 мг) и (3S,5S) (331 мг) изомеры получили из L-Orn-производного ациклического материала 93 (870 мг), следуя методике Примера 87.
Пример 89 - Синтез соединений 98-101 5-(N-Boc аминометил)-3-(N,N'-Cbz 3-гуанидинопропил)-1-(2,2-дифенилэтил)-1,4-диазепан-2-она
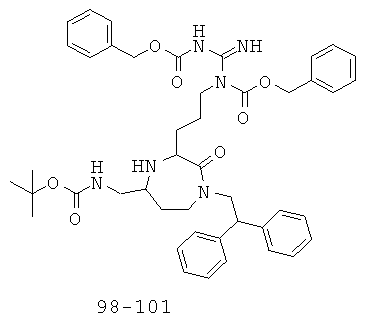
Orn Cbz группу 94 удаляли посредством гидрирования (H2, 30 psi) над каталитическим Pd/C в метаноле всю ночь. Раствор профильтровали через Целит и выпарили для получения твердого вещества. Раствор получившегося амина (187 мг, 0,39 ммоль) в DCM смешали с раствором гуанилирующего реактива CbzNHC(=NCbz)NHTf (196 мг, 0,43 ммоль) в DCM. Добавили TEA (43 мг, 0,43 ммоль) и реакцию перемешивали всю ночь. Раствор разбавили с DCM, промыли (KHSO4, насыщ. NaHCO3, соляной раствор), высушили (MgSO4) и выпарили досуха, затем очистили при помощи флэш-хроматографии на SiO2 при помощи гексан/EtOAc в качестве элюента для получения (3R,5S) 98 (182 мг, 59%). Другие изомеры 95-97 превратили подобным образом для получения:
99 (3R,5R): 171 мг (68%) из 148 мг амина
100 (3S,5S): 80 мг (65%) из 72 мг амина
101 (3S,5R): 142 мг (58%) из 144 мг амина
Пример 90 - Синтез соединений 102-105
102 N-(((3R,5S)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
103 N-(((3R,5R)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
104 N-(((3S,5R)-1-(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
105 N-(((3S,5S)-1 -(2,2-дифенилэтил)-3-(3-гуанидинопропил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
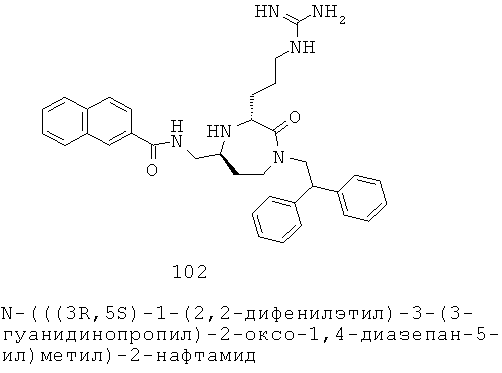
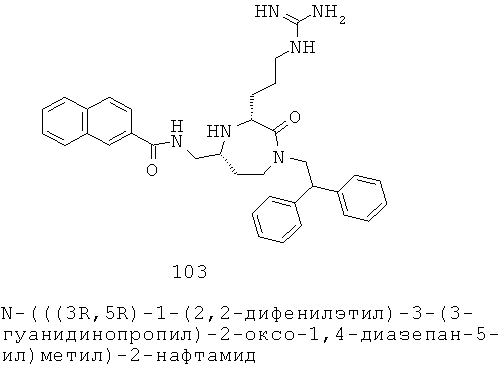
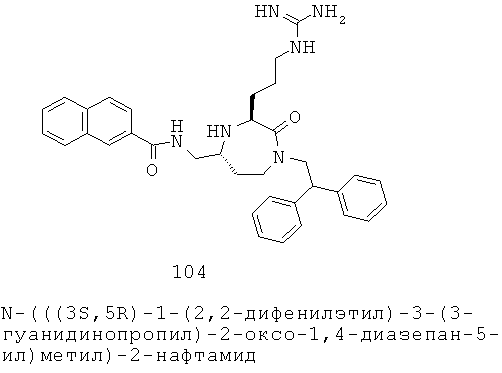
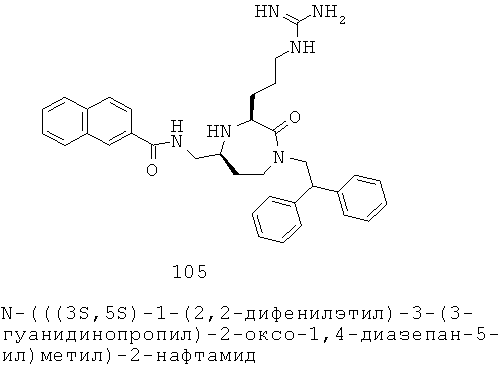
Вое производное 99 (180 мг) в DCM (1 мл) обработали TFA (1 мл) на 20 мл. Растворитель удалили посредством выпаривания, добавили раствор NaHCO3, и экстрагировали 3× DCM. Раствор дихлорметана высушили над MgSO4, профильтровали и выпарили досуха. Порцию (56 мг, 0,086 ммоль) неочищенного амина со снятыми защитными группами в DCM перемешивали с 2-нафтойной кислотой (16 мг), DIPEA (60 мкл) и ВОР (42 мг) в течение 30 мин. Добавили МеОН и реакцию перемешивали всю ночь. Реакцию профильтровали, затем очистили при помощи флэш-хроматографии на SiO2 с помощью петролейный эфир/EtOAc в качестве элюента для получения (3R,5R) изомера (43 мг, 94%). Другие изомеры превратили подобным образом для получения: (3R,5S): 41 мг (85%) из 60 мг 98, (3S,5R): 27 мг (70%) из 40 мг 101, и (3S,5S): 13 мг (74%) из 20 мг 100.
Каждое соединение растворили в диоксан:МеОН и гидрировали над каталитическим Pd/C при 30 psi H2 всю ночь. Раствор профильтровали через Целит и выпарили для получения твердого вещества. 102 (3R,5S): 27 мг (96%) из 41 мг, 103 (3R,5R): 25 мг (85%) из 43 мг, 104 (3S,5R): 11 мг (количественный) из 13 мг и 105 (3S,5S): 3 мг (73%) из 6 мг.
|
Пример 91 - Синтез соединений 425,565, 580-585
425 6-хлор-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
565 6-хлор-N-(((3S,5S)-2-оксо-1-((R)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
580 6-хлор-N-(((3R,5R)-2-оксо-1-((Р)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
581 6-хлор-N-(((3S,5R)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
582 6-хлор-N-(((3R,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
583 6-хлор-N-(((3S,5R)-2-оксо-1-((R)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
584 6-хлор-N-(((3R,5S)-2-оксо-1-((R)-2-фенилбутил)-3-(2-(пиперидин-1 -ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
585 6-хлор-N-(((3R,5R)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамид
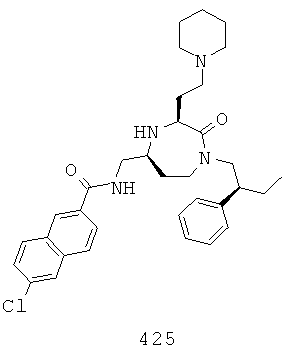
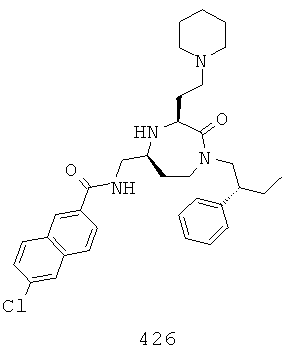
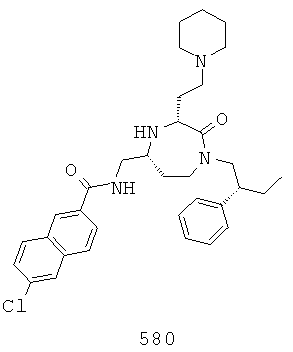
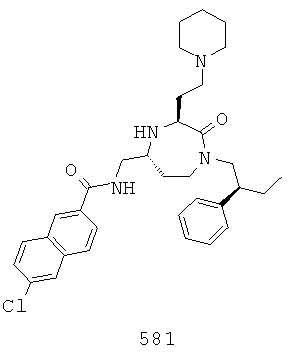
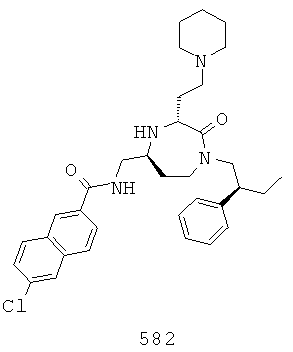
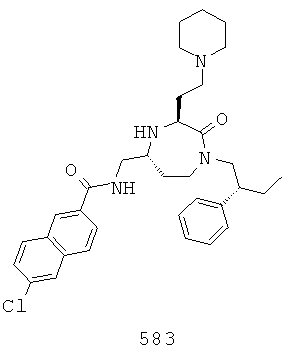
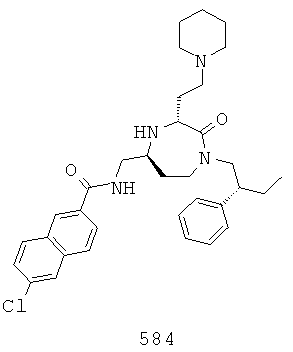
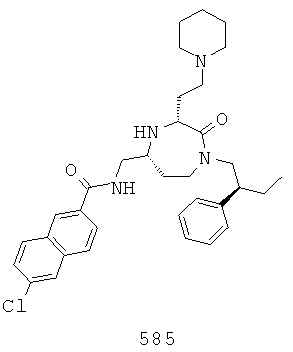
Соединения 425, 565 и 580-585 приготовили, следуя подобным методикам, как используются для приготовления соединений 102-104 (путь схемы 2). К тому же соединения 425, 565, 580 и 585 приготовили согласно пути схемы 1; подробная методика для приготовления соединения 425 содержится в Примерах 92-99.
|
Пример 92 - Синтез соединения 586 (S)-N-(2-оксо-4-(2-фенилбутиламино)бутил)-3-фенилпропанамида
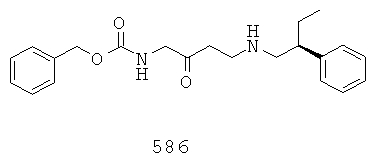
К раствору (S)-фенилбутиламина (8,5 г, 57,07 ммоль) в DCM (100 мл) добавили раствор α,β-ненасыщенного кетона 27 (12,5 г, 57,1 ммоль) в DCM (100 мл) при комнатной температуре за одну порцию. Получившуюся смесь перемешивали до тех пор, пока все α,β-ненасыщенные кетоны не израсходовались (в течение одного часа), затем аддукт сопряженного присоединения 586 применяли непосредственно в последующей реакции.
ВЭЖХ tR 5,71 минут
MS (ESI) 369,3 (М+1)
Пример 93 - Синтез соединения 587 (S)-9-флуоренилметил 10-[(S)-2-фенилбутил]-2,2-диметил-18-фенил-4,9,13,1 6-тетраоксо-3,17-диокса-5,10,15-триазаоктадекан-8-илкарбамата
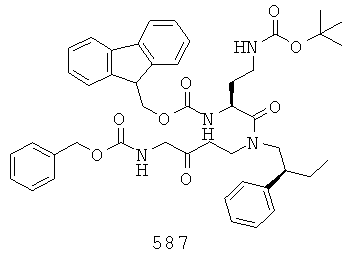
К свежеприготовленному амину 586 в DCM (200 мл) добавили Fmoc-L-Dab(Boc)OH (32,7 г, 74,2 ммоль) с последующим DIPC (11,5 г, 74,2 ммоль) при комнатной температуре. Получившуюся смесь перемешивали в течение 2 часов, побочный продукт диизопропилмочевину удалили при помощи фильтрации через прокладку Celite® и фильтрат сконцентрировали при пониженном давлении для получения неочищенного продукта, который очистили посредством силикагелевой колоночной хроматографии при помощи 30-70% EtOAc/Уайт-спирит в качестве элюента для получения 587 (19,9 г, 44% выход через два этапа).
ТСХ rf 0,23 (50% EtOAc/Уайт-спирит)
ВЭЖХ tR 10,03 минут
MS (ESI) 791,2 (М+1)
Пример 94 - Синтез соединения 588 (S)-10-[(S)-2-фенилбутил]-2,2-диметил-8-амино-18-фенил-4,9,13,16-тетраоксо-3,17-диокса-5,10,15-триазаоктадекана
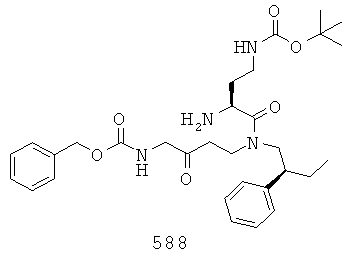
Диэтиламин (30 мл) добавили к раствору ацилированного амина 587 (19,9 г, 25,19 ммоль) в DCM (30 мл) при комнатной температуре и получившуюся смесь перемешивали в течение 30 минут. Растворитель и диэтиламин удалили при пониженном давлении для получения целевого продукта 588. Его применяли на следующем этапе без дополнительной очистки.
ВЭЖХ tR 6,85 минут
MS (ESI) 569,3 (M+1)
Пример 95 - Синтез соединения 589 (3S,5S)-3-(2-трет-бутоксикарбониламиноэтил)-5-(бензилоксикарбониламинометил)-1-[(5)-2-фенилбутил]-1,4-диазепан-2-она
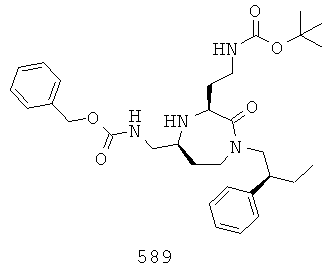
К раствору неочищенного Fmoc материала со снятыми защитными группами 588 в DCM (50 мл) добавили АсОН (15 мл), затем NaBH(ОАс)3 (5,34 г, 25,2 ммоль) за одну порцию при комнатной температуре. Получившуюся смесь перемешивали в течение 30 минут, затем промыли насыщенным раствором NaHCO3 (водн.) (80 мл × 3), соляным раствором (80 мл) и высушили над MgSO4. Фильтрацией и концентрированием органической фазы при пониженном давлении получили неочищенный продукт, который очистили при помощи силикагелевой колоночной хроматографии с помощью 50-100% EtOAc/Уайт-спирит, затем 20% MeCN/EtOAc для получения продукта 589 (12,3 г, 88% за два этапа).
ТСХ rf 0,19 (70% EtOAc/Уайт-спирит)
ВЭЖХ tR 7,06 минут
MS (ESI) 553,3 (M+1)
Пример 96 - Синтез соединения 590 трет-бутил 2-{(2S,7S)-7-аминометил-3-оксо-4-[(S)-2-фенилбутил]-1,4-диазепан-2-ил}этилкарбамата
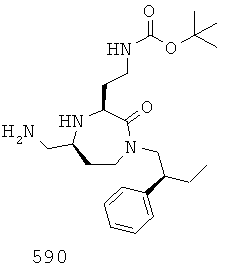
Смесь Cbz-защищенного продукта 589 (12,3 г, 22,3 ммоль) и 5% Pd/C (2 г) в МеОН (100 мл) взбалтывали при комнатной температуре под водородом при атмосферном давлении в течение одного часа. Смесь затем профильтровали через прокладку из Celite® и фильтрат сконцентрировали при пониженном давлении для получения неочищенного амина 590. Неочищенный материал применяли на следующем этапе без дополнительной очистки. ВЭЖХ tR 5,77 минут MS (ESI) 419,3 (M+1)
Пример 97 - Синтез соединения 591 трет-бутил 2-((2S,7S)-7-((6-хлор-2-нафтамид)метил)т3-оксо-4-((S)-2-фенилбутил)-1,4-диазепан-2-ил)этилкарбамата
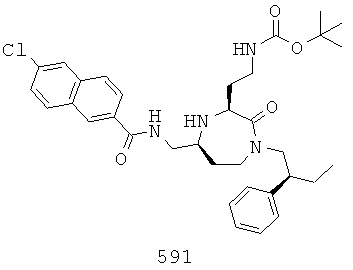
К раствору свободного амина 590 и 6-хлор-2-нафтойной кислоты (4,58 г, 22,3 ммоль) в DCM (125 мл) добавили диизопропилэтиламин (7,74 мл, 44,5 ммоль) и ВОР (9,84 г, 22,3 ммоль) при комнатной температуре. Получившуюся смесь перемешивали в течение 16 часов, затем удалили DCM при пониженном давлении. Остаток поглотили в EtOAc (80 мл), затем промыли насыщенным NaHCO3 (водн.) (100 мл × 5), соляным раствором (100 мл) и высушили над MgSO4. Фильтрацией и концентрированием органической фазы получили неочищенный материал, который очистили при помощи силикагелевой колоночной хроматографии с помощью 80-100% EtOAc/уайт-спирит в качестве элюента для получения продукта 591 (10,7 г, 79%).
ТСХ rf 0,31 (80% EtOAc/уайт-спирит)
ВЭЖХ tR 7,66 минут
MS (ESI) 607,2 (М+1)
Пример 98 - Синтез соединения 465 N-(((3S,5S)-3-(2-аминоэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамида
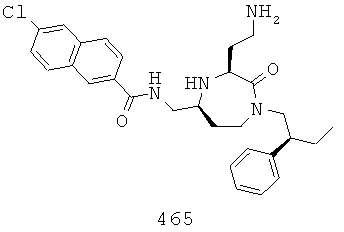
К Вос защищенному материалу 591 (10,7 г, 17,6 ммоль) в DCM (26 мл) добавили TFA (26 мл) за одну порцию, получившуюся смесь перемешивали при комнатной температуре в течение одного часа. DCM удалили при пониженном давлении и остаток поглотили в EtOAc (30 мл), промыли насыщенным NaHCO3 (водн.) (30 мл × 3), соляным раствором (30 мл) и высушили над MgSO4. Фильтрацией и концентрированием органической фазы при пониженном давлении получили неочищенный амин 465, который применяли на следующем этапе без дополнительной очистки.
ВЭЖХ tR 5,98 минут
MS (ESI) 507,0 (М+1)
Пример 99 - Синтез соединения 425 6-хлор-N-(((3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)-2-нафтамида
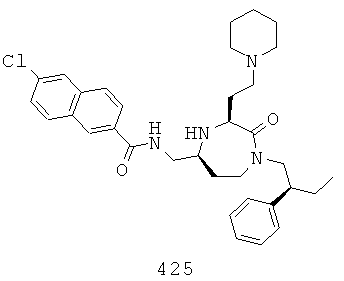
К смеси неочищенного амина 465 в CH3CN (800 мл) добавили 1,5-дибромпентан (23,9 мл, 175,7 ммоль), затем К2СО3 (48,6 г, 351,4 ммоль). Получившуюся смесь перемешивали при комнатной температуре в течение 44 часов, наблюдали при помощи ВЭЖХ для превращения sm (6,0 мин) в продукт (6,4 мин), избегая продолженных времен реакции, приводящих к переалкилированию для образования бромпентилалкилированного побочного продукта (7,1 мин). Во время выделения, следует избегать избыточного нагревания/концентрирования неочищенного раствора перед удалением избыточного дибромпропана во избежание переалкилирования пиперидинового кольца. K2СО3 удалили при помощи фильтрации через прокладку Celite® и фильтрат промыли уайт-спиритом (800 мл × 2). Фазу MeCN сконцентрировали при пониженном давлении до 400 мл и промыли уайт-спиритом (400 мл × 2). MeCN дополнительно сконцентрировали при пониженном давлении до 200 мл и промыли уайт-спиритом (200 мл × 2). Выпаривание конечной промывки уайт-спиритом показало, что экстрагировали не более 1,5-дибромпентана, так что фазу MeCN сконцентрировали при пониженном давлении.
Аминопропил-функционализованная ТСХ rf 0,05-0,47 (80% EtOAc/уайт-спирит)
Аналитическая ВЭЖХ tR 6,41 минут
MS (ESI) 575,2 (М+1).
Неочищенный продукт очистили при помощи комбинации флеш-колоночной хроматографии через аминопропил-функционализованный силикагель и/или при помощи перекристаллизации из ацетонитрила.
Флеш-колонна: В колонну, заполненную аминопропилфункционализованным силикагелем (154 г) в 20% этилацетат/уайт-спирите, загрузили неочищенное свободное базовое масло (7,2 г). Колонну элюировали 20% этилацетат/уайт-спиритом (150 мл) с последующим 50% этилацетат/уайт-спиритом (150 мл), 80% этилацетат/уайт-спиритом (150 мл × 2), 100% этилацетатом (150 мл) и, в конечном счете, 100% ацетонитрилом (150 мл). Фракции, содержащие 425, были объединены и выпарены досуха для получения белого кристаллического твердого вещества.
Кристаллизация: Белое кристаллическое твердое вещество (2,87 г), полученное колоночной очисткой, растворили в кипящем ацетонитриле (50 мл) 85°С. Активированный уголь (Darco® G-60, -100 меш, Sigma-Aldrich) (200 мг) добавили для удаления цветной примеси. Добавили дополнительную порцию ацетонитрила (50 мл) и получившуюся смесь нагревали до кипения в течение 5 минут. Древесный уголь отфильтровывали, пока раствор был горячим, фильтровальной бумагой и древесным углем, пропитанным горячим ацетонитрилом (25 мл). Чистый раствор ацетонитрила уменьшили до 50 мл и оставили стоять охлаждаться до комнатной температуры в течение 16 часов. Белые кристаллы отфильтровывали и высушили отсасыванием, для получения 2,22 г (99,0% чистоты ВЭЖХ анализом). Дополнительные 117,2 мг (93,3% чистота) получили дополнительной кристаллизацией из фильтрата.
Превращение в бисНCl соли: Свободное основание (2,4229 г, 42,1 ммоль) суспендировали в 1:1 смеси ацетонитрила и milliQ H2O (10 мл). Раствор 1 М HCl (водн.) добавляли до тех пор, пока не растворились все твердые вещества (приблизительно 5 мл). Дополнительное количество milliQ H2O затем добавили (20 мл) и получившийся раствор заморозили и лиофилизировали всю ночь, получая белый порошок (2,61 г, 95,6% выход).
ВЭЖХ tR 6,27 минут
MS (ESI) 575,1 (М+1).
1H NMR (600 MHz, CDCl3): δ 0,75 (t, 3H, J=7,2 Hz), 1,40 (m, 1H), 1,56 (m, 1H), 1,65 (m, 1H), 1,76-1,90 (m, 4H), 1,90-2,06 (m, 2H), 2,13 (m, 1H), 2,30 (br, 1H), 2,57 (m, 1H), 2,64-2,86 (m, 4H), 2,90-3,10 (m, 2H), 3,25 (dd, 1H, J=15,2, 10,4 Hz), 3,53 (m, 2H), 3,70-3,85 (m, 3H), 4,00 (m, 2H), 4,10 (dd, 1H, J=13,6, 5,6 Hz), 4,45 (m, 1H), 7,10 (d, 2 H, J=7,2 Hz), 7,18 (t, 1H, J=7,2 Hz), 7,26 (t, 1H, J=7,2 Hz), 7,37 (dd, 1H, J=9,0, 1,8 Hz), 7,71 (d, 1H, J=8,4 Hz), 7,75 (s, 1H), 7,86 (d, 1H, J=9,0 Hz), 8,09 (d, 1H, J=9,0 Hz), 8,64 (s, 1H), 8,68 (m, 1H), 9,85 (br, 1H).
13C NMR (100 MHz, CDCl3): δ 11,78, 21,86, 23,08 (2), 24,59, 26,14, 28,09, 42,01, 46,24, 47,22, 53,14, 53,53, 54,03, 56,74, 57,79, 61,96, 125,35, 126,24, 126,89, 127,20, 127,33, 127,85, 128,51, 128,72, 130,69, 130,76, 130,91, 133,48, 135,28, 142,29, 167,18, 167,74.
Пример 100 - Синтез соединения 579 6-хлор-N-(([5,6,6-2H3](3S,5S)-2-оксо-1-((S)-2-фенилбутил)-3-(2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)[2H2]метил)-2-нафтамида
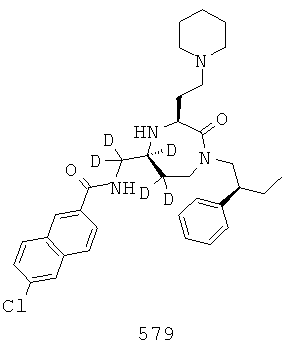
Соединение 579 синтезировали согласно методикам в Примерах 92-99, за исключением того, что этапы снятия Fmoc защитных групп/восстановительного аминирования Примеров 94 и 95 были заменены следующими методиками для введения атомов дейтерия.
К раствору (S)-9-флуоренилметил 10-[(S)-2-фенилбутил]-2,2-диметил-18-фенил-4,9,13,16-тетраоксо-3,17-диокса-5,10,15-триазаоктадекан-8-илкарбамата 587 (370,5 мг, 0,47 ммоль) в сухом THF (7,5 мл) добавили сухой триэтиламин (7,5 мл, 54 ммоль) за одну порцию при комнатной температуре с последующим D2O (99,96 атом. % дейтерия, 3,0 мл, 168 ммоль). Эту смесь перемешивали под азотом при комнатной температуре в течение 16 часов с применением реакционной смеси на следующем этапе без выделения.
MS (ESI) 573,0 (М+1).
tR 6,95 минут.
К неочищенной реакционной смеси дейтерообмена добавили NaBD3CN (152 мг, 2,31 ммоль) за одну порцию, реакцию перемешивали при комнатной температуре в течение 24 часов. Добавили дополнительную порцию NaBD3CN (182,4 мг, 3,28 ммоль) и перемешивание продолжали при комнатной температуре в течение 24 часов. Реакцию быстро охладили добавлением насыщенного NaHCO3 (водн.) и водной смеси, экстрагированной EtOAc (3 × 10 мл × 3). Объединенные органические экстракты промыли соляным раствором (15 мл), высушили над MgSO4 и сконцентрировали в вакууме. Флэш-хроматография (60% EtOAc/уайт-спирит) дала продукт (175,8 мг, 67%).
ТСХ Rf 0,32 (70% EtOAc/уайт-спирит)
Аналитический ВЭЖХ tR 7,06 мин; MS (ESI) m/z 558,0 (М+1), 559,0, 557,0, 560,0.
Пример 101 - Синтезы соединений 106-579.
Соединения 106-579, с заместителями, как идентифицировано в таблице 1, были получены как в предыдущих примерах, согласно путям, идентифицированным на схемах 1-5, как подытожено в таблице 2, с экспериментальными свойствами, подытоженными в таблице 4.
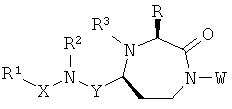
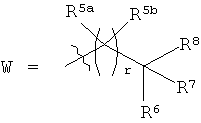
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пример 102 - испытание радиолигандного связывания человеческого MC5R
Оценка связывания соединения с человеческим MC5R (hMC5R) посредством перемещения 125I-меченого NDP-MSH рецепторного лигандного пептида осуществили в основном, как описано в спецификациях, выпускаемых Perkin Elmer для сопровождения их замороженных hMC5R мембран (Perkin Elmer номер по каталогу RBXMC5M400UA).
[125I] NDP-MSH: меченный радиоактивной меткой собственного производства и очищенный посредством ВЭЖХ:
Na125I (0,5 мКи, 17,4 Ки/мг) добавили к 50 мкл фосфата натрия (50 мМ, рН 7,4) в пробирке Эппендорфа, предварительно покрытой IODOGEN. После инкубации в течение 10 минут фосфатный буфер, содержащий йод, добавили к NDP-MSH (10 мкл в 1 мг/мл) в отдельной пробирке Эппендорфа. Ее инкубировали в течение еще 10 мин. Йодированный NDP-MSH очистили посредством ВЭЖХ на Zorbax SB 300 колонке при помощи растворителя А: 0,05% TFA и растворителя В: 90% ацетонитрил 0,045% TFA с линейным градиентом, 0-67% В в течение 60 минут. 125I NDP-MSH элюировался в 52 минуты после немеченого исходного материала (48 минут) и был подсчитан и хранился в морозильной камере. Его применяли не позднее 48 часов в качестве радиоактивного распада и разложения лиганда, что приводило к значительно уменьшенному специфическому связыванию, наблюдаемому через 72 часа.
Реактивы:
Инкубационный буфер; 25 мМ HEPES(N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислота)-КОН (рН 7,0), 1,5 мМ CaCl2, 1 мМ MgSO4, 0,1 M NaCl, 1 мМ 1,10-фенантролин и 1 таблетка протеазного ингибитора Complete™/100 мл (Roche, номер по каталогу 1873580) замороженные мембраны ПМС5 Perkin Elmer: номер по каталогу RBXMC5M400UA, 0,4 мл/пробирка; 400 микроиспытаний/пробирка, 0,78 мг/мл концентрация белка Пробирки замороженных мембран быстро размораживали непосредственно перед применением, разбавляли связывающим буфером и встряхивали. Держали ресуспендированные мембраны на льду до тех пор, пока их не добавили в лунки планшета.
Протокол связывания для 400 микроиспытаний на пробирку:
Испытания осуществляли в 96 луночных полипропиленовых планшетах. Мембраны (0,78 мкг40 мкл 1:40 разведение в инкубационном буфере) добавили к [125I] NDP-MSH (0,84 нМ; 2200 Ки/ммоль) и тестовым соединениям в общем объеме 140 мкл. Их инкубировали в течение 1 часа при 37°С. Неспецифическое связывание определяли с помощью 3 мМ NDP-MSH. Планшеты профильтровали при помощи Tomtec харвестера клеток с GF/A фильтрами (Wallac) (предварительно пропитанные в 0,6% полиэтиленимине) и промыли три раза 1,0 мл ледяного промывочного буфера (вышеупомянутый инкубационный буфер без 1,10-фенантролина и таблетки протеазного ингибитора Complete™). Фильтры высушили в 37°С печи, поместили в мешок для образцов и добавили 5 мл Betaplatescint (Wallac). Полученные фильтры подсчитали в кассетах в Microbeta Trilux (Wallac) в течение 1 мин. Неспецифическое связывание только при 5%. Анализ данных осуществили при помощи GraphPad Prism 4, задействовав конкурентное связывание с односайтовой моделью и постоянным коэффициентом Хилла. Использовали следующее уравнение: Y=Нижнее значение + (Верхнее значение - Нижнее значение)/1/10^(Х-logEC50), где Х = log (концентрация) и Y = связывание для соответствия с данными.
Пример 103 - Идентификация предпочтительного диастереомера для связывания с MC5R
Четыре диастереомера одного набора заместителей протестировали на связывание в испытании hMC5R, как в Примерах 102, как перечислено в Таблице 3.
|
Как можно видеть 3S, 5S изомер почти в десять раз активнее, чем следующий самый активный изомер и существенно активнее, чем другие два возможных изомера. Этот непредвиденно высокий уровень дифференциальной активности и, следовательно, специфичности (S,S) диастереоизомера был непредвиденным и не предсказуем из знания hMC5R или его ранее известных лигандов.
Пример 104 - Активность выбранных соединений: связывание hMC5R
Типичные соединения данного изобретения были протестированы на связывание в испытании hMC5R, как в Примере 102, как перечислено в Таблице 4. Соединения были протестированы как их трифторацетат или гидрохлоридные соли, или как их свободное основание.
|
х=<10 мкМ; хх=<1 мкМ, ххх=<100 нМ, хххх=<10 нМ
|
|
|
|
|
|
|
|
|
|
|
Пример 105 - Испытание радиолигандного связывания MC5R при помощи МС5 рецепторов из других видов
Радиолигандное связывание и испытания цАМФ также проводили при помощи мембран и клеток, экспрессирующих MC5R, клонированных из других видов (мышиные MC5R мембраны получили из Euroscreen; MC5 рецепторы собаки, макак-резуса, яванского макака и морской свинки были клонированы и экспрессированы из кДНК библиотек и временно трансфицированы, как описано в Примерах 107 и 109. Мембраны плазмы из клеток протестировали в радиолигандном испытании, как в Примере 102.
Пример 106 - Активность выбранных соединений: MC5R других видов
Типичные соединения данного изобретения были протестированы на связывание с MC5R из других видов, как описано в Примере 105, результаты перечислены в Таблице 5.
|
Эти результаты показывают избирательность соединений данного изобретения для человеческого MC5R по сравнению с MC5R у других видов. Хотя и имеется активность в других видах, она значительно уменьшена по сравнению с человеческим MC5R, которую и не следовало бы ожидать, принимая во внимание высокую рецепторную гомологию между видами.
Пример 107 - Испытание радиолигандного связывания MC1R, MC3R и MC4R человека
Испытания радиолигандного связывания проводили при помощи коммерческих или приготовленные собственной разработкой hMC1R, DMC3R и DMC4R мембран и [125I] NDP-MSH, согласно hMC5R методике в Примере 102.
Мембраны плазмы собственной разработки приготовили из трансфицированных клеток млекопитающих (приготовленных, как в Примере 109, при помощи плазмидной ДНК, содержащей человеческий MC1R, MC3R или MC4R ген или другой ген, представляющий интерес, в плазмидном векторе с точкой начала репликации млекопитающего):
Прикрепленные к субстрату клетки промыли теплым буферным солевым раствором Ханка (HBSS). 1 мл холодного HBSS добавили к каждому сосуду и клетки соскребли резиновым скребком. Соскобленные клетки добавили в 50 мл пробирку на льду. Планшеты затем прополоскали дважды 5 мл холодного HBSS, и это также добавили к пробирке. Клетки центрифугировали при 1000×g в течение 5 минут в настольной центрифуге и супернатант декантировали. Оставшийся клеточный осадок ресуспендировали в 0,25 М сахарозе. Клеточную суспензию снова центрифугировали, как ранее, и осадок ресуспендировали в 5 мл 0,25 М сахарозы, содержащей протеазные ингибиторы. Клетки гомогенизировали посредством 10 секундной пульсации Ika диспергатором с последующими 30 секундами на льду. Гомогенизацию и ледяную инкубацию повторили три раза. Смесь затем центрифугировали при 1260×g в течение 5 мин. Супернатант декантировали в другую пробирку для центрифуги, к которой добавили буфер, содержащий 50 мМ Tris (трис(гидроксиметил)аминометан), рН 7,4, 12,5 мМ MgCl2, 5 мМ EGTA (этиленгликольтетрауксусная кислота) и протеазные ингибиторы для получения объема до 30 мл. Его центрифугировали при 30,000×g в течение 90 мин при 4°С. Получившийся осадок ресуспендировали в 1 мл вышеупомянутого буфера, который также содержал 10% глицерина. Взяли аликвоты мембран в криопробирки, которые были быстро заморожены в бане сухой лед/этанол перед хранением при -80°С до тех пор, пока не потребуются для применения.
Пример 108 - избирательность выбранных соединений: связывание hMCR
Типичные соединения данного изобретения были протестированы на связывание в испытаниях hMC1R, DMC3R, hMC4R и hMC5R, как в Примерах 102 и 107, как перечислено в Таблице 6.
|
Эти результаты демонстрируют избирательность соединений данного изобретения для человеческого MC5R по сравнению с другими рецепторными подтипами человеческого меланокортинового рецепторного семейства.
Пример 109 - ингибирование или стимулирование цАМФ сигнала в клетках, 30 экспрессирующих MC5R человека
Временная трансфекция клеточных линий млекопитающих:
Клеточную линию млекопитающего, клетки человеческой эмбриональной почки (НЕК 293), содержали в модифицированной по способу Дульбекко среде Игла (DMEM) с 5% зародышевой бычьей сывороткой, L-глутамином, высокой глюкозой и антибиотиками/противогрибковыми. В день перед трансфекцией, клетки были пересеяны с использованием трипсин/ЭДТА и засеяны в 75 см2 сосуды так, чтобы они были приблизительно на 90% конфлюэнтными на следующий день. На следующий день клеточную среду заменили на свежую антибиотик/противогрибковый-содержащую DMEM. Приблизительно 100 мкл трансфекционного липида Turbofectin 8.0 (Origene Technologies, MD, США) разбавили в 1,0 мл сыворотки и не содержащей антибиотик/противогрибковый OptiMEM в стерильной 15 мл пробирке и инкубировали в течение 5 мин при комнатной температуре. После инкубации приблизительно 10-20 мкг плазмидной ДНК, экспрессирующей интересующий ген (например: pCMV6-XL4:Homo sapiens меланокортин 5 рецептор (Origene Technologies, MD, США)) разбавили в трансфекционной смеси и инкубировали в течение еще 30 мин при комнатной температуре. Раствор ДНК/липида затем добавили по капле к среде, покрывающей клетки, при осторожном покачивания сосуда. 24 часа после трансфекции клетки были пересеяны и засеяны непосредственно в два 75 см2 сосуды и оставлены для выделения. 48 часов после трансфекции клетки были собраны для применения в испытаниях с раствором для клеточной диссоциации.
Испытание стимулирования циклического-аденозинмонофосфата [цАМФ]:
Клетки НЕК 293, временно экспрессирующие меланокортиновый МС5 рецептор, были суспендированы в стимулирующем буфере (буферный солевой раствор Ханка (HBSS), 0,1% бычий сывороточный альбумин, протеазные ингибиторы и 0,5 мм 3-изобутил-1-метилксантин) при 4×106 клеток/мл. 5 мкл клеток, плюс соединения/пептиды, как описано ниже, добавили в лунки 384-луночного планшета, как можно быстрее после ресуспендирования.
Для обнаружения антагонистической активности разбавили тестовые соединения при переменных концентрациях в стимулирующем буфере в четырехкратном концентрате и добавили 2,5 мкл в лунки, содержащие клетки. 2,5 мкл четырехкратной требуемой концентрации NDP-MSH или альфа-MSH добавили во все лунки, содержащие соединения. Лунки отрицательного контроля содержали двухкратно сконцентрированный NDP-MSH или альфа-MSH отдельно без соединения.
Для обнаружения антагонистической активности, разбавили тестовые соединения при переменных концентрациях в стимулирующем буфере в двухкратном концентрате и добавили 5 мкл в лунки, содержащие клетки. Лунки положительного контроля содержали только NDP-MSH или альфа-MSH (без соединения) в двухкратном концентрате.
Лунки контроля базального уровня (цАМФ) содержали только стимулирующий буфер (без агониста или соединений). На планшете были включены известные концентрации цАМФ (стандарты) в стимулирующем буфере, но клетки в эти лунки не добавлялись. Планшет затем инкубировали в течение 30 минут при 37°С со слабым взбалтыванием. После инкубации добавили 10 мкл лизирующего буфера (10% Твин 20, 1 М HEPES, 0,1% BSA (бычий сывороточный альбумин), протеазные ингибиторы, ddH2O (дважды дистиллированная вода)) во все измеряемые лунки. Обнаружение цАМФ затем выполнили с помощью набора Alphascreen cAMP (Perkin Elmer, США), как кратко описано далее. Разведение 10 мкл гранул акцептора/мл лизирующего буфера приготовили в условиях низкой освещенности. 5 мкл разбавленных гранул акцептора добавили в каждую измеряемую лунку, затем планшет инкубировали в течение 30 мин при комнатной температуре, в темноте, со слабым взбалтыванием. В условиях низкой освещенности, гранулы донора были разбавлены в 10 мкл/мл лизирующего буфера, к которому добавили 0,75 мкл биотинилированного цАМФ/мл лизирующего буфера. Этой смеси позволили инкубироваться в течение 30 мин при комнатной температуре (в темноте) перед тем, как продолжить испытание. После инкубации по 5 мкл/мл смеси биотинилированный цАМФ/донорная гранула добавили на лунку в условиях низкой освещенности, и планшет инкубировали в темноте при комнатной температуре в течение дополнительного часа. Планшеты считывали на планшет-ридере Envision (Perkin Elmer) после 1 часа и ~16 часов инкубации. Концентрацию цАМФ в клетках определили с применением 'стандартной кривой', образованной из результатов известных концентраций цАМФ, как описано ниже.
Каждый аналитический планшет содержал «стандартную кривую» известных концентраций цАМФ, в 10-кратных разведениях. Это существенная часть анализа, так как имеется высокая межпланшетная изменчивость. Планшеты считывались на многомаркировочном планшет-ридере Envision, оснащенным Alphascreen технологией, и исходные данные импортировались в программное обеспечение GraphPad Prism 4 (GraphPad, США) для анализа. Кривую приспособили к известным концентрациям с помощью нелинейной регрессии, в особенности при помощи сигмоидального уравнения «доза - ответная реакция» (Y = Нижнее значение + (Нижнее значение + (Верхнее значение - Нижнее значение)/1+10logEC50-X), где уравнение показывает ответ как функцию логарифма концентрации. X представляет собой логарифм концентрации пептид/соединение, и Y представляет собой ответ. Также рассматриваемыми в этом уравнении являются нижнее плато, верхнее плато кривой и EC50 (эффективная концентрация, 50%)
Пример 110 - Активность выбранных соединений: hMC5R
Типичные соединения данного изобретения были протестированы на агонизм или антагонизм hMC5R, как в Примере 109, результаты перечислены в Таблице 7.
|
Ссылки
Andersen, G.N.; Hägglund, М.; Nagaeva, O.; Frängsmyr, L.; Petrovska, R.; Mincheva-Nilsson, L.; Wikberg, J.E.S. Scand. J. Immunol. 2005, 61, 279-284 «Quantitative measurement of the levels of melanocortin receptor subtype 1, 2, 3 and 5 and pro-opio-melanocortin peptide gene expression in substes of human peripheral blood leukocytes»
Barrett, P.; MacDonald, A.; Helliwell, R.; Davidson, G.; Morgan, P. J. Molec. Endocrin. 1994, 12, 203-213 «Cloning and expression of a new member of the melanocyte-stimulating hormone receptor family»
Bataille, V.; Snieder, H.; MacGregor, A.J.; Sasieni, P.; Spector, T.D. J. Invest. Dermatol. 2002, 119, 1317-1322 « The Influence of Genetics and Environmental Factors in the Pathogenesis of Acne: A Twin Study of Acne in Women»
Bhardwaj, S.S.; Rohrer, Т.Е.; Arndt, K.A. Semin. Cutan. Med. Surg. 2005, 24, 107-112 «Lasers and light therapy for acne vulgaris»
Bohm, М.; Luger, T.A.; Tobin, D.J.; Garcia-Borron, J.C. J. Invest. Dermatol. 2006, 126, 1966-1975 «Melanocortin Receptor Ligands: New Horizons for Skin Biology and Clinical Dermatology»
Buggy, J.J. Biochem J. 1998, 331, 211-216 «Binding of a-melanocyte-stimulating hormone to its G-protein-coupled receptor on B-lymphocytes activates the Jak/STAT pathway»
Burke, B.M.; Cunliffe, W.J.; Br. J. Dermatol. 1984, 112 124-126 «Oral spironolactone therapy for female patients with acne, hirsutism or androgenic alopecia»
Caldwell, H.K.; Lepri, J.J.. Chem. Senses 2002, 27, 91-94 «Disruption of the fifth melanocortin receptor alters the urinary excretion of aggression-modifying pheromones in male house mice»
Cerdá-Reverter, J.M-; Ling, M.K.; Schiöth, H.B.; Peter, R.E. J. Neurochem. 2003, 1354-1367 «Molecular cloning, characterization and brain mapping of the melanocortin 5 receptor in goldfish»
Chen, W.; Kelly, M.A.; Opitz-Araya, X.; Thomas, R.E.; Low, M.J.; Cone, R.D. Cell, 1997, 91, 789-798 «Exocrine gland dysfunction in MCS-R-deficient micee: evidence for coordinated regulation of exocrine gland function by melanocortin peptides»
Chhajlani, V.; Muceniece, R.; Wikberg, J.E.S. BBRC 1993, 195, 866-873 «Molecular Cloning of a Novel Human Melanocortin Receptor»
Clarke, S.B.; Nelson, A.M.; George, R.E.; Thiboutot, D.M. Dermatol. Clin. 2007, 25, 137-146 «Pharmacologic Modulation of Sebaceous Gland Activity: Mechanisms and Clinical Applications».
Cordain, L. Sem. Cut. Med Surg. 2005, 24, 84-91 «Implications for the Role of Diet in Acne»
Cotterill, J.A.; Cunliffe, W.J.; Williamson, B. Brit. J. Dermatol. 1971, 85, 93-94 «Severity of Acne and Sebum Excretion Rate»
Danby, F.W. J. Am. Acad. Dermatol. 2005, 52, 1071-1072 «Why we have sebaceous glands»
Eisinger, M.; Fitzpatrick, L.J.; Lee, D.H.; Pan, K.; Plata-Salaman, C.; Reitz, A.B.; Smith-Swintosky, V.L; Zhao, B. WO 03/040117 15 May 2003a «Novel 1,2,4-thiadiazole derivatives as melanocortin receptor modulators»
Eisinger, M.; Fitzpatrick, L.J.; Lee, D.H.; Pan, K.; Plata-Salaman, C.; Reitz, A.B.; Smith-Swintosky, V.L.; Zhao, B. WO 03040118 A1 15 May 2003b «Novel 1,2,4-thiadiazolium derivatives as melanocortin receptor modulators»
Eisinger, M.; Fitzpatrick, L.J.; Lee, D.H.; Pan, K.; Plata-Salaman, C.; Reitz, A.B.; Smith-Swintosky, V.L; Zhao, B. US 2003/0162819 A1 Aug 28 2003 с «Novel 1,2,4-thiadiazolium derivatives as melanocortin receptor modulators»
Eisinger, M.; Fitzpatrick, L.J.; Lee, D.H.; Pan, K.; Plata-Salaman, C.; Reitz, A.B.; Smith-Swintosky, V.L; Zhao, B. US 2003/0176425 A1 Sep 18 2003d «Novel 1,2,4-thiadiazole derivatives as melanocortin receptor modulators»
Eisinger, M.; Fitzpatrick, L.J.; Lee, D.H.; Pan, K.; Plata-Salaman, C.; Reitz, A.B.; Smith-Swintosky, V.L.; Zhao, B. US 2006/0030604 A1 Feb 9 2006a «Novel 1,2,4-thiadiazolium derivatives as melanocortin receptor modulators»
Eisinger, M.; Fitzpatrick, L.J.; Lee, D.H.; Pan, K.; Plata-Salaman, C.; Reitz, A.B.; Smith-Swintosky, V.L; Zhao, B. US 2006/0128772 A1 Jun 15 2006b «Novel 1,2,4-thiadiazole derivatives as melanocortin receptor modulators»
Fathi, Z.; Iben, L.G.; Parker, E.M. Neurochemical Res. 1995, 20, 107-113 «Cloning, Expression, and Tissue Distribution of a Fifth Melanocortin Receptor Subtype»
Follador, I.; Campelo, L. Expert Rev. Dermatol. 2006, 1 181-184 «Impact of acne on quality of life»
Fong, T.M.; Van der Ploeg, L.H.T.; Huang, R.-R.C. US 6645738 B1 Nov 11 2003 «DNA molecules encoding the melanocortin 5 receptor protein from rhesus monkey»
Gantz, I.; Shimoto, Y.; Konda, Y.; Miwa, H.; Dickinson, C.J.; Yamada, T. BBRC 1994, 200, 1214-1220 «Molecular cloning, expression and characterization of a fifth melanocortin receptor»
Goldstein, J.A.; Socha-Szott, A.; Thomsen, R.J.; Pochi, P.E.; Shalita, A.R.; Strauss, J.S. Am. J. Dermatol. 1982, 6, 760-765 «Comparative effect of isotretinoin and etretinate on acne and sebaceous gland secretion»
Goodfellow, A.; Alaghband-Zadeh, J.; Carter, G.; Cream, J.J.; Holland, S.; Scully, J.; Wise, P. Brit. J. Dermatol. 1984, 111, 209-214 «Oral spironolactone improves acne vulgaris and reduces sebum excretion»
Goulden, V.; Mcgeown, C.H.; Cunliffe, W.J. Brit. J. Dermatol. 1999, 141, 297-300 «Familial Risk of Adult Acne: A comparison between first-degree realatives of affected and unaffected individuals»
Graefe, Т.; Wollina, U.; Schuiz, H.-J.; Burgdorf, W. Dermatology 2000, 200, 331-333 «Muir-Torre Syndrome - Treatment with Isotretinoin and Interferon Alpha-2a Can Prevent Tumour Development»
Griffon, N.; Mignon, V.; Facchinetti, P.; Diaz, J.; Schwartz, J.-C.; Sokoloff, P. BBRC 1994, 200, 1007-1014 «Molecular cloning and characterization of the rat fifth melanocortin receptor»
Gupta, A.K.; Bluhm, R. Journal of the European Academy of Dermatology and Venereology 2004 18:1 13 «Seborrheic dermatitis»
Haitina, Т.; Klovins, J.; Andersson, J.; Fredriksson, R.; Lagerstrom, M.C.; Larhammar, D.; Larson, E.T.; Schiöth, H.B. Biochem. J. 2004, 380, 475-486 «Cloning, tissue distribution, pharmacology and three-dimensional modelling of melanocortin receotors 4 and 5 in rainbow trout suggest close evolutionary relationships of these subtypes»
Harper, J.C. Semin. Cutan. Med. Surg. 2005, 24, 103-106 «Hormonal Therapy for Acne using oral contraceptive pills
Harris, H.H.; Downing, D.T.; Stewart, M.E.; Strauss, J.S. J. Am. Acad. Dermatol. 1983, 8, 200-203 «Sustainable rates of sebum secretion in acne patients and mayched normal controls»
Hatta, N-; Dixon, С.; Ray, A.J.; Phillips, S.R.; Cunliffe, W.J.; Dale, M.; Todd, C.; Meggit, S.; Birch-Machin, M.A.; Rees, J.L. J. Invest. Dermatol. 2001, 116, 564-570 «Expression, candidate gene, and population studies of the melanocortin 5 receptor»
Houseknecht, K.L; Robertson, A.S.; Xiao, X. US 2003/0110518 A1 Jun 12 2003 «Melanocortin-receptor sequences and uses thereof»
Huang, R.-R.C.; Singh, G.; Van der Ploeg, L.H.T.; Fong, T.M, J. Receptor & Signal Transduction Res. 2000, 20, 47-59 «Species-dependent pharmacological properties of the melanocortin-5 receptor»
Ide, P.; Shimoyama, Т.; Horie, N.; Kaneko, Т.; Matsumoto, M. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Ehdod. 1999, 87, 721-724 «Benign lymphoepithelial lesion of the parotid gland with sebaceous differentiation»
Jeong, S.K.; Hwang, S.W.; Choi, S.Y.; An, J.M.; Seo, J.T,; Zouboulis, C.C.; Lee, S.H. J. Investigative Dermatol. 2007, 127, pS72 «Intracellular calcium mobilization is mediated by the melanocortin receptors in SZ95 sebocytes» (Abstract 431, Society for Investigative Dermatology, May 2007, Los Angeles CA)
Jih, M.H.; Friedman, P.M.; Goldberg, L.H.; Robles, M.; Glaich, A.S.; Kimyai-Asadi, A. J. Am. Acad. Dermatol. 2006, 55, 80-87 «The 1450-nm diode laser for facial inflammatory acne vulgaris: Dose-response and 12-month follow-up study».
Jones, D.H.; King, K.; Miller, A.J,; Cunliffe, W.J. Brit. J. Dermatol. 1983, 108, 333-343 «A dose-response study of 13-cis-retinoic acid in acne vulgaris»
Kim, K.S-; Marklund, S.; Rothschild, M.F. Animal Genetics 2000, 31, 230-231. «The porcine melanocortin-5-receptor (MC5R) gene: polymorphisms, linkage and physical mapping»
King, K.; Jones, D.H.; Daltrey, D.C.; Cunliffe, W.J. Brit. J. Dermatol. 1982, 107, 583-590 «A double-blind study of the effects of 13-cis-retinoic acid on acne, sebum excretion rate and microbial population»
Kligman, A.M. Brit. J. Dermatol. 1963, 75, 307-319 «The uses of sebum»
Klovins, J.; Haitina, Т.; Ringholm, A.; Löwgren, M.; Fridmanis, D.; Slaidina, M.; Stier, S.; Schiöth, H.B. Eur. J. Biochem. 2004, 271, 4320-4331 «Cloning of two melanocortin (MC) receptors in spiny dogfish»
Kruse, R.; Rütten, A.; Schweiger, N.; Jakob, E.; Mathiak, M.; Propping, P.; Mangold, E.; Bisceglia, M; Ruzicka, T.J. Invest. Dermatol. 2003, 120, 858-864 «Frequency of Microsatellite Instability in Unselected Sebaceous Gland Neoplasias and Hyperplasias»
Labbé, O.; Desarnaud, F.; Eggerickx, D.; Vassart, G.; Parmentier, M. Biochem. 1994, 33, 4543-4549 «Molecular Cloning of a mouse melanocortin 5 receptor gene widely expressed in peripheral tisssues»
Ling, M.K.; Hotta, E.; Kilianova, Z.; Haitina, Т.; Rjngholm, A.; Johansson, L; Gallo-Payet, N.; Takeuchi, S.; Schiöth, H.B. Brit. J. Pharmacol. 2004, 143, 626-637 «The melanocortin receptor subtypes in chicken have high preference to ACTH-derived peptides»
Makrantonaki, E.; Zouboulis, C.C. Brit. J. Dermatol. 2007, 156, 428-432 «Testosterone metabolism to Sa-dihydrotestosterone and synthesis of sebaceous lipids is regulated by the peroxisome proliferator-activated receptor ligand linoleic acid in human sebocytes»
Mariappan, M.R.; Fadare, O.; Jain, D. Arch. Pathol. Lab. Med. 2004, 128, 245-246 «Sebaceous Differentiation in Salivary Glands»
Mallon, E.; Newton, J.N.; Klassen, A.; Stewart-Brown, S.L; Ryan, T.J.; Finlay, A.Y. Brit. J. Dermatol. 1999, 140, 672-676 «The quality of life in acne: a comparison with general medical conditions using generic questionanaires»
Marqueling A.L; Zane, L.T. Semin. Cutan. Med. Surg. 2005, 24, 92-102 «Depression and Suicidal Behavior in Acne Patients Treated with Isotretinoin: A Systematic Review»
Morgan, C.; Thomas, R.E.; Ma, W.; Novotny, M.V.; Cone, R.D. Chem. Senses 2004a, 29, 111-115 «Melanocortin-5 receptor deficiency reduces a pheromonal signal for aggression in male mice»
Morgan, C.; Thomas, R.E.; Cone, R.D. Horm. Behav. 2004b, 45, 58-83 «Melanocortin-5 receptor deficiency promotes defensive behaviour in male mice»
Morgan, C.; Cone,, R.D. Behaviour Genetics 2006, 36, 291-300 «Melanocortin-5 receptor deficiency in mice blocks a novel pathway influencing pheromone-induced aggression»
Mourelatos, K.; Eady, E.A.; Cunliffe, W.J.; dark, S,M.; Cove, J.H. Brit. J. Dermatol. 2007, 156, 22-31 «Temporal changes in sebum excretion and propionibacterial colonization in preadolescent children with and without acne»
Nelson, A.M.; Gilliland, K.L; Cong, Z.; Thiboutot, D.M. J. Investigative Dermatol. 2006, 126, 2178-2189 «13-c/s-Retinoic Acid Induces Apoptosis and Cell Cycle Arrest in Human SEB-1 Sebocytes»
Phan, J.; Kanchanapoomi, M.; Liu, P.; Jalian, H.; Gilliland, K.; Nelson, A.; Thiboutot, D.; Kirn, J. J. Investigative Dermatol. 2007, 127, pS126 «P. acnes induces inflammation via TLR2 and upregulates antimicrobial activity in sebocytes» (Abstract 754, Society for Investigative Dermatology, May 2007, Los Angeles CA)
Piérard, G.E.; Piérard-Franchimont, T.L. Dermatologica 1987, 175, 5-9 «Seborrhoea in Acne-Prone and Acne-Free Patients»
Plewig G, Jansen T. Seborrheic dermatitis. In: Freedberg IM, EisenAZ, Wolff K, Austen KF, Goldsmith LA, Katz SI, Fitzpatrick ТВ, (Eds). Dermatology in General Medicine, 5th ed. New York: McGraw Hill, 1999: 1482-1489
Pochi, P.E.; Strauss, J.S. J. Invest. Dematol. 1964, 43, 383-388 «Sebum production, casual sebum levels, titratable acidity of sebum and urinary fractioonal 17-ketosteroid excretion in males with acne»
Porter, A.M.W. J. Royal Soc. Med. 2001, 94, 236-237 «Why do we have apocrine and sebaceous glands»
Ringholm, A.; Fredriksson, R.; Poliakova, N.; Yan, Y.-L; Postlethwait, J.H.; Larhammar, D.; Schioth, H.B. J. Neurochem. 2002, 82, 6-18 «One melanocortin 4 and two melanocortin 5 receptors from zebrafish show remarkable conservation in structure and pharmacology»
Simpson, N.B. and Cunliffe, W.J. in Rooks' Textbook of Dermatology, 7th Ed 2004 Blackwell Science, Maiden Mass, p 43.1-43.75 «Chapter 43. Disorders of the Sebaceous Glands»
Smith, K.R.; Nelson, A.; Cong, Z.; Thiboutot, D. J. Investigative Dermatol. 2007a, 127, pS68 «Iron status affects human sebocyte survival» (Abstract 408, Society for Investigative Dermatology, May 2007, Los Angeles CA)
Smith, R.N,; Mann, N.J.; Braue, A.; Makelainen, H.; Varigos, G.A. J. Am. Acad. Dermatol. 2007b, 57, 247-256 «The effect of a high-protein, low glycemic-load diet versus a conventional, high glycemic-load diet on biochemical parameters associated with acne vulgaris; A randomized investigator-masked, controlled trial»
Shuster, S. Lancet 1976, 7973, 1328-1329 «Biological purpose of acne»
Taylor, A.; Namba, K. Immunologyy Cell Biol. 2001, 79, 358-367 «In vitro induction of CD25+CD4+ regulatory Т cells by the neuropeptide alpha-melanocyte stimulating hormone (α-MSH)»
Thiboutot, D,; Sivarajah, A.; Gilliland, K.; Cong, Z.; Clawson, G. J. Invest. Dermatol. 2000, 115, 614-619 «The melanocortin 5 receptor is expressed in human sebaceous glands and rat preputial cells»
Thody, A.J.; Shuster, S. Nature 1973, 245, 207-209 «Possible role of MSH in the mammal»
Thody, A.J.; Cooper, M.F.; Bowden, P.E.; Shuster, S. J. Endocrinol. 1975a, 67, 18P-19P «The sebaceous gland response to a-melanocyte-stimulating hormone and testosterone»
Thody, A.J.; Shuster, S. J. Endocrinol. 1975b, 64, 503-510 «Control of sebaceous gland function in the rat by α-melanocyte-stimulating hormone»
Thody, A.J.; Goolamali, S.K.; Burton, J.L; Plummer, N.A.; Shuster, S. Brit. J. Dermatol. 1975 с, 92, 43-47 «Plasma β-MSH levels in acne vulgaris»
Wikberg, J.E.S. Exp. Opin. Ther. Patents 2001, 11, 61-76 «Melanocortin receptors: new opportunities in drug discovery»;
Wikberg, J.; Chhajlani, V. US6448032B1 Sep 10 2002 «Human melanocyte stimulating hormone receptor polypeptide and DNA»
Williams, C.; Layton, A.M. Exp. Rev. Dermatol. 2006, 1, 429-438 «Treatment of Acne: an update»
Yamada, Т.; Gantz, I. US5622860, Apr. 22 1997, «Genes Encoding Melanocortin Receptors»
Yaswen, L; Diehl, N.; Brennan, M.B.; Hochgeschwender, U. Nature Med. 1999, 5, 1066-1070 «Obesity on the mouse model of proo-opiomelanocortin deficiency responds to peripheral melanocortin»
Youn, S.-W.; Park, E.-S.; Lee, D.-H.; Huh, C.-H.; Park, K.-C. Brit. J. Dermatol. 2005, 153, 919-924 «Does facial sebum secretion really affect the development of acne?»
Zhang, L.; Anthonavage, M.; Huang, Q.; Li, W.-H.; Eisinger, M. Ann. N.Y. Acad. Sci. 2003, 994, 154-161 «Proopiomelanocortin peptides and sebogenesis»
Zhang, L.; Li, W.-H.; Anthonavage, M.; Eisinger, M. Peptides 2006, 27, 413-420 «Melanocortin-5 receptor: a marker of human sebocyte differentiation»
Zouboulis, C.C.; Böhm, M. Exp. Dermatol. 2004, 13, 31-35 «Neurocrine regulation of sebocytes - a pathogenetic link between stress and acne»
Детали определенных вариантов осуществления, описанных в данном изобретении, не должны истолковываться как ограничения. Разнообразные аналоги и видоизменения можно сделать без отклонения от сущности и объема данного изобретения, и понятно, что такие эквивалентные варианты осуществления являются частью данного изобретения.

