Результат интеллектуальной деятельности: СПОСОБ РАЗДЕЛЕНИЯ ЛАКТОФЕРРИНОВ ЧЕЛОВЕКА И КОЗЫ С ПОМОЩЬЮ ДИФФЕРЕНЦИАЛЬНОЙ ИММУНОАФФИННОЙ ХРОМАТОГРАФИИ С ИСПОЛЬЗОВАНИЕМ ОДНОДОМЕННЫХ МИНИ-АНТИТЕЛ
Вид РИД
Изобретение
Область техники
Изобретение относится к области биотехнологии, иммунологии. Изобретение позволяет осуществить разделение белков лактоферрина козы и рекомбинантного лактоферрина человека, содержащегося в молоке трансгенных коз, с помощью однодоменных мини-антител. Изобретение может применяться для получения высокоочищенной фракции лактоферрина человека с целью его использования в клиническом, специализированном, в том числе восстановительном питании у недоношенных детей, ослабленных пациентов, для восстановления неспецифического иммунитета, активации противомикробной защиты, в том числе в сочетании с антибиотикотерапией, а также в качестве самостоятельного иммуномодулирущего средства, в том числе вводимого пациенту путем инъекции.
Уровень техники
Известен способ разделения и очистки лактоферрина из молока с использованием сульфатного соединения; способ заключается в адсорбировании лактоферринсодержащего молока сульфатным полисахаридным соединением с последующим элюированием адсорбированного лактоферрина. Элирование адсорбированного лактоферрина предпочтительно проводится с использованием буфера, содержащего 0,4 до 1,5 M поваренной соли (патент ЕР 0348508). Данный способ не предполагает использования иммуноаффинной хроматографии и использования антител для разделения лактоферрина.
Известен способ очистки белков, способных связывать железо, в том числе лактоферрина, за счет взаимодействия со специфическим сорбентом, представляющим собой полисахарид с иммобилизованным железом (патент ЕР 0418704). Данный способ также не предполагает использование иммуноаффинной хроматографии и использование антител для разделения лактоферрина.
Известен метод выделения и очистки бычьего лактоферрина с использованием иммуноаффинной хроматографии с фиксированными антителами против бычьего лактоферрина на нерастворимом носителе с последующей элюцией (патент US 4668771). Метод не предполагает использования специфических однодоменных мини-антител для разделения лактоферрина человека.
Известен способ выделения и очистки лактоферрина человека с применением иммуноаффинной хроматографии с использованием моноклональных антител, полученных с применением гибридомной технологии (патент JP 60166619). Способ также не предполагает использования специфических однодоменных мини-антител для разделения лактоферрина человека, при этом основным недостатком данного подхода является относительная дороговизна технологии выделения и очистки целевого белка.
Известен способ очистки рекомбинантного лактоферрина человека из молока трансгенных животных (патент CN 101117351). Вначале подготавливают молочную сыворотку, удаляя молочный жир и казеин, затем сыворотку очищают катионно-обменной хроматографией, элюируют буфером 0,4-1 M NaCl и 20 мМ Na3PO4, для повышения чистоты рекомбинантного белка проводят ультрафильтрацию и диализ элюэнта. Способ не предполагает использования иммуноаффинной хроматографии и специфических однодоменных мини-антител для разделения лактоферрина человека.
Наиболее близким к заявленному изобретению является известный способ очистки лактоферрина с использованием анти-LF-одноцепочечных антител (патент CN 1730492). Способ предполагает получение анти-LF-одноцепочечных антител, выражающийся в последовательном выполнении следующих шагов: селекции и получения фаговых анти-LF-одноцепочечных антител, определение спектра антител, подходящих для дальнейшей экспрессии, выбор антител с наилучшей афинностью к антигену, трансформации в экспрессионный вектор для наработки и дальнейшая очистка с применением никель-хелатной хроматографии. Однако способ не предполагает использования иммуноаффинной хроматографии.
Таким образом, известные из уровня техники способы выделения и очистки лактоферрина предполагают, в основном, традиционные подходы для разделения белков, основанные на популярных методических приемах с различными модификациями. Согласно уровню техники способ разделения лактоферринов человека и козы с помощью дифференциальной иммуноаффинной хроматографии с использованием однодоменных мини-антител предложен авторами впервые.
Постановка задачи и раскрытие изобретения
Задачей изобретения является создание эффективного способа разделения лактоферринов человека и козы с использованием высокоспецифичных «мини-антител», позволяющих осуществлять высокоспецифическое и эффективное связывание лактоферрина человека (в том числе и рекомбинантного), при этом не связывая лактоферрин козы (эндогенный хозяйский лактоферрин трансгенного животного), что повысит выход целевого (экспрессирующегося с трансгенной конструкции) белка и существенно повысит степень его специфической очистки.
Техническая задача решается путем последовательного выполнения следующих этапов:
- Иммунизация животного (верблюда) препаратом афинноочищенного лактоферрина из женского молока. Анализ эффективности иммунизации проводится с помощью слежения за нарастанием титра соответствующих антител в сыворотке животного в ходе иммунизации.
- Генерирование специфически обогащенной библиотеки «мини-антител» путем клонирования последовательностей всего репертуара вариабельных доменов особых одноцепочечных верблюдоспецифических антител, используя мРНК из В-лимфоцитов периферической крови иммунизированного верблюда и проводя ряд последовательных генно-инженерных процедур (синтез кДНК, ПЦР-амплификации, клонирование наработанных фрагментов ДНК в фагмиде для фагового дисплея, высокоэффективная трансформация бактериальных клеток) и анализ качества получаемой библиотеки.
- Использование генерированной библиотеки «мини-антител» для различных процедур селекции методом фагового дисплея клонов мини-антител, специфически узнающих различные эпитопы человеческого лактоферрина.
- Отбор и анализ моноклонов, кодирующих мини-антитела, с помощью которых можно детектировать и осуществлять дифференциальную очистку именно человеческого лактоферрина от лактоферрина козы.
- Наработка отобранных мини-антител.
- Проверка эффективности их работы на модельных экспериментах.
Термин «однодоменные мини-антитела» означает антигенузнающие фрагменты (вариабельные домены) особых одноцепочечных антител (состоящих из димера только тяжелой цепи иммуноглобулина при отсутствии легких цепей), встречающихся в норме лишь у представителей семейства верблюдовых и некоторых видов хрящевых рыб.
Термин «элюат» означает материал, связавшийся с мини-антителами, а затем проэлюированный в щелочных условиях, разрушающих взимодействие антиген - антитело.
Термин «проскок» означает материал, не связавшийся с иммобилизованными мини-антителами.
Термин «очищенный рекомбинантный hLF» означает материал, связавшийся с мини-антителами на колонке, отмытый от примесей и затем проэлюированный.
Термин «hLF» означает лактоферрин человека.
Термин «gLF» означает лактоферрин козы.
Термины «a-hLF-1» и «a-hLF-4» означают однодоменные мини-антитела.
Основание осуществления изобретения
Лактоферрин является высококонсервативным, мономерным 80 - кДа белком, полипептидная цепь состоит из 690 аминокислот. Основным источником лактоферрина в организме млекопитающих являются мукозальные клетки эпителия, которые обеспечивают секрецию лактоферрина и обогащение им грудного молока. Кроме мукозальных клеток, его также секретируют нейтрофилы.
Лактоферрин представляет собой наиболее ценную белковую фракцию грудного молока млекопитающих. Биологические функции лактоферрина весьма разнообразны; будучи выделенным в высокоочищенную субстанцию, он обладает иммуномодулирующим, противовирусным, противобактериальным эффектом. Лактоферрин принадлежит к семейству т.н. трансферринов - особый вид специфических белков, осуществляющих транспортную функцию железа. Будучи ano-белком, лактоферрин осуществляет секвестрацию железа у микроорганизмов, что способствует обеднению их железом и дальнейшей гибели. Дополнительным преимуществом лактоферрина является его способность к связыванию с липополисахаридами бактериальной стенки, что усиливает вероятность сближения с микроорганизмами и, соответственно, создает условия для секвестрации железа.
Лактоферрин является одним из немногих белков, чья пространственная структура при попадании в желудочно-кишечный тракт не разрушается ферментами на пептиды в отличие от многих других белков. Это обстоятельство позволяет использовать лактоферрин для перорального введения, что дает ценные преимущества при изготовлении готовой лекарственной или пищевой формы белка.
Таким образом, лактоферрин представляет собой уникальное природное соединение, которое может применяться для лечения и профилактики иммунодефицитов, бактериальных и вирусных инфекций, как у взрослых, так и у детей. Отдельной строкой можно выделить использование лактоферрина при вскармливании недоношенных младенцев. Кроме вышеперечисленных свойств, у лактоферрина обнаруживаются и другие, не менее уникальные биологические активности, а именно - укрепление костной ткани (Amini & Nair, 2011), заживлении ран (Ashby et al., 2011), индукции апоптоза опухолевых клеток (Wang et al., 2011; Xu et al., 2010), многие другие.
Поскольку источником лактоферрина является грудное молоко, для получения высококонцентрированной фракции целевого белка необходимо разработать ряд высокотехнологичных приемов. Учитывая тот факт, что для получения лактоферрина в промышленных масштабах использовать в качестве сырья грудное женское молоко не представляется возможным, с этой целью необходимо разработать технологии получения, идентификации и разделения лактоферринов из молока трансгенных животных, в частности - коз.
Для эффективной очистки белка лактоферрина из биологического материала (в данном случае, молока) традиционно в ряде случаев применяется стадия иммуноаффинной хроматографии с использованием специфических антител. Данные антитела представляют собой моноклональные мышиные антитела, получение и наработка которых является весьма дорогостоящей процедурой. Эта проблема препятствует масштабному производству лактоферина. В этой связи необходимо применять иной подход, позволяющий минимизировать стоимость наработки специфических антител. Поэтому предпринимается попытка получить высокоспецифичные малые антитела, с помощью которых можно бы было целенаправленно очищать именно рекомбинантный (трансгенный) лактоферрин человека, отделяя его от козьего, мышиного либо других лактоферринов в зависимости от вида трансгенного животного.
Однодоменные мини-антитела представляют собой новый весьма перспективный инструмент для специфической детекции и очистки широкого спектра антигенов. В 1993 году группой бельгийских ученых было обнародовано важное открытие: в дополнение к классическим антителам у представителей семейства Camelidae (верблюды, ламы, викуньи) в крови присутствует значительная часть особых неканонических антител с упрощенной структурой (Hamers-Casterman et al, 1993). Они состоят из димера только одной укороченной (без СН1-домена) тяжелой цепи при отсутствии легкой цепи («heavy-chain antibody», HCAb). Антигенузнающий участок HCAb формируется лишь одним вариабельным доменом, который через шарнирный район непосредственно связан с Fc-доменом. Позднее, подобные неканонические одноцепочечные антитела были также обнаружены у некоторых видов акул и родственных им хрящевых рыб-химер. Антигенузнающий вариабельный домен этих антител обычно называют «nanobody» (нанотело), однодоменное мини-антитело или «наноантитело» (Ghassabeh et al., 2010; Тиллиб, 2011). Однодоменное мини-антитело (с размерами ~2,5 нм в диаметре и ~4 нм в высоту, 12-15 кДа) может быть эффективно клонировано и экспрессировано в бактериях и дрожжах в виде мономера и является наименьшим из известных на сегодня белков, обладающих свойством специфически связывать антиген. Репертуар возможных паратопов (антигенсвязывающих структур антитела) в случае однодоменных мини-антител, по-видимому, может заметно отличаться от репертуара классических антител. Было показано, что гипервариабельный COR3-участок в мини-антителе (но не в VH или VL классического антитела) может образовывать необычные длинные пальцеобразные выступающие структуры, которые могут входить в щели, выемки антигена, в частности, узнавать активные центры ферментов. Малый размер антигенсвязывающего участка (VHH) и его способность формировать необычные выступающие паратопы объясняют возможность получения мини-антител, способных узнавать недоступные для классических антител эпитопы. Разработана весьма эффективная процедура генерирования и селекции однодоменных мини-антител. Получаемые мини-антитела в отличие от большинства рекомбинантных антител обычно обладают весьма высокой аффинностью к заданному антигену благодаря тому, что первая стадия их получения обычно подразумевает иммунизацию животного (из сем. Верблюдовых), в организме которого происходит их аффинное созревание in vivo. Мини-антитела обладают преимуществами, предполагающими большой потенциал их использования как для различного рода исследований и создания новых биотехнологических устройств, так и для диагностики и лечения заболеваний (Ghassabeh et al., 2010; Тиллиб, 2011).
Краткое описание фигур чертежей
Фиг 1. Схема функционально значимых нуклеотидных последовательностей, кодирующих адаптированное мини-антитело в экспрессионном плазмидном векторе. Слева направо: pelB - лидерный пептид, определяющий выход образующегося мини-антитела в периплазматическое пространство бактерии; собственно последовательность мини-антитела; (His)6 - последовательность, кодирующая пептид из шести остатков гистидина, позволяющая эффективно очищать мини-антитело с помощью с Ni2+-NTA- (или иной) хелатной группой коммерчески доступного препарата геля (агарозы) для аффинной хроматографии.
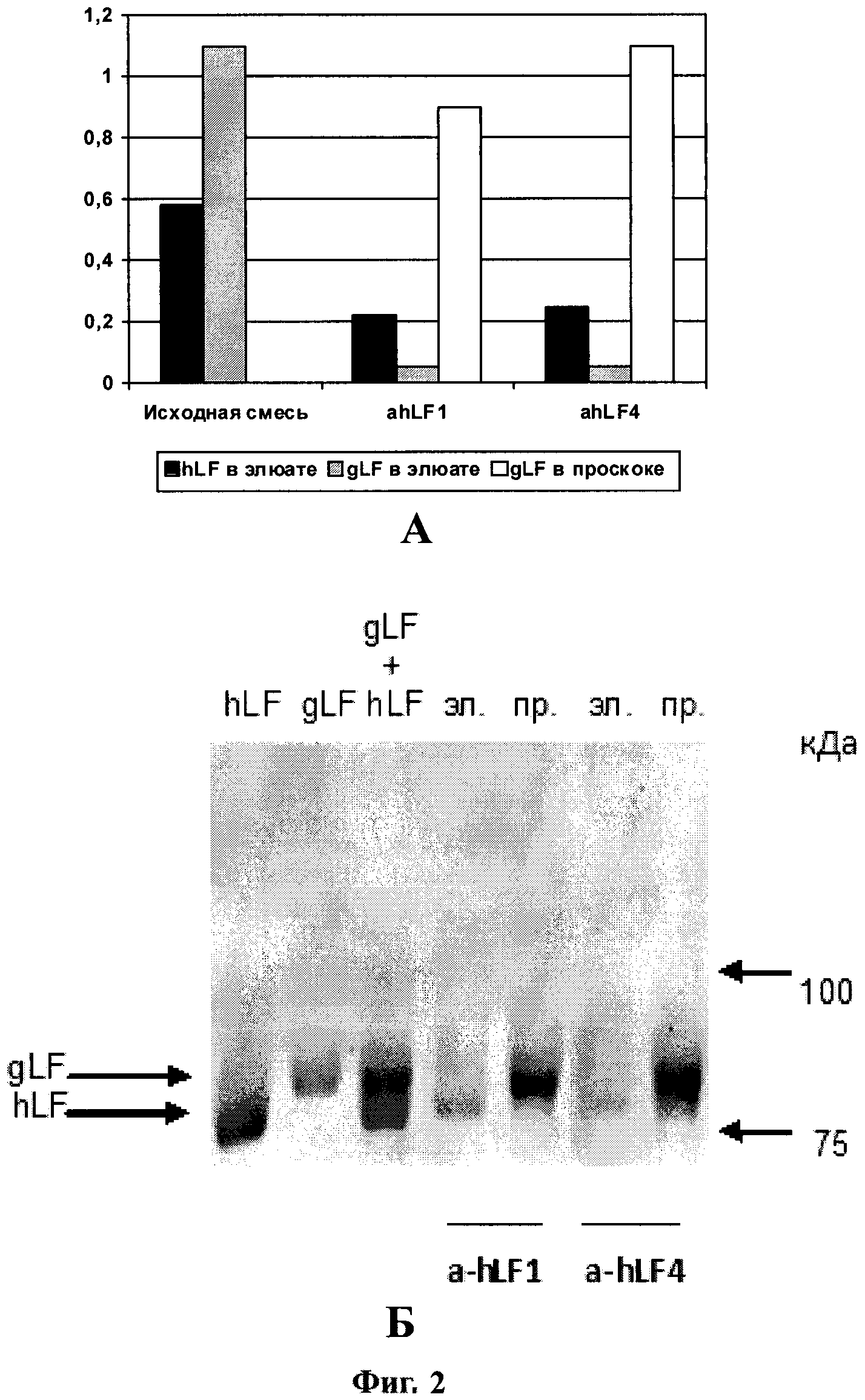
Фиг 2. А - результаты электрофоретического разделения hLF и gLF лактоферринов с помощью иммуноаффинной хроматографии на полученных колонках с иммобилизованными однодоменными антителами a-hLF-1 и a-hLF-4; Б - Сравнительная детекция hLF и gLF в элюатах после очистки на колонках с однодоменными антителами.
Фиг 3. Последовательности мини-антител a-hLF-1 и a-hLF-4. Аминокислотные последовательности представлены как SEQ ID NO:1 (Фиг. 3А) и SEQ ID NO:2 (Фиг. 3Б) (подчеркнуты гипервариабельные участки, - CDR1, CDR2 и CDR3), а нуклеотидные - как SEQ ID NO:3 и SEQ ID NO:4 (Фиг. 3В и 3Г) соответственно.
Примеры осуществления изобретения
Пример 1. Получение мини-антител для детекции лактоферрина человека Схема выбранного варианта адаптированной нуклеотидной последовательности мини-антитела в используемых экспрессионных плазмидных векторах представлена на Фиг. 1. Экспрессионными плазмидными ДНК трансформировали бактериальные клетки E. coli (штамм XL1 или BL21). Наработку адаптированных мини-антител проводили следующим образом. Из одной свежевыросшей (после инкубации в течение ночи) колонии на чашке Петри выращивали 10 мл дневной культуры продуцента мини-антитела. Эти 10 мл культуры переносили в литровую колбу с 300 мл свежеприготовленной среды (ТВ или 2xTY) и растили до плотности, соответствующей поглощению 0.6 при длине волны 600 нм, после чего добавляли 1 мМ IPTG и инкубировали культуру на шейкере при 28°С в течение ночи при интенсивном перемешивании (220-250 об./мин). Клетки осаждали центрифугированием при 3000xg в течение 10 минут в случае бакет-ротора, или при 5000g в течение 30 минут в случае углового ротора. Осадок клеток суспендировали в 4 мл буфера TES (100 мМ Трис-HCl, рН 8.0; 0.5 М сахарозы; 0.5 мМ ЭДТА, 10 мМ имидазола, 1 мМ фенилметилсульфонилфторид (PMSF)), переносили в 15-мл пробирку и затем инкубировали 30-60 мин в ледяной бане. Делали осмотический шок, добавляя 6 мл TES/5 в каждую пробирку и быстро перемешивая переворачиванием. После инкубации в ледяной бане еще раз в течение 30-60 минут проводили центрифугирование при 4°С при 15000 g в течение 20 минут. Супернатант отбирали в свежую пробирку и добавляли к нему хлорид натрия до конечной концентрации 300 мМ. Из полученного периплазматического экстракта проводили очистку адаптированного мини-антитела с помощью металл-хелатной аффинной хроматографии на Ni-NTA-агарозе (согласно протоколу фирмы-производителя, Sigma-Aldrich). Полученные препараты мини-антител были диализованы против стандартного фосфатного буфера, содержащего 150 мМ хлорида натрия. Мини-антитела после диализа эффективно узнавали в ИФА рекомбинантный лактоферрин человека. Полученные мини-антитела, a-hLF-1 и а-hLF-4 подготовлены для связывания с материалом хроматографической колонки (BrCN-сефарозой). Аминокислотные последовательности мини-антител a-hLF-1 и a-hLF-4 представлены как SEQ ID NO:1 и SEQ ID NO:2, а нуклеотидные - как SEQ ID NO:3 и SEQ ID NO:4, соответственно (Фиг. 3).
Пример 2. Способ разделения целевого белка лактоферрина человека от лактоферрина козы.
Способ разделения лактоферринов человека и козы основывается на использовании иммуноаффинной хроматографической очистки препаратов с лактоферринами на колонке, состоящей из иммобилизованных на Sepharose 4В (GE Healthcare) специфических мини-антител a-hLF-1 и a-hLF-4, дифференциально связывающих только лактоферрин человека и не связывающих лактоферрин козы.
Два препарата сефарозы с пришитыми мини-антителами, узнающими лактоферрин человека (a-hLF-1, a-LF-4), были суспендированы в буфере PB S и перенесены в 1,5-мл пробирки. Над осевшим гелем оставляли примерно 200 мкл буфера, остальной объем буфера удаляли. В каждую из 2 пробирок с соответствующими иммобилизованными на сефарозе однодоменными антителами добавляли 500 мкл раствора (в PBS), содержащего смесь 200 мкг козьего и 200 мкг рекомбинантного человеческого лактоферринов. Суспензии инкубировали, перемешивая на ротомиксе, в течение 2 часов при комнатной температуре. Затем суспензии переносили в 10-мл колонки (фирмы Bio-Rad), давали суспензии осесть (сформировать колонку), после чего пропускали через колонку раствор с несвязавшимися лактоферринами 3 раза. Дополнительно промывали колонку 300 мкл PBS. Проскоки (суммарный объем примерно 1 мл) собирали для последующего анализа. Колонки (объемом примерно 0,7 мл) со связавшимися лактоферринами тщательно промывали буфером PBS: 2 раза 5 мл и затем один раз 10 мл. Элюцию связавшихся белков проводили в свежеприготовленном 1,4% растворе триэтиламина в воде (рН~11), последовательно в три этапа пропуская через колонку по 0,7 мл элюирующего раствора. Элюаты сразу же нейтрализовали, добавляя 1М Трис-HCl, рН 7,0 (пол-объема на один объем элюата). Таким образом, полный объем нейтрализованного элюата составлял примерно 3,1 мл (примерно в 3 раза больше объема соответствующего проскока). После элюции колонки с мини-антителами сразу же регенерировали промыванием в PBS.
На Фиг. 2 продемонстрированы результаты разделения лактоферринов человека и козы с использованием мини-антител a-hLF-1 и a-hLF-4; приведены данные распределения hLF и gLF в исходной смеси, в элюатах и проскоках в случае двух параллельно проведенных фракционирований. На Фиг. 2А показаны результаты электрофоретического анализа (по Лэммли) разделения лактоферринов с использованием мини-антител a-hLF-1 и a-hLF-4. На электрофорезе рекомбинантный лактоферрин человека (rec-hLF, или hLF) и козий лактоферрин (gLF) движутся с детектируемой разницей в подвижности; gLF движется немного медленнее, чем hLF. Поэтому на электрофорограмме можно ясно видеть результат проведенного фракционирования лактоферринов: hLF количественно выявляется только в элюатах, a gLF - только в проскоках. На Фиг. 2Б показаны результаты иммуноферментного анализа разделения лактоферринов с помощью иммуноаффинной хроматографии на полученных колонках с иммобилизованными однодоменными антителами, - количественного метода оценки эффективности фракционирования этих типов лактоферринов.
На Фиг. 3 приведены последовательности однодоменных антител, a-hLF-1 и а-hLF-4, аминокислотные последовательности которых представлены как SEQ ID NO:1 (Фиг.3А) и SEQ ID NO:2 (Фиг. 3Б) (подчеркнуты гипервариабельные участки, - CDR1, CDR2 и CDR3), а нуклеотидные - как SEQ ID NO:3 (Фиг 3В) и SEQ ID NO:4 (Фиг. 3Г), соответственно.
Литертурные источники
- Actor JK, Hwang SA, Kruzel ML. Lactoferrin as a natural immune modulator. Curr Pharm Des. 2009; 15(17):1956-73.
- Amini AA, Nair LS. Lactoferrin: a biologically active molecule for bone regeneration. Curr Med Chem. 2011; 18(8):1220-9.
- Artym J. [Antitumor and chemopreventive activity of lactoferrin). Postepy Hig Med Dosw (Online). 2006;60:352-69.
- Ashby B, Garrett Q, Willcox M. Bovine lactoferrin structures promoting corneal epithelial wound healing in vitro. Invest Ophthalmol Vis Sci. 2011 Apr 25; 52(5):2719-26.
- Ghassabeh G.H., Muyldermans S., Saerens D. 2010. Nanobodies, single-domain antigen-binding fragments of camelid heavy-shain antibodies. In Current Trends in Monoclonal Antibody Development and Manufacturing, Eds. S.J. Shire et al. Springer New York., 29-48.
- Hamers-Casterman,C, Atarhouch,T., Muyldermans,S., Robinson, G., Hamers, C, Bajyana Songa, E., Bendahman, N., Hamers, R. 1993. Naturally occurring antibodies devoid of light chains. Nature 363, 446-448.
- Kruzel ML, Actor JK, Boldogh I, Zimecki M. Lactoferrin in health and disease. Postepy Hig Med Dosw (Online). 2007; 61:261-7.
- Lacasse Ρ, Lauzon К, Diarra MS, Petitclerc D. Utilization of lactoferrin to fight antibiotic-resistant mammary gland pathogens. J Anim Sci. 2008 Mar; 86(13 Suppl):66-71.
- Lacasse Ρ, Lauzon K, Diarra MS, Petitclerc D. Utilization of lactoferrin to fight antibiotic-resistant mammary gland pathogens. J Anim Sci. 2008 Mar; 86(13 Suppl):66-71.
- Wally J, Buchanan SK. A structural comparison of human serum transferrin and human lactoferrin. Biometals. 2007 Jun;20(3-4):249-62.
- Wally J, Buchanan SK. A structural comparison of human serum transferrin and human lactoferrin. Biometals. 2007 Jun; 20(3-4):249-62.
- Wang J, Li Q, Ou Y, Han Ζ, Li Κ, Wang Ρ, Zhou S. Inhibition of tumor growth by recombinant adenovirus containing human lactoferrin through inducing tumor cell apoptosis in mice bearing EMT6 breast cancer. Arch Pharm Res. 2011 Jun; 34(6):987-95.
- Xu XX, Jiang HR, Li HB, Zhang TN, Zhou Q, Liu N. Apoptosis of stomach cancer cell SGC-7901 and regulation of Akt signaling way induced by bovine lactoferrin. J Dairy Sci. 2010 Jun;93(6):2344-50.
- Zimecki M, Artym J, Chodaczek G, Kocieba M, Kuryszko J, Houszka M, Kruzel ML. Immunoregulatory function of lactoferrin in immunosuppressed and autoimmune animals. Postepy Hig Med Dosw (Online). 2007; 61:283-7.
- Zimecki M, Artym J, Chodaczek G, Kocieba M, Kuryszko J, Houszka M, Kruzel ML. Immunoregulatory function of lactoferrin in immunosuppressed and autoimmune animals. Postepy Hig Med Dosw (Online). 2007; 61:283-7.
- Тиллиб С.В. «Верблюжьи антитела» - эффективный инструмент для исследований, диагностики и терапии. Молекулярная биология 2011; 45, №1, 77-85.
Способ разделения лактоферринов человека и козы, характеризующийся тем, что проводится с помощью иммуноафинной хроматографии, отличающийся тем, что для ее проведения используются однодоменные мини-антитела a-hLF-1 и a-hLF-4, аминокислотные последовательности которых представлены как SEQ ID NO:1 и SEQ ID NO:2, а нуклеотидные - как SEQ ID NO:3 и SEQ ID NO:4 соответственно.